Neurofibromatosis tipo I, epilepsia y trastorno de la migración
Anuncio

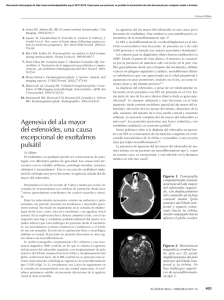
COMUNICACIONES BREVES nasofaríngeas que varían entre los 16 y 20 ºC. A ella se asocia el uso de hipotermia tópica (hielo en la cabeza del paciente) y otras técnicas como la inducción del coma barbitúrico. Existen dos métodos de perfusión cerebral: anterógrada y retrógrada. Ambos reducen el daño cerebral aunque ninguno es claramente superior al otro en sus resultados [1-7]. La perfusión anterógrada, a través de troncos supraórticos, realizada por vez primera por De Bakey [1,7], suele realizarse con flujos de 10 ml/ kg/min asegurando presiones de perfusión superiores a 30 mmHg. Precisa la confirmación preoperatoria de la integridad del polígono de Willis en caso de que se pretenda realizar perfusión a través de un solo tronco braquiocefálico. Su complejidad hace que algunos autores sólo la recomienden en caso de paradas circulatorias de más de 60 min. La perfusión retrógrada, a través de vena cava superior, se realiza a presiones que oscilan entre 18 y 25 mmHg y flujos de 200-250 cm3 /min. Retira catabolitos y mantiene uniforme la temperatura cerebral. Permite paradas circulatorias de hasta 45-100 min. En nuestro paciente se realizó perfusión cerebral anterógrada aprovechando la necesidad de reconstruir los troncos supraórticos, que estaban trombosados. Para ello, se realizó inicialmente la anastomosis de un tubo de Dacron de 8 mm a la porción cervical permeable de la arteria carótida común izquierda y se utilizó ésta para infundir a su través la perfusión cerebral anterógrada, garantizada por la integridad del polígono de Willis. Una vez reconstruido el arco aórtico, se suturó a éste la porción proximal del injerto sobre la carótida izquierda (Fig. 2). La frecuencia de complicaciones neurológicas en el postoperatorio de la reparación de aneurismas del arco aórtico se encuentra en torno al 10% en la mayoría de las series. De éstos, el 50% fallecen durante el ingreso hospitalario y de los restantes, fallecen durante el seguimiento hasta el 46%. Son factores de riesgo de complicación neurológica en estos casos [8,9]: cirugía emergente, rotura del aneurisma, pinzamiento del aneurisma, parada circulatoria superior a 40 min, accidente cerebrovascular previo, canulación femoral [1] e insuficiencia renal preoperatoria, entre otros. A pesar de que en nuestro paciente la clínica inicial fue de tipo neurológico, ninguna de estas complicaciones apareció tras la reparación quirúrgica. Estamos ante una descripción excepcional de un aneurisma del cayado aórtico que comienza como un cuadro ictal. Aunque los aneurismas arterioscleróticos de arco aórtico son patologías habitualmente asintomáticas, no se debe descartar en un sujeto joven sin antecedentes de interés y con clínica neurológica poco definida la posible existencia de una patología de estas características. Y. Carrascal-Hinojal, G. Pradas-Montilla, J.E. Centeno-Rodríguez Recibido: 06.05.01. Aceptado: 16.06.01. Unidad de Cirugía Cardíaca. Instituto Galego de Medicina Técnica. Hospital do Meixoeiro. Vigo, Pontevedra, España. REV NEUROL 2001; 33 (6) Correspondencia: Dra. Yolanda Carrascal. Bálago, 3, 6.º A. E-47009 Valladolid. E-mail: aguerrerop@ medynet.com BIBLIOGRAFÍA 1. Stowe CL, Baertlein MA, Wierman MD, Rucker M, Ebra G. Surgical management of ascending and aortic arch disease: refined techniques with improved results. Ann Thorac Surg 1998; 66: 388-95. 2. Laas J, Jurmann M, Heinemann M, Borst HG. Advances in aortic arch surgery. Ann Thorac Surg 1992; 53: 227-32. 3. Villard J. Atheromatous aneurysms of the thoracic aorta. Arch Mal Coeur Vaiss 1997; 90 (Suppl): 1741-9. 4. Coselli JS, Buket S, Djukanovic B. Aortic arch operation: current treatment and results. Ann Thorac Surg 1995; 59: 19-26. 5. Okita Y, Takamoto S, Ando M, Morota T, Matsukawa R, Kawashima Y. Mortality and cerebral outcome in patients who underwent aortic arch operations using deep hypothermic circulatory arrest with retrograde cerebral perfusion: no relation of early death, stroke, and delirium to the duration of circulatory arrest. J Thorac Cardiovascular Surg 1998; 115: 129-38. 6. Rokkas CK, Kouchoukos NT. Single-stage extensive replacement of the thoracic aorta: the arch-first technique. J Thorac Cardiovasc Surg 1999; 117: 99-105. 7. Le Mee F, Roques X, Laborde N, Guibaud JP, Baudet E. Cerebral protection by selective cerebral perfusion during surgery on the aortic arch. Arch Mal Coeur Vaiss 1995; 88: 1601-7. 8. Okita And, I Walk M, Minatoya K, Kitamura S, Takamoto S, Nakajima N. Predictive factors for mortality and cerebral complications in arteriosclerotic aneurysm of the aortic arch. Ann Thorac Surg 1999; 67: 72-8. 9. Crawford I, Svensson LG, Coselli JS, Safi HJ, Hess KR. Surgical treatment of aneurysm and/ or dissection of the ascending aorta, transverse aortic arch, and ascending aorta and transverse aortic arch. Factors influencing survival in 717 patients J Thorac Cardiovasc Surg 1989; 98: 659-73. Neurofibromatosis tipo I, epilepsia y trastorno de la migración neuronal La neurofibromatosis tipo I (NF-I) o neurofibromatosis de Von Recklinghausen es el trastorno neurocutáneo más frecuente. Entre las manifestaciones neurológicas más habituales se encuentran las dificultades del aprendizaje, el retraso mental, los tumores intracraneales e intraespinales, la macrocefalia y la epilepsia [1,2]. La frecuencia de esta última complicación no sobrepasa generalmente el 3,5% en la población afecta con NF-I [3,4]. En la mayor parte de los casos se obtiene un control terapéutico adecuado con la medicación antiepiléptica habitual. La presencia de defectos de la migración neuronal en la NF-I es excepcional. Su existencia puede ensombrecer el pronóstico terapéutico de las crisis convulsivas. Exponemos el caso de un paciente con NFI y crisis rebeldes a los tratamientos antiepilépticos convencionales. El estudio mediante RM-3D demuestra la presencia de una polimicrogiria en el lóbulo temporal. El paciente es varón y tiene 4 años en el momento que acude a la consulta de neuropediatría. El motivo es la presencia de crisis parciales con generalización secundaria que motivaron el ingreso hospitalario del paciente. La anamnesis refleja un episodio de mirada fija, sonidos guturales, movimientos clónicos que afectan predominantemente a la extremidad superior derecha, y que en escasos minutos se generaliza en forma de movimientos tonicoclónicos. Acuden al servicio de urgencias donde se administran benzodiacepinas rectales y fenitoína. La reiteración de las crisis durante el período observacional apoya el ingreso. La exploración del paciente revela la presencia de numerosas manchas café con leche, efélides en axilas y regiones inguinales. El perímetro cefálico se encuentra en el límite alto de la normalidad: 53 cm. No se observan fibromas, alteración ocular ni ósea. En los antecedentes personales del niño se refiere un embarazo controlado, que precisó reposo por amenaza de aborto; el parto se realizó por cesárea por falta de progresión, a término; el peso al nacer fue de 3.650 g, se realizó una reanimación superficial; el desarrollo psicomotor había sido normal; el pediatra le controlaba estrechamente por la presencia de manchas café con leche y macrocefalia. Los antecedentes familiares no muestran datos relevantes: los padres son jóvenes y sanos; el paciente es el primer y único hijo; no existen antecedentes de epilepsia ni manchas café con leche en la familia. Al ingreso, se mantiene el tratamiento antiepiléptico referido. Se realiza un electroencefalograma que refleja un trazado de fondo dentro de los límites normales, sobre el que se registra una actividad focal de complejos punta-onda en áreas temporales anteriores izquierdas. El estudio se acompaña de TAC craneal que no muestra alteraciones. Ante la persistencia de las crisis se realizan diferentes intentos farmacológicos sin gran resultado. Se añaden ácido valproico, clobazam, topiramato y carbamacepina en las dosis habituales, en diferentes pautas combinadas. Con la introducción de carbamacepina se obtiene una discreta mejoría, motivo por el cual el paciente es remitido a su domicilio. Un mes después del alta, el paciente acude a la consulta. Las crisis persisten con una frecuencia de 2-3 episodios semanales. Se solicita la realización de un examen oftalmológico completo y un estudio de RM cerebral. La primera exploración no revela la presencia de nódulos ni otras alteraciones. La RM cerebral pone de manifiesto la presencia de cambios hamartomatosos en pedúnculos cerebelosos medios y en núcleo pálido derecho, quiste aracnoideo que ocupa la cisterna prepontina e interpeduncular que impronta la base del III ventrículo y asocia 593 COMUNICACIONES BREVES discreta ventriculomegalia supratentorial. A estos hallazgos se suma la presencia de un engrosamiento del córtex de la porción anterior del lóbulo temporal izquierdo, incluyendo el área hipocámpica y el giro parahipocámpico, compatible todo ello con un trastorno de la migración neuronal tipo polimicrogiria (Figura). Hasta la actualidad, el paciente ha seguido presentando crisis parciales complejas y crisis parciales con generalización secundaria. Con la asociación de ácido valproico, clonacepam y topiramato, la frecuencia de las crisis ha descendido a un episodio al mes; éstas son de breve duración (menor de 1 minuto). El último EEG muestra un trazado dentro de los límites normales. Los trastornos neurocutáneos, previamente denominados facomatosis, constituyen un grupo heterogéneo de enfermedades heredofamiliares caracterizadas principalmente por la afectación de órganos y estructuras de origen ectodérmico [5]. La presencia de crisis convulsivas es objetivable en prácticamente la totalidad de los trastornos referidos. Sin embargo, la epilepsia se manifiesta como un trastorno principal en pacientes con esclerosis tuberosa, hipomelanosis de Ito o síndrome de Sturge-Weber, donde podemos objetivar crisis en el 90, 50 y 80% de los pacientes, respectivamente [6-11]. En estos casos, la fenomenología epiléptica es generalmente diversa. Sin embargo, a pesar de compartir características comunes, la presencia de epilepsia en la NF-I es claramente inferior. La prevalencia de epilepsia en pacientes con neurofibromatosis se sitúa entre el 3 y el 7,3% [3,4,12,13]. Aunque la frecuencia es claramente superior a la observada en la población general, indudablemente en muchos pacientes con NF-I, la presencia de convulsiones tan sólo pone de manifiesto una mera coincidencia de dos procesos frecuentes. Al igual que ocurre con otros trastornos neurocutáneos, se han descrito diferentes tipos de convulsiones, incluidos los espasmos infantiles [14]. En la mayor parte de los casos se obtiene un control terapéutico adecuado con los antiepilépticos actuales, lo que diferencia notablemente la NF-I de otros trastornos neurocutáneos. La presencia de crisis resistentes al tratamiento obliga a descartar otras causas o asociaciones que puedan influir en el control y pronóstico de las mismas, como refleja el caso que hemos expuesto. Los hallazgos neurorradiológicos que caracterizan la NF-I comprenden diversas alteraciones, que incluyen desde la presencia de lesiones hamartomatosas a gliomas bien definidos que afectan frecuentemente, aunque no de forma exclusiva, las vías ópticas [3,4,12]. Estos últimos se observan en el 13-50% de los pacientes. Otras complicaciones como los tumores intraespinales, afecciones vasculares encefálicas [15], siringomielia [16] o estenosis del acueducto de Silvio [17] pueden observarse también en este trastorno. La presencia de malformaciones cerebrales mayores son excepcionales en la NF-I y no así en otros trastornos neurocutáneos. Se han descrito varios casos con agenesia del cuerpo calloso [1]. Asimismo, se ha referido 594 Figura 1. Engrosamiento del córtex de la porción anterior del lóbulo temporal izquierdo compatible con polimicrogiria. la presencia de hemimegalencefalia en pacientes con neurofibromatosis [18]. Se ha descrito lisencefalia tipo I (síndrome de Miller-Dieker) en un niño con antecedentes de NF-I en la familia, aunque el estudio genético evidenció la ausencia de la mutación del gen de la NF-I que portaban su madre y abuela [19]. Los trastornos disgenéticos a nivel cortical, como el caso descrito, posiblemente refleje un hallazgo casual en el seno de la NF-I, al igual que los descritos en este mismo apartado. Creemos que es el primer caso con NF-I y polimicrogiria descrito en la literatura científica. Probablemente no se trate del único caso en la práctica médica, dada la frecuencia de ambos trastornos. Este trastorno de la migración ha modificado indudablemente la evolución y el control terapéutico de las crisis convulsivas en el caso referido. Ante la presencia de crisis resistentes al tratamiento farmacológico en el contexto de la neurofibromatosis, deben descartarse otras alteraciones que puedan empeorar el control de las mismas. A. Fernández-Jaén a, B. Calleja-Pérez b, J. Viaño c , A. Calvo d, C. Sánchez e , B. Anciones f Recibido: 09.05.01. Aceptado: 18.06.01. a Jefe de la Sección de Neurología Infantil. Departamento de Neurología. Hospital La Zarzuela. b Especialista en Pediatría. Atención Primaria. c Jefe del Servicio de Neurorradiología. Sanatorio Ntra. Sra. del Rosario. d Especialista en Neurología Infantil. Departamento de Neurología. e Especialista en Neurofisiología. Departamento de Neurología. f Jefe del Departamento de Neurología. Hospital La Zarzuela. Aravaca, Madrid, España. Correspondencia: Dr. A. Fernández Jaén. Servicio de Neurología Infantil. Hospital La Zarzuela. Pléyades, 25. E-28023 Aravaca, Madrid. E-mail: [email protected] BIBLIOGRAFÍA 1. Pascual-Castroviejo I. Neurofibromatosis tipo I (NF-I): peculiaridades y complicaciones. Rev Neurol 1996; 24: 1051-5. 2. National Institutes of Health Consensus Development Conference: neurofibromatosis conference statement. Arch Neurol 1988; 45: 575-8. 3. Pascual-Castroviejo I. Complications of neurofibromatosis type I in a series of 197 childrens. In Fukujama Y, Suzuki Y, Kamoshita S, Casaer P, eds. Fetal and perinatal neurology. Basel: Karger; 1992. p. 162-73. 4. Riccardi VM. Von Recklinghausen neurofibromatosis. N Engl J Med 1981; 305: 1617-27. 5. Nieto M. Facomatosis: criterios diagnósticos y protocolos de seguimiento: introducción. Rev Neurol 1996; 24: 1049-50. 6. Martínez-Bermejo A, López-Martín V, Carrascosa C, Vara T, Pascual-Castroviejo I. Crisis epilépticas en los trastornos neuroectodérmicos. En Pascual-Castroviejo I, ed. Trastornos neuroectodérmicos. Barcelona: Prous; 1989. p. 1-71. 7. Webb DW, Fryer AE, Osborne JP. On the incidence of fits and mental retardation in tuberous sclerosis. J Med Genet 1991; 28: 395-7. 8. Yamamoto N, Watanabe K, Negoro T, Matsumoto A, Miyazaki S, Kumagai T, et al. Long term prognosis of tuberous sclerosis with epilepsy in children. Brain Dev 1987; 9: 292-5. REV NEUROL 2001; 33 (6) COMUNICACIONES BREVES 9. Pascual-Castroviejo I, López-Rodríguez L, de la Cruz Medina M, Salamanca-Maesso C, Roche Herrero C. Hypomelanosis of Ito. Neurological complications in 34 cases. Can J Neurol Sci 1988; 15: 124-9. 10. Pascual-Castroviejo I, Díaz-González C, García-Melian RM, González-Casado I, Muñoz-Hiraldo E. Sturge-Weber syndrome: study of 40 patients. Pediatr Neurol 1993; 9: 283-8. 11. Sujansky E, Conradi S. Sturge-Weber syndrome: age of onset of seizures and glaucoma and the prognosis for affected children. J Child Neurol 1995; 10: 49-58. 12. North K. Neurofibromatosis type 1: review of the first 200 patients in an Australian clinic. J Child Neurol 1993; 8: 395-402. 13. Huson SM, Harper PS, Compston DAS. Von Recklinghausen neurofibromatosis: a clinical and population study in South-East Wales. Brain 1988; 111: 1355-81. 14. Motte J, Billard C, Fejerman N, Sfaello Z, Arroyo H, Dulac O. Neurofibromatosis type one and West syndrome: a relative benign association. Epilepsia 1993; 34: 723-6. 15. Rizzo JF, Lessell S. Cerebrovascular abnormalities in neurofibromatosis type 1. Neurology 1994; 44: 1000-2. 16. Fernández-Jaén A, Calleja B, Pascual-Castroviejo I. Siringomielia, malformación de Chiari y escoliosis en un paciente con neurofibromatosis tipo 1. An Esp Pediatr 1998; 48: 522-4. 17. Fernández-Jaén A, Calleja B, Pascual-Castroviejo I, Baquero F, de Ceano M. La estenosis del acueducto de Silvio en la neurofibromatosis tipo I. A propósito de 12 casos. Rev Neurol 1996; 24: 1130. 18. Cusmai R, Curatolo P, Mangano S, Cheminal R, Echenne B. Hemimegalencephaly and neurofibromatosis. Neuropediatrics 1990; 21: 179-82. 19.King A, Upadhyaya M, Penney C, Doshi R. A case of Miller-Dieker syndrome in a family with neurofibromatosis type I. Acta Neuropathol 2000; 99: 425-7. Cirugía de la espondilosis cervical por vía anterior La espondilosis cervical es hoy en día una de las causas más frecuentes de mielorradiculopatía en nuestros hospitales. Dos han sido las vías quirúrgicas más empleadas en su tratamiento: aquella que utilizando el acceso posterior realiza laminectomía para la descompresión de la médula y sus raíces al ampliar el continente medular, pero que no actúa sobre la causa real de la compresión [1,2], y la que empleando la vía anterior realiza exéresis de las barras óseas y de los osteofitos con o sin fusión intersomática. Teniendo en cuenta la polémica existente entre los defensores de una y otra vía, decidimos evaluar los resultados en una serie de pacientes operados por vía anterior. Nuestro trabajo revisa 30 pacientes portadores de mielopatía espondilótica cervical atendidos en el período comprendido entre marzo de 1998 y julio de 2000, cuyo diagnóstico inicial se REV NEUROL 2001; 33 (6) realizó por la historia clínica y se confirmó por métodos de diagnóstico imaginológico (Rx simple, mielografía, tomografía axial computarizada (TAC), mielo-TAC y resonancia magnética) y neurofisiológicos (electromiografía –EMG–, potenciales evocados somatosensoriales –PESS– y velocidad de conducción nerviosa periférica). En cada paciente evaluamos el dolor y la fuerza muscular según las siguientes escalas: Dolor. Grado I: dolor ocasional que no requiere analgésico. Grado II: a) Dolor ocasional que se alivia con analgésicos orales. b) Dolor ocasional que requiere para su alivio de analgésicos por vía parenteral. Grado III: a) Dolor permanente de ligera a moderada intensidad, que se alivia con analgésicos orales; b) Dolor permanente de ligera a moderada intensidad que se alivia con analgésicos por vía parenteral. Grado IV: dolor permanente de gran intensidad que se alivia con analgésicos por vía parenteral. Grado V: Dolor permanente intratable. Fuerza muscular. Grado 0: no hay contracción muscular visible, ni palpable. Grado I: contracción muscular visible y palpable, sin movimiento articular. Grado II: contracción muscular visible y palpable con movimiento articular pero sin fuerza antigravitatoria. Grado III: contracción muscular visible y palpable con movimiento articular y fuerza antigravitatoria, pero no contra la resistencia. Grado IV: contracción muscular visible y palpable con movimiento articular y fuerza antigravitatoria y contra la resistencia, pero con mínima afectación. Grado V: fuerza muscular normal. La afectación sensitiva se clasificó en: anestesia, hipoestesia, hiperestesia y normal. Dividimos los pacientes en dos grupos según los síntomas predominantes: los portadores de lesiones radiculares y los que padecían de lesiones medulares, a quienes utilizando las imágenes de TAC y Rx simple de columna cervical lateral se les midió el diámetro anteroposterior del canal vertebral. Para llevar a cabo el tratamiento quirúrgico propuesto se utilizó la técnica de Cloward modificada. La descompresión intersomática (discectomía, uncucectomía, osteofitectomía) se realizó bajo magnificación microscópica con ponches, microkerrison y drill de alta velocidad; en caso de hipertrofia o calcificación de ligamento longitudinal posterior se realizó la exéresis del mismo, colocándose injerto óseo extraído de la cresta ilíaca derecha según el método de Smith-Robinson. La colocación del mismo se hizo por distracción intersomática (distractor de Caspar) e impactación. Se colocaron lámina y tornillos del sistema AO en los pacientes con signos sugestivos de pseudoartrosis, y en los operados de tres espacios. Se recogieron las complicaciones derivadas del empleo de esta técnica. Todos los pacientes se mantuvieron con ortosis cervical externa durante tres meses. La evaluación final del tratamiento la clasificamos en: 1. Excelente: cuando la mejoría neurológica y el alivio del dolor fue total; 2. Buena: cuando la mejoría neurológica fue buena con alivio del dolor en algún grado; 3. Regular: cuando la mejoría neurológica fue regular y hubo alivio del dolor en cierto grado; 4. Mala: igual o mayor lesión neurológica con o sin alivio del dolor. Estos parámetros se valoraron al ingreso del paciente para cirugía y seis meses después del tratamiento quirúrgico. A toda la información le aplicamos la prueba no paramétrica Kolmogorov-Smirnov para probar las diferencia entre los grupos. En el 50% de los casos se trataron dos espacios, un espacio en el 40% y tres espacios en el 10%, uno de ello con corpectomía total del cuerpo de C5, para un total de 51 espacios, con un orden de frecuencia C5-C6 (45,1%), C4-C5 (29,4%), C6-C7 (21,6%) y C3-C4 (3,9%). En cuanto al dolor, predominaron los grados II-a y III-a (33,3%) para cada grupo. La evaluación del dolor postoperatorio fue excelente en 17 casos (56,7%), buena en 10 (33,3%) y mala en 3 casos (10,0%), comprobamos que existía diferencia significativa (p< 0,05). En el preoperatorio, el grado III de fuerza muscular se presentó en 13 pacientes (43,3%) y el grado IV en 8 pacientes (26,7%), el 30,0% restante lo ocuparon los demás grados. Después de la cirugía, pasaron el 66,6% de los casos a los grupos IV y V (p< 0,05), lo que les permitió reincorporarse a la vida laboral o tener una marcha independiente y adecuada, y tres pacientes (10%) lograron deambular con apoyo de ortesis. El 6,7% no tuvieron mejoría motora, entre ellos un caso con empeoramiento del defecto motor en los miembros inferiores. El 40% de los casos presentaron lesiones radiculares puras y el 60% de las lesiones neurológicas fueron medulares. El 70% de las hipoestesias e hiperestesias superficiales se normalizaron. Pudimos comprobar que hubo una estrecha relación entre el tiempo de evolución de la enfermedad mielopática y los resultados del tratamiento quirúrgico, pues se produjo una significativa mejoría entre los pacientes con menos de un año sintomático (el 77,8% de los casos obtuvieron excelentes resultados y el 22,2% resultados buenos); en este grupo no se obtuvieron resultados regulares o malos. El 100% de los pacientes portadores de radiculopatías mejoraron independientemente del tiempo de evolución. Un paciente tuvo signos de compresión de los cordones posteriores debido a hipertrofia del ligamento amarillo asociado a la compresión anterior. Los trastornos esfinterianos se presentaron en dos pacientes y fueron indicativos de un grado avanzado de la enfermedad. El canal medular tuvo un diámetro promedio de 12,4 mm en los pacientes con radiculopatías, mientras que para los casos con toma medular, el diámetro medio del canal fue de 10,3 mm, encontrándose diferencia significativa (p< 0,05). Otros de los resultados encontrados en relación con el diámetro del canal fue la correlación con los resultados posquirúrgicos (excelente 56,6% de los pacientes con canal de 12,5 mm o más, bueno 30,0% de los pacientes con canal de 11,4 a 12,4 mm, regular y malo 13,4% con canal de 11,3 mm o menos). Logramos una fusión ósea en el 100% de los 595