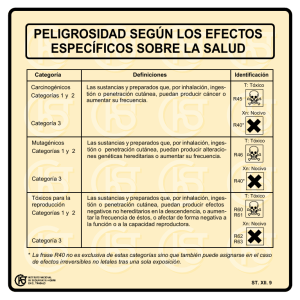
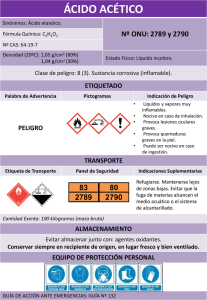
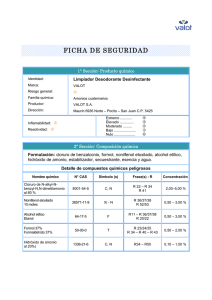
Practicas de Quimica General
Anuncio

MANUAL DE PRÁCTICAS QUÍMICA GENERAL Popayán UNIVERSIDAD DEL CAUCA Facultad de Ciencias Naturales, Exactas y de la Educación Departamento de Química 2008 CONTENIDO Instrucciones para el laboratorio Reglamento de laboratorio de química 1. Reconocimiento del material de laboratorio……………………………………...5 2. Tratamiento de datos experimentales……………………………………………24 3. Cambios físicos y cambios químicos…………………………………………....32 4. Enlace químico………………………………………………………………..…36 5. Determinación del porcentaje de hidratación de un compuesto………………....42 6. Relaciones de masa en los procesos químicos …………………………………..45 7. Reacciones de Oxido-Reducción…………………………………………………50 8. Determinación del volumen molar de un gas…………………………………….55 9. Preparación de soluciones No. 1..………………………………………………...60 10. Preparación de soluciones No.2 ………………………………………………….64 2 INTRODUCCIÓN La Química se considera como una ciencia experimental, por lo tanto su estudio gira alrededor del laboratorio. Este manual tiene como objetivo principal proporcionar los conocimientos necesarios en las técnicas básicas de las operaciones del laboratorio químico, las cuales deberán aprenderse y dominarse en detalle. En cada experimento se describe: • El objetivo principal • Una breve introducción para situar al estudiante en el tema del experimento. • Un desarrollo experimental para lograr el objetivo. • Las mediciones y observaciones a realizar, dándose importancia a las observaciones cuidadosas y a las mediciones cuantitativas bajo condiciones experimentales que se pueden controlar. • El cálculo e interpretación de los resultados. Se hace énfasis en la mayoría de los casos en la preparación de tablas para organizar los datos obtenidos y los cálculos realizados, con el fin de poder hacer deducciones más rápidas y obtener fácilmente las conclusiones de cada experimento. • Referencias bibliográficas con el objeto de que el alumno consulte la literatura referente a cada experimento antes de entrar al laboratorio. A través de toda la guía se plantean interrogantes de interés para ayudar al estudiante a aplicar principios que ha observado o que observará en los experimentos. Las instrucciones que se indican para cada experimento se deben considerar como una guía general. El estudiante debe adquirir seguridad trabajando por sí mismo en los experimentos, bajo la supervisión del profesor. Los resultados del laboratorio dependen principalmente del método y limpieza de las operaciones, la precisión de los resultados y el conocimiento de lo que se está haciendo. Las prácticas referidas en este manual se pueden realizar todas sin necesidad de equipo costoso ni procedimientos complicados, en períodos adecuados de tiempo, y no proporcionan peligro. El manual contempla el material corriente de laboratorio, así como algunas instrucciones y normas de seguridad. Por lo tanto se espera que este manual sea una herramienta valiosa para la capacitación experimental del estudiante y para que adquiera unas bases adecuadas de disciplina en el trabajo experimental. 3 REGLAMENTO DE LABORATORIO DE QUÍMICA Toda persona que trabaje en el laboratorio debe por seguridad personal y la de sus compañeros ceñirse a las siguientes instrucciones generales. 1- Portar su carnet estudiantil y de seguro estudiantil 2- Dominar el tema que se va a desarrollar durante la práctica. La información que aparece en los apuntes de clase y la guía de laboratorio debe ser complementada con la bibliografía correspondiente. 3- Presentarse puntualmente al laboratorio, con: a. Bata de laboratorio blanca de manga larga. (úsela siempre abotonada) b. La guía de laboratorio correspondiente c. Cuaderno de laboratorio d. Paño de limpieza e. Gafas de seguridad, úselas sobre los ojos mientras realiza la práctica 4- Los estudiantes deben trabajar en presencia de su profesor(a) y conjuntamente evaluar los posibles riesgos en cada acción a efectuar, como: a. Contaminación del agua y la atmósfera b. Posible escape de reactivos 5- Mantener las balanzas limpias y descargadas. 6- Entregar limpio y en orden el material y el sitio de trabajo 7- Habrá un mes de plazo para reponer el material quebrado, perdido o deteriorado. Éste debe tener la misma marca y especificación 8- Usar zapatos completamente cerrados, para evitar que penetren líquidos al pie. 9- Tener cuidado con elementos (barba, pelo largo, corbatas ó collares), que pueden enredarse, inflamarse ó absorber sustancias químicas. 10- No beber, no comer, no fumar, no llevarse las manos a la boca durante el desarrollo de la práctica. 11- No succionar un reactivo con la boca, usar un dispositivo adecuado 12- Conocer el riesgo de los reactivos que está utilizando 13- No botar reactivos, ni basura a los desagües 14- Tratar todas las sustancias químicas como tóxicas. El olor NO es guía de confianza. 15- Usar pantalones largos. 4 1/19 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD DEL CAUCA Práctica: RECONOCIMIENTO DE MATERIAL DE LABORATORIO Guía No: 01 Páginas: 1 a 19 1. INTRODUCCIÓN Bienvenidos al laboratorio de Química Antes de realizarlas es necesario familiarizarse con los nombres y usos específicos de cada uno de los materiales de trabajo que se utilizarán de ahora en adelante, para lograr así un mayor conocimiento, con un mínimo de errores o accidentes por la incorrecta manipulación de ellos. Los materiales mencionados en esta sección forman parte de un pequeño laboratorio tradicional de química, no se nombran aparatos ni nuevas técnicas automatizadas de las que la Química actual hace gala con grandes avances en aparatos de elevada complejidad técnica. Hay que tener en cuenta que en el laboratorio de química se va a trabajar con compuestos corrosivos, que van a ser sometidos a amplias variaciones de temperatura, por lo que se necesitará un material que resista estas dos condiciones. El material que cumple estas características es el vidrio, por supuesto, vidrio especial. Existen otra serie de materiales utilizados diariamente en el laboratorio que es necesario conocer y manejar y por esto en esta práctica se hará el reconocimiento de ellos. Bases teóricas Existen dos tipos de vidrio fundamentales de mayor uso y otros de características más específicas para usos concretos. El vidrio de borosilicato es duro, libre de metales pesados y muy resistente al choque térmico, y a la corrosión alcalina. Se emplea fundamentalmente cuando se van a efectuar cambios repentinos de temperatura. Tiene un punto de fusión entre 750 y 1100º C. El vidrio de cal sodada tiene un punto de fusión más bajo y puede desprender minerales, por lo que hay que manejarlo con precaución en Química Clínica. Existen otros vidrios como el libre de Boro o de alto contenido en sílice con otras propiedades particulares. A continuación se describen los materiales más comunes usados a diario en un laboratorio. En las figuras 1.1 y 1.2 se relacionan cada uno de ellos. Elaborado por: Revisado Por: Aprobada por: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Fecha de Aprobación: Rector Danilo ReinaldoVivas R. 5 Práctica: Reconocimiento del material de laboratorio. 2/19 pinzas para bureta pinzas para crisol Nuez triangulo de porcelana espatulas pinza para tubos de ensayo Gradilla tripode Figura 1.1. Material de laboratorio 6 Práctica: Reconocimiento del material de laboratorio. 3/19 unión vaso de precipitados probeta erlenmeyer de filtración embudo de decantación embudo embudo gooch balón aforado balón de fondo redondo balón de fondo redondo condensador termómetro balón de tres bocas bureta tubo de ensayo Figura 1.2. Material de laboratorio 7 Práctica: Reconocimiento del material de laboratorio. 4/19 1.1 Matraces Los matraces volumétricos están diseñados para contener un volumen específico, marcado con una línea (aforo), por lo que no deben ser sometidos a calentamiento, ya que pierden la calibración, es decir, dejan de medir exactamente el volumen que deben contener. Por tanto, se usará material no volumétrico si se necesita calentar. 1.2 Probetas Las probetas graduadas se emplean para medir líquidos de precisión intermedia y están marcadas con una serie de líneas como una regla. Se usan cuando no es muy importante la precisión. No se deben calentar porque se rompen con el calor. 1.3 Buretas Las buretas son dosificadores para medir cualquier volumen hasta su capacidad máxima. Es necesario que las buretas estén escrupulosamente limpias antes de usarlas. Se trata de recipientes alargados graduados en los que por un extremo se introduce el líquido a medir y el otro extremo termina en punta con una llave que abre y cierra el paso del líquido. 1.4 Pipetas Las pipetas se emplean para transferir pequeños volúmenes exactos de un lugar a otro. Suelen tener una capacidad de 0.1 mL a 50 mL. Son como finos tubos de vidrio terminados en una punta por uno de los lados. El líquido se absorbe hasta el interior de la pipeta mediante procedimientos mecánicos. Otro tipo de pipetas son las micro pipetas, o pipetas automáticas, que llevan incorporado el sistema de captación de líquido y lo hacen de manera exacta según su graduación que va de 0.001 mL a 1 mL habitualmente. Éstas ya no son de vidrio sino que son aparatos mecánicos plásticos a los que se les incorpora una pequeña punta desechable donde se alberga el líquido recogido. 1.5 Vaso de precipitados ó beaker Aunque pueden ir graduados, no se utilizan normalmente como instrumental volumétrico, debido a su escasa precisión. Se trata de vasos al estilo normal, con un borde superior como el de una jarra para facilitar el vertido del líquido. 1.6 Material de porcelana Puede ser refractario y no refractario. Entre el material refractario se encuentra: cápsulas, crisoles y triángulos de porcelana; entre los no refractarios tenemos: embudos, morteros y espátulas de porcelana. 1.7 Material metálico Este material por lo general sirve para soporte y montaje de diversos equipos, ejemplo: nueces, aros y pinzas en general. 8 Práctica: Reconocimiento del material de laboratorio. 5/19 1.8 Materiales varios Se emplea para efectuar uniones o conexiones, por donde van a circular fluidos, ejemplo: tubos de caucho y sintéticos; también se emplea como material de aislamiento y en gradilla para tubos de ensayo (madera, caucho, corcho, plásticos, etc). 1.9 Material especializado Comprende los instrumentos en general, los cuales no deben usarse sin un conocimiento previo de su funcionamiento y cuidados requeridos. El que más se utilizará durante el transcurso de las prácticas es la balanza analítica y por ello se debe aprender a manejarla bien desde el principio. 1.9.1 Balanza Es un instrumento o equipo de medición, que se emplea para determinar la masa de los cuerpos. La masa de una sustancia es la medida de la cantidad de materia que contiene y aunque los términos “masa” y “peso” son diferentes, ya que esta última es una fuerza que varía con la distancia del cuerpo respecto al campo gravitacional y puede llegar a valer cero. Es común que ambos se usen indistintamente por tradición y es así como la operación utilizada para determinar la masa de un objeto se denomina “pesada” cuando su nombre verdadero debía ser “masada”. En la figura 1.3 se observan algunos tipos de balanzas. Existen tres tipos de balanza a saber: 1. Las mecánicas de poca sensibilidad que permiten pesar desde varios kilos hasta 1,0 g 2. Las de platillo externo de mayor sensibilidad que las anteriores, permiten pesar desde 2000 g hasta 0.01 g. 3. Las analíticas que permiten pesar desde menos de 500 g hasta 0.0001 g. Algunas reglas generales para el correcto uso de las balanzas son: a. No colocar reactivos químicos, cuerpos húmedos o calientes directamente sobre el platillo de la balanza. b. Tener la precaución de no colocar objetos que excedan el peso máximo que puedan medir, este valor se indica siempre cerca de la escala de lectura de la balanza. c. Comprobar con el indicador de burbuja, que la balanza esté nivelada, si no lo está ajústela con las tuercas niveladoras colocadas en los soportes. 9 Práctica: Reconocimiento del material de laboratorio. 6/19 Figura 1.3. Tipos de balanzas 10 Práctica: Reconocimiento del material de laboratorio. 7/19 1.9.1.1 BALANZA ANALÍTICA DEFINICIÓN: Instrumento de operación electrónica, utilizado para medir la masa de un cuerpo, con una precisión de 0,0001 g. Este instrumento tiene una capacidad de pesada de 210 g, incluida la tara. MATERIALES, INSUMOS Y REACTIVOS: 1. 2. Pincel para limpieza Masa de calibración de 100 y 200 g, tolerancia ASTM clase 1 INSTRUCCIONES DE OPERACIÓN: 1. 2. 3. 4. 5. 6. 7. 8. Conectar el instrumento a la red de 110 voltios Nivelar el equipo con la mesa, girando las patas de éste convenientemente, hasta que la mirilla quede perfectamente centrada en el círculo Encender el instrumento pulsando la tecla → 0/T← Permitir que el equipo permanezca encendido por lo menos 15 minutos. Calibrar el instrumento según se indica en el párrafo de abajo. Una vez calibrado, proceder a efectuar las pesadas correspondientes Apagar, desconectar de la red y proteger con su funda respectiva Almacenar el instrumento en un lugar seguro CALIBRACIÓN: Usted recibirá el equipo previamente calibrado antes de efectuar cualquier medición; por tanto, deberá cerciorarse de que está en condiciones apropiadas para ser usado, esto es, estar en perfecto estado de calibración, lo cual puede realizar así: Calibración por expansión 1 2 3 4 5 6 7 8 Conectar el instrumento a la red de 110 voltios Encender el instrumento pulsando la tecla → 0/T← Permitir que el equipo permanezca encendido por lo menos 15 minutos Mantener pulsada la tecla → 0/T← hasta que aparezca en la pantalla la indicación CAL Soltar la tecla → 0/T← y visualizará unos instantes la indicación -C-, seguido del valor de la pesa de calibración, que deberá colocar sobre el platillo; en éste caso de 200 g. Nota: En este paso de calibración, no permita que la balanza vibre ó sea perturbada por corrientes de aire, lo cual resultaría en una incorrecta calibración Pulsar la tecla → 0/T← y visualizará por unos instantes la indicación –C-, y a continuación el valor de la pesada sobre el platillo. Retirar la pesa de calibración del platillo. La balanza estará en este momento calibrada y volverá automáticamente al modo de pesa. Proceda a hacer la medición de pesos. 11 Práctica: Reconocimiento del material de laboratorio. 8/19 MENSAJES DE ERROR MANTENIMIENTO: Limpiar el platillo de posibles derrames de material químico ó agresivo. Desarme las partes y proceda a hacer enjuagues con agua. SEGURIDAD: • • • • • Ubique el instrumento en un lugar libre de corrientes de aire, cambios bruscos de temperatura y vibraciones Cerciórese de que se conecta a la línea de 110 voltios No desplace por arrastre el instrumento de su sitio original de ubicación No tire objetos sobre el platillo desde alturas inadecuadas No sobrepase la pesada máxima de 210 g incluida la tara, ya que el instrumento se afectaría de manera irreversible. 1.9.1.2 BALANZA ANALÍTICA DEFINICIÓN: Instrumento de operación electrónica, utilizado para medir la masa de un cuerpo, con una precisión de 0,0001 g. Este instrumento tiene una capacidad de pesada de 200 g, incluida la tara. MATERIALES; INSUMOS Y REACTIVOS: 1. Pincel para limpieza INSTRUCCIONES DE OPERACIÓN: 1. Conectar el instrumento a la red de 110 voltios 2. Nivelar el equipo con la mesa, girando las patas de éste convenientemente, hasta que la mirilla quede perfectamente centrada en el círculo 3. Encender el instrumento pulsando hacia abajo la regleta de mando 4. Permitir que el equipo permanezca encendido por lo menos 15 minutos. 5. Calibrar el instrumento según se indica en el párrafo de abajo. 6. Una vez calibrado, proceder a efectuar las pesadas correspondientes 7. Apagar, desconectar de la red y proteger con su funda respectiva 8. Almacenar el instrumento en un lugar seguro CALIBRACION: Usted recibirá el equipo previamente calibrado antes de efectuar cualquier medición; por tanto, deberá cerciorarse de que está en condiciones apropiadas para ser usado, esto es, estar en perfecto estado de calibración, lo cual puede realizar así: Calibración por expansión: 1 2 3. 4. 5. Conectar el instrumento a la red de 110 voltios Encender el instrumento pulsando hacia abajo la regleta de mando Permitir que el equipo permanezca encendido por lo menos 15 minutos Mantener pulsada la regleta de mando por 3 segundos, hasta que aparezca en la pantalla la indicación CAL de manera titilante. Luego aparecerá la indicación 100 de manera parpadeante. Desplazar la palanca de la pesa hasta el fondo. Aparecerá en la pantalla la indicación 0 parpadeante. 12 Práctica: Reconocimiento del material de laboratorio. 9/19 6. Desplazar la palanca de la pesa hacia el frente del usuario. Aparecerá luego de unos segundos en la pantalla la indicación 0.0000, indicio de que el instrumento está calibrado Proceda a hacer la medición de pesos. 7. MANTENIMIENTO: Limpiar el platillo de posibles derrames de material químico ó agresivo. Desarme las partes y proceda a hacer enjuagues con agua. SEGURIDAD: • • • • • Ubique el instrumento en un lugar libre de corrientes de aire, cambios bruscos de temperatura y vibraciones Cerciórese de que se conecta a la línea de 110 voltios No desplace por arrastre el instrumento de su sitio original de ubicación No tire objetos sobre el platillo desde alturas inadecuadas No sobrepase la pesada máxima de 200 g incluida la tara, ya que el instrumento se afectaría de manera irreversible. 1.9.1.3 BALANZA SEMI-ANALÍTICA DEFINICION: Instrumento de operación electrónica, utilizado para medir la masa de un cuerpo, con una precisión de 0,0001 g. Este instrumento tiene una capacidad de pesada de 310 g, incluida la tara. MATERIALES; INSUMOS Y REACTIVOS: 1. Pincel para limpieza 2. Masa de calibración de 100 y 300 g, tolerancia ASTM clase 1 INSTRUCCIONES DE OPERACIÓN: 1. Conectar el instrumento a la red de 110 voltios 2. Nivelar el equipo con la mesa, girando las patas de éste convenientemente, hasta que la mirilla quede perfectamente centrada en el círculo 3. Encender el instrumento pulsando la tecla → 0/T← 4. Permitir que el equipo permanezca encendido por lo menos 15 minutos. 5. Calibrar el instrumento según se indica en el párrafo de abajo. 6. Una vez calibrado, proceder a efectuar las pesadas correspondientes 7. Apagar, desconectar de la red y proteger con su funda respectiva 8. Almacenar el instrumento en un lugar seguro CALIBRACION: Usted recibirá el equipo previamente calibrado antes de efectuar cualquier medición; por tanto, deberá cerciorarse de que está en condiciones apropiadas para ser usado, esto es, estar en perfecto estado de calibración, lo cual puede realizar así: Calibración por expansión: 1 2 3 4 Conectar el instrumento a la red de 110 voltios Encender el instrumento pulsando la tecla → 0/T← Permitir que el equipo permanezca encendido por lo menos 15 minutos Mantener pulsada la tecla → 0/T← hasta que aparezca en la pantalla la señal CAL 13 Soltar la tecla → 0/T← y visualizará unos instantes la indicación -C-, seguido del valor de la pesa de calibración, que deberá colocar sobre el platillo; en éste caso de 310 g. 5 Práctica: Reconocimiento del material de laboratorio. 10/19 Nota: En este paso de calibración, no permita que la balanza vibre ó sea perturbada por corrientes de aire, lo cual resultaría en una incorrecta calibración 6 Pulsar la tecla → 0/T← y visualizará por unos instantes la indicación –C-, y a continuación el valor de la pesada sobre el platillo. 7 Retirar la pesa de calibración del platillo. La balanza estará en este momento calibrada y volverá automáticamente al modo de pesa. 8 Proceda a hacer la medición de pesos. MANTENIMIENTO: Limpiar el platillo de posibles derrames de material químico ó agresivo. Desarme las partes y proceda a hacer enjuagues con agua. SEGURIDAD: • • • • • Ubique el instrumento en un lugar libre de corrientes de aire, cambios bruscos de temperatura y vibraciones Cerciórese de que se conecta a la línea de 110 voltios No desplace por arrastre el instrumento de su sitio original de ubicación No tire objetos sobre el platillo desde alturas inadecuadas No sobrepase la pesada máxima de 210 g incluida la tara, ya que el instrumento se afectaría de manera irreversible. 1.9.1.4 BALANZA TÉCNICA DEFINICIÓN: Instrumento de operación electrónica, utilizado para medir la masa de un cuerpo, con una precisión de 0,0001 g. Este instrumento tiene una capacidad de pesada de 600 g, incluida la tara. MATERIALES; INSUMOS Y REACTIVOS: 1. Pincel para limpieza 2. Masa de calibración de 300 g. INSTRUCCIONES DE OPERACIÓN: 1. Conectar el instrumento a la red de 110 voltios, ó inserte una batería de 9 voltios por la base del instrumento 2. Encender el instrumento pulsando la tecla Zero On 3. Permitir que el equipo permanezca encendido por lo menos 15 minutos. 4. Calibrar el instrumento según se indica en el párrafo de abajo. 5. Seleccionar las unidades de pesada, pulsando la tecla Mode Off momentáneamente 6. Apagar presionando la tecla Mode Off, desconectar de la red y proteger con su funda respectiva 7. Almacenar el instrumento en un lugar seguro CALIBRACIÓN Usted recibirá el equipo previamente calibrado antes de efectuar cualquier medición; por tanto, deberá cerciorarse de que está en condiciones apropiadas para ser usado, esto es, estar en perfecto estado de calibración, lo cual puede realizar así: Calibración por expansión: 14 1 2 Conectar el instrumento a la red de 110 voltios Encender el instrumento pulsando la tecla Zero On 3 4 5 Permitir que el equipo permanezca encendido por lo menos 15 minutos Mantener pulsada la tecla Zero On hasta que aparezca en la pantalla la indicación CAL Soltar la tecla Zero On y visualizará unos instantes la indicación -C-, seguido del valor de la pesa de calibración, que deberá colocar sobre el platillo; en éste caso de 300 g. Nota: En este paso de calibración, no permita que la balanza vibre ó sea perturbada por corrientes de aire, lo cual resultaría en una incorrecta calibración Pulsar la tecla Zero On momentáneamente y visualizará por unos instantes el valor de 300 en la pantalla con el indicador de estabilidad. Nota: Si aparece la indicación en pantalla Err1 ó Err4, se debe realizar la calibración por linealidad. Retirar la pesa de calibración del platillo. La balanza estará en este momento calibrada Proceda a hacer la medición de pesos. Práctica: Reconocimiento del material de laboratorio. 11/19 6 7 8 MANTENIMIENTO: Limpiar el platillo de posibles derrames de material químico ó agresivo. Desarme las partes y proceda a hacer enjuagues con agua. SEGURIDAD: • • • • • Ubique el instrumento en un lugar libre de corrientes de aire, cambios bruscos de temperatura y vibraciones Cerciórese de que se conecta a la línea de 110 voltios No desplace por arrastre el instrumento de su sitio original de ubicación No tire objetos sobre el platillo desde alturas inadecuadas No sobrepase la pesada máxima de 310 g incluida la tara, ya que el instrumento se afectaría de manera irreversible. 1.9.1.5 BALANZA MECÁNICA DEFINICIÓN: Instrumento de operación mecánica, utilizado para medir la masa de un cuerpo, con una precisión de 0,1 g. Este instrumento tiene una capacidad de pesada de 610 g, incluida la tara. MATERIALES, INSUMOS Y REACTIVOS: 1. Juego de pesas para ampliación de pesada compuesta por las siguientes masas: 500 g de valor aparente (147.5 g de valor nominal) y 1.000 g de valor aparente (295.0 g de valor nominal). 2. Porta-muestras de pesada INSTRUCCIONES DE OPERACIÓN: 1. Instalar el instrumento sobre una superficie estable 2. Colocar las barras de pesada en la posición cero de cada una de las tres regletas numeradas del brazo móvil 3. Si el brazo móvil de la balanza no marca cero, la balanza requiere ser calibrada. Para ello, proceda a calibrar como se indica en el párrafo de abajo. 4. Colocar el porta-muestra de pesada sobre el platillo. Comenzar a equilibrar el peso del porta-muestra, desplazando las barras en sus respectivas regletas empezando la búsqueda de menor a mayor valor 5. Hacer coincidir la indicación del brazo móvil con la indicación del brazo estático 6. Leer el peso generado sumando los valores que aporta CADA BARRA EN SU RESPECTIVA REGLETA. Este valor corresponde al peso del porta-muestra. Anotarlo. 15 7. Sumarle al peso del porta-muestra el peso que se desea determinar y colocar las barras en ésta lectura Práctica: Reconocimiento del material de laboratorio. 12/19 Nota: Suspender las pesas de extensión del gancho del brazo móvil si el peso buscado es mayor de 610 g. 8. Adicionar sobre el porta-muestra el material que se desea pesar hasta que la barra móvil coincida con la marca del brazo estático 9. La cantidad de material vertida sobre el porta-muestra corresponde a la masa deseada. SEGURIDAD • • Coloque la balanza en un lugar libre de corrientes de aire No oriente la balanza de manera vertical sin haber colocado las barras en sus respectivos ceros. 1.10 Mechero: Es una de las fuentes de calor más utilizadas en el laboratorio y existen dos tipos: el mechero Bunsen y el mechero Fischer. Se alcanza con este último temperaturas mayores que con el primero, ambos son fáciles de manejar y emplean como combustible gas, el cual entra al mechero por la parte inferior lateral y su entrada se regula por medio de una llave que está en uno de los tomas de la tubería principal: en la parte inferior del mechero existen unas ventanillas que pueden cerrarse o abrirse para permitir la entrada de menor o mayor cantidad de aire. Cuando no hay suficiente cantidad de aire (oxígeno), la combustión es incompleta y la llama será amarilla. Debido a la presencia de partículas de carbono en incandescencia. CH4(g) + O2(g) C(g) + 2 H2O(g) A medida que se aumenta la cantidad de aire, desaparece la cantidad de partículas de carbono que son reemplazadas por el monóxido de carbono. CH4(g) + 3/2 O2(g) CO(g) + 2 H2O(g) Cuando hay un exceso de aire, los hidrocarburos gaseosos que forman el combustible, se queman completamente formando dióxido de carbono y agua, la llama será de color azul, de poca luminosidad y muy caliente. CH4(g) + 2 O2(g) CO2(g) + 2 H2O(g) Al usar el mechero por lo general, también se emplean: Un trípode de metal como base para colocar recipientes no volumétricos, con líquidos para calentar. En la figura 1.4 se ilustran las diferentes zonas de la llama. 16 Práctica: Reconocimiento del material de laboratorio. 13/19 ZONA OXIDANTE Poco luminosa, muy caliente. ZONA REDUCTORA Brillante ZONA OSCURA Temperatura baja ZONA AZUL 1540º 1550º 1580º 1540º ZONA REDUCTORA 1570º 520º 1450º 350º 300º Figura 1.4. Estudio de la llama 1.11 Conductímetro: Definición: Equipo que sirve para medir la conductividad de una disolución, es decir, el grado de disociación de una sustancia en disolución acuosa. También sirve para medir el total de sólidos disueltos en una muestra. Por ser un equipo portátil, completo y muy preciso, es fácil de usar incluso en mediciones de campo. (Figura 1.5.) MATERIALES, INSUMOS, EQUIPOS Y REACTIVOS 1. 2. 3. 4. 5. 6. Conductímetro Electrodo modelo HI 76301W para medir conductividad, con su respectivo conector Batería alcalina de 9 voltios Patrón de conductividad de 12.88 mS/cm (0.1 M) Recipiente plástico para efectuar la medida Termómetro 17 Práctica: Reconocimiento del material de laboratorio. 14/19 Figura 1.5. Conductímetro CONDICIONES DE OPERACIÓN 1. 2. Conectar la celda de conductividad en la parte posterior del equipo. Calibración 1. Colocar suficiente cantidad de solución de conductividad para calibración (0.1 M) en un recipiente plástico 2. Introducir la celda de conductividad, asegurándose de que quede completamente sumergida (que cubra el orificio que trae la celda) en la solución. 3. Medir la temperatura de la solución con un termómetro confiable. 4. Rotar la celda en el fondo para asegurarse de que no queden burbuja de aire atrapadas en la manga de la celda. 5. Girar el botón de temperatura a 20 °C 6. Rotar el botón para seleccionar el rango 0-19.990 mS/cm 7. Girar el botón K% de calibración, hasta que el equipo muestre un valor de conductividad de 11.67 mS/cm a 20 °C. 8. La calibración estará completa y el instrumento estará listo para leer. 9. Las mediciones siguientes deben ser compensadas a 20 °C, ya que la conductividad de una solución depende de la temperatura y por esta razón, las medidas para calibrarlo son llevadas con referencia a un estándar de temperatura a 20 °C. Si la solución medida tiene una temperatura diferente de 20°C hay que hacerle una compensación para ser medida. En éste equipo, la compensación de temperatura se hace manualmente con el botón del lado izquierdo que indica °C. 18 Práctica: Reconocimiento del material de laboratorio. 15/19 El valor de TDS en solución acuosa es directamente proporcional a la conductividad; así, 1µS/cm es igual a 0.5 mg/L (ppm) de TDS. Para la calibración de TDS a 20 °C, el valor del patrón es 1251 mg/L. MANTENIMIENTO: • • • • Celda Enjuague la celda con agua del gripo después de cada medida. Si se requiere una limpieza completa, remueva la manga de PVC y limpie la celda con un detergente de ropa ó un detergente no abrasivo. Cuando reinserte la manga sobre la celda, esté seguro de que la manga esté en la dirección correcta, con los cuatro huecos hacia el fin del cable. Después de limpiar la celda, recalibre el instrumento. SEGURIDAD: • El cuerpo de la celda es en PVC, por esta razón nunca debe llegar a estar en contacto cerrado con una fuente de calor. Si la celda está expuesta a altas temperaturas (por encima de 50 °C/122 °F), el poder de los anillos llega a ser flojo, resultando en un serio deterioro de la celda. En estos casos, la celda tiene que ser reemplazada. 1.12 DESECADOR DEFINICIÓN: Recipiente de vidrio en forma de campana con tapa hermética, que se usa para absorber la humedad. En su interior contiene productos que absorben la humedad, como por ejemplo, la sílica gel. También se puede utilizar para enfriar productos que han estado expuestos a altas temperaturas. (Figura 1.6.) Figura 1.6. Desecador 19 Práctica: Reconocimiento del material de laboratorio. 16/19 MATERIALES; INSUMOS Y REACTIVOS: 1 2 3 4 5 Mesón para apoyar Sistema de vacío (opcional) Sustancia con alto grado de hidratación Platina sostenedora de recipiente con la muestra Pinza sostenedora de recipiente INSTRUCCIONES DE OPERACIÓN: 1 Sostener el recipiente fuertemente, poniendo el brazo a su alrededor Nota: Si se le ha hecho vacío abrir la llave Con la otra mano, tomar la tapa, deslizarla y correrla con precaución Nota: No levantar la tapa, pues esta es hermética y puede romper el recipiente Cerciorarse de que la tapa esté impregnada de vaselina para facilitar su manejo Ubicar la tapa en un sitio seguro, mientras coloca la muestra adentro Una vez colocada la muestra, colocar la tapa deslizándola y tapar inmediatamente Conectar el vacío si se va a utilizar 2 3 4 5 6 MANTENIMIENTO: • • • Mantenga el borde del desecador y la tapa impregnados de vaselina Mantenga la sílica con indicador de humedad (debe estar de color azul) Para la limpieza, utilice un paño suave humedecido de agua con detergente; seque muy bien antes de usar. 2. OBJETIVOS 2.1 Formar hábitos en el desempeño en un laboratorio, respetar las normas de seguridad consignadas en el reglamento de laboratorio de química y los criterios de limpieza y rigurosidad para llevar adelante un experimento. 2.2 Reconocer el uso específico y nombre de los materiales más utilizados en las prácticas de laboratorio. 2.3 Adquirir conocimientos y práctica en las técnicas básicas de laboratorio: medición de volúmenes, métodos de pesada, preparación de soluciones, filtración, decantación, etc. 2.4 Aprender el manejo y cuidado del mechero y la balanza analítica. 3. CONSULTAS PRELIMINARES 3.1 Investigue lo que es precisión y exactitud. 3.2 ¿Cuál es la diferencia entre el material graduado y el material volumétrico?. 3.3 Consulte qué es una propipeta, cómo funciona y haga un dibujo de ella. 3.4 Consulte para qué se emplean los materiales de porcelana refractarios. 3.5 Consultar los símbolos de peligrosidad de los reactivos y su significado 20 Práctica: Reconocimiento del material de laboratorio. 17/19 4. MATERIALES MATERIALES Balón Aforado de 25, 50, 100 mL Vasos de precipitados de 25, 50 y 100 mL Erlenmeyer de 25, 50 y 100 mL Pipeta aforada de 5,10, 25 mL Pipeta graduada de 5 y 10 mL Probeta de 100 mL Pro-pipeta Vidrio de reloj pequeño Espátula Varilla de Vidrio CANTIDAD 1 1 1 1 1 1 1 1 1 1 Picnómetro de 25 mL Frasco lavador Crisol con tapa Balón aforado de 100 mL Termómetro Mortero con mazo Tubos de ensayo con gradilla 1 1 1 2 1 1 2 5. REACTIVOS REACTIVOS CANTIDAD Agua Cloruro de sodio (NaCl) 0.1 g *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad. (Apéndice) 6. EQUIPOS EQUIPOS Balanza Analítica. Semianalítica, de Brazo, gramera CANTIDAD 1 Mechero 1 Pinza con nuez 1 Trípode con rejilla 1 Pinza para tubo de ensayo 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO: 7.1 RECONOCIMIENTO DE MATERIAL Según las consideraciones teóricas presentadas previamente, realizar una clasificación del material dispuesto en su mesa de trabajo. Esta clasificación debe contener la siguiente información: 7.1.1 Nombre y dibujo del material 7.1.2 Grupo de clasificación 7.1.3 Uso en el laboratorio 7.2 MANEJO DE MATERIAL VOLUMETRICO 21 7.2.1 Medición de volúmenes con pipeta Práctica: Reconocimiento del material de laboratorio. 18/19 7.2.1.1 Medir con una pipeta graduada 10 mL de agua y trasvasarla a un vaso de precipitados de 25 mL. 7.2.1.2 Medir 10 mL de agua destilada con una pipeta aforada de 10 mL y trasvasarla a un vaso de precipitados de 25 mL. 7.2.1.3 Analice que diferencia que encuentre entre las dos medidas y en qué caso se aplicarían cada una de las dos pipetas 7.2.2 Medición de volúmenes con probeta y balón aforado 7.2.2.1 Medir con una probeta 100 mL de agua destilada y trasvasarla a un balón aforado de 100 mL. 7.2.2.2 Llenar con agua destilada un balón aforado de 100 mL, alcanzando el aforo cuidadosamente. 7.2.2.3 Analice que diferencia encuentra entre las dos medidas y en que caso se utilizarían cada uno de estos materiales. 7.3 USO DE LA BALANZA 7.3.1 Tomar un vaso de precipitados de 50 mL y pesarlo en cada una de las balanzas presentes en la práctica. 7.3.2 Agregar al vaso previamente pesado una cantidad de cloruro de sodio (indicada por su profesor) y pesar nuevamente en las balanzas mencionadas. 7.3.3 ¿Que diferencia existe entre las valores de las pesadas? 7.4 USO DEL MECHERO 7.4.1 Conectar el mechero (ver figura) a la línea de gas del laboratorio mediante una manguera (verifique que los extremos del mismo no estén rajados, pues eso provocaría escape de gas) (Figura 1.7). Figura 1.7. Esquema de un mechero 7.4.2 Cerrar la entrada de aire del mechero, abrir la llave de gas y acercar lateralmente, el encendedor a la boca del mechero hasta que encienda. 7.4.3 Observe la llama. Probablemente será amarilla e inestable. Abra entonces gradualmente la entrada de aire para permitir que el oxígeno se mezcle con el gas de antes de la combustión. 22 7.4.4 Una adecuada proporción de gas y oxígeno dará una llama azul no muy grande pero que será eficiente para trabajar. 7.5.5 El mechero se apaga al cerrar la llave de gas. Práctica: Reconocimiento del material de laboratorio. 19/19 PRECAUCIÒN: NO ABRIR BRUSCAMENTE LA LLAVE DE GAS PORQUE PUEDE APAGARSE EL MECHERO 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS Consigne en su cuaderno de laboratorio todas las observaciones realizadas en ésta práctica. 9. PREGUNTAS 9.1 Clasifique el material de vidrio observado en esta práctica en material volumétrico y no volumétrico. 9.2 Dibuje el material visto en esta práctica y describa sus respectivos usos. 9.3 Investigue sobre el sistema internacional de medidas S.I. y diga cuáles son las medidas básicas derivadas y complementarias 9.4 Consulte los puntos de fusión y ebullición del cloruro de sodio 10. RECUPERACIÓN, DESACTIVACIÓN Y/ Ó ALMACENAMIENTO DE RESIDUOS 10.1 RECUPERACIÓN No aplica. 10.2 DESACTIVACIÓN No aplica 10.3 ALMACENAMIENTO TEMPORAL No aplica BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D. ; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. 23 CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005. 1/8 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA UNIVERSIDAD DEL CAUCA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General Práctica: TRATAMIENTO DE DATOS Guía No: 02 Páginas: 20 a 27 1. INTRODUCCIÓN En el laboratorio se obtienen una serie de datos experimentales a los cuales es necesario practicarles un análisis y una interpretación adecuada para sacar verdaderas conclusiones. Para ello es necesario hacer un tratamiento muy riguroso que implique obtener la desviación estándar, el porcentaje de desviación, descartar datos que no sean correctos o que se alejen del común de los demás, Es necesario además evaluar el error experimental para saber si una práctica tiene o no validez. Ese error se puede atribuir al instrumento, a la práctica en sí o puede ser inherente a la persona que realiza el trabajo experimental. En esta práctica se trata de hacer un tratamiento de los datos obtenidos después de una serie de medidas, con el objeto de adquirir los conocimientos necesarios para todos los trabajos experimentales que se hagan de aquí en adelante. BASES TEÓRICAS 1.1 La medida El proceso para medir consiste en evaluar una característica por comparación con una magnitud de la misma especie que se toma como unidad. Esta comparación se hace por medio de un instrumento calibrado a partir del patrón unitario respectivo. El resultado de la medida es un número aproximado que indica cuántas veces cabe el patrón tomado como unidad en el parámetro que se mide. Por ejemplo, si se toma como unidad el kilogramo y se determina la medida de la masa del cuerpo en 45.2 Kg significa que ese cuerpo tiene una masa 45,2 veces mayor que la del kilogramo patrón que sirve como unidad de masa. Las medidas pueden tener diferentes aproximaciones de acuerdo con la graduación del instrumento empleado para determinarlas. Así, en una medida de longitud si el instrumento está graduado en metros, en decímetros, en centímetros, la medida de longitud tendrá diferentes grados de aproximación. 1.2. Cálculo de error 1.2.1. Cifras significativas Son aquellas sobre las cuales se tiene certeza absoluta y la primera que presenta alguna incertidumbre. Por ejemplo, si el peso molecular del bióxido de carbono se expresa como 44.0 (tres cifras significativas), indica que este peso puede estar entre 43.95 y 44.05. Pero si el resultado se da 44 (dos cifras significativas), se puede considerar que su valor está entre 43.5 y 44.5 y que se aproximó por exceso ó por defecto a 44. Elaborado por: Revisado Por: Aprobada por: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Fecha de Aprobación: Rector Danilo Reinaldo Vivas R. 24 Práctica: Tratamiento de datos. 2/8 Si la última cifra es mayor que 5 y se requiere una aproximación, se hace hacia el dígito mayor que le sigue; si es menor que 5 hacia el menor y si es igual a 5 se debe buscar el número par. Ejemplo: 22.37 se aproxima a 22.4 22.34 se aproxima a 22.3 22.35 ó 22.45 (último dígito par) se aproxima a 22.4 Los ceros que preceden a un número natural en una fracción no son cifras significativas. Por ejemplo el número 0.00028 solo tiene dos cifras significativas y es conveniente expresarlo en -4 notación exponencial como 2.8 x 10 . Al establecer el resultado de una operación aritmética entre magnitudes cuya medida se hace con alguna incertidumbre, se debe informar con el número de cifras significativas del operando que presente el menor número de ellas. Ejemplo: 3 Si se desea calcular la densidad a partir de una masa de 23.0 g y un volumen de 15.87 cm , se debe reportar la densidad con sólo tres cifras significativas, aunque el valor del volumen tenga cuatro. 1.2.2. Error Es la medida de la diferencia existente entre el valor observado, X', y el valor verdadero, X. Si el error es pequeño comparado con la magnitud de la cantidad medida, se dice que la medida es exacta. Esto implica conocer el verdadero valor. Si diferentes medidas del mismo parámetro no se desvían en forma apreciable de un valor promedio, aunque no sea el verdadero, se dice que cada medida es precisa por ejemplo, si el verdadero valor del volumen molar de un gas en condiciones normales es 22.4 litros y una serie repetida de experiencias produce los resultados 22.3; 25.1; 25.0 y; 25.2 litros, el primer valor es más exacto pero los últimos tres son más precisos puesto que presentan menos desviación con respecto al promedio 24.4 litros. El valor del error se puede presentar como absoluto o relativo. En la realización práctica los errores se pueden dividir en experimentales e instrumentales. 1.2.3. Error absoluto Se presenta por ∆ y se define como la diferencia, en términos matemáticos absoluto, entre el valor experimental: X' y el valor verdadero (teórico): X de una medida. ∆ = X' – X (2.1) 1.2.4. Error relativo Se expresa con la relación entre error absoluto y el verdadero valor y se presenta con la letra δ δ= ∆ X '− X = X X (2.2) 25 Práctica: Tratamiento de datos. 3/8 El error relativo se suele expresar en términos de porcentaje de error % error = 100 δ (2.3) En el trabajo de laboratorio con instrumentos de uso común (probetas, buretas, balanzas mecánicas) como criterio general el error relativo no debe exceder del 5%. 1.2.5. Error experimental Inherente a la persona que realiza la experiencia. Por ejemplo, no se aprecia el cambio de color en una titulación, deficiente mezcla de reactivos, etc. 1.2.6. Error instrumental Proviene de las limitaciones de los instrumentos de medida. En instrumentos que poseen graduaciones se considera en general como máximo error instrumental (error absoluto) la mitad de la división más pequeña en el aparato. Por ejemplo, en una probeta graduada en mililitros el error absoluto instrumental es 0.5 mL. Si la medida obtenida es X' y la división más pequeña es e se acostumbra expresar la medida así: X ±- ∈ 2 (2.4) Sin embargo, esto depende del tamaño de la graduación. En algunos instrumentos el error está certificado por el fabricante, es el caso de las pipetas aforadas: ejemplo, las de 10 mL, en ellas se certifica que el máximo error posible es de ±0.038 mL, a 25 ºC. En este caso, la medida se expresa como 10.00 mL con cuatro cifras significativas, en las cuales las tres primeras son ciertas y en la última hay incertidumbre. Se pueden leer resultados con diferentes grados de aproximación. En el termómetro I( Figura 1) la medida de temperatura se puede dar con tres cifras significativas: Existe la certidumbre que está entre 21 ºC y 22 ºC, podría ser 21.5 ºC. En el termómetro II la lectura se halla entre 21.2 ºC y 21.3 ºC. Reportada con cuatro cifras significativas podría ser 21.25 ºC. En el termómetro III la lectura se ubica entre 21.52 ºC y 21.53 ºC, se podría reportar con cinco cifras significativas (la última aproximada por apreciación) como 21.525 ºC. De los termómetros de la figura 2.1, es evidente entonces que el termómetro que presenta el máximo error absoluto es el I. 26 Figura 2.1. Termómetros Práctica: Tratamiento de datos. 4/8 1.3. Métodos estadísticos Cuando se realiza una medida con una serie repetida de ocasiones es conveniente efectuar un tratamiento estadístico de los datos obtenidos, con el fin de juzgar su confiabilidad y reiteración (reproducibilidad o repetitividad). Es así, como en estadística se utilizan cálculos relativos a medidas de tendencia central o promedios (aritmético, geométrico, armónico, modo, mediana) y a desviaciones (variante, desviación típica o estándar). Por ser los de mayor utilidad, en este trabajo vamos a tratar el promedio aritmético y la desviación típica (estándar). X 1.3.1. Promedio Aritmético, Se define como la relación obtenida entre la suma de los diferentes valores y el número de ellos. X = ∑fx i i (2.5) n donde fi representa la frecuencia con la cual se repite cada valor xi 1.3.2. Desviación típica, s Es una medida del grado de dispersión de la serie de datos con respecto a un valor central (promedio aritmético). Se expresa como: s= ∑ f (X i i − X )2 n −1 (2.6) Como ejemplo de aplicación, calculemos el promedio aritmético y la desviación típica de la siguiente serie de medidas del peso molecular del amoníaco (g/mol), obtenidas en diferentes experiencias Xi 15.00 16.00 17.00 18.00 19.00 fi 3 2 6 5 4 Calculemos el promedio aritmético: Xi 15.00 16.00 17.00 18.00 19.00 fi 3 2 6 5 4 fi X i 45.00 32.00 102.00 90.00 76.00 27 ∑fX De aquí i Práctica: Tratamiento de datos. 5/8 i = 345.00 n = ∑ f i = 20 X = 345,00 = 17,250 g mol 20 Calculemos a partir de la siguiente tabla la desviación típica: Xi fi (X i − X ) 15.00 16.00 17.00 18.00 19.00 3 2 6 5 4 -2.25 -1.25 -0.25 0.75 1.75 De aquí: ∑ f (X i i (X i − X )2 5.0625 1.5625 0.0625 0.5625 3.0625 fi ( X i − X )2 15.1875 3.125 0.375 2.8125 12.25 − X ) 2 = 33.75 n − 1 = 20 − 1 = 19 s= 33.75 = 1.33 g mol 19 Con el fin de mostrar con mayor claridad la desviación típica de los resultados obtenidos con respecto al promedio, se suele calcular el llamado porcentaje de desviación representado por: %desviaciön = s × 100 X (2.7) Para nuestro ejemplo, el porcentaje de desviación de la serie es: %desviaciön = 1.33 × 100 17,25 Este porcentaje de desviación sirve como criterio para rechazar o acoger datos. Otro criterio que suele emplearse para evitar que el promedio sea afectado por valores extremos o muy alejados, es rechazar los datos que se hallen fuera del intervalo. 28 Práctica: Tratamiento de datos. 6/8 X ± 2s ′ (2.8) Donde s′ representa el error típico (estándar) de la serie y se define como: s′ = s n −1 (2.9) Siendo s la desviación típica y n el número de datos Sin embargo, los criterios para rechazar o aceptar datos dependen del grado de aproximación de los instrumentos de medida y de la viabilidad de la propiedad que se mide. 2. OBJETIVOS 2.1. Establecer el significado y alcances de las medidas y los diferentes tipos de error posibles en su determinación experimental. 2.2. Estudiar los parámetros estadísticos: promedio aritmético y desviación típica (estándar) y fijar su significado. 3. CONSULTAS PRELIMINARES 3.1. Mencionar las diferencias entre propiedades intensivas y extensivas de la materia 3.2. Cuales de las siguientes propiedades son extensivas y cuales intensivas ?. Explicar por qué. a) temperatura b) color del cobre c) volumen d) densidad e) punto de fusión del hielo f) masa 3.3. Realizar las operaciones indicadas y redondear el resultado a un número apropiado de cifras significativas. a) 1.85 + 12.33 b) 1.234 x 0.247 c) 8.74÷4.3 d) 8.649 – 2.8964 e) 0.6347 x 0.0308 f) 4567÷2.53 3.4. Realizar las operaciones indicadas y redondear el resultado a un número correcto de cifras significativas. Expresar el resultado en notación exponencial 2 2 -3 b) (4.56 + 8.7) ÷ (1.23 x 10 ) a) (1.54 x 10 ) + (2.11 x 10 ) -2 -3 -2 d) (1.54 x 10 ) + (2.11 x 10 ) c) (1.23 x 10 ) ÷ (4.56 + 18.7) 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica 4. MATERIALES MATERIAL Probeta de 25mL Picnómetro de 25 mL Vaso de 50mL Frasco Lavador de 500 mL CANTIDAD 1 1 1 1 29 Práctica: Tratamiento de datos. 7/8 5. REACTIVOS SUSTANCIAS Agua destilada (H2O) Zinc metálico (Zn) R10-15 S 7/8-43 CANTIDAD 2 barras 30g *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice) 6. EQUIPOS MATERIAL CANTIDAD Balanza Analítica 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO 7.1. Determinación experimental de la densidad del agua destilada 7.1.1. Cada integrante de cada grupo pesa el picnómetro de 25 mL perfectamente limpio y seco en una balanza analítica y escribe los resultados en el tablero. 7.1.2. Cada integrante de cada grupo llena el picnómetro previamente pesado con agua destilada a la cual previamente se le ha medido su temperatura, pesan nuevamente y escribe los resultados en el tablero. 7.2. Determinación de la densidad de un sólido: 7.2.1. Cada integrante de cada grupo coloca 15 mL de agua destilada en una probeta de 25 mL 7.2.2. Cada integrante de cada grupo toma dos barras de Zinc (aproximadamente 30 g) y las pesa en la balanza analítica. 7.2.3. Transferir esta masa de Zn pesado a la probeta que contiene los 15 mL de agua destilada. Asegurarse de que no queden burbujas de aire en la probeta. 7.2.4. Anotar el nuevo volumen. Este volumen corresponde al del Zn más el del agua destilada. Por diferencia se obtiene el volumen del Zn. Escribir los resultados en el tablero. 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 8.1. Todos los estudiantes deben copiar los datos de todos los compañeros y hacer los siguientes cálculos con todos los datos. 8.2. Calcular la densidad del agua en cada experimento con el número adecuado de cifras significativas. 8.3. Calcular la densidad del Zn en cada experimento con el número adecuado de cifras significativas. 9. PREGUNTAS 9.1. Hacer el tratamiento estadístico correspondiente a los resultados anteriores, consistente en la determinación del promedio aritmético, la desviación típica, el % de desviación, el intervalo X ± 2 s ′ , rechazar los datos que se hallen fuera del intervalo. 30 9.2. Calcular el error absoluto, error relativo, error instrumental y el porcentaje de error, con los resultados obtenidos y con los resultados de las densidades del agua destilada y del Zn obtenidos de la revisión de literatura para la temperatura determinada en el experimento Práctica: Tratamiento de datos. 8/8 10. DISPOSICIÓN, ALMACENAMIENTO Y/O DESACTIVACIÓN DE RESIDUOS QUÍMICOS 10.1 RECUPERACIÓN El Zn metálico será entregado nuevamente al encargado del almacenamiento de reactivos, para prácticas posteriores de laboratorio 10.2 DESACTIVACIÓN No aplica 10.3 ALMACENAMIENTO TEMPORAL No aplica. BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D. ; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 31 1/4 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA UNIVERSIDAD DEL CAUCA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General Práctica: CAMBIOS FÍSICOS Y CAMBIOS QUÍMICOS Guía No: 03 Páginas: 28 a 31 1. INTRODUCCIÓN Una sustancia es cualquier variedad de materia de composición y carácter definidos y reconocibles. La composición de una sustancia es la combinación de sustancias constitutivas. Algunas sustancias tienen composiciones fijas que están asociadas con sus propiedades, se dice que son sustancias puras. Por ejemplo, el óxido de herrumbre rojo se puede obtener en forma de una sustancia pura constituida por 69.94% de Fe y 30.06% de O2. Las composiciones constantes de las sustancias puras se mantienen por medio de uniones entre las unidades elementales de materia, a estas uniones se les llama enlaces químicos. Cualquier transformación que implique un cambio en la composición definida se considera que va acompañada de la formación y rompimiento de los enlaces químicos y se denomina cambio químico ó reacción química. Ejemplo: la combustión, la corrosión, la fotosíntesis, la digestión, etc. Un cambio físico de una sustancia no implica variaciones en el carácter o la composición definida. Las alteraciones en las dimensiones de los objetos ó en los estados de agregación de sus constituyentes son cambios físicos. Ejemplo: fracturas, deformaciones, pulverización, ebullición, etc. 2. OBJETIVOS 2.1 Identificar las diferencias que existen entre cambios físicos y cambios químicos. 2.2 Determinar las características de algunas sustancias antes y después de experimentar los cambios respectivos. 3. CONSULTAS PRELIMINARES 3.1 ¿En qué estados se presenta la materia y cuáles son sus diferencias en cuanto a forma y volumen? 3.2 ¿Qué se entiende por sublimación y sublimación regresiva? 3.3 ¿Qué se entiende por reacción química? Cómo se podría observar una reacción química? 3.4. ¿Qué se entiende por licuefacción, ebullición, solidificación y condensación? 32 Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Cambios físicos y cambios químicos. 2/4 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica 4. MATERIALES MATERIAL Cápsula de porcelana Vasos de precipitados de 100 mL Tubos de ensayo Tubo de ensayo con desprendimiento lateral tapón y manguera Pinza de madera Gradilla Pipeta graduada de 5mL Propipeta o o Termómetro 0 C –100 C Espátula CANTIDAD 1 2 4 2 1 1 1 1 1 1 5. REACTIVOS SUSTANCIAS Yodo (I2) R 20/21 S 23-25 Solución Permanganato de potasio (KMnO4) (0.01N) R 8-22 S2 Solución de Peróxido de hidrógeno (H2O2) (40 %v/v) R 34 S 28-39 Agua de Cal (0.05% p/v) (Ca(OH)2 Parafina sólida Etanol (C2H5OH) R 11 S 7-16 Zinc granallas (Zn) R10-15 S 7/8-43 Ácido clorhídrico 37 % p/p (HCl) R 34/37 S 2-26 Acido sulfúrico (H2SO4) R35 S2-26-30 Hielo trozos (H2O) Palillos de madera CANTIDAD 0.2 g 1 mL 1 mL 2 mL 0.2 g 30 mL 0.5 g 1 mL 0.5 mL 4 *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). 6. EQUIPOS EQUIPO Plancha de calentamiento Cucharilla Mechero CANTIDAD 1 1 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 33 Práctica: Cambios físicos y cambios químicos. 3/4 7. PROCEDIMIENTO 7.1 Cambios Físicos: 7.1.1 Colocar en un vaso de precipitados aproximadamente 0.1 g de cristales de yodo; tapar el vaso con una cápsula de porcelana que contenga trozos de hielo. Calentar suavemente. Observar los cambios y anotar sus resultados. 7.1.2 En una cucharilla colocar un pequeño trozo (0.5 X 0.5 cm) de una vela de parafina, aproximadamente 0.2 g. Calentar suavemente con el mechero. Observar los cambios y anotar sus resultados. 7.1.3 Llenar un vaso de precipitados hasta las ¾ partes con agua. En un tubo de ensayo verter 3 mL de etanol y unas perlas de ebullición e introducir dentro del vaso de precipitados. Calentar suavemente tomando temperaturas del agua y el alcohol cada 30 segundos, hasta que haya ebullición en alguno de ellos. Observar los cambios y anotar sus resultados. 7.2 Cambios Químicos 7.2.1 Conectar dos tubos de ensayo con desprendimiento lateral por medio de una manguera. Verter en uno de ellos 1 mL de solución de ácido clorhídrico concentrado. En el mismo tubo agregar una granalla de zinc (aproximadamente 0.5 g) y tapar el tubo inmediatamente. Recoger el gas desprendido en el otro tubo, el cual se tapa con el dedo pulgar y después de un minuto se acerca a la llama de un mechero retirando el dedo. Observar los cambios y anotar sus resultados. 7.2.2 En un tubo de ensayo verter 2 mL de agua de cal, introducir una pipeta dentro del líquido y burbujear el aire exhalado durante un minuto. Observar los cambios y anotar sus resultados. 7.2.3 En un tubo de ensayo colocar 1 mL de solución de permanganato de potasio, agregar 1 mL de peróxido de hidrógeno y 0.5 mL de ácido sulfúrico. Introducir inmediatamente dentro de un tubo, pero sin tocar el líquido una astilla de madera en punto de ignición. Observar los cambios y anotar sus resultados 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 8.1 Clasificar los cambios observados en los experimento anteriores en físicos o químicos, según sea el caso y dar explicaciones para dicha clasificación. 9. PREGUNTAS 9.1 Escribir las fórmulas de todas las sustancias químicas empleadas. 9.2 En los casos en que hay reacciones químicas, plantear las ecuaciones químicas correspondientes. 10 DISPOSICIÓN, ALMACENAMIENTO Y/O DESACTIVACIÓN DE RESIDUOS QUÍMICOS 34 10.1 RECUPERACIÓN 10.1.1 Los restos de yodo y parafina de las secciones 7.1.1 y 7.1.2 se depositarán en los frascos de los reactivos de los cuales se tomaron. Práctica: Cambios físicos y cambios químicos. 4/4 10.2 DESACTIVACIÓN 10.2.1 Los residuos de la sección 7.1.3 se depositarán en el recipiente de residuos etanólicos 10.2.2 Los residuos de las secciones 7.2.1, 7.2.2 y 7.2.3 se depositarán en el recipiente de residuos de Agroquímica. 10.3 ALMACENAMIENTO TEMPORAL 10.3.1 Los residuos de zinc de la sección 7.2.1 que no reaccionen deben ser retirados, lavados, secados y depositados en el recipiente del zinc. BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D. ; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 35 1/6 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD DEL CAUCA Práctica: ENLACE QUÍMICO Guía No: 04 Páginas: 32 a 37 1. INTRODUCCIÓN Las fuerzas de atracción que mantienen unidos a los átomos en los compuestos se llaman enlaces químicos. Hay dos tipos principales: -El enlace iónico formado por interacciones electrostáticas entre los iones que pueden formarse por la transferencia de uno o más electrones de un átomo o un grupo de átomos a otro. -El enlace covalente formado porque se comparte uno o más pares de electrones entre dos átomos. Estos dos tipos de enlaces constituyen dos extremos; todos los enlaces tienen, por lo menos, cierto grado de carácter iónico y covalente. Los compuestos que tienen enlace predominantemente iónico se conocen como compuestos iónicos. Los que contienen enlaces covalentes predominantes se llaman compuestos covalentes. Veamos algunas de las propiedades asociadas con compuestos iónicos y covalentes simples en casos extremos: Compuestos iónicos 1. Son sólidos con puntos de fusión altos lo general, >400°C). Compuestos covalentes (por 1. Son gases, líquidos o sólidos, con puntos de fusión bajos (por lo general, <300°C). 2. Muchos son solubles en disolventes polares, como el agua 2. Muchos de ellos son insolubles en disolventes polares. 3. La mayoría es insoluble en disolventes no polares, como el hexano, C6H14 3. La mayoría es soluble en disolventes no polares, como el hexano, C6H14 4. Los compuestos fundidos conducen bien la electricidad porque contienen partículas móviles con carga (iones). 4. Los compuestos líquidos o fundidos no conducen la electricidad. 5. Las soluciones acuosas conducen bien la electricidad porque contienen partículas móviles con carga (iones). 5. Las soluciones acuosas suelen ser malas conductoras de la electricidad porque no contienen partículas con carga. 36 Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Enlace químico. 2/6 Conductividad: Es la capacidad de conducir la corriente eléctrica que presentan algunos tipos de sustancias. Muchos compuestos iónicos son solubles en agua, y sus disoluciones acuosas conducen la electricidad debido a que estos compuestos son electrólitos fuertes. La mayoría de los compuestos covalentes son insolubles en agua, o si se llegan a disolver, sus disoluciones acuosas por lo general no conducen la electricidad porque estos compuestos son noelectrólitos. Los compuestos iónicos fundidos conducen electricidad porque contienen cationes y aniones que se mueven libremente; los compuestos covalentes líquidos o fundidos no conducen electricidad porque no hay iones presentes. 2. OBJETIVOS 2.1. Diferenciar los dos tipos de enlace: iónico, covalente (polar y apolar). 2.2. Reconocer que los compuestos iónicos están formados por cationes y aniones, los cuales se disponen en arreglos cristalinos y son buenos conductores de la corriente eléctrica. 3. CONSULTAS PRELIMINARES 3.1 Consultar las propiedades del cloruro de sodio (NaCl) y del hexano (C6H14). ¿Por qué se clasifica el NaCl como compuesto iónico y el C6H14 como compuesto covalente? 3.2 Comparar la conducción de compuestos iónicos con la conducción de metales y establezca la diferencia entre ambas. 3.3 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.4 Consultar las fichas de seguridad de los reactivos a usar en la práctica 4. MATERIALES MATERIAL CANTIDAD Tubos de ensayo pequeños Gradilla Vaso de precipitados de 25 mL 10 1 6 Probeta de 25 mL 1 Espátula Pipeta 1 1 5. REACTIVOS SUSTANCIAS Cloruro de Sodio (NaCl) CANTIDAD 0.2 g Cloruro de Potasio (KCl) 0.2 g Nitrato de Sodio (NaNO3 ) R9 S16-41 0.2 g 37 Hexano (C6H14) R11-20/21-40 S9-16-23 4 mL Éter de petróleo R 11-52/53-65, S 9-16-23.2-24-33-62 1 mL Glicerina 1 mL Solución de cloruro de sodio (NaCl) 1% p/v 30 mL Solución de cloruro de sodio (NaCl) al 10% p/v 30 mL Solución de sacarosa (C12H22O11) al 1% p/v 30 mL Solución de sacarosa (C12H22O11) al 10% p/v 30 ml Agua Destilada (H2O) *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). Práctica: Enlace químico. 3/6 6. EQUIPOS EQUIPOS CANTIDAD Balanza digital de plato 1 Conexión eléctrica 1 Conductimetro 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO Las pruebas de solubilidad se harán a micro escala de la siguiente manera: Para los compuestos líquidos: Tome un capilar e introdúzcalo en el recipiente que contiene hexano, deje que el líquido ascienda hasta una altura de 3-5 mm, tome otro capilar e introdúzcalo en el solvente (AGUA) de igual manera permita que el liquido ascienda hasta un altura similar (3-5 mm). Para realizar la prueba de solubilidad, coloque el extremo inferior de un capilar pegado al extremo inferior del otro, como se muestra en la figura 4.1 CAPILAR CON LA MUESTRA CAPILAR 1 CAPILAR CON EL SOLVENTE O REACTIVO CAPILAR 2 Figura 4.1: Diseño para realizar pruebas de solubilidad A continuación balancee los capilares suavemente hacia los lados de forma que el líquido de un capilar pase al otro. Una vez suceda esto, observe: si se forman dos fases las sustancias son insolubles (I) y si se forma una sola fase son solubles (S). Para los compuestos sólidos: Para el caso de los compuestos sólidos, realice el siguiente procedimiento: tome dos cristales del sólido y colóquelos sobre un vidrio reloj a continuación y con la ayuda de un gotero adicione dos gotas de solvente, agite con la varilla de vidrio y observe si hay o no solubilidad. 38 7.1 Pruebas de solubilidad en agua destilada Práctica: Enlace químico. 4/6 7.1.1 Tomar tres vidrios reloj, colocar en el primero cloruro de sodio, en el segundo cloruro de potasio y en el tercero nitrato de sodio y con el gotero adicione dos gotas de agua. Agitar y observar si hay o no solubilidad. 7.1.2 Tomar seis capilares, colocar en tres de ellos agua destilada y agregar al cuarto glicerina, al quinto hexano y al sexto éter de petróleo. Realizar la prueba de solubilidad como se indica en el procedimiento. 7.2 Pruebas de solubilidad en hexano 7.2.1 Tomar tres vidrios reloj, colocar en el primero cloruro de sodio, en el segundo cloruro de potasio y en el tercero nitrato de sodio y con el gotero adicione dos gotas de hexano. Agitar y observar si hay o no solubilidad. 7.2.2 Tomar seis capilares, colocar en cuatro de ellos hexano y agregar al quinto glicerina, al y al sexto éter de petróleo. Realizar la prueba de solubilidad como se indica en el procedimiento. 7.3 Conductividad 7.3.1 Tomar tres tubos de ensayo y agregar al primero 10 mL de agua destilada, al segundo 10 mL de solución al 1% de sacarosa y al tercero 10 mL de solución al 1% de cloruro de sodio. Por medio de conductímetro medir la conductividad de cada solución. 7.3.2 Tomar tres tubos de ensayo y agregar al primero 10 mL de agua destilada, al segundo 10 mL de solución al 10% de sacarosa y al tercero 10 mL de solución al 10% de cloruro de sodio. Por medio de conductímetro medir la conductividad de cada solución. 7.4 Capacidad de conducción de la corriente eléctrica Disponer del sistema de indicador de corriente consistente en bombilla, plafón, cable conductor duplex y clavija de conexión al tomacorriente como se muestra en la figura 4.2. Interrumpir el circuito de conducción eléctrica al bombillo y colocar los cables interrumpidos en un vaso de precipitados que contiene agua destilada. Observar la capacidad de iluminación del bombillo. Repetir el mismo procedimiento con el cloruro de sodio y sacarosa sólidos y sus soluciones. 39 Figura 4.2. Montaje para medir conducción de corriente eléctrica Práctica: Enlace químico. 5/6 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 8.1 Clasificar las sustancias según sus características de solubilidad, conductividad y conducción de la corriente eléctrica. 8.2 De acuerdo al información del punto 8.1 determinar el tipo de enlace predominante de cada sustancia (iónico o covalente). 9. PREGUNTAS 9.1 En cual de los siguientes estados el cloruro de sodio podría conducir electricidad? a) sólido, b) fundido, c) disuelto en agua. Explique sus respuestas. 9.2 Con los símbolos de puntos de Lewis muestre la transferencia de electrones entre los siguientes átomos para formar cationes y aniones: a) Na y F, b) K y S, c) Ba y O, d) Al y N. 9.3 Organice los siguientes enlaces en orden creciente de carácter iónico: enlace litio-flúor en el LiF, enlace potasio-oxígeno en el K2O, enlace nitrógeno-nitrógeno en el N2, enlace azufreoxígeno en el SO2, enlace cloro-flúor en el ClF3. 9.4 Cuales son los puntos de fusión y ebullición del hexano grado capilar? 9.5. Cuales son los puntos de fusión y ebullición del éter de petróleo? 10. RECUPERACIÓN, DESACTIVACIÓN Y/ Ó ALMACENAMIENTO DE RESIDUOS 10.1 RECUPERACIÓN El cloruro de sodio y la sacarosa sólida serán entregadas al encargado del almacenamiento de sustancias químicas, para ser utilizado en practicas posteriores. 10.2 DESACTIVACIÓN Los residuos de las secciones 7.1.1 pueden ser eliminados directamente lavando el vidrio reloj en el lavadero ya que no son nocivos al ambiente. Los capilares usados en las secciones 7.1.2 y 7.2.2 deben colocarse en el vaso de precipitados marcado como CAPILARES USADOS. 40 Los vidrios de reloj usados en la sección.7.2.1 se deben dejar en reposo dos minutos para que el hexano se evapore. Cuando esto suceda los vidrios reloj pueden ser lavados directamente en el lavadero. Los residuos de sacarosa de las secciones 7.3.1 y 7.3.2 deben ser almacenados en el recipiente de soluciones de sacarosa. Los residuos de cloruro de sodio de las secciones 7.3.1 y 7.3.2 deben ser almacenados en el recipiente de residuos de agroquímica Práctica: Enlace químico. 6/6 10.3 ALMACENAMIENTO TEMPORAL No aplica BIBLIOGRAFÍA BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D. ; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005. 41 1/3 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD DEL CAUCA Práctica: DETERMINACIÓN DEL PORCENTAJE DE AGUA DE HIDRATACIÓN DE UN COMPUESTO Guía No: 05 Páginas: 38 a 40 1. INTRODUCCIÓN Muchos compuestos cristalinos contienen cantidades determinadas de agua combinada químicamente dentro de su estructura de estado sólido. Estos compuestos se llaman hidratos. Las moléculas de H2O pueden presentarse en cristales hidratados ocupando posiciones en la red de la estructura cristalina sin asociarse con ningún ión específico o ocupando intersticios (huecos) de una estructura cristalina. Los iones con cargas elevadas atraen fuertemente a los átomos de hidrógeno y oxígeno de la molécula de H2O. Los iones pequeños son más efectivos que los más grandes, debido a que la carga se encuentra más concentrada en los iones pequeños. Frecuentemente permanecen iones hidratados en los sólidos cristalinos que se obtienen por la evaporación de soluciones acuosas de sales así: 3+ - FeCl3.6H2O consiste en iones Fe(H2O)6 y Cl . 4+ 2CuSO4.5H2O consiste en iones Cu(H2O)2 y SO4 En este experimento se analizará el hidrato de CuSO4.5 H2O para determinar el porcentaje de agua de hidratación que hay en él. 2. OBJETIVOS 2.1. Analizar un hidrato para determinar el porcentaje de agua de hidratación de un compuesto. 2.2. Determinar la composición porcentual de esta sustancia 3. CONSULTAS PRELIMINARES 3.1 Que significan las palabras desecar y anhidro? 3.2. Definir y establecer la diferencia entre solvatación e hidratación 3.3. Que uso se le puede dar al CuSO4 anhidro? 3.4. Que relación hay entre los compuestos sólidos del cobre y sus colores? 42 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Determinación del porcentaje de agua de hidratación e un compuesto. 2/3 4. MATERIALES MATERIAL Crisol con tapa Triángulo Desecador CANTIDAD 1 1 1 5. REACTIVOS SUSTANCIA CANTIDAD 1g Sulfato cúprico pentahidratado (CuSO4..5 H2O) R 22-36/38-50/53 S 22-6061 *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). 6. EQUIPOS EQUIPO CANTIDAD Mechero 1 Soporte 1 Aro 1 Pinzas para crisol 1 Balanza Analítica 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO 7.1 Pesar un crisol limpio y seco con la máxima exactitud de su balanza. Anotar su peso. 7.2 Pesar 1.0 g de CuSO4.5 H2O en el crisol 7.3 Colocar el crisol y su contenido en un triangulo refractario sobre un aro sujeto a un soporte vertical. 7.4 Calentar el crisol suavemente por espacio de 4 minutos procurando evitar pérdidas de sólido por salpicaduras. Luego continuar calentando más fuertemente durante 10 minutos. Observar y anotar cualquier cambio. Observar la muestra durante el calentamiento. Si el color de la muestra empieza a oscurecerse, cesar el calentamiento inmediatamente. Durante los 10 últimos minutos de calentamiento preparar el desecador. 7.5 Después de que ha terminado el período de calentamiento durante 10 minutos, dejar que el crisol se enfríe durante 1 minutos y pasarlo al desecador por medio de pinzas. 7.6 Dejar que el crisol y su contenido se enfríen a temperatura ambiente en el desecador cerrado. 43 7.7 Pesar el crisol y el residuo sólido con la máxima exactitud posible en balanza analítica. El residuo es CuSO4 anhidro. Calcular su peso. 7.8 Dejar que la muestra de CuSO4 anhidro quede expuesta al ambiente. Agregar tres gotas de agua y anotar lo que se observa. 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 8.1 Calcular el peso de agua que ha perdido la muestra original Práctica: Determinación del porcentaje de agua de hidratación e un compuesto. 3/3 8.2 Calcular el peso de sulfato de cobre anhidro 8.3 Calcular el porcentaje de agua de hidratación de la muestra 8.4 Determinar el porcentaje de error 9. PREGUNTAS 9.1 Comparar sus resultados con los obtenidos por sus compañeros. Concluiría que el CuSO4.5 H2O es un compuesto ? ¿Por qué? 9.2 Si se continúa el calentamiento fuerte, el CuSO4.5H2O no sólo perderá su agua de hidratación, sino que empezará también a descomponerse en CuO sólido negro y en gas incoloro SO3 que formará vapor en presencia de la humedad. Discutir brevemente que factores en la realización de este experimento podrían dar: 9.2.1 Resultados bajos 9.2.2 Resultados altos. 9.3 Cual es la solubilidad en agua y la constante dieléctrica del sulfato cúprico pentahidratado. 9.4 Cual es la concentración máxima permitida para los iones cloruro y el calcio en el sulfato cúprico pentahidratado. 10. RECUPERACIÓN, DESACTIVACIÓN Y/ Ó ALMACENAMIENTO DE RESIDUOS 10.1 RECUPERACIÓN El sulfato de cobre hidratado utilizado durante la práctica debe recogerse y almacenarse en el recipiente correspondiente a este reactivo. 10.2 DESACTIVACIÓN No aplica 10.3 ALMACENAMIENTO TEMPORAL No aplica BIBLIOGRAFÍA CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. 44 WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D. ; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 1/5 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD Práctica: RELACIONES DE MASA EN LOS PROCESOS DEL CAUCA QUÍMICOS Guía No: 06 Páginas: 41 a 45 1. INTRODUCCIÓN La Estequiometría trata de las relaciones cuantitativas de masa en una reacción o proceso químico, es uno de los pilares en el desarrollo de la Química moderna como ciencia exacta. Lavoisier, al introducir el uso de la balanza en 1879, dio un paso fundamental en el desarrollo de la Química, postulando su ley de “la conservación de la materia”, cuya validez y aplicación actual tiene total vigencia (excepto en reacciones nucleares). Comprobar y comprender totalmente esta ley es supremamente importante porque sirve de base para el análisis cuantitativo, rendimiento de procesos, medidas fisicoquímicas, etc. En esta práctica se observarán las relaciones de masa del cobre en una serie de reacciones en que se forman diferentes compuestos de cobre, partiendo del elemento metálico y llegando nuevamente a cobre metálico. Durante el desarrollo de la práctica se debe tener presente la estequiometría de las diferentes reacciones; entre ellas es importante resaltar las relaciones en masa que presenta el cobre con el ácido nítrico de acuerdo a las dos reacciones descritas (ver reacciones 1 y 2), la principal diferencia de estas reacciones es la obtención de dos diferentes óxidos de nitrógeno: uno, el óxido de nitrógeno, el cual es un gas incoloro, utilizado y producido por nuestro cuerpo en un gran numero de procesos bioquímicos, y otro el dióxido de nitrógeno, que es un gas café amarillento sumamente tóxico con un olor sofocante. Reacción 1: Cu(s) + 4 HNO3(ac) Cu(NO3)2(ac) + 2 H2O(l) + 2 NO2(g) Reacción 2: 3 Cu(s) + 8 HNO3(ac) 3 Cu(NO3)2(ac) + 4 H2O(l) + 2 NO(g) 45 2. OBJETIVOS 2.1. Comprobar la ley de la conservación de la materia. 2.2. Determinar el rendimiento de una reacción. Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Relaciones de masa en los procesos químicos. 2/5 3. CONSULTAS PRELIMINARES 3.1 En una reacción entre Cu y HNO3, (Ver reacciones 1 y 2), calcule la cantidad de HNO3 necesaria para que 0.2 g de Cu reaccione completamente. Tenga presente que el HNO3 se encuentra en solución al 69% y la densidad de la solución es de 1.40 g/mL 3.2 ¿Qué se entiende por reactivo límite? 3.3 ¿En qué consiste un proceso de cristalización? 3.4 ¿Qué se entiende por rendimiento de una reacción? 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica 4. MATERIALES MATERIAL CANTIDAD Vasos de precipitados de 200 mL Vasos de precipitados de 100 mL vidrio de reloj pequeño Varilla de vidrio Espátula Pipeta graduada de 5 mL Propipeta Probeta de 10 mL Frasco lavador Papel filtro 1 3 2 1 2 1 1 1 1 1 5. REACTIVOS SUSTANCIAS CANTIDAD 46 Láminas pequeñas de Cobre metálico (Cu) 0.2 g Solución de ácido nítrico (HNO3) 69%,R 35 S 23-2- 26-36/37/39-45 Bicarbonato de sodio (NaHCO3) ácido sulfúrico concentrado (H2SO4) 97.85% R 35 S 26-30-45 0.8 mL 0.6 g 0.2 mL Zinc metálico polvo grueso (Zn) R10-15 S 7/8-43 0.3g Alcohol etílico (C2H5OH) R 11 S 7-16 10 mL Hielo (H2O) *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). Práctica: Relaciones de masa en los procesos químicos. 3/5 6. EQUIPOS EQUIPO CANTIDAD Balanza semianalítica 1 Plancha de calentamiento 1 Nevera 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO 7.1 Pesar un vaso de precipitados de 200 mL limpio y seco 7.2 Pesar en un vidrio reloj 0.2 g de cobre metálico en balanza analítica. 7.3 Trasvasar el cobre al vaso de precipitados y dentro de la campana de extracción agregue poco a poco 0.6 mL de solución de ácido nítrico al 69%, d = 1.40g/mL, mezcle suavemente, hasta obtener una disolución completa del Cu y hasta que cese la salida de gas. Observar el color de la solución. 7.4 Dentro de la campana de extracción y sobre una plancha de calentamiento, caliente hasta sequedad el producto obtenido en el punto anterior. Cuando el producto obtenido esté seco, deje enfriar y pese nuevamente en balanza analítica. 7.5 Una vez pesado el producto, agregue 50 mL de agua destilada, agite con varilla de vidrio hasta disolución completa. 7.6 Pesar 0.6 g de bicarbonato de sodio en balanza analítica y agréguelo poco a poco a la solución obtenida en 7.5, agitando con una varilla de vidrio. Se obtiene un precipitado, que se debe separar mediante decantación y lavarlo con agua destilada sobre el mismo vaso 2+ de precipitados. Verifique que las aguas del sobrenadante no contengan Cu en solución. El sobrenadante obtenido así como las aguas de lavado sepárelos y páselos a un recipiente y rotúlelo como aguas de desecho # 1. 7.7 Al producto obtenido sólido, precipitado, en la reacción anterior 7.6. una vez decantado, adiciónele 0.6 mL de ácido sulfúrico concentrado (97.5% d = 1.84), agite suavemente con la varilla de vidrio hasta disolución completa. 47 7.8 Caliente suavemente la solución obtenida en 7.7. para disolver el producto obtenido (si es necesario agregue 1 mL de agua destilada). Enfríe y coloque el vaso de precipitados con el producto de reacción dentro de una nevera para lograr la cristalización del producto. Dejar en reposo en nevera para lograr el crecimiento de los cristales hasta la próxima sesión. 7.9 A los cristales obtenidos en 7.8 agregue 10 mL de etanol para disminuir su solubilidad. Separe los cristales obtenidos por decantación. El sobrenadante obtenido sepárelo en otro vaso de precipitados y llévelo al frasco de residuos de etanol. 7.10 Observar con una lente de aumento los cristales obtenidos y sus características. 7.11 Después de observar con la lente, disuelva esos cristales de CuSO4 en 10 mL de agua destilada, agite con varilla de vidrio hasta disolución completa. Práctica: Relaciones de masa en los procesos químicos. 4/5 7.12 Agregar a la solución de sulfato de cobre obtenida en 7.11, 1 gota de ácido sulfúrico concentrado (97.85% d = 1.84), y 0.3 g de Zinc en partículas muy pequeñas, para transformar el ión cobre (II) en cobre metálico, agite suavemente con varilla de vidrio. 7.13 Finalizada la reacción, separe el producto sólido obtenido por decantación y lleve el agua sobrenadante a un frasco de residuos rotulado para desechos de Zinc. 7.14 Caliente suavemente el producto sólido obtenido en 7.13 hasta sequedad, enfriar y pesar el vaso de precipitados con el producto seco. 8. CÁLCULOS Y RESULTADOS 8.1 Escribir todas las ecuaciones químicas que corresponden a los pasos 7.3, 7.6, 7.7 y 7.13 del experimento realizado. 8.2 Determine el rendimiento de reacción en el paso 7.3 teniendo presente que se obtuvo nitrato de cobre (II) mediante la reacción descrita como reacción No.2 8.3 Verificar si se cumple la ley de la conservación de la masa (determine pesos de reactivos y productos y compare) en cada una de las reacciones anteriores. 8.4 Teniendo en cuenta los pesos obtenidos en los puntos 7.2 y 7.14 determine el rendimiento de recuperación del cobre, teniendo en cuenta la eficiencia de la reacción. 8.5. Determine el reactivo límite en cada reacción. 9. PREGUNTAS 9.1 Explicar las posibles causas y fuentes de error en el cumplimiento de la ley de la conservación de la masa. 9.2 Cual es el punto de fusión, ebullición y densidad aparente del cobre en láminas 9.3 Cual es la densidad, pH y solubilidad en agua del bicarbonato de sodio 9.4 Cual es el límite de explosión y punto de inflamación del etanol ? 48 10. RECUPERACIÓN, DESACTIVACIÓN Y/ Ó ALMACENAMIENTO DE RESIDUOS 10.1 RECUPERACIÓN No aplica 10.2 DESACTIVACIÓN No aplica. Práctica: Relaciones de masa en los procesos químicos. 5/5 10.3 ALMACENAMIENTO TEMPORAL Los residuos de hidróxido de sodio de la sección 7.6 se almacenarán en el recipiente de residuos básicos. Los residuos etanólicos de la sección 7.8 serán almacenados en el recipiente de residuos de etanol. Los residuos de sulfato de cobre de la sección 7.11 serán almacenados en el recipiente de residuos de sulfato de cobre. NOTA: Esta práctica es necesario realizarla en dos sesiones. BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D. ; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 49 1/5 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD DEL CAUCA Práctica: REACCIONES DE OXIDO-REDUCCIÓN. INTERPRETACIÓN E IGUALACIÓN DE REACCIONES Guía No: 07 Páginas: 46 a 50 1. INTRODUCCIÓN Existe un gran número de reacciones químicas que involucran transferencia de electrones. Estas son reacciones de óxido-reducción. La sustancia que gana electrones está siendo reducida y la que pierde electrones es oxidada. En cualquier reacción de óxido-reducción los electrones que pierde la sustancia que se oxida tienen que ser ganados en igual número por la sustancia que se reduce. Comúnmente se llama agente oxidante a la sustancia que oxida a la otra sustancia. Similarmente, se llama agente reductor a la sustancia que reduce a la otra sustancia. Es claro ver que el agente oxidante es la sustancia que se reduce y que el agente reductor es la sustancia que se oxida. Muchas de las reacciones de óxido-reducción más utilizadas ocurren en medio acuoso. La disolución electrolítica de muchos compuestos en el agua simplifica la consideración de la reacción de óxido-reducción ya que solo se deben considerar aquellos iones o especies que intervienen en la reacción de óxido-reducción. Los otros iones presentes que no intervienen en la reacción de óxido-reducción no se consideran. Electrólisis: Cuando los electrodos se conectan a una fuente de voltaje y se sumergen en una solución que contiene iones, los iones positivos emigran al electrodo que tiene exceso de electrones llamado cátodo, y los iones negativos hacia el electrodo deficiente en electrones llamado ánodo, si la diferencia de potencial entre los electrodos es suficientemente grande, algunas especies perderán electrones en el ánodo y se oxidarán, al mismo tiempo, otras especies ganarán electrones en el cátodo y se reducirán. Se ha llevado a cabo una reacción redox mediante el suministro de energía eléctrica por una fuente externa. Este es el caso contrario de la batería el cual provee de energía eléctrica, debido a una reacción redox espontánea. La acción de someter una solución o mezcla líquida de iones a una fuente de energía eléctrica que origina una reacción redox se llama electrólisis. Ejemplo de ello es la electrólisis del cloruro de sodio en solución. Cuando los electrodos se conectan a la fuente externa de electricidad o bomba de electrones, los iones cloruro son atraídos por el ánodo, donde pierden electrones y forman cloro molecular. Debido a que el cloro molecular es diatómico, dos iones cloruro deben 50 reaccionar para formar una molécula de cloro. La reacción durante la cual una especie pierde o gana electrones en un electrodo y se convierte en una nueva especie se llama reacción en el electrodo. Tal reacción, como la que se acaba de plantear, solo ocurre cuando simultáneamente se produce una reacción que implica ganancia de electrones en el otro electrodo, el cual forma parte del sistema. En este ejemplo se esperaría que los iones sodio emigraran hacia el cátodo. Sin embargo, los iones sodio ganan electrones en solución acuosa para formar sodio metálico porque el agua se reduce más fácilmente. El agua ganará electrones de acuerdo con la reacción en el electrodo. Elaborado por: Revisado Por: Aprobada por: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Fecha de Aprobación: Rector Danilo Reinaldo Vivas R. Práctica: Reacciones de oxido-reducción, interpretación e igualación de reacciones. 2/5 2 e- (cátodo) + 2 H2O H2 + 2 OH- (oxidación) Estas dos reacciones en el electrodo se producen simultáneamente cuando se somete a electrólisis la solución de cloruro de sodio, por cada dos electrones que se ganan en el cátodo, se pierden dos electrones en el ánodo. Luego, estas reacciones en el electrodo son reacciones químicas en las que hay transferencia de electrones. El resultado final del proceso de transferencia de electrones que ocurre durante la electrólisis del cloruro de sodio en solución se representa por la ecuación. 2e- + 2 H2O 2 Cl2 Cl- + 2 H2O H2 + 2 OH- Reacción en el cátodo (reducción) Cl2 + 2 e- Reacción en el ánodo (oxidación) Cl2 + H2 Reacción total Las aplicaciones de la electrólisis en la industria metalúrgica permiten la extracción de metales y generación de aleaciones entre dos metales, así por ejemplo: En la producción electrolítica de aluminio, en donde el óxido de aluminio a partir del mismo mineral la bauxita que se disuelve en el mineral criolita fundido, se somete a electrólisis para formar aluminio metálico. En la producción electrolítica del magnesio, el cloruro de magnesio obtenido del agua de mar se funde y se somete a electrólisis para obtener magnesio metálico. En el electrolaminado de plata, el laminado de plata a través de electrólisis se emplea un ánodo de plata pura con una base metálica como el cátodo. Durante la electrólisis, la plata se deposita sobre el cátodo. En el electrolaminado de hojas de estaño, implica la transferencia de estaño, de un ánodo de estaño puro a una placa de acero. El laminado con estaño de acero se emplea para la fabricación de latas. 51 2. OBJETIVOS 2.1. Afianzar nociones sobre métodos de balanceo de ecuaciones de óxido-reducción. 2.2. Observar algunas reacciones espontáneas de óxido-reducción. 2.3. Determinar la tendencia relativa de algunos metales como agentes reductores. Práctica: Reacciones de oxido-reducción, interpretación e igualación de reacciones. 3/5 3. CONSULTAS PRELIMINARES 3.1 Qué son potenciales de oxidación 3.2 Qué información da un valor negativo en el potencial de oxidación 3.3 Esquematizar y explicar en que consiste el electrodo de hidrógeno 3.4 Dar un ejemplo de balanceo de una ecuación por el método de óxido-reducción. 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica 4. MATERIALES MATERIAL tubos de ensayo pequeños Gradilla para tubos de ensayo Gotero CANTIDAD 12 1 1 5. REACTIVOS SUSTANCIAS CANTIDAD Zinc en láminas (Zn Cobre láminas (Cu) 1g 1g Solución de permanganato de potasio (KMnO4) (1 N) R8-22 S2 4 mL Ácido sulfúrico concentrado (H2SO4) R35 S2-26-30 5 mL Solución de sulfato de Cobre (II) (CuSO4) 0.5M R-35 S2-26-30 4 mL Solución de nitrato de cobre (II) Cu(NO3)2 0.5M R20/21/22 S9-24/25 4 mL Solución de nitrato de Zinc Zn(NO3)2 0.01M R22 4 mL Ácido clorhídrico concentrado (HCl) R 36/38 S 2-28 4mL 52 Ácido nítrico concentrado (HNO3) R.35 S 2-26-30 4mL *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). 6. EQUIPOS No aplica 7. PROCEDIMIENTO 7.1 Colocar en cada uno de dos tubos de ensayo (#1 y #2), 1 mL de una solución de permanganato de potasio acidulada con 5 gotas de ácido sulfúrico. Anotar sus observaciones para los ensayos siguientes: Práctica: Reacciones de oxido-reducción, interpretación e igualación de reacciones. 4/5 7.1.1 En el tubo 1 introduzca una lámina de cobre 7.1.2 En el tubo 2 introduzca una lámina de zinc. 7.2 Tomar dos tubos de ensayo (# 3 y # 4) y colocar en cada uno 1 mL de solución de sulfato de cobre (II). Anotar sus observaciones para los ensayos siguientes: 7.2.1 En el tubo 3 introduzca una lámina de cobre 7.2.2 En el tubo 4 introduzca una lámina de zinc. 7.3 Tomar dos tubos de ensayo (# 5 y # 6) y colocar en cada uno 1 mL de solución diluida de nitrato de zinc. Anotar sus observaciones para los ensayos siguientes: 7.3.1 En el tubo 5 introduzca una lámina de cobre. 7.3.2 En el tubo 6 introduzca una lámina de zinc. 7.4 Tomar otros dos tubos de ensayo (# 7 y # 8) y colocar en cada uno 1 mL de solución diluida de nitrato de cobre. Anotar sus observaciones para los ensayos siguientes: 7.4.1 En el tubo 7 introduzca una lámina de cobre 7.4.2 En el tubo 8 introduzca una lámina de zinc. 7.5 Colocar otros dos tubos de ensayo (# 9 y # 10). Colocar en cada uno de los tubos 1 mL de ácido clorhídrico concentrado. Anotar sus observaciones para los ensayos siguientes: 7.5.1 En el tubo 9 introduzca una lámina de cobre 7.5.2 En el tubo 10 introduzca una lámina de zinc. 7.6 Colocar otros dos tubos de ensayo (# 11 y # 12). Colocar en cada uno de los tubos 1 mL de ácido nítrico concentrado. Anotar sus observaciones para los ensayos siguientes: 7.6.1 En el tubo 11 introduzca una lámina de cobre 7.6.2 En el tubo 12 introduzca una lámina de zinc. 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 53 8.1 Interpretar mediante ecuaciones químicas las reacciones que suceden en los pasos del procedimiento desde 7.1 hasta 7.6 8.2 Identificar agentes oxidantes y reductores, sustancia oxidada y sustancia reducida en cada una de las reacciones. 9. PREGUNTAS 9.1 De acuerdo a las observaciones deduzca el orden de los metales zinc y cobre en cuanto a su tendencia a ser oxidados; explique cual es el mejor agente reductor. 9.2 Consultar que es una reacción de dismutación. Dar ejemplo. 9.3 ¿Cual es el boletín de garantía del permanganato de potasio en cuanto a sulfatos y mercurio permitidos en el reactivo 9.4 ¿Cuales son los puntos de fusión y ebullición del ácido clorhídrico? Práctica: Reacciones de oxido-reducción, interpretación e igualación de reacciones. 5/5 10. DISPOSICIÓN, ALMACENAMIENTO Y/O DESACTIVACIÓN DE RESIDUOS QUÍMICOS 10.1 RECUPERACIÓN Las láminas sin reaccionar deberán ser separadas de los desechos por decantación, lavadas, secadas y almacenadas en los recipientes de donde fueron obtenidos inicialmente 10.2 DESACTIVACIÓN No aplica 10.3 ALMACENAMIENTO TEMPORAL Todos los residuos acuosos generados en la presente práctica serán almacenados en el recipiente de agroquímica. BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D.; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 54 1/5 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD DEL CAUCA Práctica: DETERMINACIÓN DEL VOLUMEN MOLAR DE UN GAS Guía No: 08 Páginas: 51 a 55 1. INTRODUCCIÓN El volumen molar es el ocupado por un mol de un gas ideal. Este volumen molar generalmente se da en condiciones normales, o sea 273 K y 1 atm de presión. En este experimento se determinará el volumen molar del oxígeno en las condiciones de laboratorio y se calculará luego su valor para las condiciones normales. El método a utilizar para determinar el volumen molar del oxígeno consiste en generar cierta cantidad de oxígeno, por descomposición térmica del KClO3, pues cuando se calienta este producto, la pérdida de masa de la fase sólida se debe exclusivamente al oxígeno desprendido. Según la reacción: MnO2 2 KCl + 3 O2 2 KClO3 calor El volumen de O2 se determina utilizando el método de desplazamiento de agua. Si se determina el volumen correspondiente a esta masa perdida podrá deducirse de él el volumen que corresponde a 32 gramos de oxígeno, esto es el volumen de una mol. Como el volumen de una muestra gaseosa varía cuando varían la temperatura y la presión, se deben medir estos valores y utilizarla para efectuar su reducción a las condiciones normales, utilizando las leyes de los gases, la cantidad de oxígeno producido y el volumen que ocupa. 2. OBJETIVOS 2.1 Determinar el volumen que ocupa una mol de un gas a 273 K y 1 atm de presión. 2.2 Aplicar la ley de Dalton de las presiones parciales. 55 3. CONSULTAS PRELIMINARES 3.1 ¿En que se diferencian los gases reales de los ideales? 3.2 ¿Cuales son las leyes de los gases ideales? 3.3 ¿Cuales son las condiciones normales de los gases? 3.4 ¿En que consiste el método de desplazamiento de agua para determinar el volumen de un gas? Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Determinación del volumen molar de un gas. 2/5 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica 4. MATERIALES MATERIAL CANTIDAD o o Termómetro 0 C - 100 C Espátula Vaso de 500 mL Probeta de 50 mL Tubo de ensayo con brazo lateral Tapón para tubo de ensayo Vaso de precipitados de 100 mL Frasco lavador Manguera larga 1 1 1 1 1 1 1 1 1 5. REACTIVOS CANTIDAD SUSTANCIAS Clorato de potasio anhidro (KClO3) R9-20/22 S2-13-16-27 0.1 g Dióxido de manganeso (MnO2) R20-22 S25 Agua destilada *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). 6. EQUIPO 56 EQUIPO CANTIDAD Pinza nuez tubos de ensayo 1 Mechero 1 Balanza semianalítica 1 Regla milimetrada (10 cm.) * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO 7.1 Pesar un tubo de ensayo limpio y seco, con una precisión de 0.001g 7.2 Introducir en el tubo aproximadamente 0.10g de KClO3 7.3 Pesar nuevamente el tubo y su contenido con una precisión de 0.01g 7.4 Adicionar con la espátula un poco de MnO2, pesar nuevamente el tubo y su contenido con una precisión de 0.001g. Retirar el tubo de la balanza. 7.5 Mezclar cuidadosamente los dos contenidos del tubo y tapar (el tapón debe quedar bien adherido para evitar que el gas producido durante la reacción se pierda durante el calentamiento). Práctica: Determinación del volumen molar de un gas. 3/5 7.6 Colocar el vaso de 500 mL dentro de una poceta llena de agua como se indica la figura 8.1 A 7.7 Colocar dentro del vaso la probeta de tal manera que quede lleno con agua y no queden burbujas de aire. Mirar figura 8.1 B. 7.8. Retirar el vaso y la probeta de la poceta y colocarlo sobre la mesa de trabajo. Mirar figura 8.1.C 7.9 Ensamblar el equipo como se indica en la figura 8.1. D. La punta del tubo del vidrio no debe llegar hasta el fondo de la probeta. 7.10 El tubo de ensayo se debe sostener con las pinzas y sujetarlo al soporte. 7.11 Cuando todo esté listo, empezar a calentar cuidadosamente el tubo y sus contenidos con el mechero. A medida que se va llenando la probeta con el gas, se va desplazando el agua que ésta contiene y va pasando al vaso. Si es necesario, se debe sacar un poco de agua del vaso para evitar que se derrame. Continuar el calentamiento, haciéndolo más fuerte al final, cuando haya disminuido la velocidad de desplazamiento del gas. 7.12 Cuando haya cesado la producción del gas, retirar y apagar el mechero, dejando enfriar el tubo de ensayo sin desensamblar el equipo. Medir las diferencias de alturas entre el nivel del agua en el vaso del precipitado y el nivel de agua de la probeta. Esta diferencia de altura corresponde a la columna de agua en mm de Hg. 7.13 Leer el volumen de gas recolectado que corresponde al volumen de gas recolectado en la probeta. Medir la temperatura ambiente y la del agua sobre la cual se recolectó el oxígeno y también la presión atmosférica. Mediante la fórmula: dH 2 O.hH 2 O = dHg.hHg (8.1) donde: 57 dH 2 O = densidad del agua a temperatura ambiente: 1.00 g/cm3 hH 2 O = altura de la columna de agua en mm dHg = densidad del mercurio hHg = altura de la columna en mm Hg se debe hallar hHg = dH 2 O.hH 2 O hHg (8.2) Presión total = Presión atmosférica = Pgas seco + PvH2O + hHg mmHg De la fórmula se deduce Pgas seco = Pat – PvH2O – hHg mmHg Práctica: Determinación del volumen molar de un gas. 4/5 (A) (B) (C) Figura 8.1. Desplazamiento de un gas (D) 58 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 8.1 Peso del KClO3 8.2 Moles de KClO3 8.3 Volumen del oxígeno producido 8.4 Temperatura ambiente 8.5 Temperatura del agua 8.6 Presión atmosférica 8.7 Presión del vapor de agua a su temperatura 8.8 Altura de la columna de agua 8.9 Presión del oxígeno seco 8.10 Moles de clorato de potasio que reaccionaron. 8.11 Moles de oxígeno producidas por la descomposición de todo el clorato de potasio 8.12 Litros de oxígeno producidos en el experimento convertidos a condiciones normales (273 K y 1 atm de presión ________ ________ ________ ________ ________ ________ ________ ________ ________ _________ _________ __________ Práctica: Determinación del volumen molar de un gas. 5/5 8.13 Volumen en litros que ocupa un mol de oxígeno en condiciones normales 8.14 Porcentaje de error del volumen molar del oxígeno obtenido en el experimento __________ __________ Consultar tabla de Pv H2O vs. Temperatura 9. PREGUNTAS 9.1 Describa el barómetro de mercurio. ¿Cómo funciona? 9.2 ¿Que diferencias hay entre gases ideales y gases reales? 9.3 ¿Cuales son los postulados de la teoría cinética molecular? 9.4 Qué usos tiene el óxido de manganeso 10. RECUPERACIÓN, DESACTIVACIÓN Y/O ALMACENAMIENTO TEMPORAL DE LOS RESIDUOS QUÍMICOS 10.1 RECUPERACIÓN No aplica. 10.2 DESACTIVACIÓN El agua del montaje y el oxígeno recolectado en la probeta serán vertidos directamente al lavadero ya que no presentan ningún efecto nocivo. 10.3 ALMACENAMIENTO TEMPORAL 59 Los residuos de manganeso y de la descomposición del clorato de potasio se almacenarán en el recipiente de residuos de agroquímica. BIBLIOGRAFÍA BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D.; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 1/4 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD Práctica: PREPARACIÓN DE SOLUCIONES No.1 DEL CAUCA 1. INTRODUCCIÓN Guía No: 09 Páginas: 56 a 59 Una solución es una mezcla homogénea de dos o más sustancias: se dice homogénea debido a que forman una sola fase (parte de un sistema físicamente diferente a las demás y mecánicamente separable de ellas). La solución se puede considerar como una especie de dispersión en la cual al componente disperso se le llama soluto y al componente dispersante se le llama solvente, o en otras palabras, la sustancia que se disuelve se le llama soluto y la sustancia que disuelve se le llama solvente. Establecer claramente cual es el soluto y cual el solvente, en una solución, puede ser a veces complicado, pero si se consideran los tipos de soluciones que existen de acuerdo al estado de los componentes, la dificultad puede obviarse así: 1.1. En las soluciones que se presentan en estado gaseoso (gas, líquido o sólido disuelto en gas) y las que se presentan en estado sólido (gas, líquido: sólido disuelto en sólido) el soluto es el componente que se encuentre en menor cantidad 1.2. En las soluciones gas -líquido o sólido – líquido se considera el gas o al sólido como soluto y al líquido como solvente. 1.3. En las soluciones líquido – líquido se considera como solvente el líquido que está en mayor cantidad, pero si uno del los líquidos es el H2O se considera a ésta como solvente aunque esté en menor cantidad. 2. OBJETIVOS 2.1. Preparar soluciones con diferentes grados de concentración a partir de sustancias sólidas. 60 2.2. Habituar al estudiante al uso de expresiones de concentración de soluciones. 3 CONSULTAS PRELIMINARES 3.1. Explique por qué las interacciones a) soluto-soluto, b) disolvente-disolvente y c) solutodisolvente, son importantes para determinar hasta qué grado se disuelve un soluto en un disolvente. 3.2. ¿Cuales son las diferentes unidades de concentración que se emplean para expresar la concentración de una solución? Explíquelas y de un ejemplo de cada una de ellas. 3.3. Realizar los cálculos para preparar 50 mL de una solución 8 M de CuSO4 a partir de CuSO4.5H2O. Determinar su densidad. Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Preparación de soluciones No. 1. 2/4 4 MATERIALES CANTIDAD MATERIAL Balón aforado de 50 y 100 mL Pipeta aforada de 5 mL Pipeta graduada de 10 mL Propipeta Probeta de 50 mL Vasos de precipitados de 50 mL Vidrio de reloj pequeño Espátula Varilla de vidrio Picnómetro de 25 mL 4 1 1 1 1 3 1 1 1 1 5. REACTIVOS SUSTANCIAS CANTIDAD Hidróxido de sodio sólido (NaOH del 98%) R35 S2-26-37/39 Sacarosa (C12H22O11) 1g 1g Cloruro de sodio (NaCl del 99.9%) 1g Papel tornasol 1 *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). 6. EQUIPOS 61 CANTIDAD EQUIPO Balanza analítica 1 pH-metro 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO 7.1 PREPARACIÓN DE UNA SOLUCIÓN DE CONCENTRACIÓN MOLAR Realizar los cálculos para determinar el peso de cloruro de sodio necesario para preparar 100 mL de una solución de concentración 0.1 M a partir de cloruro de sodio sólido al 99.9 % de pureza 7.1.1. Pesar en un vidrio de reloj el cloruro de sodio 7.1.2. En un vaso de precipitados agregar 6 mL de agua y luego agregar el cloruro de sodio. 7.1.3. Realizar tres lavados al vidrio reloj cada uno con 2 mL de agua y agregar los lavados al vaso de precipitados con la solución. 7.1.4. Mezclar la solución con varilla de vidrio y transferir al balón aforado de 100 mL. 7.1.5. Realizar tres lavados al vaso de precipitados cada uno con 2 mL de agua y agregar los lavados al vaso de precipitados con la solución. 7.1.6 Aforar con agua, mezclar y rotular la solución. 7.1.7. Determine la densidad de la solución (por medio del picnómetro). 7.1.8. Determine el pH de la solución con papel tornasol y pH-metro. Práctica: Preparación de soluciones No. 1. 3/4 7.2. PREPARACIÓN DE UNA DISOLUCIÓN DE CONCENTRACIÓN NORMAL. Realizar los cálculos para determinar el volumen de solución de cloruro de sodio (a partir de la solución de cloruro de sodio 0.1 M) para preparar 50 mL de una solución de concentración 0.01 N 7.2.1. En un balón aforado de 50 mL agregar 6 mL de agua. 7.2.2. Con una pipeta mida el volumen de solución de cloruro de sodio 0.1 M y luego agregar al balón aforado de 50 mL 7.2.3. Realizar tres lavados a la pipeta por la parte superior con el frasco lavador y agregar los lavados al balón que contiene la solución. 7.2.4. Mezclar la solución, aforar con agua y rotular la solución. 7.2.5. Determine la densidad de la solución (por medio del picnómetro). 7.2.6. Determine el pH de la solución con papel tornasol y pH-metro. 7.3. PREPARACIÓN DE UNA SOLUCIÓN CON CONCENTRACIÓN MOLAL Realizar los cálculos para determinar el peso de sacarosa necesario para mezclar con 30 g de agua y obtener una solución de concentración 0.1 m de sacarosa 7.3.1. En un vidrio reloj pesar la sacarosa 7.3.2. En un vaso de precipitados pesar 30 g de agua para la preparación de la solución. 7.3.3. Transferir completamente la sacarosa al vaso que contiene el agua 7.3.4. Mezclar y rotular la solución. 7.3.5. Determine la densidad de la solución por medio del el picnómetro. 7.3.6. Determine el pH de la solución con papel tornasol y pH-metro. 62 7.4. PREPARACIÓN DE UNA SOLUCIÓN CON CONCENTRACIÓN PORCENTAJE PESO VOLUMEN Realizar los cálculos para determinar el peso de hidróxido de sodio (a partir de hidróxido de sodio sólido al 98 % en peso) para preparar 50 mL de una solución al 1% p/v. 7.4.1. En un vidrio reloj pesar el hidróxido de sodio. 7.4.2. En un vaso de precipitados agregar 6 mL de agua y luego agregar el hidróxido de sodio. 7.4.3. Realizar tres lavados al vidrio reloj cada uno con 2 mL de agua y agregar los lavados al vaso de precipitados con la solución. 7.4.4. Mezclar la solución con varilla de vidrio y transferir al balón aforado de 50 mL. 7.4.5. Realizar tres lavados al vaso de precipitados cada uno con 2 mL de agua y agregar los lavados al balón aforado. 7.4.6. Aforar con agua, mezclar y rotular la solución. 7.4.7. Determine la densidad de la solución por medio del picnómetro. 7.4.8. Determine el pH de la solución con papel tornasol y pH-metro. 8 OBSERVACIONES, CÁLCULOS Y RESULTADOS Expresar la concentración de las soluciones preparada en los puntos 7.1, 7.2, 7.3 y 7.4 en molaridad, normalidad, molalidad, porcentaje peso/peso, porcentaje peso/volumen y fracción molar. Práctica: Preparación de soluciones No. 1. 4/4 9. PREGUNTAS 9.1. ¿Cuales son las principales interacciones que afectan la disolución de un soluto en un disolvente? 9.2. De qué factor depende la capacidad de un sólido para disolverse? Qué es la energía de red cristalina? . 9.3. Qué es energía de hidratación? 10. RECUPERACIÓN, DESACTIVACIÓN Y/ Ó ALMACENAMIENTO DE RESIDUOS 10.1. Residuos acuosos. Las soluciones 7.1 y 7.2 serán almacenadas en el recipiente de agroquímica. La solución 7.3 será almacenada en el recipiente de soluciones de sacarosa. La solución 7.4 será almacenada en el recipiente de soluciones de hidróxido de sodio. BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E. ; BURSTEN, B. E. : "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 63 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D.; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 1/4 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL Prácticas de Laboratorio de Química General UNIVERSIDAD Práctica: PREPARACIÓN DE SOLUCIONES No.2 DEL CAUCA 1. INTRODUCCIÓN Guía No: 10 Páginas: 60 a 63 La miscibilidad es la capacidad de un líquido para disolverse en otro. Frecuentemente el proceso de mezclas es exotérmico para líquidos miscibles. Los líquidos polares tienden a interaccionar fuertemente con disolventes polares y disolverse en ellos. El metanol, CH3OH, el etanol, CH3CH2OH, el acetonitrilo, CH3CN y el ácido sulfúrico, H2SO4, son todos líquidos polares solubles en la mayoría de los disolventes polares como el agua. Entre el agua y el metanol y el etanol se forman puentes de hidrógeno. Entre el ácido sulfúrico y el agua se forman puentes de hidrógeno tan fuertes, que se liberan grandes cantidades de calor al diluir ácido sulfúrico concentrado en agua. Con frecuencia, esto provoca que la solución ebulla y salpique. Cuando el principal componente de la mezcla es agua, este calor puede ser absorbido con menor aumento de temperatura, debido al calor específico inusualmente alto del agua. Por este motivo, el ácido sulfúrico (como también otros ácidos minerales) siempre se diluye añadiendo el ácido lentamente al agua. El agua nunca se agrega al ácido. En caso de que se produzcan salpicaduras al añadir el ácido al agua, se tratara de esta última y no de ácido concentrado corrosivo. Los líquidos no polares que no reaccionan con el disolvente generalmente no son muy solubles en líquidos polares, ya que las fuerzas de interacción son desiguales. Sin embargo, los líquidos no polares suelen ser bastante solubles en otros líquidos no polares. 2. OBJETIVOS 64 2.1. Preparar soluciones con diferentes grados de concentración a partir de soluciones de mayor concentración 2.2. Habituar al estudiante al uso de expresiones de concentración de soluciones 3. CONSULTAS PRELIMINARES 3.1 El agua y el alcohol son miscibles, pero el agua y el hexano no lo son. Explicar este comportamiento en términos de la polaridad de las moléculas de estos tres compuestos. 3.2 Defina y establezca la diferencia entre solvatación e hidratación. 3.3 Qué liquido será mejor disolvente para el (NH4)2SO4, el agua o el pentano, C5H12 ? Porque? 3.4 Realizar los cálculos para preparar 50 mL de una solución 0.1 M de H2SO4 a partir de H2SO4 concentrado (consulte las especificaciones de este ácido). Elaborado por: Revisado Por: Aprobada por: Fecha de Aprobación: Isabel Bravo Realpe Liliana Montalvo Vélez Luis Alfonso Vargas Jiménez Jefe Unidad de Área Presidente Comité de Plan Coordinador Comité Desactivación Residuos Químicos Presidente Comité Técnico Ambiental Rector Danilo Reinaldo Vivas R. Práctica: Preparación de soluciones No.2. 2/4 3.5 Consultar las frases de riesgo y seguridad para la manipulación de los reactivos de la práctica. 3.6 Consultar las fichas de seguridad de los reactivos a usar en la práctica. 4. MATERIALES CANTIDAD MATERIAL Balón aforado de 50 mL Pipeta aforada de 5 mL Propipeta Probeta de 50 mL Vasos de precipitados de 50 mL Varilla de vidrio Picnómetro 4 3 1 1 3 1 1 5. REACTIVOS SUSTANCIAS CANTIDAD Ácido clorhídrico concentrado (HCl 37% d= 1.19) R 36/38 S 2-28 Ácido nítrico concentrado (HNO3 65% d= 1.40) R 35 S 2-23-26-27 5 mL 5mL Ácido sulfúrico concentrado (H2SO4 97.5% d= 1.84) R 35 S 2-26-30 5 mL Papel Tornasol 1 *Remitir al manual de protocolo de riesgo/ seguridad y fichas técnicas de seguridad (apéndice). 6. EQUIPOS 65 CANTIDAD EQUIPO Balanza Analítica 1 pH-metro 1 * Remitir al manual de protocolo de calibración de equipos. Departamento de Química 7. PROCEDIMIENTO 7.1 PREPARACIÓN DE UNA SOLUCIÓN DE ÁCIDO CLORHÍDRICO 1.2 M Realizar los cálculos para determinar la cantidad de ácido clorhídrico concentrado necesario para preparar 50 mL de una solución de concentración 1.2 M. 7.1.1 Mida con una pipeta graduada la cantidad de ácido clorhídrico calculada. 7.1.2 En un balón de 50 mL agregar 6 mL de agua y luego agregar esa cantidad de ácido. 7.1.3 Enjuague la pipeta con el frasco lavador tres veces y agregar estos lavados al balón. 7.1.4 Agitar suavemente. 7.1.5 Aforar con agua, mezclar y rotular la solución. 7.1.6 Determine la densidad de la solución por medio del picnómetro. 7.1.7 Determine el pH de la solución con papel tornasol y pH-metro. 7.2 PREPARACIÓN DE UNA DISOLUCIÓN DE ÁCIDO CLORHÍDRICO 0.12 N. Realizar los cálculos para determinar el volumen de solución de ácido clorhídrico 1.2 M anterior, necesario para preparar 50 mL de una solución de concentración 0.12 N Práctica: Preparación de soluciones No.2. 3/4 Repita el procedimiento efectuado en 7.1 7.3 PREPARACIÓN DE UNA SOLUCIÓN DE ÁCIDO NITRICO 1.44 N. Realizar los cálculos para determinar la cantidad de ácido nítrico concentrado necesario para preparar 50 mL de una solución de concentración 1.44 N. 7.3.1 Mida con una pipeta graduada la cantidad de ácido nítrico calculada. 7.3.2 En un balón de 50 mL agregar 6 mL de agua y luego agregar esa cantidad de ácido. 7.3.3 Enjuague la pipeta con el frasco lavador tres veces y agregar estos lavados al balón. 7.3.4 Agitar suavemente. 7.3.5 Aforar con agua, mezclar y rotular la solución. 7.3.6 Determine la densidad de la solución utilizando el picnómetro. 7.3.7 Determine el pH de la solución con papel tornasol y pH-metro. 7.4 PREPARACIÓN DE UNA DISOLUCIÓN DE ÁCIDO NÍTRICO 0.144 N. Realizar los cálculos para determinar el volumen de solución de ácido nítrico 1.44 N preparada anteriormente necesario para preparar 50 mL de una solución de concentración 0.144 N. Repita el procedimiento efectuado en 7.3 7.5 PREPARACION DE UNA SOLUCION DE ÁCIDO SULFÚRICO 3.66 N. Realizar los cálculos para determinar la cantidad de ácido sulfúrico concentrado necesario para preparar 50 mL de una solución de concentración 3.66 N. 7.5.1 Mida con una pipeta aforada la cantidad de ácido sulfúrico calculada. 7.5.2 En un balón de 50 mL agregar 6 mL de agua y luego agregar esa cantidad de ácido. 66 7.5.3 Enjuague la pipeta con el frasco lavador tres veces y agregar estos lavados al balón. 7.5.4 Agitar suavemente. 7.5.5 Aforar con agua, mezclar y rotular la solución. 7.5.6 Determine la densidad de la solución utilizando el picnómetro. 7.5.7 Determine el pH de la solución con papel tornasol y pH-metro. 7.6 PREPARACIÓN DE UNA DISOLUCIÓN DE ÁCIDO SULFÚRICO 0.183 M. Realizar los cálculos para determinar el volumen de solución de ácido sulfúrico 3.66 N preparada anteriormente necesario para preparar 50 mL de una solución de concentración 0.183 M. Repita el procedimiento efectuado en 7.5 8. OBSERVACIONES, CÁLCULOS Y RESULTADOS 8.1 Expresar la concentración de las soluciones preparada en los puntos 7.1, 7.2, 7.3, 7.4, 7.5 y 7.6 en molaridad, normalidad, molalidad, porcentaje peso/peso, porcentaje peso/volumen y fracción molar. Práctica: Preparación de soluciones No.2. 4/4 9. PREGUNTAS 9.1 Apoye o critique la siguiente afirmación: “Las soluciones y las mezclas son iguales” 9.2 Cuales son las propiedades coligativas de las soluciones?. Comente sobre ellas. 10. RECUPERACIÓN, DESACTIVACIÓN Y/ Ó ALMACENAMIENTO DE RESIDUOS 10.1 RECUPERACIÓN No aplica 10.2 DESACTIVACIÓN No aplica. 10.3 ALMACENAMIENTO TEMPORAL Los residuos acuosos de soluciones de ácido clorhídrico de las secciones 7.1 y 7.2 serán almacenados en el recipiente de soluciones de ácido clorhídrico. Los residuos acuosos de soluciones de ácido nítrico de las secciones 7.3 y 7.4 serán almacenados en el recipiente de soluciones de ácido nítrico. Los residuos acuosos de soluciones de ácido sulfúrico de las secciones 7.5 y 7.6 serán almacenados en el recipiente de soluciones de ácido sulfúrico. 67 BIBLIOGRAFÍA BRADY, J. E.; HUMISTON, G. E.: "Química básica, principios y estructura." 2da. Ed. Limusa. 1985. BRESCIA, F.; ARENTS, J. ; MEISLICH, H. ; TURK, A.: "Métodos de laboratorio químico". Academic Press-Compañía Editorial Continental, México, 1970. BROWN, T. L.; LEMAY, H. E.; BURSTEN, B. E.: "Química. La ciencia central." 5ta. Ed., Prentice Hall Hispanoamericana, México, 1993. ISBN 968-880-290-5. CHANG, R. "Química". 7a edición. México. Mc Graw – Hill. 2002 EBBING, D. D.: "General chemistry." 4ta. Ed., Addison Wesley Iberoamericana, 1990. VOGEL'S Textbook of Practical Organic Chemistry. Fourth Ed., Longman, London and New York, 1978. WENTWORTH, R. A. D.: "Experiments in General Chemistry", 2da. Ed., Houghton Mifflin Company, U.S.A., 1990. WHITTEN, K.; GAILEY, K. D.; DABAS, R. E.: “Química General" 3ra. Ed., Mc. Graw Hill Interamericana de México, 1992. ISBN. CASTILLO, J.; VERGARA; H.; VIVAS; G.; MARTINEZ; C., “Manual de procedimientos de operación, mantenimiento y seguridad de los equipos de los laboratorios de docencia del departamento de Química”, Popayán, 2005 FRASES R Y FRASES S USADAS EN EL MANUAL DE LABORATORIO FRASES R R 1 Explosivo en estado seco. R 2 Riesgo de explosión por choque, fricción, fuego u otras fuentes de ignición. R 3 Alto riesgo de explosión por choque, fricción, fuego u otras fuentes de ignición. R 4 Forma compuestos metálicos explosivos muy sensibles. R 5 Peligro de explosión en caso de calentamiento. R 6 Peligro de explosión, en contacto o sin contacto con el aire. R 7 Puede provocar incendios. R 8 Peligro de fuego en contacto con materias combustibles. R 9 Peligro de explosión al mezclar con materias combustibles. R10 lnflamable. R11 Fácilmente inflamable. R12 Extremadamente inflamable. R14 Reacciona violentamente con el agua. R15 Reacciona con el agua liberando gases extremadamente inflamables. R16 Puede explosionar en mezcla con sustancias comburentes. R17 Se inflama espontáneamente en contacto con el aire. R18 Al usarlo pueden formarse mezclas aire-vapor explosivas/inflamables. R19 Puede formar peróxidos explosivos. R20 Nocivo por inhalación. R21 Nocivo en contacto con la piel. R22 Nocivo por ingestión. R23 Tóxico por inhalación. R24 Tóxico en contacto con la piel. R25 Tóxico por ingestión. R26 Muy tóxico por inhalación. R27 Muy tóxico en contacto con la piel. R28 Muy tóxico por ingestión. 68 R29 En contacto con agua libera gases tóxicos. R30 Puede inflamarse fácilmente al usarlo. R31 En contacto con ácidos libera gases tóxicos. R32 En contacto con ácidos libera gases muy tóxicos. R33 Peligro de efectos acumulativos. R34 Provoca quemaduras. R35 Provoca quemaduras graves. R36 lrrita los ojos. R37 lrrita las vías respiratorias. R38 lrrita la piel. R39 Peligro de efectos irreversibles muy graves. R40 Posibles efectos cancerígenos. R41 Riesgo de lesiones oculares graves. R42 Posibilidad de sensibilización por inhalación. R43 Posibilidad de sensibilización en contacto con la piel. R44 Riesgo de explosión al calentarlo en ambiente confinado. R45 Puede causar cáncer. R46 Puede causar alteraciones genéticas hereditarias. R48 Riesgo de efectos graves para la salud en caso de exposición prolongada. R49 Puede causar cáncer por inhalación. R50 Muy tóxico para los organismos acuáticos. R51 Tóxico para los organismos acuáticos. R52 Nocivo para los organismos acuáticos. R53 Puede provocar a largo plazo efectos negativos en el medio ambiente acuático. R54 Tóxico para la flora. R55 Tóxico para la fauna. R56 Tóxico para los organismos del suelo. R57 Tóxico para las abejas. R58 Puede provocar a largo plazo efectos negativos en el medio ambiente. R59 Peligroso para la capa de ozono. R60 Puede perjudicar la fertilidad. R61 Riesgo durante el embarazo de efectos adversos para el feto. R62 Posible riesgo de perjudicar la fertilidad. R63 Posible riesgo durante el embarazo de efectos adversos para el feto. R64 Puede perjudicar a los niños alimentados con leche materna. R65 Nocivo: si se ingiere puede causar daño pulmonar. R66 La exposición repetida puede provocar sequedad o formación de grietas en la piel. R67 La inhalación de vapores puede provocar somnolencia y vértigo. R68 Posibilidad de efectos irreversibles. COMBINACIÓN DE LAS FRASES R R14/15 Reacciona violentamente con el agua, liberando gases extremadamente inflamables. R15/29 En contacto con el agua, libera gases tóxicos extremadamente inflamables. R20/21 Nocivo por inhalación y en contacto con la piel. R20/22 Nocivo por inhalación y por ingestión. R20/21/22 Nocivo por inhalación, por ingestión y en contacto con la piel. R21/22 Nocivo en contacto con la piel y por ingestión. R23/24 Tóxico por inhalación y en contacto con la piel. R23/25 Tóxico por inhalación y por ingestión. R23/24/25 Tóxico por inhalación, por ingestión y en contacto con la piel. R24/25 Tóxico en contacto con la piel y por ingestión. R26/27 Muy tóxico por inhalación y en contacto con la piel. R26/28 Muy tóxico por inhalación y por ingestión. R26/27/28 Muy tóxico por inhalación, por ingestión y en contacto con la piel. R27/28 Muy tóxico en contacto con la piel y por ingestión. R36/37 lrrita los ojos y las vías respiratorias. R36/38 lrrita los ojos y la piel. R36/37/38 lrrita los ojos, las vías respiratorias y la piel. 69 R39/23 Tóxico: peligro de efectos irreversibles muy graves por inhalación. R39/24 Tóxico: peligro de efectos irreversibles muy graves por contacto con la piel. R39/25 Tóxico: riesgo de efectos irreversibles muy graves por ingestión. R39/23/24 Tóxico: peligro de efectos irreversibles muy graves por inhalación y contacto con la piel. R39/23/25 Tóxico: peligro de efectos irreversibles muy graves por inhalación e ingestión. R39/24/25 Tóxico: peligro de efectos irreversibles muy graves por contacto con la piel e ingestión. R39/23/24/25 Tóxico: peligro de efectos irreversibles muy graves por inhalación, contacto con la piel e ingestión. R39/26 · Muy tóxico: peligro de efectos irreversibles muy graves por inhalación. R39/27 · Muy tóxico: peligro de efectos irreversibles muy graves en contacto con la piel R39/28 Muy tóxico: peligro de efectos irreversibles muy graves por ingestión. R39/26/27 Muy tóxico: peligro de efectos irreversibles muy graves por inhalación y contacto con la piel. R39/26/28 Muy tóxico: peligro de efectos irreversibles muy graves por inhalación e ingestión. R39/27/28 Muy tóxico: peligro de efectos irreversibles muy graves en contacto con la piel e ingestión. R39/26/27/28 Muy tóxico: peligro de efectos irreversibles muy graves por inhalación, en contacto con la piel e ingestión. R40/20 Nocivo: posibilidad de efectos irreversibles por inhalación. R40/21 Nocivo: posibilidad de efectos irreversibles en contacto con la piel. R40/22 Nocivo: posibilidad de efectos irreversibles por ingestión. R40/20/21 Nocivo: posibilidad de efectos irreversibles por inhalación y contacto con la piel. R40/20/22 Nocivo: posibilidad de efectos irreversibles por inhalación e ingestión. R40/21/22 Nocivo: posibilidad de efectos irreversibles en contacto con la piel e ingestión. R40/20/21/22 Nocivo: posibilidad de efectos irreversibles por inhalación, contacto con la piel e ingestión. R42/43 Posibilidad de sensibilización por inhalación y en contacto con la piel. R48/20 Nocivo: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación. R48/21 Nocivo: riesgo de efectos graves para la salud en caso de exposición prolongada por contacto con la piel. R48/22 Nocivo: riesgo de efectos graves para la salud en caco de exposición prolongada por ingestión. R48/20/21 Nocivo: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación y contacto con la piel. R48/20/22 Nocivo: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación e ingestión. R48/21/22 Nocivo: riesgo de efectos graves para la salud en caso de exposición prolongada por contacto con la piel e ingestión. R48/20/21/22 Nocivo: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación, contacto con la piel e ingestión. R48/23 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación. R48/24 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por contacto con la piel. R48/25 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por ingestión. R48/23/24 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación y contacto con la piel. R48/23/25 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación e ingestión. R48/24/25 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por contacto con la piel e ingestión. R48/23/24/25 Tóxico: riesgo de efectos graves para la salud en caso de exposición prolongada por inhalación, contacto con la piel e ingestión. R50/53 Muy tóxico para los organismos acuáticos, puede provocar a largo plazo efectos negativos en el medio ambiente acuático. 70 R51/53 Tóxico para los organismos acuáticos, puede provocar a largo plazo efectos negativos en el medio ambiente acuático. R52/53 Nocivo para los organismos acuáticos, puede provocar a largo plazo efectos negativos en el medio ambiente acuático. R68/20 Nocivo: posibilidad de efectos irreversibles por inhalación. R68/20/21 Nocivo: posibilidad de efectos irreversibles por inhalación y contacto con la piel. R68/20/21/22 Nocivo: posibilidad de efectos irreversibles por inhalación, contacto con la piel e ingestión. R68/20/22 · Nocivo: posibilidad de efectos irreversibles por inhalación e ingestión. R68/21 · Nocivo: posibilidad de efectos irreversibles en contacto con la piel. R68/21/22 · Nocivo: posibilidad de efectos irreversibles en contacto con la piel e ingestión. R68/22 · Nocivo: posibilidad de efectos irreversibles por ingestión. FRASES S CONSEJOS DE SEGURIDAD S1 Consérvese bajo Ilave. S2 Manténgase fuera del alcance de los niños. S3 Consérvese en lugar fresco. S4 Manténgase lejos de locales habitados. S5 Consérvese en...... S5.1 Consérvese en agua. S5.2 Consérvese en petróleo. S5.3 Consérvese en aceite de parafina. S6 Consérvese en...... S6.1 Consérvese en nitrógeno. S6.2 Consérvese en argón. S7 Manténgase el recipiente bien cerrado. S8 Manténgase el recipiente en lugar seco. S9 · Manténgase el recipiente en lugar bien ventilado. S12 No cerrar el recipiente herméticamente. S13 Manténgase lejos de alimentos, bebidas y piensos. S14 Consérvese lejos de...... S14.1 Consérvese lejos de reductores, compuestos de metales pesados, ácidos y álcalis. S14.2 Consérvese lejos de sustancias oxidantes y ácidas y de compuestos de metales pesados. S14.3 Consérvese lejos de hierro. S14.4 Consérvese lejos de agua y lejías. S14.5 Consérvese lejos de ácidos. S14.6 Consérvese lejos de lejías. S14.7 Consérvese lejos de metales. S14.8 Consérvese lejos de sustancias oxidantes y ácidas. S14.9 Consérvese lejos de sustancias orgánicas combustibles. S14.10 Consérvese lejos de ácidos, reductores y materiales combustibles. S14.11 Consérvese lejos de sustancias combustibles. S15 Conservar alejado del calor. S16 Conservar alejado de toda llama o fuente de chispas - No fumar. S17 · Manténgase lejos de materias combustibles. S18 Manipúlese y ábrase el recipiente con prudencia. S20 No comer ni beber durante su utilización. S21 No fumar durante su utilización. S22 No respirar el polvo. S23 No respirar los gases, humos, vapores, aerosoles. S23.1 No respirar el gas. S23.2 No respirar los vapores. S23.3 No respirar los aerosoles. S23.4 No respirar el humo. S23.5 No respirar los vapores/aerosoles. S 24 Evítese el contacto con la piel. 71 S25 Evítese el contacto con los ojos. S26 En caso de contacto con los ojos, lávense inmediata y abundantemente con agua y acúdase a un médico. S27 Quítese inmediatamente la ropa manchada o salpicada. S28 En caso de contacto con la piel, lávese inmediata y abundantemente con… S28.1 En caso de contacto con la piel, lávese inmediata y abundantemente con agua. S28.2 En caso de contacto con la piel, lávese inmediata y abundantemente con agua y jabón. S28.3 En caso de contacto con la piel, lávese inmediata y abundantemente con agua y jabón a ser posible también con polietilenglicol 400. S28.4 En caso de contacto con la piel, lávese inmediata y abundantemente con polietilenglicol 300 y etanol (2:1) y a continuación con abundante agua y jabón. S28.5 En caso de contacto con la piel, lávese inmediata y abundantemente con polietilenglicol 400. S28.6 En caso de contacto con la piel, lávese inmediata y abundantemente con polietilenglicol 400 y a continuación lavar con agua abundante. S28.7 En caso de contacto con la piel, lávese inmediata y abundantemente con agua y jabón ácido. S29 No tirar los residuos por el desagüe. S30 No echar jamás agua a este producto. S33 Evítese la acumulación de cargas electroestáticas. S35 Elimínense los residuos del producto y sus recipientes con todas las precauciones posibles. S36 Úsese indumentaria protectora adecuada. S37 Úsense guantes adecuados. S38 En caso de ventilación insuficiente, úsese equipo respiratorio adecuado. S39 Úsese protección para los ojos/la cara. S40 Para limpiar el suelo y los objetos contaminados por este producto, úsese...... S40. Para limpiar el suelo y los objetos contaminados por este producto, úsese bastante agua. S41 En caso de incendio y/o de explosión no respire los humos. S42 Durante las fumigaciones /pulverizaciones, úsese equipo respiratorio adecuado. S43 En caso de incendio, no usar nunca agua. S43.1 En caso de incendio, utilizar agua. S43.2 En caso de incendio, utilizar agua o extintor de polvo. S43.3 En caso de incendio, utilizar extintor de polvo - no usar nunca agua. S43.4 En caso de incendio, utilizar carbono dióxido - no usar nunca agua. S43.6 En caso de incendio, utilizar arena - no usar nunca agua. S43.7 En caso de incendio, utilizar polvo extintor para metales - no usar nunca agua. S43.8 En caso de incendio utilizar arena, carbono dióxido o extintor de polvo - no usar nunca agua. S45 En caso de accidente o malestar, acúdase inmediatamente al médico (si es posible, muéstresele la etiqueta). S46 En caso de ingestión, acúdase inmediatamente al médico y muéstresele la etiqueta o el envase. S47 Consérvese a una temperatura no superior a..."C. S47.1 Consérvese a una temperatura no superior a 25 "C. S48 Consérvese húmedo con..... S48.1 Consérvese húmedo con agua. S49 11 Consérvese únicamente en el recipiente de origen. S50 · No mezclar con...... S50.1 No mezclar con ácidos. S50.2 No mezclar con lejías. S50.3 No mezclar con ácidos fuertes, bases fuertes, metales no férricos y sus sales. S51 Úsese únicamente en lugares bien ventilados. S52 No usar sobre grandes superficies en locales habitados. S53 Evítese la exposición – recábense instrucciones especiales antes del uso. S56 Elimínense esta sustancia y su recipiente en un puesto de recogida pública de residuos especiales o peligrosos. S57 Utilícese un envase de seguridad adecuado para evitar la contaminación del medio ambiente. 72 S59 Remitirse al fabricante o proveedor para obtener información sobre su recuperación/reciclado. S60 Elimínese el producto y su recipiente como residuos peligrosos. S61 Evítese su liberación al medio ambiente. Recábense instrucciones específicas de la ficha de datos de seguridad. S62 En caso de ingestión no provocar el vómito: acúdase inmediatamente al médico y muéstresele la etiqueta o el envase. S63 En caso de accidente por inhalación, alejar a la víctima fuera de la zona contaminada y mantenerla en reposo. S64 En caso de ingestión, lavar la boca con agua (solamente si la persona está consciente). COMBINACION DEN LAS FRASES S S1/2 Consérvese bajo llave y manténgase fuera del alcance de los niños S3/7 Consérvese el recipiente bien cerrado y en lugar fresco S3/9/14 Consérvese en lugar fresco y bien ventilado y lejos de …. S3/9/14.1 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de reductores, compuestos de metales pesados y álcalis S3/9/14.2 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de sustancias oxidantes y ácidas y de compuestos de metales pesados. S3/9/14.3 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de hierro. S3/9/14.4 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de agua y lejías. S3/9/14.5 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de ácidos. S3/9/14.6 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de lejías. S3/9/14.7 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de metales S3/9/14.8 Consérvese el recipiente en lugar fresco y bien ventilado y lejos de sustancias oxidantes y ácidas. S3/9/14/49 Consérvese únicamente en el recipiente de origen, en lugar fresco y bien ventilado y lejos de...... S3/9/14.1/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de reductores, compuestos de metales pesados, ácidos y álcalis. S3/9/14.2/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de sustancias oxidantes y ácidas y de compuestos de metales pesados. S3/9/14.3/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de hierro. S3/9/14.4/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de agua y lejías. S3/9/14.5/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de ácidos. S3/9/14.6/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de lejías. S3/9/14.7/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de metales. S3/9/14.8/49 Consérvese únicamente en el recipiente de origen en lugar fresco y bien ventilado y lejos de sustancias oxidantes y ácidas. S3/9/49 Consérvese únicamente en el recipiente de origen, en lugar fresco y bien ventilado. S3/14 Consérvese en lugar fresco y lejos de......... S3/14.1 Consérvese en lugar fresco y lejos de reductores, compuestos de metales pesados, ácidos y álcalis. S3/14.2 Consérvese en lugar fresco y lejos de sustancias oxidantes y ácidas y de compuestos de metales pesados. S3/14.3 Consérvese en lugar fresco y lejos de hierro. S3/14.4 Consérvese en lugar fresco y lejos de agua y lejías. S3/14.5 Consérvese en lugar fresco y lejos de ácidos. S3/14.6 Consérvese en lugar fresco y lejos de lejías. S3/14.7 Consérvese en lugar fresco y lejos de metales. S3/14.8 Consérvese en lugar fresco y lejos de sustancias oxidantes y ácidas. S7/8 Manténgase el recipiente bien cerrado y en lugar seco. S7/9 Manténgase el recipiente bien cerrado y en lugar bien ventilado. 73 S7/47 Manténgase el recipiente bien cerrado y consérvese a una temperatura no superior a ....."C. S20/21 No comer, ni beber, ni fumar durante su utilización. S24/25 Evítese el contacto con los ojos y la piel. S27/28 Después del contacto con la piel, quítese inmediatamente toda la ropa manchada o salpicada y lávese inmediata y abundantemente con ... S29/35 No tirar los residuos por el desagüe; elimínense los residuos del producto y sus recipientes con todas las precauciones posibles. S29/56 No tirar los residuos por el desagüe. Elimínense esta sustancia y su recipiente en un punto de recogida pública de residuos especiales o peligrosos. S36/37 Use indumentaria y guantes de protección adecuados. S36/37/39 Use indumentaria y guantes adecuados y protección para los ojos/la cara. S36/39 Use indumentaria adecuada y protección para los ojos/la cara. S37/39 Use guantes adecuados y protección para los ojos/la cara. S47/49 · Consérvese únicamente en el recipiente de origen y a temperatura no superior a..."C. 74