PLATELIA™ Candida Ag Plus 62784 - Bio-Rad
Anuncio

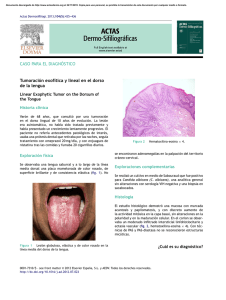
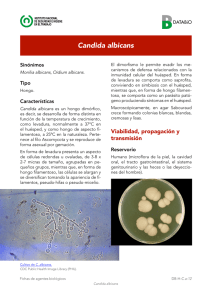
PLATELIA™ Candida Ag Plus 96 62784 DETECCIÓN DE ANTÍGENO MANANO DE CANDIDA EN SUERO O EN PLASMA HUMANO MEDIANTE EL MÉTODO INMUNOENZIMÁTICO 1- CAMPO DE APLICACIÓN Platelia™ Candida Ag Plus es una técnica inmunoenzimática de tipo sándwich en microplaca para la detección del antígeno manano de Candida en el suero o en el plasma humano. 2- INDICACIONES DE USO El diagnóstico de la candidiasis invasiva se debe basar en la búsqueda combinada de anticuerpos y de antígenos circulantes. 13 Platelia™ Candida Ag Plus (Código 62784) es una prueba que, utilizada en combinación con Platelia™ Candida Ab Plus (código 62785), contribuye a mejorar la precocidad 11 y la sensibilidad de este diagnóstico en el marco de un método de diagnóstico completo que integra los factores de riesgo intrínsecos y yatrógenos, así como los datos clínicos y micológicos 10, 13, 14 . Asimismo, se inscribe dentro de la lógica de un sistema de evaluación bioclínica de los pacientes a modo de ayuda para la toma de decisiones terapéuticas. 8 3- INTERÉS CLÍNICO Las infecciones del tipo Candida son, en primer lugar, infecciones nosocomiales fúngicas; las candidemias representan la cuarta causa de las septicemias de origen nosocomial. 12, 15, 16 En el ámbito clínico, las candidiasis invasivas son las que presentan mayor gravedad, con un índice de mortalidad que varía entre el 30 y el 70% en el caso de los pacientes inmunodeprimidos. Su diagnóstico es difícil de establecer debido a la poca especificidad de los síntomas clínicos y a la tenue sensibilidad del hemocultivo. A menudo, son sólo unos cuantos argumentos los que permiten el diagnóstico de una candidiasis invasiva y el establecimiento de un tratamiento adecuado 2. En este contexto, el diagnóstico de las candidiasis sistémicas debe conjugar obligatoriamente las técnicas serológicas y los métodos micológicos directos. La búsqueda de antígenos circulantes en el suero o en el plasma parece ser un método que permite mejorar este diagnóstico en el caso de pacientes con riesgo de padecer candidiasis invasiva 10, 13, 14. Las causas principales incluyen la neutropenia después del tratamiento con quimioterapia o con terapia inmunosupresora (tratamiento de cáncer, oncohematología, transplante) 4, 10 , la terapia antibiótica de amplio espectro, la presencia de catéteres venosos, la nutrición parenteral, la diálisis renal y la implantación de prótesis (reanimación médica y quirúrgica). 5, 13, 16 Entre los antígenos de Candida, el manano es un polisacárido que se une de manera no covalente a la pared y representa más del 7% del peso seco de C.albicans. Este antígeno se presenta como uno de los principales indicios de las candidiasis invasivas. 48 El seguimiento periódico de los pacientes de riesgo, combinado con la detección del antígeno manano y de los anticuerpos antimanano, constituye una ayuda para el diagnóstico de las candidiasis invasivas. 9, 10, 13 4- PRINCIPIOS DEL MÉTOD Platelia™ Candida Ag Plus es una técnica inmunoenzimática de tipo sándwich realizada en una etapa, sobre microplaca, que permite detectar el antígeno circulante manano de Candida en el suero o en el plasma humano. El anticuerpo monoclonal (Acm) de rata, EBCA-1, dirigido contra los α 1-5 oligomanosídicos de Candida y descrito en trabajos anteriores 13, 14, se utiliza para: • Sensibilizar los pocillos de la microplaca y unirse al antígeno manano. • Detectar el antígeno fijado a la microplaca sensibilizada (conjugado: Acm marcado con peroxidasa). Las muestras de suero o de plasma se tratan con calor en presencia de EDTA para disociar los complejos inmunes y precipitar las proteínas séricas para poder interferir finalmente con la reacción inmunoenzimática. Las muestras de suero o de plasma tratadas y el conjugado se distribuyen en los pocillos de la microplaca sensibilizados con el anticuerpo monoclonal antimanano. Después de la incubación a 37°C, las tiras se lavan para eliminar todo el material que no haya quedado fijado. Si hay presencia de manano circulante en la muestra humana, se forma un complejo: Ac antimanano – manano - Ac antimanano / peroxidasa. Si se añade el cromógeno que contiene la peroxidasa y se incuba a temperatura ambiente, es posible observar los complejos que se han formado. La reacción enzimática se detiene al añadir ácido sulfúrico 1N. La lectura de la densidad óptica se efectúa con un espectrofotómetro regulado a 450 / 620 nm. 5-REACTIVOS Los reactivos son suministrados en cantidad suficiente para realizar 96 determinaciones en un máximo de 9 series. Remitirse a las indicaciones mencionadas en la caja para conocer las condiciones de conservación y la fecha de caducidad de los reactivos. Esperar a que los reactivos alcancen la temperatura ambiente (+1830°C) antes de su utilización. Volver a poner los reactivos a +2-8°C inmediatamente después de su utilización. Devolver las tiras no utilizadas a su envoltorio de origen y cerrar con cuidado. No retirar el desecante. 49 Componente R1 R2 R3 Contenido Microplaca: - 96 pocillos (12 tiras de 8 pocillos cada una) Microplate sensibilizados con el anticuerpo monoclonal antimanano EBCA-1. Solución de lavado concentrada (20 x): Concentrated - Tampón Tris-NaCl (pH 7,4) Washing - 2%Tween® 20 Solution (20x) - Conservante: < 1,5% ProClin™ 300 Calibrator 0 Calibrador 0 pg/ml (listo para su uso): - Tampón Tris-NaCl-Trehalosa, sin manano purificado de Candida albicans - Conservante: < 1,5% ProClin™ 300 Calibrador 62,5 pg/ml (listo para su uso): - Tampón Tris-NaCl-Trehalosa - Manano purificado de Candida albicans - Conservante: < 1,5% ProClin™ 300 Calibrador 125 pg/ml (listo para su uso): - Tampón Tris-NaCl-Trehalosa R4b Calibrator 125 - Manano purificado de Candida albicans - Conservante: < 1,5% ProClin™ 300 Calibrador 250 pg/ml (listo para su uso): - Tampón Tris-NaCl-Trehalosa R4c Calibrator 250 - Manano purificado de Candida albicans - Conservante: < 1,5% ProClin™ 300 Calibrador 500 pg/ml (listo para su uso): - Tampón Tris-NaCl-Trehalosa R4d Calibrator 500 - Manano purificado de Candida albicans - Conservante: < 1,5% ProClin™ 300 R4a Calibrator 62.5 Cantidad 1 1 x 70 ml 1 x 2,0 ml 1 x 2,0 ml 1 x 2,0 ml 1 x 2,0 ml 1 x 2,0 ml R0 Negative Control Control Negativo: - Suero humano para manano - Conservante: < 1,5% ProClin™ 300 2 x 1,5 ml R5 Positive Control Control positivo: - Suero humano con contenido de manano - Conservante: < 1,5% ProClin™ 300 2 x 1,5 ml 1 x 17 ml R6 Conjugate Conjugado (listo para su uso): - Anticuerpo monoclonal antimanano, marcado con peroxidasa - Púrpura de bromocresol - Conservante:<1,5% ProClin™ 300 R7 Sample Treatment Solution Solución de tratamiento de muestras (lista para su uso): - solución ácida de EDTA sin conservante 50 1 x 10,5 ml Componente R9 Chromogen TMB R10 Stopping Solution Contenido Cantidad Solución TMB cromógeno (lista para su uso): - Solución de 3,3’,5,5’ - tetrametilbenzidina (< 0,1%), H2O2 (<1,0%) 1 x 28 ml Solución de parada (lista para su uso): - Solución de ácido sulfúrico 1N 1 x 28 ml Películas adhesivas 4 6- INSTRUCCIONES DE HIGIENE Y SEGURIDAD 1.Sólo para diagnóstico in vitro. 2.Únicamente para uso profesional. 3.No se recomienda la utilización de esta prueba con otras muestras que no sean de suero o plasma humano. 4.El control negativo (R0) y el control positivo (R5) son preparados a base de suero humano sometido a prueba y que ha resultado negativo en anticuerpos anti-VIH-1, anti-VIH-2, anti-VHC, así como en antígeno HBs con pruebas marcadas CE. No obstante, todos los reactivos deben ser manipulados como si fueran potencialmente infecciosos. Todas las pruebas deben realizarse conforme a la norma OSHA relativa a los agentes patógenos transmitidos por vía hematógena, a un nivel 2 de bioseguridad o conforme a otras prácticas de bioseguridad adaptadas. 5.Llevar ropa de protección, que incluya una bata de laboratorio, una protección para los ojos y la cara y guantes desechables (se recomiendan guantes de material sintético sin látex) y manipular los reactivos del kit así como las muestras de los pacientes de acuerdo con las Buenas Prácticas de Laboratorio (BPL) requeridas. Lavarse las manos cuidadosamente tras la realización de la prueba. 6.No pipetear con la boca. 7.No fumar, beber ni comer en las zonas de manipulación de las muestras o de los reactivos del kit. 8.Evitar las salpicaduras de muestras o de soluciones. 9.Limpiar con ayuda de un desinfectante eficaz las superficies manchadas con líquidos contaminantes sin ácido. Los desinfectantes que se pueden utilizar (sin excluir otros) son una solución de lejía diluida al 10% (solución con 0,5% de hipoclorito de sodio), de etanol al 70% o de Wescodyne Plus™ al 0,5%. El material utilizado para la limpieza deberá ser desechado arrojándose a un contenedor especial para residuos contaminantes. CUIDADO: No verter soluciones que contengan lejía en el autoclave. 51 10.Si el líquido contaminante es un ácido, limpiar o neutralizar las superficies manchadas con bicarbonato sódico y aclarar y secar la zona; en caso de que el líquido contaminante contuviera materia biológicamente peligrosa, limpiar la zona con un desinfectante químico. 11.Eliminar todas las muestras y los reactivos utilizados en la prueba como si fueran potencialmente infecciosos. La eliminación de los desechos químicos y biológicos peligrosos se debe realizar de acuerdo con las exigencias en vigor. 12.CUIDADO: A continuación, se listan los posibles riesgos químicos que pueden presentar ciertos componentes del kit (ver capítulo 5REACTIVOS). ATENCIÓN: Algunos reactivos contienen ProClin™ 300 < 1,5% Para conocer los riesgos y las recomendaciones de seguridad consulte la tabla que aparece al final del prospecto 13.La ficha de datos de seguridad (FDS) está disponible bajo petición. 7- PRECAUCIONES DE USO 1.LAS MUESTRAS DE SUERO O DE PLASMA CONGELADAS QUE HAYAN SIDO ALMACENADAS EN CONDICIONES DESCONOCIDAS PUEDEN OFRECER RESULTADOS FALSAMENTE POSITIVOS DEBIDO A LA CONTAMINACIÓN DE UN HONGO Y / O DE UNA BACTERIA. 2.No utilizar el kit ni ninguno de los reactivos después de la fecha de caducidad. 3.No mezclar, ni asociar durante una misma serie, reactivos procedentes de cajas con números de lote diferentes. OBSERVACIÓN: Es posible utilizar otros lotes de Solución de Lavado (R2, identificado* 20x en color verde), de Cromógeno (R9, identificado* TMB en color turquesa) y de Solución de Parada (R10, identificado* 1N en color rojo) diferentes a los que se suministran con el kit, a condición de utilizar reactivos estrictamente equivalentes de un solo y único lote durante una misma serie. OBSERVACIÓN: la Solución de lavado (R2, identificado* 20x en color verde) no se puede mezclar con la Solución de Lavado (R2, identificado* 10x en color azul) que incluyen los kits reactivos BioRad. * en la etiqueta del frasco 4.Esperar 30 minutos antes de la utilización para que los reactivos alcancen la temperatura ambiente (+18-30°C). 52 5.Es preferible utilizar material de un solo uso. En su defecto, utilizar instrumentos de cristal perfectamente lavados y aclarados con agua destilada. 6.Comprobar la exactitud de las pipetas y el buen funcionamiento de los aparatos utilizados. 7.Reconstituir el reactivo R2 con cuidado, evitando cualquier contaminación. 8.La reacción enzimática es muy sensible a todos los metales o iones metálicos. Por ello, ningún elemento metálico debe entrar en contacto con las diferentes soluciones que contengan el conjugado o la solución sustrato. 9.Utilizar un nuevo cono de distribución para cada suero al realizar el pipetaje de los calibradores, los controles y de las muestras. Así se evitará cualquier contaminación. 10.Para asegurarse de que los pocillos se lavan correctamente, hay que ajustarse al número de ciclos de lavado recomendados y asegurarse de que todos los pocillos están completamente llenos y después completamente vacíos. El lavado debe realizarse con un lavador de microplacas. 11.No dejar que la microplaca se seque entre el fin del ciclo de lavado y la adición de los reactivos. 12.No utilizar el mismo recipiente para el conjugado y para la solución de revelado. 13.Evitar la exposición de la solución de cromógeno o de la solución de revelado a una luz fuerte durante el almacenaje o la incubación. No dejar que las soluciones que contienen cromógeno entren en contacto con un agente oxidante. 14.El Cromógeno (R9) debe ser incoloro. La aparición de una coloración azul indica la inutilidad del reactivo, por lo que debe ser reemplazado. 15.Evitar que la solución de parada entre en contacto con cualquier agente oxidante, con metal o con iones metálicos. 16.No verter los restos de conjugado no distribuido en el frasco original. 8- PREPARACIÓN Y CONSERVACIÓN DE LOS REACTIVOS Microplaca (R1) Cada soporte de 12 tiras viene envasado en su envoltorio. Cortar el envoltorio por debajo del cierre con ayuda de unas tijeras. Abrir el envoltorio y sacar el soporte. Devolver el soporte con las tiras no utilizadas a su envoltorio original. Cerrar con cuidado el envoltorio y ponerlo de nuevo a +2-8°C. Tras la abertura del envoltorio al vacío, las tiras conservadas a +2-8°C en su envoltorio original, cerrado con cuidado, permanecen estables durante 8 semanas. Comprobar que haya desecante. 53 Solución de lavado (R2) Preparar la solución de lavado diluyendo 20 veces la solución de lavado concentrada en agua destilada: 50ml de R2 en 950ml de agua destilada. (prever 400ml de solución de lavado diluida para una placa de 12 tiras sin volumen muerto debido al aparato utilizado). Una vez diluida, la solución de lavado se puede conservar durante 14 días a +2-30°C. Una vez abierta, la solución de lavado concentrada conservada a +2-30°C, libre de contaminación, permanece estable hasta la fecha de caducidad que se indica en la etiqueta. Calibrador 0 (R3), Calibrador 62,5 (R4a), Calibrador 125 (R4b), Calibrador 250 (R4c), Calibrador 500 (R4d): Los calibradores están listos para su uso. Una vez abiertos, los reactivos conservados a +2-8°C y libres de contaminación permanecen estables durante 8 semanas. Control Negativo (R0), Control Positivo (R5): El control negativo (R0) y el control positivo (R5) se deben, tratarse con la solución ácida EDTA (R7) como las muestras de los pacientes, con el objetivo de ser también un control de tratamiento. Una vez abierto, los reactivos conservados a +2-8°C y libres de contaminación permanecen estables durante 8 semanas. Conjugado (R6), Solución de tratamiento de muestras (R7), Solución TMB cromógeno (R9): Estos reactivos están listos para su uso. Una vez abiertos, los reactivos conservados a +2-8°C y libres de contaminación permanecen estables durante 8 semanas. Solución de parada (R10): Este reactivo está listo para su uso. Una vez abierto, este reactivo conservado a +2-8°C y libre de contaminación permanece estable hasta la fecha de caducidad que se indica en la etiqueta. 9-MUESTRAS 1.Las pruebas se realizan sobre muestras de suero o de plasma recogido mediante anticoagulante del tipo EDTA, heparina o citrato. 2.Respetar las siguientes indicaciones para la extracción, el tratamiento y la conservación de las muestras de sangre: • Extraer una muestra de sangre siguiendo las prácticas de uso. • En el caso de los sueros, dejar que el coágulo se forme totalmente antes de centrifugar. • Conservar los tubos cerrados. 54 • Extraer el suero o el plasma tras el centrifugado y conservarlo en tubos cerrados. • Las muestras se conservarán a +2-8°C si la prueba se realiza en 5 días. • Si la prueba no se realiza en 5 días, las muestras se congelarán a -20°C (ó -80°C). • No se recomienda llevar a cabo más de cinco ciclos de congelación / descongelación. Las muestras deberán ser homogeneizadas minuciosamente (Vortex) tras la descongelación y antes de realizar la prueba. 3.Los resultados no se ven afectados por las muestras que contienen 60 g/l de albúmina humana o 120 g/l en proteínas totales o 200 mg/l de bilirrubina no conjugada o 200 mg/l de bilirrubina conjugada, por las muestras que contienen el equivalente a 30 g/l de trioleína (triglicérido) ó 5g/l de colesterol ni por las muestras hemolizadas que contienen 2 g/l de hemoglobina. 4.No calentar las muestras. 10-MODO DE ACTUACIÓN Material suministrado Ver el capítulo REACTIVOS Material necesario no suministrado 1.Agua destilada o agua desmineralizada estéril para diluir la solución concentrada de lavado. 2.Papel absorbente. 3.Guantes de un solo uso. 4.Gafas de protección. 5.Hipoclorito de sodio (lejía) y bicarbonato sódico. 6.Pipetas o multipipetas, automáticas o semiautomáticas, regulables o fijas, que puedan medir y liberar 10 µl a 1000 µl, 1 ml, 2 ml y 10 ml. 7.Tubos de micro centrifugación en polipropileno de 1,5 ml con tapones herméticos, capaces de soportar una temperatura de 120°C (bloque calentador) o 100°C (baño María hirviendo) • Tubos con tapa roscada: tubos cónicos de 1,5 ml, Bio-Rad ref. 2240010 o equivalente. Ó • Tubos con capuchón adherido: EZ Micro Test Tubes, 1,5 ml, Bio-Rad ref. 223-9480 o equivalente. 8.Abrazaderas de cierre hermético (VWR ref. 6054001 o equivalente). Estas abrazaderas cierran herméticamente los tubos con capuchón adherido impidiendo cualquier abertura accidental durante los cambios de temperatura o de presión. Una pequeña asa permite retirar el microtubo del bloque calentador o del baño María, evitando así cualquier riesgo de quemaduras. 55 9.Centrifugadora de mesa de laboratorio para tubos de polipropileno de 1,5 ml capaz de alcanzar 10.000 g. 10.A la hora de utilizar el bloque calentador para el tratamiento de sueros: • Bloque calentador. Se recomiendan los siguientes modelos de bloque calentador: - modelo con 1 bloque: Grant ref. QBD1 (VWR ref. 460-0074) - modelo con 2 bloques: Grant ref. QBD2 (VWR ref. 460-0076) • Bloque para bloque calentador: los dos bloques calentadores (QBD1, QBD2) se deben utilizar con el bloque Grant ref. QB-E1 (VWR ref. 4608517). A la hora de utilizar el baño María hirviendo para el tratamiento de sueros: • Gradilla flotante para tubos de microcentrifugación • Baño María hirviendo que admita un termostato a 100°C. 11.Probetas graduadas de 25 ml, 50 ml, 100 ml y 1000 ml. 12.Contenedor de desechos contaminados. 13.Agitador tipo «Vortex». 14.Incubadora de microplacas que admita un termostato a 37°C ± 1°C (*). 15.Lavador de microplacas semiautomático o automático (*). 16.Lector de microplacas equipado con filtros de 450 y 620 nm (*). (*) Póngase en contacto con nosotros para recibir una información más precisa sobre los aparatos validados por nuestro servicio técnico. Tratamiento de las muestras El control negativo (R0) y el control positivo (R5) se deben tratarse al mismo tiempo que todas las muestras de pacientes mediante la adición de 100 µl de solución de tratamiento R7. Los calibradores R3, R4a, R4b, R4c y R4d listos para su uso no deben seguir este tratamiento. 1.Distribuir 300 µl de cada una de las muestras que se va a someter a prueba y del control de negativo (R0) y del control de positivo (R5) en tubos de polipropileno de 1,5 ml. 2.Añadir 100 µl de la solución de tratamiento de los sueros (R7) en cada tubo. 3.Homogeneizar enérgicamente con Vortex. Cerrar el tubo con ayuda de una abrazadera de cierre hermético para evitar que se abra accidentalmente durante el calentamiento. No agujerear el tapón. 4.Bloque calentador: Colocar los tubos en un bloque calentador durante 6 minutos a 120°C. Los tubos se deben colocar en el bloque solo cuando se haya alcanzado la temperatura de consigna.(*) Ó 56 Baño María: En caso de utilizar el baño María: calentar los tubos durante 3 minutos a 100°C.(*) 5.Retirar con cuidado los tubos calientes del bloque calentador o del baño María y colocarlos en una centrifugadora. Centrifugar los tubos a 10.000 g durante 10 minutos. 6.El sobrenadante se utiliza para la detección del antígeno manano. Someter a prueba los sobrenadantes utilizando el siguiente procedimiento. La prueba se debe realizar en las dos horas que siguen al tratamiento del suero o del plasma. (*) El respeto estricto de las consignas de duración y de temperatura, así como la utilización del material recomendado son factores esenciales para el éxito de la prueba. Por ello, no hay que fiarse de la temperatura que indican los aparatos y conviene verificar que la temperatura se corresponde con las especificaciones utilizando una sonda térmica que se introducirá en un tubo que contiene aceite mineral: Se deben alcanzar 120°C en el interior del tubo en el bloque calentador y 100°C en el interior del tubo en el baño María hirviendo. NOTA: • Todas las muestras tratadas de acuerdo con este procedimiento se pueden utilizar con la prueba Platelia™ Aspergillus EIA, ya que los procedimientos para el tratamiento de las muestras son los mismos en ambas pruebas. • No conservar las muestras (control negativo, control positivo y muestras) después del tratamiento. Método EIA Seguir de manera estricta el protocolo propuesto. Aplicar las Buenas Prácticas de Laboratorio: • Antes de su utilización, esperar al menos 30 minutos hasta que los reactivos alcancen la temperatura ambiente (18-30°C). • Utilizar todos los calibradores, el control negativo y el control positivo en cada dosificación para validar la calidad de la prueba. Proceder como se explica a continuación: 1. Establecer minuciosamente el plan de distribución y de identificación de los calibradores, de control negativo, de control positivo y de las muestras de acuerdo con el siguiente esquema: - A1: Control positivo R5 (sobrenadante del control tratado) - B1: Calibrador 500 pg/ml (R4d) - C1: Calibrador 250 pg/ml (R4c) - D1: Calibrador 125 pg/ml (R4b) 57 - E1: Calibrador 62,5 pg/ml (R4a) - F1: Calibrador 0 pg/ml (R3) - G1: Control negativo (R0) (sobrenadante del control tradado) 1 2 3 5 6 7 8 9 10 11 12 A R5 S2 S10 4 B R4d S3 S11 C R4c S4 D R4b S5 E R4a S6 F R3 S7 G R0 S8 H S1 S9 2.Sacar el soporte y las tiras (R1) del envoltorio protector. Devolver las tiras no utilizadas a su envoltorio de origen y cerrar con cuidado. 3.Distribuir 100 µl de sobrenadante de muestra, de control R0 y de control R5 tratados en los pocillos correspondientes. 4.A continuación, distribuir 100 µl de R4d, R4c, R4b, R4a y R3 de acuerdo con el esquema de la placa. NOTA: En esta fase de manipulación es posible controlar la distribución del rango de calibración. De hecho, el rango presenta un degradado de color que va desde el naranja (R4d) hasta el amarillo claro (R3). 5.Homogeneizar el contenido del frasco R6 volteándolo antes de su utilización. En caso de utilizar una pipeta multicanales, extraer solamente el volumen necesario para la realización de la serie: prever 2,5 ml para dos tiras de 8 cúpulas. 6.Distribuir 100 µl de solución de conjugado (R6) en cada pocillo. 7.Cubrir la microplaca con una película adhesiva extendiéndola bien sobre toda la superficie para garantizar la impermeabilidad. 8.Incubar inmediatamente la microplaca en una incubadora seca de microplacas durante 90 ± 10 minutos a 37°C (± 1°C). 9.Preparar la solución de lavado diluida (ver el capítulo 8). 10.Retirar la película adhesiva. Aspirar el contenido de cada pocillo y verterlo en un contenedor de desechos contaminados (que contenga hipoclorito de sodio). Lavar la microplaca 5 veces con la ayuda de un lavador de microplacas con 800 µl de solución de lavado diluida. Después del último lavado, dar la vuelta a la microplaca y golpear ligeramente sobre el papel absorbente para retirar el líquido restante. 58 11.Protegiéndola contra la luz fuerte, distribuir rápidamente 200 µl de la solución de cromógeno TMB (R9) en cada pocillo. 12.Incubar la microplaca en la oscuridad a +19-25°C durante 30 ± 5 minutos. No utilizar la película adhesiva durante esta fase de la incubación. 13.Añadir 100 µl de solución de parada (R10) en cada pocillo, siguiendo el mismo orden y el mismo ritmo al añadir la solución de revelado. Mezclar bien. 14.Secar con cuidado la parte inferior de cada placa. 15.Leer la densidad óptica de cada pocillo a 450 nm (filtro de referencia a 620 nm) en los 30 minutos que siguen a la adición de la solución de parada (manteniendo siempre las tiras protegidas de la luz antes de la lectura). 16.Asegurarse de la concordancia entre la lectura y el plan de distribución de placas antes de transcribir los resultados. 11-CONTROL DE CALIDAD (CRITERIOS DE VALIDEZ) Utilizar los calibradores y los controles en todas las microplacas para cada análisis. Para validar la prueba, se deben respetar los siguientes criterios: • Valores de la densidad óptica: DO R4a > 0,280 DO R0 < DO R4a • Cocientes: DO R4a / DO R3 > 1,25 DO R4b / DO R4a > 1,15 DO R4c / DO R4b > 1,15 DO R4d / DO R4c > 1,20 • Concentración de manano en el control positivo R5: La concentración de R5 debe ser igual a la que se indica en la concentración indicada en el frasco ± 30%. 12-INTERPRETACIÓN DE LOS RESULTADOS Trazado de la curva de calibración La curva de calibración se realiza con los 5 puntos del rango (calibradores) 0 pg/ml; 62,5 pg/ml, 125 pg/ml ; 250 pg/ml y 500 pg/ml. Trazar la curva de calibración [DO = función (pg/ml)] trasladando sobre el eje vertical (eje de las Y) las DO de los calibradores R3, R4a, R4b, R4c y R4d, y después trasladando su concentración respectiva en pg/ml sobre el eje horizontal (eje de las X). Optar por un trazado punto a punto uniendo los diferentes puntos del rango. 59 Determinación de la concentración de manano (pg/ml) de las muestras sometidas a la prueba. A partir de la curva trazada con anterioridad, es posible determinar la concentración de manano expresada en pg/ml por cada una de las muestras sometidas a la prueba. Interpretación de los resultados • Las muestras cuyas concentraciones sean inferiores a 62,5 pg/ml (C < 62,5) se consideran «negativas» en relación con la presencia de antígeno manano. • Las muestras cuyas concentraciones estén comprendidas entre 62,5 y 125 pg/ml (62,5 ≤ C < 125) se consideran «intermediarias» en relación con la presencia de antígeno manano. • Las muestras cuyas concentraciones sean iguales o superiores a 125 pg/ ml (C ≥ 125) se consideran «positivas» en relación con la presencia de antígeno manano. • Los calibradores utilizados para el trazado de la curva de calibración no permiten una volumetría de las concentraciones superiores a 500 pg/ml. Es conveniente empezar la prueba de nuevo después de la predilución al 1/5o del sobrenadante de la muestra tratada (nuevo tratamiento) con la solución de lavado (R2) diluida (remitirse al capítulo 8) con el fin de conocer con mayor precisión la concentración de muestras potencialmente positivos. La concentración que se obtenga deberá multiplicarse por un factor 5. Se podrá confirmar un resultado «intermedio» sobre una nueva muestra extraída al paciente en las semanas posteriores a la fecha de la extracción que haya dado una concentración intermedia. 13-LÍMITES DE USO 1.Una prueba negativa no puede excluir el diagnóstico de candidiasis invasiva debido a la débil concentración de antígenos en el momento de la infección y de la rápida eliminación del manano. El diagnóstico de la candidiasis invasiva sólo se puede plantear tras la confrontación de los argumentos clínicos, terapéuticos, radiológicos, citológicos, micológicos directos y serológicos, tomando cada elemento de manera aislada e interpretándolo con prudencia. 2.La negatividad de la antigenemia también debe confrontarse con el resultado de la búsqueda de los anticuerpos antimanano: incluso en el caso de la candidiasis invasiva, es más difícil encontrar el antígeno en pacientes que han dado positivo en anticuerpos antimanano (ver el párrafo 15-Efectividad). 3.La efectividad de la detección de manano en los sueros o plasmas está relacionada con la frecuencia de las pruebas realizadas a los pacientes. 60 Con el propósito de aumentar la sensibilidad y la precocidad de la positividad de la prueba, se recomienda un seguimiento regular de los pacientes de riesgo, así como la búsqueda de anticuerpos antimanano. 4.El procedimiento y la interpretación de los resultados obtenidos en la prueba Platelia™ Candida Ag Plus se deben seguir cuando las muestras sean sometidas a una prueba por la presencia del antígeno manano. Se aconseja al usuario del kit leer con atención el prospecto antes de realizar la prueba. Es importante el buen seguimiento del protocolo, especialmente a la hora del pipetaje de las muestras y de los reactivos, del lavado de la microplaca y de la duración de las fases de incubación. 5.Si las muestras y los reactivos no se añaden como se indica en el prospecto, es posible obtener un resultado falsamente negativo. En caso de sospecha de candidiasis invasiva o en caso de error en el procedimiento, es necesario someter a prueba una nueva muestra del mismo paciente. 6.Si, en el momento de añadir los reactivos, el contenido de un pocillo rebosa y cae sobre otro a causa de una manipulación incorrecta de la microplaca o a una mala técnica de pipetaje, es posible que los pocillos que contienen los controles positivos, los calibradores o las muestras de otros pacientes contaminen los pocillos que contienen las muestras de los pacientes negativos. 7.La efectividad de Platelia™ Candida Ag Plus no ha sido probada con muestras de suero o de plasma procedente de recién nacidos o de pacientes pediátricos. 8.La efectividad de Platelia™ Candida Ag Plus no ha sido establecida por una lectura manual ni por una determinación visual de los resultados. 9.En un estudio externo, se ha podido observar una reacción cruzada en el caso de los pacientes perfundidos con algunos líquidos de reposición, compuestos de hidroxietilalmidón (tipo Hestéril 6%), utilizados para el tratamiento de los fallos circulatorios: hipovolemia, choque hemorrágico, choque séptico. 10.Se han observado resultados falsamente positivos cuando las muestras contenían un índice de gamaglobulinas humanas ≥ 60 g/l, así como con algunas muestras que han dado positivo en anticuerpos anti-Toxoplasma. 14-VALORES ESPERADOS La prevalencia del antígeno manano específico de Candida, medida con la ayuda de la prueba Platelia™ Candida Ab Plus ha sido evaluada sobre un panel de 613 muestras extraídas de 51 pacientes neerlandeses (Zona 1- Países Bajos) hospitalizados para seguir un tratamiento de cáncer (hemopatía maligna en 49 pacientes y cáncer no hematológico en 2 pacientes) mediante quimioterapia intensiva. 61 De las 613 muestras, 88 han resultado positivas y 51 intermedias, es decir, una prevalencia de 88/613 = 14,4 % [IC 95%: 11,7-17,4%] considerando los resultados intermedios como negativos y 139/613 = 22,7 % [IC 95%: 19,4-26,2%] si consideramos los resultados intermedios como positivos. En términos de pacientes, de los 51 sometidos a la prueba, 14 han presentado al menos una muestra positiva y 20 al menos una muestra intermedia sin ninguna positiva, es decir, una prevalencia de 23/51 = 45,1 % [IC 95%: 31,159,7%] considerando los resultados intermedios como negativos y 37/51 = 72,6 % [IC 95%: 58,3-84,1%] si consideramos los resultados intermedios como positivos. De estos 51 pacientes, 30 (388 muestras) no presentan candidiasis invasiva documentada. De entre ellos, 20 están colonizados por levaduras (12 por Candida albicans, 7 por Candida albicans asociada a otra especie de Candida y 1 colonizada por al menos una especie de Candida no albicans). Cuatro de estos pacientes presentan síntomas clínicos y una infección superficial por Candida demostrada microbiológicamente. 24 de estos pacientes presentan lesiones severas en las barreras mucosas. De las 388 muestras correspondientes, 41 han resultado positivas y 43 intermedias, es decir, una prevalencia de 41/388 = 10,6 % [IC 95%: 7,714,1%] considerando los resultados intermedios como negativos y 84/388 = 21,7 % [IC 95%: 17,7-26,1%] si consideramos los resultados intermedios como positivos. En términos de pacientes, de los 30 sometidos a la prueba, 10 han presentado al menos una muestra positiva y 11 al menos una muestra intermedia sin ninguna positiva, es decir, una prevalencia de 10/30 = 33,3 % [IC 95%: 17,3-52,8%] considerando los resultados intermedios como negativos y 21/30 = 70,0 % [IC 95%: 50,6-85,3%] si consideramos los resultados intermedios como positivos. 15-EFECTIVIDAD A. Estudios de reproducibilidad • Precisión intra-análisis (repetibilidad): Con el propósito de evaluar la repetibilidad intra-análisis, se han sometido a prueba las cinco muestras (dos negativas y tres positivas) 32 veces en una misma serie. Se ha determinado la concentración en pg/ml para cada muestra. En la siguiente tabla se muestra la media de las concentraciones, la desviación estándar (DE) y el coeficiente de variación (CV%) para cada muestra: 62 Precisión intra-análisis (repetibilidad) N=32 Media de las concentraciones (pg/ml) DE CV% Muestra negativa Muestra negativa fuerte Muestra positiva débil Muestra positiva media Muestra positiva fuerte 25,1 54,8 63,7 154,1 261,8 4,11 5,20 4,27 8,01 16,93 16,3% 9,5% 6,7% 5,2% 6,5% • Precisión inter-análisis (reproducibilidad): Con el fin de evaluar la reproducibilidad inter-análisis, se han sometido a prueba las cinco muestras (dos negativa y tres positivas) por duplicado y en dos series por días, dentro de un periodo total de 20 días. Se ha determinado la concentración en pg/ml para cada muestra. En la siguiente tabla se muestran las concentraciones, la desviación estándar (DE) y el coeficiente de variación (CV%) para cada muestra: Precisión inter-análisis (reproducibilidad) N=80 Muestra negativa Media de las concentraciones (pg/ml) 24,1 Muestra Muestra negativa positiva fuerte débil 55,0 Muestra positiva media Muestra positiva fuerte 161,6 264,9 70,0 DE 6,99 11,47 14,50 30,07 38,62 CV% 29,0% 20,8% 20,7% 18,6% 14,6% B. Reacciones cruzadas Número de muestras sometidas a prueba Número de positivas Número de intermedias Aspergillus 10 0 1 Anticuerpos anti-ds-ADN 10 0 0 ANA positivos 10 0 0 IgG y IgM MIeloma 20 0 1 IgG anti-Toxoplasma 10 3 1 Anticuerpos humanos anti-raón 10 0 0 Factor reumatolde 10 0 0 Patología 63 C. Linealidad El aspecto de linealidad de la prueba Platelia™ Candida Ag Plus se ha establecido entre 20 y 470 pg/ml a partir de estudios de diluciones realizadas sobre 4 muestras positivas. D. Estudios clínicos La efectividad del kit Platelia™ Candida Ag Plus ha sido evaluada en 3 zonas con un total de 852 muestras extraídas a 505 pacientes. SENSIBILIDAD La sensibilidad del kit Platelia™ Candida Ag Plus ha sido determinada sobre un panel de 436 muestras extraídas a 89 pacientes hospitalizados en 2 zonas situadas en los Países Bajos y en Francia. La distribución de las muestras es la siguiente: • Zona 1 (Países Bajos): 225 muestras extraídas de 21 pacientes neerlandeses ingresados en la unidad de oncohematología para recibir tratamiento de quimioterapia intensiva por una hemopatía maligna (19 casos) o por un cáncer no hematológico (2 casos), seguida, según los casos, de un transplante de células madre hematopoyéticas. Todos esos pacientes presentaron una candidiasis invasiva probada microbiológicamente sobre la base de al menos un cultivo positivo de Candida (hemocultivo o cultivo de tejidos normalmente estéril). 17 • Zona 2 (Francia): 211 muestras extraídas de 68 pacientes franceses hospitalizados en diferentes unidades de reanimación o de oncohematología afectados por una candidiasis invasiva probada microbiológicamente sobre la base de al menos un hemocultivo positivo de Candida spp. NOTA: Los paneles de muestras utilizados para esos dos estudios provienen de pacientes cuyas muestras sanguíneas se extrajeron entre 1999 y 2007. La estabilidad relativa de antígeno manano y del anticuerpo antimanano en estas muestras durante el periodo de congelación, así como después de cada ciclo de congelación y descongelación, hace que los resultados actuales dependan del estado de conservación del panel sometido a prueba. Por ello, los valores de estabilidad de la prueba determinados dentro del cuadro de estudios clínicos retrospectivos pueden ser inferiores a los obtenidos durante estudios clínicos prospectivos realizados sobre muestras extraídas recientemente. Risultati del Sito 1 Los 21 pacientes neerlandeses incluidos en este estudio fueron ingresados en el hospital para recibir un tratamiento de quimioterapia intensiva por una hemopatía maligna (leucemia aguda mieloblástica, leucemia aguda linfoblástica, leucemia linfoide crónica, mieloma, síndrome mielodisplásico, anemia aplásica o linfoma no Hodgkiniano) o por un cáncer hematológico, 64 seguida de un transplante de células madre hematopoyéticas Estos 21 pacientes han desarrollado una candidiasis invasiva demostrada microbiológicamente sobre la base de, al menos, un cultivo positivo de Candida spp (hemocultivo o cultivo de tejidos normalmente estéril) El estado de estos pacientes por la presencia del antígeno manano específico de Candida que se ha detectado con la prueba Platelia™ Candida Ag Plus, se considera positivo si al menos una de las muestras del paciente es positiva. Si no existen muestras positivas, el estado es intermedio siempre que, al menos, una de las muestras del paciente sea intermedia, y negativo siempre que todas las muestras del paciente sean negativas. 17 Resultados en Platelia™ Candida Ag Plus Categorías de pacientes 21 pacientes (225 muestras) que presentan al menos un cultivo positivo de Candida spp. Número de pacientes (número de muestras) Positiva 13 (47) Intermedia Negativa 3 (8) 5 (170) Sensibilidad (intermedias consideradas negativas) Sensibilidad (intermedias consideradas positivas) 61,9 % 76,2 % 95% IC [38,4-81,9%] 95% IC [52,8-91,8%] De forma paralela a la prueba Platelia™ Candida Ag Plus, estas mismas muestras han sido sometidas a prueba con el kit Platelia™ Candida Ab Plus 9 para detectar la presencia de anticuerpos antimanano. El estado del paciente por la presencia de antígeno manano o de anticuerpos antimanano específicos de Candida se considera positivo si al menos una de las pruebas es positiva. Si no hubiera pruebas positivas, el estado es intermedio siempre que al menos una de las dos pruebas sea intermedia, y negativo cuando las dos pruebas sean negativas. Categorías de pacientes 21 pacientes (225 muestras) que presentan al menos un cultivo positivo de Candida spp. Combinación de los resultados con Platelia™ Candida Ag Plus y Platelia™ Candida Ab Plus Número de pacientes (número de muestras) Positiva 15 (98) Intermedia Negativa 4 (34) 2 (93) Sensibilidad (intermedias consideradas negativas) Sensibilidad (intermedias consideradas positivas) 71,4 % 90,5 % 95% IC [47,8-88,7%] 95% IC [69,6-98,8%] Resultados de la Zona 2 Los 68 pacientes franceses incluidos en este estudio han sido ingresados en diferentes unidades de reanimación (cirugía transplante, quemados, traumatología, neumología, etc...) o de oncohematología (hemopatía maligna). 65 Todos han desarrollado una candidiasis invasiva probada microbiológicamente sobre la base de al menos un hemocultivo positivo de Candida ( albicans, parapsilosis, norvegensis, glabrata, krusei o tropicalis) 6, 7, 14 en los días anteriores o posteriores a la extracción de sangre analizada. Las muestras de sangre han sido extraídas siguiendo una media de 6 días después del primer hemocultivo positivo de Candida (como mínimo 61 días antes, como máximo 67 días después). El estado de estos pacientes por la presencia del antígeno manano específico de Candida que se ha detectado con la prueba Platelia™ Candida Ag Plus, se considera positivo si al menos una de las muestras del paciente es positiva. Si no existen muestras positivas, el estado es intermedio siempre que al menos una de las muestras del paciente sea intermedia, y negativo siempre que todas las muestras del paciente sean negativas. Resultados en Platelia™ Candida Ag Plus Categorías de pacientes Número de pacientes (número de muestras) Positiva Intermedia Negativa 68 pacientes (211 muestras) que presentan al menos un hemocultivo positivo de Candida spp. 35 (86) 7 (14) - de los cuales 34 de C. albicans (113 muestras) 22 (55) 6 (12) 6 (46) - de los cuales 15 de C. parapsilosis (37 muestras) 2 (3) 1 (1) 12 (33) - de los cuales 12 de C. glabrata (32 muestras) 7 (13) 0 (0) 5 (19) - de los cuales 4 de C. tropicalis (19 muestras) 4 (15) 0 (1) - de los cuales 2 de C. krusei (8 muestras) 0 (0) - de los cuales 1 de C. norvegensis (2 muestras) 0 (0) Sensibilidad (intermedias consideradas negativas) Sensibilidad (intermedias consideradas positivas) 51,5% 61,8% 26 (111) 95% IC [39,0-63,8%] 95% IC [49,2-73,3%] 64,7% 82,5% 95% IC [46,5-80,3%] 95% IC [65,5-93,2%] 13,3% 20,0% 95% IC [1,7-40,5%] 95% IC [4,3-48,1%] 58,3% 66,7% 0 (3) 100,0% * 100,0% * 0 (0) 2 (8) 0,0% * 0,0% * 0 (0) 1 (2) 0,0% * 0,0% * 95% IC [27,7-84,8%] 95% IC [34,9-90,1%] * : El intervalo de confianza del 95% no se ha podido calcular debido a que el tamaño de la muestra es insuficiente. De forma paralela a la prueba Platelia™ Candida Ag Plus, estas mismas muestras han sido sometidas a prueba con el kit Platelia™ Candida Ab Plus 9 para detectar la presencia de anticuerpos antimanano. El estado del paciente por la presencia de antígeno manano o de anticuerpos antimanano específicos de Candida se considera positivo si al menos una de las pruebas es positiva. 66 Si no hubiera pruebas positivas, el estado es intermedio siempre que al menos una de las dos pruebas sea intermedia, y negativo cuando las dos pruebas sean negativas. Combinación de los resultados con Platelia™ Candida Ag Plus y Platelia™ Candida Ab Plus Categorías de pacientes Número de pacientes (número de muestras) Positiva Intermedia Negativa Sensibilidad (intermedias consideradas negativas) Sensibilidad (intermedias consideradas positivas) 70,6% 82,4% 82,4% 88,2% 33,3% 73,3% 91,7% 91,7% 68 pacientes (211 muestras) que presentan al menos un hemocultivo positivo de Candida spp. 48 (122) 8 (40) 12 (49) - de los cuales 34 de C. albicans (113 muestras) 28 (74) 2 (22) 4 (17) 5 (7) 6 (15) 4 (15) - de los cuales 12 de C. glabrata (32 muestras) 11 (24) 0 (3) 1 (5) - de los cuales 4 de C. tropicalis (19 muestras) 4 (17) 0 (0) 0 (2) 100,0% * 100,0% * - de los cuales 2 de C. krusei (8 muestras) 0 (0) 0 (0) 2 (8) 0,0% * 0,0% * - de los cuales 1 de C. norvegensis (2 muestras) 0 (0) 0 (0) 1 (2) 0,0% * 0,0% * - de los cuales 15 de C. parapsilosis (37 muestras) 95% IC [58,3-81,0%] 95% IC [71,2-90,5%] 95% IC [65,5-93,2%] 95% IC [72,6-96,7%] 95% IC [11,8-61,6%] 95% IC [44,9-92,2%] 95% IC [61,5-99,8%] 95% IC [61,5-99,8%] * : El intervalo de confianza del 95% no se ha podido calcular debido a que el tamaño de la muestra es insuficiente. ESPECIFICIDAD La especificidad se ha determinado sobre un panel de 416 muestras, procedentes de 2 zonas situadas en Francia, y se reparte como se muestra a continuación: • Zona 1: 200 muestras extraídas de 200 pacientes franceses sometidos a serología para la prevención de la toxoplasmosis durante su crecimiento y que no presentan ningún síntoma clínico de infección por Candida. • Zona 2: 216 muestras de 216 pacientes franceses donantes de sangre. 67 Resultados en Platelia™ Candida Ag Plus Número de pacientes (número de muestras) Categorías de pacientes Positiva Intermedia Negativa 200 mujeres embarazadas (200 muestras) tratadas con serología para la prevención de la toxoplasmosis 3 2 195 216 donantes de sangre (216 muestras) 1 1 214 Especificidad (intermedias consideradas positivas) Especificidad (intermedias consideradas negativas) 97,5% 98,5% 99,1% 99,5% 95% IC [94,3-99,2%] 95% IC [95,7-99,7%] 95% IC [96,7-99,9%] 95% IC [97,5-100%] 16-CONTROL DE CALIDAD DEL FABRICANTE Todos los productos fabricados y comercializados por la empresa Bio-Rad se encuentran bajo un sistema de garantía de la calidad desde la recepción de las materias primas hasta la comercialización de los productos acabados. Cada lote de producto acabado es objeto de un control de calidad y solo se comercializa si cumple los criterios de aceptación. La documentación relativa a la producción y al control de cada lote está en posesión del fabricante. 68 17-BIBLIOGRAPHY 1-Alam, F.F., Mustafa, A.S., Khan, Z.U. 2007. Comparative evaluation of (1,3)-beta-D-glucan, mannan and anti-mannan antibodies, and Candida species-specific snPCR in patients with candidemia. BMC Infectious Diseases 7(103): p. 1-9. 2-Ascioglu, S., Rex, J.H., de Pauw, B., Bennett, J.E., Bille, J., Crokaert, F., Denning, D.W., Donnelly, J.P., Edwards, J.E., Erjavec, Z., Fiere, D., Lortholary, O., Maertens, J., Meis, J.F., Patterson, T.F., Ritter, J., Selleslag, D., Shah, P.M., Stevens, D.A., Walsh,T.J. 2002. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: An international consensus. Clinical Infectious Diseases 34: p. 7-14. 3-Ellepola, A.N.B., Morrison, C.J. 2005. Laboratory Diagnosis of Invasive Candidiasis. Journal of Microbiology 43(No. S): p. 65-84. 4-Ellis, M., Al-Ramadi, B., Bernsen, R., Kristensen, J., Alizadeh, H., Hedstrom, U. 2009. Prospective evaluation of mannan and anti-mannan antibodies for diagnosis of invasive Candida infections in patients with neutropenic fever. Journal of Medical Microbiology 58(5): p. 606-615. 5-Guery, B.P., Arendrup, M.C., Auzinger, G., Azoulay, E., Borges Sá, M., Johnson, E.M., Müller, E., Putensen, C., Rotstein, C., Sganga, G., Venditti, M., Zaragoza Crespo, R., Kullberg, B.J. 2009. Management of invasive candidiasis and candidemia in adult non-neutropenic intensive care unit patients: Part I. Epidemiology and diagnosis. Intensive Care Med. 35: p. 55-62. 6-Nucci, M., , Colombo, A.L. 2007. Candidemia due to Candida tropicalis: clinical, epidemiologic, and microbiologic characteristics of 188 episodes occurring in tertiary care hospitals. Diagnostic Microbiology and Infectious Disease 58: p. 77-82. 7-Oliveri, S., Trovato, L., Betta, P., Romeo, M.G., Nicoletti, G. 2008. Experience with the Platelia™ Candida ELISA for the diagnosis of invasive candidiosis in neonatal patients. Clinical Microbiology and Infection 14 (4): p. 377-397. 8-Pappas, P.G., Kauffman, C.A., Andes, D., Benjamin D.K.Jr., Calandra, T.F., Edwards, J.E.Jr, Filler, S.G., Fisher, J.F., Kullberg, B.J., OstroskyZeichner, L., Reboli, A.C., Rex, J.H., Walsh, T.J., Sobel, J.D. 2009. Clinical Practice Guidelines for the Management of Candidiasis: 2009 Update by the Infectious Diseases Society of America. Clinical Infectious Diseases 48: p. 503-535. 9-Persat, F., Topenot, R., Piens, M.A., Thiebaut, A., Dannaoui, E., Picot, S. 2002. Evaluation of different commercial ELISA methods for the serodiagnosis of systemic candidiosis. Mycoses 45: p. 455-460. 10-Prella, M., Bille, J., Pugnale, M., Duvoisin, B., Cavassini, M., Calandra, T., Marchetti, O. 2005. Early diagnosis of invasive candidiasis with mannan antigenemia and anti-mannan antibodies. Diagnostic Microbiology and Infectious Disease 51: p. 95-101. 11-Rentz, A.M., Halpern, M.T., Bowden, R. 1998. The Impact of Candidemia on Length of Hospital Stay, Outcome, and Overall Cost of Illness. Clinical Infectious Diseases 27: p. 781-788. 12-Ruan, S.-Y., Hsueh, P.-R. 2009. Invasive Candidiasis: An Overview from Taiwan. J. Formos. Med. Assoc. 108(6): p. 443-451. 13-Sendid, B., Poirot, J.L., Tabouret, M., Bonnin, A., Caillot, D., Camus, D., Poulain, D. 2002. Combined detection of mannanaemia and anti-mannan antibodies as a strategy for the diagnosis of systemic infection caused by pathogenic Candida species. J. Med. Microbiol. 51: p. 433-442. 14-Sendid, B., Caillot, D., Baccouch-Humbert, B., Klingspor, L., Grandjean, M., Bonnin, A., Poulain, D. 2003. Contribution of the Platelia™ Candidaspecific antibody and antigen tests to early diagnosis of systemic Candida tropicalis infection in neutropenic adults. Journal of Clinical Microbiology 41(10): p. 4551-4558. 15-Tortorano, A.M., Peman, J., Bernhardt, H., Klingspor, L., Kibbler, C.C., Faure, O., Biraghi, E., Canton, E., Zimmermann, K., Seaton, S., Grillot, R. 2004. Epidemiology of Candidaemia in Europe: Results of 28-Month European Confederation of Medical Mycology (ECMM) Hospital-Based Surveillance Study.Eur. J. Clin. Microbiol. Infect. Dis. 23: p. 317-322. 16-Vardakas, K. Z., Michalopoulos, A., Kiriakidou, K. G., Siampli, E. P., Samonis, G., Falagas, M. E. 2009. Candidaemia: incidence, risk factors, characteristics and outcomes in immunocompetent critically ill patients. Clin. Microbiol. Infect. 15: p. 289-292. 17-Verduyn Lunel, F.M., Donnelly, J.P., van der Lee, H. A. L., Blijlevens, N.M. A., Verweij, P. E. 2009. Circulating Candida-specific anti-mannan antibodies precede invasive candidiasis in patients undergoing myeloablative chemotherapy. Clin. Microbiol. Infect. 15(4): p. 380-386. Printed in France bio-rad 3, boulevard Raymond Poincaré 92430 Marnes-la-Coquette France Tel. : +33 (0) 1 47 95 60 00 Fax.: +33 (0) 1 47 41 91 33 www.bio-rad.com 11/2011 code: 881082