Sesion 6 - Página Personal de Jose Luis Mesa Rueda
Anuncio
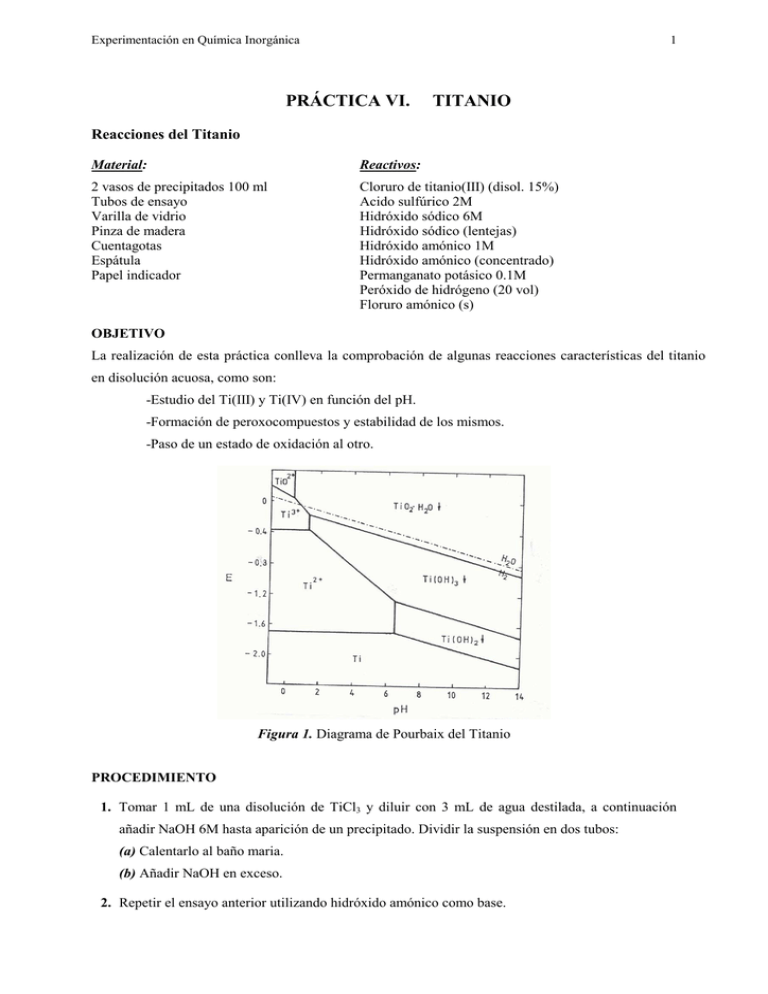
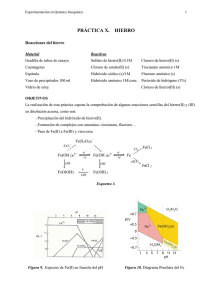
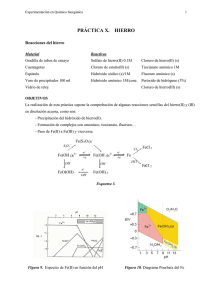
Experimentación en Química Inorgánica 1 PRÁCTICA VI. TITANIO Reacciones del Titanio Material: Reactivos: 2 vasos de precipitados 100 ml Tubos de ensayo Varilla de vidrio Pinza de madera Cuentagotas Espátula Papel indicador Cloruro de titanio(III) (disol. 15%) Acido sulfúrico 2M Hidróxido sódico 6M Hidróxido sódico (lentejas) Hidróxido amónico 1M Hidróxido amónico (concentrado) Permanganato potásico 0.1M Peróxido de hidrógeno (20 vol) Floruro amónico (s) OBJETIVO La realización de esta práctica conlleva la comprobación de algunas reacciones características del titanio en disolución acuosa, como son: -Estudio del Ti(III) y Ti(IV) en función del pH. -Formación de peroxocompuestos y estabilidad de los mismos. -Paso de un estado de oxidación al otro. Figura 1. Diagrama de Pourbaix del Titanio PROCEDIMIENTO 1. Tomar 1 mL de una disolución de TiCl3 y diluir con 3 mL de agua destilada, a continuación añadir NaOH 6M hasta aparición de un precipitado. Dividir la suspensión en dos tubos: (a) Calentarlo al baño maria. (b) Añadir NaOH en exceso. 2. Repetir el ensayo anterior utilizando hidróxido amónico como base. Experimentación en Química Inorgánica 2 3. Acidular 10 gotas de una disolución de TiCl3, preparada como en el apartado 1, con unas gotas de ácido sulfúrico 2M. Añadir unas gotas de peróxido de hidrógeno (20 volumenes). A la disolución resultante adicionarle una microespatula de floruro amónico sólido. 4. Añadir gota a gota permanganato potásico (0.1M) sobre 10 gotas de una disolución de TiCl3 , preparada como en el apartado 1, hasta la desaparición del color violeta. La disolución resultante se divide en tres tubos de ensayo a los que se adiciona respectivamente: a) Unas gotas de hidróxido sódico concentrado. b) Unas gotas de hidróxido amónico concentrado. c) Unas gotas de ácido sulfúrico 2M y peróxido de hidrógeno (20 volumenes). A la disolución resultante adicionar una microespátula de floruro amónico sólido. CUESTIONES 1.- Escribe todas las reacciones que tienen lugar. Describe todo lo que hayas observado: cambios de color, aparición de precipitados, etc… 2.- ¿Qué clase de ligando forma parte del complejo que resulta de la experiencia 3. 3.- ¿De que color es el catión titanilo?. Formúlarlo. Experimentación en Química Inorgánica PRÁCTICA VII. 3 VANADIO Reacciones del Vanadio Material Reactivos Gradilla de tubos de ensayo Metavanadato amónico (s) 1 Vidrio de reloj Hidróxido sódico (lentejas) 1 Vaso de 100 ml Acido clorhídrico 1M y 6M 1 Probeta de 10 ml Acido sulfúrico 2M 1 Espátula Sulfito sódico (s) 1 Cuentagotas Cinc (s) Papel indicador Peróxido de hidrógeno (20 vol) 1 Pinza de madera Fluoruro de amónico (s) OBJETIVO Comprobación del comportamiento del vanadio en disolución acuosa y en concreto: - Formación de diferentes oxoaniones mediante la variación de pH de una disolución de vanadio(V). - Reducción a estados de oxidación inferiores. - Formación de peroxocompuestos y estabilidad de los mismos. - Precipitación del pentóxido y síntesis por vía seca. Figura 2. Diagrama de Pourbaix del Vanadio Experimentación en Química Inorgánica 4 Figura 3. Diagrama de predominancia del Vanadio en función del pH. PROCEDIMIENTO Pesar 0.5 g de metavanadato amónico y añadir sobre él 3 lentejas de hidróxido sódico. Disolver todo en 10 ml de agua. Utilizarla la disolución resultante para los ensayos del 1 al 3: 1.- Acidular lentamente con HCl (6M). ¿Cuál es el efecto de añadir este ácido?. 2. Adicionar una microespátula de sulfito sódico sólido y unas gotas de ácido clorhídrico 1M. 3. Acidular con ácido clorhídrico concentrado hasta que la disolución tenga color amarillo y añadir un trozo de cinc granulado. Observar los cambios que tienen lugar después de 60 minutos. 4. En un tubo de ensayo añadir una microespatula de metavanadato amónico sólido y calentar fuertemente en un baño de arena . Identificar el gas que se produce y el sólido que se forma. 5. A una microespátula de metavanadato amónico sólido añadirle ácido clorhidrico concentrado. PREGUNTAS 1. Escribe las reacciones que tienen lugar en las diferentes pruebas e interprétalas en base a los cambios de color, aparición de precipitados, etc., obervados. 2. ¿Qué color tiene tiene la especie final de vanadio que se forma en el ensayo 3?. Formularla. 3.- ¿Qué gas se desprende al calentar el metavanadato amónico sólido?. Escribir su reacción de detección.