sólidos - Uruguay Educa
Anuncio
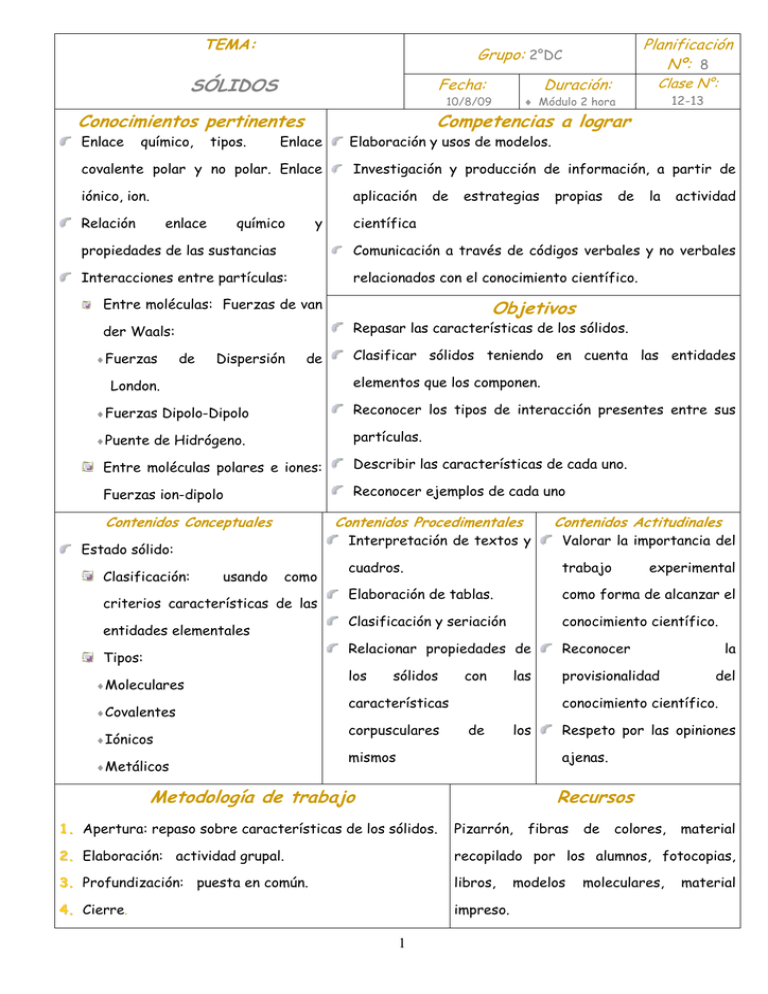
TEMA: Fecha: SÓLIDOS químico, tipos. Clase N°: Duración: ♦ Módulo 2 hora 10/8/09 Conocimientos pertinentes Enlace Planificación Nº: 8 Grupo: 2°DC 12-13 Competencias a lograr Enlace Elaboración y usos de modelos. covalente polar y no polar. Enlace Investigación y producción de información, a partir de iónico, ion. aplicación Relación enlace químico y de estrategias propias de la actividad científica propiedades de las sustancias Comunicación a través de códigos verbales y no verbales Interacciones entre partículas: relacionados con el conocimiento científico. Entre moléculas: Fuerzas de van Repasar las características de los sólidos. der Waals: ♦ Fuerzas de Dispersión de ♦ Puente Clasificar sólidos teniendo en cuenta las entidades elementos que los componen. London. ♦ Fuerzas Objetivos Reconocer los tipos de interacción presentes entre sus Dipolo-Dipolo partículas. de Hidrógeno. Entre moléculas polares e iones: Describir las características de cada uno. Fuerzas ion-dipolo Reconocer ejemplos de cada uno Contenidos Conceptuales Contenidos Procedimentales Estado sólido: Clasificación: usando como criterios características de las entidades elementales Tipos: ♦Moleculares ♦Covalentes ♦Iónicos ♦Metálicos Contenidos Actitudinales Interpretación de textos y Valorar la importancia del cuadros. trabajo Elaboración de tablas. como forma de alcanzar el Clasificación y seriación conocimiento científico. Relacionar propiedades de Reconocer los provisionalidad sólidos con las características corpusculares experimental la del conocimiento científico. de los mismos Respeto por las opiniones ajenas. Metodología de trabajo Recursos 1. Apertura: repaso sobre características de los sólidos. Pizarrón, 2. Elaboración: actividad grupal. recopilado por los alumnos, fotocopias, 3. Profundización: puesta en común. libros, 4. Cierre. impreso. 1 fibras modelos de colores, moleculares, material material Desarrollo de la clase: estructuración 1. APERTURA: breve repaso de sobre el estado sólido. Con esto se pretende: Motivar para: Promover la apropiación del conocimiento y el interés por conocer. Conocer ideas previas de los alumnos y alumnas sobre el tema. Recabar información acerca de lo estudiado por los alumnos. Preguntas motivadoras: ¿Qué características corpusculares presentan los sólidos? ¿A que se deben las diferencias corpusculares de los sólidos con los líquidos y los gases? ¿Qué características tienen las fuerzas de cohesión presentes en los sólidos? ¿Cómo se clasifican los sólidos? ¿Cuál o cuáles son los criterios usados para esta clasificación? Estrategia: lluvia de ideas. 2. ELABORACIÓN: ESTRATEGIA: actividad grupal en pequeños subgrupos. ¿CÓMO?: se entregará a los alumnos una consigna y una serie de tarjetas que forman un cuadro comparativo. CONSIGNA: ACTIVIDAD GRUPAL: CLASIFICACIÓN DE SÓLIDOS Elabora en tu cuaderno un cuadro comparativo como el que se muestra a continuación, y coloca allí las tarjetas entregadas: NATURALEZA DE FUERZAS DE ESTRUCTURA LAS ENTIDADES CARACTERÍSTICAS EJEMPLOS COHESIÓN ELEMENTALES TARJETAS QUE SE ENTREGARÁN A LOS ALUMNOS (Página 5) 2 ¿POR QUÉ? El cuadro comparativo es un organizador que se emplea para sistematizar la información y permite contrastar los elementos de un tema.1 En los cuadros comparativos se organizan “los datos en tantas columnas como elementos se quieran comparar, quedando de esta manera claramente expresadas las diferencias y las coincidencias. Cada columna se encabeza con el nombre del elemento y debajo de él se colocan sus características. Las ventajas de este tipo de cuadros es que ofrecen una visión conjunta de todo el tema”2 3. PROFUNDIZACIÓN: Puesta en común de la actividad en donde se completará el cuadro trabajo en la actividad grupal. Se remarcará la importancia de poder explicar las características de los sólidos teniendo en cuenta las características corpusculares que ellos presentan, sus entidades elementales y las fuerzas de cohesión entre sus partículas. 4. EVALUACIÓN: La misma será de carácter formativo y se realizará en tres instancias: En el comienzo de la clase, durante el repaso. Durante la realización de la actividad grupal en donde se evaluará: Material recopilado por los alumnos acerca del tema, el cual podrá ser en forma de resumen, fotocopias, libros, etc. La participación que cada alumno realice en el grupo y para el grupo, así como la colaboración con los compañeros para la comprensión del tema, respeto por los aportes y opiniones de los compañeros, comportamiento, etc. Durante la puesta en común. 3 5. BIBLIOGRAFÍA: DIDÁCTICA: De la Torre, S. y Barrios O. 2000. “Estrategias didácticas innovadoras. Recursos para la formación y el cambio” Ed. Octaedro. Barcelona. Mercer, N.: (1995) “La construcción guiada del conocimiento, El habla de profesores y alumnos”, Barcelona, Paidós, 1997. Pozo, J.I. (1999) “El aprendizaje estratégico”. Santillana. Madrid. ESPECÍFICA: Brown-Lemay-Bursten (2002) “Química, la ciencia central” Ed. Prentice-Hall. Chang, R. (2000) “Química”. Ed. Mc Graw Hill. Casabó-Gispert (2004) “Estructura atómica y enlace químico” Ed. Reverté S.A. Petrucci-Harwood-Herring (2004) “Química General” Ed. Pearson-Prentice Hall Autores Varios PÁGINAS WEB: 1. www.ulibertadores.edu.co/.../cuadros_comparativos.htm 2. www.slideshare.net/.../cuadros-comparativos-97 Próxima clase • Comportamiento ideal de los gases. Leyes de los gases. Gas ideal 4 TARJETAS QUE SE ENTREGARÁN A LOS ALUMNOS ESTRUCTURA SÓLIDOS MOLECULARES HIELO SECO(CO2 sólido) SÓLIDOS ATÓMICOS O COVALENTES SÓLIDOS IÓNICOS SÓLIDOS METÁLICOS NATURALEZA DE LAS ENTIDADES FUERZAS DE COHESIÓN Dipolo inducidodipolo inducido de London e n Yuxtaposición de moléculas d los sólidos no e entidades polares y dipolomoleculares. dipolo o puente de hidrógeno para los polares CARACTERÍSTICAS EJEMPLOS Estos sólidos tienen puntos de fusión y ebullición bajos o moderados, son blandos, conductores pobres de la corriente eléctrica tanto en estado sólido como cuando están fundidos y son generalmente, insolubles en agua. La mayor parte de las sustancias que a temperatura ambiente son gases, cuando cristalizan forman sólidos moleculares, por ejemplo el oxígeno. En cambio aquellas sustancias cuyas moléculas son fácilmente polarizables, a la misma temperatura, son sólidos. I2, CO2, H2O, CH3COOH, C6H5OH Ejemplos típicos de estos sólidos son el diamante, el silicio, y el grafito. En el diamante cada átomo de carbono está unido a otros cuatro átomos de carbono como se muestra en la figura de la izquierda. Esta matriz tridimensional Son átomos interconectada de fuertes enlaces sencillos unidos en una Se caracterizan por una elevada dureza, altos puntos de carbono-carbono contribuye a la inusitada Agrupamiento red dureza del diamante. En el grafito los de átomos(C, tridimensional fusión y ebullición, baja conductividad eléctrica y por ser átomos de carbono están dispuestos en Si) por enlaces prácticamente insolubles en la mayoría de los solventes. capas de anillos hexagonales covalentes interconectados como se muestra en la direccionales figura de la derecha. Cada átomo de carbono está unido a otros tres de la capa. . Los electrones se mueven libremente por los orbitales deslocalizados, y esto hace que el grafito sea un buen conductor de la electricidad a lo largo de las capas. Atracción electrostática (cargas opuestas) de magnitud considerable y no dirigidas, es Ordenamiento decir que cada en alternancia ion del cristal de iones está ligado por positivos y fuerzas negativos coulómbicas a todos los otros iones, de tal manera que no hay grupos discretos de partículas. Estos son, en general, duros, quebradizos, buenos aislantes y tienen puntos de fusión y ebullición altos. En la red cristalina iónica, se alternan aniones y cationes, Las fuerzas interiónicas explican la dureza y los altos puntos de fusión y ebullición; esto, sumado a la resistencia a la movilidad de los iones de la red, impide la conductividad eléctrica y los convierte en buenos aislantes. En cambio, cuando están fundidos son buenos conductores eléctricos porque los movimientos iónicos se hacen más amplios. Son poco solubles en la mayoría de los solventes, sólo lo hacen en los más polares, como por ejemplo el agua. En estos casos las fuerzas atractivas ion-solvente deben superar las fuerzas interiónicas (catión-anión). Propiedades macroscópicas: elevadas conductividades eléctrica y térmica, ductilidad, maleabilidad y brillo metálico. Los electrones de enlace se encuentran totalmente deslocalizados y se extienden sobre la totalidad del cristal metálico, en el cual los cationes se ubican en posiciones fijas. La movilidad electrónica explica la alta conductividad eléctrica y térmica de los Átomos metales. Se pueden suministrar electrones por medio de compartiendo Fuerzas de un generador de corriente eléctrica a un extremo de un electrones de enlace metálico. alambre metálico y recuperar una cantidad igual en forma valencia prácticamente instantánea por el otro extremo sin que se produzca ningún cambio observable en las propiedades físicas o químicas del metal. Cuando se calienta el metal los electrones libres pueden adquirir energía cinética térmica y al moverse rápidamente a través del cristal transportar el calor. 5 NaCl, CaF2, MgO Fe, Al, Cu, Au, Pt, etc.






