Manejo básico de datos
Anuncio

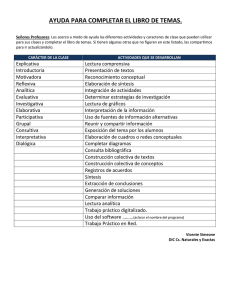
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUIA No 1.1- Manejo básico de datos. I. EL PROBLEMA. Hacer uso adecuado de los datos obtenidos en un experimento por medio de la aplicación de los conocimientos sobre cifras significativas, incertidumbre, precisión y rechazo de datos. II. FUNDAMENTO TEORICO. III. BÚSQUEDA DE INFORMACIÓN. - Explique brevemente los siguientes temas: cifras significativas, precisión, desviación estándar, exactitud, error en una medida, cuantificación del error y rechazo de datos. Elabore una ficha técnica de los siguientes reactivos: NaOH, HCl, fenolftaleina, azul de bromotimol, naranja de metilo. Diseñe el diagrama de flujo del procedimiento. IV. MATERIALES Y REACTIVOS. Material por grupo : • • • • • • • • • • • Un vidrio de reloj pequeño Una pinza para crisol Cinco erlenmeyer de 250ml Una bureta de 25ml Una pipeta aforada de 10ml Dos pipetas graduadas de 10ml Una pinza para bureta Una vaso de precipitados de 150ml Una vaso de precipitados de 100ml Una probeta de 100ml Una propipeta. Material y reactivos generales (para una práctica con 10 grupo) - Tres balanzas triple brazo Dos balanzas analítica Departamento de Ciencias Básicas 1/3 - Dos balanzas de precisión (dos decimales) Solución de ácido clorhídrico de concentración desconocida (2 litros) Solución de NaOH 0,1M (2 litros) Agua corriente Fenolftaleina Azul de bromotimol Naranja de metilo V. PROCEDIMIENTO. 1- Realice cinco medidas del peso de un vidrio del reloj limpio y seco en cada una de las balanzas que se encuentran en el laboratorio. Tabule en forma adecuada los datos, observe y realice el análisis correspondiente.( manipule el vidrio de reloj con las pinzas para crisol) No 1 2 3 4 5 Triple brazo Precisión Analítica 2- A cada uno de los cinco erlenmeyer de 250ml adicione 10ml de la solución de ácido clorhídrico de concentración desconocida con la pipeta aforada y 50ml de agua destilada medidos en una probeta, luego adicione tres gotas del indicador. Proceda a titular con la solución de NaOH 0,1M hasta el cambio de color y anote el volumen gastado de base en cada una de las cinco repeticiones. Repita el procedimiento con otro indicador. Los indicadores a utilizar son: - Fenolftaleina Azul de bromotimol Naranja de metilo 3- Pese en una balanza analítica un vaso de precipitados de 100ml, adicione 10ml de agua corriente medidos con una de las pipetas graduadas de 10ml y vuelva a pesar; realice dos nuevas adiciones de agua corriente de 10ml medidos con la misma pipeta graduada y vuelva a pesar el conjunto después de cada adición. Repita el procedimiento midiendo el agua corriente con la segunda pipeta graduada de 10ml y determine el peso de cada adición. ( no realice las adiciones de agua al interior de la balanza). VI. TABLA DE DATOS. Diseñe una tabla adecuada para la toma de los datos del laboratorio la cual debe estar en el cuaderno de laboratorio antes de iniciar la práctica. VII. PARA EL ANÁLISIS DE LA PRACTICA. - Para cada grupo de datos tener en cuenta promedio, desviación estándar y rechazo de datos. Departamento de Ciencias Básicas 2/3 El valor de peso del vidrio de reloj medido en la balanza analítica (calibrada) será considerado como el valor “real o verdadero”; y determine el porcentaje de error de la medida obtenido en los otros dos tipos de balanzas. Calcule la concentración de la solución de ácido clorhídrico, medidos con los diferentes tipos de indicador aplicando la siguiente ecuación y analice los resultados. - - V(NaOH) * N(NaOH) = V(HCl) * N(HCl) Analice el comportamiento de las dos pipetas graduadas al evacuar el mismo volumen, comparando los pesos obtenidos en cada adición. - VIII. BIBLIOGRAFÍA. - - Estándar Methods for the examination of water and wastewater editado por Arnold E. th Greenbers y otros. Publicado por Publication office American Public Health Association,18 edición, U.S.A, 1992. Harris D.C. Análisis Químico Cuantitativo, tercera edición, Grupo Editorial Iberoamericano, México,1992. Skoog D.A, West D.M. Química analítica, séptima edición, Reverte, 2000. Skoog D.A, West D.M, Holler J. Química analítica, sexta edición, Mc Graw Hill, México, 1995. Departamento de Ciencias Básicas 3/3