cáncer de mama ii
Anuncio

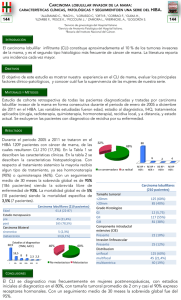
Capítulo 41 CÁNCER DE MAMA II Córdoba O, Sabadell MD, Xercavins J Historia natural del cáncer de mama FACTORES QUE INDUCEN LA CARCINOGÉNESIS. Existen múltiples factores que inducen la progresión del tejido normal hacia cáncer de mama. Por lo general, esta progresión no se debe a una única noxa. Es más bien la acumulación de cambios genéticos y epigenéticos lo que hace que una célula adquiera características cancerosas. Los cambios genéticos son cambios en el DNA. Estos podrán ser en la secuencia de pares de bases que cambian la expresión de determinados genes o bien por la delección de un gen en su totalidad. Las alteraciones epigenéticas hacen referencia a cambios en la expresividad de genes estructuralmente normales. La mayor o menor metilación de los genes hacen que estos se expresen más o menos. Así la metilación de un gen con función supresora comportará que este no se exprese y así que no efectue su acción supresora, resultando en una mayor activación del ciclo celular. Así mismo un déficit en la metilación de un gen activador resultará también en una mayor activación del ciclo celular, por mayor expresión de este gen. La epigenética explica cómo sin alterar el código genético se pueden expresar funciones cancerosas. Por regla general una única alteración genetica no es suficiente para la aparición de un cáncer. Esto es así entre otros motivos por la duplicidad de los cromosomas. Así por ejemplo alguien que presente una mutación somática en un alelo del gen BRCA-1 no presentará un cáncer en tanto y en cuanto el alelo sano tenga capacidad de compensar el alelo mutado. Sin embargo si se daña el alelo de BRCA sano (delecciones, mutaciones espontáneas) o si este sufre una excesiva metilación (alteración epigenética) será cuando actúe el alelo dañado y surja el cáncer. Esta explicación es simplista puesto que in vivo actúan multitud de factores reguladores redundantes que evitan que una única alteración pueda desencadenar un cáncer. En general los factores que inducen la carcinogénesis son aquellos que alteran el material genético o la expresión de este. Hemos de destacar: 1. Las alteraciones genéticas familiares. Las más conocidas y estudiadas son la alteración de los genes BRCA. Los genes BRCA codifican proteínas responsables de la reparación de errores en la secuencia de pares de bases. Hay muchas otras alteraciones genéticas que presentan agrupación familiar, algunas están identificadas como el síndrome de Li-Fraumeni, el síndrome de Peutz-Jeghers, la enfermedad de Cowden, etc. Sin embargo, la mayoría de alteraciones que causan una agrupación familiar no se conocen, por lo que es imposible su diagnóstico genético a dia de hoy. 2. Las radiaciones ionizantes. El efecto mutagénico de las radiaciones ionizantes és acumulativo. Lo importante es la dosis recibida a lo largo de la vida, no su fraccionamiento. La radiación sobre el tejido mamario puede conllevar alteraciones genéticas que produzcan el cáncer. La mama es especialmente sensible a estas radiaciones durante la fase de desarrollo puberal. Por ello es importante un control muy estrecho en unidades de alto riesgo de las mujeres que han recibido radioterapia sobre la zona. U na de las causas más frecuentes de recibir radiación durante el desarrollo puberal son los campos tipo manttel de los linfomas de Hodgkin. Por el contrario la radiación a la que se expone la paciente por la realización de una mamografía es insuficiente para inducir la carcinogénesis. Los modernos métodos digitales utilizan dosis de radiación menores. Las únicas pacientes que serían susceptibles a la radiación de las mamografías repetidas serían las que presentan el sd de Ataxia-telengiectasia. 3. Hormonas sexuales. Los estrógenos son un muy importante carcinogénico. Apoyan este hecho múltiples estudios. Sabemos que aumentan el riesgo de cancer de mama las elevadas concentraciones de estrógenos en orina o suero, el aumento en el Índice de Masa [ 513 ] Fundamentos de GINECOLOGÍA (SEGO) Corporal (posiblemente por aumento de acción de la Aromatasa periférica) y la terapia hormonal sustitutiva (especialmente cuando se administra conjuntamente estrógenos y gestágemos). Por contra disminuyen el riesgo de cáncer de mama los fármacos que tienen acción antagonista sobre los receptores estrógenos (los fármacos del grupo SERM) como por ejemplo el tamoxifeno o el raloxifeno. CARACTERÍSTICAS QUE HA DE PRESENTAR EL TEJIDO TUMORAL Según describieron Hanahan y Weinberg las células tumorales han de presentar 6 alteraciones esenciales en su fisiología que conjuntamente comportarán crecimiento maligno. 1. Autosuficiencia en la producción de señales de crecimiento. Las células normales no pueden proliferar en ausencia de señales de crecimiento, por el contrario las células tumorales generan sus propias señales de crecimiento, reduciendo su dependencia de la estimulación exógena, de hecho muchos oncogenes actúan imitando las señales de crecimiento. U na de las maneras sería por ejemplo la sobrexpresión de c-erbB-2. U na gran expresión de esta proteína de membrana hace que en ocasiones se puedan formar dímeros sin ligando que activen la tirosinkinasa. 2. Insensibilidad a las señales anticrecimiento. En los tejidos normales existen un gran número de señales antiproliferativas que mantienen la quiescencia celular y la homeostasis tisular. La mayoría de señales anticrecimiento coinciden en la proteína del retinoblastoma. Las células tumorales desarrollan múltiples estrategias para evitar estas señales anticrecimiento 3. Evasión de la apoptosis. La capacidad de una población tumoral de aumentar de número no sólo depende del ratio de proliferación si no también del ratio de desgaste. Este desgaste se deberá fundamentalmente a la muerte celular programada o apoptosis. 4. Pérdida de la limitación al potencial reproductivo. Las células mamarias presentan un programa celular autónomo que limita a un cierto número la capacidad de duplicación. Este sistema es independiente de las señales reproductivas recibidas. Las células tumorales han de conseguir evitar este mecanismo de limitación para poder constituir un cáncer macroscópico potencialmente mortal. 5. Estimulación de la angiogénesis. Tanto el oxígeno como los nutrientes son imprescindibles para la supervivencia de toda célula. Por ello todas las células de un tejido deben encontrarse a una distancia máxima de 100 µm de un capilar sanguíneo. Las células tumorales han de ser capaces de inducir la angiogé[ 514 ] nesis para proveerse de los nutrientes necesarios para su crecimiento. Sin esta capacidad las células del centro del tumor mueren, como sucede en los Carcinoma Ductales in situ (CDIS), en el que las células del centro del ducto no tienen aporte suficiente de oxígeno y nutrientes, lo que les provoca la muerte celular. Al morir estas células provocan unos depósitos de calcio que vemos en la mamografía en forma de microcalcificaciones. 6. Invasión de tejidos y metástasis. Durante la progresión tumoral se crean células que son capaces de romper la membrana basal e invadir el estroma circundante así como desplazarse a lugares distantes donde establecer nuevas colonias. Inicialmente, en estas nuevas colonias el espacio y los nutrientes no estarán limitadas. La capacidad o no de metastatizar será al fin y al cabo lo que comportará la peligrosidad del tumor. U n cáncer de mama no matará por su acción local si no por sus metástasis en órganos vitales como el SNC, el hígado, la médula ósea, el pulmón, etc. Los mecanismos desarrollados por las células para metastatizar son extremadamente complejos y específicos para cada órgano, implicando diferentes proteínas de adhesión y proteasas. No son las mismas características las que se precisan para invadir el SNC o el tejido óseo. En este campo se está focalizando buena parte de los esfuerzos en investigación básica con el objetivo de encontrar nuevas dianas terapéuticas. EVOLUCIÓN DESDE LA CÉLULA NORMAL A LA CÉLULA TUMORAL El tejido mamario sufre una acumulación de daños y cambios genéticos y epigenéticos que lo hacen pasar por diferentes pasos hasta llegar a cáncer. En general se admite que esta acumulación hace que el tejido normal pase por hiperplasia benigna, hiperplasia atípica, Carcinoma Ductal in situ y finalmente carcinoma infiltrante. El tiempo que sucede entre un episodio y otro es muy variable y sólo al llegar a ser infiltrante consideramos irreversible el proceso. Aún cuando es imposible demostrar que todos los tumores evolucionen de esta manera si que se considera que de una manera más o menos rápida el proceso es evolutivo y que no hay transformación directa desde la célula normal hasta la célula cancerosa. Sin embargo este concepto parte de la histología clásica que tiene en cuenta factores morfológicos e immunohistoquímicos. La aparición de los caracteres genotípicos puede hacernos cambiar ciertos conceptos. Según las clasificaciones genotípicas distinguimos tumores Luminal A, Luminal B, HER2 y Basal-Like que presentan en general una expresividad de citokeratinas específicas pero no perfectamente correlacionada, así por ejemplo los tumores luminales suelen expresar receptores hormona- CÁNCER DE MAMA II les y los Basal-Like no expresan receptoes hormonales ni HER-2. Queda pendiente cómo integrar estos conocimientos de expresividad genética en la explicación de la historia natural del cáncer de mama. La historia natural del cáncer de mama no es constante dado y que no todos los tumores han padecido la misma sucesión de noxas. En general la primera alteración es presentar una respuesta anormal a los factores de crecimiento (por ejemplo los receptores de estrógenos). Posteriormente las células dejan de responder de forma normal a las señales de apoptosis, pierden la función tumorsupresora y presentan una expresión anormal de oncogenes (por ejemplo el c-erbB-2). De forma más o menos simultánea a estas alteraciones presenta una inestabilidad genética que podemos observar como pérdida de heterozigosidad. Todo ello se acompaña de cambios en el estroma circundante (por ejemplo la angiogénesis), la aparición del fenotipo tumoral específico y finalmente la invasión del tejido circundante por aumento en la función de las células malignas y pérdida de función de las células normales. Aún y cuando no está plenamente demostrada la existencia de stem cells tumorales y existen numerosas lagunas de conocimiento, cada vez hay más datos que defienden la existencia de estas células. Las stem cells cancerosas tienen una capacidad de autorenovación constante y han perdido la capacidad de regulación del crecimiento (puntos 1 a 4 del apartado “Características que ha de presentar el tejido tumoral”) pero tienen capacidad de diferenciación. Así se convertirían en las proveedoras de nuevas células tumorales para el tejido canceroso. Se postula que las stem cells tumorales se mantienen en general en estado quiescente. Ello explicaría la resistencia a los tratamientos antineoplásicos y la recidiva tumoral. Por ello se están dirigiendo muchos esfuerzos de investigación a encontrar tratamientos específicos contra las stem cells tumorales. El objetivo es definir dianas terapéuticas propias de estas células que permitan desarrollar terapéuticas biológicas específicas. ENFERMEDADES PREINVASIVAS Definimos como enfermedades preinvasivas a aquellas lesiones que en su evolución normal desarrollarán cáncer de mama. Serían pues diferentes estaciones en el recorrido desde tejido normal hasta cáncer. Tal y como hemos enumerado en el anterior apartado son lesiones preinvasivas la hiperplasia ductal con atípias y el Carcinoma ductal in situ. Sin embargo también las neoplasias lobulillares también han de ser clasificadas dentro del grupo de enfermedades preinvasivas aún y cuando no está nada clara su evolución natural. Las neoplasias lobulillares incluyen la hiperplasia lobulillar con atípias y el carcinoma lobulillar in situ. Ambas lesiones presentan características citológicas idénticas y un aumento de la celularidad lobulillar con atípias. Sólo se distinguirá entre ambas lesiones por el porcentaje de lobulillos afectados. Las neoplasias lobulillares pueden afectar la mama de forma global y incluso ser bilaterales. Su presencia aumenta el riesgo a padecer tanto carcinoma lobulillar infiltrante como carcinoma ductal infiltrante no sólo en la zona de la mama donde se ha hallado la neoplasia lobulillar sino en ambas mamas. Por ello hay autores que la consideran un marcador de riesgo más que una lesión preinvasiva. METÁSTASIS La capacidad de hacer metástasis a distancia es lo que define la peligrosidad del cáncer de mama. La evolución de la enfermedad local difícilmente puede comprometer la vida de la paciente sin embargo las metástasis a órganos críticos sí podrán desencadenar la muerte. Inicialmente se consideraba que el cáncer de mama evolucionaba en primer lugar en la mama, posteriormente hacia metástasis ganglionares y finalmente hacia metástasis a distancia. Posteriormente prevaleció la idea de que el cáncer de mama es una enfermedad sistémica desde el inicio. Es decir que incluso los tumores pequeños y sin afectación axilar pueden hacer metástasis a distancia, A favor de esta hipótesis tenemos que la quimioterapia mejora la supervivencia de prácticamente cualquier estadio de mama. Por tanto que en cualquier estadio de mama pueden haber nidos metastásicos, indetectables por técnicas de imagen y sobre los cuales actuaría la quimioterapia. La quimioterapia es capaz de erradicar estas metástasis cuando se encuentran en los estadios incipientes de un nueva colonización. Actualmente sabemos que hay tumores con una gran capacidad de metastatización y otros por el contrario que incluso en tamaños grandes no han adquirido esa capacidad. Esto se traduce en tumores de buen pronóstico y tumores de mal pronóstico que podemos clasificar analizando su carga genética mediante arrays. Los tumores con mal pronóstico expresarían incluso en estadios muy precoces características que les capacitarían a hacer metástasis. Esto se ha demostrado en dos grandes estudios retrospectivos. Ahora se quiere demostrar que esta información es útil de forma prospectiva. Con este objetivo se ha diseñado el estudio MINDACT que analiza si tumores con y buenos factores pronósicos habituales pueden obviar la quimioterapia ya que los tumores con good signature tienen baja capacidad de hacer metástasis y por lo tanto administrar quimioterápia sería sobretratar a estas pacientes. [ 515 ] Fundamentos de GINECOLOGÍA (SEGO) lesión de mayor grado (carcinoma ductal in situ o carcinoma infiltrante). Por tanto realizaremos una biopsia escisional de la imagen radiológica que ha causado el diagnóstico. No será preciso obtener márgenes de seguridad una vez confirmado el diagnóstico. Ya hemos expuesto que típicamente la afectación es dispersa y que obtener márgenes de seguridad puede comportar la necesidad de mastectomía. Esto en una lesión que únicamente comporta un aumento de riesgo de ambas mamas no presenta proporcionalidad. Figura 1: Carcinoma ductal in situ: las células cancerosas están limitadas por la membrana basal. Se observan áreas de comedonecrosis. Carcinoma in situ CARCINOMA DUCTAL IN SITU El Carcinoma Ductal In Situ (CDIS) (Figura 1) es una lesion preinvasiva que se caracteriza por la proliferación intraductal de células atípicas que dejadas a libre evolución pueden invadir el estroma circundante y progresar a Carcinoma Ductal Infiltrante (CDI). Historia natural del CDIS CARCINOMA LOBULILLAR IN SITU El Carcinoma lobulillar in situ es una entidad poco frecuente. Consiste en una proliferación de células con características atípicas en los lobulillos terminales de los hacinos mamarios. Tal y como hemos expuesto en el apartado “Enfermedades preinvasivas” el carcinoma lobulillar in situ se encuentra clasificado dentro de las lesiones denominadas neoplasias lobulillares., que engloba tanto al carcinoma lobulillar in situ como la hiperplasia lobulillar con atípias. Dado y que sólo se diferencia entre ambas entidades por el porcentaje de lobulillos afectados muchos patólogos prefieren hablar de neoplasia lobulillar antes que de carcinoma lobulillar in situ. La neoplasia lobulillar no es en sensu estricto una lesión preinvasiva. Si fuese así cabría esperar que dejada a su libre evolución la lesión progresara a Carcinoma Lobulillar Infiltrante pero las neoplasias lobulillares aumentan el riesgo de que se presente una lesión infiltrativa (ductal o lobulillar) no sólo en la zona dónde se ha diagnosticado, si no en cualquier cuadrante y en ambas mamas. De hecho las neoplasias lobulillares típicamente afectan de forma dispersa la mama y en muchas ocasiones se presentan de forma bilateral. Por ello se las considera un diagnóstico que comporta un aumento de riesgo de cáncer de mama, no tanto una lesión a extirpar completamente. El diagnóstico de carcinoma lobulillar in situ es en la mayor parte de los casos un hallazgo casual. Esto es así porque la afectación dispersa de la mama y al hecho que su presencia no se traduce en tumor o en una imagen radiológica. El tratamiento del carcinoma lobulillar in situ es la comprobación del diagnóstico ya que en hasta un 20% de los casos el carcinoma lobulillar in situ se acompaña de una [ 516 ] Obviamente no existe ninguna serie en la que se dejen evolucionar los CDIS diagnosticados para saber exactamente su evolución natural. Sin embargo Page revisó retrospectivamente una serie de 11760 biopsias diagnosticadas de hiperplasia ductal con atípias. En ella encontró 28 casos en los que se trataba de un CDIS de bajo grado infradiagnosticado y en los que se disponía de seguimiento de las pacientes. Tras un seguimiento medio de 31 años encontró que evolucionaron a Carcinoma Ductal Infiltrante (CDI) el 40% de los casos. La mayoría de CDI aparecieron antes de los 15 años pero pasado este intervalo aún se diagnosticaron 3 casos más. No se disponen de datos sobre la evolución de CDIS de medio o alto grado pero es lógico suponer que la evolución será más rápida y en mayor porcentaje. U n CDIS de bajo grado no evoluciona a CDIS de medio grado y posteriormente de alto grado. El CDIS de bajo grado presenta típicamente delección de 16q, asociada a genotipos de tipo Luminal-A. Por el contrario el CDIS de alto grado presenta con mayor frecuencia múltiples copias de 17q, asociada a amplificación de c-erbB-2. Dado y que las alteraciones genéticas son diferentes se cree que son precursoras de diferentes tipos de CDI. Incidencia La incidencia de CDIS ha aumentado hasta doblarse en algunas series. Este incremento se debe a las campañas de cribaje. El screening con mamografías comporta que se diagnostiquen el doble de CDIS aunque no queda claro si este incremento comporta un diagnostico precoz de casos que habrían evolucionado a CDI o si en la mayor parte estos CDIS sobrediagnosticados no llegarían a causar problemas a la paciente. La incidencia de CDIS aumenta con la edad pero lo hace de igual modo CÁNCER DE MAMA II que lo hace el CDI, de manera que el cociente CDIS/CDI se mantiene muy igualado e incluso disminuye en alguna serie. Presentación y diagnóstico Antes de la implementación de las campañas de cribaje el CDIS se presentaba en forma de tumor, telorrea o como enfermedad de Paget. Sin embargo desde el inicio del screening sistemático lo más usual es que el CDIS se diagnostique por la aparición de una imagen patológica en la mamografía. La alteración más frecuentemente asociada al CDIS son las microcalcificaciones, que se pueden asociar a densidades o distorsiones. El diagnóstico de CDIS siempre deberá ser histológico, preferiblemente por el análisis de una biopsia con aguja gruesa. La citología con PAAF no es útil en el diagnóstico de CDIS ya que sólo estudia alteraciones citológicas y no hay ninguna alteración presente únicamente en las células del CDI o del CDIS. Por ello para diferenciar entre un diagnóstico y otro es preciso estudiar el tejido (histología) (figura 2) y no sólo las células (citología). Anatomia Patológica En la biopsia definitiva de la pieza aparte de los parámetros comunes con el CDI como son el grado nuclear y la immunohistoquímica hay que tener en cuenta ciertas particularidades del CDIS. 1. Extensión. Es un valor que ocasiona muchas dificultades al patólogo dado y que el CDIS tiene una distribución parcheada por la pieza quirúrgica con gaps de tejido sano entre ductos. Estos gaps son mayores en los CDIS de bajo grado que en los de alto grado. 2. Grado de Van Nuys. U tilizado en muchos centros, consiste en realizar un score que pondera edad, grado nuclear, márgenes y tamaño. Dependiendo del resul- tado de este score recomienda la complementación con radioterapia o la mastectomía. Sin embargo los resultados son difícilmente reproducibles por la subjetividad en la determinación del grado nuclear y por que no se ha demostrado prospectivamente que algún CDIS pueda prescindir de la radioterapia. 3. Márgenes. No existe consenso sobre cual es el margen de seguridad en el CDIS. En general debemos decir que un margen afectado no es aceptable en ningún caso y que idealmente el margen debe ser superior a un centímetro. Esto no significa que márgenes entre 1cm y 1mm precisen ampliación de márgenes, se debe individualizar y valorar el patrón de distribución del CDIS por la pieza. Los protocolos del National Comprehensive Cancer Network (NCCN) recomiendan ampliación de márgenes siempre cuando el margen es inferior a 1mm. 4. Microinvasión. En cáncer de mama se define como invasión del estroma inferior a 1mm. Aún y cuando la invasión del estroma hace que ya se trate de un CDI, no de un CDIS presenta un comportamiento local similar al CDIS y una frecuencia muy baja de afectación axilar. Sin embargo hemos de recalcar que ante la aparición de áreas de microinvasión en la biopsia definitiva se debe efectuar una biopsia selectiva del ganglio centinela, si esta fracasa y no lo localiza se deberá realizar una linfadenectomía axilar completa. Tratamiento El objetivo del tratamiento del CDIS es evitar la evolución de la lesión. Tal y como hemos apuntado anteriormente el CDIS puede presentar todas las características del tejido tumoral salvo la capacidad de invadir el estroma circundante y hacer metástasis. Sin embargo el CDIS dejado evolucionar puede adquirir esta última característica, por lo que el tratamiento será la exéresis de la lesión. Hay que tener en cuenta que el CDIS tiene una gran tendencia a la recidiva y que en la mitad de los casos que recidiva un CDIS lo hace ya en forma de CDI. Tratamiento quirúrgico Figura 2: Biopsia mamaria marcada con arpón El tratamiento quirúrgico puede ser conservador (tumorectomía) o radical (mastectomía). La mastectomía está indicada en aquellos casos en que no podemos ofrecer un tratamiento conservador. Así relegamos la mastectomía a los casos de CDIS extenso, microcalcificaciones dispersas, cuando preveamos un mal resultado estético, si existe una contraindicación de la radioterapia, o por deseo expreso de la paciente. Siempre que se realiza una mastectomía por CDIS se debe ofrecer a la paciente la posibilidad de realizar una reconstrucción inmediata y en caso de no disponer de cirujano plástico en el hospital derivar a la paciente a un centro en el que se pueda efectuar. El tratamiento conser[ 517 ] Fundamentos de GINECOLOGÍA (SEGO) vador es el tratamiento idóneo y estándar salvo cuando se dan las contraindicaciones antes expuestas. Es de gran importancia para evitar las recidivas locales el estudio exhaustivo de márgenes, la radioterapia y el tratamiento con tamoxifeno cuando esté indicado. El CDIS no puede afectar a los ganglios linfáticos axilares por definición, puesto que tal y como hemos apuntado en la introducción adolece de capacidad infiltrativa y metastásica. Por tanto, en teoría, no es necesario estudiar la afectación axilar en los CDIS. Sin embargo debemos considerar que en algunos casos nos encontramos una lesión infiltrativa en una lesión diagnosticada de CDIS en la corebiopsia. Por tanto efectuaremos biopsia selectiva del ganglio centinela en todos los casos tratados mediante mastectomía, ya que si apareciese infiltración o microinfiltración no sería posible efectuar la localización fiable del ganglio centinela y nos veríamos obligados a efectuar una linfadenectomía. También consideraremos realizar una biopsia selectiva del ganglio centinela en los casos de tumorectomía con alto riesgo de microinfiltración en la biopsia definitiva como son los casos de existencia de patrón comedo o CDIS de alto grado. En estos casos la biopsia selectiva del ganglio centinela no es imprescindible y se puede optar por esperar al resultado definitivo de la pieza quirúrgica. Si apareciesen áreas de microinfiltración se podría realizar la biopsia selectiva del ganglio centinela en un segundo tiempo aunque con un mayor porcentaje de no localización. Sólo estará indicada la linfadenectomía axilar cuando el ganglio centinela sea positivo. En los casos en que se encuentren células tumorales aisladas en el ganglio centinela, no estará indicada la realización de una linfadenectomia. Consideramos que la presencia de estas células pueden ser fruto de las maniobras diagnósticoterapéuticas y no tienen capacidad infiltrativa. Radioterapia La radioterapia ha demostrado disminuir la incidencia de recidivas locales. Se han realizado múltiples estudios para identificar factores de buen pronóstico que permitan obviar la radioterapia. Sin embargo, un reciente metaanálisis no identifica ningún subgrupo y concluye que la radioterapia es necesaria siempre después de un tratamiento conservador. Hormonoterapia El tratamiento hormonal con tamoxifeno reduce el porcentaje de recidivas locales en CDIS con receptores hormonales positivos, por lo que estará indicado en estos casos. No hay estudios sobre el efecto de los inhibidores de la aromatasa en reducir la incidencia de recidivas locales por lo que no existe indicación de tratamiento tras tratamiento conservador con estos fármacos. [ 518 ] En las pacientes mastectomizadas el uso del tamoxifeno sólo está indicado para disminuir la incidencia de cáncer contralateral. En estos casos el raloxifeno puede ser una alternativa con un mejor perfil de seguridad. Existe un estudio en marcha en nuestro país denominado Excel que recluta a pacientes diagnosticadas de CDIS tratadas mediante mastectomía y compara un inhibidor de la aromatasa (exemestano) con placebo. Quimioterapia No existe ninguna indicación para el uso de quimioterapia en pacientes diagnosticadas de CDIS. De igual manera no estará indicado el tratamiento con Trastuzumab. Carcinoma infiltrante CLASIFICACIÓN HISTOLÓGICA Carcinoma Ductal Infiltrante (CDI). Es la variedad más frecuente, presente en más de dos terceras partes de los casos. Suele acompañarse de mucha fibrosis por interacción con los fibroblastos. Esta intensa fibrosis es la responsable de que sea palpable (tumor) y visible por mamografía (densidad). Carcinoma Lobulillar Infiltrante (CLI). Es la segunda variedad más frecuente. No se observa nunca en varones. Es difícil de diagnosticar porque al contrario que el CDI no suele acompañarse de fibrosis. Por este mismo motivo en muchas ocasiones el tamaño histológico es superior al esperado por clínica y radiología. Resulta especialmente interesante su estudio prequirúrgico mediante Resonancia Magnética siempre que se opte por tratamiento conservador en un CLI. Carcinomas infiltrantes de buen pronóstico. Las variedades de carcinoma tubular, cribiforme, mucinoso, medular, papilar infiltrante y adenoide quístico son en general poco frecuentes y presentan una menor capacidad para hacer metástasis ganglionares o a distancia. Otros carcinomas epiteliales muy poco frecuentes son los carcinomas metaplásico, de células en anillo de sello, apocrino, histiocitoide, secretor, apocrino, etc Tumores malignos no epiteliales. También son muy poco frecuentes, en la mama podemos encontrar sarcomas, linfomas, mioepiteliomas, tumores cutáneos malignos y todo tipo de metástasis. Extensión Para valorar la extensión del cáncer se emplea la clasificación de la American Joint Comittee on Cancer (AJCC) en su versión del 2002 que distingue entre la clasificación clínica y la patológica. La clasificación clínica recoge la informa- CÁNCER DE MAMA II ción de la que se dispone por clínica o métodos de imagen. La clasificación patológica es similar pero fruto del estudio anatomopatológico se distingue de la clínica por anteponer una “p “ minúscula (pT pN M). No se reproduce aquí por problemas de copyright pero se puede consultar on-line en www.nccn.org/professionals/physician_gls/PDF/breast.pdf o adquirir en www.cancerstaging.net. CLASIFICACIÓN GENÉTICA Los avances en el campo de la genómica nos han permitido hacer una clasificación más precisad de los tumores malignos de mama. Hasta el momento los tumores se han clasificado de acuerdo a criterios de extensión (tamaño, afectación ganglionar y metástasis), histológicos (ductales, lobulillares, mucinosos, cribiformes…) e inmunohistoquìmicos (receptores hormonales, c-erbB-2, Ki-67, p53…). Sin embargo tumores que presentan igual extensión, histología e inmunohistoquímica pueden tener comportamientos muy diferentes. Estas diferencias probablemente se deben a que los actuales sistemas de clasificación y por ende de pronóstico presentan muchas limitaciones, mezclando tumores genéticamente muy distintos aunque morfológicamente similares. La técnica de microarrays permite estudiar un gran número de genes y nos ha hecho cambiar la forma de clasificar los cánceres, basándonos en su patron genético, que se traducirá en diferente patrón molecular. En general, los genes que confieren mal pronóstico están implicados en el control del ciclo celular, invasividad, metástasis y angiogénesis. Para la clasificación genética mediante microarrays existen dos sistemas que han demostrado retrospectivamente su utilidad pronóstica. La clasificación de Perou identifica dos grandes grupos: 1. Tumores que expresan mayoritariamente genes propios de las células luminales epiteliales mamarias. Son genes ligados a la expresión de los receptores hormonales. Se subdividen a su vez en: a. Luminal A: presentan el mejor pronóstico pero también presentan mala respuesta al tratamento con quimioterapia. b. Luminal B: presentan un pronóstico similar al grupo de tumores no luminales. 2. Tumores que tienen una nula o baja expresión de los genes de los receptores hormonales y expresan mayoritariamente genes propios de las células basales y/o mioepiteliales. a. HER2 positive/ER negative. Son tumores que tienen amplificados los genes de 17q22.24, que incluye el gen HER-2 (también llamado ERBB2 Tienen comportamiento agresivo y responden moderadamente al tratamiento con quimioterapia. b. Basal-like. Estos tumores se caracterizan por una gran expresión de citokeratinas 5 y 7, laminina y la proteina ligadora de acidos grasos 7. Son los tumores con menor supervivencia pero también son los que mejor responden al tratamiento con quimioterapia. c. Normal-like. Los tumores de este subtipo presentan una alta expresión de genes del tejido adiposo otros genes de celulas no epiteliales. Presentan peor pronóstico que los Luminal A. La clasificación de van de Vijver es mucho más sencilla pero igualmente eficaz. Identifica a partir del estudio mediante microarrays de 70 genes dos grupos denominados good signature si tienen buen pronostico o poor signature si el pronostico es malo. Sus resultados demuestran una mejor clasificación de los tumores cuando los compara con los factores pronósticos de St Gallen o los del National Institutes of Health (NIH). El estudio tiene la limitación de no poder distinguir el curso de los tumores con ganglios positivos no tratados puesto que todos los pacientes con axila afectada recibieron quimioterapia por su alto riesgo de aparición de metástasis. CARCINOMA INFLAMATORIO El carcinoma inflamatorio se define como la afectación tumoral invasiva de la mama con edema, eritema y calor. En la clasificación de la American Joint Comittee on Cancer (AJCC) se tipifica como T4d. Es una entidad poco frecuente, presentándose en un 1 o 6 % de los casos. El registo central americano, el Surveillance, Epidemiology and End Results (SEER) del National Cancer Institut (NCI) detectó un gran aumento en su incidencia entre el 1975 y el 1992. Durante este periodo se pasó del 0,3 al 0,7 por cada 1000 mujeres en la población blanca y del 0,6 al 1,1 por cada 1000 mujeres en la población negra. Durante este mismo periodo la incidencia global de cáncer también aumento pero no de esta forma exponencial, pasando del 25 al 27%. El diagnóstico del carcinoma inflamatorio es eminentemente clínico. Se caracteriza por la aparición, habitualmente de forma súbita de los signos clásicos de inflamación: aumento de la temperatura local de la mama, edema y eritema (Figura 3). El carcinoma inflamatorio puede presentarse sin masa palpable subyacente, lo cual complica el diagnóstico. La afectación clínica de los ganglios axilares es muy frecuente pero no imprescindible aún y cuando la etiopatogenia del carcinoma inflamatorio es precisamente por estasis linfática. El diagnóstico del carcinoma inflamatorio puede ser difícil. El diagnóstico diferencial lo debemos hacer con el carcinoma de mama localmente avanzado y con la mastitis infecciosa. En el caso del carcinoma localmente [ 519 ] Fundamentos de GINECOLOGÍA (SEGO) Figura 3: Carcinoma inflamatorio. Edema y eritema cutáneos. Figura 4: Enfermedad de Paget de la mama: lesión eczematosa del pezón y areola avanzado (T4b o T4c) la secuencia temporal determina el diagnóstico ya que inicialmente aparece el tumor y posteriormente aparece la afectación cutánea. Esta afectación cutánea está habitualmente más circunscrita que en el caso del carcinoma inflamatorio, que normalmente afecta toda la mama. Para diferenciar de la mastitis, esta suele aparecer también de forma más localizada, acompañada de más clínica y cede al tratamiento con antibióticos. En la mamografía es característica la aparición de linfangitis que provoca un engrosamiento de la piel y el borramiento de imágenes, presentando la mama un aspecto desenfocado. En el diagnóstico histológico es importante la toma de biopsias cutáneas de mama mediante bisturí circular (punch). En ellas se suele observar invasión masiva de los linfáticos con émbolos carcinomatosos. Sin embargo no es ni patognomónica ni constante. El diagnóstico del carcinoma inflamatorio es clínico y en ocasiones difícil. El tratamiento del carcinoma inflamatorio no es quirúrgico de entrada en ningún caso, se debe primero solucionar el cuadro inflamatorio. Habitualmente esto se hará mediante quimioterapia neoadyuvante. También se pueden emplear o añadir el uso de tratamiento hormonal o la radioterapia. No es preciso recalcar que el tratamiento hormonal sólo se empleará en aquellos raros casos que presenten receptores hormonales positivos. U na vez remita el componente inflamatorio se podrá realizar el tratamiento quirúrgico que siempre será una mastectomía. No se debe realizar tratamiento quirúrgico si persisten los signos inflamatorios puesto que en tal caso sería condenar a la paciente a recidiva local y/o fallo de sutura. El pronóstico del carcinoma inflamatorio es sombrío y con supervivencias e intervalos libre de enfermedad inferiores a los casos de carcinoma localmente avanzado. Por ello hacemos énfasis en el diagnóstico diferencial [ 520 ] entre ambas entidades. La supervivencia a los 5 años es próxima al 30 %. ENFERMEDAD DE PAGET La enfermedad de Paget del pezón es la aparición de células con nucleolo hipercromático y prominente (células de Paget) en la epidermis del pezón, que clínicamente se manifiesta como una lesión eczematosa del pezón y la areola y que se puede acompañar o no, de carcinoma ductal in situ o carcinoma ductal inflamatorio (figura 4). El primero en describir la enfermedad de Paget fue Alfred Velpau, médico francés que también describiría un cabestrillo al que sí daría su nombre. Sin embargo fue James Paget (cirujano real británico) el que asoció el eczema del pezón a la enfermedad tumoral subyacente por lo que pasó a la posteridad en el campo de la senología. Habitualmente la enfermedad de Paget está asociada a patología tumoral subyacente pero no necesariamente siempre es así. El proceso tumoral puede ser tanto en forma de carcinoma ductal in situ como de carcinoma ductal infiltrante. En prácticamente la totalidad de los casos estos tumores presentan sobreexpresada la proteína de membrana HER-2. Este factor explica su fisiopatogenia ya que las células epidérmicas que presentan HER-1 en su membrana, producen una sustancia llamada hergulin-. Esta, interacciona con las proteínas de membrana HER-2, HER-3 y HER-4 induciendo la quimiotaxis de las células de Paget desde la luz del ducto hasta la epidermis a través del pezón y sin necesidad de romper la membrana basal. Según los datos del SEER, la incidencia de la enfermedad de Paget asociada a enfermedad tumoral ha disminuido desde la aparición de las campañas de screening. CÁNCER DE MAMA II Posiblemente se debe a un diagnóstico temprano que impide que se manifieste clínicamente. Sin embargo es notable la estabilidad en la incidencia de enfermedad de Paget aislada, sin patología tumoral subyacente. puede presentar un tumor que deforme la silueta mamaria y que por compresión puede hacer que la piel presente un aspecto violáceo o incluso ulcerarla. El TP de grado intermedio puede debutar de ambas maneras. El tratamiento quirúrgico de la enfermedad de Paget puede ser conservador o radical, con las mismas indicaciones que en toda patología tumoral mamaria. La seguridad del tratamiento conservador no se ha demostrado en un estudio comparativo. Sin embargo el estudio EORTC obtuvo una tasa de recidivas locales baja, equiparable a la del tratamiento conservador del carcinoma ductal in situ. El tratamiento conservador incluirá al menos el complejo pezón-areola y una cuña del tejido retroareolar. Es preciso obtener márgenes de seguridad. Después del tratamiento quirúrgico se realizará tratamiento quimioterápico y/o hormonal adyuvante si así lo precisa la lesión subyacente. En todos los casos si se ha realizado tratamiento conservador se deberá realizar radioterapia. El TP se presenta en la mamografía como una masa de crecimiento expansivo bien circunscrita. En la ecografia el TP de bajo grado se confunde con el fibroadenoma, entidad más frecuente y que presenta también una morfología ovoidea, con bordes precisos y ecogeneidad homogénea. El TP de alto grado en la ecografía también presenta bordes bien definidos, propios de un crecimiento básicamente expansivo pero en su interior suele presentar mayor heterogeneidad con áreas quíticas y hemorrágicas. El pronóstico de la enfermedad de Paget es el propio de la enfermedad acompañante. La afectación del pezón no ensombrece el pronóstico. La enfermedad de Paget aislada tiene un pronóstico excelente, equiparable al del carcinoma ductal in situ. TUMOR PHILLODES El tumor phillodes (o phyllodes) es una neoplasia fibroepitelial caracterizada por su rápido crecimiento que provoca que el estroma adquiera forma de hojas (phyllodes=hojas). El tumor phillodes (TP) puede tener un comportamiento benigno, border-line o maligno. El TP es una entidad poco frecuente, presentándose en menos del 1% de los tumores de mama. Se presenta entre los 35 y 55 años, siendo la edad media de aparición de los tumores benignos de 34 años, de los border-line de 46 años y de los malignos de 52 años.. En general las diferentes series coinciden en que a mayor tamaño y edad más probable es que el tumor sea maligno y viceversa. Los porcentajes y edades medias varían entre las diferentes series por la dificultad en la interpretación de la clasificación histológica. Para intentar homogeneizar los resultados se emplean la clasificación de la OMS según los criterios de Azzopari y Salvadori. EL TP se suele presentar en forma de tumor de rápido crecimiento. El tumor de bajo grado o benigno habitualmente se suele comportar como un fibroadenoma, es decir como un tumor liso, bien circunscrito de consistencia elástica pero con crecimiento entre controles. Por ello se recomienda la exéresis de aquellas tumoraciones con características de benignidad pero que presenten aumento de tamaño. El TP de alto grado se presenta como una tumoración blanda, bien circuncrita, que ha presentado una evolución extremadamente rápida. La paciente Como en toda tumoración mamaria es necesario obtener histología antes de la intervención. En el caso del tumor de bajo grado para no retrasar el tratamiento al confundirlo con un fibroadenoma. Y en el caso del TP alto grado porque la biopsia peroperatoria por congelación tiene muy mala sensibilidad y especifidad. En muchas ocasiones debido a que se presenta como una gran masa con áreas de hemorragia y necrosis se ha confundido con carcinomas infiltrantes y se han tratado inecesariamente como tales. El tratamiento del TP es eminentemente quirúrgico, tal y como coincidimos los diferentes autores, sin embargo existen divergencias en cuanto a la extensión de la cirugía (conservador vs radical), los márgenes de los TP de bajo grado (necesarios o inecesarios) y la necesidad de tratamiento adyuvante y/o radioterapia ulterior. La exéresis por enucleación sin márgenes de seguridad de los TP de bajo grado, es una opción que consideramos aceptable, habida cuenta de la baja incidencia de recidivas locales reportadas en estas pacientes. EL TP de medio y alto grado si precisará de márgenes de seguridad ye llo condicionará el tratamiento radical o conservador (figura 5). Si se opta por tratamiento radical se debe realizar re- Figura 5: Tratamiento conservador [ 521 ] Fundamentos de GINECOLOGÍA (SEGO) construcción inmediata. En caso de no poder ofrecer una reconstrucción inmediata por adolecer el centro de un servicio de cirugía plástica se deberá derivar a la paciente a un centro de referencia. La linfadenectomía axilar o la biopsia selectiva de ganglio centinela no es precisa en los TP de ningún grado dado y que la diseminación linfática no es común en estos tumores. La radioterapia pos tratamiento conservador no es necesaria, sin embargo no hay estudios que lo demuestran puesto que tal y como hemos expuesto es una entidad poco frecuente. Tampoco hay acuerdo sobre la necesidad o no de quimioterapia adyuvante. U n estudio reciente parece indicar que el tratamiento con antraciclinas no mejora el intervalo libre de enfermedad ni la supervivencia, sin embargo el volumen de la muestra es muy pequeño. Lecturas recomendadas - Bijker N, Meijnen P, Peterse JL, Bogaerts J, Van H, I, Julien JP et al. Breast-conserving treatment with or without radiotherapy in ductal carcinoma-in-situ: ten-year results of European Organisation for Research and Treatment of Cancer randomized phase III trial 10853--a study by the EORTC Breast Cancer Cooperative Group and EORTC Radiotherapy Group. J Clin Oncol. 24(21):3381-3387. 2006. [ 522 ] - Burstein HJ, Polyak K, Wong JS, Lester SC, Kaelin CM. Ductal carcinoma in situ of the breast. N Engl J Med. 350(14):1430-1441. 2004. - Erbas B, Provenzano E, Armes J, Gertig D. The natural history of ductal carcinoma in situ of the breast: a review. Breast Cancer Res Treat. 97(2):135-144. 2006. - Esteller M. Epigenetics in cancer. N Engl J Med. 358(11):1148-1159. 2008. - Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 100(1):57-70. 2000. - Meijnen P, Peterse JL, Antonini N, Rutgers EJ, van de Vijver MJ. Immunohistochemical categorisation of ductal carcinoma in situ of the breast. Br J Cancer. 98(1):137-142. 2008. - Silverstein MJ, Lagios MD, Groshen S, Waisman JR, Lewinsky BS, Martino S et al. The influence of margin width on local control of ductal carcinoma in situ of the breast. N Engl J Med. 340(19):1455-1461. 1999. - Sumner WE, III, Koniaris LG, Snell SE, Spector S, Powell J, Avisar E et al. Results of 23,810 cases of ductal carcinomain-situ. Ann Surg Oncol. 14(5):1638-1643. 2007. - Wong JS, Kaelin CM, Troyan SL, Gadd MA, Gelman R, Lester SC et al. Prospective study of wide excision alone for ductal carcinoma in situ of the breast. J Clin Oncol. 24(7):10311036. 2006.