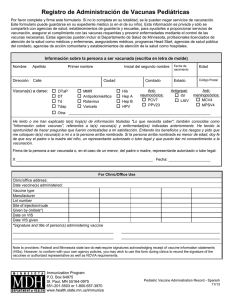
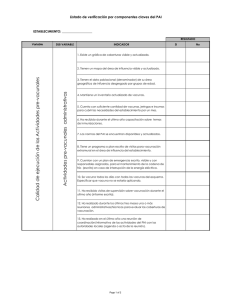
Vacunas 2012 - Vall d`Hebron
Anuncio

Portada vacunas 2012_print.pdf 1 02/11/12 12:09 M Y CM MY CY CMY 2012 K VACUNAS 2012 C Magda Campins Martí Fernando A. Moraga Llop Magda Campins Martí Fernando A. Moraga Llop iruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus nfluenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae iebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria étanos Rubéola Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre marilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos os ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla iebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre tifoidea Meningococo oliomielitis Varicela Cólera Fiebre BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela DifteriaTétanos Tos ferina Hepatitis A Hepatitis B rotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo oliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina VPH Hepatitis B Parotiditis abia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis ricela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia ubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola arampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera CG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión étanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis aponesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa ncefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCGEncefalitis japonesa Encefalitis entroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma otavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco este Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Neumococo Gripe Tétanos Rotavirus HaemophilusPapiloma Rot nfluenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae iebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria étanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Gripe Meningococo Papiloma Rotavirus Haemophilus influenzae Fiebre marilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Sarampión Carbunco Peste Viruela Difteria tanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre oidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión TétanosNeumococo Gripe Papiloma Rotavirus Sarampión Haemophilus influenzae Fiebre amarilla Fiebre oidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela BCG Rabia Difteria Tétanos Tos rina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre oidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Cómo citar este libro: Campins Martí M, Moraga Llop FA, editores. Vacunas 2012. Barcelona: Gráficas Campás; 2012. El contenido de esta obra refleja las opiniones, los criterios, las conclusiones o los hallazgos propios de los autores. Cualquier producto mencionado deberá ser utilizado de acuerdo con la ficha técnica del fabricante. Vacunas 2012 ISBN: 978-84-695-6244-4 Reservados todos los derechos. Ninguna parte de esta publicación puede ser reproducida, transmitida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo las fotocopias, grabaciones o cualquier sistema de recuperación de almacenaje de información, sin el permiso escrito de los titulares del Copyright. © Copyright: Magda Campins Martí y Fernando A. Moraga Llop, 2012 Impreso en España Depósito legal: B-29.882-2012 Vacunas 2012 Magda Campins Martí Fernando A. Moraga Llop Autores Raquel Abad Torreblanca Laboratorio de Referencia de Meningococos, Instituto de Salud Carlos III, Majadahonda, Madrid Marta Aldea Novo Centro de Vacunación de Adultos, Servicio de Medicina Preventiva y Epidemiología, Hospital Clínic, Universitat de Barcelona, Barcelona Lluís Armadans Gil Servicio de Medicina Preventiva y Epidemiología, Hospital Universitari Vall d’Hebron, Universitat Autònoma de Barcelona, Barcelona Mª Pilar Arrazola Martínez Servicio de Medicina Preventiva, Hospital Universitario 12 de Octubre, Universidad Complutense, Madrid Irene Barrabeig Fabregat Unitat de Vigilància Epidemiològica Regió Costa Ponent, Departament de Salut, Generalitat de Catalunya, Barcelona Joan Batalla Clavell Programa de Vacunacions de Catalunya, Agència de Salut Pública de Catalunya, Departament de Salut, Generalitat de Catalunya, Barcelona José María Bayas Rodríguez Centro de Vacunación de Adultos, Servicio de Medicina Preventiva y Epidemiología, Hospital Clínic, Universitat de Barcelona, Barcelona Magda Campins Martí Servicio de Medicina Preventiva y Epidemiología, Hospital Universitari Vall d’Hebron, Universitat Autònoma de Barcelona, Barcelona Alfonso Carmona Martínez Instituto Hispalense de Pediatría, Sevilla José Ramón de Juanes Pardo Servicio de Medicina Preventiva, Hospital Universitario 12 de Octubre, Universidad Complutense, Madrid V Autores Mª Isabel Fernández Cano Departament Infermeria Universitat Autònoma de Barcelona, Barcelona María Garcés-Sánchez Centro de Salud Nazaret, Valencia Instituto de Vacunas de Valencia (VIVA), Valencia Centro Superior de Investigación en Salud Pública (CSISP), Valencia Francisco Giménez Sánchez Unidad de Infectología Pediátrica, Hospital Torrecárdenas, Almería Josep Marès Bermúdez Institut Pediàtric Marès-Riera, Blanes, Girona Montse Martínez Marcos Programa de Vacunacions de Catalunya, Agència de Salut Pública de Catalunya, Departament de Salut, Generalitat de Catalunya, Barcelona Xavier Martínez Gómez Servicio de Medicina Preventiva y Epidemiología, Hospital Universitari Vall d’Hebron, Universitat Autònoma de Barcelona, Barcelona Antoni Martínez Roig Servicio de Pediatría, Hospital Universitari del Mar, Universitat Autònoma de Barcelona, Barcelona VI Glòria Mirada Masip Servei de Vigilància Epidemiològica, Servei Regional de l’Agència de Salut Pública de Catalunya, Departament de Salut, Generalitat de Catalunya, Lleida Fernando A. Moraga Llop Área Pediátrica, Hospital Universitari Vall d’Hebron, Universitat Autònoma de Barcelona, Barcelona José A. Navarro Alonso Dirección General de Salud Pública, Consejería de Sanidad y Política Social, Murcia Vaccination Advisory Group, European Centre for Disease Prevention and Control, Estocolmo José Ángel Rodrigo Pendás Servicio de Medicina Preventiva y Epidemiología, Hospital Universitari Vall d’Hebron, Universitat Autònoma de Barcelona, Barcelona Víctor Guillermo Sequera Buzarquis Centro de Vacunación de Adultos, Servicio de Medicina Preventiva y Epidemiología, Hospital Clínic, Universitat de Barcelona, Barcelona Autores Salvador Sialer Chavez Servicio de Neumología, Institut Clínic del Tórax, Hospital Clínic de Barcelona – IDIBAPS, Universitat de Barcelona, Barcelona Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES), España Montserrat Tarrés Ferran Directora de Comunicación del Grupo Novartis España, Barcelona César Tolosa Tribiño Presidente del Tribunal Superior de Justicia de Cantabria, Santander Antonio Torres Martí Servicio de Neumología, Institut Clínic del Tórax, Hospital Clínic de Barcelona – IDIBAPS, Universitat de Barcelona, Barcelona Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES), España Julio A. Vázquez Moreno Laboratorio de Referencia de Meningococos, Instituto de Salud Carlos III, Majadahonda, Madrid César Velasco Muñoz Centro de Vacunación de Adultos, Servicio de Medicina Preventiva y Epidemiología, Hospital Clínic, Universitat de Barcelona, Barcelona Alba Vilajeliu Balagué Centro de Vacunación de Adultos, Servicio de Medicina Preventiva y Epidemiología, Hospital Clínic, Universitat de Barcelona, Barcelona Luz María Vilca Yengle Comité de Ética de Investigación Clínica, Servicio de Medicina Preventiva y Epidemiología, Hospital Universitari Vall d’Hebron, Universitat Autònoma de Barcelona, Barcelona Luis C. Urbiztondo Perdices Programa de Vacunacions de Catalunya, Agència de Salut Pública de Catalunya, Departament de Salut, Generalitat de Catalunya, Barcelona VII Índice Prólogo V. Molina...................................................................................... 1 Reemergencia de enfermedades inmunoprevenibles nn Brotes epidémicos relevantes en 2011 M.P. Arrazola Martínez y J.R. de Juanes Pardo.............................. 7 nn Reemergencia de la tos ferina F. Giménez Sánchez....................................................................... 19 nn ¿Conocemos la incidencia real de la tos ferina en España? M.I. Fernández Cano, L. Armadans y M. Campins......................... 27 Seguridad vacunal nn Sistemas de vigilancia de reacciones adversas a las vacunas J.A. Navarro Alonso...................................................................... 37 nn Registro de reacciones adversas seguidas a la vacunación en Cataluña J. Batalla, L. Urbiztondo, I. Barrabeig y M. Martínez.................... 47 nn Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas................................................................................. 57 nn Seguridad vacunal. Reacciones adversas graves y no evidencia de causalidad: la presunción de inocencia M. Garcés-Sánchez........................................................................ 77 IX Índice Las vacunas, un valor cuestionado nn Doctor, no queremos vacunar a nuestro hijo J. Marès Bermúdez........................................................................ 89 nn ¿Pueden los padres oponerse a la vacunación de sus hijos, aunque ello implique un mayor riesgo de que enfermen? C. Tolosa Tribiño........................................................................... 109 nn La vacunación en los países en desarrollo A. Carmona Martínez................................................................... 123 nn Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación M. Tarrés...................................................................................... 129 Progresos en vacunología nn Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN S. Sialer y A. Torres.................................................................... 145 nn Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos M. Campins Martí..................................................................... 159 nn Posible impacto en España de la nueva vacuna antimeningocócica B J.A. Vázquez y R. Abad.............................................................. 173 nn Novedades en vacunología en 2011 F.A. Moraga-Llop....................................................................... 181 Hot topics en vacunas nn Rotavirus, sarampión, Haemophilus influenzae y meningococo del serogrupo B A. Martínez Roig....................................................................... 197 nn Virus del papiloma humano y gripe J.A. Rodrigo Pendás y L.M. Vilca Yengle....................................... 209 X Índice Aspectos prácticos de las vacunaciones nn Vacunación en situaciones de brote. Casos prácticos G. Mirada Masip y X. Martínez Gómez....................................... 233 Historia de la vacunología. Se publicaba hace 60 años nn Presentación F.A. Moraga-Llop y M. Campins Martí........................................ 259 nn El género Bordetella M. Moreno López....................................................................... 261 XI Vacunas 2012 V. Molina Prólogo Es un honor totalmente inmerecido poder escribir el prólogo de este nuevo libro sobre vacunas dirigido por los Dres. Magda Campins y Fernando A. Moraga, que recoge el contenido científico del curso de vacunas que bajo su misma dirección tuvo lugar el pasado mes de abril. Es inmerecido porque no soy investigador en vacunología ni experto en vacunas. Probablemente mis únicos méritos sean ser amigo de los directores, que no es poco, y llevar más de 30 años ejerciendo de pediatra en diferentes ámbitos, y por tanto hablando constantemente sobre vacunas y administrándolas. Esta visión de pediatra será la que orientará mis comentarios sobre el libro, como no podría ser de otra manera. No se trata de un libro clásico de vacunología, sino que intenta recoger aquellos aspectos más importantes, a criterio de los directores, relacionados con las vacunas en un momento determinado: el año 2012, año del curso. Los mismos conferenciantes, apoyados por otros coautores, plasman en sus capítulos los contenidos del citado curso. Es un libro amplio, por la cantidad de temas que incluye; serio, por el rigor expositivo y la documentación que aporta; actual, por no olvidar los aspectos más novedosos; y también práctico, por plantear situaciones que preocupan a diario al pediatra o a cualquier profesional que trabaje con vacunas. El primer bloque está dedicado a recordar la reemergencia de las enfermedades inmunoprevenibles. Recoge los brotes epidémicos relevantes en el año 2011 y analiza el aumento de la incidencia de la tos ferina, sus posibles causas y los recursos para combartirlo, aportando un estudio original sobre la infranotificación de esta enfermedad en España. El segundo bloque afronta un tema crucial: la seguridad de las vacunas. Empieza revisando los sistemas de vigilancia de las reacciones adversas y 1 Prólogo a continuación se exponen los resultados de las reacciones adversas a la vacunación recogidas en Cataluña entre los años 2000 y 2011. Son datos de extraordinario interés por su realidad, aunque se constata también que el sistema de declaración tiene que mejorar en algunos territorios. Los siguientes dos capítulos examinan de forma exhaustiva y contundente la evidencia y no evidencia de causalidad entre vacunas y reacciones adversas graves. En conjunto, un bloque muy sólido con respuestas claras a las dudas sobre seguridad. Todos los profesionales de la salud estamos preocupados por la extensión progresiva de las iniciativas antivacunas. En el bloque siguiente se analizan, por un lado, los argumentos en que se basan los que rechazan las vacunas (con la cuantificación de los riesgos que supone) y los principales razonamientos que podemos utilizar para rebatirlos; por otro, el marco legal (obligatoriedad o no) en el que se encuentra la vacunación en nuestro país. Completa el bloque una descripción sobre la vacunación en los países en vías de desarrollo, donde no existe el rechazo a la vacunas, sino todo lo contrario, y un análisis sobre los canales óptimos de comunicación en el caso de las vacunas por parte de la industria, basado en la experiencia de un importante laboratorio. Bajo el título de «Progresos en vacunología», el bloque siguiente revisa, en los dos primeros capítulos, la situación de la enfermedad neumocócica en el adulto y su posible prevención. Los resultados preliminares del estudio ODIN dibujan la situación de la enfermedad neumocócica invasiva en el adulto, y en el siguiente capítulo se recogen la eficacia y las indicaciones de uso de la vacuna neumocócica conjudada 13-valente en el adulto. Seguidamente se analiza la situación de la vacuna frente al meningococo B, una vacuna muy compleja desde el punto de vista de su concepto y fabricación, pendiente todavía de evaluación, pero de aplicación prometedora. Completa el bloque un capítulo sobre novedades en vacunología, en el cual se comentan desde los acontecimientos más relevantes en este campo durante el año 2011 hasta la repercusión mediática de los temas relacionados con las vacunas. Una excelente puesta al día de todo lo nuevo en vacunas que ha ocurrido a nuestro alrededor, enriquecido por la recogida de las preguntas del público sobre estos temas y las respuestas íntegras de los expertos. Hubo también un lugar en el curso para revisar los trabajos de investigación más recientes sobre temas candentes en relación con las vacunas. Bajo el título genérico de «Hot topics en vacunas» se revisan las publicaciones más importantes sobre la vacuna del rotavirus, el sarampión, Haemo2 V. Molina philus influenzae, el meningococo B, el virus del papiloma humano y la gripe. Una actualización de gran utilidad para los profesionales interesados. No podían faltar los aspectos prácticos de las vacunaciones, en este caso centrados en las situaciones de brote, expuestos en forma de casos prácticos con preguntas y respuestas, extraordinariamente didácticos. Completa el libro un recuerdo histórico sobre la comunicación realizada por el profesor Manuel Moreno López sobre el agente de la tos ferina, el género Bordetella, presentada en el VIII Congreso Nacional de Pediatría de Barcelona, en 1952. Como conclusión de este prólogo, creo sinceramente que se trata de una excelente revisión de temas relacionados con la vacunología, bien seleccionados y expuestos con gran rigor y claridad. El libro ayudará a recordar lo tratado durante el curso a todos los asistentes, y permitirá que los que no pudieron asistir tengan acceso a esta valiosa y útil información. Finalmente, me parece evidente que todos los profesionales que tenemos relación con el mundo de las vacunas hemos de agradecer a los directores del curso y del libro el esfuerzo que hacen año tras año, y animarles a continuar. Su curso es ya un referente y un acontecimiento esperado, como lo muestra el alto y mantenido número de asistentes. No hay duda de que su esfuerzo ha representado un aumento del interés por la vacunología por parte de los profesionales, ha contribuido a su formación y, sobre todo, ha mejorado la práctica clínica. Su esfuerzo ha valido la pena, objetivo cumplido. Hasta el próximo curso Vacunas 2013. Barcelona, 8 de octubre de 2012 Vicente Molina Pediatra Jefe del Departamento de Pediatría Institut Universitari Dexeus Barcelona 3 Reemergencia de enfermedades inmunoprevenibles M.P. Arrazola Martínez y J.R. de Juanes Pardo Brotes epidémicos relevantes en 2011 Según se recoge en el Real Decreto 2210/1995, de 28 de diciembre, del Ministerio de Sanidad y Consumo, por el que se crea la Red Nacional de Vigilancia Epidemiológica (1), se consideran situaciones epidémicas y brotes: •• La aparición de dos o más casos de la misma enfermedad asociados en persona, lugar y tiempo. •• El incremento significativo de casos en relación a los valores habitualmente observados. •• La aparición de una enfermedad, problema o riesgo para la salud en una zona hasta entonces libre de ella. •• La agregación de casos de una enfermedad en un territorio y en un tiempo comprendido entre el mínimo y el máximo periodo de incubación o de latencia. •• Los procesos de intoxicación aguda colectiva, imputable a causa accidental, manipulación o consumo. •• Cualquier incidencia de tipo catastrófico, que afecte o pueda afectar a la salud de la comunidad. En la búsqueda de brotes de enfermedades epidémicas relevantes ocurridos durante el año 2011, encontramos una serie de limitaciones que afectan a la descripción que a continuación se presenta. Entre ellas, la falta de información científica adecuada (infradeclaración o sobredeclaración, falta 7 Brotes epidémicos relevantes en 2011 de homogeneidad) o su falta de difusión (datos no publicados, retraso en la publicación), lo que complica su accesibilidad; y por el contrario, un exceso (sobre todo en algunos casos) de información no especializada. Como fuentes de información principales se utilizan: •• Organización Mundial de la Salud (www.who.int): Eurosurveillance, Weekly Epidemiological Record. •• European Center for Disease Prevention and Control – ECDC (www. ecdc.eu.int). •• Centers for Disease Control and Prevention (www.cdc.gov): Morbidity and Mortality Weekly Report. •• Instituto de Salud Carlos III – Centro Nacional de Epidemiología: Boletín Epidemiológico Semanal. •• Revistas especializadas. Para la selección de brotes relevantes hemos usado criterios de cantidad (extensión geográfica del brote, número de afectados), calidad (gravedad de la enfermedad) y persistencia (duración, dificultad de control), con la proximidad como característica común, por lo que la mayoría de los brotes que a continuación se exponen han ocurrido en Europa. BROT E S R EL EVA NTES P O R CA N T I DA D Sarampión Desde finales de 2009 se ha registrado un incremento de los casos de sarampión en muchas ciudades europeas. A finales de 2010, algunos países de la Unión Europea, como Francia, Italia, Grecia e Irlanda, presentaban altas incidencias de la enfermedad (>1/100.000 habitantes). Durante 2011 la situación se mantuvo y se comunicó la aparición de nuevos brotes epidémicos. En Europa, en 2011 se declararon al European Surveillance System 30.567 casos de sarampión, un número similar al de 2010 (30.264 casos), pero considerablemente superior al de 2009 (7175 casos) y 2008 (7817 casos). Francia declaró más de la mitad de los casos (15.206), así como la mayor tasa de notificación por 100.000 habitantes (23,4). Otros países con un número elevado de casos fueron Italia (5181 casos; tasa de notificación: 8,5/100.000), Rumanía (4015 casos; 18,7), España (1986 casos; 4,3) y Ale- 8 M.P. Arrazola Martínez y J.R. de Juanes Pardo mania (1609 casos; 2,0). Juntos, estos cinco países han declarado más del 90% de los casos de sarampión en la Unión Europea (2). En España la situación no es diferente y se observa un aumento de los casos declarados respecto a años anteriores, así como una diseminación en brotes epidémicos, no observados desde hacía décadas. Entre las comunidades con brotes importantes en 2011 destacan Andalucía (747 casos), Madrid (601), Cataluña (276) y Comunidad Valenciana (200). En Valencia, en la segunda mitad de 2011 se produjo un importante brote de sarampión nosocomial. El primer caso apareció el 15 de agosto (semana 35) en un médico residente que 17 días antes había estado en contacto en urgencias con un caso de sarampión. A partir de este primer caso nosocomial la enfermedad se propagó entre personal sanitario y no sanitario. El mayor impacto en la transmisión se produjo al inicio del brote, con un número máximo de afectados en la semana 37; el último caso de este brote se registró en la semana 42. En total se contabilizaron 21 casos: 13 entre el personal del hospital (siete médicos, dos residentes, tres enfermeros/as, dos auxiliares de enfermería y un auxiliar administrativo); los ocho restantes no eran trabajadores del centro sanitario (cuatro pacientes que acudieron a urgencias o que permanecieron ingresados en el hospital entre finales de agosto y principios de septiembre [atendidos por personal sanitario afectado], tres casos entre acompañantes de pacientes [en dos de ellos el paciente a su cargo no padeció sarampión] y un familiar de personal sanitario). Sólo tres de los afectados habían recibido la vacuna triple vírica (dos de ellos una dosis y el otro dos dosis). Los trabajadores afectados pertenecían al área de urgencias o refirieron haber tenido contacto con ésta, por lo que se consideró dicha zona como el principal foco de diseminación en el hospital. La alerta temprana a otros hospitales y la aplicación de medidas de promoción vacunal contribuyeron a que no se repitieran brotes nosocomiales en otros centros (3). Como medidas de control de los brotes es fundamental la vigilancia, el seguimiento y la evaluación de las actividades de vacunación para adaptar las políticas y estrategias vacunales. También es importante la respuesta rápida a los casos y brotes de sarampión con control de la transmisión, mediante la notificación, la recogida de muestras y el aislamiento respiratorio domiciliario de los casos, así como vacunación de los contactos susceptibles en las primeras 72 horas. La prevención en los centros sanitarios es fundamental, por lo que se recomienda no derivar un caso (sospechoso o confirmado) al hospital salvo que la situación clínica lo requiera, y en ese caso advertir al centro para que pueda implantar con celeridad medidas de 9 Brotes epidémicos relevantes en 2011 aislamiento respiratorio del enfermo y comprobar la situación inmunitaria de los profesionales sanitarios, con vacunación de los susceptibles. Parotiditis En Bosnia-Herzegovina, entre diciembre de 2010 y julio de 2011 se registró un brote de parotiditis, en el cual se detectaron 5261 casos (225,8 casos por 100.000 habitantes) (4). Un 62,3% de los casos (n = 3255) eran hombres. Por grupos de edad, el 43% de las personas afectadas tenían 15 a 19 años y el 24% entre 20 y 29 años. El antecedente vacunal se desconocía en un 34% de los afectados y otro 33% no estaba vacunado; entre los vacunados, el 18% había recibido una dosis y sólo al 15% se le había administrado dos dosis. La vacuna frente a la parotiditis se empezó a usar en Bosnia-Herzegovina en 1980 en forma de triple vírica; hasta 1992 se recomendaba vacunar a los niños de 1 a 14 años de edad con una sola dosis. Tras la guerra, en 2001, se implantó un programa de dos dosis, con la primera a los 12 meses de edad y la segunda a partir de los 7 años, pero no después de los 14 años. Las coberturas vacunales en los años 1998 a 2009 varían entre el 84% y el 92% para la primera dosis y entre el 53% y el 92% para la segunda. El brote probablemente está relacionado con fallos en los programas de vacunación durante la guerra (1992-1995) y la posguerra. Como medidas de control del brote se recomendó incrementar la cobertura de vacunación con dos dosis de triple vírica en los niños de 1 a 14 años de edad, y se insistió en la educación sanitaria sobre la importancia del aislamiento de los infectados limitando el contacto con ellos, la desinfección de los artículos de uso general y la higiene de las manos. Escherichia coli O104:H4 Escherichia coli es un bacilo gramnegativo de la familia Enterobacteriaceae, que forma parte de la flora normal del intestino de humanos y animales. E. coli productor de toxina Shiga (STEC) pertenece a uno de los grupos de cepas patogénicas de E. coli conocidas también como E. coli productoras de verotoxinas o verocitotoxinas (VTEC), o E. coli enterohemorrágico (EHEC), que pueden causar desde una enfermedad intestinal leve hasta complicaciones renales graves. Hay alrededor de 250 serotipos O de STEC, de los cuales unos 100 se han asociado con enfermedad en humanos. Aunque el serotipo O157:H7 se considera clínicamente el más importante, hasta 10 M.P. Arrazola Martínez y J.R. de Juanes Pardo un 50% de las infecciones producidas por STEC son causadas por serotipos distintos a O157. La transmisión de la infección por STEC se produce principalmente a través de alimentos contaminados, agua o contacto con animales, aunque también es posible la transmisión de persona a persona en contactos estrechos (familias, guarderías, centros de la tercera edad). El 22 de mayo de 2011, Alemania comunica a través del Early Warning Response System europeo el aumento del número de pacientes con síndrome hemolítico urémico y diarrea sanguinolenta por E.coli enterohemorrágico (STEC) (5). En este brote se registró una alta proporción de síndrome hemolítico urémico entre los casos (26%); aunque habitualmente se observa en menores de 5 años, el 88% eran de edad ≥ 20 años y de ellos aproximadamente dos tercios eran mujeres (68%). El último caso se declaró el 4 de julio y el brote se dio por cerrado el 26 de ese mismo mes. Hasta esa fecha se confirmaron 3785 casos de enfermedad por E. coli enterohemorrágica O104:H4 y 45 muertes. La investigación epidemiológica asoció el brote con el consumo de semillas germinadas (después de falsas alarmas en las que se consideraron fuente de infección primero los pepinos procedentes de España y luego unos brotes germinados de Baja Sajonia). El interés en Alemania por la comida orgánica y las semillas germinadas podría explicar las características del brote en cuanto al sexo y la edad de los afectados. El 5 de julio, la Comisión Europea decidió retirar del mercado y prohibir temporalmente la importación de ciertos tipos de semillas germinadas procedentes de Egipto, después del informe técnico emitido por la European Food Safety Authority, en el cual se asociaba un tipo de semillas de fenogreco egipcias con el brote. Se registraron casos de síndrome hemolítico urémico o de infección por E. coli enterohemorrágico en otros 12 países europeos en personas con antecedente de haber viajado a Alemania en mayo de 2011. En total hubo 3910 casos. Cólera Se estima que cada año se producen entre tres y cinco millones de casos de cólera y unas 100.000 muertes por esta enfermedad. El brote más importante de los últimos años se inició en Haití en octubre de 2010. El día 19 de ese mes, 10 meses después del terremoto que había asolado el país, el ministro de salud pública de Haití notificó un aumento de la incidencia de diarrea acuosa y deshidratación en los departamentos de Artebonite y 11 Brotes epidémicos relevantes en 2011 Centro. Dos días después, el laboratorio nacional de salud pública identificó Vibrio cholerae como patógeno causante. Desde el comienzo de la epidemia hasta abril de 2012, el número total de casos ha sido de 534.647, de los cuales 287.656 (53%) precisaron hospitalización y 7091 murieron (tasa de letalidad del 0,6%) (6). La vigilancia epidemiológica ha demostrado que se han producido brotes en las zonas urbanas muy pobladas y que se han propagado a las zonas rurales. Es probable que esta situación continúe los próximos 2 a 3 años, hasta alcanzar una fase endémica estabilizada. En los últimos meses ha aumentado el número de personas con acceso a agua potable, pero aun así el cólera sigue expandiéndose por Haití. Mejorar las infraestructuras de abastecimiento de agua y saneamiento es fundamental para reducir la transmisión (7). En relación con este brote, en República Dominicana aparecieron los primeros casos de cólera en noviembre de 2010 y desde entonces ha habido casos, fundamentalmente en las provincias de Elías Piña, San Cristóbal, San Juan, San Pedro de Macorís, Santiago y Santo Domingo. El total de casos sospechosos declarados desde el inicio de la epidemia hasta abril de 2012 ha sido de 23.347, de los cuales 17.977 (77%) fueron hospitalizados y 399 murieron (tasa de letalidad: 1,2%) (6). Se han registrado algunos casos en turistas, por lo que a las personas que viajen a este país se les debe aconsejar extremar las precauciones con el agua y la comida. Salmonella enterica serotipo Poona Salmonella enterica serotipo Poona es uno de los 2000 serotipos de este patógeno que puede causar enfermedad en humanos. Los brotes por este serotipo de Salmonella son raros, aunque se han descrito algunos asociados al consumo de melón cantaloup. El registrado en España en los años 2010-2011 es el primer brote documentado en relación con el consumo de leche maternizada (no son productos estériles y pueden estar contaminados con patógenos). El 13 de diciembre de 2010, el Laboratorio Nacional de Referencia de Salmonella y Shigella detectó un aumento de casos de S. enterica serotipo Poona durante ese año, sobre todo en niños menores de 1 año (n = 33 frente a 5 en 2009 y 7 en 2008). Un día después, el Centro Nacional de Epidemiología transmitió esta información a la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN), así como a la Dirección General de Salud Pública, y el 17 de diciembre se comunicó la situación a la Red Nacional de Vigilancia Epidemiológica y a las comunidades autónomas a que pertenecían los casos (8). 12 M.P. Arrazola Martínez y J.R. de Juanes Pardo Se inició una investigación epidemiológica en la cual se consideró como caso confirmado cualquier niño menor de 1 año con aislamiento de Salmonella Poona pulsotipo 1 en muestra clínica, desde el año 2010 en adelante. Entre el 8 de enero de 2010 y el 15 de junio de 2011 se encontraron 240 casos que cumplían esta definición (222 casos eran niños entre 0 y 6 meses de edad; mediana: 4 meses), y el 51% eran varones. Fueron casos primarios 197 (se consideraron secundarios los que refirieron contacto con un caso con sintomatología similar durante las 72 horas previas al inicio de los síntomas). Respecto a la clínica, el 98% presentaron diarrea, el 72% sangre en las heces y el 70% fiebre. Un 25% de los casos precisaron ingreso hospitalario y nueve fueron asintomáticos. En cuanto a la alimentación de los niños, sólo para dos se refería lactancia materna exclusiva, un 79% seguía lactancia artificial y un 20% mixta. Como resultado de la investigación se identificaron dos marcas de leche maternizada (producidas por la misma empresa) como fuente de infección. El 16 de febrero de 2011 la AESAN informó de la retirada por parte de la empresa propietaria del lote I de la marca B, tras la reclamación de tres consumidores. El 1 de marzo, después de detectarse un caso con inicio de los síntomas el 17 de febrero que había consumido leche del lote que se había retirado, la AESAN y el Ministerio de Sanidad, Política Social e Igualdad emitieron una nota de prensa pidiendo que no se consumieran los envases de leche de las marcas y lotes afectados. Después de esto se observó una disminución en el número de casos (los pocos que aparecieron pudieron ser por tener en casa y consumir la leche retirada, o ser casos secundarios no identificados como tales). La medida de control instaurada (retirada de la leche implicada) fue eficaz. La AESAN informó de que el lote implicado se había distribuido en toda España, pero no internacionalmente. BROTES R E L EVA NTES P O R CA L I DA D Polio En el año 2011 se declararon 650 casos de polio en todo el mundo, 341 de ellos en países endémicos (198 en Pakistán, 80 en Afganistán, 62 en Nigeria y uno en India) y 309 en no endémicos (132 en Chad, 93 en República Democrática del Congo, 36 en Costa de Marfil, 21 en China y algunos casos aislados en otros países de África) (9). En China, en la región de Xinjiang, entre los meses de julio y octubre de 2011 se registró un brote de polio cuya importancia radica no tanto 13 Brotes epidémicos relevantes en 2011 en el número de afectados (21 casos) como en que el último caso de polio autóctono se había declarado en China en 1994 y el último importado en 1999. En septiembre de 2011, el ministerio de salud de China informó a la Organización Mundial de Salud (OMS) de un caso de polio en la región de Xinjiang, que tiene frontera con tres de los cuatro países endémicos de polio que entonces quedaban en el mundo: India, Afganistán y Pakistán (los funcionarios de salud locales afirman que los tres primeros casos se originaron en el extranjero). De los 21 casos registrados, 10 eran niños menores de 3 años y 11 adolescentes mayores de 15 años (con dos muertes). El agente causante fue el poliovirus de tipo 1 (genéticamente relacionado con los virus circulantes en Pakistán). Como medidas de control se realizaron campañas de vacunación suplementarias (tres rondas en los niños menores de 15 años en septiembre, octubre y noviembre, y dos rondas en personas de 15 a 39 años en sep­ tiembre y noviembre), se potenciaron los sistemas de vigilancia nacionales y se evaluó el riesgo de polio en toda la nación para guiar las actividades preventivas (10). Mantener unas altas coberturas en los programas sistemáticos de vacunación y tener sistemas sensibles de vigilancia epidemiológica, así como implantar programas de vacunación adicionales en caso de brote, son aspectos fundamentales para limitar y bloquear la propagación del virus de la polio. La OMS recomienda fortalecer la vigilancia de la parálisis flácida aguda, principalmente en los países de Asia y del Mediterráneo Occidental, para detectar precozmente casos importados y poder dar una respuesta adecuada. Malaria En Grecia se declaró eliminada la malaria en 1974, pero entre 1975 y 2005 se han declarado unos 50 casos cada año, la mayoría de ellos importados. Entre los meses de mayo y septiembre de 2011, en el área de Evrotas (distrito de Laponia, en el Peloponeso, al sur de Grecia) se declararon 38 casos de malaria por Plasmodium vivax: 20 casos en griegos, 16 en inmigrantes (sobre todo originarios de Pakistán e ilegales, por lo que fue difícil establecer con certeza cuándo habían llegado a Grecia, dónde habían viajado y trabajado, y cuánto tiempo llevaban residiendo en la zona, y por tanto no ha podido descartarse que se trate de casos importados) y dos casos en ciudadanos rumanos (diagnosticados al retorno a su país). Hasta el 15 de 14 M.P. Arrazola Martínez y J.R. de Juanes Pardo diciembre se habían diagnosticado 63 casos (el último en la semana 44). Todos precisaron ingreso hospitalario y se produjo una muerte (11). Evrotas es una zona con condiciones adecuadas para la transmisión de la malaria: área agrícola (favorable para la presencia y la reproducción de los mosquitos transmisores de la enfermedad) con población ­inmigrante de países endémicos. Virus del Nilo Occidental El virus del Nilo Occidental se mantiene y propaga en un ciclo en el cual participan los mosquitos (principalmente Culex spp.) y las aves, con las aves salvajes como principal huésped. Las personas y los equinos son huéspedes accidentales y generalmente asintomáticos. En 2010, Grecia registró la segunda mayor epidemia de infecciones por virus del Nilo Occidental en humanos en Europa, con 262 casos (la primera ocurrió en Rumanía en 1996) (12). En los meses de julio y agosto de 2011 se declararon 31 casos de enfermedad neuroinvasiva por virus del Nilo Occidental. Los primeros ocurrieron en las regiones del norte, Macedonia central y Tessalia, y posteriormente se fue extendiendo a otras áreas. La recurrencia de casos humanos en 2 años consecutivos (2010 y 2011) y la expansión del virus a nuevas áreas sugiere que el virus se ha establecido en Grecia y que su transmisión puede persistir en los próximos años. Se consideraron casos confirmados los que cumplían como criterios clínicos presentar encefalitis, meningitis o fiebre sin diagnóstico específico, y al menos uno de los siguientes cuatro criterios de laboratorio: aislamiento del virus del Nilo Occidental en sangre o líquido cefalorraquídeo (LCR), detección de ácido nucleico de dicho virus en sangre o LCR, IgM específica en LCR o un título alto de IgM y detección de IgG antivirus del Nilo Occidental y confirmación por neutralización. De los 31 casos, 24 fueron confirmados y siete probables. La edad media fue de 70 años (intervalo: 21 a 87) y 19 (61%) eran hombres. La tasa de ataque específica por edad se incrementó significativamente con el aumento de la edad, y así, las personas de 70 años o más de edad tuvieron un riesgo de enfermedad 23 veces mayor que las menores de 30 años. Las personas de más de 50 años y algunos individuos inmunodeprimidos, por ejemplo los receptores de trasplantes, también tuvieron un riesgo más alto de enfermedad grave. Ninguno tenía antecedentes de viaje internacional ni de reciente transfusión sanguínea o trasplante de órganos, y 17 tenían alguna enfermedad de base. Respecto a la clínica, 22 cursaron como meningoencefalitis y nueve como meningitis; además, 15 Brotes epidémicos relevantes en 2011 se detectaron seis casos de infección no neuroinvasiva por virus del Nilo Occidental (edad media 44 años) que presentaron fiebre, cefalea, debilidad, náuseas o vómitos, y diarrea. Todos los casos precisaron ingreso hospitalario (seis en unidades de cuidados intensivos) y se produjo una muerte. Entre las medidas de control, tanto para la malaria como para el virus del Nilo Occidental, se encuentran: •• Información a los profesionales sanitarios: –– Guías para reconocer, manejar y diagnosticar la enfermedad. –– Guías para garantizar la seguridad de la sangre y los hemoderivados según las directivas de la Unión Europea. •• Información a los pacientes y a la población con posible riesgo de exposición sobre el mecanismo de transmisión y la clínica. •• Reforzar la capacidad diagnóstica de los laboratorios de las áreas afectadas. •• Potenciar la vigilancia entomológica e intensificar las actividades de control de vectores. •• Promoción de la salud: recomendaciones sobre protección frente a las picaduras de mosquito. BROT E S R EL EVA NTES P OR S U P ER S IS TENC I A Linfogranuloma venéreo El linfogranuloma venéreo es una enfermedad de transmisión sexual, causada por Chlamydia trachomatis (serogrupos L1, L2 o L3), endémica en los países tropicales, pero rara en los industrializados. A diferencia de las infecciones urogenitales por Chlamydia, los serogrupos L son invasores y causan una inflamación grave que se manifiesta clásicamente en forma de síndrome inguinal, caracterizado por inflamación de los nódulos inguinales o femorales, o por síndrome rectal, que se presenta como proctitis o proctocolitis con exudado y rectorragia. Desde el año 2003, en Europa se han descrito brotes de linfogranuloma venéreo en hombres homosexuales. En España, el primer caso confirmado se detectó en Barcelona en 2005, y desde 2007 es enfermedad de declaración obligatoria en esta ciudad. Esto permitió detectar, en septiembre de 2007, 16 M.P. Arrazola Martínez y J.R. de Juanes Pardo un nuevo caso producido por C. trachomatis serogrupo L2, y desde entonces hasta diciembre de 2011 se han confirmado 146 casos, todos ellos en hombres homosexuales muy promiscuos y con otras infecciones de transmisión sexual (66 con infección por el virus de la inmunodeficiencia humana [VIH]). Sesenta y siete casos presentaron un cuadro clínico de síndrome anorrectal con proctitis (13, 14). En el año 2011 se confirmaron 72 casos, con una edad media de 35 años (rango intercuartílico: 29 a 41), y 70 de ellos eran residentes en Barcelona (39 casos eran españoles, 12 de otros países europeos y de Norteamérica, y 17 de Latinoamérica). Veintidós habían sido diagnosticados de otra enfermedad de transmisión sexual (ETS) en los 12 meses previos Como parte de las medidas de control se alertó a los organismos de salud pública, las unidades de VIH, las clínicas de ETS y los hospitales para favorecer la sospecha diagnóstica, y se difundió información sobre esta enfermedad a colectivos de riesgo en revistas dirigidas a esa población. Se realizó una búsqueda activa de casos tanto en servicios clínicos como en laboratorios de microbiología, y una vez identificados se instauraba tratamiento y se proponía información a los contactos (en muchos casos no fue posible realizar un adecuado estudio de los contactos, por el tipo de prácticas de los afectados: múltiples situaciones de riesgo con parejas anónimas). Se hizo una amplia difusión de los métodos preventivos entre los grupos de riesgo. BIBLIOGRAF Í A 1.Ministerio de Sanidad y Consumo. Real Decreto 2210/1998, de 28 de diciembre, por el que se crea la Red Nacional de Vigilancia Epidemiológica. Boletín Oficial del Estado, nº 21, de 24-1-1996; 2153-8. 2.European Centre for Disease Control and Prevention. European monthly measles monitoring (EMMO). Surveillance report. Issue 8: 21 february 2012. Disponible en: http:// www.ecdc.europa.eu/en/publications/Publications/SUR_EMMO_European-monthlymeasles-monitoring-February-2012.pdf. 3.Guaita R, Giner E, Bayo J, Yuste L, Saiz C, Ortí R, et al. Brote nosocomial de sarampión. Bol Epidemiol Sem. 2011;19:220-7. 4.Hukic M, Ravlija J, Dedeic Ljubovic A, Moro A, Arapcic S, Muller CP, et al. Ongoing large mumps outbreak in the Federation of Bosnia and Herzegovina. Bosnia and Herzegovina, December 2010 to July 2011. Euro Surveill. 2011; 16. Disponible en: http://www.euro surveillance.org/ViewArticle.aspx?ArticleId=19959. 5.Centro Nacional de Epidemiologia. Área de Vigilancia de la Salud Pública. Brote de Escherichia coli O15:H4 productor de toxina shiga en Alemania. Mayo-julio de 2011. Bol Epidemiol Sem. 2011;19:86-90. 17 Brotes epidémicos relevantes en 2011 6.Subdirección General de Sanidad Exterior. Ministerio de Sanidad, Servicios Sociales e Igualdad. Alerta Sanitaria Internacional 154/2012. Cólera en Haití y República Dominicana (actualización nº 23). 10 de julio de 2012. 7.Organización Panamericana de la Salud – Organización Mundial de la Salud. Área de Preparativos para Situaciones de Emergencia y Socorro en Casos de Desastre. Boletín del Grupo de Acción Sanitaria de Haití 2011; 30 (21 de diciembre de 2011). Disponible en: http:// www.who.int/hac/crises/hti/earthquake/health-cluster-bulletin25032011-es.pdf. 8.Red Nacional de Vigilancia Epidemiológica. Instituto de Salud Carlos III y Comunidades Autónomas implicadas. Brote supracomunitario de gastroenteritis por Salmonella Poona en 2010-2011. Bol Epidemiol Sem. 2011;19:176-85. 9.Global Polio Eradication Initiative. Data and monitoring. Disponible en: http://www. polioeradication.org/Dataandmonitoring/Poliothisweek.aspx. 10.Subdirección General de Sanidad Exterior. Ministerio de Sanidad, Política Social e Igualdad. Alerta Sanitaria Internacional 272/2011. Poliomielitis en China (actualización nº 3). 20 de diciembre de 2011. 11.Danis K, Baka A, Lenglet A, Van Bortel W, Terzaki I, Tseroni M, et al. Autochthonous Plasmodium vivax malaria in Greece, 2011. Euro Surveill. 2011; 16. Disponible en: http:// www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19993. 12.Danis K, Papa A, Papanikolau E, Dougas G, Terzaki I, Baka A, et al. Ongoing outbreak of West Nile virus infection in humans, Greece, July to August 2011. Euro Surveill. 2011; 16. Disponible en: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19951. 13.Vall-Mayans M, Caballero E, García de Olalla P, Armengol P, Codina MG, Barberà MJ, et al. Outbreak of lymphogranuloma venereum among men who have sex with men in Barcelona 2007/08 – An opportunity to debate sexual health at the Eurogames 2008. Euro Surveill. 2008; 13. Disponible en: http://www.eurosurveillance.org/ViewArticle. aspx?ArticleId=18908. 14.Vargas-Leguas H, García de Olalla P, Arando M, Armengol P, Barberà MJ, Vall M, et al. Lymphogranuloma venereum: a hidden emerging problem, Barcelona, 2011. Euro Surveill. 2012;17. Disponible en: http://www.eurosurveillance.org/ViewArticle.aspx? ArticleId=20057. 18 F. Giménez Sánchez Reemergencia de la tos ferina IN TRODU C C I Ó N La tos ferina es una enfermedad infecciosa aguda causada por la bacteria gramnegativa Bordetella pertussis. Durante el siglo xx, esta enfermedad fue considerada una causa muy importante de mortalidad infantil. En los años 1940 se desarrollaron las primeras vacunas frente a la tos ferina, que se incorporaron al calendario vacunal español en la década de 1960. Desde entonces ha habido un gran descenso de la mortalidad y de la incidencia de esta enfermedad en todo el mundo. No obstante, según la Organización Mundial de la Salud, la tos ferina representa la quinta causa de mortalidad en los niños menores de 5 años, con una estimación de casi 200.000 muertes en el año 2008, por lo que resulta una de las enfermedades inmunoprevenibles peor controlada (1). B. pertussis infecta exclusivamente a humanos, tiene poca variabilidad genética y en raras ocasiones infecta de manera crónica a portadores. Estas tres circunstancias hacen que la enfermedad pueda ser erradicada mediante la vacunación. La transmisión se produce siempre por vía respiratoria, a través del contacto con secreciones o gotitas respiratorias transmitidas por el aire, siendo muy rara a través de objetos contaminados. Se trata de una enfermedad altamente contagiosa, con una tasa de ataque secundario del 80% entre los contactos domiciliarios susceptibles (2). La tos ferina es una enfermedad principalmente mediada por toxinas. La bacteria se une a los cilios de las células del epitelio respiratorio y produce toxinas que los paralizan, inflaman las vías respiratorias y obstaculizan la eliminación de las secreciones respiratorias. Los antígenos bacte- 19 Reemergencia de la tos ferina rianos alteran la quimiotaxis y permiten que el microorganismo evite el sistema inmunitario del huésped. El periodo de incubación suele ser de 7 a 10 días, pero puede llegar hasta los 42 días. La evolución clínica clásica de la enfermedad se divide en tres fases: catarral con rinorrea, febrícula y tos ocasional (1 a 2 semanas), fase de tos paroxística en salvas con esfuerzo inspiratorio y el “gallo” característico que a veces puede acompañarse de cianosis y vómitos tras el episodio, y fase de convalecencia con recuperación gradual de la tos. Sin embargo, en ocasiones los paroxismos de tos pueden reaparecer con posteriores infecciones respiratorias hasta varios meses después del comienzo de la enfermedad. Las complicaciones que llevan a la muerte pueden presentarse en recién nacidos y lactantes; entre ellas, las más frecuentes son la neumonía bacteriana secundaria, las convulsiones y la encefalopatía, el neumotórax, el hematoma subdural y las hernias (3). El cuadro clínico de la tos ferina no siempre se presenta de la manera clásica y a veces resulta difícil distinguirla de otras infecciones respiratorias en los recién nacidos y lactantes, como la bronquiolitis, causada fundamentalmente por el virus respiratorio sincitial. En nuestro hospital, al analizar la serie de pacientes con tos ferina ingresados en los últimos años se pudo comprobar que en el 39% de ellos el diagnóstico al ingreso había sido bronquiolitis. La infección por B. pertussis en adolescentes y adultos puede presentarse con un amplio espectro clínico, desde ser asintomática hasta con tos persistente de varias semanas de duración. Diversos estudios realizados en adultos han encontrado que la tos persistente de más de 2 semanas de duración corresponde a infección por B. pertussis en un 13% a un 20% de los casos (4). Por otra parte, los estudios epidemiológicos realizados en los contactos familiares de niños con tos ferina mediante el aislamiento de B. pertussis en muestras respiratorias demuestran que, en más de la mitad de los casos, la posible vía de contagio se encuentra en el propio hogar (5). Estos datos indican que los adultos y los adolescentes padecen con frecuencia cuadros clínicos de tos ferina que habitualmente pasan desapercibidos, y que constituyen la principal fuente de transmisión al lactante no inmunizado o sólo parcialmente inmunizado. En los últimos años, los pediatras hemos observado con preocupación un aumento de los diagnósticos de tos ferina (6, 7). Desde la introducción en España de la vacuna de células completas frente a la tos ferina en la década de 1960, y posteriormente la vacuna acelular en los años 1990, los casos de tos ferina han disminuido enormemente y ésta ha pasado a ser una enfermedad con una escasa mortalidad en com- 20 F. Giménez Sánchez *Hasta sem. 51 Casos × 100.000 habitantes 6 3043* 5 4 3 2 882 1 0 304 383 2005 2006 554 2007 663 2008 538 2009 2010 2011 Años Figura 1. Incidencia de la tos ferina en España (2005-2011). Sistema EDO. Instituto de Salud Carlos III. paración con la época prevacunal. No obstante, durante este tiempo se ha seguido presentando con mayor o menor frecuencia, en particular en recién nacidos y lactantes menores de 6 meses no inmunizados o inmunizados parcialmente (8), y en los últimos años los casos de tos ferina han sufrido un incremento importante en nuestro medio (9). Este fenómeno se ha observado en toda España y también se ha descrito en la mayoría de los países industrializados que cuentan con una vigilancia epidemiológica adecuada (10-12). En el año 2010, en el estado de California se detectaron más de 9000 casos, con tasas de 23 casos por 100.000 habitantes/año, cifras que no se alcanzaban desde el año 1958 (13). En España, los datos de la Red Nacional de Vigilancia Epidemiológica habían detectado una tendencia creciente en la declaración de casos desde el año 2005, que se había frenado en 2009 (8) (Fig. 1). Sin embargo, en el año 2010 se observó de nuevo un aumento, que se agudizó en 2011, cuando se detectaron más de 3000 casos con una tasa superior a 5 casos por 100.000 habitantes/año. Igualmente, en Andalucía hubo un incremento de las tasas de tos ferina, pasando de 0,61 casos por 100.000 habitantes/año en 2010 a 2,77 por 100.000 habitantes/año en 2011 (4,5 veces más), datos que coinciden con el aumento de 4,2 veces detectado en Almería (9) (Fig. 2). 21 Reemergencia de la tos ferina Casos × 100.000 habitantes <14 años 7 6 5 4 3 2 1 0 2008 2009 2010 2011 Años Figura 2. Incidencia de la tos ferina en Almería (2008-2011). causas del aumento de la incidencia de la tos ferina De manera general, el aumento de la incidencia de la tos ferina es atribuible fundamentalmente a cinco causas (Tabla 1): 1) Está claro que hay una mayor concienciación de la enfermedad, como lo demuestran los más de 6000 artículos sobre el tema indexados en Medline en los últimos 10 años. 2) La incorporación reciente del diagnóstico mediante reacción en cadena de la polimerasa (PCR) en aspirado nasofaríngeo ha significado un importante avance, que ha permitido mejorar la detección de casos respecto al cultivo de aspirado nasal o la serología utilizados en el pasado (14). 3) Desde la incorporación de las vacunas acelulares en sustitución de las de células completas, debido a la menor reactogenicidad de aquellas, se Tabla 1. Razones para la reemergencia de la tos ferina en los últimos años. •Mayor conciencia de la enfermedad. •Disponibilidad general de mejores técnicas de diagnóstico. •Menor potencia de las vacunas actuales. •Descenso de la inmunidad inducida con la vacuna. •Cambios genéticos en Bordetella pertussis. 22 F. Giménez Sánchez ha venido señalando una menor respuesta inmunógena con las vacunas actuales, lo que favorecería la reemergencia de la enfermedad. La mayoría de los estudios y ensayos clínicos realizados coinciden en que las vacunas acelulares de más de tres componentes (toxina pertúsica, hemaglutinina filamentosa, pertactina y antígenos de fimbria) tienen una eficacia similar a las de células completas (1, 15). La efectividad de las vacunas acelulares ha sido ampliamente demostrada en países como Suecia, donde su introducción tras casi dos décadas sin inmunizar frente a la tos ferina dio lugar a una disminución del 90% de los casos (16). 4) Los estudios realizados han podido comprobar que las vacunas frente a la tos ferina tienen una importante limitación en la duración de la inmunidad. La infección natural confiere inmunidad durante aproximadamente 15 años, mientras que los estudios encuentran que la inmunidad inducida por la vacunación comienza a disminuir a partir de los 4 años y desaparece alrededor de los 12 años en un porcentaje importante de los individuos vacunados (17). Esta desaparición de la inmunidad hace que exista población susceptible a la enfermedad a pesar de haber recibido correctamente las vacunas durante la infancia. 5) En los últimos años, algunos autores han sugerido que B. pertussis podría estar sufriendo cambios antigénicos que la ayudarían a evadir los tipos incluidos en la vacuna (18). Sin embargo, esta cuestión debe ser más estudiada. Recomendaciones de la vacunación frente a la tos ferina Por lo tanto, podemos concluir que hay una población de adultos y adolescentes susceptibles a la infección por B. pertussis al haber perdido la inmunidad vacunal con el tiempo (19, 20), y que presentan cuadros clínicos que habitualmente pasan desapercibidos. Por otra parte, también hay una población de recién nacidos y lactantes menores de 2 o 3 meses susceptibles a la enfermedad por no haber sido vacunados todavía (recordemos que la vacuna DTPa no puede administrarse antes de las 6 semanas de vida), lo que hace que puedan padecer la enfermedad con cuadros muy graves, hospitalizaciones e incluso muertes. Por lo tanto, la inmunización de los adultos y adolescentes que rodean al niño todavía no inmunizado es una estrategia que puede limitar los casos de tos ferina a edades tempranas (21, 22). En este sentido, en octubre de 2011 el Advisory Committee on Immunization 23 Reemergencia de la tos ferina Tabla 2. Recomendaciones del ACIP de 2011 (MMWR y Pediatrics, octubre 2011). •Vacunación de embarazadas que previamente no hayan recibido dTpa. (>20 semanas de gestación) •Estrategia del nido: vacunación de adolescentes y adultos que tienen o vayan a tener contacto con lactantes <12 meses de edad. •No intervalo mínimo con dT. •Los niños de 7-10 años de edad con vacunación frente a la tos ferina desconocida o incompleta deben recibir una dosis de dTpa. •Las personas de ≥65 años o más de edad deben recibir una dosis en lugar de dT. Practices de Estados Unidos se pronunció emitiendo sus recomendaciones con el fin de controlar de una manera más eficaz esta enfermedad (Tabla 2). C ON C LU S I O NE S •• La infección por B. pertussis es común en los adultos y adolescentes, pero tiene consecuencias graves en los lactantes pequeños. •• Hay una reemergencia de la enfermedad de origen multifactorial. •• El control de la enfermedad pasa por estrategias de vacunación del adulto y del adolescente. •• Es necesario el desarrollo de nuevas vacunas que proporcionen una mayor duración de la respuesta inmunitaria. BIBL I O G RA F ÍA 1.World Health Organization. Pertussis vaccines: WHO position paper. Week Epidemiol Rec. 2010;85:385-400. 2.Cherry JD. The present and future control of pertussis. Clin Infect Dis. 2010;51:663-7. 3.Heininger U, Klich K, Stehr K, Cherry JD. Clinical findings in Bordetella pertussis infections: results of a prospective multicenter surveillance study. Pediatrics. 1997;100:E10. 4.Cherry JD. The epidemiology of pertussis: a comparison of the epidemiology of disease pertussis with the epidemiology of Bordetella pertussis infection. Pediatrics. 2005; 115:1422. 5.Kowalzik F, Barbosa AP, Fernandes VR, Carvalho PR, Avila-Aguero ML, Goh DY, et al. Prospective multinational study of pertussis infection in hospitalized infants and their household contacts. Pediatr Infect Dis J. 2007;26:238-42. 6.Poolman JT, Hallander H, Halperin SA. Pertussis vaccines: where to now? Expert Rev Vaccines. 2011;10:1497-500. 7.Moraga-Llop F, Campins-Martí M. Nuevas perspectivas de la tos ferina en el siglo xxi. ¿Estamos fracasando en su control? Enferm Infecc Microbiol Clin. 2011;29:561-3. 24 F. Giménez Sánchez 8.Red Nacional de Vigilancia Epidemiológica de España. Área de Vigilancia de la Salud Pública. Centro Nacional de Epidemiología, Instituto de Salud Carlos III. Situación de la tos ferina en España, 2009. Disponible en: www.isciii.es. 9.Sistema de Vigilancia Epidemiológica de Andalucía. Informe semanal. 2011;16(52). 10.De Greeff SC, De Melker HE, Van Gageldonk PGM, Schellekens JFP, Van der Klis FRM, Mollema L, et al. Seroprevalence of pertussis in the Netherlands: evidence for increased circulation of Bordetella pertussis. PLoS One. 2010;5:e14183. 11.Hallander HO, Andersson MI, Gustafsson L, Ljungman M, Netterlid E. Seroprevalence of pertussis antitoxin (anti-PT) in Sweden before and 10 years after the introduction of a universal childhood pertussis vaccination program. APMIS. 2009;117:912-22. 12.CDC, ACIP. Preventing tetanus, diphtheria, and pertussis among adolescents: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines. MMWR. 2006;55:RR-3. 13.California Department of Public Health, Immunization Branch. Pertussis report. Nov. 2011. Disponible en: http://www.cdph.ca.gov/programs/immunize/Documents/ ­PertussisReport2011-11-10.pdf. 14.Fisman DN, Tang P, Hauck T, Richardson S, Drews SJ, Low DE, et al. Pertussis resurgence in Toronto, Canada: a population-based study including test-incidence feedback modeling. BMC Public Health. 2011;11:694. 15.Olin P, Rasmussen F, Gustaffsson L, Hallander HO, Heijbel H. Randomised controlled trial of two-component, three-component, and five-component acellular pertussis vaccines compared with whole-cell pertussis vaccine. Ad Hoc Group for the Study of Pertussis Vaccines. Lancet. 1997;350:1569-77. 16.Hallander HO, Gustaffsson L. Efficacy and effectiveness of acellular pertussis vaccines: a 20-year Swedish experience. Expert Rev Vaccines. 2009;8:1303-7. 17.Lugauer S, Heininger U, Cherry JD, Stehr K. Long-term clinical effectiveness of an acel­ lular pertussis component vaccine and a whole cell pertussis component vaccine. Eur J Pediatr. 2002;161:142-6. 18.Octavia S, Maharjan RP, Sintchenko V, Stevenson G, Reeves PR, Gilbert GL, et al. Insight into evolution of Bordetella pertussis from comparative genomic analysis: evidence of vaccine-driven selection. Mol Biol Evol. 2011;28:707-15. 19.Heininger U, Klich K, Stehr K, Cherry JD. Clinical findings in Bordetella pertussis infections: results of a prospective multicenter surveillance study. Pediatrics. 1997;100:E10. 20.Nuolivirta K, Koponen P, He Q, Halkosalo A, Korrpi M, Vesikari T, et al. Bordetella pertussis infection is common in nonvaccinated infants admitted for bronchiolitis. Pediatr Infect Dis J. 2010;29:1013-5. 21.Healy CM, Rench MA, Baker CJ. Implementation of cocooning against pertussis in a high-risk population. Clin Infect Dis. 2011;52:157-62. 22.Centers for Disease Control and Prevention (CDC). Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine (Tdap) in pregnant women and persons who have or anticipate having close contact with an infant aged <12 months - Advisory Committee on Immunization Practices (ACIP), 2011. MMWR. 2011;60:1424-6. 25 M.I. Fernández Cano. L. Armadans y M. Campins ¿Conocemos la incidencia real de la tos ferina en España? V igilancia epidemiológica de la tos ferina en espa ñ a La vigilancia epidemiológica de las enfermedades transmisibles se realiza en España a través del Sistema de Enfermedades de Declaración Obligatoria (EDO). El objetivo de este sistema es recoger información de forma sistemática de los nuevos casos de una serie de enfermedades infecciosas con impacto para la salud pública, a fin de disponer de datos fiables que sirvan de base para establecer medidas de prevención y control efectivas frente a ellas. Su cobertura es universal, es decir, ha de informarse de la totalidad de los casos que se detecten, y todos los médicos están obligados a comunicar esta información al sistema. La tos ferina es una enfermedad infecciosa que sigue siendo endémica en la mayoría de las regiones del mundo, a pesar de las altas coberturas vacunales logradas en la población infantil, por lo que es un importante problema de salud pública en la actualidad. En nuestro país, la tos ferina está incluida en la lista de enfermedades del sistema EDO desde 1904, hace más de 100 años, pero su notificación de manera continuada no se inició hasta 1982, con la entrada en vigor de la Resolución de 22 de diciembre de 1981, de la Dirección General de Salud Pública, por la que se modificó la lista de enfermedades de declaración obligatoria. La Directiva Europea 92/117/CEE (Consejo del 17 de diciembre de 1992) insta a los estados miembros a constituir una red de vigilancia epidemiológica de ámbito europeo dirigida inicialmente a las enfermedades trans- 27 ¿Conocemos la incidencia real de la tos ferina en España? misibles, para facilitar la coordinación y el intercambio de información entre países. En España fue preciso adaptarla a la estructura descentralizada de las comunidades autónomas, responsables en materia sanitaria, por lo que mediante el Real Decreto 2210/1995, de 28 de diciembre, se creó la Red Nacional de Vigilancia Epidemiológica. Según esta normativa, los responsables sanitarios de las comunidades autónomas debían organizar la vigilancia epidemiológica en su comunidad y transmitir la información al Ministerio de Sanidad, que ejerce las funciones de coordinación de la red y garantiza el intercambio de información entre comunidades autónomas, la red europea y la Organización Mundial de la Salud. En dicho Real Decreto también se definió la lista de EDO común a todo el estado y se estableció que la tos ferina fuese de declaración obligatoria en la modalidad de declaración numérica semanal con informe descriptivo anual. Posteriormente, entre 1996 y 1998, las comunidades autónomas elaboraron órdenes y decretos para regular los sistemas y procedimientos de la vigilancia de las EDO. En todas las comunidades, la tos ferina se incluyó como enfermedad de declaración obligatoria en modalidad numérica semanal con datos individualizados. El diagnóstico clínico de tos ferina se establece ante la aparición de un cuadro catarral con tos de 2 semanas de duración con uno de los siguientes síntomas: ataques o paroxismos de tos, seguidos de estridor inspiratorio, vómito postusígeno o apnea. En los niños menores de 6 meses, los niños vacunados, los adolescentes y los adultos, con frecuencia no se observa el estridor típico ni los ataques paroxísticos de tos. El diagnóstico de laboratorio se establece mediante el aislamiento de Bordetella pertussis o por reacción en cadena de la polimerasa de un frotis nasofaríngeo, o al hallar títulos elevados de toxina antipertussis (IgG) en suero. A efectos de vigilancia epidemiológica, se considera «caso sospechoso» de tos ferina el que presenta un cuadro clínicamente compatible, y «caso confirmado» el que presenta enfermedad confirmada por laboratorio o enfermedad clínicamente compatible relacionada epidemiológicamente con un caso confirmado. El protocolo de vigilancia epidemiológica de la tos ferina en España exige que se notifiquen tanto los casos sospechosos como los confirmados. La vigilancia epidemiológica de la tos ferina en nuestro país sólo es de tipo pasivo, ya que informar al sistema EDO depende de la voluntad de los profesionales sanitarios que diagnostican los casos. No se complementa con sistemas de vigilancia activa, en la cual los responsables del sistema de vigilancia contactan con la fuente primaria de información y se mejora la calidad de ésta. 28 M.I. Fernández Cano. L. Armadans y M. Campins V IGILAN C IA epidemiológica DE LA TO S F ER I NA E N O T RO S PA Í S E S En 2010, el grupo de expertos The Global Pertussis Initiative (GPI) se reunió en París para discutir sobre los diferentes sistemas de vigilancia de la tos ferina existentes y su efectividad (1). Se compararon los sistemas de vigilancia de los siguientes países: •• Canadá: se han de declarar los casos confirmados de tos ferina de forma obligatoria en todas las provincias. Tiene dos sistemas de vigilancia, uno pasivo, el Notificable Disease Surveillance System (sistema de declaración obligatoria con definición de caso estandarizado), y otro activo de tipo centinela, el Immunization Monitoring Program, ACTive (IMPACT), dirigido por la Canadian Paediatric Society, que incluye 12 hospitales pediátricos que cubren al 50% de la población de 0 a 16 años de edad de Canadá. •• Estados Unidos: además del sistema pasivo de notificación obligatoria en todos los estados, lleva a cabo una vigilancia activa mediante estudios de seroprevalencia en tres estados centinela (Massachusetts, Minnesota y Oregon). •• Francia: no dispone de un sistema pasivo de notificación obligatoria y la monitorización de la tos ferina se lleva a cabo mediante varios sistemas centinelas (Réseau National de la Coqueluche, Renacoq) que monitorizan a 43 hospitales pediátricos del país. Para determinar la incidencia en adultos se llevó un estudio de vigilancia centinela en adultos (en París, en 2008 y 2009) a través de médicos de familia, que se prevé mantener en un futuro. •• Holanda: además del sistema de declaración obligatoria, se realizan estudios de seroprevalencia en la población de forma periódica (1995-1996 y 2006-2007). •• Suecia: el sistema de notificación obligatoria se complementa con el seguimiento de las cohortes nacidas en los últimos 20 años. Los expertos del GPI valoraron que los sistemas de Holanda y Suecia podrían considerarse ideales para la vigilancia de la tos ferina en toda la población, pero su coste es elevado, por lo que el sistema de vigilancia de Estados Unidos resultaría ser el más coste-efectivo. El sistema centinela usado en Francia resulta útil para monitorizar la tendencia en los niños y 29 ¿Conocemos la incidencia real de la tos ferina en España? comprobar el impacto de las estrategias de vacunación (1). En la mayoría de los países existe más de un sistema de vigilancia de la tos ferina, que se complementan. EVALUAC I Ó N DE L O S S I S T E M A S DE VIG I L A NC I A E P IDE M I O L Ó G I CA Para asegurar que un sistema de vigilancia consigue sus objetivos de forma eficiente y efectiva debería evaluarse de forma periódica. En 2001, los Centers for Disease Control and Prevention de Estados Unidos publicaron una guía de evaluación de sistemas de vigilancia de la salud (Updated Guidelines for Evaluating Public Health Surveillance Systems), en la que se describen los atributos del sistema que han de incluir la evaluación y los métodos para su valoración (2). Para evaluar la sensibilidad de los métodos de vigilancia de las enfermedades inmunoprevenibles se recomienda el uso de métodos activos y de datos externos al sistema que sirvan de referencia, como registros médicos, para comparar los resultados. Este método de evaluación, en el caso de la vigilancia de la tos ferina, se ha utilizado en diferentes estudios que han usado los datos de las hospitalizaciones por tos ferina como referencia para comparar con los casos de tos ferina notificados al sistema EDO (3-5). La hipótesis de estos estudios era que, como mínimo, todos los casos de tos ferina que fueron hospitalizados durante el proceso de la enfermedad deberían haberse notificado al sistema EDO, y que su comparación con los casos realmente notificados permitía estimar una infradeclaración mínima. Incidencia de la tos ferina en españa. U na enfermedad infranotificada El objetivo general del estudio que a continuación comentamos fue estudiar la posible infradeclaración de la tos ferina en España. Los objetivos específicos fueron estimar la incidencia de hospitalización relacionada con tos ferina en el periodo de 1997 a 2010, y compararla con la incidencia declarada de tos ferina en ese mismo periodo. Metodología Estudio descriptivo en que se analizaron los datos de los casos notificados y de las hospitalizaciones por tos ferina desde el año 1997 hasta el año 2010. 30 M.I. Fernández Cano. L. Armadans y M. Campins Se calcularon las incidencias anuales (por 100.000 habitantes) de tos ferina notificada y de hospitalización. La incidencia por grupos de edad se analizó de 2005 a 2010, porque no se disponía de información individualizada consistente del sistema EDO de todo el periodo de estudio. En los menores de 1 año se utilizó el número de nacidos vivos en ese año como denominador. Se calculó la ratio entre la incidencia de notificación y la incidencia de hospitalización (EDO/CMBD), así como el porcentaje de infradeclaración mínima (la diferencia entre la incidencia de hospitalización y la incidencia de notificación, dividida por la incidencia de hospitalización). También se calculó la tasa de mortalidad y letalidad durante el periodo de estudio. Los registros anonimizados de los casos de tos ferina notificados al sistema EDO fueron facilitados por el Centro Nacional de Epidemiología (Instituto de Salud Carlos III). Los datos de hospitalización se obtuvieron de una base de datos anonimizada del Conjunto Mínimo Básico de Datos (CMBD) de los registros que tuvieron entre sus diagnósticos de alta (principales y secundarios) los códigos 033 correspondientes a tos ferina según la Novena Clasificación Internacional de Enfermedades (CIE-9-MC), facilitada por el Instituto de Información Sanitaria (Ministerio de Sanidad). Para el cálculo de las tasas se utilizaron los datos sobre población censada en España obtenidos por consulta interactiva en la página web del Instituto Nacional de Estadística (6). Resultados Entre 1997 y 2010 se notificaron al sistema EDO 7980 casos de tos ferina, para los que únicamente se disponía de información individualizada en un 43%. La incidencia de tos ferina global fue de 1,3 casos por 100.000 habitantes. En el mismo periodo se produjeron 7655 altas hospitalarias con el diagnóstico de tos ferina, de las cuales en un 85% fue el diagnóstico principal. La incidencia de hospitalización por tos ferina fue de 1,3 casos por 100.000 habitantes. La distribución de la incidencia de hospitalización y de la incidencia de notificación presentó un patrón similar a lo largo del periodo estudiado. Los aumentos de la incidencia se observaron en los años 1997, 2000, 2004, 2008 y 2010 en ambas distribuciones (Fig. 1). La ratio EDO/CMBD de tos ferina anual del periodo de estudio se mantuvo en valores próximos o inferiores a 1, siendo el valor más alto 1,48 en el año 2010 y el más bajo 0,77 en 2001. 31 ¿Conocemos la incidencia real de la tos ferina en España? Incidencia (casos × 100.000 habitantes) 3,5 H 3,0 H 2,5 H 2,0 1,5 H H 1,0 0,5 0,0 IA_EDO IA_CMDB 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2,86 0,79 1,02 2,26 0,92 0,83 1,29 1,23 0,69 0,86 1,23 1,44 1,15 1,88 2,46 0,85 1,01 2,51 1,19 0,88 0,96 1,28 0,97 1,04 1,18 1,25 1,06 1,27 H Año epidémico Figura 1. Comparación de la incidencia de hospitalizaciones con la incidencia declarada de tos ferina en España (1997-2010). Incidencia (casos × 100.000 habitantes) La incidencia de notificación de tos ferina presentó una infradeclaración mínima del 50% en el grupo de los menores de 1 año. En el resto de los grupos de edad, las notificaciones fueron superiores a las hospitalizaciones (Fig. 2). La infradeclaración en los menores de 1 año se observó en todos los años del estudio: del 52% en 2005, del 64% en 2006, del 54% en 2007, del 46% en 2008, del 48% en 2009 y del 39% en 2010. 110 100 90 80 70 60 50 40 30 20 10 0 EDO CMDB <12 meses 54,20 108,33 1 a 14 años 3,81 0,33 15 a 44 años 0,30 0,02 >44 años 0,10 0,05 Figura 2. Incidencia de notificaciones y hospitalizaciones por tos ferina por grupo de edad (2005-2010). 32 M.I. Fernández Cano. L. Armadans y M. Campins Discusión La tos ferina en España, entre los años 1997 y 2010, es una enfermedad infradeclarada al sistema EDO. Según los datos obtenidos, un 96% de los casos notificados se habrían hospitalizado, lo que hace evidente la magnitud de la infradeclaración, porque sólo los casos graves deben ingresar en centros hospitalarios. La mayoría de los casos de tos ferina se tratan en atención primaria o quedan sin diagnosticar por falta de sospecha o por presentar formas clínicas atípicas, como ocurre en los adolescentes, las personas vacunadas y los adultos. La infradeclaración se concentró en el grupo de menores de 1 año, en el cual fue de un 50%, cifra muy superior a las publicadas por otros autores. En Cataluña, durante el periodo de 1997 a 2001, en los menores de 1 año se estimó una infradeclaración mínima del 33% (5). En Australia, entre 1993 y 1999, se estimó una infradeclaración del 32% en la población de 0 a 11 años de edad (3). En el estado de Colorado (Estados Unidos) se evaluó la sensibilidad, la rapidez y la calidad de los datos del sistema de vigilancia pasiva de ocho enfermedades notificables, y se estimó una infradeclaración mínima del 41% para la tos ferina en el periodo de 2003 a 2005 en la población general (7). Las estrategias de prevención se basan en la información que aporta la vigilancia epidemiológica, por lo que se necesitan sistemas con la mayor calidad posible. Para la tos ferina, sería oportuno complementar la vigilancia con sistemas activos, sobre todo en los menores de 1 año, grupo en que se ha detectado una mayor infradeclaración. A pesar de ser considerada en general una enfermedad leve, en el periodo de estudio se produjeron 49 muertes por tos ferina, la mayoría en menores de 2 meses. Sin embargo, los porcentajes de letalidad fueron más altos en los mayores de 65 años que en el resto de los grupos. En este grupo, de los nueve pacientes fallecidos, cuatro tenían como diagnóstico principal «hemorragia cerebral», una de las complicaciones descritas en los adultos afectados por tos ferina. Una mayor sospecha diagnóstica de la tos ferina en los adultos por parte de los profesionales contribuiría al control de esta enfermedad en todos los grupos de población. El conocimiento preciso de la incidencia de la tos ferina y de su distribución en la población es clave para ajustar de forma eficiente los calendarios vacunales. La utilidad del estudio radica en poder estimar la incidencia real de la tos ferina para adaptar las estrategias de vacunación de una manera más adecuada. 33 ¿Conocemos la incidencia real de la tos ferina en España? BIBL I O G RA F ÍA 1.Guiso N, Wirsing von Konig CH, Forsyth K, Tan T, Plotkin SA. The Global Pertussis Initiative: report from a round table meeting to discuss the epidemiology and detection of pertussis, Paris, France, 11-12 January 2010. Vaccine. 2011;29:1115-21. 2.German RR, Lee LM, Horan JM, Milstein RL, Pertowski CA, Waller MN, et al. Updated guidelines for evaluating public health surveillance systems: recommendations from the Guidelines Working Group. MMWR Recomm Rep. 2001;50:1-35. 3.Torvaldsen S, McIntyre P. Do variations in pertussis notifications reflect incidence or surveillance practices? A comparison of infant notification rates and hospitalisation data in NSW. N S W Public Health Bull. 2003;14:81-4. 4.Spokes PJ, Quinn HE, McAnulty JM. Review of the 2008-2009 pertussis epidemic in NSW: notifications and hospitalisations. N S W Public Health Bull. 2010;21:167-73. 5.Moraga F, Roca J, Méndez C, Rodrigo C, Pineda V, Martínez A, et al. Epidemiology and surveillance of pertussis among infants in Catalonia, Spain, during 1997-2001. Pediatr Infect Dis J. 2005;24:510-3. 6.Instituto Nacional de Estadística. 2012. (Consultado el 30-6-2012.) Disponible en: http://www.ine.es/inebmenu/mnu_cifraspob.htm. 7.Boehmer TK, Patnaik JL, Burnite SJ, Ghosh TS, Gershman K, Vogt RL. Use of hospital discharge data to evaluate notifiable disease reporting to Colorado’s Electronic Disease Reporting System. Public Health Rep. 2011;126:100-6. 34 Seguridad vacunal J.A. Navarro Alonso Sistemas de vigilancia de reacciones adversas a las vacunas IN TRODU C C I Ó N La seguridad de las vacunas es quizás el elemento de mayor importancia en la aceptación de las políticas de vacunación por parte de la población. Tal como refiere un miembro del European Center for Disease Prevention and Control, «en el momento actual, el riesgo percibido de efectos adversos en la población es la amenaza más importante para el éxito de los programas europeos de vacunación» (1). Podríamos preguntarnos si son seguras las vacunas, a lo que podría responderse que depende de cómo se defina la palabra «seguridad». Si la definimos como completamente libre de efectos adversos, la respuesta es «no», ya que con relativa frecuencia se asocian con acontecimientos adversos, leves y autolimitados en su inmensa mayoría. No obstante, a las vacunas se les demanda una mayor seguridad que a cualquier otro fármaco, entre otros por los siguientes motivos: se administran a personas sanas, de manera repetitiva y especialmente en la infancia; su uso es poblacional en la mayoría de las ocasiones; la edad en el momento de la vacunación puede coincidir con la aparición de ciertas enfermedades relacionadas con la edad (trastornos del desarrollo inmunitario); en algunos países las vacunas son obligatorias; los beneficios de la vacunación pueden no ser visibles a corto plazo; y porque las vacunas son complejos productos biológicos que pueden incluir múltiples antígenos, adyuvantes, organismos vivos y conservantes (2). 37 Sistemas de vigilancia de reacciones adversas a las vacunas La farmacovigilancia vacunal se define, según el Council for International Organizations of Medical Sciences y la Organización Mundial de la Salud (OMS), como «la ciencia y las actividades relativas a la detección, la evaluación, la comprensión y la comunicación de acontecimientos adversos tras la vacunación, y a la prevención de los efectos adversos de las vacunas o de la inmunización» (2), y los acontecimientos adversos como «cualquier episodio médico no deseado que sigue a la vacunación y que no necesariamente tiene una relación causal con el uso de una vacuna». Este acontecimiento puede referirse a signos o síntomas clínicos, enfermedad o hallazgos de laboratorio, y las causas pueden ser relacionadas con el producto en sí, por un defecto en la calidad (sea del producto o del dispositivo de administración), por un error en el almacenamiento, el manejo, la prescripción o la administración, por ansiedad ligada a la recepción de la vacuna, o por mera coincidencia (2). De otra parte, la reacción adversa implica una cierta seguridad en la causalidad, mientras que en las sospechas de reacciones adversas hay dudas sobre la causa. En íntima relación con la seguridad de las vacunas y la vigilancia, es evidente que para facilitar la recogida y la comparación de acontecimientos posvacunales debería disponerse de definiciones estandarizadas. A este respecto es encomiable la labor desarrollada por los grupos de trabajo de la Brighton Collaboration, que desde su creación en el año 1999 por Bob Chen, Harald Heijbel, Ulrich Heininger, Tom Jefferson y Elisabeth Loupi, no ha dejado de publicar definiciones. Actualmente forman parte de los grupos 3123 personas de 124 países. Una vez publicado el documento relativo a una vacuna específica, la definición es asumida por la OMS y aceptada y utilizada por la Food and Drug Administration y los Centers for Disease Control and Prevention de Estados Unidos, y por la European Medicines Agency y el Center for Disease Prevention and Control de la Unión Europea. SISTEM AS DE M O NI T O RI Z ACI Ó N DE L A S EG U R IDAD DE L A S VACUN A S Fase precomercialización En esta fase se analiza la seguridad de una vacuna mediante los ensayos clínicos, habitualmente a doble ciego, aleatorizados y controlados con placebo, de fase I a fase III, con los cuales es relativamente sencillo establecer una relación de causalidad entre una vacuna y un acontecimiento adverso. Por los motivos antes comentados, estos ensayos incluyen un número de sujetos muy superior que los estudios sobre fármacos de uso habitual 38 J.A. Navarro Alonso en la población. Mientras que en los ensayos de algunas moléculas antihipertensivas o de anticuerpos monoclonales los individuos participantes difícilmente sobrepasan los 5000, los de algunas vacunas actualmente en uso pediátrico o adulto han sobrepasado los 30.000. Como ejemplo puede citarse el ensayo actualmente en marcha con la vacuna antineumocócica conjugada de 13 serotipos, cuyo objetivo primario es establecer su eficacia en la prevención del primer episodio de neumonía comunitaria por los serotipos vacunales, en el cual participan 85.000 personas mayores de 65 años (3). Estos estudios, aunque con un alto número de participantes, no permiten detectar acontecimientos adversos con una frecuencia menor de 1/10.000-100.000, así como tampoco los de comienzo retardado o los que aparecen en subpoblaciones específicas, por lo que hay que recurrir a los sistemas de vigilancia poscomercialización, una vez está disponible para su uso poblacional o individual. Fase poscomercialización En esta fase, los sistemas son de dos tipos: de vigilancia pasiva y de vigilancia activa. Los sistemas de vigilancia pasiva pueden subdividirse en los que se refieren a los acontecimientos observados en individuos que generan señales cualitativas y a los observados en poblaciones que generan señales cuantitativas. Sin duda, los de mayor importancia por la información que proporcionan son los poblacionales, y entre ellos el más habitualmente utilizado en todos los países de nuestro entorno es el denominado en España «Programa de tarjeta amarilla», cuyos objetivos básicos son: •• Identificar acontecimientos adversos nuevos o infrecuentes. •• Modificar el perfil de seguridad de los ya conocidos. •• Adoptar decisiones regulatorias (retirada, cambios en ficha técnica…). •• Difundir la nueva información. Mediante este sistema, de un coste económico relativamente bajo, los profesionales declaran de manera espontánea las sospechas de reacciones adversas asociadas a la recepción de una vacuna, y en especial las graves (que provoquen la muerte o amenacen la vida, lleven a hospitalización o incapacidad laboral-escolar, induzcan defectos congénitos o sean importantes bajo criterio médico) y las relativas a los medicamentos aparecidos en el mercado en los últimos 5 años (4). Es destacable que las tarjetas ama- 39 Sistemas de vigilancia de reacciones adversas a las vacunas rillas que se remiten a los centros gestores no son historias clínicas sino descripciones no estandarizadas de signos y síntomas. La misión primaria del programa es la detección precoz de «señales» de alerta, y por tanto generar hipótesis acerca de posibles nuevas reacciones adversas posvacunales o modificar la frecuencia de aparición de las previamente conocidas (5). Entre las ventajas de este sistema de vigilancia destacan su carácter poblacional y nacional, que permite detectar acontecimientos muy infrecuentes y posibles factores de riesgo en un receptor para una reacción específica (síncope en adolescentes tras las vacunas de la hepatitis B, Td y papiloma humano, efectos adversos graves en ancianos con la vacunación de la fiebre amarilla, etc.). Sin embargo, el sistema también tiene una serie de limitaciones, entre las que se encuentran: •• La administración simultánea de varias vacunas o de combinaciones antigénicas no permite en ocasiones asociar la señal de alerta a una vacuna específica. •• Al tratarse de un sistema pasivo es probable que haya una infradeclaración de casos. •• La calidad de la información declarada es variable. •• Únicamente permite conocer uno de los elementos de la tabla de contingencia 2 × 2 (vacunados que desarrollan el acontecimiento adverso o el poder de la celdilla a) (6). •• El número de declaraciones para una determinada vacuna puede estar condicionado por la publicidad en los medios de comunicación (7) y por el tiempo que lleva en el mercado. •• En general no establece causalidad por ser un método cuantitativo de detección de señales, ya que en definitiva lo que la tarjeta amarilla permite es formular la pregunta de si es posible que el acontecimiento esté provocado por la vacuna. Es sumamente importante recalcar que la asociación temporal no permite establecer si ésta es causal o casual, y que un sistema de declaración pasiva, salvo en situaciones excepcionales, nunca establece causalidad. Este dato conviene tenerlo muy presente porque es frecuente observar que, en algunos medios de comunicación y páginas de Internet, las notificaciones recibidas en el sistema de vigilancia se malinterpretan como casos verificados de muertes y lesiones causadas por la vacunación (8). Las señales 40 J.A. Navarro Alonso detectadas por el sistema deben someterse a un análisis clínico o de laboratorio, o llevar a poner en marcha estudios epidemiológicos experimentales u observacionales que nos permitan conocer si el riesgo realmente existe y en tal caso poder cuantificarlo (riesgo relativo, riesgo atribuible, razón de tasas, odds ratio…). Este sistema ha permitido conocer, entre otros, la existencia del riesgo de invaginación intestinal tras la administración de la primera vacuna comercializada frente al rotavirus, de síndrome oculorrespiratorio tras algunas vacunas antigripales inactivadas, y de narcolepsia en individuos genéticamente predispuestos tras recibir una vacuna antigripal adyuvada frente a la cepa A(H1N1)pdm09. El programa de tarjeta amarilla se sustenta en España en el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, que surgió de una iniciativa del Instituto Catalán de Farmacología y que está constituido por un centro en cada comunidad autónoma y un centro coordinador ubicado en la Agencia Española de Medicamentos y Productos Sanitarios. Las sospechas de reacciones adversas se remiten a Farmacovigilancia Española, Datos de Reacciones Adversas, que tras su depuración los envía a la Agencia Europea del Medicamento (Eudravigilance) y a su vez al Centro de Monitorización de Upsala, dependiente de la OMS, que recoge las sospechas de todos los países (9). En España es el profesional sanitario, bien sea médico, farmacéutico o de enfermería, quien obligatoriamente ha de declarar la sospecha de reacciones adversas (10). Una vez entre en vigor la nueva normativa comunitaria, en julio de 2012, también podrán declarar, al igual que en Estados Unidos, los propios pacientes (11). Los sistemas de vigilancia activa se apoyan en los ensayos clínicos poscomercialización y en los estudios de vigilancia (fase IV), así como en los programas que utilizan bases de datos relacionadas. Los ensayos clínicos poscomercialización y los estudios de vigilancia sólo se llevan a cabo en ocasiones excepcionales por ser económicamente muy costosos, consumir muchos recursos y permitir evaluar una única sospecha de reacción adversa. Las bases de datos relacionadas ligan registros de vacunación con historias clínicas, lo que permite el acceso a grandes bases de datos poblacionales y se evitan infradeclaraciones de sospechas de efectos adversos graves. Las grandes ventajas de estos sistemas son, entre otras, que incluyen grandes poblaciones con identificadores individuales y que permiten conocer las tasas de incidencia. 41 Sistemas de vigilancia de reacciones adversas a las vacunas Aun siendo un mejor sistema de monitorización que el de las declaraciones pasivas, también tiene sus limitaciones (12): •• Los registros pueden ser incompletos. •• Son retrospectivos. •• Hay un cierto retraso en disponer de los datos. •• Cuando las coberturas son altas es escaso el número de controles (no vacunados). •• No incluyen suficiente población como para verificar algunas hipótesis. •• Plantean dificultades para conocer reacciones adversas de comienzo insidioso o retardado. Este sistema permite llevar a cabo estudios observacionales (estudios de cohortes y de casos y controles, series de casos autocontrolados) tras las señales de alerta detectadas con la vigilancia pasiva, y conocer la cobertura de vacunación. También posibilita una vigilancia poscomercialización en tiempo real mediante un «análisis de ciclo rápido» (el número observado de efectos adversos sospechosos se compara con el número esperado) y estudiar otros aspectos de la vacunación tales como la cobertura, la incidencia de enfermedades y el análisis de coste-efectividad. Este sistema ha permitido descartar la asociación entre la vacuna de la hepatitis B y la enfermedad de Graves o la tiroiditis de Hashimoto (13), ha confirmado la seguridad de la vacuna antigripal inactivada en los niños de 6 a 24 meses de edad (14), la ausencia de asociación entre la exposición temprana al timerosal y trastornos neuropsicológicos a los 7-10 años de edad (15), y la ausencia de riesgo de convulsiones febriles tras la segunda dosis de la vacuna triple vírica (16). Por otra parte, ha podido cuantificar el riesgo de convulsiones febriles tras la primera dosis de la vacuna triple vírica (17, 18) y el de púrpura trombocitopénica idiopática tras la primera dosis de esa misma vacuna (19). Una vez conocido si el riesgo de un efecto adverso tras la administración de una vacuna realmente existe y es cuantificable (riesgo relativo, odds ratio…), hay que completar el proceso de establecer la causalidad. Para ello se valoran una serie de «factores clave» (20): •• ¿Se observa una asociación temporal? •• ¿Hay un efecto dosis-respuesta? •• ¿Existe una plausibilidad biológica? 42 J.A. Navarro Alonso Tabla 1. Algoritmo de Karch y Lasagna (21). Evaluación Definitiva Probable Posible Improbable Condicional Secuencia temporal razonable Sí Sí Sí No Sí Conocimiento previo de la reacción Sí Sí Sí No No Mejora tras la supresión Sí Sí Sí/no Sí/no Sí/no Reaparición tras la reexposición Sí ¿?* ¿?* ¿?* ¿?* Explicación alternativa No No Sí Sí No *Desconocida o no puede establecerse. •• ¿Hay un cuadro clínico o una prueba de laboratorio específica? •• ¿Los resultados son consistentes (reproducibles) entre investigadores y en diferentes poblaciones? Otros autores utilizan algoritmos en los que se puntúan categorías de causalidad. Los más utilizados son los de Karch y Lasagna (21), modificados por Naranjo et al. (22), en los cuales se puntúan (de manera positiva o negativa) ciertas variables (secuencia temporal, conocimiento previo de la reacción adversa, mejoría al interrumpir el tratamiento, reaparición tras la reexposición y explicaciones alternativas) para definir categorías de causalidad (definitiva, probable, posible, improbable y condicional) (Tabla 1). C ON C LU SI O NE S Es esencial la monitorización continuada de la seguridad de las vacunas si pretendemos mantener las actuales coberturas de vacunación, desde los ensayos iniciales de fase I hasta los estudios poscomercialización de fase IV, ya que permiten asegurar una relación riesgo-beneficio favorable. Por sus ventajas inherentes al sistema, sería deseable la implantación en nuestro país de bases de datos relacionadas. BIBLIOGRAF Í A 1.Lopalco P, Johansen K, Ciancio B, De Carvalho E, Kramarz P, Giesecke J. Monitoring and assessing vaccine safety: an European perspective. Exp Rev Vaccines. 2010;9:371-80. 2.CIOMS/WHO Working Group on Vaccine Pharmacovigilance. Definition and application of terms for vaccine pharmacovigilance. Council for International Organizations of 43 Sistemas de vigilancia de reacciones adversas a las vacunas Medical Sciences (CIOMS) 2012. Disponible en: http://www.cioms.ch/frame_vaccine_ pharmacovigilance.htm. 3.Hak E, Grobbee D, Sanders E, Verheij T, Bolkenbaas M, Huijts S, et al. Rationale and design of CAPITA: a RCT of 13-valent conjugated pneumococcal vaccine efficacy among older adults. The Netherlands Journal of Medicine. 2008;66:378-83. 4.Agencia Española de Medicamentos y Productos Sanitarios. Notificación de sospechas de reacciones adversas. Enero 2012. Disponible en: http://www.aemps.gob.es/vigilancia/ medicamentosUsoHumano/home.htm. 5.Chen R, Rastogi S, Mullen J, Hayes S, Cochi S, Donlon J, et al. The Vaccine Adverse Event Reporting System (VAERS). Vaccine. 1994;12:542-55. 6.Offit P. The power of box “a”. Exp Rev Vaccines. 2003;2:89-91. 7.Bureau of Infectious Diseases. Oculo-respiratory syndrome in association with the influenza vaccine: Canada, October-November 2000. Can Commun Dis Rep. 2000;26:1-2. 8.Varricchio F, Iskander J, Destefano F, Ball R, Pless R, Braun M, et al. Understanding vaccine safety information from the Vaccine Adverse Event Reporting System. Pediatr Infect Dis J. 2004;23:287-94. 9.Manso G, Hidalgo A, Carvajal A, De Abajo F. Los primeros 25 años del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano. Disponible en: http://www. unioviedo.es/farmacovigilancia/index.php/component/content/article/96-libro25anios. 10.Real Decreto 1344/2007, de 11 de octubre, por el que se regula la farmacovigilancia de medicamentos de uso humano. 11.Directiva 2010/84/UE del Parlamento Europeo y del Consejo de 15 de diciembre de 2010, que modifica, en lo que respecta a la farmacovigilancia, la Directiva 2001/83/CE por la que se establece un código comunitario sobre medicamentos para uso humano 12.Baggs J, Gee J, Lewis E, Fowler G, Benson P, Lieu T, et al. The Vaccine Safety Datalink: a model for monitoring immunization safety. Pediatrics. 2011;S1:S45-53. 13.Yu O, Bolhke K, Hanson C, Delaney K, Rees T, Zavitskosky A, et al. Hepatitis B vaccine and risk of autoimmune thyroid disease: a Vaccine Safety Datalink study. Pharmacoepidemiol Drug Saf. 2007;16:736-45. 14.Hambidge S, Glanz J, France E, McClure D, Xu S, Yamasaki Ch, et al. Safety of trivalent inactivated influenza vaccine in children 6 to 23 months of age. JAMA. 2006;296:1990-7. 15.Thompson W, Price C, Goodson B, Shay D, Benson P, Hinrichsen V, et al. Early thimerosal exposure and neuropsychological outcomes at 7 to 10 years. N Engl J Med. 2007;357:1281-92. 16.Klein N, Lewis E, Baxter R, Weintraub E, Glanz J, Naleway A, et al. Measles-containing vaccines and febrile seizures in children age 4 to 6 years. Pediatrics. Published on line April 2, 2012. 17.Farrington P, Pugh S, Colville A, Flower A, Nash J, Morgan-Capner P, et al. A new method for active surveillance of adverse events from diphtheria/tetanus/pertussis and measles/ mumps/rubella vaccines. Lancet. 1995;345:567-9. 18.Miller E, Andrews N, Stowe J, Grant A, Waight P, Taylor B. Risks of convulsion and aseptic meningitis following measles-mumps-rubella vaccination in the United Kingdom. Am J Epidemiol. 2007;165:704-9. 19.Miller E, Waight P, Farrington CP, Andrews N, Stowe J, Taylor B. Idiopathic thrombocytopenic purpura and MMR. Arch Dis Child. 2001;84:227-9. 44 J.A. Navarro Alonso 20.World Health Organization. Causality assessment of adverse events following immunization. Wkly Epidemiol Rec. 2001;76:85-9. 21.Karch F, Lasagna L. Toward the operational identification of adverse drug reactions. Clin Pharmacol Ther. 1977;21:247-54. 22.Naranjo C, Busto U, Sellers E, Sandor P, Ruiz I, Roberts E, et al. A method for estimating the probability of adverse drug reaction. Clin Pharmacol Ther. 1981;30:239-45. 45 J. Batalla, L. Urbiztondo, I. Barrabeig y M. Martínez Registro de reacciones adversas seguidas a la vacunación en Cataluña IN TRODU C C I Ó N En el año 1999, el Servicio de Medicina Preventiva del entonces Departament de Sanitat i Seguretat Social de Cataluña puso en marcha un registro de Reacciones Adversas Seguidas a la Vacunación (RASV) con un doble objetivo: colaborar con el Sistema Español de Farmacovigilancia y conocer el impacto de estas reacciones en Cataluña. En 1997, el Servicio de Medicina Preventiva inició de manera informal la recogida de información de reacciones adversas asociadas a la vacunación que comunicaban los profesionales con mayor adherencia al programa de vacunaciones, al percibir que con frecuencia consultaban dudas relativas a estas reacciones pero no siempre cumplimentaban la tarjeta amarilla. Posteriormente se formalizó el registro, a la vez que se estableció un acuerdo con el Centro de Farmacovigilancia de Cataluña para enviarle sistemáticamente todas las declaraciones recibidas, que de esta manera se incorporan al Programa de Farmacovigilancia Española de Datos de Reacciones Adversas, y éste a su vez las envía a la Agencia Europea del Medicamento y al Banco Mundial de Datos de la Organización Mundial de la Salud, actualmente ubicado en la ciudad sueca de Upsala. El segundo objetivo del registro, conocer el impacto de las reacciones adversas en Cataluña, es importante por varios motivos. Uno de ellos es para mejorar la vigilancia y el control de los programas de vacunación. 47 Registro de reacciones adversas seguidas a la vacunación en Cataluña Mediante la información aportada al registro, pueden generarse alertas, inmovilizaciones de lotes, recomendaciones, etc. Otro motivo es conocer la verdadera dimensión de las reacciones graves en los programas de vacunación. Estas reacciones, aunque son muy escasas, tienen mucha prensa y pueden dar la falsa sensación de que además de importantes son frecuentes. Este hecho preocupa a muchos técnicos que administran vacunas, y en algunos casos puede generar ansiedad y reticencia a la vacunación. Un correcto conocimiento del impacto de las reacciones adversas también sirve para que la población mantenga un alto grado de confianza en las vacunas, porque la pérdida de ésta puede comportar una caída de las coberturas vacunales y hacer que las enfermedades vuelvan a aparecer. En este sentido, cabe destacar que la incidencia de las enfermedades vacunables disminuyó intensamente a finales del siglo xx. En los últimos años de ese periodo, en siete de las diez enfermedades que cubría el calendario de vacunaciones sistemáticas, el número de reacciones adversas que producían las vacunas superaba al de casos de enfermedad que prevenían (1). En la primera década del siglo actual, en prácticamente la mitad de las enfermedades vacunables se ha producido un incremento tanto de casos (2) como de brotes epidémicos (3-7). En concreto, en Cataluña, en lo que llevamos de siglo xxi, se han registrado 563 casos de sarampión, 1782 casos de parotiditis, 2343 casos de tos ferina, 1282 casos de hepatitis B y 2682 casos de hepatitis A. Varios son los motivos que pueden explicar la aparición de estas enfermedades; unos de tipo demográfico, debido al incremento del flujo de personas procedentes de zonas con mayor endemia que se han establecido o transitan por nuestro territorio sin estar correctamente vacunados, y otros relacionados con el tema de la seguridad vacunal (para vacunarse, la población exige un riesgo cero) teniendo en cuenta que las vacunas se administran a población sana y principalmente infantil. Los incidentes relacionados con la vacunación, que son de muy rara incidencia, tienen mucha repercusión mediática y en ocasiones pueden generar dudas o inseguridad tanto en la población que ha de vacunarse como en los profesionales que han de aplicar las vacunas. Además, las nuevas tecnologías de la comunicación han facilitado la difusión de todo tipo de opiniones, entre otras las de profesionales sanitarios sin una adecuada formación en vacunología. Este espacio también es aprovechado por los grupos detractores de las vacunas, que suelen tener gran habilidad al utilizar recursos de carácter emocional para comunicarse con la población. 48 J. Batalla, L. Urbiztondo, I. Barrabeig y M. Martínez MÉTOD O La información se ha obtenido del programa de RASV de Cataluña. Los casos que se presentan son los registrados entre los años 2000 y 2011. Estos datos se recogen mediante declaración nominal pasiva de los casos sospechosos que se producen en los centros de vacunación, aunque pueden proceder de cualquier centro o profesional sanitario que se encuentre frente a un caso sospechoso o compatible con una reacción vacunal. Los formularios de declaración están disponibles en todos los centros de vacunación y para todos aquellos profesionales que los soliciten a través del Programa de Vacunas del Servicio de Medicina Preventiva de la Agencia de Salud Pública de Cataluña. En estos formularios se recogen variables epidemiológicas y clínicas, definidas estas últimas en el programa, inclu­ yendo los tiempos de aparición de la reacción y la duración de ésta, y quedando abierto el tipo de reacción a otras afecciones clínicas no descritas o no contempladas en el protocolo que puedan aparecer. Las declaraciones son revisadas en el momento de su llegada para detectar y solventar pequeñas anomalías en la correcta cumplimentación del formulario. En los resultados obtenidos se presentan las variables descriptivas de las personas afectadas y el lugar de declaración de los casos, variables temporales, características de la reacción presentada, actitud terapéutica frente a ella y vacunas implicadas. Las RASV se han clasificado en dos categorías clínicas (graves y leves), y a su vez en otras dos categorías referidas a su incidencia (frecuentes y raras). Se clasifican como graves no sólo las que pueden poner en peligro la vida, sino también las que, con independencia de su duración, requieren tratamientos especiales, a menudo en servicios de urgencias. Por otro lado, se clasifican como frecuentes aquellas reacciones cuya frecuencia relativa es superior al 1%, y como raras las que han resultado ser inferiores al 1%. De esta manera se forman cuatro grupos: frecuentes graves, frecuentes leves, raras graves y raras leves. Se ha estudiado el predominio del tipo de reacción, local o general, en función de si las vacunas eran o no adyuvadas. El exceso de riesgo se ha medido calculando la odds ratio y sus respectivos intervalos de confianza. En las reacciones adversas originadas aplicando el Calendario de Vacunaciones de Cataluña y con las vacunas de aplicación internacional, se han calculado los casos esperados en un millón de habitantes sólo de las reacciones catalogadas como graves, y para la obtención de sus intervalos de confianza se ha utilizado el método exacto para el parámetro de Poisson. 49 Registro de reacciones adversas seguidas a la vacunación en Cataluña Las tasas se han calculado basándose en la población y las vacunas distribuidas. Los datos demográficos de población total y por comarcas de Cataluña se han obtenido del Institut Estadístic de Catalunya, y los referentes a las vacunas distribuidas proceden del registro logístico del Programa de vacunas. RESU LTADO S En los 12 años de estudio se han declarado 1623 individuos afectados por RASV, con una media anual de 135 ± 61 individuos, lo que implica una tasa de 1,93 afectados por 100.000 habitantes. Esta tasa se aproxima a la observada en algunos estudios (8), pero ha de tenerse en cuenta que al hacer comparaciones nacionales con frecuencia se observan resultados diferentes porque las declaraciones de reacciones adversas están sujetas a un alto grado de variabilidad, debido a la subjetividad que existe tanto en su diagnóstico como en su padecimiento, a diferencias en las definiciones de casos y también entre los distintos sistemas de vigilancia de reacciones y métodos para declarar casos (9, 10). En conjunto, los 1623 individuos afectados han presentado 3133 reacciones vacunales. Casi en la mitad de los afectados (43,3%) se ha declarado más de una reacción adversa porque el proceso inflamatorio de la reactividad local suele asociarse a más de un síntoma, como dolor, fiebre, edema, enrojecimiento, etc. En concreto, un 56,7% de los afectados han tenido una sola reacción adversa, el 29,08 % han presentado dos reacciones, el 10,96 % tres, el 2,68 % cuatro, el 0,46 % cinco y un 0,1 % seis reacciones. En la Tabla 1 se muestran la principales vacunas implicadas en las RASV, y en ella podemos ver que para las vacunas que tienen adyuvante en su composición predominan las reacciones locales. Las reacciones graves representan muy pocos casos y entre ellas destacan los angioedemas. De los 1623 afectados por reacciones vacunales, 1399 han tenido reacciones locales y de ellas 1295 han sido por vacunas adyuvadas, mientras que de los 224 afectados por reacciones sistémicas en 122 se han producido con vacunas adyuvadas. Aplicando un cálculo de probabilidad, podemos concluir que el 92,5% de las reacciones locales han estado causadas por vacunas adyuvadas. En la Tabla 2 se detalla la distribución de los individuos afectados por las reacciones vacunales según sexo, provincia de declaración y edad. Las RASV declaradas no muestran un predominio en cuanto al sexo, pues hombres y mujeres las padecen por igual. La distribución de las declaraciones por provincias muestra notables diferencias en sus tasas, lo cual 50 J. Batalla, L. Urbiztondo, I. Barrabeig y M. Martínez Tabla 1. Reacciones locales y reacciones graves con las principales vacunas implicadas en las RASV. Cataluña, 2000-2011. n Td MCC DTPa 703 Reacciones locales, n (%) 379 (54%) 455 221 (49%) 425 314 (74%) Reacciones graves, n (%) 8 (1,14%) 12 (2,64%) 8 (1,88%) Tipos de reacciones graves 5 angioedemas 2 parálisis 1 trombocitopenia 1 lesión necrótica 6 angioedemas 2 shocks anafilácticos 2 paradas respiratorias 1 encefalopatía 5 angioedemas 2 parálisis 1 trombocitopenia DTPa+Hib+PI 302 177 (59%) 2 (0,66%) 2 angioedemas DTPa+Hib 214 132 (62%) 3 (1,40%) 2 lesiones necróticas 1 angioedema TV 170 27 (16%) 7 (4,12%) 4 angioedemas 1 parálisis 1 trombocitopenia RASV: reacciones adversas seguidas a la vacunación; Td: antitetánica y antidiftérica para adultos; MCC: antimeningocóccica C conjugada; DTPa: antidiftérica, antitetánica y antipertussis acelular; DTPa+Hib+PI: antidiftérica, antitetánica, antipertussis acelular, antipoliomielítica y Haemophilus influenzae tipo b; DTPa+Hib: antidiftérica, antitetánica, antipertussis acelular y H. influenzae tipo b; TV: triple vírica. pone de manifiesto el diferente grado de cumplimiento del programa y la necesidad de activarlo en los territorios con más baja tasa de declaración. Sin embargo, se ha observado un incremento importante en la declaración de reacciones consideradas graves. Probablemente el Departament de Salut, para corregir estas deficiencias, tenga que redefinir y uniformar los criterios de declaración en Cataluña. La distribución de las tasas de reacciones por grupos de edad muestra una alta tasa en la población menor de 1 año, hecho lógico porque en el intervalo de 1 año se administran cinco vacunas. Los tres intervalos siguientes, hasta los 14 años de edad, muestran tasas entre 4,8 y 8,8 casos por 100.000 habitantes, porque en ellos se administran dos o tres dosis en cada intervalo. En edades superiores, la actividad vacunal disminuye considerablemente y ello se refleja en las bajas tasas de incidencia de reacciones adversas. El 84,7% de las reacciones declaradas ha sido por una sola vacuna y en el 11,2 % se habían administrado dos, que es el número de dosis que se administran en tres de los cinco actos vacunales que se aplican en los primeros 2 años de vida. 51 Registro de reacciones adversas seguidas a la vacunación en Cataluña Tabla 2. Distribución de los afectados por reacciones adversas a las vacunas según sexo, provincia y edad. Tasas por 100.000 habitantes. Cataluña, 2000-2011. n (%) Tasa* Tasa ajustada** Sexo Hombre Mujer Total 780 (48,1) 843 (51,9) 1623 (100) 1,88 1,99 1,93 Provincia Barcelona Gerona Lérida Tarragona Casos perdidos Total 821 (52,36) 465 (29,66) 179 (11,42) 103 (6,57) 55 1623 (100) 1,32 5,78 3,71 1,2 1,93 1,44 5,99 4,18 1,29 Edad (años) <1 >1-2 >2-12 >12-14 >14-16 >16-60 >60 Total 566 (34,9) 61 (3,8) 525 (32,3) 118 (7,3) 6 (0,4) 242 (14,9) 105 (6,5) 1623 (100) 65,07 3,47 6,65 7,7 0,38 0,46 0,61 1,93 *Tasa cruda, IDESCAT 2000-2011. **Tasa ajustada, población Cataluña 2011 IDESCAT. Las reacciones declaradas con mayor prevalencia han sido edema, dolor y fiebre, todas ellas clasificadas como leves y asociadas a la presencia y la función que ha de cumplir el adyuvante de las vacunas particuladas. En la clasificación de reacciones leves y habituales (Tabla 3) aparece un grupo denominado «Otras», de respuesta abierta, con una prevalencia del 8,62% de las declaraciones, para anotar otras afecciones o trastornos supuestamente relacionados con la vacunación que no figuran en la lista de RASV, como hematuria, amigdalitis, otorrea, hipertransaminasemia, faringitis, herpes, etc. Probablemente muchos de ellos son cuadros concomitantes. En los 12 años de seguimiento no se ha producido ningún caso de parada cardiaca ni de síndrome de Guillain-Barré. Las reacciones consideradas graves tienen una prevalencia muy baja, un 2,15 % de totas las declaradas. Ello implica 1,9 reacciones graves por cada millón de dosis aplicadas en la población, cifra muy inferior a las complicaciones que podrían suponer el padecimiento de las enfermedades que se trata de evitar. Si calculamos el riesgo de que se produzca una reacción grave al aplicar las vacunas, vemos que la incidencia también es muy baja (Tabla 4). 52 J. Batalla, L. Urbiztondo, I. Barrabeig y M. Martínez Tabla 3. Distribución de las reacciones adversas a vacunas por síntomas clínicos y frecuencia de aparición. Graves Frecuentes Angioedema Raras Parada cardiaca Parálisis Meningitis meningoencefalitis Parada respiratoria Choque anafiláctico Lesión necrótica Trobocitopenia Encefalopatía Guillain-Barré Total n (%) 32 (1,02) 0 (0,00) 3 (0,10) 3 (0,10) 4 (0,13) 5 (0,16) 5 (0,16) 7 (0,22) 8 (0,26) 0 (0,00) 67 (2,15) Leves Frecuentes Adenopatía Artralgia Vómitos/diarreas Llanto persistente Nódulo Reacción hipotónica Exantema Urticaria Fiebre no determinada Otros Fiebre 39-40 ºC Dolor Edema Raras Parotiditis Parestesias Artritis Fiebre >40 ºC Broncoespasmo Somnolencia Absceso Convulsiones Total Por ejemplo, con las declaraciones obtenidas desde el año 2007, cuando empezó a aplicarse la vacuna hexavalente, es de esperar que se produzca una reacción grave cada 2 años, y lo mismo ocurre con la triple vírica y la de la meningitis C conjugada. Con la vacuna contra la hepatitis A+B, de aplicación en el medio escolar, cabe esperar una reacción grave cada 10 años, y con la DTPa una cada 5 años. Con ello queremos indicar que si los técnicos que administran vacunas contemplan de forma adecuada sus n (%) 44 (1,40) 49 (1,56) 52 (1,66) 55 (1,76) 63 (2,01) 93 (2,97) 114 (3,64) 199 (6,35) 199 (6,35) 270 (8,62) 336 (10,72) 367 (11,71) 1091 (34,82) 3 (0,10) 10 (0,32) 10 (0,32) 17 (0,54) 19 (0,61) 21 (0,67) 23 (0,73) 31 (0,99) 3066 (97,85) Tabla 4. Calendario de vacunas sistemáticas y reacciones graves. Hexavalente MCC TV Pentavalente DTPa HB Td Casos esperados cada 106 dosis IC95% 4,3 2,8 3,4 0,7 2,7 1,4 1,1 1,4-10,1 1,5-5,0 1,4-7,1 0,1-2,7 0,3-9,6 0,3-4,0 0,5-2,2 IC95%: intervalo de confianza del 95%; MCC: meningitis C conjugada; TV: triple vírica; DTPa: antidiftérica, anti­tetánica, antipertussis acelular; HB: hepatitis B; Td: antite­tánica y antidiftérica para adultos. 53 Registro de reacciones adversas seguidas a la vacunación en Cataluña contraindicaciones y las administran con buena praxis, el riesgo de que se encuentren con una reacción grave es extremadamente pequeño y casi anecdótico. Lo mismo ocurre con las vacunas que se aplican en centros de vacunación para viajes internacionales (Tabla 5). En este caso, al disponer como denominador de las dosis administradas, el riesgo de aparición de una RASV se ha calculado sobre la administración de 1.000.000 dosis. La vacuna contra la fiebre amarilla, considerada una de las más reactógenas, presenta un riesgo de 19,6 reacciones graves cada 1.000.000 do­sis administradas; la de la meningitis tetravalente, 15,8 casos cada 1.000.000 dosis; y la de la hepatitis A+B de adultos, 8,4 casos cada 1.000.000 dosis. Con las vacunas antitíficas y de la polio tipo Salk no se ha declarado ninguna reacción grave; con las vacunas contra la encefalitis, de menor consumo, tampoco se ha declarado, de momento, ninguna reacción grave. Junto con estas incidencias tan bajas, podemos observar unos cortos periodos de incubación entre la aplicación de las vacunas y la aparición de las reacciones adversas, la brevedad de los síntomas que se asocian a estas reacciones, y el gran predominio de las reacciones leves que se solucionan en el propio centro de vacunación. El tiempo transcurrido entre la aplicación de las vacunas y la aparición de las reacciones adversas ha sido de 3 días o menos en el 92% de los casos, y en el 80% inferior a 2 días. Las incubaciones superiores a 72 horas han correspondido principalmente a la aparición de fiebre (19,2%), exantema (14,5%), edema (10,2%), dolor (7,23%) y urticaria (6%). La duración de los cuadros clínicos declarados presenta una media con mucha dispersión. La mediana ha sido de 3 días y la moda de 2 días. Las Tabla 5. Vacunas para viajeros internacionales, reacciones adversas esperadas en 1.000.000 dosis. Vacunas Fiebre amarilla MACYW 135 VHA+B720 Hepatitis A 1440 Tifus parenteral Polio tipo Salk Tifus oral Encefalitis europea Encefalitis japonesa IC95%: intervalo de confianza del 95%. 54 Dosis Casos × 106 dosis IC95% 153.334 63.200 239.465 313.112 161.101 258.000 97.195 4.415 6.961 19,6 15,8 8,4 0 0 0 0 0 0 0,3-56 0,13-51 0,005-37 J. Batalla, L. Urbiztondo, I. Barrabeig y M. Martínez principales reacciones con una duración superior a 5 días han sido el edema (33,2%), el dolor (15,9%), la fiebre (12,3%), el exantema (7,3%) y la urticaria (5,6%). La gran mayoría de las reacciones fueron leves (Fig. 1) y el 87,1 % de ellas se solucionaron en el propio centro de vacunación. Otro parámetro que relativiza la gravedad de las reacciones vacunales es que, al finalizar este estudio descriptivo, el 97,8% de ellas estaban resueltas. De los dos fallecidos registrados uno es un niño de 8 meses de edad con retraso psicomotor y que a los 2 meses de vida se le había diagnosticado una insuficiencia cardiaca secundaria a hipertensión pulmonar. Después de la vacunación con DTP+Hib, polio oral y meningitis C conjugada ingresó por un cuadro de encefalopatía desmielinizante progresiva que le causó la muerte en 6 meses. El otro caso es un varón de 64 años que se vacunó contra la gripe y concomitantemente presentó una miositis. Ingresó en el hospital por una complicación de su enfermedad, probablemente una fibrosis pulmonar, y al mes falleció. De los tres choques anafilácticos diagnosticados en este periodo, uno corresponde al año 2008 y se trata de una mujer de 54 años de edad que tras ser vacunada de la hepatitis A+B presentó un angioedema y choque anafiláctico que se resolvió en urgencias. El siguiente caso ocurrió en el año 2009, en una niña de 2 meses de edad vacunada con vacuna hexavalente y de la meningitis C conjugada, que también se resolvió en el servicio de ur- % 90 80 87,1 70 60 50 40 30 20 10 0 Tratamiento en un centro 9,9 2,5 0,6 Urgencias Especialista Hospital Figura 1. Tratamiento de las reacciones adversas a las vacunas. 55 Registro de reacciones adversas seguidas a la vacunación en Cataluña gencias. En el año 2010 pasó exactamente lo mismo en otra niña de 2 meses al aplicarle las mismas vacunas, y de nuevo se resolvió en urgencias. C ON C LU S I O NE S •• Los registros de reacciones adversas de vacunas son básicos para la vigilancia, el control y la evaluación de los programas de vacunas. •• Las reacciones adversas a las vacunas se concentran principalmente en la infancia (<1 año de edad). •• Las reacciones adversas graves tienen una incidencia muy baja; en este estudio, 0,8 casos por millón de habitantes. •• La mayoría de las reacciones (98%) se han resuelto satisfactoriamente. El 2% restante, al finalizar este estudio, estaban en periodo de resolución. No ha habido ningún caso con secuelas. •• Cataluña debe mejorar estas declaraciones en alguno de sus territorios. BIBL I O G RA F ÍA 1.Batalla J, Urbiztondo L, Martínez M, Boldú M, Taberner JL. Incidencia de los efectos adversos asociados con la vacunación sistemática y los programas de vacunación de Cataluña. Vacunas. 2004;4:127-31. 2.Generalitat de Catalunya, Departament de Salut. Resum de les malalties de declaració obligatòria durant l’any 1986. (Varios números hasta 2011.) 3.Barrabeig I, Rovira A, Rius C, Muñoz P, Soldevila N, Batalla J, et al. Effectiveness of measles vaccination for control of exposed children. Pediatr Infect Dis J. 2011;30:78-80. 4.Barrabeig I, Rovira A, Muñoz P, Batalla J, Rius C, Sánchez JA, et al. MMR vaccine effectiveness in an outbreak that involved day-care and primary schools. Vaccine. 2011;29:8024-31. 5.Domínguez A, Torner N, Barrabeig I, Rovira A, Rius C, Caylà J, et al. Large outbreak of measles in a community with high vaccination coverage: implications for the vaccination schedule. Clin Infect Dis. 2008;47:1143-9. 6.Llach-Berne M, Panella H, Domínguez A, Caylà JA, Godoy P, Álvarez J, et al. Estudio descriptivo de los brotes de hepatitis A investigados en Cataluña (1999-2003). Enferm Infecc Microbiol Clin. 2006;24:431-6. 7.Martínez A, Broner S, Torner N, Godoy P, Batalla J, Álvarez J, et al. Hepatitis A outbreaks in the vaccination era in Catalonia, Spain. Hum Vaccin. 2011;7 (Suppl): 205-10. 8.Schumacher Z, Bourquin C, Heininger U. Surveillance for adverse events following immunization (AEFI) in Switzerland, 1991-2001. Vaccine. 2010;28:4059-64. 9.Zanoni G, Berra P, Lucchi I, Ferro A, O’Flanagan D,Levy-Bruhl D, et al, Vaccine adverse event monitoring systems across the European Union countries: time for unifying efforts. Vaccine. 2009;27:3376-84. 10.CDC. Surveillance for safety after immunization: Vaccine Adverse Event Reporting System (VAERS) - United States, 1991-2001. MMWR. 2003;52:1-23. 56 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad IN TRODU C C I Ó N La inmunización es uno de los ejes principales en el esfuerzo que realiza la humanidad para protegerse de las enfermedades infecciosas. Por este motivo, como es requerido por las agencias de evaluación de fármacos, las vacunas son intensamente probadas en cuanto a su seguridad y eficacia antes de salir al mercado. Luego esta evaluación continúa durante su uso en la población con el objetivo de identificar diferentes tipos de efectos no desados que pudieran aparecer con el tiempo. Las vacunas no están libres de efectos adversos y, como dijo el Dr. James R. Shanon, que fue director de los National Institutes of Health de Estados Unidos, «la única vacuna segura es la que no se usa», pero hay que destacar que la gran mayoría de los efectos adversos son muy raros y en general leves. Cuando una gran población es vacunada ocurren naturalmente enfermedades que pueden asociarse a la vacunación, pero en casi todos los casos la secuencia no significa consecuencia. La preocupación de la sociedad sobre la seguridad de las vacunas se debe sobre todo a que su administración se realiza a grandes poblaciones prácticamente sanas, razón por la cual cualquier efecto adverso es tan poco tolerado cuando procede de una vacuna, en contraste con un efecto adverso que sucede tras cualquier tratamiento en personas enfermas, casi siempre más frecuentes. Para demarcar ciertos aspectos sobre el tema, es necesario definir que un «acontecimiento adverso» es un incidente médico asociado a la admi- 57 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad nistración de una sustancia medicamentosa, droga o vacuna de manera temporal, sin que necesariamente haya una relación causal entre ambos fenómenos. Una «reacción adversa» es un efecto nocivo, no deseado y no intencional de un fármaco a las dosis normalmente usadas para tratamiento, diagnóstico o profilaxis, como es el caso de las vacunas, pero en el cual existe una razonable presunción de relación causal. Los acontecimientos adversos tras una vacunación también pueden clasificarse en producidos por la vacuna (por características de la propia vacuna o del huésped), potenciados por la vacuna, debidos a algún error en su preparación o administración, relacionados con una reacción al acto de la inyección, de tipo coincidente (por azar o por enfermedad subyacente) y otros de los que realmente se desconoce su causa. Como parte de la evaluación continua de las vacunas, muchos investigadores e instituciones de todo el mundo intentan obtener la evidencia suficiente que sirva para determinar si los acontecimientos adversos que siguen a la vacunación pueden asociarse causalmente a una vacuna específica. Este capítulo intenta ofrecer una síntesis sobre estas evidencias que sostienen la relación causal entre las vacunas y sus reacciones adversas graves comprobadas. AN A F I L AX IA La anafilaxia, considerada una reacción de hipersensibilidad de tipo 1 que de manera aguda y progresiva puede afectar a diversos órganos y sistemas, llegando a poner en riesgo la vida, es una muy infrecuente reacción adversa asociada a la vacunación. La anafilaxia debe diferenciarse de las reacciones anafilactoides, prácticamente indistinguibles de la primera sólo por los signos y síntomas clínicos. En este caso, la hipersensibilidad no es mediada por IgE como en la anafilaxia. Aunque la gran mayoría de los casos no terminan en acontecimientos fatales, los casos de muerte reportados tras una reacción anafiláctica se deben principalmente a la obstrucción respiratoria que se genera por el edema laríngeo y el importante broncoespasmo. Es importante destacar que es una reacción que tiene muy poca probabilidad estadística de ser detectada durante los ensayos clínicos precomercialización. También hay que decir que durante mucho tiempo fue muy difícil identificar casos de anafilaxia por la escasez de datos comunicados y la falta de una estricta definición de caso. En 2007, la Brighton Collaboration realizó una enorme revisión sistemática en la cual definió y delimitó los criterios diagnósticos de anafilaxia. 58 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas Con estos criterios, en un estudio prospectivo de 13 meses de vigilancia activa realizado en 2008-2009 por Erlewyn-Lajeunesse et al., en Reino Unido e Irlanda, se identificaron 15 casos, de los cuales sólo siete cumplían los criterios precisos de anafilaxia. Cuatro de los siete presentaron la reacción a los 30 minutos o más después de una inmunización, seis de ellos requirieron inotrópicos y fluidos intravenosos, y no hubo ninguna muerte. Excepto uno, todos los casos confirmados ocurrieron tras la exposición a la primera dosis de una vacuna. Sin embargo, al analizar los datos según el tipo de vacuna se concluyó que realmente no se declararon casos de anafilaxia tras las 5,5 millones de dosis de vacunas administradas como parte del esquema de inmunización preescolar e infantil habitual en esos países. Dos de los casos declarados se asociaron a vacunas monovalentes frente al sarampión, lo que supone una incidencia de 12 casos de anafilaxia por cada 100.000 dosis administradas de esta vacuna, y otros tres casos por la vacuna del virus del papiloma humano (VPH), con una incidencia de 1,4 casos por millón de dosis administradas. Las estimaciones de incidencias previas a las definiciones de la Brighton Collaboration oscilaban entre 1 y 10 casos por millón de dosis de inmunizaciones con cualquier tipo de vacuna. Actualmente, la Advisory Commission on Childhood Vaccines de Estados Unidos, en su propuesta de marzo de 2012, concluye que hay evidencia suficiente para sostener la asociación de riesgo de anafilaxia con las siguientes vacunas: polio (inactivada), hepatitis B, varicela, meningococo, VPH, antigripal trivalente, triple vírica, las que contienen toxoide tetánico y las que incluyen el componente pertussis en todas sus formas. EVID EN C IA DE R E AC C I O NE S ADV ERSAS G RAV ES Vacuna contra la difteria, el tétanos y la tos ferina La vacuna contra la difteria, el tétanos y la tos ferina (DTP) es una de las de mayor uso y con amplia distribución en todo el mundo. La complicación más grave observada tras la inmunización con DTP es el daño neurológico que puede ocasionar, debido principalmente al componente pertussis de la vacuna. En estudios realizados en Reino Unido con historias de inmunización de niños de 2 meses a 3 años de edad y hospitalizaciones por alteraciones neurológicas agudas (encefalitis, encefalopatías, convulsiones que no responden al tratamiento, espasmos mioclónicos infantiles 59 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad y síndrome de Reye) se realizaron comparaciones con sujetos controles, y se concluyó que puede atribuirse una alteración neurológica importante a la vacuna DTP por cada 110.000 dosis administradas, y un caso de lesión neurológica permanente o con secuelas por cada 310.000 dosis administradas. En el año 2006, un estudio realizado en Australia por Berkovic et al. halló que, de 14 casos de encefalopatía epiléptica mioclónica grave de la infancia, hoy llamada síndrome de Dravet, iniciados tras la vacunación con DTP, 11 se asociaban a la presencia de mutaciones en los genes de los canales de sodio SCN1A de transmembrana neuronal. Esto sugiere que la vacuna es un posible desencadenante de esta enfermedad en sujetos ya condicionados genéticamente por tales mutaciones de novo. Las vacunas con componente pertussis acelular tienen menos riesgo de desarrollar estos efectos. Sin embargo, estos riesgos de la inmunización con DTP deben sopesarse con los riesgos de no estar inmunizado. Las convulsiones, por ejemplo, ocurren de manera mucho más frecuente en caso de padecer la tos ferina que tras la vacunación con DTP. Asimismo, las encefalopatías y los casos de muerte por tos ferina son mucho más frecuentes en los que sufren la enfermedad (Tabla 1). Respecto al componente de toxoide tetánico de la vacuna, hay suficiente evidencia que lo asocia causalmente con casos de plexopatías o neuritis braquiales. Esta disfunción neurológica, que produce debilidad y pérdida sensorial limitada, suele aparecer entre 2 y 28 días después de la inmunización. En general afecta al sistema nervioso periférico en el miembro superior del mismo lado de la vacunación, pero puede afectar al opuesto y en algunos casos ser bilateral. No deja secuelas, aunque la recuperación completa puede tardar varios meses. Tabla 1. Vacuna frente a la difteria, el tétanos y la tos ferina. Relación de reacciones adversas graves en vacunados y en enfermos de tos ferina. Reacción Lesión cerebral permanente Encefalopatía Convulsiones Hipotonía, shock Muerte Adaptada de Galazka AM et al. 60 Tasa × 105 vacunados Tasa × 105 enfermos Razón enfermedad/vacuna 0,2-0,6 0,1-3,0 0,3-90 – 0-0,2 600-2000 90-4000 600-8000 0,5-30 100-4000 <3000 >900 >2000 – – V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas Vacuna de la polio oral La vacuna de la polio oral (VPO) de Albert Sabin es casi ideal para la erradicación de la poliomielitis: de fácil administración, induce una buena inmunidad intestinal ante el virus salvaje bloqueando su transmisión cuando se utiliza en campañas masivas, proporciona protección a largo plazo por inmunidad humoral y no es cara. Además, el virus vacunal puede propagarse e inmunizar a contactos no vacunados, con lo que aumenta el impacto de la vacuna mas allá de los vacunados. Por estas excelentes propiedades, una vez eliminada la polio del hemisferio occidental en 1988, la Iniciativa Mundial para la Erradicación de la Polio recomendó seguir utilizando la VPO como arma fundamental para la lucha contra esta enfermedad. A pesar de sus ventajas, el uso masivo de la VPO también ha tenido algún aspecto negativo. La primera evidencia de las consecuencias clínicas de la labilidad genética del virus RNA vacunal se observó en los casos de parálisis tipo polio asociados a la vacunación ocurridos desde el inicio del uso masivo de VPO en individuos inmunocompetentes. La elevada incidencia de polio por el virus salvaje ocultaba de alguna manera este raro acontecimiento. Más recientemente, en las últimas décadas, la parálisis tipo polio asociada a la vacunación ha tenido un incremento significativo en la proporción de la carga global de casos de poliomielitis. Cerca de la mitad de los casos de parálisis tipo polio asociados a la vacunación están causados por la cepa VPO tipo 2. También se han descrito casos en personas con algún tipo de inmunodeficiencia que fueron expuestas a cepas de la VPO y quedaron con una infección crónica por varios meses o años. Los excretores crónicos de este tipo de cepas son sumamente raros, y sólo se han descrito casos en países de alta y mediana renta, donde en general se cuenta con un apropiado control clínico de la inmunodeficiencia correspondiente. En los últimos años ha cambiado el perfil de riesgo de la exposición a las cepas de la VPO. En la mayor parte del mundo, la población se encuentra inmunizada frente al poliovirus exclusivamente mediante la vacuna, pero en aquellos lugares donde las coberturas de vacunación disminuyen y se continúa utilizando la VPO se generan condiciones para que aumenten las probabilidades de extender los poliovirus vacunales (VDPV, vaccine-derived polioviruses) de persona a persona. La duración y la extensión de estas cepas dependerán de la magnitud de las diferencias de inmunidad y de la intensidad de otros factores de riesgo que favorecen la circulación de los virus de la polio. Estas facilidades en las condiciones de circulación del virus vacunal para reemplazar progresivamente a las cepas salvajes son la causa de los 61 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad nuevos brotes de poliomielitis, que en estos casos se denominarían brotes de poliomielitis asociados a la circulación de virus de la polio vacunales (cVDPV). En la Figura 1 se muestran la localización geográfica y la extensión de los brotes por cVDPV entre julio de 2009 y marzo de 2011. El riesgo de adquirir parálisis tipo polio asociada a la vacunación es de aproximadamente un caso por cada 2,4 millones de dosis de vacunas VPO administradas. El riesgo es mayor con la primera dosis, de un caso por cada 750.000 dosis administradas (Tabla 2). En las personas inmunocompetentes, el riesgo de parálisis tipo polio asociada a la vacunación con la primera dosis es 7 a 21 veces mayor que el relacionado con las dosis siguientes. Las personas inmunodeprimidas, en particular las que tienen algún déficit en la producción de inmunoglobulinas, tienen mayor riesgo de desarrollar parálisis tipo polio asociada a la vacunación, entre 3200 y 6800 veces más que las personas inmunocompetentes (Tabla 2). En Estados Unidos, desde la incorporación progresiva en los esquemas vacunales de una primera dosis con la vacuna de la polio inactivada (VPI), intentando disminuir el riesgo de la primera dosis de VPO, se ha documentado una disminución de los casos de parálisis tipo polio Tipo 2 cVDPV Tipo 3 cVDPV Tipo 1 iVDPV Tipo 2 iVDPV Tipo 3 iVDPV Tipo 1 aVDPV (paciente con PFA) Tipo 2 aVDPV (paciente con PFA) Tipo 3 aVDPV (paciente con PFA) Tipo 1 aVDPV (ambiental) Tipo 2 aVDPV (ambiental) Tipo 3 aVDPV (ambiental) 355 casos de tipo 2 cVDPV (2008-2010) 37 casos de tipo 2 cVDPV (2008-2010) 7 casos de tipo 3 cVDPV (2009-2010) 16 casos de tipo 2 cVDPV (2009-209) 6 casos de tipo 2 cVDPV (2009-2009) 13 casos de tipo 2 cVDPV (2008-2011) Figura 1. Virus de la polio vacunales detectados en todo el mundo entre julio de 2009 y marzo de 2011.VDPV: poliovirus vacunales (vaccine-derived polioviruses); cVDPV: VDPV circulante; iVDP: VDPV asociado a inmunodeficiencia; aVDPV: VDPV ambiguo; PFA: parálisis flácida aguda. Adaptada de CDC. MMWR. Update on vaccine derived polioviruses. Julio 2011. 62 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas Tabla 2. Vacuna de la polio oral. Razón entre el número de casos de parálisis tipo polio asociados a la vacunación y el número de dosis de vacuna trivalente distribuidas. Estados Unidos, 1980-1995. Razón de PPAV según el número de dosis distribuidas Categoría del caso Vacunados Contactos Casos comunitarios Déficit inmunitario Total Total de dosis 1:6,1 1:7,7 1:45,3 1:9,9 1:2,4 Primera dosis 1:1,4 1:2,3 – 1:5,1 1:0,75 Dosis sucesivas 1:28,9 1:17,3 – 1:13,0 1:5,1 PPAV: parálisis por polio asociada a la vacuna. * Millones de dosis. Adaptada de CDC. MMWR 2000; 49 (RR 5). asociada a la vacunación; de los pocos casos documentados, la mayoría recibió una dosis de VPO como primera, o una segunda sin VPI previa. Desde el año 2000, el esquema vacunal norteamericano sólo incluye dosis de VPI, y en España desde 2004. Por la utilización y la difusión masiva de la vacunación con VPO en el mundo, progresivamente todos los casos de polio pronto estarán asociados al uso de la VPO, haciendo que la relación riesgo-beneficio para el uso continuo de la VPO vaya cambiando en cada país o región. Por todo ello, los esquemas de vacunación en los países con buen control y vigilancia de la poliomielitis van modificándose hacia el uso exclusivo de VPI. Vacuna triple vírica Se han descrito diferentes tipos de reacciones adversas graves a la vacuna triple vírica (TV, sarampión, rubéola, parotiditis), pero en general todas son extremadamente raras. Las reacciones adversas comunicadas se asocian en particular al virus del sarampión, y en menor medida al de la rubéola que porta la vacuna. La vacuna TV administrada a menores se asocia a un 5% a un 15 % de casos de fiebre alta y en menor medida a convulsiones febriles, pero está claro que ello no implica consecuencias a largo plazo, como nuevas convulsiones posteriores a otra vacunación, alteraciones en el desarrollo neurológico del niño o aumento del riesgo de desarrollar epilepsia. Un exantema transitorio puede presentarse hasta en un 5% de los vacunados. En una revisión realizada por Galazka et al., los informes de trastornos neurológicos en Estados Unidos, tanto de encefalitis como de encefalopatías, describen aproximadamente un caso por cada millón de vacunas 63 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad administradas. Sin embargo, esta tasa de incidencia de encefalitis o de encefalopatías tras la vacunación con la vacuna TV es muy inferior a la tasa de encefalitis de diagnóstico desconocido en la misma población (Tabla 3). Esto puede sugerir que ciertos casos no están producidos por la inmunización, aunque estén relacionados en el tiempo. Así, desde el primer caso comunicado en 1967, en el Vaccine Adverse Event Reporting System (VAERS) se encuentran abundantes ejemplos de encefalitis posteriores a la vacunación con TV, pero hasta la fecha no se ha hallado una definitiva evidencia para dicha asociación. La panencefalitis esclerosante subaguda es una rara afección que puede ocurrir varios años después de padecer el sarampión, aunque la recuperación haya sido aparentemente completa. En la actualidad se considera que la panencefalitis esclerosante subaguda no se produce nunca por el virus vacunal, y que la vacunación sistemática ha reducido su incidencia. Sin embargo, en Reino Unido se ha encontrado una asociación con encefalopatías agudas a los 7 a 14 días de la vacunación en comparación con un grupo control. El riesgo relativo para estos casos fue 2,5 veces mayor que la tasa de encefalitis esperada para la misma población. En estudios realizados en Finlandia a mediados de la década de 1980, con una cohorte de más de medio millón de niños vacunados, no se identificó ninguna asociación entre los casos de encefalitis, meningitis aséptica y autismo presentados por los vacunados al compararlos con la tasa esperada de casos para dicha población. Actualmente está bastante claro que hay una importante y convincente evidencia de la asociación causal entre la vacuna TV y el desarrollo de encefalitis por cuerpos de inclusión y neumonitis en individuos con demostrada inmunodeficiencia, tanto adultos como niños. Como es sabido, estas condiciones suponen una contraindicación de la vacuna. Tabla 3. Vacuna del sarampión. Tasas estimadas de reacciones adversas graves tras la vacuna contra el sarampión en comparación con las complicaciones estimadas de la enfermedad. Reacción adversa Encefalitis Panencefalitis esclerosante subaguda Neumonía Convulsiones Muerte Adaptada de Galazka AM et al. 64 Total vacunados/105 Tasa de enfermos/105 Razón enfermedad/vacuna 0,1 0,05-0,1 – 0,02-190 0,02-0,3 50-400 0,5-2,0 3800-7300 500-1000 10-10.000 >500 >10 – >25.000 >500 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas Tabla 4. Estudios sobre la incidencia de púrpura trombocitopénica idiopática asociada a la vacuna triple vírica. País Autor (año) Método Canadá Suecia Alemania Finlandia Reino Unido Koch et al. (1983) Bottiger et al. (1987) Fescharek et al. (1990) Nieminen et al. (1993) Farrington et al. (1995) Francia Dinamarca Reino Unido Jonville-Béra et al. (1996) Pedersen-Bjergaard et al. (1996) Miller et al. (2001) Reino Unido Países Nórdicos Japón Estados Unidos Black et al. (2003) Rajantie el al. (2007) Nakajama et al. (2007) France et al. (2008) Vigilancia pasiva Vigilancia activa Vigilancia pasiva Vigilancia activa Datos de niños hospitalizados con púrpura trombocitopénica idiopática Vigilancia pasiva Vigilancia pasiva Datos de niños hospitalizados con púrpura trombocitopénica idiopática Caso-control Estudio prospectivo Vigilancia pasiva Cohorte Incidencia × 105 1 2,7 0,2 3,33 3,44 0,95 0,88 3,1 4 3,33 0,087 2,5 Adaptada de Mantadakis E et al. Se considera que hay evidencia suficiente para aceptar el riesgo de desarrollar púrpura trombocitopénica idiopática tras la vacunación con TV, y que ésta se debe específicamente al componente de sarampión de la vacuna. Una revisión sistemática realizada por Mantadakis et al., con estudios de incidencia de casos durante los últimos 50 años, muestra que el riesgo de desarrollar púrpura trombocitopénica idiopática asociado a la vacunación con TV varía entre 0,087 y 4, con una media de 2,6 casos por 100.000 dosis administradas (Tabla 4). Las hemorragias son sumamente raras entre los casos de púrpura trombocitopénica idiopática, y un 93% de ellos evolucionan a una resolución completa al sexto mes de seguimiento. La vacunación con TV en sujetos no inmunizados que padecen púrpura trombocitopénica idiopática y en casos de revacunaciones en aquellos que previamente la desarrollaron no da lugar a una recurrencia de la trombocitopenia. En cuanto al componente de rubéola, está documentado que tras la vacunación hay una estrecha asociación con artralgias recurrentes o transitorias, principalmente en las mujeres adultas y en la infancia. Este riesgo puede ser hasta dos veces mayor en los vacunados que en los no vacunados. Actualmente no hay evidencia adecuada para aceptar ni rechazar la asociación con el riesgo de desarrollar artropatías crónicas tras la vacunación. 65 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad Vacuna frente al rotavirus La infección por rotavirus es la principal causa de diarrea grave y deshidratación en niños pequeños en todo el mundo. Se estima que produce más de 500.000 muertes al año, principalmente en los países de renta baja y media. La primera vacuna frente al rotavirus, RotaShield® (Wyeth Laboratories), era una vacuna atenuada tetravalente del rhesus (RRV-TV) de administración por vía oral que se autorizó en Estados Unidos en agosto de 1998. El Advisory Committee on Immunization Practices (ACIP), la American Academy of Pediatrics y la American Academy of Family Phisicians la recomendaron de manera sistemática para los lactantes sanos, pero entre agosto de 1998 y julio de 1999 se comunicaron al VAERS 15 casos de invaginación intestinal en niños que habían recibido la vacuna. Por ello, los Centers for Disease Control and Prevention (CDC) recomendaron a los padres y a los proveedores sanitarios posponer la vacunación frente al rotavirus hasta noviembre. Por otro lado, el fabricante dejó de distribuir la vacuna a mediados de julio de 1999. En los 27 ensayos clínicos precomercialización que se habían realizado con las distintas vacunas frente al rotavirus candidatas se observaron cinco casos de invaginación intestinal entre 10.054 niños vacunados (0,05%), incidencia comparable a la de la población general. De los 15 casos comunicados al VAERS, 13 (87%) se produjeron después de la primera dosis de vacuna y 12 (80%) desarrollaron los síntomas durante la primera semana tras recibir la vacuna (cualquier dosis). Los 15 casos fueron confirmados radiológicamente, y todos se recuperaron. La mediana de edad era de 3 meses (intervalo de 2 a 11 meses). A finales de octubre, y tras revisar la literatura científica, el ACIP concluyó que la frecuencia de invaginación intestinal se veía sustancialmente aumentada en las primeras 1 a 2 semanas después de la vacunación con RotaShield®, sobre todo tras la primera dosis, y retiró su recomendación de vacunar a los niños. Entre septiembre de 1998 y diciembre de 1999 se comunicaron al VAERS 121 casos de invaginación intestinal en niños que habían recibido la vacuna, la mayoría entre los meses de julio y agosto de 1999, justo después de que el ACIP publicara su recomendación de posponer la vacunación; todas la vacunas se habían administrado antes del 17 de julio (Fig. 2). En ese periodo se realizaron diversos estudios en Estados Unidos para investigar la posible asociación entre la vacuna RotaShield® y la invagi- 66 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas 50 Nº de casos 40 30 20 Diciembre Octubre Noviembre Septiembre Agosto Julio Junio Mayo Abril Marzo Febrero Enero Diciembre Noviembre Octubre 0 Septiembre 10 Fecha de comunicación (mes) Figura 2. Número de invaginaciones intestinales comunicadas después de la vacunación con RotaShield®. Estados Unidos, septiembre de 1998 a diciembre de 1999. nación intestinal. Murphy et al. llevaron a cabo un estudio de casos y controles y de caso-serie en el cual definieron como casos los niños entre 1 y 12 meses de edad hospitalizados por invaginación intestinal entre noviembre de 1998 y junio de 1999 en 19 estados. Se observó un aumento del riesgo de invaginación intestinal entre 3 y 14 días después de la administración de la primera dosis de vacuna RRV-TV, con una odds ratio (OR) de 21,7 en el análisis de casos y controles y un riesgo relativo (RR) de 29,4 en el análisis caso-serie. También se halló un aumento del riesgo de invaginación intestinal después de la segunda dosis de vacuna, pero menor. El riesgo atribuible de invaginación tras la vacunación fue de un caso por cada 4670 a 9474 vacunados. También se realizaron dos estudios ecológicos a partir de los datos de hospitalización. El primero, de Chang et al., se hizo en Nueva York, y el segundo, de Simonsen et al., en 10 estados de Estados Unidos, y en ninguno se observó un incremento de las hospitalizaciones por invaginación intestinal en el tiempo en que se comercializó la vacuna respecto a los periodos previos. Un estudio retrospectivo de cohortes realizado por Kramarz et al. halló un RR de sufrir invaginación intestinal de 30,4 en los 3 a 7 días después de la primera dosis de vacuna. El riesgo atribuible fue de un caso por cada 11.073 niños vacunados. Por último, Verstraeten et al. calcularon el RR de invaginación intestinal a partir de los datos del VAERS, teniendo en cuenta una exhaustividad estimada de este sistema de vigilancia del 47%, y obtu- 67 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad vieron un RR de padecer invaginación intestinal en los 3 a 7 días posteriores a la vacunación de 22,7. Finalmente, se concluyó que la evidencia científica indicaba claramente una relación causal entre la RRV-TV y la invaginación intestinal, con un riesgo de invaginación atribuible a la vacuna de un caso por cada 10.000 dosis administradas (intervalo de 1 por 5000 a 1 por 12.000). Posteriormente se han comercializado dos nuevas vacunas frente al rotavirus, RotaTeq® (Sanofi Pasteur MSD) y Rotarix® (GlaxoSmithKline). La primera es una vacuna recombinante pentavalente bovina-humana y la segunda es una vacuna atenuada humana monovalente. Tras la experiencia con la vacuna Rotashield®, en los dos ensayos clínicos que se realizaron antes de la comercialización de estas nuevas vacunas se monitorizó especialmente la aparición de invaginación intestinal y no se evidenció ningún aumento del riesgo de padecer este efecto adverso. En la actualidad estas vacunas se están introduciendo en los programas de vacunación de muchos países, y por ejemplo en México y Brasil el uso de Rotarix® se ha asociado a una gran reducción de la mortalidad por diarrea de cualquier causa. A pesar de ello, algunos estudios poscomercialización han detectado un aumento del riesgo de invaginación intestinal tras la administración de Rotarix® (en México y en Australia) y de RotaTeq® (en Australia), aunque mucho menor que con RotaShield® (OR de 4 a 6 durante la primera semana después de la primera dosis de vacuna). Por otro lado, un reciente estudio de riesgo-beneficio predijo que el uso de las vacunas actuales frente al rotavirus, sin restricciones de edad, prevendría 49.500 muertes más por rotavirus, mientras que podría causar 300 muertes más por invaginación intestinal, en comparación con la estrategia actual que restringe la vacunación a los niños de 6 a 32 semanas de edad. Con toda la información disponible, en febrero de 2012 el Global Advisory Committee on Vaccine Safety concluyó que las vacunas Rotarix® y RotaTeq® continúan mostrando un buen perfil de seguridad, y que los beneficios asociados a la vacunación superan con creces los riesgos, sobre todo en los países con una mortalidad por rotavirus moderada o alta. Vacuna frente a la fiebre amarilla La vacuna frente a la fiebre amarilla es una vacuna de virus atenuados que está disponible desde 1939, y de la cual se han distribuido más de 600 millones de dosis. Actualmente se conocen tres efectos adversos graves bien 68 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas caracterizados asociados a la vacuna: anafilaxia, enfermedad neurotrópica posvacunal y enfermedad viscerotrópica posvacunal. Hasta la década de 1990 se creía que la vacuna frente a la fiebre amarilla era una de las más seguras del mercado, pero en 1996 se comunicaron los primeros casos tanto de enfermedad viscerotrópica como neurotrópica asociadas a la vacunación. En el año 2001, los CDC intensificaron la vigilancia de estos efectos adversos y a partir de entonces se fueron identificando en Estados Unidos casos no publicados previamente y nuevos casos. Se sugirió una relación causal con la vacunación, basándose en la proximidad temporal, sin otra causa probable, y en evidencias serológicas y virológicas. La enfermedad neurotrópica posvacunal puede presentarse como diversos síndromes clínicos que incluyen meningoencefalitis, síndrome de Guillain-Barré, encefalomielitis diseminada aguda y parálisis bulbar. La meningoencefalitis se produce como resultado de la invasión del sistema nervioso central por el virus de la fiebre amarilla, y el resto de los síndromes neurológicos están causados por mecanismos autoinmunitarios. Recientemente también se ha descrito un caso de mielitis longitudinal. El diagnóstico de los casos de meningitis o encefalitis se hace por detección del virus vacunal en el líquido cefalorraquídeo (LCR). La presencia de IgM frente al virus de la fiebre amarilla y de anticuerpos neutralizantes específicos en el LCR también apoya el diagnóstico. Para las manifestaciones autoinmunitarias no hay una prueba específica, por lo que el diagnóstico sólo puede ser de sospecha o probable. El tratamiento depende del síndrome de presentación; en el caso de la meningoencefalitis es de soporte, y para las manifestaciones autoinmunitarias suele incluir inmunoglobulinas intravenosas, plasmaféresis o corticosteroides. La enfermedad neurotrópica posvacunal raramente es fatal, y en total se han descrito cinco casos mortales. Entre los años 1990 y 2006, el Yellow Fever Vaccine Safety Working Group de los CDC identificó y revisó, de manera retrospectiva y prospectiva, 29 casos de enfermedad neurotrópica posvacunal. Todos se dieron en personas que recibieron la vacuna por primera vez, y en un intervalo de 3 a 28 días después de la vacunación. La edad de los casos variaba entre 6 y 78 años. Uno de los casos, un hombre de 53 años con infección por el virus de la inmunodeficiencia humana y con <200 linfocitos T CD4/mm3, murió. Según datos del VAERS, la tasa de notificación de enfermedad neurotrópica posvacunal es de 0,4 a 0,8 casos por 100.000 dosis distribuidas. Esta tasa aumenta con la edad: 1,6 por 100.000 en personas de 60 a 69 años frente a 1,1 a 2,3 por 100.000 en mayores de 70 años. 69 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad La enfermedad viscerotrópica posvacunal imita una infección por fiebre amarilla adquirida de forma natural, debido a la proliferación y la diseminación del virus vacunal en los tejidos del huésped. Los pacientes que la sufren presentan fiebre y otros signos y síntomas inespecíficos (cefalea, malestar, mialgias, náuseas, vómitos, diarrea) en la primera semana tras la vacunación. A medida que la enfermedad progresa, pueden aparece ictericia y alteraciones analíticas (trombocitopenia y elevación de las transaminasas, de la bilirrubina y de la creatinina). En los casos graves se observan hipotensión, hemorragias e insuficiencia renal y respiratoria. Otras complicaciones menos frecuentes son la rabdomiólisis y la coagulación intravascular diseminada. Unos títulos altos de virus vacunal en suero en los primeros 7 días después de la vacuna, o la presencia de replicación del virus vacunal más allá de 7 días tras la vacunación, apoyarían el diagnóstico (caso probable), pero la confirmación sólo puede obtenerse mediante autopsia, en los casos mortales. El tratamiento es de soporte, pues no hay ninguno específico. Hasta febrero de 2010 se habían notificado a los CDC 57 casos de enfermedad viscerotrópica posvacunal ocurridos en diversos países (Australia, Bélgica, Brasil, China, Colombia, Ecuador, Francia, Alemania, Japón, Perú, España, Suiza, Reino Unido y Estados Unidos), todos tras la primera dosis de vacuna y entre 1 y 8 días después de recibirla. El 60% de los casos eran hombres. Igual que en la enfermedad neurotrópica posvacunal, el intervalo de edad es muy amplio, entre 3 y 81 años, pero la mediana difiere según el sexo (62 años en los hombres y 24 años en las mujeres). El 65% de los afectados murieron, y la letalidad fue más alta en las mujeres (90%) que en los hombres (50%). Hasta el momento se han identificado dos factores de riesgo específicos para la enfermedad viscerotrópica posvacunal: la edad avanzada y los antecedentes de enfermedad del timo o timectomía. También se cree que las enfermedades autoinmunitarias pueden ser un factor de riesgo, ya que al menos nueve de los pacientes con enfermedad viscerotrópica posvacunal sufrían alguna de este tipo, pero cuatro tenían más de 60 años de edad y dos de éstos tenían además antecedentes de timectomía. Según datos del VAERS, la tasa de notificación de enfermedad viscerotrópica posvacunal es de 0,3 a 0,4 casos por 100.000 dosis distribuidas. Al igual que con la enfermedad neurotrópica posvacunal, esta tasa aumenta con la edad: 1,0 a 1,1 por 100.000 en personas de 60 a 69 años de edad frente a 2,3 a 3,2 por 100.000 en las mayores de 70 años. Recientemente, Thomas et al. realizaron una revisión sistemática que tenía por objetivo comparar las tasas de incidencia de reacciones adversas 70 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas graves de la vacuna frente a la fiebre amarilla. Se revisaron 24 estudios que usaban sistemas de vigilancia activa (10 ensayos clínicos), 25 que usaban sistemas de vigilancia pasiva y 17 que usaban una combinación de ambos (15 eran datos de bases de farmacovigilancia). En el primer grupo de estudios se siguieron 2.660.929 sujetos tras la vacunación (el 97,7% son datos pertenecientes a un estudio de Brasil). Las tasas descritas se muestran en la Tabla 5. De los 15 estudios de farmacovigilancia revisados, 10 contribuyeron con datos a la revisión sistemática. Éstos incluían 107.621.154 sujetos (el 94% procedentes de estudios de Brasil). Los datos aportados por dichos estudios se muestran en la Tabla 6. Por último, los estudios con sistemas de vigilancia pasiva aportaron los datos mostrados en la Tabla 7. Vacuna frente a la gripe A/New Jersey/76 (Hsw1N1) A principios del año 1976 se detectaron los primeros casos de un brote de gripe porcina en Fort Dix, New Jersey, Estados Unidos. El virus causante, que fue aislado en los laboratorios de los CDC el 10 de febrero de 1976, se denominó A/New Jersey/76 (Hsw1N1) y era similar al causante de la pandemia de gripe de 1918. El 10 de marzo, el ACIP comunicó que se trataba de una nueva cepa de virus de la gripe transmisible entre personas, por lo que podía producirse una pandemia. La identificación precoz de la cepa causante del brote hizo posible producir una nueva vacuna frente al virus, ya que se disponía de margen entre la identificación del virus y el inicio de la posible pandemia, a diferencia Tabla 5. Tasas de incidencia de reacciones adversas graves asociadas a la vacuna de la fiebre amarilla. Datos de 24 estudios con sistemas de vigilancia activa. N.º de casos Tasa por 106 vacunados (IC95%) Enfermedad neurotrópica posvacunal 0 0-1,39 1 caso por 720.000 vacunados, como máximo Enfermedad viscerotrópica posvacunal 0 0-1,39 1 caso por 720.000 vacunados, como máximo Anafilaxia 1 0,009-2,1 1 caso por 480.000 a 105 millones de vacunados Urticaria 26 6,4-14,3 1 caso por 70.000 a 150.000 vacunados Efecto adverso Tasa de incidencia IC95%: intervalo de confianza del 95%. 71 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad Tabla 6. Tasas de incidencia de reacciones adversas graves asociadas a la vacuna de la fiebre amarilla. Datos de 10 estudios de farmacovigilancia. País Efecto adverso Tasa de incidencia Australia Enfermedad neurotrópica posvacunal Enfermedad viscerotrópica posvacunal 0 casos por 210.656 vacunados Enfermedad neurotrópica posvacunal Enfermedad viscerotrópica posvacunal Anafilaxia Urticaria 0,84 casos por 106 vacunados Brasil Estados Unidos (VAERS) 1 caso por 210.656 vacunados 1,19 casos por 106 vacunados 0,23 casos por 106 vacunados 9 casos por 106 vacunados Enfermedad neurotrópica posvacunal y enfermedad viscerotrópica posvacunal Efectos adversos graves 6,6 casos por 106 vacunados 11,1-15,6 casos por 106 vacunados Reino Unido Efectos adversos graves 34 casos por 106 vacunados Suiza “Eventos neurológicos” Efectos adversos graves no neurológicos 14,6 casos por 106 vacunados 40 casos por 106 vacunados Tabla 7. Tasas de incidencia de efectos adversos graves asociados a la vacuna de la fiebre amarilla. Datos de 11 estudios con sistemas de vigilancia pasiva. Tasa de efectos adversos graves Tipo de estudio N.º de sujetos N.º de casos Seis estudios de campañas en población general 94.500.528 (99% de Brasil) 48 0,51 casos por 106 vacunados 60.698 (96% de Reino Unido) 0 – Cinco estudios retrospectivos de lo que había ocurrido en ocasiones anteriores tras identificar un virus pandémico. Además, las vacunas antigripales ya se estaban usando desde hacía tiempo y habían demostrado su eficacia y seguridad. Tres días más tarde del comunicado del ACIP, los CDC recomendaron la inmunización masiva de la población de Estados Unidos y empezó a fabricarse la vacuna. A pesar de que 5 meses después del brote de Fort Dix no se habían dado casos en ningún otro lugar del mundo, se siguió adelante con el programa de inmunización y el día 1 de octubre de 1976 se administró la primera dosis de vacuna. En noviembre se detectó en Minnesotta un aumento de la incidencia de casos de síndrome de Guillain-Barré, que es un trastorno de probable 72 V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas origen autoinmunitario que provoca inflamación y desmielinización de los nervios periféricos y que se presenta en forma de debilidad muscular y parestesias bilaterales. Su incidencia basal es de 0,4 a 4 casos por 10.000 personas-año. Este síndrome se ha asociado a determinadas infecciones virales (entre ellas la gripe) y bacterianas, a intervenciones quirúrgicas y a algunas vacunas, pero en la mayoría de los casos la asociación es sólo temporal y no puede demostrarse causalidad. Tras la detección de los casos de síndrome de Guillain-Barré en Minnesotta se intensificó la vigilancia de esta enfermedad. El 16 de diciembre, basándose en los datos preliminares, los CDC recomendaron suspender la vacunación hasta terminar la investigación sobre la posible asociación de este síndrome con la vacuna de la gripe. De hecho, ese día terminó el programa de vacunación, pero en las 10 semanas que duró la campaña se vacunaron alrededor de 45 millones de personas. Mediante el sistema de vigilancia que se estableció se identificaron 1098 casos de síndrome de Guillain-Barré entre el 1 de octubre de 1976 y el 31 de enero de 1977, de los cuales 532 habían recibido la vacuna y 25 de ellos fueron mortales. Schonberger et al. estimaron un riesgo atribuible de un caso de síndrome de Guillain-Barré por cada 100.000 vacunados, y un RR entre 4,0 y 7,6 veces mayor en los vacunados respecto a los no vacunados, en las 6 a 8 semanas posteriores a la vacunación. Ésta es la asociación mejor caracterizada entre una vacuna y el síndrome de Guillain-Barré. Se han realizado numerosas investigaciones encaminadas a esclarecer el posible papel de las vacunas antigripales trivalentes estacionales, así como el de las infecciones naturales por virus gripales salvajes en la aparición del síndrome de Guillain-Barré. Aunque resulta muy difícil establecer asociaciones causales con una enfermedad infrecuente, que tiene una incidencia anual “natural” de 10 a 20 casos por millón de personas adultas, parece más plausible que la vacunación antigripal actúe más protegiendo que aumentando el riesgo de aparición del síndrome de Guillain-Barré. BIBLIOGRAF Í A –– Berkovic SF, Harkin L, McMahon JM, Pelekanos JT, Zuberi SM, Wirrell EC, et al. De-novo –– –– mutations of the sodium channel gene SCN1A in alleged vaccine encephalopathy: a retrospective study. Lancet Neurol. 2006;5:488-92. Bonanni P, Levi M, Latham NB, Bechini A, Tiscione E, Lai P, et al. An overview on the implementation of HPV vaccination in Europe. Hum Vaccin. 2011;7 (Suppl):128-35. Causality assessment of adverse events following immunization. WER. 2001;76:85-9. 73 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad –– Centers for Disease Control and Prevention. Rotavirus vaccine [Internet]. 2011. Disponible en: http://www.cdc.gov/vaccinesafety/Vaccines/RotaVSB.html. –– Centers for Disease Control and Prevention. Withdrawal of rotavirus vaccine recommen–– dation. MMWR [Internet]. 1999. (Consutado el 13-9-2012.) Disponible en: http://www. cdc.gov/mmwr/preview/mmwrhtml/mm4843a5.html. Centers for Disease Control and Prevention. Intussusception among recipients of rotavirus vaccine – United States, 1998-1999. MMWR. 1999;48:577-81. –– Chang H, Smith P, Ackelsberg J, Morse D, Glass R. Intussusception, rotavirus diarrhea, and rotavirus vaccine use among children in New York State. Pediatrics. 2001;108:54-60. –– Chen RT, DeStefano F, Pless R, Mootrey G, Kramarz P, Hibbs B. Challenges and controversies in immunization safety. Infect Dis Clin North Am. 2001;15:21-39, viii. –– Coop CA, Balanon SK, White KM, Whisman BA, Rathkopf MM. Anaphylaxis from the influenza virus vaccine. Int Arch Allergy Immunol. 2008;146:85-8. –– DiMiceli L, Pool V, Kelso JM, Shadomy SV, Iskander J, VAERS Team. Vaccination of yeast –– –– –– –– –– sensitive individuals: review of safety data in the US vaccine adverse event reporting system (VAERS). Vaccine. 2006;24:703-7. Dowdle WR. Pandemic influenza: confronting a re-emergent threat: the 1976 experience. J Infect Dis. 1997;176 (Suppl 1):69-72. Erlewyn-Lajeunesse M, Hunt LP, Heath PT, Finn A. Anaphylaxis as an adverse event fol­ lowing immunisation in the UK and Ireland. Arch Dis Child. 2012;97:487-90. Fescharek R, Quast U, Maass G, Merkle W, Schwarz S. Measles-mumps vaccination in the FRG: an empirical analysis after 14 years of use. II. Tolerability and analysis of spontaneously reported side effects. Vaccine. 1990;8:446-56. Galazka AM, Lauer BA, Henderson RH, Keja J. Indications and contraindications for vaccines used in the Expanded Programme on Immunization. Bull World Health Org. 1984;62:357-66. Greene SK, Kulldorff M, Lewis EM, Li R, Yin R, Weintraub ES, et al. Near real-time surveillance for influenza vaccine safety: proof-of-concept in the Vaccine Safety Datalink Project. Am J Epidemiol. 2010;171:177-88. –– Kew –– –– –– –– –– 74 OM, Wright PF, Agol VI, Delpeyroux F, Shimizu H, Nathanson N, et al. Circulating vaccine-derived polioviruses: current state of knowledge. Bull World Health Org. 2004;82:16-23. Khromava AY, Eidex RB, Weld LH, Kohl KS, Bradshaw RD, Chen RT, et al. Yellow fever vaccine: an updated assessment of advanced age as a risk factor for serious adverse events. Vaccine. 2005;23:3256-63. Kitchener S. Viscerotropic and neurotropic disease following vaccination with the 17D yellow fever vaccine, ARILVAX. Vaccine. 2004;22:2103-5. Kramarz P, France E, Destefano F, Black S, Shinefield H, Ward J, et al. Population-based study of rotavirus vaccination and intussusception. Pediatr Infect Dis J. 2001;20: 410‑6. Mäkelä A, Nuorti JP, Peltola H. Neurologic disorders after measles-mumps-rubella vaccination. Pediatrics. 2002;110:957-63. Mantadakis E, Farmaki E, Buchanan GR. Thrombocytopenic purpura after measlesmumps-rubella vaccination: a systematic review of the literature and guidance for management. J Pediatr. 2010;156:623-8. V.G. Sequera, M. Aldea, C. Velasco, A. Vilajeliu y J.M. Bayas –– Miller E, Andrews N, Stowe J, Grant A, Waight P, Taylor B. Risks of convulsion and aseptic –– –– meningitis following measles-mumps-rubella vaccination in the United Kingdom. Am J Epidemiol. 2007;165:704-9. Mitchell LA, Tingle AJ, Grace M, Middleton P, Chalmers AC. Rubella virus vaccine associated arthropathy in postpartum immunized women: influence of preimmunization serologic status on development of joint manifestations. J Rheumatol. 2000;27:418-23. Murphy T, Gargiullo P, Massoudi M, Nelson D, Jumaan A, Okoro C. Intussusception among infants given an oral rotavirus vaccine. N Engl J Med. 2001;344:564-72. –– Nakano –– –– –– –– –– –– –– T. Japanese vaccinations and practices, with particular attention to polio and pertussis. Travel Med Infect Dis. 2011;9:169-75. Nakayama T, Onoda K. Vaccine adverse events reported in post-marketing study of the Kitasato Institute from 1994 to 2004. Vaccine. 2007;25:570-6. Patel MK, Patel TK, Tripathi CB. Diphtheria, pertussis (whooping cough), and tetanus vaccine induced recurrent seizures and acute encephalopathy in a pediatric patient: possibly due to pertussis fraction. J Pharmacol Pharmacother. 2012;3:71-3. Patel M, Richardson V, Mattos M, Oliveira De L, Bautista A, Flannery B. Intussusception risk and health benefits of rotavirus vaccination in Mexico and Brazil. N Engl J Med. 2011;364:2283-92. Peng MM, Jick H. A population-based study of the incidence, cause, and severity of anaphylaxis in the United Kingdom. Arch Intern Med. 2004;164:317-9. Peter G, Myers MG. Intussusception, rotavirus, and oral vaccines: summary of a workshop. Pediatrics. 2002;110:e67. Pliaka V, Kyriakopoulou Z, Markoulatos P. Risks associated with the use of live-attenuated vaccine poliovirus strains and the strategies for control and eradication of paralytic poliomyelitis. Expert Rev Vaccines. 2012;11:609-28. Prevots DR, Burr RK, Sutter RW, Murphy TV; Advisory Committee on Immunization Practices. Poliomyelitis prevention in the United States. Updated recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep. 2000;49:122; quiz CE1-7. –– Ray P, Hayward J, Michelson D, Lewis E, Schwalbe J, Black S, et al; Vaccine Safety Da- –– –– –– –– talink Group. Encephalopathy after whole-cell pertussis or measles vaccination: lack of evidence for a causal association in a retrospective case-control study. Pediatr Infect Dis J. 2006;25:768-73. Rüggeberg JU, Gold MS, Bayas JM, Blum MD, Bonhoeffer J, Friedlander S, et al; Brighton Collaboration Anaphylaxis Working Group. Anaphylaxis: case definition and guide­lines for data collection, analysis, and presentation of immunization safety data. Vaccine. 2007;25:5675-84. Schonberger L, Bregman D, Sullivan-Bolyai J, Keenlyside R, Ziegler D, Retailliau H, et al. Guillain-Barré syndrome following vaccination in the National Influenza Immunization Program, United States, 1976-1977. Am J Epidemiol. 1979;110:105-23. Sencer DJ, Millar JD. Reflections on the 1976 swine flu vaccination program. Emerg Infect Dis. 2006;12:29-33. Simonsen L, Morens D, Elixhauser A, Gerber M, Van Raden M, Blackwelder W. Effect of rotavirus vaccination programme on trends in admission of infants to hospital for intussusception. Lancet. 2001; 358:1224-9. 75 Reacciones adversas graves a las vacunas. Evidencias científicas de causalidad –– Staples J, Gershman M, Fischer M. Yellow fever vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Rec and Rep. 2010;59:1-27. relation between acute persisting spinal paralysis and poliomyelitis vaccine (oral): results of a WHO enquiry. Bull World Health Org. 1976;53:319-31. Thomas RE, Lorenzetti DL, Spragins W, Jackson D, Williamson T. Active and passive surveillance of yellow fever vaccine 17D or 17DD-associated serious adverse events: systematic review. Vaccine. 2011;29:4544-55. –– The –– –– Tingle –– –– –– –– 76 AJ, Mitchell LA, Grace M, Middleton P, Mathias R, MacWilliam L. Randomised double-blind placebo-controlled study on adverse effects of rubella immunisation in seronegative women. Lancet. 1997;349:1277-81. Tro-Baumann B, von Spiczak S, Lotte J, Bast T, Haberlandt E, Sassen R, et al. A retrospective study of the relation between vaccination and occurrence of seizures in Dravet syndrome. Epilepsia. 2011;52:175-8. Verstraeten T, Baughman AL, Cadwell B, Zanardi L, Haber P, Chen RT. Enhancing vaccine safety surveillance: a capture-recapture analysis of intussusception after rotavirus vaccination. Am J Epidemiol. 2001;154:1006-12. World Health Organization. Global Advisory Committee on Vaccine Safety, December 2011. WER. 2012;87:53-60. Zhou W, Pool V, Iskander J. Surveillance for safety after immunization: Vaccine Adverse Event Reporting System (VAERS) – United States, 1991-2001. MMWR Surv Summ. 2003;52:1-24. M. Garcés-Sánchez Seguridad vacunal. Reacciones adversas graves y no evidencia de causalidad: la presunción de inocencia LAS VACU NA S C O M O F ÁR M ACO S : ¿CÓMO ABORDAR LOS EVENTOS ADVERSOS? Las vacunas constituyen un apartado especial dentro de los fármacos: a diferencia de los demás, se administran a personas sanas para evitar enfermedades y por ello es necesario que no causen, como mínimo, más daños de los que podría ocasionar la propia enfermedad; es decir, el beneficio obtenido debe ser mayor que el riesgo de presentar una reacción adversa asociada a su administración. Por tanto, deben ser lo más seguras posible. Todo programa de inmunización tiene como objetivo alcanzar la tasa más alta de protección frente a la enfermedad inmunoprevenible con el mínimo riesgo de reacciones adversas. Sólo mediante la vigilancia permanente de estos eventos es posible conocer si hay o no causalidad entre la vacuna y un episodio adverso acontecido. Las reacciones adversas son tan antiguas como los primeros remedios utilizados para el tratamiento de las enfermedades. Todo producto con actividad farmacológica puede actuar como tratamiento, pero también como veneno. Ningún producto biológico o farmacéutico desarrollado hasta ahora es seguro y eficaz al cien por cien. Se considera evento adverso cualquier incidente médico asociado a la administración de una sustancia medicamentosa o fármaco (p. ej., una 77 Seguridad vacunal. Reacciones adversas graves y no evidencia de causalidad vacuna) de manera temporal, sin que necesariamente exista una relación causal entre ambos. Una reacción adversa medicamentosa es cualquier efecto nocivo, no deseado y no intencional de un fármaco, que se presenta cuando éste se utiliza a las dosis habituales en los seres humanos para profilaxis, diagnóstico, tratamiento de una enfermedad o modificación de una función fisiológica. En este caso, y a diferencia del evento adverso, hay una posibilidad razonable de una relación causal entre el fármaco y la experiencia adversa. Las vacunas, como sustancia medicamentosa de indicación preventiva o terapéutica, están incluidas como causa de ambos conceptos. Los eventos adversos incluyen tanto las reacciones adversas como los efectos adversos derivados de los errores de administración, efectos nocivos, intoxicación accidental o intencionada, o no cumplimiento del tratamiento farmacológico. Por tanto, las reacciones adversas tras la vacunación pueden considerarse un tipo de evento adverso en el cual se sospecha una relación causal entre la administración de una vacuna y el efecto observado. A pesar de estas definiciones y a efectos prácticos, utilizaremos «reacción adversa» para hacer referencia a la clasificación global de éstas en el contexto de las vacunas, sin establecer diferencias semánticas entre «evento» y «reacción». Según la Organización Mundial de la Salud (OMS), las reacciones adversas siguientes a la vacunación pueden clasificarse, en función de su causa, en: •• Reacciones inducidas por la vacunación (incluyendo reacciones alérgicas). •• Reacciones debidas a errores de programa: en el almacenamiento, la manipulación o la administración. •• Reacciones coincidentes. •• Reacciones idiosincrásicas o de causa desconocida. En este capítulo vamos a referirnos a las reacciones incluidas en el tercer apartado: reacciones adversas en las que no hay evidencia de causalidad. REAC C IO NES ADV ER S A S G RAVE S Y N O EV I DENC I A DE CAUS A L I DA D : P RES U NC I Ó N DE I NO CE N CI A La manera más clara y razonable de determinar si un evento adverso se relaciona causalmente con la vacunación es comparando las tasas del even78 M. Garcés-Sánchez to en un país con población no vacunada frente a la tasa de un grupo vacunado en un ensayo clínico aleatorizado. Sin embargo, los ensayos clínicos previos a la comercialización nunca son lo bastante grandes (tamaño muestral) para abarcar todos los acontecimientos adversos de muy baja frecuencia. Por tanto, son necesarios otros sistemas, como los de vigilancia poscomercialización, para identificar posibles eventos relacionados que pueden no haberse presentado en los estudios previos. Por otro lado, debe disponerse de herramientas que, una vez detectado el evento adverso, nos permitan estimar el grado de causalidad del producto biológico, es decir, la vacuna. Por ello, el Global Advisory Committee on Vaccine Safety (GACVS) propone unas condiciones necesarias para que un evento adverso pueda ser atribuido a la vacunación (OMS). Cuando se evalúa un evento adverso deben tenerse en cuenta las siguientes cinco premisas para poder establecer el mayor grado de evidencia en la relación con el producto vacunal: •• Consistencia de los resultados (coherencia): la asociación entre un posible evento adverso y la administración de una vacuna debe ser constante, es decir, que los resultados deben ser reproducibles en distintos lugares y por distintos investigadores. Diferentes métodos de investigación conducen a las mismas conclusiones. •• Fuerza de la asociación: la asociación debe ser fuerte en magnitud (en el sentido epidemiológico), del mismo modo que la relación dosis-respuesta de la vacuna con los efectos adversos. •• Especificidad: la asociación debe tener un carácter diferencial. El evento adverso debe estar vinculado de forma única o específica a la vacuna en cuestión, y no presentarse con frecuencia en combinación con otros estímulos o condiciones externas. •• Relación temporal: debe haber una clara relación temporal entre la administración de la vacuna y el acontecimiento adverso, en el cual la recepción de la vacuna debe preceder a las primeras manifestaciones del evento o a la clara exacerbación de una condición preexistente. Por ejemplo, una reacción anafiláctica segundos o minutos después de la inmunización sería fuertemente indicativa de causalidad, y tras una semana sería una prueba menos clara de relación causal. •• Plausibilidad biológica: la asociación debe ser coherente, es decir, biológicamente plausible y explicable de acuerdo con los hechos conocidos en la evolución natural y biológica de la enfermedad. 79 Seguridad vacunal. Reacciones adversas graves y no evidencia de causalidad Otras organizaciones, como el Institute of Medicine (IOM), organismo independiente que representa el ámbito sanitario en la National Academy of Sciences de Estados Unidos, realizan también estudios y elaboran consensos con el fin de proporcionar el mayor grado de evidencia con los datos de los estudios actualmente disponibles. El comité de salud pública de esta organización publicó en agosto de 2011 un extenso documento en el cual se evalúa la evidencia actual de causalidad entre las vacunas y determinadas enfermedades. Utilizando los datos epidemiológicos y los datos respecto a mecanismos de acción, disponibles en la amplia literatura científica publicada, el comité estableció 158 conclusiones de causalidad y asignó cada relación entre una vacuna y un evento adverso a una de cuatro categorías de causalidad: 1) Pruebas concluyentes que apoyan una relación causal. 2) Pruebas que favorecen la aceptación de una relación causal. 3) Pruebas que favorecen el rechazo de una relación causal. 4) Pruebas inconsistentes para aceptar o rechazar una relación causal. El documento completo está disponible en http://www.iom.edu/ ­Reports/2011/Adverse-Effects-of-Vaccines-Evidence-and-Causality.aspx. Este comité encuentra pruebas concluyentes que apoyan una relación causal entre algunas vacunas y ciertos acontecimientos adversos, como la asociación entre la anafilaxia y la vacuna triple vírica (TV) y las vacunas frente a la varicela, la gripe, la hepatitis B y el meningococo C, y las vacunas que contienen toxoide tetánico. Además, encuentra suficiente evidencia para rechazar la relación de cinco acontecimientos adversos descritos relacionados con vacunas (p. ej., la vacuna TV y el autismo, y la vacuna de la gripe inactivada y los episodios de asma). En resumen, el comité dice que hay suficiente evidencia, con los datos publicados hasta la actualidad, para concluir que pocos problemas de salud tienen una relación de efecto-causa con las vacunas. Como decíamos antes, las enfermedades habitualmente consideradas como eventos adversos relacionados con las vacunas suelen cumplir una serie de características especiales, entre las cuales la primera es su escasa frecuencia. Otra característica frecuente de estas enfermedades es que se les atribuye estar causadas por un producto biológico basándose en evidencias limitadas (estudios con metodología inadecuada, informes de casos aislados…). 80 M. Garcés-Sánchez Si evaluamos estas enfermedades teniendo en cuenta las cinco premisas citadas elaboradas por el GACVS, podemos observar que: •• Con frecuencia suelen ser enfermedades que: –– Tienen causas desconocidas o no claramente identificadas. –– Ocurren con frecuencia en los mismos intervalos de edad de los vacunados. –– Se observan poco después de la vacunación. –– Son objeto de una gran atención por los medios. •• Sin embargo, no hay evidencia científica a favor de la alegación: –– No se ha demostrado un mecanismo biológico que pueda explicar una vinculación causal. –– Los estudios epidemiológicos no han hallado una relación causal. –– No aumenta la frecuencia de la enfermedad después de la vacunación en comparación con su frecuencia natural. Ejemplos de enfermedades consideradas evento adverso no relacionado con la vacunación: ausencia de indicios de causalidad Autismo y vacunación Desde hace algunos años, se ha especulado sobre que el autismo podría estar vinculado a las vacunas recibidas en la infancia. Asimismo, también se le ha querido atribuir una relación con un conservante antiguamente utilizado en la vacunas, el timerosal. Varios estudios han evaluado el uso de vacunas y los cambios en la frecuencia del autismo, y los datos obtenidos no apoyan la asociación entre timerosal y autismo. Además, el IOM, en su documento de seguridad y vacunas, concluyó que hay «pruebas que favorecen el rechazo de una relación causal» entre el timerosal y el autismo, así como entre la vacuna triple vírica y el autismo. Vacuna frente a la difteria, el tétanos y la tos ferina (DTP), y síndrome de muerte súbita del lactante Un mito que parece que no termina de desaparecer es el de que la vacuna DTP puede ocasionar el síndrome de muerte súbita del lactante. Un análisis superficial de este dato podría sugerir la existencia de una relación causal; sin embargo, tal razonamiento es erróneo. Siguiendo una deducción similar, podría afirmarse que la ingestión de agua ocasiona accidentes de 81 Seguridad vacunal. Reacciones adversas graves y no evidencia de causalidad tráfico, dado que probablemente podría comprobarse que la mayoría de los conductores que sufren accidentes han consumido agua en las 24 horas previas. Varios estudios bien controlados realizados durante la década de 1980 determinaron, casi de forma unánime, que el número de muertes por síndrome de muerte súbita del lactante asociados en el tiempo con la administración de la vacuna DTP estaba en el margen que cabría esperar por efecto del azar. En otras palabras, los casos muerte súbita del lactante se habrían producido igualmente aunque no se hubieran administrado las vacunas. De hecho, en varios de los estudios se registró una menor frecuencia de muertes entre los niños que habían recibido poco antes la vacuna. Entre 1992 y 1998, tras diferentes estudios que evaluaban múltiples variables relacionadas con este síndrome, se publicó la recomendación que modificaba la postura para dormir de todos los neonatos y lactantes, aconsejando que lo hicieran «boca arriba». La proporción de lactantes con postura «boca abajo» disminuyó de aproximadamente el 70% a más o menos el 17%. Entre los mismos años, la cifra de incidencia de síndrome de muerte súbita del lactante disminuyó un 40%, de 1,2 a 0,72 por 1000 nacidos vivos. El IOM concluye en su documento de seguridad que «todos los estudios controlados que han estudiado niños vacunados y no vacunados han determinado la inexistencia de una asociación (…) o bien una disminución del riesgo (…) de síndrome de muerte súbita del lactante en los niños vacunados» y que «las pruebas no indican la existencia de una relación causal entre la vacuna DTP y las combinaciones específicas de vacunas y síndrome de muerte súbita del lactante». Vacunación frente a la hepatitis B y esclerosis múltiple Numerosos estudios han evaluado la posible relación entre la vacuna frente a la hepatitis B y la esclerosis múltiple. La evidencia científica actual no apoya la relación de causalidad entre la vacuna de la hepatitis B y el diagnóstico o el empeoramiento clínico de la esclerosis múltiple. La esclerosis múltiple es una enfermedad de causa desconocida, progresiva y por lo general fluctuante, con exacerbaciones y remisiones durante muchas décadas. Es tres veces más frecuente en las mujeres que en los hombres, y por lo general se diagnostica en personas adultas jóvenes. Los estudios publicados no apoyan una relación causal entre la vacuna frente a la hepatitis B y la esclerosis múltiple u otras enfermedades desmielinizantes. Los estudios se han realizado en las diferentes fases de evaluación de la vacuna: 82 M. Garcés-Sánchez •• Ensayos clínicos controlados precomercialización, en los que no se documentó tal efecto. •• Estudios poscomercialización: cientos de millones de personas por todo el mundo han recibido la vacuna frente la hepatitis B sin desarrollar esclerosis múltiple ni cualquier otra enfermedad autoinmunitaria. Ejemplos de algunos de estos estudios son: –– Un estudio realizado en Francia entre 1994 y 2003 (Mikaeloff, 2007) no encontró una relación entre la vacunación frente a la hepatitis B y el desarrollo de esclerosis múltiple de inicio en la infancia. Incluyó 143 casos, entre ellos niños que presentaron esclerosis múltiple antes de los 16 años de edad, y de la población general se incluyeron 1122 sujetos controles seleccionados al azar. La tasa de un primer episodio de esclerosis múltiple no fue superior en los sujetos que habían recibido la vacuna frente a la hepatitis B. –– Un estudio europeo para evaluar la relación de las recaídas de esclerosis múltiple con la vacunación frente a la hepatitis B, el tétanos o la gripe (Confavreux, 2001) incluyó 643 individuos con esclerosis múltiple. Los resultados permiten concluir que no había ninguna evidencia de asociación entre la vacunación con estos productos y las recaídas de la enfermedad. –– Sadovnick y Scheifele (2000) estudiaron la esclerosis múltiple en 578.308 adolescentes en Columbia Británica (Canadá), antes y después de los programas de vacunación frente a la hepatitis B, y no encontraron ninguna evidencia de asociación entre esta vacuna y la esclerosis múltiple u otra enfermedad desmielinizante. C ON C LU SI O NE S •• Las vacunas son uno de los medicamentos más seguros, pero no están exentas de efectos adversos. •• La desaparición de las enfermedades por la eficacia vacunal puede desplazar la atención de la población hacia a los acontecimientos adversos. •• La coincidencia temporal de los acontecimientos adversos puede interpretarse erróneamente como causalidad. •• Son fundamentales las herramientas que permitan una cuidadosa vigilancia y unos adecuados control y evaluación de la seguridad de las vacunas. 83 Seguridad vacunal. Reacciones adversas graves y no evidencia de causalidad •• En última instancia, los profesionales sanitarios somos responsables de asegurar una adecuada información a la población. •• Los miedos injustificados pueden hacer que las personas no se protejan frente a enfermedades graves, con el consiguiente riesgo de reemergencia de algunas. BIBL I O G RA F ÍA –– Ascherio A, Zhang SM, Hernán MA, Olek MJ, Coplan PM, Brodovicz K, et al. Hepatitis B vaccination and the risk of multiple sclerosis. N Engl J Med. 2001;344:327-32. –– Confavreux C, Suissa S, Saddier P, Bourdès V, Vukusic S; Vaccines in Multiple Sclerosis –– –– –– –– –– –– Study Group. Vaccinations and the risk of relapse in multiple sclerosis. N Engl J Med. 2001;344:319-26. DeStefano F, Bhasin TK, Thompson WW, Yeargin-Allsopp M, Boyle C. Age at first measlesmumps-rubella vaccination in children with autism and school-matched control subjects: a population-based study in metropolitan Atlanta. Pediatrics. 2004;113:259-66. DeStefano F, Weintraub ES, Chen RT. Hepatitis B vaccine and risk of multiple sclerosis [letter]. Pharmacoepidemiol Drug Saf. 2007;16:705-7. Fourrier A, Touze E, Alperovitch A, Begaud B. Association between hepatitis B vaccine and multiple sclerosis: a case-control study. Pharmacoepidemiol Drug Saf. 1999;8:S140-1. Herrolen L, DeKeyser J, Ebinger G. Central nervous system demyelination after immunisation with recombinant hepatitis B vaccine. Lancet. 1991;338:1174-5. Hornig M, Briese T, Buie T, Bauman ML, Lauwers G, Siemetzki U, et al. Lack of association between measles virus vaccine and autism with enteropathy: a case-control study. PLoS ONE. 2008;3:e3140. Institute of Medicine. Immunization safety review: vaccinations and sudden unexpected death in infancy (March 2003). Disponible en: http://www.iom.edu/Reports/2003/ Immunization-Safety-Review-Vaccinations-and-Sudden-Unexpected-Death-in-Infancy. aspx. –– IOM –– –– –– –– 84 (Institute of Medicine). 2012. Adverse effects of vaccines: evidence and causality. Washington, DC: The National Academic Press. Disponible en: http://www.iom.edu/ ­Reports/2011/Adverse-Effects-of-Vaccines-Evidence-and-Causality.aspx. Jonville-Béra AP, Autret-Leca E, Barbeillon F, Paris-Llado J; French Reference Centers for SIDS. Sudden unexpected death in infants under three months of age and vaccination status: a case-control study. Br J Clin Pharmacol. 2001;51:271-6. Lewis E, Shinefield HR, Woodruff BA, Black SB, DeStefano F, Chen RT, et al. Safety of neonatal hepatitis B vaccine administration. Pediatr Infect Dis J. 2001;20:1049-54. Mandell DS, Thompson WW, Weintraub ES, Destefano F, Blank MB. Trends in diagnosis rates for autism and ADHD at hospital discharge in the context of other psychiatric diagnoses. Psychiatr Serv. 2005;56:56-62. McMahon AW, Iskander JK, Haber P, Braun MM, Ball R. Inactivated influenza vaccine (IIV) in children <2 years of age: examination of selected adverse events reported to the Vaccine Adverse Event Reporting System (VAERS) after thimerosal-free or thimerosal-containing vaccine. Vaccine. 2008;26:427-9. M. Garcés-Sánchez –– Mikaeloff Y, Caridade G, Rossier M, Suissa S, Tardieu M. Hepatitis B vaccination and the risk of childhood-onset multiple sclerosis. Arch Pediatr Adolesc Med. 2007;161:1214-5. –– Niu MT, Rhodes P, Salive M, Davis DM, Black S, Shinefield H, et al. Comparative safe- –– ty of two recombinant hepatitis B vaccines in children: data from the Vaccine Adverse Event Reporting System (VAERS) and Vaccine Safety Datalink (VSD). J Clin Epidemiol. 1998;51:503-10. Niu MT, Salive ME, Ellenberg SS. Neonatal deaths after hepatitis B vaccine. Arch Pediatr Adolesc Med. 1999;153:1279-82. –– Price CS, Thompson WW, Goodson B, Weintraub ES, Croen LA, Hinrichsen VL, et al. Pre–– –– –– –– –– –– –– natal and infant exposure to thimerosal from vaccines and immunoglobins and risk of autism. Pediatrics. 2010;126:656-64. Quast U, Herder C, Zwisler O. Vaccination of patients with encephalomyelitis disseminata. Vaccine. 1991;9:228-30. Sadovnik AD, Scheifele DW. School-based hepatitis B vaccination programme and adolescent multiple sclerosis. Lancet. 2000;355:549-50. Silvers LE, Ellenberg SS, Wise RP, Varricchio FE, Mootrey GT, Salive ME. The epidemiology of fatalities reported to the Vaccine Adverse Event Reporting System 1990-1997. Pharmacoepidemiol Drug Saf. 2001;10:279-85. Silvers LE, Varricchio FE, Ellenberg SS, Krueger CL, Wise RP, Salive ME. Pediatric deaths reported after vaccination: the utility of information obtained from parents. Am J Prevent Med. 2002;22:170-6. Sturkenboom MCJM, Abenhaim L, Wolfson C, Roulet E, Heinzelf O, Gout O. Vaccinations, demyelination, and multiple sclerosis study (VDAMS). Pharmacoepidemiol Drug Saf. 1999;8:S170-1. Touzé E, Gout O, Verdier-Taillefer MH, Lyon-Caen O, Alpérovitch A. Premier episode de demyelinisation du systeme nerveux central et vaccination contre l’hepatite B. Rev Neurol (Paris). 2000;156:242-6. Vennemann MM, Butterfass-Bahloul T, Jorch G, Brinkmann B, Findeisen M, Sauerland C, et al. Sudden infant death syndrome: no increased risk after immunisation. Vaccine. 2007;25:336-40. –– Verstraeten T, DeStefano F, Jackson L, Benson P, Okoro C, Black S, et al. Risk of demyeli–– –– nating disease after hepatitis B vaccination – West Coast, United States, 1995-1999. 50th Annual Epidemic Intelligence Service Conference; Atlanta, GA, 2001. Yu O, Bohlke K, Hanson CA, Delaney K, Rees TG, Zavitkovsky A, et al. Hepatitis B vaccine and risk of autoimmune thyroid disease: a Vaccine Safety Datalink study. Pharmacoepidemiol Drug Saf. 2007;16:736-45. Zipp F, Weil JG, Einhaupl KM. No increase in demyelinating diseases after hepatitis B vaccination. Nat Med. 1999;5:964-5. 85 Las vacunas, un valor cuestionado J. Marès Bermúdez Doctor, no queremos vacunar a nuestro hijo IN TRODU C C I Ó N La vacunación es la estrategia preventiva más beneficiosa en salud pública y es la intervención más coste-efectiva desde las perspectivas individual, social y sanitaria. Las vacunas y los programas de vacunación son bien aceptados en general por el personal sanitario y por la población, pero también, y ya desde sus orígenes, las vacunas han suscitado rechazo y oposición. La proliferación, por razones muy diversas, de grupos opositores a la vacunación, pero igualmente la mayor participación de las personas y sus familiares en la toma de decisiones respecto a aspectos vinculados a su salud, hacen que con mayor frecuencia los padres nos planteen propuestas reticentes a la vacunación de sus hijos, rechazando alguna de las vacunas, solicitando retrasar otras y más excepcionalmente en nuestro medio un rechazo total. Los ahora abuelos recuerdan la gravedad de enfermedades que ya no vemos: poliomielitis, difteria, sarampión… No lo pensaron dos veces para vacunarnos a nosotros (ahora padres), que somos los que nos cuestionamos las vacunas de nuestros hijos. Muchas de las personas que hoy rechazan la vacunación ignoran la gravedad de las enfermedades que se han reducido drásticamente gracias a las vacunas, y desconocen que dejar de vacunar está comportando una reemergencia de todas ellas. En Europa se produjeron en 2011 más de 30.000 casos de sarampión, de ellos más de 1900 en España, con un total de ocho muertes y 27 casos 89 Doctor, no queremos vacunar a nuestro hijo de encefalitis, una grave complicación de la enfermedad. Desafortunadamente, el 95% de estos casos eran personas que no habían recibido la vacunación completa frente a la enfermedad. La vacunación ofrece protección a la persona que se vacuna, pero además es un acto solidario, ya que si todos nos vacunamos aumenta la protección para toda la comunidad, incluso para aquellas personas que por alguna razón de edad o enfermedad no pueden vacunarse. Ningún otro acto médico, ni ningún tratamiento farmacológico, tiene las garantías de seguridad que poseen las vacunas incluidas en nuestro calendario de vacunación. Si somos capaces de transmitir estos conceptos a la población, será obvio que la vacunación no es sólo deseable sino esencial como parte de la salud del niño y del adulto. RECHA ZO A L A VAC U N ACI Ó N Aunque el rechazo a la vacunación es un tema realmente preocupante, en especial en sociedades desarrolladas tanto en Estados Unidos como en Europa, en nuestro país la mayoría de la población acepta y confía en las vacunas. España es uno de los países de Europa con mejores coberturas de vacunación, y esta situación es fruto de una suma de factores esenciales: la financiación pública por el Sistema Nacional de Salud del calendario de vacunaciones sistemáticas, la implicación del personal sanitario en su aplicación y la convicción de su beneficio por parte de la población. No obstante, también en nuestro país es cada vez más frecuente la presencia de bolsas de población no vacunada o con vacunaciones incompletas por razones diversas: movimientos opositores a la vacunación, familias con estilos de vida naturistas, personas que rechazan las vacunas por temor a reacciones adversas, grupos con determinadas creencias religiosas, etnias que culturalmente no acuden con regularidad al sistema sanitario para actividades preventivas, población inmigrante o grupos en situaciones socioeconómicas desfavorables o marginales. En Estados Unidos, el rechazo de las vacunas como movimiento social está en aumento; precisamente en el país donde el desarrollo de vacunas ha sido más activo también lo es el movimiento opositor. Varios autores han llamado la atención sobre el incremento sustancial del rechazo a la vacunación, con la consiguiente aparición de bolsas de pacientes susceptibles y brotes de enfermedades infecciosas que podrían haberse evitado (1-3). En una encuesta realizada a pediatras, un 54% manifestó haber tenido algún 90 J. Marès Bermúdez episodio de rechazo a todas las vacunas en el último año y un 85% alguno de rechazo parcial. Un 39% de los pediatras indicaron que no deseaban seguir prestando sus servicios a familias que rechazan todas las vacunas (4). El perfil de las familias que se oponen a la vacunación corresponde a población con formación académica superior a la media, viven en barrios de un nivel socioeconómico más alto y más frecuentemente son de raza blanca (3). El motivo principal del rechazo es el temor a las reacciones adversas de las vacunas, asociado a unas bajas percepción y preocupación por el riesgo de padecer enfermedades infecciosas que son prevenibles mediante las vacunas (1). En Europa no hay datos globales sobre el rechazo a la vacunación. Recientemente, un grupo de pediatras de atención primaria de la European Academy of Paediatrics Research in Ambulatory Setting Network realizó una encuesta sobre la percepción de este problema entre pediatras de atención primaria que trabajan en diversos países europeos (5). Un dato llamativo que aporta este estudio es que el rechazo total a todas las vacunas del calendario es considerado un hecho infrecuente que afecta, en la mayoría de los casos, a menos del 1% de los pacientes a cargo de un pediatra. En cambio, el rechazo a algunas vacunas o la solicitud de aplicar calendarios de vacunación parciales o alternativos es un fenómeno mucho más frecuente, que manifiestan entre el 1% y el 5% de las familias. A juicio de los pediatras encuestados, las vacunas con mayor porcentaje de rechazo son la triple vírica (TV) (60%) y la de la hepatitis B (40%). Las razones principales por las que las familias manifiestan su rechazo son: •• Temor a los efectos adversos de las vacunas. •• Temor a que tantas vacunas sobrecarguen el sistema inmunitario del bebé. •• Creencia en las medicinas alternativas denominadas «naturales». •• Considerar que es mejor sufrir la enfermedad que prevenirla con vacunas. •• Temor a que las vacunas provoquen autismo. •• Creencia de que actualmente no hay riesgo de caer enfermo por las enfermedades que las vacunas previenen. Los datos de este estudio sugieren que el rechazo total a la vacunación no parece ser actualmente significativo en Europa, aunque sí son más frecuentes y pueden constituir un problema sociosanitario importante el 91 Doctor, no queremos vacunar a nuestro hijo rechazo parcial y la solicitud de pautas de vacunación alternativas al calendario establecido. En España no disponemos de datos globales ni concretos sobre el grado y la extensión del fenómeno de rechazo a la vacunación. MOV IM I E NTO S A NTI VACUN A S Y AR G U M ENTO S ES G R I M I D O S Las vacunas, y en concreto los programas de vacunación, son una de las estrategias preventivas más beneficiosas para la salud del individuo que se vacuna, pero también para toda la comunidad. Sin embargo, ninguna vacuna es totalmente segura ni totalmente efectiva. En todas las regiones del mundo, tanto en los países en desarrollo como en los más desarrollados, las vacunas reducen la morbilidad y la mortalidad de las enfermedades infecciosas que previenen. Además de la erradicación de la viruela gracias a la introducción de la vacuna frente a ella, o de la reducción global de la mortalidad por sarampión en el mundo, que supera ampliamente los objetivos fijados tras la introducción de la vacuna, se ha constatado un récord de bajas tasas de enfermedades prevenibles con vacunas en los países desarrollados como consecuencia de la introducción de los programas de vacunación sistemática. No obstante, los problemas reales o percibidos en relación a la seguridad de las vacunas pueden ejercer un impacto adverso sobre los programas de vacunación. De hecho, las vacunas son o pueden ser víctimas de su propio éxito. El máximo beneficio de la vacunación se obtiene cuando se consiguen amplias coberturas, lo cual además permite con muchas vacunas la adquisición de inmunidad de grupo, con un gran impacto en la reducción de las enfermedades prevenibles en la población. Precisamente cuando el beneficio es alto y las coberturas de vacunación máximas hay más probabilidades de aparición de efectos adversos relacionados con la administración de las vacunas que cuestionan su seguridad, con un gran impacto en la población y en los medios de comunicación. Si además se da la situación de que los pacientes, los padres, la población general e incluso parte del personal sanitario carecen ya de experiencia directa con muchas de las enfermedades prevenibles con vacunas, es fácil entender las razones de esta contradictoria situación. A lo largo de la historia de la vacunación se han observado en distintos países (Japón, Reino Unido…) fenómenos de pérdida de confianza en las vacunas relacionados con informaciones que cuestionaban la seguridad de 92 J. Marès Bermúdez algunas de ellas (tos ferina, sarampión…), y que llevaron a una disminución de las coberturas de vacunación. Esta situación dio lugar a la aparición de brotes de enfermedades evitables con las vacunas, con morbilidad y en ocasiones con una significativa mortalidad. Tras esta experiencia se recobró de nuevo la confianza en la vacunación y afortunadamente se restauraron las coberturas. El tiempo necesario para devolver a la población la confianza en una determinada vacuna es muy largo, y en ocasiones transcurren muchos años hasta alcanzar los niveles de cobertura previos (6). Los argumentos en contra de las vacunas han acompañado a la historia de la vacunología desde que Jenner presentó en 1796, en la Royal Society of London, sus trabajos sobre la inoculación del contenido de pústulas de viruela vacuna que ofrecía protección frente a la viruela humana. Por el origen de su descubrimiento se le denomina «vacuna» (vaccine) y con ella empieza la estrategia preventiva que se conocerá como «vacunación». En 1800 se inició la vacunación voluntaria frente a la viruela, y en 1853 se instauró la vacunación obligatoria en Reino Unido. Las creencias religiosas y el papel del estado como impulsor de la obligatoriedad de la vacunación fueron, desde el inicio de la vacunación, y continúan siendo, la base de muchos de los argumentos en contra de las vacunas y la vacunación. Desde mediados del siglo xix hay movimientos organizados en contra de la vacunación. Una masiva manifestación en Leicester (1885), en la cual participaron más de 100.000 personas, forzó una revisión de las multas que se imponían a las personas que rechazaban la vacunación de la viruela. Los principales movimientos contrarios a la vacunación de la viruela ocurrieron en Reino Unido, Suecia y Estados Unidos, donde en 1901 se produjo un revuelta en Boston en relación a la obligatoria vacunación frente a esta enfermedad (7). Los argumentos que aducen los colectivos antivacunas son diversos, pero pueden resumirse en: •• Se violan los derechos individuales. •• Las vacunas son inseguras y peligrosas. •• Las enfermedades que previenen son poco importantes. •• Las vacunas no son eficaces. •• Las vacunas pueden producir enfermedad. •• Hay mejores alternativas que la vacunación. 93 Doctor, no queremos vacunar a nuestro hijo •• Falsedad de gobiernos y profesionales: conspiración. •• Intereses comerciales de los fabricantes. En la actualidad, los movimientos antivacunas obedecen a concepciones muy diversas, en muchas ocasiones basándose en creencias personales, culturales o religiosas, a menudo sustentadas por opiniones y hechos poco o nada documentados, con sesgos de información, y mayoritariamente sin base científica. Pueden ser representativos de: •• Organizaciones de víctimas de supuestos efectos adversos de las vacunas: autismo, enfermedades neurológicas… •• Asociaciones en defensa de la libertad de decisión entre las alternativas de salud del individuo. •• Defensores de la teoría de la conspiración de gobiernos, profesionales e industria farmacéutica. •• Grupos críticos, documentados con complejos puntos de vista sobre el mundo, el medio ambiente y la sanidad: cultura naturista, etc. •• Creencia en las medicinas alternativas que se oponen a la vacunación. •• Grupos antisistema, opositores a la tecnología, etc. •• Grupos con creencias religiosas que rechazan las vacunas. Pero lo que realmente representa un cambio sustancial entre los movimientos antivacunas actuales y los pasados es su mayor capacidad de difusión, mayoritariamente por Internet, pero también mediante publicaciones, en ocasiones de gran difusión, e incluso mediante la organización pública de reuniones a modo de eventos o congresos donde debaten sus creencias con un efecto mediático nada despreciable (7). Sin embargo, el rechazo a la vacunación no es sólo un fenómeno aislado que atañe a colectivos organizados. Muchas de las familias que manifiestan algún tipo de rechazo no pertenecen a ningún movimiento antivacunas, simplemente son personas que se documentan, se informan, consultan y buscan más conocimientos por todos los canales de la información que nuestra sociedad les brinda: Internet, medios de comunicación (revistas, prensa, televisión, radio), otras personas, profesionales sanitarios, autoridades sanitarias, publicidad… En ocasiones esta información muestra contradicciones entre sus distintos portavoces, como ocurrió con las múltiples declaraciones durante la pandemia de gripe A de 2009, a menudo 94 J. Marès Bermúdez desafortunadas y que no supieron matizar en cada momento y de forma comprensible el cambio de decisiones en función de la disponibilidad de nuevos conocimientos sobre el impacto y la gravedad de la enfermedad. Otro aspecto es el efecto de la difusión de información sobre vacunas en los medios de comunicación, con el riesgo de atemorizar a la población o generar desconfianza cuando el medio no elige un portavoz válido como fuente de la información. La manifestación pública, o el propio ejemplo por parte del personal sanitario poniendo en duda la idoneidad o la seguridad de una vacuna concreta, son aspectos que afectan de manera muy negativa a la opinión de la población, cuyos conocimientos globales sobre el beneficio y la seguridad de las vacunas son lógicamente limitados. La aparición de nuevas vacunas, con su posible riesgo de efectos adversos, con gran interés mediático y que la población recibe por distintas vías, va generando poco a poco una pérdida de confianza en la comunidad. Finalmente, la actitud actual de las familias y los pacientes, con un papel más activo y comprometido en la toma de decisiones en relación a su salud, tanto desde el punto de vista terapéutico como preventivo, conlleva la demanda o la necesidad de cuestionar al profesional la idoneidad de una u otra vacuna, y por ende su aceptación o rechazo. BROTES DE ENF E R M EDA DE S IN MU N OP R EV ENIB L ES en relación con la no vacunación Quizá olvidemos las enfermedades infecciosas que prácticamente han de­ saparecido en las zonas del mundo donde se ha instaurado la vacunación sistemática (Fig. 1), pero ellas jamás se olvidarán de nosotros. En la década de 1950 se introdujo en Reino Unido la vacunación frente a la tos ferina con vacunas de células enteras, con lo que se redujeron a sólo 2000 al año los casos de tos ferina en todo el país, cuando se consiguieron coberturas del 80%. Al final de la década de 1970, por una pérdida de confianza en la vacunación debido a comunicaciones de casos de efectos adversos temporalmente relacionados o atribuidos a la vacuna, la cobertura disminuyó al 20% de la población. Esta situación generó una reemergencia de casos en los años 1980, con más de 45.000 al año, con gran repercusión en los lactantes y una mortalidad del 1% en los menores de 6 meses. Este hecho tuvo un impacto favorable a la vacunación, se recobró la confianza, las tasas de cobertura volvieron a aumentar hasta el 90% y de nuevo la incidencia de la enfermedad disminuyó. 95 Doctor, no queremos vacunar a nuestro hijo 100 VPO Nº casos 2000 80 1500 60 1000 40 500 20 Cobertura de vacunación Incidencia de poliomielitis 1995 1991 1987 1983 1979 1975 1971 1967 1963 1959 1955 1951 1947 1943 1939 1935 0 1931 0 Cobertura vacunación 2500 Año Figura 1. Reducción de la incidencia de poliomielitis en España (1931-2011) tras la introducción de la vacuna antipoliomielítica oral en la década de 1960. Fuente: Centro Nacional de Epidemiología. La población actual ya no recuerda la polio, y desconoce que el sarampión y las tos ferina, enfermedades para las que se recomienda actualmente de forma universal la vacunación, fueron la primera causa de mortalidad en la primera mitad del siglo xx, cuando no existía la posibilidad de vacunar. Pero también la población, e incluso el personal sanitario, desconocen que estamos viviendo una reemergencia de algunas enfermedades inmunoprevenibles en relación a la existencia de bolsas de población no vacunadas correctamente. Sarampión Uno de los objetivos de la Organización Mundial de la Salud y del European Centre for Disease Prevention and Control (ECDC) fue la erradicación, gracias a la vacunación sistemática, del sarampión autóctono en Europa para el año 2010, pero de forma progresiva, durante la primera década del siglo xxi han ido aumentado los casos comunicados en la Unión Europea hasta llegar a cifras absolutamente inesperadas y muy preocupantes en los años 2010 y 2011. De enero a diciembre de 2011, según datos comunicados por el ECDC en febrero de 2012 (8), se declararon oficialmente 30.567 casos en Europa (Fig. 2). Sólo en Francia se comunicaron 15.206 casos (aproximadamente el 50% del total), en Italia 5181 casos, en España 1986 casos, en Alemania 1609 casos y en Reino Unido 1083 casos. 96 J. Marès Bermúdez Cobertura de vacunación con dos dosis (2010) 80-89% 90-94% ≥95% Número de casos 100 10.000 Figura 2. Distribución del número de casos de sarampión en Europa en 2011 y cobertura vacunal con dos dosis de triple vírica. Fuente: ECDC. European Monthly Measles Monitoring (EMMO), febrero de 2012. La mayor incidencia en Europa se ha observado en los menores de 1 año (población no vacunada todavía dada su edad), con una tasa de 35 casos por 100.000 habitantes/año, aunque se han observado casos en todas las edades y en adultos. Se han producido ocho muertes (0,3/1000) y 27 encefalitis (1/1000), y se han declarado neumonías como complicación en un 4% de los casos, entre otras como otitis media, etc. El estado de vacunación es conocido en el 83% de los casos declarados (23.112 casos): el 82% no estaban vacunados y el 13,5% sólo habían recibido una dosis. No se declaró ningún caso grave en personas que habían recibido las dos dosis de la vacuna. En cuanto al origen de los casos, el 97% se infectaron en el propio país (sarampión autóctono), un 3% fueron importados y un 0,1% estuvieron relacionados con un caso importado. El análisis de la cobertura vacunal frente al sarampión en Europa justifica esta situación. Algunos ejemplos son realmente preocupantes (9): 97 Doctor, no queremos vacunar a nuestro hijo •• En Francia no hay datos comunicados sobre la cobertura nacional frente al sarampión. En un estudio transversal realizado en personal sanitario de 15 hospitales de París se detectó una cobertura del 79% para la primera dosis y del 50% para la segunda. En otro estudio transversal realizado en 35 hospitales de Francia, la cobertura con al menos una dosis fue de tan sólo el 50% de la población estudiada. Por esta razón, en Francia se ha establecido la recomendación de vacunar con dos dosis a toda la población adulta nacida a partir de 1980. •• En España, la cobertura para la primera dosis es superior al 95% en todas las comunidades, pero para la segunda dosis es demasiado baja en algunas: en Andalucía es del 87%, en Madrid del 83% y en Cataluña del 92%. Además, debe tenerse en cuenta que el inicio de la vacunación sistemática con la vacuna TV en España fue a partir de 1981, y por tanto, en la cohorte nacida entre 1970 y 1985 (actualmente de 25 a 40 años de edad), muchas personas que no sufrieron la enfermedad tampoco recibieron la vacuna y persisten como bolsa de población susceptible. La decisión de adelantar la administración de la primera dosis de los 15 a los 12 meses de edad, que han tomado progresivamente la mayoría de las comunidades autónomas, es una buena medida ante la situación actual, pero también sería recomendable adelantar la segunda dosis a los 2-3 años de edad, tal como recomienda ya para 2012 el Comité Asesor de Vacunas de la Asociación Española de Pediatría (10). Es importante considerar que la protección en cuanto a efectividad poblacional que ofrece la primera dosis de la vacuna TV frente al sarampión es del 95% de por vida; tras la segunda dosis, la efectividad asciende a más del 98%. En Europa ya se administra la segunda dosis de TV a los 2 años de edad en 18 países, y sería recomendable que esta recomendación se extendiera a los demás. El ECDC ha fijado como nueva fecha para el objetivo de la erradicación del sarampión autóctono en Europa el año 2015, y para ello es imprescindible conseguir coberturas vacunales superiores al 95% con dos dosis (9). Parotiditis En 2010 se declararon al sistema de vigilancia europeo EUVAC.NET 14.568 casos de parotiditis, procedentes de los sistemas de declaración obligatoria de 27 países de la Unión Europea. Es probable que haya una infradeclaración 98 J. Marès Bermúdez y que por tanto el número real sea mayor. La tasa media de incidencia en Europa durante el año 2010 fue de 3,5 casos por 100.000 habitantes/año. La mayor tasa de incidencia se observó en la República Checa, con 10,2 casos por 100.000 habitantes/año, seguida de Polonia y Reino Unido con tasas de 7,2 y 7 por 100.000 habitantes/año. El 66% del total de los casos declarados en Europa ocurrieron en tres países: Reino Unido (30% de casos), Polonia (19%) y España (17%). El grupo de edad con mayor incidencia fue el de 5 a 9 años, que representó el 23% de todos los casos, con una incidencia en esta edad de 12,7 casos por 100.000 habitantes, aunque se observaron casos en todas las edades, desde menores de 1 año hasta adultos de 30 años de edad. En 9014 pacientes (62%) se conocía el estado de vacunación: el 35% no habían recibido ninguna dosis de vacuna y el 34% sólo una. Se constató que un 26% de los casos estaban correctamente vacunados con dos dosis, lo que evidencia una menor efectividad de esta vacuna en relación a otras, como la del sarampión y la rubéola. En esta situación, la efectividad global de la vacunación en la población depende de la cobertura vacunal, directamente relacionada con la inmunidad de grupo, que permite evitar el fallo vacunal individual al haber una elevada inmunidad comunitaria. No obstante, no debe obviarse que la mayoría de los casos (69%) estaban incorrectamente vacunados (11). Rubéola Se dispone de datos de vigilancia europea de casos de rubéola en Europa hasta 2009 (12). Los comunicados por el ECDC provienen de los sistemas de declaración obligatoria de los países de la Unión Europea. En el año 2008 se declararon 21.307 casos, de los cuales había confirmación serológica en 1921. En el año 2009 la declaración fue menor, 8951 casos, de los que 391 tenían confirmación serológica. Los grupos de edad con mayor tasa de incidencia fueron los niños de 0 a 4 años de edad y los adolescentes y adultos jóvenes entre 15 y 24 años de edad. En el año 2008, el estado de vacunación de los casos declarados era conocido en el 73%, y el 82% no estaban vacunados, el 16% sólo habían recibido una dosis y el 1% declararon estar correctamente vacunados con dos dosis. Los datos de 2009 son similares: se conocía el estado de vacunación en el 81% de los casos, de los cuales el 57% no habían recibido ninguna dosis de vacuna, el 41% una sola dosis y el 2% estaban vacunados con al menos dos dosis. En ambos años, el 98% o 99% de las personas que sufrieron rubéola no habían recibido una pauta completa de vacunación con dos dosis. 99 Doctor, no queremos vacunar a nuestro hijo En 2008, Italia fue uno de los países con mayor declaración de rubéola, con brotes en varias regiones y con una afectación específica de adultos jóvenes de 15 a 24 años de edad, lo que comportó paralelamente un incremento de los casos de rubéola congénita (12). En un estudio nacional de seroprevalencia realizado en Italia entre enero de 2003 y octubre de 2004 se comprobó que hasta un 15% de la población de 10 a 14 años de edad, y hasta un 20% de los jóvenes de 15 a 19 años de edad, eran susceptibles a la enfermedad. En un estudio similar realizado en 16 países europeos en 2008 también se halló que sólo en algunos de los países participantes se observa inmunidad protectora en más del 95% de las muestras analizadas. Estos datos anticipan la posible emergencia de casos de rubéola congénita si no se consiguen tasas de vacunación superiores al 95% de la población. En Holanda, país con una cobertura vacunal frente a la rubéola superior al 95%, entre septiembre de 2004 y julio de 2005 se declararon 387 casos de esta enfermedad, de los cuales el 98% no estaban vacunados. Estas personas correspondían a bolsas de población que rechazan la vacunación, en este caso mayoritariamente por motivos religiosos al pertenecer a comunidades vinculadas a la iglesia ortodoxa. Se produjeron 32 casos en mujeres embarazadas y se constataron dos muertes fetales, 14 rubéolas congénitas que condicionaron 11 casos de sordera (dos precisaron un implante coclear), seis casos con defectos del desarrollo y tres con una cardiopatía que precisó cirugía cardiaca (13). Todo ello para una enfermedad cuya vacuna presenta una efectividad superior al 99%. Tos ferina La tos ferina, la poliomielitis y el sarampión fueron conjuntamente la primera causa de mortalidad infantil en la primera mitad del siglo xx. Tras la introducción de la vacunación frente a la tos ferina, tanto en Estados Unidos como en Europa, en la década de 1950, y progresivamente en la mayoría de los países de todo el mundo, se produjo una drástica disminución de esta enfermedad. Desde mediados de los años 1990 se está produciendo tanto en Estados Unidos como en Europa un incremento de la incidencia de casos de tos ferina, con afectación de personas de todas las edades, pero con mayor incidencia en los menores de 1 año, en especial en los menores de 6 meses, los adolescentes y los adultos jóvenes (Fig. 3). Lo que confiere mayor gravedad a esta emergencia de la enfermedad es el incremento de casos en 100 J. Marès Bermúdez n Desconocido n No vacunado n Vacunado 100 90 80 Nº de casos 70 60 50 40 30 20 10 0 0 1 2 3 4 5 6 7 8 9 10 11 Edad en meses 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 >25 Edad en años Figura 3. Distribución de casos confirmados de tos ferina en España (1997-2007), distribuidos por edad y estado de vacunación. Fuente: Red Nacional de Vigilancia Epidemiológica. los menores de 6 meses, edad en que la tos ferina presenta una mortalidad cercana al 1% (14). Las razones de esta situación son varias. Tanto las vacunas de células enteras como las acelulares tienen una eficacia menor que otras vacunas del calendario infantil, que oscila entre el 70% y el 80%. Además, la inmunidad generada por la vacuna, al igual que la natural inducida por la propia enfermedad, no es permanente, se reduce con el paso del tiempo y se estima que oscila entre 6 y 8 años tras la vacunación completa o tras sufrir la enfermedad. Finalmente, la aparición de cepas con mutaciones de la toxina pertúsica o de la pertactina, con variaciones de sus características antigénicas, podría desempeñar también un papel en la emergencia de la enfermedad por una reducción en la eficacia de las vacunas disponibles. Como ocurría con la parotiditis, al disponer de vacunas con una eficacia relativamente menor, la efectividad vacunal en la población va a depender de una elevada cobertura en la comunidad, que genere una amplia inmunidad de grupo para permitir reducir el fallo vacunal. La disminución de un 1% en la cobertura de la vacunación frente a la tos ferina en una comunidad multiplica por dos el riesgo de la enfermedad en las personas vacunadas (15). 101 Doctor, no queremos vacunar a nuestro hijo Actualmente, para hacer frente a la tos ferina, además de vacunas mejores, son necesarias nuevas estrategias que permitan incrementar la cobertura de vacunación a grupos de población y a edades que hasta ahora no se contemplaban como población diana: adolescentes, adultos jóvenes, mujeres en edad fértil, embarazadas, convivientes con neonatos y lactantes, y probablemente toda la población adulta (16). La disponibilidad de vacunas acelulares frente a la tos ferina con baja carga antigénica permite extender la vacunación a todos estos grupos de edad. Aunque en España sólo algunas administraciones públicas recomiendan la revacunación de los adolescentes frente a la tos ferina con la vacuna Tdpa (Madrid, Ceuta y Melilla), el Comité Asesor de Vacunas de la Asociación Española de Pediatría recomienda su inclusión como vacuna sistemática para todos los niños entre 11 y 14 años de edad (10). Difteria Aunque no se ha producido un incremento de casos de difteria y se considera que la incidencia es estable en Europa, en 2008 se declararon 46 casos y 16 en 2009. En el año 2008, el 62% de los casos se produjeron en Letonia, aunque se comunicaron seis en Reino Unido, cinco en Francia y cuatro en Noruega. En 2009 se declararon dos casos en Reino Unido, uno en Alemania y uno en Suecia. Los grupos de edad más afectados fueron los de 5 a 14 años y de 45 a 65 años. Los casos se deben a transmisión autóctona, y por tanto debe conocerse que hay un riesgo potencial de difteria en la Unión Europea. Para evitar el incremento del número de casos y controlar aún más la enfermedad es imprescindible mantener las tasas de vacunación elevadas y especialmente no descuidar la revacunación del adulto (12). Varicela La varicela es una enfermedad para la que todavía se vacuna muy poco en Europa, ya que sólo Alemania, Grecia, Letonia, cuatro regiones de Italia y cuatro comunidades autónomas en España (Madrid, Navarra, Ceuta y Melilla) tienen programas de vacunación universal. Por esta razón, las tasas de incidencia de la varicela en Europa, con la excepción de los países o regiones que tienen vacunación sistemática, se han mantenido estables en las ultimas décadas, con una incidencia media en el periodo 2000-2007 de 319 casos por 100.000 habitantes/año (12). En ausencia de vacunación, la 102 J. Marès Bermúdez varicela es una enfermedad universal, que tarde o temprano afecta prácticamente a toda la población, generando incomodidad a las personas que la padecen y a sus familias, absentismo escolar y laboral, un elevado consumo de recursos sanitarios y complicaciones de distinta gravedad hasta en un 15% de los casos, así como necesidad de hospitalización en uno de cada 200 a 400 afectados. Los casos pediátricos representan el 90% de las hospitalizaciones por varicela; el 20% de las hospitalizaciones lo son por complicaciones neurológicas y un 8% a consecuencia de infecciones graves con riesgo vital (fascitis necrosante o septicemia) (17). La vacunación sistemática es la única medida que puede reducir la carga de la enfermedad y sus complicaciones. Países como Estados Unidos, donde la vacunación es universal, han constatado una disminución de la carga de la enfermedad a todas las edades, con una reducción del 98% en su incidencia en niños de 0 a 4 años de edad, y una reducción en la tasa de hospitalización por varicela superior al 50% en los menores de 14 años. En España, en la Comunidad de Madrid, donde la vacunación es universal desde 2006, se ha producido una reducción del 66% en la carga de la enfermedad en el periodo 2006-2009, y una reducción del 50% en las hospitalizaciones relacionadas con la varicela. Se constató además una inmunidad de grupo generada por la vacunación de los niños, con reducción de la incidencia de la enfermedad en niños mayores y adultos jóvenes no vacunados (Fig. 4) (10). Inicio de vacunación sistemática 3000 2500 Nº casos 2000 –87% 1500 1000 500 0 2002 2003 2004 2005 2006 2007 2008 2009 Años Figura 4. Número de casos declarados de varicela (sistema EDO) en la Comunidad de Madrid. Reducción del 87% del total de casos declarados en 2009, tras la introducción de la vacunación sistemática en 2006. Fuente: Servicio de Epidemiología de la Comunidad de Madrid. 103 Doctor, no queremos vacunar a nuestro hijo SEGU R IDAD DE L AS VACUN A S Las vacunas son una de las herramientas preventivas más beneficiosas en salud pública. A pesar de ello, es un hecho innegable que ninguna vacuna es totalmente segura ni totalmente efectiva. Las vacunas se administran en general a población sana, especialmente a niños, y por ello las garantías de seguridad que se les exigen son máximas. Cuando se consiguen altas tasas de cobertura vacunal se obtiene el máximo beneficio, con una muy significativa reducción de la enfermedad inmunoprevenible por la vacuna. En esta situación, cuando el beneficio es grande y las coberturas de vacunación máximas, hay más probabilidades de aparición de efectos adversos relacionados con la administración de las vacunas que cuestionen su seguridad. Muchas de estas reacciones son efectos adversos que simplemente se producen con una relación temporal con la administración de la vacuna, sin que pueda establecerse realmente ninguna relación causal. Otras sí están causalmente relacionadas con la vacunación, y ésta es la razón de la necesidad de una monitorización continuada de su seguridad tras la comercialización de las vacunas (6). Las vacunas, como productos biológicos y como cualquier otro agente farmacéutico, no están exentas de reacciones adversas. En su gran mayoría son leves, bien toleradas y aceptables, aunque en raras ocasiones pueden producirse efectos de mayor gravedad. Algunas de las reacciones adversas de las vacunas son tan raras que sólo se aprecian después de una amplia utilización posterior a su aprobación. Por todas estas razones, las consideraciones sobre la seguridad de las vacunas se evalúan con gran rigor científico, y las decisiones sobre su administración a la población deben basarse en un preciso conocimiento del cociente beneficio/riesgo de cada vacuna, garantizando que los beneficios de la vacunación para los individuos y para la comunidad son claramente superiores a los riesgos, teniendo en cuenta además la carga sociosanitaria, la morbilidad y la mortalidad de la enfermedad que se pretende prevenir. La monitorización de la seguridad de las vacunas es un aspecto clave desde el propio inicio del desarrollo clínico de toda vacuna y durante todo su proceso de investigación, siendo el aspecto más crítico exigido por las autoridades sanitarias para otorgar la autorización de comercialización. No obstante, la seguridad de las vacunas requiere una vigilancia continuada tras su comercialización, esencial para garantizar su seguridad en condiciones reales de uso, y que permite, tras la administración sistemática a un elevado número de personas, detectar reacciones adversas infrecuen- 104 J. Marès Bermúdez tes, en algunas ocasiones potencialmente graves, y cuantificar su adecuado perfil beneficio/riesgo. A diferencia de la eficacia de las vacunas, la seguridad no puede medirse directamente; la seguridad sólo puede inferirse de la ausencia relativa de efectos adversos (6). Las vacunas actuales tienen un adecuado perfil de seguridad, aunque cuando se vacuna a una gran cantidad de población pueden aparecer efectos adversos poco frecuentes relacionados temporalmente con la administración de las vacunas, que requieren su correcta evaluación. Algunos efectos adversos graves, como las reacciones anafilácticas, pueden prevenirse en muchas ocasiones con una adecuada anamnesis. A pesar de ser una reacción potencialmente grave, su frecuencia es baja y sólo se presentan uno a tres casos por millón de dosis administradas, y además con tratamiento adecuado es una reacción reversible sin secuelas. Para ello, todos los centros de vacunación deben disponer de material adecuado y personal entrenado para hacer frente a una posible reacción anafiláctica. Otras reacciones adversas pueden tener mayor gravedad, como la encefalitis tras la administración de la vacuna frente al sarampión, efecto que puede producirse en un caso por cada millón de dosis administradas. No obstante, el riesgo es mil veces menor que tras la infección salvaje, con la cual se observa un caso de encefalitis por cada mil personas que padecen sarampión. Teniendo en cuenta que, en ausencia de vacunación, el sarampión es una enfermedad de carácter universal y que todas las personas lo padecerán en algún momento de su vida, en todos los casos el beneficio/riesgo es claramente favorable a la vacunación, lo que justifica la aceptación del posible riesgo. RECOMEN DAC I O NE S frente a la no vacunación En algunos países (Estados Unidos, Canadá) se establece algún grado de obligatoriedad legal de la vacunación, en especial para iniciar la escolarización, aunque pueden presentarse excepciones por razones médicas, religiosas o por objeción de conciencia. En Australia se otorga un incentivo económico a las familias si cumplen con el calendario de vacunaciones establecido con sus hijos. En estos países se exige la exclusión escolar de los no vacunados en caso de brotes de enfermedades inmunoprevenibles. Aunque hay situaciones en que la obligatoriedad puede ser razonable, y establecerse legalmente, debido al alto riesgo de infección para la población, ante una enfermedad en que la única estrategia efectiva de control sea la vacunación (p. ej., un brote de sarampión), es preferible en general que la 105 Doctor, no queremos vacunar a nuestro hijo demanda y la aceptación de la vacunación por la comunidad sea alta y no sea necesario implantar la obligatoriedad. El rechazo a la vacunación no desaparecerá ni se silenciará: surgió al mismo tiempo que la primera vacuna. El movimiento o simplemente la posición antivacunas nos da la oportunidad de un debate creativo, no perturbador, que bien llevado puede reforzar el beneficio de las vacunas: •• La población ya no recuerda la polio, ni la mortalidad del sarampión ni de la tos ferina, que fueron la primera causa de muerte en la primera mitad del siglo xx. •• La población desconoce que al dejar de vacunar están reemergiendo las enfermedades prevenibles con vacunas. Los individuos con rechazo de más de una vacuna presentan un riesgo 22 veces mayor de sufrir sarampión y hasta seis veces más de padecer tos ferina (15). •• Muchas personas ignoran que los no vacunados aumentan el riesgo de enfermar de los correctamente vacunados. El riesgo de sufrir una determinada enfermedad se correlaciona directamente con la cobertura vacunal frente a ella de la población, especialmente en las que la vacuna tiene una menor eficacia individual. Por cada 1% de no vacunados en un colegio, se dobla el riesgo de tos ferina en los niños vacunados que acuden al mismo centro (15). •• Los padres, incluso los que vacunan, creen erróneamente que es más seguro retrasar algunas vacunas, cuando a menudo es al revés. Además, no son conscientes de que demorar las vacunas aumenta el riesgo de sufrir la enfermedad, al dejar a sus hijos en situación de desprotección. •• Las vacunas son uno de los logros más coste-efectivos como herramienta de salud pública. Ninguna otra medida, aparte de la potabilización del agua, ha salvado y salva tantas vidas ni mejora tan sensiblemente la salud global de la población. El éxito de la vacunación requiere una acción sinérgica y sin contradicciones entre todos los portavoces válidos para la población sobre temas de salud: autoridades reguladoras, autoridades sanitarias, profesionales sanitarios, medios de comunicación y académicos, e industria farmacéutica (Fig. 5). La población es muy sensible a los mensajes y las actitudes contradictorias entre sus referentes, responsables y portavoces en temas de salud. Desde nuestra posición, como profesionales sanitarios, desempeñamos un papel crucial como referentes para la población y los medios de comunica- 106 J. Marès Bermúdez Autoridades sanitarias Definir el mejor uso y garantizar el acceso y la implementación Autoridades reguladoras Valorar y vigilar la eficacia, la seguridad y la calidad Respaldar y promover la política vacunal Industria Medios de comunicación Desarrollar y fabricar vacunas eficaces y seguras Personas Informar con conocimiento y responsabilidad Contribuir a la implementación y la vigilancia Académicos Profesionales sanitarios Garantizar la investigación básica y aportar nuevos conceptos y tecnologías Asesorar a las personas acerca de las ventajas y la implementación de los programas Figura 5. Representación gráfica de los actores que deben intervenir en la transmisión de la información sobre vacunas a la población y son responsables, como portavoces válidos para la sociedad, de que esta información sea cierta, coherente, completa, entendible y sin contradicciones. ción, responsabilidad que nunca deberíamos eludir al tratar de una estrategia preventiva tan valiosa para la salud infantil y la comunidad en general, pero al mismo tiempo tan injustamente cuestionada. BIBLIOGRAF Í A 1.Omer SB, Salmon DA, Orenstein WA, deHart MP, Halsey N. Vaccine refusal, mandatory immunization and the risks of vaccine preventable diseases. N Engl J Med. 2009;360:1981-8. 2.Omer SB, Pan WK, Halsey NA, Stokley S, Moulton LH, Navar AM, et al. Nonmedical exemptions to school immunization requirement: secular trends and association of state policies with pertussis incidence. JAMA. 2006;296:1757-63. 3.Salmon DA, Moulton LH, Omer SB, Dehart MP, Stokley S, Halsey NA. Factors associated with refusal of childhood vaccines among parents of school aged children: a case control study. Arch Pediatr Adolesc Med. 2005;159:470-6. 4.Flanagan-Klygis EA, Sharp L, Frader JE. Dismissing the family who refuses vaccine. Arch Pediatr Adolesc Med. 2005;159:929-34. 107 Doctor, no queremos vacunar a nuestro hijo 5.Grossman Z, Van Esso D, Del Torso S, Hadjipanayis A, Drabik A, Gerber A, et al. Primary care pediatricians’ perceptions of vaccine refusal in Europe. Pediatr Infect Dis J. 2011;30:255-6. 6.Iskander JK, Gidudu J, Arboleda N, Huang WT. Selección de los principales problemas de seguridad de las vacunas. Ann Nestlé (Esp). 2008;66:93-102. 7.Wolfe RM, Sharp LK. Anti-vaccinationists past and present. BMJ. 2002;325:430-2. 8.ECDC. European Monthly Measles Monitoring (EMMO), Issue 8: Feb 2012. Disponible en: http://ecdc.europa.eu/en/publications/Publications/Forms/ECDC_DispForm.aspx? ID=821. 9.ECDC. European Monthly Measles Monitoring (EMMO), Sep 2011. Disponible en: http:// ecdc.europa.eu/en/publications/Publications/Forms/ECDC_DispForm.aspx?ID=761. 10.Moreno-Pérez D, Álvarez FJ, Arístegui J, Barrio F, Cilleruelo MJ, Correger JM, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: Recomendaciones 2012. An Pediatr (Barc). 2011. doi:110.1016/j.anpedi.2011.10.007. 11.EUVAC.NET. Mumps surveillance anual report 2010. Disponible en: http://ecdc.europa. eu/en/publications/Publications/Forms/ECDC_DispForm.aspx?ID=751. 12.ECDC. Annual epidemiological report 2011. Reporting on 2009 surveillance data and 2010 epidemic intelligence data. Disponible en: http://ecdc.europa.eu/en/publications/ Publications/Forms/ECDC_DispForm.aspx?ID=767. 13.Hahné S, Macey J, van Binnendijk R, Kohl R, Dolman S, van der Veen Y, et al. Rubella outbreak in the Netherlands, 2004-2005: high burden of congenital infection and spread to Canada. Pediatr Infect Dis J. 2009;28:795-800. 14.Heininger U. Update on pertussis in children. Expert Rev Anti Infect Ther. 2010;8:16373. 15.Dempsey AF, Shaffer S, Singer D, Butchart A, Davis M, Freed GL. Alternative vaccination schedule preferences among parents of young children. Pediatrics. 2011;128:848-56. 16.Campins Martí M, Moraga Llop FA. Vacunación frente a la tos ferina en el adolescente y el adulto. Enferm Infecc Microbiol Clin. 2008;26(Supl 1):12-9. 17.Van Esso D. Varicela. En: Hidalgo I, Montón JL, editores. Vacunas: algo más que el calendario vacunal. Madrid: CGA; 2010. p. 355-64. 108 C. Tolosa Tribiño ¿Pueden los padres oponerse a la vacunación de sus hijos, aunque ello implique un mayor riesgo de que enfermen? El principio de voluntariedad en la legislación espa ñ ola A la hora de afrontar el problema de la vacunación en España, ha de partirse con carácter general de una primera afirmación: la vacunación en nuestro país es voluntaria, esto es, en principio no hay vacunas obligatorias y nadie puede, por consecuencia, ser impelido a vacunarse. Sentada esta afirmación general, lo cierto es que aparecen en nuestra legislación determinadas normas que permiten plantearse si la voluntariedad no se convierte en una recomendación legal y si tal recomendación neutralmente analizada no comporta una cierta limitación a la capacidad de decisión de los afectados. En efecto, es muy importante destacar el contenido de la Ley 3/1986 de medidas especiales en materia de salud pública, cuando establece, y conviene recordarlo, que «al objeto de proteger la salud pública y prevenir su pérdida o deterioro, las autoridades sanitarias de las distintas administraciones públicas podrán, dentro del ámbito de sus competencias, adoptar las medidas previstas en la presente ley cuando así lo exijan razones sanitarias de urgente necesidad». A continuación establece que «las autoridades sanitarias competentes podrán adoptar medidas de reconoci- 109 ¿Pueden los padres oponerse a la vacunación de sus hijos? miento, tratamiento, hospitalización o control cuando se aprecien indicios racionales que permitan suponer la existencia de peligro para la salud de la población debido a la situación sanitaria concreta de una persona o grupo de personas, o por las condiciones sanitarias en que se desarrolle una actividad». Y por último señala que «con el fin de controlar las enfermedades transmisibles, la autoridad sanitaria, además de realizar las acciones preventivas generales, podrá adoptar las medidas oportunas para el control de los enfermos, de las personas que estén o hayan estado en contacto con los mismos y del medio ambiente inmediato, así como las que se consideren necesarias en caso de riesgo de carácter transmisible». Respecto a esta ley, es de destacar su carácter orgánico, que viene impuesto por la incidencia que tiene en algunas libertades personales y derechos fundamentales. Del contenido de las previsiones legales a que se acaba de hacer referencia, podemos llegar a la conclusión de que resulta legalmente posible desplazar el principio de voluntariedad en la vacunación en todos aquellos supuestos en que las autoridades sanitarias consideren que hay «razones sanitarias de urgente necesidad», «se aprecien indicios racionales que permitan suponer la existencia de peligro para la salud de la población» o se trate de «controlar las enfermedades transmisibles». En definitiva, en tales supuestos se habilita a que por la administración sanitaria se adopten las «medidas estrictamente necesarias» u «oportunas», en concreto las de «reconocimiento, tratamiento, hospitalización o control». Es fácil comprobar cómo la ley se mueve en lo que se define como «conceptos jurídicos indeterminados», esto es, se trata de expresiones lo suficientemente amplias y abstractas como para acoger en su seno numerosas posibilidades, si bien considero que la situación habrá de ser de suma gravedad para obligar a la vacunación de los ciudadanos, procediendo a primar el interés de la comunidad por encima del interés individual. Sin embargo, también conviene recordar que la Ley General de Sanidad establece, en su artículo 10, el derecho a negarse al tratamiento, excepto cuando suponga un riesgo para la salud pública, cuando no se está capacitado para tomar decisiones (en ese caso corresponde a los familiares o las personas allegadas) o cuando la urgencia no permita demoras por poder causar lesiones irreversibles o peligro de muerte. La duda está, en estos casos, en saber cuándo se está en un caso de riesgo para la salud pública, con lo que nuevamente vuelve a hacerse uso de los conceptos jurídicos indeterminados, cuya aplicación dependerá de la interpretación que quiera darse en cada momento. En principio, parece que lo que se quiere decir es que cuando el riesgo de la salud pública discurra 110 C. Tolosa Tribiño bajo los cauces ordinarios y sea susceptible de controlarse por los medios usuales que utiliza la administración pública, no puede invocarse la mencionada ley. Por otro lado, según el artículo 28 de la citada Ley General de Sanidad, «todas las medidas preventivas (…) deben atender a los siguientes principios: (…) b) no se podrán ordenar medidas obligatorias que conlleven riesgo para la vida». La cita de este precepto resulta importante, dado que es utilizado con frecuencia por aquellos que se oponen a la vacunación al defender el carácter inseguro de las vacunas. Lo que a mi juicio está fuera de toda duda es la imposibilidad de aplicar o alegar, al tratar esta cuestión, tal y como a menudo se hace, la violación del derecho constitucional a la vida o a la integridad física, consagrado en el artículo 15 de la Constitución, cuando establece que «toda persona tiene derecho a la vida y a la integridad física y moral, sin que, en ningún caso, pueda ser sometida a tortura ni a penas o tratos degradantes». El Tribunal Constitucional, en sentencia del 27-6-90, señaló que «la asistencia médica obligatoria no vulnera este derecho, porque en él no se incluye el derecho a la propia muerte, pues no puede haber trato de tortura, trato inhumano o degradante hacia aquella persona que se ve en la obligación de recibir tratamiento de forma forzosa». De igual modo, el Tribunal Constitucional señala que «no es posible utilizar la fuerza física con la finalidad de practicar pruebas médicas o implantación de tratamientos sin el consentimiento expreso de la persona, salvo para salvaguardar el interés social y el orden público, y en este caso sólo mediante una orden judicial». En la misma sentencia, el tribunal concluyó que «la libertad de rechazar tratamientos terapéuticos, como manifestación de la libre autodeterminación de la persona, no puede entenderse incluida en la esfera del art. 17.1 de la Constitución», precepto que consagra el derecho a la libertad personal. Según el propio Tribunal Constitucional, cuando en un caso concreto se constata que se encuentra comprometido el derecho a la integridad física, para que la medida se encuentre constitucionalmente justificada son exigibles los siguientes requisitos: •• Que se persiga un fin constitucionalmente legítimo. •• Que su adopción se encuentre amparada por una norma de rango legal (principio de legalidad): –– Que sea acordada judicialmente, pero sin descartar que la ley pueda habilitar a otros sujetos por razones de urgencia o necesidad; motivación de la resolución que la acuerde. 111 ¿Pueden los padres oponerse a la vacunación de sus hijos? –– Proporcionalidad de la medida, de manera que el sacrificio que la medida, idónea y necesaria a los fines constitucionalmente legítimos que se pretenden, no implique un sacrificio desmedido. A estos condicionantes se añade una última limitación, que opera tanto en el memento aplicativo como en el legislativo: «la ejecución de tales intervenciones corporales se habrá de efectuar por personal sanitario que deberá ser personal médico especializado en el supuesto de intervenciones graves que lo requieran por sus características» y «la práctica de la intervención se ha de llevar a cabo con respeto a la dignidad de la persona, sin que pueda en ningún caso constituir, en sí misma o por la forma de realizarla, un trato inhumano o degradante, aspectos éstos sobre los que pesa una prohibición absoluta (artículos 10.1 y 15 CE)». Esta doctrina del Tribunal Constitucional, al igual que la escasa seguridad que nos brindan las posibles interpretaciones de las normas legales que hemos citado, hacen que el problema de la posible obligatoriedad de la vacunación en casos concretos se convierta en una materia que pasa a ser objeto de intervención judicial, por la vía de la necesidad de una autorización judicial, exigible para que las autoridades sanitarias puedan actuar. Consecuentemente, puede afirmarse que hay situaciones en las que puede establecerse la obligación legal de vacunarse, siempre y cuando se haya obtenido la oportuna autorización que el juez concederá cuando compruebe que se acredita la existencia de circunstancias que lo permitan. En este sentido, el apartado segundo del artículo 8.6 de la Ley de la Jurisdicción Contencioso Administrativa establece que «asimismo, corresponderá a los juzgados de lo contencioso-administrativo la autorización o ratificación judicial de las medidas que las autoridades sanitarias consideren urgentes y necesarias para la salud pública e impliquen privación o restricción de la libertad o de otro de derecho fundamental». Corresponde, por tanto, a la jurisdicción contencioso-administrativa la decisión de proceder a la vacunación forzosa, como medida urgente para preservar la salud pública, en tanto que tal decisión puede suponer una restricción de la libertad individual a optar o no por la vacunación. Conviene señalar que son muy escasos los supuestos en que nuestros tribunales han tenido que hacer uso de esta potestad, y que en la gran mayoría de las ocasiones lo han hecho en supuestos de internamientos forzosos de carácter urgente por razones psiquiátricas. Pero no sólo los tribunales nacionales se han pronunciado sobre esta cuestión. El Tribunal Europeo de Derechos Humanos se ha pronunciado en 112 C. Tolosa Tribiño sentencias como la del Caso Winterwerp (supuesto de internamiento forzoso por razones psiquiátricas), estableciendo las siguientes condiciones necesarias para dar lugar a la privación de libertad: •• Existencia de dictamen médico objetivo. •• Riesgo de envergadura suficiente para justificar la medida. •• Mantenimiento de la medida el tiempo estrictamente necesario, estableciendo los oportunos controles al efecto. Estos requisitos pueden resultar perfectamente aplicables al supuesto que estamos analizando, esto es, podrá autorizarse la vacunación obligatoria cuando se constaten circunstancias objetivas por parte de las autoridades sanitarias, cuando estemos ante una situación de riesgo grave y de forma proporcionada a la entidad del riesgo concurrente, limitándose la duración de la medida al tiempo estrictamente necesario. P osibilidad de imponer la vacunación obligatoria : El caso del Albaycin de granada Dentro de los casos resueltos por nuestros tribunales, he de hacer referencia en primer término, dada su notoriedad e importancia, al Auto del Juzgado de lo Contencioso-Administrativo n.º 5 de Granada, de 24 de noviembre de 2010. Se trataba de un supuesto de un brote de enfermedad de sarampión en la ciudad de Granada, con 36 casos confirmados a 18 de noviembre de 2010, cuyo comienzo se produjo el 9 y 10 de octubre con dos casos en niños del barrio del Albaycín. Había padres que se negaban a vacunar a sus hijos, por lo que era previsible que el virus del sarampión siguiera circulando entre los niños de un colegio público y por dicho barrio. Ante esta situación, el 22 de noviembre de 2010 la Consejería de Salud de la Junta de Andalucía solicita al juzgado la vacunación forzosa de los 35 niños que se han negado a vacunarse expresamente o no han cumplimentado el requerimiento de recibir la dosis de vacuna triple vírica. El auto procedió a autorizar la vacunación obligatoria y lo hizo basándose, desde el punto de vista legal, en los siguientes argumentos: •• Para el juez, el sustento de la potestad jurisdiccional, en esta materia, lo encontramos en el artículo 43 de la Constitución, que tras reconocer el derecho a la salud precisa, en su apartado segundo, que «compete a los poderes públicos organizar y tutelar la salud pública a través de 113 ¿Pueden los padres oponerse a la vacunación de sus hijos? medidas preventivas y de las prestaciones y servicios necesarios. La Ley establecerá los derechos y deberes de todos al respecto». •• El desarrollo básico de este principio constitucional/rector de la política social del estado se encuentra en la Ley General de Sanidad, Ley 14/1986, de 25 abril; en la Ley Orgánica 3/1986, de 14 abril, sobre medidas especiales en materia de salud pública; y en la Ley 29/2006, de 26 julio, Ley de garantías y uso racional de los medicamentos y productos sanitarios. •• Todas estas leyes tienen carácter estatal, al haber sido dictadas, en virtud de la atribución competencial reconocida en el artículo 149.1.16 de la Constitución, a favor del estado, sin perjuicio del ámbito competencial que en materia de sanidad e higiene efectúa el artículo 148.1.21. a las comunidades autónomas. •• Establecido el marco legal aplicable, el auto judicial procede a la interpretación y aplicación de la Ley Orgánica 3/1986, de 4 abril, sobre medidas especiales en materia de salud pública, a la que antes se hizo referencia y que constituye el presupuesto habilitante de la competencia atribuida a los juzgados de lo contencioso-administrativo. •• Para el juez de Granada, «en ella se pretende proteger la salud pública y prevenir su pérdida y deterioro, y con este objetivo se habilita a las administraciones públicas para, dentro de sus competencias, adoptar determinadas medidas cuando así lo exijan razones sanitarias de urgencia o necesidad. Entre las medidas previstas en su artículo 2 se recogen las siguientes: el reconocimiento, los tratamientos, la hospitalización o el control cuando se aprecien indicios racionales que permitan suponer la existencia de peligro para una persona o un grupo de personas o por las condiciones sanitarias en que se desarrolle una actividad. El carácter abierto de estas medidas, exigibles y legitimadas por la defensa de la salud pública, se acentúa en el artículo 3 al habilitar a las administraciones públicas para adoptar las medidas oportunas para el control de los enfermos, de las personas que estén o hayan estado en contacto con los mismos y del medio ambiente inmediato, todo ello con el fin de controlar las enfermedades transmisibles». En conclusión, el auto procedió a autorizar la vacunación obligatoria de los menores, señalando que «entendemos que no suscita debate que la medida solicitada por la Consejería de Salud de la Junta de Andalucía persigue un fin constitucionalmente legítimo; que su adopción se encuentra ampa- 114 C. Tolosa Tribiño rada por una norma de rango legal; y que existe proporcionalidad de la medida, de manera que es idónea y necesaria a los fines constitucionalmente legítimos que se pretenden, sin implicar un sacrificio desmedido, bastando a estos efectos recordar lo reseñado en el hecho segundo de esta resolución; en resumen, que mientras con la administración de la vacuna antisarampionosa un 10% de los vacunados presentan malestar general y fiebre entre 5 y 12 días después de la vacunación, síntomas que duran de 1 a 2 días y causan pocas limitaciones a la actividad del niño, acaeciendo en contadas ocasiones convulsiones por la fiebre, que no dejan secuela alguna, sin que se asocien enfermedades de mayor gravedad con la vacunación; las complicaciones del sarampión ocurren entre un 5-15% de los casos, e incluyen otitis media, laringotraqueobronquitis, neumonía, diarrea, crisis convulsivas febriles, encefalitis y ceguera, siendo los menores de 5 años que viven en malas condiciones o están mal nutridos, los adultos y los pacientes con inmunodeficiencias los que presentan un mayor riesgo de complicaciones graves, conllevando la gravedad del cuadro clínico el ingreso en hospital de un elevado número de casos, siendo la tasa de letalidad del sarampión, en los países desarrollados, en torno al 1 por mil». supuestos jurisprudenciales sobre la vacunación Un segundo supuesto de gran interés es el resuelto por la Sala del Tribunal Superior de Justicia de Cataluña el 28 de marzo de 2000, pero antes de entrar a examinar esta sentencia conviene hacer referencia a las actuales normas de admisión de alumnos en los centros públicos de Cataluña. La Resolución ENS/315/2012, de 23 de febrero, por la que se aprueban las normas de preinscripción y matrícula del alumnado en los centros del Servicio de Educación de Cataluña y otros centros educativos, en las diversas enseñanzas sostenidas con fondos públicos, para el curso 2012-2013, establece en su artículo 19.2 que «para la formalización de la matrícula hay que presentar la documentación que acredita el cumplimiento de los requisitos académicos u otros que sean exigibles, si no se han presentado con anterioridad. Asimismo, si de acuerdo con lo que se establece en el anexo 2.2.b) de esta Resolución, no se hubiera podido presentar el DNI renovado con la nueva dirección, hay que hacerlo en este momento. En caso de guarderías, segundo ciclo de educación infantil, educación primaria y educación secundaria obligatoria, también hay que presentar fotocopia del carné de vacunaciones donde figuren las dosis de vacunas recibidas con las 115 ¿Pueden los padres oponerse a la vacunación de sus hijos? fechas correspondientes. Cuando no se tenga el carné de vacunaciones, tiene que presentarse un certificado médico oficial donde figuren las dosis de vacuna recibidas con las fechas correspondientes (artículo 4 de la Orden de 29 de junio de 1981, por la que se aprueba el establecimiento de los registros periféricos de vacunaciones). Si las niñas o los niños no han sido vacunados por contraindicación médica o por otras circunstancias, hay que presentar un certificado médico oficial justificativo». Consecuentemente, en estos supuestos, el problema jurídico planteado no era, como sucedió en Granada, que se ventilara directamente la posibilidad de imponer la vacunación obligatoria, sino que se impugnaba la adecuación a derecho de la decisión de no matricular a un alumno por no haber cumplido con la vacunación. Para la citada sentencia, la exigencia de vacunación de la población infantil forma parte de las medidas preventivas para la protección de la salud, a las que se refiere el art. 43 de la Constitución. En efecto, según la citada sentencia, «si se tiene en cuenta que compete a los poderes públicos organizar y tutelar la salud pública a través de medidas preventivas y de las prestaciones y servicios necesarios (artículo 43.2 de la Constitución), siendo uno de los principios generales contenidos en la Ley 14/1986, de 25 de abril, General de Sanidad, el que los medios y actuaciones del sistema sanitario estarán orientados prioritariamente a la promoción de la salud y a la prevención de las enfermedades (artículo 3.1), desarrollando las administraciones actuaciones tendentes a la prevención de la enfermedad del individuo y de la comunidad (artículo 18.2), y que dentro de las obligaciones impuestas a los ciudadanos se encuentran las de cumplir las prescripciones generales de naturaleza sanitaria comunes a toda la población, así como las específicas determinadas por los servicios sanitarios (artículo 11.1), fácilmente se comprende que la exigencia de vacunación de la población infantil forma parte de las medidas preventivas a las que se refiere la Norma Suprema porque con ello se está dando respuesta cabal por la administración al derecho constitucional a la protección de la salud». Dando respuesta al posible conflicto que puede producirse entre la libertad individual de elección y los intereses generales que pueden verse afectados por la negativa a la vacunación, la sentencia reconoce que «la convivencia en un estado social y democrático de derecho supone, no sólo el respeto de los derechos fundamentales a título individual, sino también que su ejercicio no menoscabe el derecho del resto de la sociedad que se rige por unas pautas de conducta que persiguen el interés general. Así pues, no estamos aquí ante una vulneración del derecho a la educación, de lo que es buena prueba la admisión de la menor en la escuela, sino ante el incum- 116 C. Tolosa Tribiño plimiento de unas obligaciones que tienen como finalidad la prevención de enfermedades, y que se traducen en la práctica en la exigencia de acreditar las vacunaciones sistemáticas que le corresponden por su edad, que responden a la idea de obtener una inmunidad del grupo que, además de proteger del contagio a los individuos no vacunados por contraindicaciones individuales, permite la eliminación de la enfermedad en un área geográfica determinada, e incluso a nivel mundial». La sentencia termina concluyendo que «al cumplimiento de esta finalidad responden el Decreto 157/1981, de 19 de junio, de Plan de Vacunaciones Sistemáticas, la Orden de 29 de junio de 1981, de aprobación de establecimiento de los registros periféricos de vacunaciones, la Orden de 11 de mayo de 1983, que regula las condiciones higiénico-sanitarias y de seguridad de cumplimiento obligatorio para los centros de atención asistencial para los niños menores de 6 años, la Resolución de 9 de febrero de 1995, por la que se regula el procedimiento de preinscripción e ingreso en parvularios públicos y privados subvencionados y el régimen de bonificación de las cuotas a las del Departamento de Enseñanza para el curso 1995/96, y la Resolución de 9 de marzo de 1996, por la que se aprueban las normas de preinscripción y matriculación de alumnos en los centros sostenidos con fondos públicos que impartan enseñanzas de régimen general para el curso 1996/97. Del conjunto de tales disposiciones resulta inequívocamente que para la formalización del ingreso en los centros de enseñanza a los que se refieren las mismas es necesario presentar un certificado médico según el cual el/la niño/a no padece ninguna enfermedad infecto-contagiosa, y un certificado médico o carnet de vacunaciones donde figuren las dosis de vacunas recibidas con las fechas correspondientes, salvadas las contraindicaciones individuales. Así pues, no habiendo cumplido esta exigencia los padres de la menor María Dolores, pese a ser requeridos para ello por la administración, sin que la oposición se fundamente más que en la elección de un determinado modelo de salud, la resolución del Rector de la Universidad Autónoma de Barcelona resulta conforme a derecho». Otro supuesto que puede traerse a título de ejemplo es lo resuelto, en este caso sobre una solicitud de internamiento forzoso, por el Juzgado de lo Contencioso-Administrativo n.º 10 de Valencia. Según el citado auto, «la regulación en nuestro derecho de situaciones como la presente se recoge en los arts. 17.1 de la Constitución Española, 5.1.f) del Convenio Europeo para la protección de los Derechos del Hombre, 2 de la Ley Orgánica 3/1986 de Medidas Especiales en Materia de Salud Pública, y art. 9 de la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de de- 117 ¿Pueden los padres oponerse a la vacunación de sus hijos? rechos y obligaciones en materia de información y documentación clínica». En concreto, este último precepto dispone, en relación con el consentimiento informado, que «2. Los facultativos podrán llevar a cabo las intervenciones clínicas indispensables en favor de la salud del paciente, sin necesidad de contar con su consentimiento, en los siguientes casos: a) Cuando existe riesgo para la salud pública a causa de razones sanitarias establecidas por la Ley. En todo caso, una vez adoptadas las medidas pertinentes, de conformidad con lo establecido en la Ley Orgánica 3/1986, se comunicarán a la autoridad judicial en el plazo máximo de 24 horas siempre que dispongan el internamiento obligatorio de personas». Se observa que el auto abre la cuestión de la vacunación a un aspecto diferente al que hasta ahora venimos examinando, en cuanto sitúa la problemática en el campo de las excepciones al consentimiento del paciente para aquellas intervenciones clínicas indispensables en favor de la salud del paciente cuando existe riesgo para la salud pública. A este respecto, conviene recordar que el artículo 10 de la Ley General de Sanidad 14/86 expresa que toda persona tiene, con respecto a las distintas administraciones públicas sanitarias, entre otros aspectos, derecho «a que se le dé en términos comprensibles, a él y a sus familiares o allegados, información completa y continuada, verbal y escrita, sobre su proceso, incluyendo diagnóstico, pronóstico y alternativas de tratamiento» (apartado 5); «a la libre elección entre las opciones que le presente el responsable médico de su caso, siendo preciso el previo consentimiento escrito del usuario para la realización de cualquier intervención» (apartado 6) excepto «cuando no esté capacitado para tomar decisiones, en cuyo caso el derecho corresponderá a sus familiares o personas a él allegadas» (letra b); y finalmente, «a que quede constancia por escrito de todo su proceso» (apartado 11). Se configura así el llamado «consentimiento informado», estrechamente relacionado, según la doctrina, con el derecho de autodeterminación del paciente característico de una etapa avanzada de la configuración de sus relaciones con el médico. La Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y derechos y obligaciones en materia de información y documentación clínica, al referirse al consentimiento informado en el artículo 3 lo define como la «conformidad libre, voluntaria y consciente de un paciente, manifestada en el pleno uso de sus facultades después de recibir la información adecuada, para que tenga lugar una actuación que afecta a su salud». El consentimiento informado se basa en el principio de autodeterminación, de libertad personal y de conciencia, esto es, tiene su fundamento en 118 C. Tolosa Tribiño el derecho a la dignidad de la persona (art. 10.1 CE) y a la libertad (art. 1.1 CE), en tanto supone el reconocimiento de la autonomía del individuo para elegir entre las diversas opciones vitales que se presenten de acuerdo con sus propios intereses y preferencias (sentencia del Tribunal Constitucional 132/1989, de 18 de junio). Dentro del campo de las relaciones de la vacunación con el consentimiento informado, debemos hacer referencia al supuesto resuelto por la reciente sentencia del Tribunal Superior de Justicia de Castilla y León (Valladolid) de fecha 2 de enero de 2012. Se trata de un caso en el que los padres de un menor vacunaron con la triple vírica (sarampión, rubéola y parotidis) a su hijo de 15 meses de edad en 1994, siguiendo lo establecido en el calendario vacunal de Castilla y León. A la semana, el niño, que hasta ese momento había tenido un desarrollo normal, presentó signos de empeoramiento general de su salud durante varios meses, que terminó en el diagnóstico de encefalitis y tetraparexia espástica, por la que en 1998 la Consejería de Sanidad le reconoció una minusvalía del 92%. La condena se fundamenta en la falta de información a los padres sobre una complicación, la encefalopatía, al suministrar la vacuna triple vírica, en la dosis contra el sarampión. El riesgo es tan «señaladamente grave, por más que se trate de un riesgo atípico por infrecuente», que hay deber de informar, dice el fallo. El Tribunal Superior de Justicia reconoce que se cumplió el calendario de vacunación y que el riesgo de encefalopatía, aunque reconocido, era una complicación «muy rara, por excepcional» y a la vez «grave, por la importancia y potencial irreversibilidad de las lesiones». Aunque no está acreditada totalmente la relación entre la vacuna y la dolencia, ya en 2005 el Consejo Consultivo de Castilla y León admitió «la posibilidad de que fuese la vacuna del sarampión la causante» de la enfermedad. Y el Tribunal Superior de Justicia considera que la reconocida relación potencial, unida a la proximidad temporal entre la inoculación y la aparición de los primeros síntomas febriles «en un niño hasta ese momento con desarrollo y evolución normal, nos lleva a admitir la alta probabilidad –suficiente a los efectos que aquí nos ocupan–, puesto que la Junta no ha conseguido probar la total inexistencia de relación». En cualquier caso, los magistrados subrayan que lo que se indemniza «es el daño moral derivado de haber privado al paciente de la información necesaria sobre los posibles riesgos y complicaciones, a fin de que adoptase la decisión que reputaba más conveniente». La Sala concluye afirmando que «sin perjuicio de reconocer que probablemente no exista en el campo de la prevención ninguna medida 119 ¿Pueden los padres oponerse a la vacunación de sus hijos? con mejor relación beneficio/coste y beneficio/riesgos que la de las vacunaciones, sí hubo violación del derecho de los recurrentes a poder optar por rechazar sin más la vacunación de su hijo tras la información que la administración sanitaria pudo y debió suministrarles». Independientemente de la tesis principal de la sentencia, aparecen en ella otra serie de valoraciones y reflexiones que merecen ser destacadas. Por una parte, y con carácter general, se señala que el defecto del consentimiento informado se considera como incumplimiento de la lex artis y revela una manifestación de funcionamiento anormal del servicio sanitario, siempre que se haya ocasionado un resultado lesivo como consecuencia de las actuaciones médicas realizadas sin tal consentimiento informado. En lo referente a la vacunación, se afirma que «la realización de las vacunaciones sistemáticas, si bien tiene como objetivo primario el defender a cada individuo contra estas infecciones, también tiene el objetivo secundario de defenderse como conjunto o colectivo ante epidemias masivas, ya que se consigue que no existan personas que difundan la enfermedad (…)». En tercer lugar, la Sala evita pronunciarse expresamente sobre la obligatoriedad de la vacunación, de tal manera que estudia la posible exigencia de la responsabilidad patrimonial desde ambas hipótesis. Así, se afirma que «si nos hiciéramos eco de la opinión generalizada y extendida de que estas campañas de vacunación son obligatorias, y aceptáramos en este sentido la consideración del perito judicial (pediatra) de la obligatoriedad a su sometimiento, consideración no contradicha por la administración demandada – que en su escrito de conclusiones insiste en que no cabe duda de que con independencia de que se informara o no a los actores sobre tales riesgos la vacuna se hubiera administrado igualmente en el marco de una política sanitaria eficaz diseñada en pro del interés general–, esta Sala compartiría el criterio sobre la concurrencia de un daño antijurídico que el perjudicado no tiene la obligación de soportar (…)». Acto seguido afirma, sin embargo, que «si por el contrario aceptáramos que el sometimiento a la triple vírica es voluntario, la demanda debe correr igual suerte estimatoria por falta de información». No obstante, parece que los magistrados optan más por esta segunda solución cuando sostienen que «esta naturaleza de mera recomendación a su sometimiento –con su corolario de participación voluntaria– se deduce de los criterios básicos de actuación contenidos en el Decreto 116/1993, de 27 de mayo, de la Consejería de Sanidad y Bienestar Social de la Comunidad Autónoma de Castilla y León, por el que se aprueba el Plan Sectorial de Vacunaciones, conforme al que “I.1. Información sanitaria a la población general. En las inmunizaciones, al ser medida preventiva por excelencia, se 120 C. Tolosa Tribiño debe llegar a la participación voluntaria y consciente de la población beneficiaria de tales actuaciones. Para ello, es preciso que dicha población conozca suficientemente las ventajas que para la salud tienen las vacunaciones y la protección que contra ciertas enfermedades confieren. Asimismo, parece indispensable también que tengan adecuado conocimiento del calendario vacunal con las edades y períodos de aplicación de las distintas dosis”». También en el ámbito de la responsabilidad patrimonial conviene destacar el contenido de la sentencia del Tribunal Superior de Justicia de la Comunidad Valenciana de 18 de diciembre de 2010, en un caso de exigencia de responsabilidad por una hipoacusia grave bilateral, lesión de origen no determinado, sufrida 10 días después de haber sido vacunado con la triple vírica. Esta sentencia parece situarse claramente en el campo de la tesis de la obligatoriedad de la vacunación. En efecto, empieza por afirmar que «la vacuna administrada es obligatoria por razones de salud pública, por lo que, de acuerdo con lo dispuesto en el art. 10.6.a) de la Ley 14/1986, General de Sanidad, es uno de los supuestos exceptuados del consentimiento escrito del usuario, norma vigente en el momento en que acontecieron los hechos». Añade a continuación que aun cuando fue posible una relación de causa a efecto entre la vacuna administrada al niño y la lesión padecida, «la comunidad científica reconoce de forma prácticamente unánime que la prevención de enfermedades infecciosas por medio de la utilización de vacunas es uno de los mayores logros alcanzados por la medicina moderna, formando parte de las estrategias de salud pública, para mejorar la salud y la calidad de vida de los individuos». A partir de tales razonamientos, consideran los magistrados firmantes de la sentencia que «la actuación médico-sanitaria se ajustó en el caso enjuiciado al mandato de la llamada lex artis, derivando no obstante hacia un resultado lesivo, que si bien era previsible en un muy reducido porcentaje, el riesgo de contraer las enfermedades infecciosas que la vacuna trataba de evitar era infinitamente superior, por lo que la ponderación de intereses en juego demandaba, conforme al dictado de la medicina actual, su administración. La previsibilidad del resultado lesivo cede pues ante la fundada garantía de éxito de la vacuna en el marco de una política sanitaria eficaz diseñada en pro del interés general». La sentencia concluye afirmando que «en el presente caso, ciertamente la lesión no puede tildarse desde la perspectiva del sistema de responsabilidad accidental, como antijurídica, en cuanto dimana de un acto lícito de la administración, que ha actuado con arreglo a la orden reglamentaria que establece la obligación de vacunarse a los menores atendiendo al calen- 121 ¿Pueden los padres oponerse a la vacunación de sus hijos? dario vacunal, representando el sistema vacunal una de las medidas más importantes de salud pública, ya que es la causa de una disminución de determinadas enfermedades infecciosas e incluso de su desaparición». En este sentido, el inspector médico razona en su informe que «su correcta aplicación es imprescindible tanto para la salud individual como colectiva, y sus beneficios muy superiores a los posibles riesgos», y que «el calendario vacunal establece que a los 6 años los niños deben ser vacunados de DTP (difteria, tétanos y tos ferina), polio y triple vírica (sarampión, rubéola y parotiditis) si no existen contraindicaciones para ello», por lo que en principio nada obsta a entender que las lesiones que dimanan de la obligación de vacunación deben de ser soportadas por los individuos, en cuanto entran dentro de los parámetros que podemos decir son consentidos, leves y admitidos por la conciencia social, pero no en aquellos casos en que los rebasan, esto es, no procede entender que siendo el acto lícito debe de asumir el perjudicado que soporta el sacrificio personal en beneficio de la colectividad social los daños graves y permanentes, pues entiende la Sala, como ya hizo el Consejo Jurídico Consultivo de la Comunidad Valenciana, «que en tales casos se han rebasado los límites impuestos por los estándares de seguridad exigibles conforme a la conciencia social, no correspondiendo al perjudicado el deber de soportar el menoscabo». Podemos entonces concluir que, habiéndose rebasado estos límites, el daño concreto producido es indemnizable, no existe entonces deber alguno del perjudicado de soportar el menoscabo y la obligación de resarcir el daño causado por la actividad administrativa será imputable a la comunidad, que es la beneficiaria del sacrificio personal del menor, máxime cuando estamos ante un supuesto donde el fin que se persigue con la obligación de la vacunación, que justifica su imposición reglada, se entronca o choca con derechos fundamentales del individuo, pues es susceptible de poner en riesgo bienes constitucionales de la mayor importancia, como la vida y la integridad física de las personas. Por lo que si bien la obligación de vacunación constituye una carga del ciudadano de asumir los efectos adversos derivados de la administración de vacunas que sean calificados de leves o moderados, el principio de evitar que unos ciudadanos sean de peor condición que otros impone que cuando la consecuencia dañosa suponga perjuicios graves y permanentes, ésta debe ser indemnizada por la comunidad, representada por la administración, porque de otro modo se produciría un sacrificio individual en favor de la salud colectiva de la sociedad, perjudicando su integridad personal sin obtener el debido reconocimiento al derecho de máxima protección en nuestro ordenamiento constitucional, como el derecho a la vida y a la integridad personal. 122 A. Carmona Martínez La vacunación en los países en desarrollo IN TRODU C C I Ó N Para los que somos provacunas, uno de los momentos más estimulantes que te puedes encontrar en el desarrollo de la implantación de programas vacunales es cuando lo haces en los países en vías de desarrollo, y entre ellos sobre todo los de África. Allí, donde el índice de analfabetismo puede llegar a veces a más del 50% de la población, y la esperanza de vida está por debajo de los 50 años de edad, la gente sabe que la vacuna es la máxima expresión de salud y el lema «una vacuna, una vida» es más cierto que en ningún sitio. Por ello, todas las personas, mayores y niños, cuando saben que se va a desarrollar una campaña de vacunación en su zona, acuden en masa para obtener esa protección que de otra manera no tendrían. En esas latitudes, donde la población no tiene acceso a prácticamente ningún medicamento, y los que hay son caros y no gratuitos, las vacunas adquieren un relieve de la máxima importancia. Es muy estimulante ver que en foros sobre vacunas tan importantes como éste se habla de las vacunaciones en los países en vías de desarrollo, para que conozcamos cómo son, por qué se hacen y cómo se hacen, y ello por cuatro aspectos verdaderamente importantes: 1) Porque la tasa de mortalidad infantil en ese continente es la mayor del mundo: en Angola es de 176/1000 habitantes, mientras que en España es de 3,29/1000 habitantes, y la tasa de mortalidad materna en Costa de Marfil es de 470/1000 habitantes y en España de 6/1000 habitantes. 2) Porque mientras un niño esté sin vacunar y sea capaz de transmitir la enfermedad a un semejante, todos estaremos en peligro de ser infecta123 La vacunación en los países en desarrollo dos. El mundo es cada vez más pequeño y la movilidad entre las personas cada vez mayor y más rápida. 3) Porque ofreciendo salud y esperanza de vida conseguiremos que los niños de hoy puedan llegar a ser los adultos del mañana. 4) Y si además ofrecemos formación y cultura, lograremos que esos pueblos vayan saliendo de la miseria en que se encuentran y puedan obtener de la riqueza que su tierra ofrece un nivel de vida fuera de la pobreza y las penurias en que hoy están sumidos. SITUAC I Ó N AC T UA L EN L O S PA ÍS E S E N DE S A RRO L L O Hay que tener en cuenta que, de todos los continentes, África es el más grande y el más pobre. La esperanza de vida es inferior a los 50 años, existen zonas con una tasa de mortalidad infantil por encima de 150/1000 nacidos vivos y la mortalidad materna está por encima de 800/100.000 nacidos vivos. Dicho esto, las pequeñas organizaciones no gubernamentales (ONG) colaboramos para alcanzar los «objetivos del milenio», entre los cuales uno de los más importantes es reducir la mortalidad infantil mediante lo que mejor sabemos hacer: vacunar. África no se conoce como turista; cuando de verdad conoces África es al convivir con su gente en la vida cotidiana, en la enfermedad y en sus necesidades. Entonces es cuando de verdad te das cuenta de las diferencias abismales que hay entre las personas, aún hoy, en el siglo xxi. Aquí tenemos magníficas vías de comunicación, con mejores vehículos cada vez más cómodos y sofisticados; excelentes centros sanitarios, públicos y privados, con buenas instalaciones e incluso a veces con ayudantes robotizados; y un gran derroche de todo tipo de energías. Allí encontramos carreteras y vías de comunicación infernales, y medios de locomoción aún mas dificultosos; infraestructuras sociales nulas, donde incluso para poder tener agua potable tienen que ir a ríos y charcas, o en el mejor de los casos pedalear todo el día hasta pozos artesianos y llevarla luego a sus casas, a veces a kilómetros de distancia; todo depende de la mujer, que es la que lleva el peso de la familia, de la casa y del campo; el sustento y la alimentación a veces son un bien escaso y en ocasiones único y repetitivo, con los efectos carenciales que ello puede producir; y todo dentro de un marco de salubridad tanto rural como urbana que da miedo. En cuanto a la sanidad, los hospitales prácticamente no tienen ninguna dotación; los profesionales sanitarios a veces cuentan 124 A. Carmona Martínez con una buena formación, pero carecen de medios y de fármacos para tratar a los pacientes que les llegan. Además, y sobre todo, la sanidad y los fármacos, incluyendo las vacunas, no son gratis. Si a todas estas dificultades se añade que son países donde hay numerosas etnias (en Costa de Marfil hay 67), muchas de ellas rivales y que frecuentemente luchan entre sí (antes con lanzas y flechas, ahora con Kalashnikov, ak-47 y bombas de mano), tenemos un panorama de lo que allí se vive hoy día. ¿EXISTE R E C HA ZO A L A VACUN ACI Ó N EN LOS PA ÍS E S E N DE S A R R O L L O ? NO, con mayúsculas. Allí los antivacunas y el Sr. Wakefiel no tienen nada que hacer. Tan sólo hay que ganarse a los chamanes y a los jefes de las tribus, que cada vez es más fácil, y puede realizarse la vacunación de forma rápida, alegre y eficaz. Cuando se anuncia una campaña de vacunación la gente acude en masa, y conforme se van vacunando se marchan y avisan a sus vecinos y amigos para que vayan ellos también. En estos países, las vacunaciones están muy bien dirigidas y apoyadas fundamentalmente por la UNICEF y la OMS en primer lugar, luego por la Fundación Bill y Melinda Gates, en tercer lugar por el Rotary Club, en cuarto lugar por las ONG más pequeñas y, por último, por los propios gobiernos. En Costa de Marfil, por ejemplo, el estado proporciona la vacunación BCG, polio oral y DTP a los 2, 4 y 6 meses de edad, y una dosis de rubéola a los 15 meses, pero a partir de esa edad todas las demás vacunas son donadas por instituciones. ¿C ÓMO D ES A R R O L L A U NA CA M PA Ñ A de vacunación U NA O NG P E Q UE Ñ A ? Durante los meses previos hay que conseguir el dinero para financiarla, y mientras se está en comunicación con los compañeros de la ONG en el país, que son quienes preparan la campaña en coordinación con las autoridades sanitarias locales. Una vez llegas al país, te reúnes con ellos y te comunican los puntos conflictivos donde tienes que ir a vacunar. Allí se emiten las órdenes de compra de vacunas, que luego se transportarán a cada zona. Las vacunas no se llevan desde aquí; se compran allí y después se aplican. Cuando llegas a las zonas de vacunación, contactas con las autoridades locales y la comunicación es más fluida, ya que habitualmente son médi- 125 La vacunación en los países en desarrollo cos epidemiólogos que conocen bien la zona y sus problemas. Se hacen los planeamientos técnicos para llevar a cabo la campaña de vacunación y nos desplazamos a los puntos donde se administrarán las vacunas. Una vez determinados los puntos de vacunación, las vacunas son transportadas en neveras con controladores de temperatura, y todo el material fungible, que habitualmente ellos te proporcionan, así como todo el material de control: hojas de epidemiología y carnet para los que no lo tuvieran. Se controlan todos los carnets de vacunas, se sellan y se aplican las vacunas. Incluso se pone una marca al niño para que no repita, ya que a veces lo intentan al creer que si se ponen más dosis quedan más protegidos. Por último se hacen una recogida y un análisis de datos, que servirán para la epidemiología y para otras campañas. ¿SOB R E Q U É ENF E R ME DA D E S ESTA M O S INC IDIENDO? Entre las enfermedades prevenibles sobre las que se está incidiendo en ese continente tenemos: •• En primer lugar la polio, que aunque se creía que estábamos en vías de erradicarla, como en su día la viruela, de los cuatro puntos del nuevo plan estratégico concebido en 2010-2012 tan sólo uno se ha alcanzado a medias, ya que de los cuatro países endémicos (Nigeria, India, Pakistán y Afganistán) tan sólo la India se ha visto libre de polio en 2011, los otros siguen con más casos y además ha rebrotado en 25 países en estos últimos años. •• En segundo lugar el sarampión, que tan popular se está volviendo últimamente en el mundo entero. Los americanos temen que se lo llevemos desde Europa, donde su resurgimiento es alarmante y ha llegado a afectar a numerosos países, con más de 30.000 casos, numerosas hospitalizaciones y más de una docena de muertes. •• En tercer lugar la meningitis, enfermedad endémica que puede afectar a una población de más de 450 millones de personas que habitan en el llamado «cinturón africano de la meningitis». La lucha contra ella en esta zona de alta endemia y de desastrosas proporciones parece que va tocando a su fin, gracias a la nueva vacuna conjugada contra la meningitis A, MenAfriVac, de la cual se han beneficiado con su protección, desde el año 2010, más de 55 millones de personas de 1 a 29 años de 126 A. Carmona Martínez edad. De aquí al año 2015 se espera poder vacunar a más de 400 millones de personas si se consigue la financiación adecuada de 550 millones de dólares, lo cual evitará la muerte de más de 150.000 jóvenes, con un ahorro de 120 millones de dólares en las partidas de los presupuestos nacionales para diagnóstico y tratamiento, que podrán utilizarse para otros problemas relacionados con otras enfermedades y la pobreza de la región. Hemos de tener en cuenta que en los dos últimos decenios se han reportado más de un millón de casos de meningitis. En 2012, en la semana 12 (del 19 al 25 marzo) se llevan declarados en estos países africanos 1288 casos, con 94 muertes y una tasa de letalidad del 7,3%. •• En cuarto lugar la infección por rotavirus, que es la causa más importante de gastroenteritis aguda grave en los menores de 2 años en todo el mundo. Afecta a todos los niños, tanto en los países en desarrollo como en los industrializados, pero en África se suman otros factores de riesgo muy importantes, como son la falta de higiene, la desnutrición y los déficit inmunitarios, que hacen que la mortalidad sea la más alta del mundo. •• En quinto lugar la malaria, que cada año afecta a más de 200 millones de personas y causa la muerte a más de 1,2 millones de ellas, la gran mayoría niños del continente africano. Se intenta que la vacuna que actualmente se está estudiando en un amplio ensayo con más de 15.000 niños en 11 centros de 11 países africanos pueda ser utilizada comercialmente en el año 2015. Es una vacuna recombinante de tres componentes: una proteína del parásito, un antígeno inmunógeno del VHB y el adyuvante AS01. El ensayo se está realizando en lactantes de 6 a 12 semanas de edad y de 5 a 17 meses de edad. La vacuna presenta una eficacia frente a la fase clínica del 56%, y frente a las fases graves del 47%, por lo que reduce los casos de malaria a la mitad durante los primeros 12 meses de la vacunación. •• En sexto lugar el sida, pues de los 36 millones de personas que lo padecen en el mundo, el 95% son de África. Es una enfermedad que anualmente causa cerca de 2 millones de muertes, y cada año se infectan unos 3 millones de personas, entre ellas 500.000 niños. Aunque se han hecho grandes avances en su prevención y tratamiento, debido a las políticas restrictivas de estos países que están recibiendo menos ayudas, los medicamentos para tratarla van escaseando y está apareciendo un mercado negro de medicamentos falsos. No obstante, el premio Nobel de me- 127 La vacunación en los países en desarrollo dicina Luc Montagner, uno de los descubridores del virus del sida hace 25 años, ha comunicado una noticia importante: «en 4 años podremos tener una vacuna terapéutica contra el sida, que controlará y mejorará la calidad de vida de los pacientes que hayan contraído la enfermedad». En enero de 2012 se ha puesto en marcha un ensayo de fase I con dos candidatas a vacunas contra el virus de la inmunodeficiencia humana (VIH) basadas en DNA, una que contiene fragmentos de una proteína de la superficie del virus del subtipo C, el más común en África (ensayo MUCOVAC2), que ha sido eficaz en ratones, conejos y macacos, y otra que codifica varias proteínas del VIH y un adyuvante interleucina-12 (ensayo B004). La vacuna que actualmente está en fase I y se ha mostrado más eficaz es la española, desarrollada por el Consejo Superior de Investigaciones Científicas, que ha logrado una respuesta inmunitaria en el 90% de los casos. Aunque las últimas noticias que van apareciendo son esperanzadoras, todavía deberemos esperar algunos años para que todo esto sea una realidad. •• Y en séptimo y último lugar la fiebre amarilla, transmitida por un molesto mosquito que tras su picadura puede contagiar esta enfermedad que afecta anualmente a unas 200.000 personas, de las cuales mueren más del 15%. En África son más de 30 países, con una población de unos 508 millones de personas, los que están expuestos al riesgo. En enero de 2011 la fiebre amarilla reapareció en Uganda por primera vez desde 1972, y ya ha infectado a 178 personas, de las que han muerto 48. Es muy importante vacunarse para evitar la enfermedad. La vacuna es efectiva desde el décimo día tras su administración y sin ella no dejan entrar en muchos países. Queda un camino pedregoso y cuesta arriba por recorrer, pero hay organizaciones y personas que tratan de que se convierta en una autopista que nos lleve a poder ver una infancia no más feliz, pues ya lo es, pero sí más sana, y que estos niños de hoy sean los adultos sanos que puedan sacar adelante a ese continente que, una vez pisado, difícilmente puede olvidarse. 128 M. Tarrés Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación N ovartis Vaccines & Diagnostics La división Novartis Vaccines & Diagnostics es uno de los líderes mundiales en investigación, desarrollo, fabricación y comercialización de vacunas y métodos de diagnóstico en todo el mundo. Esta división inició sus actividades en España y Portugal en 2006 en lo referente a su negocio de Diagnósticos. En 2009 inició las actividades de Vacunas y cambió su denominación social de Chiron Iberia, S.L. por Novartis Vaccines and Diagnostics, S.L., adaptando su objeto social para dar cabida a las dos áreas que se llevan a cabo en la entidad. Vacunas antigripales Actualmente, Novartis Vaccines está entre los mayores productores del mundo de vacunas contra la gripe. Las vacunas antigripales son una franquicia nuclear de la división. La vacunación contra la gripe es una de las intervenciones de salud pública más eficaces, que ahorra complicaciones, incluso la muerte, por esta enfermedad infecciosa, a millones de personas. Los niños pequeños y los ancianos son los más vulnerables a la enfermedad. La vacuna con adyuvante contra la gripe estacional se viene empleando desde hace más de 10 años para aumentar la respuesta inmunitaria en personas de edad avanzada, y ha ayudado a vencer su vulnerabilidad inmunitaria natural y a conseguir una protección eficaz contra la 129 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación gripe. En octubre de 2011, The New England Journal of Medicine publicó los resultados de un ensayo clínico de fase III que ponían de manifiesto que esta vacuna tenía más eficacia clínica que las vacunas convencionales sin adyuvante contra todas las cepas gripales circulantes, en niños de 6 meses a 6 años de edad, y con un perfil de seguridad similar al de las vacunas convencionales sin adyuvante. En el año 2011, Novartis fue el primer fabricante de vacunas para la gripe estacional distribuidas en Estados Unidos, donde se enviaron más de 30 millones de dosis para el periodo 2011-2012. Con cada entrega, los profesionales sanitarios podían ofrecer con la máxima celeridad protección contra la gripe. Novartis continúa colaborando con la Organización Mundial de la Salud (OMS) y con otras organizaciones dando apoyo en la preparación ante una posible pandemia mundial, lo que incluye el acceso a vacunas pandémicas asequibles y equitativas para los países en vías de desarrollo. Vacunas contra la meningitis Según indica la OMS, la meningitis bacteriana causa alrededor de 170.000 muertes al año en todo el mundo. Novartis trabaja para ofrecer vacunas de amplia cobertura que puedan proteger a todos los grupos de edad en riesgo, considerando que casi todos los casos de infección están causados por cinco serogrupos (A, B, C, W135 e Y) y que la distribución de las cepas varía en gran medida con el tiempo y la situación geográfica. Novartis Vaccines ha contribuido a la disminución de la incidencia de esta enfermedad con sus vacunas para la meningitis C y con otra vacuna que permite proteger frente a cuatro tipos de meningitis (A, C, W135 e Y). Por otro lado, continúa trabajando para lograr una vacuna frente a la meningitis B. Gracias a la vacunología inversa, tecnología que utiliza la secuenciación génica para identificar nuevos antígenos, se ha desarrollado una nueva vacuna para este tipo de meningitis. Esta vacuna se presentó a la European Medicines Agency (EMA) en diciembre de 2010 y está pendiente de aprobación. I+ D en Novartis y en Vaccines Con su experiencia científica y un alto grado de innovación tecnológica, el área Vaccines de Novartis es una pieza clave del escenario internacional en la lucha contra las enfermedades infecciosas. 130 M. Tarrés Novartis ha sido pionera en la introducción de la genómica, la bioinformática y la proteómica como componentes esenciales de la ciencia del futuro, y ha contado para ello, cuando ha sido necesario, con la colaboración de los mejores grupos del mundo. La división dispone de centros de investigación en Cambridge, Emeryville (ambos en Estados Unidos) y Siena (Italia). El centro de investigación de vacunas de Cambridge (Massachusetts, Estados Unidos) forma parte de las instalaciones de Novartis en esta ciudad, donde trabajan alrededor de 2000 empleados. Cambridge es, además, la sede central de los Institutos Novartis de Investigación Biomédica (Novartis Institutes for BioMedical Research, NIBR). Las principales líneas de investigación en el área de vacunas son las enfermedades virales causadas por el virus respiratorio sincitial, el citomegalovirus y el virus de la inmunodeficiencia humana. Por su parte, el centro de Emeryville, situado en la Bahía de San Francisco (California, Estados Unidos), es una de las bases de la investigación de la División Vaccines & Diagnostics de Novartis, y uno de los tres centros clave de los NIBR de la investigación mundial en oncología. Del centro de investigación de Siena (Italia) han salido la mayoría de las vacunas que forman parte de la cartera de Novartis. Algunas de las vacunas más innovadoras, disponibles en la actualidad, que han sido concebidas y desarrolladas en los laboratorios de Siena, abarcan desde la nueva vacuna para la gripe A pandémica y estacional adyuvada con MF59® hasta la vacuna conjugada contra el meningococo de tipo C. Instituto de Vacunas para la Salud Mundial Inaugurado en Siena, en febrero de 2008, el Instituto de Vacunas para la Salud Mundial (Novartis Vaccines Institute for Global Health, NVGH) es el primer instituto en todo el mundo que se dedica, sin ánimo de lucro, a investigar sobre nuevas vacunas para prevenir las enfermedades más extendidas en los países en vías de desarrollo. Su localización estratégica en Siena permite que los investigadores utilicen el conocimiento científico y la experiencia del centro de investigación global Novartis Vaccines & Diagnostics, que funciona en esa misma ciudad, aumentando así en gran medida la valía y la velocidad de presentación de estas vacunas. En estos momentos, las actividades de investigación que se llevan a cabo en el NVGH tienen como principal objetivo las vacunas conjugadas para enfermedades intestinales. Este tipo de enfermedades son las que tienen mayor impacto en la salud de 131 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación la población en los países en vías de desarrollo. Las enfermedades diarreicas, con más de 4500 millones de casos, están presentes en todo el mundo. Las áreas iniciales de trabajo están centradas en Salmonella enterica serotipo typhi (S. typhi), Salmonella paratyphi A y salmonelas no tifoideas, que son una causa importante de infección y de enfermedad intestinal, principalmente en la infancia. Pipe li ne La actual cartera de Vaccines & Diagnostics incluye más de 20 productos comercializados y dispone, asimismo, de más de 15 proyectos de posibles nuevos productos, en varias fases de desarrollo clínico. La Unidad de Vacunas pone a disposición de la sociedad y de los profesionales sanitarios vacunas contra la gripe, la meningitis, la rabia, la encefalitis japonesa, la encefalitis transmitida por garrapatas, la infección por Haemophilus influenzae tipo b, la poliomielitis, la difteria, el tétanos y la tos ferina. Estas vacunas permiten la protección de la sociedad frente a infecciones de nuestro entorno, así como la protección del viajero cuando se desplaza a zonas donde existen otras infecciones. Compromiso con los pacientes La responsabilidad social corporativa es parte integral del modo de operar de Novartis y se fundamenta en cuatro pilares: los pacientes, los empleados y sus comunidades, la gestión ética y la protección del medio ambiente. A través de su negocio, la compañía hace una contribución importante a la sociedad: descubrir y desarrollar productos innovadores para el cuidado de la salud y atender a necesidades médicas no cubiertas. Más de 1100 millones de pacientes son tratados cada año con medicamentos y vacunas de Novartis. El objetivo de Novartis es contribuir a mejorar la salud de la población mundial. Para alcanzar este reto, los máximos logros se consiguen en colaboración con otras partes interesadas, como gobiernos, organizaciones no gubernamentales y profesionales médicos. En 2011, más de 89 millones de pacientes sin recursos resultaron beneficiados con los programas de acceso a medicamentos de la compañía, a los que destina un 3% de sus ventas netas, lo que supone una aportación de 1700 millones de dólares. Uno de estos programas es la «Iniciativa contra la malaria», mediante la cual Novartis proporciona su antimalárico, a pre- 132 M. Tarrés cio de coste, a los sistemas de salud pública de más de 60 países en vías de desarrollo. Desde 2001, Novartis ha suministrado más de 500 millones de tratamientos contra la malaria, con los que ha ayudado a salvar un millón de vidas. La «Iniciativa contra la malaria» de Novartis se ha convertido en uno de los mayores programas de acceso a medicamentos de la industria farmacéutica. Sólo en 2011, se entregaron más de 100 millones de tratamientos contra la malaria. Asimismo, Novartis y su socio Medicines for Malaria Venture han suministrado también 100 millones de su antipalúdico pediátrico en 39 países donde la malaria es endémica. Por otro lado, desde el año 2000 Novartis distribuye su tratamiento para la lepra, con el cual se han curado hasta cinco millones de pacientes. La meta es acabar con la lepra, y para lograrlo la compañía ha ampliado su donación de tratamiento multifarmacológico para esta enfermedad hasta el año 2020. Este nuevo compromiso incluye tratamientos por un valor estimado de 22,5 millones de dólares, y hasta 2,5 millones de dólares de ayuda a la OMS para organizar la donación y la logística. Se espera que puedan beneficiarse 850.000 personas. Asimismo, la empresa ha llegado a un acuerdo para donar medio millón de tratamientos contra la tuberculosis sin coste alguno, en cooperación con el Plan Global STOP TB, una iniciativa internacional dirigida a reducir la carga de la tuberculosis como problema de salud pública. En 2009, Novartis renovó su compromiso para donar en los siguientes 3 a 4 años otros 250.000 tratamientos en Tanzania. Otra de las iniciativas de ayuda a los pacientes es el Glivec® International Patient Assistance Program, que desde 2001 ha proporcionado tratamientos para el cáncer a 38.000 pacientes de unos 80 países. Actualmente, estos programas de acceso global oscilan entre la donación completa (mediante la cual Novartis dona el producto) hasta un modelo de contribución compartida (entre gobiernos locales, organizaciones caritativas u otros contribuyentes, que comparten el coste del medicamento con Novartis), y un modelo de pago compartido (Novartis y el paciente comparten el coste de la medicación según una escala móvil, dependiendo de la capacidad de pago del paciente). En el caso de la división de Vaccines & Diagnostics, Novartis colabora, entre otros, con la OMS, la UNICEF, la Organización Panamericana de la Salud (OPS) y la Global Alliance for Vaccines and Immunization para donar vacunas contra enfermedades como la difteria, el tétanos y la poliomielitis. Gracias a estos acuerdos, la compañía suministra aproximadamente 320 millones de dosis de su vacuna contra la polio a UNICEF y la OPS para que sean distribuidas en países en vías de desarrollo. 133 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación Novartis también continúa ampliando el acceso a la asistencia sanitaria en India con la incorporación de su vacuna antirrábica a la cartera de productos de Arogya Parivar, una iniciativa social que Novartis lleva a cabo en zonas rurales del país. A través de la Fundación Novartis para el Desarrollo Sostenible (Novartis Foundation for Sustainable Development, NFSD), Novartis se establece como líder de la función que las compañías pueden desempeñar en la protección y la promoción de los derechos humanos, y actualmente está centrada en la consecución los «Objetivos de desarrollo del milenio» relacionados con la salud. Las actividades que lleva a cabo la Fundación forman parte de las acciones de responsabilidad empresarial de Novartis, que financia las operaciones de la Fundación. Creada hace más de 30 años, actúa con independencia de los intereses económicos de la compañía. La NFSD establece un puente entre Novartis y el resto del mundo preocupado por el desarrollo sostenible, que facilita el diálogo entre el sector privado, el estado y la sociedad civil, e impulsa la innovación y el desarrollo de conceptos vanguardistas para abordar conjuntamente la mejora de la situación de salud de las personas en todo el mundo. CÓMO P O DEM O S HAC E R U N A C O M U NI CAC I Ó N P RO F E S I O N A L Y Ú T IL EN S ALU D La salud es una de las principales demandas y preocupaciones de los ciudadanos, y la mejor respuesta a esta demanda consiste en proporcionar una mayor y mejor información sobre salud, ya que nos encontramos ante un público cada vez más informado y formado. Comunicar a la sociedad todo aquello que está relacionado con su calidad de vida y su salud requiere excelencia, profesionalidad, devoción, pasión y responsabilidad, puesto que desde la sociedad se nos demanda información precisa, rigurosa y accesible. En relación a los temas sanitarios, los medios de comunicación de­ sempeñan dos funciones principales: pueden interpretar para el público la información científica y las políticas gubernamentales, y al mismo tiempo reflejar las preocupaciones de la sociedad. Los periodistas demandan, cada vez más, un conocimiento profundo, especializado y preciso de los asuntos que marcan la actualidad diaria sanitaria y asistencial, por lo que desde las instituciones que trabajan en salud (compañías, instituciones sanitarias u organizaciones que trabajan 134 M. Tarrés en el sector salud) debe facilitarse a los medios la información de manera que puedan descodificarla y darle un carácter divulgativo y accesible para la sociedad. Desde una organización, cuando hablamos de salud es importante el valor añadido que aportamos a las comunicaciones, porque hablamos de ciencia, de innovación, del valor del medicamento. Es necesario hablar de ese valor más allá de la actividad empresarial, y ayudar a desarrollar y cuidar la imagen del sector. Hay que trabajar no sólo aisladamente sino también como sector, y hacerlo también de la mano de las instituciones que rodean a este campo. Es en esta línea en la que debemos trazar un camino para que la salud y la medicina no sólo se integren en la actualidad noticiosa, sino que lo hagan, al menos, con una mayor especialización y elaboración de la información. Peculiaridades de la industria farmacéutica Particularmente en el entorno de la industria farmacéutica, la comunicación está, además, sujeta a una normativa y un marco legal que rige su actividad informativa. En un primer nivel tenemos el Código Español de Buenas Prácticas de Promoción de Medicamentos, de Farmaindustria, un código de autorregulación de las relaciones de las compañías farmacéuticas con los profesionales sanitarios y con las asociaciones de pacientes por el que cualquier acción de información/concienciación dirigida a población general requiere estrictos controles de aprobación; por ejemplo, no se puede informar utilizando la marca comercial de un medicamento en aquellas comunicaciones que vayan dirigidas a la población general. En un segundo nivel encontramos, en el caso de Novartis, los propios códigos deontológicos internos, como el Código de Conducta, un referente para una conducta adecuada y para fijar las reglas, para tratar con nuestros colaboradores, clientes, proveedores, autoridades y público en general, así como para establecer unas condiciones de trabajo atractivas y para proteger los activos e intereses de Novartis. Comunicación, información y publicidad Ya en la historia de la comunicación se usaba una frase que intentaba definir no sólo la comunicación sino también todo el proceso informativo: «hacerlo bien y hacerlo saber». Hoy día quizás nos parezca un poco 135 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación denodada, pero en esencia es válida. Abundando en ello, comunicar es hacer saber lo que uno es, lo que representa, cuál es su imagen y cómo la proyecta. La comunicación es un concepto global que implica entender las necesidades de cada uno de nuestros grupos de interés (stakeholders), saber dar respuesta a ellas de una manera específica y sincrónica trasladando nuestro posicionamiento y mensajes clave a través de los medios más adecuados, que pueden ser medios de comunicación o no, y todo ello con la intención de mejorar y cuidar la reputación de la organización. Así pues, la comunicación tiene como objetivo informar a través de evidencias contrastadas sobre las características y las bondades de un producto o servicio, mientras que el objetivo de la publicidad es persuadir y generar una necesidad en el cliente mediante la puesta de manifiesto de una serie de atributos vinculados a la marca, con unas técnicas muy determinadas y específicas. Ningún proyecto de comunicación que se precie puede basarse exclusivamente en una acción publicitaria; en todo caso, un proyecto integral de comunicación deberá plantear un plan de acción que contemple a su vez el uso estratégico de la publicidad, ordenada ésta de forma eficaz, efectiva, eficiente y sincrónica con las iniciativas de comunicación que de él se deriven. Un aspecto a tener en cuenta especialmente en el ámbito de la comunicación es el del marco de referencia de globalización y evolución (o revolución) organizativa que nos toca vivir. Hemos pasado del concepto estático de marca, en el que predominaba la comunicación de las bondades del producto o servicio, al concepto dinámico en el cual no priman sólo los aspectos vinculados a aquello que hacemos o producimos, sino que a su vez se contemplan otros dinamizadores intangibles que los refuerzan y dan cohesión, y en estos aspectos la comunicación en especial, pero también la publicidad, se plantean como ejes clave de alto valor añadido en este nuevo contexto. La comunicación es una especialidad multidisciplinaria que integra toda una serie de conocimientos y habilidades propias. La «teoría de la comunicación» nos lleva de la mano a un contexto más pragmático, que trata de que el profesional adquiera los conocimientos necesarios para desarrollar una función que poco a poco va adquiriendo un carácter estratégico, clave en las organizaciones, y que a su vez se erige como vehículo informativo de una sociedad moderna y globalizada, a través de los ingentes medios de comunicación que nos rodean. 136 M. Tarrés Tengamos en cuenta que la comunicación, desde un punto de vista global, adquiere carta de naturaleza cuando en ella se consolidan prácticas como: •• Participar en la génesis del proyecto de una organización o institución y en su plan estratégico. •• Contribuir a la definición de la cultura corporativa y a la gestión de su reputación. •• Interpretar la política institucional y convertirla en estrategia, que será ejecutada y comunicada tanto externamente como en el ámbito interno a los diferentes grupos de interés. •• Gestionar de forma coordinada con otras áreas las relaciones de la empresa con sus principales stakeholders. •• Implicar a los diferentes responsables en la comprensión de la misión, la visión y los objetivos de la organización. •• Planificar, desarrollar e implantar el plan estratégico de comunicación y ejercer su supervisión y control. La comunicación en salud puede compartir el conocimiento, facilitar el entendimiento de temas, mejorar la salud de muchas personas y gestionar una crisis; sin embargo, no puede ni debe vender productos, incumplir leyes o prever una crisis. Comunicación especializada (caso Novartis) En un entorno corporativo, la comunicación se basa en la imagen, en la identidad de la compañía que define la esencia de lo que es y en los procesos de comunicación que establece para proyectar dicha imagen. La identidad de la empresa, su cultura, el sistema relacional y la comunicación son las piezas clave de la nueva gestión. En el caso concreto de Novartis, la comunicación en vacunas es un soporte para los objetivos de la organización. Desarrolla e implementa la política de información y comunicación para los públicos internos y externos, y coordina, consolida y da soporte en la implementación de políticas de reputación, responsabilidad social y transparencia. En el departamento de comunicación se detectan y canalizan las oportunidades informativas y se mantienen las relaciones con grupos de interés, además de gestionar todas aquellas actividades relacionadas con la comunicación, los medios y los canales de información. 137 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación Para llevar a cabo una comunicación eficaz y profesional dentro de una organización, es necesario proporcionar un valor añadido a la comunicación con innovación y confianza; realizar una comunicación 360º multicanal (sin pensar únicamente en la prensa escrita); y mantener un compromiso y una colaboración con las fuentes de información (sociedades científicas, organizaciones académicas, revistas de referencia, asociaciones de pacientes, gestores de hospitales y profesionales sanitarios). Todo ello con el apoyo de los medios de comunicación, adaptando las comunicaciones a los diferentes medios con estrategias diferenciales en función de las audiencias y de las necesidades de cada canal. En este nuevo entorno comunicacional son determinantes las nuevas tecnologías de la comunicación, con el uso de Internet, e-comunicación, oficina virtual de prensa, dossiers electrónicos, retransmisiones vía satélite o aplicaciones específicas para smartphones y tablets. Los pasos a seguir para realizar una comunicación eficaz son: 1) Tener la voluntad de comunicar. 2) Tener un gabinete de prensa o responsable de comunicación profesional. 3) Detectar oportunidades de comunicación. 4) Definir unos objetivos, una estrategia y un plan. 5) Implementar el plan de comunicación. 6) Elaborar materiales adecuados y específicos. 7) Utilizar los canales adecuados. 8) Coherencia, consistencia y perseverancia. 9) Seguimiento de actividades y evaluación. El gabinete de prensa Los gabinetes de prensa de las corporaciones deben ser profesionales, atender en tempo las demandas y procurar el flujo de diálogo y entendimiento en ambos sentidos. Deben saber ofrecer contenidos novedosos, interesantes y entendibles, buscar oportunidades de relación y conseguir que desde los propios medios se les vea como interlocutores válidos. Los gabinetes de prensa (tanto los integrados como los externos) dependerán directamente, dentro de la estructura organizativa, del primer nivel de dirección, apoyarán la gestión del resto de los departamentos y actua- 138 M. Tarrés rán como soporte fundamental en las acciones de comunicación interna y marketing. Esta buena posición permitirá disponer de la información necesaria para satisfacer las demandas de los medios. El gabinete de prensa debe elaborar materiales específicos para los medios, tales como dossiers o carpetas con información de interés y utilidad; realizar comunicados de prensa de forma periodística y con contenido noticiable; facilitar entrevistas con directivos capaces de transmitir mensajes; facilitar material audiovisual; mantener actualizado el contenido de la web corporativa, etc. La relación del gabinete de prensa con los medios debe basarse en la confianza, el respeto mutuo y en el entendimiento del saber hacer de unos y otros. Desde el gabinete de prensa o el área de comunicación de una organización hay que aportar el valor añadido suficiente a la organización en que se enmarca. El plan de comunicación es una herramienta indispensable para el desarrollo de una estrategia acorde con los objetivos planteados por la institución de que se trate. El plan de comunicación El plan de comunicación es el planteamiento profesional de la comunicación asumido por toda la corporación como valor añadido, e integrado en el plan estratégico de ésta. Su ejecución debe contar con un buen equipo gestor, y éste a su vez con la confianza de la organización, y ha de establecer unos objetivos y una forma de validar los resultados. Implica un pensamiento creativo, para lo cual hay que abstenerse del empeño de querer tener razón (el pensamiento lateral no busca para sí la razón, sino las nuevas ideas que surgen de los cerebros alentados por la creatividad). El brainstorming (tormenta de ideas) es una excelente herramienta de trabajo, que implica que los participantes se sientan libres, sin inhibiciones, para decir lo que se les antoje sin temer la crítica ni la evaluación. El ámbito de actuación de un plan de comunicación viene determinado tanto por el contexto externo de la organización como por el interno; es más, ambos entornos son sinérgicos e interactúan sobre los mismos sustratos, con algunos matices diferenciales determinados por las características y las necesidades expuestas por los diferentes stakeholders sobre los que interactúan ambos. No hemos de perder de vista que el refuerzo organizativo tiene que ser uno de los elementos básicos de actuación de un plan de comunicación interna. 139 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación El plan de comunicación debe comenzar por un ejercicio de análisis estratégico de la situación de la organización en todas sus dimensiones, así como por una descripción reflexiva de la situación del entorno y del mercado en todas sus extensiones, considerando las tendencias emergentes que de él se derivan. A continuación resulta imprescindible desarrollar un análisis DAFO en el cual se plasmen las Debilidades, las Amenazas, las Fortalezas y las Oportunidades (Strengths, Weaknesses, Opportunities, Threatens [SWOT]), todo ello para considerar los riesgos a los que nos enfrentamos, tratando de minimizarlos, y para aprovechar aquellas situaciones ventajosas que puede ofrecernos nuestro entorno o la propia disposición de la organización. Una vez definido este análisis estratégico, la siguiente fase del plan de comunicación corresponde al establecimiento de objetivos y prioridades que hagan factible el adecuado desarrollo de la organización, en un contexto de alineamiento estratégico con su misión, su visión y sus objetivos globales; teniendo en cuenta que estos objetivos han de ser concretos, específicos, cuantificables, medibles y por supuesto alcanzables, es decir, realistas. Para la óptima consecución de estos objetivos será necesario plantearse una serie de estrategias, que de alguna forma definirán la forma y el modo de conseguir los objetivos. Podríamos decir que mientras los objetivos representan el «qué», la estrategia viene representada por el «cómo» y las primeras fases del plan justificarían el «por qué». Una vez definida la estrategia, la siguiente fase del plan es la parte más operativa, que consiste en definir el plan de acción, las actividades que vamos a desarrollar para, mediante la estrategia planteada, conseguir alcanzar los objetivos estipulados. Este plan de acción también debe ser muy concreto, con asignación de responsabilidades claras, unos plazos de tiempo bien definidos y un ajuste realista a los presupuestos de que dispongamos. Para finalizar, un aspecto muy importante de todo plan de comunicación es definir los parámetros de medida con los cuales va a ser evaluado. Es muy importante determinar los indicadores clave que van a hacer medible dicho plan; han de ser especialmente concretos, tanto desde un punto de vista cuantitativo como desde una aproximación cualitativa. La observación periódica de la evolución de dichos indicadores (KPI, Key Performance Indicators) será la que nos determinará el grado de desarrollo e implantación de nuestro plan. Hay que tener en cuenta que toda planificación estratégica requiere un seguimiento para implantar las medidas correctoras necesarias, teniendo 140 M. Tarrés en cuenta que el plan de comunicación es un proceso de mejora continua al cual pueden aplicarse los criterios de calidad total. Una vez concluida esta fase, la parte final del proceso es el análisis global de los resultados alcanzados, para de nuevo aplicar las medidas correctoras necesarias de cara al próximo ejercicio o etapa. C ÓMO PO DEM O S HAC E R U N A COMU NICAC IÓ N P R O FE S I O N A L Y Ú TIL EN VAC U NA S El proceso de comunicación en el ámbito concreto de las vacunas se ciñe a los aspectos hasta ahora comentados, aplicando las especificaciones propias de esta área. Las líneas de trabajo en comunicación para el área de vacunas implican apoyar a las sociedades científicas en sus logros obtenidos, dando ­visibilidad a expertos de referencia, consolidando grupos de trabajo multidisciplinarios formados por expertos tanto del ámbito científico como del ámbito de la comunicación que faciliten la difusión de evidencias científicas y las publicaciones. Asimismo, es imprescindible que las actividades se centren en realizar una función educadora y de sensibilización del valor de la vacunación para la sociedad, con campañas de concienciación e informativas. Podemos establecer un plan de comunicación corporativo o institucional en un marco que englobe toda la batería de públicos objetivos, o profundizar en temas específicos en función de las necesidades de los diferentes colectivos implicados y de la sociedad, o ambas estrategias. Si nos centramos en el área de vacunas, nuestros públicos de referencia serían las instituciones, los gestores y decisores, las asociaciones de pacientes, los profesionales sanitarios, las sociedades científicas, los investigadores, las organizaciones no gubernamentales y los medios de comunicación; todos ellos por su interés o necesidades de información para la toma de decisiones en relación a procesos de salud. En general, los mensajes deberían ser sólidos, adaptados al momento y a las necesidades de información, y bajo la perspectiva de mejorar la salud de la población y de prevenir, en el caso de las vacunas, enfermedades en muchos casos evitables. Las fuentes y los apoyos para las oportunidades de comunicación en vacunas no difieren de las del entorno general de la salud. Pero en el caso concreto de las vacunas hay que hacer especial énfasis en el apoyo comunicacional a los profesionales en su empeño y quehacer diarios. 141 Vacunas e industria farmacéutica: compromiso de Novartis en la comunicación La comunicación dentro del campo de las vacunas es de interés social, ya que hay una demanda de información latente en la población y puede beneficiar a muchas personas. Las oportunidades de comunicación están ahí, y disponemos de todas las herramientas necesarias y del interés por comunicar de todas las partes implicadas. 142 Progresos en vacunología S. Sialer y A. Torres Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN introducci Ó n La enfermedad neumocócica invasiva se define como una infección confirmada por el aislamiento de Streptococcus pneumoniae en un medio normalmente estéril (1-3). S. pneumoniae es un diplococo grampositivo que se caracteriza por presentar una delgada cápsula de polisacáridos que le protege del sistema inmunitario humano (1, 2). Aunque hay más de 90 serotipos distintos y su prevalencia varía según las regiones, sólo diez son los causantes de más de dos tercios de esta enfermedad en el mundo. S. pneumoniae es una importante y bien conocida causa de bacteriemia tanto en personas inmunodeprimidas como inmunocompetentes (4-6). La importancia de esta infección y de sus complicaciones es bien conocida. Los cambios periódicos en los serotipos hacen que sigan realizándose estudios en todo el mundo, entre ellos el llevado a cabo en nueve hospitales de España, un estudio epidemiológico prospectivo de vigilancia hospitalaria de la enfermedad neumocócica invasiva, denominado estudio ODIN. En el estudio ODIN se han incluido pacientes mayores de 18 años hospitalizados con diagnóstico de enfermedad neumocócica invasiva, confirmada por el aislamiento de S. pneumoniae en cultivo. Se realizaron estudios de serotipificación y sensibilidad antibiótica, así como de biología molecular, de las cepas de neumococo aisladas. Se revisó la historia clínica de los pa- 145 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN cientes incluidos y se realizó seguimiento hasta 90 días después del alta en caso de resolución incompleta de la enfermedad (7). Revisaremos brevemente la enfermedad neumocócica invasiva en los adultos (factores de riesgo, formas clínicas, serotipos y coberturas vacunales) y comentaremos algunos de los datos preliminares del estudio ODIN. Factores de riesgo La incidencia de la enfermedad neumocócica invasiva en cualquier población dependerá de su localización geográfica, la estación del año, el serotipo prevalente, la edad y el estado vacunal de la población. En Estados Unidos, la incidencia de enfermedad neumocócica invasiva ha declinado desde la introducción y el uso extendido de la vacuna conjugada neumocócica en los niños. Desde el inicio de la vacunación sistemática se ha observado una disminución significativa en la incidencia de la enfermedad neumocócica invasiva en los niños menores de 5 años (el grupo de edad seleccionado para la vacunación), así como en los niños mayores y los adultos. Sin embargo, se ha observado un incremento de la enfermedad causada por los serotipos de neumococo no incluidos en la vacuna (5, 6, 8). Los datos preliminares del estudio ODIN muestran que el intervalo de edad de los pacientes incluidos fue de 19 a 95 años, con una media de 62,17 años de edad, y un 32% eran mayores de 75 años. El 58% de los pacientes (N = 111) eran hombres y el 42% (N = 80) mujeres. No se observaron diferencias estadísticamente significativas en la edad de los pacientes en función del sexo. El 92% (N = 176) eran de nacionalidad española (7). La incidencia de enfermedad neumocócica invasiva se incrementa en los pacientes con ciertas condiciones médicas o factores de riesgo, como edades extremas (<2 o ≥65 años), ciertos grupos raciales/étnicos (descendientes de africanos, de indios americanos, de aborígenes australianos o de nativos de Alaska), comorbilidad (pulmonar, neurológica, hepática o renal [insuficiencia renal o síndrome nefrótico], diabetes mellitus), alcoholismo, tabaquismo, condiciones inmunosupresoras (asplenia, infección por el virus de la inmunodeficiencia humana [VIH], anemia de células falciformes) o anormalidades anatómicas (fístula de líquido cefalorraquídeo, implante coclear, enfermedad cardiaca congénita) (2, 3, 5, 8). En el estudio ODIN se observó que la presencia de comorbilidad fue significativamente superior a medida que aumentaba la edad de los pacientes (p <0,05). El 93% (N = 178) de los pacientes estudiados presentaban al menos una de las afecciones mostradas en la Figura 1 (7). 146 S. Sialer y A. Torres n ≥18 y ≤49 años n ≥50 y ≤64 años n ≥65 y ≤74 años n ≥75 años N = 178 (93%) Tabaquismo Neumonía previa Hepatopatía crónica Neoplasia EPOC Diabetes mellitus Insuficiencia cardiaca Infección por VIH Ictus Alcoholismo Asma Insuficiencia renal crónica Sida Tratamiento inmunosupresor Esplenectomizado Inmunodeficiencia 0 5 10 15 20 25 30 35 40 45 50 55 60 65 Nº pacientes Figura 1. Distribución de los pacientes según la presencia de factores de riesgo (tabaquismo/alcoholismo) y enfermedades concomitantes (al menos una). En diversos estudios se ha observado una asociación entre enfermedad neumocócica invasiva y exposición a los virus respiratorios comunes durante los meses de invierno. El riesgo de desarrollar enfermedad neumocócica invasiva parece ir asociado a la presencia de una enfermedad respiratoria viral, como gripe o infección por el virus respiratorio sincitial (VRS) (1, 6, 10). La infección por el VIH incrementa sustancialmente el riesgo de enfermedad neumocócica invasiva, en particular en aquellos pacientes con un recuento de CD4 <200 células/mm3. Los pacientes infectados por el VIH, sobre todo los que no reciben tratamiento antirretroviral efectivo, se encuentran en riesgo de presentar enfermedad neumocócica invasiva recurrente. Se ha reportado que la mayoría de las infecciones neumocócicas invasivas recurrentes en estos pacientes se deben a serotipos diferentes al del episodio inicial (1, 2, 11). En el estudio ODIN, la presencia de comorbilidad aumenta significativamente con la edad. El antecedente personal más importante para padecer una enfermedad neumocócica invasiva, después del tabaquismo, es la neumonía previa, seguida de la enfermedad pulmonar obstructiva crónica (EPOC) y la insuficiencia cardiaca en los pacientes mayores de 75 años, la 147 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN n Neumonía previa n EPOC n Hepatopatía crónica n Diabetes mellitus n Hospitalización ≤2 meses n Insuficiencia cardiaca n Neoplasia n Infección por VIH 15 Nº pacientes 10 5 0 Neumonía no complicada Neumonía complicada Meningitis Bacteriemia sin foco Sepsis Peritonitis Otras Figura 2. Análisis de la comorbilidad según la forma más relevante de presentación. neoplasia y la hepatopatía crónica en los de 50 a 64 años de edad, y la infección por el VIH, que es más frecuente en los pacientes entre 18 y 49 años de edad. En el caso de la meningitis y de la peritonitis, la comorbilidad más frecuentemente asociada es la hepatopatía crónica (Fig. 2). El antecedente de neoplasia se relaciona con bacteriemia sin foco y sepsis (7). La tasa de letalidad entre los pacientes del estudio ODIN fue del 14%, mayor en aquellos con más de 75 años de edad (21%) y entre 50 y 64 años de edad (18%) (7). Formas clínicas Las manifestaciones clínicas de la infección neumocócica invasiva dependerán del lugar primario de infección y de la presencia o ausencia de bacteriemia. La más frecuente complicación grave asociada con bacteriemia neumocócica es la meningitis neumocócica. A pesar del tratamiento antimicrobiano apropiado, la meningitis neumocócica tiene una mortalidad del 20% al 30% (2, 3, 11). La endocarditis neumocócica y otras complicaciones como la artritis neumocócica, la ileítis y la pericarditis, eran mucho más comunes en la era 148 S. Sialer y A. Torres preantibiótica. La tríada clínica descrita por Robert Austrian en 1957 en los pacientes con endocarditis neumocócica (endocarditis neumocócica, meningitis y neumonía) actualmente rara vez se ve. Desde el descubrimiento de la penicilina, S. pneumoniae ha sido la causa de menos del 3% de todos los casos de endocarditis en válvula nativa (2, 3, 9, 11). Otras complicaciones, como la pericarditis purulenta, la artritis séptica, la osteomielitis y los abscesos epidurales o cerebrales por S. pneumoniae, se presentan muy pocas veces y sólo se reportan como casos aislados o pequeñas series. Estas infecciones pueden ocurrir con o sin bacteriemia concurrente o recientemente detectada (2, 8, 11). A pesar de su rareza, siguen comunicándose casos esporádicos. Por tanto, es de destacar que S. pneumoniae puede causar infecciones supurativas en casi cualquier lugar. Estas infecciones localizadas pueden seguir a un episodio de bacteriemia neumocócica u ocurrir simultáneamente (11). En el estudio ODIN, el 71% de las enfermedades neumocócicas invasivas que requirieron hospitalización eran neumonías invasivas. Las formas complicadas pulmonares fueron más frecuentes entre los menores de 75 años. En los pacientes del estudio, la causa más habitual de ingreso en la unidad de cuidados intensivos (UCI) fue la meningitis (N = 12). La estancia media en la UCI fue menor (p <0,05) para las neumonías no complicadas (6,6 días) y las meningitis (8,67 días) que para el resto de los pacientes que requirieron ingreso en ella (7). U so de vacunas para prevenir la infección neumocócica en adultos Las primeras vacunas para prevenir las infecciones neumocócicas fueron desarrolladas por Sir Almroth Wright en 1911. Consistían en preparaciones crudas de bacterias muertas. El descubrimiento de que los anticuerpos contra los polisacáridos capsulares purificados de la superficie del neumococo protegían de la infección llevó al desarrollo de vacunas de polisacáridos que se comercializaron en la década de 1940. Estas vacunas no tuvieron éxito comercial debido a la aparición de los antibióticos, pues se creyó que las infecciones neumocócicas ya no eran una amenaza. Posteriormente se evidenció que a pesar del tratamiento con antibióticos persistía una morbilidad importante por infecciones neumocócicas, así como una mortalidad del 25% al 30% en los pacientes con enfermedad neumocócica invasiva (5, 8, 12). El desarrollo de una vacuna efectiva era sumamente difícil, debido a la baja inmunogenicidad de los polisacáridos y a la gran diversidad de los 149 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN serotipos de neumococo, por lo que se desarrollaron vacunas que indujeran anticuerpos contra múltiples antígenos capsulares. El desarrollo de vacunas de polisacáridos de neumococo para adultos y la eficacia de las va­cunas conjugadas de proteínas de polisacáridos en los niños han confirmado que la inmunidad activa a los polisacáridos puede brindar una protección adecuada contra la enfermedad neumocócica invasiva del mismo serotipo, y en algunos casos protección cruzada contra otros serotipos del mismo serogrupo. La vacunación de los grupos de alto riesgo, además de la protección individual, reduce la colonización nasofaríngea por los serotipos relacionados con la vacuna (4, 6, 13). En 1977 se aprobó en Estados Unidos una vacuna de polisacáridos que contenía 14 de los más de 90 serotipos de neumococo causantes de alrededor del 80% de las enfermedades invasivas por neumococo en ese país (8, 12, 14). En 1983 se introdujo la actual formulación más amplia de la vacuna, que contiene polisacáridos de 23 serotipos de neumococo (PPV23). La elección de los serotipos se realizó para abarcar los principales que habían desarrollado resistencia y los más virulentos. La vacuna cubría un 85% a 90% de los serotipos causantes de enfermedad neumocócica invasiva (7, 12, 14). Aunque hay buena evidencia de que la PPV23 tiene por lo menos una moderada eficacia en la prevención de la enfermedad neumocócica invasiva, su eficacia para prevenir la neumonía neumocócica no bacteriémica no es consistente (4, 12). Los polisacáridos capsulares de que se compone la PPV23 son inmunógenos e independientes de las células T, para los cuales los niños menores de 2 años no tienen una respuesta inmunitaria adecuada. En las vacunas conjugadas, cada uno de los polisacáridos capsulares está unido (conjugado) a una proteína transportadora. Estos antígenos polisacáridos conjugados son procesados como inmunógenos dependientes de las células T, que provocan una fuerte respuesta inmunitaria y establecen memoria inmunitaria, por lo que tienen capacidad de inducir refuerzo en caso de reexposición de los antígenos, con lo cual se produce una respuesta inmunitaria eficaz tanto en los niños menores de 2 años como en los adultos (4, 8, 15). Distribución de serotipos y coberturas vacunales En la actualidad se conocen 46 serogrupos y 93 serotipos capsulares de neumococo; los últimos documentados son los serotipos 6C, 6D y 11E. 150 S. Sialer y A. Torres Esto hace que sea imposible manufacturar una vacuna polisacárida completa, y por ello se han desarrollado vacunas que incluyen un subgrupo de los serotipos más prevalentes (3, 12, 18). Aproximadamente 20 serotipos de S. pneumoniae son los causantes de más del 80% de los casos de enfermedad neumocócica invasiva, pero son 13 los más comunes y la causa del 70% al 75% de los casos de enfermedad neumocócica invasiva en los niños en todo el mundo (12, 18). La vacuna neumocócica polisacárida actualmente disponible incluye 23 antígenos polisacáridos capsulares purificados (serotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F y 33F). Cada 0,5 ml de vacuna contiene 25 µg de cada antígeno de polisacárido capsular disueltos en una solución salina isotónica con fenol (al 0,25%) o timerosal (al 0,01%) como conservante (la vacuna no incluye adyuvante). Estos serotipos fueron elegidos por representar entre el 85% y el 90% de los que causan enfermedad invasiva en Estados Unidos (3, 12, 19). La vacunación primaria y la revacunación con la PPV23 induce una respuesta persistente de anticuerpos en los adultos. Numerosos estudios han demostrado que protege contra la enfermedad neumocócica invasiva y sus complicaciones, como la bacteriemia y la meningitis. Sin embargo, hay datos contradictorios respecto a su eficacia para la prevención de la neumonía neumocócica (4, 7, 17, 20). Un metaanálisis realizado por el grupo Cochrane en 2008 evaluó la eficacia de la PPV23 para prevenir la infección neumocócica en los adultos y halló una fuerte evidencia de su eficacia frente a la enfermedad neumocócica invasiva, evidencia inconclusa respecto a la eficacia contra todas las causas de neumonía, y ninguna reducción en todas las causas de mortalidad (12). La PPV23 se recomienda actualmente para la vacunación sistemática en los adultos ≥50 años de edad y en los niños ≥2 años de edad en ciertas situaciones de alto riesgo de infección neumocócica. El Advisory Committee on Immunization Practices (ACIP) de Estados Unidos recomienda la vacunación sistemática de todos los adultos mayores de 65 años sin antecedentes de vacunación (administrar una dosis única); de las personas entre 2 y 18 años de edad con comorbilidad de alto riesgo, como enfermedad cardiaca crónica (en especial enfermedad cardiaca cianótica congénita e insuficiencia cardiaca), enfermedad pulmonar crónica (incluyendo asma tratada con altas dosis de corticosteroides orales), diabetes mellitus, portadores de un implante coclear, con fístula crónica de líquido cefalorraquídeo, asplenia funcional o anatómica, e inmunodeprimidos incluyendo inmunodeficien- 151 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN cia congénita; y de los adultos entre 19 y 64 años de edad con condiciones de alto riesgo, como enfermedad cardiaca crónica (incluyendo insuficiencia cardiaca y cardiomiopatía, y excluyendo hipertensión), enfermedad pulmonar crónica (incluyendo EPOC, enfisema y asma), fumadores, alcohólicos, con enfermedad hepática crónica (incluyendo cirrosis) o institucionalizados (5, 13, 16). Las recomendaciones actuales para la revacunación incluyen una dosis después de 5 años en las personas con asplenia funcional o anatómica, y en los inmunodeprimidos. Los vacunados antes de los 65 años de edad por cualquier indicación deben recibir otra dosis de vacuna al llegar a esa edad o después si al menos han pasado 5 años desde la dosis previa. Los que se vacunan pasados los 65 años de edad deben recibir una dosis única (6, 14, 15). Si bien la PPV23 es la única vacuna neumocócica polisacárida que se recomienda en los adultos, hay interés por el beneficio de una vacuna antineumocócica conjugada en adultos, ya sea sola o como parte de un régimen de inducción-refuerzo con PPV23 (4, 12, 20). Las vacunas antineumocócicas conjugadas se desarrollaron pensando en la inmunogenicidad de los niños menores de 2 años, la conveniencia de lograr un efecto de refuerzo sobre la revacunación, la erradicación de la enfermedad invasiva y la eliminación de la condición de portador. Se busca generar una respuesta inmunitaria incluyendo una proteína en la preparación del antígeno, con lo que se genera una respuesta de memoria dependiente de las células T (4, 6, 10, 21). La vacuna conjugada heptavalente (PCV7) fue aprobada en Estados Unidos en el año 2000. Contiene los serotipos 4, 6B, 9V, 14, 18C, 19F y 23F, que son individualmente conjugados con una proteína transportadora. Esta vacuna ofrece un óptimo grado de protección contra la enfermedad invasiva, con porcentajes de eficacia cercanos al 90%. Fue aprobada para niños menores de 2 años y para niños menores de 5 años con alto riesgo de enfermedad neumocócica invasiva (p. ej., anemia de células falciformes, infección por el VIH y otras condiciones inmunosupresoras o enfermedades crónicas) (4-8). El uso sistemático de la PCV7 ha dado como resultado no sólo la reducción de la enfermedad neumocócica invasiva en los niños, sino también la disminución de la frecuencia de enfermedad neumocócica en los adultos. Este resultado demuestra un efecto directo, o efecto de rebaño, en la transmisión de la bacteria de niños a adultos, probablemente por la disminución de los portadores en la nasofaringe (4, 12). 152 S. Sialer y A. Torres A pesar del éxito de la PCV7, los estudios demostraron un aumento en la incidencia de enfermedad neumocócica invasiva por los serotipos no incluidos en la vacuna. La erradicación de los serotipos vacunales en los portadores sanos creó un nicho ecológico para los serotipos no incluidos en la vacuna. Estos serotipos, llamados de reemplazo, son 1, 3, 5, 6A, 6C, 7F, 12F, 19A y 22F. Los serotipos de reemplazo pueden llevar a un incremento en la prevalencia de los serotipos ya presentes en la población, o a la aparición y la diseminación de otros previamente ausentes (4, 12, 13, 22). En 2010, una nueva vacuna neumocócica conjugada 13-valente (PCV13) fue aprobada por la Food and Drugs Administration (FDA) de Estados Unidos para prevenir la infección neumocócica invasiva en los niños. La PVC13 contiene polisacáridos capsulares de los serotipos 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F, individualmente conjugados con una proteína de reacción cruzada. Contiene 2,2 µg de cada uno de 12 polisacáridos y aproximadamente 4,4 µg del polisacárido del serotipo 6B (4, 5, 13). La PCV13 está desarrollada y manufacturada usando el mismo proceso que la PCV7. Fue aprobada para su uso en niños a partir de 6 semanas y hasta 5 años de edad reemplazando a la PCV7, y en adultos a partir de los 50 años de edad. La FDA la aprobó basándose en estudios que demostraban una seguridad y una capacidad para obtener anticuerpos protectores contra la enfermedad neumocócica invasiva comparables a las de la PVC7, y esta respuesta de anticuerpos inducidos por la PCV13 era comparable o superior a la inducida por la PPV23. La PCV13 parece tener un perfil de seguridad similar al de la PPV23 (4, 8, 13). La PVC13 se recomienda actualmente para la vacunación sistemática en los niños contra la infección y la otitis media causadas por los serotipos de S. pneumoniae incluidos en ella, y en los adultos a partir de los 50 años de edad contra la neumonía neumocócica y la enfermedad neumócica invasiva causadas por los serotipos incluidos. El ACIP recomienda la vacunación sistemática para todos los niños entre 2 y 59 meses de edad, para los niños entre 60 y 71 meses de edad con condiciones médicas subyacentes (portadores de implante coclear, con asplenia anatómica o funcional, inmunodepresión, enfermedad crónica [excluyendo el asma a no ser que se trate con altas dosis de corticosteroides orales]), para los niños que recibieron al menos una dosis de PCV7, y para aquellos entre 6 y 18 años de edad con riesgo aumentado de enfermedad neumocócica invasiva (asplenia anatómica o funcional, inmunodepresión, portadores de implante coclear o con fístula crónica de líquido cefalorraquídeo). No está indicado su uso en niños sanos mayores de 5 años (4, 6, 16, 17, 20). 153 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN PCV13 (101 casos, 52,87%) + 6C (11 casos, 5,75%) 112 casos (58,63%) 25 20 PPV 23-no PCV13 35 casos (18,32%) Nº casos 15 No PPV 23-ni 6C ni 6A 44 casos (23,02%) 10 5 0 3 19A 7F 1 6C 14 4 19F 6B 6A 9V 23F 18C 8 22F 9N 10A 12F 33F 20 17F 15B 16F 24F 15A 35B 23A 38 34 31 35F 11F 28 23B 21 11D Serotipos Figura 3. Distribución por serotipos de los casos de enfermedad neumocócica invasiva (N = 191). En el estudio ODIN se han observado diferencias respecto a los serotipos más prevalentes según la edad: el serotipo 7F presentó mayor prevalencia entre los pacientes de 18 a 49 años de edad, y los serotipos 19A y 3 entre los mayores de 50 años. Asimismo, se encontró que la cobertura estimada de serotipos de la PCV13 + 6C era de aproximadamente el 60% (7) (Fig. 3). Del total de los pacientes incluidos en el estudio ODIN, siete presentaron resolución incompleta al alta, y en tres de ellos la enfermedad estuvo ocasionada por el serotipo 3 (7). Eficacia de la vacunación antineumocócica en L O S adultos Se ha generado controversia sobre los beneficios de continuar con las vacunas de polisacáridos o adoptar las conjugadas para la vacunación sistemática en los adultos. Las vacunas conjugadas, en comparación con las de polisacáridos, presentan como inconvenientes una menor cobertura de serotipos de neumococo y la aparición de cepas de reemplazo (serotipos que no están cubiertos por la vacuna). Se ha demostrado que el uso de la PCV13 154 S. Sialer y A. Torres en los niños pequeños disminuye la colonización nasofaríngea, con lo cual se produce un efecto protector de rebaño y también disminuye la enfermedad neumocócica producida por los serotipos cubiertos por la vacuna en los niños mayores y los adultos (5, 6, 12, 20). En los resultados preliminares del estudio ODIN se constata que, de los 191 pacientes incluidos, 42 (22%) referían el antecedente de vacunación antineumocócica con PPV23 y 84 (44%) vacunación antigripal. Entre los pacientes con antecedentes de vacunación antineumocócica, el serotipo causante de la infección estaba incluido en la PPV23 en el 64,2% (27 de los 42 pacientes), y los más frecuentes fueron el 3 (en siete pacientes), el 19A (en seis pacientes) y el 24F (en cuatro pacientes) (7). En el estudio ODIN, el 19,2% de los pacientes que murieron tenían antecedentes de vacunación antineumocócica con PPV23, y los serotipos causantes de su enfermedad eran los 19A, 38, 9V y 6C. Los casos de curación con secuelas se observó que correspondían al serotipo 3 (7). Algunos estudios, como el metaanálisis del grupo Cochrane de 2008 (12), han hallado una fuerte evidencia de la eficacia de la PPV23 frente a la enfermedad neumocócica invasiva, pero sin evidencia que apoye el uso sistemático de la PPV para prevenir todas las causas de neumonía y mortalidad. No se han realizado estudios en población general para saber si la PCV produce una mejor protección que la PPV contra la enfermedad neumocócica invasiva. Sin embargo, un estudio realizado en Malawi en pacientes con infección por el VIH muestra una reducción importante después del primer año de vacunación con PCV7, e incluso los pacientes con inmunodepresión grave presentaron una respuesta clínicamente relevante a la vacuna conjugada (23). Se sabe que las vacunas conjugadas producen una inmunidad dependiente de las células T caracterizada por una respuesta inmunitaria funcional, establecer protección contra la colonización y la infección en las mucosas, e inducir memoria inmunitaria. Al realizar un análisis de coste-efectividad, parece que el uso de la PCV13 en los adultos sería más rentable que el de la PPV23, pues la eficacia de la PCV13 para prevenir la neumonía neumocócica no bacteriémica es alta. Este estudio también ha sugerido que el uso de la PCV13 en los adultos de 50 a 65 años de edad sería más costoso que si se administra según las indicaciones actuales. La justificación de la administración de la vacuna entre los 50 y los 65 años de edad es que la vacunación de todas las personas a partir de los 50 años de edad podría llevar a mayores tasas de vacunación 155 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN entre aquellas con condiciones o enfermedades concomitantes (como tabaquismo o asma) (4, 7, 13, 18, 22, 24). Basándose en esta evidencia, la Agencia Europea de Medicamentos aprobó, en septiembre de 2011, el uso de la PCV13 para prevenir la enfermedad neumocócica invasiva en la población a partir de 50 años de edad. C ON C LU S I O NE S P R EL I M I N A RE S DEL E S T U DIO O DI N •• A pesar de los avances en la prevención, el diagnóstico y el tratamiento, la morbilidad y la mortalidad por enfermedad neumocócica invasiva continúan siendo altas. Esto se debe, entre otros factores, a la aparición de nuevas cepas resistentes a los antibióticos y de serotipos de reemplazo a las coberturas vacunales. Por ello es destacable la necesidad y la importancia de los estudios de seguimiento y vigilancia epidemiológica. •• El informe preliminar del estudio ODIN nos muestra que el 55% de los pacientes con enfermedad neumocócica invasiva son menores de 65 años. La presencia de comorbilidad aumenta significativamente con la edad de los pacientes, y el 93% presenta al menos una afección concomitante (incluyendo tabaquismo y alcoholismo). Sin contar el tabaquismo, la comorbilidad más frecuente fue el antecedente de neumonía previa. Por grupo de edad, la comorbilidad con más frecuencia asociada era EPOC e insuficiencia cardiaca en los mayores de 75 años, neoplasia y hepatopatía crónica en los de 50 a 64 años de edad, e infección por el VIH en los pacientes entre 18 y 49 años de edad. El antecedente de neumonía previa es la comorbilidad más frecuentemente asociada a la neumonía invasiva. •• La tasa de letalidad de la enfermedad neumocócica invasiva fue del 14%. •• El 71,2% de las enfermedades neumocócicas invasivas hospitalizadas corresponden a neumonías invasivas. •• El 26,7% de los pacientes requirieron ingreso en la UCI. •• La cobertura estimada de serotipos de la PCV13 + 6C es de aproximadamente el 60%, y los serotipos incluidos en la PCV13 + 6C son la causa del 50% de las muertes en el grupo estudiado. •• El 22% de los pacientes incluidos en el estudio tenían antecedentes de vacunación antineumocócica con PPV23. 156 S. Sialer y A. Torres •• Será necesario continuar y realizar más estudios de seguimiento y vigilancia epidemiológica para mantener actualizados los serotipos de la cobertura vacunal, y a la vez se deberá seguir buscando la mejor combinación de vacunas que pueda administrarse a la población en riesgo. BIBLIOGRAF Í A 1.Lipsky B, Boyko E, Inui T. Risk factors for acquiring pneumococcal infections. Arch Intern Med. 1986;146:2179-85. 2.Tuomanen E, Austrian R, Masure H. Pathogenesis of pneumococcal infection. N Engl J Med. 1995;332:1280-4. 3.Cillóniz C, Polverino E, Amaro R, Torres A. Invasive pneumococcal disease today: epidemiology, treatment, and prevention. Clin Pulm Med. 2012; en prensa. 4.Huss A, Scott P, Stuck A. Efficacy of pneumococcal vaccination in adults: a meta-analysis. CMAJ. 2009;180:48-58. 5.Pitsioua G, Kioumis I. Pneumococcal vaccination in adults: does it really work? Resp Med. 2011;105:1776-83. 6.Andrews R, Moberley S. The controversy over the efficacy of pneumococcal vaccine. CMAJ. 2009;180:18-9. 7.Estudio epidemiológico prospectivo de vigilancia hospitalaria de la enfermedad neumocócica invasora. Estudio ODIN. Grupo del studio ODIN. Datos preliminares. 8.Shapiro E. Prevention of pneumococcal infection with vaccines. An evolving story. JAMA. 2012;307:847-9. 9.Alanee S, McGee L, Jackson D. Association of serotypes of Streptococcus pneumoniae with disease severity and outcome in adults: an international study. Clin Infect Dis. 2007;45:46-51. 10.Shapiro E, Berg A, Austrian R. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine. N Engl J Med. 1991;325:453-60. 11.Taylor SN, Sanders CV. Unusual manifestations of invasive pneumococcal infection. Am J Med. 1999;107(1A):12S-27S. 12.Moberley S, Holden J, Tatham DP. Vaccines for preventing pneumococcal infection in adults. Cochrane Database of Systematic Reviews 2008, Issue 1. Art. No. CD000422. DOI: 10.1002/14651858.CD000422.pub2. 13.Grabenstein J. Effectiveness and serotype coverage: key criteria for pneumococcal vaccines for adults. Clin Infect Dis. 2012;55:255-8. 14.Musher D, Rueda-Jaimes A, Graviss E. Effect of pneumococcal vaccination: a comparison of vaccination rates in patients with bacteremic and nonbacteremic pneumococcal pneumonia. Clin Infect Dis. 2006;43:1004-8. 15.Zangeneh TT, Baracco G, Al-Tawfiq JA. Impact of conjugate pneumococcal vaccines on the changing epidemiology of pneumococcal infections. J Expert Rev Vaccines. 2011;10:345-53. 16.Updated recommendations for prevention of invasive pneumococcal disease among adults using the 23-valent pneumococcal polysaccharide vaccine (PPV23). MMWR. 2010;59:1102-6. 157 Enfermedad neumocócica invasiva en adultos. Resultados preliminares del estudio ODIN 17.Recommended adult immunization schedule: United States, 2009. Advisory Committee on Immunization Practices. Ann Intern Med. 2009;150:40-4. 18.Smith K, Wateska A, Nowalk M. Cost-effectiveness of adult vaccination strategies using pneumococcal conjugate vaccine compared with pneumococcal polysaccharide vaccine. JAMA. 2012;307:804-12. 19.Paradiso P. Pneumococcal conjugate vaccine for adults: a new paradigm. Clin Infect Dis. 2012;55:259-64. 20.Musher D, Manoff S, Liss C. Safety and antibody response, including antibody persistence for 5 years, after primary vaccination or revaccination with pneumococcal polysaccharide vaccine in middle-aged and older adults. J Infect Dis. 2010;201:516-24. 21.Jackson L, Neuzil K, Yu O. Effectiveness of pneumococcal polysaccharide vaccine in older adults. N Engl J Med. 2003;348:1747-55. 22.Weinberger D, Malley R, Lipsitch M. Serotype replacement after pneumococcal vaccination. Lancet. 2012;379:1387-9. 23.French N, Gordon S, Mwalukomo T, White S, Mwafulirwa G, Longwe H, et al. Trial of a 7-valent pneumococcal conjugate vaccine in HIV-infected adults. N Engl J Med. 2010;362:812-22. 24.Jackson L, Janoff E. Pneumococcal vaccination of elderly adults: new paradigms for protection. Clin Infect Dis. 2008;47:1328-38. 158 M. Campins Martí Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos IN TRODU C C I Ó N Las infecciones neumocócicas son una importante causa de morbilidad y mortalidad en todo el mundo. Según la Organización Mundial de la Salud, la enfermedad neumocócica constituye una de las diez principales causas de muerte y representa, particularmente en los países de baja renta, el 40% de los 2,6 millones de muertes anuales por infección respiratoria aguda en niños menores de 5 años, con una cifra de más de un millón de fallecimientos. Los niños menores de 2 años son los que tienen la mayor tasa de incidencia de enfermedad neumocócica invasiva, seguidos de los adultos mayores de 65 años. Aunque la enfermedad neumocócica es más frecuente en los niños, su letalidad en los ancianos es más alta, del 20% al 40%, a pesar del tratamiento antibiótico adecuado. Por estos motivos, desde hace años en muchos países se han desarrollado estrategias vacunales dirigidas a la población mayor de 65 años, y a partir del año 2000 a los niños menores de 2 años. En la última década se ha realizado un importante progreso en la prevención de estas infecciones. Hasta hace 12 años sólo se disponía de una vacuna antineumocócica no conjugada 23-valente (VPNC23), eficaz únicamente a partir de los 2 años de edad y sin capacidad de inducir memoria 159 Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos inmunitaria. Desde el año 2000 se dispone además de vacunas conjugadas, que pueden administrarse desde los 2 meses de edad, con un excelente perfil de eficacia y seguridad. El impacto de la vacuna conjugada en Estados Unidos, donde se incluyó en el calendario vacunal en enero de 2001, ha sido muy importante, con una marcada disminución de la incidencia de la enfermedad invasiva en los niños menores de 2 años, pero también en los mayores de esa edad y en los adultos, a consecuencia de la inmunidad de grupo que induce y por la reducción del número de portadores nasofaríngeos de los serotipos vacunales. Las vacunas antineumocócicas clásicas, no conjugadas, utilizadas prin­cipalmente en los adultos, han sido controvertidas y no han alcanzado coberturas elevadas en la mayoría de los países por una serie de limita­ ciones: •• Corta duración de la inmunidad vacunal (5-10 años). •• Aumento de la reactogenicidad con las revacunaciones. •• Ausencia de memoria inmunitaria. •• Inducción del fenómeno de tolerancia inmunitaria o hiporrespuesta a las revacunaciones. •• No influencia sobre la colonización nasofaríngea. Todos estos aspectos, considerados limitaciones de las vacunas de polisacáridos planos, han sido superados por las vacunas conjugadas (heptavalente, decavalente y 13-valente), como ya ha sido comprobado no sólo en los ensayos clínicos precomercialización sino también en su utilización universal en niños de muchos países. La tecnología de conjugación ha demostrado inducir en el sujeto vacunado una respuesta inmunitaria dependiente de las células T, que permite mejorar la respuesta y generar memoria inmunitaria, en comparación con las vacunas de polisacáridos no conjugadas. Las vacunas antineumocócicas conjugadas generan respuestas de anticuerpos en las mucosas (IgA) y con ello disminuyen la colonización nasofaríngea por los serotipos presentes en la vacuna, con lo cual se consigue una disminución de la circulación de neumococos y por tanto de nuevos portadores, produciendo inmunidad de grupo. La posibilidad de utilizar las vacunas conjugadas en el adulto abre expectativas importantes en la mejora de la prevención de la enfermedad neumocócica en este grupo de edad. 160 M. Campins Martí VACU N A A NTI NE U M O C Ó C I CA CO N JUG A DA 13 -VALENTE EN L O S ADU LT O S El 27 de octubre de 2011, la European Medicines Agengy (EMA) autorizó la vacuna antineumocócica conjugada 13-valente (VC13) para la inmunización activa de los adultos de 50 años o más de edad, para la prevención de las formas invasivas de la infección neumocócica. La Food and Drug Administration de Estados Unidos la autorizó el 30 de diciembre de 2011, también para adultos a partir de los 50 años de edad. Se espera que en el año 2013 se autorice su uso en personas menores de 50 años. Composición La VC13 contiene polisacárido capsular de 13 serotipos de Streptococcus pneumoniae: 4, 6A (no incluido en la VPNC23), 6B, 9V, 14, 18C, 19F, 23F, 1, 3, 5, 7F y 19A. Contiene 2,2 µg de cada uno de ellos, excepto del 6B, que incluye 4,4 µg. Es una vacuna conjugada con proteína diftérica CRM197, adsorbida en fosfato de aluminio (0,125 mg de aluminio), y se presenta en jeringa precargada de 0,5 ml. Inmunogenicidad Hasta el momento se han realizado seis ensayos clínicos que han incluido más de 5000 adultos mayores de 50 años sanos o con enfermedades crónicas no inmunosupresoras (cardiovasculares, enfermedad pulmonar obstructiva crónica, diabetes, insuficiencia renal crónica, hepatopatía crónica), cuyos objetivos han sido: 1) Demostrar la no inferioridad en la respuesta inmunitaria (GMT OPA) inducida por la VC13 en comparación con la VPNC23. 2) Analizar el fenómeno de hiporrespuesta o tolerancia inmunitaria en función del tipo de vacuna que se administre en primer lugar y de la primovacunación previa con VPNC23. 3) Estudiar la calidad de los anticuerpos (inducción de memoria inmunitaria). 4) Valorar la coadministración con la vacuna antigripal. 5) Estudiar la seguridad vacunal. 161 Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos Los estudios precomercialización realizados en adultos, diseñados de acuerdo con los organismos reguladores de las agencias evaluadoras de medicamentos, han demostrado que la VC13, en comparación con la VPNC23, induce una respuesta inmunitaria funcional superior para ocho de los diez serotipos comunes incluidos y para el 6A. En el estudio 004 realizado en adultos de 50 a 64 años de edad no vacunados previamente con VPNC23 se aleatorizó a los sujetos de 60 a 64 años de edad para recibir una única dosis de VC13 o de VPNC23, mientras que los de 50 a 59 años de edad recibieron una única dosis de VC13 (Fig. 1). En la Tabla 1 se muestran las GMT OPA inducidas por la VC13 en comparación con la VPNC23. En los adultos de 60 a 64 años de edad, las GMT OPA de la VC13 fueron no inferiores a las inducidas por la VPNC23 para los 12 serotipos comunes a ambas vacunas. Para nueve serotipos, los títulos de OPA fueron superiores de forma estadísticamente significativa en los que recibieron la VC13. Para analizar la posible influencia de la vacunación previa con VPNC23 se compararon las respuestas inmunitarias inducidas por la VC13 y por la VPNC23 en un ensayo realizado con adultos mayores de 70 años, que habían recibido previamente una dosis única de VPNC23 al menos 5 años antes de la vacunación del estudio (estudio 3005). Se asignó a los sujetos a recibir una dosis única de VC13 o de VPNC23. Las GMT OPA inducidas por la VC13 fueron no inferiores a las generadas por la VPNC23 para los 12 serotipos comunes, y fueron superiores, de forma estadísticamente significativa, para 10 de los 12 serotipos comunes y para el 6A (Tabla 2). La admi- Sujetos Estratificación VC13 (n = 417) Edad 60-64 años VPNC23 (n = 414) Edad 50-59 años VC13 (n = 403) 1 mes (extracción OPA) Figura 1. Diseño del estudio 004 para la evaluación de la inmunogenicidad de la VC13 en comparación con la VPNC23. 162 M. Campins Martí Tabla 1. Inmunogenicidad de la VC13 y de la VPNC23 tras su administración en adultos de 50 a 64 años de edad. VC13 VPNC23 50-59 años N = 350-384 60-64 años N = 359-404 60-64 años N = 367-402 VC13 50-59 años en relación con 60-64 años VC13 en relación con VPNC23, 60-64 años Serotipos GMT GMT GMT Cociente de GMT (IC95%) Cociente de GMT (IC95%) 1 3 4 5 6A 6B 7F 9V 14 18C 19A 19F 23F 200 91 2833 269 4328 3212 1520 1726 957 1939 956 599 494 146 93 2062 199 2593 1984 1120 1164 612 1726 682 517 375 104 85 1295 162 213 788 405 407 692 925 352 539 72 1,4 (1,08-1,73) 1,0 (0,81-1,19) 1,4 (1,07-1,77) 1,4 (1,01-1,80) 1,7 (1,30-2,15) 1,6 (1,24: 2,12) 1,4 (1,03-1,79) 1,5 (1,11-1,98) 1,6 (1,16-2,12) 1,1 (0,86-1,47) 1,4 (1,16-1,69) 1,2 (0,87-1,54) 1,3 (0,94-1,84) 1,4 (1,10-1,78) 1,1 (0,90-1,32) 1,6 (1,19-2,13) 1,2 (0,93-1,62) 12,1 (8,63-17,08) 2,5 (1,82-3,48) 2,8 (1,98-3,87) 2,9 (2,00-4,08) 0,9 (0,64-1,21) 1,9 (1,39-2,51) 1,9 (1,56-2,41) 1,0 (0,72-1,28) 5,2 (3,67-7,33) GMT: media geométrica de los títulos de anticuerpos; IC95%: intervalo de confianza del 95%. Tabla 2. Efecto de la inmunización con VC13 y VPNC23 en sujetos mayores de 70 años primovacunados con VPNC23. VC13 N = 400-426 VPNC23 N = 395-445 GMT OPA con VC13 en relación con VPNC23 Serotipos GMT OPA GMT OPA Cociente de GMT (IC95%) 1 3 4 5 6A 6B 7F 9V 14 18C 19A 19F 23F 81 55 545 72 903 1261 245 181 280 907 354 333 158 55 49 203 36 94 417 160 90 285 481 200 214 43 1,5 (1,17-1,88) 1,1 (0,91-1,35) 2,7 (1,93-3,74) 2,0 (1,55-2,63) 9,6 (7,00-13,26) 3,0 (2,21-4,13) 1,5 (1,07-2,18) 2,0 (1,36-2,97) 1,0 (0,73-1,33) 1,9 (1,42-2,50) 1,8 (1,43-2,20) 1,6 (1,17-2,06) 3,7 (2,69-5,09) GMT: media geométrica de los títulos de anticuerpos; OPA: actividad opsonofagocítica; IC95%: intervalo de confianza del 95%. 163 Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos nistración de otra dosis de VC13 después de 1 año a los sujetos del estudio anterior permitió observar que no se producía tolerancia inmunitaria en los que habían recibido primero la vacuna conjugada. Los sujetos que el año anterior habián recibido la VPNC23 presentaron GMT OPA inferiores tras la revacunación con VC13. En la Figura 2 se muestran los resultados de la cinética de anticuerpos OPA para el serotipo 1; los resultados son similares para 12 de los 13 serotipos comunes. Los hallazgos de este estudio confirman el efecto negativo de la VPNC23 sobre la respuesta posterior a la vacuna conjugada, lo que permite concluir que en caso de estar indicada la administración secuencial de ambas vacunas, siempre deberá administrarse en primer lugar la conjugada. Una extensión del estudio 004 realizada para evaluar la respuesta inmunitaria a una segunda dosis de VC13 o de VPNC23, administrada 3 o 4 años después de la primera dosis del estudio inicial (Fig. 3), mostró que la administración previa de VC13 incrementa la respuesta inmunitaria a las dosis subsiguientes de VC13 o de VPNC23 para siete de los 12 serotipos comunes, en comparación con la obtenida tras la dosis inicial de VPNC23, y no es inferior para los seis restantes. Por el contario, se observó que la administración previa de VPNC23 se asociaba con respuestas disminuidas a las dosis subsiguientes de esta vacuna polisacárida. En la Figura 4 puede verse la cinética de los anticuerpos OPA para el serotipo 1 (los resultados son similares para el resto de los serotipos). Estos hallazgos permiten concluir que la administración inicial de VC13 genera memoria inmunitaria que potencia la respuesta a una segunda dosis de vacuna (VC13 o Media geométrica de los títulos 90 80 VC13 VC13 70 60 VPNC23 50 40 VC13 30 20 10 Prevacunación 1 Posvacunación 1 Prevacunación 2 Posvacunación 2 Figura 2. Cinética de anticuerpos OPA para el serotipo 1 tras la administración de una dosis de recuerdo de VC13 o de VPNC23 transcurrido 1 año desde la vacunación en sujetos mayores de 70 años primovacunados con VPNC23. 164 M. Campins Martí Reclutamiento Estratificación Ramas del estudio VC13 VC13 Características de los sujetos: • VPNC23 naive VPNC23 Seguimiento 3-4 años (N = 405) Edad 60-64 años VPNC23 VPNC23 Edad 50-59 años VC13 Seguimiento 3-4 años (N = 214) VC13 Figura 3. Diseño del estudio de extensión del ensayo clínico 004 para evaluar la calidad de la respuesta inmunitaria inducida por una segunda dosis de VC13 o de VPNC23 a los 3 a 4 años de la anterior. VPNC23), es decir, induce un efecto booster, hecho que no se observa con la vacunación inicial con vacuna no conjugada. Actualmente se están realizando ensayos clínicos con la VC13 en personas de 6 a 49 años de edad, en pacientes con infección por el VIH, en receptores de trasplante de progenitores hematopoyéticos y en enfermos con drepanocitosis. 400 350 GMT OPA 300 250 200 150 100 50 0 Predosis 1 Después de 1 mes Después de 12 meses Predosis 2 Posdosis 2 VC13/VC13 (50-59 años) VC13/VC13 (60-64 años) VC13/VPNC23 (60-64 años) VPNC23/VPNC23 (60-64 años) Figura 4. Cinética de anticuerpos OPA prevacunación y posvacunación (1 mes, 3-4 años) para el serotipo 1. GMT: media geométrica de los títulos de anticuerpos; OPA: actividad opsonofagocítica. (Datos tomados de: Paradiso PR. Clin Infect Dis. 2012;55:259-64.) 165 Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos Eficacia La autorización de la VC13 en adultos se ha basado en la comparación de la media geométrica de los títulos (GMT) de anticuerpos con actividad opsonofagocítica (OPA) (mejor medida de la capacidad funcional de los anticuerpos protectores) inducidos por ella y por la VPNC23. No se dispone aún de datos de ensayos clínicos de eficacia realizados con esta vacuna en adultos. Sólo se conocen los resultados de un estudio de eficacia de la vacuna conjugada heptavalente en adultos. Se trata de un ensayo clínico realizado en África con pacientes adultos infectados por el virus de la inmunodeficiencia humana (VIH), inmunizados con una dosis de vacuna conjugada heptavalente, en el cual se observó una eficacia del 74% (intervalo de confianza del 95%: 30-90) en la prevención de la neumonía causada por los serotipos vacunales, hecho que no se había documentado en un ensayo clínico anterior realizado por el mismo grupo utilizando VPNC23. En Holanda se está llevando a cabo un ensayo clínico de fase III (estudio CAPITA) con VC13 en adultos mayores de 65 años que incluye más de 85.000 sujetos, y que tiene como objetivo primario analizar la eficacia de la vacuna para la prevención de la neumonía, y como objetivo secundario su eficacia frente a la enfermedad neumocócica invasiva. Se espera disponer de los resultados definitivos en el año 2014. Seguridad Los ensayos clínicos precomercialización de la VC13 en adultos han mostrado un buen perfil de seguridad. Las reacciones adversas más frecuentes son similares a las observadas con la mayoría de las vacunas de uso habitual en los calendarios de vacunación sistemática. Coadministración con la vacuna antigripal Se han realizado dos ensayos clínicos para evaluar la coadministración de la VC13 con la vacuna antigripal inactivada. Las respuestas a los tres antígenos de la vacuna antigripal fueron comparables cuando ésta se administró sola y de forma concomitante con la VC13. En relación a las concentraciones de anticuerpos OPA frente a los serotipos de neumococo incluidos en la vacuna, la respuesta fue similar en ambos grupos, excepto para el serotipo 19F en uno de los estudios. Estos datos indican que ambas vacunas pueden administrarse simultáneamente. 166 M. Campins Martí RECOMEN DAC I O NE S AC TUA L E S DE VAC U NAC IÓ N C O N VAC U N A AN TIN EU MO C Ó C ICA C O NJ UG A DA 13 -VALENTE EN EL ADU LT O Las siguientes recomendaciones se basan en los resultados de los estudios disponibles hasta el momento de redactar este capítulo. En junio de 2012, el Advisory Committee on Immunization Practices de los Centers for Disease Control and Prevention de Estados Unidos publicó las primeras recomendaciones para la utilización de la VC13 en los adultos. A la espera de nuevos estudios y de los resultados del estudio CAPITA, las indicaciones para la vacunación antineumocócica con VC13 de los adultos de 19 a 64 años de edad, en Estados Unidos (Tabla 3), incluyen los siguientes grupos: •• Inmunodeprimidos. •• Asplenia congénita o adquirida. •• Drepanocitosis y otros tipos de hemoglobinopatías. •• Fístulas de líquido cefalorraquídeo. •• Implantes cocleares. Los pacientes no vacunados previamente con VPNC23 deberán recibir una dosis de VC13, seguida de una dosis de VPNC23 a las 8 semanas. Los sujetos incluidos en los grupos de mayor riesgo (inmunodeprimidos y personas con asplenia anatómica o funcional) deberán revacunarse con una segunda dosis de VPNC23 transcurridos 5 años. Las personas con implantes cocleares o fístulas de líquido cefalorraquídeo no necesitan recibir ninguna dosis adicional de VPNC23 hasta los 65 años de edad. Los adultos previamente vacunados con VPNC23 deberán recibir una dosis de VC13 con un intervalo mínimo de 1 año desde la vacunación con VPNC23. En octubre de 2012, la Sociedad Española de Medicina Preventiva, Higiene y Salud Pública (SEMPHSP) ha elaborado un documento de consenso sobre las indicaciones de la VC13 en adultos en España, en función de las condiciones médicas (Tabla 4). Según indica la ficha técnica de la VC13, la pauta de administración en los adultos es de una única dosis. Sólo los pacientes sometidos a trasplante de progenitores hematopoyéticos, según las recomendaciones europeas, de- 167 Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos Tabla 3. Condiciones médicas y otras indicaciones de administración de VC13 y de VPNC23 para adultos de ≥19 años de edad (MMWR, 2012). VC13 Grupo de riesgo Condición médica subyacente Personas Enfermedad cardiaca crónica inmunocompetentes Enfermedad pulmonar crónica Diabetes mellitus Fístula de líquido cefalorraquídeo Implante coclear Alcoholismo Enfermedad hepática crónica Tabaquismo Personas con asplenia anatómica o funcional Drepanocitosis/otras hemoglobinopatías Asplenia congénita o adquirida Personas inmunodeprimidas Inmunodeficiencias congénitas o adquiridas Infección por virus de la inmunodeficiencia humana Enfermedad renal crónica Síndrome nefrótico Leucemia Linfoma Enfermedad de Hodgkin Neoplasias Inmunosupresión iatrogénica Trasplante de órgano sólido Mieloma múltiple Recomendada VPNC23 Recomendada Revacunación a los 5 años 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 3 berán recibir tres dosis de VC13 (a partir de los 3 meses postrasplante) con un intervalo mínimo de 1 mes entre ellas, y una dosis de VPNC23 a los 12 meses de la última dosis de VC13. En los pacientes con enfermedad del injerto contra el huésped crónica puede considerarse la administración de una cuarta dosis de VC13. C ON C LU S I O NE S •• Los ensayos clínicos realizados en adultos demuestran la inmunogenicidad y la seguridad de la VC13 en las personas mayores de 50 años, incluso en aquellos primovacunados con VPNC23. 168 M. Campins Martí Tabla 4. Recomendaciones de la SEMPHSP para la utilización de la VC13 en adultos, en función de las condiciones médicas. Adultos no vacunados previamente Adultos vacunados con una o más dosis de VPNC23 Inmunodeprimidos Asplenia Fístulas de líquido cefalorraquídeo Implantes cocleares VC13 (1 dosis) + VPNC23 (1 dosis)** Intervalo ≥2 meses VC13 (1 dosis)*** Intervalo entre VPNC23 y VC13 ≥1 año Inmunocompetentes con condición médica subyacente u otra indicación VC13 (1 dosis) VC13 (1 dosis) Intervalo entre VPNC23 y VC13 ≥1 año Condición médica* *La VC13 está indicada en la inmunización activa para la prevención de la enfermedad invasiva por Streptococcus pneumoniae en adultos de 50 años o más de edad. La variación de la ficha técnica para la aprobación de la indicación en el grupo de 6 a 17 años de edad está siendo evaluada por la EMA, y antes de finalizar 2012 se evaluará la ampliación de la indicación para el grupo de 18 a 49 años de edad. Dado el posible beneficio que ofrecen las vacunas conjugadas, en especial en los inmunodeprimidos, en los afectos de asplenia anatómica o funcional, en los portadores de implantes cocleares y en los pacientes con fístulas de líquido cefalorraquídeo, se recomienda preferentemente la administración de VC13 en todos los grupos de edad (solicitar consentimiento informado en las personas de 6 a 49 años de edad y autorización correspondiente del comité de farmacoterapéutica del centro). **Basándose en la cobertura de los serotipos de la VC13 (+6C), la administración de la VPNC23 en el grupo de personas inmunodeprimidas, asplénicas, con fístulas de líquido cefalorraquídeo o implantes cocleares, no vacunadas previamente, podría valorarse por la posibilidad de ofrecer una protección adicional frente a los otros serotipos. Siempre que sea posible debe administrarse en primer lugar la VC13, dejando un intervalo de al menos 2 meses antes de administrar la VPNC23. ***En los pacientes inmunodeprimidos, asplénicos, con fístulas de líquido cefalorraquídeo o implantes cocleares que hayan recibido una dosis de VPNC23 se recomienda administrar una dosis de VC13, al menos 1 año después de la dosis de VPNC23, seguida de una segunda dosis de VPNC23 con un intervalo de al menos 2 meses desde la VC13 y de 5 años desde la primera dosis de VPNC23. •• Si se considera apropiada la revacunación con VPNC23, independientemente del estado vacunal previo, la VC13 debe administrarse en primer lugar. •• La VC13 puede coadministrarse con la vacuna antigripal. •• La pauta vacunal autorizada actualmente para los adultos es de una dosis, con independencia del tipo de comorbilidad. •• La necesidad de revacunación con otra dosis de VC13 no ha sido establecida. •• Basándonos en la amplia experiencia y los buenos resultados de la vacuna conjugada heptavalente (y recientemente también de la VC13) en los calendarios infantiles, es esperable que su beneficio sea igualmente importante en el adulto. 169 Inmunogenicidad y seguridad de la vacuna antineumocócica conjugada 13-valente en los adultos BIBL I O G RA F ÍA –– Campins M, Bayas JM. Presente y futuro de la vacunación antineumocócica en el adulto. –– –– –– –– –– –– –– –– –– –– –– –– 170 En: La enfermedad neumocócica y su prevención. Caminando hacia el futuro. Moraga Llop FA, editor. Barcelona: Lenoir; 2010. p. 211-24. CDC. ACIP provisional recommendations for use of 13valent pneumococcal conjugate vaccine in adults with immunocompromising conditions. Disponible en: http://www. cdc.gov/vaccines/recs/provisional/downloads/pcv13-adults-ic.pdf Cohen R, Levy C, Bingen E, Koskas M, Nave I, Varon E. Impact of 13-valent pneumococcal conjugate vaccine on pneumococcal nasopharyngeal carriage in children with acute otitis media. Pediatr Infect Dis J. 2012;31:297-301. Cooper D, Yu X, Sidhu M, Nahm MH, Fernsten P, Jansen KU. The 13-valent pneumococcal conjugate vaccine (PCV13) elicits cross-functional opsonophagocytic killing responses in humans to Streptococcus pneumoniae serotypes 6C and 7A. Vaccine. 2011;29:7207-11. Fenoll A, Granizo JJ, Aguilar L, Giménez MJ, Aragoneses-Fenoll L, Hanquet G, et al. Temporal trends of invasive Streptococcus pneumoniae serotypes and antimicrobial resistance patterns in Spain from 1979 to 2007. J Clin Microbiol. 2009;47:1012-20. French N, Gordon SB, Mwalukomo T, White SA, Mwafulirwa G, Longwe H, et al. A trial of a 7-valent pneumococcal conjugate vaccine in HIV-infected adults. N Engl J Med. 2010;362:812-22. French N, Nakiyingi J, Carpenter LM, Lugada E, Watera C, Moi K, et al. 23-valent pneumococcal polysaccharide vaccine in HIV-1-infected Ugandan adults: double-blind, randomised and placebo controlled trial. Lancet. 2000;355:2106-11. Gil-Prieto R, García-García L, Álvaro-Meca A, Méndez C, García A, de Miguel AG. The burden of hospitalisations for community-acquired pneumonia (CAP) and pneumococcal pneumonia in adults in Spain (2003-2007). Vaccine. 2011;29:412-6. Jackson L, Gurtman A, Rice K, Pauksens K, Greenberg R, Jones T, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in adults 70 years of age and older previously vaccinated with 23-valent pneumococcal polysaccharide vaccine. En: 21st European Congress of Clinical Microbiology and Infectious Diseases (ECCMID), Milano, 7-10 May 2011. Jackson L, Gurtman A, van Cleeff M, Jansen K, Jayawardene D, Devlin C, et al. Immunogenicity and safety of a 13-valent pneumococcal conjugate vaccine in pneumococcal vaccine naïve adults, 50-64 years of age. En: 21st European Congress of Clinical Microbiology and Infectious Diseases (ECCMID), Milano, 7-10 May 2011. Jackson L, Gurtman A, van Cleeff M, Jansen KU, Jayawardene D, Devlin C, et al. 13-valent pneumococcal conjugate vaccine (PCV13) enhances the response to subsequent PCV13 and 23-valent pneumococcal polysaccharide (PPSV23) vaccinations in adults 50 years and older. En: 49th Annual Meeting of the Infectious Disease Society of America (IDSA), Boston, USA, October 20-23 2011. Kyaw MH, Rose CE, Fry AM, Singleton JA, Moore Z, Zell ER, et al. The influence of chronic illnesses on the incidence of invasive pneumococcal disease in adults. J Infect Dis. 2005;192:377-86. Lazarus R, Clutterbuck E, Ly-Mee Yu, Bowman J, Bateman EA, Diggle L, et al. A randomized study comparing combined pneumococcal conjugate and polysaccharide vaccination schedules in adults. Clin Infect Dis. 2011;52:736-42. M. Campins Martí –– Ljungman P, Cordonnier C, Einsele H, Englund J, Machado CM, Storek J, et al. Vaccination of hematopoietic cell transplant recipients. Bone Marrow Transplant. 2009;44:521-6. –– Mäkelä PH, Käyhty H. Evolution of conjugate vaccines. Expert Rev Vaccines. 2002;1:399410. –– Miller E, Andrews NJ, Waight PA, Slack MP, George RC. Effectiveness of the new serotypes in the 13-valent pneumococcal conjugate vaccine. Vaccine. 2011;29:9127-31. –– Moberley SA, Holden J, Tatham DP, Andrews RM. Vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev. 2008;(1):CD000422. –– Paradiso PR. Pneumococcal conjugate vaccine for adults: a new paradigm. Clin Infect Dis. 2012;55:259-64. –– Prevenar13®. Ficha técnica. –– Van Hoek AJ, Andrews N, Waight PA, Stowe J, Gates P, George R, et al. The effect of un–– –– derlying clinical conditions on the risk of developing invasive pneumococcal disease in England. J Infect. 2012;65:17-24. World Health Organization. 23-valent pneumococcal polysaccharide vaccine: WHO position paper. Wkly Epidemiol Rec. 2008;83:373-84. World Health Organization. Pneumococcal conjugate vaccine for childhood immunization – WHO position paper. Wkly Epidemiol Rec. 2007;82:93-104. 171 J.A. Vázquez y R. Abad Posible impacto en España de la nueva vacuna antimeningocócica B introducción La enfermedad meningocócica está causada por Neisseria meningitidis, un “habitante” que forma parte de la flora habitual de la mucosa de la nasofaringe, y que sólo en ocasiones produce patología. En Europa, con una situación de endemia moderada (http://www.ecdc.europa.eu/en/publica tions/Publications/Forms/ECDC_DispForm.aspx?ID=767), las tasas de incidencia oscilan entre 0,3 y 4 (en España en torno a 0,9) casos por 100.000 habitantes. En situaciones epidémicas, como la que se registra cíclicamente en el llamado «cinturón africano de la meningitis», las tasas pueden oscilar entre 10 y 1000 por 100.000 habitantes (1). El meningococo presenta una cápsula que lo rodea y que es de naturaleza polisacárida, cuya estructura química constituye la base para su clasificación en serogrupos. Aunque se han reconocido 12 serogrupos diferentes, hasta hace 20 años sólo tres (A, B y C) eran la causa de más del 90% de los casos de enfermedad meningocócica invasiva; en los últimos 20 años, los serogrupos Y y W135 se han unido a los tres anteriores para, particularmente en algunas zonas geográficas determinadas, engrosar el número de serogrupos asociados a enfermedad meningocócica invasiva; finalmente, en fechas recientes, el serogrupo X, poco asociado con patología en el pasado, ha cobrado una importancia creciente sobre todo en algunos países del cinturón africano de la meningitis (2). Estos cambios e 173 Posible impacto en España de la nueva vacuna antimeningocócica B incorporaciones reflejan claramente la complejidad y la imprevisibilidad de la epidemiología de este microorganismo. Esta cápsula es la que facilita la invasión al microorganismo, y es una característica que comparte con las otras dos bacterias más frecuentemente asociadas con meningitis: Haemophilus influenzae tipo b y Streptococcus pneumoniae. Por lo tanto, el polisacárido capsular ha sido desde hace mu­ chos años el antígeno seleccionado para el desarrollo de vacunas, y se ha convertido en la vacunación sistemática de la población como la mejor estrategia para el control de las infecciones producidas por estos microorganismos (3). La vacuna conjugada frente a Haemophilus tipo b ha disminuido drásticamente el número de casos en aquellos países que la han incorporado en sus calendarios infantiles de vacunación; en el caso del neumococo, la aplicación de la vacuna conjugada heptavalente ha logrado una importante reducción del número de casos asociados a los serotipos que incluye, y este efecto seguramente aumentará con la utilización de vacunas frente a 10 o 14 serotipos; frente al meningococo, se han desarrollado vacunas conjugadas para los serogrupos A, C, Y y W135, con diferentes formulaciones monovalentes o multivalentes, y un alto grado de eficacia. Estrategias en el desarrollo de vacunas antimeningocócicas B Sin embargo, la estrategia de utilización del polisacárido capsular como antígeno vacunal no es posible para el serogrupo B porque en este caso el polisacárido (polímero de ácido N-acetil-neuramínico con unión α) (2-8) se encuentra también en los tejidos neuronales de los mamíferos, por lo que su utilización podría derivar en riesgos de autoinmunidad además de producir una respuesta deficiente (4). Por ello, las diferentes estrategias utilizadas en el desarrollo de vacunas para el serogrupo B se han basado en la utilización de antígenos no capsulares (5). Probablemente en esta historia las más conocidas, y también las más utilizadas, han sido las vacunas basadas en vesículas de membrana externa, cuyo antígeno principal son las proteínas de clase 1, unas de las porinas más importantes de la membrana externa del meningococo (6). La eficacia de estas vacunas es sumamente baja en los niños menores de 4 años, y si bien presenta una eficacia razonable en individuos mayores, su utilidad es muy limitada al producir una respuesta específica de tipo, es decir, sólo protege frente a cepas homólogas a aquella con la cual se ha desarrollado la vacuna y no frente al resto, y este aspecto es de gran importancia en el caso de N. meningitidis (4). Fun174 J.A. Vázquez y R. Abad damentalmente se han desarrollado tres vacunas, todas ellas en contextos concretos de epidemias por un solo tipo de cepa: una en Cuba con una cepa B:4:P1.19,15, otra en Noruega con una cepa B:15:P1.7,16 y más recientemente una desarrollada por Novartis y aplicada en Nueva Zelanda con una cepa B:4:P1.7b,4 (6). La enorme variabilidad de las cepas del serogrupo B hace inviable su utilización sistemática en los calendarios vacunales, y como ejemplo baste decir que, en España, la vacuna cubana produciría una respuesta inmunitaria protectora sólo frente a un 10% a 15% de los casos (muchos menos teniendo en cuenta su limitación de uso en los menores de 4 años), mientras que con la vacuna noruega o neozelandesa el porcentaje sería inferior al 5% y al 10%, respectivamente. Desarrollo de vacunas frente al serogrupo b Por lo tanto, el desarrollo de la vacuna frente al serogrupo B pasó por identificar otros antígenos que presentaran una menor variabilidad, que estuvieran presentes en el mayor número de aislamientos y que fueran capaces de producir una respuesta inmunitaria cruzada contra muchos tipos de cepas, y que esta respuesta fuera protectora. Fruto de estas investigaciones, a lo largo de los últimos 10 a 15 años hemos asistido al anuncio de prometedores desarrollos de vacunas frente al serogrupo B basados en proteínas fijadoras de hierro, antígenos de Neisseria lactamica, vacunas basadas en vesículas de membrana externas multicomponente, etc., pero hasta el momento estas estrategias no han logrado grandes avances e incluso algunas han sido abandonadas (7). Así, en este esfuerzo por desarrollar una vacuna no capsular frente al meningococo del serogrupo B, llegamos a un hito en la historia de la vacunología que supone una revolución en la manera de abordar el desarrollo de vacunas, en particular frente a microorganismos complejos desde el punto de vista antigénico: la vacunología inversa (8). Hasta ahora, el abordaje para el desarrollo de nuevas vacunas consistía en la identificación, mediante métodos bioquímicos, serológicos o microbiológicos, de antígenos expresados en la superficie del microorganismo, y posteriormente en el desarrollo de compuestos vacunales, fuera con el microorganismo completo o con esos antígenos purificados. Pero esta estrategia fallaba cuando el microorganismo no podía ser cultivado in vitro y cuando los antígenos más abundantes y evidentes eran muy variables en su secuencia. El nuevo enfoque basado en el análisis de genomas completos permite predecir todos los 175 Posible impacto en España de la nueva vacuna antimeningocócica B antígenos posibles en el microorganismo, con lo cual pueden desarrollarse vacunas incluso con antígenos poco o nada convencionales (8). Siguiendo esta estrategia genómica, se han descrito algunos antígenos que podrían usarse en el desarrollo de vacunas frente al serogrupo B. En concreto, en 2003 se describió un antígeno, llamado en ese momento GNA1870 (9), o LP2086 por otros autores (10), que ahora se conoce como fHbp (factor H binding protein) (11). Este antígeno presenta, en función de los diferentes grupos de investigación, dos subfamilias (A y B) o tres variantes (1, 2 y 3), cuya correlación sería que la subfamilia A englobaría a las variantes 2 y 3, mientras que la subfamilia B englobaría a la variante 1. Los anticuerpos dirigidos frente a la subfamilia A sólo son protectores frente a aislamientos que expresan esta subfamilia, y los dirigidos frente a la subfamilia B igualmente sólo son protectores frente a la subfamilia B (12). La estrategia seguida por Pfizer consiste en utilizar una proteína recombinante que expresa ambas subfamilias, A y B, y que ha mostrado prometedores resultados en la fase de desarrollo en que se encuentra (13). No obstante, la utilización de un solo antígeno (aunque sea como en este caso con sus dos subfamilias) podría llevar en el futuro a la aparición de cepas de meningococo que escaparan a la respuesta inmunitaria dada la alta tasa de variación de fase, recombinación y mutación en N. meningitidis. Por este motivo, es muy interesante la estrategia seguida por Novartis en el desarrollo de una vacuna multicomponente (14), presentada para su autorización de comercialización a la Agencia Europea de Medicamentos en diciembre de 2010. Para el desarrollo de esta vacuna se ha seguido la mencionada vacunología inversa, que tiene como punto de partida el conocimiento de la secuencia completa del genoma de N. meningitidis, que se analiza mediante programas informáticos con el objetivo de identificar genes que codifiquen para antígenos que podrían utilizarse en formulaciones vacunales. Los antígenos seleccionados presentan un grado aceptable de conservación, lo que permite manejar una de las más destacadas características del genoma del meningococo, que es su gran plasticidad, regulada en el microorganismo por diversos y complejos mecanismos de regulación genética. Esta primera selección de antígenos sufre un proceso de evaluación según su capacidad de expresión en Escherichia coli, y se han identificado 350 antígenos que se expresan en este microorganismo. Cada uno de estos antígenos es purificado y utilizado para inmunizar ratones, en los cuales se analiza la respuesta de anticuerpos funcionales, esto es, con capacidad bactericida. Este nuevo paso en el cribado de antígenos lleva a la selección de 91 proteínas, que una vez más pasan por un proceso de selección mediante confirmación 176 J.A. Vázquez y R. Abad de su localización en la membrana externa y su capacidad inmunógena, con lo cual el procedimiento finalmente selecciona tan sólo tres antígenos, conocidos como fHbp (proteína fijadora de factor H en suero humano), NHBA (factor de fijación de heparina) y NadA (adhesina A de Neisseria), que son parte de la formulación definitiva de la vacuna multicomponente desarrollada (14). La composición final de esta novedosa vacuna incluye los tres antígenos mencionados (dos de ellos, el fHbp y el NHBA en forma de proteínas de fusión con otras proteínas acompañantes) más las vesículas de membrana externa utilizadas en la vacuna que se utilizó en Nueva Zelanda, que incluye un tipo de proteína PorA P1.4. La inclusión de estas vesículas de membrana aumenta la diversidad de cepas frente a las que la vacuna puede ser efectiva, y genera una mejor respuesta frente a los otros tres antígenos por un mecanismo no bien conocido (15). Los antígenos han sido seleccionados según su importancia en la supervivencia del microorganismo, su funcionalidad en la patogénesis de la enfermedad y su potencial presencia y expresión en la mayoría de las cepas del serogrupo B. Hasta ahora, la eficacia de las vacunas frente a una enfermedad como ésta, de baja incidencia, que impide realizar ensayos clínicos de eficacia por la necesidad de un gran número de participantes, se ha asumido mediante parámetros subrogados de protección, y en el caso de la enfermedad meningocócica por los resultados obtenidos en ensayos de actividad bactericida del suero (6). En este caso, dichos ensayos se han utilizado para demostrar la inmunogenicidad de esta nueva vacuna frente al serogrupo B, enfrentando los sueros de individuos inmunizados con las cuatro cepas de las que se habían obtenido los diferentes antígenos incluidos en la formula­ ción vacunal. Ahora bien, la realización de ensayos clínicos para medir la eficacia protectora en general, tal y como se ha hecho con las vacunas de polisacárido conjugado, no es viable. En la evaluación de las vacunas de polisacárido, el antígeno es común a todas las cepas de ese serogrupo, por lo que los sueros se enfrentan a una única cepa que expresa ese antígeno. En el caso de la vacuna de cuatro componentes frente al serogrupo B, cada suero habría que enfrentarlo a cientos de cepas que expresaran todas o la gran mayoría de las variantes antigénicas posibles, lo que sin duda es imposible. Para dar respuesta a esta importante limitación, surge entonces la metodología que se conoce como Meningococcal Antigen Typing System (MATS) (16, 17), que combina un enzimoinmunoensayo (ELISA) específico frente a cada uno de los antígenos vacunales, detectando diferencias cualitativas y cuantitativas en la expresión de dichos antígenos; se mide, pues, tanto la reactividad cruzada inmunológica como la cantidad de antígenos 177 Posible impacto en España de la nueva vacuna antimeningocócica B NHBA, NadA y fHbp. Adicionalmente se incluye la información del subtipo de PorA para incluir la cobertura potencial también con este antígeno. Los resultados obtenidos con el ELISA se han correlacionado con la lisis de las cepas en el ensayo de la actividad bactericida del suero, y se ha hallado que los aislamientos que superan un valor umbral en la prueba ELISA para cualquiera de los tres antígenos de la vacuna tienen un 80% o más de probabilidad de ser neutralizados por el suero en el ensayo de actividad bactericida. Aquellas cepas que resultan positivas para dos o más antígenos tienen una mayor probabilidad (96%) de ser lisadas en presencia de sueros de individuos inmunizados. El ensayo MATS permite analizar grandes paneles de cepas y predecir la posible cobertura de la vacuna. El desarrollo de un ensayo simple y de alto rendimiento que se correlaciona con la actividad bactericida constituye un hito en el desarrollo de vacunas frente al meningococo, y su utilidad podría ampliarse en el futuro a la evaluación de nuevas vacunas basadas en proteínas frente a otros microorganismos. El único inconveniente de esta nueva técnica de evaluación es su compleja validación (17) con el fin de producir resultados repetitivos y extrapolables entre laboratorios, lo que ha llevado a que sólo los laboratorios nacionales de referencia de un limitado número de países (Alemania, Australia, Brasil, Canadá, España, Estados Unidos, Francia, Italia, Noruega y Reino Unido) hayan sido validados para su aplicación (17). Los resultados iniciales sobre la posible cobertura en Europa, tras el análisis de más de 1000 aislamientos, indican que esta nueva vacuna podría cubrir un 78% de las cepas asociadas con casos clínicos (18). En España, que tuvo una incorporación tardía a este Consorcio Internacional, el análisis aún no ha finalizado, y aunque los datos de cobertura podrían estar en cifras similares debemos esperar a contar con resultados definitivos. No obstante, España ha presentado históricamente algunas diferencias en las líneas clonales circulantes con respecto a Europa (19), lo que podría incidir en pequeñas variaciones en la estimación de la cobertura. Esta vacuna, que como se ha mencionado está en proceso de evaluación en la Agencia Europea de Medicamentos, todavía plantea muchos interrogantes que habrá que ir resolviendo, como son su posible impacto en los portadores asintomáticos, la posibilidad de usarla también frente a otros serogrupos que expresen estos mismos antígenos (¿podríamos hablar entonces de una vacuna universal frente a la enfermedad meningocócica?), la duración de la inmunidad conferida, etc. Sólo nuevos estudios podrán dar respuesta a estas cuestiones, pero lo que parece evidente es que hay nuevos y cercanos horizontes en la prevención con vacunas de la enfermedad por 178 J.A. Vázquez y R. Abad el meningococo del serogrupo B, con novedosas armas que podrían llevarnos a un control más adecuado y a una mejor prevención de esta letal enfermedad. BIBLIOGRAF Í A 1.Halperin SA, Bettinger JA, Greenwood B, Harrison LH, Jelfs J, Ladhani SN, et al. The changing and dynamic epidemiology of meningococcal disease. Vaccine. 2012;30 (Suppl 2):B26-36. 2.Harrison LH, Pelton SI, Wilder-Smith A, Holst J, Safadi MA, Vázquez JA, et al. The Global Meningococcal Initiative: recommendations for reducing the global burden of meningococcal disease. Vaccine. 2011;29:3363-71. 3.Van den Biggelaar AHJ, Pomat WS. Immunization of newborns with bacterial conjugate vaccines. Vaccine. 2012. Disponible en: http://dx.doi.org/10.1016/j.vaccine. 2012.06.019. 4.Abad R, Vázquez JA. Microbiología y salud pública: nuevos retos en vigilancia y control de la enfermedad meningocócica. Enferm Infecc Microbiol Clin. 2012;30:53-5. 5.Poolman JT, Feron C, Dequesne G, Denoël PA, Dessoy S, Goraj KK, et al. Outer membrane vesicles and other options for a meningococcal B vaccine. En: Ferreirós C, Criado MT, Vázquez J, editores. Emerging strategies in the fight against meningitis. England: Horizon Scientific Press; 2002. p. 135-49. 6.Vipond C, Care R, Feavers IM. History of meningococcal vaccines and their serological correlates of protection. Vaccine. 2012;30 (Suppl 2):B10-7. 7.Vázquez JA. El desarrollo de vacunas frente al meningococo: un largo, tortuoso y aún inacabado camino. Enferm Infecc Microbiol Clin. 2002;20:313-5. 8.Rappuoli R. Reverse vaccinology, a genome-based approach to vaccine development. Vaccine. 2001;19:2688-91. 9.Masignani V, Comanducci M, Giuliani MM, Bambini S, Adu-Bobie J, Arico B, et al. Vaccination against Neisseria meningitidis using three variants of the lipoprotein GNA1870. J Exp Med. 2003;197:789-99. 10.Fletcher LD, Bernfield L, Barniak V, Farley JE, Howell A, Knauf M, et al. Vaccine potential of the Neisseria meningitidis 2086 lipoprotein. Infect Immun. 2004;72:2088-100. 11.Pizza M, Donnelly J, Rappuoli R. Factor H-binding protein, a unique meningococcal vaccine antigen. Vaccine. 2008;26 (Suppl 8):I46-8. 12.Ala’aldeen DA, Flint M, Oldfield NJ, Omer SA, McNeil LK, Jiang Q, et al. Human antibody responses to the meningococcal factor H binding protein (LP2086) during invasive dis­ ease, colonization and carriage. Vaccine. 2010;28:7667-75. 13.Marshall HS, Richmond PC, Nissen MD, Jiang Q, Anderson AS, Jansen KU, et al. Safety and immunogenicity of a meningococcal B bivalent rLP2086 vaccine in healthy toddlers aged 18 to 36 months: a phase 1 randomized controlled clinical trial. Pediatr Infect Dis J. 2012; Jun 20. [Epub ahead of print.] 14.Santolaya ME, O’Ryan ML, Valenzuela MT, Prado V, Vergara R, Muñoz A, et al. Immunogenicity and tolerability of a multicomponent meningococcal serogroup B (4CMenB) vaccine in healthy adolescents in Chile: a phase 2b/3 randomised, observer-blind, placebo-controlled study. Lancet. 2012;379:617-24. 179 Posible impacto en España de la nueva vacuna antimeningocócica B 15.Findlow J, Borrow R, Snape MD, Dawson T, Holland A, John TM, et al. Multicenter, open-label, randomized phase II controlled trial of an investigational recombinant meningococcal serogroup B vaccine with and without outer membrane vesicles, administered in infancy. Clin Infect Dis. 2010;51:1127-37. 16.Donnelly J, Medini D, Boccadifuoco G, Biolchi A, Ward J, Frasch C, et al. Qualitative and quantitative assessment of meningococcal antigens to evaluate the potential strain coverage of protein-based vaccines. Proc Natl Acad Sci U S A. 2010;107:19490-5. 17.Vogel U, Stefanelli P, Vázquez J, Taha MK, Claus H, Donnelly J. The use of vaccine antigen characterization, for example by MATS, to guide the introduction of meningococcus B vaccines. Vaccine. 2012;30 (Suppl 2):B73-7. 18.Dull PM, McIntosh ED. Meningococcal vaccine development –from glycoconjugates against MenACWY to proteins against MenB– potential for broad protection against meningococcal disease. Vaccine. 2012;30 (Suppl 2):B18-25. 19.Abad R, Enríquez R, Medina V, Vázquez JA. Changes in the clonal lineages of serogroup B invasive meningococcal population in Spain (2008-2010). 11th Annual Meeting of the European Meningococcal Disease Society (EMGM); 2011. 180 F.A. Moraga-Llop Novedades en vacunología en 2011 P ERSON AJ ES Y AC O NTEC I M I E N T O S M Á S RELEVAN T E S E N ES PAÑ A E N E L CA M P O D E LA VAC U NO L O G ÍA DU RANT E E L A Ñ O 2 0 1 1 En los últimos 12 meses han aparecido muchas noticias sobre vacunas en la prensa no médica. En relación a los personajes importantes de la vacunología citaré a dos, que además han sido profesores de nuestros cursos: Ciro de Quadros y Alfonso Carmona. El profesor Ciro de Quadros ha recibido hace unos meses el importante premio Fronteras del conocimiento en cooperación al desarrollo, de la Fundación BBVA. Este epidemiólogo brasileño comenzó a trabajar en la Organización Mundial de la Salud (OMS) en 1970 como responsable del exitoso programa de erradicación de la viruela del mundo; continuó después en la Organización Panamericana de la Salud, donde puso en marcha las estrategias de vacunación sistemática contra la poliomielitis y el sarampión, que se lograron eliminar de la región americana a finales del pasado siglo; y desde 2003, con su labor en el Instituto de Vacunas Sabin en Washington, intenta que las vacunas lleguen a todo el mundo, reduciendo el tiempo desde que se comercializa una vacuna en un país hasta que llega a todos los países del mundo. «Vacunas para todos», afirma De Quadros, y dice que «las investigaciones científicas han demostrado que los niños vacunados tienen un rendimiento escolar mucho mayor que los no vacunados, la población enferma menos y por lo tanto es más productiva; además, cada dólar que se invierte en vacunas ofrece un retorno de diez». 181 Novedades en vacunología en 2011 El doctor Alfonso Carmona, de Sevilla, director del Instituto Hispalense de Pediatría, desde hace 8 años desarrolla, como asesor de vacunación en la organización no gubernamental Áfica Arco Iris, importantes campañas de vacunación que este año han beneficiado a 10.000 niños de Costa de Marfil, además de mostrar una gran preocupación por la educación de la población infantil. En cuanto a las publicaciones en 2011, un importante artículo apareció primero en la prensa no médica y luego en una revista especializada (Vacunas 2011;12:160-1): Hablemos de las vacunas desde la ciencia y el conocimiento. Es un documento de consenso de muchas sociedades y asociaciones científicas frente a la «desinformación sobre las vacunas», elaborado por la Asociación Española de Vacunología, y cuyos puntos clave, a modo de resumen, se incluyen en la Tabla 1. Otras noticias han hecho referencia a demandas, y es importante señalar hasta dónde pueden llegar. Una adolescente desarrolló un cuadro grave de sepsis meningocócica por el serogrupo C que requirió una amputación de parte de los miembros inferiores. Había sido vacunada en el año 1997 con la vacuna antimeningocócica AC no conjugada, la única disponible en aquel momento, y la familia demandó a la consejería de CastillaLa Mancha y ganó el pleito con una importante cantidad de dinero, porque en la campaña vacunal del año 2000-2001 no había recibido la suficiente información conforme esta niña, como es lógico, tendría que haberse Tabla 1. Conclusiones del documento de consenso sobre vacunas de la Asociación Española de Vacunología. •En los últimos tiempos se está observando una aumento de las declaraciones contrarias a la vacunación. •En los medios de comunicación (prensa, radio y televisión) se escuchan argumentos contra las vacunas por parte de profesionales de distintos ámbitos, a contracorriente y puede que buscando una notoriedad que de otra forma no conseguirían. •El daño realizado por la publicación de Wakfield et al. en The Lancet en 1988, en la que se relacionaba la vacuna del sarampión con la aparición del autismo, sigue hoy vigente, a pesar de que su principal autor fue inhabilitado para el ejercicio de la medicina por la falsedad empleada. •Sólo a las vacunas pueden atribuirse los cambios habidos en pocos años en la incidencia de enfermedades, como la poliomielitis, la difteria, el tétanos, la tos ferina, el sarampión, etc. •La Asociación Española de Vacunología –desde su composición multidisciplinaria, con profesionales de distintos ámbitos de la medicina relacionados con las vacunas– junto con las sociedades científicas firmantes del presente documento, creemos que ha llegado la hora de trabajar desde la unidad de estas sociedades y la administración sanitaria para desarrollar estrategias y actuaciones que hagan posible conseguir la confianza de la población en las vacunas. 182 F.A. Moraga-Llop vacunado cuando se comercializó la vacuna C conjugada como repesca (catch-up). En otro caso se condenó a la consejería de Castilla-León por no solicitar el consentimiento informado para la administración de la vacuna triple vírica explicitando el infrecuente riesgo de encefalopatía asociado a esta vacuna. También aparecieron noticias sorprendentes. Ante un brote de enfermedad meningocócica por el serogrupo C ocurrido en Sevilla se produjeron informaciones contradictorias; en 4 días la Junta de Andalucía cambió de criterio sobre la vacunación: que si hay que poner una cuarta dosis, que si no hay que ponerla, lista de espera, confusión, protestas de la población, vacunas hasta los 40 años de edad… Los errores fueron que, en el año 2000, cuando se incluyó la vacuna C conjugada en el calendario, no se hizo el catch-up hasta los 19 años de edad, y en 2005, cuando se cambió la pauta, los niños que estaban vacunados con las tres dosis del primer año de vida no recibieron el catch-up en el segundo año de vida. El Servicio Andaluz de Salud tuvo que rectificar y volver a vacunar a los niños de 7 a 12 años de edad que no habían recibido el catch-up, y ahora la Junta ofrece la vacuna de recuerdo de la meningitis que retiró (Fig. 1). EVOLU C IÓ N DE L AS C O B ERT URA S VACU N ALE S E N ES PAÑ A EN EL Ú LTI M O A Ñ O. ¿L A RE E M E RG E N CI A DE LA TO S F ER I NA Y L O S B RO T E S D E SARAMP IÓ N ES T ÁN R EL ACI O N A D O S C ON C OBERT U RAS M Á S B A JA S ? Según los datos publicados por el Ministerio de Sanidad, Servicios Sociales e Igualdad correspondientes al año 2010, las coberturas de la primovacunación y de las dos dosis de recuerdo (en el segundo año de edad y a los 4-6 años) con la vacuna de la tos ferina fueron del 96,6%, el 93,7% y el 88,9%, respectivamente. En el año 2011, la cobertura de la primovacunación se mantuvo (97,1%) en un intervalo del 92,6% al 99,6% (datos provisionales). Por tanto, la reemergencia de la tos ferina no puede explicarse por una disminución de la cobertura vacunal a estas edades, pero sí por el hecho de que la vacunación no se extiende de forma sistemática al adolescente ni al adulto. La cobertura en 2010 con la primera dosis de la vacuna triple vírica fue del 95,5%, con un límite inferior del intervalo de edad del 89,4%. Sin embargo, para la segunda dosis, con una media aceptable (92,3%) aunque 183 Novedades en vacunología en 2011 Figura 1. Informaciones en la prensa sobre un brote de meningitis meningocócica C en Sevilla. no óptima (superior al 95%), el límite inferior del intervalo fue mucho más bajo (77,6%). Estas coberturas justifican algunos brotes de sarampión que se presentan en determinados ambientes con bolsas de susceptibles debidas a la no vacunación. En cuanto a la vacunación frente al virus del papiloma humano, la cobertura correspondiente al curso escolar 2009-2010 fue del 64,3%, frente al 77,2% del curso anterior, lo que representa un importante descenso. Sin embargo, este porcentaje disminuyó drásticamente en cuatro comunidades por debajo de la media nacional, alcanzando en Andalucía sólo el 36,9%. La máxima cobertura fue del 91,1%, en La Rioja. Para el resto de las vacunaciones sistemáticas del calendario las coberturas se han mantenido estables. El fenómeno de la antivacunación en España, de momento, está limitado a colectivos concretos. 184 F.A. Moraga-Llop EL CALEN DA R I O VAC U NA L ÚN I CO EN ESPAÑ A HA S IDO NO T IC I A . ¿DÓN DE E S TA M O S ? Un tema estrella de la vacunología durante este año en la prensa ha vuelto a ser el del calendario único y las mismas vacunas para todos. El calendario único que se ha determinado establecer (y algún medio de prensa lo ha recogido muy bien) podrá serlo respecto a las fechas de administración de las vacunas, pero todavía no en cuanto a las vacunas incluidas. El calendario único de vacunas es un viejo problema de muchos gobiernos. Sin embargo, si se quiere lograr un calendario único en fechas hay que hacerlo basándose en criterios científicos, y por ejemplo, no puede ser que se determine que la pauta recomendada para la vacuna de la hepatitis B es la de 0, 2 y 6 meses porque la lógica y racional es a los 2, 4 y 6 meses, por muchos motivos conocidos desde hace tiempo. Como son dos estrategias bastante diferentes, pues una empieza en el hospital y la otra en primaria, lo mejor sería no tocar la edad de esta vacunación por las dificultades logísticas y presupuestarias que supondría para las comunidades que vacunan a partir de los 2 meses tener que hacerlo en las maternidades. En cuanto a las vacunas triple vírica y de la varicela, no ha sido un cambio importante poner la primera dosis a los 12 meses de edad, puesto que muchas comunidades ya lo hacían, a raíz de los brotes de sarampión aparecidos en los últimos 5 años. La segunda dosis, por lo que se está observando en la epidemiología del sarampión, creo que habría que adelantarla a los 2-3 años de edad. La dosis de recuerdo (booster) de la vacuna antimeningocócica C conjugada hay que administrarla preferentemente a los 12 meses de edad, o lo más precozmente posible en el segundo año de vida, porque como la enfermedad meningocócica tiene muchas veces una evolución hiperaguda no podemos confiar la respuesta inmunitaria al componente celular, debido a la disminución de los anticuerpos que se produce en el primer año de vida. La vacuna frente al virus del papiloma humano habría que incluirla para las niñas a los 11 años de edad, que es lo lógico y racional, para asegurarse al máximo de que no se ha iniciado todavía la actividad sexual. No obstante, en muchas comunidades continúa aplicándose a los 14 años porque este cambio supondría vacunar a tres cohortes, lo que incrementa el coste de la vacunación. La sexta dosis de la vacuna dTpa hay que ponerla sobre todo al principio de la adolescencia (11-12 años). 185 Novedades en vacunología en 2011 A pesar de todas estas consideraciones a favor del calendario único, durante el año 2011 se han producido ciertos cambios en los calendarios de algunas comunidades autónomas: •• Sustitución de la quinta dosis de la vacuna DTPa por la dTpa en 15 comunidades autónomas. •• Incorporación de la VNC-13v en Galicia (enero de 2011). •• Inclusión de una segunda dosis de vacuna de la varicela en Melilla (enero de 2011). •• Adición de una sexta dosis de vacuna antipertussis, en forma de vacuna dTpa, en Madrid (junio de 2011). VACU NAS AU T O R I ZADA S O I N CLUI DA S EN EL CA L ENDA R I O E N E S PA Ñ A Y EN EL M U NDO DU RA N T E 2 0 1 1 En España no se han comercializado vacunas durante el último año. La Agencia Europea de Medicamentos (EMA) ha aprobado una segunda vacuna antimeningocócica tetravalente (ACWY) conjugada con toxoide tetánico (Nimenrix®, GlaxoSmithKline), a partir de los 12 meses de edad. En este momento ya hay una vacuna comercializada (Menveo®), con CRM197 como proteína transportadora, de uso a partir de los 11 años de edad, pero la EMA acaba de aprobar que puede administrarse a partir de los 2 años de edad. La OMS ha comunicado la formulación de la vacuna antigripal de la próxima temporada (Tabla 2) y hay que destacar dos aspectos: un cambio en la cepa A H3N2 y un cambio en la cepa B. Además, en el documento de la OMS se reconoce por primera vez la posibilidad de que las vacunas Tabla 2. Formulación de la OMS para la vacuna antigripal de la temporada 2012-2013. •El componente AH3N2, cepa A/Perth/16/2009, se sustituye por la cepa A/Victoria/361/2011(AH3N2) ya que la mayoría de los virus recientes fueron antigénicamente y genéticamente distinguibles de la cepa vacunal A/Perth/16/2009 y estaban más estrechamente relacionados con la cepa de referencia A/Victoria/361/2011. •El virus de la gripe B, cepa B/Brisbane/60/2008 (linaje Victoria), se sustituye por la cepa B/Wisconsin/ 1/2010(Yamagata). Esta decisión se basa en el aumento de la proporción de virus de linaje B/ Yamagata/16/88 en muchas partes del mundo, aunque el virus B/Victoria/2/87 ha predominado en algunos países, especialmente en China. 186 F.A. Moraga-Llop trivalentes de la gripe sean tetravalentes e incluyan dos cepas del virus B. En Estados Unidos acaba de aprobarse la primera vacuna tetravalente de la gripe, la vacuna intranasal Flumix®, que es la primera con dos cepas del virus B. Además, se encuentra en estudio una vacuna, Fluarix® tetra de Glaxo­Smith Kline, que incluye una cepa adicional de tipo B. La inclusión de una segunda cepa B como parte de la vacuna estacional, en una formulación tetravalente, podría incrementar la protección de la vacuna. Es muy importante destacar el acuerdo que ha habido entre la Alianza GAVI y los laboratorios GlaxoSmith Kline y Merck (Sanofi Pasteur MSD en España), que están proporcionando vacunas antirrotavirus a los países en desarrollo a un precio muy inferior. CAMBIOS EN L AS F I C HA S T É CN I CA S DE LAS VAC U NA S C O M ERC I A L I Z A DA S En cuanto a la vacuna frente al rotavirus, ha habido un cambio en la ficha técnica de Rotateq®. Se acaba de aprobar el límite superior de edad para la vacunación hasta 32 semanas (antes era hasta las 26 semanas de edad). Como en Estados Unidos, la Agencia Española del Medicamento y Productos Sanitarios ha rectificado la ficha técnica en este sentido de cambiar 26 por 32 semanas. También ha habido cambios en las fichas técnicas de las vacunas del virus del papiloma humano. Para Cervarix® nos hemos de referir a la última ficha técnica aprobada, en diciembre de 2011, en la que cambió la edad mínima de vacunación a los 9 años. Se dispone de nuevos resultados de inmunogenicidad y eficacia con un seguimiento de hasta 9,4 años, y de los primeros datos importantes de protección cruzada basándose en dos parámetros: la infección persistente a los 6 meses y el CIN2+ frente a los serotipos 31, 33 y 45 con valores significativos. En cuanto a Gardasil®, en la última ficha técnica, de agosto de 2011, se señala su eficacia en hombres de 16 a 26 años de edad y en hombres naive, y la eficacia puente (según datos de inmunogenicidad) en adolescentes de 9 a 15 años de edad. Los datos sobre la eficacia de Gardasil®, la vacuna tetravalente, frente a las verrugas genitales son importantes: un 90,6% y un 89,3%. En Estados Unidos, en diciembre de 2011 los Centers for Disease Control and Prevention (CDC) hicieron las primeras recomendaciones sobre la vacuna tetravalente (MMWR 2011:50:1705-8) basándose en su alta eficacia frente a las verrugas genitales y la neoplasia intraepitelial anal: se recomienda la vacunación sistemática de los varones a los 11-12 años de edad, se recomienda la vacunación 187 Novedades en vacunología en 2011 de los varones de 13 a 21 años de edad no vacunados, y pueden vacunarse los varones de 22 a 26 años de edad. En Pediatrics (2012;129:602-5) acaban de publicarse todas las recomendaciones, entre las que cabe destacar los grupos de riesgo constituidos por los varones homosexuales hasta los 26 años de edad y los infectados por el virus de la inmunodeficiencia humana. En las fichas técnicas de las vacunas dTpa también ha habido cambios. Boostrix® y Triaxis® pueden administrarse siguiendo los intervalos establecidos en las recomendaciones oficiales. Además, en Boostrix® se especifica que en general debe hacerse cada 10 años, basándose en trabajos que demuestran que el recuerdo decenal con esta vacuna es inmunógeno y seguro. Según la última ficha técnica de la vacuna antineumocócica conjugada decavalente, Synflorix®, puede administrarse hasta los 5 años de edad. Y también la vacuna 13-valente, Prevenar 13®, tiene ya autorizada una nueva indicación a partir de los 50 años de edad. La Food and Drug Administration de Estados Unidos ha aprobado una modificación de la ficha técnica de Zostavax®, vacuna frente al herpes zóster, según la cual también pueden vacunarse las personas de 50 a 59 años de edad, aunque el Advisory Committee on Immunization Practices sigue reafirmando la recomendación, por criterios de eficiencia, de vacunar a partir de los 60 años de edad. Y finalmente, en cuanto a las vacunas de futuro, dos noticias: 180 asturianos se ofrecen voluntarios para el ensayo de la vacuna anticocaína, y van a comercializarse dos vacunas, según informa el doctor Pedro Alonso, frente a la malaria en 2015 y la del dengue de Sanofi Pasteur seguramente en 2014 o 2015. También se espera, para el próximo año 2013, la comercialización de la nueva vacuna antimeningocócica B de Novartis (Bexsero®). ¿HAY NU EVA S R EC O ME N DACI O N E S VAC U NAL E S ? Tos ferina Para la vacunación frente a la tos ferina (Tabla 3) hay nuevas recomendaciones desde octubre de 2011, con una nueva estrategia importante: la vacunación materna en el segundo trimestre del embarazo, a partir de las 20 semanas, o en el tercer trimestre, que se aconseja simultanear con la estrategia del nido (MMWR 2011;60:1424-6). Recientemente, en febrero y marzo de 2012, la Sociedad de Pediatría de Argentina y el Comité de la Asociación de Obstetras y Ginecólogos Americana acaban de hacer las mismas 188 F.A. Moraga-Llop Tabla 3. Estrategias de vacunación frente a la tos ferina. •Vacunación sistemática del adolescente a los 11-12 años: dTpa en lugar dT •Vacunación sistemática del adulto: dTpa en lugar dT •Estrategia del nido: precoz, al menos 15 días antes del contacto ––Contactos domiciliarios familiares ––Contactos domiciliarios no familiares ––Estrategia del nido ampliada: ·· Personal de guarderías ·· Personal sanitario •Vacunación de la embarazada a partir de la 20ª semana de gestación: ––Protección directa pasiva e indirecta del recién nacido •Vacunación materna en el puerperio inmediato •Vacunación pediátrica precoz: ––Neonatal: no hay vacunas monovalentes disponibles ––Lactante: vacunación precoz y rápida a las 6, 10 y 14 semanas •Nuevas vacunas adaptadas a las cepas de B. pertussis circulantes: en investigación recomendaciones (Obstet Gynecol 2012;119:690-1). Y en junio de 2012, la última edición del Red Book recoge esta nueva indicación, preferentemente en el tercer trimestre o al final del segundo trimestre, si la mujer no ha recibido previamente la vacuna dTpa (American Academy of Pediatrics. Pertussis. En: Pickering LK, Baker CJ, Kimberlin DW, Long SS, editores. Red Book: 2012 Report of the Committee on Infectious Diseases. Elk Grove Village, IL: American Academy of Pediatrics; 2012. p. 553-66). La situación epidemiológica de la tos ferina en Estados Unidos, en particular durante el año 2010, con importantes brotes, como el de California que afectó a 10.000 personas, y el aumento del número de muertes en los lactantes hasta los 3 meses de edad (en el último decenio se ha multiplicado por 3,5 en relación a la década de 1980: 175 frente a 49), han obligado a las autoridades sanitarias a reconsiderar la prevención de la tos ferina para proteger al recién nacido y al lactante en los primeros 3 meses de la vida. Los brotes han reaparecido en Estados Unidos en los primeros meses de 2012. Nosotros creemos que en este momento la mejor estrategia sería aunar la vacunación de la embarazada con la estrategia del nido, teniendo en cuenta que la vacunación de los contactos debería hacerse al menos 15 días antes del posible contacto. La estrategia del nido es difícil de implementar por obstáculos logísticos y económicos, como lo demuestran las 189 Novedades en vacunología en 2011 bajas coberturas alcanzadas en los países que la han incorporado, debido a la complejidad de acceder a todas las personas y los grupos candidatos a vacunarse, y por los especialistas a quienes corresponde hacerlo (obstetras, médicos de familia, pediatras, especialistas en medicina preventiva, médicos de salud laboral, geriatras…). En Australia ha habido una epidemia importantísima de tos ferina por Bordetella pertussis, con más de 38.000 casos en 2011, y se han producido cambios genéticos en los antígenos de esta bacteria. La investigación de nuevas vacunas parece urgente, porque seguramente estamos administrando una vacuna que no es adecuada para proteger frente a las actuales cepas circulantes. Hepatitis A y B Las últimas recomendaciones sobre la vacunación frente a la hepatitis A indican que todos los padres que adopten niños procedentes de países con una endemicidad de hepatitis A alta o intermedia, y los posibles contactos de estos niños, tienen que vacunarse al menos 2 semanas antes del posible contacto (Pediatrics 2011;128:803-4). Otra novedad es que un nuevo grupo de riesgo que debe recibir la vacuna frente a la hepatitis B son los enfermos con diabetes mellitus (MMWR 2011;60:1709-11). Enfermedad neumocócica invasora El 6 de abril de 2012, la OMS (WER 2012;87:129-44) publicó una revisión sobre vacunas antineumocócicas. Hay que recordar la importancia de hacer el catch-up con la vacuna 13-valente en los niños menores de 5 años, vacunados previamente con las otras dos vacunas conjugadas, la heptavalente (ya no disponible) y la decavalente, para ofrecer la protección adicional frente a los serotipos 3, 7F y 19A. P REGU NTAS Pregunta del público: Quería preguntar sobre las estrategias de vacunación antimeningocócica en general: si va a incluirse la vacuna del meningococo B, si la vacunación antimeningocócica C en el primer año de vida se reducirá a una dosis con una más en el segundo año de vida y cubrir el posible riesgo de los adolescentes con otra en la adolescencia (pauta 1+1+1), y si esta dosis de los adolescentes 190 F.A. Moraga-Llop debería hacerse con vacuna tetravalente aunque de momento aquí no tengamos los otros meningococos. Dr. Julio Vázquez (por invitación a responder): En este momento se ha abierto la discusión entre el ministerio y las comunidades autónomas para analizar cambios en la estrategia que estamos aplicando ahora mismo. Reino Unido la ha cambiado y va a empezar a aplicarla ya este año, y se ha ido a una estrategia de una dosis en el mes 3, una segunda dosis en el mes 12 y una tercera dosis de recuerdo aproximadamente entre los 12 y los 14 años de edad (todavía no está definido). Holanda se ha pronunciado en el mismo sentido, pero va a seguir con una sola dosis en el segundo año de vida y una dosis de recuerdo por definir entre los 11 y los 15 años de edad. Nosotros probablemente iremos a un esquema de 1+1+1, con una dosis a los 2 o 4 meses de edad, la segunda dosis de recuerdo a los 12-14 meses, y la tercera entre los 12 y los 14 años. Mi punto de vista es que sería mejor 1+1 nada más, porque no estoy convencido de que los anticuerpos generados en un niño de 2 o 4 meses, con una sola dosis de cualquiera de las tres vacunas disponibles en este momento, alcancen para protegerle durante el primer año de vida, y por lo tanto estamos poniendo una dosis que tiene más sentido político, de cubrirse las espaldas por si acaso, que de otra cosa. Yo creo que si se hace, que es lo que no se hizo en su día, un catch-up bueno en los adolescentes, podemos dejar protegidos a los menores de 1 año porque van a estarlo por el efecto rebaño. En cuanto a si la última dosis podría ser de vacuna tetravalente, desde el punto de vista epidemiológico no se justifica porque casi no tenemos casos, y los pequeños incrementos del serogrupo Y que se han detectado en Europa últimamente ha sido en los países nórdicos, que con el bajo número de casos que tienen cualquier pequeño incremento hace que cambien mucho las cifras. En España, los serogrupos Y y W135 suponen menos del 4% de todos los casos, por lo que epidemiológicamente no se justifica. Por potenciales problemas de futuro o posibles viajes tampoco estaría justificado, porque no se ha descrito ningún caso de viajeros, ni siquiera desplazándose a zonas con alta endemia de enfermedad meningocócica. Otra cosa es el cooperante que va a vivir ahí y que va a estar trabajando en el campo, pero en viajeros turistas yo creo que no se justifica demasiado, excepto si la industria bajara el precio de la dosis de tetravalente conjugada y lo igualara a la monovalente C conjugada, en cuyo caso creo que no habría ningún problema. Dr. Moraga: Estoy de acuerdo con el comentario del serogrupo C, pero es arriesgado quitar las dos dosis ya instauradas en el primer año de vida. 191 Novedades en vacunología en 2011 Dr. Vázquez: Desde el punto de vista médico, no político, una dosis probablemente va a producir una respuesta inmunitaria de 2-3 meses de duración, con lo cual vamos a tener a los niños igualmente desprotegidos, pero será políticamente más correcto. Dr. Josep Marés: Los meningococos B y C comparten, creo, las mismas proteínas de membrana. ¿La vacuna de proteína de membrana cubrirá también el meningococo C? ¿Podría en un futuro plantearse una vacunación universal para la meningitis con una vacuna proteica y no deberíamos usar necesariamente una vacuna conjugada para el meningococo C? ¿Comparten esas proteínas los dos meningococos? Dr. Vázquez: Ésta es una buena pregunta, pero no sé muy bien cómo responderla, probablemente porque todavía tenemos pocos datos de otros serogrupos distintos en cuanto a la presencia de esos antígenos y a las variantes que se expresan en otros serogrupos. Están presentes porque son proteínas comunes, eso es cierto; lo que ocurre es que las coberturas nunca van a ser muy altas en cuanto a número de casos, es decir, no van a estar en el 100% como en este momento tenemos con las vacunas conjugadas, lo cual quiere decir que probablemente lo que tendremos en el futuro, en mi opinión, serán vacunas combinadas, de forma que en una sola dosis tengamos vacuna conjugada tetravalente o pentavalente frente a cinco serogrupos distintos junto con vacuna proteica frente al B, pero me parece técnicamente muy difícil sustituir una vacuna eficaz al 100%, con un 100% de cobertura de casos, por una vacuna con una eficacia del 90% y un 70% de cobertura de casos. Es decir, creo que es una muy buena herramienta para el meningococo B, que podría haber sido utilizada como vacuna universal, pero que probablemente no va a serlo. Dr. Marés: En relación a la tos ferina, que tanto nos preocupa, siempre que hablamos de ella lo hacemos de la estrategia del nido, de la vacunación de la embarazada. Yo quiero hacer una reflexión: personalmente me he dedicado a intentar poner en práctica la estrategia del nido, y otros compañeros también lo han hecho en hospitales y en atención primaria. Es evidente que es una estrategia complementaria; si creemos que con ella vamos a controlar la situación, me parece que estamos equivocados. La estrategia del nido es una actitud más. Si nos olvidamos de la revacunación del adolescente, no vale la pena perder el tiempo, sinceramente. Si vacunamos al adolescente, y queremos más porque no tenemos una efectividad alta frente a la tos ferina, me parece muy bien hacer un esfuerzo, porque el esfuerzo para conseguir vacunar a los padres es grandísimo, y si ade192 F.A. Moraga-Llop más hay que vacunar a los abuelos, imposible, y si ha de ser 15 días antes de que nazca el niño, ya podemos olvidarnos. ¿Quién lo va a hacer? Tenemos ginecólogos excelentes, pero tendrán que implicarse en la vacunación de los abuelos frente a la tos ferina del bebé. Sinceramente, cuando tomamos decisiones, sobre todo las administraciones públicas, tenemos que reflexionar sobre qué efectividad vamos a conseguir con una estrategia que va a tener un coste, y en este caso la más efectiva y la más coste-efectiva es vacunar a los adolescentes, y después podemos discutir sobre qué más podemos hacer. Dr. Moraga: Asumía yo en mi planteamiento que la vacuna del adolescente ya está en el calendario de la Asociación Española de Pediatría, pero estoy completamente de acuerdo. Yo veo más factible, dentro de lo difícil, vacunar a la embarazada (no nos olvidemos de la vacunación de la gripe en la embarazada) que vacunar, por ejemplo, en el posparto, que tiene menos utilidad. Dr. José María Bayas: La vacunación de la embarazada podría ser relativamente fácil, porque es en especial sensible a los mensajes de salud, si se organiza bien y si realmente contamos con la complicidad de los responsables del cuidado de las embarazadas, que son básicamente los obstetras. Hay datos, aunque todavía no está del todo resuelto, que indican que habría una protección a través del paso de anticuerpos, con lo cual, si realmente se confirma, la embarazada podría desempeñar un papel clave, porque una parte de la protección sería no tanto por el contacto íntimo que obviamente tiene con el recién nacido sino a través del paso de anticuerpos, y dando por supuesta la vacunación de los adolescentes. Dr. Moraga: Completamente de acuerdo, pero hay que ser cautos porque tampoco sobre inmunización de la embarazada hay muchos datos, pero el paso de anticuerpos es una secuencia lógica. De todos modos, soy un poco pesimista, porque conozco las coberturas de la vacunación antigripal de la embarazada. Dr. Bayas: Sí, sería un tema a trabajar, pero probablemente podría haber más motivaciones para vacunarse, aunque es cierto que la vacunación contra la gripe en las embarazadas es prácticamente inexistente en nuestro país. Pregunta del público: ¿Cuándo podrán vacunarse los varones frente al virus del papiloma humano? Dr. Moraga: En este momento, las únicas recomendaciones oficiales que hay son las de los CDC y las de la Academia Americana de Pediatría, pero 193 Novedades en vacunología en 2011 en la ficha técnica de la vacuna tetravalente ya se incluyen los datos de inmunogenicidad y de eficacia en los varones de 9 a 26 años de edad. Pregunta del público: ¿Pero se va a hacer campaña en atención primaria o en los hospitales para que realmente se vacune a los niños? Dr. Moraga: Bueno, yo creo que lo importante y lo prioritario ahora es consolidar la vacunación en las adolescentes, pero en el futuro será también la vacunación de los varones. Pregunta del público: Quería preguntar si considera conveniente, dado el grado de morbilidad que tenemos en el hospital por neumonía neumocócica, y que además el tratamiento es muy largo, la vacunación del personal sanitario, aunque sea inmunocompetente, y si debería vacunarse con la vacuna 13-valente. Dra. Magda Campins (por invitación a responder): En principio, la transmisión del neumococo de persona a persona, como para justificar la vacunación de los contactos, no está descrita. Son pocos los brotes de infección por neumococo que se han comunicado, algunos en residencias geriátricas, pero muy pocos, y por lo tanto no justificaría que el personal sanitario, por estar en contacto con pacientes con neumonía o enfermedad invasora por neumococo, tenga que vacunarse. Por el mismo motivo, ni en nuestro hospital ni en ningún otro se recomienda aislar a los pacientes con neumonía o con enfermedad neumocócica invasora, porque la capacidad de transmisión de persona a persona es muy baja. 194 Hot topics en vacunas A. Martínez Roig Hot topics en vacunas: rotavirus, sarampión, Haemophilus influenzae y meningococo del serogrupo B ROTAV IRU S Las vacunas del rotavirus han demostrado su efectividad, pero con diferencias en la inmunogenicidad y la protección frente a las formas graves entre algunos países de baja renta y otros de renta alta. Se comenta un artículo que estudia la posible influencia de la lactancia materna en el momento de administrar la vacuna sobre el efecto inmunógeno de ésta. Inhibitory effect of breast milk on infectivity of live oral rotavirus vaccine. Moon SS, Wang Y, Shan AL, Nguyen T, Pay P, Dennehy P, et al. Pediatric Infect Dis J. 2010;29:919-23 Las dos vacunas vivas atenuadas frente al rotavirus utilizadas en la actualidad han demostrado una alta eficacia frente a las diarreas graves producidas por este virus y la necesidad de hospitalización por ellas en los países de alta renta. Sin embargo, en África y Asia han tenido menor eficacia y menor inmunogenicidad, efecto que ya se había detectado con las vacunas de la poliomielitis oral y del cólera. Una posible explicación es la administración de la vacuna durante la lactancia materna. Asimismo, el contacto precoz que las madres de estos países tienen con el rotavirus hace que haya una gran cantidad de IgG transplacentaria y altos títulos con capacidad 197 Hot topics en vacunas: rotavirus, sarampión, H. influenzae y meningococo B (TAN ≤2) 80 60 US27 US37 US7 US8 US9 US10 40 20 0 1:8 % reducción en el título de virus A 100 60 IND24 IND60 IND36 IND37 IND25 IND44 20 0 1:32 1:128 1:512 1:2048 Virus Dilución de la leche materna (TAN 8-32) 80 60 40 US5 US23 US25 US22 US43 20 0 1:8 80 40 100 B (TAN ≤8) 1:8 C 1:32 1:128 1:512 1:2048 Virus Dilución de la leche materna % reducción en el título de virus 100 % reducción en el título de virus % reducción en el título de virus neutralizante en la leche, lo cual podría dificultar o impedir la replicación del virus vacunal con una menor efectividad. Se realizó un estudio en 202 madres de lactantes de 1 a 7 meses de edad en Corea, India, Vietnam y Estados Unidos. En la leche materna se determinaron la IgA específica y la actividad neutralizante frente a las cepas vacunales RV1, RV5G1 y 116E. Los títulos de IgA (media de 64, intervalo de 16 a 2048), así como los anticuerpos neutralizantes (más del 50% de las mujeres tenían títulos ≥64 y en un 30% eran ≥128), fueron mucho más altos en las mujeres de la India. Las de Corea y Vietnam tenían unos títulos más bajos, pero comparables entre ellas (IgA 16 y 32; anticuerpos neutralizantes también más bajos, 1/2 y 1/8). Las mujeres norteamericanas mostraban títulos más bajos. En la prueba de inhibición in vitro (Fig. 1), con leche de seis mujeres de Estados Unidos y seis de la India, con títulos neutralizantes bajos (≤8) o 100 (TAN 25-2048) 80 60 IND21 IND39 IND40 IND42 IND50 IND22 40 20 0 1:8 D 1:32 1:128 1:512 1:2048 Virus Dilución de la leche materna 1:32 1:128 1:512 1:2048 Virus Dilución de la leche materna Figura 1. Reducción del título de rotavirus vacunal en leche materna de mujeres de la India (IND) y Estados Unidos (US). En A y C los títulos de anticuerpos neutralizantes (TAN) son bajos, mientras que en B y D son altos. Se comprueba que en la leche con títulos elevados los distintos porcentajes de reducción del título vacunal varían según la procedencia de las mujeres. En las de la India, con diluciones 1/128 y 1/512 todavía se neutraliza el virus vacunal. 198 A. Martínez Roig altos (256 a 2048) frente al RV1, se observó que las muestras con títulos bajos no reducían el título de virus vacunal, mientras que aquellas con títulos altos sí lo hacían y además en relación con los títulos de anticuerpos neutralizantes. A una dilución de 1/32, las seis muestras de mujeres indias reducían el título, y sólo dos de cinco mujeres norteamericanas lo hacían de forma similar. A una dilución de 1/152 se observó una reducción >50% en tres de seis mujeres indias, y en ninguna de las norteamericanas. Estos resultados sugieren que: a) la actividad neutralizante de la leche materna podría restar potencia y efectividad a la vacuna en los países de baja renta cuando se administra poco tiempo después de la toma de la lactancia; b) en los países desarrollados o de renta media no se reduce, sin que se haya recogido el momento de la administración; y c) los resultados con la leche materna en Estados Unidos y Vietnam son similares, así como su epidemiología. No obstante, hay que tener en cuenta que en este estudio sólo se han incluido cuatro países, que el tiempo de lactancia y la cantidad de leche en el momento de la vacunación pueden influir, y que no se valoraron otros factores de interferencia. La lactancia materna realizada al mismo tiempo que la administración de la vacuna podría ser un factor de baja inmunogenicidad. Los autores sugieren el estudio de una vacuna parenteral inactivada para evitar este efecto. SARAMP IÓ N Los brotes aparecidos en los países desarrollados en los últimos años ponen de actualidad las medidas profilácticas para los contactos con los casos de enfermedad. Se nos ofrece una experiencia, ya conocida, de administración de la vacuna, pero con un número de casos superior al de antiguos trabajos. Effectiveness of measles vaccination for control of exposed children. Barrabeig I, Rovira A, Rius C, Muñoz P, Soldevila N, Batalla J, et al. Pediatr Infect Dis J 2011;30:78-80 En esta publicación se plantea la efectividad de la utilización de la vacuna del sarampión como método de profilaxis postexposición en centros escolares para contactos con el caso índice de menos de 72 horas. La existencia de brotes de esta enfermedad en Europa hace plantearse tal posibilidad. La existencia de estudios previos con resultados favorables a esta práctica, y 199 Hot topics en vacunas: rotavirus, sarampión, H. influenzae y meningococo B Tabla 1. Relación de casos índice y edades. Casos índice no vacunados Número 6 a 14 meses de edad 15 meses a 4 años de edad 8 2 Tabla 2. Relación de contactos con un caso índice desglosados según vacunación y enfermedad previa. Contactos con un caso índice Número Total Vacunados 166 (de 6 a 47 meses de edad) 90 con dos dosis 1 con una dosis 75 (45%) No vacunados ni enfermedad previa con resultados adversos en publicaciones más recientes, motivó el estudio de cohorte retrospectivo en Cataluña a raíz del brote de agosto de 2006 a junio de 2007. La intervención se realizó en contactos susceptibles sin vacunación previa. Como contactos con el caso índice se consideraron los niños de la misma clase al menos entre 1 y 4 días antes y 4 días después del exantema, y como casos secundarios cuando la erupción aparecía entre 7 y 18 días después del exantema del caso índice. En las Tablas 1 y 2 se detallan el número de casos índice y sus edades, y el número de contactos, tanto que previamente hubieran pasado la enfermedad, estuvieran vacunados o no lo estuvieran. En la Tabla 3 se aprecia lo sucedido con los 75 contactos susceptibles y vacunados postexposición respecto a la aparición de casos secundarios. Se observa claramente que la aparición de casos secundarios es mayor en los no vacunados (62% frente a 22%). Cuando se valora la vacunación según el día de aplicación (<3, 4-5, 6-7, 8-9 o 10-12 días), la aparición de casos secundarios y su proporción, así como la efectividad de la vacuna, el menor número de casos secundarios se observa en el grupo de menos de 3 días, en el cual de 17 contactos sólo Tabla 3. Casos secundarios entre vacunados y no vacunados postexposición. Contactos 75 200 Contactos vacunados postexposición 1-12 días después (media 5) Casos secundarios entre 54 vacunados postexposición Casos secundarios entre no vacunados 54 (72%) 12/54 (22%) 13/21(62%) A. Martínez Roig hubo un caso secundario (5,9%), con una efectividad del 90,5% y con significación estadística (p <0,001); en los otros grupos, los porcentajes de casos secundarios fueron 28,6%, 35,7%, 12,5% y 100%. Los autores, con un número de casos superior al de estudios previos, concluyen que la efectividad de la aplicación de la vacuna postexposición es mayor cuando se realiza antes de pasados 4 días desde el contacto, pero también comentan que esta actuación no siempre será fácil realizarla antes de las 72 horas. En las escuelas y en los domicilios con una exposición continuada será difícil establecer cuándo se ha establecido el contacto. Asimismo, en las guarderías, por la posible exclusión del caso índice durante el periodo febril previo a la erupción, es difícil la intervención porque pueden superarse las 72 horas. H aemo ph i lus i nflue nz a e La administración de vacunas conjugadas frente a microorganismos con diferentes serotipos siempre presenta la posibilidad del llamado fenómeno de reemplazo. Se presentan dos estudios epidemiológicos realizados en países vecinos y prácticamente en el mismo periodo de tiempo, con resultados discordantes en relación al reemplazo. Changing epidemiology of invasive Haemophilus influenzae in Ontario, Canada: evidence for herd effects and strain replacement due to Hib vaccination. Adam AJ, Richardson SE, Jamieson FB, Rawte P, Low DE, Fisman DN. Vaccine. 2010;28:4073-8 En Ontario, entre los años 1989 y 2007, a través de su Agencia de Salud Pública, se estudió la epidemiología de la enfermedad invasiva por Haemophilus influenzae. El motivo fue evaluar el impacto de la aplicación de la vacuna conjugada frente a H. influenzae tipo b (Hib), en la década de 1990, sobre los casos de enfermedad causados por Hib, por distintos serotipos de Haemophilus y por otros no tipificables, en cohortes de vacunados y no vacunados, a la vez que valorar la posibilidad de que se hubiera producido el fenómeno del reemplazo por serotipos no vacunales. La primera vacuna conjugada se introdujo en 1988 para niños de 18 meses de edad, mientras que la actual vacuna conjugada se administra desde 1992 a los niños a partir de los 2 meses de edad. Se trabajó con 1445 aislamientos de muestras enviadas de forma voluntaria, el 81,4% correspondientes a hemocultivos, el 15,6% a líquido cefalorraquídeo y el 2,7% 201 Hot topics en vacunas: rotavirus, sarampión, H. influenzae y meningococo B 90 80 70 Aislamientos (%) 60 Serotipo a Serotipo b 50 Serotipo c Serotipo d 40 Serotipo e Serotipo f 30 No tipificables 20 10 2007 2006 2005 2004 2003 2002 2001 2000 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 1989 0 Año Figura 2. Porcentaje de los distintos serotipos aislados. Tabla 4. Edades y serotipos de Haemophilus influenzae aislados. Edad <2 años 2-10 años 11-60 años >60 años No tipificables a b c d e f 98 67 241 418 8 6 8 6 146 64 45 31 – 2 1 – 1 – – 1 12 4 8 20 19 17 36 82 de otras procedencias. Respecto a la edad, cabe señalar que el 27,1% de las muestras eran de menores de 5 años y el 37,4% de mayores de 65 años. En la Figura 2 se aprecia la distribución de los distintos serotipos durante estos años, que porcentualmente fueron: 62,3% no tipificables, 20,4% serotipo b, 11,6% serotipo f, 3,2% serotipo e, 2,1% serotipo a, y 0,2% serotipos c y d. En la Tabla 4 se muestra la distribución de serotipos por edades. En la Tabla 5 puede apreciarse que entre los niños vacunados hay una clara disminución de Hib en todas las edades, así como un marcado incremento de los no tipificables y del serotipo f en los menores de 5 años. Los autores consideran que la vacunación ha alterado la epidemiología en Ontario, y que está bien documentado el fenómeno del reemplazo por 202 A. Martínez Roig Tabla 5. Serotipos aislados y edades antes y después de iniciar la vacunación. Antes de la vacuna Después de la vacuna 64,9% Hib 29,9% no tipificable 9,4 Hib 70,3% no tipificable 13,6 f (p <0,001) Edad Hib <2 años 2-10 años 11-60 años >60 años 62% 25% 7% 6% 32% 18% 30% 19% Edad no tipificable < 2 años 2-10 años 11-60 años >60 años 12% 23% 32% 32% 12% 7% 19% 53% Serotipo el serotipo f y otros no tipificables en los menores de 5 años. También consideran que hay un desplazamiento de la edad en que se producen las infecciones por Haemophilus no tipificables a los mayores de 64 años, que la presentación porcentual de los distintos serotipos puede variar geográficamente y que es necesario establecer una vigilancia epidemiológica mediante la declaración de los casos de enfermedad invasiva por serotipos no tipificables. Los autores señalan como limitaciones de su estudio el hecho de que las declaraciones de los casos fueran voluntarias y la introducción paulatina de la vacunación. Current epidemiology and trends in invasive Haemophilus influen­ zae disease – United States, 1989-2008. MacNeil JR, Cohn AC, Farley M, Mair R, Baumbach J, Bennett N, et al. Clin Infect Dis. 2011;53:1230-6 Se trata de un artículo similar al anterior, en el cual los autores reportan lo sucedido en Estados Unidos en relación a la enfermedad invasiva por Haemophilus en un periodo de tiempo casi idéntico. El Active Bacterial Core Surveillance, con el soporte de los Centers for Disease Control and Prevention, recogió 4414 muestras de sangre, líquido cefalorraquídeo y otros lugares estériles. El promedio anual estimado de infecciones fue de 1,62 casos por 100.000 habitantes, con una incidencia más alta en las personas de edad superior a 65 años, en comparación con el resto de las edades. Entre 203 Hot topics en vacunas: rotavirus, sarampión, H. influenzae y meningococo B Serotipo a Serotipo c Serotipo d Serotipo e Serotipo f 0,30 Tasa por 100.000 0,25 0,20 0,15 0,10 0,05 2007 2006 2005 2004 2003 2002 2001 2000 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 1989 0,00 Año Figura 3. Incidencia de Haemophilus de serotipos capsulados distintos del b en Estados Unidos (19892008). los menores de 5 años, la mayor presentación fue en los menores de 1 año, con 9,54 casos por 100.000 habitantes. La proporción de Haemophilus no tipificables aislados de todas las muestras fue del 69,5%. La distribución del total por serotipos fue: 2,2% serotipo a, 3,6% serotipo b, 0,3% serotipos c y d, 5,7% serotipo e y 18,3% serotipo f (Fig. 3). Ello supuso un incremento de la incidencia de los serotipos a, e y f, sobre todo del f entre los de edad ≥18 años. Como conclusión, los autores señalan la importante disminución de la enfermedad invasiva por H. influenzae desde la introducción de la vacuna, con una presencia todavía destacable de los serotipos no b en los grupos de edad más joven y más avanzada. Consideran que en Estados Unidos no hay evidencia del reemplazo por serotipos no b en la infancia. MENI NG O C O C O DE L S E RO G RUP O B El serogrupo B del meningococo es el causante de la endemicidad de la enfermedad en la mayoría de los países occidentales. A diferencia de los otros serogrupos, hasta la fecha no se ha logrado comercializar una vacuna universal frente a él. En la actualidad, la llamada vacunología inversa ha permitido afrontar este reto. Se comentan dos estudios de fase 2b realizados con la vacuna 4CMenB en Chile y en Europa, cuyos resultados son prometedores. 204 A. Martínez Roig Immunogenicity and tolerability of a multicomponent meningococcal serogroup B (4CMenB) vaccine in healthy adolescents in Chile: a phase 2b/3 randomised, observed-blind, placebo-controlled study. Santaolaya ME, O’Ryan ML, Valenzuela MT, Prado V, Vergara R, Muñoz A, et al. Lancet. 2012;379:617-24 Se presentan los resultados de un estudio aleatorizado, doble ciego, controlado con placebo, realizado en Chile con adolescentes de 11 a 17 años de edad. De ellos, 1631 recibieron al menos una dosis de vacuna, pero distribuidos de la siguiente manera: un grupo recibió una única dosis inicial y a algunos sujetos se les administró otra dosis a los 6 meses; otro grupo recibió dos dosis de vacuna con 1 mes de diferencia y algunos sujetos recibieron una dosis a los 6 meses; un tercer grupo recibió dos dosis, administradas con 2 meses de diferencia, y algunos sujetos una dosis de vacuna a los 6 meses; otro grupo recibió tres dosis de vacuna con 1 mes de diferencia, sin dosis de recuerdo a los 6 meses; y en un último grupo todos recibieron placebo los primeros 3 meses y algunos una dosis vacunal a los 6 meses. En todos los sujetos se realizó un estudio, previamente al inicio y 1 mes después de cada dosis, de la actividad bactericida del suero humano (hSBA) frente a las tres cepas empleadas en la vacuna (44/76, 5/99 y NZ98/254). Después de recibir dos o tres dosis, los adolescentes tenían, en el 99% al 100% de los casos, unos títulos de hSBA ≥4, en comparación con el 92% al 97% tras recibir una sola dosis, con significación estadística (p <0,0145). En los que recibieron solamente placebo, el porcentaje era del 29% al 50%. A los 6 meses, el 91% al 100% de los participantes que recibieron dos o tres dosis de vacuna todavía tenían títulos ≥4 para cada cepa, mientras que de los que habían recibido una única dosis sólo los tenían el 73% al 76%. Los títulos de anticuerpos, determinados a los 6 meses por inmunoensayo enzimático (ELISA), mostraban una respuesta del 99% al 100% para cada cepa vacunal en los que habían recibido dos o tres dosis. Evidentemente, hubo más reacciones adversas en el grupo que recibió la vacuna que en el de placebo. El dolor local, el enrojecimiento y la induración fueron los efectos más frecuentes. Apareció fiebre ≥38 ºC en el 4% de los que recibieron vacuna, frente al 2% de los que recibieron sólo placebo. Los autores concluyen que, en el adolescente, la administración de dos dosis de vacuna con una separación de 6 meses confiere protección frente a las cepas 44/75, 5/99 y NZ98/254. Una tercera dosis no proporciona ningún beneficio inmunógeno adicional. Asimismo, consideran que debe estudiarse la protección frente a otras variantes. 205 Hot topics en vacunas: rotavirus, sarampión, H. influenzae y meningococo B Immunogenicity and tolerability of recombinant serogroup B meningococcal vaccine administered with or without routine vaccinations according to different immunization schedules. A randomized controlled trial. Gossger N, Snape MD, Yu LM, Finn A, Bona G, Esposito S, et al. JAMA. 2012;307:573-82 Se trata de un estudio abierto y aleatorizado, realizado en lactantes de 2 a 6 meses de edad de diferentes países europeos. Previamente a la administración de la vacuna y a los 30 días de la tercera dosis se realizó un estudio de la actividad bactericida del suero humano (hSBA), así como de anticuerpos bactericidas, mediante ELISA. Se realizó un estudio en el que participaron 1871 niños. Se formaron cuatro grupos: uno de 621 lactantes, en el que se aplicó la vacuna del meningococo B a los 2, 4 y 6 meses de forma concomitante con las vacunas del calendario DTaP, Hib, VHB-VPI y PCV7; un segundo grupo de 625 niños a quienes se administró la vacuna del meningococo a los 2, 4 y 6 meses y las vacunas del calendario a los 3, 5 y 7 meses; un tercer grupo de 315 lactantes en el cual se hizo la administración conjunta de la vacuna del meningococo con las sistemáticas del calendario, de forma acelerada a los 2, 3 y 4 meses; y por último un cuarto grupo control de 310 lactantes a los que sólo se les administraron las vacunas del calendario a los 2, 3 y 4 meses. Posteriormente se consiguió estudiar la respuesta inmunitaria en 552 niños del primer grupo, 544 del segundo grupo, 278 del tercer grupo y 262 del cuarto grupo. Después de recibir las tres dosis de vacuna antimeningocócica, el 99% o más de los lactantes desarrollaron títulos de 1/5 o superiores de hSBA frente a las cepas 44/76-SL y 5/99 al mes posterior a la administración de la tercera dosis de vacuna. Frente a la cepa NZ98/254 la proporción fue del 81,7% cuando se vacunaron a los 2, 4 y 6 meses de forma concomitante con las vacunas sistemáticas, y del 79% cuando se hizo de manera intercalada. La concentración media geométrica de títulos de anticuerpos frente al antígeno NHBA (factor de fijación de la heparina) después de la tercera dosis presentó su valor más alto en el grupo de administración intercalada. La respuesta a las vacunas sistemáticas no fue menor cuando se administró conjuntamente o por separado, excepto las respuestas frente a la pertactina y al serogrupo 6B de la vacuna antineumocócica. En cuanto a los efectos adversos, cabe señalar que se presentó fiebre en el 26% al 41% de los que recibieron exclusivamente la vacuna antimeningoócica, frente al 23% al 36% cuando sólo se administraron las vacunas del calendario vacunal. Al administrarse conjuntamente presentaron ascenso 206 A. Martínez Roig febril un 51% a un 61% de los casos. Estos resultados hacen pensar que la respuesta febril podría ser mayor que con otras vacunas. Los autores concluyen que es posible una flexibilidad en la edad de administración, que la pauta a los 2, 3 y 4 meses podría proteger en los primeros 6 meses, y que no hay interferencia de respuesta con las vacunas del calendario. Es difícil interpretar el significado de los títulos bajos de hSBA y de anticuerpos bactericidas, sin descartar que ello pueda conducir a una menor persistencia en la vacunación primaria, de la misma manera que sucede con la vacuna del meningococo C o la vacuna neozelandesa del meningococo B. Al variar los serotipos en los distintos países, la protección dependería de cada país. En Europa podría proteger frente a alrededor del 76% de los serotipos circulantes. 207 J.A. Rodrigo Pendás y L.M. Vilca Yengle Hot topics en vacunas: virus del papiloma humano y gripe virus del papiloma humano Effect of the human papillomavirus (HPV) quadrivalent vaccine in a subgroup of women with cervical and vulvar disease: retrospective pooled analysis of trial data. Joura EA, Garland SM, Paavonen J, Ferris DG, Pérez G, Ault KA, et al. BMJ. 2012;344:e1401 Este trabajo es un análisis retrospectivo de un subgrupo de participantes de los ensayos clínicos FUTURE I (1) y FUTURE II (2), que reclutaron 17.622 mujeres de 15 a 26 años de edad entre los años 2001 y 2003, y las distribuyeron aleatoriamente para recibir la vacuna tetravalente del virus del papiloma humano (Gardasil®) o placebo. Entre los criterios de inclusión estaban no haber tenido resultados anormales previos en una citología vaginal, haber tenido menos de cinco parejas sexuales y no estar embarazada. Sin embargo, a las participantes no se les realizó ningún cribado de infección por el virus del papiloma humano (VPH) antes de ser asignadas aleatoriamente a la vacuna o a placebo, con lo cual algunas se hallaban infectadas o con lesiones por VPH al comienzo de los estudios. Este hecho es aprovechado por los autores para su análisis. El objetivo era saber si la vacuna tetravalente reducía el riesgo de desarrollar lesiones por el VPH en las mujeres que ya habían tenido una lesión y habían sido tratadas por ella. Como se ha dicho anteriormente, en los ensayos FUTURE I y II se incluyeron mujeres que ya tenían una infección o una lesión por VPH. Estas lesiones o infecciones no se diagnosticaron al comienzo de los ensayos 209 Hot topics en vacunas: virus del papiloma humano y gripe porque no se realizó un cribado previo, sino que comenzaron a detectarse en las exploraciones anales y genitales, y en las citologías, que según los protocolos respectivos se realizaron cada 6 a 12 meses después de administrar la vacuna o el placebo. Cuando se detectaban alteraciones en la citología, se realizaba una colposcopia. Si las lesiones consistían en una neoplasia intraepitelial cervical de grados II o III, adenocarcinoma in situ o neo­plasia intraepitelial cervical persistente de grado I, en la mayor parte de los casos se practicaba una escisión electroquirúrgica. En cuanto a las lesiones vulvares o vaginales, se trataban según las prácticas locales de cada centro participante. Así pues, para el análisis retrospectivo por intención de tratar se seleccionaron todas aquellas mujeres con lesiones cervicales, vaginales o vulvares diagnosticadas tras haber sido aleatorizadas y haber recibido al menos una dosis de vacuna o placebo. A partir de ese momento, los autores calcularon las tasas de incidencia de las lesiones posteriores a los 60 días del diagnóstico de la primera lesión. Este periodo de 60 días se escogió para asegurar que las lesiones aparecidas fuesen nuevas, y no lesiones residuales. A partir de esa fecha, se realizó el seguimiento de cada mujer hasta la aparición de una nueva lesión o hasta la última visita de control realizada. Todas las muestras de biopsia o de piezas quirúrgicas se analizaron en busca de 14 tipos de VPH: los cuatro incluidos en la vacuna (6, 11, 16 y 18) y otros diez (31, 33, 35, 39, 45, 51, 52, 56, 58 y 59). De las 1350 mujeres estudiadas, la mayoría (763) pertenecían al grupo de placebo (Fig. 1). Sólo cinco participantes no recibieron las tres dosis de vacuna (dos mujeres) o de placebo (tres mujeres) por diversos motivos (embarazo, lactancia o razones médicas). La prevalencia basal (al comienzo del estudio) de lesiones escamosas intraepiteliales cervicales, vaginales y vulvares fue superior en las mujeres asignadas a ser vacunadas que en el grupo de placebo. En el grupo que recibió placebo, las mujeres que fueron tratadas por lesiones relacionadas con el VPH tuvieron un mayor riesgo de desarrollar lesiones posteriores respecto a las vacunadas (Fig. 1): •• En las sometidas a escisión electroquirúrgica, la incidencia de cualquier lesión posterior fue de 12,2/100 personas-año, y la incidencia de lesiones malignas de grado II o superior en cualquier localización genital fue de 3,2/100 personas-año. •• Las que no fueron intervenidas y tenían lesiones vaginales o vulvares, o verrugas genitales, tuvieron una incidencia tres veces mayor de le- 210 J.A. Rodrigo Pendás y L.M. Vilca Yengle Grupo de la vacuna (8810 mujeres): •Cirugía cervical: 587 •Lesiones vaginales o vulvares: 229 Incidencia de lesiones posteriores (× 100 personas-año) •Cirugía cervical previa: ––Cualquier tipo de VPH: 6,6 ––Tipos de VPH incluidos en la vacuna: 0,8 •Lesiones vaginales o vulvares previas: ––Cualquier tipo de VPH: 20,1 ––Tipos de VPH incluidos en la vacuna: 4,9 Estudios FUTURE I y II: 17.622 mujeres incluidas Grupo del placebo (8812 mujeres): •Cirugía cervical: 763 •Lesiones vaginales o vulvares: 475 Incidencia de lesiones posteriores (× 100 personas-año) •Cirugía cervical previa: ––Cualquier tipo de VPH: 12,2 ––Tipos de VPH incluidos en la vacuna: 3,9 •Lesiones vaginales o vulvares previas: ––Cualquier tipo de VPH: 31,1 ––Tipos de VPH incluidos en la vacuna: 13,8 Figura 1. Incidencia de lesiones por el virus del papiloma humano en mujeres con lesiones previas tratadas tras su inclusión en los estudios FUTURE I y II. siones posteriores de cualquier tipo respecto al grupo anterior: 31/100 personas-año. También fue superior la incidencia de lesiones de grado I o más: 8,4/100 personas-año. En cuanto a las mujeres vacunadas, en las que fueron sometidas a cirugía cervical (Figs. 1 a 3): •• La incidencia de cualquier lesión por cualquier tipo de VPH fue de 6,6/100 personas-año, por lo que el riesgo de desarrollar lesiones se redujo en un 46,2% respecto a las que recibieron placebo. Si se tenían en cuenta sólo los tipos virales incluidos en la vacuna, la reducción era del 79,1%. •• La incidencia de lesiones cervicales de grado II o superior fue de 1,1/100 personas-año, con lo cual la vacuna redujo el riesgo en un 64,9%. •• La incidencia posterior de verrugas genitales se redujo en un 89%. En las mujeres vacunadas que no fueron intervenidas quirúrgicamente, pero que tenían lesiones extracervicales por VPH, la incidencia de cualquier lesión por cualquier tipo de VPH fue de 20,1/100 personas-año, por lo que 211 Hot topics en vacunas: virus del papiloma humano y gripe n Cualquier tipo de VPH n Tipos de VPH incluidos en la vacuna 46,2 Cualquier tipo de lesión 79,1 64,9 61,3 Neoplasia intraepitelial cervical de grado II o superior 73,5 Neoplasia intraepitelial cervical de grado III o superior* 30,1 Neoplasia intraepitelial vaginal o vulvar de grado II o superior 61,2 63 Verrugas genitales 89 0 10 20 30 40 50 60 70 80 90 100 % * No pudo calcularse la reducción del riesgo de aparición de neoplasias epiteliales cervicales de grado III o superior producidas por los tipos virales incluidos en la vacuna. Figura 2. Porcentaje de reducción del riesgo de aparición de lesiones posteriores por distintos tipos de virus del papiloma humano en mujeres vacunadas con cirugía cervical previa. n Cualquier tipo de VPH n Tipos de VPH incluidos en la vacuna 35,2 Cualquier tipo de lesión 64,4 40,8 Neoplasia intraepitelial cervical de grado II o superior 57,7 18,5 Neoplasia intraepitelial cervical de grado III o superior 25,8 23,5 Neoplasia intraepitelial vaginal o vulvar de grado II o superior 63 35,6 Verrugas genitales 60,4 0 10 20 30 40 50 60 70 80 90 100 % Figura 3. Porcentaje de reducción del riesgo de aparición de lesiones posteriores por distintos tipos de virus del papiloma humano en mujeres vacunadas con lesiones vaginales o vulvares previas. 212 J.A. Rodrigo Pendás y L.M. Vilca Yengle el riesgo se redujo en un 35,2% respecto al grupo de placebo. La reducción del riesgo de lesiones por los tipos virales incluidos en la vacuna fue del 64,4%. En las Figuras 2 y 3 se muestran los porcentajes de reducción del riesgo de lesiones posteriores por distintos tipos de VPH en mujeres vacunadas, según sus antecedentes. Uno de los resultados más llamativos de este estudio es que las mujeres que tenían lesiones vaginales o vulvares (vacunadas o no) presentaban un alto riesgo de volver a presentar una lesión por el VPH con respecto a las mujeres que tenían una lesión cervical intervenida. Así, a los 30 meses de seguimiento, la incidencia acumulada de lesiones posteriores por cualquier tipo de VPH en el grupo de vacunadas era del 32% en las que tuvieron una lesión vaginal o vulvar previa, frente al 13% en las que tuvieron una lesión cervical. La incidencia acumulada de lesiones posteriores en las participantes que recibieron placebo fue del 46% en las que habían tenido enfermedad vaginal o vulvar, y del 23% en aquellas cuya lesión previa era cervical. Como limitaciones de este trabajo, los autores señalan que entre las mujeres con diagnóstico de lesiones vaginales o vulvares la proporción de fumadoras era mayor en el grupo de placebo (43,4%) que en el de la vacuna (36,7%). Esto pudo afectar a los resultados, ya que el riesgo de desarrollar cáncer de cuello uterino se duplica en las fumadoras. Sin embargo, el principal factor de riesgo para el cáncer de cuello uterino es la infección por el VPH (3). Además, las mujeres asignadas al grupo de la vacuna tenían una mayor prevalencia de lesiones intraepiteliales al comienzo del estudio, y aun así en este grupo hubo una reducción significativa del riesgo de aparición de lesiones posteriores. Como resumen de lo que aporta este trabajo, podríamos decir que la vacuna frente al VPH no retrasa la progresión de la enfermedad en las mujeres que ya están infectadas en el momento de la vacunación, pero sí reduce el riesgo de aparición de lesiones posteriores en un 35% a un 46%. Prevention of recurrent high-grade anal neoplasia with quadrivalent human papillomavirus vaccination of men who have sex with men: a nonconcurrent cohort study. Swedish KA, Factor SH, Goldstone SE. Clin Infect Dis. 2012;54:891-8 El virus del papiloma humano (VPH) se encuentra en el 75% al 94% de las neoplasias anales intraepiteliales de alto grado y en el 80% de los carcinomas anales de células escamosas (4). La prevalencia de las infecciones por el VPH en los hombres que tienen sexo con hombres y no infectados por el 213 Hot topics en vacunas: virus del papiloma humano y gripe virus de la inmunodeficiencia humana (VIH) es del 33% al 57% (5-8). La recurrencia de la neoplasia anal intraepitelial al cabo de 1 año en los hombres que tienen sexo con hombres tratados mediante ablación es del 50% (9). En este contexto, los autores del artículo que aquí comentamos llevaron a cabo un estudio de cohortes para conocer la efectividad de la vacuna tetravalente del VPH en la prevención de la recurrencia de la neoplasia anal intraepitelial en los hombres que tienen sexo con hombres y no están infectados por el VIH. Los pacientes fueron reclutados en un centro quirúrgico de Nueva York especializado en el cribado, el diagnóstico y el tratamiento de enfermedades anorrectales. A todos los hombres VIH negativos que tenían sexo con otros hombres se les ofreció, desde junio de 2006, la vacunación tetravalente contra el VPH. En algunos casos el seguro médico cubría los gastos de la vacunación, pero la mayoría de los pacientes la tenía que pagar de su bolsillo: 200 dólares por cada dosis de vacuna (la pauta era 0, 2 y 6 meses). Los participantes en este estudio de cohortes eran mayores de 18 años, VIH negativos y con antecedentes de neoplasia anal intraepitelial confirmada por biopsia y tratada. Se consideró como vacunados a aquellos que recibieron la pauta de tres dosis de vacuna del VPH en este centro, y se les incluyó en el estudio 1 mes después de la última dosis. Los que no recibieron ninguna dosis de vacuna en el centro ni en otro lugar formaron la cohorte de no vacunados. El resultado de interés era la neoplasia anal intraepitelial recurrente, que se definió como la confirmada por biopsia que aparecía después de un tratamiento previo. Fueron excluidos los pacientes que tenían neoplasias anales intraepiteliales al comienzo del estudio. Entre 2007 y 2010 se atendió en ese centro neoyorkino a 694 hombres que tenían sexo con hombres y eran VIH negativos, de los cuales 202 habían tenido una neoplasia anal intraepitelial previa biopsiada y tratada. De estos últimos, 88 estaban vacunados y los otros 114 no. Los hombres vacunados eran algo más jóvenes (edad media de 37,5 años) que los no vacunados (edad media de 42,6 años). En 12 hombres vacunados apareció de nuevo una neoplasia anal intraepitelial, lo que supone una tasa de incidencia de 10,2/100 personas-año. En la cohorte no vacunada, la recurrencia de las neoplasias anales intraepiteliales se produjo en 35 hombres, con una tasa de incidencia de 15,7/100 personas-año (Fig. 4). En el análisis de supervivencia univariado, la vacunación contra el VPH reducía casi a la mitad el riesgo de recurrencia de la neoplasia (hazard ratio [HR] = 0,52; p = 0,05), mientras que la presencia de un genotipo oncogénico del VPH en la neoplasia anal intraepitelial previa multiplicaba por cua- 214 J.A. Rodrigo Pendás y L.M. Vilca Yengle 88 vacunados •Edad media: 37,5 años Centro de cirugía anorrectal: 202 hombres con neoplasia anal intraepitelial previa biopsiada y tratada 114 no vacunados •Edad media: 42,6 años •Recurrencia de la neoplasia anal intraepitelial: 12 hombres •Tasa de incidencia en infectados por cualquier tipo de VPH: 10,2/100 personas-año •Tasa de incidencia en infectados por tipos de VPH oncogénicos: 15,4/100 personas-año Eficacia de la vacuna en la prevención de la recurrencia de neoplasia anal intraepitelial •Cualquier tipo de VPH: 35% •Tipos de VPH oncogénicos: 46% •Recurrencia de la neoplasia anal intraepitelial: 35 hombres •Tasa de incidencia en infectados por cualquier tipo de VPH: 15,7/100 personas-año •Tasa de incidencia en infectados por tipos de VPH oncogénicos: 28,3/100 personas-año Figura 4. Incidencia de neoplasias anales intraepiteliales recurrentes de alto grado en hombres que tienen sexo con hombres. tro el riesgo de recurrencia (HR = 4,19; p = 0,003). La información sobre los genotipos del VPH aislados en las neoplasias anales previas no estaba disponible en todos los pacientes, ya que no todas las compañías aseguradoras de los participantes pagaban la realización de pruebas para determinar si el tipo de VPH causante de la infección era oncogénico (genotipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68). En el análisis de supervivencia multivariado, la presencia de genotipos oncogénicos en las neoplasias previas se asociaba a un aumento del riesgo de recurrencia a medida que pasaba el tiempo: en el primer año de seguimiento la HR era de 3,78, en el segundo 4,06 y en el tercero 4,19. La vacuna tetravalente del VPH tenía el efecto opuesto: la reducción del riesgo en el primer año de seguimiento era del 58% (HR = 0,42), en el segundo año del 50% (HR = 0,50) y en el tercer año del 48% (HR = 0,52). Todas estas medidas de efecto eran estadísticamente significativas, excepto la de la vacunación del VPH en el tercer año de seguimiento. Se disponía de información sobre el genotipo del VPH de la infección previa en 154 pacientes de la cohorte. De ellos, 105 habían tenido un genotipo oncogénico, y de éstos, 47 (49%) estaban vacunados. En este subgrupo, las 215 Hot topics en vacunas: virus del papiloma humano y gripe tasas de incidencia de neoplasias anales intraepiteliales recurrentes fueron de 15,4/100 personas-año entre los vacunados y de 28,3/100 personas-año en los no vacunados. Al realizar el análisis univariado de supervivencia en este grupo, la vacuna tetravalente del VPH reducía el riesgo de recurrencia un 60% durante el primer año de seguimiento, un 53% en el segundo año y un 52% en el tercero. Los autores reconocen varias limitaciones de su estudio, por ejemplo que los datos de los participantes se extrajeron de las historias clínicas del centro, que no recogían de manera sistemática toda la información necesaria. Por ejemplo, no se conocían la raza o las prácticas sexuales de todos los participantes, por lo que estas variables no pudieron usarse en los análisis estadísticos. En opinión de los autores, la reducción del riesgo de recurrencia de la neoplasia anal intraepitelial no se debió a unas prácticas sexuales más seguras en la cohorte de vacunados, ya que se documentaron las infecciones de transmisión sexual aparecidas después de la inclusión en el estudio, y esta variable no se asoció con las recurrencias en el análisis estadístico. Los autores aportan una hipótesis para explicar por qué la vacunación del VPH redujo la recurrencia de las neoplasias anales intraepiteliales en los hombres de su estudio y la aparición de nuevas lesiones por el VPH en las mujeres ya tratadas previamente en el estudio de Joura et al. antes comentado. El VPH alcanza la membrana basal tras producirse un desgarro en el epitelio durante el acto sexual. Una vez adherido a la membrana basal, el virus se modifica para ligarse a las células basales epiteliales antes de entrar en su núcleo, donde puede reproducirse. Con el tiempo, las partículas virales se desplazan hacia la superficie epitelial, y desde allí se liberan para infectar a otras células del huésped o de sus parejas sexuales. En ocasiones, el DNA viral se integra con el de la persona infectada, en cuyo caso el VPH no puede reproducirse ni infectar otras células, pero sí puede producir mutaciones celulares que ocasionarán el desarrollo de neoplasias. En las personas de ambos estudios, las células con DNA viral integrado habrían sido eliminadas por los tratamientos previos, pero las células con VPH “libre” con capacidad infecciosa habrían permanecido en el huésped. Así pues, las personas que recibieron la vacuna tendrían títulos de anticuerpos contra el VPH más altos que las no vacunadas, y estos anticuerpos evitarían el anclaje del virus a la membrana basal y la entrada en las células basales (10), impidiendo la aparición de infecciones y lesiones posteriores. Para finalizar, los autores recuerdan que la vacuna del VPH está recomendada como prevención primaria en las personas de 9 a 26 años de edad 216 J.A. Rodrigo Pendás y L.M. Vilca Yengle (11), pero opinan que si sus resultados se confirmasen en un ensayo clínico bien realizado, las indicaciones de la vacuna y la edad de la población diana deberían modificarse. GRIP E Neurological and autoimmune disorders after vaccination against pandemic influenza A (H1N1) with a monovalent adjuvanted vaccine: population based cohort study in Stockholm, Sweden. Bardage C, Persson I, Ortqvist A, Bergman U, Ludvigsson JF, Granath F. BMJ. 2011;343:d5956 En junio de 2009, la Organización Mundial de la Salud (OMS) declaró una pandemia por un nuevo virus gripal, conocido como virus de la gripe A (H1N1) (12). En septiembre del mismo año, la European Medicines Agency autorizó el uso de tres vacunas antigripales, mediante un proceso expeditivo adaptado a la situación de pandemia que entonces se presentaba (13). Como era necesario disponer de una gran cantidad de vacunas, la OMS incentivó el desarrollo de vacunas con adyuvantes (14) debido a que durante el proceso de desarrollo de las vacunas de la gripe H5N1 se comprobó que el uso de adyuvantes podía reducir la cantidad de antígeno necesaria para producir una adecuada respuesta vacunal, y que además podría reforzar el desarrollo de una inmunidad duradera (15). De las tres vacunas pandémicas autorizadas, Pandemrix® y Focetria® se basaron en el uso de los adyuvantes AS03 y MF59, respectivamente, y además contenían escualeno. El uso de estos adyuvantes hizo surgir algunas dudas sobre la seguridad de las vacunas antigripales que los contienen, entre ellas la posibilidad de presentar un mayor riesgo de padecer el síndrome de Guillain-Barré u otras afecciones neuroinmunitarias, como la parálisis de Bell, después de la vacunación. El trabajo que a continuación comentamos tuvo como objetivo conocer el riesgo de enfermedades neurológicas o autoinmunitarias que suponía la administración de la vacuna antigripal pandémica Pandemrix®. Para ello se realizó un estudio retrospectivo de cohortes, compuestas por todas las personas registradas en Estocolmo en octubre de 2009. En Suecia se realizó una campaña de vacunación con Pandemrix® entre octubre de 2009 y marzo de 2010. Durante el primer mes y medio, la campaña de vacunación sueca estuvo dirigida principalmente a los trabajadores sanitarios y a los grupos con mayor riesgo de presentar complicaciones asociadas a la gripe. Los grupos de riesgo incluían a los niños con 217 Hot topics en vacunas: virus del papiloma humano y gripe trastornos multifuncionales, las gestantes, los pacientes con cardiopatía o neumopatía crónica, diabetes, insuficiencia hepática crónica, enfermedad renal crónica, inmunodepresión u obesidad mórbida, y aquellos con enfermedades neuromusculares que afectasen la capacidad ventilatoria. Se alcanzó una cobertura vacunal de aproximadamente el 60% de su población de alrededor de 9,3 millones de habitantes. En la región de Estocolmo, donde hay unos 2 millones de habitantes, se creó un registro online de administración de Pandemrix®. Este registro, llamado Vaccinera, recogía información sobre las fechas de las dosis de la vacuna y también sobre los antecedentes médicos de las personas vacunadas. Los autores enlazaron los registros individuales de este archivo informatizado con las bases de datos sanitarias de Estocolmo, que contenían información sobre visitas médicas, hospitalizaciones y diagnósticos codificados según la CIE-10 (Clasificación Internacional de Enfermedades, 10.ª revisión). La información conjunta de ambas bases de datos se usó para determinar el riesgo de un evento neurológico o autoinmunitario en las personas vacunadas durante los 8 a 10 meses siguientes a la administración de la vacuna (Fig. 5). Para el estudio se estableció que el periodo pandémico había comenzado el 1 de octubre de 2009, y se consideraron vacunadas las personas que recibieron al menos una dosis de vacuna. Los diagnósticos neurológicos considerados como resultados de interés fueron síndrome de Guillain-Barré, parálisis de Bell, esclerosis múltiple, polineuropatía, anestesia o hipostesia, parestesia, narcolepsia y condiciones autoinmunitarias tales como artritis reumatoide, enfermedad inflamatoria intestinal y diabetes mellitus de tipo 1. Estos diagnósticos eran los recogidos de forma habitual en las bases de datos sanitarias, ya que los autores no realizaron una búsqueda activa de eventos durante el periodo de estudio. Se consideraron como casos prevalentes aquellas personas que tenían alguno de los diagnósticos previos antes del 30 de septiembre de 2009, y como casos incidentes los que se diagnosticaran entre el 1 de octubre de 2009 y el 31 de octubre del 2010 (durante el periodo pandémico para los no vacunados y después de recibir la primera dosis de vacuna para los vacunados). La población incluida en el estudio ascendió finalmente a 1,98 millones de individuos, de los cuales el 52,6% recibió la vacuna. De las personas vacunadas, 222.388 tenían entre 6 meses y 12 años de edad. En las primeras 6 semanas de la campaña predominaron entre los vacunados las personas con enfermedades crónicas (el 74% de los vacunados en la primera semana). 218 J.A. Rodrigo Pendás y L.M. Vilca Yengle Estocolmo: 1,98 millones de habitantes Octubre 2009 Campaña de vacunación antigripal pandémica Vaccinera •1.024.019 vacunados •55,9% mujeres •222.388 <12 años Aumento significativo del riesgo en vacunados: •Parálisis de Bell HR = 1,25 (IC95%: 1,06-1,48) •Parestesia HR = 1,11 (IC95%: 1,00-1,23) 31 de marzo de 2010 Bases de datos sanitarias •Diagnósticos (CIE-10) •Consultas médicas •Hospitalizaciones Sin aumento significativo del riesgo en vacunados: •Síndrome de Guillain-Barré •Esclerosis múltiple •Anestesia/hipostesia •Polineuropatía •Narcolepsia •Artritis reumatoide •Enfermedad inflamatoria intestinal •Diabetes mellitus tipo 1 Reducción de la mortalidad por todas las causas en los vacunados •HR = 0,85 (IC95%: 0,82-0,89) Figura 5. Riesgo de trastornos neurológicos y autoinmunitarios después de la administración de una vacuna monovalente adyuvada contra el virus de la gripe A H1N1. HR: hazard ratio; IC95%: intervalo de confianza del 95%. El 55,9% de todos los vacunados eran mujeres y la cobertura vacunal fue mayor en la población con un nivel socioeconómico más alto. En la fase inicial de la campaña (primeros 45 días), los casos prevalentes con trastornos neurológicos y autoinmunitarios previos eran más frecuentes entre los vacunados que en los no vacunados. Esta diferencia no se observó en la segunda fase de la campaña, excepto para la enfermedad inflamatoria intestinal, cuya presencia se asociaba a la vacunación con una odds ratio (OR) de prevalencia de 1,17 (intervalo de confianza del 95% [IC95%]: 1,12-1,22). Los vacunados en la fase tardía de la campaña tuvieron una menor prevalencia de síndrome de Guillain-Barré (OR = 0,79; IC95%: 0,67-0,95) y de diabetes mellitus de tipo 1 (OR = 0,77; IC95%: 0,64-0,92). Este patrón de morbilidad concordaba con la estrategia sueca de priorizar la vacunación de los grupos de riesgo en la fase inicial de la campaña. Para estimar los efectos de la vacunación sobre el riesgo subsecuente de patología neurológica o autoinmunitaria se utilizó una regresión de Cox 219 Hot topics en vacunas: virus del papiloma humano y gripe excluyendo los casos prevalentes. Entre los resultados obtenidos destaca la asociación significativa de la vacuna con la aparición de parálisis de Bell (hazard ratio [HR] =1,25) y con la parestesia (HR = 1,11) tras ajustar por la edad, el sexo, el estado socioeconómico y la utilización de los servicios sanitarios. Esto correspondía a un exceso de riesgo absoluto de 8,4 casos por 100.000 personas-año (IC95%: 2,3-13,4) para la parálisis Bell y de 9,2 casos por 100.000 personas-año para la parestesia (IC95%: 0-17,5). El pequeño número de casos de narcolepsia en ambos grupos comparados, seis en la cohorte vacunada y dos en la no vacunada, no permitió realizar un análisis fiable. El análisis estratificado según el momento de la vacunación mostró que los vacunados en la primera fase de la campaña tenían un riesgo mayor de parálisis de Bell y de parestesia, con unas HR de 1,74 y 1,60, respectivamente. Estas cifras suponen un exceso de riesgo de 30 casos (IC95%: 10-44) por 100.000 personas-año para la parálisis de Bell y de 65 casos (IC95%: 1,5-89) por 100.000 personas-año para la parestesia. No se demostró un aumento del riesgo en los vacunados para el síndrome de Guillain-Barré, la esclerosis múltiple, la diabetes de tipo 1 ni la artritis reumatoide (Fig. 5). Finalmente, en los vacunados durante la primera fase de la campaña se produjo una reducción de la mortalidad menos pronunciada (HR = 0,94) que en los de la segunda fase (HR = 0,68), pero en conjunto las personas vacunadas tuvieron menos riesgo de muerte por todas las causas (HR = 0,85; IC95%: 0,82-0,89). Una de las limitaciones de este estudio es que los diagnósticos de enfermedades autoinmunitarias y neurológicas no se recogieron mediante búsqueda activa de casos, sino a partir de las bases de datos sanitarias. Esto podría suponer un sesgo de selección por el cual las personas con mejor acceso a los servicios sanitarios tendrían más probabilidad de ser incluidas en el estudio. Otro posible sesgo de selección puede deberse a que los grupos de riesgo se vacunaron en la primera fase de la campaña, y el tiempo de seguimiento de estas personas fue mayor que el del resto, con lo que aumentan las probabilidades de que en este grupo se detectaran enfermedades autoinmunitarias y neurológicas. Por último, el tiempo de seguimiento de los vacunados fue de 256 a 315 días, y por tanto pueden no haberse detectado enfermedades que requieren un periodo de investigación más prolongado. En conclusión, después de seguir durante 8 a 10 meses a más de un millón de personas vacunadas con Pandemrix® y a 900.000 no vacunadas, no se demostró un aumento del riesgo de síndrome de Guillain-Barré, escle- 220 J.A. Rodrigo Pendás y L.M. Vilca Yengle rosis múltiple, diabetes de tipo 1 o artritis reumatoide en los vacunados. Sí se encontró un pequeño aumento del riesgo de parálisis de Bell, parestesia y enfermedad inflamatoria intestinal en este grupo. Sin embargo, estos cuadros se observaron en personas pertenecientes a los grupos de alto riesgo que se vacunaron tempranamente, por lo que es probable que tuvieran alguna patología asociada que explicase de manera parcial o total estos hallazgos. Guillain-Barré syndrome and adjuvanted pandemic influenza A (H1N1) 2009 vaccine: multinational case-control study in Europe. Dieleman J, Romio S, Johansen K, Weibel D, Bonhoeffer J, Sturkenboom M; VAESCO-GBS Case-Control Study Group. BMJ. 2011;343:d3908 Como ya hemos mencionado, durante la pandemia de gripe A (H1N1) de 2009 se introdujeron en Europa nuevas vacunas antigripales adyuvadas que suscitaron dudas sobre su seguridad, especialmente por el posible riesgo de efectos adversos neuroinmunitarios como el síndrome de GuillainBarré. Tales dudas tenían su justificación en el aumento de casos de este síndrome que se observó en 1976 en Estados Unidos en las personas que recibieron la vacuna de la gripe A (H1N1) subtipo A/NJ/76. Entonces, la campaña de vacunación se suspendió abruptamente debido a que los vacunados presentaron siete veces más riesgo de padecer el síndrome (16). El síndrome de Guillain-Barré es una polineuropatía aguda que puede generar discapacidad por más de 6 meses en un 20% de los que la padecen, y con una mortalidad del 3% al 10% de los casos (17). El cuadro va precedido habitualmente por infecciones respiratorias (p. ej., gripe) o gastrointestinales. El papel de las vacunas antigripales como desencadenantes del síndrome es controvertido, pero hay estudios que muestran un papel protector de la vacuna de la gripe estacional, probablemente al prevenir la infección gripal (18). El artículo que ahora comentamos es el resultado de un estudio encargado por el Centro de Prevención y Control de Enfermedades de Europa (ECDC) al Vaccine Adverse Event Surveillance & Communication Consortium (VAESCO) (19) para conocer la asociación entre las vacunas de la gripe pandémica y el síndrome de Guillain-Barré. Para ello, los autores llevaron a cabo un estudio de casos y controles utilizando bases de datos de cinco países europeos (Dinamarca, Francia, Holanda, Reino Unido y Suecia). Estas bases de datos abarcaban una población total de 50 millones 221 Hot topics en vacunas: virus del papiloma humano y gripe de personas. El periodo de estudio fue del 1 de noviembre de 2009 al 30 de marzo de 2010. Todos los centros participantes utilizaron un formulario estándar de recogida de datos y un protocolo común con la definición del síndrome según los criterios de la Brighton Collaboration (20). Los casos incluyeron a las personas diagnosticadas de síndrome de Guillain-Barré y una variante de éste, el síndrome de Miller-Fisher. La información se obtuvo de los informes de los neurólogos en Francia, Suecia y Holanda, y de los datos recogidos en las historias o registros clínicos en Reino Unido y Dinamarca. La fecha de inclusión del caso fue el día que se manifestaron los primeros síntomas o que se realizó el diagnóstico de síndrome de GuillainBarré. Para cada caso se buscaron hasta 25 controles, para emparejarlos, de acuerdo a las siguientes variables: edad (hasta 1 año de diferencia), sexo, fecha de inicio de los síntomas y país de procedencia. Se consideró como exposición de interés la vacunación contra la gripe pandémica entre el día anterior y 6 semanas antes de la fecha de inicio de los síntomas (ventana de riesgo). La exposición fue clasificada en función del tipo de vacuna recibida (Celvapan®, Focetria®, Pandemrix® u otra) y según la dosis (primera o segunda). Si la vacunación se realizó antes de las 6 semanas previas a la fecha de inicio de síntomas, se etiquetó como exposición antigua. Las siguientes variables se consideraron como posibles factores confusores: antecedente de síndrome de Guillain-Barré, infección por virus de Epstein-Barr, neoplasias, inmunodepresión, enfermedades autoinmunitarias, infecciones gastrointestinales, cuadros gripales o infecciones respiratorias de vías altas, y otras vacunaciones (como la de la gripe estacional). La vacunación frente a la gripe estacional realizada 6 semanas antes de la fecha de inicio del caso fue clasificada también como exposición antigua. Los investigadores realizaron un análisis estadístico mediante regresión logística condicional múltiple, y además llevaron a cabo un análisis de sensibilidad que consideró la relación entre la enfermedad de interés y la clasificación inadecuada de la exposición a la vacuna pandémica para evaluar la robustez de los resultados obtenidos. La población de referencia de este estudio era de 50 millones de personas en los cinco países participantes. El número total de casos de síndrome de Guillain-Barré detectados fue de 154, de los cuales 104 pudieron ser emparejados con uno o más controles. La mayoría de los casos tenían entre 46 y 61 años de edad, y cumplían la clasificación de caso de la Brighton Collaboration. En Dinamarca y Reino Unido no siempre pudo realizarse la clasificación según los criterios de la Brighton Collaboration. El tipo más común de síndrome de Guillain-Barré que se presentó fue la polirradiculo- 222 J.A. Rodrigo Pendás y L.M. Vilca Yengle neuropatía desmielinizante inflamatoria, y hubo seis pacientes (5,8%) que requirieron ventilación mecánica o murieron. La vacuna pandémica más utilizada en la población de estudio fue Pandemrix®, y ésta fue la marca principal utilizada en Dinamarca, Reino Unido y Suecia. En Holanda, la más usada fue Focetria®, aunque en los niños menores de 6 años se utilizó principalmente Pandemrix®. La cobertura vacunal fue más alta en Holanda y Suecia, del 33% y el 62% respectivamente, mientras que en Dinamarca, Francia y Reino Unido las cifras fueron inferiores: 6%, 7% a 8% y 8%, respectivamente. En el análisis crudo, las vacunas antigripales pandémicas se asociaron con el síndrome de Guillain-Barré en Holanda, Reino Unido y Suecia, con unas OR que oscilaron entre 1,3 y 2,5. Al combinar los datos de estos tres países, la OR cruda global fue de 2,8 (IC95%: 1,3-6,0). En Dinamarca, la OR obtenida para los dos casos expuestos a la vacuna fue de 9,5 (IC95%: 1,7 a 53). No pudo calcularse la OR con los datos de Francia al haber un solo caso expuesto y controles no expuestos. No se encontraron diferencias entre Pandemrix® y Focetria® en el riesgo de desarrollar el síndrome tras la vacunación (Fig. 6). En Reino Unido, la vacunación frente a la gripe estacional fue más común que la pandémica, y en el análisis multivariado se asoció con la aparición de síndrome de Guillain-Barré en las 6 semanas posteriores a la inmunización (OR = 5,1; IC95%: 1,8-22). Este análisis no pudo realizarse para los otros países debido a la falta de datos. Ninguno de los casos del estudio estuvo expuesto a otro tipo de vacunas en las 6 semanas anteriores a la fecha de inicio de los síntomas. Las infecciones agudas en las 6 semanas previas a la fecha de inicio de los síntomas fueron muy habituales, principalmente en los casos, y la mayoría consistieron en cuadros gripales o enfermedades respiratorias de vías altas. Estos dos tipos de infecciones mostraron una asociación significativa con el síndrome de Guillain-Barré en Reino Unido (OR = 4,9; IC95%: 1,5-15,5) y Holanda (OR = 19,3; IC95%: 5,9-63,4). El riesgo de presentar síndrome de Guillain-Barré con las vacunas de la gripe pandémica observado en el análisis crudo desapareció al ajustar por los antecedentes de enfermedad gripal e infección de vías respiratorias altas. En Holanda y Reino Unido, que tenían información suficiente de ambas variables, las OR ajustadas obtenidas para cada país fueron 0,6 (IC95%: 0,1-4,4) y 0,7 (IC95%: 0,1-4,1), respectivamente. Al combinar los datos de ambos países, la OR ajustada global fue de 0,7 (IC95%: 0,2-2,5) (Fig. 6). Este estudio tiene varias limitaciones, como reconocen los autores. La preocupación por que la vacuna pandémica pudiera aumentar el riesgo de padecer el síndrome de Guillain-Barré pudo producir varios sesgos: 223 Hot topics en vacunas: virus del papiloma humano y gripe 5 países europeos: base poblacional de 50 millones de personas Asociación entre la vacuna antigripal pandémica y el SGB: análisis ajustado por vacunación estacional y cuadros gripales y respiratorios Asociación entre la vacuna antigripal pandémica y el SGB: análisis crudo Francia •Cobertura vacunal: 8% •37 casos de SGB OR = 9,5 (IC95%: 1,7-53) Dinamarca •Cobertura vacunal: 6% •24 casos de SGB OR = 2,5 (IC95%: 0,7-9,3) Países Bajos •Cobertura vacunal: 33% •33 casos de SGB OR = 0,6 (IC95%: 0,1-4,4) OR = 1,3 (IC95%: 0,3-6,4) Reino Unido •Cobertura vacunal: 8% •34 casos de SGB OR = 0,7 (IC95%: 0,1-4,1) OR = 2,3 (IC95%: 0,5-11,7) Suecia •Cobertura vacunal: 62% •26 casos de SGB OR = 1,8 (IC95%: 0,3-12) OR ajustada global: 0,7 (IC95%: 0,2-2,5) Periodo de estudio: 1-11-2009 a 30-3-2010 Figura 6. Síndrome de Guillain-Barré y vacuna adyuvada de la gripe pandémica A H1N1. SGB: síndrome de Guillain-Barré; OR: odds ratio; IC95%: intervalo de confianza del 95%. •• Sesgo de selección, si las personas con un riesgo basal aumentado de desarrollar síndrome de Guillain-Barré tuvieron menos probabilidades de recibir la vacuna antigripal pandémica a causa del miedo a este efecto adverso. •• Sesgo de información en el antecedente de la vacunación pandémica, ya que es probable que este dato se recogiera con mucho más rigor en los casos que en los controles. •• El mismo sesgo de información pudo darse con el resto de los antecedentes clínicos, pues es probable que las características de los casos se recogieran más exhaustivamente que las de los controles. 224 J.A. Rodrigo Pendás y L.M. Vilca Yengle Para finalizar, la mayor aportación de este trabajo es que no se encontró una asociación entre la vacuna pandémica de la gripe A (H1N1) y el síndrome de Guillain-Barré. Además, y con los resultados obtenidos, es poco probable que el riesgo absoluto de síndrome de Guillain-Barré superase los tres casos por millón de personas vacunadas. Efficacy and effectiveness of influenza vaccines: a systematic review and meta-analysis. Osterholm MT, Kelley NS, Sommer A, Belongia EA. Lancet Infect Dis. 2012;12:36-44 En esta revisión sistemática con metaanálisis, los autores incluyeron ensayos clínicos y estudios observacionales que investigaron la eficacia o la efectividad de la vacuna antigripal usando la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) o el cultivo para confirmar la infección por el virus de la gripe. El motivo de restringir el diagnóstico de la gripe a estas dos pruebas de laboratorio fue su mayor fiabilidad. Aunque algunos estudios han usado la serología como prueba para determinar la presencia de infección, ésta tiene poca sensibilidad, sobre todo en las personas que han recibido la vacuna antigripal inactivada. Un estudio de Petrie et al. (21) ha confirmado la baja sensibilidad de la serología, ya que de las personas vacunadas que posteriormente tenían gripe confirmada por RT-PCR sólo el 23% tenían una serología positiva. Esto sucede porque el diagnóstico serológico de la gripe requiere que los anticuerpos contra la hemaglutinina sean cuatro veces mayores que los valores iniciales. Sin embargo, se sabe que las personas vacunadas contra la gripe tienen unos títulos de anticuerpos elevados tras la vacunación (22), de manera que es más difícil que se cuadrupliquen si posteriormente se infectan. Así, la eficacia de la vacuna se sobrestima al usar la serología como método diagnóstico de la infección. Los autores buscaron en PubMed estudios con las características descritas y publicados en inglés entre 1967 y 2011. De un total de 5707 referencias recuperadas incluyeron 17 ensayos clínicos aleatorizados que sumaban 53.983 sujetos y 14 estudios observacionales. En esta revisión se definió la eficacia vacunal como la reducción relativa del riesgo de gripe confirmada en las personas vacunadas en un ensayo clínico aleatorizado, y la efectividad como la reducción relativa del riesgo de gripe en las personas vacunadas en los estudios observacionales. Los ensayos clínicos con vacuna atenuada incluían personas de todas las edades (Fig. 7). En cambio, los autores no encontraron ensayos clínicos 225 Hot topics en vacunas: virus del papiloma humano y gripe n Vacuna atenuada n Vacuna inactivada 1 ≥60 años 0 3 18-59 años 5 2 2-7 años 0 6 6-24 meses 2 0 1 2 3 4 5 6 7 Nº ensayos clínicos Figura 7. Número de ensayos clínicos aleatorizados incluidos según tipo de vacuna y grupos de edad. con vacuna antigripal inactivada que incluyeran participantes de 2 a 7 años de edad o mayores de 64 años. A excepción de un estudio realizado en personas infectadas por el VIH, los demás se realizaron en personas sanas. Diez ensayos clínicos estudiaron vacunas antigripales inactivadas en 12 temporadas gripales, en 11 de las cuales se demostró que las vacunas eran eficaces, si bien sólo en 8 la eficacia fue estadísticamente significativa. La vacuna atenuada también se usó en 10 ensayos clínicos que abarcaron 12 temporadas de gripe, y en 9 de ellas la eficacia fue estadísticamente significativa (Figs. 8 y 9). En el metaanálisis realizado por nosotros con los datos de Osterholm et al., la eficacia global de la vacuna inactivada en los adultos fue del 59% (intervalo de confianza del 95% [IC95%]: 48% a 68%), mientras que en los niños fue del 47% (IC95%: –82% a 85%). En cuanto a la vacuna atenuada, su eficacia global en los adultos fue del 42% (IC95%: 27% a 54%) y en los niños del 83% (IC95%: 72% a 89%). Combinando los resultados de ambos tipos de vacunas, la eficacia de las vacunas antigripales en los adultos sanos es del 53% (IC95%: 43% a 62%), mientras que en los niños es del 79% (IC95%: 67% a 87%) (Figs. 8 y 9). En este trabajo se incluyeron 14 estudios observacionales, realizados mayoritariamente con vacuna antigripal inactivada y en poblaciones heterogéneas (pacientes hospitalizados, grupos de alto riesgo, personas con cuadros gripales) con edades desde 6 meses hasta más de 65 años. Nueve estudios observacionales abarcaban 17 temporadas de gripe estacional, 226 J.A. Rodrigo Pendás y L.M. Vilca Yengle Estudio Vacuna inactivada Ohmit 2006 Ohmit 2008 Beran 2009 A Jackson 2010 A Beran 2009 B Jackson 2010 B Monto 2009 Frey 2010 Madhi 2011 Subtotal Vacuna atenuada De Villiers 2010 Ohmit 2006 Ohmit 2008 Monto 2009 OR (IC95%) Eficacia vacunal (%) Temporada gripal 18-46 años 18-48 años 18-64 años 18-49 años 18-64 años 18-49 años 18-49 años 18-49 años 18-55 años 0,23 (0,10; 0,52) 0,84 (0,32; 2,23) 0,78 (0,43; 1,40) 0,50 (0,29; 0,87) 0,38 (0,27; 0,52) 0,51 (0,24; 1,04) 0,30 (0,18; 0,49) 0,36 (0,26; 0,50) 0,24 (0,07; 0,85) 0,41 (0,32; 0,52) 77 (48; 90) 16 (–123; 68) 22 (–40; 57) 50 (13; 71) 62 (48; 73) 49 (–4; 76) 70 (51; 82) 64 (50; 74) 76 (15; 93) 59 (48; 68) 2004 2005 2005 2005 2006 2006 2007 2007 2008 ≥ 60 años 18-46 años 18-48 años 18-49 años 0,56 (0,41; 0,76) 0,50 (0,26; 0,98) 0,92 (0,35; 2,42) 0,61 (0,39; 0,95) 0,58 (0,46; 0,73) 44 (24; 59) 50 (2; 74) 8 (–142; 65) 39 (5; 61) 2001 2004 2005 2007 Edad de los participantes Subtotal 42 (27; 54) 0,47 (0,38; 0,57) 53 (43; 62) Global 0,1 1 5 Figura 8. Metaanálisis de ensayos clínicos aleatorizados sobre la eficacia de la vacuna antigripal en adultos. OR: odds ratio; IC95%: intervalo de confianza del 95%. mientras que los cinco restantes se realizaron con vacunas antigripales pandémicas con adyuvante en el año 2009. En seis de las 17 temporadas de gripe estacional, la efectividad de las vacunas empleadas fue estadísticamente significativa, con porcentajes de efectividad del 47% al 72%. La vacuna antigripal pandémica tuvo una efectividad estadísticamente significativa en cuatro de los cinco estudios incluidos, con una mediana de efectividad del 67% para prevenir la gripe atendida médicamente y del 90% en la prevención del ingreso hospitalario por gripe pandémica. Este trabajo tiene algunas limitaciones que podrían haber dejado fuera de la revisión estudios relevantes, como haber realizado la búsqueda sólo en PubMed o haber incluido sólo estudios publicados en inglés. Además, los autores no realizaron (o no la han aportado) una valoración del riesgo de sesgo ni de la calidad metodológica de los estudios primarios incluidos, tal como recomiendan las guías internacionales (23). Este último aspecto puede no ser muy importante en el caso de los ensayos clínicos aleatorizados, que a priori deben tener una mejor calidad metodológica, pero sí lo es 227 Hot topics en vacunas: virus del papiloma humano y gripe Edad de los participantes Estudio OR (IC95%) Eficacia vacunal (%) Temporada gripal Vacuna inactivada Hoberman 2003 A 6-24 meses 0,31 (0,15; 0,61) 69 (39; 85) 1999 Hoberman 2003 B 6-24 meses 1,10 (0,33; 3,65) –10 (–265; 67) 2000 0,53 (0,15; 1,82) 47 (–82;85) Subtotal Vacuna atenuada Belshe 1998 15-71 meses 0,06 (0,03; 0,11) 94 (89; 97) 1996 Belshe 2000 26-85 meses 0,11 (0,06; 0,20) 89 (80; 94) 1997 6-36 meses 0,14 (0,09; 0,23) 86 (77; 91) 2000 12-36 meses 0,29 (0,22; 0,37) 71 (63; 78) 2000 6-36 meses 0,10 (0,07; 0,16) 90 (84; 93) 2001 Tam 2007 B 12-36 meses 0,40 (0,25; 0,65) 60 (35; 75) 2001 Lum 2010 11-24 meses 0,34 (0,21; 0,56) 66 (44; 79) 2002 0,17 (0,11; 0,28) 83 (72; 89) 0,21 (0,13; 0,33) 79 (67; 87) Vesikari 2006 A Tam 2007 A Vesikari 2006 B Subtotal Global 0,1 1 5 Figura 9. Metaanálisis de ensayos clínicos aleatorizados sobre la eficacia de la vacuna antigripal en niños. OR: odds ratio; IC95%: intervalo de confianza del 95%. en el caso de los estudios observacionales, ya que al lector probablemente le interese saber si los resultados obtenidos pueden atribuirse con seguridad a la vacunación o son un hallazgo espurio. Como conclusión de este trabajo, los autores reconocen los resultados subóptimos de las vacunas actuales de la gripe y la necesidad de investigar y desarrollar una nueva generación de vacunas con mayor eficacia para hacer frente a los problemas de salud pública que suponen tanto la gripe estacional como la aparición de pandemias. Asimismo, recomiendan mantener el apoyo público a las vacunas actuales mientras llega esa nueva generación de vacunas. BIBL I O G RA F ÍA 1.Garland SM, Hernández-Ávila M, Wheeler CM, Pérez G, Harper DM, Leodolter S, et al. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med. 2007;356:1928-43. 2.FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med. 2007;356:1915-27. 228 J.A. Rodrigo Pendás y L.M. Vilca Yengle 3.American Cancer Society. What are the risk factors for cervical cancer? 2011. Disponible en: www.cancer.org/Cancer/CervicalCancer/DetailedGuide/cervical-cancer-risk-factors. 4.Giuliano AR, Tortolero-Luna G, Ferrer E, Burchell AN, de Sanjose S, Kjaer SK, et al. Epidemiology of human papillomavirus infection in men, cancers other than cervical and benign conditions. Vaccine. 2008;26 (Suppl 10):K17-28. 5.Van der Snoek EM, Niesters HG, Mulder PG, van Doornum GJ, Osterhaus AD, van der Meijden WI. Human papillomavirus infection in men who have sex with men participating in a Dutch gay-cohort study. Sex Transm Dis. 2003;30:639-44. 6.Goldstone S, Palefsky JM, Giuliano AR, Moreira ED Jr, Aranda C, Jessen H, et al. Prevalence of and risk factors for human papillomavirus (HPV) infection among HIV-seronegative men who have sex with men. J Infect Dis. 2011;203:66-74. 7.Nyitray AG, Carvalho da Silva RJ, Baggio ML, Lu B, Smith D, Abrahamsen M, et al. Agespecific prevalence of and risk factors for anal human papillomavirus (HPV) among men who have sex with women and men who have sex with men: the HPV in men (HIM) study. J Infect Dis. 2011; 203:49-57. 8.Chin-Hong PV, Vittinghoff E, Cranston RD, Buchbinder S, Cohen D, Colfax G, et al. Age-specific prevalence of anal human papillomavirus infection in HIV-negative sexually active men who have sex with men: the EXPLORE study. J Infect Dis. 2004;190:2070-6. 9.Goldstone SE, Hundert JS, Huyett JW. Infrared coagulator ablation of high-grade anal squamous intraepithelial lesions in HIV-negative males who have sex with males. Dis Colon Rectum. 2007;50:565-75. 10.Schiller JT, Day PM, Kines RC. Currently understanding of the mechanism of HPV infection. Gynecol Oncol. 2010;118:S12-7. 11.Centers for Disease Control and Prevention (CDC). FDA licensure of quadrivalent human papillomavirus vaccine (HPV4, Gardasil) for use in males and guidance from the Advisory Committee on Immunization Practices (ACIP). MMWR. 2010;59:630-2. 12.World Health Organization. New influenza A (H1N1) virus; global epidemiological situation. WER. 2009;84:249-57. 13.Johansen K, Nicoll A, Ciancio BC, Kramarz P. Pandemic influenza A(H1N1) 2009 vaccines in the European Union. Euro Surveill. 2009;14:19361. 14.World Health Organization. Influenza pandemic preparedness and response. Report by the secretariat. Geneva: WHO; 2005. 15.Schwarz TF, Horacek T, Knuf M, Damman HG, Roman F, Dramé M, et al. Single dose vaccination with AS03-adjuvanted H5N1 vaccines in a randomized trial induces strong and broad immune responsiveness to booster vaccination in adults. Vaccine. 2009;27:6284-90. 16.Schonberger LB, Bregman DJ, Sullivan-Bolyai JZ, Keenlyside RA, Ziegler DW, Rtailiau HF, et al. Guillan-Barré syndrome following vaccination in the National Influenza Immunization Program, United States, 1976-1977. Am J Epidemiol. 1979;110:105-23. 17.Van Doorn PA, Ruts L, Jacobs BC. Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome. Lancet Neurol. 2008;7:939-50. 18.Stowe J, Andrews N, Wise L, Miller E. Investigation of the temporal association of Guillain-Barré syndrome with influenza vaccine and influenza-like illness using the United Kingdom General Practice Research Database. Am J Epidemiol. 2009;169:382-8. 19.The Brighton Collaboration. The VAESCO project Website. (Consultado el 7-8-2012.) Disponible en: www.vaesco.net. 229 Hot topics en vacunas: virus del papiloma humano y gripe 20.The Brighton Collaboration. The Brighton Collaboration Website [sede Web]. (Consultado el 7-8-2012.) Disponible en: https://brightoncollaboration.org. 21.Petrie JG, Ohmit SE, Johnson E, Cross RT, Monto AS. Efficacy studies of influenza vaccines: effect of endpoints used and characteristics of vaccine failures. J Infect Dis. 2011;203:1309-15. 22.McDonald JC, Andrews BE. Diagnostic methods in an influenza vaccine trial. BMJ. 1955;2:1232-5. 23.Moher D, Liberati A, Tetzlaff J, Altman DG; PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ. 2009;339:b2535. 230 Aspectos prácticos de las vacunaciones G. Mirada Masip y X. Martínez Gómez Vacunación en situaciones de brote. Casos prácticos TOS FERIN A El servicio de urgencias pediátricas de nuestro hospital se pone en contacto con nosotros al haber diagnosticado un caso de tos ferina (clínica compatible y prueba de reacción en cadena de la polimerasa [PCR] positiva en aspirado nasofaríngeo). Se trata de una niña de 1,5 meses de edad, con tos paroxística de 10 días de evolución, que se acompaña de apneas postusígenas y estridor inspiratorio. Después de declarar el caso a la unidad de vigilancia epidemiológica territorial, se disponen a darle el alta pero les ha surgido una duda: ¿es necesario realizar un estudio de contactos de la niña? Si es así, ¿a quién deben derivar a nuestro servicio? 1) Sí, sólo a sus padres. 2) Sí, sólo a sus convivientes. 3) Sí, a toda persona que haya mantenido contacto estrecho con la niña. 4) No es necesario realizar ningún estudio de contactos en los casos de tos ferina. La respuesta correcta es la tercera: debería estudiarse a toda persona que haya mantenido contacto estrecho con el caso. Según el protocolo de actuación para la prevención y el control de la tos ferina de la Dirección General de Salud Pública de Cataluña, se considera caso confirmado el que cumple una de las siguientes condiciones: 233 Vacunación en situaciones de brote. Casos prácticos •• Tos de 2 semanas o más de duración y ataques de tos o paroxismos tusígenos, seguidos de estridor inspiratorio, con PCR positiva en frotis nasofaríngeo. •• Tos de cualquier duración con aislamiento de Bordetella pertussis en frotis nasofaríngeo. •• Contacto que cumpla la definición clínica de caso y que presente un vínculo epidemiológico con un caso confirmado Ante cualquier caso confirmado de tos ferina, forme o no parte de un brote, las medidas de control han de incluir el aislamiento y el tratamiento del paciente, además de la quimioprofilaxis y la vacunación de los contactos. Se define como contacto cercano, estrecho o íntimo cualquier persona que, sin medidas de protección adecuadas, ha tenido una exposición directa cara a cara con el paciente (<1 m), ha compartido un espacio cerrado durante cierto tiempo (>1 h) con un caso, o ha tenido contacto directo con las secreciones respiratorias de una persona con síntomas. Otros tipos de contacto, como los que ocurren en el trabajo o la escuela, en general no se consideran estrechos. Aun así, conviene analizar individualmente cada situación para valorar la presencia de contactos vulnerables: neonatos de madres sintomáticas; neonatos, lactantes y niños vacunados parcialmente o no vacunados; niños que han recibido la última dosis de vacuna DTPa hace más de 5 años; personas con enfermedades crónicas subyacentes; inmunodeprimidos; embarazadas en el tercer trimestre; y trabajadores en centros materno-infantiles, sociosanitarios o guarderías. Es importante no limitar el estudio a los familiares directos. En un trabajo realizado por el Servicio de Medicina Preventiva del Hospital Universitari Vall d’Hebron (Uriona et al.) se estudiaron más de 400 contactos de 91 casos confirmados, y el 33% estaban infectados por B. pertussis, con un 20% de estos casos primarios en no convivientes. Continuando con el caso, derivan para estudio a tres familiares de la niña: a) Su padre, de 28 años de edad, médico de UCI pediátrica, actualmente de baja, que fue vacunado con un recuerdo de dTpa hace 2 años y en la actualidad no presenta síntomas respiratorios. ¿Qué actitud preventiva debe tomarse con él? 234 G. Mirada Masip y X. Martínez Gómez 1) Administrar profilaxis frente a la tos ferina. 2) Administrar profilaxis y proponer la vacunación dTpa. 3) Proponer la vacuna dTpa. 4) Nada, al estar vacunado se desaconsejan la profilaxis y la vacunación. La respuesta correcta es la primera: administrar quimioprofilaxis antitosferínica. En este caso, al haber un antecedente reciente de administración de dTpa no se recomienda volver a administrar la vacuna. b)Su madre, de 27 años, enfermera pediátrica, que se halla actualmente de baja, lactando y sin síntomas respiratorios. La última dosis de recuerdo de la vacuna antitetánica (dT) se le administró hace 6 años. ¿Qué actitud preventiva debe tomarse con ella? 1) Administrar profilaxis frente a la tos ferina. 2) Administrar profilaxis y proponer la vacunación dTpa. 3) Proponer la vacuna dTpa. 4) Nada, no se considera que presente un riesgo elevado de contraer tos ferina. La respuesta correcta es la segunda: administrar quimioprofilaxis y proponer su vacunación con dTpa porque está en periodo de lactancia y porque es personal sanitario. c) Su abuela materna, de 62 años de edad, enfermera de pediatría en activo, que recibió la última dosis de dT hace 5 años, y presenta tos crónica, agravada en la última semana. ¿Qué actitud preventiva debe tomarse con ella? 1) Nada, por su edad es altamente probable que ya haya pasado la enfermedad. 2) Administrar profilaxis frente a la tos ferina. 3) Administrar profilaxis y proponer la vacunación dTpa. 4) Administrar profilaxis, proponer la vacuna dTpa y recomendar la baja hasta completar el tratamiento o descartar la enfermedad. 235 Vacunación en situaciones de brote. Casos prácticos La respuesta correcta es la cuarta: la paciente debería recibir profilaxis y vacunación, y por el hecho de ser personal sanitario en activo, para prevenir la aparición de casos nosocomiales, se recomienda la baja laboral. En relación al estudio de contactos de los casos de tos ferina y la administración de profilaxis, hay diferentes criterios según las diversas organizaciones: los Centers for Disease Control and Prevention (CDC) de Estados Unidos y la Dirección General de Salud Pública de Cataluña indican su administración en situación de brote, cuando hay dos o más casos asociados en espacio y tiempo, y a todos los contactos cercanos independientemente de la existencia o no de brote, mientras que el ministerio de salud de Reino Unido recomienda la profilaxis de todos los contactos cercanos (incluidos compañeros de planta) en los brotes hospitalarios y a valorar en los brotes escolares (en función de la duración, la focalidad, la practicidad y la aceptabilidad). El protocolo de estudio de contactos de los casos de tos ferina del Servicio de Medicina Preventiva del Hospital Universitari Vall d’Hebron recomienda la solicitud de muestra microbiológica para B. pertussis (aspirado nasofaríngeo) con PCR y cultivo en los siguientes supuestos: •• Contactos con síntomas sugestivos (presentación atípica). •• Contactos de alto riesgo laboral: entorno sanitario, entorno escolar y trabajos con gran exposición a población. Además, se recomienda la administración de quimioprofilaxis/tratamiento, previa a la confirmación microbiológica, así como medidas preventivas de aislamiento (exclusión laboral o uso de mascarilla). En la actualidad, las opciones recomendadas para la prevención/tratamiento de la tos ferina son los macrólidos (eritromicina, claritromicina o azitromicina) y la trimetroprima-sulfametoxazol (en caso de alergia o contraindicación). A continuación se indica la posología de azitromicina recomendada para la profilaxis de la tos ferina en función de la edad y el peso: •• Menores de 6 meses: –– 10 mg/kg al día durante 5 días. •• Mayores de 6 meses: –– Día 1: 10 mg/kg (máximo 500 mg). –– Días 2 a 5: 5 mg/kg al día (máximo 250 mg). 236 G. Mirada Masip y X. Martínez Gómez •• Adolescentes y adultos: –– Día 1: 500 mg. –– Días 2 a 5: 250 mg al día. Hasta hace pocos años, la vacunación frente a la tos ferina estaba circunscrita en exclusiva a la infancia, con la vacuna DTPa, pero en la actualidad se dispone de una nueva vacuna para suplir esta carencia: la vacuna dTpa, con un contenido bajo de antígeno acelular frente a la tos ferina. Las recomendaciones de esta vacuna son las siguientes: •• Para la primovacunación del adulto, la dTpa puede sustituir a una de las tres dosis de dT. •• Se recomienda su administración como dosis de recuerdo en las embarazadas a partir de la semana 20 de gestación. Si no se hace en este momento, se recomienda administrarla posparto. •• Se recomienda su administración como dosis de recuerdo en los adolescentes y adultos que tengan o puedan tener contacto con niños menores de 12 meses. Si es posible, se recomienda administrarla 2 semanas antes del contacto. •• Se recomienda su administración como dosis de recuerdo en personal sanitario, independientemente de la edad y del tiempo desde la última dosis de vacuna dT. A pesar de estas indicaciones, es preciso indicar que la vacunación con dTpa no excluye la administración de profilaxis postexposición. Según el protocolo de actuación para la prevención y el control de la tos ferina de la Dirección General de Salud Pública de Cataluña, además de la profilaxis postexposición con azitromicina en personal sanitario y otros trabajadores debe ofrecerse un refuerzo de la vacuna dTpa al personal sanitario que haya tenido un contacto estrecho, en especial si trabajan con pacientes menores de 1 año o con mujeres embarazadas, con independencia de cuándo hayan recibido la última dosis de vacuna dT. También es necesario relevar del contacto directo con pacientes al personal sanitario con clínica de tos ferina, hasta que hayan completado 5 días de tratamiento antibiótico. Si algún profesional con síntomas no puede o no quiere tomar el tratamiento, ha de ser excluido de su lugar de trabajo durante 21 días desde el inicio de la tos. 237 Vacunación en situaciones de brote. Casos prácticos Los resultados microbiológicos de los tres contactos estudiados resultaron negativos. Tres días después, se presentan tres contactos más: d)Tía materna: 28 años, embarazada (semana 25 de gestación), con tos ligera de 2 días de evolución. ¿Qué actitud preventiva debe tomarse con ella? 1) Administrar profilaxis frente a la tos ferina. 2) Administrar profilaxis y plantear su vacunación con dTpa. 3) Proponer la vacuna dTpa. 4) Nada, no presenta un mayor riesgo de tos ferina. La respuesta correcta es la segunda: debería administrarse profilaxis, pues el embarazo no es una contraindicación, y además debería recomendársele la administración de un recuerdo con dTpa. e) Tío materno: 30 años, informático, con tos desde hace 14 días. ¿Qué actitud preventiva debe tomarse con él? 1) Administrar profilaxis frente a la tos ferina y proponer la vacuna dTpa. 2) Administrar profilaxis. 3) Proponer la vacuna dTpa. 4) Nada, aunque su mujer esté embarazada él no es un contacto íntimo ni vulnerable. La respuesta correcta es la primera: debería administrarse profilaxis y recomendar un recuerdo con dTpa, debido a que su mujer está embarazada. f) Padre del tío materno: 60 años, receptor de trasplante renal en tratamiento con ciclosporina, padece arritmia y presenta tos de 3 semanas de evolución. ¿Qué actitud preventiva debe tomarse con él? 1) Administrar profilaxis frente a la tos ferina. 2) Administrar profilaxis y plantear la vacuna dTpa. 3) Nada, ya que presenta una contraindicación a la profilaxis con azitromicina. 4) Nada, ya que hace más de 14 días que tiene síntomas. 238 G. Mirada Masip y X. Martínez Gómez La respuesta correcta es la segunda: la profilaxis frente a la tos ferina puede realizarse con fármacos que no estén contraindicados para pacientes con alteraciones del ritmo de conducción o uso de inmunosupresores. Dentro de las contraindicaciones de la profilaxis frente a la tos ferina, hay que tener presente que el embarazo no contraindica la administración de macrólidos. Sólo se recomienda no usarlos en las personas con mayor riesgo de efectos cardiacos (como arritmias), así como tener precaución con la administración concomitante de ciclosporina (ya que debe monitorizarse su concentración plasmática y ajustar la dosis). En estos casos se recomienda valorar el uso de trimetroprima-sulfametoxazol (1 tableta cada 12 h, durante 2 semanas). En relación a la vacunación con dTpa en las embarazadas, en la actualidad su recomendación se sustenta en tres evidencias: el aumento del título de anticuerpos frente a la toxina pertúsica, la hemaglutinina filamentosa y la pertactina en las gestantes vacunadas en comparación con las no vacunadas; la mayor proporción entre anticuerpos en sangre de cordón y en sangre venosa en las gestantes vacunadas que en las no vacunades; y el aumento del título de anticuerpos en los neonatos de madres vacunadas. Por ello, aunque el nivel de evidencia no es el más alto y no hay datos respecto a su efectividad, se recomienda su uso preventivo. HEPATITIS A El hospital de referencia comunica a la Unidad de Vigilancia Epidemiológica dos casos confirmados de hepatitis A con IgM positiva. Se trata de dos hombres con edades de 37 años (caso 1) y 45 años (caso 2). Iniciaron los pródromos el mismo día, el 30 de enero de 2012, y presentaron ictericia el 7 y el 6 de febrero, respectivamente. Residen en la misma población (5000 habitantes) en calles distintas, no se conocen y no han compartido ninguna actividad (ni comida). En la población no ha habido ninguna incidencia en el suministro de agua potable. Caso 1: es agricultor y trabaja por cuenta propia. Vive con su esposa y dos hijos. La mujer, de 35 años, está embarazada de 34 semanas. Los niños tienen 2 y 7 años de edad. Resultados serológicos: – Mujer: IgM e IgG negativas. – Niño de 2 años: IgM positiva y asintomático. 239 Vacunación en situaciones de brote. Casos prácticos –Niño de 7 años: IgM positiva. Según la madre, hace unos días tuvo vómitos y diarrea. Caso 2: es propietario de un bar. Vive con su esposa y tres hijos. La mujer tiene 42 años y los hijos 9 meses, 2 años y 11 años de edad. Resultados serológicos: – Mujer: IgM e IgG negativas. – Niño de 11 años: IgM negativa. En la escuela le han administrado la primera dosis de vacuna hepatitis A+B combinada. – Niña de 2 años: IgM positiva y asintomática. – Niño de 9 meses: IgM e IgG negativas. Del estudio de las dos familias se observan los siguientes casos: – Caso 1: niño de 2 años y niño de 7 años de edad. – Caso 2: niña de 2 años de edad. Se considera brote epidémico la aparición de dos o más casos relacionados en el tiempo y en el espacio. Los niños de 2 años asisten a la misma guardería, por lo que nos encontramos ante un brote epidémico. En esta población hay un único centro de salud, una única guardería pública y también un único colegio e instituto. Los centros de preescolar, primaria y secundaria están separados en edificios independientes y en lugares distintos de la población. En el colegio hay un 25% de familias de origen africano. Las pautas de actuación serán: •• Medidas higiénicas: las buenas prácticas de higiene son los pilares de la prevención de la infección por el virus de la hepatitis A (VHA). Las medidas de protección individual para evitar la transmisión fecal-oral de persona a persona son las básicas de higiene personal, con atención especial al lavado de manos antes de comer y de preparar alimentos, después de manipular pañales, tras ir al servicio, etc. •• Profilaxis postexposición: –– Contactos íntimos: se recomienda la profilaxis de los contactos sexuales, convivientes y cuidadores no vacunados o que no hayan presentado la enfermedad. Sin profilaxis postexposición, la tasa de ataque secundaria es del 15% al 30% en los contactos domiciliarios. –– Guarderías y escuelas. 240 G. Mirada Masip y X. Martínez Gómez –– Instituciones cerradas. –– Exposición a fuente común (manipulador de alimentos). •• Las personas diagnosticadas de hepatitis A deben ausentarse del centro escolar o del lugar de trabajo hasta 1 semana después del inicio de los síntomas o hasta que se haya completado la profilaxis de los contactos. ¿Qué actuaciones de profilaxis postexposición se llevarán a cabo en la mujer (35 años) embarazada de 34 semanas? 1) Administración de vacuna de la hepatitis A. 2) Administración de inmunoglobulina (IG) polivalente. 3) Administración de IG polivalente y vacuna de la hepatitis A. 4) Dado su avanzado estado de gestación, no hace falta ninguna actuación porque no hay riesgo para la madre ni para el feto. La respuesta correcta es la primera: administrarle la vacuna de la hepatitis A. No hay evidencia de riesgo con la vacunación de las mujeres embarazadas o que están amamantando con vacunas de virus o bacterias inactivados o de toxoides. Se seguirán las recomendaciones aplicables a su grupo de edad. Durante décadas se ha recomendado la IG para la profilaxis tras la exposición al VHA, pero en 2007 se revisaron las directrices de Estados Unidos para permitir que la vacuna de la hepatitis A pudiera utilizarse después de la exposición a fin de prevenir la infección en personas sanas de 1 a 40 años de edad. Entre las ventajas de la vacuna están la inducción de inmunidad activa, la protección a largo plazo, la facilidad de administración, la mejor aceptabilidad, la mayor disponibilidad y que el coste es similar al de la IG. ¿Qué actuaciones de profilaxis postexposición se llevarán a cabo en la mujer de 42 años de edad? 1) A partir de los 40 años de edad no hay riesgo de hepatitis A, pues ya estará inmunizada de manera natural. 2) Administración de IG polivalente. 241 Vacunación en situaciones de brote. Casos prácticos 3) Administración de IG antihepatitis A. 4) Administración de IG polivalente y vacuna de la hepatitis A. La respuesta correcta es la cuarta: administración de IG polivalente y vacuna de la hepatitis A. Según las recomendaciones de los CDC, no hay evidencia directa de la eficacia de la vacuna en las personas sanas mayores de 40 años (según la Health Protection Agency de Reino Unido en las mayores de 50 años). Además, la gravedad de la enfermedad aumenta con la edad: hay evidencia de estudios de inmunogenicidad de una más lenta y menor respuesta a la vacuna conforme aumenta la edad (en especial en los mayores de 60 años), y por otra parte hay un incremento de las tasas de mortalidad en los pacientes mayores de 50 años. Por lo tanto, se recomienda la administración de vacuna y de IG, que se aplicarán en lugares anatómicos diferentes y con jeringas distintas. La dosis de IG polivalente es de 0,02 ml/kg de peso. ¿Qué actuaciones de profilaxis postexposición se llevarán a cabo en el niño de 9 meses de edad? 1) Administración de vacuna de la hepatitis A. 2) Administración de IG polivalente. 3) Administración de IG polivalente y vacuna de la hepatitis A. 4) No hace falta hacer nada, pues la hepatitis A es totalmente benigna a esta edad. La respuesta correcta es la segunda: administración de IG polivalente. Aunque los menores de 12 meses muy raramente desarrollan infección sintomática, y si la tienen suele ser leve, sí pueden infectar a otros durante la infección subclínica. Hay estudios de inmunogenicidad que proporcionan evidencia de una buena respuesta inmunitaria a la vacuna en los mayores de 2 meses, aunque de momento en las fichas técnicas de las vacunas comercializadas sólo se recomienda a partir de los 12 meses de edad. Por lo tanto, en este caso sería necesario administrar IG polivalente. ¿Qué actuaciones de profilaxis postexposición se llevarán a cabo en el niño de 11 años de edad que hace 35 días recibió en el colegio una primera dosis de vacuna combinada de la hepatitis A+B? 242 G. Mirada Masip y X. Martínez Gómez 1) Continuar la vacunación separada; la de la hepatitis A monovalente tiene doble carga antigénica. 2) Ninguna, esperar a la segunda dosis cuando le toque en el colegio. 3) Administrar la segunda dosis de vacuna combinada. 4) Administrar la IG polivalente y esperar 3 meses para continuar con la segunda dosis de vacuna combinada. La respuesta correcta es la tercera: administrar la segunda dosis de vacuna combinada. Aunque la vacuna combinada tiene la mitad de unidades de VHA, los estudios de seroconversión muestran que después de 1 mes de la administración de la primera dosis de vacuna combinada la tasa de seroconversión anti-VHA es del 91,6%. Por lo tanto, continuaremos con la administración de la segunda dosis de vacuna combinada. Sin embargo, si tuviéramos que iniciar la pauta no lo haríamos con la vacuna combinada, ya que puede proporcionar una lenta respuesta inmunógena, y como es necesario una rápida protección frente a la hepatitis A se recomienda una dosis de la vacuna monovalente (que tiene mayor cantidad de antígeno). ¿Qué actuaciones de profilaxis postexposición se llevarán a cabo en la guardería a la que asisten los dos niños de 2 años? 1) No hace falta crear una alarma social; los niños no han presentado síntomas de la enfermedad y no se recomienda profilaxis. 2) Se administrará profilaxis solamente a los niños y cuidadores de la clase de los casos. 3) Se administrará profilaxis a todos los niños que asisten a la guardería y a los cuidadores susceptibles. 4) Se administrará profilaxis a todos los niños que asisten a la guardería, a los cuidadores susceptibles y a los contactos domiciliarios de los niños sanos. La respuesta correcta es la tercera: se administrará profilaxis a todos los niños que asisten a la guardería y a los cuidadores susceptibles. La profilaxis postexposición para la hepatitis A, según las recomendaciones de los CDC, está indicada en las guarderías en las siguientes circunstancias: 243 Vacunación en situaciones de brote. Casos prácticos •• Si asisten niños incontinentes (con pañales) se realizará profilaxis a toda la guardería (niños y personal) cuando: –– Se produzcan uno o más casos en el centro entre niños y personal. –– Se produzcan dos o más casos en los contactos domiciliarios de los ninos. –– Si hay casos de hepatitis A en tres o más familias se realizará profilaxis, además de en todos los niños y todo el personal, también en todos los contactos domiciliarios de todos los niños. •• Si asisten niños continentes (sin pañales) se realizará profilaxis sólo a la clase (niños y personal) cuando: –– Se produzcan uno o más casos en el centro entre niños y personal. –– Se produzcan dos o más casos en los contactos domiciliarios de los niños. ¿Qué actuaciones de profilaxis postexposición se llevarán a cabo en el bar de uno de los casos? 1) Se cerrará el bar durante 7 días y se procederá a la desinfección. 2) Se administrará profilaxis postexposición a los clientes habituales. 3) Se administrará profilaxis postexposición a los clientes y los compañeros de trabajo. 4) Se administrará profilaxis postexposición a los compañeros de trabajo. La respuesta correcta es la cuarta: se administrará profilaxis postexposición a los compañeros de trabajo. Los manipuladores de alimentos afectados deberán apartarse de sus tareas al menos durante 7 días desde el inicio de la ictericia o de la elevación de las transaminasas. La profilaxis postexposición se realizará en los manipuladores de alimentos del mismo establecimiento. En los consumidores de alimentos manipulados por el caso índice se realizará profilaxis si la investigación epidemiológica indica que hay riesgo de transmisión en un ámbito cerrado (escuela, hospital, cuartel, etc.). En estos supuestos anteriores, ¿qué actuaciones de profilaxis deben realizarse si han pasado más de 14 días desde la exposición? No hay evidencia convincente que sugiera que administrar la IG con retraso en el periodo de incubación (han pasado más de 14 días desde la exposi- 244 G. Mirada Masip y X. Martínez Gómez ción) prevenga la infección, y hay informes contradictorios sobre si atenúa la gravedad de la enfermedad. Sin embargo, como la administración de IG supone un rápido aumento de los títulos de anti-VHA, hay razones teóricas para suponer que podría reducirse la gravedad de la enfermedad clínica cuando se administra hasta 28 días después de la exposición, y puede ser de particular importancia en aquellos sujetos con riesgo de enfermedad grave. Por lo tanto, la administración de IG puede modificar la enfermedad si se administra después de ese tiempo. Recomendaciones: •• IG: se indicará a los contactos domiciliarios con riesgo hasta 28 días después de la exposición. Si se administra entre 14 y 28 días postexposición puede reducir la gravedad, pero no la infección. •• Vacuna: se indicará la vacunación para asegurar la inmunidad a largo plazo y para evitar casos terciarios. MEN IN GITI S M E NING O C Ó CI CA Hace 12 horas ingresó en la Unidad de Cuidados Intensivos Pediátrica de nuestro hospital un niño de 4 años de edad, originario de Senegal, por sospecha de meningitis. El cuadro comenzó hace 24 horas, con fiebre y cefalea, y se ha ido agravando hasta aparecer rigidez de nuca y erupción petequial en los miembros. En el momento del ingreso se inició tratamiento con ceftriaxona, se establecieron medidas de aislamiento de gotas y se notificó de forma urgente a la unidad de vigilancia territorial. El niño llegó a Cataluña hace 3 meses, tiene su carnet vacunal al día y hasta ayer iba a la escuela. Convive con sus padres y dos hermanos. El microbiólogo de guardia nos informa de que se aísla un diplococo gramnegativo en la muestra de líquido cefaloraquídeo (LCR). ¿Qué actitud preventiva debe tomarse con el personal sanitario? 1) Ninguna: no están en riesgo de enfermedad al ser todos mayores de 18 años. 2) Administrar quimioprofilaxis yvacuna conjugada frente al meningococo del serogrupo C a todos los contactos. 3) Administrar quimioprofilaxis a los profesionales que hayan estado expuestos a un importante inóculo de gotas. 245 Vacunación en situaciones de brote. Casos prácticos 4) Ninguna: al no haber todavía confirmación microbiológica del caso, de momento no es preciso tomar ninguna medida. La respuesta correcta es la tercera: sólo deben recibir quimioprofilaxis aquellos trabajadores que hayan estado expuestos a las secreciones del caso. ¿Qué actitud preventiva debe tomarse con los familiares directos del caso? 1) Ninguna: hasta el momento no se ha identificado exactamente el microorganismo, por lo que hay que esperar. 2) Administrar quimioprofilaxis y vacunar frente al meningococo del serogrupo C a todos los contactos. 3) Administrar quimioprofilaxis. 4) Ninguna: no están en riesgo de enfermedad por ser convivientes del niño. La respuesta correcta es la tercera: todos los familiares directos, por ser contactos de alto riesgo, deben recibir quimioprofilaxis ante la sospecha de meningitis meningocócica. ¿Qué actitud preventiva debe tomarse en la escuela del caso? 1) Ninguna: por el periodo de incubación de la enfermedad, no hay riesgo de contagio. 2)Administrar quimioprofilaxis a sus compañeros más frecuentes o a toda la clase (si no pudiera delimitarse el primer grupo). 3) Administrar quimioprofilaxis a toda la escuela. 4) Administrar quimioprofilaxis y vacuna frente al meningococo del serogrupo C a toda la escuela. La respuesta correcta es la segunda: sólo los compañeros más frecuentes del caso deben recibir quimioprofilaxis. En caso de que este grupo no pueda delimitarse, se recomienda administrar medicación a toda la clase para evitar casos secundarios. Neisseria meningitidis es la causa de la enfermedad meningocócica invasiva; se transmite mediante gotas y tiene un periodo de incubación de 1 a 10 días, con un promedio de menos de 4 días. La bacteria es transmisible 246 G. Mirada Masip y X. Martínez Gómez desde 7 días antes de la enfermedad hasta 24 horas después de instaurar el tratamiento antibiótico efectivo. Se conocen hasta 13 serogrupos diferentes, que generan 1,2 millones de casos al año y 500.000 muertes en todo el mundo. La distribución de estos serogrupos es variable: el serogrupo A suele generar brotes en África subsahariana (de Senegal a Etiopía, en especial durante la estación seca, entre diciembre y junio), en Oriente Medio y el sur de Asia; el serogrupo B es más frecuente en Europa, América y Australia; el serogrupo C produce casos en Europa (España, Inglaterra) y América; y el serogrupo W135 suele originar enfermedad en Arabia Saudí (peregrinos a La Meca) y en zonas de África central, así como brotes en adolescentes en Estados Unidos. Según el protocolo de actuación frente a la enfermedad meningocócica de la Dirección General de Salud Pública de Cataluña, se considera caso sospechoso toda enfermedad infecciosa aguda de inicio súbito con fiebre, cefalea intensa, náuseas, vómitos, rigidez de nuca y erupción petequial. Así, ante la sospecha clínica se recomienda el tratamiento del caso, la información y la vigilancia epidemiológica de sus contactos (durante un máximo de 10 días), y la administración de profilaxis antibiótica (tanto para tratar la infección como para eliminar la colonización en la faringe). A pesar de estas recomendaciones, no todos los contactos deben ser tratados, sino sólo aquellos que se consideren de alto riesgo de enfermar: •• Contactos domiciliarios (hasta 7 días antes). •• Contactos esporádicos con exposición a secreciones (besos, compartir cepillos de dientes o utensilios para comer) (hasta 7 días antes). •• Contactos sanitarios con exposición a secreciones (reanimación boca a boca, intubación endotraqueal sin protección) (hasta 7 días antes). •• Contactos escolares (hasta 7 días antes): –– Guardería y parvulario: compañeros del mismo grupo o clase y educadores del grupo. –– Centros de educación primaria: compañeros más frecuentes (si puede delimitarse el grupo) o toda la clase, como máximo. –– Centros de educación secundaria: amigos frecuentes (si puede delimitarse el grupo). La quimioprofilaxis debe administrarse lo antes posible, idealmente antes de las 24 horas de la aparición del caso índice; su efecto es limitado más 247 Vacunación en situaciones de brote. Casos prácticos allá de los 8 días y la efectividad es del 85% al 95% en la eliminación del estado de portador. Las recomendaciones son las siguientes: •• Quimioprofilaxis antimeningocócica en adultos: –– Rifampicina: 10 mg/kg cada 12 horas, máximo 600 mg, durante 2 días. Puede presentar interacciones farmacólogicas con los anticonceptivos orales y los fármacos anticonvulsivantes, y está contraindicada en caso de insuficiencia hepática grave o embarazo. –– Ceftriaxona: 250 mg por vía intramuscular en dosis única. –– Ciprofloxacino: 500 mg por vía oral en dosis única. Está contraindicado en caso de embarazo. •• Quimioprofilaxis antimeningocócica en niños y lactantes: –– Rifampicina: <1 mes: 5 mg/kg cada 12 horas durante 2 días. >1 mes: 10 mg/kg cada 12 horas (máximo 600 mg) durante 2 días. –– Ceftriaxona: <15 años: 125 mg por vía intramuscular en dosis única. ≥15 años: 250 mg por vía intramuscular en dosis única. –– No se recomienda ciprofloxacino en los menores de 18 años. A las 48 horas del ingreso disponemos de los resultados microbiológicos: se ha aislado N. meningitidis en el LCR, del serogrupo W135. Después de conocer este dato, ¿es necesario realizar alguna medida extra respecto a las realizadas hasta el momento? 1) Ninguna: la quimioprofilaxis administrada hasta el momento es suficiente. 2) Administrar quimioprofilaxis y vacuna frente al meningococo del serogrupo C a toda la escuela. 3) Sería recomendable administrar la vacuna antimeningocócica tetravalente (A, C, W135, Y) polisacarídica a todos los contactos mayores de 24 meses. 4)Sería recomendable administrar la vacuna antimeningocócica tetravalente (A, C, W135, Y) conjugada a todos los contactos mayores de 24 meses. La respuesta correcta es la cuarta: se recomienda vacunar en caso de aislar serogrupos cubiertos por la vacuna, para erradicar el estado de portador y 248 G. Mirada Masip y X. Martínez Gómez proteger ante contactos no filiados que puedan mantener su transmisión en la comunidad. Respecto a la vacunación de los contactos, sólo se recomienda en los de casos producidos por serogrupos incluidos en la vacuna, debido a que pueden aparecer casos secundarios hasta semanas después. En esta situación, pueden vacunarse los contactos íntimos que hayan recibido profilaxis hasta 4 semanas después del inicio de los síntomas. En la actualidad, en Cataluña se dispone de tres vacunas diferentes frente al meningococo: la vacuna conjugada frente al meningococo del serogrupo C, la vacuna de polisacáridos frente al meningococo de los serogrupos A, C, W135 e Y, y la vacuna conjugada frente al meningococo de los serogrupos A, C, W135 e Y (en centros de vacunación internacional). Se recomienda el uso de vacunas conjugadas más que de las polisacarídicas debido a las limitaciones de estas últimas: hiporrespuesta a las dosis repetidas, baja inmunogenicidad en los niños, ausencia de efecto en la reducción de portadores y de efecto booster, limitada duración de la protección y no producción de memoria inmunitaria ni de inmunidad de grupo. Las recomendaciones de las vacunas conjugadas son: •• En el caso del meningococo del serogrupo C, la edad mínima de administración son 2 meses. La primovacunación en los menores de 1 año implica la administración de dos dosis (a los 2 y 6 meses de edad) y el uso de una dosis de recuerdo durante el segundo año de vida. En caso de administrar la primovacunación más allá de los 12 meses de vida, una única dosis es suficiente para garantizar una buena respuesta vacunal. En ningún caso se recomienda la revacunación. •• En el caso de la vacuna conjugada frente a los serogrupos A, C, W135 e Y, la edad mínima para su administración es de 2 años, y solamente se recomienda una única dosis. Al igual que para el meningococo del serogrupo C, la revacunación no está recomendada. A los 7 días nos informan de que en la escuela tres niños más han presentado síntomas compatibles con meningitis, que son derivados a nuestro hospital. Los tres pertenecen a clases diferentes. ¿Es necesario realizar alguna medida extra en el colegio? 1) Ninguna: la quimioprofilaxis administrada es suficiente. 2) Administrar quimioprofilaxis a los compañeros de clase de los nuevos casos. 249 Vacunación en situaciones de brote. Casos prácticos 3) Administrar quimioprofilaxis a toda la escuela y plantearse su vacunación, si es factible. 4) Cambiar el tipo de quimioprofilaxis utilizada, ya que ha demostrado ser inefectiva. La respuesta correcta es la tercera: puesto que el caso o la fuente de exposición ha sido capaz de diseminar la enfermedad de forma amplia, se recomienda proteger a todos los niños de la escuela para evitar la aparición de nuevos casos. Las recomendaciones para la quimioprofilaxis en entornos educativos, según el protocolo de actuación frente a la enfermedad meningocócica de la Dirección General de Salud Pública de Cataluña, son las siguientes: •• Si sólo aparece un caso en la escuela, se recomienda la quimioprofilaxis de sus compañeros más frecuentes o, en su defecto, de toda la clase. •• Si aparecen dos casos en dos clases diferentes, se recomienda quimioprofilaxis a los alumnos de las dos clases y a sus amigos íntimos. •• A partir de la aparición de tres casos en dos clases diferentes, con un intervalo máximo de 30 días entre ellos, se indicará quimioprofilaxis a toda la escuela. SARA M P IÓ N El 8 de marzo de 2012 acude a su centro de salud una mujer, de 32 años de edad, con su hijo de 9 meses. La madre refiere que hace 3 o 4 días que presenta tos, con fiebre, y además ayer le salieron unas manchas en la cara y los brazos. Su hijo hace 2 o 3 días que está resfriado, con tos, y ayer tenía fiebre. Esta mañana le ha dado un antitérmico y lo ha llevado a la guardería. A media mañana la han llamado porque tenía fiebre y una pequeña erupción en la cara y la espalda. Son derivados al hospital de referencia, donde se confirman los dos casos como sarampión. Se notifica a la Unidad de Vigilancia Epidemiológica correspondiente. Ella y su marido son de Rumanía. Viven en Cataluña desde hace 7 años. Tienen tres hijos nacidos aquí. Los otros dos niños tienen 3 y 5 años de edad. Hace 11 días que han regresado de su país, después de ir a la boda de un hermano. Han viajado sólo con el hijo pequeño porque la familia aún no lo conocía. Ella es peluque- 250 G. Mirada Masip y X. Martínez Gómez ra y ha trabajado hasta hace 2 días. Su marido es transportista. En casa viven el matrimonio con los tres hijos y una hermana de la madre, de 21 años de edad. Con los antecedentes del viaje y la situación epidémica en su país, se confirma que el origen de la infección fue el viaje a Rumanía. Las medidas de control son: – Aislamiento del caso. –Localización y seguimiento de los contactos (domiciliarios, guardería, consulta del centro de salud, urgencias, peluquería, familia, amigos, viaje…). –Inmunización de los contactos susceptibles: todas las personas que no han pasado la enfermedad o que no están adecuadamente inmunizadas. Si la fuente de infección está en el viaje a Rumanía, ¿qué actuaciones de profilaxis postexposición se recomendarán a los contactos del avión de regreso? 1) Se informará a la compañía aérea para que tome las decisiones que crea oportunas. 2) Se indicará profilaxis a todos los contactos susceptibles del vuelo. 3) Sólo se indicará profilaxis a los contactos sentados cuatro filas por delante y cuatro por detrás. 4) No está indicada la profilaxis postexposición. La respuesta correcta es la cuarta: no está indicada la profilaxis postexposición. El periodo de transmisibilidad del sarampión es de 4 días antes a 4 días después del inicio del exantema. Hace 11 días que han regresado de Rumanía. Por lo tanto, aunque estuvieran en el periodo de incubación no estaban en el de transmisibilidad y no está indicada la profilaxis. Situación inmunitaria de los contactos domiciliarios: – Marido (36 años): ha pasado el sarampión. –Niño (3 años): una dosis de triple vírica (vacunación correcta según la edad). – Niño (5 años): dos dosis de triple vírica (vacunación correcta según la edad). 251 Vacunación en situaciones de brote. Casos prácticos – Hermana (21 años): no ha pasado la enfermedad ni está vacunada. ¿Qué medidas de profilaxis postexposición se recomendarán para el niño de 3 años de edad? 1) No hace falta ninguna actuación porque está correctamente vacunado según el calendario. 2) Administración de IG polivalente porque es contacto íntimo. 3) Administración de la segunda dosis de vacuna triple vírica. Como se la adelantamos, tendremos que repetirla a los 4 años, según el calendario. 4) Administración de la segunda dosis de vacuna triple vírica. La respuesta correcta es la cuarta: administración de la segunda dosis de vacuna triple vírica (Tabla 1). Adelantamos la vacuna de los 4 años de edad, pero no hará falta repetirla cuando los cumpla. Tabla 1. Medidas postexposición: administración de la vacuna triple vírica. Nº vacunas administradas Edad Actuación 6-12 meses 0 Administrar 1 dosis 12 meses-4 años 0 1 Administrar 2 dosis (separadas 28 días) Adelantar la 2.ª dosis ≥4 años 0 1 Administrar 2 dosis (separadas 28 días) Administrar la 2.ª dosis Adultos nacidos después de 1966* 1 2 Administrar la 2.ª dosis (si >28 días) Pauta vacunal correcta *En Cataluña se considera que los nacidos en el año 1966 o antes tienen inmunidad frente al sarampión. La hermana está fuera el fin de semana. ¿Qué medidas de profilaxis postexposición se recomendarán si cuando vuelve han pasado 4 días desde la exposición? 1) Vacuna triple vírica (iniciar la pauta con dos dosis). 2) Administración de IG polivalente. 3) Vacuna triple vírica más IG polivalente. 4) Es demasiado tarde para que sea efectiva cualquier recomendación. La respuesta correcta es la segunda: administración de IG polivalente. 252 G. Mirada Masip y X. Martínez Gómez La vacunación puede evitar la Tabla 2. Medidas postexposición: administración de aparición de la enfermedad si se IG polivalente. administra hasta 72 horas desSituaciones Dosis pués de la exposición, pero si han Contactos familiares o de riesgo 0,25 ml/kg* >72 h - 6 días exposición pasado entre 72 horas y 6 días se Pacientes inmunodeprimidos 0,5 ml/kg* recomienda la administración de Niños inmunocompetentes <6 meses 0,25 ml/kg* IG polivalente. Las dosis recomenEmbarazadas 0,25 ml/kg* dadas son 0,25 ml/kg de peso o *Dosis máxima: 15 ml. 0,5 ml/kg de peso si se trata de pacientes inmunodeprimidos (Tabla 2). La vacuna triple vírica deberá administrarse transcurridos entre 5 y 6 meses (mínimo 3 meses según la Health Protection Agency de Reino Unido) desde la administración de IG polivalente. Situación inmunitaria de los contactos de la guardería: – Niños de 6-12 meses: no inmunizados. –Niños de 12 meses-3 años: correctamente vacunados con una dosis de triple vírica. – Cuidadora de 48 años: dice no estar vacunada ni haber pasado la enfermedad. – Cuidadora de 28 años embarazada: no está vacunada ni ha pasado la enfermedad. ¿Qué medidas de profilaxis postexposición se recomendarán para los niños de 6-12 meses de edad? 1) No se recomienda ninguna actuación porque aún tienen anticuerpos maternos. 2) Administración de IG polivalente. 3) Administración de vacuna triple vírica y considerarla como no válida. 4) Administración de vacuna triple vírica y considerar que dosis administrada es dosis válida. La respuesta correcta es la tercera: administración de vacuna triple vírica y considerarla como no válida. Las dosis administradas antes de los 12 meses de edad deben repetirse. En este caso, a todos los niños se les administrarán dos dosis según calendario: a los 12 meses y a los 4 años. ¿Qué medidas de profilaxis postexposición se recomendarán para la cuidadora de 48 años de edad que dice no haberse vacunado? 253 Vacunación en situaciones de brote. Casos prácticos 1) Administración de IG polivalente. 2) Iniciar vacunación con triple vírica (dos dosis separadas 4 semanas). 3) A partir de los 40 años de edad se considera que está inmunizada. 4) Como ha nacido en el año 1964 se considera que está inmunizada. La respuesta correcta es la cuarta: como ha nacido en el año 1964 se considera que está inmunizada. Por los estudios de seroprevalencia realizados, en Cataluña se considera que las cohortes nacidas a partir de 1966 no presentan inmunidad natural frente el sarampión. Esta recomendación se adaptará a las características epidemiológicas del sarampión en la zona, a las coberturas de vacunación y a los resultados de seroprevalencia locales. Así, para toda España se consideran no inmunes las cohortes posteriores a 1971, y en Estados Unidos las nacidas a partir de 1957. ¿Qué medidas de profilaxis postexposición se recomendarán para la cuidadora de 28 años, embarazada, que dice no estar vacunada? 1) Administración de una dosis de vacuna triple vírica inactivada. 2) Administración de una dosis de vacuna triple vírica atenuada. 3) Administración de IG polivalente. 4) Recomendar su exclusión durante 21 días desde el inicio del caso. La respuesta correcta es la tercera: administración de IG polivalente (Tabla 2). Considerando el riesgo teórico de afectación fetal, las vacunas atenuadas están contraindicadas durante el embarazo. No está comercializada ninguna vacuna triple vírica inactivada. BIBL I O G RA F ÍA Tos ferina –– Barrabeig I, Martínez A, Minguell S. Documents de vigilància epidemiológica - Protocol d’actuació per a la prevenció i el control de la tos ferina. Barcelona: Direcció General de Salut Pública; 2012. p. 1-17. 254 G. Mirada Masip y X. Martínez Gómez –– Centers for Disease Control and Prevention. Recommendend adult immunization schedule – United States, October 2007-September 2008. MMWR. 2007; 56:1279-80. –– Centers for Disease Control and Prevention. Updated recommendations for use of tetanus –– toxoid, reduced diphtheria toxoid and acellular pertussis (Tdap) vaccine from the Advisory Committee on Immunization Practices, 2010. MMWR. 2011;60:13-5. Centers for Disease Control and Prevention. Updated recommendations for use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccine (Tdap) in pregnant women and persons who have or anticipate having close contact with an infant aged <12 months – Advisory Committee on Immunization Practices (ACIP), 2011. MMWR. 2012;60;1424-6. –– Centers –– –– –– –– for Disease Control and Prevention. FDA approval of expanded age indication for a tetanus toxoid, reduced diphteria toxoid and acellular pertussis vaccune. MMWR. 2011;60:1279-80. Gall SA, Myers J, Pichichero M. Maternal immunization with tetanus-diphteria-pertussis vaccine: effect on maternal and neonatal serum antibody levels. Am J Obst Gynecol. 2011;334:e1-e5. Healy CM, Muñoz FM, Rench MA, Halasa NB, Edwards KM, Baker CJ. Prevalence of pertussis antibodies in maternal delivery, cord, and infant serum. JID. 2004;190:335-40. Leuridan E, Hens N, Peeters N, de Witte L, Van der Meeren O, Van Damme P. Effect of a prepregnancy pertussis booster dose on maternal antibody titers in young infants. Pediatr Infect Dis J. 2011;30:608-10. Uriona S, Martínez X, Campins M, Codina G, Ferrer A, Rodrigo JA, et al. Estudio de contactos de casos pediátricos de tos ferina en un hospital de tercer nivel de Barcelona. Med Clin (Barc). 2012; en prensa. Hepatitis A –– Centers for Disease Control and Prevention. Update: prevention of hepatitis A virus after exposure to hepatitis A virus in international travelers. Updates recommendations of the Advisory Commitee on Immunization Practices (ACIP). MMWR. 2007;56:1080-4. –– Central de Publicaciones del Gobierno Vasco. Protocolos de actuación frente a enferme- –– –– –– –– dades infecciosas (IV). Hepatitis A. 2007. (Consultado el 16 de julio de 2012). Disponible en: http://www.osakidetza.euskadi.net/contenidos/informacion/protocolos_epidem/es_ 4328/adjuntos/HepatitisA_c.pdf. Crowcroft NS, Crowcroft NS, Walsh B, Davison KL, Gungabissoon U; PHLS Advisory Committee on Vaccination and Immunisation. Guidelines for the control of hepatitis A infection. Commun Dis Public Health. 2001;4:213-27. Dirección General de Salud Pública. Región de Murcia. Protocolo de actuación frente a la hepatitis A. 2008. (Consultado el 16 de julio de 2012). Disponible en: http://www. ­murciasalud.es/recursos/ficheros/134557-hepatitisA.pdf. Health Protection Agency. Guidance for the prevention and control hepatitis A infection. 2009. (Consultado el 16 de julio de 2012). Disponible en: http://www.hpa.org.uk/webc/ HPAwebFile/HPAweb_C/1259152095231. The Green Book, 3rd edition. Department of Health 2006. Chapter 17. Hepatitis A. Updated 9/2/2011. (Consultado el 28 de septiembre de 2012.) Disponible en: https://www. wp.dh.gov.uk/immunisation/files/2012/07/chap-17.pdf. 255 Vacunación en situaciones de brote. Casos prácticos –– Joines RW, Blatter M, Abraham B, Xie F, De Clercq N, Baine Y, et al. A prospective, ran–– –– domized, comparative US trial of a combination hepatitis A and B vaccine (Twinrix) with corresponding monovalent (Havrix and Engerix B) in adults. Vaccine. 2001;19:4710-9. Plotkin SA, Orenstein WA, editores. Vaccines. 4th ed. Philadelphia: WB Saunders Company; 2004. Victor JC, Monto AS, Surdina TY, Suleimenova SZ, Vaughan G, Nainan OV, et al. Hepatitis A vaccine versus inmune globulin for postexposure prophylaxis. N Engl J Med. 2007;357:1685-94. –– Winokur PL, Stapleton JT. Immunoglobulin prophylaxis for hepatitis A. Clin Infect Dis. 1992;14:580-6. Enfermedad meningocócica –– American Academy of Pediatrics. Infecciones por meningococo. En: Pickering LK, et al., –– –– directores. Red Book: Enfermedades infecciosas en pediatría. 27.ª ed. Madrid: Editorial Médica Panamericana; 2007. p. 535-44. Barrabeig I, Ciruela P, Martínez A, Sala R. Documents de vigilància epidemiológica – Protocol d’actuació davant la malaltia meningocóccica. Barcelona: Direcció General de Salut Pública; 2006. p. 1-20. Black, S. Traveler’s protection against meningococcal disease: a new vaccine option. J Travel Med. 2010;17 (Suppl):18-25. Sarampión –– Departament de Salut. Generalitat de Catalunya. Protocol d’actuació per a la prevenció i el control del xarampió. Documents de vigilància epidemiològica. (Consultado el 16 de julio de 2012). Disponible en: http://www20.gencat.cat/docs/canalsalut/Home%20Canal%20 Salut/Professionals/Temes_de_salut/Vigilancia_epidemiologica/documents/ ­A rxius/ ­protocol_xarampio.pdf. –– Departament de Salut. Generalitat de Catalunya. Vigilància epidemiològica. Memòria de –– –– 256 salut pública 2010. (Consultado el 16 de julio de 2012). Disponible en: https://www. gencat.cat/salut/depsalut/html/ca/dir3617/vigilancia.pdf. Health Protection Agency. Post exposure prophylaxis for measles: revised guidance. May 2009. (Consultado el 16 de julio de 2012). Disponible en: http://www.hpa.org.uk/webc/ HPAwebFile/HPAweb_C/1238565307587. Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo. Protocolos de las enfermedades de declaración obligatoria. (Consultado el 16 de julio de 2012). Disponible en: http://www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilanciasalertas/protocolos-edo-revision-2000.pdf. Historia de la vacunología. Se publicaba hace 60 años F.A. Moraga-Llop y M. Campins Martí Presentación «Bordetella pertussis, una elusiva damisela» W. Ledermann D. (Rev Chil Infect. 2004;21:241-6) El artículo del doctor Manuel Moreno López que hemos elegido este año para reproducir en el capítulo de historia de la vacunología está relacionado con el microorganismo causal de la tos ferina, que en la actualidad, en los países desarrollados, es una de las enfermedades reemergentes más importantes y la más frecuente de las inmunoprevenibles. Este artículo es el extracto de la comunicación leída, hace ahora 60 años, el 21 de octubre de 1952, en el VIII Congreso Nacional de Pediatría, celebrado en Barcelona. Fue publicado en la revista Enfermedades Infecciosas y Microbiología Clínica, en el número del mes de noviembre de 1990, después del escrito “In memoriam. Dr. Manuel Moreno López” que firmaba el profesor Evelio J. Perea. Como señala Perea en el In memoriam, con una gran clarividencia Moreno López propone la creación del nuevo género Bordetella en Barcelona, y al año siguiente, en 1953, en el VI Congreso Internacional de Microbiología de Roma, después de proponerlo a los profesores Bordet, padre e hijo, con los que tenía una importante relación científica, se aceptó el 10 de septiembre de 1952. El trabajo original fue publicado en la hoy desaparecida revista Microbiología Española (1952;5:177-84). Jules Jean Baptiste Bordet y Octave Gengou aislaron el patógeno de la tos ferina en 1906, y durante los siguientes años recibió los nombres de Bacillus pertussis y Haemophilus pertussis. Medio siglo después, el doctor Moreno López propuso denominar al nuevo género Bordetella, en honor a uno de sus descubridores. Margaret Pittman, del National Institute of Health 259 Presentación de Bethesda (Estados Unidos), destacada microbióloga con quien Moreno López tuvo una estrecha amistad, propuso la aceptación del género, que se incluyó en el Bergey’s Manual por primera vez en la edición de 1954, referenciando el artículo de Moreno López. Con ello, la microbiología española desempeñó un importante papel. El Dr. Moreno López fue, desde 1967 y hasta su fallecimiento en 1990, jefe del Servicio de Microbiología y Epidemiología de la Clínica Puerta de Hierro de Madrid, y profesor de la Facultad de Medicina de la Universidad Autónoma de Madrid. Anteriormente, desde 1962, estuvo muy relacionado con la vacunología, ya que como director del Instituto Llorente desarrolló una importante labor en la fabricación de productos biológicos. Después de su estancia en Canadá y Estados Unidos, el Instituto elaboró las vacunas para las campañas contra la difteria, el tétanos, la tos ferina, la viruela y la tuberculosis, y también producía medios de cultivo y reactivos biológicos. Por tanto, Moreno López debe ser considerado un pionero en el campo de las vacunas en España. Fernando A. Moraga-Llop y Magda Campins Martí 260 M. Moreno López 261 El género Bordetella 262 M. Moreno López 263 El género Bordetella 264 M. Moreno López 265 El género Bordetella 266 Este libro se terminó de imprimir en octubre de 2012, año en que se conmemora el 40 aniversario de la presentación del “Plan de vacunación continuada de la población infantil de Barcelona” proyectado por el Instituto Municipal de Higiene (director: profesor Agustí Pumarola). *** Portada vacunas 2012_print.pdf 1 02/11/12 12:09 M Y CM MY CY CMY 2012 K VACUNAS 2012 C Magda Campins Martí Fernando A. Moraga Llop Magda Campins Martí Fernando A. Moraga Llop iruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus nfluenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae iebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria étanos Rubéola Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre marilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos os ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla iebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre tifoidea Meningococo oliomielitis Varicela Cólera Fiebre BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela DifteriaTétanos Tos ferina Hepatitis A Hepatitis B rotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo oliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina VPH Hepatitis B Parotiditis abia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis ricela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia ubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola arampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera CG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión étanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis aponesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa ncefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCGEncefalitis japonesa Encefalitis entroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma otavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco este Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Neumococo Gripe Tétanos Rotavirus HaemophilusPapiloma Rot nfluenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae iebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria étanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Gripe Meningococo Papiloma Rotavirus Haemophilus influenzae Fiebre marilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Sarampión Carbunco Peste Viruela Difteria tanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre oidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión TétanosNeumococo Gripe Papiloma Rotavirus Sarampión Haemophilus influenzae Fiebre amarilla Fiebre oidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela BCG Rabia Difteria Tétanos Tos rina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre oidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis Rabia Rubéola Sarampión Tétanos Neumococo Gripe Papiloma Rotavirus Haemophilus influenzae Fiebre amarilla Fiebre tifoidea Meningococo Poliomielitis Varicela Cólera BCG Encefalitis japonesa Encefalitis centroeuropea Carbunco Peste Viruela Difteria Tétanos Tos ferina Hepatitis A Hepatitis B Parotiditis