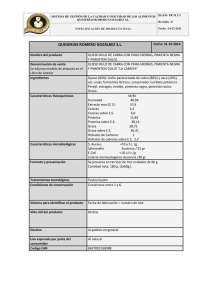
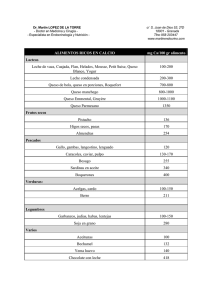
universidad simón bolívar decanato de estudios de postgrado
Anuncio

UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN DE POSTGRADO EN QUÍMICA MAESTRÍA EN QUÍMICA TRABAJO DE GRADO ANÁLISIS OLFATOMÉTRICO DEL AROMA DE QUESO DE CABRA VENEZOLANO PRODUCIDO EN LAS TRES FASES DEL PERIODO DE LACTANCIA Por: Mirtha Marlene Matute Vargas Mayo, 2012 UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN DE POSTGRADO EN QUÍMICA MAESTRÍA EN QUÍMICA ANÁLISIS OLFATOMÉTRICO DEL AROMA DE QUESO DE CABRA VENEZOLANO PRODUCIDO EN LAS TRES FASES DEL PERIODO DE LACTANCIA Trabajo de Grado presentado a la Universidad Simón Bolívar por Mirtha Marlene Matute Vargas como requisito para optar al título de Magister en Química. Realizado con la asesoría de la Dra. Aivlé Cabrera y Dra. Elba Sangronis Mayo, 2012 v DEDICATORIA A mi esposo e hija, Los amo… vi AGRADECIMIENTOS Al postgrado en química de la Universidad Simón Bolívar, por permitirme ingresar y así avanzar en mi preparación académica. A mis tutoras, por la confianza para que desarrollara el presente trabajo y su apoyo en todo momento. Al panel sensorial (Profesora Aura Cova, Gabriela Hernandez, Ivan Toro, Ignacio Buscema, Carlos Faneyth y Señor Edgar Díaz) por su interés e invalorable tiempo, el cual fue clave para llevar a cabo el proyecto. A la Sra. Elida María Peña por abrirme las puertas de su hacienda para trabajar con sus quesos y su total disposición para colaborar. A la profesora Ursula Ehrmann por su asesoramiento en la adaptación del equipo de olfatometría. Al Ingeniero Rafael Santelmo por el diseño del programa de adquisición de datos para olfatometría. A Humberto Carvajal por su asesoramiento en los análisis estadísticos y sus recomendaciones. Al jurado examinador por sus indicaciones y sugerencias que enriquecieron el trabajo. A los excelentes amigos que me apoyaron en todo momento (hasta los nueve meses de cambios hormonales) Shailili, José Gregorio, Ignacio, Lissette Jimenez, Patricia Muñoz, Carlos Faneyth, Gabriela Díaz, Ivan Toro. A Ignacio Buscema por su amistad y apoyo desde el principio, su paciencia y tiempo para compartir sus conocimientos que siempre me guiaron. A mi milo, Shailili Moreno por su amistad, sus consejos y el impulso que siempre me contagio. A my friend José Gregorio, por su amistad, apoyo y las sonrisas que siempre nos hicieron todo más fácil. A la Coordinación de Química, principalmente a Maritza Sotillo por toda la colaboración que siempre me brindo y su amistad. A la empresa Flavors Concentrados C.A de Venezuela, por suministrarme los compuestos que me permitieron culminar la tesis. vii Al taller de vidrio de la Universidad Simón Bolívar por la fabricación del puerto de detección para el equipo de olfatometría. A mi familia, mi esposo Ronald que siempre me apoyo a continuar y a mi hija Lia Corina por su paciencia en esperarme para jugar cuando tenía que escribir la tesis. A mi madre por su empuje, apoyo y amor que siempre hacen para mí todo más fácil. A mi hermanita Miriam por cuidar a Lia Corina con tanto amor y paciencia, para que me dedicara a terminar la tesis. A Dios por la fe que me permitió siempre tener la fuerza y el impulso para continuar. viii UNIVERSIDAD SIMÓN BOLÍVAR DECANATO DE ESTUDIOS DE POSTGRADO COORDINACIÓN DE POSTGRADO EN QUÍMICA MAESTRÍA EN QUÍMICA ANÁLISIS OLFATOMÉTRICO DEL AROMA DE QUESO DE CABRA VENEZOLANO PRODUCIDO EN LAS TRES FASES DEL PERIODO DE LACTANCIA Por: Matute Vargas Mirtha Marlene Carnet No.:07-86014 Tutor: Aivlé Cabrera Co-tutor: Elba Sangronis Mayo 2012 RESUMEN La percepción del aroma de los quesos de cabra es uno de los principales criterios para su aceptación por los consumidores, por ello se planteó estudiar el mencionado parámetro organoléptico del queso de cabra elaborado artesanalmente con leche de diferentes periodos de la lactancia, de cabras criadas en un sector del Municipio Iribarren en el Edo. Lara. La presente investigación se realizó en tres fases: en la primera se aislaron e identificaron los compuestos volátiles mediante microextracción en fase sólida del espacio en cabeza (MEFS-EC) con el uso de una fibra de 30/50 µm de DVB/CAR/PDMS y por cromatografía de gases con detector de FID y Espectrometría de masas (CG/EM). En la segunda fase se realizó el análisis olfatométrico, mediante el método de frecuencia de detección (FD) con un panel entrenado de 6 personas. Para la última etapa se realizó un tratamiento estadístico mediante Multidimensional Scaling (MDS) de los AGL cuantificados y el análisis olfatométrico. Se lograron identificar compuestos de las familias de ésteres, aldehídos, alcoholes, cetonas y ácidos grasos libres (AGL) y se cuantificaron mediante curva de calibración externa. Los resultados demostraron diferencias estadísticamente significativas del perfil aromático del queso elaborado en cada fase de lactancia, con un aumento en las concentraciones de los AGL en el segundo periodo de análisis, por un posible aumento del proceso de lipólisis, caracterizando a la primera fase de lactancia con aromas a frutas fermentadas, alcoholadas, a la segunda como floral, madera y a la tercera a floral y verde. Palabras Clave: queso de cabra artesanal, cromatografía de gases, espectrometría de masas, ácidos grasos libres, Multidimensional Scaling, curva de calibración. ix ÍNDICE GENERAL APROBACIÓN DEL JURADO iv DEDICATORIA v AGRADECIMIENTOS vi RESUMEN viii ÍNDICE GENERAL ix ÍNDICE DE TABLAS xiv ÍNDICE DE FIGURAS xvii LISTA DE ABREVIATURAS Y SIMBOLOS xxi INTRODUCCIÓN GENERAL OBJETIVOS 1 3 CAPITULO I. MARCO TEÓRICO 5 1.1. Características fisiológicas del sentido del olfato 5 1.2. El olor y su percepción 6 1.3. Olfatometría 9 1.4. Detección de compuestos de aroma 12 1.5. Características instrumentales de la técnica de GC-O 13 1.5.1. Puerto de olor 14 1.5.2. Sistema de detección y generación de señal 14 1.5.3. Resolución de la señal cromatográfica 16 1.6. Condiciones para la detección por olfatometría 17 1.7. Métodos de tratamientos de datos otenidos por GC-O 17 1.7.1. Método de frecuencia de detección 17 1.7.2. Método de dilución de extractos de aroma 19 x 1.7.3. Método de medición de intensidad olfativa 1.8. Método de extracción y aislamiento de los compuestos volátiles en 20 22 alimentos 1.8.1. Microextracción en Fase sólida 23 1.9. El queso: Generalidades 28 1.9.1. Composición química y propiedades físico-químicas de la leche de cabra 28 19.1.1 Papel de los diferentes componentes de la leche en la calidad del queso 30 1.9.2. Principios para la elaboración de quesos 30 Aislamiento de aleloquímicos en especies vegetales 27 1.10. Cambios bioquímicos durante el procesado y maduración del queso de cabra 34 1.10.1 Glucólisis 35 1.10.2 Lipólisis 35 1.10.3 Proteólisis 37 1.11. Producción de la leche caprina en Venezuela 38 1.11.1. Estado de lactancia de la cabra 39 1.12. Compuestos responsables del aroma y sabor en los quesos de cabra 42 1.12.1. Compuestos neutros 43 1.12.2. Compuestos alcalinos 46 1.12.3. Compuestos acídicos 47 1.13. Importancia de los AGL en queso de cabra 48 1.14. Extracción de compuestos de aromas en quesos 49 CAPITULO II. MATERIALES Y MÉTODOS 53 2.1. 53 Ubicación de la zona de elaboración del queso de cabra xi 2.2. Muestras de queso 53 2.3. Características de las cabras 54 2.4. Fabricación del queso de cabra usado en el proyecto 54 2.5. Reactivos y equipos 55 2.5.1. Reactivos 55 2.5.2. Materiales 56 2.5.3. Equipos de laboratorio 57 2.5.4. Sistema de cromatografía de gases - detector ionización de 57 llama (FID) 2.5.5. Sistema de cromatografía de gases – espectrometría de 58 masas (CG-EM). 2.6. 2.5.6. Sistema de cromatografía de gases – olfatometría. 58 Métodos y procedimiento 60 2.6.1. Preparación de las muestras de queso y muestreo por 60 microextracción en fase sólida (MEFS) 2.6.2. Obtención del panel entrenado 61 2.6.2.1. Reclutamiento de panelistas 61 2.6.2.2. Selección de panelistas 62 2.6.3. Representatividad del aroma en CG-O 65 2.6.4. Preparación de soluciones estándares de ésteres lineales 2.6.4.1. Entrenamiento del panel en la detección de los ésteres 66 lineales por olfatometría. 2.6.5. Análisis olfatométrico 67 xii 2.6.6. Curva de calibración externa para los ácidos grasos libres 67 (AGL) 2.6.6.1. Linealidad de los AGL y curva de calibración 68 2.6.6.2. Limite de detección y cuantificación 69 2.6.7. Análisis estadístico de los AGL 70 CAPITULO III. AISLAMIENTO E IDENTIFICACIÓN DE LOS COMPUESTOS VOLÁTILES EN EL QUESO DE CABRA. RESULTADOS Y DISCUSIÓN 71 3.1. 71 Selección del método de extracción y análisis de los compuestos volátiles en las muestras de queso de cabra por MEFS-CG-FID. 3.1.1. Selección de la fibra para MEFS 71 3.1.2. Selección de la columna cromatográfica 73 3.1.3. Selección cantidad de muestra de queso 75 3.1.4. Tiempo de extracción 76 3.1.5. Temperatura de extracción 77 3.2. Identificación de los compuestos de la fracción volátil de los quesos de 78 cabra mediante MEFS y CG-EM recolectados en la producción de curva de lactancia 3.2.1. Compuestos identificados mediante la separación en 78 columna DB-5 3.2.2. Análisis mediante la columna Carbowax. 80 CAPITULO IV. ENTRENAMIENTO DEL PANEL SENSORIAL Y ANÁLISIS OLFATOMÉTRICO. RESULTADOS Y DISCUSIÓN 85 4 .1. Entrenamiento del panel sensorial 85 xiii 4.1.1. Reconocimiento de aromas de alimentos y desarrollo de 85 destreza en asociar descriptores 4.1.2. Determinación del umbral de identificación de aromas de los 86 panelistas 4.1.3. Desarrollo del vocabulario del panel para olfatometría. 4.2. Representatividad sensorial de la extracción del aroma del queso de 87 89 cabra por MEFS 4.3. Análisis olfatométrico del queso de cabra en las tres fases de lactancia 91 CAPITULO V. CUANTIFICACIÓN DE LOS ÁCIDOS GRASOS DEL QUESO DE CABRA EN LAS TRES FASES DE LACTANCIA. RESULTADOS Y DISCUSIÓN 97 5.1. Curvas de calibración 97 5.2. AGL en el queso de cabra 100 CAPITULO VI. ANÁLISIS ESTADÍSTICO DE LOS AGL CUANTIFICADOS EN EL QUESO DE CABRA Y ZONAS DE AROMAS DEL ANÁLISIS OLFATOMETRICO. RESULTADOS Y DISCUSIÓN 103 6.1. Análisis de los AGL en las muestras de quesos en las tres fases de lactancia 6.2. Análisis estadístico de las zonas de aromas obtenidas en el análisis olfatométrico de los quesos de cabra. 103 CONCLUSIONES 113 RECOMENDACIONES 115 REFERENCIAS BIBLIOGRÁFICAS 116 APÉNDICE I 128 APÉNDICE II 135 APÉNDICE III 136 APÉNDICE IV 139 109 xiv ÍNDICE DE TABLAS Tabla 1.1. Clases de olores y vocabulario para el panel olfatorio en los 11 análisis por CG-O en alimentos y bebidas alcohólicas Tabla 1.2. Aplicación de métodos olfatométricos en análisis de 21 compuestos volátiles en diferentes matrices de alimentos. Tabla 1.3. Composición media de la leche de vaca, oveja y cabra 29 expresada por 100 g de leche [30]. Tabla 1.4. Propiedades físico-químicas de diferentes leches 30 Tabla 1.5. Diferentes procesos en la maduración enzimática del queso 34 fresco Tabla 1.6. Efecto del estado de lactancia sobre la composición de la 41 leche en 42 cabras de la raza Alpina Tabla 1.7. Variación en la concentración de AGL (mg/100g) en 49 muestras de queso de cabra almacenados a 4°C Tabla 1.8. Diferentes tipos de fibras para el análisis de compuestos de 51 aromas en quesos. Tabla 1.9. Compuestos comunes encontrados en diferentes tipos de 52 queso (cheddar, pecorino, azul, parmesano, cabra) Tabla 2.1. Reactivos usados en el proyecto 56 Tabla 2.2. Compuestos usados para el desarrollo de vocabulario del 64 panel en la detección de aromas. xv Tabla 3.1. Compuestos identificados para la muestra de queso 77 recolectada al inicio de la curva de lactancia (MQ1) mediante MEFS-CGEM en una columna DB-5 Tabla 3.2. Compuestos identificados para la muestra de queso 77 recolectada a la mitad de la curva de lactancia (MQ2) mediante MEFSCG-EM en una columna DB-5. Tabla 3.3. Compuestos identificados para la muestra de queso 78 recolectada a la mitad de la curva de lactancia (MQ3) mediante MEFSCG-EM en una columna DB-5. Tabla 3.4. Los ácidos grasos libres (AG) identificados en las tres 79 muestras de queso mediante MEFS-CG-EM en una columna Carbowax. Tabla 4.1. Porcentajes de aciertos individuales y grupal en el 84 Tabla 4.2. Umbral de identificación individual de los panelistas usando 85 reconocimiento de aromas de alimentos. acetato de isoamilo. Tabla 4.3. Compuestos usados para el entrenamiento del panel en 86 Tabla 4.4. Descriptores de aromas de la serie de ésteres lineales en el 87 olfatometría. entrenamiento del panel en olfatometría. Tabla 4.5. Análisis del porcentaje de representatividad del aroma del queso de cabra extraído con la fibras DVB/CAR/PDMS y CAR/PDMS. 88 xvi Tabla 4.6. Evaluación de resolución nula en CG-O de los volátiles 89 extraídos con la fibra DBV/CAR/ PDMS del queso de cabra y patrón de butanoato de etilo. Tabla 4.7. Zonas de aromas (ZA) para la muestra de queso 1 92 Tabla 4.8. Zonas de aromas (ZA) para la muestra de queso 2. 93 Tabla 4.9. Zonas de aromas (ZA) para la muestra de queso 3 94 Tabla 5.1. Concentración en el espacio en cabeza de los ácidos grasos 99 libres (AGL) en las tres fases de lactancia Tabla 5.2. Valores de actividad de olor (VAO) de los ácidos grasos 101 libres (AGL) en el queso de cabra. Tabla 6.1. Áreas medidas en CG-FID de los AGL en las tres fases de 104 lactancia y sus coeficientes de variación Tabla 6.2. Coeficientes de correlación de los AGL 105 xvii ÍNDICE DE FIGURAS Fig. 1.1. Morfología interna del olfato 5 Fig. 1.2. Estructuras químicas correspondientes a los olores primarios. 8 Fig. 1.3. Curvas teóricas dosis – respuesta para 2 compuestos diferentes (A 13 y B); n es la pendiente de la recta. Fig. 1.4. Esquema del equipo de cromatografía equipado con un detector de 14 olor. Fig. 1.5. Comparación entre una señal cromatográfica convencional y la señal 15 olfatométrica. 18 Aromagrama individual y consenso mediante el método de Figura 1.6. frecuencia de detección, cuando cuatro evaluadores participan en el experimento. Fig.1.7. Comparación de resultados obtenidos para 6 compuestos 20 determinados en el mismo extracto mediante CG-O, por diferentes métodos: (a) AEDA, (b) CharmAnalisis, (c) Frecuencia de Detección y (d) Intensidad Directa (OSME). Fig. 1.8. Dispositivo de MEFS. Fig. 1.9. Clasificación de las fibras de MEFS según si la 23 extracción se 27 produce por absorción o adsorción. Fig. 1.10. Esquema propuesto para la micela del caseinato de calcio en la 31 leche. xviii Fig. 1.11. Esquema general de elaboración de queso. 33 Fig. 1.12. Extracción de compuestos de aroma en una solución modelo por 50 MEFS con diferentes fibras. Fig. 2.1. Equipo de CG-O. (1) humidificador, (2) detector olfatométrico y/o 59 puerto de olor, (3) teclado para el registro de la señal. Fig. 2.2. Generación de la señal olfatométrica obtenida con el programa 60 LabView. Fig. 2.3. Características de la señal con el detector olfatométrico. 60 Fig. 2.4. Gráfico modelo de curva de calibración usado para determinar LD y 68 LC. Fig. 3.1. Comparación de cromatogramas de gases de los volátiles aislados 71 del queso de cabra con las fibras DVB/CAR/PDMS (a) y PDMS/CAR (b). Fig. 3.2. Optimización del tiempo de muestreo por MEFS para las muestras 73 de queso de cabra. Fig. 3.4. Optimización de las temperaturas de muestreo por MEFS del queso 74 de cabra. Fig. 3.5. Cromatogramas del perfil volátil del queso de cabra obtenidos 75 mediante MEFS y analizados en una columna de DB-5 (a) y Carbowax (b). Fig. 4.1. Aromagrama consenso mediante el método Frecuencia de detección, 90 cuando 6 evaluadores participaron en el experimento para la muestra número 1 de queso de cabra (MQ1) xix Fig. 4.2. Aromagrama consenso mediante el método Frecuencia de 93 detección, cuando 6 evaluadores participaron en el experimento para la muestra número 2 de queso de cabra (MQ2) Fig. 4.3. Aromagrama consenso mediante el método Frecuencia de 93 detección, cuando 6 evaluadores participaron en el experimento para la muestra número 2 de queso de cabra (MQ3) Fig. 5.1. Optimización del volumen usado para los patrones de AGL para las 97 curvas de calibración externa. Fig. 5.2. Curva de calibración del ácido butanoico 98 Fig. 5.3. Curva de calibración del ácido hexanoico 98 Fig. 5.4. Curva de calibración del ácido octanoico. 98 Fig. 5.5. Curva de calibración del ácido decanoico. 98 Fig. 5.6. Distribución de los AGL en las muestras de queso de cabra en las 100 tres fases de lactancia. Fig. 6.1. Histogramas de los AGL; (a) Butanoico, (b) Hexanoico, (c) 104 Octanoico, (d) Decanoico. Fig. 6.2. Dendograma de las variables (ac. butanoico, hexanoico, octanoico y 106 decanoico) en las tres fases de la curva de lactancia. Fig. 6.3. Dendograma de las muestras de quesos en las tres fases de la 107 curva de lactancia. xx Fig. 6.4. Configuración de dos dimensiones de los AGL para los quesos de 108 cabra en los tres estados de lactancia derivada del modelo de distancia euclídea. Fig. 6.5. Perfil de aromas de las muestras de quesos de cabra 109 Fig. 6.6. Dendograma de las variables (familia de aromas obtenidas por el 110 análisis olfatométrico) de los quesos elaborados en las tres fases de la curva de lactancia. Fig. 6.7. Configuración en dos dimensiones de los grupos de aromas para las 111 muestras de quesos de cabra. Fig. 6.8. Configuración en dos dimensiones para todas las muestras de 112 quesos de cabra. xxi LISTA DE ABREVIATURAS AGL: Ácidos grasos libres CAR: Carboxen CW: Carbowax CG - EM: Cromatografía de gases acoplada a espectrometría de masas CG - FID: Cromatografía de Gases con Detector de Ionización de Llama. CG: Cromatografía de Gases CG - O: Cromatografía de gases - olfatometría CV: Coeficiente de variación DVB: Divinilbenceno. EM: Espectrometría de masas. EC: Espacio en cabeza. FD: Frecuencia de detección IR: Índice de Retención de Kováts. LC: Limite de cuantificación LD: Limite de detección MDS: Multidimensional Scaling MEFS-EC: Microextracción en Fase Sólida del Espacio de Cabeza. MQ: Muestra de queso PDMS:Polidimetilsiloxano. TDS: Tiempo de duracción TR Tiempo de retención Rs: Resolución VAO: valores de actividad de olor ZA: Zona de aroma 1 INTRODUCCIÓN GENERAL La leche de cabra y sus derivados son recursos alimentarios que han recibido en los últimos años gran atención mundial. Su producción se ha incrementado notablemente en las últimas dos décadas y por ello está contribuyendo cada vez más a mejorar la economía de productores, industriales y a incrementar el aporte nutricional en varios sectores de consumidores. En algunas regiones la leche de cabra se consume directa en forma líquida, aunque también se procesa para la obtención de derivados, principalmente queso. La composición de la leche de cabra difiere de la de vaca principalmente en el contenido de las diversas fracciones de caseínas, lo cual puede propiciar rendimientos queseros menores y efectos sobre la textura del queso. El alto contenido de ácidos grasos libres de la leche de cabra la hace altamente susceptible a la lipólisis. Los ácidos grasos como butírico, caproico, cáprico y caprílico, le confieren al queso un sabor diferente, lo cual es atractivo para los consumidores [1]. Uno de los factores claves en el aumento de la producción y consumo de leche de cabra y sus derivados en el mundo, es el efecto beneficioso para la salud humana, ya que genera menos alergias [2] y es más digerible que la leche de vaca [3]. Dicha propiedad se debe a las diferencias de genotipo y fenotipo entre proteínas de vaca y las de cabra. En general, aquellos infantes y niños que exhiben reacciones alérgicas a la leche de vaca, toleran perfectamente la leche de cabra y sus derivados [4] . También se reconoce la mejor digestibilidad de la grasa de leche de cabra comparada con la de vaca, probablemente como consecuencia de la diferencia en el tamaño de los glóbulos grasos [5]. Por otro lado los atributos que más condicionan la aceptabilidad de cualquier alimento por parte del consumidor son los relacionados con la calidad sensorial, que incluye la apariencia, el aroma, el gusto y la textura. En este sentido, uno de los 2 rasgos más complejos y determinantes de dicha calidad es el aroma del alimento, que se puede definir como la sensación global producida al oler los compuestos que interaccionan con las terminaciones nerviosas sensibles del gusto y del olfato[6]. El aroma está compuesto por centenares de compuestos volátiles y semivolátiles que pertenecen a distintas familias químicas y que se encuentran a concentraciones muy variables. La elevada producción y la necesidad de encontrar alimentos aromáticamente estandarizados, requieren herramientas analíticas eficientes para su caracterización [6]. La producción de la leche de cabra depende de muchos factores, entre los que se encuentra el estado de lactancia, el cual determina diferentes niveles de producción caracterizados en tres fases: ascenso, cúspide o nivel máximo y descenso o declive, estas etapas no solo hacen variable el nivel de producción de leche sino también su composición, principalmente en el contenido graso, el cual es el componente principal en el proceso de lipólisis para la producción de compuestos responsables del aroma, en los que se encuentran los ácidos grasos libres. En Venezuela el queso de cabra es un producto que en la última década ha aumentado su demanda en la dieta diaria de la población, principalmente en la zona occidental del país. Sin embargo en la literatura no hay reportados estudios previos acerca de la calidad aromática de este producto. De esta manera se hace necesario plantear investigaciones que establezcan relaciones entre el origen geográfico, la tecnología aplicada en la elaboración del producto, la microbiología y las características sensoriales del queso de cabra, para así establecer la caracterización de estos productos y plantear mejoras tecnológicas que contribuyan al sistema de producción y la calidad para el consumidor. Por todo lo expuesto anteriormente, a continuación se plantea el objetivo en el presente estudio. 3 OBJETIVOS Objetivo general Analizar los compuestos químicos responsables del aroma de queso de cabra venezolano proveniente del estado Lara, elaborado en las tres fases de lactancia y sus perfiles aromáticos mediante la implementación de la técnica de cromatografía de gases-olfatometría. Objetivos específicos Seleccionar las condiciones experimentales adecuadas para aislar y analizar cualitativa y cuantitativamente la fracción volátil del queso de cabra venezolano proveniente del estado Lara, mediante el uso de microextracción en fase sólida (MEFS) y cromatografía de gases (CG) y cromatografía de gases - espectrometría de masas (CG-EM). Comparar los principales compuestos volátiles presentes en el queso de cabra elaborado en las diferentes fases del periodo de lactancia identificados por MEFS-CG-EM. Implementar la técnica de cromatografía de gases acoplada a olfatometría (CG-O) para la evaluación de compuestos activos de aromas presentes en el queso de cabra en las tres fases de lactancia mediante el análisis y comparación de los aromagramas. Correlacionar los resultados de CG-EM con los obtenidos mediante CG-O para identificar los principales compuestos que contribuyen al aroma del queso de cabra. 4 Estudiar la variabilidad en el tiempo de las concentraciones de los ácidos grasos libres (AGL) mediante su correlación con el periodo de lactancia de las cabras a partir de tratamientos estadísticos. 5 CAPÍTULO I MARCO TEÓRICO 1.8. Características fisiológicas del sentido del olfato La ubicación de este sentido es la nariz que se abre al exterior por dos orificios (ventanas nasales) y comunica con el interior de la cavidad bucal por las fosas nasales (Fig. 1.1) [7]. Fig. 1.1. Morfología interna del olfato [8] En la parte inferior de la mucosa pituitaria que tapiza las paredes laterales interiores de las fosas nasales, se observan numerosas glándulas secretoras de color rojo, que humedecen la cavidad, y en la parte superior se encuentran las células olfativas con una superficie aproximada de unos 10cm2, de color amarillo[7], denominadas “células de Schult” y caracterizadas por la presencia de un alargamiento que se insinúa a través de la membrana y que termina en una vesícula clara que aparece en la superficie externa de la mucosa. Dicha vesícula contiene una secreción acuosa, en la cual se encuentran inmersas las pequeñas 6 terminaciones ciliadas de la dendrita de la célula nerviosa. En la parte opuesta de la célula olfativa hay una prolongación que constituye una de las fibras del nervio olfativo. Las dendritas ciliadas de la célula olfativa constituyen el receptor del estimulo olfativo, y se calcula que en el ser humano cada neurona posee entre 30 y 40 cilios, y en estos cilios se observan lugares en los que se encuentran los puntos de recepción de los aromas [7]. Para ser detectadas, las sustancias odoríferas aspiradas por la nariz, deben solulbilizarse en la secreción acuosa que recubre las terminaciones ciliadas y luego entrar en contacto con las terminaciones nerviosas [7]. 1.9. El Olor y su Percepción El olor es la sensación producida al estimular el sentido del olfato, y el aroma es la fragancia del alimento que permite la estimulación del sentido del olfato, por eso en el lenguaje común se confunden y usan como sinónimos [9] . El olor se produce como la respuesta biológica de los sentidos a compuestos químicos en estado gaseoso, interpretada en el cerebro en el contexto de la experiencia humana [10] . De esta manera los aromas existen en virtud de una serie de interrelaciones complejas entre los sistemas biológicos y los estímulos químicos, donde la química se ha encargado de la caracterización de los compuestos activos de aromas. La psicometría es una rama de la psicología que se encarga del estudio del comportamiento humano ante los estímulos [11] . Se ha reconocido que los procesos psicológicos tales como la atención, la memoria, la cognición y la cultura tienen influencia en la respuesta humana. La neurofisiología, por su parte, ha estudiado lo concerniente a los procesos neuronales asociados con el proceso de estímulorespuesta como la percepción de un olor. A pesar que no se conocen completamente todos los procesos relacionados con la respuesta humana a los estímulos físicos, se han encontrado que se cumplen los tres siguientes aspectos en la percepción del aroma [11]: 7 • Las reacciones de los aromas se presentan en diferentes cualidades o modalidades, las cuales muestran una especificidad estructural hacia el estímulo. Es decir, dos compuestos químicos con la misma cualidad de aroma (por ejemplo olor a rosas secas) y el mismo comportamiento cromatográfico (tiempo de retención), son el mismo compuesto químico. Las reacciones a los aromas muestran una respuesta sigmoidal con respecto a la concentración del compuesto químico. Las respuestas a mezclas de estímulos están caracterizadas por inhibición y supresión y no por sinergismo. Para que un compuesto sea oloroso, éste debe ser volátil a temperatura ambiente y con un peso molecular menor a 300 uma. Usualmente son compuestos orgánicos hidrofóbicos que contienen un limitado número de grupos funcionales. Sin embargo, esto último no es prerrequisito, ya que se han reportado alcanos con potentes aromas alcanforados, como lo son; 2,4,4-trimetilpentano y ciclooctano [12]. La percepción del olor se produce en la parte superior de la cavidad nasal, definido como el epitelio olfativo (región olfativa). Este constituye una parte importante de la mucosa nasal, que cuenta con 3 a 50 millones de receptores olfativos. Las sustancias aromáticas volátiles llegan hasta ellas mezcladas con el aire de la respiración, o bien directamente por la nariz o indirectamente, a través de la cavidad faríngea posterior (retronasal), donde se liberan por trituración en la masticación, disolución en la saliva y calentamiento [7]. Los valores de umbral en la percepción de los olores en general dependen de una serie de factores como son: volumen y duración del flujo de aire que llega a la mucosa olfativa, la humedad del medio ambiente, así como el efecto de hambre; se ha demostrado una relación inversa entre éste y la sensibilidad del olfato. Existen factores de carácter interno relacionados con las variables de cada individuo, pudiendo citarse entre otros: el estado fisiológico de cada persona y la edad [8]. 8 La teoría de las bases químicas del sentido del olfato establecida por Moncrieff y Amoore [8] (1962), se basa en la interacción entre las estructuras químicas de las moléculas y los receptores olfativos. Se establece que los poros olfativos poseen receptores con formas distintas donde encajan las moléculas, su tamaño y forma le permite acoplarse al receptor e interaccionar en él. Se postulan 9 formas distintas de receptores y paralelamente 9 categorías primarias de olores (olores primarios). De acuerdo a esta hipótesis, todas las restantes impresiones olfativas resultan de la mezcla de olores primarios (Fig.1.2). Fig. 1.2. Estructuras químicas correspondiente a los olores primarios. A= dulce; B= naftalínico; C= Almizclado; D= Alcanforado; E= Jazmínico; F=Anisado; G= Graso; H= Floral; K= Leñoso[4]. En las moléculas pequeñas que apenas se diferencian entre sí en cuanto a forma y tamaño, los grupos funcionales desempeñan un papel importante respecto a la categoría del olor. Entre ellas se encuentran el amoníaco (NH3, grupo funcional – NH2; olor penetrante), el ácido sulfhídrico y el metil mercaptano (H2S y CH3SH; grupo funcional –SH, olor a huevos podridos). Al aumentar el tamaño de la molécula, disminuye la influencia dominante de los grupos funcionales, la forma y el tamaño molecular determinan en gran medida la categoría del olor [7]. La concentración del odorante puede también afectar las características en su percepción. El clásico ejemplo son los compuestos químicos pertenecientes al grupo de los tioles, los cuales a altas concentraciones presentan olores sulfurosos 9 desagradables y a bajas concentraciones, olores frutales muy agradables como parchita, naranja y piña [12]. El olor desempeña un papel muy importante en la evaluación sensorial de los alimentos, sin embargo su identificación y las fuentes de las que provienen son muy complejas. Los seres humanos disponen de unos 1000 receptores conocidos que parece ser que distinguen unos 10000 olores distintos, sin embargo, a veces el mecanismo olfativo no funciona adecuadamente y se produce una significativa pérdida de la capacidad olfativa o ausencia total de la facultad de oler, debido a varios factores como son: edad, infecciones virales, alergias, consumo de ciertos fármacos, entre otros. Dicha anomalía se conoce con el nombre de anosmia [8]. En el año 2004, Richard Axel y Linda Back obtuvieron el Premio Nobel de Medicina, por sus descubrimientos que clarifican la forma en que funciona el sistema olfativo. Su publicación en el año 1991 [13] describe la presencia de una familia de 1000 genes distintos (el tres por ciento de los genes humanos) que dan lugar a un número equivalente de distintos tipos de receptores olfativos. Los mencionados autores explican que el epitelio olfativo contiene unos 5 millones de neuronas olfativas que envían mensajes directamente al bulbo olfativo del cerebro. Cuando un olor excita a una neurona, la señal viaja a lo largo del axón de la célula nerviosa y se transfiere a las neuronas del bulbo olfativo. Esta estructura, ubicada en la parte más frontal del cerebro, es el centro de distribución para el sentido del olor. Desde el bulbo olfativo, las señales del olor se retransmiten a la corteza superior del cerebro, que maneja los procesos conscientes del pensamiento, y al sistema límbico, que genera sensaciones emotivas [13]. 1.10. Olfatometría Los estudios por cromatografía con detectores como ionización a la llama (FID) y selectivos de masas, permiten obtener información, principalmente de los 10 compuestos volátiles mayoritarios en la muestra. Sin embargo, hay notas del aroma que no pueden explicarse mediante un cromatograma, y para responder a esta incógnita se realizan los ensayos olfatométricos. Estos se basan en desviar el flujo de salida de la columna hacia un puerto de olor, de forma que puedan ser detectados por un panelista, el cual registra los olores y la intensidad de cada uno de los compuestos luego de eluir de la columna capilar [14] . Dicha detección olfatométrica o sniffing permite determinar el perfil aromático de los alimentos y bebidas a partir del análisis cromatográfico. La fracción de volátiles que constituye el aroma de un alimento consiste en una mezcla de compuestos, en donde solo unos pocos son sensorialmente relevantes [15] . En algunos casos, estos volátiles de impacto se encuentran a nivel de trazas, por lo que la sensibilidad de los detectores instrumentales comúnmente usados (ionización a la llama y espectrometría de masas) es muy baja para registrar su señal. La cromatografía de gases acoplada con olfatometría (GC-O) se convierte en una herramienta analítica invalorable en la investigación de aromas, debido a que se pueden caracterizar y correlacionar los olores de los compuestos simples o mezclas de volátiles con especies químicas. Con este método se aprovecha la alta sensibilidad del olfato humano para la evaluación de olores, ya que teóricamente la nariz humana tiene un límite de detección de 10-19 moles para ciertos compuestos de aroma [16]. El olfatómetro está formado por un panel olfatorio donde un grupo de personas es debidamente entrenado para oler los compuestos separados a la salida de la columna del cromatógrafo [17] . El panel debe hacer un consenso de los descriptores a usar en la descripción de los aromas percibidos, para lo cual se han establecido grupos de clases de olores (Tabla 1.1) presentes en análisis de alimentos y bebidas a partir de la técnica de CG-O, lo cual ayuda al desarrollo del vocabulario del panel [10] 11 Tabla 1.1. Clases de olores y vocabulario para el panel olfatorio en los análisis por CG-O en alimentos y bebidas alcohólicas [18] Clases de olores Vocabulario usado por el panel (Descriptores) Ácido – alcohol Ácido, alcohol, vinagre, ron. Tierra - suelo Champiñones, hongos, corteza de árbol, musgo, aserrín, suelo húmedo. Tostado- torrefacción Bizcocho, torta, pan caliente, chocolate, cacao, café, caramelo, (empireumático) maní tostado, mantequilla de maní, almendra, avellana, madera quemada, carne tostada, ceniza de madera. Frutal – floral Frutas cítricas, naranja, fresa, dulce de fresa, manzana roja, manzana verde, kiwi, cambur, melón, piña, vainilla, melcocha, fruta fermentada, flores, rosas, violetas, lilas. Verde – vegetales Hierbas, hierba recién cortada, hierba mojada, legumbres, zanahoria, papas, lentejas, alcachofas. Lácteo – queso Leche, leche fermentada, crema de leche, yogurt, cuajo, vómito, medias sucias, queso azul, queso emmental, parmesano. Plástico – químico Plástico, caucho, plástico derretido, cinta adhesiva, cloro, detergente, éter, piscina, alcanfor. Sulfuro - gas Azufre, huevo, huevo podrido, repollo, repollo cocido, ajo, coliflor. No clasificado Agradable, desagradable, fresco, cocina, dulce, metal, gel de baño, cremas corporales, etc. 1.11. Detección de compuestos de aroma La detección de los compuestos de aroma va a depender de un parámetro importante como el valor de actividad de aroma, el cual se define como: Ax= cx /ax (ec. 1.1) donde cx es la concentración de un compuesto X en la matriz estudiada, ax el umbral de olor, el cual es la mínima concentración detectada de un compuesto X. Un valor alto de Ax indica una mayor contribución del compuesto en el aroma [19]. 12 La evaluación de los compuestos volátiles en base al valor de aroma provee una información no muy detallada del aporte del compuesto al aroma. La dependencia de la intensidad del olor con la concentración debe ser tomada en cuenta. De acuerdo con la ley de Steven para un estímulo fisiológico: E = k (S – So)n (ec. 1.2) en la cual E= intensidad de percepción, k= constante de proporcionalidad que depende de cada odorante; S= concentración del compuesto de olor, So = umbral de detección del compuesto de olor (en unidades de concentración) y n es la pendiente de intensidad de Steven, la cual es característica para cada compuesto de olor. Esta ley establece que cada compuesto tiene una única función psicofísica (concentración-respuesta) de olor, determinado por el valor de n (Fig. 1.3), por lo que contribuyen con diferentes valores de intensidades a los atributos sensoriales de un alimento [20]. Fig. 1.3. Curvas teóricas dosis – respuesta para 2 compuestos diferentes (A y B); n es la pendiente de la recta [20]. La definición de actividad de aroma no debe confundirse con la relación detallada entre el estímulo y la respuesta descrita por la función psicofísica de dosisrespuesta. Para describir el aroma de un compuesto, se han definido otras propiedades además de la intensidad descrita anteriormente por la ecuación de Steven, tales como la potencia (persistencia de un aroma a las diluciones del medio donde existe) y el carácter (cualidad o descripción) de un olor, los cuales están 13 relacionadas con la función psicofísica, y han sido usadas para discriminar los compuestos de impacto en el aroma del resto de la fracción de volátiles de un producto [21]. 1.5. Características instrumentales de la técnica de GC-O La técnica de cromatografía de gases con detección de olor fue publicada por primera vez en 1964 por George Fuller y colaboradores [20] . Ellos determinaron los componentes de olor de perfumes, para lo cual el detector fue un asesor experto en el área de perfumes, que olía y describía los aromas detectados. La determinación del olor es posible gracias a una persona o panel entrenado, que se encuentra situada en el puerto de olor, conectada en paralelo muchas veces a otro detector convencional, tal como ionización de llama o espectrometría de masas (Fig. 1.4), y de esta manera comparar las señales obtenidas simultáneamente para la caracterización de los analitos eluidos [22]. Fig. 1.4. Esquema del equipo de cromatografía equipado con un detector de olor [22 1.5.1. Puerto de olor El diseño del puerto de olor consiste en una figura cónica de vidrio con el borde en forma de la parte inferior de la nariz, la cual se encuentra al final de la línea de transferencia (Fig.1.4). Esta línea es calentada para prevenir la condensación de 14 analitos semivolátiles en las paredes del capilar. Un gas auxiliar, que suele ser aire humidificado, es conectado al puerto de olor para prevenir la resequedad de las mucosas en las membranas odoríferas de la nariz, ya que esto puede causar incomodidad en el panel, especialmente en análisis de larga duración [22]. 1.5.2. Sistema de detección y generación de la señal El dispositivo electrónico de detección genera una señal analógica, asociada a un aumento lineal en el voltaje, dependiente del tiempo [21] , que se genera al comenzar a detectar el aroma (presionar el botón, tecla, etc.) y finaliza al dejar de percibirlo (soltar el botón), y finalmente la señal decae de forma transiente hasta llegar a voltaje cero o línea base (Fig. 1.5), originando una figura semejante a una gaussiana (señal olfatométrica), y de esta manera se puede correlacionar con el patrón de distribución de los compuestos que migran en una columna cromatográfica, la cual también es del tipo gaussiana. Fig. 1.5. Comparación entre una señal cromatográfica convencional y la señal olfatométrica [23]. Los parámetros generados de la señal olfatométrica (Fig.1.5) son característicos para cada compuesto de olor detectado: tI = tiempo del comienzo del estímulo (detectar un olor característico; floral, herbáceo; etc.). 15 tF = tiempo final del estímulo. tDS = Tiempo de duración del estímulo, calculado mediante la resta de tF y tI. tE = Tiempo de elución olfatométrica, la cual es calculada; tE = tI + ½ tDS y corresponde al máximo de la señal olfatométrica la cual se asume que posee una distribución gaussiana. Las diferencias en los valores de tDS pueden ser relacionadas con la cantidad del compuesto presente, ya que el ancho de la banda cromatográfica puede ser proporcional a la cantidad del odorante [23]. El orden de elución de los compuestos de olor en la columna, el carácter del olor, y la intensidad de olor percibido de un odorante, están directamente influenciados por la intensidad de olor percibido por los compuestos de aroma que eluyen antes y después de éste. Esto se denomina el efecto contraste [21] , y puede ser corregido balanceando el orden de presentación de los odorantes. Esto se logra cambiando algunos parámetros cromatográficos tales como temperatura del horno, presión, gas de arrastre, y usando al menos dos columnas de fases diferentes (no polar, medianamente polar y polar). 1.5.3. Resolución de la señal cromatográfica La resolución (Rs) de una columna cromatográfica constituye una medida cuantitativa de su capacidad para separar dos analitos y está definida por la ecuación: Rs = (¼ (L/H)) (α – 1/ α)( k / k + 1) 1/2 ) (ec. 1.3) Donde L es la longitud de la columna; H es la altura de plato teórico, α es la selectividad que depende de la fase estacionaria y k es el factor de retención promedio de dos picos adyacentes. 16 A partir de la ecuación anterior y para una fase estacionaria dada, la resolución puede mejorarse alargando la columna, aumentando así el número de platos. Una consecuencia negativa del aumento del número de platos es el incremento del tiempo requerido para la separación, por lo que una reducción del diámetro de la columna reduciría la altura del plato teórico sin aumentar el tiempo de corrida cromatográfica [24]. En un estudio del envejecimiento de cerveza por CG-O [21] , se compararon 2 columnas cromatográficas que solo se diferenciaban en sus longitudes para establecer las zonas de aromas características; separación de alta resolución (30 m de largo) y separación de mediana resolución (12 m de largo), concluyéndose que no hubo diferencias en el número y tipo de zonas de olor encontradas en los perfiles de aromas, y el análisis por CG-O por mediana resolución se llevó en la mitad del tiempo que el requerido para el análisis de GC-O de alta resolución. Además del análisis de los compuestos separados en alta y mediana resolución, se realiza el análisis en condición de resolución nula (columna sin fase estacionaria), el cual permite evaluar si la técnica usada para aislar los compuestos volátiles es la más idónea, ya que el evaluador debe percibir una única zona de olor (idealmente), característica al aroma del producto cuando es consumido, lo que se denomina representatividad del aroma en GC-O [25]. 1.6. Condiciones para la detección por olfatometría Para los análisis por olfatometría, los panelistas deben evitar el uso de perfumes o jabones con aromas fuertes, y una o media hora antes deben abstenerse de consumir alimentos y bebidas, para evitar de esta manera posible olores que interfieran con los eluidos en la separación cromatográfica [22.] 17 El laboratorio donde se realizarán los análisis debe estar libre de olores y ruido, evitando posibles fuentes cercanas, debe mantenerse una temperatura constante y mantenerse cerrado durante el tiempo que transcurra el análisis [20] [22]. 1.7. Métodos de tratamientos de datos obtenidos por CG-O Existen varios métodos para el tratamiento en la adquisición de la data obtenida en CG-O, clasificados para determinar la intensidad (OSME), potencia (AADE y Charm) y frecuencia de los olores detectados (FD) y su relativa influencia en el olor de las muestras. Estos métodos se describen a continuación: 1.7.1. Método de frecuencia de detección En este método el panel está conformado de 6 a 12 personas, las cuales analizan la misma muestra. Se cuantifica el número de personas que detecten un compuesto en el mismo tiempo de retención, y luego se clasifican los compuestos más frecuentemente detectados como los de mayor influencia en el olor de la muestra analizada [22]. Los resultados de cada zona de olor detectada por cada panelista bajo las mismas condiciones de CG-O son resumidas en un cromatograma (aromagrama) consenso (Fig. 1.6), en el cual la altura total de pico es el número de veces que la zona de olor fue detectada por el panel, y se define como Frecuencia de Impacto Nasal (FIN). Adicionalmente, el tiempo de duración del estímulo, el cual corresponde al ancho de la zona de aroma, puede ser medido, lo que permite calcular el área de cada pico, denominada Área de Frecuencia de Impacto Nasal (AFIN). El beneficio del método basado en la frecuencia de detección en comparación con los otros métodos olfatométricos es su simplicidad, para lo cual no se requiere un panel evaluador calificado. El método es repetible y los resultados reflejan las diferencias en sensibilidad entre los evaluadores, la cual puede ser relacionada con 18 diferencias que presente la población del panel usado. Este método es el que menos tiempo consume y es el mas fácil de realizar a diferencia del método de dilución de umbral [22]. Figura 1.6. Aromagrama individual y consenso mediante el método de frecuencia de detección, cuando cuatro evaluadores participan en el experimento [22]. Adicionalmente de las frecuencias de las zonas de aromas obtenidas con este método, se ha propuesto usar escalas de 4 puntos para obtener información intensidad del olor percibido ( 0= no detectado, 1= débil, 2= medio y 3= intenso). La señal obtenida es denominada porcentaje de frecuencia modificada (FM), la cual es calculada por la formula propuesta por Dravnieks [26]. FM (%) = (F (%) x I (%))1/2 (ec. 1.4) Donde F es la frecuencia de detección de un olor percibido expresado como porcentaje e I es la intensidad promedio expresada como porcentaje de la intensidad máxima. 1.7.2. Método de dilución de extractos de aroma En estos métodos denominados Análisis de Aroma por Dilución del Extracto (AADE) y Charm Análisis, se evalúa la potencia relativa de olor de los componentes eluidos, con diluciones seriales del extracto de una muestra. Las zonas de aromas en el aromagrama son obtenidas por evaluación olfatométrica de las sucesivas 19 diluciones del extracto inicial hasta una dilución ninguna zona de olor tal que el panelista no perciba [27] . En esta metodología se asume que el valor de dilución obtenido para cada odorante del extracto es proporcional al Valor de Actividad de Olor (VAO) de cada compuesto, de esta manera, mientras más alto sea el valor de dilución al cual el odorante es detectado por olfatometría, mayor será la contribución de dicho compuesto al olor total del alimento. Las diluciones seriales se hacen con el mismo solvente que se preparó el extracto, generalmente diluciones sucesivas 1:2 y 1:3 y se presentan de manera aleatoria al panel evaluador [28]. El método AADE mide la máxima dilución del extracto en la que el olor es percibido y se reporta este valor como el factor de dilución (FD) (Fig. 1.7a). En comparación Charm toma en cuenta la duración del olor percibido y genera un pico cromatográfico, donde el área es expresada adimensionalmente como valores de Charm y los grafica contra los índice de retención (Fig. 1.7b). El valor de Charm puede ser calculado mediante la siguiente formula: c = d n-1 (ec. 1.5) donde n es el número de respuestas coincidentes y d es el factor de dilución . 1.7.3 Método de medición de intensidad olfativa El método de tiempo-intensidad llamado OSME se basa en estimar la magnitud de la intensidad del olor percibido y fue desarrollado por McDaniel y colaboradores [29] . Este método usa una escala estructurada de 16 puntos (15 cm), en la cual los extremos están identificados de la siguiente manera; 0 = no hay ninguna intensidad percibida y 15 = la intensidad extrema [30] y el panelista debe expresar la característica del olor. Cada muestra debe contener 4 réplicas por cada asesor y luego se realiza un aromagrama consenso, denominado Osmegrama (Fig. 1.7d), donde se registran los datos de intensidad de aroma (promedio) y el índice de retención para cada odorante, así como la duración del olor (d). 20 Fig.1. 7. Comparación de resultados obtenidos para 6 compuestos determinados en el mismo extracto mediante CG-O, por diferentes métodos: (a) AEDA, (b) CharmAnalisis, (c) Frecuencia de Detección y (d) Intensidad Directa (OSME) [22]. Una diferencia importante de OSME con los otros métodos descritos anteriormente, es que éste se rige por la teoría psicofísica del olor representada por la ley de Steven [20] , ya que mide la intensidad percibida del olor detectado, a diferencia de los métodos de dilución, en los cuales no se mide la intensidad. La técnica de olfatometría ha aumentado su aplicación en el análisis de diferentes matrices. En la Tabla 1.2 se presenta un cuadro de variadas aplicaciones de esta técnica: 21 Tabla 1.2. Aplicación de métodos olfatométricos en análisis de compuestos volátiles en diferentes matrices de alimentos. Método olfatométrico Referencia Bibliográfica FD 31 (%) FM 32 FD 33 AADE 34 Caracterización del perfil volátil en aceite de pescado AADE 35 Determinación de los compuestos activos de aroma en jamón FD 36 AADE, FD 37 FD 38 Objetivo del estudio Análisis de compuestos activos de olor originados en la fabricación de papel para empaques de alimentos Análisis cuantitativo de la calidad de aromas de vinos tintos españoles Evaluación del aroma de mejillones cocidos durante el proceso de producción Determinación de compuestos activos de aroma en la producción de manzanas Fuji ahumado Bayonne Análisis de la composición aromática de dos especies de hongos Caracterización de los cambios en el aroma de leche materna a -19 ºC FD= frecuencia de detección; %FM= porcentaje de frecuencia modificada; AADE= análisis del aroma por dilución del extracto. 1.8. Métodos de extracción y aislamiento de los compuestos volátiles en alimentos Los aromas son esenciales para la evaluación de la calidad de los productos frescos y procesados. La determinación de los compuestos volátiles es uno de los retos con más dificultad en el análisis de alimentos, debido que es necesario determinar la diversidad de compuestos en bajas concentraciones y de características físico-químicas distintas. Por su condición volátil, el instrumental analítico que se requiere para su detección y separación es un cromatógrafo de gases. Sin embargo, las distintas técnicas propuestas se distinguen por la 22 preparación de la muestra, la extracción, el aislamiento y la concentración de los analitos, etapas previas a la cromatografía de gases, y que repercuten en la reproducibilidad, precisión y sensibilidad. Así el perfil aromático de un alimento está estrechamente relacionado con el procedimiento de aislamiento utilizado, el cual debe ser representativo de la muestra, por lo que se considera un paso crucial en el análisis de los compuestos volátiles. De acuerdo a las propiedades de los odorantes, la preparación puede incluir: extracción con solvente (ES), destilación - extracción simultánea (DES), extracción con fluido supercrítico (EFS), extracción con soxhlet, hidrodestilación asistida con microondas (HDAM), espacio en cabeza (EC), entre otras [39]. La extracción con solvente, hidrodestilación y extracción-destilación simultánea son las técnicas más usadas, sin embargo requieren grandes cantidades de muestras, solventes y en general los tiempos de extracciónson largos. Además, tienen el inconveniente de que las altas temperaturas de trabajo puedan producir la degradación de algunos volátiles y/o la formación de nuevos compuestos [39] . Posteriormente y para minimizar la cantidad de solvente a emplear, se desarrolló la extracción en fase sólida (Solid Phase Extraction SPE), que usa un material adsorbente para extraer compuestos orgánicos de muestras acuosas. Sin embargo, ambas técnicas requieren de una fase posterior de concentración para eliminar el exceso de disolvente, por lo que se limitan a compuestos volátiles y semivolátiles con puntos de ebullición superiores a la temperatura de ebullición del solvente. Las restricciones de la SPE (como múltiples artefactos) se superan al poner una pequeña cantidad de fase sólida en una delgada fibra de sílice fundida, lo que constituye una microextracción que permite mayor rendimiento. La pequeña geometría permite una mayor rapidez de transferencia de masa durante la extracción y desorción térmica directa de los compuestos en los equipos analíticos [40] [41] . 23 1.8.1. Microextracción en Fase Sólida (SPME, Solid Phase Microextraction) En los años 90 Pawliszyn y colaboradores[42] desarrollaron la técnica de microextracción en fase sólida (MEFS) inicialmente usada para la determinación de compuestos clorados en aguas contaminadas. La técnica se basa en la extracción de los analitos de la matriz de la muestra mediante una fibra de sílice fundida de 5 y 10 mm de longitud, recubierta por un adsorbente de 80-100 µm (del orden de 0,5 µL; casi siempre polimérico). El pequeño tamaño de la fibra y su geometría cilíndrica permiten incorporarla en una jeringa. De esta forma se facilita la manipulación y se protege la fibra cuando ésta no se utiliza [43] (Fig. 1.8). Fig. 1.8. Dispositivo de MEFS [43]. Esta técnica de preparación de muestra, extrae y concentra los analitos directamente sobre una fibra cubierta por una fase que incluye un tipo o más de polímeros adsorbentes o absorbentes. El método es rápido, fácil de aplicar, de bajo costo y, a la vez, respetuoso con el medio ambiente, ya que no usa ningún tipo de disolvente orgánico. Se emplea combinado con cromatografía de gases (CG), cromatografía de gases acoplada a espectrometría de masas (CG-EM) y olfatometría (CG-O), entre otros y es aplicado a un amplio rango de compuestos volátiles y semivolátiles en muestras biológicas, ambientales y de alimentos. La MEFS se ha introducido también como técnica acoplada a cromatografía líquida 24 (HPLC) y cromatografía líquido- espectrometría de masas (CL-EM) para analizar compuestos semi volátiles o bien compuestos termolábiles. Las principales ventajas de la técnica de MEFS son: • Gran simplicidad • Bajo costo • Utiliza pequeños volúmenes de muestra • No necesita disolventes orgánicos • Fácilmente transportable • Útil para todo tipo de muestras • Posibilidad de automatización • Permite la concentración de compuestos volátiles y semivolátiles • Bajo límite de detección (del orden de ppt) [43]. Los principales inconvenientes de la técnica de MEFS son: • Limitada capacidad de las fibras debido a que contienen una cantidad de recubrimiento muy pequeña. • La presencia de materia suspendida en la muestra puede dañar el recubrimiento de la fibra durante la agitación por efecto de abrasión. • Los compuestos de elevado peso molecular pueden adsorberse irreversiblemente en la fibra cambiando sus propiedades. • La formación de burbujas de gas en la superficie de la fibra puede afectar a la tasa de transferencia de masa • Pueden aparecer problemas de sensibilidad, ya que depende de la cantidad de analitos extraídos de la muestra; si el volumen de la muestra (Vs) es muy elevado, será muy superior al producto entre la constante de distribución (Kfs) y el volumen de recubrimiento (Vf) de la fibra (Kfs×Vf<<Vs) y, por tanto, aunque se aumente el volumen de muestra no se consigue aumentar la sensibilidad [43]. 25 La MEFS se basa fundamentalmente en la partición de los analitos entre la matriz de la muestra y el recubrimiento de la fibra [44]. Así el transporte de los analitos desde la matriz de la muestra hasta la fibra comienza cuando la fibra entra en contacto con la muestra. La extracción por MEFS se considera completa cuando la concentración del analito alcanza el equilibrio de distribución entre la matriz de la muestra y el recubrimiento de la fibra [45] , lo que en la práctica significa que, una vez llegado al equilibrio, la cantidad extraída es constante y por tanto, será independiente de un incremento del tiempo de extracción. El modelo matemático que explica la dinámica del proceso de absorción cuando la fibra se introduce directamente en la muestra fue desarrollado por Louch en 1992. En este modelo se confirma la relación lineal que existe entre la cantidad de analito absorbida por la fibra en el estado de equilibrio (n) y la concentración de éste en la muestra (Co). Esta relación se muestra en la siguiente ecuación: (ec. 1.6) n= moles de analito absorbido por la fibra Vf= volumen de fibra Vs= volumen de muestra Kfs= coeficiente de partición (constante de distribución) del analito entre fibra/muestra: Kfs= Cf/Cs Co= concentración inicial de analito en la muestra Se asume que la matriz de la muestra es una única fase homogénea y no se considera el efecto del espacio de cabeza ni de las paredes del recipiente. El modelo matemático de MEFS para la extracción de los analitos del espacio de cabeza fue desarrollado posteriormente. Las ecuaciones y conclusiones a las que se llegan son similares a las de la extracción por inmersión, pero teniendo en cuenta una tercera fase gaseosa [44] . La cantidad de analito extraída en el equilibrio, utilizando extracción por espacio en cabeza o inmersión directa, es la misma, siempre que el volumen de muestra y del espacio de cabeza se mantengan 26 constantes. Esto es debido a que la concentración en el equilibrio es independiente de dónde se encuentre la fibra, ya sea en el espacio de cabeza o en la muestra. El modelo matemático que explica la dinámica del proceso de absorción cuando la fibra se expone al espacio de cabeza se ajusta a la siguiente ecuación: (ec. 1.7) n= moles de analito absorbido por la fibra Vf= volumen de fibra Vs= volumen de muestra Vh= volumen de espacio de cabeza Kfs= coeficiente de partición del analito entre fibra/muestra: Kfs=Cf/Cs Khs= coeficiente de partición del analito entre muestra/espacio cabeza: Khs= Ch/Cs Co= concentración inicial de analito en la muestra El proceso de MEFS se puede ver afectado por una serie de variables experimentales que influyen sobre el equilibrio de analito extraído o bien sobre su desorción. Estas variables pueden ser modificadas para incrementar la eficacia del proceso de extracción, pero cualquier modificación de las variables o condiciones experimentales repercute en la cantidad de analito que se determina y, por supuesto, en la reproducibilidad del análisis [43] .Los parámetros que pueden afectar el proceso de absorción/adsorción en la extracción de los analitos son los siguientes: tiempo y temperatura de extracción, pH, volumen de la muestra, agitación, y sales en la muestras (salting out). En general, los procesos de extracción empiezan con la adsorción de los analitos en la interfase fibra/matriz. Posteriormente, los analitos difunden dentro del volumen de la fase extractiva. Si el coeficiente de difusión de los analitos en la fase extractiva es elevado, la partición de los analitos es completa entre las dos fases y 27 se llega a la absorción. Sin embargo, si el coeficiente de difusión es bajo, el analito se mantiene en la interfase y tiene lugar la adsorción. La principal ventaja de la absorción, también llamada partición, es que presenta una isoterma lineal en un amplio rango de concentraciones y las propiedades de la fibra no cambian sustancialmente hasta que la cantidad extraída no llega al 1% del peso de la fase extractiva [41]. Las fibras comerciales se pueden clasificar según el proceso de extracción que se produzca mayoritariamente bien sea por absorción o adsorción (Fig. 1.9), entre las que se encuentran: Polidimetilsiloxano (PDMS), poliacrilato (PA), Carbowax-Divinilbenceno (CW/DVB), Carboxen (CAR) y Divinilbenceno (DVB). Fig. 1.9. Clasificación de las fibras de MEFS según si la extracción se produce por absorción o adsorción. 1.9. El Queso: Generalidades El queso se define como el producto fresco o madurado, en el que la proporción entre las proteínas de suero y la caseína no sea superior a la de la leche, obtenido por la coagulación y separación de suero de leche, nata, leche parcialmente desnatada o por una mezcla de estos productos [46]. La norma COVENIN define al queso como el producto blando, semiduro, duro o extraduro, madurado o no madurado y que puede estar recubierto, donde la 28 proporción entre las proteínas solubles y la caseína no sea superior a la de la leche, obtenido mediante coagulación total o parcial de las siguientes materias primas: leche y /o productos obtenidos de la leche, por efecto del cuajo u otros coagulantes idóneos, y por escurrimiento parcial del suero que se desprende como consecuencia de dicha coagulación [30]. 1.9.1. Composición química y propiedades físico-químicas de la leche de cabra Entre los principales componentes de la leche de cabra se encuentran: agua, glúcidos, lípidos, sustancias nitrogenadas, sales minerales, vitaminas, ácidos orgánicos, enzimas, gases y flora microbiana [48] . Los valores medios de los componentes químicos pertenecientes a las leches de las especies más usadas en la fabricación de quesos (vaca, oveja, cabra) se presentan en la Tabla 1.3. El componente más abundante de la leche es el agua y en ella se encuentran en disolución, las sales y los azúcares; las proteínas, en su mayor parte en estado coloidal, y la materia grasa en emulsión. El conjunto de los componentes no acuosos y gaseosos de la leche constituye el extracto seco de la leche (ES). El contenido en extracto seco es uno de los factores que más influyen en las características de la leche para hacer queso y dentro de él la materia seca útil (MSU=Grasa+Proteína). Dicho extracto seco varía según la raza, individuo, periodo de lactancia y la especie del mamífero. Si al extracto seco se le resta el contenido en grasa de la leche, se obtiene el extracto seco magro o desengrasado (ESM o ESD), que es un valor más constante y más representativo [30] . 29 Tabla 1.3. Composición media de la leche de vaca, oveja y cabra expresada por 100 g de leche [30]. Componentes Agua Glúcidos (lactosa) Lípidos Sust. Nitrogenadas *Caseínas *Proteínas del suero *Nitrógeno no proteico Unidad Minerales Na K Ca Mg P mg Fe Cu Zn Las g µg propiedades Vaca 87,70 4,70 3,60 3,30 2,70 0,42 Oveja 81,69 4,27 7,51 5,62 4,30 1,05 Cabra 87,1 4,60 4,30 3,30 2,47 0,56 0,18 0,27 0,27 50 150 120 12 95 48 121 186 18 127 40 180 130 20 110 0,40 0,22 4,19 0,76 0,31 6,88 0,40 0,50 3,50 la de físico-químicas de leche cabra son consecuencia de su composición y estructura. Como existen variaciones en cuanto a la composición química entre las leches de vaca, oveja y cabra, tambien se observan diferencias en sus propiedades fisico-químicas . En la Tabla 1.4 se puede apreciar que los valores del índice de refracción, punto de congelación, acidez y viscosidad son superiores en la leche de oveja. El pH es muy similar en las tres leches [30]. Tabla 1.4. Propiedades físico-químicas de diferentes leches [30]. Propiedad Leche de vaca Leche de oveja Densidad a 20 °C (g/mL) Viscosidad ( mPa.s) Tensión superficial (N/m) 1,0270-1,0320 1,236 50 1,0340-1,0350 2,936 49,9 1,0260-1,0420 1,186 52 1,3440-1,3485 -0,55 0,15-0,18 6,50-6,70 1,3490 -0,583 0,18-0,22 6,60-6,68 1,3454-1,4548 -0,570 0,16-0,18 6,50-6,80 20 Índice de refracción (N0 ) Temperatura de congelación (°C) Acidez (% ácido láctico) pH Leche de cabra 30 1.9.1.1. Papel de los diferentes componentes de la leche en la calidad del Queso A continuación se presentan los diferentes componentes presentes en la leche, los cuales son los responsables de la calidad del queso: • Agua: favorece el crecimiento microbiano y por lo tanto la maduración; afecta la textura, el rendimiento e influye en la vida comercial. • Grasa: aporta textura, sabor, rendimiento y color de los quesos. • Lactosa: influye en el desuerado, textura, sabor y maduración. • Caseína: contribuye en el rendimiento, sabor y olor de los quesos. • Proteínas del Suero: aporta valor nutritivo y la maduración. Pueden afectar la coagulación. • Minerales: participan en la coagulación, influyen en el desuerado y textura de la cuajada [47] 1.9.4. Principios para la Elaboración de Quesos La fabricación del queso tiene como principio la concentración de la caseína y grasa en un factor de 6 a 12, según la variedad. En la producción tradicional, esta concentración se consigue por coagulación de la caseína, que forma un gel donde queda retenida la grasa. Las caseínas son un grupo de proteínas que contienen fósforo y son específicas de la leche, que se encuentran casi siempre en forma de micelas y precipitan a un pH de 4,6. Se conocen seis tipos de caseínas: a s1 (alfa s1), a s2 (alfa s2), b (beta), g (gamma), k (kappa) y l (lambda). La caseína k tiene propiedades físico-químicas únicas, si se compara con las otras proteínas de la leche. Algunas de estas propiedades son: insensibilidad a precipitación por iones calcio, por lo que se mantiene soluble en soluciones de calcio con concentraciones que precipitan a todas las demás caseínas; efecto estabilizador sobre las otras caseínas cuando el calcio está presente en la suspensión; sufren hidrólisis por quimosina en un enlace peptídico específico, lo que resulta en la desestabilización 31 de las micelas y la formación de precipitados; además, es la única de las caseínas que contiene residuos de cisteína y glúcidos en su estructura [49]. La caseína aparece en la leche en forma de sal cálcica. La estructura del caseinato de calcio es bastante compleja. En realidad las caseínas alfa y beta no son solubles en la leche en presencia del calcio (el grupo fosfato es muy insoluble en presencia de calcio). Sin embargo si se añade caseína k, el conjunto se solubiliza al formar una estructura para la que se postula la siguiente forma: Las tres fracciones se disponen formando submicelas (Fig. 1.10) (caseína dispuesta en forma de balón de rugby). Fig. 1.10. Esquema propuesto para la micela del caseinato de calcio en la leche [49]. La caseína se dispone de manera que interacciona por su parte hidrófoba (hacia dentro de la micela) quedando la parte hidrófila hacia fuera. Normalmente habrá entre 25 y 30 caseínas por submicela. La caseína k no tiene menos fosfato pero tiene carácter hidrófilo debido a la presencia de trisacáridos (azúcares de 3 monómeros) y también tienen en el extremo hidrófilo una alta proporción de grupos carbonilos (grupos ácidos de aminoácidos como el glutámico o el aspártico) [50] . Las submicelas se unen unas con otras y se forman las micelas gracias a la formación de fosfato cálcico por la presencia de los grupos fosfato y de calcio disuelto en la leche. La caseína puede ser coagulada y precipitada para dar productos como queso, yogur, cuajada, nata o leche agrias y otros derivados. Los procedimientos para precipitar la caseína son dos: acidificación que protona los grupos fosfato (y otros) que solubilizan a la caseína k y por acción de un enzima llamado cuajo animal 32 (rennet) que descompone un pequeño trozo de la caseína k precipitando la micela completa. En la precipitación por el uso del cuajo animal se produce una hidrólisis enzimática de las caseínas. El proceso es más lento ya que la enzima tarda varios minutos u horas en hacer efecto. En el cuajo se usan enzimas en forma de caldo (Cynara cardunculus). Esta quimosina es específica de la caseína K y logra romper la caseína K se rompe en sus dos partes: La hidrófila y la hidrófoba (para-Kcaseína). Como el péptido era la parte hidrófila donde estaban los grupos ácidos, ahora se pierden y ya no se repelen las micelas, precipitando las caseínas. La parte hidrófoba al mantener los enlaces fosfatos, forma el coágulo y precipitando el caseinato. El proceso puede representarse de la siguiente manera [50]: (ec.1.8) El gel de la caseína se corta o se rompe y se contrae (sinéresis), para liberar el lactosuero, que contiene principalmente proteínas solubles, la lactosa y una parte de los componentes salinos. La sinéresis depende fundamentalmente de la temperatura, pH, agitación, concentración proteica y de los iones calcio. Durante la fabricación se establecen estos parámetros a fin de controlar el contenido en humedad de la cuajada y así de los diferentes futuros quesos [49]. Un tipo de coagulación especialmente extendido en la fabricación de quesos de cabra es la coagulación mixta (ácida/enzimática) que suele realizarse con concentraciones elevadas de fermentos lácticos y muy diluidas de cuajo, así como a temperatura baja (20°C), muy inferior a la óptima de crecimiento de microorganismos y de la actividad enzimática. El tiempo de obtención de cuajadas por esta vía es muy largo, de 8 a 22 horas, con poca producción de desuerado. El producto así obtenido tiene unas características reológicas intermedias entre la cuajada ácida y la enzimática y se utiliza para la obtención de quesos de pasta blanda [51]. Los procesos consecutivos a la formación de la cuajada depende del tipo de queso a fabricar, si es 33 un queso de grano fino el proceso de removido y cortado será rápido para evitar un alto porcentaje de nucleación de la cuajada para luego realizar el moldeado y prensado, si es un queso de alto grado de maduración los procesos bioquímicos (proteólisis, lipólisis y glucólisis) tendrán un tiempo de acción más prolongado (Fig.1.11) [52]. Fig. 1.11. Esquema general de elaboración de queso [52]. 1.10. Cambios bioquímicos durante el procesado y maduración del queso de cabra Durante la maduración del queso intervienen numerosos fenómenos bioquímicos (Tabla 1.5) como la glucólisis, lipólisis y proteólisis, esta última especialmente importante en el queso de cabra, que se traduce en una digestión enzimática de los constituyentes de la cuajada, reacciones que le confieren características nuevas modificando su composición, su aspecto y su textura, desarrollando el sabor y la formación de compuestos aromáticos se lleva a cabo por la acción enzimática de varios agentes: [51] . La maduración 34 • La quimosina o la enzima coagulante empleada. • Las enzimas endo y exocelulares producidas por los microorganismos presentes. • Las enzimas propias de la leche [49]. Tabla 1.5. Diferentes procesos en la maduración enzimática del queso fresco [48]. PRÓTEOLISIS LIPÓLISIS GLUCÓLISIS ENZIMAS MICROBIANAS LIPASAS BACTERIAS LÁCTICAS CASEINA GRASAS PROTEOSAS PEPTONAS TRIGLICÉRIDOS PEPTIDOS DIGLICÉRIDOS LACTOSA ÁCIDO LACTICO AMINOACIDOS AMINAS CETOACIDOS AMONIACO ALDEHÍDOS MONOGLICÉRIDOS ÀCIDOS GRASOS LIBRES ÁCIDO PROPIONICO Y ACETICO •AROMA CARACTERíSTICOS Y DEFECTOS •ASPECTO DE LA PASTA (OJOS DEL QUESO) ALCOHOLES •ABLANDAMIENTO DE LA TEXTURA •INCREMENTO DEL pH •CONTRIBUCIÒN AL SABOR 1.10.1. Glucólisis. La glucólisis es el principal proceso bioquímico en la fabricación de muchas variedades de quesos, el cual se basa en la fermentación de lactosa residual (≈98% se pierde en el lactosuero) en ácido láctico, producida por las bacterias lácticas del fermento añadido o bien por la flora natural de la leche fabricados con leche cruda [53] . Las bacterias ácidos lácticas realizan un proceso homofermentativo, obteniéndose un 85-95% de ácido láctico y por un proceso heterofermentativo, en el que se obtiene un 50% de ácido láctico, además de ácido acético, succínico, 35 fórmico, anhídrido carbónico, alcohol etílico, acetona, diacetilo, y otros productos volátiles. El ácido láctico es la base para los restantes procesos bioquímicos de la maduración; además el carácter ácido que da al medio inhibe el crecimiento de determinadas bacterias indeseables y favorece el buen desarrollo de la microflora importante para la maduración. Los productos resultantes de su crecimiento serán los responsables en parte de los cambios en la apariencia, textura, olor, gusto y aroma del queso [53] 1.10.2. Lipólisis En el queso de cabra los ácidos grasos libres pueden provenir de los presentes en la leche recién ordeñada y/o como consecuencia de la lipólisis (hidrólisis enzimática de los glicéridos neutros y/o lípidos) que ha podido sufrir la materia grasa mientras estaba en la leche o posteriormente en el queso. Como resultado de la hidrólisis de los triglicéridos (glicéridos que más abundan en la grasa de la leche), se obtendrá por cada molécula de triglicérido una molécula de glicerol y tres ácidos grasos libres, aumentando así su contenido en ácidos grasos [52]. Los lípidos forman entre el 3,50 a 5,25 % de la leche, variando entre razas de bovinos y de acuerdo a la nutrición. La grasa se encuentra presente en la leche como pequeños glóbulos en suspensión en el agua; el tamaño de los glóbulos es también una característica de la raza (típicamente es 3 µm o 1000 por mililitro). A medida que la lactancia progresa, el tamaño de los glóbulos de grasa tiende a decrecer. Cada glóbulo se encuentra rodeado por una capa de fosfolípidos, que tienden a impedir que se unan entre sí repeliendo a los otros glóbulos y atrayendo agua. Siempre que esta estructura se mantenga intacta, la grasa de la leche permanece como una emulsión [48]. Las proporciones de ácidos grasos de diferente longitud determinan el punto de fusión de la grasa y pueden variar con la alimentación que el animal está recibiendo. La leche caprina contiene una baja cantidad de ácidos grasos de cadena 36 media (4-10 carbonos). Estos incluyen algunos como ácido butanoico (butírico) y ácido octanoico (caprílico), que son los responsables de su sabor característico [48] . Los ácidos grasos de cadena larga de la leche son principalmente insaturados (18 átomos de carbono), siendo el oleico el predominante. Entre los poliinsaturados están el linoleico y linolénico. Los dos últimos ácidos grasos son componentes importantes de la leche ya que el cuerpo no puede sintetizarlos y deben provenir de la dieta. Un porcentaje muy pequeño (menos del 2%) de la grasa se encuentra en la forma de ácido graso saturado, como el ácido palmítico (cadena de 16 carbonos) [53]. Los agentes responsables de la lipólisis son las lipasas propias de la leche cruda, las del coagulante (esterasas pregástrica), las bacterias y las de las levaduras y mohos. La acción de hidrólisis de estas enzimas suele producirse de modo selectivo y escalonado, por ejemplo, la lipasa de la leche actúa preferentemente sobre los ácidos grasos que ocupan las posiciones 1 y 3 de la molécula de glicerol de los triglicéridos. Esto lleva a que se formen diglicéridos 1,2 y 2,3, los cuales también sufren la lipólisis y se formarán monoglicéridos; se obtendrán predominantemente acilgliceridos [54]. El papel principal de la lipólisis, aun en los quesos en que ésta es pequeña, es el de formar compuestos (ácidos grasos y sus productos derivados) que contribuyan a formar el conjunto olfato-gustativo, siendo los ácidos grasos de cadena corta (hasta 12 átomos de carbono), los de más influencia [53]. 1.10.3. Proteólisis. La proteólisis, proceso mediante el cual la caseína se hidroliza a compuestos de menor peso molecular como péptidos y aminoácidos libres, es uno de los fenómenos más importantes que tienen lugar durante la maduración de muchos tipos de quesos, pues contribuye tanto a la textura como al aroma y sabor del producto terminado. 37 Los fenómenos proteolíticos pueden dividirse en proteólisis primaria y secundaria. La proteólisis primaria corresponde a la hidrólisis de las caseínas, liberando péptidos de distintos tamaños. Como resultado de la acción del cuajo (quimosina y pepsina) de las proteasas nativas de la leche (plasmina) y en menor medida de las proteasas de las bacterias lácticas del fermento. La proteólisis secundaria convierte estos péptidos en aminoácidos libres, y estos sirven de substrato para la producción de otras sustancias sápidas como aminas, tioles y tioésteres. Los microorganismos del queso son los principales responsables de la proteólisis secundaria, tanto bacterias lácticas como mohos y levaduras [54]. Entre las aminas formadas, podemos encontrar: putrescina, cadaverina, histamina, taurina, asparagina, glutamina y triptamina. En la proteólisis también se originan compuestos responsables de características sensoriales no deseadas como aminoácidos que imparten amargor, cuyo nivel puede superar el umbral de percepción sensorial del gusto amargo. Dichos aminoácidos son: Leucina, Glicocola, Leucina, Tirosina, Alanina, Triptófano, Fenilalanina, Lisina, Arginina, Valina y Prolina [55]. La proteólisis influye en la textura del queso debido a la rotura de la malla proteica, al incremento de pH por formación de NH3 y a la mayor capacidad de retener agua por los grupos aminos y carboxilos formados. La formación de péptidos de pequeño tamaño molecular y aminoácidos influye directamente en el sabor básico (dulce, ácido, amargo y salado) del queso. Además, los aminoácidos son precursores de otros compuestos responsables del aroma [54] . 1.11. Producción de la leche caprina en Venezuela Se estima que la población caprina en América es de 39 millones de cabezas, de las cuales el 57% está localizado en América Latina. Venezuela tiene una población estimada de 1.320.00 caprinos (FAO, 2005), constituyéndose en el cuarto país de América Latina en población de estos animales. Esto probablemente se 38 debe a que los sistemas de producción caprina se adaptan bien a las zonas de vida áridas y semiáridas, por lo cual tienen un nicho ecológico natural abundante en Venezuela. En el país existe una superficie de 41.023 km2 de estos ecosistemas, lo cual representa el 4,75 % del territorio nacional, enmarcado básicamente en los estados Lara, Falcón, y Zulia, pero con la característica principal de que el 94 % de las explotaciones son del tipo extensivo – tradicionales, con producciones de leche muy bajas, básicamente para el autoconsumo [52]. Estos sistemas de producción se caracterizan por la utilización de cabras principalmente del tipo Criollo, ausencia de prácticas racionales de manejo de los rebaños, con pastoreo en vegetación natural, muy baja productividad de los rebaños, de 200 a 250 g de leche por día, en lactancias que no sobrepasan 100 días, propios de la zona semiáridas [52] . Sin embargo, aunque la mayoría de las explotaciones de caprinos en Venezuela son de tipo extensivo, esta especie tiene un gran potencial productivo y social en la población, ya que aparte de poder utilizar ecosistemas no útiles para otras especies domésticas, tiene la posibilidad de tener un mayor número de animales por unidad de área que otras especies, un corto intervalo generacional y una elevada prolificidad, además del valor agregado de los productos derivados (principalmente queso) y adicionalmente la leche de cabra es mucho más digerible para los pacientes que no toleran la leche de vaca por alergias a sus proteínas o el tamaño de sus glóbulos de grasa [56] , todo lo cual hace que la explotación de esta especie sea altamente rentable y sus productos derivados sean muy apreciados. La producción cuantitativa y cualitativa de leche de cabra depende de muchos factores. Estos factores pueden ser agrupados en intrínsecos del animal (genética, raza, nivel de producción, estado de lactancia, estado fisiológico) y extrínsecos (estación, temperatura, prácticas de manejo, sistema de ordeño, alimentación, estado de salud, duración del periodo seco) [52]. 39 1.11.1. Estado de lactancia de la cabra El estado de la lactancia de un animal es el tiempo que dura la producción de leche después del parto, determina diferentes niveles productivos caracterizados en tres fases. Estas fases son independientes del genotipo animal, sin embargo, factores básicamente de manejo, alimentación y/o sanidad pueden incidir negativamente sobre la ocurrencia de la misma en su forma característica, y éstos afectarán indudablemente la producción total de la leche de la cabra [57] Las fases señaladas anteriormente son: Ascenso: es la primera etapa después del parto, se caracteriza por un incremento progresivo en el nivel productivo (kg leche/día), el cual se debe a la conjunción de algunos factores, tales como: aumento en el número de células alveolares, descongestionamiento de la glándula mamaria y reducción del edema preparto. Factores como la condición corporal al parto, el ordeño a fondo y la alimentación pueden modificar significativamente los cambios durante esta fase. La adecuada condición corporal permite que el animal utilice sus propias reservas alimenticias para promover la síntesis láctea, debido a que la transformación de los nutrientes que vienen por vía de los alimentos es más lenta de lo que el animal requiere. Cúspide o nivel máximo: es una fase muy breve donde la producción se encuentra estabilizada en su nivel máximo. Esta fase es consecuencia y dependiente de la anterior. La alimentación es quizá el factor de manejo más importante en ella debido a su influencia sobre la disponibilidad de nutrientes para la síntesis láctea, especialmente energía. Descenso o declive: comprende la disminución progresiva de la producción de leche, hasta hacerse prácticamente cero, en esta fase el contenido graso en la leche aumenta ya que la cabra se comienza a preparar para el periodo seco y un futuro parto e iniciar luego un nuevo período de producción láctea. 40 La lactancia no sólo es variable en cuanto al nivel de producción de leche que se produce sino en cuanto a los componentes que conforman la leche en cada fase. La variación en los componentes de la leche depende de la naturaleza del mismo, ya que cada uno se comporta de forma diferente. El contenido de grasa es el que más varía, se ha observado que a mayor nivel de producción de leche menor es el contenido de grasa y viceversa. La fracción proteica exhibe un comportamiento similar al de la grasa pero menos acentuado [59]. A medida que aumenta la lactancia, aumenta el contenido porcentual de grasa, proteína, caseína, minerales, sólidos totales, sólidos no grasos, sodio, calcio, fósforo, magnesio y acidez titulable, mientras que el contenido de lactosa, potasio y citrato disminuyen significativamente como se observa en Tabla 1.6 [58]. Al final de la etapa de producción de leche se requiere un tiempo mínimo de descanso para las cabras (periodo seco) de 45-50 días entre lactancia, para obtener una óptima producción de leche en el próximo periodo de producción. Se han reportado que periodos muy cortos o muy largos reducen la producción de leche en la lactancia subsiguiente [59]. Se necesita un promedio de 34 días de periodo seco, o de descanso productivo, para que el tejido glandular de la ubre sufra un proceso de involución y posterior regeneración de un nuevo tejido mamario que garantice una próxima lactancia adecuada. Un mayor número de días secos (> 60 días) también determina reducción de la producción de la próxima lactancia, pues hay degeneración del sistema de conductos [60]. 41 Tabla 1.6. Efecto del estado de lactancia sobre la composición de la leche en 42 cabras de la raza Alpina [58]. S e m a n a s d e l a c ta n c ia C o m p o s i c ió n e n la le c h e 8 -1 2 1 7 -2 1 2 6 -3 0 3 5 -3 8 3 9 -4 2 G ra s a (% ) 3 ,3 4 2 ,9 3 3 ,1 5 4,10 4,58 P ro te ín a (% ) 2 ,7 9 2 ,9 5 3 ,3 2 3,91 4,25 C aseína ( % ) 2 ,1 1 2 ,1 7 2 ,4 0 2,87 3,15 L a c to s a (% ) 4 ,4 6 4 ,4 2 4 ,3 5 4,08 3,96 M in e ra le s (% ) 0 ,7 2 0 ,7 8 0 ,8 0 0,82 0,84 S ó lid o s t o ta le s (% ) 11,17 10,98 1 1 ,5 4 12 ,7 8 1 3 ,4 7 S ó lid o s n o g ra s o s (% ) 7 ,8 3 8 ,0 5 8 ,3 9 8,68 8,89 pH 6 ,5 8 6 ,6 1 6 ,5 7 6,54 6,52 A c id e z tit u la b le 16,60 16,30 1 6 ,6 5 17 ,3 8 1 7 ,4 4 D e n s id a d 1,031 1,030 1,030 1 ,0 2 8 1,027 N a (m g /1 0 0 g ) 50,20 52,20 5 4 ,0 0 54 ,7 5 5 5 ,5 0 K (m g / 1 0 0 g ) 1 7 0 ,4 0 166,00 155,20 1 4 6 ,7 5 1 44 ,5 0 Na / K 0 ,2 9 0 ,3 1 0 ,3 5 0,37 0,39 C a (m g /1 0 0 g ) 1 3 4 ,5 1 135,80 139,75 1 4 5 ,4 0 1 49 ,5 0 P (m g / 1 0 0 g ) 99,44 104,20 112,40 1 1 7 ,2 5 1 21 ,5 0 Ca / P 1 ,3 6 1 ,3 0 1 ,2 4 1,24 1,23 M g ( m g /1 00 g) 12,85 13,08 1 3 ,5 0 14 ,3 0 1 4 ,8 7 C itra to (m g /1 0 0 g ) 1 4 5 ,4 2 114,50 9 9 ,6 4 88 ,2 3 8 1 ,1 7 En Venezuela existe un número creciente de rebaños que son manejados de manera tecnificada. Estos están conformados principalmente por animales mestizos obtenidos de los cruzamientos de las razas Alpina Francés, Nubia, Saanen y Toggenburg con Criollo [64] y más recientemente por animales mestizos de la raza Canaria obtenidos de la utilización de machos principalmente del tipo Majorero introducidos al país por un grupo de productores de origen español en cruzamiento con la base mestiza existente. Como lo señalan Dickson y colaboradores [64] , los resultados preliminares de este mestizaje han sido bastante halagadores, hecho que les ha otorgado una gran popularidad para la producción quesera, con un promedio de duración de lactancia de 192,4±37,7 días [64]. 42 1.12. Compuestos responsables del aroma y sabor en los quesos de cabra. A los componentes particularmente responsables del aroma característicos de un alimento se les denomina compuesto de impacto (caracter impact compound), y de acuerdo con la presencia de estas sustancias claves, se distinguen cuatro grupos [19] : • Grupo I: el aroma es debido de modo decisivo a un solo compuesto. La presencia de otras sustancias aromáticas sólo sirve para matizar el aroma característico que se percibe del alimento. • Grupo II: varios compuestos, de los cuales uno juega un papel principal. Crean o determinan el aroma típico del alimento. • Grupo III: el aroma sólo puede reproducirse con gran fidelidad gracias a un gran número de compuestos. Ordinariamente no está descrito ningún compuesto de impacto. • Grupo IV: el aroma del alimento no se puede reproducir fielmente, ni utilizando gran número de compuestos volátiles. El estudio de los compuestos volátiles responsables del aroma en los alimentos ha tenido una importante atención en los últimos años por su representatividad de la calidad de los productos. Mas de 600 compuestos volátiles han sido identificados en quesos [55] , sin embargo solo una pequeña fracción de estos compuestos es reportada en la literatura como responsables del aroma y sabor de estos productos. Las familias de compuestos químicos reportados en la literatura como responsables de los aromas en los quesos están conformadas por compuestos neutros, alcalinos y ácidos. Entre estos compuestos se tiene: 43 1.12.1. Compuestos Neutros 1.12.1.1. Alcoholes. Se han propuesto diferentes vías metabólicas en la biosíntesis de los alcoholes presentes en los quesos: metabolismos de la lactosa y amino ácidos, reducción de metil cetonas y la degradación de los ácidos linoleico y linolénico [66]. Los ácidos linoleico y linolénico son los precursores de compuestos de aroma de ocho carbonos, produciendo el 3-octen-1-ol, el cual es el alcohol más comúnmente encontrado en muchos tipos de quesos como compuesto de impacto. En los quesos de cabra españoles se ha identificado el feniletanol y el 3octen-1-ol con aromas a rosas y champiñones respectivamente como compuestos importantes característicos para este tipo de queso [67]. 1.12.1.2. Aldehídos. Los aldehídos se originan de los aminoácidos y ácidos grasos, aunque son compuestos transitorios en los quesos ya que son rápidamente reducidos a alcoholes primarios u oxidados a sus correspondientes ácidos. Los aldehídos de cadenas lineales, tales como n-butanal, n-pentanal, nhexanal y n-nonanal son compuestos comúnmente considerados en el aroma de los quesos y presentan olores característicos a grama y herbáceos pero si las concentraciones presentes exceden sus umbrales, pueden afectar la calidad aromática produciendo olores desagradables [67]. 44 1.12.1.3. Cetonas. Las cetonas son constituyentes comunes de muchos productos derivados de leche. A causa de sus típicos aromas y bajo umbral de percepción, las cetonas y especialmente las metil cetonas, son conocidas principalmente por su contribución al aroma de los quesos madurados. La síntesis de estos compuestos está relacionada a la actividad enzimática presente en la maduración. Entre los microorganismos identificados como productores de cetonas en los procesos de proteólisis se tienen al Penicillium roqueforti, Penicillium caseicolum y Geotrichum candidum [50]. Los aromas a frutas, flores y moho son asociados a metil cetonas tales como; 2-octanona, 2-nonanona, 2-decanona y 2-undecanona y una de las más importantes dicetonas es la 2,3-butanodiona (diacetilo), ya que este compuesto volátil es muy apreciado por su aroma característico a mantequilla [67]. 1.12.1.4. Ésteres. Los ésteres son los compuestos volátiles más comúnmente encontrados en los quesos. Su producción es atribuida a las reacciones de esterificación entre ácidos grasos de cadenas cortas y medianas y alcoholes primarios y secundarios derivados de la fermentación de la lactosa o del catabolismo de aminoácidos [69]. La mayoría de los ésteres encontrados en queso presentan notas aromáticas a frutas, caramelos y flores. Especialmente los etil ésteres son conocidos por su importante rol en la formación del carácter frutal en quesos. En los quesos de cabra españoles se han reportado el hexanoato de etilo y el butirato de etilo como ésteres que originan aromas a moho y a manzanas [70]. 45 1.12.1.5. Lactonas. La hidrólisis de los triglicéridos seguido por una ciclación es la vía de formación que se ha propuesto para la formación de lactonas en los quesos. Las lactonas están generalmente asociadas con descriptores de aroma tales como coco, albaricoque, melocotón, siendo la δ-decalactona una de las más importantes reportadas en quesos. En quesos de cabra españoles se han reportado las δ-octalactona y δdodecalactona, como responsables de aromas a frutas, queso y coco [70]. 1.12.1.6. Furanos. Los furanos están presentes en muchas frutas y alimentos procesados y son conocidos por sus fuertes sabores y olores, y a causa esta propiedad son sintetizados a escala industrial y son ampliamente usados como saborizantes en alimentos y bebidas. Sin embargo, se conoce muy poco sobre estos compuestos en el sabor y olor del queso. Entre los furanos reportados con una fuerte influencia en el aroma del queso se encuentra el 4-hidroxi-2,5-dimetil-3(2H)-furanona (furaneol) y 5etil-4-hidroxi-2-metil-3(2H)-furanona (homofuraneol), con aromas a caramelo, azúcar y ahumado [67]. 1.12.2. Compuestos Alcalinos 1.12.2.1. Pirazinas. Las pirazinas han sido reportadas como importantes compuestos que contribuyen al sabor y aroma en los quesos. Una vía de formación, es a partir de los 46 aminoácidos presentes. Entre estos compuestos se destacan 2-etil-3,5- dimetilpirazina, 2-isopropil-3-metoxipirazina y 2,3-dietil-5-metilpirazina, con aromas a tierra, suelo, papas fritas y moho [71]. 1.12.2.2. Compuestos azufrados. Los compuestos azufrados esencialmente se originan de la degradación de la metionina (aminoácido). Estos compuestos son responsables de los fuertes aromas a queso madurado y ajo. El 3-metiltiopropanal (metional) es el compuesto más común reportado en quesos, el cual aporta aroma a papas cocidas [67]. 1.12.2.3. Terpenos Los terpenos son compuestos característicos de quesos que se producen a partir de un proceso artesanal. Estos compuestos provienen del pasto que consume el animal, siendo transferido luego a la leche y finalmente al queso, por lo que son importantes marcadores para determinar el origen geográfico del tipo de queso fabricado. Entre los terpenos frecuentemente identificados se encuentra el α-pineno y el linalool, que aportan aromas a madera y pino [72] 1.12.3. Compuestos Acídicos 1.12.3.1. Compuestos fenólicos. Estos compuestos son producidos por la acción de levaduras sobre la tirosina (aminoácidos). Entre los más importantes reportados se encuentran el 4-metilanisol, 2-metoxifenol (guayacol) y 4-metilfenol (p-cresol), los cuales aportan a la calidad 47 sensorial de los quesos notas de aromas a moho, queso, especias, ahumado, vainilla, medicinal y mantequilloso [67]. 1.12.3.2. Ácidos grasos libres (AGL). Los ácidos grasos libres son muy importantes en el sabor y aroma de los quesos, ya que son predominantes en su composición. Estos compuestos no solo aportan aromas por sí mismos, sino que también son precursores de metil cetonas, alcoholes, lactonas y ésteres [66]. En general las cadenas largas de ácidos grasos (> 12 átomos de carbonos) juegan un rol minoritario en el aroma y sabor, ya que poseen un alto umbral de percepción. Las cadenas más cortas de 4 a 12 carbonos poseen umbrales más bajos y son los que contribuyen más a los aromas característicos de estos compuestos. Desde el punto de vista sensorial, los ácidos nonanoico, 4-etiloctanoico, hexanoico (caproico), octanoico (caprílico), decanoico (cáprico), y butírico son los principales contribuyentes al aroma y sabor en quesos de cabra europeos, los cuales aportan el aroma característico de la piel de las cabras [67] [73] . 1.13. Importancia de los AGL en queso de cabra. Los quesos fabricados de leche de cabra son muy apreciados por sus particulares características organolépticas. La lipólisis juega un rol esencial en las propiedades sensoriales de los quesos, algunos ácidos grasos libres (AGL) han demostrado contribuir directamente al aroma de muchos tipos de quesos, o indirectamente como precursores de otros compuestos de aroma. Los ácidos grasos hexanoico, octanoico y decanoico han sido considerados responsables del aroma característico del queso de cabra, dando lugar a sus nombres más conocidos como 48 lo son, ácidos caproico, caprílico y cáprico, respectivamente. Adicionalmente, ciertos ácidos grasos libres no lineales contribuyen por sí mismos al sabor y aroma cabral del queso [74] [75] [76]. En el queso de cabra, el aroma es el principal atributo sensorial evaluado para su calidad comercial, y los compuestos responsables de su olor característico son atribuidos a los AGL. En un estudio realizado por Condurso y colaboradores en 2008 [99] , se cuantificaron mediante adición de estándar los AGL presentes en queso de cabra, fabricado de manera artesanal en un periodo de almacenaje de 0 a 21 días a 4°C, para evaluar la variación en sus en el tiempo (Tabla 1.7) y determinar su influencia en la aceptación comercial. No se encontraron diferencias significativas de las concentraciones de los AGL entre los días 0 al 15 y no hubo rechazo al ser evaluado sensorialmente, pero el queso fue rechazado en el estudio de calidad en el día 21, ya que se obtuvieron valores de concentraciones superiores a las determinadas anteriormente, concluyendo que el queso de cabra estudiado presenta un máximo de 15 días de vida útil. Tabla 1.7. Variación en la concentración de AGL (mg/100g) en muestras de queso de cabra almacenados a 4°C[99]. Días de almacenamiento AG L 0 7 15 21 Ácético 32,5 a 37,3a 35,6 a 44,2b Butanoico 18,1 a 22,5a 17,6 a 39,1b Hexanoico 9,6a 9,8 a 9,7a 12,5b Octanoico 17,8 a 15,9a 16,5 a 29,4b Decanoico 13,0 a 13,2a 13,7 a 25,2b Decenoico 7,8a 9,8 a 7,3a 12,9b Dodecanoico 10,7 a 14,4a 9,0a 41,7b Tetradecanoico 8,8a 7,4 a 11,2 a 29,5b Total 118,3 130,3 120,6 234,5 El análisis fue realizado por triplicado. Diferentes letras en una fila indican diferencias significativas en las concentraciones (p<0,05); AGL=ácidos grasos libres 49 La determinación de los AGL en quesos son usados como marcadores en los análisis de caracterización de sus perfiles aromáticos y su variabilidad en el tiempo, comparación de quesos artesanales e industriales [77] [73] , asignación de origen y un parámetro importante de estudio enfocado a la vida útil de dicho producto. 1.14. Extracción de compuestos de aromas en quesos En general la percepción del aroma de los quesos es uno de los principales criterios para la aceptación y preferencia por parte de los consumidores. Los aromas típicos de estos productos resultan del balance de una mezcla compleja de componentes químicos (ácidos, cetonas, alcoholes, etc.) presentes en una correcta proporción. Sin embargo con el tiempo, este balance cambia y en consecuencia el olor también. Para la caracterización del aroma de los quesos se ha reportado el uso de varios métodos de extracción de los compuestos volátiles, tales como; extracción con solventes, destilación al vacío y análisis de espacio en cabeza (headspace) mediante microextracción en fase sólida (MEFS). Esta última es la técnica más simple y sensible [79]. En el análisis de espacio en cabeza con MEFS, la selección del tipo de fibra es determinante para una extracción exitosa de los compuestos de aroma. Lecanu y colaboradores realizaron un estudio en queso madurado (concha negra) [79] , donde se comparó la efectividad de cuatro fibras en el análisis de una solución modelo formada por ocho compuestos responsables del aroma del queso en estudio. Se analizó el área generada por cada fibra en las señales cromatográficas por CG-FID (Fig. 1.12), y la fibra que resultó más eficiente fue la recubierta con CAR/PDMS 75 µm. 50 Compuestos de Aromas A=dimetil sulfuro, B=acetona, C=butanona, D=dimetil disulfuro, E=3-metil-butanol, F=2-hidroxipropanona, G= dimetil trisulfuro, H=ácido 3-metilbutanoico Fig. 1.12. Extracción de compuestos de aroma en una solución modelo por MEFS con diferentes fibras [79] En la Tabla 1.8 se muestra un resumen realizado sobre diferentes tipos de fibras reportadas en la literatura para el análisis de compuestos de aromas en quesos. Las fibras compuestas por CAR-PDMS 75 µm y por DVB-CAR-PDMS 50:30 µm de espesor resultaron ser las más sensibles para el análisis de volátiles en las diferentes muestras de quesos tratadas. Esto se atribuye a su amplia distribución en el tamaño de poros (macro, meso y microporos) que le confiere el Carboxen (CAR), la cual combinada con PDMS y DVB incrementan la extracción de moléculas con pequeños pesos moleculares, característico de los compuestos de aroma para este tipo de productos lácteos [80]. 51 Tabla 1.8. Diferentes tipos de fibras para el análisis de compuestos de aromas en quesos. Fibra Objetivo del estudio Muestras Referencias PDMS 100 µm, PDMS-DVB 65 µm, PA 85 µm, *CAR-PDMS 75 µm, CW-DVB 65 µm, DVB-CAR-PDMS StableFlex 50 µm. Determinación de compuestos de aroma y comparación de fibras Queso de Oveja “Terrincho” de Portugal 80 76 PDMS 100 µm PA 100 µm, CAR-PDMS 75 µm, CW-DVB 70 µm, *DVB-CAR-PDMS 50:30 µm Determinación de compuestos de aroma y comparación de fibras Queso de Cabra Siciliano de Italia CAR-PDMS 75 µm Caracterización de compuestos de aroma Quesos Cheddar, Azul, Parmesano, Pecorino y Grana Pedano de Australia Diferencia en volátiles de quesos artesanales e industriales “Piacentinu” CW-DVB 65 µm, PA 85 µm, *CAR-PDMS 75 µm, CW-DVB 65 µm, Análisis de volátiles en quesos tratados con enzimas modificadas 81 Queso de Oveja de Italia 77 Queso Cheddar Frances 67 *Fibras seleccionadas por los autores con mejor respuesta en el análisis en base a sensibilidad. La cromatografía de gases acoplada a la olfatometría permite evaluar la contribución da cada compuesto volátil en el aroma global, lo que ha hecho que dicha técnica se utilice ampliamente en estudio relacionados con el aroma de los alimentos[39]. Aunque una serie de compuestos activos de olor han sido identificados y reportados en la literatura mediante la técnica de CG-O para diferentes tipos de quesos, en general para estos productos se encuentran reportados varios compuestos en común (Tabla 1.9) 52 Tabla 1.9. Compuestos comunes encontrados en diferentes tipos de queso (cheddar, pecorino, azul, parmesano, cabra) [82]. Compuesto Descriptor de olor 2,4-nonadienal Floral, grasa 4-heptenal Aceite, grasa 1-nonen-3-ona Champiñones 1-octanol Champiñones, metálico 2,3-butanediona Mantequilla, crema de leche 2-heptanona Canela, especias, frutal 2-nonanona Floral, verde 2-undecanona Floral rosas, frutal cítrico 3-metil-butanal Malta, verde Acetaldehído Pungente Ácido acético Vinagre, pungente Ácido butírico Queso, ácido, rancio Diacetilo Mantequilla Dimetil sulfuro Azufre Butanoato de etilo Frutal, piña, cambur Caproato de etilo Pastel de frutas, piña, cambur Heptanal Nuez, grasa, aceite, mantequilla Hexanal Verde, herbal Homofuraneol Dulce, caramelo Indol Fecal, mohoso Ácido isovalérico Rancio, queso, fecal, sudor, pútrido Metional Papas cocidas Nonanal Floral, verde Ácido propiónico Rancio, pungente Decalactona Coco, melocotón 53 CAPÍTULO II MATERIALES Y MÉTODOS 2.1. UBICACIÓN DE LA ZONA DE ELABORACIÓN DEL QUESO DE CABRA Los muestreos de los quesos de cabra se realizaron en una granja comercial de nombre “Quesos Doña Elida”, ubicada en el sector El Sanchero, Parroquia Aguedo Felipe Alvarado, Municipio Iribarren, Estado Lara, Venezuela, dedicada a la ganadería caprina y la producción de quesos artesanales, con cuatro rebaños de animales mestizos cuyas razas predominantes son Canaria y Saanen. Esta zona posee un clima caliente semiárido con una temperatura anual promedio entre 20 y 30°C, con precipitaciones medias anuales de 464 mm, siendo los meses más húmedos abril, mayo, junio y julio, y los meses más secos diciembre, enero, febrero y marzo. Está conformado básicamente por un valle intramontañoso con pendientes entre el 2 y 5% y en la zona pie de cerro con pendientes del 6 al 25 % [83]. 2.2. MUESTRAS DE QUESO Las muestras de queso se adquirieron en tres fechas diferentes de elaboración, de acuerdo a las tres fases de lactancia en la que se encontraban las cabras, las cuales fueron: La muestra 1 correspondiente al inicio o ascenso de la curva de lactancia, elaborada en marzo (04/03/09), la muestra 2 asignada al máximo de la curva, elaborada en junio (17/06/09) y la tercera muestra de la etapa final o descenso de la curva se adquirió en septiembre (9/09/09). En cada muestreo se tomaron 3 kg de queso, que fueron trasladados bajo refrigeración en una cava con hielo del sitio de origen hasta el laboratorio en bolsas plásticas herméticas. Allí se cortaron en piezas de 200±1 g y se guardaron al vacío 54 en bolsas FoodSaverTM usando un equipo Oster FoodSaverTM. Estas fueron catalogadas por su fecha de elaboración y almacenadas a -5 ºC hasta su uso. 2.3. CARACTERÍSTICAS DE LAS CABRAS Las cabras fueron mestizas del cruce entre cabras criollas del Estado Falcón y cabras españolas de raza Canarias. El rebaño que se utilizó para la elaboración de quesos estuvo constituido por: 20 cabras para las cuales fue su primer parto y con un peso promedio de 58-60 Kg, y 60 cabras para las cuales fue su segundo parto, con un peso promedio de 65-70 Kg. Estas cabras fueron suplementadas con 1,3 kg/animal/día de un alimento concentrado comercial a base de maíz (Procría® 18%), 1 kg/animal/día de heno y 1 kg/80animales/día de minerales lecheros de un concentrado comercial (Bayer®), suministrados en comederos comunes. La cantidad de agua que consumían fue de 400 L/80animales/día. 2.4. FABRICACIÓN DEL QUESO DE CABRA USADO EN EL PROYECTO A continuación se describen las etapas de elaboración del queso de cabra usado en la unidad de producción de la granja Quesos Doña Elida: 2.4.1. Ordeño y recepción: esta etapa se inicia en horas de la mañana (6-8 am): El productor lavaba sus manos y la ubre del animal para luego realizar un ordeño de cada pezón para verificar si la leche estaba en buen estado (evidenciado por la presencia de grumos en la leche o cambio de color hacia rosado o marrón). En caso positivo se ordeñaba en envases plásticos de 5 litros que finalmente eran trasladados al lugar donde se elaboraba el queso. 2.4.2. Filtrado: se eliminaban residuos sólidos que pudieran provenir del proceso de ordeño mediante el uso de tela de liencillo. 55 2.4.3. Higienización: se calentaba la leche cerca de los 40 ºC por un tiempo máximo de 15 minutos. 2.4.4. Salado: se realizaba junto con el proceso de higienización, y se agrega en una relación de 150 gramos de sal por 40 litros de leche. 2.4.5. Coagulación: la cuajada se obtuvó al añadir el cuajo natural (preparado enzimático proveniente del estómago de cabritos) a la leche previamente calentada en la etapa higienización. La relación fue aproximadamente 10 mL de cuajo por litro de leche. 2.4.6. Desuerado y corte de cuajada: El desuerado se realizaba amasando con las manos la cuajada producida en el proceso de coagulación durante aproximadamente 10 min. para obtener pequeños trozos de cuajada que luego eran cortadas con cuchillos de acero inoxidable. 2.4.7. Moldeado y prensado: se usaban moldes de plástico con perforaciones, que facilitan el desuerado y se colocaban pesas de metal sobre la cuajada durante 2 horas con una relación de peso de 3 a 4 veces superior a la masa de queso a producir. 2.5. REACTIVOS Y EQUIPOS 2.5.1. Reactivos Los compuestos de aroma usados (Tabla 2.1) para el entrenamiento del panel, para la identificación y la cuantificación fueron suministrados por los Laboratorios Docentes y de Investigación de Química Orgánica de la Universidad Simón Bolívar y por la empresa Flavors Concentrados C.A de Venezuela. 56 Tabla 2.1. Reactivos usados en el proyecto Compuesto Número Marca Pureza (%) Riedel-de Haen 99,8 Ungerer and Company 98 CAS Etanol 64-17-5 Propianoato de etilo 105-37-3 Butanoato de etilo 105-54-4 Hexanoato de etilo 123-66-0 Octanoato de etilo 106-32-1 Decanoato de etilo 110-38-3 Dodecanoato de etilo 106-33-2 Acetato de isoamilo 123-92-2 Merck 98 Vainillina 121-33-5 Sigma- Aldrich 98 Benzaldehído 100-52-7 Riedel-de Haen 97 Isoamilalcohol 123-51-3 Merck 98 p-Anisaldehído 123-11-5 Merck 98 Furfural 98-01-1 Merck 98 Iso-Butiraldehído 78-84-2 Merck 98 2-Butanona 78-93-3 Merck 99 Geraniol 106-24-1 Sigma- Aldrich 99 Alfa-pineno 80-56-8 Sigma- Aldrich 99 Ácido butanoico 107-92-6 Ácido hexanoico 142-62-1 Ungerer and Company 98 Ácido octanoico 124-07-2 Ácido decanocio 334-48-5 2.5.2. Materiales Los materiales usados para la microextracción en fase sólida de los volátiles en las muestras de queso de cabra fueron: • Fibras (Supelco); CAR/PDMS 75 µm y DVB/CAR/PDMS 30/50 µm • Insertos de vdrio para MEFS de 0,75 mm de diámetro interno para el puerto de inyección (Supelco) • Viales de 20 mL para headspace (Perkin Elmer) 57 • Microjeringa de 10 µL (Hamilton ±0,1µL) • Tapas de aluminio con sellos de teflón- silicona de 9 mm de diámetro para viales de headspace (Supelco) • Helio, hidrogeno, aire presurizados grado UAP (AGA). 2.5.3. Equipos de laboratorio • Balanza analítica (apreciación 0,0001g), marca PioneerTM Ohaus Corporation. • Congelador freezer/coder H400, marca Electrolux • Baño de agua termostatizado (apreciación ± 0,1 ºC) marca PRECISION • Estufa (apreciación ± 1 ºC) marca PRECISION • Cronómetro (apreciación ± 0,01 segundo) marca Athletic Works WR 100ft • Equipo para vacío marca Oster FoodSaverTM 2.5.4. Sistema de cromatografía de gases – detector ionización de llama (CGFID). Los análisis se realizaron en un equipo de cromatografía de gases Hewlett Packard modelo 5890 serie II con un detector FID y como gas portador se usó helio A.P, con el inyector en modo splitless con un tiempo de apertura de válvula de 0,7min, y una presión de entrada de 10 psi. Se utilizaron dos columnas cromatográficas, las cuales fueron HP-5® (5% fenil metil Silicona) capilar de sílica fundida de 30 m x 0,25 mm x 0,25 µm espesor de la película y Carbowax® (Quadrex) de 30 m x 0,25 mm x 0,25 µm espesor de la película. El programa de calentamiento para la columna HP-5 se inició con una temperatura de 30 °C, durante 3min con un incremento de 4 °C/min hasta 120 °C mantenidos durante 5min y finalmente un segundo incremento de 15 °C/min hasta 300 °C mantenido durante 5min. 58 El programa de calentamiento para la columna Carbowax se inició con una temperatura de 60 °C durante 5min, con un incremento de 4 °C/min hasta 120 °C mantenidos durante 5min y finalmente un segundo incremento de 15 °C/min hasta 200 °C mantenido durante 20min. El análisis de los cromatogramas para la identificación de las señales se realizó a partir de los índices de Kovats determinados con una serie de n-alcanos (C6-C44). Como los análisis cromatográficos se realizaron con programación de la temperatura del horno, la ecuación del cálculo de IR usada fue: t −t s I x = 100 N + 100 n R , x R , N t R ,( N + n ) − t R , N (ec. 2.1) s Ix = índice de retención para el componente “x” en la fase estacionaria “s”. N = número de átomos de carbono del n-alcano que eluye antes del analito. n = diferencia en número de átomos de carbono de los n-alcanos entre los que se encuentra el componente. tRx, tRN, tR(N+n) = tiempos de retención del componente x, y los n-alcanos entre los que eluye este componente. 2.5.5. Sistema de cromatografía de gases - espectrometría de masas (CG-EM). Los análisis se realizaron en un equipo de cromatografía de gases Agilent Technologies 7890A acoplado a un detector selectivo de masas 5975C, en la opción de ionización por impacto electrónico (70 eV) y como gas portador se uso helio U.A.P, con el inyector en modo splitless con un tiempo de apertura de válvula de 0,7min, con una presión de entrada de 12 psi. Se uso la columna Carbowax (Quadrex) de 30 m x 0,25 mm x 0,25 µm espesor de la película con el mismo programa de calentamiento usada en los análisis usadas en el equipo de CG-FID. La señales de los cromatogramas fueron identificadas a través de los índices de Kovats y sus espectros de masa con ayuda del algoritmo de comparación de espectros con la base de datos del software, NIST98 59 2.5.6. Sistema de cromatografía de gases-olfatometría Los análisis se realizaron en un equipo de cromatografía de gases Shimadzu modelo 14 A (Fig. 2.1). La columna para la separación fue una Carbowax (Quadrex) de 30 m x 0,25 mm x 0,25 µm espesor de la película, con helio A.P como gas portador con un flujo de 30 mL/min y un flujo de aire del gas humidificador de 30 mL/min (44). El programa de calentamiento se inicio con una temperatura de 60 ºC durante 6 minutos seguido por una rampa de calentamiento de 6 ºC/min hasta alcanzar una temperatura final de 170 ºC, la cual se mantuvo durante 2 min. Fig. 2.1. Equipo de CG-O. (1) humidificador, (2) detector olfatométrico y/o puerto de olor, (3) teclado para el registro de la señal. Para el sistema de registro de señal se usó un mini teclado Targos modelo PAUK 10U conectado al computador ViewSonic E70, procesador Intel Pentium III 868 MHz, 256 MB de RAM, con Windows XP Professional versión 2002 como sistema operativo. El programa de detección y registro de la señal olfatométrica para realización del proyecto fue diseñado con el programa LabView 8.5, el cual traduce la señal analógica a digital del pulso emitido, generando una señal periódica cuadrada positiva por un periodo de tiempo en el cual se mantiene el pulso (Fig. 2.2). Mediante el uso de algoritmos del programa mencionado para la adquisición de 60 datos, se determinó el tiempo (min) inicial y final de la señal olfatométrica correspondiente a los tiempos en el que el panelista comenzaba y dejaba de detectar el aroma, registrando simultáneamente el tiempo (s) de duración del atributo sensorial evaluado (tDS) (Fig. 2.3). Fig. 2.2. Generación de la señal olfatométrica obtenida con el programa LabView 8.5. Fig. 2.3. Características de la señal con el detector olfatométrico 2.6. MÉTODOS Y PROCEDIMIENTOS 2.6.1. Preparación de las muestras de queso y muestreo por microextracción en fase sólida (MEFS) El queso mantenido en refrigeración se llevó a temperatura ambiente antes de su uso y se removieron todos los bordes (aprox. 0,5 cm) por posibles pérdidas de volátiles de esta zona más expuesta al ambiente. 61 El procedimiento consistió en colocar las muestras de queso en un vial de 20 mL sellando con un septum de teflón-silicona, luego se dejó reposar (durante 20 min) para que se estableciera el equilibrio entre la muestra y el espacio en cabeza a una temperatura dada, la cual inicialmente fue temperatura ambiente. Se evaluaron cada uno de los siguientes parámetros en forma univarido, para seleccionar la mejor combinación. • Cantidad de muestra de queso: 1,2, y 3 g. • Tiempo de exposición de la fibra para la extracción: 30, 60, 90 min. • Temperatura de muestreo: 25, 35 y 45 ºC. Para la extracción se usó la fibras de tres fases (DVB/CAR/PDMS 30/50 µm) y cada combinación de parámetros se evaluó por triplicado en el equipo de CGFID, con la columna de Carbowax®. Los parámetros seleccionados se analizaron al comparación del área obtenida de los compuestos bajo cada condición de análisis, seleccionando aquella combinación con la cual se obtuvo mayor señal en la extracción de los analitos. 2.6.2. Obtención del panel entrenado Para disponer de un panel entrenado se cumplieron etapas recomendadas por varios autores [82] [83] [84], las cuales se describen a continuación: 2.6.2.1. Reclutamiento de panelistas Se realizó una encuesta a la comunidad del Departamento de Procesos Biológicos y Bioquímicos (empleados, estudiantes y profesores) de la Universidad Simón Bolívar, empleando un cuestionario diseñadas para tal fin (Apéndice 1.1). En base a la información recaudada en el cuestionario, las características más 62 importantes para decidir la participación de los candidatos a panelistas fueron: interés en participar en las actividades de entrenamiento, disponibilidad y estado de salud [84]. 2.6.2.2. Selección de panelistas De acuerdo con los resultados obtenidos en el cuestionario de reclutamiento, y considerando principalmente la motivación y disponibilidad de tiempo, se realizó la preselección del grupo conformado por 10 personas. Se realizó una reunión de carácter informativo y motivacional, en la cual se explicaron los objetivos, la importancia de este estudio y las consideraciones fundamentales para pertenecer a un panel evaluador en alimentos [81]. El panel quedó conformado por 2 mujeres y 4 hombres (entre 27-40 años) y se identificaron con códigos de una letra y dos dígitos, con la finalidad de no revelar sus nombres y evitar sentimientos de desmotivación en caso de que sus resultados no presentaran un buen desempeño. A su vez, considerando los resultados individuales, la líder del panel (mi persona) dedicó más tiempo en realizar repeticiones y explicaciones de la metodología en caso de que los jueces lo requirieran. Las pruebas aplicadas para el entrenamiento se indican a continuación: 2.6.2.2.1. Identificación de aromas Se presentaron 15 muestras de alimentos [84] , condimentos o esencias en envases tapados a fin de concentrar los compuestos volátiles y no dejar ver a los panelistas el contenido en cada frasco. Se les pidió abrir huecos (4-6) al momento de oler y describir el aroma percibido sin ver la muestra presente, y como agente neutralizante se uso café en granos, el cual se les pidió usar antes y después de oler cada muestra (Apéndice 1.2). 63 Las muestras se seleccionaron de acuerdo a aromas lácteos y fueron: leche condensada, ajo en polvo, queso parmesano, salsa de soya, café instantáneo en polvo, vinagre, mostaza, nata de leche, vainilla, sirope de chocolate, adobo, mezcla de chicha, queso cheddar, canela en polvo y yogurt natural. Para evaluar esta prueba se calificó con 1 punto los aciertos en muestras correctamente identificadas y con ½ punto a las asociaciones y se calculó el porcentaje de aciertos en la identificación de aroma por panelista y del grupo total. 2.6.2.2.2. Determinación de umbrales de detección e identificación de aromas Se presentó un grupo de soluciones en concentraciones crecientes de acetato de isoamilo (ISO 5496:2006 (E)) con la finalidad de determinar la mínima concentración en la que cada panelista era capaz de detectar e identificar el aroma del mencionado compuesto. Las soluciones se presentaron en el siguiente orden de concentración (ppm): 0,01; 0,05; 0,1; 0,5; 1; 5; 10; 50 Se les pidió abrir los frascos uno a uno con la boca cerrada para evitar la detección del aroma vía retronasal [85] , y una vez que la decisión hubiera sido tomada, se debía cerrar el frasco y responder en la planilla de evaluación (Apéndice 1.3). No hay una metodología estricta que plantee que los panelistas huelan todos los frascos en un intervalo determinado de tiempo y en la misma forma, por ejemplo en inhalaciones cortas, respiración profunda, etc. La determinación se realizó por triplicado y en días diferentes, con la finalidad de evitar fatiga y saturación de los receptores olfativos. 2.6.2.2.3. Desarrollo del vocabulario del panel Para el desarrollo del vocabulario a usar en la descripción de los aromas percibidos en los análisis olfatométricos, se presentó un total de 13 soluciones de 64 diferentes compuestos (ISO5496:2006 (E)) (Tabla 2.2) preparados con la concentración promedio de identificación arrojada por el panel en la prueba de umbral. Se usaron 20 mL de cada patrón en tubos de 40 mL de ensayos con tapas, y café en granos como agente neutralizante de los aromas. Para esta prueba se aplicaron 3 metodologías en la detección de los aromas, las cuales fueron: a- Detección directa de las soluciones: se les indicó abrir los frascos uno a uno con la boca cerrada y describir el aroma percibido, realizando máximo 3 repeticiones y describir en la planilla suministrada (Apéndice 1.4). b- Detección con tiras olfativas: se les indicó abrir los frascos uno a uno con la boca cerrada, sumergir las tiras olfativas de papel de filtro poroso (10 cm de largo x 1 cm de ancho), airear durante unos segundos, oler el papel y describir el aroma percibido, realizando un máximo 2 repeticiones. c- Detección del espacio en cabeza de los patrones: se equilibraron durante 20 min las soluciones patrones en los tubos de ensayos con tapa, luego se extrajo el contenido de las soluciones para dejar solo la fase de vapor del compuesto y se les indicó abrir los frascos para rápidamente detectar y describir el olor percibido en una sola medida. Esta última metodología se realizó para entrenar la rapidez en el momento de describir, simulando la detección en el equipo de olfatometría. Todas las metodologías para el desarrollo de vocabulario se realizaron por triplicado y cuando fue necesario se discutieron individualmente con los panelistas los descriptores de los aromas percibidos. 65 Tabla 2.2. Compuestos usados para el desarrollo de vocabulario del panel en la detección de aromas. Compuesto Aroma Acetato de isoamilo Vainillina Benzaldehído Alcohol isoamílico p-Anisaldehído Furfural Iso-Butiraldehído 2-Butanona Geraniol Alfa-pineno Esencia de naranja Esencia de limón Esencia de frambuesa Cambur Vainilla, caramelo Almendra, azúcar quemada, papelón Whisky, malta, cebada, tostado Menta, caramelo Pan dulce, almendra, caramelo Malta, verde, pungente Éter, solventes Pino, madera, verde Monte, madera dulce Fruta cítrica, naranja Fruta cítrica, limón, limonada Fresa, frambuesa, tutti fruti 2.6.3. Representatividad del aroma en CG-O Este análisis tuvo la finalidad de validar sensorialmente la extracción del espacio en cabeza de las muestras de queso realizadas con las 2 fibras utilizadas (CAR/PDMS y DVB/CAR/PDMS). Para esta prueba, el CG-O fue provisto de una columna de 70 cm de longitud y sin fase estacionaria, teniendo de esta manera condición de resolución nula. Se usó helio A.P como gas portador con un flujo de 30mL/min y un flujo de aire humidificador el puerto de olor de 25 mL/min. La temperatura del inyector fue 250 ºC, la de la interfase fue 200ºC y el horno se mantuvo a 50ºC. Una muestra de 2 g de queso de cabra fue llevada a temperatura ambiente durante 20 min en el vial para headspace herméticamente cerrado, en el que se expuso la fibra durante 30 min para la extracción. Luego se realizó la desorción en el inyector durante 2 min. El panel inicialmente olió directamente muestras de quesos tratadas de igual manera que las extraídas con las fibras en los viales para headspace y luego detectaron el aroma eluido en el CG-O. Se les pidió comparar los dos aromas 66 percibidos y para ello se usó una escala no estructurada de 15 cm de largo: la izquierda de la escala se asignó como ninguna igualdad y a la derecha como total igualdad (Apéndice 1.5). El procedimiento fue realizado por duplicado para los 6 panelistas, en días diferentes. 2.6.4. Preparación de soluciones estándares de ésteres lineales y su uso para la determinación de índices de retención La serie de ésteres lineales para realizar la posible identificación de los compuestos responsables del aroma del queso de cabra estudiados por la técnica de CG-O fueron: propianoato de etilo, butanoato de etilo, hexanoato de etilo, octanoato de etilo, decanoato de etilo y dodecanoato de etilo. Para ello se prepararon 250 mL de una solución patrón de 1000 ppm (m/v) en etanol, a partir de la cual se realizaron diluciones de 5, 10 y 20 ppm para el entrenamiento y determinación de los tiempos de retención por parte del panel en los análisis olfatométricos. La serie de ésteres se analizó en el equipo CG-FID y CG-O con la metodología expuesta en la sección 2.5.6 para estudiar si había una buena identificación de las zonas de aromas obtenidas de los ésteres mediante CG-O y los tiempos de retención obtenidos mediante CG-FID a partir de los índices de Kovats determinados con la serie de n-alcanos C6-C44. Luego el resultado sería extrapolado para identificar las zonas de aromas obtenidas del análisis de los quesos. 2.6.4.1. Entrenamiento del panel en la detección de los ésteres lineales por olfatometría Se utilizaron los patrones de ésteres en tres concentraciones: 5, 10 y 20 ppm (m/v), para el entrenamiento del panel y la determinación de las zonas de aromas. 67 Con cada panelista y para cada patrón, se realizó una corrida para que el panelista se familiarizara con los aromas característicos de cada compuesto y así discutir el vocabulario a usar en los descriptores de cada zona de aroma detectada. Posteriormente se realizaron 2 corridas con el patrón donde hubo mejor detección por panelista para obtener sus frecuencias de detección (FD) y los tiempos de retención. Este último permitió determinar los índices de retención de las zonas de aromas de los análisis de los quesos para su posible identificación. El total de corridas para el entrenamiento del panel fue de 12 y para el análisis olfatométrico definitivo del patrón de ésteres también fueron 12 corridas. 2.6.5. Análisis olfatométrico Las muestras de quesos fueron tratadas para su extracción y análisis según los parámetros de análisis establecidos en el procedimiento de selección de condiciones del método de extracción (2.6.1) y las condiciones para el programa de calentamiento fue el expuesto en el apartado 2.5.6. Con cada panelista y para cada muestra de queso, se realizaron dos corridas de entrenamiento para familiarizarse con los aromas de las muestras y discutir el vocabulario a usar en los descriptores de cada zona de aroma detectada. Posteriormente se realizaron 2 corridas por panelista con cada muestra de queso (las tres etapas de la curva de lactancia) para obtener las zonas de aromas y sus frecuencias de detección (FD). El total de corridas para el análisis olfatométrico de cada muestra de queso fue de 24. Se tomó una FD > 6 para ser considerada una zona de aroma de impacto al aroma del queso. Para su posible identificación se emplearon los índices de retención calculados con la serie de ésteres lineales (2.6.4). 68 2.6.7. Análisis de los ácidos grasos libres (AGL) Se realizaron las mediciones de áreas de los AGL mediante CG-FID para su cuantificación por el método de patrón externo bajo las condiciones ya seleccionadas. Los AGL cuantificados fueron ácido butanoico, hexanoico, octanoico y decanoico. 2.6.7.1. Linealidad de las señales cromatográficas los AGL y curva de calibración Se realizaron curvas de calibración en el intervalo lineal para cada AGL de 0-500 ppm (m/v), mediante patrones preparados en etanol para obtener el rango lineal del método para cada compuesto. Para ello se colocaron 2 mL de cada solución (volumen seleccionado) en un vial sellado de 20 mL y se analizaron bajo las mismas condiciones inicialmente seleccionadas en la extracción de la muestras de quesos. Se utilizaron 5 patrones de los AGL con concentraciones seleccionadas en el rango lineal determinado para uno, con un mínimo de 3 réplicas. Se graficaron las áreas obtenidas en función de las concentraciones para luego determinar el la ecuación de la recta y el coeficiente de correlación (R) y por el método de mínimos cuadrados. Para seleccionar el volumen para los patrones, se usaron volúmenes de 1, 2, 3 y 4 mL con el patrón de menor concentración (10 ppm) y se selecciono el que arrojó mayor área de la señal cromatográfica. 69 2.6.7.2. Limite de detección y cuantificación El límite de detección (LD) y el límite de cuantificación (LC) se calcularon a partir de datos obtenidos de las curvas de calibración de cada compuesto (Fig. 2.4), mediante las relaciones con las siguientes ecuaciones [86]: LD = yBn=3 + 3SB LC = yB(n=3) + 10SB (ec. 2.1) (ec. 2.2) y= medidas del blanco usado SB= Desviación estándar del blanco Los valores de yB y SB se obtuvieron experimentalmente de las curvas de regresión lineal para la calibración. Un supuesto fundamental del método de los mínimos cuadrados sin ponderar es que cada punto en la representación gráfica (incluido el que representa al blanco o ruido de fondo) tiene una variación distribuida normalmente (solo en la dirección de y) con una desviación estándar estimada Sy/x, por lo tanto es apropiado utilizar Sy/x en lugar de SB en la estimación del límite de detección. El valor de a, la ordenada en el origen calculada, se utilizó para la estimación de yB [86]. Fig. 2.4. Gráfico modelo de curva de calibración usado para determinar LD y LC. 70 2.6.8. Análisis estadístico Se realizó el análisis estadístico de los AGL cuantificados y los aromagramas obtenidos de los quesos elaborados en las tres fases de lactancia, mediante el programa de STATISTICA® Versión 6, aplicando Multidimensional Scaling (MDS) para obtener la correlación en las medidas, con un nivel de STRESS < 0,5. Para el tratamiento estadístico de usó las áreas de los AGL obtenidas por CGFID de las tres muestras de queso analizadas por microextracción en fase sólida y en el caso de los aromagramas se utilizó el número de zonas de aromas que tuvieran un n>6 mediante el método de frecuencia de detección clasificadas en grupos de familias de aromas. El MDS es una familia de procedimientos las cuales permite la exploración de tendencias y la futura transformación de la matriz de datos a representaciones gráficas de 2 o 3 dimensiones. Los datos que se pueden utilizar con esta metodología deben presentarse en forma de disimilaridades. El primer tipo de matriz indica que tan diferentes son cada par de observaciones entre sí. En general estos coeficientes de disimilaridades están relacionados de manera inversa con los coeficientes de similaridad. Existen una serie de medidas de similaridad (ó disimilaridad) sin embargo, la más popular y conocida es la distancia Euclidiana [110]. El método clásico de MDS consiste en la reducción de dimensionalidad de una matriz de puntos basada en la disimilaridad existente entre las observaciones que conforman dicha matriz. La matriz de disimilaridades es convertida en una matriz de distancias euclidianas a la cual se le va a someter a un procedimiento de reducción, resultando un espacio de dimensión reducida que realiza una exacta representación del espacio original[110]. El Stress, nombre dado por Kruskal (1964) a la varianza residual normalizada, es la medida de la bondad de ajuste de la configuración obtenida con respecto a la configuración original. 71 CAPÍTULO III AISLAMIENTO E IDENTIFICACIÓN DE LOS COMPUESTOS VOLÁTILES EN EL QUESO DE CABRA. RESULTADOS Y DISCUSIÓN 3.1. Selección de las condiciones más adecuadas de extracción y análisis de los compuestos volátiles en las muestras de queso de cabra por MEFS-CGFID. La primera etapa llevada a cabo en este proyecto de investigación fue plantear un método analítico que presentara una serie de ventajas respecto a los utilizados clásicamente, por lo cual se seleccionó la microextracción en fase sólida como la técnica a aplicar. Esta cual ha sido muy usada para la determinación del perfil volátil en productos lácteos variados como quesos, yogurt, leche, entre otros. Esta técnica es rápida, simple y con capacidad discriminativa, cualidad indispensable para detectar cualquier modificación de la calidad del queso evaluado. La evaluación de los parámetros analíticos adecuados para obtener la mayor sensibilidad de la técnica en la extracción de los compuestos volátiles se realizó de manera separada, obteniendo los efectos individuales para cada variable [87]. 3.1.1. Selección de la fibra para MEFS Inicialmente se seleccionó la fibra a usar para la extracción de los compuestos volátiles en el espacio en cabeza de las muestras de quesos de cabra, para ello se usó las condiciones iníciales de análisis para la extracción (1 g de queso, 20 min de equilibrio, 30 min de muestreo y 25 °C como temperatura de muestreo ). Se estableció como guía de 72 escogencia la fibra que aislara el mayor número de volátiles y abundancia (porcentaje del área). En la Figura 3.1 se reproducen los cromatogramas obtenidos para cada una de las fibras evaluadas mediante CG-FID y una columna DB-5®. Fig. 3.1. Comparación de cromatogramas de gases de los volátiles aislados del queso de cabra con las fibras DVB/CAR/PDMS (a) y PDMS/CAR (b). Al comparar los cromatogramas obtenidos con las dos fibras evaluadas se observó una mayor afinidad de los compuestos volátiles presentes en el queso de cabra con la fibra DVB/CAR/PDMS. Este resultado es coherente con la literatura que indica que por lo general las fibras compuestas con múltiples fases facilita la eficacia de la extracción. En esta fibra, una primera capa de PDMS/CAR se cubre con una segunda capa de PDMS/DVB, donde las 73 moléculas pequeñas con mayores coeficientes de difusión llegan a la capa interior más rápido y son adsorbidas por la fase de Carboxen (CAR) y las moléculas más pesadas son retenidas en la capa exterior de DVB. Esta configuración facilita también la desorción [88] . En estudios previos realizados con quesos de diferentes variedades reportaron la fibra de 3 fases como la más eficiente para el estudio por MEFS, atribuyéndolo principalmente a la alta polaridad de los analitos [71] [89]. Adicionalmente para la selección de la fibra, se evalúo el % de representatividad del aroma del queso de cabra con la técnica olfatométrica, donde también se obtuvo un mejor valor de representatividad con la fibra de 3 fases, resultado que se expondrá en la sección 4.2. 3.1.2. Desempeño de las diferentes fases estacionarias de las columnas cromatográficas El segundo parámetro a seleccionar fue la escogencia de las columnas cromatográfica, usando como criterios, la elución de los compuestos en un tiempo razonable de análisis y una buena resolución de los picos cromatográficos, importante para una posterior identificación de los compuestos mediante la inyección de patrones, y su cuantificación. La columna constituye la parte esencial del sistema cromatográfico y de la que depende en gran parte el éxito del análisis. En ella está contenida la fase estacionaria, que determina la selectividad y la eficacia de las separaciones. En la Fig. 3.2 se observa el perfil cromatográfico volátil obtenido mediante MEFS de queso de cabra con columnas de fases de diferentes polaridades. 74 Fig. 3.2. Cromatogramas del queso de cabra obtenidos mediante MEFS y analizados en una columna de DB-5 (a) y Carbowax (b). La columna con la cual se obtuvo una mejor resolución de las señales cromatográficas en el análisis de los volátiles del queso de cabra fue Carbowax, lo que permitió inferir que los compuestos presentes en las muestras de quesos analizadas probablemente eran de características polares. Los picos cromatográficos fueron asimétricos en la elución de los compuestos en la columna DB-5, observándose una sobrecarga de las señales como consecuencia de una mayor retención de los compuestos por la columna, lo cual origino señales anchas, y debido a la insuficiente resolución no era posible medir las áreas o altura de las señales. En estudios previos de compuestos volátiles en quesos, se ha reportado la columna Carbowax como la ideal para los análisis cualitativos y cuantitativos, ya que esta matriz se caracteriza por presentar compuestos polares y de bajos pesos moleculares [71] . Los resultados del presente trabajo corrobora que la columna Carbowax® posee la fase estacionaria adecuada para este tipo de muestra, sin embargo se utilizaron ambas columnas para los análisis de los volátiles en el queso, ya que hubo una buena identificación mediante los índices de Kovats obtenidos con la columna DB-5® y para la cuantificación de los AGL, 75 la selección de los parámetros de extracción de los volátiles y los análisis olfatométricos se usó la Carbowax®. 3.1.3. Cantidad de muestra de queso Una vez seleccionada la fibra y las columnas, se procedió a variar la cantidad de muestra de queso para la extracción, se comenzó con 1g y los parámetros restantes permanecieron constantes (20 min de equilibrio, 30 min de muestreo y 25 °C como temperatura de muestreo) y se aumento la cantidad de muestra hasta 3 g. En la figura 3.3 se observa el efecto de aumentar la cantidad de muestra de queso de cabra sobre la sumatoria del área total de sus picos cromatográficos. Para las tres cantidades usadas no se observó diferencias significativas mediante el análisis de varianza (P<0,05), sin embargo al evaluar la señales cromatográficas individuales se obtuvo una mayor área para algunos picos cuando se usó 2 g, siendo esté la cantidad seleccionada para la extracción. Fig. 3.3. Selección de la cantidad de muestra de queso en el muestreo por MEFS Al aumentar la cantidad de muestra la concentración de los compuestos volátiles debió aumentar en el espacio en cabeza y en consecuencia reflejarse en un aumento en el área de las señales cromatográficas obtenidas, sin embargo esto no se evidencio, por lo que la fibra pudo encontrarse saturada. 76 3.1.4. Tiempo de extracción En el análisis de los compuestos volátiles en el queso de cabra se trató de asegurar la eficiencia del proceso de extracción usando el tiempo necesario para alcanzar el equilibrio entre la matriz de la muestra y la fibra. Para la optimización de esta variable, se estudió la eficiencia de extracción (representada por las áreas de las señales cromatográficas) de los analitos a distintos tiempos de extracción, los cuales fueron 30, 60 y 90 min y se mantuvo constante los otros parámetros (2 g de muestra, 20 min de equilibrio, y 25 °C como temperatura de muestreo) En la Fig. 3.4 se observa que no hubo diferencias significativas (P<0,05) en las áreas de las señales para los 3 tiempos, por lo que se tomó el menor tiempo para los análisis por MEFS. Fig. 3.4. Optimización del tiempo de muestreo por MEFS para las muestras de queso de cabra. Cuando se analiza la fracción volátil y semivolátil de un alimento, los tipos de compuestos que se extraen con la técnica MEFS son muy diferentes por pertenecer a diversas familias como alcoholes, ésteres, cetonas, entre otros, causando que se necesiten tiempos muy variables para alcanzar el equilibrio. Para algunos compuestos el tiempo necesario para llegar al punto de equilibrio es muy elevado, mientras que para otros es corto. Generalmente, en estos casos se fija un tiempo de extracción de compromiso. Se suele optar por seleccionar tiempos de extracción inferiores para no alargar el tiempo de análisis, con lo cual para algunos analitos se trabajará en condiciones de no equilibrio [44], sin 77 embargo esto no se observó al no encontrar diferencias, por lo que este resultado puede afirmar que la fibra en la extracción de los volátiles se encontraba saturada. 3.1.5. Temperatura de extracción La temperatura juega un papel fundamental en el proceso de extracción de los volátiles, ya que ésta influye en las tasas de transferencia de masa y en los coeficientes de partición de los analitos. Se evaluaron tres temperaturas (Fig. 3.5) para obtener la mayor eficiencia en la extracción de los compuestos presentes en el queso de cabra. Se inició con la temperatura ambiente del laboratorio donde se realizaron los análisis (25 °C) y se fue aumentando hasta un máximo de 45 y los parámetros restantes se mantuvieron constantes (2 g de muestra, 20 min de equilibrio y 30 min de muestreo). Se obtuvó un incremento en la eficiencia del proceso al aumentar las temperaturas, reflejada en mayores áreas de los picos cromatográficos, aunque las mayores señales correspondieron a 45 °C. Se escogió la temperatura de 35 °C ya que a partir de 45 °C se observó que las muestras de queso de cabra presentaban una variación en el color (amarillo) y en la textura, lo que implica que pudieron ocurrir reacciones químicas que alteraran los compuestos de aroma. Fig. 3.5. Optimización de las temperaturas de muestreo por MEFS del queso de cabra. La temperatura fue el parámetro más crítico en seleccionar ya que se buscaba una alta sensibilidad en la extracción pero que no cambiara las características de la matriz del queso de cabra y afectara la fracción volátil a estudiar. Se sabe que la temperatura puede 78 afectar los compuestos que se encuentran originalmente en la materia prima, pudiendo desaparecer, modificarse o bien pueden aparecer nuevas moléculas, afectando el aroma original del alimento [90]. El aroma que se percibe de un alimento depende del equilibrio entre los diferentes compuestos volátiles, de su concentración y también de la matriz. La naturaleza química de los compuestos aromáticos y la composición y estructura de los productos alimenticios son las principales características que influyen en la transferencia entre las diferentes fases del alimento (acuosa, sólida y vapor) y su liberación. Así la variación de temperatura afecta la distribución de los compuestos de aromas en las diferentes fases y se puede ver reflejada en el cambio de textura de la matriz del alimento [91] . Es por esta razón que no se usó temperatura mayor a 35 °C en los análisis de las muestras de queso de cabra por MEFS. 3.2. Identificación de los compuestos de la fracción volátil de los quesos de cabra mediante MEFS y CG-EM recolectados en la producción de curva de lactancia 3.2.1. Compuestos identificados mediante la separación en columna DB-5 La identificación de los compuestos se determinó mediante la comparación e interpretación de los espectros de masas y la comparación de los índices de Kovats con los reportados en la librería de la Nist -98. En el análisis de la muestra número 1 de queso, recolectada al inicio de la curva de lactancia se identificaron un total de 13 compuestos (Tabla 3.1). Los compuestos mayoritarios fueron los alcoholes, los cuales poseen aromas herbáceos, frutales y alcoholados dulces. En la muestra número 2, recolectada a mitad de la curva de lactancia, se identificaron un total de 15 compuestos (Tabla 3.2), permaneciendo como mayoritarios compuestos los alcoholes. Para la muestra número 3 se identificaron un total de 18 compuestos (Tabla 3.3). 79 Tabla 3.1. Compuestos identificados para la muestra de queso recolectada al inicio de la curva de lactancia (MQ1) mediante MEFS-CG-EM en una columna DB-5 Número compuestos Compuesto Iones principales 1 2 3 4 5 6 7 8 9 10 11 12 13 isobutanol 3-hidroxi-2-butanona 3-metil-butanol 2-metil-butanol 2-heptanona ácido hexanoico hexanoato de etilo 2-etil-hexanol butanoato de isoamilo acetofenona nonanal ácido octanoico octanoato de etilo 43, 55, 74 43,45,58,88 43,45,58,88 41,57,70,88 43,58,71,114 41,60,73,116 43,60,88,99,144 41,57,130 43,51,71,158 77,105,120 41,57,70,98 41,60,73,85 57,88,101,172 Índice de Kovats Teórico Experimental 619 720 742 744 889 999 999 1031 1062 1066 1102 1188 1193 616 724 742 745 888 996 999 1031 1058 1064 1102 1179 1197 negrita=pico base Tabla 3.2. Compuestos identificados para la muestra de queso recolectada a la mitad de la curva de lactancia (MQ2) mediante MEFS-CG-EM en una columna DB-5. Número compuestos 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 negrita=pico base Compuesto 3-hidroxi-2-butanona 3-metil-butanol 2,3-butanodiol butanoato de etilo 3-metil-ácido butanoico hexanol 2-heptanona 2-heptanol benzaldehído ácido hexanoico hexanoato de etilo octanol nonanal ácido octanoico octanoato de etilo Iones principales 43, 45, 58,88 31, 42, 55, 70, 88 32, 45, 57, 90 43, 60, 71, 88, 116 41,60, 87, 102 43, 56, 69, 102 43, 58, 71, 114 45, 55, 70, 83, 116 51, 77, 105, 106 41, 60, 73, 116 43, 60, 88, 99, 144 41, 56, 70, 84, 130 41, 57, 70, 98, 142 41, 60, 73, 85, 144 57, 88, 101, 172 Índice de Kovats Teórico Experimental 720 722 742 738 782 758 799 802 848 856 867 869 889 890 906 900 958 959 999 996 999 999 1069 1073 1102 1102 1188 1180 1193 1197 80 Tabla 3.3. Compuestos identificados para la muestra de queso recolectada al final de la curva de lactancia (MQ3) mediante MEFS-CG-EM en una columna DB-5. Número compuestos 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Compuesto 3-hidroxi-2-butanona 3-metil-butanol pentanol 2,3-butanodiol butanoato de etilo furfuril alcohol hexanol acetato de isoamil 2-heptanona hexanoato de etilo limoneno octanol butanoato de pentilo heptanoato de etilo nonanal pentanoato de pentilo octanoato de etilo decanal Iones Índice de Kovats principales Teórico Experimental 43,45,58,88 720 716 31,42,55,70,88 742 741 32,42,55,70,88 761 762 32,45,57,90 782 787 43,60,71,88,116 799 803 41,53,81,98 850 862 43,56,69,102 869 874 43,55,70,87,130 876 881 43,58,71,114 889 891 43,60,88,99,144 999 999 68,79,93,136 1028 1029 41,56,70,84,130 1069 1069 43,55,71,89,158 1094 1094 43,60,88,113,158 1099 1098 41,57,70,98,142 1102 1103 41,57,70,85,113 1183 1181 57,88,101,172 1193 1197 43,57,70,82,156 1207 1202 negrita=pico base A diferencia de las dos primeras muestras de queso los compuestos mayoritarios en la etapa final de producción fueron los pertenecientes a la familia de los ésteres, los cuales aportan características a caramelos. 3.2.2. Análisis mediante la columna Carbowax. Las muestras de queso también fueron evaluadas en una columna Carbowax® para identificar y corroborar las señales de los AGL, ya que no fueron identificados satisfactoriamente mediante su elución en la columna DB-5, debido a que no hubo buena resolución de la serie de n-alcanos usados para el cálculo de los índices de kovats. 81 Como se observa en la Tabla 3.4, los cuatro AGL evaluados están presentes en las tres muestras de quesos, resultado que se obtuvo mediante la coelución con los compuestos puros. Tabla 3.4. Los ácidos grasos libres (AGL) identificados mediante los compuestos puros en las tres muestras de queso mediante MEFS-CG-EM en una columna Carbowax. Compuesto ácido butanoico ácido hexanoico ácido octanoico ácido decanoico Iones principales 41, 60, 73,88 41, 60, 73,116 41, 60, 73, 85,144 60, 73, 87, 129,172 MQ1 21,817 28,518 31,099 33,610 Tr (min.) MQ2 21,810 28,541 31,105 33,610 MQ3 21,787 28,517 31,093 33,604 negrita=pico base Los compuestos identificados en las muestras de quesos de cabra analizados ya han sido reportados en la literatura anteriormente y pertenecen a las siguientes familias de compuestos: Alcoholes Las muestras de quesos 1 y 2 presentaron como mayor número de compuestos los pertenecientes a la familia de los alcoholes, los cuales son importantes en la contribución al aroma de los quesos, particularmente los de alta maduración, desarrollando los aromas característicos a dulce y frutales. Se han reportado alcoholes primarios y secundarios como compuestos importantes para el desarrollo de los aromas en los quesos Parmigiano, Roquefort y Cheddar [99] , en los que se encuentra el 2-etil-hexanol. Estos alcoholes pueden ser producidos por la reducción de metil cetonas y acción de bacterias ácido lácticas como Lactococci, las cuales producen alcohol de la lactosa, y adicionalmente por el catabolismo de aminoácidos. Los metil alcoholes en el queso de cabra se han reportado como derivados de las cadenas ramificadas de los aminoácidos leucina, isoleucina y valina, y contribuyen a los aromas frutales que este presenta [100]. 82 Ésteres Los ésteres son compuestos que se caracterizan por contribuir al aroma de los alimentos con notas frutales y florales y pueden llegar a ser importantes para minimizar olores desagradables por la presencia de altas concentraciones de ácidos grasos libres y aminas [95] . Estos compuestos fueron los segundos más abundantes identificados en el espacio de cabeza en las muestras de queso de cabra, siendo mayoritarios en la muestra número tres. El hexanoato y octanoato de etilo han sido reportados como compuestos importantes para el aroma de los quesos y son producidos principalmente por reacciones enzimáticas o reacciones químicas de los ácidos grasos con los alcoholes primarios [101] y la concentración del alcohol es usualmente el factor limitante, aunque también se pueden formar por la transesterificación de los glicéridos [102]. Cetonas Las cetonas también son de gran importancia en el aroma de los quesos con alto grado de maduración como el queso azul, y son de bajo impacto para quesos de poca maduración como los quesos de cabra. Como una de las más importantes para quesos frescos se encuentra la 2-heptanona [79] (aroma a moho, madera, dulce), la cual fue identificada para las muestras de queso en las tres fases de lactancia. Aldehídos Los aldehídos fueron compuestos minoritarios en todas las muestras de queso analizadas, probablemente debido a que son rápidamente convertidos a alcoholes o a sus correspondientes ácidos [97]. Los tres aldehídos que fueron aislados e identificados, nonanal, benzaldehído y decanal, aportan al queso aromas característicos a herbal, flores, ramas y verde [97] respectivamente. Son también compuestos importantes como indicativos de que el queso ha alcanzado una maduración óptima, debido a que concentraciones elevadas pueden causar aromas desagradables [98] . El nonanal es uno de los más importantes para el aroma 83 de quesos que son madurados como Mozzarella, Grana Padano, Buffalo y Pecorino, aportando aromas y sabores herbáceos [99]. Terpenos El único terpeno identificado fue el limoneno en la muestra de queso tres. Estos compuestos son importantes en los quesos elaborados artesanalmente, ya que son usados como marcadores de la región de producción cuando el producto tiene designación protegida de origen, ya que son constituyentes de las plantas usadas en la alimentación animal, los cuales son transferidos a la leche y finalmente al queso [96]. Un ejemplo de ello es el queso Bitto, el cual posee designación de origen, ya que es producido solo al norte de Italia en los meses de junio hasta septiembre, manteniendo al ganado alimentado solo con el pasto producido en esa época del año [97] . Aunque las cabras fueron alimentadas mediante el mismo maíz comercial durante todas las etapas de lactancia, esté pudo variar su composición reflejándose en el limoneno identificado. Ácidos grasos Los ácidos grasos libres fueron identificados en todas las muestras de quesos; ácidos butanoico, hexanoico, octanoico y decanoico han sido reportados anteriormente en la literatura como los compuestos de principal importancia para el aroma del queso de cabra debido a sus bajos umbrales aromáticos [98] , por lo que serán los compuestos a cuantificar en las muestras de quesos analizadas. Durante la maduración de los quesos, los ácidos grasos libres se pueden originar a partir de tres vías bioquímicas principales: lipólisis, proteólisis y fermentación de lactosa [88]. Las enzimas con actividad lipolítica (estereasas, lipasas) pueden causar la liberación de ácidos grasos de cadena lineal (butanoico, pentanoico, hexanoico, heptanoico, octanoico, decanoico y dodecanoico), mientras que las enzimas proteolíticas son responsables de la formación de ácidos grasos de cadena ramificada (2-metilpropanoico y 3-metilbutanoico) mediante la desaminación de aminoácidos tales como valina, leucina e isoleucina [88] . En este caso, como el queso fue elaborado de leche cruda, la lipólisis podría deberse a la acción de las lipasas propias de la leche y al cultivo iniciador proveniente de las enzimas del 84 estómago del cabrito. Otro ácido graso que contribuye al aroma rancio y lácteo del queso es el 3-metilbutanoico, el cual fue identificado en la muestra dos. En el caso del queso de cabra los ácidos grasos de cadena corta son importantes para el aroma conocido como cabral [100] . Todos los compuestos identificados tienen asociado un descriptor de olor característico (Apéndice IV) que en conjunto originan el aroma del queso de cabra analizado. 85 CAPÍTULO IV ENTRENAMIENTO DEL PANEL SENSORIAL Y ANÁLISIS OLFATOMÉTRICO. RESULTADOS Y DISCUSIÓN 4 .1. Entrenamiento del panel sensorial. 4.1.1. Reconocimiento de aromas de alimentos y desarrollo de destreza en asociar descriptores. Para el trabajo sensorial, el panel estuvo conformado finalmente por 6 personas. La falta de interés y motivación del personal con el que se contó para las entrevistas y reclutamiento no permitió tener un mayor número de miembros en el panel, ya que se recomienda un número de 10 a 20 personas, atribuido a que la variabilidad de los resultados incrementa en paneles menores a 10 personas [84] . Por esta razón se dedicó un mayor tiempo de entrenamiento para un buen desempeño individual de los panelistas y mejorar así la variabilidad en las respuestas del grupo [81] . En la Tabla 4.1 se muestran los resultados obtenidos en la prueba de reconocimientos de aromas para el desarrollo de destreza en asociar descriptores. Tabla 4.1. Porcentajes de aciertos individuales y grupal en el reconocimiento de aromas de alimentos. Panelistas* % de aciertos en la prueba K11 82,1 I19 89,3 C41 78,6 F61 75,0 G71 75,0 D51 92,9 % Acierto del grupo 82,1 *panelistas identificados con códigos 86 En base a los resultados para esta prueba, el panel arrojó un promedio de grupo de 82,1 % de aciertos, lo cual según la ASTM E-18 nos ubica en el porcentaje aceptado a considerar como un panel entrenado para la prueba de reconocimiento de aromas, el cual exige un mínimo de 70% en aciertos. Para esta prueba se realizaron repeticiones hasta alcanzar los valores aceptados (sección 3.6.2.2.1). En cuanto a los valores de aciertos individuales, también se obtuvieron valores superiores al 70 %. 4.1.2. Determinación del umbral de identificación de aromas de los panelistas Para la determinación del umbral de detección e identificación del panel se usó el acetato de isoamilo preparado en concentraciones según la norma ISO 354-E. Este compuesto posee un olor característico a cambur. Los resultados obtenidos se presentan en la Tabla 4.2. Tabla 4.2. Umbral de identificación individual de los panelistas usando acetato de isoamilo. Promedio de concentración de Panelistas* umbral de identificación (ppm) D.E. Rango de identificación N= 3 (ppm) K11 6,7 2,9 3,8 – 9,6 I19 0,8 0,3 0,5 – 1,1 C41 0,7 0,3 0,4 – 1,0 F61 8,3 2,9 5,4 – 11,2 G71 8,3 2,9 5,4 – 11,2 D51 3,7 2,3 1,4 – 6,0 *panelistas identificados con códigos; D.E: desviación estándar El umbral de identificación del panel estuvo dividido en 2 grupos; un grupo con un rango de umbral bajo de (0,4 – 1,1) ppm y otro con un umbral más elevado (1,4 – 11,2) ppm, por lo que se trabajó con un valor promedio de 5 ppm para entrenar el grupo, valor para el cual el primer grupo detectó e identificó el olor de los patrones sin dificultad. Se trabajó individualmente con el segundo grupo hasta disminuir su umbral de detección y así se logró que ambos grupos trabajaran bajo esta concentración, la cual fue la usada para el desarrollo de vocabulario a usar en la detección de aromas en olfatometría. 87 4.1.3. Desarrollo del vocabulario del panel para olfatometría. En el desarrollo del vocabulario del panel, la mejor metodología para la percepción y descripción de los olores fue la usada con las tiras olfativas (sección 2.6.2.2.3), ya que los panelistas realizaron una mejor y más detallada descripción y con menos repeticiones de secciones de entrenamiento. La otra metodología usada fue la del espacio en cabeza de los patrones, la cual fue muy útil y eficaz para entrenar al panel en la rapidez para describir los olores, de esta manera cuando los panelistas realizaron detecciones en el equipo de olfatometría hubo mayor confianza y fluidez en la descripción de los olores. Para las sesiones de trabajo en el equipo de olfatometría se usaron una serie de ésteres lineales con aromas característicos reportados (Tabla 4.3), con concentraciones de 5, 10 y 20 ppm, siendo el patrón de 10 ppm el seleccionado para el entrenamiento ya que el panel detectó e identificó mejor esta concentración. Con el patrón de 5 ppm no hubo buena descripción ya que argumentaban baja intensidad de los olores y para el patrón de 20 ppm los aromas percibidos saturaban muchas veces a los panelistas. Tabla 4.3. Compuestos usados para el entrenamiento del panel en olfatometría. compuestos Aroma Propianoato de etilo frutal, dulce Butanoato de etilo frutal, piña Hexanoato de etilo frutal, concha de manzana Octanoato de etilo fruta, rancio, manzana madura Decanoato de etilo fruta cítrica, uva Dodecanoato de etilo papel, verde Al comparar los descriptores reportados para los compuestos usados en el desarrollo del vocabulario del panel (Tabla 4.3) y los arrojados por el panel (Tabla 4.4), se obtuvo una buena correlación en cuanto a los descriptores. 88 Tabla 4.4. Descriptores de aromas de la serie de ésteres lineales en el entrenamiento del panel en olfatometría. Corridas olfatométricas 1 2 tR tD tR tD Descriptores de aromas (min) (seg) (min) (seg) 6,59 7,99 7,04 2,45 crema de leche, yogurt, colita 9,14 4,71 9,34 1,77 frutal, como níspero, coco, licor dulce 13,34 1,20 14,06 3,49 caramelo de frutas, madera ahumada I91 frutal, como cambur, plátano, frambuesa 18,57 4,31 18,10 8,13 24,04 5,22 24,48 2,17 manzanilla, floral, leche hervida, cebo floral, verde, concha de fruta pero no reconoce cual 28,07 3,76 27,46 4,61 6,01 0,28 6,09 0,31 floral, herbal 9,24 0,32 9,15 0,22 frutal, níspero, herbal té verdes, grama, lavanda 13,41 0,19 14,02 0,32 K11 18,21 0,26 18,17 0,25 frutal, esencia de frambuesa, cereza 24,07 0,31 23,58 0,33 hojas de té verde, dulce, refresco de uva 27,56 0,34 27,15 0,30 menta, verde 5,32 0,41 5,19 0,30 harina de trigo, dulce 9,43 0,30 9,11 0,26 licor dulce, alcohol, fruta cítrica 14,43 0,30 14,36 0,22 lavanda, floral C41 18,28 0,29 18,24 0,22 frutal, concha de fruta no reconoce cual, cambur 24,17 1,13 24,15 0,33 caramelo, refresco de manzanita, concha de cambur 28,17 0,27 27,38 0,31 verde, café dulce, tierra 6,43 0,31 5,10 0,75 dulce criollo, menta, herbal 9,51 0,84 9,28 0,46 durazno, níspero maduro, fruta fermentada, alcohol 13,28 1,06 14,55 0,25 suavizante de flores, menta D51 18,30 1,17 18,27 0,51 tutti fruti, caramelo, frutal 24,31 0,55 24,11 1,39 hojas de té dulce, fruta madura no reconoce frutal, concha de cambur, grama, monte 27,35 0,18 27,44 0,40 6,11 4,18 6,31 1,36 perfume floral, flores frescas 9,39 1,59 9,13 1,44 lavanda, flores frescas, níspero maduro 14,01 1,62 13,54 1,86 floral, grama, monte, dulce, fruta cítrica limón G71 18,22 2,27 18,14 1,76 caramelo de frutas, concha de cambur 24,12 3,09 24,00 2,31 queso madurado, rancio, lácteo, yogurt de fruta 28,13 1,58 27,41 1,35 monte, grama, floral 6,34 0,51 6,22 1,00 frutal, caramelo 9,03 0,30 9,24 1,02 fermento lácteo, agrio-dulce, durazno maduro 13,53 0,77 14,20 1,21 cebo, rama, grama, floral F61 19,06 0,54 19,04 0,73 caramelo de fruta, concha de cambur 24,54 0,74 23,44 0,65 no reconoce bien, como frutal, camelo 27,48 1,08 28,03 0,61 herbal, tabaco dulce, concha de cambur maduro *panelistas identificados con códigos, tR= tiempo de retención, tD= tiempo de duración. * Panelista 89 Adicionalmente los tiempos de retención de la serie de ésteres lineales fueron usados para calcular los índices de retención y tratar de identificar las zonas de aromas, pero no hubo buena correlación entre los valores calculados y los valores reportados para una posible identificación de los compuestos por el método olfatométrico. 4.2. Representatividad sensorial de la extracción del aroma del queso de cabra por MEFS. Para el análisis olfatométrico se evaluó inicialmente la representatividad sensorial de la muestra de queso de cabra con las fibras analizadas en la optimización del método analítico para la extracción de los compuestos volátiles por MEFS en espacio en cabeza (sección 2.1.1). En la Tabla 4.5 se presentan los valores obtenidos para el estudio de representatividad del aroma del queso de cabra en resolución cromatográfica nula mediante la extracción con las dos fibras DVB/CAR/PDMS y CAR/PDMS. Tabla 4.5. Análisis del porcentaje de representatividad del aroma del queso de cabra extraído con la fibras DVB/CAR/PDMS y CAR/PDMS. Promedio de medidas * % Representatividad Fibras ± D.E (cm) n=20 DBV/CAR/ PDMS 11 ± 1 72 CAR/ PDMS 5±1 32 *escala no estructurada de 15 cm; D.E= desviación estándar Como se observa, se obtuvo un mayor porcentaje de representatividad con la fibra de tres fases DBV/CAR/PDMS, resultado coherente con las evaluaciones realizadas mediante CG-FID. El valor es aceptado como representativo del aroma extraído por MEFS para el queso evaluado [83]. Para verificar que el aroma del queso fue analizado en condiciones de resolución nula, se realizó un análisis adicional con un compuesto de aroma reportado para el queso de 90 cabra (butanoato de etilo). El tiempo muerto para la sustancia fue de 0,19 min. (n=20, 2 evaluaciones con cada uno de los 10 panelistas). En la Tabla 4.6 se presentan los de tiempos de retención promedio en la evaluación de la representatividad del aroma del queso obtenido con la fibra de tres fases, y para el butanoato de etilo. Tabla 4.6. Evaluación de resolución nula en CG-O de los volátiles extraídos con la fibra DBV/CAR/ PDMS del queso de cabra y patrón de butanoato de etilo. Evaluación del Zonas de Descripción del Tiempo de retención FD aroma aromas olor promedio n=20 tr ± D.E (min) n=20 Queso de cabra 1 Queso madurado 0,21 ± 0,01 20 Butanoato de etilo 1 Queso , lácteo 0,19 ± 0,01 20 FD= frecuencia de detección; D.E=desviación estándar En cromatografía de gases el factor de retención se define como: k´ = tD – tM / tM (Ec. 4.1) tD= tiempo de detección; tM= tiempo muerto Aplicando la Ec.10 a los valores reportados en la Tabla 4.6 para el cálculo del factor de retención (k) en cromatografía de gases [24] , se obtienen valores para k próximos a cero, lo cual demuestra que los análisis de representatividad para el aroma del queso de cabra evaluados con diferentes fibras, fue realizado a resolución nula (R=0). Para demostrar que los tiempos de estadísticamente iguales, se realizo una prueba t retención promedios (n=20) fueran [86] , para 38 grados de libertad, obteniendo un valor de 0,63 para un P=0,05 menor al valor critico (t=2,01), aceptando así la hipótesis nula para la cual los dos tiempos eran iguales y en consecuencia se corrobora que el análisis se realizo en resolución nula. 91 4.3. Análisis olfatométrico del queso de cabra en las tres fases de lactancia El estudio olfatométrico se realizó para verificar las zonas aromáticas individuales más importantes en cada etapa de producción del queso de cabra a partir del inicio de la curva de lactancia, y correlacionar los descriptores arrojados por el panel con los olores característicos de los compuestos identificados por CG-EM. Para las tres muestras de queso de cabra se realizó un total de 12 corridas olfatométricas para cada una y se realizó luego un aromagrama consenso (Apéndice III) para determinar las zonas de aromas con su correspondiente frecuencia de detección y los descriptores característicos de cada zona. La muestra 1 presentó un total de 31 zonas de aromas (Fig. 4.1), de las cuales 11 zonas presentaron una frecuencia de detección (FD) mayor al promedio, importantes de esta manera en la contribución del aroma del queso. Estas zonas están en su mayoría descritas por el panel como aromas a frutas fermentadas, dulces y alcoholadas (Tabla 4.7). Series n<6 n=6 n>6 Fig. 4.1. Aromagrama consenso mediante el método Frecuencia de detección, cuando 6 evaluadores participaron en el experimento para la muestra número 1 de queso de cabra (MQ1) El aromagrama correspondiente a la muestra 2 presentó un total de 43 zonas de aromas (Fig. 4.2), de las cuales 27 zonas poseen un n>6. El panel describió estas zonas en su mayoría como florales, lavanda y madera (Tabla 4.8). 92 Por su parte el aromagrama de la muestra 3 presentó un total de 52 zonas de aromas (Fig. 4.3) y sólo 17 zonas presentaron un n mayor a 6, caracterizadas como aromas florales, monte y grama; en general aromas verdes (Tabla 4.9). Fig. 4.2. Aromagrama consenso mediante el método Frecuencia de detección, cuando 6 evaluadores participaron en el experimento para la muestra número 2 de queso de cabra (MQ2) Series n<6 n=6 n>6 Fig. 4.3. Aromagrama consenso mediante el método Frecuencia de detección, cuando 6 evaluadores participaron en el experimento para la muestra número 2 de queso de cabra (MQ3) 93 Como se observa en los aromagramas obtenidos, el número de zonas de aromas detectadas aumenta con el progreso de la lactancia, lo cual es coherente con los resultados obtenidos en el análisis de CG-EM e indicando también un aumento en la complejidad del aroma hacia la última etapa de lactancia. También se puede confirmar la mayor sensibilidad del olfato en comparación con el detector por espectrometría de masas. Como se dijo anteriormente, no se lograron identificar las zonas de aromas detectadas por olfatometría a partir de la serie de ésteres lineales para realizar la comparación con los compuestos identificados en los análisis mediante CG-EM. Sin embargo se observó que la mayoría de los descriptores usados por el panel en la detección corresponden a los aromas característicos de los compuestos identificados previamente por CG-EM. Hay escasas zonas de aromas con altos valores de frecuencia de detección que se pueden correlacionar a partir de los tiempos de retención y aromas a los compuestos identificados en los análisis cromatográficos En la muestra 1 se describieron dos zonas con una alta frecuencia de detección (n>6): una zona descrita con aromas a lácteo, leche dañada y/o queso rancio a un tiempo de 16,13 min (Apéndice III) y en el análisis CG-EM se identifico el ácido hexanoico a un tiempo de elución de 15,39 min., el cual presenta estos descriptores para su aroma. La segunda zona en 20,91min descrita como frutal, fruta fermentada, floral y cítrico, la cual se puede asociar con el nonanal, identificado en el análisis cromatográfico en un tiempo de 19, 54min. 94 Tabla 4.7. Zonas de aromas (ZA) para la muestra de queso 1. negrita= descriptor usada con una frecuencia > 3 En la muestra de queso 2 se obtuvo, al igual que la muestra 1, una zona con un alto valor de FD en un tiempo de retención de 20,89 min que se puede asociar también con el compuesto nonanal. Adicionalmente esta muestra presentó dos zonas con altas frecuencias de detección (FD=10) (Apéndice III), la primera en un tiempo de elución 14,38 min con descriptores a grasa, cebo, lácteo, rancio, la cual se puede correlacionar con el ácido hexanoico identificado en un tiempo de elución de 15,35 min y una segunda zona en 8,33 min descrita como frutal, ensalada de frutas, la cual se puede asociar con el butanoato de etilo, el cual fue identificado a los 7,55 min y se caracteriza por poseer aroma frutal a manzana. 95 Tabla 4.8. Zonas de aromas (ZA) para la muestra de queso 2. negrita= descriptor usada con una frecuencia > 3 Se pudo observar la zona número 49 de la muestra 3 con descriptores como concha de naranja, mandarina, limón, fruta cítrica, irritante, con un tiempo de retención de 27,26 min (Apéndice III), y si se observan los compuestos identificados para esta muestra, se observa que solo está presenta el compuesto decanal, el cual posee un aroma a concha de naranja (Tabla 3.3) en un tiempo de 23,32 min. 96 Tabla 4.9. Zonas de aromas (ZA) para la muestra de queso 3. negrita= descriptor usada con una frecuencia > 3 97 CAPÍTULO V CUANTIFICACIÓN DE LOS ÁCIDOS GRASOS DEL QUESO DE CABRA EN LAS TRES FASES DE LACTANCIA. RESULTADOS Y DISCUSIÓN 5.1. Curvas de calibración La cuantificación de los ácidos grasos libres (AGL) en las muestras de queso de cabra se realizó mediante el método de estándar externo usando MEFS-CG-FID. Inicialmente para el análisis se optimizó el volumen total a usar de los patrones para la extracción, ya que este parámetro debe permanecer constante para que no haya variación en la cantidad de compuestos extraídos por la fibra [87] . En la Fig. 5.1 se observa que las áreas para los ácidos butanoico y hexanoico aumentaron gradualmente de forma constante al aumentar el volumen a diferencia de los ácidos de octanoico y decanoico los cuales presentaron variabilidad en el proceso de extracción, muy marcado para el ácido decanoico, posiblemente debió al fenómeno de competencia de los otros AGL presentes por los espacios activos de la fibra, por lo que se tomó 2 mL como el volumen a usar de los patrones ya que se observó una mayor sensibilidad en la extracción para la mayoría de los AGL, reflejada en el área de las señales cromatográficas y se trató de usar la menor cantidad posible de los compuestos puros. Se usaron 5 patrones de AGL para cada curva de calibración (Apéndice II) con un rango de concentración de 10 a 800 ppm, obteniendo valores de coeficientes de variación (CV) bajos, comprendidos en un rango de 1-9 % para un n=3. 98 Área (adimensional) 6000 5000 4000 Ac. Butanoico 3000 Ac. Hexanoico Ac. Octanoico 2000 Ac. Decanoico 1000 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 Volumen (mL) Fig. 5.1. Optimización del volumen usado para los patrones de AGL para las curvas de calibración externa. En otros estudios realizados en cuantificación de compuestos volátiles en alimentos por la técnica de MEFS en espacio en cabeza han reportado valores de CV que no exceden el 10 %. Díaz [96] en el análisis de volátiles en especias, reportó valores de 1,4 - 9,3 % y estudios de volátiles en quesos han reportado rangos de 2,5 - 7,9 % [92] . La reproducibilidad fue difícil de controlar ya que el tiempo de muestreo fue un parámetro crítico a controlar para obtener precisión en el proceso de extracción y mantener la linealidad de las curvas de calibración, resultado que es atribuido al fenómeno de competencia de los compuestos y afinidad por la fibra [87]. Las curvas de calibración arrojaron buenos coeficientes de correlación (R2) próximos a 1(Fig. 5.2, 5.3, 5.4 y 5.5), mostrando una relación lineal entre las áreas de las señales cromatográficas y las concentraciones de los patrones de los AGL, en el intervalo estudiado. 30000 y = 63,93x + 617,0 R² = 0,998 25000 Área 20000 15000 10000 5000 0 0 100 200 Concentración (ppm) 300 400 Fig. 5.2. Curva de calibración del ácido butanoico Área 99 y = 54,21x + 554,87 R 2 = 0,9994 50000 45000 40000 35000 30000 25000 20000 15000 10000 5000 0 0 200 400 600 800 Concentración (ppm) Fig. 5.3. Curva de calibración del ácido hexanoico 25000 y = 55,419x - 765,35 R2 = 0,9999 Áreas 20000 15000 10000 5000 0 0 100 200 300 Concentración (ppm) 400 Áreas Fig. 5.4. Curva de calibración del ácido octanoico. y = 17,89x + 418,8 R² = 0,999 14000 12000 10000 8000 6000 4000 2000 0 0 100 200 300 400 500 600 700 Concentración (ppm) Fig. 5.5. Curva de calibración del ácido decanoico 100 5.2. AGL en el queso de cabra En la Tabla 5.1 se presentan las concentraciones obtenidas de los AGL en el espacio en cabeza del queso de cabra analizado. Se observa que todos los compuestos aumentaron su concentración en el máximo de la curva de lactancia, posiblemente debido a la mayor acción de las lipasas propias de la leche cruda y/o del coagulante (provenientes del estómago del cabrito) en el proceso de lipólisis [52] . Otros factores que pudieron ocasionar el aumento de los AGL en el queso elaborado en la fase dos de lactancia, fue una mayor concentración inicial de ácidos grasos libres propios de la leche y una mayor cantidad de grasa. Tabla 5.1. Concentración en el espacio en cabeza de los ácidos grasos libres (AGL) en las tres fases de lactancia AGL LD (ppm) LC (ppm) Concentración promedio n=3 (ppm) MQ1 MQ2 MQ3 Butanoico 25 83 <LC 133 <LC Hexanoico 29 95 268 490 131 Octanoico 4 16 166 235 129 Decanoico 19 65 448 663 333 a= y= TIC área, x= concentración (ppm), LD= límite de detección, LC=límite decuantificación, MQ: muestra de queso, (1) al inicio de la curva de lactancia; (2) en la mitad de la curva de lactancia y (3) al final de la curva de lactancia Al realizar una prueba estadística aplicando un análisis de varianza de una vía para comparar cada AGL en cada fase de lactancia, se obtuvo que existen diferencias significativas entre cada una de las concentraciones de los AGL en las muestras de quesos en las tres fases de lactancia (Fig. 5.6). Estas diferencias serán tratadas posteriormente mediante el método Multidimensional Scaling (MDS). 101 Fig. 5.6. Distribución de los AGL en las muestras de queso de cabra en las tres fases de lactancia La cuantificación de los ácidos grasos libres permitió calcular sus valores de actividad de olor (VAO), los cuales son necesarios para estimar la contribución de cada compuesto al aroma del queso de cabra analizado. Este parámetro fue calculado para cada AGL cuantificado y con valores de umbrales de aromas reportados en la literatura (Tabla 5.2). Los valores de VAO para el ácido butanoico y hexanoico fueron mayores a 1, lo cual indica que las concentraciones de los compuestos son mayores que el umbral sensorial y de esta manera los compuestos contribuyen potencialmente al aroma característico del queso de cabra, siendo clasificados entonces como compuestos activos de aroma [72,78] . Para el acido octanoico, el VAO fue solo mayor a 1 en el máximo de la curva de lactancia por lo que es en este estado de producción del queso, donde este compuesto es importante, contribuyendo al olor rancio característico y apreciado por los consumidores. Tabla 5.2. Valores de actividad de olor (VAO) de los ácidos grasos libres (AGL) en el queso de cabra. AGL Umbral [72,78] sensorial VAO MQ1 MQ2 MQ3 Butanoico 7,74 7,08 17,12 3,63 Hexanoico 31,74 8,46 15,43 4,14 Octanoico 203,49 0,82 1,16 0,63 Decanoico NR - - - VAO: valores de actividad de aroma, MQ: muestra de queso, (1) al inicio de la curva de lactancia; (2) en la mitad de la curva de lactancia y (3) al final de la curva de lactancia, NR: no reportado 102 Cuando se analiza la actividad de los compuestos de aromas en alimentos, el pH es una variable importante para las medidas de los valores de umbrales, ya que se considera su efecto en el estado de los compuestos, si están disueltos, libres o unidos a otros compuestos. De esta manera las características del medio limita la volatilidad de los compuestos, influenciados por sus polaridades y coeficientes de partición [95] . Así el análisis de los compuestos de aroma puede llegar a ser muy complicado a causa de los múltiples mecanismos que afectan a los componentes, tales como transferencia de masa, impedimentos estructurales e interacciones con la matriz [91] . En el caso del queso, la caseína puede tener un efecto en la retención de los compuestos importantes para el aroma, ya que ésta proteína tiene regiones tanto hidrofóbicas como hidrofilicas en su estructura que pueden actuar como sitios de enlaces para los compuestos [92] , de esta manera para calcular los umbrales de olor lo ideal sería realizarlo en el alimento en estudio o en una réplica de la matriz. Los valores de umbrales usados en el presente trabajo para calcular los VAO, fueron tomados de la literatura en trabajos realizados en leche, por lo que la diferencias en el pH y efectos de matriz podrían arrojar valores con pequeñas desviaciones, sin embargo se han [93] reportado VAO para AGL en quesos con valores similares , por lo que se estima que los VAO reportados en el presente trabajo son valores razonables. En un estudio realizado acerca del efecto de la lipólisis en la evolución de los compuestos de aromas en el tiempo en queso de cabra [73] , fue reportado un valor promedio de 203,49 ppm para el ácido octanoico, muy similar al reportado en el presente trabajo, pero con valores menores para los ácidos butanoico y hexanoico, los cuales fueron de 10,34 ppm y 42,65 ppm, respectivamente, por lo que el ácido octanoico fue el AGL con mayor potencial en el aroma del queso de cabra para ese estudio con un VAO de 8,7 y en nuestro caso los ácidos butanoico y hexanoico influyen más en el aroma del queso analizado. 103 CAPITULO VI ANÁLISIS ESTADÍSTICO DE LOS AGL CUANTIFICADOS EN EL QUESO DE CABRA Y ZONAS DE AROMAS DEL ANÁLISIS OLFATOMETRICO. RESULTADOS Y DISCUSIÓN 6.1. Análisis de los AGL en las muestras de quesos en las tres fases de lactancia Las diferencias o similitudes en el perfil de los ácidos grasos libres durante la elaboración del queso de cabra en las tres fases de la curva de lactancia fueron analizadas mediante el método estadístico "Multidimensional Scaling" (MDS Kruskal 1964). El punto de partida fue generar una matriz de proximidades entre las áreas cromatográficas medidas para cada AGL para cada fase de análisis de muestras, y estudiar el espacio multidimensional con el mínimo número de dimensiones posible. La representación de los datos de manera gráfica permite visualizar las distancias entre variables y las muestras. Este método de análisis origina cluster que proporcionan una base para la interpretación de la estructura de la distribución del conjunto de variables o grupos de compuestos en cada estado. Este método estadístico es ampliamente usado en análisis sensorial de alimentos [102] , donde se obtiene poca data por lo restringido de trabajar con los sentidos, ya que está presente el factor fatiga de los panelistas. En quesos, se han reportado trabajos para análisis de texturas y sabor con panelistas entrenados y consumidores[103][104], y de aromas generados por microorganismos en quesos modelos [105]. Para el tratamiento estadístico inicialmente se calcularon las desviaciones estándar y los coeficientes de variación para cada AGL de los quesos elaborados en los tres estados de lactancia (Tabla 6.1). Se encontró el mayor porcentaje de variación para el ácido butanoico, con un 58%. Se obseva una mayor diferencia en las medidas para este compuesto en las tres fases de la elaboración del queso de cabra, como se representa en el histograma (Fig. 6.1a) con un mínimo de 2343 y un máximo de 9593. A diferencia del butanoico, el compuesto que menor dispersión presentó en los tres estados de lactancia fue el ácido decanoico (Figura 6.1d), con un 24% en el coeficiente de variación. 104 Tabla 6.1. Áreas medidas en CG-FID de los AGL en las tres fases de lactancia y sus coeficientes de variación AGL Prom. Áreas n=9 Mínimo Máximo Desvest. % CV Butanoico 5207 2343 9593 3035 58 Hexanoico 16627 6765 29658 8581 52 Octanoico 9029 5793 13047 2681 30 Decanoico 7030 4164 8955 1653 24 cv.=coeficiente de variación, prom=promedio Histogram: Butanoico K-S d=.26140, p> .20; Lilliefors p<.10 Expected Normal Histogram: Hexanoico K-S d=.21326, p> .20; Lilliefors p> .20 Expected Normal 3 2 No. of obs. No. of obs. 3 1 2 1 0 1000 2000 3000 4000 5000 6000 7000 8000 9000 0 10000 0 5000 X <= Category Boundary 10000 (a) 20000 25000 30000 8000 9000 (b) Histogram: Decanoico K-S d=.28023, p> .20; Lilliefors p<.05 Expected Normal Histogram: Octanoico K-S d=.17743, p> .20; Lilliefors p> .20 Expected Normal 3 No. of obs. 3 No. of obs. 15000 X <= Category Boundary 2 2 1 1 0 3000 0 5000 6000 7000 8000 9000 10000 11000 12000 13000 4000 14000 5000 6000 7000 X <= Category Boundary X <= Category Boundary (d) (c) Fig. 6.1. Histogramas de los AGL; (a) Decanoico. Butanoico, (b) Hexanoico, (c) Octanoico, (d) Para proveer una estimación cuantitativa de la relación lineal de la data mediante la configuración realizada por MDS, se calcularon los coeficientes de correlación para todos los 105 ácidos grasos libres (Tabla 6.2). Obteniendo valores mayores a 0,7 para la mayoría de los AGL a un nivel de significancia de 0,05. Tabla 6.2. Coeficientes de correlación de los AGL AGL Butanoico Hexanoico Octanoico Decanoico Butanoico 1,00 0,98 0,94 0,69 Hexanoico 0,98 1,00 0,93 0,78 Octanoico 0,94 0,93 1,00 0,73 Decanoico 0,69 0,78 0,73 1,00 Con el objetivo de representar la estructura jerárquica en la formación de los grupos o conglomerados de los AGL en los quesos, se utilizó el dendograma. Este gráfico nos permitió visualizar las distancias de enlace y obtener los valores de correlaciones de Pearson ayudándonos a establecer los grupos de los compuestos según sus similitudes. El diagrama se realizó inicialmente con las correlaciones de las variables, que fueron los AGL (Fig. 6.2), en el cual se formaron tres grupos (A, B y C). En el grupo A se encuentra el ac. butanoico y hexanoico con una misma distancia de enlace de 0,02 arrojando una correlación positiva de similitud del 100%, luego se encuentra el ac. octanoico en el grupo B con una distancia de enlace de 0,06 y una correlación del 67 % con el grupo B. Finalmente se encuentra en el grupo C, el ac. decanoico con la mayor distancia de enlace de 0, 22, lo cual origina una correlación muy baja respecto a los grupos A y B, con un 9 y 27%. 106 Fig. 6.2. Dendograma de las variables (ac. butanoico, hexanoico, octanoico y decanoico) en las tres fases de la curva de lactancia. De acuerdo a la información obtenida de la Fig. 6.2, se podría inferir que los ácidos butanoico y hexanoico se encuentran en un mismo grupo jerárquico para los quesos de cabra en todas las fases de elaboración, siendo estos los AGL que aportaron mayor contribución al aroma, ya que presentaron los valores más altos de actividad de olor. Según Urbach [106] , en quesos producidos con leche cruda la principal ruta bioquímica de producción de los AGL lineales de cadenas corta y mediana es la lipólisis, siendo muchas veces los productos más importantes los ácidos butanoico y hexanoico, el cual se evidencia en investigaciones realizadas a otros queso como el Provola del Nebrodi [108] y en la Serena [107] , Parmigiano [109] . En la estructura del dendograma realizado para obtener la distribución de los quesos en las tres fases de la curva de lactancia respecto a las variables (Figura 6.3), se obtuvieron nuevamente tres grupos, donde se observa una relación del queso 1 (grupo A) con el queso 3 (grupo C) y luego estos dos grupos con el queso 2 (grupo B). Esto se podría atribuir a que los AGL presentaron un máximo en sus concentraciones en el queso elaborado a mitad de la curva de lactancia y fueron menores en los quesos elaborados al principio y final de 107 producción. Aunque por lo pequeñas de las distancia de enlace para este diagrama (0,00 – 0,05) no se pudo concluir una correlación más detallada de los tres estados. Tree Diagram for 9 Cases Single Linkage 1-Pearson r Grupo A Q1a Q1c Q1b Grupo B Q3a Q3c Q3b Q2a Grupo C Q2b Q2c 0.00 0.01 0.02 0.03 0.04 0.05 Linkage Distance Fig. 6.3. Dendograma de las muestras de quesos en las tres fases de la curva de lactancia. En la Figura 6.4 se muestra la disposición de las variables en cuanto a sus disimilitudes a partir de la iteración realizada por el algoritmo en MDS para obtener los gráficos en dos dimensiones, el cual presento un buen ajuste del método con un bajo valor de stress (0,000), el cual según Kruskal [110] es un valor excelente de ajuste. La configuración 6.4a muestra una similitud de los ácidos butanoico y hexanoico con valores bajos de correlación tanto para la dimensión 1 como para la 2, presentando este conjunto diferencias con los ácidos restantes, ya que el octanoico presenta un valor alto en al dimensión 2, y el decanoico se ubica con un valor alto en la dimensión 1, arrojando de esta manera el mismo comportamiento obtenido en el análisis de los cluster. Al tratar de correlacionar la distribución de los AGL con la distribución de los quesos (Figura 6.4b), se podría inferir que la muestra de queso 2 se ubica con valores más altos hacia los ácidos 108 butanoico, hexanoico y octanoico, diferenciándose así de las muestras de quesos 1 y 3 que se encuentran con valores más altos en la dimensión 1. Q1= queso inicio; Q2= mitad; Q3=Final curva de lactancia; A,B,C= replicas Fig. 6.4. Configuración de dos dimensiones de los AGL para los quesos de cabra en los tres estados de lactancia derivada del modelo de distancia euclídea. El comportamiento de la distribución de los quesos en relación a los AGL en la configuración del gráfico de dos dimensiones se podría correlacionar con los resultados obtenidos de la cuantificación de los mencionados compuestos, ya que se obtuvo que la 109 concentración de todos los ácidos aumentaban en la muestra de queso 2, siendo el ácido decanoico el que presentó el valor más alto de concentración, diferenciándose de esta manera el queso 2 de los quesos 1 y 3. 6.2. Análisis estadístico de las zonas de aromas obtenidas en el análisis olfatométrico de los quesos de cabra. Para describir el aroma general de cada muestra de queso se agruparon las zonas descritas con frecuencias de detección mayores a 6 en 7 familias de aromas, las cuales fueron; frutal-dulce, caramelo-dulces, frutas fermentadas, floral-lavanda, herbal, lácteorancio y frutal-herbal. Esto permitió construir un grafico con sistemas de coordenadas concéntricas (Fig. 6.5). Esta representación se realizó con el fin de generar un perfil del producto en cada etapa de producción de acuerdo a la curva de lactancia y apreciar las diferencias prevalecientes entre productos por descriptores de aromas. En este perfil se observo que las muestra 1 y 2 presentaron un mayor número de zonas características con aromas frutales y dulces y la muestra 3 una marcada diferencia con aromas herbales. Frutal, dulce 6 5 4 Frutal, Herbal Caramelo, dulces 3 2 1 MQ1 0 Lácteo, rancio MQ2 Fruta fermentada Herbal MQ3 Floral, lavanda Fig. 6.5. Perfil de aromas de las muestras de quesos de cabra Para el análisis de los grupos de aromas conformados para generar un perfil de los quesos se realizó un análisis estadístico mediante MDS con la finalidad de estudiar las diferencias y semejanzas que existen entre los perfiles de aroma. Inicialmente se realizó el análisis de conglomerados (Fig. 6.6) a partir de la correlación de las variables (familias de aromas). Según las distancia de enlaces de las variables se pueden identificar 4 grupos. En el grupo 1 se encuentra ubicado el aroma frutal-dulce con una correlación positiva de 110 igualdad del 100% con el aroma a fruta fermentada, luego se tienen los aromas floral lavanda y lácteo-rancio en el grupo 2 con una correlación positiva con el grupo 1 de 40% y del 99 % con el grupo 3, el cual está compuesto por las variables caramelo-dulces y frutalherbal y por último se encuentra el grupo 4 con el descriptor herbal el cual tiene una mayor distancia de enlace y como consecuencia una baja correlación con los primeros tres grupos. Tree Diagram for Variables Single Linkage 1-Pearson r Frutal-dulce Grupo 2 Grupo 1 Fruta fermentada Floral-lavanda Lácteo-rancio Frutal-herbal Grupo 4 Grupo 3 caramelo-dulces Herbal 0,0 0,2 0,4 0,6 0,8 1,0 Linkage de Distance Distancia enlace Fig. 6.6. Dendograma de las variables (familia de aromas obtenidas por el análisis olfatométrico) de los quesos elaborados en las tres fases de la curva de lactancia. La similitud entre las familias de aromas para cada muestra de queso se puede apreciar mejor en la Figura 6.7, donde los aromas frutal-herbal y caramelo-dulces presentaron mayores semejanzas entre ellos como se obtuvo en el análisis de las variables en el dendograma, agrupándose en el cuadrante inferior izquierdo entre -0,4 y -0,8, clasificado como el grupo 2. El aroma a herbal se clasificó como el grupo 3 y se ubicó en el cuadrante derecho inferior entre 1,8 y -0,2 presentando diferencia con el grupo 2. Los grupos de aromas restantes presentaron similitud y se clasificaron en el grupo 1 ubicándose en el cuadrante superior izquierdo entre -0,1 y 0,6, diferenciándose de las zonas de herbal y 111 frutal-herbal y caramelos-dulces. De esta manera se obtuvo que las muestras de quesos se diferencian en tres zonas de aromas, en base a los datos de las variables estudiadas (herbal; frutal-herbal, caramelo-dulce y frutal-dulce, fruta fermentada, lácteo-rancio). El valor de stress asociado a esta configuración fue bajo (0,00), lo cual indica un buen ajuste del modelo para las familias de descriptores de aromas en el mapa de dos dimensiones realizado [110]. Scatterplot 2D Final Configuration, dimension 1 vs. dimension 2 0,8 0,6 Floral-lavanda Lácteo-rancio Fruta fermentada 0,4 Frutal-dulce Grupo 1 Dimension 2 0,2 0,0 Grupo 3 Herbal -0,2 -0,4 -0,6 -0,8 Grupo 2 Frutal-herbal caramelo-dulces -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 1,8 2,0 Dimension 1 Fig. 6.7. Configuración en dos dimensiones de los grupos de aromas para las muestras de quesos de cabra. Para correlacionar los quesos con los tres grupos de aromas generados en el análisis de las variables, se realizó el gráfico de dos dimensiones para todas las muestras de quesos (Fig. 6.8). En este análisis se obtuvo que la muestra de queso 1 se ubicó hacia el cuadrante superior izquierdo correlacionándose así con la ubicación de la familia de aromas del grupo 1 (frutal-dulce, fruta fermentada, lácteo-rancio). Esta muestra en el análisis por CG-EM presentó como compuestos mayoritarios los alcoholes, los cuales pueden contribuir con aromas característicos al grupo 1. La muestra de queso 2 se ubicó en el cuadrante inferior derecho, correlacionándose así con el grupo de aromas 3 (herbal), este resultado se puede atribuir a que esta muestra presentó las mayores concentraciones en el espacio en 112 cabeza de los ácidos grasos libres, adicionalmente se observa que esta muestra presenta un componente en el mismo cuadrante de la muestra de queso 1 y esto puede ser atribuido a que al igual que la muestra 1, posee como compuesto mayoritario los alcoholes. Finalmente la muestra 3 se ubica en el cuadrante inferior izquierdo correlacionándose con la ubicación del grupo 2 (frutal-herbal, caramelo-dulces), ya que para esta muestra se identificó como compuestos mayoritarios los ésteres, aunque con un número igual de alcoholes que los presentes en la muestra de queso 1, por lo que se observa en el gráfico un componente de la muestra 3 junto con la muestra 1. Scatterplot 2D Final Configuration, dimension 1 vs. dimension 2 0,8 MQ2C 0,6 MQ1A MQ1B MQ3B MQ3C 0,4 Dimension 2 0,2 0,0 -0,2 MQ3E MQ3D MQ3F MQ2B MQ2A -0,4 MQ3A -0,6 -0,8 -1,4 -1,2 -1,0 -0,8 -0,6 -0,4 -0,2 0,0 0,2 0,4 0,6 0,8 1,0 1,2 1,4 1,6 Dimension 1 Fig. 6.8. Configuración en dos dimensiones para todas las muestras de quesos de cabra 113 CONCLUSIONES • Se aislaron e identificaron los compuestos responsables del aroma del queso de cabra a lo largo del período de lactancia, siendo los pertenecientes a la familia de los alcoholes los mayoritarios en las muestras de queso unos y dos, y los pertenecientes a la familia de los ésteres los mayoritarios en la muestra tres. • El aroma del queso de cabra se hace más complejo a lo largo del período de lactancia, evidenciándose al aumentar el número de compuestos identificados y el número de zonas de aromas descritas en los análisis olfatométricos. • Se implementó el análisis olfatométrico mediante el acoplamiento del detector de olor al equipo de cromatografía de gases, con el funcionamiento un programa de detección y registro de la señal olfatométrica con el programa LabView 8.5. • Los aromas a frutas fermentada alcoholadas para la muestra al inicio del periodo de lactancia; floral, lavanda para la muestra número dos y floral, verde para la muestra final caracterizaron el perfil aromático de los quesos de cabra en las fases de lactancia evaluadas. • No se lograron identificar las zonas de aromas obtenidas en los análisis olfatométricos mediante el uso de ésteres lineales para la correlación con los compuestos identificados en el análisis mediante CG-EM. • Los AGL se cuantificaron mediante curva de calibración externa y presentaron concentraciones que están de acuerdo con los valores que se encuentran en 114 la bibliografía, presentado un aumento en la muestra de queso de cabra analizada en la segunda fase de la curva de lactancia. • La comparación entre el perfil de los AGL cuantificados y los análisis olfatométricos mediante el uso del MDS permitió diferenciar los quesos de cabra elaborados con leches provenientes de tres estadios de lactancia, ubicando la muestra número uno y tres en el mismo grupo jerárquico con una relación positiva a partir de los ácidos butanoico y hexanoico y con zonas de aromas características a aromas lácteos, fermentadas. 115 RECOMENDACIONES El estudio realizado permite hacer las siguientes recomendaciones: • Entrenar al panel para la determinación de intensidad de los olores en el análisis olfatométrico y así realizar cálculos de porcentajes de frecuencias modificadas para posibles análisis estadísticos de los aromagramas obtenidos. • Realizar un estudio de aceptabilidad para correlacionarlo con las concentraciones de los AGL cuantificados en el espacio en cabeza del queso de cabra en los tres estados de lactancia, y de esta manera proponer en cual fase de lactancia el producto tendría una mayor demanda para consumo. • Correlacionar los compuestos identificados en el queso de cabra mediante el análisis de CG-EM con las zonas de aromas obtenidos por olfatométria mediante el método retention time locking para una posible identificación de los compuestos por CG-O. • Realizar los análisis de extracción de los volátiles mediante MEFS usando cantidades menores de 1g de muestras de quesos para verificar la saturación de la fibra. • Determinar el contenido de grasa en las muestras de queso en las tres fases de lactancia para correlacionarlo con las concentraciones de los AGL. • Realizar investigaciones que permitan estandarizar los procesos de elaboración de quesos artesanales en el país y esto permitiría una consecuente mejoría en la caracterización del producto, como lo es el aroma. 116 REFERENCIAS BIBLIOGRÁFICAS 1. Vega S. (2005). Leche de cabra: producción, composición y aptitud industrial. Departamento de Producción Agrícola y Animal, Universidad Autónoma Metropolitana, unidad Xochimilco. http://www.alfaeditores.com/. (Consultado: 20-062008) 2. Guo, M., Wang, S., Li, z., Qu, J., Jin, L. y Kindstedt, P. (1998). Ethanol stability of goat's milk. Intern. Dairy J., 8: 57-60. 3. Jandal, J. (1996). Comparative aspects of goat and sheep milk. Small Rumim. Res., 22: 177-185. 4. Durán, L. (2007). Identificación de bacterias acido lácticas asociadas con los aromas del queso de cabra artesanal. Tesis de Maestría en ciencias de los Alimentos, Universidad Simón Bolívar. 5. Ferrandini, E. (2006). Elaboración de queso de Murcia Al Vino con cuajo natural en pasta. Tesis doctoral en veterinaria. Universidad de Murcia. http://www.tesisenred.net/handle/10803/11055. (Consultado: 6-07-10). 6. Montserrat Ria, A. (2005). Caracterización de compuestos volátiles en bebidas derivadas de fruta. Tesis doctoral en medicamentos, alimentación y salud, Universidad de Barcelona. http://www.tesisenred.net/handle/10803/2429. (Consulatdo: 3-05-09). 7. Sancho, J., Bota, E., Bota, E. y Castro, J. (1999). Introducción al análisis sensorial de los alimentos. Ediciones Universidad de Barcelona, 1ª Edición, pp. 61-67. 8. Witting, E. (2001). Evaluación sensorial. Una metodología actual para tecnología de alimentos. http://mazinger.sisib.uchile.cl/repositorio/lb/ciencias_quimicas_y_farmaceuticas/wittin ge01/index.html. (Consultada: 15-11-2008). 117 9. Heymann, H., Holt, D. y Cliff, A. (1993). Measurement of flavour by descriptive techniques. In flavor measurement. Edited by institute of Food Technologist Basic Symposium Series, Marcel Dekker Inc. New York, pp.111-118. 10. Acre, T. (1993). Bioassays for flavor, In Flavor Science. Sensible principles and techniques. Edited by Terry Acree and Roy Teranishi. ACS Profesional Reference Book, American Chemical Society, Washington DC, pp.1-20. 11. Rossiter, K. (1996). Structure-Odor relationships. Chem. Rev., 96: 3201-3240. 12. Manfungás, E. (2007). Evaluación sensorial de los alimentos. Editorial Universitaria de cuba. 1ª Edición, pp. 5-7. 13. Buck, &., Axel, R. (1991). A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell. 65: 175-187. 14. Cedrón, T. (2004). Estudio analítico de compuestos volátiles en vino. Caracterización quimiométrica de distintas denominaciones de origen. http://dialnet.unirioja.es/servlet/autor?codigo=1226295 (Consultado: 5-07-09) 15. Mistry, B., Reineccius, T., y Olson, L. (1997). Gas Chromatography – Olfactometry for the determination of key odorants in foods. In: Ray Marsili. Techniques for analyzing food aroma. Marcel Dekker. 2nd Edición, pp. 265-280. 16. Reineccius, G. (1994). Source book of flavors. Chapman & Hall. New York, 1ª Edición, pp.24. 17. Schneider, R. ( 2001). Monoterpenic and norisoprenoidic glycoconjugates of Vitis vinifera L. cv. Melon B. as precursors of odorants in Muscadet wines J. Chromat. A. 936: 145-157. 18. Berdagué, J., Tournayre, P. y Cambou, S. (2007). Novel multi-gas chromatographyolfactometry device and software for the identification of odour-active compounds. J. of Chromat. A, 1146: 85-92. 118 19. Belitz, H. y Grosch, W. (1988). Química de los alimentos. Acribia S.A, España, 1ª Edición, pp.629-677. 20. Conor, M., Graham, E. y Jean-Pierre, D. (2006). Gas chromatography – olfactometry. A review. J. Sep. Sci. 29: 2107-2125. 21. Madrid, J. (2004). Evaluación del envejecimiento de la cerveza por cromatografía de gases-olfatometría (CG-O). Tesis de pregrado en química, Universidad Simón Bolívar. 22. Plutowska, B. y Wardencki ,W. (2008). Aplication of gas chromatography – olfactometry (GC-O) in analysis and quality assessment of alcoholic beverages – A review. Food Chem. 107:449-463. 23. Bravo, A., Herrera, J., Scherer, E., Ju-Nam, Y., Rubsam, H., Madrid, J., Zufall, C. y Rangel, R. (2008). Formation of α-dicarbonyl compounds in beer during storage of pilsner. J. Agric. Food Chem. 56: 4134-4144. 24. Skoog, D., Holler, F. y Nieman, T. (2001). Principios de análisis instrumental. Mc Graw Hill S.A, España, 5ª Edición, pp. 746-748. 25. Reg,a B., Fournier, N. y Guichar, E. (2003). Solid phase microextraction (SPME) of orange juice flavour: odor representativeness by direct gas chromatography olfactometry (D-GC-O). J. Agric. Food Chem. 51: 7092-7099. 26. Dravnieks, A. (1985). Atlas of odor carácter profiles. ASTM. Philadelphia, PA. 354. 27. Ruth, S. (2001). Methods for gas chromatography – olfactometry: A review. Bimolecular Engineering. 17: 121-128. 28. Grosch, W. (1993). Detection of potent odorants in foods by aroma extract dilution analisis. Trends in Food Sci. Technol. 4: 68-93. 29. Van Ruth, S. (2001). Methods for gas chromatography – olfactometry: a review. Biomolecular Engineering. 17: 121-128. 119 30. Da Silva, M., Lundahl, D. y McDaniel, M. (1994). Trends in Flavour Research. Developments in food science. 35:191-209. 31. Nicklaus, S., Sémon, E., Mielle, P. y Guichard, E. (2004).Representativeness of extracts of offset paper packaging and analysis of the main odor-active compounds. J. Agric. Food Chem.52: 2326-2334. 32. Ferreira, V., San Juan, F., Escudero, A., Cullere, L., Zurbano P, Saenz, P. y Cach,o J. (2009). Modeling quality of Premium spanish red wines from gas chromatographyolfactometry data. J. Agric. Food Chem. 57: 7490-7498. 33. Le Guen, S., Prost, C. y Demaimay, M. (2001). Evaluation of the representativeness of the of cooked mussel extracts and the relationship between sensory descriptors and potent odorants J. Agric. Food Chem. 49: 1321-1327. 34. Komthong, P., Hayakawa, S., Katoh, T., Igura, N. y Shimoda, M. (2006). Determination of potent odorants in apple by headspace gas dilution analysis. Lebensmittel-Wissenschaft und –Technologie.39: 472-478. 35. Venkateshwarlu, G., Le,t M,. Meyer, A. y Jacobsen, C. (2004). Chemical and Olfactometric Characterization of Volatile Flavor Compounds in a Fish Oil Enriched Milk Emulsion. J. Agric. Food Chem.52: 311–317 36. Théron, L., Tournayre, P., Kondjoyan, N., Abouelkaram, S., Santé-Lhoutellier, V. y Berdagué, J. (2010). Analysis of the volatile profile and identification of odour active compounds in Bayonne ham. Meat Science. 85: 453-460. 37. Culleré, L., Ferreira, V., Chevret, B., Venturin,i M., Gimeno, A. y Blanco, D. (2010). Characterisation of aroma active compounds in black truffles (Tuber melanosporum) and summer truffles (Tuber aestivum) by gas chromatography–olfactometry. Food Chemistry. 122: 300-306. 38. Spitzer, J. y Buettner, A. (2010). Characterization of aroma changes in human milk during storage at 19 °C. Food Chemistry.120: 240-246 120 39. Acampora, B., Dugo, P., Dugo, G. y Mondello, L. (2008). Gas chromatography – olfactometry in food flavour analysis. J. Chrmatography A, 1186:123-143. 40. Alpendurada, M. (2000). Solid-phase microextraction: a promising technique for sample preparation in environmental analysis. J.Chromatogr. A, 889: 3-14. 41. Zhang, Z., Yang, J. y Pawliszyn, J. (1994). Solid phase microextraction. Anal. Chem. 66: 844-853. 42. Arthur, C. y Pawliszyn, J. (1990). Solid phase microextraction with thermal desorption using fused silica optical fibers. Anal. Chem. 62: 2145-2148. 43. Montserrat Ria, A. (2005). Caracterización de compuestos volátiles en bebidas derivadas de fruta. http://www.tesisenred.net/handle/10803/2429. (Consultado 10-0908) 44. Pawliszyn, J. (1997). Solid Phase Microextraction. Theory and practice. Wiley-VCH, New York, 1ª Edición, pp. 11-18. 45. Lord, H. y Pawliszyn, J. (2000). Evolution of solid-phase microextraction technology. J. Chromatogr. A, 885: 153-193. 46. Trujillo, A. (1996). Procesos de proteólisis primaria que intervienen en la maduración del queso de cabra. http://www.tesisenred.net/handle/10803/5692. (Consultado: 2304-11). 47. Fundamentos para la elaboración de quesos. Facultad de Ciencias Veterinarias. (2003): www.lactologia.org/. (Consultado: 8-09- 08). 48. Concepción, M., Valencia, C., Concepción, C., Manuel, M. y Arias, L. (2002). El análisis sensorial de los quesos. Mundi-Prensa, España, 1ª Edición, pp.15-138. 49. Galindo, L., Colmenares, E., y Rojas, E. (2006). Estandarización de la detección del Glicomacropéptido Por Page-SDS como índice de Adulteración de Leche. Revista Cientifica. 16: 308-314. 121 50. Cheftel, J. y Cheftel, H. (1976). Introducción a la Bioquímica y Tecnología de los Alimentos. ACRIBIA, Zaragoza, 1ª Edición, pp. 75-78. 51. Periago, J. (2002). Cambios en las características de un queso de leche de cabra sometido a alta presión hidrostática. Aceleración de la maduración. http://www.tesisenred.net/handle/10803/5633. (Consultado: 12-06-11) 52. Reinheimer, J. y Salazar, C. (2006). Avances en microbiología bioquímica y tecnología de quesos. UNL, Argentina, 1ª Edición, pp. 233-236. 53. Fox, P. (1993). Chesse: Chemistry, physics and Microbiology. Springer, Republic of Ireland ,2nd Edición, pp.79-91. 54. Young, W. (2001). Proteolysis and lipolysis of goat milk cheese. J. Dairy Sci. 84: 8492. 55. Maarse, H. y Vissche,r C. (1989). Volatile compounds in food. Qualitative and quantitative data. Zeist: Central Institute for Nutricion and Food Research TNOCIVO. 6th Edición, pp.175-184. 56. Infante, D., Tormo, R. y Conde, M. (2003). Empleo de la leche de cabra en pacientes con alergia a las proteínas de la leche de vaca. An. Pediatr. 59:138-142. 57. Zapata, A. (2004). Procesos biológicos involucrados en la producción animal etapa II. UCV. Facultad de Agronomía. Cátedra de producción animal, p.56-59. 58. Voutsinas, L., Pappas, C. y Katsiari, M. (1990). The composition of Alpine goats milk during lactation in Greece. J. Dairy Res. 57: 41-51. 59. Salvador, A., Martinez, G., Alvarado, C. y Hahn, M. (2006). Composición de leche de cabras mestizas Canarias en condiciones tropicales. Zootecnia Trop. 24:307-320. 60. García–Bojalil C. (1992). Manejo y alimentación de la vaca lechera durante el periodo seco y sus implicaciones durante el postparto. Manual de Asistencia Técnica. Guía Agropecuaria de Venezuela, Agropecuaria C.A, 1ª Edición. 122 61. Zeng, S., Escobar, E. y Popham, T. (1997). Daily variations in somatic cell count, composition, and production of Alpine goat milk. Small Rumin. Res. 26:253-260. 62. La Cabra-Razas caprinas de España. (2002). Revista trimestral España. 1ª Ediciòn, p. 15. 63. Fernández, G. (2000). Parámetros productivos de cabras Pardo Alpinas y sus cruzas, bajo régimen de pastoreo. Producción Latina XXV, España, pp. 541-544 64. Dickson, L., Gamarra, I., Salvador A y Monasterio, L. (2008). Producción de leche y duración de lactancia en cabras mestizas de la raza canaria en Venezuela. Zootecnia 57: 63-66. 65. Molimard, P. y Spinnles. (1996). Review: compounds involved in the flavour of surface mold-ripened cheeses: Origins and properties. J of Dairy Science, 79: 169184. 66. Curioni, P. y Bosset, J. (2002). Key odorants in various cheese types as determined by gas chromatography - olfactometry. International Dairy Journal 12: 959-984. 67. Bosset, J. y Liardon, R. (1984). The aroma composition of Swiss Gruyere cheeseII. The natural volatile components. Lebensmittel Wissenschaft und Tecnologie, 17: 359-362. 68. Le Quéré, J., Septier, C., Demaiziéres, D. y Salles, C. (1996). Identification and sensory evaluation of the carácter-impact compouns of goat cheese flavour. The Royal Society of Chemistry, 13: 325-330. 69. Suriyaphan, O., Drake, M., Chem, X. y Cadwallader, K. (2001). Characteristic aroma components of British farmhouse Cheddar cheese. J Agric. Food Chem. 49: 13821387. 70. Bugaud, C., Buchin, S., Coulon, J., Hauwuy, A. y Dupont, D.( 2001). Influence of the nature of alpine pastures on plasmin activity, fatty acid and volatile compound of milk. Le Lait. 81: 401-414. 123 71. Mondello, L., Costa, R., Tranchida, P., Chiofalo, B., Zumbo, A., Dugo, P. y Dugo, G. (2005). Determination of flavor components in Sicilian goat cheese by automated HSSPME-GC. Flavour Fragr. J. 20: 659-665. 72. Poveda, J. y Cabezas, L. (2006). Free fatty acid composition of regionally-produced Spanish goat cheese and relationship with sensory characteristics. Food Chemistry. 95: 307-311. 73. Le Querè J, Pierre, A., Riaublanc, A. y Demaizières ,D. (1998). Characterization of aroma compounds in the volatile fraction of soft goat cheese during ripening. Le Lait. 78 :279-290. 74. Rahmat, A. y Richter, R. (1996). Formation of volatile free fatty acids during ripening of Cheddar-like goat cheese. Journal of Dairy Science.79: 717-724. 75. Horne, J., Carpino, S., Tuminello, L., Rapisarda, T., Corallo, L. y Licitra, G. (2005). Differences in volatiles, and Chemicals, microbiol and sensory characteristics between artisanal and industrial Piacentinu Ennese cheese. International Dairy Journal, 15: 605-617. 76. Condurso, C., Verzera, A., Romeo, V., Ziino, M. y Conte, F. (2008). Solid-phase microextraction and gas chromatography mass spectrometry análisis of dairy product volatiles for the determiantion of shelf-life. International Dairy Journal.18, 819-825. 77. Lecanu, L., Ducruet, V., Jouquand, C., Gratadoux, J. y Feigenbaum, A.( 2002). Optimization of headspace solid-phase microextraction (SPME) for the odor análisis of surface ripened cheese. J. Agric. Food Chem. 50: 3810-3817. 78. Pinho, O., Pérès, C. y Ferreira, I. (2003). Solid-phase microextraction of volatile compounds in “Terrincho” ewe cheese. Comparison of different fibers. J. Chromatography A. 1011: 1-9. 79. Conrad, D., Owen, C. y Patterson, J. (2004). Solid phase microextraction (SPME) combined with gas-chromatography and olfactometry-mass spectrometry for characterization of cheese aroma compouns. Lebensm.- Wiss u.- Technol. 37: 139154. 124 80. Quintero, J. y Villegas, J. (2004). Informe técnico evaluatorio e informe físico de la granja Doña Elida, Sector el Sanchero, parroquia Aguedo Felipe Alvarado, Municipio Iribaren. Barquisimeto, pp.12-13. 81. Meilgaard, M., Civille, G. y Carr, T. (1999). Sensory evaluation techniques. CRG Press , USA, 3er Edición, p.387. 82. ASTM. 1981. Committee E-18. Guidelines for the selection and training of sensory panel members. ASTM Special Technical publication 758. Philadelphia. 83. ISO 354 E. 1998. Sensory analysis. Methodology. Sequential analysis. 84. Vivas, O. (2008). Perfil Descriptivo cuantitativo de textura de arepas, pastas y galletas elaboradas con Phaseolus vulgaris y Cajanus cajan fermentada. Tesis de Máster en Ciencias de los alimentos. Universidad Simón Bolívar. 85. Linforth, R., Martin, F., Carey, M., Davidson, J. y Taylor, A. (2002). Retronasal transport of aroma compounds. J. Agric. Food Chem: 50: 1111-1117. 86. Miller, C. y Miller, N. (1993). Estadística para química analítica. Addison-Wesley Iberoamerican, S.A , USA, 2da Edición, p. 99-103. 87. Oscar, E., Pons, B. y Maria T. (2003). Direct quantitation of volatile organic compounds in packaging materials by headspace solid-phase microextraction–gas chromatography–mass spectrometry. Journal of Chromatography A, 985, 247–257 88. Pinho O, Ferreira, I. y Ferreira, M. (2002). Solid-phase microextraction in combination with GC/MS for quantification of the major volatile free fatty acids in ewe cheese. Anal. Chem. 74:5199-5204. 89. Pillonel, L., Bosset, J. y Tabacchi, R. (2002). Rapid preconcentration and enrichment techniques for the analysis of food volatile. A Review. Lebensm.-Wiss. u.-Technol. 35: 1-14. 90. Engels, W., Dekker, R., Jong, C., Neeter, R., y Visser. (1997). A comparative study of volatile compounds in the water soluble fraction of various types of ripened cheese. International Dairy Journal. 7: 255-263. 125 91. Seuvre, A., Philippe, E., Rochard, S. y Voilley, A. (2005) Retention of aroma compounds in food matrices of similar rheological behaviour and different compositions. FoodChem. 96 (1): 104-111. 92. Seuvre, A., Turci, C., Voilley, A. (2008). Effect of the temperature on the release of aroma compounds and on the rheological behaviour of model dairy custard. Food Chemistry. 108 (4):1176-1182. 93. Lecanu, L., Ducruet, V., Jouquand, C., Gratadoux, J. y Feigenbaum, A. (2002). Optimization of headspace solid-phase microextraction (SPME) for the odor analisis of surface ripened cheese. J. Agric. Food Chem. 50: 3810-3817. 94. Molimard, P. y Spinneles. (1996). Review. Compounds involved in the flavor of surface mold-ripened cheeses: Origins and properties. J. of Dairy Science. 79:169184. 95. Damian, C., Owen, C., y Patterson, J. (2004). Solid phase microextraction (SPME) combined with gas-chromatography and olfactometry-mass spectrometry for characterization of cheese aroma compounds. LWT. 37: 139-154. 96. Díaz, M., Pérez, C. y Cabezudo, M. (2002). Headspace solid-phase micro-extraction analysis of volatile components of spices. Chromatographia. 55: 723-728. 97. Panseri, S., Giani, I., Mentasti, T., Bellagamba, F., Caprino, F. y Moretti, V. (2008). Determination of flavour compounds in a mountain cheese by headspace sortive extraction-thermal desorption-capillary gas chromatography - mass spectrometry. LWT. 41:185-192. 98. Moio, L. y Addeo, F. (1998). Grana Padano cheese aroma. Journal of Dairy Research. 65: 317-333. 99. Horne, H., Carpino S., Tuminello, L., Rapisarda, T., Corallo, L. y Licitra G. (2005). Differences in volátiles, and chemical, microbial and sensory characteristics between artisanal and industrial Piacentinu Ennese cheeses. International Dairy Journal. 15: 605-617. 126 100. Attaie, R. (2008). Quantification of volatile compounds in goat milk Jack cheese using static headspace gas chromatography. J. Dairy Sci. 92: 2435-2443. 101. Ziino, M., Condurso, C., Romeo, V., Giuffrida, D., y Verzera, A. (2005). Characterization of "Provola dei Nebrodi", a typical Sicilian cheese by volatiles analysis using SPME-GC/MS. International Dairy Journal. 15: 585-593. 102. Lawless, H. (1999). Desciptive analysis of complex odors: Reality model or illusion?. Food Qual. Pref. 10: 325-332. 103. Leiva, J. y Figueroa, H. (2010). Textura of Chanco cheese: Projection of a sensory map based on multivariate analysis. Cien. Inv. Agr. 37 (1):85-91. 104. Lawless, H., Sheng, N. y Knoops, S. (1995). Multidimensional scaling of sorting data applied to cheese perception. Food Quality and Preference. 6: 91-98. 105. Bonaiti, C., Irlinger, F., Spinnler, E. y Engel, E. (2005). An iterative sensory procedure to select odor-active associations in complex consortia of microorganism: Aplication to the construction of a cheese model. J. Dairy Sci. 88: 1671-1684. 106. Urbach, G. (1995). Contribution of lactic acid bacteria to flavour compound formation in dairy products. International Dairy Journal. 5:887-903 107. Ziino, M., Condurso, C., Romeo, V., Giuffrida, D. y Verzera, A. (2005). Characterization of Provola del Nebrodi, a typical Sicilian cheese by volatiles análisis using SPME-GC/MS. International Dairy Journal. 15: 585-593. 108. Bellesia, F., Pinetty, A., Pagnoni, U., Rinaldi, R., Zucchi, C., Cagliooti, L. y Palyi, G. (2003). Volatile components of Grana Parmigiano-Reggiano type hard cheese. Food Chemistry. 83: 55-61. 109. Carbonell, M., Nuñez, M. y Fernandez, E. (2002). Evolution of the volatile components of ewe raw milk La Serena cheese during ripening. Correlation with flavour characteristics. Le Lait. 82:683-698. 127 110. Kruskal, B. (1964). Nonmetric Multidimensional Scaling: A Numerical Method. Psychometrika. 2: 115-129. 128 APÉNDICE I A 1.1 Planilla de reclutamiento para la conformación de un panel entrenado para análisis olfatométrico Se desea formar un panel entrenado para evaluar aromas, una actividad que formará parte de una tesis de grado. En este sentido se extiende una invitación a Ud. para formar parte de este panel. A continuación se le presentan una serie de preguntas que nos permitirá hacer la selección de panelistas. Muchas gracias por su colaboración. Datos personales Nombre y Apellido Lugar de trabajo Teléfono Edad Sexo F M Disponibilidad 1-¿Está Ud. dispuesto(a) a recibir entrenamiento para formar parte de un panel evaluador de aromas en diversos alimentos? 2-¿Cuál sería su disponibilidad de tiempo para esta actividad? Indíquelo en horas y días semanales. Experiencia 1-¿Ha participado en evaluaciones sensoriales? 2- ¿Cuantas veces 3-¿En que tipo de pruebas? 4-¿Hace cuanto tiempo? Estado de salud 1-¿Considera que tiene buena salud? 2-¿Padece de alguna alergia? 3-¿Sufre de algún problema con el sistema respiratorio, como asma? 129 4- ¿Toma algún medicamento que afecte sus sentidos, o cause efectos como irritabilidad en el sistema olfativo? 5- ¿Es fumador? ¿Cuántos cigarrillos o tabacos al día? Hábitos alimentarios 1-¿Usualmente a que hora desayuna? 2-¿Usualmente a que hora almuerza? Observaciones o comentarios 130 A 1.2 Planilla de reclutamiento para el entrenamiento de reconocimiento de aromas Método de prueba: Reconocimiento de aromas Nombre del juez: ________________________________________________ Fecha: ______________________ Instrucciones: 1- Se le presenta una serie de ----- muestras. Huélalas en el mismo orden en que le fueron presentadas y diga la sensación que percibe en cada una de ellas. 2- Puede repetir si considera necesario. 3- Realice la prueba con la boca cerrada Nº. de muestra Nombre de la sustancia, descripción del olor o asociación Comentarios Gracias por su colaboración ¡ 131 A 1.3 Planilla para el entrenamiento de Umbral de aromas Método de prueba: Umbral de Aroma Nombre del juez: ________________________________________________ Fecha: ______________________ Instrucciones: 4- Se le presenta una serie de ----- muestras. Huélalas en el mismo orden en que le fueron presentadas y diga la sensación que percibe en cada una de ellas. 5- Puede repetir si considera necesario en el mismo orden. 6- Realice la prueba con la boca cerrada Nº. de muestra ¿Percibe Ud. (1) El olor? Si (1) No ¿Reconoce Ud. (1) El olor? Si Nombre de la sustancia, descripción del olor o asociación Comentarios No Colocar una (x) en la columna Gracias por su colaboración ¡ 132 A 1.4 Planilla para el entrenamiento en desarrollo de vocabulario Método de prueba: Entrenamiento de desarrollo de vocabulario Nombre del juez: ________________________________________________ Fecha: ______________________ Instrucciones: 7- Se le presenta una serie de ----- muestras. Huélalas en el mismo orden en que le fueron presentadas y diga la sensación que percibe en cada una de ellas. 8- Puede repetir si considera necesario. 9- Realice la prueba con la boca cerrada Nº. de muestra Nombre de la sustancia, descripción del olor o asociación Comentarios Gracias por su colaboración ¡ 133 A 1.5 Planilla para el entrenamiento de representatividad Método de prueba: Representatividad en olfatometría Nombre del juez: ________________________________________________ Fecha: ______________________ Instrucciones: 1- Detecte los aromas directamente en el vial y luego en el puerto de olor del equipo de olfatometría y marque con una línea vertical sobre la escala no estructurada. Ninguna igualdad Total igualdad Comentarios: Gracias por su colaboración ¡ 134 APÉNDICE II A.2.1. Áreas de las señales cromatográficas para el patrón del ácido butanoico Patrones Ác. Butanoico (ppm) 10 30 100 200 400 Áreas señal cromatográfica 1 1646 2268 6176 14313 25878 2 1528 2405 6564 13545 26333 3 1540 2278 6650 14187 25884 Promedio áreas 1571 2317 6463 14015 26032 Desvest. % CV 65 76 253 412 261 4 3 4 3 1 CV=coeficiente de variación A.2.2. Áreas de las señales cromatográficas para el patrón del ácido hexanoico Patrones Ác. Hexanoico (ppm) 30 100 300 600 800 Áreas señal cromatográfica 1 1615 5991 18648 32078 44261 2 1635 6038 16362 35103 40077 3 1544 6741 16596 32970 43375 Promedio áreas 1598 6257 17202 33384 43539 Desvest. % CV 48 420 1258 1554 3163 3 7 7 5 7 CV=coeficiente de variación. A.2.3. Áreas de las señales cromatográficas para el patrón del ácido octanoico Patrones Ác. Octanoico (ppm) 50 100 200 300 400 Áreas señal cromatográfica 1 1946 5080 10990 15816 21846 2 2228 4936 9514 15510 20313 3 1902 4510 10131 16099 22268 Promedio áreas 2025 4842 10212 15808 21476 Desvest. % CV 177 296 741 295 1029 9 6 7 2 5 CV=coeficiente de variación. A.2.4. Áreas de las señales cromatográficas para el patrón del ácido decanoico Patrones Ác. Decanoico (ppm) 50 100 300 500 700 Áreas señal cromatográfica CV=coeficiente de variación. 1 1289 2432 6072 10079 12866 2 1275 2154 5328 8978 12679 3 1112 2247 5871 9448 13016 Promedio áreas 1225 2278 5757 9502 12854 Desvest. % CV 98 142 385 552 169 8 6 7 6 1 135 APÉNDICE III A.3.1. Tiempos de retención y tiempos de duración de las zonas de aromas para la muestra de queso 1. 136 A.3.2. Tiempos de retención y tiempos de duración de las zonas de aromas para la muestra de queso 2. 137 A.3.3. Tiempos de retención y tiempos de duración de las zonas de aromas para la muestra de queso 3. 138 APÉNDICE IV A.4.1 Compuestos identificados en las muestras número 1, 2 y 3 de queso de cabra y descriptores de aromas reportados. Número compuesto 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 Compuesto isobutanol 3-hidroxi-2-butanona 3-metil-butanol 2-metil-butanol 2-heptanona ácido hexanoico hexanoato de etilo 2-etil-hexanol butanoato de isoamilo acetofenona nonanal ácido octanoico octanoato de etilo 2,3-butanodiol butanoato de etilo hexanol 2-heptanol benzaldehído octanol pentanol alcohol furfuril acetato de isoamilo limoneno butanoato de pentilo heptanoato de etilo pentanoato de pentilo decanal Aromas[88,95] alcohol, vino mantequilla, whisky, malta cebolla jabón sudor cáscara de manzana rosas, verde frutal, caramelo floral, almendras cítrico, verde, queso, rancio frutal frutal, cebolla manzana resina, flores, verde champiñones almendras, caramelo, miel metal, tostado, solvente balsámico, menta tostado, heno, moho cambur menta, cítrico cambur, pera frutal manzana cáscara de naranja