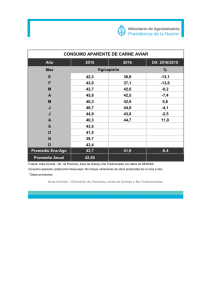
Get cached
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA IMPORTANCIA SANITARIA, PRODUCTIVA Y ECONÓMICA DE LA INFECCION DE LA BOLSA DE FABRICIO O ENFERMEDAD DE GUMBORO EN MÉXICO: ESTUDIO RECAPITULATIVO TRABAJO RECEPCIONAL EN LA MODALIDAD DE: MONOGRAFÍA COMO REQUISITO PARCIAL PARA OBTENER EL TÍTULO DE MÉDICO VETERINARIO ZOOTECNISTA PRESENTA: YOSELIN MAYO ESCUELA ASESORES: DR. ÁLVARO E. PENICHE CARDEÑA PhD. DAVID I. MARTÍNEZ HERRERA VERACRUZ, VER. ENERO 2012 ÍNDICE GENERAL Introducción 1. Antecedentes PAGINA 1 3 2. Justificación 5 3. Objetivo 3.1 Objetivos Específicos 6 6 4. Metodología 7 5. Desarrollo del Tema 5.1 Sistema Inmunológico de las aves 5.1.1 Bolsa de Fabricio 5.2 Infección de la Bolsa de Fabricio 5.3 Etiología 5.4 Sinonimias 5.5 Especies Susceptibles 5.6 Epidemiología 5.7 Distribución Geográfica 5.8 Factores Predisponentes 5.9 Transmisión 5.10 Morbilidad y mortalidad 5.11 Patogenia 5.12 Signología Clínica 5.13 Lesiones 5.14 Diagnóstico 5.14.1 Metodologías para el diagnóstico 5.14.2 Aislamiento Viral 5.14.3 Identificación de antígenos virales en tejidos 5.14.4 Observación de lesiones macroscópicas e hp 5.14.5 Medición de los niveles de anticuerpos 5.14.6 Técnicas de diagnóstico molecular 5.14.7 Técnica de RT-PCR 5.14.8 Tipificación por RFLP 5.15 Prevención y Control 9 9 10 11 11 15 15 15 16 16 16 17 17 21 22 23 24 25 26 5.15.1Bioseguridad 26 27 28 28 28 29 29 ii 5.15.1.1 Tránsito de vehículos 5.15.1.2 Desinfección y sanidad 5.15.1.3 Programas de Vacunación 5.16 Impacto Productivo y económico 5.16.1 Estrategias para el control de la IBF 5.16.2 Situación de la enfermedad a en México 5.16.3 Perspectivas de la IBF en la avicultura nacional 5.16.4 Importancia del sector avícola en Veracruz 5.16.5 Perspectivas de IBF en la avicultura de Veracruz 30 32 34 38 40 41 42 44 46 6. Conclusiones 47 7. Recomendaciones 48 8. Referencias 49 iii ÍNDICE DE CUADROS PAGINA Cuadro 1. Descripción macroscópica de las lesiones en la bolsa de Fabricio en reacción a los días post-infección 23 Cuadro 2. Pruebas y material biológico necesario para el diagnóstico de la enfermedad de Gumboro en el laboratorio 24 Cuadro 3. Principales enfermedades aviarias, sobrevivencia del agente etiológico y formas de diseminación más común en una granja 32 Cuadro 4. Características de los desinfectantes más utilizados 33 en la industria avícola iv ÍNDICE DE FIGURAS PAGINA Figura 1. Estructuras del Sistema inmunológico de las Aves 9 Figura 2. Clasificación de las cepas del virus de la IBF de acuerdo a su antigenicidad y virulencia 13 Figura 3. Esquema de la patogenia y daño viral en el sistema Inmune del ave 18 v DEDICATORIA A Dios por ser una constante en mi vida, por las bendiciones que a diario derrama en mí, por caminar a mi lado y jamás abandonarme, porque mi vida gira en torno a él, siempre por El. A mi familia por ser incondicional y la bendición más grande que Dios me ha dado. A mis padres; Edmundo Mayo Escobar por ser mi Padre, por formarme como persona, por apoyarme y amarme, a Alicia Escuela por ser mi Madre, mi amiga por cuidar de mi siempre, por hacer de mí una mejor mujer y por llevarme siempre hasta Dios. A mi hermana por permanecer a mi lado, porque es un ejemplo de profesionista y mujer para mí, porque nunca te das por vencida. A mis amigos que son un tesoro a Yazmin Zuccolotto de Aquino por ayudarme desde que me conoces, por ser mi amiga y por formar parte de mi familia; Nayeli Calte Montero, María Antonia López Duran, Héctor Mota Muñoz, José Manuel Toledo Conde por ser mis compañeros y acompañarme en esta etapa de mi vida. A la MVZ Libertad Rubí Palacios Domínguez por ser mi compañera en esta aventura, por cuidar de mí, por escucharme, guiarme y brindarme su maravillosa amistad. Al Pbro. Juan Carlos Márquez Torres por ser mi amigo, por estar a mi lado y por su cariño, por hacerme mejor persona y ayudarme a crecer, porque siempre estás aquí, porque eres irremplazable. Al Pbro. Oliver Villalobos Tecalco por ser un ejemplo para mí, por tenerme presente en sus oraciones, por ser mi amigo, por escucharme, por mostrarme la grandeza de Dios y por permanecer a mi lado, porque haces de los momentos sencillos algo grandioso. A los Pbros. Alejandro Adán Díaz Balbuena, Marcos Cruz Morales por apoyarme y creer en mí, por su gran amistad. vi AGRADECIMIENTOS A la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Veracruzana por brindarme los conocimientos y habilidades para desarrollarme como profesionista, así como a todos los académicos por su dedicación; por llevarnos siempre de la mano. Al Dr. Álvaro Peniche Cardeña por su tiempo, dedicación, consejos, apoyo, por guiarme en este trabajo paso por paso, por contribuir en mi formación como profesionista. Al Dr. David Martínez Hernández por su dedicación y apoyo para la elaboración de este trabajo. A mi tutor M. en C. Roberto Castillo Tlapa por guiarme, A la Dra. Patricia Cervantes Acosta por su apoyo y consejos, Al Dr. José Manuel Martínez Hernández por su tiempo y dedicación, Al Dr. Manuel Barrientos Lagunes por todo su apoyo. vii RESUMEN Mayo Escuela Yoselin, 2011. IMPORTANCIA SANITARIA, PRODUCTIVA Y ECONÓMICA DE LA INFECCION DE LA BOLSA DE FABRICIO O ENFERMEDAD DE GUMBORO EN MÉXICO: ESTUDIO RECAPITULATIVO. Monografía de Licenciatura. Facultad de Medicina y Veterinaria y Zootecnia, Universidad Veracruzana, Veracruz, México. La infección de la Bolsa de Fabricio (IBF) es una enfermedad infectocontagiosa de etiología viral que afecta aves jóvenes al provocar inmunosupresión y mortalidad en las parvadas, situación que propicia un fuerte impacto productivo y económico en la avicultura comercial. La inmunosupresión causada por esta enfermedad propicia importantes pérdidas económicas en la industria avícola, ya que la mortalidad en la parvada es alta y de forma adicional, las consecuentes infecciones secundarias tienen un efecto negativo en la eficiencia productiva. En México se encuentra presente desde 1965 y fue la enfermedad inmunosupresora más importante durante el período 2000-2001 en la avicultura nacional. En Veracruz no se encuentra documentada de manera científica la situación de esta patología pero al ser cosmopolita en el país, en todos los lugares donde se practique la industria avícola está presente y por ende, el estado no es la excepción. Para el control de la enfermedad los calendarios de vacunación y las medidas de bioseguridad son esenciales. La protección del ave contra la IBF con el uso de vacunas se complica debido a la presencia de dos serotipos y de varios subtipos antigénicos virales o variantes. De ahí, la importancia de estar al día en cuanto a los avances preventivos que se tienen al respecto en el sector avícola, situación que conllevará a disponer mejores esquemas para prevenir, controlar y en su caso, erradicar la enfermedad en las parvadas. Las perspectivas para su control son factibles y solo resta a los profesionistas dedicados a este sector productivo estar actualizarse en los métodos vanguardistas que conlleve y establezca la medicina preventiva. Palabras Clave: Infección de la Bolsa de Fabricio, Bolsa de Fabricio, Enfermedad de Gumboro, inmunosupresión, avicultura comercial viii INTRODUCCIÓN En las aves domésticas la competencia inmunológica es en especial importante para el desempeño productivo de la parvada; si las aves están inmunocomprometidas la eficiencia productiva disminuye, la eficacia de las vacunas utilizadas de rutina se reduce y se incrementa la susceptibilidad hacia otros agentes patógenos (Valladares, 2010). Los virus son agentes infecciosos capaces de alterar la capacidad funcional el sistema inmunológico de las aves; por su importancia sanitaria destacan los causantes de la Infección de la bolsa de Fabricio (IBF), enfermedad de Marek (EM), Anemia Infecciosa Aviar, Leucosis Aviar y reticuloendoteliosis de las aves (Valladares, 2010). La enfermedad infecciosa de la bolsa de Fabricio (EIBF) o enfermedad de Gumboro (EG) es una infección aguda, de alta contagiosidad, que afecta en especial a las aves jóvenes y cuyo agente etiológico desde la taxonomía pertenece a la familia Birnaviridae (Lucio, 1991; Banda y Villegas, 2003). La IBF es una enfermedad viral importante para la avicultura en todo el mundo (Jordan y Pattison, 1998). Desde la visión clínica y en lo general, afecta a aves jóvenes de hasta seis semanas de edad. La forma aguda se caracteriza por un inicio repentino, curso corto y una destrucción marcada de linfocitos en la bolsa de Fabricio (BF) y en otros tejidos linfoides (Jordan y Pattison, 1998). Para la avicultura comercial, la IBF representa un fuerte impacto sanitario y productivo. Las pérdidas económicas se deben por en lo general a la inmunosupresión transitoria o permanente de las parvadas cuya consecuencia 1 inminente se refleja en una morbilidad y mortalidad elevadas (Ruiz et al. 2004; Ardaya, 2010); por otra parte, la inmunosupresión puede propiciar de manera adicional, infecciones secundarias por agentes patógenos oportunistas (Tamayo, 2009; Guadarrama, 2009; Burns, 2009). A nivel nacional, durante el período 2000 – 2001 la atrofia de la BF fue la enfermedad inmunosupresora más frecuente dentro del sector avícola al representar el 68% de los casos de este tipo de padecimiento referidos en ese tiempo (Vázquez et al. 2002); sin embargo, la enfermedad solo se reporta en su presentación subclínica en la cual, la inmunodepresión deriva en enfermedades secundarias que generan importantes pérdidas a la avicultura del país (Lechuga, 2009). 2 1. ANTECEDENTES La IBF fue observada por primera vez en 1957 por Cosgrove, en granjas avícolas cercanas a la población de Gumboro, Delaware, E.U.A; por ello, se le conoce también como EG (Lucio, 1991). De forma posterior, Hitchner (1970) propuso el término EIBF debido a las lesiones que producía en la BF; por otra parte, Lukert et al. (1997) y Pizarro et al. (2001), la denominaron como Bursitis Infecciosa (BI) debido a la gran depleción de linfocitos que ocasiona en este órgano (Babaahmady, 2007). La mayoría de las enfermedades de aves son cosmopolitas, aunque algunas restringen su localización geográfica con base en la distribución de vectores. En el ámbito de la salud pública, la importancia de algunas enfermedades aviarias radica en su naturaleza zoonótica (Jordan y Pattison, 1998). Una de las características del sistema productivo es la alta concentración de aves por espacio vital, que propicia condiciones muy favorables para la diseminación rápida de diversas enfermedades. Por ello, el diagnóstico temprano de éstas es fundamental porque de lo contrario, las consecuencias inminentes por la patogenicidad y virulencia de los agentes infecciosos son una alta morbilidad, letalidad y mortalidad en la parvada, que derivará en fuertes afectaciones productivas y económicas (Jordan y Pattison, 1998). Las enfermedades de las aves se han clasificado de acuerdo con el impacto en términos socioeconómicos, de sanidad animal, salud pública y comercio nacional e internacional de aves y sus productos (Valladares, 2010). 3 En México, en 1965 Correa aisló un agente infeccioso con características similares a las del virus de la IBF y en 1969, reprodujo la enfermedad en aves susceptibles. En 1972 se confirmó la presencia de la enfermedad en México al identificarse anticuerpos contra el virus (Lucio, 1991, Báez, 1994). A nivel nacional, para el período 2000 – 2001 las principales enfermedades inmunológicas identificadas en aves de engorda fueron la IBF y la EM (Vázquez et al. 2002). En el 2004 en un estudio realizado en una granja avícola de engorda en el estado de Colima, se identificó a la IBF como una de las principales causas de mortalidad durante las primeras tres semanas de vida de la parvada (Flores et al., 2004). En 2009 Higuera hace mención de 84 brotes severos de IBF en México que obligaron a la industria farmacéutica y a técnicos especialistas en la enfermedad a trabajar más sobre esta patología, con la finalidad de mejorar su prevención y control (Higuera, 2009). 4 2. JUSTIFICACIÓN Dada la importancia de la avicultura en México, es necesario mantener actualizada la información epidemiológica sobre la presentación de casos o brotes de IBF en este sector productivo. Por ello, el presente trabajo pretende compilar la mayor cantidad de reportes sanitarios, productivos y económicos publicados sobre esta enfermedad en nuestro país, con la finalidad de conocer su impacto al día de hoy a nivel nacional y estatal. 5 3. OBJETIVO GENERAL Conocer la situación sanitaria, productiva y económica actual de la infección de la bolsa de Fabricio en la industria avícola nacional y estatal. 3.1 OBJETIVOS ESPECÍFICOS 1. Conocer la situación actual de la IBF en la industria avícola nacional. 2. Conocer la situación actual de la IBF en el sector avícola del estado de Veracruz. 6 4. METODOLOGÍA Para la realización de este trabajo se llevó a cabo una revisión documental retrospectiva de carácter técnico y científico al día de hoy en la Biblioteca de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Veracruzana, en la Biblioteca de la Unidad de Servicios Bibliotecarios y de Información (USBI) de la propia Universidad así como en cualquier otro recinto que permitiera la pesquisa de documentos escritos sobre el tema; la revisión, incluyó el escrutinio de libros, revistas y artículos científicos, memorias de foros de interés sanitario y pecuario, boletines técnico-informativos y revistas de difusión relacionados con la epidemiología, control e impacto productivo y económico de la IBF en el sector avícola nacional y estatal. Asimismo, se realizó una revisión documental electrónica del tema en diferentes páginas web al emplear el apoyo tecnológico del sistema Internet. Parte de la temática que se desarrolló en el presente estudio versó sobre los principales antecedentes reportados y publicados sobre la enfermedad de la BF en México, la distribución de los indicadores epidemiológicos de la misma a nivel nacional y estatal, las actividades empleadas para su control y prevención, el desarrollo y la evolución metodológica de los estudios de laboratorio empleados para su diagnóstico, el marco legislativo que norma las acciones para su control y prevención en nuestro país, así como una revisión de su impacto sanitario, productivo y económico en México y en el estado de Veracruz; asimismo, un punto importante que se investigó, fue el análisis sobre las perspectivas de esta 7 enfermedad en México acorde a las acciones y estrategias de prevención actuales establecidas para su control. La información analizada permitió elaborar un documento único que integró la situación que guarda al día de hoy esta enfermedad en la industria avícola nacional y estatal pero sobre todo, reconoció su importancia así como el devenir de la misma en la producción avícola del país. 8 5. DESARROLLO DEL TEMA 5.1 SISTEMA INMUNOLÓGICO DE LAS AVES El sistema inmunológico del ave es muy especializado y lo constituyen la BF, el timo y los órganos linfoides secundarios (Gómez, 2002; Robín, 2008). Estos últimos, son los responsables de la captación y del procesamiento de los antígenos y están integrados por el bazo, glándula de Harder, placas de Peyer y tonsilas cecales (Robín, 2008). Parte de estas estructuras anatómicas se aprecian en la figura 1. Figura 1. Estructuras anatómicas que integran el sistema inmunológico de las aves Fuente: Laboratorios CALIER (2011). Las investigaciones sobre inmunología aviar demuestran que tanto en las aves como en los mamíferos, los mecanismos sobre la respuesta inmune son semejantes. En este sentido, es importante mencionar la existencia en las aves de un órgano diferente y que desde el punto de vista anatómico está separado de los demás que no existe en otros animales domésticos que se conoce como bolsa o 9 bursa de Fabricio; en éste, se desarrollan y diferencian los linfocitos B que son células fundamentales del sistema inmunológico de las aves. Otra de las diferencias anatómicas significativas en aves es la ausencia de nódulos linfáticos los cuales, han sido substituidos por acumulaciones de tejido linfoide sin una organización característica a lo largo del tracto digestivo y conocidos como tonsilas cecales (Morilla, 1989); por ello, la organización del tejido linfoide intestinal de las aves es diferente a las de los mamíferos (Robín, 2008). El timo está formado por 14 lóbulos localizados en forma separada, situados de forma simétrica en la parte baja del cuello y anterior de la cavidad torácica (Morilla, 1989; UPTC, 2006). Las aves contienen en la región oculo-nasal una concentración especial de tejido linfoide denominada glándula de Harder. En el pollito se desarrollan además, dos sistemas inmunitarios cada uno responsable de la producción de dos tipos de linfocitos: los T y los B (UPTC, 2006). 5.1.1 Bolsa de Fabricio (BF) La BF es una pequeña bolsa o saco conectado por un conducto a la región dorsal de la cloaca, alcanza su máximo desarrollo entre las 4 y 6 semanas de edad en razas Leghorn y entre las 8 y 11 en aves Rhode Island (Morilla, 1989). La BF está formada por la unión del ectodermo y endodermo, se desarrolla de la membrana del urodeo, aparece al 5° día de incubación y posee pliegues con características histológicas de corteza y médula, que desde el punto de vista funcional, está relacionada con la respuesta inmune humoral. Crece entre la 3ª y 10 12ª semana de edad y, a partir de este momento, involuciona hasta la 25ª semana de vida del ave (Robín, 2008; Suárez et al., 2010). La histología de la BF muestra que se compone de tres capas que corresponden a una serosa, una de musculo liso y una mucosa cubierta de epitelio columnar o pseudo estratificado (Morilla, 1989). Existen ciertas condiciones infecciosas ó patológicas que le afectan, las cuales propician su atrofia y en consecuencia, un estado de inmunodepresión funcional en el ave; dentro de éstas, se encuentran la IBF, micotoxicosis, enfermedad de marek, leucosis linfoide, el excesivo calor o frío, deficiencias nutricionales, presencia de algunas toxinas y el origen genético del ave (Robín, 2008). 5.2 INFECCIÓN DE LA BOLSA DE FABRICIO (IBF) La IBF se define como una enfermedad viral enzoótica, aguda y contagiosa que causa inmunosupresión en aves de tres a seis semanas de edad (Báez, 1994). 5.3 ETIOLOGÍA El virus de la IBF (VIBF) pertenece al género Birnavirus de la familia Birnaviridae (Fenner, 1992; Branson et al. 1994). Los virus en esta familia poseen genomas constituidos por dos segmentos A y B con un ARN de tira doble (Murphy et al., 1999; Jackwood, 2009). Es un virus no envuelto con una sola cápside de simetría icosaédrica con un diámetro entre 55 y 60 nanómetros (Fenner, 1992; Calnek et al. 1991; Jordan et al. 11 2001). Posee cuatro proteínas virales designadas como VP1, VP2, VP3 y VP4 (Calnek, 2000, Lechuga, 2009). Las proteínas principales son la VP2 y la VP3 mientras que las VP1 y la VP4 son proteínas menores (Calnek et al. 1991). El segmento A (segmento grande del genoma) codifica las proteínas estructurales virales VP2, VP3 y VP4; la primera, favorece la neutralización de anticuerpos y las variaciones en la secuencia de nucleótidos codificantes y origina variantes antigénicas. El segmento pequeño del genoma (B) codifica la proteína VP1 el cual, es un péptido multifuncional que participa en la replicación y transcripción viral (Jackwood, 2009; Lechuga, 2009). Mediante pruebas de neutralización y electroforesis, el virus se clasifica en dos serotipos. Dentro del serotipo 1, existen variantes antigénicas con diferentes grados de virulencia; es decir, dentro de este serotipo se pueden tener desde cepas no patógenas hasta muy virulentas que propician tasas de mortalidad superiores al 50%. Esta serovariedad en contraste con los del serotipo 2, tienen tropismo por los precursores de linfocitos B de la BF y causan depleción del órgano. A la infección con el serotipo 2 no se le atribuye ninguna enfermedad (Jordan y Pattison, 1998). Se ha observado que el virus se fija en las células renales del embrión de pollo a los 75 minutos post-inoculación y el ciclo de replicación celular es de 10 a 36 Hrs. con un periodo latente de 4 a 6 (Calnek et al. 1991). De acuerdo a su patogenicidad, el virus se clasifica en tres grupos: subclínico, clásico virulento y muy virulento. Esta clasificación está sustentada en la variabilidad genética viral que se traduce en diferentes grados de virulencia, al 12 daño que produce en la BF, a los signos clínicos que causa y a la mortalidad que ocasiona (Valladares, 2010). Las cepas tipificadas como subclínicas, causan inmunodepresión pero no producen signos clínicos ni mortalidad. Las cepas clásicas virulentas propician inmunodepresión con alta morbilidad pero baja mortalidad. Las cepas muy virulentas no presentan cambios antigénicos significativos; sin embargo, la virulencia de estas cepas es alta, causan rangos elevados de morbilidad y mortalidad y las aves que sobreviven a la infección también están inmunodeprimidas (Valladares, 2009). Como se aprecia en la figura 2, dentro del serotipo 1 se encuentran dos subtipos de cepas; la variante y la estándar. El grupo de los virus variantes está compuesto por cepas que desde el punto de vista antigénico son distintas y que en lo general, no producen signos pero causan atrofia bursal severa. Las cepas variantes son capaces de infectar y causar enfermedad en pollos con niveles elevados de anticuerpos contra las cepas estándar. Los sueros de aves vacunadas con cepas estándar tienen una capacidad limitada de neutralizar a las cepas variantes (Valladares, 2010). Al serotipo 2 solo se ha aislado en pavos, patos y pocas veces en gallinas, pero no tiene una importancia clínica hasta el momento. El serotipo 1 es el que tiene la mayor importancia (Banda, 2011). 13 Figura 2. Clasificación de las cepas del virus de la IBF de acuerdo a su antigenicidad y virulencia. Fuente: Jackwood and Sommer-Wagner (2007) En la actualidad se han identificado diversos grupos filogenéticos; sin embargo, no se ha establecido en su totalidad si han ocurrido cambios significativos en sus características antigénicas. Es posible que los virus identificados en América Latina fueran originados de las cepas de los Estados Unidos debido a las similitudes genéticas observadas entre ambos grupos virales (Banda, 2009). El VIBF es muy estable y de gran resistencia a las condiciones físicas y a los agentes químicos. Puede sobrevivir a temperaturas de 60°C, es estable a un pH de 2 y resiste al éter y al fenol al 0.5%; no obstante, es susceptible a la formalina y a los iodoforos (Mosqueda y Lucio, 1985; Márquez, 1992, Calnek et al. 1991). Su estabilidad y resistencia le permiten permanecer infeccioso en el ambiente durante al menos cuatro meses en materia orgánica (Márquez, 1992). La resistencia viral es una razón de su persistencia prolongada en las casetas avícolas, aún si se efectúen procesos minuciosos de limpieza y desinfección (Calnek et al. 1991). 14 5.4 SINONIMIAS La IBF se conoce también como Bursitis infecciosa, Enfermedad de Gumboro, desorden infeccioso de la bursa e Infectious bursal disease (Báez, 1994). 5.5 ESPECIES SUSCEPTIBLES El virus se ha aislado de gallinas, pavos y patos, aunque se ha demostrado que solo produce inmunodepresión en la gallina, pollo y el pavo (Mosqueda y Lucio, 1985; Babaahmady et al,2007; Jackwood, 2009). El VIBF se presenta en reproductoras ligeras y pesadas, gallinas productoras de huevos y en pollos de engorde (Ardaya, 2010). En los Estados Unidos se aisló un virus tipo Birna del tejido bursal necrótico de un avestruz; sin embargo, se cree que el virus procedía de aves de corral. En el Reino Unido también se han aislado virus tipo Birna en pollos de avestruz (Huchzermeyer, 1999). 5.6 EPIDEMIOLOGÍA Los pollos, pavos y patos son susceptibles al serotipo viral 1 patógeno, el cual ocasiona en estas especies una infección de alta contagiosidad. Después del período infeccioso, el virus se excreta en heces durante 10 a 14 días y mantiene su viabilidad durante varios meses (Murphy et al., 1999). En este sentido, favorecen la diseminación viral las lombrices, ácaros de las camas, aves silvestres y personal de las granjas (Márquez, 1992; Jordan y Pattison, 1998). Los pollos jóvenes con anticuerpos maternos están protegidos contra la infección mientras los títulos de anticuerpos sean altos; sin embargo, se vuelven 15 susceptibles si éstos disminuyen. Algunas de las cepas virulentas más recientes parecen ser capaces de traspasar esta respuesta materna a una edad muy temprana. Existe evidencia de que algunas razas, como la Leghorn son más susceptibles a la enfermedad que otras. Por otro lado, las aves mayores cuya BF ha involucionado, parecen ser más resistentes a la infección y no desarrollan la enfermedad clínica. No hay pruebas de que exista el estado de portador o la transmisión vertical (Jordan y Pattison, 1998). 5.7 DISTRIBUCIÓN GEOGRÁFICA Se presenta en la mayoría de los países y se sabe que en la Republica Mexicana casi todas las parvadas de gallinas están infectadas (Mosqueda y Lucio, 1985). 5.8 FACTORES PREDISPONENTES Además de la edad de los animales, no se han identificado otros factores predisponentes. La edad por sí misma, puede reflejar la presencia o ausencia de una BF funcional ya que se ha demostrado que pollos bursectomizados no desarrollan la enfermedad cuando se desafían con cepas virulentas (Márquez, 1992). 5.9 TRANSMISIÓN La infección de la BF es de alta contagiosidad. El ave afectada elimina el virus con el excremento hasta dos semanas post-infección (Lucio, 1991); sin embargo, después de este tiempo parece ser que las heces ya no son infecciosas (Márquez, 16 1992). La diseminación de la infección es por agua, alimento, cama, fómites contaminados con heces y por vectores mecánicos (Báez, 1994). Por otra parte, no existe evidencia que las aves de mayor edad actúen como portadoras o que el agente se transmita por medio del huevo o por aerosoles. Debido a la viabilidad del organismo fuera del hospedero, los fómites y organismos invertebrados son importantes vehículos que favorecen la diseminación viral (Márquez, 1992). 5.10 MORBILIDAD Y MORTALIDAD En las parvadas susceptibles, la enfermedad se presenta de forma súbita con una tasa de morbilidad del 80% - 100% (Calnek et al. 1991). La muerte de los animales empieza a presentarse dos días después de los primeros signos clínicos, alcanza su máximo nivel en 72 horas (3-5 días postinfección) y declina con rapidez. La tasa de mortalidad oscila por lo normal en un rango del 5% al 30% pero en ocasiones, su frecuencia puede ser superior (Lucio, 1991; Márquez, 1992; Báez, 1994). El curso de la enfermedad en cada individuo es corto y conduce con rapidez a la muerte o la recuperación; no obstante, en una parvada donde varían las cantidades de anticuerpos maternos protectores, el curso se prolonga con pollitos que mueren si sus anticuerpos disminuyen (Jordan et al. 2001). 5.11 PATOGENIA Durante muchos años se consideraba que el pollo era la única especie en la cual se producía infección natural (Calnek et al. 1991). 17 El periodo de mayor susceptibilidad es entre tres y seis semanas de edad. Los pollos menores de tres semanas no muestran signos clínicos pero tienen infecciones subclínicas (Calnek et al. 1991). Como se aprecia en la figura 3, el virus afecta a los tejidos linfoides al causar la destrucción de células “B” dentro de la BF, el bazo y las tonsilas cecales. Los linfocitos “T” presentan una afectación relativa (Márquez, 1992; Calnek et al. 1997). Figura 3. Esquema de la patogenia y daño viral en el sistema inmune del ave Fuente: AVISA, 2011. La vía más frecuente de infección es la oral aunque también se consideran importantes la conjuntival y la respiratoria (Jordan y Pattison, 1998). Después de un lapso de cuatro a cinco horas de la infección oral, el virus se puede identificar en los macrófagos y en las células linfoides cecales, en el 18 duodeno y en las células de Küppfer del hígado. La infección llega a la BF vía sanguínea y muchas células de este órgano contienen anticuerpos durante 11 horas. El antígeno viral puede estar presente en este órgano linfoide hasta nueve días post-infección (Báez, 1994; Jordan y Pattison, 1998). En animales susceptibles se observa un periodo de incubación de dos días antes de que la BF se congestione y edematice; estos signos, son más evidentes alrededor del cuarto día post-infección (Márquez, 1992). En la presentación aguda existe una severa inflamación de la mucosa y un exudado amarillento en la superficie del órgano. En esta fase, la BF puede duplicar su tamaño normal al encontrar en las aves viremia y fiebre; después, se presenta una necrosis progresiva de los tejidos linfoides. Además, en esta etapa ocurre la destrucción completa de todos los folículos de la BF y, para el octavo día, ésta se atrofia alrededor de un tercio de su peso original (Guerrero, 1993; González et al. 2005). Otros tejidos linfoides se ven menos afectados, pero el daño en tejidos se asocia con la población de células “B”, como los folículos germinales y vainas perivasculares del bazo. Si el ave sobrevive, el tejido del bazo, timo y tonsilas cecales se regenera con rapidez (Márquez, 1992). En algunas aves, los riñones aparecen hinchados y pueden contener depósitos de uratos y restos celulares, como una consecuencia probable por el resultado del bloqueo de los uréteres por una grave hinchazón de la bolsa. Se desconoce la causa de la hemorragia muscular (Jordan y Pattison, 1998). Los cambios histológicos que se presentan en la BF reflejan la respuesta inflamatoria inicial con hiperemia, edema, infiltración heterófila acompañada por 19 necrosis de células linfoides. Existe cierta necrosis de las células linfoides en el bazo, timo y tonsilas cecales (Márquez, 1992). Se produce hiperplasia de células reticuloendoteliales y tejido interfolicular. Si la respuesta inflamatoria aguda disminuye, el epitelio corticomedular prolifera y se desarrollan cavidades quísticas en las áreas medulares de los folículos. En el bazo y las tonsilas cecales hay algo de necrosis de células linfoides y puede haber depleción de células plasmáticas en la glándula de Harder (Jordan et al. 2001). Desde el punto de vista inmunológico, anticuerpos neutralizantes y precipitantes acompañan de forma invariable la etapa clínica de recuperación de la enfermedad y su presencia puede asociarse con infección subclínica y/o vacunación; sin embargo, factores como la virulencia viral, cepa vacunal empleada, presencia de anticuerpos maternos al momento de la vacunación, el uso de adyuvantes así como la estirpe genética del ave, pueden afectar la concentración y persistencia de anticuerpos (Márquez, 1992). En cuanto a susceptibilidad se refiere, no hay diferencia en patogenicidad viral entre razas pesadas y ligeras; en este sentido, se ha observado que la raza Leghorn reacciona de manera más intensa a la enfermedad, pero estudios posteriores demostraron que no hay diferencia de susceptibilidad entre razas (Calnek et al. 1991). 20 5.12 SIGNOLOGÍA CLÍNICA La gravedad de los signos dependen de la edad del ave, de la concentración de anticuerpos maternos así como de la virulencia viral (Jordan y Pattison, 1998). Las aves de hasta cinco semanas de edad son las más afectadas con indicadores importantes de morbilidad y mortalidad en la parvada; sin embargo, la enfermedad se puede observar en aves de hasta 15 semanas de edad (Márquez, 1992). La forma aguda se observa en pollitos de entre tres y seis semanas de edad (Jordan y Pattison, 1998). El periodo de incubación es muy corto y los signos clínicos se manifiestan de dos a tres días post-infección (Calnek et al. 1991). El curso de la enfermedad es de cinco a siete días (Báez, 1994). Dentro de la signología clínica se observa anorexia, depresión, diarrea acuosa blanquecina, incoordinación, postración y tarsos amarillos y deshidratados (Báez, 1994). Algunas aves muestran cloacas pastosas e inflamadas, erizamiento de plumas y es común observar una falta de uniformidad en el crecimiento de la parvada (Márquez, 1992; Calnek et al. 1991). Uno de los signos más tempranos de infección en una parvada es la tendencia a picotear sus propias cloacas, las aves afectadas se deshidratan y en las etapas terminales de la enfermedad, la temperatura es subnormal (Calnek et al. 1991). La forma benigna produce muy pocos o ningún signo clínico evidente aparte de un crecimiento desigual en las aves; algunas veces, se observa en la parvada afectada un incremento en la presentación de otras enfermedades, además de 21 una respuesta reducida a la aplicación de vacunas (Jordan y Pattison, 1998, Ardaya, 2010). 5.13 LESIONES A la necropsia se observa en las aves deshidratación, hemorragias petequiales en los músculos de la pierna, muslo y en ocasiones en el proventrículo e incremento del moco intestinal. Hay esplenomegalia y el hígado se encuentra inflamado y con infartos periféricos (Márquez, 1992; González et al., 2005). Las lesiones macroscópicas externas en la BF se caracterizan por la presencia de trasudado amarillento gelatinoso que cubren la capa serosa, un aumento de tamaño y de peso (debido al edema y a la hiperemia), diferentes grados de atrofia y cambios de la coloración de blanco a cremoso y por último una coloración gris (Ruíz, 1991; Báez, 1994). Las lesiones internas observadas en este órgano son hemorragias petequiales equimóticas o difusas sobre la mucosa y exudado muco-caseoso en el lumen (Ruíz, 1991). De acuerdo a Wit et al. (2011), en el cuadro 1 se describen el desarrollo de las lesiones en la BF en relación con los días de infección viral en el ave. 22 Cuadro 1. Descripción macroscópica de las lesiones en Bolsa de Fabricio en relación a los días de post infección en el ave. Días post infección Tamaño 2-3 La BF aumenta de peso y tamaño 4 BF con el doble del peso y tamaño normal 5 BF con tamaño normal 8 BF con un tercio del tamaño original Morfología Se observa edematosa con transudado amarillento que cubre la superficie de la serosa. El color cambia de blanco (normal) a cremoso. Pueden estar presentes hemorragias petequiales o extensas. Desaparece el transudado y el edema. Se aprecia una BF de color gris. Fuente: Wit et al (2011) La lesión histológica característica en la BF es la necrosis de las células linfoides. A partir del primer día post-infección se observa edema, hiperemia, degeneración, necrosis de los linfocitos de la región medular de la BF, infiltración de macrófagos a los folículos afectados y necrosis de los folículos de la corteza (Mosqueda y Lucio, 1985; Calnek, 2000). Por otra parte, los riñones tienen una apariencia inflamada y blancuzca; la asociación de la dilatación de los túbulos renales con uratos y desechos celulares, son hallazgos encontrados en algunos casos, pero no son lesiones constantes (Márquez, 1992; Báez, 1994). 5.14 DIAGNÓSTICO La anamnesis de la parvada junto con los signos clínicos y las lesiones encontradas a la necropsia en las aves son suficientes para reconocer la enfermedad en su presentación aguda (Lucio, 1991). 23 5.14.1 Metodologías para el diagnóstico Con base en lo publicado por Banda y Villegas (2003), las diversas técnicas de diagnóstico virológico de la enfermedad incluyen: a) Aislamiento del agente viral “in vitro” b) Identificación de antígenos en tejidos de aves c) Observación de lesiones macroscópicas e histopatología d) Medición de los niveles de anticuerpos circulantes e) Técnicas moleculares En este sentido, en el cuadro 2 se presenta de manera condensada la propuesta práctica de Perusquía (1985) para el diagnóstico de la EG así como las muestras biológicas que deben ser colectadas para ello. Cuadro 2. Pruebas y material biológico necesario para el diagnóstico de la enfermedad de Gumboro en el laboratorio ENFERMEDAD Infección de la Bolsa de Fabricio MUESTRAS PARA EL DIAGNOSTICO BF (en formol al 10%) PRUEBA DIAGNOSTICA a) Histopatología: Necrosis de linfocitos; proliferación de células reticulares; formación de quistes foliculares linfoides en BF Sueros (en refrigeración) b) Serología: Inmunofluorescencia indirecta; Precipitación en agar; Virus neutralización; Reducción en placa. BF y riñones (en bolsas estériles) c) Aislamiento viral: Por inoculación del tejido afectado en embrión de pollo o en cultivo de tejidos Fuente: Perusquia (1985). 24 5.14. 2 Aislamiento viral El aislamiento consiste en replicar el agente viral en algún sistema bajo condiciones de laboratorio. El mejor método para realizar aislamiento viral para el diagnóstico de la IBF es mediante la inoculación de material sospechoso en aves libres de patógenos específicos de cuatro a seis semanas de edad (Banda y Villegas, 2003). Sin embargo, también se puede realizar el aislamiento mediante la inoculación de macerados de BF en huevos embrionados libres de patógenos específicos (Banda y Villegas, 2003). Los cultivos celulares también pueden ser útiles para realizar el aislamiento (OIE, 2008). Se puede recurrir a cultivos primarios de células fibroblásticas o renales de embrión de pollo, así como a líneas celulares como células Vero, QT35 ó BGM-70 entre otras. Por desgracia, el aislamiento conlleva tiempo; además, ciertas cepas de campo son difíciles de aislar, en especial las variantes antigénicas (Banda y Villegas, 2003). Por otra parte y para evitar un diagnóstico falso positivo, es importante tener cuidado en seleccionar la edad del ave a la que se le van a tomar las muestras; en este sentido, hay que cuidar que el ave no haya sido vacunada de forma reciente contra la enfermedad para evitar así el aislamiento de cepas vacunales en vez de cepas de campo (Banda y Villegas, 2003). La confirmación del diagnóstico puede realizarse al utilizar macerados de BF de aves afectadas como antígeno en la prueba de difusión en gel agar, contra antisuero positivo conocido (OIE, 2008). 25 Aunque el aislamiento viral se emplea pocas veces como diagnóstico definitivo debido al tiempo que se requiere para lograr este objetivo, muchas cepas pueden crecer en la membrana corioalantoidea de huevos embrionados de 10 a 11 días de edad. Además, algunas cepas virales crecen en aislamientos primarios en fibroblastos de embrión de pollo, células vero o ciertos cultivos de células linfoblastoides (Jordan y Pattison, 1998; OIE, 2008). 5.14.3 Identificación de antígenos virales en tejidos Las técnicas directas ó indirectas de anticuerpos fluorescentes así como las pruebas de inmunohistoquímica han demostrado ser muy confiables para identificar la presencia viral en tejidos. Con la técnica de anticuerpos fluorescentes se puede obtener el diagnóstico el mismo día si se realiza a partir de tejidos congelados (Banda y Villegas, 2003). En la actualidad, se dispone de forma comercial de una prueba de ensayo de inmunoabsorción ligado a enzimas con captura de antígeno (AC-ELISA); con esta prueba, los virus contenidos en muestras de campo pueden diferenciarse en cepas clásicas o bien, en variantes tipo Delaware E ó GLS (Banda y Villegas, 2003). 5.14.4 Observación de lesiones macroscópicas e histopatología Si se desea realizar un esquema de evaluación diagnóstica de las lesiones en BF, se recomienda tomar muestras de este órgano cada 7, 14, 21, 28 y 35 días de edad de la parvada (Banda y Villegas, 2003). 26 El muestreo rutinario de lesiones en BF aportará información acerca de la presencia y virulencia viral, determinará la edad en la que es posible que haya ocurrido la infección y al mismo tiempo, indicará el grado de inmunodepresión que presenta la parvada (Banda y Villegas, 2003). No obstante, es importante considerar la presencia de otros agentes inmunodepresores que provocan lesiones similares (OIE, 2008). Dentro de este grupo, se encuentran los virus de la anemia infecciosa de las aves, el de la EM y los reovirus, además de las aflatoxinas (Banda y Villegas, 2003). Se puede utilizar también el examen microscópico de secciones de BF para lesiones típicas o la demostración de antígenos virales por inmunofluorescencia en secciones de la misma bolsa congelada (Márquez, 1992). 5.14.5 Medición de los niveles de anticuerpos La prueba de sero-neutralización es el método más sensible para la identificación de anticuerpos contra el virus de la IBF; sin embargo, la técnica de ELISA facilita el procesamiento de grandes cantidades de muestras por estar asociada con un programa que organiza los datos obtenidos (Banda y Villegas, 2003; OIE, 2008). Es importante considerar que la prueba de ELISA mide la cantidad de anticuerpos circulantes pero no puede diferenciar las características de los mismos; es decir, miden la cantidad pero no la calidad (Banda y Villegas, 2003). 27 5.14.6 Técnicas de diagnóstico molecular Debido a la gran variabilidad genética que presenta el virus de la IBF, sus propiedades antigénicas y de patogenicidad también están sujetas a modificaciones. Por lo anterior, se ha hecho indispensable el uso de metodologías más sensibles para poder identificar las características de los virus presentes en las parvadas. Así, las técnicas de identificación y tipificación molecular han cobrado gran importancia diagnóstica en la producción avícola actual (Banda y Villegas, 2003). 5.14.7 Técnica de RT-PCR Para la técnica de RT-PCR se requieren BF refrigeradas, congeladas ó conservadas en fenol (OIE, 2008). Mediante procesos químicos y enzimáticos, se destruyen las células y se extrae el ARN viral total en la muestra (Banda y Villegas, 2003). El ARN total contiene ARN celular del ave y ARN viral. Una vez que se extrae el ARN se procede a realizar la técnica de RT-PCR que consta de dos fases: a) la transcripción reversa y b) la reacción en cadena de la polimerasa (Banda y Villegas, 2003). 5.14.8 Tipificación por prueba del análisis del polimorfismo de los fragmentos de restricción (RFLP) Después de realizar la prueba de RT-PCR, el ARN obtenido se analiza para identificar las posibles mutaciones que tenga y así poder genotipificar la cepa viral mediante la prueba del RFLP (Banda y Villegas, 2003). 28 5.15 PREVENCIÓN Y CONTROL Debido a la naturaleza estable del virus y a las grandes cantidades excretadas de éste después del período infeccioso, es casi imposible remover todas las fuentes de posible contaminación viral en la granja. Sin embargo, hay evidencia de que una buena limpieza y el empleo del sistema “todo dentro-todo fuera” reduce la exposición viral (Jordan y Pattison, 1998). 5.15.1 Bioseguridad En la industria avícola sea cual fuere el tipo de explotación, es esencial llevar estrictos programas preventivos de enfermedades, basados en controles serológicos y epidemiológicos sin descuidar medidas fundamentales de bioseguridad que ayuden a disminuir el riesgo y la posterior propagación de infecciones (Lezundry, 2006). Bioseguridad no es un conjunto de reglas establecidas en los manuales de una empresa avícola. La bioseguridad consiste en acciones efectivas para disminuir la probabilidad de introducción, establecimiento o diseminación de una enfermedad o plaga en la población animal (González, 2008). La bioseguridad en una explotación avícola es el conjunto de programas y medidas sanitarias diseñados con el objetivo de disminuir la inevitable exposición de las aves a los agentes infecciosos y a depredadores naturales (Monroy, 1992, Marrufo, 2009). Las enfermedades aviares representan una de las fuentes principales de pérdidas económicas para la industria y para que ésta pueda minimizarlas, se 29 deben establecer estrictos esquemas de prevención y control de enfermedades (Jarquin, 2010). En un programa de bioseguridad avícola, hay aspectos muy importantes que no se deben descuidar (Mosqueda, 1991; USDA, 2011). Entre éstos, se tienen: 1. Ubicación de la granja: ésta determinará el grado de aislamiento con otras granjas avícolas, con centros urbanos y plantas procesadoras avícolas (Monroy, 1992). Deben existir por lo menos entre 3 y 5 km de separación entre granjas avícolas comerciales y otro tipo de producción pecuaria que se considere un riesgo sanitario para la empresa (Monroy, 1992; Jarquin, 2010). 2. Acceso a la granja.- Debe ser restringido, para evitar la introducción de agentes patógenos. El aislamiento de ésta con respecto a su entorno, es fundamental para impedir la entrada de animales, personas y vehículos de manera indiscriminada a la unidad de producción (Mosqueda, 1991; Jarquin, 2010). Por otra parte, es necesario acortar en la manera de lo posible, el tiempo de estancia de todo personal y vehículo externo dentro de las instalaciones de la granja (Jarquin, 2010). 5.15.1.1 Tránsito de Vehículos Se recomienda que todos los vehículos que ingresen a la granja pasen por un proceso de desinfección con el empleo de lavadores de presión y el uso de vados sanitarios (Jarquin, 2010). Asimismo, que dentro de las granjas se tengan instalaciones con duchas accesibles para el personal y que uno de los requisitos 30 para entrar sea tomar un baño y realizar durante éste una buena limpieza de manos, uñas, nariz y oídos (Jarquin, 2010; Nilipour, 2011). Además, es importante para el personal el cambio de ropa de calle, por ropa de trabajo exclusivo dentro de la granja (Mosqueda, 1991; Jarquin 2010). El uso de tapetes sanitarios y desinfectantes de manos deben ser estrictos; los tapetes sanitarios, deben localizarse a la entrada de las casetas y estar alejados del sol (Monroy, 1992; Jarquin, 2010). Es muy importante evitar la entrada a la granja de aves de traspatio, aves silvestres, roedores, insectos y animales como perros o gatos (Mosqueda, 1991; Monroy, 1992). Además, es necesario limitar la presencia de vegetación entre casetas; lo anterior, con la finalidad de reducir el acceso de roedores u otros animales a la unidad de producción (Monroy, 1992; Jarquin, 2010). Un punto fundamental dentro de las medidas de bioseguridad es la destrucción correcta de los cadáveres; en este sentido, en la granja debe existir una zona destinada para la incineración o el compostaje de aves muertas (Mosqueda, 1991; Monroy, 1992). Es lógico suponer que las instalaciones ya existentes en la granja no pueden moverse o sufrir modificaciones constantes; no obstante, lo que si puede hacerse es adecuarlas lo mejor posible y, con los diferentes aspectos que no puedan cambiarse, se debe hacer un análisis epidemiológico de riesgo con base en las condiciones existentes (Jarquin, 2010). Las principales formas de transmisión y diseminación de agentes etiológicos en una granja o entre granjas se presenta en el cuadro 3 (Jarquin, 2010). 31 Cuadro 3. Principales enfermedades aviarias, sobrevivencia del agente etiológico y formas de diseminación más comunes en una granja Enfermedad Infección de la Bolsa de Fabricio Sobrevivencia del agente etiológico fuera del ave Meses Coccidiosis Cólera Aviar Coriza Infecciosa Meses Semanas Horas a días Marek Newcastle Meses - años Días a semanas Micoplasmosis Horas a días Salmonelosis Semanas a meses Laringotraqueitis Infecciosa Tuberculosis Aviar Semanas a meses Años Influenza Aviar Semanas a meses Formas de transmisión más comunes Ave-Ave, cama, aerosol, personal, aves silvestres, insectos, etc. Cama contaminada Ingesta, inhalación, insectos Ave-Ave, aerosol, agua contaminada Aerosol, polvo, plumilla Maquinaria, ropa, personal, polvo Ave-Ave, ropa, personal, polvo Ave-Ave, cama, roedores, insectos, personal, aerosol Aerosol, maquinaria, personal Ave-Ave, agua, alimento contaminado Ave-Ave, cama, personal, roedores, maquinaria Fuente: Jarquin (2010). 5.15.1.2 Desinfección y sanidad Para una producción eficaz y rentable, la limpieza, desinfección y los aspectos sanitarios son fundamentales en toda unidad de producción pecuaria; por ello, estos puntos están ligados de forma tan estrecha que semejan una cadena que funciona bien siempre que se realicen de manera correcta (Soto, 1991; Nilipour, 2011). Un programa efectivo de limpieza y desinfección es crítico para el éxito de las prácticas de bioseguridad en la granja (Jarquin, 2010). El propósito de la limpieza es la eliminación de toda materia orgánica de las instalaciones avícolas (Soto, 1991). 32 Después de retirar la materia orgánica se procede con un lavado minucioso, primero con agua a presión para remover cualquier residuo de materia orgánica, luego se debe remojar con detergente, seguido de un enjuague con agua a presión (Jarquin, 2010). Este mismo proceso, debe ser realizado en áreas perimetrales (Nilipour, 2011). La limpieza de un área de trabajo debe realizarse en forma previa a la utilización de cualquier tipo de desinfectante (Soto, 1990). En este sentido, en el cuadro 4 se presentan algunas características de los desinfectantes empleados con mayor frecuencia en la industria avícola. Cuadro 4. Características de los desinfectantes más utilizados en la industria avícola Producto Concentración final Tiempo de contacto Utilización Alcohol 70% 30 seg. a min. Utensilios pequeños y desinfección de manos Detergente común Variable 10 min. Instalaciones, jaulas Cloro 2-3% 10-30 min. Instalaciones, equipo Amonio cuaternario 2% 10 min. Equipo Hidróxido de Sodio 2% 10 min. Equipo, vehículos Carbonato de Sodio 4% 10-30 min. Equipo Formaldehído 2-10% 15-24 h Equipo eléctrico Yodo 150 ppm 10-30 min. Tapetes sanitarios, alrededores Aldehídos Variable 10-600 min. Instalaciones, tapetes sanitarios. Fuente: Soto (1990). 33 Se debe planear con antelación el tiempo adecuado para limpiar y secar las galeras entre el cambio de parvadas; así, las casetas deben permanecer vacías por un mínimo de dos semanas. Lo anterior, permite que la caseta seque de manera adecuada y propicia la eliminación de patógenos aviares en especial si se utiliza como desinfectante el formaldehído y los iodoforos (Márquez, 1992; Jordan y Pattison, 1998; Jarquin, 2010). 5.15.1.3 Programas de vacunación Dentro de un programa de bioseguridad, sin lugar a duda los calendarios de vacunación son esenciales si se ha fijado como meta obtener una parvada saludable y productiva al final del ciclo; por ello, en la actualidad no se pueden concebir en la avicultura comercial, parvadas que nunca hayan sido vacunadas de manera preventiva (Marrufo, 2009). El objetivo de implementar un programa de vacunación en una granja es en lo general evitar el impacto sanitario y productivo de un gran número de enfermedades que afectan a las aves (Robín, 2008; Marrufo, 2009). Entre los factores a considerar para diseñar un calendario de vacunación se tienen: a) La incidencia de enfermedades en la región. En ciertas zonas se presentan mayores niveles de desafío ante agentes etiológicos específicos: éstos, causan enfermedades que inciden mas durante la fase de desarrollo o recría, como ocurre con la infección de la BF, la enfermedad de Newcastle, bronquitis infecciosa, viruela aviar y EM; mientras que otras son comunes durante la fase de producción como el cólera aviar, micoplasmosis, coriza 34 infecciosa y la encefalomielitis (Robín, 2008). Por tanto, el calendario de vacunación debe establecerse en función del tipo de granja de que se trate; lo anterior, debido a que las necesidades preventivas en las granjas de pollo de engorda, de gallina de postura o aves reproductoras son diferentes y cambian en forma considerable por las edades que maneja cada una de ellas. Por otra parte, la densidad de población es también un factor importante a considerar porque el desafío por cepas infecciosas de campo es mayor en parvadas hacinadas (Tamayo, 2003). b) Presencia de anticuerpos maternos. Las aves reproductoras se vacunan contra diversos agentes y producen anticuerpos específicos mismos que serán transmitidos mediante el saco vitelino a los pollos recién nacidos. En el caso de la infección de la BF, bronquitis infecciosa y enfermedad de Newcastle, los anticuerpos maternos pueden neutralizar al virus vacunal, por lo que es necesario esperar a que esos anticuerpos desciendan de manera natural para que la vacunación preventiva en los pollitos sea eficaz (Tamayo, 2003; Robín, 2008). Los esquemas de vacunación en parvadas comerciales contra la IBF establecen la aplicación del biológico en las primeras seis semanas de vida, ya que existen informes de la ocurrencia de la enfermedad clínica en aves de 14 a 15 semanas (Robín, 2008). En la práctica el control de la enfermedad depende de la estimulación de la inmunidad activa o pasiva en la parvada por la vacunación al emplear vacunas de virus vivo, vacunas oleosas inactivadas o ambas (Márquez, 1992; Sainsbury, 2002). 35 Para que una vacuna de virus vivo sea segura y efectiva es necesario que contenga un virus atenuado de manera suficiente (no patógeno) y que no propicie inmunosupresión; además, debe inducir una buena respuesta inmune aún en presencia de anticuerpos maternos. Pocas vacunas de virus vivo cumplen a cabalidad con estos requisitos, en particular por la presencia de altas concentraciones de anticuerpos maternos. Esos anticuerpos por sí mismos pueden variar el título de ave en ave e interferir con la vacunación temprana (Márquez, 1992). Los anticuerpos neutralizantes son protectores y pueden obtenerse en la forma de anticuerpos maternos a partir de gallinas inmunizadas o como anticuerpos activos mediante la inmunización de los pollitos con vacunas vivas administradas en el agua de bebida. Se desconoce la función de la respuesta celular en la protección (Jordan y Pattison, 1998). Para obtener contra la IBF una buena respuesta inmune por anticuerpos maternos en la progenie, la parvada madre se vacuna entre 4 y 10 semanas de edad con vacuna viva y se revacuna a las 16 semanas con vacuna inactivada con un adyuvante oleoso. En la progenie la cantidad de anticuerpos maternos declina con el tiempo y protegen contra exposiciones virulentas entre las primeras cuatro semanas de edad (Jordan y Pattison, 1998; Tamayo, 2003). En las reproductoras se tienen varios tipos de programa de vacunación (Tamayo, 2003): 1. Un programa suave.- En éste, se utilizan vacunas a virus vivo para lograr una inmunidad activa, ya que los desafíos vacunales son constantes pero con cepas de baja patogenicidad (Tamayo, 2003). 36 2. Un programa moderado.- Se establece si la inmunosupresión tiene mayor probabilidad de causar problemas sobre todo si los desafíos de campo por IBF son tempranos y a esto, se asocia la presencia de otras enfermedades infecciosas (Tamayo, 2003). 3. Un programa fuerte.- Se adopta ante la presencia de cuadros clínicos tardíos y subclínicos por IBF o bien, si la mortalidad de la parvada es elevada. Se comienza a los 25–28 días de edad de la parvada reproductora y se presenta una inmunosupresión en la primera semana post-vacunación. En este programa, los anticuerpos maternos permiten un mejor control en caso de desafíos tempranos por IBF en la progenie (Tamayo, 2003). Las cepas vacunales “benignas” que no causan lesiones en la BF no deben ser aplicadas en los pollitos con anticuerpos maternos hasta después de las cuatro semanas de edad ya que, de emplearse antes de este tiempo, éstos son neutralizados (Jordan y Pattison, 1998). Las vacunas con virulencia moderada o intermedia que son menos afectadas por los anticuerpos maternos, se pueden aplicar con cierto éxito entre la segunda y tercera semana de edad de la parvada en dependencia de los títulos de anticuerpos maternos. Debido a que las concentraciones de anticuerpos maternos pueden variar dentro de una parvada y entre parvadas, la vacunación repetida se practica con el fin de asegurar la inmunización activa en los pollitos tan pronto como los anticuerpos maternos disminuyan a un nivel que no neutralicen el efecto de la vacuna (Jordan y Pattison, 1998). 37 Los pollos de engorda y las aves ponedoras reciben hasta cuatro dosis de vacuna en ciertos casos. En reproductoras se utilizan de tres a cuatro dosis de vacuna activa ó bien, una o dos dosis de vacuna inactivada (Robín, 2008). En aves cuyo status inmunológico a un día de edad se desconoce, se recomienda un esquema de doble vacunación a los 7 y 14 días de edad con una cepa vacunal intermedia administrada en el agua de bebida o por vía ocular (Márquez, 1992). En individuos con anticuerpos maternos bajos o ausentes, es recomendable vacunar durante los primeros días de edad y revacunar siete días más tarde (Márquez, 1992). En parvadas con alta inmunidad materna se aconseja el uso de cepas vacunales intermedias hacia los 14 o 21 días y si es posible, no aplicar ninguna vacuna hasta después de ese tiempo (Márquez, 1992). En aves de postura comercial, los programas preventivos incluyen la aplicación de dos o tres vacunas a virus activo durante la crianza; en pollo de engorda, los esquemas son variados con aplicación “in ovo” o bien por vía subcutánea al día de edad (Selbitz y Moss, 1997; Nieto, 2011). 5.16 IMPACTO PRODUCTIVO Y ECONÓMICO Entre los virus de mayor impacto sanitario, productivo y económico por su efecto inmunosupresor en la avicultura destaca el causante de la EIBF (Lechuga, 2009); por ello, se le considera como el agente etiológico de mayor frecuencia en las granjas comerciales (Villegas, 2011). 38 En las aves domésticas la competencia inmunológica es en especial importante para el desempeño productivo de la parvada; si las aves están inmunocomprometidas la eficiencia productiva disminuye, la efectividad de las vacunas utilizadas en forma rutinaria se reduce y se incrementa la susceptibilidad hacia otros agentes patógenos (Valladares, 2010). La IBF es de alta contagiosidad en pollos jóvenes y se caracteriza por una destrucción severa de los linfocitos de la BF. Debido a que el virus es muy resistente a las medidas convencionales de limpieza y desinfección. Una vez establecido en la granja, tiende a persistir de forma indefinida mientras las casetas se utilizan (Valladares, 2010). En México la IBF se ha reportado en forma subclínica bajo cuadros de inmunodepresión en las parvadas lo cual, deriva en enfermedades secundarias que generan grandes pérdidas productivas y económicas al sector avícola (Lechuga, 2009). La evaluación del incremento de costos por estos problemas de inmunodepresión es muy difícil, ya que interactúan una multitud de factores. Mcllroy et al. (1989) evaluaron estos costos para pollos no vacunados y afectados de forma subclínica encontrando una disminución de un 10 % en las utilidades a la venta de la parvada debido a un menor peso al sacrificio y a un decremento de los índices de conversión (Sacristán y Sagardía, 2005). Asimismo, García y Soto. (2002) refieren importantes pérdidas económicas directas por pérdida de la productividad derivadas por la presencia de mortalidad en las aves afectadas, por un incremento en los costos de medicación, alimentación, decomisos, fallas en vacunación y susceptibilidad a infecciones secundarias. 39 5.16.1 Estrategias para el control de la IBF No existe un tratamiento eficaz contra la IBF; sin embargo, se puede ayudar a las parvadas afectadas con tratamientos sintomáticos encaminados a controlar la presencia de posibles agentes infecciosos secundarios así como los efectos de la inmunosupresión (Sainsbury, 2002; HIPRA, 2011). Para la prevención de la enfermedad es fundamental la vacunación de las aves reproductoras con biológicos inactivados para proporcionar una buena inmunidad pasiva a la progenie. Los pollitos deberán inmunizarse con vacunas vivas en el momento en que los niveles de inmunidad maternal sean adecuados para que la vacuna no se neutralice. Asimismo, es importante asegurar buenos niveles de bioseguridad, desinfección y desinsectación en las granjas, así como evitar los sistemas de multiedad para reducir la incidencia de la enfermedad (HIPRA, 2011). Las empresas productoras de vacunas mejoran de forma constante, la inocuidad y la eficacia de sus productos y los diferentes patotipos de vacunas son empleados de manera universal como la medida de control más efectiva en circunstancias epidemiológicas diferentes (HIPRA, 2011; Lechuga, 2009). Nilipour (2011) menciona 10 factores que deben ser considerados para controlar y evitar la presencia de IBF en las parvadas: 1. Evaluar el programa de vacunación de las reproductoras 2. Manejo de huevos fértiles 3. Método de incubación de los huevos 4. Preparación sanitaria de las granjas 40 5. Manejo del pollito y recibimiento de éste en la granja 6. Vacunación de las aves 7. Exámenes de diagnóstico 8. Alimentos libres de micotoxinas 9. Sistema de manejo: todo dentro - todo fuera 10. Bioseguridad Los estudios más recientes para actualizar la información epidemiológica de esta enfermedad, se han encaminado a la comprensión del genoma viral y a la patogenicidad del agente etiológico (HIPRA, 2011). Para las nuevas generaciones de Médicos Veterinarios Zootecnistas así como para los profesionistas que laboran en este sector productivo, la IBF representa un reto importante en lo sanitario; las estrategias para su control, radican sólo en el establecimiento de programas preventivos eficaces y eficientes. Debido al desarrollo del proceso infeccioso, ésta es y será la única herramienta que permita minimizar su impacto productivo y económico en la avicultura nacional (HIPRA, 2011). 5.16.2 Situación de la enfermedad en México. A nivel nacional, los estados que sobresalen en producción avícola son Guanajuato, Jalisco, México, Nuevo León, Puebla, Querétaro, Sinaloa, Sonora, Veracruz y Yucatán; asimismo, la Comarca Lagunera (que abarca parte de Durango y Coahuila (UNA, 2011). En México como en Estados Unidos la IBF causa inmunosupresión o cuadros de enfermedad subclínica. A mediados de los años 80 del siglo pasado, 41 comenzaron a identificarse nuevas variantes virales por lo que a partir de entonces, se continua con el aislamiento de diferentes serotipos (Tamayo, 2003). Sin embargo, en México, se han identificado cepas estándares y algunos virus únicos que no corresponden con alguna cepa conocida (Banda y Villegas, 2011). En un estudio realizado por Lechuga (2009) sobre la situación epizootiológica del virus de la IBF en México, se demuestra que en el país existen variantes virales que producen un cuadro subclínico que generan importantes pérdidas económicas a la industria avícola nacional; dichas serovariedades, pueden ser controlados con vacunas tipo estándar. Durante el período 2000–2003 las principales enfermedades inmunosupresoras detectadas en la avicultura nacional fueron en orden de importancia IBF y la EM (Vázquez et al. 2002; Ruíz et al. 2004). Por lo anterior, la IBF está considerada como una enfermedad de importancia económica que afecta al sector avícola del país (Lechuga, 2009). 5.16.3 Perspectivas de la IBF en la avicultura nacional. La avicultura es una actividad de suma importancia económica debido al crecimiento que ha experimentado en los últimos años (Layseca, 2008). A nivel nacional, el sector avícola participa con el 63% de la producción pecuaria; en este sentido, el 33% lo aporta la producción de pollo, el 30% la producción de huevo y el 0.20% la producción de pavo (UNAM, 2009). A la producción avícola, se considera la principal industria trasformadora de proteína de origen vegetal en proteína de origen animal. Pese a las condiciones económicas desfavorables en el país, la producción de pollo ha tenido un crecimiento anual del 5.5% en los últimos 42 años, incremento que se favorece por el consumo per-cápita de pollo (UNAM, 2009). Desde 1997 la carne de pollo es la más consumida por la población mexicana y en la actualidad representa casi el 50% en la preferencia de carnes por el consumidor en el país (UNAM, 2009). A nivel nacional, la producción de huevo durante la última década creció a un ritmo anual de 4.1%; lo anterior, sitúa a la población en México como la principal consumidora de huevo fresco en el mundo. En este sentido, el consumo de huevo por habitante se incrementa de manera paulatina ya que la tasa media de crecimiento anual de este producto de los últimos años fue de casi 2%. Cabe señalar, que en los últimos tiempos los precios del huevo han estado por debajo de los índices de inflación (UNAM, 2009). Ante este marco de importancia productiva en el país, la inmunosupresión causada por la IBF impide que las parvadas respondan de forma adecuada a la vacunación contra diferentes enfermedades y las hace más susceptibles a sufrir reacciones posvacunales e infecciones secundarias con otros agentes patógenos. Las pérdidas económicas causadas por este virus se deben en lo principal a inmunosupresión transitoria o permanente de las parvadas que resulta en morbilidad y mortalidad elevada. La enfermedad está presente casi en todas las aves donde existe avicultura comercial (Ardaya, 2010). A pesar de los avances logrados en el diagnóstico de enfermedades aviares y del desarrollo constante de nuevas vacunas, la IBF continúa siendo uno de los principales problemas infecciosos en la avicultura nacional y se constituye 43 día a día, como uno de los retos más importantes a vencer en lo sanitario (Ardaya, 2010). En un estudio realizado por Barbosa et al. (2011) se demostró la variabilidad de los aislamientos de virus de la IBF en toda América Latina. La mayoría de las cepas identificadas por los autores se clasificaron como cepas variantes. Este hallazgo, evidencia el aumento de la incidencia de este tipo de cepas en América Latina. 5.16.4 Importancia del sector avícola en el estado de Veracruz Un factor que ha apoyado el crecimiento de la producción de carne de pollo es la diversificación de productos que estén disponibles en el mercado, con lo que se da alternativas al consumidor de adquirir productos con un bajo nivel de preparación y/o productos elaborados listos para su consumo (Villamar, 2009). El establecimiento de la producción avícola en ciertas regiones del país obedece a la consolidación de operaciones comerciales de las compañías avícolas (Villamar, 2009). En este sentido, en el estado de Veracruz se registró una fuerte expansión de operaciones de este sector productivo así como una fuerte tecnificación de medianas empresas avícolas que propiciaron un crecimiento del 25.9% entre el 2003 y 2008 (Villamar, 2009). En el 2003, Veracruz ocupaba el segundo lugar dentro de la producción avícola nacional; a la fecha, se le reconoce como la entidad de mayor producción de aves (Villamar, 2009). 44 En 2008, Veracruz aportó el 16% de la producción avícola nacional y comercializó 155 millones de pollos, cifra que determina que de manera mensual, se generasen en el estado, poco más de 13 millones de aves (Herrera, 2008). El valor en el mercado de las 400 mil toneladas de carne de pollo que se producen en la entidad cada año es de más de 8 mil millones de pesos, y el de la infraestructura básica de producción rebasa por mucho los 5 mil 500 millones de pesos (Herrera, 2008). La avicultura en Veracruz genera alrededor de 49 mil empleos directos e indirectos reflejándose dentro del sector productivo y laboral, como una fuerte e importante actividad económica (Herrera, 2008); lo anterior, se debe a que los empresarios avícolas han encontrado en el estado un lugar apropiado para desarrollar de manera íntegra y favorable su actividad. Este hecho, ha permitido que día a día y de forma constante y progresiva, se consolide la industria avícola en la entidad (Reyes, 2009). Así, para el 2010 Veracruz continuó siendo de los primeros productores a nivel nacional de pollo de engorda al aportar un 11% de la producción total (UNA, 2011). Como en todo sistema productivo, el buen estado sanitario de las aves es fundamental para alcanzar las metas proyectadas dentro de la actividad avícola y esto, obliga a conocer el comportamiento de los principales agentes productores de enfermedades en esta especie (Valladares, 2010). Como parte de la integración avícola, algunas compañías cuentan con sus propios laboratorios de diagnóstico y servicios técnicos que les permiten mantener altos niveles de calidad sanitaria de sus inventarios y cumplir con las exigencias establecidas por las diferentes campañas zoosanitarias oficiales (Valladares, 2010). 45 5.16.5. Perspectivas de la IBF en la avicultura de Veracruz. Aunque no existen reportes de los brotes de la enfermedad en las diferentes granjas avícolas del estado, bastará con realizar pruebas de diagnóstico de la enfermedad para darse cuenta de la presencia de ésta en las casetas. Es posible que muchas de las enfermedades a las que ahora se da mayor atención para su control, estén presentes y sean consecuencia directa de la inmunodepresión causada por la IBF; aunque las cepas presentes en México y que quizá se encuentren en el estado no sean tan agresivas, los profesionistas y productores dedicados a esta actividad pecuaria, no deben desatender ni minimizar su existencia en las granjas, ya que como se ha reportado, el virus es muy variable y podría en cualquier momento, causar importantes brotes y con ello, generar un fuerte impacto sanitario, productivo y económico en las empresas avícolas. En este sentido, la vigilancia y el reporte epidemiológico a las instancias oficiales son factores fundamentales para identificar todos aquellos casos que puedan poner en riesgo a la avicultura estatal. 46 6. CONCLUSIONES La IBF una enfermedad de importancia sanitaria, productiva y económica dentro de la actividad avícola nacional; por ello, debe tenerse una vigilancia epidemiológica constante sobre ella porque a pesar de la existencia de nuevas vacunas y eficaces esquemas de prevención, las características de patogenicidad viral no deben permitir ningún descuido en las medidas de bioseguridad establecidas en las granjas para su control. 47 7. RECOMENDACIONES El análisis de la información existente sobre la IBF en México permite sugerir las siguientes recomendaciones: a) No restar a esta enfermedad la importancia sanitaria que requiere b) No descuidar las medidas preventivas para evitar su presencia en las granjas c) Realizar más investigación epidemiológica para conocer su distribución e impacto en el país d) Reportar los brotes de ésta para coadyuvar con el Sistema Nacional de Vigilancia Epidemiológica (SIVE) y conocer las entidades y regiones geográficas donde se han presentado casos. e) Actualizar la información epidemiológica sobre su presencia a nivel nacional. 48 8. REFERENCIAS Avisa 2011. Prevención contra la enfermedad de Gumboro: Tipos de vacunas, programas vacúnales y vías de aplicación. Disponible en http://avisa.org.ve/articuloscientificos/prevencion-contra-la-enfermedad-de-gumboro-tipos-de-vacunasprogramas-vacunales-y-vias-de-aplicacion [Consultado el 13 de enero de 2012]. Ardaya C. 2010. Enfermedad infecciosa de la bolsa de Fabricio y su control. Laboratorio de Patología Aviar. Asociación de Avicultores de Santa Cruz Bolivia. Disponible en www.engormix.com. [consultado el 13 de enero de 2012]. Babaahmady E., Joa R., Noda J. 2007. Enfermedad de Gumboro. Histopatología de la Bursa de Fabricio en la enfermedad natural y experimental en pollos de engorde. Vol. VI, N° 3, Marzo 2005. Revista Electrónica de Veterinaria REDVET. Disponible en http://www.veterinaria.org/revistas/redvet. [consultado el 13 de enero de 2012]. Báez A.J. 1994. Patología de las Aves. Trillas. México D.F. México. p. 30 y 32. Banda A., Villegas P. 2003. Gumboro: Métodos de Diagnóstico e Interpretación de Resultados. En: Memorias de IX Jornada Médico Avícola. México D.F. México. p. 129-137. Banda A. 2009. Aplicación práctica de las técnicas moleculares en el diagnóstico de enfermedades inmunodepresoras en avicultura. Mississippi, USA. XXXIV Convención anual ANECA. Acapulco, Guerrero, México. Banda A. 2011. Prevención contra la enfermedad de Gumboro: Tipos de vacunas, programas vacúnales y vías de aplicación. Lima, Perú. Disponible en www.actualidadavipecuaria.com. [Consultado el 15 de enero de 2012]. Barbosa T .M. C., Turpin E., Verdi R., Tamayo M. 2011. Caracterización molecular del virus de la enfermedad de Gumboro en casos diagnosticados en América Latina en 2010. Pfizer Poultry Health. Durham, North Carolina, USA. Branson W.R; Harrison G.J; Harrison R.L. 1994. Avian Medicine: Principles and Application. Wingers Publising. Inc. Florida, USA. p. 109, 914, 1232. Burns G.K. 2009. Efectos Inmunosupresores de la Infección de la Bolsa de Fabricio y la Enfermedad de Marek. Disponible en: www.avicultura.com. [Consultado el 13 de enero de 2012]. CALIER Laboratorios. 2011. Barcelona, España. www.calier.es [consultado el 14 de enero de 2012]. 49 Calnek B. W., Barnes J.H., Beard C.W., Reid W.M., Yoder, Jr. H.W. 1991. Enfermedades de las aves. El Manual Moderno, México, D.F. México. p. 797-811. Calnek B.W. 2000. Enfermedades de las Aves. 2° ed. Edit. El Manual Moderno. México. D.F. México. p. 739-751. Calnek B.W; Barnes H.J. Beard W.C; McDougald R.L; Sait Y.M. 1997. Diseases of Poultry. 10° ed. Editorial Board for the American, Association of Avian Pathologists Iowa State University Press Ames. Iowa, USA. Fenner F., Bachmann A.P., Gibbs J.P.E., Murphy F.A., Studdert M.J., White D.O. 1992. Virología Veterinaria. Acribia, Zaragoza, España. p. 621-624. Herrera B.F. 2008. Presenta Veracruz, Primer Lugar en Producción Avícola: FHB. Diario Zona Sur octubre 16. Sec Estatal .Veracruz. México. Disponible en: http://www.diariozonasur.com/noticia/Veracruz,-Primer–Lugar-en-ProducciónAvícola:-FHB.htm. [consultado el 13 de enero de 2012]. Flores M.J.S., Prado R.O.F., García M.L.J., Prado C.L., Vázquez G.J.L., Fernández A.S., Soto C.J.B. 2004. Causas de Mortalidad del Pollo de Engorda en la Etapa de Inanición en una Empresa del Estado de Colima. En: Memorias de X Jornadas Médico Avícolas. México, D.F. México. p. 259-256. Goméz V.G. 2002. Inmunología Básica en el Pollo. En: Memorias de VIII Jornadas Medico Avicolas. México, D.F. México. p. 108-113. González I. R., Silvera P. E. A., Olazábal M. E. 2005. Frecuencia y Caracterización de Lesiones anatomo-patologicas en la Enfermedad de Gumboro y Enfermedades secundarias asociadas en nuestras condiciones ambientales, estudio retrospectivo. Vol VI, N° 10. Revista Electrónica de Veterinaria REDVET-ISSN 1695-7504. Disponible en http://www.veterinaria.org/revistas/redvet. [consultado el 13 de enero de 2012]. González S.S.A. 2008. Actualidades de Bioseguridad. En: Memorias de XIV Jornadas Medico Avicolas. México D.F. México. p. 78-84. Guadarrama J.A., Castellanos N.L., Cubillas V.C. 2009. Comparación de la Inmunidad Conferida por Vacuna de la Infección de la Bolsa de Fabricio entre las Estirpes Hy-line e Isa Brown. Boehringer Ingelheim Vetmedica. Guadalajara, Jalisco, México. Guerrero C. R. 1993. Evaluación del Daño Bursal Mediante el Índice Bursal, el Rango Tarso Bursal y el Estudio Histopatológico en Pollos de Engorda Vacunados Contra la Infección de la Bolsa de Fabricio. En: Memorias de IV jornada medico avícola. México D.F. México. p. 106. 50 Higuera B. S. 2009. Cambios Importantes en la Industria Avícola Mexicana en los Últimos años. En: Memorias de XV Jornadas Médico Avícolas. México D.F. México. p. 24-30. HIPRA, LABORATORIOS. 2011. Enfermedad de Gumboro. http://mi.hipra.com. [consultado el 13 de enero de 2012]. Disponible en Huchzermeyer F.W. 1999. Patología de Avestruces y Otras Ratites. Ediciones MundiPrensa. Zaragoza España. p. 155. Jackwood D.J. 2009. Current Status of Infectious Bursal Disease. Food Animal Health Research Program. Ohio, USA. XXXIV Convención Anual ANECA. Acapulco, Guerrero, México. Jarquin L.R. 2010. Bioseguridad para Productores Avícolas. Los Avicultores y su Entorno. Año 13, N° 74. México D.F. México. p. 91-96. Jordan F. F. W. y Pattison M. 1998. Enfermedades de las aves. 3 a ed. El Manual Moderno, México D.F. México. p. 191-194. Jordan F., Pattison M., Alexander D., Faragher T. 2001. Poultry Diseases. 5ª Edición. W.B.Saunders, Harcourt Publishers. Hong Kong, China. p. 319-323. Layseca B. F.M. 2008. El Laboratorio de Diagnóstico en la Patología Aviar. En: Memorias de XIV Jornadas Medico Avícola. México D.F. México. p. 85-91. Lechuga M. 2009. Situación epizootiológica del virus de la Infección de la bolsa de Fabricio en México, Ceva Santé Animale, México. AMVEAV 9° congreso avícola, Orizaba, Veracruz, México. 2011. Lezundry M.J.A. 2006. Sistema Inmune del Pollo. www.avicultura.com.mx. [consultado el 13 de enero de 2012]. Disponible en: Lucio D.E. 1991. La Infección de la Bolsa de Fabricio. En: memorias de II Jornada Médico Avícola. México D.F. México. p. 117. Márquez M.A. 1992. Infección de la Bolsa de Fabricio (Enfermedad de Gumboro), División Veterinaria, Sanofi de México. En: Memorias de III Jornada Medico Avícola. México D.F. México. p. 145. Marrufo V.D. 2009 Tecnología de las Vacunas. En: Memorias de XV Jornadas Médico Avícolas. México D.F. México. p. 66-70. Monroy G. M. 1992. Principios Básicos sobre Bioseguridad. En: Memorias de II Jornada Medico Avícola, México D.F. México. p. 151-154. 51 Morilla G. A. 1989. Inmunología Veterinaria. 1° ed. Diana, México D.F. México. p. 337-351. Mosqueda T. A y Lucio M. B. 1985. Enfermedades Comunes de las Aves Domésticas. 1° ed. Departamento de Producción Animal: Aves Facultad de Medicina Veterinaria y Zootecnia. México D.F. México. p. 27-36. Mosqueda T.A. 1991. Bioseguridad: Base de la Eficiencia en la Avicultura. En: Memorias de II Jornada Medico Avicola. México D.F. México. p. 217-232. Murphy F.A., Gibbs J., Horzinek C.M., Studdert J.M. 1999. Veterinary Virology. Third Edition. Academic Press. United States of America. p. 406-409. Nieto E.J. 2011. In ovo, el futuro de la vacunación. Disponible www.encolombia.com/veterinaria/ [Consultado el 16 de enero de 2012]. en: Nilipour A.H. 2010. Manejo Óptimo de Gumboro. Una Experiencia de Campo. Año 14, N° 81, Junio-Julio 2011. Los Avicultores y su Entorno. México. D.F. México. p. 92101. OIE (World Organisation for Animal Health). 2008. Terriestral Manual. Infectious Bursal Disease (Gumboro Disease). p. 549-565. Perusquía J.M.T; Passch M.L. 1985. Necropsias en Aves. Trillas. México D.F. México. p. 138, 144. Reyes, B. 2009. Presenta Avicultores de Veracruz, Líderes en Producción Nacional. Revista Veracruz Pecuario agosto 2009. México. Articulo 9. Disponible en www.revistapecuario.com.mx/agosto/art9.html. Robín O. 2008. Sistema Inmune Aviar. Estrategia de Protección de las Aves. Importancia del Buen Funcionamiento. En: Memorias de X Congreso Nacional de Avicultura. Maracaibo, Venezuela. p. 1-7. Ruiz G. J.V. 1991. Nosologías de la Bolsa de Fabricio. En: Memorias de II Jornada Medico Avícola. México D.F. México. p. 107. Ruiz V., Soto E., Lozano B., Sarfati D. 2004. Frecuencia de Infección de la Bolsa de Fabricio y Criptosporidiosis por medio del examen histopatológico en un laboratorio privado en la zona centro del país durante el año 2003. Laboratorios Avimex. México. Sacristán J.P., Sagardía J. 2005. La enfermedad de Gumboro. Incidencia en España. Ibertec. España. Sainsbury D. 2002. Salud y Manejo de las Aves de Corral Pollos, Patos, Pavos, Gansos y Codornices. 4° ed. Ter-Medica. Buenos Aires, Argentina. p. 8, 16, 19, 141. 52 Selbitz J.H., Moos M. 1997. Vacunación de los animales domésticos. Acribia. Zaragoza, España. p. 121. 136. Soto P.E. 1991. Higiene y Sanidad en las Granjas Avicolas. En: Memorias de 1° Jornada Medico Avícola. México D.F. México. p. 15-20. Suárez, Z.N.V., Aguilera, Q.I., Ardaya, C., Gianella, D.H., Rodríguez, J. 2010. Caracterización del desarrollo de la bolsa de Fabricio en pollos de engorde. Tesis de licenciatura. Facultad de Medicina Veterinaria y Zootecnia, U.A.G.R.M. Santa Cruz Bolivia. Tamayo S.M. 2003. Inmunoprofilaxis en la Infección de la Bolsa de Fabricio. En: Memorias de IX Jornada Médico Avícola. México D.F. México. p. 94-96. Tamayo S.M. 2009. La Enfermedad de Gumboro y su Impacto Económico. Fort Dodge Animal Health. Disponible en www.engormix.com [consultado el 13 de enero de 2012]. UNA (Unión Nacional de Avicultores). 2010. Avicultura mexicana: Monografía de la industria avícola. Unión Nacional de Avicultores. México. Disponible en: http://www.una.org.mx [consultado el 13 de enero de 2012]. UNAM FMVZ (Universidad Nacional Autónoma de México Facultad de Medicina Veterinaria y Zootecnia). 2009. Departamento de producción animal: Aves. México. Disponible en: http://www.fmvz.unam.mx/fmvz/departamentos/aves/impacto.html [consultado el 14 de enero de 2012]. USDA, APHIS. 2011. Biosecurity for the birds. http://www.aphis.usda.gov/animal_health/birdbiosecurity/biosecurity/.htm. [consultado el 14 de enero de 2012]. UPTC, PATOLOGIA AVIAR, 2006. Generalidades de Patología Aviar; Profilaxis e Higiene en Avicultura. Universidad Pedagógica y Tecnológica de Colombia. Disponible en http://patologiaaviaruptc.blogspot.com/. [consultado el 14 de enero de 2012] Valladares J.C., Playa V., Etcharren L., Banda A., Juárez D., Barrientos B., Angulo E., Lara A., Escobedo G., Ondarza A., Morfin R. 2009. Caracterización Genética de Cepas de Campo del Virus de la Infección de la Bolsa de Fabricio Detectados en Granjas de Pollo de Engorda en el Estado de Nuevo León. XXXIV Convención Avícola ANECA. Acapulco, Guerrero, México. Valladares J.C. 2010. Asesoría Avícola Independiente. Perspectiva del diagnóstico en aves. Nuevo León, México. Disponible en http://www.engormix.com/MAavicultura/sanidad/articulos/perspectiva-diagnostico-aves-t2909/165-p0.htm [consultado el 14 de enero de 2012]. 53 Vázquez D. O., Alvarado, C., Méndez, G., Morales A., Sarfati D., Lozano B., Rico M., García J.G., Soto P.E. 2002. Frecuencia en el Diagnóstico de las Enfermedades Aviares en el Laboratorio de Diagnósticos Clínicos Veterinarios durante los últimos 2 años. En: Memorias de XXVII Convención Nacional de ANECA. Puerto Vallarta, Jalisco, México. p. 305-307. Villamar L. 2009. Situación Actual y perspectiva de la producción de carne de pollo en México 2009. Coordinación General de Ganadería. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Disponible en http://www.sagarpa.gob.mx/ganadería [consultado el 14 de enero de 2012]. Villegas, 2011. Inmunosupresión Causada por Enfermedades Virales. Universidad de Georgia, Departamento de Medicina Aviar, Athens, Georgia 30602. Disponible en http://www.grupoidisa.com.mx/imsa/ISA_Babcock/memoria11a.htm. [consultado el 14 de enero de 2012]. Wit J.J., Baxendale W. 2011. Enfermedad de Gumboro. Disponible en http://www.enfermedad-gumboro.com [consultado el 14 de enero de 2012]. 54 55