"La Química Orgánica es la parte de la Química - todoesquimica-I
Anuncio

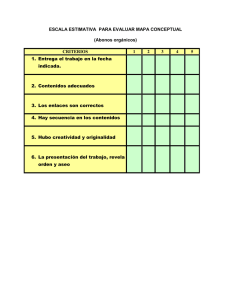
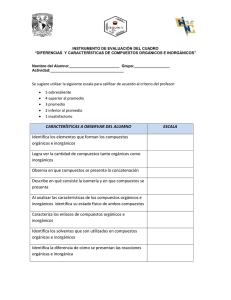
1 Asignatura: Química Curso: Segundo medio Profesora: Ivonne Gacitúa NOMBRE: NOTA (ACUMULATIVA): FECHA: PUNTAJE: ACTIVIDAD ACUMULATIVA Nº1 COMPUESTOS ORGÁNICOS Unidad: Química orgánica. Objetivo programático: Identificar las propiedades del carbono y de sus enlaces. Objetivo temático: Aprender cómo nombrar compuestos alifáticos Tiempo de aplicación: 10 horas pedagógicas. ¿Por qué se la llama "Química Orgánica"? "La Química Orgánica es la parte de la Química que se especializa en el estudio de los compuestos del carbono" (excepto del monóxido de carbono, el dióxido de carbono, los carbonatos y cianuros, que son parte de la Química Inorgánica). Los compuestos de carbono se denominan orgánicos y son bastante comunes e importantes. El alcohol es un ejemplo, su uso es muy cotidiano, como bebida e incluso en los hospitales. El vinagre (ácido acético), es un condimento habitual en nuestras comidas, y por cierto, lo usamos a diario. Otro ejemplo; el azúcar común es un hidrato de carbono vital. Así tantos otros….la gasolina es uno de los combustibles de mayor uso en el mundo. El éter (elemento aristotélico), es un solvente de uso masivo en la industria e inclusive en farmacias y hospitales. Con fórmulas más complicadas podemos citar las proteínas, vitaminas, hormonas, medicamentos, etc. De un modo más amplio, podemos decir que los compuestos orgánicos constituyen una parte fundamental de todo el ciclo de vida. Hasta casi comienzos del siglo XX, se creía que esos compuestos del carbono solamente podían ser producidos por los seres vivos (seres "orgánicos") y por eso se dio ese nombre a su estudio. La Química Inorgánica o Mineral es la parte de la Química que estudia los compuestos que no tienen carbono, esto es, los compuestos de todos los demás elementos químicos. A pesar de esto, el número de compuestos "inorgánicos" conocidos es mucho menor que la de compuestos "orgánicos". 2 ¿Por qué hay más compuestos orgánicos que inorgánicos? El átomo de carbono tiene seis protones y seis neutrones en su núcleo, y seis electrones girando a su alrededor. Es un átomo pequeño, con una electronegatividad apenas un poco más alta que la del hidrógeno. Es entonces un "no metal" pero con un comportamiento algo especial. Tiende a formar compuestos uniéndose a otros átomos de carbono mediante enlaces covalentes. Su pequeño radio atómico le permite formar cadenas muy variadas, algunas cortas y otras muy largas. ¿Qué propiedades permiten diferenciar los compuestos orgánicos de los inorgánicos? Compuestos orgánicos Pueden estar formados por unos 10 elementos distintos y se conocen unos 2.500.000 de compuestos. Se caracterizan por su enlace covalente. Compuestos inorgánicos Pueden estar formados por unos 100 elementos distintos y se conocen unos 100.000 compuestos. Predomina el enlace iónico. Comúnmente no se comportan como electrolitos. Generalmente se comportan como electrolitos. Sus puntos de fusión y ebullición son bajos. Sus puntos de fusión y ebullición son altos. Son combustibles (arden). Son poco o nada combustibles. Solubles en solventes orgánicos, pero insolubles en agua. Solubles en agua, pero insolubles en solventes orgánicos. Las reacciones entre compuestos orgánicos son complejas, lentas y preferentemente no iónicas. Las reacciones entre compuestos inorgánicos son sencillas y rápidas, y preferentemente iónicas. Los compuestos orgánicos se encuentran en la naturaleza libres o formando parte de los minerales. Los compuestos inorgánicos son exclusivos de los reinos vegetal y animal. Los compuestos orgánicos se descomponen con facilidad Los compuestos inorgánicos no se descomponen con facilidad 3 ¿Qué es una "cadena carbonada"? Es la que se forma por la unión de átomos de carbono mediante enlaces covalentes. Estas uniones pueden ser "simples", "dobles" o "triples. Las cadenas que se forman solamente por enlaces simples entre carbonos se llaman "saturadas". Cuando aparecen enlaces dobles o triples entre carbonos se llaman "insaturadas" o "no saturadas". ¿Con qué número de oxidación (valencia) actúa el carbono en los compuestos orgánicos? Los seis electrones de un carbono normal, no combinado, se encuentran repartidos en dos capas, la 1 y la 2. En la primera, la más interna, hay 2 electrones tipo "s". En la segunda capa hay 2 electrones tipo "s" y 2 electrones tipo "p". Según esto, el carbono debería actuar perdiendo esos cuatro electrones de la capa 2 para quedar con su capa 1 completa, y su número de oxidación debería ser +4. Si vemos en la Tabla Periódica, notaremos que es una de sus valencias posibles, por ejemplo en el dióxido de carbono. Pero también puede perder solamente los 2 electrones "p" de la capa 2, con lo que su número de oxidación sería +2. Volviendo a la Tabla, veremos que es también una valencia posible, por ejemplo en el monóxido de carbono. Sin embargo, dijimos que estos compuestos son "inorgánicos". Entonces, ¿cuál es el número de oxidación del carbono en los compuestos orgánicos? Analicemos la estructura del carbono no combinado: en su capa 2 hay 2 electrones apareados en una subcapa tipo "s" y 2 electrones no apareados en dos subcapas tipo "p". Esto debería hacer suponer que podría recibir 2 electrones para completar sus pares en las subcapas tipo "p" y tendría así un número de oxidación "-2". Pero esto no ocurre. Su único número de oxidación negativo posible es "-4", es decir, recibe 4 electrones de otro u otros átomos. ¿Cómo lo logra? Cuando choca con otro átomo de carbono, sus 4 electrones de la capa 2 se redistribuyen en 4 orbitales iguales, que no son ni tipo "s" ni tipo "p" sino una combinación de ambos tipos (un híbrido) que se conoce como sp3 por estar formado por 1 tipo "s" + 3 tipo "p". En cada nueva subcapa así creada, tendrá un electrón desapareado, por lo que podrá recibir ahora 4 electrones de otro u otros átomos. Así logrará su valioso número de oxidación (valencia) "-4" que será el responsable de sus más importantes propiedades en los enlaces que hemos llamado "saturados". 4 ¿Cómo se clasifican los compuestos orgánicos? Los compuestos orgánicos se clasifican según su estructura. Podemos estudiar esa clasificación simplificando el problema. Para ellos analizaremos solamente el caso de los "hidrocarburos", compuestos formados solamente por carbonos e hidrógenos. Estos pueden clasificarse en: De cadena abierta (acíclicas o alifáticas): Saturados - con sólo enlaces simples - se los conoce como "alcanos". Pueden ser "lineales" o ser "ramificados". Insaturados - con enlaces dobles - llamados "alquenos" - o con enlaces triples - llamados "alquinos". También pueden ser "lineales" o ser "ramificados". De cadena cerrada (cíclicos): Carbocíclicos - con solamente átomos de carbono en sus anillos (ciclos) Pueden clasificarse en "alicíclicos" (cicloalcanos o cicloalquenos) y "aromáticos" (mono- , bi- o policíclicos). Heterocíclicos - en sus ciclos intervienen también átomos que no son de carbono - También pueden ser mono-. bi- o policíclicos. De cadena mixta. ¿Podemos profundizar en el concepto de isomería? Aunque no es un tema demasiado sencillo. Sin embargo podemos avanzar bastante en la cuestión. DOS COMPUESTOS SON ISÓMEROS CUANDO POSEEN LA MISMA FÓRMULA MOLECULAR (los mismos "ingredientes") PERO CON DISTINTA FÓRMULA ESTRUCTURAL (diferente distribución de esos "ingredientes") O DISTINTA FÓRMULA ESPACIAL (diferente orientación en el espacio). Cada variedad (isómero) presenta propiedades físicas o químicas características. 5 ESQUEMA DE COMPUESTOS ORGÁNICOS: SATURADOS ALCANOS ALIFÁTICOS INORGÁNICOS IN SATURADOS HIDROCARBUROS ALICÍCLICOS COMPUESTOS AROMÁTICOS ORGÁNICOS HALUROS ÉTERES AMINAS GRUPOS FUNCIONALES ALCOHOLES CETONAS ALDEHÍDOS AMIDAS ÁCIDOS CARBOXILICOS ALQUENOS ALQUINOS 6 Clasificación de las Cadenas Alifáticas o Acíclicas A. Cadenas abiertas (acíclicas o alifáticas) Ejemplo: 7 B. Cadenas cerradas, también llamadas cíclicas. Ejemplo: C. Cadenas mixtas Ejemplo: Clasificación de las cadenas Cíclicas 8 9 NOMENCLATURA ORGÁNICA Se puede dividir el nombre oficial (I.U.P.A.C.) de un compuesto orgánico en tres partes: Prefijo - Medio – Sufijo a) El prefijo indica el número de átomos de carbono que el compuesto tiene en su cadena principal. Nº de C Prefijo Nº de C Prefijo Nº de C Prefijo 1 met 6 hex 11 undec 2 et 7 hept 12 dodec 3 prop 8 oct 13 tridec 4 but 9 non 14 tetradec 5 pent 10 dec 15 pentadec Cuando se trata de una cadena cíclica, se antepone la palabra CICLO antes del prefijo. b) La parte media se refiere a la saturación de la cadena carbónica. an : cadena saturada (sólo enlaces simples). en : cadena insaturada con un enlace doble. in : cadena insaturada con un enlace triple. dien : cadena insaturada con dos enlaces dobles. diin : cadena insaturada con dos enlaces triples. c) El sufijo, indica la función orgánica a la que pertenece el compuesto. 10 Radicales Orgánicos Son fragmentos moleculares ubicados en la cadena principal (central). Poseen una nomenclatura especial que los identifica. Lo corriente es: Prefijo: número de átomos de carbono que contiene. Sufijo: terminación il. ALCANOS 1. Alcanos lineales. o Se nombran mediante un prefijo que indica el número de átomos de carbono de la cadena y el sufijo -ano. Ejemplos: 2. Grupos alquilo. Son el resultado de que un alcano pierda un átomo de Hidrógeno. Se nombran sustituyendo, en el nombre del alcano correspondiente, el sufijo -ano por -ilo. 11 3. Alcanos ramificados. Se localiza la cadena continua más larga de átomos de Carbono. Esta cadena determina el nombre base del alcano. Si una molécula tiene dos o más cadenas de igual longitud se selecciona como cadena base o principal, aquella que tiene un mayor número de ramificaciones. Se nombran todos los grupos unidos a la cadena más larga como sustituyentes alquilo. Se numera la cadena principal, comenzando por el extremo más próximo a uno de los sustituyentes. Si tenemos dos sustituyentes a igual distancia de los extremos, se utiliza el orden alfabético para determinar la numeración. En una cadena lateral el carbono 1 es siempre el que está unido a la cadena principal. Para nombrar el compuesto se colocan los nombres de los sustituyentes por orden alfabético precedidos del nº del C al que están unidos y de un guión, y a continuación se añade el nombre de la cadena principal. En el caso de cicloalcanos se antepone el prefijo ciclo- al nombre del alcano de igual número de átomos de C. En caso de cicloalcanos monosustituidos si el sustituyente tiene más átomos de Carbono, entonces ese sustituyente es la cadena principal. Si el sustituyente tiene igual o menor número de átomos de Carbono, entonces la cadena principal es el cicloalcano y no es necesario numerar la posición de aquél. En caso de cicloalcanos multisustituidos se ordenan alfabéticamente los sustituyentes y se indica su posición relativa con un número asignándoles los localizadores más bajos posibles. 12 ALQUENOS Regla de nomenclatura: 1. Elegir como cadena principal aquella que contenga la mayor cantidad de instauraciones, no importando si es la más larga. 2. Numerar la cadena desde el extremo más próximo a la insaturación. 3. Nombrar la cadena, partiendo con los radicales (en orden creciente a su tamaño y complejidad), considerando el número del carbono que soporta el radical. A continuación utilizar la nomenclatura estandarizada para la cadena principal (prefijo, medio y sufijo), teniendo en cuenta, la parte media correspondiente a la regla para los alquenos. Indicar con número el o los carbono(s) que poseen la instauración. ALQUINOS Las reglas de nomenclatura son las mismas que para los alquenos: 13 CICLOALCANOS Y CICLOALQUENOS Cicloalcanos: También llamados ciclanos, presentan cadena cíclica con enlaces simples. Son hidrocarburos saturados cuyo uso principal en la industria es como solventes. Ejemplos Cicloalquenos: También llamados ciclenos, presentan cadenas cíclicas con enlaces dobles. Además de su uso como solventes, los cicloalquenos tienen aplicaciones microbicidas y fungicidas (cicloalquenos sustituidos) 14 EVALUACIÓN Nº 1: Lee el siguiente texto y responde. En general, los Alcanos o parafinas se emplean como fuentes de energía (calorífica, mecánica, etc.); como disolventes y en numerosas síntesis. El gas en cilindros usado en nuestra economía es principalmente una mezcla de butano y propano (algo de etano y metano). El trimetil 2,2,4-pentano se usa como combustible de referencia para medir las propiedades antidetonantes de las gasolinas, habiéndosele asignado un índice de octano igual a 100. El trimetil 2,2,3-butano (triptano) tiene un índice de octano de 125. Metano.- Este gas fue descubierto por A. Volta en 1778. Su síntesis fue realizada por Berthelot calentando acetileno e hidrógeno en una campana; más tarde lo obtuvo haciendo pasar una mezcla de sulfuro de carbono y sulfuro de hidrógeno sobre cobre calentando al rojo. También se le denomina gas de los pantanos y formeno. En las minas de carbón suele formar mezclas explosivas con el aire, y se le da el nombre de gas grisú. El peligro del gas grisú no sólo se debe a los efectos mecánicos y térmicos de la explosión, sino también al enrarecimiento del aire por escasez de oxígeno (asfixia), y además, por la formación del monóxido de carbono (CO) que es altamente tóxico. Etano.- Se encuentra en cantidad apreciable en el gas natural, y constituye el primer homólogo del metano. Los métodos empleados para su obtención, así como sus propiedades, son muy semejantes a las del metano. Aunque el etano tiene poca importancia práctica, su fórmula presenta nuevos aspectos, que son muy interesantes. Contesta: 1 Escribe todos los compuestos orgánicos nombrados en el texto. 2 Haz la fórmula semi desarrollada de los compuestos Orgánicos que se nombran en el texto. 3 En tu hogar están presentes estos compuestos orgánicos, ¿dónde? 4 ¿Qué funciones poseen los compuestos orgánicos nombrados en el texto? 15 EVALUACIÓN Nº 2 1. Explica por qué el Carbono puede formar más compuestos que cualquier otro elemento. 2. Explica qué es un Carbono secundario y dibuja 3 ejemplos. 3. Nombra algunas aplicaciones que poseen los Alcanos más simples (Metano, Etano) 4. Explica en qué se basaba la corriente científica “Vitalismo”. 5. Nombra 3 diferencias entre compuesto orgánico y compuesto inorgánico. 6. Desarrolla la estructura de Lewis de los siguientes compuestos que poseen Carbono: CH4, CO2, CH3OH, C2H6, C3H8 7. Indica las hibridaciones que sufren los átomos de Carbono en las moléculas dadas anteriormente. 8. Escribe la estructura para la molécula más pequeña del Alcano que contenga: Un C secundario Un C terciario Un C cuaternario Dos C secundarios Un C cuaternario y un C secundario 16 EVALUACIÓN Nº 3 1. Escribe el nombre IUPAC para las siguientes moléculas orgánicas. 2. Los siguientes nombres son incorrectos. Escribe la fórmula semidesarrollada y nómbralos correctamente: a) 4-metilbutano b) 2-metil-5-isopropilheptano c) 2-metil-4-n-butiloctano d) 2,3,3-trimetilbutano e) 2,4,6,6-tetrametilheptano 3. Escribe la fórmula semidesarrollada para los siguientes alcanos y radicales alquílicos. a) 2-metilpentano b) 2,3,4-trimetilhexano c) 2-metil-3-etil-1-hexeno d) 3,3-dimetilbutilo e) metilbenceno f) 2,4-dimetiloctano g) 1,4-dimetil-6,7-dietilnaftaleno h) 2,2-dimetil-3-etil-4-propil-5-terbutilnonano i) 3-bromotolueno 17 4. Nombre los siguientes compuestos Orgánicos: **5. Escribe la fórmula semidesarrollada para los 18 isómeros de cadena que respondan a la fórmula global C8H18. EVALUACIÓN Nº 4 Tarea de investigación Busca información que de respuesta a las interrogantes que se presentan a continuación. a) ¿Quién fue Federico Augusto Kékule? b) ¿Cuáles fueron sus aportes a la ciencia? c) ¿En qué se basa la teoría de enlace atómico del carbono creada por él? d) ¿En qué período histórico químicos de la época. nació? Relaciona su período con los avances 18 EVALUACIÓN Nº 5 Trabajo de investigación Para profundizar en la materia de estudio, harán un trabajo de investigación sobre un tema específico de química con el propósito de relacionar ese tema en particular con la Química del Carbono. A continuación se presentan las indicaciones para realizar el trabajo. Indicaciones para el trabajo: El trabajo debe considerar los siguientes aspectos: 1. Formato del documento escrito. 2. Contenido. 3. Exposición del trabajo. 4. Entrega: en la fecha estipulada. 1. Formato: a. Máximo 8 páginas. b. Escrito en computador. 2. Contenido: El documento del trabajo debe ser ameno de leer y debe contener: a. Introducción breve escrito que presenta y fundamenta el trabajo a realizar b. Desarrollo: cuerpo del informe donde se aborda con más detalle el tema del trabajo y se relaciona con la Química del Carbono. En esta parte se pueden incluir imágenes, ejemplos u otro tipo de figuras que ayude a comprender más el tema de estudio. c. Conclusiones: breve síntesis sobre los elementos abordados en el trabajo. d. Referencias: última sección o apartado del trabajo donde se registran las diferentes fuentes de información utilizadas: bibliografía, Internet, consulta a expertos. 3. Exposición del trabajo. El propósito de la disertación es presentar y explicar la relación que existe entre la química del Carbono y el tema trabajado por el grupo. En la presentación deben considerarse los siguientes aspectos: a. Presentación de ideas claras con tono de voz adecuado. b. El tiempo asignado para exponer no debe exceder a 15 minutos por grupo. c. Puede utilizarse apoyo visual (Transparencias, diapositivas, Power Point u otros) 19 d. Todos los integrantes del grupo deben participar en la disertación. Por lo tanto, organizarla de tal manera que permita una interesante, dinámica y clara presentación de ideas. Temas: Estados Alotrópicos del Carbono. (Grafito, Diamante, Amorfo) Alótropos del Carbono de gran tamaño. (Fullerenos o Buckyball) Fabricación de jabón. El petróleo y sus derivados. La industria del petróleo. Isomería óptica de Alcanos sustituidos. Isomería “Cis-Trans” en Alquenos. 20 EVALUACIÓN Nº 6 Evaluación Sumativa 1 Responde fundamentando tus respuestas. a) Explica el concepto de tetravalencia. b) Nombra 3 diferencias inorgánicos. entre los compuestos orgánicos y los c) ¿Por qué el átomo de Carbono puede formar gran número de moléculas diferentes? d) ¿Cuál es la diferencia entre hidrocarburos aromáticos y alifáticos? e) ¿Cuál es el significado de “saturado” e “insaturado” cuando se aplica a los hidrocarburos? Da ejemplos de un hidrocarburo saturado y de uno insaturado. f) Menciona 2 fuentes del Metano. g) Cómo es la fórmula global de un alcano. h) Explica la teoría vitalista. 2 Haz la fórmula semidesarrollada de las siguientes moléculas. a) 3-metil-hexano. b) 2,2,4-trimetil-pentano. c) 2,2-dimetil-3-etil-octano. d) metil-etil-propil-butil-metano (escríbelo con otro nombre) e) 1,2,3-propanotriol. f) 1,2-dicloro-pentano. g) isobuteno 3 Escribe el nombre de las siguientes moléculas. 4 ¿Cuáles son los principales derivados del petróleo? Menciona sus usos.