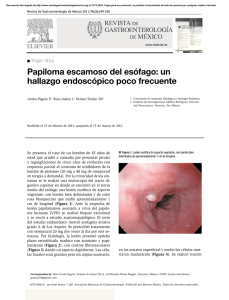
Tesis - Dirección General de Servicios Telemáticos
Anuncio

UNIVERSIDAD DE COLIMA FACULTAD DE MEDICINA IDENTIFICACIÓN DE VIRUS DE PAPILOMA HUMANO TIPO 18 EN PACIENTES CON CÁNCER CERVICO UTERINO, LESIÓN INTRAEPITELIAL CERVICAL Y SIN LESIÓN TESIS para obtener el grado de DOCTORA EN CIENCIAS MÉDICAS PRESENTA: M. en C. ALMA ROSA GUADALUPE FERNÁNDEZ SALINAS ASESORES: BÁSICO: D. en C. LUZ MARGARITA BALTAZAR RODRÍGUEZ CLÍNICO: D. en C. IVÁN DELGADO ENCISO COLIMA, COLIMA, ENERO DE 2007 iii AGRADECIMIENTOS: Mi agradecimiento a la Universidad de Colima, a la Facultad de Medicina, pero sobre todo al equipo de docentes-investigadores del Centro Universitario de Investigaciones Biomédicas por el apoyo siempre activo de parte de todos, por sus consejos pero sobre todo por su amistad. Al LABORATORIO DE GENÉTICA Y BIOLOGÍA MOLECULAR, destacando la colaboración del M. en C. Mario Ramírez Flores y del M. en C. Eloy Gerardo Moreno Galindo. A los Servicios de Salud del Estado de Colima, a través de su Secretario Dr. José Salazar Aviña, al Dr. Carlos César Romero Moreno por la confianza depositada en mí y al Hospital Regional Universitario en su Clínica de Displasias con la participación del Dr. Fernando Rendón Medina y la Dra. Nerey Lima Pineda; la L.T.S. Lidia Navarro Moctezuma; las enfermeras: Leticia Madrueño Dávila y Raquel Vega Diego. Al Instituto Mexicano del Seguro Social a través de su Delegada Lic. Concepción Sevilla Gutiérrez, al Dr. Jorge Molina Padilla, Coordinador Delegacional de Investigación, por su apoyo incondicional; al Comité de Ética del Hospital General de Zona No. 1 y a la Clínica de Displasias con la participación de los Ginecólogos Dr. Pedro Sotelo Virgen y Dr. Arnoldo Muñiz Gómez. Sin olvidar mencionar al Lic. Carlos Llerenas Tejeda, responsable de la Hemeroteca del H.G.Z. Al Consejo Nacional de Ciencia y Tecnología por haberme becado por 24 meses para mis estudios, apoyo utilizado en compra de tecnología, compra de material didáctico y de laboratorio, así como para 6 meses de contratación de personal técnico para el proyecto. Al Fondo Ramón Álvarez-Buylla de Aldana por haber apoyado el proyecto para material de laboratorio. A los estudiantes de pregrado colaboradores en la logística del proyecto: Ricardo Cárdenas Orozco, Yuraith Elizabeth Cevallos Luna y Lorena Llerenas González. iv DEDICATORIAS Al Creador de toda molécula que existe en el Universo. A mi familia: Manuel, Ricardo Emmanuel y Rodrigo Eduardo por su paciencia y por donarme el tiempo que les correspondía a cada uno. A mi madre, tía, y hermanas por su apoyo emocional. A mis amigas por los momentos de convivencia disfrutados. v INDICE Titulo………………………………………………………………………. i Carta de terminación ……………………………………………………. ii Agradecimientos ………………………………………………………... iii Dedicatorias ……………………………………………………………. . iv Indice …………………………………………………………………….. v Tabla de Cuadros y Figuras …………………………………………... 1 Resumen ………………………………………………………………… Summary ………………………………………………………………… Abreviaturas ……………………………………………………………… Introducción ……………………………………………………………… Capítulo I. Marco Teórico ……………………………………………... 1.1. Virus del Papiloma Humano (VPH) ………………….. 1.2. Papovavirus ……………………………………………... 1.3. Genoma …………………………………………………. 1.4. Características Moleculares del VPH ………………… 1.5. Mecanismo de malignización mediada por VPH ……. 1.6. Patología del VPH ……………………………………… 1.7. Virus Papiloma Humano tipo 18 (VPH-18) ………….. 1.7.1 Región Larga de Control del VPH-18 (LCR) …… 2. Lesiones Intraepiteliales y Cáncer Cérvico-Uterino ……. 2.1. Etiología ………………………………………………….. vi 2.2. Epidemiología ……………………………………………. 2.3. Etapas de Lesiones Intraepiteliales y Cáncer CérvicoUterino ……………………………………………………….. 2.4. Estadificación Histopatológica y Clínica del CaCU …………. 2.5 Tratamiento de las Lesiones Intraepiteliales y Cáncer Cérvico-Uterino. CAPÍTULO II. METODOLOGÍA ……………………………………………….. 3. Planteamiento del Problema ………………………………………… 4. Justificación ……………………………………………………………. 5. Hipótesis ………………………………………………………………... 6. Objetivos ……………………………………………………………….. 7. MATERIAL Y MÉTODO …………………………………………….. 7.1. Tipo de estudio ……………………………………………………. 7.2. Selección de la muestra ………………………………………….. 7.3. Criterios de Inclusión ……………………………………………… 7.4. Criterios de no inclusión ………………………………………….. 7.5. Criterios de exclusión ……………………………………………... 7.6. Tamaño de la muestra ……………………………………………. 7.7. Consentimiento informado y encuesta …………………………… 7.8. Procedimiento ………………………………………………………. CAPÍTULO III. RESULTADOS …………………………………………………. 8.1. Datos sociodemográficos …………………………………………… vii 8.2. Antecedentes Gineco-obstétricos ………………………………….. 8.3. Antecedentes de Riesgo …………………………………………….. 8.4. Datos Clínicos ………………………………………………………… 8.5. Diagnóstico de Citología vaginal de envío ………………………….. 8.6. Resultado de revisión colposcópica ………………………… …….. 8.7. Resultado histopatológico de biopsia y/o conización …………….. 8.8 Resultado histopatológico en Sistema Bethesda ………………….. 8.9. Resultado de tipificación de VPH-18 positivo en biopsias ………. 8.10. Resultado tipificación de VPH de Alto Riesgo (AR) …………….. 8.11 Resultado general de tipificación del VPH-18 …………………… 8.12. Correlación de biopsia-VPH-18 con Sistema Bethesda … …… 8.13. Reclasificación de pacientes por rango de edad …………………. 8.14. Tipificación de VPH-16 …………………………………………… CAPÍTULO IV. DISCUSIÓN …………………………………………………….. CAPÍTULO V. CONCLUSIONES ……………………………………………….. CAPÍTULO VI. PERSPECTIVAS ………………………………………………… viii BIBLIOGRAFÍA ……………………………………………………………………… ANEXOS …………………………………………………………………………….. ix Alma Rosa G. Fernández Salinas. 2007 ÍNDICE DE FIGURAS, CUADROS Y TABLAS Figura 1. Imagen electrónica del Virus Papiloma Humano ……………………. 12 Figura 2. Estructura Genómica del VPH ………………………………………… 16 Figura 3. Región amplificada del LCR del VPH en este trabajo ………………. 18 Figura 4. Árbol Filogenético del Virus Papiloma Humano ……………………… 26 Cuadro 1. Etapas de las lesiones precursoras y sus diferentes nomenclaturas 35 Figura 5. Esquematización gráfica de la histopatología de la Neoplasia Intraepitelial ……………………………………………………………… 36 Figura 6. Imagen de Citocepillo …………………………………………………… 46 Figura 7. Diagrama logístico de la metodología de estudio ……………………. 47 Cuadro 2. Oligonucleótidos iniciadores específicos …………………………….. 48 Figura 8. Gel de Poliacrilamida para identificación de VPH-18 ………………… 49 Cuadro 3. Principales variables sociodemográficas ……………………………… 50 Cuadro 4. Principales variables gineco-obstétricas ……………………………… 51 Cuadro 5. Principales factores de riesgo conocido ……………………………… 52 Gráfica 1. Motivo de consulta expresado por la paciente ……………………….. 53 Gráfica 2. Aspecto clínico del cérvix al realizar la exploración …………………. 54 Gráfica 3. Tratamientos recibidos por la paciente al momento de la muestra ………………………………………………………………….. 55 Gráfica 4. Sistema Bethesda como diagnóstico de citología vaginal de envío …………………………………………………………………….. 55 Gráfica 5. Resultado de biopsia en Sistema Bethesda ………………………….. 57 1 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Gráfica 6. Resultado de la revisión colposcópica ……………………………….. 57 Gráfica 7. Resultado histopatológico de biopsia o cono ………………………… 57 Gráfica 8. Resultado histopatológico de biopsia o cono en Sistema Bethesda …………………………………………………………………. 64 Gráfica 9. Distribución de VPH-18 en resultados de Biopsias en Sistema Bethesda. …………………………………………………………………. 64 Tabla 1. Distribución de VPH-AR …………………………………………………. Tabla 2. Distribución de VPH-AR eliminando co-infección 18/16 ……………… Tabla 3. Distribución de VPH-AR mediante Sistema Bethesda ………………... Gráfica 11. Resultado de tipificación VPH- 18 en las muestras con y sin Biopsia con Sistema Bethesda ……………………………………….. 61 Cuadro 6. Distribución de lesiones citológicas clasificadas en Sistema Bethesda ………………………………………………………………… 62 Cuadro 7. Distribución de resultados de Biopsias por rango de edad en Sistema Bethesda …………………………………………………….. 64 Cuadro 8. Distribución de resultados de tipificación de VPH-AR por rango de edad …………………………………………………………. 65 Tabla 4. Prevalencia del VPH-18 en diferentes publicaciones ………………… 76 Tabla 5. Concentraciones adecuadas de los reactivos en la RCP …………... 85 Tabla 6. Concentraciones adecuadas de los reactivos en la RCP …………... 85 2 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Tabla 7. Concentraciones adecuadas de los reactivos en la RCP …………... 85 Tabla 8. Concentraciones adecuadas de los reactivos en la RCP …………... 85 Tabla 9. Concentraciones adecuadas de los reactivos en la RCP …………... 85 3 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 RESUMEN Este es un estudio definió el descriptivo, retrolectivo, transversal, analítico en el cual se Virus de Papiloma Humano tipo 18 (VPH-18) y se determinó su asociación con Cáncer Cérvico-Uterino In Situ (CIS), Lesiones Intraepiteliales (LIE) de Bajo o Alto Grado (B o A) o en citologías normales, identificadas mediante técnicas de Reacción en Cadena de la Polimerasa (RCP) en un archivo de Ácido Desoxiribonucleico (ADN) de 67 muestras cervicales positivas a VPH-18 tomadas por citocepillo, obtenidas en la región de Colima, en el periodo de enero de 2004 a diciembre de 2005. Se analizaron los datos mediante el método de conteo y se compararon proporciones entre los diferentes grupos mediante pruebas exactas y chi-cuadrada. Se buscó asociación de Riesgo mediante Razón de Momios e Intervalo de Confianza (IC). Resultados: De un total de 264 muestras, se encontraron positivas a VPH-18 67 (25.4%), para algunos análisis posteriores se eliminaron las co-infecciones con VPH-16 (n = 16). En total se analizaron 22 ADN’s de mujeres sin lesión; 207 con LIEB; 35 con LIEA-CIS y se distribuyeron, por criterio citológico, en 10 muestras de mujeres sin lesión; 50 muestras con LIEB y 7 muestras con LIEA; por criterio histopatológico: NIC I 63.7% (n= 168). NIC II 7.6% (n= 20). NIC III-InSitu 5.0% (n= 14). VPH 4.6% (n= 12). Adenocarcinoma 0.5% (n=1). Negativa 5.3% (n=14); no se le practicó biopsia al 13.3% (n= 35). Comparando la prevalencia con Lizano y cols. (México 2005) para lesiones precursoras (LIEB o A) se encuentra que en las mujeres de la región de Colima hay una prevalencia mayor de VPH-18 que en la región central y que además es más prevalente en LIEB (p = 0.0025; RM 5.4. IC 95% 1.6 - 18.1) que en LIEA (p = 0.1311; RM 2.6 IC 95% 0.7- 10.0). Conclusión: El VPH-18 es más prevalente en la región de Colima con una asociación a LIEB. 4 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 SUMMARY: This is a descriptive, retrolective, transverse and analytical study in wich we defined Human Papillomavirus type 18 (VPH-18) and decided its association with Cervicaluterine Cancer In situ (CIS), Squamous Intraepithelial Lesions (SIL) of Low or High Grade (LG or HG) or in normal smears, identified by Polimerase Chain Reaction technology (PCR) in a Desoxiribonucleic Acid’s file (DNA) of 67 cervical positive samples to VPH-18 taken by citobrush, obtained in Colima’s region, in the period from January, 2004 to December, 2005. The information was analyzed by counting method and proportions were compared among the different groups by exact tests and chi-square. Association risk was reached by Odds Ratio (OR) and Confidence Intervals (CI). Results: From 264 samples, we found positive to VPH-18: 67 (25.4 %), for later analyses, co-infections with VPH-16 (n = 16) were eliminated. 22 ADN's without epithelial damage was analyzed; 207 with LGSIL; 35 with HGSIL-CIS and distributed, by citologyc criterion, in 10 women's samples without damage; 50 samples with LGSIL and 7 samples with HGSIL; for histopathologyc criterion: CIN I 63.7 % (n = 168). CIN II 7.6 % (n = 20). CIN III-InSitu 5.0 % (n = 14). VPH 4.6 % (n = 12). Adenocarcinoma 0.5 % (n=1). Negative 5.3 % (n=14); biopsy was not practised 13.3 % (n = 35). Comparing prevalence with Lizano M, y cols., (México 2005) for precursor lesions (LG or HG SIL) we show in women from Colima's region there is a major prevalence of VPH-18 than in central region and in addition is more prevalent in LGSIL (p = 0.0025; OR 5.4. CI 95 % 1.6 - 18.1) that in HGSIL (p = 0.1311; OR 2.6 CI 95 % 0.7-10.0). Conclusion: The VPH-18 is more prevalent in Colima's region with an association to LGSIL. 5 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ABREVIATURAS: ADN: Ácido Desoxiribonucleico. AIS: Adenocarcinoma endocervical in situ ARN: Ácido Ribonucleico CaCU: Cáncer Cérvico-Uterino CaCU-I: Cáncer Cérvico-Uterino Invasor. CaCU-M: Cáncer Cérvico-Uterino Microinvasor. ClD: Clínica de Displasias. CIS: Carcinoma In Situ: Cáncer cérvico-uterino que abarca todo el grosor del epitelio. ETS: Enfermedad de Transmisión Sexual. H.G.Z.M.F.No. 1: Hospital General de Zona y Medicina Familiar No. 1, en Colima, Col. H.R.U.: Hospital Regional Universitario en Colima, Col. I.M.S.S.: Instituto Mexicano del Seguro Social. LIE: Lesión Intraepitelial. LIEB: Lesión Intraepitelial de Bajo Grado LIEA: Lesión Intraepitelial de Alto Grado MAL: Marco Abierto de Lectura (open reading frame) ORF por sus siglas en inglés NIC: Neoplasia Intraepitelial Cervical. 6 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 NIC-I: Neoplasia Intraepitelial Cervical Leve. NIC-II: Neoplasia Intraepitelial Cervical Moderada. NIC-III: Neoplasia Intraepitelial Cervical Severa. nm: nanómetros (1 nanómetro = 1 millonésima parte de 1 milímetro). p53: factor regulador de replicación celular. pA: poliadenilados Rb: factor regulador del ciclo celular, que se une directamente al factor transcripcional E2F, que a su vez induce la transcripción de elementos involucrados con la replicación celular. RCP: Reacción en Cadena de la Polimerasa. RLC: Región Larga de Control, también llamada URR (upstream regulatory región) y LCR por sus siglas en inglés (Long Control Region) R.M.: Razón de Momios. rpm: revoluciones por minuto RR: Riesgo Relativo S.S.E.C.: Secretaría de Salud del Estado de Colima. Tasa de Mortalidad CaCU: número de muertes por esta causa en mujeres de 25 años o más por 100,000 mujeres en ese grupo de edad. var: variante viral constituida por cambios en la secuencia de bases menor del 5%. 7 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 VPH: Virus Papiloma Humano VPH-18 Virus Papiloma Humano tipo 18 VPH-18 Af: Virus Papiloma Humano tipo 18 variante Africana VPH-18 E: Virus Papiloma Humano tipo 18 variante Europea VPH-18 AA: Virus Papiloma Humano tipo 18 variante Asiático-Amerindia VPH-16 Virus Papiloma Humano tipo 16 VPH-AR: Virus Papiloma Humano de Alto Riesgo, en este estudio 16 y 18 8 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 INTRODUCCIÓN: El cáncer cervicouterino (CaCU), es una clase común de cáncer en la mujer, es una enfermedad en la cual existe crecimiento tisular desorganizado producido por la proliferación continua de células anormales con capacidad de invasión y destrucción en los tejidos del cuello uterino. El CaCU suele crecer lentamente por un período de tiempo. Antes de que se encuentren células cancerosas en el cuello uterino, sus tejidos experimentan cambios y empiezan a aparecer células anormales [proceso conocido como lesión intraepitelial (LIE)] detectada generalmente con la citología vaginal (prueba de Papanicolaou); posteriormente, las células precursoras de LIE comienzan a crecer y se diseminan con mayor profundidad en el cuello uterino y en las áreas circundantes. Actualmente la Neoplasia Intraepitelial Cervical (NIC) que se refiere a los cambios neoplásicos del cuello uterino confinados al epitelio superficial sin invasión del estroma, se considera equivalente a la LIE, lo que se detalla con precisión en el apartado 2.3.1. Algunas lesiones regresan o permanecen inalterables durante toda la vida, y sólo un porcentaje pequeño progresa hacia CaCU: 7,5% de NIC I, 15% de NIC II, y 25% de NIC III. La presencia de un VPH oncogénico o de alto riesgo, confiere un RR que va de 65.1-235.7 para el desarrollo de una lesión de alto grado y de 31.1-296.1 para un cáncer invasor. (Lorincz y cols., 1992). En otras palabras, la evolución a estadios invasores es evitable y depende del individuo y su interrelación con múltiples factores externos. El tiempo de evolución de las lesiones que progresan de NIC I a NIC III, y de éste a carcinoma invasor, es muy variable, generalmente de 10 a 20 años, siendo la edad promedio de las mujeres que presentan NIC I y carcinoma invasor, de 25 y 50 años, respectivamente. El CaCU es hoy en día una enfermedad de importancia en salud pública a nivel mundial. La incidencia del CaCU es mucho mayor en países de África y Latinoamérica que en Europa o Norteamérica. Hay dudas de que el muestreo inefectivo o ausente, la falta de acceso al sistema de salud, la multiparidad y la 9 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 desnutrición expliquen todas las diferencias de tasas entre estos países en desarrollo y los desarrollados. Es importante destacar que las variantes noEuropeas del VPH tipos 16 y 18 pueden tener potencial oncogénico incrementado y esto puede representar un factor de riesgo adicional contribuyente a la desproporcionadamente alta carga del CaCU en poblaciones en vías de desarrollo de las diferentes regiones del mundo (Villa LL y cols., 2000. Villa LL y cols., 2002). La carga viral también es factor de riesgo para desarrollar las lesiones precursoras y posteriormente, si no hay intervención, neoplasia. Estudios recientes empleando RCP cuantitativa para estimar la carga viral mostraron asociación entre ésta y la enfermedad incidente o prevalente (Andersson y cols., 2005). Además se ha determinado la asociación entre alta carga viral y el desarrollo de LIEA con una R.M. 7.7 (I.C. 1.6-33) en el VPH tipo 16 (van Duin y cols., 2002). En México el CaCU constituye la segunda causa de muerte por cáncer en mujeres mayores de 25 años de edad. La primera es cáncer de mama. (Mohar y cols., 2006). A este respecto, la Organización Mundial de la Salud (OMS), estima que en 25 años, de no implantarse programas organizados de prevención de cáncer cervical en países en vías de desarrollo, se presentarán 350,000 muertes anuales por ésta enfermedad, a pesar de ser una neoplasia que puede ser 100 % prevenible. (OMS. 2005) La infección por el VPH es agente etiológico un importante asociado con el desarrollo de LIE. Como quiera que sea con los métodos más sensibles de detección, el ADN del VPH ha sido detectado en el 99.7% de los casos de CaCU invasor (Tirado-Gómez y cols., 2005) y aunque existen algunos casos negativos, diversos grupos han propuesto que éstos pueden deberse a fallas técnicas en la toma de las muestras o detección viral (Delgado-Enciso I y cols., 2004); en caso de de lesiones intraepiteliales de alto riesgo (LIEA) el VPH-16 se encuentra en 40-60 % y el VPH-18 en 10-20%. Además se puede encontrar VPH-AR en 10-16% de 10 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 mujeres sanas sin evidencia clínica o citológica de lesiones cervicales. (Lizano y cols., 2005). La infección por VPH es la más frecuente de las transmitidas sexualmente, debido quizá a los cambios de conducta sexual. Se considera que 2 % de todas las mujeres sanas en edad fértil tienen VPH y 38% de estas, con actividad sexual, están infectadas, condición que puede remitir con el paso del tiempo como se mencionó anteriormente. En Colima la prevalencia de infección por VPH-AR es de 82.2% (Tamayo LE, 2002), mayor que la tasa de infección de 23.1% reportada por Lizano M. y cols. (2005). De ésta, la prevalencia de infección por VPH-18 es de 33.8% mayor que la reportada en este estudio de 4.3%. El Sistema de Información de Cáncer en la Mujer (SICAM) que registra las detecciones de CaCU a nivel nacional reporta una tasa mortalidad observada en 2004 de 24.7 y estandarizada de 38.5 por 100,000 mujeres de 25 años y más lo que dejó a Colima en primer lugar nacional por encima de Chiapas (34), Yucatán (32.5), Oaxaca y Morelos, con tasas de 31.3 cada una (Salud México 2004. SSA). En 2005, en mujeres de 25 años y más en el estado de Colima refiere una tasa neta de 14.89 por 100,000 ubicando en el 18vo. lugar a nuestro estado, antes de ajustar las tasas (Información preliminar. Fuente: Dirección de Planeación. Servicios de Salud del Estado de Colima. 16/06/2006). En el presente estudio se analizaron muestras de ADN de mujeres con CIS, LIE y sin lesión, con o sin la presencia de VPH, procedentes de la región de Colima, mediante la técnica de RCP con la utilización de iniciadores específicos para la identificación del VPH-18. 11 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 CAPÍTULO I. MARCO TEÓRICO 1. Virus del Papiloma Humano (VPH). Figura 1. Imagen electrónica del Virus Papiloma Humano (Fuente: National Cancer Institute) 1.1. Papilomavirus. El estatus taxonómico de los tipos, subtipos y variantes de VPH está basado en la secuencia de sus genes L1 que difieren de uno a otro en por al menos 10%, 2-10% y máximo 2% respectivamente. Los genomas del Virus Papiloma bovino tipo 1 (VPB-1) y el VPH-1a fueron los primeros en ser secuenciados por completo (Chen EY y cols. 1982 y Danos O y cols 1982). Esta familia fue separada recientemente de la familia PAPOVA por el Comité Internacional sobre la Taxonomía de los Virus (ICTV por sus siglas en inglés), (de Villiers EM y cols, 2004), terminando la relación con los virus Polioma y SV40 (Simian Virus 40). Al menos 200 cepas de papiloma virus humano han sido identificadas a la fecha, de las cuales más de 100 han sido registradas en el Gene Bank, y son sujetos de muchos estudios intensivos porque causan tumoraciones benignas y cancerosas. 12 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Los papilomavirus infectan a animales vertebrados incluyendo a los mamíferos (ejemplo: ganado vacuno, elefantes, humanos, ratones, monos y conejos) pájaros (ejemplo: pinzón, pollos y pericos) y reptiles (ej. tortugas) (Marantz. 1994). Los VPH infectan los queratinocitos de la membrana basal del epitelio y se replican en el núcleo de una manera dependiente de la diferenciación. La expresión genética viral en células infectadas depende de la diferenciación celular y está estrechamente regulada en los niveles transcripcionales y post-transcripcionales. Un rasgo significativo de todas las transcripciones de VPH es que estos virus son transcritos como una forma bicistrónica o policistrónica que contiene dos o más MAL’s y están poliadenilados (pA) en cualquier sitio, temprano o tardío (Zheng ZM y Baker CC, 2006). Sin embargo, la expresión genética viral y la replicación procede en una manera fuertemente controlada y regulada por la diferenciación del queratinocito; éste mecanismo no está completamente comprendido, pero hay un acuerdo general de que, en queratinocitos indiferenciados o medianamente diferenciados, la expresión génica viral lleva a la expresión de 6 proteínas regulatorias virales no estructurales (E1, E2, E4, E5, E6 y E7) desde la región temprana del genoma viral y dos proteínas estructurales virales de la cápside (L1 y L2) de la región tardía del genoma, conduciendo a la diferenciación terminal. La proteína E4 sigue siendo expresada en fase terminal en queratinocitos diferenciados. E1 y E2 están implicados en la réplica de ADN viral y la regulación de la transcripción temprana. E4 expresado en una infección productiva se asocia con el colapso del filamento citoqueratínico. E5, E6, y E7 son oncogenes virales y su expresión induce la transformación y la inmortalización de la célula. En particular, E6 y E7 son dos oncoproteínas virales que inactivan, respectivamente, p53 y pRb, dos proteínas celulares supresoras de tumores (Zheng ZM y Baker CC, 2006). 1.1.1. Morfología. 13 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Los VPH son partículas esféricas con cápsides hechas de 72 unidades morfológicas (capsómeras). Todos están descubiertos y se multiplican en el núcleo de las células infectadas. Tienen un genoma circular de ADN doble trenzado que se asocia con histonas codificados del huésped en los viriones. Los VPH (∼55 nm de diámetro) tienen un genoma de ∼8000 pb que codifica dos proteínas estructurales: la proteína mayor de la cápside L1 (∼510 residuos de aminoácidos y ∼58kDa) y la proteína menor L2 (∼470 a.a. y ∼51 kDa). Los capsómeros son protrusiones como hongos de 11 a 12 nm de diámetro, con cabezas pentaméricas en forma de estrella. Los estudios de microscopía y la cristalografía de rayos X han mostrado que todos los VPH conservan características comunes. Las 72 capsómeras son pentámeros de la proteína mayor de la cápside y están arregladas en un enrejado icosaédrico T=7. Doce pentámeros pentavalentes (cada uno rodeado por otros cinco capsómeras) están centradas sobre el eje de cinco veces icosaedro y 60 pentámeros hexavalentes (cada uno rodeado por otros seis capsómeros) están centradas sobre vértices que descansan entre el eje de cinco veces (5-fold axes). (Zheng ZM and Baker CC. 2006) 1.2. Genoma. El genoma del papiloma virus consiste de ADN circular de tamaño ∼8 kpb asociado con histonas celulares para formar una sustancia parecida a la cromatina. Se han secuenciado al menos 100 genomas de VPH diferentes (y parece que se adicionarán otros tipos conforme se vayan clonando y secuenciando otros genomas de VPH) y la organización genética de todos es similar. El ADN del VPH puede ser dividido, en general, en tres regiones principales: temprano, tardío, y una región larga de control (LCR por sus siglas en inglés o región de no codificación [NCR]). Las tres regiones en todo el virus papiloma son separadas por dos sitios pA: sitios pA temprano (AE) y pA tardío (AL). La región temprana ocupa más del 50 % del genoma viral desde su mitad 5’ y codifica seis 14 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 MAL’s (E1, E2, E4, E5, E6 y E7) (Danos O y cols. 1982) que traduce proteínas individuales como se ha descrito anteriormente. Dos otros MAL’s, E3 y E8, al principio también fueron asignados a esta región, pero sólo el MAL de E8 en BPV-1 (Lambert PF y cols. 1987. Hubbert NL y cols. 1988. Choe J y cols.1989) y HPV-31 (Stubenrauch F y cols. 2000. Stubenrauch F y cols. 2001) se han comprobado que codifican una proteína, proteína de fusión empalmada E8^E2C, que funciona como un regulador negativo de transcripción y replicación viral. El genoma se replica como episoma (plásmido nuclear multicopiado); se involucran dos mecanismos para la replicación: a) Replicación del plásmido: acontece en células de niveles inferiores de la dermis. Inicialmente, el ADN viral se amplifica de 50-400 copias diploides del genoma. Después, se replica una vez por cada división celular; el número de copias por célula permanece constante. La proteína E1 está involucrada en esta fase de replicación. b) Replicación vegetativa: ocurre en células bien diferenciadas en la epidermis. En éstas (o en células en cultivos con detención de crecimiento) el número de copias control parece estar perdido y el ADN es amplificado un número muy alto de veces. El virus es albergado en células epidérmicas y cuando estas son abandonadas es transmitido por el contacto directo (verrugas, en particular, genitales) y el contacto indirecto. 1.3. Características moleculares del VPH. 15 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Figura 2. Estructura Genómica del VPH (tomado de National Institutes of Health) Las partículas virales están compuestas por una cápside proteica, conformada en un 95% por la proteína L1 y en un 5% por la proteína L2, las cuales se ensamblan para formar capsómeros heicosaédricos. Hacia el interior de la cápside se encuentra un DNA circular de doble cadena de aproximadamente 8000 pares de bases, constituido por ocho genes y una región regulatoria no codificante la cual contiene sitios de unión para factores proteicos y hormonales del hospedero necesarios para que el virus pueda completar su ciclo de replicación (Zheng and Baker. 2006). Los VPH no producen ARNm monocistrónico sino que usan una forma muy económica de expresar sus genes desde un genoma muy compacto y los transcritos resultantes son o bicistrónicos o policistrónicos, con MAL’s múltiples en un único mensaje. Irónicamente, ni siquiera se sabe en la mayoría de los casos, cuáles transcritos son verdaderos ARNm usados para la traducción proteínica 16 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 durante la infección (Zheng and Baker. 2006). Los VPH han desarrollado mecanismos complejos para regular el empalme de pre-ARNm individual de una manera celular específica de diferenciación como se evidencia por la presencia de múltiples elementos cis- regulatorios en cada especie de pre-ARNm. En los VPHAR, muchos MAL’s importantes, incluyendo E6, E1 y L2, lleva un intrón en sus regiones de codificación; empalmando del intrón individual, romperá el MAL y anulará la producción de la proteína completa. La regulación post-transcripcional de la expresión génica del PVH está fuertemente acoplado a la diferenciación celular. Esto podría ser atribuible a la participación de factores celulares asociados a la diferenciación y algunas proteínas virales. La optimización del codón podría causar la interrupción de elementos negativos o la generación de elementos positivos reguladores en un ARN. Además, la optimización del codón podría interrumpir los sitios de unión de microARNs específico de diferenciación, abundantes diminutas moléculas de ARN (22-nts en el tamaño) recientemente descubierto para estar implicado en la regulación de un gran número de transcripciones en el nivel de translación (Zamore PD, Haley B. 2005; Alvarez-Garcia I, Miska EA. 2005). 1.3.1. Conformación del VPH. El genoma del VPH, lo conforman dos tipos de genes, aquellos que son codificados en las etapas tempranas de la infección, conocidos como genes E (del inglés Early = temprano), y aquellos que son codificados durante las etapas tardías del ciclo replicativo del mismo, conocidos como L (del inglés Late = tardío). Se conocen seis genes tempranos: E1, E2, E4, E5, E6 y E7 (aunque se considera que E4 es en realidad un gen tardío), y dos tardíos: L1 y L2. Los genes tempranos codifican proteínas involucradas en la replicación y regulación viral, así como en su capacidad carcinogénica. Por otro lado los genes tardíos codifican las proteínas estructurales que conforman la cápside viral. La región larga de control (LCR) de los papilomavirus, a veces llamado región reguladora corriente arriba (URR upstream regulatory region) o región de no 17 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 codificación (NCR), es un segmento genómico, sin Marco Abierto de Lectura principal (MAL), que contiene un gran número de elementos sensibles a cis- que gobiernan la expresión y la replicación génica. Su tamaño varía en diferentes VPH’s aproximadamente del 7 a 11 % del genoma total, formado por aproximadamente 850 pares de bases en el caso de VPH genital, y está colocado entre el final del L1 y el principio del gen E6. Figura 3. Región amplificada del LCR del VPH en este trabajo. (Editada desde figura tomada de National Institutes of Health) La Región Larga de Control operacionalmente está definida como la región de la terminación del gen L1 a la primera metionina del gen E6 (algunos autores usan el principio del gen E6). El LCR es la región menos conservada entre papilomas. Esta contiene al promotor temprano y varios motivos transcriptionales reguladores incluyendo aquellos de la familia AP-1, YY1, NF-1/CTF, Octa, TEF-2 y Sp1 y los sitios obligatorios para el regulador viral E2 codificado. El origen de réplica (ori) 18 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 también está localizado dentro del LCR, normalmente centrado entre dos E2 que une los sitios (http://cinvestav.mx/genetica/MyFiles/Papillomavirus/PAPgeno.htm#LCR). El ciclo de replicación de los VPH está estrechamente ligado al crecimiento y diferenciación de las células epiteliales hospederas. El VPH inicia su ciclo productivo infectando a las células poco diferenciadas de las capas basales del epitelio, donde inicia la transcripción de sus genes. La forma en que el VPH alcanza las células de los estratos bajos del epitelio es a través de lesiones, micro-heridas y abrasiones del tejido. El VPH exhibe un alto grado de tropismo por el epitelio escamoso en diferentes regiones corporales. Los tipos virales que inducen lesiones anogenitales se encuentran solamente en la región genital, mientras que los tipos asociados con verrugas cutáneas en manos y pies se encuentran restringidos a dichas áreas. Es posible que las diferencias en la distribución de los receptores para el VPH en dichas células sea un factor importante para la presencia restringida de tipos específicos de VPH, sin embrago los elementos más importantes que determinan la especificidad de los virus son los factores de transcripción producidos por las células hospederas. 1.4. Mecanismo molecular de malignización mediada por VPH. El VPH es capaz de transformar las células que infecta mediante la acción directa de los productos de dos de sus genes tempranos: E6 y E7. Las proteínas E6 y E7 de los VPH de alto riesgo son capaces de interaccionar con moléculas importantes para la regulación del crecimiento y replicación celular, así como para la reparación de daños sufridos por el DNA de las células sanas. La proteína E6 de los VPH de alto riesgo se une con alta afinidad a la molécula conocida como p53, induciendo su degradación. La proteína p53 es un importante factor regulador de la replicación celular y es conocido como el principal represor de 19 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 tumores en el ser humano, p53 es capaz de detectar daños sufridos en el DNA en cualquier célula del organismo. Si el daño ha sido en una etapa del ciclo celular en la que aún no ha ocurrido la replicación del DNA, p53 envía una señal para que el ciclo celular se pare y el daño sea reparado, una vez ocurrida la reparación la célula continúa su ciclo normal. Cuando el daño es sufrido durante o inmediatamente después de la replicación del DNA, p53 envía una señal para detener el ciclo celular, y como a este nivel es imposible reparar los daños, la célula sufre un proceso de eliminación por apoptosis orquestado por la misma p53. Con esto no se permite que los daños causados al DNA sean heredados a células hijas que pueden, eventualmente, ser el origen de un tumor maligno. Una alta proporción de cánceres humanos demuestra tener daños en el gen que codifica la proteína p53, el cáncer de cérvix es una excepción, ya que en este caso el gen se encuentra intacto pero la proteína no se encuentra presente en las células infectadas por VPH, ya que E6 se ha encargado de eliminarla. De esta manera la célula queda desprotegida y los tumores se desarrollan cuando el número de mutaciones desfavorables aumenta y a la par, se incrementa la malignidad de las células. Por otra parte, la proteína E7 se une específicamente al producto del gen represor de tumores Rb. Rb fue descubierto y caracterizado en el retinoblastoma, es un factor regulador del ciclo celular, ya que se une directamente al factor transcripcional E2F, que a su vez induce la transcripción de elementos involucrados con la replicación celular. La proteína E7 de los VPH de alto riesgo tiene una alta afinidad por el sitio de unión de Rb a E2F, cuando la célula ha sido infectada por el virus, la proteína E7 se une a este sitio en Rb impidiendo que éste mantenga controlado a E2F, el cual queda libre e induce la replicación celular continua. De esta manera E6 y E7 cooperan eficientemente en la transformación de las células, produciendo tumores cervicales a largo plazo. La mayoría de las infecciones por VPH desaparecen después de algunos meses posteriores al diagnóstico. El período de incubación luego de la exposición varía entre tres semanas a ocho meses. Un porcentaje importante de estas infecciones 20 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 son transitorias y desaparecen espontáneamente dentro de los dos años del contagio. Las infecciones persistentes, sobre todo si están acompañadas de otros factores de riesgo, tienen un rol muy importante en la aparición de lesiones malignas de la mucosa genital. Las infecciones causadas por el VPH-AR pueden ser detectadas en 10 a 16% de mujeres sanas sin evidencia de lesiones cervicales clínicas o citológicas. (Lazcano-Ponce. 2001, Lizano. 2005) 1.4.1. Carga Viral. En una investigación realizada por Ylitalo y col., 2000, mencionó que entre los casos que tenían una alta carga viral (HPV-16), la probabilidad de desarrollar carcinoma cervical in situ, aumentó el 22.7%, desde el primer extendido realizado hasta después de 15 años. En las pacientes con una carga viral media, en el primer extendido, la probabilidad de desarrollar carcinoma in situ aumenta a 6.6% después de 15 años. Y el tiempo de incubación estimado desde la primera confirmación de infección por VPH y el diagnóstico de cáncer fue de 17 años para las pacientes con alta carga viral y de 19 años para las pacientes con carga intermedia. En mujeres con citología anormal mostrando lesiones escamosas atípicas o LEIB, la carga viral de VPH-AR estuvo asociada significativamente al diagnóstico de LIEA (FerreiraSantos y col. 2003). A pesar del grado de LIE el número promedio de copias por célula de VPH-AR no fue significativamente diferente en los casos de LIEB y LIEA pero hubo un amplio rango de valores de carga viral de muchas magnitudes (Andersson y col. 2005) 1.4.2. Variantes. Una variante se define como diferencia en la secuencia genómica de 1-5% y es bien conocido que en los diferentes tipos de VPH ocurren numerosas formas de variantes, aunque por definición, las diferencias entre los tipos de VPH están en al menos 10% de la secuencia nucleotídica. Las variantes del VPH difieren por menos 21 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 del 2% en la secuencia nucleotídica de L1, pero ligeramente más en la región larga de control (LCR), la cual, por no codificar genes, está menos restringida a producir mutaciones viables (Stewart AC y cols. 1996. Yamada T y cols. 1997). Análisis de algunos genes críticamente relacionados con la regulación celular y viral del VPH16, han mostrado variaciones de la secuencia intratipo que pueden alterar sus propiedades biológicas. (Lizano, 2005). Además, la variación de la secuencia de nucleótidos se usa como una herramienta importante para estudios epidemiológicos de transmisión y persitencia del VPH (Franco y col., 2002). La variación intratipo del VPH-16 también ha mostrado ser un factor predictor de progresión importante hacia lesiones cervicales relevantes (Xi y col., 1997). Luisa Lina Villa y col. (2000) refiere que la neoplasia cervical está asociada preferentemente a variantes moleculares del VPH 16 y 18. 1.5. Patología del VPH. Como su nombre lo indica, los VPH inducen la formación de papilomas, que en su mayoría son crecimientos benignos fácilmente controlables. Sin embargo los VPH de alto riesgo que infectan el tracto genital están asociados con el desarrollo del cáncer cervical, que es uno de los tipos de cáncer que con mayor frecuencia afecta a la población femenina de nuestro país. Los VPH genitales son un agente de transmisión sexual que infectan el epitelio del tracto genital bajo, produciendo verrugas y papilomas. El proceso neoplásico asociado con el VPH no se limita al epitelio escamoso, sino que también está involucrado con el desarrollo de lesiones de células columnares. La infección por VPH produce cambios importantes en la morfología celular, por ejemplo se observa la formación de una amplia vacuola perinuclear, el núcleo agrandado, irregular e hipercrómico, además de ser posible encontrar binucleaciones. Las células que han sufrido esta serie de cambios son conocidas como koilocitos y son consideradas como la "huella digital" del VPH. (Gearhart y Randall, 2006) 22 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 1.5.1. Histopatología. La manifestación histopatológica más común de la infección por VPH es la verruga genital (condyloma acuminatum). Las verrugas genitales son comúnmente múltiples y ocurren con frecuencia en la vulva, extendiéndose hacia el portio vaginalis y el cérvix, produciendo lesiones filiformes pedunculadas que pueden coalescer produciendo masas similares a tumores. La verruga es esencialmente una hiperplasia epitelial benigna con acantosis y papilomatosis considerables. Sin embargo, la infección por VPH no siempre produce la formación de la lesión papilar típica, también puede producir lesiones conocidas como condiloma plano, que comparten las mismas características citológicas del condiloma acuminado, pero no se alzan sobre la superficie adyacente, por lo que no son visibles a simple vista. Nosotros sabemos que el Papilomavirus es transmitido por vía sexual, pero en el proceso de carcinogénesis se involucran otros factores que facilitan la transmisión (como el inicio a temprana edad de la actividad sexual y los múltiples compañeros sexuales) o factores que determinen el curso natural de la infección con el abuso del tabaco, anticonceptivos hormonales, deficiencias alimenticias, estrés, deficiencias inmunológicas, etc. (Cortés y Rojas. 1995). Algunos tipos de virus de papiloma humano se conocen como virus de "bajo riesgo" porque raramente se convierten en cáncer; éstos incluyen los VPH-6 y VPH-11. Los tipos de virus de papiloma humano que pueden llevar al desarrollo de cáncer se conocen como "tipos asociados con el cáncer". “Los tipos de virus más importantes de papiloma humano, transmitidos sexualmente, asociados con el cáncer en mujeres incluyen los VPH-16, VPH-18, VPH-31.” (National Cancer Institute. 2005). Estos tipos de virus de papiloma humano asociados con el cáncer causan crecimientos que normalmente parecen planos y son casi invisibles, comparados con las verrugas causadas por los HPV-6 y HPV-11. 1.6. VIRUS PAPILOMA HUMANO tipo 18 (VPH-18). 23 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 El genoma del VPH-18 que consta de 7857 pb (Ver Anexo 6) fue originalmente obtenido y clonado por S.T. Cole y O. Danos en 1987, de una muestra de una paciente brasileña con carcinoma de cérvix. Baker C.C. describió en 1993 una revisión en la secuencia en los nucleótidos 2855 a 2860 quedando de “TTGCGT” a “TGCGTT”. El MAL de E7 está situado inmediatamente enfrente de E1, una característica común a todos los papilomavirus de la zona genital secuenciados en el tiempo de la publicación. Mientras en los otros subgrupos, E7 está en uno de los otros MAL. El genoma del VPH-18 codifica un producto hidrofóbico del gen E5. El aislado brasileño es la clona de referencia y parece ser una representación de la variante Americana-India. La LCR de la variante Europea difiere de ésta clona por mutaciones en las posiciones 7529, 7567, 7592 y 7670, y de la variante Africana por cambios adicionales en 10 nucleótidos, en un segmento de 320 pares de base (Ong CK y cols. 1993). La diferencia máxima entre cualquiera de dos variantes es de 7.3% (Calleja-Macías I, y cols. 2004). El VPH-18 pertenece al Grupo C del árbol filogenético al cual pertenecen también los siguientes tipos: • VPH-39; • VPH-45; • VPH-59; • VPH-68ME180; • VPH-CP141; • VPH-AE1 y • VPH-LVX160. 24 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Los demás grupos están conformados como sigue (Fig. 4): • Grupo A: VPH 16, 31, 33,35, 35h, 52, 58, 67 • Grupo B: VPH 6b, 11, 13, 34, 44, 55, 64, MM9 • Grupo D: VPH 26, 30, 51, 53, 56, 66, 69, ISO39, L1AE2, MM4 • Grupo E: VPH 61, 62, CP4173, CP6108, CP8304, LVX82, MM7, MM8 • Grupo F: VPH 2a, 3, 7, 10, 27, 28, 29, 32, 40, 42, 43, 54, 57, CP8061 • Grupo G: VPH 1a, 4, 41, 63, 65 • Grupo H: VPH 5, 5b, 5d, 8, 9, 12, 14d, 15, 17, 19, 20, 21, 25, 47, 49, y • Grupo I: Virus Animales COPV, CRPV, EEPV, DPV, BPV1, 2, 4, PCPV1, MnPV, RhPV1. La comparación de las distancias evolutivas para la mayoría de los tipos cercanamente relacionados con 28 subtipos y variantes del VPH-2, VPH-5,VPH-6, VPH-16 y VPH-18 apoyan el tipo como una unidad taxonómica natural con subtipos y variantes que son expresiones de diversidad genómica intratipo menor similar a la encontrada en las poblaciones naturales de todas las especies biológicas (Chan SY y cols. 1992). 25 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Fig. 4 Árbol Filogenético del Virus Papiloma Humano Tomado de: The Human Papillomavirus Compendium OnLine Los VPH que se consideran paradigmas son el tipo 16 y el 18 que son de particular interés por estar asociados al cáncer genital y por lo tanto están clasificados como de “alto riesgo” (VPH-AR) (Munoz N y cols. 2003). Los VPH 16 y 18 pertenecen al grupo A y C respectivamente los cuales forman cada uno, junto con otros tipos de VPH, dos ramas filogenéticas separadas, las cuales actualmente son llamadas “especies” (de Villiers EM y cols. 2004). Una tercera rama ó especie de VPH’s de 26 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 AR es la D de la cual se considera potencialmente oncogénicos a los tipos 30, 53, 56 y 66. (Prado JC y cols. 2005). El rol etiológico de los VPH 16 y 18 en la carcinogénesis, está apoyado en sus propiedades de inmortalización de líneas celulares epiteliales in vitro. Pueden inmortalizar queratinocitos humanos en cultivo primario, resultando una resistencia al estímulo de la diferenciación terminal (Romanczuk H y cols. 1991). El ADN del VPH-18 es más eficiente que el VPH-16 en la inmortalización de células epiteliales (Barbosa M y Schlegel R. 1989. Schlegel R y cols. 1988. Villa LL y Schlegel R. 1991) suministrando así apoyo experimental a la sugerencia de que el VPH-18 se comporta más agresivamente in vivo. Los genes E6 y E7 de los VPH 16 y 18, juntos, son necesarios y suficientes para la eficiente inmortalización de células epiteliales escamosas humanas (Hawley-Nelson P y cols. 1989. Hudson JB y cols. 1990. Kaur P y cols. 1989. Münger K y cols. 1989). Fragmentos subgenómicos conteniendo las regiones largas de control (LCR’s) de VPH-16 ó VPH-18 y los genes E6 y E7 inmortalizan las células con diferente grado de eficiencia, semejando las funciones de los respectivos genomas completos (Villa LL y Schlegel R. 1991). Pero, el VPH-18 es aproximadamente 10 a 50 veces más eficiente que el VPH-16 en su potencial inmortalizador (Barbosa M y Schlegel R. 1989. Schlegel R y cols. 1988. Villa LL y Schlegel R. 1991). Esta diferencia observada no se puede contar para únicamente los genes E6 y E7 por sí solos; es posible, sin embargo, que hay otros componentes de los transcripcionales regulatorios genomas virales además de los elementos de LCR y los genes virales transformadores, los cuales pueden afectar la eficiencia de inmortalización de los genomas virales que permanecen en investigación (Romanczuk H y cols. 1991). Otra característica específica del VPH-18 publicada en 1999 (Harris SF y Botchan MR) es que la proteína E2 regula la transcripción viral y la réplica de ADN por interacciones con proteínas celulares y virales. El dominio de activación amino-terminal, que representa una clase de proteína cuyos temas estructurales son mal entendidos, contiene los residuos claves que median estos contactos funcionales. En el dominio de activación de la región E2, tiene una estructura de corazón cristaloide resistente 27 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 a la proteasa que revela un novedoso pliegue que crea una forma de castaña con una hélice alfa rica en glutamina embalada contra un marco de hoja beta. La superficie de la proteína muestra el traslape extenso de determinantes para la replicación y transcripción. Esta estructura amplía el concepto de activadores para incluir proteínas con estructuras potencialmente maleables, pero ciertamente ordenadas. Los experimentos de Bellanger S y cols., (2001) mostraron que la proteína E2 del HPV18 fue degradada por la vía del dominio de la enzima ubiquitinproteasoma mediante la transactivación amino-terminal. La estrecha regulación de la estabilidad de la proteína E2 del HPV-18 puede ser esencial para evitar la acumulación de un potente represor transcriptional y el agente antiproliferativo durante el ciclo viral vegetativo. Badal S y cols. (2004) reportan la metilación frecuente de genomas de HPV-18 en cultivos celulares y en situ. Es generalmente conocido que la metilación de ADN conduce a la represión transcriptional debido a cambios en la cromatina. De la Cruz-Hernández y cols. (2005) publicaron un empalme diferencial de la región E6 de las diferentes variantes del VPH-18 investigando los mecanismos moleculares que subyacen en la diferencia de los cambios en la transcripción temprana del gene y muestran, sin duda, que las variantes del VPH-18 exhibieron diferencias únicas en los transcriptos de E6 in vivo. Compararon los niveles de transcritos de E6 de la variante Asiática-Amerindia contra Africana encontrando menores niveles de p53 en AA que afectaron los niveles de proteínas celulares reguladas por ésta, por ejemplo, Bax. Como consecuencia directa, se encontraron niveles mayores p53 en la presencia de E6 Africana; se observaron cambios similares en los niveles relativos de transcriptos de E6 cuando se analizaron tumores conteniendo variantes de E6 de VPH-18. La habilidad para formar tumores en ratones desnudos fue considerablemente mayor cuando las células expresaron E6 AA. Un análisis de mutagénesis de la clona AA mostró que el cambio C491 A revierte el fenotipo, sugiriendo que los diferentes patrones de empalme de E6 dentro de las variantes del VPH-18 pueden tener implicaciones biológicas en la tumorigénesis viral. 28 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 1.6.1. Región Larga de Control del VPH-18 (Long Control Region: LCR) La LCR del VPH-18 puede ser analizada en tres secciones. El Segmento 1 es un área rica en purina+timidina, la cual contiene la señal de poliadenilación para los genes tardíos. El Segmento 2 que es de cerca de 200 pb de largo y solamente aparece en los VPH genitálicos. El Tercer segmento es el mejor conservado entre todos los PVH. Contiene tres palíndromes VPH-específicos y cajas TATA y CAAT; los VPH genitálicos tienen una caja TATA. La región LCR es hipervariable, así teóricamente facilita la detección de una diversidad mayor de variantes que cuando se analizan genes mejor conservados (Bernard y col., 1994). 1.6.2. Epidemiología de las Variantes del VPH-18. Aún no hay estudios claros de si las variantes en el VPH 18 tiene que ver con el amplio espectro de patologías que existen en CaCU, pero sí se conoce que el VPH 16 predomina en los tumores escamosos mientras que el 18 en otros tipos como los adenocarcinomas (Lizano y col. 1997). No está bien establecido que tanto de tales diferencias cuantitativas en la diversidad entre tipos de VPH contribuyen a las diferencias geográficas del CaCU (Calleja-Macías, 2004). Pocas diferencias nucleotídicas encontradas en las variantes del VPH corresponden a cambios en los aminoácidos. Sin embargo, es de gran interés definir las alteraciones que puedan interferir con las propiedades funcionales o antigénicas de proteínas virales específicas. En los años pasados recientes, se ha propuesto que variaciones genómicas mínimas dentro de un dado tipo oncogénico del VPH estén implicadas en las diferencias observadas en el comportamiento de lesiones premalignas. Algunos estudios proponen que variantes intratípicas del VPH pueda conferir niveles de riesgo diferenciales para el cáncer cervical (Bernard HU y cols. 1994. Xi LF y cols. 1997. Zehbe I y cols. 1998. Hildesheim A y cols. 2001). Se ha sugerido que cierto tipo de variantes de VPH-18 principalmente las encontradas en lesiones premalignas, pueden representar aislados con el potencial oncogénico 29 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 disminuido (Hecht JL y cols. 1995). La incidencia de CaCU es mucho mayor en países africanos y Latinoamericanos que en Europa y Norteamérica. Hay dudas acerca de que los siguientes parámetros expliquen todas las diferencias en las tasas de CaCU entre estos países en desarrollo y desarrollados: el programa preventivo no se lleve a cabo o que sea tan ineficaz; la falta de acceso a los servicios de salud; la multiparidad y la malnutrición. También es importante resaltar que las variantes no Europeas (Africana y AsiáticaAmerindia) del VPH 18 incrementan el potencial oncogénico y esto puede representar un factor adicional contribuyente a la carga desproporcionadamente alta de CaCU en poblaciones en desarrollo en las diferentes regiones del mundo. (Villa, 2000). 2. Lesiones Intraepiteliales o Precursoras y Cáncer Cervico-Uterino. 2.1. Etiología. El Cáncer Cérvico-Uterino (CaCU) es una patología de etiología multifactorial. Dentro de los factores de riesgo más involucrados son el inicio temprano de relaciones sexuales, número de parejas, uso de anticonceptivos orales, deficiencia de ciertas vitaminas, tabaquismo y las infecciones virales de tracto genitourinario. El principal virus asociado al CaCU es el virus del papiloma humano (VPH). Alrededor de 200 tipos de VPH se han identificado a la fecha y más de 35 se asocian a afecciones anogenitales (De la Cruz-Hernández y col. 2005) subclasificándose de acuerdo a su relación con CaCU y lesiones intraepiteliales de alto (LIEA) y de bajo (LIEB) grado en: 1) De bajo riesgo: tipos 6, 11, 42, 43, 53 y 55, se asocian principalmente a condilomas y LIEB; 2) De alto riesgo: tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68 que se encuentran en 93% de la LIEA y de los CaCU (Ferenczy y Franco . 2002); 30 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 3) De riesgo intermedio: tipos 30, 32, y 66, se asocian a ambos grados de LIE y ocasionalmente a cáncer (Vargas, 1996). La asociación entre VPH y LIE/CaCU está bien establecida (Zur Hausen, 2002). Las técnicas moleculares ofrecen una mayor sensibilidad y especificidad para el diagnóstico para VPH. Las mujeres positivas a VPH por medio de reacción en cadena de la polimerasa (RCP) tuvieron 3.8 veces más riesgo de presentar lesiones intra-epiteliales de bajo grado de malignidad y un riesgo de 12.7 veces más de desarrollar lesiones de alto grado de malignidad (Liaw, 1999); el VPH se asocia a LIE 10 veces más que en grupos controles; la citología negativa a VPH pero con ADN positivo demostró 11 veces más riesgo de desarrollar LIEA en los próximos dos a tres años; las mujeres con VPH tipos 16 y/o 18 tienen aún más riesgo que aquellas con VPH de mediano o bajo riesgo de desarrollar CaCU a partir de una LIE. Tirado-Gómez y col., 2005 encontraron que la presencia de VPH alto riesgo incrementa en 78 veces la probabilidad de presentar CaCU invasor; si el virus detectado es tipo 16 la razón de momios (RM) sube a 429.7; cuando el virus es de alto riesgo diferente al tipo 16 el riesgo se disminuye a 64.1. Se considera que el 2% de todas las mujeres en edad fértil con actividad sexual tienen VPH y el 30% de ellas están infectadas; alrededor de 25 a 65% de las personas que han tenido contacto sexual con personas infectadas la adquieren. La edad más frecuente de la infección es entre los 16 y 25 años, con predominio en las mujeres blancas sobre las negras (2:1). El intervalo entre la exposición y manifestaciones clínicas es entre tres semanas a ocho meses. Una tercera parte permanecerá con la infección, en otra cederá sola la infección, y en el resto la infección estará en un estado latente, por lo tanto este comportamiento está relacionado con otros factores. (Tamayo, 2002). Por lo que factores demográficos, sociales u otros agentes biológicos están implicados en los múltiples estadios de progresión de la infección viral a cáncer. Dentro de estos últimos puede ser el factor viral en donde se propone que ciertas 31 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 variantes de VPH están implicadas en las diferencias observadas en la historia natural y el comportamiento clínico de CaCU y LIE. En población mexicana se ha observado la presencia de tres aislados de VPH 18 denominados Var-1, Var-2 y referencia. También hay una asociación aparentemente exclusiva entre la Var-2 y tumores de células escamosas, los cuales presentan mejor pronóstico que el adenocarcinoma y el carcinoma de células pequeñas, en los cuales se ha aislado solamente la clona de referencia y la Var-1 (De la Cruz-Hernández , 2002). 2.2. Epidemiología. El CaCU (y LIE) es una patología de gran importancia en salud pública a nivel mundial ya que es la segunda causa de muerte, superada sólo por el cáncer mamario en la población adulta femenina (Mohar, 2006) y es la enfermedad neoplásica más frecuente en la población femenina en los países en vías de desarrollo. Se estima según datos en 2004 de la Organización Mundial de la Salud que 500 000 mujeres de todo el mundo la desarrollan anualmente, de las cuales el 45% fallecen (World Health Organization, 2004). En México, el CaCU ocupa el segundo lugar de muerte en la población general y el primero en mujeres mayores de 25 años de edad y equivale al 20% de los padecimientos oncológicos en mujeres en el Instituto Nacional de Cancerología (De la Garza, 2006). En el estado de Colima la Secretaría de Salud en 2005 diagnosticó por citología 803 casos de displasia, 36 de las cuales fueron severas; y 30 casos de CaCU. Por diagnóstico Colposcópico e Histopatológico confirmado se reportaron en la misma fecha 311 casos de LIE-CaCU: 237 LIEB; 54 LIEA; 15 CIS; 1 CaCU-M; 4 CaCU-I. Nuestro estado ocupó en 2004 (Salud Méx. 2004) el primer lugar de mortalidad por CaCU en el país, con una tasa de 38.5 por 100,000 superior a la media nacional que fue de 20.7 tanto en población femenina mayor de 25 años, como en tasa de mortalidad en población general, siendo la edad más afectada tanto para CaCU como para el desarrollo de LIEs la de 25 a 44 años de edad. Por ello la Norma Oficial Mexicana NOM-014-SSA2-1994 concibe como principal finalidad lograr la reducción de la 32 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 morbi-mortalidad por CaCU. La aplicación de campañas masivas de detección temprana de CaCU, junto con los avances terapéuticos, ha permitido en las últimas dos décadas una disminución notable en la incidencia y mortalidad de este padecimiento en los países desarrollados, pero aún así continúa siendo un campo de investigación primordial, lo que hace necesario un diagnóstico temprano y preciso de factores de riesgo adicional involucrados en el desarrollo de dicha patología, ya que la consulta por este padecimiento en los hospitales participantes representa casi la totalidad de la consulta de la clínica de displasia y también es de consideración en el servicio de urgencias. Por otro lado el costo de manejo de paciente con esta patología representa un alto porcentaje del gasto total hospitalario, lo que hace necesaria la implementación de medidas que disminuyan la morbi-mortalidad del CaCU lo que repercutiría en disminuir el número de consulta a nivel de especialidad y urgencia, así como los costos de atención en hospitales de 2do y 3er nivel. (Tirado-Gómez, 2005). 2.3. ETAPAS DE LESIONES INTRAEPITELIALES y CÁNCER CERVICOUTERINO 2.3.1. Conceptos precursores. En 1910, Rubin (New York, USA) habla de cáncer incipiente para nominar el concepto de transformación neoplásica confinada al espesor del epitelio. En 1912, Schottländer y Kermauner (Berlín, Germany) utilizan el término de carcinoma temprano para designar los cambios que observaban en el epitelio adyacente al carcinoma cervical invasor. Veinte años mas tarde, Broders (New York, USA), basándose en su experiencia en Dermatopatología, emplea el término de carcinoma in situ (CIS) al describir este cuadro histológico. Pese a la proliferación de estos y otros muchos sinónimos, el término acuñado por Broders es el que ha permanecido para designar estas lesiones caracterizadas por la completa sustitución del epitelio 33 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 por células anómalas semejantes a las células del carcinoma invasor. Es de resaltar que, de forma paradójica, en el trabajo inicial del afortunado Broders no figuraba la localización cervical dentro de los ejemplos de CIS. En 1949, Papanicolaou introduce los términos de «displasia» en histopatología y «discariosis» en citología para designar dichos cambios. Posteriormente, en 1953, Reagan (Cleveland, USA) consagra el término en histopatología cervical al denominar a estas lesiones, menos severas que el CIS, hiperplasias atípicas o displasias, señalando que la mayoría de ellas, dejadas a su evolución, regresan o permanecen inalteradas por mucho tiempo. Así pues, es Papanicolaou y no Reagan el que introduce por primera vez el término «displasia» en patología cervical. En 1961, en el Primer Congreso Internacional de Citología celebrado en Viena, se acuerda que los términos para designar citológicamente las tres lesiones cervicales mayores sean: carcinoma invasor, carcinoma in situ y displasia. Esta última fue graduada como leve, moderada, y severa o grave, a las que habría que añadir el CIS ya definido. La clasificación, utilizada tanto en material histológico como citológico, tuvo dos problemas fundamentales; por un lado, el gran desacuerdo respecto a cuándo una lesión debía ser considerada displasia grave o CIS, y por otro, el que muchos clínicos asumían que el CIS y la displasia eran dos lesiones biológicamente distintas e independientes, con distinto potencial maligno, no requiriendo tratamiento las lesiones displásicas. 34 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 AUTOR CLASIFICACIÓN LESIONES PRECURSORAS Papanicolaou (1949) R. Richart (1967) ¿VPH? Displasia Leve Displasia Moderada NORMAL NIC I NIC II NORMAL Displasia Severa °CIS NIC III/CIS VPH Sistema Bethesda (1989) NORMAL *LIE-BG +LIE AG (incluye VPH) Cuadro 1. Etapas de las lesiones precursoras y sus diferentes nomenclaturas. Modificado de LacruzPelea, 2003. (°Cáncer In Situ. *Lesión Intraepitelial de Bajo Grado. +Lesión Intraepitelial de Alto Grado) Para solventar estos problemas Ralph M. Richart (Nueva York, USA), en 1967, propuso el término de neoplasia intraepitelial cervical (NIC-CIN) con tres grados progresivos (I, II, III), incluyéndose en el grado III la displasia grave y el CIS de la clasificación anterior. La ventaja principal, sobre esta, es el reconocimiento de la unidad del proceso patológico lo cual conlleva una relación con las técnicas terapéuticas. Esta clasificación ha sido considerada bastante adecuada durante más de 20 años y por lo tanto la más utilizada internacionalmente. No obstante, un número creciente de publicaciones señalaron el hecho de la sorprendentemente baja seguridad diagnóstica, tanto en material cito como histológico, en la parte menos severa del espectro. Se sugirió, por lo tanto, que este sistema de gradación debía ser modificado y sustituido por un sistema binario que segregara los procesos con atipia celular muy discreta de aquellos con atipia franca (Lacruz-Pelea, 2003). En el cuadro 1 se esquematizan las diferentes clasificaciones. En la figura 5 se observa la esquematización de los cambios del epitelio cervical según el avance de la lesión escamosa. 35 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Figura 5. Esquematización gráfica de la histopatología de la Neoplasia Intraepitelial. (Fuente: www.stanford.edu) 2.3.2. Lesión Intraepitelial Escamosa (Bajo-Alto Grado) Las razones anteriormente expuestas, junto con los avances en el conocimiento de la carcinogénesis cervical y en el diagnóstico citológico, motivaron una reunión de representantes de organismos internacionales, científicos y profesionales, en el NCI de Estados Unidos en Bethesda (Maryland, USA). Fruto de dicha reunión fue un nuevo sistema de nomenclatura para informes citológicos ginecológicos (Sistema o Clasificación de Bethesda), en el que se unificaron criterios y se adoptaron recomendaciones que la experiencia general acumulada aconsejaba. La parte fundamental de esta nueva clasificación fue la elaboración de un sistema binario para catalogar las anormalidades. El termino «alto grado» incluye el NIC II y NIC III de la clasificación de Richardt, y el termino «bajo grado» el NIC I y las alteraciones celulares producidas por papilomavirus (PVH). Esta clasificación fue difundida en 1988, mínimamente modificada en 1991, y actualizada recientemente en 2001(Bethesda, USA). 36 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Es preciso comentar aquí que el sistema Bethesda, aunque universalmente conocido y ampliamente utilizado, no ha sido adoptado en todos los países. Así, en Inglaterra, se sigue utilizando la nomenclatura «B.S.C.C».; en los países de habla alemana, el «sistema Munich»; en Australia, una modificación del propio sistema Bethesda. Etc. La Sociedad Española de Citología (SEC), consciente de la necesidad de unificar criterios y considerando que son más las ventajas que aporta que los inconvenientes que suscita, adoptó esta clasificación como su nomenclatura oficial aconsejando su utilización a todos sus miembros. En México por la Normatividad oficial se aplica la clasificación de Richardt de Neoplasia Intraepitlial Cervical (NIC). Aparte de los datos de identificación y de localización de la toma, la clasificación de Bethesda en su versión de 2001 tiene los siguientes apartados por lo que respecta a las lesiones cervicales (Solomon D, y cols., . 2002): 2.3.2.1. Negativo para lesiones intraepiteliales o malignidad (Se utiliza esta categoría cuando no hay evidencia de neoplasia, independientemente de si se observan, o no, microorganismos u otros hallazgos no neoplásicos). 2.3.2.2. ANOMALÍAS CELULARES EPITELIALES 2.3.2.2.1 EN CÉLULAS ESCAMOSAS 2.3.2.2.1.1 Células escamosas atípicas (ASC) – de significado indeterminado (ASC-US) – no puede excluirse LIEA (ASC-H) 2.3.2.2.1.2. Lesión intraepitelial escamosa de bajo grado (LIEB), comprendiendo: – displasia leve/CIN 1 – PVH 2.3.2.2.1.3. Lesión intraepitelial escamosa de alto grado (LIEA), comprendiendo: 37 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 – displasia moderada, severa y CIS/CIN 2 y 3 – con características sugestivas de invasión (si se sospecha invasión) 2.3.2.2.1.4 Carcinoma epidermoide. 2.3.2.3. EN CÉLULAS GLANDULARES 2.3.2.3.1. Células glandulares atípicas (AGC) – endocervicales (NOS o especificar en comentarios) – endometriales (NOS o especificar en comentarios) – glandulares (NOS o especificar en comentarios) 2.3.2.3.2. Células atípicas, sugestivas de neoplasia – endocervicales – glandulares 2.3.2.3.3. Adenocarcinoma endocervical in situ (AIS) 2.3.2.4. Adenocarcinoma – endocervical – endometrial – extrauterino – no específico (NOS) El término «lesión» en lugar de «neoplasia», aunque etimológicamente es poco específico (significa «cualquier daño»), es utilizado para resaltar el potencial biológico incierto del proceso. Otra de las aportaciones importantes del sistema Bethesda es el concepto de «atípia escamosa» que en la reciente modificación de 2001 incluye los dos apartados siguientes: 38 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 2.3.2.5. Atipia escamosa de significado indeterminado (ASC-US) ASC-US son las siglas de «Atypical Squamous Cells of Undetermined Significance» ó células escamosas atípicas de significado indeterminado o incierto. El término fue introducido para intentar acotar con más precisión la «zona gris» entre los cambios celulares benignos y la lesión intraepitelial, por lo que la catalogación de un proceso como ASCUS se realiza por exclusión. Es decir: los cambios observados pueden deberse a un proceso benigno, pero intenso, o a una lesión potencialmente grave; por lo tanto, y debido a que no pueden ser inequívocamente clasificados, son interpretados como de significado indeterminado o incierto. Desde el punto de vista morfológico, estos cambios deben ser más acusados que los de un proceso reactivo pero, bien cuantitativamente o cualitativamente, insuficientes para clasificarlos con seguridad como LIE. Como se puede deducir de la definición, esta categoría no es reproducible y algunos autores piensan que es una invención norteamericana como parte de una práctica citológica a la defensiva para evitar, en la medida de lo posible, falsos negativos que puedan conllevar acciones legales. No obstante, se ha comprobado que un 10-20% de casos de ASCUS corresponden realmente a una lesión intraepitelial, incluso de alto grado, que no se ha puesto en evidencia en el extendido citológico, por lo que eliminar el término no parece prudente. Todos estos datos han sido contemplados en la versión 2001 de Bethesda en la que el término ASCUS pasa a ser definido como «alteraciones citológicas sugestivas de una LIE pero cuantitativamente y/o cualitativamente insuficientes para una interpretación definitiva». Es decir, se elimina el ASCUS- probablemente reactivo, reservándose el término únicamente para cuando exista sospecha de lesión intraepitelial. Como consecuencia, no debe malograrse el interés práctico del mismo siendo exageradamente utilizado. Como guía de frecuencia, se recomienda que no debiera exceder en 2-3 veces la tasa de LIE de un laboratorio determinado (Association of Directors of Anatomic and Surgical Pathology. 1989). 2.3.2.6. Atipia escamosa. No puede excluirse LIEA (ASC-H). 39 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Este término sustituye al previo «ASCUS-posible LIE». En él se recogen aquellos casos en los que las alteraciones celulares son bastante acusadas pero, bien por las características de la extensión (inflamación, hemorragia, etc.) o bien por la escasez de estas células, no pueden considerarse totalmente conclusivas. Como se comprueba también en el apartado de «anomalías celulares epiteliales», el término «AGUS» (células glandulares atípicas de significado indeterminado) de la versión anterior, ha sido sustituido en la de 2001 por el de «células glandulares atípicas» solamente, con ello desparece esta sigla de sonido gutural no demasiado eufónico, lo cual es un motivo de satisfacción, evitándose su confusión con ASCUS (Lacruz-Pelea, 2003) 2.4 ESTADIFICACÍON HISTOPATOLÓGICA Y CLÍNICA DEL CÁNCER CERVICOUTERINO (Hill EC. 1993). 2.4.1. Carcinoma in situ: De acuerdo con la definición de la OMS, es una lesión en la que todo el epitelio o la mayor parte de él muestra el aspecto celular de carcinoma. No hay invasión del estroma subyacente. 2.4.2. Carcinoma micro invasor del cuello uterino: 1 a 1 invasión mínima al estroma no mayor a 1 mm., 1 a 2 invasión al estroma menor de 5 mm. y con una extensión horizontal no mayor de 7 mm. 2.4.3. Carcinoma Invasor: toda extensión histopatológica de las células malignas mayor de 7 mm. 40 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 2.4.4. Estadificación Clínica: 2.4.4.1. Etapa 0 o carcinoma in situ El carcinoma in situ es un cáncer en su etapa inicial. Las células anormales se encuentran sólo en la primera capa de células que recubren el cuello uterino y no invaden los tejido más profundos del cuello uterino. 2.4.4.2. Etapa I El cáncer afecta el cuello uterino, pero no se ha diseminado a los alrededores. 2.4.4.2.1. Etapa IA: una cantidad muy pequeña de cáncer que sólo es visible a través del microscopio se encuentra en el tejido más profundo del cuello uterino 2.4.4.2.2. Etapa IB: una cantidad mayor de cáncer se encuentra en el tejido del cuello uterino. 2.4.4.3. Etapa II El cáncer se ha diseminado a regiones cercanas, pero aún se encuentra en la región pélvica. 2.3.4.3.1. Etapa IIA: el cáncer se ha diseminado fuera del cuello uterino a los dos tercios superiores de la vagina. 2.3.4.3.2. Etapa IIB: el cáncer se ha diseminado al tejido alrededor del cuello uterino. 2.4.4.4. Etapa III El cáncer se ha diseminado a toda la región pélvica. Las células cancerosas pueden haberse diseminado a la parte inferior de la vagina. Las células también pueden haberse diseminado para bloquear los uréteres que conectan los riñones a la vejiga. 41 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 2.4.4.5. Etapa IV El cáncer se ha diseminado a otras partes del cuerpo. 2.4.4.5.1. Etapa IVA: el cáncer se ha diseminado a la vejiga o al recto (órganos cercanos al cuello uterino). 2.4.4.5.2. Etapa IVB: el cáncer se ha diseminado a órganos dístales como los pulmones. 2.4.4.6. Recurrente. La enfermedad recurrente significa que el cáncer ha vuelto (reaparecido) después de haber sido tratado. Puede volver al cuello uterino o a otro lugar. 2.5. Tratamiento de las Lesiones Intraepiteliales y Cáncer Cérvico-Uterino. En la actualidad existen varios tratamientos para las LIE’s, pero no son efectivos para el VPH. Vamos a hacer mención general de las diferentes opciones sin ser específicos ya que el alcance de este escrito no es terapéutico en general. Estos tratamientos comprenden citotoxicidad inducida químicamente y métodos ablativos que permiten la destrucción y/o escisión del tejido infectado, como: crioterapia, electrocoagulación diatérmica, termocoagulación, vaporización con láser de CO2, asa diatérmica, conización con bisturí e histerectomía. (Hernández-Quijano y col. 2006). Existen tratamientos químicos tópicos como: ácidos orgánicos, ácido tricloroacético y bicloroacético, y los antimetabolitos que comprenden al 5fluorouracilo y agentes antimitóticos, como la podofilina y la podofilotoxina. También existen vacunas terapéuticas; antivirales como el aciclovir y la virabidina y por último los agentes inmunomoduladores como el interferón-alfa y el imiquimod que estimula la producción del factor de necrosis tumoral alfa y otras citocinas en las células infectadas, que se postula pueden terminar con el VPH. (HernándezQuijano y col. 2006). 42 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 CAPÍTULO II. METODOLOGÍA 3. PLANTEAMIENTO DEL PROBLEMA. Es probable que en mujeres de nuestra región con LIE-CaCU exista asociación con el VPH-18 pero se desconoce la frecuencia real de la distribución de LIE-CaCU con VPH-18 positivo y en consecuencia si existe dicha asociación. El desarrollo de metodología de vanguardia basada en técnicas moleculares como es la Reacción en Cadena de la Polimerasa (RCP), permite investigar la presencia de infección por VPH-18, y con ello hacer análisis para determinar asociación entre el VPH-18 y LIE-CaCU. En virtud de la importancia que en materia de Salud Pública de nuestro país tienen los padecimientos oncoginecológicos, en especial el CaCU, y la magnitud de su posible asociación con VPH-18 (riesgo relativo), fue necesario conocer si existía dicha asociación en nuestra región. 3.1 Pregunta de investigación. ¿Existe una asociación entre la frecuencia de VPH-18 que nos hable de riesgo relativo para el desarrollo de los diferentes tipos de LIE-CaCU en nuestro estado? 4. JUSTIFICACIÓN 4.1. Relevancia y pertinencia. En orden de prioridad, el CaCU es la segunda de las patologías consideradas dentro del programa nacional de salud; por lo tanto es pertinente y necesario 43 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 dilucidar a nivel molecular, factores que concedan susceptibilidad o protección para el desarrollo de LIE y su evolución a cualquiera de los diferentes tipos de CaCU. El trabajo se realizó en el Laboratorio de Genética y Biología Molecular en el Centro Universitario de Investigaciones Biomédicas de la Facultad de Medicina de la Universidad de Colima. 5. HIPÓTESIS: El VPH-18 es más prevalente en la región de Colima que en otras regiones de México. 6. OBJETIVOS 6.1. Objetivo General. Investigar y determinar la asociación entre LIE-CaCU con el VPH-18, mediante técnicas de biología molecular en una muestra de mujeres de la región de Colima. 6.2. Objetivos Específicos. 6.2.1. Conocer la prevalencia de VPH-18 en cérvix de pacientes con LIE y CaCU, así como en una población aparentemente sana. 6.2.2. Identificar la frecuencia de la infección del VPH-18 en los diferentes estadios de evolución, desde pacientes sin evidencia clínica o histológica de cambios en cérvix hasta mujeres con lesiones precursoras y Cáncer In Situ. 6.2.3. Conocer si hay asociación de riesgo entre las diferentes fases de evolución, desde pacientes sin evidencia clínica o histológica de cambios en cérvix hasta mujeres con lesiones precursoras y Cáncer In Situ y la positividad del VPH-18. 44 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 6.2.4. Identificar diferencias entre las frecuencias encontradas en el presente estudio y frecuencias encontradas en otras regiones del país y reportadas en artículos arbitrados. 7. MATERIAL Y MÉTODO 7.1. Tipo de estudio: El estudio es observacional, retrolectivo, transversal. 7.2. Selección de la muestra. Muestras de ADN’s positivas a VPH-18 de pacientes con diagnóstico de LIE- CaCU y normales o aparentemente sanas que acudieron a control a las clínicas de Displasia del Hospital Regional Universitario de la Secretaria de Salud del Estado y del Hospital General de Zona # 1 del IMSS en el período comprendido de 20042005. 7.3. Criterios de Inclusión. El grupo de pacientes consistió en mujeres con diagnóstico clínico de LIE-CaCU, así como pacientes aparentemente sanas que acudieron a revisión a las clínicas de Displasias. 7.4. Criterios de no inclusión. No se incluyeron mujeres con tratamiento antiviral. 7.5. Criterios de exclusión. Se excluyeron aquellas participantes cuyo ADN fue insuficiente en cantidad o calidad. 7.6. Tamaño de la muestra. Se analizó una base de 264 ADN’s de mujeres con diagnóstico de CaCU, LIE de Bajo y Alto Grado y de mujeres sin patología cervical. 45 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 7.6.1. Cálculo de Tamaño Muestral. n= ______Nz2 (p q)___________ (N – 1) E2 + z2 (p q) Z = 1.96 p = .8 (Tamayo-Acevedo, L.S. 2002) q = .2 E2 = .05 N = 250,000 n = 245 (mínimo a estudiar) 7.7. Consentimiento informado y encuesta (Anexo 1): Todas las personas participantes firmaron una carta de consentimiento informado una vez que aceptaron participar de manera voluntaria en el trabajo; también se elaboró una encuesta que contiene los datos adicionales que se reportan. 7.8. Procedimiento: A todas las participantes se tomó una muestra vaginal con citocepillo para realizar la búsqueda de VPH-AR. Las muestras de las participantes se sometieron a los siguientes procedimientos de laboratorio: Figura 6. Imagen de Citocepillo. 46 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 METODOLOGÍA (Consentimiento informado) TTO RAA UEESSTTR MU DEE M MAA D OM (Citocepillo) EEXXTTR DN DEELL AAD ND ÓN CIIÓ RAAC N (Método SDS-PK) C N DN DEELL AAD ND ÓN CIIÓ CAAC NTTIIFFIIC UAAN CU (Espectrofotometría) C NTTR CEEN NC ON CO N DN DEELL AAD ND ÓN CIIÓ RAAC AAM N YY TTIIPPIIFFIIC ÓN CIIÓ CAAC N DN MPPLLIIFFIIC DEELL AAD ND ÓN CIIÓ CAAC (Reacción en cadena de la polimerasa- iniciadores específicos) IID ND ÓN CIIÓ CAAC NTTIIFFIIC OSSIITTIIVVAASS DEEN H--1188 PPO RAASS VVPPH UEESSTTR MU DEE M (Electroforesis en gel de poliacrilamida 6%) (Elaboración de base de datos) Figura 7. Diagrama logístico de la metodología de estudio. 47 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 7.8.1. Extracción del ADN por métodos convencionales (Anexo 2) 7.8.2. Cuantificación del ADN (Anexo 3) 7.8.3. Dilución del ADN. Después de la verificación de la calidad y cantidad del ADN se prepararon alícuotas de ADN a una concentración de 100 ng/μl, para lo cual se utilizó la siguiente fórmula: (V1) (C1)= (V2) (C2) 7.8.4. El ADN se sometió a PCR (Anexo 4) con la utilización de iniciadores específicos (Cuadro 2) para la identificación de VPH-18. El producto amplificado fue visualizado en un gel de poliacrilamida al 6% (Anexo 5). 7.8.4.1. Amplificación del gen LCR por RCP con oligonucleótidos específicos, los cuales flanquean toda la secuencia del gen LCR (518 pb). VPH-18 LCR 5’ CCTTACAGCATCCATTTTATCCTAC forward VPH-18 LCR reverse 3’ TTGTGGTGTGTTTCTCACATCTTTT Cuadro 2. Oligonucleótidos iniciadores específicos 7.8.4.2. El producto de RCP se corrió en un gel de poliacrilamida al 6% y se identificó los genes amplificados. 48 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 1 2 3 (+) (+) 4 6 5 7 8 (+) (+) 9 10 HeLa (-) Ctrl mpm Figura 8. Gel de Poliacrilamida para identificación de VPH-18 [Control negativo (-); HeLa Control positivo; muestras positivas a VPH-18 (+); mpm marcador de peso molecular] 7.8.5. Registro de resultados en Base de Datos computarizada capturada con el programa Excel® y analizada con el programa SPSS 10®. Gráficos elaborados con el programa Excel®. 7.9. Análisis estadístico: medidas de tendencia central, comparación de proporciones con Χi cuadrada no paramétrica, pruebas exactas; razón de momios e intervalo de confianza con EPI-INFO 6.04. 49 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 CAPÍTULO III. RESULTADOS. 8.1. Datos sociodemográficos: Se obtuvieron un total de 264 muestras las cuales fueron obtenidas en 78% (n= 206) del Hospital Regional Universitario (HRU); 15.9% (n= 42) del Instituto Mexicano del Seguro Social (IMSS); el 6.1% de consultorios particulares. Con domicilio en el estado de Colima el 80.3% (n= 212) y 19.7 % (n= 52) de zonas circunvecinas principalmente de Jalisco. 8.1.1. La edad promedio fue de 37,6 (D.E. 10.17) años con mínima de 16 y máxima de 74. En el siguiente Cuadro (3) se describen otras variables investigadas: Variable n Moda % Escolaridad 116 Primaria 43.9 Ocupación 178 Hogar 67.4 Estado Civil 179 Casada 67.8 Cuadro 3. Principales variables sociodemográficas. 8.2. Antecedentes Gineco-Obstétricos se describen en el siguiente cuadro (Cuadro 4). Recategorizando el número de parejas sexuales en A (1-3); B (4-9) y C (≥10) resulta: A: 93.5% (n= 247); B: 4.7% (n= 12); C: 1.8% (n= 5). 8.2.1. Método anticonceptivo más usado: Oclusión Tubaria Bilateral (OTB) (n= 95, 36.0%), seguido de: Dispositivo Intrauterino (DIU) 24.6% (n= 65); ningún método 20.8% (n= 55), Hormonales 11.4% (n= 30) y Locales (preservativo, ritmo y coito interrupto) 7.2% (n= 19). 50 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Variable promedio mínima máxima Edad 37,6 16 74 Menarca 12,8 8 21 IVSA 18,6 12 35 Parejas 1,0 1 >10 Gestaciones 4,0 0 17 Edad primer 19,7 13 36 Tiempo uso Método de Planificación Familiar 4,0 0 27 Menopausia 49,0 38 55 sexuales parto Cuadro 4. Principales variables gineco-obstétricas. 8.3. Antecedentes de riesgo. (Cuadro 5). Familiares con antecedente de cáncer cervicouterino: madre 7.2% (n= 19), hermana 3.4% (n= 9), abuela materna 3.0% (n= 8), otra familiar 2.3% (n= 6), tía materna 1.2% (n=3); sin antecedente 83% (n= 219). 51 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Nombre SI (n) Porcentaje NO (n) Porcentaje Antecedente 45 17.0 219 83.0 Otro Ca 39 14.8 225 85.2 ETS 38 14.4 226 85.6 Tabaquismo 36 13.6 228 86.4 CaCU Cuadro 5. Principales factores de riesgo conocido 8.3.1. Enfermedades de Transmisión Sexual (ETS): NO 85.6% (n= 226) y SI 14.4% (n= 38). De éstas: VPH 6.8% (n= 18); condiloma acuminado 4.2% (n= 11); gonorrea 1,5% (n= 4); gardnerella vaginalis 1.5% (n= 4); sífilis 0.4% (n= 1). Acumulando el antecedente de VPH con Condiloma da un total de 29 (73.6%) pacientes de las 38 que refirieron conocer antecedente de ETS. 8.3.2. Tabaquismo: NO 86.4% (n= 228) y SI 13.6% (n= 36). De éstas: No han dejado de fumar 20 pacientes con un tabaquismo leve (de 1 a 3 cigarrillos diarios) 17 pacientes; tabaquismo moderado (de 4 a 10 cigarrillos diarios) 10 pacientes y tabaquismo severo (más de 10 cigarrillos diarios) 9 pacientes; edad de inicio del tabaquismo: (moda) 17 años con una mínima de 14 y máxima de 38; refieren tabaquismo pasivo 31.8% (n=84); tiempo promedio 12.35 años (∑= 1038 años), moda 10 años, mínimo 1 (n=5) y máximo 50 años (n= 1). 8.3.3. Citología vaginal previa: Nunca se habían realizado Citología vaginal: 27 pacientes (10.2%). La frecuencia de citologías previas realizadas fue de 1 a 25 con moda de 1 y 10 (33 cada una). 52 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 8.4. Datos Clínicos: El motivo de consulta o sintomatología expresada por la paciente fue principalmente envío por una citología vaginal anormal 42% (n= 111), seguida de asintomática 32.6% (n= 86), leucorrea 11.4% (n= 30) y dispareunia 7.6% (n= 20), principalmente. (Gráfica 1). Motivo de Consulta en Clínica de Displasias 120 111 100 86 80 n 60 40 30 20 20 0 Citología anormal Asintomática Leucorrea Dispareunia Gráfica 1. Motivo de consulta expresado por la paciente para acudir a la Clínica de Displasias 8.4.1. Exploración: Al momento de la exploración para la toma de la muestra se observó leucorrea en 40.9% (n= 108). 8.4.2. Sangrado: Tuvo sangrado al momento del cepillado: 33.7% (n= 89). 8.4.3. Aspecto macroscópico del cérvix al momento de la toma: sano 18.6% (n= 49), congestivo-inflamatorio: 17.0% (n= 45), pseudoerosión. 16.3% (n= 43), mosaico 15.2% (n= 40), puntilleo 14.4% (n= 38), ectropión 11.4% (n= 30) y epitelio aceto53 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 blanco: 7.2% (n= 19). Agrupando los cambios colposcópicos puntilleo, mosaico y epitelio aceto-blanco resulta un grupo de cambios epiteliales de n= 97. (Gráfica 2). Aspecto del Cérvix a la Exploración Cambios Epitelio 37% Sano 19% Ectropión 11% Pseudo erosión 16% Congest Inflamat 17% Gráfica 2. Aspecto clínico del cérvix al realizar la toma de la muestra con el citocepillo 8.4.4. Tratamientos anteriores: ninguno 34.1% (n= 90), biopsia 25.4% (n= 67), local (óvulos vaginales) 22.0% (n= 58), crioterapia 11.0% (n= 29), y cono 7,6% (n= 20). (Gráfica 3). 54 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Tratamientos anteriores 100 90 80 70 60 n 50 40 30 20 10 0 90 67 58 29 20 Ninguno Biopsia Local Crioterapia Cono Gráfica 3. Tratamientos recibidos por la paciente al momento de la muestra. 8.5. Diagnóstico de la citología vaginal de envío: NIC I: 73.5% (n= 194); NIC II: 9.1% (n= 24); Negativo 8.3% (n= 22); VPH 4.9% (n= 13); NIC III-InSitu: 4.2% (n= 11). 8.5.1. Sistema Bethesda de los resultados citológicos descritos arriba: LIEB 78,4% (n= 207); LIEA 13.3% (n= 35) y Negativo 8.3% (n= 22). (Gráfica 4) 55 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Citología en Sistema Bethesda 207 250 200 150 100 35 22 50 0 Negativo LIE A LIE B Gráfica 4. Sistema Bethesda como diagnóstico de citología vaginal de envío. 8.6. Resultado de la revisión colposcópica: NIC I + VPH 34.1% (n= 90); NIC I 30.7% (n= 81); VPH 10.2% (n= 27); NIC II 3.8% (n= 10); NIC II + VPH 3.4% (n= 9); NIC IIIInSitu 2.3% (n= 6); NIC III + VPH 0.4% (n= 1); Cáncer invasor 0.4% (n=1). Negativas 14.9% (n= 39). 8.7. Resultado histopatológico de biopsia y/o conización: No se le practicó biopsia al 13.3% (n= 35). NIC I + VPH 50.4% (n= 133); NIC I 13.3% (n= 35) en total NIC I 63.7% (n= 168). NIC II + VPH 3.8% (n= 10); NIC II 3.8% (n= 10) en total NIC II 7.6% (n= 20). NIC III + VPH atípico 0.8% (n= 2); NIC III-InSitu 4.6% (n= 12) en total NIC III-InSitu 5.0% (n= 14). VPH 4.6% (n= 12). Adenocarcinoma 0.5% (n=1). Negativa 5.3% (n=14). 56 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 8.8. Resultado histopatológico clasificado en Sistema Bethesda: LIEB: 68.2% (n= 180); LIEA: 13.3% (n= 35); Negativo 5.3% (n= 14) (Gráfica 5). Resultado biopsia en Sistema Bethesda 14 Negativo 35 LIE A LIE B 180 0 50 100 150 200 n Gráfica 5. Resultado histopatológico de biopsia o cono en Sistema Bethesda. 8.9. Resultado de Tipificación del VPH-18 positiva (n= 67) en biopsias o cono: NIC I (n= 42) 62.7%; NIC II (n= 3) 4.0%; NIC III-InSitu (n= 4) 6%; VPH (n= 1) 1.5%; Negativa (n= 3) 4.0%. No se les practicó biopsia a 14 pacientes VPH-18 positivas. Trasladando el resultado de tipificación del VPH-18 en resultados de biopsias al Sistema Bethesda quedaría según se muestra en la siguiente gráfica (Gráfica 6): 57 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Resultado tipificación VPH-18 positiva en Biopsia Sistema Bethesda No Biopsia 14 Negativa 3 LIE A 7 LIE B 43 0 10 20 30 40 50 n = 67 Gráfica 6. Resultado de tipificación VPH-18 en biopsia o cono. Sistema Bethesda 8.10. Tipificación de VPH-16. Paralelamente a la tipificación de VPH-18 hicimos tipificación de VPH-16, como un adicional a favor del control clínico de las pacientes a las cuales se tomó muestra y como apoyo a los médicos especialistas que colaboraron en este trabajo, clasificando en consecuencia una variable denominada VPH-AR y se encontró la siguiente información: VPH-AR Negativo: 57.2% (n= 151) y Positivo 42.8% (n= 113) (Gráfica 7). 58 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Muestras Positivas a Virus Papiloma Humano Alto Riesgo (VPH-AR) 43% 57% VPH-AR (+) VPH-AR (-) Gráfica 7. Resultado de tipificación VPH-AR POSITIVO (n = 113). 8.10.1. Diferenciando el VPH-AR positivo entre tipos: VPH-18 en 51 (19.3%), VPH16 en 45 (17.0%) y 18-16 (co-infección) en 17 (6.5%). Resultando así la siguiente tabla (1): 59 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 VPH AR TIPO Virus Papiloma Humano Alto Riesgo NO TOTAL SI NINGUNO 151 0 151 18 0 51 51 18-16 0 17 17 16 0 45 45 TOTAL 151 113 264 Tabla 1. Distribución de VPH-AR 8.10.2. Eliminando la co-infección de VPH-18/16 se determina la siguiente tabla: VPH 18 16 Negativos Total TOTAL 51 45 151 247 Tabla 2. Distribución de VPH-AR eliminando co-infección 18/16 8.10.3. Agregando la co-infección de VPH-18/16 se determina la siguiente tabla: 60 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 VPH 18 16 Negativos Total TOTAL 67 46 151 264 Tabla 3. Distribución de VPH-AR agregando co-infección 18/16 8.10.4. Reclasificando la infección con VPH-AR mediante Sistema Bethesda se obtiene la siguiente distribución (Tabla 4): LIEB LIEA Normales Negativos Total 89 13 11 151 264 Tabla 4. Distribución de VPH-AR mediante Sistema Bethesda 8.11. Resultado general de tipificación del VPH-18 en la muestra (n= 264). Positivo: 25% (n= 67); Negativo: 75% (n= 197). 61 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Tipificación del VPH-18 en la muestra (n= 264) VPH-18 positivo 25% VPH-18 negativo 75% Gráfica 8. Resultado de tipificación del VPH-18 en la muestra: VPH-18 positivo n = 67. 8.12 Correlación VPH-18 con Sistema Bethesda del resultado de biopsia, se describen a continuación en la gráfica 9. De las pacientes a las que NO se les practicó biopsia (n= 35) resultaron VPH-18 positivas 14 (40%) y 21 VPH-18 negativas (60%). Distribución de VPH-18 en Biopsias Sistema Bethesda 3 VPH-18 Pos Biop Neg 11 VPH-18 Neg Biop Neg 7 VPH-18 Pos LIE A 28 VPH-18 Neg LIE A 43 VPH-18 Pos LIE B 137 VPH-18 Neg LIE B 0 20 40 60 80 100 120 140 Gráfica 9. Distribución de VPH-18 en resultados de Biopsias en Sistema Bethesda. 14 muestras VPH-18 positivas NO se les practicó biopsia. 62 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 8.13. Reclasificación de pacientes por rango de edad en base a la edad reproductiva: 1.0 Jóvenes (≤ 24 años): n= 31 (11.7%); 2.0 Edad reproductiva normal (25-55 años): n= 219 (83%); 3.0 Postmenopáusicas (≥56 años): n= 14 (5.3%). 8.13.1. Distribución de lesiones citológicas clasificadas en Sistema Bethesda: (Cuadro 6). Negativo LIEB LIEA TOTAL ≤ 24 años (1) 3 26 2 31 25-55 años (2) 19 174 26 219 ≥56 años (3) 0 7 7 14 TOTAL 22 207 35 264 Cuadro 6. Distribución de lesiones citológicas clasificadas en Sistema Bethesda. 8.13.2. Distribución de resultados de Biopsias en el Sistema Bethesda: (Cuadro 7). 63 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 NO Negativo LIEB LIEA TOTAL ≤ 24 años (1) 2 1 24 4 31 25-55 años (2) 33 13 147 26 219 ≥56 años (3) 0 0 9 5 14 TOTAL 35 14 180 35 264 Cuadro 7. Distribución de resultados de Biopsias por rango de edad en Sistema Bethesda. 8.13.3. Resultado de tipificación de VPH-AR (18-16) por rango de edad (Cuadro 8): No 18 16 16-18 TOTAL ≤ 24 años (1) 17 3 7 4 31 25-55 años (2) 125 45 36 13 219 9 3 2 0 14 151 51 45 17 264 ≥56 años (3) TOTAL Cuadro 8. Distribución de resultados de tipificación de VPH-AR por rango de edad . 64 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 CAPÍTULO IV. DISCUSIÓN Este proyecto contempló la inclusión 245 muestras como mínimo, obteniendo 264 muestras de pacientes en todos los estadios de evolución desde la normalidad o ausencia de cambios clínicos e histopatológicos, hasta pacientes con desarrollo de lesiones precursoras y Cáncer Cérvico-Uterino In Situ; y a la distribución de la frecuencia de positividad a los VPH-AR, específicamente al VPH-18, considerando la nomenclatura que actualmente se reconoce a nivel internacional que es el Sistema Bethesda. Recordemos que en México la NOM utiliza el sistema NIC para reportar todos los resultados, por lo que mencionaremos (cuando sea pertinente) ésta clasificación y el Sistema Bethesda (LIEB ó LIE A) entre paréntesis. No se contempló la inclusión de pacientes con CaCU Invasor considerando que actualmente su frecuencia va disminuyendo y que, operacionalmente hablando, es diferente del sistema de manejo dentro de las instituciones de salud a las que acudimos a recolectar muestras y datos, ya que estas pacientes son referidas al Oncólogo de la unidad. En este estudio la edad media de las participantes fue de 37,6 años sin haber diferencia significativa entre otros estudios publicados, para el desarrollo de lesiones precursoras ya que el principal diagnóstico citológico, colposcópico e histopatológico fue NIC I (LIEB), sin dejar de mencionar que hubo 2 pacientes de 24 años o menos con LIEA por citológico y 4 por diagnóstico histológico. El número de parejas sexuales en rangos A (1-3), B (4-9) y C (>10) muestra que la minoría (6.5 %) tienen 4 parejas o más, no habiendo diferencia significativa con la presencia de VPH-18; el número de gestaciones promedio fue 4, que es diferente de la media de gestaciones referida a población general nacional y estatal de 2 (Fuente: Consejo Nacional de Población, CONAPO. 2006) confirmando la multiparidad como factor de riesgo. 65 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 En este trabajo se reporta 10.2% (n= 27) de pacientes que al efectuarse su primera citología vaginal es detectada con LIE-CaCU y se refiere a Clínica de Displasia (ClD) para su revisión. Este dato debe ser confiable ya que las pacientes no saben con exactitud cuántas citologías se han efectuado anteriormente, pero sí saben exactamente las que se efectuaron su primera citología y las derivan a revisión especializada. El VPH-18 aumenta su prevalencia (21.4%) en mujeres mayores de 56 años análisis que se obtiene al separar a las pacientes postmenopáusicas de las pacientes de edad reproductiva y las jóvenes lo que podría explicarse por la ausencia crónica de estrógenos y progestágenos que induce a cambios epiteliales de atrofia y por lo tanto de susceptibilidad a la infección por el VPH-18 en comparación con las mujeres de menor edad. En el Cuadro 7 podemos observar que a pesar de ser de pacientes jóvenes, 4 muestras presentaron LIE A, necesitando análisis estadísticos posteriores para determinar la relación de la edad de inicio de relaciones sexuales, número de parejas sexuales y presencia del VPH18 contra diagnóstico de LIE B ó A. Una comparación de frecuencias de VPH-18 publicadas por diferentes autores muestra que la región de Colima tiene significativamente más prevalencia de VPH-18 con un 25.4%. La tabla 5 muestra las diferentes prevalencias específicas del tipo 18 según región las cuales varían desde 1.6 a 43.4 por ciento. Todas las referencias son recientes de menos de 10 años a la fecha. De Boer MA y cols., (2005) encontraron en Asia una prevalencia de VPH-18 de 23.2% muy similar a la encontrada en este estudio, no pudiendo comparar las diferentes clasificaciones por falta de datos en la publicación. 66 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 AUTOR AÑO PAÍS REGIÓN *PREV DISEÑO CONTROLES (%) (%) Lizano, M 2005 Méx De Boer, MA Centro 15.5 C/C 4.33 Indonesia 2005 Asia Surinam 23.2 Descript ND 2005 Holanda Centro 13.3 Descript ND 2005 Suecia Estocolmo 5.6 Descript ND 2004 Méx Noreste 1.7 Descript ND 2003 USA Noreste 6.2 C/C ND 2003 Chile 2.7 Descript ND 2003 Multi Multi 14.3 Meta-an 9.7 2000 Arg Central 43.4 Descript ND 6.6 C/C 6.4 De Boer, MA Andersson, S Calleja, I Burk, RD Melo, AA IX Muñoz, N Picconi, MA Liaw, KL Portland, 1999 USA OR Tabla 5. Prevalencia (*PREV) del VPH-18 en diferentes publicaciones. 67 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 Esto puede estar relacionado con el hecho de que la región de Colima está ubicada cercana a un puerto marítimo que recibe navíos de la Cuenca del Pacífico, que es Asia y Lejano Oriente, junto con Indonesia y Australia, pudiendo ser una puerta de entrada directa para el VPH-18, lo que sería una causa directa asociado a la alta incidencia del cáncer Cérvico-Uterino que tenemos en Colima en relación a la media nacional, y también el VPH-18 está relacionado con mayor agresividad en su comportamiento clínico y biológico como hemos señalado en el capítulo 1.6 que dice que el ADN del VPH-18 es más eficiente que el VPH-16 en la inmortalización de células epiteliales, suministrando así apoyo experimental a la sugerencia de que el VPH-18 se comporta más agresivamente in vivo y que el VPH-18 es aproximadamente 10 a 50 veces más eficiente que el VPH-16 en su potencial inmortalizador (Barbosa M y Schlegel R. 1989. Schlegel R y cols. 1988. Villa LL y Schlegel R. 1991) y así ser la causa de morbilidad aumentada en base a baja respuesta a tratamientos lo que se traduciría en mayor índice de mortalidad, en la que Colima ocupa los primeros lugares nacionales desde hace años, muy por encima de la media nacional también. Para finalizar, en la comparación de las frecuencias de este trabajo con el reportado por Marcela Lizano y cols. (México, 2005) que fue el estudio mexicano que describe en su metodología datos comparables con el presente estudio, tenemos que decir que ellos encontraron una relación directamente proporcional del porcentaje de positividad del VPH-AR con el grado de lesión intraepitelial y cáncer invasor, es decir, a mayor grado de lesión mayor frecuencia de muestras positivas al ADN del VPH-AR (ver Tabla 6). En nuestra muestra de pacientes, la LIEB tuvo una frecuencia mayor que se asoció con la mayor positividad del VPH-18, con alta significancia estadística (p= 0.00001), y una RM de 5.414 (IC 95% 1.619-18.103) contra LIEA con una p = 0.131 y RM 2.687 (IC 95% 0.719-10.034). 68 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 LIEB LIEA Normales Negativos Total Reporte actual 89 13 11 151 264 M. Lizano 16 27 21 213 277 Χ2 = 69.07 p = 0.0000001 (3 g.l.) [IC 95% 5.414 (1.619-18.103)] Tabla 6. Distribución de frecuencias de Lesión Intra Epitelial de Bajo y Alto grado, normales y negativos en éste reporte y el de la Dra. Lizano (México 2005). Además esta diferencia está asociada a la alta positividad del VPH-18, aún eliminando las muestras con co-infección: n= 17), con una significancia estadística de p = 0.00000005 (ver Tabla 7): 18 16 Negativos Total Reporte actual 51 45 151 247 M. Lizano 12 52 213 277 Χ2 = 33.60 p = 0.00000005 (2 g.l.) Tabla 7. Comparación de proporciones de muestras positivas a VPH-18 Y VPH-16 a las cuales se les eliminó las co-infecciones. La combinación de reportes clínico-epidemiológicos y la comparación de prevalencias del VPH-18 entre la región central y de nuestro estado de Colima, 69 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 soportan los hallazgos de éste estudio dejando abierta la necesidad de seguir investigando al VPH-18 en nuestra región, para buscar otras posibles causalidades, (por ejemplo: la determinación de variantes del VPH-18 y VPH-16) en el hecho de tener en Colima una alta incidencia y prevalencia de Lesiones Precursoras y Cáncer Cérvico-Uterino y una alta mortalidad de pacientes, sobre todo en edad reproductiva, lo que se confirma en nuestro estudio, en el cual 4 pacientes de 24 años o menos, ya presentaron el diagnóstico de Lesión Intra Epitelial de Alto Grado confirmada histopatológicamente, lo que no deja lugar a dudas de la alta prioridad que el VPH-AR tiene en nuestra comunidad. 70 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 CAPÍTULO V. CONCLUSIONES 1.- El VPH-18 es más frecuente en la región de Colima que en otras regiones de México. 2.- La LIEA es más frecuente en mujeres menores de 24 años (4/31 = 13%), aunque la positividad del VPH-18 es de 10.4% lo que no ha sido reportado por otros estudios. 3.- El VPH-18 aumenta su prevalencia (21.4%) en mujeres mayores de 56 años. 4.- Es necesario continuar investigando otros factores asociados a la persistencia del VPH-AR como carga viral y variantes intratípicas. 5.- Las diferencias regionales en el tipo de prevalencia del VPH-AR tiene implicaciones epidemiológicas, ya que está próxima a usarse una vacuna preventiva de parte del Sistema de Salud, aunque estas vacunas tienen cobertura para el VPH-18 lo que protegería a las pacientes usuarias de ésta herramienta preventiva en nuestro estado. 71 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 CAPÍTULO VI. PERSPECTIVAS Los virus han existido desde antes que apareciera la especie humana en el contexto universal y hay datos de que han coexistido con el hombre durante milenios (Gross L, 1997). Existen también algunas evidencias de factores genéticos asociados al desarrollo del CaCu, ya que el riesgo de una mujer de padecer cáncer es mayor cuando alguna hermana o la madre lo padecieron previamente. Por medio de la medicina genómica se podrá identificar pequeñas regiones en el ADN que faciliten el determinar si una mujer tiene un riesgo muy alto o es resistente a desarrollar la enfermedad o cáncer. Esta información podrá ser importante para el diseño más eficiente de las campañas de Detección Oportuna de Cáncer (DOC) de cérvix. Además, la información genómica será útil para predecir el pronóstico de la enfermedad. También con la farmacogenómica, (que es la generación de medicamentos más efectivos y menos tóxicos con base en la estructura genómica de cada población), se identificará cuales tumores cancerosos son sensibles y cuáles resistentes a la quimioterapia y radioterapia, y predecir el grado de toxicidad de éstos tratamientos en cada paciente. Por otra parte, es probable que se podría identificar blancos terapéuticos dentro del tumor, que permita el diseño de drogas anticancerosas específicas que contribuyan a los recursos terapéuticos que actualmente existen (Berumen-Campos J, 2005). 72 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 En el contexto nacional, la gran mortalidad por cáncer cervicouterino ha sido desplazada por el emergente cáncer de mama y la perspectiva siempre ha sido el control preventivo de la enfermedad por medio de la DOC y la posible desaparición del CaCU como problema de salud pública (Crum CP, 2002. Shiffman M y Castlle PE, 2005. ). La forma de controlar a las enfermedades causadas por virus son las vacunas que previenen contra la persistencia de la enfermedad, atacando y controlando la infección. Con la reciente disponibilidad de vacunas polivalentes contra las infecciones más frecuentes con virus de bajo y alto riesgo, se vislumbra el control de la incidencia de verrugas genitales e infección asintomática persistente por VPH’s entre la población que inicia su actividad sexual y combinado con la DOC se podría terminar con el problema de la mortalidad del CaCU invasor. Lo que queda por hacer es: • Nunca detener y, por el contrario, fortalecer el programa de DOC con recursos suficientes y personal capacitado, para detectar alteraciones citológicas tempranas (Hidalgo-Martínez AC, 2006). • Una vez detectada la alteración celular, tamizar a la paciente para VPH’s con iniciadores generales y si es positiva identificar por iniciadores específicos que tipo de VPH porta y además, referir a clínicas de Displasia a control estricto de la evolución clínica. 73 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 • Vacunar a los niños y adolescentes contra los VPH’s más frecuentes (Steinbrook R, 2006); • Informar a la población sexualmente activa del riesgo de contraer otros tipos virales no cubiertos por la vacuna polivalente, que también pueden provocar lesiones intraepiteliales a largo plazo (Katz IT y Wright AA, 2006). 74 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ANEXOS ANEXO 1 CARTA DE CONSENTIMIENTO INFORMADO. Por medio de la presente hago constar que estoy informada de la realización del proyecto: “IDENTIFICACIÓN DE VARIANTES DE VPH 18 Y CANCER CERVICO UTERINO O LESION INTRAEPITELIAL CERVICAL” y se me explicó que con datos y la obtención de células del cuello de la matriz tomadas con el citocepillo para la obtención de mi muestra de papanicolou o en la revisión de control en mi clínica de displasias, se realizarán estudios especiales de biología molecular que ayudarán a entender las posibles causas del desarrollo del cáncer de cuello de la matriz y sus lesiones previas. Se me informó que los resultados de la muestra que proporciono le dará información a mi médico tratante en la clínica de displasias, que servirá para apoyar mi control del problema que presento. También se me dijo que mi participación es importante, pues los resultados de este estudio podrían ayudar en un futuro a que se realicen medidas preventivas o de diagnóstico temprano en las generaciones venideras. Las pruebas que se realizarán no tendrán ningún costo para mí y la finalidad del proyecto es exclusivamente de investigación. También quedó claro que mi participación es voluntaria y que la aceptación o negación a participar en este estudio no representará ningún cambio en la atención médica que estoy recibiendo. Entendido lo anterior, accedo de manera voluntaria a contestar el cuestionario que me será hecho, a que se recaben datos de mi expediente clínico y a donar las células remanentes de mi muestra de citología cervical o del bloque de parafina en caso de que me hayan tomado biopsia previamente como parte de mi tratamiento. Así mismo autorizo a las personas que realizan esta investigación a que utilicen los datos y las muestras biológicas para realizar las investigaciones que consideren necesarias en el entendido de que mi persona será mantenida en absoluta confidencialidad. Si tengo dudas puedo comunicarme con la Dra. Alma Rosa Guadalupe Fernández Salinas al laboratorio de biología molecular al teléfono (312) 316 11 29 o en horarios fuera de oficina: 044 312 311 96 38. También con el Dr. _________________________________ de la clínica de displasias a la que acudo. Colima, Col., a ____ de _______________________ de 2006 Nombre y firma de la paciente Nombre de quien toma la muestra _______________________________ ________________________________ Testigo (1) Testigo (2) _______________________________ _______________________________ 75 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 UNIVERSIDAD DE COLIMA FACULTAD DE MEDICINA. CENTRO UNIVERSITARIO DE INVESTIGACIÓN BIOMÉDICA DEPARTAMENTO DE GENÉTICA Y BIOLOGÍA MOLECULAR. “IDENTIFICACIÓN DE VARIANTES DE VPH-18 Y CANCER CERVICO UTERINO O LESION INTRAEPITELIAL CERVICAL” IDENTIFICACIÓN-ENCUESTA. Nombre del encuestador: __________________________________________ Fecha: __________ I. Nombre de la paciente: ____________________________________________ Edad: _________ Afiliación: __________________________________ No. Consultorio _______ Turno M ( ) V ( ) Domicilio: ________________________________ Colonia: _______________________________ C.P. ________________ Municipio: __________________________ Estado: __________________ Ocupación: ___________________________________ Estado Civil: S ( ) C ( ) UL ( ) D ( ) V ( ) TEL. 01 ( ) ____________________________________________________________________ II. SINTOMATOLOGÍA: marque con una X (1) ASINTOMÁTICA (2) DOLOR PÉLVICO (3) SANGRADO GENITAL ANORMAL (4) SANGRADO POSTCOITO (5) FLUJO (6) DISPAREUNIA (7) CITOLOGÍA ANORMAL (8) OTRO: __________ III. CÉRVIX (al momento de la toma de la muestra con citocepillo y/o biopsia): 9. LEUCORREA SI ( ) NO ( ) 10. ASPECTO: (a) sano (b) congestivo/inflamatorio (c) ectoprión (d) pseudoerosión (e) leucoplaquia (f) mosaico (g) puntilleo (h) otro: __________________ 11.- SANGRA a la toma con citocepillo: SI ( ) NO ( ) IV. FACTORES DE RIESGO: 12.- ESCOLARIDAD: (1) analfabeta (2) primaria (3) secundaria (4) técnica (5) universitario (6) otro: 13.- A que edad inició relaciones sexuales? ________ 14.- Cuántas parejas sexuales ha tenido durante toda su vida: ______ 15.- Cuántas parejas sexuales ha tenido el último año: _______ 16.- Con que frecuencia ha tenido relaciones sexuales el último año? 1) diario 2) cada tercer día 3) 2 o 3 veces por semana 4) cada semana 5) cada 15 días 6) cada mes 7) ocasional 8) sin relaciones 17.- ANTECEDENTES OBSTÉTRICOS: G __ P ___A __C __EDAD 1er PARTO: _____ FUP ______ FUA _____ FUC ______ EDAD MENARCA: ______ EDAD MENOPAUSIA: _____ FUM _____ 18.- Antecedentes familiares CaCU: 1) Madre 2) Abuela materna 3) Hermana 4) Tía materna 5) Otra: _____ 6) Otro tipo de cáncer: 7) NO CÁNCER__________ 19.- Que métodos ANTICONCEPTIVOS ha usado en toda su vida? 1) Hormonales tiempo: _______ 2) DIU cuánto tiempo _________ 3) Barrera 4) OTB/Vasectomía 5) Otros _______________ 20.- Enfermedades de transmisión sexual (ETS): SI ( ) cuál: _________________________ NO ( ) 21.- Fuma o fumó: NO ( ) SI ( ) Cuántos cigarrillos fuma al día? _____ A que edad comenzó a fumar? ___ a que edad dejó de fumar? ___FUMADORA PASIVA: NO ( ) SI ( ) cuánto tiempo? __ V. EXÁMENES, DIAGNÓSTICOS Y RESULTADOS: 22.- Se ha realizado citologías anteriores a esta? NO ( ) SI ( ) Cuántas? ______ FUDOC _______ 23.- Ha tenido tratamientos vaginales anteriores? NO ( ) SI ( ) hace cuanto? FUTto. ____________ Óvulos/cremas vaginales ____ Conización ____ Electrocauterización ____ Congelación ______ Biopsia _________ Otro: _________________________________________________________ 24.- REPORTE POR CITOLOGÍA: ____________REPORTE POR COLPOSCOPÍA: _____________ 25.- REPORTE POR BIOPSIA: _______________________________________________________ 26.- ADN VPH NO ( ) SI ( ) TIPO (S) ______________________________________ 76 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ANEXO 2 EXTRACCIÓN DEL ADN A PARTIR DE CITOCEPILLO: 1. Centrifugar las muestras con el citocepillo, por 20 seg. a 10 000 rpm. 2. Con movimientos circulares sacar el citocepillo. 3. Centrifugar de nuevo a 10 000 por 25 min. y quitar el sobrenadante con el cuidado de no tirar el botón. 4. Agregar a las muestras 100 ul de buffer de digestión que contiene 200 ug/ml de Proteinasa K. Si la cantidad de muestra es mucha agregar 200 ul. 5. Dejar en baño maría a 37º C de 48 hr. hasta 1semana. 6. Inactivar la Proteinasa K a 98º C por 8 min. 7. Agregar volumen igual (300 a 500 ul) de fenol-cloroformo-alcohol isoamílico (25:24:1). Mezclar bien, separar las dos fases por centrifugación a 10 000 rpm por 10 min. a 4º C. Tomar la fase acuosa superior y pasarla a otro tubo, cuidando de no tomar la interfase. 8. Agregar volumen igual (200 a 300 ul) de cloroformo-alcohol isoamílico (24:1). Mezclar bien. Centrifugar a 10 000 rpm por 10 min. a 4º C. Tomar la fase acuosa cuidando no tomar la interfase, transfiriendo a otro tubo. 9. Agregar dos volúmenes de alcohol absoluto frío y una décima de volumen de acetato de sodio 3 M a un pH 5.2. Permitir que el ADN precipite a 20º C al menos por una hora. 10. Centrifugar a 7 000 rpm por 10 minutos. Eliminar el exceso de alcohol, cuidando de no tirar el botón. 11. Agregar 50 ul de Alcohol al 70 %, centrifugar a 7 000 rpm por 10 min. y decantar con el cuidado de no tira el botón. 12. Secar el botón con el tubo destapado por lo menos 2 horas. 13. Posteriormente disolver con 100 ul de Buffer TE 1X estéril pH 7.5 el botón y dejar en baño maría a 37º C por 24 horas. 77 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ANEXO 3 CUANTIFICACIÓN DE ADN: Para cuantificar la cantidad de ADN o ARN, deben tomarse las lecturas de la densidad óptica a 260 nm y 280 nm. La lectura a 260 nm permite calcular la concentración de ácido nucleico en la muestra. Una D.O. de 1 corresponde a aproximadamente 50 μg/ml de ADN de doble cadena, 40 μg/ml de ADN de cadena sencilla y ARN, Y alrededor de 20 μg/ml de ADN de cadena sencilla y ARN, Y alrededor de 20 μg/rnl de oligonucleótidos de cadena sencilla. La tasa entre las lecturas a 260 nm y 280 nm (D.O.26O/D.O.280) proporciona un estimado de la pureza del ácido nucleico. Las preparaciones puras de ADN o ARN tienen valores de D.O 260/D.O.280 de 1.8 y 2, respectivamente. Si hay una contaminación con proteínas o fenol, este valor será significativamente menor y no será posible la cuantificación exacta del ácido nucleico. CUANTIFICACIÓN DE DNA POR ESPECTROFOTOMETRIA 1) Las muestras perfectamente homogéneas se bajan en la microcentrífuga. 2) Encender en el espectro la lámpara de luz UV, si es computarizada, utilizar programa para ácidos nucleicos. 3) Ajustar a blanco el espectro, midiendo 1 ml de agua bidestilada en la celdilla de cuarzo para el espectrofotómetro. 4) Colocar 5 μl del DNA a medir en la celdilla anterior, agitar perfectamente la solución y leer la muestra. 5) Se repiten los pasos 3-5 para cada muestra. 6) Se utilizan las lecturas de densidad óptica (D.O.) a 260nm y 280nm, para calcular la cantidad y pureza del ADN. 78 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 PARA CALCULAR LA CONCENTRACIÓN Y PUREZA, SE DEBEN TOMAR EN CUENTA VARIOS ASPECTOS: • 1ng/µl de DNA de doble hebra absorben 1 D.0. (260nm) • La relación de lecturas de D.0. 260nm/280nm nos proporciona una estimación de la pureza de los ácidos nucleicos. Preparaciones puras de ADN tiene valores de 1.7 a 2.0. . FORMULA PARA CALCULAR LA CONCENTRACIÓN DEL ADN CONCENTRACIÓN DE ADN = (D.O. 260nm) (Factor de dilución) (50) • El Factor de dilución en este caso es: 500/5 = 100 • 495 μl Agua + 5 μl muestra / 5 μl muestra 79 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ANEXO 4 EQUIPO Y MATERIAL NECESARIO PARA LA PCR Y ANALISIS DE PRODUCTO AMPLIFICADO * Microcentrífuga * Micropipetas * Balanza analítica * Termociclador * Espectrofotómetro * Tubos para microcentrífuga * Puntillas * Guantes y tapabocas estériles * Fuente de poder * Transiluminador de luz UV * Congelador de -20ºC * Cámaras de electroforesis *Campana de flujo laminar PROCEDIMIENTO 1.- En un tubo Eppendorf colocar la siguiente mezcla de reacción: REACTIVOS CONCENTRACION VOLUMEN TOMADO DE FINAL LAS DILUCIONES Buffer PCR 1X 1 μl MgCl2 1.5mM 0.5 μl dNTP’s 200 μM 0.2 μ l iniciador 5´ 15 pmol 1 μl iniciador 3´ 15 pmol 1 μl control C3 3.75 pmol 1 μl control C5 3.75 pmol 1 μl Taq polimerasa 0.25 U 1 μl ADN genómico 100 ng/μl 1 μl Agua c.b.p 10 μ l Aceite mineral 1 gota Tabla 8. Concentraciones adecuadas de los reactivos en la RCP 80 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 2.- Al agregar cada reactivo se debe microcentrifugar 10 segundos para asegurar que todos los reactivos se depositen en el fondo del tubo. 3.- Colocar la mezcla de reacción en el termociclador y someterlo a condiciones de amplificación previamente programadas para cada ADN en especial. ETAPAS DE LA RCP Etapa Temp Tiempo Inicial Desnaturalización 94°C 20 seg. Alineación 65°C 50 seg. Extensión 72°C 20 seg. Enfriamiento 4°C 5 min Ciclos 30 81 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ANEXO 5 GEL DE POLIACRILAMIDA AL 6% SOL. STOCK DE POLIACRILAMlDA 20% (19:1) - 19 gr Acrilamida - 1 gr Bis-acrilamida - Aforado en 100 ml MATERIALES y EQUIPO: - Cámara de electroforesis - pinzas - par de vidrios para gel - pipetas - par de separadores de los vidrios - puntas para pipetas - peine para pozos del gel - guantes y bata - empaque PREPARACIÓN DE 50 ml POLlACRILAMIDA al 9% REACTIVOS Sol Acrilamida-Bis 20% (19:1) μl CONC. FINAL 225 9% 5 0.1 % 500 0.1% Temed 100% 50 0.1% Agua Destilada Aforar a 50 ml - - TBE 10X Persulfato de Amonio 10% Tabla 9. Lista de Reactivos y cantidades necesarias para preparar solución de Poliacrilamida al 9%. 82 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 PREPARACION DEL GEL El primer paso es montar el molde para el gel, se limpian previamente los vidrios cuidando que no queden restos de poliacrilamida del gel anterior, se pone el empaque a uno de los vidrios y los separadores, se pone el segundo vidrio cuidando la posición de los separadores en los extremos, cuando estén bien se ponen las pinzas que unen los vidrios, una vez puestas todas, se aplica la preparación de 50 ml de poliacrilamida al 9%, cuidando que no queden burbujas, una vez hecho esto se pone el peine. Se deja polimerizar aproximadamente 152Omin y se acomoda en la cámara de electroforesis. ELECTROFORESIS DE LAS MUESTRAS Antes del corrimiento electroforético de las muestras, se precorre el gel por 15 min. que ayuda a eliminar fracción de monómeros de acrilamida no polimerizada así como todos los iones. A las muestras a ser aplicadas en el gel, se les pone jugo azul aprox. 1.5 μl por cada 10 μl; el volumen a aplicar en el pozo puede variar de 5 μl a 25 μl con una nitidez aceptable. El tiempo de corrimiento varía según el objetivo (sólo ver amplificado ó diferencias pequeñas entre bandas), la longitud de nuestro gel y la concentración de poliacrilamida del gel, mientras menos concentración corren más rápido las muestras, a mayor concentración corren más lento. Un corrimiento de 4 horas a 200V , nos proporciona buena separación en el gel que preparamos. 83 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 TINCIÓN CON NITRATO DE PLATA (AgNO3) 1. Sumergir el gel en solución fijadora durante 20 min. Manteniendo en agitación y eliminar. 2. Agregar solución de AgNO3 (recién preparada) al gel durante 7 min. manteniendo en agitación. Eliminar. 3. Realizar 2 lavados con solución reveladora usada. 4. Realizar un lavado con agua desionizada. 5. Agregar solución reveladora hasta aparición de bandas. Eliminar. 6. Agregar solución fijadora durante 10 min. Y eliminar. 7. Adicionar agua desionizada para facilitar la recolección del gel. Ponerlo en una bolsa de plástico para su interpretación. SOLUCION FIJADORA • Etanol 10% • Acido acético Glacial 0.5% • Aforar a 1000 ml con H2O desionizada. SOLUCION AgNO3 • AgNO3 al 0.1% • Aforar a 250 ml con solución fijadora SOLUCION REVELADORA • NaOH al 3% • Formaldehído al 0.5 % • Afora a 1000 ml. con H2O desionizada. 84 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 ANEXO 6. SECUENCIA NUCLEOTÍDICA DEL VPH-18 BASE COUNT 2365 a 1497 c 1680 g 2315 t ORIGIN 1 attaatactt ttaacaattg tagtatataa aaaagggagt aACCGAAAAC GGTcgggACC E2 bind -> E2 bind -> 61 GAAAACGGTg tatataaaag atgTGAgaaa cacaccacaa tactATGgcg cgctttgagg E6 orf start -> E6 cds -> |-> mRNA start site from P(105) promoter HPV18 I-C-5 SEP 94 121 atccaacacg gcgaccctac aagctacctg atctgtgcac ggaactgaac acttcactgc 181 aagacataga aataacctgt gtatattgca agacagtatt ggaacttaca gaggtatttg 241 aatttgcatt taaagattta tttgtggtgt atagagacag tataccccat gctgcatgcc 301 ataaatgtat agatttttat tctagaatta gagaattaag acattattca gactctgtgt 361 atggagacac attggaaaaa ctaactaaca ctgggttata caatttatta ataaggtgcc 421 tgcggtgcca gaaaccgttg aatccagcag aaaaacttag acaccttaat gaaaaacgac 481 gatttcacaa catagctggg cactaTAGag gccagtgcca ttcgtgctgc aaccgagcac E7 orf start -> 541 gacaggaacg actccaacga cgcagagaaa cacaagtaTA AtattaagtA TGcatggacc <- E6 end -> E7 cds 601 taaggcaaca ttgcaagaca ttgtattgca tttagagccc caaaatgaaa ttccggttga 661 ccttctatgt cacgagcaat taagcgactc agaggaagaa aacgatgaaa tagatggagt 721 taatcatcaa catttaccag cccgacgagc cgaaccacaa cgtcacacaa tgttgtgtat 781 gtgttgtaag tgtgaagcca gaattgagct agtagtagaa agctcagcag acgaccttcg 841 agcattccag cagctgtttc tgaacaccct gtcctttgtg tgtccgtggt gtgcatccca 901 gcagTAAgca acaATGgctg atccagaagg tacagacggg gagggcacgg gttgtaacgg <- E7 end E1 orf start -> -> E1 cds 961 ctggttttat gtacaagcta ttgtagacaa aaaaacagga gatgtaatat cagatgacga 1021 ggacgaaaat gcaacagaca cagggtcgga tatggtagat tttattgata cacaaggaac 1081 attttgtgaa caggcagagc tagagacagc acaggcattg ttccatgcgc aggaggtcca 1141 caatgatgca caagtgttgc atgttttaaa acgaaagttt gcaggaggca gcacagaaaa 1201 cagtccatta ggggagcggc tggaggtgga tacagagtta agtccacggt tacaagaaat 1261 atctttaaat agtgggcaga aaaaggcaaa aaggcggctg tttacaatat cagatagtgg 1321 ctatggctgt tctgaagtgg aagcaacaca gattcaggta actacaaatg gcgaacatgg 1381 cggcaatgta tgtagtggcg gcagtacgga ggctatagac aacgggggca cagagggcaa 1441 caacagcagt gtagacggta caagtgacaa tagcaatata gaaaatgtaa atccacaatg 1501 taccatagca caattaaaag acttgttaaa agtaaacaat aaacaaggag ctatgttagc 1561 agtatttaaa gacacatatg ggctatcatt tacagattta gttagaaatt ttaaaagtga 1621 taaaaccacg tgtacagatt gggttacagc tatatttgga gtaaacccaa caatagcaga 1681 aggatttaaa acactaatac agccatttat attatatgcc catattcaat gtctagactg 1741 taaatgggga gtattaatat tagccctgtt gcgttacaaa tgtggtaaga gtagactaac 1801 agttgctaaa ggtttaagta cgttgttaca cgtacctgaa acttgtatgt taattcaacc 1861 accaaaattg cgaagtagtg ttgcagcact atattggtat agaacaggaa tatcaaatat 1921 tagtgaagta atgggagaca cacctgagtg gatacaaaga cttactatta tacaacatgg 1981 aatagatgat agcaattttg atttgtcaga aatggtacaa tgggcatttg ataatgagct 2041 gacagatgaa agcgatatgg catttgaata tgccttatta gcagacagca acagcaatgc 2101 agctgccttt ttaaaaagca attgccaagc taaatattta aaagattgtg ccacaatgtg 2161 caaacattat aggcgagccc aaaaacgaca aatgaatatg tcacagtgga tacgatttag 2221 atgttcaaaa atagatgaag ggggagattg gagaccaata gtgcaattcc tgcgatacca 2281 acaaatagag tttataacat ttttaggagc cttaaaatca tttttaaaag gaacccccaa 2341 aaaaaattgt ttagtatttt gtggaccagc aaatacagga aaatcatatt ttggaatgag 2401 ttttatacac tttatacaag gagcagtaat atcatttgtg aattccacta gtcatttttg 2461 gttggaaccg ttaacagata ctaaggtggc catgttagat gatgcaacga ccacgtgttg 2521 gacatacttt gatacctata tgagaaatgc gttagatggc aatccaataa gtattgatag 2581 aaagcacaaa ccattaatac aactaaaatg tcctccaata ctactaacca caaatataca |-> mRNA start site from P(2598) promoter 2641 tccagcaaag gataatagat ggccatattt agaaagtaga ataacagtat ttgaatttcc 2701 aaatgcattt ccatttgata aaaatggcaa tccagtatat gaaataaatg acaaaaattg 2761 gaaatgtttt tttgaaagga catggtccag atTAGatttg cacgaggaag aggaagATGc E2 orf start -> E2 cds -> 2821 agacaccgaa ggaaaccctt tcggaacgtt taagtgcgtt gcaggacaaa atcatagacc 2881 actaTGAaaa tgacagtaaa gacatagaca gccaaataca gtattggcaa ctaatacgtt <- E1 end 2941 gggaaaatgc aatattcttt gcagcaaggg aacatggcat acagacatta aaccaccagg 3001 tggtgccagc ctataacatt tcaaaaagta aagcacataa agctattgaa ctgcaaatgg |-> mRNA start site from P(3036) promoter 3061 ccctacaagg ccttgcacaa agtcgataca aaaccgagga ttggacactg caagacacat 85 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 3121 3181 3241 3301 3361 gcgaggaact aagtatattt attatatgac tgtattatgt aatatgggaa atggaataca tgatggcaac tgatgcagga aaaggaaggg cacaggtacg gaacctactc aaagacaatt acatgggaca tacaacacgt tgggaagtac actgctttaa gtatgaccta aaaccgctac tttatataga attttgggaa aaaaggtggc tgtagcatgg ctgtgtaagt atttaaaagt taatgTAAtt caaacagtac gacagtgtgt cacaggggat gaatgtgaaa gattgtaATG tcagcttgtt caccgcaaag ggagaagcag caacaaaaga cagaaacagt aaacagctac acctacggcc cattgtggac cggaaactct ttaaaatgtt tatatcatcc aacataccat tgtacaaata atcacttatt acctggcatt agtgaaacac ttggtgggat tttttatttt tttgccatct aataacgtcc actattgcat gtattgtaca gtctgtatgt cctgccacag atacatgcta ttgtatattt HPV18 I-C-6 SEP 94 E4 orf start -> E4 cds -> 3421 actctatgtg cagtaccagt gacgacacgg tatccgctac 3481 agcacacccc ctcaccgtat tccagcaccg tgtccgtggg 3541 agacgtcggc tgctacacga cctggacact gtggactcgc 3601 ctgtcaaccc acttctcggt gcagctacac ctacaggcaa 3661 gtagtggtaa cactacgcct aTAAtacatt taaaaggtga <- E4 end 3721 tacggtacag attgcgaaaa catagcgacc actatagaga 3781 ggacaggtgc aggcaatgaa aaaacaggaa tactgactgt 3841 aaagaacaaa atttttaaat actgttgcaa ttccagatag 3901 acatgacaat gTAAtacata tgctgtagta ccaatATGtt <- E2 end E5 cds -> E5 orf start -> 3961 gcttttgtgt atgcatgtat gtgtgctgcc atgtcccgct 4021 gtgcgtatgc atgggtattg gtatttgtgt atattgtggt 4081 cattcacagt atatgtattt tgttttttat tgcccatgtt 4141 tattgtcttt acagTAAttg taTAGgttgt tttatacagt <- E5 end L2 orf start -> 4201 tgttttatac cttttatgct ttttgtattt ttgtaataaa L2 cds -> 4261 cgcacgacgc aaacgggctt cggtaactga cttatataaa 4321 atgtccacct gatgttgttc ctaaggtgga gggcaccacg 4381 atggtcaagc cttggtatat ttttgggtgg acttggcata 4441 gggtcgtaca gggtacattc cattgggtgg gcgttccaat 4501 tacacgtccc ccagtggtta ttgaacctgt gggccccaca 4561 aatagaggac tccagtgtgg ttacatcagg tgcacctagg 4621 tgggtttgat ataacatctg cgggtacaac tacacctgcg 4681 gtctacctct gtgtctattt ccacaaccaa ttttaccaat 4741 cattattgaa gttccacaaa ctggggaggt ggcaggtaat 4801 atctggaaca catgggtatg aggaaatacc tttacaaaca 4861 ggaggaaccc attagtagta ccccattgcc tactgtgcgg 4921 ttacagtagg gcctaccaac aagtgtcagt ggctaaccct 4981 ctctttaatt acatatgaca acccggcctt tgagcctgtg 5041 tcctcgtagt gatgttcctg attcagattt tatggatatt 5101 tttaacatcc aggcgtggga ctgttcgctt tagtagatta 5161 tacccgcagc ggtacacaaa taggtgctag ggttcacttt 5221 tgcaccttcc ccagaatata ttgaactgca gcctttagta 5281 cttgtttgat atatatgcag atgacatgga ccctgcagtg 5341 tacctccttt gcatttttta aatattcgcc cactatatct 5401 tgtaacggtc ccttTAAcct cctcttgggA TGtgcctgta L1 orf start -> L1 cds -> 5461 attaccatct actacctctg tatggcccat tgtatcaccc 5521 gtatattggt atacatggta cacattatta tttgtggcca 5581 gaaacgtaaa cgtgttccct atttttttgc agatggcttt |-> mRNA start site from P(5600) promoter <- L2 end 5641 ccgtatatct tccacctcct tctgtggcaa gagttgtaaa 5701 ccacaagcat attttatcat gctggcagct ctagattatt 5761 ttagggttcc tgcaggtggt ggcaataagc aggatattcc 5821 atagagtatt tagggtgcag ttacctgacc caaataaatt 5881 tttataatcc tgaaacacaa cgtttagtgt gggcctgtgc 5941 gtcagccttt aggtgttggc cttagtgggc atccatttta 6001 aaagttccca tgccgccacg tctaatgttt ctgaggacgt 6061 attataagca gacacagtta tgtattttgg gctgtgcccc 6121 ctaaaggcac tgcttgtaaa tcgcgtcctt tatcacaggg 6181 ttaaaaacac agttttggaa gatggtgata tggtagatac 6241 ttagtacatt gcaagatact aaatgtgagg taccattgga 6301 aatatcctga ttatttacaa atgtctgcag atccttatgg 6361 tacggcgtga gcagcttttt gctaggcatt tttggaatag 6421 ctgtgcctca atccttatat attaaaggca caggtatgcc 6481 tgtattctcc ctctccaagt ggctctattg ttacctctga 6541 catattggtt acataaggca cagggtcata acaatggtgt 6601 ttgttactgt ggtagatacc actcccagta ccaatttaac agtATGgtat cccaccgtgc acatgtaaac ttagcagata ggtactggca acagtggtgg gacccatcta cctacgttta gttttggata cctgcatttt gtatttgttg tttgcttctt cgtgtagcag gagtttctta gacactacat atccgtctac ggtcaacggg tatcatgata tctgccacgg cctgtaccat tctgcctctt tacacgggtc aatctggtac aaatattgca gtggtacagg atgttggtcc ttgttacatt ctggcacgtc tcacaccttc ctgatccgtc gtacccctac ctggtacggg gtccccgcct cacgtccatc taacatttga ataggcctgc caactatgtt taagtcctat aggacaatga cgcgttctac cctatagtaa ctgatattac acggcccctg cctctacaca ttatattatt ttattcctaa gtggcggccT AGtgacaata taccgatgat aactgttggt taaggtttct tggtttacct tggagtggaa taataaatta tagggacaat tgctattggg cgattgcccc tggatatggt tatttgtcag ggattccatg agcaggtact tgcttcacct ctcccagttg ttgctggcat aatatgtgct tatgtgactc aatccatatt gcataccaat gatactagta attggccgtg gatgacactg gtgtctgtag gaacactggg cctttagaac gccatggact tctatttgta tttttttgct atgggtgaca ggcagctgtg tttaataaac aatcaattat tctacacagt HPV18 I-C-7 SEP 94 86 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 6661 ctcctgtacc 6721 aatatgattt 6781 cctatattca 6841 ccccaactac 6901 aaaaggatgc 6961 tggatttaaa 7021 tggttcaggc 7081 ctgccactac <- L1 end 7141 tgtgtgtgta 7201 tgtatgattg 7261 gttggtatgt 7321 ctagtgagta 7381 tgtcctgtat 7441 ctccattttg E2 bind -> 7501 caatacagta 7561 ttgaacaatt 7621 tgtccaggtg 7681 tgcttttagg 7741 caactacttt 7801 tgtgcataca E2 bind -> tgggcaatat gcagtttatt tagtatgaat tagtttggtg tgcaccggct ggaaaagttt tggattgcgt gtcttctaaa gatgctacca tttcagttgt agcagtattt gatacatatc gaaaataagg tctttagact cgcaagccca cctgccaagc aatttaagca gtactattac tagaggattg gttttgtaca atccctatga tagatcaata ccataggccc gtgtgcgtgt gtatagcaga tttaactgca gaactttggt atctgttgct taagttaaag tccccttgga tcgcaaacgt acgtgccagg catgttgagg gatgttatgt gttccccccc attacctgtc ttttggaatg cgtaaatttt tctgctccat aagTAAtatg tatatatata cattgtatgg ggcattaaat acaactgtat ttcaagttat ctgtgcaACC catctattgt tatgtatggt aaaatatgtt ttgtgtttgt aaaactgcac GATTTCGGTt tgtgtttgta tgttgttgta ttgtggttct ggtatgggtg accttacagc gcctttggct tgtcctgtgt tgttgtatgt gtgtgttatg ttgcttgttg atccatttta tatgtctgtg ttgtgtttgt tactatattt tggttgcgcc ggctatatat tcctacaatc gttttctgca cgctggcact ggcgcgcctc cgctacaaca cacatatttt catgtccaac tagtttatgc attgcaaact tttggcgcat attgcttgca agtttgtttt attctgtcta aACCGAAATA ttaatctttt ataaggcgca taactatatc tacttaagct cccttaacat GGTtgggcag gggcactgct cctggtatta cactccctaa aattgcatac gaactataat cacatactat cctacatatt gtcattttcc gtaataaaac ttggcttgta atgactaagc acttttc REFERENCIAS. 1. Alvarez-Garcia I, Miska EA. 2005. MicroRNA functions in animal development and human disease. Development; 132:4653–4662. 2. Andersson S, Safari H, Mints S, Lewensohn-Fuchs I, Gyllensten U and Johansson B. 2005. Type distribution, viral load and integration status of highrisk human papillomaviruses in pre-stages of cervical cancer (CIN). British Journal Cancer; 92: 2195-2200. 87 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 3. Arias-Pulido H, Peyton CL, Torrez-Martinez N, Anderson DN, Wheeler CM. 2005 Human papillomavirus type 18 variant lineages in United States populations characterized by sequence analysis of LCR-E6, E2, and L1 regions. Virology. Jul 20;338(1):22-34. 4. Association of Directors of Anatomic and Surgical Pathology. 1989. Standardization of the surgical report. Am J Surg Pathol, 16: 84. 5. Badal S, Badal V, Calleja-Macias IE, Kalantari M, Chuang LS, Li BF, Bernard HU. 2004 The human papillomavirus-18 genome is efficiently targeted by cellular DNA methylation. Virology. Jul 1;324(2):483-92 6. Baker CC. 1993. Genetic maps; Locus maps of Complex Genomes: 1-1 in: O’Brien SJ (Ed.) The Genomes of the Papillomaviruses. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, USA. 7. Barbosa M., and Schlegel R. 1989. The E6 and E7 genes of HPV-18 are sufficient for inducing two-stagge in vitro transformation of human keratinocytes. Oncogene 4: 1529-1532. 8. Bellanger S, Demeret C, Goyat S, Thierry F. 2001. Stability of the human papillomavirus type 18 E2 protein is regulated by a proteasome degradation pathway through its amino-terminal transactivation domain. J Virol. Aug;75(16):7244-51. 9. Berumen-Campos J. 2003. Nuevos virus del Papiloma Humano descubiertos en México: su asociación a la alta incidencia del cáncer del cérvix. Gac Med Méx 139; Supl 4: 3-10 88 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 10. Bernard HU, Chan SY, Manoz MM, Ong CK, Villa LL, Delius H, Peyton CL, Bauer HM & Wheeler CM. 1994. Identification and assessment of known and novel human papillomavirus by polymerase chain reaction amplification, restriction fragment length polymorphisms, nucleotide sequence, and phylogenetic algorithms. J Infect Dis 170: 1077-1085. 11. Bosch FX, Manos MM, Munoz N, Sherman M, Jansen AM, Peto J, Schiffman MH, Moreno V, Kurman R, Shah KV. 1995. Prevalence of human papillomavirus in cervical cancer: a worldwide perspective. International biological study on cervical cancer (IBSCC) Study Group. J Natl Cancer Inst. 87(11):796-802. 12. Burk RD, Terai M, Gravitt PE, Brinton LA, Kurman RJ, Barnes WA, Greenberg MD, Hadjimichael OC, Fu L, McGowan L, Mortel R, Schwartz PE, Hildesheim A. 2003. Distribution of Human Papillomavirus types 16 and 18 variants in squamous ell carcinomas and adenocarcinomas of the cervix. Cancer Research 63, 7215-7220 13. Calleja-Macías IE, Kalantari M, Huh J, Ortiz-López R, Rojas-Martínez A, González-Guerrero JF, Williamson AL, Hagmar B, Willey DJ, Villareal L, Bernard HU, Barrera-Saldaña HA. 2004. Genomic diversity of human papillomavirus-16, 18, 31, and 35 isolates in a Mexican population and relationship to european, African and native American variants. Virology; 319(2): 315-323. 14. Carrillo A, Mohar A, Meneses A, Frias-Mendivil M, Solorza G, Lizano M. 2004. Utilidad en la combinación de oligonucleótidos universales para la detección del virus del papiloma humano en cáncer cérvicouterino y lesiones premalignas. 89 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 [Usefulness of combining universal oligonucleotides in detecting human papillomavirus in cervical cancer and premalignant lesions] Sal Pub Mex 46; 1:7-15. 15. Chan SY, Bernard HU, Ong CK, Chan SP, Hofmann B, Delius H. 1992. Phylogenetic analysis of 48 papillomavirus types and 28 subtypes and variants: a showcase for the molecular evolution of DNA viruses. J Virol. 66; 10:5714-25 16. Chen EY, Howley PM, Levinson AD, Seeburg PH. 1982. The primary structure and genetic organization of the bovine papillomavirus type 1 genome. Narture 299:529-534. 17. Chloe J, Vaillancourt P, Stenlund A, Botchan M. 1989. Bovine papillomavirus type 1 encodes two forms of a transcriptional repressor: structural and functional analysis of new viral cDNAs. JVirol; 63:1743–1755. 18. Chow VT, Loh E, Yeo WM, Tan SY, Chan R. 2000 Identification of multiple genital HPV types and sequence variants by consensus and nested typespecific PCR coupled with cycle sequencing. Pathology. 32; 3: 204-8 19. Cole ST, and Danos O. 1987. Nucleotide sequence and comparative analysis of the human papillomavirus type 18 genome. J Mol Biol 193: 599-608. 20. Consejo Nacional de Población. CONAPO. República Mexicana: Indicadores demográficos, 1990-2050 21. Cortes Elva, Rojas Ma de los A. 1995. Algunos factores epidemiológicos en el Cáncer Cervico-Uterino. Rev Med IMSS. México, (33) 177-182. 90 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 22. Crum CP. 2002. The beginning of the end for cervical cancer? N Engl J Med 347; 21: 1703-04. 23. Danos O, Katinka M, Yaniv M. 1982. Human Papillomavirus 1 a complete DNA sequence: a novel type of genome organization among papovaviridae. EMBO J 1:231-236. 24. De Boer MA, Peters LA, Aziz MF, Siregar B, Cornain S, Vrede MA, Jordanova ES, Fleuren GJ. 2005. Human papillomavirus type 18 variants: histopathology and E6/E7 polymorphisms in three countries. Int J Cancer. Apr 10;114(3):422-5. 25. De la Cruz Hernández E, Dueñas González A, García Carrancá A, Mohar A, Lizano Soberón M. 2002. Análisis Funcional de las Proteínas E2, E6 y E6*1 de las variantes del virus del Papiloma Humano tipo 18. Memorias del VII Encuentro Nacional de Investigadores. SSA. Veracruz, Ver. Méx. 26. De la Cruz-Hernández Erick, García-Carrancá A, Mohar Betancourt A, DueñasGonzález A, Contreras-Paredes A, Pérez-Cárdenas E, Herrera-Goepfert R, Lizano-Soberón M. 2005. Diferential splicing of E6 within human papillomavirus type 18 variants and functional consequences. Journal of General Virology; 86: 2459-2468. 27. De la Garza, Jaime. Programa Nacional de Control y Prevención del Cáncer Cérvico-Uterino. Instituto Nacional De Cancerología. Secretaría de Salud. 2006. 28. Delgado- Enciso I, Rojas-Martínez A, Barrera-Saldaña HA, Ortiz-López R. 2004. Los virus: Una importante causa de neoplasias en los seres humanos. Rev Inv Clin 56; 4: 495-506. 91 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 29. de Villiers EM, Fauquier C, Broker TR, Bernard HU, zur Hausen H. 2004. Classification of papillomaviruses. Virology. Jun 20;324(1):17-27 30. Ferenczy A, Franco E. 2002. Persistent human papillomavirus infection and cervical neoplasia. Lancet Oncol; 3:11-16. 31. Fernandes-Brenna SM and Syrjänen KJ. 2003. Regulation of cell cycles is of key importance in human papillomavirus (HPV)-associated cervical carcinogenesis. Sao Paulo Med J 121; 3: 128-132. 32. Ferreira-Santos AL, Mauricette-Derchain SF, Martins MR, Zanatta-Sarian LO, Zangiacome-Martínez E, Syrjänen KL. 2003. Human papillomavirus viral load in predicting high-grade CIN in women with cervical smears showing only atypical squamous cells or low-grade squamous intraepithelial lesion. Sao Paulo Med J; 121(6): 238-243. 33. Gearhart PA, Randall TC. Human Papillomavirus. e-Medicine. 06/07/2006. 34. Goldie SJ, Gaffikin L, Goldhaber-Fiebert JD, Gordillo-Tobar A, Levin C, Mahe C, Wright TC; Alliance for Cervical Cancer Prevention Cost Working Group. 2005 Cost-effectiveness of cervical-cancer screening in five developing countries. N Engl J Med. Nov 17;353(20):2158-68 35. Gustincich S, Manfioletti G, Del Sal G, Schneider C, Carninci P. 1991. A fast method for high-quality genome DNA extraction from whole human blood. Biotechniques 111: 298-301. 92 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 36. Harris, SF and Botchan MR. 1999. Crystal structure of the human papillomavirus type 18 E2 activation domain. Science 284(4): 1673-6. 37. Hawley-Nelson P, Vousden KH, Gubert NL, Lowy DR, and Schiller JT. 1989. HPV16 E6 and E7 proteins cooperate to immortalize human foreskin keratinocytes. EMBO J. 8: 3905- 3910. 38. Hecht JL, Kadish AS, Jiang G, Burk RD. 1995. Genetic characterization of the human papillomavirus (HPV) 18 E2 gene in clinical specimens suggests the presence of a subtype with decreased oncogenic potential. Int J Cancer. Jan 27; 60(3):369-76. 39. Hernandez-Avila M, Lazcano-Ponce EC, Berumen-Campos J, Cruz-Valdez A, Alonso de Ruiz PP, Gonzalez-Lira G. 1997 Human papilloma virus 16-18 infection and cervical cancer in Mexico: a case-control study. Arch Med Res. 28; 2: 265-71 40. Hernandez-Hernandez DM, Garcia-Carranca A, Guido-Jimenez MC, GonzalezSanchez JL, Cruz-Talonia F, Apresa-Garcia T, Martinez-Elizondo OA, OrnelasBernal L, Alvarado-Cabrera I, Munoz S. 2002. Virus de Papiloma Humano de Alto Riesgo (VPH-AR) y Neoplasia Intraepitelial Cervical (NIC) en mujeres de dos hospitales de la cuidad de México. [High-risk human papilloma virus and cervical intraepithelial neoplasia in women at 2 hospitals in Mexico City]. Rev Invest Clin. 54; 4: 299-306. 41. Hernández-Quijano T, Illanes-Aguilar B, Salas-Linares N, Alarcón-Romero LC, Hernández-Valencia M. 2006. Evaluación del tratamiento en infección 93 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 persistente por el virus del papiloma humano con el método de reacción en cadena de la polimerasa. Ginecol Obstet Mex; 74: 317-26. 42. Hidalgo-Martínez AC. 2006. El cancer cérvico-uterino, su impacto en México y el porqué no funciona el programa nacional de detección oportuna. Rev Biomed 17; 81-4. 43. Hildesheim A, Schiffman M, Bromley C y 12 autores más. 2001. Human papillomavirus type 16 variants and risk of cervical cancer. J Natl Cancer Inst. 93: 315-18 44. Hill EC. 1993. Transtornos premalignos y malignos del cuello uterino. En Diagnóstico y Tratamiento Gineco-Obstétricos. 6a Ed. Pernoll MI. Manual Moderno, México, pp. 1111-30. 45. Hubbert NL, Schiller JT, Lowy DR, Androphy EJ. 1988. Bovine papilloma virustransformed cells contain multiple E2 proteins. Proc Natl Acad Sci; U.S.A. p. 5864-5868. 46. Hudson JB, Bedell MA, McCance DJ and Laimins LA. 1990. Inmortalization and altered differentiation of human keratinocytes in vitro by the E6 and E7 open reading frames of human papillomavirus type 18. J Virol. 64: 519- 526. 47. Kaur P, McDougall JK, and Cone R. 1989. Inmortalization of primary human epithelial cells by cloned cervical carcinoma DNA containing human papillomavirus type 16 E6/E7 open reading frames. J Gen Virol. 70: 1261- 1266. 48. Katz IT, Wright AA. 2006 Preventing cervical cancer in the developing world. N Engl J Med. Mar 16;354(11):1110. 94 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 49. Kaufmann AM, Stern PL, Rankin EM, Sommer H, Nuessler V, Schneider A, Adams M, Onon TS, Bauknecht T, Wagner U, Kroon K, Hickling J, Boswell CM, Stacey SN, Kitchener HC, Gillard J, Wanders J, Roberts JS, Zwierzina H. 2002 Safety and immunogenicity of TA-HPV, a recombinant vaccinia virus expressing modified human papillomavirus (HPV)-16 and HPV-18 E6 and E7 genes, in women with progressive cervical cancer. Clin Cancer Res. 8; 12: 3676-85 50. Lacruz-Pelea, C. 2003. Nomenclatura de las lesiones cervicales (de Papanicolaou a Bethesda 2001). Rev Esp Patol; 36(1): 5-9. 51. Lacruz Pelea C, Di Martino ortiz B, Álvarez Fernández E. 2003. Incidencia de los diferentes tipos de papiloma virus humano (HPV) en las lesiones escamosas del cérvix uterino. Rev Esp Patol. 36; 1: 79-84. 52. Lambert PF, Spalholz BA, Howley PM. 1987. A transcriptional repressor encoded by BPV-1 shares a common carboxy-terminal domain with the E2 transactivator. Cell;50:69–78. 53. Lazcano-Ponce E, Herrero R, Munoz N, Cruz A, Shah KV, Alonso P, y cols., . 2001. Epidemiology of HPV infection among Mexican women with normal cervical citology. Int J Cancer; 9(3): 412-20. 54. Liaw KL, Glass AG, Manos MM y cols., . 1999. Detection Of human Papillomavirus DNA in citologically normal women and subsequent cervical squamons intraepitelial lesions. J Natl Cancer lnst; 29 (11): 954-60. 55. Lizano M, Berumen J, Guido MC, Casas L y García-Carrancá A. 1997. Association between human papillomavirus type 18 variants and histopathology of cervical cáncer. J Natl Cancer; 89: 1227-1231. 95 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 56. Lizano M, De la Cruz-Hernández E, Carrillo-García A, García-Carrancá A, Ponce de León-Rosales S, Dueñas-González A, Hernández-Hernández DM, Mohar A. 2005. Distribution of HPV 16-18 intratypic variants in normal citology, intraepithelial lesions and cervical cancer in a Mexican population. Ginecologyc Oncology. En Prensa. 57. Lizano M y García-Carrancá A. 1997. Las variantes moleculares de papiloma virus humanos tipo 16, 18 y 45 en tumores del cuello uterino, en México. Gac Med Méx 133; (1): 43-8. 58. Lorincz AT, Reid R, Jenson AB, Greenberg MD, Lancaster WD, and Kurman RJ. 1992. Human papillomavirus infection of the cervix: relative risk associations of 15 common anogenital types. Obestet Gynecol; 79:328–337 59. Marantz, Robin. 1994. Las fronteras del virus. Ed. Acento, Madrid. 60. Melo A, Montenegro S, Hooper T, Capurro I, Roa JC, Roa I. 2003. Tipificación del virus papiloma humano (VPH) en lesions preneoplásicas y carcinoma del cuello uterino en mujeres de la IX región de Chile. [Human papilloma virus (HPV) typing in preneoplastic and neoplastic lesions of the uterine cervix in the IX region-Chile] Rev Med Chil. Dec;131(12):1382-90. 61. Mendoza JA, Muñoz M, Vielma S, Noguera ME, López M, Toro M. 2000. Infección cervical por el virus del papiloma humano: diagnóstico por citología y por captura de híbridos del ADN viral. Rev Obstet Ginecol Venez. 60; 2: 103-7 96 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 62. Mohar A., Mayo 2006. Frecuencia de CaCU en México y Colima. Instituto Nacional de Cancerología (INCAN): Comunicación personal. Centro Estatal de Cancerología. Colima. 63. Münger K, Phelps WC, Bubb V, Howley PM and Schlegel R. 1989. The E6 and E7 genes of the human papillomavirus type 16 together are necessary and sufficient for transformation of primary human keratinocytes. J Virol. 63: 44174421. 64. Munoz N, Bosch X, deSanjosè S, Herrero R, Castellsagué X, Shah KV, Snijders PJF, Meijer CJLM. 2003 Epidemiologic Classification of Human Papillomavirus Types Associated with Cervical Cancer. New Engl J Med. 348; 6: 518-527. 65. National Cancer Institute (http//:www.nci.nhl.gov/) 66. Norma Oficial Mexicana NOM 014 -SS22 1994: Para la Prevención, tratamiento y control del cáncer del cuello del útero y mamario en la atención primaria. Lesgislación Sanitaria. México. 67. Norma 0ficial Mexicana NOM 014 SSA2 1994. Modificación, 1998. En Vigilancia Epidemiológica del Cáncer Cérvicouterino: REV. CONADAMED; 2(6): 18-19. 68. O’Connor M, Chan SY, and Bernard HU. 1995. Transcription Factor Binding Sites in the Long Control Region of Genital HPVs. Institute of Molecular and Cell Biology, National University of Singapore. LCR Review. 69. Ong CK, Chan SY, Campo MS, Fujinaga K, Mavromara-Nazos P, Labropoulou V, Pfister H, Tay SK, ter Meulen J, Villa LL, Bernard HU. 1993. Evolution of 97 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 human papillomavirus type 18: an ancient phylogenetic root in Africa and intratype diversity reflect coevolution with human ethnic groups. J Virol. Nov; 67(11):6424-31 70. Picconi MA, Alonio LV, Garcia Carranca A, Lizano M, Cervantes Vazquez G, Distefano AL, Mural J, Bazan G, Teyssie AR. 2000. Molecular variants of human papillomavirus (HPV) types 16 and 18 in adenocarcinomas of the cervix. Medicina (B Aires).;60(6):889-94 71. Pirog EC, Kleter B, Olgac S, Bobkiewicz P, Lindeman J, Quint WG, Richart RM, Isacson C. 2000 Prevalence of human papillomavirus DNA in different histological subtypes of cervical adenocarcinoma. Am J Pathol. Oct;157(4):1055-62 72. Prado JC, Calleja-Macias IE, Bernard HU, Kalantari M, Macay SA, Allan B, Williamson AL, Chung LP, Collins RJ, Zuna RE, Dunn ST, Ortiz-Lopez R, Barrera-Saldana HA, Cubie HA, Cuschieri K, von Knebel-Doeberitz M, Sánchez GI, Bosch FX, Villa LL. 2005. Worldwide genomic diversity of the human papillomaviruses-53,56 and 66 a group of high-risk HPVs unrelated to HPV-16 and HPV-18. Virology. 340; 1:95-104. 73. Richart RM. 1969. Theory of Cervical Carcinogenesis. Obstet Ginecol Survey; 24: 874. 74. Riviero-Carrano J. 2002. Importancia de la tipificación del Virus Papiloma Humano (VPH). Rev Venez Oncol 14; 3: 175-77 75. Romanczuk H, Villa LL, Schlegel R and Howley P. 1991. The viral transcriptional Regulatory Region Upstream of the E6 and E7 genes is a major 98 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 determinant of the differential immortalization activities of Human Papillomavirus types 16 and 18. J Virol 65; (5), 2739-2744. 76. Sambrook J, Fritsch EF, Maniatis T. 1989. Molecular conditioning, a laboratory manual, 2nd Edition. Cold Spring Harbor Laboratory Press. 77. Schiffman M, Castle PE. 2005 The promise of global cervical-cancer prevention. N Engl J Med. 353; 20: 2101-4 78. Secretaría de Salud. Salud: México 2004. 2ª Edición. 2005. México. Pág. 201. 79. Schlegel R, Phelps WC, Zhang YL and Barbosa M. 1988. Quantitative keratinocyte assay detects two biological activities of human papillomavirus DNA and identifies viral types associated with cervical carcinoma. EMBO J 7: 3181- 3187. 80. Sherris J, Herdman C, Elias C. 2001 Cervical cancer in the developing world. West J Med. 175; 4: 231-3. 81. Snijders PJ, Hogewoning CJ, Hesselink AT, Berkhof J, Voorhorst FJ, Bleeker MC, Meijer CJ. 2006 Determination of viral load thresholds in cervical scrapings to rule out CIN 3 in HPV 16, 18, 31 and 33-positive women with normal cytology. Int J Cancer. 119; 5: 1102-7. 82. Solomon D, Davey D, Kurman R, Moriarty A, y cols., . 2002. The 2001 Bethesda System. JAMA, 287: 2114. 83. Steinbrook R. 2006. The potencial of Human Papillomavirus Vaccines. N Engl J Med 354; 11: 1109-11. 99 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 84. Stewart AC, Ericsson AM, Manos MM, Muñoz N, Bosch FX, Peto J, --Wheeler CM. 1996. Intratype variation in 12 human papillomavirus types: a worldwide perspective. J. Virol. 70, 3127- 3136. 85. Stubenrauch F, Hummel M, Iftner T, Laimins LA. 2000. The E8E2C protein, a negative regulator of viral transcription and replication, is required for extrachromosomal maintenance of human papillomavirus type 31 in keratinocytes. JVirol;74:1178–1186. 86. Stubenrauch F, Zobel T, Iftner T. 2001. The E8 domain confers a novel longdistance transcriptional repression activity on the E8E2C protein of high-risk human papillomavirus type 31. JVirol;75:4139–4149. 87. Tamayo-Acevedo, L.S. 2002. Asociación y Predicción del riesgo de Lesión Intraepitelial Escamosa y Cáncer Cérvico-uterino en función de los factores: infección por el Virus del Papiloma Humano, Gineco-obstétricos, Comportamiento Sexual, Sociodemográficos y Antecedentes Genéticos en Mujeres mayores de 15 años. Estado de Colima, México, 2002. Tesis de Doctorado en Ciencias Médicas. Universidad de Colima. México. 88. Tirado-Gómez LL, Mohar-Betancourt A, López-Cervantes M, García-Carrancá A, Franco-Marina M, Borges, G. 2005. Factores de riesgo de cáncer cervicouterino invasor en mujeres mexicanas. Salud Pub Méx.; 47:342-350. 89. van Duin M, Snijders PJ, Schrijnemakers HF, Voorhorst FJ, Rozendaal L, Nobbenhuis MA, van den Brule AJ, Verjeijen RH, Helmerhorst TJ, Meijer CJ. 100 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 2002. Human papillomavirus 16 and load in normal and abnormal cervical scrapes: an indicator of CIN II/III and viral clearance. Int J Cancer. 98(4): 590-5. 90. Vargas-Hernández VM. 1996. Virus del papiloma humano. Aspectos epidemiológicos, carcinogenéticos, diagnósticos y terapéuticos. Ginec Obstet Méx.; 64: 411-17. 91. Villa LL, Bernard HU, Kast M, Hildesheim A, Amestoy G, Franco EL. 2002. Past, present, and future of HPV research: highlights from the 19th International Papillomavirus Conference-HPV 2001. Virus Res 89; 2: 163-73. 92. Villa LL and Schlegel R. 1991. Differences in transformation activity between HPV-18 and HPV-16 map to the viral LCR/E6/E7 region. Virology 181; 1: 3747. 93. Villa LL, Sichero L, Rahal P, Caballero O, Ferenczy A, Rohan T and Franco EL. 2000. Molecular variants of human papillomavirus types 16 and 18 preferentially associated with cervical neoplasia. J Gen Virol; 81(pt 12): 2959–68. 94. Walboomers JM, Jacobs MV, Manos MM, Bosch FX, Kummer JA, Shah KV, Snijders PJ, Peto J, Meijer CJ, Munoz N. 1999 Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol. Sep;189(1):12-9. 95. Wright TC Jr, Schiffman M. 2003. Adding a test for human papillomavirus DNA to cervical-cancer screening. N Engl J Med. 348; 6:489-90 101 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 96. World Health Organization. (WHO) 2004. The world health report 2004: Changing History, Statistical Annex. Geneva: (http://whqlibdoc.who.int/2004/924156265X.pdf). 97. Xi LF, Koutsky LA, Galloway DA, Kuypers J, Hughes JP, Wheeler CM, Holmes KK, Kiviat NB. 1997. Genomic variation of human papillomavirus type 16 and risk for high grade cervical intraepithelial neoplasia. J Natl Cancer Inst 89: 796802. 98. Yamada T, Manos MM, Peto J, Greer CE, Muñoz N, Bosch FX, Wheeler CM. 1997. Human papillomavirus type 16 sequence variation in cervical cancers: a worldwide perspective. J. Virol. 71, 2463- 2472. 99. Ylitalo N, Sorenesen P, Josefsson AM, Magnusson PK, Andersen PK, Ponten J, Adami HO, Gyllensten UB, Melbye M. 2000. Consistent high viral load of human papillomavirus 16 and risk of cervical carcinoma in situ: a nested case-control study. Lancet; 355: 2194-8. 100. Zamore PD, Haley B. 2005. Ribo-genome: the big world of small RNAs. Science; 309:1519–1524. 101. Zehbe I, Wilander E, Delius H y Tommasino M. 1998. Human papillomavirus 16 E6 variants are more prevalent in invasive cervical carcinoma than the prototype. Cancer Res. 58: 829- 833. 102. Zheng Z-M and Baker CC. 2006. Papillomavirus Genome Structure, Expression, and Post-transcriptional Regulation. Front Biosci. ; 11: 2286–2302. 103. Zur Hausen Harald. 2002. Papillomaviruses and Cancer: from basic studies to clinical application. Cancer; 2: 342-350. 102 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN Alma Rosa G. Fernández Salinas. 2007 103 Identificación de Virus de PAPILOMA HUMANO tipo 18 en pacientes con CÁNCER CERVICO-UTERINO, LESIÓN INTRAEPITELIAL CERVICAL y SIN LESIÓN