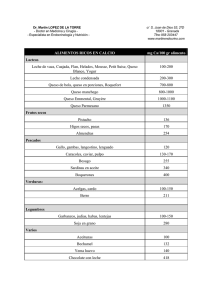
MIRIAM GUADALUPE RODRIGUEZ OLVERA
Anuncio

Instituto Politécnico Nacional CENTRO DE INVESTIGACIÓN EN CIENCIA APLICADA Y TECNOLOGÍA AVANZADA UNIDAD QUERÉTARO POSGRADO EN TECNOLOGÍA AVANZADA Análisis químico de los compuestos importantes del sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ TESIS QUE PARA OBTENER EL GRADO DE MAESTRÍA EN TECNOLOGÍA AVANZADA PRESENTA Q. en A. Miriam Guadalupe Rodríguez Olvera Directores de Tesis: Dr. Pedro Alberto Vázquez Landaverde Dra. Blanca Estela García Almendárez Querétaro, Qro. Diciembre de 2013. A Dios por permitirme cumplir una meta más y bendecirme en el camino. A mi mamita hermosa por ser mi motor, mi inspiración y mi soporte en todo momento. Gracias por recordarme en todo momento lo grande que soy, porque cuando ya no tengo fuerzas para continuar, siempre estás para impulsarme y recordarme que puedo lograr todo lo que me proponga. Te adoro mami!!! A mi esposo amado por ser mi amigo, confidente y compañero de aventuras. Gracias por la infinita paciencia y apoyo que me brindaste en todo momento para culminar una de mis más grandes metas y por permitirme robarte mucho del tiempo en el que merecía estar contigo. Gracias por soportar mis momentos de estrés y por compartir mis alegrías… gracias por aceptar mis locuras por más simples que parecieran, como dormir con la luz prendida porque me daba miedo estudiar sola por las noches, gracias por creer en mi e impulsarme siempre. Te amo! A mi Ximenita preciosa por ser mi razón de ser, por ser toda una guerrera y enseñarme que no existe obstáculo que impida superar cualquier adversidad, sólo la falta de fe y la falta de coraje para salir adelante. Eres grande princesa, nunca lo olvides!!!! A mi papito lindo por enseñarme a ser perseverante, a luchar por mis sueños y a nunca conformarme con lo menos si siempre existe la oportunidad de crecer. Eres un gran ejemplo de éxito. Te quiero papi!!! A mis hermanis Fer, Panda y Paco por ser mis cómplices de locuras, por siempre ayudarme a terminar mis metas, por ser excelentes tíos y hacerla de papás cuidando y guiando a Xime cuando yo necesitaba terminar mis tareas… pero sobre todo gracias por todas esas sesiones de risoterapia para olvidar el estrés. Los quiero!!!!!!!!!!!!!!!!!!!!!!!!! Familia Hermosa: sabiendo que jamás existirá una forma de agradecer toda una vida de lucha, sacrificio y esfuerzo constante, sólo quiero que sientan que el objetivo logrado también es suyo y que la fuerza que me ayudó a conseguirlo fue su incondicional apoyo. Los amo!! Al Dr. Pedro Alberto Vázquez Landaverde por darme la oportunidad de crecer tanto personal como profesionalmente y transmitirme todo su conocimiento. Gracias por confiar en mí y hacerme partícipe del gran ímpetu que se puede tener a la ciencia, a amar grandemente lo que uno hace y a querer seguir creciendo en este apasionante mundo de los sabores. Gracias por su todo su apoyo en esta aventura. A la Dra. Blanca Estela García Almendárez y al Dr. Carlos Regalado González por tantos años de compartir tanto profesional como personalmente todas su experiencias, ya que todas las bases para crecer en esta profesión las obtuve de ustedes. Gracias por todo su apoyo. A la Dra. Norma Gabriela Rojas Avelizapa, Dr. Reynaldo Carlos Pless Elling y Dr. Gonzalo Velázquez de la Cruz por su apoyo, colaboración, entrega y enriquecedoras aportaciones a este trabajo. Gracias por su excelente labor docente y por siempre tener tiempo para las cosas escolares y personales. A la Dra. Ma. Guadalupe del Carmen Méndez Montealvo por su sincera y excelente labor en pro de los derechos de los estudiantes, por brindarnos apoyo y confianza en los momentos más complicados de esta aventura llamada maestría. A mi flavor team… Bibis, Chivis, Gera, Luisa y Rosy por su sincera amistad, por sus experiencias y los momentos inolvidables de risa y llanto que hicieron más llevadero el trabajo… pero en especial a mis mellizas ñoñolsen!!! Jary y Yoss por su inigualable amistad, por todos los momentos únicos que nos hicieron llorar para crecer (Chachis!!!!!!!) pero sobre todo por todos los momentos llenos de alegría que han hecho mi estancia en CICATA una de las mejores experiencias de mi vida. Las quiero mil!!!!!!! A mis amigos malteadosos… Luz, Renata, Anita y Claudia por hacerme empezar el día con una sonrisa… pero en especial a mi amigo Pepe… gracias amigo por todas tus enseñanzas de vida, por nuestras terapias en el club, por nuestros momentos de reflexión que muchas veces me ayudaron a retomar este reto con la mejor actitud. Eres una gran persona y estoy agradecida de haberte conocido. Al Departamento de posgrado: Lupita, Israel y Lucy… pero con especial cariño a Gerardo, por estar siempre dispuesto a ofrecer una sonrisa a pesar del mal día. Gracias por su gran labor. A todos los que hicieron posible este sueño… Gracias. Índice General Índice General ...................................................................................................................................... i Índice de tablas ................................................................................................................................... v Índice de figuras ................................................................................................................................. vii Resumen ............................................................................................................................................. ix Abstract ............................................................................................................................................... xi CAPÍTULO 1 ......................................................................................................................................... Introducción ......................................................................................................................................... 1 CAPÍTULO 2 ......................................................................................................................................... Antecedentes....................................................................................................................................... 5 2.1 Queso ....................................................................................................................................... 5 2.2 Sabor en queso ........................................................................................................................ 6 2.2.1 Proteólisis ........................................................................................................................... 6 2.2.2 Hidrólisis de lactosa ........................................................................................................... 8 2.2.3 Lipólisis............................................................................................................................... 9 2.2.4 Otros................................................................................................................................. 10 2.2.5 Adición de cultivos ........................................................................................................... 11 2.3 Lactococcus lactis UQ2Rif Lac+ ............................................................................................ 12 2.4 Sabor de queso inoculado con Lactococcus lactis UQ2Rif Lac+........................................... 13 2.5 Análisis de los compuestos aromáticos ................................................................................. 15 2.5.1 Espacio de cabeza (Headspace, HS) ............................................................................. 17 2.5.2 Microextracción en fase sólida (SPME) ........................................................................... 17 2.6 Identificación de compuestos activos olfativamente .............................................................. 19 2.7 Cuantificación de compuestos activos olfativamente ............................................................ 19 2.7.1 Adición de estándar interno múltiple ................................................................................ 19 2.7.2 Adición de estándar en matriz real con estándares internos múltiples ........................... 20 2.7.3 Estándares externos ........................................................................................................ 21 2.8 Valor de actividad de aroma (OAV) ....................................................................................... 22 CAPÍTULO 3 ......................................................................................................................................... Justificación ....................................................................................................................................... 25 i ÍNDICE GENERAL: Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ CAPÍTULO 4 Hipótesis ............................................................................................................................................ 27 CAPÍTULO 5 ......................................................................................................................................... Objetivos ............................................................................................................................................ 29 5.1 General ................................................................................................................................... 29 5.2 Específicos ............................................................................................................................. 29 CAPÍTULO 6 ......................................................................................................................................... Materiales y métodos ........................................................................................................................ 31 6.1 Activación de L. lactis UQ2Rif Lac+ para su incorporación como inóculo en queso panela . 31 6.2 Incorporación de L. lactis UQ2Rif Lac+ en la elaboración de queso panela como cultivo protector ....................................................................................................................................... 31 6.3 Desarrollo de una técnica de cuantificación de compuestos volátiles mediante la adición de estándar en matriz real con estándares internos múltiples.......................................................... 32 6.4 Desarrollo de una técnica de cuantificación de ácidos grasos libres mediante curva de calibración externa con estándares internos múltiples ................................................................ 34 6.5 Extracción de los compuestos volátiles por SPME ................................................................ 35 6.6 Extracción de ácidos grasos libres ......................................................................................... 36 6.7 Determinación de los valores de actividad de aroma (OAV) para los compuestos identificados ................................................................................................................................. 36 CAPÍTULO 7 ......................................................................................................................................... Resultados y discusión ...................................................................................................................... 37 7.1 Desarrollo de una técnica de cuantificación de compuestos volátiles mediante la adición de estándar en matriz real con estándares internos múltiples.......................................................... 37 7.2 Desarrollo de una técnica de cuantificación de ácidos grasos libres mediante curva de calibración externa con estándares internos múltiples ................................................................ 38 7.3 Extracción y cuantificación de los compuestos volátiles por SPME ...................................... 39 7.4 Determinación de los valores de actividad de aroma (OAV) para los compuestos identificados ................................................................................................................................. 41 7.5 Determinación de los valores de actividad de aroma (OAV) para los ácidos grasos libres identificados ................................................................................................................................. 62 ii ÍNDICE GENERAL: Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ CAPÍTULO 8 ......................................................................................................................................... Conclusión y perspectivas ................................................................................................................. 65 CAPÍTULO 9 ......................................................................................................................................... Referencias ....................................................................................................................................... 67 iii Índice de tablas Tabla 1. OAV de algunos componentes volátiles del aroma de queso Camembert ........................ 23 Tabla 2. Concentración real de las soluciones de compuestos de calibración ................................ 33 Tabla 3. Concentración real de las curvas de calibración para compuestos volátiles en la muestra final de queso .................................................................................................................................... 34 Tabla 4. Ecuaciones de regresión lineal para compuestos de sabor en queso panela.................... 37 Tabla 5. Ecuaciones de regresión lineal para ácidos grasos libres en queso panela ...................... 38 Tabla 6. Compuestos volátiles identificados en los quesos control e inoculado con Lactococcus lactis UQ2Rif Lac+ analizados por .................................................................................................... 42 Tabla 7. Ácidos grasos libres identificados en los quesos control e inoculado con Lactococcus lactis UQ2Rif Lac+ ...................................................................................................................................... 62 v Índice de figuras Figura 1. Degradación de los componentes del queso involucrados en la formación de componentes del sabor ....................................................................................................................... 7 Figura 2. Análisis de componentes principales (ACP), tendencia de 38 compuestos identificados para los diferentes tipos de quesos. ................................................................................................. 14 Figura 3. Rango de recuperación de compuestos volátiles mediante diferentes métodos de separación de compuestos volátiles. ................................................................................................ 16 Figura 4. Secuencia de eventos que muestran los pasos para la extracción por medio de SPME. 18 Figura 5. Representación gráfica del método de adición de estándar en matriz real. ...................... 21 Figura 6. Elaboración de queso panela adicionado con Lactococcus lactis UQ2Rif Lac+. .............. 32 Figura 7. Efecto del tiempo de extracción en los compuestos volátiles de queso panela ................ 39 Figura 8. Compuestos con los valores de OAV más altos en los quesos control e inoculado con Lactococcus lactis UQ2Rif Lac+ ....................................................................................................... 55 Figura 9. Compuestos con los valores de OAV más altos en el queso control comparados con su contraparte en el queso inoculado con L. lactis UQ2Rif Lac+ .......................................................... 56 Figura 10. Compuestos con los valores de OAV más altos en el queso inoculado con L. lactis UQ2Rif Lac+ comparados con su contraparte en el queso control .................................................. 58 vii Resumen Las notas de sabor y aroma que caracterizan a los quesos no pasteurizados son cualidades que el consumidor aprecia y busca. Sin embargo, es incuestionable el riesgo asociado a su consumo debido a la falta de medidas que controlen la inocuidad de este tipo de productos. Una modificación en la microflora inicial que reduce microorganismos y elimina patógenos, se logra con la pasteurización, misma que hace posible una producción de calidad uniforme; pero trae consigo un sabor insípido en el queso, ya que diversos estudios han confirmado que la flora nativa, en especial las bacterias ácido lácticas del género Lactococcus son importantes en el desarrollo de compuestos de sabor. Se ha comprobado que es posible restaurar el sabor, lograr uniformidad en la calidad y asegurar la inocuidad del producto, pasteurizando la leche y añadiendo cultivos lácticos, como el Lactococcus lactis UQ2Rif Lac+. En este trabajo se identificaron los compuestos importantes del sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ por HSSPME-GC-MS y el perfil de ácidos grasos libres por extracción con solventes. En el queso control se identificaron 9 alcoholes, 6 aldehídos, 4 compuestos de azufre, 19 cetonas, 33 ésteres, 3 éteres, 2 pirazinas, 3 terpenos, 12 compuestos aromáticos y 22 hidrocarburos; haciendo un total de 113 compuestos volátiles. En el queso inoculado con L. lactis UQ2Rif Lac+ se identificaron 11 alcoholes, 10 aldehídos, 4 compuestos de azufre, 15 cetonas, 13 ésteres, 5 éteres, 4 terpenos, 8 compuestos aromáticos y 26 hidrocarburos; haciendo un total de 96 compuestos volátiles. Se identificaron 12 ácidos grasos tanto en el queso control como en el queso inoculado con L. lactis UQ2Rif Lac+. Este estudio mostró que el decanal, el hexanal, el 2,4-ditiapentano, el etil éster del ácido 3-metilbutanóico, el etil éster del ácido heptanóico, el etil éster del ácido hexanóico, el ácido acético, el ácido butanóico, el ácido hexanóico y el ácido oléico son los compuestos con mayor valor de actividad de aroma en el queso control, sugiriendo que son los compuestos clave para el sabor de queso tipo panela. Por otro lado, este trabajo mostró que el 3-metil-1-butanol, el bencenacetaldehído, el 3-metilbutanal, el dimetil sulfuro, el metanotiol, la 2,3-butanodiona, la 2pentanona, el ácido acético, el ácido butanóico, el ácido hexanóico y el ácido oléico son los compuestos con mayor valor de actividad de aroma, sugiriendo que son los compuestos clave para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+. La adición del cultivo protector L. lactis UQ2Rif Lac+ durante la elaboración de queso panela ofrece un efecto bifuncional, ya que cumplió con el objetivo de sintetizar la bacteriocina nisina brindando un efecto bioprotector y favoreciendo la estabilidad microbiológica del queso, además de favorecer la síntesis de compuesto volátiles específicos que son percibidos como agradables por el consumidor. Con esto se logra un producto de calidad uniforme, inocuo y con sabor agradable pues la flora presente en el producto y las características sensoriales se estandarizan, lo cual es muy buscado por la industria láctea hoy en día. Palabras clave: queso, Lactococcus lactis UQ2Rif Lac+, compuestos volátiles. ix Abstract The flavor and aroma notes that characterize unpasteurized cheeses are qualities that consumers appreciate and seek. However, there is unquestionably a risk associated with their use, due to the lack of measures to control the safety of this type of product. Pasteurization achieves a modification of the initial microflora, reduces and eliminates pathogenic microorganisms; it also enables a production of uniform quality, but it brings with it a flat taste in the cheese, since several studies have confirmed that the native flora, especially the lactic acid bacteria of the genus Lactococcus, are important in the development of flavor compounds. It has been found possible to restore the taste uniformity in the quality, and to ensure the safety of the product, by adding pasteurized milk and dairy cultures, such as Lactococcus lactis UQ2Rif Lac+. This study identified key flavor compounds in fresh basket cheese (panela) inoculated with Lactococcus lactis UQ2Rif Lac+ by HS-SPME-GC-MS and the free fatty acid profile by solvent extraction. In the control cheese were identified 9 alcohols, 6 aldehydes, 4 sulfur compounds, 19 ketones, 33 esters, 3 ethers, 2 pyrazines, 3 terpenes, 12 aromatic compounds and 22 hydrocarbons, making a total of 113 volatile compounds. In cheese inoculated with L. lactis UQ2Rif Lac+ were identified 11 alcohols, 10 aldehydes, 4 sulfur compounds, 15 ketones, 13 esters, 5 ethers, 4 terpenes, 8 aromatic compounds and 26 hydrocarbons, making a total of 96 volatile compounds. In both cheeses were identified 12 fatty acids. This study showed that decanal, hexanal, 2,4-dithiapentane, 3-methylbutanoic acid ethyl ester, heptanoic acid ethyl ester, hexanoic acid ethyl ester, acetic acid, butanoic acid, hexanoic acid and oleic acid are the compounds with the highest odor activity value in control cheese, suggesting that these are key compounds in the flavor of fresh basket cheese (panela). Furthermore, this study demonstrated that 3-methyl-1-butanol, benzeneacetaldehyde; 3-methyl-butanal, dimethyl sulfide, methanethiol, 2,3-butanedione, 2-pentanone, acetic acid, butanoic acid, hexanoic acid and oleic acid are compounds with the highest odor activity value, suggesting that this are key compounds in the flavor of fresh cheese inoculated with Lactococcus lactis UQ2Rif Lac+. The addition of a protective culture of L. lactis UQ2Rif Lac+ during the making of panela cheese provides a bifunctional effect, as it meets the objective to synthesize the bacteriocine nisin give a bioprotective effect and favoring the microbiological stability of cheese, it also helps the synthesis of specific volatile compounds that are perceived as pleasant by the consumer. These achieve a product of uniform quality, safe and with good taste as the flora present in the product and sensory characteristics are standardized, which is highly desirable in the dairy industry. Keywords: cheese, Lactococcus lactis UQ2Rif Lac+, volatile compounds. xi CAPÍTULO 1 Introducción El queso fresco es un producto de alta demanda en México. Entre 2005 y 2011, la producción industrial de leche y derivados lácteos registró un comportamiento favorable en la mayor parte de los productos. De acuerdo a la información proporcionada por el INEGI, destacan la producción de quesos, con una tasa de crecimiento anual promedio de 5.7%, al pasar de 178,000 toneladas en 2005 a 247,000 toneladas en 2011. México se ubica en el noveno lugar en la producción de quesos a nivel global con una oferta en el 2010 de 244,000 toneladas. El consumo de queso también mostró un comportamiento favorable al pasar de 265,000 toneladas consumidas en 2005 a 321,000 toneladas en 2011 (SAGARPA, 2011). Por otro lado, la producción y consumo de quesos frescos también ha ido incrementando en otros países. En Estados Unidos, la producción de queso fresco en 2007 fue de 190,580,000 libras, mientras que en 2011 la producción aumentó a 224,649,000 libras (USDA-NASS, 2012) En México el queso más consumido es el queso panela con un 52.3% de preferencia por la población, donde los atributos más importantes evaluados por el consumidor son su sabor y aroma (SAGARPA, 2011). En nuestro país muchas veces se elige no pasteurizar la leche para la elaboración de quesos frescos ya que conserva en el producto sabores y olores agradables, sin embargo esto viola la norma NOM-091-SSA1-1994 establecida por la Secretaria de Salud (SSA) y pone en riesgo la inocuidad sanitaria del producto así como la seguridad del consumidor. En Estados Unidos se reportaron 121 brotes de enfermedades transmitidas por alimentos (ETAs) relacionados con el consumo de productos lácteos entre 1996 – 2006, dando como resultado 4,413 reportes de personas enfermas. De éstos, 1,571 (36%) fueron asociados al consumo de productos lácteos sin pasteurizar. Los brotes relacionados con productos lácteos sin pasteurizar se tradujeron en 202 hospitalizaciones (tasa de hospitalización del 13%), mientras que los brotes donde se vieron involucrados productos lácteos pasteurizados dieron como resultado 37 hospitalizaciones (tasa de hospitalización del 1%). Se asociaron 2 muertes con un brote causado por productos lácteos sin pasteurizar. La incidencia de brotes causados por los productos lácteos sin pasteuriza fue mayor en los estados que permiten la venta de productos lácteos sin pasteurizar, que en los estados que prohibían dicha venta. De los brotes donde se vieron involucrados productos lácteos elaborados sin pasteurizar, se identificaron como causantes de las 1 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ enfermedades bacterias como Campylobacter spp., Salmonella spp., Listeria spp., Escherichia coli, Brucella spp. y Shigella spp (Langer et al., 2012). Los productos lácteos tienen sabores característicos que han sido asociados a la actividad metabólica de la flora nativa de la leche. Sin embargo, además del problema sanitario por la gran variedad de microorganismos presentes en la leche cruda, el proceso de manufactura del queso fresco no es uniforme y varía con la localidad y las tradiciones regionales. Una modificación en la microflora inicial que reduce microorganismos y elimina patógenos, se logra con la pasteurización. Sin embargo, las características sensoriales de los productos lácteos se modifican por el proceso de pasteurización ya que afecta compuestos de sabor además de reducir considerablemente la flora nativa. El incorporar cultivos protectores del mismo origen lácteo, puede favorecer la síntesis de nuevos compuestos de sabor que asemejen perfiles sensoriales de productos no pasteurizados. Se ha considerado el uso de co-cultivos o cultivos protectores para la elaboración de productos lácteos tradicionales elaborados con leche pasteurizada, ya que se busca que el cultivo protector desarrolle en el producto las características de quesos artesanales, siendo doblemente efectivo, brindando características sensorialmente aceptables y protegiendo al alimento mediante la bioconservación. La bioconservación es una alternativa de conservación de alimentos frescos, implica una serie de métodos en los cuales se usan bacterias y/o sus metabolitos como medio de protección en diversos alimentos. Las bacterias más utilizadas e investigadas recientemente son aquellas que pertenecen al grupo de las bacterias ácido lácticas (BAL), que se caracterizan por fermentar azúcares transformándolos en ácido láctico y otros metabolitos. Resulta de interés la capacidad de estas bacterias en la síntesis de bacteriocinas, que son polipéptidos de bajo peso molecular capaces de inhibir el desarrollo de diversos microorganismos patógenos o deterioradores de alimentos. La nisina fue la primer bacteriocina aislada a partir de la bacteria ácido láctica Lactococcus lactis subsp. lactis. Es la bacteriocina mejor caracterizada y utilizada como conservador de alimentos y es la única reconocida por la FDA con categoría GRAS (Generally Recognized As Safe). Se produce de forma natural en algunos productos lácteos y se utiliza en la conservación del alimento. De igual forma se emplea como aditivo en productos lácteos para prevenir el crecimiento de microorganismos deterioradores y patógenos principalmente por bacterias Gram positivas, especialmente de los géneros Clostridium, Staphylococcus, Bacillus y Listeria. El Diario Oficial de la Federación en el acuerdo por el que se determinan los aditivos y coadyuvantes en alimentos, bebidas y suplementos alimenticios, su uso y disposiciones sanitarias publicado el 16 de julio de 2012 permite la utilización de la nisina como conservador en quesos frescos, teniendo un límite máximo de 12.5 mg/kg. 2 INTRODUCCIÓN En el laboratorio de biotecnología de la Facultad de Química de la Universidad Autónoma de Querétaro se aisló una cepa de Lactococcus lactis, identificada como L. lactis UQ2, esta cepa fue posteriormente modificada por conjugación para favorecer su desarrollo en leche, la cepa resultante L. lactis UQ2Rif Lac+ muestra un buen crecimiento en leche y sintetiza la bacteriocina genéticamente identificada como nisina A. La cepa modificada L. lactis UQ2Rif Lac+ se incorporó como cultivo bioprotector en queso panela y en el Centro de Investigación de Ciencia Aplicada y Tecnología Avanzada del Instituto Politécnico Nacional unidad Querétaro se analizó el perfil químico de los compuestos importantes para el sabor mediante técnicas instrumentales de extracción de compuestos volátiles, lo que permitió conocer y caracterizar el sabor de queso tipo panela elaborado con Lactococcus lactis UQ2Rif Lac+. 3 CAPÍTULO 2 Antecedentes 2.1 Queso Se define al queso como un producto elaborado con la cuajada de leche estandarizada y pasteurizada de vaca o de otras especies animales, con o sin la adición de crema, obtenida por coagulación de la caseína con cuajo, gérmenes lácticos, enzimas apropiadas, ácidos orgánicos comestibles y con o sin tratamiento ulterior por calentamiento, drenada, prensada o no, con o sin adición de fermentos de maduración, mohos especiales, sales fundentes e ingredientes comestibles opcionales. La proporción entre las proteínas de suero y la caseína debe ser igual o menor al de la leche. No debe contener grasa y proteínas de origen diferente al de la leche, ni almidones y féculas (NOM-121-SSA1-1994). De acuerdo al proceso de elaboración, el queso puede clasificarse en: fresco, madurado o procesado. Los quesos frescos son aquellos que se caracterizan por un alto contenido de humedad, sabor suave y sin corteza, pudiendo o no contener ingredientes opcionales y teniendo un periodo de vida de anaquel corto, para consumo preferentemente dentro de los primeros 20 días a partir de su fecha de elaboración, requiriendo condiciones de refrigeración (NOM-121-SSA11994). Durante su elaboración, los quesos pueden ser adicionados con cultivos bacterianos, puede ser con cepas puras o combinadas. Se utilizan para el desarrollo de acidez inicial de la leche, la formación de aromas específicos o la producción de gas y formación de ojos durante la maduración del queso, consiguiendo entre todos el mejor resultado para cada tipo específico de queso (NMX-F-713-COFOCALEC-2005). Los quesos con cultivos bacterianos pueden estar adicionados con microorganismos que justifiquen la declaración del atributo probiótico, siempre y cuando se cuente con los estudios científicos y reportes de su funcionalidad, que lo sustenten ante la autoridad competente. También pueden estar adicionados con cultivos protectores, que evitan características no deseables en el producto y aseguran que el cultivo específico se desarrolle adecuadamente (NMX-F-713COFOCALEC-2005). 5 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ 2.2 Sabor en queso Una de las características de calidad del queso es su sabor (Fox et al., 2000). La formación de los compuestos de sabor en el queso depende de la humedad, contenido de sal y pH, así como condiciones de maduración como temperatura de almacenamiento, humedad del aire en la cámara de maduración y duración del periodo de maduración (Forde et al., 2000; Marilley et al. 2004). Los componentes específicos del sabor y aroma del queso son difíciles de distinguir, ya que se hallan en una mezcla equilibrada y compleja (Fox et al., 2000). Basándose en evaluación sensorial y análisis químicos de quesos, se han identificado varios compuestos volátiles como responsables del sabor y aroma final del queso (Ayad et al., 2004). Estos compuestos volátiles (hidrocarburos, alcoholes, aldehídos, cetonas, ésteres, ácidos grasos libres, compuestos de nitrógeno y de azufre) son resultado de la digestión de proteínas y lípidos, así como la degradación de aminoácidos y ácidos grasos (Forde et al., 2000). Aminas, aldehídos, alcoholes y amonio, derivados de la degradación de aminoácidos, son importantes en el desarrollo del sabor del queso al igual que la formación de ácidos grasos libres. Los compuestos volátiles como metilcetonas, tioésteres y lactonas resultan del catabolismo de los ácidos grasos libres y juegan un papel importante en el sabor del queso (Marilley et al., 2004). El sabor del queso es derivado principalmente del rompimiento de las proteínas y grasa de la leche, así como la hidrólisis de la lactosa por medio de la actividad de algunas enzimas. Las enzimas pueden ser tanto propias de la leche (plasmina y lipasa), añadidas a la leche (quimosina o renina y esterasa pregástrica), secretadas por microorganismos o liberadas de células microbianas seguidas de la muerte celular y lisis. Algunos compuestos son producidos por reacciones químicas, por ejemplo, reacciones de Maillard y Strecker entre aminoácidos y varios carbonilos, especialmente dicarbonilos, como diacetilo, glioxal o metil glioxal (Fox et al., 2000; Forde et al., 2000). 2.2.1 Proteólisis La proteólisis es la reacción bioquímica más importante en la elaboración de quesos y juega un papel vital en el desarrollo de textura y sabor. Las enzimas proteolíticas proporcionan una mezcla de aminoácidos así como cambios directos en el sabor del queso. Los aminoácidos son precursores de compuestos volátiles de aroma, los cuales son degradados a compuestos como aminas, aldehídos, alcoholes y amoniaco, compuestos que participan en la formación de sabor y aroma (Figura 1). La hidrólisis de proteínas juega un papel importante ya que conduce a cambios de textura en la matriz del queso (Fox et al., 2000). 6 ANTECEDENTES La proteína es casi insípida, pero tiene tanta influencia como la materia grasa considerando que ambas diluyen, suavizan y mezclan los diversos sabores. Los productos finales de la proteólisis son sápidos; las peptonas son amargas, por lo que no deben ser demasiado abundantes. Los aminoácidos libres desempeñan un papel importante pues favorecen el desarrollo de distintos sabores. Algunos tienen un sabor azucarado: glicina, alanina, serina etc., otros amargo: leucina, lisina, triptófano entre otros. La tirosina es insípida y la cistina tiene un singular sabor a caucho; los diácidos (aspártico y glutámico) tienen un sabor a caldo (Fox et al., 2000). Figura 1. Degradación de los componentes del queso involucrados en la formación de componentes del sabor (Marilley et al., 2004) La proteólisis es muy importante considerando que los pequeños péptidos y aminoácidos, los cuales son resultado de la proteólisis, contribuyen directamente en el sabor del queso. La presencia de aminoácidos en quesos depende de la actividad de las aminopeptidasas, la cual está relacionada con la lisis celular producida por lactococos. Entonces, los aminoácidos pueden ser catabolizados a compuestos aromáticos como aminas, ácidos, carbonilos y compuestos que contienen azufre (Fox et al., 2000). 7 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Se cree que el catabolismo de los aminoácidos es logrado por bacterias ácido lácticas (BAL), las cuales son responsables de la formación de aroma en queso. Los aminoácidos son catabolizados por dos vías; una conduce a la formación de compuestos azufrados, mientras que la otra se inicia por reacciones de transaminación, vía principal de la degradación de aminoácidos por BAL. Estas reacciones conducen a la formación de α-cetoácidos los cuales comienzan a degradarse en componentes de aroma (Curioni y Bosset, 2002). El indol y el escatol (3-metilindol) son compuestos que contienen nitrógeno, los cuales se ha visto que contribuyen significativamente al perfil de aroma de algunos quesos. El indol es un producto de la degradación del triptófano por levaduras, Micrococcus y Brevibacterium linens. Gallois (1984) encontró que las pirazinas que dan aroma a papa cruda son un defecto producido por la degradación de L-valina por Pseudomonas taetrolens (Curioni y Bosset, 2002). 2.2.2 Hidrólisis de lactosa La proporción de lactosa afecta el sabor de los quesos. El desarrollo del sabor es mucho más rápido en los quesos con alto contenido de lactosa que en los quesos que requieren lavado de la pasta (Fox et al., 2000; Forde et al., 2000). La hidrólisis de la lactosa produce moléculas de glucosa y galactosa, donde la glucosa es convertida a piruvato. El piruvato es iniciador de formación de componentes de sabor de cadena corta, tales como diacetilo, acetona, acetato, acetaldehído y etanol. Los productos de degradación de la lactosa: ácidos volátiles (acético, propiónico, butírico, etc.), cetonas (diacetilo) y ésteres, son sápidos y odorantes (Cogan y Hill, 1993; Escamilla-Hurtado et al., 1996; Henriksen y Nilsson, 2001; Syu, 2001; Melchiorsen et al., 2002). En la concentración adecuada el ácido láctico imparte un sabor refrescante a los quesos frescos. El ácido láctico y el ácido acético son resultado de glicólisis, los cuales causan disminución en el pH del queso y pueden causar la formación de sabores desagradables. Por lo tanto, el sabor de quesos con bajo contenido de lactosa se describe como limpio y suave (Fox et al., 2000; Forde et al., 2000). El acetato puede contribuir en el sabor del queso. El acetato se produce de la oxidación del lactato, y depende de la población de bacterias ácido lácticas no iniciadoras y de la disponibilidad de oxígeno. El acetato también se puede producir de lactosa y citrato por bacterias iniciadoras o de aminoácidos por bacterias iniciadoras y lactobacilos. Altas concentraciones de acetato pueden causar off-flavors (Fox et al., 2000). 8 ANTECEDENTES Cepas de Lactococcus lactis subsp. lactis y Leuconostoc spp metabolizan el citrato a diacetilo en presencia de azúcares fermentables durante la producción y maduración temprana. Por lo tanto, el diacetilo es un compuesto de aroma significativo para quesos no madurados (Fox et al., 2000). 2.2.3 Lipólisis La grasa en la leche es esencial para el desarrollo de sabor ya que los lípidos son muy importantes para el sabor de queso por dos razones. La primera razón es la función de los lípidos como solventes para compuestos aromáticos que se forman a partir de lípidos, proteínas y lactosa. Sin embargo, los lípidos también pueden absorber del ambiente compuestos que causan offflavors. La segunda razón es que son la fuente de ácidos grasos de cadena corta que tienen sabores fuertes y característicos (Fox et al., 2000; Curioni y Bosset, 2002). Los ácidos grasos son producidos por la lipólisis y una proporción menor de ácidos grasos libres se originan a partir de la degradación de lactosa y aminoácidos (Fox et al., 2000; Curioni y Bosset, 2002). Estas reacciones dependen de la acción de lipasas endógenas de la leche o de la acción de lipasas microbianas. Los ácidos grasos de cadena más corta también se pueden derivar a partir de cetonas, ésteres y aldehídos por oxidación. Sin embargo, la intensa lipólisis en queso es indeseable por el desarrollo de rancidez (Bosset y Gauch, 1993; Fox et al., 1995). Aunque los lípidos en queso pueden ser oxidados o hidrolizados, la oxidación es poco probable por el bajo potencial redox en quesos. La hidrólisis de los triglicéridos de la leche forma ácidos grasos de cadena corta e intermedia, éstos junto con la formación de compuestos volátiles, están directamente relacionados con el sabor de queso (Delgado et al., 2009). En general, los ácidos grasos de cadena larga (>12 átomos de carbono) tienen características de sabor menores que los de cadena corta e intermedia (C4-C12). Por ejemplo, el ácido acético y propiónico tienen olor típico a vinagre, el cual tiene importancia para el sabor de muchos quesos (Curioni y Bosset, 2002). El ácido acético puede resultar del catabolismo de lactosa, citrato, aminoácidos, o de la fermentación del ácido propiónico. Además, el ácido propiónico, butírico, hexanóico y ácidos grasos volátiles de cadena ramificada son importantes para el sabor de algunos tipos de queso. El ácido propiónico es el producto final de la fermentación de la lactosa por propionobacterias. El ácido butírico puede originarse del catabolismo de triglicéridos y de la fermentación de lactato por clostridios. El ácido hexanóico es liberado por la lipólisis de triglicéridos. Los ácidos grasos volátiles de cadena ramificada son ácido 2metilpropanóico (isobutírico), 2-metilbutanóico, 3-metilbutanóico (isovalérico), resultado del catabolismo de los aminoácidos valina, isoleucina y leucina respectivamente (Beuvier y Buchin, 2004). 9 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ En algunos quesos que tienen alto potencial redox, los aldehídos insaturados que tienen sabor fuerte y son causantes de defectos en el sabor, pueden ser originados por la oxidación de ácidos grasos poliinsaturados (Fox et al., 2000). Los ácidos grasos también son precursores de metilcetonas, alcoholes, lactonas y ésteres, los cuales tienen influencia importante en el sabor de queso (Azarnia, 2006; Beuvier y Buchin, 2004). Por ejemplo, el metabolismo de ácidos grasos por Penicillium spp. en queso incluye la liberación de ácidos grasos por sistemas lipolíticos, oxidación de β-cetoácidos y la reducción de metilcetonas correspondientes a alcoholes secundarios bajo condiciones aerobias (Fox et al., 2000). Por lo tanto, sus niveles dependerán del balance entre la producción y la degradación, el cual depende a su vez del grado de madurez del queso (Beuvier y Buchin, 2004). Las cetonas, especialmente las metilcetonas, tienen olores característicos importantes para el aroma de los quesos madurados por hongos en la superficie y para quesos azules (Curioni y Bosset, 2002). La concentración de metilcetonas está relacionada con la lipólisis. En la superficie de quesos madurados, estos compuestos son originados por la actividad enzimática de Penicillium roqueforti, Penicillium camemberti o Geotrichum candidum en cetoácidos. Los cetoácidos están naturalmente presentes a bajas concentraciones en la grasa de la leche (Fox et al., 2000; Curioni y Bosset, 2002). Las lactonas poseen un aroma fuerte y tienen un rol importante en el sabor del queso (Fox et al., 2000). Las lactonas se producen por la liberación de cetoácidos por lipólisis, seguido de reducción hasta hidroxiácidos y su ciclación espontánea (Fox et al., 2000; Beuvier y Buchin, 2004). La presencia de lactonas en el queso está relacionada directamente con la alimentación del animal (Beuvier y Buchin, 2004). 2.2.4 Otros Los ésteres juegan un papel importante en el sabor del queso. Tienen aroma dulce, frutal y floral. En especial los etil ésteres juegan un papel importante en la formación del sabor frutal en el queso (Curioni y Bosset, 2002; Beuvier y Buchin, 2004). Se sabe que las reacciones de esterificación ocurren entre ácidos grasos de cadena corta a mediana y alcoholes primarios y secundarios (Curioni y Bosset, 2002). Los ácidos grasos reaccionan con grupos de alcohol para formar ésteres como butanoato de etilo, hexanoato de etilo, acetato de etilo, octanoato de etilo, decanoato de etilo y hexanoato de metilo (McSweeney et al, 1997). Los alcoholes tienen efecto en el sabor de la mayoría de los quesos. Molimard y Spinnler en 1996 afirmaron que muchas vías metabólicas están implicadas en la biosíntesis de los alcoholes, 10 ANTECEDENTES como el metabolismo de la lactosa, la reducción de metilcetonas y el metabolismo de aminoácidos, así como la degradación de los ácidos linoléico y linolénico (Curioni y Bosset, 2002). La presencia de la microflora nativa en leche afecta la producción de alcoholes en quesos (Beuvier y Buchin, 2004). Los aldehídos son compuestos aromáticos importantes para el sabor del queso. Los aldehídos se originan de los aminoácidos por transaminación o por degradación de Strecker, la cual incluye reacciones no enzimáticas durante la maduración. Los aldehídos son compuestos transitorios en queso porque son reducidos rápidamente a alcoholes primarios u oxidados a sus ácidos correspondientes (Curioni y Bosset, 2002). Los compuestos volátiles de azufre juegan un papel importante en el sabor de queso. Éstos son el sulfuro de hidrógeno (H2S), dimetilsulfuro [(CH3)2S], dimetildisulfuro (CH3-S-S-CH3) y metanotiol (CH3SH) los cuales se encuentran en la mayoría de los quesos. Los compuestos de azufre en queso derivan de los aminoácidos azufrados. Estos compuestos tienen olores fuertes a ajo y a queso maduro (Fox et al., 2000; Beuvier y Buchin, 2004). 2.2.5 Adición de cultivos El desarrollo de aroma en quesos resulta de las actividades metabólicas de las bacterias presentes, por glicólisis, lipólisis y proteólisis. Para responder a la creciente demanda de productos con las características de aroma mejorado, se han usado de manera prometedora cepas para la madurar los quesos con un aumento en la producción de sabor (Marilley et al., 2004). Durante la elaboración de algunos tipos de queso, el inicio del proceso de fermentación comienza con la adición de cultivos iniciadores en la leche. Se utilizan microorganismos iniciadores mesófilos y termófilos, con temperaturas óptimas de crecimiento entre 30 y 45 °C, respectivamente. Los iniciadores termófilos se adicionan para la producción de quesos semiduros y duros. Algunas de las bacterias ácido lácticas termófilas iniciadoras utilizadas son Streptococcus salivarius subsp. thermophilus, Lactobacillus helveticus, Lactobacillus delbrueckii subsp. lactis, mientras que Lactococcus lactis subsp. cremoris, Lactococcus lactis subsp. lactis, Leuconostoc lactis y Leuconostoc mesenteroides subsp. cremoris se usan como iniciadores mesófilos (Cogan y Hill, 1993). En una amplia variedad de quesos, las bacterias ácido lácticas contribuyen al sabor mediante la acción de las células vivas y, cuando ocurre lisis, mediante la liberación de material 11 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ intracelular que incluye enzimas como peptidasas y enzimas catalíticas a la matriz del queso (Garde et al., 2007). El uso de cultivos adjuntos productores de bacteriocinas ha demostrado un desarrollo más rápido de la intensidad de sabor (Garde et al., 2007). Algunas cepas de L. lactis productoras de bacteriocinas han sido evaluadas en la manufactura de diferentes variedades de queso. Seguido de su adición el microorganismo comienza su actividad peptidolítica y de transaminación, que son factores clave en la formación de compuestos de aroma y sabor (Alegría et al., 2010). Durante la elaboración de queso, L. lactis se enfrenta a varias condiciones de estrés que afectan su actividad metabólica y por lo tanto, la formación de textura y sabor (Yvon et al., 2011). L. lactis posee un complejo sistema proteolítico que junto con otras enzimas convierten la caseína en péptidos y aminoácidos. Los aminoácidos son los precursores clave de la formación de compuestos volátiles de sabor, una vez que son metabolizados en aldehídos, cetonas, amidas, alcoholes y compuestos sulfurados (Gutierrez-Méndez et al., 2008). L. lactis es capaz de producir compuestos volátiles de cadena ramificada, derivados del catabolismo de aminoácidos de la leche (Centeno et al., 2002). Se ha visto que los principales mecanismos de adaptación en el ambiente de un queso están mediados por la acidificación del medio y el requerimiento de aminoácidos (Yvon et al., 2011). 2.3 Lactococcus lactis UQ2Rif Lac+ La presencia de cultivos iniciadores no es suficiente para explicar la formación del sabor en quesos, pues la flora nativa juega un papel importante. De hecho, algunas características de sabor sólo se observan en productos lácteos artesanales y se detectan en muy bajas cantidades en quesos procesados industrialmente (Centeno et al., 2002). Mauriello et al. (2001) mostraron que la producción de compuestos volátiles responsables del sabor varían entre Lactococcus, Streptococcus, Enterococcus, Lactobacillus (mesófilos y termófilos) y en algunos casos varía entre cultivos. Ayad et al. (1999) enfatizan que Lactococcus nativo aislado de productos lácteos y no lácteos producen sabores específicos diferentes a los que producen cepas industriales. Wouters et al. (2002) demostraron que distintos Lactococcus nativos muestran características sensoriales más pronunciadas que las cepas iniciadores industriales. En estudios recientes sobre la flora asociada en queso fresco, utilizando leche pasteurizada y sin pasteurizar para su elaboración, se encontró que la cepa Lactococcus lactis está presente 12 ANTECEDENTES para ambos quesos, pudiendo contribuir con las características sensoriales del queso. Otras cepas que fueron identificadas molecularmente fueron Leuconostoc mesenteroides y Enterococcus faecium, de las cuales se ha reportado su capacidad para desarrollar características sensoriales asociadas con el queso tradicional (Renye et al., 2008). Lactococcus lactis, es una bacteria ácido láctica mesófila capaz de fermentar la lactosa produciendo ácido láctico en gran cantidad, se utilizan diversos medios para su cultivo (Salminen y Von Wright, 1993). Es ampliamente utilizada en fermentaciones alimentarias, como en la producción de queso y mantequilla, pero en los últimos años se ha estudiado la fisiología y genética de esta bacteria debido a que se han encontrado diversas aplicaciones de los metabolitos que produce (Mireau et al., 2005). Lactococcus lactis UQ2, es una cepa nativa aislada de un queso panela de la región y es productora de nisina A (García-Almendárez et al., 2008). L. lactis UQ2 puede ser usado como cultivo protector para mejorar la calidad de quesos frescos, además de contribuir a mejorar las características sensoriales del producto (García-Parra et al., 2009). En estudios previos se ha observado el crecimiento de L. lactis UQ2 utilizando leche como 7 medio de cultivo donde alcanza una población máxima de 10 UFC/mL y una producción entre 3 y 5 UI/mL de nisina (García-Parra et al., 2010). Por su baja producción de nisina se realizó una modificación por transconjugación de L. lactis UQ2, la cual es aceptada por la legislación de la Comunidad Europea, para ser utilizada sin perder su grado alimenticio. Lactococcus lactis NCDO712 contiene un plásmido, el pLP712 con un peso de 56.5 kb, que proporciona la capacidad de utilizar las proteínas de la leche, así como de llevar a cabo la hidrólisis de la lactosa. Este plásmido fue trasferido por conjugación a la cepa nativa L. lactis UQ2. La cepa modificada se denominó Lactococcus lactis UQ2Rif Lac+ (GarcíaParra et al., 2010). 2.4 Sabor de queso inoculado con Lactococcus lactis UQ2Rif Lac+ La diversidad e interacción de la flora asociada en el ecosistema del queso, es uno de los principales factores que contribuyen a su complejo sabor, estas interacciones pueden ser benéficas si resultan en un buen balance del sabor. La comunidad microbiana en un queso es muy compleja, más en el queso elaborado con leche sin pasteurizar que en aquel elaborado con leche pasteurizada, ya que la flora asociada establece la diferencia entre estos dos tipos de queso. La pérdida de la calidad sensorial en queso subsecuentemente está dada por la pasteurización. En 13 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ busca de mejorar estas características sensoriales en queso pasteurizado se han realizado diferentes estudios en relación a la formación del sabor por cepas nativas, en diferentes casos la percepción del sabor producida por cepas nativas fue distinta en dos modelos leche y queso (Peláez y Requena, 2005; Randazzo et al., 2008). En estudios previos se utilizó el cultivo protector Lactococcus lactis UQ2Rif Lac+ en la elaboración de quesos con el fin de evaluar la formación de compuestos de sabor durante la vida de anaquel. Se realizaron 4 tratamientos: pasteurizado-con inóculo (P-CI), sin pasteurizar-con inóculo (SP-CI), pasteurizado-sin inóculo (P-SI) y sin pasteurizar-sin inóculo (SP-SI) (Ochoa, 2011). Se identificaron 38 compuestos durante el almacenamiento de los quesos producidos y se evaluaron mediante un análisis estadístico de componentes principales (ACP) (Figura 2). Los diferentes tipos de queso: pasteurizado-con inóculo (P-CI), sin pasteurizar-con inóculo (SP-CI), pasteurizado-sin inóculo (P-SI) y sin pasteurizar-sin inóculo (SP-SI) mostraron tendencias diferentes. El queso elaborado P-CI, se encuentra determinado por alcoholes, cetonas y aldehídos, contrario al queso P-SI el cual está determinado por ácidos y ésteres (Ochoa, 2011). Componente 2 (12.4 %) Octanoato de metilo PSI30 Decanoato de metilo PSI7 PSI21 Acido decanoico Acido octanoico Butanoato de metilo Hexanoato de metilo PSI0 2-Metil 1-propanol 3-Hidroxi 2-butanona 2-Nonanona Fenil etil alcohol 3-Metil 1-butanol PCI0 PCI7 PCI30 PCI14 PCI21 Hexanal SPCI0 SPSI0 PSI14 Acido butanoico SPCI7 SPCI30 SPCI14 SPCI21 SPSI30 SPSI7 Acido hexanoico SPSI14SPSI21 Componente 1 (77.3 %) Figura 2. Análisis de componentes principales (ACP), tendencia de 38 compuestos identificados para los diferentes tipos de quesos (Ochoa, 2011). PCI: pasteurizado-con inóculo, (SP-CI): sin pasteurizar-con inóculo, (P-SI): pasteurizado-sin inóculo, (SP-SI): sin pasteurizar-sin inóculo 14 ANTECEDENTES La elaboración del queso con y sin adición del cultivo protector así como el empleo de leche pasteurizada y sin pasteurizar determina la tendencia de formación de los componentes de sabor en la matriz del queso (Ochoa, 2011). Dentro de los 38 compuestos seleccionados se encontraron 4 previamente reportados como producidos por Lactococcus lactis: hexanal, 3-metilbutanal, 3-metil-1-butanol y 2-metilpropanol, los cuales podrían estar determinando la orientación del sabor en el queso adicionado del cultivo protector (Ochoa, 2011). Además, sensorialmente se percibe una mejora en el sabor del queso inoculado con la cepa protectora, ya que Piña en 2012, evaluando la preferencia del consumidor por estos quesos, encontró que el queso con 3% de grasa y 0.1% de nivel de inóculo fue el que tuvo mayor preferencia del consumidor en relación a los tratamientos control. Si bien estos estudios mostraron que existe diferencia en el perfil de compuestos de sabor entre los distintos tratamientos y que además se tiene una tendencia a mejorar el sabor, hace falta investigar cuáles son los compuestos importantes involucrados. 2.5 Análisis de los compuestos aromáticos Desde hace tiempo, la investigación del sabor radica principalmente en el estudio de sustancias volátiles de un alimento o de un saborizante. Tanto la industria como los investigadores están muy concentrados en entender el sabor por medio de la búsqueda de todos los posibles compuestos responsables del sabor de cierto alimento, ya que como se conoce, el sabor viene definido por todos aquellos compuestos volátiles. Por otro lado, el aroma de un alimento es muy complejo, incluso el aroma más ligero es clave para la percepción, sin embargo, un simple resfriado podría privar al cerebro de los estímulos de aroma, que es pieza importante para la percepción del aroma, dejando a la percepción del sabor con los sabores básicos (salado, ácido, dulce, amargo) y respuestas quimiostéticas. Sin aroma es muy difícil identificar el sabor de un producto, así que es justificable tanta atención por parte de los académicos y de la industria hacia la comprensión del sabor a partir del aroma (Reineccius, 2006). La industria y los académicos están comenzando a extender sus definiciones de sabor para incluir otras estímulos sensoriales, entre los más notables, el sabor, quimiostéticas, textura y apariencia (Reineccius, 2006). El estudio del aroma comprende varios factores que constituyen un reto analítico. Entre estos factores se encuentran la baja sensibilidad de la instrumentación analítica comparada con la alta sensibilidad del sentido del olfato, el cual tiene un límite de detección teórico cercano a 10 -19 moles (Reineccius, 2006), nivel mucho menor que cualquier detector instrumental, lo cual sumado al amplio rango de concentraciones en las cuales se encuentran los componentes responsables 15 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ del aroma (0,1-15 mg/kg), la diversidad de funciones químicas, el gran número de componentes y la inestabilidad de algunos analitos, conllevan a que un solo método de separación o análisis no sea suficiente para proveer un panorama completo de los componentes responsables del aroma. Además, estas características hacen que el análisis de todos los componentes del aroma de un alimento merezcan un estudio “bioguiado” para enfocar los esfuerzos de identificación y cuantificación en aquellos componentes volátiles capaces de interactuar con las proteínas receptoras en el bulbo olfativo humano y determinar así los compuestos activos olfativamente y diferenciar aquellos que son clave en el aroma del alimento (Molyneux y Schieberle, 2007). No hay método que asegure extraer completamente el aroma de un alimento y de igual forma, ninguno lo hará de la misma manera, para ello, tiene que tenerse en mente cuál es el objetivo, para poder emplear un método de extracción adecuado. En la Figura 3, se puede observar que ningún método logra extraer al máximo todos los compuestos, hay algunos que lo hacen para los últimos compuestos (entendiendo por éstos a los que se encuentran en la parte final de un cromatograma), pero otros que lo hacen para la otra parte. Es decir, para construir un perfil completo del aroma es necesario combinar varios métodos de extracción (Reineccius, 2006). Figura 3. Rango de recuperación de compuestos volátiles mediante diferentes métodos de separación de compuestos volátiles. (Leahy, M.M., G.A. Reineccius, 1984). (ET-etanol, PRO-propanol, BAL-butil alcohol, OCT-octano, DEC-decano, EPR-propionato de etilo, EBU-butirato de etilo, EVA-valerato de etilo, HEP-heptanona, ACE-acetofenona, BAC-acetato de benzilo, MSA-salicilato de metilo, CAR-carvona, ION-β-iononona, MAN-antranilato de metilo, EMP-etilmetilfeniglicidato, IEU-isoeugenol. El análisis de los compuestos de un aroma comienza con la separación de la fracción volátil a partir del alimento. Para el estudio del aroma global, es imprescindible que el aroma del extracto sea idéntico o al menos muy similar al del alimento objeto de estudio y que no haya cambiado por transformaciones térmicas o enzimáticas. De tal forma que mediante una evaluación olfativa primero se debe confirmar que el extracto obtenido cumpla esta condición antes de hacer cualquier otro análisis químico (Schieberle, 1995). 16 ANTECEDENTES Entre las técnicas comúnmente usadas se pueden mencionar procesos de concentración del headspace (HS), extracción por procesos de absortividad y métodos con solventes por extracción o destilación (Schieberle, 1995). 2.5.1 Espacio de cabeza (Headspace, HS) Un análisis de espacio de cabeza en el equilibrio por encima del alimento resulta ser un análisis conveniente para el estudio de los aromas. Es muy fácil, manejable, simple y fácilmente automatizable. En este análisis se coloca el alimento dentro de un frasco de vidrio que tenga tapa de “septum” inerte, comúnmente compuesto de teflón, que permita llegar al equilibrio entre el alimento y el espacio de cabeza, en un periodo de 30 min a 60 min; después se colecta una muestra del gas del espacio de cabeza dentro de una jeringa y se hace una inyección directa en el cromatógrafo de gases (CG). Sin embargo, la primera limitación es la falta de sensibilidad, empezando por el volumen de inyección ya que se limita únicamente a 10 ml o menos; sólo los -6 compuestos volátiles presentes que excedan la concentración de 10 g/L (en el espacio de cabeza) -4 serán detectados por el CG, y sólo aquellos que excedan de 10 g/L serán adecuados para la identificación en el espectrómetro de masas. Sin embargo, la concentración de la mayoría de los -4 -10 compuestos en los alimentos están en el rango de 10 g/L a 10 g/L (o menos), de esta forma sólo los componentes más abundantes serán detectados de manera directa por el muestreo de headspace (Reineccius, 2006). Los componentes trazas necesitarán algún método de headspace de concentración, el cual permita un muestreo de grandes volúmenes de espacio de cabeza, así como una compensación de las bajas concentraciones (Reineccius, 2006). Otra desventaja de este método es que representa cierta dificultad en usarlo como método cuantitativo ya que la sensibilidad que se puede obtener por este método es baja, la cual podría ser enriquecida por adición de sales, ya que por su alta afinidad a soluciones acuosas del producto despojarían a los compuestos volátiles de los sitios de atrapamiento de la matriz, llevando consigo a los compuestos de aroma al headspace (Reineccius, 2006). 2.5.2 Microextracción en fase sólida (SPME) La microextracción en fase sólida es una técnica nueva, rápida, robusta y no necesita de una extracción de solventes o de alguna preconcentración de los compuestos volátiles y semivolátiles. Utiliza una partición de componentes orgánicos entre la masa acuosa, la fase vapor y la película polimérica de sílica fundida dentro del aparato de la microextracción en fase sólida (SPME, por sus siglas en inglés). La técnica fue descrita por primera vez por Berlardi y Pawliszyn para el análisis ambiental de componentes químicos en el agua. En los subsecuentes años, numerosos reportes 17 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ han aparecido, para problemas ambientales, ciencia forense, toxicología, botánica, microbiología, entomología, sabores de alimentos, fisicoquímica y estudios fundamentales de la técnica de SPME (Harmon, 2002). La técnica de microextracción en fase sólida es independiente de la forma de la matriz. Líquidos, sólidos y gases pueden ser muestreados rápidamente. La técnica SPME es una técnica de equilibrio y asegura los requerimientos cuantitativos que según las condiciones de extracción pueden ser controladas cuidadosamente. Cada componente químico se comporta diferente dependiendo de su polaridad, volatilidad, coeficiente de partición en compuestos orgánicos/agua, volumen de la muestra en el espacio de cabeza, la velocidad de agitación, el pH de la solución y la temperatura de la muestra. La incorporación de un estándar interno en la matriz y la adherencia a tiempos de muestreo establecidos usualmente resulta en una excelente correlación cuantitativa. Considerando que la técnica de SPME no requiere el uso de solventes ni el calentamiento forzado de la muestra, la formación de artefactos químicos es reducida de forma considerable, aunque no eliminada completamente (Harmon, 2002). El proceso de la microextracción en fase sólida es ilustrado en la Figura 4, donde la muestra es colocada dentro de un vial o algún otro contenedor apropiado que está sellado con un septum. La fibra normalmente debería limpiarse antes de cualquier análisis porque la fase polimérica puede absorber químicos del aire y producir picos falsos en el cromatograma. La limpieza puede llevarse a cabo en poco minutos, con la sola inserción de la fibra dentro de un puerto de inyección sobre el cromatógrafo de gases (Harmon, 2002). PROCEDIMIENTO DE EXTRACCIÓN Retirar fibra y Perforar el septum Exposición de la jeringa del contenedor de la fibra SPME/extraer muestra analitos PROCEDIMIENTO DE DESORCIÓN Perforar el septum del puerto de inyección del CG Retirar fibra y jeringa Exponer fibra/desorber Figura 4. Secuencia de eventos que muestran los pasos para la extracción por medio de SPME. (Harmon, 2002). 18 ANTECEDENTES 2.6 Identificación olfativamente de compuestos activos La identificación de los compuestos activos olfativamente involucra la comparación de los siguientes parámetros: los índices de retención en al menos dos columnas de diferente polaridad, el valor del umbral de olor, la nota olfativa y el espectro de masas de los analitos contra los obtenidos para sustancias de referencia bajo las mismas condiciones de estudio. Si el componente de referencia no se encuentra disponible, se requiere realizar su síntesis para corroborar esta identificación mediante la comparación de los parámetros analíticos y olfativos antes mencionados 1 13 e inclusive la comparación de sus espectros de RMN H y C (Schieberle, 1995). 2.7 Cuantificación olfativamente de compuestos activos El método convencionalmente usado en la cuantificación de compuestos del aroma, es la adición de un estándar interno, cuyas propiedades físicas y químicas sean semejantes a las del analito a cuantificar y luego la determinación de la relación de un comportamiento cromatográfico o espectral determinado. Sin embargo, esta cuantificación es aproximada por cuanto el estándar no reproduce exactamente las propiedades del analito (Schieberle, 1995). 2.7.1 Adición de estándar interno múltiple El estándar interno es una sustancia que se añade a todas las muestras y estándares en cantidad conocida y a la vez en cantidad suficiente para ser determinado sin problemas. Es decir, es una sustancia patrón. La sustancia patrón también puede ser un componente mayoritario de las muestras que esté en una concentración suficientemente elevada para que pueda ser la misma en todos los casos (Lorenzo, 2006). Los métodos basados en la adición de un estándar interno generalmente se utilizan cuando el analista está interesado en la concentración de uno o algunos de los componentes y el método de análisis es susceptible a errores tanto sistemáticos como al azar. El método está basado en que cuando las señales del analito y del estándar interno responden proporcionalmente a las fluctuaciones del método y del instrumento empleado, entonces la razón de estas señales es independiente de dichas fluctuaciones. De esta forma el método compensa por errores provenientes de la manipulación de la muestra por analizar, ya que se minimizan los errores instrumentales debido a que el analito y el estándar varían de la misma forma (Lorenzo, 2006). 19 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Para hacer la representación gráfica, se calcula el cociente entre la respuesta del analito y la respuesta del estándar interno y en la gráfica se representan frente a las concentraciones de los patrones. En el eje y se representan la relación de respuestas y en el eje x la concentración del analito. Si la concentración del estándar interno es constante en las disoluciones con diferentes concentraciones de analito, la curva de calibración será lineal (Lorenzo, 2006). La dificultad para llevar a cabo este método es encontrar a la sustancia con las condiciones adecuadas para ser el estándar interno, ya que se requiere que dé una señal similar a la del analito pero a la vez que sea lo suficientemente diferente como para que el instrumento pueda diferenciarlas. También se debe asegurar que no haya estándar interno en la matriz de la muestra para asegurar que la única procedencia del patrón sea la cantidad añadida. Es importante que la señal sea reproducible, así como que el estándar sea una sustancia estable y de alta pureza que genere una señal similar a la del analito (Lorenzo, 2006). 2.7.2 Adición de estándar en matriz real con estándares internos múltiples Para realizar el método de adición de estándares internos múltiples en matriz real se realizan curvas de calibración donde se añaden una serie de soluciones que contienen igual cantidad del estándar interno e incrementos en la cantidad del analito a la muestra real, de manera que todas tengan una concentración de analito que es la suma de la original y la añadida (Lorenzo, 2006). Se obtiene una señal para cada alícuota y se representan en función de las concentraciones del estándar añadido. Así, se obtiene una recta de calibración. Si se comparan las gráficas de calibración externa o normal y la obtenida por adiciones patrón, se ve que es paralela a la obtenida con estándares puros, es decir, con la misma pendiente, significa que no hay efectos de matriz (interferencias) (Lorenzo, 2006). La concentración de analito en la muestra se obtiene por extrapolación de la recta de calibrado, con lo que la precisión es menor que si se calculara por interpolación, como en el método de estándar externo. Una desventaja de este método es que se requiere más tiempo para realizar las adiciones y las medidas, pero la ventaja es que se puede comprobar que se cumple la relación lineal entre la respuesta y la concentración del analito (Lorenzo, 2006). 20 ANTECEDENTES Figura 5. Representación gráfica del método de adición de estándar en matriz real. 2.7.3 Estándares externos Un estándar externo se prepara por separado de la muestra. En cambio, un estándar interno se añade a la muestra. Los estándares externos se usan para calibrar instrumentos y procedimientos cuando no hay efectos de interferencia de la matriz de componentes sobre la disolución del analito. También pueden usarse para calibrar un análisis en el que el analista tiene suficiente control sobre las condiciones como para que la contribución producida por los interferentes sobre las medidas puedan mantenerse constantes; así puede realizarse la oportuna corrección del error determinado por el interferente (Rubinson y Rubinson, 2001). Se prepara una serie de estándares externos que contienen el analito en concentraciones conocidas. Lo ideal es usar tres o más de las disoluciones en el proceso de calibración. No obstante, se puede confiar en calibraciones de dos puntos en algunos análisis de rutina (Skoog et al., 2008). La calibración externa de la respuesta del instrumento se realiza utilizando estándares que contienen distintas concentraciones de analito. En una determinación ideal, sólo las concentraciones de la especie ensayada debería cambiar en una serie de disoluciones estándar (Rubinson y Rubinson, 2001). La calibración se consigue al obtener la señal de respuesta (absorbancia, altura del pico, área del pico) en función de la concentración conocida del analito. Una curva de calibración se prepara con una gráfica de los datos o ajustándolos a una ecuación matemática aceptable, como la ecuación de la recta dada por la pendiente y la ordenada al origen que se usa en el método de los 21 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ mínimos cuadrados lineales. El paso siguiente es la etapa de predicción, en la que se obtiene la señal de respuesta para la muestra y se usa para predecir la concentración desconocida del analito, Cx, a partir de la curva de calibración o de la ecuación con mejor ajuste. La concentración del analito en la muestra original se calcula luego mediante C x aplicando los factores de dilución convenientes tomados de los pasos que se siguieron para preparar la muestra (Skoog et al., 2008). 2.8 Valor de actividad de aroma (OAV) La percepción de la nariz humana hacia los compuestos volátiles liberados de los alimentos, depende de la cantidad de liberación del compuesto de la matriz y de las propiedades de aroma del compuesto. Se sabe que sólo una pequeña parte del gran número de compuestos volátiles que conforman la matriz contribuyen a la percepción global del aroma. Además, estas moléculas no contribuyen igualmente al perfil global del sabor en un alimento, por lo tanto, un pico de cromatografía con área grande (generada por un detector químico) no corresponde necesariamente a altas intensidades de olor, debido a las diferencias en la relación de intensidad/concentración. Por consiguiente, el interés general de los investigadores se ha dirigido a la determinación de la contribución de los componentes individuales al sabor del producto (d'Acampora et al., 2008). En general, la importancia sensorial de un compuesto activo aromáticamente depende de su concentración en la matriz y su límite de detección por la nariz humana. Por otra parte, también debe considerarse el grado impredecible de la interacción de las moléculas de sabor, entre ellas y con otras moléculas, así como con otros constituyentes de los alimentos (lípidos, proteínas, carbohidratos, etc.) (d'Acampora et al., 2008). Una vez identificados y cuantificados aquellos componentes con actividad olfativa en el aroma de un alimento, se busca estimar la importancia de cada componente en cuanto a su aporte a la percepción global. Patton y Josephson (1957) propusieron estimar dicho aporte relacionando la concentración del analito en el aroma del alimento con su valor umbral de olor (odor-threshold), relación actualmente conocida como Odor Activity Value (OAV) o valor de actividad de aroma (Reineccius, 2006). Para ilustrar los beneficios del uso de OAV en la estimación del aporte de cada compuesto al aroma, en la Tabla 1 se presentan los OAVs calculados para algunos compuestos de aroma presentes en queso Camembert. Estos resultados indican que en el aroma del queso camembert el metanotiol es fundamental para lograr el aroma característico de este queso. Sin embargo, este aporte no es únicamente debido a la concentración de este analito, pues su bajo umbral de olor le permite tener un aporte relevante para el aroma. Es así como los OAV del metanotiol, metional, 22 ANTECEDENTES dimetil sulfuro y acetaldehído, indican que estos poseen un aporte importante en el aroma global del queso camembert e inclusive superior al ofrecido por componentes mayoritarios como la 2undecalactona y la δ-decalactona. Sólo aquellos componentes con OAV>1 pueden ser considerados como los más importantes para el aroma global del alimento y por ende ser empleados en los ensayos de recombinación y omisión para la determinación de los componentes impacto del aroma del alimento. Tabla 1. OAV de algunos componentes volátiles del aroma de queso Camembert (Kubícková y Grosch, 1998) Concentración Umbral de olor (µg/Kg) (µg/L) 2,3-Butanodiona 110 10 11 3-Metilbutanal 142 13 11 Metional 125 0.2 625 2-Undecalactona 700 3,400 <1 δ-Decalactona 1080 400 3 Metanotiol 260 0.06 4,333 Dimetil sulfuro 250 1.2 208 Acetaldehído 25 0.22 114 Componente OAV 23 CAPÍTULO 3 Justificación El sabor de un queso no pasteurizado es sumamente importante, pues las notas de sabor y aroma que lo caracterizan son cualidades que el consumidor aprecia y busca. Sin embargo, es incuestionable el riesgo asociado a su consumo debido a la falta de medidas que controlen la inocuidad de este tipo de productos. Además del problema sanitario por la gran variedad de microorganismos presentes en la leche cruda, el proceso de manufactura del queso fresco no es uniforme y varía con la localidad y tradiciones regionales. Una modificación en la microflora inicial que reduce microorganismos y elimina patógenos, se logra con la pasteurización, misma que hace posible una producción de calidad uniforme; pero trae consigo un sabor insípido en el queso. Por lo tanto, poder ofrecerle al consumidor quesos pasteurizados pero con buen sabor (como el de los quesos artesanales) y seguros es muy importante. Es posible mejorar el sabor de manera natural, lograr uniformidad en la calidad del producto e incrementar la vida de anaquel añadiendo cultivos lácticos a quesos pasteurizados, como el Lactococcus lactis UQ2Rif Lac+. Es por esto que conocer y caracterizar el sabor de queso elaborado con Lactococcus lactis UQ2Rif Lac+ permitirá generar un perfil químico que puede ser controlado y monitoreado para producir queso de sabor superior de manera consistente. 25 CAPÍTULO 4 Hipótesis Es posible determinar los compuestos clave para el sabor de un queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ por medio del estudio del perfil químico del sabor. 27 CAPÍTULO 5 Objetivos 5.1 General Determinar los compuestos volátiles importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+. 5.2 Específicos 1) Producir queso panela con y sin adición de Lactococcus lactis UQ2Rif Lac+. 2) Desarrollar una técnica de cuantificación para compuestos volátiles mediante la adición de estándar en matriz real con estándares internos múltiples. 3) Desarrollar una técnica de cuantificación para ácidos grasos libres mediante curva de calibración externa con estándares internos múltiples. 4) Extraer, identificar y cuantificar los compuestos volátiles generados en los quesos por medio de la técnica HS-SPME-GC-MS. 5) Extraer, identificar y cuantificar los ácidos grasos libres (FFA) por medio de extracción por solventes. 6) Determinar los valores de actividad de aroma (OAV) para la fracción volátil. 7) Determinar los valores de actividad de aroma (OAV) para los ácidos grasos libres. 8) Establecer un perfil de compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ considerando los resultados obtenidos por las distintas técnicas de análisis. 29 CAPÍTULO 6 Materiales y métodos 6.1 Activación de L. lactis UQ2Rif Lac+ para su incorporación como inóculo en queso panela L. lactis UQ2Rif Lac+ proveniente de una conserva a -70°C, se colocó en un tubo con caldo M17 adicionado al 0.5% de lactosa y se incubó durante 24 h a 30°C. Una vez activada la cepa, se tomaron 100 L y se inocularon en otro tubo con 5 mL de leche pasteurizada (esterilizada a 112°C/15 minutos) y se incubó a 30 °C por 12 h. El cultivo del último tubo, se inoculó en un matraz conteniendo leche pasteurizada suplementada con soluciones estériles de sulfato de magnesio 0.5 g/L y sulfato de manganeso 0.1 g/L, y se incubó a 30°C por 6 h. La cepa de Lactococcus lactis UQ2Rif Lac+ fue proporcionada por el laboratorio de Biotecnología del Departamento de Investigación y Posgrado en Alimentos de la Facultad de Química. 6.2 Incorporación de L. lactis UQ2Rif Lac+ en la elaboración de queso panela como cultivo protector El queso se elaboró con leche pasteurizada comercial marca Lala, la cual se consiguió en un supermercado local y todos los litros utilizados fueron del mismo lote. La leche se calentó a 30°C y se agregó el inóculo (1% v/v). La leche se dejó reposar por 15 min para asegurar el crecimiento de Lactococcus lactis UQ2Rif Lac+. Transcurrido este tiempo se agregó el cloruro de calcio (0.05 g/L; Baker, Xalostoc, México). Posteriormente se adicionó el cuajo microbiano (0.4 mL/L; QuaLact, México) y se agitó constantemente para lograr su completa incorporación. Se dejó reposar por 15 min favoreciendo la formación de la cuajada. Una vez obtenido el cuajo se cortó por medio de liras en forma horizontal y vertical, se dejó reposar 10 min más para lograr un desuerado lento, manteniendo una temperatura de 32°C. 31 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Se procedió a la eliminación parcial del suero (2/3 del volumen inicial) y la pasta resultante se adicionó con 0.7% de NaCl (Baker, Xalostoc, México) p/v respecto al volumen inicial de leche, seguido de un desuerado total. La pasta obtenida se colocó en moldes, en donde se continuó el desuerado por autoprensado durante 12 h a 4°C. Una vez transcurrido este tiempo el queso se desmoldó y se empacó al vacío (Figura 6). El queso se congeló y se almacenó a -24°C hasta su análisis. El queso control se elaboró de la misma manera, sin la adición de Lactococcus lactis UQ2Rif Lac+. Figura 6. Elaboración de queso panela adicionado con Lactococcus lactis UQ2Rif Lac+. 6.3 Desarrollo de una técnica de cuantificación de compuestos volátiles mediante la adición de estándar en matriz real con estándares internos múltiples Se preparó una solución patrón de estándar de calibración en metanol la cual contenía 17.32 mg/kg de dimetilsulfuro, 8,622.05 mg/kg de 2-metil-1-propanol, 8,225.95 mg/kg de 3-metil-1butanol, 17.69 mg/kg de 1-octanol, 88.16 mg/kg de 3-metilbutanal, 16.75 mg/kg de hexanal, 17.53 mg/kg de nonanal, 17.62 mg/kg de 2-nonanona, 899.29 mg/kg de 2,3-butanodiona, 17.20 mg/kg de 32 MATERIALES Y MÉTODOS 2-heptanona, 18.66 mg/kg de etilbutirato y 18.63 mg/kg de etilhexanoato. La solución patrón de calibración se diluyó en metanol para obtener cuatro puntos más de calibración, hasta obtener las concentraciones que se muestran en la Tabla 2. Se añadieron alícuotas (0.01 g aproximadamente) de las soluciones diluidas a la muestra de queso para obtener las concentraciones finales que se muestran en la Tabla 3. Tabla 2. Concentración real de las soluciones de compuestos de calibración Grupo Compuesto Concentración de calibración funcional Alcoholes (mg/kg) 2-Metil-1-propanol 905.43, 2134.28, 4331.84, 6464.11 y 8622.05 3-Metil-1-butanol 863.83, 2036.23, 4132.84, 6338.93 y 8225.95 1-Octanol 1.86, 4.38, 8.89, 13.73 y 17.69 3-Metilbutanal 9.26, 21.82, 44.29, 69.35 y 88.16 Hexanal 1.76, 4.15, 8.42, 13.18 y 16.75 Nonanal 1.84, 4.34, 8.81, 12.12 y 17.53 Azufrados Dimetil sulfuro 1.82, 4.29, 8.70, 12.61 y 17.32 Cetonas 2-Nonanona 1.85, 4.36, 8.85, 12.90 y 17.62 2,3-Butanodiona 94.44, 222.61, 451.82, 671.87 y 899.29 2-Heptanona 1.81, 4.26, 8.64, 13.15 y 17.20 Etil butirato 1.96, 4.62, 9.38, 13.73 y 18.66 Etil hexanoato 1.96, 4.61, 9.36, 14.21 y 18.63 Aldehídos Ésteres Se preparó una solución patrón de estándar interno en metanol la cual contenía 232.40 mg/kg de cis-6-nonen-1-ol, 24.39 mg/kg de trans-2-octenal, 23.34 mg/kg de dimetil disulfuro, 21.78 mg/kg de 5-hexen-2-ona y 24.06 mg/kg de etil 6-heptenoato. Las curvas de calibración de los compuestos volátiles se construyeron basados en la técnica de adición de estándar (Penton, 1999) y aplicando análisis de regresión lineal del índice de la concentración (µg/kg de compuesto por µg/kg de estándar interno) y el índice del área del pico (área del compuesto/área del estándar interno). El análisis se realizó por triplicado para cada nivel de concentración, en dos columnas: DB-5MS y DB-Wax. Para la cuantificación, se agregaron 0.01 g aproximadamente de la solución de estándar interno a las muestras de queso para obtener una concentración final de 1.35 mg/kg de cis-6nonen-1-ol, 140 μg/kg de trans-2-octenal, 140 μg/kg de dimetil disulfuro, 1.13 mg/kg de 5-hexen-2ona y 140 μg/kg de etil 6-heptenoato; los compuestos volátiles se analizaron siguiendo el 33 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ procedimiento descrito previamente. Las concentraciones se calcularon basándose en el índice del área del pico del compuesto entre el área del estándar interno. Tabla 3. Concentración real de las curvas de calibración para compuestos volátiles en la muestra final de queso Grupo Compuesto Concentración de calibración funcional Alcoholes 2-Metil-1-propanol 5.55, 13.03, 26.34, 39.44 y 49.39 mg/kg 3-Metil-1-butanol 5.30, 12.43, 25.13, 38.68 y 47.12 mg/kg 1-Octanol 10, 30, 50, 80 y 100 μg/kg 3-Metilbutanal 60, 130, 270, 420 y 510 μg/kg Hexanal 10, 30, 50, 80 y 100 μg/kg Nonanal 10, 30, 50, 80 y 100 μg/kg Azufrados Dimetil sulfuro 10, 30, 50, 80 y 100 μg/kg Cetonas 2-Nonanona 10, 30, 50, 80 y 100 μg/kg 2,3-Butanodiona 0.58, 1.36, 2.75, 4.10 y 5.15 mg/kg 2-Heptanona 10, 30, 50, 80 y 100 μg/kg Etil butirato 10, 30, 60, 80 y 100 μg/kg Etil hexanoato 10, 30, 60, 90 y 110 μg/kg Aldehídos Ésteres 6.4 Desarrollo de una técnica de cuantificación de ácidos grasos libres mediante curva de calibración externa con estándares internos múltiples Se preparó una solución patrón de estándar de calibración en hexano-isopropanol 1:1 la cual contenía 300 µg/kg de cada uno de los siguientes ácidos: butanóico, hexanóico, octanóico, decanóico, dodecanóico, tetradecanóico, hexadecanóico y octadecanóico. La solución patrón de calibración se diluyó con hexano-isopropanol 1:1 hasta concentraciones finales de 250, 200, 150, 100, 75 y 50 µg/kg. Se preparó una solución patrón de estándar interno en hexano-isopropanol 1:1 la cual contenía 1.0 g/kg de cada uno de los siguientes ácidos: pentanóico, heptanóico, nonanóico, undecanóico, pentadecanóico y heptadecanóico. 34 MATERIALES Y MÉTODOS Se realizó un análisis de regresión lineal del índice de la concentración (µg/kg de compuesto por µg/kg de estándar interno) y el índice del área del pico (área del compuesto/área del estándar interno). El análisis se realizó por triplicado para cada nivel de concentración. 6.5 Extracción de los compuestos volátiles por SPME La extracción de compuestos volátiles se llevó a cabo utilizando la técnica HS-SPME modificada de Verzera et al. (2004) y de Jae-Hwan et al. (2003). La muestra de queso congelada se rayó finamente y se pesaron 3 g de queso congelado en un vial ambar de 40 mL (I-CHEM). Posteriormente se adicionaron 6 g de agua destilada deodorizada (hervida 30 min) al 25% de NaCl. La muestra se equilibró por 30 min y se evaluó el tiempo de extracción de 30 min, 1 h, 2 h y 3 h para observar la mayor obtención de compuestos volátiles. La extracción se llevó a cabo a 40°C con una fibra de 2 cm de tres fases: DVB/CAR/PDMS (Divinilbenceno/Carboxeno/Polidimetilxilosano) 50/30 µm de espesor de fase (Supelco, Bellefonte, VA, EUA). Durante la extracción se agitó constantemente la muestra con una barra magnética en un plato agitador a 500 rpm. Una vez trascurrido el tiempo de extracción los compuestos fueron desorbidos de la fibra en el puerto de inyección por 8 min a 230°C en modo splitless. Se utilizó un cromatógrafo de gases 7890A (Agilent Techologies, Inc., Wilmington), acoplado a un detector de espectrometría de masas cuadrupolar modelo 5975C (Agilent Techologies, Inc., California, EUA). Se utilizaron dos columnas: una columna capilar DB-Wax (30 m x 250 µm de diámetro, 0.25 µm de espesor de fase, Agilent Technologies Inc., California, EUA) y una columna capilar DB-5MS (60 m x 250 µm de diámetro, 0.25 µm de espesor de fase, Agilent Technologies Inc., California, EUA). El programa de temperatura del horno fue el siguiente: 40°C por 3 min, seguido de un incremento a 180°C con una velocidad de 5°C/min, finalmente un incremento a 230ºC con una velocidad de 20°C/min donde se mantuvo por 5 min. El gas de arrastre utilizado fue helio (pureza 99.999%), a flujo constante dentro de la columna de 1 mL/min. El detector de espectrometría de masas se utilizó en modo de impacto electrónico a 70 eV, con un gain factor de 1, las temperaturas de la línea de transferencia, fuente de ionización y cuadrupolo fueron 250°C, 230°C y 150°C respectivamente, y un rango de masas de 33 a 800 uma. La identificación de los compuestos volátiles se realizó a partir de su espectro de masas, tomando como identificación positiva un 80% de similitud al indicado en la base de datos NIST/EPA/NIH Mass Spectra Library, versión 1.7, USA. 35 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ 6.6 Extracción de ácidos grasos libres La extracción de los ácidos grasos libres se llevó a cabo basándose en la técnica de Chavarri et al. (1997). Se pesaron 10 g de la muestra de queso en un mortero de porcelana. Se añadieron 4 mL de ácido sulfúrico 2 N y 1 mL de la solución de estándar interno y se mezclaron hasta su completa incorporación a la muestra. Se agregaron 40 mL de éter-heptano (1:1 v/v) y se mezclaron por 2 minutos. El sobrenadante se colectó en viales de 20 mL y se congeló hasta su purificación por intercambio iónico. Para la purificación de los ácidos grasos libres se utilizó un cartucho SPE NH 2 Hypersep de 500 mg de fase (Thermo Scientific, Bellefone, VA, EUA), el cual se acondicionó con 10 mL de heptano. Posteriormente se adicionó el extracto de la muestra. Los lípidos neutros se eluyeron de la columna con 5 mL de una mezcla de cloroformo-isopropanol (2:1), y los ácidos grasos libres se eluyeron con 5 mL de ácido fórmico al 2.0% en éter. Se inyectaron 3 µL del extracto con un split 1:1 directamente en el cromatógrafo de gases 7890A (Agilent Techologies, Inc., Wilmington) con detector de ionización de flama (FID). Se utilizó una columna capilar DB-FFAP (30 m x 0.53 µm de diámetro, 1.0 µm de espesor de fase, Agilent Technologies Inc., California, EUA). El programa de temperatura del horno fue el siguiente: 60°C por 2 min, seguido de un incremento a 220°C con una velocidad de 6°C/min. El gas de arrastre utilizado fue nitrógeno (pureza 99.999%), a flujo constante dentro de la columna de 15 mL/min. La temperatura del puerto de inyección y del detector fue de 230 °C. La identificación de los ácidos grasos libres se realizó considerando su tiempo de retención. Las concentraciones se calcularon basándose en el índice del área del pico del compuesto entre el área del estándar interno. 6.7 Determinación de los valores de actividad de aroma (OAV) para los compuestos identificados Los OAV se calcularon dividiendo la concentración de los compuestos de aroma entre su umbral de detección reportados en la literatura (Burdock, 2010). 36 CAPÍTULO 7 Resultados y discusión 7.1 Desarrollo de una técnica de cuantificación de compuestos volátiles mediante la adición de estándar en matriz real con estándares internos múltiples La técnica de adición de estándar en matriz real permite la extrapolación regresiva para calcular la cantidad original de analito presente en la muestra. Se construyeron 12 curvas de calibración para compuestos derivados de la interacción de Lactococcus lactis UQ2Rif Lac+ con la 2 matriz de queso, en dos columnas, obteniéndose buenos coeficientes de correlación (R >93%) (Tabla 4). Tabla 4. Ecuaciones de regresión lineal para compuestos de sabor en queso panela Grupo funcional Alcoholes Aldehídos Compuesto COLUMNA DB-Wax Ecuación Ecuación de R 2 regresión 2-Metil-1-propanol R 2 regresión 0.979 y = 0.363x 0.994 3-Metil-1-butanol y = 0.164x 0.986 y = 0.390x 0.994 1-Octanol y = 0.637x 0.943 y = 5.229x 0.987 y = 0.169x 0.968 y = 0.425x 0.992 Hexanal y = 2.041x 0.954 y = 4.217x 0.997 Nonanal y = 3.100x 0.969 y = 2.562x 0.990 y = 0.165x 0.953 y = 0.557x 0.992 y = 1.383x 0.972 y = 0.704x 0.974 2,3-Butanodiona y = 0.008x 0.991 y = 0.019x 0.995 2-Heptanona y = 1.894x 0.965 y = 1.368x 0.984 y = 0.713x 0.935 y = 6.004x 0.984 y = 2.448x 0.930 y = 2.650x 0.986 3-Metilbutanal Dimetil sulfuro Cetonas 2-Nonanona Etil butirato Etil hexanoato cis-6-Nonen-1-ol de y = 0.036x Azufrados Ésteres Estándar interno COLUMNA DB-5MS trans-2-Octenal Dimetil disulfuro 5-Hexen-2-ona Etil 6-heptenoato 37 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Estos coeficientes indican que todos los puntos observados muestran un comportamiento lineal, es decir, el aumento de la concentración es directamente proporcional al aumento del área obtenida. En base a esta correlación es posible determinar las concentraciones de las muestras a partir de sus áreas de manera confiable. El uso de estándares internos múltiples se ha sugerido para una cuantificación más precisa (Qian y Reineccius, 2003).Cada compuesto, dependiendo de sus características de polaridad y grupo funcional, tendrá diferente afinidad a la matriz de queso. La adición de un estándar para cada grupo funcional presente es especialmente útil para analizar muestras cuya matriz compleja (como el queso) hace altamente probable la presencia de interferencias no espectrales y variacioes en el sistema o proceso de extracción que no son tomadas en cuenta. Es importante destacar que esta técnica no elimina las interferencias sino que las compensa, ya que permite obtener la señal de los estándares y los compuestos de la muestra bajo las mismas condiciones; pues el cociente de las señales del analito y del estándar interno es independiente de dichas fluctuaciones y algunos efectos de la matriz. 7.2 Desarrollo de una técnica de cuantificación de ácidos grasos libres mediante curva de calibración externa con estándares internos múltiples Se construyeron 8 curvas de calibración para ácidos grasos libres derivados de la interacción de Lactococcus lactis UQ2Rif Lac+ con la matriz de queso, obteniéndose buenos 2 coeficientes de correlación (R >91%) lo que indica que todos los puntos observados muestran un comportamiento lineal, es decir, el aumento de la concentración es directamente proporcional al aumento del área obtenida. En base a esta correlación es posible determinar de manera confiable las concentraciones de las muestras a partir de sus áreas (Tabla 5). Tabla 5. Ecuaciones de regresión lineal para ácidos grasos libres en queso panela Ácido 38 Estándar interno Ecuación de regresión R 2 Butanóico Pentanóico y=0.015x 0.989 Hexanóico Heptanóico y=0.018x 0.988 Octanóico Nonanóico y=0.019x 0.983 Decanóico Undecanóico y=0.022x 0.980 Dodecanóico Pentadecanóico y=0.020x 0.914 Tetradecanóico Pentadecanóico y=0.020x 0.926 Hexadecanóico Heptadecanóico y=0.018x 0.953 Octadecanóico Heptadecanóico y=0.012x 0.967 RESULTADOS Y DISCUSIÓN 7.3 Extracción y cuantificación de los compuestos volátiles por SPME Debido a la diferencia de tiempos utilizados en las técnicas de Verzera et al. (2004) y de Jae-Hwan et al. (2003), se evaluó el tiempo de extracción de la muestra (queso con 3.5% de grasa, sin inóculo) de 30 min, 1 h, 2 h y 3 h para lograr mayor sensibilidad en la técnica. Se observó que incrementando el tiempo de extracción aumenta la sensibilidad (Figura 7). Esto concuerda con lo reportado por Vázquez Landaverde et al. (2005), donde se demuestra que el tiempo es el parámetro más significativo que afecta la extracción de compuestos volátiles con fibra SPME para muestras de leche. A las 2 h existe un incremento importante en la extracción de compuestos volátiles comparado con 30 min y 1 h, sin embargo, aumentar el tiempo parece no tener un efecto en la extracción. Por otro lado, de acuerdo a las barras de error, no existe diferencia entre la extracción de 2 h y 3 h, por lo que el tiempo elegido para la técnica de extracción de compuestos volátiles fue 2 h. Otra consideración acerca del tiempo con respecto a la extracción de compuestos volátiles en la técnica SPME es que el aumento del tiempo durante la extracción en el headspace puede concentrar ciertos compuestos volátiles, con el desplazamiento simultáneo de otros (Wercinski y Pawliszyn, 1999; Dufour et al., 2000; Pinho et al., 2002). Esto puede llevar a la exclusión progresiva de algunos compuestos importantes de bajo peso molecular. 30 min 1h 2h 3h 9,000,000,000 8,000,000,000 Área total (UA) 7,000,000,000 6,000,000,000 5,000,000,000 4,000,000,000 3,000,000,000 2,000,000,000 1,000,000,000 0 Figura 7. Efecto del tiempo de extracción en los compuestos volátiles de queso panela 39 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ En el queso control se cuantificaron 9 alcoholes, 6 aldehídos, 4 compuestos de azufre, 19 cetonas, 33 ésteres, 3 éteres, 2 pirazinas, 3 terpenos, 12 compuestos aromáticos y 22 hidrocarburos; haciendo un total de 113 compuestos. En el queso inoculado con L. lactis UQ2Rif Lac+ se cuantificaron 11 alcoholes, 10 aldehídos, 4 compuestos de azufre, 15 cetonas, 13 ésteres, 5 éteres, 4 terpenos, 8 compuestos aromáticos y 26 hidrocarburos alifáticos; haciendo un total de 96 compuestos. Se puede observar que para el queso control los grupos funcionales con mayor cantidad de compuestos volátiles son las cetonas y los ésteres. Se cuantificaron un total de 19 cetonas, perteneciendo la mayoría al grupo de metilcetonas. Las cetonas son los constituyentes comunes en la mayoría de los productos lácteos y se consideran una fracción importante en el perfil de compuestos volátiles de los quesos, principalmente las metilcetonas de C 3 a C15 (prevaleciendo la 2-pentanona, heptanona y 2-nonanona), el diacetilo y la acetoína (Barbieri et al., 1994; Bellesia et al., 2003; Careri et al., 1994; Lee et al., 2003; Qian y Reineccius, 2002a). La mayoría de las cetonas están asociadas a notas a mantequilla, frutales, florales y a hongo (Boscaini et al., 2003; Curioni y Bosset, 2002; Frank et al., 2004: Qian y Reineccius, 2002a; Qian y Reineccius, 2002b). Se cuantificaron un total de 33 ésteres. Los ésteres son compuestos comúnmente encontrados en el queso, resultado de la esterificación entre cadenas cortas y medias de ácidos grasos al igual que de alcoholes primarios y secundarios derivados de la fermentación de la lactosa o del catabolismo de amino ácidos. La mayoría de los ésteres encontrados describen notas dulces, afrutadas y florales. Especialmente los etil ésteres son conocidos por su papel importante en la formación de carácter afrutado en queso. Estos compuestos contribuyen al buen sabor en queso ya que minimizan la acidez y notas amargas que proporcionan los ácidos grasos y las aminas, respectivamente. Los ésteres juegan un importante rol en perfiles de aroma de quesos como: Gorgonzola, Cheddar, Grana, Pecorino y Ragusano (Curioni y Bosset, 2002). Se ha atribuido un papel importante en el aroma de algunas variedades de queso a ésteres como el butanoato de etilo y hexanoato de etilo (Garde et al., 2007). En el queso inoculado con L. lactis UQ2Rif Lac+ los grupos funcionales con mayor cantidad de compuestos volátiles son los alcoholes, aldehídos, cetonas y ésteres con 11, 10, 15 y 13 compuestos respectivamente. Se puede observar que existe un mayor balance entre la cantidad de compuestos volátiles. Numerosas vías metabólicas se encuentran involucradas en la biosíntesis de alcoholes que se encuentran en quesos: el metabolismo de la lactosa, la reducción de metilcetonas, el metabolismo de los aminoácidos al igual que la degradación del ácido linoléico y linolénico. La presencia de alcoholes primarios de cadenas ramificadas como el 3-metil-1-butanol, indican la 40 RESULTADOS Y DISCUSIÓN reducción de aldehídos producidos a partir de leucina, compuesto identificado en queso Mozzarella el cual confiere un agradable aroma a queso fresco (Curioni y Bosset, 2002). Además se ha reportado el 3-metil-1-butanol como un compuesto que se encuentra normalmente en el queso y en algunas variedades puede estar presente en cantidades elevadas, de hecho, este compuesto se ha encontrado predominando en cultivos lácteos de algunas cepas de L. lactis (Centeno et al., 2002). La presencia de alcoholes metilados ha sido asociada con sabores producidos por ciertas cepas de Lactococcus; han sido identificados como compuestos clave del sabor de quesos artesanales y se ha sugerido que en balance con otros compuestos volátiles, contribuyen positivamente al sabor del queso (Morales et al., 2003). Algunos aldehídos provienen de aminoácidos de cadena ramificada como leucina, isoleucina y valina (Centeno et al., 2002). Su síntesis depende de la disponibilidad de los precursores (Morales et al., 2003). El tipo de cultivo influye en la abundancia relativa de los aldehídos encontrados en productos lácteos. Durante la maduración del queso, los aminoácidos son liberados mediante proteólisis. Una vez que los aminoácidos se encuentran en su forma libre, su degradación ocurre fácilmente. Se han identificado diversas aminotransferasas de diversos grupos de bacterias ácido lácticas, incluyendo cepas de L. lactis (Carunchia et al., 2005). La adición de un cultivo protector Lactococcus lactis subsp. lactis INIA 415 productor de nisina Z contribuye a la formación de aldehídos (Garde et al., 2002). 7.4 Determinación de los valores de actividad de aroma (OAV) para los compuestos identificados El valor de actividad de aroma (OAV) es el índice entre la concentración de un compuesto en un producto y el umbral nasal o retronasal del compuesto. La cuantificación de los compuestos y el cálculo de sus OAV es necesario para obtener una estimación más precisa de la contribución de cada uno de los compuestos al sabor del queso. La Tabla 6 muestra los compuestos volátiles obtenidos por la técnica SPME para el queso control y el queso inoculado con L. lactis UQ2Rif Lac+, así como sus OAV. En el queso control los compuestos con valor de actividad de aroma (OAV) mayor a 1 fueron: decanal, heptanal, hexanal, nonanal, octanal, 2,4-ditiapentano, dimetil sulfuro, metanotiol, 2,3-butanodiona, 2-butanona, 2-pentanona, 3-pentanona, etil éster del ácido 3-metilbutanóico, etil éster del ácido butanóico, metil éster del ácido butanóico, etil éster del ácido heptanóico, etil éster del ácido hexanóico, metil éster ácido hexanóico, etil éster del ácido propanóico, D-limoneno y eucaliptol; siendo un total de 21 compuestos (5 aldehídos, 3 compuestos de azufre, 4 cetonas, 7 ésteres y 2 terpenos). 41 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6. Compuestos volátiles identificados en los quesos control e inoculado con Lactococcus lactis UQ2Rif Lac+ analizados por HS-SPME-GC-MS CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis DESCRIPTOR ID ALCOHOLES 1549 1,6-Octadien-3-ol, 3,7dimetil- 000078-70-6 0.005 0.003 0.01 0.511 0.280 806 653 1-Butanol 000071-36-3 0.060 0.000 509 0.000 0.000 1212 734 1-Butanol, 3-metil- 000123-51-3 0.236 48.023 4.1 0.058 11.713 919 1-Heptanol 000111-70-6 0.000 0.014 0.003 0.000 4.779 1373 879 1-Hexanol 000111-27-3 0.023 0.000 20 0.001 0.000 1575 1075 1-Octanol 000111-87-5 0.014 0.511 2 0.007 0.255 1-Propanol 000071-23-8 0.607 0.190 40 0.015 0.005 1-Propanol, 2-metil- 000078-83-1 0.000 8.590 3.3 0.000 2.603 731 1101 42 621 Aroma floral, notas terpénicas, frescas, a producto natural Sabor seco y quemante, olor similar al alcohol amílico Característico a whiskey, olor pungente Fragante, madera, aceite, aromático, olor a grasa y pungente, sabor picante Herbáceo, madera, fragante, dulce, fruta verde, sabor aromático Fresco, olor a rosa, naranja, dulce, sabor herbáceo Olor alcohólico maduro, sabor frutal Olor desagradable, penetrante a vino MS, RI MS, RI MS, RI MS MS, RI MS, RI MS MS, RI RESULTADOS Y DISCUSION Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis 1474 7-Octen-2-ol, 2,6-dimetil- 018479-58-8 0.008 0.005 NR 932 Etanol 000064-17-5 3.339 4.548 10 0.334 0.455 Feniletil Alcohol 000060-12-8 0.000 10.403 3.5 0.000 2.972 Fenol 000108-95-2 0.004 0.003 5.5 0.001 0.001 000432-25-7 0.000 0.004 NR 057266-86-1 002277-19-2 0.000 0.511 0.173 0.000 0.13 25 0.000 0.020 1.334 0.000 1950 1118 1996 DESCRIPTOR Cítrico, lima, herbáceo, floral Sabor quemante Olor característico a rosas, sabor inicial ligeramente amargo, luego dulce y resabio a durazno Olor fuerte repugnantemente dulce e irritante ID MS MS, RI MS, RI MS, RI ALDEHÍDOS 963 1104 1-Cyclohexeno-1carboxaldehído, 2,6,6trimetil2-Heptenal, (Z)6-Nonenal, (Z)- 1648 1050 Bencenacetaldehído 000122-78-1 0.000 1.304 0.004 0.000 325.903 1528 968 Benzaldehído 000100-52-7 0.000 4.821 4.1 0.000 1.176 1229 43 Olor a alcanfor MS, RI Agrio, almendras Olor a melón, cítrico Olor verde, pungente, sabor amargo, a bajas concentraciones se torna dulce y frutal Sabor y aroma característico, similar a la almendra MS, RI MS, RI MS, RI MS, RI Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis 915 646 Butanal, 3-metil- 000590-86-3 0.000 10.409 0.013 0.000 800.654 1501 1209 Decanal 000112-31-2 0.851 0.082 0.002 425.566 40.948 1183 904 Heptanal 000111-71-7 0.278 0.049 0.25 1.112 0.198 1069 803 Hexanal 000066-25-1 0.859 0.494 0.05 17.190 9.874 1400 1107 Nonanal 000124-19-6 3.040 0.431 1 3.040 0.431 1299 1005 Octanal 000124-13-0 0.096 0.291 0.056 1.714 5.197 DESCRIPTOR Olor pungente, a manzana, olor a almendra, animal, frutal Olor penetrante, dulce, floral ,cítrico, a grasa Olor pungente, fuerte, áspero, sabor a grasa Olor fuerte, penetrante, verde, pasto, sabor característico frutal Olor fuerte a grasa, en dilución tiene notas a rosa y naranja. Sabor cítrico Olor a grasa, cítrico, miel ID MS, RI MS MS, RI MS, RI MS, RI MS, RI AZUFRADOS 1918 741 44 892 2,4-Ditiapentano 001618-26-4 0.062 0.023 0.003 20.822 7.667 920 Dimetil sulfona 000067-71-0 0.054 0.048 0.25 0.216 0.193 Dimetil sulfuro 000075-18-3 0.474 0.495 0.01 47.432 49.494 Olor a mostaza Sulfuroso, leche quemada Intenso, rábano crudo, cebolla. Nota verde a bajas concentraciones MS, RI MS, RI MS, RI RESULTADOS Y DISCUSION Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS CONTROL QUESO CON L. lactis 000074-93-1 0.329 0.417 2,3-Butanodiona 000431-03-8 5.336 2,3-Octanediona 000585-25-1 OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis 0.004 82.179 104.244 17.133 0.015 355.724 1142.186 0.018 0.000 NR 2,5-Cyclohexadieno-1,4diona, 2,6-bis(1,1000719-22-2 dimetiletil)- 0.001 0.000 NR 2,5-Octanediona 003214-41-3 0.007 0.000 NR DB-Wax DB-5MS Metanotiol DESCRIPTOR ID Cebolla o ajo en descomposición MS CETONAS 618 1328 1494 1325 a MS a NR 903 600 2-Butanona 000078-93-3 8.928 8.304 5 1.786 1.661 1292 709 2-Butanona, 3-hidroxi- 000513-86-0 0.000 1.338 10 0.000 0.134 1181 893 2-Heptanona 000110-43-0 0.087 0.022 0.14 0.622 0.159 1294 2H-Pyran-2-ona, 6heptiltetrahidro 000713-95-1 0.003 0.023 10 0.000 0.002 1394 1092 2-Nonanona 000821-55-6 0.078 0.149 0.2 0.391 0.746 1295 992 2-Octanona 000111-13-7 0.028 0.007 2.5 0.011 0.003 45 Aroma fuerte mantequilla, placentero Sabor "recalentado" Olor a caramelo, dulce, frutal Olor dulce a albaricoque Olor a madera, yogurt, sabor a crema, mantequilla Olor frutal, picante, canela, plátano Olor fuerte, fresco, cacahuate, mantequilla Sabor a té, rosas, olor a ruda Olor frutal (manzana verde), amargo, verde, alcanforado MS MS MS MS, RI MS, RI MS, RI MS MS, RI MS, RI Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS 678 2-Pentanona 000107-87-9 6.818 QUESO CON L. lactis 21.837 850 3-Hexanona, 2,5-dimetil- 001888-57-9 0.000 797 691 3-Hexen-2-ona 3-Pentanona 4-Octanona, 5-hidroxi2,7-dimetil 000763-93-9 000096-22-0 953 2.964 0.050 0.93 0.000 0.053 Olor herbáceo MS 0.001 4.337 0.003 4.031 0.002 1.1 0.545 3.943 1.572 3.664 Olor herbáceo Olor frutal, etéreo MS MS 006838-51-3 0.000 0.017 NR CONTROL 5-Hepten-2-ona, 6-metil- 000110-93-0 0.013 0.022 0.05 0.267 0.430 1656 1072 Acetofenona 000098-86-2 0.019 0.044 0.17 0.113 0.259 Acetona 000067-64-1 7.343 6.977 40 0.184 0.174 1157 Camfor 000464-49-3 0.013 0.001 1 0.013 0.001 682 Cyclobutanona, 2-etil- 010374-14-8 2.339 0.000 NR 896 Cyclohexanona 000108-94-1 0.007 0.000 197 Cyclohexanona, 5-metil2-(1-metiletil)- 010458-14-7 0.003 0.000 NR 1459 46 Olor frutal, etéreo NR 988 1292 ID 2.3 CONTROL 1344 817 DESCRIPTOR QUESO CON L. lactis 9.494 DB-Wax DB-5MS 972 OAV UMBRAL (mg/kg) MS Olor cítrico, verde, sabor agridulce, resabio a pera Olor fuerte, pungente, dulce, medicina, sabor amargo, aromático a cereza Olor aromático característico, pungente, sabor dulce Aroma etéreo a menta, cálido NR 0.000 0.000 Olor a pimienta NR MS, RI MS MS, RI MS MS, RI MS acetona, MS, RI MS RESULTADOS Y DISCUSION Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis DESCRIPTOR ID ÉSTERES 1122 885 1373 1161 857 1149 1307 1008 1690 1-Butanol, 3-metil-, acetato 000123-92-2 0.000 0.102 0.043 0.000 2.379 1-Etilpentil acetato 005921-83-5 0.089 0.000 10 0.009 0.000 010544-63-5 0.238 0.000 10 0.024 0.000 054340-72-6 0.004 0.000 NR 002396-83-0 0.014 0.000 10 032210-23-4 0.098 0.017 NR 2-Ácido butanóico, etil éster 2-Ácido heptenóico, etil éster, (E) 3-Ácido hexenóico, etil éster 4-tert-Butilciclohexil acetato NR 0.001 0.000 610 Acetato de etilo 000141-78-6 0.642 0.068 5 0.128 0.014 1061 820 Ácido acético, butil éster 000123-86-4 0.009 0.000 0.5 0.017 0.000 Ácido acético, hexil éster 000142-92-7 0.021 0.000 0.48 0.044 0.000 47 Aroma verde, frutal NR 885 1271 Olor fuerte, dulce, frutal a plátano, sabor agridulce con resabio a pera Sabor fuerte, floral, frutal, a geranio Sabor fuerte, agrio, frutal a caramelo Olor frutal etéreo, a brandy, evocando a piña Olor fuerte frutal, sabor quemante y luego dulce con resabio a piña Olor placentero floral, manzana, cereza, pera, sabor agridulce MS, RI MS MS, RI MS MS, RI MS MS, RI MS, RI MS, RI Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS Ácido butanedióico, hidroxi-, dietil ester 1691 1028 866 1027 804 982 714 986 1591 Ácido butanóico, 3-metil, 000108-64-5 etil éster Ácido butanóico, etil 000105-54-4 éster Ácido butanóico, metil 000623-42-7 éster CONTROL QUESO CON L. lactis 0.002 0.000 NR 0.033 0.000 0.0004 83.688 0.000 1.063 0.324 0.18 5.907 1.801 0.088 0.064 0.043 2.052 1.495 0.091 0.000 CONTROL QUESO CON L. lactis 855 Ácido butanóico, propil éster 000105-66-8 0.011 0.000 0.124 613 Ácido carbónico, dimetil éster 000616-38-6 0.000 0.070 NR 1394 Ácido decanóico, etil éster 000110-38-3 0.002 0.000 0.012 1327 Ácido decanóico, metil éster 000110-42-9 0.012 0.002 NR 1543 Ácido dodecanóico, metil 000111-82-0 éster 0.004 0.000 20 0.000 0.000 000106-30-9 0.038 0.000 0.002 18.897 0.000 1000302-89-9 0.028 0.000 NR 000123-66-0 0.791 0.054 0.005 1329 1097 1276 989 1238 1000 48 000626-11-9 OAV UMBRAL (mg/kg) Ácido heptanóico, etil éster Ácido hex-5-enoico, etil éster Ácido hexanóico, etil éster DESCRIPTOR ID NR MS Olor fuerte frutal, vino, a manzana Olor frutal con nota a piña y dulce Olor a manzana, sabor dulce Olor a piña y albaricoque, sabor frutal, dulce, a plátano y piña NR 0.191 0.000 Olor frutal resabio a (cognac) 10.860 MS, RI MS, RI MS MS con uva NR 158.205 MS, RI Olor floral, graso, evocando olor a vino Olor frutal evocando a cognac MS, RI MS, RI MS MS, RI NR MS Olor fuerte frutal con notas a piña-plátano MS, RI RESULTADOS Y DISCUSION Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS CONTROL QUESO CON L. lactis 000106-70-7 0.087 0.029 0.087 003050-69-9 0.057 0.000 NR DB-Wax DB-5MS 1177 929 988 Ácido hexanóico, metil éster Ácido n-capróico, vinil éster OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis 1.003 0.339 Ácido octanóico, etil éster 000106-32-1 0.061 0.002 0.092 0.665 0.021 1125 Ácido octanóico, metil éster 000111-11-5 0.017 0.000 0.87 0.020 0.000 1595 Ácido propanóico, 2metil-, 1-(1,1-dimetiletil)2-metil-1,3-propanediil éster 074381-40-1 0.006 2.875 NR 1060 Ácido propanóico, 2metil-, 3-metilbutil éster 002050-01-3 0.000 0.015 0.014 918 676 Ácido propanóico, 2metil-, metiléster 000547-63-7 0.017 0.000 35 950 706 Ácido propanóico, etil éster 000105-37-3 0.059 0.000 1250 Etil (E)-2-octenoato 007367-82-0 0.007 1048 Etil 2-hexenoato 027829-72-7 Isobornil acetato 000125-12-2 1343 1590 49 Olor etéreo, piña NR 1196 1426 DESCRIPTOR Olor frutal, floral con notas a vino y albaricoque Olor fuerte a vino, frutal, a naranja ID MS, RI MS MS, RI MS, RI NR MS 1.043 Olor frutal con notas remanentes a piña MS 0.000 0.000 Olor frutal a piña, manzana, con notas remanentes a albaricoque MS, RI 0.045 1.308 0.000 Olor a ron y piña MS, RI 0.000 10 0.001 0.000 0.110 0.000 10 0.011 0.000 0.012 0.007 2 0.006 0.004 0.000 Olor frutal, verde con notas a madera Olor frutal, verde, a pulpa de piña y manzana Olor a alcanfor MS, RI MS, RI MS Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L.lactis OAV UMBRAL (mg/kg) CONTROL QUESO CON L.lactis DESCRIPTOR Olor dulce, manzana, piña, verde, frutal Olor frutal, a ron, sabor dulce Olor débil a cebolla, miel, a lirio Olor frutal, pera, sabor agridulce ID 947 Isopentil hexanoato 002198-61-0 0.005 0.000 25 0.000 0.000 622 Metil propionato 000554-12-1 0.154 0.000 8.8 0.017 0.000 1731 Metil tetradecanoato 000124-10-7 0.002 0.000 708 n-Propil acetato 000109-60-4 0.065 0.000 2.7 033100-27-5 000629-14-1 000111-76-2 000060-29-7 0.000 0.286 0.107 0.159 0.097 0.000 0.079 0.107 NR NR NR NR NR NR NR NR MS MS MS MS 053897-30-6 0.000 0.341 NR NR MS 000625-44-5 0.000 0.340 NR NR MS 2,3-Dietilpirazina 015707-24-1 0.176 0.000 10 0.018 0.000 917 Pirazina, 2,5-dimetil- 000123-32-0 0.003 0.000 1.8 0.002 0.000 937 TERPENOS 1R-alfa-Pineno 007785-70-8 0.007 0.063 NR 0.024 0.000 MS MS, RI MS, RI MS ÉTERES 1966 1409 620 1232 706 15-Crown-5 éter Etano, 1,2-dietoxiEtanol, 2-butoxiEtil éter Oxirano, 2-(1,1dimethiletil)-3-metilPropano, 1-metoxi-2metilPIRAZINAS 1454 50 Aroma a nuez, nuez de castilla Olor terroso, a papa Aroma a pino MS MS, RI MS RESULTADOS Y DISCUSION Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis DESCRIPTOR Aroma a madera, picante, seco Olor a limón, naranja Olor característico alcanforado, fresco, pungente, sabor refrescante ID 1452 Cariofileno 000087-44-5 0.000 0.210 0.09 0.000 2.331 MS, RI 1185 1033 D-Limoneno 005989-27-5 0.603 0.252 0.2 3.017 1.261 1195 1037 Eucaliptol 000470-82-6 0.436 0.125 0.064 6.813 1.948 Benceno Benceno, 1,2,3,4tetrametil- 000071-43-2 0.028 0.024 NR NR MS, RI 000488-23-3 0.009 0.000 NR NR MS MS, RI MS, RI COMPUESTOS BENCÉNICOS 650 1121 1266 965 Benceno, 1,3,5-trimetil- 000108-67-8 0.048 0.042 NR NR MS 1174 876 Benceno, 1,3-dimetil- 000108-38-3 0.202 0.028 NR NR MS, RI 1194 965 Benceno, 1-etil-3-metil- 000620-14-4 0.058 0.000 NR NR MS, RI 000099-87-6 0.040 0.054 10 NR MS 000128-37-0 000100-42-5 000100-41-4 000095-47-6 000106-42-3 000108-88-3 0.089 0.050 0.148 0.281 0.371 1.726 0.193 0.000 0.028 0.000 0.002 0.762 NR 0.08 NR NR NR NR NR NR NR NR NR NR MS, RI MS, RI MS, RI MS, RI MS, RI MS, RI 1028 1934 1241 1111 1165 1126 1025 51 1531 869 897 878 756 Benceno, 1-metil-4-(1metiletil)Butilhidroxitolueno Estireno Etilbenceno o-Xileno p-Xileno Tolueno 0.004 0.005 0.619 0.000 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) CONTROL HIDROCARBUROS 1025 807 1,3,5-Cicloheptatrieno 1256 1684 682 1035 788 52 0.193 NR NR MS 0.000 0.057 NR NR MS 0.000 0.000 0.342 0.019 NR NR NR NR MS, RI MS 0.050 0.000 NR NR MS, RI 006874-32-4 0.000 0.037 NR NR MS, RI 007239-23-8 002198-23-4 0.000 0.011 0.015 0.000 NR NR NR NR MS MS 002146-41-0 0.000 0.193 NR NR MS 000694-87-1 0.000 0.035 NR NR MS 000291-64-5 000292-64-8 0.000 0.000 0.017 0.053 NR NR NR NR MS MS 000822-50-4 0.000 1.094 NR NR MS, RI 062238-09-9 0.000 0.052 NR NR MS 038851-69-3 0.008 0.016 NR NR MS 000124-18-5 0.000 0.050 NR NR MS, RI 1-Penteno, 3-etil-2-metil- 019780-66-6 1728 ID 0.000 757 1192 891 1003 000544-25-2 993 1025 2-Octeno, 3,7-dimetil-, (Z)3-Dodeceno, (Z)4-Noneno Biciclo[2.2.1]heptano, 2etilBiciclo[4.2.0]octa-1,3,5trieno Cicloheptano Ciclooctano Ciclopentano, 1,2dimetil-, trans Ciclopropano, 1-hexil-2metilcis-1-Butil-2metilciclopropano Decano DESCRIPTOR NR 1,4,7,10,13,16017455-13-9 Hexaoxaciclooctadecano 1-Deceno 000872-05-9 1-Decino 000764-93-2 971 QUESO CON L. lactis RESULTADOS Y DISCUSION Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DB-Wax DB-5MS 1003 706 ID 0.000 0.102 NR NR MS 1039 Decano, 2,6,8-trimetil- 062108-26-3 0.000 0.014 NR NR MS 1077 1200 1552 1708 017312-54-8 000112-40-3 000112-95-8 000629-78-7 0.056 0.027 0.025 0.000 0.009 0.007 0.002 0.001 NR NR NR NR NR NR NR NR MS MS, RI MS MS, RI 054833-48-6 0.002 0.000 NR NR MS 000142-82-5 0.211 0.017 NR NR MS, RI 013475-82-6 0.018 0.000 NR NR MS 001632-16-2 0.111 0.000 NR NR MS, RI 062108-31-0 0.104 0.000 NR NR MS 000544-76-3 000110-54-3 0.006 0.135 0.002 0.000 NR NR NR NR MS, RI MS, RI 003404-80-6 0.087 0.000 NR NR MS 901 Decano, 3,7-dimetilDodecano Eicosano Heptadecano Heptadecano, 2,6,10,15tetrametil Heptano Heptano, 2,2,4,6,6pentametilHeptano, 3-metilenoHeptano, 4-etil-2,2,6,6tetrametilHexadecano Hexano Hexano, 2-metil-4metilenoNonano 000111-84-2 0.000 0.011 NR NR MS, RI 1036 Nonano, 3-metil-5-propil- 031081-18-2 0.112 0.008 NR NR MS 801 1056 1523 Octano Octano, 2,6-dimetilPentadecano Pentano, 3-metileno- 0.004 0.126 0.004 0.160 0.013 0.000 0.000 0.000 NR NR NR NR NR NR NR NR MS, RI MS MS MS 698 1024 1600 602 837 53 DESCRIPTOR 062108-23-0 784 662 CONTROL QUESO CON L. lactis Decano, 2,5,6-trimetil- 1011 1003 CONTROL QUESO CON L. lactis OAV UMBRAL (mg/kg) 000111-65-9 002051-30-1 000629-62-9 000760-21-4 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Tabla 6 Continuación CONCENTRACIÓN (mg/kg) (CV<7.04%) KOVATS IR COMPUESTO No. CAS DESCRIPTOR ID NR NR MS, RI 1400 Tetradecano 000629-59-4 0.005 QUESO CON L. lactis 0.126 1032 Tetradecano, 2,2-dimetil- 059222-86-5 0.037 0.000 NR NR MS 1305 Tridecano 0.018 0.003 NR NR MS, RI DB-Wax DB-5MS CONTROL 000629-50-5 NR: NO REPORTADO MS: IDENTIFICADO POR ESPECTROMETRÍA DE MASAS RI: IDENTIFICADO POR ÍNDICE DE RETENCIÓN DE KOVATS 54 OAV UMBRAL (mg/kg) CONTROL QUESO CON L. lactis RESULTADOS Y DISCUSION En el queso inoculado con L. lactis UQ2Rif Lac+ los compuestos con valor de actividad de aroma (OAV) mayor a 1 fueron: 3-metil-1-butanol, 1-heptanol, 2-metil-1-propanol, feniletil alcohol, (Z)-2-heptenal, bencenacetaldehído, benzaldehído, 3-metilbutanal, decanal, hexanal, octanal, 2,4ditiapentano, dimetil sulfuro, metanotiol, 2,3-butanodiona, 2-butanona, 2-pentanona, 3-hexen-2ona, 3-pentanona, 1-butanol-3-metil acetato, etil éster del ácido butanóico, metil éster del ácido butanóico, etil éster del ácido hexanóico, 2-metil-3-metilbutil éster del ácido propanóico, cariofileno, D-limoneno y eucaliptol, siendo un total de 27 compuestos (4 alcoholes, 7 aldehídos, 3 compuestos de azufre, 5 cetonas, 5 ésteres y 3 terpenos). Normalmente los compuestos activos aromáticamente con valores altos de OAV suelen ser más importantes para el sabor global, aunque también puede existir sinergia o supresión de aroma por la interacción de los compuestos. En la Figura 8 se muestran los compuestos con los valores de OAV más altos en los quesos control e inoculado con L. lactis UQ2Rif Lac+. 1200 1142 CONTROL 1000 QUESO CON L. lactis 801 OAV 800 600 426 400 356 326 200 0 0 12 0 0 41 17 21 10 8 49 47 158 104 82 84 39 0 19 0 11 Figura 8. Compuestos con los valores de OAV más altos en los quesos control e inoculado con Lactococcus lactis UQ2Rif Lac+ En la Figura 9 se muestran los compuestos que presentan mayor OAV en el queso control comparados con su contraparte en el queso inoculado con L. lactis UQ2Rif Lac+. 55 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Los aldehídos son compuestos transitorios en el queso, ya que se reducen rápidamente a alcoholes primarios o incluso oxidados a los ácidos correspondientes. Los aldehídos de cadena lineal como el hexanal, nonanal y decanal se forman durante la β-oxidación de ácidos grasos insaturados; se caracterizan por aromas herbáceos, pero se vuelven muy desagradables cuando sus concentraciones exceden ciertos niveles (Garde et al., 2007). Sin embargo, se sabe que contribuyen en el sabor del queso debido a sus bajos umbrales de detección y su rápida conversión a los alcoholes correspondientes (Irigoyen et al., 2007). 450 426 CONTROL 400 QUESO CON L. lactis 350 OAV 300 250 200 158 150 84 100 50 41 17 10 21 8 0 19 0 11 0 Decanal Hexanal 2,4-Ditiapentane Ácido butanóico, Ácido heptanóico, Ácido hexanóico, 3-metil-, etil ester etil ester etil ester Figura 9. Compuestos con los valores de OAV más altos en el queso control comparados con su contraparte en el queso inoculado con L. lactis UQ2Rif Lac+ El decanal es un aldehído con olor penetrante, dulce, floral, cítrico y a grasa, con un umbral de 0.002 mg/kg (Burdock, 2010). De acuerdo con Vázquez-Landaverde et al. (2005), la concentración total de aldehídos no es diferente entre la leche cruda y la leche pasteurizada. Además, basándose en el OAV, el nonanal y decanal parecen ser contribuyentes importantes del aroma en leche cruda, pasteurizada y ultrapasteurizada. El decanal ha sido reportado en el perfil de sabor de quesos Cheddar, Ras Egipcio, Bitto, de Cabra Griego y en queso Hispánico (Singh et al., 2003; Ayad et al., 2004; Panseri et al., 2008; Bontinis et al., 2012; Garde et al., 2002). El hexanal es un aldehído con olor fuerte, penetrante, pasto, sabor característico frutal, con un umbral de 0.05 mg/kg. El hexanal además de resultar de la autooxidación de ácidos grasos insaturados puede resultar de la descomposición espontánea de hidroperoxidasas promovidas por calentamiento (Grosch, 1982). El hexanal también puede ser transferido a la leche de la alimentación de la vaca (Scanlan et al., 1968). El hexanal ha sido reportado en el perfil de sabor de 56 RESULTADOS Y DISCUSION quesos Cheddar, Ras Egipcio, Bitto, Parmesano, Camembert y Gouda (Singh et al., 2003; Ayad et al., 2004; Panseri et al., Qian et al., 2003; Kubícková y Grosch, 1998, Smith et al., 2005). Los ésteres son compuestos comúnmente encontrados en queso, resultado de la esterificación entre cadenas cortas y medias de ácidos grasos al igual que de alcoholes primarios y secundarios derivados de la fermentación de la lactosa o del catabolismo de amino ácidos. La mayoría de los ésteres encontrados describen notas dulces, afrutadas y florales. Estos compuestos contribuyen al buen sabor en queso ya que minimizan la acidez y notas amargas que proporcionan los ácidos grasos y las aminas, respectivamente (Curioni y Bosset, 2002). El etil éster del ácido 3-metilbutanóico, (etil-3-metilbutanoato) es un compuesto con olor fuerte frutal, a vino, a manzana, con un umbral de 0.0004 mg/kg; que juega un papel importante en las características sensoriales y el aroma de los quesos Mozzarella y Emmental, ya que se ha visto que la característica de sabor de estos quesos depende principalmente de los ésteres ramificados, además, los etil ésteres son conocidos por su papel importante en la formación de carácter afrutado en queso (Moio et al., 1993; Preininger y Grosch, 1994). El etil éster del ácido hexanóico, (hexanoato de etilo) es un compuesto con notas a piña o plátano, pero también se ha correlacionado positivamente con olor a acre y notas a salado, ácido y picantes como a pimienta. Tiene un umbral de 0.005 mg/kg y juega un importante rol en perfiles de aroma de quesos como: Parmesano, Bitto, Gorgonzola, Cheddar, Grana, Pecorino, Camembert, Emmental, Mozzarella y Ragusano (Panseri et al., 2008; Curioni y Bosset, 2002). Garde y colaboradores en 2002 lo reportaron como un compuesto producido por la incorporación de Lactococcus lactis subsp. lactis INIA 415 productor de nisina Z en queso Hispánico. En la Figura 10 se muestran los compuestos con los valores de OAV más altos en el queso inoculado con L. lactis UQ2Rif Lac+. Numerosas vías metabólicas se encuentran involucradas en la biosíntesis de alcoholes que son encontrados en quesos: el metabolismo de la lactosa, la reducción de metilcetonas, el metabolismo de aminoácidos, así como la degradación de los ácidos linoléico y linolénico (Mollimard y Spinnler, 1996). El 3-metil-1-butanol es un alcohol que presenta notas características a whisky y olor pungente, con un umbral de 4.1 mg/kg. La presencia de alcoholes primarios de cadenas ramificadas como el 3-metil-1-butanol, indican la reducción de aldehídos producidos a partir de leucina (Curioni y Bosset, 2002). Se ha reportado el 3-metil butanol como un compuesto que se encuentra normalmente en el queso y en algunas variedades puede estar presente en cantidades 57 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ elevadas; de hecho, este compuesto se ha encontrado predominando en cultivos lácteos de algunas cepas de L. lactis (Centeno et al., 2002). Es responsable del aroma en quesos suaves, dando notas florales alcohólicas (Mollimard y Spinnler, 1996). La presencia de alcoholes metilados ha sido asociada con sabores producidos por ciertas cepas de Lactococcus, han sido identificados como compuestos clave del sabor de quesos artesanales y se ha sugerido que en balance con otros compuestos volátiles contribuyen positivamente al sabor del queso (Morales et al., 2003). El 3-metil-1-butanol ha sido reportado en el perfil de sabor de quesos Cheddar, Ras Egipcio, Bitto, Parmesano, Mozzarella y Gorgonzola (Singh et al., 2003; Ayad et al., 2004; Panseri et al., 2008; Qian et al., 2003). Garde y colaboradores en 2002 reportaron mayor producción de 3-metil-1butanol en quesos elaborados con cepas productoras de bacteriocinas que en sus respectivos quesos elaborados sin ellas. 1142 1200 CONTROL 1000 801 OAV 800 QUESO CON L. lactis 600 356 326 400 200 0 12 0 0 4749 104 82 3 9 0 Figura 10. Compuestos con los valores de OAV más altos en el queso inoculado con L. lactis UQ2Rif Lac+ comparados con su contraparte en el queso control Los aldehídos ramificados son originados probablemente por la degradación de aminoácidos mediante vía enzimática (Moio et al., 1993), así como a reacciones no enzimáticas (degradación de Strecker) (Griffith y Hammond, 1989). El 3-metilbutanal es un compuesto con olor pungente, a manzana, a almendra, frutal, con un umbral de 0.013 mg/kg. Proviene de la leucina por transaminación o degradación de Strecker. Se encontraron niveles altos de este compuesto en queso tipo Gouda elaborado con L. lactis subsp. lactis S19 y con lactococos nativos de productos lácteos y no lácteos como cultivos iniciadores, 58 RESULTADOS Y DISCUSION donde se le atribuyeron notas a malta, a cocoa y picantes (Weerkamp et al., 1996; Ayad et al., 2000). También se ha encontrado en queso Proosdij, en el cual es responsable del sabor a chocolate y picante (Engels et al., 1997); y en el queso Emmental, donde sus niveles incrementan durante la maduración (Thierry et al., 1999). Garde y colaboradores en 2002 encontraron mayores niveles de 3-metilbutanal en quesos elaborados con la bacteria productora de bacteriocina E. faecalis INIA 4 y bacterias mesófilas como cultivo iniciador. El 3-metilbutanal también ha sido reportado como compuesto clave en el perfil de sabor de quesos Cheddar, Ras Egipcio, Bitto, Parmesano, Camembert, Gouda, Azul, Gorgonzola y Suizo (Singh et al., 2003; Ayad et al., 2004; Panseri et al., Qian et al., 2003; Kubícková y Grosch, 1998; Smith et al., 2005; Qian et al., 2002). Uno de los aldehídos aromáticos más importantes es el bencenacetaldehído, formado por la degradación de la fenilalanina a través de reacciones de transaminación, descarboxilación y reducción. Tiene un umbral de 0.004 mg/kg y presenta notas verdes, pungentes con sabor amargo, y a bajas concentraciones se torna dulce y frutal. Es uno de los compuestos con mayor actividad aromática en queso Gruyere (Rychlik y Bosset, 2001a, b) y Mozzarella elaborado de leche bovina (Moio et al., 1993). En queso Cheddar se han reportado resabios a notas florales y tendientes a rosa, las cuales han sido atribuidas a la presencia de este aldehído aromático. La adición de bencenacetaldehído (50 a 500 ppb) a queso Cheddar suave imparte intensidades distintas de notas a rosa (Dunn y Lindsay, 1985). A concentraciones más altas, este compuesto da notas astringentes, amargas y picantes. (Singh et al., 2003). El bencenacetaldehído ha sido reportado en el perfil de sabor de quesos Cheddar, Bitto, Parmesano, Camembert y queso Azul (Singh et al., 2003; Panseri et al., 2008; Qian et al., 2003; Kubíckova y Grosh, 1998; Qian et al., 2002). La fracción volátil de los quesos contiene varios compuestos con azufre, como metanotiol, metional, dimetil sulfuro, dimetil disulfuro, dimetil trisulfuro, sulfuro de carbono y sulfuro de hidrógeno (Lindsay y Rippe, 1986; Urbach 1995; Weimer et al., 1999) y son contribuyentes importantes para el sabor del queso (Milo y Reineccius, 1997). Los compuestos de azufre se originan esencialmente por la degradación de la metionina (Yvon y Rijen, 2001). Estos compuestos tienen notas fuertes a cebolla y a quesos muy maduros. Por otra parte, sus umbrales de percepción son muy bajos y por lo tanto es probable que estén involucrados en el aroma final del queso (Panseri et al., 2008). El metanotiol es un compuesto con notas a cebolla o ajo, con un umbral de 0.004 mg/kg. Es derivado de la metionina y puede ser precursor de otros compuestos de azufre como el dimetil disulfuro y el dimetil trisulfuro vía reacciones oxidativas. Existen microorganismos capaces de producir metanotiol a partir de metionina, especialmente P. camemberti, G. candidum y B. linens (Jollivet et al., 1994). Ha sido reportado como compuesto clave en quesos Camembert, Cheddar y Gruyere (Panseri et al., 2008). Una comparación de la composición de compuestos volátiles en 59 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ quesos Cheddar reducidos y no reducidos en grasa mostró que el nivel de metanotiol en el queso está altamente correlacionado con el sabor. Esta observación indica que la falta de aroma en queso Cheddar reducido en grasa se debe principalmente a la falta de metanotiol, además una combinación de metanotiol y ácido decanóico o ácido butanóico dieron una mejor correlación con queso Cheddar que sólo metanotiol (Dimos et al., 1996). La adición de metanotiol a la pasta de queso Cheddar reducido en grasa produce un aroma fuerte a Cheddar (Urbach, 1997). El dimetil sulfuro es un compuestos con notas intensas, a rábano crudo, cebolla, con notas verdes a bajas concentraciones, con un umbral de 0.01 mg/kg. El DMS es un producto del metabolismo de propionobacterias y se forma a partir de la metionina. Ha sido reportado como un potente compuesto de sabor en queso Cheddar y Camembert (Panseri et al., 2008). Debido a sus aromas típicos, las cetonas, en especial las metilcetonas, son conocidas principalmente por su contribución al aroma de queso y son más abundantes en quesos fabricados de manera artesanal (Karahadian et al., 1985). Por otra parte, la 2-heptanona junto con la 2nonanona y el diacetilo son considerados los componentes principales en el aroma a mantequilla (Belitz y Grosch, 1999). La 2-pentanona es un compuesto con notas frutales, dulces con olor etéreo y tiene un umbral de 2.3 mg/kg. Contarini et al (1997) y Contarini y Povolo (2002) reportaron que las concentraciones de distintas metilcetonas, entre ellas la 2-pentanona, incrementan en proporción de acuerdo a la severidad del tratamiento térmico y están asociadas con el desarrollo de sabor a leche cocida en la leche UHT. Este compuesto ha sido reportado en el perfil de sabor de queso Cheddar y Grana (Panseri et al., 2008). La 2,3-butanodiona (diacetilo) es el compuesto característico con aroma fuerte a mantequilla, placentero, con un umbral de 0.015 mg/kg. El diacetilo es producido como consecuencia del metabolismo de lactococos, principalmente por la vía de lactosa y de citrato, pero también puede ser producido a partir de ácido aspártico (Yvon y Rijnen, 2001). La reducción del diacetilo resulta en la formación de acetoína y la reducción de ésta forma 2,3-butanediol, luego 2butanona y finalmente 2-butanol (Izco y Torre, 2000). La 2,3-butanodiona juega un papel muy importante en la fracción volátil de un gran número de productos lácteos fermentados, debido a sus notas a mantequilla dulce y aroma a vainilla (Bontinis et al., 2012). No parece estar involucrada en el sabor de quesos madurados, aunque está presente en quesos frescos y disminuye su concentración mientras el queso madura (Singh et al., 2003). El diacetilo ha sido reportado como compuesto clave en el perfil de sabor de quesos Cheddar, Ras Egipcio, Bitto, Parmesano, Camembert, Gouda, Azul, de Cabra Griego y queso 60 RESULTADOS Y DISCUSION Xinotyri (Singh et al., 2003; Ayad et al., 2004; Panseri et al., 2008; Qian et al., 2003; Kubícková y Grosch, 1998; Smith et al., 2005; Qian et al., 2002; Bontinis et al., 2012). Garde et al. (2002) encontraron mayores niveles de diacetilo en quesos elaborados con bacterias productoras de bacteriocina como cultivo iniciador. El objetivo final de la investigación del sabor de un alimento es identificar y clasificar compuestos químicos aromáticos únicos que contribuyen al olor y sabor característicos de ese alimento. Este conocimiento permite a la industria de los aromas duplicar mejor los sabores a través de rutas biosintéticas y pueden facilitar un mejor control en la calidad de las materias primas por la búsqueda específica de compuestos clave. Sin embargo es importante recordar que no sólo la concentración individual de los compuestos es importante, sino también el equilibrio entre éstos, ya que esto es lo que causa la percepción global en el consumidor. Por otro lado, cuando se conocen los compuestos clave con mayor impacto en el sabor global del alimento, se brindan herramientas únicas a los saboristas los cuales son capaces de usar estos materiales como compuestos básicos en la formulación de versiones mejoradas de sabores existentes. Mientras se sigan desarrollando técnicas analíticas con mayor sensibilidad, la investigación en sabores continuará con esfuerzos para descubrir nuevos sabores con carácter de impacto, los cuales permitan desarrollar sistemas de sabor de nueva generación. 61 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ 7.5 Determinación de los valores de actividad de aroma (OAV) para los ácidos grasos libres identificados Se identificaron 12 ácidos grasos libres tanto en el queso control como en el queso inoculado con L. lactis UQ2Rif Lac+. Los ácidos grasos son importantes e incluso predominantes componentes de sabor de muchos tipos de quesos. Tabla 7. Ácidos grasos libres identificados en los quesos control e inoculado con Lactococcus lactis UQ2Rif Lac+ KOVATS IR DB-FFA CONCENTRACIÓN (mg/kg) ÁCIDO GRASO No. CAS CONTROL QUESO CON L. lactis CONTROL QUESO CON L. lactis Atributo ID 1460 Acético 000064-19-7 139.39 ± 1.44 100.33 ± 1.12 15.00 9.933 7.020 Vinagre, agrio ST, RI 1588 Butanóico 000107-92-6 1.34 ± 0.05 1.11 ± 0.01 0.24 5.583 4.625 Rancio, queso ST, RI 1797 Hexanóico 000142-62-1 0.96 ± 0.04 0.76 ± 0.06 0.093 10.323 8.172 Queso, cabra, establo ST, RI 2008 2184 2538 Octanóico Decanóico Dodecanóico 000124-07-2 000334-48-5 000143-07-7 0.65 ± 0.13 1.11 ± 0.24 1.01 ± 0.11 0.66 ± 0.10 5.14 ± 0.52 1.09 ± 0.15 0.910 2.20 5.00 0.714 0.505 0.202 0.725 2.336 0.218 Queso, dulce Jabón, cera Jabón, metálico ST, RI ST, RI ST, RI Tetradecanóico 000544-63-8 3.66 ± 1.02 4.27 ± 0.17 10.00 0.366 0.427 Hexadecanóico Palmitoléico Octadecanóico Oléico Linoléico 000057-10-3 000373-49-9 000057-11-4 000112-80-1 000060-33-3 7.01 ± 1.24 0.68 ± 0.12 6.6 ± 1.07 215.59 ± 0.93 2.03 ± 0.15 7.03 ± 0.61 0.66 ± 0.05 5.60 ± 1.11 190.24 ± 1.48 2.38 ± 0.28 10.00 10.00 20.00 20.00 20.00 0.701 0.068 0.330 10.780 0.102 0.703 0.066 0.280 8.760 0.119 2940 3184 NR: NO REPORTADO ST: IDENTIFICADO CON ESTÁNDAR PURO RI: IDENTIFICADO POR ÍNDICE DE RETENCIÓN DE KOVATS 62 OAV UMBRAL (mg/kg) Ligero a cera, aceite Aceitoso NR NR NR NR ST, RI ST, RI ST, RI ST, RI ST, RI ST, RI RESULTADOS Y DISCUSION Los ácidos grasos no sólo son compuestos de aroma por sí mismos, sino que también sirven como precursores de metilcetonas, alcoholes, lactonas y ésteres. Es importarte tomar en cuenta que el valor de pH del queso afecta la concentración de los ácidos grasos volátiles. Sólo la forma libre, protonada de los ácidos grasos es activa aromáticamente y contribuye al sabor del queso (Brennand et al., 1989). En el queso control los ácidos grasos con mayor valor de actividad de aroma (OAV > 1) fueron: acético, butanóico, hexanóico y oléico. En el queso inoculado con L. lactis UQ2Rif Lac+ los ácidos grasos con mayor valor de actividad de aroma (OAV > 1) fueron: acético, butanóico, hexanóico, decanóico y oléico. Los ácidos grasos que contienen cuatro o más átomos de carbono pueden ser originados de la lipólisis de la grasa de leche o del rompimiento de aminoácidos. La lípolisis se debe a la acción de lipasas presentes en la leche y en el caso de queso elaborado con leche sin pasteurizar se debe a la acción de lipasas microbianas. Las bacterias ácido lácticas presentes como cultivos iniciadores sólo generan débil actividad lipolítica. En general, los ácidos grasos de cadena larga (>12 carbonos) juegan un papel menos importante en el sabor debido a sus altos umbrales de percepción (Preininger et al., 1996), contrario a las cadenas de 4 a 10 átomos de carbono que poseen un umbral bajo y cada uno cuenta con notas características. En ambos quesos se encontró que los ácidos grasos con mayor OAV fueron los de cadena corta. El ácido acético cuenta con un típico olor a vinagre y tiene un umbral de 15 mg/kg. Aunque el ácido acético no se considera un producto de la lipólisis sino principalmente un producto de otras vías bioquímicas, como la fermentación de lactato o el metabolismo de los aminoácidos por bacterias, contribuye en gran medida al sabor final del queso Feta (Kondylia et al., 2002). Además se ha encontrado como el compuesto de aroma mayoritario en quesos Cheddar, Gruyere, Roncal y Emmental (Curioni y Bosset, 2002). También ha sido reportado en el perfil de sabor de quesos Brie, Camembert, Azul, Colby y Brick (Mullin y Emmons, 1997). El ácido butanóico presenta notas de sabor a queso y tiene un umbral de 0.24 mg/kg. Este compuesto juega un papel importante en el olor de muchos tipos de quesos como Camembert, Cheddar, Grana Padano, Gruyere, Pecorino, Ragusano y Roncal (Curioni y Bosset, 2002; Randazzo et al., 2008). Las diferentes concentraciones de ácido butanóico encontradas en queso se deben en parte a la actividad hidrolítica de las lipasas (Marilley et al., 2004). El ácido hexanóico presenta notas penetrantes, a cabra, a establo, y tiene un umbral de 0.093 mg/kg. El ácido decanóico presenta notas cerosas y tiene un umbral de 2.2 mg/kg. El ácido hexanóico es también un compuesto característico en el sabor de queso Grana Padano y queso 63 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Roncal, mientras que el ácido octanóico y decanóico figuran entre los principales compuestos de sabor de este último tipo de queso (Curioni y Bosset, 2002). En estudios recientes sobre recombinación y omisión de compuestos, se encontró que los mayores cambios en las calificaciones de un panel entrenado para el descriptor a “sudado” presente en el queso se debieron a la eliminación del ácido hexanóico y decanóico. Para el descriptor a “mantequilla” se observó un mayor cambio en la calificación cuando se omitió el ácido propiónico. El mayor cambio en el descriptor a “tierra” se dio por la omisión del ácido acético, mientras que para el descriptor “crema” se dio con la eliminación del ácido propiónico. Para el descriptor a “nuez” el mayor cambio producido se debió a la omisión del ácido pentanóico. Una disminución en la concentración de estos ácidos grasos permitió que los descriptores “crema” y “mantequilla” se volvieran más intensos (Curioni y Bosset, 2002). Una baja concentración en ácidos grasos caracteriza a los quesos jóvenes (aquellos que no tienen mucho tiempo de maduración), mientras que una alta concentración de éstos se percibe como “off flavors”; de tal forma que un adecuado balance en el nivel de concentración de los ácidos grasos presentes contribuye a un buen sabor en el queso (Curioni y Bosset, 2002). Se observa que los niveles de los ácidos grasos libres son bajos en el queso inoculado con L. lactis UQ2Rif Lac+ y en el queso control. Para el queso control esto indica prácticamente una nula actividad lipolítica ya que la lipasa natural de la leche fue destruida por el proceso de pasteurización y no se añadió lipasa durante la fabricación del queso. En el caso del queso inoculado con el cultivo protector, esto puede deberse a dos factores: a una baja actividad lipolítica por parte del microorganismo, o bien, a que los ácidos grasos libres generados por el cultivo fueron utilizados como precursores para la formación de compuestos volátiles de sabor. 64 CAPÍTULO 8 Conclusión y perspectivas El perfil de compuestos de sabor para el queso control es muy distinto al perfil de queso tipo panela inoculado con la cepa L. lactis UQ2Rif Lac+. Mientras que el queso control presenta notas florales, frescas y verdes, el queso inoculado presenta notas fuertes a queso madurado, pero a su vez mantiene notas a queso fresco gracias a la formación de grandes cantidades de 2,3butanodiona, debido a la adición del cultivo protector. La adición del cultivo protector L. lactis UQ2Rif Lac+ durante de elaboración de queso panela ofrece un efecto bifuncional ya que sintetiza la nisina brindando un efecto bioprotector y favoreciendo la estabilidad microbiológica del queso, además de favorecer la síntesis de compuesto volátiles específicos que son percibidos como agradables por el consumidor. Con esto se puede suponer que se logra un producto de calidad uniforme, inocuo y con buen sabor pues la flora presente en el producto y las características sensoriales se podrían estandarizan. Esta aplicación tiene un gran futuro en dos grandes vertientes, la primera debida a que la adición de L. lactis UQ2Rif Lac+ permite generar un sabor dirigido hacia notas de sabor encontradas en los quesos no pasteurizados las cuales son sensorialmente aceptadas. Además, cuenta con un valor añadido ya que es productor de nisina y consecuentemente, se puede ofrecer al mercado un producto pasteurizado sin los riesgos microbianos asociados a quesos elaborados con leche no pasteurizada y con sabor superior de manera consistente, lo cual es muy buscado por la industria láctea. A su vez, la industria demanda la producción de sabores de manera biotecnológica, siendo éste el segundo campo de aplicación ya que puede ofrecerse este queso como ingrediente de sabor a la industria de quesos enzimáticamente modificados. 65 CAPÍTULO 9 Referencias Alegría, A., Delgado, S., Roces, C., López, B., Mayo., B. (2010). Bacteriocins produced by wild Lactococcus lactis strains isolated from traditional, starter-free cheeses made of raw milk. International Journal of Food Microbiology. 143: 61-66. Ayad, E.H.E., Verheul, A., de Jong, C., Wouters, J.T.M., Smit, G. (1999). Flavour forming abilities and amino acid requirements of Lactococcus lactis strains isolated from artisanal and non-dairy origin. International Dairy Journal. 9: 725–735. Ayad, E.H.E., Awad, S., Attar, A. E., Jong, C., and Soda, M. E. (2004). Characterization of Egyptian raw cheese. 2. Flavour formation. Food Chemistry. 86: 553–561. Ayad, E. H. E. Verheul, A., Wouters, J. T. M., Smit, G. (2000) Application of wild starter cultures for flavour development in pilot plant cheese making. International Dairy Journal. 10: 169-179. Azarnia, S. (2006). Biotechnological methods to accelerate cheddar cheese ripening. Critical Reviews in Biotechnology. 26: 121-143. Barbieri, G., Bolzoni, L., Careri, M., Mangia, A., Parolari, G., Spagnoli, S. (1994). Study of the volatile fraction of parmesan cheese. Journal of Agricultural and Food Chemistry. 42: 1170–1176. Belitz, H. D., Grosch, W. (1999). Food Chemistry. Berlin: Springer. Bellesia, F., Pinetti, A., Pagnoni, U., Rinaldi, R., Zucchi, C., Caglioti, L. (2003). Volatile components of grana Parmigiano-Reggiano type hard cheese. Food Chemistry, 83: 55–61. Berlardi, R., Pawliszyn, J. (1989). The application of chemically modified fused silica fibers in the extraction of organics from water matrix samples and their rapid transfer to capillary columns. Water Pollution Research Journal of Canada. 24:179-191. Beuvier E., Buchin S. (2004). Raw Milk Cheeses, Cheese: Chemistry, Physics and Microbiology. Elsevier Ltd. Chapter 1. Blank, I., Milo, C., Lin, J. and Fay, L.B. (1999). Quantification of aroma-impact components by isotope dilution assay. Flavor Chemistry. New York, pp. 63–74. Bontinis,Th.G., Mallatou, H., Pappa, E. C., Massouras, Th., Alichanidis, E. (2012). Study of proteolysis, lipolysis and volatile profile of a traditional Greek goat cheese (Xinotyri) during ripening. Small Ruminant Research 105: 193-201 67 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Boscaini, E., van Ruth, S., Biasioli, F., Gasperi, F., Märk, T. D. (2003). Gas chromatography– olfactometry (GC–O) and proton transfer reaction-mass spectrometry (PTR-MS) analysis of the flavor profile of Grana Padano, Parmigiano Reggiano, and Grana Trentino cheeses. Journal of Agricultural and Food Chemistry. 51: 1782–1790. Bosset, J.O., Gauch, R. (1993). Comparison of the volatile flavour compounds of six European “AOC” cheeses by using a new dynamic headspace GCMS method. International Dairy Journal. 3: 359-377. Brennand, C. P., Ha, J. K., Lindsay, R. C. (1989). Aroma properties and thresholds of some branched-chain and other minor volatile fatty acids occurring in milk fat and meat lipids. Journal of Sensory Studies, 4: 105–120. Burdock, G. A. (2010). Fenaroli’s Handbook of Flavor Ingredients. Sixth Edition. Taylor and Fracis Group, LLC. Careri, M., Manini, P., Spagnoli, S., Barbieri, G., Bolzoni, L. (1994). Simultaneous distillation– extraction and dynamic headspace methods in the gas chromatographic analysis of parmesan cheese volatiles. Chromatographia, 38(5–6): 386–394. Carunchia, M. E., Cadwallader, K. R., Drake, M. (2005). Characterization of aroma compounds responsible of the rosy/floral flavor in Cheddar cheese. Journal of Agricultural and Food Chemistry. 53: 3126-3132. Centeno, J. A., Tomillo, E., Fernández-García, P., Nuñez, M. (2002). Effect of wild strains of Lactococcus lactis on the volatile profile and the sensory characteristucs of ewe´s raw milk cheese. American Dairy Sci. Association. 85: 3164-3172. Cogan, T.M., Hill, C. (1993) Cheese starter cultures. Cheese: Chemistry, Physics and Microbiology. 2nd ed. Chapman & Hall, London, Pp. 193-255. Curioni, P.M.G., J.O. Bosset. (2002). Key odorants in various cheese types as determined by gas chromatography-olfactometry. International Dairy Journal. 12: 959–984. Contarini, G., Povolo, M., (2002). Volatile fraction of milk: comparison between purge and trap and solid phase microextraction techniques. Journal of Agricultural and Food Chemistry. 50: 7350-7355. Contarini, G., Povolo, M., Leardi, R., Toppino, P.M., (1997). Influence of heat treatment on the volatile compounds of milk. Journal of Agricultural and Food Chemistry. 45: 3171-3177. Chavarri, F., Virto, M., Martin, C., Najera, A.I., Santisteban, A., Barron, L.J.R., de Renoblaes, M. (1997). Determination of free fatty acids in cheese: comparison of two analytical methods. Journal of Dairy Research. 64: 445-452. d'Acampora, Z. B., Dugob, P., Mondello, L. (2008). Gas chromatography–olfactometry in food flavour analysis. Journal of Chromatography A. 1186: 123–143 Delgado, J. F., González-Crespo, J., Ladero, L., Cava, R., Ramírez, R. (2009). Free fatty acids and oxidative change of a Spanish soft cheese (PDO “Torta del Cesar”) during ripening. International Journal of Food Science and Technology. 44: 1721-1728. Dimos, A., Urbach, G. E., Miller, A.J. (1996). Changes in flavor and volatiles of full-fat and low-fat Cheddar cheeses during maturation. International Dairy Journal. 6:981-95. 68 REFERENCIAS Dufour, J. P., P. Delbecq., L. P. Albela. (2000). Solid-phase microextraction combined with gas chromatography-olfactometry for analysis of cheese aroma. American Chemical Society, Washington, D.C. Dunn, H. C., Lindsay, R. C. (1985). Evaluation of the role of microbial Strecker-derived aroma compounds in unclean-type flavors of Cheddar cheese. Journal of Dairy Science. 68:2859-74. Engels, W. J. M., Dekker, R., De Jong, C., Neeter, R., Visser, S. (1997) A comparative study of volatile compounds in the watersoluble fraction of various types of ripened cheese. International Dairy Journal. 7, 255-263. Escamilla-Hurtado, M.L., Tomasini-Campocosio, A., Valdés-Martínez, S., Soriano-Santos, J. (1996). Diacetyl formation by lactic bacteria. Revista Latinoamericana de Microbiología. 38: 129-137. Forde, A., G. F. Fitzgerald. (2000). Biotechnological approaches to the understanding and improvement of mature cheese flavour. Current Opinion in Biotechnology, 11:484489 Fox, P.F., Singh, T.K., MacSweeney, P.L.H. (1995). Biogenesis of flavour compounds in cheese. Advances in Experimental Medicine and Biology. 367: 59-98. Fox, Patrick F., Timothy P. Guinee, Timothy M. Cogan, and Paul L. H. McSweeney. (2000). Fundamentals of Cheese Science. Gaithersburg, Maryland: Aspen Publishers. Frank, D., Owen, C., Patterson, J. (2004). Solid phase microextraction (SPME) combined with gas-chromatography and olfactometry–mass spectrometry for characterization of cheese aroma compounds. Lebensmittel-Wissenschaft undTechnologie. 37: 139–154. Gallois, A. (1984). Biosynthese de la methoxy-2-isopropyl-3-pyrazine par Pseudomonas taetrolens. Ph.D. thesis, Institut Nationale de Recherche Agronomique, Paris-Grignon. García-Almendárez, B. E., Cann, I. K. O., Martin, S. E., Guerrero-Legarreta, I., Regalado, C. (2008). Effect of Lactococcus lactis UQ2 and its bacteriocin on Listeria monocytogenes biofilms. Food Control. 19: 670-680. García-Parra, M. D., García-Almendárez, B. E., Guevara-Olvera, L., Guevara-González, R. G., Rodríguez A., Martínez B., Domínguez-Domínguez J., Regalado C. (2009). Effect of sub-inhibitory amounts of nisin and mineral salts on nisin production by Lactococcus lactis UQ2 in skim milk. Food and Bioprocess Technology. 4: 646-654. García-Parra, M., Campelo A.,García-Almendárez, B. E.,Regalado, R., Rodríguez, A., Martínez, B. (2010). Enhancement of nisin production in milk by conjugal transfer of the protease-lactose plasmid pLP712 to the wild strain Lactococcus lactis UQ2. International Journal of Dairy Technology. 63: 523-529. Garde, S., Carbonell, M., Fernández-García, E., Medina, M., Núñez, M. (2002). Proteolysis in Hispánico cheese manufactured using a mesophilic starter, a thermophilic starter, and bacteriocin-producing Lactococcus lactis Subsp. lactis INIA 415. Journal of Agriculture and Food Chemistry. 50: 6752-6757. 69 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Garde, S., Ávila, M., Fernández-García, E., Medina, M., Nuñez, M. (2007). Volatile compounds and aroma of Hispánico cheese manufactured using lacticin 481producing Lactococcus lactis subsp. lactis INIA 639 as an adjunct culture. International Dairy Journal. 17: 717-726. Griffith, R., Hammond, E. G. (1989). Generation of Swiss cheese flavor components by the reaction of amino acids with carbonyl compounds. Journal of Dairy Science, 72: 604–613. Grosch, W. (1982). Lipid degradation products and flavour. In: Morton, I.D., Macleod, A.J. (Eds.), Food Flavours. Part A. Introduction. Elsevier, Oxford, pp. 325 - 385. Gutiérrez-Mendez, N., Vallejo-Cordoba, B., González-Córdova, A.F., Nevárez-Moorillón, G.V., Rivera-Chavira, B. (2008). Evaluation of aroma generation of Lactococcus lactis with an electronic nose and sensory analysis. Journal of Dairy Science. 91: 49-57. Harmon, A. D. (2002). Flavor, fragrance, and odor analysis. Marcel Dekker, New York. Chapter 4. Henriksen, C.M., Nilsson, D. (2001). Redirection of pyruvate catabolism in Lactococcus lactis by selection of mutants with additional growth requirements. Applied Microbiology and Biotechnology. 56: 767-775. Irigoyen, A., Ortigosa, M., Juansaras, I., Oneca, M., Torre, P. (2007). Influence of an adjunct culture of Lactobacillus on the free amino acids and volatile compounds in a Roncal-type ewes-milk cheese. Food Chemistry. 100: 71-80. Izco, J. M., & Torre, P. (2000). Characterisation of volatile flavour compounds in Roncal cheese extracted by the ‘‘purge and trap’’ method and analysed by GC–MS. Food Chemistry. 70: 409–417. Jae-Hwan, L., Raymond, D., Gur-Yoo, K., David, B. M. (2003). Optimization of solid phase microextraction analysis for the headspace volatile compounds of Parmesan Cheese. Journal of Agriculture and Food Chemistry. 51: 1136-1140. Jollivet, N., Chataud, J., Vayssier, Y., Bensoussan, M., Belin, J. M. (1994). Production of volatile compounds in model milk and cheese media by eight strains of Geotrichum candidum. Journal of Dairy Research, 61: 241–248. Karahadian, C., Josephson, D.B., Lindsay, R.C. (1985). Contribution of Penicillium sp. to the flavors of Brie and Camembert cheese. Journal of Dairy Science. 68: 1865-1877. Kondylia, E., Katsiaria,M. C., Masourasb, T., Voutsinasa, L. P. (2002). Free fatty acids and volatile compounds of low-fat Feta-type cheese made with a commercial adjunct culture. Food Chemistry. 79: 199-205. Kubícková, J., Grosch, W. (1998). Quantification of Potent Odorants in Camembert Cheese and Calculation of their Odour Activity Value. International Dairy Journal. 98: 17-32. Leahy, M.M., G.A. Reineccius. (1994). Analysis Volatiles: Methods, Applications, Procedures. P. Schreier, Ed., de Gruyter, New York, p.19 Lee, J-H., Diono, R., Kim, G-Y., Min, D. (2003). Optimization of solid phase microextraction analysis for the headspace volatile compounds of parmesan cheese. Journal of Agricultural and Food Chemistry, 51: 1136–1140. 70 REFERENCIAS Lindsay, R. C., Rippe, J. K. (1986). Enzymic generation of methanethiol to assist in flavor development of Cheddar cheese and others foods. In: Parliment H, Croteau R, editors. Biogeneration of aromas. Washington D.C.: American Chemical Society. p 286308. Lorenzo, M. (2006). Introducción a las técnicas de análisis instrumental. México. Marilley, L., Casey, M. G. (2004). Flavours of cheese products: metabolic pathways, analytical tools and identification of producing strains. International Journal of Food Microbiology. 90: 139-159. Mauriello, G., Moio, L., Moschetti, G., Piombino, P., Addeo, F., Coppola, S., (2001). Characterization of lactic acid bacteria strains on the basis of neutral volatile compounds produced in whey. Journal of Applied Microbiology. 90: 928– 942. McSweeney, P.L.H., Sousa, M.J. (2000). Biochemical pathways for the production of flavour compounds in cheese during ripening: a review. Lait. 80: 293-324. Melchiorsen, C.R., Jokumsen, K.V., Villadsen, J., Israelsen, H., Arnau, J. (2002). The level of pyruvate-formate lyase controls the shift from homolactic to mixed-acid product formation in Lactococcus lactis. Applied Microbiology and Biotechnology. 58: 338344. Milo, C., Reineccius, G. A. (1997). Identification and quantification of potent odorants in regular-fat and low-fat mild Cheddar cheese. Journal of Agricultural and Food Chemistry. 12:4625-9. 45:3590-4. Mireau, I., Olieman, K., Mond, J., Smid, E. J. (2005). Optimization of the Lactococcus lactis nisin-controlled gene expression system NICE for industrial applications. Microbial Cell Factories. 4: 16-24. Moio, L., Langlois, D., Eti!evant, P. X., Addeo, F. (1993). Powerful odorants in water buffalo and bovine Mozzarella cheese by use of extract dilution sniffing analysis. Italian Journal of Food Science, 3: 227–237. Moio, L., Piombino, P., Addeo, F. (2000). Odour-impact compounds in Gorgonzola cheese. Journal of Dairy Research. 67: 273–285. Molimard, P., H. E. Spinnler. (1996). Dairy Foods Review: Compounds Involved in the Flavor of Surface Mold Ripened Cheeses: Origins and Properties. Journal of Dairy Science. 79: 169 – 184. Molyneux, R.J., Schieberle, P. (2007). Compound identification: a journal of agricultural and food chemistry perspective. Journal of Agricultural and Food Chemistry. 12:4625-9. Morales, P., Fernández-García, E., Gaya, P., Núñez, M. (2003). Formation of volatile compounds by wild Lactococcus lactis strains isolated from raw ewes’ milk cheese. International Dairy Journal. 13: 201-209. Mullin, W. J., Emmons, D. B. (1997). Determination of organic acids and sugars in cheese, milk and whey by high performance liquid chromatography. Food Research International. 30: 147-151. NOM-121-SSA1-1994. Norma Oficial Mexicana de Bienes y Servicios. Quesos: frescos, madurados y procesados. Abril 04 del 2012. 71 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ NMX-F-713-COFOCALEC-2005, Sistema Producto Leche – Alimentos – Lácteos – Queso y queso de suero – denominaciones, especificaciones y métodos de prueba. Abril 04 del 2012. Ochoa, V. (2010). Incorporación de Lactococcus lactis UQ2 rif L+ en queso panela y su efecto en la bioconservación y desarrollo de compuestos de sabor. Universidad Autónoma de Querétaro, Querétaro, México. Panseri, S., Giani, I., Mentasti, T., Bellagamba, F., Caprino, F., Moretti, V. M. (2008). Determination of flavour compounds in a mountain cheese by headspace sorptive extraction-thermal desorption-capillary gas chromatography-mass spectrometry. LWT- Food Science and Technology. 41: 185-192. Peláez, C., Requena, T. (2005). Exploiting the potential of bacteria in the cheese ecosystem. International Dairy Journal. 15: 831- 844. Penton, Z. (1999). Method development with solid phase microextraction. Pages 27–56 in Solid Phase Microextraction: A practical guide. S. A. S. Wercinski, ed. Marcel Dekker, Inc., New York, NY. Pinho, O., I. M. P. L. V. O. Ferreira, M. A. Ferreira. (2002). Solidphase microextraction in combination with GC/MS for quantification of the major volatile free fatty acids in ewe cheese. Analytical Chemistry. 74:5199–5204. Preininger, M., y Grosch, W. (1994). Evaluation of key odorants of the neutral volatiles of Emmentaler cheese by the calculation of odour activity values. LebensmittelWissenschaft und-Technologie. 27: 237–244. Preininger, M., Warmke, R., Grosch, W. (1996). Identification of character impact flavour compounds of Swiss cheese by sensory studies of models. Zeitschrift für Lebensmittel-Untersuchung und-Forschung. 202: 30–34. Qian, M., Nelson, C., Bloomer, S. (2003). Evaluation of Fat-Derived Aroma Compounds in Blue Cheese by Dynamic Headspace GC/Olfactometry-MS. Journal of the American Oil Chemists' Society. 79: 663-667Qian, M., Reineccius, G. (2002a). Identification of aroma compounds in ParmigianoReggiano cheese by gas chromatography/olfactometry. Journal of Dairy Science. 85: 1362–1369. Qian, M., Reineccius, G. (2002b). Potent aroma compounds in Parmigiano Reggiano cheese studied using a dynamic headspace (purge-trap) method. Flavour and Fragance Journal. 18(3): 252–259. Qian, M., Reineccius, G. (2003). Static Headspace and Aroma Extract Dilution Analysis of Parmigiano Reggiano Cheese. Food Chemistry and Toxicology. 68: 794–798. Randazzo, C. L., Pitin,o I., De Luca, S., Scifò, G. O., Caggia, C. (2008). Effect of wild strains used as starter cultures and adjunct cultures on the volatile compounds of the Pecorino Siliciano cheese. International Journal of Food Microbiology. 122: 269-278. Reineccius, Gary (2006). Flavor Analysis in Flavor Chemistry and Technology. 2nd ed. Chapter 3. Boca Raton. 72 REFERENCIAS Renye, J. A., Somkuti, G. A., Vallejo-Cordoba, B., Van Hekken, D. L., González-Cordova, A. F. (2008). Characterization of the microflora isolated from Queso Fresco made from raw and pasteurized milk. Journal of Food Safety. 28: 59-75. Rychlik, M., Bosset, J. O. (2001a). Flavour and off-flavour compounds of Swiss Gruyere cheese. Evaluation of potent odorants. International Dairy Journal, 11: 895–901. Rychlik, M., Bosset, J. O. (2001b). Flavour and off-flavour compounds of Swiss Gruyere cheese. Identification of key odorants by quantitative instrumental and sensory studies. International Dairy Journal, 11: 903–910. Rubinson, K. A., Rubinson, J.F. (2001). Análisis instrumental. Prentice Hall. Pp. 113-115. SAGARPA. (2011). Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Boletín de Leche. Pp. 36-37. Salminen, S., Von Wright, A. (1993). Lactic acid bacteria. Marcel Dekker. USA. 97: 104-150. Scanlan, R.A., Lindsay, R., Libby, L.M., Day, E.A. (1968). Heat-induced volatile compounds in milk. Journal of Dairy Science. 51: 1001-1007. Schieberle, P. (1995). New Developments in Methods for Analysis of Volatile Compounds and their Precursors. Characterization of Food: Emerging Methods. A.G. Gaonkar. Elsevier Science B.V., S., Pp 403-431. Skoog, S. R., Crouch, F., Holler, J. (2008). Principles of Instrumental Analysis. Cengage learning. Sixth Edition . Pp.13-16. Singh, T. K., Drake, M. A., Cadwallader, K. R. (2003). Flavor of Cheddar Cheese: A Chemical and Sensory Perspective. Comprehensive Reviews in Food Science and Food Safety. 2: 139-162. Smit, G., Smit, B. A., Engels, W. J. M. (2005). Flavor formation by lactic acid bacteria and biochemical flavor profiling of cheese products. FEMS Microbiology Reviews. 29: 591-610. Syu, M.J. (2001) Biological production of 2,3-butanediol. Applied Microbiology and Biotechnology. 55:10-18. Thierry, A., Maillard, M. B., Le Quéré, J. L. (1999). Dynamic headspace analysis of Emmental aqueous phase as a method to quantify changes in volatile flavour compounds during ripening. International Dairy Journal. 9: 453-463. Urbach G. (1995). Contribution of lactic acid bacteria to flavor compound formation in dairy products. International Dairy Journal. 5:877-903. Urbach G. (1997). The chemical and biochemical basis of cheese and milk aroma. In: Law BA, editor. Microbiology and biochemistry of cheese and fermented milk. London, U.K.: Blackie Academic and Professional. p 253-98. USDA-NASS. (2012). United States Department of Agriculture National Agricultural Statistics Service, Dairy Products 2012 Summary. (http://www.nass.usda.gov/Publications/Ag_Statistics/2012/chapter08.pdf). 73 Análisis químico de los compuestos importantes para el sabor de queso tipo panela inoculado con Lactococcus lactis UQ2Rif Lac+ Vázquez-Landaverde, P.A., Velázquez, G., Torres, J.A., Qian, M.C. (2005). Quantitative determination of thermally derived volatile compounds in milk using solid-phase microextraction and gas chromatography. Journal of Dairy Science. 88: 3764-3772. Verzera, A., Ziino, M., Condurso, C., Romeo, V., Zappala, M. (2004). Solid-phase microextraction and gas chromatography-mass spectrometry for rapid characterization of semi-hard cheese. Analytical and Bioanalytical Chemistry. 380: 930-936. Weerkamp, A. H., Klijn, N., Neeter, R., Smit, G. (1996) Properties of mesophilic lactic acid bacteria from raw milk and naturally fermented raw milk products. Neth. Milk Dairy Journal. 50: 319-332. Weimer B. C., Seefeldt K., Dias B. (1999). Sulfur metabolism in bacteria associated with cheese. Antonie van Leeuwenhoek 76:247-61. Wercinski, S. A. S., J. Pawliszyn. (1999). SPME Theory. Pages 1–24 in Solid phase microextraction: A practical guide. S. A. S. Wercinski, ed. Marcel Dekker, Inc., New York, NY. Wouters, J.T.M., Ayad, E.H.E., Hugenholtz, J., Smit, G., (2002). Microbes from raw milk for fermented dairy products. International Dairy Journal. 12: 91– 109. Yvon M., Rijnen L. (2001). Cheese flavor formation by amino acid catabolism. International Dairy Journal. 11: 185-201. Yvon, M., Gitton, G., Chambellon, E., Bergot, G., Monnet, V. (2011). The initial efficiency of the proteolytic system of Lactococcus lactis strains determines their responses to a cheese environment. International Dairy Journal. 21: 335-345. 74