Diapositiva 1
Anuncio

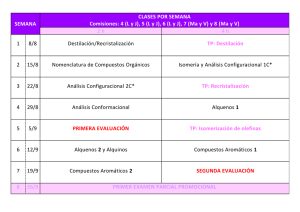
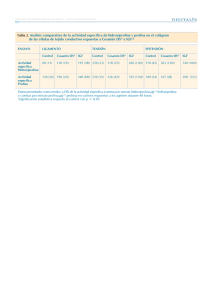
SÍNTESIS ORGÁNICA UNIDAD I DESCONEXIONES Y REORDENAMIENTO NUCLEOFÍLICO INTRODUCCIÓN A LA SÍNTESIS ORGÁNICA La síntesis orgánica es la construcción planificada de moléculas orgánicas mediante reacciones químicas Así pues, la síntesis de compuestos orgánicos se ha convertido en uno de los ámbitos más importantes de la química orgánica. Objetivo: persigue la preparación de nuevos compuestos en función de su interés, bien sea industrial o teórico (científico). Cada procedimiento sintético consta generalmente de múltiples etapas. Existen varios campos de acción de la síntesis orgánica. La síntesis de productos naturales presenta un especial interés Taxol, antitumoral La síntesis de compuestos para su aprovechamiento en diferentes campos como el farmacéutico, la industria alimentaria, colorantes, plaguicidas, etcétera fluoxetina (o Prozac), antidepresivo TIPOS DE SÍNTESIS ORGÁNICA SÍNTESIS TOTAL Es la síntesis química de moléculas orgánicas complejas partiendo de moléculas simples comercialmente ascequibles. En una síntesis lineal, es decir el producto de una etapa previa es reactivo para la siguiente, así desde la primera materia prima hasta que se obtiene la molécula objetivo SÍNTESIS CONVERGENTE El producto final se obtiene por condensación de fragmentos grandes que se han obtenido, a su vez, por unión de otros más pequeños hasta llegar a diversos reactivos de partida TIPOS DE SÍNTESIS ORGÁNICA SÍNTESIS METODOLOGICA SÍNTESIS PARCIAL Síntesis donde se parte de un producto natural, que no ha sido previamente sintetizado, que sí es fácilmente accesible. Se usa cuando es una alternativa mejor a una síntesis total. Un ejemplo sería la síntesis del LSD. La investigación de nuevos métodos sintéticos implica tres etapas: • descubrimiento, •optimización y • estudios de ámbito de aplicación y limitaciones DISEÑO DE UNA SÍNTESIS El diseño de una síntesis se basa en el análisis retrosintético, es un enfoque del diseño de síntesis aportado por el químico americano Elias James Corey Con esta técnica el diseño de la síntesis se planifica hacia atrás, partiendo desde el producto final hasta llegar a unos compuestos de partida factibles mediante una secuencia de pasos lógicos donde cada vez las estructuras precursoras son más sencillas. ANÁLISIS RETROSINTÉTICO ESTUDIO DE LA MOLÉCULA OBJETIVO: El primer paso para realizar el análisis retrosintético es el conocimiento estructural de la molécula objetivo, referido concretamente a: • mapa de potenciales • grupos funcionales presentes • enlaces e insaturaciones • estereoquímica MÉTODO DE LAS DESCONEXIONES Desconexión: operación analítica teórica consistente en la fisión de un enlace la cual convierte a la molécula en dos fragmentos que deben considerarse reactivos de partida. La condición para que una desconexión sea útil es que exista una reacción química real que en la práctica sea capaz de establecer el enlace que en la desconexión ha roto. En cada etapa de desconexión se supone la ruptura de un enlace para dar lugar a dos fragmentos llamados SINTONES, una vez desconectada la estructura y analizados los sintones se propone los EQUIVALENTES SINTÉTICOS IGF Cl sintón catiónico Cl sintón aniónico TERMINOLOGÍA Desconexión o análisis: Símbolo de ruptura de enlace y generación de un nuevo grupo funcional Interconversión de grupo funcional: IGF, proceso de conversión de un grupo funcional a otro Molécula objetivo: MO o TM, molécula que se pretende desconectar Análisis: Proceso por el cual iniciamos la desconexión Síntesis: Proceso de preparación de la MO INTERCONVERSIÓN DE GRUPO FUNCIONAL uno de los procesos prácticos más usados en el análisis retrosíntetico se realiza con la interconversión de grupos funcionales. CONVERSIÓN DE ALCANOS alquenos aldehídos ALCANOS cetonas halogenuros de alquilo CONVERSIÓN DE ALCANOS CONVERSIÓN A ALQUENOS ANÁLISIS IGF SÍNTESIS H2/Cat. CONVERSIÓN DE ALCANOS CONVERSIÓN A HALOGENUROS DE ALQUILO ANÁLISIS IGF SÍNTESIS CH2Cl Zn, HCl CH2Cl CONVERSIÓN DE ALCANOS CONVERSIÓN A REACTIVO DE GRIGNARD Los R-X se pueden convertir a RMgX y luego con agua produce R-H ANÁLISIS IGF CH2MgCl IGF Cl SÍNTESIS Mg/ Et 2O Cl CH2MgCl H3O+ CONVERSIÓN DE ALCANOS CONVERSIÓN A ALDEHÍDOS Y CETONAS IGF R-H ANÁLISIS RCHO IGF R-H R C R O SÍNTESIS RCHO Zn/Hg, RCH2-H HCl R C O R H2NNH 2, KOH dietilenglicol RCH2-R CONVERSIÓN DE ALQUENOS Deshalogenación de dihaluros vecinales alcoholes ALQUENOS alquinos halogenuros de alquilo CONVERSIÓN DE ALQUENOS CONVERSIÓN A ALCOHOLES ANÁLISIS IGF RCH2-CH2OH RCH=CH2 SÍNTESIS RCH2-CH2OH H+/-H2O calor RCH=CH2 La deshidratación debe generar el alqueno más estable, Regla de Zaitsev CONVERSIÓN DE ALQUENOS DESHIDROHALOGENACIÓN DE R-X ANÁLISIS IGF RCH2-CH2X RCH=CH2 SÍNTESIS RCH2-CH2X KOH alcohol -HX RCH=CH2 CONVERSIÓN DE ALQUENOS DESHALOGENACIÓN DE DIHALUROS VECINALES ANÁLISIS IGF RCH=CH2 RCH-CH2X X SÍNTESIS RCH-CH2X Zn -X2 X RCH=CH2 CONVERSIÓN DE ALQUENOS HIDROGENACIÓN CATALÍTICA DE ALQUINOS ANÁLISIS IGF RC RCH=CH2 CH SÍNTESIS RC CH H2 catalizador de Lindlar RCH=CH2 CONVERSIÓN DE ALCOHOLES Adic. De react. Organometa. A aldehídos y cetonas Reducción a aldehídos y cetonas ALCOHOLES Alquenos halogenuros de alquilo CONVERSIÓN DE ALCOHOLES CONVERSIÓN A R-X POR SN ANÁLISIS R-OH IGF RX SÍNTESIS -OH RX R-OH CONVERSIÓN DE ALCOHOLES CONVERSIÓN A ALQUENOS OXIMERCURACIÓN-DEMERCURACIÓN ANÁLISIS RCHCH3 IGF RCH=CH2 OH SÍNTESIS 1. Hg(OAc)2, H2O RCH=CH2 RCH-CH3 2. NaBH4 OH Regla de Markovnikov: Según esta regla el H va al C que tenga más hidrógenos CONVERSIÓN DE ALCOHOLES CONVERSIÓN A ALQUENOS HIDROBORACIÓN OXIDACIÓN ANÁLISIS IGF RCH2CH2-OH SÍNTESIS RCH=CH2 1. B2H6, diglime RCH=CH2 RCH2CH2OH 2. H2O2, NaOH Se da contrario a la Regla de Markovnikov. CONVERSIÓN DE ALCOHOLES CONVERSIÓN A ALDEHIDOS Y CETONAS REDUCCIÓN DE COMPUESTOS CARBONILO Para Aldehídos ANÁLISIS IGF RCH2CH2-OH RCH2CHO SÍNTESIS 1. NaBH4 RCH2CHO RCH2CH2OH 2.H2O CONVERSIÓN DE ALCOHOLES CONVERSIÓN A ALDEHIDOS Y CETONAS REDUCCIÓN DE COMPUESTOS CARBONILO Para Cetonas ANÁLISIS RCHCH3 IGF OH RCCH3 O SÍNTESIS RCCH3 1. NaBH4 RCHCH3 2. H2O O OH CONVERSIÓN DE ALCOHOLES CONVERSIÓN A ALDEHIDOS Y CETONAS REDUCCIÓN DE COMPUESTOS CARBONILO Para ácidos carboxílicos ANÁLISIS O RCH2CH2OH SÍNTESIS IGF RCH2COH O RCH2COH 1. LiAlH4, Et2O RCH2CH2OH 2. H2O Solamente con LiAlH4, el NaBH4 no tiene la capacidad de reducir los A.C CONVERSIÓN DE ALCOHOLES ADICIÓN DE REACTIVOS ORGANOMETÁLICOS A ALDEHIDOS Y CETONAS ANÁLISIS O OH IGF C C H H H + MgBr H SÍNTESIS O C H + H MgBr H+ OH C H H CONVERSION DE ALDEHIDOS Y CETONAS Oxidación de metilbencenos Oxidación de alcoholes Aldehídos y cetonas Condensación aldólica Alquilación de Friedel - Crafts Hidroboración – oxidación de alquinos terminales CONVERSIÓN DE ALDEHIDOS Y CETONAS CONVERSIÓN A ALCOHOLES PRIMARIOS Agente oxidante suave ANÁLISIS O R IGF C OH C R H H H SÍNTESIS R C H O OH CrO3 H Py C R H CONVERSIÓN DE ALDEHIDOS Y CETONAS CONVERSIÓN A ALCOHOLES SECUNDARIOS Agente oxidante suave ANÁLISIS O IGF R C OH C R R R H SÍNTESIS R C R O OH K2CrO7 H C R R CONVERSIÓN DE ALDEHIDOS Y CETONAS POR OXIDACIÓN DE METIL BENCENOS O ANÁLISIS H IGF Cl SÍNTESIS O H 1. CrO3, AC2O Cl 2. H2O, H2SO4 Cl CONVERSIÓN DE ALDEHIDOS Y CETONAS ACILACIÓN DE FRIEDEL - CRAFTS DE COMPUESTOS AROMÁTICOS ANÁLISIS O O H IGF + H Cl SÍNTESIS O O + H Cl AlCl3 H CONVERSIÓN DE ALDEHIDOS Y CETONAS CONDENSACIÓN ALDÓLICA O ANÁLISIS R O OH H2 C C C ß IGF H + C R H O CH3 C H H ALDOL SÍNTESIS O O O R + C R CH3 -OH C H C OH H2 C C ß H H ALDOL H CONVERSION DE ÁCIDOS CARBOXÍLICOS Oxidación de aldehídos Hidrólisis de esteres Oxidación de alcoholes Ácidos carboxílicos Reactivo de Grignard Oxidación de aquilbencenos Ruptura oxidativa de alquenos Reordenamiento de aldehídos CONVERSION DE ÁCIDOS CARBOXÍLICOS CONVERSIÓN A ALCOHOLES PRIMARIOS ANÁLISIS O IGF R C R OH C OH H H SÍNTESIS R C H O OH KMnO4 H C R OH CONVERSION DE ÁCIDOS CARBOXÍLICOS CONVERSIÓN A ALQUILBENCENOS O ANÁLISIS OH SÍNTESIS IGF O K2Cr2O7 OH CONVERSION DE ÁCIDOS CARBOXÍLICOS RUPTURA OXIDATIVA DE ALQUENOS ANÁLISIS O IGF C R RCH=CHR OH SÍNTESIS O RCH=CHR 1. KMnO4 2. H C + R OH CONVERSION DE ÁCIDOS CARBOXÍLICOS POR REACTIVO DE GRIGNARD O ANÁLISIS IGF C R RMgBr OH SÍNTESIS O RMgBr 1. CO2 2. H3O+ C R OH CONVERSION DE ÁCIDOS CARBOXÍLICOS HIDRÓLISIS DE ESTERES O ANÁLISIS O IGF C R SÍNTESIS C OH R OR O O H2O/ H+ C R OR C R OH CONVERSION DE ÁCIDOS CARBOXÍLICOS REORDENAMIENTO DE ALDEHIDOS O ANÁLISIS O IGF C R SÍNTESIS C OH R O O H+ C R H C H R OH REFERENCIAS • Nicolaou, K. C.; Sorensen, E. J. (1996), Classics in total synthesis : targets, strategies, methods, •March, J.; Smith, D. (2001), Advanced Organic Chemistry, Wiley. •Corey, E. J.; Cheng, X-M. (1995), The logic of chemical synthesis, Wiley. • Serratosa, F., Organic Chemistry in Action. The Design o f Organic Synthesis, Elsevier, Amsterdam, 1991 • Warren, S., Diseño de Síntesis Orgánica. Introducción Programada al Método del Sintón, Alhambra, Madrid, 1983. • Warren, S., Organic Synthesis. The Disconnection Approach, John Wiley, New York, 1989. GRACIAS