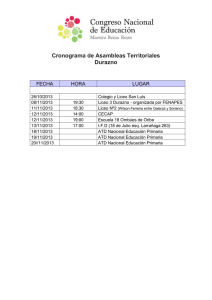
f á rm acos coan algésicos y coad yu van t es f á rm acos coan
Anuncio

F Á RM ACOS COAN ALGÉSICOS Y COAD Y U VAN T ES Estos fármacos originalmente se probaron para el tratamiento de procesos distintos al dolor. La mayoría se siguen utilizando con sus indicaciones concretas, pero alivian también el dolor en situaciones específicas. Los fármacos que no están clasificados farmacológicamente como analgésicos, pero se usan solos o en combinación con los narcóticos para aliviar el dolor, se conocen como coanalgésicos. Otros medicamentos, que se utilizan con frecuencia para tratar los síntomas que comúnmente acompañan al dolor, los trastornos del sueño, se denominan medicamentos coadyuvantes. El uso apropiado de estos fármacos depende de una valoración cuidadosa de cada persona y de sus síntomas. Específicamente, los coanalgésicos están indicados cuando un síndrome doloroso no responde a los narcóticos, por ejemplo, el dolor del miembro fantasma, causalgia o neuralgia postherpética. Los medicamentos coadyuvantes son apropiados cuando en el dolor hay un componente que los analgésicos solos no pueden tratar, como insomnio, ansiedad o depresión. Puede haber un considerable solapamiento de estos fármacos, es decir, un fármaco antidepresivo (ATD) puede servir para propósitos duales. El uso de un medicamento coadyuvante puede no sólo aliviar el dolor, sino también abarcar una dimensión de bienestar que el narcótico únicamente no hubiera conseguido. Típicamente, la acción de los fármacos coadyuvantes consiste en una de estas dos: potencian los efectos de los analgésicos narcóticos o no narcóticos o tienen propiedades analgésicas por sí mismos. Las posibles limitaciones de los analgésicos coadyuvantes son: —Los resultados son impredecibles. —Los miembros del equipo de salud tienen poca información sobre el uso de estos fármacos y sobre los llamados “potenciadores” de la analgesia narcótica. —Todos tienen el potencial de causar efectos secundarios indeseables. —El alivio del dolor no siempre es inmediato, y el pleno efecto de alguno de estos medicamentos puede no producirse hasta pasados varios días o semanas. —En ocasiones el paciente no sigue el horario prescrito de la medicación porque el alivio no es inmediato o no ha comprendido por qué se prescribe. —Muchos coanalgésicos se denominan tranquilizantes o antidepresivos, y esto puede 147 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor hacer que el paciente crea que no se valora su dolor y que está empezando a ser tratado sólo para la ansiedad o la depresión. ANTIDEPRESIVOS La depresión puede afectar la capacidad de la persona para controlar el dolor. La imagen clínica de la depresión consiste en insomnio, anorexia, fatiga y pérdida de peso, entre otros. En la persona con cáncer u otra enfermedad prolongada éstos pueden ser signos de dolor o de la propia enfermedad. Por tanto, la identificación de la depresión debe depender de los síntomas psicológicos, como sensación de tristeza, ansiedad, desesperanza, inutilidad, sentimiento de culpa, pérdida de autoestima y pensamientos de “desear la muerte”. La diferenciación entre la causa y el efecto en el ciclo de dolor-depresión-insomnio-ansiedad es difícil. Lo más importante es la valoración rápida de la presencia de este ciclo, de forma que pueda iniciarse un tratamiento activo. ABORDAJE TERAPÉUTICO La depresión es un síndrome que tiene manifestación clínica no sólo en pacientes con dolor crónico sino también en dolor agudo (dolor postoperatorio) diferente del abatimiento, la tristeza normal, presentando: —Un patrón de sintomatología relativamente estable que puede ser identificado. —Dependiente de alteraciones funcionales ligadas al sistema límbico. —Mediatizadas por las distorsiones de la neurotransmisión. 148 En algunos pacientes los factores genéticos parecen claramente determinantes y las variables ambientales poco relevantes. Éstos tienden a repetir el cuadro clínico depresivo de forma bastante automática, generalmente cíclica, a lo largo del padecimiento de dolor crónico. En otros enfermos, sin embargo, los desencadenantes ambientales quedan bastante claros y quizás no haya datos para afirmar el componente genético o familiar. Todas las medidas terapéuticas empleadas en la depresión intentan controlar la situación clínica mediante la modificación de los factores que la determinan. Dado que en todas las depresiones existen componentes biológicos y psicológicos, no hay subgrupos delimitados que sean susceptibles de ser tratados exclusivamente con psicoterapia o exclusivamente con fármacos ATD. Existen evidencias de que un grupo importante de estas depresiones, responden bien a los ATD (70-80%), pero incluso en éstas deben aplicarse medidas psicoterapéuticas. Es frecuente que el tratamiento ATD falle porque no se ha cuidado el aspecto psicológico del paciente, por ejemplo cuando éste se culpabiliza de su situación y el médico no se da cuenta de ello o no trata de corregir esta falsa creencia. Inversamente, muchos síndromes depresivos de carácter reactivo o situacional no parecen responder a la psicoterapia cuando se emplean de forma exclusiva y, sin embargo, responden bien cuando se suma un tratamiento farmacológico. Un error, excesivamente extendido, es el de pensar que las medidas terapéuticas (psicoterapia, farmacoterapia) son excluyentes. En ningún caso debe dejarse de hacer psicoterapia, siendo importante dedicar tiempo y atención al enfermo, así como escucharlo sin prisas. A su vez, en la mayoría de las ocasiones, junto a esta psicoterapia habrá que administrar antidepresivos. Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes TRATAMIENTO FARMACOLÓGICO Hoy en día, el tratamiento ATD es uno de los más eficaces y seguros dentro de la psicofarmacología del dolor, en depresiones secundarias a otra patología médica (cáncer, neuralgias) o psiquiátrica (enfermedad de Parkinson, anorexia nerviosa, depresiones farmacógenas), también son útiles cuando se emplean conjuntamente con la corrección del factor orgánico o el dolor que éste origina, sobre todo, cuando constituyen un cuadro de depresión mayor. También responden al tratamiento ATD las depresiones enmascaradas, donde predomina una sintomatología física (cefaleas, algias), en ocasiones de larga evolución. La historia de la terapéutica con ATD se resume brevemente en 3 etapas: 1. A finales de los años 50 se descubre que un análogo estructural de la isoniazida, la iproniazida poseía efectos activadores y ATD notables, y que los pacientes tuberculosos que la recibían mejoraban en su tono vital. Se comprobó que la iproniazida era un inhibidor de la monoaminoxidasa (MAO), y a partir de aquí se elaboraron nuevos inhibidores de la MAO, hidrazínicos y no hidrazínicos, que fueron el fundamento del tratamiento farmacológico de las depresiones. 2. Simultáneamente se descubrió que una sustancia que se estaba ensayando como antipsicótico, la imipramina, poseía efectos ATDs. Estos efectos parecieron desde el primer momento superiores a los de los IMAOs. Asimismo, su uso parecía menos complicado, en función de menor cantidad de efectos secundarios. Es probable que el entusiasmo por las nuevas moléculas hiciera cargar las tintas en los efectos adversos y reacciones indeseables (reacciones hipertensivas por interacción con la tiramina de ciertos alimentos) que se habían observado en los IMAOs. Se fueron desarrollando nuevos componentes tricíclicos parecidos a la imipramina, con la esperanza de igualar o mejorar su efecto ATD, con disminución al máximo de los efectos secundarios generalmente anticolinérgicos. 3. Una tercera etapa, que se solapa con la anterior, lleva a la creación de los denominados nuevos ATD, que pertenecen a estructuras químicas muy diferentes y que ponen en juego, asimismo, distintos mecanismos de acción. Lo que se ha perseguido en esta tercera etapa es, obviamente, el mejorar la acción antidepresiva y evitar al máximo los efectos secundarios (Tabla 1). Antidepresivos tricíclicos Son metabolizados en el hígado por desmetilación, oxidación e hidroxilación aromática. Sus metabolitos, también activos como ATDs, generalmente, se conjugan con las proteínas plasmáticas. La vida media varía, yendo desde 8 horas (imipramina) a 35 horas (amitriptilina), aunque incluso con el mismo fármaco aparecen oscilaciones de esta vida media. Los niveles plasmáticos que se obtienen, después de una dosis fija de un mismo ATD tricíclico, no son constantes y la relación entre dichos niveles y la respuesta terapéutica no está del todo aclarada, siendo uno de los terrenos más fructíferos en la investigación actual. Muchos trabajos van a favor de unos niveles plasmáticos óptimos, para una buena 149 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor ANTIDEPRESIVOS MÁS COMUNES COMERCIALIZADOS EN ESPAÑA Familia farmacológica Principio activo Nombre comercial Bicíclicos Trazodona Deprax Tricíclicos Amineptina Amitriptilina Amoxapina Clorimipramina Doxepina Imiprina Imipraminóxido Lofepramina Nortriptilina Trimipramina Survector* Tryptizol Demolox* Anafranil Inequan* Tofranil Imiprex* Deftan* Martimil, Paxtibi* Surmontil* Tetracíclicos Pirindol Maprotilina Mianserina Lifril* Ludiomil Lantanon Inhibidores recaptación serotonina Fluoxetina Fluvoxamina Paroxetina Sertralina Citalopram Prozac, Adofen Dumirox Seroxat Besitran Seropram, Prisdal Precursores de la serotonina Oxitriptan Cincofarm Rimas Moclobemida Manerix* Inhibidores recaptación serotonina y noradrenalina Venlafaxina Vandral Otros Viloxacina Vivarint* *Baja o nula aplicación en la actualidad. Tabla 1. 150 Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes respuesta clínica, con la nortriptilina varia entre 50/150 µg/100/ml. Niveles por encima o por debajo de esta franja no serían efectivos, existiendo lo que se ha dado en llamar una ventana terapéutica. Con la imipramina no ocurriría lo mismo, la buena respuesta terapéutica aparece alrededor de 150 µg/100/ml, pero la relación entre nivel plasmático y respuesta terapéutica sería lineal; valores por debajo de esa cifra serían inefectivos, pero por encima de 160 µg/100/ml aumentaría la eficacia. Es importante recalcar las grandes variaciones individuales en este terreno, de tal forma que factores como edad, sexo, peso, dieta, pH urinario, tabaco, clase de dolor, sin contar la utilización simultánea de otros fármacos, pueden influir en forma de grandes oscilaciones de los niveles plasmáticos. Ello hace comprensible la dificultad para estandarizar definitivamente un método de dosificación plasmática en relación directa con la eficacia terapéutica. Así, en pacientes de edad avanzada, cáncer terminal o en depresiones, que no responden a las dosis habituales de ATD tricíclicos, se aconseja la determinación de niveles plasmáticos, que laboratorios bien equipados pueden proporcionar. La excreción de tricíclicos es rápida y se efectúa en su mayor parte por la orina. No se ha demostrado que la vía endovenosa de estos fármacos sea superior a la oral en eficacia terapéutica para liberar su componente activo. frecuente. Parece que existe una predisposición individual a la acetilación, así, son los pacientes catalogados de “acetiladores lentos” los que con más frecuencia pueden sufrir problemas de toxicidad farmacológica. La irreversibilidad para recuperar las MAO inhibidas, hace que deban pasar semanas antes de ser sustituidas por otras de nueva síntesis. Durante este tiempo la posibilidad de interaccionar con otros fármacos sigue persistiendo, por ello, se hace aconsejable esperar unas tres semanas, tras interrumpir el tratamiento con IMAOs, antes de administrar ATD tricíclicos. Estos fármacos se eliminan casi por completo por el riñón en forma de metabolitos. No tiene una indicación importante en el tratamiento del dolor. Otros antidepresivos no tricíclicosno IMAOs Dado que este grupo es muy heterogéneo, como ya se ha indicado, no existe una farmacocinética común, por lo que es recomendable el conocimiento de los datos básicos de cada uno de estos fármacos por separado. Debe hacerse mención de las interacciones nocivas que los ATD pueden tener con otros fármacos por: 1. Inhibición o inducción del metabolismo, microsomial hepático. 2. Alteración de la fijación a las proteínas plasmáticas. IMAOs 3. Alteración de la fijación a los receptores tisulares. Son bien absorbidos por vía oral. Las hidrazidas se hidrolizan para liberar su componente activo. La acetilación es una biotransformación 4. Interferencia de distribución en los lugares de los receptores activos. 5. Favorecimiento o retraso de la excreción. 151 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor NORMAS GENERALES DE TRATAMIENTO CON ANTIDEPRESIVOS 1ª. Elección del antidepresivo: no existen criterios definidos acerca del ATD que idealmente debería prescribirse en una situación concreta. La mayoría de las veces el clínico tiende a seguir su propia experiencia, lo que tiene la ventaja de que, con el tiempo, va familiarizándose con el uso de determinados grupos de fármacos, pero también el inconveniente de disminuir las posibilidades reales de actuación. Muchos algólogos prefieren acostumbrarse al uso de unos pocos ATD, enviando al paciente al psiquiatra cuando se muestra refractario. Sin embargo, dada la frecuencia de la depresión, cada día será más conveniente que el médico no especialista se familiarice con su tratamiento. En la práctica las dos variables que se utilizan a la hora de elección son: —Antecedentes de buena respuesta terapéutica a este fármaco o grupo de fármacos en el mismo paciente o en familiares de primer grado. —Limitaciones debidas a los efectos secundarios. A título orientativo pueden tenerse en cuenta las indicaciones siguientes: IMAOs: Cuando el paciente o un familiar de primer grado ha obtenido una buena respuesta con IMAOs, en situación clínica similar, constituye una buena indicación de su prescripción, con probabilidad de buena respuesta. En los trastornos generados por dolor crónico, los IMAOs parece que no mejoran los resultados obtenidos con otros ATD, aunque en algunos casos de “depresiones resistentes” a otros ATD están recomendados. 152 Tricíclicos: generalmente se puede empezar con dosis mínimas 24 horas, pueden administrarse en 3 tomas diarias o en una sola toma cuando se trate de compuestos de acción prolongada. La dosis “ideal” mínima para una buena respuesta clínica se sitúa en 150 mg/24 horas. Ésta puede conseguirse al cabo de una semana de iniciado el tratamiento. Una vez alcanzada, se observarán los posibles efectos secundarios, y si no aparecen o son soportables, se seguirá 2/3 semanas con esta dosificación de mantenimiento. Si al cabo de este tiempo no se ha apreciado ningún tipo de respuesta terapéutica, está indicado aumentar la dosis hasta 300 mg/24 horas. Si al cabo de 6 semanas no se aprecia mejoría, nos encontramos frente a una depresión resistente al tricíclico. Sin embargo, antes de catalogar la depresión como resistente, puede efectuarse un último intento. Se trata de cambiar de ATD, en función de sus hipotéticas afinidades por uno u otro sistema neurotransmisor. Así, si se ha tratado al paciente con un ATD de acción noradrenérgica, deberá repetirse el intento con otro de acción serotoninérgica o viceversa. En el cambio no es necesario observar la pauta de dosificación progresiva, y puede pasarse en forma rápida a una dosis equivalente del segundo fármaco elegido (Tabla 2). No IMAOs-no tricíclicos: fármacos de más moderna síntesis, elaborados con el afán de hallar sustancias con buena eficacia antidepresiva, al menos igual a los tricíclicos, pero con menos efectos secundarios. Con la maprotilina las dosis iniciales medias son muy similares a las de los tricíclicos. La mianserina se inicia a dosis de 20-30 mg/día hasta llegar a 60-90 mg/día. La viloxacina se inicia con dosis de 100-200 mg/día hasta llegar a 200-400 mg/24 horas. Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes ANTIDEPRESIVOS TRICÍCLICOS. DOSIFICACIÓN Fármaco Dosis inicial Dosis de mantenimiento Imipramina 10-25 mg/día 150-300* mg/día Amitriptilina 10-25 mg/día 150-300* mg/día Clomipramina 10-25 mg/día 150-300* mg/día Desipramina 25-50 mg/día 100-250* mg/día Nortriptilina 25-50 mg/día 100-250* mg/día Doxepina 50-75 mg/día 150-300* mg/día Protriptilina 5-15 mg/día 20-60* mg/día * Las dosis más elevadas indicadas en la dosificación de mantenimiento no son habituales. Sólo deben utilizarse en pacientes que no han respondido durante 3-4 semanas a dosis medias inferiores. Tabla 2. Tricíclicos y no tricíclicos: los antecedentes personales o familiares, de buena respuesta a un determinado ATD, aconsejan repetir el fármaco en un nuevo episodio y numerosos trabajos apoyan la idea de que son los fármacos de primera elección en depresiones por dolor crónico. Así, la pérdida de apetito, pérdida de peso, insomnio medio o tardío, despertar precoz y empeoramiento matutino hacen elegir a los antidepresivos no IMAOs como primer agente. Dentro del grupo de los tricíclicos, algunos autores considerar fármacos de primera elección a las aminas terciarias (imipramina y amitriptilina), que aunque tienen más efectos anticolinérgicos que las secundarias (desipramina, nortriptilina, protiptilina) serían más eficaces. Dado que las aminas terciarias tienen mayor afinidad serotoninérgica y las secundarias noradrenérgica, el criterio de elegir una amina ter- ciaria, como primer fármaco, tendrá la ventaja de asegurar la presencia en el organismo de una doble acción. La clomipramina y la amitriptilina tienen un efecto sedativo asociado a su propia acción farmacológica, y algunos autores recomiendan emplear estos tricíclicos como fármacos de primera elección en las depresiones, en pacientes con dolor agudo recurrente de origen neoplásico. Se tratará de aprovechar terapéuticamente en un individuo un efecto asociado del fármaco (no un efecto secundario no deseable). Sin embargo, esa misma sedación, necesaria en algunas ocasiones, podrá conseguirse administrando conjuntamente ansiolíticos (depresión ansiosa) o neurolépticos (clorpromazina o levopromazina) en depresión con agitación. Tanto los ansiolíticos como los neurolépticos podrán retirarse progresivamente cuando se consiga la sedación al cabo de una o dos semanas. 153 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor 2ª. Inicio del tratamiento y mantenimiento del mismo: los tricíclicos requieren iniciar el tratamiento con una dosis relativamente baja y aumentar progresivamente esta dosis inicial, hasta alcanzar al cabo de una semana la dosis terapéutica. Otros ATD, llamados también de “segunda generación”, no requieren indispensablemente esta pauta progresiva. Así como la aparición del cuadro depresivo es gradual, también suele ser progresiva la desaparición de la sintomatología, y algunos rasgos clínicos mejoran antes que otros. Los “síntomas objetivos” (pérdida de apetito, retardo motor) suelen ser los primeros en aparecer y resolverse, es un momento delicado, ya que persistiendo la ideación depresiva, puede mejorar la inhibición; el paciente tiene entonces las “fuerzas” que le faltaban para suicidarse. Por ser el más conocido del grupo de los IMAOs, y del que se dispone mayor cantidad de trabajos controlados, se escoge la fenelzina como prototipo. Inicialmente se venían administrando alrededor de 45 mg/día, pero parece que deben prescribirse dosis más altas, ya que se ha comprobado que una inhibición de más del 80% de la MAO plaquetaria, sólo se consigue con dosis de alrededor de 60 mg/día. La dosis inicial de fenelzina es de 15-30 mg/día, aumentándose hasta 60 mg/día en 34 días, y esperando 3-4 semanas. Si no aparece ningún signo de mejoría, se aumenta hasta 75-90 mg/día, y de persistir la sintomatología en 6 semanas se puede considerar el cuadro depresivo “resistente a los IMAOs” (Tabla 3). Con nomifensin el tratamiento se inicia administrando 75-150 mg/día, según la gravedad y características del cuadro depresivo, pudiéndose llegar, en caso necesario, hasta una dosis total de 300 mg/día. Por carecer prácticamente de acción anticolinérgica, no es necesario seguir una pauta de dosificación progresiva. En estos fármacos siguen siendo válidas las mismas observaciones, en cuanto a duración de tratamiento y mantenimiento de la dosis, que se hicieron con respecto a los tricíclicos (Tabla 4). 3ª. Disminución de la dosificación y retirada del fármaco: una vez se ha logrado el control de la sintomatología, deben mantenerse los ATD por espacio de 3 a 6 meses. Una parte im- ANTIDEPRESIVOS IMAOs. DOSIFICACIÓN Fármaco Fenelzina Nialamida Iproniazida Dosis inicial 15-30 mg/día 25-50 mg/día 25 mg/día Dosis de mantenimiento 45-90 * mg/día 100-200* mg/día 100-150* mg/día * Las dosis más elevadas indicadas en la dosificación de mantenimiento no son habituales. Sólo deben utilizarse en pacientes que no han respondido durante 3-4 semanas a dosis medias inferiores. Tabla 3. 154 Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes NO IMAOs Y NO ANTIDEPRESIVOS. DOSIFICACIÓN Fármaco Nomifensin Viloxacina Mianserina Maprotilina Dosis inicial 75-150 mg/día 20-30 mg/día 150-300* mg/día 60-90 * mg/día Dosis de mantenimiento 150-200 mg/día 50-75 mg/día 200-400* mg/día 150-300* mg/día * Las dosis más elevadas indicadas en la dosificación de mantenimiento no son habituales. Sólo deben utilizarse en pacientes que no han respondido durante 3-4 semanas a dosis medias inferiores. Tabla 4. portante de los fracasos es debida a un mantenimiento corto en el tiempo del ATD, y a una retirada brusca. La supresión debe ser progresiva para que no aparezcan fenómenos de rebote. Así, deberían bajarse las dosis a un ritmo de 25-50 mg/semana. En esta etapa muchos enfermos temen volver a encontrarse mal, se les ha de dar seguridad en la eficacia del tratamiento. 4ª. Control y manejo de los efectos secundarios. Quizá la principal razón por la que los pacientes con dolor y tratamiento con ATD abandonan o disminuyen la medicación es la aparición de efectos secundarios indeseables. Éstos se presentan durante el tratamiento con la mayoría de los ATD. En ocasiones, son simplemente molestos y no revisten importancia clínica, en otras, son importantes para la salud y la propia vida del paciente. El médico debe acostumbrarse a su manejo y prevención. Muchas veces el efecto es soportable para el enfermo, a condición de que se le haya advertido sobre su posible aparición y se le haya quitado importancia. Una exploración general será suficiente para tener una idea del estado físico previo. Esta exploración sirve también para saber si los signos y síntomas que se observarán después bajo el tratamiento ya estaban presentes con anterioridad, a veces formando parte del propio cuadro depresivo. No es infrecuente que el paciente con dolor crónico se queje de sequedad de boca o disminución de la libido, ambas pueden aparecer debidas a los fármacos ATD, es obvio la importancia de conocer si previamente ya existían (Tabla 5). También hay que recordar que los ATD tricíclicos pueden desencadenar crisis maníacas (elevación del ánimo con exageración e hiperactividad) en pacientes bipolares, que tienden a pasar rápidamente de un extremo a otro de su afectividad (“cicladores rápidos”). Si esto aparece se remite al especialista para control y probablemente comienzo de tratamiento con carbonato de litio. Pueden agravarse los signos positivos de una esquizofrenia (delirio, alucinaciones). Es recomendable que se abstenga de recetar ATD, canalizando al paciente al especialista si aparece una depresión secundaria. La acción sobre el feto no está aclarada, habiéndose considerado que existe un potencial 155 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor EFECTOS SECUNDARIOS DE LOS ANTIDEPRESIVOS TRICÍCLICOS Vegetativos Sequedad de boca Estreñimiento, íleo paralítico Palpitaciones (taquicardia) Sudoración Sofocaciones Visión borrosa (alteraciones en la acomodación, midriasis) Hipotensión ortostática (mareos, inestabilidad, vértigos) Disuria, retención urinaria (agravamiento de síndromes prostáticos) Alteraciones en la eyaculación, anorgasmia Agravamiento de un glaucoma de ángulo agudo Centrales Temblor Precipitación de episodios psicóticos (manía, esquizofrenia) Síndrome anticolinérgico central (delirium atropínico) Crisis convulsivas (disminución del umbral convulsivógeno) Neuroendocrinos Síndrome de amenorrea-galactorrea Descenso de la libido Incremento de peso Cardiovasculares Alteraciones en el ECG Aplanamiento onda T Alargamiento segmento ST Ensanchamiento complejo QRS Retardo de la velocidad de conducción Arritmias, bloqueos, taquicardia sinusal Vegetativos Exantema cutáneo Tabla 5. 156 dismorfogenético de los tricíclicos. Deben administrarse con precaución en el embarazo y es recomendable que no se prescriban durante los tres primeros meses. También se han descrito alteraciones en el lactante, debidas al paso de ATD a la leche materna. Es recomendable la lactancia artificial si la madre debe ser tratada por una depresión puerperal, o por depresión previa. Aunque no ha quedado bien aclarado el mecanismo, es posible que si se suprimen bruscamente los ATD, se produzcan reacciones de “rebote”, como náuseas, malestar, trastornos gástricos y trastornos del sueño. Hay que retirar el fármaco de forma paulatina, siendo recomendable que el paciente se mantenga con dosis bajas durante un par de semanas. Recordar la importancia del efecto psicológico, puesto que muchos pacientes temen que al retirar el fármaco volverá la depresión. Los IMAOs presentan en general similares efectos secundarios. Sin embargo, las diferencias de manejo de éstos con los tricíclicos o con los “nuevos antidepresivos” han hecho que los IMAOs sean considerados por muchos clínicos como los ATD de tercera elección. No obstante, algunos clínicos siguen utilizándolos de forma rutinaria, pero es probable que se hayan familiarizado con ellos y controlen bien los efectos secundarios. La viloxacina tiene escasos efectos anticolinérgicos. La maprotilina es similar en efectos secundarios a la mayoría de tricíclicos y se ha informado de la aparición de crisis convulsivas, en personas predispuestas. La mianserina tiene un perfil sedativo y pocos efectos cardiovasculares. El trazodone y la zimelidina son serotoninérgicos de escasa acción anticolinérgica. El L-triptófano es un aminoácido sin acción anticolinérgica, que puede producir náuseas y otros trastornos digestivos desde el comienzo del tratamiento. Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes A los esquemas anteriores hay que añadir, en los pacientes con mal estado general (dolor agudo recurrente de origen neoplásico) y con antecedentes de problemas clínicos, similares a los que el propio tratamiento ATD puede originar, el screening completo: exploración general, ECG, hemograma y búsqueda de signos referentes a: glaucoma de ángulo estrecho, hipertrofia prostática, cardiopatía, hepatopatía y antecedentes convulsivos. La presencia de un efecto secundario de repercusión clínica implica: —Intentar valorarlo y controlarlo con las medidas correspondientes. —Si lo anterior no es posible se impone el cambio de ATD, pasando a fármacos de escasa o nula acción anticolinérgica. 5ª. Vigilancia del cumplimiento de las indicaciones médicas. Instrucciones al paciente y a los familiares ya que un porcentaje muy elevado de pacientes no sigue correctamente las instrucciones y abandona la medicación o se autodosifica, por considerar que no es un fármaco que les produzca un efecto antiálgico. En el tratamiento de las depresiones, la vigilancia del cumplimiento de la prescripción médica cobra un valor superior a cualquier otra patología. Cinco son las características que obligan a asegurarse el cumplimiento: 1. La propia alteración depresiva, que tiende a ser de curso fásico con comienzos, períodos más o menos severos, y remisión progresiva, todo ello en un espacio de varias semanas o meses. Muchas personas esperan resolver la situación en pocos días y ante el fracaso de esta expectativa, abandonan el tratamiento. 2. La creencia extendida de que lo importante en el tratamiento del dolor son los analgésicos. A veces, es el propio paciente y los familiares los que mantienen la idea y tienden a infravalorar el uso de otros fármacos. 3. La creencia de algunos enfermos con dolor crónico de que su curación no es posible, que nadie les puede ayudar y que no tienen solución, incluso pueden surgir ideas delirantes depresivas de la tríada hipocondria, culpa y ruina. 4. La latencia bioclínica de los ATDs es de unas dos semanas hasta que la sintomatología empieza a remitir. Muchos pacientes tienen la dificultad en aceptar que durante este periodo seguirán deprimidos. 5. La probable presencia de efectos secundarios anticolinérgicos, hace incómodo el tratamiento en sus comienzos. Si no existe una buena información a pacientes y familiares, creen que se trata de fármacos “fuertes” y dañinos. En la práctica, el cumplimiento de la prescripción del paciente aumenta si se le entrega información escrita con las normas a seguir y los efectos que pueden presentársele debidos al tratamiento (Tabla 6). ANTIDEPRESIVOS Y TRATAMIENTO DEL DOLOR Los ATD han sido repetidas veces utilizados en el tratamiento de diversos tipos de dolor crónico que no respondieron a las terapéuticas habituales. Así Davis y cols. trataron a varios enfermos afectos de dolor crónico debido a 157 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor INSTRUCCIONES AL PACIENTE Y FAMILIARES ANTE EL TRATAMIENTO CON ANTIDEPRESIVOS 1. Los medicamentos que va a tomar le pueden producir algunas molestias, sobre todo durante los primeros días. Es probable que tenga sequedad de boca, sensación de mareo, somnolencia o estreñimiento, no obstante, estas molestias no disminuyen el efecto beneficioso del tratamiento. Algunas personas son más sensibles que otras a tales efectos, que paulatinamente irán desapareciendo. 2. Hasta que no pasen unos 10-15 días, no puede decirse realmente que los medicamentos están haciendo efecto, por lo que no debe dejar de tomarlos prematuramente. A partir de estos 10-15 días, se irá encontrando mejor poco a poco. Quizá mejore antes en algunos aspectos que en otros, y notará que empieza a dormir mejor o que se encuentra algo más activo. Eso es buena señal. Después la mejoría será más rápida. 3. Las dosis que debe tomar, y las horas en que debe hacerlo, han sido pensadas concretamente para no aumentar la dosis de la medicación por su cuenta, pensando que acelerará la mejoría. Tampoco la disminuirá si se empieza a encontrar mejor, o duerme ya bien. Consúltenos las dudas que tenga o los problemas que puedan surgir, pero no modifique la pauta de medicación que se le ha indicado. 4. Si durante los primeros días se encuentra excesivamente somnoliento, podría ser útil que se quedara en cama durante 2 o 3 días, siempre que le sea posible. Después, al ir desapareciendo esa somnolencia, se encontrará con más ánimos y fuerzas para realizar su vida normal. 5. Ya le hemos indicado que tardará 1 o 2 semanas en empezar a encontrarse mejor en todos los aspectos. De momento, hasta que eso ocurra, no le pedimos que haga ningún esfuerzo especial aparte de tomarse la medicación. Nosotros sabemos que está poniendo de su parte todo lo posible para mejorar y curarse, pero, precisamente porque está enfermo, esas fuerzas le fallan. Sabemos que no está así porque quiere. Hasta que no se encuentre algo mejor, no se preocupe, confíe en el tratamiento y no se culpabilice por estar así, ya que no depende de su voluntad. En el momento en que empiece a encontrarse mejor, entonces es necesario que ponga de su parte todo lo posible, saliendo de casa, no quedándose demasiado tiempo en la cama, distrayéndose lo posible, haciendo ejercicio, ayudando en las tareas domésticas o encargándose de ellas, haciendo un esfuerzo por volver a leer los periódicos o ver la TV, si esa era su costumbre, etc. Entonces comprobará que esos esfuerzos son útiles, y se sentirá partícipe activo de los progresos del tratamiento. 6. Muchas personas no han pasado por esta alteración y no comprenden que se trata de una enfermedad, por lo que pueden pensar que los medicamentos no sirven demasiado, y que es el enfermo el que debe poner de su parte. No le extrañe si le dicen que está tomando demasiada medicación o que ésta no es buena para el organismo. No debe hacer caso, y debe confiar en su médico y en el tratamiento indicado. Es muy diferente ver las cosas desde fuera que sufrirlas desde dentro. Sólo usted sabe realmente que su abatimiento es anormal y no depende de su voluntad. Tabla 6. 158 Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes INSTRUCCIONES AL PACIENTE Y FAMILIARES ANTE EL TRATAMIENTO CON ANTIDEPRESIVOS (continuación) 7. Mientras esté en tratamiento no debe beber alcohol, ni siquiera las bebidas alcohólicas de baja graduación como el vino de mesa. La mezcla de alcohol con la medicación le podría sentar mal. 8. No suprima el tratamiento si por cualquier razón debe añadir alguna otra medicación, por una gripe, una infección, etc. El tratamiento es compatible con antibióticos, aspirinas u otros medicamentos que le han administrado para el tratamiento del dolor. De todas formas, si otro médico le prescribe un tratamiento mientras está tomando éste, consúltenos y le indicaremos lo que debe hacer. 9. Cuando se encuentre bien, todavía deberá tomar medicación por algún tiempo, ya se lo indicaremos en su momento, pero cuente con ello desde ahora. Para entonces, es posible que no tenga demasiadas molestias de efectos secundarios, de tal forma que no le será difícil el seguir tomando la medicación durante varias semanas más. Esta medicación no debe suprimirse bruscamente, por lo que ya se indicará la forma de hacerlo. A pesar de que tenga que tomar medicación durante algún tiempo, no se va a habituar a estas medicinas. Si se hace correctamente, tal como se le indica, una vez suprimida la medicación se encontrará bien del todo. 10. Consúltenos cualquier duda que tenga. No deje de comentar con nosotros, aunque sea por teléfono, cualquier aspecto del tratamiento sobre el que quiera saber más. Si no nos dice nada, pensaremos que las cosas van bien y que todo se desarrolla según el plan previsto. La mayor parte de las veces en que este tratamiento falla, es porque no se han seguido correctamente las instrucciones. Nosotros sabemos que el paciente es el primero en querer curarse y salir de este bache, por lo que también confiamos en que seguirá el tratamiento al pie de la letra. Tabla 6. neuropatía periférica diabética con amitriptilina (75 mg), con buenos resultados en todos ellos, tras fracasar la terapéutica con fenotiazinas, fenitoína, carbamacepina y vitaminas. En la misma línea están los trabajos realizados por Castaigne y cols. utilizando clorimipramina (25 a 200 mg/día), para el tratamiento de dolores en neuropatías periféricas, fundamentalmente post-herpéticas. Observan una disminución del dolor espontáneo y provocado, a pesar de que persisten sensaciones “anormales”. También Radebold ha usado la clorimipramina en el tratamiento del dolor crónico en pacien- tes neurológicos, con mejoría en el 75% de los casos. A pesar de los buenos resultados en el tratamiento del dolor en neuropatías periféricas, la mayoría de las publicaciones hasta la actualidad se refieren a la utilización de imipramínicos en el tratamiento del dolor canceroso (Shim y cols.), destacando los de Daxemuller, Monkemeier y Steffen. Barjou y Deuschmann, utilizaron imipramina y Adjan emplea clorimipramina. Los ATD más utilizados para este tipo de dolor han sido, según Shim y cols., la imipramina y amitriptilina. Probablemente, el efecto analgésico de 159 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor los ATD tricíclicos descansa sobre 3 pilares: a) capacidad para potenciar los analgésicos; b) el propio efecto ATD (efecto placebo) y c) un efecto analgésico per se (Shimm y cols.). Potenciación de la analgesia narcótica Los imipramínicos puedan prolongar los efectos de diversas drogas activas sobre el SNC (Liu y Wang). La desmetilimipramina potencia la analgesia morfínica (Saarnivara y Mattila) y la inducida por metadona (Liu y Wang). Similares resultados se han obtenido frente a morfina y pentazocina con la administración previa de clorimipramina (Lee y Spencer) y nomifensina (González y cols.) así como con amitriptilina y nortriptilina (Malseed y Goldstein). Los mecanismos por los cuales los ATD aumentan el efecto analgésico de los opioides no están bien establecidos. Se atribuye a interacciones: farmacocinéticas y a nivel del SNC. Efecto antidepresivo y efecto placebo El carácter crónico del dolor influye en el desarrollo de alteraciones psicológicas: angustia, ansiedad y cuadros depresivos, dando lugar a una depresión exógena o reactiva. El tratamiento con ATD mejora tanto la sintomatología psíquica como la dolorosa. Así, un ensayo clínico realizado en depresivos con dolor facial o de cabeza, el tratamiento con fenelzina (15 mg/3-4 veces al día) e imipramina (25-50 mg/3 veces al día), solas o en asociación, alivió síntomas psiquiátricos y el dolor (Nebb y Lascelles). Sin embargo, el efecto ATD no debe ser el único mecanismo por el cual estas sustancias presentan actividad analgésica, ya que han sido 160 efectivas en cuadros dolorosos que no presentaban sintomatología depresiva (Gastaigne y cols.). Además, las dosis para tratar el dolor son menores, según Reuler y cols., que las necesarias para efectos psicoterapéuticos. El autor achaca la analgesia al bloqueo del círculo vicioso dolor-ansiedad-depresión-dolor. Hay autores que ven la acción analgésica de los ATD como un efecto placebo. De hecho, una revisión realizada por Beecher, en 1.682 pacientes con cuadros dolorosos orgánicos, reveló que un 35% había experimentado mejoría con un placebo. No obstante, la opinión de Veylon es que esta hipótesis no es probable, en base al porcentaje de éxitos conseguidos y a que el efecto analgésico es sólo evidente en enfermos afectos de dolores crónicos resistentes a otras terapéuticas. Finalmente, los resultados favorables en cuadros dolorosos tratados con ATD alcanzan un 75% de los casos, unido a las consideraciones anteriormente expuestas, hace difícil admitir esta hipótesis (Tourlinhac). Acción analgésica per se El mecanismo íntimo de la acción analgésica de los ATD hay que buscarlo en las modificaciones que estas sustancias producen sobre la bioquímica de los sistemas centrales de neurotransmisión. Se sabe que la 5-hidroxitriptamina o serotonina participa en los mecanismos centrales neuromoduladores, responsables de la reducción del dolor (Messing y Lytle). El aumento de niveles mediante la administración de triptófano, precursor de esta indolamina, produce efecto analgésico (Mayer y Price). Ya que los ATD tricíclicos aumentan los niveles de serotonina a nivel sináptico (Sulser y cols.) sería lógico pensar que éste podría ser responsable de la analgesia. Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes Por otro lado, parece ser que la serotonina, cuyos niveles centrales se elevan tras la administración de morfina (Lee y cols.), desempeña un importante papel en el mecanismo de acción de diversos analgésicos. Así, se ha propuesto que la analgesia morfínica estaría mediada, en parte, por la activación de vías serotoninérgicas descendentes que bloquean los impulsos nociceptivos a nivel del asta posterior de la médula (Weil-Fugazza y cols.). Esto concuerda con resultados obtenidos por Alamo y cols., según los cuales la administración de paraclorofenilalanina, inhibidor de la síntesis de serotonina, antagoniza la analgesia morfínica en el animal de experimentación. Teniendo presentes todas estas consideraciones, no es difícil explicar que la acción analgésica de los narcóticos se vea potenciada por la administración de ATD tricíclicos, ya que puede existir un sinergismo entre las dos con relación a la activación de las vías serotoninérgicas centrales (Ossipov y cols.). Por otro lado, los sistemas adrenérgicos centrales también parecen representar un papel importante en la neuromodulación de la sensación dolorosa, de tal manera que la acumulación a nivel central de noradrenalina ha sido asociada con un efecto antinociceptivo (Mayer y Price). Así, la administración intracerebroventricular de noradrenalina produce un efecto analgésico en el animal de experimentación (Gardella e Izquierdo), mientras que la administración de metil-paratirosina antagoniza la acción analgésica de la morfina. Una de las acciones bioquímicas de los imipramínicos es el aumento de los niveles sinápticos de noradrenalina, por tanto, esta acción puede jugar un papel en el desarrollo del efecto analgésico y/o potenciador de otros analgésicos. En dolores crónicos el mecanismo estriba en las modificaciones que los imipramínicos inducen sobre los sistemas centrales de neuro- modulación. En cuanto a la potenciación de la acción analgésica de los opioides parece ser que, además, intervienen factores de tipo farmacocinético. El efecto placebo, así como una acción estrictamente antidepresiva, parecen estar descartados. ANTIDEPRESIVOS ATÍPICOS A pesar de la efectividad de los compuestos heterocíclicos en el tratamiento de la depresión, diversos factores han propiciado la búsqueda de nuevos compuestos ATD, para obtener productos con (Tabla 7): 1. Mayor rapidez de acción. 2. Mayor eficacia terapéutica. 3. Menores efectos adversos. Dentro de los ATD se ha introducido recientemente para el tratamiento de la depresión la venlafaxina. Su mecanismo de acción consiste en inhibir la recaptación de noradrenalina y serotonina y en menor grado la dopamina. No presenta actividad sobre los receptores muscarínicos, histamínicos y, α y β adrenérgicos, lo que da buena tolerancia, presentando pocos efectos adversos. Es importante recalcar que la acción de estos fármacos parece ser independiente de su efecto antidepresivo. De hecho, mejoran los procesos dolorosos a dosis mucho más bajas de las habitualmente eficaces en trastornos depresivos. Los inhibidores selectivos de recaptación de serotonina y los inhibidores de recaptación de serotonina y noradrenalina, de reciente introducción, están mostrando ser casi tan eficaces como los ATD clásicos en estos procesos sin la mayoría de los efectos secundarios (Tabla 8). 161 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor PROPIEDADES FARMACOCINÉTICAS DE LOS ISRS Pico plasmático máximo Fluoxetina Fluvoxamina Paroxetina Sertralina Citalopram 6-8 2-8 2-8 6-8 2-3 Vida media 1-3 días 15 horas 20 horas 25 horas 36 horas Metabolitos activos Norfluoxetina No No Desmetilsertralina Desmetilcitalopram Tabla 7. EFECTO ANALGÉSICO DE ANTIDEPRESIVOS TRICÍCLICOS FRENTE A ISRS Sustancia Zimelidina Amitriptilina Fluvoxamina Desipramina Moclobemida Paroxetina Imipramina Fluoxetina Desipramina Amitriptilina Fluvoxamina Dosis (mg/día) 100-300 10–75 225 75 450 40 12-150 12–150 20–40 50 Duración 3 sem. Dolor Resultado Neuralgia postherpética AMI > ZIM Inducido DMI > FVX DMI > MCB FVX > MCB PXT > PLC* IMI > PLC* IMI > PXT AMI = DMI FXT = PLC* FVX > AMI 8 sem. Neuropatía diabética 12 sem. Neuropatía diabética 12 sem. Cefalea PLC= placebo Tabla 8. 162 Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes La fluoxetina y la paroxetina se han estudiado como tratamiento para la neuropatía diabética, con resultados de menor eficacia que los tricíclicos. La sertralina y la fluvoxamina también se han estudiado como tratamiento de varios tipos de cefalea, con resultados dispares. Los últimos estudios indican que la venlafaxina tiene efectos analgésicos demostrados, y algunos como la sertralina, en patologías concretas abren sólidas líneas de investigación en cuadros de dolor crónico, como es la fibromialgia (Tabla 9). Estos fármacos representan un avance sobre el resto de los ATD en el perfil de efectos colaterales. Carecen de efectos anticolinérgicos e histamínicos. No bloquean los receptores adrenérgicos no provocando hipotensión ortostática. En general, son más seguros desde el punto de vista cardiovascular, son de baja toxicidad y relativa seguridad en sobredosis. No potencian los efectos del alcohol, sedantes, fármacos anticolinérgicos e histamínicos. Los efectos adversos son de tipo gastrointestinal, náuseas y diarrea, los pacientes pueden presentar un grado variable de efecto estimulante en forma de incremento de ansiedad, temblor, insomnio o cefalea. Su cuadro más intenso es similar al síndrome serotoninérgico. MEDIDAS PSICOTERAPÉUTICAS EN LA DEPRESIÓN No puede hablarse de una psicoterapia, totalmente estructurada, encaminada de forma estricta al tratamiento de enfermedades que cursen con dolor y depresión. Sin embargo, debe tenerse en cuenta un conjunto de medidas psicoterapéuticas básicas, que sumadas a la farmacoterapia, tienen un efecto de sinergismo o potenciación mutua, cuyo empleo en unidades de dolor tiene que pasar a ser rutinario. Básicamente debe prestarse apoyo: —Al paciente y familiares, en sus posibles sentimientos de culpa e intentando suprimirlos EFECTO ANALGÉSICO DE DIVERSOS ANTIDEPRESIVOS ISRS Sustancia Citalopram Fluoxetina Fluoxetina Fluoxetina Fluoxetina Fluoxetina Fluoxetina Dosis (mg/día) Duración 20–40 20-40 20 20-60 20-40 20 8 sem. 4 sem. 3 meses crónico 3 meses 6 sem. Dolor Reumático Cefalea Reumático Miembro fantasma Diverso Cefalea Reumático Resultado CTP = PLC* Analgesia No analgesia Analgesia Analgesia FXT > PLC* FXT = PLC* PLC= placebo Tabla 9. 163 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor en la medida de lo posible. Se debe hacer ver que sus esfuerzos para salir de la crisis son importantes y necesarios, que el médico cuenta con que los ponga en práctica y sabe que no está así por su voluntad. Muchos pacientes depresivos creen que los demás pueden pensar que no está enfermo, o no está poniendo la suficiente fuerza de voluntad. tes de la entidad médica y estar exacerbada por ésta. La terapéutica de relajación y las técnicas de distracción son eficaces en su tratamiento. Si el dolor está controlado, pero persiste aún la ansiedad, son útiles las benzodiazepinas (BZD), antipsicóticos, antihistamínicos y ATD. —La autoimagen y autoestima de estos pacientes suelen estar deterioradas. Por ello, es importante reforzar aspectos positivos y adaptativos del paciente, es decir, una actitud positiva hacia la curación. Objetivos generales —El paciente depresivo con dolor crónico tiende a aislarse. En una primera etapa del tratamiento, debería ser admitida esta actitud. Pasados los primeros días, y pensando que la farmacoterapia empieza a ser clínicamente efectiva, es el momento de potenciar y propiciar salidas, relaciones sociales y, en suma, todo aquello que vaya hacia una progresión de la resolución del cuadro clínico. ANSIOLÍTICOS ABORDAJE TERAPÉUTICO La ansiedad es un síntoma habitual en los pacientes con dolor. Los esfuerzos para hacerle frente deben centrarse en el alivio del dolor con analgésicos, cuando se consigue esto, suele remitir la ansiedad. Los diferentes trastornos de ansiedad, en pacientes con dolor, suelen ser incapacitantes. La ansiedad puede ser aguda o crónica. La ansiedad aguda se relaciona con el tratamiento de la enfermedad subyacente: cirugía, espera del diagnóstico o resultados de las pruebas. La ansiedad crónica puede haber existido an- 164 Toda terapéutica ansiolítica, debe procurar: —Devolver al paciente a niveles previos de funcionamiento adaptativo, normalizando comportamientos interferidos por la ansiedad. —Mejorar o reestructurar la autoimagen o autoestima del paciente, relaciones interpersonales, adaptación y rendimiento sociolaboral. —Favorecer la aparición de defensas que el individuo posee y no utiliza por el propio bloqueo del cuadro de ansiedad. Muchos pacientes con dolor saben cómo enfrentarse a determinados conflictos interpersonales, pero son incapaces de poner en marcha conductas concretas de control de esta situación. —Aprender mecanismos adaptativos nuevos, enseñarle formas de actuación, facilitar que el propio paciente pueda cambiar actitudes o comportamientos. Puede postularse que este “enseñar” o “facilitar el aprender” es en todo caso terreno del especialista. Las terapéuticas comportamentales pretenden cambiar comportamientos y aprendizajes no adaptativos, por otros adaptativos. El médico de la Unidad del Dolor puede estar más capacitado, si conoce a fondo al paciente y su entorno, para proponer conductas o actitudes alternativas. Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes —Posibilitar que se enfrente al conflicto, estrés, y a sus variables vitales del momento, con capacidad de dominio de la situación. Muchos pacientes con esta patología se sienten dominados, indefensos, o impotentes para cambiar aquellos aspectos concretos que, equivocadamente o no, constituyen la base de su disconfort. La terapéutica no puede modificar este conjunto de variables externas, pero debe favorecer que cambie una actitud pasiva y fatalista por otra activa de control de la situación. —Liberarlo de sintomatología incapacitante. Hay pacientes que focalizan su atención en síntomas que le preocupan: taquicardias, disnea suspirosa, temblor. La terapéutica de los trastornos de ansiedad, especialmente la psicofarmacoterapia, no tiene como misión sustituir las defensas propias del individuo, sino facilitar que éstas se pongan en marcha cuando están bloqueadas o interferidas por la propia ansiedad. No tienen tampoco la intención de eliminar el estrés y el conflicto real del paciente, sino conseguir que el individuo se enfrente a él. El médico debe ser cauto en confirmar las “etiologías” (problemas previos, enfermedad actual, estrés, exceso de trabajo, conflictos familiares), pero negarlas totalmente y hacer hincapié en el “automatismo” psicofisiológico de la patología, puede ser vivido de forma negativa, situándolos en una atmósfera de fatalismo siendo inútil entonces medidas adaptativas personales. Instrumentos terapéuticos Psicofarmacoterapia La psicofarmacoterapia de los trastornos de ansiedad es muy variada, porque existen múl- tiples preparados útiles en el control total o parcial de los cuadros. Disponemos de un espectro más o menos concreto de psicotropos, ansiolíticos, capaces de aliviar, o controlar esta patología. Barbitúricos: están hoy día totalmente desplazados del tratamiento de los trastornos de ansiedad (características depresoras). Se habían empleado los de vida media intermedia: amobarbital y butabarbital, o de vida media larga: fenobarbital. Existen pacientes que utilizan barbitúricos “habitualmente”, con fines hipnóticos, que esconden una ansiedad mitigada por el sueño “como defensa”. De interés a nuestros propósitos, hay que señalar tres puntos: —Relevancia de la inducción enzimático-microsomial hepática. —Tolerancia cruzada con alcohol y BZD. —Sumación de efectos con las BZD (muerte por sobredosis). Propanodioles: antes de la comercialización de las BZD, el meprobamato y el tibamato eran los fármacos “antiansiedad” prototipos. Su efectividad en la reducción del nivel general de ansiedad está probada, pero es inferior a la de las BZD. La potencialidad suicida por sobredosificación, es superior. Su uso puede ser considerado no rutinario, indicados como alternativa en refractariedad. Antihistamínicos: la hidroxicina y la clormezanona han sido utilizados en esta área de patologías, aprovechando la marcada acción sedante central. También se hallan desplazados por las BZD por su eficacia. La hidroxicina es utilizada por personas con rasgos ansiosos, como “sedante” o “hipnótico habitual”. Neurolépticos: fármacos utilizados en el tratamiento del dolor crónico, la mayoría son bloqueantes dopaminérgicos, se denominan 165 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor también, “antipsicóticos”. A pequeñas dosis, (1/5 de dosis antipsicótica), se muestran efectivos en el tratamiento de la ansiedad. No deben ser prescritos de forma rutinaria como “antiansiedad”, por su desplazamiento por las BZD, y sus reacciones extrapiramidales y disquinesias tardías. Su “lugar de acción” es central a nivel del tracto nigroestrial y los circuitos mesolímbico y tuberoinfundibular. Beta-bloqueadores: Desde los años 60 se han realizando estudios, especialmente con el propranolol, para dilucidar el efecto de los beta-bloqueadores. El máximo beneficio se deriva de su acción bloqueante beta-adrenérgica periférica con la supresión de síntomas como taquicardia y temblor. Las dosis son inferiores a las del tratamiento de la hipertensión. En la actualidad, su uso debe ser limitado a casos concretos en los que el paciente presenta gran disconfort por su temblor y/o taquicardia. Aunque el algólogo valore estos síntomas, esos pacientes pueden “no mejorar”, por su focalizada atención a los síntomas. Su supresión o control pueden ser beneficiosos, por un mecanismo de feed-back mejorando autoimagen y autoestima. Antidepresivos: su uso es tan “clásico” como repleto de resultados contradictorios. La efectividad de ciertas moléculas antidepresivas, en cuadros en los que no hay aparentemente componente de depresión, plantea importantes cuestiones teóricas como la posibilidad de un cierto continuum ansiedaddepresión o en de depresiones enmascaradas. En la práctica, puede resumirse así: la fenelzina y la imipramina son eficaces en el tratamiento de la recurrencia de las crisis de ansiedad (70-90% de efectividad respectivamente). Los ISRS se han incorporado al tratamiento de campos concretos de la ansiedad (fobias, TOC,...). Las BZD por sí mismas no parecen evitar la recurrencia de estas crisis. Su 166 acción es prioritaria, reduciendo el nivel de ansiedad generalizada. Factores específicos y no específicos del tratamiento En el tratamiento de los trastornos de ansiedad, intervienen: factores específicos propios de los instrumentos terapéuticos y factores no específicos de éstos, que no hay que infravalorar en el dolor crónico. Estos factores influyen decisivamente en la eficacia del tratamiento (Tabla10). BENZODIAZEPINAS Son los fármacos más eficaces en la reducción del nivel general de ansiedad en el paciente con dolor: mejora de la perfomance del sujeto, facilita la psicoterapia, posibilita la puesta en marcha de defensas o recursos del individuo, paso de una situación pasiva del paciente a una posición más activa de control de la situación. Su “lugar de acción” está a nivel central, en íntima relación con las estructuras del sistema límbico, y puede esperarse: —Un cambio en la expresión verbal y no verbal de las vivencias y sentimientos de disconfort, inseguridad, nerviosismo y angustia. —Una adecuación a la perfomance, con me jora de rendimientos más directamente ligados a él: sueño, motivaciones psicofisiológicas (sexual, alimentación). —Una disminución o supresión de la sintomatología periférica del cuadro clínico. El efecto global de este triple vector es una mejora de las relaciones interpersonales, un Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes FACTORES NO ESPECÍFICOS QUE MEJORAN GLOBALMENTE LOS CUADROS DE ANSIEDAD Del propio médico —Relación buena, cálida y afectuosa con el paciente —El médico se siente confortable —Actitud positiva y realista hacia la prescripción de psicofármacos —Expectativas a priori de buen pronóstico —Resolución del dolor Del paciente —Mujer, edad adulta —Inteligencia normal y/o normal-alta —Carácter no-débil, indefenso o pobremente estructurado —Estatus socioeconómico, educacional y ocupacional, medios y altos —Casado; estatus marital estable —Etiología subjetiva emocional (vs. somática) —Expectativas y aspiraciones terapéuticas realistas y adecuadas —Baja hostilidad verbal Del cuadro clínico —Nivel de ansiedad moderado-alto —Relevancia de las somatizaciones —Bajo o nulo componente obsesivo-compulsivo —Bajo o nulo componente depresivo —Baja o nula disminución de relaciones interpersonales —Cuadro crónico —Estrés precipitante plausible o reconocible (cuadro situacional) —Enfermedad médica estructurada concomitante —No menopausia o histerectomía —Tratado por el médico de familia o cabecera —No tratamientos anteriores con psicofármacos, o escasos y breves —Antecedentes de buena respuesta a tratamientos similares anteriores —Sedación mínima o moderada, buena respuesta global, experimentadas en las dos primeras semanas Tabla 10. 167 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor cambio positivo en la autoestima del paciente al verse liberado de las interferencias ansiosas y sin tantas limitaciones en su funcionamiento cotidiano, y finalmente, una mejor disposición para afrontar la presión estresante ambiental. Uso de benzodiazepinas Prescripción y consumo Existe un aparente abuso y sobreprescripción de las BZD en el mundo occidental. En 1972 el diazepam fue el fármaco más prescrito en los Estados Unidos como complemento de la analgesia en las Unidades del Dolor. Mientras llegaba a esta cota, el fenobarbital, el meprobamato y otros antiguos tranquilizantes, fueron descendiendo. Desde los años 70 hasta la actualidad existe una disminución de las prescripciones de estas sustancias. Además hay que destacar su posible mal uso, no sólo por parte de los pacientes, sino de los propios médicos. Así, se ha podido comprobar una mala práctica de administrar BZD de forma ocasional y discontinua. Los expertos coinciden en que no hay una sobreprescripción de ansiolíticos, aunque sí un uso incontrolado. El problema está en conocer qué población, de las Clínicas del dolor, precisa estos fármacos y cuáles son las variables que condicionan un posible riesgo de dependencia. Acciones farmacodinámicas 1. Efecto ansiolítico: es la acción farmacodinámica específica por la que de forma prioritaria se utilizan. No se han podido demostrar diferencias sustanciales en cuanto a potencia de esta acción entre los diferentes fármacos del grupo, ésta podría 168 explicarse por dosificación o farmacocinética. 2. Acción miorrelajante: sobre la fibra esquelética puede ser tenida en cuenta como acción terapéutica en cuadros con dolor, deseada en casos en los que se pretende disminuir tensión muscular, o como efecto adverso indeseado en otros. 3. Acción anticonvulsiva: la rápida concentración del diazepam en el cerebro, le ha hecho ser el fármaco de primera elección en el tratamiento de cuadros con convulsiones, especialmente por vía endovenosa. El clorazepam, otro derivado BZD, ha sido comercializado de forma exclusiva en función de este efecto farmacodinámico. El efecto anticonvulsivo de las BZD tiende a desaparecer tras su uso en las Unidades de dolor. 4. Acción hipnótica: todos los fármacos de este grupo tienen acción inductora del sueño. Ninguno se ha revelado como reestructurador o corrector de las alteraciones del ritmo del sueño, produciendo más bien distorsiones del mismo. 5. Acción sobre la memoria: estos fármacos producen un déficit temporal de la memoria a largo plazo, en forma de amnesia anterógrada, y cierto déficit en la memoria a corto plazo. Tal acción ha sido deseada como medicación preanestésica, teniendo un efecto negativo en la administración a largo plazo. 6. Acción sobre la agresividad y sobre ciertos aprendizajes: en el animal de experimentación, las BZD se muestran como “antiagresivos” y a la vez inhibidores de la res- Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes puesta de evitación a un estímulo aversivo. No está claro si en el hombre se da un cierto paralelismo de tal acción. Ello sería una buena razón para limitar su utilización a períodos de tiempo concretos. En resumen, puede decirse que el conjunto de acciones farmacodinámicas puede dividirse en deseables o no deseables, en función de los objetivos terapéuticos. En algunos casos puede interesar un efecto ansiolítico y a la vez hipnótico. En otros, un efecto ansiolítico sin la acción inductora de sueño y sin relajación muscular. Finalmente, puede interesar la obtención de una relajación muscular que disminuya la tensión del paciente. La complicación técnica real viene dada fundamentalmente por las diferencias farmacocinéticas (Tabla 11). Desde el punto de vista práctico pueden proponerse dos grandes grupos terapéuticos: 1. Benzodiacepinas de absorción y eliminación rápida de compuestos de acción corta, con metabolitos inactivos: temazepam, lorazepam, oxazepam y triazolam, fundamentalmente. De uso frecuente en dolor. 2. Benzodiacepinas de eliminación lenta de compuestos de acción prolongada, con metabolitos activos: clordiazepóxido, clobazam, clonazepam, diazepam, flunitrazepam, flurazepam y nitrazepam, fundamentalmente (los metabolitos del clonazepam y nitrazepam son inactivos y por lo tanto excepciones del subgrupo). Efectos adversos Junto a lo anterior, hay que destacar los siguientes efectos generalmente considerados como adversos y no deseados: —Somnolencia excesiva. —Sensaciones de “mareo” y “desconexión del medio ambiente”. —Cefaleas y pesadez de cabeza matutinas: con BZD hipnóticas o dosis nocturna. —Efectos anticolinérgicos: sequedad bucal, constipación, diarrea o visión borrosa. —”Reacciones paradójicas”: agitación, confusión, irritabilidad, depresión, insomnio. —Disminución de la libido. —Amnesia. —Ataxia. —Interferencias con la performance. En la presentación de estos efectos adversos es significativa en primer lugar la dosificación del fármaco, y en segundo lugar la idiosincrasia del paciente o su vulnerabilidad (cáncer o de edad avanzada). El mayor efecto adverso es la interferencia de las BZD con la performance del individuo. Se ha podido comprobar que hasta un 20% de los conductores de vehículos, tras accidentes de tráfico, estaban tomando BZD. Se ha postulado que las llamadas “nuevas BZD“ o 1,5-benzodiazepinas, fundamentalmente el clobazam, tienen más ventajas, en la medida en que la interferencia con la performance cognitiva y/o motora es más baja o nula y no ejerce “efectos negativos” sobre la memoria. Contraindicaciones relativas Las principales contraindicaciones relativas de la utilización de estos fármacos para el tratamiento del dolor, son: 1. Los extremos de edad de la población: niños y ancianos. 169 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor PROPIEDADES DE LAS BENZODIAZEPINAS Compuestos Vida media (horas) Características Vida media larga: Long acting Clordiazepóxido Diazepam 5-30 Absorción rápida y completa por vía oral dependiente de la edad 20-100 Niños: pico plasmático rápido; edad avanzada: absorción lentificada Absorción muy irregular vía im (=60% vía oral). Alta fijación a proteínas plasmáticas. Extensa biotransformación hepática. Acumulación del metabolito principal, desmetildiazepam, en "steady-staW', más alta de 3-4 semanas presente, pues, durante este tiempo, aun tras haber suprimido la administración Medazepam Se transforma en diazepam Clorazepato Se transforma en el metabolito del diazepam, desmetildiazepam Prazepam No alcanza la circulación sistémica. Precursor del desmetildiazepam que alcanza la circulación general, tras la administración de dosis única, más lentamente que proviniendo del clorazepato Pinazepam Pro-desmetildiazepam Flurazepam 50-100 Comercializado como hipnótico, su metabolito principal tiene una vida media de 50100 horas, por lo que tal extensa biotransformación hace que su farmacocinética no sea “adecuada” como hipnótico y sí como ansiolítico. A la 7ª noche de tratamiento se encuentran concentraciones hemáticas 4-6 veces mayores del metabolito principal que la primera noche Flunitrazepam 20-30 Uso como hipnótico Tabla 11. 170 Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes PROPIEDADES DE LAS BENZODIAZEPINAS (continuación) Compuestos Vida media (horas) Clonazepam 24-48 Clobazam 18-50 Vida media intermedia-corta: Short-acting Nitrazepam 20-30 Bromazepam 10-20 Estazolam Alprazolam Temazepam 10-30 6-20 8 Lorazepam 10-15 Oxazepam 4-15- Vida media ultracorta: Ultra-short acting Triazolam 2 Características Comercializado como antiepiléptico, sus dos metabolitos principales son inactivos Su metabolito, desmetilclobazam, llega a acumularse en suero hasta 8 veces la concentración del clobazam, en tratamientos prolongados. Clasificado farmacocinéticamente como "longacting" se trata de una 1,5 benzodiazepina a diferencia del resto de este grupo. Posible ausencia de efectos adversos de déficit amnésico o interferencias con performance Comercializado como hipnótico véase no obstante que su vida media no es muy corta. Antiguamente indicado en algunas formas de epilepsia Compuesto pro-nordiazepam, aunque de vida media más corta que el resto del subgrupo que se transforma en nordiazepam o desmetildiazepam Rápidamente absorbido y eliminado con pico plasmático en 1h, cumpliría pues los "requerimientos" de un hipnótico "ideal" Metabolitos inactivos. Excreción urinaria. Indicación en cirróticos y hepatopatías, así como en pacientes de edad avanzada. Mayor posibilidad sin embargo de efectos "rebote" y acaso de dependencia Idem al Temazepam en cuanto a las características de su farmacocinética que lo convierten en hipnótico ideal. El triazolam es por el momento el hipnótico benzodiazepínico con mejor relación beneficio/ riesgo y efectividad Midazolam Tabla 11. 171 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor 2. Enfermedades neuromusculares: miastenia gravis y la distrofia muscular. 3. Personas expuestas a riesgo potencial: conductores de vehículos o manipuladores de instrumentos o máquinas de cierto peligro. 4. Pacientes respiratorios: riesgo de depresión respiratoria. Diferencias farmacocinéticas Absorción y distribución: las BZD se absorben rápidamente por vía oral. Se alcanzan picos de niveles plasmáticos entre los 30 y 240 minutos. La biodisponibilidad está en función de las diferentes vías de administración, de tal forma que, el diazepam y el clordiazepóxido, su administración intramuscular produce una absorción lenta y errática. Por ello, no deberían administrarse por esta vía. Este grupo de fármacos tiende a distribuirse bien en diferentes tejidos, alcanzando concentraciones cerebrales de forma rápida, lo que constituye el argumento de la indicación de esta prescripción (de fármaco y vía) en la resolución y control del estatus epiléptico. Metabolismo y eliminación: al menos pueden diferenciarse tres grupos desde el punto de vista de su vida media y de los pasos metabólicos. El conocimiento de las diferencias es básico para su utilización correcta. Modalidades de dosificación El efecto de las BZD a nivel central depende de su concentración en los receptores correspondientes, lo cual implica que la elección de las BZD debe incluir no sólo el tipo de pro- 172 ducto sino: dosificación, intervalo entre dosis y vía de administración. Mientras concentraciones elevadas a nivel central pueden implicar una depresión de los mecanismos de control, concentraciones demasiado bajas pueden resultar ineficaces terapéuticamente. Lo que justifica la atención a los datos farmacocinéticos. Importancia en la dosificación de las BZD: 1. Dosis única: debe tenerse en cuenta que la dosis única se asocia con la rapidez de comienzo de la acción clínica, como la reducción de la ansiedad. Una absorción lenta puede disminuir la percepción del paciente de la atenuación o eliminación de la ansiedad. Una absorción rápida es deseable y se utiliza con fines hipnóticos o en un estado de ansiedad agudo y situacional. Una absorción demasiado rápida puede ser percibida en forma de somnolencia o desconexión. El diazepam y clorazepato se absorben rápidamente, por lo que además de ansiolíticos, son frecuentemente propuestos como hipnóticos. 2. Terapéutica con dosis múltiples: las BZD con vida media larga se acumulan extensa y lentamente, mientras que las de vida media corta presentan una acumulación no extensiva y completada rápidamente. Debe insistirse en que el efecto del fármaco no se incrementa en proporción directa a la concentración en plasma, en una terapéutica con dosis múltiple. Factores como la tolerancia y la adaptación pueden contraponerse o modificar los efectos farmacocinéticos. Un ejemplo de lo anterior es la “depresión no específica del sistema nervioso central”. Los pacientes que experimentan de forma rápida una sedación «no prevista», en los comienzos Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes mismos del tratamiento con diazepam, pueden tender a dejar de experimentar sedación después, a pesar de que se continúe administrando la misma dosificación, y hay evidencia de una acumulación del fármaco. Efectos ansiolítico y sedante en función de la dosis Un fármaco de esta familia BZD pueda actuar como ansiolítico no sedante o como sedante en función de la dosificación. No está clara la equivalencia de dosis y efectos entre los diferentes componentes de este grupo químico. Algunos pacientes responden con sedación a una dosificación teóricamente ajustada a su situación clínica, mientras que otros no experimentan tal efecto. Recordar la presencia de diferencias individuales: personalidad de base y nivel previo de ansiedad. A mayor intensidad del nivel base de ansiedad, mayor efecto ansiolítico de las BZD, y los efectos sedantes aparecerían más en pacientes con niveles más bajos. Interacciones farmacológicas, grado de seguridad y otros factores que condicionan la eficacia clínica global Las BZD son fármacos de alta seguridad. Utilizadas a dosis terapéuticas, las modificaciones de parámetros fisiológicos: presión sanguínea, pulso, respiración, peso y ECG son mínimas. El principal riesgo es la excesiva sedación que puede producirse con dosis elevadas, con lo que la sedación puede ser primer efecto adverso y finalmente situación de riesgo: conducción de vehículos. El ejemplo de esta seguridad es la sobredosis en intentos de suicidio. En la mayoría de casos letales está presente otra circunstancia: la combinación de BZD con otros fármacos o alcohol. Dentro de los primeros hay que señalar, por su frecuencia, el efecto de sumación de ATD y BZD. En cualquier situación en la que se observe una intensa depresión central, y se postule una BZD como causante, se ha de sospechar la asociación de algún otro fármaco o de alcohol. En cuanto a las interacciones (Tabla 12), debe insistirse en los factores de edad y situación del metabolismo hepático, los dos más importantes en una posible modulación del efecto clínico deseado. Los pacientes ancianos y con mal estado general tienden a una mayor acumulación de los fármacos, por un enlentecimiento del metabolismo o de la propia absorción, requieren una dosificación más baja de BZD de vida media larga. Algunos autores y Unidades del dolor postulan la indicación de tratar sistemáticamente a estos pacientes con BZD de vida media corta, lo que reduciría el espectro al lorazepam y oxazepam, como ansiolíticos sin acción hipnótica a dosis terapéuticas. Estos sujetos tienen mayor vulnerabilidad a efectos paradójicos. La mínima acción anticolinérgica, de estos fármacos, puede desencadenar: confusión, depresión, insomnio, más que en otros pacientes y debe pensarse en una cuestión de vulnerabilidad y retirar el fármaco. En los niños pueden hacerse argumentaciones paralelas. Existen preparados en los que se propone un uso infantil de derivados BZD. Se debe ser cauto en su administración, ya que en estas edades suele haber una mayor contaminación de variables psicológicas que son responsables del comportamiento ansioso. La situación del metabolismo hepático es también determinante. En casos de insuficien- 173 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor INTERACCIONES DE LAS BENZODIAZEPINAS Alcohol y depresores del SNC Depresión SNC. Incremento de los efectos de ambos Antiácidos Posible disminución de la velocidad de absorción Fenitoína Metabolismo de las benzodiazepinas y cambios en niveles plasmáticos de fenitoína Aumento de los efectos sedantes Antidepresivos tricíclicos Cimetidina Posible disminución del metabolismo de las benzodiazepinas, excepto con lorazepam y oxazepam (excreción urinaria) Barbitúricos Incremento de los efectos de ambos Tabla 12. cia, muy especialmente de hepatitis vírica y cirrosis, debe preferirse la prescripción del lorazepam u oxazepam. Dependencia, fenómenos de rebote, supresión y tolerancia La dependencia estricta a BZD es rara, tras el análisis de los resultados de encuestas en Unidades de Dolor, se estiman cifras de 1 por 2,5 millones tratamiento /mes. El estado actual de la cuestión puede resumirse en los siguientes puntos: 1. El riesgo de dependencia es mayor a dosis elevadas, superiores a las indicadas como terapéuticas y cuando se utilizan durante un tiempo prolongado. Sería deseable la prescripción de BZD a períodos de tiempo cortos, ajustados al paciente, sin un período ideal. El riesgo de dependencia de BZD es inferior al de los barbitúricos. En pacientes dependientes, se en- 174 cuentra: uso, abuso o dependencia de alcohol u otras drogas. 2. Una disminución o supresión brusca de la concentración disponible de BZD, evidente cuando se utilizan las de vida media corta con fines ansiolíticos o hipnóticos, puede producir un efecto de “rebote” o supresión, caracterizado por un incremento aparente de ansiedad. En una situación de este tipo, se debe valorar: —Un efecto de “rebote” o supresión real. —Persistencia de un estado de ansiedad no suficientemente controlado y que reaparece en el momento en que no hay cobertura farmacológica adecuada. —Se trata de un tratamiento del dolor inadecuado. Si se trata del primer caso, una espera de varias horas o días sería suficiente para comprobar la desaparición paulatina de la sintomatología de “rebote”. Es aconsejable explicar al Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes paciente tal mecanismo. Si se trata del segundo caso, la sintomatología no sólo no desaparecerá, sino que puede aumentar. En el tercer caso debe ser corregido el tratamiento antiálgico. 3. El cuadro clínico de abstinencia o supresión, en la situación de dependencia real a BZD, es similar al de la abstinencia a alcohol o barbitúricos, con los que hay “relación cruzada”. Se caracteriza por la presencia de síntomas vegetativos (temblor, taquicardia, insomnio, hipertensión, sudoración) y quejas subjetivas sobre dificultades de concentración y síntomas depresivos. Se han descrito excepcionalmente delirios, confusión y crisis convulsivas. El perfil de un paciente, potencialmente dependiente, se caracteriza por: —Dosis por encima del promedio y tiempo de tratamiento prolongado. —Autoincremento de la dosis para mantener un efecto terapéutico (tolerancia). —Solicitud de prescripción de BZD sin indicación médica actual. —Prescripciones de BZD de diferentes médicos. —Síntomas de abstinencia, cuando se suprime el tratamiento. —Historia o sospecha de adicciones anteriores. Criterios en la evaluación de la sintomatología de rebote: —Cuando aparecen síntomas de supresión, y no se trata de un paciente que está tomando BZD a dosis elevadas y durante tiempo prolongado, debe sospecharse una reaparición de sintomatología ansiosa no controlada. —Cuando el paciente está tomando BZD de vida media larga, durante un período de tiempo no excesivamente prolongado, una supresión brusca puede producir sintomatología de rebote o supresión, incluso hasta dos semanas después. —Si se utilizan BZD de vida media corta, tal sintomatología de rebote puede aparecer en las horas siguientes a la supresión. —Si tomando BZD de vida media larga aparecen síntomas de supresión, en las horas siguientes a su disminución o retirada, debe sospecharse un efecto psicológico. Benzodiazepinas y tratamiento del dolor A pesar de la enorme extensión del empleo de estos psicofármacos, principalmente como automedicación, las indicaciones de estas sustancias para paliar la sintomatología dolorosa deben ser muy precisas. Las BZD carecen de actividad analgésica en la experimentación animal (Shanon y cols.), el oxacepan modifica la actividad analgésica de la morfina, y el clordiacepóxido antagoniza, incluso, la analgesia morfínica (Weiss). Asimismo, el diazepam y el midazolam antagonizan la actividad analgésica del opioide, y carecen de actividad analgésica per se (Mantegazza y cols.). Sin embargo, existen cuadros dolorosos en los que las BZD pueden resultar eficaces. Así, por estar dotados de propiedades hipnóticas, pueden facilitar el sueño. El uso de flurazepan (15 a 30 mg) puede ser de utilidad, pero debe emplearse durante períodos cortos de tiempo, ya que en tratamientos crónicos su eficacia disminuye (tolerancia). Es necesario tener precaución cuando se asocian con opioides, ya 175 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor que pueden potenciar la depresión respiratoria que éstos inducen (Shimm y cols.). Otros cuadros en los que las BZD pueden ser efectivas para paliar el dolor, son los que presentan un componente de espasmo muscular. Así, en la cervicoartrosis la administración de diazepam puede, gracias a sus propiedades como relajante muscular, romper el círculo vicioso dolor-espasmo-dolor. CORTICOIDES ACCIONES FARMACOLÓGICAS Estructura Todos los corticoides derivan del colesterol. El núcleo básico consiste en una estructura formada por el ciclopentano-perhidrofenantreno. Los naturales se sintetizan en la glándula suprarrenal, zona fasciculada, junto a los mineralcorticoides en la glomerular y los gonadales en la reticular. Los glucocorticoides sintéticos se obtienen por modificaciones de los naturales. Farmacocinética. Consideraciones generales El comportamiento de los corticoides exógenos está relacionado e influido por los endógenos y porque los procesos de biosíntesis, liberación, de estos últimos, pueden verse alterados, por la administración de los primeros. La vida media plasmática del cortisol es de 90 minutos. Sin embargo, su vida media biológica (efecto antiinflamatorio) permanece durante 8 o 12 horas. Como la potencia antiinflamatoria de los glucocorticoides naturales o sintéticos y la supresión del eje hipotálamo-hi- 176 pófisis-suprarrenal corren paralelas en términos de grado y duración, las vidas medias biológicas se determinan por la duración de la supresión de dicho eje. La duración de la acción permite clasificar a los glucocorticoides en: —Hidrocortisona, cortisona, prednisolona y prednisona: glucocortidoides de acción corta. —Parametasona y triamcinolona: glucocorticoides de acción intermedia. —Betametasona y dexametasona: glucocorticoides de acción larga (Tabla 13). Aproximadamente el 90% del cortisol se une, de modo reversible, a las proteínas plasmáticas y el 10% restante circula libre. Esta fracción libre (entre 0,7 y 1,0 mg/dl) ejerce la actividad biológica de la hormona. La capacidad de unión de la transcortina es aproximadamente de 20-25 mg de cortisol/dl de plasma. Con niveles de cortisol superiores a 25 mg/dl, las zonas de unión de la transcortina se saturan y el cortisol se une mayoritariamente a la albúmina, receptor de alta capacidad y baja afinidad (25% libre y 75% unido). Puesto que la fracción libre es eliminada por la orina por filtración glomerular, los pacientes con síndrome de Cushing eliminarán elevadas cantidades de cortisol libre (no metabolizado). En cambio, los derivados sintéticos del cortisol se unen en una menor proporción a la transcortina (aproximadamente un 70%) y se difunden de forma más completa a los tejidos, lo que explica la tendencia a producir efectos cushingoides a dosis bajas. El cortisol desaparece rápidamente de la circulación y es captado y metabolizado por el hígado, convirtiéndolo en unos compuestos acídicos inactivos. Los derivados sintéticos tardan más en ser metabolizados, motivo por el Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes CLASIFICACIÓN DE LOS CORTICOIDES SEGÚN LA DURACIÓN DE LA ACCIÓN Compuesto Potencia antiinflamatoria relativa (cortisol=1) Acción corta —9α fluohidrocortisona —Hidrocortisona (cortisol) —Cortisona —Prednisona —Prednisolona —6-Metilprednisolona Acción intermedia —Parametasona —Triamcinolona Acción larga —Betametasona —Dexametasona Equivalente dosis glucocorticoidea (mg) 10 1 0,8 4 4 6 20 25 5 5 4 0 5 2 4 30 30 0,60 0,60 Potencia mineralcorticoide relativa (DOC=1) 4,5 0,03 0,03 0,04 0,04 0,02 0 0 Levemente natriurética Levemente natriurética Tabla 13. cual la vida media plasmática se prolonga 200 o más minutos. La cortisona y la prednisona se transforman en metabolitos activos, hidrocortisona y prednisolona respectivamente. FACTORES ESPECÍFICOS Y NO ESPECÍFICOS DEL TRATAMIENTO Prednisona y prednisolona Son interconvertibles y el equilibrio está fuertemente desplazado a favor de la formación de prednisolona. La conversión de prednisona en prednisolona es rápida y completa, considerándose un profármaco o prodroga (Tabla 14). Biodisponibilidad: se refiere tanto a la velocidad como al alcance o extensión con que el fár- maco llega a la circulación general. La prednisona oral tiene una biodisponibilidad cuya concentración máxima aparece entre 1,3-3 horas (“pico”). La de la prednisolona oral es rápida y casi completa (80% al 100%). El revestimiento entérico de las tabletas retrasa la absorción pero no la cantidad de fármaco absorbida. La administración por otras vías, como los enemas de prednisolona, proporciona una buena absorción, aunque hay una gran variabilidad individual; la administración intraarticular de prednisolona, en enfermos con dolor por artritis reumática, proporciona una absorción sistémica de alrededor del 50%, lo que condiciona la supresión de los niveles de hidrocortisona plasmáticos. Siendo inferior cuando se administra por vía epidural. 177 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor DOSIS EQUIVALENTE DE LOS PRINCIPALES CORTICOIDES (EN MILIGRAMOS) Prednisona Prednisolona 5 7,5 10 20 30 40 50 100 Metilprednisolona 4 6 8 16 24 32 40 80 Fluohidrocortisona 5 7,5 10 20 30 40 50 100 Triamcinolona 4 6 8 16 24 32 40 80 Betaprednisolona Metasona 0,75 1 1,5 3 4,5 6 75 15 Tabla 14. La hepatitis aguda, la crónica activa, en fase de actividad, y la cirrosis disminuyen la velocidad de transformación, pero no la cantidad total de prednisona convertida en prednisolona. La colitis aguda retarda la absorción de prednisolona, pero no la cantidad total absorbida. No es posible establecer una relación temporal directa entre la concentración plasmática y el efecto clínico. Un ejemplo es el paréntesis entre la administración iv y la aparición de la respuesta, en el tratamiento de una crisis aguda de asma o un proceso anafiláctico. Las alteraciones en la cantidad total absorbida podrían alterar el efecto, ya que su magnitud en función del tiempo depende de la presencia del corticoide a nivel de sus receptores. La biodisponibilidad, cuando la prednisona o la prednisolona se administran por vía oral, no es el principal problema. La gran variabilidad en cuanto a la absorción sistémica, cuando se administran en forma de enema, hace que la vía rectal quede relegada a los casos en que se desee obtener una acción local. Por otra 178 parte, la importancia de la unión de los corticoides a las proteínas se centra más en la consecuencia que tiene como determinante de la medida de otros parámetros farmacocinéticos, el volumen de distribución (VD) y el aclaramiento (CL), que sobre sus efectos farmacocinéticos. La administración repetida produce inducción enzimática. No ha podido comprobarse en enfermos asmáticos o trasplantados renales, con medicación prolongada. Sin embargo, otras sustancias inductoras, como los barbitúricos, fenitoína o rifampicina, aumentan significativamente su metabolización, pudiendo provocar que las concentraciones de prednisolona se sitúen hasta por la mitad de los valores esperados. Los anticonceptivos orales aumentan los niveles de transcortina, por lo que pueden originar una disminución del CL y VD. Quizás lo más manifiesto de estos efectos sea el aumento de reacciones indeseables, en enfermos afectados de hepatitis crónica en fase de actividad y en tratamiento de larga du- Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes ración. De todo ello, puede deducirse que la completa farmacocinética de la prednisona y la prednisolona tiene un interés más académico que importancia práctica, ya que uno de los factores que podrían condicionar en mayor grado su efecto es la hipoproteinemia, que por otra parte, es fácilmente detectable. Semejante consideración podría hacerse de las enfermedades hepáticas y su influencia sobre su metabolismo. ramiento puede verse acortado en los niños y alargado en los neonatos. La VD y CL están aumentados en enfermos, en pacientes con dolor crónico. El metabolismo es más inducible por fenitoína y barbitúricos y puede proporcionar “falsos positivos” en el test de supresión de la dexametasona. Cortisona e hidrocortisona Durante muchos años la eficacia de los corticoesteroides, para el alivio del dolor canceroso, ha sido ampliamente reconocida, particularmente en el dolor óseo, el relacionado con la compresión nerviosa o de la médula espinal o la cefalea por aumento de la presión intracraneal debido a edemas peritumorales. Muchos informes describen que los esteroides alivian este dolor y reducen la cantidad de narcótico necesaria (American Pain Society, 1987). No obstante, hasta 1988 sólo se había informado de un estudio controlado respecto a los efectos analgésicos de los esteroides en el dolor canceroso. Un estudio cruzado a doble ciego comparó un placebo con 16 mg de metilprednisolona oral 2v/d., para establecer su capacidad de aliviar el dolor en cáncer en estadio final. Los pacientes que recibieron metilprednisolona durante 8 días mostraron una reducción significativa del dolor y uso de analgésicos (Bruera y cols., 1985). Se requieren más investigaciones para explorar la dosis efectiva, las consecuencias del uso a largo plazo y las diferencias entre esteroides. Los datos disponibles sugieren que, incluso con la administración crónica de esteroides, la incidencia de intoxicación es baja. Aunque los posibles efectos secundarios incluyen la úlcera péptica, hemorragia gastrointestinal, edema sistémico y aumento de peso, en la mayoría de La relación de la cortisona y la hidrocortisona es similar a la de la prednisona y prednisolona. La biodisponibilidad es del 55% y 45% respectivamente para la hidrocortisona y cortisona cuando se administran por vía oral, respecto a su administración por vía intravenosa. Esta “pérdida” se atribuye a la conversión de la cortisona en tetrahidrocortisona inactiva. Existe una relación dosis/dependiente, ya que dosis de 5 mg manifiestan una biodisponibilidad del 71%, mientras que 20 mg, la proporciona del 56%. El volumen de distribución aumenta cuando aumenta la dosis, de 0,3 a 0,5 l/kg, para dosis respectivamente de 5 y 40 mg. El metabolismo sigue la vía de la tetrahidrocortisona. El aclaramiento es dosis dependiente y oscila entre 10 l/h a 17 l/h con dosis de 5 a 40 mg. En cuanto a la eliminación y los factores que la modifican, ofrecen un comportamiento similar al señalado para la prednisolona. Otros glucocorticoides La dexametasona se absorbe bien en administración oral (alrededor del 80%). El metabolismo y los otros parámetros fármacocinéticos son similares a los de la prednisolona. El acla- CORTICOIDES Y TRATAMIENTO DEL DOLOR 179 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor los casos proporcionan bienestar a pacientes con expectativas de vida cortas, superando los riesgos. De uso en el dolor lacerante, cuyas características son: comienzo y final brusco, y forma repetida en el mismo área. El paciente lo describe “como una descarga”,o “como alcanzado por un rayo”, y puede ir acompañado de espasmo muscular. Todas éstas son descripciones de dolor neuropático (lesión del tejido nervioso). Es el dolor característico de: neuralgia del trigémino, neuralgia postherpética, neuropatía diabética y neuralgias traumáticas. ANTICONVULSIVANTES Los fármacos anticonvulsivantes, la fenitoína y la carbamacepina son particularmente útiles para el dolor lacerante. Su mecanismo de acción consiste en la supresión de los estímulos nerviosos anormales, como resultado de una lesión del tejido nervioso. La carbamacepina es el fármaco de elección para el dolor de la neuralgia del trigémino (American Pain Society, 1987), pero hay opiniones conflictivas sobre la elección de fármacos para otros síndromes dolorosos neuropáticos. En muchos pacientes el dolor punzante tiene una dimensión adicional de quemazón o dolorimiento. En algunos pacientes se ha encontrado que la terapéutica anticonvulsivante no es efectiva en el control de este componente del dolor. CARBAMACEPINA La carbamacepina se aprobó en los Estados Unidos para usar como agente antiepiléptico en 1974. Se emplea desde la década de los 60 para tratar la neuralgia del trigémino (Blom, 1963). La carbamacepina tiene relación quími- 180 ca con los ATD tricíclicos. Es un derivado del iminoestilbeno con un grupo carbamilo en la posición 5; esta fracción es esencial para una actividad antiepiléptica potente. Existe considerable superposición entre las estructuras tridimensionales de la fenitoína y la carbamacepina. Efectos anticonvulsivos Los efectos anticonvulsivos de la carbamacepina en los animales se parecen a los de la fenitoína. En concentraciones terapéuticas, la carbamacepina puede inhibir las crisis máximas de electroshock y abolir las descargas encefálicas focales inducidas por la aplicación local de penicilina. Además, es más eficaz que la fenitoína para elevar el umbral de las crisis mínimas por electroshock y para bloquear crisis en respuesta al pentilenotetrazol. Krupp anunció que la carbamacepina tiene poco efecto inhibidor sobre el PTP en la médula espinal del gato. Las acciones electrofisiológicas y bioquímicas responsables de los efectos anticonvulsivos son desconocidas. Absorción, distribución, biotransformación y excreción La carbamacepina se absorbe rápidamente después de su administración oral, pero con gran variabilidad individual. Las concentraciones plasmáticas máximas se observan 2-6 horas después de la ingesta, la unión con las proteínas plasmáticas llega al 80%. Se metaboliza al 10,11-epóxido, y este compuesto también tiene actividad anticonvulsiva y su vida media menor que la del compuesto original (5-8 horas). La vida media es de 13 a 17 horas. Debido a la autoinducción del metabolismo de la dro- Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes ga, éste es más corto que en los individuos que han recibido una sola dosis. Menos del 1% de la carbamacepina se recupera en la orina en forma del compuesto original o del epóxido. El metabolismo continúa hasta la carbamacepina-10,11-dihidróxido y la conjugación con ácido glucurónico. Toxicidad Los efectos indeseables más frecuentes incluyen diplopia, visión borrosa, somnolencia, mareos, náuseas, vómitos y ataxia. También se ha observado gran variedad de otros efectos sobre el SNC, gastrointestinales, cardiovasculares y dermatológicos. Otros efectos adversos y precauciones son semejantes a los de los ATD tricíclicos. Se desarrolla cierta tolerancia a los efectos desfavorables, y pueden minimizarse aumentando gradualmente la dosis y ajustando la dosis de mantenimiento. La carbamacepina ha causado muertes por anemia aplásica y por efectos cardiovasculares, pero es una droga valiosa (Livingston y cols., 1974). Los efectos adversos serios, además de la depresión de la médula ósea, incluyen leucopenia, púrpura trombocitopénica, ictericia hepatocelular y colestática, oliguria aguda con hipertensión, tromboflebitis, insuficiencia ventricular izquierda y colapso cardiovascular. Hay erupción cutánea, a menudo con otras manifestaciones de alergia a la droga, en el 3% de los pacientes. Además, síndrome de StevensJohnson, dermatitis exfoliativa, fotosensibilidad, alteración de la pigmentación cutánea y lupus eritematoso sistémico. El tratamiento para la neuralgia del trigémino comienza con una dosis de 200 mg por día; ésta debe aumentarse gradualmente, según sea necesario, hasta un nivel de 1.200 mg por día si el mismo se tolera. No existe una relación simple entre la dosis de carbamacepina y las concentraciones de la droga en el plasma. Las concentraciones terapéuticas se estiman en 6 a 8 µg/ml, aunque existen variaciones. Los efectos secundarios atribuibles al SNC son frecuentes en concentraciones de 8,5 a 10 µg/ml. Son pocas las interacciones. El fenobarbital aumenta el metabolismo de la carbamacepina; la biotransformación de la fenitoína puede aumentar con ella. TOPIRAMATO Se introdujo en el mercado mundial en 1995 y se autorizó en el Reino Unido como tratamiento coadyuvante en los pacientes con crisis parciales, con o sin generalización secundaria. Es un monosacárido sulfamato sustituido. Los estudios electrofisiológicos y bioquímicos, realizados en cultivos de neuronas, sugieren múltiples mecanismos de acción de su eficacia antiepiléptica: 1. Bloqueo estado dependiente de los canales del sodio voltaje dependientes, reduciendo la duración de las descargas epileptiformes y el número de potenciales de acción generados en cada descarga. 2. Aumento de la inhibición mediada por el GABA, por su acción en los receptores GABA(A) que no son modulados por los barbitúricos ni las BZD. 3. Antagoniza la activación de los aminoácidos excitadores agonistas a nivel de receptores específicos no-NMDA (N-metilD-aspartato) A pesar de que esta sustancia inhibe algunas isoenzimas de la anhidrasa carbónica, su 181 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor efecto es más débil que el de la acetazolamida, por lo tanto, no se cree sea uno de los efectos que contribuya a la acción antiepiléptica del mismo. Sin embargo, esta inhibición puede explicar alguno de los efectos secundarios asociados como la formación de cálculos renales y las parestesias. La semivida de eliminación plasmática en varones sanos tratados con 50 mg o 100 mg durante 14 días es de 21 horas. Sin embargo, la concentración disminuye en un 50% al combinarlo con inductores enzimáticos como la fenitoína o carbamacepina; la semivida de eliminación, al ser administrado como tratamiento adyuvante con inductores enzimáticos, es de 12-15 horas en régimen de 2v/d. Como tratamiento adyuvante, 400 mg/día divididos en dos tomas. Algunos pacientes pueden responder con 200 mg/día. Se llevará a cabo una es- calada de dosis gradual hasta alcanzar la respuesta clínica óptima. Se deben administrar 25-50 mg/día hasta la dosis efectiva, con incrementos semanales o bisemanales de 50 mg/día (Tabla 15). Topiramato y tratamiento del dolor El Topiramato es un nuevo anticonvulsivante de última generación, con una estructura química diferente de sus antecesores. Parece actuar bloqueando los canales de Na y Ca con acción glutamatérgica y GABAérgica y por inhibición de las isoenzimas de anhidrasa carbónica tipo II y IV. Estos mecanismos le dan un rol especial en el dolor neuropático. En estudios recientes se han comunicado los siguientes resultados: EFECTOS ADVERSOS DEL TOPIRAMATO RELACIONADOS CON LA DOSIS Topiramato + Fármaco antiepiléptico previo 200 mg/día 400 mg/día 600-1.000 mg/día Fatiga Nerviosismo Temblor Depresión Ansiedad Confusión Anorexia Pérdida de peso Alteraciones emocionales Dificultad concentración/atención Problemas del lenguaje Problemas cognitivos no específicos Tabla 15. 182 11 13 13 9 2 9 4 4 0 7 2 0 12 18 9 7 3 10 6 9 6 9 9 0 31 20 14 13 9 15 11 13 10 15 12 4 Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes —Reduciendo significativamente: • Dolor espontáneo (74,3%). • Alodinia táctil (44,3%). • Painful attacks (45,7%). —El 50,7% manifiestan alivio del dolor moderado o completo. —La duración y calidad del sueño mejora en un 81,4%. —La dosis varía ampliamente entre 12,5-400 mg, aunque la media es baja, de 86 mg al día, en comparación con las dosis antiepilépticas. En el manejo de la neuropatía dolorosa diabética se empleó una dosis de 400 mg/día durante 9 semanas y los pacientes presentaron significativamente menos dolor, con puntuaciones en el Cuestionario de McGill (SF-MPQ) menores. En la neuralgia del trigémino se utilizó una dosis de 175 mg/día, con un alivio intenso en monoterapia y en terapia combinada con carbamacepina. En el tratamiento profiláctico de la migraña crónica intratable la dosis media empleada fue de 98 mg/día (49-200 mg/día). El seguimiento fue de 9 semanas y los resultados fueron de un 56% de mejoría. En el tratamiento de la profilaxis de migraña severa o cefalea crónica diaria se utilizaron dosis media de 100 mg/día. La respuesta positiva fue evidente a las 8-10 semanas, obteniéndose 60% de mejoría moderada o importante. GABAPENTINA El tratamiento de los trastornos afectivos en nuestros días requiere una farmacoterapia en evolución constante, debido a: —La frecuente aparición de trastornos bipolares. —Prácticamente todos los ATD provocan el cambio de fase. —Los tratamientos con ATD a dosis altas y prolongadas provocan disregulación afectiva y problemas de “homeostasis afectiva”. —Aumento de depresiones cronificadas y de “estados mixtos”. Los ATD tradicionales han tenido que dejar paso a ATD de segunda generación, y a los “estabilizadores del ánimo”. La gabapentina es un anticonvulsivo autorizado como tratamiento coadyuvante en las crisis parciales resistentes. Es un análogo del GABA, pero no tiene interacción con ningún receptor GABA conocido, no afecta la recaptación de GABA y no inhibe su degradación. Tiene un bajo riesgo de toxicidad, una cinética sin complicaciones, no presenta interacciones farmacológicas importantes y no son necesarios los niveles plasmáticos (Tabla 16). Las propiedades como “estabilizador del estado de ánimo”, son: —Ansiolítico: es poco habitual en otros estabilizadores del humor. La ansiolisis se presenta progresivamente a lo largo de los días. —Estabilización: el mejor resultado y más característico. Tiene buenos resultados en las personalidades límite. —Antimaníaco: control de la manía sin sedación. Menos potente que el Litio pero bastante útil en la manía en la tercera edad. 183 Plan Nacional para la Enseñanza y Formación en Técnicas y Tratamiento del Dolor INDICACIONES CLÍNICAS DE LA GABAPENTINA AJENAS A LA EPILESIA Dolor neuropático Neuralgia del trigémino Distrofia simpática refleja Mielopatía postradiación Neuralgia postherpética Axonopatía simétrica distal en VIH Alodínica bucofaríngea Trastornos del movimiento Síndrome de las piernas inquietas Temblor esencial Nistagmo Coreoatetosis familiar Espasticidad Esclerosis lateral amiotrófica Esclerosis múltiple Espasmo hemifacial Enfermedad de Parkinson Trastornos psiquiátricos Trastornos bipolares Fobia social Manía Migraña Ansiedad Profilaxis de la migraña Pánico Agitación en la enfermedad de Alzheimer Trastorno con déficit de atención e hiperactividad Conductas autoagresivas en enfermedad de Lesh-Nyhan Tabla 16. —Preventivo: acción profiláctica para episodios maníacos y o depresivos. —Control de los impulsos: el descontrol de los impulsos tiene su origen en la motivación, muy relacionado con el estado del humor. —Grado de satisfacción: manifiestan una cierta confortabilidad. —Potenciación de ATD y neurolépticos. —Acción sobre la “ciclación rápida” (resultados modestos). —Refuerzo del Litio. La gabapentina es un fármaco eficaz en pacientes de todas las edades con crisis parciales, con o sin generalización secundaria. Las dosis que se requieren para efectos psiquiátricos son menores que como antiepiléptico. 184 Se observan buenos resultados en pacientes con dosis de 600 mg, y a veces con solo 300 mg (1 cápsula/día). Tiene eficacia en dosis menores cuando refuerza otros medicamentos, en prevención y ansiolisis. La tolerancia de la gabapentina es buena, dispone de mayor rapidez de instauración del fármaco y carece de interacción con otros fármacos, presentando efectos secundarios de: embotamiento (sedación), cefaleas, inestabilidad, vértigo, somnolencia y astenia. Pocos de polineuropatía y agitación psicomotora (Tabla 17). Las recomendaciones de dosificación son: 1. En pacientes de nuevo diagnóstico, en los que la gabapentina es el primer fármaco: 900 a 2.400 mg/día. 2. Como alternativa terapéutica: 1.800 a 3.600 mg/día. 3. Cuando han fracasado varios antiepilépticos: 2.400 a 4.800 mg/día. Unidad Didáctica 3. Capítulo 3. Fármacos coanalgésicos y coadyuvantes EFECTOS ADVERSOS EN MONOTERAPIA DE GABAPENTINA Y CARBAMACEPINA Efecto adverso Mareo Cefalea Cansancio Náuseas – Vómitos Somnolencia Dolor abdominal Nerviosismo Aumento de peso GBP 300 mg/d GBP 900 mg/d 3,6 7,2 6,5 2,9 1,4 2,2 0,7 2,9 7,9 7,2 6,5 3,6 3,6 2,2 2,2 1,4 GBP 1.200 mg/d CBZ 600 mg/d 8,1 7,4 4,3 4,3 3,6 2,9 3,6 1,5 7,4 7,4 16,3 6,7 7,4 0,7 0 0,7 Tabla 17. PRUEBAS CLÍNICAS CON GABAPENTINA Tipo de dolor Neuralgia postherpética Dolor neuropático diabético Esclerosis múltiple Esclerosis múltiple Dolor neuropático oncológico Dolor neuropático central y periférico Dolor neuropático diabético Estudio Sujetos Dosis diaria Resultados Controlado Controlado Abierto Abierto Abierto 229 165 21 25 22 3.600 mg 3.600 mg 1.200 mg Variada Variada Mejora VAS Mejora VAS Reducción dolor Reducción dolor Mejora VAS Abierto Randomizado 18 21 2.400 mg 1.565 mg Variada 52% responde Tabla 18. Con niveles séricos superiores a 20 µg/ml raramente aumenta la eficacia del fármaco aunque se eleva la dosis del mismo. Tratamiento del dolor con Gabapentina Su efectividad en el alivio del dolor se ha demostrado clínicamente en: neuralgia postherpética, neuropatía diabética, esclerosis múltiple, dolor neuropático, y se ha utilizado con efectos favorables en: distrofia simpático refleja, eritromialgia, neuropatía idiopática del trigémino, neuropatía periférica y síndrome dolor central (Tabla 18). Una mayor ventaja de las pruebas preclínicas es que, el efecto de la gabapentina en el dolor neuropático, puede ser examinado por síntomas individuales, tales como: alodinia, hiperalgesia, o el dolor espontáneo. Los actuales estudios de laboratorio con Gabapentina indican que : 1. No afecta al umbral del dolor. 2. Es efectiva en la reducción de alodinia e hiperalgesia (animales). 3. Puede tener un efecto selectivo en el proceso nociceptivo. 185