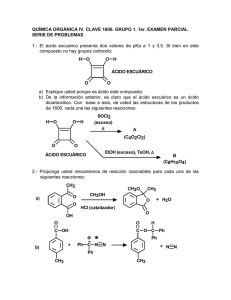
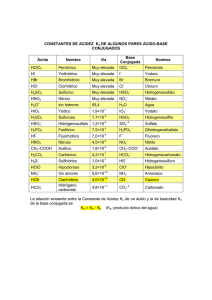
La Relación Entre La Estructura Orgánica y el pH por
Anuncio

La Relación Entre La Estructura Orgánica y el pH por Rosa Betancourt-Pérez, Ph.D Según Bronsted-Lowry, cualquier sustancia que tenga un hidrógeno tiene potencial para actuar como ácido y cualquiera que tenga un par de electrones sin enlazar puede actuar como base. La reacción en la que ocurre una transferencia de un protón a una base se llama una reacción ácido-base. Cuando una sustancia pierde un protón, se convierte en una base conjugada: Cl- es la base conjugada de HCl; HO- es la base conjugada de H2O; H2O es la base conjugada de H3O+ . Cuando una base acepta un protón se convierte en ácido conjugado: H3O+ es el ácido conjugado de H2O; y NH 4+ es el ácido conjugado de NH3. Por lo general, mientras más grande es esta constante, más débil es la base conjugada. Los ácidos tienen diferentes fortalezas. La fortaleza de un ácido depende de la capacidad que tiene para transferir un protón. La constante de de disociación de un ácido es directamente proporcional a la constante de equilibrio de una reacción. Es una medida de cuán disociado está un ácido en un disolvente. Mientras más grande es esta constante, más disociado está el ácido y por tanto más fuerte es. HA + H3O+ H2O Ka = Keq[H2O] = + A- [ H3O+][ A-] [HA] Las constantes de disociación de los ácidos usualmente son números pequeños. El negativo del logaritmo de un número pequeño como 10-5, es un número positivo y sencillo. Por eta conveniencia, se trabaja con el negativo del logaritmo de las constantes de disociación. A este valor se le llama pKa. A menor pKa, más fuerte es el ácido. -log Ka = pKa Las reacciones ácido-base son muy comunes con compouestos orgánicos. A continuación aparece una tabla con las electronegatividades de algunos elementos y otra con los valores de pKa de algunos ácidos orgánicos. Estudia estas tablas con mucho cuidado y luego contesta las preguntas de pensamiento crítico. REL.EST./pH-QUIM-3031-OLA#1 Tabla 1-Electronegatividad: IA IIA IB IIB IIIA IVA VA VIA VIIB H 2.2 Li 1.0 Be 1.5 B 2.0 C 2.5 N 3.1 O 3.5 F 4.0 Na 1.0 Mg 1.2 Al 1.5 Si 1.7 P 2.1 S 2.4 Cl 2.8 K 0.9 Ca 1.0 Br 2.7 I 2.2 Tabla 2-Fortaleza Acídica: Número Acido Conjugado pKa Número Acido Conjugado O O 1 4.8 CH3 OH 7 OH O O 4.8 8 OH 2.8 ClCH2 O 4.7 Cl 1.3 9 OH Cl2CH O OH O OH 4.5 10 0.64 Cl3C Cl OH O O 5 4.1 OH 6 3.8 OH REL.EST./pH-QUIM-3031-OLA#1 0.2 11 F3C O H OH O 3 4 2.8 Cl 2 Cl pKa OH Preguntas de Pensamiento Crítico 1. Estudia el orden de fortaleza de los ácidos incluidos en esta tabla. Recuerda que a menor el pKa, más fuerte el ácido. Considera los ácidos 9 y 10. ¿ Crees que existe alguna relación entre la electronegatividad del sustituyente y el pKa del ácido? Dibuja las bases conjugadas de los ácidos 4 y 5. ¿Qué efecto tiene Cl en estos ácidos? ¿ Cómo se afecta el pka cuando se cambia la posición del sustituyente? ¿Cómo se afecta al pKa cuando se cambia la posición del sustituyente? 2. Coloca estos compuestos en orden de acidez, comenzando con el más ácido. Considera la acidez de los protones señalados. Explica como determinaste este orden. O O CH3 F O CH3 CH3 A CH3 Cl C B _______ > _______ > _______ 3. Coloca los siguientes aniones en orden de estabilidad, comenzando con el más estable. Explica como determinaste este orden. CH3O F O A CH3NH O B O C _______ > _______ > _______ > _______ REL.EST./pH-QUIM-3031-OLA#1 O D 4. Circula el hidrógeno más ácido en los siguientes compuestos: O O a. CH3 c. CH3 NH2 OH O b. 5. CH3 d. NH2 OH NH3 Coloca los siguientes compuestos en orden de acidez, comenzando con el más ácido. H H H CH3 CH NH3 Cl A CH3 CH NH3 F B Cl C C NH3 CH3 C NH3 H H H C D _______ > _______ > _______ > _______ REL.EST./pH-QUIM-3031-OLA#1