i. introducción y objetivos
Anuncio

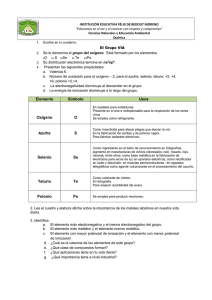
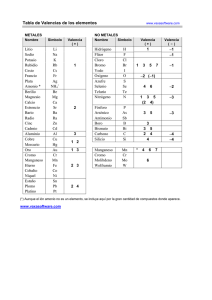
I. INTRODUCCIÓN Y OBJETIVOS 1 1.1 INTRODUCCIÓN El telurio fue descubierto en 1782 por el químico australiano F. J. Muller von Reichenstein quién lo observó por primera vez en minerales de oro extraídos en regiones de Transilvania [1]. Tiempo después, dicho elemento fue nombrado por otro químico australiano M.H. Klaproth quién lo aisló en 1798 [2]. El telurio es un elemento relativamente raro; ocupa el lugar numero 78 en abundancia entre los elementos de la corteza terrestre, 0.002 ppm aproximadamente [1], y se puede encontrar en su estado natural, en rocas como Telurito o dióxido de telurio (TeO2) [3], o combinado con oro, plata, cobre, plomo y níquel en minerales como la silvanita, la patcita y la tetradimita. La principal fuente comercial de telurio son los lodos anódicos producidos durante la refinación electrolítica de cobre [4] y los principales depósitos de este elemento se encuentran en México, Estados Unidos, Perú, Japón, oeste de Australia y Ontario en Canadá [3 y 4]. 1.1.1 CARACTERÍSTICAS DEL TELURIO El telurio es un elemento de color blanco plateado que cristaliza en forma hexagonal. Cuando se encuentra en estado puro, este exhibe un brillo metálico y se caracteriza por ser un metaloide frágil y fácil de pulverizar [5]. También, el telurio, es un semiconductor de tipo p que muestra conductividades más grandes en ciertas direcciones las cuales dependen del alineamiento atómico, además, este presenta pequeños incrementos en la conductividad cuando es expuesto a la luz solar. El telurio quemado al aire libre, produce una flama de color verde azulada y como resultado, se forma el dióxido de Telurio (TeO2) [3]. En estado liquido, se dice que el telurio puede ser un agente corrosivo para el cobre, hierro y el acero inoxidable [5]. 2 1.1.2 ISÓTOPOS Existen 30 isótopos de telurio conocidos cuyas masas atómicas varían desde 108 hasta 137 unidades. Naturalmente, podemos encontrar 8 isótopos de telurio estables – tres de ellos con características radioactivas – por lo que algunas veces este elemento sufre algunas impresiciones en su peso atómico. Entre los isótopos de Telurio mas abundantes se encuentran 128 130 Te (33.87%) y el Te (31.70%), este último con un período de vida media de 2.2 × 1024 años, lo cual lo hace el isótopo con el período de vida media mas largo de todos los isótopos radioactivos. El telurio es un elemento que puede sufrir decadencia alfa; decadencia que resulta de la emisión de partículas alfa y los isótopos que sufren este tipo de decadencia son 106 Te y 110Te [1]. 1.1.3 USOS DEL TELURIO Entre los principales usos del telurio se encuentran las aleaciones metálicas y como semiconductor. En aleaciones metálicas, el telurio es utilizado con plomo para producir un mejoramiento en su manejabilidad, fuerza, durabilidad y para disminuir la acción de corrosión del ácido sulfúrico. En aleaciones con acero inoxidable, el telurio se usa para disminuir los efectos de deterioro en sus propiedades mecánicas. En aleaciones con hierro, el telurio es utilizado para controlar el factor de enfriamiento y la porosidad de los productos. Por último, en aleaciones de cobre, el telurio es utilizado para mejorar su manejabilidad e incrementar la re-cristalización [2]. Como semiconductor, el telurio tiene grandes aplicaciones industriales. El teluluro de bismuto (Bi2Te3), es utilizado como un mecanismo termoeléctrico; el telururo de cadmio (CdTe), es utilizado en paneles solares; el teluluro de cadmio y zinc (CdZnTe), es empleado en detectores de rayos X en estado sólido y, por último, el teluluro de cadmio y magnesio, es utilizado como un semiconductor sensitivo a infrarrojo [4]. 3 Algunos usos adicionales del telurio incluyen: los cerámicos, para la hidrogenación de aceites, como antioxidante en aceites lubricantes, como fungicida en tratamientos relacionados con la dermatitis, en vidrios como un aditivo de color y en detonantes como agente retardador [2]. Debido al auge en la investigación y fabricación de materiales nanoestructurados compuestos de telurio, lo cual requiere de la utilización de telurio elemental de alta pureza, se ha hecho necesario la disponibilidad de un método efectivo para la refinación y obtención de telurio elemental de alta pureza [6 y 7]. 1.2 OBJETIVO GENERAL • El objetivo general de este trabajo consiste en el estudio de la oxidación del telurito de sodio en medio alcalino variando las condiciones experimentales. 1.3 OBJETIVOS PARTICULARES Los objetivos particulares de este trabajo incluyen: • Evaluar el efecto de la velocidad de agitación. • Evaluar el efecto de la cantidad de oxidante (H2O2). • Evaluar el efecto de la temperatura. • Caracterizar el producto de reacción. 4