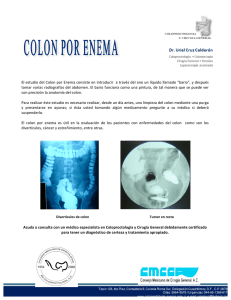
Por favor lea, descargue o imprima este documento aquí
Anuncio

VIDEOCOLONOSCOPIA DIAGNÓSTICA Y TERAPÉUTICA Primavera del 2015 Relato oficial 40 Congreso Argentino de Coloproctología Prof. Dr. Héctor Baistrocchi. Córdoba. Rep. Argentina Colaboradores: Dr. Julio D. Baistrocchi*, Dr. Leandro Correa*, Dr. Alejandro Delgado*, Dra. Mariana Werenitzky*, Prof. Dr. Luis Santos Spitale**, Dr. Manuel Lorenzo***, Dra Verónica Vera****, Dra. Silvia Zunino****, Dr. Nicolás Sarría*****, Dr. Jhon Bejar*****. * Unidad de Aparato Digestivo Baistrocchi.Córdoba. ** Cátedra de Anatomía Patológica, Fac. de Ciencias Médicas Universidad Nacional de Córdoba. *** Servicio de Gastroenterología y Endoscopia Dr. Carlos Oulton Córdoba. **** Fundacion Madame Curie. Servicio de Radioterapia. Córdoba. Argentina. ***** Servicio de Anestesiología, Unidad de Aparato Digestivo Baistrocchi Córdoba. 1 ÍNDICE VIDEOCOLONOSCOPIA DIAGNÓSTICA Y TERAPÉUTICA ............................................................... 1 INTRODUCCIÓN ............................................................................................................................ 9 Evolución de las Imágenes Endoscópicas en las Patologías Colorrectales .............................. 9 Agradecimientos......................................................................................................................... 12 CAPÍTULO 1 ................................................................................................................................. 19 Conceptos básicos del método .............................................................................................. 19 Videocolonoscopia ................................................................................................................. 22 Calidad en la colonoscopia ..................................................................................................... 23 CAPÍTULO 2 ................................................................................................................................. 29 Consentimiento informado y limpieza colónica..................................................................... 29 Escala de Boston ,, .............................................................................................................. 30 Comentario final del Autor ................................................................................................. 36 CAPÍTULO 3 ................................................................................................................................. 44 Sedación y analgesia/anestesia .............................................................................................. 44 Objetivos: ........................................................................................................................... 55 Material y método:................................................................................................................. 55 PROFILAXIS ANTIBIÓTICA ....................................................................................................... 61 CAPÍTULO 4 ................................................................................................................................. 62 INDICACIONES DE LAS VIDEOCOLONOSCOPIAS ..................................................................... 62 1. El control o vigilancia del Cáncer Colorrectal en adultos de riesgo promedio. ..... 62 Penetración genética familiar del cáncer colorrectal y asociación a otros tumores. ........ 72 Rastreo de cáncer en familiares directos; .......................................................................... 74 Evaluación y Resección de los Pólipos del Colon y Recto. ......................................................... 80 2 PARTE 2....................................................................................................................................... 83 CAPÍTULO 5 ................................................................................................................................. 83 La videocolonoscopia en las enfermedades inflamatorias del recto y colon ........................ 83 VIDEOCOLONOSCOPIA CON ILEOSCOPIA ............................................................................... 85 ENTEROSCOPIA – CAPSULA ENDOSCOPICA ....................................................................... 90 ENDOSCOPIA DE LA BOLSA ILEAL (Pouchoscopia) (Ileal Pouch Endoscopy). ..................... 91 Pequeñas neoplasias colorrectales planas, en pacientes con colitis ulcerosa, detectada con cromoscopía y magnificación. ......................................................................... 97 Momento adecuado de Vigilancia de la Videocolonoscopia en la EII.............................. 100 El uso de la cromoendoscopia para la Vigilancia del Cáncer en la EII.............................. 100 La historia natural de la displasia polipoide en la EII. ...................................................... 101 Factores de riesgo en la colitis ulcerosa y enfermedad de Crohn ................................... 103 Clasificación de los hallazgos histopatológicos: ............................................................... 110 Clasificación de los hallazgos en Videocolonoscopia de luz convencional. ..................... 110 Clasificación de los hallazgos con Videocolonoscopia Magnificada ................................ 110 CAPÍTULO 6 ............................................................................................................................... 116 La videocolonoscopia en las hemorragias digestivas bajas (HDB) con especial referencia a la videocolonoscopia en la enfermedad diverticular del colon. .............................. 116 Hematoquezia aguda ....................................................................................................... 118 Efectividad diagnostica de la colonoscopia en la hemorragia digestiva grave ................ 127 Principales Causas de Sangrado Intestinal Bajo, para numerosos Autores comparados entre si: ................................................................................................................. 128 Sangramiento por Lesión Actínica del Recto su Tratamiento Endoscópico..................... 134 Hemorragia Digestiva Baja post-polipectomía..................................................................... 137 Tratamiento Endoscópico del sangramiento Diverticular ................................................... 143 Tratamiento Endoscópico de las Angioectasias ............................................................... 143 3 RECOMENDACIONES DE LAS ASGE: (Asociación Americana de Endoscopia Digestiva) .. 144 Causas más comunes de Hematoquezia de acuerdo a la edad del Paciente .................. 146 Colitis Isquémica ............................................................................................................... 148 CONCLUSIÓN .................................................................................................................... 150 PARTE 3..................................................................................................................................... 152 CAPÍTULO 7 ............................................................................................................................... 152 LA VIDEOCOLONOSCOPIA EN EL CANCER COLORRECTAL ........................................................ 152 Diagnóstico diferencial ..................................................................................................... 154 Screening de alto riesgo ................................................................................................... 155 CAPÍTULO 8 ............................................................................................................................... 157 Secuencia Pólipo – Cáncer................................................................................................ 157 Pólipo con Cáncer Invasor. Riesgos. ................................................................................. 159 Clasificación macroscópica del Cáncer temprano Colorrectal ......................................... 164 TIPO PROTRUIDO .............................................................................................................. 165 TIPO SUPERFICIAL ............................................................................................................. 165 Desarrollo del Cáncer Colorrectal temprano en las lesiones deprimidas. (Flat Adenomas)............................................................................................................ 166 CLASIFICACIÓN DEL GRADO DE INVASIÓN SUBMUCOSA .................................................... 167 METÁSTASIS A LOS GANGLIOS LINFÁTICOS EN LOS CÁNCERES SUBMUCOSOS .............. 168 BREVE RESUMEN DE LAS BASES GENÉTICAS, Y CAMINOS ALTERNATIVOS (PATTHWAY) EN LA CARCINOGENESIS DEL CANCER COLORRECTAL. .................................................. 170 MECANISMOS DE LA CARCINOGENESIS ........................................................................... 170 RUTA PRINCIPAL DEL DESARROLLO DEL CANCER COLO-RECTAL. HISTORIA NATURAL. .. 172 VIDEOCOLONOSCOPIA MAGNIFICADA Y CROMOSCOPIA ........................................................ 173 CEM en la Enfermedad Inflamatoria Intestinal (EII)............................................................. 180 LIMITACIONES DE ENDOCYTOSCOPY Y CONFOCAL Endomicroscopía. ............................ 180 4 CROMOSCOPIA EN EL COLON .......................................................................................... 181 OBJETIVOS DE LA CROMOSCOPIA .................................................................................... 182 MECANISMOS DE ACCIÓN ................................................................................................ 182 TINCIONES MÁS COMUNES USADAS EN LA ACTUALIDAD. .............................................. 183 CLASIFICACIÓN DE LAS IMÁGENES CON MAGNIFICACIÓN Y CROMOSCOPÍA DE SHIN EI KUDO. .................................................................................................................. 184 PROCEDIMIENTO: ............................................................................................................. 186 EJEMPLOS DE LAVADO Y COLORACIÓN ........................................................................... 188 LA ENDOSCOPIA MAGNIFICADA APLICADA A LA DETECCION DE ADENOMAS DEL COLON Y RECTO. ...................................................................................................................... 193 NUEVAS ESTRATEGIAS PARA EL TRATAMIENTO DEL CANCER COLO-RECTAL TEMPRANO.. 194 PARTE 4..................................................................................................................................... 200 CLASIFICACIÓN MORFOLÓGICA DE PARÍS PARA LOS PÓLIPOS DEL COLON Y RECTO. ......... 200 POLIPOS ASERRADOS (SERRATUM POLYPS)......................................................................... 205 Definición y clasificación .................................................................................................. 205 Tipo II Modelo a cielo abierto es una característica específica de los SSA ...................... 212 POLIPECTOMIAS DEL 2014 Y 2015 CON SISTEMA OLYMPUS® EXERA II NBI, (Cromoscopía Electrónica) SOBRE 4726 COLONOSCOPIAS, SE REALIZARON 515 (10,89%) POLIPECTOMIAS, DE LAS CUALES 51 (9,91%) FUERON MUCOSECTOMIAS. ............................................................................................... 221 CASOS, CLINICOS Y QUIRÚRGICOS ........................................................................................... 223 Type IIa (slightly elevated).................................................................................................... 223 Type IIa + dep (Slightly elevated adenoma with pseudo depression) ................................. 224 Type IIc + IIa (depressed lesion with marginal elevation) .................................................... 225 Laterally Spreading Tumor (LST) .......................................................................................... 226 CRIPTAS ABERRANTES (Aberrant Cript Foci) ........................................................................ 227 PARTE 5..................................................................................................................................... 229 5 VIDEOCOLONOSCOPIA TERAPEUTICA EN LOS POLIPOS DEL COLON Y RECTO. ....................... 229 Polipectomía Endoscópica................................................................................................ 229 RESECCIONES COLÓNICAS CON TÉCNICAS ESPECIALES. MUCOSECTOMÍA. PIECEMEAL. .... 233 USO DE ENDOCLIPS EN GRANDES RESECCIONES DE POLIPOS. ........................................ 247 DIFICULTADES TECNICAS EN LAS POLIPECTOMIAS ............................................................. 248 Algoritmo de vigilancia después de haber resecado un adenoma ................................. 253 Elementos de riesgos tomados para la estratificación y el seguimiento: ........................ 254 Multiplicidad:.................................................................................................................... 254 Tamaño ............................................................................................................................. 254 CONTROL Y VIGILANCIA DESPUES DE UNA POLIPECTOMIA COLO-RECTAL. ACTUALIZACIÓN DE CONCENSO POR EL GRUPO DE TRABAJO MULTI SOCIEDADES DE LOS ESTADOS UNIDOS REFERIDAS AL CANCER COLORECTAL ......................................................... 255 Nuevas Guías sobre Vigilancia Post polipectomía Recto Colónica .................................. 255 Nuevos intervalos de vigilancia ........................................................................................ 256 Pólipos Aserrados: ............................................................................................................ 256 ¿Cuándo se debe dejar de vigilancia? .............................................................................. 257 PARTE 6:.................................................................................................................................... 258 LA VIDEOCOLONOSCOPIA EN EL CONTROL DE LOS PACIENTES QUE RECIBIERON RADIOTERAPIA PREOPERATORIA EN EL CÁNCER DE RECTO ........................................ 258 Introducción ......................................................................................................................... 258 Radio quimioterapia Preoperatoria ..................................................................................... 258 RADIOQUIMIOTERAPIA PREOPERATORIA Y PRESERVACIÓN DE ESFINTER.......................... 264 ESQUEMA DE RADIOQUIMIOTERAPIA PREOPERATORIA CONCOMITANTE ......................... 264 QUE HACER ANTE LA RESPUESTA COMPLETA: .................................................................... 266 QUE HACER ANTE LA RESPUESTA INCOMPLETA: ................................................................. 268 PROTOCOLO DE CONTROL; TIEMPOS DE OBSERVACIÓN POST-RADIOTERAPIA: ................ 269 6 Regresión Histológica del Grado de Tumor...................................................................... 274 Marcadores predictivos de la sensibilidad celular a la Radioterapia. .................................. 275 Conclusión ........................................................................................................................ 275 PARTE 7:.................................................................................................................................... 278 LA VIDEOCOLONOSCOPIA EN EL MEGACOLON Y DESCOMPRESION DEL VOLVULO COLÓNICO. .................................................................................................................... 278 Etiologías de la obstrucción del Colon ................................................................................. 279 FUNCIONALES ................................................................................................................... 279 Tratamiento ...................................................................................................................... 279 MECANICAS: Clasificación de las causas mecánicas de obstrucción del Colon en el adulto.................................................................................................................... 280 Oclusión colónica por Vólvulo del Colon Sigmoides. ....................................................... 280 a) VóIvulo agudo............................................................................................................... 281 PARTE 8:.................................................................................................................................... 287 LA VIDEOCOLONOSCOPIA EN EL TRATAMIENTO DE LAS ESTENOSIS BENIGNAS Y MALIGNAS DEL RECTO-COLON. ...................................................................................................... 287 CLASIFICACION Y ETIOPATOGENIA DE LAS LESIONES PARIETALES ...................................... 287 COLORECTALES. ................................................................................................................ 287 LESIONES COLÓNICAS EXTRÍNSECAS ................................................................................ 287 TRATAMIENTO ENDOANAL CON STENT EN LA OCLUSION O ESTENOSIS COLORRECTAL SEVERA. INDICACIONES Y UTILIDADES. ........................................................................ 292 CONTROL VIDEOCOLONOSCOPICO. ..................................................................................... 292 PARTE 9:.................................................................................................................................... 296 COMPLICACIONES DE LAS VIDEOCOLONOSCOPIAS ................................................................. 296 Perforación Post-Polipectomía............................................................................................. 299 Sindrome de Coagulación post-polipectomía. ..................................................................... 312 7 Dificultades de avance del videocolonoscopio en pacientes con adherencias postOPERATORIAS. .............................................................................................................. 313 PARTE 10: ................................................................................................................................. 317 CASUISTICA ............................................................................................................................... 317 HEMORRAGIAS DIGESTIVAS BAJAS: ..................................................................................... 323 Hemorragia Post-Polipectomía experiencia de la Unidad de Aparato Digestivo Baistrocchi. Córdoba............................................................................................. 325 ESTENOSIS COLO-RECTALES ................................................................................................. 326 DISTRIBUCION DE LAS ESTENOSIS SEGÚN SU UBICACIÓN ANATÓMICA COLORRECTAL ..... 327 STENT RECTO-COLONICOS ................................................................................................... 328 COMPLICACIONES DE LAS VIDEOCOLONOSCOPIAS ............................................................. 328 UBICACIÓN ANATÓMICA DE LAS PERFORACIONES COLÓNICAS .......................................... 329 OTRAS COMPLICACIONES..................................................................................................... 329 ENFERMEDADES INFLAMATORIAS. ...................................................................................... 329 BIBLIOGRAFÍA ........................................................................................................................... 331 8 INTRODUCCIÓN Evolución de las Imágenes Endoscópicas en las Patologías Colorrectales La misma enfermedad con sus mismas características genéticas y evolutivas nos estaban esperando para que viéramos de que se trataba y como cambiaba su característica endoscópica a través de su historia natural. Quizás el cáncer del Recto y el Colon comenzaba su evolución genética y celular y era sin duda lo que más nos preocupaba y al que pusimos mayor interés. Nuestros ojos con los primeros endoscopios trataron de escudriñar entre los pliegues mucosos los cambios que ella efectuaba, primero con una tenue luz de las lamparitas de Chevallier Jackson, luego con un Fibroscopio que nos mostró la totalidad del colon. Pero en el sitio correcto donde se producían los cambios tisulares que el K Ras no pudo evitar en la hipometilacion del DNA en el cromosoma 12 p, que comenzó con la hiperproliferación del epitelio y que caminaría luego a la formación de un crecimiento pequeñísimo se ocultaba a nuestros ojos o se mezclaba con la mucosa normal y solo veíamos ya a lo que aprendimos a llamarle Pólipo, sésil y pequeño, y con él al verlo logramos el avance más grande de la Endoscopia Colónica mundial, y las conductas que tomamos con su exéresis hasta el día de hoy es invencible. Hoy sabemos que su resección y control impide el crecimiento de un Cáncer en ese sitio. Y hasta la fecha el hallarlos a modo de screening o en búsqueda de otra patología, constituye la herramienta más poderosa en la detección precóz del cáncer colorrectal. Esas imágenes esquivas que por muy pequeñas no las detectábamos, tuvieron su mejor expresión en la mente de muchos endoscopistas del mundo, nosotros, ya proponiamos su resección temprana en un Trabajo que presentaramos con mi querido primo ya fallecido el Dr. Julio A. Baistrocchi , en esta Sociedad y que merecería el Premio Accesit del año 1977, “Pólipos Rectocolónicos su tratamiento mediante la endoscopía a fibra óptica con corte y coagulación fría” y en mi Tesis de Doctorado (Pólipos del Colon, su diagnóstico y Tratamiento con corte y coagulación fría, un nuevo método, la Colonofibroscopia 1981) presentada en la Facultad de Ciencias Médicas de la Universidad Nacional de Córdoba. Junto con Muto, Nivatongs, Morson, Bacon, 9 Welch, Espeche de Argentina y Christopher Williams, entre tantos ya proponíamos que las clasificaciones de los mismos deberían estar de acuerdo con su histología, y que habían lesiones que por pequeñas y planas no debían ser descuidadas, y proponíamos nuevas clasificaciones. El genio Japonés y una firma Americana (ACMI) no demoró mucho en mostrarnos nuevos aparatos cuya imagen era digitalizada en el extremo distal del aparato y traducida a una pantalla que hasta el día de hoy sigue siendo de suma utilidad. Pero el hecho era que había que avanzar sobre esas imágenes para poderlas observar mejor, y los aparatos comenzaron a agrandar y mejorar la calidad de la digitalización, y se llamaron Magnificados, y hasta el día de hoy esa calidad de digitalización se llamó mejor resolución o alta definición. Y comenzamos a ver imágenes que necesitaron nuevas interpretaciones, imágenes elevadas levemente, imágenes con bordes, imágenes deprimidas, planas, etc.; ya el Dr. Kariya en los años 1977 nos mostraba que habían imágenes pequeñas pero de muy distina evolución. 1 Pasó poco tiempo mas y el Dr.Shin ei Kudo de Tokio, Japon en 1996 nos muestra que con un colorante suave como el Indigo Carmín dispersado a modo de spray sobre la superficie mucosa colónica, se podían ver figuras que dibujaba la deformación de las papilas del colon y recto avisándonos que sobre ellas ocurria una transformación que pronto podría ser grave, y puso en marcha otra herramienta invalorable para el Coloproctólogo y Endoscopista que fue la Cromoscopía 2. Tan cierto e importante fue este evento en la Endoscopia Mundial que los fabricantes de sistemas y aparatos incorporaron a sus aparatos sistemas electrónicos de Cromoscopía como Banda Estrecha, Narrow band imagin (NBI) de Olympus®, Fice de Fujinon®, y el iScan de Pentax®, con los que podemos realizar una Cromoscopía similar solo con apretar un botón. Tuvimos el honor con mi grupo de participar en la primera edición del primer Atlas de imágenes endoscópica con Cromoscopía editado por la Editorial Ravizza, en Milano Italia, a cargo del que fuera presidente de la SIED en ese momento el Dr. Felice Cosentino, que con su equipo maravilloso del Hospital Angelo Paolo de Milan, Dra Roberta Motta, A. Grassi, Th Ponchon, A. Treca y J.L. Vasquez Iglesias, en el año 2000, titulado “La Cromoendoscopia L´Impiego dei coloranti In Endoscopia Digestiva”. Esto 10 hizo que debiéramos mejorar en Argentina nuestros aparatos y sistemas, y tuvieron eco mis palabras en el Departamento de Gastroenterología del Instituto Oulton de la ciudad de Córdoba con el Dr. Nolberto Lorenzo, Jefe de la Unidad, y su hijo el Dr. Manuel Lorenzo que adquirieron el Primer Colonoscopio Magnificado de la casa Fujinon, que nos permitio realizar la cromoscopía con el colorante Indigo Carmín, y con el cual presentaramos numerosos trabajos en Congresos de Gastroenterología y Coloproctologia Argentinos , y que me valiera el Relato en el Congreso Mundial de ISUCRS realizado en San Pablo con el tema de “Flat Lessions, Western Experience” en el mes de Julio del año 2000. Pero no estaba todo dicho, ni lo estará, hoy la Microscopic Videocolonoscopy, la Confocal Microendoscopy, Endo Microscopic Technique, Ultra High Magnification, nos provee una imagen muy cercana al Microscopio. ¿Y el futuro?, cuál será el futuro, ¿seguiremos avanzando entre esas células mucosas y veremos su multiplicación? Sí ya hay trabajos que miran el crecimiento de las Papilas Mucosas en sus diferentes aspectos de crecimiento, ya el Dr. Wong del King Elizabeth de Hong Kong lo hacia observando el diferente crecimiento de las Papilas para mejorar el concepto de Displacia, con el concepto de Fisión Críptica. 3 El lo hacia en realidad contando el numero de mitosis en una determinada zona de las criptas, dividiendo para su estudio 5 zonas a las que le daba de acuerdo al número de multiplicaciones mitóticas el grado de avance de las displacia. Y ¿ya está? No lo sé, pero si se que hoy la Genética dio grandes pasos y no pasarán muchos años en que marcadores genéticos de cambios estructurales se puedan ver. Esta es la breve historia de nuestras imágenes que costó mucho dinero y se pagó un precio muy grande, las empresas invirtieron en estos sistemas fortunas incalculables, mi mayor respeto a todas ellas que nos llevaron de la mano en búsqueda cada día de nuevas imágenes en todas las enfermedades del Colon y el Recto. 11 Agradecimientos 1. A la Comision Directiva de la Sociedad Argentina de Coloproctología que tuvieron la enorme responsabilidad de elegirme para este Relato, sabiendo que los que yo les traería seria la Historia de mi vida. Todos aprendimos juntos, nuestra generación fue un poco visagra de la Historia de la Medicina, nadie tiene mas mérito que otro esto es solo un Relato mas de todo lo que vivimos juntos a lo largo de estos años. Muchas Gracias. Presidente: Dr. Jorge Hector Arias Vicepresidente: Dr. Jorge Alberto Latif Secretario General: Dr. Luis Zanoni Tesorero: Dr. Fernando Gabriel Bugallo Secretario de Actas: Dr. Marcelo Javier Colinas Vocal Titular 1º: Dr. Juan Carlos Patron Uriburu Vocal Titular 2º: Dr. Gustavo Leandro Rossi Vocal Titular 3º: Dra. Karina Andrea Collia Avila Vocal Suplente 1º: Dr. Mauricio Abel Fantozzi Vocal Suplente 2º: Dr. Sergio Hernán Labiano Vocal Suplente 3º: Dr. Alejandro Ariel Moreira Grecco. 2. Mis Colegas, que colaboraron en este relato, y todos los que conmigo comenzamos esta Historia que por primera vez se escribía en la República Argentina como pioneros de esta tan linda y maravillosa Historia que ha sido la Colonoscopia en la República Argentina, simultáneamente con todos los Autores del resto del mundo, y esto hace que el valor de nuestras palabras tenga trascendencia mundial porque las experiencias fueron simultaneas. Todos los endoscopistas del mundo fuimos evolucionando y aprendiendo en la medida que interpretábamos las imágenes en las distintas patologías y en la medida que fuimos interpretando y conociendo cada día más la evolución natural de las mismas. 12 Esta interpretación fue evolucionando en la medida que veíamos mas y mejor. Primero aprendimos de nuestros maestros lo que veíamos a través de un instrumento rígido con una tenue luz, el Recto y a veces la primera porción del Sigma. Poco podíamos clasificar los grados en las enfermedades inflamatorias quizás las más difíciles, ya en Buenos Aires el Dr. Marcelo Fraise del Hospital Bonorino Udaondo, el Dr. Hugo Parodi y el Dr. Roal Martini en la provincia de Córdoba habían dado las primeras pautas para poder estadificar y calsificar a la Colitis Ulcerosa con Rectosigmoidoscopia Rígida. 4 Pero contábamos con la inestimable posibilidad de la muestra biopsia con lo que la Anatomía Patológica era la asociación diagnóstica más precisa que podíamos obtener. En Córdoba al Dr. Valeriano Torres y luego al Dr. Luis Spitale tuvieron también que actualizarse a las nuevas clasificaciones de acuerdo a las últimas publicaciones, que en la época solo podía hacerse por Publicaciones en Revistas y Textos. El Dr. Jorge Andruet en los años 1970 Jefe de nuestro Servicio de Coloproctologia del Hospital San Roque de Córdoba, insistia en que toda imagen endoscópica debía biopsiarse. Los tumores del Recto que veíamos eran ya avanzados, el paciente venia tarde a la consulta especializada, el médico clínico no estaba habituado al Tacto Rectal pese a que en nuestra Cátedra de Cirugía de la Facultad de Ciencias Médicas de la Universidad Nacional de Córdoba, en esa época dirigida por el Dr. Manuel Cuenca Perez, inculcábamos a nuestros alumnos la necesidad de la inspección anal y el Tacto Rectal. Veiamos Pólipos también, distinguíamos entre sésiles y pediculados, y su aspecto de velloso y planos a los de mayor tamaño. Habíamos aprendido de los Autores mas famosos de esa época a clasificarlos y observar el aspecto superficial a través de un instrumento rígido, y luego la maravilla de la fibra óptica, Autores de clasificaciones de Pólipos como Morson 5, Bacon 6, Welch 7, Goligher 8, Espeche 9, Turrel 10, Benhamour 11, Maruyama 12, Bokus13, Finochietto 14, Duhamel 15, Mac Leod 16, y Wolff 17. Donde comenzaban las controversias o las confusiones como lo expresaba Turrel 18 era cuando se tenía que clasificar o definir a estas lesiones y no se especificaba el criterio a seguir. Por eso el gran capítulo de los Pólipos del Colon y Recto debía abrirse considerando claramente que estas lesiones se las debía estudiar desde dos puntos de vista, como lo expresara en mi Tesis de Doctorado: Pólipos del Colon y Recto 13 1981 19, y la Dra. Rita Pastore en su excelente Relato de Pólipos Colorrectales no Hereditarios del 34º Congreso Argentino de Coloproctología del año 2009 20. Estos son: el histológico donde la tipificación celular, su disposición y organización nos dará el encuadre general de Pólipo con su nombre específico; y el morfológico que importa tanto al Radiólogo, Cirujano y Anatomopatólogo. Pero este criterio interesaba mucho mas al Endoscopista queveia muchas veces dificultada la definición de la lesión por ser este un estudio dinámico expuesto a fáciles errores de interpretación, como pasar por alto lesiones planas, deprimidas, etc., por dificultades en la preparación, dolor manifiesto del paciente (no contábamos con la sedación/anestesia) movilidad del mismo. Esto ya lo expresábamos con la Colonofibroscopia en el año 1981, y hoy nos encontramos con similares inconvenientes. Tanto es así que en múltiples estudios multicéntricos se controla la calidad de la Colonoscopia bajo estos mismos parámetros, porcentaje de arribo al Ciego (CER – Cecal Intubation Rate), cantidad de de Adenomas detectados (ADR – Adenoma detection Rate) según la calidad de la preparación, y si se usa sedación o no. Concluia en ese momento diciendo junto a Henry Bockus 21, quien decía a comienzos del siglo XX que en el sentido mas estricto era una designación anatómica que se aplicaba a la forma o tipo de una lesión sin tener en cuenta las estructuras histológicas o el carácter Patológico del Tumor. Todo cambió con el tiempo y hoy los aparatos de alta definición o alta resolución, además de las tinciones como la cromoscopía o la misma electrónica, como el Narrow Band, Fice, iScan y Microendoscopy dan la sospecha clara de ante que lesión estamos o donde biopsiar, tomando así una conducta mas precisa y mas segura para el paciente. Su resección también era compleja, pese a que ya a comienzos del siglo XX con diversas modificaciones se venían recomendando, como las del Dr. Garcia Matta22 o los Trabajos con ansas diseñadas propias como las del Dr. Amadeo Espeche comunicadas a esta Sociedad Argentina y en el 24 Congreso Brasilero de Coloproctología en el año 1974 23. Varios Autores Argentinos comenzaron con sus publicaciones al respecto como las del Dr. Jorge Rodriguez Martín, de no poderlas resecar mediante ansas la resección endoanal para los Pólipos del Recto era la regla. Pero realmente lo que nos llevó de la mano a los Coloproctólogos fue la aparición de la Colonofibroscopia, tanto para el diagnóstico como la terapéutica. 14 Hubo infinidad de autores japoneses, europeos y americanos que comenzaron a comunicar sus experiencias. Las primeras experiencias en el mundo comienzan a ser publicadas con el verdadero Colonofibroscopio en 1966 por Koyama y cols 24, Wolff y Shinya 25 del Departamento de Cirugía del Beth Israel Medical Center, Mount Sinai School of Medicine en New York, publican los primeros 241 exámenes Colonoscópicos realizados con el aparato CF-LB de Olympus que les permitía arribar hasta Ciego. Estos estudios los llevaron a cabo en un período que fue de junio de 1969 a diciembre de 1970. Sobre el total de estudios realizados (241) estos autores encuentran 43 Pólipos (17,8%) y 3 Adenomas Vellosos (1,2%). Joshiro Sakai 26, en 1969, modifica el Esofagofibroscopio original en cooperación con la casa Olympus Company, introduciéndole unas variantes, obteniendo así dos tipos de Colonofibroscopios el modelo CF-SB corto y el CFLB más largo para poder arribar a Ciego. La Escuela Argentina se hace presente en el año 1973 con el Dr. Jorge Alberto Rodriguez Martín y Zulema Forcinito quienes presentan en el 5° Congreso Argentino e Internacional de Coloproctología el trabajo El valor de la Colonofibroscopia en las lesiones Polipoideas.27 Al año siguiente el Dr. Rodriguez Martín de Argentina publica en la Prensa Médica Argentina el Trabajo; Colonofibroscopia 28. La más grande experiencia hasta los años 1975 referidos a colonofibroscopías la tienen sin dudas Wolff y Shinya 29 quienes presentan 7.000 Colonoscopias realizadas en el Beth Israel Medical Center de Nueva York. En ese mismo año también en Argentina el Dr. Horacio Rubio presenta en el 6° Congreso Latinoamericano de Proctología, Utilidades de la Colonofibroscopia y sus complicaciones 30. Al año siguiente 1976, el Prof. Juan R. Michans, Carlos Vaccareza, Coronado Quesada y Horacio Rubio también de Argentina 31, publican un trabajo en los Boletines de la Academia Nacional de Medicina de Buenos Aires, con la experiencia obtenida en 750 Colonoscopias. Nuestro grupo integrado por el Prof. Dr. Julio A. Baistrocchi, ya fallecido y quien subscribe, comenzamos por el año 1973 estimulados por el Prof. Dr. Antonio Higa primer Endoscopista de Córdoba que nos trajo toda la experiencia que Japón ya venía desarrollando y nos estimuló a que compráramos un colonoscopio, y lo hicimos adquiriendo un Colonofibroscopio de la casa Olympus el CMB2, y luego el CMB3 colonofibroscopio que arribaba al ciego de 1,80 m de longitud, para luego ir renovando los equipos con Colonoscopios de dos canales, como los de la firma Fujinon. Nuestros 15 primeros trabajos dieron su fruto porque la experiencia Argentina con estos instrumentos era aún escasa, y nos animamos a presentar en Jornadas y congresos, Trabajos como “Conductas en la Colitis Ulcerosa nuestra experiencia diagnóstica y Terapéutica con un Colonofibroscopio”en el 1º Congreso de Proctología del Interior realizado en Córdoba-Argentina, en el año 1974 32. Ya en el año 1977 con el Dr. Julio Baistrocchi en colaboración con quien subscribe y nuestro fenomenal equipo formado por los Dres. Remo Copello, Roberto Copello, Marcelo Antoraz, Daniel Malvares y Prof. Valeriano Torres, publicamos “Pólipos Rectocolónicos. Conceptos histopatológicos. Su tratamiento mediante la endoscopia a fibra óptica del colon, con corte y coagulación fría”, que valió el Relato oficial del 2° Congreso Nacional de Coloproctología del Interior en el año 1977 33. Este trabajo se presentó al Premio “Accesit” de la Sociedad Argentina de Coloproctología, con el que ganáramos dicho premio. También en ese año presentamos “Análisis de 200 Colonoscopias” en el 2º Congreso Nacional de Coloproctología del Interior, realizado en Mar del Plata - Argentina 34, en donde publicábamos nuestras primeras Polipectomías y sus dificultades, trabajos que llevamos a Europa al Primer Congreso Mundial de Coloproctología que se desarrolló en Madrid España en el año 1978 35. Los Pólipos del Colon y Recto fueron para nosotros un atractivo muy especial, porque no estaba bien definida su conducta, Japón con varios Autores como Maruyama 36, autores anglosajones como Morson 37 hablaban de su resección completa con sus mayores cuidados sobre todo el especial cuidado hacia las lesiones planas. Turell R. 38 expresaba referido a estas lesiones; La confusión existente acerca de adenomas colorrectales se deben en gran parte a su comportamiento biológico variable (lo cual es inevitable) y parcialmente a la circunstancia de que muchos autores no indican la base precisa de su diagnóstico. Para eliminar la confusión existente acerca de los Adenomas del Recto y del Colon es imperativo que aquellos que escriban sobre Adenomas se refieran al criterio imperante para su examen microscópico de modo que el lector conozca fácilmente el fundamento del diagnóstico. Cuan cierto fue esto que con el correr de los años hasta el presente hemos venido discutiendo de que si los Pólipos Hiperplásicos se transformaban en malignos o no en alguna etapa de su crecimiento, y hoy tenemos el concepto histológico de Pólipos Aserrados (Serrated Polyps) y Pólipos Mixtos ambos con un cierto potencial de transformación maligna. 16 Hoy disponemos en la bibliografía mundial de numerosos trabajos referidos a la posibilidad de transformación maligna de estos Pólipos, en donde la relación de estabilidad microsatelital, y un fenotipo definido como CpG island methylator phenotype, da la pauta precisa de que esta tipificación Histológica es reconocida como pretumoral 39 que confirmaría las sospechas conceptuales de la época. Esto tuvo tal importancia que los conceptos de Haggit para entender la invasión carcinomatosa o no de los Pólipos pediculados y planos publicadas en 1985 40, se mantienen hasta la fecha, pese a las modificaciones de los Japoneses Kashida y Kudo que en el 2006 introdujeron el concepto de invasión de acuerdo al espesor y profundidad sm1, sm2 y sm3 41 dando aun mayor sensibilidad de diagnóstico endoscópico y anatomopatológico de la invasión carcinomatosa en los pólipos. En el año 1978 tuve la suerte de asistir al Hospital S´t Marks de Londres y conocer al Dr. Cristopher Williams con quien compartimos varias horas de Endoscopia, y conocer en persona al famoso Prof. Dr. Basil C. Morson Anátomo Patólogo por excelencia una figura de la época por sus trabajos y Libros editados traducidos a casi todos los idiomas. Pasaron los años y pudimos adquirir sobre los años 90 los videocolonoscopios, de la casa Olympus (CV I) ya la visión había mejorado tanto que nos parecía que nada podría superarlo, y no solo eso sino que digitalizábamos las imágenes, pudiendo hacer archivos de las mismas en cintas grabadas o en imagines archivadas en la computadora, mejoraron también los informes a los pacientes a los que podíamos entregar fotos o películas grabadas. Pero el verdadero adelanto fue que la amplificación y la mejor definición de la imagen nos dieron posibilidades a nuevas clasificaciones de los Pólipos y enfermedades inflamatorias. La terapéutica mejoró notablemente por la alta definición de las imágenes, comenzamos a realizar polipectomías de mayor calidad, realizar dilataciones de las estricturas, coagulación discriminada en las Rectitis Actínicas, mejor definición en las isquemias colónicas y el hallazgo de Angiodisplasias seguidas de su terapéutica. Y cuando creíamos que ya nada iba a mejorar aparecieron los aparatos de alta definición o magnificados, lo que nos permitió realizar tinciones in vivo (cromoscopía) 17 lo que hizo que esas deformaciones de las vellosidades que ahora podían verse con claridad y aprendimos nuevas clasificaciones de acuerdo a su estructura 42. Varias empresas compitieron en la fabricación de estos aparatos destacándose las firmas Olympus®, Fujinon®, Pentax®, Acmi®, Störz®, y hasta una firma Argentina “Endoscopy” se animó en manos del Ing. Juan Carlos Zinni a ensamblar estos sistemas a más bajo costo con muy buenos resultados como verán a lo largo de este relato, todos buscaban calidad en la presentación de la superficie colorrectal. 18 CAPÍTULO 1 Conceptos básicos del método A través de la historia los médicos han confiado en sus percepciones sensoriales para la diagnóstica médica, olfatoria, gustativa, táctil, auditiva y sobre todo visual. El desarrollo de los medios para intensificar o ampliar dichas percepciones ha constituido durante siglos una de las primeras metas de la Ciencia médica. La investigación del cuerpo humano fue un motivo de preocupación permanente por los Científicos de épocas muy remotas y lo sigue siendo en la actualidad, sin que hayamos concluido todavía con un acabado conocimiento de la estructura y las funciones del cuerpo humano. No hace más de unos años se nos ha informado del conocimiento total del Genoma Humano, y cuantas cosas más faltarán para que la verdadera utilidad de los mismos nos traiga el progreso necesario. Dando una mirada a la Historia es sorprendente reconocer como los dibujos de Galeno (en el Siglo II), basados en la disección de monos se utilizaron hasta el siglo XVI, pese a que solo dos veces en su vida a este médico Greco-Romano le fue posible disecar cadáveres de estos. La enfermedad era considerada una posesión del demonio, brujería, o efectos del pecado por muchas religiones, sobre todo la cristiana, por lo que la disección de cadáveres humanos estaba prohibida. A pesar de esto la más alta figura del Renacimiento, Leonardo da Vinci dirigió su arte hacia el aprendizaje de los secretos del cuerpo humano. Realizó más de 30 autopsias, dejándonos un legado insuperable del conocimiento anatómico. Otro gran anatomista el Flamenco Vesalius prosiguió sus estudios entre el miedo y la hostilidad, hasta 1543 cuando publica su inmortal Atlas “De Corporis humani fabrica”, este fue recibido con tal violencia que tuvo que solicitar la protección del Papa para salvar su vida. Tuvieron que pasar muchos años más en donde el estudio a través de lentes desarrollara la Microscopia, y luego la Radiología, con Whilhelm Conrad Roentgen, para llegar al aprovechamiento de lentes y tubos especiales que desarrollaran la Endoscopia del tubo digestivo. Pese a que se tiene noticias de que Hipócrates había usado un tubo con una vela para examinar el Recto de un paciente, ya se conocía que 19 en la Civilización Egipcia, Griega y Romana había datos de que los prácticos introducían tubos por el Recto para examinar a sus pacientes. El desarrollo del endoscopio Gastrointestinal se puede dividir en tres fases bastante diferenciadas. El período del endoscopio rígido, (1807-1932), el período del endoscopio semiflexible (1932-1957) y el período del fibroendoscopio (1957-al presente) En todo este periodo hubieron destacados Coloproctólogos Alemanes, Ingleses y Franceses, como la escuela del St. Mark's Hospital, que junto con Raoul Bensaude, quien publica su Libro “Rectoscopie Sigmoidoscopie” en 1919 teniendo una influencia importantísima en Europa en lo referente al examen del paciente proctológico. Frederic Salmon, en el año1835 funda este famoso Hospital, el St. Mark`s para los pobres que sufrían fístulas y otras enfermedades del Recto. Desde fines de los 60 y comienzo de los 70 nuestra arma de trabajo que parecía haber llegado a la perfección fueron los Colonofibroscopios. Esto fue sin lugar a dudas el método con el que adquirimos la mayor experiencia. Nuestra Unidad adquirió los primeros fibroscopios en el año 1973, y desde esa época a la fecha hemos adquirido experiencia en las etapas diagnósticas y terapéuticas. Y cuando se creía que no habría visión ocular más perfeccionada, aparecieron en los años 80 las Videocámaras que adaptadas al ocular del fibroscopio nos daba la imagen en un Televisor ampliando aún más la visión de las paredes del Recto y Colon. Esto permitió la documentación y archivo de imágenes cosa que antes lo hacíamos solo a través de fotografías (Diapositivas que luego podían proyectarse). Pero como el ingenio humano no descansa nunca sobre el filo de los años 81 y 82 aparecieron los Video-endoscopios, aparatos que aprovechando los microchips y las minicámaras adaptaron un sistema flexible óptico electrónico (las guías de luz siguen siendo de fibra) sobre la base de la estructura de los fibroscopios aprovechando sus guías de movilidad, lavado, canales de trabajo, etc. Una de las primeras casas constructoras fue la firma Welch A. en los años 80 que comercializa sus aparatos en EEUU, la competencia no se hizo esperar y la Casa Olympus, y Pentax de Japón promocionan sus aparatos mejorados en imagen y documentación a la que ya se suma la Computación 20 como medio de archivo de imágenes. Luego la casa Fujinon con sistemas interactivos de documentación, archivo e impresión. El Dr. Eran Goldin (Argentino) del M. Sinai de Israel participó no hace muchos años en un proyecto de un sistema Endoscópico unitario a modo de oruga y de forma ovoidea como un supositorio, que comandada desde el exterior podría tomar imágenes y muestras recorriendo todo el tubo digestivo. Esto por su elevado costo todavía no ha sido puesto en el mercado. Pasaron algunos años y en los 90, el médico gastroenterólogo inglés del Royal London Hospital, Profesor Paul Swain, junto al ingeniero electrónico Gavriel Iddan de la empresa israelí Given Imaging, inventaron y desarrollaron la videocápsula endoscópica (M2A). La misma alberga componentes electrónicos miniaturizados, una videocámara, una fuente de luz, una batería y un radiotransmisor. Transita el tubo digestivo del paciente en pocas horas como cualquier alimento. Realiza el recorrido ayudada por el movimiento natural del tracto digestivo, propulsión por peristalsis, para luego ser expulsada sin esfuerzo por el recto-ano. El sistema ha demostrado que es seguro y permite, además, visualizar zonas del intestino delgado de difícil acceso para la endoscopia tradicional. La videocápsula transmite la información a sensores externos adheridos a la pared abdominal del paciente, que a su vez están conectados a un videograbador portátil tipo Walkman que almacena las imágenes y se acopla a la cintura del paciente mediante un cinturón especial. Posteriormente, mediante un programa especial (Rapid software) en una estación de trabajo, se realiza el procesamiento de las imágenes y análisis de resultados para la elaboración diagnóstica final. En la actualidad nuestra Unidad de Aparato Digestivo cuenta con la PILLCAM SB y ESO, esta cápsula mide 2,6 cm. de largo y 1,1cm de ancho, pesa 4 gramos y se encuentra fabricada con un material de plástico. Su funcionamiento responde mientras la píldora va pasando por el tracto gastrointestinal del individuo, obteniendo imágenes de vídeo del mismo. La píldora, en un procedimiento normal (unas 8 horas) genera unas 57.000 imágenes aproximadamente, a una velocidad de dos imágenes por segundo. Pero lo que ha venido a convulsionar a la Gastroenterología de todo el mundo es la mejor resolución en imágenes de los endoscopios (High resolution) al aumentar la 21 imagen observada nos dio la oportunidad de describir la configuración de la superficie mucosa en forma más detallada, con un nuevo mapeo de la misma, donde tuvimos que aprender a interpretar esta nuevas imágenes. A esto se le sumó el uso de colorantes que desde hace mucho ya se venían usando, y que con una mejor resolución perfeccionó este método tan útil, haciendo resaltar lesiones muy pequeñas imposibles de observar con Colonoscopia normal. Videocolonoscopia La colonoscopia es la técnica endoscópica que permite la visualización de todo el colon y del último tramo del íleon terminal. Es una exploración que puede ser dificultosa, requiere una preparación previa, es molesta y en ocasiones dolorosa para el paciente si no se realiza con algún tipo de premedicación anestésica y conlleva una serie de complicaciones por lo que hay que valorar bien la indicación de la misma, pese a que por lo general en todos los Servicios del mundo este procedimiento es bien tolerado, sobre todo si se realiza con Sedación/Analgesia o lo que llamamos en la actualidad Neuroleptoanalgesia. Es posible alcanzar el ciego en más del 90% de las exploraciones en la mayoría de las publicaciones y estudios multicéntricos del mundo entero, pudiéndose conseguir la intubación del íleon distal en la mayoría de las ocasiones (más del 75%): existen una serie de situaciones que limitan esta posibilidad como son la existencia de adherencias por cirugía abdominal previa o por peridiverticulitis, mala preparación, alteraciones anatómicas y la presencia de estenosis inflamatorias o neoplásicas. El índice de complicaciones es relativamente bajo del 0,5% al 3%. Las estadísticas Internacionales oscilan entre el 0,1% al 0,8% para los procedimientos diagnósticos, y del 0,5% al 3% para los terapéuticos. 43,44 Existen algunas contraindicaciones para la misma pero con un índice muy bajo, y las publicaciones en el mundo entero son pocas. Se considera al embarazo como un probable motivo para diferir el estudio al puerperio a no ser de que se sospeche de un proceso neoplásico y/o obstructivo y se aconseja realizarlo en un Centro Sanatorial donde exista un Centro de Ginecología y Obstetricia. La sospecha de una Diverticulitis Aguda, demostrada por una TAC hace que este procedimiento sea diferido hasta mejorar el proceso agudo. 22 Calidad en la colonoscopia Hoy la calidad en la realización de una Colonoscopia es fundamental para el diagnóstico precoz del cancer Colorrectal, y juegan varios ponderables desde la calidad de la imagen, hasta la habilidad y destreza del operador. Tan es así que numerosos trabajos que miden calidad en las endoscopias toman parámetros como la intubación cecal, y el hallazgo de Pólipos menores de 1 cm. Otros trabajos están más referidos al operador en lo que se refiere a calidad de la Colonoscopia eje importantísimo sobre el que gira el hallazgo de lesiones. Un trabajo reciente realizado en Northamptonshire, Inglaterra, por el grupo de Verma, Dixon y Chilton del Kettering General Hospital Dto. De Gastroenterología, correlacionan la intubación cecal promedio de aquellos Colonoscopistas que realizan por lo menos 120 procedimientos por año. La medición de la calidad de la colonoscopia ha estado en la vanguardia de la mejora de la calidad. El Grupo Consultivo Mixto Endoscopia gastrointestinal (JAG) ha publicado una guía para los profesionales para lograr tasas de intubación cecal (CIR) de ≥90% y que realizan ≥100 colonoscopias anuales. La Sociedad Británica de Gastroenterología Auditoría Nacional de colonoscopia publicó en 2012-2013 demostrando una CIR de 92,3%. En 2012, publicamos los datos de 16.064 colonoscopias que muestran un CIR combinado de 90.57% estándar de JAG. El análisis de nuestra auditoría observó la relación de volumen y el resultado. CIR de operadores que realizan ≥100 procedimientos por año fue 91,76%; aquellos que realizan <100 fue 87,77%. Los datos de 2 años que recoge más de 120 operadores involucrados. Esto proporcionó una oportunidad para estudiar la correlación entre el volumen y CIR en detalle. Concluyen en este análisis que de acuerdo a los datos suministrados por el sistema de calidad en la Colonoscopia un operador debe realizar más de 120 procedimientos por año para lograr un CIR (promedio de Intubación Cecal) del 90% lo que da un promedio de por lo menos tres Colonoscopias por semana.45 Personalmente me parece escaso el número que toma la Sociedad Británica de Gastroenterología, comparando con nuestro centro Unidad de Aparato Digestivo Baistrocchi de la ciudad de Córdoba Argentina, que es una población cercana a millón de habitantes, y nuestro centro un centro privado externo y ambulatorio, nuestro promedio de Videocolonoscopías mensual es de 120 promedio, con una carga anual cercana a 1.440 estudios colónicos. Con un promedio de arribo a Ciego del 98%. 23 Estos parámetros son quizás el eje práctico más importante en la calidad del estudio: 1. El operador es un médico Coloproctólogo y Cirujano entrenado en endoscopia, que además de endoscopia realiza otras prácticas médicas como Videolaparoscopia, Cirugía anoorificial y a cielo abierto, Manometría, Ecografía endorrectal de 360 grados, consulta médica donde el paciente le manifiesta sitios del dolor y trastornos funcionales por los que consulta. La formación intelectual, y la fijación de la enfermedad en su esfera cognoscitiva, hacen que en la habilidad y destreza puesta en marcha en el momento de la colonoscopia, tome todos estos parámetros como luces de prevención tanto sea en la diagnóstica como en los accidentes probables. 2. La limpieza del colon es fundamental para poder observar la superficie mucosa en sus detalles mínimos y arribar al Ciego, e incluso poder en ocasiones introducir el colonoscopio en el Íleon terminal. Hoy existen Clasificaciones de los parámetros de limpieza colónica como la de Boston, y otras, algunas de ellas que ya enumeraremos desarrolladas por los mismos Autores de trabajos corporativos, donde se trata de demostrar las virtudes de uno y otro producto de limpieza colónica. 3. El aparato (Videocolonoscopio) es el tercer ojo del Coloproctólogo, la calidad de los nuevos instrumentos que han desarrollado alta definición, y cromoscopía electrónica son la ayuda más eficiente. La cromoscopía con colorantes como el Índigo Carmín es la definición más pura de los cambios estructurales de la superficie mucosa. Todo esto vale más aún en la práctica terapéutica, donde se pone a prueba la habilidad y la experiencia del operador. De no ser así los índices de complicaciones aumentan en forma ponderable. 4. El tiempo de entrada y salida en la Videocolonoscopia es fundamental para el diagnóstico de pequeñas lesiones, en nuestra Unidad el promedio de entrada y arribo a Ciego es de 3 a 7 minutos y tratamos que la salida no sea menor a 6 minutos, consideramos como muchos 24 trabajos que el tiempo de salida es más importante que el de entrada, pues la plicatura en el avance del colonoscopio de las austraciones puede ocultar lesiones hasta de 1 cm, y las curvaturas naturales del colon pueden rectificarse y darnos una visión programa mayor a los 10 cm por lo que respetamos este parámetro. 5. El manejo precoz de las complicaciones es de fundamental importancia, no solo por la terapéutica a implementar, sino por el diagnóstico precoz de la misma, el darse cuenta rápidamente de que es lo que le está sucediendo al paciente y tomar las medidas urgentemente más allá de los horarios nocturnos o feriados que a veces complican este mecanismo. Esto es fundamental y básico para disminuir no solo la mortalidad sino la morbilidad. Cirugías indicadas por temor cuando una terapéutica expectante era lo adecuado, o una expectación con el paciente en el domicilio cuyos datos son recibidos por un paramédico, o un médico operador que le resta importancia al síntoma de enorme valor diagnóstico. 6. La sedación y/o anestesia fue clave en estos últimos años para el confort del paciente y la comodidad para el operador debido a la miorrelajación que se obtiene con la Neuroleptoanalgesia. Vivimos un periodo a partir de los años 70 hasta el 2000 en que solo realizábamos sedación y antiespasmódicos, y la época del uso de la Neuroleptoanalgesia con drogas maravillosas como el Fentanilo y el Propofol, asociados a sedativos de última generación como el Bromazepan, del 2000 hasta la fecha. No la realizamos nosotros ni nuestras enfermeras, estas drogas son manejadas por Anestesistas que disponen de medios de control como Cardioscopios, Oxímetro de pulso y resucitadores. Esto mejoró notablemente el confort del paciente, y la tranquilidad del operador, lo que mejoro también el promedio de arribo a Ciego notablemente, independiente del aparato a usar. La Videocolonoscopia terapéutica se realizó con mayores márgenes de seguridad sin que esto aumentara el número de complicaciones. Y las complicaciones propias de la anestesia siempre fueron menores. El índice de mortalidad fue cero. 25 Cuando estos parámetros no se cumplen, el error de no arribar al Ciego o suspender el estudio por alguna causa el paciente tiene una posibilidad de portar alguna patología no encontrada y esto es morbilidad que se podría traducir en mortalidad si el paciente no es estudiado nuevamente. Quiero aclarar que hay Gastroenterólogos clínicos que han sido entrenados en Cursos de capacitación en nuestro País o en Servicios de mucha capacidad práctica y didáctica que me merecen el mayor de los respetos, y los índices de calidad para ellos es muy similar que para nosotros los Coloproctólogos, pero estoy dando mi punto de vista después de más de 40 años realizando endoscopias, con más de 40.000 estudios entre fibra y video, y unos 20.000 enfermos operados luego de un estudio colonoscópico. Hay trabajos que vale la pena el comentario porque expresan en cierta medida la preocupación que tuvimos con mi grupo (Unidad Digestiva Baistrocchi) Un grupo del Departamento de Cirugia Digestiva de Cleveland de Ohio, titulan un trabajo “Lograr realizar un nuevo estudio en los pacientes con una Colonoscopia incompleta vale la pena el esfuerzo”.46 Fueron incluidos en este estudio 25.645 pacientes estudiados con colonoscopia desde el año 1982 al 2009. A 242 pacientes (0,95%), no se les pudo completar el estudio colonoscópico por las siguientes razones: inadecuada preparación (34%), dolor (30%), tortuosidad del colon (20%), no se pudo trasponer la flexura esplénica (71%). Se les ofrecio repetir el estudio a 218 (90%) pacientes de los que solo aceptaron 179 pacientes (82%). A 74 (41%) se les realizo un enema baritado, se repitió la colonoscopia a 71 (40%), una CT colonography (Colonoscopia Virtual) a 17 (9%) y colonoscopia con anestesia general A 9 pacientes (5%). 8 pacientes requirieron (4%) colonoscopia intraoperatoria. De las colonoscopias que se repitieron se encontraron 32 lesiones, 24 Adenomas Tubulares, 4 Tubulovellosos y 4 Pólipos Aserrados. En general como promedio se encontraron lesiones clínicamente significantes en 19 pacientes. Esto hace concluyen, que vale la pena el esfuerzo de buscar a estos pacientes y ofrecerles algún tipo de estudio, para completar hasta el Ciego la seguridad de no ser portador de una patología. Para el Dr. Gualdrini de Argentina, en las Guías Endoscópicas de Garantías de calidad en Colonoscopias dentro del Programa Nacional de prevención y detección 26 temprana del cáncer colorrectal en la República Argentina, la detección de pequeños Adenomas es uno de los parámetros más importantes para determinar la calidad de la Colonoscopia.47 Un trabajo presentado en Alemania dentro del Berlín Colonoscopy Proyect 3, BECOP-3, titulado Factores que determinan la Calidad de la Colonoscopia en el Screening del CCR, 48 determinan también que el hallazgo de Pólipos a lo que denominan ADR (Adenoma Detection Rates) promedio de detección de Adenomas Colorrectales, es uno de los marcadores más importantes en la Calidad de la Colonoscopia. Para muchos Países el promedio de detección ronda del 8 al 35%. Esto está influenciado por numerosas variantes o factores que dividen en factores relacionados al paciente, medicación previa, limpieza colónica la que clasifican en 5 puntos que van de excelente a pobre, factores referidos al Colonoscopista, como promedio anual de estudios realizados (Las Guías Europeas de calidad en la Colonoscopia establece como mínimo un número de 300 estudios anuales), la experiencia desarrollada por el Colonoscopista no solo en la práctica privada , sino también en Hospitales Públicos como enseñanza de la Endoscopia. El promedio de intubación Cecal. El tiempo de duración de la Introducción y del retiro del Colonoscopio, que debe ser como normativa general superior al 90%. El número de asistencia a Cursos de Educación Médica continúa en los 5 años anteriores al comienzo del Proyecto CME (Continuing medical education). Y Factores realacionados al Endoscopio usado y la calidad de los mismos. Los autores usaron los equipos de la Casa Pentax®, Olympus® y Fujinon® divididos en los de 1,2 y 3 generacion. Se realizaron 12.134 Colonoscopias con 21 operadores seleccionados bajo los parámetros que ya detallara. Del número total se seleccionaron solamente los que cumplían con los requisitos del Screening quedando solamente 11.166 casos, todo esto controlado por un Comité especializado en Berlín. El promedio de ADR (detección de Adenomas) oscilo entre el 7,5% al 33% (21,7%). El promedio de extracción del aparato fue de 6 a 11 minutos. El promedio de arribo a Ciego del 98% (del 93% al 99%) y el promedio de introducción del aparato oscilo de 8,8 ± 6,55 minutos. Se encontraron complicaciones solo en el 0,46% de los casos. Todos estos datos fueron sometidos a pruebas de sensibilidad estadística encontrando algunas variables diferentes entre los operadores, 27 no así en la preparación, siendo el 40% de las variables de Calidad en la Colonoscopia el Colonoscopista y su preparación previa y el aparato con que realizo los estudios. He querido comentar este trabajo porque los porcentajes de todos los parámetros son los se relatan en casi todos los estudios qué miden los mismos en todo el mundo, como para tener una referencia muy buena a aplicar en nuestras conductas cotidianas de trabajo endoscópico. Son tan importantes estos parámetros, que se respetan en todo el mundo, y dan al final de los resultados variables de calidad que han sido medidos. Por ejemplo en Inglaterra donde están muy bien reglados los Estudios corporativos de Screening de CCR, que miden los posibles efectos de errores en la búsqueda de Pólipos y Cáncer en grandes números de pacientes. Por ejemplo este trabajo llevado a cabo en Inglaterra agrupa el número importante de 31.088 colonoscopias49 Los siguientes factores técnicos aumentaron el riesgo relativo de detección de Adenomas (P <0,001 en el análisis multivariado): 1) Intubación Cecal 2) Aumento del tiempo de retirada 3) Mejor calidad de preparación intestinal.4) uso de antiespasmódicos endovenosos. 5) Procedimiento realizado al inicio de la jornada laboral (P=0,018)6) Una mayor experiencia del Colonoscopista. Como se deduce de este excelente estudio, los parámetros que se miden son los aceptados en todo el mundo. Esto fue realizado a pacientes con Test de Sangre oculta en m. fecal positivo. Podemos deducir a través de este estudio que la sedación (anestesia y/o similar) mejoro la calidad de la endoscopia. El tiempo horario al comienzo de la jornada marca que el cansancio del operador es un factor muy importante, como la capacitación del mismo que lo remarca el estudio. Con respecto al operador como dije anteriormente en parámetros de importancia en la calidad de la colonoscopia hay numerosos artículos en el mundo que se refieren a que el práctico en Colonoscopia debería ser alguien entrenado en la diagnóstica de las Enfermedades Colorrectales. Un artículo que comenta el Dr. Luis Diaz miembro de nuestra Sociedad en Resúmenes seleccionados de la Revista Argentina de Coloproctología del año 2012 50 referido a una encuesta que hizo en EEUU a los miembros de la Sociedad Estadounidense de Cirujanos de Colon y Recto preguntando el sobre la inclusión en sus prácticas de la Colonoscopia a 47 Estados Americanos y 30 Países extranjeros. El 90,5% de los encuestados respondió realizar ellos sus colonoscopias utilizando un cuarto de hora clínica y gastos totales, solo el 28 9,5% derivaba a un clínico sus colonoscopias. El 81 % de los encuestados cree que en la reunión anual de la Sociedad Americana de Cirujanos de Colon y Recto debería incluirse el tema Colonoscopias o dar cursos referidos al tema 51. CAPÍTULO 2 Consentimiento informado y limpieza colónica Antes de la realización de una colonoscopia es necesario obtener consentimiento informado por parte del paciente y preparar el colon, utilizando las pautas de limpieza adecuadas al tipo de exploración (rectoscopia, etc.) y a la situación especial de cada paciente (estreñido crónico, portador de colostomía, sospecha de obstrucción, etc.). En nuestra Unidad de Aparato Digestivo hace años que usamos la proforma de la AAED Asociación Argentina de Endoscopia Digestiva de la cual tuve el honor de participar en los años 90 de su Comisión Directiva. Es aconsejable una dieta líquida con pocos residuos durante las 24 a 48 horas previas, eliminando los preparados que contengan sales de hierro. Para la práctica de una rectosigmoidoscopia puede ser suficiente la aplicación de enemas de limpieza, mientras que para la realización de una colonoscopia completa es necesaria la utilización de preparados orales como laxantes o soluciones evacuantes (sulfatos disódicos y monosódicos, electrólitos o polietilenglicol), asociados o no a enemas. Una adecuada preparación del intestino antes de la colonoscopia es esencial para la correcta visualización de la mucosa del colon durante la colonoscopia. La limpieza inadecuada se ha asociado a una menor tasa de detección de pólipos, aumento de las molestias, el aumento de la atención en salud y el costo del paciente, y un posible aumento en las tasas de complicaciones. 52,53 La preparación intestinal ideal para colonoscopia eficaz y rápida sería vaciar el colon de materia fecal, sin alteración grave o histológica de la mucosa del colon. No deberían causar incomodidad al paciente, y no debería haber cambios en el equilibrio de líquidos y electrolitos, además debe ser de bajo costo. Desafortunadamente, ningún 29 agente de preparación intestinal hoy cumple con todos estos requisitos, y la preparación del intestino sigue siendo uno de los elementos disuasorios más frecuentemente citados para la disposición del paciente a someterse a una colonoscopia. Innumerables trabajos se han presentado en el mundo entero asociando productos como el Fosfato de Sodio y el Polietilenglicol, asociados o no con enemas evacuantes una o dos horas antes del estudio. Lo cierto es que en la Rep. Argentina los métodos de lavado intestinal obteniendo una buena visión y limpieza colónica usando las Escala de Boston u otras escalas como la de Otawa, requieren dos días de dieta sin residuos, donde especificamos no granos, no semillas, no medicamentos con colorantes en lo posible. El uso del Polietilenglicol; hay Servicios que usan los 4 litros del preparado, pero por lo general la calidad de la preparación es igual con dos litros. Muchos trabajos de calidad de las colonoscopias lo asocian con Gatorade®, 54 poniendo especial cuidado en la deshidratación probable del paciente y todos los inconvenientes que pueden suceder ante una brusca hipotensión o deshidratación. Escala de Boston 55,56,57 Los tres segmentos del colon (Izquierdo incluido Recto, Transverso y Colon Derecho) son calificados de acuerdo a la calidad de la limpieza obtenida. A cada Segmento se le asigna una puntuación de va de cero (0) a tres (3): 0 Puntos: Segmento del colon mal preparado donde la visualización de la superficie mucosa es imposible, presencia de restos sólidos y líquidos. No puede realizarse la Videocolonoscopia. 1 Punto: Hay sectores del Colon que no pueden ser evaluados debido a la presencia de restos sólidos o líquidos, y debe aclararse en el informe que estos sectores no fueron vistos con claridad. 2 Puntos: Escaso contenido líquido solamente que puede aspirarse o lavarse intraluminalmente, que luego de estas maniobras puede evaluarse correctamente. 3 Puntos: Excelente preparación y muy buena visualización. Sería la preparación ideal y correcta. La suma de los puntos asignados a cada sector del colon incluido el Recto da por resultado una numeración estimativa de la calidad de la preparación. Si la suma es 30 mayor (>) o igual a 5 es satisfactoria. Si esta es menor a 5 (<) la preparación no ha sido satisfactoria. Las mayores preocupaciones surgieron que el paciente podría desarrollar una insuficiencia renal a partir del uso de una solución oral de Fosfato de Sodio en pacientes sin antecedentes de enfermedad renal o contraindicación reconocida para el uso de estos Fosfatos. Esto sucedió después de un estudio de Markowitz y colaboradores58 en donde identificaron 31 casos de nefrocalcinosis entre 7349 muestras de biopsias de Riñón procesadas durante el año 2000 al 2004. De estos pacientes, 21 presentaron insuficiencia renal aguda teniendo como antecedente una Colonoscopia reciente, habiendo sido preparados con Fosfato de Sodio oral. La Creatinina basal media fue de 1,0 mg/dl antes de la Colonoscopia. En el seguimiento, 4 pacientes requirieron hemodiálisis permanente, y los 17 restantes desarrollaron una insuficiencia renal crónica (media de creatinina sérica, 2,4 mg/dL). Los autores sugieren que factores etiológicos potencian estas complicaciones, como la hidratación inadecuada durante la preparación del colon, el aumento de la edad del paciente, antecedentes de hipertensión, y el uso concomitante de un inhibidor de la enzima convertidora de la angiotensina o un bloqueador del receptor de angiotensina. Independientemente del método utilizado como laxantes, se debe tener en cuenta que los pacientes deben tomar por lo menos catorce vasos grandes de agua o bebidas claras durante el día antes de la colonoscopia para prevenir la deshidratación. No es infrecuente que los pacientes reporten una disconformidad para tolerar la preparación de limpieza de colon, a menudo secundaria al sabor desagradable y un gran volumen de la preparación. Muchos pacientes informan que las náuseas y los vómitos, o calambres y distensión abdominal hicieron suspender la preparación, por lo que este inconveniente deberá ser superado con el desarrollo de nuevos productos. El autor recomienda con frecuencia la colocación de la preparaciones de polietilenglicol (PEG) en el refrigerador 1 día antes de su uso o el agregado de paquetes de sabor sin azúcar (por ejemplo, Crystal Light) en un esfuerzo para mejorar el sabor de la solución de PEG. 31 Tanto es la preocupación de los Endoscopistas a nivel mundial por la limpieza del colon, que se encuentran con la dualidad que las mejores preparaciones son las que más molestaron al paciente que a veces no quiere repetirse el estudio. En aras de darle mayor comodidad al paciente y de ello el confort en la preparación para la colonoscopia algunos autores han desarrollado hasta tecnológicamente algo que ayude. En la DDW (Semana de Enfermedades Digestivas de los EEUU) del 2013 en Boston, los Dres. Bergreen, Kavathia y Friedman presentan una nueva aplicación para teléfonos inteligentes que puede ayudar a asegurar que los pacientes tengan una buena preparación del intestino antes de la colonoscopia, según los médicos de Arizona Salud Digestiva, quien desarrolló la aplicación. 59 La aplicación médico-diseñado, el primero de su tipo, cuenta con instrucciones y alertas programadas para ayudar a los pacientes seguir su protocolo de preparación del intestino. "Sabemos que mejores preparaciones intestinales resultan en mejores exámenes de colonoscopia, y la aplicación de teléfono inteligente es el aprovechamiento de la tecnología para un mejor resultado de salud", Paul Berggreen, MD, presidente de Arizona Salud Digestiva en Phoenix, dijo a los periodistas que asisten a una conferencia de prensa aquí en la Digestive Disease Week (DDW) 2013. "Prepararse para una colonoscopia es difícil e implica un montón de pasos", agregó el codesarrollador Nilay Kavathia, MD, un compañero de gastroenterología en el Hospital de la Administración de Veteranos de Phoenix. "Para los pacientes, con una aplicación interactiva, simplificada, y personalizada en sus teléfonos, es como tener un médico a su lado durante todo el proceso." Los pacientes entran en la fecha y hora de su colonoscopia y con la medicación y preparación intestinal elegido por su médico. En el teléfono aparecen alertas programados a continuación para recordar al paciente el siguiente paso en la preparación del intestino. La aplicación también explica el procedimiento, da consejos, y proporciona imágenes de calidad de la preparación. "No hay capacidad de adaptación en términos de las 4 preparaciones intestinales que utilizamos", explicó el Dr. Berggreen. "También dice que el programa advierte de evitar los frutos secos, palomitas de maíz y similares 3 días de antelación. 32 Es la misma información que los pacientes recibirían en forma escrita. “El uso de una aplicación de teléfono inteligente es un enfoque ingenioso. Dr. Berggreen y su equipo evaluaron la utilidad de la aplicación en 2 fases. En la primera fase, antes de su lanzamiento, se preguntó a los pacientes si ellos poseían un teléfono inteligente y si eran propensos a utilizar la aplicación. El endoscopista, que desconocía sus respuestas, anotó la calidad de la preparación con la Escala Boston para preparación Intestinal. En la primera fase, el 49% de los 326 pacientes dijo que poseían un teléfono inteligente. No hubo diferencia significativa en la puntuación media de Boston preparación intestinal entre los pacientes con un Smartphone y los que no (6,92 vs 6,76; P= 0,414). En la segunda fase del estudio, los pacientes recibieron instrucciones sobre cómo descargar la aplicación gratuita. En el momento de la colonoscopia, se les preguntó si utilizaban la aplicación y si estaban satisfechos con él. Una vez más, el endoscopista fue cegado a las respuestas y anotó la preparación del intestino mediante la escala de Boston para preparación intestinal. Esta puntuación ha mejorado significativamente de la puntuación de 6.9 vimos antes de la publicación de la aplicación, Dr. Berggreen señaló. Tabla. Valor de Smartphone App para preparación intestinal Mida App Usado Valor P App No se utiliza Puntuación Boston Preparación Intestinal (0-9) 8,1 6,5 <0,001 Buena preparación del intestino (BBPS> 7) 84% 62% <0,001 "Llegamos a la conclusión de que la aplicación hizo hacer una diferencia significativa en la calidad de preparación intestinal, y que la diferencia no pudo ser explicada por el hecho de que algunas personas son tecnológicamente más habituadas o pueden seguir instrucciones mejor", dijo el Dr. Berggreen. "Esto tiene implicancias bastante grandes. Estamos utilizando la aplicación para mejorar preparaciones intestinales y las tasas de detección de pólipos. Pero alentados por estos resultados, 33 estamos trabajando en una actualización para dar a la aplicación aún más funcionalidad." En la Digestive Disease Week (DDW) 2013, el presidente del consejo, Lawrence Friedman, quien es catedrático de medicina de Newton-Wellesley Hospital de Massachusetts, dijo que una de las barreras para la detección del cáncer colorrectal exitosa es la preparación intestinal inadecuada. "Tenemos datos que muestran que cuanto mejor sea la calidad de la preparación, mejor será la calidad de la colonoscopia y la más confiable de los resultados en la detección y el tratamiento de pólipos y adenomas," dijo. "Todo el mundo sabe que la peor parte de la colonoscopia es tomar la preparación, así que cualquier cosa que anima a los pacientes a completarlo y quizás disfrutar haciendo más de lo que generalmente haría es bienvenida. El uso de una aplicación de teléfono inteligente es un enfoque ingenioso, y creo que mejorará la calidad de la detección ", explicó el Dr. Friedman. Un limpiador de colon de bajo volumen es el óxido de Picosulfato sódico/magnesio/ácido cítrico anhidro (Prepopik® para los EEUU) (Dulcolax® gotas); Rapilax; Trali; Verilax en Argentina, Picoprep de Lab. Ferring) que fue aprobado recientemente por la FDA en julio de 2012. La administración oral se administra en dosis de 5 sobres de 5 onzas. La primera dosis se administra en la noche antes de la colonoscopia seguido de 8 vasos grandes de líquidos claros. La segunda dosis se toma al día siguiente algunas horas antes del procedimiento (6 horas), seguido de tres (3) vasos grandes de líquidos claros. La actividad laxante estimulante de picosulfato de sodio junto con la actividad laxante osmótico de citrato de magnesio (formado a partir de óxido de magnesio y los componentes de ácido cítrico después de la mezcla con agua) produce un efecto purgante, que cuando se ingiere con fluidos adicionales, produce diarrea acuosa. La aprobación se basó en datos de 2 estudios pivotantes de fase III que comparan Prepopik a 2L PEG + E plus + 2 tabletas de bisacodilo de 5 mg. En ambos estudios, Prepopik (Picosulfato) consigue la limpieza de colon con éxito sobre la base de la escala de Aronchick, lo que demuestra que no es inferior al comparador [Estudio 1: 84.2% v 74.4%; Estudio 2: 83.0% v 79.7%]. Además, Prepopik demostró superioridad estadística en la limpieza del colon en comparación con la preparación de control. 60,61 34 Miralax (Polyethylene Glycol 3350) con Gatorade es un régimen de preparación intestinal de bajo volumen que se ha utilizado ampliamente en la práctica comunitaria y los pacientes comunican que es mejor tolerada que GoLYTELY (Polietilenglicol). Un estudio de 2012 demostró que la sólida preparación intestinal con Miralax con Gatorade es tan eficaz como el uso de GoLYTELY, y que la dosificación dividida es más eficaz que una dosis única. Miralax es mejor tolerado y mejoró la experiencia del paciente. Como preparación del intestino es anecdóticamente la peor parte de una limpieza en la colonoscopia, lo que equivale a una preparación más fácil puede conducir a un mejor cumplimiento de preparación en el futuro.62 El Visicol (sodium biphosphate and sodium phosphate (oral) (para Argentina, Fosfo Dom (Lab. Dominguez) Gadolax (Lab. Gador) Denverlax (Lab. Denver) /Colonil (Lab. Europharma) / Fosfacol (Lab. Sanitas) / Dicofan (Lab. Rivero) es relativamente una nueva preparación diseñada para limpiar el colon antes de la colonoscopia. En un estudio realizado por Aronchick y cols 63, esta forma de tabletas de fosfato de sodio fue tan efectiva y segura como las preparaciones acuosas existentes. Sin embargo, como con Fosfosoda, Visicol contiene una alta carga de fosfato que puede no ser seguro para pacientes con riñón, corazón, hígado, o ciertas enfermedades intestinales. Unas de las Revisiones más destacadas en la Literatura es la publicada en el Alimentary Pharmacology & Therapeuties del 2007, por dos grupos muy importantes de Inglaterra y Francia 64. Los grupos de estos dos Hospitales, el Royal Free Hospital, Hampstead, de Londres y el Servicio de Maladies de L’Apparel Digestif del Centro Hospitalario regional de la Universidad de Rennes Francia, identificaron ochenta y ocho (88) estudios a través de Medline, Embase, Cinnahl y Cohrane Central databases publicados antes de enero del 2006. El Polietilenglicol y el Fosfato Sódico fueron las preparaciones más frecuentemente investigadas. En el análisis comparativo de ambos en lo referente a alta calidad de preparación, medida con dos o tres métodos, comparando eficacia y tolerabilidad, no hubieron significativas diferencias entre ambas preparaciones, considerando que los fosfatos sódicos fueron mejor tolerados. Informan que el Picosulfato/Citrato de Magnesio que se investigó en 4(cuatro) estudios, es la indicación más frecuente, pero que no hubieron datos a favor que esta medicación sea claramente más efectiva que las otras. Pero que si se publican complicaciones 35 clínicamente significantes referidas a los disturbios electrolíticos, con los Fosfatos Sódicos. Comentario final del Autor La realidad de hoy en todos los Servicios de Endoscopia del mundo es que hay una alta proporción de pacientes que no llegan con una preparación adecuada al estudio colónico. Las preparaciones pre Colonoscopia pueden ser clasificados en tres grupos: 1) Los laxativos Osmóticos serían los más comunes, algunas preparaciones incluyen agentes como el Fosfato de Sodio (NaP) el Citrato de magnesio y el Manitol. Estos productos incrementan el contenido de agua en el colon atrayendo líquido extracelular a través de la pared del colon y manteniendo los fluidos orales que son ingeridos, en la luz del colon. 2) El Polietilenglicol (PEG) (para Argentina; Barex sol. y Barex Kit (Lab. Dominguez) Nulytely (Lab. Raffo) Adital (Lab. Gobbi Novag) es similar a los laxativos osmóticos pero trabaja de manera diferente. Este posee moléculas de mayor tamaño no absorbibles. Este Polímero macrólido es administrado como una solución diluida de electrolitos. Como resultado de este efecto del polímero, la solución electrolítica se mantiene dentro del colon donde ejerce su efecto de limpieza. Solo una pequeña cantidad de líquidos es extraída a través de la mucosa colónica limitando así el potencial desequilibrio electrolítico sistémico. Estos macrólidos se comercializan en el mundo entero en diferentes tamaños moleculares (de 3550 a 4000 Da) 3) Este grupo de productos de limpieza intestinal está formado por laxativos como el Sen, Picosulfato de Sodio y el Bisacodilo cuya acción principal es incrementar la actividad muscular de la pared del colon. La elección de la preparación actualmente no parece reflejar una evidencia clara referida a la Calidad de la limpieza evaluados con todos las escalas de limpieza existentes, sino que la preocupación de todos los Endoscopistas del mundo está puesta 36 en las complicaciones que en mayor o menor escala estas producen. Ya hay demasiada evidencia de que existen severas complicaciones de acuerdo a la edad del paciente, si bien con casi nula mortalidad pero si con franca “Morbilidad”. Por ejemplo y referido a la elección por los Servicios de Endoscopia del método, lo refleja un Trabajo realizado en el Reino Unido y publicado en un GUT del 2004 por un grupo de 68 Hospitales de toda Inglaterra 65. La asociación más usada para ellos fue el Picosulfato de Sodio, más el Citrato de Magnesio (36,8%) el Polietilenglicol mas el aporte de bebidas con Electrolitos (20,6%) y con Sulfato de Sodio (15,6%). Si bien presentan estos Hospitales de UK, como asociación más usada el Picosulfato de Sodio más el Citrato de Magnesio, esta preparación la consideran como no satisfactoria. El uso del Polietilenglicol no mejora esta preparación y no encuentran diferencias de calidad. En general y en realidad estos protocolos no demuestran que exista una garantía clara de un colon bien limpio en el momento de la visión endoluminal de la colonoscopia. Muchos estudios en la actualidad presentan y evalúan el impacto de la preparación previa a la colonoscopia con el hallazgo de pequeñas Neoplasias. 66 En un análisis retrospectivo de 93.000 Colonoscopias la detección de pequeños Pólipos (<10mm) está significativamente asociada a la calidad de la preparación. En otro estudio Multinacional y observacional en 5832 pacientes67 la detección de los Pólipos y su tamaño depende de la Calidad de la Preparación. En nuestra Unidad de Aparato Digestivo Baistrocchi, después de varios años de preparación tanto sea para la Colonofibroscopia y luego de los 90 para la Videocolonoscopia, cursamos con las preparaciones primero con dietas y laxativos estimulantes de la peristalsis colónica, hasta la aparición de los Fosfatos Sódicos en que mejoraron ostensiblemente la limpieza. Luego la aparición del Polietilenglicol que nos sirvió como comparativo a los Fosfatos sin tener una clara diferencia en lo referido a limpieza. Con la aparición en la Bibliografía mundial después del 2000, sobre todo el de Markowitz ya citado, de los desequilibrios hidroelectrolíticos y sus consecuencias en pacientes que superan los 70 años, en realidad el trabajo previene a todas las edades, en nuestra Unidad establecimos como regla para todos los endoscopistas y con esto un trabajo de Secretaria, que a los mayores de 70 años como normativa los prepararíamos con Polietilenglicol y a los menores de esta edad con Sulfatos Sódicos. 37 No hemos tenido diferencias en la calidad de la preparación y usando como parámetro la escala de Boston, ni hemos tenido mayores complicaciones en los dos días previos al estudio que se acompaña de dietas libres de residuos, pero no de laxativos, no los usamos en ninguna de las dos preparaciones. Coincidiendo con la bibliografía Internacional no hemos podido superar el disconfort provocado por estos factores de limpieza colónica en el paciente, lo que hace en algunas oportunidades que el paciente no quiera repetirse el estudio que debe hacerse como screening en familias de alto riesgo o como control de sus Pólipos. En estas preparaciones hemos notado que una cuidadosa explicación por parte de Secretaria o el propio Profesional es fundamentalmente importante. El paciente debe entender que una mala preparación induce al endoscopistas a cometer errores muy grandes o debe repetir esta preparación y volver nuevamente. Nuestras preparaciones se dividen en pacientes menores y mayores de 70 años para tratar de respetar todo lo antedicho. Son estas con estas advertencias: 38 39 40 41 42 43 CAPÍTULO 3 Sedación y analgesia/anestesia La utilización sistemática de premedicación durante la colonoscopia es un tema controvertido. Dado que, en ocasiones, es una exploración molesta y dolorosa, se debería ofertar la posibilidad de recibir sedación o analgesia a todos los pacientes, sin embargo esto está limitado, en parte, por la falta de los medios adecuados para su realización: anestesistas, sala de recuperación, etc. Por otro lado, estos fármacos, habitualmente benzodiacepinas de acción corta como el diazepán o el midazolam asociados o no a analgésicos opiáceos, tienen efectos secundarios potencialmente graves que limitan su uso, sobre todo, en pacientes ancianos con patología respiratoria o cardíaca grave: la mortalidad relacionada con la sedación es de un 0,3% con complicaciones cardiorrespiratorias graves en un 5,4 por cada 1.000 endoscopias, respectivamente. Algunos estudios han demostrado que el uso rutinario de sedación/anestesia en la Colonoscopia no parecería ser necesario, debido a que en grandes trabajos randomizados y comparativos, como el realizado en numerosos Centros de Endoscopia de Austria; Quality Assurance Working Group of the Austrian Society for Gastroenterology and Hepatology, Vienna, Austria; Division of Gastroenterology and Hepatology, Department of Internal Medicine III, Medical University of Vienna, Vienna, Austria; Center for Medical Statistics, Informatics and Intelligent Systems, Medical University of Vienna, Vienna, Austria; Department of Internal Medicine, Krankenhaus der Barmherzigen Schwestern, Ried/Innkreis, Austria; Department of Internal Medicine I, Klinikum Wels, Wels, Austria, no encuentran diferencias significativas entre varios parámetros comparados, entre sedación y no sedación. Ellos analizan 52.506 colonoscopias por screening llevada a cabo por 196 Endoscopistas entre Noviembre del 2007 a Abril del 2011 dentro del “Quality management for colon cancer prevention program”. Este trabajo muy bien llevado por estos grupos comparan la llegada al ciego (CIR) (Cecal Intubations Rates), la detección de Pólipos (ADR)(Adenoma Detection Rate), (PDR) (Polip Detection Rate) comparan tiempos de intubación y salida, 44 comparan distintos operadores como Endoscopistas, Clínicos y Cirujanos, hacen un análisis estadístico entre pacientes hombres y mujeres, comparan la influencia del Endoscopista muy entrenado con el entrenado básico después de su formación básica (Residencia) sin encontrar variables entre ellos, con y sin sedación, comparan colonoscopias incompletas y dan las razones de estas como pobre preparación, estenosis y complicaciones. El dolor como razón para una colonoscopia incompleta no tuvo un valor estadístistico. 68 Demuestran que las variables comparadas como Intubación Cecal, hallazgo de Pólipos o Cáncer no influye ni en el tiempo ni en la calidad. Consideran que el examen puede ser tolerado por el paciente produciendo un mínimo de incomodidad. Sin embargo, algunos investigadores han propuesto que con sedación la tasa de intubación a Ciego y la detección de Pólipos pueden disminuir si esta no se realiza. 69 En realidad este trabajo presentado por el grupo Austriaco en el 2012, nos deja varios interrogantes a los Servicios de Endoscopia que usamos la sedación/anestesia como practica rutinaria y permanente tanto en endoscopias altas como bajas, como en nuestra Unidad de Aparato Digestivo Baistrocchi (Córdoba – Argentina) desde el año 2000. Ellos realizaron trabajos estadísticos de sensibilización de la prueba usando numerosos datos estadísticos cruzados, que demuestran la seriedad del Trabajo. Las características de los pacientes fueron descriptas por la mediana y 25a-75a percentiles para las variables no normales, y por las frecuencias y porcentajes para las variables categóricas. Utilizaron χ2 o la prueba exacta de Fisher para comparar variables categóricas o continuas, respectivamente. Para ADR y PDR, al menos un adenoma o un pólipo tuvieron que ser detectados por paciente. El principal interés fue describir las posibles diferencias de sexo, sedación, y la edad de los siguientes tres indicadores de calidad: colonoscopia incompleta, detección de adenomas, y la detección de pólipos. Presentaron la estructura de datos en clúster (el mismo endoscopista realiza varias colonoscopias en diferentes pacientes) mediante la aplicación de un modelo condicional, generalizado lineal mixto, con una ordenada al azar para realizar por el endoscopista (SAS: proc GLIMMIX). El efecto de la edad continua se modeló con un polinomio de orden 2. Para todos los tres modelos, se probó para las interacciones de pares. Se encontró una interacción estadísticamente significativa entre el sexo y la 45 edad, incluidos en el modelo para la colonoscopia incompleta. Se muestran las probabilidades predictivas marginales, es decir, se les da la probabilidad predictiva sin efectos en los endoscopistas al azar, para los tres indicadores de calidad. Muestran las probabilidades antedichas con los efectos de los endoscopistas al azar. En un segundo análisis se utilizó un modelo mixto marginal, lineal generalizado y fueron resultados muy similares. Además, se evaluó la influencia de los parámetros-examinador, específico sobre la intubación cecal, detección de adenomas, y la detección de pólipos. Como años de entrenamiento se definen los años de práctica desde que alcanzó el título de especialista y como el volumen de los procedimientos se utilizó el número de colonoscopias realizadas anualmente (cualquier indicación), y como experiencia endoscópica se calculó el número total de las colonoscopias realizadas por la multiplicación de años de entrenamiento y el volumen de procedimientos. Se realizaron diagramas de dispersión y correlación de Spearman que se utilizó para describir la asociación entre la experiencia procesal, ADR, CIR, y PDR. Regresión lineal entre CIR, ADR, o PDR como variables dependientes y la subespecialidad de endoscopistas, años de entrenamiento, y el volumen de procedimientos, se calcularon como variables explicativas. No registraron las asociaciones no lineales e interacciones. Para todas las pruebas de hipótesis, se consideró p <0,05 como estadísticamente significativo y todas las pruebas fueron de dos caras. Todos los cálculos estadísticos se realizaron con SAS System V9.2 (2008, SAS Institute, Cary, NC, EE.UU.). Se realizaron todos los gráficos con el software R (www.r-project.org). Este estudio ha sido aprobado por el Comité de Protección de Datos de Austria. Como el total de hallazgos macroscópicos, que es interesante para compararlo con los hallazgos de nuestros Endoscopistas en Argentina, fueron; sobre 52.596 Colonoscopias recordemos, 31.779 estudios normales donde no se encontró patología alguna (60,52%), número total de pacientes portadores de un pólipo o más, 18342 (34,93%), Cancer de Colon 194 (0,37%), Cáncer de Recto 117 (0,22%), y otros hallazgos no tabulables 2074 (3,95%). Estos resultados del trabajo son los que personalmente les he prestado mucha atención debido a que es una minuciosidad increíble, para un trabajo creíble. En 18.418 (35,38%) pacientes, se encontró al menos un pólipo. PDR fue más frecuente entre los hombres que entre las mujeres (n= 10,705, 41,61% en hombres vs 46 n = 7713, 28,80% en mujeres; p <0,0001). PDR no cambió ni en mujeres ni en hombres, cuando los pacientes se sometieron a una colonoscopia con sedación en comparación con la colonoscopia sin sedación (p = 0,3711). La sedación no tuvo impacto en los números (P = 0.2329) o tamaño (P = 0.5195) de los pólipos detectados. Este resultado, referido a los Pólipos Planos (“Flat lesions”, que presentáramos con el Dr. Manuel Lorenzo en el Congreso Mundial de ISUCRS en el año 2000)70 y la distinción que tuvimos del Grupo Internacional, en la página que promovió ISUCRS, publicada y dirigida por al Dr. Reis Neto, publica nuestro trabajo de Magnificación y Cromoscopía que presentáramos en ese Congreso 71. Abala los años de experiencia que tenemos los Argentinos en Endoscopia que como dijera anteriormente, desde los años 70 crecimos todos juntos en el mundo entero con los mismos aparatos endoscópicos de Fibra de Vidrio primero y de Video después, con similares experiencias. Se encontraron pólipos planos con mayor frecuencia en pacientes sin sedación que en pacientes sedados (P <0,0001). Con respecto a este resultado debo aclarar que se debe a una situación muy especial referida a la mayor o menor insuflación que se realiza en los distintos sectores colónicos. A mayor insuflación estos se pierden en la pared mucosa del colon debido a su tamaño a veces menores de 1 cm, y que con moderada aspiración y ojos entrenados, se detectan con facilidad, sobre todo si se usa Cromoscopía con Índigo Carmín o cromoscopía electrónica ejemplo. Olympus con (NBI) banda estrecha. Influyendo también la importancia del tiempo de retirada que nunca debe ser menor de 6 minutos. La sedación para este grupo no tuvo ninguna influencia sobre la distribución de los pólipos detectados en todo el colon en mujeres (p = 0,4009). En contraste, en los hombres sedados los pólipos en sigma / recto fueron encontrados con más frecuencia que en los hombres no sedados (P = 0,0162). En 10.561 (20,11%) de los exámenes, se encontró al menos un adenoma. La sedación no tuvo influencia en ADR en ambos sexos (p = 0,8676). La tasa de polipectomía fue 96,04% (n = 17.500). A diferencia de los PDR y ADR, la polipectomía se realizó con mayor frecuencia en pacientes con sedación que en pacientes sin sedación (P <0,0001). Incluso para los pólipos rectosigmoideos, que fue la localización más frecuente de la detección de pólipos, las tasas de polipectomía fueron mayores en 47 pacientes sedados que en los pacientes no sedados (97,11% en los pacientes sedados vs 94,14% en los pacientes sedados, P <0,0001). El promedio de intubación Cecal para el grupo Austriaco, fue de un total de 50.203 (95,61%) colonoscopias completas, con un CIR mayor para los hombres (n= 24.847, 96,58%) que en mujeres (n= 25.356, 94,68%; P <0,0001;). La tasa de colonoscopia completa en toda la población aumentó bajo sedación (94,31%, n = 6758 sin sedación a 95,82%, n= 43.445 con sedación; P <0,0001). El uso de sedación aumentó la CIR en pacientes de sexo femenino (de 92,01%, n= 2,292 a 94,96%, n= 23,064; P <0,0001), así como en los pacientes masculinos (de 95,53%, n= 4,466 a 96,81%, n= 20.381; p <0,0001). Esta mejora fue más notable en las mujeres que en los hombres (2,95 vs. 1,28%). Las razones para una colonoscopia incompleta fueron dolor (n= 635, 27,56%, calificada por el endoscopista), preparación deficiente intestinal (n= 467, 20,27%), estenosis (n= 296, 12,85%), complicaciones (n= 55, 2,39%), y otros (n= 851, 36,94%). El dolor como una razón para la colonoscopia incompleta fue con mayor frecuencia en las mujeres que en los hombres (n= 443, 31,13% vs n= 192, 21,82%; P <0,0001). En las colonoscopias realizadas con premedicación, el dolor fue significativamente menor en comparación con las colonoscopias sin premedicación (n= 496, 26,16% frente a n= 139, 34,07%; P= 0,0012). Similares resultados se muestran en los hombres (n= 129, 19,23% vs n= 63, 30,14%; P = 0,0008) y en mujeres (n= 367, 29,98% vs n= 76, 38,19%; P = 0,0204). Las complicaciones de los estudios de videocolonoscopia son relatados comparativamente concluyendo que con sedación o sin sedación no modificaron las variables. En total, se registraron 132 complicaciones clínicamente relevantes (0.25% de todas las colonoscopias). Estas fueron clasificadas como 54 eventos CP (Severe Cardiopulmonary complications) (40,91%), 62 episodios de sangrado (46,97%), 6 perforaciones (4,55%), y otras 10 complicaciones (7,58%). El número de complicaciones fue similar entre hombres y mujeres (n = 59, 0,11% en mujeres vs. n = 73, el 0,14% en los hombres, P = 0,1468), pero la distribución varió (P = 0,0021). De las 59 complicaciones que ocurrieron en mujeres, 34 eran eventos CP (57,63%), 18 episodios fueron sangrado (30,51%), 3 perforaciones (5,08%), y fueron reportadas otras 4 complicaciones menores (6,78%), mientras que en los hombres 73 48 complicaciones incluyen 20 eventos CP (27,40%), 44 casos de hemorragia (60,27%), 3 perforaciones (4,11%), y otras 6 complicaciones (8,22%). Las Severas complicaciones Cardiopulmonares (CP) eran casi dos veces más común en las mujeres en comparación con los hombres (n= 34, 57,63% en mujeres vs. n= 20, 27,40% en hombres, p <0,0001). La presencia de complicaciones fue aproximadamente igual con y sin sedación (n= 11, 0,15% sin sedación vs. n= 121, 0,27% con sedación; P = 0,0749). Las CP ocurrieron raramente; sin embargo, se observaron los números más altos en pacientes sedados en comparación con colonoscopias de pacientes no sedados (n= 52, 42,98% con sedación vs. n= 2, 18,18% sin sedación). Debido a que la muestra es pequeña, esta diferencia no fue estadísticamente significativa (p = 0,1983). Todas las complicaciones CP fueron tratados de forma conservadora o de forma ambulatoria. Nadie tuvo que ser hospitalizado y todos los pacientes se recuperaron completamente. Del mismo modo, la distribución de complicaciones fue independiente de la sedación (P = 0,2922) en toda la población, así como en mujeres (p = 0,3144) y en hombres (P = 1,000). Se evalúan luego los operadores no encontrando una diferencia significativa entre ellos. La tasa media de colonoscopias incompletas por endoscopista fue 2,49% (percentil 25ta-75ta, 0,75-6,35%). Teniendo en cuenta las diferencias entre los endoscopistas, la sedación no tuvo impacto en el CIR (P = 0,1365). Una interacción estadísticamente significativa entre la edad y el sexo no lineal (P = 0,0042) influyó en la tasa de colonoscopias incompletas. Se muestra la probabilidad marginal predictiva, es decir, la probabilidad predictiva sin componente aleatorio de los endoscopistas, en la colonoscopia incompleta. Las mujeres de cualquier edad tuvieron una mayor probabilidad predictiva de colonoscopia incompleta que los hombres. Incluso cuando fueron sedados, las mujeres tenían una mayor probabilidad de una colonoscopia incompleta que los hombres no sedados. La mediana de ADR por endoscopista fue (percentil 25ta-75o, 14,02-26,38%) 19,89%, y PDR mediana por endoscopista fue (percentil 25to-75ta, 23,17-44,81%) 33.49%. Al corregir el impacto del endoscopista, ADR y PDR eran estadísticamente significativa influenciada por la edad y el sexo (todos p <0,0001), pero no por el estado de sedación (p = 0,1292 y 0,0576). Ellos concluyen que: 49 Se recomienda un CIR (promedio de intubación cecal) por encima del 95% para la detección de patologías en las colonoscopias, 72 a causa de que existe un tipo reducido de cáncer a detectar con la colonoscopia en una tasa de finalización que debe ser de ≥95% 73. El programa de cribado de Austria cumple estos criterios según lo revelado por este estudio, con un CIR global de 95,6%. Por otra parte, encontramos una CIR mayor bajo sedación (95,82% vs. 94,31 con sedación% sin sedación), que está muy cerca de estudios anteriores. 74,75,76 Radaelli y cols 77 reportaron una CIR de 76,1% sin sedación y el 84,2% en los procedimientos con sedación, que es mucho menor que en el estudio Austriaco. En un gran estudio retrospectivo en Alemania de más de 230.000 colonoscopias, la premedicación sedante /analgésica reduce a la mitad el riesgo de insuficiencia 78. Otros factores de riesgo sugeridos para una colonoscopia incompleta son la edad y la preparación intestinal. Aunque existe un amplio consenso en que la mala limpieza intestinal se asocia con menor CIR debido a la dificultad de procedimiento. 79,80,81 Hay algunas controversias con respecto a la influencia de la edad sobre CIR. Crispin y cols77 encontraron una relación conformada entre la edad y el riesgo de insuficiencia, con un riesgo mínimo a la edad de 41 años. Esto está en línea con los resultados del trabajo Austriaco con la misma incidencia en la probabilidad de la colonoscopia incompleta, donde los hombres tienen el riesgo más bajo de manera similar en unos 40 años, y las mujeres en alrededor de 55 a 60 años. En resumen, el trabajo Austriaco nos muestra que la ADR y PDR, indicadores importantes para el rendimiento técnico de las colonoscopias de cribado, se ven afectados por la sedación. Además, ADR y PDR no están influenciados por los parámetros del examinador específico, incluyendo la sub-especialidad, años de entrenamiento, el volumen de procedimientos, y la experiencia en procedimientos colonoscópicos. Las mujeres se someten a una colonoscopia de cribado más a menudo con premedicación. Con la sedación, el ciego se alcanza con mayor frecuencia que sin sedación. En las mujeres, el CIR es inferior al de los hombres, que puede ser causado por diferentes predisposiciones anatómicas (¿?). Incluso bajo sedación, el CIR de las mujeres no es más alto que el CIR de los hombres sin sedación. ParámetrosExaminador específico como subespecialidad, años de entrenamiento, o el volumen de 50 procedimientos, no influyeron en el CIR de la población. Las complicaciones son raras y no aumentan con sedación, aunque las complicaciones CP (Cardiopulmonares) son más comunes entre las mujeres. Sin embargo el riesgo-beneficio promedio con sedación es bien discutido. Esta es muy comúnmente usada por muchos grupos de endoscopistas en todo el mundo en todas estas décadas pasadas. Es cierto que la sedación reduce el disconfort y el dolor de los pacientes, y le da al operador mayor tranquilidad.82 Como existe otro trabajo que muestra también que la sedación no incrementa el riesgo de complicaciones Respiratorias ni Cardiopulmonares 83. Hay recientes trabajos Italianos que demuestran que con anestesia/sedación existe una alta probabilidad de arribar al Ciego que sin sedación.84 Este análisis esta realizado en base 12.825 colonoscopias que muestran un CIR (Cecal detection rates) de 76,1% en pacientes sin sedación versus un 84,2% de arribos con sedación. Otros estudios proveen un alto promedio de arribo a Ciego con sedación que van del 93,3 % al 100%. 85,86 Las drogas más usadas en todos los trabajos revisados en todos los servicios del mundo incluidos los Argentinos, utilizados como premedicación en la Colonoscopia ya sea solo o con un narcótico, son el Midazolam (2-5 mg) y Diazepan (5-10 mg), con más frecuencia suelen usarse la Meperidina (25.100 mg). La combinación de Benzodiacepinas y Narcóticos puede lograr sedación sin problemas, pero está asociada con un mayor riesgo de depresión respiratoria. En estos últimos años el uso del Propofol que es un sedante intravenoso de acción corta, se ha convertido en la droga más común de uso para las Colonoscopias en todo el mundo 87. Aclara el Autor que el paciente debe ser Monitorizado durante todo el procedimiento. El Dr. Luis Gabriel Alfaro Fattell de la Universidad de México en el Texto de Procedimientos Endoscópicos en Gastroenterología de Córdoba y De la Torre 88 dice que la Sociedad Americana de Anestesiología da lineamientos muy claros de los parámetros a controlar en este tipo de anestesias : ventilación Pulmonar, oxigenación y control hemodinámico. Esta Sociedad Americana de Anestesiología ha sugerido emplear el término de sedación-analgesia, este describe mejor el estado de depresión de la conciencia, 51 inducido por drogas y permite tolerar procedimientos de diagnóstico y terapéutica de una forma más placentera, respondiendo a veces a un estímulo verbal. La analgesia se define como la disminución en la respuesta al estímulo doloroso o a estímulos nociceptivos inducido por medicamentos del tipo de los opioides. Los analgésicos sin usados en bajas dosis para disminuir la respuesta dolorosa sin afectación del estado de conciencia, en dosis altas, ocasionan depresión respiratoria e inducen sedación, disminución de los reflejos, y en ocasiones apnea87. En Nuestro País el Dr. Fabio Leiro y Colaboradores presentan un exhaustivo Trabajo en la Revista Argentina de Coloproctología 89 referido a la Experiencia Inicial en estudios de Videocolonoscopia en un Servicio de Cirugía General y Médicos en formación, del Hospital J.M. Penna de Buenos Aires, considerando que La videocolonoscopia con sedación (VCC c/ sed.) es considerado el Patrón Oro o Gold Estándar para el diagnóstico y terapéutica de las enfermedades del colon. Para su adecuada realización requiere, de un equipamiento completo y profesionales entrenados. Como todo método es recomendable que cada grupo lleve adelante una auditoría de sus propios resultados a través del análisis del rédito diagnóstico y terapéutico, considerando determinadas variables relacionadas con el paciente. En nuestra Unidad de Aparato Digestivo Baistrocchi dese el año 2000 hasta le fecha, realizamos sedación/anestesia a todos nuestros pacientes y comparando todos los estudios realizados dese el año 1973 pese a que los aparatos eran de distinta calidad de resolución, y maniobrabilidad como son los Colonofibroscopios y los Videocolonoendoscopios de primera generación, tuvimos una sensible diferencia con el arribo a Ciego (CIR) y con la detección de Pólipos (PDR), sin contar que en los procedimientos terapéuticos como polipectomías, dilatación de estricturas, colocación de endoprótesis y solución de complicaciones intraprocedimiento como hemorragias, nos sentimos más cómodos y se trabajó con mayor tranquilidad por parte del endoscopista con sedación/anestesia que sin sedación /anestesia o con solo sedación. Los números variaron para unas 10.000 Videocolonoscopías solo con sedación un promedio de arribo a Ciego de 87%, comparado en 15.500 Videocolonoscopías con sedación/anestesia de 92%. En realidad para la sedación en la Colonoscopia se han probado varios medicamentos con el objetivo de relajar al colon y provocar al paciente una sedación 52 para evitar el dolor que provoca la distención del colon a la insuflación controlada del aparato. Muchos Endoscopistas sobre todo en el ámbito privado usaron antiespasmódicos endovenosos con alguna benzodiacepina con la simple ayuda de algún paramédico. Esta experiencia tuvo sus riesgos y con el advenimiento de nuevas drogas anestésicas más inocuas y con menor índice de complicaciones (Fentanilo, Propofol) acompañado de depresores del Sistema Nerviosos central (Diazepan, Bromazepan, Midazolam) se necesitó de Anestesistas diplomados que comenzaron a tener mayor experiencia en endoscopias. Hubo autores que presentaron trabajos con el uso del Óxido Nitroso para la sedación en Colonoscopia. El grupo de la Universidad de Oslo, Noruega, presenta un trabajo a doble ciego, aleatorizado, controlado con placebo. 90 Este estudio incluyó los pacientes sometidos a colonoscopia electiva. Se reclutaron 199 pacientes. Se aleatorizaron 97 pacientes en el grupo de Óxido Nitroso y 102 para el grupo control. El dolor fue clasificado de 1 (sin dolor) a 4 (dolor intenso). El Óxido Nitroso fue suministrado en forma de gas inhalante en forma intermitente y no de forma continua (a demanda). La mediana del dolor informado por los pacientes fue de 2 tanto para el grupo al que se le administro Óxido Nitroso como en el grupo control (rango intercuartilo 2-3 en ambos grupos). No se observaron efectos adversos para el Óxido Nitroso. Concluyen los Autores, el Óxido Nitroso no es un sustituto eficaz a la administración de sedantes y analgésicos intravenosos en la Colonoscopia sin sedación. Sucede que una revisión de Cochrane publicada en Agosto del 2010 91 concluía que el Óxido Nitroso era más eficiente y seguro que los diversos métodos utilizados para aliviar el dolor durante la Colonoscopia. Como comenta el Dr. Díaz la muestra de Cochrane es muy superior en número muestral que el trabajo de Oslo, quedaría planteada la duda si la muestra es lo suficientemente grande como para objetivar una diferencia entre los grupos evaluados. Otros Autores en la actualidad comparan y evalúan la acción analgésica y satisfacción por parte de los pacientes a dos combinaciones suministradas durante el estudio Colonoscópico. El grupo Khajavi y cols 92 en la Revista Anesth. Pain Med del 2013, comparan la efectividad y satisfacción del paciente con la combinación Ketamina/Propofol comparada con Fentanilo/Propofol. Un grupo de 60 pacientes que dividen en partes iguales para La administración de ambas combinaciones de Drogas. 53 El grupo de Fentanilo/Propofol recibió un bolo de 1 µg/kg de Fentanilo y 0,5 mg/kg de Propofol, y el grupo Ketamina/Propofol, recibió un bolo de 0,5 mg/kg de Ketamina y 0,5 mg/kg de Propofol. Como objetivo principal del estudio se evaluó la satisfacción del paciente en la recuperación mediante el uso de un sistema de calificación de cinco niveles Likert. Los parámetros de presión parcial de O 2 , frecuencia cardiaca, presión arterial sistólica, presión arterial diastólica, y los efectos secundarios tales como vómitos, nauseas, reacciones psicológicas durante el periodo de recuperación fueron objetivos secundarios. El nivel de sedación durante la colonoscopia se evaluó con la escala de Alerta/Sedación (OAA/S) del observador. Resultados: La media de puntuación de satisfacción en el grupo Propofol Ketamina fue significativamente mejor que en el grupo Propofol Fentanilo, mientras que el nivel de sedación durante el procedimiento fue similar. Los parámetros hemodinámicos y los valores de SpO 2 no fueron significativamente diferentes. Y la incidencia de náuseas y vómitos fueron los mismos en ambos grupos. Concluyen los Autores que la inyección en bolo de Propofol/Ketamina puede conducir a la satisfacción de los pacientes más que otros protocolos anestésicos durante la colonoscopía. Nuestros anestesistas de la Unidad de Aparato Digestivo Baistrocchi realizaron un trabajo comparativo de Fentanilo/Propofol versus Lidocaína/Propofol para el manejo anestésico de pacientes a quienes se le realiza videoendoscopia digestiva baja, este Trabajo fue publicado en la Revista Argentina de Anestesiología 93 y presentado también en el 37 Congreso Argentino de Anestesiología, Buenos Aires, agosto del 2008, Volumen 66, No 3 (Suplemento Congreso) Presentación oral. Aclaran los Autores que la realización de este estudio bajo cuidado anestésico, por parte de un médico anestesiólogo le brinda mayor seguridad al paciente y medico endoscopista, como así también reduce al mínimo el disconfort que dicho estudio puede provocar a la persona que se va a someter al procedimiento. La técnica de anestesia general endovenosa (comúnmente llamada neuroleptoanestesia) bajo estricto monitoreo cardiorrespiratorio es la más utilizada en el mundo, quedando demostrado su eficacia y seguridad. Dentro de las opciones farmacológicas actuales, el propofol se transformó en el gold Standard, debido a sus propiedades farmacocinéticas y farmacodinámicas. Entre ellas mencionaremos, inducción suave, vida media corta, estabilidad 54 hemodinámica a dosis subanestésicas, emergencia suave y sin resaca, lo que la convierte en la droga ideal para procedimientos cortos y ambulatorios. Cabe aclarar que dicha droga carece de propiedades analgésicas. Siguiendo los preceptos de anestesia balanceada o equilibrada, la cual afirma que la asociación de determinadas drogas tiene efecto sinérgico lo cual redunda en incrementos en su eficacia y reducciones de sus efectos adversos al reducir la dosis individual de cada uno de los fármacos, es lógico deducir que agregando medicación analgésica al propofol se lograra los efectos antes mencionados. Dos de estos son los actualmente más utilizados, la lidocaína, anestésico local del tipo amida, de probado efecto analgésico administrado parenteralmente con algunas ventajas como por ejemplo no tener efecto sedativo manifiesto, y gran estabilidad cardiovascular. Y el fentanilo, agonista opiode µ, 100 veces más potente que la morfina, con efecto sedativo y depresor cardiorrespiratorio dosis-dependiente, con marcado bloqueo neurovegetativo de las manifestaciones del dolor. Objetivos: 1. comparar la eficacia analgésica y de la combinación fentanilopropofol vs lidocaína- propofol. 2. comparar la estabilidad hemodinámica y grado de depresión respiratoria de ambas combinaciones. 3. Valorar con que combinación de drogas se logró mayor porcentaje de exploración del colon derecho.(CIR) 4. Analizar la dosis total de propofol utilizada, en cada grupo. 5. Valorar el grado de comodidad de trabajo del médico endoscopista, en ambos grupos. 6. Valorar el nivel de confort del paciente. 7. Analizar le recuperación del paciente a los 5 y 40 minutos. Material y método: Población: Se estudiaran 100 pacientes ASA I y II a quienes se le realizara videocolonoscopia en el periodo comprendido entre el 1 de abril y el 15 de julio del 55 2008 en nuestro instituto. 50 pertenecientes al grupo A (fentanilo-propofol) y 50 pertenecientes al grupo B (lidocaína-propofol). Estudio prospectivo, randomizado a simple ciego. Criterios de inclusión: • Pacientes de ambos sexos entre 25 y 75 años de edad. • Clasificación ASA I, II. • < 120kg de peso • Estudios de duración de menos de 40 minutos. Criterios de exclusión: • Pacientes menores de 25 años y mayores de 75 años. • Aquellos portadores de enfermedad psiquiátrica con diagnóstico preciso en tratamiento con benzodiacepinas y antidepresivos. • Pacientes de más de 120kg. • Estudios de duración mayor a 40` de estudio per se. • Pacientes con enfermedades crónicas descompensadas en el momento del estudio. • Pacientes con antecedentes de recuperación lentas en otras anestesias. Metodología: Los pacientes llegaban al momento del estudio con la correspondiente preparación de su colon, ayuno total de 6 horas y con estudios prequirúrgicos (ECG y pruebas de laboratorio). El paciente asiste al centro en donde se realiza el estudio siempre acompañado de familiar o amigo. Se le explica al paciente en que consiste el acto anestésico y se procede a firmar el consentimiento informado. Una vez en la sala de endoscopía, previo control de signos vitales se accede a una vena periférica del miembro superior con aguja de venoclisis # 21, sin conexión alguna a fisiológico (salvo situaciones especiales). Se le coloca el sensor de oximetría de pulso, cardioscopio, y se le coloca el tensiómetro. Luego al paciente se le coloca mascarilla con oxígeno al 100% 56 a 5 litros por minuto. 5 minutos previo a iniciarse el estudio, se inyectará, 1 µg/kg de fentanilo en el grupo A y 30`` previa a la inserción del colonoscopio se seguirá con propofol (1 mg/kg) la anestesia y en el grupo B se utilizará 0.5 mg/kg Lidocaína al 2% mas propofol (en igual dosis) antes de la colocación del colonoscopio. En caso de disconfort del paciente se inyectará entre 50 mg de propofol en bolo (SOS). Evaluación: Se dejara constancia en la foja el motivo por el cual se realiza el estudio, según los siguientes ítems 0: screening, control por antecedentes familiares de pólipos intestinales y/o tumores. I: sospecha de lesión tumoral y/o pólipos. II: control y/o terapéutica de lesión tumoral y/o pólipos. III: sintomatología sugerente de colopatía inflamatoria o hemorragia digestiva baja. Se registrará • antecedentes personales patológicos. • controles de signos vitales y spo2, antes de la colocación de la aguja de venoclisis, después de realizar la medicación (durante la anestesia) y al finalizar el estudio. • tiempo total de duración del estudio (en minutos, desde la introducción del videocolonoscopio hasta el retiro del mismo.) • dosis total de propofol utilizada. • Si se logró explorar colon derecho y el motivo sino se lo hizo. • grado de comodidad de trabajo del médico endoscopista, entrevistándolo y según la siguiente escala de relajación del paciente y grado de tensión muscular. 0: insatisfactoria, relajación y tensión muscular inaceptable. 1: satisfactoria, relajación y tensión muscular aceptable pero molesta. 2: excelente, relajación y tensión muscular no molesta. 57 Finalizado el estudio se dejara al paciente en la misma camilla por un lapso mínimo de 5` y se evaluara su recuperación según siguiente escala: 1. Paciente muy despierto, algo mareado, absolutamente lúcido y hemodinámicamente estable que pasa a recuperación a los 5` de terminado el estudio. 2. Paciente somnoliento, lucido, muy mareado, debilidad general y hemodinámicamente estable que pasa a recuperación en más de 5` y en menos de 10 minutos de terminado el estudio. 3. Paciente muy dormido, debilidad general. Hemodinámicamente estable que tarda más de 10 minutos en pasar a la sala de recuperación. Posterior a dicha evaluación el paciente pasara (si está en condiciones) a sala de recuperación, donde a los 20 min. Se le iniciara la tolerancia oral ingiriendo un té azucarado. 40 minutos después de finalizado el estudio se le realizará al paciente el siguiente interrogatorio: Nivel de confort durante el estudio (escala de 0-10) en donde 0 es nada de confort y 10 muy confortable. Se preguntará al paciente si en caso de ser necesario se volvería a hacer el estudio bajo anestesia. Y finalmente se evaluara su alta según los criterios de Aldrete, modificados para procedimientos de cirugía ambulatoria. Actividad Respiración Mueve las cuatro extremidades Mueve solo dos extremidades No mueve ninguna extremidad Respira profundamente, tose libremente Disnea con limitación para toser Apnea 2 1 0 2 1 0 Circulación TA <20% del nivel preanestésico TA 21 a 49 % del nivel preanestésico TA >50 % del nivel preanestésico 2 1 0 Conciencia Completamente despierto Responde al ser llamado No responde 2 1 0 58 Saturación Mantiene >92% Sa0 2 en aire Necesita inhalar 0 2 para mantener Sa0 2 de 90% Sa0 2 <90% aun inhalando oxigeno 2 1 0 Dolor Sin dolor Dolor leve a moderado analgésico v.o. Dolor severo requiere analgésicos parenterales 2 1 0 Deambulación Puede pararse y caminar Vértigo cuando se levanta Mareo en posición supina 2 1 0 Ayuno Puede beber líquidos Nauseas Vómitos 2 1 0 Gasto urinario Ha orinado No puede orinar sin molestia No ha orinado, muy incomodo 2 1 0 (el puntaje debe ser por lo menos 18 puntos para el alta) Resultados No hubo diferencias significativas en las variables demográficas. La calidad de analgesia, la estabilidad hemodinámica, respiratoria, el confort y la recuperación de los pacientes fueron similares. No se observaron signos de toxicidad local ni sistémica con ambas combinaciones. En el grupo B se observó́ mayor grado de relajación muscular y menos hipotensión, aunque esto último no fue significativo. Conclusión. Si bien ambas combinaciones resultaron efectivas y se recomiendan para el manejo anestésico de la videocolonoscopia, la lidocaína como analgésico tendría algunas ventajas que deben continuar estudiándose con muestras mayores. En la Digestive Disease Week (DDW) del 2009,94 la Dra. Katherine M. Hoda, investigadora principal en el Departamento de Gastroenterología de la Oregon Health & Science University en Portland EEUU, con sus colegas de Equipo analizaron los resultados de todas las colonoscopias de cribado realizadas entre enero de 2002 y diciembre de 2007 para evaluar el rendimiento diagnóstico de las que se realizan con 59 sedación consciente moderado en comparación con las que se realizan con sedación profunda. La sedación profunda permite una mejor visualización del colon y la inspección de los pólipos durante la colonoscopia y tiene un rendimiento diagnóstico significativamente mayor que la sedación consciente moderada, de acuerdo con un análisis de datos de (CORI) (Resultados de Iniciativa en la Investigación Clínica) La sedación consciente moderada es recomendada actualmente por los Protocolos de la Sociedad Americana del Cáncer (ACS). Además, la satisfacción del paciente es mayor con sedación profunda, y la sedación profunda en realidad puede aumentar la eficiencia del endoscopista y de la unidad de endoscopia. CORI es una base de datos que recibe los resultados de endoscopias de 61 centros en los Estados Unidos. Un análisis de esta base de datos fue presentado durante la Semana de Enfermedades Digestivas 2009 por Katherine M. Hoda, MD, investigador principal en el Departamento de Gastroenterología de la Oregon Health & Science University en Portland. Se realizaron un total de 101.367 procedimientos bajo sedación consciente moderada y 3501 bajo sedación profunda. Las edades medias fueron 61,3 años y 60,8 años, respectivamente (p <0,0002). No hubo diferencia en la calidad de la preparación entre los 2 grupos. Los hombres representaron el 54,6% de los sometidos a sedación moderada y el 51,1% de los sometidos a sedación profunda (P <0,0001). La mayoría de las colonoscopias, independientemente de su indicación, se llevaron a cabo en el entorno de la organización (Programa) de mantenimiento de la comunidad / salud. Aproximadamente dos tercios de las colonoscopias se realizaron con Anestesiólogos pertenecientes a la Sociedad Americana de Anestesiología y con pacientes (ASA II) es decir, los pacientes con enfermedad sistémica leve. Los investigadores encontraron 251 pólipos mayores de 9 mm de diámetro entre los 3.501 procedimientos realizados bajo sedación profunda (7,2%) en comparación con 6109 pólipos mayores de 9 mm (6.0%) que se encontraron con sedación consciente moderada (P = 0,01). Después de controlar por edad, sexo, raza, clase ASA, y la ubicación de los pólipos, los pacientes con sedación profunda tenían más probabilidades de tener 60 pólipos en comparación con la sedación consciente moderada, (odds ratio, 1,25; intervalo de confianza del 95%, 1,09-1,42). Otro punto a tener en cuenta en la diferencia de estos 2 tipos de anestesia, opinan los Autores, es que con sedación consciente moderada, la atención del endoscopista podría estar en el paciente, con el objeto de mantenerlo cómodo y adecuadamente sedado, más que en el procedimiento. Esto ofrece posibilidades de distracción, que podrían interferir en el procedimiento, incluso hasta el punto de no completar el estudio. PROFILAXIS ANTIBIÓTICA El riesgo de bacteriemia tras la realización de una colonoscopia es bajo siendo inferior al de la colangiopancreatografía retrógrada endoscópica (CPRE), la dilatación de estenosis o la esclerosis de várices esofágicas y similares al de la esófagogastroscopía, no modificándose este riesgo con la práctica de biopsias o de polipectomía. No existen datos suficientes para recomendar profilaxis antibiótica de manera sistemática en pacientes con lesiones cardíacas de alto riesgo (prótesis valvulares, historia previa de endocarditis o de cirugía previa de shunt) para prevenir la endocarditis bacteriana, cirróticos con ascitis y en pacientes inmunodeprimidos. De acuerdo con las recomendaciones del año 1997 de la American Heart Association, el porcentaje de Bacteriemia asociado a la Colonoscopia es del 2 al 5% y las Bacterias que han podido ser identificadas tienen pocas posibilidades de causar una Endocarditis95 y estas probables bacteriemias no se incrementan con la biopsia fría, con la biopsia caliente ni con las Polipectomías. Debido a esto la profilaxis antibiótica en las colonoscopias solo se recomienda como opcional para los pacientes que tengan un riesgo aumentado debido a que poseen prótesis valvulares, algún antecedente de Endocarditis, Enfermedades congénitas Cardíacas o Pulmonares, enfermos portadores de cirugías cardiacas o Trasplantes. Los antibióticos más usados pre y post procedimiento son; AmpicilinaAmoxicilina en dosis que varían de 2 g EV/IM, Gentamicina 1,5 g/kg, Gentamicina 1,5 mg/kg o la Vancomicina 1 g EV. 61 CAPÍTULO 4 INDICACIONES DE LAS VIDEOCOLONOSCOPIAS 1. El control o vigilancia del Cáncer Colorrectal en adultos de riesgo promedio. Las recomendaciones varían entre las organizaciones líderes en este campo, a saber, la Sociedad Americana del Cáncer (ACS), la Organización Mundial de la Salud (OMS), el Grupo de Trabajo de Servicios Preventivos de Estados Unidos (USPSTF), y el Colegio Americano de Médicos (ACP). En general se recomienda, sin embargo, que los adultos con riesgo promedio deben comenzar el cribado del cáncer colorrectal en la edad de 50 años, utilizando una de varias opciones para la selección, entre los cuales es la colonoscopia, cada 10 años96 como lo expresa el Dr. David Stein del Dto. De Cirugía de la Hahneman University de los EEUU en las Guías de recomendaciones para el rastreo del Cancer Colorrectal (screening) en 1997 la Asociación Americana de Gastroenterología publico los lineamientos para el screening del cáncer colorrectal, con recomendaciones específicas para la población con riesgos. Estas recomendaciones comienzan a los 50 años de edad en las que incluyen la investigación de sangre oculta en materia fecal anualmente, sigmoidoscopía flexible cada 5 años o colon por enema a doble contraste cada 5 a 10 años, o colonoscopía cada 10 años. En el 2001 el programa de prevención del cáncer colorrectal de la Canadian Task Force 97 recomienda el uso de investigación de sangre oculta anual o bianualmente y controles periódicos con sigmoidoscopía flexible, porqué según este artículo, no hay suficiente evidencia de incluir o excluir la colonoscopía como estudio inicial o screening. Sin embargo, estudios recientes que compararon la sigmoidoscopía con la colonoscopía advierten que con este concepto sería como en un screening de CA de mama, investigar solo una de ellas. 98 A partir de los años 2001 y 2002 el Colegio Americano de Gastroenterología aconseja la colonoscopía total cada 10 años, en contraste con el European Union Advisory Committee on Cancer 99 que recomienda para la población en riesgo el screening con sangre oculta en materia fecal anual o 62 bianual, limitando el screening endoscópico solo para aquellos positivos del FOBT (fecal occult blood testing). Con Los Alumnos de Grado de la Facultad de Ciencias Médicas de la UNC, en nuestro proyecto de “Detección precoz del Cáncer Colorrectal”, usando el marcador FIT (Laboratorios Montebio®) para sangre oculta en materia fecal, en pacientes con riesgo familiar 1 a 2, obtuvimos una positividad del 30% para Pólipos del Recto y Colon y 1,52 % (2 pacientes de examinados con sangre oculta en materia fecal positiva al Test FIT) para Cancer de Recto y Colon , cabe aclarar que todos eran pacientes asintomáticos , solo positividad en la investigación de sangre oculta que realizamos en 131 pacientes a los que se le realizo una Videocolonoscopia. Para Hermann Brenner, Professor of Epidemiolog y, Christian Stock, senior researcher in epidemiology, de la Division of Clinical Epidemiology and Aging Research, German Cancer Research Center de Alemania. En una revisión sistemática y metaanálisis, Randomizado de estudios Multicéntricos de Inglaterra y Alemania llegan a las siguientes conclusiones. 100 Con sigmoidoscopía, se identificaron cuatro ensayos controlados aleatorios y 10 estudios observacionales que encontraron consistentemente una reducción importante en la incidencia de colon proximal distal pero no el cáncer y la mortalidad. Estimaciones del resumen de la reducción en la incidencia de cáncer colorrectal distal y la mortalidad fueron 31% (95% intervalo de confianza 26% a 37%) y 46% (33% a 57%) en intención de pantalla de análisis, 42% (29% a 53%) y el 61% (27% a 79%) en el análisis por protocolo de ensayos controlados aleatorios, y el 64% (50% a 74%) y 66% (38% a 81%) en los estudios observacionales. Para la colonoscopía, la evidencia se limitó a seis estudios de observación, cuyos resultados sugieren tentativamente una reducción aún mayor en la incidencia de cáncer colorrectal distal y la mortalidad, junto con una reducción significativa de la mortalidad por cáncer del colon proximal. Las comparaciones indirectas de los resultados de los estudios observacionales sobre sigmoidoscopía y la colonoscopia sugieren un riesgo de 40% a 60% menor de cáncer colorrectal incidental y la muerte por cáncer colorrectal después de la colonoscopia de cribado, aunque esta reducción del riesgo de incremento fue estadísticamente significativa de las muertes por cáncer de colon proximal solamente. 63 Conclusiones: evidencia convincente y coherente de los ensayos controlados aleatorios y estudios observacionales sugieren que la detección por sigmoidoscopía y la colonoscopia de cribado previenen la mayoría de las muertes por cáncer colorrectal distal. Los estudios observacionales sugieren que la colonoscopia en comparación con la sigmoidoscopía flexible reduce la mortalidad por cáncer del colon proximal. Este valor añadido debe ser examinado en la investigación adicional y pesaba contra los costos más altos, la incomodidad, las tasas de complicaciones, las capacidades necesarias, y las posibles diferencias en el cumplimiento. Desde 1992, varios estudios observacionales han sugerido un efecto protector importante de la endoscopia digestiva baja (en particular, la sigmoidoscopía y la colonoscopia) contra el cáncer colorrectal a través de la detección y eliminación de las lesiones precancerosas. 101,102,103 Como resultado de ello, y con el apoyo de otras mejoras en la tecnología, el uso de la sigmoidoscopía y la colonoscopia con fines de diagnóstico y de detección han aumentado sustancialmente en muchos países. 104,105 Ambos procedimientos han sido recomendados como opciones de detección del cáncer colorrectal por los comités de expertos y se ofreció como cribado primario en varios países europeos (incluyendo Alemania, Italia, Polonia y Austria) mucho antes de la disponibilidad de los resultados de los ensayos controlados aleatorios. 106,107,108,109 Estudios recientes de las tendencias en la incidencia y mortalidad por cáncer colorrectal sugieren que un mayor uso de la endoscopia digestiva baja ya ha dado lugar a importantes reducciones en la incidencia de Cancer colorrectal y defunciones por cáncer colorrectal en los Estados Unidos. 110,111 En nuestro país, el Dr. Ubaldo Gualdrini en su Texto Cancer colorrectal en la República Argentina, 112 propone las recomendaciones sobre la prevención secundaria del Cancer Colorrectal en los diferentes grupos de riesgo. El riesgo general de adquirir un Cancer Colorrectal está muy relacionado a la agregación familiar que presente el individuo, donde se asocian componentes multifactoriales, que hasta la fecha no están del todo descriptos, pero se conocen bastantes, sobre todos los referidos a las mutaciones genéticas que pueden ser heredo trasmisibles, y ya no solo a la posibilidad de que algún familiar en primer o segundo 64 grado haya desarrollado la enfermedad CCR (cáncer colorrectal), sino enfermedades genéticamente emparentadas en grupos familiares asociados como, Cancer de Mama, Cancer de Ovario, Cancer de Endometrio, Cancer de Vejiga, Cancer de Intestino Delgado, Tracto Biliar y algunos otros. Estos verdaderos Sindromes tienen cada uno su especificación en la metodología de estudio como la Poliposis Adenomatosa Familiar, enfermedad autosómica dominante de alta penetración ocasionada por una mutación germinal que desarrolla Adenocarcinoma de Colon a través de algunos de sus innumerables Pólipos en adultos jóvenes, por lo que establece pautas muy estrictas en el control de estos grupos, la Videocolonoscopia ocupa un lugar importantísimo además de las marcaciones genéticas en el diagnóstico y control de estos grupos. Se estima su incidencia poblacional en 1 por 700.000-30.000 nacimientos.113 Como así también el Sindrome de Lynch que es el cáncer hereditario más frecuente 3 al 6% del total de los CCR. Los Criterios de búsqueda como los de Amsterdam y sus modificaciones, los criterios de Bethesda y sus modificaciones, incluyen en sus protocolos la realización de Videocolonoscopia reglada en su sospecha y control. Pero los individuos que no cumplen con criterios específicos para sospechar que poseen algún Sindrome Hereditario en relación al CCR o que no han sido estudiados, deben ser asesorados que en la incidencia poblacional es más frecuente que estos nombrados el Cáncer Colorrectal Esporádico que ocupa el tercer lugar como causa de muerte por Cáncer en la República Argentina, cifras muy similares a las de los Países Europeos y del Norte de América. El 9,4% para las mujeres después del Cancer de Mama y de Cuello Uterino en el 2008, y el 15,2% para los varones después del Cancer de Próstata y de Pulmón en el mismo año.111 El Dr. Ubaldo Gualdrini establece las tablas de vigilancia primero para los pacientes que tienen algún familiar implicado en esta búsqueda que ya detalláramos en párrafos anteriores, y luego para los que ya fueron operados de algún CCR. Me parece un muy buen protocolo para cumplir en la República Argentina. 65 Antecedente Familar FPG con CCR 50-60 años Vigilancia Videocolonoscopia 40 años Periodicidad Cada 5 años FPG con CCR < 50 años Videocolonoscopia 40 años o 10 años antes del Dx más temprano Videocolonoscopia 50 años Cada 3-5 años según genealogía. Videocolonoscopia 40 añoso 10 años antes del Dx más temprano Videocolonoscopia 50 años Cada 3-5 años según genealogía Cada 5 años Videocolonoscopia 50 años Cada 10 años FPG con CCR 60 años Dos FPG relacionados con CCR a cualquier edad Dos FSG relacionados con CCR a cualquier edad Un FSG o cualquier FTG con CCR o un FPG con adenoma Antecedentes de Enfermedad de Lynch Antecedentes de PAF Enfermedad Intestinal Inflamatoria Antecedentes personales de Adenomas 3 a 10 adenomas o uno > de 10mm. O Adenomas Vellosos con displasia de alto grado. Videocolonoscopia a partir de los 20-25 años, o 10 años antes del caso de familiar más joven detectado. Videocolonoscopia a partir de los 10-12 años, evaluar las posibilidades de Cirugía. Videocolonoscopia con biopsias escalonadas a partir de los 10-15 años de evolución de la enfermedad. Con biopsias escalonadas a partir de los 8 años en las Pancolitis. Videocolonoscopia a los 3 años. Antecedentes personales de adenomas 10 adenomas o uno > de 20 mm Videocolonoscopia al año. Antecedentes personales de adenomas 1,2 3, adenomas < 10 mm o con displ. bajo grado Antecedentes personales de CCR Pesquisa de rutina (videocolonoscopia a los 10 años) Videocolonoscopia al año de operado. Cada 5 años Cada 1 a 2 años Cada 1 a 2 años Cada 1 – 2 años Examen negativo: cada 5 años. Dos exámenes negativos consecutivos pesquisan de rutina a los 10 años. Hallazgo de adenomas de bajo riesgo cada 3 años. Examen negativo o adenoma de riesgo bajo cada 3 años. Dos exámenes negativos consecutivos: cada 5 a. Cada 10 años Si es normal repetir a los 3 y a los 5 años, luego cada 5 años. FPG: familiar primer Grado./ FSG: familiar segundo grado / FTG: familiar tercer grado/ CCR cáncer colorrectal./ Dx diagnóstico / (Modif. Dr. Héctor Baistrocchi)/ En nuestro relato “Estado actual del Tratamiento del Cáncer de Recto” del año 2008 con el Prof. Dr. Carlos Olivato, publicamos en la Actas del 26º Congreso de Cirugía de Córdoba 114 como la Historia Familiar y los conceptos de Penetración Genética 66 Familiar con el transcurso de los años se convirtió en el mundo entero en el eje de la búsqueda del cáncer colorrectal en nuestras Sociedades en Desarrollo, donde las costumbres Higiénico dietéticas y Sedentarismo constituían un riesgo considerable de adquirir un CA colorrectal, incrementado esto por los factores genéticos adquiridos de Países Europeos después de la primera y segunda Guerra mundial, donde Argentina se convirtió en unos de los Países más elegidos para todos los Inmigrantes. De los años 1914 a la fecha llevamos 100 años de tradición genética heredable donde las mutaciones trasmisibles después de 4 Generaciones muestran en las estadísticas Argentinas, similares resultados que en los Países Europeos y Anglosajones. La Colonoscopia se convirtió en el instrumento de mayor utilidad para la pesquisa de pequeñas lesiones, pólipos en general, y cáncer Colorrectal. Existen numerosas publicaciones que indican un incremento en la incidencia del cáncer colorrectal en aquellos grupos familiares portadores de esta enfermedad en primer grado, sobre los que no la tienen. Fuchs y cols 115, en un estudio prospectivo que enroló a 32.085 hombres y 87.031 mujeres, lograron demostrar que los portadores de un familiar en primer grado, tenían 1,72 veces más posibilidades de desarrollar un cáncer colorrectal que aquellos que no poseen un familiar portador de la enfermedad. Este riesgo ascendía aún más si en la familia había dos o más familiares en primer grado, se estimaba este riesgo en 2,75 veces más que aquellos que no los tenían. En los participantes enrolados menores de 45 años que tenían uno o más familiares en primer grado portadores de un cáncer colorrectal el riesgo ascendía a 5,37 veces. Slattery y cols 116, evaluaron el riesgo de desarrollar múltiples tumores primarios después de diagnosticar un cáncer colorrectal y determinaron el impacto de tener una historia familiar de carcinoma, y el riesgo de adquirirlo. Para este estudio se utilizaron los registros del Utah Cancer Registry y el de Utha Population Database. Se incluyeron 2236 pacientes con carcinoma primario colónico, en los que se observó subsecuentemente otro carcinoma adicional. En este grupo se demostró una mayor incidencia para estos tres tumores en grupos de portadores primarios, fue 2,77 para cáncer de colon, 2,26 el cáncer de recto y 2,38 para el de páncreas. Los grupos cuyos familiares habían sido portadores de cáncer de recto, tenían una posibilidad de riesgo 67 promedio de 1,99, de adquirir un cáncer de páncreas, y un riesgo de 2,35 para el cáncer de vejiga. Si se compara el riesgo relativo de pacientes con cáncer colorrectal diagnosticado a diferentes edades, este riesgo cambia sensiblemente. Hall y cols 117, estudiaron 2 grupos de pacientes. En 65 pacientes el tumor fue diagnosticado antes de los 45 años de edad y 212 pacientes en todas las edades. El promedio de riesgo con familiares en primer grado fue del 5,2 para el primer grupo y 2,3 para el segundo. El índice acumulativo de incidencia de cáncer colorrectal, relativo a las edades, definido como riesgo fue el siguiente: los familiares en primer grado que desarrollaron un cáncer colorrectal antes de los 40 años, en este grupo el riesgo adquirido fue del 5% a los 50 años, y del 10% a los 70 años. Si lo comparamos con el grupo de familiares en primer grado de más edad, los riesgos de adquirirlo van del 5 % a los 70 años, y del 10% a los 80 años. Cuando los padres tenían algún hermano también portador de un CCR, el riesgo era 2,1 veces más grande, 3,7 para los pacientes que fueron diagnosticados antes de los 45 años y 1,8 veces para los que tenían el familiar que lo había desarrollado a los 45 años o más. Historia Familiar • Sin antecedentes • Un familiar en primer grado c/CCR • Más de un familiar en primer grado c/CCR • Un familiar en primer grado c/CCR menor de 45 años • Un familiar en primer grado c/Adenomas CR Riesgo relativo 1 2,3 Riesgo absoluto hasta los 79 años 4% 9% 4,3 16 % 3,9 15 % 2 8% Riesgo absoluto y relativo estimado en desarrollar un cáncer colorrectal (No HNPCC) Datos obtenidos del SEER database (Genetics of Colorrectal Cáncer. (PDQr) Nov. 19. 2003 /// www.cancer.gov/cancerinfo/pdq/genetics/colorrectal) 68 ALGORITMO PARA EL SCREENING Y VIGILANCIA DEL CANCER COLORRECTAL, EN POBLACIONES DE MEDIANO Y ALTO RIESGO. 118 Este tipo de rastreo es en la actualidad el más usado en todos los países El Dr. Carlos Vaccaro112 en su libro Cancer Colorrectal se refiere a la Videocolonoscopia cada 10 años. Se trata de una estrategia en uso cada vez mayor en los Países desarrollados porque a pesar de su mayor complejidad, es un procedimiento que cuenta con buena aceptación por parte de los pacientes y debe ser repetida con una frecuencia menor que las otras estrategias de rastreo. Desde el año 2001 es aceptada por el Medicare, de Estados Unidos, el sistema de Salud más grande del País. La Videocolonoscopia cada diez años es la estrategia recomendada por el American College of Gastroenterology. 119 En un trabajo publicado en el 2014 en una de las revistas más prestigiosas del mundo (GUT), el grupo de Michel Kamiski, del Departamento de Oncología del María Sklodowska-Curie Memorial Cancer Centre and Institute of Oncology, Varsovia, Polonia, tuvo como objetivo desarrollar y validar un modelo para estimar la probabilidad de 69 detectar CCR avanzado en pacientes caucásicos. Se realizó un análisis transversal de los registros de base de datos para los 40 años de edad, a los pacientes de 66 años de edad que ingresaron a un programa de cribado basado en la colonoscopia primaria nacional para el cáncer colorrectal en 73 centros en Polonia en el año 2007. Se utilizó una logística multivariante de regresión para investigar la asociación entre las variables clínicas y la presencia de neoplasia avanzada en un conjunto de prueba seleccionada al azar, y confirmó las asociaciones en un conjunto de validación. Utilizaron coeficientes del modelo para desarrollar una escala de riesgo para la detección de neoplasia colorrectal avanzada.120 Se detectó Neoplasia colorrectal avanzada en 2544 de los participantes incluidos (35.918) (7,1%). En el equipo de prueba, un modelo de regresión logística mostró que los factores de riesgo independientes para la neoplasia colorrectal avanzada fueron: edad, sexo, antecedentes familiares de cáncer colorrectal, el tabaquismo (p <0,001 para estos cuatro factores), y el índice de masa corporal (p = 0.033). En el conjunto de validación, el modelo fue bien calibrado (relación de espera para riesgo observado en neoplasias avanzadas: 1,00) (IC del 95%: 0,95 a 1,06) y tenía poder discriminatorio moderado (c-estadística 0,62). Hemos desarrollado dicen los Autores una puntuación que estima la probabilidad de detectar la neoplasia avanzada en el conjunto de validación, de 1,32% para los pacientes que califican 0, a 19,12% para los pacientes que califican 7 a 8. Los pacientes entre las edades de 50 años o de 66 años (40 años y 66 años en caso de antecedentes familiares de cáncer de cualquier tipo) fueron asesorados por su familia o los médicos generales para participar en el cribado. Los criterios de exclusión fueron la sospecha clínica de cáncer colorrectal; características que cumplieron con los criterios para el síndrome de Lynch, poliposis adenomatosa familiar, o la enfermedad inflamatoria intestinal; y la colonoscopia en los 10 años precedentes. Para este estudio, se excluyeron los pacientes que tenían pólipos detectados de 10 mm o más grandes que no se resecaron (de estos la histología no estaba disponible) y los pacientes que no habían completado plenamente el cuestionario epidemiológico. El screening mediante colonoscopia está sobradamente demostrado por numerosos trabajos actuales. 121,122 Todos los colonoscopistas e histopatólogos participaron en el programa con garantía de calidad 123 los hallazgos colorrectales se 70 clasificaron sobre la base de la lesión más avanzada identificada en el cribado (incluyendo colonoscopias adicionales necesarias para eliminar todos los pólipos, cuando estaba indicado). 124,125 La neoplasia avanzada fue definida como el cáncer o adenoma que era por lo menos de 10 mm de diámetro, tenía displasia de alto grado, tenía características histológicas vellosos o tubulovellosos o cualquier combinación de los mismos para el propósito del análisis, los adenomas serrados tradicionales, las lesiones serradas sésiles, y pólipos serrados mixtos se clasificaron como adenomas tubulares. Los pólipos <10 mm de tamaño que no fueron retirados o recuperados fueron categorizados como no neoplásico. Resultados: la colonoscopia se completó hasta ciego en 34.469 pacientes (96,0%). Un total de 6.909 pacientes (19,2%) tenía un adenoma o cáncer. Un total de 232 pacientes (0,6%) tenía pólipos <10 mm de tamaño que no fueron retirados o recuperados, por lo tanto se clasifica como alteraciones no neoplásicas. Neoplasias avanzadas fueron detectadas en 2544 pacientes (7,1%), incluyendo 336 participantes (0,9%) con adenocarcinoma. Se produjeron complicaciones clínicamente significativas que requirieron tratamiento en 42 pacientes (0,1%) y se incluyeron siete casos de perforación (tres de los cuales se produjeron después de la polipectomía), 21 episodios de sangrado, nueve eventos cardiovasculares, y otros cinco eventos clínicos indeterminados. No se produjeron muertes como resultado de la colonoscopia de cribado o de sus complicaciones. Hace ya algunos años en la práctica privada hemos adoptado un modo fácil de hacer comprender a nuestros pacientes que cuando se encuentran algunos avisos de poder estar ante la presencia de alguna de las mutaciones que provocan una serie de tumores asociados, se debe alertar a la familia para tener ciertos cuidados para con los hijos y nietos. Esto es ante la presencia en el paciente de un Cáncer Colorrectal, Pólipos adenomatosos del Colon, Cáncer de Mama, Cáncer de Ovario, Cáncer de Endometrio, Cáncer de Vejiga. Se le entrega un cuadro donde colocamos inclusive los nombres de los Familiares en primer y segundo grado, con sus respectivas patologías relacionadas a estos tumores que estamos advirtiendo. Esto fue tomado de la Bibliografía Internacional como ya he relatado en párrafos anteriores. 71 Penetración genética familiar del cáncer colorrectal y asociación a otros tumores. 126 TUMORES ASOCIACIOS GENETICAMENTE Cáncer de Mama Cáncer de Ovario Cáncer de Endometrio Cáncer de Colon (Pólipos) Cáncer de Vejiga Cáncer de Estómago (Pólipos) Cáncer de Páncreas Sólo se colocan en color rojo los pacientes que tuvieron algún Tumor de la Lista. 72 ADVERTENCIA y RECOMENDACIONES A HIJOS Y NIETOS MUJERES: GINECOLOGO A PARTIR DE LOS 25 AÑOS TODOS LOS AÑOS, Y COLONOSCOPIA / GASTROSCOPIA, CADA 5 a 7 AÑOS. EXAMEN DE GLANDULA TIROIDES. VARONES: ENDOSCOPIA COLONICA / GASTRICA ENTRE LOS 40 Y 50 AÑOS, CADA 5 / 7 AÑOS. EXAMEN DE GLANDULA TIROIDES. (Este esquema es entregado al paciente con los nombres de los Familiares que se logran obtener, y se marcan en rojo los portadores de Tumores asociados Genéticamente. Se hace una copia para el paciente y cónyuge, y una copia para cada uno de los hijos, cualquiera sea la edad que tengan.) La Sociedad Americana de Oncología Clínica, en un artículo reciente de Febrero de 2014, 127 publica las recomendaciones de un panel de 15 Expertos, preguntados por Karen Lu, del Anderson Cancer Center de Houston, de la Universidad de Texas. "Una historia familiar adecuada es clave para identificar a aquellos pacientes cuyo cáncer puede estar asociado con factores genéticos heredados," el presidente de ASCO (American Society of Clinical Oncology) Clifford A. Hudis, dijo en un comunicado. Se puede "obtener una información importante que puede ayudar a un oncólogo determinar el mejor curso de tratamiento individualizado”. El principal problema en estos grupos familiares es la marcación genética que no está al alcance de todos los sistemas de salud, además, los sistemas de salud electrónica existentes "carecen de la funcionalidad necesaria para capturar los datos de historia familiar adecuados", señalan los autores. A pesar de estas barreras, sin embargo, proponen que tomar una historia familiar para todos los pacientes oncológicos es una "meta alcanzable a corto plazo para todas las prácticas de oncología". Alrededor del 5% al 10% de todos los cánceres son atribuibles a un síndrome de predisposición al cáncer hereditario, escriben los autores. Estos incluyen de mama hereditario y cáncer de ovario relacionados con las mutaciones BRCA1 / 2, y también el síndrome de Lynch, lo que aumenta el riesgo para el Cáncer colorrectal y otros tipos de 73 cáncer. La identificación de los pacientes que tienen este síndrome "tiene un beneficio significativo" para los pacientes y sus familiares. Rastreo de cáncer en familiares directos; Reconstruir la historia de nuevo a 3 generaciones es la norma actual en genética médica, pero después de revisar la evidencia disponible, ASCO (The American Society of Clinical Oncology) 128 concluyó que los antecedentes familiares informados es más precisa en los familiares cercanos, y pierde precisión en los parientes más lejanos. Una historia de cáncer en familiares de primer y segundo grado es a menudo suficiente, concluyen los autores. Por lo tanto, para todos los pacientes con cáncer, ASCO recomienda conocer si hay alguna historia de cáncer en familiares de primer grado, incluyendo a los padres, hijos y hermanos completos, y en familiares de segundo grado, como abuelos, tíos/as, sobrinos/as, los nietos y los medio hermanos. Para cada relación con un historial de cáncer, ASCO recomienda registrar los detalles como la edad al momento del diagnóstico y el tipo de cáncer primario (s), así como linaje (paterno de la madre y/o), la etnicidad, y los resultados de cualquier prueba genética del cáncer relacionado. Llamadores rojos de predisposición al cáncer hereditario son la edad temprana de la aparición de cáncer, varios familiares afectados con cáncer en el mismo lado de la familia, y de tumores primarios múltiples, sobre todo en el mismo órgano (por ejemplo, de mama, de colon o de riñón) en un solo individuo. Los pacientes también deben ser preguntados directamente si tienen algún conocimiento de predisposición al cáncer, como las pruebas genéticas, o el origen étnico que puede ser relevante (por ejemplo, ascendencia Judía Asquenazí que se asocia con una mayor prevalencia de mutaciones) (BRCA 1 / 2). "Por lo tanto, los pacientes con cáncer de mama y/o cáncer de ovario se les debe preguntar específicamente si tienen alguna ascendencia materna o paterna", escriben los autores. Los oncólogos de todo el mundo ya están familiarizados a realizar algunas preguntas para recabar la historia familiar en pacientes con cáncer, pero hay "margen de mejora", concluye este estudio publicado en línea el 03 de febrero en el Journal of Clinical Oncology. Este estudio fue presentado en la reunión anual de ASCO 2012, y se presentó en detalle. El estudio informa los resultados de una encuesta de 271 74 prácticos (Médicos y Paramédicos) que participan en la Iniciativa de la Práctica de Oncología de Calidad de la ASCO en 2011. Se observaron los procedimientos de asesoramiento y pruebas genéticas para 10. 466 pacientes con cáncer de mama u colorrectal. Los autores, dirigidos por Marie Wood, MD, de la Universidad de Vermont en Burlington, encontraron que el 77,0% de todos los registros médicos revisados había documentado la presencia o ausencia de cáncer en familiares de primer grado, y el 61,5% lo habían hecho por familiares en segundo grado. Sin embargo, la historia completa de la familia solo fue documentada en menos de 40,0% de los pacientes. El asesoramiento genético / prueba, se realizó solo en el 22,1% de todos los pacientes. Sin embargo, en menos de la mitad (42,7%) de los pacientes eran propensos a tener una forma hereditaria de cáncer con las mutaciones buscadas. Los autores señalan que los oncólogos eran más propensos a buscar pistas sobre cáncer hereditario entre los pacientes con cáncer de mama, en comparación con aquellos con cáncer colorrectal. Hubo una tasa significativamente mayor de la documentación de cáncer de mama, en comparación con los pacientes con cáncer colorrectal. Entre los pacientes que eran propensos a tener cáncer hereditario, el 52,2% de los pacientes eran con cáncer de mama, pero sólo el 26,4% de los pacientes referían a cáncer colorrectal y fueron enviados para test genéticos. Concluyen los autores que "Nuestro estudio pone de manifiesto la necesidad de continuar con la educación y el apoyo a los Médicos en general para recopilar y documentar la historia de la familia". Conseguir una historia familiar adecuada en los registros médicos es el primer paso para asegurar que los pacientes adecuados sean enviados para asesoramiento de pruebas genéticas. En nuestro Proyecto de detección precoz del Cancer Colorrectal llevado a cabo en la Cátedra de Cirugía II de la Facultad de Ciencias Médicas de la Universidad Nacional de Córdoba , el que ya lleva 2 (dos) años de puesta en marcha, el sistema de recolección de pacientes asintomáticos se basa en la publicación de pancartas y avisos en los lugares públicos de que la posibilidad de desarrollar un Pólipo maligno, o un Cancer Colorrectal, podría estar ligado a la participación de uno o dos familiares en 75 primer o segundo grado, portadores de otros tumores como: Cáncer de Ovario, Cáncer de Mama, Cáncer de Endometrio, Cáncer de Vejiga etc… Fue tan efectivo el llamado que concurre a los Hospitales señalados, (esto ocurre en Traslasierra provincia de Córdoba, que abarca desde el límite con la provincia de San Luis, lo que comprende el Dto. De San Javier, las poblaciones de Villa Dolores, Nono, Los Hornillos, Mina Clavero, Cura Brochero, la Pampa de Pocho hasta el Departamento de Cruz del Eje) pacientes con el solo caso de presentarse a la encuesta. Los pacientes son ordenados de acuerdo al grado de Penetración Genética Familiar como lo marca la Organización Mundial de la Salud y todas las Sociedades del Mundo que agrupan a los especialistas de Colon y Recto (Coloproctología). Esto está referido a que a pacientes con Riesgo de Familiar en primer grado, o familiar de enfermedad asociada en segundo grado, o familiar no directo que haya desarrollado alguna de las enfermedades tumorales asociadas, se le entrega un marcador de sangre oculta en materia fecal FIT (Test Inmunológico de detección de Hb humana de Laboratorios Montebio 1) Si este marcador da positivo al paciente se le realiza una Videocolonoscopia de rutina y el tratamiento correspondiente si se tratara de un pólipo o un cáncer colorrectal. Nuestros hallazgos estuvieron en una positividad para los Pólipos del Colon y Recto en pacientes con test de sangre oculta positivo del 48% y de positividad en el hallazgo de cáncer colorrectal del 7,76%. En general todos los trabajos del mundo coinciden en asignar el mismo valor a la presencia de un pólipo adenomatoso que a un cáncer colorrectal 129,130 1 Montebio SRL. Juan Ramirez de Velazco 426. Capital Federal. Producido por ABON BIOPHARM (HANGZHQU) CO LTD. 198 12° Street East Hangzhou. Economic & Technological. Development Area. Hangzhou 310018. PR China 76 Este cartel es colocado en los Hospitales, Dispensarios, lugares públicos, Supermercados, etc. En un Trabajo presentado en la UEG week (Semana de la Union Europea de Gastroenterología) en Octubre del 2014 un grupo del Reino Unido Titulado: “¿Podemos explicar el aparente descenso en la captación de participaciones en el COLORRECTAL CÁNCER SCREENING EN INGLATERRA?”. 2 El Programa de Detección del Cáncer de intestino NHS (BCSP) ofrece prueba bianual basada en el test del guayaco para sangre oculta en heces (SOH) la detección del cáncer colorrectal (CCR) para individuos de 60 a 74 años (ambos inclusive). La adopción de las invitaciones de cribado (ingreso en el Proyecto) en Inglaterra, con un promedio de alrededor del 55%, se ve afectada por factores individuales que incluyen la historia de cribado, el sexo y el nivel de privación social. Los datos correspondientes a 2013 indican una marcada disminución en la participación durante el segundo semestre de 2013. El BCSP en Inglaterra es coordinado por cinco sub-regionales; cada una trabaja con centros de detección locales que proveen investigaciones de seguimiento (generalmente colonoscopia) para individuos con un resultado FOBT positivo. El Eje del Sur ofrece el servicio de detección de alrededor del 26% de la población de Inglaterra (14,6 millones); envía más de un millón de invitaciones para la 2 UEG WEEK october 2014. Monday 20 . Abstarct view. online.com/guest/ID1e548099460d2f/WhoIsWhoView? PRSID=40723 https://uegw.congress- 77 detección y análisis de aproximadamente ¾ de millón de kits de pruebas cada año. La captación en los promedios Eje del Sur 61% (2012/2013), pero demuestra el descenso desde junio 2013 que se informó a través del resto del país, una observación importante al respecto. Resultados: Entre los individuos de edades 60-74 años, aunque sujeto a las fluctuaciones marcadas a lo largo de cada año, la tendencia general fue hacia un aumento de la captación hasta junio de 2013, después la captación se redujo drásticamente. La captación entre los invitados por primera vez de 60 años fue el más consistente (55%) entre 2009 y 2012, a pesar de una marcada caída en la captación fue evidente desde mediados de 2013. El más desfavorecido mostró la mayor caída en el primer episodio de invitación (60 años de edad) y no hubo cambios en la absorción por las personas menos desfavorecidas. Diferentes patrones observados a través de centros de detección pueden reflejar diferentes fechas de inicio que resulta en una mezcla diferente de episodios, con la población siendo la historia más larga de cribado posiblemente sujeto a la "fatiga de selección“. Comentario: Una población entrenada, de amplio conocimiento del Tema se ve sentida en la recolección de datos debido a la no concurrencia de las personas en situación de riesgo, en nuestro País esto se hace aún más difícil debido a la poca información popular que tenemos en los medios de comunicación social y por parte de los Ministerios de Salud Pública. Pese que en los últimos 10 años se ha avanzado muy mucho al respecto. En nuestro País son numerosas las Publicaciones referidas al Tema ; los Servicios de Gastroenterología, Cirugía , Endoscopia, Coloproctología del Hospital Alemán de la provincia de Buenos Aires publican en la Reviste Argentina de Coloproctología en el año 2008 los resultados de la Pesquisa del Cancer Colorrectal mediante Videocolonoscopia en una población cerrada 131 y de 1788 videocolonoscopías realizadas entre Marzo de 2005 y Marzo de 2006, se halló patología en el 60% de éstos se encontraron pólipos. La prevalencia de pólipos en esta población fue del 20% y de cáncer colorrectal del 1,4%. Se hallaron 59 pólipos en 43 pacientes. 42,4% fueron hiperplásicos, 52,5% adenomatosos y el 5,1% cánceres. Concluyen que la Videocolonoscopia es eficaz como método de pesquisa en una población cerrada. 78 El Dr. Fabio Leiro del Hospital J.M. Penna, División Cirugía General; Servicio de Gastroenterología, de la ciudad de Buenos Aires, publica con sus colaboradores en el año 2013, Viedeocolonoscopias en un Servicio de Cirugía General realizado por médicos del Servicio y Médicos en formación 132. Revisaron los estudios videocolonoscópicos realizados en el servicio de cirugía, entre julio de 2009 y julio de 2011. Se efectuaron 221 VCC con sedación. Informan el hallazgo de lesiones polipoideas sésiles 43 (20%), lesiones polipoideas pediculadas 17 (8%), más de 2 a 3 lesiones polipoides 10 (5%). Con relación al hallazgo de lesiones neoplásicas, hubo 3 lesiones neoplásicas tempranas tipo IIa de la Clasificación de Paris (1%), y 23 lesiones avanzadas (10%). Los Dres, Estefanía, Tyrrell, Bugallo, Patrón Uriburu, Díaz, y colaboradores del Servicio de Coloproctología, Hospital Británico de Buenos Aires, publican un trabajo retrospectivo de Videocolonoscopías realizadas entre los años 2009 y 2010 analizando 1246 Videocolonoscopia 133, en 100 pacientes se encontraron y se resecaron pólipos (25% de todas las VCC por pesquisa). Distribución por sexo: 68% hombres y 32% mujeres. El 61 % de los pacientes tenía 1 pólipo, el 22% 2, el 12% 3, el 4% 4 y el 1% 6 pólipos. El 88 % eran menores a 10 mm, y el 22 % mayor a 10 mm. El 50,9% eran adenomas tubulares Viena 3, el 32% eran pólipos hiperplásicos, el 5,45% adenomas serratos, el 3,63% adenomas tubulares con displasia de alto grado Viena 4, y el 0,9% adenomas vellosos Viena 3. Concluyen los Autores que sus resultados coinciden con la Bibliografía Internacional, y que la detección precoz de los Pólipos del Colon y Recto detiene la secuencia Pólipo-Cáncer, obteniendo con esto la prevención en el desarrollo del Cáncer Colorrectal. En nuestro País el Dr. Hugo García de la ciudad de Viedma, Rio Negro, en el año 2004 organizó un Simposio que se Tituló: “Cáncer recto-colónico ¿Es una enfermedad previsible?”, este fue organizado por la Sociedad de Gastroenterología de la Pcia de Rio Negro, con la colaboración de casi todas las Sociedades de Gastroenterología y Cirugía invitadas al evento que se realizó los días 6 al 8 de mayo del 2004. Se invitó a disertantes importantes de nuestro País como; Dr. Salvador Aschkenazy, Dr. Mario Antozzi, Dra. Ángela Solano, Dr. Jorge Cardozo, Dr. Ricardo Pileggi, Dr. Víctor Albizzatti, Dr. Horacio Muñoz, Dr. Rubén Kowalyszyn, Dr. Hector Mazzini, Dr. Carlos Brodersen, Dr. Eduardo Cueto Rua. Su organizador Dr. Hugo García 79 y Dr. Hector Baistrocchi, que fui invitado para desarrollar el Tema de Diagnóstico precoz del Cancer Colorrectal. Este Simposio fue declarado de interés provincial por la legislatura de Río Negro y el Consejo Provincial de Salud Pública de Río negro y de interés municipal por el Concejo deliberante de Viedma. Nuestro País comenzaba a darse cuenta que el Cáncer Colorrectal se ubicaba en una de las causas más frecuente de muerte por Cáncer. Se desarrollaron todos los Temas más importantes para la época, la Dra. Ángela Solano dio una clase magistral sobre la importancia que cobraba ya la Genética en esta enfermedad, y se hicieron Talleres con Organizaciones no médicas como una Conferencia de prensa y reunión con la comunidad, coordinada por LALCEC filial Viedma. He querido destacar este Simposio por el tremendo esfuerzo personal y económico de sus organizadores, ya estábamos en el nivel de los Países desarrollados en la puesta al día de este tema. Evaluación y Resección de los Pólipos del Colon y Recto La identificación de los Pólipos del Colon y Recto fue un desafío para los primeros endoscopistas y lo sigue siendo en la actualidad, afirmado esto con la demostración clara que estos preceden a un tumor, en la secuencia adenomas – cáncer. La Videocolonoscopia (Colonoscopía) marcó un antes y un después en la identificación de las pequeñas lesiones y la instrumentación adecuada para su resección. El conocer que a mayor tamaño mayor peligrosidad de que incluyan en su estructura una displasia severa o un adenocarcinoma, alertó a todos los Gastroenterólogos, Cirujanos y Endoscopistas del mundo entero a que había que resecarlos de la manera más segura posible y de no tener esa seguridad se indica la resección del sector involucrado. 80 Los aparatos mejoraron en la definición de la imagen y comenzaron a identificar las características de la superficie mucosa y con ello a distinguir entre lo normal y lo patológico, como los bordes y límites del mismo. Como no se podía identificar la penetración en la pared del Colon o Recto, pero ya se tenían los conceptos de Kariya 134, autores de extraordinaria percepción y deducción de lo que sucedía en la profundidad de la lesión definieron por deducción lógica que si la estructura tenía grandes cambios como la depresión de la misma se suponía que este proceso ya tenía una estructura interior cambiada que muy probablemente estaba referida a la inclusión de un proceso displásica o tumoral. Muchas fueron las clasificaciones macroscópicas (Endoscópicas) de los Pólipos del Colon y Recto que a través del tiempo y de acuerdo a la peligrosidad que estos demostraban se fueron presentando en todo el mundo. La Dra Rita Pastore hace un excelente resumen de las Clasificaciones existentes en la actualidad en su Relato del 34 Congreso Argentino de Coloproctología 135 haciendo una de las mejores puestas al día de diagnóstico y tratamiento de los mismos. La Escuela Argentina estuvo actualizada siempre al mismo ritmo que las mejores descripciones de todos los Servicios del mundo. Nuestro grupo ya había presentado las conductas de la época en 1977.136 El Dr Amadeo Espeche había dado las pautas claves para las conductas de la época en 1971 137, El Dr Jorge Rodriguez Martín fue el que prácticamente nos estimuló en este maravilloso mundo de los Pólipos y presentó en la Sociedad de Coloproctología numerosos Trabajos referidos al Tema.138 En el año 1979 El Dr. Donelly publica Polipectomía transcolonoscópica. Consideraciones clínicas y resultados.139 La escuela de Rosario con el Dr. Pedro Ruiz, Dr. E. Pollastri y Dr. Tavella publicaban un racconto de polipectomías endoscópicas colónicas de siete años 140. En el año 1998 el Dr. Jorge Arias, nuestros recordados Roberto Castiglione y Amadeo Espeche obtienen el Premio de la Sociedad Argentina de Coloproctología al mejor Trabajo con el Tema Pólipos del Colon y Recto. Diagnóstico y Tratamiento. Experiencia multicéntrica con un bisturí de radiofrecuencia.141 La Dra. Rita Pastore, Coronado Quesada y colaboradores en el 2002, publicaban polipectomía endoscópica y manejo de los pólipos colorrectales malignos. 81 Experiencia de 20 años. 142 Y numerosos más referidos a colonoscopias hallazgos y conductas. Los adenomas planos fueron descriptos por Muto y Cols como ya expresáramos en 1985. En esta publicación Muto describe 33 lesiones colónicas que median menos de 1 cm. de diámetro. La Colonoscopia mostró para estos autores que estas lesiones podían ser deprimidas en su centro, o elevadas en sus bordes, o ambas situaciones a la vez. Encontrando lo que fue sorpresa para todo el mundo, “focos de carcinoma con severa atipia” en el 25% de las lesiones que median menos de 0,4 cm. de diámetro. El 40% de las lesiones que median entre 0,5 y 0,8 cm. y en el 80% de las lesiones que median 0,9-1,0 cm. Esto fue publicado y llamó la atención debido a que era por todos conocido que los Pólipos menores de 1 cm. rara vez mostraban potencial maligno. 143 Pero en Japón (Chiba) ya en el año 1977 el Dr.Kariya y Colegas publican el trabajo referido a un caso de Cáncer Colo-rectal Temprano deprimido (IIc) 144. Y el Dr. Shin-ei Kudo y Cols 145, en 1986 publican haber encontrado numerosos casos de cáncer deprimido (IIc). Quedaba entonces para la opinión mundial la vieja controversia de si el cáncer de colon provenía siempre de un Pólipo Adenomatoso, o si la mucosa normal tenía capacidad para desarrollar por si sola un cáncer (de Novo). O lo que habíamos estado viendo con nuestros colonoscopios eran en realidad ¿lesiones planas? ¿adenomas planos?. Todos sabemos que muchas veces en estas pequeñas lesiones no quedan restos histológicos de adenoma. Lo cierto es que debemos rendir verdaderos honores a la Escuela Oriental que nos dio luz y claridad a estas tan controvertidas lesiones. Hoy la Escuela Genética del Este nos servirá para dar aún más claridad a la etiopatogenia y desarrollo de las mismas. Este siempre fue un problemas de los Países del Este, pero hoy la Westernización de los hábitos higiénico dietéticos de los Países Orientales, amenazan con aumentar la incidencia estadística del cáncer colorrectal, como bien lo expresa el Dr. Kudo. 82 PARTE 2 CAPÍTULO 5 La videocolonoscopia en las enfermedades inflamatorias del recto y colon La Videocolonoscopia hoy más que nunca ha venido a colaborar exitosamente en el hallazgo de las Enfermedades Inflamatorias del Colon y Recto. Todos los aparatos que ofrecen las principales firmas como Olympus®, Fujinon® y Pentax® en la Argentina, son todos de alta resolución y casi siempre vienen con la incorporación de la cromoscopía electrónica lo que hace aún más precisa la visión de la superficie colónica, con los cambios estructurales que la deforman, como son las E.I.I.; esto hace que podamos agrupar y diferenciar con patrones establecidos casi con una precisión del 90%, y diferenciar una Colitis Ulcerosa de una Enfermedad de Crohn o de otra Enfermedad Inflamatoria como la TBC , Parasitarias, Micóticas, etc. La lesión primaria de la Colitis Ulcerosa es la criptitis o absceso en la cripta de Lieberkun. Existe un infiltrado de polimorfonucleares en el extremo de la cripta con alteración degenerativa de célula epiteliales. La Microscopia Electrónica permite observar acortamiento de las microvellosidades intestinales, dilatación del retículo endoplásmico, tumefacción de Mitocondrias, ensanchamiento de espacios intercelulares y aumento de lisosomas. Se presentan microabscesos de las criptas. La confluencia de estos produce alteraciones superficiales de la mucosa que se manifiestan como úlceras. Los puentes mucosos que unen a estas formaciones se rompen en un determinado momento, dejando penachos de mucosa libre que es teóricamente el Pólipo Inflamatorio o Pseudopólipos. Todo este proceso en gran parte hoy es observado con mucho mayor detalle que los endoscopios de alta resolución por aparatos de alta precisión como el CEM (Confocal endomicroscopy) sistema este que logra observar las criptas y sus deformaciones con mayor claridad, además del edema intersticial y configuración de las células. La colitis ulcerosa es una enfermedad inflamatoria de la mucosa del colon, caracterizada por la presencia de múltiples úlceras, que se inicia en el recto y que 83 compromete el resto del colon en forma progresiva ascendente y simétrica. 146 La enfermedad puede presentarse como: forma fulminante aguda (5%), puede ser el primer episodio de la enfermedad o aparecer durante la evolución de una forma crónica. Forma crónica recurrente (64%) o crónica continua (31%). 147,148 Las características endoscópicas de la EII, tiene sus parámetros a seguir según sea el sector del Colon investigado. La CU como sabemos comienza en el Recto y desde este sector avanza en forma superficial sobre la mucosa al Sigma primero, al colon izquierdo y en un bajo porcentaje al colon derecho. La congestión y el edema con aumento de la trama vascular en las primeras etapas de la CU es un patrón compatible con otras enfermedades inflamatorias infecciosas o parasitarias, salvo la enfermedad de Crohn que tiene sus parámetros algo mejor definidos y que cuando toma al Colon lo hace en forma segmentaria (Colitis Segmentaria), y que por ser una enfermedad de la submucosa su apariencia endoscópica es granular o de empedrado (Cobblestone). En grados más avanzados la CU se muestra con erosiones y sufusiones hemorrágicas, ulceras características, edema y friabilidad, presencia de pus, y en grados donde la remisión ya ocurrió los Pseudopólipos dan un aspecto de crecimiento sobre una mucosa arrasada (ya no existe y solo se observa en sectores la submucosa con fibrosis). El diagnóstico diferencial de la Enfermedad Inflamatoria Intestinal (EII), debe realizarse con cualquier otra patología que curse con Diarrea y hemorragia del tubo digestivo distal , se incluyen Colitis Seudomembranosa por Clostridium difficile, la diarrea infecciosa aguda, Ileitis aguda por Yersinia, colitis actínicas, endometriosis, tuberculosis intestinal, estados de inmunodeficiencia adquirida, ulceras solitarias de recto, isquemia intestinal, colitis inducida por drogas y cáncer colorrectal.149 En general para todos los endoscopistas la siguientes características endoscópicas de la superficie mucosa para la diferenciación óptica de la CU y la enfermedad de Crohn son las siguientes, dando de antemano sobreentendido que la confirmación solo debe hacerse con la interpretación de la muestra biopsia: a) Las ulceras de la Colitis Ulcerosa nunca aparecen sobre mucosa sana, cuando lo hacen es otro tipo de Colitis. b) Las úlceras aftoides y longitudinales son patognomónicas de la Enfermedad de Crohn. El empedrado mucoso es característico de la Enfermedad de Crohn. c) Granularidad y friabilidad son comunes en la Colitis Ulcerosa. 84 La Asociación Americana de Gastroenterología (ASGE) en el 2006 dio las directrices o Guías para el diagnóstico endoscópico y tratamiento de la enfermedad inflamatoria intestinal.150 Esta es una de una serie de comunicaciones para discutir el uso de la endoscopia gastrointestinal en situaciones clínicas comunes. Las normas del Comité de la American Society for Gastrointestinal Endoscopy, preparó este texto de Prácticas. En la elaboración de esta guía, se usaron literaturas en MEDLINE, y se realizó la búsqueda de referencias adicionales que fueran obtenidas a partir de las bibliografías de los artículos identificados y a partir de las recomendaciones de consultores expertos. Que cantidad de datos existen prospectivos además de ensayos bien diseñados, dando énfasis a los resultados de las grandes series e informes de expertos reconocidos. Las Guías para el uso criterioso de la endoscopia se basan en una revisión de datos y de expertos consultados. Concluye la ASGE que se necesitan más estudios clínicos controlados adicionales para aclarar aspectos de esta Guía, y puede ser necesaria una revisión y modificación cuando aparezcan nuevos datos. En general estos lineamientos obedecen a desarrollar la Endoscopia como un importante método diagnóstico y aún terapéutico de la Enfermedad Inflamatoria Intestinal (EII), hacer el diagnóstico inicial, evaluar la extensión de la enfermedad, su actividad, monitorear el tratamiento, la respuesta al mismo, permitir la vigilancia de la displasia o neoplasia, y realizar tratamientos como la dilatación de las Estenosis. VIDEOCOLONOSCOPIA CON ILEOSCOPIA La Videocolonoscopia permite la visualización directa y la biopsia de la mucosa del recto, colon, y el íleon terminal a menos que esté contraindicado debido a una colitis severa o posible megacolon tóxico, una colonoscopia completa con intubación del íleon terminal se debe realizar durante la evaluación inicial de los pacientes con un cuadro clínico sugerente de EII. Debido a preparaciones en base a fosfato de sodio, y/o fármacos antiinflamatorios no esteroideos (AINEs). 151,152,153 Éstos pueden causar cambios en la mucosa imitando a EII. Estos causales se deben tener en cuenta antes de iniciar una Videocolonoscopia. 85 En nuestra Práctica diaria de la Colonoscopia, en la Unidad Digestiva Baistrocchi, desde la aparición en el mercado de los Fosfatos Monosódicos y Disódicos hemos observado muchas veces estas pequeñas Ulceraciones de tipo aftoides que simulan más una enfermedad Parasitaria o Micótica que una CUC, pero que debe tenerse en cuenta. No así en cambio con el uso del Polietilenglicol (PEG). Los pacientes con otras colitis pueden tener presentaciones clínicas similares y características endoscópicas similares a los pacientes con EII. Estos incluyen colitis infecciosa, colitis inducida por drogas, colitis isquémica, y colitis por radiación. El valor de la endoscopia sola en distinguir la EII de no-EII es limitada. 154 Sin embargo, la adquisición detallada de la información colonoscópica es un índice importante para el diagnóstico diferencial de EC (enfermedad de Crohn) y CU (Colitis Ulcerosa), ya que, una vez que la terapia se ha iniciado, puede ocultar características discriminantes de EC o de CU como colitis segmentaria (agregación) y escasa manifestación rectal. En el de estudio Tedesco,9 de 39 pacientes tratados de CU, solo el 44% de los pacientes tenían características endoscópicas claras de la enfermedad y el 13% tenían endoscopía con preservación rectal; el 33% tenían evidencia histológica de CU y el 15% tenían histología dudosa. En estos parámetros de porcentajes nos hemos encontrado en nuestra Unidad, y muchas de las veces (15 al 20%) el Anatomopatólogo tuvo dificultad de hacer el diagnostico. Las Colitis intermedias vinieron a ocupar esa franja de histología poco clara. En el momento de la colonoscopia, se debe prestar atención al área perianal porque las anomalías que se observan con frecuencia en el contexto de EC (Crohn) pueden ser muy útiles para orientar el diagnóstico. En particular, la endoscopia inicial o índice se utiliza para diferenciar la EC de la CU. Son la colitis segmentarias con ausencia de imágenes en el recto, la participación del íleon terminal, y la presencia de enfermedad anal. Otras características endoscópicas sugestivas de Crohn incluirá las ulceras aftoides, úlceras serpiginosas y empedrado de la mucosa. Sin embargo, ninguna de las características endoscópicas es específica para EC o CU. La Ileoscopía del Íleon terminal es importante para distinguir la verdadera ileítis del EC. Durante la Colonoscopia hay un gran porcentaje de veces que podemos intubar el Íleon y por consiguiente observar alguna alteración en el mismo como ulceras o estenosis, y tomar muestras Biopsias. 155,156 86 La biopsia de la mucosa es un componente crítico de la endoscopía para los pacientes con sospecha de EII para diferenciar IBD de otras causas de colitis tales como infección bacteriana, isquemia, y el uso de AINEs. Aunque no existe un único criterio patológico diagnóstico que pueda establecer definitivamente un diagnóstico de la EII, las muestras biopsias son el patrón fundamental a diferenciar EC de la CU y diferenciar EC y CU de otras colitis. Las muestras deben ser tomadas tanto de sectores endoscópicamente enfermos como de mucosa adyacente a la misma. Las muestras según algunos Autores deben ser tomadas a una distancia longitudinal siguiendo el eje del colon, a no más de 10 cm de diferencia, desde diferentes lugares y deben ser etiquetadas por separado. Aunque la presencia de granulomas sugiere EC, la frecuencia de detección de granulomas varía de 15% a 36% en las tasas de detección. 157 Fig. Nº 1. Colitis Ulcerativa (Pancolitis) tomadas con Olympus® Exera II la del medio con NBI, en donde se observa la desestructuración de los vasos superficiales (Microvasos). El último de la derecha la remisión con tratamiento médico del mismo paciente. Fig. Nº 2. Colitis ulcerativa crónica activa. Mucosa ulcerada con exudado fibrinoleucocitario en la superficie. Coloración H&E, 25X 87 Fig. Nº 3. Colitis ulcerativa crónica activa. Glándulas mucosas de Lieberkühn con disminución de la masa de células caliciformes y migración de neutrófilos intraepiteliales (flecha). Corion interglandular con denso infiltrado inflamatorio difuso mono y polimorfonuclear, con eosinófilos agregados. Coloración H&E, 25X Fig. N° 4. La primera de la izquierda con videocolonoscopia convencional de alta definición, CU que muestra edema, trazos de fibrina y erosiones múltiples. La segunda con Cromoscopía de Índigo Carmín que muestra apariencia Coraliforme. (Coral Reef Appearence de Fujiya) Y la última de la derecha en el mismo paciente, muestra la asociación de CU con un Pólipo Adenomatoso (Pit III L de Kudo). 88 Fig. N° 5. Radiografía que muestra las estenosis (Colitis Segmentaria) de Enf. Crohn. Endoscopia con Alta definición que muestra el empedrado de los granulomas submucosos, y la estenosis. Visto con Cromoscopía los mamelones no muestran lesión displásica y la mucosa solo muestra hiperplasia. Pieza operatoria con estenosis anular la de la izquierda. Pieza completa con tres (3) estenosis, en Sigma, ángulo esplénico y colon derecho. (Mismo paciente). Fig, N°6. Videocolonoscopia con Equipo Fujinon® y Cromoscopía de Índigo Carmín. CU con lesión “DALM” (ambas fotos). Obsérvese la destrucción total de la mucosa con mamelones inflamatorios y reducción del calibre, indicación absoluta de Cirugía. 89 Fig. Nº 7. Colitis ulcerativa crónica activa. Se observa un seudopólipo con displasia moderada del epitelio glandular (flecha). Corion interglandular con napas de infiltrado inflamatorio difuso mono y polimorfonuclear. Coloración H&E, 25X ENTEROSCOPIA – CAPSULA ENDOSCOPICA La Enteroscopia de pulsión tiene un papel limitado en la investigación de los pacientes con EII, especialmente en la era de la cápsula endoscópica (CE). La cápsula endoscópica (CE) permite la visualización directa y mínimamente invasiva de la mucosa del intestino delgado. Puede ayudar a identificar lesiones superficiales que no se pueden detectar mediante endoscopia y radiografía tradicional. Podría ser útil en el diagnóstico inicial de EC, para la detección de recurrencias, para establecer la extensión de la enfermedad, para evaluar la respuesta a la terapia, y para diferenciar EC de la CU o colitis indeterminada. El rendimiento diagnóstico de la Cápsula Endoscópica (CE) varía de 10% a 71%, dependiendo del entorno clínico. La CE ha demostrado ser más sensible en la detección de EC del intestino delgado que la tomografía computarizada (TC) (Enterografía). 158 Un estudio reciente realizado en 39 pacientes, la mayoría con CD conocida, informaron sensibilidad y especificidad de la CE, de 89,6% y 100%, respectivamente.159 Pocos estudios han evaluado el beneficio de CE en la evaluación de la Colitis Indeterminadas. Un estudio encontró que 5 de 22 pacientes con colitis indeterminada tenían erosiones y disrupción de la mucosa del intestino delgado en la CE, cambiando así su diagnóstico a EC. 160 90 La retención de la cápsula en pacientes con Enfermedad de Crohn es un evento indeseable pero que ocurre en el 1% al 13% de los pacientes sometidos a este estudio. 161 Este evento puede requerir cirugía en pacientes que no la necesitaban. Debido a este problema se recomienda realizar previamente una tránsito de intestino delgado (Rx) esto se debe a que un 22% de estos pacientes pueden tener una estenosis del intestino delgado asintomática. 162 Fig. N° 8. Imágenes de Cápsula Endoscópica, analizada por nuestros Médicos de la Unidad de Aparato Digestivo Baistrocchi. Córdoba. ENDOSCOPIA DE LA BOLSA ILEAL (Pouchoscopia) (Ileal Pouch Endoscopy). Ileal pouch anal anastomosis (IPAA), la Bolsa ileal (POUCH) se ha convertido en el tratamiento quirúrgico de elección para los pacientes con CU que necesitan una coloprotectomía total. El Pouch Ileal ha mejorado sin lugar a dudas la calidad de vida de estos pacientes portadores de Colitis Ulcerativa como también en la Poliposis Múltiple Familiar (PAF), aunque pueden surgir complicaciones. Además de las complicaciones postoperatorias inmediatas tales como pérdida de la bolsa por problemas isquémicos, abscesos pelvianos, inflamación a largo plazo conocidas como pouchitis, cuffitis, síndrome irritable de la bolsa. La Pouchitis es la complicación más común a largo plazo y la evaluación de los síntomas solo se confirman con la endoscopia. 163,164 y la evaluación histológica que permita el diagnóstico de Pouchitis. La cuffitis y estenosis de la bolsa son otras de las complicaciones comunicadas. En un trabajo reciente en el 2013, de la Cleveland Clinic Foundation, Cleveland, OH, USA, Zhu H, Wu X, Queener E. titulado “Valor clínico de la vigilancia en la Pouchoscopia en pacientes portadores de una bolsa ileal asintomáticos con 91 enfermedad inflamatoria intestinal subyacente”, 165 dicen los Autores que no hay consenso sobre la necesidad y el intervalo de vigilancia del Pouch Ileal en pacientes asintomáticos con bolsa ileal con Colitis Ulcerosa subyacente (UC). Se trató de evaluar la probabilidad de encontrar displasia o trastornos bolsa ileal incidental en pacientes asintomáticos sometidos Pouchoscopia de vigilancia. Un total de 138 pacientes cumplieron los criterios de inclusión, el intervalo medio desde el cierre de la ileostomía al inicio de la primera Pouchoscopia de vigilancia fue 89,4 ± 78,8 meses. Se encontró un paciente con displasia indefinida en la biopsia de la mucosa corporal de la bolsa (0,7%), y dos pacientes presentaron granulomas no caseificantes, lo que sugiere la enfermedad de Crohn (EC) de la bolsa ¡!. De los 138 pacientes, 69 (50%) tenían hallazgos endoscópicos anormales, 102 (73,9%) tenían inflamación aguda y / o crónica en la histología, y 62 (44,9%) tenían tanto endoscopia anormal como su histología. Los hallazgos endoscópicos anormales incluyen úlcera aislada de la bolsa (n = 29, 21%), pouchitis activa (n = 31, 22,5%), pólipos inflamatorios (n = 10, 7,2%), estenosis en la anastomosis (n = 5, 3,6%), de entrada (n = 10, 7,2%) o de salida (n = 2, 1,4%). Trece pacientes (13/17, 76,5%) con estenosis de la bolsa se sometieron a terapia de dilatación endoscópica con balón y a nueve se les realizó (9/10, 90%) polipectomía endoscópica. El análisis multivariable mostró que los pacientes con un diagnóstico preoperatorio de EC (Crohn) y manifestaciones extraintestinales concomitantes tenían un mayor riesgo de hallazgos endoscópicos anormales en la bolsa con un odds ratio de 2,552 (95% intervalo de confianza, 1,108 a 16,545, p = 0.035) y 4.281 (95% CI 1,204-5,409, p = 0,014), respectivamente. Concluyen los Autores que la Displasia es rara en pacientes asintomáticos con proctocolectomía restaurativa que se sometieron Pouchoscopia de vigilancia en este estudio transversal. Sin embargo, la endoscópica incidental anormal y / o hallazgos histológicos fueron comunes, que a menudo requieren intervención terapéutica endoscópica. En un Trabajo presentado por nuestro Grupo en el XXII Congreso Latinoamericano de Coloproctología y VII Jornadas Argentinas de Coloproctología realizadas en la Ciudad de Mendoza, Argentina, hicimos un cuadro comparativo entre las complicaciones más comunes de nuestro Grupo, con uno de los Grupos que más 92 experiencia tiene hasta la fecha en Argentina que es el Grupo del Hospital Bonorino Udaondo de la ciudad de Buenos Aires, dirigido por el Dr. Alfredo Graziano (Ex Jefe del Servicio de Coloproctología) que al cabo de 15 años logró reunir 500 bolsas realizadas en pacientes portadores de CUC y PAF. Fig. N° 9. Bolsa ya fabricada, colocada y anastomosada a la línea del Pecten en Pelvis. 93 (Graziano A. Masciangoli G Ileal Pouch Complications and treatment. New Trend in Coloproctology.J.A. Reis Neto. Revinter Edit. 295-316. 2000) (Cattaneo D. Cheli J. H.Santilli. RELATO OFICIAL COLOPROCTOLOGIA 2010.Complic. Intrabd de la Cir. Col. Compl. Pouch Ileal Rev. Arg. Coloproctología 2010. 22: 127-254. 2010 Comentador COMPL. POUCH ILEAL. DR. A. GRAZIANO.) (Wexner S et al. Ileal Pouch vaginal fistulas, Incidence, etiology and management. Dis.Col.and Rectum.1989,32 460.) (Ozuner G. Fazio V. What happens to a Pelvic Pouch when a fistula develops ? Dis.Col and Rectum 1997; 40:543-7) Es esta una Técnica quirúrgica que más beneficios ha dado en la sobrevida de todos los pacientes a los cuales se les realizó una coloprotectomía total, dándoles una calidad de vida aceptable, para reintegrarlos a su actividad Laboral y Familia. Fig.N° 10. Pouchoscopia, que muestra la Bolsa Ileal con sus dos líneas de sutura, superior e inferior. Una vista de mayor aproximación que muestra con claridad la superficie mucosa del Intestino Delgado con el que se fabricó la Bolsa. La inflamación de la Bolsa que lleva a la Pouchitis es un ejemplo de Enfermedad Inflamatoria Intestinal en el Ser Humano y su evolución biológica podría 94 tener similitudes, remedando elementos de la patogenia de la CUC, como hace unos años lo demostrara la Universidad de Los Ángeles. California. 166 Se trataría de un cuadro fundamentalmente clínico asociado a signos histológicos macro y microscópicos de inflamación idiopática e inespecífica del Reservorio Ileal constatado por vía endoscópica. Diarrea acuosa, trazos de sangre, urgencia defecatoria, cólicos abdominales, incontinencia.167,168 ¿Qué es la inflamación de la mucosa ileal? El Dr R. Nicholls. en el 18th Annual International Col. Rec. Diseases Symposium. Cleveland Clinic. Fl. 2007 expresaba que aunque la metaplasia Colónica completa no se produce, es posible que la Colonización que se ve dentro de la Bolsa puede actuar como blanco Inmunológico especialmente en pacientes con CUC. Por lo tanto podría ser responsable de desarrollar inflamación de la Bolsa con la gravedad clínica suficiente para ser un verdadero problema y en ocasiones es necesario levantar la Bolsa. Los cambios morfológicos de la superficie intestinal del POUCH, comienzan desde el primer día del cierre de la ileostomía de protección, y por los 6 meses subsiguientes, algunos pacientes son propensos a desarrollar una POUCHITIS que se manifiesta por cambios agudos inflamatorios tipo “C”.21 no tiene hipervínculo Tras el cierre de la Ileostomía la mucosa Ileal en la Bolsa está expuesta a heces que contienen concentraciones de bacterias en 1 millón o más, que son las que se encuentran en el Íleon terminal. Durante los primeros 6 meses se lleva a cabo una atrofia de las vellosidades tanto en los pacientes con CUC o PAF. En los pacientes con CUC la infiltración de las células de cobertura del POUCH es algo muy común de ver en las Pouchoscopias. Se pueden observar manchas Características de “COLONOCITOS” que han perdido la actividad de las DISACARIDASAS. 95 Fig. N° 11. En Las fotos de Pouchoscopia, se observan con alta resolución y Cromoscopía los Parches mucosos. (Colonocitos) .169,170 En la República Argentina sabemos aproximadamente de las Complicaciones del Pouch, gracias a la encuesta que hiciera el Dr. Daniel Cattaneo en su Relato del XXXV Congreso Argentino de Coloproctología, (129) Complicaciones Intraabdominales de la Cirugía Coloproctológica, Complicaciones del Pouch Ileal como lo hace Ud.: Fig. N° 12. Esquemas que representan las complicaciones tempranas y tardías del Pouch en la Rep. Argentina. Fig. N° 13. Esquema demostrativo y comparativo con las complicaciones del Pouch Ileal de la Ochsner Fundation Hospital en un periodo de 1995-2005, en donde muestra resultados muy similares a los de los Cirujanos Argentinos 96 Fig. N° 14. Pouch Ileal. La primera foto de la izquierda observa la anastomosis de la Bolsa Ileal a la línea Ano-cutánea. La del medio y la derecha con equipo Fujinon, una visión directa con Cromoscopía de Índigo Carmín. Se observa la línea de sutura que se realizó con Lineal Cortante dos de 7,4 cm. Se pueden observar con claridad las Vellosidades del Intestino Delgado. Fig.N° 15. Pouch Ileal realizado en paciente de 38 años portadora de una Poliposis Familiar Múltiple. El Sistema es de Videocolonoscopio es Olympus Exera II , la imagen de la derecha es con NBI (Narrow Band) en donde se aprecia la superficie del tejido mucoso del Intestino Delgado. Pequeñas neoplasias colorrectales planas, en pacientes con colitis ulcerosa, detectada con cromoscopía y magnificación. En un excelente trabajo Edgar Jaramillo, Watanabe y Col. Del Hospital Karolinska, Suecia,171 investigaron 85 pacientes que desarrollaron una Colitis Ulcerosa extensiva total más allá del ángulo esplénico, con un promedio de 10 años de duración, dentro de un plan de detección y control del Cáncer Colorrectal en Suecia. Sus resultados son muy interesantes pues brindan la posibilidad a este método de magnificación apoyado por la cromoscopía, de detectar pólipos neoplásicos, con la posibilidad también de estudiar el posible rol de la histogénesis del cáncer colorrectal en la colitis ulcerosa. 97 Este grupo estudia 85 pacientes portadores de Colitis Ulcerosa, encontrando Pólipos no inflamatorios (pseudopólipos) en 38 pacientes, los cuales eran portadores de 104 lesiones sésiles y pediculadas. De estas 77 (74%) fueron planas 21 (20%) sésiles y 3 (3%) pediculadas. Lo interesante del trabajo fue el hallazgo de Pólipos Neoplásicos 23 (22%), cuya distribución morfológica se distribuyó de la siguiente manera; planos 15, sésiles 5 y 3 pediculados. De estos 21 eran de bajo grado de displasia, y 2 de alto grado, encontrando en uno de ellos invasión carcinomatosa submucosa. Blackstone, Riddell y cols 172, en 1981, publican un excelente trabajo referido al hallazgo en Colitis Ulcerosa de larga data, DALM ("Dysplasia Associated Lesion or Mass”) Estas lesiones son indicadoras de alto riesgo de Cáncer. Los autores llaman la atención a que estas lesiones elevadas o planas deben ser biopsiadas durante el transcurso de una Colonoscopia, pues podría pasar inadvertida una Displasia de alto grado, y podría en otro lugar del colon haber un cáncer invasor, por lo que de estar presente e histológicamente comprobada, aconsejan la cirugía. En un magnífico trabajo del 2005, Hurlston, Sanders, Lobo y cols 173 del Hospital Royal Hallamshire, Sheffield del Reino Unido, demuestran con dos grupos control, a pacientes portadores de Colitis Ulcerativa crónica de más de 8 años de evolución, uno realizado con Colonoscopia convencional, y el otro con magnificación y coloración con Índigo Carmín (Cromoscopía), que en el grupo que se realizó Colonoscopia con Magnificación y Cromoscopía el hallazgo de lesiones intraepiteliales neoplásicas fue sensiblemente mayor al grupo de Colonoscopia convencional. Los Autores usaron para la detección de las lesiones, la Clasificación de Kudo. En nuestro Centro de Endoscopia, sobre 192 (1,25%) pacientes portadores de Colitis Ulcerativa, encontramos 15 (7,81%) portadores de Displasia leve, 13 (6,77%) Displasia moderada, Displasia severa 2 (1,04%) y un paciente portador de un Adenocarcinoma (0,4 %). 98 Fig. Nº 16. Cuadro de colitis ulcerativas por videocolonoscopías con displasia. El Dr Fernando Velayos de California opina al respecto sobre el Adenocarcinoma Colorrectal y su relación con las EII (Enfermedades Inflamatorias Intestinales) en una comunicación titulada; Cáncer Colorrectal y EII - ¿Qué dice la evidencia?174 Hace un estudio comparativo de frecuencia de la enfermedad y la aparición de la displasia. Establece los parámetros de búsqueda de la enfermedad CU, y la importancia de la interpretación de la muestra Biopsia. El cáncer colorrectal es una complicación temida en la inflamación del colon de larga data. 175 El riesgo de cáncer se incrementa 6 veces más en los pacientes con enfermedad inflamatoria intestinal (EII) en comparación con la población general, y es una causa importante de mortalidad en la EII. 176 Varios estudios epidemiológicos importantes y los ensayos clínicos fueron presentados durante la reunión del año 2007 en la Digestive Disease Week (DDW) que abordó temas difíciles en el área de cáncer colorrectal y la EII, incluyendo el momento adecuado de la colonoscopia de vigilancia en la EII, el uso de la cromoendoscopia para la vigilancia del cáncer en la EII, la historia natural de la displasia polipoide en la EII, y los factores de riesgo para el cáncer de intestino delgado. 99 Momento adecuado de Vigilancia de la Videocolonoscopia en la EII En un intento de detectar displasia precancerosa y cánceres asintomáticos en pacientes con EII, las principales sociedades de gastroenterología recomiendan iniciar la vigilancia colonoscópica comenzando 8-10 años después de la aparición de la enfermedad en la pancolitis y después de 15 a 20 años para la colitis del lado izquierdo. Sin embargo, no hay una fuerte evidencia científica que apoye estos puntos de partida. En un estudio presentado durante la DDW 2007, Lutgens y cols 177 utilizan una base de datos automatizada de la patología a nivel nacional para identificar a los pacientes con diagnóstico de cáncer colorrectal asociado a la EII en todos los centros médicos universitarios en los Países Bajos entre los años 1990 y 2006. Determinaron cuántos pacientes desarrollaron cáncer colorrectal antes del tiempo que se recomienda comenzar la vigilancia. Entre 104 pacientes diagnosticados con EII y cáncer colorrectal, el 26% desarrolló cáncer colorrectal antes del inicio de los controles recomendados, aunque estos datos sugieren que el diagnóstico de cáncer colorrectal se puede retrasar o perder el uso de los concejos de vigilancia actual, y no está claro cuál es el punto o el tiempo apropiado para iniciar la vigilancia, ya que aparentemente en cualquier momento de la evolución de la enfermedad desarrollaran cáncer antes del comienzo de la vigilancia . El uso de la cromoendoscopia para la Vigilancia del Cáncer en la EII. En las recomendaciones actualmente, la detección de displasia precancerosa en la EII son un reto para el endoscopista porque las lesiones son planas, sutiles o difíciles de detectar en la colonoscopia de vigilancia convencional. 178,179 Por otra parte, pocos médicos toman las 32 biopsias de colon necesarias para detectar displasia plana.180 A fin de mejorar la detección y la visibilidad de estas lesiones displásicas planas y sutiles, la cromoendoscopia, que consiste en la pulverización colorantes (azul de metileno o índigo carmín) en la mucosa del colon, se ha defendido como una buena estrategia de vigilancia. 181 Durante la reunión de ese año, se presentaron los resultados de 2 estudios prospectivos, utilizando diferentes colorantes para la cromoendoscopia. Estos estudios proporcionaron datos importantes que apoyan la idea de que la cromoendoscopia incrementa la detección de las displasias en 100 comparación con la estrategia de vigilancia con Videocolonoscopios de luz convencional. 182,183 En el primer estudio, Kandiel y cols, realizaron colonoscopias-backto-back en 21 pacientes con colitis ulcerosa, 9 con enfermedad de Crohn, y en 3 pacientes con colitis indeterminada. La primera colonoscopia consistió en un cuidadoso examen del colon con fotografía de las lesiones (colonoscopia convencional), y en el segundo, con pulverización de colorante índigo carmín al 0,1%, con la identificación y toma de muestras de las lesiones planas y polipoides. Los autores del estudio encontraron 4 lesiones polipoides con el primer estudio de colonoscopia convencional, y 6 con el segundo, encontrando así 2 lesiones adicionales con cromoendoscopia. No se detectó displasia en las biopsias. En el segundo estudio, Marion y cols. realizan colonoscopias de vigilancia en tándem en 102 pacientes con EII (79 con colitis ulcerosa, 23 con enfermedad de Crohn) y se compararon 3 métodos de detección. El primero consistió en la colonoscopia con 4 biopsias aleatorias tomadas cada 10 cm en todo el colon con un total de al menos 32 biopsias (Método A). La segunda colonoscopia consistía en un protocolo de biopsia dirigida (Método B), luego realizaban las biopsias con un protocolo de biopsias orientadas con tinción segmentaria del colon usando 0,1% de azul de metileno (Método C). Los autores del estudio encontraron que (biopsias dirigidas con spray de tinte) (Método C) revelaron mayor cantidad de displasias (17 lesiones) que lo que logró el Método B (9 lesiones) o Método A (3 lesiones). Concluyen los Autores que el uso de la cromoendoscopia para la vigilancia en la EII no está en los protocolos generales a seguir; sin embargo, estos estudios se suman a un creciente cuerpo de literatura que sugiere que esta técnica puede mejorar la detección de la displasia en la EII. El protocolo óptimo para la cromoendoscopia, particularmente con respecto a biopsias dirigidas y tipo de tinte de usar, queda por determinar. La historia natural de la displasia polipoide en la EII. Independientemente del método de detección, una vez que se detecta displasia, la mayoría de los expertos recomiendan la proctocolectomía debido a un alto riesgo de encontrar un cáncer oculto en la muestra de colectomía, o así como por el 101 riesgo de un futuro cáncer. Los estudios de la historia natural de las Displasias más antiguos muestran que sólo el 19% de los pacientes que tienen displasia deben someterse a una colectomía inmediata. El 50% de los pacientes con displasia polipoide ya tienen un cáncer oculto en la muestra de la pieza de la colectomía, y el 43% son diagnosticados con cáncer en las futuras colectomías. 184 Velayos y cols. 185 evaluaron una cohorte moderna de 97 pacientes con colitis ulcerosa para determinar la displasia y si estos datos han mejorado desde la cohorte histórica dada la técnica de imagen y muestreo endoscópico mejorado. En este estudio de cohorte retrospectivo, sólo el 26% de los pacientes (25/97) fueron sometidos a colectomía en un plazo de 4 meses con un diagnóstico de displasia; el 50% de los pacientes con displasia polipoide ya tenía un cáncer oculto en la muestra de la colectomía, y el 55% fueron diagnosticados con cáncer en las futuras colectomías. Es de destacar que la descripción del endoscopista de la lesión polipoide tuvo un impacto significativo en la probabilidad de encontrar cáncer oculto. No se detectaron cánceres ocultos en pacientes con pólipos simples. Sobre la base de estos datos, los autores del estudio concluyeron que la colectomía inmediata su indicación está todavía garantizada en la displasia polipoide; sin embargo, los pólipos simples pueden ser manejados de manera diferente. Se necesita más investigaciones en esta área. Kisiel y cols186, determinaron la historia natural de la polipectomía en los adenomas esporádicos, adenomas como DALM (lesiones o masas con displasia asociada) en 102 pacientes con colitis ulcerosa; 85 de 102 pacientes fueron sometidos a una polipectomía. De estos 85 pacientes, el 49% tenía una DALM-adenoma en la pieza de resección, y el 51% tenían adenomas esporádicos. Los autores del estudio encontraron un mayor riesgo de displasia plana posterior o cáncer (6%) en estos 85 pacientes que se informó anteriormente (0% al 3%). Por lo tanto, mientras que la polipectomía parece ser una estrategia segura para el tratamiento de los adenomas que se producen en la colitis ulcerosa, este enfoque no deja de tener cierto riesgo dado el riesgo mayor de lo esperado en desarrollar displasia plana o cáncer después de la polipectomía. En un excelente artículo reciente publicado por una de las revistas más prestigiosas del mundo el New England Journal of Medicine, Laurent Beaugerie, y Steven H. Itzkowitz, hacen una excelente Review, sobre en qué medida afecta el 102 Cáncer de distintos órganos en la Enfermedades Inflamatorias del Colon 187. Opinan al respecto que la enfermedad de Crohn y la colitis ulcerosa son enfermedades inflamatorias del intestino de toda la vida de origen desconocido, que generalmente comienzan en la edad adulta. Se estima que al menos el 0,4% de los europeos y norteamericanos viven con estas enfermedades inflamatorias intestinales.188 La expectativa de vida se reduce en pacientes con enfermedad de Crohn y en pacientes con colitis ulcerosa que se diagnostica cuando la colitis es ya extensa o que se diagnostica en la juventud. 189,190 Hay un mayor número de muertes por infecciones, enfermedades cardiovasculares y cánceres en pacientes con esta enfermedad inflamatoria intestinal. Existen algunas diferencias en desarrollar un cáncer entre los pacientes con enfermedad inflamatoria intestinal y la población en general, que pueden ser el resultado de diferencias en factores relacionados al estilo de vida. Por ejemplo, los fumadores están en un riesgo mayor entre los pacientes con enfermedad de Crohn, y este riesgo aumentado es el resultado en una tasa mayor de cánceres relacionados con el tabaquismo en la población total con enfermedad de Crohn, por el contrario, los no fumadores están sobrerrepresentados entre los pacientes con colitis ulcerosa, por lo que hay una disminución de la tasa de este tipo de cáncer en la población total con colitis ulcerosa.191 El objetivo de esta revisión es sobre las características epidemiológicas, la carcinogénesis, y la prevención del exceso de cánceres que puede atribuirse a la inflamación intestinal crónica o para los efectos cancerígenos de los fármacos inmunosupresores utilizados para tratamiento de la enfermedad inflamatoria intestinal. Factores de riesgo en la colitis ulcerosa y enfermedad de Crohn El cáncer colorrectal es el tercer cáncer más común del mundo. 192 El cáncer colorrectal esporádico y el cáncer en la colitis asociada pueden desarrollarse en pacientes con ambas enfermedades inflamatorias. Los principales factores de riesgo para el cáncer colorrectal esporádico aumentan después de los 50 años, sexo masculino, y un historial de cáncer colorrectal en familiares de primer grado. Aunque los factores de estilo de vida aumentan en un 20% el riesgo de cáncer colorrectal 103 esporádico, estos no se han evaluado en pacientes con enfermedad inflamatoria intestinal. Los factores de riesgo para el cáncer colorrectal que son específicos de los pacientes con enfermedad inflamatoria intestinal han sido identificados en los registros de estudios de la población,193 estudios cohortes en todo el país (Reino Unido), 194,195 y cohortes 196,197 Los pacientes con enfermedad inflamatoria del intestino sin participación del colon y pacientes con colitis ulcerosa limitada al recto no tendrían un riesgo aumentado para desarrollar un adenocarcinoma colorrectal.47 En contraste, los pacientes con colangitis esclerosante primaria asociados con la enfermedad inflamatoria del intestino están en alto riesgo de adquirir un cáncer colorrectal, desde el momento de su primer diagnóstico.48 En otros pacientes con la enfermedad inflamatoria intestinal, el aumento de riesgo de cáncer colorrectal, en comparación con el riesgo entre personas de la misma edad y sexo sin enfermedad inflamatoria intestinal, está incrementado por la extensión, duración y severidad de la inflamación del colon. Hasta un 15% de los cánceres colorrectales que se producen en los pacientes con enfermedad inflamatoria intestinal son diagnosticados dentro de los primeros 7 años de enfermedad, 198,199 pero el aumento de riesgo de cáncer de la colitis asociada se convierte en riesgo aumentado después de ese tiempo, y epidemiológicamente se incrementa linealmente, con una pendiente más pronunciada en los pacientes con colitis extensa. Además, las características de evolución en la colitis anterior o teniendo una actualmente activa, 200,201,202 incluyendo pseudopólipos e inflamación de la mucosa, son factores de riesgo independientes para el cáncer colorrectal. Ya sea en una edad temprana al momento del diagnóstico de la enfermedad inflamatoria intestinal que es un factor de riesgo independiente de la duración de la enfermedad es un concepto bastante controvertido. En contraste con el riesgo relativamente alto de contraer un cáncer colorrectal (aproximadamente 0,5% al 1% por año) se sugirió en un meta-análisis del 2001 203 una disminución progresiva en el riesgo de cáncer colorrectal en pacientes con enfermedad inflamatoria intestinal, controlados durante largo tiempo.48 basado en la población danesa. Esta tendencia, fue confirmada en otro metaanálisis, 204 y se atribuyó a un mejor control de la inflamación, mejorando la vigilancia endoscópica, el 104 aumento de la indicación temprana de la colectomía en algunos países, y el posible efecto quimiopreventivo de 5-aminosalicilatos (5-ASA). Se sabe mucho acerca de los eventos genéticos moleculares que conducen a la aparición y progresión del cáncer colorrectal esporádico, 205 aunque el factor o los factores que desencadenan la carcinogénesis ambiental aún no se han dilucidado. La patogénesis molecular del cáncer en la colitis está asociada a muchas características del cáncer colorrectal esporádico, pero hay diferencias con respecto a la sincronización y la frecuencia de algunas alteraciones en la secuencia displasia-carcinoma. Se asume que la inflamación crónica es la base de la causa de la colitis asociada a cáncer, con daño en el ADN inducido por el estrés oxidativo que resulta en la activación de genes procarcinógenos y silenciamiento de las vías de los supresores. Nuevas perspectivas desde el estudio de modelos animales sugieren que tanto el inicio y la progresión de la neoplasia de colon pueden ser exacerbados o acelerados por la agresión inflamatoria. 206 Por otra parte, los estudios de mapeo de la mucosa indican que la mucosa del colon con inflamación crónica en los pacientes con enfermedad inflamatoria intestinal se somete a un "cambio de campo" de las alteraciones moleculares asociadas con el cáncer antes de que haya evidencia histológica de displasia. 207,208 Esto sugiere que la mucosa del colon inflamado crónicamente está preparado para desarrollar cambios precancerosos y cancerosos multifocales. Por ejemplo, las mutaciones TP53 se producen antes de la aparición de la displasia como un cambio de campo en la inestabilidad de los microsatélites en la mucosa del colon humano,209 una metilación aislada CpG, y las alteraciones de micro ARN se han descrito en las fases tempranas de la neoplasia 210 tanto esporádica como colitis asociada a neoplasia. La vigilancia exitosa para la neoplasia colorrectal depende de la cooperación adecuada del paciente, la limpieza intestinal adecuada, toma de suficientes muestras de la mucosa, y la habilidad del endoscopista para reconocer las lesiones displásicas. La presencia de estenosis, mucosa activamente inflamada y pseudopólipos inflamatorios hace la colonoscopia de vigilancia más difícil. Al igual que en el cáncer colorrectal esporádico, en el que la lesión displásica precursora es por lo general un pólipo visible, en la colitis, la mayoría de las displasias son también visibles en el colon. 211 Sin embargo, las lesiones displásicas en la colitis a menudo son más planas y tienen bordes 105 a veces no definidos, y pueden incluso no ser visibles cuando se utilizan técnicas endoscópicas estándar. Esto ha llevado a la recomendación de realizar extensas biopsias en todo el colon y recto, teniendo el cuidado de marcar las lesiones elevadas o sospechosas. Las técnicas endoscópicas más nuevas, especialmente la colonoscopia de alta definición con luz blanca y cromoendoscopia con tinción de índigo carmín, o cromoscopia electrónica (NBI/FICE/IScan) mejoran la detección de la displasia, en comparación con el estándar de la colonoscopia de luz. Fig. N° 17. “Cancers Complicating Inflammatory Bowel Disease”.212 Fases e interfases de acción de Genes supresores y activadores, en comparación del cáncer esporádico con la Enfermedad Inflamatoria Intestinal. 106 Fig. N° 18. Casuística personal. Imágenes de Videocolonoscopia con Cromoscopía que muestra lesiones planas en la “Colitis Ulcerosa” una con severa displasia. Y la otra una lesión plana adenomatosa con inclusión displásica severa, rodeada de Pseudopólipos, lo que hace difícil a veces pese a la coloración elegir el sitio de la biopsia. Fig.N° 19. Las imágenes de la derecha y del centro son tomadas con el Sistema Olympus CV Exera II NBI, y el de la derecha con Sistemas CV Fujinon y Cromoscopía de Índigo Carmín. La clasificación de este estado de Colitis Ulcerosa es, Grado 3; Minute Defects of Ephitelium (Mínimos defectos del Epitelio) de la Clasificación de Fujiya. Es un grado avanzado de la enfermedad, la foto central muestra moco y pus. 107 Las Clasificaciones Endoscópicas de la Colitis Ulcerosa fueron siendo modificadas a través de los años a medida que los sistemas ópticos fueron mejorando en su definición, y entendiendo mejor la evolución o regresión de esta enfermedad de características clara de Autoinmunidad específicamente contra las células del colon. En su evolución primero congestiva y edematosa, generalmente en el Recto y continuando en su extensión a toda la superficie mucosa del colon, ganando profundidad de la mucosa a la submucosa, e Histológicamente con etapas muy claras, ayudó a la Endoscopia a interpretar las imágenes que hasta el día de hoy continúan evolucionando en su interpretación. Uno de los Trabajos más contundentes en la interpretación de las imágenes endoscópicas de la Colitis Ulcerosa fue el publicado por Mikihiro Fujiya y colaboradores en el año 2002, “Pequeñas imágenes y hallazgos colonoscópicos de magnificación, son útiles para la evaluación de la colitis ulcerosa. “ 213 En este trabajo por primera vez en la era de la Magnificación, Cromoscopía y alta resolución de imágenes se describen los distintos grados de la Enfermedad, marcando su interpretación y peligrosidad de acuerdo a la imagen de nuevas recaídas en muy corto tiempo. Decia el Prof. Fujiya en este artículo que la colonoscopia tiene un papel importante en el diagnóstico de la Colitis Ulcerosa. Sin embargo, los hallazgos endoscópicos son inadecuados para la predicción de una recaída sin examen histológico. En este estudio, se evaluó el papel de magnificar la colonoscopia en la colitis ulcerosa. La colitis ulcerosa (CU) es una enfermedad crónica que se caracteriza por la inflamación difusa de la mucosa del colon. Habitualmente tratamos a estos pacientes con aminosalicilatos, corticosteroides214,215,216,217 y agentes inmunosupresores. 218,219 Los criterios clínicos basados en los síntomas han sido de uso común para evaluar la actividad de la enfermedad 220 en lugar de los hallazgos colonoscópicos o clasificación histopatológica de muestras biopsias. Los criterios clínicos son considerados y apropiados como método no invasivo para estimar la calidad de vida. Sin embargo, cuando se utilizan solo criterios clínicos para evaluar la actividad de la enfermedad, el 40% de los pacientes en los que se logra la remisión de la enfermedad hay un alto promedio de recaída dentro del primer año 221. Esta alta tasa de recaída 108 puede explicarse por el hecho de que la terapia que induce a la remisión fue suspendida en pacientes que clínicamente se pensó que habían remitido según los criterios clínicos, pero el 30% al 60% de estos pacientes en realidad continuaban teniendo la enfermedad activa, si nos basábamos en los hallazgos histopatológicos.222 Por lo tanto, los criterios clínicos son considerados como insuficientes para la evaluación de la remisión. Se necesitaba un método alternativo que refleje con precisión la remisión, uno que evite la posibilidad de recaída temprana. Continúa el Autor diciendo; la evaluación histopatológica de las muestras de biopsia se consideran el estándar para la evaluación de actividad de la enfermedad en pacientes con CUC porque la recaída se puede predecir por los hallazgos tales como la infiltración de leucocitos, la erosión de la superficie, y microabscesos crípticos. 223 Por esta razón, se recomienda siempre la toma de muestras Biopsias múltiples. Como alternativa, la colonoscopia ha sido considerada como potencialmente útil para la evaluación de la actividad de la enfermedad que ofrece la observación directa de cambios superficiales en la mucosa. Se han propuesto numerosas clasificaciones colonoscópicas para este fin,224,225,226 pero sigue siendo controvertido si la clasificación colonoscópica se correlaciona con los hallazgos histopatológicos. 227 Las colonoscopias de magnificación ya se han utilizado principalmente para el diagnóstico de la neoplasia colorrectal. 228 Sin embargo, sólo unos pocos estudios retrospectivos han usado este tipo de endoscopio en pacientes con CUC 229 En el estudio del Dr. Fujiya se usó la Videocolonoscopia Magnificada de alta resolución y la Cromoscopia para desarrollar una nueva clasificación de los hallazgos colonoscópicos en pacientes con CU, una que es más sencilla que las clasificaciones previamente propuestas. Con esta nueva clasificación se compararon las imágenes obtenidas con la histopatología de las muestras. Además, un grupo de pacientes con CUC se estudió de forma prospectiva para determinar si los resultados de la videocolonoscopia magnificada y la Cromoendoscopia podrían predecir la recaída de la enfermedad. 109 Clasificación de los hallazgos histopatológicos: Se utilizaron los criterios propuestos por Matts y cols. 230 Clasificando los hallazgos histopatológicos de la siguiente manera: Grado 1, aspecto completamente normal; Grado 2, moderada infiltración de la mucosa o la lámina propia, ya sea con células redondas o leucocitos polimorfonucleares; Grado 3, marcada infiltración celular de la mucosa, lámina propia, y la submucosa; Grado 4, presencia de abscesos en las criptas, con marcada infiltración de todas las capas de la mucosa; y Grado 5, ulceración, erosión, o necrosis de la mucosa, con infiltración celular de algunas o todas las capas. El Grado 1 se consideró como una fase de inactividad de la CU, mientras que los grados 2 a 5 se consideraron como de enfermedad activa. Recordemos que a la fecha se conocen varias modalidades histopatológicas de la Colitis Ulcerosa, incluyendo la Colitis Microscópica (Microscopic Colitis) que ya fuera descripta por Lindström en 1976,231 y este año (2015) en un magnífico trabajo el Prof. Bodil Ohlsson del Dto. De Ciencias Médicas División de Medicina Interna del Skane Hospital University, de Malmo Suecia, 232 informa de los criterios clínicos e histológicos cada vez más claros de la Colitis Microscópica. Estos Grados de tipificación Histológica que publica el Dr. Fujiya son en realidad los patrones básicos de esta Enfermedad. Clasificación de los hallazgos en Videocolonoscopia de luz convencional. Una de las clasificaciones más usadas que se utilizan para los grados de actividad de la CU endoscópicos, también propuesta por Matts84 en los años 60 es: Grado 1, la mucosa aparece completamente normal; Grado 2, granularidad leve y friabilidad de la mucosa que puede provocar un sangrado leve; Grado 3, marcada granularidad y edema de la mucosa, sangrado de contacto, y sangrado espontáneo; y Grado 4, ulceración severa de la mucosa con hemorragia. Clasificación de los hallazgos con Videocolonoscopia Magnificada Esta Clasificación que propone el Dr. Fujiya es la que hemos adoptado en estos últimos años, agrupando los enfermos y correlacionándolos con la Histopatología, siendo los resultados de muy buena sensibilidad. 110 Este nuevo sistema de clasificación simplificado fue ideado en base a hallazgos mínimos en el que se incluyen los conceptos descritos anteriormente. La clasificación está compuesta por 5 categorías de la siguiente manera: 1, regularly arranged crypt openings, round in shape (las aberturas de las criptas están dispuestas regularmente, de forma redonda. 2, villous-like, shaggy, appearance similar to that of small intestinal villi without typical crypt openings (de aspecto velloso, lanudo, de apariencia similar a la de pequeña vellosidades intestinales sin aberturas típicas de las criptas, e histológicamente asociado con la regeneración de la mucosa colónica. 3, Minute Defects of Ephitelium (Mínimos defectos del epitelio (MDE) que aparecen como minimas depresiones poco profundas rodeadas de mucosa edematosa con aberturas de las criptas dispuestas irregularmente), correspondiente a la microerosiones descriptas por Tada y cols.83. 4, small yellowish spots (SYS) that appear as minute patches of whitish or yellowish coat (pequeñas manchas amarillentas (SYS) que aparecen como pequeños parches de color blanquecino o amarillento. 5, coral reef-like appearance (aspecto de coral) que incluye la mucosa engrosada o nodular con ulceraciones. Ejemplos de esta Clasificación original del Dr. Fujiya, comparadas las imágenes con las obtenidas por nosotros y con el Dr. Manuel Lorenzo, Aparato Fujinon de Magnificación, con Cromoscopía de Índigo Carmín. Fig N° 20. Grado 1: Regular Arranged Crypt openinngs.“Round Shaped Crypts”. 111 Fig. N° 21. Grado 2: Villus – Like appearence. Fig. N° 22. Grado 3; Minute Defects of Ephitelium. Fig. Nº 23. Grado 4 ; Small Yellowish Spot. Fig. N° 24. Grado 5; Coral Reef-Appearance. (Es este el estadio predictor de nuevos Pousses, en no menos de 6 meses, según al Autor) 112 El Autor compara la sensibilidad y especificidad de la Colonoscopia convencional con la Colonoscopia de Magnificación y Cromoscopía, para comparar los pequeños hallazgos y compararlos a su vez con los Histopatológicos. Estos fueron comparados por el Spearman Coefficient 233 y el rango de correlación de las curvas de supervivencia se construyó con el método de Kaplan-Meyer. Las distribuciones univariadas de supervivencia se compararon con el Breslow-Gehan-Wilcoxon test.234 Paso a paso se realizó un análisis multivariado de la supervivencia por el modelo de riesgo proporcional de Cox 235 para determinar si la presencia o ausencia de MDE (minute defects of epithelium) fue un factor predictivo independiente para la recidiva. El método de Bonferroni se utiliza para corregir los niveles de significación para la prueba múltiple de los datos en las pruebas univariadas de importancia. El análisis de los factores predictivos de recidiva se hizo sin corrección, lo que hizo en un entorno multivariante mediante el análisis de riesgos proporcionales del modelo Cox, un valor de p <0,05 que fue considerado estadísticamente significativo. Este trabajo tuvo la virtud de introducir en el mundo entero las posibilidades diagnósticas de la Colonoscopia Magnificada y la Cromoscopía que ya habían sido demostradas sus cualidades en la detección precoz de pequeñas lesiones. Su adaptación a la Enfermedades Inflamatorias, en especial en la CUC, son todavía hoy respetadas y valoradas por muchas Escuelas Endoscópicas del mundo. La capacidad de hacer estas distinciones con la Colonoscopia Magnificada y la Cromoscopía es tanto clínicamente beneficiosa como las ventajas adicionales de la comodidad en la evaluación rápida de la actividad de la enfermedad en pacientes con CU. La CEM (Confocal endomicroscopy) se puede utilizar con una gran precisión en el diagnóstico de la lesión o masa displasia asociada (DALM) en el entorno de la Enfermedad Inflamatoria Intestinal, CEM fue utilizado en un estudio de 36 pacientes con colitis ulcerosa que tenían un DALM diagnosticado dentro de las 16 semanas anteriores236 el coeficiente Kappa de acuerdo entre las imágenes de histopatología y endomicroscopía confocal tradicionales fue de 0,91 con un 97% de precisión. Esta técnica in vivo permitió la diferenciación entre los dos diferentes tipos de mucosas, lo que ofrece una oportunidad de seguridad en determinar qué pacientes requieren 113 derivación inmediata para colectomía total frente a los pacientes que se les podría realizar una resección endoscópica. Del total de las Colitis Ulcerosas 192 pac. (1,25%) del total de Videocolonoscopias realizadas solo el 15% fueron Pancolitis, el 40% tomaban al Recto y Sigma, 45% al Colon izquierdo y todas afectaban al Recto. La Enfermedad de Crohn fue realmente un rara eventualidad en nuestra casuística, (Unidad Digestiva Baistrocchi) solo pudimos realizar la Videocolonoscopia a 24 pacientes 0,15%, el 50% de ellos fueron referidos de otros Centros Médicos, y el otro 50% tratado por nuestro Equipo. De estos 12 pacientes llevamos a cirugía sólo 3 (25%). El diagnóstico endoscópico de la enfermedad de Crohn no siempre resulta fácil, se confunde muy fácilmente con la Colitis Ulcerativa sobre todo en estados avanzados de esta. Su aspecto granular y de empedrado le es característico a esta enfermedad pero no siempre es así. He querido reunir algunos parámetros básicos Endoscópicos que pueden delimitar al buen observador (Endoscopista) en algunos casos. 1) Las Ulceras en la Colitis Ulcerativa nunca aparecen sobre mucosa sana, cuando lo hacen es otro tipo de Colitis. 2) Las Ulceras Aftoides son patognomónicas de la Enfermedad de Crohn. 3) El empedrado mucoso es característico de la Enfermedad de Crohn. 4) Granularidad y friabilidad son características comunes a la Colitis Ulcerativa. 5) Recordar que la Enfermedad de Crohn cuando asienta en el Colon lo hace en forma Segmentaria (Colitis Segmentaria) en algunas oportunidades, por lo que podríamos encontrar si se puede trasponer la primera es buscar otras en el resto del Colon. El Diagnostico endoscópico más frecuente es con el Cáncer sincrónico de Colon. Cuando la reducción del calibre colónico es más del 50%, se aconseja suspender el estudio y realizar otros estudios por Imágenes como la Radiografía de Colon a doble contraste o la Videocolonoscopia Virtual. 114 Fig. N° 25. Se observa en la Videocolonoscopia una reducción de la luz colónica de más del 50% en una estenosis en la Enfermedad de Crohn. (Casuística personal) 115 CAPÍTULO 6 La videocolonoscopia en las hemorragias digestivas bajas (HDB) con especial referencia a la videocolonoscopia en la enfermedad diverticular del colon. La Hemorragia Digestiva baja es muchas veces una situación clínica confusa difícil de resolver, y su evaluación satisfactoria, manejo y aproximación diagnóstica requiere un orden muy disciplinado para su manejo. El uso discriminado y en el momento oportuno, hacen que los nuevos y sofisticados métodos diagnósticos tengan realmente positividad en sus resultados. Consultados varios Autores de reciente publicación, hemos preferido seguir un ALGORITMO sencillo y acorde con las Patologías más frecuentes en nuestro País, usando los Sistemas que prácticamente ya existen en nuestro medio. 237 Decidimos usar el Término HEMATOQUEZIA(a) como apropiado, referido del griego Haima = Sangre y Chez (Quez) defecada o por heces. Decimos de una Hematoquezia que proviene de alguna Patología ubicada por debajo del ángulo de Treitz, pero estadísticamente solo un 10 a un 15% provienen de este sector (Intestino Delgado) hasta la Válvula Ileocecal, como Malformaciones arterio-venosas, Divertículos, y las Neoplasias que se ubican entre un 3 a un 5% de todos los casos. La Hemorragia Digestiva Baja en General y por estadística se refiere a la Hemorragia Colorrectal y Ano-orificial. En nuestro medio sin lugar a dudas la causa más común de estas hemorragias son la Enfermedad Diverticular del Colon y las Hemorroides, (pese a que estas en rara ocasión dan Hemorragia Grave), su control es relativamente fácil, aunque en algunas oportunidades, se observan pacientes que concurren a la consulta con una Anemia de origen no determinado, habiendo sido estudiados con Endoscopias, Cámara Gamma, Arteriografías, y en al examen Proctoscópico de consultorio nos encontramos con paquetes hemorroidarios enormes internos y estigmas de sangrado. 116 En segundo lugar se encontrarían patologías como Angiodisplasias, Tumores, Pólipos, Colitis Inflamatorias, etc. En Países como los Anglosajones, las Enfermedades Inflamatorias Especificas e inespecíficas, constituyen una causa frecuente de Hemorragia digestiva, en nuestro País estas cifras no se repiten, pero en estos últimos años han sufrido un importante incremento, su mejor conocimiento y metodología diagnóstica han sido factores importantes en su reconocimiento. La incidencia anual de la Hemorragia digestiva baja en EUA es de 20.5–27 casos por 100.000 para personas en riesgo, las estadísticas arrojan que en el 80-85% en la mayoría de los casos ceden en forma espontánea. 238 Para el Colegio Americano de Gastroenterología las Hemorragias Digestivas bajas representan un 24% del total de las hemorragias digestivas. 239 Para el Dr. J. Latif en su Relato Hemorragia Digestiva Grave, del XXXII Congreso Argentino de Coloproctología del 2007, en su Servicio la Hemorragia Digestiva baja se ubicó en un 60% de los ingresos por sangrados digestivos. 240 Zuckerman y col. 241 relatan un incremento en la tasa de incidencia del 200 % si se comparan pacientes entre la tercera y la novena etapa de la vida. Como así también que el 2% al 11% de los sangrados presumiblemente bajos se deben a lesiones del tracto superior. Sin embargo, a pesar de HDB es estadísticamente menos frecuente que la hemorragia digestiva alta (HDA), se ha sugerido que la incidencia de la HDB es mayor debido a que un gran porcentaje de pacientes afectados no buscan atención médica. 242,243 De hecho, HDB sigue siendo una causa frecuente de ingreso en el hospital y es un factor de morbilidad hospitalaria y la mortalidad de HDB es distinta de la HDA en epidemiología, manejo y pronóstico. La mortalidad en los casos graves oscila en Argentina entre el 3% y 36% para la consulta Bibliográfica del Dr. J. Latif.94 En una Review del 2013 de HDB Burt Cagir et al. del Christus Coushatta Rural Health Clinic publicada en Medscape,97 esta tiene una tasa de mortalidad que varía de aproximadamente 10-20%, con pacientes de edad avanzada (> 60 años) y los pacientes con enfermedades concomitantes (por ejemplo, enfermedad del sistema multiorgánico, las necesidades de transfusión de más de 5 unidades, la necesidad de una operación, y el estrés reciente, como la cirugía, trauma y sepsis). HDB es más 117 probable en las personas mayores debido a una mayor incidencia de diverticulosis y la enfermedad vascular en estos grupos. La incidencia de la HDB es mayor en hombres que en mujeres.97 Las clasificaciones en General Como aclara el Dr. Latif en su relato94, se basan en cuatro aspectos; la forma de presentación, la magnitud del sangrado, la topografía de la lesión y el carácter evolutivo de la hemorragia. Según la forma de presentarse se clasifican en agudas y crónicas, según la magnitud en leves, moderadas, graves y masivas. Según el lugar anatómico de la lesión; colónicas, rectales, anales y del intestino delgado. Según su curso evolutivo en autolimitadas, persistentes y recurrentes. Para seguir un ALGORITMO ordenado las hemos dividido en HEMATOQUEZIAS AGUDAS Y CRONICAS. Hematoquezia aguda (a) INTERROGATORIO, una detallada historia clínica es de suma importancia. Si el paciente ha tenido una hemorragia previa o no, si logra ver la sangre, esta que colorido tiene, rutilante?, en coágulos?, mezclada con la materia fecal?, en gotas después de defecar?, moja el papel de higiene, moja la ropa interior ¿ Si el paciente es portador de Diarrea y está acompañada de Moco y estrías sanguinolentas? nos orientaran a pensar en Enfermedades Inflamatorias, CUC? CROHN?/ Antecedentes de Hemorroides o no, antecedentes de Enfermedades hepáticas o tomador permanente de AINES. Todo esto nos orientará a numerosísimas patologías y a las posibles opciones terapéuticas. (b) EXAMEN CLINICO, la palpación anal y el Tacto Rectal son mandatarios para detectar un sin número de Patologías Anoorificiales que se complementan con la Anoscopia y la Rectosigmoidoscopia que pueden realizarse en cualquier servicio de Emergencia. / (c) Es de suma utilidad dividir a la Hematoquezia Aguda en SEVERA y MODERADA porque el manejo de estos pacientes es diferente. El 118 paciente que ha tenido una pérdida de más de 1500 cc en 24 hs tendrá signos shock y requerirá transfusiones de inmediato. (d) En caso de Sangramiento severo es preciso poner en marcha métodos de resucitación para prevenir que el paciente entre en Shock severo. Después de la resucitación si es posible continuar con los procedimientos diagnósticos. A veces es necesario seguir con la metodología diagnostica si la hemorragia continua y no se detiene. Afortunadamente es esta una situación muy rara pues las Hemorragias Digestivas Bajas se detienen espontáneamente entre un 70% y 80% de los casos! en general dándonos tiempo para el diagnóstico y tratamiento. 244 (e) En caso de Hemorragias severas es importante excluir las lesiones del tracto Esófago-gastro-duodenal. Muchas veces Ulceras Pépticas sangrantes masivas, Várices esofágicas, Fístulas aorto-entéricas, van acompañadas de Shock. Un 10% de pacientes con Hematoquezia severa tienen una lesión superior al ángulo de Treitz. Es necesario entonces realizar una Endoscopia alta si las condiciones lo permiten, o al menos colocar una Sonda Nasogástrica que la mayoría de las veces nos orientará al diagnóstico. De ser negativa se realizara una Colonoscopia, si esta no revela el sitio de sangrado, se procederá a lavar el intestino el mismo día o al día siguiente. (f) Si la Hemorragia continua se deberá realizar una COLONOSCOPIA DE EMERGENCIA. Esta es una situación a veces muy difícil en una Hemorragia activa, y debe ser realizada por Endoscopistas entrenados y con experiencia. Si así no se encontrará la causa del sangramiento, se deberá ir planeando una posible OPERACION. El uso del Enema Baritado está muy limitado, debido a que imposibilita maniobras Endoscópicas, Centellografías y Angiografías, por lo que trata de evitarse. (g) Si hasta este punto no hemos encontrado la causa se impone una ANGIOGRAFIA SELECTIVA mesentérica, cuyo requisito incondicional es que el sangramiento sea superior a 0,5 mL/min, y que este sangrando en el momento de la inyección del medio de contraste. 119 (h) Si la lesión se encuentra durante el estudio ANGIOGRAFICO es posible la embolización o la inyección de sustancias vasopresoras (Vasopresin). Teniendo en cuenta que estos procedimientos podrían provocar necrosis en la pared intestinal. De todas maneras si esto ocurriera facilitaría la localización de la lesión en el momento de la Cirugía. (i) Otra de las posibilidades es la del uso del TECNECIO 99 como Sulfuro Coloidal o Glóbulos Rojos marcados. Las experiencias varían en una positividad de un 30% a un 90%. Si el Scan es positivo es razonable continuar con la Angiografía. El método más sensitivo según las estadísticas de detectar lesiones sangrantes lentas o babeantes, es inyectar Tc99 a través del catéter de la Angiografía una vez posicionado. (j) Si la Hemorragia continúa y no se encuentra aún la causa es imprescindible la LAPAROTOMIA EXPLORADORA. Se aconseja la profilaxis antimicrobiana durante la anestesia debido a las maniobras a realizar en búsqueda del lugar del sangramiento. (k) La realización de la COLONOSCOPIA INTRAOPERATORIA es un conjunto de maniobras engorrosas que deben ser realizadas también por un equipo entrenado. Se debe arribar con ayuda manual del Cirujano hasta la Válvula Íleo-cecal y comenzar el descenso en búsqueda de Angiodisplasias o Telangiectasias. La ayuda de la transiluminación puede ser efectiva para la búsqueda de pequeñas lesiones. Hay Autores que proponen la ligadura escalonada con el lavado del sector, y así ir descendiendo hasta el Recto. Otros Autores proponen la intubación manual del Intestino Delgado con un Gastroscopio introducido por vía peroral, y el Colonoscopio ubicado en la Válvula Ileocecal, realizando maniobras manuales a cielo abierto de intubación. Las Colostomías en los ángulos clásicos para detectar el sentido de la hemorragia ya han sido dejadas de lado por la inefectividad y la contaminación que sobrellevan. (l) Si aun así la lesión no fue encontrada se deberá realizar una COLECTOMIA TOTAL E ILEOSTOMIA, como única solución de salvataje. / 120 (m) Si la Hemorragia ha cesado se impone URGENTEMENTE UNA COLONOSCOPIA pues es el momento apropiado para preparar al enfermo y realizarla. Se lo puede preparar con Fosfato di sódico y mono sódico sin ningún inconveniente. O con solución de Barex (Polietilenglicol) si dieran los tiempos de preparación sobre todo si el paciente es mayor de 75 años. Se trata de realizar aunque sea una Sigmoidoscopia flexible antes de intentar una radiografía de Colon contrastada. (n) Si con todo así no encontramos la lesión se impone la realización del Enema Baritado. (o) Si así no se encontrara lesión se procederá a la OBSERVACION ATENTA, y solo en caso de resangrado intentar una LAPAROTOMIA con una COLONOSCOPIA INTRAOPERATORIA. En la actualidad está bien establecido en todas las Instituciones del mundo, que la Colonoscopia debe ser el tratamiento inicial de la H.D.B.G. Algunos Autores recomiendan comenzar con Sigmoidoscopía solamente ya que en este sector Anatómico del Recto Sigma se ubica gran número de Patologías, otros prefieren en cambio realizar una Colonoscopia total. J.J. Farrel y L.S. Fridman lo afirman en un excelente Review. 245 Hay numerosos Trabajos en la Literatura de Autores que presentan como principal inconveniente a la realización de una Colonoscopia intrahemorrágica la dificultad de la presencia de sangre retenida y restos fecales por lo que recomiendan la limpieza previa, pese a ser un cuadro agudo. Esto figura como principal recomendación en las Guías de la ASGE (American Society for Gastrointestinal Endoscopy). Jenssen y Colaboradores de la Universidad de California en una recopilación de más de 200 trabajos científicos entre 1988 y 2000, resumen que los Autores consultados obtienen un alto índice de positividad lavando el colon previamente. Las Guías de la ASGE (8) recomiendan llegar hasta el Ciego, lavarlo y observar la válvula Ileocecal durante unos minutos, pues la hemorragia podría provenir del intestino delgado. Estas Guías aconsejan la preparación con Polietilenglicol. Se aconseja administrar esta solución por SNG preferiblemente de buen calibre, Durante 30 a 40 121 minutos. Este procedimiento mejora la visualización y disminuye el riesgo de perforación.246 La Hemorragia Digestiva Baja que requiere hospitalización tiene una incidencia anual para los Estados Unidos, de 21 casos por 100.000 adultos 247 el promedio de edad para esta estadística es de 63 a 77 años. La mortalidad informada por Farrel y Fridman en el 2001 para los pacientes hospitalizados entre estas edades es de 2% al 4% 248. La Colonoscopia en estas circunstancias tiene una especificidad para el diagnóstico que oscila entre el 72% y 86% para el grupo de Rossini y Zuckerman. 249,250 El Dr. Guillermo Ojea Quintana del Hospital Italiano en nuestro País en su publicación Revisión: Hemorragia Digestiva baja, 251 coincide con Jenssen y Machinado que en la Hemorragia digestiva baja masiva logran alcanzar el ciego en el 80% de los casos. Pero para el grupo del Hospital Italiano de Ojea Quintana solo logran hacer el diagnóstico en el 56% de los pacientes. En nuestra experiencia personal en la Unidad Digestiva Baistrocchi, siempre fue una situación muy difícil, pero se pudo arribar al ciego y hacer diagnóstico en el 80,8 % de los casos utilizando Colonoscopios de doble canal de trabajo y de un solo canal pero con gran visión de ángulo. Sobre 25.000 Colonoscopias realizadas solo el 1,8 % fueron Hemorragias Digestivas Graves (Copiosas), 451 pacientes en el término de 30 años. En la recopilación actual del 2000 al 2015, que dio un total de 15.286 pacientes endoscopiados con los nuevos sistemas ópticos fue de 261 (1,70%) pacientes, por Hemorragia Digestiva baja, lo que no difirió de la recopilación anterior como de sus etiologías. Por lo que mantuvimos similares porcentajes. Principales Causas de Sangrado en grandes series Internacionales consultadas252,253,254,255: 1. Enfermedad Diverticular del colon. 2. Malformaciones Vasculares (tipo 1, tipo 2, tipo 3). 3. Ectasias Vasculares del colon (venosas-Boley). 4. Colitis Isquemicas. 5. Pólipos. 6. Cancer colorrectal. 7. Enfermedades Inflamatorias (cuc y crohn). 122 8. Proctitis Actínicas. 9. Colitis infecciosas. 10. Endometriosis colorrectal. 11. Lesiones colorrectales tipo Dielafoy (malfor. vasc.). 12. Ulcera solitaria de recto. 13. Varices ano-recto-colónicas. 14. Tumores del intestino delgado. 15. Divertículos de Meckel. 16. Divertículos del intestino delgado. 17. Fistulas aorto-entéricas. 18. Patologías ano-orificiales. 19. Lesiones iatrogénicas. 20. Traumatismos ano-recto-colónicos. Para el Dr. Juan Astiz de la Clínica Güemes de Lujan en su trabajo de Ectasias Vasculares del Tubo Digestivo 256 la Colonoscopia fue efectiva en solo 5 de los 9 enfermos a los que se les efectuó este método como primer paso. 55% de sensibilidad y 100% de especificidad. Lo atribuye el Autor a mala preparación. El Dr. Roberto Castiglioni, Zanoni y col. Presentan un excelente Trabajo de preparación del colon en procedimientos electivos en endoscopia y cirugía 257 obtienen una muy buena preparación del colon tanto con Fosfatos como con Politilen Glicol, aunque en la Hemorragias Bajas masivas en su opinión personal (Dr. Castiglioni) prefiere realizar la Colonoscopia en primera instancia sin preparación, aprovechando la acción lavadora de la sangre fresca, si así no pudiera recién prepara con Polietilenglicol. En otras series y experiencias las controversias son significativas. Por ejemplo para Robert W. Beart de la Universidad del Sur de California, Los Ángeles 258 al referirse al tema Diagnóstico y Terapéutica en las hemorragias intestinales bajas, en el 18th Annual International Colorectal Disease Symposium del 2007, y a quien tuve el agrado de escuchar personalmente, comienza siempre el estudio de estas hemorragias con una Rectosigmoidoscopia rígida, pues aclara que es fácil la limpieza y alta frecuencia de patología. Sin embargo pese a todo lo que publican muchas Instituciones de los 123 Estados Unidos refiere el Autor, a favor de la Colonoscopia inicial, a él le ha sido de suma dificultad y de tratamiento imposible la mayoría de las veces. Aclara que no ha sido una buena experiencia en lo personal, reemplazándola inmediatamente por la Radiolabelled red cell scaning (Centellografía – Cámara Gamma) debido a que tiene mínimos riesgos, y las chances de ver topográficamente el sitio del sangramiento son excelentes. Dándole la posibilidad si esta persiste más de 24 hs. A la arteriografía selectiva un segundo lugar muy valioso por la alta precisión y la posibilidad terapéutica. Para el Dr. Jorge Rodríguez Martín de la Clínica Modelo de Lanús, en las HDB comienza con una Rectosigmoidoscopia, lavado rectal, hasta el ángulo recto sigmoideo descartando así toda patología ano-rectal. Realiza a continuación la colonoscopia con preparación de fosfatos o Polietilenglicol. En su experiencia personal 259 no han sido buenos los resultados con la Colonoscopia inicial en las hemorragias graves, por lo que se inclina a iniciar el estudio con la pan arteriografía selectiva abdominal dándole posibilidad también a la terapéutica. En la Bibliografía Internacional y en varias argentinas la Enfermedad Diverticular del Colon fue la primera causa de HDB Grave. Para el Dr. J. Hequera y J. Latif 260,94 la enfermedad diverticular del colon es responsable del 25 al 55 % de todas las Hemorragias digestivas graves. La identificación del vaso sangrante para todos los Autores e inclusive en nuestra experiencia personal ha sido muy difícil. La aparición de un coágulo (clot) adherido a un orificio Diverticular no garantiza que sea el causante de la hemorragia 261 Para Foutch y Zimmermank el hallazgo de este clot es signo de hemorragia reciente Diverticular. El Dr. Fernando Bonadeo del Servicio de Cirugía General del Hospital Italiano de Buenos Aires, en su excelente Relato Oficial del 30 Congreso Argentino de Coloproctología, opina al respecto de la Videocolonoscopia en la Enfermedad Diverticular; 262 que un Adenocarcinoma de colon ocasionalmente puede simular su presencia tanto en su presentación clínica como la apariencia tomográfica de una diverticulitis aguda, y aclara, solo la Videocolonoscopia posee valor diagnóstico. Sin embrago en su experiencia y en la del Hospital Italiano luego de un episodio de Diverticulitis aguda en la práctica los ha llevado a posponer su realización por un periodo de 6 semanas para evitar la transformación de una perforación contenida, en 124 una libre en la cavidad peritoneal. O de llevar un Hinchey 1 de la Clasif. Modificada por Wexner a un Hinchey 4. Ellos logran en un tiempo prudencial promedio de 5,8 dias desde la internación logrando arribar al ciego en un 81,7% de los casos de Diverticulitis aguda (107 casos), encontrando que la principal causa de no arribar al ciego fue la imposibilidad de trasponer la estenosis inflamatoria. Agregando que en ese número de casos buscando la Diverticulitis encontraron un Adenocarcinoma de Colon que coincide aproximadamente con las estadísticas de asociación de Cáncer en la Enfermedad Diverticular. En artículo reciente de Sasan Mosadeghi de la Unversidad de California, publican un artículo excelente donde comentan la aparición de adenocarcinoma y enfermedad diverticular en los siguientes porcentajes. Dice el Autor; que Brar y cols. 263, ya habían publicado en el 2013, en una revisión retrospectiva, que la sensibilidad diagnóstica de neoplasia clínicamente significativa en la colonoscopia de seguimiento dentro de 1 año después del tratamiento no quirúrgico exitoso de la diverticulitis aguda es importante. En ese trabajo se excluyeron pacientes con colonoscopia previa. Todos los pacientes tuvieron el diagnóstico confirmado por CT, y de esos 249 (54%) pacientes fueron sometidos a una colonoscopia dentro del año de la primera admisión. Se encontraron Adenocarcinoma invasor y neoplasia clínicamente significativa (Pólipos con inclusión carcinomatosa) en 1,6% y 9,2%, respectivamente. En el análisis de subgrupos, los pacientes con diverticulitis complicada tuvieron una incidencia significativamente mayor de adenoma avanzado (18,9% frente al 5%) y los tumores malignos invasivos (5,4% frente a 0%) en comparación de los pacientes con diverticulitis no complicada. En el análisis multivariado, la edad y la presencia de abscesos fueron identificadas como factores de riesgo significativos para la neoplasia clínicamente significativa. La desventaja de una videocolonoscopia temprana en pacientes con diverticulitis aguda es que tiene una tasa aumentada de perforación que en las publicaciones ronda el 1,07% conllevando una segunda colonoscopia ante la imposibilidad, 6 semanas después en un 17,2% de los casos.117 Nuestra Unidad de Aparato Digestivo tiene protocolizado que no antes de 6 semanas de haber superado clínicamente el cuadro de Diverticulitis aguda debe realizarse una Videocolonoscopia, pues como bien dice el Dr. Bonadeo Lasalle y muchos Autores en el mundo esto trae posibles complicaciones, agravando el cuadro 125 del paciente y entrando en costos sanatoriales y medicamentosos, como quirúrgicos innecesarios. Es muy común esta sobreindicación en las Entidades Sanatoriales que apremiadas por los tiempos y el diagnóstico dudoso obligan a los endoscopistas a situaciones como las relatadas. En la Cirugía electiva de la Enfermedad Diverticular aclara el Dr. Bonadeo en la evaluación preoperatoria se debe incluir en forma sistemática una Videocolonoscopia, a fin de descartar patología asociada en el resto del colon. Y el Autor opina que además de la asociación patológica permite establecer la longitud y sector a resecar. Fig. Nº 26. Lesiones 0-II c (con centro deprimido) altamente sospechosas de CA in situ. Las dos primeras de la Izquierda, lesión que se ubica dentro de un Divertículo (Olympus Exera II.NBI) La tercera de la derecha Fijinon Fice (Dr. Lorenzo) la misma lesión próxima a un Divertículo. Fig. Nº 27. Orificios Diverticulares asociados a Angiodisplacias cercanas. Las dos primeras de la izquierda Aparato firma “Endoscopy”, con Cromoscopía de Índigo Carmín, la última de la derecha Olympus CV I (Casuistica personal) 264. 126 Efectividad diagnostica de la colonoscopia en la hemorragia digestiva grave Autor Nro. de casos Efectividad (%) Rossini P, et al. 409 73 Jensen D, et al. 80 74 Green B. 50 42 Orillac J. 144 51 García Sanchez M, et al. 32 47 Maté Jiménez J, et al. 8544 92 Fugarolas G, et al. 1064 68 Shinga H. 2200 54 Finlay I. 1757 69 Kao, et al. 80 62 Vernava A, et al. --- 74-82 Balen E, et al. 40 75 Bocic A. 40 80 Garcia Osogobio S. 27 80 Baistrocchi H. 451 80,8 Clínica Modelo,Dr. J. Latif29 153 < 30 Ojea Quintana14 Review del Autor (Héctor Baistrocchi) 56 15.071 65,5 % videocolonoscopias (Tabla comparativa de efectividad de la Videocolonoscopia en la Hemorragia Digestiva Grave cedida por Dr. Latif y modificada por el Autor, los números corresponden a esta Bibliografia del Capítulo.) 127 Principales Causas de Sangrado Intestinal Bajo, para numerosos Autores comparados entre si: Otras como Divertículos Angiodisplasias % % Cáncer- Pólipos % CUC % Anoorificiales Actínicas, % Endometriosis e Desconocidas % Isquémicas % Latif J.,Hequera J (1-31) 43 28 2,3 - - - - Jensen et al. UCLA (12) 9 24 9 7 3 3 5 24 7 10 21 9 4 25 48 12 11 6 3 6 14 Bramley et al. (Suecia) (54) Richter et al.(Boston) (55) Longstreth (S.Diego Calif.) (10) Baistrocchi y col. (Argentina) (6)(rec.act.) 41 3 9 16 5 14 12 30 20 7 8 19,5 9,5 6 Recopilación de datos del Autor. ( Las citas corresponden a esta Bibliografia) Causas de Hemorragia Digestiva baja grave expresada en porcentajes de diversos Autores. (EDC=Enf. Divert .del Colon. MV=Malformaciones Vasculares. EII=Enferm. Inflamat. Intestinal) rec.act.=Recopilación actual 128 Autor Pacientes EDC MV (n) Caos A, et al. 35 23 20 Rossini F, et al. 409 15 15 Jensen D. 80 16 30 Leitman I., et al 68 27 24 Vernava A., et al 4410 40 2 Pedro L. --20-50 10-25 Farner R 77 55 18 Bocic A., et al 40 47 7.5 Ojea Quintana G. 216 32 9 Baistrocchi H. 251 26 15,4 Clínica Modelo 153 43 28 Cáncer 17 30 11 9 14 ------7.5 4 3,8 2,3 Pólipo s 0 3 3 0 ---------15 5 4.1 0,8 EII Isquemia 9 13 9 5 21 ------2.5 2 7,7 ---- 0 5 0 5 ---------5 1,3 ---- (Recopilación de datos Dr. Jorge Latif (29) donde incluye experiencia del Autor en Artículos anteriores. La Bibliografía corresponde a esta publicación y Relato.) En nuestra experiencia sobre 451 pacientes portadores de H.D.B Graves la Enfermedad Diverticular estuvo presente en 135 pacientes (30%), considerando que no llegamos al diagnóstico en 27 pacientes (6% del total de HDB) y la mayoría de ellos detuvieron su sangrado, es probable que no hayamos podido realizar el diagnóstico en varias Enfermedades Diverticulares. Para el Dr. Ojea Quintana y el Dr. Fernando Bonadeo del Hospital Italiano de Buenos Aires el 23% al 55% de las H.D. B. masivas fueron Diverticulares cuando esta sucedió en mayores de 60 años. La segunda causa sin lugar a dudas en la Bibliografía mundial y en nuestra experiencia personal, fueron las Ectasias vasculares del Colon (Displasias- Angiodisplasias), para Schuetz y Jauch 265 son las responsables del 11% de las Hemorragias Digestivas Bajas Graves, en su casuística, y estaban localizadas predominantemente en el Ciego y en el Colon ascendente. En nuestra estadística personal de las 451 H.D.B. Graves 90 pacientes (20%) eran portadores de una Ectasia Colónica, muy pocas de ellas pudieron ser tratadas con coagulación endoscópica o métodos de esclerosis, la mayoría de ellos fueron operados y 129 muy pocas cohibieron espontáneamente, solo 5 de 90 (4,5%), fallecieron y en 3 (0,66%) y el diagnóstico se hizo intraoperatorio. Fig. N° 28. Angiectasias tratadas con Argon Plasma Coagulation, en la segunda línea primera de la izquierda, se aprecian las características vasculares de la lesión, vista con NBI (Narrow Band) de Olympus. Fig. Nº 29. Angiectasia colónica. Se observan numerosos vasos sanguíneos dilatados de tamaño variado, con hematíes en la luz. H&E, 25X (Prof.Dr. Luis Spitale) 130 Para el Dr. Juan Astiz, Tinghitella, Beraudo y col. Del Servicio de Cirugía de la Clínica Güemes de Lujan, de 1980 a 2002 trataron quirúrgicamente o endoscópicamente a 28 pacientes afectados por Ectasias Vasculares. Se hizo el diagnóstico con Colonoscopia solo en solo 5 de 9 pacientes estudiados por este método, la mayoría de estos pacientes fueron operados sin diagnostico por lo que en 17 de ellos el diagnostico de Ectasia Vascular se hizo con la pieza operatoria. Otras patologías a tener en cuenta son las Colitis. Isquémicas, Actínicas, Inflamatorias del Colon que suman un 20% de las HDB Graves en la Bibliografía Internacional y por supuesto el Cáncer de Colon. Para el grupo de la ASGE los Autores que reúnen tienen un 14% de Hemorragias copiosas en el Cáncer de Colon, y un 10% de causas anorrectales. En nuestra experiencia personal de los 451 pacientes tuvimos : 135 pacientes con Diverticulosis sangrante (30%) 90 pacientes con una angiodisplasia del colon (20%) de estas el 70% se ubicaron en el colon Proximal, Derecho y Angulo Hepático y solo el 30% en el marco Izquierdo, 36 con Colitis Ulcerosa (8%), 17 pacientes que sangraron por CA de Colon/Recto/Pólipos (3,8%), 6 pacientes por Isquemias colónicas (1,3%), 17 pacientes eran portadores de colitis pseudomembranosa (3,8%), 27 pacientes sangraron severamente post-polipectomía (6,16%) y 43 pacientes sangraron copiosamente por ser portadores de una Rectitis Actínica (9,56%) todas las Rectitis Actínicas menos una, fueron cohibidas endoscópicamente, (Coagulación Discriminada/Argón Plasma) solo una necesito ser intervenida quirúrgicamente, debiendo realizar una Amputación abdómino-perineal de Miles. Fig. N° 30. Imagen Endoscópica de la Endometriosis en el Sigma, y pieza operatoria. 131 Fig. Nº 31. Endometriosis colónica manifestada por la presencia de glándulas y de estroma endometrial en el corion del colon (flecha). H&E, 25X (Prof.Dr. Luis Spitale) Fig. Nº 32. Endometriosis colónica. Se observa una glándula endometrial y estroma citógeno, en el espesor de la túnica muscular propia del colon (flecha). Esta muestra Biopsia, puede en algunas circunstancias inducir al error Anatomopatológico de Adenocarcinoma Diferenciado. H&E, 25X (Prof.Dr. Luis Spitale) Nuestras hemorragias digestivas bajas graves se comportaron paradójicamente en forma atenuada, de los 451 pacientes sangrantes solo fueron llevados a cirugía 19 (4,21%) y se distribuyeron entre 1 paciente portador de una rectitis actínica (5,26%), 10 (52,6%) pacientes portadores de una enfermedades diverticular del colon sangrante, 5 (26,3%) angiodisplasias, y 1 invaginación intestinal del ciego (5,26%). 132 Solo 2 enfermos fallecieron luego de la Cirugía debido a la gravedad de la misma constituyendo el 10,5 % de mortalidad Post-operatoria, no tuvimos índices de mortalidad Intraoperatoria. La arteriografía selectiva de la arteria Mesentérica Inferior/superior, y de las cólicas no fue una conducta de rutina ni fácil de realizar, pese a que tenemos dos Instituciones que las realizan con sustracción digital y muy buena instrumentación y operabilidad, la situación clínica de llevar al paciente al Servicio de Rayos en el momento preciso fue siempre muy dificultoso y muchas veces cuando lo logramos la hemorragia se había detenido. Solo 20 pacientes fueron investigados por este método (4,43%), teniendo una efectividad para determinar el sitio de sangrado solo en un 50% (10 pacientes). Se intentó coagular con éxito 1 paciente mediante terapéutica con Endocoil y descarga eléctrica (Instituto de Diagnóstico por Imágenes Dr. Carlos Oulton. Córdoba). La Centellografía, con uso del TECNECIO 99 como Sulfuro Coloidal o Glóbulos Rojos marcados fue un instrumento diagnóstico que con los años se mantuvo en índices de detección topográfica muy bueno como orientación del sitio de sangrado. Se logró realizar este procedimiento en 250 pacientes (55,4%), teniendo una efectividad del 96% y solo falló con dudas debido también a la probable detención del sangrado solo en un 4% lo que lo hace un método seguro aunque de indefinición de órgano preciso. Con respecto a la Terapéutica Endoscópica, existe un arsenal de métodos descriptos en la Bibliografía que van desde la aplicación de Clips hemostáticos, Coagulación de contacto, con Hot Biopsy o Heater probe, bipolar o monopolar y el Laser Argón Plasma. Algunos Autores relatan haber usado bandas elásticas para tratamiento de sangramientos como el de Dieulafoy en Recto.266 Nosotros tenemos experiencia en un solo caso de sangramiento de un tallo Polipoideo sangrante en donde usamos bandas de uso similar a las de Banding para Varices Esofágicas (Speedband Superview. Súper 7 Band Ligator. Microvasive. Boston Cientific). En los tallos que sangraron, hemos intentado el reenlace del mismo que con precaución es posible hacerlo. Hemos usado la Hot Biopsy de Olympus para la Coagulación de los tallos sangrantes que con solo apoyarla durante unos segundos cerrada se obtiene buena cauterización. Y el uso del Argón Plasma en caso de bases más 133 amplias que la de un tallo elongado es la regla, además de completar el tratamiento de la lesión como ya lo expresáramos en al Capítulo de Polipectomías. Fig. N° 33. Pólipo de gran Tamaño Tetralobulado, con tallo grueso en donde solo usamos para su resección inyección del tallo solo con soluciones fisiológicas, no usamos Epinefrina. Sangramiento por Lesión Actínica del Recto su Tratamiento Endoscópico El uso de la Radioterapia con el objetivo de tratar las Neoplasias Pélvicas es cada vez más utilizado en todo el mundo. Sus beneficios no están exentos de complicaciones. La Rectitis Actínica o sea la inflamación crónica del Recto inducida por la Radioterapia está presente en el 1% al 20% de los pacientes a los que se les realizó este tratamiento. 267,268 En nuestra experiencia personal hemos recibido enfermos que fueron tratados con Radioterapia de patologías en: próstata, vejiga, útero, ovario, cuello uterino y un caso de terapia intersticial para el cáncer de recto (con varillas de radium). De estos pacientes que presentan rectitis actínica solo el 5% desarrollara rectitis actínica grave la cual conlleva sangrado intenso e intermitente, por lo general son pacientes que tienen un sangramiento de leve a moderado en forma intermitente y su consulta acopla la anemia que desarrollan. 134 Fig N° 34. Muestra el colocador de varillas de Radium con fuente radiactiva manual con aplicador de iridium 192 hace ya 25 años, con las que lograramos junto con el Dto. De Radioterapia Fundación Madame Curie Córdoba, uno de las variantes en el tratamiento del Cancer Rectal. Fotos de colección personal. La radiación causa fibrosis del tejido conjuntivo y endarteritis de las arteriolas de la mucosa del Recto, provocando isquemia, friabilidad y sangramiento de la mucosa, ulceraciones y hasta fístulas a órganos adyacentes. La morfología de la superficie celular a nivel de las glándulas del colon, dependen de la adhesión del CELL-CELL, mediante un complejo Aminoácido: el CADHERIN-CATENIN, las alteraciones producidas en este, trastocan la morfología superficial de la mucosa. Esta cadena de adhesión intercelular se encuentra habitualmente en la Placenta en grande estratos, también en las Colitis y durante los cambios neoplásicos del Cáncer de Colon; las Terapias radiantes sobre mucosas normales en modelos experimentales ha demostrado severas alteraciones en la expresión del P-cadherin. Esto fue estudiado por reacciones Inmunohistoquímicas, y se observa como en el proceso de regeneración tisular luego de la acción actínica, está expresión comienza a mejorar. Por lo que estaría muy relacionado a lo que provoca la radioterapia en la superficie celular.269 135 En las Rectitis Actínicas realizamos con sumo cuidado y mucha paciencia, lo que hemos denominado “Coagulación Discriminada”. Lo realizamos con la pinza Hot Biopsy (Pinza de Williams) cerrada, coagulando cada nacimiento de cabeza de medusa de la telangectasia afectada por la acción actínica, obteniendo muy buenos resultados y con costos muy reducidos.270 El tratamiento endoscópico con argón plasma con el endoscopio flexible fue descripto en 1994 por Grund. 271 Este método diatérmico es fácil de llevar a cabo, el gas argón que se maneja con un catéter transcanular y se direcciona con el Videocolonoscopio, realizando múltiples focos de coagulación, principalmente centrando el área en la cabeza de medusa que a veces se logran visualizar, realizando un buen lavado. La penetración del gas en la mucosa es pequeña, por lo que el riesgo a las complicaciones como perforación, estenosis y fístulas 272. En estos últimos años hemos incorporado el uso del Argon Plasma Coagulation, que nos brinda rapidez, efectividad y coagulación de mayor extensión en la superficie mucosa, logrando muy buenos resultados en menor cantidad de tiempo y sin complicaciones. El uso del Argón Plasma tiene muchas publicaciones de su uso en todo el mundo y grupos Argentinos como el nuestro y el del Hospital Italiano lo han usado con buenos resultados273. Fig. N° 35. Rectitis Actínicas, tratadas con Argon Plasma Coagulation. 136 Fig N° 36. Angiodisplacias del Colon Derecho, vistas con Equipo Olympus Exera II (NBI), la primera de la izquierda en visión directa, la segunda con Banda Estrecha, Cromoscopía Electrónica (NBI), y la tercera de la derecha coagulación in situ con Argon Plasma Coagulation. (Casuística Personal) Hemorragia Digestiva Baja post-polipectomía. A partir de los años 70 todos los Pólipos del Recto y Colon pasaron a ser resecados a través de un colonoscopio flexible, y dejaron de hacerse cirugías de resección o colotomías. El desarrollo de mejores equipos dio la posibilidad de resecar desde pequeñísimas lesiones a grandes lesiones planas o pediculadas mediante diversas técnicas como el Piecmeal. Sin embargo este procedimiento no está exento de complicaciones, entre las cuales el sangramiento ocupa un 0,2 a un 3,3 % de los casos según diversos Autores.274 Para el Dr. Daniel Cattaneo en su excelente Relato Oficial del 35 Congreso Argentino de Coloproctología, Complicaciones Intraabdominales de la Cirugía Colorrectal 275 en las series consultadas oscila esta complicación entre el 0,02 y el 6% de las polipectomías colónicas. En nuestra experiencia personal en la Unidad de Aparato Digestivo Baistrocchi esta complicación fue infrecuente, (todas cohibieron espontáneamente, solo requirieron control y reposo, solo una de ellas necesito internación y se le realizaron solo 500 cc de sangre entera en forme preventiva. En nuestra experiencia la hemorragia post-polipectomía leve y grave ocupó el 5,99% (629 pacientes) en 10.490 Polipectomías realizadas a la fecha. En el Relato Oficial de Coloproctología del año 2009 “Pólipos Colorrectales no Hereditarios” la Dra. Rita Pastore, en su excelente Encuesta Nacional referida a Complicaciones de las 137 Polipectomías, los encuestados respondieron que la complicación más frecuente fue la Hemorragia. En las series consultadas por el Dr. Cattaneo en su Relato Oficial “Complicaciones intraabdominales de la Cirugía Colorrectal”129 en el 35 Congreso Argentino de Coloproctología del año 2010, esta complicación oscilo entre el 0,02 y el 6%. Este sangramiento puede ser inmediato o tardío. Inmediato: este ocurre en el momento de la resección por varios factores a considerar, coagulación insuficiente del pedículo o base sésil según sea la lesión. La causa más común en esta es la sección de la mucosa en tiempos diferentes a la acción del coagulador, (a destiempo). Esto ocurre casi siempre porque en este procedimiento se necesita de un segundo operador. Otro de los motivos de sangramiento inmediato es alguna falla del coagulador o una intensidad inadecuada para el grosor de la mucosa a resecar. La toma inadecuada o no suspendida de anticoagulantes no interrumpidos en una rara eventualidad. Pero está presente como complicación hemorrágica en varios trabajos Internacionales.276,277,278 Pero un artículo publicado en el 2010 del Crouse Hospital de New York, observan que con el anticoagulante Clopidrogel (nuevo antiagregante plaquetario), no es necesario suspenderlo para realizar una Polipectomía Colónica 279. El sangramiento tardío ocurre por lo general a la caída de la escara de coagulación. Este por lo general se detiene espontáneamente y solo se deben prescribir medicamentos de apoyo a los factores de coagulación. Un interesante trabajo referido a la necesidad o no de reendoscopiar al paciente fue publicado por el grupo de la Universidad de Portland Oregon, EEUU, en el 2013. 280 El título del trabajo es: Manejo de la hemorragia post-polipectomía tardía: un análisis de decisión. El beneficio de repetir la colonoscopía en el manejo de la hemorragia tardía pospolipectomía es desconocida. Este estudio presenta como objetivo evaluar los resultados de repetir la colonoscopía para lograr la hemostasia terapéutica. El tratamiento endoscópico de la hemorragia postpolipectomía fue modelado en un árbol de decisiones, midiendo la fracción global esperada de los pacientes beneficiados de la hemostasia terapéutica y el número de pacientes necesario a tratar (NNT) para lograr una hemostasia beneficiosa. Repetir la colonoscopía para identificar y tratar la hemorragia post-polipectomía es beneficioso en cerca del 22% de los pacientes, lo que corresponde a un NNT de 4,5 pacientes. Variando estas probabilidades en un amplio intervalo cambia la fracción de pacientes que se 138 benefician de la endoscopia entre 3% y 33% y el NNT entre 28 y 3 pacientes, respectivamente. Concluyen que el resultado esperado de repetir la colonoscopía se encuentra justificado por los resultados de la hemostasia terapéutica endoscópicos demostrados. Pero que los resultados de este trabajo también sugieren que en muchos pacientes el tratamiento expectante dirigido a la resolución espontánea de la hemorragia sigue siendo una opción válida. Para la prevención de los sangramientos en las Polipectomías en nuestra Unidad de Aparato Digestivo Baistrocchi usamos de rutina en los Pólipos sésiles como pediculados que superan 1 cm, la inyección submucosa con Solución Fisiológica, no usamos Epinefrina. Hemos usado en algunos casos también el Endo-Loop con muy buenos resultados. El Hemoclip es usado por muchos grupos Argentinos, y en el mundo, nosotros no tenemos experiencia con ellos. Pero el grupo del Departamento de Gastroenterología del Dr. Manuel Lorenzo, Instituto de Diagnóstico por Imágenes Dr. Carlos Oulton los han usado en un número escaso de veces. Pero hay numerosos trabajos publicados al respecto, inclusive no solo como prevención del sangramiento de los tallos poliposos sino de Biopsias sangrantes en pacientes con problemas de Coagulación.281 Fig. N° 37. Pólipo sésil, inyección submucosa previa a su resección. En la última foto de la derecha, aplicamos como prevención Banding para Varices Esofágicas (Speedband Superview. Súper 7 Band Ligator. Microvasive. Boston Cientific), para un Pólipo sangrante. Muchos Autores la han usado en tallos sangrantes post-polipectomías. O como tratamiento de la Enfermedad de Dieulafoy en Recto. 139 Fig. N° 38. Uso del Endoloop, Argon Plasma y colocación de Endoclips. (Fotos cedidas por Dr. Manuel Lorenzo, Servicio de Gastroenterología y Endoscopia del Instituto Carlos Oulton. Córdoba). Sobre el uso de la Enteroscopia nosotros no tenemos experiencia, pero actualmente se están publicando cada vez más artículos referidos al uso del Enteroscopio de doble balón en las Hemorragias del Intestino delgado.282,283,284 Si tenemos en cambio experiencia con la cápsula endoscópica, para las patologías del intestino delgado (a las que se le agrega colon con la cápsula de visión anterógrada y retrograda) con un muy buen resultado de positividad en el hallazgo de las patologías sangrantes. Fig. N° 39. Cápsula Endoscópica PillCam, ejemplos de sangrado del Intestino Delgado. (Casuística Personal) Quiero hacer el comentario de dos grandes Trabajos referidos al tema de Hemorragias Digestivas bajas y el rol de la Videocolonoscopia dadas por entidades muy importantes en el mundo de la Gastroenterología y la Cirugía que es dable comentar. El primero es el que publica las Guías de conductas a tener en cuenta ante una Hemorragia 140 digestiva preparadas por el Comité de la Sociedad Americana de endoscopia Gastrointestinal (American Society for Gastrointestinal Endoscopy (ASGE)), ellos prepararon los estándares básicos para este documento basándose en la Literatura de Trabajos y Resúmenes publicados por los principales y más importantes Autores y Grupos desde el mes de Enero de 1990 y Marzo del 2013, usando PubMed. Estas Guías se basan en recomendaciones basadas en el grado de la evidencia. La fuerza de las recomendaciones individuales se basa en la calidad de la evidencia agregada y una evaluación de los beneficios esperados y los riesgos. Las recomendaciones más débiles se indican con frases tales como "Sugerimos". Mientras que las recomendaciones más fuertes son típicamente declaradas como "Recomendamos". Este comentario es para reforzar que las conductas en Argentina son similares a las mejores recomendaciones de estas grandes Sociedades. Las Hemorragias Digestivas bajas se diagnostican en los EEUU en un 20% a un 30% de todos los pacientes que se presentan con una Hemorragia baja, la incidencia anual de Hemorragias Digestivas bajas es de un 0,03%, y se incrementa en 200 veces de la segunda a la octava década de la vida. 285 La edad de presentación tiene un rango que va de los 63 años a los 77 años 286. Aproximadamente 35,7 cada 100.000 adultos en los EEUU se hospitalizan anualmente, y un Gastroenterólogo de tiempo completo maneja por lo menos 10 casos por año.287,288,289 Aunque la pérdida de sangre HDB puede ir desde trivial, masiva y peligrosa para la vida, la mayoría de los pacientes tienen sangrado autolimitado y una hospitalización sin complicaciones. En comparación con el sangrado de las HDA, los pacientes con HDB tienden a presentar un nivel de hemoglobina superior y son menos propensos a desarrollar shock hipotensivo o requerir abundantes trasfusiones de sangre. 290,291 La tasa de mortalidad varía de 2% al 4% y por lo general resulta de comorbilidades e infecciones nosocomiales. 292 Un estudio epidemiológico reciente publicado presenta una menor incidencia de HDB (41,8 / 100.000 en 2001 vs 35,7 / 100.000 en 2009; P Z 0,02) con una menor edad, y el caso índice de mortalidad ajustada por sexo (1,93% en 2001 vs 1,47% en 2009; P Z 0,003) en la última década. (60). 141 Cuadro de etiologías de las HDB, en los EEUU, y el porcentaje estimativo de sangrado de cada una de ellas. (resumen).) (60). Etiologies of lower GI % bleeding Diverticular bleeding 3% to 15% of patients with colon diverticula. Ischemic colitis 1% to 19% of patients with LGIB Angioectasia Studies suggest that angioectasias account for 3% to 15% of patients with LGIB. Hemorrhoids Hemorrhoidal bleeding has been reported to account for only 2% to 10% of acute LGIB. Colorectal neoplasia Colorectal neoplasia accounts for up to 17% of all etiologies in patients with LGIB and presents more commonly with occult Bleeding. Postpolypectomy bleeding A recent large study of 50,000 colonoscopies that used Medicare claims data reported a bleeding rate of 8.7/1000 procedures. Inflammatory bowel disease Only 1.2% to 6% of all admissions in patients with Crohn’s disease and 0.1% to 4.2% in patients with ulcerative colitis. Infectious colitis LGIB occurs in 2.6% of patients with HIV, usually in the setting of AIDS-related thrombocytopenia, and is associated with an inpatient mortality rate of 28%. NSAID colopathy The prevalence of NSAID use is reported to be as high as 86% in patients with LGIB. Radiation proctopathy LGIB has been reported in 4% to 13% of patients with radiation proctopathy. Stercoral ulcer No data Rectal varices/ulcers Rectal ulcers have been reported in 8% of patients who present with severe hematochezia Dieulafoy lesion No data 142 Tratamiento Endoscópico del sangramiento Diverticular La Coagulación térmica local incluye, Heatre Probe y Coagulación bipolar, pueden ser usadas en combinación con inyección de Epinefrina en solución diluida en 1:10.000 o 1: 20.000, es inyectada intermitentemente en el sitio de sangrado o alrededor del sitio en dosis de 1 mL a 2 mL, cuando el vaso sangrante no es visible. La aplicación de la Heater Probe o de la coagulación bipolar en aplicaciones intermitentes de 2 a 3 segundos. Si en el sitio es visible el coágulo se puede usar el ansa de polipectomía, enlazando la base del sitio de sangrado. (En nuestra experiencia personal de la Unidad Digestiva Baistrocchi nos ha sido de mucha dificultad encontrar el sitio y el vaso sangrante pero cuando lo hemos sospechado hemos usado la Pinza de Wiliams (Hot Biopsy), cerrada haciendo pequeños toques intermitentes o el Argón plasma que es de mucha más practicidad. Han sido publicadas complicaciones de estos métodos en la Enfermedad Diverticular, como perforaciones en el 2,5% de los pacientes que fueron sometidos a este método de coagulación.293 La colocación de Clips es una alternativa más y es de fácil aplicación 294, estos casi siempre se colocan en la boca diverticular que es por donde sangran habitualmente. El uso de la Endocap ha sido descripto tratando de evertir el divertículo haciendo más fácil su colocación. No han sido publicados resangramientos luego de la colocación de Endoclips o Endocap.295 El Tatuaje de la zona del sangramiento es muy útil para ser identificada por la endoscopia en un futuro resangramiento. Como la identificación del endoclip en un futuro resangramiento, puede ser usado si se necesita una Angiografía. 296 Tratamiento Endoscópico de las Angioectasias El tratamiento endoscópico de las Angioectasias se realiza con coagulación térmica, el Argon Plasma es la técnica de elección, se pueden abarcar áreas extensas con menor peligro por lo escaso de su penetración. El uso del mismo en valores que van de 30 W a 45 W y 1 L/minuto, disminuye las posibilidades de perforación sobre todo en la pared del Colon Derecho que es más fina que la del Izquierdo. La probe preferiblemente se debe usar con aplicaciones de pulso de 1 a 2 seg. 297 Se han publicado trabajos que asocian el uso de los aplicadores térmicos con Endoclips con muy buenos resultados. 298 (En nuestra Unidad de Aparato Digestivo usamos 143 durante mucho tiempo la Hot Biopsy de Williams para la coagulación de estas lesiones, hasta que adquirimos el Argon Plasma que es el tratamiento actual que realizamos a estas patologías) RECOMENDACIONES DE LAS ASGE: (Asociación Americana de Endoscopia Digestiva) (8) 1. Recomendamos realizar una Colonoscopia en pacientes con una Hemorragia Intestinal oculta. (Grado alto de recomendacion). 2. Recomendamos realizar una Esofagogastroduodenoscopia en aquellos pacientes donde no se identificó lesión de sangrado en el Recto Colon, especialmente en pacientes síntomas Gastrointestinales altos, anemia con deficiencia de hierro o uso de AINES. (Grado moderado de recomendación). 3. Nosotros sugerimos una evaluación del Intestino Delgado, ante una Colonoscopia y Gastroscopia negativas, ante un paciente con sangre oculta en materia fecal y en el cual persiste la Anemia. (Grado Intermedio de recomendación). 4. Se recomienda la videocolonoscopia para la evaluación de pacientes con escasa hematoquezia o crónica intermitente en pacientes con edad> 50 años y para los pacientes que tienen deficiencia de hierro, anemia, factores de riesgo de neoplasia colorrectal, o los síntomas de alarma como pérdida de peso o cambios del ritmo intestinal. (Grado moderado de recomendación). 5. Sugerimos que en pacientes jóvenes que presentan escasa hematoquezia intermitente crónica sin síntomas de alarma , un examen rectal digital y una sigmoidoscopia flexible puede ser suficiente la evaluación.(Grado intermedio de recomendación) 6. Recomendamos EGD en la evaluación inicial de los pacientes con melena seguida de una colonoscopia si el resultado de una EGD es negativo.(Alto grado de recomendación) 7. Recomendamos una EGD inicial en pacientes con severa hematoquezia e inestabilidad hemodinámica, para evaluar la posibilidad de una lesión 144 gastrointestinal superior de alto riesgo, seguido de la colonoscopia si el resultado de la EGD es negativo. (Alto grado de recomendación) 8. Sugerimos una colonoscopia dentro de las 24 horas de ingreso después de una preparación intestinal rápida en la evaluación de pacientes con Proctorragia severa.(Grado moderado de recomendación) 9. Se recomienda el tratamiento endoscópico con inyección de epinefrina; esta solución se puede combinar con coagulación térmica o la colocación de clips endoscópicos como la indicación adecuada en pacientes que presentan sangrado diverticular. (Alto Grado de Recomendación) 10. Recomendamos clips endoscópicos o colocación de tatuajes adyacente a un divertículo sangrante si se identifican en la videocolonoscopia, para la futura localización en caso de sangrado recurrente. (Grado intermedio de Recomendación) (Opinion del Autor del relato: aprovecho esta recomendación de suma importancia no solo por la eventualidad del Resangrado, sino ante la posibilidad de una Resección quirúrgica abierta o por Videolaparoscopia). 11. Se recomienda el tratamiento de coagulación endoscópica con argón plasma como lo indicado en pacientes con sangrado por angioectasias.(Alto grado de Recomendación) 12. Recomendamos consulta quirúrgica y radiológica en pacientes que se presentan con hematoquezia grave en donde el paciente no puede ser estabilizado para la endoscopia o en los que la evaluación endoscópica ha fallado para revelar la fuente de sangrado.(Grado de recomendación moderada) No quiero dejar de comentar un último trabajo referido al costo y beneficios que tienen estos pacientes sangrantes, y sobre todo una clasificación muy interesante que divide a las etiologías de las HDB por edades. Me refiero a un Trabajo publicado en la Revista Clin Colon Rectal Surg (2012), por Raphaeli y Menon de la Swedish Colon and Rectal Clinic de Seattle, Washington, titulado El tratamiento actual en la Hemorragia Digestiva Baja. Dicen los Autores que la HDB, es un problema importante y costoso que requiere una evaluación, manejo y tratamiento metódico. Después de la resucitación inicial, se debe tener cuidado en localizar el sitio de sangrado. Una vez localizado, las 145 lesiones pueden ser entonces tratadas con intervenciones endoscópicas o angiográficas, reservando la cirugía para un sangrado recurrente que no se pueda controlar. 299 La mayoría de las Hemorragias Digestivas bajas masivas típicas requieren un promedio de 3 a 5 unidades de sangre en las primeras 24 hs. La incidencia anual de la Hemorragia Digestiva baja Grave se estima en unos 20 a 30 casos por 100.000 habitantes en Países Occidentales. 300 El costo promedio por admisión oscila en los 9.700 U$A, a 11.800 U$A. Considerando que en los EEUU ha ido en aumento este tipo de ingresos Hospitalarios en un 8% desde el año 1998 al 2006, los costos son muy importantes301. Aunque una Hemorragia Digestiva Baja puede ocurrir a cualquier edad, hay procesos patológicos específicos a distintas edades y grupos. La familiaridad de esto en los Médicos de recepción de la patología, puede ayudar a orientar que estudios selectivamente necesita ese paciente. Causas más comunes de Hematoquezia de acuerdo a la edad del Paciente Grupo Etario Adolescentes y Adultos Jóvenes Adultos hasta la sexta década Adultos que superan la sexta década Etiología de las Hemorragias Digestivas bajas Divertículo de Meckel, Enfermedades Inflamatorias Intestinales y Pólipos. Diverticulosis colónica, Enfermedad Inflamatoria Intestinal y Neoplasias. Malformaciones Arteriovenosas, Diverticulosis y Neoplasias. Los niños y adolescentes presentan con mayor frecuencia el sangrado de un divertículo de Meckel, enfermedad (EII) inflamatoria intestinal y pólipos (normalmente pólipos juveniles) La incidencia de divertículos de Meckel en la población general está en el intervalo de 1% a 3% y aproximadamente el 20% de los pacientes con divertículos de Meckel son sintomáticos, con mayor frecuencia presentan obstrucción o sangramiento del Divertículo. Pueden albergar mucosa gástrica que produce secreción ácida, se ulcera y luego produce el sangramiento, esto lo hace en episodios intermitentes y tiene grandes posibilidades de resangrado luego de detenida.302 Los pólipos juveniles son hamartomas benignos que pueden crecer a un gran tamaño y sangrar espontáneamente. Los pólipos son generalmente solitarios y ceden por lo general espontáneamente en la mayoría de los pacientes.303 146 La enfermedad inflamatoria intestinal tiene una distribución bimodal, como la mayoría de los diagnósticos se produce en la edad adulta o cercana a la sexta década de la vida. El sangrado es generalmente el síntoma inicial, pero la hemorragia masiva solo ocurre estadísticamente en el 1% de los pacientes. 304 Distinguir colitis de Crohn de la colitis ulcerosa es de real importancia debido a que la decisión de una Intervención quirúrgica; en la hemorragia masiva puede requerir una colectomía urgente ante un diagnóstico preciso. Los adultos con mayor frecuencia que presentan un sangrado importante este se presentan en un 3% a 5% de los pacientes con diverticulosis. En general el Divertículo sangrante puede estar situado a lo largo de todo el colon, pero en grandes series se demostró que en el 50% de las veces este se encuentra en el colon derecho. 305 La etiología del sangrado diverticular no se entiende con claridad, sin embargo, varias teorías han evolucionado con el tiempo. La lesión crónica en esta enfermedad provoca que los vasos rectos penetrantes a través del foramen Diverticular con la contracción muscular favorecería su ruptura y por lo tanto el sangramiento 306 Casi el 70 al 80% de esta enfermedad Diverticular sangra y tiende a resolverse espontáneamente, con nuevas posibilidades de resangrado hasta en el 38% de los pacientes.307,308 Recientemente se publicaron los resultados de un análisis prospectivo, ensayo aleatorio, que buscaba, comparar la Videocolonoscopia urgente (dentro de las 12 horas de la presentación) con la videocolonoscopia electiva (36 a 60 horas después de la presentación). Aunque el trabajo tuvo que ser cerrado antes de tiempo debido a la falta de reclutar suficientes pacientes para ser estadísticamente suficientemente, los resultados son interesantes. El grupo de videocolonoscopia urgente no tenía menos cantidad de intervenciones diagnósticas o terapéuticas posteriores, menos cantidad de transfusiones de sangre, o la duración de la estancia hospitalaria era menor 309. Sólo el 15% al 18% de los pacientes hospitalizados continuaron sangrando, la Videocolonoscopia tan urgente no está justificada, ya que la mayoría de los pacientes han dejado de sangrar si la videocolonoscopia se realiza con urgencia o electivamente 310. En algunos casos, la videocolonoscopia inmediata después del episodio de hematoquezia utilizando un enema para limpiar el colon distal y recto, puede ser capaz de distinguir rápidamente el sangrado del colon derecho comenzando en el izquierdo y 147 distinguir el sitio que sangra. Esta es una situación difícil, y si no llega a prepararse el Colon derecho correctamente, es difícil detectar el sitio de sangrado en el momento del examen. Solo si la sangre se encuentra en el Colon Izquierdo podría orientarnos mejor para tomar una conducta terapéutica. 311 Esta ventaja teórica de la Videocolonoscopia tanto como para el diagnóstico y una intervención terapéutica a menudo es desmentida por la dificultad del examen real en la dificultad de preparar el colon en una hemorragia masiva. Sin embargo, la videocolonoscopia, cuando arriba al lugar correcto, es una herramienta muy valiosa. Colitis Isquémica La Colitis Isquémica generalmente se presenta como Hematoquezia acompañada de dolor abdominal leve localizado en el flanco izquierdo, aunque puede presentarse sin dolor. La mayoría de los casos no tienen causa identificable, pero entre los factores predisponente a tener en cuenta son, la cirugía cardíaca, cirugía Aórtica, sobre todo en los Aneurismas aórticos donde se produce una disminución del flujo sanguíneo en la arteria mesentérica inferior por lo que se denomina Robo Aórtico. En las vasculitis y algunos productos medicamentosos en pacientes añosos. El diagnóstico la mayoría de las veces se hace con la videocolonoscopia 312 En casos severos el diagnostico se puede sospechar en el Colon por enema por la presencia de la identaciones digitiformes (stamp finger print), o el engrosamiento de la pared colónica. Las características endoscópicas son el eritema segmentario, friabilidad y exudado. Las características le son comunes a las enfermedades inflamatorias del colon por lo que muchas veces la Anatomopatológica es indicatoria. Fig. N° 40. Imágenes de Isquemia con sangrado en el ángulo Esplénico del colon, uno de los sitios de mayor incidencia porcentual de las Isquemias colónicas. Sectores de isquemia 148 parduzca rodeada de sectores congestivos. La arteriografía selectiva confirmó el diagnóstico. Fotos tomadas con Sistemas Olympus Exera II (NBI). Foto N° 41. Imágenes que muestran la Arteriografía por sustracción digital, la zona del sangrado ubicada en el marco colónico izquierdo, dependiente de la arteria Mesentérica inferior, varias zonas de llenado, remedando zonas múltiples (Divertículos) en la etapa de inyección del medio de contraste, y luego en la etapa venosa la marca característica de las Angiodisplasias Colónicas. Esta asociación ha sido frecuente en nuestra casuística. Fotos personales. Unidad Digestiva Baistrocchi. Fig. Nº 42. Histopatología de colitis isquémica aguda, con pérdida de la configuración glandular secundaria a necrosis coagulativa. Patron Espectral-simil. H&E, 25X(Prof. Dr. Luis Spitale) 149 Fig. Nº 43. Colitis isquémica aguda. Se observa pérdida de la configuración glandular con edema, congestión y hemorragia del corion. H&E, 25X (Prof. Dr. Luis Spitale). Fig. Nº 44. Figura X. Colitis isquémica crónica. La presencia de necrosis de coagulación o isquémica es el gold estándar, sumado a la fibrosis, atrofia de las criptas y hemorragia hialinización de la lámina propia, antigua. H&E, 25X (Prof. Dr. Luis Spitale -Unidad Digestiva Baistrocchi). CONCLUSIÓN Se debe cumplir con una metodología y un algoritmo universal, conociendo de antemano cuales son las Patologías prevalentes en el lugar donde nos desempeñamos, no es lo mismo una Institución con poblaciones cautivas, que un Hospital abierto, o un Hospital Rural con Poblaciones de costumbres higiénico dietéticas completamente 150 diferente a las de los pacientes de grandes Ciudades. La edad del paciente que consulta es clave para la determinación de que Patologías son incidentalmente más comunes. En General y con algunas leves modificaciones de acuerdo a los Países el rango de las Enfermedades es prácticamente coincidente en todas las estadísticas, como podrá verse en este relato. La Videocolonoscopia intrahemorrágica es un método difícil que entraña riesgo para el paciente cuyas condiciones hemodinámicas están comprometidas. Es este un método en estas circunstancias totalmente operador dependiente, no pudiendo estar en manos con poca experiencia, esto requiere además, dedicación y suma paciencia para que el método tenga el éxito deseado. El método por sí solo no es diagnosticador, sino que es el complemento de una Unidad Interdisciplinaria, donde se debe actuar rápidamente. La Unidad de Sangrantes debe ser hoy una realidad en todos los grandes centros, y su actividad debe tener 24 hs con guardias para actuar en el momento preciso. Ninguno de los métodos descriptos tienen efectividad por si solos, adquieren relevancia en el diagnóstico preciso cuando se los aplica correctamente. 151 PARTE 3 CAPÍTULO 7 LA VIDEOCOLONOSCOPIA EN EL CANCER COLORRECTAL La Videocolonoscopia es sin duda el método de elección para la detección de Pólipos y Cáncer Colorrectal, superando a los métodos Radiológicos de doble contraste, a la Tomografía Computada, a la Resonancia Magnética Nuclear y a la Colonoscopia Virtual, que tiene su indicación específica. En realidad la Videocolonoscopia y la Radiografía a doble contraste son dos métodos de muy buena sensibilidad e interpretación teniendo ambas muy alta sensibilidad.313 Video colonoscopia Sensibilidad CEDC 95% al 97% 84% 0,1% al 0,3% 0,03% FRSC 96% (colon distal) CEDC/FRSC 98% Morbilidad: Perforación 0,0015% 0,045% Hemorragia Los Tumores del Recto y del Colon en sus características endoscópicas pueden ser indistinguibles de las lesiones Adenomatosas como ya nos extendiéramos en el capítulo de Pólipos de Colon y Recto, o la sospecha de que estas estén invadidas por un Adenocarcinoma. En el Cáncer avanzado los tumores pueden ser Polipoideos, sésiles, o en dispersión mucosa lateral, pueden abracar gran parte del radio de circunferencia del Colon hasta llegar a ser sub-obstructivos u obstructivos. El total de los Tumores avanzados de Cáncer Colorrectal encontrados en las 15.286 Videocolonoscopías realizadas en esta recopilación, fue de 351 lesiones (2,96 %) del total de patología encontradas. 152 Los tumores obstructivos de la luz colónica fueron: de las 45 estricturas infranqueables de Colon (o, 29 % de todas las Videocolonoscopías) 29 correspondían a Tumores del Colon (17,36%) de los 167 Cánceres de Colon avanzados encontrados. De todos los tumores del Colon avanzados, (167) solo 15 (8,98%) fueron Sincrónicos, de dos y tres lesiones, ubicadas a los largo del colon hasta el Ciego. Las ubicaciones de estas fueron más comúnmente en el Sigma, ángulo esplénico, ángulo Hepático y Ciego. Casi siempre nos detuvimos en la primera lesión aunque esta fuera subobstructiva, y el resto de las lesiones se hizo diagnóstico con Radiografía de Colon por Enema o Colonoscopia Virtual por substracción digital. Nuestras lesiones avanzadas de Cáncer colorrectal se ubicaron en los siguientes lugares anatómicos: (Fig. N° 1) En el Recto 184 lesiones (1,20%) del total de las Videocolonoscopías y el (52,4%) de todas las lesiones avanzadas. El Cáncer de Colon 167 (1,09 %) de todas las Videocolonoscopías y (47,5 %) de todas las lesiones avanzadas, se ubicaron en los siguientes lugares anatómicos: 56% en la unión Rectosigmoidea, 12% en el Colon Izquierdo, 7% en el Colon Transverso y ángulo Hepático, y 25% en el colon Derecho y Ciego. Fig. 45. Muestra los distintos sectores anatómicos de la ubicación de los tumores avanzados hallados en este recuento de Videocolonoscopías realizadas El Síndrome de cáncer de colon hereditario sin poliposis (HNPCC, el síndrome de Lynch) tiene un riesgo de penetración del 40% al 80% de desarrollar cáncer colorrectal; las personas con este síndrome también están en mayor riesgo de cáncer uretral, cáncer 153 de endometrio, y otros cánceres menos comunes. El Síndrome de Lynch se caracteriza por reparación de genes deficientes (dMMR) debido a una mutación hereditaria en uno de los genes de reparación, como hMLH1, hMSH2, hMSH6, HPMS 1, PMS2, y posiblemente otros genes no descubiertos. El cáncer colorrectal es un proceso de enfermedad multifactorial. Los factores genéticos, exposiciones ambientales (incluyendo la dieta), y las condiciones inflamatorias del tracto digestivo están involucrados en el desarrollo del cáncer colorrectal. Aunque mucho de la genética del cáncer colorrectal se desconoce, la investigación actual indica que los factores genéticos tienen la mayor correlación con el cáncer colorrectal. Mutación hereditaria del gen APC es la causa de la poliposis adenomatosa familiar (PAF), en la que los individuos afectados llevan un riesgo casi el 100% de desarrollar cáncer de colon en un adulto joven de 18 años hasta los 40 años de edad. HNPCC es una causa de aproximadamente el 6% de todos los cánceres de colon. Aunque el uso de la aspirina puede reducir el riesgo de neoplasia colorrectal en algunas poblaciones, un estudio de Burn et al encontró ningún efecto sobre la incidencia de cáncer colorrectal en los portadores del síndrome de Lynch con el uso de la aspirina, el almidón resistente, o ambos. 314 En nuestra experiencia en la Unidad Digestiva Baistrocchi, Córdoba, no tuvimos la oportunidad de marcar para esta lesión a nuestros pacientes, aunque sospechamos que en varios de los pacientes con Tumores Sincrónicos eran portadores de un Sindrome de Lynch porque reunían algunos de los criterios de Amsterdam y Bethesda. Diagnóstico diferencial En realidad con la marcación superficial de la Cromoscopía ya sea con Índigo Carmín como la Cromoscopía Electrónica de NBI de Olympus el aspecto superficial de la mucosa desestructurada es una típica clasificación de grado V de Kudo, en algunas oportunidades hemos dudado en las Diverticulitis aguda edematosa, pese a que el patrón mucoso es inflamatorio, nos ha llevado a la toma repetida de muestras biopsias en el mismo procedimiento. Si bien la Enfermedad de Crohn ha sido escasa (solo 24 pacientes, 0,15% de las Videocolonoscopías) la estenosis tumoral e inflamatoria de la luz colónica 154 puede llevar a un error interpretativo de la imagen, por supuesto que la Anatomía Patológica siempre fue aclaratoria, teniendo la precaución de tomar más de una muestra Biopsia. Screening de alto riesgo El Screening en familias portadoras de Poliposis Adenomatosa Familiar o Síndrome de Lynch (CCHSP), debe ser cuidadoso. Estos Síndromes son responsables del 1 al 2% de los Cánceres de Colon y Recto en los Países desarrollados. 315 En la Poliposis Familiar los hijos de personas con PAF, deben iniciar el programa de control a los 10 a 12 años de edad con Videocolonoscopia anual hasta por lo menos 25 años de edad. Luego cada 2 años hasta los 35. Y después cada tres años hasta los 50 años de edad. Existen en la actualidad como nombráramos en al Capítulo de PAF numerosas pruebas Genéticas que permiten la identificación de las mutaciones en un 80% de los portadores En el CCHSP o Síndrome de Lynch el screening se inicia con Videocolonoscopia a todos los miembros de la Familia que cumplen con los Criterios de Amsterdam y Bethesda. Los estudios deben comenzarse entre los 20 y 25 años de edad o 10 años que el pariente directo más joven y realizarla una por año o cada 2 años. Además de los estudios Genéticos correspondientes. 316 155 Fig. 46. El Panel de Fotografías realizadas con Olympus Exera II (NBI) y Sistemas Endoscopy Argentina, muestran en la primera fila un Pólipo Adenomatoso que ocupa un 40% de la luz del colon, luego un Adenocarcinoma obstructivo, con las características de la Banda Angosta (NBI) de la desestructura del epitelio mucoso. En la Segunda Línea la Enfermedad de Crohn subobstructiva con patrones mucosos inflamatorios, pero que podrían prestarse a confusión. Y en la última línea Diverticulitis del Colon Izquierdo con lesión deprimida en un Foramen Diverticular, y la última de la derecha un edema con fibrina típico de las Enfermedades Inflamatorias del colon. Unidad Digestiva Baistrocchi. 156 CAPÍTULO 8 Secuencia Pólipo – Cáncer Los pólipos neoplásicos recto-colónicos son los adenomas tubulares, los vellosos y los tubulovellosos. Los adenomas tubulares son en proporción el 75% de los pólipos hallados en el tubo colorrectal, los adenomas vellosos el 10% y los mixtos o tubulovellosos el 15%. El potencial maligno de estos pólipos está relacionado al tamaño de los mismos. El promedio de malignización consultando varios autores y en nuestra estadística de los pólipos adenomatosos es alrededor del 5%. 317 Los vellosos tendrían mayor poder de malignización ubicándose en un porcentaje que es del 35% al 40%, y un 22% de los mixtos. El cáncer invasor es raro en los pólipos menores de 1 cm. y su incidencia aumenta a medida que la lesión aumenta de tamaño. Hoy este concepto está en plena revisión debido al estudio exhaustivo de las pequeñas lesiones elevadas del colon, que con nuevos métodos de detección como la magnificación y la coloración de los mismos (Cromoscopía) se puede detectar más precozmente la invasión submucosa del adenocarcinoma, y es probable que esto vuelque las estadísticas a mayor cantidad de pólipos menores de 1 cm. con invasión carcinomatosa detectados. 318 El concepto de que el cáncer colorrectal proviene de los pólipos adenomatosos fue ya observado por Dukes en el St. Marks Hospital de Londres en el año 1926 319. R.J.Jackman y C.W. Mayo acuñaron el término adenoma-carcinoma – sequence en el año 1951 320. Numerosos trabajos avalaron en estos últimos años el fundamento de que los pólipos del colon y recto caminan indudablemente hacia un cáncer colorrectal. Uno de los trabajos más significativos al respecto fue el de Fearon y Voglestein en 1990,321 que fueron conocidos en todo el mundo como los creadores del Modelo de tumorogénesis. 157 Fig. N° 47: Modelo de la tumorogénesis de Fearon y Voglestein. 1990. En varios países del mundo adoptaron como medida segura, en aras a reducir la incidencia del CCR, la extirpación de los pólipos del colon, aceptando como verdadera esta secuencia, y numerosos trabajos al respecto 322 aconsejan su screening en pacientes alrededor de los 50 años y su remoción precoz 323. Numerosos estudios, la mayoría de ellos retrospectivos basados en registros de tumores, publicaciones, fichas hospitalarias, informes anatomopatológicos, piezas quirúrgicas y colonoscopías, muestran la coexistencia de adenomas con adenocarcinomas. Estas publicaciones324 muestran porcentajes para el colon y el recto de 13% al 62%. En nuestro país muchos autores publican esta relación de los pólipos adenomatosos y vellosos con el cáncer colorrectal, Donnelly, Salomón y Bugallo publican en la Revista Argentina de Cirugía la experiencia del Hospital Británico de Buenos Aires, advirtiendo del riesgo que significa el aumento del tamaño de los mismos y la relación con la malignización. 325 Otros autores argentinos como Bossisio, Graziano, Ramírez, del Hospital Bonorino Udaondo en un trabajo sobre la resección transanal de los adenomas vellosos del recto, admiten los numerosos riesgos de malignización que ya fueron advertidos hace años por Morson, Winaver y Maruyama 326,327. 158 Pólipo con Cáncer Invasor. Riesgos. Como lo expresa Santhat Nivatongs el término de “Carcinoma Invasor” o “Cáncer Invasor” es aplicado solo cuando células malignas invaden el pólipo, sean sésiles o pediculados, parcial o totalmente a través de la “Muscularis Mucosae”. El carcinoma que se ubica por encima de la Muscularis Mucosae, no da metástasis y puede ser clasificado según su atipia. Se lo puede identificar como carcinoma “In Situ” o carcinoma superficial, para este tipo de lesiones es necesaria su resección completa y el seguimiento es similar al de los pólipos benignos. Los pólipos sésiles tienden, cuando sobre ellos asienta un carcinoma invasor de dar metástasis linfática, y el riesgo es mucho más alto en los carcinomas indiferenciados o carcinoma polipoide, pues invaden con facilidad los vasos o los linfáticos. A estos pacientes se les debe realizar una cirugía radical. Que para la ubicación en el recto inferior hoy la microcirugía con aparatos especiales (TEM. Transanal, Endoscopy Microsurgery) 328 o la videocolonoscopia de alta resolución o videocolonoscopia magnificada acompañada de la Cromoscopía 329,330 que limita muy bien las márgenes, pueden hacernos resecar una lesión completamente y con buenos márgenes. Fig. 48: Delimitación de la lesión del recto con cromoscopía, y su resección. obsérvese el lecho coagulado. En los pólipos pediculados la invasión limitada a la cabeza o al tallo tienen bajo riesgo de invadir linfáticos, y por consiguiente de dar metástasis. La polipectomía completa brinda seguridad. La literatura referida al tratamiento de los pólipos colorrectales con “Carcinoma Invasor” no está totalmente definida en sus criterios, para decidir si el pólipo debe ser 159 resecado endoscópica o quirúrgicamente con patrones no muy bien definidos. Algunas series hasta resecan quirúrgicamente el espécimen sin haber realizado previamente la Polipectomía, sin aclarar como hicieron para definir esta circunstancia. Lo cierto es que hoy casi en forma unánime se consideran los criterios de Haggitt 331 como un sistema válido para la clasificación de la invasión carcinomatosa en los pólipos. Este autor en el año 1985 publica trabajos haciendo consideraciones al respecto que son a mi criterio las más definidas. El nivel 4 (invasión de la sub-mucosa en la pared del colon) significa uno de los aspectos más adversos para el pronóstico de este paciente, considerando que estos deberían ser resecados quirúrgicamente cuando los márgenes de la resección endoscópica no eran los adecuados. Consideran al tamaño y el aspecto del tumor poliposo, como la invasión linfática, verdaderos predictores adversos para el huésped. (Fig. Nº ………..) Fig. 49: Criterios de Haggitt. 160 Criterios de Haggitt. NIVEL GRADO DE INVASION Nivel 0 Carcinoma “In Situ” Nivel 1 Invasión de la “Muscularis Mucosae” a través de la Submucosa en la cabeza del pólipo Nivel 2 Invasión de la base de la cabeza. Nivel 3 Invasión del tallo. Nivel 4 Invasión de la submucosa en la pared del colon por debajo del tallo Para los pólipos sésiles “son clasificados en NIVEL 4, cuando el carcinoma se extiende más allá de la MUSCULARIS MUCOSAE. En realidad el factor tamaño esta en directa relación con la malignización del pólipo, se estima que el riesgo de incluir un carcinoma en un adenoma menores a 1 cm es del 1%, del 10% en adenomas entre 1 y 2 cm., y del 20 al 50% en adenomas que superan los 2 cm. 332 Las posibilidades de que un pólipo adenomatoso pueda transformarse en maligno durante el transcurso de la vida si no es resecado es de un 5 a 10%, esto fue evaluado en un trabajo de Johannsen y Momsen de Dinamarca 333. Pero si evaluamos las posibilidades en el transcurso de la vida de acuerdo a los años de evolución de los mismos pólipos adenomatosos si no son resecados, adquieren mayor posibilidad con el número de años, parecería que esto además del tamaño está ligado al tiempo de permanencia en el colon o recto; esto también fue evaluado en un trabajo de Stryker, Wolf y cols 334 Los riesgos de malignización de los pólipos dependerá también como ya lo expresaran Haggitt y Morson, de la conformación anatómica de los mismos. Dependiendo si son con tallo o estos son sésiles. 335,336 Fig. 50: Pólipo sésil del Colon 161 Fig. 51: Pólipo pediculado del Colon Uno de los Trabajos al respecto es el la Ochsner Medical Fundación de New Orleans, en donde con estos criterios en 15.975 colonoscopias, realizan 8.685 polipectomías, y en las cuales encuentran 65 casos con invasión carcinomatosa (0,8%). Para este grupo la indicación de la colectomía fue: 1) Nivel 3 y 4 de Haggitt, 2) Márgenes inadecuados, 3) El paciente prefirió, 4) Pobre diferenciación. Nivatongs y cols 337, en 1991, revisan 151 casos de pacientes a los cuales se les había realizado una colectomía por pólipos colorrectales que tenían invasión carcinomatosa, no todos los pacientes fueron polipectomizados antes de la colecto mía, y solo los pacientes con Nivel 4 de Haggitt tenían invasión en los ganglios linfáticos, y esto ocurrió solo en el 11,5% de los casos. Ellos concluyen que solo el Nivel 4 de Haggitt es el factor más predictivo de metástasis ganglionares en estas lesiones. El pólipo velloso del recto tiene características que le son propias, primero por su alto porcentaje de malignización, y después por su tamaño que la mayoría de las veces cuando lo descubrimos ya ha superado los dos o tres cm., y se ha extendido en alfombra por la superficie mucosa del recto. En realidad su génesis histológica es la misma que el adenomatoso solo difiere en su distribución de las glándulas que lo hacen en empalizada y en mayor número. El riesgo de malignización que tiene históricamente esta lesión, solo se debe a que el número de glándulas y por lo tanto células, es tres a cuatro veces mayor que las que acumula un pólipo adenomatoso, y por ende la mayor posibilidad que en su crecimiento se injerte un adenocarcinoma. Esto ya fue estudiado por Nakamura en un trabajo 338 donde detallan que el aspecto diferente de los adenomas tubulares y los vellosos estaría dado por el distinto número y distintas mutaciones en el Gen Ki-ras, DCC Y P53. 162 El Dr. Bossisio y Graziano en un trabajo que publican en La Revista Argentina de Cirugía en el 2001 339, advierten sobre el alto potencial de malignización de estos pólipos en su experiencia vivida en el Hospital Bonorino Udaondo de Buenos Aires, la dificultad en el diagnóstico histológico de certeza, la elevada frecuencia de residuos y/o recurrencias además de las dudas que pueden suscitar en cuanto a la elección de la táctica quirúrgica cuando asientan en el recto. Existen varios procedimientos para el manejo de estos pólipos extendidos, entre los quirúrgicos los más usados son la resección transanal (RTA) resección anterior, resección transvaginal, y resección por vía posterior, cualquiera de las variantes. Hoy contamos con el aparato denominado TEM (Transanal, Escisión, Microsurgery) para la exéresis de estas lesiones, o con separadores anales se logran también buenos resultados. Los separadores más usados son el de Parks, o el de Zorraquin que en tamaño amplio otorga una luz de trabajo de 3 cm. de apertura posterior. Estas lesiones deben ser resecadas incluyendo buenos márgenes. Cuando la lesión central presenta fijación en la base, es dable sospechar que podría haber invasión submucosa y el procedimiento debería incluir la pared total del recto y tomar la decisión definitiva con el resultado de la anatomía patológica 340. Fig. 52: Resección de gran pólipo velloso de recto por video colonoscopia 163 Fig. 53: Resección de gran pólipo velloso, por vía endoanal, con separador de Parks. Los adenomas vellosos, y los adenomas tubulovellosos, comprenden entre el 19% y el 53% de los adenomas colorrectales, asentando en el recto un 70% de ellos, con predilección en el tercio inferior. 341 En la figura 8 puede observarse la resección endoscópica de un adenoma velloso de recto de gran tamaño, que mediante inyección submucosa y resección en trozos puede resecarse. La Fig. 9 muestra la utilidad del separador de Parks para una resección endoanal de un gran adenoma velloso del recto. Clasificación macroscópica del Cáncer temprano Colorrectal 342 164 TIPO PROTRUIDO 1. Tipo Ip (con pedículo) Este tipo se refiere a lesiones con distinto tallo, largo o corto. Lesiones con largo o mediano pedículo son referidas a adenomas benignos. Y aunque estos estén invadidos en alguna porción por un cáncer difícilmente toman la submucosa. Estas lesiones aparecen preferentemente en la sigma y recto quizás debido a la peristalsis del tránsito intestinal. 2. Tipo Isp (sin pedículo) Estos se refieren a pólipos cuya cabeza no está muy lejos del tallo, estas tienden a ser de mayor tamaño que las sésiles. 3. Tipo Is (Sésiles) Son lesiones desprovistas de tallo y son por lo general pequeñas y su diámetro nunca supera el tamaño de su profundidad. TIPO SUPERFICIAL A) TIPO SUPERFICIAL ELEVADO 1. Tipo IIa. Lesiones ligeramente elevadas, comúnmente su profundidad es la mitad de su diámetro. En general con la visión de un endoscopio común es más difícil predecir su profundidad sobre todo si se tratara de un cáncer temprano. Pero en general este Tipo IIa no supera los 2mm de altura. 2. Tipo IIa + dep. Estos adenomas ligeramente elevados pueden aparecer con una ligera depresión o pseudodepresión, esta es poco profunda y no es extensa en superficie 3. Tipo IIa + II c Estos si son “Flat elevated Tumors” con depresión. La mayoría de las lesiones son mayores de 1 cm de tamaño y por lo general son “Cánceres Submucosos” B) TIPO SUPERFICIAL PLANO 1. Tipo IIb. Este es el FLAT ADENOMA O FLAT TUMORS clásico, sin elevación o con depresión. Por lo general son menores de 5 mm de diámetro. El más frecuente es el adenoma. 165 C) TIPO SUPERFICIAL DEPRIMIDO 1. Tipo IIc. Tumores ligeramente deprimidos pero sin márgenes elevados. La depresión es evidente cuando lo observamos de perfil. La mayoría son cánceres submucosos 2. Tipo IIc + IIa. Tumores deprimidos pero con márgenes elevados. En estos casos solo la porción deprimida es cáncer, los bordes pueden ser tejido hiperplásico no neoplásico. Desarrollo del Cáncer Colorrectal temprano en las lesiones deprimidas. (Flat Adenomas) Estos pequeños cánceres o cánceres deprimidos son clasificados en tres tipos de acuerdo a la lesión patológica del desarrollo de los patrones de penetración e invasón sub-mucosa: 1) Tipo penetrado. 2) Tipo de expansión lateral y 3) Tipo de extensión superficial. El Tipo 1 invade la submucosa y los vasos en un estadio relativamente temprano pese a su pequeño tamaño. Compromete rápidamente a la muscularis mucosae. El Tipo 2 de expansión lateral invade la submucosa, compromete a la muscularis mucosae, pero eleva la mucosa que lo rodea formando un círculo montañoso periférico. El Tipo 3 en cambio demora su penetración, no eleva la mucosa pero termina invadiendo en un estadío más tardío el plano submucoso. Estos procesos tienen características endoscópicas propias que con la magnificación pueden ser distinguidas más precozmente. El Tipo penetrante (1) su tamaño no es mayor a los 5 mm pero desarrolla una muesca submucosa muy difícil de distinguir endoscópicamente. A estos procesos se les debería agregar la Ecoendoscopía con la sonda transcanular para determinar su verdadero grado de penetración, su visión Magnificada podría corresponder a un Pit Pattern III S. Los tumores de expansión lateral (2) tipo IIc+IIa o IIa+IIc es el resultado de la elevación de la mucosa que lo rodea, esto ocurre comúnmente cuando el tumor ya ha 166 penetrado el plano sub-mucoso, estos son de alto riesgo porqué se descubren casi siempre con la submucosa comprometida. Los tumores de difusión superficial (3) son de una coloración normal, por lo tanto muy difíciles de detectar por el endoscopista, no tiene márgenes elevados y solo con coloración, muy atentamente, lavando la zona y magnificando la imagen varias veces pueden ser descubiertos. Su desarrollo por suerte es muy lento y la incidencia baja, pero de todas maneras terminan invadiendo los planos submucosos. Fig. N° 54. Desarrollo del Cáncer Colorrectal temprano en las lesiones deprimidas. (Flat Adenomas) (Shin-ei Kudo’s Early Colorectal Cancer, 1996) (Early Colorectal Cancer, detection of depressed types of Colorectal Carcinoma. Igaku-Shon, Tokyo-New York.1996) CLASIFICACIÓN DEL GRADO DE INVASIÓN SUBMUCOSA La clasificación del grado de penetración submucosa, se divide en tres categorías, que fueron propuestas por Dr. Kudo en 1984: sm1, sm 2, sm 3. Basados en el porcentaje de extensión lateral con el de penetración submucosa se establecieron para las lesiones sm1 tres categorías, estas fueron propuestas por Kudo en 1984 : Sm1 a la relación es menor al 1/4 167 Sm1 b la relación es 1/4 - 1/2 Sm1 c la relación es mayor a 1/2 Fig 55: From Shin-ei Kudo’s Early Colorectal Cancer, 1996. METÁSTASIS A LOS GANGLIOS LINFÁTICOS EN LOS CÁNCERES SUBMUCOSOS 343 Aproximadamente el 10% de los canceres submucosos metastatizan a nódulos linfáticos. Es por eso que es de real importancia determinar qué tipo de canceres submucosos tienen posibilidad de invadir los ganglios. En el Japón, “General Rules for clinical and Pathological Studies on Cancer of the Colon, Rectum and Anus” 344 dice lo siguiente: Cuando el cáncer invade la submucosa debe ser considerada la resección intestinal. Pero sin embargo no todos los canceres que invaden el plano submucoso dan recurrencias o metástasis. El riesgo de metástasis es particularmente alto en las siguientes situaciones: - Invasión carcinomatosa intravascular - Adenocarcinoma pobremente diferenciado o indiferenciado. - Invasión de los bordes de sección En realidad en la práctica clínica los adenocarcinomas pobremente diferenciados y los indiferenciados son muy raros de encontrar en las invasiones submucosas de estos canceres. En la experiencia del Dr. Kudo en 139 canceres submucosos se encontraron 14 168 (10.0 %) metástasis a ganglios linfáticos. La mayoría de ellos eran mayores de 10 mm en tamaño, de tipo IIa+IIc o tipo I en su configuración. Y en la tipificación de sm1 el sm1c, los sm1a ninguno presentaron metástasis. Para la toma de estas decisiones nos ha sido de singular ayuda el uso de la Ecosonografía Transendoscópica (SONOPROBE). Esta sonda transcanular que se introduce por el canal de trabajo del colonoscopio, nos da la imagen de penetración en pared de la lesión que estamos observando, corroborando con esto la sospecha de invasión Submucosa, que teníamos con la magnificación y cromoscopía. En nuestra casuística casi el 60% de los pólipos encontrados fueron hiperplásicos, y una lesión hiperplásica con inclusión carcinomatosa. Siempre hemos aconsejado que estos pólipos pese a su muy bajo potencial maligno, deben resecarse, inclusive en la misma sesión diagnóstica que puede hacerse con facilidad. 345 Fig.N° 56. Ecosonografía transendoscópica que muestra lesión que penetra la submucosa. Fig. 57: Pólipo Pit Pattern. Izquierda: III L con depresión central. Derecha III L con inclusión carcinomatosa. 169 Fig. 58: Pólipo adenomatoso de colon con focos de adenocarcinoma intramucoso (flechas). H&E,25X BREVE RESUMEN DE LAS BASES GENÉTICAS, Y CAMINOS ALTERNATIVOS (PATTHWAY) EN LA CARCINOGENESIS DEL CANCER COLORRECTAL. MECANISMOS DE LA CARCINOGENESIS En realidad todos los cánceres se desarrollarían mediante un mismo mecanismo, más aún es verdad que no todos los colon desarrollan cáncer mediante los mismos sucesos genéticos. Dos de estos mecanismos son en general. Los más estudiados. Uno es el modelo de carcinogénesis de etapas múltiples que provino del Laboratorio de Bert Vogelstein en el año 1988. El otro es el Modelo de cáncer de Colon familiar que hoy está siendo estudiado con mayor preocupación cómo se verá más adelante. Para el modelo somático, se ha propuesto que existen lesiones genéticas específicas que llevan al desarrollo del cáncer en un único proceso. Aparentemente se requiere la acumulación de diversas lesiones genéticas que carecen los tejidos normales, y muchas son halladas en el cáncer. El gen APC se inactiva primero mediante dos pasos de un gen supresor del tumor, y este proceso origina el pólipo adenomatoso. El adenoma crece y hasta cierto grado, el promedio de crecimiento y el aspecto diferente de los adenomas tubulares y de los adenomas vellosos se producen por distintas mutaciones en el gen Ki-ras, el gen p53 y el gen DCC. Luego este neoplasma benigno se vuelve maligno por medio de una inactivación de dos pasos del gen p53. 170 Hay dos puntos muy importantes en el desarrollo del cáncer colorrectal, el primero es el APC locus, y el otro es el p53. El locus APC del gen APC tiene mayor importancia debido a que las mutaciones de línea germinal en este gen causan Poliposis Adenomatosa Familiar. Las células normales se caracterizan por el crecimiento controlado, la inhibición por contacto y una vida limitada. Estas características están determinadas por una compleja interacción de factores extracelulares e intracelulares en la que intervienen numerosos genes que se integran en sistemas de señales conocidos como canonical signaling cassettes. 346 Los sistemas de señales con reconocida asociación al cáncer colorrectal son: el sistema Wnt (Winless signaling pathway o B catenin signaling) el EGF (Factor de Crecimiento Epidermoide) y el TGF-B (transforming growth factor beta). Cada uno de estos sistemas envía señales desde la superficie celular al núcleo, donde una serie de genes puede ser activada o inactivada. Otro sistema frecuentemente implicado es el de la apoptosis (muerte programada) que responde al daño del ADN y en el que el gen p53 desempeña un papel relevante. Fig. N° 59: Las imágenes fueron obtenidas con videocolonoscopia de alta resolución y cromoscopia. En la figura 59 se esquematizan los principales cambios mutacionales relacionados con la progresión adenoma-carcinoma. La flecha superior representa los 171 diez años que tardaría cuando los genes implicados son los relacionados a la inestabilidad cromosomal. Cuando hay un déficit de función de los genes reparadores (flecha inferior), las mutaciones se producen en otro grupo de genes específicos (Bcatenina, TGF, BII, etc.) estimándose que el proceso de malignización se acorta a menos de tres años. RUTA PRINCIPAL DEL DESARROLLO DEL CANCER COLO-RECTAL. HISTORIA NATURAL. En realidad las lesiones elevadas del Recto-Colon tienen solo dos rutas a seguir en su desarrollo. La de las lesiones elevadas IIa que pueden crecer siguiendo la ruta de la montaña (elevación) hasta terminar en un Ip (pediculado) o interfiriendo en su camino lesiones semipediculadas Isp o sesiles Is. Para luego transformarse o incluir en ellas lesiones Carcinomatosas. Pero la ruta más peligrosa por la velocidad de desarrollo es la “Directa”. Lesiones IIa +IIc, IIb o IIc, procesos que rápidamente toman la submucosa para convertirse de “Cáncer Temprano” a “Cáncer avanzado” al penetrar rápidamente la submucosa. Muchos Autores han especulado que esta es la ruta más común y más rápida de desarrollo tumoral, que avanza hacia otros estadios. En Estómago hay numerosas publicaciones del seguimiento de estos pequeños tumores, sin embargo en Colon hay pocos trabajos referidos al seguimiento de estas. Hay un estudio importante radiólogo de Ushio y cols. 347 Publicado en 1995 en donde demuestra que lesiones IIa +IIc de 10-19 mm de tamaño tienen altísimo riesgo porque rápidamente avanzan a cáncer con estenosis en pocos años. Cambios Morfológicos en los ADENOMAS Y CARCINOMAS “MOUNTAIN ROUT AND DIRECT ROUT”: El desarrollo del cáncer colorrectal y su avance en los distintos estadios sub-mucosos ha sido dividido en dos rutas. 348 La ruta de la montaña que forma los Pólipos y la ruta directa que representa el “Cancer de Novo”. La primera ruta es de larga duración y de baja incidencia, en cambio la ruta directa es de corta duración y de alta incidencia. Los cánceres que eligen la ruta directa y son superficiales como IIa/II+IIc/IIc+IIa, son pequeños pero invaden profundamente en un estadio temprano. El Tipo IIc. Cáncer deprimido profundamente en particular se desarrolla rápidamente. De acuerdo a la experiencia de la escuela Japonesa los cambios morfológicos en el cáncer colorrectal temprano pueden ser resumidos en los siguiente: 172 A – IIc y IIc+IIa Representan un Borman 2 a 3 de Cáncer Avanzado. B – IIb ----- IIa + IIc Tipo 2 de cáncer avanzado. C – IIb ----- IIa --------- Tipo protruido, Cáncer temprano ¡! tipo 1 de Cáncer avanzado ¡! D – LST ( Creeping tumor) --------- Tipo 1 o 2 de Cáncer Avanzado. Las categorías A y B representan los “CA DE NOVO” y la categoría “C “ es la secuencia Adenoma – Carcinoma. Fig 60: VIDEOCOLONOSCOPIA MAGNIFICADA Y CROMOSCOPIA La Colonoscopía Magnificada (CM) provee la observación de imágenes de la superficie mucosa, en sus finas estructuras, los orificios glandulares (PITS) de las Criptas colorrectales, proveyendo una nueva morfología para su interpretación. Como pequeñas neoplasias colorrectales con significativas atipias, zonas de displasias, pequeños Pólipos planos (Flat Adenomas), pequeñas lesiones ulceradas, que con el agregado de la 173 coloración (Cromoendoscopia) proveen al observador datos imposibles de reconocer con una Colonoscopía Fibra óptica o un Videocolonoscopio convencional. El avance en las observaciones nos ha llevado a demostrar su utilidad también en las Lesiones de la Colitis Ulcerosa, demostrando la presencia de Pólipos Adenomatosos, Vellosos, Hiperplásicos y Mixtos, además de Displasias, dándonos la posibilidad de estudiar la histogénesis del cáncer colorrectal en las enfermedades inflamatorias del colon. El desarrollo de la Colonoscopía Magnificada ha representado un significativo avance en la Colonoscopía diagnóstica, al mostrarle al observador imágenes de la superficie mucosa que instantáneamente puede ampliar 40, 60 y 100 veces. La habilidad para establecer una relación entre el diagnóstico endoscópico y el histológico fue un largo anhelo de los endoscopistas durante muchos años. El disponer en la actualidad de un método que nos acerque a una mejor sospecha de cambios estructurales y/o histológicos nos da la posibilidad de ser más precisos en el diagnóstico de las lesiones pre-neoplásicas y neoplásicas. Hoy disponemos ya de una Clasificación para los patrones Mucosos (Pit Pattern) elaborada por un Pionero de esta práctica, el Dr. Shin-ei Kudo director del Dto. De Cirugía, División de Gastroenterología del Akita Red Cross Hospital de Akita Japón. Existen publicaciones de varios autores más en el resto del mundo pero principalmente de Japón como Hideki Mitooka, que tuvo el mérito de publicar por primera vez un Vídeo al alcance de todos que edito la American Society for Gastrointestinal Endoscopy (ASGE) en el Congreso de esta, realizado en Orlando, Florida EEUU, en mayo de 1999 (DDW). 349 Consisten en clasificar la visión magnificada de las criptas colónicas de acuerdo a la deformación que sufren, comparadas con la normalidad (PITS) Hoy existen aparatos de alta Tecnología y alta resolución que traen incorporados en el mismo sistema como una condición incluso de competencia , lo que llamamos Magnificación que es obtener una imagen de mayor ampliación en promedio 60 a 80 veces la imagen observada incluso con Cromoendoscopia Electrónica incorporada como La Narrow band Imaging (NBI de la casa Olympus) sistema que utilizamos de rutina en la actualidad, el sistema FICE (Flexible Spectral Imagin Color Enhancement) de la firma Fujinon y el iSCAN de Pentax, estos grandes adelantos además de tecnologías ópticas de 174 avanzada tienen la comodidad de que con solo la presión de un botón incorporado en el cabezal se obtiene la ampliación de la imagen y la Cromoscopía Electrónica, compitiendo con la inyección en spray a través de una canal de trabajo o con una cánula del Índigo Carmín usado en la primera y gran forma de detectar las irregularidades de la superficie mucosa. Esta tecnología de avanzada posibilita tener imágenes espectrales en el FICE , y con filtros ópticos en NBI, esta combinación de ondas de luz reflejadas sobre la mucosa nos permite observar con muchísima sensibilidad los cambios superficiales de la mucosa colónica y los patrones vasculares que los define con mayor exactitud, estos elementos que conforman los plexos subepiteliales. Otros de los sistemas a los que personalmente no he tenido alcance es Endomicroscopia con láser confocal, los primeros sistemas consistían e pasar una sonda a través del canal de trabajo de cualquier Videocolonoscopio. Se trata de un sistema endomicroscopía de Mauna Kea Technologies con sede en París. El principal producto de esta empresa, la Cellvizio® Fibered sistema de microscopía confocal, permite insertar una mini sonda (sólo 300 µm a 2,8 mm de diámetro) en un endoscopio convencional y grabar películas de nivel microscópico del tejido muy rápido (12 cuadros/seg). Uno de los últimos trabajos presentados en la Digestive Disease Week del 2014, (May 3-6, 2014, Chicago, Illinois, USA) por Mori Yuichi, Shin–ei Kudo, Kunihiko Wakamura y cols del Digestive Disease Center, Showa University Northern Yokohama Hospital, Yokohama, Japan. 350 Se refiere a un sistema de Computación que ayuda a detectar las lesiones del Colon denominado Endocytoscopy. El Endocitoscopio permite el estudio in vivo de los núcleos a 450 × de magnificación durante la endoscopia gastrointestinal, lo que permite la predicción exacta de la patología de la lesión. Sin embargo, debido a que requiere formación y experiencia, puede ser beneficioso sólo cuando es realizada por endoscopistas expertos, aclaran los Autores. Equipos de prueba compararon las imágenes endoscópicas de luz blanca e imágenes “endocytoscopy” de 176 pequeños pólipos colorrectales (137 neoplásicos y 39 pólipos no neoplásicos) fueron evaluados por EC-CAD, por 2 endoscopistas expertos, y 2 endoscopistas en prácticas. EC-CAD tuvo una sensibilidad del 92,0% y una precisión del 89,2%; éstos eran comparables a los alcanzados por los endoscopistas expertos (92,7% y 175 92,3%, p = 0,868 y 0,256, respectivamente), y significativamente más altos que los logrados por los endoscopistas en formación (81,8% y 80,4%, p <0,001 y 0,002, respectivamente). EC-CAD alcanzó una especificidad del 79,5%; esto no difirió significativamente de la alcanzada por los expertos y aprendices. EC-CAD también permitió el diagnóstico inmediato, tomando sólo 0,3 segundos por cada lesión con reproducibilidad perfecta. Pero ya en el año 2012, había sido publicado un artículo muy interesante titulado (Ultra high magnification endoscopy: Is seeing really believing?) Ultra magnificación endoscópica, es real lo que vemos o interpretamos ¿Es creible? Este grupo corporativo de Ontario Canadá, y de Londres, Aman V Arya y Brian M Yan. De la División de Gastroenterología, del Departamento de Medicina, de la Western University, London, ON N6G 5W9 Ontario, Canada. 351 He querido comentar este trabajo que reúne a mi impresión la opinión de un grupo de expertos que disponen de esta Tecnología que a veces nos confunde y que día a día van cambiando en sus actualizaciones técnicas, que de pronto equipos que adquirimos hace un año, de pronto se vuelven desactualizados ante el tremendo avance de la Ultra tecnología, creo que sirve como razonamiento para ver hasta donde son útiles estos sistemas si los aplicáramos y usáramos en la República Argentina, en donde disponemos de muy buenos equipos con la amplificación necesaria y la coloración, que de pronto es muy sencilla, como la del Índigo Carmín. (Cromoendoscopia de colorantes). O con los nuevos Sistemas Olympus NBI incorporados o FICE de Fujinon, que con solo apretar una tecla realizan Cromoscopia electrónica de luz de fase o colimada de multiples colores con un sistema computado que analiza el patrón vascular y la superficie mucosa. Endocytoscopy y endomicroscopía confocal son dos tipos de técnicas de endoscopia de alta y ultra magnificación. La Endoscopia estándar permite 50× de ampliación, mientras que el endocytoscopy puede magnificar hasta 1400× y la endomicroscopía confocal puede magnificar hasta 1000×. Estos métodos abren la posibilidad de la evaluación microscópica en tiempo real del tracto GI, incluyendo las estructuras celulares y subcelulares. La Endomicroscopía Confocal tiene la ventaja adicional de ser capaz de visualizar las estructuras del subsuelo. El uso de la endoscopia de alta magnificación en conjunción con endoscopia estándar permite una evaluación microscópica en tiempo real de las zonas con anomalías macroscópicas, proporcionando 176 "biopsias virtuales" con información valiosa acerca de los cambios celulares y subcelulares. Esto puede minimizar el número de biopsias tomadas en el momento de la endoscopia. El uso de esta tecnología puede ayudar en la detección de cambios premalignos o malignos en un estado temprano, lo que permite la intervención y tratamiento precoz. Esta alta endoscopia de ampliación ha mostrado resultados prometedores en ensayos clínicos para el esófago de Barrett, el adenocarcinoma de esófago, cáncer de células escamosas de esófago, cáncer gástrico, enfermedad celíaca, cáncer colorrectal y la enfermedad inflamatoria intestinal. Como el uso de técnicas de endoscopia de alta magnificación aumenta, las aplicaciones clínicas aumentarán también. Endocytoscopy (ECS) es una modalidad de ultra-alta ampliación que permite la visualización de la arquitectura epitelial de superficie en el nivel celular y subcelular. Se trata de una técnica de microscopía de contacto donde se requiere el contacto físico con la superficie de la mucosa para obtener la imagen. ECS proporciona en tiempo real en imágenes in vivo en una sección paralela a la superficie de la mucosa. Imágenes muy ampliada de un pequeño sitio de muestreo (<0,5 mm de diámetro) se obtienen usando un foco fijo, de alta potencia de la lente objetivo. Estas imágenes se proyectan en un dispositivo de copla cargada. El uso de un agente de contraste es necesario para la visualización de las entidades subcelulares. La mucosa se pre-trata con un agente mucolítico, tal como N-acetilcisteína, y luego teñidas directamente con 0,5% -1% azul de metileno o 0,25% de azul de toluidina. Estos modelos (hay dos) son desarrollados por Olympus (Tokio, Japón; modelos XEC-300 y XEC-120). Un modelo es capaz de proporcionar magnificación de 450 × representa un campo de visión de 300 micras x 300 micras, y el otro modelo magnifica a 1125 ×, lo que representa un área de tejido 120 micras × 120 micras. El uso de un monitor de 19 pulgadas, estos dos modelos amplían la imagen a 570 × 1400 × y respectivamente. Cuanto mayor sea el monitor, mayor será el aumento, pero a costa de la disminución de la resolución en función de las capacidades de resolución de la sonda y el monitor. Los dispositivos basados en el endoscopio tienen un endocitoscopio integrado y el endoscopio. Hay 2 modelos de Olympus (modelos XGIF-Q260EC1 y XCF-Q260EC1) que cada uno proporciona una magnificación de 580 × en un monitor de 19 pulgadas. Una tapa de plástico blando en el extremo del endoscopio permite para la estabilización contra la superficie de la mucosa. 177 CEM (confocal endomicroscopy) requiere el uso de un agente de contraste fluorescente que es excitable y tiene los espectros de emisión dentro de la gama de luz azul (longitud de onda de excitación 488 nm). La mayoría de los estudios en humanos han utilizado fluoresceína sódica intravenosa. La fluoresceína es no tóxica, se distribuye por todo el tejido en cuestión de segundos, y es seguro para el paciente. La fluoresceína es eficaz para demostrar el diseño estructural de los grupos celulares, y los componentes celulares, pero no tiene buen contraste para los núcleos. La acriflavina es otro agente de contraste tópico común, que permite la visualización eficaz de núcleos. En la práctica, la fluoresceína y la acriflavina se pueden usar juntas. En estudios con animales se han producido otros agentes de contraste usados anticuerpos, así como la etiqueta fluorescente. En el Colon y Recto el Endocitoscopio (ECS) proporciona el 91,4% de sensibilidad para la displasia de bajo grado y especificidad del 100% para la ausencia de displasia. El valor kappa interobservador entre un endoscopista entrenado y el patólogo (IC del 95%: 0,59 a 0,78) 0,68. Un estudio reciente que observo a 52 lesiones colorrectales polipoides y no polipoides en 49 pacientes mostró que ECS proporciona una buena correlación con el diagnóstico histopatológico final. El valor predictivo positivo (VPP) de endocytoscopy en comparación con la Anatomía Patológica fue del 100% para la mucosa normal, pólipo hiperplásico y cáncer invasivo submucosa. El PPV fue del 93,1% para adenoma de bajo grado y de alto grado de adenoma 90,1%. En una publicación reciente una lesión microscópica sincrónica (confirmado con patología) fue encontrada con ECS a 7 cm de distancia de un cáncer resecado del colon transverso. 352 La sensibilidad y la especificidad de la CE para el diagnóstico de neoplasia tiene rangos que van de 79% -91% y el 90% 100%, respectivamente 353. 178 Fig. N° 61. Imágenes del Endocytoscopy de neoplasias colorrectales a 450 × magnificación. A: adenoma de bajo grado con núcleos alargados; B: bajo grado de adenoma demostrando núcleos alargados, criptas poligonales, y la disposición heterogénea; C: adenoma de alto grado demostrando criptas irregulares y núcleos que son más grandes en tamaño y distorsionado en forma. Imágenes adaptadas de Rotonda et al (usadas con permiso).( Rotondano G, Bianco MA, Salerno R, Meucci C, Prisco A, Garofano ML, Sansone S, Cipolletta L. Endocytoscopic classification of preneoplastic lesions in the colorectum. Int J Colorectal Dis. 2010;25:1111-1116) (World J Gastrointest Endosc. 2012 October 16; 4(10): 462-471. Published online 2012 October 16. doi: 10.4253/wjge.v4.i10.462. Copyright©2012Baishideng Publishing Group Co., Limited. All rights reserved.) Fig. N° 62. Endomicroscopía láser. A: de colon normal; B: adenocarcinoma de colon demostrando distorsión de la arquitectura, vasos dilatados e irregulares, y la pérdida de criptas. Imágenes adaptadas de De Palma (De Palma GD. Confocal laser endomicroscopy in the "in vivo" histological diagnosis of the gastrointestinal tract. World J Gastroenterol. 2009;15:5770-5775.) (usado con permiso, del trabajo Arya A., Yan B. Ultra high magnification endoscopy: Is seeing really believing? World J Gastrointest Endosc. 2012 October 16; 4(10): 462-471.) 179 CEM en la Enfermedad Inflamatoria Intestinal (EII) Los pacientes con enfermedad inflamatoria intestinal de larga data que comprometen el colon tienen un mayor riesgo de desarrollar cáncer de colon. Se debe realizar una Colonoscopia de rutina cada 1-2 años con múltiples biopsias (> 32 biopsias) y se recomienda de rigor para las personas con pancolitis después de 8 años de la enfermedad. 354 La Cromoendoscopia aumenta aún más la sensibilidad de la detección temprana neoplasia.355 La Citoendoscopia (CEM) puede ayudar a realizar biopsias dirigidas de las áreas sospechosas y se ha asociado a una mejor detección de la neoplasia intraepitelial en comparación con el estándar actual de biopsias al azar con cuatro muestras de tejidos cada 10 cm.356,357 LIMITACIONES DE ENDOCYTOSCOPY Y CONFOCAL Endomicroscopía. Tanto confocal ECS y CEM no son eficaces para su uso rutinario, requiere un periodo de entrenamiento separado del entrenamiento Endoscópico general. Ambos son de utilidad para las imágenes específicas (biopsias ópticas) de anormalidades identificadas mediante una técnica de gran campo (convencional). Como con cualquier nueva técnica, hay una curva de aprendizaje inicial. En este campo, la curva de aprendizaje es no sólo los aspectos técnicos de la consecución de imágenes de alta calidad, sino que también incluye el aprendizaje de la patología in vivo. Aunque la mayoría de los endoscopistas probablemente será capaz de aprender los aspectos técnicos, identificar la patología normal y anormal correctamente es más difícil. Tanto ECS y CEM entrañan un proceso que consume tiempo con múltiples etapas que incluyen el lavado, la tinción y la imagen. ECS y CEM para fines de diagnóstico también están limitados por la actual falta de criterios validados para el diagnóstico. 358 Por último, el costo elevado de los equipos de la endoscopia de ultra alta magnificación puede limitar su uso. El sistema endocytoscopy actualmente no está disponible para uso comercial. La rentabilidad actual es incierta. A largo plazo ambas técnicas pueden ser económicas si un número significativo de biopsias tomadas por paciente se reduce o se abandonan por completo 359,360 Sin embargo, al menos hasta que los métodos sean validados en estudios prospectivos con muy altas precisiones histológicas, seguirá siendo por ahora el estándar de oro para el diagnóstico. 180 CROMOSCOPIA EN EL COLON El uso de colorantes en el campo de la diagnostica clínica para observar la superficie de los tejidos del tubo digestivo tiene una historia de muchos años. Ya W. Schiller en el año 1933 utilizó el Lugol para la búsqueda del Cáncer de Cuello uterino. Aprovechando esta experiencia R. Voegeli en 1966 puso en evidencia un Cáncer de Esófago con el uso del Lugol, en ese mismo año Yamakawa 361 publica la coloración con Azul de Metileno para poner en relieve lesiones de la mucosa Gástrica. Sucesivamente se comenzaron a usar otros colorantes para el tubo digestivo todos con el mismo propósito. Quizá el principal interés estuvo cifrado en buscar pequeñas lesiones (diminutas) que habitualmente no se ven con Videocolonoscopia convencional o con Fibra óptica, pues además de mejorar la calidad de la imagen (High resolution) se necesitaba poner en evidencia ante los ojos del observador algo más, que era la delineación casi geográfica de la forma que adopta la superficie mucosa ante los cambios estructurales provocados por las distintas enfermedades o contingencias que le ocurren. Los “Adenomas planos” por ejemplo fueron uno de los principales objetivos de estudio de la Escuela Oriental como así también las lesiones diminutas elevadas con o sin depresión que fueron descriptas ya por Muto y Colaboradores ,en 1975 362 donde se publicaron treinta y tres lesiones colónicas de menos de 1 centímetro de diámetro. Éstos eran ligeramente elevados con una superficie rojiza y una depresión central. En ese momento esos resultados fueron sorprendentes y alarmantes, pues rara vez se encontró inclusión Carcinomatosa en los Pólipos Adenomatosos menores de 1 cm. y el hallazgo de displasia severa no era considerado de importancia 363. En 1977, Dr. Kariya y Colaboradores de Japón publican un caso de cáncer colorrectal de tipo deprimido (IIc). 364 El Dr. Shin-ei Kudo y cols. 365 publicaron en 1986 muchos carcinomas del tipo deprimido (IIc) llamándolos “Carcinomas fantasmas” (“phantom carcinomas”). En ese momento existía la controversia sobre el origen del Adenocarcinoma, si estos se originaban en un pólipo adenomatoso o de una mucosa normal de Novo. Hoy debemos rendir honores a la escuela Oriental, pues fueron verdaderos pioneros en arrojar luz a este problema tan controvertido. Hoy el trabajo de investigación en el genoma humano proporcionará un panorama más claro sobre el verdadero origen de estas patologías. El cáncer colorrectal ha sido siempre un problema mayor en los países occidentales, pero 181 hoy la occidentalización de los hábitos dietéticos orientales como dice Kudo, amenaza con aumentar la mortalidad por cáncer colorrectal lo que exige un descubrimiento temprano y tratamiento precoz. El valor de los pequeños hallazgos en la Colitis Ulcerosa usando la Magnificación y la Cromoscopía, ha hecho que muchos Autores como Fujiya Mikihiro y colaboradores, de Asahikawa, Japón, en un excelente trabajo publicado recientemente en la revista Gastrointestinal Endoscopy 366, demuestran que con este método se puede evaluar mejor la actividad de la enfermedad y predecir con mayor exactitud los periodos de remisión. Edgar Jaramillo, Watanabe y cols. 367 del Hospital Karolinska, Suecia, investigaron 85 pacientes que desarrollaron una Colitis Ulcerosa extensiva total más allá del ángulo esplénico, con un promedio de 10 años de duración, dentro de un plan de detección y control del cáncer colorrectal en Suecia. Sus resultados son muy interesantes de mostrar pues brinda la posibilidad a este método de Magnificación apoyado por la Cromoscopía, de detectar Pólipos Neoplásicos, con la posibilidad también de estudiar el posible rol de la histogénesis del cáncer colorrectal en la colitis ulcerosa. OBJETIVOS DE LA CROMOSCOPIA • Visualizar en forma más detallada los relieves de la superficie mucosa. • Realzar las características de las lesiones detectadas contrastando los márgenes de la lesión, diferenciándola del tejido normal. • Detectar lesiones anormales en forma más rápida y eficiente, al resaltar los detalles de su superficie. MECANISMOS DE ACCIÓN • Tinciones Vitales o de absorción: son tomadas por la célula epitelial a través de la membrana celular. (Lugol, Azul de Metileno, Azul de Toluidina). • Tinciones de Contraste: estas sustancias no penetran la célula, pero penetran los interpliegues mucosos resaltando los cambios de superficie. (Ejemp. Índigo Carmín, Cresil Violeta). 182 • Tinciones Reactivas: son las que reaccionan con algún constituyente específico de la célula epitelial mucosa, o con la secreción ácida a un nivel específico de pH. (Ejemplo Rojo Congo). • Tinción para Tatuaje: fue ideada con el fin de marcar lesiones gastrointestinales para su identificación quirúrgica. (Ejemplo Tinta China). TINCIONES MÁS COMUNES USADAS EN LA ACTUALIDAD. Colorantes Vitales: • Lugol • Azul de Metileno • Azul de Toluidina • Índigo Carmín • Cresil Violeta • Rojo Congo • Tinta China TINCIONES USADAS EN COLON La preferencia en el mundo entero de las tinciones para Colon son: Índigo de Carmín, Cresil Violeta, Azul de Metileno, Azul de Toluidina y Tinta China. El colorante usado por nosotros es el Índigo Carmín, por su fácil manejo, (tinción de contraste) no mancha los aparatos, es fácilmente removible de la superficie mucosa del colon, dando la opción de colorear varias veces. La marcación para tatuaje sin lugar a dudas es la tinta China, y la usamos para marcar la resección de grandes Pólipos, o las zonas de resección de Pólipos numerosos, para su mejor control posterior. En algunas oportunidades esta marcación ha superado el año de colocada. La COLONOSCOPIA MAGNIFICADA y la CROMOSCOPIA es la expresión técnica más acaba de estos procedimientos. La Colonoscopía Magnificada (CM) provee la observación de imágenes de la superficie mucosa, en sus finas estructuras, los orificios glandulares (PITS) de las Criptas 183 colorrectales, proveyendo una nueva morfología para su interpretación. Como pequeñas Neoplasias Colorrectales con significativas atipias, zonas de displasias, pequeños Pólipos planos (Flat Adenomas), pequeñas lesiones ulceradas, que con el agregado de la coloración (Cromoendoscopia) proveen al observador datos imposibles de reconocer con una Colonoscopía Fibra óptica o un Videocolonoscopio convencional. La habilidad para establecer una relación entre el diagnóstico endoscópico y el histológico fue un largo anhelo de los endoscopistas durante muchos años. El disponer en la actualidad de un método que nos acerque a una mejor sospecha de cambios estructurales y/o histológicos nos da la posibilidad de ser más precisos en el diagnóstico de las lesiones pre-neoplásicas y neoplásicas. Hoy disponemos ya de una Clasificación elaborada por un Pionero de esta práctica, el Dr. Shin-ei Kudo director del Dto. De Cirugía, División de Gastroenterología del Akita Red Cross Hospital de Akita Japón.368 Existen publicaciones de varios Autores más en el resto del mundo pero principalmente de Japón como Hideki Mitooka, que tuvo el mérito de publicar por primera vez un Video al alcance de todos que editó la American Society for Gastrointestinal Endoscopy (ASGE) realizado en Orlando, Florida EEUU, en mayo de 1999 (DDW). Y a quien tuviéramos el agrado de conocer personalmente en el Congreso Argentino de Gastroenterología y Endoscopia realizado en la provincia de Córdoba, República Argentina. Consiste en clasificar la visión magnificada de las criptas colónicas de acuerdo a la deformación que sufren, comparadas con la normalidad, a esta visión altamente magnificada del extremo de las Criptas que es puntiforme se las denomina PITS. CLASIFICACIÓN DE LAS IMÁGENES CON MAGNIFICACIÓN Y CROMOSCOPÍA DE SHIN EI KUDO. 369 Esta clasificación que hemos adoptado por lo sencilla, se basa en la comparación de la superficie mucosa normal de la patológica, debido a los cambios que ella sufre al ser modificada por diversas contingencias, neoplásicas, inflamatorias, cicatrizales, etc. 184 Esto se debe a que el colorante no penetra en la célula sino que se introduce en los pliegues de las criptas, dibujando un mapa perfectamente delimitado con una figura patrón, que las distingue del resto. TIPO I: (Round Pits) Glándulas redondeadas sin deformación que no superan los 0,07 mm (±0,002). Que corresponde a los tejidos normales. TIPO II: (Stellar or papillary Pits) Glándulas de aspecto estelar o estrelladas en sus cúpulas papilares, el tamaño de las mismas no supera los 0,09 mm (±0,002). Estos dos primeros Tipos de Pits son los característicos patrones de los tejidos, (No tumorales) normales, inflamatorios, o tejidos hiperplásicos. TIPO III (L): (Large tubular or roundish Pits) Aspecto tubular agrandado, deformado o redondeado de las papilas. Típico de los Adenomas Protruidos. Su tamaño es de 0,22 mm (±0,09). TIPO III (S): (Small tubular or roundish Pits) Aspecto tubular corto con deformación. Su tamaño es de 0,03 mm (±0,01). Es el patrón clásico de los Tumores deprimidos (el tamaño de las cúpulas papilares es menor al normal!) TIPO IV: (Branch-like or gyrus like Pits) Aspecto de ramas deformadas o conjuntos de trabeculado sin patrón fijo. Tamaño 0,93 (±0,32). (El Tipo III L y IV es típico de los Tumores protruidos.) TIPO V: (Irregular or non structural Pits) Aspecto de desestructuración completa de las Papilas. (El Tipo III S y V es típico de los Tumores deprimidos.) El Tipo V puede mezclarse con algún tipo estructural como el III S y constituye el patrón clásico de las Lesiones Neoplásicas, submucosas o avanzadas ¡!/ En raras ocasiones existe la posibilidad de una lesión inflamatoria, que la AP tendrá el diagnóstico final. 185 Figura 63: Las imágenes son propias Unidad Digestiva Baistrocchi y Servicio de Gastroenterología Instituto Oulton, Córdoba, obtenidas con Fujinon EC-410 CM. PROCEDIMIENTO: Equipo de trabajo: Fujinon Magnifying Videocolonoscope CM-400 de última generación, con aumento digital. Olympus Exera II 180 NBI (Cromoscopía electrónica de banda angosta). 1. Preparación cuidadosa del paciente. Lo logramos con una dieta blanda/liquida el día anterior, y la ingesta de Fosfato Monosódico y Disódico (“Fosfo-Dom” de Laboratorios Domínguez en Argentina, nombre comercial) 2. Procedemos a la observación convencional. Videocolonoscopía de alta resolución. 186 3. Lavado vigoroso con agua (por catéter o a través del canal de biopsia con jeringa de 20 cc en las zonas elegidas para colorear seleccionadas previamente. (lesiones planas, semipediculadas, y la periferia de las mismas, en las Enfermedades inflamatorias como la Colitis ulcerosa con mayor cuidado, en las zonas con Pseudopólipos y en los bordes de los remanentes mucosos. En las Ulceras Aftoides de la Enfermedad de Crohn, etc. 4. Se procede a la coloración mediante catéter o por el canal de Trabajo especialmente diseñado de estos nuevos aparatos a modo de SPRAY sobre la superficie mucosa con Índigo Carmín en dilución de del 0,4 % al 0,5%. Observación luego de 5 minutos de espera. Lavado con agua nuevamente. Se procede ahora en las mismas lesiones u otras elegidas para tal fin a Inyectar nuevamente Índigo Carmín. Este colorante penetra mejor en las Criptas Glandulares y da mejor imagen en la observación de los PITS (orificios de las criptas glandulares).// Esto no siempre es necesario con el Sistema Olympus Exera II NBI, que con solo la presión del botón del cabezal para banda angosta cambia la coloración de la imagen observada con filtro de tonalidad verde que muestra muy bien la estructura vascular y la superficie mucosa. Usamos la misma clasificación de Kudo para la tipificación de las imágenes. 5. Observación luego de unos minutos de espera, (Para el Sistema Olympus NBI la imagen de coloración es instantánea) aunque la mayoría de las veces a los pocos segundos ya se comienzan a observar las estructuras, llamando la atención cómo lesiones que no fueron vistas pese a la magnificación mayor (60 para este Sistema) (Y hasta 100 para el Sistema Olympus NBI) son observadas claramente con colorante. 6. Tipificación de los PITS PATTERN. 187 EJEMPLOS DE LAVADO Y COLORACIÓN Fig. N° 64. Remoción del moco. Se debe lavar con vigor para remover todo el moco posible, el colorante debe penetrar en las intercriptas. Vista de la lesión luego del lavado. Fig. N° 65 Spray de Índigo Carmín. Fig. 66. Vista de la lesión (III L) con ampliación de 60 veces Fig. N° 67. La observación acá es con el Videocolonoscopio Olympus Exera II 180 con Narrow Band Image (NBI) donde se puede apreciar que con buena distancia focal y limpieza colónica, claramente una lesión plana sésil Pit III L de Kudo altamente sospechosa de Pólipo Adenomatoso sin depresión de la superficie. 188 Numerosos artículos en la Bibliografía mundial avalan estadísticamente el uso de colorantes en spray sobre la superficie mucosa, que mejorados con la alta resolución en pixeles de los nuevos instrumentos, y la incorporación de Banda estrecha de filtros de color (NBI), o el FICE (Fujinon intelligent color enhancement),o el iScan de Pentax (i-scan image processing provides digital image enhanced endoscopy (IEE)) hizo que el hallazgo de lesiones que no eran vistas en la Videocolonoscopia convencional integraran ahora un grandísimo número de aspectos y tamaños que hubo la necesidad de clasificar. Kudo, Mitoka, y colaboradores con la Escuela Japonesa a la cabeza, luego la Escuela Europea y toda América cambiaron sus aparatos a mejor resolución y ya todas las Escuelas Endoscópicas del mundo comenzaron a comunicar sus experiencias. El Dr. Fumio Konischi a quien tuve el honor de conocer, Presidente de la Sociedad Japonesa de Cirugia y Coloproctología, Presidente de la Sociedad Europea de Coloproctología, del Instituto Nacional del Cáncer de Japón, me invitó personalmente después haber escuchado una de mis conferencias sobre Magnificación y Cromoscopia a Relatar el Tema “Flat Lesions. Western Experience” en la Mesa Redonda que el conducia en el XVIII Congreso de la International Society of University Colon and Rectum Surgeons, que se desarrollara en la Ciudad de San Pablo, Brasil en el mes de Julio del año 2000.370 Corria el año 2000 y la Cromoscopia con Spray de Indigo Carmín era la mejor imagen que se podía obtener hasta la fecha. Y en la actualidad sigue teniendo vigencia de no contar con sistemas de Cromoscopia Electrónica, y aun así, se pueden comparar ambas técnicas en el mismo aparato. En un trabajo que presentan de la Universidad de Texas, Houston, la Dra Sharmila Anandasabapathy, titulado “Imagen endoscópica: Técnicas Ópticas Emergentes para la detección de neoplasia colorrectal” hace una excelente Review de las nuevas modalidades que revolucionaron las imagines endoscópicas 371. Dice la Dra Sharmila; Propósito de la revisión: Los avances en bioingeniería han dado lugar a diversas modalidades de imagen que han revolucionado la endoscopia. Algunas de estas tecnologías proporcionan en tiempo real, de alta resolución, imágenes subcelulares. Esta revisión proporciona una actualización de estas tecnologías y su papel en la evaluación del Colon y Recto. Hallazgos recientes: la imagen de banda estrecha ha demostrado que puede visualizar los patrones capilares en el cáncer temprano y es complementaria a la 189 endoscopia de magnificación. El análisis tomográfico óptico se ha utilizado para evaluar la progresión neoplásica y distinguir la enfermedad de Crohn de la colitis ulcerosa. La Endomicroscopía confocal ha demostrado predecir con precisión los cambios neoplásicos en pólipos e identificar áreas de neoplasia en pacientes con colitis. Entre las técnicas espectroscópicas, la autofluorescencia estudia mejor los patrones mucosos del colon y se ha utilizado para identificar adenomas y displasia en la enfermedad inflamatoria intestinal. Endocytoscopy es una tecnología relativamente nueva, pero se muestra prometedora en distinguir las lesiones neoplásicas. Gono y cols372 encontraron que la tecnología de NBI era útil para visualizar los patrones de los capilares en el cáncer de colon y, como tal, era complementario a la endoscopia de ampliación. En un estudio realizado por Machida y cols., NBI se comparó con la colonoscopia convencional y cromoendoscopia para la capacidad de diferenciar entre lesiones neoplásicas y no neoplásicas. En este estudio piloto de 34 lesiones, NBI y cromoendoscopia tenían sensibilidad similar (100%) y especificidad (75%) y las tasas de ambas técnicas eran superiores a la endoscopia convencional (sensibilidad 83%, especificidad del 44%). No es sorprendente que, NBI haya demostrado ser mejor en la evaluación de los patrones de capilares, y cromoendoscopia el patrón pit de superficie. Un estudio más reciente compararon las características de los pólipos diminutos evaluados tanto por la ampliación NBI y cromoendoscopia. Los 33 pólipos fueron evaluados por los japoneses con experiencia y endoscopistas evaluados y entrenados en Europa. Cromoendoscopia y NBI los patrones de protuberancias (Pits) eran diferentes en 12/33 y 20/33 casos (japoneses y europeos, respectivamente). Mientras que la sensibilidad, especificidad y exactitud de neoplasia fueron comparables para ambas técnicas, la red de vasos y claridad del patrón pit fueron mejores con NBI que cromoendoscopia. Los autores concluyeron que en NBI la evaluación de la intensidad del patrón vascular era tan precisa como la evaluación de los patrones de protuberancias; Sin embargo, puede necesitar ser revisada antes de ser aplicado a NBI la clasificación tradicional de Kudo. Ya en el 2007 el Cochrane Database Syst Rev., publica una Review realizada en Sheffield Teaching Hospitals, Surgery, Dept Surgery, Northern General Hospital, Herries Rd, Sheffield, South Yorkshire, UK, con el título de “Chromoscopy versus conventional endoscopy for the detection of polyps in the colon and rectum” por los Autores; Brown SR, 190 Baraza W y Hurlstone P.373 Los Autores relatan que aunque la colonoscopia convencional es la prueba más sensible disponible para la investigación del colon y recto para detectar pólipos, hay datos que expresan preocupación por su sensibilidad. La Cromoscopía puede ser una manera de mejorar la capacidad de la colonoscopia para detectar pólipos lesiones planas particularmente diminutas que pueden ser de otra manera muy difícil de detectar. Determinar si el uso de cromoscopía mejora la detección de pólipos y neoplasias durante la revisión endoscópica del colon y el recto. La estrategia de búsqueda se basó en MEDLINE, EMBASE y en las bases de datos de estudios Cochrane junto con una búsqueda manual de los resúmenes de las reuniones pertinentes. Los términos de búsqueda incluyeron ensayos aleatorios que contienen combinaciones de lo siguiente: 'cromoscopía' 'colonoscopia' 'tinte en spray' 'cromoendoscopia' 'índigo carmín' “endoscopia magnificada”. Criterios de selección: Se incluyeron todos los ensayos aleatorios que comparan cromoscopía con la revisión endoscópica convencional del tracto gastrointestinal inferior. Se excluyeron pacientes con enfermedad intestinal o de poliposis, síndromes inflamatorios. Recopilación y análisis de datos: Tres revisores evaluaron la calidad metodológica de los ensayos potencialmente elegibles y extrajeron los datos de los ensayos incluidos. Los resultados incluyeron la detección de pólipos (neoplásicos y no neoplásicos), la detección de lesiones diminutas, el número de pacientes con múltiples lesiones neoplásicas y el tiempo de extubación. Resultados principales: Cuatro ensayos cumplieron los criterios de inclusión y, aunque hubo algunos inconvenientes metodológicos y diferencias en el diseño del estudio, la combinación de los resultados mostró una diferencia significativa a favor de cromoscopía para todos los resultados de detección. En particular, cromoscopía es probable que el rendimiento significativamente mayor de pacientes con al menos una lesión neoplásica (OR 1.61 (IC 1.24 a 2.9)) y significativamente más pacientes con tres o más lesiones neoplásicas (OR 2,55 (IC 1,49-4,36)). No es sorprendente que los tiempos de retiro fueron significativamente más lentos para el grupo de cromoscopía. Conclusiones de los revisores: Esto parece ser una fuerte evidencia de que la “Cromoscopía” mejora la detección de neoplasias en el colon y el recto. Los pacientes con pólipos neoplásicos, particularmente aquellos con múltiples pólipos, tienen mayor riesgo de desarrollar cáncer colorrectal. Estas lesiones, que probablemente se perderían con la 191 colonoscopia convencional, podrían contribuir a aumentar los números de cánceres, en cualquier programa de vigilancia. La ASGE (Asociación Americana de Gastroenterología) que rige prácticamente las pautas de conductas y Guias de procedimientos en Gastroenterología en los Estados Unidos de Norteamerica publicó un trabajo en el 2014 titulado “High-definition and highmagnification endoscopes Gastrointestinal Endoscopy” (Alta definicón y magnificación de los Endoscopios en Endoscopia Gastrointestinal). 374 El comité de Tecnología de, ASGE ofrece nuevas opiniones, o tecnologías emergentes endoscópicas existentes que tienen un impacto en la práctica de la endoscopia digestiva. Se utiliza una metodología basada en la evidencia, con una búsqueda bibliográfica en MEDLINE para identificar los estudios clínicos pertinentes sobre el tema y un Centro de Administración de Alimentos y Medicamentos para Dispositivos y Salud Radiológica, (MAUDE) sistema de búsqueda de base de datos para identificar las complicaciones publicadas de una tecnología determinada. Ambos se complementan con el acceso a la función "artículos relacionados" de PubMed y escudriñando referencias pertinentes citadas por los estudios identificados. Los ensayos clínicos controlados se enfatizan, pero, en muchos casos, los datos de ensayos controlados aleatorios son insuficientes. En tales casos, grandes series de casos, estudios clínicos preliminares, y se utilizan opiniones de expertos. Los datos técnicos se recolectan de publicaciones tradicionales y basadas en la Web, publicaciones propias, y las comunicaciones informales con proveedores pertinentes. Los informes de evaluación Tecnología de estado son elaborados por 1 o 2 miembros del Comité de Tecnología ASGE, son revisados y editados por el Comité en su conjunto, y aprobados por la Junta de Gobierno de la AGE. Cuando se indica orientación en costos, se proporcionan los datos de codificación de los precios y la lista más reciente en el momento de su publicación. Para esta revisión, la base de datos MEDLINE fue registrada hasta octubre de 2013, para los artículos relacionados con la endoscopia mediante el uso de las palabras clave "alta resolución", "alta definición", "gran aumento" y "endoscopia de aumento." La tecnología existente e Informes de evaluación, son opiniones científicas proporcionadas exclusivamente para fines educativos e informativos. La Tecnología e Informes de evaluación no son reglas y no debe interpretarse como una norma legal del 192 Establecimiento (Clínica, Hospital, etc…) en la atención o como sugiriendo, abogando, lo que requiere, o desalentando cualquier tratamiento particular practicado por ese grupo, o el pago de dicho tratamiento. LA ENDOSCOPIA MAGNIFICADA APLICADA A LA DETECCION DE ADENOMAS DEL COLON Y RECTO. En un GRAN ensayo aleatorio, HD (Alta Definición) (850.000 píxeles) la cromoscopía (con índigo carmín) se comparó con la colonoscopia convencional en la detección de adenomas en alto riesgo en pacientes. 375 El número de lesiones detectadas fue la misma entre la colonoscopia HD sin tinción de tejidos y el colonoscopio estándar. Más pólipos hiperplásicos y adenomas planos se detectaron mediante el uso de tinción de tejidos y colonoscopias HD que cuando se utiliza colonoscopias estándar sola, pero el número total de adenomas (el criterio principal de valoración) era la misma entre los 2 grupos. Los investigadores concluyeron que el HD cromo colonoscopia no era necesario para la atención de rutina. En un estudio más reciente que comparó la colonoscopia HD a solas con colonoscopia HD más cromoscopía, se observó un aumento moderado en la detección de adenomas planos y pequeños. HD cromocolonoscopía detectó significativamente más adenomas planos y adenomas menores de 5 mm por paciente, y los pólipos no neoplásicos por paciente en comparación con la colonoscopia de Alta Definición. 376 Otro, estudio de cohorte prospectivo mostró tasas de detección de adenoma similares entre colonoscopia HD sola y colonoscopia HD con i-scan - cromo electrónica.377 La Colonoscopia de Alta Definición también encontró un aumento de la tasa de detección de Pólipos Planos en el colon derecho en un Trial controlado.378 La Cromoendoscopia de Magnificación ha informado para ser útil en la predicción de la histología y la profundidad de cáncer invasivo, aunque la sensibilidad puede ser baja. La Colonoscopia con NBI también ha mostrado ser prometedora en la predicción de la histología y la profundidad de invasión. En última instancia, la colonoscopia de magnificación con Cromoscopía, o NBI puede ayudar a dirigir la terapia 193 endoscópica, por ejemplo, EMR (Endoscopic Mucosal Resection) y para evaluar la integridad de la resección. NUEVAS ESTRATEGIAS PARA EL TRATAMIENTO DEL CANCER COLORECTAL TEMPRANO La combinación de la observación ordinaria con la Colonoscopia Magnificada y Cromoscopia, visualizando los Pit Patterns nos proveerá un más adecuado tratamiento de las lesiones elevadas, planas y penetrantes. En la actualidad podemos entonces determinar cuáles son los procesos que deben ser resecados luego de la observación Magnificada y de la biopsia, determinando su resección endoscópica o quirúrgica, o solo simplemente la observación reglada. Sin lugar a dudas que ante la observación de un Pit Pattern V, sabremos que pertenece a un Cáncer que ya ha invadido la muscularis mucosae y es patrimonio de la exéresis quirúrgica. Es importante entonces determinar la diferenciación entre Neoplasias y No Neoplasias, siendo necesaria su resección en las primeras etapas de acuerdo a las características de su superficie, tamaño y Pit Pattern. Las lesiones Adenomatosas deben ser resecadas. Para la toma de tan delicadas decisiones nos ha sido de singular ayuda el uso de la ECOSONOGRAFIA TRANSENDOSCOPICA (SONOPROBE), que usamos en la Fundación Carlos Oulton, en el Servicio de los Dres. Norberto y Manuel Lorenzo (Córdoba. Argentina) del año 1999 al 2001. Esta sonda transcanular que se introduce por el canal de trabajo del Colonoscopio, nos da la imagen de penetración en pared de la lesión que estamos observando, corroborando con esto la sospecha de invasión Submucosa ¡! que teníamos con la magnificación y cromoscopía. En nuestra casuística casi el 60% de los Pólipos encontrados fueron hiperplásicos. Encontramos en esta casuística una lesión Hiperplásica con inclusión Carcinomatosa. Siempre hemos aconsejado que estos Pólipos pese a su muy bajo potencial maligno demostrado, deban resecarse, inclusive son tan pequeños a veces que en la misma sesión diagnóstica puede hacerse con facilidad. 194 Pero por ejemplo en un protocolo de trabajo de la Cleveland Clinic de los EEUU, los Pólipos Hiperplásicos no son resecados, solo son seguidos endoscópicamente. Y bien como dice Shin-ei Kudo es esto real ¿es esto verdad? Los Cirujanos y los Clínicos deberán preguntarse entonces luego de este minucioso análisis, que es lo que debemos hacer con nuestros pacientes. Este concepto la habíamos emitido en el año 2000, cuando presentamos en el Congreso Argentino de Gastroenterología (Panelista del Forum Italo Argentino de Endoscopia Digestiva. Congreso Argentino de de Gastroenterología y Endoscopia Digestiva 2000. Buenos Aires, Octubre de 2000) Todavía no teníamos el concepto del Pólipo Aserrado (Serratum Polyps) que luego y hasta la fecha constituye uno de los avances Histológicos más claros y contundentes, en donde por unanimidad en el mundo entero se indica su resección. Hoy existen numerosos trabajos en el mundo entero y también en nuestro País como el trabajo del Hospital Alemán titulado, Encontrar adenomas sésiles aserrados: ¿es posible identificarlos durante la colonoscopia convencional? Este trabajo da pautas de caracterización de la superficie mucosa de estos Pólipos, dando la posibilidad de encontrarlos durante un estudio de rutina. 379 La configuración Aserrada o en serrucho aparece cuando las células continúan generándose pero no logran alcanzar una ubicación correcta en la superficie de las criptas. A consecuencia del incremento de la presión debido al número aumentado de células pueden producirse otros cambios, como dilatación, horizontalización y fusión de Criptas. 380 La Dra. Rita Pastore describe de una manera excelente las divisiones actuales que hoy clasifican a estos Pólipos, Adenoma Aserrado, Pólipo Aserrado sésil, Pólipo Aserrado Mixto, y la Poliposis Hiperplásica en donde una gran mayoría de estos Pólipos son de características Histológicas de Aserrados o Mixtos. La malignización de estos ha sido comprobada en numerosos trabajos.381 La malignización de un Pólipo sésil Hiperplásico, en cualquiera de sus clasificaciones es igual/similar a un Adenoma colorrectal, y ya conocemos la secuencia Pólipo-Cáncer. Se estima que estos, los Aserrados tienen un riesgo estimado del 4% de transformación maligna, por lo que el tratamiento y la conducta debería ser la misma. Los de expansión lateral Fig 68, tienen aún mayor riesgo de tener esta tipificación sobre todo si se encuentran en el colon derecho donde los riesgos de su resección son importantes, debiendo tomarse todas las 195 precauciones, valorarlo, medirlo, ver las probabilidades de inyectarlo, y ante la menor duda indicar su resección quirúrgica. Fig. N° 68. Pólipo Sésil Plano (Pit III L de Kudo) (O-Is de la Clasific. De Paris) del Colon Derecho, infiltración, enlace y corte del mismo, lecho. Olympus® Exera II NBI. Fig. N° 69. Lesiones planas, marcadas con el círculo la primera con visión normal de Olympus® Exera II NBI, la segunda con Indigo Carmín, (Oit II de Kudo) (0-Is de la clasificación de París) Pero con la características de los Pólipos Aserrados (0-Iss) Fig. Nº 70. Adenoma serrado de colon, con patrón glandular en “serrucho” y glándulas profundas en “L” o ”zapatilla” (flecha) .H&E, 25X En el año 2002 en la Revista Gut, el Dr. Wong del Departamento Universitario de Medicina del Queen Mary Hospital de Hong Kong, 382 publica un artículo Titulado Histogénesis de los Pólipos Adenomatos y de los Pólipos Hiperplásicos en los humanos, el rol de la proliferación celular y la Fisión Críptica. Este artículo marcó un rumbo inesperado 196 en la Bibliografía moderna porque Wong quería explicar que el concepto de Displasia a veces no explicaba bien el por qué del desarrollo celular en las Criptas y la Proliferación de estas en los pólipos del Colon y Recto. Decía el Dr. Wong; que la histogénesis de los pólipos hiperplásicos colorrectales humanos y adenomas colorrectales es mal entendido, incluso ahora. Los adenomas colorrectales Humanos, pólipos hiperplásicos y mucosa colorrectal normal, (los pacientes con poliposis adenomatosa familiar y el carcinoma colorrectal hereditario sin poliposis eran excluidos en su trabajo) se obtuvieron muestras de estos durante la colonoscopia y se realizó microdisección en criptas individuales. Se estudiaron entonces las características de la morfología y proliferación celular, los índices de fisión de criptas aisladas a partir de estas lesiones. Resultados: Las Criptas aisladas de adenomas colorrectales y pólipos hiperplásicos colorrectales eran significativamente mayor (p <0,001) que las criptas de la mucosa colorrectal normal. La Fisión criptica era un evento poco común en la mucosa colónica normal, pero común en criptas aisladas de adenomas y pólipos hiperplásicos (p <0,001). El análisis de la distribución de mitosis sugiere una expansión hacia arriba del compartimento de la proliferación en los adenomas a la superficie de la cripta sin inversión de la distribución y proliferación celular, como se ha descrito anteriormente. Conclusiones: Los adenomas colorrectales humanos esporádicos y pólipos hiperplásicos crecen por el proceso de fisión de las criptas. La ampliación del compartimento proliferativo que se demostró en las criptas de adenomas, coincide con la desregulación de control del ciclo celular. 197 Fig. N° 71. Microdissected crypts from normal colonic mucosae, hyperplastic polyps, and adenomas. (A) Low power view of crypts isolated from normal colonic mucosae. (B) Symmetrical fission of normal colonic crypts. (C) Crypts isolated from hyperplastic polyps. Note that these crypts are larger in size and with frequent crypt branching. (D) Crypts from hyperplastic polyps with multiple branching. (E) A crypt isolated from an adenoma. Crypt fission was very frequent with atypical and asymmetrical branching. (F) Another crypt from an adenoma with bizarre shape and asymmetrical branching. (G) Multiple budding of a crypt isolated from an adenomas. (H) Markedly elongated crypt isolated from the margins of the adenoma.(Corresponde al Trabajo original del Dr. Wong) 383 198 Junto con el Dr. Kudo en el año 2000, proponíamos este esquema que resumía las conductas a tomar de acuerdo a la morfología ya descripta en su clasificación del Pólipo, que presumía o no la invasión de un proceso severo de displasia en el mismo. Estos conceptos que habíamos tomado de Shin ei Kudo 384 y los publicamos en el Atlas que publicara el Dr. Felice Cosentino de Milán Italia, La Cromoendoscopia Limpiego dei Coloranti in Endoscopia Digestiva, en ese Atlas nos tocó escribir con el Dr. Manuel Lorenzo y cols, Lesiones Planas Colónicas, donde poníamos mucho énfasis en que las pequeñas lesiones cualquiera fuera su tipificación Cromoscópica debían resecarse, pese a que la Escuela Americana (EEUU), decía lo contrario. 385 Fig. Nº 72 199 PARTE 4 CLASIFICACIÓN MORFOLÓGICA DE PARÍS PARA LOS PÓLIPOS DEL COLON Y RECTO. 386 Un grupo internacional de endoscopistas, cirujanos y patólogos se reunieron en París en el año 2003, para realizar un taller intensivo diseñado para explorar la utilidad y relevancia clínica de la clasificación endoscópica japonesa de lesiones neoplásicas superficiales del tracto gastrointestinal. Esto informe resumió y dio conclusiones del taller y propuso un marco general para la clasificación endoscópica de las lesiones superficiales del esófago, estómago y colon. La relevancia clínica de esta clasificación se demostró en las tablas que mostraron la proporción relativa de cada subtipo en el esófago, estómago y colon, evaluaron el riesgo de invasión submucosa y el riesgo de metástasis en los ganglios linfáticos. Muchos endoscopistas, sobre todo en Occidente, consideraban a la clasificación japonesa, con sus numerosas divisiones para el esófago, el estómago y colon, que era una Botánico Manía demasiada compleja para uso práctico. Los endoscopistas occidentales tienden a basar las decisiones de tratamiento en gran medida de acuerdo al tamaño, la localización del tumor y de la histología de la biopsia. Sin embargo, los endoscopistas japoneses han encontrado que la clasificación endoscópica de una lesión puede ser un factor determinante muy importante de cuando se debe aplicar la endoscopia terapéutica. En la elección de la terapia, el aspecto endoscópico puede complementarse con otros criterios endoscópicos, incluyendo la USE (Ultra sound Endoscopy) y EMR (Endoscopic Mucosal Resection), para evaluar el relieve de la lesión durante la endoscopia y para obtener una gran muestra Histológica. En pacientes con un aumento del riesgo para la cirugía, EMR puede ser la indicación del tratamiento, complementado según sea necesario mediante ablación, como la electrocoagulación o terapia fotodinámica. El escepticismo del valor de la clasificación endoscópica de las lesiones neoplásicas superficiales ha ido más lejos, alentado por las diferencias Este / Oeste en la clasificación patológica de neoplasia intramucosa. La reciente clasificación de Viena ha resuelto, en cierta medida estas diferencias en el uso de la terminología de displasia, adenoma, cáncer temprano y cáncer avanzado. Los comentarios del análisis de 200 la patología del espécimen son fundamentales para la enseñanza del diagnóstico endoscópico en Japón, y contribuye a la formación continua que ayuda mover endoscopistas lo largo de la curva de aprendizaje. Fig N°73. Diagram 1. Schematic representation of the major variants of type 0 neoplastic lesions of the digestive tract: polypoid (Ip and Is), non-polypoid (IIa, IIb, and II c), nonpolypoid and excavated (III). Terminology as proposed in a consensus macroscopic description of superficial neoplastic lesions. (Esquema del Trabajo original) 387 Fig.N° 74 Diversos Esquemas que representaron a la Clasificación de Paris a través de los años, y su Interpretación para los Pólipos del colon. 201 Fig. N° 75. Clasificación por su forma • Tipo I - "pólipos" - Pediculado (Ip) - aproximadamente el 5% de todos los pólipos. - Sesiles (Is) - aproximadamente el 50% de todos los pólipos. • Tipo II - 40 a 50% de todas las lesiones precancerosas - también Llamadas "lesiones plana y deprimidas" o " neoplasia colorrectal no polipoide” Fig. N°76. Lesiones Planas (Fotos tomadas con Olympus® Exera II NBI) • IIa -muy común sin riesgos. • IIb- raro y sin mayores riesgos. 202 - Deprimido (IIc, IIa + IIc, IIc + IIa) - muy poco común y de dificil obtencion de muestra biopsia positiva o de interpretación. Fig. N°77. ASPECTO DEL POLIPO. (Lateral spreading tumor) tumorales de propagación lateral (esencialmente una lesión IIa: a menudo llamada "lesión de alfombras" en Occidente.)- Granular (más común, menos preocupante). No granular (de peor histología menos común) Fotos tomadas con Sistema Fujinon Fice (Fotos cedidas por Dr. Manuel Lorenzo .Dto. de Gastroenterologia Carlos Oulton Cba.) Estos son algunos ejemplos más expresivos de esta Clasificación que hoy se usa en todo el mundo y que contiene más aspectos de sus bordes o elevaciones centrales que un Endoscopista avezado debe distinguir. Fig. 78: Adenoma tubular plano de colon. Las glándulas exhiben displasia epitelial moderada, sin evidencias de carcinoma mucoso. H&E, 25. 203 Fig. 79: Adenoma tubular sésil de colon. Vista panorámica de la resección completa de la lesión. H&E, 20X. Fig. 80. Adenoma tubular sésil de colon. Vista panorámica de la lesión, que muestra focos de displasia epitelial (flecha). H&E, 20X. Figura 81. Adenoma tubular sésil de colon. Vista a mayor aumento de la lesión, que muestra focos de displasia epitelial severa (flecha). H&E, 20X 204 POLIPOS ASERRADOS (SERRATUM POLYPS) Los pólipos colorrectales se han clasificado tradicionalmente en hiperplásicos y adenomatosos, con capacidad solo el adenomatoso de progresar a carcinoma. Sin embargo, ahora se reconoce que ciertos subtipos de pólipos serrados tienen un riesgo de transformación maligna a través de una vía neoplasia dentada. Los pólipos serrados son un grupo heterogéneo de lesiones con morfológica distinta, histología y perfiles de genética molecular también distintos. Con base en la evidencia disponible, hay razones para sospechar que esta vía puede contribuir al intervalo o perdidas de cánceres debido a que las lesiones serradas son más propensas a perderse o no encontrarlas que los adenomas convencionales. La evolución de los pólipos aserrados a cáncer puede ser más rápida. Por lo tanto, es fundamental que los endoscopistas deben conocer la importancia de estos pólipos y estar al tanto de los últimos protocolos de vigilancia. 388 Definición y clasificación Pólipos serrados se llaman así porque las criptas tienen un patrón de "dientes de sierra". Esta disposición se cree que refleja la disminución de la apoptosis de las células epiteliales con la inducción de la senescencia de las células epiteliales de la cripta mucosa. 389 Hay varios subtipos de pólipos con arquitectura dentada y la nomenclatura pólipo dentada sigue evolucionando. La clasificación actual de los pólipos serrados se basa en la cuarta. Además del libro de la OMS publicado en 2010 390, y se resume en este sistema de clasificación que incluye el pólipo hiperplásico, adenoma serrado sésil / pólipo (SSA / P), SSA / P con displasia citológica y adenoma serrado tradicional (TSA). 205 Tabla : Tomada del Trabajo de Seth Sweetser, Thomas C Smyrk, Aravind Sugumar. Serrated Polyps. Critical Precursors to Colorectal Cancer. Rev Gastroenterol Hepatol. 2011;5(5):627-635.) No Displásicos Displásicos Los pólipos hiperplásicos: hiperplasia de células cáliz(Golbet cell) pólipo Microvesicular hiperplásico y pólipo pobre en Mucina, pólipo hiperplásico. Adenoma aserrado sésil / pólipo con displasia Adenoma aserrado sésil / polipo Adenoma aserrado tradicional. Los Pólipos hiperplásicos convencionales son el tipo más común de pólipo dentados, que representan aproximadamente el 80% de los pólipos aserrados. 391 Por lo general estos son pequeños (<5 mm), aparecen ligeramente elevados y se producen con mayor frecuencia en el recto-sigmoide.392 Es difícil diferenciar los pólipos hiperplásicos de otros pólipos por endoscopia con luz blanca convencional y se requiere la histología (Biopsia) (AP) para el diagnóstico. Las características histológicas de los pólipos hiperplásicos incluyen un patrón con dientes de sierra de invaginación epitelial (estrías) en la mitad superior de la cripta con una falta de displasia citológica Históricamente, se consideraba que los pólipos hiperplásicos no tenían potencial neoplásico. Trabajos recientes muestran que estos pólipos suelen tener las mismas anomalías genéticas moleculares que se encuentran en las lesiones serradas más avanzados (SSA / P con displasia), a saber, las mutaciones BRAF y un fenotipo CpG isla methylator (CIMP). 393,394 Además suelen ser más grandes ( ≥1 cm) y estos pólipos hiperplásicos comprometen al colon derecho, como también los que se observan en el contexto del síndrome de poliposis dentada (término histórico es el síndrome de poliposis hiperplásica) tienen más probabilidades de albergar potencial maligno. 395,396 Una subclasificación de los pólipos hiperplásicos ha sido propuesta en base a características histológicas y moleculares: copa rica celular, microvesicular y las variantes de mucina pobres de pólipos hiperplásicos. 397 La importancia clínica de esta distinción no está clara, 206 pero las características moleculares sugieren que los pólipos hiperplásicos caliciformes celulares ricos, pueden representar el precursor de la TSA, mientras que los pólipos hiperplásicos microvesicular puede ser el precursor de SSA / Ps. 398 En la actualidad, sin embargo, los pólipos hiperplásicos no están subclasificados en la práctica clínica de rutina. Fig. N° 82. Pólipo hiperplásico convencional de colon. El epitelio superficial es dentado o en “serrucho”, sin evidencias de displasia epitelial ni de carcinoma. Coloración H&E, 25X. 399 Fig. N° 83. Endoscópicamente Con Olympus® Exera II .NBI (Narrow Band) (Unidad Digestiva Baistrocchi), se observan como lesiones que se elevan ligeramente con bordes irregulares y pueden ser cubiertas con moco. Y en la Histopatología igual que los pólipos hiperplásicos, han cerrado criptas pero las criptas SSA / P se distorsionan y estan ensanchadas, la base de la cripta es "en forma de bota" esta es una característica típica, como se muestra en la Figura. (Tomado del Trabajo de Seth Sweetser, Thomas C Smyrk, 207 Aravind Sugumar. Serrated Polyps. Critical Precursors to Colorectal Cancer. Rev Gastroenterol Hepatol. 2011;5(5):627-635.) Figura 84: Adenoma serrado con patrón en “L” o en “zapatilla”, en una glándula profunda que contacta con la muscularis mucosae. Coloración H&E, 25X Seth Sweetser, Thomas C Smyrk, and Aravind Sugumar de la Division de Gastroenterologia y Hepatologia, de la Mayo Clinic College of Medicine, y Division of Anatomic Pathology, Mayo Clinic College of Medicine 400, opinan que los adenomas serrados tradicionales son poco frecuentes y representan menos del 1% de todos los pólipos colorrectales. Esta lesión descrita por primera vez por Longacre y Fenoglio-Preiser como “adenoma serrado”. 401 Al igual que los pólipos hiperplásicos y SSA / Ps, que tienen un epitelio de criptas dentadas; características histológicas estas distintivas que incluyen proyecciones similares a dedos revestidos por células altas, rosa, a menudo con una mínima displasia citológica. De hecho, a estas células a menudo se hace referencia como 'displásico' en TSA y así no puede ser displásica en absoluto, pero pueden ser metaplásicas donde no hay proliferación de células senescentes.402,403 El rasgo más característico es la formación de criptas ectópicas, en el que las criptas han perdido su anclaje a la capa muscular subyacente mucosa. (Figura ). 404 TSAs (Typically Adenoma Serratum) se observan frecuentemente en el colon distal y recto, y tienden a tener un patrón de crecimiento polipoide pediculado o de base amplia en 208 comparación con SSA / P. La formación de cripta ectópica que define TSA proporciona una base biológica para el crecimiento protuberante 405. Fig. N° 85. El rasgo más característico es la formación de criptas ectópicas, en el que los criptas han perdido su anclaje a la mucosa muscular subyacente. Polipos Sesiles de mayor tamaño ( 1 x 1 cm) en el Colon distal y Recto, con cromoscopia, Patron Pit II de Kudo. Fig. 86. Adenoma serrado, con patrón en “L” en las glándulas profundas que contactan las fibras de la muscularis mucosae. Coloración H&E, 25X. (Fotos de casuística personal Prof. Dr. Luis Spitale) El reconocimiento de una vía neoplásica de Serratum para CRC tiene implicaciones clínicas importantes con respecto a la detección, vigilancia y tratamiento. Idealmente, la búsqueda de la neoplasia de colon dentada debe basarse en la historia natural y el potencial maligno de los diversos tipos de pólipos aserrados. Sin embargo, la historia natural y el potencial maligno de las lesiones aserradas no han sido claramente definidos. Ha habido intentos de evaluar la historia natural de los pólipos serrados, pero estos estudios fueron realizados antes de la distinción entre las CST y SSA / Sal. Una cuestión fundamental en relación con pólipos aserrados es si progresan a cáncer invasivo 209 más rápido que los adenomas convencionales. Se sabe que el gen de reparación de genes MLH1 ADN es silenciado en cánceres esporádicos y MSI y parece ser un evento tardío. Cuando se produce este silenciamiento, estos tumores son propensos a desarrollar mutaciones adicionales a un ritmo rápido, similar a lo que ocurre en los pacientes con síndrome de Lynch. 406 Además, carcinomas microsatélites inestables pueden desarrollar rápidamente de SSA / P con menos de 1 cm de tamaño. 407,408 La capacidad para detectar pólipos aserrados por la prueba de sangre oculta en materia fecal, tomografía computarizada (TC) y la Colonoscopia Virtual (CT Colonography) es limitada. Los pólipos aserrados son menos propensos que los adenomas a que sangren, por lo que las pruebas de sangre oculta en heces es poco probable para detectar estas lesiones. No hay datos específicos respecto a la sensibilidad y especificidad de la detección de pólipos aserrados por la colonografía por TC, pero dada su naturaleza plana es probable que no se detecten. Además, la detección colonoscópica de pólipos serrados, en particular el SSA / P, es difícil debido a que tienden a ser lesiones planas y pálidas con cambios mínimos en la vascularización de la mucosa. Puesto que hay datos limitados sobre la historia natural y la tasa de progresión de los pólipos aserrados a malignidad, las recomendaciones acerca de la vigilancia de las lesiones aserradas provienen en su mayoría de la opinión de expertos. Como adenomas convencionales, el riesgo de CCR entre los pacientes con pólipos aserrados depende del tamaño, el número y la presencia de displasia. Así, es posible estratificar pólipos aserrados por el tamaño, el número y la presencia de displasia con la vigilancia realizada de acuerdo con el riesgo subsiguiente de probable malignización. Las siguientes recomendaciones para la vigilancia de los pólipos serrados dicen los autores del Trabajo Pólipos Aserrados de la Mayo Clinic se basan en la opinión de expertos409,410 y la literatura reciente muestra un marcado incremento en el riesgo de neoplasia avanzada sincrónica entre los individuos con pólipos proximales aserrado grandes. 411,412 Se establecieron entonces en la actualidad pautas de control de los Pólipos Aserrados según el criterio de displasia. Como lo proponen East, Saunders y Jass en su trabajo, Historia natural y el manejo clínico y genético de los Pólipos Aserrados. 413 210 Tabla. East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol. Clin North Am. 37, 25– 46, v .2008). Lesion found Surveillance interval (years) Serrated polyposis 1 Serrated polyp with any cytological dysplasia 3 Serrated polyp proximal to the splenic flexure 3 Serrated polyp ≥10 mm 3 Serrated polyps <10 mm and distal to the splenic flexure 10 En un reciente Trabajo del grupo del Dto. De Gastroenterología y de Biologia Molecular del Akita Red Cross Hospital de Akita Japón, Kimura, Jamamoto y cols414 describen perfectamente su morfologia y estructura molecular muy similar al trabajo que presentara anteriormente. Dicen los Autores que Adenomas sésiles dentados (SSA) son conocidos por ser los precursores de cáncer colorrectal esporádico (CRC) con inestabilidad de microsatélites (MSI), y estar estrechamente asociados con la mutación BRAF y el fenotipo CpG methylator (CIMP). En consecuencia, la identificación endoscópica de los SSA tiene implicaciones importantes para la prevención del CRC, pero el diagnóstico endoscópico exacto es a menudo difícil. Nuestro objetivo fue aclarar que los hallazgos endoscópicos son específicos de acuerdo a los aparatos endoscópicos utilizados, y al uso de la Cromoscopía sea con Índigo Carmín o Cromoscopía electrónica que proveen los nuevos aparatos. A través del análisis retrospectivo de un conjunto de entrenamiento (n = 145), ellos identificaron una nueva microestructura de la superficie, la forma abierta del patrón pit tipo II (tipo II-O), que sería específico para los SSA con mutación BRAF y CIMP. El posterior análisis prospectivo de un conjunto de validación independiente (n = 116), confirmó que el patrón II-O es el Tipo altamente predictivo de los SSA (sensibilidad, 65,5%; especificidad, 97,3%). La Mutación BRAF y CIMP se produjeron con una frecuencia significativa en las lesiones serradas Tipo II-O-positivos. La progresión de los SSA a las 211 lesiones más avanzadas se asoció con una mayor acumulación de la metilación del ADN aberrante y los cambios morfológicos adicionales, incluyendo el tipo III, IV y V de los Pit Patterns de Kudo. La identificación colonoscópica de las lesiones aserradas y adenomas convencionales tiene implicaciones importantes para la prevención del CRC. Sin embargo, el diagnóstico preciso de las lesiones aserradas es a menudo difícil, y es particularmente difícil distinguir los SSA de otras patologías de la superficie mucosa únicamente a través de la observación de la colonoscopia. 415,416 En ese sentido la colonoscopia, de alta resolución de aumento es ahora reconocida como una poderosa herramienta de diagnóstico para predecir la malignidad de adenomas convencionales, la eficacia de los cuales se ha confirmado en una serie de estudios independientes.417 Según la clasificación de Kudo,418 los patrones de las criptas en las lesiones no neoplásicas están clasificados como Tipo I (colon normal) o II (HP), mientras que los patrones de criptas y papilas de lesiones neoplásicas se clasifican como tipos III, IV y V. Debido a que Tipo II deprimidas son indicativos de lesiones HP no neoplásicas y también se observan en las lesiones aserradas, SSA y TSA eran consideradas como benignas cuando se estableció la clasificación de patrones de depresión mucosa.419,420 Sin embargo, dada la evidencia antes mencionada de que los SSA puede ser precursores de los CRC con MSI, continúan los Autores del Akita Red Cross Hospital,421 parecería necesario refinar los criterios para el patrón pit tipo II, basándonos en las características histológicas y moleculares. Tipo II Modelo a cielo abierto es una característica específica de los SSA Para lograr un diagnóstico colonoscópico más preciso, lo primero que se examinó fueron los patrones de criptas en una serie de lesiones histológicamente definidas como dentadas (n= 69) y lesiones adenomatosos convencionales (n= 76) como un conjunto de entrenamiento (Figura 87). A través de este estudio retrospectivo, hemos identificado un patrón pit interesante que era específico de acuerdo a los nuevos endoscopios (Figura 1). Hemos denominado este patrón Tipo II-abierta (Tipo II-O), porque era similar al patrón convencional de tipo II, pero los orificios de las criptas eran más anchos y más redondeados en forma, mostrando una dilatación de las criptas. Las formas de los 212 orificios II-O Tipo también diferían de los de tipo I pits, en que eran más grandes en tamaño con estrías que rodean el orificio críptico. Las lesiones con Tipo II O a menudo mostraron Tipo convencional II de criptas en el campo circundante. Fig. N° 87.(Tomada del Trabajo del Red Cross Akita Tomoaki Kimura MD1,7, Eiichiro Yamamoto MD et al. Am J Gastroenterol. 2012;107(3):460-469) Fig Nº 88. De nuestra casuística personal con Olympus® Olympus® Exera II.NBI y Cromoscopia con Indigo Carmín. Polipo sésil tipo Pit II (Hiperplásico) de Kudo. Fig Nº 89. Pólipo hiperplásico (Casuistica personal Prof. Dr. Luis Spitale) 213 Fig N° 90. (Tomada del Trabajo del Eiichiro Yamamoto MD et al. Red Cross Akita Tomoaki Kimura MD1,7, Am J Gastroenterol. 2012;107(3):460-469)Se observan las aperturas redondeadas de las criptas en el Tipo II-O y estrellado de Kudo para el Tipo II Hiperplasico de Kudo. Figura 91. Pólipo hiperplásico de colon. El epitelio en “serrucho” o “dientes de sierra” se limita a las glándulas superficiales. Coloración H6E, 25 X. (fotos personales Prof. Dr. Luis Spitale) 214 Figura 92. Adenoma serrado de colon. El epitelio en “serrucho” o “dientes de sierra” con patrón en “L” compromete a las glándulas profundas. Coloración H&E, 25 X. (fotos personales Prof. Dr.Luis Spitale) Fig N° 93. Las imágenes superiores Muestran Polipo. Hiperplásico Pit II Con Indigo Carmín y Pit II- O Las imagines con NBI image Olympus® (Aserrados).(Casuistica Personal). Fig N° 94. Las imágenes superiores Muestran Polipo. Hiperplásico Pit II Con Carmín y Pit IIO Las imagines con NBI image Olympus® (Aserrados).(Casuistica Personal) 215 Fig.N° 95. Estas lesiones Hiperplásicas Pit II de Kudo tomadas con NBI y vision directa del Olympus®, son muy difíciles de encontrar y requieren la atención y mejorar el tiempo de retirada del observador. A la derecha la Anatomia Patológica típica de los Adenomas Aserrados. Fotos personales y del Prof. Dr. Luis Spitale. Fig. N° 96. (Tomada del Trabajo del Red Cross Akita Tomoaki Kimura MD1,7, Eiichiro Yamamoto MD et al. Am J Gastroenterol. 2012;107(3):460-469) En este ejemplo de las nuevas estructuras halladas con gran amplificación y Cromoscopia, son los procesos evolutivos de los Pólipos Aserradosn que al transformarse o mutar en su crecimiento toman distintos aspectos Endoscopicos. El Tipo II plus Type IV, se refiere a la asociación de componentes del Hiperplasico clásico de Kudo con desestructuración de las criptas. El Tipo II-O Type IV corresponde a una mezcla de aperturas de las criptas Hiperplásicas Tipo II, Tipo II-O y desestructura del resto. Y el Tipo II-O con el Type V la expresión máxima de transformación del proceso más cercano al CCR. 216 Fig. N° 97. Pólipos Hiperplásicos Aserrados que muestran la combinación de criptas Tipo IIO (A) y Tipo II plus con Type V.(B)(Olympus® Exera II NBI.) Fig. N° 98. Imágenes con Índigo Carmín, en el mismo paciente alternan, la primera de la izquierda Hiperplásica Aserrada Tipo II-O Type IV, y la segunda un típico Adenoma Tipo III L de Kudo. (Sistema Endoscopy, J.C.Zini. Fabricación Argentina). Figura 99. Adenoma serrado con focos de adenocarcinoma intramucoso (flechas). Coloración H&E, 25 X 217 Figura 100. Adenoma tubular o pólipo adenomatoso de colon. Glándulas con epitelio seudoestratificado. Coloración H&E, 25 X Uno de los últimos Trabajos publicados de real importancia es el del grupo de Lynn Butterly, Christina M Robinson y col. Del Dartmouth-Hitchcock Medical Center, Lebanon, New Hampshire, Estados Unidos. Ellos publican un Trabajo Multicentrico y comparativo, Los Polipos Aserrados y Adenomatosos incrementan su hallazgo con un tiempo más prolongado de retiro del colonoscopio. 422 La detección y eliminación de adenomas y pólipos serrados clínicamente significativos (CSSPs) es fundamental para la eficacia de la colonoscopia y para prevenir el cáncer colorrectal. Aunque se ha encontrado que un mayor tiempo de retiro para aumenta la detección de pólipos, esta asociación y el uso de tiempo de retiro como indicador de calidad sigue siendo controvertido. Pocos estudios han informado sobre el tiempo de retiro y la detección de pólipos aserrados. Utilizando datos de Registro de las colonoscopias en Nueva Hampshire, examinamos cómo el tiempo la retirada de un endoscopista en colonoscopias normales afecta la detección de adenomas y de pólipos aserrados. Se analizaron 7.996 colonoscopias realizadas en 7972 pacientes entre 2009 y 2011 por 42 endoscopistas en 14 hospitales, centros de cirugía ambulatoria y las prácticas Hospitalarias. CSSPs (pólipos serrados clínicamente significativos) se definieron como sésiles aserrados los pólipos hiperplásicos proximales al sigmoide. Las tasas de detección de adenomas y CSSP se calcularon con base en el tiempo medio de retirada endoscopista en los exámenes normales. Se utilizaron modelos de regresión para estimar la asociación de aumento del tiempo normal de retiro y pólipo, adenoma, y detección CSSP. 218 Resultados: las tasas de detección de adenomas fueron más altas entre los endoscopistas con una mediana de 9 min de tiempo normal de retiro, y la detección de CSSP alcanzaron sus niveles más altos en 8-9 min. Las razones de tasas Incidentales para la detección de adenoma y CSSP aumentaron con cada minuto de tiempo normal de retirada por encima de 6 min, con el máximo beneficio a los 9 min para los adenomas (1,50, 95% intervalo de confianza (IC) (1.21, 1.85)) y CSSPs (1.77, 95 IC% (1.15, 2.72)). Al modelar se utilizó para establecer el tiempo mínimo de retirada en 9 min. Se objetivo que los adenomas y CSSPs serían detectados en 302 (3,8%) y 191 (2,4%) a más pacientes. El aumento de la detección fue más sorprendente para los CSSPs, con casi un aumento relativo del 30%. Conclusiones: El tiempo de retirada de 9 min fue traducido en un aumento estadísticamente significativo en la detección de pólipos y adenoma serrados. La calidad de la colonoscopia se puede mejorar con una mediana de referencia normal de tiempo de espera de 9 min. En este trabajo se demuestra que la media internacional que aconseja no menos de 6 minutos en el retiro del colonoscopio, debe ser mejorada para mejor hallazgo de las lesiones mínimas. En el 2014 la Escuela Argentina vuelve hacerse presente en la Bibliografía internacional, los Dres. Pereyra, Gómez, González, Fischer, Eraña, Torres, Correa, Cimmino y Boerr del Hospital Aleman de Buenos Aires, publican un muy interesante Trabajo; en el Digestive Disease. 423 ¿Es posible encontrar Adenomas Aserrados durante una colonoscopia convencional? Hacen un análisis detallado de los nuevos aspectos superficiales de los pólipos hiperplásicos basándose en la clasificación de Kudo y sus nuevas actualizaciones para los pólipos Aserrados, consideran la observación del colorido rojizo de la superficie y la presencia de moco en el mismo, el aspecto plano considerando que la mayor presencia de los mismos es en el colon derecho. Incluyen 272 pacientes, evaluaron 440 pólipos (1.6 pólipos por paciente). Treinta y cuatro pólipos (8%) fueron SSA (Sesile Serrated Adenoma), 135 (31%) hiperplásicos, y 249 (56%) adenomatosos. Las características endoscópica más frecuente de SSA fueron en el colon derecho (94%), tipo II patrón pit Kudo (91%), cobertura de moco (41%), de morfología plana (29%) y la superficie de color rojo (26%). El análisis multivariado reveló que la morfología plana (p = 0,002, OR = 3,81 IC 1,53-9,09), la superficie de color rojo (p 219 <0,001, OR = 12,97 IC 4,43 a 37,69), la ubicación del lado derecho (p <0,001, OR = 22,21 IC 5,09 a 135,94) y el moco (p <0,001, OR 8.77 IC 3,76-20,44) fueron predictores independientes de los SSA. Otro grupo de trabajo, este del Instituto de Enfermedades Digestivas y el Laboratorio de enfermedades Digestivas del Li Ka Shing Institute of Health Science of Hong Kong, China, Dr. Wong y colaboradores publican un trabajo en el corriente año (2015), titulado; Asociación Entre pólipos aserrados y el riesgo de neoplasia colorrectal sincrónica avanzada en individuos de riesgo Promedio. 424 Parten de la base que los Pólipos aserrados de colon y recto tienen características histológicas distintas y potencial maligno. Ellos analizaron 4989 individuos chinos asintomáticos de 50 a 70 años que se sometieron a una colonoscopia de cribado, 281 casos con neoplasia avanzada (adenoma ≥1 cm, con histología tubulovelloso / velloso, con displasia de alto grado o adenocarcinoma invasor) éstos fueron comparados con 4.708 controles sin neoplasia avanzada por edad, sexo, antecedentes de tabaquismo, índice de masa corporal, antecedentes familiares de cáncer colorrectal y la presencia de pólipos serrados. Los predictores independientes de neoplasias avanzadas se determinaron mediante análisis de regresión logística multivariada. Ellos concluyen, que la prevalencia de neoplasia avanzada y pólipos serrados (excluyendo pequeños pólipos hiperplásicos distales) fue de 5,7% y 5,6%, respectivamente. 3,7% y 0,4% de los sujetos que tenían pólipos proximales y grandes (≥10 mm) serrados, respectivamente. Los predictores independientes de neoplasias sincrónicas colorrectales avanzadas fueron la presencia de adenomas sésiles serrados (OR: 4,52; IC del 95%: 2,40 a 8,49), pólipos proximales serrados (OR: 2,23; IC del 95%: 1,38 a 3,60), grandes pólipos serrados (O : 59,25; IC del 95%: 18,85 a 186,21), pólipos hiperplásicos (OR: 1,66; IC del 95%: 1,03 a 2,67), tres o más pólipos serrados (OR: 4,86; IC del 95%: 1,24 a 19,15) y uno o más adenomas no avanzados tubulares (OR: 3,58 IC del 95%: 2,59 a 4,96). En conclusión, la detección de pólipos proximales, sésiles y / o pólipos serrados en la colonoscopia de cribado se asoció de forma independiente con un mayor riesgo de neoplasia avanzada sincrónica. 220 POLIPECTOMIAS DEL 2014 Y 2015 CON SISTEMA OLYMPUS® EXERA II NBI, (Cromoscopía Electrónica) SOBRE 4726 COLONOSCOPIAS, SE REALIZARON 515 (10,89%) POLIPECTOMIAS, DE LAS CUALES 51 (9,91%) FUERON MUCOSECTOMIAS. Con los años no solo mejoraron las imágenes que año tras año los aparatos fueron mejorando en su definición, hasta llegar a la Alta Definición (High Definition), pasando lo que se dio en llamar en un primer momento Magnificación de imagen, porque los aparatos tenían y tienen hasta la fecha amplificación de la imagen en 80X, 150X, dependiendo de la Industria que los fabrique, en realidad en Argentina los Aparatos de Alta definición que se pueden conseguir son de la casa Olympus® el Exera II Cv 180 NBI, la línea Fujinon Fice, y la de Pentax® con el I Scan. Pero estos aparatos no solo mejoraron en la definición de la imagen sino que la ductibilidad y maniobrabilidad mejoró ostensiblemente haciendo de ellos en su uso un mejor (CIR) o sea arribo a Ciego con mayor celeridad estableciendo tiempos de entrada y de salida como ya lo hemos expresado en inumerables trabajos que comparan uno con otro,y la sensibilidad de detectar Pólipos desde planos hasta pediculados (ADR) detección de adenomas . Estableciendo ahora valores en tiempo de entrada y arribo a ciego en 7 minutos, y tiempo recomendado de salida en 9 minutos. Por ejemplo dentro de los últimos dos años, del 2014 al 2015 que adquirimos el nuevo aparato Olympus® Exera II cv-180 NBI con el logramos realizar 4726 Videocolonoscopias. La Tasa de Detección de Adenomas (ADR) fue de 41% con Olympus® Exera II, contra 32,6 % con los aparatos anteriores Olympus® CV 1 y Endoscopy de fabricación Nacional de muy buena resolución. Lo mismo sucedió con el (CIR) tasa de arribo a ciego que de un 75% con los sistemas anteriores pasamos a una tasa de intubación a Ciego con Olympus® Exera II del 96%. La Sensibilidad con este Sistema Olympus® fue del 76%, y una Especificidad del 91%. En realidad con el comienzo del uso de la Cromoscopía con Índigo Carmín estas cifras no se modificaron con valores de mayor sensibilidad y especificidad, lo que si cambió fue la comodidad del NBI (Narrow Band) o sea la cromoscopía electrónica , cuyo aspecto principal es la visión de los vasos y la estructura superficial muy similar a la de la 221 Cromoscopía con Índigo, para poder aplicar la Clasificación de Kudo (Pits), y luego con la aparición de la Clasificación de Paris pudimos agruparlos de otra manera como veremos a continuación. Lo mismo con estos aparatos comenzamos a Clasificar la limpieza del Colon con la Clasificación de Boston que ya describiera anteriormente fue una nueva modalidad que tomamos y está reflejada en los dos últimos años de estudios. Preparación. Clasificación de Boston. Gº % 0 0,6 1 3,2 2 12,4 3 83,8 Tasa de intubación a ciego 96 Clasificación de París 0Is 72 0Ip 6 41 Tasa de detección de adenomas II III Sensibilidad 76 Especificidad 9 Se descartó paciente que se realizó polipectomía 0II 11 % LST 4 % TUMOR 7 % I : 2% III: 38% V: 7% II: 31 % IV: 6% DEL 31 % EL 37 PORCIENTO SON SERRATOS. LOS SERRATOS SERIAN DEL TOTAL 11, 4 % T 41% TV 13 % V 7% 222 CASOS, CLINICOS Y QUIRÚRGICOS Type IIa (slightly elevated) Caso 1 Localización: Colon Sigmoides. Macroscopia: Type IIa. Clasificación endoscópica: Type pit pattern II. Tamaño: 3 x 4 mm. Tratamiento: Resección endoscopia. Diagnóstico Histológico: Lesión Hiperplásica. Fig. 101 Type II: claras características de una Lesión Hiperplásica. Fig. 102 Hallazgo histológico que muestra las características de tejido Hiperplásico. 223 Type IIa + dep (Slightly elevated adenoma with pseudo depression) Caso 2 Localización: Colon Sigmoides. Aspecto Microscópico: IIa + dep. Tamaño: 2 x 2 mm. Type: III L pits. Diagnóstico Histológico: Adenoma Tubular con moderada atipía. Fig. 103: Se observa ligera depresión luego de la aplicación del colorante. Índigo Carmín. Fig. 104: La Histología revela un Adenoma Tubular. Se observa ligera depresión. 224 Type IIc + IIa (depressed lesion with marginal elevation) Caso 3 Localización: Recto. Morfología macroscópica: IIc + IIa. Tamaño: 4 x 6 mm. Tratamiento: Polipectomia. Type III S + V pits. Diagnóstico Histológico: Adenoma Tubular con severa Atipía. Fig. 105 Radiología: Pequeña Irregularidad en el enema baritado doble. Fig. 106: Resección endoscópica previa inyección sub-mucosa. “MUCOSECTOMIA”. Fig.107: La Histología demuestra Pólipo Adenomatoso con Atipía severa. 225 Laterally Spreading Tumor (LST) Caso 4 Localización: Colon Sigmoides. Morfología Macroscópica: LST. Tamaño: 20 x 20 x 5 mm; Tratamiento: Cirugía: Type III L pits. Diagnostico Histológico: Adenoma Tubular con severa atipía. La Ultrasonografía endoscópica transacanular, demostró una lesión hipoecoica de 20 mm que aparentemente invadía el plano sub-mucoso. Procedimiento Pre-operatorio: La lesión es marcada con azul de metileno (Tinción para tatuaje) Macroscopia: El espécimen resecado tenía pequeñas protrusiones granulares con bordes elevados. Fig. 107 Figa 108 226 CRIPTAS ABERRANTES (Aberrant Cript Foci) Bird Rp y cols publican en el año 1987 un artículo que nos llamó la atención y que lo vinimos a recordar al ver ciertas imágenes que nos llamaron la atención, con los aparatos magnificados y con cromoscopía de índigo carmín diluida al 1% en pacientes portadores de cáncer de recto y de grandes pólipos con posibilidad de infiltración adenocarcinomatosa, luego del año 2000.425 Este Autor había experimentado en Ratas de Laboratorios, más específicamente Murínidos a los cuales se los sometía a agentes cancerígenos en el curso de una investigación en Ratones CF1, que son más sensibles al desarrollo de tumores de colon. Ratones hembra CF1 (7-8 semanas de edad), se inyectaron (ip) con azoximetano (5 mg/kg de peso corporal por semana) durante 4 semanas. Sus colon fueron extirpados, abiertos en el eje medio y fijados en formalina tamponada. Estos se tiñeron con azul de metileno. El lado de la mucosa se examina bajo un microscopio de luz. Las criptas aberrantes, que son más grandes y tienen un revestimiento epitelial más grueso, se visualizaron fácilmente utilizando objetivos 4X o 10X. Estos ratones CF1, que son más sensibles al desarrollo de tumores de colon, tenían un mayor número de criptas aberrantes / colon que sus homólogos menos sensibles, ratones C57BL / 6J (5,0 ± 0,7 vs. 2,4 ± 0,7). La utilidad de esta observación como una posible medida de acontecimientos neoplásicos se discute en el animal y la posibilidad de su desarrollo en los humanos. Otros Autores como Pretlow TP, O'Riordan MA y cols 426 publican en 1992 similares resultados de la observación de Criptas aberrantes en roedores alimentados con carcinogeneticos. Bird publica otro trabajo, en el año 2000,427 en el que manifiestamente dice que estas criptas aberrantes podrían aparecer en los Humanos y ser un patrón que acompañe a la presencia de un Adenocarcinoma. Autores Japoneses como Yokota, Sugano y cols publican en un Gastrointestinal Endoscopy de 1997, 428 un Trabajo titulado Detección de Criptas aberrantes en la Colonoscopia Magnificada. Estos Endoscopistas de la División de Endoscopia, Medicina Interna, Cirugía y Laboratorio del National Cancer Center de Tokio, y de la división de Endoscopia del National Cancer Center del Hospital East de Chiba, Japón. Ellos muestran que en pacientes portadores de Poliposis Familiar Múltiple o de Cáncer Colorrectal Esporádico era muy frecuente observar esta criptas que aparecen elongadas, aumentadas 227 de tamaño y de mayor espesor que las normales, que rara vez se las observaba en pacientes sin patologías de ningún tipo. Douglas G. Adler y Christopher Goustou publican en un Gastroeintestinal Endoscopy del 2002,429 un trabajo titulado Identificación endoscópica y cuantificación de Criptas Aberrantes en el colon humano. Este Trabajo que demostraba que podrían aparecer estas deformaciones crípticas en portadores de Poliposis o Cáncer Colorrectal, es aprobado y demostrado luego en el año 2005 por el mismo autor en otra publicación :“Aberrant Crypt Foci as Biomarkers for Colonic Dysplasia”. 430 En el que concluye afirmativamente que hubo un notable aumento en el riesgo relativo de fenómenos displásicos ACF (Aberrant Cript Foci) en pacientes con adenomas o bien cánceres planos o lesiones de colon planas, fortaleciendo el argumento de que ACF son de hecho biomarcadores para el desarrollo de adenomas de colon proximal o cáncer colorrectal. Fig. N° 109. Fotos originales del trabajo de Douglas Adler. Fig. N° 110. Baistrocchi - Lorenzo - 1999. Congreso Argentino de Gastorenterología. (Buenos Aires), y XVIII Congress International Society Colon and Rectal Surgeons. San Pablo. Brasil, 2000. En Humanos portadores de Pólipos, Poliposis no familiar y Adenomas planos deprimidos con cáncer In situ, o displasias Severas. 228 PARTE 5 VIDEOCOLONOSCOPIA TERAPEUTICA EN LOS POLIPOS DEL COLON Y RECTO. Polipectomía Endoscópica Es este uno de los capítulos más apasionantes de la terapéutica endoscópica como ya lo habíamos expresado. La polipectomía endoscópica colónica (PEC) ha sido la revolución en el tratamiento de la neoplasia colónica benigna, es sin duda el procedimiento más frecuentemente utilizado desde su introducción en el manejo de los pólipos de colon. El propósito de la polipectomía es remover toda la lesión o las lesiones y así dejar la cirugía convencional sólo para los pólipos en que una simple polipectomía no es suficiente o impracticable, constituyéndose en un procedimiento de rutina, seguro, rápido y eficaz. Los pólipos colónicos es un tópico que ha tomado gran importancia a nivel mundial, sobre todo en países desarrollados, los cuales presentan niveles elevados de morbimortalidad por cáncer de colon, ya que se sabe que estos constituyen lesiones preneoplásicas que se asocian a factores genéticos y ambientales. El creciente interés por los pólipos es consecuencia del avance en la capacidad de detectarlos con alto grado de sensibilidad y extirparlos por vía endoscópica, está demostrado que la mayor parte de las neoplasias de colon hasta en un 97%, se originan en un pólipo de tipo adenomatoso previamente benigno. La extirpación total del pólipo permite al patólogo tener una visión completa de la lesión, el grado y ubicación de las atipias que pudieran existir y de la presencia de degeneración. En la actualidad existe ya suficiente evidencia para afirmar que la (PEC) disminuye la incidencia de cáncer colorrectal, la remoción de pólipos disminuye la probabilidad de desarrollar cáncer en 70 a 90%. Para la extirpación total de estas lesiones que como han venido viendo a través de este Relato es ya un Consenso Mundial su extirpación en la Prevención del Cáncer Colorrectal, no está aún todo definido. Donde comenzaban las controversias o las confusiones ya lo expresaba Turrel en el año 1962, 431 era cuando se tenía que clasificar o definir a estas lesiones y no se especificaba su criterio a seguir. 229 Por eso este gran Capítulo de los Pólipos del Colon y Recto debía abrirse y considerar su extirpación desde dos puntos de vista, el Histológico donde la tipificación celular, su disposición y organización nos dará el encuadre general del Pólipo con su nombre específico. Y el morfológico que importa tanto al Radiólogo, Cirujano y Anatomopatólogo. Pero este criterio interesara mucho más al Endoscopista que muchas veces ve dificultada la definición de la lesión por ser este un estudio dinámico expuesto a fáciles errores de interpretación o pasar por alto una lesión. Esto ya lo decíamos con los colonofibroscopios en los años 1973 y en 1081 con mi Tesis de Doctorado, o la Dra. Rita Pastore 432 en su excelente Relato de Polipos Colorrectales no Hereditarios del 34º Congreso Argentino de Coloproctología. Henry Bockus 433 a comienzo de Siglo XX decía que en el sentido más estricto la designación que le diéramos o aplicáramos era a una lesión sin tener en cuenta sus estructuras Histológicas o el carácter patológico del tumor. hoy todo cambió y el estudio de la estructura superficial del pólipo nos muestra la deformación o no de las criptas con nbi o cromoscopía, y la microendoscopy o confocal microendoscopy nos muestran con seguridad que lesión histológica estamos tratando. Históricamente hemos resecado a los pólipos pediculados y semipediculados, con ansas diatérmicas por enlace de diversos tamaños comercializadas ya por numerosas casas de Sistemas Ópticos y numerosas más que se dedicaron a fabricar estas ansas mejorando su performance y ductilidad. En general el Endoscopista debe usar el Equipo de polipectomía al que más se adapte. Estas ansas pueden conectarse a sistemas de coagulación y corte convencionales ya adaptadas de baja longitud de Onda, estos también fueron adaptándose con el tiempo tratando de no lesionar a la pared colónica y obtener una pieza que pueda ser estudiada por el Anatomopatólogo sin mayor proceso de carbonización del límite de corte. En los años 80 usábamos la Fuente Martin Electrotom® que nos proveía un corte limpio sin carbonización del borde de sección similar a un corte frío. Hoy en la actualidad usamos cortes de frecuencia modulada como el que provee el mismo sistema de corte del Argón Plasma.(EMED ES 350) Las maniobras de enlace deben ser aprendidas por el Endoscopista en un Curso de Especialidad que actualmente numerosas Instituciones de Endoscopia brindan en nuestro País, desee la Federación Argentina de Gastroenterología o de Diversos Servicios de Endoscopia y Gastroenterología de mucho Hospitales que disponen de Torres de alta Tecnología que actualmente es usada en todos los Servicios del mundo. 230 Esta técnica es depurada y tiene sus complicaciones tanto sea en el enlace (Monopolar) como en el paso de la corriente eléctrica a través de ella provocando el corte y la coagulación del tallo del pólipo o de la base de implantación si este es sésil. Cualquier distracción puede hacer que ya sea la cabeza del Pólipo toque la pared opuesta o el paso de la corriente de coagulación sea insuficiente y el corte mecánico supere al corte diatérmico, lo que sobrevendría una hemorragia en la base del Pólipo siendo esta una de las complicaciones en este procedimiento. El exceso del paso de la misma puede provocar una quemadura en la base que haga que la escara en un tiempo corto provoque la perforación de la pared y por consiguiente si esta no tiene una resolución natural y clínica sin cirugía como suele ocurrir en un número de pacientes (tratamiento clínico de la perforación colónica sin cirugía) la regla será tener que intervenir a este paciente evitando así una peritonitis segura. Todo este tipo de maniobras deben ser aprendidas con rigurosidad y delicadeza haciendo de este procedimiento uno de los gestos quirúrgicos endoscópicos más útiles y significativamente más positivos en todo el mundo para la prevención del desarrollo del Cáncer Colorrectal. Por los años 1975 Cristopher Williams con quien tuve el honor de trabajar, diseña para la casa Olympus® una pinza especial similar a la pinza usada para toma de muestra Biopsia, que conectada a una sistema de coagulación tomaba pequeños Pólipos menores de 1 cm y coagulaba su base. Su nombre se debió a la interpretación de Biopsia en caliente o con coagulación (Hot Biopsy). Esta pinza tuvo una difusión en todo el mundo maravillosa porque hace de esta una maniobra rápida de exéresis de numerosos Pólipos pequeños en el mismo acto endoscópico con toma de muestras Histológicas. Si bien su uso debió ser instrumentado con ciertos cuidados de tiempo y coagulación pues provocaba en algunos sectores del Colon como el Ciego o colon derecho de paredes de menor grosor, perforaciones con mayor frecuencia, su uso hasta el día de hoy es de extraordinaria utilidad. Estas ansas son de tremenda utilidad en los Pólipos menores de 0,5 cm, su uso ha sido asociado a mayor número de complicaciones en el colon derecho. 434 El hallazgo de mayor cantidad de lesiones Planas en Occidente hizo que hubieran parámetros de referencia para tomar conductas y saber si debían resecarse o no. Numerosos trabajos en el Oriente y Occidente y avalaron esta conducta. Para ello debíamos contar con técnicas de avanzada y poder resecarlos. 231 Uno de los Trabajos y comentarios referido a estas lesiones fue publicado por el Dr. Douglas K. Rex, Gastroenterologo de EEUU, Profesor de la Universidad de Indiana, Colonoscopista dedicado a los mayores Programas de Screening del cáncer colorrectal titulado Las lesiones planas del colon son cada vez más frecuente en los EE.UU. 435 Datos publicados recientemente decía Douglas Rex, han puesto de relieve la prevalencia de lesiones planas y deprimidas de la población de Estados Unidos y el riesgo de displasia de alto grado y cáncer invasivo que se asocia con estas lesiones. Muchos han pensado que lesiones no polipoides (planas) como las neoplasias colorrectales se limitaron a la población japonesa, pero hay un creciente reconocimiento de que estas lesiones son ahora prevalentes en la población occidental. Datos publicados recientemente han puesto de relieve la prevalencia de lesiones planas y deprimidas de la población de Estados Unidos y el riesgo de displasia de alto grado y cáncer invasivo que se asocia a este tipo de lesiones. La morfología de las lesiones se clasificó de acuerdo a las Clasificaciones de la Sociedad Japonesa para el cáncer del colon y el recto. Nuestros Colonoscopistas buscaron lesiones utilizando luz blanca, y las áreas cuestionables se realizaron con cromoscopía utilizando colorante índigo carmín (0,1% -0,4%) para el análisis definitivo. Neoplasias planas y deprimidas fueron diagnosticados en el 9,4% de la población total del estudio. La prevalencia fue mayor en el grupo de vigilancia (15,4%) que en el grupo de cribado (5,8%) o en el grupo sintomático (6,0%). De 1308 pólipos encontrados, 8 mostraron cáncer invasivo, y 5 mostraron carcinoma in situ (displasia de alto grado). Entre 209 lesiones planas, 2 mostraron cáncer invasivo, y 7 mostraron displasia de alto grado. Entre 18 lesiones deprimidas, 2 mostraron cáncer invasivo, y 4 mostraron displasia de alto grado. Lesiones planas y deprimidas con histología avanzada fueron más pequeños y eran lesiones polipoides con histología avanzada (media, 15,9 mm frente a 19,2 mm). En este artículo genero una enorme atención en la prensa después de su publicación en la revista JAMA. Estudios previos en los EE.UU., el Reino Unido y Suecia han demostrado resultados similares acerca de la prevalencia de las lesiones planas y deprimidas y su asociación con displasia de alto grado y cáncer invasor. Sin embargo, cuando la displasia de alto grado no se incluyó en este análisis el estudio de la asociación entre las lesiones y el carcinoma de adenomas planos, la incidencia de cáncer invasivo 232 fue extremadamente baja en la población de cribado. Además, este estudio clasifica los pacientes con carcinoma in situ con cáncer, que ya no es la metodología convencional pacientes con estas lesiones deben ser designados como poseedores de displasia de alto grado. En nuestra unidad de aparato digestivo en estos últimos 15 años hemos encontrado una totalidad de 10.490 pólipos distribuidos en los siguientes sectores: el 75% en el recto y colon izquierdo y el 25% entre el colon derecho y transverso. las lesiones planas fueron un total de 3.283 (31,29%) del total divididas entre no neoplásicas y neoplásicas. Todas fueron resecadas Endoscópicamente y solo se enviaron a cirugía las lesiones Vellosas ubicadas en Recto que superaban más del 30% de la luz rectal, con los Sistemas Olympus® CV.I, Endoscopy (fabricación Nacional). Con el Sistema Olympus® Exera II NBI, todas las lesiones Rectales y colónicas se resecaron Endoscópicamente, ya sea en forma de Mucosectomía o Piecemeal. Solo tres en estos últimos dos años se enviaron a cirugía del total de 515 Pólipos encontrados (0,58%), dos de ellos por estar ubicados en el colon derecho y ser de dispersión lateral mayores de 4 cm (II-a +II-c y el otro 0-III) RESECCIONES COLÓNICAS CON TÉCNICAS ESPECIALES. MUCOSECTOMÍA. PIECEMEAL. La resección endoscópica Mucosa, en los canceres gastrointestinales tempranos y en las lesiones pre-tumorales (pólipos planos) ha sido presentada en el mundo entero como una técnica factible de realizar con ciertos márgenes de seguridad. Esta debe ser realizada en block y en la mayoría de los trabajos se sostiene que debe completarse con Laser Argon Plasma en los márgenes y en la base, para dar al paciente mayor margen de seguridad. Se ha visto en numerosos trabajos que la recidiva local cuando este no es usado es elevada 436 Pese a que hay trabajos como los de Hintze, Adler y Veltzke 437 que demuestra que pese a haber usado la Mucosectomia como primer paso y el Nd: YAG láser 233 vaporisation, tuvieron una recidiva del 28% al 1,4 año de control con displasias similares a las encontradas anteriormente. Esta conducta viene siendo motivo de controversias desde los años 95 a la parte, muchísimos Autores han publicado sus experiencias referidas a esta técnica de Mucosectomía solamente o comparada con la Mucosectomía seguida o completada por el Laser vaporisation o Argon Plasma como hemos usado en nuestra experiencia personal. Junto con la Mucosectomía de los Pólipos Planos de gran tamaño desde hace muchos años se practica la resección en trozos hoy llamada Piecemeal o resección paso a paso, esta técnica ha venido a completar el arsenal de posibilidades para la resección de grandes Pólipos de base amplia. El índice de recidivas después de la resección de Pólipos de base amplia va del 16 al 46% según algunos autores 438, pero asociando el tratamiento con el Argon Plasma (APC), se obtiene la erradicación más completa de la lesión con índices menores de recidivas. En este estudio retrospectivo Zlatanic y cols. usando la técnica de Piecemeal además del APC obtienen un promedio de recidiva del 50 %, que comparado con el grupo al que se le realizo solo Mucosectomía y Piecemeal la recidiva fue del 100%. Brooker y cols. 439 publican que tratando los grandes Pólipos de base amplia con Piecemeal y APC tienen una recidiva solo del 10 % comparada con los pacientes a los que se les realizo solo Piecemeal del 64%. Debemos considerar que en estos valores de múltiples trabajos realizados juega un papel preponderante el saber distinguir visualmente con el endoscopio cuales son los márgenes verdaderos de la lesión, porque si no la recidiva estaría condicionada por la resección incompleta y no el uso de los sistemas o técnicas descriptas. Es por eso que la mejor visión y ampliación de la imagen dada por la Magnificación endoscópica o la de los aparatos de gran resolución provee mejor visión de los márgenes de la lesión. Si a esto le sumamos lo que en estos últimos años se ha ido proponiendo a todos los centros endoscópicos del mundo que es la Cromoscopía realizada con algún colorante como el Índigo Carmín o azul de metileno, los bordes de la lesión a resecar son vistos con precisión y mayor definición. Hurlstone y cols. 440 usando esta técnica de coloración superficial de la mucosa del colon obtiene un 84% de valor predictivo positivo y un 95% de valor predictivo negativo para estas lesiones, y una valoración clara de los bordes en un 93%. Estas muestras son de gran valor para tener en cuenta que la Cromoscopía no 234 solo ayuda a predecir cuál es la tipificación Histológica de la lesión sino también a distinguir sus márgenes en este tipo de resecciones. Fig. N° 111. Estas pequeñas lesiones deben ser resecadas con Técnicas especiales para su extracción y estudio completo. Fig. N° 112. Inyección submucosa y resección de la pieza. Mucosectomía. Fig. N° 113. La pieza debe ser fijada y extendida para que el Anatomopatólogo no tenga dificultad en el examen de los márgenes e invasión. 235 Fig. N° 114. Piecmeal Mucosal Resection. El lecho se terminó de coagular en la base y sus bordes con Argón Plasma. En un Trabajo publicado por Kashida, Kudo y cols.441 del Digestive Disease Center, Showa Hospital Universitario del Norte Yokohama, dicen que en el cáncer colorrectal, aunque las lesiones planas y de tipo depresivo se encuentran por la visión endoscópica regular sin mayor lesión. Cuando se emplea la ampliación/coloración y observación de los pit-patern, estos aparecen con el diagnóstico preciso de la lesión. Las lesiones de tipo deprimido parecen tener una tendencia prominente para mostrar características malignas, y el reconocimiento y tratamiento oportuno de estas lesiones es importante para mejorar la morbilidad y la mortalidad del cáncer colorrectal. La Cromoscopía es obligatoria para un diagnóstico preciso de estas lesiones. La clasificación pit-patrón se correlaciona bien con el diagnóstico Histológico. Estas conclusiones pueden proporcionar información adicional importante antes del tratamiento endoscópico de la lesión. La resección submucosa en base a varios trabajos mejoró aún más la posibilidad de recidiva local. se trata de una instrumentación especial que trabaja disecando la submucosa mientras se tracciona la mucosa de la lesión encontrada. En el año 2012 se conocen las primeras publicaciones de este método con un trabajo de Nozomu Kobayashi y colaboradores de la Universidad de Tokio que publican un trabajo Titulado “Estudio de casos y controles emparejados Comparando endoscópia submucosa con La disección y resección endoscópica de los tumores de la Mucosa Colorrectal” 442. Para los grandes tumores colorrectales, la línea de tasa de resección en bloque alcanzado por la resección endoscópica de la mucosa (REM) es insuficiente, y esto lleva a una alta tasa de recidiva local. Como se ha informado de la disección endoscópica de la submucosa (ESD) para lograr una mayor tasa de resección en bloque, y una menor tasa de recidiva local en el corto plazo, se espera con este método superar las limitaciones de la REM. 236 Se realizó un estudio de casos y controles emparejados entre la EDS y EMR para aclarar la eficacia de la EDS para los tumores colorrectales. Resultados: Los tamaños medios de las lesiones eran 27,1 mm en el grupo de ESD y 25,0 mm en el grupo de EMR. La tasa de resección en bloque fue significativamente mayor en el grupo ESD (92,9% frente a 37,5% con ESD vs EMR), y la tasa de perforación también fue significativamente mayor (10,7% vs 0%). Todos los casos de perforación fueron manejados en forma conservadora. No se observó recurrencia en el grupo de ESD, mientras que se detectaron recidivas locales en 12 casos de EMR (21,4%). Once de los 12 recurrencias (91,7%) fueron manejados por vía endoscópica, y solo uno requirió resección quirúrgica. Estas “Mucosectomía”, “Piecemeal”, o resecciones ampliadas que hemos podido realizar, no así la disección submucosa, deben ser realizadas en block y en la mayoría de los trabajos se sostiene que debe completarse con Argon Plasma Coagulation (APC) en los márgenes y en la base ,para dar al paciente mayor margen de seguridad. Se ha visto en numerosos trabajos que la recidiva local cuando este no es usado es elevada (16% al 46%). 443 Fig N° 115. Técnica de la Resección submucosa, que muestra la disección que debe realizarse en el plano submucoso. 237 Fig. N° 116. Cuadro comparativo del uso o no, del Argon Plasma coagulation, al terminar de resecar un Pólipo Plano o por Piecmeal. Nuestra experiencia del año 1999 al 2012. Nuestro Grupo de Trabajo de la Unidad Digestiva Baistrocchi, presento en el 35 Congreso Argentino de Coloproctologia del 2010, el Trabajo Resección Mucosa Endoscópica en Grandes Pólipos, 444 el objetivo era analizar la experiencia de un centro especializado en cirugía ambulatoria de Coloproctología, en resección mucosa endoscópica (Mucosectomía) y terapia local con argón plasma posterior a la misma, como una opción terapéutica en lesiones rectocolónicas ≥2,5 cm de diámetro (lesiones de gran tamaño), para conocer el tipo histológico, la resecabilidad endoscópica, factores de riesgo de recidiva y complicaciones. Material y Método; se realizó un estudio prospectivo, longitudinal y descriptivo de pacientes tratados con resección mucosa endoscópica (EMR) en lesiones rectocolónicas de gran tamaño (≥2,5 cm) durante 3 años (noviembre 2007-noviembre 2010) en la Unidad Digestiva Baistrocchi donde se incluyeron 47 pacientes, los cuales fueron 23 de sexo masculino y 24 de sexo femenino; con una edad promedio de 68 años; a todos los pacientes se les realizo colonoscopia de control en un plazo mínimo de 12 meses siguientes a la resección endoscópica. De los 47 pacientes, a 25 individuos se les realizo EMR únicamente y a 22 individuos EMR + APC. En ambos grupos las 238 complicaciones fueron similares, en el siguiente orden de frecuencia, dolor abdominal, distensión, náuseas y por ultimo perforación. Resultados: El total de pacientes fue de 47, 25 para el grupo de EMR y 22 para el grupo de EMR + APC. Las complicaciones fueron similares en ambos grupos. Se registraron 2 pacientes con recidiva a los 12 meses del tratamiento cuyo informe de anatomía patológica informaba adenocarcinoma los cuales debieron ser sometidos a cirugía. La complicación más frecuente fue el dolor abdominal y la distensión abdominal. En los pacientes que presentaron complicaciones graves como la perforación 445 fueron manejadas con tratamiento conservador. No se registraron complicaciones hemorrágicas. El porcentaje de recidiva fue del 4%. Discusión: en nuestra serie de pacientes el total de las lesiones planas la mayoría correspondieron adenomas. La recurrencia local fue del 4 %, más baja que otras series publicadas. La resección en bloque disminuye notablemente el riesgo de recidivas y facilita el estudio histopatológico. Cuando esto no es posible y se deba realizar la resección mediante picemeal, se debe programar un estricto seguimiento endoscópico dejando marcado el sitio de resección (Tinta China o Azul de Metileno) para una mejor valoración. La hemorragia intra procedimiento fue controlada en forma exitosa con termocoagulación mediante argón plasma. Conclusión: la resección mucosa endoscópica de grandes pólipos en manos experimentadas es un procedimiento seguro, con baja tasa de complicaciones, que se presentó tan solo en un 4% de los casos y fue resuelta de manera favorable mediante tratamiento médico y o endoscópico. Registra también bajos índices de recidiva local. Discusión: Se puede esperar la cura completa del cáncer temprano si el tejido neoplásico está limitado a la mucosa y no excede una superficie de 2cms. de diámetro, sin embargo hay estudios recientes que demuestran que lesiones colónicas mayores de 2 cm. de diámetro, sobre todo del tipo de diseminación lateral (LST), pueden ser satisfactoriamente resecadas si se realiza una adecuada selección de los pacientes. Hurlstone y cols. 446 que evaluó la eficacia y seguridad de la REM en bloc asociada a la cromoendoscopia magnificada para el manejo de lesiones colorrectales sésiles o planas de un tamaño igual o menor a 2 cm. Se realizó REM en 599 pacientes obteniéndose una resección completa en el 96% de las lesiones. Con respecto a las complicaciones un 239 paciente presento una perforación (0,2%) y 12% sangrado post-REM. La tasa de recurrencias en esta serie fue de 2.5%. Conio, Blanchi y cols.447 incluyeron 136 pacientes que presentaron 139 pólipos sésiles. La técnica evaluada fue la inyección submucosa seguida de la resección mediante un asa de polipectomia sola o asistida con capuchón. Las lesiones tenían un diámetro promedio de 20 mm en el colon derecho y de 30 mm en el resto de los segmentos. El 10.8% de las REM presentaron hemorragia post-polipectomia y 3,7% síndrome postpolipectomia. La tasa de recurrencias en esta serie fue de 21,8%. Church JC 448 describió una serie consecutiva de casos en donde se removieron 311 pólipos mayores de 2 cm en 252 pacientes. La tasa de recurrencia fue de un 11%. Un 7.5% presentaron complicaciones post-polipectomía (17 hemorragias tardías y 2 quemaduras). En Argentina son pocos los centros que realizan este tipo de tratamientos ya que se necesita de personal entrenado y experto en el manejo de lesiones tempranas así como también de un equipo de soporte quirúrgico en el manejo de las neoplasias digestivas. Representan, por lo tanto, un gran desafío técnico. Actualmente, gracias al avance tecnológico unido a la mayor experiencia adquirida por los cirujanos endoscopistas, es posible abordar estas lesiones de gran tamaño, en forma segura y con mínima invasión. Dentro del armamento terapéutico contamos con alternativas como son los endoclips que permiten tratar eventuales complicaciones y la terapia local con argon plasma coagulator (APC). Si bien hay un importante número de recidivas que se asocian al número de sesiones y técnica de piecemeal, para lo cual, la terapia local con argón plasma posterior a la mucosectomía que destruye el tejido residual; tiene una altísima tasa de éxito con la consiguiente disminución de la morbilidad y aumento de expectativa de vida relacionada con estas lesiones, y cómo no decirlo, de la curación de las mismas. En nuestra serie de pacientes el total de las lesiones planas la mayoría correspondieron adenomas. La recurrencia local fue del 4,2%, más baja que otras series publicadas. La resección en bloque disminuye notablemente el riesgo de recidivas y facilita el estudio histopatológico. Cuando esto no es posible y se deba realizar la resección mediante piecemeal, se debe programar un estricto seguimiento endoscópico dejando marcado el sitio de resección para una mejor valoración. La hemorragia intra procedimiento fue controlada en forma exitosa con termocoagulación mediante argón plasma. 240 Conclusión: la resección mucosa endoscópica de grandes pólipos en manos experimentadas es un procedimiento seguro, con baja tasa de complicaciones, que se presentó tan solo en un 4% de los casos y fue resuelta de manera favorable mediante tratamiento médico y o endoscópico. Registra también bajos índices de recidiva local. Fig. N° 117. Pólipo de gran tamaño, de aspecto Adenomatoso con NBI (Pit II L de Kudo), (1S de Cl. París) Su base es coagulada con Argon Plasma. Un Trabajo publicado en el Hospital Sir Charles Gairdner, Departmento de Gastroenteroloia y Hepatología, Perth, Australia, relata que la resección endoscópica de los tumores colorrectales grandes cada vez más se está utilizando como una alternativa a la cirugía. 449 Sin embargo, los datos sobre las tasas de fracaso, la seguridad y los resultados a largo plazo siguen siendo limitados. El objetivo de este estudio fue reportar los resultados a corto y largo plazo de la resección endoscópica de los tumores colorrectales grandes de un solo centro y utilizar un modelo para predecir la mortalidad si se hubiera realizado la cirugía. Fueron remitidos para la resección endoscópica de tumores colorrectales grandes (≥20 mm) de enero 2001 a febrero 2008. Los detalles de resección se registraron en una base de datos prospectiva mantenida. Los datos fueron recogidos en las tasas de complicaciones de 30 días, y el seguimiento de los resultados de la colonoscopia. La puntuación colorrectal-POSSUM se utilizó para estimar la mortalidad por cirugía abierta. 241 Había 154 grandes neoplasias en 140 pacientes. La edad media fue de 68 años (rango 22-94). La media de tamaño de la neoplasia fue de 26 mm (rango 20-80 mm, 24 ≥ 40 mm). La Extracción endoscópica completa se logró en el 95% de los casos. Veinte pacientes fueron referidos para cirugía (14%). En el grupo de endoscopia, no hubo muertes dentro de los 30 días. Doce (12) pacientes tuvieron una complicación incluyendo dos (2) perforaciones. Se disponía de datos de seguimiento endoscópico en el 90% de los casos y cinco pacientes (4%) se encontró que tenían adenoma residual que fue tratado endoscópicamente con resección posterior. Si se hubiera realizado la cirugía, la media que predijo la mortalidad fue del 2,2% (rango 0,5% a 10%). Hubo dos muertes (10%) en pacientes sometidos a cirugía electiva en 30 días. Concluyen los Autores que la resección endoscópica de los tumores colorrectales grandes es segura y eficaz incluso para las grandes neoplasias benignas. Cuando la lesión es endoscópicamente resecable esto debería ser el tratamiento de elección. Nuestra opinión al respecto es la misma siempre que se sepa valorar el tamaño y medir los inconvenientes como la situación anatómica del Pólipo, siempre en la ampolla Rectal la maniobrabilidad y seguridad es distinta a la del resto del Colon. Las resecciones en la ampolla Rectal merece un pequeño comentario especial, ya que está al alcance de las Resecciones Transanales (TEM) con aparatos especiales de muy alto costo pero de muy buena maniobrabilidad y visión de la lesión que se ubica hasta los 12 a 15 cm de la ampolla Rectal, estos sueles descubrirse tarde y el tamaño por lo general supera los 3 a 10 cm, se extienden en alfombra y a veces la resección manual transanal bajo anestesia se vuelve dificultosa. En estos últimos años la seguridad de visión y maniobrabilidad de los nuevos endoscopios dio la posibilidad de su uso en las resecciones mucosas (EMR) de este sector más amplio y de mayor comodidad de trabajo como es el Recto. Un Trabajo publicado en el 2009, por el Departamento de Gastroenterología y Hepatología del Academic Medical Centre, Amsterdam, The Netherlands y 15 grupos más de Holanda, como Rotterdam, Nieuwegein, Amersfoort, Alkmaar etc., titulado Transanal Endoscopic Microsurgery versus Endoscopic Mucosal Resection for Large Rectal Adenomas (TREND-study), en donde se comparan los beneficios de uno y otro método 450 con especial referencia a inconvenientes de la Técnica misma, beneficios de una y otra, costos, internación y complicaciones. 242 Dicen los Autores, recientes estudios no aleatorios indican que la resección endoscópica de la mucosa extendida (EMR) es igualmente eficaz en la eliminación de grandes adenomas rectales como la microcirugía endoscópica transanal (TEM). Son ambos igualmente eficaces, EMR podría ser más rentable ya que esta estrategia no requiere equipo costoso, anestesia general y hospitalización. Además, EMR parece estar asociada con menos complicaciones. El trabajo se llevó a cabo de forma Multicéntrica aleatorizado entre los 15 hospitales en los Países Bajos. Los pacientes con un adenoma rectal ≥ 3 cm, situados entre 1-15 cm del ano, serán asignados al azar a una estrategia EMR o TEM. Para TEM, los pacientes serán tratados con anestesia general, los adenomas se disecaron en bloque por una escisión de espesor total, y los pacientes serán ingresados en el hospital. Para EMR, no o se utiliza la sedación consciente, las lesiones se resecaron a través del plano de la submucosa de una manera gradual, y los pacientes serán tratados como cirugía ambulatoria. Si se demostrara que hubiera un Adenoma residual que fuera visible durante la primera endoscopia de vigilancia a los 3 meses se eliminará endoscópicamente en ambas estrategias de tratamiento y se consideró como parte del tratamiento primario. Como medidas primarias de evaluación se tomó la proporción de pacientes con recidiva después de 3 meses. Medidas de resultado secundarias son: 1) número de días que pasó en el hospital desde el tratamiento inicial hasta los 2 años después; 2) la morbilidad mayor y menor; 3) Calidad específica y general de la vida; 4) La función anorrectal; 5) la utilización y los costos de atención de la salud. Un análisis de costoefectividad y coste-utilidad de EMR contra TEM para grandes adenomas rectales se llevó a cabo desde una perspectiva social, con los costos por paciente libre de recurrencia y el costo por año de vida ajustando calidad como medidas de resultado. La EMR (Endoscopic Mucosal Resection) ha ganado más y más apoyo en los últimos años, principalmente debido a los buenos resultados clínicos después de EMR en el esófago y el estómago. 451,452 La resección endoscópica de la mucosa también se ha descrito para el tratamiento de grandes adenomas colorrectales, que revelan tasas de recurrencia de 0-9% y las tasas de complicaciones de sólo el 0-9%. 453,454 en los casos que los adenomas no se puedan eliminar por completo durante un intento de EMR, se repite EMR para la enfermedad residual y generalmente conduce a una tasa de éxito global de 96-100%. Recientemente, el primer estudio analizando prospectivo extendió la EMR para 243 grandes adenomas rectales, revelando una tasa de recurrencia del 8% y una tasa de complicación de 8%. 455 En este estudio, se detectaron todas las recidivas durante la primera endoscopia de control después de los 3 meses; se repitió EMR en la enfermedad residual, llevando a una tasa de éxito del 98,4%. Microcirugía endoscópica transanal: TEM se realizó como fue descripta por Buess 456, bajo anestesia general / raquídea. Se inserta un resectoscopio TEM especializado de 12 o 20 cm de longitud (Wolf GmbH Knittlingen o Storz GmbH Tuttlingen, Alemania) dentro del recto para asegurar visualización adecuada de la lesión. El resectoscopio se fija a la mesa de operaciones por un dispositivo de soporte, proporcionando la oportunidad de cambiar la posición del resectoscopio durante la cirugía en curso. La cavidad rectal se insufla con CO2 por una unidad de Endosurgical combinado para lograr la distensión constante para la visualización adecuada del adenoma rectal. La unidad combinada Endoquirúrgica regula irrigación y aspiración, manteniendo así una presión rectal intraluminal constante. Con el uso de un ocular estereoscópico binocular para visión tridimensional (Wolf GmbH solamente) o un telescopio oblicuo hacia adelante (Storz GmbH) ampliada. Con diversos instrumentos (TEM400 multifuncional (Erbe Elektromedizin GmbH, Tubingen, Alemania), bisturí armónico Ultracision (Ethicon Endo-Surgery, Cincinnati, EE.UU.), aguja diatérmica, pinzas de manipulación de tejidos, soporte de la aguja, la sonda de aspiración, aguja de inyección, clip aplicador) del adenoma será diseccionado por medio de una escisión de la pared rectal en bloque de espesor completo hasta que la grasa perirrectal. Después de la operación, los pacientes quedan con un catéter urinario que se retira en el primer día del postoperatorio. Los pacientes son admitidos en el hospital, de acuerdo con la práctica actual. Fig. N° 118. TEM. 244 Fig. N° 119. Transanal Minimally Invasive Surgery. (TAMIS) La resección endoscópica de la mucosa se lleva a cabo como se describe por Karita 457 y Hurlstone 458. A discreción del endoscopista, sedación consciente se utiliza con 2,5-10 mg de midazolam y/o 25-100 g de fentanilo. Un endoscopio (gastroscopio o sigmoidoscopio) se inserta en el recto y el aire de insuflación a través del endoscopio proporcionará distensión adecuada del recto. La submucosa debajo de la lesión se inyecta a través de un catéter de inyección endoscópica con una solución de salina al 0,9%, 1 mL de azul de metileno, y 1: 10.000 unidades de adrenalina con el fin de levantar el adenoma (sin límite de volumen superior). Cada parte del adenoma será resecado de manera gradual hasta que toda la lesión es macroscópicamente eliminada y la submucosa se visualiza de color azul. Los vasos submucosos visibles serán tratados por los clips endoscópicos o electro-coagulación para evitar la posibilidad de sangrado. De aquí en adelante, los bordes del defecto de la mucosa y los restos potenciales dentro del cráter resección siempre serán tratados con APC (Argon Plasma Coagulation) para disminuir la posibilidad de recidiva. Si el sangrado durante el procedimiento de aspiración y lavado llega al 100%de visión de la lesión, el procedimiento de EMR se continuó después de 1 día hasta que se resecó todo el tejido adenomatoso. En caso de pérdida de sangre estimada en más de 100 mL o si se sospecha de probable perforación, los pacientes son admitidos en el hospital para observación; de lo contrario, son dados de alta después del procedimiento de conformidad con la práctica actual. 245 Fig.N° 120. Las primeras dos de la izquierda con Equipo Fujinon Fice (cedidas por Dr. Lorenzo. Inst. Oulton Cba. Arg. La tercera Lesion enorme de Recto en el momento de la inyección submucosa para su posterior Mucosectomia (EMR) con equipo Olympus Exera II NBI, de la Unidad Digestiva Baistrocchi,Cba. Arg. Nuestra opinión al respecto coincide plenamente con los Equipos de trabajo de Holanda; tradicionalmente, las lesiones colorrectales adenomatosas que no podían ser resecadas endoscópicamente fueron referidas para cirugía. Los abordajes quirúrgicos convencionales como la cirugía radical y operaciones transesfinterianas o trans-sacras hoy han sido sustituidos por el TEM, ya que este procedimiento tiene mayor eficacia y menor morbilidad.459,460 Sin embargo, no hay ninguna mejora en la calidad de vida usando TEM, cuando se compara con la cirugía radical convencional 461. En los últimos años se han desarrollado terapias endoscópicas como resultado de lo cual grandes adenomas rectales más a menudo son tratados endoscópicamente, a expensas de TEM. En una serie de casos, la resección endoscópica de adenomas colorrectales grandes han tenido la recurrencia de tasas que fueron comparables a TEM (2,0% vs 3,6% respectivamente), y las tasas de complicaciones fueron más bajas (4,4% vs 10,7%). 462,463,464,465,466,467 Además, EMR puede ser realizado de forma segura sin sedación, o sólo con sedación consciente, y generalmente no se requiere el ingreso hospitalario en contraposición a TEM. La reducción de la morbilidad, la reducción de la hospitalización y la anestesia asociados con EMR son beneficiosos tanto de los pacientes y como de los Servicios Sociales. Sin embargo, la práctica clínica actual en relación con el tratamiento de grandes adenomas rectales depende principalmente de la experiencia con TEM o EMR en varios hospitales y en el juicio clínico del médico involucrado en lugar de trabajo. Aunque la literatura sugiere que TEM y EMR son técnicas equivalentes relativas a la eficacia y que 246 aparece en relación con la morbilidad EMR más favorable, una comparación formal de costo-efectividad y costo-utilidad nunca se ha realizado y no hay estudios en curso que comparen estas dos técnicas. Insisto personalmente como Autor que todo dependerá de la disponibilidad de los Sistemas y el entrenamiento adquirido para el desarrollo de ambas, pero como opinan los Holandeses creo que en Argentina se inclina la balanza hacia la EMR debido a que la difusión de los sistemas endoscópicos flexibles, su mejoramiento en cuanto a visión y contextura, la posibilidad Hospitalaria o individual de adquirirlos es más viable y sus resultados como verán es lo mismo. USO DE ENDOCLIPS EN GRANDES RESECCIONES DE POLIPOS. El uso de los Endoclips está indicado cuando se tienen dudas de haber sobrepasado la submucosa en las grandes resecciones submucosas como las descriptas, en las hemorragias post-polipectomías, o hemorragias de otro tipo como Divertículos, Angiodisplasias, o como solución de las perforaciones del colon en el trascurso de algún procedimiento. 468,469,470 En 1975, dos grupos japoneses desarrollaron un método por el cual el despliegue de un clip de metal hemostático a través de un endoscopio flexible para el propósito de la hemostasia 471,472. Los primeros clips eran engorrosos y difíciles de usar, complicado por las fallas en el disparo que eran frecuentes, y dificultades técnicas en la colocación del clip durante la endoscopia. Sin embargo, su uso se extendió rápidamente a través de Japón inicialmente y luego en Europa. Más recientemente esta tecnología con mejores sistemas de aplicación y más seguros han sido aceptados en todo el mundo. Las más recientes modelos de endoclips son una mejora con respecto a los modelos anteriores. Están disponibles en varios tamaños y algunos se pueden girar o reabrieron al ser desplegados a través del endoscopio .Dos compañías producen endoclips desechables para uso en el mercado de los Estados Unidos, y que están al alcance en nuestro País • Olympus® EE.UU., Corp. produce la QuickClip 2, que es un dispositivo de pinza giratoria .Estos dispositivos se fabrican en dos tamaños, de 8 mm o 247 12 mm de ancho cuando se abre y 165 cm a 230 cm de longitud, lo que permite el despliegue a través de un colonoscopio. • Boston Scientific Inc. produce el the Resolution Clip (videoclip Resolución), que no se puede girar, pero puede ser reabierto después del cierre si se requiere reposicionamiento. El videoclip Resolución tiene un diámetro de apertura de 11 mm y está disponible en longitudes de 165 cm y 235 cm. En nuestra Unidad de Aparato Digestivo no hemos usado nunca estos sistemas de clips, si en cambio en el Servicio de Gastroenterología y Endoscopia del Dr. Manuel Lorenzo en el Instituto Oulton de la Ciudad de Córdoba, con quien trabajáramos en nuestros primeros trabajos de Magnificación y Cromoscopía con equipos Fujinon®. En contados casos cuando el lecho de la Mucosectomía fue mayor de 3 a 4 cm. Y en dos casos más de hemostasia post polipectomía. Fig.N° 121. Colocación de Endoclips en grandes lechos post Mucosectomía (2) (Fotos Dr. M. Lorenzo. Inst. Oulton. Córdoba) Fig. N° 122. Colocación de Endoloop previo a la resección de Pólipos de tallo grueso, y una vez colocado. (Fotos Dr. M.Lorenzo. Inst. Oulton. Córdoba) DIFICULTADES TECNICAS EN LAS POLIPECTOMIAS Muchas veces lo que se muestra en los Trabajos referidos a resecciones de Pólipos, sea por enlace, con Hot Bipsy o Pinza de Williams, Mucosectomía, uso del Argon 248 Plasma, etc. No considera algunas situaciones de dificultad, como posición del aparato, posición del paciente, muchas veces hay que rotarlo para que la lesión se nos presente de manera más cómoda para el enlace o marcación. Un artículo publicado por Douglas B. Nelson, MD, del Minneapolis Veterans Affairs Medical Center, Minneapolis, Minnesota; Associate Professor of Medicine, University of Minnesota, Minneapolis, en Octubre del 2004 473 el Dr. Douglas opina sobre la Polipectomías difíciles. Se pregunta que es un Pólipo difícil, un Centro por el conocido presento su experiencia de pacientes que fueron derivados para cirugía por un Pólipo que creyeron difícil de extirpar por vía endoscópica 474, otro grupo con similares dificultades reportó que la polipectomía endoscópica tuvo un éxito de un 74%, otro centro presento similares éxitos en la resección, enviando a cirugía un menor número de pacientes475. Aunque en reuniones profesionales dice el Dr. Douglas Nelson, siempre es impresionante ver a un experto demostrar su técnica de eliminación de lesiones extremadamente difíciles, sugiere esto que cada endoscopista ¿debe tratar de eliminar todo pólipo? Este es probablemente el mensaje equivocado. Los pólipos grandes son, de hecho, asociados con una mayor tasa de complicaciones. Algunos pólipos requerirán la extirpación quirúrgica, pero el mejor indicador de si un determinado endoscopista debe intentar la eliminación es el grado de experiencia y nivel de comodidad de que endoscopista lo realiza. Sin embargo, no se debe asumir que porque se supera el propio nivel de capacidad, que esto exige necesariamente la cirugía; en tales casos, el endoscopista debe estar dispuesto a consultar con un colega más experimentado o considerar remitir al paciente a otro centro. Otro médico consideró quizás que nunca un pólipo pediculado fue demasiado grande como para respetar (aunque la resección fragmentaria de la cabeza del pólipo puede ayudar a veces a desplazar el lazo alrededor del tallo) En general y pese a las nuevas técnicas descriptas de Mucosectomía, y de Disección de la Submucosa, siguen habiendo parámetros para respetar en este tipo de resecciones, debido al alto índice de complicaciones perforativas y de sangrado que ocurren con ellas: 1- Los Pólipos que abarcan lateralmente más de un tercio de la circunferencia en el colon (podría ser considerado el Recto) 2- Los que se extienden en dos haustras sucesivas 3- Los que por su apariencia (Pit IV y V de Kudo , o 0II a + IIc de la 249 Clasificación de París) irregularidad, friabilidad, dureza y sangrado. 4- Pólipos que se extienden en el apéndice, un Divertículo o la válvula ileocecal. Fig. N° 123. Puede observarse un Pólipo Adenomatoso (Pit III L de Kudo)(II-c de París) dentro de un Divertículo. Olympus Exera II NBI. (la foto de la derecha con NBI muestra las características Adenomatosas del Pólipo)(Foto personales) Fig.N° 124.Un error frecuente es pellizcar parte de mucosa sana redundante dentro del ansa de polipectomía, como muestra la foto de la izquierda, se debe retirar y reenlazar al Pólipo en este caso Sésil. Fotos personales con Olympus Exera II NBI. Siempre es cómodo llevar al Pólipo a la posición de hora 6 hs, cambiando la posición del paciente, o la rotación del colonoscopio, la visión si no es clara puede llevar al atrapamiento de un pliegue con la consiguiente complicación perforativa. Es más fácil realizar la Polipectomía durante la retirada del colonoscopio, esto hizo que numerosos Trabajos ya relatados dieran como tiempo de retirada ideal para la detección de los Pólipos de 6 a 9 minutos. En la resección es lo mismo es preferible superarlo y luego enlazarlo en la retirada. Siempre es conveniente la inyección submucosa salina que recomiendo personalmente así se tratara de un Pólipo pediculado, ayudado siempre por la Cromoscopía ya sea electrónica o la del Índigo Carmín que nos marca los límites de la sección en la base que muchas veces se extiende más allá de los 250 observado por el sistema de luz clara y que si no se lo reseca es causa segura de recidiva local. Fig. N° 125. En las resecciones de Pólipos ya sea Sésiles o Pediculados, la causa más frecuente es dejar lesiones que no son vistas en la Polipectomía. En la foto de la izquierda tres (3) Pólipos de aspecto Aserrados cercanos al lecho de la Polipectomía realizada. Y en la foto de la derecha una lesión sésil de aspecto Hiperplásica en el tallo del Pólipo pediculado que se dejará luego de la sección. En los Pólipos de mayor tamaño existe mayor riesgo de sangrado las estadísticas van de 2% al 24%,476477 por lo que el endoscopista debe estar familiarizado con las técnicas de detención del sangrado. Cuando es el tallo el que sangra se puede intentar el reemplazo del mismo, aplicar cauterio nuevamente, nosotros lo hemos hecho con la pinza de Williams cerrada o con el Argon Plasma sin mayores consecuencias. En otras ocasiones está indicada la colocación de clips como ya describiera en el Servicio del Dr. Lorenzo o de bandas en lo cual no tenemos experiencia. En otras ocasiones está indicada la inyección de Epinefrina con una dilución de 1:10.000, la que tampoco hemos utilizado en más de 10.000 polipectomías a lo largo de todos estos años. 251 Fig. N° 126. Se muestra secuencialmente una Polipectomía de enlace donde la sección de la base del Pólipo sangra por su arteria central después de la sección, y se procede a reenlazar la misma produciéndole coagulación y cese del sangrado. Los trabajos multicéntricos actuales recomiendan que el sitio de la polipectomía de Pólipos sésiles >20 mm deben ser reevaluados entre 3 y 6 meses. 478,479 dada la tendencia a la recidiva, el uso del Argon Plasma cambio hoy esta perspectiva de recidiva como en el cuadro que mostré anteriormente. Aunque algunos pólipos requerirán la extirpación quirúrgica, la mayoría pueden ser removidos por un endoscopista experimentado. La familiaridad con las técnicas de hemostasia endoscópica es un requisito importante para intentar la remoción de las lesiones de gran tamaño. Como se acumula experiencia y las instalaciones Hospitalarias y Sanatoriales disponen instrumentación para desarrollar técnicas de polipectomía avanzadas, el endoscopista puede intentar resecar progresivamente lesiones más difíciles. 252 Fig. 127. Se aprecia en la primera imagen una lesión plana, de 5x7cm con centro ligeramente deprimido II-a + II-c i Pit III L de Kudo. Se procede a la inyección submucosa en primer lugar, luego co enlace se realiza Piecmeal, y una vez terminada la Mucosectomia se Coagula con Argon Plasma Coagulation sus bordes y base. Algoritmo de vigilancia después de haber resecado un adenoma 253 El seguimiento post polipectomía no estuvo claro en sus primeros momentos. Numerosas guías fueron publicadas en todo el mundo, pero he querido presentar en este relato una de las más actuales la cual tiene varios parámetros de seguimiento y mucha utilidad. Estas guías de seguimiento post-polipectomía fueron introducidas en EEUU en el año 1997, modificadas en el 2003 y actualmente en el 2006 usadas por el consenso de Sociedades reunidas por la American CAncer Society Task Force for colorectal cAncer and the American Cáncer Society Updated the Guidelines further. 480 Elementos de riesgos tomados para la estratificación y el seguimiento: Estos fueron tomados basados en los conocimientos generales de que los adenomas avanzados de colon y recto desencadenan inexorablemente en un cáncer colorrectal, compromisos basados en tamaño (+ de 1 cm.), número, histología (velloso o con alto grado de displasia). Multiplicidad: Se considera que el hallazgo de más de 3 adenomas en un paciente incrementa el riesgo de posibilidades de adquirir o incorporar un cáncer con un cálculo de posibilidades OR en 2,25. 481 Tamaño Es generalmente aceptado que a mayor tamaño mayor posibilidades de inclusión carcinomatosa salvando las excepciones como el adenoma plano y pequeñas lesiones con depresión central que ya los hemos descrito. El grupo VA Cooperative study482 encontraron que el seguimiento de los pólipos iguales o mayores a 1 cm., al cabo de 5 años tenian neoplasias avanzadas en un porcentaje del 2,6%, comparadas con los que presentaban pólipos menores de 1 cm. en donde la invasión carcinomatosa solo fue del 0,5%. Saitoh, Waxman y col. por primera vez en los EEUU (2001) donde los adenomas planos y pólipos hiperplásicos eran considerados de escasísimo potencial de malignidad, muestran que estos en determinados casos podrían incluir un cáncer. Investigan la 254 prevalencia de estas lesiones planas y deprimidas puestas en relieve con la tinción del índigo carmín. 483 Este grupo estudiando una población numerosa encuentran un 22 % de individuos con estas pequeñas lesiones, recomendando a todos los colonoscopistas de EEUU que deberían usar esta tinción para descubrir lesiones pre-tumorales. Fig. N° 128. Lesiones planas con severa atipia (inclusión carcinomatosa) CONTROL Y VIGILANCIA DESPUES DE UNA POLIPECTOMIA COLO-RECTAL. ACTUALIZACIÓN DE CONCENSO POR EL GRUPO DE TRABAJO MULTI SOCIEDADES DE LOS ESTADOS UNIDOS REFERIDAS AL CANCER COLORECTAL Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. December 14, 2012. Professor of Medicine, Chief of Gastroenterology, Eastern Virginia Medical School, Norfolk, Virginia. 484 Nuevas Guías sobre Vigilancia Post polipectomía Recto Colónica Las nuevas guías del Grupo de Trabajo Multi-Sociedad (MSTF) sobre el Cáncer Colorrectal (Colegio Americano de Gastroenterología, la Asociación Americana de Gastroenterología y la Sociedad Americana de Endoscopia Gastrointestinal),los intervalos de vigilancia post polipectomía después de la colonoscopia han sido recientemente actualizada de las recomendaciones del 2006. Nuevos aspectos de riesgo han surgido desde las guías del 2006, incluyendo el riesgo de cáncer colorrectal (CRC) proximal, sus intervalos, y la importancia de la detección de pólipos aserrados como su papel en la carcinogénesis del colon. Un principio clave de las guías 2006 fueron la estratificación del riesgo de los pacientes sobre la base de los hallazgos en la colonoscopia basal. El esquema de vigilancia 255 identificó 2 principales grupos de riesgo sobre la base de la probabilidad de desarrollar neoplasia avanzada durante la vigilancia: • adenoma de bajo riesgo (LRA), definida como 1-2 adenomas tubulares de medición <10 mm • adenoma de alto riesgo (HRA), definido como el adenoma velloso con su histología, la displasia de alto grado (DAG), tamaño ≥ 10 mm, 3 o más adenomas. Nuevos intervalos de vigilancia El cambio clave en la guía 2012 es la recomendación de que los intervalos de vigilancia deben basarse en los resultados, no sólo desde la más reciente colonoscopia del paciente, sino también de una colonoscopia previa que identificó neoplasia. En consecuencia, los pacientes que tenían hallazgos del LRA (Low-risk adenoma) en la colonoscopia primaria, y luego no tenían adenomas posteriores detectados en la primera exploración de vigilancia a los 5 años, posteriormente se deben devolver a la población de selección de riesgo promedio y se someten al siguiente examen de vigilancia a los 10 años. Sin embargo, los pacientes que tenían hallazgos HRA (High-risk adenoma) en la colonoscopia basal y luego no tenían adenomas posteriores detectados en un primer examen de vigilancia debe continuar la vigilancia colonoscópica a intervalos de 5 años. Pólipos Aserrados: El segundo cambio importante en las guías 2012 aborda la importancia de los pólipos aserrados. Algunos 20% -30% de los CRCs puede surgir a través de una vía molecular caracterizada por hipermetilación de genes, conocidos como CpG fenotipo methylator (CIMP). Se cree que los precursores de esta forma de CRC proviene de este tipo de pólipos aserrados. La importancia de la detección y eliminación de adenomas aserrados ha recibido amplia atención, dado que hasta el 50% son de inestabilidad microsatelital, y estos tumores CIMP-positivos están sobrerrepresentados en los cánceres de intervalo, en particular en el colon proximal. Los tumores en esta vía tienen una alta frecuencia de mutación BRAF y la inactivación de genes supresores de tumores múltiples. Esta vía se asocia principalmente con el colon derecho y CRC pobremente diferenciado. Además, los cánceres relacionados con la lesión-aserrados pueden evidenciar la 256 inactivación de k-ras y un silenciamiento de los genes de reparación del ADN, MGMT. Esta alteración se asocia particularmente con CRC distal. La guía recomienda que los pacientes con un pequeño pólipo sésil dentado (<10 mm) sin displasia deben tener un control colonoscópico en 5 años. Los pacientes con un pólipo sésil dentado ≥ 10 mm, un pólipo aserrado sésil con displasia (de cualquier tamaño), o un adenoma aserrado tradicional (de cualquier tamaño) deben someterse a una colonoscopia en 3 años. El Síndrome de poliposis aserrada debe ser seguido a 1 año, aunque los exámenes posteriores que identifican una prevalencia de pólipos hay disminuido, pueden ser seguidos por intervalos ampliados. ¿Cuándo se debe dejar de vigilancia? La vigilancia y detección deben suspenderse en tanto y en cuanto el riesgo pese más que los beneficios de la detección. Los EE.UU. Preventive Services Task Force (USPSTF) determinó que el cribado no se debe continuar después de la edad de 85 años, ya que el riesgo podría superar los beneficios potenciales. El MSTF no estableció un límite de edad absoluta sino más bien recomienda que la decisión de continuar la vigilancia deba ser individualizada sobre la base de una evaluación de los beneficios, riesgos y condiciones de comorbilidad. Esto sería particularmente importante si el paciente nunca tuvo una colonoscopia índice. Se desprende de las evaluaciones de la base de datos que el cumplimiento con las pautas de detección / vigilancia colonoscópica es subóptima y refleja tanto el uso excesivo y la infrautilización. 485 La colonoscopia estará sujeta a un mayor escrutinio por parte de los sistemas de seguros. El cumplimiento de las guías es uno de los factores utilizados en la definición de “Calidad en la Colonoscopia”. En consecuencia, los médicos deben ser plenamente conscientes de estas nuevas recomendaciones. Aunque los intervalos de vigilancia después de la resección de las lesiones serradas se basaron en pruebas de baja calidad, la MSTF espera hacer modificaciones a las Guías, según corresponda, cuando se presentan nuevos datos. 257 PARTE 6: LA VIDEOCOLONOSCOPIA EN EL CONTROL DE LOS PACIENTES QUE RECIBIERON RADIOTERAPIA PREOPERATORIA EN EL CÁNCER DE RECTO Introducción De acuerdo al resultado de numerosos ensayos clínicos, los pacientes con cáncer de recto localmente avanzado, manejados solo con cirugía incluyendo el concepto actual de cirugía curativa han mostrado tasa de recidiva local o loco regional entre 25 y 50%. 486 La recidiva local del cáncer de recto es a menudo catastrófica, difícil de curar, y los síntomas asociados son muy debilitantes para el paciente. En consecuencia, la prevención debe ser uno de los principales objetivos del tratamiento a elegir. En el meta-análisis publicado en Lancet de 2001, se estudiaron 8507 pacientes en 22 ensayos randomizados comparando cirugía sola vs radioterapia preoperatoria más cirugía (6350 pacientes en 14 ensayos) y cirugía sola vs cirugía más radioterapia postoperatoria (2157 pacientes en 8 ensayos). Los resultados demuestran que la radioterapia adyuvante pre o postoperatoria con dosis biológicas equivalentes iguales o mayores de 30 Gy, disminuye el riesgo de recidiva local y muerte por causa específica. La reducción proporcional de muertes por cáncer rectal no difiere significativamente en relación a la edad o el estadio clínico. Aunque se observó mayor efecto de la radioterapia en la sobrevida en pacientes con estadio Duke C y menores de 55 años, todos los grupos se beneficiaron con el tratamiento adyuvante. 487,488 Radio quimioterapia Preoperatoria El interés que plantea esta modalidad de tratamiento en pacientes con tumores resecables, localmente avanzados (estadificación endoscópica, ecográfica y radiológica) está justificado en beneficios comprobados en ensayos clínicos relacionados con disminución de tamaño tumoral y estadio (Down Staging), mejor aceptación del 258 tratamiento, menor toxicidad y mayor sobrevida comparado a radio quimioterapia postoperatoria. La disminución del tamaño tumoral patológico (pT) y ganglios metastásicos (pN) es significativa porque se traduce en 8 a 30% de respuesta completa tumoral. 489 El ensayo clínico multicéntrico mas importante por número de pacientes y diseño fue realizado en Alemania y se conoce por sus siglas CAO/ARO/AIO 94. Se randomizaron 823 pacientes provenientes de 26 hospitales en dos ramas: radio quimioterapia preoperatoria versus radio quimioterapia postoperatoria. La técnica quirúrgica estándar realizada en todos los pacientes fue la resección mesorrectal total. El objetivo principal del estudio fue sobrevida global y el objetivo secundario incluye: sobrevida libre de enfermedad, recidiva local y a distancia, complicaciones postoperatorias, toxicidad aguda y tardía y preservación de esfínter. Los resultados a 5 años mostraron similar tasa actuarial de sobrevida global (p=0.8) y sobrevida libre de enfermedad (p=0.32) con los dos esquemas de tratamiento. Sin embargo y de importancia clave fue la tasa de recidiva local en el grupo de radioquimioterapia preoperatorio del 6%, menos de la mitad que en el grupo de radioquimioterapia postoperatoria que fue del 13% (p=0.0006). A 11 años de seguimiento se confirman los resultados; no diferencia en SVG y en SLE, y una disminución de la tasa de recidiva local con radioquimioterapia preoperatoria 7,1% (p= 0.048). 490 Radioquimioterapia preoperatoria presenta menor tasa de toxicidades agudas y crónica y mayor aceptación del tratamiento, comparada con radioquimioterapia postoperatoria. Este estudio con un adecuado poder estadístico, provee evidencias convincentes de la superioridad de radioquimioterapia preoperatoria sobre postoperatoria en pacientes con cáncer de recto estadio II o III. Debido a que la Quimioradioterapia demostró sobradamente que esta provocaba la disminución del volumen tumoral y hasta en algunos pacientes lograr la reducción total del tumor, comenzaron a aparecer trabajos que espectaban a estos pacientes para observar si la respuesta a la Radioterapia había sido completa o esta era incompleta y el paciente necesitaba de algunas de las técnicas resectivas, sean de excéresis total del órgano con su mesorrecto o en algunos casos solo la resección local. 259 Es en estos casos es que La Videocolonoscopia y la coloración con Índigo Carmín primero y ahora con la Cromoscopía Electrónica como el NBI de Olympus® y el FICE de Fujinon® tuvieron una importancia clave para detectar recidivas de estas lesiones y poder biopsiar en su control. Este fue el punto de inflexión sobre el cual giró el tratamiento con esta modalidad, del Cáncer del Recto logrando en algunos casos su destrucción completa. El primer trabajo que circuló en el mundo fue realizado por el Grupo del Hospital Das Clicas de San Pablo con la Dra. Angelita Habr Gamma a la cabeza que publican en el año 1998 un trabajo Titulado Cáncer Rectal Bajo, el impacto de la Radio y Quimioterapia en el Tratamiento Quirúrgico. 491 Teóricamente, la reducción del tamaño tumoral inducida por la radioterapia preoperatoria debería mejorar la preservación del esfínter anal en aquellos pacientes con tumores de localización baja. Diversos estudios fase II y III se han realizado sobre este tema, sin lograr un impacto estadísticamente significativo en sus resultados. De esta manera, la radioquimioterapia preoperatoria no debería ser propuesta para lograr en forma segura mayores tasas de resecciones anteriores bajas con preservación del esfínter. Al paciente se debería advertir que el efecto probado de Radioquimioterapia preoperatorio es disminución de recidivas locales y aumento de sobrevida. Teniendo en cuenta esta diversidad de conceptos que hasta incluyen algún tipo de confusión en las opiniones médicas, Bujko y col dirigieron una revisión sistemática de 10 estudios randomizados, donde se incluyeron un total de 4596 pacientes. El objetivo principal de éste meta-análisis fue evaluar la tasa de preservación de esfínter después de Radioquimioterapia en tumores de recto bajo. La hipótesis en la cual se basa la indicación de Radioquimioterapia preoperatoria para este fin, es la disminución del tamaño tumoral y el consecuente aumento de la distancia entre el esfínter y el polo inferior del tumor. Los resultados de estos autores muestran que la reducción tumoral o la respuesta clínica completa no se expresa en mayores tasas estadísticamente significativas de resecciones anteriores bajas, en ninguno de los estudio.492 Excepto el ensayo alemán CAO/ARO/AIO 94 en el cual se observó 20% de beneficio en la tasa de resecciones anteriores en la rama de radioquimioterapia preoperatoria.493 La crítica que Bujko hace a este ensayo es que la preservación de esfínter no fue el objetivo primario del CAO/ARO/AIO 94 y el análisis en relación a la preservación de esfínter se hizo en un subgrupo del ensayo randomizado. En ese subgrupo se compararon pacientes con 260 distintas distancias tumorales en la rama de radioquimioterapia y control, por lo tanto los resultados tienen sesgo estadístico. Finalmente la radioquimioterapia preoperatoria ha probado beneficios en control local y sobrevida. Pero de acuerdo al meta-análisis de Bujko, no se debería esperar obtener resultados óptimos en preservación de esfínter en tumores rectales muy bajos. El trabajo del grupo de San Pablo comenzó con un grupo de pacientes publicados por la Dra. Angelita Habr-Gama y Dr Pedro Santino del Dto de Gastroenterologia y Radioterapi del Hospital Das Clinicas de San Pablo 494 118 pacientes con cáncer de recto bajo, entre los años 1991-1996, habían desarrollado tumores rectales potencialmente resecables dentro de 3-7 cm del margen anal. Las terapia consistió en: 5040 c Gy (6 semanas), Leucovorina concurrente (20 mg / m2 / día) con dosis en bolo de 5fluorouracilo IV: 425 mg / m2 / día. Inicio el día 1 de los pacientes RT recibieron un ciclo de 3 días (3 días), y otro ciclo últimos tres días de RT. La sobrevida y causas de muerte de este trabajo fueron las siguientes: En el momento de la presentación 100 (84,7%) pacientes estaban vivos, y 90 (77,5%) de estos estaban libres de la enfermedad, pero 10 (8,6%) tenían enfermedad metastásica o recidiva local. Hubo 10 muertes relacionadas con el cáncer (8,6%) y 6 pacientes (5,1%) que murieron por otras causas .Entre los sobrevivientes, 61 (52,5%) no tienen diversión fecal. 495 La Dra. Gamma en el año 2007 nos invita a participar en lo que Las Sociedades de Cirugía y Coloproctología de Brasil y otras Latinoamericanas y su propia Institución habían fundado el FICARE, (Fórum Internacional do Cáncer de Recto), en el que tuvimos el honor de participar. En ese evento la Dra. Presento lo que seria los nuevos conceptos de que la Radioterapia en los Tumores del Recto en dosis manejables ya sea para los T4 y T3 más conflictivos y en los que ya los Servicios del mundo venían realizando inclusive con quimioterapia asociada en dosis sensibilizante o no pero como conducta sin la cual no se intervenía un Cáncer de Recto sin esperar antes un tiempo prudencial que se estableció en un mínimo 6 semanas, pues como ya explicaba anteriormente esto lograba la reducción volumétrica del tumor la destrucción de sus ganglios periféricos. Intervalos mayores a 8 semanas se asocia a un aumento de la tasa de respuesta patológica 261 completa, pCR (17% al 35%) , mayor pCR tiene una implicancia significativa a 5 años, en conceptos de SVG, SVLE y menor tasa de metástasis a distancia. 496 Avances en alta tecnológica de Radioterapia, permiten realizar técnicas de radioterapia de intensidad modulada IMRT guiada por imágenes IGRT, con Aceleradores lineales Novalis TX, con colimadores multiláminas y sistema de Exatrac como los utilizados en el Instituto de Radioterapia Oncológica– Fundación Marie Curie. Técnicas de IMRT – IGRT permiten diferentes gradientes de dosis, escalación de dosis a nivel tumoral, permitiendo reducir su tamaño y se podía ahora si lograr por lo menos un Downstanding y una máxima protección en los órganos a riesgos OARs. Bajos estos conceptos de nuevos sistemas y nuevas conductas el equipo de San Pablo propuso una modalidad Terapéutica para este proceso denominado “The Watch & Wait Rationale”. Que consistía en un plan de Neoadyuvancia al paciente portador del Cáncer de Recto sobre todo medio y bajo, 8 semanas de espera. Este paciente a las 8 semanas era endoscopiado (una Videocolonoscopia, rutina de TAC y RNM, antígenos CEA y CA 19.9) y se valoraba la respuesta. Si los signos de los estudios daban que no había reducción del tumor o los valores volumétricos de la TAC o la RMN, y sobre todo la Videocolonoscopia había encontrado signos de ulceras de bordes, lesiones sésiles elevadas que podrían biopsiarse, con una respuesta positiva para Adenocarcinoma, este paciente era sometido a la cirugía de acuerdo a la altura del mismo. Si por el contrario la respuesta para la Dra. era completa, o sea signos negativos para la Videocolonoscopia y Biopsia, lesiones planas ulcerada sin bordes elevados o la desaparición completa de la lesión con solo una zona de fibrosis que podía incluso colorearse con Índigo Carmín (Cromoscopía) como propusimos la escuela Argentina, tomar la muestra con mayor sensibilidad en la dirección que debía hacerse, esta daba negativa para neoplasia y las imágenes de TAC y RMN no mostraban ganglios periféricos, este enfermo seguía en situación de espera lo que ella llamaba Mirar y Esperar. Pero si en algunas de las imágenes Resonantes aparecían ganglios periféricos sospechosos este enfermo también iba a cirugía. El próximo control se realizaba en uno a dos meses, retomando el protocolo ya descripto de control. Si en cambio este paciente en las imágenes presentaba sospechas de pequeños ganglios, se le realizaban nuevas biopsias o le que la Dra Angelita denominaba escarectomía, para mayor seguridad. Si todo era negativo el próximo control 262 era al año que con el protocolo negativo se lo daba de alta denominando a esta situación “Respuesta Completa” Figura 129. En nuestra Unidad de Aparato Digestivo Trabajando en conjunto con la Dra. Silvia Zunino especialista en Radioterapia Oncológica, de reconocida relevancia Internacional, fundadora del Instituto de Radioterapia Oncológica – Fundación Marie Curie- , al que nuestra Unidad pertenece comenzó a aceptar estos conceptos emitidos no solo por el grupo de FICARE sino que ya habían otros trabajos circulando referidos a Respuesta completa de la Neoadyuvancia preoperatoria que comentaremos más adelante, donde la Videocolonoscopia de control cobra una relevancia importantísima. Esta modalidad de tratamiento en pacientes con tumores resecables, localmente avanzados está justificada en beneficios comprobados en ensayos clínicos relacionados con disminución del tamaño tumoral y estadio (“Down Staging”). Mejor aceptación del tratatamiento, menor toxicidad y mayor sobrevida comparado a radioquimio post-operatoria.497 263 RADIOQUIMIOTERAPIA PREOPERATORIA Y PRESERVACIÓN DE ESFINTER. La reducción del tamaño tumoral inducida por la radioterapia preoperatoria debería mejorar bajo estos conceptos la preservación del esfínter anal en aquellos pac. con tumores de localización baja. Los estudios fase II y III no han logrado impacto estadísticamente significativo en sus resultados, el único estudio randomizado fase III CAO/ARO/AIO 94 (en la rama experimental), mostró mayor tasa de preservación de esfínter. La radioquimioterapia preoperatoria ha probado beneficios en control local y sobrevida.498 ESQUEMA DE RADIOQUIMIOTERAPIA PREOPERATORIA CONCOMITANTE Instituto de Radioterapia Oncológica -Fundación Marie CurieCórdoba, Argentina NUESTRO PROCEDER: Simulación Virtual en Tomógrafo Institucional Somaton Spirit Power Siemens Delimitación de Volúmenes en el planificador Brain lab iplannet Según: International Commission on Radiation Units and Measurements (ICRU Report Nº 83) • GTV (Gross Tumor Volume) Tumor estricto • CTV (Clinical Target Volume) • CTV1 expansión de GTV 8 mm • CTV2 subsitios ganglionares • PTV (Planning Target Volume): extensión de 5 mm para los CTVs • Plan de Radioterapia: volúmenes, dosis y fraccionamiento • IMRT-IGRT: 25 fracciones (5 semanas) • GTV: SIB al volumen tumoral: • Dosis diaria: 2.28 Gy Dosis Total: 57 Gy (dosis equivalente 64 Gy) 264 • CTV: regiones ganglionares (presacro, mesorecto, laterales e inferior) según la localización del tumor. • Dosis diaria: 2 Gy Dosis total 50 Gy • Qumioterapia Concomitante • Capecitabine 1600 mg/m2 por 14 días consecutivos por 2 ciclos con intervalo de 7 días (Instituto de Radioterapia – Fundación Marie Curie- . Córdoba, Argentina) Fig. N° 130. Acelerador Lineal Novalis TX (Colimador multiláminas, Sistema Exatrac Gaiting Respiratorio) Radioterapia de Intensidad Modulada con boost simultáneo integrado, guiada por imágenes IMRT SIB- IGRT. Fig.º º 131. NIMRT-IGRT. Corte axial: 95% del volumen tumoral GTV recibe 57 Gy. Dosis Equivalente a 64 Gy. 265 Fig. Nº 132. NIMRT- IGRT. Corte Sagital Fig. Nº 133. Reconstrucción Tridimensional. Planificación IMRT- IGRT: 7 incidencias de haces no coplanares con energía de 6 MV de fotones QUE HACER ANTE LA RESPUESTA COMPLETA Para la Dra. Angelita Habr-Gamma, se entiende por respuesta CLINICA completa al tratamiento neoadyuvante preoperatorio en el “cáncer de recto”: Ausencia de Síntomas (Pujo, Tenesmo, Mucorrea, Proctorragia), Hallazgos negativos al examen clínico, digital y endoscópico. Biopsia negativa. Ecografía Endorectal (desaparición de masa tumoral).TAC completa de Tórax, Abdomen y Pelvis, negativa. (PET-CT). CEA (-) 266 Fig. N° 134. Paciente con lesión tumoral Adenocarcinomatosa en el tercio inferior del Recto, que fue sometido a Quimioradioterapia según el Esquema enunciado y su control entre 6 y 8 semanas. El Ejemplo muestra la Respuesta endoscópica completa de la lesión que prácticamente ha desaparecido. Fig.N° 135. La Videocolonoscopia y la Cromoscopía con Índigo Carmín, nos ayudó sobremanera para distinguir los bordes de la lesión tumoral primero, y Post-Radioterapia, los bordes , límites, y características del fondo ulceroso, orientando el lugar de la toma Biopsia. 267 QUE HACER ANTE LA RESPUESTA INCOMPLETA: Persistencia Macroscópica o Microscópica de lesión residual, en cualquiera de las fases de Estudio!!! Fig.N° 136. Paciente que recibió la Neoadyuvancia del Protocolo habitual pero que tanto los estudios de imágenes como endoscópicos con biopsia positiva nos llevó a realizar una Cirugía con anastomosis ultrabaja. 268 Fig. Nº 137. Histopatología de radioterapia preoperatoria de adenocarcinoma de recto. Se observa detritus tisulares, necrosis fibrinoide vascular (flecha negra) y células neoplásicas epiteliales viables (flecha blanca), que forman glándulas. Coloración de H&E, 25X (Prof. Dr. Luis Spitale.) PROTOCOLO DE CONTROL; TIEMPOS DE OBSERVACIÓN POST- RADIOTERAPIA: El primer control se realiza entre la 6ª. Y 8ª. Semana de concluida la Radioterapia, estableciendo un Protocolo que consta de Tacto rectal, Videoendoscopia, TAC de Tórax y abdomen y Pelvis, CEA y si fuera posible PET-CT. Luego cada 4 a 8 semanas el primer año. Los años subsiguientes a partir del segundo un control del Protocolo cada 12 semanas, y así hasta el 5° año en que se lo da por curado. Ante la positividad de alguno de los parámetros de control: Escarectomía, Resección Local, Resección baja , Amputación AP, op. de Hartman, son las posibilidades sin dudarlo de estos enfermos. El primer trabajo que leímos de la Dra. Abr-Gama y su equipo fue “Low Rectal Cancer, Impact of Radiation and Chemotherapy on Surgical Treatment”, publicado en un Diseases of the Colon and Rectum del año 1998. 499 269 Nuestra Experiencia; sobre un total de 150 casos vistos y estudiados de tumores alojados en el Recto tercio medio e inferior del año 2009 al 2015 todos con Neoadyuvancia, el mismo protocolo de control tenemos 14 enfermos vivos con respuesta completa, (9,33%) controlados a la fecha el 50% (7 casos) superaron los 5 años de riguroso control, el resto está bajo protocolo llevando promedio tres años de control, y los últimos entre 12 y 24 semanas. Tuvimos que realizar resecciones locales (Tratamiento local del Cáncer de Recto) ante la duda de la Biopsia obtenida, la imagen endoscópica, pese a que las imágenes Tomográficas, Resonantes como Ecografía Endorrectal eran negativas, hicimos Escarectomía en uno siendo negativa, y resección completa de pared en el otro, comportándose como un T1, que está vivo y sin enfermedad hasta la fecha, lleva ya tres años. En un tercer paciente la imagen ulcerosa de la Videoendoscopia era muy evidente, la Biopsia era negativa, las imágenes Tomográficas eran solo de fibrosis como así la Resonante, la lesión estaba casi sobre la línea del Pecten, la edad del paciente era de 35 años. Todo nos movilizó a realizar una operación de Miles, por razones de seguridad o pensando que podría haber células tumorales incluidas en la fibrosis, no había ganglios periféricos. Cual fue la sorpresa que la pieza operatoria estaba libre de enfermedad sin ganglios en el mesorrecto. Los controles tomográficos y resonantes de su abdomen y Pelvis ya habían dado negativos, no había tumor en ese paciente. Es este otro dilema al que nos enfrentamos en este tipo de conducta pero que nos lleva a razonar que debería haber otro tipo de marcadores que nos ayuden a decidir a tomar esta conducta. 270 Fig. N° 138. Paciente al cual se le realizo Amputación abdómino-perineal de Miles siendo su Anatomía Patológica negativa. Fig. Nº 139. Paciente que se le realiza “Escarectomia” ante la duda, y la respuesta negativa de la Anatomía Patológica. 271 Figura 140. Microfotografía de adenocarcinoma de recto irradiado. Se observa exudado, detritus celulares y necrosis fibrinoide de los vasos. (flecha). Coloración de H&E, 25 X y 40 X (Prof. Dr. Luis Spitale) Los controles Endoscópicos de estos pacientes irradiados cobró tal importancia que dependiendo de ello y de los estudios complementarios en varios Trabajos de todo el mundo cifraron la expectativa en la obtención de la muestra o de la Escarectomía para poder comprobar si estábamos o no ante una respuesta completa. Tan es así que el Grupo que dio el inicio a esta conducta Terapéutica el del Hospital San pablo de Brasil con la Dra. Gama a la cabeza, publican reciente mente un Trabajo titulado, Utilidad de la biopsia endoscópica en pacientes con cáncer de recto con respuesta incompleta al tratamiento neoadyuvante. Es suficiente para descartar tumor viable? 500 El objetivo de este trabajo fue estudiar la utilidad de las Biopsias endoscópicas en los tumores de Recto bajo que sufrieron una disminución significativa del tamaño luego de la Neoadyuvancia para predecir la presencia de tumor viable. Realizaron la revisión retrospectiva de los pacientes sometidos a este procedimiento en el Instituto Angelita & Joaquim Gama desde 1991 a 2010. De 173 pacientes sometidos a Neoadyuvancia 113 presentaron respuesta incompleta, 39 de los cuales tuvieron una disminución significativa (>30% del tamaño tumoral). Se realizaron 53 biopsias. De los 39 pacientes 25 tuvieron biopsias positivas y 14 negativas. Solo 3 biopsias negativas tuvieron remisión tumoral completa en la patología final. (VPN del 21%).Si se consideran todas las biopsias realizadas solo 3 de 28 (VPN del 11%) fueron verdaderos negativos. Los Autores 272 concluyen que en los pacientes con cáncer de recto bajo sometidos al protocolo de quimioradioterapia neoadyuvante y que presentan una significativa reducción tumoral, las biopsias endoscópicas luego del tratamiento son de limitada utilidad. Una biopsia negativa no descarta la presencia de tumor viable. Y es esta una pregunta que nos hacemos a permanencia ante lo que observamos en nuestros pacientes como respuesta completa. “Debemos utilizar el Enfoque "esperar y ver" para los pacientes con cáncer rectal?” es la opinión del Albert B. Lowenfels, MD. Professor, Department of Surgery, New York Medical College; Emeritus Attending, Westchester Medical Center, Valhalla, New York. El Profesor Albert Lowenfels, opina sobre un artículo publicado hace poco en el Br J Surg. del 2012, Valoración crítica del Enfoque "esperar y ver" en el cáncer rectal para casos clínicos de respuesta completa después Quimiorradiación. El artículo es publicado por Glynne-Jones R, Hughes del Reino Unido 501 ¿Se puede evitar la cirugía en pacientes con cáncer de recto que tienen una remisión clínica evidente después de la quimiorradioterapia? Los autores revisaron cuidadosamente los informes disponibles sobre este tema, pero a causa de las diferencias en el diseño del estudio, no fueron capaces de realizar un metanálisis formal. De los más de 980 informes publicados, 30 fueron incluidos en este estudio, de los cuales 18 procedían de América del Sur. En algunos de los estudios de América del Sur, la supervivencia a los 5 años después de la quimiorradioterapia fue tan alta como 100%. En 289 pacientes de otros centros, el fracaso locorregional ocurrió en 34% de los pacientes. En una serie de 92 pacientes reportados en los últimos 2 años, el fracaso local se produjo en el 29% de los pacientes con cáncer rectal después de la quimiorradioterapia. Opina el Dr. Lowenfels que desde su punto de vista el problema serio en todos los estudios fue que es difícil de definir una respuesta clínica completa en ausencia de la cirugía. Por otra parte, no hubo ensayos aleatorios, por lo que el sesgo de selección podría haber influido en los resultados. Asimismo, no hay datos fiables para determinar si la cirugía de rescate es posible si el cáncer recurre después del tratamiento inicial no quirúrgico. Los pacientes y los cirujanos tienen que equilibrar la morbilidad y la mortalidad de la cirugía y la posibilidad de una colostomía contra el resultado esperado si la cirugía se pospone. Esta revisión crítica hace hincapié en la necesidad obvia de datos adicionales para complementar los estudios de observación existentes. 273 En un trabajo publicado por el Department of Anatomical Pathology, Liverpool Hospital, University of Western Sydney, Liverpool BC, New South Wales, Australia, titulado Predictive Markers of Radiotherapy-Induced Rectal Cancer Regression-cuyos Autores J-S Shin; T-G Tut; V Ho; C S Lee, deciden ahondar un poco en los motivos de la regresion celular o la fibrosis inducida por la Radioterapia o por el propio tumor. 502 Dicen los Autores que la radioterapia preoperatoria se utiliza a menudo en el tratamiento curativo del cáncer de recto, pero el grado variable de regresión del tumor histológico visto en el intestino resecado y su influencia en el control local de la enfermedad y la supervivencia global posiblemente, exige un uso juicioso de este tratamiento . Sin embargo, los marcadores clínicamente aplicables que son predictivos de la regresión del cáncer rectal sigue siendo difícil. Esta opinión tendrá como objetivo detallar la comprensión actual de las interacciones moleculares en la respuesta de las células tumorales a la radiación y la lesión en la patogénesis del cáncer de recto, que pueden servir como objetivos para la evaluación predictiva. Regresión Histológica del Grado de Tumor. Lo anterior se reconoce implícitamente por el American Joint Committee on Cancer sobre las recomendaciónes del grado histológico, al grado de pérdida de células tumorales en el intestino posteriormente resecado. 503 Se graduó en 4 el "grado de regresión del tumor (TRG) ', que van desde" 0 "para respuesta completa sin células tumorales residuales y '4' con mínima o ninguna evidencia de la desaparición del tumor, que sigue en la misma línea que otros varios sistemas de clasificación publicados. 504,505 Estos tienen varios nombres, entre ellos el "TRG" original, un sistema de clasificación de 5 niveles descrito inicialmente en los cánceres de esófago por Mandard et al. y posteriormente adaptado para neoplasias rectales. 506 Pero el término TRG también se utiliza libremente en referencia a un número de otros criterios de clasificación en la literatura. La posibilidad de confusión tanto para los patólogos y los médicos es aún mayor por el hecho de que algunos de estos criterios de manera desigual asignan ya sea progresivamente o regresión en tumores en donde retrocedió el grado histológico.507 A pesar de la premisa de medir el volumen residual relativo en el tumor, y las áreas de la fibrosis libre de tumor dentro de la lesión parece simple, no siempre es así. 508 La 274 distinción histológica entre la fibrosis inducida por un tumor invasivo frente a la la regresión inducida por la radioterapia no siempre es clara. Además, hay inconsistencias en el volumen del tumor macroscópico muestreado para la evaluación histológica entre los patólogos e instituciones y en el tiempo transcurrido entre el final de la radioterapia y la cirugía posterior. Si se acorta este período, ya sea por razones logísticas tales como operativo Sistemas y/o disponibilidad del cirujano o, tal vez, como parte del protocolo del tratamiento, entonces puede ser insuficiente para la regresión tumoral. Se ha demostrado que como se esperaba, la regresión del tumor fue mayor cuando se evaluó a las 4-6 semanas versus 1 semana siguiente de la quimioradioterapia para el cáncer rectal localmente avanzado. 509 Marcadores predictivos de la sensibilidad celular a la Radioterapia. Existe un grupo de proteínas modificadas que demuestran el valor clínico de estas como predictores de respuesta a la radioterapia, pero esto sigue siendo difícil de interpretar. Por ejemplo, la expresión ausente o reducida del complejo MRE11, que es el sensor de daño del ADN que inicia la señalización corriente abajo en DDR, en teoría debería reflejar radiosensibilidad elevada. Esto se ha observado previamente en los estudios de células, donde fibroblastos de la piel al truncar la mutación en el gen MRE11 eran inusualmente sensibles a la radiación.510 Sin embargo, más de una década después de este hallazgo, la aplicabilidad clínica de MRE11, especialmente en el cáncer rectal que ha sido sometido a radioterapia, sigue siendo algo no demostrado. Los pocos estudios recientes que exploran al MRE11 como marcador predictivo han examinado, que este se encuentra en otros tumores invasivos, como en el músculo de la vejiga y de mama, donde se observó la tendencia inversa inesperada de relación reducida en la tinción inmunohistoquímica MRE11 (IHC) con peor respuesta a la radioterapia. 511 Conclusión El tratamiento del cáncer rectal con frecuencia utiliza la radioterapia preoperatoria para la regresión del tumor (downstaging), con éxito variable entre los individuos. Se carece de una evaluación predictiva para la estratificación del paciente actualmente. Esto a pesar de lo que se ha detallado de las vías moleculares implicadas en la capacidad de las células tumorales para superar la lesión por radiación y los posibles 275 marcadores que se han destacado en el proceso. Mientras que los estudios de células de base han mostrado una correlación entre un número de tales factores y radiosensibilidad, estos hallazgos deben aún replicarse de manera convincente en cohortes clínicas de los cánceres rectales. Aunque su estado de MSI es prometedor en este sentido, y también tentador porque ya tiene un valor comprobado en el pronóstico y se puede evaluar de manera rutinaria, el mensaje no ha podido mostrar una fuerte relación con la respuesta del tumor morfológica en los cánceres rectales tratados. Sin embargo, se están realizando esfuerzos para agrupar grandes bancos de tejidos y bancos de datos para caracterizar la respuesta de la radioterapia en los tejidos normales y tumorales, 512 por no hablar de muchos investigadores que siguen y se centran en la evaluación predictiva de los cánceres rectales y otros. Esto último dicen los autores 513 debe enfatizar en la traducción del cuerpo actual de los datos experimentales para los estudios clínicos, en los que su aplicabilidad en el manejo del paciente puede ser probada. Pero si consideramos que la Dra Angelita Abr Gama y su equipo publicaron en el 2013 un trabajo que nos hace opinar que si estamos cerca de manejar al Cáncer de Recto distal como el Cáncer de Ano? 514 El propósito de este estudio fue demostrar los resultados a largo plazo de los pacientes que tuvieron una respuesta clínica completa después de un régimen de quimioradioterapia alternativo y fueron manejados sin cirugía. Se estudiaron Setenta pacientes consecutivos con cáncer de recto distal T2-4N0-2M0. Se realizó Quimioradioterapia neoadyuvante que incluyó 54 Gy y 5-fluorouracilo / leucovorina realizado en 6 ciclos cada 21 días. Los pacientes se evaluaron para la respuesta tumoral a las 10 semanas desde la finalización de la radiación. Los pacientes con respuesta clínica incompleta fueron remitidos a cirugía inmediatamente. Los pacientes con respuesta clínica completa no se operaron inmediatamente y fueron monitoreados. Los principales aspectos a medir en este trabajo : Los resultados primarios medidos fueron las tasas iniciales de respuesta clínica completa después de 10 semanas y las tasas de respuesta clínica completa controladas después de 12 meses a partir de la quimioradioterapia. RESULTADOS: Un paciente murió durante la quimioradioterapia debido a complicaciones cardíacas. Cuarenta y siete (68%) pacientes tuvieron una respuesta clínica completa inicial. De ellos, 8 desarrollaron recidiva local dentro de los primeros 12 meses 276 de seguimiento (17%). Treinta y nueve tuvieron respuesta clínica completa con una mediana de seguimiento de 56 meses (57%). 4 pacientes adicionales (10%) desarrollaron recidivas locales tardías (> 12 meses de seguimiento). En total, 35 pacientes nunca fueron sometidos a cirugía (50%). CONCLUSIÓN: La extensión de quimioradioterapia con ciclos de quimioterapia adicionales y 54 Gy de radiación puede resultar en más del 50% de los controlados (> 12 meses) tasas de respuesta clínica completa que puede en última instancia, evitar la resección radical del recto. Los fracasos locales ocurren con más frecuencia durante los primeros 12 meses de seguimiento en hasta el 17% de los casos, mientras que las recurrencias tardías son menos comunes pero aún posibles, llevando a 50% los pacientes que nunca requirieron cirugía. El estricto seguimiento puede permitir el tratamiento de rescate en la mayoría de estos pacientes. Creo personalmente que es esta una nueva modalidad de tratamiento que sigue todos los parámetros que siguió la medicina en general desde sus comienzos, “primero no hacer daño” que en este caso sería disminuir en lo posible la morbilidad de las conductas en el tratamiento del Cáncer de Recto. En el cáncer de Recto distal cuando la opción terapéutica es cirugía de Miles, se debería intentar en primer lugar radioquimioterapia concomitante neoadyuvante, con técnicas avanzadas de radioterapia de IMRT-IGRT a dosis mayores de 50 Gy Y en esto la mejor visión de lo que ocurre en ese Recto tratado es la imagen y sus cambios en tamaño y aspecto, la Videocolonoscopia y Cromoscopía han tenido junto con los otros medios de valoración un papel más que fundamental. Fig. N° 141. En la primera imagen de la izquierda enfermo que recibió la dosis del Protocolo de Radioquimioterapia, con pequeña escara de la que se tomó biopsia siendo esta negativa para células carcinomatosas. La imagen del medio otro paciente que recibió la misma dosis del mismo esquema, todos vistos con Sistema Olympus Exera II, y en la derecha la visión con NBI (Narrow Band) en donde se observa la desaparición completa de la lesión tumoral en el Recto medio, y el patrón vascular de la acción actínica. 277 PARTE 7 LA VIDEOCOLONOSCOPIA EN EL MEGACOLON Y DESCOMPRESION DEL VOLVULO COLÓNICO. Las causas de la Oclusión colónica son esencialmente FUNCIONALES y/o MECANICAS. La primera que debemos señalar es el Síndrome de Ogilvie, provocados por causas ajenas a la compresión del órgano que ya describiremos. Y las mecánicas donde veremos las obstrucciones que le caben al órgano en si por procesos generados en su propia pared, intraluminales y compresivos extracolónicos. Ante la Obstrucción aguda del Colon cabe recordar dos o tres premisas básicas que todo cirujano debe considerar antes de establecer una táctica y una conducta. Primero; elección de la Táctica y técnicas correctas, en base a su propia experiencia y a la adquirida en la bibliografía internacional como presentaciones más frecuentes. Segundo; la valoración correcta del paciente y de sus riesgos. Para esto son medidas las palabras del Dr. Jorge Latif de la Clínica Modelo de Lanús, provincia de Buenos Aires: “La aplicación de una táctica depende de diversos factores, que para el caso de la resolución quirúrgica de la Obstrucción Colónica podemos agruparlos en aquellos referidos al paciente, al cirujano, y a la Institución donde se realiza la Cirugía”. A veces es preciso realizar cirugías mínimas descompresivas, ante la posibilidad de riesgos mayores por no contar con personal entrenado, ayudantes, residentes de la especialidad, instrumental, etc. Es por eso que siempre me refiero en estos casos agudos al estado general del enfermo para poder considerar que es, lo menos agresivo. La esencia entonces de la evaluación fisiológica preoperatoria, es determinar cuáles pacientes pueden desarrollar una sobrevida razonable con la cirugía, y si el paciente habrá de soportar el procedimiento quirúrgico indicado. Se debe juzgar con objetividad entonces para distinguir lo que es técnicamente posible, de lo que es funcionalmente adecuado. 278 Para este tipo de evaluaciones hay que tener muy presente las escalas de Zubrod y Karnofsky que nos pueden dar un panorama más adecuado de la situación clínica del paciente. Etiologías de la obstrucción del Colon FUNCIONALES Pseudo-obstrucción aguda del colon. Es esta una entidad clínica caracterizada por la dilatación masiva del colon, por lo general del ciego, colon ascendente y transverso, sin poder reconocer una obstrucción mecánica distal.515,516,517 Este cuadro fue originalmente descripto por Murphy en 1896 al que llamó íleo espástico. En 1948 Ogilvie 518 establece las bases fisiológicas de este cuadro clínico en dos de sus pacientes que eran portadores de una infiltración retroperitoneal por Cáncer. A partir de esta descripción se reconoce este cuadro como Síndrome de Ogilvie. Este puede producirse a cualquier edad, pero se lo observa más frecuentemente después de los 60 años519. Cuando se presenta en las mujeres la edad promedio desciende debido que se lo ha observado asociado a procedimientos Obstétricos. El mecanismo de esta afección no está claro aún pero se sabe que está asociado a la disfunción de los nervios sacros parasimpáticos. 520 Es frecuente ver este Síndrome en pacientes ingresados graves, y asociado a patologías como trauma, fracturas, quemaduras, trasplantes renales, cirugía torácica y cardiovascular, ginecológica, obstétrica, abdominopélvica y neurocirugía. No es infrecuente también observarlo en pacientes con enfermedades no quirúrgicas como, infarto agudo de miocardio, neumonías, pancreatitis y diabetes. 521 Tratamiento El tratamiento inicial es conservador, descompresión nasogástrica, sonda rectal, corrección de medio interno, y tener precaución de que el paciente no esté tomando medicamentos que disminuyan la motilidad intestinal. La conducta adecuada debe ser tomada con celeridad si los parámetros como el diámetro del Ciego en una Radiografía directa de abdomen superan los 9 a 12 cm. En este caso para muchos autores la 279 descompresión con “Colonoscópica” arribando a las proximidades del colon derecho, les ha dado muy buen resultado.522 En realidad este procedimiento fue descripto por Kokura y Dent 523, en 1977, pese a sus ventajas posee inconvenientes como la presencia de materia fecal que impide una buena aspiración. Algunos Autores dejan a través de este método una sonda de descompresión a permanencia 524. Este tratamiento tiene probabilidades de éxito para algunos Autores entre el 70% y el 90%, con un índice de recidiva de un 10% al 39%. 525 Si este procedimiento no es efectivo se debe realizar una Colostomía o una Colostomía transversa a la brevedad. MECANICAS: Clasificación de las causas mecánicas de obstrucción del Colon en el adulto. • Obstrucciones intraluminales: Impactación fecal, Litos, Cuerpos Extraños. • Obstrucciones murales: Neoplasias, Endometriosis. • Inflamatorias: Enfermedad Diverticular del colon, Enfermedad de Crohn, Colitis Ulcerativa. Megacolon Tóxico. Tuberculosis. Schistosomiasis. Linfogranuloma Venéreo. • Congénitas: Hirschsprung del adulto. Colitis isquémicas. Intususcepción intestinal colónica. Colitis actínica. • Estricturas anastomóticas. • Obstrucciones extramurales: Adherencias. Vólvulos. Tumores extracolónicos. • Inflamatorios: Abscesos • Hernias internas y externas. Oclusión colónica por Vólvulo del Colon Sigmoides. Es indudable que la complicación más temida del Megacolon cualquiera sea su etiología es la oclusión por Volvulación del mismo en el Sigmoides, sitio ideal para esta patología por la complacencia del meso sigma y la dilatación enorme, acompañada muchas veces de Fecalomas del Sigmoides. Antes del Siglo XX los tratamientos que se usaban para la descompresión del Vólvulo eran basados en supositorios, enemas, insuflación, tubos rectales, no teniendo lugar aún el tratamiento quirúrgico. 526 A partir de 280 Bruusgaard en 1947, múltiples publicaciones proponen la “devolvulación endoscópica” como primer tratamiento. Debemos tener la precaución que este procedimiento está contraindicado si hay signos de Peritonitis, perforación intestinal o indicios endoscópicos de isquemia de la mucosa. Según el Prof. Dr. Hugo Amarillo, MAAC Prof. Tit de Cirugía. Fac de Medicina Universidad Nacional de Tucumán y Miembro Correspondiente Nacional de la Academia Argentina de Cirugía, el Vólvulo es la complicación más importante del megacolon adquirido del adulto y se lo define como: "la torsión del asa sigmoidea dilatada sobre su meso, con obstrucción parcial o total del tránsito intestinal, pudiendo existir o no, compromiso de su vascularización”. El vólvulo del sigmoides, como complicación del megacolon congénito, es raro siendo en cambio muy frecuente en el megacolon adquirido del adulto enfermedad que se ve en vastas regiones de nuestro país. Continúa diciendo el Dr. Amarillo uno de los Cirujanos de Argentina que más experiencia tiene en esta patología; que reconocemos tres formas clínicas de vólvulo sigmoideo: a) VóIvulo agudo. A éste, a su vez, lo subdividimos en dos tipos según el grado de compromiso vascular: 1) Con compromiso vascular precoz (Vólvulo con shock) y 2) Con compromiso vascular tardío (Vólvulo subagudo), b) Vólvulo crónico. c) Vólvulo recurrente. Dentro de las etapas diagnósticas de esta patología, clínicas por los antecedentes y la historia natural del desarrollo de la enfermedad evolucionada en el tiempo que el paciente relata, no debe omitirse el Tacto Rectal, la Radiografía directa de abdomen y contrastada con sus signos clásicos; en la placa simple de abdomen se pueden describir los siguientes signos: a) Lo que primero llama la atención es la gran disensión gaseosa del asa volvulada, que por sí sola es capaz de ocupar casi la totalidad de la cavidad abdominal. Esta claridad radiológica es el signo de Hintz. b) Desaparición de las haustraciones del sigmoides y en su reemplazo el contorno intestinal es liso y curvilíneo, como trazado por un compás o tiralíneas (Signo del tiralíneas Ferreira). 281 c) La presencia de dos segmentos de asa paralelos, de la misma longitud y características, constituyen el signo de Arias-Bellini, para el vólvulo sigmoideo, d) En el centro del asa distendida se observa una imagen opaca de la cual parten tres o cuatro ramas semejantes a las aspas de un molino. Este signo se conoce con este nombre de Frihman-Dahl-Uriburu. En posición de pie se destacan niveles líquidos intraintestinales y a veces una marcada elevación del hemidiafragma izquierdo. La radiografía contrastada sirve para diferenciarlo de otros tipos de oclusión colónica. La capacidad del rectosigma está disminuida, lo que se demuestra por intolerancia al enema baritada; la columna de bario al llegar al pie del vólvulo dibuja imágenes típicas que han sido comparadas a una llama de vela, cabeza de ofidio por Puyó Víllafañe, o pico de ave por Mondor. Hoy la ecografía abdominal, la tomografía computada, y la resonancia magnética han venido a completar el arsenal diagnóstico de esta patología. La “videocolonoscopia” completa este arsenal con los cuidados necesarios de reconocer un cuadro que no sea peritoneal (peritonitis) y el color del asa al superar el Recto no tenga signos de necrosis o isquemia, en estos casos debe suspenderse inmediatamente el estudio por los riesgos de perforación. El tratamiento médico-endoscópico es el primero que debe intentarse en estos casos de Vólvulos por ser este inocuo, se lo realiza con anestesia y sedación como ya relatara en el capítulo de Preparación y Anestesia, cosa que realizamos en toda Videocolonoscopia. Y sigue teniendo vigencia las palabras experimentadas del Dr. Amarillo cuando se refiere a la endoscopia hoy de tremendo valor en la Videocolonoscopia, el Tratamiento médico o endoscópico: También conocido como método de Bruusgaard, por ser este autor quién lo difundió. 527 El procedimiento consiste en llegar al sitio de torsión con un recto-sigmoidoscopio y visualizar el remolino del vólvulo. Esto se observa entre los 15 cm y los 25 cm. Llegado allí, deberá verse si existen signos de sufrimiento del asa sigmoides. La presencia de líquido sanguinolento, la visualización de mucosa negruzca o la existencia de placas de necrosis contraindican el método obligando a suspender el examen y operar de inmediato, como ya lo he relatado. Si se consigue vencer la obstrucción, comienza a salir mediante la aspiración, gran 282 cantidad de gases y materias fecales líquidas, produciendo un alivio instantáneo al enfermo. Decía el Dr. Amarillo, se extrae el rectosigmoidoscopio dejando la sonda en su lugar, fijada al muslo o nalga con tela adhesiva o con un punto, el tiempo necesario para que a su través se realice la limpieza mecánica del colon y a la vez sirva de vástago al sigmoides para que no se volvule; de este modo se evita la recidiva temprana. En nuestro caso y adaptando las palabras del Dr. lo hemos realizado el número de veces que fuera necesario siempre más de una vez pese al escaso número que tenemos de esta conducta, con sumo cuidado repitiendo las maniobras descriptas pero sin dejar ninguna sonda. Las complicaciones que se le atribuyen a este procedimiento son: Posibilidad de perforación. Posibilidad de dejar un asa necrosada en la cavidad abdominal y recidiva del vólvulo. Como el retardar el procedimiento quirúrgico. En la experiencia del Dr. Amarillo (Curso de Post Grado para especialistas de Coloproctología 2006) relata que se trataron 840 pacientes con oclusión intestinal, de los cuales 120 (22,5%) eran debidos a un vólvulo del sigmoides. En 12 se realizó desvolvulación endoscópica sin mortalidad. Además hay casos publicados en la literatura internacional como el de Ghazi y Shinya 528 y en la literatura Nacional como la del Dr. Claudio Barredo y cols. 529. el Dr.Heidenreich del Hospital Alemán de Buenos Aires 530, La Dra Angelita Habr Gamma de San Pablo Brazil con similares experiencia y resultados531 y la propia Tesis de Doctorado del Prof. Amarillo donde explica todo lo relatado referido a la Desvolvulación Endoscópica del Vólvulo por megacolon a través de un Endoscopio. 532 El Dr. Jorge Latif en su publicación sobre el algoritmo en los Vólvulos agudos del Colon 533 dice lo siguiente, luego del interrogatorio debemos descartar a través de la clínica y Radiología un Neumoperitoneo o Peritonitis. Descartado este diagnóstico se puede realizar una Colonofibroscopia o Videocolonoscopia e intentar una Devolvulación mediante este sistema, si esto no es positivo, lavado colónico y Cirugía electiva. Si en la Colonoscopia hay signos de isquemia el enfermo debe ser operado de emergencia lo mismo que ante los signos de peritonitis o neumoperitoneo. El mismo algoritmo publica el Dr. Latif referido al Sindrome de Pseudo Obstrucción Colónica o Sindrome de Oglivier. Tácticas en obstrucción colónica: 1) Tratamiento médico 2) Tratamiento farmacológico 3) Tratamiento Endoscópico 4) Tratamiento Quirúrgico. Nuestros criterios son similares a los descriptos por el Dr. Latif aplicados en la Videocolonoscopia. 283 El Dr. Tyrrell, Patron Uriburu, Dr. Bugallo y colaboradores presentan en la Revista Argentina de Coloproctología del año 2000, 22 pacientes que fueron sometidos a este tipo de devolvulación con Videocoloscopio, de ellos, Pacientes c/recidivas 12 (54,5%), Pacientes sin recidivas 10 (45,5%) con un total de Tratamientos Endoscópicos 43/22. 534 En nuestra experiencia personal de la Unidad de Aparato Digestivo Baistrocchi solo vimos en 15 años 38 pacientes portadores de Megacolon solo el 0,24% de todas las Videocolonoscopías. Solo logramos Desvolvular en forma repetida en tres sesiones de promedio a solo tres (7,84%) (pacientes portadores de un Megacolon Volvulado.) El método fracasó en todos, y fueron llevados a cirugía en forma electiva una vez descomprimidos. Es esta una patología que es más vista en los Consultorios de Guardia de nuestros Hospitales que son: Hospital San Roque y Hospital Córdoba de la Ciudad de Córdoba, donde no contamos con un Videocolonoscopio ni un Colonofibroscopio. MEGACOLON, Complicaciones: Fig. N° 142. La primera foto muestra el pie del Vólvulo, la introducción e insuflación del aparato, y la trasposición del mismo. 284 Fig. N° 143. Operación de Duhamel, Reseccion y Anastomosis endoanal Rectal posterior, existiendo la posibilidad también de realizarla con anastomosis mecánica posterior, como el esquema. (fotos de Cirugias personales) La modificación con sutura mecánica en un tiempo es utilizada desde hace varios años por distintos Autores en todo el mundo: Gordon (1983) Doble sutura mecánica, AbrGama en Megacolon Chagásico, sin agrandar la boca, morbilidad 6,9 %, sin dehiscencias. H.Moreira , amplia la boca con instrumento lineal cortante. Habiendo practicado numerosas técnicas, y considerando los resultados obtenidos, nuestra preferencia se ha inclinado nuevamente hacia la “RESECCION ANTERIOR”. Se reseca la bolsa megacólica realizando la anast. Descendo-rectal termino-terminal o laterolateral de acuerdo con el caso. Hacemos la anast. A nivel de la 2a. vértebra sacra, no muy alta, ni muy baja. Las bajas próximas a los elevadores aumenta considerablemente el número de complicaciones, tales como las dehiscencias y la impotencia sexual. (Prof. Dr. Roberto Garriz, Maestro de la Coloprotología Argentina.) (1989) 285 Nuestro Servicio de Cirugía del Hospital San Roque practicó durante muchos años todas las variantes de cirugías de resección y de descenso. Tuvimos el honor de contar con la presencia de figuras señeras en esta patología, como Prof. D.Cutait, Angelino Manzione, J.Reis Neto, Angelita Habr Gama, y grandes Cirujanos Argentinos. Pero debemos advertir a nuestros médicos y residentes, que ante la complicación de la enfermedad sigue siendo heroica la operación de H.Hartmann. (Prof.Dr.Julio Dante Baistrocchi, Maestro de la Cirugía Argentina. Foto inferior) (1965) El Dr. Jorge Yaya de la Prov. De Salta en el Curso de Post Grado para especialistas en Coloproctología, del año 2005, presento un Poema de Eduardo Galeano tan cierto y tan cerca de nuestra realidad referido al mal de Chagas el primer responsable del 90% de los Megacolon que vemos en la República Argentina, que me tomo el atrevimiento de colocarlo en mi relato. No estalla como las bombas, ni suena como los tiros. Como el hambre, mata callando. Como el hambre, mata a los callados: a los que viven condenados al silencio y mueren condenados al olvido. Tragedia que no suena, enfermos que no pagan, enfermedad que no vende. El mal de Chagas no es negocio que atraiga a la industria farmacéutica, ni es tema que interese a los políticos ni a los periodistas. Elige a sus víctimas en el pobrerío. Las muerde lentamente, poquito a poco, va acabando con ellas. Sus víctimas no tienen derechos, ni dinero para comprar los derechos que no tienen. Ni siquiera tienen el derecho de saber de qué mueren. “Eduardo Galeano” 286 PARTE 8 LA VIDEOCOLONOSCOPIA EN EL TRATAMIENTO DE LAS ESTENOSIS BENIGNAS Y MALIGNAS DEL RECTO-COLON. Estenosis, estructuras, y obstrucciones colorrectales. A la estenosis se la define como una estrechez patológica congénita, o accidental adquirida de un orificio o conducto, cuyo sinónimo es la estrictura. Esta puede ser Anular que significa obstrucción en forma de anillo alrededor de las paredes de un órgano, o completamente obstructiva con acumulación de materias sólidas o líquidas en el interior de un vaso o conducto. 535 CLASIFICACION Y ETIOPATOGENIA DE LAS LESIONES PARIETALES COLORECTALES. 1) Tumores: Carcinoma / Linfoma / Sarcoma 2) Enfermedades Inflamatorias: Diverticulitis / Enfermedad de Crohn / Colitis Ulcerosa. 3) Enfermedades Infecciosas, Granulomatosas: Actinomicosis, Tuberculosis, Blastomicosis y Lifogranuloma Venereo. 4) Enfermedades Parasitarias: Colitis Amebianas, Esquitosomiasis. 5) Colitis Isquémicas. 6) Atresias. 7) Estenosis Actínicas. LESIONES COLÓNICAS EXTRÍNSECAS (Como Diagnóstico Diferencial) • Tumores • Abscesos • Invaginación (Intususcepción Intestinal) 287 • Vólvulos • Adherencias • Mesenteritis retráctil. • Hernias (Inguinales, Crurales, Diafragmáticas, Internas, Paracolostómicas). • Patologías Urológicas¸ Tumores prostáticos, Dilatación vesical. • Patologías Ginecológicas: Tumores de Ovario, Grandes Miomas, Endometriosis. Cualquiera de estas causas enumeradas podría ser motivo de compresión de la luz colorrectal, procediendo a provocar en el paciente una detención del paso de líquidos y gases. En la práctica médica las estenosis post-operatorias colorrectales ocupan casi hasta el 30% de todas las anastomosis postoperatorias y son las que más estamos acostumbrados a ver en la práctica diaria. 536 La fisiopatología y las causas para el desarrollo de estas estenosis todavía no están bien esclarecidas, se sospecha de isquemia del tejido suturado, inflamación o infección local, dehiscencia de la anastomosis, técnica de la sutura y radioterapia han sido todas involucradas en este fenómeno que termina reduciendo la luz del paso estercoral. En general si estas estricturas o reducción de las anastomosis son muy bajas, simplemente con dilataciones manuales al alcance del dedo se hacen en forma progresiva y a veces es innecesaria la sedación. En otras de mayor fibrosis hemos usado dilatadores de tipo rígidos como los que circulan en el comercio similares al mandril de un rectoscopio, por lo general se consigue buen calibre. Entre los tratamientos para estas anastomosis que no están al alcance de la mano se han usado endoscópicamente balones hidrostáticos asociados a laser o Argón Plasma, dilatadores del tipo Savary-Guillard, incisiones sobre la misma con cualquiera de los coaguladores usados de rutina en las resecciones de Pólipos, y en las de mayor longitud o grosor se han usado prótesis autoexpandibles que las mostraremos en el uso de la retransitación por obstrucción del Cáncer Rectal. Desde hace muchos años comenzamos a usar las primeras sondas de balón dilatador que con el tiempo se fueron perfeccionando, algunas eran insufladas con aire, otras con agua, lo cierto que hasta que aparecieron en el mercado las sondas para 288 Achalasia, nos dimos cuenta que estas también podrían ser usadas en aquella estenosis debida las suturas mecánicas que hasta que se aprendió a usar el calibre correcto, tuvimos un sin número de estricturas colorrectales que debíamos dilatar. A partir de esta publicación en 1996 del Department of Surgery, Karolinska Institutet, Danderyd Hospital, Sweden, publicado por Claes Johanson nos animamos a comenzar a dilatar esta Estenosis con balones de mayor calibre. 537 Fig. N° 145. Figura 144: Pasaron los años y cuando aparecieron en el mercado las sondas dilatadoras transcanulares, comenzamos a usar estos balones; “Balones Quantum TTC” de WilsonCook con excelentes resultados. En algunas ocasiones y de acuerdo al calibre de la estenosis comenzábamos primero usando el Quantum QD-18X8, para luego usar el Rigiflex de mayor resistencia (Microvasive Inc.) Ya en una segunda o tercera dilatación nos quedábamos con este balón insuflable que tiene medidas de 35x12, que es con el que nos quedamos y en la actualidad se consiguen en el mercado. Figura 145: 289 Fig.N° 146. Se muestra en la Rx a doble contraste estrictura por anastomosis mecánica. La visión endoscópica puntiforme con agrafes coronando la lesión. Luego la introducción de la Guía y el Balón, se consigue una dilatación aceptable, y su control todo bajo visión endoscópica. En el año 2013 La Sociedad Americana de Gastroenterología y Endoscopia Digestiva publicó un artículo referido a las Herramientas (Balones y dilatadores) que se aconsejaban a usar en todas las estricturas del tubo digestivo.538 Para promover el uso adecuado de nuevas o emergentes tecnologías endoscópicas y aquellas tecnologías que pueden tener un impacto en la práctica endoscópica, la ASGE, Comité de Tecnología, presenta información relevante para la práctica de los médicos en forma de reseñas de tecnología. Se usa para esto la metodología basada en la evidencia a través de MEDLINE se realizó la búsqueda bibliográfica para identificar estudios sobre el tema, MAUDE (Centro de administración de Alimentos y Medicamentos de EE.UU) de búsqueda de base de datos para identificar las complicaciones reportadas de una determinada tecnología, y ambos se complementan con el acceso a los "artículos relacionados de PubMed y por búsqueda de referencias pertinentes citadas en los estudios identificados. Cuando la orientación financiera es adecuada, se publica la lista de precios y codificación provistos en el momento de la publicación. La terminología usada para esta búsqueda fue: dilatación mediante el uso de las palabras clave "dilatación endoscópica”, "Dilatadores bougie", "dilatadores de balón", 290 "estenosis esofágicas," "Estenosis anastomóticas," "estricturas por enf. inflamatoria intestinal”"," estenosis pancreáticas "," estenosis biliares ","Estenosis de colon", "acalasia," "estenosis pilórica," y " stents Autoexpandibles de metal." Para cada uno de los problemas de estenosis o estricturas se aconseja un determinado balón o dilatador con sus costos comerciales y nombres específicos. En lo referido a Colon y Recto la Sociedad Americana se expresa así; Colon: La dilatación de las estenosis benignas colorrectales de diferentes etiologías(por ejemplo, la anastomosis, estenosis inducidas por fármacos antiinflamatorios no esteroideos, diverticulitis, actínicas e inflamatorias por enfermedad del intestino) mediante el uso de dilatadores de balón o de tipo vela. Se ha demostrado ser eficaz en múltiples series. 539,540 En un ensayo prospectivo aleatorizado de 30 pacientes con síntomas de estenosis anastomóticas postoperatorias colorrectales benignas se dilataron, con un balón TTS 18-mm o un dilatador de 35-mm neumático sobre el alambre guía diseñado para la acalasia. La dilatación tuvo éxito en todos los pacientes, y no hay complicaciones relatadas, pero el grupo sobre la guía de alambre requiere menos sesiones (1,6 vs 2.6, PZ 0,009) y tenían una mayor efectividad en la duración de la respuesta (560,8 días vs 245,2 días, P Z 0.016). 541 En nuestra experiencia personal, de la Unidad de Aparato Digestivo Baistrocchi tenemos contabilizadas unas 26 Estenosis por suturas mecánicas en Recto medio y superior,(36,6% de las Estenosis Colorrectales) (0,17% de todas las Videocolonoscopías) todas fueron dilatadas en un promedio de tres a 4 sesiones con los, “Balones Quantum TTC” de Wilson-Cook con excelentes resultados. Y el otro usado por nuestra Unidad es el Quantum QD-18X8, para luego usar el Rigiflex® de mayor resistencia (Microvasive Inc.) obteniendo un calibre aceptable (Mayor a 2 cm) para el tránsito intestinal. Cabe considerar que estos pacientes cuando las estricturas son muy bajas quedan siempre con premura defecatoria y otras veces con Tenesmo que con ejercicios esfinterianos se van superando en el tiempo. Hemos tenido dos (2) complicaciones perforativas en tercio medio y tercio superior de Recto que necesitaron cirugía, ambos pacientes destransitados 291 sin opción de retránsito. Las hemorragias post dilatación todas fueron controladas y ninguna requirió algún tipo de transfusión y/o internación. El dolor fue manejado en el momento de la dilatación con la Neuroleptoanalgesia convencional de cualquier Videocolonoscopia de rutina, y en el postoperatorio con analgésicos convencionales. Ninguno requirió internación, salvo las perforaciones. Encontramos 45 estricturas infranqueables de Colon (o, 29% de todas las Videocolonoscopías) 29 correspondían a Tumores del Colon (17,36%) de los 167 Cánceres de Colon encontrados. El resto (16) (35,5% de las infranqueables) fueron enfermedades Inflamatorias (Diverticulitis, Colitis Isquémica, Enf. De Crohn, respuesta Actínica, Bridas/Adherencias ) Todas las Estenosis manejadas por nuestro equipo (80%) el resto fueron solo referidas para el diagnóstico, se les realizó a posterior de la Videocolonoscopia una Radiografía de Colon por Enema a doble contraste o una Videocolonoscopia Virtual. Solo esto fue diferido en los procesos Inflamatorios Agudos en los que se esperó un periodo de Acalmia o fueron referidos para Cirugía. TRATAMIENTO ENDOANAL CON STENT EN LA OCLUSION O ESTENOSIS COLORRECTAL SEVERA. INDICACIONES Y UTILIDADES. CONTROL VIDEOCOLONOSCOPICO. La obstrucción intestinal representa un severo problema para pacientes portadores de un cáncer colorrectal, es este un proceso que ocurre la mayoría de las veces en pacientes de edad avanzada y en mal estado general que se acompaña con un índice significativo de morbilidad y mortalidad como lo expresa el Dr. Mariano Giménez del Hospital Santojanni de Buenos Aires, 542 una de las experiencias más grandes de nuestro país y uno de los primeros en Argentina de colocar endoprótesis colorrectales. Esta patología aguda requiere de una colostomía temporaria que muchas veces debido al mal estado del paciente y lo avanzado de la edad termina siendo definitiva sin solucionar en los casos del recto, el malestar del pujo, tenesmo, mucorrea y sangramiento permanente. 292 Si se decide por un acto quirúrgico debido a las mismas circunstancias la mayoría de las veces se debe optar por un procedimiento a lo Hartman obligado por la emergencia y el mal estado del paciente, pues una anastomosis primaria está asociada a una mortalidad del 12% o más, y a una morbilidad del 39%.8,543,544 En la actualidad muchos grupos quirúrgicos se han abocado al tratamiento en un tiempo, pero también esto está asociado a un significativo riesgo de complicaciones y mortalidad. 545,546,547,548,549,550 Los Stent vienen a solucionar un espacio intermedio logrando la retransitación del paciente, esperando que este recupere su estado general, ofreciéndole así una cirugía con mejor pronóstico en forma diferida. Según el Dr. Mariano Giménez en su Conferencia de las 3ª Jornadas de Coloproctología del año 2003, las indicaciones para la colocación de estas endoprótesis serían; obstrucción intestinal (colorrectal) aguda, cáncer colorrectal, fístula coloentérica y fístula colovesical. La única contraindicación que existiría sería la constatación clínica o radiológica de perforación. El desarrollo de la tecnología en estos sistemas ha ido variando en estos años haciendo a estos stent más apropiados para su utilización, más flexibles, más blandos y más adaptables mediante guías muy delicadas a las diversas estenosis.(Fig. 148) Los más conocidos en la actualidad en el mundo entero son el Wallstent de la casa Boston Scientific, Natick, Massachusetts, USA. el de Gianturco Z stent (Wilson Cook, WinstonSalem, North Carolina, USA. En la lesiones de rectosigma los Stent pueden ser colocados con guías especiales bajo control radiológico y con apoyo endoscópico. Son autoexpandibles y su total expansión en los tumores de recto se produce en unas horas después de su colocación, logrando una retransitación alrededor de las 24 hs. de colocado.(Fig. 149) Fig. 147 Fig. 148 Fig 149 293 Figura 150: WallaStent® Colonic % Duodenal Endoprosthesis Figura 151: Colocación Endoscópica de Endoprotesis Wallstent, con control Radiológico. (fotos de Casúistica personal 294 Los resultados exitosos en la colocación de estas prótesis es alrededor del 78% al 100%. Estos procedimientos mejoran las estenosis distales que son las que se presentan con más asiduidad.551,552,553,554,555 Una de las complicaciones de estos stent es la migración. En distintos trabajos su presentación varía del 6% al 23%. Esto depende de la presión que ejerza el tumor sobre la prótesis y la calidad de fijación de la misma. La otra complicación es la perforación, que puede ocurrir en el momento de la colocación con la guía o luego de colocada por efracción del tubo intestinal. Los controles deben efectuarse, radiológicamente a las 24 hs de colocada para comprobar la expansión de la misma, y a los 15 días para comprobar su fijación. Puede realizarse un control endoscópico a los 30 días. En nuestra experiencia personal solo hemos logrado usarlo solo en dos (2) oportunidades en Recto superior, por lo que no tiene incidencia estadística y solo lo mostramos como Miscelánea, los dos pacientes no llegaron a la cirugía por tratarse de lesiones muy avanzadas. Su indicación es teóricamente para evitar un Ostoma. 295 PARTE 9 COMPLICACIONES DE LAS VIDEOCOLONOSCOPIAS Los riesgos son aceptados cuando los beneficios los superan, y las complicaciones son inaceptables si la endoscopía esta dudosamente indicada 556. Las estrategias y conductas para evitar las complicaciones son el punto de partida de toda endoscopia colónica. 1. Endoscopistas entrenados y desempeñándose en su nivel de competencia y experiencia. 2. Supervisión adecuada de endoscopistas en entrenamiento. Hoy el aprendizaje por error es inaceptable. (Formación y Práctica en Endoscopia Digestiva. Reglas. Asociación argentina de Endoscopia Digestiva. AAED.) 557 3. Los procedimientos deben ser realizados en instalaciones apropiadas, con equipos en condiciones técnicas y con controles de lavado y desinfección. Normas de Organización y funcionamiento de área de la Endoscopía Digestiva.558 4. Explicación apropiada al paciente del procedimiento que se realizará. Consentimiento informado claro y aceptado por el paciente. Esto más allá de resguardo legal, es una explicación clara de qué se realizará, sus riesgos y complicaciones posibles. Esto en la República Argentina está reglado por la AAED (Asociación Argentina de Endoscopia Digestiva) y sus formularios. (Consentimiento Informado) 559 5. Uso racional de sedación y analgesia, preferiblemente realizado por un anestesista. En nuestra Unidad Digestiva Baistrocchi, hace ya 20 años que la sedación y analgesia es dada por un Anestesista de experiencia. Esto evitó numerosos riesgos y se compartieron responsabilidades, además de dar una comodidad de trabajo. 560 Es indudable que como en todos los pasos en medicina, si tenemos las precauciones, y los recaudos necesarios, las posibilidades de complicación derivadas de esta práctica serán sensiblemente menores. 296 Podríamos definir que la complicación en la Colonoscopia diagnóstica y/o terapéutica es un cambio adverso en el curso de la enfermedad causado por la intervención del médico. 561 Las comunicaciones en nuestro País no son numerosas, algo más en el extranjero, pero todas se resumen en las que el Dr. Cattaneo presenta en su Relato Oficial del 35 Congreso Argentino de Coloproctología en su Capítulo de Complicaciones de las Colonoscopias que me he permitido ampliar 562: • Hemorragia • Perforación • Distención dolorosa y/o distención Cecal (Bowel distention) • Producidas por la colocación de Stents. • Inflamatoria, Sindrome Post- polipectomía o Sindrome de coagulación postpolipectomía. • Infecciosas por contaminación (Bacteriemia) • Desgarro mucoso. • Atrapamiento instrumental. • Complicaciones Cardiopulmonares y relacionadas con la sedación. • Complicaciones de la farmacoterapia y preparación. Con respecto a la Hemorragia que no se detiene, el endoscopista tiene una serie de maniobras y elementos que pueden hacer que esta se detenga, que muy bien enumera el Dr. Cataneo. Primero las preventivas para todo método endoscópico diagnóstico y mucho más para los terapéuticos (Polipectomías, Mucosectomías, Coagulación de patologías hemorrágicas como Angiodisplasias y Rectitis Actínicas, Dilataciones con balón, colocación de Endoprótesis, inyección de sustancias marcadoras y submucosas para exéresis) deberán seguir las siguientes precauciones: 1. En el tratamiento antiplaquetario deberá suspender el Fármaco 7 a 10 días antes. Hoy existen trabajos publicados sobre el uso del Clopidogrel (nuevo antiagregante plaquetario) 563 donde no es necesario suspenderlo previo a las Polipectomías del colon. 2. Pacientes anticoagulados con Warfarina Sódica (Ej. Coumadin® Sidus) que requieran un procedimiento de alto riesgo deberán suspender la droga 3 a 297 5 días anteriores, se deberá sustituirla por Heparina EV la cual deberá suspenderse solo 6 hs. Antes del procedimiento y reiniciarla solo después de 6 a 12 hs. Después del mismo 564,565 El uso del Endoloop y de los clips previos a la sección de los Pólipos pediculados suele ser de buena efectividad. Numerosas publicaciones avalan el método que requiere un colocador y algunos detalles de precisión. Cuando estos elementos no pueden ser colocados, y cuando las ansas no pueden tomar la lesión que a veces supera los 4 cm, aun cuando se proponga la resección en trozos (Piecemeal) se deberá ir pensando en la resección quirúrgica de la lesión por dificultades técnicas.566,567 Los hemos usado en contadas oportunidades. En cambio la inyección submucosa para la resección de las lesiones sésiles grandes y pequeñas es casi una rutina que no dejamos nunca de implementar. Fig N° 152. Inyección submucosa, colocación de endoloop, y sección del Pólipo. Imagen de sección y endoloop terminado. Fotos de casuística personal con equipo Fujinon, en Dto de Gastroenterologia Dr. Lorenzo. Inst. Oulton Cba. Fig.N° 153. Lesión plana de más de 3 cm de diámetro con colocación posterior de hasta 4 Endoclip. Foto cedida por Dr. Manuel Lorenzo Instituto Oulton Cba. 298 Fig.N° 154. Se realiza Polipectomía de lesión sésil de 1 x 1 cm, la que ha sido inyectada su submucosa previamente. La sección no coagula el vaso central del Pólipo y comienza a sangrar como se observa en el segundo cuadro. En el último de la derecha se logra reenlazar el tallo, y se procede a su coagulación. Experiencia Personal. El reenlace del tallo de un pólipo sangrante constituye una maniobra difícil, la debe realizar un endoscopista entrenado, la sangre invade rápidamente la luz del colon y es necesario el lavado y la aspiración efectiva. Esta situación es inquietante y se debe manejar la misma con mucha prudencia y tranquilidad pues una maniobra intempestiva lleva a otra complicación más importante como el desgarro y la perforación. El sangrado en la Polipectomía no es en realidad una complicación importante ya que casi siempre se detiene espontáneamente, con reposo y muy pocas veces requiere alguna transfusión o cirugía. En nuestra experiencia la hemorragia considerable ocupó el 0,02% en más de 3.000 Polipectomías realizadas a la fecha. Pese a que en el Relato Oficial de Coloproctología del año 2009 “Pólipos Colorrectales no Hereditarios” la Dra. Rita Pastore, en su excelente Encuesta Nacional referida a Complicaciones de las Polipectomías, los encuestados respondieron que la complicación más frecuente fue la Hemorragia. En las series consultadas por el Dr. Cattaneo esta complicación oscilo entre el 0,02% y el 6%. 568,569,570,571,572,573,574,575,576,577 En el Capítulo de Hemorragias Digestivas Bajas se dan las pautas a seguir en la Hemorragia Digestiva Baja post-polipectomia. Perforación Post-Polipectomía La perforación del colon es la mayor complicación para el colonoscopista y es motivo de intranquilidad desde el punto de vista terapéutico y legal. Las estadísticas 299 Internacionales oscilan entre el 0,1% al 0,8% para los procedimientos diagnósticos, y del 0,5 al 3% para los terapéuticos,578,579 porcentajes que coinciden con los presentados en el Relato del Dr. Cattaneo. La información en trabajos extranjeros es múltiple y numerosa, pero debemos destacar que en la Rep. Argentina ya hace muchos años se vienen publicando series de Trabajos referidos al tema. El Dr. Viacava R y Gianoni C. en el 23 Congreso Argentino de Gastroenterología del año 1987 comunican 282 Polipectomías colónicas el primero y 118 el segundo con porcentajes de complicaciones que van del 0,9% al 2,8%, siendo la hemorragia y la perforación las más frecuentes. Nosotros (Baistrocchi H, Baistrocchi J) en el año 1977 presentamos en el 2ª Congreso Nacional de Coloproctología del Interior realizado en Mar del Plata dos trabajos referidos al tema con porcentajes similares, aunque la hemorragia siempre fue una complicación menor para nosotros y las perforaciones para esa época ya éramos cautos con la cirugía y fueron tratadas en forma médica 580,581. El Dr. Menéndez S., en el 23 Congreso Argentino de Gastroenterología 1987, presenta 747 polipectomías con 0,7% de hemorragias y 0,36% para las perforaciones. Ya para el año 1994 el Dr. Secin F. publica en la Revista Argentina de Cirugía un caso de perforación colónica con tratamiento conservador. La Dra. Mirta Fajre publica en la Rev. De la Asociación Med. Arg. En 1995, presenta 2060 colonoscopias con un porcentaje del 0,2% de perforaciones, 5 en total con solo una resolución quirúrgica y el resto con tratamiento médico. Luego varias publicaciones más, el Dr. Landoni 582, J. Rodriguez Martín 583, J. Latif 584, Hendereich y Fisher 585, Patrón Uriburu, Amarillo y Tyrrel 586, E. Donelly 587, Pollastri E y Ruiz D 588, y muchos más se preocuparon por informar sus complicaciones en las colonoscopias. Para los encuestados de Argentina por la Dr. R. Pastore ante la complicación perforativa el 64% indica cirugía en tanto que el 36% la maneja en forma conservadora. Nuestra experiencia en la Unidad Digestiva Baistrocchi Córdoba, fue totalmente diferente, primó el tratamiento conservador con los parámetros ya expresados por el Dr. Cattaneo en su esquema, de Presunción de perforación. El Dr Cattaneo los divide con irritación peritoneal y sin irritación peritoneal, dando privilegio a la Cirugía a los pacientes con irritación peritoneal ya sea Laparoscópica o abierta. Nosotros en cambio seguimos expectando en ambas pues la irritación de la pequeña perforación da un signo de dolor importante y las maniobras de descompresión del 300 abdomen suelen ser positivas. La conducta se basa en algunos parámetros que mostramos. Hoy los métodos de control por imágenes ya sea ecográfico o tomográfico han tenido un avance increíble y se pueden controlar estas perforaciones aún con una Leucocitosis que supere los 20.000 glóbulos blancos en el conteo, además de los demás parámetros que mostramos a continuación. Sobre las ultimas 15.286 videocolonoscopias realizadas la perforación estuvo presente en el 0,13 % (21 pacientes) de los casos. El 70% (14 pacientes) recibió solo tratamiento médico y el 28,5% (6 casos) restantes cirugía. Recordemos que el mayor inconveniente para realizar el diagnóstico precoz de una perforación es el Sindrome de Coagulación Post-polipectomía causado por la penetración del cauterio en la pared de la muscular involucrando en su inflamación a la serosa en el colon. Esto ocurrió en solo tres casos y como siempre en horas de la noche donde hay que trasladar al paciente y realizarle los estudios de rutina que siempre comienzan con un Laboratorio y una placa de Tórax, y abdomen de pie y acostado. Una de las características es que nunca hicieron fiebre. Solo tuvimos 5 casos (0,04%) en las 10.490 polipectomías realizadas. En nuestros casos esto ocurrió dentro de las 24 hs de realizado el procedimiento. Solo un caso del Interior de la Provincia nos comunicó su Médico de cabecera a los 5 días del procedimiento, y solo se realizó internación y expectación armada 48 hs solo con analgésicos, tampoco hizo fiebre, lo manejamos solo telefónicamente. Las perforaciones se ubicaron en un 30% en el Colon Derecho (Ciego, Colon Ascendente y Angulo Hepático) el 70% en el Colon restante, uno en el Angulo Esplénico, el resto en la unión Recto Sigmoidea y solo uno en Recto. Se realizó Resección y Anastomosis en la mayoría de los casos y solo dos necesitaron de exteriorización por ser una contaminación peritoneal importante. El resto todos necesitaron de una Ileostomía o Colostomía. En uno solo no se encontró la lesión (recto) y evolucionó bien con solo una descarga Ileostómica. El procedimiento clínico de los pacientes que no operamos fue el siguiente: 1. Placa de Tórax y abdomen de pie y costado. 2. Tomografía axial computada de Abdomen y Pelvis solo con contraste EV, el 1º,3º y 6º día (que es el promedio de días de internación de nuestros casos) 3. Laboratorio de rutina diario, y especializado si hiciera falta. 301 4. Buena vía de canalización o Vía Central que se mantiene hasta el día de alta. 5. Medicación antibiótica asociada: • Ceftriazona (3 gr. día) • Metronidazol (1,5 gr. Día) • Aminoglucosidos (dependiendo de la función renal) 6. Analgesia: Morfina. Tratamos de evitar el uso de Nubaina. Luego de las primeras 24 hs a 48 hs se suele cambiar a Diclofenac EV. 7. Alimentación oral. Dependiendo de la evolución pero en promedio después del 3er. Día. No hubo en nuestra experiencia casos de conducta Clínica que convirtiéramos a cirugía. Además de las descriptas tuvimos Serositis (Síndrome de coagulación post polipectomía) el 0,08%, Dolor severo más distensión (Bowel distention) el 0,2%. Ruptura de pinza con atrapamiento (0,02%), Bacteriemia (E. coli) 0,04%. No hemos tenido ruptura Esplénica ni efectos adversos de la anestesia. Para el Dr. Everson Artifon ,el Dr. Paulo Sakai y Colaboradores en su excelente Texto de Tratamiento de las Complicaciones en Endoscopia Terapéutica, cuando se refieren a perforación Colónica post-polipectomía 589 después de revisar varias publicaciones relatan que la perforación durante una colonoscopia es descripta en alrededor de 0,03% al 0,2%y el riesgo de perforación con polipectomías aumenta al 0,41%. Continuan expresando que los factores de riesgo de perforación durante una colonoscopia son: poca experiencia del Endoscopista, mala calidad de la preparación intestinal, presencia de sangramiento activo, pólipos con pedículos gruesos, pólipos sésiles de base ancha, pólipos localizados en angulaciones, comorbilidad del paciente y dificultad técnica durante el examen. Fig. N° 155. Imágenes; la primera de la izquierda, Tele de Tórax que muestra aire libre subdiafragmático producto de perforación Colónica por Videocolonoscopia. Las restantes Tomografías del mismo paciente. 302 Fig. 156: la enfermedad diverticular del colon es una de las enfermedades con mayor incidencia en nuestro país y es una de las que más cuidado se debe tener al insuflar con el videocolonoscopio, pues muchas veces lejos del lugar examinado por lo general unos cm más adelante de la insuflación, pueden ocurrir accidentes como el que estamos observando (se observa la grasa epiploica a través de la perforación) ocurrido en un formato diverticular, o por el atrapamiento del aire en el Colon derecho que debido al espasmo propio de la enfermedad suele desgarrar al Ciego por la hiperpresión, como también nos ha ocurrido. Algunos autores describen que los pólipos sésiles de base ancha mayor de 2 cm son más propensos al sangramiento pero no a la perforación, la resección en trozos Piecmeal, parece disminuir la posibilidad de perforación en pólipos de base mayor de 2 cm. 590 Con respecto a la ubicación topográfica de las perforaciones, el equipo del Dr. Iqbal CW, Chun YS, Farley DR., de la División de Gastroenterología y Cirugía General de la Mayo Clinic, Rochester, Minnesota, publican una excelente review, en donde dan la topografía de las lesiones perforativas del colon. Realizan un análisis retrospectivo sobre 78.702 colonoscopias realizadas desde el año 1994 hasta el 2000, con un cálculo aproximado de 11.243 colonoscopias por año. Se realizó la evaluación clínica de todos los pacientes tratados por perforación colónica en esa Institución. Sesenta y seis pacientes de esa institución (tasa de perforación, 0,084%; 1 por cada 1.192 procedimientos) y seis pacientes de instituciones externas fueron tratados por perforación de colon tras la colonoscopia (41 mujeres, 31 hombres; edad, 30-92 años; una media de 73 años). Sesenta y dos pacientes fueron sometidos a laparotomía, mientras que 10 fueron manejados sin 303 cirugía. Los 10 pacientes manejados sin cirugía no tenían signos de irritación peritoneal en el examen físico; ocho pacientes evolucionaron bien (mediana de estancia hospitalaria, 5,5 días; rango, 0-12), pero tuvieron una muerte (la familia no autorizó la intervención quirúrgica) y se observó un absceso pélvico que requirió drenaje percutáneo. La irritación peritoneal en el examen físico fue evidente en 57 de 62 pacientes sometidos a laparotomía. Las perforaciones se ubicaron, el 31% en el colon derecho, (17% Ciego, 11% en el colon ascendente, y 3% en el ángulo hepático), 7% en el colon transverso, 61% en el colon izquierdo (4% en el descendente, 36% en el colon sigmoides, 16% en la unión rectosigmoidea y 1% en el recto) Hay un 1% de los casos que no se encontró la lesión perforativa. Treinta y ocho pacientes (61%) fueron sometidos a reparación primaria o resección con anastomosis. Se realizó derivación fecal en el 100% de los pacientes con extensa contaminación peritoneal (n = 12) y 40% de los pacientes con contaminación moderada (12 de 30). La morbilidad perioperatoria (39%) y mortalidad (8%) fueron significativas. Terminan diciendo que los factores que predicen un mal resultado incluyen retraso en el diagnóstico, extensa contaminación peritoneal y los pacientes que usaban anticoagulantes (P <0,05). En comparación con estudios anteriores del mismo equipo, la presente revisión destaca una mayor prevalencia de lesiones basado en un uso más frecuente de la colonoscopia en estos últimos años. Los porcentajes de perforación permanecen alrededor de 0,08%. Mientras que el manejo no operatorio es viable en pacientes sin peritonitis, la intervención quirúrgica oportuna parece facilitar la recuperación del paciente. 591 El grupo del Departamento de Cirugía, de la Escuela de Medicina de la Universidad de Indiana EEUU, y del Lower Keys Medical Center, Key West, Florida, Rose Chan y Don J. Selzer, publican un artículo titulado; Endocliping en las perforaciones Iatrogenicas para evitar la cirugía. 592 El estudio se llevó a cabo durante un período de 34 meses y se encuentra en un centro de referencia de nivel terciario. Se realizaron un total de 7.589 colonoscopias (5413 diagnósticas, y 2176 terapéuticas). Un total de 30 pacientes con perforaciones. Tres perforaciones ocurrieron en el grupo de la colonoscopia diagnóstica y 27 se produjeron en el grupo terapéutico. Veintiséis de las 27 perforaciones en el grupo terapéutico se produjeron durante resecciones submucosas, y 1 durante una coagulación con argón plasma. 304 Cinco de los 30 pacientes con perforaciones fueron sometidos a tratamiento quirúrgico, mientras que los restantes 25 fueron manejados sin cirugía. Veintiocho de estas perforaciones fueron reconocidas en el momento de la colonoscopia. Veintisiete de estas perforaciones reconocidas se cerraron con Endoclipping. De estos 27 pacientes, 25 (92%) fueron tratados con éxito con una combinación de endoclipping y posterior tratamiento conservador incluyendo no ingesta oral durante 1-5 días y antibióticos de amplio espectro por vía intravenosa con una cefalosporina de segunda generación. Sólo 2 de estos 27 pacientes necesitaron una exploración quirúrgica. La duración media de la hospitalización postoperatoria en pacientes sometidos a tratamiento quirúrgico inicial fue de 12,2 días. En comparación, los pacientes que se sometieron a la reparación endoluminal (Endoclipping) fue de 3,5 días. Los Autores mencionan algo muy importante a tener en cuenta, el reconocimiento de que el cierre endoclip crea aposición sólo de la mucosa y submucosa. La aposición de la muscular propia y serosa no es posible debido a que el atrapamiento del clip es solo superficial. También, el cierre es manejable sólo si el diámetro de la lesión (perforación) es más pequeña que las ramas abiertas de los endoclips (11 mm). El autor hace hincapié en la importancia de seguir el tratamiento conservador después de la reparación endoluminal. Además, subrayan que estos pacientes requieren una evaluación cuidadosa durante el periodo de observación post-procedimiento. Si los pacientes desarrollan signos de contaminación peritoneal o sepsis abdominal, se debe considerar la opción de la Cirugía. No debemos olvidar que en el arsenal de medidas en aras a solucionar una perforación colónica post colonoscopia, una vez diagnosticada, la terapéutica además de la cirugía a cielo abierto debe considerarse la opción de la Videolaparoscopia, hoy un método de uso potencialmente primario en toda opción quirúrgica. El grupo de la Universidad de Houston Texas, de la División de Cirugía Mínimamente invasiva, del Dto. De Cirugía publican en el 2013, un artículo titulado; Colorrafia Laparoscópica primaria en las perforaciones iatrogénicas por colonoscopias.593 Presentan una experiencia con colorrafia laparoscópica como modalidad quirúrgica definitiva para la solución de las perforaciones colonoscópicas. Métodos: Durante un período de 17 meses, se evaluaron los resultados de los pacientes consecutivos que presentaban perforaciones colonoscópicas agudas. Se tabularon características de los 305 pacientes y los parámetros perioperatorios. Los resultados postoperatorios fueron evaluados dentro de los 30 días después del alta. Resultados: Cinco mujeres con una edad media de 71,4 ± 9,7 años (rango: 58-83), con una media de IMC de 26,4 ± 3,4 kg / m2 (rango: 21,3-30,9), y la mediana de la puntuación ASA de 2 (rango: 2-3) presentaron perforaciones colonoscópicas agudas. Todas las perforaciones se solucionaron con éxito a través de colorrafia laparoscópica dentro de las 24 horas de producidas. Las perforaciones fueron secundarias a un traumatismo directo o lesión térmica y se localizaron en el sigmoide y en el ciego. Ninguno de los pacientes requirió resección quirúrgica, o la conversión a un procedimiento abierto. No se encontraron complicaciones intra o postoperatorias. La estancia media hospitalaria fue de 3,8 ± 0,8 días (rango: 3-5). No hubo reingresos o reintervenciones. Conclusión: Las perforaciones colonoscópicas agudas se pueden solucionar de forma segura a través de la reparación primaria laparoscópica sin necesidad de resección u ostomía. El reconocimiento y la intervención temprana son esenciales para obtener resultados exitosos. Si bien la casuística es escasa hay artículos que recopilan gran número de casos y su conducta de solución Laparoscópica. Uno muy reciente publicado por el Dto de Cirugía Mínimamente invasiva del Royal University Hospital de Londres, titulado Técnica del Endoloop Laparoscópico un nuevo enfoque para el tratamiento de la perforación iatrogénica cecal, y revisión bibliográfica. 594 Dicen los Autores Meralia N y Hussain A., que la Sociedad Mundial de Cirugía de Emergencia (WSES) 2013 en las recomendaciones para el tratamiento de la perforación colónica, sugirió que un enfoque laparoscópico precoz es un tratamiento seguro y eficaz para la perforación de colon relacionados con la colonoscopia. No existen pautas nacionales y la conducta es dictada por la condición clínica del paciente, comorbilidad, el tamaño y el lugar de la perforación, así como la escala de la preparación intestinal, y la experiencia quirúrgica. Una perforación cecal iatrogénica es rara, pero es una complicación grave asociada con morbilidad y mortalidad significativas. Tradicionalmente, se ha logrado con la laparotomía exploratoria, el cierre primario o resección intestinal. La aparición de la laparoscopia ha permitido la reparación localizada bajo visión directa con numerosos beneficios, como la reducción del dolor, disminuir la duración de la estancia hospitalaria, y más rápida recuperación post-operatoria. El riesgo de perforación del colon después de 306 la colonoscopia diagnóstica se informa cercana al 0,03%. 595 En una serie publicada recientemente de 110.785 procedimientos de diagnóstico y terapéuticos de colonoscopia (86.800 casos de diagnóstica y 23.985 casos terapéuticos), se reportaron un total de 14 incidentes (0,012%) de perforación de colon.596 Dicen los Autores que presentan un vídeo de 4 min y 50 s de en una nueva invención realizada durante el manejo laparoscópico de la perforación cecal postpolipectomía. Una nueva utilización del endoloop king (nudos desmontables) en el lugar de la perforación, como se presenta, no se ha descrito en la literatura actual y podría ser aplicada para las primeras perforaciones que están dentro de una distancia corta de la base apendicular. El procedimiento se completa bajo visión directa liberando el apéndice con márgenes de tejido sano antes de aplicar el sistema de endoloop proximal a la pequeña perforación. Es una nueva y eficaz opción de tratamiento quirúrgico que ha sido un éxito bajo nuestro cuidado. Describen un caso en el que fue utilizado y hacen el comentario del uso del Endoloop por otras vías de acceso. La literatura actual ha demostrado que la técnica del endoloop ha tenido éxito en el cierre de perforaciones del tracto gastrointestinal identificados durante la endoscopia terapéutica y cierre del sitio de acceso. Mathews et al.597 describen el uso de endo bucle de cierre primario de incisiones trans acceso viscerales que se crearon en el colon y el estómago. El estudio comparó la curación temprana de la cirugía endoscópica transluminal por orificios naturales transcolónico y transgástrica (NOTES). Las incisiones cerradas por endoloop fueron favorecidas a lo largo de los sitios del colon con intenso llenado de tejido de granulación del defecto y la baja tasa de perforación en comparación con T-Tags y endo-clips , Von Renteln y cols. 598 informaron sobre la comparación del uso videoclip Over-The-Scope (OTSC) o la técnica endoloop utilizada para fijar la base de la resección. El cierre completo se asegura con la técnica endoloop, reduciendo las tasas de complicaciones .Un proyecto de laboratorio de animales dirigido por Hucl y cols. 599 publicó una novedosa técnica de doble endoloop para el cierre endoscópico de incisiones de gastrostomía. El posicionamiento correcto y el cierre del endoloop se logró en todos los animales (10 cerdos) y el examen post-mortem reveló cierre gástrico de espesor completo del órgano en todas sus capas, sin ninguna 307 evidencia de infección o necrosis .Como tal, la técnica de doble endoloop significó un método simple y seguro dentro del tracto gastrointestinal. John B. Marshall, del ACG, American College of Gastroenterology, ASGE, American Society for Gastrointestinal Endoscopy, publico un crítico artículo en el 2011 sobre La incidencia de complicaciones después de la colonoscopia; capturar un dato muy difícil de alcanzar.600 Calidad y seguridad son temas centrales de la práctica endoscópica moderna. Entre los indicadores de calidad de la colonoscopia establecidos en 2006 por la Sociedad Americana de Endoscopia Gastrointestinal (ASGE) y el Colegio Americano de Gastroenterología (ACG) en el informe de la / ACG Task Force ASGE, de Calidad de la endoscopia son las incidencias de perforaciones y sangrado posterior a una colonoscopia. Sin embargo, en la reflexión sólo por esta cuestión, al menos dos preguntas importantes de inmediato me vienen a la mente dice el Autor. Primero, cuan buenas que son nuestras estimaciones de la incidencia de perforación y sangrado? obviamente se necesitan comunicaciones serias y verdaderas para establecer puntos de referencia. En segundo lugar, y un tema crítico enfrentado por cada comité de calidad que supervisa su práctica, es si podemos tener éxito en la captura de la información sobre todas estas complicaciones post endoscopia. La cuestión se vuelve aún más compleja cuando consideramos los eventos adversos después de la endoscopia, además de la perforación y sangrado. En última instancia, nosotros (y nuestros comités de calidad) que preguntarnos cuando debemos recoger datos de complicaciones, durante qué período de tiempo deberíamos buscar complicaciones, y en algunos casos, la forma de saber si un evento adverso fue causado por el procedimiento endoscópico o no. Uno de los primeros intentos serios para definir la tasa de complicaciones asociadas a la endoscopia GI fue una encuesta realizada por el comité de investigación de la ASGE, publicado en 1976.601 Se informaron los datos sobre más de 25.000 colonoscopias para los años 1972 y 1973. Los datos fueron recolectados mediante el envío de cuestionarios a 642 miembros de la ASGE, de los cuales 404 (64%) respondió. Curiosamente, el 36,4% de los encuestados informaron que sus datos no estaban registrados. Otro 4,3% de los encuestados no especificó el método de recolección de datos. Afortunadamente, nuestros métodos de obtención de datos de complicaciones ya 308 se han vuelto mucho más sofisticados. Sin embargo, la grabación de los eventos adversos que se producen después de que los pacientes dejan la unidad de endoscopia sigue siendo un reto importante para la gran mayoría de prácticas endoscópicas. 602 Este es particularmente el caso de los centros de referencia cuyos pacientes con frecuencia viajan de largas distancias. Dos artículos recientes, incluyendo uno por Rabeneck y cosl. 603 en este número de Endoscopia Gastrointestinal, ofrecen nuevas perspectivas en la captura de los informes elusivos de complicaciones endoscópicas. El estudio realizado por Rabeneck et al trató de determinar el curso temporal de la perforación y hemorragia que requiere ingreso hospitalario después de la colonoscopia ambulatoria en personas de 50 a 75 años de edad. Una mejor comprensión de la evolución en el tiempo nos ayudaría a saber cuánto tiempo tenemos en buscar las complicaciones después de la colonoscopia. El estudio hizo uso de datos retrospectivos de un estudio anterior que examinó las tasas de perforación relacionados con la colonoscopia, el sangrado, y la muerte de una cohorte de base poblacional de las personas que se sometieron a colonoscopia ambulatoria en 4 provincias canadienses durante un período de 12 meses entre 2002 y 2003.604 Canadá tiene la ventaja de contar con un sistema de información médica integrada que permite a toda unidad hospitalaria y de cirugía ambulatoria concertar una cita para ser rastreado y vincular las admisiones a los procedimientos recientes. El estudio anterior identificó 97.091 personas a los que se les realizaron colonoscopias ambulatorias. Se encontró que la tasa de perforación del 0,85 / 1000, la tasa de sangrado fue de 1,64 / 1000, y la tasa de muerte llegó a 0,074 / 1,000. Los datos actuales de estudios de la provincia de Ontario, en el que se realizaron 67.632 colonoscopias ambulatorias. Los investigadores encontraron que durante los 30 días después de la endoscopia 37 pacientes fueron ingresados con perforación, y 83 fueron admitidos con sangrado. Para aquellos con perforación, el 92% fueron admitidos dentro de los 2 días y el resto dentro de los 5 días. Para aquellos con hemorragia, el 36% fueron admitidos dentro de los 2 días y el 96% dentro de los 14 días. Los autores concluyeron que después de la colonoscopia ambulatoria, se debe tener presente que en un período de 14 días sería suficiente para capturar todas las perforaciones y la gran mayoría (96%) de los casos de hemorragia que requieran admisión hospitalaria. 309 Los autores confían en que fueron reconocidas todas las perforaciones pero reconocieron que los casos menores de sangrado que no requirieron hospitalización pueden no haber sido contados. Se realizó Polipectomía en 16 542 (24,5%) de los 67.632 pacientes de colonoscopia en el estudio. Suponiendo que casi todos de los 83 casos observados de hemorragia se produjeron en pacientes que se sometieron a la polipectomía, la tasa de sangrado pospolipectomía sería de alrededor de 0,5%, lo cual está dentro del punto de referencia de <1% sugerido por la ASGE / ACG Grupo de Trabajo sobre la Calidad en Endoscopia. 605 Cabe señalar que las tasas de sangrado significativamente más altas se observan cuando los pólipos removidos son más grandes >2 cm. No hay datos sobre el tamaño de los pólipos en el estudio de Rabeneck et al. Un aspecto desconcertante de su estudio es que 12 (32%) de los 37 pacientes con perforación fueron manejados exitosamente con sólo observación. Los autores no pudieron proporcionar ningún detalle sobre estos casos. Otro artículo importante sobre las complicaciones endoscópicas, es el publicado por por Leffler y cols.606, que apareció en la revista Archives of Internal Medicine. Este grupo evaluó prospectivamente la incidencia y el costo de las visitas al hospital resultantes de endoscopia ambulatoria. El estudio utilizó el sistema de historia clínica electrónica en el Beth Israel Deaconess Medical Center en Boston y sus instituciones afiliadas, incluyendo oficinas satélites y unidades de procedimientos ambulatorios utilizados por los 34 gastroenterólogos en el sistema. El sistema estaba vinculado a la generación automática de informes de todos los pacientes atendidos en el servicio de urgencias dentro de los 14 días después de una EGD o colonoscopia ambulatoria. El sistema de seguimiento automatizado no capta datos de los pacientes ingresados directamente al hospital sin pasar por el servicio de urgencias, aunque se creía que la mayoría de estos casos habrían sido recogidos por un sistema voluntario tradicional en la que los avisos mensuales habían sido enviados a todos los endoscopistas, pidiéndoles que reporten las complicaciones del mes anterior. También había un sistema en el lugar en el que un posible evento adverso podría ser registrado por cualquier tratamiento clínico (médicos o enfermeras) en el punto de atención. Se recogieron los datos durante un período de 9 meses en el 2007 de todos los pacientes que se sometieron a una EGD o colonoscopia. Se hizo un comentario de que el 96% de los pacientes seguidos en el sistema de Beth Israel son controlados por el estado. Se realizó 310 revisión manual de las visitas al hospital por dos médicos, para determinar si la visita al hospital fue causada por el procedimiento endoscópico. Si los dos revisores llegaron a conclusiones diferentes, a continuación, un tercer médico revisó el caso y el caso fue discutido hasta que se alcanzó el consenso. En el estudio participaron 6.383 EGD y 11.632 colonoscopias, de los cuales se llevaron a cabo 7.392 colonoscopias de cribado o vigilancia. Entre estos procedimientos, se realizaron 419 visitas a urgencias y 266 hospitalizaciones que fueron recogidas por el sistema de seguimiento automático en un plazo de 14 días post procedimientos. De estos, 134 visitas (32%) se consideraron relacionadas con el procedimiento por los revisores médicos. Treinta y una complicaciones fueron identificadas a través de informes médico estándar, y 8 las visitas al hospital que tuvieron lugar en instituciones externas. Las otras 23 complicaciones médico-reportadas fueron recogidas por el sistema de seguimiento automatizado. Para las visitas de complicaciones / hospitalarias relacionadas con el procedimiento un total de 142, la razón más común fue el dolor abdominal en 63 pacientes (no había desglose por EGD o colonoscopia). Hubo 16 casos de sangrado gastrointestinal (12 asociado con la colonoscopia), y 4 perforaciones (sin desglose por EGD o colonoscopia). Las Instituciones con buenos sistemas de registros médicos electrónicos, que se utilizan para consultas prácticamente todas clínicas y que son capaces de vincular las visitas al servicio de urgencias a 14 días de los procedimientos endoscópicos / hospital, tienen una poderosa herramienta que mejorará en gran medida las tasas de captura de eventos adversos. Sin embargo, en centros en los que muchos pacientes son remitidos desde distancias considerables, esto todavía tiene una tasa de fallos significativa. Aunque llamar a todos los pacientes de 14 a 30 días después de sus procedimientos suena atractivo, es muy costoso y requiere mucho tiempo, y muchos pacientes son difíciles de contactar. Por lo tanto, no sería práctico para prácticas endoscópicas, a menos que el gobierno federal disponga aportar el dinero para tal fin (que obviamente no es probable que suceda). Los pacientes también podrían potencialmente ser enviados a casa con un cuestionario con franqueo pagado dirigido al correo electrónico de 14 a 30 días después. Sin embargo, la tasa de respuesta probablemente sería decepcionante. Se ha sugerido que en el futuro, las "llamadas telefónicas automáticas" generadas por computadora o correos electrónicos automatizados pueden ser de utilidad. 607 Eso está por verse dice el 311 Autor. Por ahora, vamos a necesitar ideas y el pensamiento en como implementamos las formas de mejorar la información de las complicaciones del procedimiento. Muchos todavía están lejos de conseguirlo. Esto deja en nuestra conciencia que estamos obligados a comunicar nuestras complicaciones en Argentina y publicar Las mismas en nuestras Revistas más reconocidas. Sindrome de Coagulación post-polipectomía. Un diagnóstico diferencial a estas complicaciones sobre todo por el dolor manifiesto del paciente es el Sindrome de Coagulación post polipectomía que consiste en un daño de la pared del intestino post electrocoagulación, causando una quemadura transmural. Esto ocurre en alrededor del 0,51% al 1,2% de todos los pacientes sometidos a una polipectomía colónica. 608 Esto ocurre de 1 a 5 días después del procedimiento, suelen presentar fiebre, dolor abdominal localizado, signos de irritación peritoneal y leucocitosis. Se debe seguir al paciente y si se considera necesario internarlo y realizar el protocolo ya conocido de placas de Tórax y abdomen directas y TAC si fuera necesario. Este proceso involuciona solo y el paciente después del tercer día ya no tiene síntomas. Quiero recordar que cuando hemos realizado tatuajes con tinta china, es probable que si la aguja profundizó su penetración más allá de la submucosa el paciente también puede presentar una Serositis importante con intenso dolor, debemos tenerlo en cuenta. Esto ocurrió en nuestra estadística en solo dos pacientes a los que les realizamos tatuajes, para marcación de control posterior, y el otro para referirlo a Cirugía. Hemorragia Post-Polipectomía experiencia de la Unidad de Aparato Digestivo Baistrocchi. Córdoba En nuestra experiencia personal en la Unidad de Aparato Digestivo Baistrocchi esta complicación fue infrecuente, (todas cohibieron espontáneamente, solo requirieron control y reposo, solo una de ellas necesito internación y se le realizaron solo 500 cc de sangre entera en forme preventiva. En nuestra experiencia la hemorragia post-polipectomía leve y grave ocupó el 5,99% (629 pac.) en 10.490 Polipectomías realizadas a la fecha. En el Relato Oficial de Coloproctología del año 2009 “Pólipos Colorrectales no Hereditarios” la Dra. Rita Pastore, 312 en su excelente Encuesta Nacional referida a Complicaciones de las Polipectomías, los encuestados respondieron que la complicación más frecuente fue la Hemorragia. En las series consultadas por el Dr. Cattaneo en su Relato Oficial “Complicaciones intraabdominales de la Cirugía Colorrectal” 86º en el 35 Congreso Argentino de Coloproctología del año 2010, esta complicación oscilo entre el 0,02 y el 6%. Dificultades de avance del videocolonoscopio en pacientes con adherencias post-OPERATORIAS. Es esta una situación a veces irresoluta y trae aparejado muchas de las veces desgarros en la mucosa, y sangramientos que se pueden evitar, cuando no están relatados casos de perforación colónica por insistir en avanzar el colonoscopio en ángulos del colon que muchas de las veces están atrapados o adheridos a pared abdominal (peritoneal) debido a cirugías anteriores, sobre todo las cirugías en la Pelvis de la mujer. Esto es un punto a tener en cuenta en el interrogatorio y debe figurar en la Historia clínica del paciente, pues en algunas oportunidades no es el Coloproctologo el que realiza su propia Videocolonoscopia, sino algún Endoscopista de su grupo de trabajo, y estos son datos como los de la toma de medicamentos, sedantes, anticoagulantes que ya debían haber sido suspendidos y entre estas preguntas deben estar los antecedentes de cirugías anteriores. El Colon Sigmoides con mucha facilidad se adhiere al piso perineal o a la pared abdominal anterior en la línea de sutura (cicatriz) y es este un inconveniente muchas veces insalvable y debe suspenderse el estudio endoscópico para recurrir a otros menos invasivos como la Colonoscopia Virtual o el radiológico Colon por Enema que continua teniendo vigencia según los sistemas de apoyo Sanatoriales o Institucionales. No siempre se tiene el recurso dela Colonoscopia Virtual y en estos casos la Radiologia es aclaratoria. Garrett KA y Church J, del Departamento de Cirugía Digestiva, y el Digestive Diseases Institute de la Cleveland Clinic, Cleveland, Ohio, USA.609 Publican en el 2010 un artículo referido a este problema titulado: Antecedentes de histerectomía: un problema significativo para colonoscopistas que no tienen presente este evento y los pacientes que han tenido una colectomía sigmoide. Propósito: Durante la colonoscopia, a menudo es difícil atravesar el colon sigmoide en pacientes que han tenido una histerectomía, 313 presumiblemente debido a adherencias pélvicas posquirúrgicas. Se realizó este estudio para documentar esta dificultad y para determinar si la colectomía sigmoidea también era un problema debido a adherencias post-quirúrgicas. Los datos fueron adquiridos a partir de una base de datos prospectiva de endoscopistas individualmente. Las colonoscopias realizadas en mujeres se agruparon de acuerdo al antecedente de histerectomía y / o colectomía sigmoide. Se compararon los grupos para determinar quiénes completaron la colonoscopia, (CIR) el medicamento utilizado, y el tiempo de examen. La participación de los becarios y se registraron la tasa de complicaciones. Se excluyeron los pacientes con antecedentes de resección-abdominal perineal del recto. De 1989 a 2006, se realizaron un total de 4.116 colonoscopias en las mujeres: 993 habían sufrido una histerectomía (24,1%), de los cuales 108 (10,9%) también se había sometido a una colectomía sigmoide. Había 3.123 exámenes en la mujer que tenía a su útero (75,9%); 320 (10,2%) se habían sometido a una colectomía sigmoide. Los pacientes que todavía tenía un colon sigmoide, pero tenían antecedentes de histerectomía, tenían tasas significativamente más bajas de completar la colonoscopia (89,2%) y significativamente más tiempo medio de examen (28,9 ± 12,3 minutos), y un número mayor de ellos requirieron sedación con benzodiazepinas (88,7%) que los otros grupos (p <0,05). La participación de los Fellow aumentó el tiempo total de la colonoscopia y las complicaciones fueron más frecuentes en los pacientes con histerectomía. Concluyen que las adherencias post histerectomía para el colon sigmoide hacen la colonoscopia más difícil y más dolorosa. Estos efectos adversos no están presentes en mujeres histerectomizadas que han sido sometidos a resección sigmoidea. En Argentina también hemos tenido Trabajos referidos a las complicaciones de las Colonoscopias, ya me referí a muchos de ellos al comienzo pero quiero terminar comentando un Trabajo reciente, realizado por varios grupos de trabajo de nuestro País en el que tuvimos el honor de participar, titulado: Estudio multicéntrico Nacional. Análisis de las complicaciones de Colonoscopias realizadas por Coloproctologos. Sus Autores fueronlos doctores: Amarillo HA, Manson R, Borquez V, García M, Tacchi P, Gorodner A, Baistrocchi J, Rodríguez GM, Salomón M, y quien escribe este Relato. Participaron de este trabajo además de nuestro grupo de Córdoba, el Sanatorio Modelo, de Tucumán, el 314 CIDEC de Salta, el Sanatorio Antártida de Resistencia Chaco. Unidad Digestiva, Córdoba. Clínica Vrasalovic de Formosa, y Hospital Británico de Buenos Aires. Tuvo como objetivo analizar las complicaciones de la videocolonoscopía en series institucionales. Su diseño fue un estudio multicéntrico nacional de registro prospectivo. Estudio prospectivo no aleatorio. Se analizaron las videocolonoscopías de cada centro realizadas entre enero 2009 y diciembre de 2010. Se trabajó con el número total de complicaciones atribuidas al procedimiento No se registraron las complicaciones relacionadas con la anestesia. Se evaluaron: patología previa, sexo y edad, indicación, tipo de endoscopia, tipo de complicación, número y sitio de la complicación, presentación clínica, metodología y momento del diagnóstico, tratamiento (tiempo, procedimiento, mortalidad y morbilidad postoperatoria) y evaluación de complicaciones atribuidas al procedimiento. Resultados: de 6629 colonoscopías, el 58,1% (3852) fueron del sexo femenino. Hubo un promedio de 94,7% de arribos al ciego (CIR) para todos los trabajos Internacionales). El tiempo fue de 28,7’ (20’-45’). La edad fue de 53,5 años (13-92). Fueron ambulatorias en el 90,1%. Se hicieron 4057 (61,2%) estudios diagnósticos y 2572 (38,8%) terapéuticos. Fueron programados en el 99%. Se registraron 17 lesiones (0,25%), 12 (0,18%) estaban relacionadas al procedimiento (9 perforaciones, 2 sangrados y una necrosis posterior a intento de resección). Las complicaciones luego de colonoscopías diagnosticas fue del 0,12% y del 0,31% en procedimientos terapéuticos. Las complicaciones fueron resueltas con expectación en cuatro, cirugía en siete (rafia 1, laparoscópica en 2, resección convencional en 4) y endoscopia en 1. No hubo mortalidad ni morbilidad asociadas. Existieron resultados similares entre los diferentes centros participantes y distribuidos en zonas distantes entre sí. Discusión: La incidencia de complicaciones luego de videocolonoscopía fue baja en centros de referencia o especialistas entrenados. Las más frecuentes fueron la perforación y la hemorragia. La incidencia fue similar tanto en estudios diagnósticos como en terapéuticos (Esto fue diferente a los grandes grupos de estudios Internacionales como los que ya presente, en donde las complicaciones son más frecuentes en los estudios Terapéuticos que en los de Diagnóstico). El tipo de tratamiento se relacionó con el momento del diagnóstico, tipo de lesión y factores del paciente. Fue evidente que cuando el diagnóstico fue precoz y el tratamiento oportuno, la morbimortalidad fue baja 315 o nula. La relación de equivalencia de resultados entre centros de referencia (hospital alto volumen) y centros del interior infiere que la calidad del estudio fue similar entre ambos. Cuando se considera que los autores fueron entrenados en centros similares al de referencia es dable atribuir a la colonoscopia realizada por coloproctologos los mismos resultados. Concluyen: Es la primera vez que contamos con datos a nivel nacional del tema de estudio. (Los estudios Internacionales presentados anteriormente en este Relato avalan la opinión de los Autores, para todas las Instituciones del Mundo es este un tema de muy difícil recolección de datos) La colonoscopia puede realizarse por coloproctologos como elemento diagnóstico y terapéutico seguro, factible y de alta calidad. 610 316 PARTE 10 CASUISTICA Se trabajó durante los años 2000 al 2013 con los siguientes equipos; Sistema Olympus CV-1, Videcolonoscopio de Luz con pantalla y secuencial a computadoras con captor de imágenes de Microsoft que eran archivadas en estas y en videos de cinta. Sistema de Videoendoscopios “Endoscopy” de fabricación Nacional de la firma Endoscopy SRL (Av. Rivadavia 1479 6° 13) Ciudad Autónoma de Buenos Aires. Tel Fax (54-11 43830309), en nuestra Unidad de Aparato Digestivo Baistrocchi, Sucre 364, Córdoba 5000. Durante los años 2014 y 2015 con Equipo Olympus Exera II NBI (de Cromoscopia electrónica (Narrow Band). Se trabajó con equipo Fujinon EC-410 en forma simultánea con el Departamento de Gastroenterología del Dr. Manuel Lorenzo, Instituto de Tomografía Computada Dr. Carlos Oulton de la Ciudad de Córdoba, Av. Vélez Sarsfield 562, Ciudad de Córdoba 5000, los años 2000 al 2006 con quien presentáramos el primer trabajo a nivel Nacional sobre Videocolonoscopia Magnificada y Cromoscopía de Índigo Carmín, diagnóstico de las lesiones Colorrectales, nuestra experiencia. En el Congreso Argentino de Gastroenterología en el año 2006. Se realizaron 15.286 Videocolonoscopias con los equipos Olympus CV-1, Endoscopy Nacional y Olympus Exera II NBI. La estadística del Equipo simultáneo del Dr. Manuel Lorenzo, Instituto Privado de Tomografía Córdoba Dr. Carlos Oulton, se presenta en forma comparativa de sensibilidad y especificidad, y el hallazgo de Lesiones Planas y Deprimidas con Cromoscopía. En la Unidad Digestiva Baistrocchi desde el año 2000 al 2015, se realizaron 15.286 Videcolonoscopias llegando al Ciego en el 75% de las Videocolonoscopias realizadas con los sistemas ya descriptos, del 2000 al 2013. (CIR)(Tasa de arribo a Ciego). Con el nuevo sistema Olympus Exera II NBI, una tasa de arribo a Ciego del 96%. Los Diagnósticos realizados con estos Equipos están detallados en la Tabla. 317 Hallazgos Endoscópicos N° % Enf. Diverticular del Colon 7.556 49,43 Pac. con Pólipos Colon y Recto 5.262 34,42 Rectitis Actínicas 192 1,25 CA de Recto 184 1,20 CA de Colon 167 1,09 Ectasias vasculares 144 0,94 Colitis Ulcerosa 192 1,25 Otras Colitis 167 1,09 Estenosis Colo-Rectales 71 0,46 Colitis Pseudomembranosa 23 0,15 1.204 7,87 Megacolon 38 0,24 Enfermedad de Crohn 24 0,15 Colitis Isquemicas 8 0,05 Colitis Linfociticas/Eosinofilicas 6 0,03 PAF 31 0,20 Endometriosis Colonica 17 0,11 Colon Normal TOTAL de PACIENTES 15.286 La edad promedio osciló en 46 años para ambos Sexos. El Sexo Femenino fue el más numeroso con el 57% (8713 pac.), siendo el masculino el 43% (6.573 pac.) EDAD : Rango 11 – 81 (46 a.) SEXO: Fem. 8.713 (57 %) / Masc. 6.573 (43 %) En nuestra experiencia personal, de la Unidad de Aparato Digestivo Baistrocchi tenemos contabilizadas unas 26 Estenosis por suturas mecánicas en Recto medio y superior,(36,6% de las Estenosis Colorrectales)(0,17% de todas las Videocolonoscopias) todas fueron dilatadas en un promedio de tres a 4 sesiones con los, “Balones Quantum 318 TTC” de Wilson-Cook con excelentes resultados. Y el otro usado por nuestra Unidad es el Quantum QD-18X8, para luego usar el Rigiflex de mayor resistencia (Microvasive Inc.) obteniendo un calibre aceptable (Mayor a 2 cm) para el tránsito intestinal. Encontramos 45 estricturas infranqueables de Colon (o,29 % de todas las Videocolonoscopias) 29 correspondían a Tumores del Colon (17,36%) de los 167 Cánceres de Colon encontrados. El resto (16)( 35,5% de las infranqueables) fueron enfermedades Inflamatorias (Diverticulitis, Colitis Isquémica, Enf. De Crohn, respuesta Actínica, Bridas/Adherencias). Todas las Estenosis manejadas por nuestro equipo (80%) el resto fueron solo referidas para el diagnóstico, se les realizó a posterior de la Videocolonoscopia una Radiografia de Colon por Enema a doble contraste o una Videocolonoscopia Virtual. Solo esto fue diferido en los procesos Inflamatorios Agudos en los que se esperó un periodo de Acalmia o fueron referidos para Cirugía. El total de Estenosis Colorrectales sería de 71 pacientes lo que hace un 0,46 % de todas las videocolonoscopias realizadas.(15.286) Lesiones encontradas en los 5.262 pacientes portadores de Pólipos del Colon y Recto se encontraron 10.490 lesiones elevadas que se agruparon de la siguiente manera. Distribución Morfológica de las Lesiones. En 5.262 pacientes portadores de 10.490 Lesiones (Pólipos) del Colon y Recto. Morfología de las Lesiones no Lesiones Neoplásicas Neoplásicas (Pit I y Pit (Pit III L, Pit III S, Pit IV Lesiones TOTAL II de Kudo) y Pit V de Kudo) Lesiones Planas 2.090 (63,66%) 1.193 (36,33 %) 3.283 (31,29 %) Lesiones Sésiles 2.165 (47,08%) 2.433 (52,91 %) 4.598 (43,23 %) Lesiones 399 (15,29 %) 2.210 (84,70 %) 2.609 (24,87 %) Pediculadas TOTAL 4.654 (44,36 %) 5.836 (55,63 %) 10.490 (100 %) 319 TAMAÑO DE LAS LESIONES LESIONES SESILES 75 % DE TODAS LAS LESIONES / =/< 1 cm 70% DE TODAS LAS LESIONES SESILES LESIONES PEDICULADAS 25 % DE TODAS LAS LESIONES / =/< 1 cm 10 % DE TODAS LAS PEDICULADAS. HISTOLOGÍA DE LAS LESIONES PÓLIPOS HIPERPLÁSICOS ……………………………………………….. 75 % PÓLIPOS ADENOMATOSOS/VELLOSOS o MIXTOS ………….. 25 % TAMAÑO DEL PÓLIPO Vs. HISTOLOGÍA Menores de 1 cm ………………………………… 85 % …………. Hiperplásicos 15% …………. Adenomatosos Mayores de 1 cm ………………………………. 85% …………. Adenomatosos 15% …………. Hiperplásicos HISTOLOGIAS DE LAS LESIONES / DISPLACIA MODERADA a SEVERA/ Menores de 1 cm …………………………………. 6 lesiones (0,05 %) Mayores de 1 cm …………………………………..1.574 lesiones (15 %) Se debe aclarar que : •Carcinoma “In Situ” es: Severos cambios displásicos confinados al epitelio Mucoso. •Carcinoma Intramucoso es: Displacia severa confinada a la Lamina Propia pero no a la Mucosa. •Ambas “Carcinoma In Situ” y “Carcinoma Intramucoso” son designados como alto grado de Displacia. Ambos son benignos, y el paciente puede ser curado en el 100% de los casos con la Resección Endoscópica. 611 320 El total de las lesiones (Pólipos) se agruparon 25% en el Colon proximal, Colon Derecho Y Angulo Hepático del colon, y el 75% restante se ubicaron en el Colon Distal, Sigma y Angulo Esplénico. Pero cuando se agruparon las Lesiones Adenomatosas mayores o menores de 10 mm, estas se ubicaron el 57% en el colon Proximal y 43% en el Colon Distal. Fig. N°157 Fig Nº 158 321 POLIPECTOMIAS DEL 2014 Y 2015 CON SISTEMA OLYMPUS EXERA II NBI, (Cromoscopia Electrónica) SOBRE 4726 COLONOSCOPIAS, SE REALIZARON 515 (10,89%) POLIPECTOMIAS, DE LAS CUALES 51 (9,91%) FUERON MUCOSECTOMIAS. Con los años no solo mejoraron las imágenes que año tras año los aparatos fueron mejorando en su definición, hasta llegar a la Alta Definicion (High Definition), pasando lo que se dio en llamar en un primer momento Magnificación de imagen, porque los aparatos tenían y tienen hasta la fecha amplificación de la imagen en 80 x, 150 x, dependiendo de la Industria que los fabrique, en realidad en Argentina los Aparatos de Alta definición que se pueden conseguir son de la casa Olympus el Exera II Cv 180 NBI, la línea Fujinon Fice, y la de Pentax con el I Scan. Pero estos aparatos no solo mejoraron en la definición de la imagen sino que la ductibilidad y maniobrabilidad mejoró ostensiblemente haciendo de ellos en su uso un mejor (CIR) o sea arribo a Ciego con mayor celeridad estableciendo tiempos de entrada y de salida como ya lo hemos expresado en inumerables trabajos que comparan uno con otro,y la sensibilidad de detectar Pólipos desde planos hasta pediculados (ADR) detección de adenomas . Estableciendo ahora valores en tiempo de entrada y arribo a ciego en 7 minutos, y tiempo recomendado de salida en 9 minutos. Por ejemplo dentro de los últimos dos años, del 2014 al 2015 que adquirimos el nuevo aparato Olympus Exera II cv-180 NBI con el logramos realizar 4726 Videocolonoscopias. La Tasa de Deteccion de Adenomas (ADR) fue de 41% con Olympus Exera II, contra 32,6 % con los aparatos anteriores Olympus CV 1 y Endoscopy de fabricación Nacional de muy buena resolución. Lo mismo sucedió con el (CIR) tasa de arribo a ciego que de un 75% con los sistemas anteriores pasamos a una tasa de intubación a Ciego con Olympus Exera II del 96%. La Sensibilidad con este Sistema Olympus fue del 76 %, y una Especificidad del 91%. En realidad con el comienzo del uso de la Cromoscopia con Indigo Carmin estas cifras no se modificaron con valores de mayor sensibilidad y especificidad, lo que si canbió fue la comodidad del NBI (Narrow Band) o sea la cromoscopia elctronica , cuyo 322 aspecto principal es la visión de los vasos y la estructura superficial muy similar a la de la Cromoscopia con Índigo, para poder aplicar la Clasificación de Kudo (Pits), y luego con la aparición de la Clasificación de Paris pudimos agruparlos de otra manera como veremos a continuación. Lo mismo con estos aparatos comenzamos a Clasificar la limpieza del Colon con la Clasificación de Boston que ya describiera anteriormente fue una nueva modalidad que tomamos y está reflejada en los dos últimos años de estudios. Preparación según Clasificación de Boston Tasa de intubación a ciego Clasificación de París Tasa de detección de adenomas Sensibilidad Especificidad 0 1 2 3 porcentaje 0,6 % 3,2 % 12,4 % 83,8 % 96 % 0Is 72% 0Ip 6 % 41 % II III 76 % 91% Se descartaron los pacientes que se les realizo polipectomía (estos ya tenían estudio anterior completo). 0II 11 % LST 4 % TUMOR 7 % I : 2% III: 38% V: 7% II: 31 % IV: 6% DEL 31 % EL 37 PORCIENTO SON SERRATOS. LOS SERRATOS SERIAN DEL TOTAL 11, 4 % T 41% TV 13 % V 7% HEMORRAGIAS DIGESTIVAS BAJAS En nuestra experiencia personal en la Unidad Digestiva Baistrocchi, siempre fue una situación muy difícil, pero se pudo arribar al ciego y hacer diagnóstico en el 80,8 % de los casos utilizando Colonoscopios de doble canal de trabajo y de un solo canal pero con gran visión de ángulo. Sobre 25.000 Colonoscopias realizadas solo el 1,8 % fueron Hemorragias Digestivas Graves (Copiosas), 451 pacientes en el término de 30 años. En la recopilación actual del 2000 al 2015, que dió un total de 15.286 pacientes endoscopiados con los nuevos sistemas ópticos fue de 261 (1,70%) pacientes, por Hemorragia Digestiva baja, lo que no difirió de la recopilación anterior como de sus etiologías. Por lo que mantuvimos similares porcentajes. 323 Principales Causas de Sangrado Intestinal Bajo, para numerosos Autores comparados entre si: Divertículos % Angiodisplacias % Cáncer- CUC % Anoorificiales Pólipos % % Otras como Desconocidas Actínicas, % Endometriosis e Isquémicas % Latif 43 28 2,3 - - - - 9 24 9 7 3 3 5 24 7 10 21 9 4 25 48 12 11 6 3 6 14 41 3 9 16 5 14 12 30 20 7 8 19,5 9,5 6 J.,Hequera J (1-31) Jensen et al. UCLA (12) Bramley et al. (Suecia) (54) Richter et al.(Boston) (55) Longstreth (S.Diego Calif.) (10) Baistrocchi y col. (Argentina) (6)(rec.act.) Recopilación de datos del Autor. ( Las citas corresponden a esta Bibliografia) Causas de Hemorragia Digestiva baja grave expresada en porcentajes de diversos Autores. (EDC=Enf. Divert .del Colon. MV=Malformaciones Vasculares. EII=Enferm. Inflamat. Intestinal) rec.act.=Recopilación actual En nuestra experiencia sobre 451 pacientes portadores de H.D.B Graves la Enfermedad Diverticular estuvo presente en 135 pacientes (30 %), considerando que no llegamos al diagnóstico en 27 pacientes (6% del total de HDB) y la mayoría de ellos detuvieron su sangrado, es probable que no hayamos podido realizar el diagnóstico en varias Enfermedades Diverticulares. En nuestra estadística personal de las 451 H.D.B. Graves 90 pacientes (20%) eran portadores de una Ectasia Colónica, muy pocas de ellas pudieron ser tratadas con coagulación endoscópica o métodos de esclerosis, la mayoría de ellos fueron operados y 324 muy pocas cohibieron espontáneamente, solo 5 de 90 (4,5 %), fallecieron y en 3 (0,66 %) y el diagnóstico se hizo intraoperatorio. De los 451 pacientes tuvimos : 135 pacientes con Diverticulosis sangrante (30%) 90 pacientes con una Angiodisplasias del colon (20%) de estas el 70% se ubicaron en el colon Proximal, Derecho y Angulo Hepático y solo el 30% en el marco Izquierdo, 36 con Colitis Ulcerosa (8%), 17 pacientes que sangraron por CA de Colon/Recto/Pólipos (3,8%), 6 pacientes por Isquemias colónicas (1,3%), 17 pacientes eran portadores de Colitis Pseudomembranosa (3,8%), 27 pacientes sangraron severamente post-polipectomía (6,16 %) y 43 pacientes sangraron copiosamente por ser portadores de una Rectitis Actínica (9,56%) todas las Rectitis Actínicas menos una, fueron cohibidas endoscópicamente, (Coagulación Discriminada/Argon Plasma) solo una necesito ser intervenida quirúrgicamente , debiendo realizar una Amputación abdomino perineal de Miles. Nuestras Hemorragias Digestivas Bajas Graves se comportaron paradójicamente en forma atenuada, de los 451 pacientes sangrantes solo fueron llevados a cirugía 19 (4,21%) y se distribuyeron entre 1 paciente portador de una Rectitis Actínica (5,26%), 10 (52,6%) pacientes portadores de una Enfermedades Diverticular del Colon sangrante, 5 (26,3%) Angiodisplasias, y 1 Invaginación Intestinal del Ciego (5,26%). Solo 2 enfermos fallecieron luego de la Cirugía debido a la gravedad de la misma constituyendo el 10,5% de mortalidad Post-operatoria, no tuvimos índices de mortalidad Intraoperatoria. Hemorragia Post-Polipectomía experiencia de la Unidad de Aparato Digestivo Baistrocchi. Córdoba En nuestra experiencia personal en la Unidad de Aparato Digestivo Baistrocchi esta complicación fue infrecuente, (todas cohibieron espontáneamente, solo requirieron control y reposo, solo una de ellas necesito internación y se le realizaron solo 500 cc de sangre entera en forme preventiva. En nuestra experiencia la hemorragia post-polipectomía leve y grave ocupó el 5,99% (629 pac.) en 10.490 Polipectomías realizadas a la fecha. En el Relato Oficial de Coloproctología del año 2009 “Pólipos Colorrectales no Hereditarios” la Dra. Rita Pastore, 325 en su excelente Encuesta Nacional referida a Complicaciones de las Polipectomías, los encuestados respondieron que la complicación más frecuente fue la Hemorragia. En las series consultadas por el Dr. Cattaneo en su Relato Oficial “Complicaciones intraabdominales de la Cirugía Colorrectal” en el 35 Congreso Argentino de Coloproctología del año 2010, esta complicación oscilo entre el 0,02 y el 6%. ESTENOSIS COLO-RECTALES En nuestra experiencia personal, de la Unidad de Aparato Digestivo Baistrocchi tenemos contabilizadas unas 26 Estenosis por suturas mecánicas en Recto medio y superior,(36,6% de las Estenosis Colorrectales)(0,17% de todas las Videocolonoscopías) todas fueron dilatadas en un promedio de tres a 4 sesiones con los, “Balones Quantum TTC” de Wilson-Cook con excelentes resultados. Y el otro usado por nuestra Unidad es el Quantum QD-18X8, para luego usar el Rigiflex de mayor resistencia (Microvasive Inc.) obteniendo un calibre aceptable (Mayor a 2 cm) para el tránsito intestinal. (No contabilizamos las Estenosis ultrabajas al alcance del dedo (tacto Rectal) que fueron pocas, y se dilataron manualmente o con dilatadores rígidos) Cabe considerar que estos pacientes cuando las estricturas son muy bajas quedan siempre con premura defecatoria y otras veces con Tenesmo que con ejercicios esfinterianos se van superando en el tiempo. Hemos tenido dos (2) complicaciones perforativas en tercio medio y tercio superior de Recto que necesitaron cirugía, ambos pacientes destransitados sin opción de retránsito. Las hemorragias post dilatación todas fueron controladas y ninguna requirió algún tipo de transfusión y/o internación. El dolor fue manejado en el momento de la dilatación con la Neurolepto analgesia convencional de cualquier Videocolonoscopia de rutina, y en el postoperatorio con analgésicos convencionales. Ninguno requirió internación, salvo las perforaciones. Encontramos 45 estricturas infranqueables de Colon (63,3% de todas las Estricturas) y (0,29 % de todas las Videocolonoscopías) 29 correspondían a Tumores del Colon (17,36%) de los 167 Cánceres de Colon encontrados. El resto (16)( 35,5% de las infranqueables) fueron enfermedades Inflamatorias (Diverticulitis, Colitis Isquémica, Enf. De Crohn, respuesta Actínica, Bridas/Adherencias). 326 Todas las Estenosis manejadas por nuestro equipo fueron solo 56 pacientes el 79% el resto fueron solo referidas de otros Centros para el diagnóstico, se les realizó a posterior de la Videocolonoscopia una Radiografía de Colon por Enema a doble contraste o una Videocolonoscopia Virtual. Solo esto fue diferido en los procesos Inflamatorios Agudos en los que se esperó un periodo de Acalmia o fueron referidos para Cirugía. El total de Estenosis Colorrectales sería de 71 pacientes lo que hace un 0,46 % de todas las videocolonoscopías realizadas. (15.286) Que se distribuyeron de la siguiente manera según su ubicación Anatómica en los distintos sectores Colorrectales; 26 (18,46%) de los casos en Recto, 43(30,53%) en el Sigma y Colon Izquierdo, y solo 2(1,42% en el ángulo Hepático del Colon. DISTRIBUCION DE LAS ESTENOSIS SEGÚN SU UBICACIÓN ANATÓMICA COLORRECTAL Figura 159 327 STENT RECTO-COLONICOS Un nuestra experiencia personal solo hemos logrado usarlo solo en dos (2) oportunidades en Recto superior, por lo que no tiene incidencia estadística y solo lo mostramos como Miscelánea, los dos pacientes no llegaron a la cirugía por tratarse de lesiones muy avanzadas. Su indicación es teóricamente para evitar un Ostoma. COMPLICACIONES DE LAS VIDEOCOLONOSCOPIAS Sobre las ultimas 15.286 videocolonoscopias realizadas la perforación estuvo presente en el 0,13 %(21 pacientes) de los casos. El 71,4% (15 pacientes) recibió solo tratamiento médico y el 28,5% (6 casos) restantes cirugía. Recordemos que el mayor inconveniente para realizar el diagnóstico precoz de una perforación es el Sindrome de Coagulación Post-polipectomía causado por la penetración del cauterio en la pared de la muscular involucrando en su inflamación a la serosa en el colon. Esto ocurrió en solo tres casos y como siempre en horas de la noche donde hay que trasladar al paciente y realizarle los estudios de rutina que siempre comienzan con un Laboratorio y una placa de Tórax, y abdomen de pie y acostado. Una de las características es que nunca hicieron fiebre. Solo tuvimos 5 casos (0,04%) en las 10.490 polipectomías realizadas. En nuestros casos esto ocurrió dentro de las 24 hs de realizado el procedimiento. Solo un caso del Interior de la Provincia nos comunicó su Médico de cabecera a los 5 días del procedimiento, y solo se realizó internación y expectación armada 48 hs solo con analgésicos, tampoco hizo fiebre, lo manejamos solo telefónicamente. Las perforaciones se ubicaron en un 30% en el Colon Derecho (Ciego , Colon Ascendente y Angulo Hepático) el 70% en el Colon restante, uno en el Angulo Esplénico, el resto en la unión Recto Sigmoidea y solo uno en Recto. Se realizó Resección y Anastomosis en la mayoría de los casos y solo dos necesitaron de exteriorización por ser una contaminación peritoneal importante. El resto todos necesitaron de una Ileostomía o Colostomía. En uno solo no se encontró la lesión (recto) y evolucionó bien con solo una descarga Ileostómica. 328 UBICACIÓN ANATÓMICA DE LAS PERFORACIONES COLÓNICAS Figura 160 OTRAS COMPLICACIONES Además de las descriptas tuvimos Serositis (Síndrome de coagulación post polipectomía) el 0,08%, Dolor severo más distensión (Bowel distention) el 0,2%. Ruptura de pinza con atrapamiento (0,02%), Bacteriemia (E. coli) 0,04%. No hemos tenido ruptura Esplénica ni efectos adversos de la anestesia. ENFERMEDADES INFLAMATORIAS. En nuestro Centro de Endoscopia, sobre 192 (1,25%) pacientes portadores de Colitis Ulcerativa, encontramos 15 (7,81%) portadores de Displasia leve, 13 (6,77%) Displasia moderada, Displasia severa 2 (1,04%) y un paciente portador de un Adenocarcinoma (0,4 %). Del total de las Colitis Ulcerosas 192 pac. (1,25%) del total de Videocolonoscopias realizadas solo el 15% fueron Pancolitis, el 40% tomaban al Recto y Sigma, 45% al Colon izquierdo y todas afectaban al Recto. 329 Del total de las Colitis Ulcerosas 192 pac. (1,25%) del total de Videocolonoscopias realizadas solo el 15% fueron Pancolitis, el 40% tomaban al Recto y Sigma, 45% al Colon izquierdo y todas afectaban al Recto. La Enfermedad de Crohn fue realmente un rara eventualidad en nuestra casuística, solo pudimos observar y realizar una Videocolonoscopia a 24 pacientes 0,15%, el 50% de ellos fueron referidos de otros Centros Médicos, y el otro 50% tratado por nuestro Equipo. De estos 12 pacientes llevamos a Cirugía solo 3 (25%). Las Colitis Pseudomembranosas que observamos casi siempre fueron referidas de otros Centros por desconocer el diagnóstico, solo 5 casos (21,3%) de los casos (23) fueron de nuestra casuística personal y todos respondieron al Tratamiento médico (Vancomicina/Metronidazol), no tuvimos complicaciones perforativas, pero si Hemorrágicas que mostramos en este relato en HDB.(Hemorragias Digestivas Bajas) Las Colitis Eosinofílicas y Linfocíticas fueron escasas, solo 6 (0,03%) casos y siempre en menores de 15 años, por ser derivados de un Centro Pediatrico muy conocido en nuestro medio en la Ciudad de Córdoba, (Dres Carlos Rezzónico y Carlos Rezzónico (h)) 330 BIBLIOGRAFÍA 1 Kariya A, et al : A case of early colonic cancer type II c associated whit familial polyposis colonic. I to cho (Stomach and Intestine) 1977; 12:1359. 2 Kudo, Shin – ei. Early Colorrectal Cancer Detection of Depressed Types of Colorrectal Carcinoma.// IGAKU-SHOIN Ltda. Tokyo. 1996 3 Wong, WM. Crypt Fission. Gut 2002; 50:212. 4 Parodi H., Martini Roald B., Clasificación e Imágenes Endoscópicas de la Colitis Ulcerosa Crónica. Tribuna Médica. Tomo XV, N° 10. 641-644. 1972 5 Morson B.C. –Enfermedades del Colon Recto y Ano-Londres-Edit.Jins-1972- Cap 1 – pp 113. 6 Bacon.H.E.-Cancer of the Colon Rectum and Anal canal J.B. Lippincott C.O.Philadelphia – 1964. 7 Welch C.-Hedberg J.E.- Polypoid lession of the gastrointestinal Trac. Second Edition.W. R. Saunders Company-1975 8 Goligher J.C. –Cirugía del ano Recto y Colon.- tercera edicion –Salvat Editores SA1979. 9 Espeche A.N. –Patologia colo-rectal Actualizacao Angelino Manzione 24 Congreso Brasileiro de Proctología- San Pablo Oct. 1974. 10 Turrel R. –Enfermedades del Ano Recto y Colon. T.I.Cap.17-18-Edit..Beta, BsAs 1962. 11 Benhamour G. – Tratado de Enfer.del Ap. Dig.- Toray Mansson – S. A. 1980. 12 Maruyama M. – Diag.Radiol.de Polipos y Carcinoma de Colon. Espax S.A. publ med. 1980. 13 Bokus H.L.- Gastroenterologia – Salvat SA – Barcelona 1948. 14 Finochietto R. Cirugia básica – Lopez Libreros Edit. SRL Buenos Aires, 1962. 15 Duhamel J. Proctologia – Salvat SA –Barcelona. 1974 16 Mac Leod – a method of Proctology – Medical Departament – Harper and Row, Publishgrs – Hagerstown Maryland 1979. 17 Wolff W I – Shynia H.- Definitive Treatment of malignant Polyps of the colon. An Surg 1975; 182:516-525. 331 18 Turrel R. –Enfermedades del Ano Recto y Colon. T.I.Cap.17-18-Edit..Beta, BsAs 1962. 19 Baistrocchi, HO. Pólipos del Colon y Recto. Su diagnóstico y Tratamiento mediante un nuevo método, la Colonofibroscopia y Polipectomía Endoscópica a corte y coagulación fría. Tesis de Doctorado. Biblioteca de Medicina, Facultad de Ciencias Médicas, Universidad Nacional de Córdoba, 1981. 20 Pastore Rita L.O. Polipos Colorrectales no Hereditarios. Relato oficial 34 Congr.Arg.de Coloproct.2009. Rev. Arg.de Coloproct. 2009; 20: 111-176 21 Bokus H.L.- Gastroenterologia – Salvat SA – Barcelona 1948. 22 García Matta. Clase sobre Poliposis de ano, recto y colon. Prensa Med Arg 1944; 31:1023-1028. 23 Patologia Colorrectal, Actualizacao. Angelino Manzione. 24 Congreso Brasileiro de Coloproctología. San Pablo. Octubre 1974. 24 Koyama Y. Fiberoscopic Examination of colo-rectal Diseases Ann J Proctol 1974; 15:51-59. 25 Wolff WI, Shinya H. Colonofiberoscopy. JAMA 1971; 271:1509-1512. 26 Sakai Y. The tecnic of Colonofiberoscopy. Dis Col and Rec 1972; 15:403-412. 1972. 27 Rodriguez Martin J.A. Forcinito Z- Valor de la Colonofibroscopia en las lesiones Polipoideas. Actas del V Congreso Argentino e Internacional de Proctología. 2: 1517. 1973 28 Rodriguez Martín J.A., Colonofibroscopia. Pren.Mes.Arg.61: 728-731. 1974. 29 Wolff W I – Shynia H.- Definitive Treatment of malignant Polyps of the colon. An Surg. 182 :516-525- 1975 30 Rubio H. Coloscopia. Actas del VI Congreso Latinoamericano de Proctología. P38. 1975. 31 Michans JR, VacarezzaC, Coronado Quesada E, RubioH. Polipos del ColonPolipectomia endoscópica y cáncer temprano del colon. Bol Ac Nac Med BsAs 1976; 54:221-226. 32 Baistrocchi JA, Baistrocchi HO. Nuestra Experiencia Terapéutica en la Colitis Ulcerosa" 1 Congreso de Proctología del Interior.1974. Córdoba. Actas CongresoTomo II,p.74. 33 2º Congreso Nacional de Coloproctologia del Interior. Actas Congreso, p. 135. 1977. 34 Actas Congreso, p. 420. Mar del Plata 1977. 332 35 Fibropolipectomía Colónica a coagulación fría. IV Congreso Mundial de Endoscopia Digestiva. Actas Congreso, p.152. Madrid. España. Junio 1978. 36 Maruyama M. Diagnostico Radiologico de pólipos y carcinoma de colon Espax SA publicaciones medicas 1980 37 Morson, BC. The polyp cancer sequence in the large bowel. Proc Royal Soc Med 1974; 67:451-457. 38 Turell R. Colonic Adenomas. Am J Surg 1948; 76:783-789. 39 Messick, Craig A. M.D.; Church, James M.B., Ch.B.; Casey, Graham Ph.D.; Kalady, Matthew F. M.D. Identification of the Methylator (Serrated) Colorrectal Cancer Phenotype Through Precursor Serrated Polyps. Diseases of the Colon & Rectum: September 2009 - Volume 52 - Issue 9 - pp 1535-1541doi: 0.1007/DCR.0b013e3181afbe05.Original Contribution 40 Haggitt RC Glotzbach RE Soffer EE Wruble LD Prognostic factors in colrectal carcinomas arising in adenomas: Implications for lesions emoved by endoscopic polypectomy. Gastroenter. 1985: 89:328-36. 41 Kashida H, Kudi S. Early colorrectal cáncer : concept, diagnosis, an manegement Int J Clin Oncol 2006; 11:1-8 42 Kudo, Shin–ei. Early Colorrectal Cancer Detection of Depressed Types of Colorrectal Carcinoma.// IGAKU-SHOIN Ltda. Tokyo. 1996 43 Kwon R, Carr-Locke D. Closure of endoscopic perforations whith Endoscopic Clips. Medscape Gastroenterology 4(2) 2002. www.medscape.com 44 Kavin H, Sinicrope F, Esker AH. Management of perforation of the colon at colonoscopy. Am. J Gastroenterol. 1992;87: 161-167 45 Ajay M Verma, Andrew D Dixon, Andrew P Chilton Correlation of Caecal Intubation Rate to Volume: Colonoscopists Should Undertake at Least 120 Procedures Per Year.Frontline Gastroenterol. 2014;5(3):156-160. 46 Ridolfi, Timothy J. M.D.; Valente, Michael A. D.O.; Church, James M. M.D. Achieving a Complete Colonic Evaluation in Patients With Incomplete Colonoscopy Is Worth the Effort. Department of Colorrectal Surgery, Digestive Diseases Institute, Cleveland Clinic Foundation, Cleveland, Ohio. Diseases of the Colon & Rectum:March 2014 Volume 57 - Issue 3 - p 383–387 333 47 Gualdrini U.,Lummato L.,Collia Avila K.,Bidart L.M. Garantias de Calidad en Colonoscopias, Guia programática de procedimientos, Programa Nacional de Prevencion y detección temprana del CCR. Ministerio de Salud. Presidencia de la Nación. 2013. 48 Adler A, Wegscheider K, Lieberman D, Aminalai A, Aschenbeck J, Drossel R, Mayr M, Mroß M, Scheel M, Schröder A, Gerber K, Stange G, Roll S, Gauger U, Wiedenmann B, Altenhofen L. Rosch T. Factors Determining the Quality of Screening Colonoscopy. A Prospective Study on Adenoma Detection Rates, From 12 134 Examinations (Berlin Colonoscopy Project 3, BECOP-3). Gut 2013; 62(2):236-241. 49 Lee TJ, et al. Factores Endoscópicos asociados con la detección de adenomas en un programa nacional de detección del cáncer colorrectal. Endoscopy 2014; 46(3):20311. 50 Diaz, L. Resumenes seleccionados, Rev Argent Coloproct 2012; 23:115-117. 51 Brian R, Margolin Davis, Scott A., et al.The importance of Colonoscopy in Colorrectal Surgeons´ Practices: Results of a Survey. Dis Colon & Rectum 2006; 49(11):17631767. 52 Mamula P, Adler DG, Conway JD et al. Colonoscopy preparation. Gastrointest Endosc 2009; 69:1201–1209. 53 Hjelkrem M, Stengel J, Liu M et al. MiraLAX is not as effective as GoLytely in bowel cleansing before screening colonoscopies. Clin Gastroenterol Hepatol 2011;9:326– 332. 54 Samarasena JB, Muthusamy VR, Jamal MM. Split-Dosed MiraLAX/Gatorade Is an Effective, Safe, and Tolerable Option for Bowel Preparation in Low-Risk Patients- A Randomized Controlled Study. Am J Gastroenterol. 2012;107(7):1036-1042 55 Lai, E.J., Calderwood, A.H., Doros, G. et al. The Boston bowel preparation score: a valid and reliable instrument for colonoscopy-oriented research. Gastrointest Endosc. 2009; 69: 620–625. 56 Mittal, S., Mummadi, R.R., Trang, T. et al. Excellent cecal cleansing with split dose of phosphosoda and 30 mg of bisacodyl: a retrospective study using cecal photograph as a reflector of the quality of colon cleansing. Am J Gastroenterol. 2007; 102: S162. 334 57 Mittal, S., Sagi, S., and Raju, G. How good is the quality of colonoscopy preparation under monitored anesthesia care (MAC)?. Am J Gastroenterol. 2008; 103: S192. 58 Markowitz GS, Stokes MB, Radhakrishnan J, D'Agati VD. Acute phosphate nephropathy following oral sodium phosphate bowel purgative: an underrecognized cause of chronic renal failure. J Am Soc Nephrol. Nov 2005;16(11):3389-96. 59 Berggreen, Kavathia, Friedman have disclosed no relevant financial relationships. Digestive Disease Week (DDW) 2013: Abstract 143c. Presented May 18, 2013. 60 Parsippany, NJ. Prepopik(sodium picosulfate/magnesium oxide/anhydrous citric acid) Ferring Pharmaceuticals Inc; July 2012. 61 Flemming JA, Vanner SJ, Hookey LC. Split-dose picosulfate, magnesium oxide, and citric acid solution markedly enhances colon cleansing before colonoscopy: a randomized, controlled trial. Gastrointest Endosc. Mar 2012;75(3):537-44. 62 Samarasena JB, Muthusamy VR, Jamal MM. Split-Dosed MiraLAX/Gatorade Is an Effective, Safe, and Tolerable Option for Bowel Preparation in Low-Risk Patients: A Randomized Controlled Study. Am J Gastroenterol. May 8 2012. 63 Aronchick CA, Lipshutz WH, Wright SH, Dufrayne F, Bergman G. A novel tableted purgative for colonoscopic preparation: efficacy and safety comparisons with Colyte and Fleet Phospho-Soda. Gastrointest Endosc. Sep 2000;52(3):346-52. 64 Belsey J, Epstein O, Heresbach D. Systematic review: oral bowel preparation for colonoscopy. Aliment Pharmacol Ther 2007; 25, 373-384. 65 Bowles CL, Lecister R, Romaya C, Swarbrick E, Williams CB, Epstein O. A prospective study of colonoscopy practice in the UK. To day: are we adequately prepared for national colorrectal cáncer screening tomorrow?. GUT 2004;53: 277-83. 66 Harewood GC, Sharma VK, de Garmo P. Impact of Colonoscopy preparation quqlity on detection of suspected colonic Neoplasia. Gastrointestinal Endosc. 2003; 58: 76-9. 67 Froelich F, Wietlisbach V, Gonvers H, et al. Impact of colonic cleasing on quality and diagnostic yield of colonoscopy: the Eurpean Panel of Apropiateness of Gastrointestinal Endoscopy. Eurpean multicenter study. Gastrointest.Endosc. 2005; 61: 378-84. 335 68 Christina Bannert MD, Karoline Reinhart MD, Daniela Dunkler PhD, Michael Trauner MD, Friedrich Renner MD, Peter Knoflach MD, Arnulf Ferlitsch MD, Werner Weiss MD, Monika FerlitschMD. Sedation in Screening Colonoscopy.Am J Gastroenterol. 2012;107(12):1837-1848. 69 Chelazzi C, Consales G, Boninsegni P et al. Propofol sedation in a colorrectal cancer screening outpatient cohort. Minerva Anestesiol 2009;75:677–83. 70 Baistrocchi H, Lorenzo M, Spitle L, Baistrocchi J. Flat Lesions. Western Experience. XVIII Congress of the International Society of University. San Pablo. Brasil Julio 2000. Actas 71 Baistrocchi H., Lorenzo N, Lorenzo M , Spitale LS, Canals de Cohen N.,Garzon RE., Baistrocchi JD, Godoy Mercedes Paramedica. Endoscopia). http://www.proctosite.com/ Colorrectal Library./E-Books / Coloproctologia Actual /Colonoscopia Magnificada. Cromoscopia. / 72 Rex DK, Bond JH, Winawer S et al. Quality in the technical performance of colonoscopy and the continuous quality improvement process for colonoscopy: recommendations of the US Multi-Society Task Force on Colorrectal Cancer. Am J Gastroenterol 2002;97:1296–308. 73 Baxter NN, Sutradhar R, Forbes SS et al. Analysis of administrative data fi nds endoscopist quality measures associated with postcolonoscopy colorrectal cancer. Gastroenterology 2011;140:65–72. 74 Chelazzi C, Consales G, Boninsegni P et al. Propofol sedation in a colorrectal cancer screening outpatient cohort. Minerva Anestesiol 2009;75:677–83. 75 Crispin A, Birkner B, Munte A et al. Process quality and incidence of acute complications in a series of more than 230,000 outpatient colonoscopies. Endoscopy 2009;41:1018–25. 76 Conigliaro R, Rossi A. Implementation of sedation guidelines in clinical practice in Italy: results of a prospective longitudinal multicenter study. Endoscopy 2006;38:1137–43. 77 Radaelli F, Meucci G, Sgroi G et al. Technical performance of colonoscopy: the key role of sedation/analgesia and other quality indicators. Am J Gastroenterol 2008;103:1122–30. 336 78 Crispin A, Birkner B, Munte A et al. Process quality and incidence of acute complications in a series of more than 230,000 outpatient colonoscopies. Endoscopy 2009;41:1018–25. 79 Nelson DB, McQuaid KR, Bond JH et al. Procedural success and complications of largescale screening colonoscopy. Gastrointest Endosc 2002;55:307–14. 80 Aslinia F, Uradomo L, Steele A et al. Quality assessment of colonoscopic cecal intubation: an analysis of 6 years of continuous practice at a university hospital. Am J Gastroenterol 2006;101:721–31. 81 Lee SK, Kim TI, Shin SJ et al. Impact of prior abdominal or pelvic surgery on colonoscopy outcomes. J Clin Gastroenterol 2006;40:711–6. 82 Imperiali G, Minoli G, Meucci GM et al. Effectiveness of a continuous quality improvement program on colonoscopy practice. Endoscopy 2007;39:314–8. 83 Chelazzi C, Consales G, Boninsegni P et al. Propofol sedation in a colorrectal cancer screening outpatient cohort. Minerva Anestesiol 2009;75:677–83. 84 Radaelli F, Meucci G, Sgroi G et al. Technical performance of colonoscopy: the key role of sedation/analgesia and other quality indicators. Am J Gastroenterol 2008;103:1122–30. 85 Chelazzi C, Consales G, Boninsegni P et al. Propofol sedation in a colorrectal cancer screening outpatient cohort. Minerva Anestesiol 2009;75:677–83. 86 Cardin F, Minicuci N, Andreotti A et al. Maximizing the general success of cecal intubation during propofol sedation in a multi-endoscopist academic centre. BMC Gastroenterol 2010;10:123. 87 David E Stein, MD; Chief Editor: John Geibel, MD, DSc, MA Chief, Division of Colorrectal Surgery, Associate Professor, Department of Surgery, Director, MiniMedical School Program, Drexel University College of Medicine; Chief, Division of Colorrectal Surgery, Department of Surgery, Hahneman University Hospital; Consultant, Merck; Consultant, Ethicon Endo-Surgery; Consultant, Health Partners; Consultant, Cook Surgical . Colonoscopy. www.medscape.com 2014 88 Córdoba Villalobos, de la Torre Bravo Antonio. Procedimientos endoscópicos en Gastroenterologia. Editorial Médica Panamericana SA. 2009. 337 89 Leiro F, y col. Experiencia Inicial en Estudios Videocolonoscópicos en un Servicio de Cirugía General y Médicos en Formación. Rev Soc Arg Coloproc 2013; 2(24). 90 Meining A. Colonoscopía: ¿Es el óxido nitroso útil para la sedación? Am J Gastroenterol. 2012 Mar;107(3):339-42. Presentado por Dr.Luis Díaz MAACMSACP. Revisiones Bibliograficas. Rev Arg Colproct 2013; 24. 91 Aboumarzouk, OM. Nitrous oxide for Colonoscopy. Cochrane Database Syst.Rev. 2011.Aug 10;(8). 92 Khajavi M, et al. Analgesia y sedación consciente en Colonoscopía: la combinación Ketamina/Propofol presenta mayor satisfacción en los pacientes que Fentanilo/Propofol.Anesth Pain Med. 2013 Summer; 3(1):208-13. 93 Bejar J, Sarria N, Baistrocchi H, Baistrocchi JD. Estudio comparativo fentanilo-propofol vs lidocaína- propofol para videocolonoscopía. Revista Argentina de Anestesiologia.Buenos Aires: Sociedad Argentina de Anestesiologia 2008; 66(3):3740. 94 Hoda KM. Digestive Disease Week (DDW) 2009: Abstract 722. Presented June 1, 2009. www.medscape.com 95 Dajani AS, Taubert KA, Wilson W, et al. Prevention of bacterial endocarditis. Recommendations by the American Heart Association. Circulation. Jul 1 1997;96(1):358-66. 96 Stein DE, MD Chief, Division of Colorrectal Surgery, Associate Professor, Department of Surgery, Director, Mini-Medical School Program, Drexel University College of Medicine; Chief, Division of Colorrectal Surgery, Department of Surgery, Hahneman University Hospital; Consultant, Merck; Consultant, Ethicon Endo-Surgery; Consultant, Health Partners; Consultant, Cook Surgical. www.medscape.com 97 Canadian Task Force on Preventive Healt Care: Colon Cancer Screening. Can. Med. Assoc.J. 2001,165: 206-208 98 Podolsky D. Going the distance: the case for true colorrectal cancer screening. N Engl J Med 2001, 343: 207-208. 99 Recomendation on cancer Screening in the European Union. Advisitor Committee on cancer prevention. Eur. J.Cancer 2000, 36: 1473-1478. 338 100 Systematic Review and Meta-analysis of Randomised Controlled Trials and Observational StudiesHermann Brenner, Christian Stock, Michael Hoffmeister. 1Division of Clinical Epidemiology and Aging Research, German Cancer Research Center, INF 581, 69120 Heidelberg, Germany.2German Cancer Consortium, Heidelberg, Germany3Institute of Medical Biometry and Informatics, University of Heidelberg, Heidelberg, Germany. [email protected] . PubMed, Embase, and Web of Science 101 Newcomb PA, Norfleet RG, Storer BE, Surawicz S, Marcus PM. Screening sigmoidoscopy and colorrectal cancer mortality. J Natl Cancer Inst 1992;84:1572-5. 102 Selby JV, Friedman GD, Quesenberry CP, Weiss NS. A case-control study of screening sigmoidoscopy and mortality from colorrectal cancer. N Engl J Med 1992;326:6537. 103 Winawer SJ, Zauber A, Ho MN, O’Brien MJ, Gottlieb LS, Sternberg SS, et al. Prevention of colorrectal cancer by colonoscopic polypectomy. N Engl J Med 1993;329:1977-81.1, 2, 3 104 Stock C, Ihle P, Schubert I, Brenner H. Colonoscopy and fecal occult blood test use in Germany: results from a large insurance-based cohort. Endoscopy 2011;43:771-9. 105 Shapiro JA, Klabunde CN, Thompson TD, Nadel MR, Seeff LC, White A. Patterns of colorrectal cancer test use, including CT colonography, in the 2010 National Health Interview Survey. Cancer Epidemiol Biomarkers Prev 2012;21:895-904.4,5. 106 Rex DK, Johnson DA, Lieberman DA, Burt RW, Sonnenberg A. Colorrectal cancer prevention 2000: screening recommendations of the American College of Gastroenterology. Am J Gastroenterol 2000;95:868-77. 107 Winawer S, Fletcher R, Rex D, Bond J, Burt R, Ferrucci J, et al. Colorrectal cancer screening and surveillance: clinical guidelines and rationale—update based on new evidence. Gastroenterology 2003;124:544-60. 108 Smith RA, Cokkinides V, Eyre HJ. American Cancer Society guidelines for the early detection of cancer, 2005. CA Cancer J Clin 2005;55:31-44. 109 Schmiegel W, Pox C, Adler G, Fleig W, Fölsch UR, Frühmorgen P, et al. S3 Guidelines colorrectal cancer 2004. [In German.] Z Gastroenterol 2004;42:1129-77.6, 7, 8, 9. 339 110 Stock C, Pulte D, Haug U, Brenner H. Subsite-specific colorrectal cancer risk in the colorrectal endoscopy era. Gastrointest Endosc 2012;75:621-30. 111 Siegel RL, Ward EM, Jemal A. Trends in colorrectal cancer incidence rates in the United States by tumor location and stage, 1992-2008. Cancer Epidemiol Biomarkers Prev 2012;21:411-6.10,11. 112 Gualdrini Ubaldo. Cancer colorrectal en la Argentina. Organización, cobertura y calidad de las acciones de prevención y control. Informe final de diciembre de 2011: diagnostico de situación de la Argentina. Instituto Nacional del Cancer. Ministerio de Salud. Presidencia de la Nacion. Edicion 2012.www.msal.gov.ar 113 Vaccaro Carlos A Cancer Colorrectal.. del Hospita Ediciones Agosto 2007 Latin Grafica SRL BsAs.p. 71 114 Baistrocchi, Héctor, Olivato Carlos. Estado actual del tratamiento del Cáncer de Recto.26 Congreso de Cirugía de Córdoba. 2008. Actas. 115 Fuchs CS, Giovanucci, Coldite GA, et al. A prospective study of family history and de risk of colorrectal cancer. N. Engl.J. Med. 1994.331: 1669-1674. 116 Slattery ML, Mori M, Gao R., et al. Impact of family history of colon cancer. Dis.Col.Rectum 1995; 38 : 1053-1058. 117 Hall NR, Bishop DT, Stephanson BM, et al. Hereditary susceptibility To colorrectal cancer. Relativies of early onset cases are particulary at risk. Dis.Col. Rect. 1996, 739-743. 118 Winawer SJ, Fletcher RH, Miller L. et al. Colorrectal cancer screening: clinical guidelines and rationale. Gastroent. 1997, 112: 594-642. 119 Rex D., et al. Colorrectal Colorrectal Cancer Prevention 2000, ;95 (4) 868-77. 120 Kaminski MF, Polkowski M, Kraszewska E, Rupinski M, Butruk E, Regula J. A Score to Estimate the Likelihood of Detecting Advanced Colorrectal Neoplasia at Colonoscopy. Gut 2014;63(7):1112-1119. 121 Regula J, Rupinski M, Kraszewska E, et al. Colonoscopy in colorrectal-cancer screening for detection of advanced neoplasia. N Engl J Med 2006;355:186372. 122 von Karsa L, Patnick J, Segnan N, et al. European guidelines for quality assurance in colorrectal cancer screening and diagnosis: overview and introduction to the full supplement publication. Endoscopy 2013;45:51-9. 340 123 Kaminski MF, Regula J, Kraszewska E, et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010;362:1795-803. 124 Lieberman DA, Weiss DG, Bond JH. Use of colonoscopy to screen asymptomatic adults for colorrectal cancer. Veterans Affairs Cooperative Study Group 380. N Engl J Med 2000;343:162-68. 125 Regula J, Rupinski M, Kraszewska E, et al. Colonoscopy in colorrectal-cancer screening for detection of advanced neoplasia. N Engl J Med 2006;355:1863-72. 126 Rex D., et al. Colorrectal Colorrectal Cancer Prevention 2000; 95(4):868-77. 127 J Clin Oncol- febr. 2014. 128 J Clin Oncol. Published online February 3, 2014. Lu abstract, Wood abstract. 129 Vaccaro, CA. Cancer Colorrectal. del Hospital Ediciones Agosto 2007 Latin Grafica SRL BsAs 130 Ko R, et al. Pratice parameter for the detection of colorrectal neoplasms; an intarin report (revised). Dis.Colon Rectum 2006; 49(3):229-301. 131 Lencinas SM, Rotholtz NA, Peczan CE, Pedreira SC, Boerr L, Cimmino DG. Resultados de la pesquisa del cáncer colorrectal mediante videocolonoscopía en una población cerrada. Rev Argent Coloproct 2008; 19:30-36. 132 Chaar E, Labiano S, Travieso L, Marta E, Bichara F, Cordoba A, Naguila G, di Risio C, Leiro F. Experiencia Inicial en Estudios Videocolonoscópicos en un Servicio de Cirugía General y Médicos en Formación. Rev. Arg. de Coloproctologia 2013.Rev Argent.Coloproct /2013/Vol.24. N°2. 133 Estefanía D, Tyrrell C, Bugallo F, Patrón Uriburu JC, Díaz L, Gómez A, Cillo M. Pesquisa del cáncer colorrectal en un hospital de comunidad: experiencia, resultados y eficacia del método. Rev Argent Coloproct 2011; 22:10-15. 134 Kariya A, et al : A case of early colonic cancer type II c associated whit familial polyposis colonic. I to cho (Stomach and Intestine) 12:1359, 1977. 135 Pastore Rita L.O., Svidler Lopez Laura, Ganduglia J.M. Ochoa F. Pólipos Colorrectales no hereditarios. Rev.Arg.Coloproct.; 20: 111-176. 136 Premio Anual Sociedad Argentina de Coloproctologia."Accesit 1977" Tema "Pólipos Rectocolonicos.S u tratamiento mediante Fibroen-doscopia, con corte y coagulación fría". 341 137 Espeche A.N. Pólipos del Colon y Recto. Rev. Arg. de Cirugía 1971; 21: 203-5. 138 Rodriguez Martín J.A. Tratamiento del Pólipo con cáncer invasor. Rev. Arg.Coloproct. 1999 ; N° extr. 1,10: 66-7. 139 Donelly,J.H. Polipectomia transcolonoscópica. Consideraciones clínica y resultados.Rev.Arg. de Cirugía 1979.36: 171-76. 140 Ruiz Pedro, Pollastri E., Tavella O.S. Polipectomía endoscópica colónica raconto de siete años. Prens.Med.Arg.1986, 73: 498-500. 141 Arias j., Castiglione J., Espeche A. Pólipos del Colon y Recto. Diagnóstico y Tratamiento. Experiencia multicentrica con un bisturí de radiofrecuencia. Rev.Arg.Coloproct. 1998; 9:5-30. 142 Pastore R.,Coronado Quesada E. Concetti H.,Sanchez Basso A.,Alvarez S., Reusmann A. Polipectomia endoscópica y manejo de los Pólipos colorrectales malignos. Experiencia de 20 años. Rev.Arg.Coloproct. 2002; 13: 62-8. 143 Drikman D., Riddel R., Flat adenomas and flat carcinomas: do you see what I see?, Gastrointestinal Endoscopy 37/70/51387, 1994. 144 Kariya A, et al : A case of early colonic cancer type II c associated whit familial polyposis colonic. I to cho (Stomach and Intestine) 12:1359, 1977 145 Kudo S, et al: Endoscopic Diagnosis and treatment of flat or depressed type early colorectal cancers. I to Cho stomach and intestine 24: 317, 1989 146 Graziano A, Ramirez R, Collia Avila, Rectocolitis ulcerosa inespecífica: Tratamiento quirúrgico Cirugía Digestiva, F. Galindo. www.sacd.org.ar, 2009; III-351: 1-18. 147 Edwards FC, Truelove S C: The course and prognosis of Ulcerative Colitis. Short term prognosis. Gut 1964; 4:299 148 Jalan KN, Circus W, Cord WI, et al. An experience with ulcerative colitis: toxic dilatation in 55 cases. Gastroenterology 1969; 57:68-82. 149 Abdo Francis JM. El valor ce la Colonoscopia en el estudio de la enfermedad inflamatoria del colon. Cap. 58. Procedimientos Endoscopicos en Gastroenterologia. Ed. Panamericana. 2°edicion. 2009 150 ASGE guideline: endoscopy in the diagnosis and treatment of inflammatory bowel disease. Gastrointestinal Endoscopy. 2006; 63(4). 342 151 Zwas FR, Cirillo NW, El-Serag HB, et al. Colonic mucosal abnormalities associated with oral sodium phosphate solution. Gastrointest Endosc 1996;43:463-6. 152 Rejchrt S, Bures J, Siroky M, et al. A prospective, observational study of colonic mucosal abnormalities associated with orally administered sodium phosphate for colon cleansing before colonoscopy. Gastroint. Endosc 2004; 59:651-4. 153 Lengelling RW, Mitros FA, Brennan JA, et al. Ulcerative ileitis encountered at ileocolonoscopy: likely role of nonsteroidal agents. Clin Gastroenterol Hepatol 2003; 1:160-9. 154 Tedesco FJ, Hardin RD, Harper RN, et al. Infectious colitis endoscopically simulating inflammatory bowel disease: a prospective evaluation.Gastrointest Endosc 1983;29:195-7. 155 Chutkan RK, Wayne JD. Endoscopy in inflammatory bowel disease.In: Kirshner JB, editor. Inflammatory bowel disease. 5th ed. Baltimore:Williams & Wilkins; 2000. p. 453-77. 156 Rutgeerts P. Strategies in the prevention of post-operative recurrence in Crohn’s disease. Best Pract Res Clin Gastroenterol 2003;17:63-73. 157 Ramzan NN, Leighton JA, Heigh RI, et al. Clinical significance of granuloma in Crohn’s disease. Inflamm Bowel Dis 2002;8:168-73. 158 Chong AKH, Taylor A, Miller A, et al. Capsule endoscopy vs. push enteroscopy and enteroclysis in suspected small-bowel Crohn’s disease.Gastrointest Endosc 2005;61:255-61. 159 Dubcenco E, Jeejeebhoy KN, Petroniene R, et al. Capsule endoscopy findings in patients with established and suspected small-bowel Crohn’s disease: correlation with radiologic, endoscopic, and histologic findings. Gastrointest Endosc 2005;62:538-44. 160 Eliakim R, Suissa A, Yassin K, et al. Wireless capsule video endoscopy compared to barium follow-through and computerized tomography in patients with suspected Crohn’s diseasedfinal report. Dig Liver.Dis 2004;36:519-22. 161 Furukawa A, Yamasaki M, Furuichi K, et al. Helical CT in the diagnosis of small bowel obstruction. Radiographics 2001;21:341-55. 343 162 Boudiaf M, Soyer P, Terem C, et al. CT evaluation of small bowel obstruction. Radiographics 2001;21:613-24. 163 Sandborn WJ, Tremaine WJ, Batts KP, et al. Pouchitis after ileal pouch-anal anastomosis: a pouchitis disease activity index. Mayo Clin Proc 1994; 69:409-15. 164 Shen B, Achkar J-P, Lashner BA, et al. Endoscopic and histologic evaluations together with symptom assessment are required for the diagnosis of pouchitis. Gastroenterology 2001;121:261-7. 165 Zhu H, Wu X, Queener E, Kiran R, Remzi F, Shen B; Clinical value of surveillance pouchoscopy in asymptomatic ileal pouch patients with underlying inflammatory bowel disease. 166 Surg Endosc. 2013 Nov;27(11):4325-32. Nicholls R. 18 th Annual International Col.Rec. Diseases Sympsium. Cleveland Clinic. Fl. 2007. 167 Fazio V, Shen B, Lashner B, et al. Comprehensive evaluation of inflamatory sequele of Ileal Pouch anal anast. Am J Gastr 2005; 100: 93-101. 168 Graziano A. Comentario al Relato Oficial de Coloproctología 2010. Complicaciones intraabdominalesde la Cirugía Colorectal- complicaciones de las Cirugías del Pouch Ileal. Rev.Arg. Coloproctología 2010; 22:127-254. 169 Baistrocchi H. Lorenzo M.“Flat Lasions. Western Experience”. ACTAS DEL XVIII Congreso of the Internacional Society of University CÓLON and Rectal Súrgenos. San Pablo. Brasil. Julio 2000. 170 R. Nicholls. 18 th Annual International Col.Rec. Diseases Sympsium. Cleveland Clinic. Fl. 2007. 171 Jaramillo E., et al. Small, flat colorectal neoplasias in long – standing ulcerative colitis detected by high – resolution electronic video endoscopy. Gastrointestinal Endoscopy 1996; 44(1):15. 172 Blackstone MO, Riddell RH, Rogers BH, Levin B. Dyplasia-associated lesion or mass (DALM) detected by colonoscopy in longstaning ulcerative colitis: an indication for colectomy. Gastroenterology, 80(2): 366-74. 173 Hurlstone DP, Sanders DS, Lobo AJ, Mc Alindon ME, Cross SS. Indigo carmineassisted high-magnification chromoscopic colonoscopy for the detection and 344 characterisation of intraepithelial neoplasia in ulcerative colitis: a prospective evaluation. Endoscopy 2005; 37(12):1186-92. 174 Velayos, FS. Colorectal Cancer and IBD -- What Does the Evidence Say? MPH Medscape Gastroenterology. 2007; ©2007 Medscape Posted 05/23/2007. 175 Itzkowitz SH, Yio X. Inflammation and cancer IV. Colorectal cancer in inflammatory bowel disease: the role of inflammation. Am J Physiol 2004; 287:G7-G17. 176 Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer. A population-based study. N Engl J Med. 1990; 323:1228-1233. 177 Lutgens MW, Vleggarr FP, Oldenburg B, et al. Screening and surveillance for colorectal carcinoma in patients with ulcerative colitis and Crohn's disease: Are current surveillance guidelines adequate? Interim analysis of a retrospective multicenter descriptive study. Gastroenterology 2007; 132:A-66. 178 Kandiel AE, Lashner B, Achkar K, et al. Chromoendoscopy for colonic dysplasia surveillance in inflammatory bowel disease. Gastroenterology. 2007;132:A-66. 179 Marion JF, Waye JD, Present DH, et al. Methylene blue dye-spray targeted biopsies are superior to standard colonoscopic surveillance biopsies for detecting dysplasia in patients with ulcerative and Crohn's colitis: A prospective endoscopic trial. Gastroenterology. 2007;132:A-67. 180 Bernstein CN, Weinstein WM, Levine DS, Shanahan F. Physicians' perceptions of dysplasia and approaches to surveillance colonoscopy in ulcerative colitis. Am J Gastroenterol. 1995; 90:2106-2114. 181 Kiesslich R, Neurath MF. Surveillance colonoscopy in ulcerative colitis: magnifying chromoendoscopy in the spotlight. Gut 2004; 53:165-167. 182 Kandiel AE, Lashner B, Achkar K, et al. Chromoendoscopy for colonic dysplasia surveillance in inflammatory bowel disease. Gastroenterology. 2007;132:A-66. 183 Marion JF, Waye JD, Present DH, et al. Methylene blue dye-spray targeted biopsies are superior to standard colonoscopic surveillance biopsies for detecting dysplasia in patients with ulcerative and Crohn's colitis: A prospective endoscopic trial. Gastroenterology. 2007;132:A-67. 184 Bernstein CN, Shanahan F, Weinstein WM. Are we telling patients the truth about surveillance colonoscopy in ulcerative colitis? Lancet 1994; 343:71-74. 345 185 Velayos F, Terdiman JP, Liu L, et al. Probability of occult cancer in ulcerative colitis with dysplasia: A modern assessment. Gastroenterology. 2007; 132:A-67. 186 Kisiel JB, Loftus EV, Harmsen WS, et al. Outcome of sporadic adenomas and adenoma-like DALMs in patients with ulcerative colitis. Gastroenterology 2007; 132:A-37. 187 Laurent Beaugerie, M.D., Ph.D., and Steven H. Itzkowitz, M.D. Cancers Complicating Inflammatory Bowel Disease. N Engl J Med 2015; 372:1441-1452. 188 Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology 2012; 142:46.e42-54. 189 Duricova D, Pedersen N, Elkjaer M, Gamborg M, Munkholm P, Jess T. Overall and cause-specific mortality in Crohn’s disease: a meta-analysis of population-based studies. Inflamm Bowel Dis 2010;16:347-353. 190 Jess T, Gamborg M, Munkholm P, Sørensen TI. Overall and cause-specific mortality in ulcerative colitis: meta-analysis of population-based inception cohort studies. Am J Gastroenterol 2007;102:609-617. 191 Jess T, Gamborg M, Munkholm P, Sørensen TI. Overall and cause-specific mortality in ulcerative colitis: meta-analysis of population-based inception cohort studies. Am J Gastroenterol 2007;102:609-617. 192 Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136:E359-E386. 193 Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer: a population-based study. N Engl J Med 1990; 323:1228-1233. 194 Jess T, Simonsen J, Jorgensen KT, Pedersen BV, Nielsen NM, Frisch M. Decreasing risk of colorectal cancer in patients with inflammatory bowel disease over 30 years. Gastroenterology 2012;143:375.e1-381.e1. 195 Beaugerie L, Svrcek M, Seksik P, et al. Risk of colorectal high-grade dysplasia and cancer in a prospective observational cohort of patients with inflammatory bowel disease. Gastroenterology 2013;145:166.e8-175. 346 196 Rubin DT, Huo D, Kinnucan JA, et al. Inflammation is an independent risk factor for colonic neoplasia in patients with ulcerative colitis: a case-control study. Clin Gastroenterol Hepatol2013;11:1601.e4-1608.e4. 197 Gupta RB, Harpaz N, Itzkowitz S, et al. Histologic inflammation is a risk factor for progression to colorectal neoplasia in ulcerative colitis: a cohort study. Gastroenterology2007; 133:1099-1105 198 Beaugerie L, Svrcek M, Seksik P, et al. Risk of colorectal high-grade dysplasia and cancer in a prospective observational cohort of patients with inflammatory bowel disease. Gastroenterology 2013; 145:166.e8-175. 199 Lutgens MW, Vleggaar FP, Schipper ME, et al. High frequency of early colorectal cancer in inflammatory bowel disease. Gut 2008;57:1246-1251. 200 Rubin DT, Huo D, Kinnucan JA, et al. Inflammation is an independent risk factor for colonic neoplasia in patients with ulcerative colitis: a case-control study. Clin Gastroenterol Hepatol2013; 11:1601-1608. 201 Gupta RB, Harpaz N, Itzkowitz S, et al. Histologic inflammation is a risk factor for progression to colorectal neoplasia in ulcerative colitis: a cohort study. Gastroenterology 2007; 133:1099-1105. 202 Rutter M, Saunders B, Wilkinson K, et al. Severity of inflammation is a risk factor for colorectal neoplasia in ulcerative colitis. Gastroenterology 2004; 126:451-459. 203 Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001;.48:526-535. 204 Lutgens MW, van Oijen MG, van der Heijden GJ, Vleggaar FP, Siersema PD, Oldenburg B. Declining risk of colorectal cancer in inflammatory bowel disease: an updated meta-analysis of population-based cohort studies. Inflamm Bowel Dis 2013; 19:789-799. 205 Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA Jr, Kinzler KW. Cancer genome landscapes. Science 2013; 339:1546-1558. 206 Itzkowitz SH, Yio X. Inflammation and cancer IV. Colorectal cancer in inflammatory bowel disease: the role of inflammation. Am J Physiol Gastrointest Liver Physiol 2004;287:G7-G17. 347 207 Galandiuk S, Rodriguez-Justo M, Jeffery R, et al. Field cancerization in the intestinal epithelium of patients with Crohn’s ileocolitis. Gastroenterology 2012; 142:855.e8864.e8. 208 Risques RA, Lai LA, Himmetoglu C, et al. Ulcerative colitis-associated colorectal cancer arises in a field of short telomeres, senescence, and inflammation. Cancer Res 2011; 71:1669-1679. 209 Brentnall TA, Crispin DA, Rabinovitch PS, et al. Mutations in the p53 gene: an early marker of neoplastic progression in ulcerative colitis. Gastroenterology 1994; 107:369-378. 210 Scarpa M, Castagliuolo I, Castoro C, et al. Inflammatory colonic carcinogenesis: a review on pathogenesis and immunosurveillance mechanisms in ulcerative colitis. World J Gastroenterol 2014; 20:6774-6785. 211 Rubin DT, Rothe JA, Hetzel JT, Cohen RD, Hanauer SB. Are dysplasia and colorectal cancer endoscopically visible in patients with ulcerative colitis? Gastrointest Endosc 2007; 65:998-1004. 212 Beaugerie L, Itzkowitz SH. REVIEW ARTICLE. Dan L. Longo, Editor. N Engl J Med 2015; 372:1441-1452April 9, 2015DOI: 10.1056/NEJMra1403718. 213 Fujiya M, Maemoto A, Saitoh Y, Nomura M, Fujiya M, et al. Minute findings by magnifying colonoscopy are useful for the evaluation of ulcerative colitis. Gastrointest Endosc 2002; 56:535-42. 214 Dissanayake A, Truelove SC. A controlled therapeutic trial of long-term maintenance treatment of ulcerative colitis with sulphasalazine (Salazopyrin). Gut 1973; 14:923-6. 215 Mulder CJ, Tytgat GNJ, Weterman IT, Dekker W, Blok P, Schrijver M, et al. Doubleblind comparison of slow-release 5-aminosalicylate and sulfasalazine in remission maintenance in ulcerative colitis. Gastroenterology 1988; 95:1449-53. 216 Truelove SC, Jewell DP. Intensive intravenous regimen for severe attacks of ulcerative colitis. Lancet 1974; 1:1067-70. 217 Ruddell WS, Dickinson RJ, Dixon MF, Axon ATR. Treatment of distal ulcerative colitis (proctosigmoiditis) in relapse: comparison of hydrocortisone enemas and rectal hydrocortisone foam. Gut 1980;21:885-9. 348 218 Goldstein F. Immunosuppressant therapy of inflammatory bowel disease. J Clin Gastroenterol 1987; 9:654-8. 219 Lichtiger S, Present DH, Kornbluth A, Gelernt I, Bauer J, Galler G, et al. Cyclosporine in severe ulcerative colitis refractory to steroid therapy. N Engl J Med 1994; 30:18411845. 220 Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines in adults. Am J Gastroenterol 1997;92:204-11. 221 Rampton DS, MacNeil NI, Sarner M. Analgesic ingestion and other factors preceding relapse in ulcerative colitis. Gut 1983; 24:187-9. 222 Binder V. A comparison between clinical state, macroscopic and microscopic appearance of rectal mucosa, and cytologic picture of mucosal exudate in ulcerative colitis. Scand J Gastroenterol 1970; 5:627-32. 223 Riley SA, Mani V, Goodman MJ, Dutt S, Herd ME. Microscopic activity in ulcerative colitis: what does it mean? Gut 1991; 32:174-8. 224 Binder V. A comparison between clinical state, macroscopic and microscopic appearance of rectal mucosa, and cytologic picture of mucosal exudate in ulcerative colitis. Scand J Gastroenterol 1970; 5:627-32. 225 Powell-Tuck J, Day DW, Buckell NA, Wadsworth J, Lennard-Jones JE. Correlations between defined sigmoidoscopy appearances and other measures of disease activity in ulcerative colitis. Dig Dis Sci 1982; 27:533-7. 226 Beattie RM, Nicholls SW, Domizia P, Williams CB, Walker-Smith JA. Endoscopic assessment of the colonic response to corticosteroids in children with ulcerative colitis. J Paediatr Gastroenterol Nutr 1996;22:373-9. 227 Games P, Boulay CD, Smith CL, Holdstock G. Relationship between disease activity indices and colonoscopic findings in patients with colonic inflammatory bowel disease. Gut 1986; 27:92-5. 228 Nishizawa M, Okada T, Sato F, Kariya A, Mayama S, Nakamura K. A clinicopathological study of minute polypoid lesions of the colon based on magnifying fiber-colonoscopy and dissecting microscopy. Endoscopy 1980; 12:124-9. 349 229 Tada M, Misaki F, Shimono M, Motoi S, Suto Y, Katoh S, et al. Endoscopic studies on the minute structures of colonic mucosa in the follow-up observation of ulcerative colitis. Gastroenterologia Japonica 1978; 13:72-6. 230 Matts SFG. The value of rectal biopsy in the diagnosis of ulcerative colitis. Quarterly J Med 1961; 30:393-407. 231 Lindström, C. (1976) 'Collagenous colitis' with watery diarrhoea – a new entity? Pathol Eur 11: 87–89. 232 Bodil Ohlsson, MD, PhD. New Insights and Challenges in Microscopic Colitis. Ther Adv Gastroenterol. 2015; 8(1):37-47. 233 Hulley SB, Cummings SR. Designing clinical research. 1st ed. Baltimore (MD): Williams & Wilkins; 1988. 234 Miller RG. Survival analysis. New York (NY): John Wiley & Sons; 1981. 235 Cox DR. Regression models and life tables (with discussion). J Roy Statist Soc 1972; B74:187-220. 236 Hurlstone DP, Thomson M, Brown S, Tiffin N, Cross SS, Hunter MD. Confocal endomicroscopy in ulcerative colitis: differentiating dysplasia-associated lesional mass and adenoma-like mass. Clin Gastroenterol Hepatol 2007; 5:1235-1241. 237 Baistrocchi, H. Hemorragias Digestivas bajas, algoritmo diagnóstico. Rev Arg Coloproct 1999; 10:55-58. 238 Eisen GM, Dominitz JA, Faigel DO, Goldstein JL, Kalloo AN, et al; American Society for Gastrointestinal EndoscopY. Standards of Practice Committee. An annotated algorithmic approach to acute lower gastrointestinal bleeding. Gastrointest Endosc 2001; 53(7):859-63. 239 ASGE Guideline: the role of endoscopy in the patient with lower GI bleeding. Gastr Intest End 2005; 62(5):656-60. 240 Latif, JA. Hemorragia Digestiva Grave. Relato Oficial del 32 Congreso Argentino de Coloproctología. Rev Argent Coloproct 2007; 18:392. 241 Zuckerman GR, Prakash C, Askin MP, Lewis BS, AGA technical review on the evaluation and management an occult and obscure gastrointestinal bleeding. Gastroenterol 2000; 118:201-21. 350 242 Talley NJ, Jones M. Self-reported rectal bleeding in a United States community: prevalence, risk factors, and health care seeking. Am J Gastroenterol. Nov 1998; 93(11):2179-83. 243 Cagir B, Chico GF, Consulting Staff, Christus Coushatta Rural Health Clinic et al. Lower Gastrointestinal Bleeding. Review, Medscape.com.2013. 244 Leiro FO. Hemorragia digestiva baja grave. Capítulo 20. Pag. 235-44 en Abdomen agudo de origen colónico en Hequera JA, Latif JA. Editorial Akadia. 2004. Buenos Aires Argentina. 245 Farrell JJ; Friedman LS. Review Article: The management of lower gastrointestinal bleeding.. Aliment Pharmacol. Ther. 2005;21 (11): 1281-1298. 246 Elsen GM, Dominitz JA, et al.ASGE standar of practice Committee.An annotated algorithmic approach. Gastr Intest Endosc 2001; 53:859-63. 247 Longstreth, GF. Epidemiology and outcome of patients hospitalized with acute lower gastrintestinal hemorrhage: a population based study. Am J Gastroent 1997; 92:41924. 248 Farrel JJ, Friedman L. Gastrointestinal bleeding in the ederly. Gastroenterol Clinic North Am 2001; 30:377-407. 249 Jensen DM, Machinado GA. Diagnosis and treatment of severa haematochezia. The role of urgent colono after purge. Gastroenterology 1988; 95:1569-74. 250 251 Rossini FP, Ferrari A, et al. Emergency colonoscopy. Word J Surg 1989;13 190-92. Ojea Quintana, G. Revisión: Hemorragia Digestiva Baja. Rev Arg Coloprot 2006; 17:215-225. 252 ASGE Standards of Practice Committee, Laurel Fisher, MD, Mary Lee Krinsky, DO, Michelle A. Anderson, MD, Vasundhara Appalaneni, MD, Subhas Banerjee, MD, Tamir Ben-Menachem, MD, Brooks D. Cash, MD, G. Anton Decker, MD, Robert D. Fanelli, MD (SAGES Representative), Cindy Friis, RN (SGNA Representative), Norio Fukami, MD, M. Edwyn Harrison, MD, Steven O. Ikenberry, MD, Rajeev Jain, MD, Terry Jue, MD, Khalid Khan, MD (NASPGHAN Representative), John T. Maple, DO, Laura Strohmeyer, RN (SGNA Representative), Ravi Sharaf, MD, Jason A. Dominitz, MD (MHS Committee Chair) The role of endoscopy in the management of obscure GI 351 bleeding. Gastrointestinal Endoscopy.Volume 72, Issue 3 , Pages 471-479, September 2010. 253 Vernava AM, Moore BA, Longo WE, Jhonson FE. Lower gastrointestinal bleeding. Dis Col Rectum 1977; 40; 846-58. 254 Fearnhead, NS. Acute lower gastrointestinal bleeding. MEDICINE 2007; 35(3):164167. 255 Lin S, Suhocki PV, Ludwig KA, Shetzline MA. Gastrointestinal Bleeding in Adult Patients With Meckel's Diverticulum: The Role of Technetium 99m Pertechnetate Scan. South Med J 2002; 95(11). 256 Astiz J, Tinghitella G, et al. Ectasias vasculares del tubo digestivo. Rev Arg Coloprot 2004; 15(1-2):64-70. 257 Castiglioni L, Zanoni Y, et al. Preparacion del colon para procedimientos electivos en endoscopia y cirugía. Rev Arg Coloproct 1999; 10(1):20-29. 258 Beart, RW. Diagnostic and therapeutic approaches to lower gastrointestinal hemorrhage. 18th Annual International Colorectal Disease Symposium. Cleveland Clinic. Florida Febr. 15-17 2007.Vol. 3. 259 Rodríguez Martín, JA. Métodos Diagnósticos en Hemorragia Digestivas bajas. Uso racional. Ventajas y desventajas. Rev Arg Coloprot 2001; 12(2):56-58. 260 Hequera, J. Métodos auxiliares de diagnóstico en la enfermedad diverticular del colon. Rev Argent Coloproct 1988; 2:154-62. 261 Foutch PJ, Zimmermank.Diverticular Bleeding and the pigmented protuberance (sentinel clot) clinical implicationshistopatologyc correlation, an results of endoscopic intervention. Am J Gastroent 1996; 91:2589-93. 262 Bonadeo Lasalle, F. Nuevas estrategias en la Enfermedad Diverticular del Colon. Relato oficial. 30 Congreso Argentino de Coloproctologia. Rev Arg Coloproct 2006; 17:1-68. 263 Brar MS, Roxin G, Yaffe PB, et al. Colonoscopy following nonoperative management of uncomplicated diverticulitis may not be warranted. Dis Colon Rectum 2013; 56:1259–1264. 264 Mudhar H.Balsitis M. “Colonic angiodysplasia and true Diverticula; is there association?” Histopatology 2005; 46:81-8. 352 265 Schuetz A, Jauch KW. Lower Gastorintestinal bleeding, therapeutic strategies, surgical techniques and results. Langbecks Arch Surg 2001; 386:17-25. 266 Tatsuya Fujimaru, Kasuya Akahosi, et al Depat. Of Gastroenterol.Aso Izuka Hosp. Japan. Bleeding rectal Dieulafoy´s Lesion. Gastrointest.Endosc. Vol 57,2003 N 7, 922. 267 Seow-Choen HS, Eu KW, Tay SK. A simple and efective treatment for hemorrhagic radiation proctitis using formalin. Dis Col Rectum 1993; 36:135-138. 268 Lisehora GB, Rothemberg DA Radiation Proctitis. Semin Colon Rectal Surg 1993; 4:240-248. 269 Hardy RG; Brown RM; Miller SJ; Tselepis C; Morton DG; Jankowski JA; Sanders DS Department of Surgery, Clinical Research Institute, University of Birmingham, Birmingham, UK. Transient P-cadherin expression inradiation proctitis; a model of mucosal injury and repair. J Pathol 2002; 197(2):194-200. 270 Baistrocchi, H. La Colonoscopia en las Hemorragias Digestivas Bajas.V Congreso Paraguayo de Coloproctología y XIX Congreso Latinoamericano de Coloproctologia Asunción. Junio 2005. Actas. 271 Grund KE, Storek D, Farin G. Endoscopic argón plasma coagulation (APC) first clinical experiences in flexible endoscopy. Endosc Surg Allied Technol 1994; 2:42-46. 272 Cotti G, Seid V, Araujo S. Silva e Souza Jr., Habr-Gama A. Conservative therapies for hemorragic radiaton Proctitis a review. Hops Clin (Sao Paulo) 2003; vol 58. 273 Suzuki N, Arebi N, Saunders B. A novel method of treating colonic angiodysplasia. Gastrointest Endosc 2006; 64(3):424–27. 274 Bounds BC, Kelsey PB. Lower gastrointestinal bleeding. Gastrointest Endosc Clin N Am 2007;17:273-88, vi. 275 Cattáneo D., Cheli JD. Complicaciones intraabdominales de la cirugía colorrectal. Relato Oficial del 35 Congreso Argentino de Coloproctología. Rev Argent Coloproct 2010, 22:127-254. 276 Hui AJ, et al. Risk of colonoscopic polypectomy with anticoagulants and antiplatelet agents: analysis of 1657 cases. Gastrointestinal Endosc 2004; 59: 44-48. 277 Parra Blanco A, Kaminaga N et al. Colonoscopic Polypectomy with cutting current: is it safe? Gastrointest Endosc 2000; 51:690-696. 353 278 Gossum AV, Cozzoli A, et al. Colonoscopic snare polypectomy: analysis of 1485 resections comparing two types if current. Gastrointest Endosc 1992; 38: 472-475. 279 Singh M, Mehta N, Murthy UK. Postpolypectomy bleeding in patients undergoing colonoscopy on uninterrupted clopidogrel therapy. Gastrointestinal Endoscopy 2010; 71(6):998-1005. 280 Sonnenberg, A. Manejo de la hemorragia pospolipectomía tardía: un análisis de decisión. Clin Gastroenterol Hepatol 2013. 281 Kaminaga, K. Hemoclipping for postpolypectomy and post biopsy colonic bleeding. Gastrointest Endosc 2000; 51:37-41. 282 Cave DR, Ell C. Introduction: global perspectives on double ballon enteroscopy. Gastroint Endosc 2007; 66(3):S2. 283 Yamamoto, H. Foreword: Double baloon Endoscopy. Gastroint Endosc 2007; 66(3):S1. 284 Chao F, Yue ZH, et al. Diagnostic value of double baloon enteroscopy for small intestinal diseases. Experience from China. Gastrointest Endosc 2007; 66(3):19-21. 285 Bramley PN, Masson JW, McKnight G, et al. The role of an open-access bleeding unit in the management of colonic haemorrhage: a 2-year prospective study. Scand J Gastroenterol 1996; 31:764-9. 286 Farrell JJ, Friedman LS. Gastrointestinal bleeding in the elderly. Gastrointest Endosc Clin N Am 2001; 30:377-407. 287 Laine L, Yang H, Chang SC, et al. Trends for incidence of hospitalization and death due to GI complications in the United States from 2001 to 2009. Am J Gastroenterol 2012; 107:1190-5. 288 Savides TJ. Lower GI bleeding. In: Ginsberg GG, Kochman ML, Norton ID, et al, editors. Clinical gastrointestinal endoscopy, 2nd ed. St. Louis (MO): Elsevier; 2012:164-72. 289 Longstreth GF. Epidemiology and outcome of patients hospitalized with acute lower gastrointestinal hemorrhage: a population-based study. Am J Gastroenterol 1997; 92:419-24. 290 Peura DA, Lanza FL, Gostout CJ, et al. The American College of Gastroenterology Bleeding Registry: preliminary findings. Am J Gastroenterol 1997; 92:924-8. 354 291 Zuckerman GR, Prakash C. Acute lower intestinal bleeding: part I:clinical presentation and diagnosis. Gastrointest Endosc 1998; 48: 606-17. 292 Richter JM, Hedberg SE, Athanasoulis CA, Schapiro RH. Angiodysplasia. Clinical presentation and colonoscopic diagnosis. Dig Dis Sci 1984; 29(6):481-5. 293 Barnert J, Messmann H. Lower intestinal bleeding disorders. In: Classen M, Tytgat GN, Lightdale CJ, editors. Gastroenterological Endoscopy, 2nd ed. New York: Thieme; 2010. p. 641-57. 294 Hokama A, Uehara T, Nakayoshi T, et al. Utility of endoscopic hemoclipping for colonic diverticular bleeding. Am J Gastroenterol 1997;92:543-6. 295 Kaltenbach T, Watson R, Shah J, et al. Colonoscopy with clipping is useful in the diagnosis and treatment of diverticular bleeding. Clin Gastroenterol Hepatol 2012;10:131-7. 296 Wong Kee Song LM, Baron TH. Endoscopic management of acute lower gastrointestinal bleeding. Am J Gastroenterol 2008;103:1881-7. 297 Wong Kee Song LM, Baron TH. Endoscopic management of acute lower gastrointestinal bleeding. Am J Gastroenterol 2008;103:1881-7. 298 Laine L, Yang H, Chang SC, et al. Trends for incidence of hospitalization and death due to GI complications in the United States from 2001 to 2009. Am J Gastroenterol 2012;107:1190-5. 299 Tal Raphaeli, Raman Menon. Current Treatment of Lower GastrointestinalHemorrhage. Clin Colon Rectal Surg 2012;25:219–227. 300 Parker DR, Luo X, Jalbert JJ, Assaf AR. Impact of upper and lower gastrointestinal blood loss on healthcare utilization and costs: a systematic review. J Media Econ 2011;14(3):279–287. 301 Zhao Y, Encinosa W. Hospitalizations for gastrointestinal bleeding in 1998 and 2006. Healthcare Cost and Utilization Project (HCUP) Statistical Brief #5. Rockville, MD: Agency for Healthcare Research and Quality; 2008). 302 Yahchouchy EK, Marano AF, Etienne JC, Fingerhut AL. Meckel’s diverticulum. J Am Coll Surg 2001;192(5):658–662. 355 303 Elitsur Y, Teitelbaum JE, Rewalt M, Nowicki M. Clinical and endoscopic data in juvenile polyposis syndrome in preadolescent children: a multicenter experience from the United States. J Clin Gastroenterol 2009; 43(8):734–736. 304 Robert JR, Sachar DB, Greenstein AJ. Severe gastrointestinal hemorrhage in Crohn’s disease. Ann Surg 1991; 213(3):207–211. 305 Casarella WJ, Kanter IE, Seaman WB. Right-sided colonic diverticula as a cause of acute rectal hemorrhage. N Engl J Med 1972; 286(9):450–453. 306 Meyers MA, Alonso DR, Gray GF, Baer JW. Pathogenesis of bleeding colonic diverticulosis. Gastroenterology 1976; 71 (4):577–583. 307 Reinus JF, Brandt LJ. Vascular ectasias and diverticulosis. Common causes of lower intestinal bleeding. Gastroenterol Clin North Am.1994 ;23(1):1–2018. 308 McGuire HH Jr. Bleeding colonic diverticula. A reappraisal of natural history and management. Ann Surg 1994; 220(5):653–656. 309 Laine L, Shah A. Randomized trial of urgent vs. elective colonoscopy in patients hospitalized with lower GI bleeding. Am J Gastroenterol 2010; 105(12): 2636–2641. 310 Strate LL. Lower GI bleeding: epidemiology and diagnosis. Gastroenterol Clin North Am 2005; 34 (4):643–664. 311 Hoedema RE, Luchtefeld MA. The management of lower gastrointestinal hemorrhage. Dis Colon Rectum 2005; 48(11):2010–2024. 312 Córdoba Villalobos JA, de la Torre Bravo A. Procedimientos Endoscópicos en Gastroenterología. 2ª. Edición. Editorial Panamericana.2009. p.547. 313 Winawer y Col. 2001 (1) Dr. Ubaldo Gualdrini. Jornadas de COLORMED. 2001. 314 Burn J, Bishop DT, Mecklin JP, McRae F, et al. Effect of aspirin or resistant starch on colorectal neoplasia in the Lynch syndrome. N Engl J Med. 2008; 359(24):2567-78 315 Levin B, Lieberman D, et al. Screening and Surveillance for de early detection of de Colorectal Cancer and Adenomatous Polyps, 2008: A Joint Guide lance from de American Cancer and de American College of Radiology. CA Cancer J Clinic March 2008. 316 Cordoba Villalobos JA, de la Torre Bravo A., Editorial Panamericana. Mexico. 2009. 356 317 Ishikawa T, et al. Natural history of colorectal adenoma. I to Cho. Stomach and Intestine 1989; 24:167. 318 Kudo, S. Early Colorectal Cancer Detection of Depressed Types of Colorectal Carcinoma.// IGAKU-SHOIN Ltda. Tokyo. 1996 319 Dukes C. Simple tumors of the large intestine and their relationship to cancer. Br J Surg 1926; 13:720-733. 320 Jackman, RJ, Mayo CW. The adenoma-carcinoma sequence in cancer of the colon. Surg Gynecol Obstet 1951; 93:327-330. 321 Fearon ER, Voglestein B. A genetic model for colorectal tumorogenesis, Cell 1990; 61:759-767. 322 Jong A, Morreau H, Nagengast FM, Mathus-Vliegen EM, Kleibeuker JH, et al. Prevalence of adenomas among young individuals at average risk for colorectal cancer. Am J Gastroenter 2005; 100(1):139-143. 323 Winaver SJ, Schotlenfeld D, Flehinger BJ. Colorectal Cancer Screening. J Nat Cancer Inst 1991; 83:24353. 324 Tierney RP, Ballantyne G., Modlin IM, The adenoma to carcinoma sequence. Surg Gynecol Obstet 1990; 171:81-94. 325 Donnely E, Salomon M, Bugallo F, Tyrrell C, Patron Uriburu J, David M. Adenoma Vellosos de Colon y Recto, su relación con el Cáncer. Nuestra Experiencia. Rev Arg Cir 2001; 81(3-4):71-79. 326 Bossisio O, Graziano A, Ramirez P, Gomez C. Resección transanal de los Adenomas Vellosos del Recto. Análisis retrospectivo. Rev Arg Cir 2001; 81(3-4):96-106. 327 Muto T, Bussey HJ, Morson BC. The evolution of cancer of the colon and rectum. Cancer 1975; 36:2251-70. 328 Zoller S, Joos A, Dinter D, et al. Retrorectal Tumors; Excision by transanal endoscopic microsurgery. Rev Esp Enferm Dig 2007; 99(9):547-50. 329 Baistrocchi, H. Pólipo con Cáncer invasor. ¿Cuándo la Polipectomía es suficiente? Seguimiento Post-Polipectomía. Rev Arg Coloproct 2001; 12:15-19. 330 Baistrocchi H, Lorenzo N, Lorenzo M, Spitale L, Baistrocchi J, Godoy M, Canals N. Diagnosi e Trattamento delle lesioni Colorettali precoci mediante Cromoendoscopia e Magnificazione Endoscopica: “La Cromoendoscopia 357 Limpiego dei Coloranti in Endoscopia Digestiva”. Felice Cosentino e Roberta Motta. Editoriale: Directed SRL. Ravizza Milán Italia, pp59-72. 2002. 331 Haggitt RC, Gloztbach RE, et al. Prognostic factors in colorectal carcinomas arising in adenomas: implications for lesions removed by endoscopic polypectomy. Gastroenterology 1985; 89:328-36. 332 Fenoglio-Preiser CM, Noffsinger AE, Stemmerman GN, et al. Gastrointestinal Pathology. Atlas and Text. Lippincott-Raven. Philadelphia, New York.1998. p.961 333 Johansen G, Momsen O, Jacobsen NO. Polyps of the large intestine in Arthus, Denmark, Scan J Gastroenterol 1989; 24:799. 334 Stryker SJ, Wolf BG, Culp CE, Libbe SD, Ilstrip DM, Mac Cartky RL. Natural History of Untreated Colonic Polyps. Gastroenterology 1987; 93:10091013. 335 Haggitt RC, Glotzbach RE, Soffer EE, Wruble LD. Prognostic factors in colorectal cardcinomas arising in adenomas; implications for lesions removed by endoscopic polypectomy. Gastroenterology 1985; 89:328-36. 336 Morson BC, Whiteway JE, Jones EA, Macrae FA, Williams CB. Alimentary tract and Pancreas. Histopathology and prognosis of malignant colorectal Polyps treated by endoscopic polypectomy. Gut 1984; 25: 437-44. 337 Gordon P, Nivatongs S. Neoplasms of the Colon Rectum, and anus. Second Edition; Informa Healtcare USA, Inc. 2007. 338 Nakamura K, et al : Adenoma – carcinoma sequence of colorectal carcinomas analyzed by use of objective indices of grade of a typicality, and their growing process in early phase. I to Cho stomach and intestine 1985; 20:887. 339 Bossisio O, Graziano A, Ramirez P, Gomez C, Resección transanal de los Adenomas Vellosos del Recto. Análisis retrospectivo. Rev Arg Cir 2001; 81(3-4):96-106. 340 Christansen J, Kirkegaard P. ,Prognosis after treatment of Villous adenoma of the colon an rectum. Ann Surg 1979, 189:404-8. 358 341 Bossisio O, Graziano A, Ramirez P, Gomez C, Resección transanal de los Adenomas Vellosos del Recto. Análisis retrospectivo. Rev. Arg Cir 2001; 81(3-4):96-106. 342 Kariya A, et al : A case of early colonic cancer type II c associated whit familial polyposis colonic. I to cho (Stomach and Intestine) 1977; 12:1359. 343 Igaku-Shon, Early Colorectal Cancer, detection of depressed types of Colorectal Carcinoma. Tokyo-New York. 1996 344 Japanese Research Society for cancer of the colon and rectum: general rules for clinical and pathological studies on cancer of the colon, rectum and anus, 5° edition (in japanese ), 58, 1994 345 Baistrocchi H, Lorenzo N, Lorenzo M, Spitale L, Baistrocchi JD, Godoy M., Canals N. Diagnosi e Trattamento delle lesioni Colorettali precoci mediante Cromoendoscopia e Magnificazione Endoscopica: “La Cromoendoscopia Limpiego dei Coloranti in Endoscopia Digestiva”. Felice Cosentino e Roberta Motta. Editoriale: Directed SRL. Ravizza Milán Italia P.59-72. Enero 2002. 346 Vaccaro C, Varela E, Lastiri J, Santa Fé L. Latin Grafic SRL.Del Hospital Ediciones. 2007 347 Ushio K, et al. Retrospective radiographic study of colonic carcinoma. I to Cho (Stomach and Intestine) 1979; 14:537. 348 Kudo, Shin–ei. Early Colorectal Cancer Detection of Depressed Types of Colorectal Carcinoma.// IGAKU-SHOIN Ltda. Tokyo. 1996. 349 Hurlstone DP, Sanders DS, Lobo AJ, Mc Alindon ME, Cross SS. Indigo Carmine-assisted Chromoscopic colonoscopy for the detection and characterization of intraepithelial neoplasia in ulcerative colitis : a prospective evaluation. Endoscopy 2005; 1186-92. 350 Mori Yuichi, Shin-ei Kudo, Kunihiko Wakamura, et al. Novel computer-aided diagnostic system for colorectal lesions by using endocytoscopy. Gastrointest Endosc 2014;79:AB357. 351 Arya A., Yan B. Ultra high magnification endoscopy: Is seeing really believing? World J Gastrointest Endosc. 2012 October 16; 4(10): 462-471. 359 352 Meroni E, Gatteschi B, Fasoli A, Munizzi F, Frascio F, Pugliese V, Truini M. Detection of tissue abnormalities in normal mucosa surrounding colorectal cancer using an endocytoscopy system. Endoscopy. 2007;39:369. 353 Cipolletta L, Bianco MA, Rotondano G, Piscopo R, Meucci C, Prisco A, Cipolletta F, de Gregorio A, Salvati A. Endocytoscopy can identify dysplasia in aberrant crypt foci of the colorectum: a prospective in vivo study. Endoscopy. 2009;41:129-132. 354 Levin B, Lieberman DA, McFarland B, Smith RA, Brooks D, Andrews KS, Dash C, Giardiello FM, Glick S, Levin TR. Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology. CA Cancer J Clin. 2008;58:130-160. 355 Buchner AM, Shahid MW, Heckman MG, Krishna M, Ghabril M, Hasan M, Crook JE, Gomez V, Raimondo M, Woodward T. Comparison of probebased confocal laser endomicroscopy with virtual chromoendoscopy for classification of colon polyps. Gastroenterology. 2010;138:834-842. 356 Stallmach A, Bielecki C, Schmidt C. Malignant transformation in inflammatory bowel disease - surveillance guide. Dig Dis. 2009;27:584590. 357 Ali S, Tamboli CP. Advances in epidemiology and diagnosis of inflammatory bowel diseases. Curr Gastroenterol Rep. 2008;10:576-584. 358 Goetz M, Kiesslich R. Advances of endomicroscopy for gastrointestinal physiology and diseases. Am J Physiol Gastrointest Liver Physiol. 2010;298:G797-G806. 359 Smith LA, Tiffin N, Thomson M, Cross SS, Hurlstone DP. Chromoscopic endomicroscopy: in vivo cellular resolution imaging of the colorectum. J Gastroenterol Hepatol. 2008;23:1009-1023. 360 East JE, Guenther T, Saunders BP. Novel approaches in colorectal endoscopy: what do we need biopsies for?. Pathol Res Pract. 2008;204:459-467. 360 361 Yamakawa K; Naito S, Kanai J. Superficial staining of gastric lesions by fibroscopy. Proceedings of the first Congress of the International Society of Endoscopy. Tokyo: 1966: 586-590. 362 Muto T., et al : The evolution of cancer of the colon and rectum. Cancer 36: 2251, 1975. 363 Drikman D, Riddel R. Flat adenomas and flat carcinomas : do you see what I see? Gastrointestinal Endoscopy 1994; 37(70):51387. 364 Kariya A, et al : A case of early colonic cancer type II c associated whit familial polyposis colonic. I to cho (Stomach and Intestine) 1977; 12:1359. 365 Kudo S, et al: Endoscopic Diagnosis and treatment of flat or depressed type early colorectal cancers. I to Cho ( stomach and intestine ) 24: 317, 1989. 366 Fujiya M, Saitoh Y, et. Al. Gastrointest Endosc 2002; 56(4):535-542. Fujiya M, Saitoh Y, et. Al. Gastrointest Endosc 2002; 56(4):535-542. 367 Jaramillo E, et al. Small, flat colorectal neoplasias in long – standing ulcerative colitis detected by high – resolution electronic video endoscopy. Gastrointestinal Endoscopy 1996; 44(1):15. 368 Kudo S.,et al : Colorectal tumors and pitt pattern. J Clin pathol. 47:880, 1994. 369 Kudo S.,et al : Colorectal tumors and pitt pattern. J Clin pathol. 47:880, 1994. 370 Baistrocchi H., “Flat Lesions. Western Experience” XVIII Congress of the International Society of University Colon and Rectum Surgeons. San Pablo. Brasil. Jul.2000. 371 Sharmila Anandasabapathy, MD. Endoscopic Imaging: Emerging Optical Techniques for the Detection of Colorectal Neoplasia. Curr Opin Gastroenterol. 2008;24(1):64-69. 372 Sharmila Anandasabapathy, MD. Endoscopic Imaging: Emerging Optical Techniques for the Detection of Colorectal Neoplasia. Curr Opin Gastroenterol. 2008;24(1):64-69. 373 Brown SR, Baraza W, Hurlstone P. Chromoscopy versus conventional endoscopy for the detection of polyps in the colon and rectum. Cochrane Database Syst Rev. 2007; (4):CD006439 (ISSN: 1469-493X)( PreMedline Identifier:17943910. 361 374 High-definition and high-magnification endoscopes. Gastrointestinal Endoscopy Volume 80, Issue 6, Pages 919–927, December 2014 375 Le Rhun M, Coron E, Parlier D, et al. High resolution colonoscopy with chromoscopy versus standard colonoscopy for the detection of colonic neoplasia: a randomized study. Clin Gastroenterol Hepatol 2006; 4:349– 354. 376 Kahi CJ, Anderson JC, Waxman I, et al. High-definition chromocolonoscopy vs. high-definition white light colonoscopy for average-risk colorectal cancer screening. Am J Gastroenterol 2010; 105:1301–1307. 377 Basford PJ, Longcroft-Wheaton G, Higgins B, et al. High-definition endoscopy with i-Scan for evaluation of small colon polyps: the HiSCOPE study. Gastrointest Endosc 2014; 79:111–118. 378 Rastogi, A., Early, D.S., Gupta, N. et al, Randomized, controlled trial of standard-definition white-light, high-definition white-light, and narrow-band imaging colonoscopy for the detection of colon polyps and prediction of polyp histology. Gastrointest Endosc. 2011;74:593–602. 379 Pereyra L, Gómez EJ, González R, Fischer C, Eraña GB, Torres AG, Correa L, Mella JM, Panigadi GN, Luna P, Pedreira SC, Cimmino DG, Boerr LA, Finding sessile serrated adenomas: is it possible to identify them during conventional colonoscopy? Dig Dis Sci. 2014 Dec;59(12):3021-6. 380 Pastore R, et al. Pólipos Colorrectales no Hereditarios. Rev. Arg. de Coloproct 2009; 20:111-176. 381 Higuchi T, Jass JR. My Approach to Serrated polyps of the colorectum. J Clin Pathol 2004: 57:682-6. 382 Wong W-M, Mandir N, Goodlad R A, Wong B C Y, Garcia S B, Lam S-K, Wright N A Histogenesis of human colorectal adenomas and hyperplastic polyps: the role of cell proliferation and crypt fission. Gut 2002;50:212–217. 383 Wong W-M, Mandir N, Goodlad R A, Wong B C Y, Garcia S B, Lam S-K, Wright N A Histogenesis of human colorectal adenomas and hyperplastic polyps: the role of cell proliferation and crypt fission. Gut 2002;50:212–217. 384 Kudo, Shin–ei. Early Colorectal Cancer Detection of Depressed Types of Colorectal Carcinoma.// IGAKU-SHOIN Ltda. Tokyo. 1996. 362 385 Baistrocchi H, Lorenzo N, Lorenzo M, Spitale L, Baistrocchi J, Godoy M, Canals N. Diagnosi e Trattamento delle lesioni Colorettali precoci mediante Cromoendoscopia e Magnificazione Endoscopica: “La Cromoendoscopia Limpiego dei Coloranti in Endoscopia Digestiva”. Felice Cosentino e Roberta Motta. Editoriale: Directed SRL. Ravizza Milán Italia P.59-72. Enero 2002. 386 The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach and colon. Gastroint Endosc 2003; 58(6 Suppl.) 387 Schlemper RJ, Hirata I, Dixon MF. The macroscopic classification of early neoplasia of the digestive tract. Endoscopy 2002;34:163-8.16. 388 Sweetser S, Smyrk TC, Sugumar a. Serrated Polyps. Critical Precursors to Colorectal Cancer. Rev Gastroenterol Hepatol 2011; 5(5):627-635. 389 Carragher LAS, Snell KR, Giblett SM et al. V600E BRAF induces gastrointestinal crypt senescence and promotes tumour progression through enhanced CpG methylation of p16. EMBO Mol Med 2010; 11:458–471. 390 Snover DC, Ahnen DJ, Burt RW et al. Serrated polyps of the colon and rectum and serrated ('hyperplastic') polyposis. In: WHO Classification of Tumours. Pathology and Genetics. Tumours of the Digestive System (4th Edition). Bozman FT, Carneiro F, Hruban RH (Eds). Springer–Verlag, Berlin, Germany, 2010. 391 Mäkinen MJ. Colorectal serrated adenocarcinoma. Histopathology 2007; 50:131– 150. 392 Spring KJ, Zhao ZZ, Karamatic R et al. High prevalence of sessile serrated adenomas with BRAF mutations: a prospective study of patients undergoing colonoscopy. Gastroenterology 2006; 131:1400–1407. 393 O'Brien, MJ. Hyperplastic and serrated polyps of the colorectum. Gastroenterol. Clin N Am 2007; 36:947–968. 394 Boparai KS, Dekker E, van Eden S et al. Hyperplastic polyps and sessile serrated adenomas as a phenotypic expresion of MYH-associated polyposis. Gastroenterology 2008; 135:2014–2018. 363 395 Goldstein NS, Bhanot P, Odish E, Hunter S. Hyperplastic-like colon polyps that preceded microsatellite-unstable adenocarcinomas. Am J Clin Pathol 2003; 119:778–796. 396 Goldstein, NS. Small colonic microsatellite unstable adenocarcinomas and highgrade epithelial dysplasias in sessile serrated adenoma polypectomy specimens: a study of eight cases. Am J Clin Pathol 2006; 125:132–145. 397 Torlakovic E, Skovlund E, Snover DC, Torlakovic G, Nesland JM. Morphologic reappraisal of serrated colorectal polyps. Am J Surg Pathol 2003; 27:65–81. 398 Groff RJ, Nash R, Ahnen DJ. Significance of serrated polyps of the colon. Current Gastroenterol Rep 2008; 10:490–498. 399 Seth Sweetser, Thomas C Smyrk, Aravind Sugumar. Serrated Polyps. Critical Precursors to Colorectal Cancer. Rev Gastroenterol Hepatol. 2011;5(5):627-635. 400 Seth Sweetser, Thomas C Smyrk, Aravind Sugumar. Serrated Polyps. Critical Precursors to Colorectal Cancer. Rev Gastroenterol Hepatol 2011; 5(5):627-635. 401 Snover DC, Jass JR, Fenoglio-Preiser C et al. Serrated polyps of the large intestine: a morphologic and molecular review of an evolving concept. Am J Clin Pathol 2005; 124:380–391. 402 Snover DC. Serrated polyps of the large intestine. Semin Diagn Pathol 2005; 22:301– 308. 403 Oka S, Tanaka S, Hiyama T et al. Clinicopathologic and endoscopic features of colorectal serrated adenoma: differences between polypoid and superficial types. Gastrointest Endosc 2004; 59:213–219. 404 Goldstein NS, Bhanot P, Odish E, Hunter S. Hyperplastic-like colon polyps that preceded microsatellite-unstable adenocarcinomas. Am J Clin Pathol 2003; 119:778–796. 405 Vogelstein B, Fearon ER, Hamilton SR et al. Genetic alterations during colorectaltumor development. N Engl J Med 1988; 319:525–532. 406 Jeevaratnam P, Cottier DS, Browett PJ, Van De Water NS, Pokos V, Jass JR. Familial giant hyperplastic polyposis predisposing to colorectal cancer: a new hereditary bowel cancer syndrome. J Pathol 1996; 179:20–25. 364 407 Sheridan TB, Fenton H, Lewin MR et al. Sessile serrated adenomas with low- and high-grade dysplasia and early carcinomas: an immunohistochemical study of serrated lesions 'caught in the act'. Am J Clin Pathol 2006; 126:564–571. 408 East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol Clin North Am 2008; 37:25–46. 409 East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol Clin North Am 2008; 37:25–46. 410 Baxter NN, Goldwasser MA, Paszat LF, Saskin R, Urbach DR, Rabeneck L. Association of colonoscopy and death from colorectal cancer. Ann Intern Med 2009; 150:1–8. 411 Terdiman JP, McQuaid KR. Surveillance guidelines should be updated to recognize the importance of serrated polyps. Gastoenterology 2010; 139:1444–1447. 412 Froehlich F, Wietlisbach V, Gonvers JJ, Burnand B, Vader JP. Impact of colonic cleansing on quality and diagnostic yield of colonoscopy: the European Panel of Appropriateness of Gastrointestinal Endoscopy European multicenter study. Gastrointest Endosc 2005; 61:378–384. 413 East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol Clin North Am 2008; 37:25–46 414 Kimura T, Yamamoto E, Yamano H, Suzuki H, Kamimae S, Nojima M, Sawada T, et al. A Novel Pit Pattern Identifies the Precursor of Colorectal Cancer Derived From Sessile Serrated Adenoma. Am J Gastroenterol 2012; 107(3):460-469. 415 Hetzel J, Huang C, Coukos J et al. Variation in the detection of serrated polyps in an average risk colorectal cancer screening cohort. Am J Gastroenterol 2010; 105:2656–2664. 416 Boparai KS, van den Broek FJ, van Eeden S et al. Hyperplastic polyposis syndrome: a pilot study for the differentiation of polyps by using high-resolution endoscopy, autofluorescence imaging, and narrow-band imaging. Gastrointest Endosc 2009; 70:947–955. 365 417 Kudo S, Tamura S, Nakajima T et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointest Endosc 1996; 44:8–14 418 Kudo S, Lambert R, Allen J et al. Nonpolypoid neoplastic lesions of the colorectal mucosa. Gastrointest Endosc 2008;68:S3–47 419 Morita T, Tamura S, Miyazaki J et al. Evaluation of endoscopic and histopathological features of serrated adenoma of the colon. Endoscopy 2001; 33:761–765. 420 Oka S, Tanaka S, Hiyama T et al. Clinicopathologic and endoscopic features of colorectal serrated adenoma: differences between polypoid and superficial types. Gastrointest Endosc 2004; 59:213–219. 421 Kimura T, Yamamoto E, Yamano H, Suzuki H, Kamimae S, Nojima M, et al. A Novel Pit Pattern Identifies the Precursor of Colorectal Cancer Derived From Sessile Serrated Adenoma. Am J Gastroenterol 2012; 107(3):460-469. 422 Butterly L, Robinson LM, Anderson JC, Weiss JE, Goodrich M, Onega TL, Amos CI, Beach ML. Serrated and Adenomatous Polyp Detection Increases With Longer Withdrawal Time. Am J Gastroenterol 2014; 109(3):417-426. 423 Pereyra L, Gómez EJ, González R, Fischer C, Eraña GB, Torres AG, Correa L, Mella JM, Panigadi GN, Luna P, Pedreira SC, Cimmino DG, Boerr LA. Finding sessile serrated adenomas: is it possible to identify them during conventional colonoscopy? Dig Dis Sci 2014; 59(12):3021-6. 424 Ng SC, Ching JYL, Chan VCW, Wong MSC, Tang R, Wong S, Luk AKC, Lam TYT, Gao Q, Chan AWH, Wu JCY, Chan FKL, Lau JYW, Sung JJY. Association Between Serrated Polyps and the Risk of Synchronous Advanced Colorectal Neoplasia in Average-risk Individuals. Aliment Pharmacol Ther 2015; 41(1):108-115. 425 Bird, RP. Observation and quantification of aberrant crypts in the murine colon treated whit a colon carcinogen; preliminary findings. Cancer Lett 1987; 37:147-51. 426 Pretlow TP, O'Riordan MA, Pretlow TG, Stellato TA. Aberrant crypts in human colonic mucosa: putative preneoplastic lesions. J Cell Biochem Suppl 1992; 16G:5562. 427 Bird, RP. Role of aberrant crypt foci in understanding the pathogenesis of colon cancer. Toxicol Lett 2000; 112-113:395-402. 366 428 Yokota T, SuganoK, KondoH, Saito Dsugihara K, Fukayama N, Ohkura H, Ochiai A, Yoshida S. Detection of aberrant crypt foci by magnifying colonoscopy. Gastrointest Endosc 1997; 46:61-65. 429 Adler DG, Gostout CJ. Endoscopic idetificatification and quantification of aberrant crypt foci in the human colon. Gastrointest Endosc 2002; 56(5):657-62. 430 Adler, DG. Aberrant Crypt Foci as Biomarkers for Colonic Dysplasia. Nat Clin Pract Gastroenterol Hepatol. 2005 Sep;2(9):390-1 431 Turrell, R. Enfermedades del Ano Recto y Colon. T. I. Cap. 17 y 18 Ed-Beta. Buenos Aires. 1962. 432 Pastore R, et al. Pólipos Colorrectales no Hereditarios. Rev. Arg. de Coloproct 2009; 20:111-176. 433 Bockus HL, Gastroenterología Salvat SA. Barcelona 1948 434 Repici A, Tricerri R. Endoscopic polipectomy: techniques, complicattions and followup. Tec Coloproctol 2004; 8:S28-90. 435 Rex, DK. Flat Lesions Becoming More Prevalent in the U.S. Journal Watch Gastroenterology March 21, 2008. Disponible en: http://www.medscape.com/viewarticle/572334 436 Ushio K, et al. Retrospective radiographic study of colonic carcinoma. I to Cho Stomach and Intestine 1979; 14:537. 437 Hintze RE, Adler A, Veltzke W. Endoscopic resection of large colorectal adenomas: a combination of snare and laser ablation. Endoscopy 1995; 27(9):665-70. 438 Zlatanic J, Waye JD, Kim PS, et al. Large sessile colonic adenomas: use of argon plasma coagulator to supplement piecemeal snare polypectomy. Gastrointest Endosc 1999; 49:731-7359. 439 Brooker JC, Saunders BP, Shah SG, et al. Treatment with argon plasma coagulation reduces recurrence after piecemeal resection of large sessile colonic polyps: a randomized trial and recommendations. Gastrointest Endosc 2002; 55:371-375. 440 Hurlstone DP, Cross SS, Slater R, Sanders DS, Brown S Detecting diminutive colorectal lesions at colonoscopy: a randomized controlled trial of pan-colonic versus targeted chromoscopy. Gut. 2004;53:376-380. 367 441 Kashida H, Kudo SE. Early colorectal cancer: concept, diagnosis, and Management. Int J Clin Oncol 2006; 11(1):1-8. 442 Kobayashi N, Yoshitake N, Hirahara Y, Konishi J, Saito Y, Matsuda T, Ishikawa T, Sekiguchi R, Fujimori T. Matched Case-control Study Comparing Endoscopic Submucosal Dissection and Endoscopic Apr 25, 2012 .Mucosal Resection for Colorectal Tumors. J Gastroenterol Hepatol 2012; 27(4):728-733. 443 Fukami N, Lee JH. Endoscopic Treatment of Large Sessile and Flat Colorectal Lesions. Curr Opin Gastroenterol 2006; 22(1):54-59. 444 Baistrocchi J, Baistrocchi H, Correa L, Werenitzky M. Resección Mucosa Endoscópica en Grandes Pólipos Unidad Digestiva Baistrocchi, Córdoba, Argentina. 35º Congreso Argentino de Coloproctologia Actas 2010. 445 Von Roon AC, Tekkis PP, Clark SK, Heriot AG, Lovegrove RE, Truvolo S, Nicholls RJ, Phillips RK. The impact of technical factors on outcome of restorative proctocolectomy for familial adenomatous polyposis. Dis Colon Rectum 2007; 50(7):952-61. 446 Hurlstone DP, Cross SS, Slater R, Sanders DS, Brown S Detecting diminutive colorectal lesions at colonoscopy: a randomized controlled trial of pan-colonic versus targeted chromoscopy. Gut. 2004;53:376-380 447 Conio M, Repici A., Demarquay J, Blanchi S, Dumas R, Filiberti R, RME of large sessile colorrectal polyps Gastrointest Endosc. 2004; 60:234-41. 448 Church, JC. Experience in the endoscopic management of large colonic Polyps ANZ J Surg 2003; 73:988-95. 449 Salama M, Ormonde D, Quach T, Ee H, Yusoff I. Outcomes of Endoscopic Resection of Large Colorectal Neoplasms: An Australian Experience. J Gastroenterol Hepatol. 2010; 25(1):84-89. 450 Frank JC van den Broek, Eelco JR de Graaf, Marcel GW Dijkgraaf, Johannes B Reitsma, Jelle Haringsma, Robin Timmer, Bas LAM Weusten, Michael F Gerhards, Esther CJ Consten, Matthijs P Schwartz, Maarten J Boom, Erik J Derksen, A Bart Bijnen, Paul HP Davids, Christiaan Hoff, Hendrik M van Dullemen, G Dimitri N Heine, Klaas van der Linde, Jeroen M Jansen, Rosalie CH Mallant-Hent, Ronald Breumelhof, Han Geldof, James CH Hardwick, Pascal G Doornebosch, Annekatrien 368 CTM Depla, Miranda F Ernst, Ivo P van Munster, Ignace HJT de Hingh, Erik J Schoon, Willem A Bemelman, Paul Fockens, Evelien Dekker. Transanal Endoscopic Microsurgery versus Endoscopic Mucosal Resection for Large Rectal Adenomas (TREND-study). BMC Surgery 2009, 9:4 doi:10.1186/1471-2482-9-4. 451 Wang YP, Bennett C, Pan T: Endoscopic mucosal resection for early gastric cancer. Cochrane Database Syst Rev 2006, CD004276. 452 Ell C, May A, Gossner L, Pech O, Günter E, Mayer G, Henrich R, Vieth M, Müller H, Seitz G, et al.: Endoscopic mucosal resection of early cancer and high-grade dysplasia in Barrett's esophagus. Gastroenterology 2000, 118:670–677. 453 Bories E, Pesenti C, Monges G, Lelong B, Moutardier V, Delpero JR, Giovannini M: Endoscopic mucosal resection for advanced sessile adenoma and early-stage colorectal carcinoma. Endoscopy 2006, 38:231–235. 454 Kanamori T, Itoh M, Yokoyama Y, Tsuchida K: Injection-incision – assisted snare resection of large sessile colorectal polyps.Gastrointest Endosc 1996, 43:189–195. 455 Hurlstone DP, Sanders DS, Cross SS, George R, Shorthouse AJ, Brown S: A prospective analysis of extended endoscopic mucosal resection for large rectal villous adenomas: an alternative technique to transanal endoscopic microsurgery. Colorectal Dis 2005, 7:339–344. 456 Buess G, Kipfmuller K, Hack D, Grussner R, Heintz A, Junginger T: Technique of transanal endoscopic microsurgery. Surg Endosc 1988, 2:71–75 457 Karita M, Tada M, Okita K, Kodama T: Endoscopic therapy for early colon cancer: the strip biopsy resection technique.Gastrointest Endosc 1991, 37:128–132. 458 Hurlstone DP, Sanders DS, Cross SS, George R, Shorthouse AJ, Brown S: A prospective analysis of extended endoscopic mucosal resection for large rectal villous adenomas: an alternative technique to transanal endoscopic microsurgery.Colorectal Dis 2005, 7:339–344. 459 Middleton PF, Sutherland LM, Maddern GJ: Transanal endoscopic microsurgery: a systematic review. Dis Colon Rectum 2005,48:270–284. 460 Lin GL, Meng WC, Lau PY, Qiu HZ, Yip AW: Local resection for early rectal tumours: Comparative study of transanal endoscopic microsurgery (TEM) versus posterior trans-sphincteric approach (Mason's operation). Asian J Surg 2006,29:227–232. 369 461 Doornebosch PG, Tollenaar RA, Gosselink MP, Stassen LP, Dijkhuis CM, Schouten WR, et al.: Quality of life after transanal endoscopic microsurgery and total mesorectal excision in early rectal cancer. Colorectal Dis 2007, 9:553–558. 462 Hurlstone DP, Sanders DS, Cross SS, George R, Shorthouse AJ, Brown S: A prospective analysis of extended endoscopic mucosal resection for large rectal villous adenomas: an alternative technique to transanal endoscopic microsurgery.Colorectal Dis 2005, 7:339–344. 463 Schafer H, Baldus SE, Holscher AH: Giant adenomas of the rectum: complete resection by transanal endoscopic microsurgery (TEM). Int J Colorectal Dis 2006, 21:533–537. 464 Guerrieri M, Baldarelli M, Morino M, Trompetto M, Da RA, Selmi I, et al.: Transanal endoscopic microsurgery in rectal adenomas: experience of six Italian centres. Dig Liver Dis 2006, 38:202–207. 465 Mihai R, Borley N: Transanal endoscopic microsurgery – impact on the practice of a colorectal surgeon in a district general hospital. Ann R Coll Surg Engl 2005, 87:432– 436. 466 Rokke O, Iversen KB, Ovrebo K, Maartmann-Moe H, Skarstein A, Halvorsen JF: Local resection of rectal tumors by transanal endoscopic microsurgery: experience with the first 70 cases. Dig Surg 2005, 22:182–189. 467 Katti G: An evaluation of transanal endoscopic microsurgery for rectal adenoma and carcinoma. JSLS 2004, 8:123–126. 468 Richard S. Kwon, MD, David L. Carr-Locke, MD, FRCP. Closure of Endoscopic Perforations With Endoscopic Clips. Medscape Gastroenterology 4(2), 2002. © 2002 Medscape 469 Katsinelos P, Chatzimavroudis G. Endoclipping-assisted Resection of Large Colorectal Polyps. Surgical Laparoscopy, Endoscopy & Percutaneous Techniques: 2008; 18(1):19-23. 470 Cho SB, Lee WS, Joo YE, Kim HR, Park SW, Park CH, Kim HS, Choi SK, Rew JS SO Therapeutic options for iatrogenic colon perforation: feasibility of endoscopic clip closure and predictors of the need for early surgery. Surg Endosc. 2012 feb;26 (2):473-9. 370 471 Hayashi, T, Yonezawa, M, Kawabara, T AU The study on staunch clip for the treatment by endoscopy. Gastroenterol Endosc. 1975; 17:92. 472 Kuramata, H, et al. Evaluation of gastrofiberscope for treatment (TGF proto-type by Olympus Co) Stomach Intestine. 1974; 9:355. 473 Techniques for Difficult Polypectomy. Medscape. Oct 26, 2004. ww.medscape.com 474 Church JM. Avoiding surgery in patients with colorectal polyps. Dis Colon Rectum 2003; 46:1513-1516. 475 Brooker JC, Saunders BP, Shah SG, Williams CB. Endoscopic resection of large sessile colonic polyps by specialist and non-specialist endoscopists. Br J Surg 2002; 89:1020-1024. 476 Regula J, Wronska E, Nasierowska-Guttmejer A, Pachlewski J, Rupinski M, Butruk E. Argon plasma coagulation after piecemeal polypectomy of sessile colorectal adenomas: long-term follow-up study. Endoscopy. 2003; 35:212-218. 477 Walsh RM, Ackroyd FW, Shellito PC. Endoscopic resection of large sessile colorectal polyps. Gastrointest Endosc. 1992; 38:303-309. 478 Eisen G, Chutkan R, Goldstein JL, et al. ASGE Guidelines for colorectal cancer screening and surveillance. Gastrointest Endosc 2000; 51:777-782. 479 Bond JH. Polyp guideline: diagnosis, treatment, and surveillance for patients with colorectal polyps. Am J Gastroenterol. 2000; 95:3053-3063. 480 Winawer S.J. ZA, Fletelver R H et al Gudelines for Colonoscopy Surveillance after polypectomy, a concensus update by the US Multi Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterology 2006; 130:1872-85. 481 Van Stolk Rubgi, Baron JA, Adenoma characteristic at first colonoscopy as predictor of recurrence and characterisitic at follow up. The Polyp Prevention Study Group. Gastroent.1997; 115:13-18 482 Yang G, Sun QR, et al Pathologic features of initial adenomas as predictors of metachronous adenomas of the rectum. J Nat Cancer, Int. 1998, 90 1661-5. 483 Saitoh Y., Waxman I.,West AB, et al. Prevalence and distintive biologic features of flat colorectal adenomas in a North American population. Gastroenterology 2001; 120: 1657-1665 371 484 Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Guidelines for Colonoscopy Surveillance After Screening and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012; 143:844-857 485 Saini SD, Nayak RS, Kuhn L, Schoenfeld P. Why don't gastroenterologists follow colon polyp surveillance guidelines? Results of a national survey. J Clin Gastroenterol 2009; 43:554-558. 486 Zhu A and Willet G. Combined modality for rectal cancer. Semin Oncol 2005; 32: 103-112 487 Colorectal Cancer Collaborative Group. Adjuvant radiotherapy for rectal cancer: a systematic overview of 8507 patients from 22 randomized trials. Lancet 2001; 358: 1291-1304. 488 Vera Merino VV, Zunino S. Avances en el tratamiento de Radio quimioterapia adyuvante del Cáncer de Recto. Instituto de Radioterapia Oncológica – Fundación Marie Curie.(Córdoba – Argentina). 489 Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351:1731-40. 490 Sauer R, Liersch T. J clin. Oncol 30 ; 1926- 1933, 2012. 491 Abr-Gama A, Santhino PM, Souza B de, et al. Low Rectal Cancer impact of Radiation and Chemotherapy on surgical Treatment. Diseases of the Colon and Rectum 1998; 41(9). 492 Bujko K, Kepka L, Michalski W,et al. Does rectal cancer shrinkage induced by preoperative radio (chemo) therapy increase the likelihood of anterior resection? A systematic review of randomized trials. Radiotherapy and Oncology 2006; 80:4-12. 493 Sauer R, Becker H, Hohenberger W, et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351:1731-40 494 Abr-Gama A, Santhino PM, Souza B de , et al. Low Rectal Cancer impact of Radiation and Chemotherapy on surgical Treatment. Diseases of the Colon and Rectum. September 1998; 41(9) 495 Abr-Gama A, Santhino PM, Souza B de , et al. Low Rectal Cancer impact of Radiation and Chemotherapy on surgical Treatment. Diseases of the Colon and Rectum. September 1998; 41(9) 496 Martin ST, Heneghan HM. Systemic review an meta-analysis of outcomes following pathological complete response to neoadyvant chemoradiotherapy for rectal cáncer. Br Journal Surg , 2012. 497 Bujko K, Kepka L, Michalski W, et al. Does rectal cancer shrinkage induced by preoperative radio (chemo) therapy increase the likelihood of anterior resection ? A systematic review of randomized trials. Radiotherapy and Oncol. 2006 ;80:4-12 372 498 Bujko K, Kepka L, Michalski W, et al. Does rectal cancer shrinkage induced by preoperative radio (chemo) therapy increase the likelihood of anterior resection ? A systematic review of randomized trials. (Radiotherapy and Oncol. 2006 ;80:4-12 499 Habr-Gama A., Santinho B. de Souza PM, et al.Low Rectal Cancer.Impact of Radiation and Chemotherapy on Surgical Treatment. Dis.Colon and Rect. Vol.41,N°9. Sept.1998 500 Oliva Perez R.,Habr-Gama A.,Lym P.,et al. Utilidad de la biopsia endoscópica en pacientes con cáncer de recto con respuesta incompleta al tratamiento neoadyuvante. Es suficiente para descartar tumor viable? Rev. Coloproct Latinoamer 2012, 1:9-14 501 Glynne-Jones R, Hughes Critical Appraisal of the 'Wait and See' Approach in Rectal Cancer for Clinical Complete Responders After Chemoradiation R.Br J Surg. 2012;99:897-909 502 J-S Shin; T-G Tut; V Ho; C S Lee. Predictive Markers of Radiotherapy-Induced Rectal Cancer Regression. J Clin Pathol. 2014;67(10):859-864. 503 Edge SB, Byrd DR, Compton CC, et al. eds. AJCC cancer staging manual. New York, NY: Springer-Verlag, 2010:143–64 504 Berger C, de Muret A, Garaud P, et al. Preoperative radiotherapy (RT) for rectal cancer: predictive factors of tumor downstaging and residual tumor cell density (RTCD): prognostic implications. Int J Radiat Oncol Biol Phys 1997;37:619–27. 505 Mandard A-M, Dalibard F, Mandard J-C, et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer 1994;73:2680–6. 506 Bouzourene H, Bosman FT, Seelentag W, et al. Importance of tumor regression assessment in predicting the outcome in patients with locally advanced rectal carcinoma who are treated with preoperative radiotherapy. Cancer 2002;94:1121– 30. 507 Dworak O, Keilholz L, Hoffmann A. Pathological features of rectal cancer after preoperative radiochemotherapy. Int J Colorect Dis 1997;12:19–23 508 Morgan MJ, Koorey DJ, Painter D, et al. Histological tumour response to preoperative combined modality therapy in locally advanced rectal cancer. Colorect Dis 2002;4:177–83. 509 Santos MD, Silva C, Rocha A, et al. Prognostic value of Mandard and Dworak tumor regression grading in rectal cancer: study of a single tertiary center. ISRN Surg. Published Online First: 4 March 2014. doi: 10.1155/2014/310542 510 Söderlund K, Stål O, Skoog L, et al. Intact Mre11/Rad50/Nbs1 complex predicts good response to radiotherapy in early breast cancer. Int J RadiatOncol Biol Phys 2007;68:50–8. 373 511 Choudhury A, Nelson LD, Teo MT, et al. MRE11 expression is predictive of causespecific survival following radical radiotherapy for muscle-invasive bladder cancer. Cancer Res 2010;70:7017–26. 512 West CM, McKay MJ, Hölscher T, et al. Molecular markers predicting radiotherapy response: report and recommendations from an International Atomic Energy Agency technical meeting. Int J Radiat Oncol Biol Phys 2005;62:1264–73. 513 Glynne-Jones R, Hughes Critical Appraisal of the 'Wait and See' Approach in Rectal Cancer for Clinical Complete Responders After Chemoradiation R.Br J Surg. 2012;99:897-909. 514 Habr-Gama A, Sabbaga J, Gama-Rodrigues J, São Julião G, Proscurshim I, Bailão Aguilar P, NadalinW, Perez RO. Watch and Wait Approach Following Extended Neoadjuvant Chemoradiation for Distal Rectal Cancer: Are We Getting Closer to Anal Cancer Management? Diseases of the Colon Rectum 2013; 56(10): 1109– 1117. 515 Addison N.V. Pseudo-obstruction of the large bowel. J Royal Soc. Of Med. 76:25255, 1983. 516 Chousterman M., Petite JP. Prostaglandins and acute intestinal pseudoobstruction. Lancet 2: 138-9,1997. 517 Dudley Haf, Paterson B., Pseudoobstruction .Br.Med.J. 292:1157-8, 1986. 518 Dorudi S, Berry AR. Acute colonic pseudo-obstruction. Brit J Sur 1992; 79:99-103. 519 Vanek VW, Al-Salti M. Acute pseudo-obstruction of the colon (Ogilvie`s syndrome): an analysis of 400 cases. Dis Col Rect 1986; 29:203-210. 520 Santhat Nivatvongs. Complication of colonic Diseases. Edition1992. 521 Schlegel Rodolfo Daniel, H.J. Waisman. Pren.Med.Arg.1996. 522 Shan M, KodnerIJ. Colon Recto y Ano. Washington e Mc. Nevi School of Medicine. 2005. 523 Kokura J., Dent, T. Colonoscopic decopression of massive nonobstructive cecal dilatation.Arch Surg. 1977 112: 512-17. 524 Saradiego J., MatsumotoT, Colonoscopically guided tube decompression in Ogilvie’s síndrome. Dis.Co. and Rec.1991,34. 720-22. 525 Latif J, Leiro F, Brizuela G. Rev.Arg. de Coloproctol. 2005. 526 Tyrrell C, Patrón J, Bugallo F, Salomón M, Donnelly E. Hospital Británico. BsAs. Rev. Soc. Arg. Coloproctología. Sep. 2000. 527 Dorudi, Berri. Op cit. 528 Ghazi A, Shinya H, Wolff W. Treatment of volvulus of the colon by colonoscopy. Ann Surg 1976; 183:263. 529 Barredo C, Mancini B, Witis S, Minetti A. Vólvulos del colon. Rev Argent Cirug 1981; 41:183. 530 Heidenreich A. Vólvulos del intestino grueso. Patología aguda ano-recto-colónica. Cirugía Panamericana 1973; 3:66. 374 531 Habr Gama A, Simonsen A, Hadad J y col. Volvo do sigmoide. Rev Assoc Med Brasil 1968; 14:287. 532 Amarillo H. Megacolon del adulto. Tesis Univ. Nac. de Tuc. 1982. 533 Latif Jorge. Vólvulos Agudos del Colon.Rev.Aergent. Coloproct. 1993,5.45-52 534 C.Tyrrell,J. Patrón,F.Bugallo, M.Salomón y E. Donnelly H.Británico. BsAs. Rev.Soc.Arg.Coloproctología. Sep.2000. 535 Diccionario de Terminología Médica. Prof. León Cardenal. Fac. Ciencias Médicas. Madrid 536 Paccos JL, Maldonado Pourerio JF, Tratamiento endoscópico de la estenosis benigna de la anastomosis colorrectal. Cap 44. Tratamiento de las complicaciones en Endoscopia Terapéutica con base en la práctica. Editorial Amolca 2009 537 Johansson C. Endoscopic dilation of rectal strictures: a prospective study of 18 cases. Dis Colon Rectum 1996; 39(4):423-8. 538 Tools for endoscopic stricture dilation. Gastroentestinal Endoscopy. 391Volume 78, No. 3 : 2013 539 Sabate JM, Villarejo J, Bouhnik Y, et al. Hydrostatic balloon dilatation of Crohn’s strictures. Aliment Pharmacol Ther 2003;18:409-13. 540 Werre A, Mulder C, van Heteren C, et al. Dilation of benign strictures following low anterior resection using Savary-Gilliard bougies. Endoscopy 2000;32:385-8. 541 DiGiorgio P, De Luca L, Rivellini G, et al. Endoscopic dilation of benign colorectal anastomotic stricture after low anterior resection: a prospective comparison study of two balloon types. Gastrointest Endosc 2004;60:347-50. 542 Gimenez M. Empleo de prótesis expandibles metálicas en el tubo digestivo. Rev. Arg. de Cirugía 73 (1/2) 41-8. 1997 543 Boyle P. Some recent developments in the epidemiology of colorectal cancer. In: Bleiberg HRP, Wilke H-J, editors. Management of colorectal cancer. London: Martin Dunitz; 1998. pp. 19-34. 544 Ohman U. Prognosis in patients with obstructing colorectal carcinoma. Am J Surg 1982; 143:742-747. 545 Koruth NM, Krukowski ZH, Youngson GG, et al. Intra-operative colonic irrigation in the management of left-sided large bowel emergencies. Br J Surg 1985; 72:708-711. 375 546 Tan SG, Nambiar R, Rauff A, et al. Primary resection and anastomosis in obstructed descending colon due to cancer. Arch Surg 1991; 126:748-751. 547 Benati, M. Curso Internacional Hospital Italiano BsAs. 2000. 548 Schrock Theodore R. El Dominio de la Cirugía. Ed.Panamericana. 2004. p. 1805. 549 Pedro L, Dezanzo V, Romero O. Rev. Arg. Coloproct. 2004. 550 Ojea Quintana, C.Vaccaro, F. Bonadeo. “CA oclusivo del Colon Izquierdo” Curso Internacional Hospital Italiano BsAs. 2002. 551 Choo IW., Do YS, Suh SW, et al. Malignant colorectal obstruction: treatment with a flexible covered stent. Radiology 1998;206:415-421. 552 Saida Y, Sumiyama Y, Nagao J et al. Stent endoprosthesis for obstructing colorectal cancers. Dis Colon Rectum 1996;39:552-555. 553 Baron TH, dean PH, Yates MR, et al. Expandable metal stents for the treatment of colónico obstruction: techniques and outcomes. Gastrointest Endosc 1998;47:277286. 554 Mainar A, De Gregorio MA, Tejero E. et al. Acute colorectal obstruction: treatment with self expandable metallic stent before scheduled surgery: results of a multicenter study. Radiology 1999;210:65-69. 555 Canon CL, Baron TH, Morgan DE et al. Treatment of colonic obstruction with expandable metal stents: radiologic features. AJR Am J Roentgenol 1997;168:199205. 556 Vásquez Reta, A. Complicaciones de las Endoscopías. Cap.62. Procedimientos Endoscópicos en Gastroenterología. J.A.Córdoba Villalobos. A, de la Torre Bravo. Edit. Panam.Méjico.p.643. 557 AAED. Asociación Argentina de Endoscopía Digestiva. www.aaed.org.com 558 AAED Op cit 559 AAED Op cit 560 Bejar J, Sarria N, Baistrocchi H, Baistrocchi J. Unidad Digestiva Baistrocchi. Córdoba. Estudio comparativo Fentanilo-Propofol vs. Lidocaina-Propofol para Videocolonoscopia. Rev. Arg. Anest. 37 Congreso Argentino de Anestesiología. Volumen 66 · Nº 3 Suplemento Congreso. P. 215-216. 2008. 561 Vásquez Reta, A Op cit. 562 Cattáneo D., Cheli JD. Complicaciones intraabdominales de la cirugía colorrectal. Relato Oficial del 35 Congreso Argentino de Coloproctología . Rev. Argent. Coloproct. 2010, 22:127-254. 563 Mandeep Singh, MD, Nilesh Mehta, MD, Uma K. Murthy, MD. Postpolypectomy bleeding in patients undergoing colonoscopy on uninterrupted clopidogrel therapy. Gastrointestinal Endoscopy Volume 71, Issue 6 , Pages 998-1005, May 2010. 564 Eisen GM, Baron TH, Dominitz JA, et al.Guidelines on the management of anticoagulation and antiplatelet therapy for endoscop`y procedures. Gastrointestinal Endosc. 2002;55:775-779. 376 565 Tamai Y, Ishizawa TK, Takami H. Management of antiplatelet therapy for endoscopic procedures: ptimal cessation period of antiplatelet therapy for Japanese. Gastrointestinal Endosc. 2002; 55: 780783. 566 Salama M, Ormonde D, Quach T, Ee H, Yusoff E. Outcomes of Endoscopic Resection of large colorectal neoplasms: An Australian Experience. J. Gastroenterol Hepatol. 2010 ; 25 (1) : 84-89 567 Church JM, Experience in the endoscopic management of large colonic polyps. Anz J. Surg 2003; 73: 988-995. 568 Di Baise J, Thompson J. Diagnóstico , imagine and therapeutic techniques for colonic evaluation. Diseases of the Colon. Wexner S.2007 text book.Ed. 569 Aronchik C, Lipshults E, et al. A novel tableted purgative for colonoscopy preparation:efficacy and safety comparatión with Colyte and phospho soda. Gastrointest Endosc. 2000. 52:346-352. 570 Bigard M, Gaucher P, et al. Fatal colonic explosion during colonoscopy polipectomy. Gastroenterology 77. 1979. 1307-1310. 571 Landoni N. Complicaciones de las polipectomías endoscópicas. Congreso Italiano de Gastroenterología y Cirugía endoscópica. 2006. Nápoles. 572 Patrón Uriburu J, Amarillo H, Tyrrel C y col. Complicaciones de la videocolonoscopía. Estudio institucional. Rev Argent Coloproctología. 2005. 16(3). 200-202. 573 Kann B, Margolin D, et al.. The importance of colonoscopy in colorectal surgeons practices. Result of a survey. Dis Colon Rectum. 2006. 49 :763-767. 574 Donnelly E. y col. Experiencia en fibrocolonoscopía. Pren Med Arg. 1977, 64(6). 188. 575 Donnelly E y col. Polipectomía trans colonoscópica. Consideraciones clínicas. Resultados. Rev Argent Cirugía. 1979.(4) 576 Pollastri E, Ruiz D. y col.. Polipectomía endoscópica colónica. Raconto de siete años. Pren Med Argent. 1986 73;498-500. 577 Heindenreich A, Fisher M, y col. Colonoscopía.10 años e experiencia. Rev Argent Coloproctología 1993; 5:92-99 578 Kwon R, Carr-Locke D. Closure of endoscopic perforations whith Endoscopic Clips. Medscape Gastroenterology 4(2) 2002. www.medscape.com 579 Kavin H, Sinicrope F, Esker AH. Management of perforation of the colon at colonoscopy. Am. J Gastroenterol. 1992;87: 161-167. 580 Baistrocchi H., Baistrocchi J. "Pólipos Rectocolónicos. Conceptos histopatológicos. Su tratamiento mediante la endoscopia a fibra óptica del colon, con corte y coagulación fría 2 Congreso Nacional de Coloproctologia del Interior. Actas Congreso, p. 135. 1977. 581 Baistrocchi H., Baistrocchi J.,"Análisis de 200 Colonoscopias" 2 Congreso Nacional de Coloproctología del Interior. Actas Congreso, p. 420. Mar del Plata 1977. 582 Landoni N. Op cit 583 Rodriguez Martín JA.Metodos Diagnósticos en Hemorragia Digestivas bajas. Uso racional. Ventajas y desventajas. Rev. Arg. De Colopr. 2001. 12 Num extr. 2. 56-58. 584 Latif J.A., Leiro FO, Rizzello MC, et al. Hemorragias digestivas bajas graves. Rev. Argent Coloproct 1998; 9(3): 123-7. 585 Heindenreich A, Fisher M, y col. Colonoscopía.10 años e experiencia. Rev Argent Coloproctología 1993; 5:92-99. 586 Patrón Uriburu J, Amarillo H, Tyrrel C y col. Complicaciones de la videocolonoscopía. Estudio institucional. Rev Argent Coloproctología. 2005. 16(3). 200-202. 587 Donnelly E y col. Polipectomía trans colonoscópica. Consideraciones clínicas . Resultados. Rev Argent Cirugía. 1979. (4) 588 Pollastri E, Ruiz D. y col.. Polipectomía endoscópica colónica. Raconto de siete años. Pren Med Argent. 1986 73;498-500. 377 589 Artifon Everson LA, Sakai Paulo, et al Tratamiento de las Complicaciones en Endoscopia Terapéutica con base en la practica. Ediciones Amolca. 2009. 590 Christie JO, Marrazzo J, Miniperforation of the colon-not all postpolypectomy perforations requiere laparoyomy. Dis.Colon Rectum, 34 (2):132-135, 1991. 591 Iqbal CW, Chun YS, Farley DR. Colonoscopic perforation: a retrospective review. J.Gastroeintestinal Surg. 9(9):1229-123, 2005. 592 Rose Chan, MD, Don J. Selzer, MD, Endoclipping of Iatrogenic Colonic Perforation to Avoid Surgery, Surgical Endoscopy (2008;22:1500-1504. 593 Eric M. Haas, Rodrigo Pedraza, Madhu Ragupathi,Ali Mahmood, and T. Bartley Pickron. Laparoscopic Primary Colorrhaphy for Acute Iatrogenic Perforations during Colonoscopy. Minimally Invasive Surgery.Volume 2013 (2013) Article ID 823506. 594 Meralia N, and Hussain A. Laparoscopic endoloop technique – A novel approach of managing iatrogenic caecal perforation and literature review. Int J Surg Case Rep. 2015; 9: 31–33. 595 Korman L.Y., Overholt B.F., Box T., Winker C.K. Perforation during colonoscopy in endoscopic ambulatory surgical centers. Gastrointest. Endosc. 2003;58:554–557. 596 Shi X, Shan Y, Yu E, Fu C, Meng R, Zhang W. Lower rate of colonoscopic perforation: 110,785 patients of colonoscopy performed by colorectal surgeons in a large teaching hospital in China. Surg. Endosc. 2014;28:2309–2316. 597 Mathews J., Chin M., Fernandez-Esparrach G., Shaikh S., Pietramaggiori G., Thompson C. Early healing of transcolonic and transgastric natural orifice transluminal endoscopic surgery access sites. J. Am. Coll. Surg. 2010;210(April (4)):480–490. 598 Von Renteln D., Schmidt A., Vassiliou M.C., Rudolph H.U., Caca K. Endoscopic full-thickness resection and defect closure in the colon. Gastrointest. Endosc. 2010;71(7):1267–1273. 599 Hucl T, Benes M, Kocik M, Krak M, Maluskova J, Kieslichova E, et al. A novel double-endoloop technique for natural orifice transluminal endoscopic surgery gastric access site closure. Gastrointest. Endosc. 2010;71(April (4)):806–811. 600 Marshall John B. Incidence of complications after colonoscopy: capturing an elusive beast. Gastrointestinal Endoscopy Volume 73, Issue 3 , Pages 524-526, March 2011. 601 Silvis SE, Nebel O, Rogers G, et al. Endoscopic complications: results of the 1974 American Society for Gastrointestinal Endoscopy Survey. JAMA. 1976;235:928–930. 602 Cotton PB, Eisen GM, Aabakken L, et al. A lexicon for endoscopic adverse events: report of an ASGE workshop. Gastrointest Endosc. 2010;71:446–454. 603 Rabeneck L, Saskin R, Paszat LF. Onset and clinical course of bleeding and perforation after outpatient colonoscopy: a population-based study. Gastrointest Endosc. 2011;73-520-3. 604 Rabeneck L, Paszat LF, Hilsden RJ, et al. Bleeding and perforation after outpatient colonoscopy and their risk factors in usual clinical practice. Gastroenterology. 2008;135:1899–1906. 605 Rex DK, Petrini JL, Baron TH, et al. ASGE/ACG Taskforce on Quality in Endoscopy Quality indicators for colonoscopy. Gastrointest Endosc. 2006;63:S16–S28. 606 Leffler DA, Kheraj R, Garud S, et al. The incidence and cost of unexpected hospital use after scheduled outpatient endoscopy. Arch Intern Med. 2010;170:1752–1757. 607 Cotton PB, Eisen GM, Aabakken L, et al. A lexicon for endoscopic adverse events: report of an ASGE workshop. Gastrointest Endosc. 2010;71:446–454. 608 Damore LJ, Peter CR, Vernava AM,Walter EL Colonoscopic perforation. Dis. Colon Rectum, 39(11) 1308-1313, 1996. 609 Garrett KA, Church J. History of hysterectomy: a significant problem for colonoscopists that is not present in patients who have had sigmoid colectomy. Dis Colon Rectum. 2010 Jul;53(7):1055-60. 610 Amarillo HA, Manson R, Borquez V, García M, Tacchi P, Gorodner A, Baistrocchi J, Baistrocchi H, Rodríguez GM, Salomón M. Rev. Arg. de Coloprotogía . Volumen 25 Número 1:. 2014. 378 611 Lieberman DA, Rex DK, Winawer SJ, Giardielllo FM, Johnson DA. Guidelines for Colonoscopy Surveillance After Screening and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology 2012; 143:844–857. 379