Problemas Bloques d y f
Anuncio
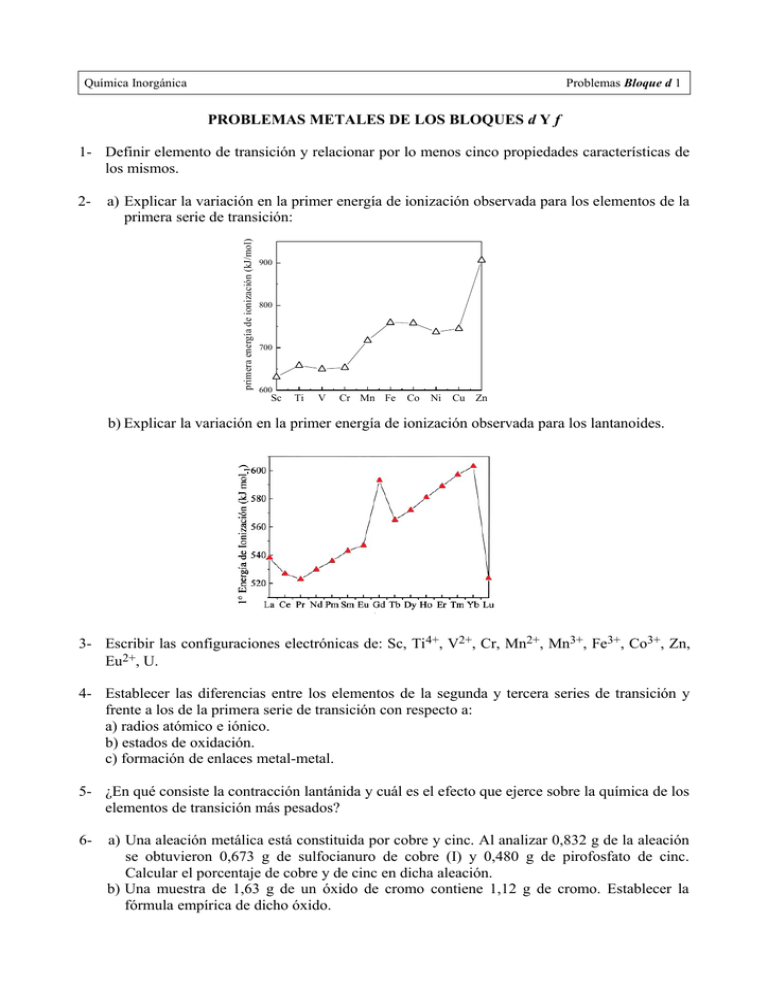
Química Inorgánica Problemas Bloque d 1 PROBLEMAS METALES DE LOS BLOQUES d Y f 1- Definir elemento de transición y relacionar por lo menos cinco propiedades características de los mismos. a) Explicar la variación en la primer energía de ionización observada para los elementos de la primera serie de transición: primera energía de ionización (kJ/mol) 2- 900 800 700 600 Sc Ti V Cr Mn Fe Co Ni Cu Zn b) Explicar la variación en la primer energía de ionización observada para los lantanoides. 3- Escribir las configuraciones electrónicas de: Sc, Ti4+, V2+, Cr, Mn2+, Mn3+, Fe3+, Co3+, Zn, Eu2+, U. 4- Establecer las diferencias entre los elementos de la segunda y tercera series de transición y frente a los de la primera serie de transición con respecto a: a) radios atómico e iónico. b) estados de oxidación. c) formación de enlaces metal-metal. 5- ¿En qué consiste la contracción lantánida y cuál es el efecto que ejerce sobre la química de los elementos de transición más pesados? 6- a) Una aleación metálica está constituida por cobre y cinc. Al analizar 0,832 g de la aleación se obtuvieron 0,673 g de sulfocianuro de cobre (I) y 0,480 g de pirofosfato de cinc. Calcular el porcentaje de cobre y de cinc en dicha aleación. b) Una muestra de 1,63 g de un óxido de cromo contiene 1,12 g de cromo. Establecer la fórmula empírica de dicho óxido. Química Inorgánica Problemas Bloque d 2 7- Una de las primeras etapas para la refinación de minerales sulfurados es el procedimiento de tostación, en el que el mineral se calienta en presencia de oxígeno para formar un óxido metálico y SO2 (g). Calcular para la tostación de esfalerita (ZnS): a) ∆H° 298 K. b) ∆G° 298 K de la reacción. 8- Dada la celda galvánica Zn/Zn2+//Cu2+/Cu a 25 °C, calcular el potencial de la misma cuando las concentraciones de Cu2+ y Zn2+ son iguales. 9- ¿Se desproporcionan los siguientes iones en condiciones estándar? Calcular Δ G0r y la constante de equilibrio para la reacción de dismutación. a) Cu+ 2+ b) Hg 2 10- Balancear las siguientes ecuaciones de óxido-reducción: − a) MnO 4 + Co(OH)2 ( s) → MnO 2 ( s) + Co(OH)3 ( s) b) Ag ( s) NO−3 + H3 O+ → Ag+ + NO + H 2 O − 2− − c) Cr (OH )3 + ClO3 → CrO 4 + Cl d) e) Zn ( s) + OH− + H2 O → [ Zn(OH)4 ]2 − + H 2 AgNO3 + Zn( s) → Zn( NO3 )2 + Ag (s) 11- Para la reacción: Fe + Zn2+ ⇆ Fe2+ + Zn. ¿Cuál es la concentración de equilibrio de Fe 2+ que se alcanza cuando se coloca un trozo de hierro dentro de una disolución 1 M de Zn 2+, suponiendo que la concentración de Zn2+ no varía? 12- Una disolución de permanganato de potasio se prepara disolviendo 3,16 g de la sal en agua y llevando el volumen a 1 L. Calcular: a) La molaridad de la solución de permanganato. b) El volumen de dicha solución necesario para neutralizar 12 mL de peróxido de hidrógeno de 5,60 volúmenes. 13- Una disolución es 0,01 M en iones cromato e iones cloruro. Si se le añade a la misma una disolución de nitrato de plata: a) ¿Qué sal precipita primero? b) ¿Cuál es la concentración del ion que precipita en primer lugar cuando se inicia la precipitación del segundo? Kps Ag2CrO4= 1,1x10-12; Kps AgCl= 1,8x10-10. 14- a) Analizar la disolución de oro con agua regia. Justificar. b) Explicar por qué se ennegrece la plata al estar expuesta al aire. 15- Se encontró que una muestra de 90Y aislada recientemente tenía una actividad de 9,8x105 desintegraciones por minuto a la 1:00 P.M. del 3 de diciembre de 2004. A las 2:15 P.M. del 17 de diciembre de 2004, su actividad era de 2,6x10 4 desintegraciones por minuto. Calcular la vida media del 90Y.