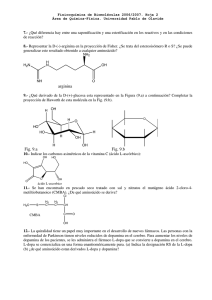
10 626,6( )1112( × = × × × × × +×= − =∆ E EE nm 1250 == C
Anuncio

Fisicoquímica de Biomoléculas 2006/2007. Hoja 1 Área de Química-Física. Universidad Pablo de Olavide 1.- El -caroteno se ve naranja: El -caroteno es un polieno lineal que posee 21 enlaces, 10 simples y 11 dobles alternados a lo largo de una cadena de 22 átomos de carbono. Suponemos que la distancia en el enlace C-C es de 140 pm. Utilizando la teoría de la partícula en una caja, determinar la longitud de onda de la radiación requerida para inducir una transición electrónica desde el nivel 11 al 12 en la molécula de caroteno. Comparar y discutir la longitud de onda calculada con la experimental. Dato: h=6,6×10-34 Js; me=9,1×10-31 kg; Velocidad de la luz: 3×108 ms-1. Experimentalmente, el máximo de absorbancia se encuentra a 497 nm. Corr.: Mientras que los electrones de los enlaces simples ( ) están muy localizados (ubicados en una pequeña región entre átomos adyacentes), los electrones de los dobles enlaces ( ) en sistemas conjugados (alternancia de enlaces simples y dobles en un mismo plano) pueden moverse a lo largo del sistema conjugado. El resultado de esta estructura es que los electrones son compartidos por los carbonos de la cadena. La teoría de la partícula en una caja es de utilidad para explicar la distribución de los electrones en los polienos conjugados. Si asumimos que la distancia en el enlace C-C es de 140 pm, la longitud total de la cadena L en la caja molecular del -caroteno es: L=21*(1,40*10-10m)= 29,4*10-10m Sabiendo que solo un electrón por carbono puede moverse libremente y que en el estado de menor energía de la molécula cada nivel está ocupado por dos electores y que hasta el nivel 11 todos están ocupados según la siguiente formula la diferencia de energía entre el estado fundamental y aquel en el que un electrón es excitado desde el nivel 11 al 12 es: h2 h2 h2 2 ∆E = En +1 − En = (n + 1) −n = ( 2n + 1) 8mL2 8mL2 8mL2 2 (6,626 ×10 −34 ) 2 ∆E = E12 − E11 = (2 ×11 + 1) = 1,60 × 10−19 J − 31 −10 2 8 × (9,110 × 10 ) × (29,4 × 10 ) El paso de un electrón de un nivel al superior puede ser el resultado de la absorción de energía de un fotón ( E = hv ). Esa energía cedida por el fotón debe coincidir con las posibles transiciones en la molécula. Se dice que una molécula sufre una transición espectroscópica, (un cambio de estado) cuando se cumple la igualdad de Bohr ∆E = hv De lo anterior se deduce que la frecuencia de la radiación requerida para inducir una transición electrónica desde el nivel 11 al 12 en la molécula de -caroteno es: v= ∆E 1, 60*10−19 J = = 2, 41*1014 s −1 −34 h 6, 626*10 Js λ= C ν = 1250 nm El valor experimental es 6,03*1014s-1 ( =c/ =497 nm) lo que corresponde a una radiación en el espectro visible. El modelo teórico consigue una aproximación en el orden de magnitud aunque el Fisicoquímica de Biomoléculas 2006/2007. Hoja 1 Área de Química-Física. Universidad Pablo de Olavide modelo sea muy sencillo. Permite explicar la disminución de la frecuencia a medida que la conjugación aumenta, principio en el que se basan los colorantes orgánicos. 2.- Niveles de energía degenerados: Considérese una partícula en una caja tridimensional de lados Lx, Ly, Lz tales que Lx=Ly Lz. Construya una tabla con los valores posibles de nx, ny, nz, en la que los números cuánticos varían de 1 a 3 y las energías asociadas. Deducir de ellos las degeneraciones de los niveles. Dado que en realidad los valores de n pueden ser arbitrariamente grandes, ¿a partir de qué energia habría que estudiar valores de n superiores a 3 para estar seguro de que la degeneración obtenida es la verdadera? Tome para este ejercicio L2x / L2z = 2 . Corr: h2 E= 8mLx nz 2 ( * n x 2 + n y 2 + 2n z 2 nx 1 1 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2 2 3 3 3 3 3 3 3 3 3 2 ny 1 1 1 2 2 2 3 3 3 1 1 1 2 2 2 3 3 3 1 1 1 2 2 2 3 3 3 2 E( *h /8mLx ) 4 7 10 12 13 15 16 18 20 21 23 26 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 ) ordenado por energia nx**2+ny**2+2nz**2 creciente 4 4 7 7 12 7 7 10 10 10 15 12 12 12 15 13 20 13 10 15 13 15 18 16 13 18 16 18 21 20 18 20 21 21 26 21 20 23 23 23 28 26 23 26 26 28 31 28 28 31 31 31 36 36 degeneración 1 2 2 2 2 2 1 2 2 2 2 2 Fisicoquímica de Biomoléculas 2006/2007. Hoja 1 Área de Química-Física. Universidad Pablo de Olavide 28 2 31 2 36 1 La combinación de números cuánticos incluyendo n= 4 tiene una energía de al menos: 42+12+2*12=19 (*h2/8mLx2). Es decir que la degeneración de los niveles hasta 18 esta asegurada. 3.- Vibración de la unión N-H en el enlace peptídico. Efecto de despreciar el movimiento del átomo pesado Calcular la frecuencia fundamental de vibración del enlace N-H considerando que se comporta como un oscilador armónico. La constante de fuerza para el enlace N-H está establecida en 300 Nm-1 y la masa del átomo de hidrógeno es m = 1,67×10-27 Kg. a) Se considerará que el átomo N está inmóvil. b) Repetir el cálculo de la frecuencia como si fuera una molécula diatómica. ¿Cuánto cambia en por cientos con respecto al caso a? c) Calcular la separación energética entre los niveles de vibración en el caso a. Estimar la amplitud de la vibración en el nivel de vibración fundamental. Dato: h=6,6×10-34 Js Corr: a) Los átomos de una molécula vibran unos respecto a otros con el enlace actuando como un muelle. La siguiente ecuación describe los niveles de energía vibracionales permitidos en las moléculas: En=(n+1/2) hv donde n= 0, 1, 2…… 1 k 12 ( ) 2π m m=masa dela partícula n= numero cuántico vibracional ν= Para el estudio del enlace N-H vamos a suponer que el átomo pesado N permanece inmóvil durante la vibración, mientras que el mucho más ligero hidrógeno se mueve vibrando como un oscilador armónico simple. La constante de fuerza para el enlace N-H está establecida en 300 Nm-1 y la masa del átomo de hidrogeno es m= 1,67*10-27 Kg: −1 1 300 Nm 2π 1, 67 *10−27 Kg v= b) 1 µ = µ= ν= 1 2 = 6, 75*1013 Hz = 2250 cm-1 1 1 + mH m N mH m N 1× 14 = × 1,67 × 10− 27 kg mH + mN 1 + 14 1 2π k µ = 6.982 × 1013 Hz La frecuencia es por tanto 3,5% más elevada en el segundo caso (masa efectiva más pequeña). c) La separación entre niveles sucesivos es h veces esta frecuencia o, lo que es lo mismo, 4,47*10-20 J. Fisicoquímica de Biomoléculas 2006/2007. Hoja 1 Área de Química-Física. Universidad Pablo de Olavide Esto significa que una radiación con una frecuencia de 6,75*1013Hz, en la parte infrarroja del espectro electromagnético, induce una transición entre los niveles v=0 y v=1 del oscilador. La amplitud clásica es: 2E 2 × (0 + 1 / 2)hν = = 0,122 × 10−10 m k 300 A= 4.-Efecto isotópico: Calcular la frecuencia fundamental de vibración de la molécula de CO considerando su comportamiento como oscilador armonico con una constante de fuerza de 1902,5Nm-1. ¿Cual sería la variación de la frecuencia si la molécula tuviera el isótopo 13C en lugar del más abundante 12C? Corr: Para la especie principal 12C16O la expresión para la masa reducida es mc mo 12 *16 1 kg = * = 1,1385 *10− 26 kg molecula−1 26 mc + mo 28 molecula 6,023 *10 µ= 1 1902,5 Nm −1 ν= 2π 1,1385 * 10 − 26 kg 1/ 2 = 6,506*1013s-1 Los espectroscopistas de infrarrojo suelen expresar esta frecuencia en números de onda (obtenido dividiéndo la frecuencia por la velocidad de la luz c=2,9979*1010cm s-1). ν 0=2170cm-1 Si la molécula contuviera 13C, la masa reducida cambiaria pero no la constante de fuerza ya que esta es la medida de la fuerza del enlace electrónico que mantiene la molécula unida. ν 0 13C µ 12 CO = 13 µ CO ν 0 12 C ν0 1/ 2 12 *16 29 C= * 28 13 *16 13 1/ 2 * 2170cm −1 = 0,9778 * 2170 = 2122cm −1 Esta diferencia es detectable en el espectro de infrarrojo. 5.- Los sistemas macroscópicos están en estados cuánticos elevados: Una masa de 45 g en un muelle cuyo otro extremo esta fijo oscila a una frecuencia de 2,4 vibraciones por segundo, con una amplitud de 4,0 cm. Calcule la constante de fuerza del muelle. ¿Cuál será el número cuántico n si el sistema se tratase mecanocuánticamente? Dato: h=6,6×10-34 Js Corr: f = 1 2π k m k = m(2πf )2 = 10,23Nm −1 Fisicoquímica de Biomoléculas 2006/2007. Hoja 1 Área de Química-Física. Universidad Pablo de Olavide E = (n + 1 / 2) ω = (n + 1 / 2)hf 1 E = kA2 2 kA2 − 1 / 2 ≈ 5,17 ×1030 n= 2hf 6.-Especies reactivas de oxígeno: En ciertos procesos metabólicos se escapan electrones que son captados por el oxígeno molecular convirtiéndolo en el ión superóxido que es muy reactivo y debe ser convertido de forma controlada a una especie poco reactiva. Bajo la acción de la enzima superóxido dismutasa, el ión superóxido se dismuta en agua oxigenada, un oxidante fuerte, y O2. El paso siguiente es la dismutación del agua oxígenada para formar agua y O2, llevada a cabo por catalasas y peroxidasas. Escribir la secuencia de reacciones de desactivación que se describen. Dar los estados de oxidación de los oxígenos en las distintas especies mencionadas. Dibujar el diagrama de orbitales moleculares de O2, y de la especie O2- (ión superóxido). Decir si son radicales y cuales son los órdenes de enlace. Corr: 1) 2O2- +2H+ H2O2+O2 2) 2H2O2 2H2O+O2 O2-: -0.5 H2O2: -1 O2: 0 H2O: -2 Diagramas de orbitales moleculares de O2 y O2-. σ∗pz 2p 2p O σ∗pz π∗2px,π∗2py π2px,π2py σpz O 2p 2p O π∗2px,π∗2py π2px,π2py σpz O- σ∗ σ∗ 2s 2s 2s 2s σ σ Los diagramas de orbitales moleculares muestran que O2 es un birradical (dos electrones desapareados), y O2- es un radical. Orden de enlace: 1/2(nº electrones enlazantes - nº electrones antienlazantes) OE(O2)=2 OE(O2-)=1,5 Eliminado: 6.- Distancia más probable y distancia media del electrón en el orbital 1s: Calcular la distancia núcleoelectrón más probable en el orbital 1s del hidrógeno y la distancia media. Comparar con el modelo de Bohr. Pista: Realizar una integración por partes. Tomando la función de onda 1 1 ψ (1s ) = π a0 3/ 2 [ψ n ( x, y, z )]2 dv = 1 +∞ ψ 2 4πr 2 dr = 1 0 (1s) en coordenadas esféricas (es una función radial): e − r / a0 = Ne − r / a0 Fisicoquímica de Biomoléculas 2006/2007. Hoja 1 Área de Química-Física. Universidad Pablo de Olavide 2 2 La máxima probabilidad es el máximo de la función: p ( r ) = ψ 4πr Derivando y resolviendo p'(r)=0, se obtiene la solución: r=a0 Para la distancia media obtenemos: r = ψrψ d v = +∞ +∞ 0 0 Ne − r / a0 rNe − r / a0 4πr 2 dr = 4πN 2 r 3e − 2 r / a0 d r Integración por partes: uv' dr = [uv] − u ' vdr u = r3 u' = 3r 2 v' = e − 2 r / a0 v= − a0 − 2r / a0 e 2 − a0 3 − 2 r / a0 r = r e 2 =0+ +∞ − 4πN 0 2 +∞ 0 − 3a0 2 − 2 r / a0 r e dr 2 +∞ 3a0 4πN 2 r 2e − 2 r / a0 d r 2 0 1 En la última ecuación, el factor marcado corresponde al integral sobre el espacio entero del cuadrado de la función de onda, que vale 1 dado que está normalizada.