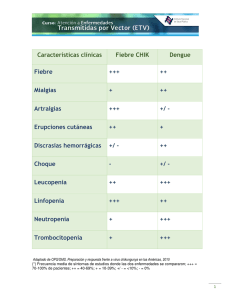
Artículo completo
Anuncio

Fiebre Q: Evaluación de Riesgos para la Salud Pública y Herramientas de Gestión de Riesgos en Cría de Rumiantes Informe adoptado por el Comité de Expertos Especializado “Sanidad Animal” a 8 de junio de 2004 - Diciembre de 2004 - 2 Coordinadores de redacción Françoise Gauchard Anne-Marie Hattenberger Secretaría administrativa Sheila Gros-Désirs Coordinación editorial Juliette Chevalier Carole Thomann 3 COMENTARIOS PREVIOS EN TORNO A LA NATURALEZA DE LAS RECOMENDACIONES FORMULADAS POR LA AGENCIA FRANCESA DE SEGURIDAD SANITARIA DE LOS ALIMENTOS EN RELACIÓN CON EL INFORME DEL GRUPO DE TRABAJO “FIEBRE Q” En diciembre de 2002, en el marco del apoyo técnico y científico que presta al Ministerio de Agricultura, la Agencia Francesa de Seguridad Sanitaria de los Alimentos recibió una consulta por parte de la Dirección General de Alimentación, en relación con diversas cuestiones relativas a la fiebre Q, zoonosis que provocó una epidemia humana en el valle de Chamonix. La complejidad e importancia del tema justificaban la creación de un grupo de trabajo que diera respuesta a esta consulta, que incluía cuestiones relativas tanto a Sanidad Animal como a Salud Pública, y que exigía llevar a cabo una evaluación de riesgos. El grupo de trabajo reunió durante 18 meses a expertos y miembros de organizaciones profesionales, así como a un representante de la Dirección General de Alimentación. Las conclusiones extraídas fueron sometidas al Comité de Expertos Especializado “Sanidad Animal”, comité al cual dicho grupo de trabajo estaba ligado. En algunos puntos se solicitó la intervención del Comité de Expertos Especializado “Microbiología”. De esta forma se llegó a una evaluación de riesgos para la Salud Pública en relación con la fiebre Q, a un análisis de las herramientas disponibles para el control de dichos riesgos, y a la formulación de recomendaciones. En relación con las recomendaciones del grupo de trabajo, resultó evidente que la AFSSA no podía adoptar algunas de ellas tal como estaban planteadas. De hecho, a pesar de haber sido aprobadas por el Comité de Expertos que validó el informe, algunas de las medidas generaron una serie de interrogantes por parte del Director de Salud Animal y de la Directora de Evaluación de Riesgos, así como propuestas alternativas para matizarlas o completarlas. Las diferencias no se referían al análisis de riesgos, que había sido realizado por el grupo de expertos, sino a las consecuencias derivadas de dicho análisis, en coherencia con los razonamientos seguidos en diferentes trabajos de la Agencia sobre control de riesgos en zoonosis. Para mayor claridad, se ha decidido mostrar en tres apartados distintos las enmiendas formuladas, y explicar en la Introducción la razón de haber elegido, en el informe final que vincula a la Agencia Francesa de Seguridad Sanitaria de Alimentos, formular de madera distinta a la original algunas de las recomendaciones hechas por el grupo de trabajo a las autoridades sanitarias. Se trata de las siguientes cuestiones, más ampliamente desarrolladas en la Introducción del presente informe: En primer lugar, la Agencia ha considerado que no puede tomar en cuenta las proposiciones del grupo de trabajo que hacen referencia a recomendaciones médicas, en especial aquellas según las cuales determinadas poblaciones de riesgo o grupos de pacientes debían beneficiarse sistemáticamente de una prueba de detección de fiebre Q. La Agencia considera que este tipo de recomendaciones va más allá de las competencias del grupo de trabajo, teniendo en cuenta su objetivo y su composición, y debe ser discutido más bien por un equipo pluridisciplinar de expertos médicos, como por ejemplo la sección de Enfermedades Infecciosas del Consejo Superior de Higiene Pública de Francia, o cualquier otra instancia capaz de discutir colegiadamente el interés que tienen para la Salud Pública las diferentes estrategias 4 de detección de un agente infeccioso de esta naturaleza en poblaciones humanas. Por consiguiente, la Agencia no recomienda ninguna medida concreta de detección en población humana, sino que sugiere a las autoridades sanitarias solicitar un asesoramiento complementario a expertos en la materia. Por el contrario, la Agencia no ha tomado en cuenta las reservas del grupo de trabajo que llevan a éste a descartar determinadas recomendaciones concernientes a rebaños susceptibles de presentar riesgo para la salud pública y a las condiciones de consumo de los productos obtenidos de dichos rebaños. Aunque la Agencia comprende el razonamiento según el cual las medidas de carácter imperativo pueden conducir a que no se declaren los casos, considera necesario afirmar claramente que no se puede autorizar la comercialización para consumo humano de leche cruda procedente de rebaños infectados e identificados como excretores que impliquen un riesgo para la salud pública, así como fijarse como objetivo un plan de saneamiento destinado a identificar todas las ganaderías infectadas y excretoras. En consecuencia, en lo que concierne a los focos de fiebre Q en rumiantes, la Agencia formula sus recomendaciones de la manera siguiente: “- Establecer, por vía reglamentaria o contractual y de forma progresiva, un plan de saneamiento de la fiebre Q; - Poner en marcha un estudio de campo que permita validar el resto de las herramientas de diagnóstico y de prevención; - En cuanto se disponga de herramientas de detección fiables, iniciar un proceso de certificación en ganaderías que produzcan leche cruda o quesos a base de leche cruda, y hacer evolucionar esta certificación a medida que progrese la validación de las herramientas de diagnóstico; - Evitar el consumo de leche cruda o productos a base de leche cruda (lo cual por otra parte ya se había recomendado) por parte de personas pertenecientes a poblaciones de riesgo (…); - además de las medidas que se proponen en el informe, de cara al saneamiento de ganaderías infectadas e identificadas como excretoras de Coxiella burnetti (medidas de higiene, tratamiento antibiótico, vacunación…), pasteurizar (pasteurización baja a 72 ºC durante 15 segundos) la leche procedente de dichas ganaderías”. Es con la adición de estos matices y de estos complementos respecto a algunas de las formulaciones utilizadas por el grupo de trabajo en la expresión de sus recomendaciones, que la Agencia Francesa de Seguridad Sanitaria de los Alimentos transmite a los ministros responsables de Agricultura, Salud y Consumo su informe sobre la evaluación de riesgos para la Salud Pública y las herramientas de gestión de riesgos en cría de rumiantes. Realizado en Maisons-Alfort, a 1 de diciembre de 2004 Martin Hirsch, Director General 5 Composición del grupo de trabajo “Fiebre Q”: Evaluación de Riesgos para la Salud Pública y Herramientas de Gestión en Cría de Rumiantes Presidente Annie RODOLAKIS INRA Nouzilly Directora de la Unidad de Investigación en Patología Infecciosa e Inmunología Vicepresidente Michel AUBERT AFSSA – Centro de Sophia Antipolis Director del Laboratorio de Estudios e Investigación sobre pequeños rumiantes y abejas Miembro del Comité de Expertos Especializado “Sanidad Animal” Miembros del grupo de trabajo Nathalie ARRICAU-BOUVERY INRA Nouzilly Unidad de Investigación en Patología Infecciosa e Inmunología Thibault DELCROIX Federación Nacional de Agrupaciones de Defensa Sanitaria del Ganado Barbara DUFOUR Enfermedades Contagiosas, Escuela Nacional de Veterinaria, Maisons Alfort Miembro del Comité de Expertos Especializado “Sanidad Animal” Sébastien LAVIEILLE AFSSA – Dirección de Evaluación de Riesgos Nutricionales y Sanitarios Unidad de apoyo epidemiológico al análisis de riesgos Elodie ROUSSET AFSSA – Centro de Sophia-Antipolis Laboratorio de Estudios e Investigación sobre pequeños rumiantes y abejas Hervé TISSOT DUPONT Unidad de Rickettsia y Patógenos Emergentes CNRS UMR 6020 Centro Nacional de Referencia de Rickettsia, Coxiella y Bartonella Elisabeth VINDEL CNIEL (Centro Nacional Interprofesional de Economía Lechera) Jefe del Departamento de Seguridad Alimentaria Representantes ministeriales Jérôme LANGUILLE DGAI – Subdirección de Sanidad y Protección Animal Oficina de Salud Animal Jean Cristophe TOSI DGAI – Subdirección de Seguridad Sanitaria de los Alimentos Agencia de Establecimientos de Producción y de Transformación 6 Agencia Francesa de Seguridad Sanitaria de Alimentos Anne-Marie HATTENBERGER AFSSA – Persona autorizada ante el Director de Salud y Bienestar Animal Secretaría Científica del Comité de Expertos Especializado “Sanidad Animal” Françoise GAUCHARD AFSSA – Dirección de Evaluación de Riesgos Nutricionales y Sanitarios Unidad de apoyo epidemiológico al análisis de riesgos Secretaría Científica del Comité de Expertos Especializado “Sanidad Animal” Han contribuido también a este informe (Introducción y cuadros AFSSA): Philippe VANNIER AFSSA – Director de Sanidad y Bienestar Animal Muriel ELIASZEWICZ AFSSA – Dirección de Evaluación de Riesgos Nutricionales y Sanitarios 7 Requerimiento MINISTERIO DE AGRICULTURA, ALIMENTACIÓN, PESCA Y ASUNTOS RURALES Dirección General de Alimentación Calle Vaugirard, 251 75 732 Paris Cedex 15 Expediente seguido por: Jean-Christophe TOSI – Tlf: 01 49 55 84 91 Jérôme LANGUILLE – Telf. : 01 49 55 84 66 Señor Director General de la Agencia Francesa de Seguridad Sanitaria de los Alimentos Avenida del General de Gaulle B.P. 19 94701 MAISONS-ALFORT Cedex Ref. Interna: BSA/0212027 Objeto: Fiebre Q Paris, a 20 de diciembre 2002 Señor Director General, Tengo el honor de solicitar el apoyo científico y técnico de la Agencia Francesa de Seguridad Sanitaria de los Alimentos, conforme a las disposiciones del segundo apartado del artículo L.1323-2 del código de Salud Pública, en la definición de las medidas de control requeridas en caso de foco animal de fiebre Q, tanto en el dominio de la seguridad sanitaria de los animales como en el de la sanidad animal. La reciente epidemia humana de fiebre Q en el valle de Chamonix ha llamado la atención sobre las importantes consecuencias de esta afección sobre la Salud Pública. Entre junio y principios de noviembre de 2002 se han contabilizado 89 casos humanos confirmados serológicamente, de los cuales 71 presentaban signos clínicos. Entre los enfermos, 9 pertenecían a grupos de riesgo (mujeres embarazadas o personas con valvulopatías) y precisaron de tratamientos médicos de larga duración. El estudio caso-testigo realizado entre los enfermos por el Instituto de Seguimiento Sanitario ha permitido identificar el contacto cercano con pequeños rumiantes como el principal factor de riesgo. Este elemento ha dado lugar, por parte de la Dirección general de Alimentación, a investigaciones veterinarias en cría, a fin de identificar posibles cabañas excretoras de Coxiella burnetti. Desde el punto de vista de la seguridad sanitaria de los alimentos, y en la medida en que la transmisión de Coxiella burnetii por leche cruda o productos a base de leche cruda es referida de forma regular, la reglamentación francesa ha previsto que la leche cruda de vaca destinada a consumo humano pueda venderse en circuitos “cortos” (en origen, mercados o tiendas) únicamente cuando provengan de una explotación que no haya presentado ningún caso clínico de fiebre Q durante un período mínimo de un año (artículo 3 del decreto de 6 de agosto de 1985 relativo a las normas de higiene y salubridad, que regula la leche cruda entregada como tal y destinada a consumo humano). Con excepción de este caso, no existe ninguna otra prescripción de naturaleza reglamentaria que limite la venta de leche cruda o productos a base de leche cruda en relación con la aparición de la enfermedad en la explotación. Sin embargo, se han dado instrucciones administrativas a las direcciones departamentales de los servicios veterinarios en lo que concierne a los productores de quesos de leche cruda que dispongan de una marca de salubridad comunitaria en el momento en que sus cabañas estén aquejadas de fiebre Q (memoria explicativa DGAL/SDHA/N97), para que descarten la leche de las hembras que hayan abortado y 8 sometan la de las otras productoras de la explotación a una pasteurización llamada “alta” (85 ºC durante 30 segundos). El estudio realizado en el marco de la convención S 98/34, que reunió a la Federación Nacional de Agrupaciones de Defensa Sanitaria (FNGDS) con la Dirección General de Alimentación (DGAL) y finalizó en el 2002, permitió confirmar la excreción de C. burnetti en leche y secreciones vaginales por los animales (pequeños rumiantes) pertenecientes tanto a ganaderías infectadas de forma clínica como latente. Teniendo en cuenta dichas conclusiones, se consultó a la AFSSA sobre el nivel de riesgo que presenta la leche de un animal serológicamente positivo en ausencia de toda manifestación clínica asociada a la fiebre Q. En concreto: ¿Cuál es la probabilidad de excreción de C. burnetti por un animal serológicamente positivo? Si esta probabilidad es elevada, ¿hay que buscar entonces C. burnetti en la leche? Y en caso afirmativo, ¿a partir de qué título de seropositividad? ¿Y por qué método? Tratándose de Sanidad Animal, hasta el momento la fiebre Q no ha sido clasificada ni entre las enfermedades contagiosas, ni entre las enfermedades de declaración obligatoria fijadas en los artículos 224, 225 y 225-1 del segundo libro del Código Rural. La lucha contra esta afección en cría no está regulada por ninguna de las disposiciones del artículo L.221-1 del Código Rural y depende únicamente del ejercicio de la medicina veterinaria. Se consulta a la AFSSA: - sobre la probabilidad de transmisión de la infección a otra población ganadera en caso de manifestación clínica o de seropositividad (en función del porcentaje de animales seropositivos y del título de seropositividad); sobre la eficacia de los procedimientos de lucha disponibles (desinfectantes, antibióticos…) que conciernen tanto a los animales como al saneamiento del medio ambiente; sobre el interés comparativo de vacunas inactivadas fase I y fase II, de cara a limitar la excreción y la circulación bacteriana en la población ganadera. Sería deseable disponer del informe de la AFSSA para el 1 de marzo de 2003. Reciba Usted mis más cordiales saludos. La Directora General de Alimentación Catherine GESLAIN-LANEELLE 9 Decisión relativa al grupo de trabajo “Fiebre Q”: Evaluación de Riesgos para la Salud Pública y Herramientas de Gestión de Riesgos en Cría de Rumiantes AGENCIA FRANCESA DE SEGURIDAD SANITARIA DE LOS ALIMENTOS Decisión nº 2003/056 Relativa al grupo de trabajo “Fiebre Q” El Director General de la Agencia de Seguridad Sanitaria de los Alimentos, Visto el Código de la Salud Pública, y sobre todo los artículos L.1323-4 y R.794-23; Visto el Decreto nº 99-242 del 26 de marzo de 1999 relativo a la organización y al funcionamiento de la Agencia Francesa de Seguridad Sanitaria de los Alimentos; Vista la Orden del 23 de agosto del 2000, relativa a los Comités de Expertos ante la Agencia Francesa de Seguridad Sanitaria de los Alimentos; Visto el Reglamento Interno de la Agencia de Seguridad Sanitaria de los Alimentos. DECIDE: Artículo primero. Se crea, por proposición del Comité de Expertos Especializado “Sanidad Animal” en la reunión del 8 de enero del 2003, un grupo de trabajo denominado “Fiebre Q”, encargado de 1. Evaluar, de cara a la salud pública: - 2. los riesgos de contaminación que presenta la leche de oveja y derivados contaminados por Coxiella burnetti, responsable de la fiebre Q; los riesgos de contaminación de poblaciones humanas expuestas a otros modos de transmisión de Coxiella burnetti. Estudiar, en el campo de la Sanidad Animal: 3. la probabilidad de transmisión de la infección a otra población ganadera en caso de manifestaciones clínicas o de seropositividad (intentando evaluar el riesgo en función del perfil serológico del rebaño: porcentaje de animales seropositivos, título serológico...); eficacia de los procedimientos de lucha disponibles (desinfectantes, antibióticos, medidas sanitarias...) en relación tanto con los animales como con el saneamiento del medioambiente; los efectos comparativos de las vacunas inactivadas fase I y fase II sobre la excreción y la circulación bacteriana en el interior de un rebaño y cuando se utilizan con fines preventivos. Establecer recomendaciones sobre las medidas a adoptar en caso de foco animal de fiebre Q, para limitar o prevenir los riesgos, tanto en el dominio de la Seguridad Sanitaria de los Alimentos como en el de la Sanidad Animal. Artículo 2. El grupo de trabajo mencionado en el artículo primero está compuesto por los siguientes miembros: - Miembros del Comité de Expertos Especializado “Sanidad Animal”: D. Michel AUBERT Doña. Annie RODOLAKIS - Otros expertos: Doña. Nathalie ARRICAU-BOUVERY (INRA. Tours Nouzilly) D. Sébastien LA VIEILLE (AFSSA, DERNS) Doña. Barbara DUFOUR (AFSSA, DERNS) Doña. Elodie ROUSSET (AFSSA Sophia-Antipolis) D. Hervé TISSOT-DUPOND (CNRS-UPRES-A 6020 Faculté de Marseille) 10 - Miembros de la Administración: D. Jean-Christophe TOSI (DGAI) - Miembros del grupo de trabajo procedentes de organizaciones profesionales: D. Thibault DELCROIX (FNGDS) Doña. Elisabeth VINDEL (CNIEL) Artículo 3. Se nombra presidente del grupo de trabajo mencionado en el artículo primero a Doña. Annie RODOLAKIS. El señor AUBERT es nombrado vicepresidente. Artículo 4. Las conclusiones del grupo de trabajo se presentarán al Comité de Expertos Especializado “Sanidad Animal” en un plazo de cuatro meses. Artículo 5. El Director de Salud Animal participa en el grupo de trabajo y la secretaría mencionada en el artículo primero está cubierta por la Secretaría Científica del Comité de Expertos Especializado “Sanidad Animal”. En Maisons-Alfort, a 27 de enero de 2003 El Director General de la Agencia Francesa de Seguridad Sanitaria de los Alimentos Martin HIRSCH 11 Introducción Este informe sobre la evaluación de riesgos asociados a la fiebre Q de cara a la Salud Pública y sobre las herramientas de gestión de dichos riesgos en cría de rumiantes, ofrece información completa sobre Coxiella burnetii, responsable de la fiebre Q, y sobre las consecuencias de la infección en Salud Pública y en Sanidad Animal. Muestra bien la complejidad del problema y las dificultades para el control de la infección y de la enfermedad, dada la extrema dificultad de obtener una evaluación precisa de la seroprevalencia de la fiebre Q en el ganado ovino, caprino y bovino de Francia, las limitaciones de las herramientas de gestión actualmente disponibles, y el gran número de factores implicados en la transmisión del agente. Tratándose de recomendaciones emitidas por el Comité de Expertos Especializado “Sanidad Animal” respecto a protección de la salud humana, la AFSSA considera que algunas de ellas pueden no parecer adecuadas con respecto al grado de exposición estimado de determinados grupos de población, tal como el Comité de Expertos los define. En efecto, algunas de estas recomendaciones ponen en el mismo plano los grupos de población “en contacto directo, estrecho y habitual1”, y aquellos que presentan una exposición “rural directa o indirecta2”. Estas recomendaciones son: - proceder a la detección clínica sistemática de valvulopatías; - proceder a la detección serológica sistemática en el período inicial del embarazo. Dado que el Comité de Expertos Especializado “Sanidad Animal” indica niveles de exposición diferentes para estos dos grupos de población3, el hecho de dar recomendaciones equivalentes resulta discutible, y además podría ocasionar problemas de logística y coste. Igualmente, sería pertinente afinar aún más la identificación de poblaciones expuestas en los casos en que el perímetro de definición es difícil de delimitar y, sobre todo, de cuantificar. Es el caso de “los adeptos al turismo de naturaleza o los visitantes de granjas pedagógicas”. Teniendo en cuenta todos estos elementos, la AFSSA considera que consultar instancias tales como InVS (N.T.: Institut de veille sanitaire, Instituto de Vigilancia Sanitaria) o la sección de Enfermedades Transmisibles del CSHPF (N.T.: Conseil supérieur d'hygiène publique de France, Consejo Superior de Higiene Pública de Francia) contribuiría a aclarar estos puntos (ver cuadro AFSSA n° III, capítulo 3, párrafo 3.3.1). Además, es necesario subrayar la importancia epidemiológica de los rebaños excretores de cara a los riesgos para la Salud Pública. Es esencial definir un cierto número de recomendaciones para estos rebaños y poner en marcha, de forma progresiva, un conjunto de medidas que contribuyan a la mejora sanitaria de la población doméstica, al tiempo que se protege también las poblaciones humanas en contacto con los animales excretores, y los consumidores. Entre estas medidas, además de las incluidas en el informe para el saneamiento de ganaderías infectadas e identificadas como excretoras de Coxiella burnetii (medidas de higiene, tratamiento antibiótico, vacunación...), la AFSSA recomienda pasteurizar (pasteurización baja a 72 °C durante 15 segundos)4 la leche procedente de estas ganaderías (ver cuadro AFSSA n° II, capítulo 3, párrafo 3.2). En efecto, incluso si parece claro que la vía respiratoria es la más importante y frecuente de contaminación del hombre a partir de animales infectados y excretores, conviene recordar que la leche de animales infectados puede contener Coxiella burnetii en concentraciones de hasta 1.000 veces la dosis infectiva en cobaya (ver Anexo I del informe). Además, se han observado seroconversiones en consumidores de leche cruda con expresión clínica inconstante, en condiciones donde la contaminación por vía aérea parecía poco probable (ver Anexo I del informe). Además, las conclusiones del Comité de Expertos Especializado “Sanidad Animal” que estiman que “un número desconocido pero probablemente grande de ganaderías son excretoras aunque no han sido identificadas como tales, y que la generalización de la investigación de Coxiella burnetii 12 en leche no es realista, que estas medidas (medidas de aplicación general en leche cruda) necesariamente imperativas, tendrían un carácter discriminatorio y conducirían a una situación de déficit de información sobre los focos que abocaría en un resultado negativo del plan de protección de la Salud Pública (ausencia de reducción del riesgo de transmisión por vía aérea). Sin embargo, debería animarse a las ganaderías que comercializan leche cruda o productos frescos a base de leche cruda a implicarse en un proceso de certificación” (párrafo 3.1.2.) no pueden justificar, según la AFSSA, no tomar las medidas adaptadas, ni permitir el consumo de leche cruda procedente de rebaños infectados e identificados como excretores que representen un riesgo para la Salud Pública. Adicionalmente, la AFSSA recomienda poner en marcha, por vía reglamentaria o contractual, y de forma progresiva, un plan de saneamiento de fiebre Q que permitiría finalmente identificar todas las ganaderías infectadas y excretoras. Además, la AFSSA se une a las recomendaciones del Comité de Expertos Especializado “Sanidad Animal” en lo que respecta a: - - la puesta en marcha de un estudio piloto, en campo, que permita validar las herramientas de diagnóstico y de prevención; desde el momento en que se disponga de herramientas fiables de detección, iniciar un proceso de certificación en ganaderías que produzcan leche cruda o quesos a base de leche cruda, y hacer avanzar esta certificación a medida que progrese la validación de las herramientas de diagnóstico; la necesidad de evitar el consumo de leche cruda y de productos a base de leche cruda (como ya se había recomendado) por parte de poblaciones de riesgo. De manera más general, la AFSSA considera que la afirmación según la cual “la fiebre Q constituye sin duda una preocupación más importante para la Salud Pública que para la Sanidad Animal” debería ser matizada (ver cuadro AFSSA n° I, capítulo 3), debido a la actual falta de información epidemiológica, tanto en Sanidad Animal como en Salud Humana, que impide una estimación precisa de la incidencia de esta patología en animales. Las causas principales son: - conocimiento insuficiente de los signos clínicos en animales (al igual que en el hombre) (ver § 1.2.2.1.); déficit de herramientas de diagnóstico fiables y validadas en condiciones reales (ver § 1.2.2.4.); ausencia de una investigación sistemática en determinadas situaciones patológicas de animales (abortos...) (ver § 1.3.2.). Philippe Vannier Director de Salud y Bienestar Animal y Muriel Eliaszewicz Directora de Evaluación de Riesgos Nutricionales y Sanitarios 1 “Personas en contacto directo, estrecho y habitual (casi siempre profesional) con rumiantes (criadores, veterinarios, personal de matadero)”. 2 “Poblaciones bajo exposición rural, directa o indirecta: personas que viven cerca de explotaciones ganaderas, aficionados al turismo de naturaleza, visitantes de granjas pedagógicas. Los cazadores y los excursionistas pueden presentar algunas peculiaridades, dada su exposición a la fauna salvaje (sobre la cual se tiene muy poco conocimiento) y de su sobre exposición a las garrapatas (aunque la contribución de éstas a la transmisión de la fiebre Q al hombre es anecdótica en Francia)”. 3 Población en contacto directo con los rumiantes domésticos o con la bacteria (personal de laboratorio): riesgo calificado de moderado a alto. Población llamada rural: riesgo calificado de bajo a moderado. 4 Memoria explicativa de la DGAl n°2004-8055 del 10/02/2004. Esta memoria seguía a otra de la AFSSA de fecha 29/01/2004 sobre un informe del Comité Experto Especializado “Microbiología”. 13 Índice Glosario ...........................................................................................................................................16 Respuestas a las preguntas formuladas......................................................................................17 Introducción 1 1.1 Evaluación del riesgo en Salud Pública.............................................................................21 Presentación del método................................................................................ 21 1.1.1 1.1.2 1.1.3 1.2 Fuentes de materias virulentas................................................................................38 Especies animales.........................................................................................38 Medio ambiente.............................................................................................42 Productos alimentarios de origen animal.......................................................42 Prevalencia de fiebre Q en animales.......................................................................43 Rumiantes domésticos..................................................................................43 Otras especies...............................................................................................46 Balance sobre la prevalencia.........................................................................47 Valoración de la emisión.........................................................................................60 Exposición........................................................................................................... 60 1.4.1 1.4.1.1 1.4.1.2 1.4.1.3 1.4.1.4 1.4.2 1.4.3 1.5 1.6 Germen responsable...............................................................................................23 Variaciones antigénicas y poder infeccioso de la bacteria............................23 Vía intracelular...............................................................................................24 Enfermedad animal..................................................................................................26 Signos clínicos en los rumiantes domésticos................................................26 Persistencia de la bacteria en animales infectados.......................................27 Transmisión de la infección entre rebaños....................................................27 Herramientas de diagnóstico en medicina veterinaria...................................27 Enfermedad humana...............................................................................................32 Fiebre Q aguda..............................................................................................33 Fiebre Q crónica............................................................................................34 Variabilidad de la expresión clínica...............................................................35 Diagnóstico....................................................................................................36 Tratamiento....................................................................................................37 Vacunación en humanos...............................................................................37 Aspecto reglamentario de la fiebre Q en el hombre......................................38 Emisión............................................................................................................... 38 1.3.1 1.3.1.1 1.3.1.2 1.3.1.3 1.3.2 1.3.2.1 1.3.2.2 1.3.2.3 1.3.3 1.4 Principio general del método...................................................................................21 Valoración de la probabilidad de cada suceso........................................................21 Valoración del riesgo...............................................................................................21 Identificación del peligro..................................................................................23 1.2.1 1.2.1.1 1.2.1.2 1.2.2 1.2.2.1 1.2.2.2 1.2.2.3 1.2.2.4 1.2.3 1.2.3.1 1.2.3.2 1.2.3.3 1.2.3.4 1.2.3.5 1.2.3.6 1.2.3.7 1.3 ................................................................................................................................19 Diferentes vías de exposición..................................................................................60 Vía aérea.......................................................................................................61 Contacto con los mamíferos y en particular con el ganado ovino.................62 Exposición alimentaria...................................................................................63 Fauna salvaje y diversa.................................................................................63 Diferentes poblaciones expuestas...........................................................................65 Valoración de la exposición....................................................................................66 Valoración de las consecuencias....................................................................... 67 Valoración del riesgo.......................................................................................... 67 1.6.1 1.6.2 Valoración de la probabilidad de ocurrencia de la infección...................................67 Valoración de los riesgos brutos y reducidos..........................................................68 14 2 2.1 2.2 2.3 Medios disponibles para la lucha en ganaderías...............................................................71 Desinfectantes................................................................................................ 71 Antibióticos..................................................................................................... 71 Medidas sanitarias......................................................................................... 72 2.3.1 2.3.1.1 2.3.1.2 2.3.2 2.3.2.1 2.3.2.2 2.3.2.3 2.4 Vacunas animales............................................................................................... 76 2.4.1 2.4.2 2.4.3 2.4.4 3 Medidas sanitarias de ataque.................................................................................72 Reemplazo de los animales excretores.........................................................73 Medidas generales de higiene.......................................................................73 Medidas sanitarias de defensa................................................................................75 Precauciones en incorporación de animales.................................................75 Precauciones frente a ganaderías vecinas....................................................75 Precauciones frente a otros vectores de Coxiella burnetii.............................76 En bovino.................................................................................................................76 En caprino................................................................................................................77 En ovino...................................................................................................................78 Conclusión...............................................................................................................78 Recomendaciones................................................................................................................80 3.1 Recomendaciones para un mayor conocimiento de la epidemiología de la fiebre Q en rumiantes............................................................................................................ 81 3.1.1 Ventajas e inconvenientes de la inclusión de la fiebre Q en la lista de enfermedades animales de declaración obligatoria.........................................................................81 3.1.2 Posibles medidas a aplicar en explotaciones que comercializan leche cruda o productos frescos a base de leche cruda.........................................................................................82 3.2 3.3 Recomendaciones con respecto a los focos de fiebre Q en rumiantes.............. 82 Recomendaciones con respecto a la protección de la salud humana................ 83 3.3.1 3.3.2 Información de profesionales de la salud................................................................84 Información de personas que presentan factores agravantes.................................85 3.4 Recomendaciones sobre los estudios e investigaciones a realizar para mejorar los conocimientos sobre la bacteria y sobre las herramientas necesarias para su control......................................................................................................................... 85 3.4.1 3.4.2 Investigación sobre la bacteria y su transmisión....................................................85 Investigación sobre las herramientas de control.....................................................86 ANEXOS I, II................................................................................................................ 88 BIBLIOGRAFÍA………………………………………………………………………………97 15 Lista de Figuras Figura 1: Presentación del esquema general de análisis (según el método OIE1).....................................22 Figura 2: Ciclo de multiplicación de Coxiella burnetii..................................................................................26 Figura 3: Posible evolución de la infección por Coxiella burnetii en humanos...........................................33 Figura 4: Respuestas serológicas en caprino tras vacunación y prueba. La tasa de anticuerpos se ha medido con la ayuda de un kit ELISA (CHEKIT -Q-Fever enzyme immuno-assay kit; Bommeli diagnostics, Switzerland) que permite detectar los anticuerpos anti-fase I y anti-fase II................................................78 Lista de Tablas Tabla I: Resultados de la combinación de diferentes valoración cualitativas empleadas en el análisis cualitativo del riesgo (Nulo = N, D = Despreciable, B = Bajo, M = Moderado y E = Elevado)....................23 Tabla II: Datos provinciales o regionales relativos a la seroprevalencia de la fiebre Q en rebaños de bovino.........................................................................................................................................................47 Tabla III: Datos provinciales o regionales relativos a la seroprevalencia de la fiebre Q en rebaños de de ovino...........................................................................................................................................................52 Tabla IV: Datos provinciales o regionales relativos a la seroprevalencia de la fiebre Q en rebaños de de caprino........................................................................................................................................................57 Tabla V: Valoración cualitativa de la emisión de Coxiella burnetii.............................................................60 Tabla VI: Principales epidemias descritas en los últimos veinte años........................................................64 Tabla VII: Datos epidemiológicos de los últimos veinte años en Francia...................................................65 Tabla VIII: Valoración cualitativa de la exposición a Coxiella burnetii........................................................67 Tabla IX: Valoración cualitativa de las consecuencias brutas y reducidas de la infección por Coxiella burnetii mediante tratamiento.....................................................................................................................67 Tabla X: Probabilidad de infección por Coxiella burnetii............................................................................68 Tabla XI: Valoración del riesgo bruto y reducido mediante tratamiento en caso de contaminación por Coxiella burnetii causada por rumiantes domésticos...............................................................................::68 Tabla XII: Valoración del riesgo bruto y reducido mediante tratamiento en caso de contaminación por Coxiella burnetii causada por consumo de alimentos contaminados (especialmente leche cruda)..........69 Tabla XIII: Valoración del riesgo bruto y reducido mediante tratamiento en caso de contaminación por Coxiella burnetii causada por contacto con carnívoros domésticos...........................................................69 Tabla XIV: Valoración del riesgo bruto y reducido mediante tratamiento en caso de contaminación por Coxiella burnetii causada por contacto con fauna salvaje..........................................................................70 Tabla XV: Partos patológicos, contaminación de placentas, cabritos y cabras, excreción en heces, secreciones vaginales y en leche tras una prueba con 104 Coxiella burnetii cepa CbC1 en cabras gestantes no vacunadas (Lote NV), vacunadas con vacuna fase I (Lote I) o fase II (Lote II), comparadas con un lote de cabras no inoculadas (Lote NI)..........................................77 Tabla XVI: Ventajas e inconvenientes de la inscripción de la fiebre Q en rumiantes en la lista de enfermedades de declaración obligatoria (EADO).....................................................................................81 16 1 N.T.: OIE: Organización Mundial de Sanidad Animal 17 Glosario ADN: Acido desoxirribonucléico AFSSA: Agencia Francesa de Seguridad Sanitaria de los Alimentos ATU: Autorización transitoria de utilización ATVP: Autorización transitoria de venta a profesionales CES SA: Comité de Expertos Especializado “Sanidad Animal” CHG: Centro hospitalario general CME: Extracto cloroformo-metanol CMR: Residuo cloroformo-metanol CNR: Centro Nacional de Referencia CR3: Receptor de la bacteria para el fragmento ic3b del complemento EID: Acuerdo interdepartamental para la eliminación de mosquitos EILA: Ensayo interlaboratorios de aptitud ELIFA: Enzyme-Linked- Immunosorbent Fluorescence Assay ELISA: Encime-Linked-Immunosorbent Assay FC: Fijación del complemento IAP: Integrin-associated proteins IFI: Inmunofluorescencia indirecta LCV: Large cell variant LPS: Lipopolisacárido de superficie LRI: Leukocyte response integrin MADO: Enfermedades animales de declaración obligatoria NSB: Nivel de seguridad biológica OIE: Oficina Internacional de Epizootias PCR: Polymerase chain reaction PCR – RFLP: Polymerase chain reaction – Restriction fragment length polymorphism PFGE: Pulse field gel electrophoresis RIA: Radio-Immuno-Assay SCV : Small cell variant SDC: Small dense cell SLP: Spore like particle V-H+-ATPase: Vacuolar proton ATPase WC: Whole cell 18 Respuestas a las preguntas formuladas La Dirección General de Alimentación ha consultado a la AFSSA sobre las medidas de control a adoptar en caso de foco animal de fiebre Q, tanto en lo que concierne a seguridad sanitaria de los alimentos como a sanidad animal, formulando las siguientes preguntas: 1) Respecto a la seguridad sanitaria de los alimentos, nivel de riesgo que presenta para el hombre la leche de un animal serológicamente positivo, en ausencia de toda manifestación clínica relacionada con la fiebre Q y, sobre todo: • probabilidad de excreción de Coxiella burnetii en leche por un animal serológicamente positivo y existencia o no de una relación entre el título serológico y dicha probabilidad de excreción; Respuesta: un resultado serológico positivo en un animal indica que ha estado en contacto con el agente causante de la fiebre Q. Las técnicas serológicas actuales no permiten establecer conclusiones acerca de la antigüedad de la contaminación, ni tampoco sobre el carácter agudo o crónico de la infección, o sobre la capacidad de excreción del animal (§ 1.2.2.4). • necesidad de estudiar dicha excreción en leche; Respuesta: Dado que la vía alimentaria es una vía menor de contaminación, no parece ni deseable ni justificable recomendar medidas de detección sistemática en la comercialización de leche cruda. En efecto, sabiendo que un número indeterminado pero presumiblemente elevado de ganaderías son excretoras sin haber sido identificadas como tales, y que una generalización de la investigación de Coxiella burnetii en leche no sería realista, este tipo de medidas obligatorias tendría un carácter discriminatorio y conducirían a una situación de infradeclaración de focos, que finalmente daría lugar a un balance negativo del plan de protección de salud pública (recomendación 3.1.2). En cambio, debería acometerse la detección de Coxiella burnetii tanto en leche como en otros excreta, con fines de investigación o diagnóstico, en los estudios epidemiológicos que se realicen en los focos de fiebre Q (recomendación 3.4.1). • método a seguir para estudiar Coxiella burnetii en leche. Respuesta: La técnica recomendada es el PCR. Sin embargo, éste debe asociarse a un test ELISA en suero para detectar la infección en un rebaño (§ 1.2.2.4). 2) Con respecto a la Sanidad Animal, se consulta a la AFSSA sobre: • probabilidad de transmisión de la infección a otra población ganadera en caso de manifestaciones clínicas o de seropositividad, teniendo en cuenta el porcentaje de animales seropositivos y el título serológico; Respuesta: con las herramientas serológicas de las que se dispone actualmente, lo único que se puede afirmar es que un rebaño en el que todos los resultados serológicos son negativos no puede ser excretor en el momento del estudio. En el resto de casos, no es posible evaluar el riesgo de excreción o de transmisión a otra población ganadera basándose solamente en la serología (§ 1.2.2.4). Teniendo en cuenta las limitaciones de las herramientas de diagnóstico y el gran número de factores implicados en la transmisión, actualmente es imposible prever cual será el escenario que predominará en la transmisión entre rebaños. 19 Aunque el grupo de trabajo considera altamente probable la contaminación de poblaciones ganaderas vecinas a un rebaño que presente signos de fiebre Q (§ 1.3.1), señala que no es posible pronunciarse sobre la probabilidad de contaminación de una población ganadera a partir de otra seropositiva (§ 1.2.2.4). • eficacia de los procedimientos de lucha disponibles (antibióticos y desinfectantes) para los animales, así como de los procedimientos utilizados para el saneamiento del entorno; Respuesta: En espera de otras experiencias que demuestren con mayor precisión la eficacia y las limitaciones de los tratamientos antibióticos, se recomiendan estos últimos para disminuir la excreción en caso de episodios de aborto o en el secado, en caso de que la excreción en leche persista (§ 2.2). Los purines contaminados pueden tratarse con cianamida cálcica (§ 2.1). • interés comparativo de vacunas inactivadas fase I y fase II de cara a limitar la excreción y la circulación bacteriana dentro de un rebaño; Respuesta: La vacuna fase II disponible en rumiantes no impide la excreción de Coxiella burnetii en leche, secreciones vaginales o heces. Por el contrario, la vacuna en fase I la previene. En efecto, se ha visto experimentalmente que las vacunas inactivadas en fase I reducen de forma muy eficaz la frecuencia de abortos y de forma aún más eficaz la excreción en leche. Reducen considerablemente la duración de la excreción en heces y vaginal, así como la cantidad de bacterias excretada (§ 2.4). Con el fin de dar respuesta al requerimiento de la DGAL, mediante la Decisión n° 2003/056 de fecha 8 de enero de 2003, el Director General de la AFSSA ha decidido crear un grupo de trabajo llamado “Fiebre Q”, el cual deberá responder a las preguntas formuladas y evaluar, de cara a la Salud Pública: • el riesgo de contaminación que presentan la leche y los productos lácteos de pequeños rumiantes infectados por Coxiella burnetii, responsable de la fiebre Q; Respuesta: Dicho riesgo ha sido evaluado como “de nulo a despreciable” para la población normal, y “despreciable” para los grupos de población que presentan factores agravantes (mujeres embarazadas, pacientes que sufren valvulopatías cardiacas o inmunodepresión) (§ 1.6). • el riesgo de contaminación de poblaciones humanas expuestas a otros modos de transmisión de Coxiella burnetii. Respuesta: En lo que concierne a la población general que no presenta ningún factor agravante (embarazo, valvulopatía o inmunodepresión), el riesgo puede considerarse extremadamente bajo (“de nulo a despreciable”) El riesgo es mayor para las poblaciones que presentan factores agravantes, por lo que la utilización de un tratamiento adaptado resulta especialmente importante en esta categoría de población. En efecto, un diagnóstico precoz acompañado de un tratamiento adaptado reduce el riesgo de manera considerable. Para la población que presenta factores agravantes, el riesgo bruto varía de “despreciable” a “bajo”, mientras que el riesgo reducido mediante tratamiento resulta “de nulo a despreciable”. El riesgo asociado a la fauna salvaje es, en global, “de nulo a despreciable” (§ 1.6). 20 Introducción La fiebre Q es una zoonosis cuya incidencia no se conoce bien en Francia, debido a la variedad de síntomas con que se relaciona, y a la dificultad de su diagnóstico. Entre todos los episodios que han atraído la atención sobre las consecuencias de esta enfermedad para la Salud Pública, la más reciente es la epidemia de fiebre Q humana que tuvo lugar en el año 2002 en el valle de Chamonix. Entre los meses de junio y noviembre se censaron 89 casos de fiebre Q, de los que 71 presentaban signos clínicos. Nueve de ellos precisaron tratamiento médico de larga duración, ya que pertenecían a grupos de riesgo. La reglamentación francesa en materia de fiebre Q concierne sólamente a la seguridad sanitaria de los alimentos, ya que autoriza la comercialización de leche cruda de vaca destinada a consumo humano únicamente cuando proviene de una explotación que no presente signos clínicos de fiebre Q. Además, las instrucciones administrativas recomiendan a las direcciones provinciales de los servicios veterinarios asegurarse de que los productores de queso a base de leche cruda tienen una marca de salubridad comunitaria, descartan la leche de las hembras que hayan abortado, y de que tratan la leche del resto de rebaño mediante una pasteurización “alta” (85°C durante 30 segundos), en caso de que sus poblaciones ganaderas estén aquejadas de fiebre Q 1. Teniendo en cuenta estos elementos, con fecha de 20 de diciembre de 2002 la DGAL consultó a la AFSSA sobre dos cuestiones: 1) Respecto a la seguridad sanitaria de los alimentos, sobre “el nivel de riesgo que presenta para el hombre la leche de un animal serológicamente positivo en ausencia de toda manifestación clínica que pueda relacionarse con la fiebre Q”, y especialmente sobre: - la probabilidad de excreción de Coxiella burnetii en leche por un animal serológicamente positivo, y sobre la existencia de una relación entre título serológico y dicha probabilidad de excreción; - la necesidad de estudiar dicha excreción; - el método a utilizar para ello. 2) Respecto a la sanidad animal, se consulta a la AFSSA sobre: - la probabilidad de transmisión de la infección a otra población en caso de manifestaciones clínicas o de seropositividad, teniendo en cuenta el porcentaje de animales seropositivos y el título serológico; - la eficacia de los procedimientos de lucha disponibles (antibióticos y desinfectantes) para los animales, así como de los utilizados para el saneamiento del entorno; - el interés comparativo de las vacunas inactivadas fase I y II de cara a disminuir la excreción y la circulación bacteriana en el interior del rebaño. Para responder a estas cuestiones, el Director General de la AFSSA ha decidido crear un grupo de trabajo llamado “Fiebre Q”, por medio de la Decisión n° 2003/056 de fecha 8 de enero de 2003, encargado de: 1. Evaluar, de cara a la Salud Pública: - el riesgo de contaminación que presenta la leche y sus derivados cuando proceden de ovejas infectadas por Coxiella burnetii, responsable de la fiebre Q; - el riesgo de contaminación de poblaciones humanas expuestas a otros modos de transmisión de Coxiella burnetii. 1 La memoria explicativa del 10 de febrero de 2004 ha dejado obsoleta esta obligación. La leche de ganaderías contaminadas por fiebre Q puede ser tratada mediante una pasteurización a 72°C durante 15 segundos o un tratamiento equivalente. 21 2. Estudiar, de cara a la Sanidad Animal: - la probabilidad de transmisión de la infección a otra población ganadera en caso de manifestaciones clínicas o de seropositividad (intentando evaluar el riesgo según el perfil serológico del rebaño: porcentaje de animales seropositivos, título serológico...); - la eficacia de los procedimientos de lucha disponibles (desinfectantes, antibióticos, medidas sanitarias...) que conciernen tanto a los animales como al saneamiento del entorno; - los efectos comparativos de las vacunas inactivadas fase I y fase II sobre la excreción y la circulación bacteriana dentro de un rebaño infectado, utilizadas con carácter preventivo. 3. Establecer recomendaciones sobre las medidas a adoptar en caso de foco animal de fiebre Q, con el fin de limitar o prevenir los riesgos, tanto en el dominio de la seguridad sanitaria de los alimentos como en el de la sanidad animal. Así, el informe redactado por el grupo de trabajo comprende tres partes: - por una parte, un análisis cualitativo del riesgo en Salud Pública de la transmisión de la fiebre Q al hombre originada por rumiantes, en función de la vía de excreción de la bacteria; - por otra parte, un análisis de las herramientas disponibles en Sanidad Animal para reducir el riesgo de propagación de la fiebre Q dentro de un rebaño, o entre rebaños; - para concluir, las recomendaciones derivadas de los apartados anteriores. El grupo de trabajo se ha reunido 14 veces (3/03/03, 19/03/03, 8/04/03, 1/07/03, 15/09/03, 7/10/03, 23/10/03, 02/12/03, 27/01/04, 11/02/04, 8/04/04, 13/04/04, 26/05/04 y 02/06/04) y ha requerido al Comité Experto Especializado “Microbiología” sobre las conclusiones a extraer de anteriores trabajos sobre la eficacia de la pasteurización a 72 o a 74°C. Las conclusiones del Comité Experto Especializado “Microbiología” se recogen en el Anexo. El informe del grupo de trabajo sobre evaluación de riesgos para la Salud Pública y herramientas de gestión de riesgos en cría de rumiantes ha sido presentado al Comité Experto Especializado “Sanidad Animal” a lo largo de las sesiones del 4 de mayo y 8 de junio de 2004, y validado el 8 de junio de 2004. 22 1 Evaluacion del riesgo en Salud Pública 1.1 Presentación del método 1.1.1 Principio general del método Entre los distintos procedimientos que permiten llevar a cabo una evaluación de riesgos, el grupo de trabajo del Comité de Expertos Especializado “Salud Animal” (CES SA) ha preferido utilizar el método recomendado por la Oficina Internacional de Epizootias (OIE). Dicho método comprende las cinco etapas siguientes: • Identificación del peligro • Valoración de la emisión (probabilidad de emisión a partir de la fuente) • Valoración de la exposición (probabilidad de exposición al peligro) • Valoración de las consecuencias (frecuencia y gravedad) • Estimación del riesgo (lo cual consiste en combinar las probabilidades de frecuencia de emisión y de exposición con las consecuencias). La estimación del riesgo puede llevarse a cabo de forma cualitativa o cuantitativa. La elección de un método u otro depende de la mayor o menor cantidad de datos disponibles. El método para realizar una estimación cualitativa del riesgo se apoya en la misma base teórica que la evaluación cuantitativa del riesgo. Cada uno de los sucesos, a veces complejos, que constituyen la emisión, la exposición y las consecuencias, puede a su vez descomponerse en varios parámetros simples. La probabilidad de un suceso dado puede así evaluarse combinando las probabilidades de estos diferentes parámetros de la forma en que se indica en la figura 1. 1.1.2 Valoración de la probabilidad de cada suceso La contribución a la racionalización de la estimación, adaptada a partir de los trabajos de ZepedaSein (1998), completó el procedimiento general de evaluación cualitativa del riesgo. Este autor propone analizar cada cada uno de los parámetros a la luz de toda la información disponible, y realizar separadamente una estimación de la probabilidad de ocurrencia de cada uno de ellos, de forma que se obtenga finalmente un nivel dado de probabilidad (calificado de una de estas cinco formas: nulo, despreciable, bajo, moderado o elevado) o una horquilla determinada (por ejemplo, de despreciable a bajo): • • • • • Nulo: la ocurrencia del suceso no es posible; Despreciable: la ocurrencia del suceso sería posible sólo en circunstancias excepcionales; Bajo: la ocurrencia del suceso es poco probable pero posible en determinadas circunstancias; Moderado: la ocurrencia del suceso es claramente posible; Elevado: la probabilidad de ocurrencia del suceso es grande. 1.1.3 Valoración del riesgo El grupo de trabajo “Rabia en murciélagos” del CES SA adaptó la combinación de probabilidades de dos niveles dados propuesta por Zepeda-Sein, con el fin de tener en cuenta la imprecisión de determinados datos, así como para reflejar la inevitable parte de subjetividad de la estimación de las diferentes probabilidades seleccionadas por el grupo. Sin embargo, este grupo de trabajo no había tenido en cuenta que la combinación de probabilidades conduce a una probabilidad más baja que cada una de las iniciales por separado, como ilustra el siguiente ejemplo cuantitativo (10-4 x 104 =10-8). Para compensar este punto, el ajuste de calificativos es el siguiente: • dos probabilidades con el mismo calificativo dan lugar al calificativo inferior (baja x baja = despreciable); 23 • dos probabilidades contiguas dan lugar a la horquilla inferior de la probabilidad más baja (baja x moderada = de despreciable a baja) ; • dos probabilidades no contiguas (pero no opuestas) dan lugar a la probabilidad más baja de entre ellas (baja x elevada = baja) ; • dos probabildades opuestas dan lugar a la horquilla superior de la probabilidad más baja (despreciable x elevada = de despreciable a baja). La combinación de probabilidades puede hacerse también incluyendo una o dos horquillas. La tabla 1 muestra los posibles cruces. Parámetros de la emisión Parámetros de la exposición Prevalencia del agente patógeno Modalidades de excreción Poblaciones expuestas Vías de exposición de la población Estimación de la emisión Estimación de la exposición Combinación Probabilidad de ocurrencia de la infección Consecuencias Combinación Evaluación del riesgo bruto Consecuencias reducidas por las medidas adoptadas Combinación Evaluación del riesgo reducido Figura 1: Presentación del esquema general de análisis (según el método OIE) La combinación de las diferentes probabilidades correspondientes a cada suceso da lugar a la probabilidad de ocurrencia del peligro. Así, éste último es calificado de igual manera que en lo precedente: nulo, despreciable, bajo, moderado o elevado), o con las horquillas correspondientes. La tabla I ilustra estos principios. 24 Tabla 1: Resultados de la combinación de las diferentes estimaciones cualitativas utilizadas en el análisis cualitativo del riesgo (N = Nulo, D = despreciable, B = bajo, M = moderado y E = elevado) N NaD D DaB B M MaE E N N N N N N N N N N NaD N NaD NaD NaD NaD NaD D D D D N NaD NaD NaD NaD D D D DaB DaB N NaD NaD NaD D D D DaB B B N NaD NaD D D D DaB B B N NaD D D D DaB B B B M N D D D DaB B B B MaE N D D DaB B B B M E N D DaB B B B M M Esta tabla tiene en cuenta el hecho de que, en un análisis cuantitativo, el resultado del producto de de dos probabilidades es una probabilidad inferior a cada una de ellas. 1.2 Identificacion del peligro La fiebre Q es una afección febril inicialmente descrita por Derrick en empleados de mataderos australianos (Queensland, Brisbane). La llamó “query fever”, es decir “la fiebre a clarificar” [Derrick 1937]. El agente causante de la fiebre Q fue aislado por Burnet [Burnet 1937]. Simultáneamente, en los Estados Unidos, Cox identificó una bacteria patógena aislada a partir de garrapatas recogidas en Montana, cerca de Nine Mile Creek, la cual había causado al personal de laboratorio una epidemia caracterizada por fuertes fiebres [Cox 1938]. En homenaje a ambos descubridores, el agente patógeno recibió el nombre de Coxiella burnetii [McDale 1990]. 1.2.1 Germen responsable La fiebre Q es una zoonosis ubicua causada por Coxiella burnetii, bacteria pleomorfa y de pequeña talla (de 0,2 a 0,4 µm de amplitud et 0,4 à 2 µm de longitud) e intracelular estricta. El agente de la fiebre Q comparte numerosas propiedades con las Rickettsias, pero los estudios filogenéticos han mostrado que el género Coxiella debe excluirse de la familia Rickettsieae, y situarse dentro de las Coxiellaceae en el orden de las Legionellales, concretamente en el grupo gamma de las Proteobacteria [Bergey 2003, Stein et al. 1993, Weisburg et al. 1989, Wilson et al. 1989], cerca de los géneros Legionella, Francisella et Rickettsiella. La cubierta exterior de estas bacterias muestra en general una estructura característica a las bacterias Gram negativas, aunque resultan difíciles de teñir por la técnica de Gram. Las tinciones más utilizadas son las de Gimenez, Ziehl-Neelsen modificada o Stamp, Giemsa, Macchiavello y Koster modificada. El genoma completo de la cepa de referencia Nine Mile fue secuenciado en 2003 [Seshadri et al. 2003). Se reparte entre un cromosoma y, a veces, un plásmido, del cual no existen más de 4 a 5 copias. El cromosoma es circular y, según las cepas, la talla varía entre 1,5 y 2,4 X 106 pares de bases. Se han descrito tres tipos de plásmidos: QpH1, QpRS y QpDV [Minnick et al.1990, Samuel et al. 1983, Savinelli y Mallavia 1990, Lautenschlager et al. 2000]. Estos plásmidos difieren en su talla y tienen secuencias comunes conservadas, que se encuentran igualmente en el cromosoma de las cepas que no poseen plásmidos. La multiplicación de Coxiella burnetii tiene lugar únicamente en condiciones intracelulares. El reservorio animal está constituído principalmente por rumiantes, pero la mayoría de los mamíferos (sobre todo durante el parto), las aves y ciertos artrópodos (las garrapatas) pueden excretar la bacteria. En el huésped, las principales células diana de las Coxiella son los monocitos y los 25 macrófagos. Los métodos de aislamiento y cultivo más empleados son la infección de huevos embrionados o de células en cultivo (líneas macrofágicas como las células P388D1 y J774, líneas fibroblásticas como las células L929 o HEL...). También se emplean animales de laboratorio para poner en evidencia y recontar el agente de la fiebre Q. La inoculación intraperitoneal de Coxiella burnetii en ratón se caracteriza por una esplenomegalia. 1.2.1.1 Variaciones antigénicas y poder infeccioso de la bacteria Coxiella burnetii presenta una variación antigénica similar a las variaciones “smooth-rough” (lisarugosa) que se observa en la familia de las Enterobacteriaceae. Esta variación de fase está unida a modificaciones del lipopolisacárido de superficie (LPS). La fase I es la fase natural, presente en el hombre y en el animal infectado (incluidos los artrópodos). Posee un LPS completo. La bacteria en fase I corresponde a la fase “smooth”. La fase II, menos virulenta y contagiosa, se obtiene sólamente en laboratorio tras pasar por cultivos celulares o por huevos embrionados (es decir, por sistemas vivos no inmunocompetentes). La fase II, correspondiente a la fase “rough”, presenta un LPS incompleto, pérdida de ciertas proteínas de la membrana exterior, y podría acompañarse de una importante deleción cromosómica [Thompson et al 2003, Vodkin y Williams 1986]. In vivo, las bacterias en fase II son sensibles a la acción del complemento, y son rápidamente eliminadas por los macrófagos, mientras que las bacterias en fase I sobreviven a la acción bactericida de dichos macrófagos. En el hombre o en cualquier otra especie de mamífero que haya sido infectado, la respuesta en anticuerpos es generalmente más precoz y más elevada en el caso de un antígeno constituído por bacterias en fase II. Por el contrario, el poder protector de los anticuerpos anti-fase I es claramente mayor que el de los anticuerpos anti-fase II. No se ha precisado aún la existencia o el papel de esta variación de fase en el huésped. Coxiella burnetii en fase I es extremadamente infecciosa por vía aérea, en comparación con otros agentes conocidos [Hackstadt 1996, Tigertt et al.1961]. Por otra parte, bastan menos de cinco bacterias para provocar una infección en cobaya o ratón por vía peritoneal, sobre huevo embrionado o cultivo celular [Ormsbee et al.1978]. La administración intraperitoneal de un inóculo con cuatro bacterias provocó en cobaya seroconversión, hipertermia y presencia de bacterias en bazo treinta días más tarde [Moos y Hackstadt 1987]. En cualquier caso, es su capacidad de propagación y no su poder patógeno, relativamente bajo para el hombre, la causa de que se haya incluido entre los diez agentes potencialmente utilizables para la elaboración de armas químicas [Center for Disease Control, 2000]. 1.2.1.2 Vía intracelular El ciclo de multiplicación de Coxiela burnetii comprende una división celular binaria transversal así como una fase de esporulación. Coxiela burnetii existe en la célula huésped bajo tres formas morfológica y metabólicamente distintas: una gran forma llamada LCV (de “Large Cell Variant”), metabólicamente activa y que contiene pocos LPS (“lipopolisacárido de superficie”), y una pequeña forma SCV (de “Small Cell Variant”), metabólicamente poco activa, más densa a los electrones y resistente en el medio exterior [Melnicakova et al. 2003]. Las SDC (“Small Dense Cell”) serían más pequeñas que las SCV y podrían asimilarse a pseudo-esporas, diferentes de las esporas producidas por las bacterias Gram positivas (ausencia de ácido dipicolínico y de una cubierta rica en cisteína, y presencia de una proteína “histone-like” que compacta el ADN [McCaul et al.1991]. A lo largo de su multiplicación, las LCV parecen capaces de presentar un fenómeno cercano al de la esporulación, ya que a veces es posible observar la presencia de un septo que divide el citoplasma de la célula en dos compartimentos de talla desigual, cada uno de los cuales contiene un material nuclear completo. El compartimento pequeño constituiría una endospora situada en una extremidad del LCV [McCaul et Williams 1981, Norlander 2000]. Estas pseudo-esporas han sido descritas en el interior de las LCV, pero también han sido detectadas en las válvulas cardíacas infectadas por Coxiella burnetii [McCaul et al.1994]. Las amebas (Acanthamoeba castellanii) 26 podrían también representar un nicho intracelular para la formación de pseudo-esporas y la supervivencia de Coxiella burnetii en el medio ambiente [La Scola y Raoult, 2001]. El desarrollo posterior conduciría a un SCV que sería liberado en la lisis de las LCV o en una división celular asimétrica. Los mecanismos de transformación de las SDC en SCV, a día de hoy, no se conocen. La presencia en el genoma de la cepa Nine Mile de una secuencia de 1.741 pares de bases que presentan fuertes homologías con el gen spoIIIE, implicado en la esporulación de Bacillus subtilis, confirma la existencia de un ciclo de esporulación [Oswald y Thiele, 1993]. Sin embargo, no todos los autores aceptan la esporulación, y es posible que las LCV puedan dar lugar a SCV por condensación, sin pasar por el estadío intermedio de SDC. Tanto las LCV como las SCV son infecciosas [Wiebe et al. 1972]; sin embargo la ausencia de resistencia de las LCV a los choques osmóticos sugiere que sólo las SCV son capaces de sobrevivir en el medio extracelular y jugar un papel en la transmisión. Por el contrario, parece que las LCV son las responsables de la propagación de la bacteria en el interior de un organismo infectado. Estas dos variantes se diferencian también por sus proteínas, sobre todo por las de la membrana externa. Por ejemplo, la proteína P1 de 29 kD es abundante en las LCV y prácticamente ausente en las SCV, mientras que con la proteína OMP34 (« Outer membrane Protein » de 34 kD) se observa lo contrario. El ciclo de multiplicación de Coxiella burnetii en la célula eucariota commienza con la fijación y la penetración de las SCV en la célula, que recurre a diferentes receptores según la fase antigénica. Estas diferencias de comportamiento entre Coxiella burnetii en fase I y Coxiella burnetii en fase II permiten explicar que sólo las bacterias en fase I sean infecciosas. Coxiella burnetii en fase II se fija sobre los receptores CR3 (receptor para el fragmento iC3b del sistema complementario). La bacteria penetra fácilmente en la célula pero es rápidamente destruída por el sistema fagolisosomal [Mege et al. 1997]. En cambio, la forma infectante de la bacteria (fase I) bloquea el receptor CR3 y utiliza receptores relacionados con las integrinas, el complejo LRI (leukocyte response integrin, αvβ3) – IAP (integrinassociated proteins) [Mege 1997]. La bacteria en fase I induciría la reorganización de los filamentos de actina y la formación de seudópodos, al igual que las Salmonella, para penetrar en los macrófagos por fagocitosis [Honstettre et al. 2004]. Por esta vía, los CR3 se localizan fuera de estos seudópodos mientras que las integrinas αvβ3 están presentes en ellos. Así la bacteria es débilmente introducida en la célula, pero es capaz de sobrevivir y de multiplicarse en su interior [Mege et al. 1997, Capo et al. 2003]. Tras penetrar en la célula, las SCV se localizan en los fagosomas, que se acidifican sobre todo gracias a la adquisición de una V-H+-ATPasa [Ghigo et al. 2002]. Producen factores capaces de bloquear la fusión del fagosoma con los lisosomas y, activadas por el medio ácido del fagosoma (pH 5,5), se transforman en LCV. Después, en los macrófagos, el fagosoma se fusiona con los lisosomas para formar un fagolisososoma, mientras que las bacterias virulentas inhibirían esta fusión en los monocitos [Howe et al. 2002]. A continuación los diferentes fagolisosomas se fusionan en una única vacuola gracias a la síntesis de proteínas de Coxiella burnetii que por el momento se desconocen [Hackstadt y Williams 1981, Howe et al. 2003]. Al final del ciclo, las LCV se condensan en SCV o inician una esporogénesis que da lugar a la formación de SDC [McCaul y Williams 1981, Mc Caul 1991]. Coxiella burnetii se ha adaptado para sobrevivir en el fagolisosoma de las células eucariotas [Hackstadt y Williams 1981] y tener un metabolismo óptimo en medio ácido (pH entre 4,7 y 5,2) [Akporiaye et al. 1983, Maurin et al. 1992b]. La necesidad de un medio ácido, igualmente observado para las formas amastigotes de Leishmania sp, sólo ha sido descrita en dos especies bacterianas: Coxiella burnetii y Francisella tularensis. 27 Fijación penetración SCV Fusión lisosoma Liberación fuera de la célula Formación pseudo-esporas Multiplicación LCV Figura 2: Ciclo de multiplicación de Coxiella burnetii 1.2.2 Enfermedad animal 1.2.2.1 Signos clínicos en rumiantes domésticos En los rumiantes, como en el hombre, la vía de penetración de Coxiella burnetii parece ser esencialmente la respiratoria. Los primeros objetivos de la bacteria durante la infección son a menudo los macrófagos alveolares y las células de Küpfer. Se ha encontrado la bacteria en estos macrófagos, y en los monocitos y macrófagos de muchos otros órganos (bazo, ganglios linfáticos, médula ósea, páncreas, corazón...) (Baumgartner et al.1993). Sin embargo muy rara vez se han descrito infecciones pulmonares o cardíacas en rumiantes, al margen de la infección experimental de doce novillas por inoculación intradérmica, que les provocó neumonía (Plommet et al. 1973). Una de estas novillas murió tres meses después de la inoculación de una insuficiencia cardíaca, y el examen histológico reveló zonas de degeneración y esclerosis del miocardio. También en ese momento, dos de las once novillas restantes presentaron un electrocardiograma de perfil atenuado que generalmente obedece a la existencia de adherencias cardiopericárdicas o a exudaciones pericárdicas. En el sacrifio, diecisiete meses después de la inoculación, dos de las vacas presentaban lesiones vasculares y otra mostraba una esclerosis generalizada en el pulmón izquierdo. La infección en ovino y caprino puede provocar abortos hacia el final de la gestación, partos prematuros o nacimiento de animales raquíticos o muertos [Palmer et al. 1983, Waldham et al. 1978]. En bovino puede causar metritis [Tainturier 1987], abortos, esterilidad, terneros que nacen con bajo peso, así como neumonías [Ho et al. 1995, Plommet et al. 1973, Schmeer et al. 1987, Wittenbrink et al. 1994]. El ganado bovino, ovino y caprino infectado por Coxiella burnetii presenta mayoritariamente una infección asintomática, con o sin respuesta serológica, y pueden excretar la bacteria. Los conocimientos sobre las vías de excreción de la bacteria son limitados y a menudo obsoletos. Determinadas precisiones sobre las diferentes vías no se han conocido hasta la aparición de las técnicas moleculares por PCR. Estas técnicas se pusieron en marcha inicialmente para el 28 diagnóstico en pacientes, y desde hace poco se utilizan para realizar investigaciones en muestras de origen animal. De forma general, la carga bacteriana es alta en placenta, productos del parto y secreciones vaginales, más baja en leche, y poco conocida en heces, orina y esperma (ver 1.3.2). 1.2.2.2 Persistencia de la bacteria en los animales infectados Pocos estudios experimentales en rumiantes tratan sobre la persistencia de la bacteria. En ratón y cobaya, la inoculación de Coxiella burnetii da lugar a la acumulación de un gran número de bacterias en hígado y bazo al principio de la infección, a lo que sigue una eliminación de bacterias que sin embargo persisten en riñones u órganos genitales durante un período de más de seis meses [Kazar et Kovacova 1983]. La infección se reactiva con la gestación, ocasionando sucesivos partos de camadas reducidas. En rumiantes, son las hembras las preferentemente afectadas, ya que la multiplicación del microorganismo, reactivada a lo largo de la gestación, ocasiona la colonización bacteriana de la placenta [Baca y Paretsky 1983, Luoto y Huebner 1950, Plommet et al. 1973, Welsh et al. 1957]. La excreción a partir del útero y de las secreciones vaginales puede persistir mucho tiempo tras el aborto o el parto: al menos 70 días en oveja [Berri et al. 2001] y al menos 110 días en vaca [Rodolakis, resultados sin publicar]. En cambio, en el caso de los rumiantes no parece que Coxiella burnetii afecte durante varias gestaciones sucesivas como es el caso en la mujer o en el ratón. Las hembras abortarían sólo una vez y muy excepcionalmente excretarían en varios partos [Berri et al. 2002]. El punto de infección crónica lo constituyen sobre todo las glándulas mamarias y los ganglios retromamarios [Behymer et al. 1977, Bell et al. 1949, Moretti 1984]. En vacas por ejemplo, puede encontrarse Coxiella burnetii hasta al menos veinte meses después de la infección en diferentes órganos pero sobre todo en ganglios, incluídos los retromamarios [Plommet et al. 1973]. 1.2.2.3 Transmisión de la infección entre rebaños La difusión aérea de Coxiella burnetii en el momento del aborto o del parto juega un papel muy importante en la contaminación de los animales y en la transmisión de la infección entre rebaños, con la agravante de que esta contaminación puede diferir en el tiempo. Dado que Coxiella burnetii resiste el calor y la desecación, puede sobrevivir 150 días al sol [Welsh et al. 1957]. Una placenta infectada abandonada en un prado, estiércol o purines esparcidos en un campo, pueden infectar rebaños situados a varios kilómetros de distancia. También es posible la transmisión por garrapatas. Si la vía respiratoria es la principal vía de penetración, la contaminación por vía ocular, que juega un papel importante en la brucelosis y en la clamidiasis, no se ha considerado en el caso de la fiebre Q. Por lo que sabemos, tampoco se ha estudiado la contaminación por ingestión de placenta contaminada por Coxiella burnetii, pero no se considera una vía importante ya que se ha visto que el ratón es 10.000 veces menos sensible a esta vía que a la intraperitoneal [Durand 1993]. Esta opinión debe ser matizada: se sabe que una placenta contaminada contiene un gran número de Coxiella, estimado en 109 Coxiella por gramo [Babudieri 1959], y se admite que su consumo puede causar la contaminación de gatos y perros [Maurin y Raoult 1999]. Por lo tanto sería necesario explorar la importancia de esta vía de transmisión en el interior de un rebaño. Con el fin de prevenir la transmisión de la infección de un rebaño a otro, es indispensable identificar los animales y los rebaños que excretan Coxiella burnetii de forma masiva, tanto en placenta como en secreciones vaginales y en heces. 1.2.2.4 Herramientas de diagnóstico en medicina veterinaria Se dispone de diversas herramientas para el diagnóstico directo e indirecto de la fiebre Q, generalmente destinadas a rumiantes. Se emplean frecuentemente después de un episodio abortivo en un rebaño. En este caso se recomienda recurrir a un diagnóstico de grupo e investigar al mismo tiempo otros agentes abortivos (Brucella, Chlamydophila abortus, Toxoplasma, Salmonella…) [Sanchis et al. 1997]. Gradualmente, la importancia de la fiebre Q como zoonosis 29 conduce al desarrollo de nuevas herramientas destinadas a buscar una fuente de contaminación, evaluar zonas o períodos de riesgo, y comprender mejor su epidemiología [Rousset et al. 2004]. Herramientas serológicas FC y ELISA En serología, la fijación del complemento (FC) sigue siendo la técnica de referencia de la OIE [Herr et al. 1985, Peter et al. 1985]. Se ha propuesto su estandarización a escala francesa dentro del marco del programa COFRAC 109 (norma AFNOR NFU47-006). Se han puesto en marcha ensayos interlaboratorio de aptitud (EILA) en fiebre Q para la fijación del complemento, según técnicas referenciadas por AFNOR. La técnica ELISA, comercializada más recientemente, se utiliza cada vez más [Kovacova et al. 1987, Peter 1988, Uhaa et al.1994, Waag et al. 1995, Williams et al. 1986]. Al igual que la serología en medicina humana, sería util disponer de una técnica serológica eficaz que permitiera distinguir en animales los títulos de anticuerpos anti-fase I y anti-fase II. La técnica ELISA disponible en Francia permite la detección de los anticuerpos totales (anti-fases I y II) de Coxiella burnetii, mientras que la FC emplea un antígeno preparado en fase II. IFI y otras técnicas El recurso a la inmunofluorescencia indirecta resulta más excepcional [Boni et al. 1998, Hatchette et al. 2002, Martinov et al. 1989, Meskini et al. 1995, Muramatsu et al. 1997, To et al. 1998]. Otras técnicas serológicas se han ido abandonando, como es el caso de la microaglutinación [Fiset et al. 1969, Kazar et al. 1981, Nguyen et al. 1996], el Radio-Immuno-Ensayo (RIA) [Doller et al. 1984], la hemólisis indirecta [Tokarevich et al. 1990], el ELIFA (Enzyme-Linked- Immunosorbent Fluorescence Assay) [Schmeer etal. 1988], el Dot Blot y el Western Blot [Blondeau et al.1990b, Willems et al. 1992]. En la práctica rutinaria del diagnóstico de la fiebre Q, es conveniente utilizar preferentemente la técnica ELISA, más sensible y específica que la FC. Herramientas bacteriológicas Tinción bacteriana La técnica más empleada es la tinción en frotis o calcos a partir de cotiledón placentario, de órganos de feto abortado, o de muestras vaginales. Las tinciones que permiten observar Coxiella burnetii en microscopía son Stamp, Ziehl-Neelsen modificado, Gimenez, Giemsa y Koster modificado. La más utilizada en Francia es la de Stamp [Gimenez 1964, Quinn et al.1994, Russo et al. 1997]. Detección de bacterias En diagnóstico directo, también puede utilizarse la técnica de inmunofluorescencia [Brouqui et al. 1994). Emplea anticuerpos específicos de todas las cepas de Coxiella burnetii. Sin embargo no se prevé utilizar esta técnica en diagnóstico de rutina, ya que estos anticuerpos no se comercializan. También se han puesto a punto técnicas de ELISA captura [Thiele et al. 1992], especialmente para detectar Coxiella burnetii directamente en leche con una sensibilidad de 4.000 bacterias/mL [Dackau 1993], pero no han pasado a ser utilizadas. Detección del ADN bacteriano Recientemente, la amplificación genómica del ADN de Coxiella burnetii por PCR ha permitido poner en evidencia el ADN de las bacterias directamente en la muestra, enfoque actualmente considerado como prometedor. Esta técnica puede adaptarse a una amplia diversidad de tipos de 30 muestra [Berri et al. 2000]. Es sensible y rápida, y el equipamiento que requiere está cada vez más extendido en los laboratorios de diagnóstico de Francia. Cuantificación de bacterias El abanico de métodos utilizado en los modelos animales para definir el inóculo y la expresión de los resultados obtenidos da cuenta de la dificultad de obtener recuentos fiables de Coxiella burnetii (contaje directo de bacterias teñidas con acridina naranja, determinación de dosis infecciosas medianas en huevo, EID50, en cobaya o en ratón). La mejor técnica para contar Coxiella burnetii es la que consiste en realizar diluciones del inóculo y sembrarlas sobre la alfombra celular de los botes bijoux [Raoult et al. 1991]. La lectura se realiza por recuento de vacuolas tras poner de manifiesto las bacterias mediante inmunofluorescencia. Se están desarrollando técnicas de PCR en tiempo real [Brennan y Samuel 2003, Harris et al. 2000], sobre todo para cuantificar Coxiella burnetii en muestras como leche [Stemmler et Meyer 2002]. Aislamiento de cepas También puede realizarse un aislamiento de cepas bacterianas a partir de muestras. Existen tres modos de cultivar estas bacterias intracelulares: en animal (cobaya, ratón), en huevo embrionado o en cultivo celular en botes bijoux [Ormsbee 1952, Perrin y Bengtson 1942, Williams et al. 1986a, Raoult et al. 1990]. Sin embargo, estas técnicas son pesadas y proporcionan un resultado tardío. Se requieren precauciones de nivel 3 de seguridad microbiológica (NSB3) para proteger tanto el manipulador como el ambiente durante el aislamiento y el cultivo de una cepa, así como para la manipulación de muestras contaminadas (especialmente las placentas, que pueden contener un gran número de Coxiella burnetii). La técnica que presenta menos riesgo para el manipulador es la de cultivo bacteriano en botes bijoux [Raoult et al. 1990], pero no resulta adecuada cuando las muestras poseen abundante flora competitiva (quesos, estiércol...). En estos casos es útil emplear animales de laboratorio. Se han obtenido numerosos aislados, aunque casi siempre dentro del marco de la investigación. El CNR dispone de la muestroteca de cepas de Coxiella burnetii más importante a nivel mundial: 114 cepas de origen humano y algunas de origen animal. Tipificación de bacterias La tipificación bacteriana necesita aún encontrar una herramienta eficaz. Ciertos anticuerpos monoclonales permiten distinguir los aislados [Sekeyova et al. 1996, Wen et al. 1991] o los estadíos de desarrollo de la bacteria [Seshadri et al. 1999]. Se han llevado a cabo numerosas tentativas para encontrar marcadores y estrategias moleculares para distiguir las cepas de Coxiella burnetii. El análisis por secuenciación (PCR-RFLP) de genes susceptibles de presentar una alta tasa de variabilidad ha proporcionado resultados esperanzadores [Sekeyova et al. 1999, Zhang et al. 1997]. El otro enfoque de genotipificación es el análisis de la totalidad del cromosoma, restricción y separación de los fragmentos de ADN por electroforesis en campo pulsado (PFGE) y la comparación posterior de los perfiles obtenidos. Este método ha permitido caracterizar variaciones genómicas, así como aislados similares procedentes de las mismas zonas geográficas [Heinzen et al. 1990, Jäger et al. 1998, Thiele et al. 1993, Vodkin et al. 1986]. En cambio, no se ha asociado ningún genotipo a una forma aguda o crónica de la enfermedad, ni a una forma clínica particular, ni a ninguna especie concreta de huésped. Interpretación En serología Las diferencias metodológicas se abordarán más adelante. La FC es considerada como menos sensible y específica que la ELISA. Distintas comparaciones de técnicas han mostrado la importante influencia del antígeno (cepa, preparación) y de los tipos de anticuerpos que pueden ser detectados (clases de inmunoglobulinas, anticuerpos que fijan o no el complemento) sobre el resultado serológico [Peter et al. 1985, Worswick y Marmion 1985]. Las reacciones cruzadas pueden ser la causa de las dificultades de 31 interpretación de los test serológicos, y varían según la técnica. En lo que respecta a Coxiella burnetii, las principales reacciones cruzadas tienen lugar con Legionella pneumophila [Dyer et al. 1988, Finidori et al. 1992], Legionella micdadei [Dobija-Domaradzki et al.1984, Musso et al. 1997], Bartonella quintana y Bartonella henselae [La Scola et al. 1996]. Estas reacciones cruzadas pueden influenciar el resultado, sobre todo cuando los títulos son bajos. Globalmente, la serología presenta grandes dificultades de interpretación, ya que la respuesta serológica a nivel individual no es significativa. Estas dificultades están sobre todo asociadas a la falta de conocimiento de la respuesta serológica en función de la vía de infección, de la dosis, y de factores relativos al huésped como pueden ser el estado de gestación, la edad o la especie (plazo de incubación, cinética y persistencia de anticuerpos...). A día de hoy no se ha podido establecer ninguna correlación con la excreción bacteriana: un animal seropositivo no es necesariamente excretor, y ciertos animales son excretores aunque su nivel de anticuerpos anti-Coxiella burnetii en suero sea bajo [Adesiyun et al. 1985, Berri et al. 2001, Muramatsu et al. 1997]. En cambio, un rebaño en el que todos los animales son seronegativos no puede ser excretor, y puede ser considerado no infectado. Así, no se han evaluado los umbrales para distinguir una infección reciente de una antigua, una latente de una clínica, o, más aún, para distinguir los anticuerpos procedentes de vacunas de los anticuerpos infecciosos. A escala de rebaño, se ha asociado una seroprevalencia alta y una fuerte proporción de títulos elevados con rebaños afectados de abortos por fiebre Q, pero los estudios o bien carecían de grupos control o bien el tamaño de la muestra era demasiado limitado para poder demostrar esta asociación con claridad [Sanford et al. 1994]. Con las herramientas serológicas actualmente disponibles, la único que se puede afirmar es que un rebaño negativo en su totalidad no puede ser excretor en el momento del estudio. En el resto de casos, no se puede evaluar el riesgo de excreción o de transmisión a otra población ganadera basándose únicamente en la serología. En bacteriología Entre las técnicas que permiten revelar la Coxiella burnetii para su observación directa, la técnica de tinción, aunque rápida, es sólamente presuntiva. Le falta especificidad, ya que Coxiella burnetii puede confundirse con Brucella ou Chlamydophila. La sensibilidad de esta técnica es baja y depende de la calidad de las muestras. Sería interesante recurrir a la inmunofluorescencia, que además de ser claramente más específica y sensible, permite obtener una evaluación de las lesiones histológicas. Sin embargo, no se dispone de reactivos estandarizados. También pueden utilizarse las técnicas de amplificación genómica por PCR, que permiten confirmar un diagnóstico directo. Son claramente más sensibles y rápidas que el aislamiento, y más precoces que la respuesta serológica en la fase aguda de la infección [To et al. 1996]. Sin embargo, la sensibilidad del método PCR no ha sido determinada, debido a la dificultad de realizar contajes de Coxiella burnetii. En el INRA, donde se ha puesto a punto la técnica PCR para el gen que codifica para la transposasa de Coxiella burnetii, se puede detectar del orden de 500 bacterias por ml de leche [A. Rodolakis, resultados no publicados]. En general, las técnicas PCR prometen mayor sensibilidad que las técnicas de observación directa, y permiten además la detección de fragmentos del genoma bacteriano directamente en la muestra sin tener que recurrir al cultivo. Así, se consideran el método a elegir de cara a la detección de Coxiella burnetii en leche, secreciones vaginales, e incluso en heces, garrapatas y polvo [Berri et al. 2000, Spitalska et Kocianova 2003, Yanase et al. 1998]. Actualmente se dispone de un primer kit PCR que contiene un patrón interno que permite detectar la presencia de inhibidores, evitando así los falsos negativos, el cual ha sido testado en campo sobre más de 20 cepas procedentes de rumiantes, 1.500 muestras de leche, 600 muestras vaginales obtenidas mediante torunda, y otras tantas de heces. Se ha verificado la especificidad de la amplificación frente a una decena de gérmenes abortivos bacterianos. Sin embargo, esta técnica debe utilizarse de forma muy rigurosa, para evitar los falsos positivos debidos a los amplificados generados en el laboratorio [A. Rodolakis, resultados no publicados]. 32 Finalmente, el principal problema asociado a las técnicas de detección molecular por PCR convencional consiste en que la técnica detecta tanto el ADN de las bacterias vivas como el de las muertas. En el caso de bacterias como la Listeria, la deteccón de bacterias vivas se consigue fácilmente por enriquecimiento bacteriano, pero esto no puede realizarse en el caso de Coxiella burnetii. Una forma de evitar este problema consiste en la utilización de técnicas de biología molecular basadas en la detección de ARN mensajero, presente en un número elevado de copias y sólo en bacterias vivas. De todas formas, para emplear estas técnicas PCR es necesario distinguir las muestras que presentan un buen valor para el diagnóstico de aquellas cuya interpretación resulta difícil. Las muestras que proceden directamente del animal y se han tomado, en la medida de lo posible, en condiciones de esterilidad (secreción vaginal, heces, leche) tienen un buen valor para el diagnóstico. En efecto, la detección del ADN de Coxiella burnetii indica su origen animal en la medida en que esta bacteria se multiplica exclusivamente en el interior de las células de un huésped. Por el contrario, la interpretación de muestras tomadas en leche de mezcla resulta delicada, ya que es difícil asegurar que esta muestra no haya sido contaminada por el ambiente. Teniendo en cuenta el límite de detección y de muestreo, es posible que el PCR sólo detecte esta contaminación externa cuando el ambiente está altamente contaminado. Incluso si en los últimos años la técnica PCR está cada vez más extendida en los laboratorios de diágnostico, sobre todo para la investigación de Coxiella burnetii en leche, no se dispone aún de suficiente perspectiva para juzgar el valor de esta herramienta. Así, para confirmar la circulación de este agente dentro de una población ganadera, deberá igualmente demostrarse la presencia de anticuerpos específicos a Coxiella burnetii. En conclusión, las limitaciones a la interpretación son los mismos que para la serología. No es posible extraer ninguna conclusión de resultados obtenidos mediante una sola técnica y sobre un número excesivamente limitado de animales. Aplicaciones Hay que considerar distintas aplicaciones: - Diagnóstico clínico en caso de abortos: En campo, a menudo la serología es el único examen que se practica de cara al diagnóstico de gérmenes abortivos en rumiantes. Las técnicas serológicas FC y ELISA se comercializan para el diagnóstico de abortos en rumiantes. El diagnóstico de grupo permite sospechar un diagnóstico de aborto por fiebre Q, pero el resultado es incierto dado que no se realiza simultáneamente la investigación del agente infeccioso. El procedimiento es diferencial: consiste en investigar diferentes agentes abortivos. - Detección de la infección animal: La serología es la técnica a elegir (es más específica y permite tratar rápidamente un gran número de sueros [Behymer et al. 1985], en asociación a la investigación por PCR a partir de muestras vaginales obtenidas mediante torunda o en leche, en caso de resultado positivo. Conclusión sobre las herramientas de diagnóstico en medicina veterinaria: Es necesario utilizar simultáneamente varias técnicas de diagnóstico de la fiebre Q, y la interpretación de sus resultados debe limitarse a escala de rebaño. Un resultado serológico positivo en un animal indica que éste ha estado en contacto con el agente de la fiebre Q, pero las técnicas serológicas actuales no permiten discriminar entre una infección reciente, latente o en período de excreción. 33 En un rebaño, todavía hoy es difícil averiguar si es excretor, o pudiera serlo, sin poner en marcha un pesado protocolo de múltiples tomas de muestra sobre un número suficiente de animales y de manera continuada en el tiempo. En cambio, un rebaño en el que todos los animales fueran seronegativos no puede ser excretor, e incluso puede considerarse como no infectado. Teniendo en cuenta las limitaciones de las herramientas de diagnóstico, y el elevado número de factores implicados en la transmisión, actualmente es imposible prever el escenario de contaminación entre rebaños que resultará predominante. Así, el grupo de trabajo no puede pronunciarse respecto a la probabilidad de contaminación de una población ganadera a partir de otra seropositiva. 1.2.3 Enfermedad humana La gran particularidad de la fiebre Q es la variabilidad de su expresión clínica, que explica la dificultad de diagnóstico. La historia natural de la enfermdad comienza con un contacto entre un individuo no inmune y Coxiella burnetii. Se estima [Raoult et al. 2000] que la infección primaria que sobreviene es asintomática en el 60% de los pacientes, o sintomática en el 40% restante, en los que toma la forma de fiebre Q aguda. La expresión clínica más frecuente de la fiebre Q aguda es un síndrome pseudo-gripal, que se resuelve de forma espontánea. Sin embargo, entre las infecciones sintomáticas de casos de fiebre Q aguda, un 4% necesita hospitalización debido a su gravedad [Dupuis et al. 1985] (Figura 3). En estos casos la sintomatología es variable y toma principalmente la forma de hepatitis, neumopatías o meningoencefalitis. En determinados sujetos, Coxiella burnetii es capaz de multiplicarse, a pesar de la respuesta inmune que pone en marcha la infección primaria, sea ésta sintomática o no. Cuando el sistema inmunitario es incapaz de controlar la infección, se desarrolla una forma crónica. Esta teoría está reforzada por todos los estudios realizados tanto en el hombre como en el ratón [Maurin et Raoult 1999]. En determinados sujetos, las formas crónicas presentan factores agravantes. Es el caso de: • pacientes que sufren valvulopatías cardíacas; • pacientes inmunodeprimidos a causa de un tratamiento o de una patología crónica (pacientes cancerosos o infectados por VIH); • mujeres embarazadas. Estos datos han sido establecidos a partir de estudios realizados por numerosos autores, en especial por investigadores del CNR de Marsella. A modo de ejemplo, se pueden señalar los siguientes resultados: - la seroprevalencia en una muestra de 924 donantes de sangre de Marsella (18 a 65 años, sanos), era de 4,03% (38 / 924), siendo el título umbral de 25 en IgG fase II [Tissot Dupont 1992]; - estos datos son coherentes con los obtenidos en otros estudios llevados a cabo anteriormente en Francia: 5% en el sur de Francia y 4,4% en Borgoña. La persistencia de los anticuerpos, con una tasa umbral de 25, es de unos diez años. Si asociamos esta seroprevalencia a la populación marsellesa de 18 a 65 años, es decir unas 500.000 personas, el número de nuevas infecciones anuales en Marsella puede estimarse en cerca de 2.000; - por otra parte, cada año se diagnostican en el CNR (según Informes Anuales de Actividad) una veintena de casos hospitalizados en Marsella, lo que da una estimación de 1.000 infecciones por año, más baja que la que se obtiene de la zona de afluencia al CHU (Centro Hospitalario Universitario) de Marsella; - en promedio, durante los cinco últimos años se han diagnosticado en el CNR 170 casos anuales, procedentes de la mayoría de los CHU de Francia y de numerosos CHG (Centro Hospitalario General), es decir, de pacientes hospitalizados. Esta incidencia, ampliamente subestimada ya que muchos de los casos no se diagnostican en el CNR, representa 8.500 infeccciones anuales en Francia, lo que da una tasa anual de incidencia de infección por Coxiella burnetii de 0,14 por 1000; 34 - el estudio llevado a cabo con 12.716 mujeres embarazadas de la región PACA (Provence-AlpesCôte d'Azur) entre marzo y mayo de 1996, y 1.834 mujeres embarazadas de Martigues (Bouchesdu-Rhone) a lo largo de un año [Rey et al., 2000] daba seroprevalencias (con una tasa umbral de 400 en IgG fase II, correspondiente a infecciones de menos de un año) de 0,8 por 1.000 y de 1,3 por 1.000 respectivamente. Incluso si la prevalencia de la fiebre Q en Francia no se conoce con precisión, ya que los exámenes necesarios para su diagnóstico no se practican sistemáticamente, estos datos permiten acotar la estimación de la incidencia anual de la infección entre 0,1 por 1.000 y 1 por 1.000, lo que confirma la cifra publicada de 0,5 por 1.000 [Maurin et Raoult 1999, Tissot-Dupont et al. 1992]. Según esta hipótesis, el número anual de infecciones en Francia estaría comprendido entre 6.000 y 60.000 casos, es decir de 2.400 a 24.000 casos asintomáticos y de 120 a 1.200 hospitalizaciones [Raoult et al. 2000]. 60% asintomáticas Infección por Coxiella burnetii Incubación: 2-3 semanas 40% sintomáticas: Síndrome pseudo-gripal Hepatitis Neumopatías Meningoencefalitis Enfermedad aguda Endocarditis, infecciones vasculares... 2% de las infecciones evolucionan a... De las cuales 4% son graves: hospitalización Enfermedad crónica Embarazos afectados: - falsos partos espontáneos - muertes fetales en útero - partos prematuros Figura 3: Posibles evoluciones de la infección por Coxiella burnetii en el hombre 1.2.3.1 Fiebre Q aguda Cuadro clínico En Francia, dos grandes series de casos de fiebre Q aguda han permitido describir el siguiente cuadro clínico [Raoult et al. 2000, Tissot-Dupont et al. 1992]: el comienzo es generalmente brutal, con un cuadro que muestra fiebre alta (91%), cefaleas (51%), mialgias (37%), artralgias (27%) y tos (34%). Con menor frecuencia se observa también erupción (11%) o síndrome meníngeo que exige punción lumbar (4%). La biología inespecífica muestra una trombocitopenia (35%), incremento de enzimas hepáticas (62%) y aceleración de la velocidad de sedimentación eritrocitaria (55%). La variabilidad de la expresión clínica es importante y difiere según el país, incluso según la región, sin que se conozca la razón exacta. Se han propuesto algunas hipótesis para explicar esta diversidad: un interés particular de los expertos en medicina clínica por un cuadro clínico, así como la variabilidad de la cepa y la especificidad del huésped. 35 Predominan tres cuadros clínicos: • la forma febril aislada (sin hepatitis ni neumonía) se acompaña habitualmente de cefaleas severas y puede durar lo suficiente como para cumplir los criterios que definen una fiebre prolongada de origen indeterminado. La duración de la fiebre es mayor en ancianos [Clark 1951 a y b] y se asocia con mayor frecuencia a la erupción (20%) que el resto de formas clínicas. Los pacientes que no muestran ni hepatitis ni neumopatías son con mayor frecuencia mujeres [Raoult et al. 2000]; • la neumopatía es el cuadro más frecuentemente observado en Nueva Escocia (Canada), País Vasco Español y Reino Unido. Los pacientes aquejados de neumopatía presentan características demográficas y clínicas particulares: en comparación con aquellos que presentan la forma febril aislada, con frecuencia éstos son de edad más avanzada, menos febriles, presentan con menor frecuencia cefaleas, mialgias y trombocitopenia, y más frecuentemente inmunodepresión y anomalías electrocardiográficas [Raoult et al. 2000]; • la hepatitis es la forma clínica más extendida en todo el mundo, empezando por Francia y Australia. A menudo se define por un incremento de transaminasas, pero algunos pacientes presentan ictericia y/o hepatomegalia. Si se practica una biopsia hepática, se observa hepatitis granulomatosa, con lesiones anatomo-patológicas características [La Scola et al. 1997]. Los pacientes que presentan hepatitis son más jóvenes, menos veces inmunodeprimidos, más febriles, con mayor frecuencia de cefaleas, mialgias, trombocitopenia y aceleración de la velocidad de sedimentación. También se han descrito otras formas clínicas, aunque son más raras: • anomalías en el embarazo: hipotrofia, partos prematuros, falsos partos espontáneos o muerte fetal in utero; • afecciones cardíacas: la miocarditis representa la primera causa de muerte [Fournier et al. 2001]. La fisiopatología de la lesión cardíaca no está demostrada, pero hay datos experimentales que muestran una relación entre la aparición de una miocarditis y el tamaño del inóculo [La Scola et al. 1997]. Generalmente la pericarditis no es específica. Sin embargo Coxiella burnetii es la causa más frecuente de pericarditis en Marsella [Levy et al. 1999] e importante en España e Inglaterra. Entre los pacientes que presentan una pericarditis, un 10% desarrollan pericarditis crónica y presentan recidivas sin causa identificada. • las afecciones neurológicas, descritas de manera excepcional, comprenden meningitis, meningoencefalitis y neuropatías periféricas [Bernit et al. 2002, Derrick 1973]. Evolución de la fiebre Q aguda En Australia [Ayres et al. 1998] y Reino Unido [Penttila et al. 1998] se ha descrito una evolución hacia un síndrome de fatiga crónica en la población general. Los pacientes referían con mayor frecuencia sudores, sofocos, visión borrosa y fatiga [Ayres et al. 1998]. El pronóstico es generalmente favorable, con una recuperación sin secuelas. Los pacientes con lesión valvular, aneurisma o prótesis vascular, aquejados de fiebre Q aguda, presentan un elevado riesgo de evolucionar hacia una forma crónica [Raoult et al. 2000]. 1.2.3.2 Fiebre Q crónica El cuadro clínico más frecuente y mejor conocido es el de la endocarditis, que da cuenta de la gravedad de la infección, con una letalidad de 25 a 60% en ausencia de tratamiento. Se han referido más de 800 casos en diversos estudios realizados entre 1949 y 2000 [Boyle et Hone 1999, Brouqui et al 1993, Duroux-Vouilloz et al. 1998, Raoult et al. 2000, Sanchez-Recalde et al. 2000, 36 Siegman-Igra et al. 1997]. En Francia, Coxiella burnetii es el agente etiológico del 5% de las endocarditis, con una prevalencia estimada de un caso por cada millón de habitantes y año, próxima a la observada en Suiza e Israel. La endocarditis de la fiebre Q afecta a sujetos más jóvenes (media de edad 48 años), que presentan bien lesiones valvulares anteriores, bien válvulas prostéticas, con mayor frecuencia que el resto de casos de endocarditis [Brouqui y Raoult 2001]. La infección vascular es el segundo cuadro clínico de fiebre Q crónica [Fournier 1998 et al., Raoult et al. 2000]. Un aneurisma de la aorta puede así infectarse y complicarse con una fístula intestinal o una espondilitis. Coxiella burnetii puede incluso infectar una prótesis vascular. En ausencia de tratamiento, el pronóstico es reservado. Se han descrito otras manifestaciones de fiebre Q crónica: osteomielitis [Cottalorda et al. 1995], hepatitis crónicas en alcohólicos [Raoult et al. 2000], pseudo-tumores esplénicos o pulmonares, infección del drenaje ventrículo-peritoneal [Lohuis et al. 1994]. 1.2.3.3 Variabilidad de la expresión clínica Edad y sexo Se han referido pocos casos en niños: una revisión reciente cuenta 46 casos publicados [Maltezou et al. 2002a y 2002b], mientras que los estudios sero-epidemiológicos muestran una frecuencia de exposición elevada en niños [Dupuis et al. 1985a]. Así, los niños tienden con mayor frecuencia a presentar casos asintomáticos y formas clínicas más atenuadas. Los niños de 11 a 14 años tienen 12 veces más riesgo de presentar síntomas clínicos que las franjas de edad inferiores, y tienden con mayor frecuencia a desarrollar formas pulmonares [Maltezou et al. 2002a y 2002b]. Las grandes series de casos clínicos en adultos muestran generalmente un ratio de sexo de 2,5 hombres por cada mujer [Raoult et al. 2000, Tissot-Dupont et al. 1992], mientras que la seroprevalencia es la misma en los dos sexos. En niños, el ratio de sexo es de 1. Esta modificación del ratio de sexo hacia los hombres apunta a un papel protector de las hormonas femeninas frente a la expresión clínica. Esta hipótesis se encuentra actualmente en estudio [Leone 2004]. En consecuencia, es lógico que la mayor parte de los cuadros clínicos y de las hospitalizaciones se concentren en hombres entre 30 y 70 años, con un pico más alto en la franja de edad de 50 a 59 años [Raoult et al. 2000]. Sujetos que presentan factores agravantes - Sujetos inmunodeprimidos En lo que concierne a pacientes inmunodeprimidos, la fiebre Q se ha estudiado en enfermos de cáncer [Raoult et al. 1992] y en sujetos infectados por el VIH [Raoult et al. 1993]. Dichos trabajos han mostrado que estos pacientes presentan un riesgo elevado de recaída o de evolución hacia una forma crónica. En particular, los sujetos infectados por el VIH y los pacientes aquejados de linfomas son los únicos que pueden desarrollar una endocarditis de fiebre Q en ausencia de lesión valvular previa [Raoult et al. 1995, Raoult et al. 2000]. - Mujeres embarazadas Según un estudio reciente [Raoult et al. 2002], de 27 casos de infecciones de fiebre Q durante el embarazo, contabilizados tanto en Francia como en el extranjero (Reino Unido, Estados Unidos, República Checa, Israel y Canada), sólo cinco niños nacieron al término del embarazo con buena salud. Se han referido: • Ocho casos de parto prematuro; • Seis falsos partos espontáneos, antes del primer trimestre de embarazo; • Dos muertes in utero, después del primer trimestre de embarazo; 37 Según Stein y Raoult, [Raoult et al. 2002, Stein et Raoult 1998], más de la mitad de las pacientes infectadas durante el curso de su embarazo sufren un parto prematuro o un falso parto espontáneo. A pesar de la ausencia de un sistema de vigilancia, se ha realizado una estimación de la incidencia anual de la enfermedad en mujeres embarazadas de la región de Martigues, a partir de un recuento del número de nacimientos en la región (5 casos sobre 2.700 nacimientos declarados a lo largo de 3 años). La incidencia anual de la fiebre Q en la región de Martigues se estima así en un caso por cada 540 embarazos. Sin embargo, no es posible extrapolar esta cifra al conjunto del territorio francés, a causa del pequeño número de casos descritos y de consideraciones geográficas que no pueden tomarse en cuenta. El análisis de estos casos, así como de otros 18 censados en la bibliografía, muestra asimismo que estos accidentes (partos prematuros, falsos partos espontáneos) pueden darse: • en el marco de un episodio de fiebre Q aguda (infección primaria) durante el curso del embarazo; • en el marco de una sintomatología reactivada a lo largo del embarazo, en una paciente que presente un perfil serológico de infección crónica. Así, se estima que el 50% de estas pacientes infectadas durante el embarazo presentarán a continuación un perfil serológico de infección crónica. En ausencia de tratamiento, se observan abortos de repetición o problemas de parto prematuro en posteriores embarazos. En cambio, una mujer que desarrolle fiebre Q fuera del embarazo no presentara recaídas en sus siguientes embarazos [Raoult et al. 2002, Stein et Raoult 1998]. - Pacientes aquejados de valvulopatías Un 38% de los pacientes aquejados de valvulopatías que son infectados por Coxiella burnetii, desarrollan una endocarditis en 2 años [Fenollar et al. 2001]. Si consideramos que del 1 al 2% de la población presenta una valvulopatía, encontraremos entre 3 y 6 casos que evolucionan originando una endocarditis, por cada 1.000 casos de fiebre Q aguda. Es por lo tanto necesario detectar si existe una valvulopatías ante un caso de fiebre Q aguda, y diagnosticar la fiebre Q en pacientes aquejados de valvulopatías que presenten fiebre o fatiga anormal [Fenollar et al. 2001]. Vías de inoculación y dosis La vía de inoculación natural más frecuente es la respiratoria. Parece lógico atribuir la variabilidad de la expresión clínica a la vía de inoculación. En ratón [Marrie 1996], tanto la infección por vía intraperitoneal como la intranasal originan neumopatías, mientras que sólo la vía intrapeitoneal origina hepatoesplenomegalias, y sólo la vía intranasal da lugar a lesiones de las vías aéreas. Se ha demostrado el papel del tamaño del inóculo en el animal [La Scola et al.1997], ya que los inóculos más fuertes son capaces por sí solos de dar lugar a miocarditis y bacteriemias en cobaya. En el hombre, se considera que el tamaño del inóculo modula la gravedad de la expresión clínica, en especial en la miocarditis [Fournier et al. 2001]. 1.2.3.4 Diagnóstico En la práctica de rutina del Centro Nacional de Referencia, el diagnóstico de la fiebre Q se apoya en la serología. El test de referencia es la inmunofluorescencia, que permite detectar los anticuerpos dirigidos contra las dos fases de Coxiella burnetii. Siendo las reacciones cruzadas poco importantes (cuando la serología es cuantitativa), la seroconversión o multiplicación por 4 del título de anticuerpos puede considerarse como diagnóstico de fiebre Q. Además, el diagnóstico puede generalmente basarse en un solo suero [Dupuis et al. 1985, Field et al. 1983, Peacock et al. 1983, Peter et al. 1985, Tissot-Dupont et al. 1994]: un título de lgG anti-fase II = 100 hace el 38 diagnóstico altamente improbable. En las formas agudas, el principal problema es el plazo de seroconversión. No puede darse un diagnóstico definitivo hasta al menos mes y medio después del comienzo de los signos clínicos. Los títulos diagnósticos para las formas agudas (IgG fase II = 200 y IgM fase II = 50), cuyo valor predictivo es de 100%, se encuentran sólo en el 10% de los pacientes a la segunda semana tras el comienzo de los signos clínicos, en el 50% a la tercera semana y en el 70% a la cuarta semana. En el caso de los títulos intermedios es preciso testar un segundo suero al menos dos semanas más tarde. En el caso de las formas crónicas, un título de IgG anti-fase I = 800 tiene un valor predictivo positivo de 98%, mientras que un título = 1.600 es predictivo al 100%. Los lgA anti-fase I que se utilizaban para el diagnóstico de las formas crónicas, se utilizan ahora sólo para el seguimiento del tratamiento. El aislamiento de Coxiella burnetii a partir de sangre o de biopsias, aunque poco sensible, es interesante de cara a las colecciones de cepas bacterianas, y para testar la sensibilidad a los antibióticos. Las técnicas de biología moleclar (amplificación genómica por PCR) pueden utilizarse sobre fragmentos de biopsias, y confirmar un diagnóstico cuando los cultivos son negativos. La técnica de PCR anidado en tiempo real en sangre, en una fase precoz (antes de la seroconversión), se encuentra actualmente en desarrollo [Fournier et al. 2003]. 1.2.3.5 Tratamiento Estos tratamientos conciernen a los pacientes que presentan factores agravantes. La finalidad del tratamiento específico no es la misma en función del cuadro clínico: en el caso de fiebre Q aguda en un paciente inmunocompetente, basta un tratamiento antibiótico bacteriostático para que el sistema inmunitario controle rápidamente el proceso infeccioso. Cuando la respuesta inmunitaria es más violenta, como en los casos de hepatitis con auto-anticuerpos, el tratamiento antibiótico no basta para controlar la infección: sin embargo, es suficiente asociar a este tratamiento una corticoterapia para curar rápidamente al paciente. Los inmunodeprimidos, las mujeres embarazadas o los sujetos que presentan una lesión valvular o vascular son generalmente incapaces de controlar la infección por Coxiella burnetii. En estas condiciones, el tratamiento ideal es el bactericida (se dispone de información complementaria en el sitio Web del CNR http://ifr48.free.fr/recherche/labo/rickettsies/rickettsies.html ). Tratamiento de la fiebre Q aguda Generalmente la enfermedad se cura espontáneamente, como demuestra la evolución favorable de las numerosas formas asintomáticas (las formas asintomáticas no son formas clínicas). Sin embargo, si el diagnóstico se realiza durante la fase aguda de la enfermedad, se puede proponer un tratamiento. Hay un estudio que demuestra el interés de un tratamiento con tetraciclinas con respecto a la ausencia de tratamiento. Desgraciadamente, generalmente el diagnóstico se confirma cuando el paciente ya se ha curado, razón por la cual muy pocos estudios han podido evaluar el beneficio del tratamiento de la fiebre Q aguda [Raoult 1993a]. Tratamiento de la fiebre Q crónica Estos tratamientos conciernen a los pacientes que presentan factores agravantes. La asociación de doxiciclina con fluoroquinolonas, rifampicina o cotrimoxazol durante al menos tres años resulta eficaz, al igual que la asociación doxiciclina – hidroxicloroquina durante un período de 18 a 36 meses [Raoult et al. 1999]. Esta última asociación representa actualmente el tratamiento de referencia. En todos los casos, el tratamiento podrá interrumpirse sólamente tras el retorno a un perfil serológico no crónico. 1.2.3.6 Vacunación humana En Australia se comercializa una vacuna (no disponible en Francia salvo ATU) bajo el nombre de Q-Vax (Commonwealth Serum Laboratories, Parkville, Victoria, Australia). Se compone de Coxiella 39 burnetii cepa Henzerling en fase I, cultivada sobre huevo embrionado (segundo paso), inactivada mediante formol y purificada por fraccionamiento y ultracentrifugación. Contiene trazas de proteínas de huevo. Esta vacuna no debe admnistrarse si ha existido contacto previo con Coxiella burnetii, lo cual implica realizar una serología y un test cutáneo antes de cualquier inyeccion (riesgo de hipersensibilidad). La inyección de 0,5 ml de vacuna con 25 µg de antígeno se hace de forma subcutánea. Está indicada en caso de exposición profesional (mataderos, práctica veterinaria, laboratorios) y contraindicada en caso de antecedentes de fiebre Q, alergia al huevo o inmunodepresión. La vacunación en período de incubación no previene el desarrollo de fiebre Q. En términos de eficacia, en sujetos en contacto profesional (inmunidad anterior entre 24 y 47%), 3 sujetos de entre 2.716 vacunados desarrollaron fiebre Q, frente a 52 de entre 2.012 no vacunados. Entre los sujetos con contacto regular (inmunidad anterior entre 12 y 13%), 4 sobre 292 vacunados desarrollaron la fiebre Q, frente a 26 de 150 no vacunados. En estos dos grupos, hay que añadir que los sujetos vacunados que desarrollaron fiebre Q habían recibido la vacuna en período de incubación. Finalmente, en el caso de los sujetos cuyo contacto era esporádico (inmunidad anterior 9%), ningúno de los 524 vacunados desarrolló fiebre Q, frente a 19 de los 150 no vacunados. La tasa de seroconversión varía entre 50 y 80% (IgM anti fase I), pero la inmunidad por mediación celular es eficaz. 1.2.3.7 Aspectos legales de la fiebre Q en el hombre En Francia, la fiebre Q humana no es una enfermedad de declaración obligatoria. Sin embargo, las “afecciones causadas por Rickettsias, y en particular la fiebre Q” están reconocidas como enfermedades profesionales en los dos regímenes: tabla 53 del Régimen General y tabla 49 del Régimen Agrícola. En ellas se contemplan las manifestaciones agudas por un período de 21 días y las crónicas (endocarditis y hepatitis granulomatosa) por un período de 10 años. El diagnóstico debe ser confirmado por un examen de laboratorio específico. Las actividades profesionales que se consideran susceptibles de provocar la enfermedad son aquellas que impliquen contacto con bovino, caprino u ovino, sus vísceras y heces, así como el trabajo realizado en laboratorios de diagnóstico de fiebre Q o de investigación biológica veterinaria. 1.3 Emisión La emisión, que tiene en cuenta las fuentes de materias virulentas y la prevalencia de la fiebre Q (figura 1), varía en función de las especies animales. 1.3.1 Fuentes de materias virulentas Las materias virulentas proceden de animales infectados, que hacen de reservorios. 1.3.1.1 Especies animales Todos los animales son reservorios potenciales de Coxiella burnetii [Babudieri 1959, Lang 1990]. Generalmente, los rumiantes domésticos representan la fuente de infección humana más frecuentemente identificada, originando las epidemias con mayor número de pacientes [Norlander 2000, Marrie 1990]. La seroprevalencia en la población en contacto directo con estos animales es generalmente elevada [Thibon et al. 1996]. Rumiantes domésticos Los métodos de detección que se utilizaban anteriormente se basaban en el modelo animal, a menudo en cobaya. Este método tiene la ventaja de poder dar información cualitativa (investigación de Coxiella burnetii viva) y cuantitativa (dosis mínima infectiva). 40 La utilización cada vez más frecuente de métodos rápidos basados en la técnica PCR no permite cuantificar ni obtener información sobre el estado de las bacterias detectadas. Es por lo tanto difícil comparar los resultados de los trabajos anteriores con los de las publicaciones recientes. - placenta: La bacteria puede encontrarse en la placenta, incluso al término de la gestación, en vaca [Luoto et Huebner 1950, Plommet et al. 1973], en oveja [Zeman et al. 1989] y en cabra [Marmion et Watson, 1961]. Una placenta de oveja infectada puede contener más de 109 bacterias por gramo [Babudieri 1959, Welsh et al. 1951]. - secreciones vaginales: - En vaca En bovino, la infección experimental llevada a cabo en el INRA de Tours mostró la presencia de Coxiella burnetii en secreción vaginal [Plommet et al. 1973]. Tres lotes de novillas fueron inoculadas con Coxiella burnetii e inseminadas cinco meses más tarde. Las dosis infectantes crecientes de los lotes no mostraron diferencias, pero se observó la excreción vaginal de Coxiella burnetii antes de cada fecundación. Más recientemente, se ha aislado Coxiella burnetii de las secreciones vaginales de vacas (13/61, 21,3%) procedentes de un rebaño que presentaba problemas de reproducción, mientras que el aislamiento a partir de leche se obtenía en 36/214 vacas (16,8%) [To et al. 1998]. - En oveja Un estudio de Berri et al. realizado sobre un rebaño de 34 ovejas, en el que había habido casos de aborto, reveló la presencia de Coxiella burnetii en las secreciones vaginales de 15 animales después de llevar a término la gestación [Berri et al. 2002]. Diez semanas después del parto, sólo dos ovejas seguían excretando la bacteria en sus secreciones vaginales. - En cabra Recientemente se han llevado a cabo dos infecciones experimentales en cabras anteriormente libres de fiebre Q, según un protocolo similar (inoculación con una dosis elevada de bacterias, 104, por vía subcutánea, hacia la mitad de la gestación). Casi la mitad de los animales abortaron (100% en el primer experimento, 75% en el segundo). A partir del día del aborto, la investigación de Coxiella burnetii mostró que todos los animales excretaban en sus secreciones vaginales (7 de 7 en el primer experimento, 12 de 12 en el segundo) de manera continua durante un período entre 3 días y 5 semanas. Se estimó un número de entre 105 y 108 bacterias por ml en las muestras positivas, y se vió que estas bacterias son infecciosas en el ratón [Arricau-Bouvery et al. 2003, Arricau-Bouvery enviado para su publicación]. - leche: La excreción de Coxiella burnetii por vía mamaria ha sido demostrada en bovino, ovino y caprino. - En vaca La presencia de Coxiella burnetii en leche de vaca ha sido demostrada por un cierto número de trabajos tanto antiguos como recientes [Arricau-Bouvery et al. 2001, Durand y Limouzin 1983, Lorenz et al. 1998, Schaal 1977]. La excreción se describe como intermitente, de duración variable, y que puede persistir durante largos períodos (dos años) en un rebaño [Becht y Hess 1964]. A veces se observa en agunos animales una excreción post-parto de corta duración. No hay relación sistemática entre la aparición de signos clínicos y la excreción [Schaal, 1982]. Así, una vaca que ha sufrido un aborto no tiene por qué ser necesariamente excretora y, si es el caso, esta excreción 41 puede durar poco tiempo. Si se desarrolla una metritis, esta excreción parece ser más estable en el tiempo, pero esta observación no está confirmada [Arricau-Bouvery et al. 2001]. En un rebaño con serología positiva, no existe una relación clara entre la seropositividad individual de una vaca y la excreción de Coxiella burnetii en leche. - En oveja Las publicaciones sobre la presencia de Coxiella burnetii en leche de oveja son más limitadas. Schaal 1977, apoyándose en trabajos basados en la contaminación experimental de 31 ovejas, mostró que Coxiella burnetii no se detecta en las ubres o en leche aunque esté presente en el útero. En cambio, su presencia en leche ha sido demostrada en oveja uno, dos y ocho días después del parto, con una buena correlación entre la excreción fecal y mamaria [Berri et al. 2001]. Los trabajos en curso (INRA Nouzilly) han confirmado igualmente la presencia de Coxiella burnetii en excreciones vaginales de oveja, pero no se dispone aún de información sobre la frecuencia y la duración de la excreción en leche (fuera del período de calostro). - En cabra Dos estudios de infección experimental en cabras mostraron la posibilidad de excreción de Coxiella burnetii en leche durante 56 días, es decir hasta el final de la primera prueba [Arricau-Bouvery et al. 2003]. La segunda prueba apoyó estos primeros resultados, ya que la excreción duraba desde 3 días en algunos animales hasta 9 semanas, de forma discontinua, para otros. Otros trabajos en curso muestran la posible persistencia durante al menos 4 ó 5 meses, en casos de infección natural [Rodolakis, resultados no publicados]. En cabras, los abortos no parecen provocar necesariamente una excreción prolongada pero, como en vacas, esta observación está sin confirmar. No se ha encontrado ninguna correlación entre la presencia de Coxiella burnetii en las muestras vaginales tomadas mediante torunda, y en leche. La vacuna fase I se ha probado eficaz para eliminar la excreción de Coxiella burnetii en leche. En conclusión, se ha demostrado la excreción en leche de Coxiella burnetii en rumiantes. La duración de la excreción puede ser extremadamente variable, dependiendo de la especie, del punto de infección y de su cronicidad. Faltan datos sobre los posibles efectos de las cepas, poco estudiadas hasta el momento [Zhang et al. 1997]. - Heces: Tras proceder a la infección experimental en cabra (descrita más arriba [Arricau-Bouvery et al. 2003]), se vio que antes del aborto algunas excretaban la bacteria en heces, pero después del aborto lo hacían todas. La excreción bacteriana tuvo lugar los veinte días siguientes a la infección y duró un promedio de cuarenta días. - Esperma : Sólo un trabajo ha permitido aislar bacterias viables a partir de esperma de toros seropositivos [Kruszewska et Tylewska-Wierzbanowska 1997]. Animales de compañía Perros y gatos son reservorios de Coxiella burnetii. Los perros pueden infectarse por picadura de garrapata [Mantovani et Benazzi 1953], ingestion de productos contaminados (placentas, etc.), o por aerosoles. La infección en perras gestantes se ha asociado con el nacimiento de cachorros muertos [Buhariwalla et al. 1996]. Diversos autores asocian la infección humana al contacto con perros [Buhariwalla et al.1996, Laughlin et al. 1991, Marrie et al. 1985, Marrie et al.1988]. En Canadá, se han podido aislar dos cepas de Coxiella burnetii a partir de útero de perro [Maurin et Raoult 1999]. 42 Boni [Boni et al. 1998] analizaron perros procedentes de bases militares, mediante una técnica de inmunofluorescencia de umbral 1/50 con antígenos fase I y II. Dieron resultado positivo 42 perros sobre 429, es decir un 9,7%. Aves Se ha aislado Coxiella burnetii a partir de palomas, pollos, patos, gansos y pavas [Babudieri 1959]. En Francia, la primera infección se encontró en los Alpes en 1968, en córvidos [Seigneurin et Seigneurin 1968]. Pollos infectados experimentalmente excretaron Coxiella burnetii en heces durante cuarenta días, comenzando a partir del séptimo día tras la infección [Raska 1956]. La contaminación en humanos puede sobrevenir por inhalación de partículas infectadas procedentes de excrementos desecados. Esto explica la microepidemia familiar referida en el Luberon tras la limpieza de un antiguo palomar en desuso [Stein et al.1999]. Se ha detectado presencia de Coxiella burnetii en excrementos de palomas y en sus garrapatas. Otros vertebrados De manera ocasional, se ha podido aislar la Coxiella burnetii en muchos otros mamíferos, salvajes o domésticos, como caballos, liebres, cerdos, dromedarios, búfalos, ratas y ratones [Babudieri 1959]. En la India se han detectado anticuerpos en diversas especies de serpientes y tortugas, pero no se ha aislado Coxiella burnetii en estos animales [Babudieri 1959]. Se ha observado una placentitis debida a Coxiella burnetii en una foca común [Lapointe 1999]. También se ha implicado a los conejos en la transmisión de Coxiella burnetii al hombre [Marrie et al. 1986]. Un estudio seroepidemiológico inglés ha mostrado una seroprevalencia (anticuerpos anti-fase II) variable, de entre 7 y 53%, en ratas comunes [Webster et al. 1995]. Los autores proponen la hipótesis de que las ratas representan un reservorio primordial de Coxiella burnetii, a partir del cual se infectarían los animales domésticos, en especial los gatos. Artrópodos Poco después de ser infectados por Coxiella burnetii, la mayoría de los mamíferos y aves sufren una bacteriemia transitoria. En consecuencia, las garrapatas podrían ingerir la bacteria a través de su alimento sanguíneo. Más de cuarenta especies de garrapatas se infectan así de forma natural de Coxiella burnetii, entre ellas Rhipicephalus sanguineus, la garrapata del perro [Mantovani et Benazzi 1953, Spyridaki et al. 2002]. Coxiella burnetii se multiplica en la garrapata. Se ha conseguido experimentalmente infectar cobayas mediante la picadura de distintas especies de garrapatas infectadas: Ixodes holocyclus, Haemaphysalis bispinosa y Rhipicephalus sanguineus [Smith 1940, Smith 1941], así como con Dermacentor andersoni [Parker et Davis 1938]. Mientras se alimenta de sangre, la garrapata excreta una sustancia (excreta) altamente contaminada sobre la piel de su huésped. También se ha encontrado Coxiella burnetti en los ovarios de la garrapata, lo que sugiere una transmisión vertical y la persistencia de la infección en la garrapata [Babudieri 1959]. A pesar de ello, las garrapatas no se consideran un factor primordial de contaminación en animales, que cuentan con muchas otras formas de infectarse [Babudieri 1959]. En cambio, es probable que las garrapatas representen un papel importante en la transmisión de Coxiella burnetii a vertebrados salvajes, principalmente roedores, lagomorfos y aves [Babudieri 1959, Lang 1990, Marrie et al. 1986]. Coxiella burnetii también ha sido ocasionalmente aislada de otros artrópodos como ácaros [Babudieri 1959], piojos [Giroud y Jardin 1954] y moscas [Philip 1948]. Existen otros estudios realizados sobre piojos, pulgas, moscas, mosquitos, pequeños acáridos y otros artrópodos procedentes de bovino, ovino y roedores, pero no se ha podido aislar la bacteria. No se ha establecido el papel de estos artrópodos en el ciclo natural de Coxiella burnetii. Su papel en la infección humana, si existe, es probablemente anecdótico en Francia, aunque en países como Alemania y Suiza se les otorga mayor importancia [Eklund et al. 1947, Janbon et al. 1989, Opinión del “Bundesinstitut für Risikobewertung” del 17 de junio de 2003, respecto a la “Dictámen de expertos sobre la importancia de la fiebre Q para la salud de los consumidores” (www.bfr.bund.de)]. 43 Balance sobre la excreción animal La excreción es máxima en período de parto, en correlación con la carga bacteriana de las placentas. En las secreciones vaginales, se estima que hay un gran número de bacterias durante los dos días siguientes al parto y que después este número baja rápidamente. Así, la dispersión al ambiente tiene lugar principalmente en el momento del parto. Sin embargo, la contaminación de las personas a partir de polvo puede prolongarse en el tiempo. En rumiantes, no se ha estudiado con precisión la cinética de la excreción bacteriana por diferentes vías. En otras especies, se conoce todavía menos. Potencialmente, Coxiella burnetii puede estar presente en las secreciones y excreciones de todo animal infectado, pero los estudios realizados proporcionan información insuficiente en cuanto a intensidad, duración o frecuencia. En rumiantes, la excreción en leche se produce a lo largo de varios meses en bovino y en caprino. En ovino, este período sería más breve. La excreción en heces tendría lugar durante las semanas siguientes a la infección. En caprino puede durar alrededor de cuarenta días. 1.3.1.2 Ambiente El ambiente se considera una fuente de contaminación, debido a los aerosoles procedentes de las secreciones de animales infectados. Las “pseudo-esporas”, formas de supervivencia de la bacteria, son pequeñas y extremadamente resistentes. Se han encontrado estas pseudo-esporas en el aire hasta dos semanas después del parto, y durante un período de 150 días al sol [Welsh et al. 1957]. Estas partículas infecciosas pueden ser transportadas por el aire a través de largas distancias [Tissot-Dupont et al. 1999]. El viento, un tiempo seco o una vegetación árida, son factores que favorecen la diseminación de Coxiella burnetii [Tissot-Dupont et al. 2004]. Recientemente, se ha aislado Coxiella burnetii a partir de heno [Rustscheff et al. 2000], y se ha detectado por PCR en muestras de polvo recogidas en un establo [Yanase et al. 1998]. La estación y el manejo de cría, es decir si los partos se hacen al interior o al exterior, los desplazamientos del rebaño, abono con estiércol o purines, etc., pueden tener una gran influencia sobre la importancia de la contaminación ambiental. 1.3.1.3 Productos alimentarios de origen animal Debido a la presencia de Coxiella burnetii en distintos órganos, se ha planteado la posible contaminación humana a través de la carne. En contraste con el elevado número de artículos publicados sobre su excreción en leche, no se dispone de referencias bibliográficas en relación con el riesgo asociado a la carne. La leche como materia prima La presencia de Coxiella burnetii en leche puede deberse a la excreción mamaria, a contaminación fecal, o incluso a contaminación ambiental por contacto con el aire. Aunque la excreción mamaria está bien descrita, faltan estudios reales que cuantifiquen la contaminación fecal o ambiental. Generalmente, pocas publicaciones estudian la concentración de bacterias presentes en leche. Durand, 1993, estima la excreción en leche de vaca en 10-20 bacterias por ml, pero otros trabajos dan cifras en torno a 105 células/ml [Bell 1949]. Los resultados obtenidos en modelos animales permiten razonar en forma de “dosis infectivas” para un modelo y vía de inoculación determinados. Pocos trabajos abordan la comparación entre diferentes vías de contaminación. Durand, 1993, ha estudiado la diferencia relativa entre vías de 44 contaminación y estima que para provocar una contaminación en ratón hace falta 10.000 veces más Coxiella burnetii por vía oral que por vía intraperitoneal. Supervivencia en derivados lácteos No existen trabajos recientes que versen sobre la supervivencia de Coxiella burnetii en productos lácteos. Se ha observado una supervivencia de varias semanas en quesos de pasta blanda [Sipka 1959] o de cuarenta y un días en mantequilla [Lerche 1965], así como una eliminación durante la etapa final de maduración en algunos quesos de pasta dura “Hartkäse” 2 [Kaestli 1965]. Sin embargo, este tipo de trabajos deberían confirmarse mediante otros que utilicen métodos de cuantificación validados. La posibilidad de que los productos lácteos pasteurizados constituyan una fuente de infección en humanos se ha sugerido en una publicación reciente basada en un estudio epidemiológico [Hatchette et al. 2001]. Sin embargo los mismos autores afirman que la pasteurización elimina Coxiella burnetii en leche [Enright et al. 1957). Por otra parte, señalan que en dicho estudio epidemilógico el consumo de leche cruda no ha sido asociado a un mayor riesgo, y que no se ha encontrado Coxiella burnetii en el queso en cuestión. Termorresistencia La cuestión de la termorresistencia ha sido estudiada utilizando el modelo animal [Enright et al.1957, Lenette et al. 1951], y reexaminada por otros autores. Schaal, 1977, estima que una Temperatura de 72 a 74°C durante un intervalo de 30 a 40 segundos sería suficiente para eliminar los gérmenes. Por otra parte, el mismo autor analizó, entre 1958 y 1967, 4.997 muestras de leche pasterizada o UHT. Ninguna de ellas resultó positiva. El análisis del mismo número de muestras de leche cruda dio un resultado positivo en el 0,94% de los casos [Schaal y Schaaf 1969]. Con el fin de avanzar sobre este tema, el grupo de trabajo consultó al Comité de Expertos Especializado “Microbiología” (CES “Microbiología”) sobre las siguientes cuestiones: 1) Según la bibliografía y los enfoques experimentales actuales, ¿cuáles son las conclusiones que se pueden extraer acerca de la eficacia de la pasterización, de cara a inactivar Coxiella burnetii en leche? 2) Si los trabajos existentes no permiten responder a esta cuestión, o aportan sólamente una respuesta parcial, ¿qué estudios deberían ponerse en marcha? 3) En cualquier caso, ¿cuál es el método recomendado para medir la termorresistencia? Los portavoces nombrados por el CES “Microbiología” han suministrado al grupo de trabajo un informe sobre estas cuestiones. Los elementos del informe que tratan sobre estas cuestiones (ver Anexo II), validados por el CES Microbiología, permiten concluir que no hay razón para cuestionar las temperaturas de pasterización utilizadas desde 1957. 1.3.2 Prevalencia de la fiebre Q en animales La contaminación de humanos a partir de animales está estrechamente ligada a la prevalencia de la enfermedad en cada especie. 1.3.2.1 Rumiantes domésticos En Francia, la fiebre Q no es una enfermedad de declaración obligatoria, y no existe ningún laboratorio veterinario de referencia para esta enfermedad. No se ha constituído ningún banco de datos epidemiológicos relativos a la fiebre Q en Francia. Se han realizado trabajos destinados a estimar la importancia de la fiebre Q en una zona geográfica y en un período determinado, a menudo originados de iniciativas locales. Esquemáticamente, estos documentos pueden agruparse en varias categorías: 45 2 Se refiere a todos los quesos de pasta prensada, cocidos o no, que hayan sufrido un largo proceso de maduración. • publicaciones en revistas veterinarias; • tesis veterinarias; • exámenes médicos preventivos puestos en marcha por organismos provinciales o regionales, como las agrupaciones de defensa sanitaria o de interés económico; • diagnósticos complementarios de fiebre Q, realizados en el marco de la declaración obligatoria de abortos dentro de la lucha contra la brucelosis. La compilación de estos datos, recogidos en las tablas II, III y IV, muestra el alcance de las “distintas prevalencias” de la fiebre Q en Francia. Prevalencia de la fiebre Q abortiva La prevalencia de abortos por fiebre Q podría considerarse en un primer análisis como el mejor indicador de la prevalencia clínica de la fiebre Q: • entre los distintos problemas de reproducción, el aborto es un síntoma frecuente de fiebre Q en todas las especies. En campo, frecuentemente criadores y veterinarios limitan la clínica de la fiebre Q a su aspecto abortivo; • se trata de un síntoma fácilmente visible y de importantes consecuencias económicas; • los abortos en rumiantes domésticos son objeto de supervisión reglamentaria. Así, no es raro que se pongan en marcha de forma rutinaria los procedimientos necesarios para llegar a un diagnóstico etiológico de los abortos, incluyendo la fiebre Q [Berger 1999]. Desgraciadamente, el recuento de abortos por fiebre Q no puede acometerse de forma coherente en el conjunto de las provincias, ya que: • la investigación de la fiebre Q no es obligatoria. Sólo algunas provincias la realizan de forma sistemática sobre todas las muestras de abortos declarados; • los métodos de muestreo varían de una provincia a otra (feto abortado, uno o varios sueros, suero precoz o tardío tras el aborto); • los resultados obtenidos en las diferentes provincias o en una misma provincia a lo largo del tiempo no son comparables, debido a la variedad de métodos de análisis empleados (Stamps, PCR, fijación del complemento, ELISA) y de su falta de estandarización, incluidos los criterios de interpretación. No obstante, como muestra de su alcance, se puede señalar que: • en un conjunto de veintiún rebaños caprinos de Deux-Sèvres, al menos cinco sufrieron abortos debidos a fiebre Q durante los cinco años precedentes, y otras cuatro ganaderías a lo largo de un mismo año [Chartier et al. 1997]; • en los estudios realizados entre 1993 y 1996, entre los abortos acaecidos en ganado bovino de las provincias de Côte-d’Or (2.883 informes), Côtes-d’Armor (429 informes), de la Loire-Atlantique (386 informes) y de la Manche (1.383 informes), se diagnosticó fiebre Q con seguridad en 0,5% (14), 1,1% (5), 3,8% (15) et 2,3% (32) de los casos respectivamente, y con carácter probable en 2% (59), 15,8% (68), 16% (62) et 4,6% (64) de los casos respectivamente [Berger 1999]. Prevalencia de la infección La prevalencia de la infección se aborda a través de la seroprevalencia. Actualmente no es posible evaluar la tasa de animales excretores, ya que los métodos de diagnóstico directo son o demasiado pesados (cultivos), o demasiado costosos (PCR). 46 Los distintos trabajos que se resumen en las Tablas II, III y IV muestran una gran variabilidad en la tasa de animales seropositivos en la cabaña francesa. Esta gran variabilidad de la seroprevalencia entre diferentes estudios realizados en el mismo país no es exclusivo de Francia; se ha observado también en Japón, por ejemplo [Harai et To 1998]. Diversas razones explican esta variabilidad: • por una parte, la falta de estandarización de las técnicas (por ejemplo, no existe un suero de referencia internacional para la fijación del complemento), y por otra, el hecho de que no exista correlación (al menos, correlación simple) entre las diferentes técnicas empleadas (es el caso entre FC y ELISA); • la calidad del muestreo, su representatividad, o la interpretación que se hace de ella. Las tomas de muestra realizadas en el marco de la declaración de abortos conducirían a sobreestimar la seroprevalencia, si ésta se extrapolara al conjunto de la cabaña; • interferencia con la vacunación para la fiebre Q. Aunque se cita a menudo, habría que relativizar la influencia de este parámetro: la única vacuna disponible en el mercado (vacuna fase II) induce en realidad pocos anticuerpos; • variaciones reales en la incidencia de la enfermedad o en la intensidad de la respuesta inmunitaria, que pueden depender por jemplo de la estación o del manejo: o la estación : Yanase et al. [1997] han demostrado, realizando un seguimiento de dos años en vacas, que el título de anticuerpos y el número de animales seropositivos es mayor en invierno. o el manejo: Capuano et al. [2001] han demostrado que, para una especie, región y período determinados, la seroprevalencia individual puede ser 6,8 veces mayor en ganaderías criadas enteramente al interior que en aquellas criadas en pasto (13,2% et 1,9% respectivamente). Así, la seroprevalencia ovina, caprina y bovina de la fiebre Q no puede evaluarse con precisión a partir de la bibliografía. Esta evaluación, salpicada de numerosos errores a nivel individual para un rebaño determinado, lo está aún más a nivel de poblaciones ganaderas, teniendo en cuenta la irregular distribución geográfica y temporal (aditiva) de la enfermedad. Como ejemplo, se puede citar el estudio realizado entre 1982 y 1984 por un mismo equipo (GIE Ovin1 Rhône Alpes), por lo tanto probablemente siguiendo los mismos métodos, en las provincias de Ain, Ardèche, Drôme, Isère, Loire, Rhône, Savoie y Haute-Savoie. Se observa una gran variabilidad entre provincias de la seroprevalencia en rebaños ovinos, a lo largo del mismo año (diferencia máxima: de 0 a 89% de rebaños con al menos un animal seropositivo) y dentro de la misma provincia, de un año al otro (diferencia máxima: de 8 a 89% de rebaños). Teniendo en cuenta todas estas reservas, los datos extremos de prevalencia son de 1 a 15% para bovino, de 0 a 20% para ovino, y de 2 a 12% para caprino. Con las mismas reservas, los datos extremos de prevalencia de rebaños varían de 39 a 73% para bovino, de 0 a 89% para ovino, y 10 a 40% para caprino. Conclusión No existe ningún estudio a nivel nacional que se haya realizado siguiendo una metodología suficientemente rigurosa (muestreo, técnica...) para poder estimar correctamente las tasas de infección en materia de fiebre Q animal. Sólo se dispone de datos a nivel provincial o regional para rumiantes domésticos. Estos datos reflejan diferencias geográficas y cronológicas, pero también metodológicas. Sería inutil establecer una comparación entre resultados obtenidos de forma tan diferente. Sin embargo, la estimación cualitativa de riesgos que se desarrolla en este informe precisa de una estimación de la importancia de la fiebre Q en rumiantes. 47 1 N.T.: GIE (Groupement d’Intérêt économique) Ovin: Grupo de Interés Económico en relación con ganado ovino. Sabiendo que existe diversidad geográfica real, parece que algunas zonas presentan una baja tasa de infección. Sin embargo, se puede afirmar que la fiebre Q es una infección bastante extendida en ovino y caprino, probablemente más en el sur que en el norte de Francia, y que un porcentaje bastante elevado de rebaños (que puede llegar hasta un 90%) están o han estado infectados. En lo que concierne al ganado bovino, la situación no se conoce bien ya que en esta especie la infección provoca metritis con mayor frecuencia que abortos, al contrario de lo que se observa en pequeños rumiantes [Lang 1990]. La etiología no se ha investigado aún, y a menudo se precisan estudios complementarios. Así, la frecuencia de la infección en bovino en Francia está probablemente subestimada 1.3.2.2 Otras especies Aparte de los rumiantes domésticos, hemos indicado anteriormente que hay otras especies (perros, gatos, artrópodos, aves...) que pueden igualmente ser infectadas por Coxiella burnetii y excretarla. Con la excepción de trabajos que refieren contaminación humana probablemente a partir de carnívoros domésticos [Boni et al.1998, Marrie et al.1985], existen pocos datos que permiten conocer la prevalencia de esta infección en dichas especies (ver 1-3-2-1). Así, los gatos y perros de granja cuentan con numerosas ocasiones de contacto (directo o alimentario a través del consumo de placentas) y de infección a partir de los rumiantes de las ganaderías, y es probable que la infección de estos animales siga la de los rebaños infectados. Por otra parte, los perros y los gatos del medio rural pueden también infectarse a partir de garrapatas. No se conoce la importancia de la infección de las especies salvajes que participan en el ciclo salvaje de la enfermedad. 48 1.3.2.3 Balance sobre la prevalencia Tabla II: Datos provinciales o regionales relativos a la seroprevalencia de la fiebre Q en rebaños de bovino Referencia GOYON (resultados sin publicar) Origen de las muestras Técnicas empleadas Provincia de Sarthe Fijacion del complemento Declaración de abortos en bovino 1975/1980 Antígeno Roger Bellon Umbral 1/16 Prevalencia animal Prevalencia en poblaciones ganaderas Año - nº sueros negativo 1/16 1977 – 120 95,9% 4,1% 1978 – 634 98,2% 1,8% 1978 – 108 85,2% 14,8% 1975 – 1980 partos normales 95,5% 3,5% DURAND (1977) Provincia de Puy –deDôme Fijación del complemento Especie - nº sueros negativo 1/10 Profilaxis Bovino – 2.222 98,2% 1,8% Bovino abortos - 575 95,9% 4,1% MIEGE (1983) Provincia de Haute-Savoie Profilaxis bovina 1980/1981 Fijación del complemento Antígeno Behring nº sueros negativo 1/10 1/20 266 poblaciones bovinas controladas 130 infectados (al menos 1 positivo): 49% del efectivo controlado >1/40 positivo 4.236 88,7% 2,0% 5,3% 4,0% 11,3% Provincia de LoireAtlantique DELCUEILLERIE (1984) Declaración de abortos en bovino 1981/1983 Coloración de Stamp Fijación del complemento Stamps positivos 23% en el 81; 15,9% en el 82; 11% en el 83 Año - nº sueros negativo 1/20 >1/40 positivo 1981 – 4.031 88,3% 4,7% 7,0% 11,7% 1982 – 3.816 88,8% 3,8% 7,4% 11,2% 1983 – 2.000 88,2% 2,7% 9,1% 11,8% Región de Rhône-Alpes Centro de ecopatología bovina de Lyon (resultados no publicados) Profilaxis bovina 1989/1990 93 poblaciones ganaderas controladas Fijación del complemento nº sueros negativo 3.216 479 (14,9%) % bovino positivo nº poblaciones Prevalencia constatada Nulo 25 26,9% 50 < 10% 24 25,9% ( 10% - 20%) 20 21,5% ( 20% - 30%) 11 11,8% ( 30% - 40%) 9 9,6% > 40% 4 4,3% Al menos 1 68 73,1% 51 Referencia GDS 1 Origen de las muestras Provincia de Charente – Maritime Técnicas empleadas ELISA Chekit (resultados sin publicar) Controles de entrada Origen del ganado bovino: Provincia 44: 53% Región de Pays de Loire: 70% Prevalencia animal Prevalencia en poblaciones ganaderas año 1997 1998 1999 2000 2001 2002 nº sueros 6795 7261 6401 6473 5909 6374 % positivos 3,7% 1,9% 1,7% 2,2% 3,6% 3,4% 2 LDA / GDS (resultados sin publicar) Provincia de la Manche Coloración de Stamp Declaración de abortos en bovino 1999/2002 Fijación del complemento año Stamp positivo FC > 1/40 Antígeno Behring 1999 – 2000 2% (647) 5,9% (669) Lectura al 50% de inhibición de la hemólisis 2000 – 2001 1,4% (653) 4,3% (685) 2001 - 2002 2,9% (585) 6,5% (609) 52 Cinética de anticuerpos Año nº sueros neg/neg Título estable Título en alza Título a la baja 1999-2000 383 92,0% 21 2 6 2000-2001 319 93,0% 9 5 9 2001-2002 281 95,0% 6 5 3 DGAI 3 (resultados sin publicar) Provincia de HauteSavoie Estudio realizado tras la epidemia humana del verano de 2002 en Chamonix ELISA Chekit 4 Test positivo: DO 20% nº poblaciones controladas efectivo total nº animales testados serologías positivas % serologías positivas 24 300 286 24 8,5% nº poblaciones controladas nº poblaciones infectadas prevalencia población prevalencia intra- rebaño 24 10 43% 4 a 32% 53 1 N.T.: GDS: Groupement de Défense Sanitaire N.T.: LDA: Laboratorio veterinario francés (http://www.zoopole.com/fr/comptechnic/lda.htm) 3 N.T.: DGAl: Direction Générale de l’Alimentation 4 N.T.: DO: Densidad óptica 2 Tabla III: Datos provinciales o regionales relativos a la seroprevalencia de la fiebre Q en rebaños de ovino Referencia FONTAINE (1975) Origen de las muestras Provincias del Sud-Ouest (7) Poblaciones ganaderas voluntarias 3 a 5 ovejas / población y abortos Técnicas empleadas Prevalencia animal Fijacion del complemento nº sueros negativo 1/16 Antígeno Behring Umbral 1/20 Prevalencia en poblaciones ganaderas 458 poblaciones controladas 202 poblaciones infectadas (44,1%) Ovejas que han sufrido aborto 78,7% 21,3% 1973/1974 Ovejas que no han sufrido aborto 83,2% 16,8% DURAND (1977) Provincia de Puy –deDôme Fijación del complemento Profilaxis 1977/1978 GUIGNARD (1981) Especie - nº sueros negativo 1/10 - 352 controlados (12 sueros analizados/ cheptel) - 12 positivos (3,5% del efectivo controlado) - 10 poblaciones (1 suero positivo / 12 sueros) - 2 poblaciones (2 sueros positivos / 12 sueros) ovino – 4.222 99,7% 0,3% Región de Midi-Pyrénées Fijación del complemento Profilaxis y declaración de abortos en ovino 1978/1979 Antígeno Behring Umbral 1/8 nº sueros negativo 1/8 Dudoso Ovino – 3.983 54 99,0% 0,2% 0,8% Ovino abortos – 839 96,0% 2,9% 1,0% Región de Rhône-Alpes Fijación del complemento GIE ovino Rhône-Alpes (resultados sin publicar) Profilaxis ovina (10 sueros / población) 1982/1984 Prevalencia constatada población/año Provincia 1982 1983 1984 Loire 70% 59% 92,6% Rhône 0% 10% 60% Ain 14% 3% 30% Haute-Savoie 89% 8% 20% Savoie 27% 33% 57% Isère 0% 55 33% 13,5% Drôme 24% 40% 82,7% Ardèche 22% 24% 49% 56 Referencia Origen de las muestras Provincia del Sud-Est DAVOUST (1986) Técnicas empleadas Prevalencia animal Fijacion del complemento Bases militares 4 poblaciones 60 sueros/población Antígeno Behring Umbral 1/10 1985 Inmunoperoxidasa Prevalencia en poblaciones ganaderas Fijación complemento negativo 1/10 >1/20 Total 86,0% 13,5% 0,5% Inmunoperoxidasa negativo dudoso positivo Total 33,3% 28,0% 39,0% Región Rhône-Alpes GDS (resultados sin publicar) Profilaxis ovina 1996/1997 Fijación del complemento nº poblaciones nº poblaciones infectadas Prevalencia constatada población Antígeno Virion Umbral 1/10 4 sueros/ población 417 409 98% DGAI (resultados sin publicar) Provincia de HauteSavoie ELISA Chekit Test positivo: DO Estudio realizado tras 20% la epidemia humana nº poblaciones cotroladas Efectivo total nº animales testados nº poblaciones cotroladas nº poblaciones infectadas Prevalencia 57 del verano de 2002 en Chamonix Serología positiva % serología positiva 20 1251 328 28 8,5% constatada población Prevalencia intra-rebaño constatada 20 7 35% 4 a 46% 58 Tabla IV: Datos provinciales o regionales relativos a la seroprevalencia de la fiebre Q en rebaños de caprino Referencia Origen de las muestras Provincias GUERRAULT Y Deux-Sèvres GODU (1981) Profilaxis caprina 1980 1 FRGDS Centre (resultados no publicados) Región Centro Programa voluntario Muestreo de profilaxis 20 sueros/cheptel Técnicas empleadas Fijacion del complemento Antígeno Behring Umbral 1/10 Prevalencia animal nº sueros negativo >1/10 Prevalencia en poblaciones ganaderas 472 poblaciones controladas 48 poblaciones infectadas (10,8%) 4000 88,2% 11,8% Fijación del complemento 1990/1991 1991/1992 1992/1993 Umbral 1/10 nº poblaciones 159 157 212 1990/1993 poblaciones indemnes 77% 64% 46% poblaciones dudosas 12% 20% 28% poblaciones infectadas 11% 16% 26% poblaciones dudosas: 1 o varios FC 1/10 ó 1/20 DORDAIN (2001) Provincias de Ain, Isère, Loire, HauteSavoie Profilaxis caprina 1995/1996 Fijación del complemento Antígeno Virion Lectura al 50% ELISA Chekit Dudoso: DO 30- nº sueros Negativo 1/10 1/20 >1/40 59 40% 1530 (FC) 38,2% 29,3% 21,4% 11,10% nº sueros Negativo Positivo Dudoso 1255 (ELISA) 96,8% 2,2% 1,0% 2 DDSV Corse du Sud Provincia de Corse du Sud (resultados no publicados) 15 ganaderías voluntarias 2002 DGAL (resultados no publicados) Provincia de HauteSavoie Estudio realizado tras la epidemia humana del verano de 2002 en Chamonix ELISA chekit Test positivo: DO 40-50% ELISA chekit Test positivo: DO 20% nº sueros Positivo 15 poblaciones controladas – 4 poblaciones infectadas Prevalencia población constatada: 27% 150 9 (6%) 1 a 4 animales positivos sobre 10/ población controlada nº poblaciones cotroladas Efectivo total nº animales testados Serología positiva % serología positiva 5 153 82 16 19,5% 1 nº poblaciones cotroladas nº poblaciones infectadas Prevalencia constatada población Prevalencia intra-rebaño constatada 5 2 40% 50% N.T.: FRGDS: Fédération Régionale de Groupements de Défense Sanitaire; 60 2 DDSV: Direction Départamentale des Services Veterinaires 61 1.3.3 Valoración de la emisión La emisión, que tiene en cuenta las fuentes de material patógeno y la prevalencia de la infección (figura 1), varía en función de las especies animales (rumiantes, carnívoros domésticos, fauna salvaje). Para evaluarla, conviene diferenciar: • el ciclo doméstico, caracterizado por la infección de ganado bovino, ovino, caprino y, posiblemente, carnívoros domésticos de granja, la posible contaminación de sus productos (sobre todo leche y productos lácteos) y la difusión de esta infección por contacto directo o aéreo; • el ciclo salvaje, caracterizado por la infección de rumiantes salvajes, roedores, lagomorfos y aves (posiblemente también de carnívoros domésticos que viven en el medio rural), y la difusión de esta infección por intervención de garrapatas y por contacto directo entre estos animales. Estos dos ciclos están relativamente separados, aunque pueden interferir ocasionalmente por mediación de etapas-enlace como carnívoros domésticos, roedores o especies salvajes infectadas por aerosoles procedentes de ganaderías contaminadas. La valoración cualitativa de la emisión que se propone más abajo responde a una síntesis de datos de fuentes y de prevalencias, realizada por el grupo de trabajo (tabla V). En lo que concierne al ciclo doméstico, la emisión es máxima durante el período de partos. Según el procedimiento de valoración cualitativa definido en el punto 1.1.2, la emisión puede considerarse como moderada para todos los rumiantes domésticos. Las condiciones de cría (trashumancia, partos en el exterior...) y el clima (calor y viento) hacen que la emisión sea probablemente más importante para los pequeños rumiantes del sur de Francia que para el ganado bovino del norte. Sin embargo, aunque esta diferencia es apreciable, no conduce a una valoración cualitativa de la emisión diferente para las dos especies, debido al reducido número de calificativos empleados para la valoración del riesgo. La emisión puede considerarse de despreciable a baja en el caso de los carnívoros domésticos, sobre todo para la majoría de ellos que vive en medio urbano. Teniendo en cuenta que la excreción en leche es posible pero poco importante, la emisión a partir de productos lácteos puede considerarse baja. La emisión en el ciclo salvaje puede considerarse despreciable. Tabla V: Valoración cualitativa de la emisión de Coxiella burnetii Emisión Directa Moderada Rumiantes Productos alimentarios Baja Carnívoros domésticos Fauna salvaje De despreciable a baja Despreciable 1.4 Exposición La exposición tiene en cuenta las diferentes vías de exposición y las poblaciones expuestas al riesgo. 1.4.1 Diferentes vías de exposición La exposición humana a Coxiella burnetii es particularmente multifactorial, por lo que los estudios epidemiológicos raramente consiguen poner en evidencia una fuente única de exposición. Sea en la descripción de las grandes series de casos, o en los estudios epidemiológicos, rara vez se puede distinguir entre la exposición directa por contacto con animales y la exposición indirecta, medioambiental, por inhalación de polvo infectado. La noción de la exposición alimentaria se distingue pocas veces. En otros países europeos, la mayoría de los estudios realizados tras epidemias señalan el contacto, a menudo indirecto, con rebaños. Del conjunto de estos estudios se concluye que la presencia de rebaños, casi siempre de ovino, se situa en el origen de la mayoría de las epidemias estudiadas con rigor. Es difícil estimar la contribución diferencial del contacto directo y del indirecto. En la mayoría de estudios epidemiológicos se investiga la noción de exposición profesional a los animales, a menudo sin encontrar diferencias significativas entre casos y testigos, lo que muestra una vez más la dificultad de identificar una fuente única. En una serie de 323 casos diagnosticados en el CNR [Tissot-Dupont et al.,1992], sólo 149 casos incluían la noción de profesión, siendo la proporción de granjeros-criadores de 9,4%, proporción estadísticamente similar a la proporcionada por el INSEE1 (7,5%). El modo de vida rural aparecía en 40 (29,8%) de los 134 informes en los que este ítem estaba presente. La noción de factores de riesgo “clásico” (contacto directo con animales o sus despojos, ingestión de productos lácteos crudos) se mencionaba sólo en 164 informes, 33 de los cuales (20,1%) presentaban uno o varios factores de riesgo (de los cuales dos tercios consistían en contacto con ovino o con placentas de ovino o caprino). En la serie de 1.383 infecciones diagnosticadas en el CNR entre 1985 y 1998 [Raoult et al. 2000], sólo 477 informes relativos a fiebre Q aguda podían explotarse en términos de exposición. Entre ellos había un 8% de responsables de explotación y veterinarios, modo de vida rural en el 38% de los pacientes y contacto con animales recién nacidos o preñados en el 35% de los pacientes. La comparación de los principales cuadros clínicos (fiebre – hepatitis – neumopatías) no mostraba diferencias en términos de factores de exposición a Coxiella burnetii. Una revisión de 80 casos de neumopatías causadas por Coxiella burnetii en Francia arroja un balance de 32 casos en los que puede señalarse contacto con animales, de los cuales un 59% (19 pacientes) habían tenido contacto con ovino, 15,6% (5 pacientes) con bovino, 28,1% (9 pacientes) con caprino y un 14,6% (5 pacientes) con gatos [Caron et al. 1998]. 1.4.1.1 Vía aérea En relación con la dosis infectiva, habitualmente se considera que, por inhalación, Coxiella burnetii es infectiva “a la unidad”. El hecho de que haya habido casos a una distancia considerable de las zonas de excreción y de generación de aerosoles, hace pensar que basta un inóculo muy bajo para infectar un individuo [Tissot-Dupont et al. 1999]. Ningún estudio reciente cuantifica este inóculo. En 1996, la ciudad de Briançon sufrió una epidemia de más de 120 casos de los cuales 61% eran asintomáticos. El estudio caso-testigo permitió poner en evidencia la exposición al medio ambiente del matadero, como factor de riesgo (OR ajustado sobre edad y sexo=6,8 [IC95%: 1,1 40,3]). Este vetusto matadero, lugar de tránsito de paseantes y deportistas, contaba con una fosa de desechos al aire libre, situada a algunas decenas de metros de un helipuerto de gran actividad. En esta epidemia, excepcional al estar mayoritariamente ligada a una fuente única, resultó evidente el papel de los aerosoles de Coxiella burnetii en un entorno altamente transitado [Carrieri et al. 2002]. El papel del viento El papel del viento en la dispersión de aerosoles infectados se ha puesto en evidencia en la región de Etang de Berre (Bouches-du-Rhône), que presenta una incidencia de casos de fiebre Q aguda 5,4 veces superior a la ciudad de Marsella. En la llanura de Crau se crían alrededor de 70.000 cabezas de ganado ovino, que habitualmente paren al aire libre. En el período principal de partos, en octubre, el ambiente es húmedo y el viento de mistral sopla poco, lo que genera un pico mínimo de casos de fiebre Q. En cambio, el período compensatorio de partos, en marzo, corresponde al período en el que el mistral sopla con mayor frecuencia y violencia, en un ambiente seco, lo que explica el reparto estacional de los casos, que presenta un pico en mayo – junio. Además, los casos se sitúan geográficamente bajo el viento de la llanura de Crau [Tissot-Dupont et al. 1999, Tissot-Dupont et al. 2004]. 1 N.T.: INSEE: Institut National de la Statistique et des Etudes Économiques 63 En el Reino Unido, en 1984, el paso de un vehículo de transporte de ganado ovino originó 29 casos en medio urbano, sin contacto directo [Salmon et al. 1982]. La epidemia más importante tuvo lugar en Birmingham en 1989, con 147 casos en medio urbano, sin contacto directo con animales. Coincidiendo con el período de exposición, había una ganadería de ovino situada en la dirección del viento de la zona de la epidemia, viento que soplaba con una intensidad poco habitual [Hawker et al. 1998]. Rebaños trashumantes o paso de ovinos Tras la epidemia de más de 100 casos que tuvo lugar en el valle de Chamonix el verano de 2002, se llevó a cabo un estudio caso-testigo en busca de factores de exposición [informe InVS, sin publicar]. Para el período considerado, no se pudo asociar la enfermedad con la frecuentación de distintos barrios o municipios de la zona, ni con la participación en fiestas o reuniones, ni con el contacto directo con animales, ni con el consumo de productos lácteos. En cambio, se encontró una asociación entre la enfermedad y el hecho de haber tenido contacto cercano con ganado ovino y/o haber asistido a la trashumancia de ganado ovino. En Suiza, en el valle de Bagnes (Valais), se diagnosticaron 415 casos en 1983, tras el paso en trashumancia de 900 cabezas de ovino [Dupuis et al. 1987]. En Italia, tras una epidemia de 53 casos en la region de Vicenza en 1996, el estudio caso-testigo puso de manifiesto el papel de los rebaños de ovino que habían atravesado la zona de la epidemia (OR= 6,1 [2,5 - 16,3]). La seroprevalencia en estos rebaños variaba de 45 a 53% [Manfredi Selvaggi et al. 1996]. 1.4.1.2 Contacto con mamíferos y en particular con ovino En diciembre de 1996, ante la aparición de varios casos clínicos de fiebre Q aguda entre el personal de la Estación de Investigación sobre Fisiología de la Reproducción (PRMD) del centro INRA de Nouzilly (Tours), se realizó un estudio seroepidemiológico entre 306 personas [TissotDupont, resultados no publicados]. El primer caso fue el de un hombre que se encargaba de limpiar (con alta presión, generalmente aerosoles) los remolques de transporte de canales. Este estudio mostró la ausencia de la epidemia, así como una hiperendemia (seroprevalencia global: 15%). En términos de reparto por lugar de trabajo, no se encontró ningún sujeto positivo entre el personal de servicios generales, de las fincas, de la estación de patología aviar y de patología infecciosa. La seroprevalencia era de 22,5% (38/170) en la estación PRMD y de 16,7% (5/30) para la estación vecina, de investigación avícola. Dentro de la estación PRMD, se encontró un gradiente de seroprevalencia según la frecuencia de contacto con los animales (Servicios Centrales 2,3%, Unidades de Investigación 15,5%, Instalaciones Experimentales 18,7%), mientras que dos de los cuatro empleados del hospital-matadero dieron positivo. En las instalaciones experimentales, no se detectó ningún positivo entre el personal del animalario (pequeños roedores) ni entre los responsables de porcino; 12,5% entre los responsables de bovino y caprino, 14,3% entre los responsables del equino, y 30,7% entre los responsables del ovino. Se encontró igualmente un gradiente de seroprevalencia en las unidades de investigación: ningún positivo en la unidad de reproducción equina, 5,2% entre los neuroendocrinólogos, 7,1% entre los comportamentalistas, 35% en la unidad de investigación sobre testículos y 16,7% en la unidad de ovarios – FIV. Así, este estudio mostró varios gradientes de exposición según la intensidad y frecuencia de contacto con animales, y según la especie animal. De nuevo en la región de Etang de Berre, un estudio caso-testigo investigó los factores de riesgo más individuales, comportamentales. Se encontró contacto con ovino en el 16,4% de los casos y en el 6% de los testigos, y contacto con mamíferos recién nacidos en el 15,3% de los casos y el 4,3% de los testigos. Además, contrariamente a los testigos, un 4,7% de los casos declararon haber visitado una granja pedagógica, único factor de riesgo independiente [Tissot-Dupont, enviado para su publicación]. Estas granjas pedagógicas, cuya finalidad es favorecer el contacto directo del público con los animales, pueden constituir lugares de riesgo, sobre todo para las personas que presentan factores agravantes: por una parte, los visitantes son a menudo personas 64 que residen en medio urbano, acompañadas de niños, los cuales son atraídos por los animales; por otra parte, los animales con los que cuentan estas granjas son a menudo hembras con sus crías, lo cual supone un mayor riesgo de excreción de Coxiella burnetii. Contacto con otros mamíferos El papel de los gatos, principalmente durante el parto y la manipulación de las crías recién nacidas, se puso de manifiesto por primera vez durante una epidemia familiar en 1984 en Nueva Escocia (Canada) [Kosatsky 1984] y ha sido ampliamente descrito desde entonces [Langley et al. 1988, Marrie et al. 1988, Matthewman et al. 1997, Pinsky et al. 1991]. La infección de perros como consecuencia de la picadura de garrapatas se conoce desde los años 50 [Mantovani y Benazzi 1953]. También pueden contaminarse por ingestión de placentas o de leche de rumiantes infectados, o por aerosoles [Maurin y Raoult 1999]. La infección de perras gestantes puede asociarse al nacimiento de cachorros muertos [Burahiwalla et al. 1996]. Autores canadienses han señalado varias veces el papel de los perros en la transmisión de la fiebre Q al hombre [Burahiwalla et al. 1996, Laughlin et al. 1991, Marrie et al. 1985]. En Francia se ha realizado un estudio sobre perros que viven en bases militares, el cual muestra una seroprevalencia de 9,8% [Boni et al. 1998]. 1.4.1.3 Exposición alimentaria A menudo se cita la vía digestiva como posible fuente de infección humana, pero la ingestión de productos lácteos no pasteurizados, aunque sistemáticamente investigada, no es sino un modo menor de transmisión [Benson et al. 1963, Krumbiegel et al. 1990]. Los estudios realizados sobre voluntarios han dado resultados variables [Anonyme 1950, Benson et al. 1963, Krumbiegel y Wisniewski 1970]. En uno de estos estudios, 34 voluntarios con buena salud consumieron leche contaminada de forma natural durante aproximadamente un mes. La contaminación real de la leche se controló y cuantificó sobre hámster y huevo embrionado. Ninguna de estas personas desarrolló síntomas o seroconversión. En un estudio similar, Benson et al. [1963] pusieron de manifiesto una seroconversión asintomática. Esta diferencia en los resultados podría explicarse por la diferencia en las dosis ingeridas y en las cepas utilizadas en ambos estudios. El informe del CES “Microbiología” menciona también la contaminación por vía alimentaria (Anexo II) e indica que “el número de gérmenes necesarios para provocar la enfermedad es claramente mayor por vía oral que por inhalación”. Esto nos permite concluir que esta vía de exposición debe considerarse actualmente como menor. 1.4.1.4 Fauna salvaje y diversa El papel de los animales salvajes no se conoce bien [Marrie et al. 1993]. Estas poblaciones constituyen un reservorio secundario en relación a los animales domésticos. Las pruebas serológicas y bacteriológicas han permitido estimar la extensión de la fiebre Q en la mayoría de los países, y en una gran diversidad de especies animales y sus ectoparásitos. Por el contrario, no se ha descrito ninguna situación de transmisión de la enfermedad al hombre a partir de la fauna salvaje, salvo a partir de lagomorfos, en Canada [Marrie et al. 1986]. En general, el riesgo sería mayor para las poblaciones en contacto cercano con los animales salvajes, como cazadores y excursionistas. Por ejemplo, se sospecha que las excreciones de las garrapatas infectadas pueden constituir una fuente de transmisión, ya que la carga bacteriana que contienen puede ser elevada. Sin embargo, un estudio ha mostrado que el riesgo de infección por Coxiella burnetii era similar en una población de tramperos y en una población testigo [Levesque et al. 1995]. Algunos autores han señalado otras posibilidades. Se sospecha del papel del reservorio salvaje en la transmisión de la enfermedad a la población suburbana de la Guayana francesa, pero las investigaciones no se han terminado aún [Gardon et al. 2001]. En Japón, se ha constatado una fuerte prevalencia entre las aves que viven en las proximidades de las ganaderías [Hirai y To 65 1998]. Las aves podrían desempeñar el papel de etapas-enlace entre ganaderías y poblaciones urbanas. En resumen, es probable que la fauna salvaje este detrás de algunos casos esporádicos o algunos accesos epidémicos de escasa importancia. Así, no debe ignorarse esta forma de exposición, y conviene retener que el desplazamiento de animales salvajes a las proximidades de las poblaciones humanas puede contribuir a aumentar la incidencia de la fiebre Q. En Alemania se han analizado recientemente 40 epidemias acaecidas entre 1947 y 1999 [Hellenbrand et al. 2001]. Los autores hacen notar que estas epidemias son cada vez más urbanas (junto con una urbanización de zonas rurales que aproximan los habitantes de la ciudad a las fuentes de Coxiella burnetii). Veinticuatro de las epidemias estaban asociadas a ovino, de las cuales 11 tenían que ver con la manipulación de productos del parto, 1 a la manipulación de camas para el ganado, 3 a la manipulación de lana, 12 al paso de rebaños por las proximidades, y 14 al viento y a la sequedad. Seis epidemias se debían a ganado bovino, de las cuales 4 eran de carácter comunitario (manipulación de abortones, ferias de ganado) y 2 tuvieron lugar en mataderos. Dos epidemias, las más antiguas, ocurrieron en laboratorios de investigación, y hay 8 epidemias para las que no se conoce la fuente. Las Tablas VI y VII resumen las principales epidemias descritas en el mundo y los datos epidemiológicos de los veinte últimos años en Francia. Tabla VI: Principales epidemias descritas desde hace una veintena de años Fuente Ovino Bovino Caprino Gato Perro Conejo Paloma Año 1981 1982 1983 1993 1996 1996 1996 1982 1996 1992 1998 2000 1984 1988 1989 1996 1986 2000 País EEUU Inglaterra Suiza Italia Alemania Alemania Francia EEUU Polonia Francia Eslovaquia Canada Canada Canada EEUU Canada Canada Francia Número de casos humanos 81 14 415 58 45 18 204 25 25 40 113 62 13 12 15 3 4 4 Referencia Meiklejohn 1981 Hall 1982 Dupuis 1987 Manfredi 1996 Anon.1997 Schulze 1996 Armengaud 1997 ; Carrieri 2002 Hall 1982 Tylewska- Wierzbanowska 1996 Fishbein 1992 Kovacova 1998 Hatchette 2001 Kosatsky 1984 Langley 1988 Pinsky 1991 Buhariwalla 1996 Marrie 1986 Stein 1999 66 Tabla VII: Datos epidemiologicos correspondientes a los ultimos 20 años en Francia Año 1988 Lugar Marsella Estudio 924 donantes de sangre Exposición Seroprevalencia 4% 1982-1990 Francia CNR Serie de 323 casos 1985-1998 Francia CNR Serie de 1.383 casos 1989-1996 Poitiers (86) Serie de 80 pneumopatías 1987 Banon (04) Epidemia Centro de Rehabilitación mediante el Trabajo 18 casos 1996 1990-1995 Briançon (05) Crau – Etang de Berre (13) Crau – Etang de Berre (13) Epidemia 120 casos Incidencia 5,4 veces mayor que en Marsella Estudio caso-testigo Criadores 9,4% Vida rural 29,8% Contacto con animales 20,1% de los cuales 2/3 ovino y placentas Criadores y veterinarios 8% Vida rural 38% Contacto con animales recién nacidos o hembras preñadas 35% Contacto con animales 40% de los que: Ovino 59% Bovino 15,6% Caprino 28,1% Gatos 14,6% Exposición a cabras: 65% de los positivos Exposición a productos lácteos crudos: 75% de los positivos No expuestos: 0 Matadero (OR=6,8) Influencia del mistral 1996 Tours (37) Centro INRA Estudio 306 personas 2000 Montoison (26) 2002 Chamonix (74) 10 casos Estudio caso testigo (50 testigos) Epidemia más de 100 casos 1996-1998 Granja pedagógica Hiperendemia 15% Seroprevalencia de 0 a 50% según exposición a los animales Proximidad explotaciones de caprino (seroprevalencia de 66 a 80%) Movimiento de ovino en la proximidad: OR de 2,9 a 5,8 según el período Referencia Tissot Dupont et al. 1992 Tissot Dupont et al. 1992 Raoult et al. 2000 Caron et al. 1998 Fishbein et al. 1992 Carrieri et al. 2002 Tissot Dupont et al. 1999 Tissot Dupont, resultados no publicados Tissot Dupont, resultados no publicados Informe InVS Informe InVS, resultados no publicados 1.4.2 Poblaciones expuestas En términos de exposición, parece lógico distinguir distintas poblaciones: 1) En primer lugar los sujetos en contacto directo, estrecho y habitual (casi siempre profesional) con los rumiantes (criadores, veterinarios, personal de mataderos). Un estudio inglés ha realizado el seguimiento de una cohorte formada por 404 sujetos que trabajan en ganaderías, comparándola a 395 testigos [Thomas et al. 1994, Thomas et al. 1995]. La seroprevalencia era casi tres veces mayor en los criadores (27,3%) que en los testigos (10,9%). La presencia de anticuerpos anti-Coxiella burnetii estaba significativamente asociada al contacto con el ganado gestante y con los productos del parto. En Francia, actualmente se está realizando un estudio entre criadores de Hautes-Alpes y de Alpes-de-Haute Provence. 2) A continuación vienen las poblaciones cuya exposición es rural, directa o indirecta: personas que viven en las proximidades a explotaciones ganaderas, adeptos al turismo de naturaleza, visitantes de granjas pedagógicas. Los 67 cazadores y excursionistas, aparte de la exposición a rebaños, pueden presentar algunas particularidades debido a su exposición a la fauna salvaje (sobre la cual el conocimiento es muy limitado) y de una sobreexposición a las garrapatas (aunque el papel de éstas en la transmisión de la fiebre Q al hombre se considera anecdótica en Francia). 3) La población general, principalmente urbana, expuesta a menudo a aerosoles transportados a distancia, o al paso de transportes de ganado. Esta población es la menos consciente de su exposición. 1.4.3 Valoración de la exposición Toma en cuenta las diferentes vías de exposición y las poblaciones expuestas al riesgo. Existen varias vías de exposición a Coxiella burnetii: • • • • contacto directo con rumiantes domésticos excretores; vía aérea, que puede darse a distancia; vía alimentaria; contaminación por ciclo salvaje: especialmente por garrapatas. Cuando ha habido contaminación tras un contacto directo con rumiantes domésticos, no se puede saber en qué medida se trata de una contaminación por vía aérea, o por otras vías de contaminación directa (en particular las mucosas). Así, se ha decidido, para el análisis del riesgo, agrupar estas dos vías de exposición (contacto directo y vía aérea). La valoración cualitativa de la exposición que se propone en este apartado corresponde a una síntesis de datos realizada por el grupo de trabajo, sobre las distintas formas de contaminación y sobre los tipos de población expuestos (tabla VIII). No todas las personas se han expuesto de la misma manera. En efecto, las tres categorías de poblaciones, descritas según sigue, tienen un tipo de exposición diferente: • la población en contacto directo: o Con rumiantes domésticos: se trata de criadores, inseminadores, técnicos de cría y matadero, veterinarios, tratantes ... o Con la bacteria. Se trata en este caso de personal de laboratorio. Es esta población la que presenta un mayor riesgo de exposición a Coxiella burnetii. Esta exposición, por vía aérea, se califica de moderada a elevada; • la población llamada “rural”, que puede contaminarse sbore todo por vía aérea: se trata de personas que habitan en las proximidades a explotaciones contaminadas; pueblos y cuidades próximas a lugares de trashumancia de rebaños; personas que realizan turismo de naturaleza en las cercanías de rebaños contaminados; cazadores; niños que visitan granjas pedagógicas. En la tabla VIII, que presenta la valoración de la exposición, esta categoría se llama población “rural”. Como recuerdan a menudo las epidemias, esta población, aunque está menos expuesta que la anterior, tiene en cualquier caso cierto riesgo de contacto con la bacteria, que se ha catalogado de bajo a moderado; • la población general, cuyo contacto con rumiantes domésticos es mucho más raro, y que no vive en una zona potencial de contaminación aérea. En global, esta populación está poco expuesta. No se puede excluir la fiebre Q como forma clínica ligada al consumo de alimentos crudos, pero tampoco se ha podido probar con certeza. Por este motivo, la valoración cualitativa de esta exposición se ha considerado “de nula a despreciable”, para las tres categorías de población. 68 La Tabla VIII presenta el resultado de la valoración cualitativa de la exposición en estas tres poblaciones: Tabla VIII: Valoración cualitativa de la exposición a Coxiella burnetii Contaminación directa y por vía aérea Contaminación alimentaria Contaminación por ciclo salvaje 2 Población en contacto directo con rumiantes Población “rural” 1 Población general De moderada a elevada De baja a moderada Despreciable De nula a despreciable Despreciable 1 El término “rural” comprende la población vecina a explotaciones contaminadas, pueblos y ciudades pequeñas en las proximidades a lugares de transhumancia de rebaños, personas que realizan turismo de naturaleza en las proximidades a rebaños contaminados, y cazadores. 2 La contaminación por ciclo salvaje corresponde esencialmente a la contaminación por garrapatas. 1.5 Valoración de las consecuencias Las consecuencias corresponden tanto a la gravedad de la enfermedad aguda (morbilidad y mortalidad) como a la de las formas crónicas. Se distinguen por una parte las consecuencias brutas, es decir, las que tienen lugar sin que medie un tratamiento, y las consecuencias reducidas, las que tienen lugar tras la puesta en marcha de una terapéutica adaptada (tratamiento antibiótico). Las consecuencias de una infección causada por el agente de la fiebre Q se consideran idénticas para las tres poblaciones que se distinguen en cuanto a exposición. La gravedad de las consecuencias varía en función de la situación de los individuos frente a los “factores agravantes”. Así, para cada población se distinguen por una parte los individuos con “factores agravantes”, es decir personas inmunodeprimidas, mujeres embarazadas y personas que sufren vavulopatías; y por otra, los individuos con buena salud (sin factores agravantes). La tabla IX recoge la estimación de las consecuencias brutas y las consecuencias reducidas mediante terapéutica. Tabla IX: Evaluación cualitativa de las consecuencias brutas y reducidas de la infección por Coxiella burnetii Consecuencias brutas Consecuencias reducidas mediante aplicación de terapéutica Población Con factores agravantes Sin factores agravantes Elevadas Leves De leves a moderadas Nulas a despreciables 1.6 Valoración del riesgo 1.6.1 Valoración de la probabilidad de infección La probabilidad de infección de una persona en Francia, a partir de las diferentes fuentes de Coxiella burnetii, corresponde a la combinación de la probabilidad de emisión con la de exposición (tabla X). Se ha determinado cruzando las probabilidades de emisión y de exposición estimadas por el grupo de trabajo, siguiendo la tabla I (presentada en el apartado 1.1). 69 Tabla X: Probabilidad de infección por Coxiella burnetii Emisión Directa (Moderada)b Rumiantes Productos alimentarios (Baja)b Carnívoros domésticos (De despreciable a leve)b Fauna salvaje (Despreciable)b Exposición (población expuesta) Población en contacto Población “rural” Población general directo con rumiantes (De moderada a elevada)a (De leve a moderada)a (Despreciable)a Baja Baja Despreciable (De nula a despreciable)a De nula a despreciable (De moderada a elevada)a (De leve a moderada)a (Despreciable)a De despreciable a baja Despreciable De nula a despreciable (De moderada a elevada)a De despreciable a baja a: la valoración entre paréntesis corresponde al resultado de la valoración de la exposición (ver tabla VIII) b: la valoración entre paréntesis corresponde al resultado de la valoración de la emisión (ver tabla V) 1.6.2 Valoración de los riesgos brutos y reducidos El riesgo corresponde a la combinación de la probabilidad de infección con las consecuencias. Teniendo en cuenta que es posible reducir el riesgo mediante una terapéutica apropiada, el riesgo bruto (la probabilidad de infección cruzada con las consecuencias brutas) será diferente del riesgo reducido (la probabilidad de infección cruzada con las consecuencias reducidas). Las tablas XI, XII, XIII y XIV presentan estas valoraciones cualitativas del riesgo en función de la vía de contaminación (rumiantes, alimentación, carnívoros domésticos y fauna salvaje) y por cada categoría de población (en contacto estrecho, “rural”, y general) en función de la existencia o no de factores agravantes (valvulopatía, embarazo, inmunodepresión). Todas las tablas que se presentan a continuación se han realizado utilizando la tabla de cruce presentada en el apartado 1.1. La tabla XI muestra la valoración cualitativa del riesgo de contaminación por contacto directo. Tabla XI: Valoración de los riesgos bruto y reducido mediante tratamiento en el caso de contaminación por Coxiella burnetii procedente de rumiantes domésticos. Población en contacto directo con rumiantes (Baja)a Con factores Sin factores agravantes* agravantes (Elevadas)b (Leves)b Leves Despreciables Probabilidad de infección Población “rural” (Baja)a Población general (Despreciable)a Con factores agravantes* (Elevadas)b Leves Sin factores agravantes (Leves)b Despreciables Con factores agravantes* (Elevadas)b De despreciables a leves Sin factores agravantes (Leves)b De nulas a despreciables (De nulas a despreciables)b (De leves a moderadas)b (De nulas a despreciables)b De nulas a Despreciables despreciables a: la valoración entre paréntesis corresponde al resultado de la valoración de la probabilidad de la infección (ver tabla X) b: la valoración entre paréntesis corresponde al resultado de la valoración de las consecuencias (ver tabla IX) * Se consideran factores agravantes el embarazo, la valvulopatía y la inmunodepresión De nulas a despreciables Brutas Consecuencias Reducidas mediante tratamiento (De leves a moderadas)b (De nulas a despreciables)b (De leves a moderadas)b Despreciables Despreciables Despreciables La valoración cualitativa del riesgo de contaminación por consumo de alimentos (sobre todo de leche cruda) se muestra en la tabla XII. 70 Tabla XII: Valoración de los riesgos bruto y reducido mediante tratamiento en el caso de infección por Coxiella burnetii causada por consumo de alimentos contaminados (en especial leche cruda) Brutas Población en contacto directo con rumiantes (De nula a despreciable)a Con factores Sin factores agravantes* agravantes (Elevadas)b (Leves)b De nulas a Despreciables despreciables Consecuencias Reducidas (De leves a moderadas)b (De nulas a despreciables)b Probabilidad de infección Población “rural” (De nula a despreciable)a Población general (De nula a despreciable)a Con factores agravantes* (Elevadas)b Sin factores Con factores Sin factores agravantes agravantes* agravantes (De despreciables a (Elevadas)b (De despreciables a De nulas a leves)b leves)b despreciables Despreciables De nulas a De nulas a despreciables despreciables (De leves a (De nulas a (De leves a (De nulas a moderadas)b despreciables)b moderadas)b despreciables)b De nulas a De nulas a De nulas a De nulas a De nulas a despreciables despreciables despreciables despreciables despreciables a: la valoración entre paréntesis corresponde al resultado de la valoración de la probabilidad de la infección (ver tabla X) b: la valoración entre paréntesis corresponde al resultado de la valoración de las consecuencias (ver tabla IX) * Se consideran factores agravantes el embarazo, la valvulopatía y la inmunodepresión De nulas a despreciables La tabla XIII muestra la valoración cualitativa del riesgo de contaminación por carnívoros domésticos. Tabla XIII: Valoración de los riesgos bruto y reducido mediante tratamiento en el caso de contaminación por Coxiella burnnetii causada por contacto con carnívoros domésticos Brutas Población en contacto directo con rumiantes (De despreciable a leve)a Con factores Sin factores agravantes* agravantes (Elevadas)b (Leves)b De nulas a despreciables Leves Consecuencias (De nulas a despreciables)b Con factores agravantes* (Elevadas)b De despreciables a leves (De leves a moderadas)b Sin factores agravantes (Leves)b De nulas a despreciables (De nulas a despreciables)b Población general (De nula a despreciable)a Con factores Sin factores agravantes* agravantes (Elevadas)b (Leves)b Despreciables De nulas a despreciables (De leves a moderadas)b (De nulas a despreciables)b De nulas a Despreciables De nulas a De nulas a despreciables despreciables despreciables a: la valoración entre paréntesis corresponde al resultado de la valoración de la probabilidad de la infección (ver tabla X) b: la valoración entre paréntesis corresponde al resultado de la valoración de las consecuencias (ver tabla IX) * Se consideran factores agravantes el embarazo, la valvulopatía y la inmunodepresión De nulas a despreciables Reducidas (De leves a moderadas)b Probabilidad de infección Población “rural” (Despreciable)a Despreciables La tabla XIV muestra la valoración cualitativa del riesgo de contaminación por fauna salvaje. 71 Tabla XIV: Valoración de los riesgos bruto y reducido mediante tratamiento en el caso de contaminación por Coxiella burnetii causada por contacto con fauna salvaje. Brutas Población en contacto directo con rumiantes (De nulo a despreciable)a Con factores Sin factores agravantes* agravantes (Elevadas)b (Leves)b De nulas a Despreciables despreciables Probabilidad de infección Población “rural” (De nulo a despreciable)a Con factores agravantes* (Elevadas)b Sin factores agravantes (Leves)b Despreciables De nulas a despreciables (Nulas a despreciables)b Consecuencias (Nulas a despreciables)b (Leves a moderadas)b Con factores Sin factores agravantes* agravantes (Elevadas)b (Leves)b Despreciables De nulas a despreciables (Leves a moderadas)b (Nulas a despreciables)b De nulas a De nulas a De nulas a De nulas a De nulas a despreciables despreciables despreciables despreciables despreciables a: la valoración entre paréntesis corresponde al resultado de la valoración de la probabilidad de la infección (ver tabla X) b: la valoración entre paréntesis corresponde al resultado de la valoración de las consecuencias (ver tabla IX) * Se consideran factores agravantes el embarazo, la valvulopatía y la inmunodepresión De nulas a despreciables Reducidas (Leves a moderadas)b Población general (De nulo a despreciable)a Comentarios: • El riesgo asociado a la población general que no presenta factores agravantes (embarazo, valvulopatía o inmunodepresión) puede considerarse extremadamente bajo (de nulo a despreciable). • El riesgo es mayor para las poblaciones que presentan factores agravantes, lo que hace que la aplicación de un tratamiento adaptado sea especialmente importante pra esta categoría de población. En efecto, un diagnóstico precoz, acompañado de un tratamiento adecuado, reduce considerablemente el riesgo. Para la población que presenta factores agravantes, el riesgo bruto varía de despreciable a leve, mientras que el riesgo reducido mediante tratamiento se vuelve de nulo a despreciable. • El riesgo asociado a la fauna salvaje es, en global, de nulo a despreciable. • El riesgo asociado al consumo de alimentos contaminados es, en global, de nulo a despreciable. Para las poblaciones que presentan factores agravantes, el riesgo es despreciable. El riesgo más alto corresponde a la vía aérea o al contacto estrecho con animales contaminados. Así, las personas que corren mayor riesgo son aquellas que, presentando factores agravantes, pertenecen a la población que presenta un contacto estrecho con animales, o a las llamadas poblaciones “rurales”. 72 2 Medios disponibles para la lucha en explotaciones ganaderas La resistencia de las formas SCV y SDC de Coxiella burnetii a las condiciones ambientales desfavorables y a los agentes fisico-químicos es muy elevada. Coxiella burnetii sobrevive varios meses en el ambiente exterior (materias fecales desecadas, excreciones de garrapatas...), lo que contribuye de manera importante a perpetuar su presencia en distintos nichos ecológicos, y a diseminarla. Sobrevive por lo menos 586 días en las excreciones de las garrapatas, de siete a nueve meses en lana mantenida a 20°C, 182 días en sangre de cobaya desecada y conservada a Temperatura ambiente. Resiste a la desecación, a la presión osmótica, a la radiación ultravioleta, a los ultrasonidos, a las variaciones de pH, a los amonios cuaternarios, a los desinfectantes (formol al 5%, fenol al 1%, lejía1 al 0,5%), a una Temperatura de 62°C durante 30 minutos, de -20°C durante al menos 2 años, a la sonicación en agua destilada durante más de 30 minutos y a las radiaciones [Babudieri 1959 , Scott y Williams 1990]. Sin embargo, la mayoría de estos datos son anteriores a 1959. Deberían realizarse nuevos estudios, con los métodos actuales, para estudiar la viabilidad de Coxiella burnetii sobre cultivo celular. 2.1 Desinfectantes Una exposición prolongada (de 24 a 48 horas) al formol concentrado (>10%), al éter, al cloroformo al 5%, al ácido clorhídrico al 0,5%, a la cloramina al 3% y al etanol al 70% permiten destruir la bacteria [Scott y Williams 1990]. Los purines contaminados pueden tratarse con cianamida cálcica al 0,6% final durante una semana [Arricau-Bouvery et al. 2001a]. 2.2 Antibióticos Coxiella burnetii es sensible a los antibióticos (tetraciclinas, macrólidos, fluoroquinolonas y oxazolidinonas) in vivo e in vitro. En consecuencia, un tratamiento antibiótico adaptado puede limitar la excreción de bacterias al ambiente. Debido a su multiplicación intracelular, la actividad de los antibióticos no puede medirse mediante las técnicas clásicas de reducción del número de colonias. Se han desarrollado diversos métodos para evaluar y, sobre todo, comparar, la eficacia de los antibióticos in vitro [Brennam y Samuel 2003, Gikas et al. 1998, 2001, Maurin et al. 1992a, Maurin y Raoult 1997, 1999, Raoult et al. 1991], pero este tipo de estudios precisan el recuento de Coxiella, lo cual por el momento resulta difícil. Todos estos ensayos in vitro muestran que los antibióticos ensayados son bacteriostáticos, y que únicamente la asociación de doxiciclina con agentes como la cloroquina, la amantadina o el cloruro de amonio permiten obtener una actividad bactericida, a través de la alcalinización del entorno de Coxiella burnetii, que potencia la acción de las tetraciclinas [Maurin et al. 1992a]. Estos modelos han permitido también poner en evidencia la diferente sensibilidad/resistencia de las cepas frente a macrólidos, tetraciclinas o fluoroquinolonas [Maurin y Raoult 1999, Musso et al. 1996]. Se ha desarrollado un test PCR que permite identificar las cepas resistentes [Spyridaki et al. 2000]. En medicina veterinaria sólo se utilizan las oxitetraciclinas. 1 N.T.: en el original, eau de Javel: Mezcla en solución acuosa de hiplocorito y cloruro sódico o potásico, utilizado como detergente, decolorante y antiséptico. 73 Se ha testado la eficacia de un tratamiento oral diario en dosis de 8 mg/kg/día durante 30 días en el periodo de secado de dos vacas infectadas de forma natural [Behymer et al. 1977]. Se siguió la excreción de Coxiella burnetii en secreción mamaria durante 35 días de tratamiento. Antes de dicho tratamiento, las dos vacas eran excretoras. Después, en una de ellas la excreción se hizo intermitente. En la otra desapareció, pero sin embargo 31 días despues del comienzo del tratamiento parió un ternero vivo y otro muerto. Los ensayos de aislamiento de Coxiella burnetii a partir de placenta, calostro y órganos del ternero muerto, no ofrecieron resultados positivos, aunque éste último resultó seropositivo. Los autores concluyen que este ternero había sido infectado antes del comienzo del tratamiento, que éste fue eficaz y que debería ser recomendado en el caso de vacas lecheras cuya leche cruda se comercializa, o en regiones donde la incidencia de la fiebre Q es elevada. La oxitetraciclina inyectable, en su formulación de acción de larga duración, se considera el antibiótico de elección, aunque pocos trabajos han medido su eficacia sobre la excreción de Coxiella burnetii. Por razones económicas, los tratamientos se limitan generalmente a una o dos inyecciones hacia el final de la gestación, lo cual resulta insuficiente para suprimir la excreción tanto en placenta [Woernle et al. 1985] como en secreciones vaginales [Berri et al. 2002] o leche [Arricau-Bouvery, resultados no publicados]. No se ha podido encontrar ninguna diferencia significativa entre dos lotes de vacas infectadas de forma natural, de las cuales uno había recibido una sola inyección de terramicina (Terramycine LA 50 ml/vaca por vía intramuscular) aproximadamente 3 semanas antes del parto: 7/20 en el lote no tratado presentó una placenta positiva, frente a 8/33 en el lote tratado. En cambio, se observó una diferencia significativa cuando al asociar el tratamiento a una vacuna fase II, vacuna que no se había revelado eficaz sobre la excreción cuando se utilizó en solitario [Woernle et al. 1985]. Durante el seguimiento de la infección de un rebaño ovino aislado pero infectado de forma natural, el tratamiento sistemático de 300 ovejas con 20 mg/kg durante 105 y 120 días no impidió la excreción durante el parto, pero dicho tratamiento pudo contribuir a prevenir la excreción durante las siguientes gestaciones. Por desgracia, la ausencia de un lote testigo no tratado impide poder establecer conclusiones [Berri et al. 2002]. En espera de otros trabajos experimentales que demuestren con más precisión la eficacia y limitaciones de los tratamientos antibióticos, se recomienda su empleo con el fin de disminuir la excreción en episodios abortivos (dos inyecciones de 20 mg/kg de terramicina de liberación controlada en un intervalo de 15 días, en el ultimo mes de gestación) o en el período de secado en caso de que las excreciones persistan en leche. 2.3 Medidas sanitarias No se conoce bien la eficacia de las medidas sanitarias en la lucha y prevención de la fiebre Q en ganadería. El hecho de que hasta hace poco no se haya otorgado mucho interés económico a esta enfermedad explica que no se hayan realizado protocolos de evaluación de este tipo de medidas. Lo que se presenta a continuación procede más bien de la adaptación de medidas sanitarias de carácter general al caso de la fiebre Q que del resultado de datos experimentales u obtenidos en campo. 2.3.1 Medidas sanitarias de ataque La puesta en marcha de medidas sanitarias de ataque exige una reflexión previa sobre su objetivo. 74 Es diferente disminuir la presión de infección en una ganadería infectada que erradicar la Coxiella burnetii en esa misma ganadería. Sólo se puede aspirar a conseguir este segundo objetivo en la situación más favorable (pocos animales infectados), al coste de una inversión económica (ej. recambio de animales) y logística (ej. tratamiento del estiércol) considerables. Además, el saneamiento de la ganadería no ofrece garantía real sobre si esta situación favorable se mantendrá (ver medidas sanitarias defensivas). De manera general, la puesta en marcha de medidas sanitarias de ataque debe contemplarse tomando en cuenta tanto los beneficios esperados como las limitaciones técnicas, logísticas y económicas existentes, con el fin de evitar que dichas medidas resulten contraproducentes. 2.3.1.1 Recambio de animales excretores El recambio de animales excretores, con el fin de limitar la excreción bacteriana y, en consecuencia, los riesgos de contaminación humana y animal, constituye un medio factible pero a menudo extremadamente farragoso y costoso. Para identificar los animales excretores es necesario realizar previamente pruebas de detección, con la ayuda de herramientas de diagnóstico cuyas limitaciones ya se han señalado anteriormente (apartado 1-2-2-4). A las limitaciones de dichas pruebas de detección, hay que añadir otras asociadas a la propia reforma, que dependen de: • las posibilidades de contaminación de los animales no sustituidos, a partir del medio exterior o del entorno • del riesgo de excreción del animal positivo, ya que hay que tener en cuenta: - una posible excreción varios meses después de la contaminación - edad, sexo, estado fisiológico y tipo de producción del animal • tiempo que transcurre entre la detección y la sustitución propiamente dicha. 2.3.1.2 Medidas generales de higiene Precauciones a adoptar durante el parto Teniendo en cuenta que la excreción de Coxiella burnetii es especialmente importante durante los abortos/partos, así como la gran capacidad infectiva de las placentas, resulta especialmente pertinente aplicar medidas generales de higiene a placentas y estiércol. Dichas medidas corresponden a: • confinar los partos a cubículo específico; tras el parto, es preciso desinfectar tanto el cubículo como los productos del parto, y tratar el estiércol (ver más abajo); • la destrucción de placentas y de abortones, por incineración o descuartizado. Esta destrucción debe realizarse a la mayor brevedad posible con el fin de evitar su consumo o dispersión por parte de otros animales domésticos o salvajes. Polydorou refiere que en 1979 se puso en marcha en la isla de Chipre un programa aplicado a poblaciones ganaderas infectadas por fiebre Q. Dicho programa consistía en el aislamiento y destrucción de los productos de parto de todas las hembras que sufrían abortos, y estaba asociado a un tratamiento parenteral con tetraciclina durante 4 días consecutivos. La prevalencia serológica frente a fiebre Q en pequeños rumiantes que abortaban pasó de 28,6% (en un efectivo de 1.753) en 1979 a 4,7% (efectivo de 1.965) en 1982. 75 Precauciones a adoptar en relación con estiércol/purines La excreción de Coxiella burnetii por vía fecal y los partos en el interior de las instalaciones ganaderas hacen del estiércol y los purines importantes fuentes de contaminacion bacteriana. El empleo de estos materiales como abono contribuye a la formación de aerosoles, aumentando así el riesgo de dispersión de la bacteria, sobre todo en el caso del estiércol fresco. Se pueden considerar dos procedimientos de inactivación de Coxiella burnetii: Inactivación térmica: La fermentación natural del estiércol provoca un aumento de la Temperatura en el interior de la pila, del orden de 50 °C los primeros días, disminuyendo aproximadamente a 30°C entre los 5 y 12 días siguientes, en función de las condiciones climáticas. El compostaje del estiércol permite obtener una Temperatura de al menos 50 °C (hasta unos 70 °C) durante los días siguientes a la mezcla. Una segunda mezcla permite mantener la Temperatura por encima de 50 °C durante 3 ó 4 semanas [Hacala 1998, Lorthios 1998]. Sobre todo, la mezcla asegura el aumento de la Temperatura en todos los puntos de la pila. Estos procedimientos no han sido testados de cara a Coxiella burnetii, pero se dispone de más perspectiva en el caso de las salmonelas, consideradas bacterias menos resistentes. Su destrucción es rápida (en unos días) en el estiércol, incluso en ausencia de mezcla inicial [Hacala 1998] pero más lenta en purines: dos meses sin refuerzo de purín fresco [Marly et al. 1995]. No obstante, la mezcla del estiércol implica el riesgo de dispersión de Coxiella burnetii mediante aerosoles, sobre todo si se realiza de forma intensa. Inactivación química: Arricau-Bouvery et al. [2001a] han llevado a cabo la esterilización de los purines procedentes de una población caprina infectada de fiebre Q, con ayuda de cianamida cálcica al 0,6% durante una semana. La naturaleza líquida de los purines permite un tratamiento químico homogéneo. En cuanto al estiércol, podría realizarse una mezcla con el fin de repartir lo mejor posible el desinfectante, pero presenta el riesgo de la dispersión de Coxiella burnetii medainte aerosoles. El compostaje/mezcla de éstiercol puede realizarse con distintos tipos de equipamiento, desde el más rústico (cargador hidráulico) al más sofisticado (volteador de hileras), pasando por la utilización de erizos para la dipersión de abono. Es una operación que requiere mucho tiempo. El tiempo medio para sacar y convertir en compost cien toneladas de estiércol asciende a 11 horas, es decir, el doble que un proceso simple de sacado y apilado del estiércol [Hacala 1998]. Este aspecto logístico es importante, ya que el volumen de residuos considerado puede ser importante (una tonelada de estiércol por vaca y mes, en función de la cantidad de paja que se emplee como cama). En la práctica, hay tres tipos de estiércol/purines a tratar: 1. los purines; 2. el estiércol en las instalaciones de cría; 3. el estiércol ya sacado y apilado en el exterior de las instalaciones de cría. En el primer caso, la naturaleza líquida del residuo y la disponibilidad de hélices en las ganaderías permiten un tratamiento químico homogéneo sin riesgo especial de formación de aerosoles. 76 En el segundo caso, en primer lugar hay que sacar el estiércol al exterior de las instalaciones. Esta etapa es propicia a la realización en paralelo de las operaciones de mezcla (tratamiento químico) o aireación (tratamiento térmico), contemplados en el tratamiento habitual del estiércol. No existe un riesgo suplementario de formación de aerosoles asociado a este tratamiento. En el tercer caso, el riesgo de formación de aerosoles es mayor que en el precedente, ya que exige mezclar/hacer compost del estiércol “en reposo”, teniendo en cuenta además que puede haber múltiples zonas de almacenamiento de estiércol. Hay otras soluciones que se pueden contemplar: incinerar el estiércol (pero esto implica también un riesgo de formación de aerosoles en el momento de carga/descarga y transporte del estiércol) o, si es posible, cubrirlo con un desinfectante químico de superficie y mantenerlo bajo una lona antes de su utilización. En el caso de las instalaciones catalogadas la legislación autoriza el almacenamiento de estiércol en campo hasta un período de diez meses. Finalmente, el estiércol o purines tratados deverían esparcirse idealmente a una cierta distancia de las viviendas, y sobre superficies que no se vayan a destinar, durante las semanas/meses siguientes, a los animales de cría (barbechos...). El tratamiento del estiércol y de los purines no debe realizarse en completo detrimento de las normas agronómicas y medioambientales. Si el estiércol o los purines no pueden utilizarse de ningún modo, se compromete su gestión a largo plazo. 2.3.2 Medidas sanitarias defensivas Tienen como objeto limitar la entrada de Coxiella burnetii en las poblaciones ganaderas cuyo correcto estado sanitario se conoce con anterioridad. Esta información sólo está disponible en un escaso número de ganaderías. Sólo en ellas podrían aplicarse todas o una parte de las medidas que se describen en este apartado. 2.3.2.1 Precauciones a adoptar de cara a la incorporación/mezcla de animales Esta gestión está basada en las siguientes medidas: • pruebas de detección a los animales a incorporar, de forma exhaustiva o por muestreo, en las instalaciones del comprador o, aún mejor, del vendedor. Estas pruebas de detección podrían completarse o sustituirse por el conocimiento, de forma exhaustiva o por muestreo, del estado sanitario de la población ganadera de origen; • cuarentena de los animales incorporados, al menos hasta la obtención de un resultado favorable en las pruebas de detección; • se recomienda limitar el riesgo de contaminación durante el transporte de la población ganadera de origen hasta la de destino, por ejemplo mediante transporte directo. El control individual en la incorporación de animales al rebaño resulta poco eficaz. La concentración de animales con ocasión de concursos o pastoreo de verano, plantea la misma problemática que la incorporación, pero multiplicando el número y diversificando el origen de los animales afectados. 2.3.2.2 Precauciones de cara a ganaderías próximas En general, es deseable contar con una separación física adecuada entre poblaciones ganaderas (cercado, o incluso doble cercado con un especio intermedio de un metro), de cara a enfermedades infecciosas, con el fin de limitar el contacto entre animales y, en consecuencia, el riesgo de contaminación. En el caso de la fiebre Q, se desconoce el interés real de estas medidas de cara a la contaminación entre poblaciones ganaderas, sobre todo teniendo en cuenta el elevado poder de contagio de esta bacteria, y su dispersión a través del viento. 77 2.3.2.3 Precauciones frente a otros vectores de Coxiella burnetii La gran capacidad de contagio de esta bacteria, su carácter ubicuo y su resistencia, multiplican el número de vectores activos (fauna salvaje, especies domésticas distintas de rumiantes, plagas, artrópodos...) o pasivos (intercambio de material entre explotaciones, tránsito de personal...). Toda gestión realizada en este sentido, como la separación por especies, o la desinfección de materiales comunes, resulta deseable en el marco general de la lucha contra las enfermedades infecciosas. En el caso de la fiebre Q, no se ha evaluado el impacto de estas medidas sobre la contaminación de poblaciones ganaderas. La puesta en marcha de medidas sanitarias defensivas no es generalizable a todas las ganderías, por dos razones: - falta de conocimiento previo de la situación de las ganaderías. Además, no existe una definición precisa del estatus de población ganadera libre de fiebre Q; - el coste de estas medidas sanitarias defensivas es importante, pero su eficacia muy limitada, teniendo en cuenta la capacidad de contagio y el carácter ubicuo de Coxiella burnetii. Así, el centro INRA de Tours, a pesar de implantar medidas preventivas similares a las adoptadas en laboratorio de investigación, en condiciones de cría no comparables, sólo pudo mantener indemne un rebaño ovino durante cuatro años, en las proximidades de otro rebaño infectado. 2.4 Vacunas animales Se han testado distintos tipos de vacunas sobre ratón o cobaya: vacunas constituidas por bacterias completas (WC) fase I o fase II inactivadas mediante formaldehído, de fracciones de bacterias fase I o fase II inactivadas mediante formaldehído y extraídas mediante cloroformo-metanol (CMR, CME), de diferentes fracciones de LPS fase I o fase II, o de proteínas de membrana exterior. Los mejores resultados se han obtenido con las vacunas CMRI (fase I) y WCI (fase II) [Kazard et al.1995, Waag et al.1997, Williams et al. 1990, Zhang et al. 1994]. Las vacunas fase II son cien veces menos eficaces contra la colonización del bazo en ratón que las vacunas fase I [Gajdosova 1994 et al.]. Por otra parte, el efecto de la vacunación (fase I) sobre ratón y cobaya infectados por Coxiella burnetii mostró que la vacunación post-infección daba lugar únicamente a la disminución del número de órganos infectados y no a la eliminación de la bacteria [Kazard et al.1983]. 2.4.1 Bovino En bovino, la mayoría de los ensayos de vacunación se ha realizado sobre animales situados en un medio infectado de forma natural. Cuando se vacunan y analizan las vacas, y se devuelven al rebaño infectado, la vacuna fase I parece eficaz contra los abortos, la excreción en leche y la contaminación de placentas, aunque algunas siguen excretando en leche bajas cantidades de bacterias después de la vacunación [Behymer et al. 1976, Biberstein et al. 1977, Sadecky et al. 1975 a, Sadecky et al. 1975 b, Sadecky y Brezina 1977]. La vacunación de rebaños con una vacuna fase I o fase II durante varios años, asociada a la eliminación de vacas excretoras, condujo a la desaparición de la excreción en la leche de estas vacas, mientras que la vacunación fase II, sola o con tratamiento por tetraciclinas, sólo conseguía disminuir esta infección [Durand 1993, Schmeer et al. 1987b]. Sin embargo, la duración de algunos de estos estudios era limitada. No se ha probado realmente el contacto con el agente infeccioso, por lo que la inhibición de la excreción en leche podría estar asociada a una evolución normal de la fiebre Q en estos animales. Sólamente el estudio de Behymer [1976] testó sobre tres vacas la eficacia de una vacuna consistente en la cepa Nine Miles en fase I, frente a una prueba virulenta, y demostró que la excreción en leche disminuía en gran medida tras la vacunación. 78 2.4.2 Caprino En caprino sólo se ha testado una vacuna bivalente Coxiella burnetii fase II/Chlamydophila en cuanto a su capacidad para inducir anticuerpos específicos [Schmeer et al.1987b]. En el INRA de Tours-Nouzilly se llevó a cabo una infección experimental de cabras gestantes para testar la eficacia de una vacuna inactivada fase I, y compararla a la de una vacuna mixta inactivada Coxiella burnetii fase II. Se vacunaron respectivamente dos lotes de cabras con la vacuna fase I (lote I) y la vacuna fase II (lote II), seis semanas antes de la monta, con una vacunación de recuerdo tres semanas después de la primera inyección. Las cabras de estos dos lotes, así como las de un tercer lote no vacunado (lote NV), fueron analizadas a los 84 días de gestación por vía subcutánea en la región preescapular con Coxiella burnetii cepa CbC1 en concentración 104, y situadas en una explotación aislada de nivel 3 de seguridad. La tasa de partos patológicos (abortos, nacimiento de animales muertos) entre las cabras vacunadas con la vacuna fase I fue equivalente a la de las cabras no inoculadas (lote NI) y la contaminación placentaria de estas cabras se redujo de forma notable en relación a las cabras de los lotes II y NV, similares entre ellas (disminución del número de bacterias en un factor de 106 a 107 en placentas) (Tabla XV). La excreción vaginal y fecal se redujo notablemente en el lote I (disminución del número de bacterias en un factor de 104 a 105 en secreciones vaginales) y ninguna muestra de leche resultó positiva en estas cabras. La excreción de las cabras del lote II fue similar a las del lote NV. Las cabras del lote I tuvieron una respuesta serológica tras la vacunación, seguida de una disminución en la tasa de anticuerpos (Figura 4). Tras la inoculación, las cabras tuvieron en promedio una respuesta serológica moderada, lo que indica un control de la multiplicación bacteriana. Las cabras del lote II tuvieron sólo una respuesta serológica débil, lo que indica que los antígenos fase II son menos inmunógenos que los de fase I, pero un aumento rápido y constante de la tasa de anticuerpos anti-Coxiella burnetii tras el análisis, reflejando una multiplicación importante de Coxiella burnetii. La tasa de anticuerpos para el lote NV aumentó progresivamente tras la inoculación y seis semanas más tarde, siendo comparable a la de las cabras vacunadas con la vacuna fase II. Tabla XV: Partos patológicos, contaminación de placentas, de cabritos y de cabras, y excreción en heces, secreciones vaginales y leche tras el ensayo con 104 Coxiella burnetii cepa CbC1 de cabras gestantes no vacunadas (Lote NV) o vacunadas con vacuna fase I (Lote I) o vacuna fase II (Lote II), comparadas a un lote de cabras no inoculado (Lote NI). La detección de Coxiella se realizó mediante PCR. Número de cabras Duración de la gestación % de partos patológicos % de placentas positivas (PCR) % fetos positivos (PCR) Número de cabras con al menos un órgano positivo Duración media de la excreción (días) Heces Secreciones vaginales Leche Lote NV 12 141 (±8) 75 100 62 0 Lote II 15 134 (±15) 87 90 44 6* Lote I 16 153 (±3) 6* 30* 8* 0 27 22 17 28 16 14 10* 1,5* 0* Lote NI 27 150 (±1,8) 15 0* 0* 79 Recuerdo Ensayo Abortos y partos Porcentaje de positividad DO Vacunación Días tras la vacunación Lote de cabras no vacunado (▲) Lote de cabras vacunado con vacuna fase I (■) Lote de cabras vacunado con vacuna fase II (●) ¢ Diferencias significativas entre los tres grupos (p<0,01) * Diferencia significativa en relación con los otros lotes (test de Kruskall-Wallis) Figura 4: Respuesta serológica de las cabras tras la vacunación y la prueba. La tasa de anticuerpos se midió mediante un kit ELISA (CHEKIT-Q-Fever enzyme immuno-assay kit; Bommeli diagnostics, Switzerland), que permite detectar los anticuerpos anti-fase I y anti-fase II Los resultados clínicos y bacteriológicos indican claramente que la vacuna fase I protege a las cabras contra el aborto y la excreción en leche cuando la infección ha tenido lugar hacia la mitad de la gestación por Coxiella burnetii CbC1, disminuyendo considerablemente la excreción en heces y en secreciones vaginales, y que la vacuna fase II no es eficaz en estas condiciones. Por otra parte, los pacientes de un centro de acogida para minusválidos contrajeron la fiebre Q tras contacto directo con cabras vacunadas con esta vacuna bivalente fase II, o tras la ingestión de queso a base de leche cruda procedente de estas cabras, que excretaban bacterias en leche [Fishbein y Raoult 1992]. Así, parece que incluso en condiciones de infección natural, esta vacuna fase II no impide la excreción de Coxiella burnetii en cabras. 2.4.3 Ovino Se han realizado diversos estudios en ovino, pero en ellos sólo se ha tenido en cuenta la respuesta serológica. El estudio de Brooks et al. [1986] mostró que dos vacunas fase I WC y CMR reducían la 80 contaminación placentaria e inhibían la excreción en calostro tras un ensayo a los 100 días de la gestación con 104 Coxiella burnetii cepa Nine Mile. Otro estudio realizado sobre seis ovejas mostró que la vacunación con una vacuna fase I administrada a las siete semanas de gestación había prevenido la excreción en leche de oveja procedente de un rebaño infectado de forma natural [Sadeky et al. 1977]. 2.4.4 Conclusión La vacunación es la estrategia más lógica de prevención de fiebre Q en sujetos expuestos y en animales. Las vacunas consistentes en Coxiella burnetii en fase I son más eficaces que las consistentes en Coxiella burnetii en fase II, tanto en ratón como en cabra (vacuna fase II ineficaz en condiciones experimentales), y los animales seronegativos desarrollan con menor frecuencia reacciones secundarias, en relación a los animales seropositivos. En ganado bovino y ovino, no se ha realizado ningún estudio para comparar estas dos vacunas, pero deberían obtenerse resultados similares a los observados en caprino. Ni el tratamiento antibiótico ni la vacuna fase II disponible impiden la excreción de Coxiella burnetii por rumiantes en leche, secreciones vaginales o heces. En cambio, la vacuna en fase I previene esta excreción. En efecto, experimentalmente, las vacunas inactivadas en fase I reducen de forma muy eficaz la frecuencia de abortos y con mayor eficacia aún la excreción en leche. Reducen considerablemente la duración de la excreción fecal y vaginal así como la cantidad de bacterias excretada. Las vacunas inactivadas en fase II no reducen ni el número de abortos ni la excreción vaginal, fecal, o en leche. 81 3 Recomendaciones La fiebre Q constituye indiscutiblemente una preocupación mayor para la salud pública que para la sanidad animal. Por lo tanto las medidas de gestión del riesgo deben centrarse en limitar el riesgo de la contaminación humana. Cuadro AFSSA nº 1 Teniendo en cuenta los elementos desarrollados en el informe, la AFSSA estima que la afirmación según la cual “la fiebre Q es indiscutiblemente una preocupación mayor para la salud pública que para la sanidad animal” debería ser matizada, ya que por el momento se carece de una estimación precisa de la incidencia de esta patología en animales... Los principales argumentos que justifican esta matización son: - Conocimiento insuficiente de los signos clínicos en animales (al igual que en el hombre) (ver 1.221.); - Déficit de herramientas de diagnóstico fiables y validadas en condiciones reales (ver § 1.2.2.4.); - Falta de investigación sistemática de determinadas situaciones patológicas en animales (abortos…) (ver 1.3.2) Philippe Vannier y Muriel Eliaszewicz La mayoría de las contaminaciones humanas se deben a contacto con rumiantes domésticos. Sin embargo, hay que recalcar que el principal riesgo de exposición de las poblaciones humanas, aparte del contacto directo con animales infectados, corresponde a la vía aérea, que es difícil de controlar. La vía alimentaria, si bien parece mas fácil de controlar, no constituye más que una vía menor de contaminación (ver la conclusión del CES “Microbiología” de noviembre del 2003, en respuesta a la consulta recibida sobre la eficacia de la pasteurización de la leche de cara a Coxiellla burnetii, agente de la fiebre Q), sin olvidar que las consecuencias de la contaminación difieren según los tipos de población afectada. (Ej.: inmunodepresivos, personas con valvulopatías y mujeres embarazadas). La eliminación del riesgo de contaminación humana en Francia a partir de explotaciones ganaderas de rumiantes no puede alcanzarse más que a través de la erradicación de la infección en estas especies. Sin embargo actualmente esta erradicación no parece muy realista: - No se conoce bien la prevalencia de la infección en animales pero se estima bastante elevada; Los medios técnicos disponibles en la actualidad para la detección no resultan satisfactorios; Los recursos humanos y financieros necesarios serían considerables; Se necesitaría mucho tiempo para alcanzar los objetivos; El riesgo de recontaminación de las poblaciones ganaderas ya saneadas es importante, sobre todo debido a un escaso conocimiento epidemiológico; No se puede asegurar la disponibilidad de una o varias vacunas capaces de asegurar el control de la excreción en animales. Además, sería necesario evaluar su eficacia en un medio infectado; Los riesgos asociados a carnívoros domésticos y a fauna salvaje seguirían existiendo. Así, los esfuerzos deben encaminarse a un mejor conocimiento de la epidemiología de la enfermedad en el caso de los rumiantes, así como hacia una reducción del riesgo de contaminación, en particular en personas que presentan factores agravantes. Los expertos recomiendan por lo tanto: - Estudios e investigaciones destinados a obtener un mejor conocimiento de la situación epidemiológica en rumiantes. la instauración de nuevas medidas con el fin de limitar los riesgos de contaminación del medio exterior por los focos de la fiebre q en el caso de los rumiantes y mas particularmente, el estudio de la implantación, sin demora, de medidas de certificación de las ganaderías. la información del cuerpo médico y de las personas que presentan factores agravantes con el objetivo de una prevención personalizada y una mejor detección de la infección. 82 - Estudios e investigaciones dirigidas a ampliar el conocimiento sobre la bacteria y su transmisión. 3.1 Recomendaciones para ampliar el conocimiento en cuanto a la epidemiología de la fiebre Q en rumiantes La situación epidemiológica en el caso de los rumiantes es todavía desconocida y este desconocimiento hace que las opciones sanitarias resulten delicadas. En consecuencia, sería deseable identificar mejor las ganaderías en fase de excreción que presenten riesgos para la salud pública, con el fin de optimizar las propuestas en cuanto a medidas de gestión. En esta línea, el grupo de trabajo ha considerado: - Las ventajas e inconvenientes (Tabla XVI) de incluir la fiebre Q en la lista de enfermedades animales de declaración obligatoria. - La pertinencia de las medidas generales concernientes a las explotaciones que comercializan leche cruda o productos frescos de leche cruda. 3.1.1 Ventajas e inconvenientes de incluir la fiebre Q en la lista de enfermedades animales de declaración obligatoria (EADO) Tabla XVI: Ventajas e inconvenientes de inscribir en la lista EADO la fiebre Q en rumiantes Ventajas Inconvenientes Identificación de los focos de fiebre Q con el fin de limitar los riesgos zoonóticos Las medidas reglamentarias actuales sobre declaración de leche cruda y productos derivados procedentes de ganaderías infectadas resultan disuasorias (en términos de gastos y obligaciones) para los ganaderos Las herramientas técnicas para el diagnóstico de ganaderías excretoras no están aún validadas Las herramientas de gestión del riesgo (incluyendo la vacunación) no están aún validadas Mejor conocimiento epidemiológico de la situación en Francia. Manifestación de interés por parte del poder público en relación con esta zoonosis, en términos de protección de la Salud Pública La percepción bastante negativa de la declaración obligatoria en el mundo de la ganadería, que contribuye a frenar la declaración de casos Aunque reconocen el interés de la inscripción de la fiebre Q en la lista de enfermedades de declaración obligatoria, los expertos consideran esta media prematura. Dado que los medios científicos y técnicos validados son escasos, y las herramientas reglamentarias inapropiadas, esta medida contribuiría, paradójicamente, a limitar la información sobre la distribución de los focos. En efecto: - Si se inscribe la fiebre Q en la situación actual, teniendo en cuenta los inconvenientes citados en la tabla XVI, se podría obtener un efecto contrario al deseado. En cambio, las medidas de incentivo (ayuda al diagnostico y/o a la vacunación) permitirían mejorar la percepción actualmente negativa que tienen los ganaderos de esta declaración obligatoria; 83 - La reglamentación actual sobre la leche cruda es un potente freno a esta declaración; convendría revisar esta reglamentación (y las instrucciones para su aplicación) ya que el principal riesgo se debe a la contaminación aérea; - Las herramientas de diagnóstico y gestión deben ser validadas previamente en campo. Una fase “de prueba” de gestión en campo permitiría ir llegando progresivamente a recomendaciones sobre las medidas de prevención y control más apropiadas, de cara a reducir el riesgo de transmisión. Para obtener una mayor información sobre la situación sanitaria en esta fase transitoria, los expertos recomiendan que se ponga en marcha una centralización nacional de los trabajos, llevados a cabo a nivel local, por organismos profesionales agrícolas o veterinarios. A este efecto, los expertos recomiendan estudiar, sin demora, las condiciones de la puesta en marcha de medidas de certificación de ganaderías, que permitirían: • La evaluación en campo de las herramientas de lucha y de diagnóstico; • La definición, a nivel nacional, de un protocolo técnico de certificación; • La adhesión de los ganaderos a las medidas de control concernientes a la fiebre Q; • Un mejor conocimiento epidemiológico de la situación gracias a la centralización de datos. 3.1.2 Pertinencia de las medidas concernientes a explotaciones que comercializan leche cruda o productos frescos a base de leche cruda Teniendo en cuenta que la vía alimentaria es una vía de contaminación menor, no parece ni deseable ni adecuado recomendar medidas de aplicación general sobre la leche cruda. En efecto, sabiendo que un numero de ganaderías desconocido, pero probablemente elevado, es excretor sin haber sido identificado como tal, y que plantearse generalizar la investigación de Coxiellla burnetii en leche no es realista, estas medidas de carácter necesariamente obligatorio resultarían discriminatorias y conducirían a una situación de déficit de información concerniente a los focos de fiebre Q. Todo esto conduciría a un balance negativo en el plano de la protección de la Salud Pública (ausencia de reducción del riesgo de transmisión por vía aérea). Por el contrario, se debería fomentar la implicación de las ganaderías que comercializan leche cruda o productos frescos derivados de la misma en un proceso de certificación. 3.2 Recomendaciones concernientes a los focos de fiebre Q en rumiantes La multiplicidad de reservorios y de vectores, la difusión principalmente aérea de la bacteria y su gran resistencia a la deshidratación hacen que plantearse una política de erradicación resulte prácticamente imposible. En cambio, dado que el origen principal de la infección humana son los rumiantes, es necesario confirmar la eficacia de las medidas que permitan reducir la excreción de la bacteria por parte de los rumiantes domésticos infectados (medidas de higiene, tratamientos antibióticos y vacunación con una vacuna fase I). Aunque es difícil distinguir entre ganaderías excretoras y no excretoras, dentro de las ganaderías contaminadas, los expertos recomiendan aplicar las medidas técnicas en un primer momento en rebaños que presenten signos clínicos o se asocien a casos de enfermedad en humanos, y validarlas. En la práctica, ante un foco de Coxiella burnetii (rebaño que muestra signos clínicos o está relacionado con casos de infección humana, identificado por PCR y ELISA), de cara a reducir el riesgo de transmisión a otros rebaños o al hombre, los expertos recomiendan: 84 - la aplicación de las medidas de higiene descritas anteriormente (§ 2.3.1.2) - el tratamiento de hembras gestantes con antibióticos activos sobre Coxiellla Burnetii, durante el ultimo mes de gestación (§ 2.2); - la vacunación con una vacuna en fase I de todos los animales de ese rebaño y de los rebaños vecinos, durante un tiempo suficiente para limitar la difusión de la bacteria (§ 2.4); - la aplicación de las recomendaciones para la protección de la salud humana en las proximidades de los focos (§ 1.3.1.3). A este respecto, los expertos recuerdan que sólo se puede distribuir para consumo humano la leche de los animales que están en perfecto estado de salud (Artículo R224-60 del Código Rural). Por otra parte, los expertos recomiendan que se defina y valide en campo un plan nacional de saneamiento de rebaños infectados, en coordinación con los organismos profesionales, agrícolas y veterinarios. Cuadro AFSSA nº II La AFSSA recomienda: - Poner en marcha, por vía reglamentaria o contractual, y de manera progresiva, un plan de de saneamiento de la fiebre Q - Poner en marcha un estudio piloto, en condiciones reales, que permita validar el resto de las herramientas de diagnóstico y prevención - Iniciar, en las ganaderías que produzcan leche cruda o quesos a base de leche cruda, un proceso de certificación en cuanto se disponga de herramientas de detección fiables, y hacer progresar esta certificación a medida que se vayan validando las herramientas de diagnóstico. - Evitar el consumo de leche cruda o productos a base de leche cruda por parte de las personas con mayor riesgo (como ya se ha recomendado anteriormente). En efecto, aunque está claro queel hombre se contamina sobre todo por vía aérea, a partir de animales infectados y excretores, conviene recordar que la leche de los animales infectados puede contener Coxiella burnetii en concentraciones que pueden alcanzar hasta 1000 veces las dosis infectiva en cobaya (ver anexo I del informe). Además, se han observado seroconversiones en casos de consumidores de leche cruda con expresión clínica inconstante, en condiciones donde la contaminación por vía aérea parecía poco probable (ver anexo I del informe) - Además de las medidas recomendadas en el informe para el saneamiento de las ganaderías infectadas e identificadas como excretoras de Coxiella burnetii (medidas de higiene, tratamiento antibiótico, vacunaciones…), es necesario pasteurizar la leche procedente de estas ganaderías (pasteurización baja a 72 ºC durante 15 segundos). Philippe Vannier 3.3 Recomendaciones concernientes a la protección de la salud humana Sabiendo que la prevalencia de la fiebre Q humana está subestimada, conviene en primer lugar informar a los profesionales de la salud sobre las diferentes formas clínicas que puede adoptar la enfermedad. Existen fichas de información que están disponibles en la página de Internet del Centro Nacional de Referencia: http://ifr48.free.fr/recherche/labo/rickettsies/rickettsies.html. Al margen de esta información destinada al ámbito de la Medicina, es también necesario poner en marcha medios de información dirigidos a la población que presenta factores agravantes. • Sabiendo que la importancia de la exposición a Coxiella burnetii varía para los 3 tipos de población señalados en este informe (“población general”, “población rural” y “población en contacto directo con rumiantes”); • Sabiendo que la gravedad de las consecuencias varía en función de la situación de cada individuo frente a factores agravantes personales (pacientes aquejados de valvulopatías cardíacas, pacientes inmunodeprimidos y mujeres embarazadas); 85 Conviene formular recomendaciones destinadas por una parte a los profesionales sanitarios, y, por otra, a la población que presenta factores agravantes, teniendo en cuenta las diferentes categorías de exposición y la situación sanitaria particular de cada individuo. 3.3.1 Información a los profesionales de la salud En el caso de la población general, los profesionales habilitados deberían tner en mente un posible diagnóstico de fiebrfe Q ante un síndrome seudo gripal (fiebre, mialgias, artralgia y astenia), una neumopatía, una hepatitis moderada o una fiebre aislada sin causa aparente, sobre todo si durante el cuestionrio previo se refiere exposición a rumiantes o contacto con un animales que hayan parido. Deberían realizarse pruebas serológicas de fiebre Q a toda mujer embarazada que presente fiebre sin causa aparente o cuyo embarazo haya evolucionado de forma anormal (aborto tardío, hipotrofia del feto). Todo paciente que sufra una valvulopatia, lleve una válvula cardíaca protésica o una prótesis vascular, debería someterse a pruebas serológicas de fiebre Q, ante la aparición de fiebre sin causa aparente o de astenia. Inversamente, todo paciente que haya sufrido una fiebre aguda debería someterse a pruebas de detección de valvulopatías, con el fin de prevenir que se convierta en una enfermedad crónica. En el caso de las “poblaciones rurales” y las “poblaciones en contacto con rumiantes”, los profesionales sanitarios deberían proceder sistemáticamente a la detección clínica de valvulopatías, informando y vigilando regularmente el estado de los pacientes. Debería realizarse una serología de fiebre Q en cuanto exista la menor duda clínica. En el caso de las mujeres embarazadas, se debería realizar una detección serológica de la fiebre Q al comienzo del embarazo. Los profesionales sanitarios deberían recomendar al conjunto de personas que presenten factores agravantes, y cuyo resultado del examen serológico de fiebre Q sea negativo, limitar su exposición a las fuentes potenciales de contaminación, evitando el contacto con productos del parto o con mamíferos recién nacidos, la manipulación de la caza, las visitas a ganaderías y granjas (incluyendo las granjas pedagógicas), y el consumo de leche cruda o productos frescos a base de leche cruda (medida de prevención ampliamente difundida entre las mujeres embarazadas, especialmente en el marco de lucha contra la listeriosis). Estas medidas deberían ser igualmente recordadas por el veterinario en el momento en que se confirme un foco de fiebre Q. Por otra parte, cuando se disponga de una vacuna humana, sus indicaciones se discutirán en función de la exposición y riesgo individuales. Cuadro AFSSA nº III La AFSSA considera que consultar a instancias tales como el InVS (Instituto de Vigilancia Sanitaria) o la sección de “ Enfermedades transmisibles” del CSHPF ( Consejo Superior de Higiene Pública de Francia) aportaría un punto de vista complementario sobre los puntos concernientes, por una parte, al perímetro de definición de las poblaciones de riesgo y, por otra, al hecho de que se formulen recomendaciones equivalentes para las poblaciones “en contacto estrecho, directo y habitual” y aquellas que presentan una exposición “rural directa o indirecta”. Muriel Eliaszewic 86 3.2 Información a personas que presentan factores agravantes Convendría, de cara a la prevención, enfocar estas informaciones hacia las personas que presentan factores agravantes. En el caso de pacientes aquejados de valvulopatía cardíaca, inmunodeprimidos y mujeres embarazadas, debería recomendarse reducir el riesgo de exposición, evitando asistir a partos, el contacto con todo mamífero recién nacido, la manipulación de la caza, las visitas a ganaderías y granjas-escuela, y el consumo de leche cruda o de productos frescos a base de leche cruda. En el caso de las poblaciones que no presenten los factores anteriormente mencionados, no hace falta formular ninguna recomendación en particular. 3.4 Recomendaciones acerca de los estudios e investigaciones a desarrollar de cara a ampliar los conocimientos sobre la bacteria y las herramientas necesarias para su control Los expertos han identificado: • Lagunas de conocimiento y aspectos sujetos a controversia que han dificultado la caracterización del riesgo. • Deficiencias o, en algunos casos, ausencia, en la validación de las herramientas necesarias para la gestión del riesgo. Es necesario promover investigaciones centradas en la bacteria y en su transmisión. Es igualmente fundamental disponer de medios fiables y rápidos cuya calidad asegure la eficacia de los planes de saneamiento. 3.4.1 Investigación sobre la bacteria y su transmisión Ecología de la bacteria Para proponer medidas de prevención apropiadas que permitan limitar el riesgo de transmisión, es indispensable conocer con precisión la supervivencia de Coxiella burnetii en diferentes condiciones ecológicas. Deberían llevarse a cabo estudios sobre la capacidad de supervivencia de Coxiella burnetii en el medio ambiente, en suelo, estiércol y purines, en productos a base de leche cruda elaborados con diferentes técnicas de fabricación, y en otros alimentos crudos. Habría que verificar también si las propiedades de resistencia extrema de la bacteria se asocian únicamente a su estado “pseudo-esporulado”. Para llevar a cabo estos estudios debería previamente ponerse a punto un test de cuantificación que permita determinar la concentración de bacterias presentes en el entorno y en los alimentos, así como un test rápido de viabilidad. Las técnicas actuales para identificar la viabilidad de la Coxiella burnetii son difíciles de llevar a la práctica, puesto que precisan la inoculación de animales de laboratorio, huevos embrionados o cultivos celulares. Virulencia de las cepas La gravedad o la forma que la enfermedad adopta en humanos (endocarditis, abortos, fatiga crónica) o incluso el carácter enzoótico de la infección en los rumiantes de algunas zonas, comparados con los focos explosivos en otros casos, podrían estar relacionadas con la diferencia 87 de virulencia de las distintas cepas. Al igual que los factores asociados al huésped, también debería estudiarse la posible diferencia en cuanto a virulencia de las distintas cepas. Debería analizarse la relación con la especie a que pertenece el huésped (las posibilidades de atenuación o amplificación de la virulencia dentro de un reservorio). Sería importante, además, investigar las propiedades de esporulación y de supervivencia, que tienen consecuencias en la persistencia en el huésped, y su resistencia en el ambiente. Previamente habrá que poner a punto modelos de medida de la virulencia. Patogénesis Hoy en día, solo los abortos rumiantes domésticos, pero orientar el diagnóstico de la infertilidad observados estos importante. permiten sospechar la enfermedad animal en las tres especies de deberían tenerse en cuenta otras manifestaciones clínicas para fiebre Q. Hay que prestar especial atención a los problemas de últimos años en vacuno, donde su impacto económico podría ser Se requiere un mejor conocimiento de la inmunopatogénesis, incluyendo precisiones sobre las distintas etapas de la infección (reciente o antigua, clínica o asintomática), la circulación de la bacteria en el huésped infectado y los núcleos de persistencia (órganos, tipos de células), así como las modalidades cinéticas y duración de la excreción en las tres especies de rumiantes. Con este propósito, debería acometerse la investigación de Coxiella burnetii, especialmente en leche, materias fecales y secreciones vaginales, en los estudios epidemiológicos que se realicen en focos de fiebre Q. Estos conocimientos son esenciales para una mejor detección de la infección y los factores que modulan la excreción, y, por lo tanto, para optimizar la gestión de los riesgos en campo. 3.4.2 Estudio sobre las herramientas de control Diagnostico indirecto • En rumiantes: es importante recordar que el diagnóstico de aborto debido a la fiebre Q es muchas veces presuntivo, ya que con frecuencia no se realizan investigaciones sobre otras posibles etiologías. Finalmente, hay que recalcar la falta de conocimiento de la relación entre la prevalencia serológica y la excreción de Coxiella burnetii. Es, por lo tanto, indispensable precisar la sensibilidad y la especificad de las herramientas disponibles o que se pondrán a punto en un futuro (Apartado 1.2.2.2. Herramientas disponibles en medicina veterinaria) y evaluarlas en función de su aplicación específica: diagnostico clínico o detección de la infección. Es también interesante desarrollar tests serologicos: O que discriminen las infecciones antiguas de las recientes; O que permitan la detección de animales excretores; O que permitan distinguir los animales infectados de los vacunados. • En otras especies: Habría que adaptar las técnicas serológicas a las especies distintas a rumiantes. Diagnóstico directo Deberían desarrollarse y ponerse en práctica herramientas que permitan investigar la Coxiella burnetti en el entorno, también en su estado de pseudo-espora. La puesta en práctica de la 88 vigilancia epidemiológica depende de la fiabilidad y del coste de las herramientas. En veterinaria, hay que evaluar urgentemente las herramientas disponibles y desarrollar otras que permitan realizar estudios sobre la prevalencia y modalidades de difusión de Coxiella burnetii, no sólo en los principales reservorios (ganado ovino, caprino y bovino) sino también en especies rara vez consideradas en estos estudios (perros, gatos, aves, lagomorfos, pequeños roedores, garrapatas). Las técnicas de PCR son las mejores, pero hay que tener siempre en cuenta las precauciones a adoptar para obtener un resultado válido: problemas de falsos negativos (presencia de inhibidores, posible existencia de variabilidad genética) o de falsos positivos (contaminación en laboratorio, reacciones cruzadas con otras especies bacterianas). Estudio de marcadores moleculares de las cepas Habría que buscar marcadores antigénicos y genómicos para distinguir las cepas dentro de la especie bacteriana. Estos marcadores serían útiles para identificar la fuente de contaminación, pero también para determinar los reservorios y los vectores implicados, estudiar los modos de transmisión, y comparar las cepas de los pacientes con las de las fuentes potenciales de contaminación. Se podría así profundizar en los estudios caso/testigo con el fin de entender mejor el papel de las distintas vías de transmisión, especialmente la transmisión por vía oral. Para terminar, se podría también medir la eficacia de las estrategias de control de la infección, particularmente la eficacia de la vacuna frente a las cepas que presentan diferencias antigénicas con las empleadas en las vacunas. Vacunación El seguimiento serológico de los rebaños vacunados en un entorno infectado, así como el seguimiento de la respuesta por mediación celular permiten conocer la duración de la inmunidad obtenida mediante la vacuna, y definir con mayor precisión el modo de aplicación requerido para proteger todos los animales de un rebaño (años de vacunación, vacunación de todos o sólo de los animales jóvenes, necesidad de vacunas de recuerdo). Teóricamente, para definir la estrategia de vacunación a adoptar debería conocerse también la capacidad de transmisión, es decir, el número de animales que cada individuo infectado es capaz de infectar. Si por ejemplo la infección progresa lentamente, convendría vacunar en un perímetro determinado en caso de aparición de fiebre Q. 89 ANEXO I Transmisión de Coxiellla burnetii a través de la leche cruda Extracto del informe del CES “Microbiología” Históricamente, la enfermedad fue descrita por primera vez en 1935 en empleados de un matadero de Australia, y se denominó fiebre Q (la primera letra del termino inglés « query » que significa consulta o interrogante). Ese mismo año, se descubrió en los Estados Unidos una enfermedad transmitida a través de garrapatas, a la que se le llamó fiebre eruptiva de las Montañas Rocosas y, más tarde, fiebre de “Nine Mile”. Se determinó rápidamente que el agente causante era el mismo en Australia y en los Estados Unidos [Marrie y Raoult 1997]. Mas tarde se atribuyó a la leche cruda la responsabilidad de casos de fiebre Q (ver más adelante) y se intentó medir la termorresistencia del agente causante, hoy conocido con el nombre de Coxiella burnetii. Como se detallará más adelante, a partir de 1957 se establecieron baremos de pasteurización más rigurosos en Estados Unidos [Anónimo 1957], ya que C. burnetii era más resistente al calor que Mycobacterium bovis, bacteria para la cual se habían ajustado los baremos hasta el momento. Desde entonces , la definición de pasteurización de la leche según la Federación Internacional de Centrales Lecheras [Staal 1986] registrada por el Codex Alimentarius [Anónimo 2003c] hace referencia a la C. burnetii y se encuentra a menudo en la información general sobre la fiebre Q que es necesario pasteurizar la leche o no consumir la leche cruda o los productos derivados de la misma [Kazar y Brezina 1991, Brouqui et al. 1993, Hahn y Koch 1993, Tissot-Dupont y Raoult 1993, Vincent y Desjardins 2001, Kotton 2002, Maltezou y Raoult 2002, Anónimo 2003d, Rousset, Arricau Bouvery et al. 2003]. C. burnetii es una Rickettsia de la que son portadores un gran número de ácaros e insectos, y que ha sido observada en la mayoría de los animales domésticos así como en mamíferos salvajes en todo el mundo con la única excepción de Nueva Zelanda (Marrie T. y Raoult 1997). Se trata de un parásito obligatorio, de manera que el método tradicional de identificarla y contarla es realizando pruebas de laboratorio sobre animales como cobayas, ratones o hámsters. En el hombre, las manifestaciones más frecuentes son fiebre, neumonía y hepatitis, a veces seguidas de complicaciones. Cuando la enfermedad es sintomática, la mortalidad es del 1% (Raoult et al. 2000). Sin embargo, la infección puede permanecer como subclínica y traducirse sólamente en una seroconversión. En el caso de los animales, la enfermedad, a veces llamada coxiellosis, se puede presentar bajo distintas formas, pero son los abortos y los nacimientos de animales muertos lo que causa mayores problemas a los ganaderos (Marrie y Raoult 1997, Rousset et al. 2001). La leche de los animales infectados contiene concentraciones de C. burnetii que pueden alcanzar hasta 1.000 veces la dosis infectiva en cobaya (Enright, Sadler et al. 1957a). La vía mas frecuente de infección por C. burnetii es la vía respiratoria. La enfermedad aparece tras inhalación de aerosoles procedentes del ganado de producción o de animales domésticos infectados (ganado bovino, caprino y ovino, conejos, perros y gatos), ya sea en las ganaderías, en los mataderos o en los laboratorios donde se estudian estos animales o sus órganos. Los aerosoles pueden provenir de líquidos infectados tales como orina, líquido de placenta o leche (Anónimo 2002c). Las personas afectadas o bien han estado en contacto cercano o directo con animales enfermos, o bien simplemente se encontraban en las proximidades de un rebaño afectado, o en la misma dirección del viento que dicho rebaño, por ejemplo como espectadores de la trashumancia. Es por lo tanto una enfermedad frecuente en personas relacionadas con el ganado, así como en veterinarios [Acha y Szyfres 1989, Jorm et al. 1989, Connolly et al. 1990, Connolly et al. 1990, Fishbein y Raoult 1992, Brouqui et al. 1993, Thomas et al. 1995, Manfredi et al. 1996, Pebody et al. 1996, Armengaud et al. 1997, Lyytikäinen O et al. 1997, Serbezov et al. 1999, Tissot-Dupont et al. 1999, Baret v al. 2000, Norlander 2000, Petersen et al. 2000, Hatchette et al. 2001, Hellenbrand et al. 2001, Nebreda et al. 2001, Rousset et al. 2001, Vincent C y Desjardins 2001, Anonimo 2002e b a c, Benoist et al. 2002, Carrieri et al. 2002, Cekanac et al. 2002, Kotton 2002, Kovacova y Kazar 2002, Maltezou y Raoult 2002, Stiles 2002, Anónimo 2003a d e, Rey et al. 2003, Rousset et al. 2003, Weise 2003]. 90 En Francia, la fiebre Q figura entre las enfermedades ocupacionales del régimen general (tabla nº 53) y del régimen agrícola (tabla nº 49) para “manifestaciones clínicas agudas; manifestaciones crónicas, endocarditis, hepatitis granulomatosa”. La lista limitante de trabajos susceptibles de provocar la fiebre Q es: “Trabajos que expongan al contacto con ganado bovino, caprino, ovino, sus vísceras o sus excrementos; trabajos realizados en laboratorios donde se efectúe el diagnóstico de fiebre Q o investigaciones biológicas veterinarias” (ver por ejemplo perso.wanadoo.fr/mgd/epipath/doc/MalPro_RGeneral.pdf y perso.wanadoo.fr/mgd/epipath/doc/MalPro_RAgricole.pdf ). Otra vía de infección consiste en la inyección por picadura de un artrópodo hematófago [Wegener 1957, Kazar y Brezina 1991, Tissot-Dupont y Raoult 1993, Domingo et al. 1999, Baret et al. 2000, Kotton 2002, Anonimo 2003d]. La transmisión de persona a persona no se considera significativa (Marrie y Raoult 1997) La vía oral es objeto de controversia. Algunos están convencidos de la importancia de este modo de infección, mientras que otros afirman que la vía bucal, aunque lleve a una seroconversión, no por eso provoca fiebre Q propiamente dicha, y por tanto no presenta una amenaza para la salud pública. Existen por supuesto puntos de vista intermedios que presentaremos a continuación. La opinión vigente hace 45 años se resume en el artículo de KH Wegener [Wegener 1957], sobradamente documentado: “La leche es la fuente más significativa entre los productos animales. […] El personal de las centrales lecheras y sus familias, cuyo consumo de leche cruda es más importante, están fuertemente infectados en las regiones problemáticas, que son América y el Norte de Italia” Este autor cita un estudio norteamericano según el cual, de 1.701 personas que habían consumido leche cruda, un 10.7 % eran seropositivos, mientras que entre las personas que no habían consumido más que leche pasteurizada, la tasa de seropositivos era sólamente del 0.7 %. KH Wegener señalaba a continuación la persistencia de C. burnetii durante 41 días en mantequilla fabricada con crema no calentada. Para complicar el cuadro, menciona también la supervivencia durante 42 días en el queso Cottage pero nos tranquiliza a propósito de la leche acidificada, del kéfir y del lactoserum, donde la supervivencia está limitada a 2 días [Sipka 1959, Lerche 1965, Mitscherlich y Marth 1984]. Se cita siempre de manera casi sistemática una publicación de la misma época [Marmion B y Stoker 1958, Connolly et al. 1990].He aquí la cita íntegra de los argumentos utilizados por estos autores: “Aunque haya habido uno o dos casos donde determinadas personas al margen de los propietarios de un rebaño o de veterinarios, hayan sido infectadas durante el nacimiento de un ternero, la vía principal por donde se transmite la fiebre Q del ganado al hombre en Inglaterra parece ser la leche. El papel de la leche como vía de transmisión de la fiebre Q ha sido demostrado en dos ciudades de la zona 8 de Kent. En estas ciudades se ha encontrado una preponderancia de consumidores de leche cruda entre los pacientes de fiebre Q en comparación con un grupo testigo de pacientes que sufrían otros tipos de fiebre o neumonía. La mayoría de los casos de fiebre Q, y también la proporción más alta de adultos en buena salud pero con una prueba serológica de infección, se descubrieron entre los clientes de 5 lecherías de venta al detalle, sobre un total de 16 o 17 que vendían leche en las 2 ciudades. Se demostró la presencia de la Rickettsia en la leche distribuida en 2 de las 5 centrales lecheras. En estas 2 ciudades parecía imposible que la infección se debiera a otras vías diferentes a la leche, ya que los contactos, profesionales o no, con animales o productos animales, o con personas relacionadas con animales, no eran más frecuentes en los pacientes de fiebre Q que en el grupo testigo. Los resultados de la encuesta realizada a adultos en buena salud en el conjunto de Kent y en los diferentes cantones de East Anglia proporcionaron una confirmación independiente de la importancia de la infección transmitida por la leche. En las dos zonas, se encontró que, después de haber tenido en cuenta la exposición por otros medios, la proporción de adultos en buena salud con anticuerpos anti-fiebre Q era significativamente mayor entre los que habían consumido leche cruda en sus hogares durante la totalidad o parte del período entre 1942-1953, que entre los que habían consumido sólamente leche pasteurizada” 91 Se observa que el artículo que sigue no contiene datos cuantitativos sobre los factores de riesgo. Entre las publicaciones que los autores conocen, tan sólo una presenta un argumento seriamente documentado en favor de la hipótesis de la vía oral (Brown et al. 1968). Estos autores estudiaron un incidente ocurrido en una prisión: “25 detenidos y 5 funcionarios han padecido la fiebre. La serologia se realizó sólamente en 19 de los presos y en los 5 funcionarios, y fue positiva en todos. Ninguno de los prisioneros había estado en contacto con animales infectados. Pero la leche cruda de la granja del establecimiento penitenciario se consumía una o dos veces por semana con cereales durante el desayuno. Los funcionarios añadían dicha leche a su té, donde la bacteria sobrevivía a pesar del calor de la bebida. Las familias de los funcionarios (no enfermos) sólo bebían leche pasteurizada. El granjero, su mujer y dos trabajadores de la granja tenían contacto constante con los animales pero no bebían jamás leche cruda, y ninguno de ellos tuvo la fiebre o una seroconversión”. “El hecho de saber que la mayor parte de los enfermos no había tenido contacto directo con la granja permite excluir la posibilidad de una infección transmitida por el polvo. La propagación por insectos parásitos se podía excluir completamente, ya que ningún preso estaba infestado. La infección trasmitida por un alimento aparecía como la única explicación verosímil del incidente. La única sustancia alimentaria a la que se podía apuntar en este caso era la leche cruda”. Sin embargo, se señala que la prisión y la granja eran adyacentes: ¿Se puede excluir con certeza la posibilidad de la transmisión por el polvo? La importancia de la contaminación por vía oral continua siendo remarcada por algunos equipos de investigación. Los dos argumentos que utilizan son: • Los síntomas serían diferentes según la vía de entrada de la Rickettsia [La Scola y al. 1997, Norlander 2000]. Así, según [De Alarcón et al. 2003]: “Se ha demostrado que la inhalación de C. burnetii causa neumonía [Tiggert y Benenson 1956, Marrie et al. 1988, Domingo et al. 1999] y se sospecha que su ingestión en la leche cruda causa hepatitis en humanos. [Fishbein y Raoult 1992, Tissot-Dupont y Raoult 1993]”; así pues, si la enfermedad se presenta bajo la forma de la hepatitis, seria necesario, según esta hipótesis, sospechar de la ingestión de producto contaminado. Más adelante se indica que la hipótesis ha sido rechazada. • En episodios más recientes, entre las personas enfermas a las que se ha planteado la cuestión, muchos habían consumido leche cruda o derivados de leche cruda [Marmion y Stoker1958, Connolly et al. 1990, Fishbein y Raoult 1992, Brouqui et al. 1993, Hahn y Koch 1993, Tissot-Dupont y Raoult 1993, Tselentis et al. 1995, Suarez-Estrada et al. 1996, Serbezov et al. 1999]. Se indica más adelante que este tipo de deducción se puede realizar si media un enfoque epidemiológico serio, pero no es el caso. La cita siguiente ilustra la conclusión que sostienen los defensores de esta opinión [Fishbein y Raoult 1992]: “C. burnetii podría ser infecciosa o al menos transmitida de manera eficaz tanto por la vía oral como por aerosoles, pero la asociación de productos lácteos no pasteurizados con la fiebre Q clínica y subclínica parece más que suficiente para añadir esta enfermedad a la lista de otras enfermedades infecciosas transmitidas por los productos lácteos no pasteurizados, y para recomendar que todos los productos lácteos sean pasteurizados”. La opinión se puede articular de la siguiente manera: “Las observaciones epidemiológicas como las investigaciones experimentales que hemos realizado hasta el momento presente, prueban que la infección por vía bucal (en animales) en el tifus pulmonar (es decir, en la fiebre Q) es posible. Queda por saber en qué medida se puede producir la infección natural en el caso del hombre “(Combiesco 1957). “La ingestión de un alimento contaminado como pueda ser la leche puede causar la infección y la seroconversion y en ciertas circunstancias activar la enfermedad. Estas circunstancias especiales están aún por definir” (Taller del 2-5 de septiembre de 1988 en la Universidad Justus-Liebeg de Giessen, citada en una opinión oficial sobre la fiebre Q por (Weise 2003). 92 “La ingestión de leche es una causa rara, pero posible” (Benson et al. 1963, Suarez-Estrada et al. 1996; Anonimo 2002e 2003d, Rousset et al. 2003); “pero la dosis infectante es muy elevada”: 10.000 veces más que por la vía peritoneal utilizada en el laboratorio (Durand y Limouzin 1983, Rousset et al. 2003). “Aunque la contaminación por vía oral no se puede excluir, no constituye un problema de salud publica” Aquí la argumentación se presenta de varias formas: “Se conocen muy pocos casos de infección humana causada por consumo de leche contaminada. Podría ser que el hombre se contamine por vía digestiva, pero la infección contraída así es en la mayoría de los casos subclínica, probablemente debido al gran numero de anticuerpos que contiene la leche” (Acha y Szyfres1989). “La contaminación humana procede rara vez de la ingestión de carne o leche contaminada” (Anonimo 2003 b) “La hipótesis según la cual la vía de infección determinaría la forma de la enfermedad no ha sido confirmada” por el estudio retrospectivo de 1.383 infecciones (Raoult et al. 2000). “La ingestión de leche, seguida de regurgitación y de inspiración del alimento” puede ser la causa de la enfermedad (anónimo 2003d)”. “Las pruebas con voluntarios humanos no han sido concluyentes”. Así el 35% de un grupo de presos adultos que habían consumido leche cruda de vacas infectadas durante tres meses resultó seropositivo, mientras que en los grupos testigo que sólo habían consumido leche pasteurizada, sólamente el 8,9% de presos de una prisión vecina y el 4% de un grupo de hombres hospitalizados, fueron seropositivos. Pero ningún prisionero desarrolló fiebre Q (Benson et al. 1963). Krumbiegel (1970) citado por (Stiles 2002) habría llegado a la misma conclusión tras un estudio donde la leche contaminada había sido ingerida por voluntarios humanos, que tampoco desarrollaron la enfermedad. “Todas las epidemias estudiadas recientemente son atribuibles a la inhalación de aerosoles contaminados o a la picadura de ácaros » (Anonimo 2003e). Esto es así en los episodios registrados en Alemania de 1947 a 1999: aunque “La exposición al ganado bovino infectado y un poco de excreción en leche explicó un episodio comunitario en 1950”, todas las epidemias del período considerado se explican por inhalación o por contacto con animales infectados. (Lyytikäinen et al. 1997, Hellenbrand et al. 2001). Las epidemias que tuvieron lugar en Francia tienen la misma explicación (Armengaud et al. 1997, Tissot-Dupont et al. 1999, Baret, Dos Santos et al. 2000; Vincent y Desjardins 2001, Anonimo 2002a, Benoist et al. 2002, Re S Viannez-Gaide et al. 2003), especialmente la epidemia sufrida en Chamonix en el 2002 (Benoist et al. 2002), al igual que las padecidas en los Estados Unidos (Mcquiston y Childs 2002), en el Reino Unido (Pebody et al. 1996), en Japón (Anonimo 2002b), en Australia (Mak et al. 2003). “La seroconversión no es la prueba de la ingestión de células vivas de C. burnetii”: así dice un estudio realizado en España: “El consumo de leche y/o de productos lácteos procedentes directamente de granjas ha sido registrado en el 20 % de las entrevistas, las personas consumen la leche hervida en la totalidad de los casos. Se ha detectado un porcentaje significativamente más elevado de anticuerpos para C. burnetii entre las personas que tienen este hábito de consumo (52%) que entre aquellos que no consumen leche y/o productos lácteos (38%) (odds ratio OR = 1,83; IC95% = 1,1 - 3,06, chi2 = 5,33, p = 0,02)” (Suarez-Estrada et al. 1996). “La asociación no implica demostración”: en la mayoría de los trabajos citados anteriormente, los autores que han sometido a los enfermos a encuestas epidemiológicos han formulado un número limitado de preguntas. La mayoría se refieren a la frecuentación de granjas, la profesión, contactos con animales, especialmente en el periodo del parto, y una o dos preguntas tratan sobre el consumo de leche cruda y/o de queso (a veces sin determinar si se trata de cruda o no). Cuando no se refiere el número exacto de respuestas, se permite no creer las conclusiones a pies juntillas. Es no obstante lo que se ha venido haciendo hasta ahora (Marmion y Stoker 1958). Cuando los resultados son incompletos o, no se presentan considerando las herramientas estadísticas epidemiológicas, se puede ser crítico. Por lo tanto, lo seremos también con (Rault et al. 2000) quienes, en su estudio –que por otra parte consideramos notable- indican que el 23,2% de los infectados han consumido queso o leche cruda, sin indicar si han tenido o no contacto directo o indirecto con animales. Finalmente, cuando se calculan los Odd Ratio (OR), y no es posible llegar 93 a una conclusión clara, se permite rechazar la hipótesis de la infección mediante un producto lácteo. También se ha estudiado la fiebre Q asociada a las cabras de Terra Nova (Hachette y al. 2001): la ingestión de leche pasteurizada se asociaba de manera significativa a la infección detectada por seroconversión (OR = 1,07; p = 0’022), así como la ingestión de queso de cabra fabricado con leche pasteurizada (OR = 5, 27), y el hecho de ahumar el producto (OR = 3, 27). Por regresión logística, solo se asociaban a la infección de manera significativa estos últimos factores de riesgo. ¿Pero eran verdaderamente éstos los agentes causantes de la infección? Como dicen los mismos autores, “por el momento sólo se trata de una asociación epidemiológica, puesto que la C. burnetii no se ha encontrado en los quesos de cabra”. Estos autores indican también que “la pasteurización destruye efectivamente la C. burnetii en leche”. Así, (Fishbein y Raoult 1992), en un examen de casos agrupados, encontraron una diferencia no significativa entre las proporciones de seropositividad de individuos que habían sido expuestos a cabras o a productos lácteos no pasteurizados, pero significativa cuando habían sido expuestos a los animales y a los productos lácteos crudos. Sin embargo el test carecía de potencia y, como en el ejemplo precedente, no había argumentos suficientes para achacar la responsabilidad a los productos lácteos”. ANEXO II Destrucción de Coxiella burnetii por calor Extracto del informe de CES “Microbiología” Para introducir esta sección, recordaremos que en la mayoría de los casos, cada uno de los minutos de calentamiento reduce la populación microbiana en un porcentaje constante, idéntico al destruido durante el minuto precedente. Se dice que la cinética de destrucción es de primer orden3. El parámetro utilizado para describir este fenómeno es el tiempo en reducción decimal (símbolo D). Es el tiempo de calentamiento (expresado en minutos y segundos), a una temperatura determinada, que reduce la populación en un 90% o la divide por 10. La influencia de la temperatura se describe mediante el parámetro z (sin nombre): aumento de la Temperatura en grados Celsius o en grados Kelvin que permite obtener una división de D por 10. Cuando se expone un elevado numero de unidades de un producto4 a un tratamiento térmico durante meses e incluso años, como es el caso de la industria, siempre existe una proporción no nula de unidades que contienen todavía uno o varios microorganismos no deseados que han sobrevivido al calentamiento. La ecuación que permite calcular dicha proporción es la siguiente: P = C 0 x V x 10-t/D En la que C0 representa la concentración inicial de microorganismo no deseado en el producto crudo, V el volumen de la unidad de envasado, D el tiempo de reducción decimal del microorganismo no deseado para la Temperatura de calentamiento, y t el tiempo de calentamiento. Otras ecuaciones permiten calcular la evolución de temperatura a lo largo del tratamiento térmico industrial (Cerf 2001). Para elegir el baremo de pasteurización, es decir, la relación tiempo/Temperatura, hay que conocer los siguientes datos: - Características D y z del micro-organismo que nos interesa; - Volumen V de las unidades en que se envasa y distribuye el producto; - Proporción P de las unidades en las que se tolera la supervivencia del microorganismo considerado. Si las características del microorganismo son un elemento invariable en la solución de la ecuación, y el volumen de unidades es una cuestión comercial, es a la autoridad responsable en materia de 94 Salud Pública a quien corresponde fijar los objetivos de seguridad alimentaria, quien deberá hacerse cargo de la elección de la proporción aceptable de unidades de venta que contendrán todavía microorganismos patógenos5. (FSO, Food Safety Objectives). (Huebner RJ et al. 1949) La C. Burnetii no sobrevive a la pasteurización a alta Temperatura (a flujo constante a 71,1°C durante al menos 15 seg.), pero sobrevive a la pasteurización a baja temperatura (pasteurización en masa a 61,7°C por lo menos durante 30 minutos.) (Citados por (Lennette et al. 1952.) (Kirberger 1951) El autor infectó los ratones tras los siguientes tratamientos (tubos de ensayo que contenían 0,5 ml de leche calentados al baño maría): la C. Burnetii sobrevive después de 30 minutos a 55°C o una hora a 60°C; pero no sobrevive 15 minutos a 65°C. (Citado por (Wegener 1957). (Bingel y Engelhardt 1952) Después de la inoculación artificial de la leche (inóculo: dilución a 1:20 en leche), la C. burnetii se manifestó mediante fiebre en las cobayas después de los siguientes tratamientos: 5 seg. a 85ºC, 7 o 14 seg. a 80 ºC, 60 seg a 70ºC. También se encontró la C. burnetii al hacer una observación de los testículos al microscopio a 20, 14 o 7 seg. a 85 º C, a 60 seg. a 75 º C o a 30 min. a 62 º C (citado por (Wegener 1957). Una lectura en profundidad del artículo original muestra que Bingel y Engelhardt (1952) utilizan sus propias cifras con prudencia: “No es seguro que esta manera de calentar la leche (85ºC durante 7 seg.) mate todas las unidades de Coxiella burnetii, sin embargo, las inactiva de tal manera que cuando se pasan sobre el animal para su detección, la proporción de unidades supervivientes es tan baja como en una dilución 1: 20.000 de la materia original. Es posible que las bacterias Coxiella burnetii sobrevivientes sufran otros daños cualitativos. La inactivación de un material en fuerte concentración (1000 veces la dosis mínima infectiva) es tan fuerte que en las cobayas no aparece la fiebre típica, y el desarrollo de Coxiella burnetii en los testículos es muy débil. Incluso en el caso de un 50% de contaminación de la leche, la dosis se suprime al mezclarla en la central lechera, y ya no es patógena para las cobayas. Una dosis como ésa se inactiva completamente mediante la pasteurización, gracias a la dilución de la contaminación. Además, la capacidad patógena de Coxiella burnetii a través de la alimentación es baja, y no hay ninguna razón para creer que la leche pasteurizada es un peligro para la salud, aunque hay que temer la leche que contiene Coxiella burnetii en la recogida. En la práctica, la pasteurización de la leche infectada por Coxiella es suficiente para que la bacteria resulte inofensiva“. 3 Los casos en los que la cinética no es de primer orden, se abordarán al final de esta sección. Es decir, los contenedores o envases de volumen unitario idéntico, por ejemplo cartones, botellas o envases de cartón que contengan 1 Kg. de alimento. 5 “Frecuencia y/o concentración máxima de un peligro (microbiano) en un alimento en el momento de su consumo que ofrece todavía el nivel apropiado de protección sanitaria” (definición en discusión en el Codex alimentarius) 4 95 (Marmion et al. 1951) citado por (Lennette et al. 1952) Los tratamientos durante 15 seg. de 67,8 º C a 68,9 º C destruyen la C. burnetii de la leche infectada de forma natural, pero no en la leche contaminada artificialmente y que contenía 105 veces la dosis mínima infectiva en cobaya. Éstas seguían dando positivo incluso después de calentar la leche durante 15 seg. a 70,0 º C o a 70, 6 º C. Pero los resultados eran negativos después de 15 seg. a 71,7 º C (Lennette et al. 1952). Estos autores han estudiado la leche en las mezclas, y han comparado el numero de muestras positivas de C. burnetti antes y después de la pasteurización en masa a baja temperatura a 61,7 ºC por lo menos durante 30 min., o la pasterización a alta temperatura en flujo continuo a 71,1 º C durante al menos 15 seg. La presencia de la bacteria se verificó mediante seroconversión después de la inyección intraperitoneal de cobayas. Después de la pasteurización a baja temperatura, el 97 % de las muestras carecían de C. burnetii. No fue el caso de una muestra de 757 l que dió positivo después de un tratamiento de 30 minutos a 62,2 º C. Pero esta muestra dio positivo en los análisis de la fosfatasa alcalina, lo que muestra que el calentamiento fue inadecuado. Después de la pasteurización a alta temperatura, el 95 % de las muestras dieron negativo. Una de ellas fue tratada a 73,9 ºC durante 17 seg.; y la otra, durante 15,2 seg. Estos periodos de tiempo corresponden al tiempo mínimo de permanencia en la sección de retención de los pasteurizadores. Los autores concluyen que la pasteurización pudo ser insuficiente. (Wegener 1957) Despues del estudio detallado de las citas anteriores, sobre todo las de Bingel y Emgelhardt (1952), este autor concluye: “En general, en cuanto a la cuestión de la destrucción o no de C. burnetii en la leche infectada por medios naturales en las condiciones en que se pasteuriza en Alemania, los resultados de los estudios realizados por diversos autores son distintos. La investigación de Coxiella burnetii en leche pasteurizada muestra que no todos los gérmenes se destruyen. Además, en la práctica, cuando debe obtenerse una mayor dilución y más daño térmico, los resultados de Kästli y de Schoop muestran que no hay que elegir condiciones de pasteurización hacia el limite más bajo de Temperatura, o a una Temperatura un poco más alta, pero todavía queda cierta incertidumbre en torno a esta cuestión”. Wegener no tenía conocimiento de los trabajos que se estaban llevando a cabo en los Estados Unidos en el momento en el que preparaba su artículo, trabajos que se resumen a continuación. (Anónimo 1957; Enright et al. 1957a, b) Estos autores han mejorado la técnica de detección de Coxiella burnetii supervivientes practicando dos tandas de tratamiento en las cobayas. Analizaron 109 muestras de leche de granja, de las cuales 8 fueron positivas; y 376 leches o cremas vendidas al por menor, mezclas de leche procedente de varias granjas, de las cuales 14 eran positivas. El número máximo de Coxiella burnetii en estos productos contaminados era el equivalente a 1.000 veces la dosis infectiva en cobaya. Entre las distintas muestras de leche de 18 vacas infectadas (sobre 137 examinadas), 5 contenían 1.000 veces la dosis infecciosas en cobaya, 5 contenían 100, otras 5 contenían 10, y finalmente 5 que contenían una vez la dosis infectiva. La leche de vaca infectada artificialmente contenía 10.000 veces la dosis infectiva en cobaya. Para el estudio de termoresistencia los autores utilizaron leche que contenía 100.000 veces la dosis infecciosa en cobayas. Se hizo una primera serie de medidas de termoresistencia de 60,6 a 66,1ºC en el laboratorio, y se estableció una regresión lineal que se extrapoló a Temperaturas superiores. La tabla 1 recoge los resultados. Las dos SIGMAS (dos veces la desviación típica) mencionadas en la tabla corresponden al intervalo de confianza del ajuste por regresión lineal. La Temperatura de 61,7 º C 96 corresponde a la Temperatura recomendada entonces para la pasteurización en alta Temperatura (en flujo constante). Tabla 1: Tiempos a las Temperaturas pertinentes sobre las rectas de regresión obtenidas a partir de los resultados de laboratorio Temperatura (ºC) Punto de 50% de destrucción 61,7 62,8 29,39 min. 16,29 min. Rectas de regresión Tiempo mínimo de Tiempo mínimo de destrucción destrucción mas dos sigmas 33,02 min. 46,03 min. 18,31 min. 25,42 min. 71,1 71,1 72,2 11,7 seg. 8,7 seg. 6,6 seg. 13,2 seg. 9,8 seg. 7,3 seg. 20,4 seg. 15,4 seg. 11,6 seg. Se tomó una segunda serie de medidas con un pasteurizador en flujo constante, de 68,1 a 72,8°C. Los resultados confirmaron los obtenidos en el laboratorio. Los autores exponen que, tomando una muestra de leche contaminada 10 veces más que la leche más altamente contaminada que se pueda encontrar en vacas infectadas, y aconsejando combinaciones de tiempo–Temperatura superiores a 2 veces la desviación típica de ajuste de las combinaciones que resultan de la recta de regresión lineal, pueden aconsejar sobre los valores “adecuados para eliminar las C. burnetii viables de la leche entera cruda”. Esas combinaciones son las siguientes: 30 min. a 145°F (62,8°C) o 15 seg. a 161°F (71,7°C). Ya no hay controversia alguna después de estos estudios, que por primera vez utilizan descriptores de la termorresistencia (tiempo para dividir por dos la dosis infectiva en el 50% de las a cobayas, y la influencia de la temperatura) muy semejantes a los descritos más arriba. Todos los manuales, incluso el de la Federación Internacional de Lechera (Staal 1986) recogida en el Codex Alimentarius (Anonimo 2003c) recomiendan: 30 min. a 63°C o 15 seg. a 72°C. Estas combinaciones, o sus equivalentes obtenidos por interpolación entre estas dos Temperaturas se utilizan en el mundo entero con satisfacción general. La legislación estadounidense autoriza las combinaciones obtenidas por extrapolación, hasta 100ºC durante 0,01 seg. (Anónimo 2002d). Se recomienda generalmente aumentar la Temperatura algunos grados Celsius si el contenido de materia grasa es superior al natural en leche. Así, en Estados Unidos, si el contenido en materia grasa es superior o igual al 10%, hay que aumentar la temperatura de pasteurización 3ºC (5 ºF). Utilizando las fórmulas indicadas por (Cerf 2001) podemos deducir los resultados de (Enright et al. 1957a): D72 °C = 1,35 seg. z = 4,28 °C. Por lo tanto, un tiempo de 15 segundos a 72ºC asegura 11 reducciones decimales, o el 99,999999999% de destrucción de la población de C. burnetii (resultado obtenido dividiendo 15 por 1,35). Esta cifra está cerca de las 12 reducciones decimales exigidas para Clostridium botulinum en conservas. Es una cifra mucho más elevada que las 4-5 reducciones decimales necesarias para destruir la Mycobacterium tuberculosis (Névot et al. 1958). 97 Sin embargo, hay que tener en cuenta que los razonamientos seguidos se basan en la hipótesis que dice que la cinética de destrucción de la C. burnetii por calor es de primer orden. Sin embargo, la destrucción de la C. burnetii no ha sido objeto de ningún estudio. No está demostrado, pues, que la curva de supervivencia sea perfectamente rectilínea, ni que las extrapolaciones hechas a partir de las 5 reducciones decimales sean totalmente legítimas. En el peor de los casos, si hubiese una cinética bifásica con una fuerte deceleración o una parada total de la destrucción (esta última posibilidad es inverosímil) cuando se prolonga el tratamiento térmico, no hay razón para dudar de que el tratamiento térmico alcanza esas 5 reducciones decimales. Dado que la autoridad responsable en materia de Salud Pública no ha publicado la proporción aceptable de unidades de venta que contengan todavía microorganismos patógenos, no parece que haya que cuestionar las combinaciones de tiempo-Temperatura utilizadas desde 1957. (Anónimo 1997) La orden del 6 de agosto de 1985 relativa a las normas de higiene y de salubridad a las que debe atenerse la leche cruda comercializada como tal y destinada al consumo humano (JORF, del 2908-1985) exige que la leche provenga de: “establos en los que no se haya dado ningún caso clínico de fiebre Q desde hace al menos un año”. Haciendo referencia a esta orden, una memoria explicativa emitida en 1997 por la Dirección General de la Alimentación del Ministerio de Agricultura, en vigor, dice lo siguiente: Articulo 2 1ºb 1) Enfermedades animales contagiosas y transmisibles al hombre mediante la leche … c) Otras enfermedades Caso de la fiebre Q: Procedimiento a seguir por los fabricantes de queso o leche cruda titulares de un sello comunitario de inspección veterinaria, cuando su ganado sufre la fiebre Q: - la leche de los animales que hayan abortado no debe utilizarse en la recogida, tratamiento, transformación y venta para el consumo humano. - la leche procedente de otros animales de la explotación sólo se puede utilizar después de un tratamiento de “pasteurización a alta Temperatura”, es decir, a 85º C durante 30 seg. Por lo tanto, este organismo ministerial, mediante un texto sin carácter obligatorio, pero utilizado con rigor: - Considera que la fiebre Q se transmite al hombre mediante la leche, - Fija, sin tener en cuenta el consenso internacional relativo a la termorresistencia de la C. burnetii existente desde 1957, la aplicación de un tratamiento térmico mayor que todos los estudiados en 1952 por Bingel & Engelhardt, y que estos mismos autores juzgaban como excesivo, - Exige ese baremo también en la leche de animales en los que no se ha probado la excreción de C. burnetti. Así, podemos leer en un libro que dedica varias páginas a esta cuestión (Notermans S; Barendsz AW et al. 2002): “Un trabajo a subrayar (sobre la valoración cuantitativa del riesgo) es el realizado por Enright et al. (1956, 1957), que establecieron los criterios de rendimiento para la pasteurización de la leche que proporcionan el nivel apropiado de protección sanitaria contra Coxiella burnetii, agente causante de la fiebre Q. [...] Este trabajo es un ejemplo precoz del empleo de los principios de valoración de riesgos para obtener los criterios de procedimiento.” Los criterios de rendimiento conciernen a la tasa de destrucción de Rickettsia; los criterios de procedimiento son las combinaciones de tiempo-Temperatura recomendadas. Los portavoces comparten la opinión de (Notermans S, Barendsz AW et al. 2002). 98