PDF Completo - Instituto Nacional de Cancerología
Anuncio

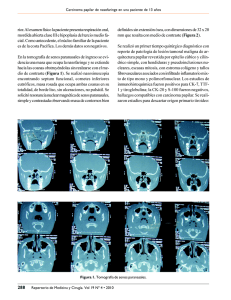
Reporte de caso Adenofibroma metanéfrico asociado a carcinoma papilar de células renales Metanephric Adenofibroma Associated with Papillary Renal Cell Carcinoma Carmen Lucía Roa B.1, María Constanza Navarrete N.2 1 2 Grupo de Patología y docente del Instituto Nacional de Cancerología. Bogotá, Colombia. Grupo de Patología, Instituto Nacional de Cancerologia. Residente III año de patología. Resumen El adenofibroma metanéfrico es un tumor renal bifásico estromal-epitelial infrecuente, que ocasionalmente se asocia a carcinoma papilar de células renales. Se describe el caso de una niña con un cuadro clínico de cuatro años de evolución de hematuria intermitente, a quien se le diagnosticó, en una biopsia renal izquierda por trucut, un tumor de Wilms con componente estromal y epitelial, sin evidencia de anaplasia. Posteriormente, en el producto de la nefrectomía izquierda, realizada en el Instituto Nacional de Cancerología, se le diagnosticó adenofibroma metanéfrico asociado a un carcinoma papilar de células renales. Palabras clave: adenofibroma metanéfrico, carcinoma papilar de células renales, tumor de Wilms, hematuria. Abstract Metanephric adenofibroma is an infrequent biphasic epithelial-stromal renal tumor, occasionally associated with papillary renal cell carcinoma. We describe a case of a girl with a four year clinical history of intermittent hematuria; she was diagnosed, using a left-side tru-cut renal biopsy, with a Wilms’ tumor with stromal and epithelial component, with no sign of anaplasia. Later, through the product of the left-side nephrectomy that was performed at the National Cancer Institute of Colombia, she was diagnosed with metanephric adenofibroma associated with papillary renal cell carcinoma. Key words: Metanephric adenofibroma, papillary renal cell carcinoma, Wilms tumor, hematuria. Correspondencia: Carmen Lucía Roa B. Grupo de Patología. Instituto Nacional de Cancerologia. Av. 1ª No. 9-85. Bogotá, Colombia. Tel.: 334 2471. Correo electrónico: [email protected]. Fecha de recepción: 17 de julio de 2008. Fecha de aprobación: 05 de agosto de 2008. 106 Rev Colomb Cancerol 2008;12(2):106-110 Carmen Lucía Roa B., María Constanza Navarrete N. Introducción El diagnóstico más frecuente en niños menores de 6 años con masa renal es tumor de Wilms, el cual se manifiesta clínicamente por hematuria, dolor abdominal y, menos frecuentemente, hipertensión arterial. En este contexto clínico, el nefroma mesoblástico, la nefroblastomatosis, el adenoma metanéfrico y el adenofibroma metanéfrico son los diagnósticos diferenciales más importantes. En 1992, Hennigar y Beckwith describieron una serie de cinco casos de adenofibroma nefrogénico, cuyo nombre fue cambiado posteriormente a adenofibroma metanéfrico. Este es un tumor raro, de origen renal, bifásico, con un componente epitelial y otro estromal (1,2). Este tumor está descrito tanto en niños como en adultos, en un rango entre los 5 meses y los 36 años, con predominio por el género femenino, con una relación de 2:1; los síntomas más frecuentes son hematuria, dolor abdominal asociado con masa y policitemia; sin embargo, hasta un 50% de los pacientes son asintomáticos. En los casos asociados con carcinoma papilar de células renales, la edad promedio es de 13,8 años y el síntoma más frecuente es la hematuria (1,3). Macroscópicamente, son lesiones sólidas, amarillentas, de bordes no definidos, con diámetro entre 1,8 cm y 11 cm, con áreas quísticas, ubicadas en la médula renal (1,4); es inusual encontrar focos de hemorragia o necrosis (1). Microscópicamente, el porcentaje de los componentes estromal y epitelial varía ampliamente, en unos con predominio del componente estromal, idéntico al del tumor estromal metanéfrico, y muy escasos focos epiteliales, y, en otros, con predominio del componente epitelial, similar al adenoma metanéfrico (1). El estroma está compuesto por células fusiformes con diferente densidad celular, las cuales adoptan una distribución concéntrica en forma de collar o “bulbo de cebolla” alrededor de los glomérulos, los túbulos renales o los vasos sanguíneos (1-3,5); en algunos casos, se pueden observar áreas de diferenciación heteróloga (tejido glial, condroide, estructuras rosetoides de tipo neuroblástico o tejido adiposo), o presencia de cuerpos de psammoma (1,3,5); las mitosis son escasas y no hay invasión vascular (3,5), aunque en los casos con estroma de celularidad alta se ha visto un ligero incremento en el índice mitótico (5 mitosis por 20 campos de alto poder), sin que esto modifique el diagnóstico (5). El componente epitelial usualmente tiene una distribución nodular dentro del componente estromal (4,6), y está compuesto por acúmulos de células cuboidales pequeñas y monótonas, con núcleos hipercromáticos, sin nucleolo evidente, que pueden dar una apariencia embrionaria. También, se pueden disponer en formaciones papilares que se proyectan hacia espacios quísticos, dando una imagen similar al glomérulo renal (1,3,7,8); sin embargo, las formaciones papilares mayores a 5 mm, por definición, deben ser consideradas como carcinomas papilares de células renales, a pesar de tener una citología de apariencia benigna (3,6). Se ha mencionado asociación entre los adenofibromas metanéfricos y otros tumores renales, como el tumor de Wilms y el carcinoma papilar de células renales. Arroyo y colaboradores describieron, en una serie de 25 pacientes con diagnóstico de adenofibroma metanéfrico, cinco casos de asociación de éste con carcinoma papilar de células renales, en los cuales la arquitectura del componente epitelial fue puramente papilar, pero las papilas difirieron de las vistas en el componente epitelial benigno, porque eran más grandes, gruesas y acompañadas por grupos de macrófagos, tal como se describen en los carcinomas papilares de células renales (1,3). En el estudio realizado por Brunelli y colaboradores se evaluaron siete pacientes con diagnóstico de adenoma metanéfrico, a los cuales se les realizó estudio de hibridización fluorescente in situ (FISH), buscando pérdida del cromosoma Y o ganancia de los cromosomas 7 o 17, que son las alteraciones cariotípicas más comúnmente encontradas en los carcinomas papilares de células renales; así, se concluyó que en los adenomas metanéfricos no se demostraron dichas alteraciones, y que los estudios de FISH pueden ayudar en el diagnóstico diferencial entre estas dos entidades (9,10). En los estudios de inmunohistoquímica se ha descrito que el componente estromal es positivo para CD34 y vimentina, sin expresión de EMA, Rev Colomb Cancerol 2008;12(2):106-110 107 Adenofibroma metanéfrico asociado a carcinoma papilar de células renales citoqueratina (AE1/AE3), desmina o actina de músculo liso. El componente epitelial es positivo para CD57 y WT-1, focalmente positivo para CK7 y negativo para EMA y racemasa. El carcinoma papilar de células renales es positivo difusamente para CK7, racemasa y EMA, y negativo para WT-1 (1-3,8,10). Materiales y métodos Se revisa el caso de una paciente de 9 años con masa renal, diagnosticada inicialmente como tumor de Wilms, a quien realizan nefrectomía; el espécimen quirúrgico es evaluado luego de realizar el procesamiento habitual: descripción macroscópica, fijación con formol bufferado, obtención de cortes, inclusión en parafina, corte y coloraciones con hematoxilinaeosina e inmunohistoquímica, la cual se realizó con la técnica clásica de estreptavidina-biotina, de acuerdo con las instrucciones del fabricante, usando como adherente poli L-lisina y con secado durante doce horas; la recuperación antigénica se realizó con calor, utilizando buffer citrato (pH 6.0); el bloqueo de la peroxidasa endógena se realizó con hidrógeno al 3% por diez minutos; el revelado se efectuó con diaminobenzidina, y las láminas se contrastaron con hematoxilina de Mayer (Tabla 1). Para el análisis se consideró el nivel de reacción del tejido y se realizó una escala de 0 a 3 cruces (negativo, leve, moderada e intensa); igualmente, se evaluó la localización de la tinción (nuclear, citoplasmática o de membrana), dependiendo del anticuerpo. Reporte de caso Paciente de 9 años remitida de Ibagué (Tolima), con cuadro de cuatro años de evolución de hematuria intermitente, tres veces a la semana; en julio de 2007 presenta incremento de la hematuria, por lo que es valorada por urología, quienes solicitan tomografía axial computarizada, la cual reporta masa renal izquierda con adenopatías retroperitoneales, sin compromiso hepático; ecografía renal (24/07/07), que reporta tres lesiones en parénquima renal izquierdo y vena cava inferior de calibre normal sin trombosis en su interior. Se realizan, además, radiografía de tórax, cuadro hemático, electrolitos, albúmina, deshidrogenasa láctica y ácido úrico, que estaban dentro de límites normales. El 3 de agosto de 2007 se realiza biopsia por trucut de la masa renal, que fue reportada en otra institución como tumor de Wilms (nefroblastoma), con componente estromal y epitelial, sin evidencia de anaplasia; con este diagnóstico se inicia primer ciclo de quimioterapia con vincristina y actinomicina, y es remitida al Instituto Nacional de Cancerología para realizar ureteronefrectomía izquierda. Ésta se realiza el 20 de septiembre del 2007. En el servicio de patología se recibe riñón izquierdo que macroscópicamente tiene dos lesiones; la primera, una masa firme, blanquecina, de bordes mal definidos, de 7 cm x 4 cm x 3 cm, que reemplaza el 70% del parénquima renal, y, la segunda, una lesión quística con componente papilar, localizada Tabla 1. Resumen de anticuerpos usados para la técnica de inmunohistoquímica Anticuerpos primarios 108 Clonalidad Laboratorio Dilución Localización tinción positiva AE1AE3 Monoclonal Dako 1:100 Citoplasma CK7 Monoclonal Dako 1:100 Citoplasma Racemasa Monoclonal Dako 1:50 Citoplasma WT-1 Monoclonal Novocastra 1:40 Nuclear EMA Monoclonal Dako 1:50 Citoplasma VIMENTINA Monoclonal Biogenex 1:200 Citoplasma CD57 Monoclonal Novocastra 1:100 Citoplasma CD34 Monoclonal Dako 1:50 Citoplasma S100 Policlonal Neomarkers 1:200 Nuclear CD10 Monoclonal Vector 1:80 Membrana Citoqueratina de alto peso molecular Monoclonal Dako 1:50 Citoplasma Rev Colomb Cancerol 2008;12(2):106-110 Carmen Lucía Roa B., María Constanza Navarrete N. en el polo superior, que mide 3 cm x 3 cm x 2 cm, la cual se encuentra en contacto con la primera lesión descrita (Figura 1). En la histología se observan las dos lesiones descritas macroscópicamente, la de mayor extensión corresponde a una lesión tumoral bifásica, con un componente epitelial de células cuboideas sin anaplasia, que se disponen en acinos y estructuras tubulares, con escasos cuerpos de psammoma, mezclados con un componente estromal fusocelular, que se localiza, de forma concéntrica, alrededor de los ductos, con escasos focos de componente heterólogo cartilaginoso (Figura 2). La segunda lesión es de arquitectura papilar, constituida por células cuboideas altas, de citoplasma amplio eosinófilo, cromatina vesicular y ligera atipia, e infiltra parcialmente el estroma de la lesión bifásica descrita (Figura 3). Estos hallazgos se interpretan como un tumor mixto con adenofibroma metanéfrico y carcinoma papilar de células renales. Figura 1. Aspecto macroscópico del riñón, donde se observa el área sólida y el área papilar El parénquima renal no tumoral adyacente presenta áreas de fibrosis. El borde de sección del uréter y el único ganglio linfático disecado en el hilio renal no presentan compromiso por el tumor. Los estudios de inmunohistoquímica fueron positivos en el estroma de la lesión bifásica para CD34, y negativos para S100 y vimentina; también, positivos en el componente epitelial para CD 57 y WT1, y negativos para EMA. En el carcinoma papilar fueron positivos para EMA, coctel de queratinas (AE1/AE3), queratina de alto peso molecular, racemasa y difusamente para CK7, y negativos para WT1 y CD10 (Figura 4). Figura 2. Aspecto microscópico, adenofibroma metanéfrico. (A) Parénquima renal residual y componentes estromal y epitelial. (B) El componente epitelial se dispone en patrón acinar y tubular, acompañado por escasos cuerpos de psammoma. (C) El componente estromal se dispone en forma concéntrica alrededor de los túbulos A Conclusiones En resumen, es importante contemplar dentro de los diagnósticos diferenciales de pacientes pediátricos con masa renal el adenofibroma metanéfrico, ya que tiene implicaciones terapéuticas y de pronóstico; así mismo, debe realizarse un adecuado muestreo de dichas lesiones para descartar la presencia de componente de tumor de Wilms o carcinoma papilar de células renales, que le da un potencial de comportamiento maligno a la lesión. Para realizar dichos diagnósticos diferenciales, la inmunohistoquímica (racemasa, CK7 y CD57) ha demostrado ser una herramienta útil; igualmente, los estudios de biología molecular pueden ser de ayuda en la clasificación de la lesión. B C Rev Colomb Cancerol 2008;12(2):106-110 109 Adenofibroma metanéfrico asociado a carcinoma papilar de células renales Figura 3. Aspecto microscópico carcinoma papilar de células renales. Referencias (A) Carcinoma papilar adyacente a los componentes del adenofibroma metanéfrico. (B) Estructuras papilares grandes y gruesas. (C) Citología 1. Arroyo MR, Green DM, Perlman EJ, et al. The spectrum of metanephric adenofibroma and related lesions. Cli- del componente papilar nicopathologic study of 25 cases from National Wilms Tumor Study Group Pathology Center. Am J Surg Pathol A 2001;25(4):433-44. 2. Shek TW, Luk IS, Peh WC, Chan KL, Chan G. Metanephric adenofibroma: report of a case and review of the literature. Am J Surg Pathol 1999;23(6):727-33. 3. Argani P. Metanephric neoplasms: the hyperdifferentiated, benign end of the Wilms tumor spectrum? Clin Lab Med 2005;25:379-92. 4. Murphy W, Grignon D, Perlman E. AFIP atlas of tumor pathology, series 4. Tumors of kidney, bladder and related urinary structures. Washington DC: American Registry of B C Pathology; 2004. 5. Argani P, Beckwith JB. Metanephric stromal tumors: report of 31 cases of a distinctive pediatric renal neoplasm. Am J Surg Pathol 2000;24(7):917-26. 6. Grignon DJ, Eble JN. Papillary and metanephric adenomas of the kidney. Semin Diagn Pathol 1998;15(1):41-53. 7. Eble JN, Sauter G, Epstein JI, Sesterhenn IA, editors. World Health Organization Classification of Tumours. Pathology and genetics of tumours of the urinary system and male Figura 4. Estudios de inmunohistoquímica en el carcinoma papilar de células renales. (A) CK7. (B) Coctel de citoqueratinas (AE1/AE3). (C) EMA. genital organs. Lyon: IARC Press; 2004. 8. Olgac S, Hutchinson B, Tickoo S, Reuter VE. Alpha-methylacyl-CoA racemase as a marker in the differential diagnosis (D) Racemasa. (E) WT1 of metanephric adenoma. Mod Pathol 2006;19:218-24. A B 9. Brunelli M, Eble J, Zhang S, Martignoni G, Cheng L. Metanephric adenoma lacks the gains of chromosome 7 and 17 and loss of Y that are typical of papillary renal cell carcinoma and papillary adenoma. Mod Pathol 2003;16(10):1060-3. 10. Drut R, Drut M, Ortolani C. Metastasic metanephric adenoma with foci of papillary carcinoma in a child. A D C E 110 Rev Colomb Cancerol 2008;12(2):106-110 combined histologic, immunohistochemical, and FISH study. Int J Surg Pathol 2001;9(3):241-7.