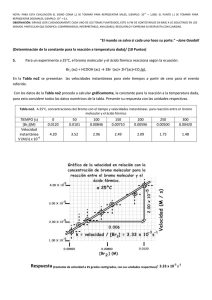
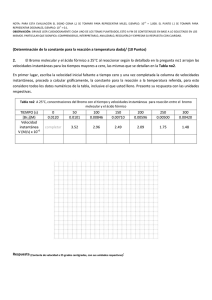
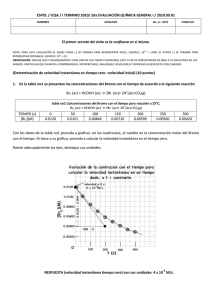
soluciones acuosas concentradas de bromo y su preparacion.
Anuncio

19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS A01N 59/00 (2006.01) A01N 25/22 (2006.01) C02F 1/76 (2006.01) C01B 7/24 (2006.01) ESPAÑA 12 11 Número de publicación: 2 269 498 51 Int. Cl.: TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01989936 .8 86 Fecha de presentación : 08.11.2001 87 Número de publicación de la solicitud: 1343376 87 Fecha de publicación de la solicitud: 17.09.2003 54 Título: Soluciones acuosas concentradas de bromo y su preparación. 30 Prioridad: 07.12.2000 US 732601 73 Titular/es: ALBEMARLE CORPORATION 451 Florida Street Baton Rouge, Louisiana 70801-1765, US 45 Fecha de publicación de la mención BOPI: 01.04.2007 72 Inventor/es: McKinnie, Bonnie, G.; Harkins, Alvin, E., Jr. y Moore, Robert, M., Jr. 45 Fecha de la publicación del folleto de la patente: 74 Agente: Carvajal y Urquijo, Isabel ES 2 269 498 T3 01.04.2007 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, 75 – 28071 Madrid ES 2 269 498 T3 DESCRIPCIÓN Soluciones acuosas concentradas de bromo y su preparación. 5 10 15 20 Antecedentes Los biocidas basados en bromo han demostrado ventajas biocidas sobre la cloración-descloración para el control biológico de aguas de enfriamiento y desinfección de sistemas de tratamiento de residuos. La industria de tratamiento de aguas reconoce éstas ventajas como un control efectivo en costos a valores más altos de pH, aunque sin pérdida en la actividad biocida en presencia de amoníaco, y el control efectivo de bacterias, algas y moluscos. Una forma normal de introducir biocidas basados en bromo en un sistema de aguas es a través del uso de NaBr acuoso junto con lejía de NaOCl. El usuario alimenta ambos materiales hacia un punto común donde el NaOCl oxida el ión bromuro a HOBr/OBr . Esta solución activada es introducida directamente en el sistema acuoso que va a ser tratado. La alimentación de los dos líquidos de esta forma es necesaria porque la mezcla HOBr/OBr es inestable y tiene que ser generada en el sitio justo antes de su introducción al agua. Además, la alimentación, y medición de los dos líquidos es complicada, especialmente puesto que el sistem tiene que ser diseñado para permitir un tiempo para la activación del ión bromuro. Consecuentemente muchos usuarios de biocidas han expresado la necesidad de un biocida basado en bromo de alimentación sencilla. El bromo elemental y el cloruro de bromo molecular han sido considerados como satisfactorios para estas demandas. Ambos son líquidos a temperatura ambiente, pueden ser alimentados directamente al sistema de agua, donde ocurre una hidrólisis inmediata para producir HOBr. 25 Br2 + H2 O → HOBr + HBr (1) BrCl + H2 O → HOBr + HCl (2) Las propiedades del bromo y del cloruro de bromo se comparan en la Tabla 1. 30 TABLA 1 Propiedades físicas de bromo y cloruro de bromo 35 40 45 50 Propiedad Bromo (Br2 ) Cloruro de Bromo (BrCl) Apariencia Líquido fumante, rojo oscuro Líquido o gas rojo, fumante Punto de ebullición 59ºC 5ºC Presión de vapor (25ºC) 214 mm 1800 mm Corrosividad Corroe la mayoría de los metales en presencia de agua Corroe la mayoría de los metales en presencia de agua Puede verse que ciertas características de estos materiales -especialmente su poder corrosivo, altas presiones de vapor y tendencias a desprender vapores- necesita el cuidado y experiencia en su manejo y uso. Los primeros esfuerzos para superar las deficiencias de estos materiales comprendían la formación de complejos del bromo con un exceso de ión bromuro en la presencia de un ácido fuerte y estabilizando las soluciones resultantes con etanolamina. Las soluciones resultantes de perbromuro de etanol amonio hidrógeno contenían hasta 38% en peso de bromo elemental. Véase con respecto a esto Favstritsky, U. S. Pat. No. 4,886,915; y Favstritsky, Hein, and Squires, U. S. Pat. No. 4,966,716. 55 60 65 Éstas soluciones permitieron la introducción de bromo a un sistema de agua utilizando un alimentación simple. Como en el caso del bromo y del cloruro de bromo, el perbromuro de etanol amonio hidrógeno se hidrolizaba en agua para liberar HOBr. Las presiones de vapor de estas soluciones eran inferiores a las del bromo elemental y el cloruro de bromo. No obstante, las soluciones aún poseían presiones de vapor medibles, y tendían así a producir vapores indeseables de color rojizo durante su almacenamiento y uso. Una forma económicamente aceptable de estabilizar altas concentraciones de soluciones acuosas de cloruro de bromo está escrita en la patente de los Estados Unidos 5141652 de Moore et al. La solución se prepara a partir de cloruro de bromo, agua y una sal de haluro o ácido hidrohálico. Estas soluciones se encontró que descomponían a una velocidad de menos de 30% por anión y en casos de alta concentración de sal de haluro, menos de 5% por anión. Además, podía ser preparada la solución con un contenido equivalente al 15% de bromo elemental. Desafortunadamente, la acidez es relativamente alta de estas soluciones y su tendencia a ser corrosivas y a desprender vapores imponían limitaciones a su aceptación comercial. 2 ES 2 269 498 T3 5 10 15 20 25 30 35 40 45 Muchos derivados de bromo sólido tales como BCDMH (N,N-bromocloro-5,5-dimetilhidantoina) están limitados en la cantidad de material que puede ser disuelto en agua y alimentarse como un líquido al sistema de tratamiento de aguas. Por ejemplo, la solubilidad de BCDMH en agua es sólo aproximadamente 0.15%. Otra limitación de tales derivados es que a pH neutro el HOBr se descompone rápidamente, formando eventualmente iones bromuro. Así, la habilidad para almacenar y transportar estas soluciones acuosas está limitada grandemente y es de factibilidad comercial cuestionable. La patente de los Estados Unidos 3,55 8,503 a Goddenough et al. describe ciertas soluciones de bromo acuoso estabilizadas con diversos agentes de estabilización y diversos usos a los cuales pueden dedicarse tales soluciones. Las composiciones descritas en la patente comprenden una solución acuosa de bromo que tiene desde aproximadamente 0.01 hasta aproximadamente 100.000 ppm en peso de valores de bromo donde la relación molar del bromo al nitrógeno presente en los estabilizadores del bromo varía desde 2.0 hasta uno hasta 0.50 hasta 1.0. El estabilizador utilizado es biuret, succinimida, urea, una urea alifática monosustituida que contiene de 2 a 4 átomos de carbono en cada grupo sustituyente, ácido sulfámico o una alquilsulfonamida de fórmula RSO3 NH2 donde R es un grupo metilo o etilo. La solución también contiene suficiente hidróxido adicionado para proveer un pH en la solución que varía de 8 a 10, siendo el hidróxido de aditivo un hidróxido de un metal alcalino o un hidróxido de un metal alcalino térreo. La patente de los Estados Unidos 5,68 3,654 de Dallmier et al. discute la preparación de soluciones acuosas de hipobromito con metales alcalinos o metales alcalinotérreos, mezclando una solución acuosa de un hipoclorito de un metal alcalino o alcalino térreo con una solución en agua y ión bromo para formar una solución no estabilizada de un hipoclorito de metal alcalino o alcalino térreo. A esta solución se añade una solución acuosa de un sulfato de un metal alcalino que tiene una temperatura de al menos 50ºC y en una cantidad que provea una relación molar de sulfamato de metal alcalino a hipobromito de metal alcalino o alcalino térreo que va de 0.5 a 6 mediante la cual se forma una solución estabilizada acuosa de hipobromito de metal alcalino o alcalino térreo. La patente de Dallmier et al. revela que niveles mucho más altos de halógeno disponible para la desinfección fueron alcanzados mediante esta aproximación en comparación con el intento de Goodenough et al. Pero la patente de Dalmier et al. reconoce que en su proceso, la estabilización debe ocurrir rápidamente después de que se forme el NaOBr inestable. La patente de los Estados Unidos números 5,795,487 de Dalmier et al. describe un método para preparar una solución de hipobromito de un metal alcalino o alcalino térreo estabilizada. El método comprende la mezcla de una solución acuosa de un hipoclorito de un metal alcalino o alcalino térreo que tiene aproximadamente 5-70% de halógeno disponible como cloro con una solución fuente de ión bromuro soluble en agua, que permite que la fuente de ión bromo y el hipoclorito reaccionen para formar una solución acuosa de 0.5-70% en peso de hipobromito de metal alcalino o alcalino térreo no estabilizado, añadiendo a esta solución no estabilizada una solución acuosa de un sulfato de metal alcalino en una cantidad suficiente para proveer una relación molar de sulfamato de metal alcalino a hipobromito de metal alcalino o alcalino térreo de aproximadamente 0.5 a 0.7, y recuperar una solución de hipobromito de metal alcalino o alcalino térreo acuosa estabilizada. Se dice que el orden de adición en el proceso es crítico. La patente de los Estados Unidos números 6,007,726 de Yang et al. describe la formación de formulaciones de bromo estabilizadas. En ese proceso, una solución de un bromuro de un metal alcalino o alcalino térreo y un estabilizador halógeno tal como ácido sulfámico se forma y se ajusta a un pH de 4 a 8. A esta solución se añade ozono, un peróxido, o un peróxido tal como ácido pero acético, para generar un compuesto de bromo oxidante en la solución. El pH de la solución puede ser elevado a 13 o más. El proceso se demuestra mediante el uso de ozono a partir de un ozonador, y se indica que es importante mantener un alto pH de reacción y una baja temperatura de reacción para mantener los bromos oxidantes estables libres de la descomposición térmica. 50 La patente WO99/62339 revela un proceso para producir una formulación biocida líquida concentrada que comprende mezclar entre sí (a) cloruro de bromo o bromo, y (b) una solución acuosa de una sal de ácido sulfámico de un metal alcalino que tiene un pH de al menos aproximadamente 7, en cantidades tales que (i) el contenido de bromo activo de la solución es al menos 100.000 de pm (peso/peso), y (ii) la relación atómica de nitrógeno a bromo activo de (a) y (b) es mayor de uno cuando se usó bromo, y es mayor de 0.93 cuando se usa cloruro de bromo. No hay revelación de un pH de control de la mezcla de reacción durante el período de alimentación, durante la formación de la composición y antes de la subsecuente adición de más base. 55 Breve resumen de la invención Una tecnología de proceso mejorado para formar soluciones acuosas concentradas de bromo con actividad biocida y soluciones acuosas concentradas mejoradas de bromo con actividad biocida son provistos por esta invención. 60 65 Esta invención involucra, entre otros, el descubrimiento de que cuando se producen soluciones concentradas de bromo con actividad biocida en las cuales se está presente en sulfamato en la mezcla de reacción el control adecuado del pH de la mezcla de reacción acuosa a lo largo del proceso de producción puede tener efectos benéficos importantes tanto en la reacción misma como en el producto con actividad biológica que está siendo producido. Por ejemplo, se produce una composición biocida líquida concentrada mezclando (a) cloruro de bromo, o bromo y cloro con (b) una solución acuosa que contiene el ión sulfamato, una porción sustancial del sulfamato puede sufrir hidrólisis más bien rápidamente a sulfato bajo condiciones ácidas. Aunque la mezcla de reacción es suficientemente estable para producir una solución biocida acuosa concentrada, la pérdida de sulfamato debido a la hidrólisis a sulfato durante el proceso de producción puede resultar en una estabilidad disminuida al almacenamiento del producto 3 ES 2 269 498 T3 5 10 15 20 25 30 35 40 45 terminado aunque se introduzca suficiente base en la solución como la última etapa del proceso de producción para elevar el pH de la solución a 13 o por encima. Además, la pérdida de sulfamato impone un riesgo económico en operación. Por otro lado, el uso de condiciones de reacción altamente básicas a lo largo del proceso de producción puede resultar en la declaración de los reactores recubiertos de vidrio que son deseablemente empleados para minimizar la posibilidad de la extracción de metales pesados de la superficie de los reactores metálicos, una posibilidad que debe ser evitada puesto que las soluciones biocidas se utilizan primariamente en tratamientos de aguas. De acuerdo con ello, con relación a esta invención las dificultades anteriores son minimizadas, si es que no son eliminadas. Además, esta invención permite la producción económica a una escala industrial de concentrados acuosos estables en almacenamiento los cuales, debido a la forma en que son producidos, pueden proveer un control especialmente efectivo de bacterias, algas, moluscos y biomasa. De acuerdo con ello, con respecto a una modalidad que esta invención se provee un proceso para producir una composición biocida líquida concentrada, proceso que comprende: A) poner juntos en cualquier manera adecuada para formar una mezcla de reacción (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i) cloruro de bromo, (ii) bromo elemental y (iii) cloruro elemental, (b) una fuente de iones sulfamato, preferiblemente un sulfamato de metal alcalino, y más preferiblemente sulfamato de sodio, (c) base de un metal alcalino, preferiblemente una base de sodio, y más preferiblemente hidróxido de sodio y/o oxido de sodio, y (d) agua, tal que la relación numérica de átomos de bromo átomos de cloro puestas en la mezcla esté en el rango de 0.7:1 a 1.7:1, y preferiblemente en el rango de 1:1 a 1.2:1, y B) proveer antes y/o durante A) suficiente base de metal alcalino en la mezcla que está siendo formada en A) para mantener el pH tal mezcla del rango de 7 a 11, y preferiblemente en el rango de 8 o 10, durante todo o sustancialmente todo el tiempo durante el cual estará transcurriendo A), las cantidades de (a), (b), (3), y (d) utilizadas son cantidades que formen una solución que contienen bromo activo en la cual (i) el contenido de bromo activo es al menos 50.000 partes por millón (peso/peso) (esto es, al menos aproximadamente 5% en peso de la mezcla es un contenido del bromo activo), y preferiblemente al menos 100000 ppm (peso/peso), y más preferiblemente al menos 120.000 ppm (peso/peso), y (ii) la relación atómica de nitrógeno a bromo activo que se origina de (a) y (b) es mayor de aproximadamente 0.93, y preferiblemente mayor de 1; y donde si está presente cualquier sulfato en la solución que contiene bromo activo según se forma, tal contenido de sulfato es tal en la relación molar de sulfato a sulfamato en la solución es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05, C) elevar el pH de las soluciones que contienen bromo activo así formadas hasta al menos 12 mezclando una base de metal alcalino adicional con las mismas. Según se usa en cualquier parte de este documento, incluyendo las reivindicaciones, la frase “poner juntos de cualquier manera adecuada” denota que (a), (b), (c), y (d) pueden ponerse juntos en cualquier forma química adecuado de alimentación, y que (a), (b), (c), y (d) pueden ponerse juntos como entidades individuales y/o como una o más subcombinaciones químicas adecuadas de dos o más de ellos. Como cualquier químico o ingeniero químico puede entender fácilmente, hay un número considerable de maneras adecuadas de poner (a), (b), (c), y (d) juntos en una forma químicamente adecuada de manera que no haya turbulencia, excesiva generación de calor, por reacción violenta cuando se juntan. Es suficiente decir aquí, el sentido común ordinario desde un punto de vista químico es esperado tanto en interpretar esta frase como en implementar esta frase. Una modalidad preferida de esta invención es un proceso para producir una composición biocida líquida concentrada, proceso que comprende: 50 A) alimentar (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i) cloruro de bromo, (ii) bromo elemental, y (i) cloruro elemental en (b) agua que contiene iones sulfamato, o alimentar cada uno de (a) y (b) en un recipiente de reacción, tal que la relación numérica del número total de átomos de bromo alimentados frente al número total de átomos de cloro alimentados está en el rango de 0.7:1 a 1.7:1, y preferiblemente en el rango de 1:1 a 1.2; y 55 B) proveer antes y/o durante A) suficiente base de metal alcalino en la mezcla que se está formando en A) para mantener el pH tal mezcla del rango de 7 a 11, y preferiblemente en el rango de 8 10, durante todo o sustancialmente todo el tiempo en el juego cubre la alimentación en A), las cantidades de (a), (b), (c), y (d) que están siendo utilizadas son cantidades que formen una solución que contienen bromo activo en la cual (i) el contenido de bromo activo es al menos aproximadamente 50.000 ppm (peso/peso) y preferiblemente al menos aproximadamente 100.000 ppm (peso/peso), y más preferiblemente al menos aproximadamente 120.000 ppm (peso/peso), y (ii) la relación atómica de nitrógeno frente a bromo activo que se origina de (a) y (3) es mayor de aproximadamente 0.93, y preferiblemente mayor de uno; y cuando sí cualquier sulfato está presente en la solución que contiene bromo activo según se forma, tal contenido de sulfato es tal que la relación molar de sulfato a sulfamato en la solución en menos de aproximadamente 0.2, y preferiblemente en menos de aproximadamente 0.05, 60 65 C) elevar el pH de las soluciones que contienen bromo activo así formadas a al menos 12 mezclando base de metal alcalino adicional con ellas. 4 ES 2 269 498 T3 Preferiblemente, después de completar la alimentación en A) en los procesos anteriores, el pH de la solución que contienen bromo activo se eleva a un pH que está al menos en el rango de 13 a 13.5. Típicamente esto se logra por la adición de una base de metal alcalino adicional, o de otra manera la mezcla de una base de metal alcalino adicional con la solución que contiene el bromo activo. 5 Otra modalidad de esta invención es un proceso para minimizar o eliminar la pérdida de sulfamato durante la producción de una composición biocida líquida con sulfamato estabilizado, proceso que comprende: 10 15 20 A) alimentar (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i) cloruro de bromo, (ii) bromo elemental, y (ii) cloruro elemental en (b) algo que contiene anión sulfamato, o alimentar cada uno de (a) y (b)s separadamente en un recipiente de reacción, o de otra forma poner (a) y los componentes de (b) juntos alimentando los en cualquier forma excepto alimentando cualquiera de los componentes de (b) simplemente o en cualquier combinación en (a), y B) minimizar la formación de sulfato en la solución acuosa resultante proveyendo antes y/o en durante A) suficiente base de metal alcalino en la mezcla que está siendo formada en A) para mantener el pH de la mezcla del rango de 7 a 11, y preferiblemente en el rango de 8 a 10, durante todo o sustancialmente todo el tiempo en el que la alimentación de A) está ocurriendo de manera que la pérdida de sulfamato es minimizada o eliminar. Así sí cualquier sulfato se forma y está presente, la relación molar de sulfato sulfamato en la composición biocida líquida concentrada según se forma es típicamente menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05, C) elevar el pH de la solución que contiene el bromo activo así formado a al menos 12 mezclando base de metal alcalino adicional con ella. 25 30 35 Para llevar a cabo esta modalidad se prefiere, pero no es esencial, proporcionar (a) y (b) de tal manera que la relación numérica del número total de átomos de bromo alimentados al número total de átomos de cloro alimentados está en el rango de 0.7:1 a 1.7:1, y preferiblemente del rango de 1:1 a 1.2:1. También, a llevar a cabo esta modalidad se prefiere, pero no es esencial, utilizar (a) y (b) en cantidades que formen una solución que contiene bromo activo en la cual (i) el contenido de bromo activo es al menos 50 1000 ppm (peso/peso), y preferiblemente al menos) 100000 ppm (peso/peso, y más preferiblemente al menos aproximadamente 120.000 ppm (peso/peso), y (ii) la relación de átomos de nitrógeno a bromo activo que se originan de (a) y (b) es mayor que aproximadamente 0.93, y preferiblemente mayor de 1. Además, es preferible que cuando se conduzca esta modalidad para elevar el pH de una solución acuosa después de completar la alimentación de A) a un pH que está al menos en el rango de 13 a 13.5. Como se describirán más detalladamente en lo sucesivo, hay diversas formas mediante las cuales los átomos de bromo y cloro de (a) pueden ser alimentados utilizando miembros del grupo consistente de cloruro de bromo, bromo y cloro. Por ejemplo, algunas de las formas preferidas involucra la alimentación (1) de cloruro de bromo por sí mismo, (2) cloruro de bromo en una mezcla, como, o (3) bromo y cloro alimentados separadamente y concurrentemente y/o alimentados separadamente y secuencialmente con cualquiera de ellos siendo alimentados primero. 40 45 50 55 60 65 En todas las modalidades de esta invención descritas anteriormente, las alimentaciones en A) pueden ser llevadas a cabo de cualquier manera en cuanto el pH de la mezcla que está siendo formada permanezca o se mantenga en el rango de 7 a 11, y preferiblemente en el rango de 8 a 10, durante todo o sustancialmente todo el tiempo durante el cual está ocurriendo la alimentación en A). Por ejemplo la alimentación de (a) en (b) puede ser continua o intermitente o ambas. De la misma forma las alimentaciones separadas de (a) y (b) en un recipiente de reacción puede ser continuas, intermitentes, o ambas, y estas alimentaciones separadas son concurrentes o sustancialmente concurrentes, y/o estas alimentaciones separadas son llevadas a cabo en secuencias alternantes. Para mantener el pH del rango de 7 a 11, y preferiblemente del rango de 8 a 10, durante todo o sustancialmente todo el tiempo en que está ocurriendo A): (1) puede incluirse una base de un metal alcalino disuelto en (b) y/o (2) puede alimentarse separadamente una solución en agua de una base de metal alcalino, continua o intermitentemente, o ambos, bien (i) como una alimentación en (b), o (ii) como alimentación separadas de (a) y (b) en un recipiente de reacción, cualquiera que sea (i) o (ii) se está llevando a cabo en A). En modalidades preferidas, el anión sulfamato de (b) es provisto mezclando juntos en agua, (i) ácido sulfámico y/o una sal de metal alcalino de ácido sulfámico, y (ii) base de metal alcalino en proporciones tal que la solución acuosa de la sal de metal alcalino de ácido sulfámico se forma con un pH de al menos 7 y preferiblemente al menos 8. Si el ácido sulfámico por sí mismo se utiliza como material de partida, se utiliza inicialmente como una pasta en agua con la cual se mezcla la base de metal alcalino. La operación de acuerdo con las anteriores modalidades de esta invención no solamente resulta en una hidrólisis minimizada de sulfamato a sulfato, sino que las soluciones biocidas acuosos producidas de esta manera cuando se utilizan en niveles de dosis apropiadas proveen un control especialmente efectivo de bacterias, algas, moluscos y biomasa. También, si la reacción de (a) con (b) se lleva a cabo en un recipiente de reacción recubierto de vidrio, el recubrimiento de vidrio no sufrirá un ataque severo como si la reacción completa fuese conducida a un pH más alto tal como 12, 13 o 14. Aun otra modalidad de esta invención es un proceso que produce una composición biocida líquida donde el pH de la mezcla de reacción es controlado en al menos tres etapas. El proceso de esta modalidad comprende: 5 ES 2 269 498 T3 5 I) Poner juntos de cualquier manera factible para formar una mezcla de reacción (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i) cloruro de bromo, (ii) bromuro elemental, y (iii) cloro elemental, (b) una fuente de aniones sulfamato, preferiblemente un sulfamato de metal alcalino, y más preferiblemente sulfamato de sodio, base de metal alcalino, preferiblemente una base de sodio, y más preferiblemente hidróxido de sodio y/o óxido de sodio, y (d) agua, tal que (1) la relación numérica de átomos de bromo a átomos de cloro puestos en la mezcla está en el rango de 0.7:1 a 1.7:1, preferiblemente del rango de 1:1 a 1.2:1, y (2) la relación de átomos de nitrógeno a bromo activo que se originan de (a) y (b) es mayor de aproximadamente 0.93, y preferiblemente mayor de aproximadamente 1; para formar una mezcla de producto de reacción que contienen bromo activo que tiene, inicialmente, un pH por encima de 11, preferiblemente al menos aproximadamente 12 y más preferiblemente al menos aproximadamente 13; 10 II) proveer antes y/o durante la conducción de I) una cantidad de base de metal alcalino en relación a la cantidad total de ácido o productos que van a formarse en la reacción, que resultan en que el pH del tal mezcla producto de la reacción disminuyan al menos 1 unidad de pH durante la ejecución de I), hasta un pH en el rango de 7 a 11, y preferiblemente a un pH en el rango de 8 a 10; 15 III) mantener la mezcla de reacción a un pH en el rango de 7 a 11, y preferiblemente a un pH del rango de 8 a 10 por un período de tiempo que incremente la efectividad microbicida de la composición biocida líquida concentrada que está siendo formada; y entonces 20 25 IV) elevar el pH de la mezcla de productos de reacción que contienen bromo activo resultante hasta al menos 12, y preferiblemente hasta un pH que esté al menos en el rango de 13 a 13.5, mezclando con ella base de un metal alcalino adicional. Entre las formas factibles de poner juntos (a), (b), (c) y (d) según I) arriba están las operaciones donde (b), (c) y (d) son llevados a la mezcla de reacción alimentando (b), (c) y (d) como entidades individuales y/o alimentando cualquiera de los dos o todo los tres de (b), (c) y (d) como una o más mezclas reformadas de tales cualquier dos o tres de los mismos, y operaciones donde (a), (b), (c) y (d) son puestos. Sin cualquier manera químicamente adecuada de alimentación. Típicamente, ni (b), (c), (d), de forma sencilla o en cualquier combinación o su combinación con otro puede ser alimentados en (a). 30 Aún otra modalidad de esta invención en donde el pH de la mezcla de reacción es controlado en al menos tres etapas es un proceso para producir una composición biocida líquida concentrada, proceso que comprende: 35 I) alimentar (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i) cloruro de bromo, (ii) bromo elemental, y cloro elemental, en (b) una solución acuosa de aniones sulfamato y base de metal alcalino, o alimentando cada uno de (a) y (b) en un recipiente de reacción, de tal forma que la relación numérica de átomos de bromo átomos de cloro alimentados esté en el rango de 0.7:1 a 1.7:1, y preferiblemente en el rango de 1:1 a 1.2:1, para formar una mezcla de producto reacción que contiene bromo activo que tenga, inicialmente, 1 pH por encima de 11, preferiblemente al menos aproximadamente 12, y más preferiblemente al menos aproximadamente 13; 40 II) proveer antes y/o durante el alimentación en I) una cantidad de base de metal alcalino en relación con la cantidad total de ácido (HBr y/o HCl)), productos que se van a formar en la reacción, lo que hace que el pH de tal producto reacción en mezcla disminuya en al menos 1 unidad que pH durante la alimentación en I) hasta un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 8 a 10; 45 III) mantener la mezcla del producto reacción en un pH en el rango de 7 a 11, y preferiblemente en un pH en el rango de 8 a 10, durante un periodo de tiempo que incremente la efectividad microbicida de la composición biocida líquida concentrada que está siendo producida; y entonces 50 55 IV) elevar el pH de la mezcla de producto reacción que contienen bromo activo resultante hasta al menos aproximadamente 12, preferiblemente hasta un pH que esté al menos en el rango de 13 a 13.5, mezclando con ellas base de metal alcalino adicional. En vez de llevar a cabo II) como se especifico anteriormente, el descenso en pH que sigue II) y cada uno de los anteriores procesos puede ocurrir después de completar la alimentación en I) utilizando una base suficiente para mantener el pH por encima de 11, preferiblemente al menos aproximadamente 12, y más preferiblemente al menos aproximadamente 13 durante la alimentación, ni añadiendo a la mezcla de reacción resultante después de completar la alimentación en I) suficiente HBr y/o HCl para hacer que el pH descienda como se especifica en II) más arriba. Sin embargo ésta es una forma menos preferida de operación. 60 Si se desea, la operación que sigue a IV) en cada uno de los procesos anteriores puede ser conducido a que dos o más etapas de niveles de pH incrementados. Sin embargo, preferiblemente el pH se ajustó al valor de pH final deseado en una operación de una etapa. 65 En cada una de las modalidades de esta invención, la relación atómica de nitrógeno con base en ácido sulfámico (más base de metal alcalino) o sulfamato de metal alcalino utilizado para activar el bromo es preferiblemente mayor de 1, y más preferiblemente en el rango de 1.1 a 1.5. Si se desea, pueden emplearse relaciones aún más altas. 6 ES 2 269 498 T3 La anterior y otras modalidades de esta invención serán aún más evidentes a partir de la descripción que sigue y de las reivindicaciones anexas. Breve descripción de los dibujos 5 La figura 1 es un diagrama de flujo esquemático de una disposición de planta adecuada para la práctica del proceso continuo. 10 La figura 2 es un diagrama de esquemático de una disposición de planta en la cual se incluye un sistema de control de flujo automático. La figura 3 es un diagrama de flujo esquemático de otra disposición de planta en la cual fluye un sistema de control de flujo. 15 20 25 30 Descripción detallada adicional de la invención La modalidad que involucró un proceso que produce una composición biocida líquida concentrada donde el pH de la mezcla de reacción se controla en al menos tres etapas (de aquí en adelante denominada o a veces “proceso en tres etapas”) involucra ciertas consideraciones especiales, y aun también, en parte, aspectos de las otras modalidades de esta invención. Por lo tanto, los detalles de estas otras modalidades se describen en “Parte uno” más abajo. Los detalles del proceso de tres etapas se establecen en “Parte dos” más abajo. A lo largo de esta divulgación se hace referencia frecuentemente a “cloruro de bromo”, un término usado comúnmente por los químicos para describir una sustancia hecha por combinación de bromo y cloro. Esta sustancia se representa generalmente en la ciencia química por la fórmula molecular de BrCl o Br-Cl. Queremos evitar cualquier especulación basada en híper tecnicismos, para hacer notar el hecho de que hay evidencia que indica que el “cloruro de bromo” por sí mismo es una mezcla equimolar de bromo elemental y cloro elemental, y adicional de que bajo condiciones ordinarias BrCl 100% puro tal vez no existe como tal, sino que más bien la mezcla equimolar por sí misma existe aparentemente como una mezcla de aproximadamente 60% de Br-Cl, 20% de Br2 20% del Cl2 . Pero cualquiera que sea, la sustancia conocida para los químicos como “cloruro de bromo” es aquella a la que se hace referencia. La referencia aquí a una mezcla de “cloruro de bromo y bromo” o una mezcla de “cloruro de bromo y cloro” simplemente significa que además de la mezcla y equimolar de bromo y cloro conocida para los químicos como “cloruro de bromo” como quiera que esté constituida, hay una cantidad en exceso de bromo o cloro, respectivamente, sobre la cantidad equimolar de bromo y cloro. 35 Parte uno 40 45 50 55 60 65 Como se ve de lo anterior, la tecnología de proceso de esta invención involucra, en parte, poner en contacto (a) y (b) anteriores, usualmente alimentando (a) y (b), o alimentando cada uno de (a) y (b) en un recipiente de reacción para formar una o más especies de bromo activo estabilizado, e incrementando luego el pH de la solución resultante a un pH de al menos aproximadamente dosis, y preferiblemente un pH que está al menos en el rango de 13 a 13.5 mediante el uso de una base adecuada, preferiblemente una base de metal alcalino. Uno de los gastos de este proceso es controlar el pH a un valor entre 7:11, y preferiblemente entre 8 a 10, durante todo sustancialmente todo el tiempo durante el cual está tomando lugar tal alimentación, y más preferiblemente a través de o sustancialmente a través del tiempo desde la iniciación de tal alimentación hasta que el pH de la solución resultante se eleve a un pH de al menos aproximadamente 12, y preferiblemente un pH quiste al menos en el rango de 13 a 13.5. Si se deja caer el pH por debajo de aproximadamente 7 por un cualquier período de tiempo sustancial, se acelera la hidrólisis de sulfamato a sulfato, y cuanto más bajo sea el pH y más largo sea el tiempo en que el pH está por debajo de 7, mayor es la cantidad de tal hidrólisis indeseable. Así el pH se mantiene introduciendo la solución (de manera continua o intermitente, según se desee) base de metal alcalino adicional, tal como mediante un arco alimentación de una solución de una base de metal alcalino acuosa. Otra forma de alcanzar tal mantenimiento del pH es proveyendo inicialmente suficiente base de metal alcalino en el agua para tener el pH inicial del agua en aproximadamente 11 o ligeramente por encima de 11 antes de iniciar la alimentación de (a) en (b). Luego se inicia una alimentación controlada de (a). A medida que la alimentación de (a) procede y el pH del medio acuoso cae debido a la formación de especies ácidas (por ejemplo, HBr y/o HCl) en la solución de la reacción, se introduce suficiente cantidad de base de metal alcalino a la solución (de manera continua o intermitente, según se desee) antes de que el pH caiga por debajo de aproximadamente 7 para mantener el pH entre 7:11, y preferiblemente entre 8 a 10, a medida que se alimenta más (a) si (a) y (b) son cada uno alimentado separadamente en un recipiente de reacción, puede colocarse inicialmente agua más base de metal alcalino en el recipiente de reacción de bandera que al iniciar las alimentación es de (a) y (b), el pH de la mezcla que se está formando este aproximadamente 11 o ligeramente por encima de 11. Las alimentaciones controladas de (a) y (b) en el recipiente de reacción se inicien entonces. Si se alimenta (a) en (b) se alimenta cada uno de (a) y (b) separadamente un recipiente de reacción, el pH de la solución en reacción puede ser, y preferiblemente es, monitoreado mediante el uso de un medidor de pH o de otro indicador de pH adecuado. Además, la reacción acuosa resultante en solución puede ser agitada o batida de alguna otra manera adecuada para asegurar una mezcla exhaustiva al menos durante la continuación de las alimentación es para asegurarse de que el pH no solamente está siendo controlado de forma adecuada entre 7:11, y preferiblemente entre 8 a 10, sino que el pH de las reacciones solución es uniforme o sustancialmente un informe a lo largo de la solución. 7 ES 2 269 498 T3 5 10 15 20 25 30 El control o mantenimiento del pH de acuerdo con esta invención provee así un cierto número de importantes ventajas. Por ejemplo, las conversiones de sulfamato a sulfato se mantienen típicamente por debajo de aproximadamente 5 por ciento molar, y la efectividad microbicida de la solución biocida terminada tiende a ser más alta y si la operación completa fuese conducida a un pH por encima de aproximadamente 11. También, el efecto adverso a largo término sobre los recipientes de reacción recubiertos de vidrio es significativamente menor operarlo un pH de aproximadamente 11 o menor en comparación con una operación a un pH más alto tal como 12, 13 o 14. Aunque se prefiere que el pH esté en el rango especificado de 7 a 11 o más preferiblemente, en el rango de 8 a 10, durante todo sustancialmente todo el tiempo de la alimentación en A), uno o más separaciones paredes de tal rango son permisibles. La condición aquí es que la magnitud y duración de tales separaciones (i) no incremente sustancialmente la cantidad de hidrólisis de sulfamato a sulfato, (ii) significativamente disminuya la efectividad microbicida de la solución biocida resultante, y/o (iii) incremente el daño a largo término del recipiente de reacción recubiertos de vidrio en el cual se está llevando a cabo el proceso. Por lo tanto, el término “sustancialmente todo el tiempo” se utiliza aquí para denotar que tales separaciones permisibles son aceptables y que están dentro del escrito y alcance de esta invención. También es importante entender la frase “durante todo o sustancialmente todo el tiempo en que la alimentación en A) está ocurriendo” según se usará aquí. Hay básicamente dos juegos de circunstancias que deben tenerse en cuenta. El primer caso es cuando el proceso está siendo conducido como un proceso en lotes para hacer una cantidad cada o un lote de la solución acuosa. Aquí la frase anterior se refiere al período de tiempo que se inicia cuando se inicie el contacto entre (a) y (b) según la alimentación en A), y termina cuando la alimentación en A) termina por qué el lote y con la cantidad particular de solución acuosa con un pH en el rango de 7 a 11, o con un pH en el rango preferido de 8 o 10, ácido forma. El segundo caso es con el proceso está siendo conducido como un proceso continuo en el cual la solución acuosa está siendo forma de manera continua a lo largo de un periodo largo de tiempo y está siendo removida bien de forma continua o intermitente desde el recipiente o zona de reacción en la cual está siendo formada. Aquí la frase anterior se refiere al período de tiempo que se inicia cuando la alimentación de (a) divulgó entrar en contacto una con otra en el recipiente o zona de reacción, y termina cuando la solución acuosa con un pH en el rango de 7 a 11, o con un pH en el rango preferido de 8 a 10, es removida del recipiente o zona de reacción en la cual fue forma. En general hay dos cosas deben hacerse con la solución acuosa con un pH en el rango de 7 a 11, un pH en el rango preferido de pH de 8 a 10: 1) toda o parte de la solución acuosa puede ser usada como biocida y entonces tal porción es consumida dentro de un período de tiempo adecuado después de su formación; y/o 35 40 45 50 55 60 65 2) el pH de toda o parte de la solución acuosa puede ser elevado hasta un pH de al menos 12, y preferiblemente hasta un pH de éste al menos en el rango de 13 a 13.5 dentro de un periodo adecuado de tiempo después de su formación, típicamente incluyendo base de metal alcalino adicional en tal solución acuosa El uso de acuerdo con 1) ocurrirá típicamente cuando se emplea periódicamente 1 unidad de producción a pequeña escala al lado de un cuerpo de agua que requiere un saneamiento periódico. Un tratamiento adicional de acuerdo con dos numéricos) representa la situación más usual cuando la solución acuosa con un pH en el rango de 7 a 11, o un pH en el rango de pH preferido de 8 o 10, se utiliza como preacuosor de una composición biocida líquida concentrada terminada adecuada para su almacenamiento y embarque a sitios donde finalmente será puesta en uso y consumida. El “período de tiempo adecuado” referido en 1) y 2) anteriormente es un período de tiempo antes de que cualquier cambio de degradación significativo (esto es, inaceptable) ocurra en la solución acuosa con un pH dentro del rango de pH de 7 a 11, o dentro del rango preferido de pH de 8 a 10. El “periodo adecuado de tiempo” a su vez variará dependiendo de factores tales como el pH y la temperatura de la solución acuosa; típicamente cuanto más alto el pH entre 7:11, cuanto más baja la temperatura de la solución, mayor puede ser este período de tiempo. En cualquier caso particular cuando la duración de tal periodo adecuado de tiempo no ha sido establecida previamente, pueden llevarse a cabo algunas pocas pruebas preliminares para determinar el tiempo antes de que ocurra el cambio con degradación significativa bajo unas condiciones particulares de pH temperatura en cualquier solución acuosa dada un pH en el rango de 7 a 11, o con un pH en el rango preferido de 8 a 10. Cuando las alimentaciones separadas coordinadas de (a) y (b) se hacen juntas dentro de un recipiente de reacción, en distinción a alimentar (a) en (b), estas alimentación separadas de ambos (a) y (b) en el recipiente de reacción no necesitas ser pero pueden ser continuas o intermitentes, y/o concurrentes o no concurrentes. Típicamente son alimentaciones concurrentes continuas o intermitentes. Pero pueden ser alimentaciones concurrentes sustancialmente continuas o intermitentes (esto es, alimentaciones donde parte del tiempo uno de entre (a) o (b) no está siendo alimentado mientras que en otros han sido alimentados). No importa cómo estas alimentación separadas coordinadas tanto de (a) como de (b) en el recipiente de reacción se lleven a cabo, la cosa importante es asegurarse de que tales alimentaciones son conducidas de manera que resulten en mantener en el recipiente de reacción un pH entre 7:11, y preferiblemente entre 8 a 10, a través o sustancialmente a través del tiempo desde la iniciación de la alimentación hasta que el pH de la solución resultante se libera un pH de al menos 12, preferiblemente un pH que al menos este en el rango de 13 a 13.5. El uso de cloruro de bromo y/o bromo y cloro como fuente para el bromo activo permite flexibilidad en el diseño y operación de una instalación que emplea la tecnología de proceso de esta invención y además, puede seleccionarse la fuente de estos alojemos más económica a partir de los que están disponibles para uso en tal instalación. Por ejemplo, la alimentación de (a) empleado puede ser (i) una fuente de cloruro de bromo, alimentaciones separadas y concurrentes 8 ES 2 269 498 T3 5 10 15 20 25 30 35 40 45 50 de bromo y cloro, (iii) bromo y cloro alimentados sucesivamente o alimentados alternativamente tres o más veces, con cualquiera de ellos siendo la alimentación inicial, (iv) una alimentación de una mezcla de cloruro de bromo y bromo, (v) alimentación separadas y concurrentes de cloruro de bromo y bromo, (vi) cloruro de bromo y bromo alimentados sucesivamente o alimentados alternativamente tres o más veces, con cada uno de ellos siendo la alimentación inicial, (vii) alimentación de separadas y concurrentes de cloruro de bromo, bromo y cloro (viii) cloruro de bromo, bromo y cloro alimentados en diversas secuencias y/o sus combinaciones y/o combinaciones. Las alimentación preferidas son corrientes de alimentación simple bien de cloruro de bromo o de una mezcla de cloruro de bromo y bromo, o corrientes separadas de cloro y bromo, alimentada separar concurrentemente, o alimentada separar y secuencialmente ciento cualquiera de ellas alimentad primero. Nos escapado a nuestra tensión que puede ser posible diseñar aún otras formas de obtener alimentación es de cloruro de bromo, bromo y cloro, y que tales otras formas de alimentación están dentro de la contemplación y alcance de esta invención puesto que serían equivalentes a las alimentación es identificadas como (i) hasta (viii) en este párrafo. No importa cuáles que entre cloruro de bromo, bromo y cloro es alimentado y no importa en qué secuencias o combinaciones son alimentados, ambos átomos de bromo y átomos de cloro deben ser alimentados, y la cantidad total de átomos de bromo alimentados (si se alimentan como bromo elemental o como el contenido de bromo del cloruro de bromo, o ambos) no sería apreciablemente menor que la cantidad total de átomos de cloro se alimenta (si se alimenta como cloro elemental o como el contenido de cloro del cloruro de bromo, o ambos), porque la cantidad, si la hay, por la cual la alimentación de átomos de cloro excede el alimentación total de átomos de bromo, resulta en una efectividad bióxido disminuida del producto final que está siendo producir. Así en menos modalidad preferida es donde el número total de átomos de cloro alimentados exceder el número total de átomos de bromo, tal exceso no debe ser más de aproximadamente 5%. Preferiblemente, la cantidad total de átomos de bromo alimentados (si se alimenta como bromo elemental o como el contenido de bromo del cloruro de bromo, o ambos, debería ser menos igual, o hasta aproximadamente 2% en exceso por encima de la cantidad total de átomos de cloro alimentados (si se alimentan como cloro elemental o como el contenido de cloro del cloruro de bromo, o ambos). Se prefiere emplear como (a), por ejemplo, la fuente del bromo activo del proceso anterior, (i) cloruro de bromo, (ii) una mezcla de cloruro de bromo y bromo elemental (por ejemplo, hasta aproximadamente 0.35 moles de bromo a formol de cloruro de bromo), o (iii) bromo elemental y cloro elemental (por ejemplo en el rango de uno a 1.7 moles de bromo por amor de cloro). Primeramente, estas son las maneras más simples de proveer átomos de bromo y cloro a la mezcla de reacción. En segundo lugar, con las alimentaciones de la cantidad de al menos un átomo de bromo por átomo de cloro, la mayor parte del bromo se hace disponible como bromo activo en la composición biocida acuosa resultante. En otras palabras, el cloro del cloruro de bromo o de la alimentación de cloro es convertido en el proceso a una sal de cloruro de metal alcalino disuelto, liberando por lo tanto el bromo del cloruro de bromo como el contenido de bromo activo de la composición biocida, y/o permitiendo que la alimentación de bromo como tal constituya el contenido de bromo activo de la composición biocida. Así el componente más costoso del cloruro de bromo y el elemento más costoso entre el bromo y el cloro, esto es el bromo, son utilizados de manera efectiva en formar bromo activo en la composición biocida acuosa, y concurrentemente el componente menos efectivo, el cloro aniónico en el cloruro de bromo o el cloro alimentado como tal, así que este beneficio resulte posible. Por la misma razones, en el bromo y cloro a la solución de reacción, bien (1) separadamente o concurrentemente, o (2) sucesiva y opcionalmente, alternativamente, sus proporciones serían tales que 1 a 1.7 y preferiblemente 1 a aproximadamente 1.2 moles de bromo son alimentadas por cada mol de cloro alimentado. Utilizando los reactivos de bromo y cloro de (a), especialmente cloruro de bromo una mezcla de cloruro de bromo y bromo o alimentación separadas de bromo y cloro, con un cáustico en la composición de bromo estabilizada, más altos niveles son alcanzables, en comparación con los niveles obtenidos con la adición de hipoclorito de sodio a bromuro de sodio. El proceso y las composiciones también pueden tener aproximadamente dos veces el contenido de bromo activo que las soluciones más concentradas producidas siguiendo la patente de Goodenough et al. Sin embargo, aún en los niveles altos de bromo activo que existen preferiblemente en las composiciones de esta invención, se encontró posible proveer composiciones biocidas que mantienen estos altos niveles de bromo activo durante al menos un período de dos meses, y que no exhiben un vapor u olor visible u ofensivo durante este período. Los procesos de esta invención pueden ser conducidos como procesos en lotes o como procesos continuos. Una forma preferida de llevar a cabo los procesos como un proceso continuo comprende las siguientes operaciones: 55 60 A) alimentar continuamente en el aparato de mezcla (a) átomos de bromo y cloro en la forma de uno o más de (i) cloruro de bromo, (ii) bromo elemental, y (iii) lo elemental, de tal forma que la relación numérica del número total de átomos de bromo alimentados frente al número total de átomos de cloro que están siendo alimentados están el rango del (a), y (b) agua que contiene anión sulfamato, preferiblemente una solución de la sal de sodio del ácido sulfámico, estando separadas las alimentaciones desde (a) y (b) una de otra; 65 B) alimentar continuamente en tal aparato de mezcla base de metal alcalino disuelta en agua, siendo alimentada esta solución como una parte de la alimentación (b), o como una alimentación continua concurrente separada en tal aparato de mezcla, o ambos, estando las alimentaciones de A) y B) proporcionadas para producir una solución de producto acuoso que contiene: (i) un pH en el rango de 7 a 11, y preferiblemente en el rango de 8 a 10, 9 ES 2 269 498 T3 (ii) un contenido de al menos 50000 ppm (peso/peso) de bromo activo, esto es, al menos 5% en peso de la solución que está siendo producida es bromo activo, preferiblemente al menos aproximadamente 100.000 ppm (peso/peso) de bromo activo, y más preferiblemente al menos aproximadamente 120.000 ppm de bromo activo, 5 (iii) una relación atómica de nitrógeno frente al bromo activo que se origina de (a) y (b) de más de 0.93, y preferiblemente mayor de 1, tal como por ejemplo, en el rango de 1.1 a 1.5, y 10 (iv) o bien no hay contenido de sulfato o si el sulfato está presente, un contenido de sulfato en una cantidad tal que la relación molar de sulfato a sulfamato en la solución está siendo producida es menos de 0.2, y preferiblemente menos de 0.05; y C) retirar dicha solución de producto acuoso del aparato de mezcla a una rata suficiente para permitir que se mantenga la alimentación continua y A) y B). 15 El aparato de mezcla puede ser un mezclador estático, un sistema de mezcla no estática tal como un recipiente equipado con un mezclador mecánico. Si el aparato de mezcla comprende un recipiente equipado con un mezclador mecánico, la solución de producto acuoso puede ser retirada del recipiente bien de manera continua o intermitentemente. 20 25 30 Al llevar a cabo el proceso continuo anterior, se prefiere producir (b), es decir el agua que contiene el anión sulfamato, preferiblemente una solución acuosa de la sal de sodio del ácido sulfámico en el mismo sitio de la planta. Esta solución también puede contener un exceso de base de metal alcalino tal como hidróxido de sodio. Una forma altamente eficiente de producir esta solución es retirar continua, pero alternativamente, desde al menos una y luego desde al menos otra de al menos los dos recipientes de reacción, una solución acuosa de sal de metal alcalino de ácido sulfámico a una rata que mantenga la alimentación continua de (b) en A), y durante el tiempo en que la solución está siendo retirada de al menos uno de tales recipientes de reacción, formar una solución acuosa adicional de sal de metal alcalino del ácido sulfámico en al menos otro recipiente de reacción del cual la solución no está siendo retirada en ese momento. De esta forma siempre hay disponible un suministro de la solución acuosa de sulfamato para uso como alimentación de (b) en A) más arriba. Todo esto es necesario, en el caso de que dos recipientes donde vaya a retirarse solución del recipiente lleno (I) hasta que se alimenta concurrentemente se hace en hice y en el recipiente (II) con solución fresca, conmutada desde el recipiente vacío (I) hasta el recipiente lleno (ii) retirar solución del recipiente (ii) hasta que esté vacío mientras que concurrentemente se vacíe el recipiente (i) con solución fresca, y repitiendo este procedimiento una y otra vez hasta que de manera continua se tenga un suministro de la solución para la alimentación continua. 35 Una forma particularmente preferida de llevar a cabo los procesos de esta invención es un proceso continuo que comprende las siguientes operaciones: 40 45 50 1) continuamente formar cloruro de bromo una mezcla de cloruro de bromo y bromo a partir de corrientes de alimentación separadas de bromo y cloro manteniendo dichas corrientes bajo un control automático de la rata de flujo mediante cual las corrientes son proporcionar de manera continua para juntarse con el fin de formar el cloruro de bromo una mezcla preseleccionada de cloruro de bromo y bromo, 2) alimentar continuamente en el aparato de mezcla (a) cloruro de bromo formado en 1), una mezcla de cloruro de bromo con bromo elemental formado en 1), y (b) agua que contiene anión sulfamato, preferiblemente una solución acuosa de la sal de sodio del ácido sulfámico, estando separadas las alimentación desde (a) y (b) una de otra y bajo un control automático de la rata de alimentación; 3) alimentar de manera continua en tal aparato de mezcla una base de metal alcalino disuelta en agua, siendo alimentada esta solución como una parte de la alimentación 2), o como una alimentación continua concurrente separada hacia tal aparato de mezcla, o ambas, siendo proporcionadas las alimentación es de 2) y 3) para producir una mezcla de reacción y se convierte en una solución de producto acuosa que tiene: i) un pH en el rango de 7 a 11, y preferiblemente en el rango de 8 a 10, 55 ii) un contenido de al menos 50 1000 ppm (peso/peso) de bromo activo, esto es, al menos 5% en peso de la solución que está siendo producida es bromo activo, preferiblemente al menos 100000 ppm (peso/peso) de bromo activo, y más preferiblemente al menos aproximadamente 120.000 ppm de bromo activo, 60 65 iii) una relación atómica de nitrógeno al bromo activo que se origina de (a) y (b) de más de 0.93, y preferiblemente mayor de 1, tal como por ejemplo, en el rango de 1.1 a 1.5, y iv) si un contenido de sulfato está presente, o no está presente en una cantidad tal que la relación molar de sulfato a sulfamato en la solución que está siendo producida es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05; 4) mantener la temperatura de la mezcla de reacción en un rango de temperatura de aproximadamente -10 hasta aproximadamente 50ºC y preferiblemente en el rango de 15 a 25ºC enfriando tal mezcla de reacción; y 10 ES 2 269 498 T3 5) retirar la mezcla de reacción y/o dicho producto acuoso en solución del aparato de mezcla a una rata suficiente para permitir que se mantenga una alimentación continua en 2) y 3). 5 10 15 20 En relación con 5) de este proceso será evidente que aunque las reacciones que toman lugar son rápidas, alguna reacción puede estar aún ocurriendo en la mezcla si está siendo retirada de manera continua desde un mezclador estático como un corto tiempo de residencia. En tal caso lo que está siendo retirado de 5) es al menos en parte mezcla de reacción. Por otro lado si el aparato de mezcla es un recipiente grande equipado con un mezclador mecánico un circuito de mezcla por bombeo, la mayoría sino todo lo que está siendo retirado el aparato de mezcla será probablemente solución de producto acuosa. En cualquier caso, la solución de producto acuosa recuperada del proceso puede ser, y preferiblemente es, tratada con suficiente base soluble en agua tal como hidróxido de sodio para elevar el pH hasta al menos 12 preferiblemente hasta un pH que esté al menos en el rango de 13.0 a 13.5. Como se anotó anteriormente, el aparato de mezcla utilizado en el proceso de continuo anterior puede ser un estado estático, un sistema de mezclador estático tal como un recipiente equipado con un mezclador mecánico o un circuito de mezclado por bombeo. Si el aparato de mezcla es un mezclador estático, la solución de producto acuosa será retirada de manera continua usualmente del mismo. Si el aparato de mezclado comprende un recipiente equipado con un mezclador mecánico un circuito de mezcla por bombeo, la solución de producto acuosa será retirada del recipiente bien de manera continua o intermitente. Preferiblemente, los controles de rata de alimentación automáticos en 1) y 2) están bajo un control de flujo por relación de cascada por estantes. Si la solución de base de metal alcalino disuelta en agua es alimentada como una alimentación continua concurrente separada al aparato de mezcla, esta corriente de alimentación también debería estar bajo control automático de rata de alimentación y pH, y preferiblemente bajo control de flujo y pH por relación de cascada en estantes. 25 30 35 40 45 Algunos de los procesos conducimos involucran alimentación es continuos al aparato de mezcla. Además, algunos de los procesos continuos involucran la formación continuo de cloruro de bromo, o el contacto continuo de bromo y cloro para formar cloruro de bromo, o el retiro alternado continua de una solución acuosa de sal de metal alcalino de ácido sulfámico desde al menos un recipiente de reacción mientras que otra cantidad de tal solución se está formando en al menos otro de tales recipientes. En tales modalidades el término “continuo” o “continuamente” no pretende excluir alimentaciones correctivas interrumpidas. Generalmente, si ocurren tales introducciones, son de corta duración y son tales que materialmente no afectan el estado de equilibrio de la operación del proceso general, y también son tales que no causan la producción de una cantidad significativa de una solución de producto concentrado fuera de especificaciones. Un ejemplo de una de tales interrupciones ligeras no adversas puede ocurrir cuando se conmuta el flujo de una solución acuosa de sal de metal alcalino de ácido sulfámico de al menos un recipiente de reacción a otro de tales recipientes, una operación a la que se hizo referencia anteriormente como parte de una alimentación “continuo”. En tanto tal operación de conmutación lo perturba la operación o resultado la formación de una cantidad significativa de solución de producto concentrado fuera de especificación, tal intrusiones aceptable y está dentro del estricto del término “continuo”. Existe una sección con el término “continuo” no permite una interrupción, principalmente en cualquier caso donde tanto una operación continua como lo continua (por ejemplo “intermitente”) en una etapa dada de la operación es mencionada de manera expresa. Un ejemplo de esta expresión es la modalidad en la cual el producto retirado de manera continua desde el recipiente al cual se ha hecho referencia anteriormente que está equipado con un mezclador mecánico o con un circuito de mezclado por bombeo. Tal retiro “continuo” no es interrumpido porque en otra modalidad a la cual se hace referencia expresa, el retiro del mismo producto desde el mismo recipiente es escrito específicamente como “intermitente”. Así a ambas alternativas “continúa y no continua”, se ha hecho referencia expresamente. Se hace ahora referencia a los dibujos, los que se explican suficientemente por sí mismos. 50 55 60 65 Figura 1 En el diagrama de flujo de planta esquemáticamente representado en la figura 1, se alimentan corrientes separadas de bromo y cloro, preferiblemente de manera continua, en un reactor con camisa agitado 10. El contenido del reactor 10 se mantiene típicamente a una temperatura del rango de -30 a 30ºC de manera que se produce cloruro de bromo, preferiblemente de manera continua. El cloruro de bromo liquido es transmitido de manera continua hacia el aparato de mezcla 20. Concurrentemente se cargan ácido sulfámico, una solución acuosa de hidróxido de sodio (por ejemplo 15-50% en pesos) y agua en cualquiera de los reactores con camisa 30 o 40, y la mezcla resultante allí es agitada y mantenida a 10 a 50ºC. El ácido sulfámico y el hidróxido de sodio son proporcionados para producir en el reactor una solución acuosa de sulfamato de sodio que tiene un pH que preferiblemente están el rango de 7.0 a 14.0. El reactor 30 o 40 que no está inutilizado para preparar la solución acuosa de sulfamato de sodio, contiene una solución acuosa idéntica hecha previamente en el de la misma manera. Una corriente de tal solución acuosa de solución de sulfamato de sodio es retirada continuamente del reactor 30 o 40 (según sea el caso) que contiene la solución previamente hecha, y esta corriente es alimentada de manera continua en el aparato de mezcla 20. La interacción entre el cloruro de bromo y la solución de sulfamato de sodio tiende a ser exotérmica. Por lo tanto, es deseable, particularmente en instalaciones a gran escala, enfría la mezcla a medida que se va formando. El afluente del aparato de mezcla 20 es la mezcla de reacción que tiene un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 8 a 10, y así las alimentación es del reactor píes y del reactor 30 o 40 (cualquiera que en el momento sea la fuente de la alimentación) están proporcionadas para producir una solución que tiene tal pH. Alternativamente, álcali adicional 11 ES 2 269 498 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 puede ser añadido continuamente de manera directa al recipiente 20 para controlar el pH deseado. Este álcali adicional puede ser controlado midiendo el pH de la corriente de salida del recipiente 20 utilizan dos señales de la sonda de pH 60 y mediante el uso de la válvula 70 en la línea de suministro del alcalino al recipiente 20, siendo operada la válvula 70 mediante un controlador de flujo en respuesta a las señales de la sonda de pH 60. Esta solución de producto precursor es transferida desde el aparato de mezcla 20 a otro recipiente de mezcla 50. Si el aparato de mezcla 20 y su mezclador estático, él es un ente del mezclador estático es transferido continuamente al recipiente de mezcla 50. Por otro lado, si el aparato de mezcla de interés, por decir algo, 1 recipiente equipado con un mezclador mecánico o con un circuito de mezclado por bombeo, y tal recipiente estrenado de manera intermitente de manera que su contenido oscile entre contenidos altos y bajos de solución de producto, la transmisión de la solución de producto de tal aparato de mezcla 20 al recipiente de mezcla 50 es intermitente. Se incluyen medios (no mostrados) tales como válvulas operadas eléctricamente electrónica asociada para percibir y señalar cuando se debe cerrar una válvula mientras que se abre la otra, de manera que el flujo alterno continuo de la solución acuosa de sulfamato de sodio de uno y del otro de los reactores 30 y 40 así el aparato de mezcla 20 puede ser mantenido en condiciones básicas. Una solución acuosa de base de metal alcalino tal como solución de hidróxido de sodio acuosa al 25 o 50% en peso, es alimentada preferiblemente de manera continua, en el recipiente de mezcla 50 proporcionado para elevar el pH del contenido del recipiente de mezcla hasta al menos aproximadamente 12, y preferiblemente hasta un pH que esté al menos en el rango de 13.0 a 13.5, para formar a partir de ello la solución biocida acuosa estabilizada concentrada. El contenido de los recipientes de mezcla 20 y 50 es enfriado preferiblemente de manera que la temperatura del contenido no exceda aproximadamente 35ºC, y preferiblemente es una temperatura por debajo o alrededor de la temperatura ambiente, por ejemplo, aproximadamente 10 hasta aproximadamente 25ºC. El contenido del recipiente 50 puede ser transferido a un tanque de almacenamiento (no mostrados) o un contenedor equivalente tal como un vagón o un remolque. En lugar de la alimentación separada representada en la figura 1 de ácido sulfámico, de solución acuosa de hidróxido de sodio al 10-50% en peso, y agua que se alternan hacia delante y hacia atrás entre uno y otro de los reactores 30 y 40 mientras que el otro reactor está haciendo de lado, pueden alimentarse flujos separados de la solución acuosa de hidróxido de sodio y una pasta acuosa formada de sulfámico de manera alternativa a esos reactores. Puede esperarse que otras variaciones y detalles en el diagrama de flujo de planta esquemático representado y/o en el modo de operación serán ahora fácilmente evidentes para aquellos de práctica ordinaria en la técnica. Controles de flujo de proceso automáticos Al conducir procesos continuos como los descritos anteriormente, los diversos procesos continuos en sus modalidades son llevados a cabo preferiblemente con controles de flujo de procesos automáticos que van a ser descritos ahora. Diagramas de flujo como ejemplo involucran los controles de flujo de procesos automáticos como los representados esquemáticamente en las figuras 2 y 3. Ambos diagramas de flujo tales utilizan el mismo método para dar alimentar simultáneamente en bromo, cloro y sulfamato de sodio. La diferencia entre los dos es que la figura 2 requiere los recipientes. El primer recipiente se utiliza para neutralizar el ácido sulfámico a sulfamato de sodio. El segundo recipiente se utiliza como tanque de alimentación para alimentar de manera continua sulfamato de sodio al resto del proceso. El diagrama de flujo de la figura 3 es un proceso de “un recipiente” que utiliza un recipiente reactor sencillo para neutralizar de manera continua el ácido sulfámico y alimentar sulfamato de sodio al resto del proceso. Debe notarse que las figuras 2 y 3 ilustran diagramas de flujo ejemplo e involucran control de flujo de procesos continuos automático en las etapas de (a) formar cloruro de bromo o cloruro de bromo que contiene algún exceso de bromo elemental a partir de bromo y cloro, y (b) que forma una solución de reacción que contiene bromo activo acuosa que tiene (numérico) un pH en el rango de 7 a 11 y preferiblemente un pH en el rango de 8 a 10, (2) un contenido de bromo activo de al menos aproximadamente 50.000 ppm (peso/peso), y preferiblemente al menos 100000 ppm (peso/peso), (3) una relación atómica de nitrógeno a bromo activo que se origina en el cloruro de bromo o en el cloruro de bromo más exceso de bromo elemental, y el sulfamato y la base que está siendo usada en el proceso hasta esta etapa, y (4) sino al contenido de sulfato presente, una cantidad de sulfamato tal que la relación molar de sulfato a sulfamato en la solución sea menor de aproximadamente 0.2 y preferiblemente menor de aproximadamente 0.05. Características de control de flujo automáticos similares pueden ser aplicadas y se desea alimentar la base a esta reacción que contiene bromo activo acuoso para incrementar el pH hasta al menos 12 o preferiblemente hasta un pH quiste al menos en el rango de 13.0 a 13.5. Las siguientes descripciones de proceso con referencia a las figuras 2 y 3 utilizan la lógica de control de procesos de retroalimentación. Una descripción de los elementos de instrumentación típicos se provee aquí para ayudar un mejor entendimiento de cómo trabaja esta lógica de procesos. Un núcleo de control de retroalimentación (para control de flujo) consiste de tres elementos (uno un dispositivo sensor para medir el flujo, (dos) una válvula de control para variar el flujo y (3) un controlador de flujo para dirigir la válvula de control que se abre o se cierra según sea necesario para mantener el flujo deseado. Un bucle de control de retroalimentación (para control de pH) consiste de tres elementos: (1) un dispositivo sensor para medir el pH, (2) una válvula de control para variar el flujo, y (3) un controlador de flujo para dirigir la válvula de control para que se abra o cierre según sea necesario para mantener el pH deseado. Se han utilizado medidores de flujo de masas Micro Motion coriolis en procesos anteriores con exactitud de flujo y son representados en las siguientes descripciones de proceso. Estos instrumentos están disponibles en Micro Motion, Inc. USA, 7070 Winchester Circle, Boulder, CO 80301. Estos instrumentos particulares usan tecnología coriolis para proveer una indicación directa de la rata de flujo de masas (en oposición a una indicación de flujo volumétrica que 12 ES 2 269 498 T3 5 10 15 20 25 30 debe ser convertida en unidades de masa y corregida en cuanto a la variación de temperatura) y también contiene un transmisor de señales de flujo utilizado para proveer señales de flujo de retroalimentación a un ordenador del sistema de control. La especificación de tamaño del medidor de masa depende de la magnitud del flujo deseado, de las características de densidad/viscosidad del líquido que fluye y de la calidad de presión inherente con la tubería asociada. Las válvulas de control automáticas típicas son accionadas neumáticamente para elevar/bajar, un vástago en el cuerpo de la válvula. Una “pestaña” está maquinada y contorneada específicamente unida al vástago y reside internamente en el camino de flujo dentro del cuerpo de la válvula. La pestaña sirve para variar el tamaño del orificio de flujo a medida que el pasado se mueve hacia arriba y hacia. El tamaño de la Pestaña está especificado para proveer un rango de flujo particular para una caída de presión dada a través de la válvula. La señal de actuación neumática está provista típicamente a partir de un dispositivo y/de utilizado para convertir una señal electrónica de un controlador (usualmente medida en miliamperios un rango de 4-20 mA) a una señal neumática correspondiente (usualmente medida en una prisión de paso con un rango de 20-103 kPa [rango de 3-15 psig]). Se suministra aire a un dispositivo I/P que a su vez suministra una presión precisa para actuar la válvula. El dispositivo I/P está usualmente en una escala 0-100% de una señal electrónica de 4-20 mA que corresponde a una señal neumática de 20-103 kPa (3-15 kPa (15% psig) = 100% flujo). La representación de los dispositivos I/P ha sido emitida en los diagramas de flujo propuestos de las figuras 2 y 3 puesto que se asumen que universalmente se requiere la especificación de tamaño de la válvula en particular que depende de la calidad de presión deseada a través de la válvula, del tamaño del tubo, y la selección de la que Pestaña para proveer el rango de flujo deseado. Las válvulas de control para 1.27 cm (1/2 pulgada) a 2.54 cm (1 pulgada) en líneas de proceso son disponibles típicamente en Badger Meter, Inc. Industrial Division, 6116 East 15th St., Tulsa, OK 74158. El controlador es el corazón del bucle de control y es usualmente una “caja negra” dentro del software del ordenador del sistema de control. La mayoría de los controladores son de uno de tres tipos: proporcional (3), proporcional integral (PID), un proporcional integral derivado (equilibrio). Los nombres reflejan el tipo de acción de respuesta será, para ajustar la señal de control. No se proveerán descripciones detalladas de cada tipo aquí, puesto que estas características son conocidas para aquellos que tengan una práctica ordinaria en el arte del control de proceso automático. La mayoría de los bucles de control utilizan controlador P/I debido a la naturaleza de respuesta rápida de la medición de flujo y del control de válvula. El bucle de control de retroalimentación global funciona como sigue: 35 Un valor de flujo deseado (punto de partida) es introducido en el controlador. Un dispositivo sensor mide el flujo actual (variable medida) y regresa el valor del flujo de corriente al controlador. El controlador calcula el error entre la variable medida y el valor fijado deseado. El controlador suministra entonces una señal al I/P y a la válvula de control para variar la posición (variable manipulada) de la válvula de control bien para reducir o incrementar el flujo con el fin de minimizar el error entre los valores reales y deseados de flujo. 40 La determinación de la rapidez o de cuánto varía a la posición de la válvula de control depende de los parámetros de sincronización suministrados al controlador para una respuesta integral proporciona. El bucle de controles “sintonizados” cambiando estos parámetros para alcanzar una respuesta óptima (minimización del error) para procesar cambios en los puntos variables o fijados. 45 Los procesos de las figuras 2 y 3 utilizan control de flujo de relación de cascada con estantes para producir de manera continua las composiciones biocidas líquidas concentradas. El control de la relación de cascada está basado en los bucles de control de retroalimentación. Para este tipo de control, se controla una corriente de material fijado del flujo deseado. El transmisor de flujo que provee la respuesta de retroalimentación al controlador, usualmente llamado el controlador maestro, envía también una señal de flujo a un controlador de radio. Esta señal se convierte en el punto de partida para unos o controlador de flujo de corriente de material y por lo tanto de la cascada terminal. Este controlador, usualmente denominado el controlador esclavo, provee una señal para controlar la válvula que controla el flujo de una segunda corriente de material. Un elemento de flujo en la segunda corriente mide el flujo y enviar de regreso una señal al controlador de relación de flujo. El controlador secundario calcula el error entre el valor de flujo medido y el punto de partida suministrado de manera remota. El controlador secundario provee entonces una señal para variar la segunda válvula de control de acuerdo para mantener el flujo secundario como una relación del flujo primario. 50 55 60 Los dos controladores son usualmente contenidos como elementos en bloque individuales dentro del soporte de operación de un sistema ordenador de control de proceso. Un sistema de control típico es Foxboro I/A Distributed Control System (DCS). Figura 2 65 Se hará referencia ahora específicamente a la figura 2. Esta figura describe como un sistema de control de flujo en el cual el sulfamato del metal alcalino forma sulfamato de sodio utilizando hidróxido de sodio. Sin embargo, el sistema es aplicable para utilizar otros sulfamato de metales alcalinos formados utilizando bases solubles en agua diferentes al hidróxido de sodio. La base de control para el proceso de la figura 2 ese sistema de control de flujo en relación de cascada está antes empleado para controlar simultáneamente la rata de flujo de cloro en una relación dada de una 13 ES 2 269 498 T3 rata de flujo deseada de bromo. La rata de flujo combinado total bromo/cloro se usó entonces para simultáneamente controlar en la rata de flujo de sulfamato de sodio a una rata deseada de la rata de flujo de bromo/cloro. 5 10 15 20 25 Uno de los recipientes representados se utiliza para neutralizar el ácido sulfámico para formar sulfamato de sodio. La carga de algo deseada se añade a tal recipiente. Se carga ácido sulfámico sólido desde bolsas individuales o sacos hasta el mismo recipiente con agitación para formar una solución pastosa de ácido sulfámico uso. Una solución acuosa de soda cáustica (NaOH) 10-50% es alimentada a la solución de ácido sulfámico para formar sulfamato de sodio. La solución de sulfamato de sodio es transferida entonces a través de presión con una bomba al segundo recipiente representado que está equipado con un bucle de circulación de bombeo. Una corriente de alimentación desde el bucle de circulación es utilizada para alimentar sulfato de sodio a la porción continua restante del proceso. Se alimenta bromo líquido continuamente desde un recipiente de suministro de bromo presurizado. El bromo (corriente primaria) fluye a través de un medidor de flujo de masas micro mucho en nuevo a través de una válvula de control automática. La rata de fuego de bromo deseada es introducida como punto de partida al controlador de flujo de bromo (controlador maestro). El controlador de flujo el día en sus una señal a la válvula de control de bromo para variar el flujo con el fin de mantener la rata de flujo deseada. Una válvula de inspección de una vía es instalada corriente abajo de la válvula de control de bromo para prevenir un retro flujo en la línea de suministro de bromo. Se suministra cloro líquido de manera continua a partir de un recipiente suministro en volumen bien a través de la presión de vapor de un tanque o aumentada compresión de nitrógeno. El cloro (corriente secundaria) fluye entonces a través de un medidor de flujo de masas micro muestran y luego a través de una válvula de control automática. La señal de rata de flujo del primer medidor/transmisor del flujo de masa de bromo primario es enviada al controlador de flujo de relación de cloro como un punto de partida remoto. El controlador de flujo relación de cloro en vientos una señal a la válvula de control de cloro para variar el flujo de cloro de acuerdo con la rata de flujo de bromo. Una válvula descripción de una vía es instalada corriente abajo de la válvula de control de cloro para prevenir el retro flujo en la línea de suministro de cloro. Las líneas de bromo y cloro son puestas juntas en un mezclador estático y elementos, comúnmente disponible en Koch Engineering Company, Inc., P.O. Box 8127, Wichita, KS 67208. 30 El mezclador estático funciona para proveer una mezcla en la línea dinámica con mínimo espacio lineal y sin partes móviles. 35 40 45 50 55 Las señales de rata de flujo de ambos medidores/transmisores de la masa de flujo de bromo y cloro son salidas así el sistema de control del ordenador y se suman entre sí para tener una rata de flujo global de ambas corrientes. El valor de la rata de flujo global es enviado entonces a un segundo controlador de flujo de relación como un punto de partida remoto para la corriente de sulfamato de sodio. La corriente de sulfamato de sodio suministrada a partir depresión con bomba desde el bucle de circulación, bombeo del segundo recipiente representado. Esta corriente fluye a través de un medidor de flujo de masas micro mucho a través de una válvula de control automática. La señal de la rata de flujo y el medidor/transmisor de flujo de masa de sulfamato de sodio es enviada al controlador de radio que limpie una señal a la válvula de control para variar la rata de flujo de sulfamato como una relación de la rata de flujo combinada bromo/cloro. Una válvula de revisión de una vía se instala corriente abajo de la válvula de control de sulfamato de sodio para prevenir el retro flujo en la línea de suministro de sulfamato de sodio. La corriente de sulfamato de sodio y la corriente combinada bromo/cloro que sale del primer mezclador estático se juntan en un segundo mezclador estático multi elementos. Pueden añadirse soda cáustica adicional después del primer mezclador estático, cuya rata de agresiones controlada por un medidor de pH corriente abajo de este segundo mezclador estático multi elemento tal que el pH del líquido que sale del segundo mezclador estático multi elemento está en el rango deseado. La corriente salida de este mezclador estático es la solución de reacción acuosa que contienen bromo activo que tiene (1) un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 8 a 10, (2) un contenido de bromo activo de al menos 50000 ppm (peso/peso) y preferiblemente de al menos 100000 ppm (peso/peso), (3) una relación atómica de nitrógeno a bromo originado desde el cloruro de como o cloruro de bromo con exceso de bromo elemental, y los ambos sulfamato en la base en el proceso hasta esta etapa, y (4) no está presente un contenido adicional de sulfato o sin sulfato está presente una cantidad de sulfamato tal que la relación molar de sulfato sulfamato en la solución es de aproximadamente 0.2 como máximo, y preferiblemente menos de aproximadamente 0.05. Como se notó anteriormente, es preferible elevar el pH de esta solución en relación hasta al menos aproximadamente 12 y preferiblemente un pH quiste al menos en el rango de 13.0 a 13.5 por inclusión dentro del mismo de base adicional, tal como hidróxido de sodio, cuando entonces la composición biocida líquida concentrada deseada, la cual es enviada a un tanque de almacenamiento del producto en volumen. 60 65 La ventaja del sistema de flujo de proceso de la figura 2 es que la preparación de la solución de sulfamato de sodio puede tomar lugar utilizando las diferentes porciones del proceso. El agua, la soda cáustica, y el ácido sulfámico puede ser creados como operaciones de lote normal, solución que está siendo preparada con anticipación y transferida al recipiente de alimentación de sulfamato sodio según se requiera. Adicionalmente, el proceso completo puede ser controlado introduciendo un punto de partida sencillo para la rata de flujo del bromo deseada. Todas las otras ratas de flujo de los materiales son obtenidas como puntos de definición internos remotos. Debe notarse que la magnitud de las ratas del grupo deseadas para los controladores de radio está típicamente configurada con el controlador individual como parámetro fijado en oposición a los valores enterados por el usuario. 14 ES 2 269 498 T3 Figura 3 5 10 15 20 Los flujos de proceso y los sistemas de control de la figura 3 serán considerados ahora. Como en el caso de la figura 2, la figura 3 se describe con referencia un sistema de control de flujo en el cuarto el sulfamato de metal alcalino de sulfamato de sodio. Sin embargo, el sistema es aplicable para el uso de cualquier sulfamato de metal alcalino soluble en agua que se forme utilizando bases de metales alcalinos solubles en agua. El proceso de la figura 3 elimina el recipiente segundo representado la figura 2, el recipiente que es causado en la figura 2 como un recipiente de suministro de sulfamato de sodio. El sistema global de la figura 3 involucra elementos de control adicionales para el recipiente sencillo de la figura 3 para neutralizar de manera continua el ácido sulfámico y para alimentar solución de sulfamato de sodio al proceso. El proceso de mezcla continua para alimentar bromo, cloro y sulfamato de sodio permanece como la figura 2. En el proceso de la figura 3, una solución acuosa de soda cáustica 10-50% se alimenta al recipiente de reacción representado a través de un medidor de flujo de masas micro muestran y luego a través de una válvula controladora de flujo automática. Un punto de partida de la rata de flujo de soda cáustica deseado es introducido en el controlador de rata de flujo de soda cáustica. El controlador de flujo de soda cáustica en bien entonces una señal a la válvula de control para variar adecuadamente el flujo de soda cáustica con el fin de mantener la rata de flujo deseada. La señal de rata de flujo desde el medidor de flujo transmisor del flujo de masa de soda cáustica es enviada también como un punto de partida remoto a un controlador de flujo de la relación de agua. Se alimenta agua al recipiente de reacción ilustrado a través de un medidor de flujo de masa Micro Motion a través de una válvula de control automática. El controlador de relación de agua puede enviar una señal a la válvula de control para variar el flujo de agua como una relación de la rata de flujo de soda caústica. 25 30 35 40 45 Se carga ácido sulfámico sólido al recipiente representado a una rata de flujo consistente con el flujo agua/soda cáustica para proveer la necesaria concentración de ácido sulfámico/sulfamato de sodio dentro del recipiente. Una válvula rótulo se instala típicamente en la línea de carga de sólidos para cumplir con la alimentación de sólidos a una rata de flujo establecida. Este tipo de válvula es una válvula rotatoria de pasos múltiples acoplada con un motor de corriente directa (d. C.) con un controlador de velocidad. La velocidad del motor se ajusta para proveer la rata de alimentación de sólidos (como se determina a partir de la calibración separada de velocidad vs. rata de flujo). El sistema no puede adicionalmente ser mejorado por instrumentación para control de retroalimentación automática. Esto se logra usualmente montando el separador de sólidos que alimentan la válvula rótulo en celdas de peso. Para estatización, se introduce una rata de alimentación de sólidos deseada en un controlador de alimentación. La rata se obtiene por cálculo interno de la perdida en peso con el tiempo el título dos de sólidos. Si la carga de ácido sulfámico en su sistema está instrumentada para control automático, la extensión lógica al controlador de flujo de cáusticos como un punto de partida remoto para el flujo de cáusticos deseado. Puesto que esta capa consiste de una reacción de neutralización, se requiere un cierto tiempo de residencia para una neutralización completa a sulfamato de sodio. La información disponible indica que la neutralización es una transferencia de masa limitada por la rata de alimentación de la soda cáustica y también por la capacidad enfriador o del reactor. Esta reacción es en alguna manera hizo térmica y requiere enfriamiento para remover el calor generado. Una bomba de circulación alrededor del bucle es una manera de proveer suficiente tiempo de residencia sin sulfamato de sodio requerido cuya una rata para el resto del proceso no excesivamente larga. Se alimentan entonces bromo cloro, soda cáustica y sulfamato de sodio, con un control de flujo y control de pH, de manera idéntica como en el proceso de la figura 2. El sulfamato de sodio se alimenta de manera continua tomando una corriente alimentación de la bomba alrededor del bucle de circulación del reactor y siendo a través de un medidor de flujo de masa y una válvula de control. La rata de flujo deseadas y tiene como un punto de partida remoto para un controlador de flujo desde la suma de la rato de alimentación total bromo/cloro. 50 La ventaja del proceso de la figura 3 es la eliminación de un recipiente de proceso. Esta eliminación es compensada, al menos hasta cierto grado, por el uso de elementos de control adicionales requeridos para alimentar agua, soda cáustica y ácido sulfámico. 55 60 65 Se entenderá y aprecia el sistema de control de flujo automáticos descritos aquí pueden ser utilizados efectivamente en procesos diseñados diferentes a los representados en las figuras 2 y 3. Un ejemplo de tales otros procesos diseñados se describe con referencia a la figura 1. Un procedimiento general para preparar las composiciones de esta invención sobre la base de lotes utilizando ácido sulfámico involucra, como una primera etapa, la formación de una pasta de ácido sulfámico en agua. Típicamente, el pH está pasta está por debajo de 1 unidad de pH. Se añade entonces hidróxido de sodio acuoso en una concentración adecuada, por ejemplo, 25% a 50% de concentración, hasta que el sólidos se disuelva completamente. Se añade NaOH adicional hasta que el pH deseado en el rango de 7 a 11 se ha alcanzado. La solución resultante corresponde entonces a (b) más arriba. La alimentación de (a) a (b) por la alimentación de cada uno de (a) y (b) en el recipiente de reacción se inicia entonces a una rata para permitir que (a) se disuelva y reaccione con el ácido sulfámico sin formar un poso de halógeno en el fondo del reactor, y sin hacer que el pH de la solución resultante materialmente se separe del rango de 7 a 11 (o del rango de 8 a 10, si este rango de pH preferido es el que se va a utilizar). Se alimenta entonces hidróxido de sodio (por ejemplo de 25% a 50%) al reactor para mantener el pH en el rango de 7 a 11, y preferiblemente del rango 15 ES 2 269 498 T3 de 8 a 10. Se ha encontrado que las soluciones estables que contienen más del 26% de bromo activo (por encima de 11.5% sobre una base de cloro activo) puede ser preparados por la tecnología de proceso de esta invención. 5 10 15 La fuente de iones sulfamato, tal como un sulfamato de metal alcalino hubo agua que contiene iones sulfamato, se deriva preferiblemente del ácido sulfámico neutralizando el ácido sulfámico con una cantidad de base de metal alcalino para neutralizar totalmente el ácido, o mezclando una sal de metal alcalino soluble en agua del ácido sulfámico con agua. El uso de, o la formación de, una sal de metal alcalino del ácido sulfámico es un rasgo deseable de esta invención puesto que ésta sale son más solubles en agua y el ácido sulfámico mismo, y así la mezcla de reacción contendrá una concentración más alta de anión sulfamato que pueda ser provisto para el uso del ácido sulfámico. Es posible, sin embargo, alimentar ácido sulfámico mismo puesto que la mezcla de reacción contendrá agua y base de metal alcalino, y así se formará el anión sulfamato en la mezcla de reacción. Las sales de metales alcalinos utilizados son usualmente sales de litio, sodio o potasio, así como las sales de rubidio y cesio, y aunque utilizables, tiene de hacer considerablemente más costosas. De estas sales, se prefiere el sulfamato de calcio, y el sulfamato de sodio es el más preferido del ácido sulfámico junto con un proceso de esta invención, la base utilizada para formar tales sales es una base de metales alcalinos. Mientras que pueden usarse diversas sales de metales alcalino (por ejemplo carbonato de metales alcalinos tales como carbonato de sodio), de litio, sodio o potasio, son usados típicamente, de nuevo por razones de costes, y de éstos se prefieren el hidróxido de potasio o el óxido de potasio, siendo el hidróxido de sodio o el óxido de sodio más preferidos. El más preferido es el hidróxido de sodio. Pueden utilizarse mezclas de bases de metales alcalinos, si se desea. 20 25 30 35 40 45 La base de metal alcalino que puede ser como alimentada a la mezcla de reacción para mantener el pH en el rango de 7 a 11 y preferiblemente en el rango de usuarios durante la alimentación de (a) y (b), y para incrementar el pH de la solución después de la terminación de tales alimentación es hasta al menos 12 y preferiblemente hasta un pH esté al menos en el rango de 13 a 13.5 son las bases de metales alcalinos, incluyendo las preferencias, con referencia al párrafo inmediatamente precedentes. Mientras que la base utilizada durante la alimentación y la base utilizada después de la alimentación pueden diferir una de otra, se prefiere utilizar la misma base de metal alcalino, preferiblemente óxido de potasio o hidróxido de potasio, y más preferiblemente óxido de sodio o hidróxido de sodio, y lo más preferiblemente hidróxido de sodio, en ambas tales operaciones. La duración del período de tiempo entre (i) la terminación de la alimentación de (a) en (b) o la terminación de las alimentación es separada de (a) y (b) en el recipiente de reacción; y quinto el comienzo de la visión de base adicional para elevar el pH de la solución producida hasta al menos 12 y preferiblemente hasta un pH y está al menos en el rango de 13 a 13.5, puede variar dentro de límites razonables. La estabilidad de especies de bromo activas, aunque estabilizadas por el sulfamato, se incrementan con el incremento del pH. Así si, después de terminar la alimentación de (a) a (b) o las alimentación es separada de (a) y (b) en el recipiente de reacción, la solución de producto tiene un pH de 7, el pH debería ser incrementado con menos temor a que si la solución de producto después de la terminación de tales alimentación es tiene un pH de 11. El sentido común debe ser ejercitado entonces para determinar durante cuánto tiempo, si es así, debe esperarse después de completar la alimentación antes de incrementar el pH por adición de la base de metal alcalino hablando en general, cuanto más corto sea el período entre la terminación de la alimentación y el incremento de pH, mejor si por casualidad una solución de productos se ha dejado en reposo durante más tiempo del usual sin haber incrementado a un su pH, una muestra del producto en solución puede ser sometida a titulación almidón y todo para determinar la concentración de un bromo activo en la solución de producto. Si la concentración es más baja que la deseada, el producto puede ser sometido a limitaciones adicionales para incrementar la concentración de bromo activo en la solución hasta el nivel deseado, seguida por la etapa de incrementar el pH del producto hasta al menos 12 aproximadamente y preferiblemente hasta un pH quiste al menos en el rango de 13 a 13.5. Al elevar el pH de la solución de producto después de la alimentación, los incrementos paso a paso del pH pueden utilizarse si se desea. Sin embargo se prefiere usualmente elevar el pH hasta el nivel de pH final pretendido en una sola etapa. 50 55 60 65 Las operaciones de proceso pueden ser conducidas bajo condiciones ambiente ordinarias, es decir, iniciando la reacción a temperatura ambiente y no aplicando calor durante la reacción. Sin embargo, se prefiere enfriar la mezcla de reacción de manera que la temperatura de la reacción en mezcla se mantenga por debajo de aproximadamente 35ºC (por ejemplo, en el rango de 25 a 35ºC) a lo largo de todo el período de reacción. El intercambio de calor indirecto con un fluido de enfriamiento tal como aire refrigerado o agua de enfriamiento es una forma conveniente de mantener la temperatura de la reacción por debajo de aproximadamente 35ºC. Sin embargo, pueden usarse otros métodos de enfriamiento, si se desea. También las temperaturas por debajo de la temperatura ambiente pueden ser usadas, si se desea. Una forma preferida de llevar a cabo el proceso en una base de lotes utiliza un reactor recubierto en vidrio equipado con un mezclador mecánico, un tubo de profundidad para alimentar el cloruro de bromo por debajo de la superficie al líquido contenido en el reactor, y un bucle de bombeo que incluye un intercambiador de calor para enfriar el contenido que fluye en el buque. El procedimiento de operación es cargar al reactor, enfriar el agua por debajo de 25ºC, añadir solución acuosa al 50% al reactor, enfriar la mezcla por debajo de 25ºC y luego añadir ácido sulfámico mientras se mantiene la temperatura por debajo de aproximadamente 25ºC y agitar el contenido del reactor. Luego se inician las alimentaciones separada de cloruro de bromo y NaOH acuosa, conteniendo el cloruro de bromo y en la cantidad estquiométrica de bromo para BrCl, esto es, 69.3% en pesos de Br2 o un pequeño exceso de bromo de hasta aproximadamente 0.1 mol por mol del BrCl, tal como aproximadamente 0.034 moles de exceso de bromo 16 ES 2 269 498 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 por mol de BrCl Durante ésta co-alimentación la temperatura del contenido del reactor se mantiene por debajo de aproximadamente 20ºC, el contenido de la reacción es agitado, y el pH del contenido del reactor es mantenido a 9.0 hasta 9.5. Después de que estas alimentaciones hayan sido completadas, la mezcla resultante se mantiene bajo estas condiciones durante un período de marcha de aproximadamente 15 minutos. Luego se añade solución acuosa de NaOH al 50% en una cantidad suficiente para llevar el pH hasta aproximadamente 13.0-13.5. Al conducir esta operación los componentes están proporcionados preferiblemente para producir una solución de producto final que tienen las siguientes características: un pH de 13.1; un contenido de bromo activo de 15.5% en peso (esto es, 155.000 ppm (peso/peso) de bromo activo); una relación atómica de nitrógeno a bromo activo original del ácido sulfámico y del cloruro de bromo (mas el pequeño exceso antes citado de bromo, si tal exceso está presente) cargado al reactor de 1.4: y una gravedad específica de >1. 31 a 20ºC. El término “bromo activo” se refiere desde luego a todas las especies que contienen bromo que son capaces de actividad biocida. Se acepta en general en la técnica que todo el bromo del estado de oxidación +1 tiene actividad biocida y se incluya así en el término “bromo activo”. Como es bien conocido en la técnica, el bromo, el cloruro de bromo, el ácido hipobromoso, el ión hipobromito, el bromuro de hidrógeno, el ión tribromuro, y los compuestos órgano-N-bromados tienen bromo en el estado de oxidación + 1. Así estos lo mismo que otras especies tales en el grado en que estén presentes constituyen el contenido de bromo activo de las composiciones de esta invención. Véase, por ejemplo US 4,382,779 y US 5,679,239. Un método y establecido en la técnica para determinar la cantidad de bromo activo en una solución es la titulación almidón-yodo, la cual determina todo el bromo activo en una muestra, independientemente de que éste sí pueda constituir el bromo activo. La utilidad y exactitud del método clásico almidónyodo tienen todo para la determinación cuantitativa del bromo y de muchos otros agentes oxidantes ácido conocida durante mucho tiempo, como lo atestigua el capítulo XIV de Willard-Furman, Elementary Quantitative Analysis, Third Edition, D. Van Nostrand Company, Inc., New York, Copyright 1933, 1935, 1940. Una titulación típica almidón-yodo para determinar el bromo activo se lleva a cabo como sigue: un agitador magnético y 50 ml de ácido acético glacial se colocan en un matraz con yodo. La muestra (usualmente de alrededor de 0.20.5 g) para la cual se va a determinar el bromo activo se pesa y se añade al matraz que contiene el ácido acético. Se añade entonces agua (50 ml) y yoduro de potasio acuoso (15% (peso/peso); 25 ml). El matraz es tapado utilizando un sello de agua. La solución es agitada entonces durante 15 minutos, después de la cual el matraz es destapado y el tapón y el área de sellado son enjuagados dentro del matraz con agua. Una bureta automática (Metrohm Limited) es llenada con solución 0.1 normal de tiosulfato. La solución en el matraz de yodo es titulada con el tiosulfato de sodio 0.1 normal; cuando se observa un leve color amarillo, se añade 1 ml de una solución de almidón al 1% en peso, también el color de la solución en el matraz del amarillo tenue a azul. Se continúa la titulación con tiosulfato de sodio hasta que el color azul desaparezca; la cantidad de bromo activo es calculada utilizando el peso de la muestra y el volumen de solución de tiosulfato de sodio titulada. Así, la cantidad de bromo activo en una composición de esta invención, independientemente de la forma química real, puede ser determinada cuantitativamente. Una modalidad adicional de esta invención es una composición biocida líquida concentrada que comprende una solución acuosa que contiene un compuesto estable que oxida el bromo -esto es un contenido de bromo activo establedesde la solución es libre de bromato detectable, y la solución está bien libre de sulfato, o si el sulfato está presente, la relación molar de sulfato a sulfamato en la composición biocida líquida concentrada según se forma es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. Preferiblemente tal composición desde su formación está libre de cantidades detectables de formato, o en otras palabras, la solución contiene en todo momento de su formación menos de 50 ppm de bromato. Tal es composiciones biocidas líquidas concentradas pueden ser producidas mediante el uso de la tecnología de proceso de esta invención. El contenido de bromo activo de las composiciones biocidas líquidas concentradas de esta invención es típicamente al menos alrededor de 50000 ppm (peso/peso) (esto es, al menos aproximadamente 5% en peso), preferiblemente al menos aproximadamente 100.000 ppm, y más preferiblemente al menos aproximadamente 120.000 ppm, con base en el peso total de la solución acuosa, las composiciones que contienen en el rango de 145.000 a 160.000 ppm (peso/peso) el bromo activo puede ser preparadas siguiendo esta invención. Cantidades por encima de 160.000 ppm (peso/peso) también están dentro del alcance de esta invención. En otras palabras, cualquier concentración de los componentes de bromo activo estabilizados anteriores alrededor de 160.000 ppm (peso/peso) que no resultan en la formación de precipitado durante el almacenamiento o transporte de la solución concentrada bajo condiciones de temperatura ambiente normal constituye una composición de esta invención. Cuando se utilizan para control microbiológico, las soluciones concentradas de esta invención son mezcladas frecuentemente o diluidas con, o introducidas en, agua adicional, la cual típicamente es el agua que está siendo tratada para tal control microbiológico, de manera cada cantidad de bromo activo en el agua que está siendo tratada para control microbiológico es una cantidad micro biológicamente efectiva. Las diversas composiciones de las modalidades mencionadas en este párrafo preferiblemente contienen de manera adicional-es cloruro disueltos, más preferiblemente en la presencia de un exceso estquiométrico de un catión de metal alcalino, tal como cationes sodio o potasio. En contraste con algunos otras sales de metales alcalinos, las sales de cloruro de metales alcalinas tienen alta solubilidad es el medio acuoso de los concentrados de esta invención, y así no representan un problema con respecto a la formación de precipitado durante el almacenamiento, transporte o utilización. Además, el cloruro de metal alcalino disuelto las soluciones de esta invención minimiza el grado en el cual el oxígeno o el aire se disuelven en las soluciones concentradas. Un rasgo de esta invención es que es innecesario producir las composiciones biocidas acuosa son centradas de esta invención mediante el uso de oxidantes poderosos tales como ozono o peróxidos, los cuales se sabe que poseen 17 ES 2 269 498 T3 características indeseables y en efecto peligrosas. Así a partir de la iniciación de su producción, las composiciones de esta invención, aunque no purificadas, son y permanecen en todo momento libres de cantidades adversas de peróxidos. Aún otras modalidades de esta invención incluyen lo siguiente: 5 10 15 20 25 1) una composición biocida concentrada que contiene ión bromonio estabilizado con sulfamato, teniendo tal composición (i) un pH de al menos 2 y preferiblemente al menos en el rango de 13 a 13.5, (ii) desde su formación no ha tenido un pH por debajo de 6, (iii) desde su formación no ha tenido un pH por debajo de 7 por un tiempo más allá total de aproximadamente una hora, (iv) no habiendo tenido un contenido de sulfatos un contenido de sulfatos en la cual la relación molar de sulfato a sulfamato en la composición que sea menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05, y (v) teniendo al menos 5% en peso preferiblemente al menos aproximadamente 10% en peso de ión bromonio presente, medido como Br2 , estando basado tal porcentaje en peso en el peso total de la composición. 2) Una composición biocida concentrada que contiene-bromo niño estabilizado con sulfamato, conteniendo tal composición (i) en el rango de 5% en peso hasta al menos 16% en peso ión bromonio, medido como Br2 , estando basado tal porcentaje en peso en el peso total de la composición, (ii) antes de su inicio no teniendo un pH por debajo de 6, (iii) desde su inicio no teniendo un pH por debajo de 7 durante más de un período total de aproximadamente una hora, (i) no teniendo contenido de sulfato un contenido de sulfato en el cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05, y (v) desde su inicio, estando libre de cantidades detectables-bromato. 3) Una composición biocida concentrada que contiene ión bromonio estabilizado con sulfamato, conteniendo tal composición (i) al menos aproximadamente 5% en peso y preferiblemente al menos 10% en peso ión bromonio, medido como por un, estando basado tal porcentaje en peso en el peso total de la composición, (ii) teniendo un pH superior aproximadamente 12, (iii) no conteniendo-bromato detectable, y (iv) no teniendo contenido de sulfato o un contenido de sulfato en el cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. 30 35 40 4) Una composición biocida concentrada que contiene halógeno oxidante estabilizado obtenido por la reacción de (a) BrCl y Br2 , o Br2 y Cl2 y (b) SO3 NH2 , teniendo tal composición (i) hasta aproximadamente 16% en peso ión bromonio, medido como Br2 , basado tal porcentaje en peso en la peso total de la composición, (ii) teniendo un pH de al menos aproximadamente 12 y preferiblemente al menos en el rango de 13 a 13.5, y (iii) no teniendo contenido de sulfato o un contenido de sulfato en el cual la relación molar de sulfato a sulfamato en la composición sea menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. 5) Una composición biocida concentrada que contiene halógeno oxidante estabilizado obtenida por la reacción de (a) BrCl y Br2 , o Br2 y Cl2 y (b) SO3 NH2 , teniendo tal composición (i) un pH de al menos aproximadamente 12 y preferiblemente al menos en el rango de 13 a 13.5, y (iii) no teniendo contenido de sulfato o un contenido de sulfato en el cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. 45 6) Una composición biocida concentrada que contiene halógeno oxidante estabilizado obtenido por la reacción de (a) BrCl y Br2 , o Br2 y Cl2 y (b) SO3 NH2, no teniendo tal composición contenido de sulfato o un contenido de sulfato en el cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. 50 7) Una composición biocida concentrada que contiene al menos 10% en peso de SO3 NH2 , y que no tiene contenido de sulfato o tiene contenido de sulfato del cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. 55 60 65 8) Una composición biocida concentrada que contiene párrafo 8 teniendo tal composición (i) un pH de al menos aproximadamente 12 y preferiblemente al menos en el rango de 13 a 13.5, y (ii) teniendo ningún contenido de sulfato o un contenido de sulfato del cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2 y preferiblemente menor de aproximadamente 0.05. 9) Una composición acuosa que contiene al menos una especie de bromo oxidante estabilizado por sulfamato y que tiene bien ningún contenido de sulfato un contenido de sulfato del cual la relación molar de sulfato a sulfamato en la composición es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05. Preferiblemente, pero no necesariamente, la composición de 1, 2, 3, 7, 8, y 9 inmediatamente anteriores son caracterizadas adicionalmente porque comprenden ión cloruro en solución en las mismas. Como es conocido en la técnica, el bromato es un componente muy indeseable en sistemas acuosos. Por ejemplo, la patente de los Estados Unidos 5,92 2,745 señala que en 1995 la Agencia de Protección Ambiental de los Estados 18 ES 2 269 498 T3 Unidos publicó un artículo identificando algunas preocupaciones de salud relevantes con respecto a la formación del bromato (G. Amy, et al., Water Supply, 1995, 13(1), 157) 5 10 15 y que en el mismo anión la carcinogénesis animal fue vinculada con la presencia de bajos niveles de bromato en agua potable (J. K. Falwell, and G. O’Neill, Water Supply, 1995, 13(1),29). Mientras que algunos procesamientos previos alcanzaron reducciones en la cantidad de bromato formado cuando se producían biocidas que contenían bromo acuoso estabilizado, prevaleció una necesidad o reducciones aún mayores en la cantidad de bromato presenten tales biocidas. Siguiendo esta invención, tales reducciones adicionales han sido hechas posibles. Se cree que debido a las condiciones de pH utilizadas al formar las composiciones de esta invención, la posibilidad de formación de bromato causada por exposición significativa de la composición condiciones ácidas está virtualmente eliminada. El procedimiento analítico para ser utilizado en la determinación de la concentración, si la hay, en bromato en las composiciones de esta invención es un procedimiento de cromatografía iónica, en la cual se emplea la detección ultravioleta. El equipo requerido para conducir este procedimiento es como sigue: a) cromatógrafo de iones Dionex DX-500 fue equivalente, equipado con un detector ultravioleta y un auto muestreador. 20 b) dispositivo de adquisición y análisis de datos-VAX MULTICHROM o un sistema equivalente de recolección y procesamiento de datos de cromatografía. 25 c) columna de cromatografía iónica Dionex IonPac AG9-HC con guarda columna (p/n 051791) en línea con una columna Dionex IonPac AS9-HC (p/n 051786). d) pitetas volumétricas-cualquier tipo estándar de volumen adecuado. e) viales de auto muestreador-1 ml con tapas. 30 f) matraces volumétricos-100 ml. g) jeringa plástica de 5 cm3 . 35 h) Cartucho de pretratamiento OnGuard-H from Dionex (p/n 039596). Las sustancias químicas para su uso en el procedimiento son como sigue: a) agua desionizada con una resistividad específica de 17.8 megaohm-cm o mayor. 40 b) carbonato de sodio, Baker Analyzed®” grado reactivo o equivalente. c) bromato de sodio, Baker Analyzed® grado reactivo o equivalente. 45 Las condiciones utilizadas para la cromatografía de iones son como sigue: eluyente: 4.5 milimoles (m/M de carbonato de sodio) rata de flujo 1.0 ml/minuto 50 volumen de inyección: 50 µl rango del detector: UV a 210 nm 55 60 65 El eluyente se prepara disolviendo 0.47 70 g de carbonato de sodio en 1 l de agua desionizada. Se mezclan bien y las soluciones filtradas a través de un filtro compatible 0.21 C para desgasificar la solución. La solución estándar de bromato concentrada es preparada pesando 0.11 80 g más menos 0.001 g del bromato de sodio en un matraz volumétrico de 100 ml y diluyendo a volumen con agua desionizada. Esto produce una solución que contiene 1000 µg por mililitro de bromato. La solución de bromato concentrada debe prepararse fresca al menos semanalmente. La solución estándar de trabajo de bromato se prepara tomando con pipeta 100 µl de la solución estándar concentrada de bromato en un matraz volumétrico de 100 ml y llenando el matraz hasta volumen con agua desionizada. La solución se mezclan bien, y produce una concentración estándar de 1.0 µg por mililitro de bromato. El procedimiento detallado utilizado para llevar a cabo el análisis de una solución acuosa de esta invención involucra las siguientes etapas: a) pesar 0.25 g de la solución demuestra en un matraz volumétrico de 100 ml. Y llenar a volumen con agua desionizada y mezclar bien. 19 ES 2 269 498 T3 b) enjuagar el cartucho on-guard con 2 ml de agua desionizada. c) cargar 5 ml de la muestra en la jeringa conectada al cartucho OnGUard, pasando a través de él a una rata de flujo de 2 ml por minuto, y descartar los primeros 3 ml. Recoger en un vial de auto muestredor 1 ml y tapar para el análisis. 5 d) analizar las muestras, haciendo inyecciones en duplicado, utilizando las condiciones del instrumento de cromatografía de iones dadas más arriba. Los cálculos involucrados en el procedimiento son como sigue: 10 a) estándar de calibración: para el bromato, calcular un factor de respuesta como sigue: R = A/C donde R. es el factor de respuesta, A es un recuento de área promedio (dos inyecciones), y C es la concentración en microgramos por mililitro (µg/ml). 15 20 25 30 b) Muestras: partes por millón de bromato = A/(RxW) donde A es el área promedio del pico de muestra (dos inyecciones), R. es el factor de respuesta y W es el peso de la muestra en gramos. Aún otras modalidades de esta invención son soluciones biocidas concentradas acuosas estables en almacenamiento y comprenden al menos una especie de bromo activo estabilizado por la presencia en la solución de aniones sulfamato, teniendo tal solución una relación molar de sulfato a sulfamato de menos de aproximadamente 0.2, y preferiblemente menos de aproximadamente 0.05; un contenido de bromo activo de al menos 50000 ppm, preferiblemente al menos 100000 ppm, y más preferiblemente al menos 120000 ppm de solución; una relación atómica de nitrógeno del sulfamato al bromo activo de más de 0.93 y preferiblemente mayor de 1; y un pH de al menos aproximadamente 12, y preferiblemente en el rango de 13 a 13.5, donde la efectividad biocida desdicha solución biocida concentrada acuosa estable es al menos igual y preferiblemente mayor que la efectividad biocida de una solución hecha con los mismos ingredientes en las mismas cantidades y proporciones y de la misma forma, excepto el pH, especialmente efectivo en el control de bacterias, algas, moluscos y biomasa. Se contempla sobre la base de indicaciones experimentales preliminares, que una composición biocida líquida concentrada acuosa formada mediante un proceso de esta invención tendría una mayor efectividad biocida de una composición comparable hecha en la misma forma a partir de los mismos materiales en las mismas cantidades con la excepción de que el pH está bien por debajo de 7 o por encima de 11 durante todo o sustancialmente todo el tiempo de alimentación en A). Así modalidades aún adicionales de esta invención incluyen una composición biocida líquida concentrada acuosa formada por un proceso que comprende: 35 A) alimentar algunos átomos de bromo y átomos de cloro en la forma de uno o más de cloruro de bromo, promueve mental y cloro elemental en (b) agua que contiene aniones sulfamato, o alimentar cada uno de (a) (b) en un recipiente de reacción, tal que la relación numérica del número total de átomos de bromo alimentados frente al número total de átomos de cloro alimentados está en el rango de 1:1 a 1.2:1; y 40 45 B) proveer suficiente base de metal alcalino en la mezcla que está siendo formada en A) para mantener el pH de tal mezcla en el rango de 7 a 11 durante todo o sustancialmente todo el tiempo durante el cual está ocurriendo la alimentación en A), siendo las cantidades de (a) (b) utilizadas cantidades que forman una solución que contienen bromo activo en la cual y por el bromo contenido activo es al menos 50000 ppm (peso/peso), preferiblemente al menos 100000 ppm (peso/peso), y más preferiblemente al menos 120000 ppm (peso/peso) (ii) la relación atómica de nitrógeno a bromo activo que se origina de (a) (b) es mayor que aproximadamente 0.93 y preferiblemente mayor de 1 y (iii) y cualquier sulfato está presente en la solución a medida que se forma al contenido de sulfato es tal que la relación molar de sulfato a sulfamato la solución es menor de aproximadamente 0.2, y preferiblemente menor de aproximadamente 0.05; y 50 C) elevar el pH de la solución que contiene bromo activo así formada hasta al menos aproximadamente 12, y preferiblemente al menos a un pH en el rango de 13 a 13.5, mezclando base de metal alcalino adicional con la misma; 55 60 65 Los siguientes ejemplos se presentan para propósitos de ilustración y no de limitación. En estos ejemplos, las reacciones fueron llevadas a cabo en un matraz de vidrio de 2 l con una sonda de pH, termómetro, agitador mecánico y en los ejemplos 1-4, un tubo 31 75 cm (1/8 de pulgada) de diámetro externo hecho de polímero de teflón marca registrada para alimentar el cloruro de homo, el bromo o el cloro a la mezcla de reacción. El del ejemplo 5 tales dos tubos de inversión fueron usados, uno para alimentar el bromo y el otro para alimentar el cloro. El matraz fue enfriado durante cada reacción mediante el uso bien de un baño de agua externo o de un baño externo de agua y hielo. Se utilizó 11 bomba peristáltica para alimentar la solución acuosa de hidróxido de sodio en la mezcla de reacción, y cuando se utilizó bromo como alimentación de halógeno, se utilizó otra una bomba peristáltica para efectuar la alimentación del bromo. En todo los casas el pH fue monitoreado pisando un medidor de pH Orion Model 520A utilizando un electrodo 8272BN (Orion Research Incorporated, The Schrafft Center, 529 Main Street, Boston, MA 02129). Como es usual en las técnicas de tratamiento de aguas, los resultados se expresan como “cloro disponible total”, aunque en la práctica de esta invención el análisis realmente representa el bromo activo disponible total en el producto formado. 20 ES 2 269 498 T3 Ejemplo 1 5 10 15 20 Un cilindro de alimentación fue cargado con NaOH (313 mL; 401 g, 25% peso). Agua (333 g), ácido sulfámico (232.2 g, 2.39 mol), y NaOH acuoso (653 g, 25% peso) fueron cargados a un reactor de 2 l equipado con un agitador mecánico, el cual fue enfriado a 20ºC a esta solución, se añadió Br2 (139.4 g, 0.87 mol) durante 25 minutos para mantener la temperatura del reactor en o por debajo de 20ºC. Cuando se terminó la adición debe ruedos, el pH de la solución era 11.3. A continuación, la rata de agitación fue incrementada a 600 rpm y se añadió Cl2 (58.1 g, 0.82 mol). Durante la adición de se L2, la temperatura de la solución fue mantenida a todos ellos -18ºC. Cuando se había añadido aproximadamente el 80% del cloro (después de 40 minutos), pH la solución fue 7.28. En este punto, alimentando un poco más de hidróxido de sodio en el cilindro de alimentación, se inició. Mientras se continuaba con las adiciones de hidróxido de sodio y cloro, el pH de la solución fue mantenido entre 6.9 y 7.1, y la temperatura de la solución se mantuvo a 18-23ºC. Después de aproximadamente 10 minutos más, todo el cloro y ácido añadido, y también se detuvo la alimentación del hidróxido de sodio. El pH de la solución fue 6. 9 y se mantuvo a un pH 6.9-7.3 y aproximadamente 20ºC durante una hora; cantidades muy pequeñas adicionales de hidróxido de sodio tuvieron que ser añadidas ocasionalmente para mantener el pH por encima de 6.9. Después de que la hora había pasado, se añadió el resto del hidróxido de sodio del cilindro alimentador, llevando la solución a un pH >12 mientras se mantenía la temperatura del reactor bajo 20ºC. La solución fue analizada por titulación con almidón-yodo, se encontró que contenía 6.49% en peso de “cloro disponible” (esto es, 14.6% en peso de bromo disponible) en un rendimiento del 98%. Los datos detallados sobre las alimentaciones de cloro e hidróxido de sodio se presentan en la tabla 1; las cantidades mostradas son acumulativas. TABLA 1 25 30 35 40 45 50 55 Ejemplo 2 60 65 Un cilindro de alimentación fue cargado con NaOH (313 mL; 401 g, 25% peso). Agua (333 g), ácido sulfámico (232.2 g, 2.39 mol), y NaOH acuoso (653 g, 25% peso) fueron cargados a un reactor de 2 l equipado con un agitador mecánico, el cual fue enfriado a 20ºC a esta solución, se añadió Br2 (139.4 g, 0.87 mol) durante 25 minutos para mantener la temperatura del reactor en o por debajo de 20ºC. Cuando se terminó la adición debe ruedos, el pH de la solución era 11.3. A continuación, la rata de agitación fue incrementada a 600 rpm y se añadió Cl2 (58.1 g, 0.82 mol). Durante la adición de se L2, la temperatura de la solución fue mantenida a todos ellos -18ºC. Cuando se había añadido aproximadamente el 80% del cloro (después de 40 minutos), pH la solución fue 7.28. En este punto, alimentando un poco más de hidróxido de sodio en el cilindro de alimentación, se inició. Mientras se continuaba con las adiciones de hidróxido de sodio y cloro, el pH de la solución fue mantenido entre 6.9 y 7.1, y la temperatura de la solución 21 ES 2 269 498 T3 5 se mantuvo a 18-23ºC. Después de aproximadamente 10 minutos más, todo el cloro y ácido añadido, y también se detuvo la alimentación del hidróxido de sodio. El pH de la solución fue 6.9 y se mantuvo a un pH 6.9-7.3 y aproximadamente 20ºC durante una hora; cantidades muy pequeñas adicionales de hidróxido de sodio tuvieron que ser añadidas ocasionalmente para mantener el pH por encima de 6.9. Después de que la hora había pasado, se añadió el resto del hidróxido de sodio del cilindro alimentador, llevando la solución a un pH >12 mientras se mantenía la temperatura del reactor bajo 20ºC. La solución fue analizada por titulación con almidón-yodo, se encontró que contenía 6.49% en peso de “cloro disponible” (esto es, 14.6% en peso de bromo disponible) en un rendimiento del 98%. Los datos detallados sobre las alimentaciones de cloro e hidróxido de sodio se presentan en la tabla 1; las cantidades mostradas son acumulativas. 10 TABLA 2 15 20 25 30 35 40 45 50 55 Ejemplo 3 60 65 Un cilindro de alimentación fue cargado con NaOH (313 mL; 401 g, 25% peso). Agua (333 g), ácido sulfámico (232.2 g, 2.39 mol), y NaOH acuoso (653 g, 25% peso) fueron cargados a un reactor de 2 l equipado con un agitador mecánico, el cual fue enfriado a 20ºC a esta solución, se añadió Br2 (139.4 g, 0.87 mol) durante 25 minutos para mantener la temperatura del reactor en o por debajo de 20ºC. Cuando se terminó la adición debe ruedos, el pH de la solución era 11.3. A continuación, la rata de agitación fue incrementada a 600 rpm y se añadió Cl2 (58.1 g, 0.82 mol). Durante la adición de se L2, la temperatura de la solución fue mantenida a todos ellos-18ºC. Cuando se había añadido aproximadamente el 80% del cloro (después de 40 minutos), pH la solución fue 7.28. En este punto, alimentando un poco más de hidróxido de sodio en el cilindro de alimentación, se inició. Mientras se continuaba con las adiciones 22 ES 2 269 498 T3 5 10 de hidróxido de sodio y cloro, el pH de la solución fue mantenido entre 6.9 y 7.1, y la temperatura de la solución se mantuvo a 18-23ºC. Después de aproximadamente 10 minutos más, todo el cloro y ácido añadido, y también se detuvo la alimentación del hidróxido de sodio. El pH de la solución fue 6.9 y se mantuvo a un pH 6.9-7.3 y aproximadamente 20ºC durante una hora; cantidades muy pequeñas adicionales de hidróxido de sodio tuvieron que ser añadidas ocasionalmente para mantener el pH por encima de 6.9. Después de que la hora había pasado, se añadió el resto del hidróxido de sodio del cilindro alimentador, llevando la solución a un pH >12 mientras se mantenía la temperatura del reactor bajo 20ºC. La solución fue analizada por titulación con almidón-yodo, se encontró que contenía 6.49% en peso de “cloro disponible” (esto es, 14.6% en peso de bromo disponible) en un rendimiento del 98%. Los datos detallados sobre las alimentaciones de cloro e hidróxido de sodio se presentan en la tabla 1; las cantidades mostradas son acumulativas. TABLA 3 15 20 25 30 35 40 45 50 55 60 65 Ejemplo 4 Un cilindro de alimentación fue cargado con NaOH (313 mL; 401 g, 25% peso). Agua (333 g), ácido sulfámico (232.2 g, 2.39 mol), y NaOH acuoso (653 g, 25% peso) fueron cargados a un reactor de 2 l equipado con un agitador mecánico, el cual fue enfriado a 20ºC a esta solución, se añadió Br2 (139.4 g, 0.87 mol) durante 25 minutos para mantener la temperatura del reactor en o por debajo de 20ºC. Cuando se terminó la adición debe ruedos, el pH de la solución era 11.3. A continuación, la rata de agitación fue incrementada a 600 rpm y se añadió Cl2 (58.1 g, 0.82 mol). Durante la adición de se L2, la temperatura de la solución fue mantenida a todos ellos-18ºC. Cuando se había añadido aproximadamente el 80% del cloro (después de 40 minutos), pH la solución fue 7.28. En este punto, alimentando un poco más de hidróxido de sodio en el cilindro de alimentación, se inició. Mientras se continuaba con las adiciones de hidróxido de sodio y cloro, el pH de la solución fue mantenido entre 6.9 y 7.1, y la temperatura de la solución se mantuvo a 18-23ºC. Después de aproximadamente 10 minutos más, todo el cloro y ácido añadido, y también se detuvo la alimentación del hidróxido de sodio. El pH de la solución fue 6.9 y se mantuvo a un pH 6.9-7.3 y 23 ES 2 269 498 T3 5 aproximadamente 20ºC durante una hora; cantidades muy pequeñas adicionales de hidróxido de sodio tuvieron que ser añadidas ocasionalmente para mantener el pH por encima de 6.9. Después de que la hora había pasado, se añadió el resto del hidróxido de sodio del cilindro alimentador, llevando la solución a un pH >12 mientras se mantenía la temperatura del reactor bajo 20ºC. La solución fue analizada por titulación con almidón-yodo, se encontró que contenía 6.49% en peso de “cloro disponible” (esto es, 14.6% en peso de bromo disponible) en un rendimiento del 98%. Los datos detallados sobre las alimentaciones de cloro e hidróxido de sodio se presentan en la tabla 1; las cantidades mostradas son acumulativas. TABLA 4 10 15 20 25 30 35 40 45 50 55 60 Ejemplo 5 65 Un cilindro de alimentación fue cargado con NaOH (313 mL; 401 g, 25% peso). Agua (333 g), ácido sulfámico (232.2 g, 2.39 mol), y NaOH acuoso (653 g, 25% peso) fueron cargados a un reactor de 2 l equipado con un agitador mecánico, el cual fue enfriado a 20ºC a esta solución, se añadió Br2 (139.4 g, 0.87 mol) durante 25 minutos para 24 ES 2 269 498 T3 5 10 15 mantener la temperatura del reactor en o por debajo de 20ºC. Cuando se terminó la adición debe ruedos, el pH de la solución era 11.3. A continuación, la rata de agitación fue incrementada a 600 rpm y se añadió Cl2 (58.1 g, 0.82 mol). Durante la adición de se L2, la temperatura de la solución fue mantenida a todos ellos-18ºC. Cuando se había añadido aproximadamente el 80% del cloro (después de 40 minutos), pH la solución fue 7.28. En este punto, alimentando un poco más de hidróxido de sodio en el cilindro de alimentación, se inició. Mientras se continuaba con las adiciones de hidróxido de sodio y cloro, el pH de la solución fue mantenido entre 6.9 y 7.1, y la temperatura de la solución se mantuvo a 18-23ºC. Después de aproximadamente 10 minutos más, todo el cloro y ácido añadido, y también se detuvo la alimentación del hidróxido de sodio. El pH de la solución fue 6.9 y se mantuvo a un pH 6.9-7.3 y aproximadamente 20ºC durante una hora; cantidades muy pequeñas adicionales de hidróxido de sodio tuvieron que ser añadidas ocasionalmente para mantener el pH por encima de 6.9. Después de que la hora había pasado, se añadió el resto del hidróxido de sodio del cilindro alimentador, llevando la solución a un pH >12 mientras se mantenía la temperatura del reactor bajo 20ºC. La solución fue analizada por titulación con almidón-yodo, se encontró que contenía 6.49% en peso de “cloro disponible” (esto es, 14.6% en peso de bromo disponible) en un rendimiento del 98%. Los datos detallados sobre las alimentaciones de cloro e hidróxido de sodio se presentan en la tabla 1; las cantidades mostradas son acumulativas. TABLA 5 20 25 30 35 40 45 50 55 Como se anotó anteriormente, el aparato fue el mismo que los demás ejemplos excepto que se utilizaron dos tubos de punta de polímero de teflón de .3175 cm (1/8-pulgada), uno para alimentar el bromo y otro para alimentar el cloro. 60 65 Para emplear las composiciones de esta invención para desinfectar una superficie tal como un drenaje, un suelo, la superficie de una mesa, la superficie de un mostrador, una bañera, una ducha, un sanitario, 1 filtro de aire o superficies enfriadoras de un acondicionador de aire, en la composición, con o sin posterior dilución con agua, puede ser aplicada a tales superficies de una manera apropiadas. Por ejemplo, la composición puede ser aplicada la superficie vertiéndolas dejando la composición biocida líquida sobre dicha superficie bien en su estado original concentrado o después de dilución con agua. Alternativamente, la composición biocida líquida con o sin dilución posterior con agua, puede ser aplicada por medio de un aplicador, tal como por ejemplo un paño, esponja, toalla de papel, o mopa. Si el concentrado se diluye con agua antes o durante su uso, la cantidad de dilución debería por supuesto provee una solución diluida que tenga la efectividad microbicida requerida. Hablando en términos generales, la concentración del concentrado diluido de ser al menos 2 miligramos por litro de “cloro activo” o “cloro total disponible”. Debido a las 25 ES 2 269 498 T3 5 10 15 20 25 costumbres anteriores y al uso en la técnica, las cantidades de la gente biocida se expresan frecuentemente en términos de “cloro activo” o “cloro disponible total” aun contra lo que no puede ser en efecto bromo para convertir una concentración de bromo activo a “cloro activo” o “cloro disponible total”, la concentración de bromo activo se multiplica por 0.444. Dependiendo de la fuerza de un concentrado particular de esta invención (esto es su concentración de bromo activo (típicamente expresada en la técnica como cloro activo o cloro disponible), y del rango de usos para los cuales se recomienda la composición, pueden colocarse instrucciones adecuadas en términos fácilmente entendibles por el consumidor en los recipientes por las etiquetas fijadas a los recipientes en los cuales el concentrado particular de esta invención es vendido o distribuido para la venta. El método para sanear un cuerpo de agua usando una composición biocida líquida concentrada de esta invención comprende introducir tal composición, con o sin dilución previa con agua, en el cuerpo de agua. Una variedad de métodos puede ser usada para introducir la composición biocida líquida concentrada al cuerpo de agua que se va a sanear. La composición biocida líquida concentrada puede ser añadida directamente al cuerpo de agua, bien toda la vez o lentamente a lo largo del tiempo, por ejemplo a través de una bomba o alimentador. En sistemas en los cuales el agua circula a través de un aparato, la composición biocida líquida concentrada puede ser añadida en este aparato. La adición de la composición biocida líquida concentrada al cuerpo de agua que se va a sanear produce preferiblemente una concentración de biocida en el cuerpo de agua tal que está presente en el rango de 2 a 10 mg por litro de “cloro activo” o cloro disponible total“, expresado como cloro en el cuerpo de agua. En una modalidad preferida, la composición biocida líquida concentrada se introduce en el cuerpo de agua según se requiere, de tal manera que se mantiene en el rango de 2 y cuadrillas miligramos por litro de ”cloro activo“ o cloro disponible total” expresado como Cl2 dentro del cuerpo de agua. Una cantidad más preferida de “cloro disponible total”, expresada como Cl2 , en el cuerpo de agua parte 2 a 5 miligramos por litro. Estas concentraciones de halógeno disponible total, expresadas como Cl2 , son conocidas en la técnica como suficientes para sanear un cuerpo de algo y para mantener el saneamiento de un cuerpo de agua. Parte Dos 30 35 40 Se recordará que una de las modalidades de esta invención es un proceso para producir una composición biocida líquida donde el pH de la mezcla de reacción se controla en al menos tres etapas. El proceso de esta modalidad comprende: I) poner en contacto de una manera adecuada para formar una mezcla de reacción (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i)cloruro de bromo, (ii) bromo elemental y (iii) cloro elemental, purgó una fuente de aniones sulfamato, preferiblemente un sulfamato de metal alcalino y más preferiblemente sulfamato de sodio, (c) base de metal alcalino, preferiblemente una base de sodio y más preferiblemente hidróxido de sodio y/o oxido de sodio y (d) agua, tal que (1) la relación numérica de átomos de bromo a átomos de cloro puesta en la mezcla está en el rango de 0.7:01 a 1.7:1, y preferiblemente en el rango de 1:1 a 1.2:1, y (2) la relación de átomos de nitrógeno a bromo activo que se origina de (a) y (b) es mayor que aproximadamente 0.93, y preferiblemente mayor de aproximadamente 1; para formar una mezcla de productos de reacción que contiene bromo activo que tenga, inicialmente, 1 pH por encima de 11, preferiblemente al menos 12, y más preferiblemente al menos tres; 45 II) proveer antes de y/o durante la conducción de I) una cantidad de base de metal alcalino en relación con la cantidad total que ácido (HBr y/o HCl), en sus o productos que se van a formar en la reacción, lo que resulta en que el pH de tal mezcla de producto reacción disminuya en al menos 1 unidad de pH durante la conducción de I), hasta un pH en el rango de 7 a 11 preferiblemente a un pH en el rango de 8 a días; 50 III) mantener la mezcla de reacción un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 8 a 10, durante un periodo de tiempo que incremente la efectividad microbicida de la composición biocida líquida concentrada que está siendo formada, y luego 55 IV) elevar el pH de la mezcla de producto de reacción que contiene bromo activo resultan que hasta al menos aproximadamente 12, y preferiblemente un pH que este al menos en el rango de 13 a 13.5, mezclando con él hace de metal alcalino adicional. Una manera preferida de llevar a cabo el proceso anterior comprende: 60 65 I) alimentar (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i)cloruro de bromo, (ii) bromo elemental, y (iii) cloro elemental, en (b) una solución acuosa de aniones sulfamato y base de metal alcalino, o alimentar cada uno de (a) y (b) en un recipiente de reacción, a que (1) la relación numérica del número total de átomos de bromo alimentados a la alimentación de átomos de cloro está en el rango de 0.7:01 a 1.7:1, y preferiblemente en el rango de 1:1 a 1.22 puntos uno, ir (2) la relación de átomos de nitrógeno a bromo activo que se origina de (a) y (b) es mayor de aproximadamente 0.93, y preferiblemente mayor de 1; para formar un producto de mezcla de reacción que contiene bromo activo que tiene, inicialmente,1 pH por encima de 11, preferiblemente al menos por encima de dosis, y más preferiblemente al menos aproximadamente 13; 26 ES 2 269 498 T3 II) proveer antes y/o durante la alimentación en I) una cantidad de una base de metal alcalino en relación con la cantidad total de ácido párrafo 108 que se va formar en la reacción, lo que resulta en que el pH de la mezcla de productos de reacción de la mezcla en al menos 1 unidad de pH durante la alimentación en I) a un pH en el rango de 7 a 11, y preferiblemente a un pH en el rango de 8 a 10; 5 III) mantener la mezcla de reacción a un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 8 a 10 para un período de tiempo que incremente la efectividad microbicida de la composición biocida líquida concentrada que está siendo formada; y luego 10 15 20 IV) elevar el pH de la mezcla de producto reacción resultante que contiene bromo activo al menos aproximadamente 12, preferiblemente un pH que este al menos en el rango de 13 a 13.5, mezclando con ella paso de metal alcalino adicional. Las sesiones I) y II) anteriores involucran en parte mezclar (a) y (b) de una manera adecuada, tal que alimentando (a) en (b) en la presencia de un medio acuoso alcalino en el cual el pH está por encima de 11, o introduciendo alimentación de separadas de (a) y (b) un recipiente de reacción para qué esta sedimentación es se unan en presencia de un medio acuoso alcalino en el cual el pH está por encima de 11. Sin embargo, otras manera de poner (a) y (b) en contacto entre sí en la presencia de un medio acuoso alcalino en el cual el pH está por encima de 11 pueden ser usadas, tales como alimentación de separadas concurrentes de (a) y (b), y de otras alimentación separadas de una solución de base metal alcalino, en un recipiente de reacción, como alimentación es concurrentes separadas de (a) de una alimentación separada de una solución acuosa que contiene aniones sulfamato y de una base de metal alcalino en un recipiente de reacción. Para resumir, cualquier manera de poner (a), (b), agua y base de metal alcalino juntos puede ser utilizado excepto que no es deseable alimentar (b), agua y base de metal alcalino sobre (a). 25 Las cantidades de (a) y (b) utilizadas en I) son preferiblemente, pero no necesariamente, cantidades que formen una mezcla de productos de reacción que contiene bromo activo en la cual (i) el contenido de bromo activo es al menos 50000 ppm (peso/peso) (esto es, al menos 5% en peso del peso total tratar mezcla de producto), más preferiblemente al menos 100000 ppm (peso/peso) y aún más preferiblemente al menos 120000 ppm (peso/peso). 30 Como se especifica en la sección II) anterior, una cantidad de base de metal alcalino desprovista antes de y/o durante la alimentación en I) con respecto a la cantidad de ácido que está siendo formado como coproductor en la mezcla de la reacción para restar en que el pH de la reacción en su mezcla disminuya hasta al menos 1 unidad de pH durante la alimentación en I) a un pH en el rango de 7 Domenico 11, y preferiblemente en el rango de 8 o 10 se entiende en general entre las reacciones que toman lugar durante la mezcla de (a) y (b) cuando la base es una base de sodio están las siguientes reacciones: 35 Br2 + H2 N − SO3 Na → Br − NH − SO3 Na + HBr 40 Cl2 + H2 N − SO3 Na → Cl − NH − SO3 Na + HCl BrCl + H2 N − SO3 Na → Br − NH − SO3 Na + HCl 45 50 55 60 65 Así el ácido de halógeno (por ejemplo, HBr o HCl) se genera en la mezcla de reacción a medida que la reacción toma lugar. Después de II) la cantidad de base de metal alcalino utilizada es proporcionada en relación con la cantidad de ácido que se está formando y que se va a formar durante la reacción de manera que ocurra el descenso especificado en pH. No hay necesidad de intentar la identificación de los ácidos particulares formados en la mezcla de reacción. El uso de la descripción materia de la formación de ácidos tal como mediante el uso de ecuaciones tales como las dadas anteriormente es suficiente para calcular la cantidad de base que será utilizar para resultado de una reducción de pH que se va a alcanzar. Y si es necesario pueden utilizarse mediciones de pH para asegurarse que en un descenso del pH seleccionado por encima de 1 unidad de pH a 1 unidad pH dentro del rango de 7 a 11 (y preferiblemente dentro del rango de otro médico o a 10) ácido alcanzada en efecto. Mientras que esta disminución es una disminución de al menos 1 unidad de pH, preferiblemente es una disminución de al menos dos unidades de pH, y más preferiblemente una disminución de al menos tres unidades de pH, pero cualquiera que sea el grado del descenso, el pH de la mezcla de reacción no debería disminuir por debajo de 7, aunque uno o más descensos por debajo de un pH de aproximadamente 7 son permisibles y están dentro del alcance de la presente invención dado que la conducción del proceso o las características y propiedades del producto final no son aceptados adversamente de una manera equitativa. El descenso en pH por debajo de aproximadamente 7, si lo hay, debería ser entonces minimizado en duración y magnitud hasta el mayor grado posible bajo cualquier juego dado de circunstancias. Si el proceso es conducido en un recipiente de reacción recubierto en vidrio, que es la manera preferida para ejecutar el proceso, la degradación del vidrio puede ser minimizada minimizando el tiempo durante el cual el pH está por encima de 11, o por encima de 12, y especialmente en 13 o más, iniciando la disminución del pH tan pronto un muy pronto después de que la mezcla con el pH inicial por encima de 11, 12 o 13, se ha formado en I). 27 ES 2 269 498 T3 5 10 15 20 25 30 35 40 45 Durante la etapa I) se forma una mezcla de reacción que contiene bromo activo la cual se cree que contiene, entre otras cosas, (1) especies moleculares que contienen átomos de bromo o nitrógeno, y (2) especies moleculares que contienen átomos de cloro limítrofe. Típicamente cerca de 20 por ciento molar del halógeno disponible en esta mezcla de reacción está hecho aparentemente de especies moleculares que contienen cloro y nitrógeno. La evidencia disponible indica además, bastante convincentemente, que las tesis moleculares que contienen átomos de bromo y nitrógeno son más efectivas en su efecto microbicida que las especies moleculares que contienen átomos de cloro y nitrógeno Después de la sección II) de este “proceso de tres etapas” el pH de la mezcla de reacción que contiene bromo activo formado inicialmente en la sección I) es reducido en al menos 1 unidad de pH y preferiblemente en al menos 2 unidades de pH y más preferiblemente en al menos 3 unidades de pH, a un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 7 a 10. Esta reducción en pH, causada por la proporción adecuada de la cantidad de base utilizada, puede ser equipo una transición continua progresiva desde el pH inicial alto al pH seleccionado del rango de 7 a 11, o (ii) una transición paso a paso del pH alto inicial al pH seleccionado del rango de 7 a 11, o (iii) una combinación (i) y (ii), que depende de las técnicas de alimentación utilizadas. Alternativamente y menos deseable mente, el pH puede ser reducido en todo buen parte por la adicción a la mezcla de reacción de ácido clorhídrico, o preferiblemente ácido bromhídrico. En la sección III) la mezcla de reacción es mantenida a un pH en el rango de 7 a 11, y preferiblemente un pH en el rango de 7 a 10 durante un período de tiempo. Este periodo de tiempo típicamente es un período de tiempo después del cual se ha terminado la alimentación, pero que también puede incluir el tiempo durante la alimentación cuando el pH ácido disminuido a un pH de 11 y permanece un pH de 11 hacia abajo hasta aproximadamente 7. La longitud mínima de este período de tiempo no es susceptible de precisar una definición numérica, puesto que depende de factores tales como el pH real de la mezcla de reacción, y aparentemente de otros factores tales como la temperatura. Como regla general, cuanto mayor sea el valor de pH dentro del rango seleccionado, más corto puede ser este período de tiempo y cuanto mayor sea el valor de pH dentro del rango seleccionado, más largo será este período de tiempo. Pero, el hecho de que el pH no tendrá que permanecer en un pH dentro de estos rangos de pH sino que en vez de puede variar dentro de los rangos durante este período de tiempo, resalta aún más la futilidad de tratar de definir el período de tiempo mínimo en que la mezcla de reacción es mantenida dentro de uno o ambos de los anteriores rangos. Lo que se puede decir, sin embargo, es que la longitud de este período de tiempo debería ser tal que resulte en la producción de una composición biocida líquida concentrada que tenga efectividad micro sido incrementada. Sin apegarse a la teoría, se cree que en el rango de pH de 7 a 10, toma lugar alguna clase de desplazamiento o reemplazo de halógeno mediante la cual él cloro atómico de la especie molecular que contienen cloro y los átomos de nitrógeno en la mezcla de reacción son desplazados o removidos, y reemplazados por bromo atómico de una o más de las fuentes dentro de la mezcla de reacción, formándose así una especie molecular adicional que contiene átomos de bromo limítrofe. Tal transformación in situ postulada de las especies moleculares que contienen átomos de cloro y nitrógeno en especies moleculares adicionales que contienen átomos de bromo y nitrógeno, sin embargo lumbar, requiriendo un período de tiempo para ocurrir. Así, de acuerdo con esta teoría, el periodo mínimo de tiempo es el requerido para que tal transformación ocurra. En efecto se sostiene la teoría, por lo tanto, de que este período de tiempo es un pedido del cual ahí, en la mezcla de reacción, un incremento en la relación molar de las especies moleculares que contienen átomos de bromo y nitrógeno frente a las tesis moleculares que contienen átomos de cloro y nitrógeno. Independientemente de las reacciones o transformaciones químicas que ocurran realmente en la mezcla de reacción durante el período de tiempo, se espera que el resultado neto será un incremento en la efectividad microbicida. Puesto que parece no haber, dentro de la razón, cualquier límite superior acerca de la duración de este período de tiempo, deben mantenerse estas condiciones de pH durante un período que sea lo suficientemente largo para asegurar una efectividad microbicida mejorada. El período de tiempo mínimo fue entonces estar en términos de minutos o en términos de horas. El límite superior sin embargo materia de sentido práctico y ordinariamente no se prevé mantener la mezcla de reacción bajo estas condiciones de pH reducido por madre, por ejemplo, aproximadamente 24 horas, aunque períodos más largos están dentro de la visión y alcance de esta invención. 50 55 60 65 Al ejecutar la sección IV) se usan las mismas bases de metal alcalino de la misma forma que las bases utilizadas para elevar el pH de las composiciones biocidas líquidas concentradas según se describe bajo parte 1. Preferiblemente la base utilizada siguiendo la sección IV) es la misma especie de base utilizada siguiendo la sección II) anterior. Por ejemplo si la base utilizada siguiendo la sección II) es hidróxido de sodio, es preferible entonces usar hidróxido de sodio para adelantar la sección IV). Las operaciones que siguen a las secciones I), II) III) y IV) se ejecutan técnicamente bajo las mismas condiciones de temperatura que se usaban otras modalidades de esta invención. Por ejemplo, es deseable ejecutar estas operaciones a temperatura ambiente o con algún tipo de enfriamiento por debajo de temperatura ambiente. Así las temperaturas en el rango de 25 a 35ºC son recomendadas para estas operaciones, aunque aún pueden utilizarse temperaturas más bajas si se desea. Será evidente que han que las modalidades en la parte dos pueden resultar en algún ataque un poco mayor al vidrio de los recipientes de reacción recubiertos en vidrio, las otras ventajas de la parte uno son alcanzables en la parte 2. Estas incluyen una mínima, si la hay, con versión de sulfamato a sulfato, y la capacidad de formar composiciones biocidas líquidas concentradas de efectividad microbiológica mejorada. 28 ES 2 269 498 T3 5 Aunque las reivindicaciones que siguen a continuación pueden referirse a sustancias, componentes y/o ingredientes en tiempo presente (“comprende”, “es”), la referencia es a la sustancia componente hubo ingrediente tal como existía en el momento justo antes de que fuera puesta en contacto, mezclada o revuelta con una o más sustancias adicionales, componentes y/o otros ingredientes, o si esta forma de solución, tal como existiría si no estuviese forma de solución, todo de acuerdo con la presente divulgación. No importa si una sustancia, componente o ingrediente pueda haber perdido su identidad original a través de una reacción o transformación química durante el acuoso de tal cuesta en contacto, mezcla, involucración o formación in situ, si se lleva a cabo de acuerdo con esta divulgación. 10 15 20 25 30 35 40 45 50 55 60 65 29 ES 2 269 498 T3 REIVINDICACIONES 1. Un proceso para producir una composición biocida líquida concentrada, proceso que comprende: 5 10 15 20 25 A) poner en contacto alimentando de cualquier manera adecuada para formar una mezcla de reacción (a) átomos de bromo y átomos de cloro en la forma de uno o más que ir o cloruro de bromo; (ii) bromo elemental y (iii) cloro elemental, (b) una fuente de aniones sulfamato, (c) base de metal alcalino y (d) agua, de tal manera que la relación numérica de átomos de bromo átomos de cloro puesta en la mezcla está en el rango de 0.7:01 a 1.7:1; B) proveer antes y como durante A) suficiente base de metal alcalino en la mezcla que está siendo formada en A) para mantener el pH de tal mezcla en el rango de 7 a 11 durante todo o sustancialmente todo el tiempo de alimentación en A), las cantidades de (a), (b), (c) y (d) utilizadas son cantidades que forman una solución que contienen bromo activo en la cual (i) el contenido de bromoactivo es al menos de 50.000 ppm (peso/peso) y (ii) la relación de átomos de nitrógeno a bromo activo que se originan de (a) y (b) es mayor de 0.93; y donde exista presente cualquier sulfato en la solución que contiene bromo activo según se forma, tal contenido de sulfato es tal que la relación molar de sulfato a sulfamato en la solución es menor de 0.2; y para ser insertado desde la reivindicación 16. 2. Un proceso de acuerdo con la reivindicación 1 donde (b) es un sulfamato de metal alcalino, donde la base de metal alcalino con referencia hecha en A) y B) es una base de sodio, y donde dicha relación de átomos de nitrógeno a bromo activo es mayor de aproximadamente 1. 3. Un proceso de acuerdo con la reivindicación 1 donde (b) es sulfamato de sodio, donde la base de metal alcalino a la que se hace referencia en A) y B) es hidróxido de sodio y/o óxido de sodio, y donde dicha relación de átomos de nitrógeno a bromo activo es mayor que aproximadamente 1. 4. Un proceso de acuerdo con cualquiera de las reivindicaciones 1, 2 o 3 donde dicho contenido de bromo activo es al menos de 100000 ppm. 30 5. Un proceso de acuerdo con cualquiera de las reivindicaciones 1, 2 o 3 donde dicho contenido de bromo activo es al menos aproximadamente 120.000 ppm. 6. Un proceso de acuerdo con cualquiera de las reivindicaciones 1, 2 o 3 donde dicha relación molar de sulfato a sulfamato es menor de aproximadamente 0.05. 35 40 45 50 7. Un proceso de acuerdo con la reivindicación 1 donde dicha mezcla de reacción en A) se forma alimentando dicho (a) en agua que contiene uniones sulfamato o alimentando dicho (a) y agua que contiene uniones sulfamato en un recipiente de reacción. 8. Un proceso de acuerdo con la reivindicación 7 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de base de metal alcalino a la mezcla que está siendo formada en A). 9. Un proceso de acuerdo con la reivindicación 7 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo una base de metal alcalino soluble en agua en (b). 10. Un proceso de acuerdo con la reivindicación 7 donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de base de metal alcalino a la mezcla que está siendo formada en A), y donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo una base de metal alcalino soluble en agua en (b). 11. Un proceso de acuerdo con la reivindicación 7 donde siguiendo B) el pH de la mezcla que está siendo formada en A) se mantiene en el rango de 8 a 10 durante todo o sustancialmente todo el tiempo en que ocurre la alimentación en A). 55 60 65 12. Un proceso de acuerdo con la reivindicación 11 en donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de una base de metal alcalino a la mezcla que está siendo formada en A). 13. Un proceso de acuerdo con la reivindicación 11 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo una base de metal alcalino soluble en agua en (b). 14. Un proceso de acuerdo con la reivindicación 11 donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de base de metal alcalino a la mezcla que se está formando en A), y donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo una base de metal alcalino soluble en agua en (b). 30 ES 2 269 498 T3 5 15. Un proceso de acuerdo con cualquiera de las reivindicaciones 7, 8, 9, 10, 11, 12, 13, o 14 donde dicha base de metal alcalino es una base de sodio, donde las cantidades de (a) y (b) utilizadas son tales que forman una solución que contienen bromo activo en la cual y por el contenido de bromo es al menos 100000 ppm (peso/peso) y (ii) la relación de átomos de nitrógeno a bromo activo que se origina de (a) y (b) es mayor de aproximadamente 1; y donde si cualquier sulfato está presente en la solución a medida que se forma, tal contenido de sulfato es tal que la relación molar de sulfato a sulfamato en la solución es menor de aproximadamente 0.05. 16. Un proceso de acuerdo con la reivindicación 1 donde en C) el pH es elevado hasta al menos un pH en el rango de 13 a 13.5. 10 17. Un proceso de acuerdo con la reivindicación 1 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) se provee alimentando una solución de una base de sodio a la mezcla que se está formando en A). 15 20 25 18. Un proceso de acuerdo con la reivindicación 1 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) se provee teniendo una base de sodio soluble en agua en (b). 19. Un proceso de acuerdo con la reivindicación 1 donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de una base de sodio a la mezcla que se está formando en A), y donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo una base de sodio soluble en agua en (b). 20. Un proceso de acuerdo con la reivindicación 1 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de hidróxido de sodio a la mezcla que está siendo formada en A). 21. Un proceso de acuerdo con la reivindicación 1 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo hidróxido de sodio en (b). 30 22. Un proceso de acuerdo con la reivindicación 1 donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de hidróxido de sodio a la mezcla que se está formando en A) y donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo hidróxido de sodio en (b). 35 23. Un proceso de acuerdo con la reivindicación 1 donde siguiendo B) el pH de la mezcla que está siendo formada en A) se mantiene en el rango de 8 a 10 durante todo o sustancialmente todo el tiempo en que está ocurriendo la alimentación en A). 40 24. Un proceso de acuerdo con la reivindicación 23 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de hidróxido de sodio a la mezcla que está siendo formada en A). 25. Un proceso de acuerdo con la reivindicación 24 donde al menos una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo hidróxido de sodio en (b). 45 26. Un proceso de acuerdo con la reivindicación 24 donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista alimentando una solución de hidróxido de sodio a la mezcla que se está formando en A) y donde una porción de dicha base de metal alcalino provista de acuerdo con B) es provista teniendo hidróxido de sodio en (b). 50 55 60 65 27. Un proceso de acuerdo con cualquiera de las reivindicaciones 16, 17 o 24 donde la relación numérica del número total de átomos de bromo alimentados frente al número total de átomos de cloro alimentados de acuerdo con A) está el rango de 1:1 a 1.2:1, donde dicha base de metal alcalino provista de acuerdo con B) es hidróxido de sodio, óxido de sodio, o carbonato de sodio, donde dicha base de metal alcalino adicional C) es la misma clase de base de sodio que la base provista de acuerdo con B), donde las cantidades de (a) y (b) son tales que evite la solución que contiene bromo activo tiene (i) un contenido de bromo de al menos 100000 ppm (peso/peso), y (ii) una relación de átomos de nitrógeno a bromo activo y se originan de (a) y (b) es mayor de aproximadamente 1. 28. Un proceso de acuerdo con la reivindicación 28 donde la base de sodio provista de acuerdo con B) es hidróxido de sodio, donde la base de sodio adicional en C) es hidróxido de sodio, donde dicho contenido de bromo activo de dicha solución que contiene bromo activo está en el rango de 120.000 a 160.000 ppm (peso/peso), y donde si hay presente sulfato en la solución a medida que se forma, tal contenido de sulfato es tal que la relación molar sulfato a sulfamato en la solución es menor de aproximadamente 0.05. 29. Un proceso de acuerdo con la reivindicación 16 donde los átomos de bromo y los átomos de cloro son alimentados en la forma de (i)cloruro de bromo por sí mismo, (ii) cloruro de bromo en una mezcla con bromo, o (iii) bromo y cloro alimentados separadamente y concurrentemente, y/o alimentados separada y secuencialmente siendo cualquiera de ellos alimentado primero. 31 ES 2 269 498 T3 30. Un proceso para minimizar o eliminar la pérdida de sulfamato durante la producción de una composición biocida líquida estabilizada con sulfamato, proceso que comprende: 5 10 15 A) alimentar (a) átomos de bromo y átomos de cloro en la forma de uno o más de (i)cloruro de bromo, (ii) bromo elemental, y (iii) cloro elemental en (b) agua que contiene anión sulfamato, o alimentar cada uno de (a) y (b) o separadamente en un recipiente de reacción, o de otra forma con él (a) y los componentes de (b) juntos alimentándolos de cualquier forma excepto alimentando los componentes de (b) de manera simple o en cualquier combinación en (a); B) minimizar la formación de sulfato de la solución acuosa resultante proveyendo antes y/o durante A) suficiente base de metal alcalino en la mezcla que se está formando en A) para mantener el pH de la mezcla del rango de 7 a 11 durante todo o sustancialmente todo el tiempo durante el cual ocurre la alimentación de A) de manera que si cualquier sulfato se forma y está presente, la relación molar de sulfato a sulfamato en dicha solución acuosa resultante a medida que se forma es menor de aproximadamente 0.2 y C) elevar el pH de dicha solución acuosa resultante hasta al menos 12 mezclando base de metal alcalino adicional con ella. 31. Un proceso de acuerdo con la reivindicación 30 donde el pH de dicha solución acuosa resultante es elevado al menos hasta un pH que está en el rango de 13 a 13.5. 20 32. Un proceso de acuerdo con cualquiera de las reivindicaciones 30 o 31 donde el pH de la mezcla que está siendo formada en A) es mantenido en el rango de 8 a 10 durante todo o sustancialmente todo el tiempo en que ocurre la alimentación de A). 25 33. Un proceso de acuerdo con cualquiera de las reivindicaciones 30 o 31 donde las proporciones de (a) y (b) alimentadas son tales que la relación numérica del número total de átomos de bromo alimentados frente número total de átomos de cloro alimentados está en el rango de 0.7:01 a 1.7:1. 34. Un proceso de acuerdo con la reivindicación 33 donde dicha relación numérica están el rango de 1:1 a 1.2:1. 30 35. Un proceso de acuerdo con cualquiera de las reivindicaciones 30 o 31 donde las proporciones de (a) y (b) alimentadas son tales que dicha solución acuosa resultante tiene (i)un contenido de bromo activo de al menos 50000 ppm (peso/peso), y (ii) una relación de átomos de nitrógeno a bromo activo que se originan de (a) y (b) que es mayor de aproximadamente 1. 35 36. Un proceso de acuerdo con la reivindicación 36 donde dicho contenido de bromo activo es al menos aproximadamente 100.000 ppm (peso/peso). 40 45 37. Un proceso de acuerdo con cualquiera de las reivindicaciones 30 o 31 donde las proporciones de (a) y (b) alimentadas son tales que (1) la relación numérica del número total de átomos de bromo alimentados frente al número total de átomos de cloro alimentados está en el rango de 1:1 a 1.2:1, y (2) el contenido de bromo activo de dicha solución acuosa resultante es al menos aproximadamente 100.000 ppm (peso/peso), y (3) dicha solución acuosa resultante tiene una relación atómica de nitrógeno a bromo activo que se origina de (a) y (b) es mayor de aproximadamente 1; y donde si el sulfato está presente, la relación molar de sulfato a sulfamato en dicha solución acuosa resultante a medida que se forma es menor de aproximadamente 0.05. 38. Un proceso de acuerdo con la reivindicación 30 donde dicha base de metal alcalino provista de acuerdo con B) es una base de sodio. 50 55 39. Un proceso de acuerdo con la reivindicación 31 donde la base de metal alcalino provista de acuerdo con B) es hidróxido de sodio, óxido de sodio, o carbonato de sodio, y donde dicha base de metal alcalino adicional en C) es la misma clase de base de metal alcalino utilizada en B). 40. Un proceso de acuerdo con la reivindicación 21 donde dicha base de metal alcalino provista de acuerdo con B) es hidróxido de sodio, y donde dicha base de metal alcalino adicional en C) es hidróxido de sodio. 41. Un proceso de acuerdo con la reivindicación 1 donde: I) en A) se forma dicha mezcla para tener un pH inicial de más de 11; 60 II) proveer antes y/o durante la conducción de I) una cantidad de base de metal alcalino en relación con la cantidad total de co-productos ácidos que se van a formar en la reacción, tal que resulte en que el pH de tal mezcla de productos de reacción decrezca en al menos 1 unidad de pH durante la conducción de I), a un pH en el rango de aproximadamente 7 a aproximadamente 11; 65 III) mantener la mezcla de reacción a un pH en el rango de aproximadamente 7 a aproximadamente 11 durante un período de tiempo que incremente la efectividad microbicida de la composición biocida líquida concentrada que está siendo formada; y luego 32 ES 2 269 498 T3 IV) elevar el pH de la mezcla de productos de reacción que contienen bromo activo resultante a al menos aproximadamente 12 mezclando base de metal alcalino adicional con ella. 5 10 15 42. Un proceso de acuerdo con la reivindicación 41 donde (b) es un sulfamato de metal alcalino, donde (c) es una base de sodio, donde dicha relación de átomos de nitrógeno a bromo activo es mayor de aproximadamente 1, donde dicho pH inicial es al menos aproximadamente 12, y donde el pH de dicha mezcla de productos de reacción que contienen bromo activo resultante se eleva a un pH que está al menos en el rango de 13 a 13.5. 43. Un proceso de acuerdo con la reivindicación 41 donde (b) es sulfamato de sodio, donde la base de metal alcalino referida en I, II), y IV) es hidróxido de sodio, y donde el pH de dicha mezcla de productos de reacción que contienen bromo activo resultante se eleva a un pH que está al menos en el rango de 13 a 13.5. 44. Un proceso de acuerdo con cualquiera de las reivindicaciones 41, 42 o 43 donde de acuerdo con II) el pH de tal mezcla de productos de reacción disminuye en al menos 2 unidades de pH a un pH en el rango de 8 a 10, y en donde de acuerdo con III) la mezcla de reacción se mantiene a un pH en el rango 8 a 10 durante dicho período de tiempo. 45. Un proceso de acuerdo con cualquiera de las reivindicaciones 41, 42 o 43 donde dicha relación numérica de átomos de bromo frente a átomos de cloro están el rango de 1:1 a 1.2:1. 20 25 46. Un proceso de acuerdo con cualquiera de las reivindicaciones 41, 42 o 43 donde dicha relación numérica de átomos de bromo a átomos de cloro está en el rango de 1:1 a 1.2:1, donde de acuerdo con II) el pH de tal mezcla de productos de reacción disminuye en al menos 2 unidades de pH a un pH en el rango de 8 a 10, y donde de acuerdo con III) la mezcla de reacción se mantiene a un pH en el rango de 8 a 10 durante dicho periodo de tiempo. 47. Un proceso de acuerdo con la reivindicación 7 donde: I) en A) llevar a cabo dicha alimentación para proveer dicha mezcla con un pH inicial por encima de 11; 30 35 II) proveer antes y/o durante la alimentación en I) una cantidad de una base de metal alcalino en relación con la cantidad total de co-productos ácidos que se van a formar en la reacción, que resulta en que el pH de tal mezcla de productos de reacción disminuye en al menos 1 unidad de pH durante la alimentación en I), a un pH en el rango de aproximadamente 7 a aproximadamente 11; III) mantener la mezcla de productos de reacción en un pH en el rango de aproximadamente 7 a aproximadamente 11 durante un período de tiempo que incremente la efectividad microbicida de la composición biocida líquida concentrada que está siendo producida; y luego IV) elevar el pH de la mezcla de producto resultante que contiene bromo hasta al menos aproximadamente 12 mezclando con ella una base de metal alcalino adicional. 40 48. Un proceso de acuerdo con la reivindicación 47 donde dicha relación numérica de átomos de bromo a átomos de cloro citada en I) está en el rango de 1:1 a 1.2:1. 45 49. Un proceso de acuerdo con la reivindicación 47 en donde dicho pH inicial de la mezcla de productos de reacción que contienen bromo activo citada en I) es al menos aproximadamente 12. 50. Un proceso de acuerdo con la reivindicación 47 donde dicho pH inicial de la mezcla de productos de la reacción que contienen bromo activo citado en I) es al menos aproximadamente 13. 50 51. Un proceso de acuerdo con la reivindicación 47 donde el descenso del pH citado en II) es un descenso a un pH en el rango de 8 a 10. 52. Un proceso de acuerdo con la reivindicación 47 donde el descenso del pH citado en II) es un descenso de al menos 2 unidades de pH. 55 53. Un proceso de acuerdo con la reivindicación 47 donde el descenso de pH citado en II) es un descenso de al menos 3 unidades de pH. 60 54. Un proceso de acuerdo con la reivindicación 47 donde el descenso de pH citado en II) es un descenso de al menos 2 o unidades de pH hasta un pH en el rango de 8 a 10. 55. Un proceso de acuerdo con la reivindicación cuente 7 donde el descenso del pH citado en II) es un descenso de al menos 3 o unidades de pH hasta un pH en el rango de 8 a 10. 65 56. Un proceso de acuerdo con la reivindicación 47 donde el descenso de pH citado en II) es un descenso hasta un pH en el rango de 8 a 10, y donde siguiendo a III) la mezcla del producto de reacción se mantiene un pH en el rango de 8 a 10. 33 ES 2 269 498 T3 57. Un proceso de acuerdo con la reivindicación 47 donde en IV) el pH de la mezcla de productos de reacción resultante que contiene bromo activo es elevado a un pH que está al menos en el rango de 13 a 13.5. 5 58. Un proceso de acuerdo con la reivindicación 47 donde dicha relación numérica de átomos de bromo a átomos de cloro citada en I) está en el rango de 1:1 a 1.2:1, donde en IV) el pH de la mezcla de productos de reacción resultante que contienen bromo activo se eleva hasta un pH que está al menos en el rango de 13 a 13.5. 10 59. Un proceso de acuerdo con cualquiera de las reivindicaciones 47, 48, 57 o 51 donde la base alcalina citada en I), en II) y en IV) consiste esencialmente de hidróxido de sodio y donde si hay sulfato presente en IV) en dicha mezcla de productos de reacción resultante que contienen bromo activo a medida que se forma, la relación molar de sulfato a sulfamato en dicha mezcla de productos de reacción resultante que contienen bromo activo es menos de aproximadamente 0.2. 15 20 25 30 35 40 45 50 55 60 65 34 ES 2 269 498 T3 35 ES 2 269 498 T3 36 ES 2 269 498 T3 37