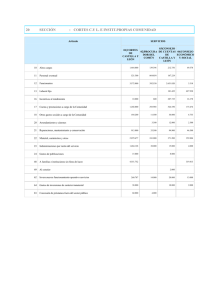
Richard-Allan Scientific Chromaview
Anuncio

ITALIANO Thermo Scientific™ Richard-Allan Scientific Chromaview® – Tinción Avanzada Tinción de verde Metil-Pironina Y Instrucciones de uso Análisis técnico Comentarios técnicos Microtomía Realice los cortes de 4 a 6 micrones. Fijación La fijación de cortes congelados con metanol es el procedimiento y fijador de elección. El fijador de Carnoy puede utilizarse para los cortes de parafina. La fijación del tejido con formol es adecuada para la demostración de células plasmáticas. Control de calidad Debe utilizarse un corte que contenga múltiples células plasmáticas. Cuando esta tinción se utiliza sin diluir, el tono de la Pironina Y se ve optimizado y la relación de contraste verde a rojo se ve reducida. El tono verde puede volverse más rojo-violeta. Cuando los cortes congelados se fijan con metanol, el ADN siempre adquiere una tonalidad verde y el ARN adquiere una tonalidad roja (presente tanto en el nucléolo como en el citoplasma). Cuando el tejido se fija con Carnoy, los resultados son similares a los procedimientos de cortes congelados fijados con metanol. Las extensiones de sangre o los frotis de médula ósea deben secarse al aire, fijarse con metanol, secarse al aire nuevamente y teñirse usando el procedimiento para cortes congelados. Pueden usarse tejidos fijados con formol para demostrar células plasmáticas, pero no es el método de fijación de elección. Probable modo de acción Procedimiento técnico Solución de trabajo de Verde Metil-Pironina Y Verde Metil-Pironina Y...................................................... 5 ml Agua desionizada ..........................................................50 ml Protocolo de tinción para cortes congelados 1. Fijar los cortes en alcohol metílico durante 5 minutos. 2. Teñir los cortes en la solución de trabajo Verde Metil-Pironina Y durante 5 minutos, a temperatura ambiente. 3. Enjuagar bien los cortes con agua desionizada. 4. Deshidratar los cortes en dos cambios de alcohol anhidro durante 1 minuto cada uno. 5. Aclarar los cortes con tres cambios de absoluto aclarante durante 1 minuto cada uno y proceder al montaje. Protocolo de tinción para cortes con parafina 1. Quitar la parafina e hidratar los cortes con agua desionizada. 2. Enjuagar los cortes con agua desionizada durante 1 minuto. 3. Teñir los cortes en la solución de trabajo de Verde Metil-Pironina Y durante 5 minutos, a temperatura ambiente. 4. Enjuagar bien los cortes con agua desionizada. 5. Deshidratar los cortes con dos cambios de alcohol absoluto durante 1 minuto cada uno. 6. Aclarar los cortes con tres cambios de reactivo aclarante durante 1 minuto cada uno y proceder al montaje. Existen dos tipos de ácidos nucleicos presentes en la cromatina nuclear de las células: ADN (ácido desoxirribonucleico) presente en los núcleos de las células y ARN (ácido ribonucleico) presente en los nucléolos. El ARN también se encuentra presente en el citoplasma de las células. La técnica principalmente usada para distinguir el ADN y ARN en los cortes de tejidos es el método de Verde Metil-Pironina Y. El mecanismo probable de esta reacción se basa en la competencia entre la tinción lenta, pero con doble carga de verde metilo, y la tinción más rápida, con carga única de Pironina Y. El Verde Metilo tiene dos grupos de carga catiónica que se unen a los grupos funcionales del ADN. La Pironina Y desplaza el Verde Metilo de todos los sitios de unión, excepto donde la doble carga le aporta una ventaja selectiva (polímero acídico, como el ADN). En consecuencia, el Verde Metilo tiñe el ADN y retiene su unión a esta sustancia contra la acción competitiva de la pironina y. La Pironina Y tiñe el ARN menos polimerizado rápidamente y puede desplazar el Verde Metilo de las uniones que tienen sustancias acídicas poliméricas más pequeñas (ARN). Esta reacción se realiza a pH 4,2 – pH 4,3. La ventaja de un pH bajo es mantener los ácidos nucleicos en una condición de carga y en su estado menos soluble. Referencias Resultados 1. Bancroft, J.D. y Stevens, A. Theory and Practice of Histological Techniques. Churchill Livingstone, New York, NY, 1977. 2. Sheehan, D.C. y Hrapchak, B.B. Theory and Practice of Histotechnology, 2nd Edition. Mosby, St. Louis, MO, 1980. 3. Thompson, C.C. Selected Histochemical and Histopathological Methods. Springfield, IL, 1966. 4. Lillie, R.D., H.J. Conn’s Biological Stains. Williams & Wilkins, Baltimore, MD, 1972. 5. Chayen, J.; Bitensky, L.; Butcher, R.G.; Poulter, L.W.; A Guide to Practical Histochemistry. J.B. Lippincott, 1969. 6. Carson, F. L. Histotechology: A Self-Instructional Text, 2nd Edition. ASCP Press, Chicago, 1997. Ácido desoxirribonucleico (ADN): Verde a agua Ácido ribonucleico (ARN): Rojo Información para pedidos Análisis Producto Tamaño Cant.Ref. Verde Metil-Pironina Y 125 ml 1 La solución de tinción de Verde Metil-Pironina Y debe almacenarse a temperatura ambiente. De ocurrir contaminación, deseche la solución. La solución de tinción de Verde Metil-Pironina Y es solo para uso “In Vitro”. Consulte las Hojas de datos de seguridad de los materiales para conocer la Información de salud y seguridad. Esta solución es estable y no debe formar precipitados de aplicarse los parámetros de almacenamiento habituales. Se recomienda que la solución de trabajo de Verde Metil-Pironina Y se deseche después de su uso. Todos los colorantes utilizados en esta formulación están certificados por la Biological Stain Commission. ©2013 Thermo Fisher Scientific Inc. All rights reserved. All trademarks are the property of Thermo Fisher Scientific Inc. and its subsidiaries. Anatomical Pathology IS87011ES R4/13 Richard-Allan Scientific Subsidiary of Thermo Fisher Scientific 4481 Campus Drive, Kalamazoo, MI 49008 Phone: 1 (800) 522-7270 Phone: + 1 (269) 544-5600 www.thermoscientific.com/pathology Thermo Shandon Limited Subsidiary of Thermo Fisher Scientific Tudor Road, Manor Park, Runcorn, Cheshire WA7 1TA, UK Phone: +44 (0) 1928 534 050 Fax: + 44 (0) 1928 534 049 87011