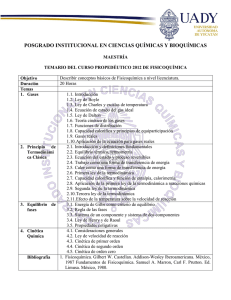
Lab. Fisicoquímica I - Benemérita Universidad Autónoma de Puebla
Anuncio

Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA
FACULTAD DE CIENCIAS QUÍMICAS
LICENCIATURA: QUÍMICO FARMACOBIÓLOGO
ÁREA ESPECÍFICA DE:.
FISICOQUÍMICA............................
NOMBRE DE LA ASIGNATURA:.
LABORATORIO DE FISICOQUÍMICA I
CÓDIGO:
LQF 117L.................................
FECHA DE ELABORACIÓN:
PRIMAVERA 2006 ..............................
NIVEL EN EL MAPA CURRICULAR:
BÁSICO...............................
TIPO DE ASIGNATURA:
...CIENCIAS BÁSICAS..............................
PROFESORES QUE PARTCIPARON EN SU ELABORACIÓN:
Quím. Jaime González Carmona
Dr.Ramón Gudiño Fernández
Quím. Andrés Camacho Iyáñez
Quím. Carlos K. Noda y Domínguez
Dra. Patricia Amador Ramírez
Dr. Gelasio Aguilar Armenta
M.C. Libertad Márquez Fernández
Dr. Francisco Meléndez Bustamante
Dr. Marino Dávila Jiménez
Dra. Delia López Velásquez
Quím. Pedro Soto Estrada
Dr. Roberto Portillo Reyes
Quím. Eugenio López Gaspar
L.en C. Héctor Mendoza Hernández
M.C. Hilda Lima Lima
Dr. Henoc Flores Segura
Dr. Juan Carlos Ramírez García
Dra. Verónica Hernández Huesca
Dr. Mario González Perea
Dr. Arnulfo Rosas Juárez
HORAS DE TEORIA:. 5
HORAS PRÁCTICA. 2
TOTAL DE CRÉDITOS: 12
PRE-REQUISITOS: S/R
RECOMENDACIONES: Conocimientos previos de Dinámica de partículas, Física
Molecular, Electricidad, Cálculo de varias variables, Química General.
1
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA
FACULTAD DE CIENCIAS QUÍMICAS
ÁREA DE FISICOQUÍMICA
USO DE LA BALANZA ANALÍTICA Y MÉTODO DE MÍNIMOS CUADRADOS
OBJETIVOS.
Conocimiento y manejo de la balanza analítica y del método de mínimos
cuadrados para los cálculos de las prácticas posteriores.
INTRODUCCIÓN.
La masa de un cuerpo es una propiedad característica del mismo, que está
relacionada con el número y clase de las partículas que lo forman. Se mide en
kilogramos (kg) y también en gramos, toneladas, libras, onzas, etc.
El peso de un cuerpo es la fuerza con que lo atrae la Tierra y depende de la
masa del mismo. Un cuerpo de masa el doble que otro, pesa también el doble. Se
mide en Newtons (N) y también en kg-fuerza, dinas, libras-fuerza, onzas-fuerza,
etc.
El kg es por tanto una unidad de masa, no de peso. Sin embargo, muchos
aparatos utilizados para medir pesos (básculas, por ejemplo), tienen sus escalas
graduadas en kg en lugar de kg-fuerza. Esto no suele representar, normalmente,
ningún problema ya que 1 kg-fuerza es el peso en la superficie de la Tierra de un
objeto de 1 kg de masa. Por lo tanto, una persona de 60 kg de masa pesa en la
superficie de la Tierra 60 kg-Fuerza. Sin embargo, la misma persona en la Luna
pesaría solo 10 kg-fuerza, aunque su masa seguiría siendo de 60 kg. (El peso de
un objeto en la luna, representa la fuerza con que ésta lo atrae).
BALANZA
Se utilizan las básculas o balanzas para medir el peso. La balanza es uno
de los instrumentos de medición mas antiguos; probablemente fue inventada por
los antiguos egipcios o babilonios hacia el año 5000 a. de C. Las balanzas
primitivas consistían en un simple trozo de madera dura, que pivotaba en su
centro, suspendido de una cuerda, la cual pasaba por un agujero y dos platos, que
colgaban de los extremos mediante cuerdas también; en uno de los platos se
colocaban pesas estándar y en el otro el objeto a pesar. Este sistema sigue siendo
el principio básico de las balanzas modernas; aquellos viejos instrumentos eran
capaces de pesar con un alto grado de precisión. Algunas de las utilizadas en
Egipto hacia el año 1350 a C. tenían una precisión cuyo posible error era del 1%.
Las balanzas y básculas se basan en comparar un peso desconocido con
otro conocido. La balanza de resorte se vale de una relación lineal entre la
deformación de un muelle y la fuerza aplicada. La deformación del muelle es
amplificada por una cremallera y piñón, y medida por una aguja indicadora que
oscila sobre una carátula circular. En siglo XVII ya había referencias a esta
balanza. Su precisión es inferior a la de las balanzas que comparan un peso
2
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
desconocido con otro conocido, debido a que influían la temperatura y la histéresis
(permanencia del efecto después de la causa).
La balanza de dos platos constituye sin duda el dispositivo de pesada más
sencillo y mejor conocido del mundo. Para la práctica cotidiana no se requiere una
precisión excepcional, por lo que resultan adecuadas las balanzas robustas y
sencillas, pero cuando los pesos que intervienen son muy pequeños o requieren
mediciones precisas, el diseño y la construcción del instrumento han de ser muy
perfectos para minimizar los errores. Las balanzas de este tipo, como las
empleadas en trabajos de laboratorio, se montan en una base que se nivela por
medio de apoyos ajustables y un nivel incorporado.
Balanza de resorte
Balanza de resorte
Balanza de platillos
Resorte y
contrapesas
Contrapesas
MÉTODO DE MÍNIMOS CUADRADOS
En el análisis de datos experimentales se utilizan métodos de regresión lineal,
principalmente el método de mínimos cuadrados, para verificar la relación entre dos o
más variables.
Frecuentemente los datos experimentales presentan desviaciones de su
comportamiento ‘normal’, debido a diferentes causas, algunas de ellas son: mal
manejo del equipo, descuido en medir volumen y masa, temperatura, etc.
Para conocer la calidad de los datos experimentales obtenidos y conocer su
posible falla se utilizan los métodos de análisis de regresión.
En una colección de puntos experimentales se puede observar una
tendencia entre una variable independiente (se coloca en el eje de las X) y la otra
variable llamada dependiente (se coloca en el eje de las Y), Figura 1.
Fig. 1 Grafica de puntos experimentales
Fig. 2 Grafica que representa el paso de una recta
por en medio de los puntos.
3
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Esta colección de datos experimentales se pueden representar por una
recta que pase en medio de todos los puntos, de tal forma que esta recta se
encuentre a una distancia promedio’ cercana o igual a cero.
Se utilizarán solo tres puntos experimentales P1, P2 y P3.
Fig. 3 Representación de los tres puntos
experimentales tomados.
Fig. 4 Proyección sobre el eje de las diferentes xi
Cada uno de los puntos Pi, tiene asociado un par ordenado Xi,Yi y la recta tiene la
ecuación Y = A + BXi.
Los puntos experimentales tienen una proyección sobre el eje de las X, y se
puede proyectar también sobre la recta Y = A + BXi, de tal modo que en la recta
se localizan los valores de X1, X2 y X3.
La distancia (di) entre el punto experimental (Xi,Yi) y el punto (Xi,Y) de la recta, esta
dado por:
di = Y – Yi
Donde Y = A + BXi, y Yi es la ordenada del par Xi, Yi.
Finalmente, la ecuación Y = A + BXi que mejor represente al conjunto de puntos es aquella que tenga por suma de las distancias di
elevadas al cuadrado igual acero.
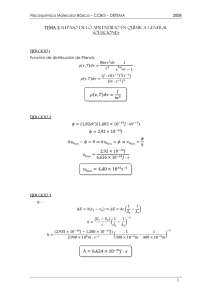
∑ di = ∑ (Y (i) − Yi) = 0
∑ di = ∑ ( A + BX − Yi) = 0
2
2
2
(1)
2
(1A)
Cuando se tenga esta condición se tendrá a la mejor recta que represente a
todos los puntos.
Sin embargo la recta que represente a todos los puntos, puede tener
cualquier valor de A y B de la ecuación:
Y = A + BX
4
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Donde A es la intersección de la recta con el eje de la Y, y B = tgα (donde α es el
ángulo que forma con el eje X).= pendiente.
Fig. 5 Representación de la ecuación de la recta y sus elementos geométricos
De todas las rectas que pueden representar a los puntos experimentales, se
elegirá aquella cuyos valores de A y B cumplan con la ecuación 1 y 1a, teniendo
que valorar A y B. Estas serán variables de una función F(A,B) y para encontrar
los valores mínimos de esta función, se derivará respecto a cada variable.
Siendo
F ( A, B) = ∑ ( A + BXi − Yi) 2
(2)
dF dF
Las derivadas de dA y dB serán
dF
= 2∑ ( A + BXi − Yi) = 0
dA
dF
= 2∑ ( A + BXi − Yi) = 0
dB
Reorganizando las ecuaciones quedaran como:
nA + B ∑ Xi = ∑ Yi
A∑ Xi + B∑ Xi 2 = ∑ XiYi
Empleando cualquier método de resolución de ecuaciones simultáneas, los
valores de A y B quedaran como:
∑ Y (∑ X ) − (∑ X )(∑ XY )
A=
n∑ X − (∑ X )
n∑ XY − (∑ X )(∑ Y )
B=
2
n∑ X 2 − (∑ X )
2
2
2
(3)
(4)
Otra medida de la calidad de relación entre datos es el coeficiente de correlación:
5
r=
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
n∑ XY − (∑ X )(∑ Y )
[n∑ X
2
][
− (∑ X ) n∑ Y 2 − (∑ Y )
2
2
]
(5)
El valor de r mide que tan bien la recta obtenida por mínimos cuadrados (o
regresión lineal) se adjunta a los datos experimentales.
HIPÓTESIS*.
MÉTODO EXPERIMENTAL.
Balanza analítica y Análisis estadístico
A) Sartorius Gem BL3100
Es una balanza electrónica de precisión de características:
Capacidad de pesada 3100 g.
Legibilidad 0.1 g
Rango de tara 3100 g
Calibrar / ajustar
Paso
Encender (en caso necesario)
Tecla
Indicación en pantalla
Tecla
Indicación en pantalla
Tarar la balanza
Pesar
Paso
Encender (en caso necesario)
Colocar recipiente para la muestra
“peso” g
Tarar la balanza
Poner muestra en el recipiente
0.0 g
“peso muestra” g
B) Ohaus Explorer
Es una balanza electrónica de precisión con características:
6
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Capacidad de pesada 61.00 g. Se requiere de contrapesas para aumentar.
Legibilidad 0.01 g
Calibrar / ajustar
Paso
Tecla setup
Tecla enter
Tecla enter
Tecla enter
Indicación en pantalla
CAL
CAL TYPE
CAL TYPE InCAL
INCAL
WEIGH
Pesar
Paso
Tecla ÆO/TÅ
Indicación en pantalla
Pantalla a cero
Colocar el objeto a pesar en el platillo. Máximo 62 g.
Esperar al indicador de estabilidad antes de leer el peso.
Ahora que se pueda llevar a cabo la pesada del objeto comenzaremos por
conocer el peso aproximado del objeto.
ETAPAS EXPERIMENTALES.
1. Se elegirán objetos idénticos, tal como monedas del mismo valor, máximo 10
objetos.
2. Se formarán equipos, para que se pesen las monedas de una en una hasta
llegar a 10.
3. Anótese el peso de cada moneda.
RESULTADOS Y CÁLCULOS.
1. Registre los datos de los pesos acumulados de las monedas, en la tabla:
xiyi
xi
xi2
yi2
Yi
(No. Dato) (Masa de la moneda en g)
1
.
.
10
2
2
∑ xi =
∑ yi =
∑ xi yi =
∑x =
∑y =
i
2.
3.
4.
5.
Grafique los datos experimentales Xi, Yi
Calcule el valor de cada una de las sumatorias de la tabla.
Utilizando las ecuaciones 4, 5 y 6, obtenga los valores de A, B y r.
Considere los valores de A y B para obtener la recta ajustada
7
i
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
6. Representar en la misma hoja las dos gráficas.
CONCLUSIONES*.
BIBLIOGRAFÍA*.
COMENTARIOS*.
*Aspectos propuesto por los estudiantes
8
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Determinación del Calor de combustión alcoholes
OBJETIVOS:
¾ Determinar el calor de combustión (∆CH) de varios
alcoholes alifáticos utilizando la acetona como líquido de
referencia.
¾ Calcular el ∆CH por cada grupo metileno.
¾ Estudiar la relación que existe entre el tamaño de la
cadena y el calor del combustión en los alcoholes.
INTRODUCCIÓN:
Una reacción de combustión se define como aquella que
tiene lugar entre un elemento o compuesto y el oxígeno para
formar productos de combustión determinados. Para
compuestos orgánicos formados únicamente por carbono
hidrógeno y oxígeno, los productos de la combustión son
dióxido de carbono y agua.
La reacción de combustión para el etanol es la siguiente:
CH3CH2OH + 3O2
2CO2 + 3H2O
El calor de combustión de una sustancia es el que
resulta de la combustión de un mol de dicha sustancia en su
estado normal a 25°C y 1 atm de presión. Experimentalmente
se puede calcular el calor de combustión aproximado de
algunos alcoholes determinando las temperaturas inicial y
final alcanzadas al calentar una determinada cantidad de
agua con el calor liberado de la combustión de dichas
sustancias. Esto se puede llevar a cabo utilizando un liquido
de referencia (acetona) al cual se le conoce su calor de
combustión (∆CH) y usando un sistema diseñado para usarse
en el laboratorio.
La cantidad de energía en forma de calor QA de la
acetona se puede expresar de la siguiente forma:
9
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
QA =
mA
∆ C Η (acetonaℓ
MA
)
..........(1)
O bien:
QA =
δ AV A
MA
∆ C Η (acetonaℓ
)
.........(2)
Donde: δA, VA, mA y MA, son; la densidad, el volumen, la
masa y el peso molecular de la acetona respectivamente.
De esta energía, al calentar el agua en un recipiente de
vidrio, sólo una fracción sirve para calentar el agua, por lo que
la energía QH O aprovechada por el agua es:
2
Q H 2O = K
δ AV A
MA
∆ C Η (acetonaℓ
)
..........(3)
La energía en forma de calor QH2O que sirvió para elevar la
temperatura del agua, puede expresarse también como:
Q H 2O = m H 2O C H 2O (TFA H 2O − Ti A H 2O )
..........(4)
Donde: C H O es la capacidad calorífica del agua (4.184 J.g-1.K1
), m H O es la masa del agua, Ti A H O y TFA H O son las
temperaturas inicial y final (en K) que alcanza el agua cuando
se quema acetona, respectivamente.
2
2
2
2
Igualando (2) y (3), tenemos:
m H 2O C H 2O (TFA, H 2O − Ti ,AH 2O ) = K
δ AV A
MA
∆ C Η (acetonaℓ
)
...........(5)
Una ecuación similar a (4) se puede obtener para cada
alcohol:
10
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
OH
m H 2O C H 2O (TFOH
, H 2 O − Ti , H 2 O ) = K
δ OH VOH
M OH
∆ C Η (alcoholℓ
)
...........(6)
Donde el superíndice y el subíndice OH está representando a
los términos del alcohol considerado.
Como se supone que la proporción de energía que se
pierde en forma de calor es la misma para la combustión de
cada alcohol, las K son iguales, por lo tanto, despejando K de
ambas ecuaciones, igualando las expresiones resultantes y
posteriormente despejado la ∆CH para un alcohol se tiene:
∆ C Η (alcohol λ ) =
OH
OH
δ AV A M OH TF , H O − Ti , H O
. A
.∆ C Η (acetonaℓ
δ OH VOH M A TF , H O − Ti ,AH O
2
2
2
2
)
........(7)
MATERIAL Y SUSTANCIAS:
1 Lata perforada
Agua destilada
1 Corcholata
Metanol
1 Pinza para bureta
Etanol
1 tela de asbesto
1-propanol
1Matraz erlenmeyer de 250 ml
Acetona
1 Termómetro (-10°C – 100°C
1 Vaso de precipitados de 250 ml
3 Pipetas graduadas de 5 ml (o de 10 ml)
1 Balanza granataria
Borlas de algodón
Encendedor o cerillos
Precaución: Evite que los recipientes con los disolventes estén cerca de alguna
flama o de una parrilla encendida, ya que son inflamables.
Nota: Los alumnos deben traer el encendedor o cerillos
HIPÓTESIS*
MÉTODO EXPERIMENTAL: Combustión
ambiente y presión atmosférica.
11
de
alcoholes
a
temperatura
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Figura No. 1: Sistema utilizado para llevar a cabo la combustión de alcoholes
ETAPAS EXPERIMENTALES:
¾ Pese el matraz el matraz erlenmeyer limpio y seco.
¾ Agregue 200 g de agua de la llave.
¾ Sujete el matraz erlenmeyer con las pinzas a una varilla de la mesa de
trabajo y a una altura adecuada para llevar a cabo la combustión del los
alcoholes (ver figura No.1)
¾ Mida la temperatura inicial del agua del matraz y anótela como Ti.
Mantenga el termómetro dentro del agua.
¾ Coloque una pequeña borla de algodón sobre la corcholata que se
encuentra sobre una tela de asbesto. Cuide que no quede muy compacta ni
muy floja.
¾ Adicione 2 ml de acetona sobre la borla de algodón rápidamente y de
Inmediato enciéndala y colóquela debajo del matraz.
¾ Agite cuidadosamente el agua con el termómetro y cuando se apague la
flama anote la temperatura máxima alcanzada (TF).
¾ Quite el matraz, tire el agua y enjuáguelo varias veces con agua de la llave
para enfriarlo.
¾ Agregue nuevamente 200 g de agua de la llave y repita el procedimiento
con el metanol y posteriormente con los otros alcoholes.
RESULTADOS Y CÁLCULOS:
1.
Anote sus datos experimentales:
T°C amb. =
12
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Líquido
Densidad
(g/ml)
T(°C)i
T(K) i
T(°C)F
T(K)F
Acetona
Metanol
Etanol
1-propanol
2. Escriba la reacción de combustión para cada una de las sustancias.
3. Determine la ∆CH de cada alcohol utilizando la ecuación No. 7.
4. Calcule la ∆CH del grupo metileno en los alcoholes. Para esto calcule: (a) la
diferencia de los valores de ∆CH entre el etanol y el metanol, (b) la diferencia
entre los valores de ∆CH entre el 1-propanol y el etanol, (c) el promedio entre
los dos valores anteriores.
5. Investigue los valores reportados en la bibliografía de ∆CH para cada uno de
los alcoholes; además, el valor de ∆CH para el metileno y calcule el porcentaje
de error.
6. Explique las posibles fuentes de error en sus determinaciones.
7. En la siguiente tabla anote sus resultados:
Líquido
∆CH teórico ∆CH experimental % de error
8. Con base a sus resultados anteriores, calcule los valores aproximados de ∆CH
del n-butanol y del n-pentanol.
9. Explique porque se debe usar el mismo matraz en todas sus determinaciones.
10. Cada gramo de gas natural libera aproximadamente 45 kJ de energía al
quemarse:
a). Calcule la energía almacenada en un tanque de 20 kg de gas natural.
b). ¿Cuántos litros de agua pueden calentarse de 20°C a 50 °C con ese tanque
de gas natural?. Supóngase que no se pierde energía al medio.
11. Uno de los principales componentes de la gasolina en el
n-octano (C8H18). Su calor de combustión es de 6,500 kJ.
mol-1.
a). ¿Qué cantidad de energía se desprende al quemar 1 g de n-octano?
b). ¿Cuánta energía hay almacenada en un tanque de gasolina
de un coche con 30 kg de gasolina?
CONCLUSIONES*
BIBLIOGRAFÍA*
COMENTARIOS*
*Aspectos propuesto por los estudiantes
13
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
CAPACIDAD CALORÍFICA Y ENTALPÍA DE FUSIÓN
OBJETIVOS:
Determinar experimentalmente la Capacidad Calorífica de un calorímetro (ε
)
y
la
entalpía de fusión del hielo, ∆H fh .
calor
INTRODUCCIÓN.
La Capacidad Calorífica C de un sistema, se define como la cantidad de
Calor “Q” que es necesario suministrar a un sistema para elevar su temperatura
en un grado celsius, es decir :
C=
Q
∆T
--------(1)
Dicha magnitud depende de la cantidad de sustancia que
constituye el sistema y su naturaleza, así como de la Presión,
el Volumen y la Temperatura.
Si el sistema está constituido de una sola sustancia o bien de una
disolución, y su peso es de un gramo, entonces la Capacidad Calorífica se
denomina Capacidad Calorífica Específica o Calor Específico; del mismo
modo, para un mol de una sustancia pura, la Capacidad Calorífica del sistema es
la Capacidad Calorífica molar o Calor molar de la sustancia.
Si el sistema está constituido por más de una sustancia, entonces la
Capacidad Calorífica total del sistema será igual a la suma de las Capacidades
Caloríficas de cada componente; matemáticamente se expresa como:
n
CT = ∑ C i
---------(2)
i =1
En nuestro caso, el sistema consta de dos partes, el agua y el calorímetro.
Tomando en cuenta la expresión anterior, tenemos que la capacidad calorífica
total CT es:
CT = C cal + C a
Donde: C cal = Capacidad calorífica del calorímetro
C a = Capacidad calorífica del agua (1.0 cal/g K)
14
(3)
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
La capacidad calorífica realmente significa capacidad energética (εcalor)
debido a que su valor indica la capacidad del sistema para almacenar energía. La
energía puede almacenarse parcialmente en movimiento de vibración; esto es; las
moléculas pueden ser promovidas a un nivel energético de vibración más alto, o
bien puede almacenarse parcialmente en movimiento electrónico o de rotación. En
cada caso, las moléculas son promovidas a un nivel energético más alto.
En el caso ideal en el que el calor desarrollado en un proceso o reacción,
no escape, entonces la suma del calor ( Qr ) que se desprende en el proceso (o
reacción) y el calor absorbido ( QS ), por el sistema (calorímetro más agua), es igual
a cero, es decir:
Qr + Q S = 0
(4)
Como: QS = CT ∆T ( I ) y ∆T ( I ) = T f − Ti
Donde: T f = Temperatura final del agua en el calorímetro (en equilibrio térmico en
un proceso).
Ti = Temperatura inicial del agua (de equilibrio) en el calorímetro antes de
un proceso o reacción.
Considerando que el sistema incluye una cantidad inicial de agua Wia entonces:
QS = (C c + C a Wia )∆T ( I )
------(5)
Donde:
Wia = Wca − Wcv
Por lo tanto: Wca = peso del calorímetro con agua fría (a temperatura ambiente)
Wcv = Peso del calorímetro vacío
Sustituyendo la ecuación (5) en la ecuación (4) se tiene:
Qr + (C c + C a Wia )∆T ( I ) = 0
Qr + [C c + C a (Wca − Wcv )]∆T ( I ) = 0
[C c + C a (Wca − Wcv )]∆T ( I ) = −Qr
[C c + C a (Wca − Wcv )]∆T ( I ) = −
− Qr
∆T ( I )
-------(6)
Finalmente el calor Qr producido por la adición de agua caliente al sistema
y considerando que dicha cantidad agregada es Wac entonces:
15
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Qr = Wac C a ∆T (II )
-------(7)
Donde: Wac = W fc − Wca y ∆T ( II ) = T f − Ta
W fc = peso final del calorímetro (con agua fría y caliente).
Ta = Temperatura del agua caliente agregada al calorímetro.
T f y Wca se definieron anteriormente.
Sustituyendo (7) en (6) se tiene:
Cc = −
(W fc − Wca ) C a (T f − Ta )
(T f − Ti )
− C a (Wca − Wcv )
O bien;
ε calor = −C
a
(W fc − Wca ) (T f − Ta )
+ (Wca − Wcv )
(T f − Ti )
------(8)
Como la cantidad de calor “Q” desprendido o absorbido por el sistema en
un proceso, es en general indefinido ya que depende de la trayectoria que siga el
proceso, también la Capacidad Calorífica lo será, a menos que se especifiquen
condiciones de Volumen o Presión constantes.
La expresión matemática que define a la Capacidad Calorífica a Volumen
constante C v es la siguiente:
Q
Cv =
∆T v
--------(9)
Lo que significa que la Capacidad Calorífica a volumen constante es la cantidad
de calor QV suministrado al sistema en un proceso que transcurre a volumen
constante, para elevar su temperatura en un grado celsius.
La CV se ha definido en términos del calor suministrado a un cuerpo bajo
condiciones específicas (volumen constante, sin involucrar otras formas de
trabajo) Sin embargo se puede relacionar con el incremento de energía interna
porque cuando el sistema no está realizando trabajo, dW = 0 y por lo tanto
dU = dQ o sea; CV = dU dT , a volumen constante.
16
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Del mismo modo, la Capacidad Calorífica a presión constante se define
matemáticamente como:
Q
Cp =
∆T p
------10)
Es decir, la Capacidad Calorífica a presión constante, es la cantidad de calor Q P
suministrado al sistema en un proceso que transcurre a presión constante, para
elevar su temperatura en un grado celsius.
La entalpía es la cantidad de energía de un sistema termodinámico que
puede intercambiar con su entorno y se representa matemáticamente de la
siguiente forma:
H = U + PV
P se considera la presión del sistema y la forma PV es parte de la definición de la
entalpía de una sustancia y no implica una restricción a gases perfectos.
Cuando un sistema pasa de una condición inicial a otra final; se mide el
cambio de entalpía (∆H ).
∆H = H f − H i
Si un sistema absorbe calor, su entalpía aumenta y ∆H
es un número positivo, pero si el sistema desprende calor, su
entalpía disminuye y ∆H es un número negativo.
En un cambio de fase por ejemplo de líquido a gas, el cambio de
entalpía del sistema es el calor latente de vaporización. También en un simple
cambio de temperatura, el cambio de entalpía por cada grado de variación
corresponde a la capacidad calorífica del sistema a presión constante.
Estrechamente relacionada con las entalpías de evaporación y de
sublimación es la entalpía de fusión.
El calor latente de fusión es la cantidad de energía en forma de calor
absorbido en la fusión de 1 g de sustancia a temperatura constante. Los calores
de fusión son inferiores a sus correspondientes calores de vaporización.
La entalpía de fusión es el calor absorbido cuando un mol de sólido se
convierte en líquido a presión constante. Para la transición de hielo–agua
tenemos:
m hielo ∆H fh = − (m H 2O C H 2O + C cal ) (T f ( III ) − Ti ( II ) )
donde:
∆H fh
= Entalpía de fusión del hielo
17
------(11)
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Ti ( II ) = Temperatura inicial (equilibrio II) del agua
T f ( III ) = Temperatura final (equilibrio III) del agua
C H 2O = Capacidad calorífica del agua (4.184 J g-1 K-1)
C cal = ε
= Capacidad calorífica del calorímetro
calor
m H 2O = Masa total del agua agregada
mhielo = Masa del hielo en gramos
HIPÓTESIS*.
MÉTODO EXPERIMENTAL.
Determinación de la Capacidad Calorífica de un calorímetro y de la Entalpía
de Fusión del hielo por Calorimetría.
MATERIAL Y REACTIVOS
1 Calorímetro (termo)
1 Probeta de 100 ml
1 Parrilla
1 Termómetro.
1 Vaso de precipitados de 250 ml.
1 Balanza granataria.
Agua destilada.
Hielo en cubitos.
ETAPAS EXPERIMENTALES.
ETAPA I: DETERMINACIÓN DE LA CAPACIDAD CALORÍFICA
1. Pese el calorímetro vacío (limpio y seco) y anote el dato (WCV ) .
2. Agregue al calorímetro 250 ml de agua destilada y pese inmediatamente; anote
el dato (Wca ) .
3. Registre la temperatura del calorímetro cada uno o dos durante 10 minutos ó
hasta que se alcance el equilibrio térmico; anote el dato como ( Ti ). Agite para
alcanzar más rápidamente el equilibrio térmico.
4. En un vaso de precipitados caliente 100 ml de agua destilada a 50 ºC, anótelo
como ( Ta ); agréguela rápidamente al calorímetro y tápelo; péselo
inmediatamente y anote el dato ( W fc ).
5. Registre la variación de la temperatura del agua en el calorímetro cada uno o
dos minutos durante 10 minutos ó hasta que se alcance el equilibrio térmico;
18
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
anote el dato como ( T f ). Agite para alcanzar más rápidamente el equilibrio
térmico.
NOTA: No tire el agua del calorímetro.
ETAPA II: DETERMINACIÓN DE LA ENTALPÍA DE FUSIÓN DEL
HIELO
1. Verifique la temperatura del calorímetro y anótela como ( Ti ( II ) ).
2.
Agregue, lo más rápido posible, un cubo de hielo al calorímetro y tápelo.
Pese el calorímetro y anótelo como ( Wch).
3.
Registre la variación de la temperatura del calorímetro durante 10 minutos ó
hasta que se alcance el equilibrio térmico; anote el dato como ( T f ( III ) ). Agite
para alcanzar más rápidamente el equilibrio térmico.
RESULTADOS Y CÁLCULOS.
1. Anote sus datos experimentales en una tabla.
2. Utilice la ecuación (8) para calcular la capacidad calorífica del calorímetro
3. ¿Qué consideración termodinámica se hace al deducir la ecuación (8)?
4. Utilizando la ecuación (11) calcule la entalpía de fusión del hielo. La masa del
agua será igual a Wch - Wcv.
5. Deduzca las unidades de la ε
y de la ∆H fh por separado.
calor
6. Calcule el porcentaje de error de la ∆H fh con respecto a el valor reportado.
7. Diga cuales fueron las posibles fuentes de error en el desarrollo de su práctica.
8. ¿En que unidades se expresan las siguientes magnitudes: calor, capacidad
calorífica y entalpía de fusión?
9. Investigue valores de capacidad calorífica para diferentes sustancias.
CONCLUSIONES*.
BIBLIOGRAFÍA*.
COMENTARIOS*.
*Aspectos propuesto por los estudiantes.
19
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
DETERMINACION EXPERIMENTAL DEL ESTADO TERMODINÁMICO
DE UN SISTEMA GASEOSO
OBJETIVOS.
∗ Medir experimentalmente los valores de las variables termodinámicas que fijan
el estado de un sistema gaseoso.
∗ Determinar experimentalmente el rendimiento (%) de una reacción química.
∗ Aplicar el método de recolección de gases por desplazamiento de agua.
∗ Aplicar de forma experimental las leyes de los gases ideales.
∗ Interpretar el carácter fenomenológico de la termodinámica.
INTRODUCCIÓN.
Las condiciones termodinámicas de un sistema en estado gaseoso se
define en término de cuatro propiedades macroscópicas características, a saber:
presión, volumen, temperatura y composición. Para una determinada cantidad de
materia, la presión, el volumen y la temperatura no son independientes entre si,
sino que están relacionadas mediante una ecuación matemática denominada
ecuación de estado. Evidentemente, si alguna de estas variables cambia, el
estado del sistema también cambiará.
HIPÓTESIS*.
MATERIAL Y SUSTANCIAS
1 Frasco de 10 ml.
1 Matraz Kitasato de 500 ml.
1 Tapon de hule.
1 Bureta de 50 ml.
1 Tubo de vidrio.
1 Vaso de precipitado de 400 ml.
1 Termómetro.
Tubo de hule e Hilo de coser.
Ácido sulfámico (HSO3NH2)
Nitrito de sodio
(NaNO2)
Agua destilada
MÉTODO EXPERIMENTAL.
Producción de Nitrógeno en fase gaseosa a partir de la reacción entre ácido sulfámico y
nitrito de sodio:
20
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
NaNO2 + HSO3NH2 → NaHSO4
+ N2 ↑ + H2O
El equipo a usar se muestra en la siguiente figura :
Bureta invertida y llena de agua
Matraz
Kitasato
Cero arbitrario
Hilo y frasco
Termómetro
Tubo de hule
Vaso de precipitado con agua
destilada
Tubo de
vidrio
Nota: Antes de ensamblar y montar el equipo, asegúrese de que se encuentre
completamente limpio y que la bureta invertida esté llena de agua destilada y
ajustado su nivel a cero.
ETAPAS EXPERIMENTALES.
a) Pese 0.6 g de ácido sulfámico, páselo a un vaso de precipitados de 250 ml y
añada con agitación 100 ml de agua destilada para obtener una solución.
b) Pese 0.4 g de nitrito de sodio, páselo a un vaso de precipitado de 150 ml, añada
40 ml de agua destilada y agite hasta disolver.
c) Tome una alícuota de 25 ml, de solución de ácido sulfámico y deposítela, en el
matraz Kitasato.
d) Transfiera 10 ml de la solución de nitrito de sodio al frasco de 10 ml y coloque
alrededor de cuello de este, una cuerda o un hilo de coser de aproximadamente
15 cm de longitud.
e) Baje el frasco dentro del Kitasato cuidadosamente para evitar cualquier derrame
prematuro de la solución de nitrito de sodio que permita el inicio de la reacción.
f) Ajuste el tapón al matraz Kitazato y verifique que todo esté en orden. Deje un
poco de hilo de tal forma que pueda caer horizontalmente el frasco.
g) Inicie la reacción, inclinando con cuidado el frasco y moviendo suavemente para
evitar romper el matraz Kitasato y/o el frasco. De esta forma las dos soluciones
entraran en contacto y la reacción se llevará cabo completamente.
h) Anote en su libreta la temperatura del agua del vaso y el volumen de nitrógeno
producido cuando haya terminado la reacción.
i) Repita el procedimiento a partir de ﴾c), pero ahora agregue en exceso solución
de ácido sulfámico (50 ml).
21
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
j) Repita el procedimiento usando las cantidades que se emplearon en los incisos
(c y d) y utilizando agua destilada a 40oC, aproximadamente.
k) La reacción considerada dura aproximadamente 6 minutos. Como el nitrógeno
será colectado sobre agua, su presión de vapor deberá tomarse en cuenta en
los cálculos.
RESULTADOS Y CÁLCULOS.
1. En la siguiente tabla anote los datos experimentales de cada uno de los
experimentos:
No.
NaNO2 HSO3NH2
Patm
T (°C) T (K) PV(H2O)
PN2
VN2
exp. (moles) (moles) (mm Hg)
(mmHg (mmHg) (ml)
1
2
3
2. Calcule la cantidad de nitrógeno, en moles, formado durante los
experimentos realizados.
3. Calcule el rendimiento teórico de la reacción involucrada, a partir de
su ecuación química.
4. Calcule el rendimiento porcentual de la reacción química en los experimentos.
5. ¿Qué efecto tiene la temperatura del baño de agua, en la cantidad de
nitrógeno formado? Explique.
6. Si se añade un exceso mayor de ácido sulfámico, manteniendo la
misma cantidad de nitrito de sodio,¿Qué volumen de nitrógeno se
formará?.Explique.
7. ¿Cuántos gramos de nitrito de sodio deberá añadirse para asegurar la
reacción completa de 0.6 g de ácido sulfámico.
CONCLUSIONES*.
BIBLIOGRAFÍA*.
COMENTARIOS*.
*Aspectos propuesto por los estudiantes
22
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
LA SOLUBILIDAD COMO FUNCIÓN DE LA TEMPERATURA
OBJETIVOS:
Determinar el calor diferencial de solución para el ácido benzóico en agua.
INTRODUCCIÓN:
El calor diferencial de solución dHS es el calor involucrado cuando un mol
de s{olido se disuelve en una solución que está prácticamente saturada. Este calor
se determina conociendo la solubilidad de una sustancia a diferentes
temperaturas.
La relación termodinámica a utilizar es una extensión de la ecuación de
Clausius-Clapeyron que se deriva de la siguiente manera. Considerando un
sistema en donde un sólido está en equilibrio con una solución saturada del
mismo, la ecuación de equilibrio es:
G lS = G sS
l
------(1)
s
donde: G S o G S es la energía molar parcial del soluto en el líquido ó en el sólido
respectivamente.
Utilizando la definición de dGi = RTd ln f i para ambas fase:
f
l
l
S
= f
s
S
--------(2)
s
donde: f S ó f S = fugacidad molar parcial del soluto en el líquido y en el sólido
respectivamente.
Expandiendo los términos de fugacidad en sus partes y tomando el estado
puro del soluto en la fase respectiva como el estado de referencia para la
fugacidad (convención 1), la ecuación anterior es:
Χ lS γ Sl f Sl = Χ sS γ Ss f Ss
-------(3)
donde: Χ S ó Χ S = fracción molar del soluto en el líquido ó en el sólido,
respectivamente.
γ Sl ó γ Ss = coeficiente de actividad del soluto en el líquido ó en el sólido
l
s
respectivamente.
l
S
s
S
f ó f = Fugacidad del soluto puro en la fase líquida ó en la fase sólida a
la temperatura y presión del sistema.
Es preciso hacer algunas observaciones pertinentes. En primer lugar, el
s
s
soluto se encuentra como sustancia pura y por tal razón Χ S = γ S = 1 y la fugacidad
23
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
parcial se reduce a la fugacidad del soluto puro. En el caso del líquido, el soluto s
no existe como líquido puro a la temperatura y presión del sistema (esto sólo
sucede en la temperatura de fusión), y por eso es necesario encontrar otro estado
de referencia para la fugacidad.
En el presente caso es conveniente escoger el estado de referencia como
la fugacidad del soluto en una solución saturada (su límite de solubilidad) por la
facilidad de determinar su fracción molar o molalidad experimentalmente.
Entonces, haciendo las sustituciones necesarias:
f =Χ γ
s
S
donde:
l
S
l
S
f Sl l ss
f = Χ ss γ S f S = Χ lS γ Sss f Sss
fS
l
S
l
S
---------(4)
f Sss = Fugacidad de una solución saturada del soluto.
γ Sss = Coeficiente de actividad de una solución saturada.
Multiplicando por RT y nuevamente aplicando la definición dGi = RT d ln f i ,
se obtiene otra forma de la ecuación anterior:
donde
RT ln f Ss = G Ss = RT ln Χ ssS γ Sss + RT ln f Sss
---------(5)
G Sss = RT ln Χ ssS γ Sss + G Sss
---------(6)
− ∆G S = G Ss − G Sss = RT ln Χ ssS γ Sss
---------(7)
∆G S = Energía libre diferencial de solución.
Diferenciando la ecuación (7) con respecto a la temperatura y aplicando la
expresión termodinámica que relaciona el cambio de la energía libre de Gibbs con
la temperatura y con la entalpía, se obtiene:
∆G S
∂
T
∂T
= − ∆H S
2
T
P
∂ ln Χ ssS γ Sss d ln K S
∆Η
=
=
dT
∂T
RT 2
24
--------(8)
---------(9)
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
K S = a S = γ Sss Χ ssS
--------10)
Al integrar la ecuación (9) y considerando ∆Η S ≠ f (T ) se obtiene:
ln
donde
K S´
∆Η S T ´ − T
=
KS
R T ´T
-------(11)
K S´ y K S son las solubilidades del soluto a las temperaturas T´ y T (en K)
respectivamente.
HIPÓTESIS*.
MATERIAL Y SUSTANCIAS:
4 Matraces erlenmeyer de 250 ml
1 Probeta de 100 ml
1 Parrilla de eléctrica
2 Termómetros
2 Baños con controlador de temperatura
1 Pipeta graduada de 25 ml
2 Vasos de precipitados de 100 ml
1 Bureta de 50 ml
2 Trozos de manguera
Algodón
Ácido benzóico
Agua destilada
Solución de NaOH 0.05 M
MÉTODO EXPERIMENTAL.
Uso de la solubilidad de un sólido en agua a diferentes temperaturas.
ETAPAS EXPERIMENTALES.
1) Poner a trabajar los recirculadores de los baños fijando la perilla reguladora
de temperatura a 25°C y 45°C respectivamente.
2) Coloque 0,5 g de ácido benzóico en un matraz erlenmeyer de 250 ml y
agregue 100 ml de agua destilada.
3) Caliente el contenido del matraz hasta ebullición y manténgalo durante 10
minutos. Evite calentar bruscamente ya que de lo contrario se le proyectará la
mezcla por la boca del matraz
4) Enfríe al chorro de agua hasta 30°C.
25
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
5)
Introduzca el termómetro en la mezcla del matraz y éste en el baño a 25°C.
Manténgalo hasta alcanzar el equilibrio térmico (aproximadamente 30 min),
agitando ocasionalmente.
6) Tome una alícuota de 25 ml de solución (por duplicado) colocando en la
punta de la pipeta un tubo pequeño de hule con algodón (servirá como filtro
para evitar el paso de cristales de ácido benzóico). Cada alícuota se
depositará en un matraz erlenmeyer.
7) Titule cada alícuota con solución de NaOH 0.05M utilizando fenolftaleína
como indicador.
8) En el segundo matraz erlenmeyer coloque 2.5 gr de ácido benzóico y 100 ml
de agua destilada.
9) Calentar la mezcla a ebullición como en el caso anterior y después enfríela a
50 °C al chorro de agua.
10) Introduzca el termómetro en la mezcla y lleve el matraz al baño de 45°C.
11) Cuando alcance el equilibrio térmico tome dos alícuotas de 5 ml por separado
y titúlelas con la solución de NaOH en presencia de fenolftaleína.
RESULTADOS Y CÁLCULOS.
1. Anote sus datos experimentales.
2. Determine la solubilidad del ácido benzóico para cada temperatura. Para esto
considere as≅ M (mol/l).
3. Calcule el calor diferencial de solución.
4. Deduzca por separado las unidades de ∆ΗS
CONCLUSIONES*.
BIBLIOGRAFÍA*.
COMENTARIOS*.
*Aspectos propuesto por los estudiantes
26
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
PROPIEDADES MOLARES PARCIALES
OBJETIVO.
Determinar el volumen parcial molar en una solución binaria.
INTRODUCCIÓN.
Las propiedades parciales molares son de gran utilidad en el estudio de
soluciones, en donde el sistema depende también de la concentración de los
distintos componentes de la solución.
Para soluciones binarias, un cambio diferencial en una propiedad
termodinámica X, se expresa.
∂X
∂X
dX =
dT +
∂T P ,n1 ,n2
∂p
∂X
∂X
dP +
dn1 +
dn2
T ,n1 ,n2
∂n1 P ,T ,n2
∂n2 P ,T ,n1
(1)
P y T constantes:
∂X
∂X
dX =
dn1 +
∂n1 P ,T ,n2
∂n2
dn2
P ,T ,n1
(2)
Siendo X 1 y X 2 las propiedades parciales molares de X con respecto a
n1 y n2 molares, se tiene:
∂X
X 1 =
∂ n1
P ,T , n 2
∂X
X 2 =
∂n2 P ,T ,n1
(3)
(4)
Por lo tanto:
dX = X 1n1 + X 2 n2
(5)
En general
dX = ∑ X i dni
27
(6)
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
Dado que la ecuación anterior es una función homogénea, podemos
integrarla para obtener la siguiente:
X = X 1 n1 + X 2 n 2
X = ∑ X i ni
Las propiedades parciales molares (X), son propiedades intensivas y se
considera que son la contribución por mol de cada constituyente al valor total de la
propiedad X en el sistema en cuestión. Algunas propiedades parciales molares
tienen nombres particulares, por ejemplo:
H i = Li = Calor de solución de i es la entalpía parcial molar de i.
Gi = µ i = Potencial químico de i es la energía libre parcial molar de i.
Volumen Parcial Molar
El volumen parcial molar V es una propiedad que se puede determinar en
el laboratorio. Se define como el cambio en volumen causado al agregar un mol de
i a una cantidad muy grande de solución, de tal forma que la composición de la
solución no cambia; matemáticamente se representa:
()
V = V1 n1 + V 2 n 2
∂V
V 1 =
∂ n1
V
2
P ,T , n 2
∂V
=
∂n2
P , T , n1
(7)
(8)
(9)
Donde V 1 se refiere al solvente y V 2 .
Para una solución binaria el volumen parcial molar se puede calcular a
partir de los volúmenes específicos (inverso de las densidades) de soluciones
cuya concentración se conoce. Las densidades se determinan en un picnómetro.
HIPÓTESIS*
MATERIAL Y SUSTANCIAS:
5 Matraces volumétricos de 100 mL
1 pipeta graduada de 5 mL
28
Fac. Cs. Qs. Dpto. De FISICOQUÍMICA
LABORATORIO DE FISICOQUÍMICA I
Q.F.B
1 pipeta graduada de 25 mL
5 pipetas volumétricas de 10 mL
1 picnómetro
1 par de guantes de hule
1 perilla
200 mL de etanol
Limpiador de vidrio de laboratorio
Agua destilada
MÉTODO EXPERIMENTAL: Determinaciones por
Densitometría
DESARROLLO EXPERIMENTAL:
1. Se preparan cinco soluciones de 30, 35, 40, 45, 50% en volumen de etanol.
2. Para la determinación de las densidades se utiliza el picnómetro de la siguiente
forma:
a. Pesar el picnómetro completo ( con termómetro y tapón) seco y vacío.
b. Llene el picnómetro introduciendo su termómetro, cuidando que no
existan burbujas de aire atrapado y que la solución llene todo el
capilar. Coloque el tapón.
c. Pese nuevamente el picnómetro cuidando que el exterior esté
completamente seco
RESULTADOS Y CÁLCULOS:
1.
2.
Anote sus datos experimentales
Determine las fracciones mol de etanol X e tan ol , y los volúmenes específicos
de las soluciones utilizadas: Vmez , Ve tan ol y Vagua .
3.
4.
Graficar Vmez vs. Ve tan ol .
Determinar Ve tan ol y Vagua para los diferentes valores de etanol.
CONCLUSIONES*.
BIBLIOGRAFÍA*.
COMENTARIOS*.
*Aspectos propuesto por los estudiantes
29