enlace de van der waals - Física y Química en Flash
Anuncio

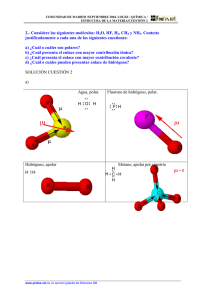
ENLACE DE VAN DER WAALS Ninguno de los enlaces limite (iónico, covalente, metálico) puede explicar la cohesión de los gases nobles en estado sólido (o líquido) o las fuerzas intermoleculares de los cristales orgánicos. Estas fuerzas que existen en esos casos se conocen como enlaces de VAN DER WAALS, puesto que ya fueron postulados por VAN DER WARLS en 1873 al estudiar la ecuación de estado de los gases aunque sin analizar su naturaleza. Estas fuerzas existen siempre, aunque son débiles y pasan desapercibidas si se comparan con las propias fuerzas iónicas, covalente o metálicas Teoría del enlace de VAN der WAALS. - En 1912, KEESOM consideró la existencia de un efecto de orientación entre moléculas neutras polares que presentan dipolos permanentes. La atracción electrostática entre los dipolos orientados justificaría la cohesión entre las moléculas. DEBYE consideró que las predicciones del efecto de orientación no concordaban exactamente con la realidad, Por esta razón considero un efecto de inducción entre los dipolos permanentes ya existentes. De esta forma el efecto electrostático se vería incrementado. Estos efectos van siempre asociados. Los dos efectos anteriores son validos en sólidos o líquidos con moléculas polares pero no pueden jugar ningún papel en casos como: Gases nobles, metano, hidrógeno, benceno... en los que ni las moléculas ni los átomos (caso ce los gases nobles) poseen momento dipolar permanente. LONDON considero un efecto de dispersión asociado con la polarización dinámica de la molécula. De acuerdo con LONDON incluso los sistemas completamente simétricos, sin momento dipolar permanente, pueden tener momento dipolar instantáneo o transitorio, puesto que, en un instante dado los electrones no estarían distribuidos con la alta simetria correspondiente a un gran periodo de tiempo. El dipolo instantáneo polariza a sus vecinos tal como ocurriría en el efecto de inducción. En general, el efecto de dispersión es el mas importante (salvo en el caso de moléculas muy polares tales como H2O, NH3 , ...). Los efectos de dispersión e inducción se ven favorecidos por la complejidad creciente de los átomos (radio y número de electrones) puesto que su polarización seria más fácil, Un ejemplo del papel primordial de este efecto es el estado físico de los halógenos. F2, Cl2, Br2, I2 ENLACE POR PUENTES DE HIDROGENO. Se conoce desde hace tiempo que en determinadas condiciones un átomo de hidrógeno es atraído por fuerzas relativamente intensas hacia otros dos átomos en lugar de hacia uno sólo como cabria esperar. Dado que el hidrógeno solo pude formar un enlace covalente el puente de hidrógeno que se establece con el otro átomo es necesariamente de carácter iónico. A pesar de que la energía de estos enlaces (2 a 10 kcal/mol) es tan sólo una décima parte de la de un enlace covalente, si tienen gran importancia en las propiedades de las substancias donde se presentan (pueden formarse muchos enlaces de este tipo). La primera mención de este enlace se debe a Moore y Winmill (1912) que explicaron la débil basicidad del hidróxido de trimetil amonio por relación al hidróxido de tetrametilamonio por la formación de estos enlaces. Latimer y Rodebusch (1920) reconocieron la importancia de este tipo de enlace y usaron este concepto en el estudio y justificación de propiedades de líquidos altamente asociados tales como el agua y el fluoruro de hidrógeno, la pequeña ionización del hidróxido de amonio y la formación de moléculas dobles (dímeros) de Acido acético. En primer lugar la unión hidrogeno es un enlace entre dos átomos mediante un hidrógeno. En segundo lugar solo los átomos mas electronegativos podrán formar uniones hidrógeno. La experiencia indica que el flúor forma uniones hidrógeno muy fuertes; el oxigeno mas débiles; y el nitrógeno, más débiles aún. Aunque el cloro tiene la misma electronegatividad que el nitrógeno, su poder de formación de uniones hidrógeno es muy pequeño (lo que puede atribuirse a que su tamaño es mucho mayor que el del nitrógeno haciendo más débiles sus interacciones electrostáticas). La representación habitual de la unión hidrógeno es A—H•••••B y, en general, el átomo de hidrogeno está más cerca de uno de los dos átomos electronegativos adyacentes que del otro. Como ya hemos dicho las uniones de hidrógeno son más débiles que los enlaces covalentes pero son más intensos que las fuerzas de Van der Waals; lógicamente las longitudes de enlace de los puentes de hidrógeno (2'5 - 3 Å), son intermedias entre ambos casos. Efecto sobre las propiedades físicas de las substancias: Cuando se considera la serie H2Te, H2Se, H2S se aprecia que los puntos de fusión y de ebullición muestran el orden creciente esperado a la vista de la disminución de pesos moleculares y de las fuerzas de Van der Waals (el efecto predominante, el de dispersión, disminuye al hacerlo Z para elementos de estructura similar). De acuerdo con esta secuencia , seguida en el caso de toda la serie de los gases nobles, cabria esperar en el caso del agua valores de -100 ºC y -80 ºC para los respectivos p.f. y p.eb. del H2O. Como es bien conocido los valores reales son mucho más altos: la justificación está en la formación de puentes de hidrógeno que tienen la extraordinaria propiedad de duplicar el valor del punto de ebullición del agua en la escala Kelvin de temperatura. Esta misma circunstancia se observa con el fluoruro de hidrógeno respecto al resto de la serie HX , y con el amoniaco respecto a la serie XH3. La existencia de este efecto tanto en el p.f. como en el p.eb. se debe interpretar como que parte de las uniones de hidrógeno existentes en los cristales del sólido se rompen en la fusión, pero que otras (más de la mitad del total) se mantienen en el líquido aún en el punto de ebullición y se rompen por la vaporización. Incluso, los fuertes puentes de hidrógeno existentes en el fluoruro de hidrógeno persisten en el vapor que se encuentra polimerizado en un cierto grado. Los puentes de hidrógeno son responsables de las propiedades especiales del agua y amoniaco: valores anormalmente elevados de los puntos de fusión y de ebullición, constante dieléctrica, calor de fusión y vaporización. En el caso del agua es igualmente singular la estructura muy abierta del hielo con muy baja densidad , lo que hace que sea uno de los raros casos en que una sustancia sólida a flote en su fundido: igualmente singular es la dilatación anómala del agua líquida que hace que alcance su máxima densidad a unos 4 °C . En el caso de las substancias orgánicas los puentes de hidrógeno son muy frecuentes en los alcoholes y en los ácidos carboxílicos con 1a formación de las correspondientes agrupaciones poliméricas y efecto consiguiente sobre las propiedades. Además de los casos, de uniones entre átomos de moléculas distintas (uniones intermoleculares), también existen muchos casos de uniones de hidrógeno entre átomos de una misma molécula (uniones intramolecuares). Así por ejemplo el nitrofenol presenta uniones hidrógeno en su forma orto, que se ponen de manifiesto por la diferencia entre los p.f. y eb., por relación a las formes meta y para. Más importante sin duda son las uniones, de hidrógeno N—H•••••0 en las proteínas, puestas de manifiesto por Pauling y Corey (11954). Igualmente de excepcional importancia son la, uniones N—H•••••O y N—H•••••N que se presentan en los ácidos nucleicos.