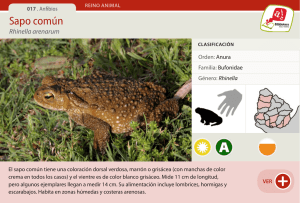
Rescate y Relocalización
Anuncio

UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Informe sobre mitigación de impacto ambiental en Fauna Silvestre: Rescate y Relocalización Este Informe fue elaborado por la Facultad de Ciencias de la U. de Chile por encargo del Servicio Agrícola y Ganadero, SAG. Ramiro O. Bustamante1, Alex Oporto P. 2, Sergio Moraga V., Francisco de la Barrera, Gonzalo Sepúlveda, Darío Moreira. 1Contacto: [email protected] 2Contacto: [email protected] UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Índice 1 Introducción .............................................................................................................1 1.1 Bases conceptuales.........................................................................................1 1.1.1 Generación de Medidas de Mitigación ..................................................1 1.1.2 Protección de especies y/o procesos ecológicos .................................3 1.1.3 Estrategias de Filtro Fino ..............................................................................4 1.1.4 Estrategias de Filtro Grueso.........................................................................6 2 Rescate y Relocalización de Especies.................................................................7 2.1 Principios Ecológicos........................................................................................7 3 Identificación de Especies Objetivo.................................................................. 11 4 Descripción de Hábitat........................................................................................ 18 4.1 Requerimientos de Hábitat por grupo ...................................................... 18 4.1.1 Mamíferos.................................................................................................... 18 4.1.2 Reptiles ........................................................................................................ 19 4.1.3 Anfibios ........................................................................................................ 20 4.2 Selección de Hábitat Receptor.................................................................. 21 4.2.1 Protocolo para Caracterización del hábitat natural de las especies 21 4.2.2 Criterios para Elección del sitio ............................................................... 22 4.2.3 Revisión de literatura específica............................................................. 26 5 Procedimiento para el muestreo ....................................................................... 29 6 Métodos de Captura ........................................................................................... 31 6.1 Métodos indirectos........................................................................................ 31 6.2 Métodos directos........................................................................................... 33 6.2.1 Trampas de captura viva......................................................................... 33 6.2.2 Muestreo por Encuentro Visual (“Visual Encounter Survey VES”)...... 37 6.3 7 Consideraciones de los métodos de captura ......................................... 37 Marcaje de Individuos ......................................................................................... 41 7.1 Criterios de Elección de la técnica............................................................ 41 7.2 Descripción de Técnicas de Marcaje ....................................................... 42 7.2.1 Corte de Dedos (Toe Clipping):.............................................................. 42 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 7.2.2 Perforación de Orejas............................................................................... 43 7.2.3 Corte de Escamas ..................................................................................... 44 7.2.4 Tatuado de Individuos .............................................................................. 44 7.2.5 Uso de Pinturas ........................................................................................... 45 7.2.6 Etiquetas Subcutáneas............................................................................. 45 7.2.7 Etiquetas Superficiales .............................................................................. 46 7.2.8 Microtransmisores ...................................................................................... 47 8 Estimación de Tamaños Poblacionales ............................................................ 50 8.1 Modelo de Lincoln-Peterson ....................................................................... 51 8.2 Modelos de historia de captura ................................................................. 52 8.2.1 Modelos para poblaciones cerradas: ................................................... 53 8.2.2 Modelos para poblaciones abiertas:..................................................... 53 8.3 9 Modelos Bayesianos de captura-recaptura ........................................... 55 Traslado y liberación ............................................................................................ 56 9.1 Cuarentena.................................................................................................... 57 9.1.1 Roedores. .................................................................................................... 57 9.1.2 Marsupiales. ................................................................................................ 57 9.1.3 Anfibios ........................................................................................................ 58 9.1.4 Reptiles ........................................................................................................ 58 10 Evaluación de la medida.................................................................................... 59 10.1 Caracterización de Individuos.................................................................... 61 10.2 Tiempos de monitoreo.................................................................................. 62 10.3 Potenciar el éxito de la medida .................. ¡Error! Marcador no definido. 11 Bibliografía.............................................................................................................. 64 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 1 1.1 BASES I NTRODUCCIÓN CONCEPTUALES 1.1.1 G E N E R A C I Ó N DE MEDIDAS DE MITIGACIÓN En el contexto del Sistema de Evaluación de Impacto Ambiental (SEIA), la elaboración de medidas de mitigación ocurren cuando se han identificado efectos ecológicos negativos luego que se ha elaborado un Estudio de Impacto Ambiental (Art. 11/Ley 19.300). En consecuencia, las medidas de mitigación de impactos sobre la fauna silvestres tienen por objetivo evitar o reducir los efectos generados por un proyecto de inversión que, para el caso de la fauna silvestre. Estos impactos se relacionan con los siguientes procesos: Destrucción o pérdida de hábitat Corresponde al impacto de mayor complejidad y magnitud generado sobre la fauna silvestre. Asociado principalmente con Mega-proyectos de alta inversión; estos impactos implican la remoción total de la vegetación, del suelo lo cual modifica significativamente las condiciones y recursos para muchas especies nativas. El concepto de hábitat suele emplearse para referirse a un sector del espacio que reúne ciertas condiciones que permiten la existencia de algunas especies pero no de otras En rigor, no existen medidas que puedan mitigar el impacto que significa la destrucción de un hábitat, siendo posible sólo proponer que las perturbaciones sean graduales como la única forma de evitar un efecto masivo sobre el conjunto de especies afectadas. Por otro lado se han propuesto las medidas de Compensación tales como la instauración de áreas protegidas tales como parques y reservas, que incluyan hábitats similares a los ya destruidos. Fragmentación de Hábitat 1 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS La fragmentación resulta de la subdivisión de un hábitat originalmente continuo en subunidades discretas (fragmentos) de diversos tamaños y más o menos separadas entre sí. Otro efecto de la fragmentación es la aparición de un nuevo componente del paisaje denominado matriz, con condiciones ecológicas diferentes a las de los fragmentos. Corresponde a uno de los efectos más frecuentes de los proyectos que se sitúan sobre áreas naturales con bajos niveles de intervención. En esencia, la fragmentación debe ser entendida como una limitación en los rangos de hogar de las especies animales, en donde las posibilidades de desplazamiento se ven afectadas por la separación de los fragmentos o por la existencia de la matriz. La fragmentación ocurre tanto cuando un área es parcialmente dividida y/o reducida en superficie, como cuando el paisaje original se divide por caminos, canales, vías férreas, líneas de transmisión, gasoductos, cercos, cortafuegos o cualquier otra barrera al libre desplazamiento de las especies (SAG, 2004). Desde la perspectiva de las especies, la fragmentación del hábitat implica una reducción en la calidad del hábitat por un aumento del efecto de borde, reducción de la superficie de forraje, aislamiento y reducción del tamaño poblacional, introducción de especies exóticas, entre otros. Muchas de las medidas orientadas a mitigar los impactos producidos por la fragmentación del hábitat se enfocan a incrementar la conectividad utilizando como referencia el concepto de corredor biológico. En este sentido, es importante hacer notar que tanto la generación de un corredor como la construcción de infraestructuras que permitan mantener la continuidad del paisaje, funcionan solo sobre algunas especies focales. En consecuencia, es frecuente que para la evaluación de los impactos generados por la fragmentación se desconozca el impacto generado sobre la totalidad de las especies que habitan en un área Degradación del hábitat Corresponde a un cambio sistemático en las condiciones y recursos que permiten la existencia de una o más especies en un ambiente determinado. Este fenómeno se asocia principalmente alteración de la calidad del hábitat producto de la modificación de la cobertura vegetal o por la incorporación al medio de elementos contaminantes que alteren las condiciones naturales de los componentes bióticos y abióticos de los sistemas ecológicos. El fenómeno de la degradación representa un desmedro en las condiciones y los recursos que sustentan la existencia de una o más especies, y en donde la continuidad del proceso de degradación podría eventualmente significar la destrucción del hábitat. 2 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS A diferencia de los puntos anteriores, la degradación de un hábitat representa un cambio en el ambiente que en general se expresa en el mediano y largo plazo, esto último, como consecuencia de los efectos acumulativos que genera la exposición continua del ambiente a las perturbaciones generadas por algún proyecto. De esta manera, la identificación de este fenómeno requiere necesariamente del desarrollo de estudios o monitoreos que permitan determinar la magnitud de los efectos generados en la fauna silvestre, los que a su vez constituyen el insumo base para la implementación de medidas que mitiguen los efectos adversos identificados previamente. Introducción de especies exóticas La introducción de especies exóticas constituye un riesgo constante para la conservación de la fauna nativa. Si bien no es posible asociar directamente la generación de este impacto con un tipo de proyecto o actividad en particular, es importante destacar que gran parte de las intervenciones antrópicas que se realizan en el contexto de un proyecto de inversión pueden favorecer la dispersión de especies domesticas que afecten la riqueza o abundancia de las especies nativas. La presencia de especies exóticas puede generar impactos importantes sobre la biota nativa. Entre estrés se considera la depredación de la fauna, así como también la exclusión competitiva que puede provocarse producto de la sobre posición de nicho. 1.1.2 P R O T E C C I Ó N DE ESPECIES Y/O PROCESOS ECOLÓGICOS Es importante notar que las medidas destinadas a la protección de la fauna silvestre pueden ser implementadas desde distintos enfoques conceptuales. Cuando nos basamos en las categorías de conservación, las medidas propuestas se centrarán en el concepto de especie y, en consecuencia, se implementaran las acciones tendientes a la protección y conservación de los grupos de fauna e individuos de interés. Por otro lado, cuando nos centramos sobre conceptos ecológicos de mayor jerarquía, el foco de interés deberá cambiar, haciendo relevante la conservación de las interacciones inter-específicas, en el caso de una comunidad, o la protección de los flujos de energía y materiales, en el caso de un ecosistema. 3 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Los distintos enfoques o aproximaciones que pueden ser utilizadas para la generación de medidas de mitigación de impactos ambientales no deben ser vistos como excluyentes, sino más bien como decisiones que permiten definir y explicitar claramente los objetivos de las medidas propuestas, así como el adecuado diseño de las mismas. Más aun, la elección explicita de un enfoque en particular no representa un error o sesgo por parte de quien lo elige, sino que constituye una declaración transparente respecto de las consecuencias operativas que tendrán estas decisiones. En general, existen referencias a Estrategias de Filtro Fino y estrategias de Filtro Grueso para la protección de la fauna. En el primer caso, ellas está dirigida hacia especies individuales que presentan problemas de conservación o que son consideradas prioritarias, mientras que en el segundo, apuntan a la protección de hábitat, comunidades o ecosistemas (SAG, 2004). 1.1.3 E S T R A T E G I A S DE FILTRO FINO Como se mencionó anteriormente, muchas de las medidas de mitigación se enfocan en los efectos que los impactos generan sobre una o un grupo de especies en particular. En este sentido, las medidas suponen un conocimiento previo de las características ecológicas de las especies afectadas y requieren además de una evaluación o seguimiento posterior que determine el grado de éxito de las medidas implementadas. Desde un enfoque especie-especifico, los impactos ambientales son vistos como perturbaciones antrópicas que pueden afectar el nicho ecológico de una especie. Al respecto, la idea de nicho debe entenderse, de forma general, como el conjunto de condiciones y recursos que las especies requieren para su existencia. El concepto de nicho se puede también entender como la forma en que un organismo interactúa con su ambiente, la cual se va a expresar en su sobrevivencia y reproducción. De acuerdo a lo anterior, bajo este enfoque las medidas de mitigación deben ser diseñadas e implementadas con el objetivo de preservar, conservar o mejorar, el conjunto de condiciones ambientales que permiten la existencia de las especies. Como se indica en la siguiente figura, un organismo presenta un rango de tolerancia para cada una de sus variables de nicho. En consecuencia, un impacto ambiental supone la generación de nuevas condiciones las cuales podrían en casos extremos quedar fuera del nicho de la especie; el desafío será entonces realizar un proyecto de inversión de modo de que se mantengan las condiciones dentro de los rangos de tolerancia de la especie. 4 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Figura 1. Representación en dos dimensiones del nicho ecológico y el efecto esperado por la implementación de medidas de mitigación sobre un proyecto sometido al SEIA. 5 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 1.1.4 E S T R A T E G I A S DE FILTRO GRUESO. Un segundo enfoque conceptual utilizado para la protección de la fauna silvestre lo constituyen las aproximaciones poblacional-comunitarias y ecosistémica para entender los efectos de un proyecto de inversión. A diferencia del punto anterior, este tipo de enfoque genera beneficios sobre las especies de interés a partir de la implementación de medidas que minimicen los impactos sobre las relaciones comunitarias y ecosistémicas que existen en un sistema ecológico, y que permiten la existencia tanto de las especies con problemas de conservación como del resto de la fauna que habita sobre el área impactada. Es importante hacer que notar que dada la protección legal que entregan las categorías de conservación definidas por el D.S. 5/98 y los decretos supremos 151/07, 50/08 y D.S. 51/08, que oficializan el primer, segundo y tercer proceso de clasificación de especies, muchas de las medidas de mitigación de impactos sobre la fauna serán planificadas para la protección de especies objetivos. Sin embargo, esto no implica a priori la utilización de un enfoque especie-especifico, más aun, la utilización de una “estrategia de filtro grueso” posibilitará la conservación de interacciones que no solo beneficien a las especies de interés sino que también se conserve la continuidad de las interacciones ecológicas y/o los procesos ecosistémicos. 6 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 2 R ESCATE Y R ELOCALIZACIÓN DE E SPECIES 2.1 PRINCIPIOS ECOLÓGICOS El movimiento de individuos desde una población local a otra determina lo que se llama dinámica de metapoblaciones. Una metapoblación es un conjunto de poblaciones locales que interactúan entre sí a través del movimiento de individuos. La ecología de metapoblaciones presume, de forma simplificada, que el hábitat adecuado para una especie de interés se manifiesta como una red de parches o hábitats adecuados separados entre sí los cuales varían en tamaño, grado de aislación y calidad, rodeados a su vez de una matriz correspondiente a un hábitat más o menos hostil (Hanski, 1998). Para efectos del rescate y relocalización de especies, es posible asumir que la destrucción de hábitat gatillará la necesidad de movilizar individuos desde el parche degradado hacia uno sin degradar (Figura 2). Figura 2. A. Representación esquemática de una metapoblación sin intervención; B: Representación 7 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS de las consecuencias migratorias generadas por la influencia de un proyecto o actividad y los flujos de especies hacia otros parches de la metapoblación propiciados por las actividades de rescate de especies. Es importante mencionar que tanto en la matriz como los parches que constituyen las poblaciones locales no tienen, en el modelo, una escala espacial definida a priori. En consecuencia, el movimiento de especies entre parches puede cubrir kilómetros en especies de gran capacidad de movimiento o bien unos pocos metros entre organismos con movilidad limitada. En algunos casos, los parches pueden estar conectados por corredores biológicos, los cuales pueden ser parches alargados, cursos de agua o incluso caminos y carreteras. Una metapoblación incluye también parches parcialmente no ocupados por individuos de una especie focal. En un escenario ideal, el rescate y la relocalización de especies podrían ser realizados en aquellos parches no ocupados o parcialmente ocupados que presentan las condiciones de hábitat que requiere la especie de interés. Sin embargo, para que una recolocación sea exitosa, es necesario conocer la existencia de potenciales competidores y/o depredadores que podrían limitar su establecimiento. En base a la aproximación conceptual expuesta anteriormente y la naturaleza del fenómeno de rescate y relocalización de especies, se ha propuesto un modelo conceptual que incorpora los aspectos ecológicos más relevantes derivado del marco de metapoblaciones y que deben tenerse presentes (Figura 3). Este modelo tiene por finalidad explicitar aquellas variables que deben ser consideras y, en lo posible, cuantificadas en las distintas etapas del proceso de rescate y relocalización de especies. De acuerdo al modelo, el rescate implica el traslado de individuos desde un parche en donde su hábitat será destruido (Parche A), hacia un lugar que presenta un hábitat de condiciones similares y donde eventualmente puede existir otra población de la misma especie (Parche B). El modelo supone que ambos parches presentan dinámicas locales que determinan tamaños poblacionales (NA y NB), en este sentido, la natalidad, la mortalidad, así como los procesos la inmigración (i) y emigración (e) son variables que determinan sus tamaños poblacionales. O sea, cada parches es un sistema abierto que permite el movimiento de individuos. 8 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Figura 3. Modelo Metapoblacional de rescate y relocalización de especies. El rescate de individuos desde el parche A al parche B, constituye la dinámica metapoblacional; este proceso supone que el movimiento de individuos es unidireccional desde el parche A al B; una vez realizada la recolocación el tamaño poblacional del parche B sería NR si es que el parche estaba vacío o bien (NB + NR) si es que existían individuos previamente (NB). Es importante considerar que la incorporación de un conjunto de individuos de una o más especies a un parche determinado conlleva, eventualmente, a la generación de nuevas interacciones o procesos que no siempre son fáciles de identificar y cuantificar, pero cuyos efectos podrían traducirse en un impacto negativo sobre el éxito de las medidas de rescate. La interacción de las poblaciones puede generar competencia por recursos que limiten la sobrevivencia tanto de la población local como de la relocalizada. Por otro lado, parte de la población relocalizada podría experimentar procesos migratorios tanto hacia otros parches como en dirección a la misma área desde donde fueron rescatados (retorno). Esto último, considera el supuesto de que no todos los individuos se adaptarán a su nuevo hábitat, y por lo tanto, se pueden presentar flujos de retorno a partir de la fidelidad que los individuos tengan hacia el hábitat original. El nivel de perturbación puede correlacionarse directamente con la calidad de hábitat, esto, en vista de que el grado de intervención o alteración del ambiente se traducirá en el nivel de la oferta de recursos y la existencia de condiciones que pueden favorecer o no la sobrevivencia de la población. En consecuencia, el nivel de perturbación de los parches objetos de una medida de rescate destaca como una variable necesaria de cuantificar, de manera de determinar, desde el punto de vista ambiental y ecológico, tanto la similitud de los ambientes como la probabilidad de éxito que tendrá la medida de acuerdo a la selección de parches que sea realizada. En resumen, el modelo sitúa al rescate y la relocalización de especies como una acción que puede forzar la generación de interacciones previamente inexistentes, y en donde además puede haber movimiento de individuos hacia 9 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS otros parches o hacia los parches de origen. Así, a partir de este modelo, algunos de los puntos más relevantes de considerar frente a una medida de rescate y relocalización serían: • La estimación de los tamaños poblacionales de los parche A y B • Monitorear recolonizaciones en la zona a ser impactada (antes, durante y después) • Considerar la calidad (grado de perturbación) de los parches A , B y matriz circundante • Considerar la similitud de hábitat entre parches A y B, y composición de la fauna residente en parche A y B. • Monitorear el parche B para evaluar éxito de establecimiento de individuos relocalizados o su migración hacia otros puntos. 10 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 3 I DENTIFICACIÓN DE E SPECIES O BJETIVO El rescate y relocalización de especies de fauna es una medida que comprende varias etapas. Dentro de ellas, la identificación de la o las especies que serán objeto de la medida, es el primer paso. Si bien, las medidas de rescate y relocalización pueden ser ejecutadas sobre un conjunto de especies o grupos definidos como de baja movilidad. La aplicación de este tipo de medidas se ha sustentado en la presencia, en los sitios de intervención, de especies clasificadas en las categorías de conservación de En Peligro o Vulnerable. Más aún, las restricciones de movilidad que presentan algunos grupos hacen que esta medida se enfoque en mayor grado sobre el grupo de los reptiles, los anfibios y los micromamíferos. En consecuencia, es necesario tener en consideración aquellos documentos oficiales que proponen categorías de conservación para la fauna silvestre y el listado de especies que pueden ser objeto de protección con medidas como el rescate y relocalización a partir de una resolución de calificación ambiental. Al respecto, existen varias fuentes de información que han propuesto categorías de conservación para la fauna silvestre, a saber, la Ley de Caza (D.S. 5/98), los procesos de clasificación de especies desarrollados por CONAMA (D.S. 151/07; D.S. 50/08; D.S. 51/08), los Libros Rojos (Glade 1993, Serey et al. 2008) y algunas publicaciones científicas (Díaz-Páez & Ortiz 2003). Sin embargo, la regulación ambiental ha tendido a generar una única fuente de consulta exigible legalmente reflejada en los procesos de clasificación de especies elaborados por CONAMA, convirtiéndose las otras fuentes en entradas de información relevantes para ayudar en el mismo proceso. No obstante, actualmente la Ley de Caza continúa siendo una herramienta útil como fuente de consulta, y cuyo listado y clasificación de especies permite, al igual que el proceso de clasificación de CONAMA, la incorporación de medidas de rescate y la relocalización de fauna 11 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS en las resoluciones de calificación ambiental en parte de los proyectos sometidos al sistema de calificación de impacto ambiental. De acuerdo a la lista de especies existente en la ley de Caza, el conjunto de especies que actualmente presentan alguna categoría de conservación que justificaría la implementación de medidas de rescate corresponden a las indicadas en la siguiente tabla. Tabla 1. Especies en Categorías de Conservación En Peligro, Vulnerable e Inadecuadamente Conocida de acuerdo a la Ley de Caza (D.S. 5/98) ANFIBIOS Estados de Conservación Z. Norte Z. Central Z. Sur Z. Austral FAMILIA BUFONIDAE: Sapo de Atacama Bufo atacamensis Sapo de rulo Bufo chilensis Sapo Bufo rubropunctatus Sapo espinoso Bufo spinulosus Sapo variegado Bufo variegatus P I V V P V V V I F FAMILIA LEPTODACTYLIDAE: Rana chilena Caudiverbera caudiverbera P P Sapo de cuatro ojos del sur Pleurodema bufonina I I I Sapito de cuatro ojos Pleurodema thaul V F F Sapo Alsodes coppingeri Sapo arriero Alsodes nodosus P Sapo Alsodes tumultuosus P Sapo de Vanzolini Alsodes vanzolinii P Sapo verrugoso Alsodes verrucosus I I Sapo Batrachyla taeniata V F Sapo de Contulmo Eupsophus contulmoensis V Sapo de Nabuelbuta Eupsophus nahuelbutensis I Sapo Eupsophus roseus Sapo Eupsophus vertebralis V Rana arbórea Hylorina sylvatica I Sapo de monte Telmasodes montanus Sapo Telmatobius halli P Sapo de Atacama Bufo atacamensis P Sapo de rulo Bufo chilensis P I V I I I P FAMILIA BUFONIDAE: I V V 12 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS ANFIBIOS Sapo Bufo rubropunctatus Sapo espinoso Bufo spinulosus Sapo variegado Bufo variegatus Estados de Conservación Z. Norte Z. Central Z. Sur Z. Austral P V V V I F FAMILIA LEPTODACTYLIDAE: Rana chilena Caudiverbera caudiverbera P P Sapo de cuatro ojos del sur Pleurodema bufonina I I I Sapo de cuatro ojos del norte Pleurodema marmorata R Sapito de cuatro ojos Pleurodema thaul P V F F Sapo de Barros Alsodes barrioi Sapo Alsodes coppingeri Sapo montano Alsodes monticola Sapo arriero Alsodes nodosus P Sapo Alsodes tumultuosus P Sapo de Vanzolini Alsodes vanzolinii P Sapo verrugoso Alsodes verrucosus I I Sapo Batrachyla taeniata V F Sapo de Contulmo Eupsophus contulmoensis V Sapo de Nabuelbuta Eupsophus nahuelbutensis I Sapo Eupsophus roseus Sapo Eupsophus vertebralis Rana arbórea Hylorina sylvatica Sapo de monte Telmasodes montanus Sapo Telmatobius halli Sapo Telmatobufo venustus R I R V I F I V I I P P R V FAMILIA RHINODERMATIDA Ranita de Darwin Rhinoderma darwini Ranita Rhinoderma rufum REPTILES P P P P Estados de Conservación Z. Norte Z. Central Z. Sur V V V V Z. Austral FAMILIA COLUBRIDAE Culebra de cola larga Philodryas chamissonis R Culebra de cola larga de Camarones Culebra elegante de cola larga Philodryas tachymenoides R Philodryas elegans R Culebra de cola corta Tachymenis chilensis V 13 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS REPTILES Culebra peruana Tachymenis peruviana Estados de Conservación Z. Norte Z. Central Z. Sur Z. Austral R FAMILIA GEKKONIDAE Salamanqueja del norte chico Salamanqueja del norte grande Salamanqueja Homonota gaudichaudi Phyllodactylus gerrhopygus Phyllodactylus inaequalis R V V V FAMILIA POLYCHRIDAE Cabezón leopardino Diplolaemus leopardinus Gruñidor de Alvaro Pristidactylus alvaroi P Gruñidor del sur Pristidactylus torquatus P Gruñidor de Valeria Pristidactylus valeriae P Gruñidor de El Volcán Pristidactylus volcanensis P I P FAMILIA TROPIDURIDAE Lagarto chileno Liolaemus chiliensis Lagartija de Donoso Liolaemus donosoi Lagartija de Gravenhorst Liolaemus gravenhorsti Lagartija de Ortiz Liolaemus juanortizi Lagarto de kulmann Liolaemus kuhlmanni V Lagartija lemniscata Liolaemus lemniscatus V Lagarto de Müller Liolaemus lorenzmulleri V Lagartija magallánica Liolaemus magellanicus Lagartija de los montes Liolaemus monticola Lagartija de cabeza negra Liolaemus nigriceps V Lagartija de mancha Liolaemus nigromaculatus V Lagartiga negro verdosa Liolaemus nigroviridis V Lagarto nítido Liolaemus nitidus V I Lagartija Liolaemus pictus V V Lagartija de Roth Liolaemus rothi Lagartija de Schröeder Liolaemus schroederi Lagartija de Silva Liolaemus silvai Lagartija esbelta Liolaemus tenuis V Lagarto de Zapallar Liolaemus zapallarensis V Corredor de Atacama Corredor de cuatro bandas Corredor de Tarapacá Microlophus atacamensis Microlophus quadrivittatus Microlophus tarapacensis I I P P P F V V R V V I V I V V V I I Dragón de Reiche Phrynosaura reichei I Matuasto Phymaturus flagellifer P P P 14 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS REPTILES Dragón grande Estados de Conservación Z. Norte Ctenoblepharis erroneus I Callopistes palluma V Z. Central Z. Sur Z. Austral FAMILIA TEIIDAE: Iguana MICRO-MAMIFEROS V Estados de Conservación Z. Norte Z. Central Z. Sur Z. Austral ORDEN PAUCITUBERCULATA Comadrejita trompuda Rhyncholestes raphanurus P ORDEN RODENTIA Tuco-tuco de Atacama Ctenomys magellanicus Ctenomys fulvus V Tuco-tuco del Tamarugal Ctenomys robustus V Chinchilla laniger P Tucu-tuco de Magallanes Chinchilla costina Vizcacha Chinchilla brevicaudata Lagidium viscacia Chinchilla cordillerana Vizcacha austral Lagidium wolffsohni Coipo Myocastor coypus Ratón chinchilla común Abrocoma bennetti Ratón chinchilla de cola corta Degú de los matorrales Abrocoma cinerea P P P P P V V V I V Degú costino Octodon lunatus V Cururo Spalacopus cyanus P Ratón lanudo común Abrothrix longipilis Ratón topo del matorral Chinchillón Ratón sedoso chinchilloide Ratón sedoso nortino Euneomys mordax Ratón sedoso de Peterson Euneomys petersoni V I I Octodon bridgesi Chelemys megalonyx Chinchillula sahamae Euneomys chinchilloides P I I I I P P I I I Así mismo, el conjunto de especies que actualmente presentan alguna categoría de conservación que justificaría la implementación de medidas de rescate de acuerdo al proceso de clasificación de especies de CONAMA corresponden a los indicados en la Tabla 2 . Tabla 2. Especies en Categorías de Conservación En Peligro, Vulnerable e Inadecuadamente Conocida de acuerdo a los procesos de clasificación de especies de CONAMA (D.S. 50/08; D.S. 51/08). 15 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Mamíferos Proceso de Clasificación Nombre Común Nombre Científico Categoría de Conservación Comadrejita trompuda Rhyncholestes raphanurus Insuficientemente Conocida D.S 151/07 Monito del Monte Dromiciops gliroides Insuficientemente Conocida D.S 151/07 Nombre Común Nombre científico Categoría de conservación Sapo de Barros Alsodes barrioi En Peligro y Rara D.S 50/2008 Sapo montano Alsodes monticola En Peligro y Rara D.S 50/2008 Sapo arriero Alsodes nodosus Insuficientemente Conocida D.S 50/2008 Sapo Alsodes tumultuosus En Peligro y Rara D.S 50/2008 Sapo de Vanzolini Alsodes vanzolinii En Peligro y Rara D.S 50/2008 Sapo verrugoso Alsodes verrucosus Insuficientemente Conocida D.S 50/2008 Sapo Alsodes vittatus Insuficientemente Conocida y Rara D.S 50/2008 Sapo Batrachyla taeniata Regiones V a VII: Insuficientemente Conocida D.S 50/2008 Rana chilena Caudiverbera caudiverbera Vulnerable D.S 50/2008 Sapo de Contulmo Eupsophus contulmoensis En Peligro D.S 50/2008 Sapo de Isla Mocha Eupsophus insularis En Peligro y Rara D.S 50/2008 Sapo de Miguel Eupsophus migueli En Peligro y Rara D.S 50/2008 Sapo de Nabuelbuta Eupsophus nahuelbutensis En Peligro y Rara D.S 50/2008 Rana arbórea Hylorina sylvatica Regiones VIII a IX: Insuficientemente Conocida D.S 50/2008 Sapo Insuetophrynus acarpicus En Peligro y Rara D.S 50/2008 Sapo de cuatro ojos del norte Pleurodema marmorata En Peligro y Rara D.S 50/2008 Ranita de Darwin Rhinoderma darwini Regiones VIII a IX: En , Regiones X a XI: Insuficientemente Conocida D.S 50/2008 Ranita Rhinoderma rufum Insuficientemente Conocida y Rara D.S 50/2008 Sapo Telmatobius halli Insuficientemente Conocida y Rara D.S 50/2008 Sapo Telmatobius laevis Insuficientemente Conocida y Rara D.S 50/2008 Sapo de Pafeur Telmatobius pefauri En Peligro y Rara D.S 50/2008 Sapo peruano Telmatobius peruvianus En Peligro y Rara D.S 50/2008 Sapo de Zapahuira Telmatobius zapahuirensis En Peligro y Rara D.S 50/2008 Sapo Austral Telmatobufo australis Vulnerable D.S 50/2008 Sapo de Bullock Telmatobufo bullocki Vulnerable y Rara D.S 50/2008 Anfibios Proceso de clasificación 16 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Anfibios Proceso de clasificación Nombre Común Nombre científico Categoría de conservación Sapo Telmatobufo venustus Insuficientemente Conocida y Rara D.S 50/2008 Sapo montano Alsodes monticola En Peligro y Rara D.S 50/2008 Sapo arriero Alsodes nodosus Insuficientemente Conocida D.S 50/2008 Sapo Alsodes tumultuosus En Peligro y Rara D.S 50/2008 Sapo de Vanzolini Alsodes vanzolinii En Peligro y Rara D.S 50/2008 Sapo verrugoso Alsodes verrucosus Insuficientemente Conocida D.S 50/2008 Sapo Alsodes vittatus Insuficientemente Conocida y Rara D.S 50/2008 Sapo Batrachyla taeniata Regiones V a VII: Insuficientemente Conocida D.S 50/2008 Rana chilena Caudiverbera caudiverbera Vulnerable D.S 50/2008 Sapo de Contulmo Eupsophus contulmoensis En Peligro D.S 50/2008 Sapo de Isla Mocha Eupsophus insularis En Peligro y Rara D.S 50/2008 Sapo de Miguel Eupsophus migueli En Peligro y Rara D.S 50/2008 Sapo de Nabuelbuta Eupsophus nahuelbutensis En Peligro y Rara D.S 50/2008 Rana arbórea Hylorina sylvatica Regiones VIII a IX: Insuficientemente Conocida D.S 50/2008 Sapo Insuetophrynus acarpicus En Peligro y Rara D.S 50/2008 Sapo de cuatro ojos del norte Pleurodema marmorata En Peligro y Rara D.S 50/2008 Ranita de Darwin Rhinoderma darwini Regiones VIII a IX: En , Regiones X a XI: Insuficientemente Conocida D.S 50/2008 Ranita Rhinoderma rufum Insuficientemente Conocida y Rara D.S 50/2008 Sapo Telmatobius halli Insuficientemente Conocida y Rara D.S 50/2008 Sapo Telmatobius laevis Insuficientemente Conocida y Rara D.S 50/2008 Sapo de Pafeur Telmatobius pefauri En Peligro y Rara D.S 50/2008 Sapo peruano Telmatobius peruvianus En Peligro y Rara D.S 50/2008 Sapo de Zapahuira Telmatobius zapahuirensis En Peligro y Rara D.S 50/2008 Sapo Austral Telmatobufo australis Vulnerable D.S 50/2008 Sapo de Bullock Telmatobufo bullocki Vulnerable y Rara D.S 50/2008 Sapo Telmatobufo venustus Insuficientemente Conocida y Rara D.S 50/2008 17 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 4 D ESCRIPCIÓN DE H ÁBITAT A continuación se presenta una revisión de los aspectos que deben ser considerados al momento de evaluar los requerimientos de hábitat por grupo de organismo (micromamíferos, reptiles y anfibios). Posteriormente, se presenta como esta información es de utilidad para la identificación de los sitios para la relocalización de las especies a rescatar. 4.1 REQUERIMIENTOS DE HÁBITAT POR GRUPO 4.1.1 M A M Í F E R O S De acuerdo a lo mencionado anteriormente, esta sección considera sólo aquellos mamíferos de movilidad reducida, pertenecientes exclusivamente a los géneros Thylamys, Rhyncholestes, Dromiciops, Chaetophractus, Zaedyus, Cavia, Galea, Microcavia, Ctenomys, Chinchilla, Lagidium, Myocastor, Abrocoma, Octodon, Spalacopus, Abrothrix, Auliscomys, Chelemys, Chinchillula, Euneomys y Geoxus. En general las descripciones poseen variabilidad en el detalle con que se expone el hábitat de cada especie. Sobre muchas especies, por ejemplo, se dice que habitan en zonas de matorrales, o bosques con sotobosque. Otras especies son habitantes de terrenos abiertos, arenosos, o a una distancia determinada de cursos de agua, estepas, roqueríos o pastizales. Para el coipo (Myocastor coypus), en cambio, se describe un hábitat que es propio de esta especie, como son los humedales y cuerpos de agua en general, incluyendo ríos, lagos y lagunas (Tabla 3). Además de las características físicas del hábitat de las especies que sea necesario relocalizar, se debe incluir el estudio caso a caso de su hábito y 18 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS comportamiento, consultando la literatura específica referente al tema, con el fin de aminorar los efectos de la intervención y el posible fracaso de la medida. Las características generales de los hábitats descritos fueron clasificadas de acuerdo a atributos del ambiente donde se encuentran las especies. Estos atributos deberían ser comparados para obtener una mejor evaluación de la aptitud de los sitios donde los individuos rescatados serán finalmente liberados. Tales atributos se muestran en la Tabla 3. Tabla 3. Ejemplos de diversidad de hábitat y atributos ambientales asociados Hábitats tipo identificados Atributos del ambiente asociados Matorrales Bosques bosques con sotobosque zonas abiertas áridas y semiáridas estepas suelos arenosos, vecindades de ríos, roqueríos terrenos escarpados y rocosos humedales y cuerpos de agua, matorrales en sustrato rocoso pastizales altiplánicos espinales, valles áridos, pajonales, planicies con gramíneas cobertura vegetacional estructura y fisionomía vegetacional tipo de sustrato distancia a cursos de agua humedad 4.1.2 R E P T I L E S Los “hábitats tipo” de los reptiles no se diferencian a grandes rasgos con los de los micromamíferos, siendo frecuentes los roqueríos, arbustos, matorrales bajos y laderas rocosas, entre otros. La escala a la que se describe el hábitat de los reptiles es menor que la de los mamíferos pero se relacionan con los mismos atributos del ambiente. Sin perjuicio de lo anterior, por tratarse de animales más pequeños con un ámbito de hogar más reducido que los micromamíferos, su hábito es gravitante en la disponibilidad de hábitat. Esto es, si los individuos son saxícolas o arborícolas, por ejemplo, será importante considerar la disponibilidad de rocas o árboles, respectivamente. En la siguiente tabla se resumen los tipos de hábitats identificados, los distintos hábitos extraídos de la literatura y los atributos del ambiente que se asocian a las características del hábitat. 19 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Hábitats tipo identificados Hábito especies Roqueríos Arbustos matorral bajo terrenos arenosos terrenos de vegetación achaparrada laderas rocosas con suculentas suelos pedregosos ambientes rocosos cercanos a arroyos y lagunas bosques terrenos abiertos con herbáceas. terrícola saxícola trepador arenícola arborícola de Atributos del ambiente asociados cobertura vegetacional estructura y fisionomía vegetacional tipo de sustrato distancia a cursos de agua humedad 4.1.3 A N F I B I O S En general, para anfibios se dispone de considerablemente menor cantidad de información bibliográfica en comparación con los grupos de fauna restantes, obteniéndose una idea muy general de qué tipos de hábitat utilizan las diversas especies. De acuerdo a lo revisado, los anfibios son un grupo especialista de hábitat que suele requerir ambientes con características particulares, como son los cursos de agua, para su establecimiento. Por lo mismo, se ha documentado que la relocalización de anfibios es dificultosa, dependiendo en gran medida del número de individuos que serán liberados (Germano & Bishop 2008, Matson et al. 2004). Entre las diferencias posibles de apreciar, cuentan algunas especies que son decididamente acuáticas, mientras que otras pueden establecerse más lejos de cursos de agua, a veces en zonas de cultivos. Sin embargo, dentro de estas diferencias la mayoría comparte el vivir bajo rocas, entre hojarasca o bajo troncos caídos (Cei 1962), siendo estos los microhábitat típicos ocupados por este grupo. Siguiendo el mismo razonamiento que el aplicado a los reptiles, la disponibilidad de estos microhábitats en los sitios donde se piensa liberar individuos rescatados puede influir en gran medida en el éxito de la relocalización. 20 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 4.2 SELECCIÓN DE HÁBITAT RECEPTOR De acuerdo a la información obtenida puede concluirse que es más conveniente establecer un protocolo en términos generales permita flexibilizar el procedimiento y acomodarlo a las necesidades de cada caso específico para la aplicación de medidas de rescate y relocalización de fauna. De modo grueso, el procedimiento para aumentar la probabilidad de éxito de relocalización de fauna puede resumirse en 4 pasos centrales: 1. Caracterización del hábitat natural de las especies a ser relocalizadas 2. Revisión de literatura específica dichas especies 3. Caracterización de sitios potenciales para la liberación de fauna seleccionada 4. Elección del sitio adecuado De forma consistente con la información presentada anteriormente, el desglose de los 4 pasos centrales recién mencionados debería ser como sigue a continuación. 4.2.1 P R O T O C O L O PARA CARACTERIZACIÓN DEL HÁBITAT NATURAL DE LAS ESPECIES La caracterización del hábitat natural debería hacerse en función de los atributos del ambiente presentados más arriba, y consistiría en lo siguiente: 4.2.1.1 Cobertura vegetacional Corresponde al porcentaje de la superficie de la unidad de trabajo, en este caso, del lugar de donde los individuos a relocalizar serán extraídos, cubierto por la vegetación de manera horizontal, ya sea en su conjunto o por estratos o especies. Suele expresarse en rangos o grados que corresponden a un rango de porcentaje de la cobertura sobre el área. 4.2.1.2 Estructura vegetacional Consiste básicamente en la distribución espacial de la biomasa. Puede definirse a través de la estructura vertical, que es la distribución en estratos (arbóreo, arbustivo, herbáceo, etc.), estructura horizontal, que es el patrón de distribución de los individuos sobre el área (abierta, cerrada, densa, semidensa, etc.). 21 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 4.2.1.3 Fisionomía vegetacional Se puede afirmar que la fisionomía vegetal corresponde a clasificaciones de biotipos en relación con caracteres diversos entre los individuos. Una de las clasificaciones de los biotipos más utilizadas en la actualidad consiste en distinguirlos en función de la forma de vida dominante bosque (árboles), matorral (arbustos), praderas (herbáceas); también es importante considerar la existencia de otras plantas como epífitas y lianas, las cuales configuran una mayor complejidad estructural. 4.2.1.4 Tipo de sustrato El tipo de sustrato debe ser entendido como las características de la capa de terreno superficial en el área de estudio, que es aquella donde se posan y sobre la cual estructuran su hábitat los individuos de los grupos faunísticos en evaluación. Dentro de las características más relevantes a considerar se cuentan la pedregosidad y proporción de afloramientos rocosos y la textura del suelo, ya que estos elementos pueden determinar la disponibilidad de micrositios para el establecimiento de los individuos liberados. 4.2.1.5 Distancia a cursos de agua Ya que existen organismos que requieren cursos de agua cercanos para su establecimiento y desarrollo, la distancia a cursos de agua es un elemento a considerar en función de lo gravitante que pueda ser para la especie que vaya a ser relocalizada. En este caso, este atributo resulta fundamental para los anfibios, dado que estos organismos requieren de agua disponible para reproducirse. 4.2.1.6 Humedad Por último, la humedad del ambiente donde habitan sobre todo reptiles y anfibios es importante, dado que se trata de organismos especialistas de hábitat. La actividad de relocalización de fauna debe considerar que su resultado no involucre un cambio significativo en las condiciones de humedad del sitio donde los individuos serán liberados, dado que ello puede afectarlos negativamente. 4.2.2 C R I T E R I O S PARA ELECCIÓN DEL SITIO Sin bien la evaluación de las características ambientales mencionadas en los puntos anteriores constituyen el escenario ideal para la elección del sitio adecuado para la translocación, en un escenario real, proceder a medirlas puede ser un problema en términos tanto económicos, y logísticos, y también términos espaciales y/o temporales. Por esta razón, a continuación se proponen 22 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS algunos factores que han sido discutidos como predictores de la efectividad de la relocalización de especies. Estos se han basados en aproximaciones comparativas que se han utilizado para identificar los criterios generales que subyacen el éxito o el fracaso de entre especies de baja movilidad (ver Dodd et al 1991, Griffith et al. 1989, Griffith et al. 1990, Wolf et al 1996, Fischer & Lindenmayer 2000). Estos factores son: Área (superficie). El área del nuevo hábitat debiera ser, al menos, equivalente en superficie al hábitat original que será intervenido por la actividad productiva que da origen a la implementación de la medida. Representatividad de ambientes. El hábitat recipiente debiera contener una muestra representativa de los ambientes y especies sensibles que serán afectados. Cantidad de recursos disponibles en el hábitat para los individuos acuerdo a la especie Calidad de los recursos disponibles en el hábitats para los individuos de acuerdo a la especie Presencia de depredadores o interacciones que podrían afectar negativamente la sobrevivencia de los individuos (depredadores). Ubicación del sitio de relocalización en el núcleo o límite histórico de su distribución. La cantidad de recursos disponibles y las condiciones existentes dentro de un hábitat (para alimentación, reproducción, crecimiento), constituye el factor de mayor importancia al momento de la selección de un sitio adecuado. En este sentido, la estructura y fisonomía de la vegetación junto con la densidad de rocas, han sido descritas como factores claves para algunos reptiles debido a que le otorgan un espectro de condiciones termales necesarias para sus actividades diarias (Dodd and Seigel 1991, Szaro & Johnston 1996, Towns & Ferreira 2001). Por su parte, en el caso de los micromamíferos, se ha descrito que la cobertura y composición vegetacional presente en el área, es una variable puede predecir la sobrevivencia de los individuos, debido a que disminuye su probabilidad de ser depredados y puede predecir el establecimiento de las poblaciones (Rizkalla & Swihart 2007). En este mismo sentido, como se describe anteriormente, la presencia y abundancia de depredadores constituye otro factor determinante en la sobrevivencia de las poblaciones (Wolf et al. 1996). Finalmente, debido a que en el centro de sus distribuciones las poblaciones suelen presentar mayores tamaños, con menos varianza (excepto cuando el hábitat en la periferia es de mayor calidad que en el centro), los casos estudiados en la literatura, muestran una clara correlación positiva entre la probabilidad de éxito de la relocalización y la cercanía de las áreas seleccionadas a los centros de distribución histórica de las especies (Wolf et al. 1996). 23 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Si bien como se comentó, estos factores son los más recurrentes en la literatura científica para predecir el éxito de relocalizaciones, estos pudieran no presentar el mismo peso a la hora de decidir la elección del sitio más adecuado. Por esta razón es necesario poder ponderarlos en función de la capacidad que tienen estos de poder explicar la variabilidad en el éxito de la relocalización para las especies en general. Por medio del uso de métodos estadísticos multivariados se ha podido conocer el efecto de estos factores independientes (tanto discretos como continuos), obteniendo así coeficientes robustos que han permitido construir un modelo explicativo del éxito de relocalización de las poblaciones. A continuación se presentan estos valores, basándose en los estudios de Griffith et al. (1989 y 1990), y Wolf et al. (1996 y 1998), siendo estos considerados como una aproximación general para el objetivo de este trabajo. Estos coeficientes han sido expresados matemáticamente como un modelo multivariado de la forma Y = β0 + β1X1+ β2X2 + β3X3 +ε Donde los coeficientes denominados βi, corresponde al peso de cada variable (Xi), y su contribución a la variabilidad de Y (en este caso definida como la probabilidad de éxito de relocalización (PR) para una especie). De esta manera el coeficiente β1, que expresa la importancia de la calidad y cantidad de la cobertura y estructura de la vegetación presente en el sitio de relocalización (X1), tiene un valor de 0,817. El coeficiente β2, que expresa la importancia de la abundancia de depredadores en el sitio (X2), tiene un valor de -0,48. Finalmente, el coeficiente β3, que expresa la importancia de la distancia del sitio de relocalización al núcleo histórico de distribución de la especie (X3), tiene valor de 0,28. Re-expresando la formula: PR = β0 + 0,817X1- 0,48X2 + 0,28X3 +ε Es necesario expresar que esta aproximación matemática ha sido utilizada para explicar un patrón. Por consiguiente es necesario recalcar que el uso de estos valores más que entregar predicciones, sirve para representar de manera casi cualitativa la importancia de cada factor (correspondientes a los atributos del área elegida) sobre la probabilidad de éxito de la relocalización en una especie, existiendo un rango mayor de posibilidades para cada factor y variaciones para cada especie. De igual modo, es necesario además factores relacionados con atributos a nivel individual y de especie para tener predicciones más adecuadas. 24 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS A modo de resumen, se muestra una tabla con el procedimiento propuesto para la evaluación de sitios adecuados para el establecimiento de individuos de fauna relocalizada. Tabla 4. Resumen del procedimiento propuesto para evaluación de sitios para relocalización de fauna. Etapa Análisis general Atributos o elementos a caracterizar o considerar 1 Caracterización del hábitat natural de las especies a ser relocalizadas 2 Revisión de literatura específica de especies a relocalizar 3 Caracterización de sitios potenciales para la liberación de fauna seleccionada 4 Elección del sitio adecuado • Cobertura vegetacional • Estructura y fisionomía vegetacional • Tipo de sustrato • Distancia a cursos de agua • Humedad • Etología • Hábitat específico o micrositios preferidos • Hábito. • Ecología trófica • Interacciones potenciales • Existencia de recursos alimenticios. • Comportamiento reproductivo. • Cobertura vegetacional • Estructura y fisionomía vegetacional • Tipo de sustrato • Distancia a cursos de agua • Humedad • Superficie de hábitat equivalente. • Representatividad de ambientes • Evaluación de la calidad y cantidad de recursos presenten en el habitat de acuerdo 25 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Etapa Análisis general Atributos o elementos a caracterizar o considerar a la especie. • Cantidad y calidad de Sitios de reproducción • Presencia de depredadores o interacciones potencialmente perjudiciales. • Ubicación del sitio de relocalización en relación a su distribución histórica. Finalmente, en la literatura resulta recurrente la necesidad de evaluar de manera sistemática, el éxito de las relocalizaciones y los procesos de restauración ecológica en su contexto general, esto es, midiendo la efectividad de las medidas tomadas. Aunque no se duda de que las relocalizaciones puedan jugar positivamente un rol dentro de las medidas de mitigación para especies con baja movilidad, es necesario que todos los aspectos relacionados con proyectos altamente manipulativos deban ser cuidadosamente evaluados caso a caso, siguiendo aproximaciones experimentales antes de proponer recomendaciones de manejo especificas. Ahora, bien, una vez que estas recomendaciones son propuestas, se debe señalar que estas no necesariamente tendrán efectividad al ser aplicadas en situaciones similares. 4.2.3 R E V I S I Ó N DE LITERATURA ESPECÍFICA Debido a que no es conveniente generar una norma de relocalización dada la inflexibilidad que ello conlleva, una vez que se tenga claridad sobre la o las especies que deben ser rescatadas y relocalizadas, debe seguir una revisión acabada de literatura específica sobre tales organismos, que contemplen aspectos de su etología o comportamiento. En este punto, los elementos que se han considerado fundamentales a nivel específico son el potencial reproductivo de la especie (Griffith et al. 1989, Wolf et al. 1996). Especies con un potencial reproductivo alto (tres o más crías o eventos reproductivos después del segundo año) responden mejor a los eventos de relocalización que especies con potencial reproductivo bajo (menos de tres crías o eventos reproductivos después del 26 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS segundo año). El comportamiento reproductivo también es esencial a la hora de evaluar la efectividad de la relocalización. Especies que presentan una mayor cantidad de conductas reproductivas (displays reproductivos) pueden ser menos sensibles que aquellas que presentan un conjunto de conductas menor. Especies que presentan patrones de movimientos definidas (no azarosos), rangos de movimiento mayores y en dos dimensiones (por ejemplo dispersarse horizontalmente mayores distancias, además de utilizar estratos verticales en sus actividades) pueden colonizar una mayor cantidad de ambientes estableciéndose en ellos, que especies con menor rango de movimiento y unidimensional. Finalmente, y que puede ser asociado de manera tangencial a atributos conductuales, es el hecho de que el éxito/fracaso en la relocalización pueda estar asociada con el tiempo de cautividad de los organismos, siendo señalado como un factor a considerar en estudios a nivel de especie. Un aspecto que cobra cada vez mayor relevancia en los proyectos de relocalización, es el estado de salud de los individuos a relocalizar o bien las condiciones sanitarias de las poblaciones receptoras (esta última de más difícil diagnostico), debido la potencial transmisión de enfermedades (Cunningham 1996, Letty et al. 2007), lo que ha señalado como altamente perjudicial sobretodo en el caso de anfibios (Daszak et al. 1999). Por otro lado, deben considerarse que una vez relocalizada, una especie comienza a interactuar con residentes de su misma especie o de otras especies. En este sentido la depredación se ha señalado como un factor determinante en efectividad de las relocalizaciones. La literatura es concluyente en este punto, señalando a este factor como el segundo más importante, después de las características del hábitat receptor. Otro factor ampliamente citado en la literatura como un elemento que debe ser considerado, es el número de individuos liberados (presión de propágulos). Esta variable juega un papel importante en la efectividad de la relocalización debido principalmente a que las poblaciones pequeñas son susceptibles a procesos aleatorios de estocasticidad genética, demográfica y/o ambiental, aumentando así su probabilidad de extinción en el nuevo ambiente. En una revisión llevada a cabo por Fischer & Lindenmayer (2000), muestran que la proporción de relocalizaciones exitosas ha sido mayor cuando la cantidad de individuos liberados superaba los cien (no necesariamente al mismo tiempo). Adicionalmente, se debe tener en cuenta la dieta de los organismos, puesto que el nuevo sitio debe otorgar los recursos alimentarios necesarios para la sobrevivencia de los nuevos individuos y asegure el éxito de la relocalización. En general la información sobre la dieta de los organismos es escaza en la literatura, salvo ciertas excepciones sobre las que se han realizado estudios más detallados. Debe tenerse especial cuidado con aquellas especies de dieta restringida y 27 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS también con aumentar la sobreposición trófica que pueda existir entre especies (más detalles ver Correa y Roa 2005). 28 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 5 P ROCEDIMIENTO PARA EL MUESTREO Como se menciona en las consideraciones, conocer el tamaño poblacional de una especie en el sitio que se va a perturbar o bien en el nuevo sitio de relocalización; en este caso se hace necesario extraer una muestra de esta (comúnmente conocido como muestreo). Con este objeto, se subdivide el área ocupada por la población en una serie de unidades aproximadamente del mismo tamaño, donde se obtiene la información requerida. Estas no deben solaparse entre sí y, en su totalidad, deben comprender a la población de la especie en estudio. Como no es posible, muchas veces, la evaluación de todas estas unidades de muestreo, se selecciona un grupo de ellas a partir de cuyos resultados se estima el tamaño de la población. Esta información servirá para evaluar la magnitud de los efectos adversos que puedan generar las actividades de un proyecto y decidir el número mínimo de individuos que deben ser relocalizados para disminuir los riesgos en la población. Tal como lo siguiere Steinmann et al. (2009), para calcular el tamaño de muestra (el número de unidades a evaluar) generalmente se parte de la información aportada por un muestreo previo. Un procedimiento sencillo por el que se puede calcular el tamaño de la muestra se basa en el estudio del comportamiento del valor promedio de abundancia. A medida que vaya aumentando el número de unidades de muestreo va a llegar un momento que el valor de promedio abundancia estimado se estabiliza. Es decir que, si se aumentan nuevas unidades, el valor de abundancia promedio estimado no aumenta ni disminuye en forma significativa. Otra manera de calcular el tamaño de muestra es aplicando un algoritmo en el que participan los valores de abundancia promedio y el error estándar, obtenidos de un pre-muestreo y la posición con la que se quiere trabajar, para alcanzar un determinado nivel de confiabilidad en los resultados. 29 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Una vez que han quedado fijados los objetivos, la planificación de la obtención de los datos requeridos exige elegir una determinada técnica de muestreo. El método más básico y sencillo es el muestreo aleatorio simple, dado que no requiere ningún conocimiento previo sobre las características de la población estudiada. La puesta en práctica de este método implica una selección al azar de las unidades de muestreo. Para ello se requiere: • • • Realizar un inventario completo y sin repetición de todas las unidades de muestreo; Numerar todas las unidades de muestreo de 1 a N; Seleccionar al azar (por ejemplo, mediante una tabla de números aleatorios) n unidades de muestreo. Otro método utilizado en el muestreo de poblaciones es el muestreo sistemático. Este método se basa en la obtención al azar de una primera unidad de muestreo a partir de la cual se seleccionan las siguientes unidades mediante algún criterio fijado previamente en la planificación del muestreo. Por ejemplo una determinada distancia entre las unidades de muestreo (100m, 200m); un recorrido específico (norte-sur, este-oeste), etc. Así, en este método las unidades de muestreo no son seleccionadas de manera independiente como en el anterior, puesto que la elección de la primera unidad más los criterios fijados previamente determinan la selección de toda la muestra. Las diferentes maneras de utilizar el espacio por parte de las distintas especies pueden constituir un factor de incertidumbre al momento de calcular los valores de abundancia de sus poblaciones mediante un muestreo. Si bien una de las formas de paliar esta incertidumbre consiste en aumentar la intensidad de muestreo, procedimiento básico de incremento de la precisión de los resultados, existen otros métodos que permiten aumentarla sin necesidad de aumentar el esfuerzo de muestreo. Este es el caso del muestreo estratificado o en bloque que delimita, dentro del área censada, una serie de unidades de muestreo más homogéneas fisonómicamente llamadas estratos o bloques. La delimitación de los estratos se realiza en función a determinadas características, variables ambientales por ejemplo, que inciden en la distribución de las abundancias de los roedores diferencialmente, por ejemplo un tipo de vegetación o cobertura vegetacional. Esta estratificación se realiza sobre la base del conocimiento previo de la distribución de la especie objeto de estudio o a la realización de un muestreo previo realizado con este objetivo. Posterior a la elección del procedimiento de muestreo, se selecciona el método más apropiado para la captura, estimación de la abundancia (absoluta / relativa) de las poblaciones de especies (por el método de captura-marcadorecaptura, éxito de trampeo entre otros). Esto permite, como se mencionó anteriormente, conocer el tamaño de la población o poblaciones que serán 30 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS relocalizadas, evaluando procedimiento. el mínimo de individuos 6 a considerar en el M ÉTODOS DE C APTURA La siguiente sección tiene como objetivo señalar y presentar los procedimientos y técnicas descritas en la literatura para la captura, mantención, y liberación de fauna vertebrada terrestre de baja movilidad, dentro del contexto de las medidas de relocalización. Para esto se ha revisado la literatura científica y técnica, tratando de abordar a un nivel de detalle adecuado que permita generar un protocolo de trabajo adecuado para cada grupo de organismos (anfibios, micromamíferos y reptiles). Inicialmente se describen los métodos usados para: i) detectar la presencia directa e indirecta de microfauna, analizando las técnicas usadas; ii) procedimientos de mantención de los individuos antes de su liberación; y iii) procedimientos de liberación en las nuevas áreas. En cada uno de estos puntos, se plantean recomendaciones sobre aspectos que pueden afectar la efectividad de los procedimientos. 6.1 MÉTODOS INDIRECTOS Con el fin de detectar la presencia de los organismos podrían ser objeto de rescate y relocalización se puede usar los denominados “métodos indirectos”. Los métodos indirectos permiten verificar la presencia de microfauna, y en algunos registrar la composición de la comunidad y actividad de las especies presentes, siendo esta última una forma indirecta de estimar la abundancia de cada una de ellas. Los signos indirectos más frecuentes considerados en los estudios de vida silvestre son: 31 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS • Heces o excrementos. Estas señales pueden ser encontrados en los corredores usados por los individuos, cerca de los refugios, en los sitios de alimentación u otros lugares donde los roedores sean más frecuentes. Las heces frescas son más brillantes, húmedas y blandas que las antiguas, que se presentan secas duras y opacas (Steinmann et al., 2009). • Marcas de los dientes sobre alimentos u otros materiales, así como el tamaño de las partículas disgregadas, son otros signos que pueden proveer información sobre la presencia de microfauna, principalmente roedores (Steinmann et al., 2009). • Madrigueras, identificándose si están activas a través de la presencia o ausencia de un montículo con tierra fresca frente a ella (Steinmann et al., 2009). • Rutas de tránsito usadas en el movimiento diario entre los sitios de alimentación, reproducción, descanso entre otros. En el movimiento diario entre estos sitios, los roedores tienden a usar las mismas “rutas” o caminos. Los indicios más visibles se encuentran a través de cercos vegetales, bajo arbustos y donde el tránsito continuo impide el crecimiento de la vegetación (Steinmann et al). La búsqueda de estos indicios (huellas, restos corporales, fecas, etc.), es un método muy citado en la literatura como una evidencia efectiva de la presencia de especies de roedores y herpetofauna en general. En el caso de los roedores, al ser plantígrados, es decir que caminan apoyando la planta del pie, permite visualizar las huellas dejadas por las patas traseras principalmente (Steinmann et al). Sin embargo, se debe tener especial atención debido a lo difícil que puede ser encontrar evidencias claras de manera natural que permitan identificar a la especie. Para solucionar este problema, se utilizan trampas de huella constituidas de una base metálica oscurecidas con humo, por ejemplo, facilitando la impronta por parte de los individuos (Murúa 1982). El registro de huellas permite detectar la presencia y, en algunos casos, estimar la abundancia relativa de roedores. Otra forma de verificar la presencia para microfauna, es por medio de la huellas dejadas por otras partes del cuerpo. Cuando tanto roedores como reptiles se mueven lentamente sobre superficies planas, la cola puede ser arrastrada dejando una clara línea, lo que permite evaluar su presencia (Steinmann et al.). • El establecimiento de trampas de pelo puede complementar la información obtenida por otros métodos. Esta técnica fue desarrollada por Suckling (1978) para el monitoreo de pequeños marsupiales arborícolas y actualmente es utilizada en otros países como Argentina para el monitoreo de la ardilla de vientre rojo Callosciurus erythraeus (Fasola et al., 2005). Esta consiste en un tubo abierto en ambos lados, provisto de un cebo en su interior y de cinta adhesiva en los extremos. La trampa 32 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS funciona de manera que el animal que entra en el tubo atraído por el cebo, deja pelos adheridos a la cinta. Las trampas pueden ser construidas con tubos de PVC blanco de 25 cm de largo y 6 cm de diámetro (Fasola et al., 2005). En el interior de cada trampa se adhiere un recipiente plástico de 3 cm de diámetro y 1,5 cm de alto, donde se coloca el cebo. En la parte superior de ambos extremos de la trampa se coloca un trozo de cinta adhesiva. Se pueden utilizar tres tipos de cintas (cinta doble faz, cinta tipo "silver tape" y cinta de embalaje) para probar la duración del adhesivo a la intemperie. Las trampas de pelo son confiables para detectar la presencia de una especie en un área determinada aunque presentan dificultades si se quieren usar para estimar su abundancia poblacional (Gurnell et al., 2004). 6.2 MÉTODOS DIRECTOS Para determinar presencia de microfauna de manera directa y permitir su captura, se debe contar con dispositivos que permitan llevar a cabo esta tarea de manera eficiente. Existen diferentes modelos de trampas/técnicas diseñadas para capturar roedores, reptiles y anfibios según sus diferentes tamaños, hábitos, etc. Las más comúnmente utilizadas en la literatura se describen a continuación. 6.2.1 T R A M P A S DE CAPTURA VIVA 6.2.1.1 Trampas de tipo “Sherman”. Son trampas de captura viva construidas en aluminio o malla (metálica), y plegables, lo cual las hace livianas y de fácil transporte. El peso ejercido por el animal al ingresar en la trampa libera el mecanismo de acción que mantenía la puerta abierta. Pesan aproximadamente 200 g y al estar plegadas presentan un grosor de 1,5 cm. Se presentan en dos tamaños: de 30,5 x 8 x 9,5 y de 22,9 x 8 x 9,5 cms. En un estudio comparativo realizado por Slade et al., (1993), donde se midió la e la efectividad de captura con los dos tamaños en un periodo de 5 años, se encontró una mayor efectividad cuando utilizaba el modelo de mayor tamaño, sin importar el tamaño corporal de los individuos. El estudio señala además que las trampas pitfall serían más apropiadas para organismos pequeños como las musarañas (en el caso de Chile, las yacas, por ejemplo). 33 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 6.2.1.2 Trampas de tipo “Longworth”. Este tipo de trampas (Figura 4) está diseñado para capturar pequeños mamíferos, reduciendo su stress post-captura. La trampa consiste en dos partes. Un túnel (13x4.5x4.5 cm), donde se active la puerta que cerrará la trampa, y una caja nido (14 x 6.5 x 9 cm), la cual provee un mayor espacio para los individuos, con alimento y material para cobijarse. Se suele usar en ángulo para prevenir la entrada de agua proveniente de la lluvia, y facilitando además el drenaje de la orina y la condensación hacia la sección del túnel. Figura 4. Trampa tipo Longworth en el campo, y en vista lateral 6.2.1.3 Trampas de tipo “Ungglan”. Este tipo de trampa asemeja la estructura y funcionamiento de las trampas tipo Sherman (Figura 5). Su principal diferencia es la posibilidad de hacer múltiples capturas, con una menor probabilidad de ser trabada por otros organismos (preferentemente invertebrados). Los animales entran a un compartimento no cebado que está comunicado con un compartimento adyacente de captura donde se encuentra el cebo. Una vez entrado el individuo, este se cierra dejando al individuo en su interior. Figura 5. Estructura trampa tipo Ungglan 34 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 6.2.1.4 Trampas de tipo “Hipólito”. Este tipo de trampa también asemeja la estructura de las trampas tipo Sherman de malla, sin embargo su funcionamiento es distinto. Su principal diferencia es que el cebo cuelga de un hilo que detiene la puerta, por lo que el animal al consumir este, hace que la puerta se cierre activando la trampa. De preferencia se han utilizado con especies cuyo tamaño corporal es menor, lo que dificulta la activación de trampas de piso. 6.2.1.5 Trampas de tipo “pitfall” o de caída. Estas trampas, normalmente utilizadas sin cebo, son poco selectivas, por lo que permiten la captura de una amplia gama de micromamíferos, reptiles y anfibios, dependiendo del hábitat donde se utilice. Una de los métodos de utilización es disponerlos en cuadrantes en cada ambiente (Santos-Barrera & Pacheco-Rodríguez 2006). Su eficacia puede ser aumentada a partir de la utilización de vallas interceptoras. En la Figura 6 se presenta una trampa permite la captura del individuo vivo, con un embudo (3) que impide su escapatoria (Steinmann et al.). 6.2.1.6 Trampas de embudo. Consiste en una malla soportada por anillos de aluminio con un mecanismo similar a una nasa de pescadores. Este método es bastante efectivo en aguas someras y debe ser revisado frecuentemente para evitar la muerte del animal capturado. Las trampas tipo embudo han sido ampliamente utilizadas para capturar anfibios terrestres y semiacuáticos. Figura 6. Modelo de trampa de tipo “pitfall” (modificado de Tellería J. L. 1986. “Manual para el censo de los vertebrados terrestres, en Steinmann et 35 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS al.) Como complemento se han propuesto la utilización de cebos, que permiten atraer de manera diferencial a las especies (principalmente roedores, Figura 7). Figura 7. Esquema de modelos de trampas pitfall con cebos (Veiga et al. 1989). Las trampas pitfall en combinación con vallas interceptoras y trampas de embudo doble son frecuentemente usadas para capturar principalmente reptiles y anfibios (Crosswhite et al., 1999). Esta combinación consiste en disponer de tres mallas (15.2-m x 30.5-cm) igualmente espaciadas a lo largo de un transecto con el objetivo de direccionar el movimiento de los individuos, y que comunica las tres trampas pitfall (30 cm aprox. de profundidad). En cada valla son colocadas dos trampas de embudo doble que permiten direccionar la entrada de los individuos a estas (Figura 8). Figura 8. Diseño de trampas combinadas pitfall-malla. A) Configuración de las mallas, trampas pitfall y trampas de entrada (embudos). B) Vista lateral de un segmento de intersección de pitfall con la malla de dirección (Crosswhite et al. 1999). 36 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 6.2.2 M U E S T R E O POR ENCUENTRO ENCOUNTER SURVEY VES”) VISUAL (“VISUAL Este método, utilizado principalmente en anfibios y en menor medida en reptiles (Doan 2003), consiste en caminatas diurnas y nocturnas, para la observación y captura manual de los ejemplares. Es mucho más recomendado para aquellos organismos que hacen un uso acotado del espacio, o que son altamente dependientes de las condiciones encontradas en micrositios que constituyen sus hábitats. 6.2.2.1 Captura de tipo lazo También conocido como método del nudo corredizo, es uno de los métodos más ampliamente utilizados, principalmente para la captura de reptiles. Consiste en un nudo corredizo ubicado en el extremo de una vara de tamaño variable (1 a 1,5 m) según las necesidades. Permite una captura rápida y de bajo costo. 6.2.2.2 Capturas de tipo malla para reptiles y anfibios. El uso de mallas dispuestas en ambientes acuáticos puede aumentar la efectividad de captura de especies de anfibios y sobretodo de larvas. Para muchas especies de reptiles y anfibios pueden obtenerse muestras numerosas debido a que sus hábitats están limitados a áreas relativamente pequeñas. Las redes de manos son utilizadas frecuentemente para atrapar reptiles, especialmente lagartijas. 6.3 CONSIDERACIONES DE LOS MÉTODOS DE CAPTURA Las trampas Sherman, Ungglan, Hipólito y Longworth son utilizados preferentemente con pequeños mamíferos. Los procedimientos de captura para medidas de relocalización que se desarrollan para este grupo de organismos, requieren trampas eficientes para la captura (alta atrapabilidad) de las especies objetivos, además de ser económicas y que disminuyan al máximo los efectos adversos sobre los individuos. Diversos estudios llevados a cabo han permitido comparar la efectividad (y en algunos casos eficiencia) entre estos procedimientos (Jacob et al. 2002, Ylonen 2003, Anthony et al. 2005, Carro et al. 2007, Doan 2003, Mills et al. 1998). 37 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Jacob et al., (2002) comparó la efectividad de las trampas Ungglan y Longworth sobre Mus domesticus en el sur este de Australia. Las capturas y recapturas fueron mayores con las trampas Longworth, mientras el porcentaje de muerte de los individuos fue menor. El tamaño de los individuos capturados no difirió entre las trampas. Finalmente los autores señalan que aún cuando las trampas Ugglan tienen el potencial para múltiples capturas, estas podrían ser ineficientes con bajas o medias densidades de esta especie. Otro factor que explica los resultados desfavorables para las trampas Ugglan en este estudio, son las características conductuales de Mus domesticus. De igual manera Ylonen (2003) comparó la atrapabilidad de tres métodos (Sherman, Ugglan y Longworth) en ambientes áridos (Australia e Israel). Las trampas Longworth fueron las más efectivas capturando la mayor cantidad de individuos, seguido de las trampas Sherman y finalmente las trampas Ugglan, siendo esta última inefectiva para capturar especies altamente sociales como los Gerbils (rata del desierto) en ambientes abiertos. Los autores señalan que la baja efectividad de las trampas Ugglan podría deberse a las condiciones ambientales del área (existen antecedentes de la alta efectividad de estas trampas en ambientes Boreales con mayor cobertura vegetal e incluso en agro-ecosistemas), al comportamiento de las especies estudiadas o bien a estos factores combinados. Anthony et al., (2005) comparó la eficacia de captura de trampas Sherman y Longworth en la comunidad de micromamíferos en las praderas de Wisconsin, incluyendo además algunas trampas Pitfall. Los resultados mostraron que los tres métodos presentan diferencias especificas en las tasas de capturas (algunas especies fueron mayormente capturadas con un tipo de trampa). Aún cuando la diversidad de especies capturadas fue similar para los dos métodos principales, la similaridad en la composición de especies fue baja. Por su parte las trampas Pitfall fueron efectivas para capturar un tipo de especie. Nuevamente, los métodos usados no difirieron en el tamaño de los individuos capturados. Los autores señalan que el uso de ambos métodos combinados (Sherman y Longworth) disminuye el error asociado al muestreo, permitiendo estimar de mejor manera parámetros comunitarios como la diversidad y composición de especies de micromamíferos. Finalmente en un estudio llevado a cabo por Carro et al., (2007), de un total de 1.870 trampas/noche, y 196 ejemplares representando a ocho especies de micromamíferos, el índice de capturabilidad medio fue de 10% de efectividad, siendo el máximo el presentado por las trampas de tipo Hipólito (12%) y el mínimo el de las trampas tipo Ugglan (3%). Para el caso de anfibios, Doan (2003) desarrolló un estudio comparativo de técnicas de muestreo con datos tomados en bosque lluvioso. El autor señala que en un muestreo en corto periodo, el método del encuentro visual (VES) fue más 38 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS efectivo en capturar una mayor cantidad de especies e individuos de anfibios y reptiles, que por medio del método de trampas pitfall en cuadrantes. Sin embargo, grupos con determinados micro-hábitat fueron mejor capturados por medio del método de cuadrantes. El autor señala que en estudio más a largo plazo, ambos métodos tuvieron la misma eficacia en la captura. A la luz de los métodos directos e indirectos señalados anteriormente, es posible destacar algunas consideraciones importantes. • Trampas pitfall o de caída son poco selectivas, su efectividad aumenta con el uso de vallas interceptoras y con la elección del cebo. • Las trampas tipo Ungglan, son poco efectivas en lugares desprovistos de vegetación. Las tramas Longworth presentan un alto grado de atrapabilidad de roedores. • De igual manera, el tamaño de la trampa, puede no ser determinante a la hora de capturar individuos de especies que poseen tamaños similares. • Se sugiere que una combinación de distintos tipos de trampas puede mejorar los resultados de la estimación de la composición de una comunidad de micromamíferos. Se debe considerar el grado de respuesta de las especies de roedores a capturar ante cada tipo de trampas. • En el caso de las trampas metálicas cerradas, estas deben ser colocadas de manera tal que impida el sobrecalentamiento de éstas debido a condiciones de alta radiación o calor, evitando así la muerte de los individuos. De igual manera, para el caso de las trampas de mallas estas deben ser colocadas de manera tal de impedir que estas se mojen producto de episodios de lluvias. Junto con lo anterior, las trampas deben ser revisadas en las primeras horas de la mañana. • Los atributos biológicos o ecológicos de las especies deben ser considerados (se debe recopilar información bibliográfica para este propósito). • Disponer trampas limpias (sin olores) constituye una efectiva medida, debido a que los roedores no sólo discriminan entre los olores de otras especies (olores heteroespecíficos) y olores de la misma especie (olores intraespecíficos o coespecíficos), sino también entre los olores de los diferentes sexos de su misma especie, afectando la eficiencia de la captura. • Se obtiene un buen cebo con avena arrollada mezclada con una pequeña cantidad de pasta de maní. Se puede usar la avena sin pasta de maní donde las hormigas constituyan un problema. El grano molido también puede ser un buen cebo de uso general (con o sin pasta de maní) (Mills et al., 1998). 39 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS • Localización de las trampas. En general se propone que los objetos nuevos como cebos, trampas, etc. sean colocados cerca de los caminos de los roedores, pero nunca sobre el camino cortándoles el paso, dado que evitan por horas y en oportunidades por días utilizar un camino en donde se le ha colocado un elemento no familiar en el trayecto. • Todo proceso de captura /rescate de roedores para su relocalización debe tener una línea de base previa donde se obtiene la composición de especies y sus abundancias relativas (las abundancias absolutas son escasamente conocidas). • Usando múltiples periodos de muestreo permiten obtener una estimación más adecuada de la composición y abundancia de especies. 40 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 7 M ARCAJE DE I NDIVIDUOS La capacidad de diferenciar organismos capturados en distintos momentos, (capturas frescas y capturas previas), es un aspecto relevante para diversos estudios de fauna silvestre. Muchos análisis relativos a la diversidad, abundancia, son posibles si es posible identificar las recapturas. Marcar los individuos capturados en estudios de fauna permite también el seguimiento de parámetros individuales como el crecimiento, desarrollo sobrevivencia, etc., además de facilitar el seguimiento de parámetros poblacionales en el tiempo por distintos periodos de estudio. En el contexto del rescate y relocalización de fauna, el marcaje de los individuos es clave en varios de sus pasos pues la marca es la única señal que permitiría identificar el estado de un organismo que ha sido relocalizado. El marcaje de individuos es clave también para las estimaciones de los tamaños poblacionales, así como también para los procedimientos que permitan evaluar la medida en el tiempo. 7.1 CRITERIOS DE ELECCIÓN DE LA TÉCNICA Existe una variedad de técnicas y procedimientos para marcar los individuos capturados (Enge, 1997; Spellerberg & Prestt, 1978; Swingland, 1978) (ver Tabla 5). Por esta razón, resulta necesario tener algunos criterios en mente al momento de seleccionar la técnica adecuada para el caso en cuestión. Beausoleil et al. (2004) señaló aquellos aspectos con los que debiera contar un método de marcaje “ideal”, entre estas características esta: Infringir al individuo el menor daño o estrés posible. Es decir que no disminuya el desempeño biológico (fitness) del individuo. 41 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS No generar modificaciones en el comportamiento del individuo, ni modificar el comportamiento de otros individuos (tanto de la misma especie como de otra) hacia el individuo marcado. Registrar la identidad del individuo Ser fácil de aplicar, sobre todo en condiciones de campo Ser fácil de observar, y no ambiguo. Ser confiable durante el periodo de estudio Ser de bajo costo Con una relación positiva costo-efectividad Ser adecuado para el tamaño del organismo Es claro que no existe a priori uno que reúna todas las condiciones descritas anteriormente, sin embargo la consideración de los factores presentados anteriormente permite identificar los aspectos con los que debiera contar la técnica a usar en función del organismo y el contexto particular, con el fin de seleccionar la técnica adecuada y minimizar los efectos negativos. La respuesta que pueden presentar los individuos es altamente taxadependiente, dependiendo de las características particulares de cada especie. Por esta razón es importante manejar con claridad las ventajas y desventajas de cada alternativa para este procedimiento. 7.2 DESCRIPCIÓN DE TÉCNICAS DE MARCAJE Algunas de las técnicas que forman parte de la gama de posibilidades en este contexto consisten son: en el corte de dedos, recorte de escamas, tatuajes, teñido con pinturas, etiquetas superficiales y subcutáneas, marcas con bandas, inserción de “transponders” (microtransmisores) o sustancias radioactivas. Cada una de las técnicas mencionadas presentan ventajas en determinados casos y en otros no resultan recomendables. Algunos tienen la ventaja de ser rápidos, de bajo costo, otros la característica de ser permanentes, etc. A continuación se presenta una descripción general de las principales técnicas usadas para marcar animales en estudios de fauna. 7.2.1 C O R T E DE DEDOS (TOE CLIPPING): Entre las técnicas descritas anteriormente, una de las más usadas y registradas en la literatura es el corte de dedos por su rapidez y bajo costo (Ferner 2007). Sin 42 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS embargo, existen estudios que indican que el corte de dedos puede reducir la sobrevivencia (Clarke 1972; McCarthy & Parris 2004) y además pueden causar infección en la herida (Golay & Durrer 1994). Adicionalmente, este procedimiento no es del todo confiable ya que los dígitos perdidos en algunos organismos podrían regenerarse (Donelly et al. 1994), y las larvas y adultos de ciertas especies (de anfibios y reptiles) carecen de patas, sin considerar que además esta práctica ha sido éticamente cuestionada (May 2004). A pesar de los posibles efectos negativos que esta técnica podría generar en los individuos marcados, cuando el procedimiento es realizado de manera apropiada los riegos para la fauna serían bajos (Ferner 2007, Phillott et al. 2007). Existen distintas precauciones y recomendaciones que deben considerarse al momento de realizar el corte de dedos como técnica de marcaje, tales como limpiar con un agente antiséptico adecuado la zona donde se hará la incisión, usando una tijera quirúrgica de acero inoxidable. La tijera debe ser desinfectada antes de usar con cada individuo. Remover la menor porción posible de cada digito cortado (idealmente entre falanges), evitando remover dígitos con alguna función ecológica conocida, nunca remover más de dos dígitos de un mismo miembro. Luego de eso es recomendable mantener en monitoreo (al menos unas horas) los individuos con el fin de evitar sangramientos excesivos que obliguen a suspender el procedimiento. Un protocolo detallado para este procedimiento puede encontrarse en el trabajo de Perry (2008)1. 7.2.2 P E R F O R A C I Ó N DE OREJAS La perforación de orejas es una técnica para el marcaje de micromamíferos. Consiste simplemente en la generación de una perforación en distintas zonas de las orejas de los micromamíferos que permitiría identificar un número limitado de individuos mediante un gráfico de identificación (ver Figura 9). De acuerdo a este gráfico sería posible identificar los individuos con un código numerado usando distintas combinaciones de perforaciones. Por ejemplo, para identificar un individuo con el número 15, haría que realizar las perforaciones 10, 4, y 1. 1 Articulo disponible en: http://www.rw.ttu.edu/ethics/pdf's/SOP058%20ToeClipping%20of%20Amphibians%20and%20Reptiles%20-%20APPROVED.pdf). 43 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 5=1+4 6=2+4 7=3+4 8=1+2 9=2+3 50 = 10 + 40 60 = 20 + 40 70 = 30 + 40 80 = 10 + 20 90 = 20 + 30 Figura 9. Gráfico de identificación para perforación de orejas en micromamíferos. (Fuente: Hogan et al. 1994) 7.2.3 C O R T E DE ESCAMAS Esta técnica consiste en el corte o remoción de escamas ventrales o subcaudales. Es más recomendada para serpientes y puede resultar poco conveniente para especies que carecen de escamas grandes. 7.2.4 T A T U A D O DE INDIVIDUOS El tatuado de individuos ha sido usado con resultados positivos en algunas especies de lagartijas y también micromámiferos. Al igual que en el caso de otras técnicas una serie de consideraciones son necesarias para su uso adecuado. Estas aspectos tienen relación la selección del pigmento adecuado para el marcaje; tener en cuenta que las marcas pueden volverse ilegibles debido a la degradación del pigmento, y evitar el uso sustancias que puedan resultar tóxicas para los individuos al momento de marcarlos de esta manera. 44 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Figura 10. Marcaje individuos por tatuado. 7.2.5 U S O DE PINTURAS En algunos casos donde no se requiere una marca por mucho tiempo es posible usar otras formas de marcar los individuos capturados. Una de estas formas es mediante el uso de pinturas temporales. Estas pinturas (no tóxicas) pueden ser aplicadas directamente a la piel o pelo de los individuos. Es menos invasiva que otras técnicas para los organismos pero tiene un efecto considerable aumentando la conspicuidad de los organismos lo que podría modificar el comportamiento de otros individuos hacia el individuo marcado o bien hacerlos más susceptibles a los depredadores. . 7.2.6 E T I Q U E T A S S U B C U T Á N E A S En este caso el marcaje de los individuos se realiza mediante el uso de implantes visibles hechos de un material biocompatible, flexible y fluorescente (elastomer)2 en inglés denominados como VIE (visible implant elastomer)3. Este método es una de las mejores alternativas al corte de dedos. Se aplica usando un inyector para insertar la etiqueta bajo la piel del individuo. Este método presenta la gran ventaja de usar una pequeña etiqueta visible, que genera poco daño al individuo y donde una de las variantes de estos implantes tiene la importante característica de poder incluir un código numérico que identifica a cada individuo. 2 3 Se denomina “elastomer” al material de polímero elástico con que elaboran las etiquetas subcutáneas Mayor información sobre VIE y otros métodos de marcaje pueden encontrarse en http://www.nmt.us/index.htm 45 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Si bien este método podría usarse tanto en micromamíferos, reptiles y anfibios, es particularmente ventajoso para este último grupo. Figura 11. Etiqueta subcutánea (VI) numerada usada en un anfibio. Figura 12. Etiqueta fluorescente (VIE) usada en un anfibio 7.2.7 E T I Q U E T A S S U P E R F I C I A L E S Estos dispositivos pueden ponerse cerca de las patas, dorso o cola de los individuos. El tamaño y forma de de estas etiquetas o bandas debe minimizar el riesgo de generar impedimento físico o posibles enredos que dejen atrapado al animal. Generalmente, el uso de etiquetas externas no es recomendado para reptiles y anfibios. Está técnica también aumentaría la conspicuidad de los individuos marcados lo que acarrea algunos efectos no deseados. Otros riesgos asociados con las infecciones y posibles necrosis. Un tipo particular de etiquetas superficiales son aquellas que se han usado para lagartijas usando pequeñas “mostacillas” (Araya 2007) (ver Figura 13). Esta técnica consiste en usar marcas de colores compuestas de pequeñas mostacillas adheridas con una un hilo plástico bajo la piel generalmente en el dorso de los individuos. Figura 13. Individuo de Phymaturus flagellifer marcado con “mostacillas”. (Fotografía: Sergio 46 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Araya) 7.2.8 M I C R O T R A N S M I S O R E S Los microtransmisores o PIT, según su sigla en inglés (passive integrated transponders) son unos pequeños dispositivos que se implantan en los individuos capturados y permiten una identificación permanente guardando la identidad de cada individuo marcado. Es una técnica que se presenta como alternativa al corte de dedos para animales sobre todo por sus ventajas desde el punto de vista ético. Estos microtransmisores son típicamente inyectados bajo la piel de los individuos mediante jeringa de aguja hipodérmica. Los posibles efectos de la inserción del dispositivo y el tamaño que este tenga pueden hacer que esta técnica no sea recomendable para especies pequeñas. Otras posibles contraindicaciones guardan relación con la posible migración del dispositivo, su rotura, o la salida del dispositivo por la herida luego de la incisión. La aplicación de pegamento de tejido luego de la inyección. Una de las principales restricciones, en términos de de costos, es que esta técnica requiere equipo especializado para la lectura y registro de los datos del dispositivo. 47 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Tabla 5. Técnicas de marcaje por grupo de organismo Grupo Técnica de Marcaje Ventajas Desventajas Mamíferos “Microtransmisores” Rescata identidad, permanente, no modifica conspicuidad Mayor costo, requiere equipamiento Perforación de oreja Rápido, y bajo costo Limitada capacidad de rescatar identidad, posibles infecciones Corte de dedos Rápido, y bajo costo No rescata identidad, posibles infecciones Tatuado Rescata identidad Lento, poco práctico Pinturas Rápido Aumenta conspicuidad Etiquetas subcutáneas Rescata identidad, permanente, inerte Mayor costo, posiblemente menos visible “Microtransmisores” Rescata identidad, permanente, no modifica conspicuidad Mayor costo, requiere equipamiento Etiquetas superficiales Podría rescatar identidad, menor costo, rápido aplicación Aumenta conspicuidad, mayor riesgo de pérdida de marca. Corte de dedos Rápido, bajo costo No rescata identidad, posibles infecciones, no aplica para familia Colubridae (culebras) Corte de escamas Rápido, bajo costo Tiempo limitado de efectividad. Pinturas Rápido Aumenta conspicuidad Etiquetas subcutáneas Rescata identidad, permanente, inerte Mayor costo Etiquetas subcutáneas Rescata identidad, permanente, inerte Mayor costo Corte de dedos Rápido, y barato No rescata identidad, posibles infecciones “Microtransmisores” Rescata identidad, permanente, no modifica conspicuidad Mayor costo, requiere equipamiento Reptiles Anfibios 48 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 49 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 8 E STIMACIÓN DE T AMAÑOS P OBLACIONALES El muestreo de poblaciones animales puede realizarse de varias maneras. Principalmente la forma de vida del organismo en estudio y su abundancia determinarán el método que se deberá utilizar. Por ejemplo algunos métodos son la recepción de cantos en aves, transectos aéreos para mega-fauna o el conteo de ejemplares recogidos en operaciones de pesca comercial. Sin embargo todos los métodos poseen un problema común, todos son conteos estadísticos en el que el número de individuos contados es una fracción menor al número actual de individuos en la zona muestreada. Es decir, el muestreo corresponde a una fracción desconocida de la población de interés. Si el investigador es capaz de estimar a que fracción del total corresponde la muestra podrá estimar el tamaño poblacional. Los ecólogos animales se refieren a los conteos estadísticos obtenidos en condiciones estándar como “índices” del tamaño poblacional (Nichols 1992). Los índices son usados para comparar los tamaños poblacionales en diferentes puntos en el espacio o en el tiempo. Cuando la estandarización de las condiciones de conteo es asumida para producir fracciones muestréales (pi) que son iguales (en promedio) las poblaciones pueden ser comparadas evaluando y estimado sus diferencias. El éxito de esta estandarización depende de nuestra habilidad para identificar todos los factores que influencian la fracción muestreada y el control de esos factores. Desafortunadamente, la fracción muestreada cambia en el tiempo y en el espacio, en respuesta a los factores que no son controlados. Por ejemplo en la realización de varios muestreos dentro de un año no podemos controlar el cambio climático estacional o el ciclo reproductivo de la especie estudiada. Por lo tanto el uso de conteos estadísticos como índices poblacionales requiere satisfacer un supuesto de invarianza ambiental y que frecuentemente es falso. 50 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Adicionalmente, el conocimiento de las fracciones muestréales es necesario para conocer otros parámetros poblacionales, además de su tamaño. Por ejemplo, asumiendo que estamos interesados en obtener tasa de sobrevivencia, podemos estudiarla liberando una cantidad conocida de individuos marcados en el comienzo de un intervalo temporal de interés, y al final de ese intervalo obtener un conteo del número de animales marcados que aun se encuentran en la población. Nuevamente necesitamos estimar la fracción muestreada para trasladar el conteo en una estimación real del número de animales marcados sobrevivientes. Por lo tanto, la estimación de pi es un problema metodológico central asociado al estudio de poblaciones naturales de animales. Los modelos de captura y recaptura fueron desarrollados para estudios de campo en que los conteos estadísticos son números de animales atrapados marcados y no marcados o en algunas circunstancias, vistos. Estos modelos proveen formas razonables de estimar la probabilidad de captura o avistamiento, y parámetros de interés biológico como el tamaño poblacional y la tasa de sobrevivencia. 8.1 MODELO DE LINCOLN-PETERSON Uno de los primeros métodos para estimar el tamaño poblacional de animales marcados es el Lincoln-Peterson. Éste método involucra la captura de una muestra inicial de n1 animales, aplicando marcas a cada animal, y luego soltando los animales de vuelta a la población. Luego al día siguiente, se captura otra muestra n2 de la población, anotando el número de animales de la segunda muestra que estaban marcados denotándola como m2. Si N es el número actual de animales en el área muestreada, podemos describir la fracción capturada en la muestra inicial como n1/N. Si algunos supuestos son verdaderos, la proporción de animales marcados en la segunda muestra debiera estimar la proporción de animales marcados en la población: m2/n2 = n1/N Re-ordenando esa ecuación obtenemos el estimador Lincoln-Peterson (Ň) del tamaño de la población: Ň = n1n2 / m2 Este estimador es el más simple y habría sido derivado intuitivamente por Lincoln-Peterson, independientemente. Posteriormente, los bioestadísticos han efectuado modificaciones que permiten estimar la varianza y reducir sesgos que son especialmente importantes cuando los tamaños muestreados son pequeños. 51 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS El estimador Lincoln-Peterson ha sido ampliamente utilizado, pero la necesidad de aumentar las situaciones de muestreo ha llevado a realizar cambios en los modelos de captura-recaptura. 8.2 MODELOS DE HISTORIA DE CAPTURA Las principales modificaciones al modelo de Lincoln-Peterson han sido dirigidas a aumentar el número de muestreos. En esos casos, los animales son inicialmente capturados y marcados, y luego liberados. En muestreos posteriores, los animales recapturados (ya marcados) son anotados y luego liberados, y los animales no marcados son marcados y liberados. Los datos resultantes son registrados en una tabla de historias de captura (Tabla 6). Tabla 6. : Ejemplo de matriz obtenida mediante historias de captura. 1: denota captura y 0 denota ausencia de captura. Individuo Muestreo 1 Muestreo 2 Muestreo 3 Muestreo 4 Muestreo 5 Muestreo 6 1 1 0 1 1 1 1 2 0 0 1 1 0 1 3 1 0 0 1 1 1 4 1 1 1 1 1 1 Los estadísticos desarrollaron métodos probabilísticos que describen la secuencia de eventos que producen cada historia de captura y luego se derivan estimadores que cuantifican el ajuste al modelo. Los tipos de parámetros requeridos para modelar los datos de historia de captura difieren entre clases de modelos. Estas clases están definidas por la idea de población aislada. Una población abierta está definida como aquella en que los animales pueden entrar y salir (vía nacimiento, muerte, inmigración y emigración) entre períodos de muestreos. Una población cerrada es aquella que no cambia su composición en el transcurso del estudio (i.e. exactamente el mismo número de animales se encuentran en la población y expuestos a los mismos esfuerzos de captura para cada período de muestreo). Generalmente, los modelos cerrados son aplicados en estudios de corto plazo, mientras que los modelos abiertos a estudios de largo plazo. 52 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 8.2.1 M O D E L O S PARA POBLACIONES CERRADAS: Las historias de capturas resultantes de poblaciones cerradas son modeladas en términos de probabilidades de captura. 1. M0: se asume una probabilidad constante de captura para todos los individuos en todos los periodos de muestreo. 2. Mt: se asume que la probabilidad de captura cambia entre periodos de muestreo pero no dentro del muestreo en que todos los individuos poseen la misma probabilidad de captura 3. Mb: modelo que considera una respuesta conductual a la captura inicial (“felicidad” en trampa o “timidez” en trampa). Los animales que nunca han sido capturados exhiben una probabilidad y los individuos ya capturados otra. 4. Mh: considera heterogeneidad en la probabilidad de captura entre individuos. Los modelos Mb y Mh no consideran variaciones en las probabilidades de captura entre periodos de muestreo. Adicionalmente, a éstos modelos que consideran una sola fuente de variación en las probabilidades de captura se pueden utilizar combinaciones de modelos que consideren más de una fuente de variación (i.e. Mbh, Mtb, Mth o Mtbh). Sin embargo, la combinación de modelos puede llevar a la dificultad en la estimación de parámetros, incluyendo problemas en distinguir las fuentes de variación. Software recomendado para este tipo de análisis puede encontrarse en: CAPTURE http://www.mbr-pwrc.usgs.gov/software/bin/capture.zip 8.2.2 M O D E L O S PARA POBLACIONES ABIERTAS: Las historias de capturas resultantes de poblaciones abiertas son modeladas usando dos tipos de parámetros: probabilidades de captura (pi) y probabilidades de sobrevivencia (φi). Los primeros modelos utilizados son el Cormack (1964) y Jolly-Seber (1965), ambos modelos permiten que las probabilidades de captura y sobrevivencia varíen entre periodos de muestreo. Las principales diferencias son que en el modelo de Cormack las nuevas liberaciones son consideradas como constantes y no informativas, mientras que en el modelo Jolly-Seber son consideradas como variables aleatorias (proveyendo información sobre el tamaño poblacional). Ambos modelos poseen formulas equivalentes para la estimación de tasas de sobrevivencia y recaptura, pero llevan a diferentes interpretaciones en la formula de la varianza esperada (Brownie 1987). 53 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Para ambos modelos se utiliza una aproximación de máxima verosimilitud para estimar los parámetros pi y φi. Desde la formulación de los modelos el Cormack y Jolly-Seber se han realizado modificaciones, principalmente orientadas a la restricción de parámetros en que las probabilidades de sobrevivencia o de captura (o ambos) son modeladas como constantes que no dependen del muestreo. La idea básica de esas modificaciones es que la varianza del muestreo aumenta con el número de parámetros del modelo, por lo que es deseable el uso del menor número de parámetros que describan adecuadamente la variación de los datos (principio de máxima parsimonia). Otras modificaciones a los modelos Cormack y Jolly-Seber involucran la adición de parámetros que relajan los supuestos y aumentan la generalidad. Software: POPAN3 CMR JOLLY JOLLYAGE SURVIV SURGE Band recovery models: corresponden a un grupo de casos especiales de modelos de poblaciones abiertas en que el animal es recapturado como máximo solo una vez. La aplicabilidad más común es en caza, pesca, o en conservación cuando los animales encontrados están muertos (Lebreton et al. 1992). Software: BROWNIE ESTIMATE MULT SURVIV El diseño robusto (Pollock 1982): Este tipo de diseño permite usar modelos de poblaciones cerradas y abiertas en mismo estudio, ya que incluye muestreos secundarios dentro de cada periodo primario de muestreo. El tiempo de intervalo entre periodos secundarios sucesivos de muestreo es corto, permitiendo el uso de modelos de poblaciones cerradas para el análisis de datos. Los periodos de muestreos primarios consecutivos son realizados en intervalos relativamente largos, permitiendo el análisis de acuerdo a un modelo de poblaciones abiertas. 54 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS El fundamento de este diseño es que los resultados obtenidos mediante modelos de poblaciones abiertas pueden verse fuertemente sesgados producto del no cumplimiento de los supuestos, mientras que para modelos de poblaciones cerradas permiten la estimación de tamaño poblacional en presencia de varias fuentes de variación en las probabilidades de captura. Dentro de los softwares más completos y mayormente utilizados se encuentran MARK y M-SURGE. Ambos softwares poseen varias opciones de modelos y diseños experimentales para ser utilizados en el análisis de datos. Además, poseen la ventaja de ser de distribución gratuita en los siguientes sitios web: MARK (White & Burnham 1999): http://welcome.warnercnr.colostate.edu/~gwhite/mark/mark.htm M-SURGE (Choquet et al. 2004): http://www.cefe.cnrs.fr/biom/en/softwares.htm El resto de los softwares de marcaje captura-recaptura pueden ser bajados del siguiente sitio web: Patuxent Wildlife Research Center's Software Archive: http://www.mbr-pwrc.usgs.gov/software.html 8.3 MODELOS BAYESIANOS DE CAPTURA- RECAPTURA La aproximación bayesiana posee cada vez mayor influencia en la ecología (Clark 2005). Las estimaciones de probabilidades de captura y del tamaño poblacional pueden ser obtenidos a partir de series de tiempo, asumiendo que ambas estimaciones fueron muestreadas de una distribución de probabilidades común con parámetros desconocidos (Rivot & Prévost 2002). Ésta aproximación se considera particularmente útil cuando los tamaños de muestra son pequeños, ya que en esos casos los métodos clásicos son susceptibles a sesgos. Además permiten operar con modelos altamente complejos. Software: WinBUGS® software (Lunn et al. 2000): http://www.mrc-bsu.cam.ac.uk/bugs/ 55 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 9 T RASLADO Y LIBERACIÓN La literatura concerniente a los procedimientos de traslado de los individuos en la etapa post-captura o pre-liberación es escasa, siendo principalmente evaluada caso a caso. Sin embargo uno de los aspectos altamente citados en estos procedimientos (considerando sólo la microfauna), corresponde a la mantención de las condiciones de temperatura de los individuos y a la reducción de movimiento para disminuir el stress, en general, se recomienda tomar las medidas sanitarias y de bioseguridad necesarias, así como técnicas de contención y manejo que eviten o disminuyan la tensión, sufrimiento y dolor de los ejemplares durante esta práctica. En el caso de anfibios y reptiles, éstos pueden ser transportados en bolsas plásticas siempre y cuando estén aisladas del calor. No obstante, se recomienda el uso de bolsas de tela, las cuales deben estar cosidas con puntadas seguidas de forma de evitar que los animales puedan forzar su salida hacia afuera. Los anfibios requieren un ambiente húmedo dentro de la bolsa, lo que en ocasiones también es recomendable también para réptiles. Las bolsas deben mojarse ocasionalmente, especialmente si durante la captura quedan expuestas al sol. En un estudio de translocación llevado por Truett et al. (2001) en Cynomys spp, los individuos fueron trasladados a sitios de liberación al interior de jaulas cubiertas fijadas al pick-up de los vehículos. También se utilizaron acoplados. Una vez llegados a los sitios de liberación, los individuos fueron dispuestos al interior de jaulas cubiertas con vegetación natural, donde fueron monitoreados por un periodo previo a su liberación final. Para el caso de herpetofauna, Nuñez H. (com.pers) señala que los individuos capturados pueden ser colocados al interior de bolsas de género con algodón humedecido en su interior, para permitir la mantención de la temperatura y humedad. Finalmente, el establecimiento de un periodo de pre-liberación, donde se pueda monitorear el comportamiento de los 56 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS individuos puede ser un importante predictor del éxito de la relocalización en las especies (Wanless et al., 2002, Munkwitz et al., 2005,). 9.1 CUARENTENA Esta etapa constituye un factor crucial en la sobrevivencia de las poblaciones relocalizadas, como también en las poblaciones receptoras. En la actualidad se han desarrollado varios estudios que evalúan los efectos de las relocalizaciones sobre las poblaciones, concluyendo la necesidad de establecer periodos de cuarentena (mínimo de 30 días) para reducir el riesgo de transmisión de enfermedades, muchas de las cuales son letales para algunas especies. A continuación se dan a conocer algunos puntos que deben ser considerados para cada grupo Cunningham (1996) y Woodford (2000). 9.1.1 R O E D O R E S . La relocalización de micromamíferos se considera altamente peligrosa debido al contagio de virus como la mixomatosis y en particular en Chile el virus Hanta. Enfermedades bacterianas con consecuencias zoonóticas como la Brucelosis y la Tularaemia pueden ser altamente peligrosas para las poblaciones receptoras. Se considera una cuarentena con un tiempo mínimo de 35 días durante el cual se deben llevar a cabo diferentes procedimientos tales como: a) Exanimación fecal en busca de endo-parasitos. b) Cultivos fecales para detectar la presencia de Salmonella Campylobacter sp., Yersinia pseudotuberculosis, Clostridium piliforme, etc. sp., c) Cultivos bacteriológicos de tejidos respiratorios (tracto nasal). d) Análisis hematológicos, urinarios y chequeo de ectoparásitos. 9.1.2 M A R S U P I A L E S . Los estudios desarrollados en marsupiales de Norteamérica y Centro América han encontrado una baja prevalencia de rabia en las poblaciones. Sin embargo, los marsupiales son el principal hospedero de Sarcocystis neurona implicada en una amplia variedad de enfermedades. Se ha descrito la transmisión de enfermedades neurológicas por parte de algunos marsupiales a especies de cérvidos. 57 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 9.1.3 A N F I B I O S Las enfermedades asociadas a los anfibios se han venido reconociendo como importantes causas de declinación en las poblaciones nativas. Dentro de estas, se destaca recientemente la Chytridiomycosis y la Ranavirus. Los procedimientos de cuarentena pueden minimizar la transmisión de estas enfermedades. Los individuos muertos durante los periodos de cuarentena deben ser necropsiados, incluyendo examinaciones histopatológicas para detectar la presencia de estas u otras bacterias como Cutaneous chytridiomycosis, Erythrocytic iridoviruses entre otras. 9.1.4 R E P T I L E S La cuarentena de los reptiles se recomienda por un periodo de 90 días. La cuarentena además seria adecuada para facilitar el comportamiento termo regulatorio de las especies. Durante este proceso es necesario realizar las siguientes evaluaciones: • • • • Exanimación fecal en búsqueda protozoos (Cryptosporidia sp. y Amoeba sp.) Cultivos de fecas para detector la presencia de Salmonella sp. Exámenes de sangre para hemoparásitos Examinación nasal y cloacal para la presencia de Mycoplasma sp. y Mycobacteria sp. Si los animales han sido capturados y son mantenidos en cautiverio por un largo tiempo, es necesario realizar una cuidadosa evaluación de los procesos de habituación. La presencia de aversión y otros tipos de comportamientos propios que pueden emerger en las condiciones de cautiverio. De igual forma, es necesario considerar la posible pérdida de la habilidades competitivas por los recursos (espacio y alimentación) indispensable para la sobrevivencia de los individuos en condiciones naturales. A fin de minimizar este problema, toda manipulación debe interrumpirse con un periodo adecuado de anticipación antes de su liberación. 58 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 10 E VALUACIÓ N DE LA MEDIDA La implementación del rescate y relocalización de especies es una medida que debe considerar como etapa clave el monitoreo de los individuos relocalizados, con el fin evaluar el éxito de dicha medida, proponer mejoras en los planes de rescate y relocalización, implementar medidas alternativas y finalmente aportar al aumento del conocimiento de interés para la conservación de especies amenazadas o de interés para la conservación. El éxito asociado a los planes o proyectos de rescate y relocalización de especies es escasamente evaluado en Chile y en términos conceptuales la literatura reconoce una confusión respeto de lo que se entiende por éxito en este contexto (Dodd & Siegel 1991). Entendiendo que la finalidad del rescate y relocalización de especies es el establecimiento o fortalecimiento de una población viable y autosustentable (Griffith et al. 1989), el éxito de esta medida solo podrá verificarse en tanto exista evidencia de dicho establecimiento. Pero no siempre es claro identificar la presencia de evidencias que den cuenta de una población ya se ha establecido en un nuevo hábitat potencial, además de que muchas veces las evidencias de posible establecimiento correspondan a fenómenos demasiado ideales (Burke 1991). El trabajo de Griffith et al. (1989) da una visión general de los aspectos deben tenerse en consideración al momento de estimar el probabilidad de éxito de una relocalización. Entre estos aspectos se cuenta: Calidad del hábitat: resulta evidente que la calidad del hábitat es un factor determinante de la cantidad de organismos que pueden coexistir en un ambiente dado. A mayor calidad de hábitat, mayor será la probabilidad de éxito de la medida. 59 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Localización del lugar de liberación: El lugar específico liberación de los organismos rescatados, con respecto al rango de distribución de la especie, puede considerarse un buen estimador del potencial éxito de la medida. Liberaciones realizadas dentro del centro (core) del rango de distribución debieran ser más exitosas que liberaciones que se realicen en la periferia o fuera del rango de distribución natural de la especie. El grado de amenaza o peligro de la especie. La condición o estado de conservación de la especie da cuenta de su grado de sensibilidad a posibles cambios ambientales o perturbaciones producidas por actividades antrópicas. Esta susceptibilidad de las especies amenazadas puede influir en las posibilidades de que se establezca exitosamente en un nuevo hábitat potencial. Tipo de dieta: organismos herbívoros tienen una mayor probabilidad de establecerse exitosamente en un nuevo hábitat que organismos carnívoros u omnívoros. Otros organismos en el hábitat receptor: la presencia de depredadores o competidores en el nuevo hábitat puede reducir la probabilidad de éxito de la medida. Potencial reproductivo: organismos que presentan un mayor potencial reproductivo podrían establecerse con mayor éxito en nuevos hábitats. Número de organismos liberados: una variable que se considera como relevante para aumentar el éxito del rescate tiene relación con el número de animales relocalizados. Todo rescate y relocalización debiera considerar la captura y liberación del mayor número de organismos posible. En particular en el contexto de aplicación de esta medida capturar la mayor cantidad de organismos es esencial (idealmente la totalidad de ellos). Un número mayor de organismos aumenta la probabilidad de establecimiento de los organismos en un nuevo hábitat. Sin embargo la naturaleza asintótica de la relación entre el éxito del rescate y el número de animales relocalizados hace que luego de cierto punto, una mayor cantidad de animales no incremente significativamente el éxito de la relocalización (Griffith et al. 1989). Por lo tanto se hace necesario considerar otras variables para asegurar el éxito de la medida. La consideración de este conjunto de variables puede dar cuenta de las posibilidades de éxito del rescate y relocalización de especies. Distintas revisiones han cuenta de estos y otros criterios a considerar con el fin diseñar y evaluar distintos escenarios de planes de rescate y relocalización de especies (Griffith et al. 1989; Wolf et al. 1996). De estos trabajos se obtienen 60 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS distintas consideraciones que podrían orientar un plan que pueda tener mayores expectativas de éxito. 10.1 CARACTERIZACIÓN DE INDIVIDUOS Una de las etapas necesarias para el seguimiento y la evaluación del éxito de una relocalización, lo constituye la obtención de información de las características a nivel individual de los organismos, que permitirá tener información de la estructura demográfica la población que será relocalizada. En el caso de micromamíferos, pueden registrarse medidas corporales externas o exomorfológicas tales como: longitud total del cuerpo, longitud de la cola y masa corporal (Figura 14). Además se puede determinar el sexo y su estado reproductivo (juvenil, sub-adulto, adulto). Para este último, en machos se determina la posición de los testículos (abdominales o escrotales); en hembras, se considera a) el estado de la vagina: abierta o cerrada, b) el estado de las mamas: elongadas y desnudas son indicadoras de lactancia y se las considera activas; mientras que si son pequeñas se las considera inactivas, y c) detección de preñez: por la forma del cuerpo y palpación. También pueden registrarse otras observaciones (presencia de lastimaduras, de ectoparásitos, Steinmann et al., 2009). Para estos procedimientos es recomendable contar al interior del equipo con profesionales que puedan reconocer estas características (médicos veterinarios, biólogos). En el caso de reptiles y anfibios, es necesario medir la longitud total del cuerpo, longitud de la cola (reptiles) y masa corporal, la determinación del sexo y el estado reproductivo (juvenil, adulto al menos, en el caso anfibios, considerar el estado larval). Presencia de ectoparásitos. Debido a las características ecofisiológicas, es necesario caracterizar las condiciones meteorológicas generales para el momento de la captura. Actividad y posición (estrato horizontal o vertical) durante el momento de la captura. 61 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Descripción del área: Ejecutor: Tipo de trampa: Grilla N°: Datos del tiempo: N° de orden de captur a Fech a Línea: Total trampas: de Cebo empleado: N° de Marc a Especi e Sex o Estado de órgano s sexual es Destino del ejempl ar Pes o Larg o total Larg o cola Observacion es Figura 14. Planilla de registro de animales capturados. Fuente: Modificado de Steinmann et al. La recaptura de los individuos en la etapa de monitoreo permite obtener información de a nivel de la población relocalizada, y además entrega indicadores del desempeño individual de los organismos en el nuevo ambiente. Esto podría dar cuenta de algunas evidencias de establecimiento de la población como por ejemplo el registro de individuos que evidencien maduración reproductiva (estructuras reproductivas) o signos de haber producido crías recientemente. 10.2 TIEMPOS DE MONITOREO La diversidad de organismos que pueden ser objeto de rescate y relocalización impide definir a priori un protocolo de tiempos a los cuáles debiera realizarse el monitoreo de esta medida. Sin embargo hay ciertos aspectos que deben ser considerados con el fin de detallar un plan de rescate y relocalización que incluya una evaluación pertinente de la medida. En principio el monitoreo de un plan de rescate y relocalización debiera incluir al menos la evaluación de los individuos presentes en el nuevo hábitat en un tiempo cercano al momento de liberación (cercano a una semana, máximo 10 días) con el fin evaluar la proporción de individuos que se van del hábitat receptor en la primera fase de la relocalización. Luego de eso, y en función de los atributos ecológicos y de historia de vida (biología reproductiva) de los organismos, una segunda fase de monitoreo debiera realizarse al completarse el paso de una estación reproductiva de la 62 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS población con el fin de evaluar si se está expresando en alguna medida el potencial reproductivo de los individuos y por ende si la población relocalizada podría estar inserta en un proceso de establecimiento en el nuevo hábitat. Estos resultados podrían ser analizados mediante curvas de sobrevivencia, análisis de estructura de la población, con lo que podría predecirse el devenir de la población en tiempos sucesivos. 63 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS 11 B IBLIOGRAFÍA Anthony N. M, Christine, A. R., Bautz, R. & Garland, T. (2005). Comparative effectiveness of Longworth and Sherman live traps. Wildlife Society Bulletin, 33(3), 1018-1026. Araya, S. (2007). Aspectos autecológicos relevantes para la conservación de Phymaturus flagellifer (reptilia, tropiduridae) en la reserva nacional Altos de Lircay, Región del Maule. Memoria para optar al título profesional de Ingeniero en Recursos Naturales Renovables. Santiago, Chile. Beausoleil, N. J., Mellor, D. J. & Stafford, K. J. (2004). Methods for marking New Zealand wildlife: amphibians, reptiles and marine mammals. Wellington, Department of Conservation. 147 pp. Begon, M., Townsend, C. & Harper, J. L. (2006). Ecology: from individuals to ecosystems. 4th ed. Oxford: Blackwell. Bell, W. J. & Kramer, E. (1979) Search for anemotactic orientation of cockroaches. Journal of Insect Physiology 25, 631–640. Börger, L., Dalziel, B. D. & Fryxell, J. M. (2008). Are there general mechanisms of animal home range behaviuor? A review and prospects for future research. Brownie, C. (1987). Recent models for mark-recapture and mark-resighting data. Biometrics 43, 1017-1019. Burke, R. (1991). Relocations, repatriations, and translocations of amphibians and reptiles: taking a broader view. Herpetologica 47(3), 350-357. Burt, W. H. (1943) Territoriality and home range concepts as applied to mammals. Journal of Mammalogy 24, 346-352. Calhoun, J. B. & Casby, J. U. (1958) Calculation of home range and a density of small mammals. United States Public Health Monograph 55, 1–24. 64 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Carro, F., D. Pérez-Aranda, A. Lamosa, H. Schmalenberger, X. Pardavila, M. Gegundez & R. Soriguer (2007). Eficiencia de tres tipos de trampas para la captura de micromamíferos. Galemys: Boletín informativo de la Sociedad Española para la conservación y estudio de los mamíferos, ISSN 1137-8700, Vol. 19, Nº. Extra 1, 2007 (Ejemplar dedicado a: VII Jornadas de la Sociedad Española para la Conservación y Estudio de los Mamíferos), pp. 73-81. Disponible en http://dialnet.unirioja.es/servlet/articulo?codigo=2524944 Tiffany M. Doan T. M. (2003). Which Methods Are Most Effective for Surveying Rain Forest Herpetofauna?. Journal of Herpetology, 37(1), 72-81. Cei, J. M. (1962). Batracios de Chile. Ediciones de la Universidad de Chile. Santiago de Chile. 185 pp. CEDREM (2004). Medidas de mitigación de impactos ambientales en fauna silvestre. Servicio Agrícola y Ganadero. Santiago de Chile, 180 pp. Choquet, R., Reboulet, A.M., Pradel, R., Gimenez, O., & Lebreton, J. D. (2004) M–SURGE: new softwarespecifically designed for multistate capture–recapture models. Animal Biodiversity and Conservation 27, 207–215. Clark JS (2005) Why environmental scientists are becoming Bayesians. Ecology Letters 8, 2-14. Clarke, R. D. (1972). The effect of toe-clipping on survival in Fowler’s toad (Bufo woodhousei fowleri). Copeia 1972, 182-185. Cormack RM (1964) Estimates of survival from the sighting of marked animals. Biometrika 51, 429–438. Correa, P. & Roa, A. (2005). Relaciones tróficas entre Oncifelis guigna,Lycalopex culpaeus, Lycalopex griseus y Tyto alba en un ambiente fragmentado de la zona central de Chile. Mastozoología Neotropical 12(1), 57-60. Cunningham, A. A. (1996). Disease risks of wildlife translocations. Conservation Biology 10, 349–353. Cunningham, A.A. (1996). Disease risks of wildlife translocations. Conservation Biology 10, 349-353. Daszak, P., Berger, L., Cunningham, A. A., Hyatt, A. D., Green, D. E., & Speare, R. (1999). Emerging infectious diseases and amphibian population declines. Emerging Infectious Diseases 5, 735–748. Díaz-Páez, H., Ortiz, J.C. (2003). Evaluación del estado de conservación de los anfibios en Chile. Revista Chilena de Historia Natural 76, 509-525. Donnelly, M. A., Gutoad, C., Juterbock, J. E., & Alford, R. A. (1992). Techniques for marking amphibians. In W. R. Heyer, M.A. Donnely, R. W. McDiarmid, L.-A. D. Hayek, and M. S. Foster (eds.). Measuring and Monitoring Biological Diversity: 65 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Standard Methods for Amphibians, pp. 275-276. Smithsonian Institution Press, Washington, D.C. Dood, K.C & A. R. Siegel (1991). Relocation, repatriation, and translocation of amphibians and reptiles: are they conservation strategies that work? Herpetologica, 47(3), 336-350 Enge, K. M. (1997). A standardized protocol for drift-fence surveys. Tallahassee, Florida: Florida Game and Fresh Water Fish Commission. Fasola, L., Marcelo, B., & Guichon, M. L (2005). Uso de trampas de pelo y caracterización de los pelos de la ardilla de vientre rojo Callosciurus erythraeus. Mastozool. neotrop., 12(1), 9-17. Ferner, J. W. (2007). A review of marking and individual recognition techniques for amphibians and reptiles. Herpetological Circulars 35. Society for the Study of Amphibians and Reptiles, Salt Lake City UT. Fieberg, J. (2007) Kernel density estimators of home range: smoothing and autocorrelation red herring. Ecology 88, 1059-1066. Fischer, J. & Lindenmayer, D.B. (2000). An assessment of the published results of animal relocations. Biological Conservation 96, 1-11 Fox, S. F. & Thill, R. E. (1999). Comparison of Methods for Monitoring Reptiles and Amphibians in Upland Forests of the Ouachita Mountains. Proc. Okla. Acad. Sci. 79, 45-50. Germano, J. & Bishop, P. (2008). Suitability of Amphibians and Reptiles for Translocation. Conservation Biology 23(1), 7-15. Glade, A. (1993). Libro rojo de los vertebrados terrestres de Chile. Corporación Nacional Forestal, Santiago, Chile. 68 pp. Griffith, B., Scott, J. M., Carpenter, J. W. & Reed, C. (1989). Translocation as a Species Conservation Tool: Status and Strategy. Science 245, 477 – 480. Griffith B., Scott, J. M., Carpenter, J. W. & Reed, C. (1990). Translocation of captive- reared terrestrial vertebrates, 1973-1986. Endangered Species Update 8, 10-14. Gurnell J., P.PW Lurz, M.D. Shirley, S. Cartmel,P.J. Garson, L. Magris & J Steele (2004). Monitoring red squirrels Sciurus vulgaris and grey squirrels Sciurus carolinensis in Britain. Mammal Review 34, 51-74. Hanski, I. (1998). Metapopulation dynamics. Nature 396, 41-49. Hayne, D. (1949). Two methods for estimating population from trapping records. Journal of Mammalogy 30, p399. Hayne, D. W. (1949) Calculation of size of home range. Journal of Mammalogy 30, 1-18. 66 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS JACOB J., YLÖNEN, H., & HODKINSON, C. G. (2002). Trapping efficiency of Ugglan traps and Longworth traps for house mice in south-eastern Australia, 29(1), 101-103. Jolly, G. M. (1965) Explicit estimates from capture-recapture data with both death and immigration stochastic model. Biometrika 52, 225–247. Katajisto. J. & Moilanen, A. (2006) Kernel-based home range method for data with irregular sampling intervals. Ecological Modelling 195, 405-413. Kenward, R. E., South, A., & Walls, S. (2002) RANGES VI. AnaTrack, Wareham, Dorset, United Kingdom. Kie, J. G., Baldwin, J. A., & Evans, C. J. (1996) CALHOME: a program for estimating animal home ranges. Wildlife Society Bulletin 24, 342–344. Lair, H. (1987) Estimating the location of the focal center in the red squirrel home ranges. Ecology 68, 1902-1101. Laver, P. N., & Nelly, M. J. (2008) A critical review of home range studies. Journal of Wildlife Management 72, 290-298. Lebreton, J. D., Burnham, K. P., Clobert, J., & Anderson, D. R. (1992) Modelling survival and testing biological hypotheses using marked animas: a unified approach with case studies. Ecological Monographs 62, 67-118. Letty J., Marchandeau, S., Aubineau, J. (2007). Problems encountered by individuals in animal translocations: Lessons from field studies. Ecoscience, 14(4), 420-431. Lunn, D. J., Thomas, A., Best, N., & Spiegelhalter, D. (2000) WinBUGS a Bayesian modelling framework: concepts, structure, and extensibility. Statistics and Computing 10, 325-337. Matson T. K., Goldizen A. W. & Jarman P. J. (2004). Factors affecting the success of translocations of the black-faced impala in Namibia. Biological Conservation 116( 3), 359-365. May, R. M. 2004. Ecology: Ethics and amphibians. Nature 431, 403. McCarthy, M. A. & Parris, K. M. (2004). Clarifying the effect of toe clipping on frogs with Bayesian statistics. Journal of Applied Ecology 41,780-786. Mella J. (2005). Guía de campo, reptiles de Chile: Zona Central. Peñaloza, Novoa y Contreras (Eds.). Ediciones del Centro de Ecología Aplicada Ltda. Mills, J., Childs, J., Ksiazek , T., Peters, C. J., Velleca, W. (1998). Métodos para Trampeo y Muestreo de Pequeños Mamíferos para Estudios Virológicos. Traducción al español por Calderón Gladys E. Organización Panamericana de la Salud (OPS), 66 pp. Disponible en http://www.paho.org/Spanish/HCP/HCT/hct98_104.htm 67 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Munkwitz N.M., J.M. Turner, E. L. Kershner, S. M. Farabaugh & S. R. Heath (2005). Predicting release success of captive-reared loggerhead shrikes (Lanius ludovicianus) using pre-release behavior, 24(5), 447-458. Muñoz-Pedreros, A. & J. Yáñez (eds). (2000). Mamíferos de Chile. Centro de Estudios Agrarios y Ambientales (CEA) Ediciones, Valdivia, Chile. viii + 464 pp. Murua R (1982) Caracterización de las huellas de roedores cricetidos del bosque valdiviano. Boletín de la Sociedad de Biología de Concepción 53, 78-86. Nichols JD (1992) Capture-recapture models: using marked animals to study population dynamics. Bioscience 42, 94-102. Phillott, A. D., Skerratt, L. F., McDonald, K. R., Lemckert, F. L., Hines, H. B., Clarke, J. M., Alford, R. A., & Speare, R. (2007). Toe-clipping as an acceptable method of identifying individual anurans in mark recapture studies. Herpetological Review 38, 305-308. Pincheira-Donoso, D. & Núñez, H. (2005). Las especies chilenas del género Liolaemus Wiegmann, 1834 (Iguania: Tropiduridae: Liolaeminae). Taxonomía, sistemática y evolución. Publicación ocasional N°59, Museo Nacional de Historia Natural, Chile. Pollock, K. H. (1982) A capture–recapture design robust to unequal probability of capture. Journal of Wildlife Management 46, 757–760. Reaman, D. E., Griffith, B., & Powell, R. A. (1998) KERNELHR: a program for estimating animal home ranges. Wildlife Society Bulletin 26, 95–100. Rivot, E., & Prevost, E. (2002) Hierarchical Bayesian analysis of capture-markrecapture data. Canadian Journal of Fisheries and Aquatic Sciences 59, 1768– 1784. Rizkalla, C.E. & Swihart, R. K. (2007). Explaining movement decisions of forest rodents in fragmented landscapes. Biological Conservation 140, 339-348. Rodgers, A. R. & Carr, A. P. (1998) HRE: the Home Range Extension for ArcViewe: user’s manual. Ontario Ministry of Natural Resources, Centre for Northern Forest Ecosystem Research, Thunder Bay, Canada. Santos-Barrera G. & J. Pacheco-Rodríguez (2006). Diversity of Amphibians and Reptiles Associated with Grasslands of Janos–Casas Grandes,Chihuahua, Mexico (Summary). Instituto de Ecología, Universidad Nacional Autónoma de México. USDA Forest Service Proceedings RMRS-P-40. Scheffer, M., Carpenter S.R. (2003). Catastrophic regime shifts in ecosystems: linking theory to observation. Trends in Ecology and Evolution 18(12). Seaman, D.E., & Powell, R.A. (1996) An evaluation of the accuracy of kernel density estimators for home range analysis. Ecology 77, 2075–2085. 68 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Seber, G. A. F. (1965) A note on the multiple recapture census. Biometrika 52, 249–259. Serey, I., Ricci, M. y Smith-Ramírez, C. (2007). Libro Rojo de la Región de O’Higgins. Universidad de Chile - Corporación Nacional Forestal. Slade N. A., Eifler, A. M., Gruenhagen, N. M., & Davelos, A. L. (1993). Diferential effectiveness of standard and long Sherman livetraps in capturing small mammals. J. Mamm., 74(1), 156-161. Spellerberg, I., & Prestt, I. (1978). Marking snakes. In B. Stonehouse (Ed.), Animal Marking - Recognition marking of animals in research (pp. 132-141). London: The Macmillan Press. Steinmann, A., C. Provensal & E. Castillo. Métodos de censo de las poblaciones de roedores. Módulo IV. Serie Enfermedades Transmisibles, pp. 29-36. Disponible en http://www.mundosano.org/documentos/monografias/Monografia%204%20%20Modulo2.pdf. Visitado por última vez 22.01.2009 Swingland, I. R. (1978). Marking reptiles. In B. Stonehouse (Ed.), Animal Marking Recognition marking of animals in research. London: The Macmillan Press. Szaro, R.C., Johnston, D. W. (1996). Biodiversity in Managed Landscapes: Theory and Practice. Oxford University Press US.778 pp Towns D. R. & Ferreira, S. M. (2001). Conservation of New Zealand lizards (Lacertilia: Scincidae) by translocation of small populations. Biological Conservation, 98, 211-222. Truett, J. C., Dullum, J. A., Matchett, M. R., Owens, E., & Seery, D. (2001). Translocating prairie dogs: a review. Wildlife Society Bulletin, 29(3), 863-872. Veiga J. M., Lobo, J. M. & Martin-Piera, F. (1989). Las trampas pitfall con cebo, sus posibilidades en el estudio de las comunidades coprofagasde Scarabaeoidea (Col.). II: Análisis de efectividad. Rev. Ecolo. Biol. Sol, 26(1), 91-109. Vogt, R. C., Hine, R. L.. (1982). Evaluation of techniques for assessment of amphibian and reptile populations in Wisconsin. In: Scott, N. J. Jr, editor. Wildlife Research Report 13, U.S. Department of the Interior, Fish and Wildlife Service, Washington DC. pp 201-217. Wanless R. M, Cunninghamb, A. J., Hockeya, P. A. R., Wanlessa, J., Whitec, R. W. & Wisemana, R. (2002). The success of a soft-release reintroduction of the flightless Aldabra rail (Dryolimnas [cuvieri] aldabranus) on Aldabra Atoll, Seychelles. Biological Conservation, 107 (2), 203-210. Wolf, C. M., Garland, T. & Griffith, B. T. (1998). Predictors of avian and mammalian translocation success: reanalysis with phylogenetically independent contrasts. Biological Conservation 86, 243-255. 69 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS Wolf, C. M., Griffith, B. T., Reed, C. & Templet, S. A. (1996). Avian and Mammalian Translocations: Update and Reanalysis of 1987 Survey Data. Conservation Biology, 10(4), 1142- 1154. 70