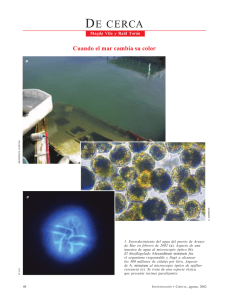
Biblioteca Central UABCS - Universidad Autónoma de Baja
Anuncio

UNIVERSIDAD AUTÓNOMA DE BAJA CALIFORNIA SUR __________________________________________________________________ ÁREA DE CONOCIMIENTO DE CIENCIAS DEL MAR DEPARTAMENTO ACADÉMICO DE BIOLOGÍA MARINA Efecto de toxinas paralizantes de Gymnodinium catenatum en el copépodo Pseudodiaptomus euryhalinus TESIS PROFESIONAL QUE PARA OBTENER EL TÍTULO DE BIÓLOGO MARINO PRESENTA Jairo Antonio Fuentes Pascacio Director de tesis Dr. Felipe de Jesús Ascencio Valle La Paz, Baja California Sur, 2010 Todo tiene su tiempo, y todo lo que se quiere debajo del cielo tiene su hora: Tiempo de nacer y tiempo de morir; tiempo de plantar y tiempo de arrancar lo plantado; tiempo de matar y tiempo de sanar; tiempo de destruir y tiempo de construir; tiempo de llorar y tiempo de reír; tiempo de estar de duelo y tiempo de bailar; tiempo de esparcir piedras y tiempo de juntar piedras; tiempo de abrazar y tiempo de dejar de abrazar; tiempo de buscar y tiempo de perder; tiempo de guardar y tiempo de arrojar; tiempo de romper y tiempo de coser; tiempo de callar y tiempo de hablar; tiempo de amar y tiempo de aborrecer; tiempo de guerra y tiempo de paz. Eclesiastés 3; 1-22. Dedicatoria In Memoriam Dr. José Luís Ochoa [1951-2007] Maestro, tutor y una persona increíble que nos enseño a tener perseverancia y amor a la ciencia. Muchas Gracias por haberme aceptado en su equipo. I Dedicatoria A mis padres: Rubén Fuentes de la Cruz, que me enseño a vivir y luchar por mis sueños, así como mantenerme tranquilo en situaciones difíciles con una simple llamada, te amo papá! Miriam Guadalupe Pascacio Jiménez: gran mujer y excelente madre, no puedo pedir más amor que el que me brindaron en mi desarrollo como persona y así como en lo académico. Gracias mamita por darme la oportunidad de ser tu hijo o como a veces digo su experimento, te amo mamita!! A mis hermanos: Alma Yazmín Fuentes Pascacio y Rubén Alejandro Fuentes Pascacio, siempre me han demostrado todo su amor y respeto, siento haberlos dejado muy chicos para seguir mis sueños, pero e aquí resultados, se que con el paso de su desarrollo académico me superaran y me sentiré orgulloso de ustedes. A mi familia Chiapaneca Pascacio Jiménez, muchas gracias por estar en toda mi vida echando porras y ayudando a levantarme cuando intento caer. A mi familia Oaxaqueña Fuentes de la Cruz, por todo su cariño y excelentes comidas que me regalan cada vez que los veo. A mi familia Veracruzana Fuentes Montalvo y amigos: Jorge Fuentes Álvarez, gracias por ser un amigo y una de mis guías en esta vida, no tengo más que decirle muchas gracias tío George por aceptarme en su casa y darme el amor de hijo!! Dulce Maria Montalvo, gracias por soportar a un niño chiqueado y brindarme su amor, por enseñarme a disfrutar las cosas buenas y que cuando se ganan a pulso saben mucho mejor los logros, gracias tía por también tratarme como hijo!! II Agradecimientos Agradezco Centro de Investigaciones Biológicas del Noroeste por todo el apoyo y facilidades otorgadas para la realización de este trabajo, en especial al proyecto ―Histología por Exposición Crónica a Saxitoxina (PSP) y Brevetoxina (NSP) en el Modelo Experimental de Ratón-SAGARPA-2003-98‖, que me brindo el apoyo económico para el desarrollo del experimento. A los responsables de los siguientes Laboratorio: Manuel Moreno (Biotoxinas Marinas), Marte Virgen (Cepario), Orlando y Norma (Laboratorio de Salud Ambiental y Biomedicina), Dr. Juan Carlos Pérez Urbiola (Sala Húmeda), gracias por su ayuda y colaboración al proporcionarme los copépodos y un agradecimiento a todos los que estuvieron ayudándome en el laboratorio de Química Analítica y Alimentaría de la Universidad de Vigo, España (Diana, Laura, Dr. Manuel Leão, Jesús, Nati, Cori y si se me va alguno pss no se sienta tengo un problema con los nombres, pero le agradezco a todas las personas que me brindaron su cariño y amistad en Vigo). Mi mas sincero agradecimiento al Dr. Tania Zenteno por aceptarme en su laboratorio y sus consejos, al Dr. Felipe Ascencio, por su consejos y la amistad y apoyo después de la perdida del Dr. José Luís Ochoa, así como hacernos parte de la ―Patobanda‖ (muchas gracias a todo el equipo de trabajo que siempre estuvo al pendiente de mi). Al Dr. Carlos Rangel por sus consejos y su amistad para el desarrollo de este trabajo. A la M. C. Erika Torres Ochoa gracias por tu amistad y preocuparte por mi en todo el proceso universitario. Al biologaso y nuestro jefecito de Biología Marina Marco Medina, gracias por tu amistad y ayudarme en este proceso de papeleo para mi examen que fue un martirio para mi. A mi asesor universitario Dr. Gerardo Gonzáles Barba, gracias por su amistad y buenos consejos en mi vida académica en la UABCS. A la Dra. Ana Gago en el Laboratorio de Química Analítica y Alimentaría de la Universidad de Vigo (España), gracias por aceptarme para realizar mi estancia y confiar en que no iba a destruir el equipo. III Al M. C. Ricardo Flores, gracias por tu amistad y brindarme copépodos de tu experimento para los primeros ensayos que realice. A la Lic. Alejandra Tapia que sin su ayuda yo hubiera sido como una aguja en un pajar en el mundo de los copépodos, gracias por levantarte tempra y ayudarme con mi experimento, estaré infinitamente agradecido. Al Equipo JLO, Gorette Solís, Axel Falcon, Leyberth Fernández, Laura González, Jesús Pérez, gracias a su apoyo y buena vibra se ha cumplido otro objetivo del Dr. Ochoa. A mi amigo Pablo Gil Sánchez (Alias el Pabliuca, moncoco, el palito anches, pablini), gracias hermano por estar a mi lado toda una vida y sigamos cosechando mas años de esta amistad que muchos envidian a pesar de la distancia!! Te quiero mucho hermano. A mis hermanos de la UABCS (el orden de los factores no altera mí cariño eé, así que no se sientan): Pakoles Vergara, gracias hermano por tu amistad y por las buenas platicas, por ayudarme a pensar en lo mecánico para mi experimento ya sabes aquí no hay estrés, solo buena vibra. Carlos López Fletes (El Fletes), gracias bro!, por soportarme esos 3 años en la misma casa ja, por darme ánimos y estar ahí cuando se te necesitaba, ya sabes cuentas conmigo para todo. Georgina Ramírez (Gashina), mi amiguisima (eres niño), no tengo palabras que describan cuantas cosas me enseñaste o la cantidad de cosas que hicimos juntos las cuales eran unas babosadas pero muy divertidas, te quiero musho, asi que en nuestra próxima vida vamos a juntarnos y postularnos por la beca bailando como pollito. Víctor Vargas (el negro), gracias carnal por tu amistad incondicional, aunque estés dormido y te pedíamos un mapa de Beirut, sabia que estabas con nosotros, nunca fallaste para ir a dar el rol y mucho menos cuando me sentía triste en la Paz, gracias! Claudia Miranda, parte fundamental de mi vida académica y una chica de buen corazón, que no brinda una amistad a cualquiera y pude ganármela a pulso, muy chikiona y que no IV da su brazo a torcer, pero forma parte de una etapa muy feliz de mi vida estando conmigo en las buenas y en las malas, muchas gracias. Eduardo Villalón (Villa...amigo), gracias man por hacerme reír, por tu amistad, por todo en la Paz, profundamente agradecido Alfredo Vergara, el buen ta tan tan (tu me entiendes), gracias por tu amistad y por darme un rato asilo en tu house, eres un buen compa, gracias! Tzitziki Loeza (chichiki), uy amiga todo lo que hemos vivido y la amistad se fortalece cada día mas, te quiero musho y donde estés siempre me acordare de ti, gracias! Osvaldo Hernández (el hongos), mi buen fuiste la primera persona de la UABCS que conocí en La Paz y me hizo ir a la clase de las 7 de la mañana, sabiendo que iba en la tarde jajaja, gracias por tu amistad carnal. Magali Gómez Valdez (maguita), contigo las palabras sobran, desde que entramos a la carrera la conexión jalapeña se dio, sabes cuanto te quiero mushashita y también adoro tu toque en la cocina, eres mi amiguisima, gracias por la ayuda para lograr esta meta Denisse Perea (Renis ée), muchisimas gracias por tu amistad chiquilla, te quiero musho. José Alberto Torres (Pepe Juguetes), compatriota gracias por tus enseñanzas y ponerme siempre a prueba, gracias por tu amistad y la ayuda que me brindaste estando en La Paz, la frase ―engañen al Paska‖ estará por la eternidad!! A los que de una u otra manera me ayudaron y se preocuparon por mí en todo este proceso mis más profundos agradecimientos, Luís (Kiwi), Diego (pony), Merít del Rocío, Sara de las Heras (sarixis), Nats, Kalita, Lalex, Isma, A la Banda Paceña (El grillo, Wolfy, Rafa, Chato, Cea, Poncho, si se me va alguno, sorry). Gracias a mis nuevos amigos por presionarme y terminar el proceso de titulación: Félix Olivares, Leonora Martínez, Sergio Castillo, Ana Cabello, Laura Camacho, Mariela Brito, Andrea Figueroa, Samanta, Carlos Abraham. V Por si pensaste que me había olvidado, como puedes imaginarte eso eé Jesús? E tenido a muchas personas que han guiado mi camino pero el Dr. Jesús Pérez Linares, se lleva mis honores, sus cualidades como maestro, amigo, compañero, mentor, etc., etc., me ha enseñado a tener amor a la ciencia, muchas gracias por todos tus consejos, tus regaños, tus chistes, tus abrazos cuando estaba triste, el rinconcito que me diste pa dormí en España, por aguantarme y hacer que fuera perseverante aunque a veces mostraba desanimo por las cosas, por tu sinceridad y lo principal que nunca se me va olvida tu ética profesional, de veraz de todo corazón mi querido Sen Sei, muchas gracias! Y a todos los que no fueron mencionados por este medio, saben que son parte fundamental de mi vida, les envió un abrazo y un gracias en general! Siempre les brindare una sonrisa de oreja a oreja para hacerles ameno el día, aunque llueva, truene o tiemble, ATTE JAFP (Alias el Paska, shamako, mocoso, come crayolas, mowly, jayo, jairini, paskaleta, entre otros) VI Resumen En la última década las Proliferaciones Microalgales Nocivas (PMN) han ido en aumento, lo cual ha provocado que las investigaciones científicas vayan enfocadas hacia los efectos tóxicos que pueden producir estos eventos masivos aleatorios, afectando la salud pública, actividades acuícolas y sobre todo a una gran escala al medio ambiente. Muchos de los estudios relacionados con PMN describen a organismos interactuando con estos eventos, desde filtradores hasta depredadores, por lo tanto uno de los organismos más importantes es aquel que depreda activamente a las PMN, tal como los copépodos, los cuales pueden considerarse como vectores potenciales al estar expuestos a ficotoxinas. En este estudio, el copépodo Pseudodiaptomus euryhalinus fue expuesto durante 3 días a diferentes densidades celulares de Gymnodinium catenatum para observar la posible bioacumulación y efectos tóxicos producidos por las toxinas paralizantes. No se observó diferencia significativa (p>0.05) en el porcentaje promedio de supervivencia de los copépodos expuestos al dinoflagelado tóxico en ninguna de las densidades celulares estudiadas (1x1062x106 cél/mL). Sin embargo, después de 7 horas los copépodos presentaron aletargamiento prolongado en presencia de G. catenatum. Los análisis de actividad enzimática mostraron que no hubo diferencia significativa (p<0.05) entre los copépodos expuestos a G. catenatum y los controles, por lo que se presume que la presencia de esta microalga tóxica no les produce daño oxidativo. Por otro lado, se pudo comprobar la presencia de toxinas paralizantes en los tejidos de los copépodos expuestos a G. catenatum (STX, NEO, GTX14 y dcSTX). Estos resultados muestran que los copépodos son capaces de retener toxinas paralizantes y sobreviven en presencia de G. catenatum, representando un riesgo potencial de biomagnificación de toxinas paralizantes a través de la cadena trófica. VII Abstract Harmful Algal Blooms (HAB’s) represent a worldwide problem that has been increasing in the last decades. These natural phenomena have provoked that the scientists focus their research to the toxic effects produced in human health, aquaculture, and environment. Important studies regarding to HAB’s describe interactions among these microalgae and surrounding organisms, principally those that are their predators. The copepods are considered one of the main potential vectors of phycotoxins when they are exposed to toxic microalgae. This work ran bioassays with copepods from the species Pseudodiaptomus euryhalinus, fed and exposed to different cell densities of the toxic dinoflagellate Gymnodinium catenatum during three days. The aim of this study was to evidence possible effects of paralytic toxins (PSP) on the crustaceans, as well as to corroborate if they were able to accumulate those biotoxins in their tissues. There was no significant difference (p>0.05) in the average percentage of survival between the copepods exposed to G. catenatum in any of the cell densities tested (1x106-2x106 cell/mL). Nevertheless, after seven hours of exposure the organisms showed long-term lethargy. Enzymatic activity assays (catalase and lipoperoxidase) showed no significant difference (p<0.05) between copepods fed by G. catenatum comparing with controls. These results lead as to conclude that presumably these organisms did not experienced oxidative harm in presence of the toxic dinoflagellate. On the other hand, there was corroborated the presence of paralytic toxins (STX, NEO, GTX1-4, dcSTX) in the tissues of P. euryhalinus after the exposure with G. catenatum, confirming that these crustaceans are able to accumulate PSP toxins, but survive without oxidative damage. These findings evidence that P. euryhalinus VIII represents a potential threat to the environment due to the possible biomagnification of paralytic toxins throughout the marine food chain. IX ÍNDICE Pág. Dedicatoria I Agradecimientos III Resumen VII Abstract VIII Índice X Lista de Tablas XIII Lista de Figuras XIV 1. Introducción 1 1.1 Generalidades 4 1.1.1 Pseudodiaptomus euryhalinus 4 1.1.2 Gymnodinium catenatum 7 2. Antecedentes 8 3. Justificación 12 4. Hipótesis 13 5. Objetivo general 13 5.1 Objetivos Particulares 6. Material y Métodos 6.1.1 Pseudodiaptomus euryhalinus 13 14 14 X 6.1.2 Cultivo de Pseudodiaptomus euryhalinus 15 6.1.3 Gymnodinium catenatum 16 6.1.4 Cultivo de GCCV-6 16 6.1.5 Determinación de la cantidad eq. STX/cél de GCCV-6 17 6.1.6 Prueba de depredación 18 6.1.7 Diseño del bioensayo agudo de P. euryhalinus vs. GCCV-6 19 6.1.8 Bioensayo de ingestión 20 6.2 Daño Oxidativo 21 6.2.1 Peroxidación de lípidos (TBARS) 21 6.2.2 Catalasa 22 6.3 Cromatografía Líquida de Alta Eficacia con detección de fluorescencia (HPLC-FLD) 23 6.3.1 23 Extracción y análisis de toxinas paralizantes (PSP) 6.4 Análisis Estadísticos 7. Resultados 25 26 7.1 Ingestión de Gymnodinium catenatum por Pseudodiaptomus euryhalinus en el ensayo agudo 26 7.2 Daño Oxidativo 33 XI 7.2.1 Peroxidación de lípidos 33 7.2.2 Catalasa 34 7.3 Determinación de toxinas paralizantes mediante oxidación pre-columna y análisis por HPLC-FLD 8. Discusión 34 43 8.1 Ingestión de Gymnodinium catenatum por Pseudodiaptomus euryhalinus 43 8.2 Daño celular (estrés oxidativo) 45 8.3 Detección de toxinas paralizantes mediante HPLC-FLD 47 9. Conclusiones 49 10. Recomendaciones 50 11. Bibliografía 51 XII Lista de Tablas Tabla Título Página Tabla I Clasificación taxonómica de P. euryhalinus 5 Tabla II Clasificación taxonómica de Gymnodinium catenatum 7 Tabla III Resumen de cosechas previas de GCCV-6 para conocer promedios 17 de diferentes parámetros del cultivo. Tabla IV Ensayo prospectivo de P. euryhalinus vs. G. catenatum Tabla V Programación para el análisis de detección de toxinas paralizantes mediante oxidación pre-columna y HPLC-FLD (Lawrence et al., 19 25 2004) Tabla VI Estimación del porcentaje promedio de células de G. catenatum 28 ingeridas por P. euryhalinus en el Tabla VII Estimación del porcentaje promedio de células de G. catenatum 29 ingeridas por P. euryhalinus en el tratamiento B del ensayo agudo Tabla VIII Estimación del porcentaje promedio de células de G. catenatum 31 ingeridas por P. euryhalinus en el tratamiento C del ensayo agudo. Tabla IX Comparación de toxinas paralizantes ausentes (-) y presentes (*) en 42 los cromatogramas integrados por el HPLC-FLD. XIII Lista de Figuras Figura Figura 1 Título Página Gymnodinium catenatum (Graham, 1943) 3 Distribución del Género Pseudodiaptomus en América (Mapa tomado 4 Figura 2 de Walter, 1989). Figura 3 Figura 4 Estructura general de Pseudodiaptomus euryhalinus 6 Micrografías de Gymnodinium catenatum con MEB. A) Estructura 8 intracelular mostrando el núcleo (n) y B) mostrando los cloroplastos (escala= 10 m) (Imágenes tomadas de Blackburn et al., 1989). Micrografía de Pseudodiaptomus euryhalinus (20X2) (Imagen: R. 15 Figura 5 Flores). Micrografías de las microalgas Chaetoceros calcitrans (A) e Isochrysis 15 Figura 6 galbana (B) con las que se mantuvieron los cultivos de copépodos Micrografía de células de Gymnodinium catenatum (cepa GCCV-6) Figura 7 Figura 8 Figura 9 16 Imagen: J. Fuentes-Pascacio. Placa NUNC y ubicación de pozos en la prueba de depredación 18 Diagrama de flujo del diseño experimental del bioensayo agudo de 21 Pseudodiaptomus euryhalinus a diferentes concentraciones de Gymnodinium catenatum (cepa GCCV-6). XIV Tratamiento A: ensayo de exposición aguda de P. euryhalinus con una 28 Figura 10 densidad de 103 cél/mL de G. catenatum. Tratamiento B: ensayo de exposición aguda de P. euryhalinus con una 29 Figura 11 densidad de 2x103 cél/mL de G. catenatum. Tratamiento C ensayo de exposición aguda de P. euryhalinus con una 31 Figura 12 densidad de 2x103 cél/mL de G. catenatum + P. euryhalinus. Consumo promedio de células ingeridas por copépodo en cada día del 32 Figura 13 ensayo agudo y cada tratamiento. Daño oxidativo de P. euryhalinus en respuesta a los tratamientos con 33 Figura 14 diferentes densidades de microalgas. Actividad enzimática de P. euryhalinus en respuesta a los tratamientos 34 Figura 15 con diferentes densidades de microalgas. Cromatograma del extracto de Gymnodinium catenatum (cepa GCCV- 35 Figura 16 6) oxidado con H2O2 [10%]. Cromatograma del extracto de Gymnodinium catenatum (cepa GCCV- 36 Figura 17 6) oxidado con HIO4 [0.03 M]. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de 37 Figura 18 G. catenatum [1x106 cél] (tratamiento A). Figura 19 Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de 38 G. catenatum [2x106 cél] (tratamiento B). XV Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de 38 Figura 20 G. catenatum [2x106 cél] + C. calcitrans [1.2x108 cél] (tratamiento C). Cromatogramas de extractos de P. euryhalinus expuestos sólo a C. 39 Figura 21 calcitrans [1.2x108 cél] en el tratamiento Control (-) (-). Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de 39 Figura 22 G. catenatum [1x106 cél] (tratamiento A). Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de 40 Figura 23 G. catenatum [2x106 cél] (tratamiento B). Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de 40 Figura 24 G. catenatum [2x106 cél] + C. calcitrans [1.2x108 cél] (tratamiento C). Cromatogramas de extractos de P. euryhalinus expuestos sólo a C. 41 Figura 25 calcitrans [1.2x108 cél] en el tratamiento control (-) (-) (-). 1. XVI Introducción El mar es una fuente importante de alimento para el ser humano, por lo que diversas ramas de la ciencia como epidemiología, toxicología, biología marina, etc., centran su atención a las biotoxinas marinas producidas por microalgas (Pérez-Linares, 2001). Las proliferaciones microalgales nocivas (PMN) o mareas rojas, como comunmente se les conoce, son crecimientos masivos de microalgas que generalmente producen una coloración particular en la superficie marina en forma de parches o manchas (Ochoa et al., 2003). Entre los organismos que son capaces de formar estos eventos se encuentran dinoflagelados, diatomeas, cianobacterias, protozoarios y bacterias. Estos organismos por sí solos o en densidades bajas (104 cél/L) no tienen un impacto negativo, pero al desarrollar proliferaciones mayores pueden causar daños al ambiente, alterando la dinámica y el equilibrio del fitoplancton, zooplancton y otros organismos superiores (Alonso et al.., 2005). Recientemente se ha puesto especial atención a las PMN debido a que muchas especies producen metabolitos secundarios(ficotoxinas), que pueden intervenir en intoxicaciones humanas y llegan a afectar la salud ambiental, produciendo un impacto negativo en pesquerías, acuicultura y en el sector turístico (Yasumoto y Murata, 1993; Anderson, 1994). Las ficotoxinas son moléculas que contienen grupos funcionales muy diversos y heterogéneos, teniendo como único común denominador su naturaleza no proteica (Cortes, 1998; Lehane, 2001). Debido a su heterogeneidad, las ficotoxinas se han clasificado en 5 grupos de acuerdo a los síntomas que producen en el humano: intoxicación diarreica o DSP (por sus siglas en inglés Diarrhetic Shellfish Poisoning); intoxicación amnésica o ASP (por 1 sus siglas en inglés Amnesic Shellfish Poisoning); intoxicación neurotóxica o NSP (por sus siglas en inglés Neurotoxic Shellfish Poisoning); intoxicación por azaspirácidos o AZP (por sus siglas en inglés Azaspiracid Poisonig); intoxicación paralizante o PSP (por sus siglas en inglés Paralythic Shellfish Poisoning) (Hallegraeff et al.., 1995; Lindahl, 1998; FAO, 2004). La intoxicación en el humano se puede producir por tres vías principales: I) ingestión de organismos filtradores contaminados con ficotoxinas (e.g. moluscos bivalvos); II) biomagnificación (por bioacumulación) al ingerir un depredador intoxicado (e.g. peces, crustáceos, etc.); y III) por el contacto directo con la toxina disuelta en el agua después de la lisis celular (Pérez-Linares, 2001). Las proliferaciones de microalgas capaces de producir toxinas pueden cambiar las comunidades zooplanctónicas en el ambiente marino, en donde la adaptación de éstos organismos tóxicos en los nichos ecológicos pueden ocasionar disturbios importantes al ecosistema como la muerte de diversos animales (Cortés, 1998). Como los ocasionados por Gymnodinium catenatum que se distribuye ampliamente en aguas tropicales y subtropicales, incluyendo regiones del Pacífico de México. Es una microalga con un crecimiento óptimo a temperaturas entre 12.5-25°C, halotolerancia de 23-34 PSU y una irradiancia 50-300 pE.m-2.s- (Blackburn et al., 1989). Su reproducción incluye una diversidad de patrones tanto en su forma haploide como diploide, y una característica importante en esta especie es que la deficiencia de nutrientes no permite que disminuya su supervivencia (Blackburnet et al., 1989). Miden de 31-40 m de largo y 34-42 m de transdiámetro, tiene la capacidad de formar cadenas muy largas (Fig. 1) (Blackburnet et al., 1989). 2 G. catenatum está en contacto directo con especies del género Pseudodiaptomus, el cual incluye copépodos muy abundantes en el zooplancton y por su posición ecológica en el medio entran en contacto directo con proliferaciones de microalgas (Turner y Tester, 1997). Pseudodiaptomus euryhalinus es un crustáceo que se alimenta de fitoplancton en las costas del Pacífico mexicano. Por lo tanto, este copépodo se ha convertido en un depredador muy eficaz para muchos dinoflagelados, como Gymnodinium catenatum, una de las especies más importantes por su impacto negativo en el litoral mexicano (Osorio, 1998; Cortés, 1998). Por lo anterior, el estudio de las especies consumidoras (principalmente las secundarias) es de gran importancia ya que las exposiciones a ficotoxinas pueden provocar la bioacumulación de estos compuestos biomagnificándose hacia poblaciones consumidoras de zooplancton y afectar su crecimiento, reproducción y supervivencia, llegando a perturbar los ciclos de una comunidad o hasta todo un ecosistema (Barman y Campbell, 2003; Traas y Leeuwen, 2007). Figura 1. Micrografía de Gymnodinium catenatum (cepa GCCV-6) es un dinoflagelado capaz de formar cadenas de varias células, generalmente menos de 14, pero se han reportado cadenas de más de 60 células (Blackburn et al., 1989). Imagen: J. Fuentes-Pascacio. 3 1.1Generalidades 1.1.1 Pseudodiaptomus euryhalinus Pseudodiaptomus es un género de copépodos calanoideos zooplanctónicos. Se distribuye ampliamente en mares tropicales y subtropicales del Pacífico Oriental (desde las costas de California, EEUU hasta Ecuador). En específico, la especie P. euryhalinus se distribuye desde la Bahía de San Francisco, CA (EEUU) hasta las costas de Baja California Sur, México (Fig.2) (Walter, 1989). ). Esta especie fue descrita por primera vez por Johnson en 1939 y su clasificación taxonómica se presenta en la Tabla I. Figura 2. Distribución del Genero Pseudodiaptomus en América (Mapa tomado de Walter, 1989). 4 Tabla I. Clasificación taxonómica de P. euryhalinus Reino Animalia Phylum Artrópoda Subphylum Crustacea Clase Maxillopoda Subclase Copepoda Orden Calanoidea Género Pseudodiaptomus Especie Pseudodiaptomus euryhalinus Clasificación obtenida de http://www.itis.gov Bajo condiciones de laboratorio, P. euryhalinus presenta una distribución diferencial en sus respectivos estadios: los nauplios tienden a ser pelágicos, mientras que los adultos suelen ser epibentónicos, por lo que la mayoría tratan de acercarse al fondo, así como sujetarse de algún sustrato que esté suspendido en la columna de agua o las paredes del área de cultivo (Osorio, 1998). P. euryhalinus presenta dimorfismo sexual con respecto a la talla de los individuos, donde las hembras tienen en promedio 1465 m y los machos 805 m; estas medidas se pueden diferenciar a partir del 8º día de cultivo (Johnson, 1939). Este copépodo presenta cinco estadios naupliares de vida libre después de la eclosión y la larva se puede reconocer desde Nauplio II por medio de sus estructuras ya desarrolladas. Eventualmente desarrolla seis estadios copepodito con dimorfismo sexual en su talla a partir de Copepodito IV. Sin embargo, no alcanza la madurez sexual hasta el estadio de Copepodito VI, a partir del cual desarrollan el segmento genital por completo (Johnson, 1939 y 1948). 5 En general los copépodos calanoideos presentan un cuerpo dividido en dos partes principales: cefalotórax y abdomen; la primera se subdivide en cabeza y tórax, las cuales se encuentran fusionadas y unidas al abdomen por medio de un punto de flexión por detrás de el último segmento torácico (Fig. 3). Una característica particular es la primera antena que es más larga que la segunda y consta de 16 a 28 segmentos (Marshall y Orr, 1972; CamposHernández y Suárez-Morales, 1994). CB Cefalotórax TX AB Figura 3. Estructura general de Pseudodiaptomus euryhalinus (CB: cabeza, TX: tórax, AB: abdomen). Imágen obtenida de http://copepodes.obs-banyuls.fr/en/index.php 6 1.1.2 Gymnodinium catenatum Gymnodinium catenatum es un dinoflagelado de la clase Gymnodiniales (Tabla II) y en estado individual tiene forma elipsoidal, con un cingulum bien excavado, ecuatorial, desplazado y descendente; el sulcus es largo y angosto, ensanchado en su parte posterior y se prolonga en la epiteca hasta el ápice, donde termina en una bifurcación que delimita una pequeña protuberancia que sirve de unión con el individuo que le precede. La epiteca es truncada, redondeada o cónica. Las células miden de 31-40 m de largo y 34-42 m de transdiámetro (Cortés, 1998). Tiene un núcleo elipsoidal y ecuatorial, y numerosos cloroplastos de color verde oliva (Fig. 4). Tabla II. Clasificación taxonómica de Gymnodinium catenatum Reino Protozoa Phylum Dinophyceae Clase Gymnodiniales Orden Gymnodiniaceae Género Gymnodinium Especie Gymnodinium catenatum Clasificación obtenida de http://www.algaebase.org Este organismo es capaz de producir toxinas paralizantes (PSP) y fue descrito por Graham en 1943. Su distribución es mundial y en México se le ha descrito desde el Golfo de California hasta las costas de Oaxaca y Chiapas (Cortés, 1998). Se estima que para que este organismo pueda causar daños importantes su densidad debe alcanzar entre 1,800 y 6.6x106 cél/L. Una de las toxinas que puede producir G. catenatum es la saxitoxina, la cual se considera entre las más peligrosas por su toxicidad (80g/100g, limite máximo permisible 7 en moluscos para consumo humano), ya que puede acumularse en tejidos comestibles de moluscos bivalvos, crustáceos y peces que llegan a consumir directa o indirectamente a este dinoflagelado (Lehane, 2000; Band-Schmidt et al., 2003; FAO, 2004; Pérez-Linares et al., 2009). B A Figura 4. Micrografías de Gymnodinium catenatum con MEB. A) Estructura intracelular mostrando el núcleo (n) y B) mostrando los cloroplastos (escala= 10 m) (Imágenes tomadas de Blackburn et al., 1989). 2. Antecedentes El efecto de toxinas las paralizantes y su acumulación en organismos marinos se ha estudiado en muchos casos durante eventos nocivos, causando daños severos en peces, moluscos, crustáceos, e incluso en el humano, en éste último debido generalmente al consumo de productos contaminados (Yasumoto y Murata, 1993; Lehane, 2000; PérezLinares et al., 2008; Pérez-Linares et al., 2009). Los vectores o centinelas por excelencia para la detección de toxinas paralizantes son los moluscos bivalvos (Lehane, 2000, Band et al., 2003). Sin embargo, recientemente se han descrito vectores poco convencionales también capaces de acumular toxinas paralizantes como pulpos, camarones, cangrejos y peces (Montoya et al., 1996; Negri y Llewellyn, 1998; Halstead, 2002; Pérez-Linares et al., 2008 y 2009). La saxitoxina se aisló por primera 8 vez de extracto obtenido intraperitonealmente de la almeja Saxidomus giganteus, los cuales fueron analizados por medio de ensayo en ratón, obteniéndose 10 mg de STX/Kg (Harada, et al., 1983). Durante la década de los 80, Bricelj y colaboradores (1990) estudiaron el comportamiento del mejillón Mytilus edulis en Alaska durante una proliferación de Alexandrium fundyense. Estos autores reportaron que las toxinas paralizantes no tenían efecto en el mejillón, el cual continuaba filtrando y consumiendo dinoflagelados, acumulando las toxinas en sus vísceras, excediendo los 80 g eq. de STX/100 g en menos de una hora. El Pacífico mexicano no ha sido excepción en la presencia de saxitoxina en moluscos; por ejemplo, en la almeja Catarina (Argopecten ventricosus) se reportó una acumulación de 63 g eq.STX/100 g del metabolito tóxico, vinculado a la proliferación microalgal producida por Gymnodinium catenatum en Bahía Concepción (Band-Schmidt et al., 2003). En el 2004 Gárate y colaboradores realizaron una comparación de perfiles tóxicos de dos bivalvos de la Bahía de Mazatlán y Bahía Concepción, los cuales estuvieron en contacto con Gymnodinium catenatum, presentando las concentraciones más altas en Bahía Concepción (298 g eq.STX/100g), mientras que en la Bahía de Mazatlán no superaron los 39.40 g eq.STX/100 g. Además de bivalvos, también se ha reportado acumulación de toxinas paralizantes en otros moluscos. En 1984 Halstead y Schantz encontraron concentraciones de 4000 µg de PSP/kg en gasterópodos (Thais lapillus, Lunatia heros, Turbo spp., Tectus spp., Lambis lambis, Buccinum undatum, Neptunea decemcostata y Colus stimpsoni) después de haberse alimentado con Jania sp. la cual presenta perfiles de PSP (Lehane, 2000). 9 Existen otros vectores de toxinas paralizantes además de los moluscos. Se ha reportado que algunas especies de crustáceos son capaces de acumular dichas toxinas. Oshima y colaboradores en 1984 obtuvieron perfiles de PSP en 10 especies de cangrejos obteniendo en sus resultados la presencia de neosaxitoxina y saxitoxina en sus tejidos. En los crustáceos el hepatopáncreas se considera un órgano blanco de toxinas paralizantes, debido a que se han reportado varios casos de acumulación, de PSP. Arnott en 1998 estudió las vísceras langostas en Australia encontrando que los perfiles PSP (180 g eq.STX/100g) sobrepasaban los límites permisibles y sugiriendo que la obtención de las toxinas se llevó a cabo a través de la cadena trófica. Pérez-Linares y colaboradores (2008 y 2009) mediante un diseño experimental con camarones de cultivo (Litopeneus vannamei) alimentados con G. catenatum y Karenia brevis, demostraron que éstos crustáceos con alto valor comercial, son capaces de acumular toxinas PSP y NSP en el hepatopáncreas y músculo después de estar expuestos 45 días a los dinoflagelados aún en densidades bajas pero en exposiciones crónicas. Aunque existen muchos reportes sobre la acumulación de ficotoxinas en moluscos y otros animales, los trabajos realizados con el zooplancton son muy reducidos, a pesar de la importancia que tienen debido a que son los primeros organismos que interactúan con las PMN y quienes comienzan la probable bioacumulación de toxinas, así como su transporte a través de la red trófica entre organismos pelágicos y bentónicos (Turner, 2006). Existen varias especies de copépodos que se alimentan de fitoplancton tóxico y recientemente se han realizado estudios sobre el efecto adverso inducido por ingerirlos. 10 Uye y Takamatsu en 1990 examinaron la ingestión, mortalidad y tasa de producción de huevos en Pseudodiaptomus marinus y Acartia omorii al retarlos con 15 especies que producían PMN en las costas de Japón, concluyendo que no hubo ningún daño sobre estos organismos. Sin embargo, reportaron un comportamiento alimenticio diferente, regurgitando las células ingeridas después de unos minutos transcurridos. Frangópulos y colaboradores en el 2000 desarrollaron un experimento alimentando al copépodo Acartia clausi con Alexandrum minutum registrando los parámetros de tasa de ingestión, producción de huevos, sucesos de eclosión y la salud naupliar. Los autores reportaron una baja eclosión y desarrollo naupliar atribuido a la acumulación de toxinas paralizantes en los tejidos y huevos ya que se detectaron altas concentraciones de GTX-1-4 (Frangópulos et al., 2000). Por otro lado, la siguiente generación de nauplios alimentados con las microalgas no tóxicas, rechazaron la interacción con el estadio copepodito que fueron eclosionados de copépodos alimentados con dinoflagelados tóxicos, los autores concluyen que posiblemente la interacción con la toxina este afectó o inhibió el estado nutricional de las nuevas eclosiones (Frangópulos et al., 2000). Kozlowsky y colaboradores en el 2009 mencionan que específicamente las toxinas tienden a afectar el estado nutricional de los copépodos y sugieren que el bajo nivel nutricional de las microalgas provoque un déficit en cuanto a moléculas fundamentales para el desarrollo de los organismos, por lo tanto desarrollaron un bioensayo con las especies de Acartia tonsa y Temora longicornis, induciéndolos a consumir Alexandrium minutum y Alexamdrium tamarense, incluyendo la detección de daño en los tejido por medio de ensayo enzimático de glutatión transferasa. Sin embargo, los resultados no fueron los esperados ya que los tratamientos con el control no produjeron evidencia significativa, por lo cual concluyen que 11 tal vez ésta enzima no juegue un rol importante en la desintoxicación de copépodos expuestos a fitoplancton tóxico (Kozlowsky et al., 2009). 3. Justificación En diversas partes del mundo se han publicado trabajos acerca del efecto que producen las ficotoxinas en la dinámica de los consumidores primarios (omnívoros zooplanctónicos) y los demás niveles tróficos (moluscos, crustáceos, peces, aves y mamíferos) (Teegarden, 1999). La forma en la que se contaminan se puede llevar a cabo por diferentes procesos como ingestión directa, bioacumulación en tejidos en organismos depredados, la absorción y adsorción directa al encontrarse disuelta la toxina en el agua, incluso por la defecación de muchos organismos que logran eliminar los productos nocivos por sus procesos naturales (Frangópulos et al., 2000; Lehtiniemi, 2002). Debido al impacto negativo de las ficotoxinas sobre el ambiente y la salud pública a nivel internacional y en específico aquellas que involucran toxinas paralizantes (Barman y Campbell, 2003; Hamasaki et. al, 2003), se ha puesto especial interés a las rutas de transferencia de las toxinas a través de la red trófica y los posibles efectos que producen en un nivel clave en el proceso alimenticio, como es el zooplancton (Turner y Tester 1997). En México existen pocos trabajos relacionados con la transferencia de ficotoxinas en varios niveles tróficos y los daños causados en organismos planctónicos por toxinas paralizantes. Aunado a lo anterior, los reportes publicados sobre problemas específicos de toxinas paralizantes en el litoral mexicano, no cuentan con suficiente información para aclarar el proceso y efecto de estas biotoxinas en organismos zooplanctónicos como Acartia clausi y 12 Pseudodiaptomus euryhalinus, que son especies importantes por su abundancia y principales consumidores del fitoplancton en el Pacífico mexicano (Palomares et al. 2006). 4. Hipótesis El copépodo calanoideo Pseudodiaptomus euryhalinus es capaz de acumular toxinas paralizantes en sus tejidos y no presenta daño celular después de ingerir células del dinoflagelados tóxico Gymnodinium catenatum. 5. Objetivo general Corroborar que no existe acumulación de toxinas paralizantes y evidenciar daño celular debido a la interacción de ficotoxinas con los tejidos de P. euryhalinus después de alimentarlo con el dinoflagelado tóxico G. catenatum 5.1 Objetivos Particulares Establecer cultivos de Pseudodiaptomus euryhalinus bajo condiciones de laboratorio. Cultivar y mantener la cepa GCCV-6 de Gymnodinium catenatum bajo condiciones de laboratorio para la obtención de biomasa. Diseñar un bioensayo para corroborar la depredación de P. euryhalinus sobre G. catenatum. 13 Registrar la densidad celular promedio de G. catenatum ingerida por cada copépodo. Obtener la toxicidad de GCC-6 por bioensayo en ratón (g eq. STX/cél). Obtener la densidad celular mínima de GCCV-6 que necesita consumir cada copépodo para la detección de toxinas PSP de acuerdo al Límite de Detección del método de Lawrence et al., 2004. Diseñar un bioensayo agudo de exposición/alimentación de P. euryhalinus con GCCV-6 para conocer sus efectos. Analizar extractos de P. euryhalinus para determinar si existe daño celular por la ingestión de G. catenatum, midiendo la actividad enzimática de catalasa y lipoperoxidación. Analizar los extractos de P. euryhalinus mediante HPLC-FLD para confirmar la presencia/ausencia de toxinas paralizantes después del bioensayo con G. catenatum. 6. Material y Métodos 6.1 Pseudodiaptomus euryhalinus Los copépodos (Fig. 5) fueron donados por el Dr. J. C. Pérez-Urbiola (Sala Húmeda de Bioensayos, CIBNOR) y fueron colectados en enero de 2006 de los estanques supralitorales del CIBNOR, con la técnica de arrastre utilizando una malla de plancton de 150 m. 14 Figura 5. Micrografía de Pseudodiaptomus euryhalinus (20X2) (Imagen: R. Flores). 6.1.2 Cultivo de Pseud|odiaptomus euryhalinus Los organismos muestreados se mantuvieron durante 15 días en 2 tanques cilíndricos (88 L) de fibra de vidrio y con fondo plano. Para mantenerlos en condiciones óptimas, se hicieron recambios diarios de agua mediante sifoneo para eliminar desechos. Se empleó agua de mar (35±2psu), filtrada (5 m) y con aireación constante en cada tanque (Flores, 2008) La alimentación de los copépodos fue proporcionada por el laboratorio de Microalgas del CIBNOR, suministrando a cada tanque una mezcla de las microalgas Chaetoceros calcitrans e Isochrysis galbana a una densidad aproximada de 3.4x108 cél/L (Fig. 6). Los copépodos fueron alimentados cada 24 horas con la mezcla de microalgas, las raciones con las que se alimentaban a los crustáceos iban en aumento con forme iban cambiando de estadio y a la biomasa orgánica en cada tanque (Flores, 2008). A B Figura 6. A Micrografías de las microalgas Chaetoceros calcitrans (A)(imagen: M. Hoppenrath) e Isochrysis galbana (B) (Imagen: F. Jouenne), con las que se mantuvieron los cultivos de copépodos. Después de 15 días de cultivo los organismos fueron divididos en dos tanques aforados a 500 L, manteniendo las condiciones anteriormente mencionadas. 15 6.1.3 Gymnodinium catenatum La cepa GCCV-6 (Fig. 7) fue adquirida comercialmente de la CODIMAR, CIBNOR, la cual fue aislada de la parte central del Golfo de California, se extrajo de una proliferación microalgal nociva presente en Bahía Concepción, afectando a una gran cantidad de invertebrados marinos. (http://www.cibnor.gob.mx/eplant1.php?pagID=colecciones/codimar/codimar). Figura 7. Micrografía de células de Gymnodinium catenatum (cepa GCCV-6) Imagen: J. Fuentes-Pascacio. 6.1.4 Cultivo de GCCV-6 La cepa GCCV-6 se cultivó en el cepario del CIBNOR, utilizando medio f/2+Se (Guillard y Ryther, 1962; Guillard, 1975). Para prepararlo se empleó agua de mar filtrada (0.45m) con 33 PSU y esterilizada en autoclave (121°C, 15lb, 20’). Los cultivos se mantuvieron en cámaras con lámparas de luz blanca (150 mol m-2 sec-1), con ciclos de luz y oscuridad (12:12 h) y a una temperatura de 26 ± 1 °C. La densidad celular se determinó sustrayendo 1mL del cultivo previamente homogenizado, agregando una gota de Lugol (5% I2 + 10% KI) y cuantificando con la ayuda de una cámara Sedwick-Rafter y un microscopio compuesto. 16 Los cultivos se dividieron en lotes destinados para la alimentación de los copépodos para los bioensayos y para la extracción de toxinas (obtención del perfil de toxinas de GCCV-6). Todos los lotes fueron escalados al alcanzar su fase logarítmica (~20 días posteriores a su inoculación según Band-Schmidt et al., 2005) para disponer de células vivas y suficiente biomasa durante los experimentos. Para cosechar los cultivos primero se homogenizaron varios lotes, midiendo su volúmen total, se tomaron 3 alícuotas (1 mL c/u) para conocer la densidad celular y el resto se centrifugó (6,200xg, 15’, 4°C). El sobrenadante se desechó y la biomasa sedimentada se utilizó para extracción de toxinas paralizantes (PSP) utilizando el método recomendado por la AOAC. 6.1.5 Determinación de toxicidad por célula de GCCV-6 Estudios previos con GCCV-6 han demostrado que produce en promedio 6.06 g eq STX/mL y 58.8 pg eq STX/cél. También se ha reportado que dentro del perfil de toxinas incluye STX, dcSTX, GTX2, 3, NEO y GTX1, 4 (Pérez-Linares, 2008; Pérez-Linares et al., 2008 y 2009). Para estimar la concentración de toxina paralizante por célula fue necesario realizar los cálculos en los lotes previamente cultivados. En la Tabla III se resumen los resultados. Tabla III. Resumen de volúmenes de extractos y densidad celular promedio de cosechas previas de GCCV-6. Volumen de cultivo (L) Volumen de extracto (mL) en HCl [0.1 N] Densidad celular promedio (cél/mL) 5 390 6750 5 410 9940 7 500 5980 17 6.1.6 Prueba de depredación El primer ensayo prospectivo se realizó en una placa NUNC de 24 pozos (Fig. 8), agregando en 12 pozos agua de mar filtrada (0.45m) y una densidad celular de 103 cél. de GCCV-6 en cada uno. Posteriormente se colocaron 20 copépodos en cada pozo. Su comportamiento se observó bajo un microscopio estereoscópico para corroborar la depredación del copépodo sobre el dinoflagelado. . Figura 8. Placa NUNC y ubicación de pozos en la prueba de depredación El segundo ensayo prospectivo se realizó con cinco recipientes (por triplicado) conteniendo agua de mar con las mismas condiciones que las anteriores, copépodos y diferentes densidades celulares de G. catenatum y Chaetoceros calcitrans. La Tabla IV resume los parámetros empleados en del ensayo. Este bioensayo tuvo como objetivo estudiar el comportamiento alimenticio de los copépodos al estar expuestos a G. catenatum, a una mezcla de G. catenatum y C. calcitrans y estimar la mortandad de G. catenatum y P. 18 euryhalinus juntos y separados. La Tabla IV muestra el resumen de las características desarrolladas en el ensayo. Tabla IV. Ensayo prospectivo de P. euryhalinus vs. G. catenatum No. de Lote P. euryhalinus G. catenatum C. calcitrans 1 90 1x104 cél - 2 90 5x104 cél - 3 90 1x104 cél 6.7x106 cél 4 90 - 6.7x106 cél 5 0 5x104 cél - 6.1.7 Diseño del bioensayos agudo de P. euryhalinus vs. GCCV-6 Para el bioensayos agudo se utilizaron adultos de P. euryhalinus con un promedio de 1x104 organismos por lote. Los copépodos se agruparon en 18 matraces de 2 L (utilizando la ½ de su capacidad) a una densidad de 10 copépodos/mL. Los organismos se mantuvieron en ayuno por 5 h. Los lotes experimentales se mantuvieron con un sistema de aireación mediante dos bombas y a una temperatura de 26 ±1°C (clima artificial automatizado), en agua de mar filtrada y con 35 UPS. Al inicio del ensayo los copépodos se alimentaron con diferentes densidades celulares de GCCV-6: 1x103 cél /mL, 2x103 cél/mL y una combinación de GCCV-6 (2x103 cél/mL) y 1.2x108 células de Chaetoceros calcitrans. Lo anterior se realizó con el objeto de producir una exposición directa, simulando una proliferación microalgal, la cual se considera desde densidades >1800 cél/L (Lehane, 2000; Band-Schmidt et al., 2003). Además se 19 consideraron lotes control con la misma densidad celular de copépodos, bajo las mismas condiciones, pero alimentándolos con de C. calcitrans (1.2 x108 cél) sin la presencia de GCCV-6. El lote control de GCCV-6 se estableció en las mismas condiciones que los anteriores pero sin depredadores, para conocer el porcentaje de mortalidad de las células bajo estas condiciones y poder estimar la cantidad real consumida por los copépodos. Todos los lotes se realizaron por triplicado y con una sola dosis diaria de dinoflagelados durante tres días. A lo largo del experimento se registró el comportamiento y los daños aparentes en los copépodos. Una vez finalizado el bioensayo, los organismos se sacrificaron y se mantuvieron a -20°C hasta su procesamiento para los análisis químicos. La figura 9 representa el diagrama de flujo del ensayo agudo 6.1.8 Bioensayo de ingestión Para poder estimar la cantidad de células de GCC-6 y C. calcitrans ingeridas por los copépodos, durante el bioensayo se realizaron conteos celulares periódicos. Se tomó 1 mL de agua la columna de cada uno de los matraces 5 horas después de agregar las dosis de G. catenatum, posteriormente se tomaron muestras cada hora por 5 h y todas se fijaron con lugol [10%]. Los controles fueron procesados de la misma forma para estimar el porcentaje de mortalidad de las microalgas por separado. 20 Figura 9. Diagrama de flujo del diseño experimental del bioensayo agudo de Pseudodiaptomus euryhalinus a diferentes densidades celulares de Gymnodinium catenatum (cepa GCCV-6). 6.2 Daño Oxidativo 6.2.1 Peroxidación de lípidos (TBARS) Para conocer el grado de daño celular que presentaron los organismos al estar expuestos a las microalgas tóxicas se empleó la prueba de peroxidación de lípidos, la cual se estimó cuantificando el contenido de sustancias reactivas al ácido tiobarbitúrico presente en el tejido de los copépodos (Okhawa et al., 1979; Persky et al. 2000). Se homogenizaron 100mg de tejido en 2 mL de solución salina fría (450 mM NaCl, 10 mM KCl, 1 mM PMSF) y se centrifugaron (2000xg, 10’, 4°C). Se tomaron 250L del sobrenadante y se colocaron en tubos de 1.5 mL para posteriormente incubarse por 15’ en un baño de agua 21 con agitación constante a 37°C. Transcurrido el tiempo de incubación las muestras se colocan en un baño de agua fría (4°C) y se les adicionaron 250 L de ácido tricloroacético (TCA) al 12.5% en HCl y 500 L de ácido tiobarbitúrico (TBA) al 1%. Los tubos fueron puestos nuevamente a incubar en un baño de agua durante 10’ y centrifugados nuevamente bajo las condiciones antes mencionadas. El sobrenadante fue traspasado a celdas de cuarzo (1 mL) para poder cuantificar en un espectrofotómetro a una = 532nm. Los resultados se calcularon a partir de una curva estándar de malondialdehido bis-(dietilacetal) y se expresaron en nanomoles de TBARS/g de tejido húmedo. 6.2.2 Catalasa Además de la prueba de peroxidación de lípidos, se realizaron ensayos para medir la actividad enzimática de la catalasa y estimar la pérdida de H2O2 en los tejidos de los organismos y estimar el estrés oxidativo manifestado por los organismos expuestos a G. catenatum. Para esto se mezcló la solución de trabajo (PBS 100mM, H2O2 10mM) y 10 L de muestra (homogenizado de copépodos) en una celda de cuarzo (1 mL) y se cuantificó la absorbancia con un espectrofotómetro a una = 240 nm. La actividad enzimática se expresó en unidades de catalasa por mg de proteína. Una unidad de catalasa se define como la cantidad de enzima necesaria para reducir 1 mol de H2O2 por minuto (Aebi, 1984). 22 6.3 Cromatografía Líquida de Alta Eficacia con detección de fluorescencia (HPLCFLD) 6.3.1 Extracción y análisis de toxinas paralizantes (PSP) El análisis de toxinas paralizantes (PSP) se llevó a cabo utilizando el método oficial propuesto por la AOAC (AOAC, 1997; Lawrence et al., 2004). Brevemente, se causó lisis celular de los tejidos de copépodos mediante congelamiento y descongelamiento y por medio de un homogenizador o polytrón. Se tomaron 1.5g de muestra, se agregó 1 mL de HCl [0.1N] para obtener un mejor homogenizado y comenzar la extracción de toxinas paralizantes. Posteriormente las muestras se calentaron hasta ebullición y de mantuvieron por 5 min retirando inmediatamente después. Al enfriarse las muestras se aforaron nuevamente a 1 mL con HCl [0.1N] para recuperar el volumen inicial y se filtraron con un filtro Whatman© No. 1 y dos veces con membranas de nitrocelulosa (0.45m) hasta obtener un extracto claro y desechar remanentes de células. Todo este proceso se realizó en una campana de flujo laminar, con ayuda de una bomba de vacío y una unidad de filtración de 250 mL. Como medida de seguridad todos los materiales utilizados y los desechos obtenidos del cultivo/cosecha de GCCV-6 y extracción de PSP fueron tratados con NaOH [0.2 N] por 15 min para matar células vivas y destruir trazas de toxinas antes de vertirse al drenaje (Wannemacher, 1989; Jeong et al., 2002). Para detectar los componentes tóxicos de los extractos por medio de HPLC-FLD, fue necesario oxidarlos en purinas antes de inyectarse, como señala el protocolo propuesto por Lawrence et al. (2004). Todas las muestras antes de oxidarlas se purificaron con cartuchos de extracción en fase sólida (SPE-C18 SUPELCO®, VisiprepTM), utilizando una cámara de 23 vacío (Supelco, Visiprep) para eliminar posibles compuestos con fluorescencia natural. Posteriormente las muestras se oxidaron con H2O2 [10%] provocando una oxidación alcalina en las toxinas paralizantes y originando compuestos fluorescentes (detección de toxinas H-hidroxiladas). Para el caso de toxinas N-hidroxiladas (GTX 1,4, Neo, B2, C3, 4) la reacción se realizó utilizando ácido periódico [HIO4] en medio alcalino. Para corroborar las toxinas paralizantes presentes en el extracto de GCCV-6y en los tejidos de los copépodos se utilizaron estándares certificados (National Reserch Council, Halifax, Canadá) que fueron proporcionados por el Laboratorio de Química Analítica y Alimentaria de la Universidad de Vigo, donde se llevaron a cabo los análisis cromatográficos. El equipo utilizado y las características del protocolo fueron las siguientes: Sistema HPLC-FLD con bomba cuaternaria (Agilent modelo 1200 Series), equipado con el programa Chemstation para el análisis e integración de datos. El detector de florescencia se programó a una λ=330 nm de excitación y una λ=390 nm de emisión. Para la separación de los analitos se empleó una columna C18 (5 m, 4.6x250 mm, Phenomenex Luna) y una elución en gradiente con un flujo de 1.5 mL/min de las siguientes fases móviles A: formiato de amonio [0.1] en agua MilliQ y B: formiato de amonio [0.1M] en 4% de acetonitrilo acuoso, ambas con un pH 6.0. En la Tabla V se resume el programa utilizado para el análisis de PSP mediante HPLCFLD. 24 Tabla V. Programación para el análisis de detección de toxinas paralizantes mediante oxidación pre-columna y HPLC-FLD (Lawrence et al., 2004) Minutos Fase A Fase B 0-6 100-95% 0-5% 6-10 95-30% 5-70% 10-14 30-100% 70-0% 14-18 100% 0% 6.4 Análisis Estadísticos Los resultados se presentan como media ± desviación estándar. Con los datos se realizaron los estadísticos descriptivos y las pruebas de normalidad correspondientes (KolmogorovSmirnov & Lilliefors) y de homocedasticidad (Cochran, Hartley, Batlett). Para detectar diferencias significativas entre las horas de muestreo por cada día de cada tratamiento, utilizando una ANOVA de una vía; también se realizo una ANOVA de una vía para mostrar diferencias significativas entre tratamientos A, B y C vs control (- -) en las pruebas de ensayo enzimático y daño oxidativo. Para todos los casos se consideró el 95% como nivel de confianza y α<0.05 como tendencia no significativa. Todos los análisis estadísticos se llevaron a cabo usando el paquete Statistica© 7.0 (StatSoft, Inc. 1984-2004). 25 7 Resultados 7.1 Ingestión de G. catenatum por P. euryhalinus: ensayo agudo Se observó diferencia significativa (p<0.05) en la ingesta promedio de dinoflagelados por Pseudodiaptomus euryhalinus, consumiendo entre el 40% y el 50% del total de Gymnodinium catenatum después de transcurridas 5 horas (ver Tablas VI, VII y VIII), después de exponerlos a densidades de 1X106 células (tratamiento A: Figuras 10, 11 y 12), 2X106 células (tratamiento B: Figuras 13, 14 y 15) y 2X106 células mezcladas con Chaetoceros calcitrans (tratamiento C: Figuras 16, 17 y 18). Este comportamiento siguió el mismo patrón en los tres días del experimento. Después de la tercer hora de haber realizado el primer conteo en los tratamientos A, B y C (6 y 7 horas después de haberle agregado G. catenatum), se presenta una disminución drástica entre <8% a 0% de pastoreo por parte de P. euryhalinus durante los tres días de experimento. Lo anterior coincidió con el nivel de flotabilidad del copépodo, pues la mayoría comenzaron a mostrar signos de aletargamiento, sedimentándose en el fondo del matraz. Este comportamiento fue contrastante con las primeras horas después de agregar los dinoflagelados, ya que todos los crustáceos se observaron en la parte superior de la columna de agua desplegando gran actividad depredatoria. Después de haber transcurrido 4 horas, la tasa de ingestión se incrementó, observándose entre <70% a 3% de células promedio ingeridas por los copépodos. Asimismo, el comportamiento de los organismos también se modificó, presentándo intensa actividad en la columna de agua. Finalmente, posterior a las 5 horas, el consumo de células en los tres tratamiento fue diferente entre ellos (desde <18% hasta un 0% de células promedio 26 consumidas), registrándose nuevamente una disminución en la dinámica de P. euryhalinus dentro de los acuarios. a) b) 27 c) Figura 10. Tratamiento A: ensayo de exposición aguda de P. euryhalinus con una densidad de 103 cél/mL de G. catenatum. a) Primer día del ensayo; b) Segundo día de exposición; c) Tercer día de exposición. Se observa que el segundo día los copépodos tuvieron la mayor actividad de pastoreo sobre los dinoflagelados. Tabla VI. Estimación del porcentaje promedio de células de G. catenatum ingeridas por P. euryhalinus en el tratamiento A del ensayo agudo. Horas de muestreo 1er. Día 2do. Día 3er. Día 1 2 3 4 442 5 3 24 710 7 20 14 369 24 8 4 5 19 0 83 Datos en rojo: diferencia significativa (p<0.05) entre las 5 horas de muestreo Segundo Tratamiento a) 28 b) c) Figura 11. Tratamiento B: ensayo de exposición aguda de P. euryhalinus con una densidad de 2x103 cél/mL de G. catenatum. a) Primer día del ensayo; b) Segundo día de exposición; c) Tercer día de exposición. Se observa la misma ingestión despues de la primera hora de agregar a los dinoflagelados, pero el segundo dia hubo mucho mayor consumo que el primer y tercer día. Tabla VII. Estimación del porcentaje promedio de células de G. catenatum ingeridas por P. euryhalinus en el tratamiento B del ensayo agudo. Horas de muestreo 1 2 3 4 5 717 127 1er. Día 3 38 45 1638 2do. Dia 9 13 29 27 1127 3er. Día 38 33 23 35 Datos en rojo: diferencia significativa (p<0.05) entre las 5 horas de muestreo 29 Tercer tratamiento a) b) 30 c) Figura 12. Tratamiento C ensayo de exposición aguda de P. euryhalinus con una densidad de 2x103 cél/mL de G. catenatum + P. euryhalinus. a) Primer día del ensayo; b) Segundo día de exposición; c) Tercer día de exposición. Se observa la misma ingestión despues de la primera hora de agregar a los dinoflagelados, pero el segundo dia hubo mucho mayor consumo que el primer y tercer día. Tabla VIII. Estimación del porcentaje promedio de células de G. catenatum ingeridas por P. euryhalinus en el tratamiento C del ensayo agudo. Horas de muestreo 1 2 3 4 5 787 1er. Día 0 3 15 61 1512 2do. Dia 0 25 29 5 1394 15 35 3er. Día 9 67 Datos en rojo: diferencia significativa (p<0.05) entre las 5 horas de muestreo Se comparó el porcentaje promedio de células de microalgas que ingirieron los copépodos entre los tratamientos y durante cada día del ensayo agudo (Fig. 13). Se observó que no hubo diferencia significativa (p>0.05) en el consumo de dinoflagelados entre los tres días dentro de cada tratamiento. Sin embargo, al comparar los resultados entre los diferentes lotes se observó en diferencia significativa (p<0.05) en los tratamientos B y C con respecto al tratamiento A, donde su tasa de alimentación es mayor. 31 Figura 13. Consumo promedio de células ingeridas por copépdodo en cada día del ensayo agudo y cada tratamiento.. A = 1x103 cél /mL de G. catenatum, B =2x103 cél /mL de G. catenatum, C = 2x103 cél /mL de G. catenatum + Chaetoceros calcitrans. Encontrando diferencia significativa (p<0.05) entre B y C, con respecto a A, pero comparando los 3 días dentro de cada tratamiento no hubo tal diferencia. 32 7.2 Daño Oxidativo 7.2.1 Peroxidación de lípidos Después de analizar los datos obtenidos en el ensayo de la peroxidación de lípidos con la prueba ANOVA (de dos vías y 95% de confianza) se observó que no hay diferencia significativa (p<0.05) entre los grupos control y los expuestos a G. catenatum. Estos resultados son consistentes con los obtenidos en el ensayo de la actividad de la catalasa, sugiriendo que no hay daño o alteración los procesos enzimáticos en los tejidos de P. euryhalinus expuestos a los dinoflagelados tóxicos. En la Figura 14 se puede observar que el grupo que contenía al copépodo alimentado sólo con Chaetoceros calcitrans (tratamiento D) no se observó la producción de metabolitos secundarios tóxicos, y por consiguiente no hubo diferencia en su actividad TBARS con respecto a los expuestos a G. catenatum. TBARS (nmol/g de tejido humedo) Ensay o tisular para identif car la peroxidación de lípidos 2.6 2.4 2.2 2.0 1.8 1.6 1.4 1.2 1.0 0.8 0.6 0.4 0.2 0.0 -0.2 a b c d Mean Mean±SD Outliers Extremes Tratamiento Figura 14. Daño oxidativo de P. euryhalinus en respuesta a los tratamientos con diferentes densidades de microalgas. Los valores se presentan como promedio ± desviación estándar. A = 1x10 3 cél /mL de G. catenatum, B =2x103 cél /mL de G. catenatum, C = 2x103 cél /mL de G. catenatum + Chaetoceros calcitrans, D = C. calcitrans 33 7.2.2 Catalasa Los resultados obtenidos en el ensayo de la actividad enzimática de la catalasa en tejidos de copépodos expuestos a dinoflagelados tóxicos se analizaron con la prueba ANOVA (de dos vías y 95% de confianza), observándose que no hubo diferencias significativas comparándolos con los controles, ni entre los tratamientos. Lo anterior nos lleva a la conclusión de que los copépodos no presentan alteraciones en la actividad de la catalasa al estar expuestos al dinoflagelado tóxico Gymnodinium catenatum y por consiguiente se puede inferir que no existe estrés oxidativo bajo estas condiciones. Analisis tisular para la catalasa 260 240 220 200 180 160 140 120 CAT (U/mg de proteína) 100 80 60 a b c d Mean Mean±SD Outliers Extremes Tratamientos Figura 15. Actividad enzimática de P. euryhalinus en respuesta a los tratamientos con diferentes densidades de microalgas. Los valores se presentan como promedio ± desviación estándar. A = 1x103 cél /mL de G. catenatum, B =2x103 cél /mL de G. catenatum, C = 2x103 cél /mL de G. catenatum + Chaetoceros calcitrans, D = C. calcitrans 7.3 Determinación de toxinas paralizantes mediante oxidación pre-columna y análisis por HPLC-FLD Se pudo observar que las muestras (extractos de GCCV-6 y tejidos de copépodos) contenían compuestos con fluorescencia natural al inyectarlas antes de purificarlas con los cartuchos SPE-C18 y previos a la oxidación. Esto es importante porque varios de éstos 34 compuestos presentan los mismos tiempos de retención que algunas de las toxinas paralizantes, traslapando las señales. Lo anterior puede llevar a una sobreestimación de los resultados. Por esta razón, el paso de ―clean-up‖ fue decisivo para la obtención de resultados fiables. Al oxidar el extracto de GCCV-6 con H2O2 se pudo determinar que la cepa produce dcSTX, GTX2, 3 y STX (Fig. 16); y con la oxidación con ácido periódico (HIO4) se identificaron las toxinas NEO y GTX 1,4 (Fig. 17). Estos resultados son consistentes con trabajos realizados previamente con esta cepa y utilizando el mismo método (Pérez-Linares, 2008; Pérez Linares et al., 2008 y 2009). Para corroborar el perfil de toxinas que produce GCCV6 se utilizaron mezclas de patrones certificados (NRC, Halifax, Canadá) proporcionados por el Laboratorio de Química Analítica y Alimentaria de la Universidad de Vigo (España). FLD1 A, Ex=330, Em=390(PSP_MX2\09031300.D) LU FLD1 A, Ex=330, Em=390(PSP_MX2\09031301.D) dcSTX 9.726 GTX 2, 3 11.457 STX 14.325 30 9.760 25 20 B1 11.415 13.142 15 * 10 10.415 5 0 0 2 4 6 8 10 12 14.2 30 14 16 min Figura 16. Cromatograma del extracto de Gymnodinium catenatum (cepa GCCV-6) oxidado con H2O2 [10%]. Se observa la presencia de dcSTX, GTX 2-3 y STX [flechas] producidas por el dinoflagelado (línea azul), corroborándolo con la mezcla de estándares: dcSTX, GTX 2-3, B1, STX (línea roja). * Producto de oxidación secundaria de dcSTX (Cada cromatograma en escala diferente debido a que la señal del extracto de GCCV-6 era mayor y ocultaba la señal de los estándares). 35 FLD1 A, Ex=330, Em=390 (PSP_MX2\09030907.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09030910.D) * LU 12.054 18 16 14 12 10 8 11.877 NEO 6 GTX 1,4 11.042 11.190 6.814 4 6.596 10.606 5.833 8.392 2 0 2 4 6 8 10 12 14 16 min Figura 17. Cromatograma del extracto de Gymnodinium catenatum (cepa GCCV-6) oxidado con HIO4 [0.03 M]. Se observa la presencia de GTX 1,4 y NEO [flechas] producidas por el dinoflagelado (línea azul), corroborándolo con la mezcla de estándares: GTX 1,4 y NEO (línea roja). * Producto de oxidación secundaria de GTX 1, 4. (Cada cromatograma en escala diferente debido a que la señal del extracto de GCCV-6 era mayor y ocultaba la señal de los estándares). Se compararon extracciones de la misma cepa (GCCV-6) realizadas en 2006 (PérezLinares, 2008) para verificar si existía algún cambio en el perfil de toxinas producido por el dinoflagelado cultivado bajo condiciones de laboratorio en los últimos tres años. Se comprobó que el perfil seguía siendo el mismo, detectándose dcSTX, GTX 2, 3, STX con la oxidación con H2O2 [10%] y NEO y GTX 1,4 con la oxidación con HIO4 [0.03 M]. Con respecto a la detección de toxinas paralizantes en tejidos de copépodos expuestos a células de G. catenatum se observó que los crustáceos fueron capaces de retener toxinas PSP. La dcSTX se detectó en los tejidos de los organismos de los tres tratamientos estudiados, pero la GTX 2, 3 y la STX solo se pudieron detectar en 2 tratamientos. Los copépodos del tratamiento A retuvieron todas las toxinas que produce GCCV-6 (Fig. 18 y 36 22). En las muestras de copépodos del tratamiento B sólo se detectaron la dcSTX, la GTX 2,3 y la NEO (Figs. 19 y 23). Los organismos del tratamiento C retuvieron dcSTX, STX y NEO (Figs. 20 y 24). En los controles (- -) no se detectaron toxinas paralizantes (Figs. 21 y 25). En la tabla IX se muestra un resumen de las toxinas presentes y ausentes durante el experimento, todos los tratamientos (A, B, C) se comparan con la cepa de GCCV-6 (control -) y con Pseudodiaptomus euryhalinus alimentado con una microalga no toxica (Control - ). Se distingue que la única toxina que se detectó en los tejidos de copépodos de los tres tratamientos fue dcSTX. FLD1 A, Ex=330, Em=390 (PSP_MX2\09031002.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031000.D) dcSTX LU 9.917 2.2 2 1.8 1.6 GTX 2,3 11.561 1.4 9.951 STX *10.586 14.350 B1 11.570 13.213 1.2 14.447 10.597 1 0 2 4 6 8 10 12 14 16 min Figura 18. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de G. catenatum [106 cél] (tratamiento A). Se pueden observar las toxinas dcSTX, GTX 2-3 y STX [flechas] retenidas por los copépodos (línea azul). La línea roja representa las señales de la mezcla de estándares: dcSTX, GTX 2-3, B1, STX. (*Producto de oxidación secundaria de dcSTX). Oxidación con H 2O2 [10%]. Ambos cromatogramas a la misma escala. 37 FLD1 A, Ex=330, Em=390 (PSP_MX2\09031007.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031006.D) dcSTX LU 9.847 2 1.8 1.6 GTX 2,3 1.4 11.496 9.851 STX 14.316 * 10.526 B1 1.2 13.170 11.483 0 2 4 6 8 10 12 14 16 min Figura 19. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de G. catenatum [2x106 cél] (tratamiento B). Se pueden observar las toxinas dcSTX y GTX 2-3 [flechas] retenidas por los copépodos (línea azul). La línea roja representa las señales de la mezcla de estándares: dcSTX, GTX 2-3, B1, STX. (*Producto de oxidación secundaria de dcSTX). Oxidación con H 2O2 [10%]. Ambos cromatogramas a la misma escala. FLD1 A, Ex=330, Em=390 (PSP_MX2\09031012.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031011.D) dcSTX LU 9.630 2 1.8 1.6 * 10.346 1.4 GTX 2,3 9.626 11.301 STX 14.026 B1 1.2 12.943 0 2 4 6 8 10 12 14.018 14 16 min Figura 20. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de G. catenatum [2x106 cél] + C. calcitrans [1.2x108 cél] (tratamiento C). Se pueden observar las toxinas dcSTX y STX [flechas] retenidas por los copépodos (línea azul). La línea roja representa las señales de la mezcla de estándares: dcSTX, GTX 2-3, B1, STX. (*Producto de oxidación secundaria de dcSTX). Oxidación con H 2O2 [10%]. Ambos cromatogramas a la misma escala. 38 FLD1 A, Ex=330, Em=390 (PSP_MX2\09031016.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031011.D) * LU 10.346 1.4 dcSTX 1.35 9.626 GTX 2,3 11.301 1.3 STX 14.026 1.25 1.2 B1 12.943 1.15 1.1 0 2 4 6 8 10 12 14 16 min Figura 21. Cromatogramas de extractos de P. euryhalinus expuestos sólo a C. calcitrans [1.2x108 cél] en el tratamiento Control (-) (-). No se detectaron toxinas paralizantes ni compuestos con fluorescencia natural (línea azul). La línea roja representa las señales de la mezcla de estándares: dcSTX, GTX 2-3, B1, STX. (*Producto de oxidación secundaria de dcSTX). Oxidación con H2O2 [10%]. Ambos cromatogramas a la misma escala. FLD1 A, Ex=330, Em=390 (PSP_MX2\09030913.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09030912.D) LU 2 1.8 1.6 1.4 NEO 11.346 *12.246 GTX 1,4 1.2 7.049 1 0 2 4 6 8 10 12 14 16 min Figura 22. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de G. catenatum [1x106 cél] (tratamiento A). Se pueden observar las toxinas GTX1, 4 y NEO [flechas] retenidas por los copépodos (línea azul). La línea roja representa las señales de la mezcla de estándares: GTX 1,4 y NEO. (*Producto de oxidación secundaria de GTX1, 4). Oxidación con HIO4 [0.03 M]. Ambos cromatogramas a la misma escala. 39 FLD1 A, Ex=330, Em=390 (PSP_MX2\09031102.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031103.D) * LU 11.308 1.26 1.24 NEO 1.22 10.319 1.2 1.18 10.290 1.16 GTX 1,4 5.789 1.14 1.12 1.1 1.08 0 2 4 6 8 10 12 14 16 min Figura 23. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de G. catenatum [2x106 cél] (tratamiento B). Se puede observar la toxina NEO [flecha] retenidas por los copépodos (línea azul). La línea roja representa las señales de la mezcla de estándares: GTX 1,4 y NEO. (*Producto de oxidación secundaria de GTX1, 4). Oxidación con HIO4 [0.03 M]. Ambos cromatogramas a la misma escala. FLD1 A, Ex=330, Em=390 (PSP_MX2\09031107.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031108.D) * LU 1.28 11.195 1.26 1.24 NEO 10.229 1.22 1.2 1.18 10.125 GTX 1,4 5.724 1.16 1.14 1.12 1.1 0 2 4 6 8 10 12 14 16 min Figura 24. Cromatogramas de extractos de P. euryhalinus expuestos a cultivos de G. catenatum [2x106 cél] + C. calcitrans [1.2x108 cél] (tratamiento C). Se puede observar la toxina NEO [flecha] retenidas por los copépodos (línea azul). La línea roja representa las señales de la mezcla de estándares: GTX 1,4 y NEO. (*Producto de oxidación secundaria de GTX1, 4). Oxidación con HIO 4 [0.03 M]. Ambos cromatogramas a la misma escala. 40 FLD1 A, Ex=330, Em=390 (PSP_MX2\09031112.D) FLD1 A, Ex=330, Em=390 (PSP_MX2\09031113.D) * LU 1.28 11.239 1.26 1.24 NEO 10.250 1.22 1.2 GTX 1,4 1.18 5.666 1.16 1.14 1.12 0 2 4 6 8 10 12 14 16 min Figura 25. Cromatogramas de extractos de P. euryhalinus expuestos sólo a C. calcitrans [1.2x108 cél] en el tratamiento control (-) (-) (-). No se detectaron toxinas paralizantes ni compuestos con fluorescencia natural (línea azul). La línea roja representa las señales de la mezcla de estándares: dcSTX, GTX 2-3, B1, STX. (*Producto de oxidación secundaria de GTX1, 4). Oxidación con HIO 4 [0.03 M]. Ambos cromatogramas a la misma escala. 41 Tabla IX. Comparación de toxinas paralizantes ausentes (-) y presentes (*) en los cromatogramas integrados por el HPLC-FLD. Tratamientos\ dcSTX GTX2,3 B1 STX GTX1,4 NEO * * - * * * * * - * * * * * - - - * * - - * - * - - - - - - Toxinas Cepa GCCV-6 A: Gymnodinium catenatum 1X103 cél/litro B: Gymnodinium catenatum 2X103 cél/litro C: Gymnodinium catenatum 2X103 cél/litro + Chaetoceros calcitrans Control(-) Pseudodiaptomus euryhalinus 42 8. Discusión 8.1 Ingestión de Gymnodinium catenatum por Pseudodiaptomus euryhalinus Muchas investigaciones relacionadas con la interacción de toxinas producidas por proliferaciones micoalgales nocivas sugieren que la presión por medio de la ingestión que ejerce el zooplancton puede moderar los ―blooms‖ (Turner y Anderson, 1983; Watras et al., 1985; Uye, 1986). Sin embargo, otros investigadores reportan que al presentarse una PMN existe un decremento en la alimentación de crustáceos causado por la producción de metabolitos secundarios de las microalgas responsables de las mareas rojas, disminuyendo la presión depredatoria y siendo un factor muy importante para el crecimiento exponencial de las microalgas (Fiedler, 1982; Huntley, 1982; Uye and Takamatsu, 1990). En este estudio se llevaron a cabo bioensayos en laboratorio tratando de simular las densidades celulares promedio en una marea roja monoespecífica de Gymnodinium catenatum. Al poner en contacto a los copépodos (P. euryhalinus) con el dinoflagelado, su comportamiento fue depredatorio inmediatamente, debido a que los organismos se encontraban en ayuno (Figs. 10, 11 y 12). Esta tasa alta de consumo se presentó debido a los reflejos naturales para alimentarse que tienen los calanoideos, paralelo a que la cantidad de luz presente fue un factor importante para la depredación, ya que en la oscuridad se reduce esta actividad. Este fenómeno ha sido reportado anteriormente para Acartia tonsa donde los crustáceos fueron alimentados con cultivos de Thalassiosira Weissflogii y posteriormente se midió por medio de la pigmentos de clorofila la cantidad consumida en intervalos de 1 hora durante las 24 horas, reportando gran actividad de alimentación después de agregarle los cultivos de T. weissflogii, durante la primeras horas del día, 43 mientras que en la noche se mantuvo uniforme el consumo pero en menor cantidad que en presencia de luz (Durbin et al., 1990). En este trabajo, después de 6 horas de iniciado el ensayo se observó una disminución en la tasa de ingestión (Figs. 10, 11 y 12). Teegarden y Cembella (1996) reportaron que Acartia tonsa disminuye su tasa de ingestión entre 7 y 9 horas después de estar expuesto a varias especies del dinoglagelado del género Alexandrium. Sugieren que las toxinas paralizantes que produce Alexandrium spp. Lo incapacita en su actividad depredadora durante un período. Esto se pudo observar también en el experimento con P. euryhalinus, ya que después de ingerir células de G. catenatum se registró una disminución de su ingestión, pero después de algunas horas los copépodos recuperaron sus capacidades de depredación. Estos resultados sugieren que el comportamiento de P. euryhalinus no difiere de otros copépodos calanoideos reportados en otros trabajos. A pesar de que la ingestión de células del dinoflagelado tóxico fue inducida en gran medida por el ayuno, existen otros factores que influyeron para que P. euryhalinus se alimentara con una especie de microalga tóxica. Este organismo es altamente selectivo cuando la comida es abundante y variada, pero cuando el alimento es escaso su instinto por sobrevivir y alimentarse lo conduce a no discriminar entre el alimento disponible (Price, 1983; Price y Paffenhöfer, 1986; Osorio, 1998). Por otro lado, se observó una disminución en el consumo de células de G. catenatum después de 24 h del experimento. Esto pudo haberse llevado a cabo por el aletargamiento que experimentaron los organismos, pero también pudo contribuír la capacidad químicasensorial que tiene el zooplancton gracias a los apéndices bucales (setas) especializados con los que cuentan (Huntley et al., 1986; Sykes y Huntley, 1987; Teegarden y Cembella, 44 1996). Boyd en 1976 propuso que la filtración y selectividad del zooplancton se realiza con la segunda maxila, generando un proceso de reconocimiento y discriminación del alimento apto/no apto entre setas y enditas. Teegarden en 1999 observó que el mecanismo de ingerir dinoflagelados tóxicos productores de PSP, por lo que los organismos llegan a presentar consecuencias iniciales como peristalsis reversible (regurgitación), pérdida de capacidad motora, parálisis progresiva, así como disminución de reproducción (Haney et al. 1995; Huntley et al. 1986; Sykes y Huntley, 1987). Esto último es consistente con el comportamiento que observó P. euryhalinus al ingerir G. catenatum. Uye y Takamatsu (1990) y Sykes (1991) demuestran que los copépodos aprenden a reconocer sus alimentos por medio de ―ensayo y error‖ (ingestión y consecuencia) para eventualmente distinguir el alimento peligroso del que no lo es. Debido a esta capacidad que tienen muchos organismos del zooplancton, el consumo de G. catenatum muy probablemente fue disminuyendo a medida que los organismos presentaban efectos nocivos, llegando a manifestar un comportamiento alimenticio evasivo en las últimas horas de cada día del experimento. Lo anterior se evidenció cuando se alteró la flotabilidad de los copépodos y presentaron movimientos natatorios irregulares. Este comportamiento anómalo ha sido utilizado previamente como indicador de intoxicación en organismos marinos (Calow, 1993; PérezLinares et al., 2008 y 2009). 8.2 Daño celular (estrés oxidativo) Debido a las anomalías experimentadas por los copépodos en su comportamiento, así como la retención de toxinas paralizantes en sus tejidos (Figs. 20-22 y 24-26, Tabla IX) después haberlos expuesto a los dinoflagelados tóxicos, se esperaba una cambio en las líneas defensivas mediante la actividad de enzimas metabólicas: por un lado la peroxidación de 45 lípidos en las membranas de las células excitables, al manifestarse un problema estructural; y por otro lado un decremento en la actividad de catalasa y de la producción de H2O2, debido a que el zooplancton presentaba aletargamiento al consumir dinoflagelados con toxinas, provocando un impedimento para el consumo de oxígeno. Sin embargo, no hubo diferencias significativas en la actividad enzimática de tejidos de copépodos expuestos a G. catenatum comparado con los controles (Figs. 14 y 15). Kozlowsky-Suzuki y colaboradores (2009) mencionan que los procesos de oxido-reducción son mecanismos que controlan la acumulación de toxinas en muchos organismos marinos. Ellos estudiaron la formación de conjugados con microcistinas, que representó el primer paso para la desintoxicación por consumo de cianobacterias tóxicas en copépodos. Sin embargo, en estudios con toxinas PSP en copépodos expuestos a Alexandrium minitum, no encontraron relación de la Glutation S-Transferasa (GST) con esta vía de detoxificación, la cual se ha reportado previamente en procesos de oxidación, haciendo más solubles los compuestos tóxicos en la célula y excretándolos de manera más rápida. Kankaanpää y colaboradores en el 2007 observaron que no había cambios en las actividades oxidativas de la GST en el bivalvo Mytilus edulis al estar expuestos a extractos de cianobacterias tóxicas, sugiriendo que ésta enzima no está implicada en la destoxificación. La explicación de la ausencia de diferencia significativa en la actividad enzimática entre los copépodos expuestos a G. catenatum y los controles puede estar relacionada a que la actividad de la lipoperoxidasa y de la catalasa no están vinculadas directamente en la detoxificación y estrés oxidativo causados por ficotoxinas en estos organismos, a pesar de haber acumulado toxinas paralizantes en sus tejidos (Figs. 18-20 y 22-24 ). 46 8.3 Detección de toxinas paralizantes mediante HPLC-FLD Los resultados obtenidos en el análisis por HPLC-FLD de extractos de copépodos expuestos a G. catenatum corroboraron que éstos organismos son capaces de retener toxinas paralizantes bajo exposiciones agudas. La Tabla IX muestra que se detectaron todas las toxinas PSP que produce GCCV-6 (Figs. 16 y 17). Estos resultados son consistentes con los trabajos realizados por Dutz (1998) y Frangópulos y colaboradores (2000), quienes estudiaron a los copépodos Acartia clausi y Acartia Tonsa, respectivamente, y reportaron la bioacumulación de toxinas GTX (1-4) producidas por Alexandrium minutum al que fueron expuestos. En este trabajo se comprobó la presencia de toxinas paralizantes acumuladas en tejidos de copépodos, pero también se pudo observar que en cada tratamiento la relación de toxinas detectadas fue diferente (Tabla IX). La STX no se detectó en el tratamiento B, la GTX1, 4 en el tratamiento B y C, y la GTX2, 3 en el tratamiento C (Tabla IX). Esto indica que probablemente hubo una biotransformación metabólica/enzimática de éstas toxinas o una depuración de ellas por los copépodos, o bien que se encontraban presentes pero en cantidades por debajo del límite de detección del equipo utilizado. Existen varios trabajos que han probado que los copépodos son capaces de alimentarse de dinoflagelados tóxicos y posteriormente transformar o eliminar las toxinas. Turiff y colaboradores (1995) observaron que después de alimentar a Calanus finmarchicus con Alexandrium excavatum, las toxinas N-sulfocarbamoyl acumuladas fueron disminuyendo de sus tejidos en un plazo de 48 horas. Palomares y colaboradores (2006) también observaron el mismo comportamiento después de alimentar a Acartia clausi con 47 Gymnodinium catenatum, ya que el perfil de toxinas reportado para el dinoflagelado (cepa GCCV-14) contenía dcSTX, dcGTX2, dcGTX3, C1 and C2 y las toxinas paralizantes detectadas en los copépodos fueron NEO, dcSTX, dcGTX2, dcGTX3, B1, B2 y C2. Guisande y colaboradores en el 2002 sugieren que las toxinas se modifican dentro del copépodo Acartia clausi mediante la epimerización de las Gonyautoxinas. Probablemente este mismo proceso de transformación se lleve a cabo en P. euryhalinus, ya que se observa la presencia de GTX 2-3 y GTX 1-4 en el tratamiento A, pero en los tratamientos B y C no se detectaron. Otra manera de desintoxicación, además de la transformación de toxinas por el metabolismo del organismo, es mediante las heces. Estos procesos, junto con la transferencia de toxinas hacia los huevos pueden representar >3% de las toxinas acumuladas por día (Guisande et al., 2002; Frangópulos et al., 2000). Desafortunadamente fue imposible colectar y analizar desechos y huevos de P. euryhalinus en estos experimentos para comprobar esta hipótesis. La retención de toxinas paralizantes de GCCV-6 ya ha sido reportada previamente en crustáceos. Pérez-Linares y colaboradores (2008) observaron la acumulación de toxinas PSP en órganos blanco de camarones (L. vanammei), detectando dcSTX, NEO, GTX2,3 y GTX1,4 en hepatopáncreas y músculo, las mismas que se pudieron detectar en el tratamiento A de P. euryhalinus. Cabe mencionar que en los camarones si se experimentaron mortalidades y que la densidad celular a la que se expusieron los es mayor (1x104) que la utilizada en copépodos (1x103), lo que sugiere que éstos últimos tienen mayor resistencia a su exposición y son más susceptibles de acumular toxinas PSP. Este resultado es importante desde el punto de vista ecológico, ya que el zooplancton es el 48 primer consumidor al que se enfrentan las células de una marea roja y representan un vector potencial de biomagnificación de éstos compuestos dañinos a través de la cadena trófica. 9. Conclusiones La depredación de P. euryhalinus sobre G. catenatum ocurre en mayor medida durante la primera hora en todos los tratamientos. En el segundo ensayo prospectivo se determinó que a una densidad de 1x104 y 5x104, no se registró mortandad en los copépodos, pero mostraron un comportamiento aletargado. El consumo promedio de células de G. catenatum calculado fue de 210 cél/copépodo durante los 3 días de experiemento. Relacionándolo con la concentración de STX/célula (58.8 pg eq STX/cél; Pérez-Linares et al., 2008) se pudo estimar que teóricamente era suficiente para poder determinarlas por HPLC-FLD de acuerdo al límite de detección del método (LODSTX=0.022 g eq STX/g; Lawrence et al., 2004). Los copépodos después de 7 horas de haberles agregado el dinoflagelado tóxico (GCCV-6), presentaron aletargamiento, depositándose en el fondo del matraz debido a la acumulación de toxinas paralizantes. De acuerdo a los análisis de la actividad enzimática de la Catalasa y por Peroxidación de lípidos, no existe daño celular en tejidos de P. euryhalinus por la ingestión de G. catenatum 49 Se comprobó que si hay acumulación de toxinas paralizantes en tejidos de P. euryhalinus al ingerir al dinoflagelado tóxico Gymnodinium catenatum. Estos resultados demuestran que P. euryhalinus es capaz de acumular toxinas paralizantes y sobrevivir sin sufrir daños, representando una amenaza potencial para el ambiente, ya que pueden actuar como vectores de ficotoxinas y biomagnificar estos compuestos peligrosos a través de la cadena trófica. 10. Recomendaciones Los resultados obtenidos en estos bioensayos proporcionan evidencias suficientes para tomar decisiones importantes sobre el estudio y manejo de contingencias relacionadas con PMN, como las que se sugieren a continuación: Implementar métodos sensibles y fiables en el sector de salud mexicano para la identificación y cuantificación de ficotoxinas (como HPLC-FLD, LC/MS, etc.), así como el uso de estándares certificados para su corroboración. Realizar estudios exhaustivos con la diversidad de zooplancton que coexiste con miacroalgas tóxicas y determinar parámetros y rutas de desintoxicación para evitar posibles transferencias a través de la cadena trófica que puedan llegar a productos de consumo humano. Durante una contingencia relacionada con PMN, se recomienda un período de veda determinado por estudios de bioacumulación de ficotoxinas en el zooplancton (e.g. copépodos). Lo anterior es debido a que representan la dieta de organismos superiores como los peces, moluscos cefalópodos y crustáceos decápodos que 50 pueden biomagnificar las concentraciones de ficotoxinas pudiendo afectar la salud pública con intoxicaciones serias; y a la economía (pesquerías y acuicultura) por las leyes de inocuidad alimentaria. 11. Bibliografía 1. AOAC. 1997. Official Method 959.08. Paralytic shellfish poisoning toxins in shellfish. Pp 22-23. In: Chapter 35: Fish and other marine products, Sec. 35.1.37. AOAC International. Gaithersburg, MD, EUA. 2. Alonso-Rodríguez, R., J. L. Ochoa-Ochoa y M., Urbe-Alcocer, 2005. Grazing of heterotrophic dinoflagellate Noctiluca scintillans (Mcartney) Kofoid on Gymnodinium catenatum Graham. Revista Latinoamericana de Microbiología. 47(1-2):5-10. 3. Aebi, H., 1984. Catalase in vitro. Methods Enzymol. 105, 121– 126. 4. Arnott, G. H. 1998. Toxic marine microalgae: a worldwide problem with major implications for seafood safety. Advancing Food Safety. 1:24–34. 5. Band-Schmidt, C. J., J. Bustillos-Guzmán, I. Gárate-Lizárraga , C.H. LechugaDevéze, K. Reinhardt, B. Luckas.2003. Paralytic shellfish toxin profile in strains of the dinoflagellate Gymnodinium catenatum Graham and the scallop Argopecten ventricosus G.B. Sowerby II from Bahía Concepción, Gulf of California, Mexico. México. 6. Band-Schmidt, C. J., Bustillos-Guzmán, J., Gárate-Lizárraga, I., Lechuga-Devéze, C.H., Reinhardt, K., Luckas, B. 2005. Profiles of paralytic shellfish toxin in strains of the dinoflagellate Gymnodinium catenatum and the scallop Argopecten ventricosus from Bahía Concepción, Gulf of California, Mexico. Harmful Algae. 4: 21–31. 7. Barman, M. y R. Campbell. 2007. The Effect of Saxitoxin Ingestion on the Reproductive Health of Calanus finmarchicus after Exposure to Alexandrium spp C.J. van Leeuwen and T.G. Vermeire (eds.), Risk Assessment of Chemicals: An Introduction, 281–356. 51 8. Blackburn, S. I., G. M. Hallagraeff y C. J. Bolch. 1989. Vegetative reproduction and sexual life cycle of the toxic dinoflagellate Gymnodinium catenatum from Tasmania, Australia. J. Phycol. 25: 577-590. 9. Boyd, C. M. 1976. Selection of particle sizes in filtering-feeding copepods: A plea for reason. Limmol. Oceanogr. 21: 175-180. 10. Bricelj, V.M., Lee, JH, Cembella, AD, Anderson, D. M.1990. Uptake of Alexandrium fundyense by Mytilus edulis and Mercenaria mercenaria under controlled conditions. In: Toxic marine phytoplankton, pp. 269–75 11. Campos-Hernández, A. y E. Suárez-Morales.1994. Copépodos del Golfo de México y Mar Caribe. Biología y Sistemática. CiQro. Inst. de Ocean. y CONACYT; México, D.F. 360 pp. 12. Calow, P. 1993. Handbook of ecotoxicology. Blackwell. London. 478-416 pp 13. Cortes, R. 1998. Las Mareas Rojas. AGT. México. 161 pp. 14. Durbin, A. G., Durbin, E. G. y Wlodarczyk, E. 1990. Diel feeding behavior in the marine copepod Acartia tonsa in relation to food availability. Mar. Ecol. Prog. Ser. 68: 23–45. 15. Dutz, J. 1998. Repression of fecundity in the neritic copepod Acartia clausi exposed to the toxic dinoflagellate Alexandrium lusitanicum: relationship between feeding and egg production. Mar Ecol Prog Ser. 175:97–107 16. FAO. 2004. Marine Biotoxins. Food and Agriculture Organization of the United Nations. Roma, Italia, 281 pp. 17. Fiedler, P. C. 1982. Zooplankton avoidance and reduced grazing responses to Gymnodinium splendens (Dinophyceae). Limnol. Oceanogr. 27: 961 -965. 18. Flores, R. 2008. Variación en el Contenido de Ácidos Grasos del Copépodo Calanoide Pseudodiaptomus euryhalinus (Johnson, 1939), Alimentados con las microalgas Chaetoceros calcitrans e isochrysis galbana. Tesis de Maestría. CIBNOR. 52 pp. 19. Frangópulos M., C. Guisande, I. Maneiro, I. Riveiro, J. Franco.2000. Short-term and long-term effects of the toxic dinoflagellate Alexandrium minutum on the copepod Acartia clausi. Mar. Ecol. Prog. Ser. 203: 161-169. 52 20. Garate-Lizarraga, I., J.J. Bustillos-Guzman, R. Alonso-Rodrıguez, B. Luckas. 2004. Comparative paralytic shellfish toxin profiles in two marine bivalves during outbreaks of Gymnodinium catenatum (Dinophyceae) in the Gulf of California. Mar. Poll. Bull. 48: 378-402. 21. Guisande, C., Frangópulos, M., Carotenuto, Y., Maneiro, I., Riveiro, I., Vergara, A.R., 2002. Fate of paralytic shellfish poisoning toxins ingested by the copepod Acartia clausi. Mar. Ecol. Prog. Ser. 240, 105–115. 22. Hallegraeff, G.M. 1995. 1. Harmful algal blooms: a global overview. In Hallegraeff, G.M. et al. eds. Manual on Harmful Marine Microalgae, pp. 1-22. IOC Manuals and Guides No. 33.UNESCO. 23. Halstead, B. W., Schantz, E. J. 1984. Paralytic shellfish poisoning. WHO Offset Publication No. 79:1–60. World Health Organization, Geneva, Switzerland. 24. Hamasaki, K., Takahashi, T., Uye, S., 2003. Accumulation of paralytic shellfish poisoning toxins in planktonic copepods during a bloom of the toxic dinoflagellate Alexandrium tamarense in Hiroshima Bay, western Japan. Mar. Biol. 143: 981–988. 25. Haney, J.F., Sasner J. J., Ikawa M. 1995. Effects of products released by Aphanizomenon flos-aquae and punfied saxitoxina on the movements of Daphnia carinata feeding appendages. Limnol Oceanogr. 40:263-272 26. Harada, T, Oshima, Y, Yasumoto, T.1983.Agric. Biol. Chem. 47, 191-193 27. Huntley, M. E. 1982. Yellow water in La Jolla Bay, California, July 1980. 2. Suppression of zooplankton grazing. J. Exp. Mar. Biol. Ecol. 63: 81-91. 28. Huntley M, Sykes P, Rohan S, Marin V. 1986. Chemically mediated rejection of dinoflagellate prey by the copepods Calanus pacificus and Paracalanus parvus: mechanism, occurrence and significance. Mar Ecol Prog Ser 28:105-120 29. Jeong, HJ, H.R. Kim, K.I. Kim, K.Y. Kim, K.H. Park, S.T. Kim, Y.D. Yoo, J.Y. Song, J.S. Kim, K.A. Seong, W.H. Yih y S.J. Pae. 2002. NaOCl produced by electrolysis of natural seawater as a potential method to control marine red-tide dinoflagellates. Phycologia, 41(6): 643-656. 30. Johnson, M. W. I939.Pseudodiaptomus (Pseudodiaptallous) euryhalinus a new subgenus and species of copepoda, with preliminary notes on its ecology. Trans. Am. Microsc. Soc. 58(3): 349-355. 53 31. Johnson, M. W. 1948. The postembryonic development of the copepod Psudodiaptomus ewyhditms Johnson, and its phylogenetic significance. Trans. Am. Microsc. Soc. 68(4): 3 19-330 32. Kankaanpää, H., Leiniö, S., Olin, M., Sjo¨ vall, O., Meriluoto, J., Lehtonen, K.K., 2007. Accumulation and depuration of cyanobacterial toxin nodularin and biomarker responses in the mussel Mytilus edulis. Chemosphere 68, 1210–1217. 33. Kozlowsky-Suzuki, B. M., Koski, E. Hallberg, R. Walle, P. Carlsson. 2009. Glutathione transferase activity and oocyte development in copepods exposed.to toxic phytoplankton. Harmful Algae 8 (2009) 395–406. 34. Lehane, L. 2000. Paralytic Shellfish Poisoning: A review. National Office of Animal and Plant Health, Agriculture, Fisheries and Forestry — Australia, Canberra. 35. Lehtiniemi M., Engström-Öst J., Karjalainen M., Kozlowski-Suzuki B., Viitasalo M. 2002. Fate of cyanobacterial toxins in the pelagic food web: transfer to copepods or to faecal pellets?, Mar. Ecol. Prog. Ser. 241: 13-21. 36. Lindahl, O. 1998. Occurrence and Monitoring of harmful algae in the marine environment. In Miraglia, M., Van Egmond, H., Brera, C. & J. Gilbert, eds. 1998. Mycotoxins and phycotoxins developments in chemistry, toxicology and food safety. Proceedings of the IX Internationa IUPAC Symposium on Mycotoxins and Phycotoxins, pp. 409-423. Fort Collins, Colorado, Alaken Press. 37. Lawrence, J.F., B. Niedzwiadek y C. Ménard. 2004. Quantitative determination of paralytic shellfish poisoning toxins in shellfish using prechromatographic oxidation and liquid chromatography with fluorescence detection: interlaboratory study. Journal of AOAC International, 87(1): 83-100. 38. Marshall, S. M. y A. P. Orr. 1972. The hiology of a marine copepod. SpringerVerlag. Darmstadt, Germany. 195 pp. 39. Montoya, N. G., Akselman, R., Franco, J. M., Carreto, J. I. 1996. Paralytic shellfish toxins and mackerel (Scomber japonicus) mortality in the Argentine Sea. In: Reguera B, Blanco J, Fernández ML Wyatt T (eds) Harmful algae. Xunta de Galicia and IOC of UNESCO.417–420 pp. 54 40. Negri, A. y Llewellyn, L. 1998. Comparative analyses by HPLC and the sodium channel saxiphilin 3H saxitoxin receptor assay for shellfish toxins in crustaceans and molluscs from tropical North West Australia. Toxicon.36: 283-298. 41. Ochoa, J. L., Nuñez V. E. y Saad, J., 2003. Diferentes términos utilizados para describir las ―mareas rojas‖. Revista de biología tropical, 3-4:621-628. 42. Oshima, Y, Kotaki, Y, Harada, T, Yasumoto, T. 1984. Paralytic shellfish toxins in tropical waters, pp. 161–70. In: Seafood toxins, EP Ragelis (ed.). ACS Symposium Series 262, American Chemical Society, Washington, DC. 43. Osorio, M. 1998. Efecto de la Temperatura y La Salinidad en Parametros Poblacionales de Pseudodiaptomus ezuyhalinus Johnson (CRUSTACEA: COPEPODA: CALANOIDEA) En Condiciones Controladas. Tesis de Maestría. CICIMAR-IPN. La Paz, B.C.S., México. 68 pp. 44. Ohkawa, H., Ohishi, N., Yagi, K., 1979. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal. Biochem. 95, 331–358. 45. Palomares-García, R., Bustillos-Guzmán, J.J., Band-Schmidt, C.J., López-Cortés, D.J., Luckas, B. 2006. Effect of the toxic dinoflagellate Gymnodinium catenatum on the grazing, egg production, and hatching success of the copepod Acartia clausi. Ciencias Marinas. 32 (1B): 111– 119. 46. Pérez-Linares, J. 2001. Histopatología de Postlarvas de camarón blanco Litopenaueus vannamei Expuesta a la cianobacteria Schizothrix calcicola. UABCS. Tesis de Licenciatura. México. 47. Pérez-Linares, J. 2008. Retención de Toxinas y Daños en Tejidos de Camarón Patiblanco Litopenaeus vannamei Producidos por la Exposición a Gymnodinium catenatum (PSP) y Karenia brevis (NSP). CIBNOR. Tesis de Doctorado. México. 151 pp. 48. Pérez-Linares, J., J.L. Ochoa y A. Gago-Martínez. 2008. Effect of PSP toxins in white leg shrimp Litopenaeus vannamei (Boone, 1931). J. Food Science: Food Chemistry and Toxicology, 73: 233-237. 49. Pérez-Linares, J., J.L. Ochoa y A. Gago-Martínez. 2009. Retention and tissue damage of PSP and NSP toxins in shrimp: Is cultured shrimp a potential vector of toxins to human population? Toxicon, 53: 185-195. 55 50. Persky, A.M., Green, P.S., Stubley, L., Howell, C.O., Zaulyanov, L., Brazaeua, G.A., Simpkins, J.W., 2000. Protective effect of estrogens against oxidative damage to heart and skeletal muscle in vivo and in vitro. Proc. Soc. Exp. Biol. Med. 223, 59–66. 51. Price, P.W. 1983. Hypothesis on organization and evolution in herbivorous insect communities. In Variable plants and herbivores in natural and managed systems. R.F. Denno and M.S. McClure.559-598 pp. 52. Price, H.J. y G.A. Paffenhöfer. 1986. Capture of small cells by the copepod Eucalanus elongatus. Limnol. Oceanogr. 31-1: 189-194. 53. Sykes, P. F. y Huntley, M. E. 1987. Acute physiological reactions of Calanus pacificus to selected dinoflagellates: direct observations. Mar. Biol.94: 19–24. 54. Sykes, P. F. 1991. Physiological ecology and chemical ecology of copepoddinoflagellate interactions. PhD dissertation, University of California. San Diego 55. Teegarden, G. J.1999. Copepod grazing selection and particle discrimination on the basis of PSP toxin content. Mar. Ecol. Prog. Ser 191:163–176 56. Teegarden, G. J. y Cembella, A. D. 1996. Grazing of toxic dinoflagellates, Alexandrium spp., by adult copepods of coastal Maine: implications for the fate of paralytic shellfish toxins in marine food webs. J. Exp. Mar. Biol. Ecol. 196: 145– 176. 57. Traas, T. P. y C. J. Van Leeuwen. 2007. Ecotoxicological Effects. Springer. 686 pp. 58. Turriff N, Runge, J. A., Cembella, A. D. 1995. Toxin accumulation and feeding behaviour of the planktonic copepod Calanus finmarchicus exposed to the red-tide dinoflagellate Alexandrium excavatum. Mar Biol. 123:55–64 59. Turner, J. T. y D. M. Anderson. 1983. Zooplankton grazing during dinoflagellate blooms in a Cape Cod embayment, with observations of predation upon tintinnids by copepods. Mar. Ecol. 4: 359-374. 60. Turner, J.T., Tester, P.A., 1997. Toxic marine phytoplankton, zooplankton grazers, and pelagic food webs. 61. Turner, J. T. 2006. Harmful Algae Interactions with Marine Planktonic Grazers 62. Uye, S. 1986. Impact of copepod grazing on the red-tide flagellate Chattonella antiqua. Mar. Biol. 92: 35-43. 56 63. Uye, S. y K. Takamatsu. 1990. Feeding interactions between planktonic copepods and red-tide flagellates from Japanese coastal waters. Mar. Ecol. Prog. Ser. 59:97107 pp. 64. Wannemacher, R. W. 1989. Procedures for Inactivation and Safety Containment of Toxins. In: Proceeding of the Symposium on Agents of Biological Origin, U.S. Army Research, Development and Engineering Center. Aberdeen Proving Ground, Maryland, EUA, 15-122 pp. 65. Walter, T. C. 1989. Review of the new world species of Pseudodiaptomus (COPEPODA: CALANOIDA) with a key to the species. Bull. Mar. Sci. 45 (3): 590-628. 66. Watras, C. J., Garcon, V. C., Olson, R. J., Chisholm, S. W. y D. M. Anderson. 1985. The effect of zooplankton grazing on estuarine blooms of the toxic dinoflagellate Gonyaulux tamarensis. J. Plankton Res. 7: 891-908. 67. Yasumoto, T., Murata, M., 1993. Marine Toxins. Chem Rev 93: 1897-1909. 57