Taller Unidad 7
Anuncio

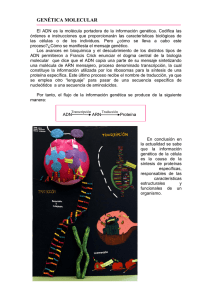
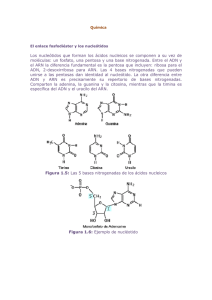
Curso de Bioquímica y Biología Molecular Maestría en Bioinformática PROBLEMAS- UNIDAD 7 1- Diferencias entre replicación y transcripción 2- Las ADN polimerasas tienen capacidad de editar y corregir errores en la replicación, mientras la capacidad de corregir errores por la ARN polimerasa parece ser bastante limitado, dado que la incorporación de una base errónea ya sea en la replicación o en la transcripción puede resultar en un error en la síntesis proteica, discuta alguna posible explicación biológica para esta diferencia 3- Unir cada término con su definición: I. Secuencia consenso II. Factor general de transcripción III. ARNm IV. Promotor V. ARN polimerasa VI. Holoenzima ARN polimerasa VII. Splicing ARN VIII. ARNr IX. Spliceosoma X. TATA box XI. Terminador a- Colabora en el posicionamiento correcto de la ARN polimerasa en el promotor, en la separación de las dos hebras de ADN para permitir el comienzo de la transcripción y en la liberación de la ARN polimerasa del promotor en la elongación. b- Secuencia nucleotídica en el ADN a la cual se une la ARN polimerasa para comenzar la trancipción c- Una de varias moléculas de ARN específico que forma parte de la estructura del complejo macromolecular responsable de la síntesis de proteínas, a menudo se distinguen por su coeficiente de sedimentación, ej 28S o 5S d- Molécula de ARN que especifica la secuencia aminoacídica de una proteína e- Proceso en el cual las secuencias intrónicas son escindidas de los transcriptos ARN en el núcleo durante la formación del mensajero y otros ARNs. f- Señal en el ADN bacteriano que indica el fin de la transcripción Curso de Bioquímica y Biología Molecular Maestría en Bioinformática 4- Con el afán de caracterizar las ARN polimerasas eucariotas, se obtuvieron 3 picos de actividad polimerasa mediante fraccionamiento de extractos celulares en columnas cromatográficas (Figura A). El problema fue que no estaba claro si estos picos correspondían a diferentes ARN polimerasas o a diferentes formas de una sola polimerasa. Cuando se incubaron las tres fracciones de la polimerasa en presencia de 1 ug/mL o 10 ug/mL de amanitina (del hongo Amanita phalloides, Figura B) se obtuvieron los resultados mostrados en la figura A. Con estos resultados, se puede concluir si se trata de tres diferentes polimerasas o si son diferentes formas de la misma ARN polimerasa? Explique su respuesta. 5- En la micrografía electrónica de la figura, ¿podría decir hacia qué dirección se está moviendo la ARN polimerasa? Por qué los transcriptos ARN parecen mucho más cortos que el largo del ADN que los codifica? Curso de Bioquímica y Biología Molecular Maestría en Bioinformática 6- Cuál es el rol de los factores generales de transcripción en la transcripción mediada por la ARN polimerasa II? Por qué se los llama “generales”? Procesamiento del ARN 7- Qué función tiene el CAP 5’ y la cola poli A en los ARNm? discuta que implicancias en la expresión génica podría tener una mutación en la secuencia de poliadenilación. 8- Durante la transcripción de la ARN polimerasa II, se forsforila el dominio CTD (carboxiterminal) de la ARN polimerasa II. Qué función/es cumple esta fosforilación del CTD? 9- En la micrografía electrónica de la figura A se muestra el resultado de la hibridación del ARNm de la ovoalbúmina con un segmento de ADN que contiene dicho gen. En la misma se ve un set de bucles simple hebra emanando de un dúplex central cuyos exteremos corresponden a los extremos del ARNm (Figura B). Describa la estructura de este gen. Regulación en procariotas 10- Defina en qué consisten los controles negativos y positivos en la regulación de la transcripción, qué moléculas lo ejercen y en qué sitios actúan. 11- Explique qué implicancias regulatorias tiene el hecho de qué en las bacterias los genes se encuentren agrupados en operones. Curso de Bioquímica y Biología Molecular Maestría en Bioinformática Regulación en eucariotas En la figura A se muestra la estructura del gen xpr . (A) Exón 1 500 0 Exón 2 Intrón 1 1200 Exón 3 Intrón 2 3200 sonda 4200 5200 Para evaluar la expresión del mismo se realizan ensayos de Northern blot con ARN extraído de diferentes tejidos de ratón utilizando como sonda la región de ADN señalada en la figura A amplificada por PCR y marcada con 32P. El resultado del ensayo se muestra en la figura B. Discuta los resultados. músculo hígado Tej. nervioso 5000 3500 3200 1500 1000 Bibliografía Molecular Biology of The Cel. Wilson and Hunt. Fifth Edition.