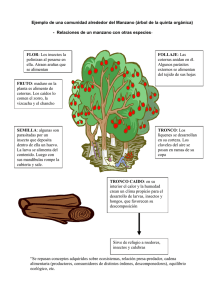
Embothrium coccineum - Tesis Electrónicas UACh
Anuncio

Universidad Austral de Chile Facultad de Ciencias Agrarias Escuela de Agronomía Entomofauna asociada a flores de notro (Embothrium coccineum J.R. et G.Forster) y maqui (Aristotelia chilensis (Mol.) Stuntz) en la zona de Valdivia. Tesis presentada como parte de los requisitos para optar al grado de Licenciado en Agronomía Julio Nicolás Mendoza Contreras VALDIVIA – CHILE 2012 PROFESOR PATROCINANTE: ____________________________________ Miguel Angel Neira Caamaño Ingeniero Agrónomo Instituto de Producción y Sanidad Vegetal PROFESORES INFORMANTES: ____________________________________ Roberto Carrillo Llorente Ingeniero Agrónomo, M.Sc., Ph.D. Instituto de Producción y Sanidad Vegetal ___________________________________ Rubén Palma Millanao Ingeniero Agrónomo, Dr. Instituto de Producción y Sanidad Vegetal A mi madre, por su amor y educación. A mi abuelo, por lo importante que fue y es en mi vida. A mi querida y presente familia (Tío Feño, Tía Vero, Tía Mónica, Caro, Jackie, Lalo, Alejandra, Silvana, Fernando, Cata, Cuchito, Sofía, Nico, Julieta, Renato y María Jesús), gracias por su incondiconalidad!!! Agradecimientos Como dice el dicho, no hay plazo que no se cumpla ni deuda que no se pague…. Después de un largo periodo, tuve la oportunidad de cerrar mi proceso de graduación y titularme de Ingeniero Agrónomo. Sin duda, cerrar este proceso, es una satisfacción personal inconmensurable. En este andar quiero agradecer inicialmente a mi profesor patrocinante, don Miguel Neira, quien gentilmente me recibió y aceptó ser guía de esta investigación. Muchas gracias por sus consejos, orientación y el tiempo compartido en otros espacios de compañerismo, alegrías y buena conversa. También quiero agradecer a mis profesores informantes: Maritza Reyes, quien me apoyó desde el inicio de la investigación - de forma desinteresada y sin conocerme – y hasta antes de partir a Francia a realizar sus estudios de post-doctorado. Al profesor Rubén Palma, por su orientación, intercambio de ideas, correcciones al escrito y especialmente su ayuda en el análisis estadístico, como olvidar tampoco aquellos variados almuerzos y conversadas sobremesas. A don Roberto Carrillo, por su sabiduría y entrega de conocimientos, sin duda nuestras conversaciones fueron un constante aprendizaje para mí. Quiero agradecer especialmente su ayuda en el diseño de la investigación y su invaluable experiencia como taxónomo. Al glorioso Laboratorio de Entomología, encabezado por Leticia, quien con su tremenda calidad humana, hicieron de la estadía un tiempo agradable y muy confortable. Agradezco su amistad y el importante apoyo en la clasificación de insectos. A los amigos Enrique, Caro, Sebastián, Francisca, Lucía, Janito, por su buena onda, newen (fuerza) y compañía en múltiples tertulias y eventos. A la querida Silvita, quien con sus cariñosos retos y preocupación constante porque terminará mi tesis, fue también parte de este proceso. Y a mis queridos amigos de universidad Hevert, Carlos, Javier y Alex, con quienes seguimos en contacto a pesar del tiempo, grande cauros!!!! i INDICE DE MATERIAS Capítulo Página RESUMEN 1 SUMMARY 3 1 INTRODUCCIÓN 4 2 REVISIÓN BIBLIOGRÁFICA 6 2.1 Antecedentes generales de notro (Embothrium coccineum J.R. et 6 G.Forster) 2.1.1 Descripción de la especie 6 2.1.2. Distribución geográfica 6 2.1.3 Características de las flores 6 2.1.4 Características de los frutos 7 2.2 Antecedentes generales de maqui (Aristotelia chilensis (Mol.) Stuntz) 7 2.2.1 Descripción de la especie 7 2.2.2 Distribución geográfica 8 2.2.3 Características de las flores 8 2.2.4 Características de los frutos 9 2.3 Polinización 9 2.3.1 Tipos de polinización 10 ii 2.3.1.1 Autopolinización 10 2.3.1.2 Polinización cruzada 10 2.3.2 Transporte de polen 11 2.3.2.1 Polinización anemófila 11 2.3.2.2 Polinización entomófila 11 2.4 Características de los insectos polinizadores 11 2.4.1 Clasificación de los insectos polinizadores 13 2.5 Factores climáticos que influencian las visitas de los insectos 14 2.5.1 Temperatura 14 2.5.2 Humedad 15 2.5.3 Luminosidad 15 2.5.4 Viento 15 2.6 Diversidad biológica o biodiversidad 16 2.6.1 Escalas de la diversidad 17 2.6.2 Diversidad de los insectos 17 2.6.3 Medición de la diversidad 17 3 MATERIAL Y METODOS 20 3.1 Material 20 3.1.1 Ubicación geográfica del muestreo 20 3.1.2 Características climáticas 20 iii 3.1.3 Características del suelo 20 3.1.4 Material vegetal 21 3.1.5 Instrumentos y materiales utilizados 21 3.2 Método 21 3.2.1 Periodo experimental 21 3.2.2 Instalación del estudio 21 3.2.3 Evaluación de la entomofauna asociada a flores de notro y maqui 22 3.2.4 Medición de la intensidad de floración 23 3.2.5 Registro de factores ambientales 23 3.2.6 Establecimiento de índices de diversidad de la entomofauna colectada 23 3.2.7 Análisis estadístico 25 4 PRESENTACIÓN Y DISCUSIÓN DE RESULTADOS 26 4.1 Entomofauna asociada a flores de notro y maqui 26 4.1.1 Influencia del horario en las visitas de los insectos 32 4.2 Correlaciones entre el número de flores abiertas, las variables climáticas y la visita de insectos en notro y maqui 37 4.3 Indices de diversidad de la entomofauna colectada en notro y maqui 41 5 CONCLUSIONES 46 6 BIBLIOGRAFÍA 48 7 ANEXOS 57 iv INDICE DE CUADROS Cuadro 1 Página Importancia porcentual de los grupos de insectos que visitan los cultivos. 2 Insectos visitadores de las flores masculinas de maqui, número y frecuencia relativa de las visitas durante el periodo experimental. 3 37 Relación entre el número de flores abiertas, las variables climáticas y la visita de insectos en maqui. 8 36 Relación entre el número de flores abiertas, las variables climáticas y la visita de insectos en notro. 7 33 Número de visitas realizadas por los insectos a flores de notro en relación con el horario de visita. 6 27 Número de visitas totales realizadas por los insectos a flores masculinas de maqui en relación con el horario de visita. 5 26 Insectos visitadores de las flores de notro, número y frecuencia relativa de las visitas durante el periodo experimental. 4 12 38 Cálculo de riqueza específica (S), índice de Simpson (l) e índices de diversidad de Shannon Wiener (H’) y Simpson (1 - l), para la entomofauna asociada a notro y maqui. 42 v INDICE DE FIGURAS Figura Página 1 Flor de notro. 7 2 Flor masculina (a) y flor femenina (b) de maqui. 9 3 Frecuencia relativa visita de insectos en notro y maqui. 29 4 (a) Apis mellifera (Hymenoptera: Apidae) y (b) Diphaglossa gayi 30 (Hymenoptera: Colletidae) visitando flores de notro. 5 Número de visitas (totales) del orden Hymenoptera; Diptera (Syrphidae) e insectos totales, entre horarios, en flores masculinas de 34 maqui. 6 Número de (Syrphidae) e visitas (totales) del orden Hymenoptera; Diptera insectos totales, entre horarios, en flores de notro. 35 vi INDICE DE ANEXOS Anexo 1 Página Registros de temperatura (°C) y humedad (H°) durante el periodo de muestreo en maqui. 2 Registros de temperatura (°C) y humedad (H°) durante el periodo de muestreo en notro. 3 Número de flores abiertas en el parche de exclusión de 0,25 x 0,25, durante el periodo de muestreo en maqui. 4 Número de flores abiertas en el parche de exclusión de 0,25 x 0,25, durante el periodo de muestreo en notro. 5 57 59 62 62 Cálculo de riqueza específica (S), índice de Simpson (l) e índices de diversidad de Shannon Wiener (H’) y Simpson (1 - l), para la entomofauna asociada a notro y maqui. 63 6 Diphaglossa gayi (Hymenoptera: Colletidae) 64 7 Corynura chloris (Hymenoptera: Halictidae) 64 8 Ruizantheda mutabilis (Hymenoptera: Halictidae) 65 9 Bombus dahalbomii (Hymenoptera: Apidae) 65 10 Bombus terrestris (Hymenoptera: Apidae) 66 11 Cadeguala occidentalis (Hymenoptera: Colletidae) 66 1 RESUMEN En el Fundo Teja Norte y en el Jardín Botánico, de la Universidad Austral de Chile en Valdivia, se realizó entre octubre y diciembre del 2011, un estudio para evaluar la entomofauna asociada a flores de las especies nativas notro (Embothrium coccineum J.R. et G.Forster) y maqui (Aristotelia chilensis (Mol.) Stuntz), con el fin de determinar si los insectos son atraídos en forma selectiva y corresponden a especies nativas. Se seleccionaron 4 árboles para cada especie y en cada uno se delimitó una superficie de observación y colecta correspondiente a 2 m2, definiéndose para ello dos horarios: mañana (11:00 a 13:00 h) y tarde (14:00 a 16:00 h). Se colectaron e identificaron las principales especies de insectos visitadores de flores de notro y maqui. Se correlacionó la visita de los insectos y el número de flores abiertas por especie, como también la visita de los insectos y dos variables climáticas: temperatura y humedad. Además, se establecieron índices de diversidad de la entomofauna colectada. Se identificaron 16 especies de insectos que visitan las flores de notro y 9 especies que visitaron las flores de maqui. Entre los insectos más importantes que visitaron las flores de ambas especies tenemos a Apis mellifera L., Diphaglossa gayi Spinola, Ruizantheda sp y Policana albopilosa Spinola. Todos pertenecen al orden Hymenoptera y son consideradas abejas chilenas nativas, a excepción de A. mellifera. Las correlaciones realizadas determinaron principalmente, en el caso de notro, que la abundancia relativa de D. gayi correlaciona positivamente con el número de flores abiertas y la temperatura. En maqui, importante es el nivel de asociación que existe entre P. albopilosa y el número de flores abiertas, variables que se correlacionan positiva y altamente, posicionando a este insecto como un visitante muy vinculado a maqui, situación corroborada por otros autores. Se establecieron tres índices de diversidad para la entomofauna censada. En el caso de riqueza específica, para notro corresponde a 16 especies y para maqui 9 especies. El índice de diversidad de Shannon Wiener alcanzó valores de 1,87 y 1,56 para notro y 2 maqui respectivamente y el índice de diversidad de Simpson de 0,75 y 0,72 en el mismo orden. 3 SUMMARY In “Teja Norte” farm and “Universidad Austral de Chile” Botanical Garden (Valdivia, Chile), from October to December 2011, it was made a study to evaluate the insect fauna associated with native flowers species notro (Embothrium coccineum J.R. et G.Forster) and maqui (Aristotelia chilensis (Mol.) Stuntz) in order to determine if insects are attracted selectively and correspond to native species. Four trees for each species were selected and in each one, it was delimited an area of observation and collection corresponding to 2 m2, two times were considered: morning (11:00 to 13:00) and afternoon (14:00 to 16: 00 h). The main species of insect visitors to flowers notro and maqui were collected and identified. The visit of the insects and the number of open flowers per species was correlated, as well as the visit of insects and two climatic variables: temperature and humidity. In addition, diversity indices were established for the insect fauna caught. There were identified 16 species of insects visiting notro flowers and 9 species visiting male maqui flowers. Among the most important insects that visited flowers of both species, we have Apis mellifera L., Diphaglossa gayi Spinola, and Policana albopilosa Spinola. All of them belong to the Hymenoptera order and are considered chilean native bees, except for A. mellifera. Correlations performed determined mainly, in the case of notro, that the relative abundance of D. gayi correlates positively with the number of open flowers and temperature. In maqui, is important the association level between P. albopilosa and the number of open flowers, variables that correlate positively and highly, positioning this insect as a closely linked visitor to maqui, situation which was confirmed by other authors. Three diversity indices for entomofauna census were established. For specific richness, for notro, it corresponds to 16 species and 9 species for maqui. The Shannon Wiener diversity index values reached 1.87 and 1,56 respectively for notro and maqui and Simpson diversity index reached values of 0.75 and 0.72 for the same species. 4 1 INTRODUCCION En Chile existen numerosas especies arbóreas nativas con un gran valor e interés científico, ya sea por su importancia ecológica, su valioso potencial genético o por ser consideradas una alternativa económica interesante. Dentro de estas especies se encuentran notro (Embothrium coccineum J.R. et G.Forster) y maqui (Aristotelia chilensis (Mol.) Stuntz), las cuales presentan condiciones o características que merecen ser consideradas y estudiadas, por lo que su desarrollo a escala pueden ser iniciativas productivas interesantes. Notro es una especie promisoria para la restauración de suelos de baja productividad o que presenten limitaciones edáficas (Ej: ñadis) y puede ser incluido en planes de reforestación por su rápido crecimiento y adaptación a terrenos difíciles. Como planta ornamental, es una especie muy valiosa y se emplea mucho en Europa y EEUU. En tanto, maqui produce un excelente colorante natural muy utilizado en la textilería en lana y hace un par de años en la industria alimenticia, como colorante natural para alimentos, jugos y bebidas. Además, su capacidad antioxidante es muy alta y la exportación de su fruto aumenta cada año. En la propagación de estas especies, los insectos cumplen un rol importante en la polinización, por lo que es necesario definir que tipo de insectos visitan las flores de notro y maqui, como estudio base para futuras investigaciones. La visita de estos insectos puede ser afectada por factores bióticos, como la densidad de flores o el despliegue floral de las especies propuestas, lo que ha sido ampliamente documentado. No obstante, factores abióticos tales como las condiciones climáticas imperantes en el sitio donde se encuentran las plantas, también pueden influir fuertemente sobre el comportamiento y la actividad de los polinizadores, siendo estos especialmente sensibles a cambios de temperatura, humedad, velocidad del viento y nubosidad. En concordancia con lo anterior, tanto notro como maqui y la entomofauna asociada a ellos, se insertan dentro de ecosistemas dinámicos, donde el significado e importancia de la diversidad biológica cobra cada vez mayor relevancia, como un indicador del 5 estado de estos sistemas ecológicos, con aplicabilidad práctica para fines de conservación, manejo y monitoreo ambiental Según lo expuesto, las hipótesis planteadas para esta investigación son las siguientes: 1) Las flores de estas especies nativas atraen a sus insectos visitadores selectivamente. 2) Las flores de notro y maqui son visitadas principalmente por especies de insectos nativos. El objetivo general planteado para este estudio fue: Evaluar la entomofauna asociada a flores de las especies nativas notro y maqui. Los objetivos específicos que dan respuesta al objetivo general son: 1) Identificar los insectos que visitan flores de notro y maqui para determinar si corresponden a especies nativas o introducidas. 2) Determinar correlaciones posibles entre la visita de los insectos versus el número de flores abiertas de cada especie y la visita de los insectos versus factores climáticos como temperatura y humedad, tanto para notro como maqui. 3) Establecer índices de diversidad de la entomofauna colectada en notro y maqui. 6 2 REVISION BIBLIOGRAFICA 2.1 Antecedentes generales de notro (Embothrium coccineum J.R. et G.Forster). Purnell (1960), citado por DONOSO (2004), menciona que notro (Embothrium coccineum J.R. et G.Forster) es un árbol que pertenece a un género monotípico dentro de la familia Proteaceae. 2.1.1 Descripción de las especie. Es un árbol pequeño que puede medir hasta 15 m de altura con un DAP de hasta 50 cm. El tronco es generalmente recto, pero puede torcerse y bifurcarse fácilmente al crecer en busca de la luz. Claramente los mayores tamaños y mejores formas los obtiene hacia al sur de Valdivia. La corteza es delgada, no especialmente característica. Las hojas simples, casi sin pecíolo son de forma y tamaños muy variables, desde aovadas o elípticas hasta oval-lanceoladas, de color verde oscuro en el haz y glauco-blanquecino en el envés (RODRIGUEZ et al., 1983). En promedio, las hojas tienen un largo y un ancho de 5,72 y 2,04 cm, respectivamente, y un perímetro y un área de 16,18 y 8,08 cm2, respectivamente (DONOSO, 2004). 2.1.2 Distribución geográfica. Notro crece desde la VII a la XII región y en algunas zonas de Argentina. Habita lugares abiertos, arenosos y húmedos, siendo una de las especies pioneras en lugares donde el bosque ha sido cortado. No forma bosques puros, siendo frecuente en los tipos forestales: Roble-Raulí-Coihue, Coihue de Magallanes, Lenga, Ciprés de las Guaitecas, Araucaria, Alerce y Siempreverde. Existen dos variedades de esta especie; E. coccineum var. coccineum, que es la más común con sus flores de color rojo y E. coccineum var. lutea, poco común de flores amarillas (DONOSO y RAMIREZ ,1994 ; HOFFMAN, 1997). 2.1.3 Características de las flores. Urban (1934), Donoso (1974) y Muñoz (1980), citados por DONOSO (2004), menciona que las flores son hermafroditas en inflorescencias tipo corimbo, vistosas, desde color rojo que varía desde muy intenso hasta más apagado en diferentes individuos. Posee cuatro tépalos rojos, que unidos apretadamente antes de abrirse la flor, encierran en una punta globosa los estambres, lo que ha determinado el nombre de “fosforito”, como se le conoce vulgarmente.. 7 Cuando la flor se despliega, sostenida por un largo pedicelo, los tépalos se enroscan hacia fuera, dejando descubiertos el pistilo y los cuatro estambres (Figura 1). FIGURA 1 Flor de notro. FUENTE: LE-QUESNE (s/f) 2.1.4 Características de los frutos. Los frutos de notro, son folículos verdosos, casi leñosos, que mantienen el estilo persistente. Las dos valvas del folículo se abren longitudinalmente en la madurez, dejando al aire las numerosas semillas aladas imbricadas - como las tejas de un tejado - en el interior del folículo (RODRIGUEZ et al., 1983). 2.2 Antecedentes generales de maqui (Aristotelia chilensis (Mol.) Stuntz). El maqui (A. chilensis), es una especie arbustiva perteneciente al grupo de las dicotiledóneas, familia Elaeocarpaceae (HOFFMAN, 1997). 2.2.1 Descripción de la especie. Urban (1934) y Rodríguez et al. (1983), citados por DONOSO (2004) indican que maqui es un pequeño árbol siempreverde o caducifolio 8 facultativo, dioico que alcanza una altura de hasta 5 m y un diámetro de hasta 15 cm. Posee una corteza lisa, blanda y que se desprende fácilmente en tiras. Sus hojas son simples, perennes y en casos facultativamente caducas. Se pueden disponer en forma opuesta, alterna y subalterna, no obstante su apariencia es de filotaxia decusada. Coriáceas, generalmente péndulas, con estipulas tomentosas caedizas y un peciolo rojizo, al igual que las ramificaciones nuevas. El peciolo es pubescente y mide entre 1,5 a 2 cm. La forma de la hoja es oval- lanceolada, de borde aserrado, ápice agudo, base redonda, nervadura reticular marcada y color verde claro brillante, Su tamaño va desde 3 a 8 cm de longitud y 1,5 a 3,5 cm de ancho. 2.2.2 Distribución geográfica. Según RODRIGUEZ et al. (1983); DONOSO Y RAMIREZ (1994), maqui es una especie endémica de los bosques subantÁrticos de Chile y Argentina. En Chile se distribuye desde la provincia de Limarí (31° S) hasta la provincia de Aysén (43° S) por el valle central y ambas cordilleras desde el nivel del mar hasta los 2500 m.s.n.m. Prefiere los lugares húmedos y ricos en tierra vegetal; pero se halla además en las laderas de cerros y bordes de bosque . Es de las primeras especies que invaden los terrenos recién rozados, y estas asociaciones monoespecíficas reciben la denominación de “macales” (HOFFMANN 1997). Frecuentemente se encuentra en los tipos forestales: Esclerófilo, Palma Chilena, Roble - Hualo, Roble – Raulí - Coihue, Siempreverde y Ciprés de la Cordillera. 2.2.3 Características de las flores. Maqui es considerada una especie dioica (Figura 2), sin embargo, su dioecia es incompleta, pues las flores masculinas pueden presentar un ovario fértil que ocasionalmente permite el desarrollo de frutos. En general, las flores son péndulas y se encuentran reunidas en inflorescencias tipo corimbo de 2 a 4 unidades, las cuales nacen en las axilas de las hojas (RODRIGUEZ et al., 1983). Donoso (1974), citado por MORA (1999), indica que cada flor está provista de 5 a 6 sépalos lanceolados, agudos, algo pilosos, casi enteramente libres de 2 a 2,5 mm de largo; en forma alterna a los sépalos encuentran 5 a 6 pétalos amarillentos , de forma aovada, de 3 a 4 mm de largo. Las flores masculinas poseen 10 a 15 estambres, distribuidos en 2 verticilos que rodean al pistilo rudimentario (muy pequeño e infértil). Las anteras son largas, pubescentes y adnatas, y se encuentran sobre pequeños filamentos delgados. Las flores femeninas poseen estaminodios y un ovario grueso, verdoso y trilocular, el cual 9 sostiene un estigma trífido alargado. No presenta claras estructuras nectaríferas, sin embargo, sobre el tálamo presenta un disco protuberante con posibles estomas nectaríferos (CARDENAS, 1998). (a) (b) FIGURA 2 Flor masculina (a) y flor femenina (b) de maqui. FUENTE: LE-QUESNE (s/f) 2.2.4 Características de los frutos. El fruto de maqui cuando maduro, es una baya carnosa de color morado oscuro a negro brillante, rara vez blanco, de 3 a 7 mm de diámetro, que puede contener 2 a 4 semillas angulosas de 3 mm de largo y 2 mm de ancho (RODRIGUEZ et al., 1983). 2.3 Polinización La reproducción sexual y el desarrollo de la semilla dependen de la polinización, la que se define como el acto de llevar el grano de polen desde la antera de una flor a los pistilos de otras flores, sean o no pertenecientes al mismo pie de planta (WESTWOOD, 1982 y RALLO, 1986). La polinización es importante porque es el preludio de la fecundación (RALLO, 1986), términos que a menudo se confunden. Este último comprende la actividad que tiene lugar después que el polen es puesto en contacto con la superficie del estigma hasta la fusión de los gametos femenino y masculino, pasando por la formación del tubo polínico (ROOT, 1976). 10 De esta manera, la reproducción sexual y el desarrollo de la semilla dependen de la polinización y éste es el requerimiento previo al cuajado en la mayoría de los frutos, lográndose además a través de estos procesos maximizar la producción (Mc GREGOR, 1976). 2.3.1 Tipos de polinización. Las plantas presentan una extraordinaria diversidad de mecanismos reproductivos. Cada especie vegetal ha desarrollado en el transcurso de la evolución un mecanismo particular para la transferencia de los granos de polen hacia la superficie estigmática (ROOT, 1976). Existen dos tipos de polinización, dependiendo del origen del polen: 2.3.1.1 Autopolinización. Se define como la transferencia de polen desde las anteras al estigma de la misma flor, o a estigmas de otras flores de la misma planta o flores de diferentes plantas del mismo genotipo (HOOPINGARNER y WALLER, 1993). Es así como la polinización puede ser realizada sin la intervención de un agente externo, pero este sistema es generalmente deficiente y limitado (Mc GREGOR, 1976). Según RALLO (1986), las plantas, a lo largo de su evolución, han intentado evitar la autopolinización como procedimiento para obtener semillas y perpetuar la especie, ya que este mecanismo conduce a un elevado grado de consanguinidad genética que puede acarrear la manifestación de numerosos defectos congénitos. Es decir, la autopolinización no promueve la variabilidad genética, por lo tanto, las plantas que utilizan este mecanismo generalmente presentan una disminución, tanto en rendimiento como en calidad (FRANKEL y GALUN, 1977; FREE, 1993). STRASBURGER et al. (1994), indican que la autogamia se produce en flores hermafroditas, mientras que geitonogamia se produce obligadamente en individuos monoicos, pero también puede presentarse en individuos hermafroditas con diferente grado de madurez sexual. 2.3.1.2 Polinización cruzada. ROOT (1976) la define como la transferencia del polen desde la flor de un cultivar, a otra planta de un cultivar diferente. Es decir, cuando la procedencia del polen a una flor es de otro pie de planta genéticamente diferente. STRASBURGER et al. (1994), añaden que el éxito de la polinización, la producción de semillas capaces de germinar y la prosperidad de la descendencia dentro de una 11 misma especie, en general, son mayores cuando la polinización es cruzada que cuando es autógama, esto debido a que aumentan las posibilidades que se forman nuevas combinaciones de factores hereditarios. 2.3.2 Transporte del polen. Existen dos vías principales de transporte de polen desde la antera al estigma de la flor. Puede ser llevado por los insectos (polinización entomófila), o bien puede ser conducido por el viento (polinización anemófila) (WESTWOOD, 1982). Según Mc GREGOR (1976), ambas son las más importantes para la mayoría de las plantas. 2.3.2.1 Polinización anemófila. El transporte de polen se produce por medio del aire. Es un tipo de polinización poco segura, y las plantas deben producir grandes cantidades de polen para tener posibilidades de que algún grano llegue hasta el estigma de otra flor de distinta planta (RALLO, 1986). 2.3.2.2 Polinización entomófila. El polen es transferido por medio de insectos. En este caso el transporte de polen alcanza un radio de acción más reducido, que depende de la conducta del vector (RALLO, 1986). Las plantas que requieren de polinización cruzada deben presentar uno o más factores de atracción que la hagan ser visitada por los insectos polinizadores, tales como la abundancia de néctar, polen o ambos (RALLO, 1986), además de poseer medios llamativos (color, olor, etc.) y polen viscoso que asegure su adherencia al visitante logrando llegar al estigma de otras flores (Mc GREGOR, 1976). NEIRA et al. (1997), señalan que el atractivo que ejerce un cultivo sobre los insectos estaría basado en el color de las flores, aroma, volumen del néctar, concentración y tipo de sus azúcares. Además es importante la cantidad de flores disponibles durante el período de floración. 2.4 Características de los insectos polinizadores. FREE (1993), señala que muchos insectos visitan las flores en busca de recompensa, pero relativamente pocos son buenos polinizadores. Para ser un eficiente polinizador, un insecto debe visitar varias flores de la misma especie sucesivamente, moverse frecuentemente de una flor a otra llevando abundante polen en su cuerpo y cepillarse contra los estigmas de las flores y así transferir el polen. 12 Muchos insectos son ineficaces en el proceso de polinización y muchos otros ocasionalmente lo hacen, debido a su comportamiento, tamaño pequeño y superficies del cuerpo lisas. Los insectos polinizadores más importantes son las abejas melíferas, abejas solitarias, abejorros y diversas moscas. Sin embargo, aunque los cuerpos peludos de muchas moscas llevan tanto o más polen sobre sus cuerpos que las abejas, no trabajan sobre las flores tan persistentemente. Otros insectos visitan igualmente las flores de muchos cultivos, sin embargo, carecen de suficiente pilosidad en su cuerpo y los necesarios patrones de comportamiento, y probablemente pocos transfieren el polen desde las anteras al estigma de las flores que visitan (FREE, 1993). Entre las especies de insectos, la eficiencia como agentes polinizadores varía significativamente (DAVIS, 1997). WILSON y THOMPSON (1991) mencionan que los insectos son diferentes en su efectividad como polinizadores debido a que difieren, principalmente, en tamaño y conducta, agregando que una alta remoción de polen no se traduce en una alta depositación siguiente del mismo o en altas producciones de semillas. Además, los insectos que son colectores de polen remueven mucho, pero depositan menos que los colectores de néctar, siendo estos últimos los más eficientes. En las abejas y otros himenópteros, la visita repetida varias veces con éxito a un tipo de flor determinada, provoca una especie de asociación, una fijación a la misma durante un cierto tiempo y una gran actividad de recolección (STRASBURGER et al., 1994). CUADRO 1 Importancia porcentual de los grupos de insectos que visitan los cultivos. Tipo de insecto Visitas (%) Insectos domésticos: abejas. 73-88 Insectos silvestres: Abejorros y abejas 6-21 silvestres. Moscas, mosquitos, escarabajos, mariposas, polillas, etc. FUENTE: RALLO (1986) 6-14 13 2.4.1 Clasificación de los insectos polinizadores. Debido a la gran cantidad de insectos que visitan las flores, diversos autores los clasifican y agrupan de acuerdo a sus características. ROOT (1976), agrupó a los insectos polinizadores de acuerdo a su importancia en el proceso de polinización. Grupo 1: Representa las especies más ineficientes desde el punto de vista de la polinización, ya que su acercamiento al polen o néctar estaría determinado por la única y exclusiva necesidad de satisfacer requerimientos alimenticios, que luego de ser satisfechos, provocan el alejamiento del insecto. Además carecen de estructuras adaptadas y la polinización que realicen es sólo accidental. Entre los insectos que se agrupan aquí están trips, escarabajos, mariposas, polillas y moscas. Grupo 2: Comprende abejas solitarias de muchas especies, ellas se aprovisionan de alimentos para su descendencia en desarrollo. La ventaja que presentan frente al grupo 1, es su abundante pilosidad y adaptaciones especiales para llevar polen. Esta posición se debe a que su mayor actividad polinizadora, no solo resulta por el acopio de alimentos para sí, sino que también, hay un instinto natural de proveer de los mismos a la descendencia. Esto último lleva consigo un instinto polinizador acentuado y continuo, con el resultado que cada insecto rinde un máximo trabajo. Un factor que restringe el número de individuos en una población, es la reducida capacidad de postura de la hembra, además de las pocas generaciones anuales. Grupo 3: Corresponden a insectos más evolucionados representados por los abejorros (Bombus sp), los cuales se caracterizan por acopiar alimentos, guardando los excedentes de polen y néctar en grandes celdas de almacenamiento en sus nidos. Tienen organización social, donde la reina es protegida por las obreras. La intensidad de visitas de los abejorros a las flores es muy pronunciada; por su tamaño y características físicas pueden llevar grandes cantidades de néctar y polen, pero éstas también son una desventaja, ya que las flores pequeñas no soportan su peso. Grupo 4: Insectos altamente evolucionados, su representante máximo es la abeja melífera (A. mellifera); considerada como el principal insecto polinizador. Aventaja a los otros insectos por su desarrollada vida social, que le permite perdurar a través del tiempo, sobreviviendo el invierno como unidad social compacta. Un instinto sobresaliente y superior a cualquier otro insecto, es su constante inclinación a acopiar 14 néctar y polen, todo lo cual tiene fundamento en el hecho que las exigencias alimenticias de una colonia pueden ser muy altas, tanto de miel como de polen. Las abejas serían el grupo más eficiente, pues visitan las flores metódicamente colectando polen y néctar, sin dañar las flores al alimentarse, contribuyendo eficazmente a la polinización (ROOT, 1976). LOBOS (1995) y ULLOA (1997), en frambueso (Rubus idaeus L.) y arándano (Vaccinium corymbosum L.), respectivamente, en Chile señalan a los órdenes Hymenoptera y Diptera como los más abundantes, destacando las especies A. mellifera L. y los abejorros Bombus ruderatus Fab. y Bombus dahalbomii Guerin (Hymenoptera) como los polinizadores más importantes. De la misma forma, ANDRADE (2000), TAPIA (2000) y MORA (1999), en murta (Ugni molinae Turcz.), avellano (Gevuina avellana Mol.) y maqui (A. chilensis) respectivamente, en la zona sur de Chile, señalan al orden Hymenoptera como el principal grupo polinizador, destacando las especies A. mellifera, P. albopilosa, D. gayi y Corynura chloris Spin., como los polinizadores más importantes. 2.5 Factores climáticos que influencian las visitas de los insectos. Las condiciones climáticas en períodos cortos de tiempo son más incidentes que un promedio de condiciones a mediano o largo plazo (clima), dado que éste ya ha determinado los tipos de ecosistemas en regiones extensas. Toda la comunidad de un ecosistema se ve afectada directa o indirectamente por condiciones climáticas tales como temperatura, humedad, luz y vientos (APABLAZA, 2000). Las variables microclimáticas como luminosidad, viento, humedad y temperatura, afectan la actividad de los polinizadores en su comportamiento en la flores, así, diferentes polinizadores pueden responder diferencialmente a variaciones en el ambiente físico (KEVAN Y BAKER, 1983). Los mismos autores indican que la actividad de las abejas prácticamente se detiene bajo condiciones de lluvia y puede ser muy influenciada por factores como temperatura, viento y luminosidad. 2.5.1 Temperatura. La temperatura ambiente es un factor importante para el desarrollo de las actividades de los polinizadores. Las temperaturas bajas afectan la actividad de recolección de alimento, como también de vuelo (WESTWOOD, 1982; RIVEROS et al., 1991). 15 APABLAZA (2000), menciona que cada especie tiene un mínimo, óptimo y máximo de temperatura en el cual se desenvuelve. En A. mellifera, el factor temperatura reduce los vuelos de pecoreo drásticamente cuando ésta desciende de un mínimo de 13°C. Con temperaturas entre 15 y 26°C las abejas desarrollan una mayor actividad, la cual decrece al disminuir las temperaturas. Por debajo de los 10°C la actividad es nula, y sobre los 32°C las abejas orientan su actividad al acarreo de agua para ventilar la colmena (RALLO, 1986). 2.5.2 Humedad. La humedad atmosférica es el segundo factor en importancia. El efecto directo sobre los procesos fisiológicos de los insectos no es tan crítico como el de la temperatura, pero ambos factores juntos ejercen una notable influencia sobre la biología y también sobre la distribución de insectos, al afectar a plantas y animales (APABLAZA, 2000). La humedad, probablemente, tiene su mayor efecto indirecto sobre los insectos a través de su influencia sobre la concentración de néctar. Sin embargo, existen pocos estudios sobre el efecto de la humedad del aire en la actividad de los polinizadores (KEVAN Y BAKER, 1983) 2.5.3 Luminosidad. La luz tiene un efecto directo sobre el comportamiento de los insectos, e indirecto al intervenir en la fotosíntesis de plantas verdes. El fotoperíodo puede inducir diapausa o hibernación. La luz determina la actividad de los insectos diurnos, crepusculares y nocturnos. También influye en el apareamiento de algunos insectos, y en la estimulación del desarrollo, que tiende a ser más lento en insectos subterráneos y taladradores de madera. Los colores ayudan para ubicar los alimentos (APABLAZA, 2000). 2.5.4 Viento. Los vientos afectan indirectamente a los insectos al influenciar la evaporación, humedad y temperatura. Su mayor importancia radica en la diseminación de insectos. Cuando son de alta intensidad pueden causar gran mortalidad. Los vientos suaves pueden favorecer vuelos de dispersión (APABLAZA, 2000). El viento a velocidades muy altas, provoca que se detenga el forrajeo de los insectos. Este también puede afectar a través de la aerodinámica del vuelo por el movimiento de los olores de las flores, debido a que una mayor velocidad del viento, deben esforzarse más y gastar más energías (KEVAN y BAKER, 1983) 16 2.6 Diversidad biológica o biodiversidad La diversidad biológica constituye una de las características más destacables de nuestro planeta, es esencial para la sobrevivencia y bienestar económico de la humanidad, y juega un rol preponderante para el funcionamiento y estabilidad de los ecosistemas (SINGH, 2002). Sin embargo, el alto grado de impacto antrópico que actualmente amenaza este patrimonio, está desencadenando altas tasas de extinción de especies, en lo que se considera como el sexto evento de extinciones masivas en la historia de la vida en el planeta (DIRZO y RAVEN, 2003). El término biodiversidad es una contracción de la expresión “diversidad biológica” y refleja el número, la variedad y la variabilidad de los organismos vivos y cómo éstos cambian de un lugar a otro y con el paso del tiempo. Incluye la diversidad dentro de las especies (diversidad genética), entre especies (diversidad de las especies) y entre ecosistemas (diversidad de los ecosistemas) (GREENFACTS, 2006). Para United Nations Environmental Program (UNEP) (1992), citado por MORENO (2001), los insectos representan los componentes más numerosos de los ecosistemas terrestres, tanto en número de especies como de individuos; están distribuidos en todos los hábitats del mundo y constituyen el grupo de organismos más diversos. Los artrópodos engloban más del 85% de las especies animales conocidas del planeta. Se estima que sólo dentro de la clase insecta hay entre 1 y 10 millones de especies. Su distribución es cosmopolita, gracias a las características de su exoesqueleto, su capacidad de vuelo y su pequeño tamaño, lo que ha permitido que colonicen un sinnúmero de nichos ecológicos (GREENFACTS, 2006). WILSON (1999), menciona que existen entre 1,5 y 1,7 millones de especies descritas de los 13,6 millones de especies estimadas por el Global Biodiversity Assessment del Programa Ambiental de la Organización de las Naciones Unidas, siendo los insectos el grupo con mayor de especies, tanto conocidas como desconocidas. Es decir, todo nuestro conocimiento y las medidas para la conservación de la biodiversidad que se están generando actualmente, se basan en menos del 15 % de lo que realmente existe y en consecuencia, muchas de estas especies podrían extinguirse aún antes que sean descubiertas (PIMM y RAVEN, 2000). 17 2.6.1 Escalas de la diversidad. Uno de los aspectos de gran importancia para contextualizar temporal y espacialmente el estudio de la diversidad en los ecosistemas está referido a lo que se conoce como la escala de la diversidad. Esta puede ser medida en tiempos y espacios diferentes y corresponden a las denominadas diversidad alfa, diversidad beta y diversidad gamma (GLIESSMAN, 1998). De manera muy esquemática, la diversidad alfa está referida, habitualmente, a la diversidad de especies en un lugar determinado y en un área relativamente pequeña de una comunidad. Del mismo modo, la diversidad beta se entiende como la diversidad de especies a través de comunidades o hábitats. Finalmente, la diversidad gamma corresponde a una medida de la diversidad de especies de una región amplia. La utilidad de estos tres conceptos nos permiten describir como varían los ecosistemas y paisajes en su estructura y diversidad (PEREDO y BARRERA, 2002). 2.6.2 Diversidad de insectos. CASTILLO (2004), menciona que los insectos deben ser tomados en cuenta de manera importante en la conservación de los ecosistemas ya que proveen de una gran cantidad de servicios ecológicos a las comunidades, los ecosistemas y al paisaje, además de los servicios que le dan al ser humano. Son elementos claves dentro de la cadena alimenticia, ejercen un control natural sobre las plagas, su papel en la polinización de miles de especies de angiospermas es vital y su participación como descomponedores de materia orgánica junto con otros invertebrados y microorganismo es fundamental. 2.6.3 Medición de la diversidad. Según MORENO (2001), es necesario contar con parámetros que nos permitan monitorear el efecto de las perturbaciones sobre el ambiente y así tomar decisiones con el fin de conservar áreas o taxas amenazados. La gran mayoría de los métodos propuestos para evaluar la diversidad de especies se refieren a la diversidad dentro de las comunidades (alfa), siendo la variable mas medida en el estudio de la ecología de las comunidades. Sin embargo, este concepto ha resultado muy confuso, debido a que consta de tres componentes: el número de especies dentro de una comunidad (riqueza), la equidad (importancia relativa de cada especie) y la dominancia (parámetro inverso a la equidad) que hay entre las especies (MORENO, 2001). 18 El número de especies (riqueza) es quizás, el atributo más frecuentemente utilizado en la descripción de taxocenosis, ya que permite obtener información rápida y sencilla de su diversidad (MAGURRAN, 2004). Para integrar los parámetros mencionados, se utilizan los índices de diversidad, los cuales son herramientas que nos permiten tener una perspectiva de la situación de la comunidad, con el fin de realizar monitoreos ambientales y tomar decisiones de control y manejo (SPELLERBERG, 1991). Sin embargo, únicamente son números que no tienen un valor conceptual real, y por lo tanto, por si solos no dicen mucho (MAGURRAN, 2004). Es necesario obtener información sobre la historia y evolución de la comunidad, la función e interacción de los grupos estudiados dentro de la comunidad y comparar comunidades similares. WILSON (1999), indica que existen una gran cantidad de índices y una controversia general sobre cuál es el mejor, por lo tanto, es importante comprender lo que toma en cuenta cada índice con el fin de poder elegir el más apropiado. Dentro de los índices más importantes se encuentran los de Margalef, Gleason, Menhinick, Brillouin, Simpson y Shannon Wiener. Las diferencias principales tienen que ver con el peso que da cada índice a los componentes de riqueza, equidad y dominancia, la sensibilidad del índice al tamaño de la muestra, las características y conocimientos de la diversidad del área muestreada (MAGURRAN, 2004) Los índices de Margalef, Gleason, Menhinick no toman en cuenta la equitatividad, uno de los componentes de la biodiversidad y, por lo tanto, han dejado de ser tan útiles como los de Shannon Wiener y Simpson. En ocasiones resulta interesante utilizar diversos índices para complementar los análisis (CASTILLO, 2004). SAMWAYS (1984), indica que el índice de Shannon Wiener es utilizado para muestreos de comunidades grandes y con una diversidad indefinida. Asume que los individuos fueron muestreados aleatoriamente y que la mayoría de las especies están representadas en la muestra. Este índice es tan ampliamente utilizado que se ha convertido en una medida estándar en comparaciones de comunidades. Margalef (1992), citado por MELIC (1993), menciona que el valor del índice de Shannon - Wiener se incrementa con el número de especies en la comunidad y en 19 teoría pueden alcanzar valores muy altos, situándose en un máximo constante cercano a 5,3. El índice de dominancia de Simpson es útil para localizar la presencia de especies con valores altos de abundancia dentro de la comunidad (MAGURRAN, 2004), aunque no precisamente la especie dominante, ya que hay otros factores, además de abundancia, que hacen a una especie dominante (con alta influencia en el ecosistema), como pueden ser su tamaño corporal o su rol ecológico. 20 3 MATERIAL Y METODO 3.1 Material A continuación se realiza una descripción del lugar donde se realizó el estudio y los materiales utilizados. 3.1.1 Ubicación geográfica del muestreo. El estudio se realizó en dos zonas geográficas: a) Fundo Teja Norte. Perteneciente a la Universidad Austral de Chile, ubicado en la comuna de Valdivia, en el paralelo 39° 30’ S y 74° 04’ O, en la confluencia de los ríos Cruces y Cau Cau. El fundo tiene una extensión de 230 hectáreas y está conformado por parches de bosque nativo, con flora y fauna característica de la selva valdiviana. En esta zona geográfica se llevó a cabo el estudio correspondiente a maqui. b) Jardín Botánico de la Universidad Austral de Chile. Ubicado en el Campus Isla Teja, comuna de Valdivia, en el paralelo 39° 45’ S y 73° 14’ O. El jardín tiene una superficie de 10 hectáreas y se ubica a 9 m.s.n.m, contando con alrededor de 950 especies de plantas. En esta zona geográfica se llevó a cabo el estudio correspondiente a notro. 3.1.2 Características climáticas. El clima de Valdivia es templado lluvioso, con precipitaciones cercanas a 2.500 mm anuales, distribuidas en todas las estaciones, pero más abundantes en invierno. Las temperaturas máximas de verano excepcionalmente pueden superar los 30 °C, situándose en torno a 25°C y las mínimas se encuentran en el rango de 5° a 10 °C. En invierno, la temperatura máxima alcanza los 14°C y la mínima es cercana a 0 °C (UNIVERSIDAD AUSTRAL DE CHILE, 2004). 3.1.3 Características del suelo. El sitio de muestreo ubicado en el Jardín Botánico, corresponde a un suelo derivado de depósitos fluviales, no asociado a ninguna serie conocida1. El sitio de muestreo ubicado en el Fundo Teja Norte, corresponde a un NISSEN, J. (2012). Ingeniero Agrónomo, Dr. Instituto de Ingeniería Agraria y Suelos, Universidad Austral de Chile. Comunicación personal. 1 21 suelo proveniente de cenizas volcánicas, que pertenece a una zona de transición entre la serie Correltué y Valdivia (SCHLEGEL, 1983). 3.1.4 Material vegetal. En el Fundo Teja Norte se seleccionaron cuatro ejemplares correspondiente a la especie maqui y en el Jardín Botánico cuatro ejemplares correspondientes a la especie notro. Tanto para maqui como para notro, los ejemplares seleccionados se establecieron en forma natural y no cuentan con ningún tipo de manejo, teniendo un desarrollo natural, sin intervención antrópica como fertilización, poda, control de malezas, entre otros. 3.1.5 Instrumentos y materiales utilizados. Los instrumentos y materiales utilizados en el trabajo experimental de este estudio, tanto en campo como laboratorio, son los siguientes: Instrumentos y materiales de campo. Red entomológica, termohigrómetro marca Veto, frascos de vidrio, cinta autoadhesiva, cinta plástica, planillas de registro. Instrumentos y materiales de laboratorio. Microscopio marca Zeiss 500x de aumento, lupa marca Leica 40x de aumento, claves de identificación entomológica para la clasificación de insectos, de los autores CHIAPPA et al. (1990); ARTIGAS (1994a); ARTIGAS (1994b) y PEÑA (1988), e insectarios de los ordenes recolectados, pertenecientes al Laboratorio de Entomología del Instituto de Producción y Sanidad Vegetal de la Universidad Austral de Chile (UACH). 3.2 Método A continuación se describen las metodologías utilizadas para llevar a cabo el estudio. 3.2.1 Periodo experimental. El ensayo se realizó entre el 26 de octubre y el 05 de diciembre de 2011, periodo en el que las especies estudiadas se encontraban en el estado de plena floración. 3.2.2 Instalación del estudio. Para seleccionar las plantas, se utilizó el criterio de ubicación espacial, quedando los árboles distribuidos a una distancia promedio entre ellos de 200 m en el caso de notro y 150 m en maqui. Además, se consideraron 22 parámetros como: homogeneidad de la estructura de la planta; altura promedio (5 m en notro y 3,5 m en maqui); diámetro promedio a la altura del pecho (DAP) (30 cm en notro y 10 cm en maqui); sanidad de plantas (árboles con buen estado sanitario, que no presentaran signos y/o síntomas visibles de enfermedades o plagas) y porcentaje de floración al iniciar el estudio (plantas con menos de 30% de flores abiertas). Considerando lo acotado del periodo de floración de maqui, su característica dioica y el estado de la floración al momento de comenzar el estudio, las observaciones se realizaron sólo en ejemplares con flores masculinas, ya que a diferencia de los ejemplares con flores femeninas, evidenciaron un mayor porcentaje de flores cerradas (considerando el estándar propuesto), lo que permitió obtener una mayor cantidad de observaciones. Los arboles fueron enumerados del 1 al 4 y de forma aleatoria se asignó el horario que les correspondieron las observaciones y colectas, en los días definidos para ello. 3.2.3 Evaluación de la entomofauna asociada a flores de notro y maqui. Para identificar las principales especies de insectos que visitan las flores de notro y maqui, en cada árbol seleccionado se delimitó una superficie de observación correspondiente a 2 m2, ubicada en la cara norte de cada uno de ellos y a una altura aproximada de 1,5 m, las cuales se marcaron con cinta plástica. Las observaciones y capturas se realizaron en un intervalo promedio de 4 días en cada uno de los árboles seleccionados, estableciendo para ello dos horarios diferentes: uno por la mañana desde las 11:00 h hasta las 13:00 h (GMT -3) y uno por la tarde - desde las 14:00 h hasta las 16:00 h (GMT -3) - con una duración de las observaciones de 20 minutos por árbol y un intermedio de 10 minutos, tiempo que permitió el traslado entre los individuos observados. Por medio de una red entomológica, se colectaron todos los insectos que visitaron las flores en la superficie de observación delimitada, a una distancia de 1,5 m aproximadamente para evitar distraerlos. Cada insecto se depositó en un frasco de vidrio etiquetado con el nombre de la especie arbórea, fecha, hora y el número del árbol en que se efectuó dicha captura. Posteriormente fueron llevados al Laboratorio de Entomología del Instituto de Producción y Sanidad Vegetal de la Universidad Austral 23 de Chile, donde fueron congelados a – 18 °C, para evitar su descomposición y así realizar su posterior clasificación. Los insectos colectados fueron clasificados al máximo nivel taxonómico posible (especie), utilizando para ello claves de identificación y consulta a especialistas (especialmente para la clasificación de insectos de la familia Syrphidae2). Para la clasificación taxonómica se utilizaron las claves de identificación entomológicas de CHIAPPA et al. (1990); ARTIGAS (1994a); ARTIGAS (1994b) y PEÑA (1988). Además, se revisó la colección de insectos pertenecientes al Laboratorio de Entomología del Instituto de Producción y Sanidad Vegetal de la Universidad Austral de Chile (UACH). 3.2.4 Medición de la intensidad de floración. Con el propósito de determinar los posibles efectos de la intensidad de la floración sobre el número de visitas de los insectos, en la superficie de observación definida (2 m2), se delimitó con cinta plástica una superficie de 0,25 x 0,25 m (parche), donde se contabilizó el número de flores abiertas en cada árbol seleccionado cada día de observación, durante todo el periodo de estudio. Se consideró flor abierta, aquella en que el insecto visitante era capaz de introducir su cuerpo. 3.2.5 Registro de factores ambientales. Con el propósito de determinar la relación entre algunos factores ambientales que puedan afectar la visita de los insectos en los horarios de observación y colecta, se registró la temperatura y humedad por medio de un termohigrómetro ubicado a la sombra, a una altura aproximada de 1,5 m en cada uno de los árboles. La información permitió hacer correlaciones entre las variables con la visita de los insectos colectados. 3.2.6 Establecimiento de índices de diversidad de la entomofauna colectada. Según lo planteado por MORENO (2001), para describir la diversidad alfa de las comunidades de insectos asociadas a notro y maqui, se utilizaron tres índices complementarios entre sí, los cuales se explican a continuación: La riqueza específica (S), la cual describe el número total de especies obtenidos en los muestreos censales. CARRILLO, R. (2012). Ingeniero Agrónomo, M.Sc., Ph.D. Instituto de Producción y Sanidad Vegetal, Universidad Austral de Chile. Comunicación personal. 2 24 Para establecer la equidad de especies, se utilizó el índice de diversidad de Shannon Wiener (H’), el cual es el más utilizado entre los índices de diversidad y requiere de dos tipos de variables: el número de especies y el número de individuos en cada especie. La fórmula se describe en la ecuación 3.1: H’ = – ∑pi ln pi (3.1) Donde: H’ = Indice de diversidad pi = Abundancia proporcional de la especie i. Para su cálculo, se utiliza la fórmula expresada en la siguiente ecuación: pi = ni/N Donde ni = Número de individuos de la especie i N = Número de todos los individuos de todas las especies Según Margalef (1992), citado por MELIC (1993), el índice de Shannon Wiener (H’) tiene, posiblemente, una ventaja sobre otros índices: tiene un valor máximo constante en torno a 5,3, por lo tanto, conocido un resultado, puede compararse directamente con éste como medida de referencia. Finalmente, se calculó el índice de dominancia de Simpson (l), el cual expresa la probabilidad que dos individuos tomados al azar de una muestra, sean de la misma especie (MORENO, 2001). El índice varía entre 0 y 1, por lo tanto, si la probabilidad de que ambos individuos pertenezcan a la misma especie es alta o se aproxima a uno, entonces, la diversidad de la muestra es baja (MIJAIL, 2004). La fórmula se describe en la ecuación 3.2: l = ∑pi 2 (3.2) 25 Donde: l= Indice de Simpson pi = Abundancia proporcional de la especie i. El índice de Simpson es inverso a la equidad, por lo que la diversidad puede calcularse como 1-l (LANDE, 1996). De esta forma, los valores de diversidad también varían entre 0 y 1, pero ahora, cuando mayor es el valor, mayor es la diversidad de la comunidad. El índice de diversidad calculado de esta manera, representa la probabilidad que dos individuos seleccionados al azar de una muestra, pertenezcan a diferentes especies. 3.2.7 Análisis estadístico. Los datos obtenidos fueron sometidos a pruebas de normalidad, utilizando para ello el test de Shapiro-Wilk, lo que permitió determinar si los datos presentaban una distribución normal. Posteriormente, los datos fueron sometidos a una prueba de homogeneidad de varianzas (ZAR, 1999) Para determinar las relaciones que pudiesen existir entre el número de insectos que visitan las flores de notro y maqui con las variables de temperatura, humedad relativa y el número de flores abiertas en el parche delimitado (0,25 x 0,25 m), se realizó un análisis de correlación de Pearson, así como la determinación del valor de probabilidad asociada (ZAR, 1999). Para determinar si existían diferencias significativas entre las visitas realizadas por los insectos durante el horario de la mañana y el horario de la tarde, se realizó un análisis de bondad de ajuste para la frecuencia observada, a través de la prueba G, con un nivel de significación del 5 % (SOKAL y ROHLF, 1995) 26 4 PRESENTACION Y DISCUSION DE RESULTADOS 4.1 Entomofauna asociada a flores de notro y maqui. La entomofauna asociada a flores de notro y maqui se muestran en los cuadros 2 y 3. La identificación y cuantificación de los insectos que visitaron las flores de ambas especies arbóreas se realizó mediante la observación y colecta de las especies de insectos que visitaron las plantas e introdujeron su cuerpo en la flor. CUADRO 2 Insectos visitadores de las flores masculinas de maqui, número y frecuencia relativa de las visitas durante el periodo experimental. Orden Familia Especie Hymenoptera Apidae Apis mellifera L. Apidae Bombus terrestris L. 7 5,47 Apidae Bombus dahalbomii Guerin 1 0,78 Colletidae Policana albopilosa Spin. 26 20,32 Colletidae Diphaglossa gayi Spin. 22 17,19 Colletidae Cadeguala occidentalis (Haliday) 2 1,56 Halictidae Ruizantheda mutabilis Spin. 3 2,34 Halictidae Ruizantheda sp. 6 4,69 125 97,66 3 2,34 3 2,34 128 100,00 Subtotal del orden Diptera Subtotal del orden Total Syrphidae Carposcalis fenestratum (Macquart) Visita (N°) 58 Frecuencia relativa (%) 45,31 27 CUADRO 3 Insectos visitadores de las flores de notro, número y frecuencia relativa de las visitas durante el periodo experimental. Orden Familia Especie Hymenoptera Apidae Apis mellifera L. Apidae Bombus terrestris L. Colletidae Cadeguala occidentalis (Haliday) Colletidae Subtotal del orden Diptera Subtotal del orden Total Visita (N°) 122 Frecuencia relativa (%) 45,52 14 5,23 8 2,99 Diphaglossa gayi Spin. 44 16,43 Halictidae Corynura chloris Spin. 1 0,37 Halictidae Ruizantheda mutabilis Spin. 7 2,61 Halictidae Ruizantheda sp. 30 11,20 Vespidae Polistes dominulus Christ 1 0,37 227 84,72 Allograpta pulchra Shannon 7 2,61 Carposcalis chalconatus (Philippi) 4 1,49 Carposcalis fenestratum (Maquart) 6 2,24 Dolichogyna nigris Bigot 13 4,85 Scaeva occidentalis Shannon 4 1,49 Syrphus melanostoma Nob. 1 0,37 Syrphus sexamaculatus Maquart 2 0,74 Syrphus similis Bl. 4 1,49 41 15,28 268 100,00 Syrphidae 28 En el cuadro 2 y 3 se observa que del total de insectos recolectados durante el período de observaciones, los del orden Hymenoptera realizaron el mayor número de visitas tanto para maqui como para notro, con un 97,66% y 84,72% del total respectivamente, comparado con las visitas realizadas por insectos del orden Diptera. Dentro del orden, A. mellifera fue la especie con mayor frecuencia relativa con un 45,31% de visitas en maqui y un 45,52% de visitas en notro. En maqui, en segundo lugar se ubica P. albopilosa con un 20,32% y tercero D. gayi con un 17,19%. En notro, en segundo lugar se encuentra D. gayi con un 16,43 % y tercero Ruizantheda sp con 11,2 %. La información es coincidente con la clasificación elaborada por ROOT (1976) para los insectos polinizadores, donde el orden Hymenoptera estaría incluido en los grupos tres y cuatro, que corresponden a los principales insectos polinizadores. Según KEVAN y BAKER (1983), la superfamilia Apoidea es la más importante y altamente adaptada del orden Hymenoptera. Los insectos de este grupo son muy diversos morfológicamente y en su conducta, así como taxonómicamente. Sus partes bucales están bien adaptados para embeber néctar y sus cuerpos para recoger el polen. Son casi en su totalidad antófagos, tanto en sus estados larvales como adultos. Según lo anterior y considerando la información obtenida, los resultados son coherentes con los obtenidos por MORA (1999) para maqui, en la zona de Valdivia, donde sitúa al orden Hymenoptera con un 95,31 % de las visitas (similar al 97,66 % obtenido en este estudio), siendo P. albopilosa la especie mayoritaria con un 87,5%, información que evidencia la alta vinculación de este insecto con maqui, lo que es confirmado por los datos expuestos en el presente estudio y que también fue reportado por JOSEPH (1960), quien evidenció la alta presencia de Policana herbsti Fr. sobre plantas de maqui, la cual de acuerdo a ROZEN (1984), corresponde a P. albopilosa. Sin embargo, el estudio de MORA (1999) evidenció una baja presencia de A. mellifera sobre flores de maqui, lo que no es coincidente con la información obtenida por este estudio, donde A. mellifera aparece como el insecto que visitó mayoritariamente a maqui (45,31%). La importancia exhibida por A. mellifera tanto para notro como maqui (45,52% y 45,31% respectivamente), se podría explicar según lo propuesto por MASIS y LEZAMA (1991), quienes señalan que la superioridad de la abeja melífera como visitante por 29 sobre los demás insectos, se debe a diversos factores, tales como: una mayor capacidad de comunicación, mayor sentido de distancia y dirección entre la colmena y la fuente de alimento, tamaño corporal y por poseer colonias numerosas. Es importante mencionar que durante el periodo de muestreo, no existieron colmenas de A. mellifera en el radio de acción de este insecto, que pudiesen incidir en los resultados obtenidos. Con respecto a D. gayi, RIVEROS et al.(1991), en un estudio realizado en Parque Nacional Puyehue, Región de Los Ríos, Chile, encontraron especies de la familia Colletidae y Halictidae, entre otras, como visitadoras de flores de maqui. De la misma forma, un estudio realizado por AIZEN et al. (2002) en el Parque Nacional Nahuel Huapi, Argentina, determinaron que otra especie de la misma familia Cadeguala albopilosa Spin. (Colletidae:Diphaglossinae), fue el polinizador casi exclusivo de maqui. La figura 6 resume la frecuencia relativa de visitas realizadas por insectos a flores de notro y maqui. FIGURA 3 Frecuencia relativa de visita de insectos en notro y maqui. 30 La figura anterior muestra las visitas realizadas por P. albopilosa, D. gayi, Ruizantheda mutabilis Spin., C. occidentalis, B. dahalbomii, Corynura chloris Spin. a flores de notro y maqui. Los insectos mencionados se encuentran entre los apidos chilenos nativos, dentro de los cuales, la familia Colletidae destaca por poseer la mayor diversidad de especies, mientras que la familia Halictidae muestra una menor diversidad (TORO et al., 2009). Esta mayor presencia de especies de insectos nativos, sobre arbustos y/o árboles también nativos, hace suponer que existe algún grado de interdependencia insecto-flor, que en el caso de maqui, se beneficiaría por el transporte de granos de polen hacia las flores femeninas, debido a que requiere obligadamente de un agente externo que asegure la llegada del polen al estigma, mientras que los insectos podrían obtener néctar y polen. (a) FIGURA 4 (b) (a) Apis mellifera (Hymenoptera: Apidae) y (b) Diphaglossa gayi (Hymenoptera: Colletidae) visitando flores de notro . 31 Las flores de Embothrium son visitadas por más de 20 especies, que incluyen 2 órdenes de aves: Passeriformes y Apodiformes, y 4 órdenes de insectos: Hymenoptera, Diptera, Lepidoptera y Coleoptera (ROVERE y CHALCOFF, 2010). Según las mismos autoras, los polinizadores de E. coccineum son diversos y abundantes, tanto morfológica como taxonómicamente, ya que existe una gran variación geográfica, no solo en la composición del mismo sino también en las frecuencias de visitas de éstos. No solo visitantes frecuentes de ciertas poblaciones están completamente ausentes en otras, sino que además la misma especie de polinizador visita de manera diferente (en términos de frecuencia de visitas) cada población en la que está presente. Chalcoff (1998), citado por ROVERE y CHALCOFF (2010) y SMITH-RAMIREZ y ARMESTO (1998), indican que entre los principales insectos polinizadores se encuentran algunos como el díptero Trichophthalma sp., los himenópteros D. gayi, Corynura sp., abejorros (Bombus sp.) y la abeja doméstica (A. mellifera), los cuales son visitantes frecuentes a lo largo de buena parte de su distribución. Esta información es coincidente con los resultados obtenidos en el presente estudio, donde A. mellifera (45% de las visitas), D. gayi (17% de las visitas), B. terrestris (5% de las visitas) y Corynura chloris (0,4% de las vistas), fueron observados visitando E. coccineum. En toda el área de distribución de Embothrium y desde la introducción del abejorro exótico B. terrestris (aproximadamente en 1998 en Chile), se ha observado robo de néctar por este insecto en flores de Embothrium. Los abejorros realizan un orificio en la base de la corola accediendo al néctar de manera ilegítima. Este robo puede tener importantes implicancias en el éxito reproductivo de la especie, si además del daño directo producido en los tejidos reproductivos, el abejorro compite con los polinizadores nativos por el recurso del néctar y así evita o disminuye la visita de éstos (ROVERE y CHALCOFF, 2010). Las afirmaciones expresadas por las autoras, no fueron corroboradas en las observaciones realizadas, considerando que la presencia de B.terrestris en el lugar de estudio tuvo una frecuencia relativa de visitas del 5% (Cuadro 2). 32 En notro, interesante es la presencia del orden Diptera, representado por la familia Syrphidae, que alcanza un 15,28% de las visitas, con ocho especies presentes, a diferencia de maqui, que fue visitada por una sola especie. LLORENS (1990); KEVAN y BAKER (1983) y TOOKER et al., (2006), señalan que los sírfidos son algunos de los enemigos naturales más importantes de los artrópodos herbívoros, siendo los adultos muy activos, ya que vuelan durante el día entre las flores succionando néctar. Las proteínas del polen les son necesarias para la maduración de las gónadas y, por lo tanto, para realizar la puesta que puede alcanzar los 1000 huevos por hembra adulta. Esto implica que después de los himenópteros, algunos dípteros de la familia Syrphidae son polinizadores potenciales, debido a su abundancia, mayor diversidad y movilidad. La dependencia nutricional de los recursos florales mencionados, sugiere que los sírfidos podrían regular las plagas de insectos herbívoros en aquellas comunidades de plantas donde exista una oferta de polen y néctar interesante (KEVAN y BAKER, 1983 y TOOKER et al., 2006). El control efectivo de las especies de plagas por esta forma de control biológico conservativo, dependerá del conocimiento que se tenga de las asociaciones entre las floraciones anfitrionas y estos agentes de control biológico. 4.1.1 Influencia del horario en las visitas de los insectos. La influencia que pudo haber tenido el horario de muestreo en el número de visitas realizadas por los insectos a flores de notro y maqui durante el día, se muestran en los cuadros 4 y 5 y en las figuras 5 y 6. Para notro y maqui, no se registraron diferencias estadísticamente significativas entre las visitas realizadas por el total de los insectos durante la mañana y la tarde, tal como lo muestra la figura 5 y 6. Lo mismo sucedió con el total de insectos pertenecientes a los órdenes Hymenoptera y Diptera (Syrphidae), los cuales, estadísticamente, visitaron las flores con la misma frecuencia durante el horario de la mañana como el de la tarde. 33 CUADRO 4 Número de visitas totales realizadas por los insectos a flores masculinas de maqui en relación con el horario de visita. Especie insecto Mañana (11:00 – 13:00 AM) 32 Tarde (14:00 – 16:00 PM) 26 Bombus dahalbomii 0 1 Bombus terrestris 3 4 Cadeguala occidentalis 0 2 Carposcalis fenestratum 0 3 Diphaglossa gayi 6 16 11 15 Ruizantheda mutabilis 0 3 Ruizantheda sp. 1 5 53 75 Apis mellifera Policana albopilosa Total De lo anterior se infiere que entre mañana y tarde, el flujo de visitas de insectos es similar, lo mismo sucede cuando el análisis se desagrega en los órdenes Hymenoptera y Diptera. Sin embargo, la literatura menciona que los insectos muestran diferente actividad a través del día. Por ejemplo, para P. albopilosa , muy ligado a maqui, JOSEPH (1960) menciona que tendría preferencia por realizar las visitas en horas tempranas de la mañana o en las últimas horas de la tarde. Esto también es mencionado por ROZEN (1984), respecto a las especies de la subfamilia Diphaglossinae, las cuales presentan hábitos preferentemente crepusculares o nocturnos, representando a la única subfamilia, dentro de las abejas, que presenta esta tendencia. 34 Letras distintas indican diferencias estadísticas significativas al 5 % (prueba G). FIGURA 5 Número de visitas (totales) del orden Hymenoptera; Diptera (Syrphidae) e insectos totales, entre mañana y tarde, en flores masculinas de maqui. Existen estudios que demuestran que la actividad de los insectos varía en el transcurso del día y además que dentro de un periodo determinado la naturaleza de dicha actividad es diferente. HEARD (1994), al referirse a este parámetro, observó en flores de macadamia, que el periodo de mayor actividad fue al mediodía, coincidente con las temperaturas más altas, Así, de este modo, A. mellifera se encontraba recolectando néctar y Trigona carbonaria Smith colectando principalmente polen. En A. mellifera, el factor temperatura reduce los vuelos de pecoreo drásticamente. Con temperaturas entre 15 y 26°C las abejas desarrollan una mayor actividad, la cual decrece al disminuir las temperaturas, siendo nula bajo los 10 °C. Sobre los 32 °C, las abejas orientan su actividad al acarreo de agua para ventilar la colmena (RALLO, 1986). En este caso, las temperaturas en los horarios de evaluación fueron adecuadas para el pecoreo de las abejas. SOTOMAYOR (1999) y TAPIA (2000), en estudios de entomofauna asociada a murta (Ugni molinae Turcz) y avellano (Gevuina avellana Mol.) respectivamente, realizados 35 en la zona de Valdivia, evidenciaron diferencias en el número de visitas de insectos, en los distintos horarios de muestreo a través del día. Las diferencias en la actividad de los insectos durante el día, se explicaría según lo propuesto por Biri (1976), citado por RIOS (1996), quien sostiene que a pesar de que el néctar se forma en las flores, no siempre junto a una abundante floración, corresponde una gran producción de néctar, ya que su formación está muy influenciada por condiciones ambientales. La secreción de néctar sigue un ciclo diario, alcanzando un máximo a una hora determinada, por lo que la atracción de las flores sobre los polinizadores puede variar a distintas horas del día en las distintas etapas de la floración (FREE, 1993). Letras distintas indican diferencias estadísticas significativas al 5 % (prueba G) FIGURA 6 Número de visitas (totales) del orden Hymenoptera; Diptera (Syrphidae) e insectos totales, entre mañana y tarde, en flores de notro. 36 CUADRO 5 Número de visitas realizadas por los insectos a flores de notro en relación con el horario de visita. Especie insecto Mañana (11:00 – 13:00 AM) 5 Tarde (14:00 – 16:00 PM) 2 66 56 Bombus terrestris 8 6 Cadeguala occidentalis 6 2 Carposcalis chalconatus 1 3 Carposcalis fenestratum 4 2 Corynura chloris 0 1 Diphaglossa gayi 24 20 Dolichogyna nigris 7 6 Polistes dominulus 1 0 Ruizantheda mutabilis 3 4 11 19 Scaeva occidentalis 1 03 Syrphus melanostoma 0 01 Syrphus similis 1 03 Syrphus sexamaculatus 1 01 139 129 Allograpta pulchra Apis mellifera Ruizantheda sp. Total 37 4.2 Relación entre el número de flores abiertas, las variables climáticas y la visita de insectos en notro y maqui. Las variables climáticas (temperatura y humedad) son conocidas por su influencia en la actividad polinizadora de los insectos y su comportamiento en las flores. Es así, como diferentes insectos polinizadores, pueden responder en forma distinta a una variación en el medio ambiente (WILLMER, 1983). Al respecto, Herrera (1995b) y Rozzi et al.(1997), citados por TORRES-DIAZ et al. (2007) mencionan que se ha documentado que las variaciones microclimáticas pueden determinar las diferencias en la composición de polinizadores asociados a plantas individuales o poblaciones de plantas. Los cuadros 6 y 7 reportan las correlaciones existentes entre las variables climáticas, el número de flores abiertas y la visita de insectos en notro y maqui. CUADRO 6 Relación entre el número de flores abiertas, las variables climáticas y la visita de insectos en notro. N° flores abiertas Temperatura del aire (°C) 0,23 1 Humedad relativa del aire (%) -0,42 N° flores abiertas --- N° total visitas de insectos 0,62 0,60 -0,56 (0,032) (0,038) (0,056) (0,476) 2 (0,179) Hymenoptera 0,71 0,63 -0,63 (0,01) (0,028) (0,03) Diptera (Syrphidae) -0,56 -0,05 0,23 (0,093) (0,89) (0,525) A. mellifera 0,89 0,44 -0,50 (0,000) (0,155) (0,097) D. gayi 0,76 0,67 -0,47 (0,005) (0,018) (0,123) 1 Coeficiente de correlación de Pearson 2 Valor de probabilidad 38 CUADRO 7 Relación entre el número de flores abiertas, las variables climáticas y la visita de insectos en maqui. N° flores abiertas Temperatura del aire (°C) -0,85 1 Humedad relativa del aire (%) 0,41 N° flores abiertas --- N° total visitas de insectos 0,27 0,12 -0,07 (0,554) (0,802) (0,876) (0,016) 2 (0,364) Hymenoptera 0,26 0,13 -0,06 (0,568) (0,789) (0,903) A. mellifera -0,11 0,34 -0,20 (0,816) (0,450) (0,661) P. albopilosa 0,79 -0,52 0,43 (0,033) (0,229) (0,332) D. gayi 0,61 -0,23 0,21 (0,145) (0,616) (0,657) 1 Coeficiente de correlación de Pearson 2 Valor de probabilidad Para notro, se puede observar en el cuadro 6, que la variable número de flores abiertas correlacionó positivamente con el total de visitas realizadas por los insectos de todos los órdenes; con las visitas totales del orden Hymenoptera, con A. mellifera y D. gayi. Es decir, a medida que aumenta el número de flores abiertas, aumenta el número de visitas del orden e insectos mencionados. Existe una correlación negativa con la familia Syrphidae (Diptera) igual a -0,56, pero ésta no fue estadísticamente significativa, lo cual podría haber indicado una exclusión de ellos, al aumentar las otras especies que reaccionan positivamente aumentando su presencia. Al respecto, KEVAN y BAKER (1983) señalan que la mayoría de los insectos visitan las flores para alimentarse. Aunque el polen se cree ha sido el alimento original solicitado por los Hymenoptera más primitivos, el néctar es ahora la recompensa que más utilizan. El néctar es principalmente azúcar en solución acuosa y proporciona la energía como carbohidratos para el vuelo de muchas especies de insectos, aunque a veces los lípidos juegan un papel importante. La disposición de néctar está de acuerdo 39 con las necesidades energéticas de estos visitantes. Así, las flores influyen en la cantidad de movimientos interflorales de los insectos. Este delicado equilibrio es mantenido de la siguiente forma: un visitante no debe quedar saciado antes de realizar el número requerido de visitas que asegure la polinización necesaria para la reproducción de la planta y, sin embargo, debe recibir suficiente recompensa para mantener su interés en la visita. En notro (cuadro 6), la variable temperatura correlacionó positivamente con el total de visitas realizadas por los insectos de todos los órdenes; con las visitas totales del orden Hymenoptera y con D. gayi, por lo que al aumentar la temperatura, existe un aumento en las visitas de los insectos del orden Hymenoptera, en especial de D. gayi. Esto permitiría inferir que, para Hymenoptera, temperaturas más elevadas le son más propicias que para los otros ordenes. Esto le permitiría a Hymenoptera, pecorear en momentos en que los dípteros tienen una baja actividad o están ausentes. Al respecto, FREE (1993), señala que la temperatura afecta la fisiología de las flores, actuando sobre la producción de polen y néctar, por lo que la atracción que las flores ejercen sobre los polinizadores, va a registrar variaciones tanto en las horas del día, como en las distintas etapas de la floración. Los efectos de la temperatura a menudo están estrechamente relacionados con los efectos de la luz. En abejas melíferas, la temperatura más baja a la que van a comenzar su actividad es de aproximadamente 10 °C, pero en el vuelo de primavera por lo general comienza en 12 a 14 °C y 14 a 16 °C en verano. La alimentación se realiza principlamente a 18 °C (KEVAN y BAKER, 1983). Al considerar el efecto de la temperatura directamente sobre los insectos vistantes, es importante mencionar en términos generales que los insectos ectotermos son principalmente dípteros y lepidópteros, mientras que dentro de los endotermos predominan los himenópteros (HEINRICH 1975). Sin embargo, en el caso de los insectos endotermos, donde se encuentra el orden Hymenoptera. MENA (2000) señala que la producción de calor en ellos no suele ser continua. Y aunque se ha descrito la producción de calor en actividades como incubación de los nidos, o competencia por el alimento, la generación interna de calor en los insectos está asociada, de modo general, únicamente a la actividad de vuelo y sus preparativos; comportándose como 40 ectotermos durante el resto de sus actividades. Por lo tanto, su principal fuente de calor procederá del calor existente en su entorno, detalle este último que les hace depender de la temperatura ambiente existente a la hora de llevar a cabo sus diferentes actividades Siguiendo con el análisis de correlaciones en notro (cuadro 6), la variable humedad relativa correlacionó negativa y significativamente con las visitas totales del orden Hymenoptera (-0,63). En tanto, A. mellifera, también correlacionó negativamente con la variable(-0,50 ; p=0,097). Para el orden Hymenoptera, y en especial para A. mellifera, las variaciones en las concentraciones de néctar producto del aumento de la humedad relativa, provocarían una menor visita de las flores de notro, situación que sería indiferente para las especies visitantes de la familia Syrphidae, que se alimentan frecuentemente de polen. Esto es afirmado por CORBET et al. (1979), quien asevera que dentro de los factores ambientales, la humedad relativa es la que más influye en las oscilaciones de la concentración de néctar de las especies vegetales. Explica que al aumentar la humedad relativa del ambiente, el volumen de néctar aumenta y su concentración disminuye, haciéndolo menos atractivo para los insectos En el caso de notro, los resultados muestran que las diferencias microclimáticas locales pueden influir claramente sobre las tasas de visitas y la composición de especies de insectos polinizadores asociadas a él (cuadro 6). Para maqui, se puede observar en el cuadro 7, que las únicas correlaciones estadísticamente significativas ocurrieron entre las variables número de flores abiertas versus temperatura (correlación negativa igual a -0,85) - probablemente debido a que al avanzar la estación aumenta la temperatura y las flores comienzan a disminuir - y número de flores abiertas versus las visitas de P. albopilosa (correlación positiva igual a 0,79). Con respecto al efecto de la temperatura sobre el número de flores abiertas, existe una relación negativa (-0,85) entre ambas variables, por lo que a medida que aumenta la temperatura, las flores abiertas van disminuyendo. Esta asociación, sumada al posible efecto de otras variables no evaluadas en este estudio, podría explicar lo acotado del periodo de floración de maqui y la rápida senescencia de sus flores. 41 Para la correlación positiva entre el número de flores abiertas y P. albopilosa, los datos obtenidos son coherentes con la información presentada en el punto 4.1 (Entomofauna asociada a flores de notro y maqui), en donde los resultados obtenidos por MORA (1999) para maqui, en la zona de Valdivia, sitúa a P. albopilosa como la especie mayoritaria con un 87,5% de las visitas realizadas a las flores, lo que es confirmado por los datos expuestos en el presente estudio (20 % de las visitas) y que también por lo reportado por JOSEPH (1960), quien evidenció la alta presencia de P. albopilosa en plantas de maqui. La información evidencia la alta vinculación de este insecto con las flores de maqui, confirmando la asociación de este insecto con el estado de floración de este arbusto. JOSEPH (1960) y Rozen (1984), citado por MORA (1999), concuerdan con lo indicado anteriormente, señalando para este insecto un ciclo de vida anual, que se inicia con la presencia de los adultos en las flores a principios de septiembre, realizando una alta actividad de nidificación en octubre, época en donde maqui florece, dedicándose casi exclusivamente a la visita de sus flores, las cuales le proveen de néctar y polen, que sirven para la posterior alimentación de las larvas. Interesante es la situación de A. mellifera, quien a pesar de mostrar una alta tasa de visita a flores de maqui (45 %), no evidencia una correlación con el número de flores abiertas, lo que podría atribuirse a que A. mellifera no sería el principal polinizador de maqui. Al respecto, VIDAL y RAMIREZ (2005) mencionan que se debería tener especial cuidado en la interpretación de los resultados que involucren a A. mellifera como especie polinizadora, ya que ésta abeja tiende a forrajear sobre un amplio número de especies de plantas morfológicamente diferentes. 4.3 Indices de diversidad de la entomofauna colectada en notro y maqui. Según lo mencionado en el capítulo Material y Método, para establecer índices de diversidad en las comunidades de insectos asociadas a notro y maqui, se utilizó la riqueza de especies (S), el índice de diversidad de Shannon Wiener (H’) y el índice de dominancia de Simpson (l), el cual a su vez permitió calcular el índice de diversidad de Simpson (1 – l) (MORENO, 2001). En el cuadro siguiente podemos ver el cálculo de los índices de diversidad, tanto para notro como maqui. 42 CUADRO 8 Cálculo de riqueza específica (S), índice de Simpson (l) e índices de diversidad de Shannon Wiener (H’) y Simpson (1 - l), para la entomofauna asociada a notro y maqui. Indices de diversidad Notro Maqui Riqueza específica (S) 16 9 Indice de Shannon – Wiener (H’) 1,87 1,56 Indice de dominancia de Simpson (l) 0,25 0,28 Indice de diversidad Simpson (1 – l) 0,75 0,72 Según MORENO (2001), la riqueza específica (S) es la forma más sencilla de medir la biodiversidad, ya que se basa únicamente en el número de especies presentes, sin tomar en cuenta la valoración de las mismas. La forma ideal de medir la riqueza específica es contar con un censo de la comunidad, lo que nos permita conocer el número total de especies (S). Según el cuadro 8, para notro, la riqueza específica corresponde a 16 especies de insectos, desagregados en ocho especies del orden Hymenoptera y ocho especies del orden Diptera, distribuidas en cinco familias (cuadro 3). Para maqui, la riqueza específica corresponde a 9 especies de insectos (cuadro 8), desagregados en 8 especies pertenecientes al orden Hymenoptera y 1 especie del orden Díptera, distribuidas en cuatro familias (cuadro 3). Sin embargo, la riqueza específica no considera el número de individuos en cada especie censada (abundancia), lo que sí es integrado por el índice de diversidad de Shannon Wiener (H’) y Simpson (1 - l). En el caso de las comunidades de insectos estudiadas, tenemos que para notro H’ corresponde a 1,87 y para maqui alcanza un valor de 1,56. En cambio, el índice de diversidad de Simpson, alcanzó valores de 0,75 y 0,72 , para notro y maqui respectivamente (cuadro 8). 43 Según Margalef (1992), citado por MELIC (1993), el índice de Shannon Wiener (H’) tiene un valor máximo constante en torno a 5,3, por lo tanto, considerando esto, los índices de diversidad establecidos para los polinizadores en notro y maqui, serían relativamente bajos. Sin embargo, considerando que este índice es una medida del grado promedio de "incertidumbre" al predecir a qué especie pertenece un individuo escogido al azar de una comunidad de “S” especies y “N” individuos, en la práctica, este índice se verá sesgado, porque el número total de especies en la comunidad será probablemente mayor que el número de especies recolectadas en la muestra (MIJAIL, 2004). Al complementar el análisis con el índice de diversidad de Simpson y la riqueza específica de las comunidades de insectos asociadas a notro y maqui, podemos interpretar y entender de mejor forma la estructura ecológica de ambas comunidades. En el caso de notro, la riqueza específica es de 16 especies, siendo A. mellifera la especie que presenta la más alta abundancia relativa (cuadro 3), secundada por D. gayi y Ruizantheda sp. Las 13 especies restantes muestran una abundancia relativa baja en comparación a las especies mencionadas, pero su distribución es más uniforme. Al integrar la información mencionada y calcular el índice de diversidad de Simpson, nos entrega un valor de 0,75, lo que se traduce en que existe un 75 % de probabilidad de que dos individuos seleccionados al azar de esta comunidad pertenezcan a diferentes especies, lo que conlleva a inferir que la diversidad es relativamente alta. Para el caso de maqui, el índice de diversidad de Simpson fue similar al obtenido en notro (cuadro 8), a pesar del hecho de que la riqueza específica de la entomofauna asociada es notoriamente menor que en notro. Esta situación puede ser explicada debido a que el índice de Simpson sobrevalora las especies más abundantes en detrimento de la riqueza total de especies (MARTIN – PIERA, 1999), que en este caso correspondería a P. albopilosa y D. gayi, especies cuya abundancia tienen una magnitud similar a A. mellifera, que es la especie más abundante. En Veracruz, México, se estudió el efecto del sistema de cultivo sobre la diversidad y abundancia de insectos visitantes del café (Coffea arabica L.) en cuatro agroecosistemas. Los resultados obtenidos muestran índices de diversidad de 44 Shannon-Wiener en un rango de 0,12 y 0,67 y de Simpson en un rango de 0,04 y 0,28 para los ecosistemas estudiados, donde A. mellifera evidenció una dominancia cercana al 90 %, lo que se traduce en una baja diversidad (FERRARI, 2005). En otro estudio realizado en Medellín, Colombia, donde el objetivo era entender cómo la diversidad de abejas cambia durante la sucesión en un bosque húmedo neotropical, considerando cuatro estados sucesionales (pastizal, rastrojo bajo, rastrojo alto y bosque), arrojó un H’ igual a 4 y 4,1, para pastizal y rastrojo. El bosque, a pesar de tener una alta diversidad y riqueza estructural, no presentó la mayor diversidad y riqueza de abejas (3,8) (SMITH-PARDO y GONZALEZ, 2007). PAREDES et al. (s.f.) obtuvieron valores de H’ entre 0,96 y 3,4 para once conjuntos de muestras de una comunidad natural de insectos en un bosque de Ecuador, con el objetivo de medir la diversidad alfa de dicho ecosistema. La presencia de P. albopilosa, D. gayi, R.mutabilis, C.occidentalis, B. dahalbomii, C. chloris en las comunidades de insectos asociadas a notro y maqui, muestra la relación específica que tienen estas abejas nativas con ambas especies arbóreas, formando parte de su biodiversidad. En notro, las visitas de abejas nativas alcanzaron una frecuencia relativa de un 33,6% y en maqui un 46,9%. De la misma manera, importante fue la presencia de A. mellifera en ambas especies, con una participación del 45% del total de visitas realizadas, tanto para notro como maqui, no evidenciándose colmenas cercanas que pudiesen haber incidido en estos resultados. Esto confirma la gran adaptabilidad de A. mellifera para visitar diferentes especies florales, teniendo la capacidad de explorar una variada fuente de alimentos, lo que contribuyó al alto grado de superposición del nicho de polinización (VIDAL y RAMIREZ, 2005). La presencia de A.mellifera, puede afectar la condición poblacional de los polinizadores nativos y consecuentemente podría alterar la biodiversidad. Aunque no se tiene información sobre la exclusión de polinizadores por parte de A. mellifera, esta abeja presenta una tasa de polinización comparativamente mayor que la tasa de polinización de las abejas nativas (VIDAL y RAMIREZ, 2005). Sin embargo, KEPHART (1983) considera que aunque la presencia de A. mellifera ha modificado considerablemente la naturaleza de las comunidades de himenópteros, los 45 experimentos de exclusión de A. mellifera podrían solamente incrementar las visitas proporcionales de los otros insectos polinizadores, en vez de resultar en una mayor diversidad de insectos visitantes. Percival (1974) y Schaffer et al. (1983), citados por VIDAL y RAMIREZ (2005), mencionan que Apis mellifera es un serio competidor con los polinizadores nativos por el néctar, ya que debido a su tendencia por forrajear sobre un amplio número de especies de plantas morfológicamente diferentes, disminuye considerablemente el volumen de néctar en las especies florales visitadas. Además, en varios casos resultó ser un polinizador inefectivo que ejerce una presión sobre los polinizadores nativos. El impacto de A. mellifera sobre la reproducción de las especies de plantas y en las relaciones con otros insectos no es fácil de establecer. En el estudio realizado por VIDAL y RAMIREZ (2005), se demostró que A. mellifera puede alterar los niveles de especialización de la ecología de polinización. Sin embargo, señalar que las consecuencias y efectos de A. mellifera sobre la ecología de polinización, solo podrá ser determinado a muy largo plazo. En consecuencia, un análisis riguroso de la variación temporal de los grupos de polinizadores - considerando el número de especies y el número de individuos en cada especie (diversidad biológica) - demanda estudios a largo plazo. Los escasos estudios realizados usando serie temporales mayores de dos años han encontrado variación temporal en el tipo, abundancia e importancia de los polinizadores de la mayoría de las plantas estudiadas. Es el caso de Herrera (1988); Petterson (1991); Gómez y Zamora (1992;1999); Traveset y Sáez (1997); Vaughton (1992); Obeso (1992); Bingham (1998); Fenster y Dudash (2001) y Thompson (2001), todos citados por GOMEZ (2002), que determinaron en sus estudios que las especies Lavandula latifolia Medic, Silene vulgaris (Moench.) Garcke, Hormathophylla spinosa (L.) P. Küpfer, Banksia spinulosa Sm., Asphodelus albus Mill., Euphorbia dendroides L., Campanula rotundifolia L., Silene virginica L. y Jasminum fruticans L., respectivamente, evidenciaron las variaciones temporales mencionadas. Los índices de diversidad son pues, medidas en si mismas que tienen escaso valor, salvo que establezcan comparaciones espacio- temporales (MELIC, 1993). 46 5 CONCLUSIONES Considerando los resultados obtenidos y las condiciones en que fue realizado este estudio, se presentan las siguientes conclusiones: Se identificaron 16 especies de insectos asociados a la floración de notro y 9 especies de insectos asociados a maqui, de los órdenes Hymenoptera y Diptera. El mayor porcentaje de insectos visitantes de flores de notro son del orden Hymenoptera (84,7%). Los insectos con mayor presencia son las especies: A. mellifera (45,5%), D. gayi (16,4%) y el género Ruizantheda (13,8%), con R. mutabilis y Ruizantheda sp. El mayor porcentaje de insectos visitantes de flores masculinas de maqui son del orden Hymenoptera (97,7%). Los insectos con mayor presencia son las especies: A.mellifera (45,3%), P. albopilosa (20,3%) y D. gayi (17,2%). Los insectos del orden Hymenoptera asociados a notro y maqui, a excepción de A. mellifera, corresponden en su totalidad a abejas nativas chilenas, lo que permite concluir una estrecha relación entre esta entomofauna nativa y las especies arbóreas nativas estudiadas, por lo tanto, las hipótesis propuestas que las flores de especies nativas atraen a sus insectos visitadores selectivamente y son principalmente nativos, son aceptadas. Las correlaciones entre las variables climáticas temperatura y humedad, número de flores abiertas y la visita de insectos a las flores de notro y maqui, determinaron principalmente, en el caso de notro, que D. gayi correlaciona positivamente con el número de flores abiertas y la temperatura, en tanto, A. mellifera correlaciona positivamente sólo con el número de flores abiertas. En maqui, es importante el nivel de asociación que existe entre P. albopilosa y el número de flores abiertas, variables que correlacionan positiva y altamente, posicionando a este insecto como un visitante muy vinculado a maqui, situación que es corroborada por otros estudios. 47 Se establecieron tres índices de diversidad para la entomofauna censada. En el caso de riqueza específica, para notro corresponde a 16 especies y para maqui 9 especies. En tanto, el índice de diversidad de Shannon Wiener alcanzó valores de 1,87 y 1,56 para notro y maqui respectivamente y el índice de diversidad de Simpson de 0,75 y 0,72 en el mismo orden. Estos resultados permiten concluir que las comunidades de insectos asociadas a notro y maqui como visitadores de flores, presentan una diversidad media. La alta presencia de A.mellifera, puede afectar la condición poblacional de los insectos visitadores nativos y, consecuentemente, podría alterar la biodiversidad de las comunidades de insectos nativos estudiadas. 48 6 BIBLIOGRAFIA AIZEN, M.; VASQUEZ, D. y SMITH-RAMIREZ, C. 2002. Historia natural y Conservación de los mutualismos planta-animal del bosque templado de Sudamérica austral. Revista Chilena de Historia Natural 75:79-97. ANDRADE, V. 2000. Aspectos de bilogía reproductiva en murta (Ugni molinae Turcz.) y evaluación de la actividad de los polinizadores. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias.84 p. APABLAZA, J. 2000. Introducción a la entomología general y agrícola. 3a ed. Universidad Católica de Chile. Santiago. 339 p. ARTIGAS, J. 1994a. Entomología económica: insectos de interés agrícola, forestal, médico y veterinario (nativos, introducidos y susceptibles de ser introducidos).Volumen 1. Concepción, Chile. Universidad de Concepción. 1126 p. ARTIGAS, J. 1994b. Entomología económica: insectos de interés agrícola, forestal, médico y veterinario (nativos, introducidos y susceptibles de ser introducidos). Volumen 2. Concepción, Chile. Universidad de Concepción. 943 p. CARDENAS, C. 1998. Aspectos de la morfología floral, producción de néctar y fructificación en Berveris darwinii Hook, Aristotelia chilensis (Mol) y Ugni molinae Turcz. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 111 p. CASTILLO, A. 2004. Efecto de la perturbación antropogénica por cambio de uso de suelo y variación temporal de la diversidad de cinco órdenes de insectos del desierto de Sonora. Tesis Lic. Biología. Puebla, México. Universidad de Las Américas. Departamento de Química y Biología. s/p. (On line). 49 <http://catarina.udlap.mx/u_dl_a/tales/documentos/laec/castillo_l_a/> (15 julio 2012). CORBET, S.; UNSIN, D. y PRYS-JONES, O. 1979. Humidity, nectar and insects visits to flowers whit special reference to Crataegus, Tilia and Echium. Ecological Entomology (USA) 4:9-22. CHIAPPA, E.; ROJAS, M. y TORO, H. 1990. Clave para los géneros de abejas de Chile (Hymenoptera: Apoidea). Revista Chilena de Entomología. 18: 67-81. DAVIS, A. 1997. Pollination efficiency of insects. In: Shivanna, K. y Sawhney, V. (eds). Pollen Biotechnology for Crops Production and Improvement. Cambridge University Pres. New York, USA. pp: 87-111. DIRZO, R. y RAVEN, P. 2003. Global state of biodiversity and loss. Annual Review of Environment and Resources (USA) 28: 137-167. DONOSO, C. 2004. Variación intraespecífica en especies arbóreas de los bosques templados de Chile y Argentina. Ed. Universitaria. Santiago, Chile. 420 p. DONOSO, C. y RAMIREZ, C. 1994. Arbustos Nativos de Chile, guía de reconocimiento. Marisa Cuneo ediciones. Valdivia, Chile. 119 p. FERRARI, R. 2005. Efecto del sistema de cultivo sobre la diversidad y abundancia de insectos visitantes del café (Coffea arabica L.) en el centro del estado de Veracruz. Tesis Lic. Biología. Puebla, México. Universidad de Las Américas. Departamento de Química y Biología. s/p. (On <http://catarina.udlap.mx/u_dl_a/tales/documentos/laec/ferrari_l_r/> line). (21 oct 2012). FRANKEL, R. y GALUN, E. 1977. Pollination mechanisms, reproduction and plant breeding. Springer-Verlag. Berlin, Germany. 281 p. 50 FREE. J. 1993. Insect pollination crops. 2a ed. Academic Press, London, England. 652 p. GLIESSMAN, S. 1998. Agroecology. Ecological Processes in Sustainable Agriculture. Ann Arbor Press. USA. 357 p. GOMEZ, J. 2002. Generalización en las interacciones entre plantas y polinizadores. Revista Chilena de Historia Natural (Chile) 75: 105-116. GREENFACTS, 2006. Consenso Científico sobre la Biodiversidad y Bienestar Humano (On line). < http://www.greenfacts.org/es/biodiversidad/index.htm#il1> (16 en. 2012). HEARD, T. 1994. Behavior and pollinator efficiency of stingless bees and honey bees on macadamis flowers. Journal of Apicultural Research. 33(4): 191-198. HEINRICH, B. 1975. Energetics of pollination. Annual Review of Ecology and Systematics (USA) 6: 139-169. HOFFMAN, A. 1997. Flora silvestre de Chile, Zona Araucana: una guía ilustrada para la identificación de plantas leñosas del sur de Chile (entre el río Maule y el seno de Reloncaví). 4a (ed). Ediciones Claudio Gay. Santiago, Chile. 258 p. HOOPINGARNER, J. y WALLER, G. 1993. Crop pollination. In: Graham, J. (ed). The hive and the honeybee. Bookcrafers. Michigan, USA. pp: 269-361. JOSEPH, C. 1960. Investigaciones biológicas sobre himenópteros de Chile (Melíferos). Trad.: María Etcheverry y Agustín Valenzuela. Publicaciones del Centro de Estudios Entomológicos. Facultad de Filosofía y Educación, Universidad de Chile. Santiago, Chile. 1:7-60. KEPHART, S. R. 1983. The partitioning of pollinator among three species of Asclepias. Ecology (USA) 64: 120-133. 51 KEVAN, P y BAKER, H. 1983. Insects flower visitors and pollinators. Annual Review of Entomology (USA) 28: 407 – 453. LANDE, R. 1996. Statistics and partitioning of species diversity, and similarity among multiple communities. Oikos 76: 5-13. LE – QUESNE, C. s.f. Enciclopedia de la flora chilena (On line). <http://www.florachilena.cl/Niv_tax/Angiospermas/Ordenes/Oxidales/Eleocarpac eae/Aristotelia/Aristotelia%20chilensis.htm> (17 nov 2011). LLORENS, J.M. 1990. Homoptera II: Pulgones de los cítricos y su control biológico. Valencia, Pisa Ediciones. 170 p. LOBOS, N. 1995 Entomofauna asociada al frambueso (Rubus idaeus L.) y evaluación del atrayente feromonal Beescent en la actividad polinizadora de Apis mellifera L. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 72 p. MC GREGOR, S. 1976. Insect pollinators of cultivated crop plants. Department of Agriculture United States. Washington. 441 p. MAGURRAN, A. E. 2004. Measuring Biological Diversity. Blackwell Science Ltda. Malden, USA. 256 p. MARTIN de – PIERA, Insectos: (Boletín F. 1999. Apuntes Dilemas, electrónico de sobre Ficciones entomología) Biodiversidad y y Conservación ¿Soluciones?. (On Aracnet line).<http://www.sea- entomologia.org/aracnet/2/biodiv/index.htm> (21 oct 2012). MASIS, C. Y LEZAMA, H. 1991. Estudio preliminar sobre los insectos polinizadores de macadamia en Costa Rica. Turrialba 41(4): 520 – 523. 52 MELIC, A. 1993. Biodiversidad y riqueza biológica. Paradojas y problemas. Revista Aragonesa de Entomología (España) 3: 97-103. MENA, J. 2000. Los grandes insectos también son animales de sangre caliente. Boletín del Centro de Interpretación de la Naturaleza de Valladolid (España). 48:7-8. MIJAIL, A. 2004. Aspectos conceptuales, análisis numérico, monitoreo y publicación de datos sobre biodiversidad. Ed. Araucaria – Marena. Managua, Nicaragua. 336 p. MORA, A. 1999. Producción de néctar por flores de maqui (Aristotelia chilensis (Mol.) Stuntz) y entomofauna asociada a su polinización. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 97 p. MORENO, C. 2001. Métodos para medir la biodiversidad. Editores: CYTED; ORCYT – UNESCO & SEA. Zaragoza (España). 83 p. NEIRA, M., PALACIOS, J., CARRILLO, R., PESSOT, R., MUNDACA, N. 1997 Conducta polinizadora de Apis mellifera L. y Bombus ruderatus (Hymenoptera: Apidae) sobre dos cultivares de Cranberry, Vaccinium macrocarpon Ait. (Ericaceae). Agro-Ciencia 13:337-344. PAREDES, J.; ARIAS DE LOPEZ, M.; FLOWERS, W.; MEDINA, M.; HERRERA, P. y PERALTA, E. s.f. Medición de la Biodiversidad Alfa de Insectos en el Bosque “Cruz del Hueso” de Bucay, Guayas-Ecuador (On line). <http://cibe.espol.edu.ec/sites/cibe.espol.edu.ec/files/documents/CONGRESO% 20PIURA%20Jorge%20Paredes.pdf> (31 julio 2012). PEÑA, L. 1988. Introducción a los insectos de Chile. 2a ed. Santiago (Chile). Ed. Universitaria. 256 p. 53 PEREDO, S.F. y BARRERA, C. 2002. Aplicaciones agroecológicas de los índices de diversidad: análisis de su utilidad para la evaluación de la biodiversidad agrícola. In: Dapena, E. y Porcuna, J. (Eds.). La agricultura y ganadería ecológicas en un marco de diversificación y desarrollo solidario. Servicio Regional de Investigación y Desarrollo Agroalimentario, Sociedad Española de Agricultura Ecológica. Gijón-Asturias (España). Tomo I pp: 399-408. PIMM, S. L. y RAVEN, P. 2000. Extinction by numbers. Nature (USA) 403: 843-845. RALLO, J. 1986. Frutales y abejas. Madrid, Publicaciones de Extensión Agraria. 231 p. RIOS, M. 1996. Influencia de la polinización entomófila sobre los parámetros productivos y características de los frutos de la zarzaparrilla roja (Ribes rubrum L.) cv Jonkheer Van Test. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 110 p. RIVEROS, M.; HUMAÑA, A. y LANFRANCO, D. 1991. Actividad de los polinizadores en el Parque Nacional Puyehue, X Región, Chile. Medio Ambiente (Chile) 11(2): 5-12. RODRIGUEZ, R.; MATTHEI, O. y QUEZADA, M. 1983. Flora Arbórea de Chile. Universidad de Concepción. Concepción, Chile. 408 p. ROOT, L. 1976. ABC y XYZ de la apicultura. Enciclopedia científica y práctica de abejas. Librería Hacchette. Buenos Aires, Argentina. 670 p. ROVERE, A. y CHALCOFF, V. 2010 . Embothrium coccineum J. R. Forst. et G. Forst Kurtziana (On line). 35(2): 23-33. http://www.scielo.org.ar/pdf/kurtz/v35n2/ v35n2a05.pdf > (31 julio 2012). ROZEN, J. 1984. Nesting biology of diphaglossine bees (Hymenoptera, Colletidae). American Museum Novitates 2786:1-33. 54 SAMWAYS, M.J. 1984. A practical comparison of diversity indices based on a series of small agricultural ant communities. Phytophylactica (Sudáfrica) 16: 275-278. SCHLEGEL, F. 1983. Arboreto. Universidad Austral de Chile. Facultad de Ciencias Forestales. 25 p. SINGH, J. S. 2002. The biodiversity crisis: a multifaceted review. Current Science (India) 82(6): 638-647. (On line). <http://repository.ias.ac.in/72925/1/72925.pdf> (16 julio 2012). SMITH-PARDO, A. y GONZALEZ, V. 2007. Diversidad de abejas (Hymenoptera: Apoidea) en estados sucesionales del bosque húmedo tropical. Acta Biológica Colombiana (Colombia) 12: 43 – 56. SMITH-RAMÍREZ, C y ARMESTO, J. 1998. Nectarivoría y polinización por aves en Embothrium coccineum (Proteaceae) en el bosque templado del sur de Chile. Revista Chilena de Historia Natural 71: 51-63. SOKAL, R. y ROHLF, J. 1995. Biometry. 3a ed. W.H. Freeman and Company. Basingstoke, England. 887 p. SOTOMAYOR, O. 1999. Caracterización de la compatibilidad polínica y evaluación de la entomofauna asociada a flores de Ugni molinae Turcz. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 114 p. SPELLERBERG, I.F. 1991. Monitoring ecological change. Cambridge University Press. London, England. 334 p. STRASBURGUER, E.; NOLL, F.; SCHENK, H. y CHIMPER, A. 1994. Tratado de Botánica. 8a ed. Ediciones Omega. Barcelona, España. 1086 p. 55 TAPIA, C. 2000. Caracterización de entomofauna asociada a flores de avellano chileno (Gevuina avellana Mol) y algunos aspectos de biología reproductiva. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 115 p. TOOKER, J.; HAUSER, M. y HANKS, M. 2006. Floral Host Plants of Syrphidae and Tachinidae (Diptera) of Central Illinois. Annals of the Entomological Society of America (USA) 99: 96 – 112. TORO, H.; CHIAPPA, E. y TOBAR, C. 2009. Biología de insectos. 3ª ed. Ediciones Universitarias de Valparaíso, Pontificia Universidad Católica de Valparaíso. Valparaíso, Chile. 249 p. TORRES-DIAZ, C.; CAVIERES, L.; MUÑOZ-RAMIREZ, C. y ARROYO, M. 2007. Consecuencias de las variaciones microclimáticas sobre la visita de insectos polinizadores en dos especies de Chaetanthera (Asteraceae) en los Andes de Chile central. Revista Chilena de Historia Natural (Chile) 80: 455-468. UNIVERSIDAD AUSTRAL DE CHILE. 2004. XXI Congreso de la Asociación Latinoamericana de la Papa (ALAP). (On line). <http://www.uach.cl/alap2004/valdivia.htm> (03 agosto 2012). ULLOA, M. 1997 Identificación de la entomofauna asociada a la flor de arándano (Vaccinium corymbosum L.) y rol en su polinización. Tesis Lic. Agr. Valdivia, Universidad Austral de Chile, Facultad de Ciencias Agrarias. 82 p. VIDAL, M. C. y RAMIREZ, N. 2005. Especificidad y nicho de polinización de especies de plantas de un bosque deciduo secundario. Ecotropicos (Venezuela) 18: 73-88. WESTWOOD, M. 1982. Fruticultura en zonas templadas. Mundi – prensa. Madrid, España. 461 p. 56 WILLMER, P. 1983. Thermal constraints on activity patterns in nectar feeding insects. Ecological Entomology (USA) 8: 455-469. WILSON, E. O. 1999. The diversity of life. W. W. Norton & Company. New York, USA. 421 p. WILSON, P. y THOMPSON, J. 1991. Heterogeneity among floral visitors leads to discordance between removal and deposition of pollen. Ecology (USA) 72(4): 1503-1507. ZAR, J. H. 1999. Biostatistical Analysis. 4ta ed. Prentice – Hall. New Jersey, USA. 663 p. 57 7 ANEXOS ANEXO 1 Registros de temperatura (°C) y humedad (H°) durante el periodo de muestreo en maqui. Fecha 26 oct. 2011 28 oct. 2011 31 oct. 2011 03 nov. 2011 Horario N° árbol T° (°C) H° (%) 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 1 3 4 2 4 1 3 2 3 1 4 2 4 3 1 2 2 4 1 3 3 1 2 4 3 1 4 2 2 1 3 4 19,0 19,6 19,8 19,8 21,2 22,1 22,7 22,8 20,6 20,6 19,6 19,6 23,2 22,1 24,0 24,0 20,4 20,6 21,0 21,3 27,2 26,4 23,4 22,3 10,9 11,5 13,8 16,2 17,0 17,0 17,7 16,0 58,0 58,0 57,0 57,0 46,0 44,0 43,0 44,0 51,0 51,0 57,0 57,0 46,0 44,0 43,0 44,0 43,0 48,0 50,0 51,0 25,0 30,0 42,0 45,0 73,0 70,0 66,0 59,0 54,0 54,0 54,0 59,0 58 Continuación Anexo 1 10 nov. 2011 15 nov. 2011 18 nov. 2011 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 4 1 3 2 3 1 2 4 1 2 3 4 3 1 2 4 3 1 4 2 4 3 1 2 13,8 13,2 13,7 13,7 17,1 15,2 14,1 13,4 20,6 18,4 22,8 22,0 24,2 24,3 22,5 22,3 20,6 20,6 19,6 19,6 23,2 22,1 24,0 24,0 51,0 50,0 50,0 49,0 41,0 48,0 53,0 55,0 51,0 54,0 49,0 50,0 42,0 42,0 48,0 47,0 51,0 51,0 57,0 57,0 46,0 44,0 43,0 44,0 59 ANEXO 2 Registros de temperatura (°C) y humedad (H°) durante el periodo de muestreo en notro. Fecha 27 oct. 2011 01 nov. 2011 04 nov. 2011 11 nov. 2011 Horario N° árbol T° (°C) H° (%) 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 2 1 4 3 3 1 2 4 4 1 2 3 1 2 3 4 2 3 1 4 4 1 3 2 4 1 3 2 3 1 4 2 18,9 19,2 19,3 19,2 21,1 22,0 22,2 23,0 16,2 16,0 15,9 15,9 15,0 14,7 14,1 14,7 16,7 20,7 20,8 18,0 19,0 20,0 20,0 18,5 17,8 17,0 18,2 19,8 22,3 21,0 21,4 21,6 50,0 49,0 49,0 55,0 41,0 41,0 40,0 40,0 59,0 52,0 54,0 54,0 54,0 55,0 57,0 58,0 49,0 40,0 35,0 39,0 40,0 39,0 38,0 39,0 52,0 53,0 51,0 48,0 40,0 43,0 43,0 44,0 60 Continuación Anexo 2 16 nov. 2011 19 nov. 2011 22 nov. 2011 24 nov. 2011 25 nov. 2011 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 4 2 1 3 2 3 1 4 1 3 2 4 4 2 3 1 4 3 2 1 4 3 2 1 2 1 3 4 2 1 4 3 1 2 4 3 3 4 1 2 21,4 24,2 24,0 24,9 25,6 24,6 25,0 26,1 14,2 13,9 14,0 15,5 15,5 16,6 17,0 17,1 17,6 19,1 15,9 19,7 17,6 18,6 19,1 19,6 14,7 15,3 14,8 15,6 15,2 14,4 14,1 13,5 18,6 16,3 20,3 19,0 20,2 18,9 17,8 17,0 45,0 38,0 45,0 43,0 37,0 42,0 40,0 40,0 47,0 47,0 46,0 43,0 43,0 38,0 35,0 35,0 57,0 49,0 58,0 48,0 56,0 51,0 48,0 50,0 67,0 68,0 68,0 67,0 70,0 79,0 83,0 87,0 49,0 55,0 49,0 54,0 50,0 52,0 53,0 52,0 61 Continuación Anexo 2 30 nov. 2011 02 dic. 2011 05 dic. 2011 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 11:00 - 11:20 11:30 - 11:50 12:00 - 12:20 12:30 - 12:50 14:00 - 14:20 14:30 - 14:50 15:00 - 15:20 15:30 - 15:50 4 3 2 1 3 2 1 4 1 2 3 4 4 1 3 2 3 2 1 4 2 3 1 4 18,5 15,3 16,1 21,6 19,5 20,8 23,3 23,3 19,4 18,1 18,5 17,4 19,7 19,5 17,5 17,0 16,8 17,6 19,2 22,3 18,4 18,3 19,3 21,0 52,0 55,0 58,0 40,0 41,0 39,0 35,0 35,0 48,0 49,0 49,0 50,0 43,0 45,0 52,0 54,0 62,0 60,0 52,0 54,0 59,0 61,0 55,0 55,0 62 ANEXO 3 Número de flores abiertas en el parche de exclusión de 0,25 x 0,25, durante el periodo de muestreo en maqui. Fecha Arbol N°1 Arbol N°2 Arbol N°3 Arbol N°4 Promedio 26 oct. 2011 42 4 50 11 27 28 oct. 2011 48 6 70 17 35 31 oct. 2011 105 13 84 21 56 03 nov. 2011 186 29 134 29 95 10 nov. 2011 150 40 154 57 100 15 nov. 2011 3 4 6 4 4 18 nov. 2011 3 2 3 2 2 ANEXO 4 Número de flores abiertas en el parche de exclusión de 0,25 x 0,25, durante el periodo de muestreo en notro. Fecha Arbol N°1 Arbol N°2 Arbol N°3 Arbol N°4 Promedio 27 oct. 2011 16 54 45 90 51 01 nov. 2011 64 162 45 137 102 04 nov. 2011 72 205 72 137 121 11 nov. 2011 112 216 167 177 168 16 nov. 2011 62 200 225 57 136 19 nov. 2011 40 108 180 68 99 22 nov. 2011 34 124 117 27 76 24 nov. 2011 21 43 99 41 51 25 nov. 2011 11 59 113 68 63 30 nov. 2011 8 32 50 55 36 02 dic. 2011 6 22 68 22 29 05 dic. 2011 2 0 27 5 9 63 ANEXO 5 Cálculo de riqueza específica (S), índice de Simpson (l) e índices de diversidad de Shannon Wiener (H’) y Simpson (1 - l), para la entomofauna asociada a notro y maqui. .Especie Notro Maqui ni pi ni pi Allograpta pulchra 07 0,026 0 0 Apis mellifera 122 0,455 58 0,453 Bombus dahalbomii 0 0 01 0,008 Bombus terrestris 14 0,052 07 0,054 Cadeguala occidentalis 08 0,03 02 0,016 Carposcalis chalconatus 04 0,015 0 0 Carposcalis fenestratum 06 0,022 03 0,023 Corynura chloris 01 0,004 0 0 Diphaglossa gayi 44 0,164 22 0,171 Dolichogyna nigris 13 0,049 0 0 Policana albopilosa 0 0 26 0,203 Polistes dominulus 01 0,004 0 0 Ruizantheda mutabilis 07 0,026 03 0,023 Ruizantheda sp 30 0,111 06 0,047 Scaeva occidentalis 04 0,015 0 0 Syrphus melanostoma 01 0,004 0 0 Syrphus sexamaculatus 02 0,007 0 0 Syrphus similis 04 0,015 0 0 N° total de individuos (N) 268 128 Riqueza específica (S) 16 9 Indice de Simpson (l) 0,25 0,28 Indice diversidad Shannon – Wiener (H’) 1,87 1,56 Indice de diversidad Simpson (1 – l) 0,75 0,72 64 ANEXO 6 Diphaglossa gayi (Hymenoptera: Colletidae) ANEXO 7 Corynura chloris (Hymenoptera: Halictidae) 65 ANEXO 8 Ruizantheda mutabilis (Hymenoptera: Halictidae) ANEXO 9 Bombus dahalbomii (Hymenoptera: Apidae) 66 ANEXO 10 Bombus terrestris (Hymenoptera: Apidae) ANEXO 11 Cadeguala occidentalis (Hymenoptera: Colletidae)