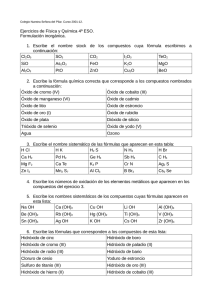
monografía - DSpace de la Universidad Catolica de Cuenca
Anuncio

UNIVERSIDAD CATOLICA DE CUENCA UNIDAD ACADÉMICA DE INGENIERIA QUÍMICA, INDUSTRIAL, ALIMENTOS, BIOMOLECULAR, BIOCOMBUSTIBLES, Y BIOFARMACIA. “NOMENCLATURA DE QUÍMICA INORGÁNICA” MONOGRAFÍA PREVIA A LA OBTENCIÓN DEL TÍTULO DE INGENIERO QUÍMICO Realizado por : Fredy Acero Montero. Director : Ing. Quím. Santiago Gómez. CUENCA - ECUADOR 2011 1 Dedicatoria Dedico el presente trabajo, a la luz de mi vida y fuente de mi éxito, mi familia y de forma muy especial a mi esposa Angélica y mi hijo Matías por su amor, cariño, comprensión y permanente apoyo que constituyen mi inspiración para salir adelante cada día. 2 AGRADECIMIENTO Mis reconocimientos y gratitud: A la Unidad Académica de INGENIERÍA QUÍMICA, INDUSTRIAL, ALIMENTOS, BIOMOLECULAR, BIOCOMBUSTIBLES Y BIOFARMACIA en la persona del señor Decano y a los maestros, por haberme recibido en sus aulas y haber hecho de mí un profesional en INGENIERÍA QUÍMICA. A mi Director de monografía, Ing. Quím. Santiago Gómez por su acertada dirección y orientación, en el desarrollo de la investigación hasta su culminación exitosa. A mis queridos padres por su constante apoyo, amor y comprensión que me supieron prodigar a cada instante para cristalizar mis ideales. 3 INTRODUCCIÓN Desde muy antiguo se conocen ciertas sustancias por nombres relacionados con lugares, o propiedades de las mismas; otros son muy empleados en el comercio y de uso frecuente, porque son más sencillos y fáciles de recordar que los nombres técnicos. Para unificar criterios, la Unión Internacional de Química Pura y Aplicada (IUPAC) ha propuesto una nomenclatura sistemática que facilita la nomenclatura química, y al mismo tiempo pretende que cada cuerpo tenga un solo nombre. Para nombrar los numerosísimos cuerpos químicos que se conocen, es indispensable poder servirse de un lenguaje simbólico que pueda ser entendido por los estudiantes de cualquier cultura. La monografía de Nomenclatura de Química Inorgánica que ofrecemos al estudiante de Bachillerato, y Universidad, es una ayuda para relacionar los nombres con que se designan o se han designado las diferentes sustancias químicas y ofrecerlo de forma sintética al lector. Se define la formación del nombre de un compuesto, descartando palabras en exceso. Se presenta un procedimiento ágil para escribir y leer una fórmula, sin embargo se podrá utilizar el mecanismo que creyera conveniente. En cada clase de compuestos se incluye un modelo de la distribución de los átomos en la fórmula desarrollada y la determinación del número de cargas asignadas a los átomos con lo cual se podrá deducir el número de oxidación de un átomo en particular. Contamos con numerosos ejemplos de nomenclatura, de cada una de las funciones estudiadas para ayudar al estudiante en éste no muy fácil aprendizaje de la formulación química, a disponer la consulta que faciliten el aprendizaje de un buen número de fórmulas fundamentales. Tambien encontramos las aplicaciones y usos en la vida diaria de los compuestos inorgánicos más utilizados y los riesgos que estos producen al ser manipulados Esperemos que está investigación sea un aporte muy valioso y se convierta en un amigo inseparable del futuro profesional químico. 4 Objetivo General. Estudiar los compuestos químicos inorgánicos a travez de su formación para luego darles una formulación correcta y posteriormente saber como son utilizados cada uno de los compuestos en nuestra vida cotidiana. Objetivos específicos. 1. Formar compuestos químicos 2. Formular los compuestos 3.1. Escribir correctamente una fórmula 3.2. Leer correctamente una formula 3.3. Conocer los tipos de fórmulas 3.4. Identificar un compuesto a que grupo pertenece 3. Describir los fundamentos, aplicaciones y riesgos de los compuestos químicos más utilizados. 5 PARTE I GENERALIDADES 1 DIVISIBILIDAD DE LA MATERIA 1.1. INTRODUCCIÓN. La observación diaria nos demuestra que la materia es divisible en fracciones cada vez más pequeñas. Si no fuera por esta propiedad no pudiéramos trabajar de diferentes maneras con materiales que se emplean en la fabricación de implementos utilizados en la vida diaria. 1.2. DIVISIÓN DE LA MATERIA. La materia se divide en: Cuerpo: cualquier porción de materia comúnmente visible. Partícula: parte de materia que apenas se observa. Esto resulta cuando un cuerpo lo dividirnos en porciones pequeñas. Molécula: mínima porción de materia que existe libre y conserva sus propiedades. No es visible, pero se le puede apreciar en las disoluciones. Estas se obtienen mediante la división de las partículas. Átomo: etimológicamente significa indivisible. Es la porción más pequeña de la materia que puede participar en una reacción química y formar compuestos. Modernamente se dice que el átomo es un conjunto de corpúsculos subatómicos asociados en números determinado que tiene masa y carga eléctrica específico. 6 1.3. MODELO ATÓMICO ACTUAL Está basado en los estudios de la mecánica cuántica. Según los investigadores el átomo no tiene forma definida, y más bien se parece a una nube cósmica que varía constantemente. En la actualidad este modelo nos permite estudiar y conocer las diferentes partes constitutivas del átomo. 1.4. ESTRUCTURA ATÓMICA En el átomo se consideran dos porciones: el núcleo y la corona. 1.4.1. EL NÚCLEO ATÓMICO. Es la parte interna del átomo y está formado por partículas llamadas nucleones, que son de dos clases: protones y neutrones Protones Son partículas con masa 1 y carga eléctrica positiva. Se lo0s representa con la letra “Z”. Su número es igual en todos los átomos de un mismo elemento químico el número de protones de unjh átomo se llama también número atómico y ha servido para ordenar los elementos químicos en la tabla periódica. Es por esto que un elemento se identifica por el número de protones y no por el número de neutrones. Número atómico (z) = número de protones Neutrones Son, asimismo, partícula con masa 1 pero no tienen carga electica. Se los representa con la letra “n”. Su núm ero puede variar entre los átomos del mismo elemento; a esa variación se la llaman isótopo y cada uno ocupa la misma casilla en la tabla periódica. Iso = igual topo = posición o lugar 7 Los isótopos tienen igual número o protones y electrones, pero diferente número de neutrones. Los distintos isótopos constituyen un elemento que se encuentran en cantidades fijas y determinadas, las mismas se expresan en porcentajes. La suma de protones y neutrones de un átomo se representa con “A”, que significa “número de masa”. Es diferente en los distintos elementos y en los átomos de un mismo elemento. Por ejemplo: El helio tiene 2 protones, 2 electrones y 2 neutrones A= 4; Z=2, entonces, como A – Z = n, tenemos 4 – 2 = 2 El sodio tiene 11 protones, 11 electrones y 12 neutrones A= 23; Z=11, entonces, como A – Z = n, tenemos 23 – 11 = 12 Masa atómica Se deduce indirectamente comparando la masa del átomo con la de otro que se toma como referencia. Se encuentra concentrada en su mayor parte en el núcleo, ya que la masa en la corteza es insignificante. En la actualidad la escala de masas atómicas está fundamentada en un tipo particular de átomo de carbono (Carbono 12). Es decir es la doceava parte de un átomo de car bono y equivale a la masa de un protón o de un neutrón aproximadamente. En la tabla periódica se indica junto al símbolo, la masa atómica relativa de cada elemento. El término peso atómico o masa atómica se utiliza en forma general. La masa atómica puede ser absoluta y relativa. Masa atómica absoluta: La masa real de un átomo, por ser tan pequeña, solo puede medirse directamente con unos instrumentos llamados espectrógrafos de masas. Masa atómica relativa: Masa que presenta los elementos químicos con relación a uno de ellos, tomando como índice, y como ejemplo, el isótopo de carbono con masa 12. Índice de masa: Isótopo del carbono con masa 12 ó 12 C, sirve para determinar la masa relativa de los demás átomos. 8 Peso atómico gramo: también llamado átomo gramo. Es la masa atómica expresada en gramos. Ejemplo: La masa atómica del oxígeno es 16, por tanto, su peso atómico gramo es 16 gramos. También podemos decir: 1 átomo gramo de oxígeno = 16 gramos. Número de avogadro Este científico italiano sostuvo que las unidades de los gases no eran átomos, sino moléculas y que eran estas las que se combinaban. Para defender su hipótesis. Avogadro anunció los siguientes principios: 1. “Volúmenes iguales de gases, medidos a la misma presión y temperatura, contienen el mismo número de moléculas”. Tras este postulado se ha comprobado que el volumen ocupado por una molécula gramo en las mismas condiciones de temperatura y presión, vale 22.4 para todos los gases. Igualmente Avogadro determinó el número 6,023 x 10²³ para indicar la cantidad de moléculas que tiene un mol de cualquier gas. Por ejemplo, 32 gramos de oxígeno y 44 de dióxido de carbono, conjuntamente contiene 6.023 x 10²³ moléculas y ocupan un volumen de 22.4 l. 2.”Las partículas de un gas elemental contiene dos átomos unidos” tal como se presentan en la naturaleza. Así: HH, OO, HeHe, NN, ClCl. Por mucho tiempo fue el oxígeno el elemento patrón para determinar pesos atómicos; pero, por la presencia de elementos isotópicos, introduce una ligera variación, por lo que ahora, en vez del oxígeno, se utiliza el isótopo 12 del carbono como patrón de referencia. Entonces, el número de Avogadro se define como “el número de átomos en 12 gramos (1mol) de C-12”. Es una de las constantes más importantes en química y la razón fundamental en la determinación de los pesos moleculares y relaciones estequiométricas. 9 1.4.2. CORONA ATÓMICA También llamada envoltura o nube atómica, es la parte externa del átomo, por donde circulan los electrones. Si comparamos el número de electrones con el de protones de los respectivos átomos, vemos que son iguales ya que el átomo completo es eléctricamente neutro: tiene igual número de electrones y protones. Electrón Partícula con carga eléctrica negativa (e⁻) y masa insignificante, 1 800 veces menor que la del protón. Los electrones giran alrededor del núcleo, acercándose y alejándose de él, a la vez que cambian de plano, de modo que circulan en un espacio llamado orbital. Durante las reacciones químicas, los electrones externos suelen saltar de unos átomos a otros para formar los enlaces atómicos; por esta razón su número no es fijo. Todo átomo es eléctricamente neutro, por lo que la carga está neutralizada por la carga de la corona, es decir, el número de protones es igual al de los electrones. #p⁺ = #e⁻ #de cargas positivas = # de cargas negativas Niveles de energía Son las capas de electricidad negativa que forman los electrones en la zona externa del núcleo. Los electrones giran en los niveles de energía a velocidades próximas de la luz (300 000 km/s) y a distintas distancias del núcleo, según su cantidad o nivel energético. Dichos niveles de energía se encuentran numerados, del 1 al 7, desde adentro hacia afuera; y se los representa con las letras K, L, M, N, O, P, Q. El nivel K es el de menor energía y se satura con 2 electrones; L con 8; M con 18, N y O con 32; P con 18; y Q es el nivel más externo y de mayor energía, se satura con un número aún no definido de electrones. El nivel más externo nunca supera los 8 electrones, como es el caso de los átomos de los gases raros, que forman la familia O u Vlll A (tabla periódica). Mecánica Cuántica Es la teoría que explica los estados energéticos del electrón dentro del átomo y sus propiedades como partícula y onda. Gracias a investigadores como, Luis de Broglie se estableció el carácter dual del electrón, al indicar que es partícula por su masa; y onda por su movimiento ondulatorio alrededor del núcleo. Conserva los valores de distancia media hacia el núcleo, pero designándolos con los números 1, 2, 3, 4, 5, 6, 7 en lugar de K, L, M, N, O, P, O. 10 Werner Heisemberg formuló su principio de incertidumbre, que dice: “No se puede establecer la posición y velocidad del electrón en el átomo; hay incertidumbre en estos dos aspectos, lo cual elimina cualquier modelo atómico estático, pues el electrón es una partícula muy veloz que en un instante puede estar en cualquier lugar alrededor del núcleo. El único límite es la cantidad de energía que lleva” Desde entonces ya no se habla de radio del átomo, sino de su valor más probable. Movimiento ondulatorio de los electrones alrededor del núcleo Erwin Schródinger desarrolló la ecuación de onda, que describe la probabilidad de movimiento ondulatorio de pequeñas partículas y de cómo las ondas asociadas a esas partículas se alteran por influencia externa. Probabilidad de encontrar al electrón de un orbital 15. En definitiva, para la mecánica cuántica el electrón no es más que una onda electromagnética similar a la de la naturaleza de la luz, y nunca se mantiene estable, girando alrededor del núcleo, sino siempre describe movimientos ondulatorios. 1.5. NÚMEROS CUÁNTICOS Con la cuantificación de la energía del electrón, se trata de explicar la forma cómo están distribuidos los electrones alrededor del núcleo. Para ello utilizaremos un sistema semejante al de las coordenadas, que recibe el nombre de números cuánticos. Los números cuánticos pueden ser: 11 1.5.1. Número cuántico principal: Se lo representa con n y define la distancia existente entre el electrón y el núcleo; y su nivel de energía o cantidad de energía potencial. También podemos decir que este valor indica la posición del electrón en el nivel. Valores de “n” K L M N O P Q 1 2 3 4 5 6 7 (niveles) Cada nivel puede llevar un número determinado de electrones, este número máximo de electrones se calcula aplicando la siguiente regla: # de electrones = 2n ² Ejemplo: K= 2 electrones, entonces K = 2 x 1 ² = 2e⁻ 1.5.2. Número cuántico secundario, orbital o azimutal: Representa a un subnivel o subcapa de energía. Ya que cada una de las capas electrónicas principales se subdivide en un determinado número de subcapas electrónicas. Se lo representa por “1”. También indica la forma geométrica de la región en que se mueve el electrón. Cada nivel tiene un número determinado de subniveles: el nivel 1 tiene un subnivel; el nivel 2 tiene dos; el nivel 3 tiene tres, etc. Aunque teóricamente existen 7 niveles, en la práctica se ha encontrado que los electrones ocupan solo hasta el cuarto subnivel. 12 Para determinar los valores de “l” debe conoce el valor de “n” de su respectiva capa electrónica, puesto que están relacionados con la siguiente regla: l=n–1 Aplicación de la regla La capa principal K corresponde n = 1 y está formada por una sola subcapa. Reemplazando los valores tendríamos: l=1–1=0 Cuando n = 2, existen dos subniveles con los siguientes valores: l=2–1=1 Cada una de las subcapas u orbitales (l) tiene formas diferentes, que se representan con las letras minúsculas s, p, d, f. El orbital s es de forma esférica y se satura con dos electrones. Los orbitales p tienen formas bilobulares ubicados en los ejes x, y, z, semejantes a los peras unidas por su parte más estrecha. Se completa con seis electrones. 13 Los orbitales d tienen formas tetralobulares su número máximo de electrones es de diez. Los orbitares f son mucho más completos, inciuyen formas heptalobulares. Abarca hasta catorce electrones. 1.5.3. Número cuántico magnético Representado por “m”, indica la orientación del orbital electrónico dentro del eje coordenado. Los orbitales p presentan tres orientaciones distintas (px, py, pz): Los orbitales d tienen estas orientaciones: 14 Los orbitales s no poseen orientación por ser esféricos. Los f tienen formas muy difíciles de graficarlas, pero son importantes para los lantánidos y actínidos. Cada subnivel tiene un número determinado de orbitales. Para encontrar este número se aplica la siguiente regla: # de orbitales = 2l + 1 Ejemplo: Subnivel l 2l + 1 s 0 1 orbital p 1 3 orbitales d 2 5 orbitales f 3 7 orbitales El valor de los electrones en cada orbital son números enteros que van de - l a +1 pasando por cero. Por tanto: l = 3 ml = -3, -2, -1, 0, +1, +2, +3 1.5.4. Número cuántico de spin Se lo representa por “ms”; caracteriza la orientación del electrón según la propiedad de giro de los cuerpos electromagnéticos. El giro puede darse en el sentido de las manecillas del reloj y recibe el nombre de dextrógiro (d), o en el sentido contrario y se llama levógiro (l). La representación más elemental se la hace con vectores, así: el vector orientado hacia arriba corresponde al dextrógiro y hacia abajo indica levógiro. Como el electrón no gira una vuelta completa (360º) sino apenas la mitad, entonces sus valores se representan con + fi (d) y - fi (l). Este número cuántico (ms) es importante porque a través de él se explica toda la estabilidad de la materia, ya que la asociación de spines de sentidos opuestos se atrae y de sentidos idénticos se repelen. Estos mecanismos rigen en todas las asociaciones de átomos para formar moléculas. 15 1.6. DISTRIBUCIÓN ELECTRÓNICA DE LOS ELECTRONES EN EL ÁTOMO La distribución electrónica de los electrones o notación espectral se realiza de tal forma que cumple el principio de exclusión de Pauli: que establece que dos electrones de un mismo átomo no pueden tener valores iguales para sus cuatro números cuánticos; es decir, que dos electrones pueden ocupar un orbital atómico únicamente si sus giros o spines son opuestos. Los electrones están distribuidos en niveles de energía, dentro de cada nivel existen distintos subniveles de energía. n 2n² 1s² K 1 2e⁻ L 2 8e⁻ M 3 18e⁻ N 4 32e⁻ O 5 32e⁻ P 6 18e⁻ 2s² 2p⁶ 3s² 3p⁶ 3d¹⁰ 4s² 4p⁶ 4d¹⁰ 4f¹⁴ 5s² 5p⁶ 5d¹⁰ 5f¹⁴ 6s² 6p⁶ 6d¹⁰ 7s² 7p⁶ Q 7 8e⁻ 1.7. ORDEN CRECIENTE DE LOS SUBNIVELES DE ENERGÍA 1s, 2s 2p, 3s 3p, 4s 3d 4p, 5s 4d 5p, 6s 4f 6p, 7s 5f 6d 7p, es el orden creciente de las energías relativas de los orbitales atómicos (OA), el mismo está en concordancia con a tabla periódica y se lo puede ilustrar así: Capa K L M N O P Q Nivel 1 2 3 4 5 6 7 Subnivel 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p Capacidad 2e⁻ 8e⁻ 8e⁻ 18e⁻ 18e⁻ 32e⁻ 32e⁻ 16 2. CLASIFICACIÓN PERIÓDICA 2.1. INTRODUCCIÓN Ley periódica: en 1814 Juan Jaboco Berzelius publicó, mucho antes de establecerse la tabla periódica, una clasificación en donde agrupaba dos tipos de elementos, los metales y no metales. En 1829, Döbereíner, realizó un intento de clasificación de los elementos químicos, agrupando de tres en tres a lo que llamó triadas en las que el peso atómico del elemento central era aproximadamente la media aritmética de los extremos. Cada grupo tenía propiedades semejantes. Así, el calcio (Ca, 40), el estroncio (Sr, 88) y el bario (Ba, 173) forman una triada y el cloro (Cl, 35), el bromo (Br, 80) y el yodo (1, 127) forman otra. En 1864, Newlands propuso un sistema de clasificación de los elementos en el orden creciente de sus masas atómicas y observó que las propiedades del primer elemento se parecían a las del noveno; es decir, las propiedades parecían repetirse cada ocho elementos, a esta clasificación se la llamaba octanas de Newlands. Pero posteriormente esta tabla resultó inaplicable, puesto que los elementos a partir del potasio no cumplían con propiedades análogas. En 1869 el ruso Mendeleiev y el alemán Meyer, independientemente uno de otro, establecieron una clasificación de los elementos de acuerdo con los siguientes principios: o Colocaron los elementos por orden creciente de sus masas atómicas. o Reunieron en familias de acuerdo con sus propiedades físicas y químicas. 17 La clasificación actual esta hecha según el orden creciente del número atómico de los elementos. Las propiedades químicas de un elemento dependen del número de electrones que posee, principalmente de los de la última capa. Werner estableció una de as tablas más utilizadas en la que constan siete filas horizontales o períodos y ocho columnas verticales o grupos. Cada grupo va dividido en dos familias: A y B. Cada periodo, menos el primero, empieza por un metal alcalino y termina en un gas noble. Los elementos del mismo grupo poseen propiedades semejantes. Eso es más notable en los elementos tipo o representativos, por ejemplo, en los alcalinos y en los halógenos. En cada una de las casillas se coloca el símbolo y el nombre del elemento. En la parte superior izquierda se coloca el número atómico y en la parte superior derecha, la masa atómica. Ejemplo: 2.2. CLASES DE ELEMENTOS Los elementos tipo o representativos poseen distribución electrónica idéntica en la última capa. Los elementos que están situados en el centro y a la izquierda de la tabla periódica poseen carácter metálico. Los que se encuentran a la derecha son los no metales y los gases nobles, que constituyen una excepción dentro de los no metales por su inercia química. Los elementos de transición externa: ocupan el centro de la tabla, se llaman así porque tiene incompleto el penúltimo nivel de energía y en el último nivel poseen dos electrones. Debido a esto funcionan con valencia múltiple. Los elementos de transición interna: Forman dos series y están clasificados en los casilleros correspondientes a los lantánidos y actínidos, Tienen incompleto el antepenúltimo nivel. Son elementos raros que se encuentran formando algunos minerales. Los actínidos son elementos radiactivos artificiales y han sido descubiertos en las reacciones nucleares. 18 2.3. LOS PERÍODOS Se llaman períodos porque las propiedades de sus elementos químicos (que dependen de sus electrones externos) se repiten en forma periódica. Siempre comienzan con átomos de un electrón externo (familia 0 u VIIIA), a excepción del primer período. Son siete y están organizados según el número de niveles electrónicos que tienen los átomos de los distintos elementos, comenzando por el nivel K o 1. o o o o o El primer período contiene los elementos H y He. En el segundo están el Li, Be, B, C, N, O, F y Ne. Al tercero corresponden el Na, Mg, Al, Si, P, S, Cl y Ar. Los períodos cuarto y quinto tienen 18 elementos cada uno. El sexto tiene 32 elementos, de este se aíslan 14 elementos que se colocan fuera de la tabla principal, los llamados lantánidos. o El séptimo es largo e inconcluso porque todavía no se han descubierto todos los elementos necesarios para completarlo y de él también se aíslan 14 elementos los cuales se colocan fuera y paralelamente a los lantánidos, son los llamados actínidos. 2.4. LAS FAMILIAS O GRUPOS Son los 16 grupos verticales de la tabla periódica que reúnen a los elementos con propiedades químicas iguales o que varían poco, debido a que tienen igual número de electrones en su nivel más externo Una propiedad que depende del grupo en el que se encuentra el elemento es su valencia o número de oxidación. Se clasifican en 8 principales (A) y 8 secundarias (B). 2.4.1. Familias A: Integran los elementos principales de estructura s y p. IA es la familia de los metales alcalinos, cuyos átomos tienen un electrón externo. El hidrógeno es un gas, los demás son metales. IIA es la de os metales alcalino-térreos. Todos sus átomos tienen 2 electrones externos. En III A, a excepción del B que es un no metal, están los metales térreos Al, Ga, In, Ti. Sus átomos tienen 3 electrones externos. A VA corresponden los nitrogenoides cuyos átomos tienen 5 electrones externos. El Sb y Bi son metales y los demás no metales. A VIA pertenecen los no metales anfígenos y el metal Po. Estos átomos tienen seis electrones externos. VIIA agrupa a los no metales halogenados F, Cl, Br, I y At. Sus átomos poseen siete electrones externos. 0 u VIIIA es la familia de los gases nobles. Grupo de elementos constituidos por gases monoatómicos que tiene poca reacción químicas y que solo en circunstancias especiales pueden formar compuestos, Los átomos tienen 8 electrones externos, a excepción del He que tiene un nivel y esta saturado con 2 electrones. 19 2.4.2. Familias B: Las familias secundarias están constituidas por los metales de transición. A excepción de la familia IB que tiene solo 1, todos sus átomos poseen 2 electrones externos. Cómo metal en la reacción química pierden electrones. Como no-metales forman oxisales al asociarse con el oxígeno. 2.5. PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS Son aquellas que aparecen repetidas en varios elementos y dependen de la distribución electrónica en los diferentes niveles; por ello, todos los que tienen igual número de electrones en su último nivel poseen propiedades químicas similares. 2.5.1. Configuración electrónica de los elementos A partir del Hidrógeno que cuentan tan solo con un electrón, vamos a obtener a configuración electrónica de los demás elementos, ya que cada uno tendrá un electrón más que el anterior. Este electrón se denomina electrón diferenciador. 2.5.2. Valencia química do los elementos Nos indica la proporción en la que los átomos de dicho elemento se combinan con los de los elementos restantes. La valencia coinciden con el número de electrones que pierden (oxidación) o ganan (reducción) para lograr que la última capa tenga ocho electrones. Si gana 2 electrones, como ocurre con el azufre, su valencia iónica es -2. Si pierde 2 electrones, como ocurre con el bario, su valencia iónica es +2. En el caso del carbono al tener 4 electrones externos, no cede ni gana electrones no tiene valencia iónica. Todos sus compuestos son covalentes. Algunos elementos químicos presentan más de una valencia, lo cual significa que pueden unirse con otros átomos en más de una proporción. El hierro, por ejemplo, tiene valencias iónicas +2 y +3. La valencia se clasifica en positiva, negativa y variable. Positiva: Corresponde a todos los átomos de carácter metálico, y algunos no-metales que pierden electrones y quedan con cargas eléctricas positivas, sin neutralizar su núcleo. Negativa: Es propia de los no-metales, constituyen átomos que ganan electrones para completar un nivel externo y adquieren cargas eléctricas negativas. Variable: Tienen todos los metales de transición y la mayoría de no-metales, al combinarse con el oxígeno pierden electrones en distintas cantidades. El número de valencia se refiere a la o las valencias de un elemento químico, también se lo llama número de oxidación. 20 2.5.3. Electronegatividad Cuando se ligan dos átomos del mismo elemento, como el H, compartiendo un par de electrones, estos son atraídos con igual fuerza por los núcleos de los átomos. Pero cuando se ligan dos átomos de distinto elemento, por ejemplo H y Cl, el par de electrones es atraído con más fuerza por el elemento más electronegativo, en este caso el cloro, y forma una molécula polar: tiene polo positivo y negativo. Electronegatividad es la capacidad que tiene el núcleo de un átomo para atraer electrones, participantes en un enlace químico con otro átomo. 2.5.4. Carácter metálico o electropositividad Químicamente es la tendencia de los elementos a ceder uno o más electrones. Esta propiedad ha hecho que, en principio, los elementos químicos sean considerados como metales y no metales; pero ahora se los subdivide en: Metales absolutos: Cuando solo pierden electrones y nunca están libres en la naturaleza. Elementos de transición: Pueden encontrarse puros en la naturaleza y perder o ganar electrones. No metales: han perdido la electropositividad y sus átomos únicamente tienden a ganar electrones. En general, se pueden encontrar en la naturaleza como gases o formando compuestos. Elementos inertes: Presentan poca actividad química y no muestran electropositividad ni electronegatividad. Todos son gases. El carácter metálico disminuye de izquierda a derecha en cada período y aumenta de arriba abajo en cada grupo. 2.5.5. Potencial de ionización Se corresponde inversamente con el carácter metálico. Por lo general, a mayor carácter metálico menor potencial de ionización. Potencial de ionización es la energía recibida por un átomo para perder un electrón de la última capa. En un mismo grupo el potencial de hidrógeno disminuye al aumentar el número atómico. En un periodo el potencial de ionización aumenta con el número atómico. 21 3. ENLACES QUÍMICOS 3.1. COMBINACION QUÍMICA O AFINIDAD QUÍMICA Es la preferencia que tienen los elementos para combinarse y formar moléculas. La combinación química se puede realizar ya sea por transferencia de electrones de un átomo a otro, o por compartimiento de electrones. Se realiza con los electrones de la última capa o electrones de valencia, estos átomos enlazados tendrán una estructura más estable que cuando están libres. Los gases nobles presentan una estructura más estable y completa. Todos presentan 8 electrones en la última capa con excepción del helio que solamente posee dos. Ejemplos: el hidrógeno y el oxígeno, o el sodio y el cloro, por sobre cualquier otro elemento que los rodee, se atraen y unen para formar las moléculas de agua y cloruro de sodio, respectivamente. Esta preferencia por combinarse con unos elementos más que con otros es mayor entre los metales absolutos I y IA y los no-metales de VI y VIIA. Los primeros, por ser electropositivos, pierden fácilmente sus electrones externos. Los segundos, electronegativos, ganan con fuerza electrones extras. 3.2. CLASES DE ENLACES ATÓMICOS Es importante saber cómo están unidos (enlazados) los átomos para despejar las interrogantes respecto de las propiedades de los cuerpos compuestos. Conociendo la clase de enlace, podemos deducir porqué un cuerpo es blando, conductor de la corriente eléctrica, está en estado sólido, funde a baja temperatura, etc. En general los átomos pueden unirse mediante los siguientes enlaces: Enlace Electrovalente o iónico. Enlace Covalente. Enlace Metálico. 22 3.2.1. ENLACE ELECTROVALENTE O IÓNICO Enlace electrovalente tiene lugar entre los elementos químicos y consiste en la transferencia de electrones; es decir, es la capacidad que tienen los átomos para ceder o atraer electrones y adquirir la estructura de un gas noble. Los átomos o grupo de átomos que han perdido o ganado electrones adquiriendo carga positiva o negativa se los denomina IONES. Los iones positivos o cationes ceden electrones y adquieren carga positiva. Ejemplo: Li -1e ⁻ → Li ⁺ (ion litio) Ca -2e ⁻ → Ca ⁺ ² (ion calcio) Los iones negativos o aniones ganan electrones y adquieren carga negativa. Ejemplo: Br +1e ⁻ → Br⁻ (ion bromo o bromuro) Ar +3e ⁻ → Ar ³⁻ (ion arsénico o arseniuro) Un enlace iónico se realiza cuando: - Cada uno de los átomos completan 8 electrones en su última capa. - Un átomo gana electrones y otro pierde electrones. - El elemento que gana electrones (anión) es no metálico porque es muy electronegativo; y el elemento que pierde electrones (catión) tiene carácter metálico y es poco electronegativo. - Los elementos mediante el enlace electrovalente no forman una molécula, sino iones; los mismos se neutralizan por su carga diferente y forman compuestos. - El número de electrones que se pierden es igual al número de electrones ganados. Propiedades del enlace electrovalente o iónico: - Son más abundantes en la química inorgánica. Tienen puntos de fusión y ebullición elevados. Conducen la corriente eléctrica. Los cristales de las sustancias iónicas son transparentes, duros y tienen formas características. Reaccionan instantáneamente. Cada ion tiene propiedades características, que son diferentes a las del átomo original. Son solubles en el agua y no en disolventes orgánicos. Cuando se disuelven se disocian en iones y forman disoluciones iónicas. 23 3.2.2. ENLACES COVALENTES Es la unión entre átomos electronegativos o no metálicos, en los que no hay transferencia de electrones sino un comportamiento mutuo de cada átomo. En este tipo de enlaces no existe pérdida ni ganancia de electrones. Para que se realice un enlace covalente se deben reunir las siguientes condiciones: - Completar ocho electrones en el último nivel. Poseer un mismo valor de electronegatividad o cuya diferencia sea menor que 1,7. Compartir electrones en forma eléctricamente neutra. En el enlace covalente, los pares de electrones compartidos ocupan orbitales comunes a los átomos ligados y son atraídos por estos con igual fuerza, de modo que las cargas eléctricas están distribuidas en forma equilibrada en la molécula. El momento en que los orbitales atómicos se transforman o convierten en orbitales moleculares, se produce el fenómeno de la hibridación o traslape. Por ejemplo: para la formación de la molécula de oxígeno cada uno de los dos átomos de oxígeno posee 6 electrones de valencia. Los dos electrones no apareados son los que intervienen en el enlace covalente, así. 24 Clases de enlaces covalentes a. De acuerdo con el numere de pares de electrones compartidos: Enlace simple: cuando cada átomo participa con un electrón (un par). Ejemplo: Enlace doble: cuando cada átomo participa con dos electrones (dos pares). Ejemplo: Enlace triple: cuando cada átomo participa con tres electrones (tres pares). Ejemplo: b. De acuerdo a la electronegatividad de los átomos que se unen: - Enlace covalente apolar o no polar: También llamado puro, si los átomos unidos son idénticos; es decir, con igual electronegatividad. Ejemplo: Cl₂ - Enlace covalente polar: Cuando los átomos unidos son diferentes; o sea, con diferente valor de electronegatividad. Ejemplo: H₂O c. De acuerdo con el átomo que aporta los electrones del enlace: - Covalente normal: Si ambos átomos unidos contribuyen con el mismo número de electrones. Ejemplo: H₂S. 25 - Covalente coordinado: Llamado también dativo es la unión entre dos átomos no metálicos de distinta electronegatividad en el que el par de electrones compartido pertenece a uno solo de los átomos o iones enlazados. Al elemento que dona los electrones se le llama dador y al que se enlaza, aceptor. En el enlace dativo se usa una flecha que va dirigida desde el dador al aceptor. Ejemplo: El ion NH4 puede representarse así: Propiedades del enlace covalente: Son más abundantes en la química orgánica. Tienen puntos de fusión bajos. No conducen la corriente eléctrica. Son suaves. Reaccionan lentamente porque los enlaces covalentes son difíciles de romper. No son solubles en el agua sino en disolventes orgánicos. Al disolverse no se disocian sus moléculas y forman disoluciones moleculares. 3.2.3. ENLACE METÁLICO Es la unión entre átomos electropositivos de masa metálica mediante una nube electrónica. Los átomos de un metal son iones positivos por haber perdido sus electrones externos, pero estos no se han esfumado sino en conjunto forman la nube electrónica que circula por todo el metal aprisionado en los iones positivos. Por tal razón, los metales son buenos conductores de la electricidad y pueden alearse con facilidad mediante la fundición. 3.3. FÓRMULA QUÍMICA Las fórmulas químicas son representaciones gráficas de las sustancias químicas puras, simples, compuestas y de su molécula o composición química. La fórmula representa el peso molecular de una sustancia. En la nomenclatura química los elementos se representan mediante símbolos y los compuestos mediante fórmulas. La fórmula H2 representa a la sustancia simple, hidrógeno y su mínima porción o molécula formada por dos átomos del mismo elemento, indicado por el subíndice 2. 26 H2O simboliza a la sustancia compuesta, agua y su molécula constituida por dos átomos de hidrógeno, señalados por el subíndice 2, y uno de oxígeno, sin subíndice porque el mismo símbolo representa un átomo. Ca(OH)2 representa a la sustancia hidróxido de calcio y su composición mínima integrada por un átomo de calcio, sin subíndice, y dos grupos atómicos OH, encerrados entre paréntesis, identificados con el subíndice 2. Las sustancias simples están constituidas por átomos de un mismo elemento, que no pueden ser descompuestas por métodos químicos. 3.4. NOTACIÓN DE LOS ELEMENTOS Se representan mediante símbolos, que contienen la primera letra del elemento en latín o castellano. Algunos símbolos pueden contener dos letras una mayor diferenciación; en este caso, la primera letra se escribe con mayúscula y la otra en minúscula. Ejemplo: H K Cu Ag hidrógeno kalium = potasio cobre argentum = plata 3.5. NOMENCLATURA DE LOS ELEMENTOS Los nombres dados a las sustancias simples o elementos se deben muchas veces a una propiedad de ellos, así por ejemplo: hidrógeno = engendrador de agua oxigeno = oxidante Otras veces se toma en cuenta su lugar de descubrimiento; ejemplo: - europio = descubierto en Europa. - polonio = descubierto en Polonia. Se han puesto nombres de los planetas en donde se cree que existen en grandes cantidades; ejemplo: - uranio, de Urano - plutonio, de Plutón Otros llevan nombres de científicos notables; ejemplo. - Kurchatovio en honor a Dr. Kurchatov Einstenio en honor a Einstein Otros elementos conservan sus nombres primitivos: ejemplo: - Oro - plata 27 3.6. CLASIFICACIÓN DE LOS ELEMENTOS Las sustancias simples se pueden clasificar de acuerdo a sus propiedades físicas, en metales y no metales. 3.6.1. Metales Presentan las siguientes propiedades: Son buenos conductores del calor y la electricidad. Son dúctiles y maleables. Poseen brillo metálico. Son duros y resistentes. Todos son sólidos con excepción del mercurio. Son electropositivos (ceden electrones con facilidad). Al unirse con el oxígeno forman sustancias llamadas óxidos metálicos. Los metales de acuerdo a su valencia pueden ser: Alcalinos (+1): Li, Na, K, Rb, Cs, Fr, Ag, NH₄ (radical amonio) Alcalinos térreos (+2): Ba, Be, Cd, Ca, Mg, Sr, Ra, Zn. Trivalentes (+3): Al, Bi, B. Tretravalentes (+4): Pt, Ir, Os, Pd, Zr. Hexavalentes (+6): U, W, Mo. Con valencia (+1, +2): Cu, Hg. (+1, +3): Au. (+2, +3): Co, Cr, Fe, Mn, Ni. (+2, +4): Pb, Sn. (+3, +5): V. 3.6.2. No metales Estos tienen las siguientes características: Son malos conductores del calor y la electricidad. No son dúctiles ni maleables. No poseen brillo metálico A temperatura ordinaria son sólidos frágiles o generalmente gases. El único no metal líquido es el bromo. Son electronegativos (ganan electrones con facilidad).Al unirse con el oxígeno forman anhídridos. Los no metales se clasifican en: Halógenos: (-1) (+1, +3, +5, +7): F, Cl, Br, I. Anfígenos: (-2) (+2, +4, +6): O, S, Se, Te. Nitrogenoides: (+3) (+1, +2, +3, +4, +5): N, P, As, Sb. Carbonoides: (- 4) (+4): C, Si, Ge. 28 3.6.3. Elementos más usados Elementos que generalmente se usan para formar compuestos. Los números de valencia están en valor absoluto. Elemento Símbolo Número de Valencia Elemento Símbolo Número de Valencia Aluminio Al 3 Antimonio Sb 3y5 Arsénico As 3y5 Astato At 1, 3, 5 y 7 Azufre S 2, 4 y 6 Bario Ba 2 Berilio Be 2 Bismuto Bi 3y5 Boro B 3 Bromo Br 1y5 Cadmio Cd 2 Calcio Ca 2 Carbono C 2y4 Cesio Cs 1 Cinc Zn 2 Circonio Zr 4 Cloro Cl 1, 3, 5 y 7 Cobalto Co 2y3 Cobre Cu 2y1 Cromo Cr 2, 3, 4, 5 y 6 Escandio Sc 3 Estaño Sn 2y4 Estroncio Sr 2 Flúor F 1 Fósforo P 1,3 y 5 Galio Ga 3 Germanio Ge 2,4 y -4 Hafnio Hf 4 Hidrógeno H 1 y -1 Hierro Fe 2y3 Iridio Ir 2, 3, 4 y 6 Itrio Y 3 Lantano La 3 Litio Li 1 Magnesio Mg 2 Manganeso Mn 2, 3, 4, 6, 7 Mercurio Hg 1y2 Molibdeno Mo 2, 3, 4, 5 y 6 Niobio Nb 3 Níquel Ni 2y3 Nitrógeno N 2, 3, 4 y 5 Oro Au 1y3 Osmio Os 2, 3, 4 y 6 Plata Ag 1 Platino Pt 2y4 Plomo Pb 2y4 Potasio K 1 Renio Re 1, 2, 4, 6 y 7 Rodio Rh 2, 3 y 4 Rubidio Rb 1 Rutenio Ru 2, 3, 4, 6 y 8 Selenio Se 2, 4 y 6 Silicio Si 4 Sodio Na 1 Talio Tl 1y3 Tántalo Ta 5 Tecnecio Tc 7 Telurio Te 2, 4 y 6 Titanio Ti 3y4 Vanadio V 2, 3, 4 y 5 Yodo I 1,3, 5 y 7 29 3.7. SUSTANCIAS COMPUESTAS Todo compuesto químico es el resultado de una combinación o unión íntima entre dos o más elementos diferentes. Si el compuesto está formado por dos elementos, se denomina binario; por tres, ternario; por cuatro, cuaternario; y por más de cuatro se llaman compuestos complejos. Se las representa mediante fórmulas que pueden ser: 3.7.1. Fórmulas condensadas o mínimas Indican la composición de una sustancia mediante la simbología de los elementos componentes y la proporción de sus átomos a través de subíndices numéricos. Entre paréntesis se encierran los grupos atómicos que se repiten. A su vez, estas fórmulas pueden ser empíricas, si señalan la composición mínima sin proporcionar datos de la constitución molecular, y moleculares cuando denotan esta. Ejemplos: Fórmula empírica (CH)n (CH₂O)n Fórmula molecular C₂H₂ C₂H₁₂O₆ Sustancia etileno glucosa En general la formulación empírica se utiliza en la química orgánica, porque al dar valores a “n” se obtiene un sinnúmero de compuestos; esto no ocurre en la química inorgánica. 3.7.2. Semidesarrolladas Mediante rayas indican los enlaces importantes entre grupos atómicos característicos. Ejemplos: 30 3.7.3. Desarrolladas o estructurales Determinan con rayas la ubicación espacial de los átomos en la molécula y todos sus enlaces. Ejemplo: 3.7.4. Electrónicas Son fórmulas desarrolladas y escritas con símbolos electrónicos para mostrar las transferencias de electrones entre los átomos, hasta que adquieran la estructura electrónica estable. Para establecer la procedencia de los elementos se les representa con puntos claros y oscuros. Ejemplos: 3.8. COEFICIENTE, PREFIJOS, SUBÍNDICE Y PARÉNTESIS. Coeficiente: Número grande colocado antes de la fórmula; factor que afecta a todos los términos; por ejemplo: el 2CaCl2 en donde el primer 2 es el coeficiente por tanto existen 4 átomos de cloro y 2 de calcio. Prefijos: Se utilizan algunos prefijos para la sistematización del nombre de los compuestos. Algunos prefijos numéricos mono, di, tri, tetra, penta, hexa, etc. En los prefijos multiplicativos tenemos: bis, tris, tetrakis, pentakis, etc. Subíndice: Nos indica el número de veces que el átomo o grupo atómico se repite en la estructura molecular. Los subíndices son números pequeño que se coloca en la parte inferior derecha de cada átomo y afecta solo a este; por ejemplo: CaCl2 en donde el subíndice es el 2 e índica 2 átomos de cloro. Paréntesis: en la nomenclatura química aparece con más frecuencia el paréntesis y el corchete. El paréntesis utilizamos para encerrar un grupo atómico que se repite en la estructura molecular o fórmula; por ejemplo: A12(CO3)3. El corchete es usado exclusivamente en los compuestos de coordinación. “Efectuando prácticas es la mejor forma de aprender química, ya que con el tiempo recordamos… 10-20% de lo que oímos; 20-40% de lo que vemos y 60-80% de lo que hacemos” (José María Casas Sabata) 31 4. PRINCIPALES COMBINACIONES QUÍMICAS INORGÁNICAS 4.1. COMPUESTOS BINARIOS. Como se indicó anteriormente, estos compuestos están formados por dos elementos; y pueden ser oxigenados y no oxigenados. Dentro de los compuestos oxigenados tenemos los anhídridos, óxidos básicos, neutros, salinos, anfóteros y peróxidos. Como compuestos no oxigenados están los ácidos hidrácidos, hidruros metálicos, compuestos especiales, sales halógenas neutras, compuestos no salinos, aleaciones y amalgamas. 4.2. FORMULACIÓN DE LOS COMPUESTOS BINARIOS Para escribir sus fórmulas se intercambian valencias entre los elementos reaccionantes, escribiéndolas como subíndices del elemento contrario, así: En el tricloruro de aluminio, el cloro tiene el subíndice 3, que corresponde a la valencia del aluminio; este debería tener el subíndice 1, correspondiente a la valencia del cloro, pero no se escribe porque el mismo símbolo (Al) ya representa un átomo. El orden de la escritura química consiste en ubicar primero los elementos menos electronegativos y luego los otros; por ejemplo en las sales se coloca en primer lugar el símbolo del metal y luego el del no metal. Igual se hace con los otros compuestos. 4.3. SIMPLIFICACIÓN DE FÓRMULAS Si después de intercambiar valencias se encuentra que los subíndices mayores que son iguales entre si, o el uno es múltiplo del otro, se procede a “simplificar la fórmula” dividiendo dichos subíndices para un número común divisor. Ejemplo: 4.4. SISTEMAS DE NOMENCLATURA Utilizaremos tres tipos de nomenclaturas a. Nomenclatura Sistemática b. Nomenclatura IUPAC. c. Nomenclatura Tradicional. 32 4.4.1. NOMENCLATURA SISTEMÁTICA. Para nombrar compuestos químicos según esta nomenclatura se utilizan los prefijos: Prefijos griegos Atomicidad mono1 di2 tri3 tetra4 penta5 hexa6 hepta7 octa8 9 nona- (o eneá) deca10 4.4.2. NOMENCLATURA IUPAC Este nombre es tomado de la UNIÓN INTERNACIONAL DE QUÍMICA PURA Y APLICADA, entidad encargada de establecer una reglamentación racional para la formulación y nombre de las sustancias. Este sistema parte de la estructura real de las moléculas dando nombres a las fórmulas en base a los distintos átomos utilizando prefijos adecuados a una sistematización clara y sencilla. Al estudiar cada grupo de compuestos se indica las reglas propuestas por la IUPAC, sin embargo tomaremos en cuenta algunas normas importantes: 1.- En los compuestos binarios se tendrá la siguiente sistematización general. - nombre del constituyente más electronegativo (anión) con el sufijo URO de nombre del constituyente electropositivo sin ninguna variación. 2.- para el catión que presenta varios estados de oxidación se utilizará la Notación STOCK. Notación stock. La notación Stock es un sistema de nomenclatura se basa en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento con “nombre específico” (valencia o número de oxidación, es el que indica el número de electrones que un átomo pone en juego en un enlace químico, un número positivo cuando tiende a ceder los electrones y un número negativo cuando tiende a ganar electrones), anteponiendo a este número, encerrado entre paréntesis, se escribe el nombre genérico y el específico del compuesto de esta forma: Nombre genérico + de + nombre del elemento específico + el No. de valencia. 33 Normalmente, a menos que se haya simplificado la fórmula, la valencia puede verse en el subíndice del otro átomo (en compuestos binarios y ternarios). Los números de valencia normalmente se colocan como superíndices del átomo en una fórmula molecular. Ejemplo: Fe2+3S3-2, sulfuro de hierro (III) [Se ve la valencia III del hierro en el subíndice o atomicidad del azufre]. 3.- El uso de los sufijos OSO e ICO que afectan al nombre del metal o constituyente electropositivo queda eliminado de la nomenclatura química 4.- si por la estructura especial del compuesto, no se puede dar un nombre claro con las normas específicas se utilizará prefijos de cantidad adecuados. Este sistema le vamos a denominar “Nombre lectura” y debe usarse principalmente en los casos que los nombres de las sustancias no tengan una sistematización adecuada. 4.4.3. NOMENCLATURA TRADICIONAL, CLÁSICA O FUNCIONAL En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos griegos. La forma de nombrar los compuestos es: prefijo-nombre genérico + prefijo-nombre específico Cuando el elemento sólo tiene una valencia, simplemente se coloca el nombre del elemento precedido de la sílaba “de” (Na2O, oxido de sodio). Cuando tiene dos valencias diferentes se usan los sufijos -oso e -ico. … -oso cuando el elemento usa la valencia menor: Fe+2O-2, hierro con la valencia +2, óxido ferroso … -ico cuando el elemento usa la valencia mayor: Fe2+3O3-2, hierro con valencia +3, óxido férrico Cuando tiene tres distintas valencias se usan los prefijos y sufijos hipo - … - oso (para la valencia inferior) … - oso (para la valencia intermedia) … - ico (para la valencia superior) Cuando tiene cuatro distintas valencias se usan los prefijos y sufijos hipo - … - oso (para las valencias 1 y 2) … - oso (para la valencias 3 y 4) … - ico (para la valencias 5 y 6) per - … - ico (para la valencia 7): 34 Ejemplo: Mn2+7O7-2, óxido permangánico (ya que el manganeso tiene más de dos números de valencia y en este compuesto está trabajando con la valencia 7) 4.5. OTRAS REGLAS Y CONCEPTOS GENERALES Los compuestos (binarios y ternarios) en su nomenclatura están formados por dos nombres: o Genérico o Específico. El nombre genérico o general: Es el que indica a qué grupo de compuestos pertenece la molécula o su función química, por ejemplo si es un óxido metálico/básico, un óxido no metálico/ácido, un peróxido, un hidruro, un hidrácido, un oxácido, una sal haloidea, etc. El nombre específico: Es el que diferencia a las moléculas dentro de un mismo grupo de compuestos. Por lo general en los tres sistemas de nomenclatura se escribe primero el nombre genérico seguido del específico. Por ejemplo: óxido ferroso y óxido férrico, estos dos compuestos pertenecen al grupo de los óxidos y por eso su nombre genérico es óxido y a la vez los nombres específicos ferroso y férrico hacen referencia a dos compuestos diferentes FeO y Fe2 O3, respectivamente. En general, en una fórmula molecular de un compuesto se coloca a la izquierda el elemento con carga o número de valencia positivo (elemento más electropositivo) y a la derecha el que contenga el número de valencia negativo (elemento más electronegativo). Y al contrario de esto, en nomenclatura se coloca primero el nombre genérico, que es el que designa al elemento de la derecha (el más electronegativo), y el nombre específico en segundo lugar, que es el que designa al elemento de la izquierda (el menos electronegativo). “Que tu influencia sea tan fuerte y tan suave, tan amorosa y respetuosa, que el contacto contigo note tu alumno una fuerza misteriosa que lo transforme en otro, sin darse cuenta.” (J. A. Ríos) 35 PARTE II NOMENCLATURA Y NOTACIÓN DE LOS COMPUESTOS QUÍMICOS INTRODUCCIÓN Para iniciar el estudio de la nomenclatura es necesario distinguir primero entre compuestos orgánicos e inorgánicos. Los compuestos orgánicos son los que contienen carbono, comúnmente enlazados con hidrógeno, oxígeno, boro, nitrógeno, azufre y algunos halógenos. El resto de los compuestos se clasifican como compuestos inorgánicos. Éstos se nombran según las reglas establecidas por la IUPAC. Los compuestos inorgánicos se clasifican según la función química que contengan y por el número de elementos químicos que los forman, con reglas de nomenclatura particulares para cada grupo. Una función química es la tendencia de una sustancia a reaccionar de manera semejante en presencia de otra. Por ejemplo, los compuestos ácidos tienen propiedades características de la función ácido, debido a que todos ellos tienen el ion H+1; y las bases tienen propiedades características de este grupo debido al ion OH-1 presente en estas moléculas. Las principales funciones químicas son: óxidos, bases, ácidos y sales. La nomenclatura, es el conjunto de reglas que se siguen para denominar a los elementos y sustancias compuestas desde el punto de vista científico. De acuerdo a esto las sustancias se dividen en sustancias simples, compuestas y especiales. 36 1. COMPUESTOS NO OXIGENADOS 1.1. HIDRUROS Son compuestos que contienen hidrógeno y átomos de cualquier otro elemento Se dividen en: - Hidruros metálicos Hidruros no metálicos 1.1.1. HIDRUROS METÁLICOS Metal + Hidrógeno → Hidruro metálico Son compuestos binarios o diatómicos formados por hidrógeno y un metal. En estos compuestos, el hidrógeno siempre tiene valencia -1, los metales tendrán por lo tanto número de oxidación positivo. Su fórmula general es Metal + H. Nomenclatura. a.- nomenclatura IUPAC El nombre se forma de la siguiente manera: - Hidruro de nombre del metal El nombre del metal sin ninguna variación. Si el metal presenta dos o más estados de oxidación se utilizarán la notación Stock. Ejemplos: NaH CaH2 FeH2 FeH3 Hidruro de sodio Hidruro de calcio Hidruro de hierro (II) Hidruro de hierro (III) También podemos utilizar el nombre lectura. Ejemplo: PbH4 Crh3 Tetrahidruro de plomo Trihidruro de cromo 37 b.- Nomenclatura tradicional. Por las razones conocidas este sistema tiende a desaparecer. Veamos como se estructura un nombre tradicional. - Hidruro de nombre del metal Si el metal tiene dos valencias se empleará el sufijo OSO para la menor valencia e ICO para la mayor valencia. En estos casos desaparece la preposición “de”. Ejemplos: LiH CoH2 CoH3 Hidruro de litio Hidruro cobaltoso Hidruro cobáltico Formulación. Es norma internacional escribir la fórmula poniendo en primer lugar el símbolo del metal y luego el del hidrógeno. Las fórmulas desarrolladas presentan la siguiente estructuta: CaH2 AuH3 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación es igual a cero. FeH3 3+ 3– Fe H3 (3+) + 3(1-) = 0 Escritura y lectura de una fórmula Escritura. - Colocar los simbolos en el orden establecido. Intercambiar los números de oxidación. 38 Ejemplos: - Hidruros de cobalto(III) 3+ 1Co H - Co H3 Hidruro de bismuto 3+ 1Bi H Bi H3 Lectura. - Recordar los números de oxidación de los átomos presentes en la fórmula. Establecer el número de oxidación del metal. Aplicar las normas establecidas. Ejemplos: - NiH2 - SnH4 NiH2 X Ni 2H3 2+ Ni 2H2 4H4 4+ Sn 4H4 Hidruro de niquel (II) SnH4 X Sn Hidruro de estaño (IV) Hidruros Metálicos Compuesto Nomenclatura sistemática Nomenclatura Stock Nomenclatura tradicional KH monohidruro de potasio o hidruro de potasio (I) o hidruro de potasio hidruro de potasio hidruro potásico o hidruro de potasio NiH3 trihidruro de níquel hidruro de níquel (III) hidruro niquélico PbH4 tetrahidruro de plomo hidruro de plomo (IV) hidruro plúmbico 39 1.1.2. HIDRUROS NO METÁLICOS No metal + Hidrógeno → Hidruro no metálico Son compuestos formados entre el hidrógeno y un no metal de las familias VIA y VIIA ( anfígenos y halógenos respectivamente). Para dar facilidad al estudio de estos compuestos les agruparemos en base a la clasificación periódica de los elementos. Hidruros de los grupos VI y VII Cuando estas sustancias se hallan disueltas en agua tienen un carácter ácido, por ello se denominan ACIDOS HIDRÄCIDOS. Elementos del grupo VII: F, Cl, Br y I. No. de oxidación 1- Elementos del grupo VI: S, Se, Te No. de oxidación 2- El número de oxidación del hidrógeno es 1+ Nomenclatura a.- Nomenclatura IUPAc. El nombre se forma: - Raíz del nombre del no metal con la terminación URO de hidrógeno Podemos también utilizar un nombre lectura Ejemplos: HCl H2S HI H2Te H2S7 Cloruro de hidrógeno Sulfuro de hidrógeno Ioduro de hidrógeno Teluro de hidrógeno Heptasulfuro de dihidrógeno. Nota: la fórmula correcta para el fluoruro de hidrógeno es H2F2 y no la forma simple HF. b.- Nomenclatura tradicional. Los nombres tradicionales se admiten cuando estas sustancias se hallan disueltas en agua. 40 El nombre se forma de la siguiente manera: - Ácido raíz del nombre del no metal con la terminación HIDRICO. Ejemplos: HCl H2S Hi H2F2 Ácido clorhídrico Ácido sulfhídrico Ácido iodhídrico Ácido fluorhídrico Formulación. Se escribe en primer lugar el símbolo del hidrógeno y luego el del no metal. Es costubre hacer lo contrario, por favor no lo hagamos. Las formulas desarrolladas presentan la siguiente estructura: HCl H2Te En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación es igual a cero. H2Se 2+ 2H2 Te 2(1+) + (2-) = 0 Hidruros de los grupos III, IV y V. Tradicionalmente se denominan compuestos especiales Elementos del grupo III: B No. de oxidación 3Elementos del grupo IV: C, Si No. de oxidación 4Elementos del grupo V: N, P, As, Sb No. de oxidación 3El número de oxidación del hidrógeno en estos compuestos es 1+ 41 Nomenclatura. a.- Nomenclatura IUPAC - Hidruro con el prefijo de cantidad adecuado de nombre del no metal b.- Nomenclatura tradicional. Los nombres tradicionales especiales son admitidos por la IUPAC Ejemplos: Fórmula: Nombre IUPAC: BH3 CH4 SiH4 NH3 PH3 AsH3 SbH3 Si3H8 Trihidruro de boro Tetrahidruro de carbono Tetrahidruro de silicio Trihidruro de nitrógeno Trihidruro de fósforo Trihidruro de arsénico Trihidruro de antimonio Octahidruro de trisilicio Nombre tradicional: Borano Metano Silano Amoniaco Fosfina Arsina Estibina Trisilano Formulación. La IUPAC acepta la formulación citada anterior mente, primero el símbolo del no metal y luego el del hidrógeno. 1.1.2.1. HIDRÁCIDOS Hidruro no metálico + Agua → Hidrácido Los hidrácidos provienen de disolver en agua a los hidruros no metálicos y por esa misma razón son estos los que se encuentran en estado acuoso. Se nombran con la palabra ácido, como nombre genérico, y como nombre específico se escribe el nombre del no metal y se le agrega el sufijo –hídrico. Al igual que en estado gaseoso el nombre genérico es nombrado por el elemento más electropositivo. 42 Ejemplos: Compuesto HCl HF HBr HI H2S H2Se H2Te 1.2. En estado puro cloruro de hidrógeno fluoruro de hidrógeno bromuro de hidrógeno yoduro de hidrógeno sulfuro de hidrógeno seleniuro de hidrógeno teluluro de hidrógeno En disolución ácido clorhídrico ácido fluorhídrico ácido bromhídrico ácido yodhídrico ácido sulfhídrico ácido selenhídrico ácido telurhídrico ALEACIONES Y AMALGAMAS Una aleación es la unión de dos o más metales en cantidades variables. Son sistemas homogéneos donde los constituyentes se hallan en proporciones fijas formando una mezcla o una combinación (compuestos intermetálicos). Las aleaciones se preparan mezclando metales fundidos para que sus iones puedan difundirse mutuamente, luego se solidifican y producen nuevas sustancias metálicas con características especiales. Las propiedades varian según la proporción de sus componentes, que no intervienen con sus valencias y por esto se les llama “compuestos intermetálicos”. En general las aleaciones son mas duras y tenace, tieen menor punto de fusión, menor conductividad térmica, menor maleabilidad y ductilidad, se dilatan en menor grado y reíste a la oxidación mejor que sus elementos constituyentes aislados. Las aleaciones poseen gran importancia, más que los metales puros, en las aplicaciones técnicas y práct6icas por sus exelentes propiedades. Ejemplos de aliaciones. Nombre Binarias acero bronce de aluminio plata de acuño oro de acuño amalgama de dentista plomo de bateria suelda de estaño latón amarillo Composición Fe 99% ; C 1% Cu 90% ; Al 10% Ag 90% ; Cu 10% Au 90% ; Cu 10% Hg 70% ; Cu 30% Pb 94% ; Sb 6% Pb 67% ; Sn 33% Cu 65-90% ; Zn 35-10% Aplicaciones clavos, tornillos, láminas bielas, cajas de cigüeñal acuñación de monedas, joyas acuñación de monedas, joyas curaciones dentales acumuladores de plomo soldadura de hojalata, alambres piezas decorativas 43 Nombre Ternarias bronce ordinario electrón oro de dentista manganio acero inoxidable acero al níquel-cromo acero al molibdeno acero al tungsteno Composición Aplicaciones Cu 92% ; Sn 6%; Zn 2% Mg 95% ; Zn 4,6% ; Cu 2% Au 58% ; Cu 14-28%; Hg 28-14% Cu 82,5% ; Mn 16% ; Ni 1,5% Fe 60-80% ; Cr 20-10% ; Ni 20-8% Fe 95-98% ; Ni 1-4% ; Cr 0,5-2% Fe 90-95% ; Mo 6-7% ; Cr 2-4% Fe 80-94% ; W 4-18% ; Cu 2-4% campanas, cerraduras armazones de aviones corona dentales aparatos eléctricos recipientes para laboratorio blindajes, alambres herramientas, rieles navajas, cuchillos Nombre Cuaternarias duraluminio plomo de imprenta Composición Al 94% ; Cu 5%; Mn 0,5% ; Mg 0,5% Pb 58% ; Sn 26% ; Sb 15%; Cu 1% Aplicaciones aeroplanos, barcos, vagones caracteres de imprenta Nomenclatura. Con frecuencia se emplea nombres vulgares aceptados en la industria Podemos sistematizar la siguiente nomenclatura: - Aleación o amalgama de nombre del metal o metales Ejemplos: CuZn CuNiZn CuSn HgPt HgAg HgCu Aleación de cobre-cinc Aleación de cobre-níquel-cinc Aleación de cobre-estaño Amalgama de platino Amalgama de plata Amalgama de cobre Latón Plata alemana Bronce de campanas En los casos que la unión de metales se forme compuestos intermetálicos, el nombre se obtiene con el sistema “nombre lectura” Ejemplos: Cu Zn2 Cobre-cinc-dos Mg2Ni Magnesio-2-níquel En la fórmula irá en primer lugar el símbolo del elemento más electropositivo. 44 Formulación. En las aleaciones se escribe la fórmula colocado los símbolos en orden descendiente a su composición porcentual. En las amalgamas se escribe primero el símbolo del mercurio y a continuación los otros. 1.3. COMPUESTOS ENTRE NO METALES. Tradicionalmente se denomina compuestos no salinos. Son sustancias que provienen de la combinación de los no metales entre si. Para la estructura de la fórmula es necesario que recordemos el orden de electronegatividad de los no metales. F, O, Cl, N, Br, I, S, C, Se, Te, H, P, As, Sb, Si, B. Electronegatividad decreciente. Nomenclatura. Nomenclatura IUPAC - Raíz del nombre del no metal más electronegativo terminado en URO de nombre del oro no metal Si el elemento menos electronegativo presenta varios estados de oxidación se emplea la notación Stock. Se recomienda utilizar el nombre lectura. Ejemplos: BrCl CS2 PCl3 PCl5 CCl4 Cloruro de bromo Sulfuro de carbono Cloruro de fósforo (III) Cloruro de fósforo (V) Tetracloruro de carbono Tricloruro de fósforo Pentacloruro de fósforo Formulación. Escribir en primer lugar el símbolo del no metal menos electronegativo y luego el símbolo del otro no metal. 45 La estructura desarrollada de estas fórmulas presenta la siguiente característica. CS2 P2S3 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero CCl4 4+ 4C Cl4 (4+) + 4(1-) = 0 Escritura y lectura de una fórmula Escritura. - Colocar los símbolos en el orden establecido Intercambiar mentalmente las valencias Ejemplo: Sulfuro de arsénico (III) 3 As 2 S As2S3 Lectura. Recordar las normas indicadas Ejemplo: SbI3 SeCl2 1.4. Triyoduro de arsénico Clururo de selenio Yoduro de arsénico (III) COMBINACIÓN ENTRE METAL Y NO METAL 1.4.1. Sales binarias neutras Provienen de la combinación de un metal con un no metal de los grupos VI y VII de la tabla periódica. 46 Tradicionalmente se denomina “sales halogenadas”, “sales halóideas”. Resultan de reemplazar teóricamente los hidrógenos de un ácido hidrácido. También puede formarse de la reacción de un ácido hidrácido con un hidróxido NaOH + HCl = NaCl + H2O 3H2S + 2 Al(OH) 3 = Al2S3 + 6 H2O Recordemos los números de oxidación de los no metales Grupo VI: S, Se, Te 2Grupo VII: F, Cl, Br, I 1Los metales tienen número de oxidación positivo. Nomenclatura. a.- nomenclatura IUPAC. - Raíz del nombre del no metal con la terminación URO de nombre del no metal o radical catiónico El nombre del metal sin ninguna variación. Si el metal tiene varios estados de oxidación se utilizará la notación Stock. Si no es posible dar un nombre claro con la norma anterior, se empleará el sistema nombre lectura. Ejemplos: LiCl CaS Mn2Se3 CuS PbCl4 Cloruro de litio Sulfuro de calcio Seleniuro de manganeso (III) Sulfuro de cobre (II) Tetracloruro de plomo NOTA.- En las sales de mercurio (I), el mercurio actúa formando una unión –Hg-Hgcomo el número de oxidación es 1+ al ser dos mercurios será 2+. Por esta razón los compuestos binarios serán: Hg2I2 Hg4S2 Ioduro de mercurio (I) ó Diyoduro de dimercurio Sulfuro de mercurio (I) ó Disulfuro de tetramercurio 47 b.- Nomenclatura tradicional. Este sistema tiende a desaparecer, recomiendo utilizar el sistema IUPAC. Ejemplos: FeBr2 FeBr3 NiS Ni2S3 Bromuro ferroso Bromuro férrico Sulfuro niqueloso Sulfuro niquélico Formulación. Es norma internacional escribir en primer lugar el símbolo del metal o radical catiónico y luego el del no metal. NaCl NH4Br Cloruro de sodio Bromuro de amonio Las estructuras desarrolladas tienen a los átomos distribuidos de la siguiente manera: Co2S3 MgCl2 En una fórmula, la suma algebraica de las cargas asignadas a loa átomos en base a los números de oxidación será igual acero. Al2Te3 6+ 6Al2 Te3 2(3+) + 3(2-) = 0 Escritura y lectura de una fórmula Escritura. - Colocar los símbolos en el orden establecido. Intercambiar mentalmente los números de oxidación prescindiendo del signo. De ser necesario simplificar los subíndices para tener la fórmula mínima. 48 Ejemplos: 1+ NH4 3+ Fe Bromuro de amonio 1Br NH4Br Sulfuro de hierro 2S Fe2S3 Lectura. - Establecer el número de oxidación del metal Aplicar las normas conocidas Ejemplos: - CrI3 X Cr 3I3 3+ Cr 3I3 El cromo tiene números de oxidación 2+ y 3+ Nombre de la fórmula propuesta: Ioduro de cromo (III) ó Triyoduro de cromo - SnS2 X Sn 4S2 4+ Sn 4S2 El estaño tiene números de oxidación 2+ y 4+ Nombre de la fórmula propuesta: Sulfuro de estaño (IV) ó Disulfuro de estaño 1.4.2. Combinación de metales con no metal de los grupos IV y V. La nomenclatura y notación de estos compuestos es semejante a las sales binarias. El número de oxidación de los no metales es: Grupo V: N, P, As, Sb Grupo IV: C, Si 3449 Ejemplos: Ca3P2 K3H Al4C3 K3As Fosfuro de calcio Nitruro de potasio Carburo de aluminio Arseniuro de potasio 1.4.3. Polisulfuros, poliseleniuros y politelururos En estas sustancias hay una condensación del no metal. El número de oxidación del grupo condensado coincide con el usual del elemento frente al hidrógeno o sea de 2Para el nombre de estas sustancias utilizamos el sistema “nombre lectura”. Ejemplos: FeS2 Na2Se4 CaS4 K2Te5 Disulfuro de hierro Tetraseleniuro de disodio Tetrasulfuro de calcio Pentatelururo de dipotasio La formula desarrollada presenta la siguiente distribución de los átomos: K2 S3 En la fórmula, la suma algebraica de los números de oxidación será igual a cero. Ba Sb 2+ 2Ba (S) (2+) + (2-) = 0 “¿Serás médico, abogado, ingeniero? ¡Qué importa! Cualquier cosa que seas, exigirá un elemento invariable que tiene el nombre de responsabilidad.” (Juan el Presbítero) 50 2. COMPUESTOS OXIGENADOS 2.1. ÓXIDOS Son compuestos químicos inorgánicos diatómicos o binarios formados por la unión del oxígeno con otro elemento diferente de los gases nobles. Según si este elemento es metal o no metal serán óxidos básicos u óxidos ácidos. El oxígeno siempre tiene valencia -2 con excepción en los peróxidos (ion peróxido enlazado con un metal) donde el oxígeno utiliza valencia “-1”. Los óxidos se pueden nombrar en cualquiera de los tres sistemas de nomenclaturas; si se utiliza el sistema Stock, el número romano es igual a la valencia del elemento diferente del oxígeno; si se utiliza el sistema tradicional los sufijos y prefijo se designan de acuerdo a la valencia del elemento diferente del oxígeno y si se utiliza la nomenclatura sistemática, no se tienen en cuenta las valencias, sino que se escriben los prefijos en cada elemento de acuerdo a sus atomicidades en la fórmula molecular. 2.1.1. ÓXIDOS BÁSICOS U ÓXIDOS METÁLICOS Metal + Oxígeno → Óxido básico Son aquellos óxidos que se producen entre el oxígeno y un metal cuando el oxígeno trabaja con un número de valencia -2. Su fórmula general es metal + O. NOMENCLATURAS a.- Nomenclatura IUPAC. Nomenclatura sistemática: El nombre genérico es óxido y el específico, el nombre del metal precedido por de. Ambos se acompañan de los prefijos cuantitativos. Ejemplos. FeO monóxido de hierro Fe₂O₃ trióxido de dihierro Nomenclatura Stock: El nombre genérico es óxido y el específico, el del metal y entre paréntesis la valencia en números romanos. Ejemplos: FeO óxido de hierro (II) Fe₂O₃ óxido de hierro (III) 51 b.- Nomenclatura Tradicional En la nomenclatura tradicional el nombre genérico es óxido y el específico, el del metal precedido por se el sufijo -oso e -ico si la valencia es mayor o menor respectivamente. Ejemplo: FeO óxido ferroso u óxido de hierro Fe₂O₃ óxido férrico En la nomenclatura tradicional para los óxidos que se enlazan con metales que tienen más de dos números de valencia se utilizan las siguientes reglas: - Metales con números de valencia hasta el 3 se nombran con las reglas de los óxidos. Metales con números de valencia iguales a 4 y mayores se nombran con las reglas de los anhídridos. Ejemplos: V2+3O3-2 se nombra como óxido, óxido vanádico; V2+5 O5-2 se nombra como anhídrido, anhídrido vanádico. Los átomos de vanadio con número de valencia: 2 (-oso) y 3 (-ico) se nombran como óxidos 4 (-oso) y 5 (-ico) como anhídridos. Formulación: Los óxidos básicos se formulan escribiendo en primer lugar el símbolo del metal y luego del oxigeno y se intercambian las valencias. La estructura desarrollada de las fórmulas presenta la siguiente distribución de los átomos: Li2O Fe2O3 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. Co2O3 6 + 6Co2O3 2(3+1) + 3(2-) = 0 52 Escritura y lectura de una fórmula. Escritura - Colocar los símbolos en el orden establecido. Intercambiar estos números, prescindiendo de la carga. Simplificar en los casos que los subíndices sean divisibles. Ejemplos: - Óxido de cadmio 2 + 2Cd O Cd O - Cd2O2 Cd O Óxido de cadmio 3 + 2Cr O Cr O Cr2O3 Lectura: - Establecer los números de oxidación. Si el metal presenta varios estados de oxidación, utilizar la notación Stock. Puede también utilizarse el nombre lectura - SnO2 x 4Sn O2 4 + 4Sn O2 Nombre de la fórmula propuesta: Óxido de estaño (IV) o dióxido de estaño - Re2O3 x 6Re2O3 6 + 6Re2O3 Nombre de oxidación del Renio 6/2 = 3+ Nombre de la fórmula propuesta: Óxido de renio (III) o trióxido de direnio 53 Óxidos Metálicos Nomenclatura Nomenclatura Nomenclatura Sistemática Stock Tradicional Compuesto Li2O monóxido de dilitio u óxido de dilitio óxido de litio (I) u óxido de litio óxido lítico u óxido de litio Na2O monóxido de disodio u óxido de sodio (I) u óxido de disodio óxido de sodio K2O monóxido de dipotasio óxido de potasio (I) u óxido potásico u u óxido de dipotasio óxido de potasio óxido de potasio Rb2O monóxido de dirubidio óxido de rubidio (I) u óxido rubídico u u óxido de dirubidio óxido de rubidio óxido de rubidio Cs2O monóxido de dicesio u óxido de cesio (I) u óxido de dicesio óxido de cesio Fr2O monóxido de difrancio óxido de francio (I) u óxido fráncico u u óxido de difrancio óxido de francio óxido de francio Ag2O monóxido de diplata u óxido de plata (I) u óxido de diplata óxido de plata óxido plático u óxido de plata BaO monóxido de bario óxido de bario (II) óxido bárico u óxido de bario BeO monóxido de berilio óxido de berilio (II) óxido berílico u óxido de berilio CdO monóxido de cadmio óxido de cadmio (II) óxido cádmico u óxido de cadmio óxido sódico u óxido de sodio óxido césico u óxido de cesio 54 CaO monóxido de calcio óxido de calcio (II) óxido cálcico u óxido de calcio MgO monóxido de magnesio óxido de magnesio (II) óxido magnésico u óxido de magnesio SrO monóxido de estroncio óxido de estroncio (II) óxido estróncico u óxido de estroncio RaO monóxido de radio óxido de radio (II) óxido rádico u óxido de radio ZnO monóxido de zinc óxido de zinc (II) óxido de zinc Al2O3 trióxido de dialuminio óxido de aluminio (III) óxido alumínico Bi2O3 trióxido de dibismuto óxido de bismuto (III) óxido bismútico B2O3 trióxido de boro óxido de boro (III) óxido bórico PtO2 dióxido de platino óxido de platino (IV) óxido platínico IrO2 dióxido de iridio óxido de iridio (IV) OsO2 dióxido de osmio óxido de osmio (IV) óxido ósmico PdO monóxido de paladio óxido de paladio (II) óxido paladioso PdO2 dióxido de paladio óxido de paladio (IV) óxido paládico óxido irídico 55 óxido de zirconio (IV) ZrO2 dióxido de zirconio óxido zircónico Cu2O monóxido de dicobre u óxido de cobre (I) u óxido de dicobre óxido de cobre óxido cuproso u óxido de cobre CuO monóxido de cobre óxido de cobre (II) óxido cúprico Hg2O monóxido de dimercurio u óxido de dimercurio óxido de mercurio (I) óxido mercurioso u u óxido mercurio óxido de mercurio HgO monóxido de mercurio óxido de mercurio (II) óxido mercúrico Au2O monóxido de dioro u óxido de dioro óxido de oro (I) u óxido de oro óxido áuroso u óxido de oro Au2O3 trióxido de dioro óxido de oro (III) óxido aurico CoO monóxido de cobalto óxido de cobalto (II) óxido cobaltoso Co2O3 trióxido de dicobalto óxido de cobalto (III) óxido cobáltico CrO monóxido de cromo óxido de cromo (II) Cr2O3 trióxido de dicromo óxido de cromo (III) óxido crómico FeO monóxido de hierro óxido de hierro (II) óxido ferroso Fe2O3 trióxido de dihierro óxido de hierro (III) óxido férrico óxido cromoso 56 MnO monóxido de manganeso óxido de manganeso óxido manganoso (II) Mn2O3 trióxido de dimanganeso óxido de manganeso óxido mangánico (III) NiO monóxido de niquel óxido de niquel (II) Ni2O3 trióxido de diníquel óxido de níquel (III) óxido niquélico PbO monóxido de plomo óxido de plomo (II) PbO2 dióxido de plomo óxido de plomo (IV) óxido plúmbico SnO monóxido de estaño óxido de estaño (II) SnO2 dióxido de estaño óxido de estaño (IV) óxido estánico V2O5 pentóxido de divanadio óxido de vanadio (V) óxido vanadoso V2O3 trióxido de divanadio óxido de vanadio (III) MoO monóxido de molibdemo óxido de molibdemo óxido molibdoso (II) Mo2O3 trióxido de dimolibdemo óxido de molibdemo óxido molibdénico (III) TiO monóxido de titanio óxido de titanio (II) óxido niqueloso óxido plumboso óxido estañoso óxido vanádico óxido titánico 57 Er2O3 trióxido de dierbio óxido de erbio(III) óxido érbico WO monóxido de wolframio óxido de wolframio (II) óxido wolfrámico In2O3 trióxido de indio óxido de indio(III) Óxido indico U2O3 trióxido de diuranio óxido de uranio(III) óxido uránico Bk2O3 trióxido de diberkelio óxido de uranio(III) óxido berkélico La2O3 trióxido de lantánico óxido de lantano(III) óxido lantánico 2.1.2. ÓXIDOS ÁCIDOS O ANHÍDRIDOS No Metal + Oxígeno → Óxido ácido o anhídrido Son aquellos formados por la combinación del oxígeno con un no metal. Su fórmula general es no metal + O. En este caso, la nomenclatura tradicional emplea la palabra anhídrido en lugar de óxido, a excepción de algunos óxidos de nitrógeno y fósforo. Debido a que muchos de estos cuerpos no existen en la naturaleza y el no metal funciona con valencia positiva (presta electrones al oxigeno, en los enlaces coordinados), se les considera como óxidos ácidos, puesto que al reaccionar con el agua forman los ácidos oxácidos. Se llaman anhídridos porque muchos de ellos se obtienen por deshidratación de los ácidos oxácidos. NOMENCLATURAS a.- Nomenclatura IUPAC. Nomenclatura sistemática: El nombre genérico es óxido y el específico, el nombre del no metal precedido por de. Ambos se acompañan de los prefijos cuantitativos. 58 Ejemplos: Cl₂ O Cl₂ O₃ Cl₂ O₅ Cl₂ O₇ monóxido de dicloro trióxido de dicloro pentóxido de dicloro heptóxido de dicloro Nomenclatura Stock: El nombre genérico es óxido y el específico, el del no metal, entre paréntesis, la valencia en números romanos. Ejemplo: Cl₂ O óxido de cloro (I) Cl₂ O₃ óxido de cloro (III) Cl₂ O₅ óxido de cloro (V) Cl₂ O₇ óxido de cloro (VII) b.- Nomenclatura Tradicional El nombre genérico es la palabra anhídrido y el específico, el del no metal terminado en oso o ico y antepuesto los prefijos según su valencia de la siguiente manera: hipo - … - oso (para números de valencia 1 y 2) … - oso (para números de valencia 3 y 4) … - ico (para números de valencia 5 y 6) per - .… - ico (para el número de valencia 7) Cuando el flúor reacciona con el oxígeno se crea un compuesto diferente a un oxido acido ya que el oxígeno deja de ser el elemento más electronegativo, distinto a como pasa con todos los óxidos donde el oxígeno es el elemento más electronegativo. El único elemento más electronegativo que el oxígeno es el flúor con 4.0 mientras el oxígeno tiene 3.5. Así que el compuesto deja de llamarse óxido y se nombra como fluoruro de oxígeno para el sistema tradicional, fluoruro de oxígeno (II) para el sistema Stock y difluoruro de oxígeno para el sistemático. La fórmula es O2F2-1. Los óxidos de nitrógeno, al igual que los óxidos del azufre, son importantes por su participación en la lluvia ácida. Con el término óxido de nitrógeno se hace alusión a cualquiera de los siguientes: NO NO2 N2O N2O3 N2O4 N2O5 Óxido nítrico u Óxido de nitrógeno (II). Dióxido de nitrógeno. Óxido nitroso o Monóxido de dinitrógeno. Trióxido de dinitrógeno. Tetróxido de dinitrógeno. Pentóxido de dinitrógeno. 59 Entre las excepciones a las reglas de anhídridos para la nomenclatura tradicional están los óxidos de nitrógeno y óxidos de fósforo. Estos compuestos se nombran así: N21O-2 N2O-2 N23O3-2 N24O4-2 N4O2-2 N25O5-2 P23O3-2 P4O2-2 P25O5-2 Anhídrido hiponitroso Óxido hiponitroso Anhídrido nitroso Óxido nitroso Óxido nitroso Anhídrido nítrico Anhídrido fósforoso Óxido fósforoso Anhídrido fosfórico Formulación Para formar los anhídridos se coloca primero el símbolo del no metal y luego del oxigeno y se intercambian las valencias. En las fórmulas desarrolladas los átomos se hallan distribuidos de la siguiente manera. Br2O3 SO3 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual acero. I2O3 6 + 6I2O3 2(3+1) + 3(2-) = 0 Escritura y lectura de una fórmula Escritura - Colocar los símbolos en el orden conocido. Establecer los números de oxidación Intercambiar los números de oxidación, prescindiendo del signo. Simplificar en los casos que los subíndices sean divisibles. 60 Ejemplos: - Óxido de fósforo 5 + 2Cd O PO P2O5 Anhídrido hiponitroso. Recordando el significado del prefijo HIPO Intercambiando mentalmente las valencias Sabemos que: 1+ 3+ 5+ Hipo…..oso …..oso …..oso 1 2 N O N2 O N2O Anhídrido hiponitroso. Lectura. - Utilizando el nombre lectura se lee directamente Determinar el número de oxidación del no metal Aplicar las normas conocidas. Ejemplo: P2O5 x 10 - 10 + 10 - P2 O5 P2 O5 Número de oxidación del fósforo 10/2 = 5+ Nombre de la fórmula propuesta: Óxido de fósforo (V) Óxido ácido o anhídrido Compuesto Cl2O Nomenclatura sistemática. óxido de dicloro o monóxido de dicloro Nomenclatura Stock óxido de cloro (I) Nomenclatura tradicional anhídrido hipocloroso 61 Cl2O3 trióxido de dicloro óxido de cloro (III) anhídrido cloroso Cl2O5 pentóxido de dicloro óxido de cloro (V) anhídrido clórico Cl2O7 heptóxido de dicloro óxido de cloro (VII) anhídrido perclórico Br2O óxido de dibromo o monóxido de dibromo óxido de bromo (I) anhídrido hipobromoso Br2O3 trióxido de dibromo óxido de bromo (III) anhídrido bromoso Br2O5 pentóxido de dibromo óxido de bromo (V) anhídrido brómico Br2O7 heptóxido de dibromo óxido de bromo (VII) anhídrido perbrómico I2O óxido de diyodo o monóxido de diyodo óxido de yodo (I) anhídrido hipoyodoso I2O3 trióxido de diyodo óxido de yodo (III) anhídrido yodoso I2O5 pentóxido de diyodo óxido de yodo (V) anhídrido yódico I2O7 heptóxido de diyodo óxido de yodo (VII) anhídrido peryódico SO2 dióxido de azufre óxido de azufre (IV) anhídrido sulfuroso SO3 trióxido de azufre óxido de azufre (VI) anhídrido sulfúrico SeO2 dióxido de selenio óxido de selenio (IV) anhídrido selenioso SeO3 trióxido de selenio óxido de selenio (VI) anhídrido selénico 62 TeO2 dióxido de telurio óxido de telurio (IV) anhídrido telurioso TeO3 trióxido de telurio óxido de telurio (VI) anhídrido telúrico N2O óxido de dinitrógeno o monóxido de dinitrógeno óxido de nitrógeno (I) anhídrido hiponitroso N2O3 trióxido de dinitrógeno óxido de nitrógeno (III) anhídrido nitroso N2O5 pentóxido de dinitrógeno óxido de nitrógeno (V) anhídrido nítrico N2O7 heptóxido de dinitrógeno óxido de nitrógeno (VII) anhídrido pernítrico P2O óxido de difósforo o monóxido de difósforo óxido de fósforo (I) anhídrido hipofosforoso P2O3 trióxido de difósforo óxido de fósforo (III) anhídrido fosforoso P2O5 pentóxido de difósforo óxido de fósforo (V) anhídrido fosfórico P2O7 heptóxido de difósforo óxido de fósforo (VII) anhídrido perfosfórico As2O óxido de diarsénico o monóxido de diarsénico óxido de arsénico (I) anhídrido hipoarsenioso As2O3 trióxido de diarsénico óxido de arsénico (III) As2O5 pentóxido de diarsénico óxido de arsénico (V) anhídrido arsénico anhídrido arsenioso 63 As2O7 heptóxido de diarsénico óxido de arsénico (VII) anhídrido perarsénico Sb2O óxido de diantimonio o monóxido de diantimonio óxido de antimonio (I) anhídrido hipoantimonioso Sb2O3 trióxido de diantimonio óxido de antimonio (III) anhídrido antimonioso Sb2O5 pentóxido de diantimonio óxido de antimonio (V) anhídrido antimónico Sb2O7 heptóxido de diantimonio óxido de antimonio (VII) anhídrido perantimónico CO2 dióxido de carbono óxido de carbono (IV) anhídrido carbónico SiO2 dióxido de silicio óxido de silicio (IV) anhídrido silícico GeO2 dióxido de germanio óxido de germanio (IV) anhídrido germánico B2O3 trióxido de diboro óxido de boro (III) anhídrido bórico 2.1.2.1. Óxidos ácidos de metales Algunos metales al combinarse especialmente con números de oxidación superiores dan como el oxígeno óxidos ácidos. El criterio par la nomenclatura es el indicado anteriormente. Es recomendable utilizar nombres sistemáticos antes que tradicionales. 64 Ejemplos: o Óxidos ácidos del cromo Cr2O3 Óxido de cromo (III) Anhídrido cromoso Cr O3 Óxido de cromo (VI) Anhídrido crómico o Óxidos ácidos del manganeso MnO2 Óxido de manganeso (IV) Anhídrido manganoso MnO3 Óxido de manganeso (VI) Anhídrido mangánico MnO7 Óxido de manganeso (VII) Anhídrido permangánico o Óxidos ácidos del molibdeno y wolframio MoO3 Óxido de molibdeno (VI) Anhídrido molíbdico WO3 Óxido de wolframio (VI) Anhídrido wolfrámico 2.1.3. ÓXIDOS NEUTROS No Metal + Oxígeno → Óxido neutro Son óxidos de los no metales que en vez de reaccionar con el agua, se disuelven de modo que no forman hidróxidos ni oxácidos. Formulación: Estos compuestos binarios se forman al colocar primero el del no metal y luego el símbolo del oxígeno y se intercambia sus valencias. a.- Nomenclatura IUPAC. Nomenclatura sistemática: El nombre genérico es óxido y el específico, el nombre del no metal precedido por de. Ambos se acompañan de los prefijos cuantitativos. Ejemplos: - NO NO2 CO CO2 monóxido de nitrógeno dióxido de nitrógeno monóxido de carbono dióxido de carbono 65 Nomenclatura Stock: El nombre genérico es óxido y el específico, el nombre del no metal y entre paréntesis la valencia en números romanos. Ejemplos: NO óxido de nitrógeno (II) NO2 óxido de nitrógeno (IV) b.- Nomenclatura Tradicional El nombre genérico es óxido y el especifico, el nombre del no metal precedido por de o terminado en oso e ico, si la valencia es variable. Ejemplos: NO óxido nitroso u óxido de nitrógeno NO2 óxido nítrico Existen algunos óxidos no metálicos de estructura especial donde la relación oxígeno-no metal es diferente a la conocida normalmente. Ejemplos: - NO3 Trióxido de nitrógeno - Cl2O6 Hexaóxido de dicloro - P4O6 Hexaóxido de tetrafósfororo - P4O10 Decaóxido de tetrafósfororo - N2O4 Tetraóxido de dinitrógeno - P4O6 Hexaóxido de tetrafósfororo 2.1.4. ÓXIDOS COMPUESTOS Son los óxidos básicos de los metales de valencia variable que se combinan con el oxígeno. Óxido de menor valencia + óxido de mayor valencia → óxido compuesto Formulación: se coloca primero el símbolo del metal y luego del oxígeno. NOMENCLATURAS a.- Nomenclatura IUPAC. Nomenclatura Sistemática: El nombre genérico es óxido y el específico, el nombre del metal precedido por de. Ambos se acompañan de los prefijos cuantitativos. Ejemplo: Cu2O + CuO → Cu3O2 Dióxido de tricobre 66 Nomenclatura Stock: El nombre genérico es óxido y el específico el del metal y entre paréntesis las dos valencias en números romanos. Ejemplos: Cu2O + CuO → Cu3O2 Sn3O4 Fe3O4 Óxido de cobre (I, II) Óxido de estaño (II, IV) Óxido de hierro (II, III) b.- Nomenclatura Tradicional Reconoce tres formas distintas de nombrar a los óxidos salinos. 1. Nombre genérico es la palabra óxido y el específico está formado por los nombres de los dos óxidos del mismo metal. 2. Nombre genérico dado por las palabras óxido salino, y específico el nombre del metal precedido por de. 3. Nombre genérico, la palabra sesquióxido, que significa óxido y medio y específico el nombre del metal antepuesta la preposición de. Ejemplos: Cu2O + CuO → Cu3O2 Óxido cuproso-cúprico Óxido salino de cobre Sesquióxido de cobre Sn3O4 Óxido estañoso-estánico Óxido salino de estaño Sesquióxido de estaño Fe3O4 Óxido ferroso-férrico Óxido salino de hierro Sesquióxido de hierro 2.1.5. PERÓXIDOS Metal + O₂²⁻ → peróxido Son compuestos binarios que resultan de la combinación de un metales de las familias I y IA (alcalinos y alcalinotérreos) y de unos pocos metales de tracción con el grupo peróxido (O₂²⁻) con enlace electrovalente. El grupo peróxido es la unión de dos oxígenos de tal manera que tiene un número de oxidación 2-. 67 Los peróxidos resultan inestables porque pierden oxigeno para convertirse en simples óxidos. Los dos átomos de oxigeno que intervienen en la composición están ligados entre si por un enlace covalente simple, por lo que sobra una valencia a cada átomo de oxígeno; este enlace da lugar a que el grupo peróxido sea divalente negativo. En el caso de estos compuestos, no se puede simplificar los subíndices. Estos compuestos presentan nombres especiales como cuando reaccionan con el hidrógeno y forman el agua oxigenada o peróxido de hidrógeno. NOMENCLATURAS a.- Nomenclatura IUPAC. Nomenclatura sistemática: El nombre genérico es óxido y el específico, el nombre del metal precedido por de. Ambos se acompañan de os prefijos cuantitativos. Ejemplo: Cu2O2 → dióxido de dicobre Nomenclatura Stock: El nombre genérico es óxido y el específico el del metal y entre paréntesis la valencia en números romanos. Ejemplo: Cu2O2 óxido de cobre (I) b.- Nomenclatura Tradicional Nombre genérico la palabra peróxido; especifico, el nombre del metal precedido por de. Ejemplo: Na2O2 peróxido de sodio Los peróxidos son obtenidos cuando reacciona un óxido con el oxígeno monoatómico y se caracterizan por llevar el grupo peróxido o unión peroxídica (-o-o-). Son compuestos diatómicos en donde participan el grupo peróxido y un metal. La fórmula general de los peróxidos es Metal + (O-1) 2-2. Pueden considerarse que resultan de reemplazar teóricamente los hidrógenos del agua oxigenada (peróxido de hidrógeno) por metales. 68 Formulación: Se coloca el símbolo del metal y luego del grupo peróxido. Los subíndices no se simplifican cuando tienen la fórmula mínima característica. Existe un grupo de compuestos que tienen una formulación parecida a los peróxidos pero químicamente no tienen las propiedades de estas sustancias. Son óxidos simples del metal con número de oxidación 4+. Ejemplos: MnO2 Óxido de manganeso (IV) o Dióxido de manganeso. SnO2 Óxido de estaño (IV) o Dióxido de estaño. En la estructura desarrollada de las fórmulas debe establecer la unión especial del oxigeno CaO2 K2O2 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación, será igual a cero. BaO2 2 + 2BaO2 (2+) + 2(1-) = 0 Escritura y lectura de una fórmula Escritura: - Colocar los símbolos en el orden establecido. Recordar el número de oxidación del metal. El número de oxidación del grupo peróxido es -2 Intercambiar mentalmente los números de oxidación, prescindiendo de la carga. Simplificar los subíndices en los casos necesarios. Ejemplos: 1 + 2Li O2 Peróxido de litio Li2O2 2 + 2Ba O2 Peróxido de bario Ba2(O2) 2 BaO2 69 Lectura: Aplicar las normas establecidas. Ejemplos: Ag2O2 Peróxido de plata Al2O6 Peróxido de aluminio Peróxidos Compuesto Nomenclatura sistemática Nomenclatura Stock Nomenclatura tradicional H2O2 dióxido de dihidrógeno peróxido de hidrógeno agua oxigenada Li2O2 dióxido de dilitio peróxido de litio peróxido de litio Na2O2 dióxido de disodio peróxido de sodio peróxido de sodio K2O2 dióxido de dipotasio peróxido de potasio peróxido de potasio Rb2O2 dióxido de dirubidio peróxido de rubidio peróxido de rubidio Cs2O2 dióxido de dicesio peróxido de cesio peróxido de cesio Fr2O2 dióxido de difrancio peróxido de francio peróxido de francio BeO2 dióxido de berilio peróxido de berilio (II) peróxido de berilio MgO2 dióxido de magnesio peróxido de magnesio (II) peróxido de magnesio CaO2 dióxido de calcio peróxido de calcio (II) peróxido de calcio SrO2 dióxido de estroncio peróxido de estroncio (II) peróxido de estroncio 70 BaO2 dióxido de bario peróxido de bario (II) peróxido de bario RaO2 dióxido de radio peróxido de radio (II) peróxido de radio Cu2O2 dióxido de dicobre peróxido de cobre (I) peróxido cuproso CuO2 dióxido de cobre peróxido de cobre (II) peróxido cúprico CdO2 dióxido de cadmio peróxido de cadmio peróxido de cadmio Fe2O6 dióxido de dihierro peróxido de hierro (III) peróxido de hierro ZnO2 dióxido de cinc peróxido de cinc Ni2O6 dióxido de diníquel peróxido de níquel (III) peróxido de níquel Au2O2 dióxido de dioro peróxido de oro (I) peróxido de oro HgO2 dióxido de mercurio peróxido de mercurio(II) peróxido de mercurio 2.1.5.1. peróxido de cinc Superóxidos Metal + Grupo peróxido → Superóxido También llamados hiperóxidos, son compuestos binarios que contienen el grupo o anión superóxido. Aparentemente, el oxígeno tiene valencia -1/2. Generalmente el grupo superóxido reacciona con los elementos alcalinos y alcalinotérreos. Se nombran como los peróxidos tan sólo cambiando peróxido por superóxido o hiperóxido. Ejemplos: KO2 superóxido o hiperóxido de potasio CaO4 ó Ca (O2)2 superóxido de calcio CdO4 superóxido de cadmio 71 2.1.5.2. Ozónidos Metal + Grupo ozónido → Ozónido Son compuestos binarios formados por el grupo ozónido, que son 3 oxígenos enlazados con una valencia total de -1. Los ozónidos se nombran de forma análoga a los peróxidos con la diferencia que en estos compuestos se utiliza el nombre ozónido en lugar de peróxido. Ejemplos: KO3 ozónido de potasio RbO3 ozónido de rubidio CsO3 ozónido de cesio 2.2. HIDRÓXIDOS METALICOS O BASES Óxido básico + agua → Hidróxido Compuestos ternarios en los que siempre están presentes el hidrógeno, oxígeno y un metal. Resultan de la combinación de los óxidos básicos con el agua, donde se forman grupos hidróxidos (HO-1) que se unen al metal con enlace electrovalente. Los hidróxidos cuando se disuelven en agua se ionizan formando cationes metal e iones hidroxilo u oxhidrilo. Este proceso de ionización es reversible, es decir que así como se forma los cationes metal e iones hidroxilo a partir de un hidróxido, inversamente, también se pueden formar hidróxidos a partir de los cationes e iones ya mencionados. (Agua)…….. Na(OH) →→→→ Na+1 + (OH)-1 ……..(Agua) Na+1 + (OH)-1 →→→→ Na(OH) Un caso especial lo constituye el hidróxido de amonio. El amoníaco es un gas muy soluble en agua, su fórmula es NH3. Al disolverse reacciona con el agua formando el compuesto hidróxido de amonio. Este proceso es reversible. …..(Agua) NH3 + H2O →→→→ NH4(OH) (Agua)….. NH4(OH) →→→→ NH3 + H2O 72 Propiedades de los hidróxidos o bases: o o o o o Son sustancias cáusticas: atacan a tejidos y otros compuestos. Tienen sabor amargo. Irritan la piel. Se disuelven en el agua y conducen la corriente eléctrica. Al disolverse en el agua liberan iones hidróxido (OH-). NaOH hidróxido de sodio Na1+ sodio + OH1ion hidróxido o Se neutralizan con los hidrácidos para formar sales binarias y agua. NaOH hidróxido de sodio + HCl cloruro de hidrógeno hidróxido + hidrácido NaCl cloruro de sodio + sal binaria + H2O agua agua o Se neutralizan con los oxácidos para formar oxisales y agua. hidróxido + oxácido oxisal + agua o Hacen que el rojo de tornasol y el papel indicador universal tomen color azul (comprobar con una disolución de ceniza de leña en agua que contiene hidróxido de sodio y potasio). La reacción entre bases y ácidos, que son sustancias con propiedades contrarias, se llama neutralización porque sus productos (sales y agua) son neutros. hidróxido + ácido sal + agua NOMENCLATURAS: a.- Nomenclatura IUPAC: Nomenclatura sistemática: El nombre genérico hidróxido acompañado de mono, dí, tri. etc., de acuerdo al grado de oxidación del metal y el específico el nombre del metal precedido por la preposición de. Ejemplo: Cu(OH)2 dihidróxido de cobre Algunos hidróxidos tienen nombres propios como por ejemplo: NaOH KOH Ca(OH)2 sosa cáustica potasa cáustica cal apagada 73 Stock: El nombre genérico hidróxido y el específico el nombre del metal precedido por la preposición de y entre paréntesis la valencia del metal en números romanos. Ejemplos: CuOH Cu(OH)2 LiOH hidróxido de cobre (I) hidróxido de cobre (II) hidróxido de litio b.- Nomenclatura Tradicional: El nombre genérico hidróxido y el específico el nombre del metal precedido por la preposición de o terminado en oso e ico si tiene valencia variable. Ejemplos: CuOH hidróxido cuproso o hidróxido de cobre Cu(OH)2 hidróxido cúprico Formulación: Para escribir las fórmulas de los hidróxidos basta acompañar al símbolo del metal tantos grupos OH como valencia tenga el metal, porque OH funciona como si fuera un solo átomo (monovalente negativo). Al3+ + OH1Al2O3 + 3H2O Al (OH)3 2Al (OH)3 hidróxido de aluminio hidróxido de aluminio En la fórmula desarrollada encontramos la siguiente distribución de los átomos. Al(OH)3 Ni(OH)2 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual acero. AgOH 1 + 1Ag (OH) (1+) + (2-) + (1+) = 0 Escritura y lectura de una fórmula Escritura. - Colocar el símbolo del metal y del grupo hidróxido. Establecer la valencia del metal o grupo catiónico. Intercambiar mentalmente los números de oxidación, prescindiendo de la carga. 74 Ejemplos: o Hidróxido de plomo (IV) o Hidróxido de osmio (III) 4 + 1Pb (OH) Pb(OH)4 3 + 1Os (OH) Os(OH)3 En general, se escribe tantos gropos “OH” cual sea la valencia del metal Lectura. - El subíndice que lleva el grupo hidróxido es el número de oxidación del catión. Aplicar las normas conocidas. Podemos emplear el nombre lectura Ejemplo: PH4OH Cr(OH)3 Hidróxido de fosfonio Hidróxido de cromo (III) Hidróxidos Compuesto Nomenclatura sistemática Nomenclatura Stock Nomenclatura tradicional LiOH hidróxido de monolitio o hidróxido de litio (I) o de litio hidróxido de litio hidróxido lítico NaOH hidróxido de monosodio hidróxido de sodio (I) o o de sodio hidróxido de sodio hidróxido sódico KOH hidróxido de monopotasio o de potasio hidróxido de potasio (I) o hidróxido de potasio hidróxido potásico RbOH hidróxido de monorubidio o de rubidio hidróxido de rubidio (I) o hidróxido de rubidio hidróxido rubídicó CsOH hidróxido de monocesio hidróxido de cesio (I) o o de cesio hidróxido de cesio hidróxido césico 75 FrOH hidróxido de monofrancio o de francio AgOH hidróxido de monoplata hidróxido de plata (I) o o de plata hidróxido de plata hidróxido plático NH4OH hidróxido de hidróxido de amonio (I) o monoamonio o de plata hidróxido de amonio hidróxido amónico Ba(OH)2 dihidróxido de bario hidróxido de bario (II) o hidróxido de bario hidróxido bárico Be(OH)2 dihidróxido de berilio hidróxido de berilio (II) o hidróxido de berilio hidróxido berílico Cd(OH)2 dihidróxido de cadmio hidróxido de cadmio (II) o hidróxido de cadmio hidróxido cádmico Ca(OH)2 dihidróxido de calcio hidróxido de calcio (II) o hidróxido de calcio hidróxido cálcico Mg(OH)2 dihidróxido de magnesio hidróxido de magnesio (II) o hidróxido hidróxido de bario magnésico Sr(OH)2 dihidróxido de estroncio hidróxido de estroncio (II) o hidróxido de estroncio hidróxido estróncico Ra(OH)2 dihidróxido de radio hidróxido de radio (II) o hidróxido de radio hidróxido rádico Zn(OH)2 dihidróxido de zinc hidróxido de zinc (II) o hidróxido de zinc hidróxido zíncnico Al(OH)3 trihidróxido de aluminio hidróxido de aluminio (III) o hidróxido hidróxido de aluminio alumínico hidróxido de francio (I) o hidróxido de francio hidróxido fráncico 76 Bi(OH)3 trihidróxido de bismuto hidróxido de bismuto (III) o hidróxido de bismuto hidróxido bismútico B(OH)3 trihidróxido de boro hidróxido de boro (III) o hidróxido de boro hidróxido bórico Pd(OH)4 tetrahidróxido de paladio hidróxido de paladio (IV) o hidróxido de paladio hidróxido paládico Pt(OH)4 tetrahidróxido de platino hidróxido de platino (IV) o hidróxido de platino hidróxido platínico Ir(OH)4 tetrahidróxido de iridio hidróxido de iridio (IV) o hidróxido de iridio hidróxido irídico Os(OH)4 tetrahidróxido de osmio hidróxido de osmio (IV) o hidróxido de osmio hidróxido ósmico Zr(OH)4 tetrahidróxido de zirconio hidróxido de zirconio (IV) o hidróxido de zirconio hidróxido zirconico CuOH hidróxido de monocobre hidróxido de cobre (I) o o de cobre hidróxido de cobre Cu(OH)2 dihidróxido de cobre hidróxido de cobre (II) o hidróxido de cobre hidróxido cúprico HgOH hidróxido de monomercurio o de mercurio hidróxido de mercurio (I) o hidróxido de mercurio hidróxido mercurioso Hg(OH)2 dihidróxido de mercurio hidróxido de mercurio (II) o hidróxido de mercurio hidróxido mercúrico AuOH hidróxido de monoplata hidróxido de plata (I) o o de plata hidróxido de plata hidróxido cuproso hidróxido auroso 77 Au(OH)3 trihidróxido de oro hidróxido de oro (III) o hidróxido de oro hidróxido áurico Co(OH)2 dihidróxido de cobalto hidróxido de cobalto (II) o hidróxido de cobalto hidróxido cobaltoso Co(OH)3 trihidróxido de cobalto hidróxido de cobalto (III) o hidróxido de cobalto hidróxido cobáltico Cr(OH)2 dihidróxido de cromo hidróxido de cromo (II) o hidróxido de cromo hidróxido cromoso Cr(OH)3 trihidróxido de cromo hidróxido de cromo (III) o hidróxido de cromo hidróxido crómico Fe(OH)2 dihidróxido de hierro hidróxido de hierro (II) o hidróxido de cromo hidróxido ferroso Cr(OH)3 trihidróxido de hierro hidróxido de hierro (III) o hidróxido de cromo hidróxido férrico Mn(OH)2 dihidróxido de manganeso hidróxido de manganeso (II) hidróxido o hidróxido de manganeso manganoso Mn(OH)3 trihidróxido de manganeso hidróxido de manganeso (III) hidróxido o hidróxido de manganeso mangánico Ni(OH)2 dihidróxido de níquel hidróxido de níquel (II) o hidróxido de níquel hidróxido niqueloso Ni(OH)3 trihidróxido de níquel hidróxido de níquel (III) o hidróxido de níquel hidróxido niquélico Pb(OH)2 dihidróxido de plomol hidróxido de plomo (II) o hidróxido de plomo hidróxido plumboso 78 Pb(OH)4 tetrahidróxido de plomo hidróxido de plomo (IV) o hidróxido de plomo hidróxido plúmbico Sn(OH)2 dihidróxido de estaño hidróxido de estaño (II) o hidróxido de estaño hidróxido estanoso Sn(OH)4 tetrahidróxido de estaño hidróxido de estaño (IV) o hidróxido de estaño hidróxido estánico V(OH)3 trihidróxido de vanadio hidróxido de vanadio (III) o hidróxido de vanadio hidróxido vanadoso V(OH)5 pentahidróxido de vanadio hidróxido de vanadio (V) o hidróxido de vanadio hidróxido vanádico 2.3. ÁCIDO OXÁCIDOS Anhídrido + Agua → Ácido oxácido También llamados oxoácidos y oxiácidos, son compuestos ternarios originados de la combinación del agua con un anhídrido u óxido ácido y dejan en libertad iones hidrógeno o hidrogenoides (H)+1. La fórmula general para los oxácidos es H+No Metal +O. Los ácidos oxácidos son compuestos que presentan uniones covalentes, pero cuando se disuelven en agua ceden fácilmente iones H+1 (protones). Esto se debe a que el agua, por la naturaleza polar de sus moléculas, tiene tendencia a romper las uniones covalentes polares de los ácidos, con formación de iones H+1 y del anión ácido correspondiente. Por ejemplo, el ácido nítrico que se disuelve en agua da lugar a un anión nitrato y un catión hidrógeno. (Agua)………. HNO3 →→→→ NO3-1 + H+1 La ionización de un oxácido al disolverse en agua es un ejemplo de proceso que se cumple en ambos sentidos, es decir que, al mismo tiempo que se forman iones a partir del ácido, este se regenera constantemente por la unión de aniones y cationes. Los procesos de esta naturaleza se denominan reversibles. 79 (Agua)………. HNO3 →→→→ NO3-1 + H+1 ………. (Agua) NO3-1 + H+1 →→→→ HNO3 Estructura de Lewis proceso de ionización reversible para el hidróxido, ácido nítrico. Propiedades de los ácidos Tienen sabor agrio, como el zumo de limón (que también es ácido). Los ácidos fuertes, producen quemaduras en la piel y en las telas. Se disuelven en el agua y liberan H+ o protones. Atacan a los metales y liberan hidrógeno. Hacen que el azul de tornasol y el papel indicador universal cambien a color rojo. Disueltos en el agua conducen la corriente eléctrica. Formulación: Para la formación de los ácidos oxácidos se escribe primero el símbolo del hidrógeno y luego los del anión. NOMENCLATURAS a.- Nomenclatura Tradicional: El nombre genérico es la palabra ácido y el específico, el mismo nombre del anhídrido de origen. Ejemplo: HS2O4 ácido sulfúrico b.- Nomenclatura IUPAC: Para nombrar los oxácidos se considera una parte negativa formada por un elemento central no metálico y por el oxigeno; y la parte positiva que seria el o los hidrógenos. HNO3 H+ + NO3- En el ácido nítrico el grupo negativo o radical ácido es el NO3- y la parte positiva H+. Nomenclatura Stock: El nombre genérico se forma escribiendo el vocablo oxo (que representa el oxigeno) precedido de los respectivos prefijos cuantitativos y el nombre del radical terminado en ato para todos los casos y entre paréntesis y en números romanos la valencia del no metal y el específico es la palabra hidrógeno precedido de la preposición de. 80 Ejemplo: H2S04 tetraoxo sulfato (VI) de hidrógeno. Nomenclatura sistemática: Los oxácidos se consideran como oxisales de hidrógeno. El nombre genérico se forma escribiendo el vocablo oxo (que representa el oxigeno) y el del radical terminado en ato; para todos los casos acompañados de los respectivos prefijos cuantitativos. Nombre específico, la palabra hidrógeno precedido de la preposición de, con sus prefijos cuantitativos respectivos. Ejemplos: HNO3 H2C03 trioxonitrato de hidrógeno trioxocarbonato de dihidrógeno También se los puede designar poniendo al nombre genérico la palabra ácido y el específico el vocablo oxo (oxigeno) precedido de los respectivos prefijos cuantitativos y el nombre del radical terminado en ico; y entre paréntesis y en números romanos la valencia del no metal. H2S03 H2S04 Ácido trioxosulfúrico (IV) Ácido tretraxosulfúrico (VI) Dependiendo del número de moléculas de agua al que se unen los ácidos oxácidos pueden ser oxácidos meta, piro y orto. Oxácidos meta: Son aquellos que resultan de la unión de una molécula de agua al anhídrido. Los oxácidos meta al unirse a un elemento centrar de valencia impar (1, 3, 5, 7) presentan un solo protón. Pero si el elemento central tiene valencia par (2, 4, 6) muestra 2 protones (H+). Ejemplos: Cl2O3 SO3 + + H2O H2O 2HClO2 H2SO4 Oxácidos piro: Son aquellos que resultan de la unión de dos moléculas de agua a un óxido ácido de valencia 3 y 5 (P, As, Sb), presentan 4 protones en su molécula. Ejemplo: Sb2O3 Sb2O5 + + 2H2O 2H2O H4Sb2O5 H4Sb2O7 Oxácidos orto: Son aquellos que resultan cuando al anhídrido se unen tres moléculas de agua. Se forman igual que en el caso anterior. Ejemplo: As2O3 As2O5 + + 3H2O 3H2O 2H3AsO3 2H3AsO4 81 2.3.1. OXÁCIDOS SIMPLES Son aquellos que resultan de la combinación de un óxido con una sola molécula de agua. Ejemplo. SO3 + H2O = H2SO4 Formulación: Se escribirá siempre en primer lugar el símbolo del hidrógeno y luego los del anión. La fórmula desarrollada presenta la siguiente distribución de los átomos: HClO3 H2SeO4 En fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. H Br O4 1 + 7 + 8Escritura y lectura de una fórmula H Br O4 (1+) + (7+) + 4(2-) = 0 Escritura: Para formular una sustancia tengamos presente lo siguiente: - - El nombre del átomo central indica la naturaleza del óxido del cual proviene. Recordamos el número de oxidación, formamos el óxido, realizamos la reacción con una molécula de agua. Simplificamos los subíndices si es necesario y da lugar. Ácido brómico Directamente: HBrO3 Análisis brómico El bromo pertenece al grupo VII, tiene los números de oxidación 1+, 3+, 5+, 7+. La sistematización para los sufijos y prefijos es: 1+ 3+ 5+ 7+ Hipo……oso …………oso …………ico Per...........ico 82 Por lo tanto el número de oxidación para el bromo en este compuesto es de 5+ todo el proceso anterior se realiza mentalmente Oxido que forma Br2O5 Reacción Br2O5 + H2O = H2Br2O6 = HBrO3 Fórmula de la sustancia propuesta HBrO3 Escritura de una fórmula con nombres sistemáticos: - Escribir la fórmula general. Establecer el número de cargas para cada átomo. La carga propuesta para el hidrógeno será su subíndice Ejemplo: Ácido tetraoxobrómico (VII) x 7 + 8H Br 04 HBrO4 x 7 + 8H Br O4 HBrO4 Lectura: Lectura de una fórmula con nombre sistemático Aplicar las normas establecidas. Ejemplo: H2TeO4 Ácido tetraoxotelúrico (VI) Ácido telúrico (VI) Tetraoxotelúrico (VI) de hidrógeno Telurato (VI) de hidrógeno Lectura de una fórmula con nombre tradicional admitido - Establecer el número de oxidación del átomo central. Establecer los prefijos y sufijos de acuerdo ala sistematización del número de oxidación. Esto realizamos mentalmente. Ejemplo: 1 + 5 + 6H I O3 Análisis mental Número de oxidación del Iodo 5+ HIO3 1+ 3+ 5+ Hipo……oso …………oso …………ico Nombre de la fórmula propuesta. Ácido yódico 83 En base a la organización de los óxidos ácidos (anhídridos) por grupos de la clasificación periódica de los elementos tendremos un modelo de formación. Grupo VII: Cl, Br, I. Cl2O Cl2O3 Cl2O5 Cl2O7 + + + + H2O H2O H2O H2O Compuesto = = = = H2Cl2O2 H2Cl2O4 H2Cl2O6 H2Cl2O8 = = = = HClO HClO2 HClO3 HClO4 Nomenclatura sistemática Ácido hipocloroso Ácido cloroso Ácido clórico Ácido perclórico Nomenclatura Stock Nomenclatura tradicional HClO ácido monoxoclórico(I) monoxoclorato (I) de hidrógeno ácido hipocloroso HClO2 ácido dioxoclórico(III) dioxoclorato (III) de hidrógeno ácido cloroso HClO3 ácido trioxoclórico(V) trioxoclorato (V) de hidrógeno ácido clóriso HClO4 ácido tetraoxoclórico (VII) tretraoxoclorato (VII) de hidrógeno ácido perclórico HBrO ácido monoxobrómico(I) monoxobromato (I) de hidrógeno ácido hipobromoso HBrO2 ácido dioxobrómico (III) dioxobromato (III) de hidrógeno ácido bromoso HBrO3 ácido trioxobrómico (V) trioxobromato (V) de hidrógeno ácido brómico HBrO4 ácido tetraoxobrómico (VII) tretraoxobromato (VII) de hidrógeno ácido perbrómico HIO ácido monoxoyódico(I) monoxoyodato (I) de hidrógeno ácido hipoyodoso 84 HIO2 ácido dioxoyódico (III) dioxoyodato (III) de hidrógeno ácido yodoso HIO3 ácido trioxoyódico (V) trioxoyodato (V) de hidrógeno ácido yódico HIO4 ácido tetraoxoyódico (VII) tretraoxoyodato (VII) de hidrógeno ácido periódico Grupo VI: S, Se, Te. SO + H2O = H2SO2 SO2 + H2O = H2SO3 SO3 + H2O = H2SO4 Compuesto Ácido hiposulfuroso Ácido sulfuroso Ácido sulfúrico Nomenclatura sistemática Nomenclatura Stock Nomenclatura tradicional H2SO2 ácido dioxosulfúrico (II) dioxosulfato (II) de hidrógeno ácido hiposulfuroso H2SO3 ácido trioxosulfúrico (IV) trioxosulfato (IV) de hidrógeno ácido sulfuroso H2SO4 ácido tetraoxosulfúrico tetraoxosulfato (VI) de (VI) hidrógeno ácido sulfúrico H2SeO2 ácido dioxoselénico (II) dioxoseleniato (II) de hidrógeno ácido hiposelenioso H2SeO3 ácido trioxoselénico (IV) trioxoseleniato (IV) de hidrógeno ácido selenioso H2SeO4 ácido tetraoxoselénico tetraoxoseleniato (VI) de (VI) hidrógeno ácido selénico 85 H2TeO2 ácido dioxotelúrico(II) dioxotelurinato (II) de hidrógeno ácido hipotelurinoso H2TeO3 ácido trioxotelúrico (IV) trioxotelurinato (IV) de hidrógeno ácido telurinoso H2TeO4 ácido tetraoxotelúrico (VI) tetraoxotelurinato (VI) de hidrógeno ácido telúrico Grupo V: N, P, As, Sb. N2O + H2O = H2N2O2 N2O3 + H2O = H2N2O4 = HNO2 N2O5 + H2O = H2N2O6 = HNO3 Compuesto Nomenclatura sistemática Ácido hiponitroso Ácido nitroso Ácido nítrico Nomenclatura Stock Nomenclatura tradicional H2N2O2 ácido monoxonítrico(I) monoxonitrato (I) de hidrógeno ácido hiponitroso HNO2 ácido dioxonítrico (III) dioxonitrato (III) de hidrógeno ácido nitroso HNO3 ácido trioxonítrico (V) trioxonitrato (V) de hidrógeno ácido nítrico H2P2O2 ácido monoxofosfórico(I) monoxofosforato (I) de hidrógeno ácido hipofosforoso HPO2 ácido dioxofosfórico (III) dioxofosforato (III) de hidrógeno ácido fosforoso HPO3 ácido trioxofosfórico (V) trioxofosforato (V) de hidrógeno ácido fosfórico 86 H2As2O2 ácido monoxoarsénico(I) monoxoarseniato (I) de hidrógeno ácido hipoarsenioso HAsO2 ácido dioxoarsénico (III) dioxoarseniato (III) de hidrógeno ácido arsenioso HAsO3 ácido trioxoarsénico (V) trioxoarseniato (V) de hidrógeno ácido arsénico H2Sb2O2 ácido monoxoantimónico(I) monoxoantimoniato (I) de hidrógeno ácido hipoantimonioso HSbO2 ácido dioxoantimónico (III) dioxoantimoniato (III) de hidrógeno ácido antimonioso HSbO3 ácido trioxoantimónico trioxoantimoniato (V) de (V) hidrógeno ácido antimónico Grupo IV: C, Si, Ge. CO2 + H2O = H2CO3 Compuesto Nomenclatura sistemática Ácido carbónico Nomenclatura Stock Nomenclatura tradicional H2CO3 ácido trioxocarbónico (IV) trioxocarbonato (IV) de hidrógeno ácido carbónico H2SiO3 ácido trioxocilicico (IV) trioxociliciato (IV) de hidrógeno ácido cilícico H2GeO3 ácido dioxogermánico dioxogermaniato (II) de (IV) hidrógeno ácido germánico 87 2.3.2. OXÁCIDOS POLIHIDRATADOS Son oxácidos que resultan de la reacción del óxido ácido (anhídrido) con mas de una molécula de agua algunos de estos ácidos no tienen una existencia probada. En los no metales encontramos estos ácidos con el fósforo, arsénico, teluro. NOMENCLATURAS a.- Nomenclatura Tradicional El interés por conocer el mecanismo de formación de un nombre tradicional nos lleva al análisis de este sistema de nomenclatura. El nombre genérico es la palabra ácido y el específico, el nombre del anhídrido del cual proviene con el prefijo respectivo así: meta.…. (1 molécula de agua) piro.….. (2 moléculas de agua) orto.….. (3 moléculas de agua) este prefijo se puede omitir Ejemplo: CO2 + 2SO3 + P2O3 + P2O + 2H2O = H4CO4 H2O = H2S2O7 2H2O = H4P2O5 H2O = HPO Ácido ortocarbónico Ácido pirosulfúrico Ácido pirofosforoso Ácido metahipofosforosoç b.- Nomenclatura IUPAC Nomenclatura sistemática: - nombre del anión de hidrógeno Nomenclatura sistemática funcional: - ácido nombre del anión En los dos sistemas empleamos las normas indicadas en el estudio de los oxácidos simples. Cuando se repite el átomo central se utilizará el prefijo de cantidad adecuado En algunos casos se puede omitir la notación del oxigeno y utilizar un prefijo de cantidad para el número de hidrógenos. Siempre que el nombre sistemático funcional permita escribir con facilidad la fórmula, se puede omitir la notación del oxígeno. 88 Ejemplos: H4CO4 Ácido tetraoxocarbónico Tetraoxocarbonato de hidrógeno Carbonato de tetrahidrógeno H2S2O7 Ácido heptaoxodisulfúrico (VI) Heptraoxodisulfato de hidrógeno Disulfato (VI) de hidrógeno H2S2O5 Ácido pentaoxodisulfúrico (IV) Pentaoxodisulfato (IV) de hidrógeno Disulfato (IV) de hidrógeno H4PdO4 Ácido tetraoxopaládico Tetraoxopaladato (IV) de hidrógeno Paladato (IV) de tetrahidrógeno H3FeO3 Ácido trioxoférrico (III) Trioxoferrato (III) de hidrógeno Ferrato (III) de trihidrógeno Formulación: Escribir en primer lugar el símbolo del hidrógeno y luego los del anión. La fórmula desarrollada presenta la siguiente distribución de los átomos: H3BO3 H2S2O5 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. H4As2O7 4+ 10+ 14H4 As2 O7 4(1+) + 2(5+) + 7(2-) = 0 Nota: Es oportuno y necesario indicar las estructuras reales de los oxácidos del fósforo y como cierta generalización para el arsénico y antimonio. 89 Téngase como premisa el siguiente criterio: “En las moléculas de los oxácidos del fósforo, arsénico y antimonio, el número de átomos del hidrógeno sustituibles por átomos de metales o grupo de átomos con número de oxidación positivo es igual al número de átomos de oxigeno que poseen dichas moléculas menos uno.” Para no confundir el carácter de lo hidrógenos no sustituibles se les coloca entre el átomo central y el oxígeno. Por lo tanto. a.- Cada fósforo monovalente retiene dos hidrógenos, presentando un solo hidrógeno ionizante. Por ejemplo la estructura desarrollada de ácido hipofosforoso: HPH2O2 b.- Cada fósforo trivalente retiene un hidrógeno, presentando dos hidrógenos ionizables. Ejemplo: Ácido fosforoso H2PHO3 c.- Cada fósforo pentavalente tiene todos sus hidrógenos sustituibles. Ejemplo: Ácido fosfórico H3PO4 El nombre sistemático de estos ácidos, con estructuras que tienen hidrógenos no sustituibles, es confuso y muy poco utilizable. Se recomienda mantener los nombres tradicionales. Escritura y lectura de una fórmula 90 Escritura: Escritura de una fórmula con nombre sistemático. - Escribir los símbolos de la fórmula. Establecer el número de cargas para cada átomo. Deducir el subíndice del hidrógeno o del oxígeno. Ejemplo: Ácido heptaoxodifosfórico (V) x 10 + 14H P2 O7 HP2O7 4 + 10 + 14H4 P2 O7 H4P2O7 Escritura de la fórmula con nombre tradicional Ácido piroselénico Analizar el nombre del anión Determinar al óxido y luego hacer la reacción con agua Nombre del anión piroselénico Piro: 2 óxidos + 1H2O Selénico: óxido selénico, donde el selenio está con numero de oxidación 6+ Reacción: 2SeO3 + 1 H2O = H2Se2O7 Fórmula de la sustancia propuesta. Lectura: Lectura de una fórmula con nombre sistemático - Averiguar el número de oxidación del átomo central Aplicar las normas conocidas. 4+ 4+ 8H4 Pb O4 Tetraoxoplumbato (IV) de hidrógeno Plumbato (IV) de tetrahidrógeno Ácido tetraoxoplúmbico(IV) Ácido Plúmbico (IV) H4PbO4 2.3.3. OXÁCIDOS DE METALES Algunos metales al funcionar con números de oxidación 4+, 5+, 6+, 7+ y a veces 3+, forman oxácidos. Muchos de estos ácidos son desconocidos en estado libre, se hallan frecuentemente en forma de sales La nomenclatura de estas sustancias es puramente didáctica Muy pocos nombres tradicionales son admitidos por la IUPAC, por ello es recomendable utilizar sus nombres sistemáticos. La formación teórica de estos oxácidos seguirá los mecanismos indicados anteriormente. 91 2Cr + 1 H2O = H2Cr2O7 V2O5 + 3 H2O = H6V2O8 = H3VO4 Ácido dicrómico Ácido dicrómico NOMENCLATURA a.- Nomenclatura IUPAC. Las normas para el nombre de estas sustancias son las mismas indicadas anteriormente Ejemplo: HCrO2 Ácido dioxocrómico (III) Dioxocromato (III) de hidrógeno Cromato (III) de hidrógeno. b.- Nomenclatura Tradicional los nombres tradicionales no son aconsejables, llevan a mucha confusión y no facilitan la escritura de la fórmula. Los criterios que se utilizan para estos nombres son los indicados en los oxácidos polihidratados. Formulación Se escribe en primer lugar el símbolo del hidrógeno y luego los del anión. En la fórmula desarrollada los átomos tienen la siguiente distribución: H3CrO3 H2CrO4 En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. H3 Fe O3 3+ 3+ 6H3 Fe O3 3(1+) + (3+) + 3(2-) = 0 Ejemplos: H3CrO3 H4GeO4 H2SnO3 H2FeO4 Ácido trioxocrómico (III) o Trioxocromato (III) de hidrógeno Ácido tetraoxogermánico (IV) o Tetraoxogermanato (IV) de hidrógeno Ácido trioxoestánnico (IV) o Estannato (IV) de dihidrógeno Ácido tetraoxoférrico (VI) o Ferrato (VI) de dihidrógeno 92 H2PtO3 H3U2O7 H2PbO3 H2MoO4 Ácido trioxoplatínico (IV) o Platinato (IV) de dihidrógeno Ácido heptaoxodiuránico (VI) o Heptaoxodiuranato (VI) de hidrógeno Ácido trioxoplúmbico (IV) o Trioxoplumbato (IV) de hidrógeno Ácido tetraoxomolíbdico (VI) o Molibdato (VI) de hidrógeno 2.3.4. TIOÁCIDOS, SELENOÁCIDOS Y TELUROÁCIDOS Son aquellos oxácidos que resultan de la sustitución de uno o varios oxígenos del ácido por átomos de azufre, selenio o teluro. Como el número de oxidación del oxígeno es 2lo mismo del azufre, selenio y teluro; el remplazo se realiza átomo por átomo Nomenclatura a.- Nomenclatura IUPAC Nomenclatura tradicional admitida: La IUPAC admite los nombres tradicionales de un grupo de ácidos que fueron indicados anteriormente El nombre formado de la siguiente manera: - ácido nombre del ácido del cual proviene con el prefijo tio por un azufre, seleno por un selenio, teluro por un teluro. En una polisustitución se empleará un prefijo de cantidad adecuado al número de átomos sustituidos. Ejemplos: Ácido de origen Ácido formado H3PO4 Ácido fosfórico HClO3 Ácido perclórico H2CO3 Ácido carbónico H3PO3Se HClO3S H2CO2Te Ácido selenofosfórico Ácido tioperclórico Ácido telurocarbónico Nomenclatura Sistemática El nombre sistemático se forma - nombre del anión de hidrógeno El nombre sistemático funciona - ácido nombre del anión 93 En el anión tengamos presente las siguientes normas - - Nombrar el ligado oxígeno oxo luego el otro ligado, si es azufre tio, para el selenio seleno y para el teluro, teluro. En una polisustitución se utilizará el prefijo de cantidad adecuado al número de átomos sustituidos. Nombre del átomo central con el sufijo ato para todos los casos. En el nombre sistemático funcional cambiar ato por ico. Si es necesario se acompañará la notación del número de oxidación. No se deja espacios ni se escribe guiones. Ejemplos: H2S2O2 H3PO3S H2COTe2 HClOSe2 Dioxotiosulfato (IV) de hidrógeno o Ácido dioxotiosulfúrico (IV) Trioxotiofosfato (V) de hidrógeno o Ácido trioxotiofosfórico (V) Oxoditelurocarbonato de hidrógeno o Ácido oxoditelurocarbónico Oxodiselenoclorato (V) de hidrógeno o Ácido oxodiselenoclórico (V) b.- Nomenclatura tradicional Es preferible utilizar el nombre sistemático o el tradicional admitido. Los nombres tradicionales se forman de idéntica manera a lo manifestado en el sistema tradicional admitido. Se utiliza el prefijo sulfo cuando el oxígeno es totalmente sustituido. Ejemplo: H2CS2 HBrO2Se HClOSe2 H2TeO3S Ácido sulfocarbónico Ácido selenibrómico Ácido diseleniclórico Ácidotiotelúrico Formulación Escribir primero el símbolo del hidrógeno, luego el del átomo central, el del oxígeno y al final el símbolo del sustituyente. La fórmula desarrollada presenta la siguiente distribución de los átomos. HClO2S H2CS3 94 Tioácidos Compuesto Nomenclatura sistemática Nomenclatura Stock Nomenclatura tradicional H2S2O3 ácido trioxotiosulfúrico (VI) trioxotiosulfato (VI) de hidrógeno ácido tiosulfúrico HNSO2 ácido dioxotionítrico (V) dioxotionitrato (V) de hidrógeno ácido tionítrico H3PS2O2 ácido dioxoditiofosfórico (V) dioxoditiofosfato (V) de hidrógeno ácido ditiofosfórico Las tiosales se nombran de forma análoga a las oxisales. Compuesto FeS2O3 Nomenclatura sistemática y stock trioxotiosulfato (VI) de hierro (II) Nomenclatura tradicional tiosulfato ferroso Al2(HPS4)3 hidrógenotetratiofosfato (V) de aluminio hidrógenotiofosfato de aluminio Na3PS3O oxotritiofosfato (V) de sodio tritiofosfato de sodio 2.3.5. PEROXOÁCIDOS Son aquellos oxoácidos que han sustituido un oxígeno por un grupo peroxo O2-. Su fórmula no se simplifica. En la nomenclatura tradicional (la más frecuente) se añade peroxo-, y en las restantes se indica con -peroxo- el oxígeno sustituido. Si a la hora de formular pudiera haber confusión con otro oxoácido, se indica el grupo peroxo entre paréntesis. Se indica algunos procedimientos para la formación de estas sustancias, a veces confusos. 95 Un procedimiento simple que facilita la formulación y estructura es considerar que resultan de remplazar un oxígeno del ácido por el grupo peroxo. Simplemente, para obtener un mono peróxido, aumentamos un oxigeno al ácido normal. Ejemplos: H2SO4 H3PO4 H2S2O7 H2SO3(O2) H3PO3(O2) H2S2O6(O2) H2SO5 H3PO5 H2S2O8 Se establece la existencia de dos tipos de peroxoácidos a.- Peroxomonoácidos que contiene el grupo -O-O-H b.- Peroxodiácidos que contienen el grupo -O-OEjemplo: Ácido peroxonítico HNO4 Ácido peroxodisulfúrico H2S2O8 En ausencia de otros datos, las estructuras de los demás peroxoácidos pueden considerarse análogas. Nomenclaturas a.- Nomenclatura IUPAC. Nomenclatura tradicional admitida. Este sistema utilizaremos para los ácidos con nombres tradicionales admitidos por la IUPA. - ácido nombre del ácido normal con el prefijo peroxo 96 Ejemplo: HClO5 Ácido peroxoperclórico HNO4 Ácido peroxonítrico HClO2(O2) Ácido peroxoclórico Nomenclatura sistemática - nombre del anión de hidrógeno El nombre del anión se forma con las normas conocidas, añadiendo luego de oxo la palabra peroxo. Ejemplo: HNO4 H3PO5 HClO5 Dioxoperoxonitrato (V) de hidrógeno Trioxoperoxofosfato (V) de hidrógeno Trioxoperoxoclorato (VII) de hidrógeno Nomenclatura sistemática funcional. - ácido nombre del anión El nombre del anión se estructura de la manera conocida, añadiendo la palabra peroxo luego de oxo. Ejemplo: HNO4 HIO5 H2MnO5 Ácido dioxoperoxonítrico (V) Ácido trioxoperoxoyódico (VII) Ácido trioxoperoxomangánico (VI) En los nombres sistemáticos hay que tener presente que en la formulación del peroxoácido existe el grupo peroxo. b.- Nomenclatura Tradicional - ácido nombre del ácido normal con el prefijo per Este sistema no es recomendado. El uso del prefijo per queda restringido a los compuestos cuyo átomo central presenta un elevado estado de oxidación, por ejemplo ion perclorato, ion permanganato, etc. 97 Formulación Escribir en primer lugar el símbolo del hidrógeno, luego el del átomo central y al final el del oxigeno que incluye al grupo peroxo. Obtenido la fórmula no se simplifica Cuando existen casos de isomería o sea que la fórmula del peroxoácido es semejante a un ácido normal, se indicará el grupo peroxo entre paréntesis. HNO3 Ácido nitroso HClO2 Ácido cloroso HNO(O2) Ácido peroxonitroso HClO(O2) Ácido peroxocloroso Escritura y lectura de una fórmula. Escritura Escritura de una fórmula como nombre tradicional admitido - Establecer el ácido de origen. Reemplazar un oxígeno por el sustituyente peroxo. El ácido de origen puede deducirse directamente o mediante el procedimiento expuesto en su debida oportunidad. Escritura de una fórmula con nombre sistemático - Escribir la fórmula con los subíndices indicados. Establecer el número de cargas para cada átomo. Deducir el subíndice del hidrógeno o del oxigeno, de acuerdo al caso. Escribir el grupo peroxo separadamente y luego, de ser posible, añadir al total de oxígenos. Lectura Lectura de una fórmula con nombre sistemático. - Determinar el número de oxidación del átomo central. Si el grupo peroxo está condensado con el oxígeno simple, separar el grupo mediante un paréntesis. Aplicar las normas conocidas. Lectura de una fórmula con nombre tradicional admitido - Si el grupo peroxo está condensado, separar mediante un paréntesis Deducir el ácido de origen. Establecer el nombre de la fórmula propuesta en base a las normas establecidas. 98 Peroxoácidos Compuesto Nomenclatura sistemática Nomenclatura Stock Nomenclatura tradicional H2SO5 ácido trioxoperoxosulfúrico (VI) trioxoperoxosulfato (VI) de hidrógeno HOONO ó HNO (O2) ácido monoxoperoxonítrico (V) monoxoperoxonitrato (V) ácido de hidrógeno peroxonítrico H3BO4 ácido dioxoperoxobórico dioxoperoxoborato (III) de ácido peroxobórico (III) hidrógeno ácido peroxosulfúrico Las peroxisales se nombran de forma análoga a las oxisales. Compuesto K2S2O8 Nomenclatura sistemática y Stock Nomenclatura tradicional hexaoxoperoxodisulfato (VI) de potasio peroxodisulfato de potasio Ba[NO (O2)]2 oxoperoxonitrato (III) de bario peroxonitrito de bario o bárico CaSO5 peroxosulfato de calcio trioxoperoxosulfato (VI) de calcio 99 2.4. SALES Experimentalmente pueden obtenerse por varios métodos. Pueden formarse de la neutralización de un ácido por un hidróxido. HCl + NaOH = NaCl + H2O H3PO4 + 3KOH = K3PO4 + 3H2O En general, una sal resulta de reemplazar total o parcialmente los hidrógenos ionizables de un ácido, por metales o grupos de átomos con número de oxidación positivo. Las sales derivan de los ácidos hidrácido o de los oxoácidos. Las sales se clasifican en: 1.- Sales neutras. 2.- Sales ácidas. 3.- Sales básicas. 4.- Sales dobles. 2.4.1. SALES NEUTRAS. Proceden de la neutralización total de un ácido por un hidróxido. Todos los hidrógenos ionizables son reemplazados por metales o radicales catiónicos. 3H2SO4 + 2 Al(OH) 3 = Al2 (SO4)3 + 6 H2O 2.4.1.1. Sales de oxoácidos simples Se forman en base a los oxoácidos simples, caracterizados por ser el resultado de la reacción de un solo óxido ácido (anhídrido) con una molécula de agua. En general, la fórmula de un oxoácido está formada por dos partes: - Los átomos de hidrógeno sustituibles. Un radical aniónico formado por lo que queda de quitar el o los hidrógenos. El número de oxidación del anión será igual al número de hidrógenos sustituibles. 100 Ejemplos: Nomenclatura a.- Nomenclatura IUPAC Nomenclatura tradicional admitida. Este sistema es válido para los aniones con nombres tradicionales facultados por la IUPAC. El nombre se nombra de la siguiente manera: - Nombre del ácido del cual proviene, cambiando la terminación oso por ito e ico por ato. - de - nombre del metal o radical catiónico. El nombre del metal sin ninguna variación. Si el metal tiene varios estados de oxidación se utilizará la notación Stock. Ejemplos: FeCO3 Carbonato de hierro (II) Fe2(CO3) 3 Carbonato de hierro (III) Na2SO4 Sulfato de sodio KClO Hpioclorito de potasio Nomenclatura sistemática. - Nombre del anión de nombre del metal o radical catiónico. El nombre del metal sin ninguna variación. Si el metal tiene varios estados de oxidación se utiliza la notación Stokc. 101 El nombre del anión se forma con las normas establecidas. Si el átomo central se repite se utiliza un prefijo de cantidad adecuado. Ejemplos: K2SiO3 Trioxosilicato de potasio Mn2 (SO4)3 Tetraoxosulfato (VI) de magnesio (III) NH4IO2 Dioxoyodato (III) de amonio NaIO4 Tetraoxoyodato (VII) de sodio Podemos prescindir de la notación del oxigeno cuando el nombre no lleve a confusiones y se pueda escribir fácilmente la fórmula. Podemos emplear prefijos de cantidad para el número de átomos del catión. Ejemplos: K2SiO3 Silicato de potasio NH4IO2 Yodato (III) de amonio NaIO4 Yodato (VII) de sodio Ca(ClO)2 Clorato (I) de calcio b. Nomenclatura tradicional No se permite este sistema por las razones conocidas. En su lugar utilicemos el sistema tradicional admitido o el nombre sistemático simplificado. Ejemplos: FeCO3 Carbonato ferroso Fe2(CO3) 3 Carbonato férrico Formulación Se escribirá primeramente el símbolo del metal o los del grupo catiónico y luego los símbolos de anión. En la fórmula. La suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. 2+ 5+ 6-2Ba (ClO3)2 1(2+) + 2((5+) + (3(2-)) ═ 0 102 Estructuralmente, los átomos tienen la siguiente distribución. Pb (SO3) 2 CaCO3 Escritura y lectura de una fórmula Escritura Escritura de una fórmula con nombre sistemático. - Se puede escribir directamente - En algunos casos será necesario deducir el número de oxigenos o del catión. - A veces se establece la fórmula del anión y se intercambia los números de oxidación con los del metal o grupo catiónico. Ejemplos: - Tetraoxosulfato (VI) de potasio Directamente K2SO4 - Trioxotelurato (IV) de manganeso (III) Anión trioxotelurato (IV): TeO32Intercambiamos números de oxidación 3+ 2Mn TeO3 Mn2 (TeO3)3 - Bromato (III) de estaño (IV) Anión bromato (III) BrO21Intercambiamos números de oxidación: 4+ 1Sn BrO2 Sn (BrO2)4 103 Escritura de una fórmula con nombre tradicional admitido. Directamente, intercambiando en la mente los números de oxidación del anión y del catión. Ejemplos: - Nitrito de sodio NaNO2 - Silicato de bismuto Bi2 ( SiO3)3 Deducir al anión en base al ácido de origen. Intercambiar los números de oxidación prescindiendo de la carga. Si ambos subíndices son divisibles, simplificar. Ejemplos: - Carbonato de níquel (II) Acido de origen carbónico Anión carbonato CO3 2Intercambio de números de oxidación. 2+ 2Ni CO3 Ni2 (CO3) 2 NiCO3 Fórmula de la sustancia propuesta NiCO3 - Bromito de bismuto Acido de origen bromoso Anión bromito BrO21- Intercambio de números de oxidación: 3+ 1Bi BrO2 Bi(BrO2)3 Una alternativa es realizar la reacción entre el acido respectivo y el hidrogeno. Ejemplo: Nitrato de aluminio 3 HNO3 + Al (NO3) 3 + 3 H2O Lectura: Lectura de una fórmula con nombre sistemático. - Averiguar los números de oxidación de los átomos. - Aplicar las normas conocidas. 104 Ejemplos: - 1+ Ag AglO3 5+ l 6O3 Trioxoyodato (V) de plata Yodato (V) de plata - Cr2(SeO4) 3 3+ 2Cr (SeO4) 3+ Cr 6+ 8- 2(SeO4) Tetraoxoseleniato (VI) de cromo (III) Seleniato (VI) de cromo (III) Lectura de una fórmula con nombre tradicional admitido. - Reconociendo el número de oxidación del catión y estableciendo el nombre del anión podemos nombrar una sal directamente. Na2SO4 Na4NO2 Sulfato de sodio Nitrito de amonio Un procedimiento sencillo es establecer el número de oxidación del átomo central, con el utilizar el sufijo adecuado y en los casos requeridos el prefijo respectivo. Ejemplos: CuClO3 1+ Cu 5+ 6Cl O3 Número de oxidación del cloro 5+ Criterio: 1+ Hipo…. oso 3+…..…….oso 5+…..…….ico 7+ Per….…ico 105 En las sales el sufijo ICO cambia a ATO por lo tanto: CuClO3 Clorato de cobre (I) - También podemos deducir el nombre son los siguientes datos: En base al anión, estructurar al ácido de origen Conocer el número de oxidación del catión Determinar el nombre del ácido y con el para el anión. Aplicar las normas conocidas. Ejemplos: Co3 (PO4) 2 2+ Co 3PO4 Anión: PO43Acido: H3PO4 Nombre del ácido: fosfórico u ortofosfórico Nombre del anión: fosfato u ortofosfato Nombre de la fórmula propuesta: Fosfato de cobalto (II) 2.4.1.2. Sales de oxácidos polihidratados Son compuestos que se obtienen sustituir todos los átomos de hidrogeno reemplazables de las moléculas de los ácidos por átomos de metales o grupos cationicos. H2S2O7 2 Na Na2S2O7 Es importante que el lector aprenda las características y estructura de los ácidos. El conocimiento complejo del uso de los prefijos Meta, piro y orto facilitará la lectura y escritura de la fórmula de una sal. Nomenclatura a.- Nomenclatura IUPAC Nomenclatura tradicional admitida La existencia de algunos aniones con nombres tradicionales admitidos por la IUPAC nos lleva a emplear la siguiente sistematización: - Nombre del ácido del cual proviene, cambiando la terminación OSO por ITO e ICO por ATO. - de - Nombre del metal o radical cationico. 106 El nombre del metal sin ninguna variación. Cuando el metal presenta varios estados de oxidación se empleará la notación Stock. Ejemplos: Na3BO3 Borato de sodio Ca2SiO4 Ortosilicato de calcio Al2TeO6 Ortotelurato de aluminio Bi(PH2O2)3 Hipofosfito de bismuto Nomenclatura sistemática - Nombre del anión de nombre del metal o radical cationico El nombre del anión se formara de acuerdo a los criterios conocidos. Si se repite el átomo central se empleará el prefijo de cantidad adecuado y siempre con la terminación ATO. El las sales del fósforo, arsénico y antimonio que tienen hidrógenos no sustituibles se obtienen nombres sistemáticos poco manejables y confusos. Como es un caso que no está solucionado por la IUPAC pueden darse nombres tradicionales. Ejemplos: (NH4) 2 PHO3 Fosfito de amonio CO2 CO 4 Tetraoxocarbonato de cobalto (II) K2S2O5 Pentaoxodisulfato (IV) de potasio Cu4V2O7 Heptaoxodivanadato (V) de cobre (I) Podemos prescindir de la notación del oxigeno para tener nombres sistemáticos simplificados. Esta sistematización es más aconsejada CO2 CO 4 Carbonato de dicobalto K2S2O5 Disulfato (IV) de dipotasio En algunos casos se puede utilizar un prefijo de cantidad para el metal y un prefijo multiplicativo para el anión. Este criterio es útil para compuestos de estructura complicada. Ejemplo: Bi5S(IO6)3 Ortoperyodato de bismuto Hexaoxoyodato (VII) de bismuto Tris (hexaoxoyodato) (VII) de pentabismuto b.- Nomenclatura tradicional Pocos nombres tradicionales son facultados por el IUPAC y por las razones que son de conocimiento, esta nomenclatura no se permite. 107 Ejemplos: Cu2S2O5 Li2SiO3 Pirosulfito cuproso Metasilicato de litio Formulación. En primer lugar ira el símbolo del metal o radical catiónico. Es una norma tradicional. En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. 4+ 10+ 14Pb P2 O7 1(4+) + 2(5+) + 7(2-) = O En la fórmula los átomos tienen la siguiente distribución. Ca2O5 Escritura y lectura de una fórmula. Escritura: Aplicando los mecanismos que hemos venido utilizando tenemos: - Tetraoxosilicato de bismuto Anión tetraoxosilicato (4+ 8- ) 4SiO4 (Si O4 ) Intercambio de los números de oxidación 3+ Bi 4(SiO4) Bi4 (SiO4) 3 Fórmula de la sustancia propuesta Bi4 (SiO4) 3 - Diantimoniato (V)de dicromo Cr2Sb2O 4+ 10+ xCr2 Sb2 O 4+ 10+ 14Cr2 Sb2 O7 108 Fórmula de la sustancia propia Cr2Sb2O7 - Pirosulfato de hierro (III) Anión: pirosulfato Acido: pirosulfúrico Formula del ácido H2S2O7 Formula del anión: S2O72Formula de la sustancia propuesta: 3+ 2Fe S2O7 Fe2 (S2O7) 3 - Ortosilicato de molibdeno (III) Anión: Ortosilicato Acido: ortosilísico Fórmula del ácido: H4SiO4 Fórmula del anión: SiO44Fórmula de la sustancia propuesta 3+ Mo 4SiO4 Mo4 (SiO4) 3 Lectura. Con el mecanismo que se utilizo con los temas anteriores tenemos: - SnSb2O7 4+ 44+ 10+ 14-4Sn (Sb2O7) Sn (Sb2O7) Número de oxidación del antimonio 5+ Nombre de la fórmula propuesta: Heptaoxodiantimoniato (V) de estaño (IV) Diantimoniato (V)de estaño (IV) - Sr Te2O5 2+ 2Sr Te2O5 2+ 8+ 10-2Sr (Te2O5) Número de oxidación del teluro 4+ Nombre de la fórmula propuesta: Pentaoxoditelurato (IV) de estroncio Ditelurato (IV) de estroncio - (NH4) 3 PO4 Directamente: Fosfato de amonio 109 - Cd2B2O54- Anión: B2O5 Acido: H4B2O5 Nombre del acido: Piroborico Diborico Nombre del anión: Piroborato Diborato Nombre de la fórmula propuesta: Piroborato de cadmio Diborato de cadmio 2.4.1.3. Sales de oxácidos de metales Se obtienen de reemplazar teóricamente los hidrógenos de los ácidos que forman algunos metales. H2MoO4 2Na Na2MoO4 Nomenclatura a.- Nomenclatura IUPAC Es el sistema aconsejado, los nombres son sencillos y de formación fácil. Son admitidos unos pocos aniones con nombres tradicionales. Ejemplo: KMnO4 CaCrO4 FeReO4 K ReO4 Permanganato de potasio Cromato de calcio Renato de hierro (III) Perrenato de potasio En los nombres sistemáticos utilizaremos las normas conocidas: Son importantes los nombres sistemáticos, simplificados. Ejemplos: KCrO2 Dioxocromato (III) de potasio Li3FeO3 trioxoferrato (III)de litio K2 FeO4 Tetraoxoferrato (VI) de potasio Cu3VO4 Tetraoxovanadato (V) de cobre (I) Al omitir la notación de oxigeno se tiene nombres sistemáticos simplificados. En lo posible utilizamos prefijos de cantidad para el metal. Ejemplos: Li3FeO3 Ferrato (III) de trilitio K2 FeO4 Ferrato (VI) de dipotasio 110 b.- Nomenclatura tradicional Este sistema no debe ser utilizado. Los nombres tradicionales llevan a muchas confusiones y no podemos escribir con facilidad las fórmulas. Ejemplo: NiCoO3 CaFeO4 Cobaltito niqueloso Ferrato de calcio Formulación Se escribirá siempre el símbolo del metal en primer lugar. El la fórmula, la suma algebraica de las cargas asignadas a los átomos en base en base a los números de oxidación será igual a cero. 1+ 5+ 6Au V O3 1(1+)+ 1(5+)+ 3(2-) = O En las fórmulas desarrolladas encontramos los átomos con la siguiente distribución: NiVO4 Escritura y lectura de una fórmula Escritura Con el procedimiento indicado en apartados anteriores tenemos: - Tetraoxomolibdato de dicobre Directamente: Cu2MoO4 - Manganato (VII) de plata AgMnO - 1+ Ag 7+ Mn x O 1+ 7+ 8Ag Mn O AgMnO4 Cromato de estroncio Anión: cromato Acido: crómico 111 Fórmula del acido H2CrO4 Formula del anión: Cr O42Fórmula de la sustancia propuesta 2+ Sr 2CrO4 Sr2 (CrO4) 2 SrCrO4 Lectura: - NiCrO3 2+ Ni 4+ 6Zr O3 Trioxozirconato (IV) de niquel (II) Zirconato (IV) de niquel - SnMn O4 2+ Sn 6+ 8Mn O4 Tetraoxomanganato (VI) de estaño (II) Manganato (VI) de estaño Manganato de estaño (II) - CaCr2 O7 2+ Ca 12+ Cr2 14O7 Dicromato de calcio Dicromato (VI) de calcio 2.4.1.4. Sales de tioácidos, selenoácidos y teluroácidos. Es importante revisar la formación y características de los ácidos para facilitar la nomenclatura y formulación de las sales. Formaremos teóricamente estas sales reemplazando los hidrógenos de los ácidos por metales o radicales catiónicos. HClO3S H3SbS4 Na K NaClO3S K3SbS4 112 Nomenclatura a.- Nomenclatura IUPAC Nomenclatura tradicional admitida. Para los aniones con nombres tradicionales facultados por la IUPAC, tenemos: - Nombre del anión - de - nombre del metal o radical catiónico El nombre del metal sin ninguna variación. Si el metal presenta varios números de oxidación se usará la notación Stock. Ejemplos: NaS2O2 Tiosulfito de sodio Fe(ClO2Te) 3 Teluroclorato de hierro (III) FeAsO2S2 Ditioarseniato de hierro (III) MnPSe3 Triselenofosfato de manganeso (III) Nomenclatura sistemática - Nombre del anión de nombre del metal o radical catiónico Conocemos las normas para los nombres del metal y del anión. Ejemplos: Na2S2O2 Dioxotiosulfato (IV) de sodio N2S2O3 trioxotiosulfato (VI) de potasio Ag2 CS3 Triotiocarbonato de plata NiSiOSe2 Oxodiselenosilicato de niquel (II) Se puede omitir la notación del oxigeno para tener nombres sistemáticos simplificados. Na2S2O2 Tiosulfato (IV) de disodio K2S2O3 Tiosulfato (VI) de dipotasio b.- Nomenclatura tradicional Por las limitaciones al uso de los sufijos OSO e ICO afectando al nombre del metal es aconsejable emplear el sistema tradicional admitido o el nombre sistemático simplificado. Formulación Escribir primero el símbolo del metal o radical cationico y luego los del anión. En la fórmula, la suma algebraica de las cargas asignadas a los atomos en base a los números de oxidación será igual a cero. 113 KMnO3S 1+ K 7+ Mn 6O3 2S En la fórmula desarrollada más probable, los átomos se distribuyen de la siguiente manera: Ba (NOS2) 2 Escritura y lectura de una fórmula Escritura Escritura de una fórmula con nombre sistemático. - Puede escribir directamente. En caso contrario deduce la fórmula del anión e intercambia los números de oxidación, prescindiendo de la carga. En algunos casos tendrá que determinar el número de oxígenos o del metal. Ejemplos - Trioxotelurofosfato (V) de manganeso (III) Anión: trioxotelurofosfato (V) (PO3Te)x 5+ 6- 2P O3 Te (P O3 Te)3- Intercambio de los números de oxidación. 3+ 3Mn (PO3Te) Mn3 (PO3Te) 3 MnPO3Te Fórmula de la sustancia propuesta MnPO3Te 114 - Tioyodato (VII) de sodio Na I O S 1+ Na 7+ x- 2I O S 1+ 7+ 6- 2Na I O S Na I O3 S Formula de la sustancia propuesta: NaIO3S Escritura de una fórmula con nombre tradicional admitida. - Podemos escribir directamente. En caso contrario seguimos el siguiente procedimiento: A partir del anión deducir el ácido de origen. Formular al anión Intercambiar los números de oxidación. Simplificar los subíndices si son divisibles. Ejemplo: - Ditiocarbonato de amonio Directamente: (NaH4) 2COS2 Indirectamente: Anión: Ditiocarbonato Acido: Ditiocarbónico Fórmula del ácido: H2COS2 Fórmula del anión: COS22Fórmula de la sustancia propuesta: 1+ 2 NH4 COS2 (NH4) 2COS2 Lectura Lectura de una fórmula con nombre sistemático. - Averiguar los números de oxidación de los átomos. Aplicar las normas conocidas. Ejemplos: - Na2SO2Se 2+ 4+ 4- 2Na2 S O2 Se Dioxoselenosulfato (IV) de sodio. Selenosulfato (VI) de disodio 115 - Fe(ClOS2) 3 3+ 5+ 2- 4- 3Fe (Cl O S2) 3 Ditioclorato (V) de hierro (III) Oxoditioclorato (V) de hierro (III) Lectura de una fórmula con nombre tradicional admitido. Apliquemos el procedimiento de las sales simples. Ejemplos: - AuPS4 Directamente: Tetratiofosfato de oro (III) Indirectamente: 3+ 3Au (PS4) Anión: PS43Acido: H3PS4 Nombre del ácido: tetratiofosfórico. Nombre del anión: tetratiofosfato Nombre de la formula propuesta: Tetratiofosfato de oro (III) - Ca (NOTe)2 2+ 1Ca (NOTe) Directamente: Teluronitrito de calcio Indirectamente: Anión: NOTe1Acido: HNOTe Nombre del acido: Teluroitroso Nombre del anión: Teluronitrito Nombre de la sustancia propuesta: Teluronitrito de calcio. 2.4.1.5. Sales de peroxoácidos. Se obtienen al reemplazar los hidrógenos del peroxoácido por radicales catiónicos. H2SO5 2Na Na2SO5 Nomenclatura a.- Nomenclatura IUPAC 116 Nomenclatura tradicional admitida. Para los oxoaniones facultados por la IUPAC, tenemos: - Nombre del anión de nombre del metal o radical catiónico. El nombre del metal sin ninguna variación. Cuando al metal presenta varios estados de oxidación se usará la notación Stock. Ejemplos: NH4NO4 Peroxonitrato de amonio KNO (O2) Peroxonitrito de potasio Ni2 (SeO5)3 Peroxoseleniato de níquel (III) Ca(ClO2(O2))2 Peroxoclorato de calcio Nomenclatura sistemática - Nombre del anión de nombre del metal o radical catiónico. El nombre del anión se forma con las normas generales conocidas. Es interesante aclarar que en muchas fórmulas el grupo peroxo se halla incluido en el total de átomos de oxigeno. Será necesario, por lo tanto, tomar en cuenta ese particular para la estructuración de un nombre sistemático. Ejemplos: BiAsO5 KMnO5 AgBrO3(O2) Trioxoperoxoarseniato (V) de bismuto Trioxoperoxomanganato (VII) de potasio Trioxoperoxoclorato (VII) de plata. Es criterio del autor que en fórmulas de uso poco frecuentes se indique separadamente el grupo peroxo. Ejemplo: MgB4O6 (O2) Cu3VO3 (O2) Hexaoxoperoxotetraborato de magnesio Peroxotetraborato de magnesio Trioxoperoxovanadato (V) de cobre (I) Peroxovanadato (V) de tricobre Puede omitirse la notación del oxigeno para tener nombres sistemáticos simplificados. K2CO4 Peroxocarbonato de potasio BiNO4 Peroxonitrato (V) de bismuto. 117 b.- Nomenclatura tradicional No esta permitido los números tradicionales. Formulación. Escribir en primer lugar el símbolo del metal o radical cationico y luego los del anión. En los casos de isomería se indicará el grupo peroxo mediante un paréntesis. En la fórmula, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero. K2CO4 K2CO2(O2) 2+ 4+ 4- 2K2C O2 (O2) 2(1+) + 1(4+) + 2(2-) + (2-) = 0 En los compuestos simples, las fórmulas desarrolladas pueden estructurarse de la siguiente manera: Fe(NO4) 2 Escritura y lectura de una fórmula: Escritura: - Puede escribirse directamente. Deducir el anión y luego intercambiar los números de oxidación. En algunos casos será necesario calcular el número de oxígenos. Ejemplos: - Peroxobromato (V) de calcio Anión. Peroxobromato (V) Ácido de origen: brómico (V) Fórmula del ácido de origen: HBrO3 Fórmula del anión: HBrO3 HBrO2(O2) Fórmula de la sustancia propuesta: 2+ 1Ca BrO2(O2) Ca(BrO2(O2)) 2 BrO2(O2)1- 118 - Trioxoperoxoantimoniato (V) de plomo (IV) Anión: Trioxoperoxoantimoniato (V) Fórmula del anión: 5+ 6- 2Sb O3 (O2) SbO3 (O2)3- SbO53- Fórmula de la sustancia propuesta: 4+ 3Pb SbO5 Pb3(SbO5) 4 Escritura de una fórmula con nombre tradicional admitido El lector puede escribir directamente. Una alternativa es el siguiente mecanismo: - Deducir el ácido de origen. Estructurar el anión. Intercambiar el número de oxidación. Ejemplos: - Peroxonitrato de plata. Anión: Peroxonitrito Ácido: Peroxonitroso Fórmula del ácido: HNO2 HNO(O2) Formula del anión: NO(O2)1Fórmula de la sustancia propuesta: 1+ 1- Ag NO(O2) - AgNO(O2) Peroxodisulfato de manganeso (III) Anión: Peroxonitrito Ácido: Peroxodisulfúrico Fórmula del ácido H2S2O7 Fórmula del anión S2O82Formula de sustancia propuesta 3+ 2Mn S2O8 Mn2(S2O8) 3 H2S2O6(O2) H2S2O8 119 Lectura: Lectura de una formula con nombre sistemático. - Averiguar los números de oxidación de los átomos Aplicar las normas conocidas Ejemplo: - Hg(IO2(O2)) 2 2+ 12+ 5+ 42Hg (IO2(O2) Hg ((IO2(O2)) Dioxoperoxoyodato (V) de mercurio (II) Peroxoyodato (V) de mercurio (II) 1- Lectura de una fórmula con nombre tradicional admitido. Utilicemos las instrucciones dadas en el estudio de las sales neutras simples. Ejemplo: - (NH4) 2SO5 Anión: SO52Ácido. H2SO5 H2SO3(O2) Nombre de ácido: Peroxosulfúrico Nombre del anión: Peroxosulfato Nombre de la fórmula propuesta: Peroxosulfato de amonio 2.4.1.6. Sales de ácidos especiales. Las sales de los ácidos de estructura especial se forman de reemplazar teóricamente los hidrógenos por metales o radicales catiónicos H4Fe(CN) 6 4Na Na4Fe(CN) 6 Nomenclatura a.- nomenclatura IUPAC Nomenclatura tradicional admitida. Para todos los aniones con nombres tradicionales facultados por la IUPAC se empleará la siguiente sistematización. - Nombre del anión con la terminación URO, ITO y ATO - De - Nombre del metal 120 El nombre del metal sin ninguna variación. Cuando el metal presenta varios estados de oxidación se usará la notación Stock. Algunos aniones tienen nombres especiales Ejemplos: NaN3 KCN NH4OCN MgC2 Na2S2O6 Azida de sodio Cianuro de potasio Cianato de amonio Acetiluro de magnesio Ditionato de sodio Nomenclatura sistemática Se emplean las normas conocidas y aplicadas en apartados anteriores. Ejemplos: K3Fe(CN) 6 Na2SO2 LiClF4 Hexacianoferrato (III) de tripotasio Dioxosulfato (II) de sodio Tetrafluorclorato de litio b.- Nomenclatura tradicional. No recomendable 2.4.2. SALES ÁCIDAS Son compuestos con carácter ácido por contener en su estructura hidrógenos ionizables. Por el tipo de unión tenemos dos grupos de sales ácidas. - Sales derivadas de los ácidos hidrácidos. Sales derivadas de los oxoácidos. Hemos de esperar verdaderas especies químicas cuando los ácidos posean dos o más átomos de hidrógenos sustituibles. Teóricamente proceden de reemplazar parcialmente los hidrógenos del ácido por metales o radicales catiónicos. H2S H2CO3 Na NaHS Na NaHCO3 121 Puede formarse de la neutralización parcial de un ácido por un hidróxido Na OH + H2Se = NaHSe + H2O Ca(OH) 2 + 2 H2SO4 = Ca(HSO4) 2 + 2H2O Es importante que manifestemos extrañeza sobre la utilización de nombres antiguos, arbitrarios, que confunden y no permiten una racional estructuración de la fórmula. Estas denominaciones deben desaparecer, la comunidad científica internacional acepta las normas de la IUPAc i es deber nuestro aplicarlas. A modo de ejemplo citemos algunos casos: - El uso del prefijo “Bi” cuando se remplaza la mitad de los hidrógenos sustituibles. Ejemplos: Bisulfito de sodio NaHSO3 Bicarbonato de calcio Ca(HCO3) 2 Cuando se ha reemplazado un hidrógeno del ácido utilizan el prefijo MONO, antes del nombre del metal; si se han reemplazado dos hidrógenos, el prefijo Di y si son tres los hidrógenos reemplazados usan el prefijo TRI. Ejemplos: Ca(H 2PO 4) 2 CoH 2As 2O 7 CaHPO 4 Ca 3(PO 4) 2 2.4.2.1. Fosfato monocálcico Piroarseniato dicobaltoso Fosfato dicálcico Fosfato tricálcico Sales ácidas de los ácidos hidrácidos Específicamente encontraremos con los aniones del azufre, selenio y teluro. Nomenclatura. a.- Nomenclatura IUPAC. - Nombre del anión de nombre del metal o radical cationico El nombre del metal sin ninguna variación. Si el metal tiene varios estados de oxidación se utilizará la notación stock. 122 El anión se forma con el nombre del no metal y el sufijo URO anteponiendo la palabra HIDROGENO, sin guiones ni espacios. Ejemplos: KHS Mn(HTe)3 NH4HSe Hidrógenosulfuro de potasio Hidrógenoteluro de magneso (III) Hidrógenoseleniuro de amonio b.- Nomenclatura tradicional. Los nombres tradicionales con el prefijo “Bi” no se permiten. Se tolera en poquísimos compuestos la palabra “ACIDO”. No se permite el uso de los sufijos OSO e ICO afectando al nombre del metal. Por los antecedentes anotados se recomienda el sistema IUPAC. Ejemplos: KHS NH4HSe 2.4.2.2. Sulfuro ácido de potasio Seleniuro ácido de amonio Sales ácidas de los oxoácidos. Se obtiene al reemplazar parcialmente los hidrógenos del ácido o por una neutralización parcial del ácido por un hidróxido. Especies químicas reales se obtienen si el ácido posee por los menos dos hidrógenos ionizables. H3PO4 Cu CuH2PO4 H3PO4 Cu CuHPO4 CuOH + H3PO4 = CuH2PO4 + H2O Cu(OH) 2 + H3PO4 = CuHPO4 + 2 H2O Nomenclatura. a.- nomenclatura IUPAC. Nomenclatura tradicional admitida. Como puede verse, los aniones tendrán nombres facultados por la IUPAC y el metal llevará la notación Stock en los casos covenidos. 123 Por lo tanto. - Nombre del anión con la terminación ITO o ATO - De - Nombre del metal o radical catiónico. En el nombre del anión se escribe primero la palabra HIDRÖGENO. Si existen dos o más hidrógenos se empleará el prefijo adecuado. No se permite el uso del prefijo “Bi” ni palabras que afecten al catión. En pocos casos se tolera la palabra ácido. Ejemplos: NH4HSO4 Fe(H2PO4) 3 KHCO3 Ag2HAsO4 Hidrógenosulfato de amonio Dihidrógenofosfato de hierro (III) Hidrógenocarbonato de potasio Hidrógenoarseniato de plata Nomenclatura sistemática. - Nombre del anión de nombre del metal o radical catiónico El nombre del metal sin ninguna variación, con la notación Stock en los casos necesarios. El nombre del anión se forma colocando delante del nombre sistemático la palabra HIDRÓGENO. Si existe dos o mas hidrógenos se empleará un prefijo adecuado. Si bien esta denominación se pone en desacuerdo con las normas establecidas en la nomenclatura del átomo especial central, se aceptan totalmente. Ejemplo: NaHSO3 Mn(H2PO4)3 (NH4)HCO3 KHSeO3 Hidrógenosulfato (IV) de sodio Dihidrógenotetraoxofosfato (V) de manganeso (III) Hidrógenotrioxocarbonato de amonio. Hidrógenotrioxoseleniato (IV) de potasio Se obtienen nombres sistemáticos simplificados y mas recomendables al omitir la notación del oxigeno. Ejemplos: NaHSO3 Mn(H2PO4) 3 Hidrógenosulfato (IV) de sodio Dihidrógeno (V) de manganeso (III) 124 Nombres sistemáticos mas complejos y no aconsejados para estos casos sencillos, se tiene usando prefijos multiplicativos para el anión. Ejemplo: Pt(HAsO) Tetrakis(dihidrógenotetraoxoarseniato (V)) de platino b.- Nomenclatura tradicional Este sistema da diversos nombres para una misma sustancia. Acostumbra colocar la palabra ácido entre el catión y el anión . se tolera en poquísimos casos el uso de la palabra ácido. Utiliza el prefijo “Bi” antes del nombre de la sal neutra y en otros casos usa prefijos arbitrarios que afectan al catión. Emplea los sufijos OSO e ICO en el nombre del metal. Todos estos criterios no son permitidos por la Unión Internacional de Química Pura y Aplicada y por lo tanto no debemos utilizarlos. Por ejemplo: NaHCO3 CaHPO4 KHSiO3 Carbonato ácido de sodio Fosfato dicálcico Bisilicato de potasio 2.4.3. SALES BÁSICAS Con la denominación de “sales básicas” se conocen un conjunto de compuestos de cierta complejidad que no resulta sencillo llegar a una sistematización de su nomenclatura. En primer término, la denominación de sal básica se da a cualquier sustancia que posee una composición intermedia entre una sal normal y un óxido o hidróxido del metal. Lo que pretendemos en esta parte es un estudio de la nomenclatura y formulación de los compuestos que llamaremos HIDROXISALES. Es conveniente mencionar que el grupo aniónico OH- tiene la denominación de HIDROXIDO y no “hidroxilo” u “oxidrilo” que lamentablemente utilizamos con mucha frecuencia. 125 Para simplificar la formación de una hidroxisal es conveniente considerar que resulta de la neutralización parcial de un hidróxido por ácido. Si queremos tener especies químicas verdaderas es indudable que el hidróxido debe poseer más de un grupo hidróxido. Estas sales básicas, formalmente pueden considerarse sales dobles, formadas por un catión y dos aniones, donde uno de ellos es el ion hidróxido. Debe advertirse que en la nomenclatura tradicional se utiliza el prefijo SUB y la palabra “básico” entre el nombre del anión y el del metal. Estos criterios no están facultados por la IUPAC, por lo cual sería improcedente seguir empleándoles. Ahora, de acuerdo a la naturaleza del anión encontramos principalmente dos grupos de hidroxisales. - 2.4.3.1. Sales básicas con aniones derivados de los ácidos hidrácidos Sales básicas con aniones derivados de los oxoácidos. Sales básicas de aniones simples. Provienen en especial de la reacción parcial de un hidróxido con un ácido hidrácido. Es necesario que el hidróxido tenga mas de un grupo hidróxido. 126 Nomenclatura. a.- nomenclatura IUPAC. - Nombre de los aniones separados con un guión de nombre del metal El nombre del metal sin ninguna variación con la notación Stock en los casos necesarios Si en la fórmula existen más de un grupo hidróxido, se usará el prefijo adecuado. Ejemplos: Ba(OH)Br Mg(OH)I Fe(OH) 2Cl Ni2(OH) 2S Hidróxido-bromuro de bario Hidróxido-yoduro de magnesio Dihidróxido-cloruro de hierro (III) Dihidróxido-sulfuro de niquel(II) Es conveniente acotar la palabra HIDROXIDO a HIDROXI por su analogía y por el uso que se da en la nomenclatura tradicional. En este caso no es necesario mantener el guión. Ejemplos: Ni(OH)Br Pb(OH) 2Cl2 Hidroxibromuro de níquel (II) Dihidroxicloruro de plomo (IV) b.- nomenclatura tradicional La IUPAC no considera lógico que se siga utilizando nombres tradicionales sistemáticos. Formulación Para formular estas sales se escribe en primer lugar el símbolo del metal y a continuación los dos aniones. A veces será necesario separar al grupo hidróxido mediante un paréntesis para una mejor definición de la fórmula total de la sal. En la fórmula, la suma algebraica de lasa cargas asignadas a los átomos será igual a cero Al(OH) 2F 3+ 2- 1Al (OH) 2F 1(3+) + 2(1-) + (1-) = 0 127 Las fórmulas desarrolladas tienen a los átomos distribuidos de la siguiente manera: Cd(OH)Cl 2.4.3.2. Ni 2(OH) 2S Sales básicas con aniones de oxoácidos. Estas sales contienen un catión, uno mas grupos hidráxido y un oxoanión. Hemos de esperar sales básicas con estructuras de verdaderas especies químicas cuando el hidróxido tenga más de un grupo OHNomenclatura. a.- Nomenclatura IUPAC. Nomenclatura tradicional admitida. En el estudio de los oxoácidos se vieron los aniones con nombres tradicionales aceptados por la IUPAC. Con estos aniones podemos sistematizar la siguiente nomenclatura: - Nombres de los aniones separados por un guión de nombre del metal El nombre del metal sin ninguna variación, en los casos necesarios se utilizará la notación Stock. Si en la fórmula existe más de un grupo hidróxido, se empleará los prefijos adecuados. No se permite el prefijo SUB ni la palabra básico. 128 Ejemplos: Ni(OH)NO3 Al(OH)CO3 Cu2(OH)2SO4 Sn(OH)3IO4 Hidróxido-nitrato de níquel (II) Hidróxido-carbonato de aluminio Dihidróxido-sulfato de cobre(II) Trihidróxido-peryodato de estaño (IV) Nomenclatura sistemática. - Nombres de los aniones separados por un guión - de - nombre del metal Tanto para el nombre del oxoanión y del metal se aplicará las normas establecidas. Si por la estructura especial del compuesto es indispensable dar un nombre claro, se usará prefijos multiplicativos para el oxoanión y prefijos numéricos para el catión. Ejemplos: Ca(OH)ClO4 Cr(OH)SiO3 Pb(OH)PO4 Zn4(OH) 2(CO3) 3 Hidróxido-tetraoxoclorato (VII) de calcio Hidróxido-trioxosilicato de cromo (III) Hidróxido-tetraoxofosfato(V) de plomo (IV) Dihidróxido-tris(trioxocarbonato) de tetracinc. Para tener nombres sistemáticos simplificados podemos omitir la notación del oxigeno. Ca(OH)ClO4 Ca(OH)ClO Hidróxido-clorato (VII) de calcio Hidróxido-clorato (I) de calcio b.- Nomenclatura tradicional. Este sistema no se recomienda Formulación. Escribir en primer el símbolo del metal luego los del hidróxido y al final los simbolos del oxoanión. La suma algebraica de las cargas será igual a cero. Al(OH)SO 3+ 1- 2Al (OH) (SO4) (3+) + (2-) + (1+) + (6+) + 4(2-) = 0 129 La distribución de los átomos en la formula desarrollada es Ni (OH) 2IO2 2.4.4. SALES DOBLES. Son compuestos que contienen varios cationes o aniones en su red sólida, los mismos que en soluciones acuosas quedan nuevamente libres. Ejemplos: KAl(SO4) 2 NaKS BiClS FeBrO3SO4 Sulfato doble de aluminio-potasio Sulfato doble de sodio-potasio Cloruro-sulfuro de bismuto Bromato-sulfato de hierro(III) De los ejemplos indicados podemos deducir que estas sales pueden dividirse en dos grupos generales: - Sales formadas por un anión y dos cationes - Sales formados por un catión y dos aniones Es de esperar un mayor número de aniones o cationes, por ejemplo las sales triples. 2.4.4.1. Sales formadas por un anión y dos cationes. Estas sustancias contienen dos cationes diferentes y un anión. Tradicionalmente se denominan “SALES DOBLES” NaKTe NH4NaCO3 Cu3Au(PO4) 3 Se pueden originar de la reacción de un ácido con dos hidróxidos diferentes 2 H2SO4 + KOH + Al (OH)3 = KAl(SO4) 2 + 4 H2O 130 En concreto, dos metales han reemplazado los hidrógenos del ácido Estas sustancias han sido consideradas mezclas equimoleculares de dos sales neutras del mismo anión con dos metales diferentes. Por algunas consideraciones, muchos de estos compuestos son verdaderas especies químicas. Además, algunos autores formulan estas sales colocando las fórmulas de las sales neutras simples una a continuación de otra, separadas por un punto. Estos pueden admitirse siempre que se consideren como compuestos de adición y también sería válido para cuerpos con estructuras muy complicadas, a falta de datos de la naturaleza de unión de los átomos y no para casos sencillos. Obviamente las dos maneras de escribir tendrán nombres diferentes. Ejemplos: (NH4)SO4. Al2(SO4) 3 NH4Al(SO4) 2 Sulfato de amonio-sulfato de aluminio Sulfato doble de amonio-aluminio Por la naturaleza del anión tenemos dos tipos de sales: - Sales derivadas de los oxoácidos. Sales derivadas de los ácidos hidrácidos. Nomenclatura. a.- nomenclatura IUPAC Nomenclatura tradicional admitida Para los aniones con nombres tradicionales facultados por la IUPAc tenemos la siguiente sistematización: - Nombre del anión con la terminación URO, ITo o ATO de acuerdoal caso. de nombre de los metales los nombres de los metales sin ninguna variación, separados por un guión y con la nomenclatura Stock si fuera necesario. Puede utilizarse el adjetivo “DOBLE” a continuación del nombre del anión. El orden de los nombres de los cationes será el mismo que tiene en la fórmula. De ser necesario, por la estructura de la fórmula, se empleará prefijos de cantidad. 131 Ejemplos. FeCuS2 KMgF3 CSAgSO4 NH4NaCO3 Ag10Sb2S8 Sulfuro de hierro (II)-cobre (II) Fluoruro doble de potasio-magnesio Triffloruro de potasio-magnesio Sulfato doble de cesio-plata Sulfato de cesio-plata Carbonato de amonio-sodio Carbonato doble de amonio-sodio Octasulfuro de decaplata-diantimonio (III) Nomenclatura sistemática - Nombre del anión - de - nombre de los metales Los nombres de los cationes sin ninguna variación, acompañados de los números de oxidación en los casos necesarios y separados por un guión. Puede utilizarse el adjetivo “DOBLE”, luego del nombre del anión. El orden de los nombres de los cationes es el mismo del que tienen en la fórmula Cuando se quiera dar nombres claros se empleará prefijos de cantidad para los cationes y multiplicativos para el anión. El uso de prefijos de cantidad mal utilizados puede traer confusiones graves. Ejemplos: MnZnCo4 K2Ca(SO4) 2 Na2Ba3(CO3) 4 NaKTe Tetraoxocarbonato de manganeso (II)-cinc. Tetraoxocarbonato doble de manganeso (II)-cinc. Tetraoxosulfato (VI) de potasio-calcio Tetraoxosulfato (VI) doble de potasio-calcio Tetrakis(trioxocarbonato) de disodio-tribario Teluro de sodio-potasio Teluro doble de sodio-potasio Nombres sistemáticos simplificados se obtiene al omitir la notación del oxigeno, los cuales son los más recomendados. Ag3Al(PO4) 2 Fosfato (V) de plata-aluminio Fosfato (V) doble de plata-aluminio Fosfato (V) de triplata-aluminio NH4Al(SO3) 2 Sulfato (IV) de amonio-aluminio Sulfato (IV) doble de amonio-aluminio 132 La misma sistematización servirá para las sales dobles de oxoaniones especiales Ejemplos. CuFeAsO3S RbAgS2O8 LiBiSiO4 NiCo(WO4)2 Be3Al2(S16O18) Tioarseniato (V) de cobre (I)-hierro (III) Peroxodisulfato (VI) de rubidio-plata Tetraoxosilicato doble de litio-bismuto Tetraoxowolframato (VI) de niquel (II)-cobalto (II) 18-oxo-hexasilicato doble de triberilio-dialuminio Formulación. Estas sales se formulan colocando primero los símbolos de los cationes y luego los del anión. El orden está en relación a su carga creciente. Si ambos cationes tienen la misma carga se empleará un orden alfabético. Este orden servirá para la denominación del compuesto. La IUPAC reconoce un orden alfabético al citar los nombres de los cationes, sin importar el orden de los símbolos en la fórmula. Si se desea formular las sales neutras simples, se usará un punto que les separe. Cu2CO3.3CaCO3 AlF3.3KF En una estequiometria equivalente, la manera sencilla de formular una sal doble es sumar sus sales neutras y simplificar si da lugar la fórmula Ejemplo. - Sulfato doble de potasio-bismuto K2SO4 Bi2(SO4)3 K2Bi2(SO4)4 KBi(SO4) 2 En la unidad formular, la suma algebraica de las cargas asignadas a los átomos en base a los números de oxidación será igual a cero Rb2Pb(SeO4)3 2+ 4+ (6+ 8-) 6Rb2 Pb (Se O4)3 2(1+) + (4+) + 3(6+) + 12(2-) = 0 133 En las fórmulas desarrolladas los átomos se distribuyen de la siguiente manera más probable. CuKS AgK(SO3Te) Escritura y lectura de una fórmula. Escritura: Un procedimiento sencillo es sumar las sales simples y simplificar si da lugar la fórmula. Puede escribirse directamente. El lector deberá escribir fácilmente el anión y en él equilibrar las cargas con los cationes. Ejemplos: - Trifluoruro de potasio – magnesio Directamente: KMgF3 - Nitrito doble de litio-calcio LiNO2 Ca(NO2)2 Li Ca(NO2)3 - Tiocarbonato de hierro (II)-cadmio Fe(CO2S) Cd(CO2S) FeCd(CO2S)2 134 Lectura. - Averiguar los números de oxidación. Determinar el nombre del anión. Aplicar las normas conocidas. Ejemplos. Disulfuro de disodio – calcio Sulfuro doble de sodio – calcio Sulfito doble de amonio – rubidio Sulfito de amonio – rubidio Heptaoxodisulfato (VI) doble de sodio - cesio Disulfato (VI) de sodio – cesio Na2CaS2 NH4RbSO3 NaCsS2O7 2.4.4.2. Sales formadas por un catión y dos aniones. Estas sustancias contienen en su estructura formular dos aniones diferentes y un metal o radical catiónico. Son llamados tradicionalmente. “SALES MIXTAS”. Muchas sustancias, cuyas estructuras han sido investigadas, son especies químicas reales. Sin embargo se consideran mezclas de dos sales neutras del mismo metal. Se originan de una neutralización parcial de un hidróxido con dos ácidos diferentes. Para tener especies químicas verdaderas, el hidróxido deberá tener más de un grupo OH. Por la naturaleza de los aniones, pueden tenerse las siguientes sales: - Cuando los aniones son derivados de oxoácidos. Cuando los aniones son derivados de los ácidos hidrácidos. Cuando los aniones son de los dos tipos anteriores. Nomenclatura a.- Nomenclatura IUPAC. Nomenclatura tradicional admitida. - Nombres de los aniones con los sufijos URO, ITO o ATO, separados por un guión - de - nombre del metal o radical catiónico. 135 El nombre del metal sin ninguna variación, con la notación Stock en los casos necesarios. El orden de los nombres de los aniones será el mismo del que tiene en la fórmula. A veces, por la estructura de la fórmula y para dar nombres más claros se emplearán prefijos de cantidad simples y multiplicativos. Ejemplos: BiClS Fe(NO2)SO4 Pb2CO3(PO4) 2 CoBr(ClO3) Al(Cn)(IO)2 Cloruro-sulfuro de bismuto Nitrito-sulfato de hierro (III) Carbonato-fosfato de plomo (IV) Bromuro.Clorato de cobalto(II) Cianuro-hipoyodito de aluminio Cianuro-bis(hipoyodito) de aluminio Nomenclatura sistemática - Nombres de los aniones de nombre del metal o radical catiónico El nombre del metal sin ninguna variación, con la notación Stock en los casos necesarios. Los nombres de los aniones se forman de la manera conocida. El orden de los nombres será el mismo del que tiene en la fórmula. Para nombres más claros, en algunos casos, se utilizarán prefijos de cantidad simples o multiplicativos. Ejemplos: AlCl2NO3 HgI(NO2) K6ClF(S2O7) Fe2(NO2)4SO4 Dicloruro-nitrato (V) de aluminio Dicloruro-trioxonitrato (V) de aluminio Ioduro-nitrato (III) de mercurio(II) Ioduro-dioxonitrato (III) de mercurio (II) Cloruro-fluoruro-disulfato (VI) de hexapotasio Cloruro-fluoruro-heptaoxodisulfato (VI) de hexapotasio Tetrakis (nitrato (III))-sulfato (VI)de dihierro Tetrakis (dioxonitrato (III))-tetraoxosulfato (VI) de dihierro Hemos presentado nombres sistemáticos simplificados al omitir la notación del oxígeno. 136 Formulación Se escribirá en primer lugar el símbolo del catión y los aniones en el siguiente orden: - aniones monoatómicos sencillos en orden su carga creciente. Si ambos aniones tienen igual carga e utilizará un orden alfabético. Aniones poliatómicos en orden creciente a su carga. Si ambos aniones tienen igual carga se empleará un orden alfabético. Este mismo orden formular se mantendrá para la denominación del compuesto. Para una mayor comprensión de la estructura de la fórmula será necesario individualizar a un anión mediante un paréntesis. Ejemplo: AuBrCl(ClO4) En algunas obras de química se formulan estas sales separadas las sales neutras mediante un punto. Será válida esta manera de escribir si se consideran “sumas” de las sales simples y cuando presentan estructuras complicadas a falta de datos definidos. Ejemplos: CaSo4.Ca(NO3)2 3CaSO4.Ca(NO3)2 Sulfato de calcio-nitrato de calcio. 3-sulfato de calcio-nitrato de calcio En una estequiometria equivalente, una manera sencilla de formular estas sales es la de escribir las sales simples, sumar y simplificar si da lugar la fórmula. Ejemplo: Selenio-fosfato de níquel (III) Ni2(SeO3)3 NiPO4 Ni3(SeO3)3(PO4) 137 La distribución de los átomos en la forma desarrollada será: MnBrCl AlClO(CO3) Escritura y lectura de una fórmula. Escritura - Un procedimiento es sumar las sales simples y simplificar si da lugar la fórmula. - El lector puede escribir directamente. - En algunos casos será necesario deducir al anión o aniones. Ejemplos: - Dicloruro-bis(sulfato9 de hexalitio Directamente Li6Cl2(SO4)2 - Yodito-sulfito de cobalto (III) Anión yodito: IO2Anión sulfito. SO32Co(IO2)3 Co2(SO3)3 Co3(IO2)3(SO3)3 - Co(IO2)(SO3) Tetrakis (bromato(III))-seleniato (IV) de trialuminio Anión bromato (III): BrO21Anión seleniato (IV). SeO32Fórmula de la sustancia propuesta: Al3(BrO2)4SeO3 138 - Sulfuro-silicato de cromo (III) Cr2S3 Cr2(SiO3)3 Cr4S3(SiO3)3 Fórmula de la sustancia propuesta: Cr4S3(SiO3)3 Lectura. - Determinar los números de oxidación. Establecr el nombre de cada anión. Aplicar las normas conocidas Ejemplos: - CdClI 2+ 1- 1Cd Cl I Nombre de la fórmula propuesta: Cloruro-yoduro de cadmio - CoBr2MnO4 - Ni(IO4)(TeO4) - Pb2(SO3(O2))(PO3S)2 3+ 2- 1Co Br2 MnO4 Nombre de la formula propuesta: Dibromuro-permanganato de cobalto (III) 3+ 1- 2Ni (IO4) (TeO4) Nombre de la sustancia propuesta: Peryodato-telurato de niquel (III) Yodato (VII)-telurato (VI) de níquel (III) Anión (SO3(O2))x (SO3(O2))2Peroxosulfato (VI) x 3Anión (PO3S) (PO3S) Tiofosfato (V) Nombre de la fórmula propuesta: Peroxosulfato (VI)-bis(tiofosfato(V)) de diplomo. “Para ser un buen químico necesitas… ser un buen observador y detallista; trabajar ordenadamente y con limpieza; anotar la mínima modificación que observes, cualquier pequeño detalle puede ser el principio de un gran descubrimiento.” (José María Casas Sabata) 139 PARTE III FUNDAMENTOS APLICACIONES Y RIESGOS DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS INTRODUCCIÓN Una mayor comprensión del comportamiento químico de los elementos y de los compuestos inorgánicos ha permitido desarrollar una gran variedad de técnicas de síntesis y ha posibilitado el descubrimiento de nuevas sustancias inorgánicas. La química inorgánica moderna se entrecruza con otros campos científicos como la bioquímica, la metalurgia, la mineralogía, la química orgánica, la química física y la física del estado sólido Los metales, los halógenos y el silicio han sido tradicionalmente objeto de estudio de los químicos inorgánicos. Desde la II Guerra Mundial, la química del boro ha tenido un rápido desarrollo por su similitud con el carbono y el silicio. Por ejemplo, el boro forma enlaces covalentes consigo mismo y con otros elementos determinados, de modo muy semejante a como lo hacen el carbono y el silicio. En la química de los metales, la síntesis de compuestos organometálicos y de coordinación, así como el estudio de sus propiedades químicas y físicas, han atraído el interés de los químicos en las tres últimas décadas. Los compuestos organometálicos son moléculas orgánicas que contienen al menos un átomo de un metal enlazado a un átomo de carbono. Un ejemplo conocido de esta clase de sustancias es el tetraetilplomo, que se añade como antidetonante a la gasolina en los motores de combustión interna. Otros compuestos organometálicos son los catalizadores utilizados en la fabricación de plásticos y en numerosas reacciones de síntesis orgánica. Las moléculas de los compuestos de coordinación se caracterizan por tener un átomo metálico central rodeado de átomos no metálicos o grupos de átomos, llamados ligandos, a los que aquél se encuentra unido. Ejemplos de esta clase de compuestos son la mayoría de los tintes y pigmentos, como la sal de Zeise. Otras ramas de la química inorgánica son la química del estado sólido, que se ocupa, entre otras materias, de la química de los semiconductores; la química de la cerámica; la química de alta temperatura y presión; la geoquímica y la química de los elementos transuránicos, de actínidos y de los lantánidos. A continuación describiremos los compuestos químicos inorgánicos más utilizados. 140 3.1. ÁCIDO SULFÚRICO El ácido sulfúrico, aceite de vitriolo, espíritu de vitriolo, licor de vitriolo o tetraoxosulfato (VI) de hidrógeno es un compuesto químico muy corrosivo cuya fórmula es H2SO4. Es el compuesto químico que más se produce en el mundo, por eso se utiliza como uno de los tantos medidores de la capacidad industrial de los países. Una gran parte se emplea en la obtención de fertilizantes. También se usa para la síntesis de otros ácidos y sulfatos y en la industria petroquímica. Generalmente se obtiene a partir de óxido de azufre (IV), por oxidación con óxidos de nitrógeno en disolución acuosa. Normalmente después se llevan a cabo procesos para conseguir una mayor concentración del ácido. Antiguamente se lo denominaba aceite o espíritu de vitriolo, porque se producía a partir de este mineral. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Acidez (pKa) Solubilidad en agua Líquido Aceitosa incolora (PURO) o aceitosa ambarino (NO PURO) 1800 kg/m3; 1.8 g/cm3 98,08 g/mol 283 K (10 °C) 610 K (337 °C) pKa1 = -6.62; pKa2 = 1.99 Miscible APLICACIONES La industria que más utiliza el ácido sulfúrico es la de los fertilizantes. Otras aplicaciones importantes se encuentran en la refinación del petróleo, producción de pigmentos, tratamiento del acero, extracción de metales no ferrosos, manufactura de explosivos, detergentes, plásticos y fibras. En muchos casos el ácido sulfúrico funge como una materia prima indirecta y pocas veces aparece en el producto final. En el caso de la industria de los fertilizantes, la mayor parte del ácido sulfúrico se utiliza en la producción del ácido fosfórico, que a su vez se utiliza para fabricar materiales fertilizantes como el superfosfato triple y los fosfatos de mono y diamonio. 141 Cantidades más pequeñas se utilizan para producir superfosfatos y sulfato de amonio. Alrededor del 60% de la producción total de ácido sulfúrico se utiliza en la manufactura de fertilizantes. Cantidades substanciales de ácido sulfúrico también se utilizan como medio de reacción en procesos químicos orgánicos y petroquímicos involucrando reacciones como nitraciones, condensaciones y deshidrataciones. En la industria petroquímica se utiliza para la refinación, alquilación y purificación de destilados de crudo. En la industria química inorgánica, el ácido sulfúrico se utiliza en la producción de pigmentos de óxido de titanio (IV), ácido clorhídrico y ácido fluorhídrico. En el procesado de metales el ácido sulfúrico se utiliza para el tratamiento del acero, cobre, uranio y vanadio y en la preparación de baños electrolíticos para la purificación y plateado de metales no ferrosos. Algunos procesos en la industria de la Madera y el papel requieren ácido sulfúrico, así como algunos procesos textiles, fibras químicas y tratamiento de pieles y cuero. En cuanto a los usos directos, probablemente el uso más importante es el sulfuro que se incorpora a través de la sulfonación orgánica, particularmente en la producción de detergentes. Un producto común que contiene ácido sulfúrico son las baterías, aunque la cantidad que contienen es muy pequeña. PRECAUCIONES La preparación de una disolución de ácido puede resultar peligrosa por el calor generado en el proceso. Es vital que el ácido concentrado sea añadido al agua (y no al revés) para aprovechar la alta capacidad calorífica del agua. En caso de añadir agua al ácido concentrado, pueden producirse salpicaduras de ácido. 3.2. ÁCIDO CLORHÍDRICO El ácido clorhídrico, ácido hidroclórico, espíritu de sal, ácido marino, ácido de sal o todavía ocasionalmente llamado, ácido muriático (por su extracción a partir de sal marina en América) o agua fuerte (en España), es una disolución acuosa del gas cloruro de hidrógeno (HCl). 142 Es muy corrosivo y ácido. Se emplea comúnmente como reactivo químico y se trata de un ácido fuerte que se disocia completamente en disolución acuosa. Una disolución concentrada de ácido clorhídrico tiene un pH inferior a 1; una disolución de HCl 0,1 M da un pH de 1 (Con 40 ml es suficiente para matar a un ser humano, en un litro de agua. Al disminuir el pH provoca la muerte de toda la flora y fauna). A temperatura ambiente, el cloruro de hidrógeno es un gas ligeramente amarillo, corrosivo, no inflamable, más pesado que el aire, de olor fuertemente irritante. Cuando se expone al aire, el cloruro de hidrógeno forma vapores corrosivos densos de color blanco. El cloruro de hidrógeno puede ser liberado por volcanes. El cloruro de hidrógeno tiene numerosos usos. Se usa, por ejemplo, para limpiar, tratar y galvanizar metales, curtir cueros, y en la refinación y manufactura de una amplia variedad de productos. El cloruro de hidrógeno puede formarse durante la quema de muchos plásticos. Cuando entra en contacto con el agua, forma ácido clorhídrico. Tanto el cloruro de hidrógeno como el ácido clorhídrico son corrosivos. PROPIEDADES Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Viscosidad Acidez (pKa) líquido incoloro o levemente amarillo 1190 (solución 37%); 1160 solución 32%; 1120 solución 25% kg/m3; 1,12 g/cm3 36,46 g/mol 247 K (-26 °C) 321 K (48 °C) 1,9 -6,2[1] RIESGOS Ingestión: Puede producir gastritis, quemaduras, gastritis hemorrágica, edema, necrosis. Se recomienda beber agua o leche y NO inducir el vómito. Inhalación: Puede producir irritación, edema y corrosión del tracto respiratorio, bronquitis crónica. Se recomienda llevar a la persona a un lugar con aire fresco, mantenerla caliente y quieta. Si se detiene la respiración practicar reanimación cardio pulmonar. Piel: Puede producir quemaduras, úlceras, irritación. Retirar de la zona afectada toda la vestimenta y calzados y lavar con agua abundante durante al menos 20 minutos. Ojos: Puede producir necrosis en la córnea, inflamación en el ojo, irritación ocular y nasal, úlcera nasal. Lavar el o los ojos expuestos con abundante agua durante al menos 15 minutos. 143 APLICACIONES El ácido clorhídrico se utiliza sobre todo como ácido barato fuerte y volátil. El uso más conocido es el de desincrustante para eliminar residuos de caliza (carbonato cálcico: CaCO3). En esta aplicación se transforma el carbonato cálcico en cloruro cálcico más soluble y se liberan dióxido de carbono (CO2) y agua: CaCO3 + 2 HCl → CaCl2 + CO2 + H2O En química orgánica se aprovecha el ácido clorhídrico a veces en la síntesis de cloruros orgánicos bien por sustitución de un grupo hidroxilo de un alcohol o por adición del ácido clorhídrico a un alqueno aunque a menudo estas reacciones no transcurren de una manera muy selectiva. Otra importante aplicación del ácido clorhídrico de alta calidad es en la regeneración de resinas de intercambio iónico. El intercambio catiónico suele utilizarse para eliminar cationes como Na+ y Ca2+ de disoluciones acuosas, produciendo agua desmineralizada. Na+ es reemplazada por H3O+ Ca2+ es reemplazado por 2 H3O+ En la industria alimentaria se utiliza por ejemplo en la producción de la gelatina disolviendo con ella la parte mineral de los huesos. En metalurgia a veces se utiliza para disolver la capa de óxido que recubre un metal, previo a procesos como galvanizado, extrusión, u otras técnicas. También es un producto de partida en la síntesis de policloruro de aluminio o de cloruro férrico (FeCl3): Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O EFECTOS NOCIVOS El cloruro de hidrógeno es irritante y corrosivo para cualquier tejido con el que tenga contacto. La exposición breve a bajos niveles produce irritación de la garganta. La exposición a niveles más altos puede producir respiración jadeante, estrechamiento de los bronquiolos, coloración azul de la piel, acumulación de líquido en los pulmones e incluso la muerte. La exposición a niveles aún más altos puede producir hinchazón y espasmos de la garganta y asfixia. Algunas personas pueden sufrir una reacción inflamatoria al cloruro de hidrógeno. Esta condición es conocida como síndrome de malfuncionamiento reactivo de las vías respiratorias, que es un tipo de asma causado por ciertas sustancias irritantes o corrosivas. La mezcla del ácido con agentes oxidantes de uso común, como la lejía, también llamada lavandina en algunas partes, (hipoclorito de sodio, NaClO) o permanganato de potasio (KMnO4), produce el tóxico gas cloro. 144 Dependiendo de la concentración, el cloruro de hidrógeno puede producir desde leve irritación hasta quemaduras graves de los ojos y la piel. La exposición prolongada a bajos niveles puede causar problemas respiratorios, irritación de los ojos y la piel y descoloramiento de los dientes. A pesar de estas características los jugos gástricos en el estómago humano contienen aproximadamente el 3 % de ácido clorhídrico. Allí ayuda a coagular las proteínas y desempeña un papel importante como coenzima de la pepsina en su digestión. También ayuda en la hidrólisis de los polisacáridos presentes en la comida. Es secretado por las células parietales. Éstas contienen una extensiva red de secreción desde donde se secreta el HCl hacia el lumen del estómago. Diversos mecanismos previenen el daño del epitelio del tracto digestivo por este ácido: Reguladores negativos de su salida. Una gruesa capa mucosa que cubre al epitelio. Bicarbonato de sodio secretado por las células epiteliales gástricas y el páncreas. La estructura del epitelio. Un abastecimiento sanguíneo adecuado. Prostaglandinas (con múltiples efectos: estimulan las secreciones mucosas y de bicarbonato, mantienen la integridad de la barrera epitelial, permiten el adecuado flujo sanguíneo, estimulan la reparación de las membranas de la mucosa dañadas). También puede ocurrir que no se produzca suficiente cantidad de ácido clorhídrico en el estómago. Estos cuadros patológicos son conocidos por los términos hipoclorhidria y aclorhidria. Pueden conducir a una gastroenteritis. El ácido clorhídrico en contacto con ciertos metales puede desprender hidrógeno pudiendo formar atmósferas explosivas en el ambiente, esto puede ocurrir por ejemplo cuando se usa en los trabajos de decapado de metales. 3.3. ÁCIDO FLUORHÍDRICO El ácido fluorhídrico es la solución acuosa de fluoruro de hidrógeno, compuesto químico formado por hidrógeno y flúor (HF)X. No debe ponerse en contacto con elementos de vidrio ya que puede corroerlo, por esto se manipula utilizando material de plástico. La forma más común en el que podemos encontrarlo en la naturaleza es HF o (HF)6. 145 PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Acidez (pKa) Solubilidad en agua Momento dipolar líquido incolora 1.140 kg/m3; 1.14 g/cm3 20,01 g/mol 190 K (-83,15 °C) 293 K (19,85 °C) 3,19 >70 g/100 ml agua (20 °C, 293 K) 1,98 D APLICACIONES El fluorhídrico se utiliza en química orgánica en la obtención de compuestos orgánicos fluorados, como catalizador en petroquímica, para obtener criolita (Na3AlF6) artificial que se emplea en la obtención del aluminio, fluoruros inorgánicos como el hexafluoruro de uranio (UF6) y a veces como disolvente. También es utilizado en la industria y preparación de vidrio o cristal en el tallado y grabado del mismo. En estudios petrográficos de rocas graníticas es utilizado en estado puro para atacar con sus vapores los silicatos que componen la roca, para luego de un suave lavado con agua destilada ser cubierto con cobalto-nitrito-de sodio el cual pintara selectivamente de un color amarillo intenso los feldespatos de potasio, que luego podrán ser distinguidos de los feldespatos plagioclasas en base a su color y de esta manera se podrá clasificar la roca ígnea. Toxicología Se trata de una sustancia irritante, corrosiva y tóxica. En la piel produce quemaduras muy dolorosas que curan muy mal. Esto se debe a que el calcio necesario en el proceso de curación precipita con los fluoruros como fluoruro cálcico (CaF2). En caso de haberse producido una quemadura con fluorhídrico se recomienda lavar con abundante agua y tratar como primera medida con un gel de gluconato de calcio (que debe estar disponible en todos los lugares donde haya o se maneje esta sustancia), en su defecto, utilizar una disolución de lactato cálcico o citrato cálcico o en su defecto con leche. En caso de aspiración de vapores, se trata de una emergencia médica. Se trata aplicando oxígeno por máscara (se desaconseja por irritantes otros materiales) si el afectado respira, controlando su nivel de conciencia. Llegado el caso, se debe aplicar resucitación de la persona afectada si fuera necesario. En caso de salpicaduras en los ojos, solamente tratar con solución fisiológica estéril en muy abundante cantidad; al igual que la respiración, se desaconseja por irritante sustancias basadas en compuestos cálcicos. En absolutamente todos los casos, se debe tratar en forma médica avanzada luego de prestar los primeros auxilios. 146 3.4. ÁCIDO BROMHÍDRICO El ácido bromhídrico o bromuro de hidrógeno, en disolución acuosa es un ácido fuerte, reacciona violentamente con bases y es corrosivo: altamente irritante para los ojos y para la piel. Es la solución acuosa del gas bromuro de hidrógeno. Tiene un Ka igual a -9, lo que lo hace un ácido más fuerte que el ácido clorhídrico y menos fuerte que el yoduro de hidrógeno. Es uno de los ácidos minerales más fuertes conocidos, reacciona violentamente con oxidantes fuertes como nitratos o cloratos y muchos compuestos orgánicos, originando peligro de incendio y explosión. Ataca a muchos metales formando gas inflamable de hidrógeno. En temperatura ambiente, este tiene forma de gas; es volátil, fumante al aire y más denso que este, es no inflamable y tiene un olor picante muy parecido al del ácido clorhídrico. Su densidad es 2,8 g/cm³ respecto al aire, y por presión y enfriamiento se liquida a -73º C formando un líquido incoloro, que puede solidificarse a -120º C en una masa cristalina. El peso de un litro de bromhídrico a la presión normal y a 0º C de temperatura es de 3,6167 gramos. Al igual que el ácido clorhídrico, el ácido bromhídrico es muy soluble en el agua; reaccionando de forma violenta y liberando gas inflamable así como gases tóxicos; además, da un líquido de propiedades ácidas enérgicas que contiene los iones Br- y H+; un volumen de agua a 10º C disuelve unos 600 volúmenes de bromhídrico, y la disolución saturada a 0 °C tiene un peso específico de 1,78 y contiene 82% de HBr. PROPIEDADES Estado de agregación Apariencia Masa molar Punto de fusión Punto de ebullición Acidez (pKa) Solubilidad en agua líquido líquido acuoso transparente y amarillento. 80,91 g/mol 186 K (-87 °C) 206 K (-67 °C) -9,0 100 g/ 100 ml RIESGOS Inhalación: Produce corrosión, sensación de quemazón, tos, dolor de garganta. Edema pulmonar. Piel: Produce enrojecimiento, quemaduras cutáneas, dolor, corrosión, congelación grave. Ojos: Produce corrosión, enrojecimiento, dolor, quemaduras profundas y graves. 147 APLICACIONES El ácido bromhídrico se utiliza para elaborar productos químicos y farmacéuticos, principalmente para la producción de bromuros inorgánicos, especialmente el bromuro de zinc, calcio y sodio, también se lo emplea como solvente y en medicación veterinaria. Es un reactivo útil para la regeneración de compuestos organobromados. Ciertos éteres se rompen con ácido bromhídrico. También funciona como catalizador de reacciones de alquilación y de la extracción de ciertos minerales. A partir de ácido bromhídrico se crean importantes compuestos orgánicos útiles para la industria, como lo son: bromuro de alilo, fenol y ácido bromoacético. 3.5. ÁCIDO NÍTRICO El compuesto químico ácido nítrico es un líquido corrosivo, tóxico, que puede ocasionar graves quemaduras. Es utilizado comúnmente como un reactivo de laboratorio, se utiliza para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT), así como fertilizantes como el nitrato de amonio. Tiene usos adicionales en metalurgia y en refinado, ya que reacciona con la mayoría de los metales y en la síntesis química. Cuando se mezcla con el ácido clorhídrico forma el agua regia, un raro reactivo capaz de disolver el oro y el platino. El ácido nítrico también es un componente de la lluvia ácida. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Líquido Límpido - transparente (si es puro) o amarillento (si posee residuos de la síntesis industrial) 1500 kg/m3; 1,5 g/cm3 63.012 g/mol 231 K (-42 °C) 356 K (83 °C) Miscible en cualquier proporción RIESGOS Ingestión: Corrosivo. Dolor abdominal, sensación de quemazón, shock. Inhalación: Sensación de quemazón, tos, dificultad respiratoria, pérdida del conocimiento. Piel: Puede causar graves quemaduras. Ojos: Quemaduras graves e irritación ocular. 148 APLICACIONES 1· Como agente nitrante en la fabricación de explosivos. 2· En la fabricación de abonos. 3· El ácido nítrico es empleado, en algunos casos, en el proceso de pasivación. 4· El ácido nítrico es utilizado en grabado artístico (aguafuerte), también se usa para comprobar el oro y el platino. 3.6. ÁCIDO HIPOCLOROSO El ácido hipocloroso es la denominación que se le otorga al ácido que resulta de la unión del óxido ácido de cloro con H2O. Recibe tal nombre debido a que el cloro actúa con el estado de oxidación +1, que es el menor de los cuatro que posee: +1, +3, +5 y +7. Su fórmula química es la siguiente: HClO. PROPIEDADES Masa molar 52.46 g/mol Acidez (pKa) 7.49 Solubilidad en agua Soluble APLICACIONES Usos clínicos Múltiples laboratorios a nivel mundial también trabajan por obtener soluciones estables de HClO con fines terapéuticos, dirigidas al tratamiento de diversas patologias de piel, con el fin de ratificar al HClO como el antiséptico del futuro. El HClO es recomendado en patologias como: Ulceras de miembros inferiores de cualquier origen (úlceras varicosas, isquémicas, ulceras de pie diabético etc) Quemaduras de 2 y 3 grado Control de infecciones cutáneas. Cuidado de heridas Limpias, contaminada y con tejido Necrótico. Lavado y cuidado de exposiciones óseas Celulitis, Abscesos, Hongos tópicos. 149 Otros usos Debido a que el cloro es el desinfectante universal y a que el HClO es el componente activo del cloro. El HClO a concentraciones elevadas trabaja muy bien como desinfectante de superficies y como sustancia dirigida a la inactivación de desechos hospitalarios. Induciendo desinfección de alto nivel. 3.7. CLORURO DE ZINC El cloruro de Zinc es un compuesto químico cuya fórmula es ZnCl2. Se conocen nueve formas cristalinas diferentes de cloruro de zinc, incoloras o blancas, muy solubles en agua. El ZnCl2 es higroscópico e incluso delicuescente. Por tanto, las muestras deben protegerse de las fuentes de humedad, incluido el vapor de agua presente en el medio ambiente. El cloruro de zinc tiene muchas aplicaciones en los procesos textiles, fabricación de decapantes y de catalizadores para síntesis orgánica. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Estructura cristalina Solubilidad en agua Sólido Gránulos cristalinos blancos. 2907 kg/m3; 2,907 g/cm3 136,3 g/mol 556 K (283 °C) 1029 K (756 °C) Cuatro formas conocidas En estado anhidro, la única forma estable es la Hexagonal de empaquetamiento cerrado (δ) 432 g/100 mL (25 °C) APLICACIONES Decapante en metalurgia El cloruro de zinc tiene la capacidad de atacar a los óxidos metálicos dando derivados de fórmula MZnOCl2. Esta reacción es importante por el uso del ZnCl2 como decapante en soldadura metálica - disuelve las capas de óxido exponiendo la superficie de metal limpia. Estos decapantes se preparan disolviendo una hoja metálica de zinc en ácido clorhídrico hasta que el líquido deja de desprender hidrógeno. Debido a su naturaleza corrosiva, este decapante no es adecuado para situaciones en las que no puedan limpiarse los residuos, tales como en trabajos de electrónica. Esta propiedad también permite su uso en la fabricación de cementos de óxido de magnesio para empaste dental y como ingrediente activo en ciertos enjuagues bucales. 150 En síntesis orgánicas En el laboratorio, es ampliamente usado el cloruro de zinc, principalmente como ácido de Lewis de fuerza moderada. Puede catalizar reacciones en las que intervienen anillos aromáticos activados, como: Síntesis de índoles de Fischer, y también Acilación de Friedel-Crafts. En procesado textil Las disoluciones acuosas concentradas (más del 64% masa/masa de cloruro de zinc en agua) tienen la interesante propiedad de disolver el almidón, la seda, y la celulosa. Por tanto, tales disoluciones no se pueden filtrar a través de papel de filtro ordinario. El ZnCl2 se usa como agente resistente al fuego y en ambientadores o absorbeolores textiles tales como Febreze. Consideraciones de seguridad Las sales de zinc son relativamente no tóxicas. Las precauciones aplicables al cloruro de zinc anhidro ZnCl2 son las mismas aplicables a otros haluros de metal anhidro, esto es, la hidrólisis puede ser exotérmica y debería evitarse el contacto. Las disoluciones concentradas son ácidas y corrosivas, atacando especificamente a la celulosa y la seda. 3.8. CLORURO DE HIERRO El cloruro de hierro (III) o tricloruro de hierro (tradicionalmente llamado cloruro férrico) es un compuesto químico utilizado a escala industrial perteneciente al grupo de los haluros metálicos, cuya fórmula es FeCl3. También se le denomina equivocadamente percloruro de hierro e incluso percloruro férrico. El color de los cristales de cloruro de hierro (III) dependen del ángulo de visión: cuando reflejan la luz los cristales tienen un color verde oscuro, pero cuando transmiten la luz su color es rojo purpúreo. Por otra parte, el hexahidrato (FeCl3·6 H2O) es de color amarillo o amarillo anaranjado. El cloruro de hierro (III) anhidro es delicuescente y forma una neblina de cloruro de hidrógeno en presencia de aire húmedo. Se observa muy raramente en su forma natural, el mineral molisita, que puede hallarse en algunas fumarolas. El cloruro férrico en solución al 40%, coagulante para tratamiento de aguas y efluentes, se comercializa habitualmente a granel. 151 PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Sólido verde oscuro (cristal) 2800 kg/m3; 2,8 g/cm3 162,20 g/mol 533 K (260 °C) 588 K (315 °C) 92 g/100 ml (20 °C) RIESGOS Ingestión: náuseas, vómitos. Piel: Irritaciones, quemaduras. Ojos: Irritaciones, quemaduras. APLICACIONES Industriales Se utiliza como coagulante para: Tratamiento de aguas residuales(efluentes cloacales y efluentes industriales) Potabilización de agua (tratamiento de agua de río para obtener agua de consumo) FeCl3 en medio acuoso ligeramente básico reacciona con el ión hidróxido para formar flóculos de FeO(OH)-, que puede eliminar los materiales en suspensión. Fe3+ + 4 OH− → Fe(OH)4− → FeO(OH)2−·H2O Otro uso importante del FeCl3 es para grabar o decapar el cobre en una reacción redox que oxida el cobre a cloruro de cobre (I) y luego a cloruro de cobre (II) en la producción de circuito impreso. FeCl3 + Cu → FeCl2 + CuCl FeCl3 + CuCl → FeCl2 + CuCl2 El cloruro de hierro (III) se usa como catalizador de la reacción de adición de etileno con cloro, formando (1,2-dicloroetano), una materia prima importante para producir industrialmente cloruro de vinilo, el monómero para fabricar PVC. H2C=CH2 + Cl2 → ClCH2CH2Cl 152 De laboratorio El cloruro de hierro (III) se usa en el laboratorio como ácido de Lewis para reacciones de catálisis tales como cloración y reacción de Friedel-Crafts de compuestos aromáticos. Es menos potente que cloruro de aluminio, pero esta menor fortaleza conduce a veces a rendimientos más altos, como en la alquilación de benceno: La prueba del cloruro férrico es una prueba colorimétrica tradicional para fenoles, que usa una disolución al 1% de cloruro de hierro (III) que ha sido neutralizada con hidróxido de sodio hasta que se forme una pequeña precipitación de FeO(OH).6 La mezcla se filtra antes de ser usada. La sustancia orgánica se disuelve en agua, metanol o etanol, luego se añade la disolución neutra de cloruro: una coloración transitoria o permanente (normalmente púrpura, verde o azul) indica la presencia de un fenol o enol. Uso en Electrónica Una de sus más importantes aplicaciones es en electrónica para producir placas de circuito impreso en bajas cantidades. El cloruro férrico reacciona con el cobre dando cloruro ferroso y cloruro cúprico. Otros usos El cloruro de hierro (III) anhidro se usa a veces como reactivo deshidratante en ciertas reacciones. Lo usan los fabricantes de cuchillos y espadas artesanales para teñir las hojas y para dar un efecto de contraste al metal y para ver las imperfecciones del mismo. También se usa para el fotograbado de láminas de cobre para imprimir imágenes fotográficas al aguafuerte o por intaglio y para grabar los cilindros de fotograbado usados en la industria de artes gráficas. PRECAUCIONES El cloruro de hierro (III) es corrosivo para los metales ferrosos y algunos metales no ferrosos como el cobre y sus aleaciones. Evite el contacto con metales. El material anhidro es un poderoso agente deshidratante pudiendo provocar quemaduras en la piel, en solución mancha la piel y puede provocar irritación. Use guantes. Provoca quemaduras por contacto con los ojos. Use antiparras. Las sales de hierro son moderadamente tóxicas por inhalación. Cuando trabaja con sales de hierro en polvo use la campana del laboratorio o use mascara con filtro para polvos. 153 3.9. CLORURO DE SODIO El cloruro de sodio, sal de mesa, o en su forma mineral halita, es un compuesto químico con la fórmula NaCl. El cloruro de sodio es una de las sales responsable de la salinidad del océano y del fluido extracelular de muchos organismos. También es el mayor componente de la sal comestible, es comúnmente usada como condimento y conservante de comida. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Estructura cristalina Solubilidad en agua KPS Sólido Incoloro; aunque parece blanco si son cristales finos o pulverizados. 2165 kg/m3; 2,165 g/cm3 58,4 g/mol 1074 K (801 °C) 1738 K (1465 °C) f.c.c. 35,9 g por 100 mL de agua 37,79 mol2 RIESGOS Ingestión: Peligroso en grandes cantidades; su uso a largo plazo en cantidades normales puede traer problemas en los riñones. Inhalación: Puede producir irritación en altas cantidades. Piel: Puede producir resequedad. Ojos: Puede producir irritación y molestia. APLICACIONES El sodio es un nutriente esencial que las plantas necesitan en muy bajas dosis. Sin embargo, con dosis un poco altas la sal es tóxica. Ciertos grupos de plantas como las plantas C4 o la CAM necesitan dosis mayores de este elemento y otras llamadas halófitas son más tolerantes al exceso de sal. 154 3.10. CLORURO DE HIDRÓGENO El cloruro de hidrógeno es un compuesto químico de fórmula HCl, formado por un átomo de cloro unido a uno de hidrógeno. A condiciones normales de presión y temperatura (CNPT) es un gas más denso que el aire. Es un compuesto tóxico, corrosivo, de olor picante y sofocante. En su forma anhidra, no ataca metales ni aleaciones. Pero en presencia de humedad produce vapores de ácidos que atacan a la mayoría de los metales exceptuando la plata, el oro, el platino y el tantalio. PROPIEDADES Estado de agregación Densidad Masa molar Punto de fusión Punto de ebullición Acidez (pKa) Gas 118 kg/m3; 0.118 g/cm3 36,46 g/mol 158.25 K (-114,9 °C) 188.09 K (-85.06 °C) -4 RIESGOS Ingestión: Puede producir gastritis, quemaduras, gastritis hemorrágica, edema, necrosis. Se recomienda beber agua o leche y NO inducir el vómito. Inhalación: Puede producir irritación, edema y corrosión del tracto respiratorio, bronquitis crónica. Se recomienda llevar a la persona a un lugar con aire fresco, mantenerla caliente y quieta. Si para la respiración practicar reanimación cardiopulmonar. Piel: Puede producir quemaduras, úlceras, irritación. Remover de la zona afectada toda la vestimenta y calzados y hacer correr agua por al menos 20 minutos. Ojos: Puede producir necrosis en la córnea, inflamación en el ojo, irritación ocular y nasal, úlcera nasal. Lavar el o los ojos expuestos con abundante agua por al menos 15 minutos. PRECAUCIONES Es altamente peligroso el contacto con la piel, los ojos y otras mucosas, y no se debe inhalar ni ingerirse disuelto en agua. Por lo tanto, a la hora de emplear este gas reactivo, es necesario usar guantes, lentes y mascarillas. En caso de ingestión, asistir a su médico lo más pronto posible. 155 3.11. ÓXIDO DE HIERRO Los óxidos de hierro son compuestos químicos formados por hierro y oxígeno. Se conocen 16 óxidos de hierro. Estos compuestos son óxidos (hematita, magnetita, maghemita, β-Fe2O3, ε-Fe2O3, Wüstite), o hidróxidos y oxihidróxidos (goetita, lepidocrocita, akaganeíta, feroxihita, δFeOOH, FeO(OH) de alta presión, ferrihidrita, bernalita, Fe(OH)2). Algunos de estos óxidos son utilizados en cerámica, particularmente en vidriados. Los óxidos de hierro, como los óxidos de otros metales, proveen el color de algunos vidrios después de ser calentados a altas temperaturas. También son usados como pigmento. Óxidos de hierro Óxido de hierro (II) u óxido ferroso (FeO). El polvo de óxido ferroso puede causar explosiones ya que literalmente entra en combustión. Óxido de hierro (III) u óxido férrico (Fe2O3). En su estado natural es conocido como hematita. También es purificado para su uso como soporte de almacenamiento magnético en audio e informática. Esta es la forma de óxido comúnmente vista en hierros y estructuras de acero oxidadas que ataca desde puentes hasta carrocerías de automóviles y la cual es tremendamente destructiva. Óxido de hierro (II, III) u óxido ferroso férrico (Fe3O4). En su estado natural es conocido como magnetita, un mineral de color negruzco que constituye una de las fuentes principales de obtención de hierro. Esta forma de óxido tiende a ocurrir cuando el hierro se oxida bajo el agua y por eso es frecuente encontrarlo dentro de tanques o bajo la línea de flotación de los barcos. La variedad de colores de óxido de hierro III (azul, verde y violeta) que simula el atardecer, se debe principalmente a la habilidad del hierro de cambiar sus electrones en el penúltimo nivel de energía con modificación en el spin. De esto se intuye, que el camuflaje de las iguanas se debe a la inclusión de este elemento sobre su piel. El óxido de hierro (II) (también conocido como óxido ferroso) es uno de los óxidos de hierro, cuya fórmula es FeO. El óxido ferroso es un polvo de color negro. En este compuesto, la valencia del hierro es +2. Su forma mineral es la wustita. APLICACIONES El óxido ferroso se usa como pigmento. La Administración de Drogas y Alimentos lo ha aprobado para su uso en productos cosméticos y, además, se utiliza en algunas tintas de tatuajes. 156 PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Sólido cristales negros 5745 kg/m3; 5,745 g/cm3 71.844 g/mol 1650 K (1377 °C) 3687 K (3414 °C) Insoluble 3.12. ÓXIDO DE NITRÓGENO El óxido de nitrógeno (II), óxido nítrico o monóxido de nitrógeno (NO) es un gas incoloro y poco soluble en agua presente en pequeñas cantidades en los mamíferos. Está también extendido por el aire siendo producido en automóviles y plantas de energía. Se lo considera un agente tóxico. No debe confundirse con el óxido nitroso (N2O), con el dióxido de nitrógeno (NO2) o con cualquiera del resto de los óxidos de nitrógeno existentes. Es una molécula altamente inestable en el aire ya que se oxida rápidamente en presencia de oxígeno convirtiéndose en dióxido de nitrógeno. Por esta razón se la considera también como un radical libre. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Temperatura crítica Solubilidad en agua Momento dipolar Gas Gas incoloro 1.03 kg/m3; 0,00103 g/cm3 30,01 g/mol 109,5 K (-163,65 °C) 121 K (-152,15 °C) 180 K ( °C) 0,0056 g 0,15 D RIESGOS Ingestión: Usado en medicina, pero las sobredosis son perjudiciales. Inhalación: Peligroso, puede ser fatal. Piel: Irritante. Ojos: Puede causar irritación. 157 Efectos medioambientales Este gas en el aire puede convertirse, más tarde, en ácido nítrico produciendo así lluvia ácida. Además el NO y el NO2 participan en la depleción de la capa de ozono. Su efecto para con la radiación solar es doble. Mientras se encuentra en la baja atmósfera contribuyen al calentamiento global, en cambio, en la alta lo hacen al oscurecimiento global. APLICACIONES El monóxido de nitrógeno es el producto primario de la combustión catalítica del amoníaco mediante el método de Ostwald y, por lo tanto, un intermediario importante en la producción del ácido nítrico (HNO3). En el laboratorio se genera más convenientemente por reacción de ácido nítrico diluido con cobre, si los otros productos posibles de la reacción como el dióxido de nitrógeno no molestan o pueden ser eliminados (por ejemplo, por absorción en agua). Se usa para detectar radicales en la superficie de polímeros. 3.13. ÓXIDO DE CALCIO El óxido de calcio, cal o cal viva, es un compuesto químico de fórmula CaO. Esta palabra interviene en el nombre de otras sustancias, como por ejemplo la «cal apagada» o «cal muerta», que es hidróxido de calcio, Ca(OH)2. Antiguamente se usaba «cal» en vez de «calcio», en algunos nombres de compuestos donde interviene este elemento, como el "talco" o "aljez" (sulfato de calcio dihidratado, CaSO4•2H2O) o el mármol o "gis" (carbonato de calcio, CaCO3). Los depósitos sedimentarios de carbonato de calcio se llaman caliches. Este material utilizado para hacer mortero de cal se obtiene de las rocas calizas calcinadas a una temperatura entre 900 y 1200 °C, durante días, en un horno rotatorio o en un horno tradicional, romano o árabe. En estas condiciones el carbonato es inestable y pierde una molécula de óxido de carbono (IV). 158 El óxido de calcio reacciona violentamente con el agua, haciendo que ésta alcance los 90 °C. Se forma entonces hidróxido de calcio, también llamado cal apagada, o Ca(OH)2. El hidróxido de calcio reacciona otra vez con el óxido de carbono (IV) del aire para formar de nuevo carbonato de calcio (cal). En esta reacción la masa se endurece. Por esto el óxido de calcio forma parte de formulaciones de morteros, especialmente a la hora de enlucir paredes de color blanco. La cal se ha usado, desde la más remota antigüedad, de conglomerante en la construcción; también para pintar (encalar) muros y fachadas de los edificios construidos con adobes o tapial, habitual en las antiguas viviendas mediterráneas, en la fabricación de fuego griego. En algunos países de Latinoamérica, la cal se utiliza para el proceso de nixtamal, proceso utilizado para hacer sémola de maíz y masa para tortillas. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Sólido Blanco 3300 kg/m3; 3,3 g/cm3 56,1 g/mol 3200 K (2927 °C) 3773 K (3500 °C) Reacciona RIESGOS Ingestión: Peligroso, causa irritación, en grandes dosis puede ser fatal. Inhalación: Peligroso; causa irritación, bronquitis química o la muerte en casos de exposición a largo plazo. Piel: Irritación y posibles quemaduras. Ojos: Puede causar daños permanentes. Aspectos relacionados con la salud A causa de la fuerte reacción de la cal al entrar en contacto con el agua, la cal produce irritaciones severas si es inhalada o si entra en contacto con piel húmeda o los ojos. Su inhalación puede causar tos, estornudos, y respiración anormal. En el siguiente estado puede producir la perforación del tabique nasal, dolores abdominales, náusea y vómitos. Si bien la cal no está considerada un riesgo de incendio, su reacción con el agua puede liberar una cantidad de energía como la requerida para encender materiales combustibles. 159 3.14. ÓXIDO DE NITRÓGENO El óxido de nitrógeno (I), óxido de dinitrógeno, protóxido de nitrógeno, anhídrido nitroso, óxido nitroso, gas hilarante, o también gas de la risa (N2O) es un gas incoloro con un olor dulce y ligeramente tóxico. Provoca alucinaciones, un estado eufórico y en algunos casos puede provocar pérdida de parte de la memoria humana. No es inflamable ni explosivo, pero soporta la combustión tan activamente como el oxígeno cuando está presente en concentraciones apropiadas con anestésicos o material inflamable. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Temperatura crítica Solubilidad en agua Gas Gas incoloro 1.2228 kg/m3; 0,0012228 g/cm3 44,01 g/mol 182,29 K (-90,86 °C) 184,67 K (-88,48 °C) 309,6 K ( °C) 0,112 g en 100 g de agua RIESGOS Inhalación: Puede causar asfixia. Piel: Peligroso comprimido o criogénico. Ojos: Peligroso comprimido o criogénico. APLICACIONES Usos en automovilismo Hoy en día este gas es utilizado en automóviles convencionales modificados. La cadena molecular del gas se rompe durante la combustión en la cámara, a unos 275 °C de temperatura, produciendo un aumento del oxígeno disponible para la combustión con el consecuente aumento de potencia. Así mismo el nitrógeno liberado presente en la cámara actúa como un amortiguador térmico tras el aumento de energía liberada. Las características en la entrega de potencia de los equipos de óxido nitroso limitan su uso en vehículos de serie a aumentos de potencia que normalmente no superan los 100 caballos y que más bien rondan entre los 50 y 75 caballos. Para el uso de mayores potencias se han diseñado sistemas progresivos de inyección del gas en cuestión, permitiendo así una rampa de aumento de potencia y evitar así las sobrecargas por shock en el conjunto motriz y la transmisión. 160 Además para altas potencias es necesaria la modificación de diversos componentes del motor. El uso de equipos de óxido nitroso en vehículos de serie, requiere una variación en la puesta a punto del avance de encendido, siendo necesario un atraso del mismo. También se recomienda el uso de bujías con un grado térmico mayor ("bujías frías"), lo cual asegura una mejor extracción del exceso de calor en la cámara para así evitar la detonación. (Detonación en Motores). Es necesario recordar que debido al aumento de comburente en la cámara durante la inyección del gas, se necesita un aumento también del combustible inyectado hacia la cámara, para así mantener una relación aire/combustible adecuada (Relación Aire Combustible). Farmacocinética El óxido nitroso es muy insoluble en sangre y otros tejidos, proveyendo de una inducción rápida de la anestesia y a la vez, rápida recuperación después de suspender el suministro. Es casi completamente eliminado por los pulmones, con una mínima difusión a través de la piel. No se biotransforma. Este gas quizás sea desintegrado por la interacción con la vitamina B12, presente en las bacterias intestinales. Esto resulta en una disminución en la síntesis de metionina, originando signos de deficiencia de vitamina B12 (anemia megaloblástica, neuropatía periférica) al utilizar óxido nitroso a largo plazo. Por esa razón no se utiliza como analgésico a largo plazo o como sedante en situaciones de cuidado intensivo. Calentamiento global El óxido nitroso es un poderoso gas de efecto invernadero, por lo que las emisiones de este gas se las responsabiliza parcialmente junto con el dióxido de carbono, el metano y algunos aerosoles, como los de provocar el calentamiento global. 3.15. MONÓXIDO DE CARBONO El monóxido de carbono también denominado óxido de carbono (II), gas carbonoso y anhídrido carbonoso (los dos últimos cada vez más en desuso) cuya fórmula química es CO, es un gas inodoro, incoloro, inflamable y altamente tóxico. Puede causar la muerte cuando se respira en niveles elevados. Se produce por la combustion incompleta de sustancias como gas, gasolina, keroseno, carbón, petróleo, tabaco o madera. Las chimeneas, las calderas, los calentadores de agua o calefones y los aparatos domésticos que queman combustible, como las estufas u hornallas de la cocina o los calentadores a kerosina, también pueden producirlo si no están funcionando bien. Los vehículos detenidos con el motor encendido también lo despiden. También se puede encontrar en las atmósferas de las estrellas de carbono. 161 PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Gas Incolora 1.145 kg/m3; 0,001145 g/cm3 28,0 g/mol 68 K (-205,15 °C) 81 K (-192,15 °C) 0,0026 g en 100 g de agua RIESGOS Ingestión: Puede causar vómito y diarrea. Inhalación: Muy peligroso, puede ser fatal. Piel: Inhalación puede causar lesiones cutáneas. Evitar contacto con líquido criogénico. Ojos: Inhalación puede causar problemas a largo plazo en la visión. Intoxicación Si se respira, aunque sea en moderadas cantidades, el monóxido de carbono puede causar la muerte por envenenamiento en pocos minutos porque sustituye al oxígeno en la hemoglobina de la sangre. Una vez respirada una cantidad bastante grande de monóxido de carbono (teniendo un 75% de la hemoglobina con monóxido de carbono) la única forma de sobrevivir es respirando oxígeno puro. Cada año un gran número de personas pierde la vida accidentalmente debido al envenenamiento con este gas. Las mujeres embarazadas y sus bebés, los niños pequeños, las personas mayores y las que sufren de anemia, problemas del corazón o respiratorios pueden ser mucho más sensibles al monóxido de carbono. 3.16. DIÓXIDO DE CARBONO El dióxido de carbono, también denominado óxido de carbono (IV), gas carbónico y anhídrido carbónico (los dos últimos cada vez más en desuso), es un gas cuyas moléculas están compuestas por dos átomos de oxígeno y uno de carbono. Su fórmula química es CO2. Su representación por estructura de Lewis es: O=C=O. Es una molécula lineal y no polar, a pesar de tener enlaces polares. Esto se debe a que, dada la hibridación del carbono, la molécula posee una geometría lineal y simétrica. 162 PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Estructura cristalina Viscosidad Acidez (pKa) Solubilidad en agua Gas Gas incoloro 1.6 kg/m3; 0,0016 g/cm3 44,0 g/mol 195 K (–78 °C) 216 K (–57 °C) Parecida al cuarzo 0,07 cP a −78 °C 6,35 y 10,33 1,45 kg/m³ RIESGOS Ingestión: Puede causar irritación, náuseas, vómitos y hemorragias en el tracto digestivo. Inhalación: Produce asfixia, causa hiperventilación. La exposición a largo plazo es peligrosa. Piel: En estado líquido puede producir congelación. Ojos: En estado líquido puede producir congelación. APLICACIONES Se utiliza como agente extintor eliminando el oxígeno para el fuego. En la industria alimentaria, se utiliza en bebidas carbonatadas para darles efervescencia. También se puede utilizar como ácido inocuo o poco contaminante. La acidez puede ayudar a cuajar lácteos de una forma más rápida y por tanto barata, sin añadir ningún sabor, y en la industria se puede utilizar para neutralizar residuos alcalinos sin añadir otro ácido más contaminante como el sulfúrico. En agricultura, se puede utilizar como abonado. Aunque las plantas no pueden absorberlo por las raíces, se puede añadir para bajar el pH, evitar los depósitos de cal y hacer más disponibles algunos nutrientes del suelo. También en refrigeración se utiliza como una clase de líquido refrigerante en máquinas frigoríficas o congelado como hielo seco. Este mismo compuesto se usa para crear niebla artificial y apariencia de hervor en agua en efectos especiales en el cine y los espectáculos. Otro uso que está incrementándose es como agente extractante cuando se encuentra en condiciones supercríticas, dada su escasa o nula presencia de residuos en los extractos. 163 Este uso actualmente se reduce a la obtención de alcaloides como la cafeína y determinados pigmentos, pero una pequeña revisión por revistas científicas puede dar una visión del enorme potencial que este agente de extracción presenta, ya que permite realizar extracciones en medios anóxidos, lo que permite obtener productos de alto potencial antioxidante. Es utilizado también como material activo para generar luz coherente (Láser de CO2). Junto con el agua, es el disolvente más empleado en procesos con fluidos supercríticos 3.17. PERÓXIDO DE HIDRÓGENO El peróxido de hidrógeno (H2O2), también conocido como agua oxigenada o dioxidano, es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, que por lo general se presenta como un líquido ligeramente más viscoso que éste. Es conocido por ser un poderoso oxidante. A temperatura ambiente es un líquido incoloro con sabor amargo. Pequeñas cantidades de peróxido de hidrógeno gaseoso se encuentran naturalmente en el aire. El peróxido de hidrógeno es inestable y se descompone lentamente en oxígeno y agua con liberación de calor. Su velocidad de descomposición puede aumentar mucho en presencia de catalizadores. Aunque no es inflamable, es un agente oxidante potente que puede causar combustión espontánea cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce. El peróxido de hidrógeno se encuentra en bajas concentraciones (3 a 9%) en muchos productos domésticos para usos medicinales y como blanqueador de vestimentas y el cabello. En la industria, el peróxido de hidrógeno se usa en concentraciones más altas para blanquear telas y pasta de papel, y al 90% como componente de combustibles para cohetes y para fabricar espuma de caucho y sustancias químicas orgánicas. En otras áreas, como en la investigación, se utiliza para medir la actividad de algunas enzimas, como la catalasa. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Viscosidad Acidez (pKa) Solubilidad en agua Líquido Incolora 1400 kg/m3; 1,4 g/cm3 34,0147 g/mol 272.6 K (–0.4 °C) 423.35 K (150.2 °C) 1,245 cP a 20 °C 11,65 Miscible 164 RIESGOS Ingestión: Serios daños, posiblemente fatal. Inhalación: Irritación severa, posiblemente fatal. Piel: Agente aclarante y desinfectante. Causa ardor casi inmediatamente Ojos: Peligroso. APLICACIONES Industriales El peróxido de hidrógeno tiene muchos usos industriales, como el blanqueo de la pulpa de papel, blanqueo de algodón, blanqueo de telas y en general cada día se usa más como sustituto del cloro. En la industria alimenticia se usa mucho para blanquear quesos, pollos, carnes, huesos, y también se usa en el proceso para la elaboración de aceites vegetales. En la industria química se usa como reactivo, y es muy importante en la elaboración de fármacos. Se está usando también para blanqueos dentales. Aeroespaciales El peróxido de hidrógeno se usa en la industria aeroespacial como combustible de cohetes en motores de cohete monopropelentes o como aportación de oxígeno en motores bipropelentes. Este peróxido se usa por lo general a una concentración del 90%, y es extremadamente puro. También se usa en concentraciones al 80% como impulsor de las turbo bombas que alimentan tanto el combustible como el oxidante en grandes motores de cohete. Restauración de objetos de arte El peróxido de hidrógeno se emplea en trabajos de restauración. En muchas pinturas antiguas, los pigmentos blancos a base de carbonato de plomo (II) se han decolorado debido a la formación del sulfuro de plomo (II), que posee un particular color negro. El peróxido de hidrógeno, reacciona de manera que logra convertir el sulfuro de plomo (II) a sulfato de plomo (II) (color blanco). Ambas sales son insolubles en agua. Uso terapéutico El peróxido de hidrógeno está generalmente reconocido como seguro por las principales agencias sanitarias del mundo para su uso como agente antimicrobiano, agente oxidante y otros propósitos. Ha sido utilizado como agente antiséptico y antibacteriano desde hace muchos años debido a su efecto oxidante. Aunque su uso ha descendido los últimos años debido a la popularidad de otros productos sustitutivos, todavía se utiliza en muchos hospitales y clínicas. 165 Desinfección El peróxido de hidrógeno es un antiséptico general. Su mecanismo de acción se debe a sus efectos oxidantes: produce OH y radicales libres que atacan una amplia variedad de compuestos orgánicos, entre ellos lípidos y proteínas que componen las membranas celulares de los microorganismos. La enzima catalasa presente en los tejidos degrada rápidamente el peróxido de hidrógeno, produciendo oxígeno, que dificulta la germinación de esporas anaerobias. Se utiliza en dermoaplicaciones, limpieza de dentaduras y desinfección bucal, así como en desinfección de lentes de contacto en el campo de la óptica. Además, aprovechando la actividad de la peroxidasa presente en la sangre, también se usa junto a la fenolftaleína para detectar la presencia de sangre (Prueba de KastleMeyer). Otros usos domésticos Acuarios (desinfección): el peróxido de hidrógeno (de 10 volúmenes) puede ser usado en los acuarios de peces tropicales para combatir a la Cyanobacteria, la cual muere en un plazo inferior a las 12 horas desde su aplicación incorporando 15 ml/100 L de agua. 3.18. HIDRÓXIDO DE SODIO El hidróxido de sodio (NaOH) o hidróxido sódico, también conocido como sosa cáustica o soda cáustica, es un hidróxido cáustico usado en la industria (principalmente como una base química) en la fabricación de papel, tejidos, y detergentes. Además es usado en la Industria Petrolera en la elaboración de Lodos de Perforación base Agua. A temperatura ambiente, el hidróxido de sodio es un sólido blanco cristalino sin olor que absorbe humedad del aire (higroscópico). Es una sustancia manufacturada. Cuando se disuelve en agua o se neutraliza con un ácido libera una gran cantidad de calor que puede ser suficiente como para encender materiales combustibles. El hidróxido de sodio es muy corrosivo. Generalmente se usa en forma sólida o como una solución de 50%. El hidróxido de sodio se usa para fabricar jabones, crayón, papel, explosivos, pinturas y productos de petróleo. También se usa en el procesamiento de textiles de algodón, lavandería y blanqueado, revestimiento de óxidos, galvanoplastia y extracción electrolítica. Se encuentra comúnmente en limpiadores de desagües y hornos. 166 El hidróxido sódico, en su mayoría, se fabrica por el método de caustificación, es decir, juntando otro hidróxido con un compuesto de sodio: Ca(OH)2 (aq) + Na2CO3 (aq) → 2 NaOH (aq) + CaCO3 (s) Aunque modernamente se fabrica por electrólisis de una solución acuosa de cloruro sódico o salmuera. Es un subproducto que resulta del proceso que se utiliza para producir cloro. Ánodo: 2Cl- → Cl2 (gas) + 2eCátodo: 2H2O + 2e- → H2 + 2OHAl ir progresando la electrólisis se van perdiendo los cloruros siendo sustituidos por iones hidróxido, que combinados con los cationes sodio presentes en la disolución forman el hidróxido sódico. Los cationes sodio no se reducen a sodio metálico debido a su bajísimo potencial. Se utiliza una solución de una pequeña porción de sosa diluida en agua en el método tradicional para producir margarina común, una pretzel y también es usado para elaborar el lutefisk, comida tradicional de los países nórdicos a base de pescado. Además este producto se usa como desatascador de cañerías. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Sólido Blanco 2100 kg/m3; 2,1 g/cm3 39,99713 g/mol 596 K (323 °C) 1663 K (1390 °C) 111 g/100 ml (20 °C) RIESGOS Ingestión: Puede causar daños graves y permanentes al sistema gastrointestinal. Inhalación: Irritación con pequeñas exposiciones, puede ser dañino o mortal en altas dosis. Piel: Peligroso. Los síntomas van desde irritaciones leves hasta úlceras graves. Ojos: Peligroso. Puede causar quemaduras, daños a la córnea o conjuntiva. 167 3.19. HIDRÓXIDO DE POTASIO El hidróxido de potasio (también conocido como potasa cáustica) es un compuesto químico inorgánico de fórmula KOH, tanto él como el hidróxido de sodio (NaOH), son bases fuertes de uso común. Tiene muchos usos tanto industriales como comerciales. La mayoría de las aplicaciones explotan su reactividad con ácidos y su corrosividad natural. Se estiman en 700 000 a 800 000 toneladas la producción de hidróxido de potasio en 2005 (del NaOH se producen unas cien veces más). PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Sólido Blanco 2040 kg/m3; 2,04 g/cm3 56,1056 g/mol 633,15 K (360 °C) 1593,15 K (1320 °C) 119 g en 100 g de agua RIESGOS Ingestión: Muy peligroso, puede causar daños permanentes, incluso la muerte. Inhalación: Muy peligroso, altas dosis pueden causar daños permanentes. Efectos debido a la exposición a largo plazo desconocidos. Piel: Causa quemaduras de diversos grados. Ojos: Causa quemaduras de diversos grados. APLICACIÓN El KOH es especialmente significativo por ser el precursor de la mayoría de jabones suaves y líquidos, así como por estar presente en numerosos compuestos químicos que contienen potasio. La saponificación de grasas con KOH se utiliza para preparar los correspondientes "jabones de potasio", que son más suaves que los jabones derivados del hidróxido de sodio. Debido a su suavidad y mayor solubilidad, los jabones de potasio necesitan menos agua para licuificarse, y por tanto pueden contener mayor cantidad de agente limpiador que los jabones licuificados basados en sodio. 168 3.20. HIDRÓXIDO DE CALCIO El hidróxido de calcio, también conocido como cal muerta y/o cal apagada, es un hidróxido cáustico con la fórmula Ca(OH)2. Es un cristal incoloro o polvo blanco, obtenido al reaccionar óxido de calcio con agua. Puede también precipitarse mezclando una solución de cloruro de calcio con una de hidróxido de sodio. Si se calienta a 512 °C,1 el hidróxido de calcio se descompone en óxido de calcio y agua. La solución de hidróxido de calcio en agua es una base fuerte que reacciona violentamente con ácidos y ataca varios metales. Se enturbia en presencia de dióxido de carbono por la precipitación de carbonato de calcio. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de descomposición Estructura cristalina Alcalinidad (pKb) Solubilidad en agua Sólido Polvo blanco 2211 kg/m3; 2,211 g/cm3 74,093 g/mol 653 K ( °C) Hexagonal -2.37 0.185g/100 cm³ APLICACIONES Por su carácter de base poderosa, tiene usos variados como: o o o o o o o En el proceso para la neutralización de ácido sobrante En la remineralización de agua desalada En la industria petrolera para la manufactura de aditivos para el petróleo crudo En la industria química para la manufactura de estereato de calcio En la industria alimenticia para el procesamiento de agua para bebídas alcohólicas y carbonatadas Para librar una salmuera de carbonatos de calcio y magnesio en la manufactura de sal para comida y farmacopea Componente para la nixtamalización del maíz para producir tortillas. 169 Como rellenante o En la industria petroquímica para la manufactura de aceite sólido o Para la manufactura de discos de freno o Para la manufactura de ebonita o Para la preparación de mezclas secas para pintura y decoración o Para mezclas de pesticidas o Como material de tratamiento de los conductos radiculares Endodoncia ó protección pulpar directa o indirecta en caso de restauraciones coronarias dentales [operatoria dental] Como pintura para muchas canchas de deportes como el fútbol y el tenis 3.21. CARBONATO DE CALCIO El carbonato de calcio es un compuesto químico, de fórmula CaCO3. Es una sustancia muy abundante en la naturaleza, formando rocas, como componente principal, en todas partes del mundo y es el principal componente de conchas y esqueletos de muchos organismos (moluscos, corales) o de las cáscaras de huevo. Es la causa principal del agua dura. En medicina se utiliza habitualmente como suplemento de calcio, como antiácido y agente adsorbente. Es fundamental en la producción de vidrio y cemento, entre otros productos. Es el componente principal de los siguientes minerales y rocas: Calcita. Aragonito. Caliza. Travertino. Mármol. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Solubilidad en agua Sólido Polvo blanco inodoro. 2700 kg/m3; 2,7 g/cm3 100,1 g/mol 0,0013g por cada 100g de agua 170 RIESGOS Ingestión: En cantidad excesiva puede causar irritación gástrica leve e inflamación en la garganta. Su ingestión crónica puede causar hipercalcemia, alcalosis y daño renal. Inhalación: En grado excesivo puede causar irritación respiratoria leve. Piel: Leve riesgo, puede causar irritación. Ojos: Leve riesgo, puede causar irritación. Presencia en los organismos vivos El carbonato cálcico es componente principal de muchas estructuras presentes en organismos vivos. Algunos ejemplos son: Reino Protista, En algas como Padina pavonica. Reino Metazoo. En las cáscaras de huevo de reptiles y aves. 3.22. CARBONATO DE SODIO El carbonato sódico es una sal blanca y translúcida de fórmula química Na2CO3, usada entre otras cosas en la fabricación de jabón, vidrio y tintes. Es conocido comúnmente como barrilla, natrón, soda Solvay, ceniza de soda y sosa (no confundir con la sosa cáustica). Puede hallarse en la naturaleza u obtenerse artificialmente, gracias a un proceso ideado y patentado en 1791 por el médico y químico francés Nicolás Leblanc. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Solubilidad en agua Sólido Sólido blanco 2540 kg/m3; 2,54 g/cm3 105.9885 g/mol 1124 K (851 °C) 1873 K (1600 °C) 10,9 g por cada 100 g de agua RIESGOS Ingestión: Causa irritación. Inhalación: Dañina, deben evitarse especialmente exposiciones prolongadas. Piel: Irritaciones y posiblemente quemaduras. Ojos: Irritación grave, posiblemente con heridas graves. 171 APLICACIONES El carbonato de sodio es usado para tostar (calentar bajo una ráfaga de aire) el cromo y otros extractos y disminuye el contenido de azufre y fósforo de la fundición y del acero. En la fabricación de detergentes, el carbonato de sodio es indispensable en las formulaciones al objeto de asegurar el correcto funcionamiento del resto de sustancias que lo componen, enzimas, tensioactivos, etc. durante las diferentes fases del lavado. No es de menos importancia el empleo del carbonato de sodio en aquellos procesos en los que hay que regular el pH de diferentes soluciones, nos referimos al tratamiento de aguas de la industria, así como en los procesos de flotación. Cerámica, jabones, limpiadores, ablandador de aguas duras, refinación de petróleos, producción de aluminio, textiles, pulpa y papel. Procesamiento metalúrgico, preparación de farmacéuticos, soda cáustica, bicarbonato de sodio, nitrato de sodio y varios otros usos. El carbonato de sodio y sus derivados se usan para bajar el punto de fusión del silicio y poder trabajarlo mejor, también aporta el sólido necesario para formar la red. 3.23. CIANURO DE POTASIO El cianuro de potasio o KCN es la sal de potasio del cianuro de hidrógeno o ácido hidrociánico. Es un compuesto cristalino incoloro, similar en apariencia al azúcar, y altamente soluble en agua. Altamente tóxico, el KCN tiene un olor como el de las almendras amargas, pero no todos pueden oler porque la capacidad de la misma se debe a un rasgo génico. Es una de las pocas sustancias que forma compuestos solubles con el oro, y por esto se usa en joyería para el dorado químico y para darle brillo. Puede usarse en la minería de oro para extraer el metal de los minerales, aunque se usa cianuro de sodio más comúnmente. Se usa a menudo por entomólogos como un agente para matar en los tarros de insectos, ya que la mayoría de los insectos sucumben en segundos, minimizando el daño en incluso las clases más frágiles. PROPIEDADES Estado físico y aspecto Punto de ebullición Punto de fusión Densidad Solubilidad en agua Cristales higroscópicos o sólido en diversas formas, de olor característico. Inodoro seco. 1625 °C 634 °C 1.52gr / cm3 71,60 gr/100 ml a 25 °C 172 RIESGOS La sustancia irrita fuertemente los ojos, la piel y el tracto respiratorio, puede causar efectos en respiración celular, dando lugar a convulsiones y pérdida del conocimiento. La exposición puede producir la muerte. Se recomienda vigilancia médica. 3.24. BICARBONATO DE SODIO El bicarbonato de sodio (también llamado bicarbonato sódico o hidrogeno carbonato de sodio o carbonato ácido de sodio) es un compuesto sólido cristalino de color blanco muy soluble en agua, con un ligero sabor alcalino parecido al del carbonato de sodio, de fórmula NaHCO3. Se puede encontrar como mineral en la naturaleza o se puede producir artificialmente. Cuando se expone a un ácido moderadamente fuerte se descompone en dióxido de carbono y agua. Debido a la capacidad del bicarbonato de sodio de liberar dióxido de carbono se usa junto con compuestos acídicos como aditivo leudante en panadería y en la producción de gaseosas. Algunas levaduras panaderías contienen bicarbonato de sodio. Antiguamente se usaba como fuente de dióxido de carbono para la gaseosa Coca Cola. Es el componente fundamental de los polvos extintores de incendios o polvo BC. PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de descomposición Índice de refracción Solubilidad en agua Sólido blanco cristalino 2173 kg/m3; 2,173 g/cm3 84,0 g/mol 323,15 K (50 °C) 543,15 K ( °C) 1,3344 10,3 g/100 g de H2O RIESGOS Ingestión: No peligroso excepto en cantidades muy grandes Inhalación: Puede causar irritación Piel: Puede causar irritación Ojos: Puede causar ceguera 173 APLICACIONES El bicarbonato de sodio se usa principalmente en la repostería, donde reacciona con otros componentes para liberar CO2, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen bitartrato de potasio (también conocido como crema de tártaro), jugo de limón, yogur, ácido acético Uso cultural El bicarbonato de sodio se utiliza como un agente alcalinizante que actúa en combinación a la saliva en el coqueo, de manera que se suaviza y se produce la extracción de los metanolitos de la hoja de coca haciéndose de esa manera el coqueo un proceso placentero y duradero en contraposición si no se usara el bicarbonato de sodio. El bicarbonato de sodio es a la coca lo que el azúcar al café, de manera que en la serranía del Perú y Bolivia (donde se practica el coqueo) el consumo de bicarbonato es alto. En china se usa para lavarse los pies 3.25. HIPOCLORITO DE SODIO PROPIEDADES Estado de agregación Apariencia Densidad Masa molar Punto de fusión Punto de ebullición Sólido Blanco 1210 kg/m3; 1,21 g/cm3 74,4 g/mol 291 K (18 °C) 374 K (101 °C) RIESGOS Ingestión: Peligroso en grandes concentraciones. Inhalación: Peligroso en grandes concentraciones. Piel: Causa quemaduras y cáncer de piel en grandes cantidades. Ojos: Causa quemaduras. 174 El hipoclorito de sodio o hipoclorito sódico, ( cuya disolución en agua es conocida popularmente como agua lavandina, cloro, lejía, agua de Javel o agua Jane) es un compuesto químico, fuertemente oxidante, cuya fórmula es NaClO. Contiene el cloro en estado de oxidación +1 y por lo tanto es un oxidante fuerte y económico. Debido a esta característica destruye muchos colorantes por lo que se utiliza como blanqueador. Además se aprovechan sus propiedades desinfectantes. En disolución acuosa sólo es estable a pH básico. Al acidular en presencia de cloruro libera cloro elemental, que en condiciones normales se combina para formar el gas dicloro, tóxico. Por esto debe almacenarse alejado de cualquier ácido. APLICACIONES El hipoclorito sódico se usa mucho como oxidante en el proceso de potabilización del agua, a dosis ligeramente superiores al punto crítico (punto en que empieza a aparecer cloro residual libre). Se utiliza también como desinfectante en piscinas, ya sea por aplicación directa en forma de líquido (125 ml diarios por cada 10m3 de agua), pastillas concentradas o en polvo, o a través de un aparato de electrólisis salina por el que se hace circular el agua de la piscina. Para que la electrólisis tenga lugar se debe salar ligeramente la piscina (necesitaremos 4g de sal por litro de agua). El aparato de electrólisis, mediante descargas eléctricas trasforma la Sal (NaCl) en Hipoclorito Sódico consiguiendo desinfectar el agua. También se usa en el proceso de identificación de especies de los distintos filos de animales que poseen espículas o escleritos, como poríferos o equinodermos (holoturoideos). El hipoclorito de sodio disuelve la materia orgánica dejando al descubierto estas estructuras (únicas en cada especie), que son de carbonato cálcico (calcáreas) o dióxido de silicio (silíceas) y, por tanto, no se disuelven. Este químico se puede también utilizar como blanqueador para las fibras textiles, así como para desinfectar los lavabos gracias a su poder fungicida y bactericida. En parasitología puede ser utilizado para la esporulación invitro de quistes de protozoos del phylum apicomplexa en el método denominado de Cawthorn. “Dios confía en el hombre y por eso le confía la transformación del mundo”. (Escrivá de Balaguer) 175 CONCLUSIONES Luego de realizar esta investigación se ha obtenido las siguientes conclusiones en base a los objetivos planteados al inicio Los temas se detallaron de manera sistemática y ordenada, sin abundar en palabras para que pueda seguirse, paso a paso, el aprendizaje del lenguaje de la química. Sobre la base de las recomendaciones de la Unión Internacional de Química Pura y Aplicada (IUPAC) se introducen considerables reformas que facilitan el conocimiento. Precisamente, la modificación digna de señalar es la unificación de criterios en dos sistemas de nomenclaturas: - Nomenclatura IUPAC.- Esta denominación me permitió utilizar para agrupar todos los principios que aparecen como resultado de la aplicación de las recomendaciones de esta institución. - Nomenclatura Tradicional.- En este sistema se utilizaron los principios, muchos de ellos arbitrario, conflictivos e innecesarios, que todavía se mantienen en algunos libros y que en un corto tiempo serán abandonados. He creído conveniente expresar aquí los fundamentos las propiedades, las aplicaciones y los riesgos de los compuestos mas utilizados. 1. FORMACIÓN DE COMPUESTOS Todo compuesto químico es el resultado de una combinación o unión íntima entre dos o más elementos diferentes. Si el compuesto está formado por dos elementos, se denomina binario; por tres, ternario; por cuatro, cuaternario; y por más de cuatro se llaman compuestos complejos. 1.1. Clasificación de los compuestos inorgánicos Los compuestos inorgánicos pueden ser oxigenados y no oxigenados. 176 Compuestos no oxigenados están los ácidos hidrácidos, hidruros metálicos, compuestos especiales, sales halógenas neutras, compuestos no salinos, aleaciones y amalgamas. Compuestos oxigenados tenemos los anhídridos, óxidos básicos, neutros, salinos, anfóteros y peróxidos. A continuación se muestra un diagrama de cómo se forman los compuestos respectivos 177 En resumen tenemos el siguiente diagrama. 2. FORMULACIÓN DE COMPUESTOS Las fórmulas químicas son representaciones gráficas de las sustancias químicas puras, simples, compuestas y de su molécula o composición química. La fórmula representa el peso molecular de una sustancia. En la nomenclatura química los elementos se representan mediante símbolos y los compuestos mediante fórmulas. La fórmula H2 representa a la sustancia simple, hidrógeno y su mínima porción o molécula formada por dos átomos del mismo elemento, indicado por el subíndice 2. H2O simboliza a la sustancia compuesta, agua y su molécula constituida por dos átomos de hidrógeno, señalados por el subíndice 2, y uno de oxígeno, sin subíndice porque el mismo símbolo representa un átomo. 178 Las sustancias simples están constituidas por átomos de un mismo elemento, que no pueden ser descompuestas por métodos químicos. 2.1. Escritura de una fórmula Para escribir las fórmulas se intercambian valencias entre los elementos reaccionantes, escribiéndolas como subíndices del elemento contrario, así: En el tricloruro de aluminio, el cloro tiene el subíndice 3, que corresponde a la valencia del aluminio; este debería tener el subíndice 1, correspondiente a la valencia del cloro, pero no se escribe porque el mismo símbolo (Al) ya representa un átomo. El orden de la escritura química consiste en ubicar primero los elementos menos electronegativos y luego los otros; por ejemplo en las sales se coloca en primer lugar el símbolo del metal y luego el del no metal. Igual se hace con los otros compuestos. Si después de intercambiar valencias se encuentra que los subíndices mayores que son iguales entre si, o el uno es múltiplo del otro, se procede a “simplificar la fórmula” dividiendo dichos subíndices para un número común divisor. Ejemplo: 2.2. Lectura de una fórmula Para leer una fórmula tenemos que tener presente lo siguiente Los compuestos (binarios y ternarios) en su nomenclatura están formados por dos nombres: o Genérico o Específico. 179 El nombre genérico o general: Es el que indica a qué grupo de compuestos pertenece la molécula o su función química, por ejemplo si es un óxido metálico/básico, un óxido no metálico/ácido, un peróxido, un hidruro, un hidrácido, un oxácido, una sal haloidea, etc. El nombre específico: Es el que diferencia a las moléculas dentro de un mismo grupo de compuestos. Por lo general en los tres sistemas de nomenclatura se escribe primero el nombre genérico seguido del específico. Por ejemplo: óxido ferroso y óxido férrico, estos dos compuestos pertenecen al grupo de los óxidos y por eso su nombre genérico es óxido y a la vez los nombres específicos ferroso y férrico hacen referencia a dos compuestos diferentes FeO y Fe2O3, respectivamente. En general, en una fórmula molecular de un compuesto se coloca a la izquierda el elemento con carga o número de valencia positivo (elemento más electropositivo) y a la derecha el que contenga el número de valencia negativo (elemento más electronegativo). Y al contrario de esto, en nomenclatura se coloca primero el nombre genérico, que es el que designa al elemento de la derecha (el más electronegativo), y el nombre específico en segundo lugar, que es el que designa al elemento de la izquierda (el menos electronegativo). 2.3. Tipo de fórmulas a. Fórmulas condensadas o mínimas Indican la composición de una sustancia mediante la simbología de los elementos componentes y la proporción de sus átomos a través de subíndices numéricos. Entre paréntesis se encierran los grupos atómicos que se repiten. 180 A su vez, estas fórmulas pueden ser empíricas, si señalan la composición mínima sin proporcionar datos de la constitución molecular, y moleculares cuando denotan esta. Ejemplos: Fórmula empírica Fórmula molecular Sustancia (CH)n C₂H₂ etileno (CH₂O)n C₂H₁₂O₆ glucosa En general la formulación empírica se utiliza en la química orgánica, porque al dar valores a “n” se obtiene un sinnúmero de compuestos; esto no ocurre en la química inorgánica. b. Semidesarrolladas Mediante rayas indican los enlaces importantes entre grupos atómicos característicos. Ejemplos: c. Desarrolladas o estructurales Determinan con rayas la ubicación espacial de los átomos en la molécula y todos sus enlaces. Ejemplo: 181 d. Electrónicas Son fórmulas desarrolladas y escritas con símbolos electrónicos para mostrar las transferencias de electrones entre los átomos, hasta que adquieran la estructura electrónica estable. Para establecer la procedencia de los elementos se les representa con puntos claros y oscuros. Ejemplos: 2.4. Identificación de un compuesto a que grupo pertenece Al ver una fórmula, generalmente lo podemos ubicar en uno de estos grupos. 1. Ácidos cuando observamos el símbolo del hidrógeno al extremo izquierdo de la fórmula, como HCl (ácido clorhídrico) 2. Bases cuando observamos un metal al principio de la fórmula unido al anión hidróxido (OH-) al final, como NaOH (hidróxido de sodio). 3. Óxidos a los compuestos binarios del oxígeno, (ojo, debe ser binario contener sólo dos elementos en la fórmula, uno de ellos es el oxígeno que va escrito su símbolo al extremo derecho. Óxido metálico cuando es un metal el que se enlaza al oxígeno (óxidos metálicos binarios), como Fe2O3 (óxido férrico). Óxido no metálico cuando es un no-metal el enlazado al oxígeno, como CO (monóxido de carbono). 4. Sales son aquellas que están formadas por un metal y un anión que no es ni óxido ni hidróxido, como el NaCl (cloruro sódico). 3. APLICACIONES Y RIESGOS DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS Debido a la gran magnitud de compuestos químicos describiremos las aplicaciones y riesgos de los compuestos inorgánicos más utilizados. 182 ÁCIDO SULFÚRICO La industria que más utiliza el ácido sulfúrico es la de los fertilizantes. Otras aplicaciones importantes se encuentran en la refinación del petróleo, producción de pigmentos, tratamiento del acero, extracción de metales no ferrosos, manufactura de explosivos, detergentes, plásticos y fibras. En el caso de la industria de los fertilizantes, la mayor parte del ácido sulfúrico se utiliza en la producción del ácido fosfórico, que a su vez se utiliza para fabricar materiales fertilizantes como el superfosfato triple y los fosfatos de mono y diamonio. Alrededor del 60% de la producción total de ácido sulfúrico se utiliza en la manufactura de fertilizantes. En la industria química inorgánica, el ácido sulfúrico se utiliza en la producción de pigmentos de óxido de titanio (IV), ácido clorhídrico y ácido fluorhídrico. En el procesado de metales el ácido sulfúrico se utiliza para el tratamiento del acero, cobre, uranio y vanadio y en la preparación de baños electrolíticos para la purificación y plateado de metales no ferrosos. Algunos procesos en la industria de la Madera y el papel requieren ácido sulfúrico, así como algunos procesos textiles, fibras químicas y tratamiento de pieles y cuero. ÁCIDO CLORHÍDRICO Se usa, para limpiar, tratar y galvanizar metales, curtir cueros, y en la refinación y manufactura de una amplia variedad de productos. El cloruro de hidrógeno puede formarse durante la quema de muchos plásticos. El uso más conocido es el de desincrustante para eliminar residuos de caliza (carbonato cálcico: CaCO3). En la industria alimentaria se utiliza en la producción de la gelatina disolviendo con ella la parte mineral de los huesos. En metalurgia se utiliza para disolver la capa de óxido que recubre un metal, previo a procesos como galvanizado, extrusión, u otras técnicas. Riesgos Ingestión: Puede producir gastritis, quemaduras, gastritis hemorrágica, edema, necrosis. Inhalación: Puede producir irritación, edema y corrosión del tracto respiratorio, bronquitis crónica. Piel: Puede producir quemaduras, úlceras, irritación. Retirar de la zona afectada toda la vestimenta y calzados y lavar con agua abundante durante al menos 20 minutos. Ojos: Puede producir necrosis en la córnea, inflamación en el ojo, irritación ocular y nasal, úlcera nasal. ÁCIDO FLUORHÍDRICO El fluorhídrico se utiliza en química orgánica en la obtención de compuestos orgánicos fluorados, como catalizador en petroquímica, para obtener criolita (Na3AlF6) artificial que se emplea en la obtención del aluminio, fluoruros inorgánicos como el hexafluoruro de uranio (UF6) y a veces como disolvente. También es utilizado en la industria y preparación de vidrio o cristal en el tallado y grabado del mismo. En estudios petrográficos de rocas graníticas es utilizado en estado puro. 183 Riesgos Se trata de una sustancia irritante, corrosiva y tóxica. En la piel produce quemaduras muy dolorosas que curan muy mal. ÁCIDO BROMHÍDRICO El ácido bromhídrico se utiliza para elaborar productos químicos y farmacéuticos, principalmente para la producción de bromuros inorgánicos, especialmente el bromuro de zinc, calcio y sodio, también se lo emplea como solvente y en medicación veterinaria. Es un reactivo útil para la regeneración de compuestos organobromados. Ciertos éteres se rompen con ácido bromhídrico. También funciona como catalizador de reacciones de alquilación y de la extracción de ciertos minerales. A partir de ácido bromhídrico se crean importantes compuestos orgánicos útiles para la industria, como lo son: bromuro de alilo, fenol y ácido bromoacético. Riesgos Inhalación: Produce corrosión, sensación de quemazón, tos, dolor de garganta. Piel: Produce enrojecimiento, quemaduras cutáneas, dolor, corrosión, congelación grave. Ojos: Produce corrosión, enrojecimiento, dolor, quemaduras profundas y graves. ÁCIDO NÍTRICO Es utilizado comúnmente como un reactivo de laboratorio, se utiliza para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT), así como fertilizantes como el nitrato de amonio. Tiene usos adicionales en metalurgia y en refinado, ya que reacciona con la mayoría de los metales y en la síntesis química. Cuando se mezcla con el ácido clorhídrico forma el agua regia, un raro reactivo capaz de disolver el oro y el platino. El ácido nítrico también es un componente de la lluvia ácida. El ácido nítrico se utiliza; como agente nitrante en la fabricación de explosivos, en la fabricación de abonos, es utilizado en grabado artístico (aguafuerte), también se usa para comprobar el oro y el platino. Riesgos Ingestión: Corrosivo. Dolor abdominal, sensación de quemazón, shock. Inhalación: Sensación de quemazón, tos, dificultad respiratoria, pérdida del conocimiento. Piel: Puede causar graves quemaduras. Ojos: Quemaduras graves e irritación ocular. 184 ÁCIDO HIPOCLOROSO Debido a que el cloro es el desinfectante universal y a que el HClO es el componente activo del cloro. El HClO a concentraciones elevadas trabaja muy bien como desinfectante de superficies y como sustancia dirigida a la inactivación de desechos hospitalarios. Induciendo desinfección de alto nivel. El HClO es recomendado en patologias como: Ulceras de miembros inferiores de cualquier origen (úlceras varicosas, isquémicas, ulceras de pie diabético etc) Quemaduras de 2 y 3 grado Control de infecciones cutáneas. Cuidado de heridas Limpias, contaminada y con tejido Necrótico. Lavado y cuidado de exposiciones óseas CLORURO DE ZINC El cloruro de zinc tiene muchas aplicaciones en los procesos textiles, fabricación de decapantes y de catalizadores para síntesis orgánica. El cloruro de zinc tiene la capacidad de atacar a los óxidos metálicos dando derivados de fórmula MZnOCl2. Esta reacción es importante por el uso del ZnCl2 como decapante en soldadura metálica disuelve las capas de óxido exponiendo la superficie de metal limpia. Estos decapantes se preparan disolviendo una hoja metálica de zinc en ácido clorhídrico hasta que el líquido deja de desprender hidrógeno. Debido a su naturaleza corrosiva, este decapante no es adecuado para situaciones en las que no puedan limpiarse los residuos, tales como en trabajos de electrónica. Esta propiedad también permite su uso en la fabricación de cementos de óxido de magnesio para empaste dental y como ingrediente activo en ciertos enjuagues bucales. Riesgos Las sales de zinc son relativamente no tóxicas. Las precauciones aplicables al cloruro de zinc anhidro ZnCl2 son las mismas aplicables a otros haluros de metal anhidro, esto es, la hidrólisis puede ser exotérmica y debería evitarse el contacto. Las disoluciones concentradas son ácidas y corrosivas, atacando específicamente a la celulosa y la seda. CLORURO DE HIERRO Es utilizado a escala industrial perteneciente al grupo de los haluros metálicos. El cloruro férrico en solución al 40%, coagulante para tratamiento de aguas y efluentes, se comercializa habitualmente a granel. Se utiliza como coagulante para; tratamiento de aguas residuales(efluentes cloacales y efluentes industriales), potabilización de agua (tratamiento de agua de río para obtener agua de consumo) El cloruro de hierro se usa como catalizador de la reacción de adición de etileno con cloro, formando (1,2-dicloroetano), una materia prima importante para producir industrialmente cloruro de vinilo, el monómero para fabricar PVC. 185 Una de sus más importantes aplicaciones es en electrónica para producir placas de circuito impreso en bajas cantidades. El cloruro férrico reacciona con el cobre dando cloruro ferroso y cloruro cúprico. Lo usan los fabricantes de cuchillos y espadas artesanales para teñir las hojas y para dar un efecto de contraste al metal y para ver las imperfecciones del mismo. También se usa para el fotograbado de láminas de cobre para imprimir imágenes fotográficas al aguafuerte o por intaglio y para grabar los cilindros de fotograbado usados en la industria de artes gráficas. Riesgos Ingestión: náuseas, vómitos. Piel: Irritaciones, quemaduras. Ojos: Irritaciones, quemaduras. CLORURO DE SODIO El cloruro de sodio, sal de mesa, o en su forma mineral halita, es una de las sales responsable de la salinidad del océano y del fluido extracelular de muchos organismos. También es el mayor componente de la sal comestible, es comúnmente usada como condimento y conservante de comida. El sodio es un nutriente esencial que las plantas necesitan en muy bajas dosis. Sin embargo, con dosis un poco altas la sal es tóxica. Riesgos Ingestión: Peligroso en grandes cantidades; su uso a largo plazo en cantidades normales puede traer problemas en los riñones. Inhalación: Puede producir irritación en altas cantidades. Piel: Puede producir resequedad. Ojos: Puede producir irritación y molestia. CLORURO DE HIDRÓGENO Es un gas más denso que el aire. Es un compuesto tóxico, corrosivo, de olor picante y sofocante. En su forma anhidra, no ataca metales ni aleaciones. Pero en presencia de humedad produce vapores de ácidos que atacan a la mayoría de los metales exceptuando la plata, el oro, el platino y el tantalio. Riesgos Es altamente peligroso el contacto con la piel, los ojos y otras mucosas, y no se debe inhalar ni ingerirse disuelto en agua. Por lo tanto, a la hora de emplear este gas reactivo, es necesario usar guantes, lentes y mascarillas. En caso de ingestión, asistir a su médico lo más pronto posible. 186 ÓXIDO DE NITRÓGENO El monóxido de nitrógeno es el producto primario de la combustión catalítica del amoníaco mediante el método de Ostwald y, por lo tanto, un intermediario importante en la producción del ácido nítrico (HNO3). En el laboratorio se genera más convenientemente por reacción de ácido nítrico diluido con cobre, si los otros productos posibles de la reacción como el dióxido de nitrógeno no molestan o pueden ser eliminados (por ejemplo, por absorción en agua). Se usa para detectar radicales en la superficie de polímeros. Riesgos Ingestión: Usado en medicina, pero las sobredosis son perjudiciales. Inhalación: Peligroso, puede ser fatal. Piel: Irritante. Ojos: Puede causar irritación. ÓXIDO DE CALCIO La cal se ha usado, desde la más remota antigüedad, de conglomerante en la construcción; también para pintar (encalar) muros y fachadas de los edificios construidos con adobes o tapial, habitual en las antiguas viviendas mediterráneas, en la fabricación de fuego griego. En algunos países de Latinoamérica, la cal se utiliza para el proceso de nixtamal, proceso utilizado para hacer sémola de maíz y masa para tortillas. Riesgos Ingestión: Peligroso, causa irritación, en grandes dosis puede ser fatal. Inhalación: Peligroso; causa irritación, bronquitis química o la muerte en casos de exposición a largo plazo. Piel: Irritación y posibles quemaduras. Ojos: Puede causar daños permanentes. ÓXIDO DE NITRÓGENO Hoy en día este gas es utilizado en automóviles convencionales modificados. La cadena molecular del gas se rompe durante la combustión en la cámara, a unos 275 °C de temperatura, produciendo un aumento del oxígeno disponible para la combustión con el consecuente aumento de potencia. Así mismo el nitrógeno liberado presente en la cámara actúa como un amortiguador térmico tras el aumento de energía liberada. Las características en la entrega de potencia de los equipos de óxido nitroso limitan su uso en vehículos de serie a aumentos de potencia que normalmente no superan los 100 caballos y que más bien rondan entre los 50 y 75 caballos. El óxido nitroso es muy insoluble en sangre y otros tejidos, proveyendo de una inducción rápida de la anestesia y a la vez, rápida recuperación después de suspender el suministro. Es casi completamente eliminado por los pulmones, con una mínima difusión a través de la piel. No se biotransforma. 187 Riesgos Inhalación: Puede causar asfixia. Piel: Peligroso comprimido o criogénico. Ojos: Peligroso comprimido o criogénico. MONÓXIDO DE CARBONO Se produce por la combustión incompleta de sustancias como gas, gasolina, keroseno, carbón, petróleo, tabaco o madera. Las chimeneas, las calderas, los calentadores de agua o calefones y los aparatos domésticos que queman combustible, como las estufas u hornallas de la cocina o los calentadores a keroseno, también pueden producirlo si no están funcionando bien. Los vehículos detenidos con el motor encendido también lo despiden. También se puede encontrar en las atmósferas de las estrellas de carbono. Riesgos Ingestión: Puede causar vómito y diarrea. Inhalación: Muy peligroso, puede ser fatal. Piel: Inhalación puede causar lesiones cutáneas. Evitar contacto con líquido criogénico. Ojos: Inhalación puede causar problemas a largo plazo en la visión. DIÓXIDO DE CARBONO Se utiliza como agente extintor eliminando el oxígeno para el fuego. En la industria alimentaria, se utiliza en bebidas carbonatadas para darles efervescencia. También se puede utilizar como ácido inocuo o poco contaminante. La acidez puede ayudar a cuajar lácteos de una forma más rápida y por tanto barata, sin añadir ningún sabor, y en la industria se puede utilizar para neutralizar residuos alcalinos sin añadir otro ácido más contaminante como el sulfúrico. En agricultura, se puede utilizar como abonado. Aunque las plantas no pueden absorberlo por las raíces, se puede añadir para bajar el pH, evitar los depósitos de cal y hacer más disponibles algunos nutrientes del suelo. También en refrigeración se utiliza como una clase de líquido refrigerante en máquinas frigoríficas o congelado como hielo seco. Este mismo compuesto se usa para crear niebla artificial y apariencia de hervor en agua en efectos especiales en el cine y los espectáculos. Es utilizado también como material activo para generar luz coherente (Láser de CO2). Junto con el agua, es el disolvente más empleado en procesos con fluidos súper críticos Riesgos Ingestión: Puede causar irritación, náuseas, vómitos y hemorragias en el tracto digestivo. Inhalación: Produce asfixia, causa hiperventilación. La exposición a largo plazo es peligrosa. Piel: En estado líquido puede producir congelación. Ojos: En estado líquido puede producir congelación. 188 PERÓXIDO DE HIDRÓGENO El peróxido de hidrógeno tiene muchos usos industriales, como el blanqueo de la pulpa de papel, blanqueo de algodón, blanqueo de telas y en general cada día se usa más como sustituto del cloro. En la industria alimenticia se usa mucho para blanquear quesos, pollos, carnes, huesos, y también se usa en el proceso para la elaboración de aceites vegetales. En la industria química se usa como reactivo, y es muy importante en la elaboración de fármacos. Se está usando también para blanqueos dentales. El peróxido de hidrógeno se usa en la industria aeroespacial como combustible de cohetes en motores de cohete monopropelentes o como aportación de oxígeno en motores bipropelentes. Este peróxido se usa por lo general a una concentración del 90%, y es extremadamente puro. También se usa en concentraciones al 80% como impulsor de las turbo bombas que alimentan tanto el combustible como el oxidante en grandes motores de cohete. Se utiliza en dermoaplicaciones, limpieza de dentaduras y desinfección bucal, así como en desinfección de lentes de contacto en el campo de la óptica. Riesgos Ingestión: Serios daños, posiblemente fatal. Inhalación: Irritación severa, posiblemente fatal. Piel: Agente aclarante y desinfectante. Causa ardor casi inmediatamente Ojos: Peligroso. HIDRÓXIDO DE SODIO El hidróxido de sodio se usa para fabricar jabones, crayón, papel, explosivos, pinturas y productos de petróleo. También se usa en el procesamiento de textiles de algodón, lavandería y blanqueado, revestimiento de óxidos, galvanoplastia y extracción electrolítica. Se encuentra comúnmente en limpiadores de desagües y hornos. Se utiliza una solución de una pequeña porción de sosa diluida en agua en el método tradicional para producir margarina común, una pretzel y también es usado para elaborar el lutefisk, comida tradicional de los países nórdicos a base de pescado. Además este producto se usa como desatascador de cañerías. Riesgos Ingestión: Puede causar daños graves y permanentes al sistema gastrointestinal. Inhalación: Irritación con pequeñas exposiciones, puede ser dañino o mortal en altas dosis. Piel: Peligroso. Los síntomas van desde irritaciones leves hasta úlceras graves. Ojos: Peligroso. Puede causar quemaduras, daños a la córnea o conjuntiva. HIDRÓXIDO DE POTASIO Tiene muchos usos tanto industriales como comerciales. La mayoría de las aplicaciones explotan su reactividad con ácidos y su corrosividad natural. Es especialmente significativo por ser el precursor de la mayoría de jabones suaves y líquidos, así como por estar presente en numerosos compuestos químicos que contienen potasio. 189 La saponificación de grasas con KOH se utiliza para preparar los correspondientes "jabones de potasio", que son más suaves que los jabones derivados del hidróxido de sodio. Debido a su suavidad y mayor solubilidad, los jabones de potasio necesitan menos agua para licuificarse, y por tanto pueden contener mayor cantidad de agente limpiador que los jabones licuificados basados en sodio. Riesgos Ingestión: Muy peligroso, puede causar daños permanentes, incluso la muerte. Inhalación: Muy peligroso, altas dosis pueden causar daños permanentes. Efectos debido a la exposición a largo plazo desconocidos. Piel: Causa quemaduras de diversos grados. Ojos: Causa quemaduras de diversos grados. HIDRÓXIDO DE CALCIO Por su carácter de base poderosa, tiene usos variados como: o o o En el proceso para la neutralización de ácido sobrante En la remineralización de agua desalada En la industria petrolera para la manufactura de aditivos para el petróleo crudo o En la industria química para la manufactura de estereato de calcio o En la industria alimenticia para el procesamiento de agua para bebídas alcohólicas y carbonatadas o Para librar una salmuera de carbonatos de calcio y magnesio en la manufactura de sal para comida y farmacopea o Componente para la nixtamalización del maíz para producir tortillas. Como rellenante o En la industria petroquímica para la manufactura de aceite sólido o Para la manufactura de discos de freno o Para la manufactura de ebonita o Para la preparación de mezclas secas para pintura y decoración o Para mezclas de pesticidas o Como material de tratamiento de los conductos radiculares Endodoncia ó protección pulpar directa o indirecta en caso de restauraciones coronarias dentales [operatoria dental] Como pintura para muchas canchas de deportes como el fútbol y el tenis CARBONATO DE CALCIO Es una sustancia muy abundante en la naturaleza, formando rocas, como componente principal, en todas partes del mundo y es el principal componente de conchas y esqueletos de muchos organismos (moluscos, corales) o de las cáscaras de huevo. Es la causa principal del agua dura. En medicina se utiliza habitualmente como suplemento de calcio, como antiácido y agente adsorbente. Es fundamental en la producción de vidrio y cemento, entre otros productos. El carbonato cálcico es componente principal de muchas estructuras presentes en organismos vivos. En las cáscaras de huevo de reptiles y aves. 190 Riesgos Ingestión: En cantidad excesiva puede causar irritación gástrica leve e inflamación en la garganta. Su ingestión crónica puede causar hipercalcemia, alcalosis y daño renal. Inhalación: En grado excesivo puede causar irritación respiratoria leve. Piel: Leve riesgo, puede causar irritación. Ojos: Leve riesgo, puede causar irritación. CARBONATO DE SODIO El carbonato de sodio es usado para tostar (calentar bajo una ráfaga de aire) el cromo y otros extractos y disminuye el contenido de azufre y fósforo de la fundición y del acero. En la fabricación de detergentes, el carbonato de sodio es indispensable en las formulaciones al objeto de asegurar el correcto funcionamiento del resto de sustancias que lo componen, enzimas, tensioactivos, etc. durante las diferentes fases del lavado. No es de menos importancia el empleo del carbonato de sodio en aquellos procesos en los que hay que regular el pH de diferentes soluciones, nos referimos al tratamiento de aguas de la industria, así como en los procesos de flotación. Cerámica, jabones, limpiadores, ablandador de aguas duras, refinación de petróleos, producción de aluminio, textiles, pulpa y papel. Procesamiento metalúrgico, preparación de farmacéuticos, soda cáustica, bicarbonato de sodio, nitrato de sodio y varios otros usos. El carbonato de sodio y sus derivados se usan para bajar el punto de fusión del silicio y poder trabajarlo mejor, también aporta el sólido necesario para formar la red. Riesgos Ingestión: Causa irritación. Inhalación: Dañina, deben evitarse especialmente exposiciones prolongadas. Piel: Irritaciones y posiblemente quemaduras. Ojos: Irritación grave, posiblemente con heridas graves. CIANURO DE POTASIO Es la sal de potasio del cianuro de hidrógeno o ácido hidrociánico. Es un compuesto cristalino incoloro, similar en apariencia al azúcar, y altamente soluble en agua. Altamente tóxico, el KCN tiene un olor como el de las almendras amargas, pero no todos pueden oler porque la capacidad de la misma se debe a un rasgo génico. Es una de las pocas sustancias que forma compuestos solubles con el oro, y por esto se usa en joyería para el dorado químico y para darle brillo. Puede usarse en la minería de oro para extraer el metal de los minerales, aunque se usa cianuro de sodio más comúnmente. Riesgos La sustancia irrita fuertemente los ojos, la piel y el tracto respiratorio, puede causar efectos en respiración celular, dando lugar a convulsiones y pérdida del conocimiento. La exposición puede producir la muerte. Se recomienda vigilancia médica. 191 BICARBONATO DE SODIO Debido a la capacidad del bicarbonato de sodio de liberar dióxido de carbono se usa junto con compuestos acídicos como aditivo leudante en panadería y en la producción de gaseosas. Algunas levaduras panaderías contienen bicarbonato de sodio. Es el componente fundamental de los polvos extintores de incendios o polvo BC. El bicarbonato de sodio se usa principalmente en la repostería, donde reacciona con otros componentes para liberar CO2, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen bitartrato de potasio (también conocido como crema de tártaro), jugo de limón, yogur, ácido acético El bicarbonato de sodio se utiliza como un agente alcalinizante que actúa en combinación a la saliva en el coqueo, de manera que se suaviza y se produce la extracción de los metanolitos de la hoja de coca haciéndose de esa manera el coqueo un proceso placentero y duradero en contraposición si no se usara el bicarbonato de sodio. Riesgos Ingestión: No peligroso excepto en cantidades muy grandes Inhalación: Puede causar irritación Piel: Puede causar irritación Ojos: Puede causar ceguera HIPOCLORITO DE SODIO Se utiliza también como desinfectante en piscinas, ya sea por aplicación directa en forma de líquido (125 ml diarios por cada 10m3 de agua), pastillas concentradas o en polvo, o a través de un aparato de electrólisis salina por el que se hace circular el agua de la piscina. Para que la electrólisis tenga lugar se debe salar ligeramente la piscina (necesitaremos 4g de sal por litro de agua). El aparato de electrólisis, mediante descargas eléctricas trasforma la Sal (NaCl) en Hipoclorito Sódico consiguiendo desinfectar el agua. También se usa en el proceso de identificación de especies de los distintos filos de animales que poseen espículas o escleritos, como poríferos o equinodermos (holoturoideos). El hipoclorito de sodio disuelve la materia orgánica dejando al descubierto estas estructuras (únicas en cada especie), que son de carbonato cálcico (calcáreas) o dióxido de silicio (silíceas) y, por tanto, no se disuelven. Este químico se puede también utilizar como blanqueador para las fibras textiles, así como para desinfectar los lavabos gracias a su poder fungicida y bactericida. Riesgos Ingestión: Peligroso en grandes concentraciones. Inhalación: Peligroso en grandes concentraciones. Piel: Causa quemaduras y cáncer de piel en grandes cantidades. Ojos: Causa quemaduras. 192 BIBLIOGRAFÍA ARMENDÁRIZ, Gerardo: Química inorgánica, Editorial UNPSA, Quito, 1981. CAICEDO, Byron: Nomenclatura de química inorgánica. Gráficas Mediavilla Hnos., Quito, s/f. CLARKLE, John: Química. Red Editorial Iberoamericana Andes, Bogotá, 1987. EQUIPO DE REDACTORES DE EDITORIAL DON BOSCO: Química, Editorial Don Bosco, Cuenca, 1997. G.F, Liptrot: Química Inorgánica Moderna. Editorial Continental S.A, Mexico, 1977, Ingles, Traducido por Quim. Gustavo Garduño Sanchez. GISPERT, Carlos y otros: Enciclopedia autodidáctica Océano, tomo 3. Ediciones Océano- Éxito S. A., Barcelona 1987. GRAN ENCICLOPEDIA ILUSTRADA CÍRCULO: Química. Circulo de lectores, Barcelona, 1988. MARTINEZ, Antonio y otros: Nomenclatura y formulación químicas. Segunda edición, Editorial Bruño, Madrid, 1980. HAMPEL y HAWLEY: Diccionario de química. Editorial Grijalbo S. A., Barcelona, 1986. SÁNCHEZ, Fausto: Química General. V curso, Cuenca, 1992. SÁNCHEZ, Jorge: Química 1. Editorial Don Bosco, Cuenca, s/f. 193 INDICE Páginas Portada………………………………………………………….………...……………...1 Dedicatoria…………………………………………………….………………..……….2 Agradecimiento……………………………………………….…………………….…...3 Introducción…………………………………………………….……………………….4 Objetivo general………………………………………………..………………………..5 Objetivos específicos…………………………………………………………...............5 PARTE I GENERALIDADES…………………………………..………………...6 1. DIVISIBILIDAD DE LA MATERIA……………………………………………….6 1.1. Introducción…………………………………….…………………………………..6 1.2. División de la materia…………………………………………………....................6 1.3. Modelo atómico actual……………………………………………………………..7 1.4. Estructura atómica………………………………………………………………….7 1.5. Números cuánticos……………………………………………………..................11 1.6. Distribución electrónica de los electrones………………………………………...16 1.7. Orden creciente de los subniveles de energía…………...........................................16 2. CLASIFICACIÓN PERIÓDICA……………………..……...……………………...17 2.1. Introducción…………………………………………………….………………….17 2.2. Clases de elementos…………………………………………………….………….18 2.3. Los períodos…………………………………………………………………….....19 2.4. Las familias o grupos………………………………………………………………19 2.5. Propiedades periódicas de los elementos…………………………………………..20 3. ENLACES QUÍMICOS…………………………………………………………....22 3.1. Combinacion química o afinidad química……………………..............................22 3.2. Clases de enlaces atómicos………………………………………………………...22 3.3. Fórmula química…………………………………………………………………...26 3.4. Notación de los elementos…………………………………………………………27 3.5. Nomenclatura de los elementos……………………………………………………27 3.6. Clasificación de los elementos…………………………………………………….28 3.7. Sustancias compuestas…………………………………………………………….30 3.8. Coeficiente, prefijos, subíndice y paréntesis………………………………………31 4. PRINCIPALES COMBINACIONES QUÍMICAS………………….…………........32 4.1. Compuestos binarios…………………………………………………...…………..32 4.2. Formulación de los compuestos binarios…………………………………….........32 4.3. Sistemas de nomenclatura………………….……………………………………...32 4.4. Otras reglas y conceptos generales………………………………………...………35 194 PARTE II NOMENCLATURA Y NOTACIÓN DE LOS COMPUESTOS QUÍMICOS.36 1. COMPUESTOS NO OXIGENADOS………………………………………….…...37 1.1. HIDRUROS………………………………………………………………….....37 1.1.1. Hidruros metálicos……………………………………………………..……..37 1.1.2. Hidruros no metálicos……………………….……………….……………….40 1.2. ALEACIONES Y AMALGAMAS…………………………………………....43 1.3. COMPUESTOS ENTRE NO METALES……………………………………..45 1.4. COMBINACIÓN ENTRE METAL Y NO METAL…………………………..46 1.4.1. Sales binarias neutras…………………………………………………………46 1.4.2. Combinación de metales con no metal de los grupos IV y V………………..49 1.4.3. Polisulfuros, poliseleniuros y politelururos………………………………….50 2. COMPUESTOS OXIGENADOS…………………………………………………51 2.1. ÓXIDOS………………………………………………………………………..51 2.1.1. Óxidos básicos u óxidos metálicos…………………………………………...51 2.1.2. Óxidos ácidos o anhídridos…………………………………………………..58 2.1.3. Óxidos neutros………………………………………………………………...65 2.1.4. Óxidos compuestos……………………………………………………………66 2.1.5. Peróxidos………………………………………………………………………67 2.2. HIDRÓXIDOS METALICOS O BASES...……………………………………72 2.3. ÁCIDO OXÁCIDOS……………………………………………….…………..79 2.3.1. Oxácidos simples……………………………………………………………...82 2.3.2. Oxácidos polihidratados………………………………………………………88 2.3.3. Oxácidos de metales…………………………………………………………..91 2.3.4. Tioácidos, selenoácidos y teluroácidos……………………………………….93 2.3.5. Peroxoácidos…………………………………………………………………..95 2.4. SALES………………………………………………………………………...100 2.4.1. Sales neutras………………………………………………………………...100 2.4.1.1. Sales de oxoácidos simples……………………………………………….100 2.4.1.2. Sales de oxácidos polihidratados…………………………………………106 2.4.1.3. Sales de oxácidos de metales………………………………………….....110 2.4.2. Sales ácidas…………………………………………………………………..121 2.4.2.1. Sales ácidas de los ácidos hidrácidos…………………………………….121 2.4.2.2. Sales ácidas de los oxoácidos…………………………………………... 123 2.4.3. Sales básicas…………………………………………………………………125 2.4.3.1. Sales básicas de aniones simples…………………………………………126 2.4.3.2. Sales básicas con aniones de oxoácidos………………………………….128 2.4.4. Sales dobles………………………………………………………………….130 2.4.4.1. Sales formadas por un anión y dos cationes……………………………..130 2.4.4.2. Sales formadas por un catión y dos aniones……………………………..135 PARTE III FUNDAMENTOS APLICACIONES Y RIESGOS……..….…….. 140 CONCLUSIONES………………………………………………………………….....176 BIBLIOGRAFÍA………………………………………………………..………….....193 INDICE………………………………………………………………………………..194 195