5TA SEMANA CEPRE UNMSM
Anuncio
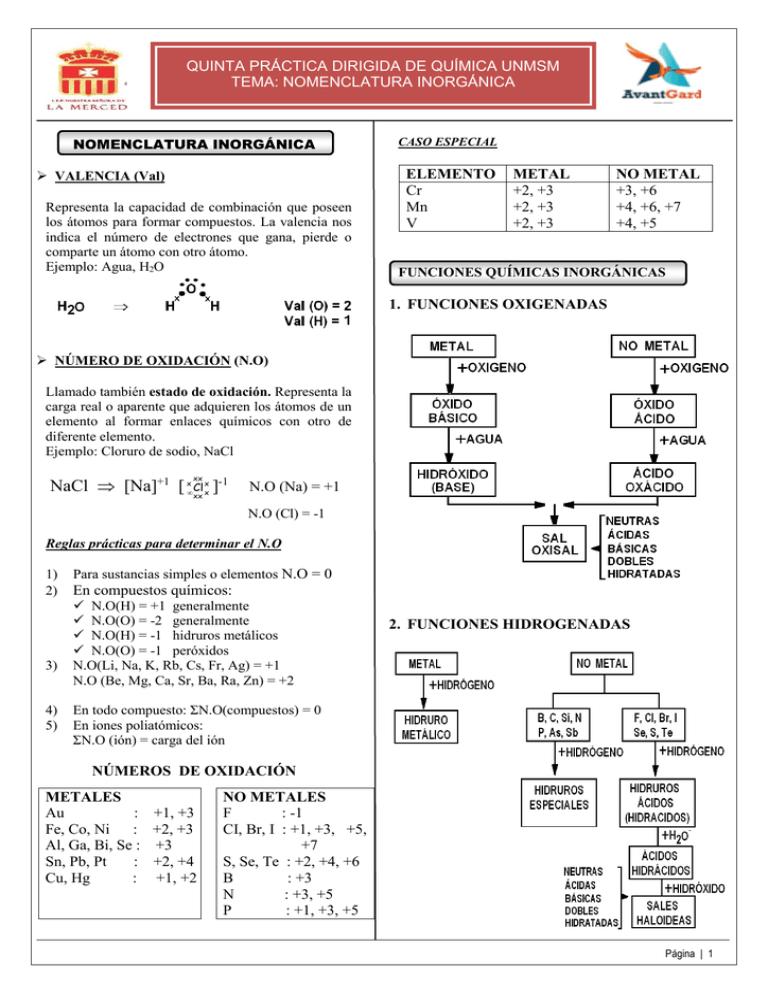
QUINTA PRÁCTICA DIRIGIDA DE QUÍMICA UNMSM TEMA: NOMENCLATURA INORGÁNICA NOMENCLATURA INORGÁNICA VALENCIA (Val) Representa la capacidad de combinación que poseen los átomos para formar compuestos. La valencia nos indica el número de electrones que gana, pierde o comparte un átomo con otro átomo. Ejemplo: Agua, H2O CASO ESPECIAL ELEMENTO Cr Mn V METAL +2, +3 +2, +3 +2, +3 NO METAL +3, +6 +4, +6, +7 +4, +5 FUNCIONES QUÍMICAS INORGÁNICAS 1. FUNCIONES OXIGENADAS NÚMERO DE OXIDACIÓN (N.O) Llamado también estado de oxidación. Representa la carga real o aparente que adquieren los átomos de un elemento al formar enlaces químicos con otro de diferente elemento. Ejemplo: Cloruro de sodio, NaCl xx x -1 NaCl ⇒ [Na]+1 [ x• Cl ] xx x N.O (Na) = +1 N.O (Cl) = -1 Reglas prácticas para determinar el N.O 1) 2) 3) 4) 5) Para sustancias simples o elementos N.O = 0 En compuestos químicos: N.O(H) = +1 generalmente N.O(O) = -2 generalmente N.O(H) = -1 hidruros metálicos N.O(O) = -1 peróxidos N.O(Li, Na, K, Rb, Cs, Fr, Ag) = +1 N.O (Be, Mg, Ca, Sr, Ba, Ra, Zn) = +2 2. FUNCIONES HIDROGENADAS En todo compuesto: ΣN.O(compuestos) = 0 En iones poliatómicos: ΣN.O (ión) = carga del ión NÚMEROS DE OXIDACIÓN METALES Au : +1, +3 Fe, Co, Ni : +2, +3 Al, Ga, Bi, Se : +3 Sn, Pb, Pt : +2, +4 Cu, Hg : +1, +2 NO METALES F : -1 CI, Br, I : +1, +3, +5, +7 S, Se, Te : +2, +4, +6 B : +3 N : +3, +5 P : +1, +3, +5 Página | 1 “Año de la Diversificación Productiva y del Fortalecimiento de la Educación” SISTEMA DE NOMENCLATURA 1. NOMENCLATURA CLÁSICA O ANTIGUA 3. Marque la alternativa que corresponde a la función oxigenada y el nombre correcto para los compuestos propuestos. A) B) C) D) E) 4. Respecto a la formación de compuestos oxigenados, marque la secuencia de verdadero (V) o falso (F) según corresponda. 2. NOMENCLATURA STOCK Se nombra escribiendo: O xido de nom bre del elem ento ( E.O. ) (E.O): estado de oxidación 3. NOMENCLATURA SITEMÁTICA (IUPAC) Se nombra escribiendo: Prefijo óxido de prefijo nombre del elemento El prefijo que se utiliza depende de la cantidad de átomos PREFIJO MONO DI TRI TETRA #ÁTOMOS 1 2 3 4 NOTA: Si en el óxido hay un solo átomo del elemento, se omite el prefijo mono SEMANA N°5: NOMENCLATURA INORGÁNICA 1. Respecto a los Números de Oxidación (N.O.), marque la alternativa INCORRECTA. A) Los metales alcalinos y alcalino-térreos presentes en los compuestos, toman valores de +1 y +2 respectivamente. B) El hidrógeno combinado a un metal tiene el número de oxidación – 1 C) En los peróxidos el número de oxidación del oxígeno es –1 D) En un ión poliatómico, la suma de los N.O. debe ser igual a la carga del ión. E) Un elemento metálico libre tiene el número de oxidación positivo. 2. Marque la alternativa que contiene el mayor número de oxidación del nitrógeno en las siguientes especies: A) NH4OH D) NO B) NH3 Fe2O3 : óxido básico - óxido de hierro (II) P4O10 : anhídrido - anhídrido fosforoso CaO : óxido ácido - óxido de calcio Pb(OH)2 : hidróxido - hidróxido plumboso Co2O3 : óxido ácido - óxido cobáltico C) (NO2)1– E) N2O5 I. Hidróxido + ácido oxácido = sal oxisal + agua. ( ) II. Anhídrido + agua = hidróxido. ( ) III. Oxido ácido + agua = ácido oxácido. ( ) IV. Oxido básico + agua = hidróxido. ( ) A) VVFF D) FFVV B) VFFV C) FVVF E) VFVV 5. Complete escribiendo la fórmula y el nombre del producto respectivamente I. SnO2 + H2O → …………………… II. SO3 + H2O → .………..…………. III. Br2O3 + H2O → …………………… A) Sn(OH)2 (hidróxido estannoso); H2SO4 (ácido sulfúrico): HBrO2 (ácido bromoso ) B) Sn(OH)4 (hidróxido estannico); H2SO3 (ácido sulfuroso): HBrO2 (ácido brómico ) C) Sn(OH)2 (hidróxido estannoso); H2SO4 (ácido sulfúrico); HBrO4 (ácido perbrómico ) D) Sn(OH)4 (hidróxido estannico); H2SO4 (ácido sulfúrico); HBrO (ácido hipo bromoso ) E) Sn(OH)4 (hidróxido estannico); H2SO4 (ácido sulfúrico); HBrO2 (ácido bromoso ) 6. Relacione la fórmula con la función respectiva. a) N2O5 ( ) hidróxido b) H2CO3 ( ) óxido ácido c) SrO ( ) ácido oxácido d) Ni(OH)2 ( ) óxido básico e) NaClO ( ) sal oxisal A) dabce D) bceda B) cbdea C) dacbe E) ecbda 7. Indique la alternativa que muestra el nombre y la formación correcta de la sal oxisal. A) HBrO4 + KOH → KBrO4 + H2O de potasio B) HNO3 + Ca → Ca(NO3)2 + H2 de cálcio bromato dinitrato Página | 2 “Año de la Diversificación Productiva y del Fortalecimiento de la Educación” C) HClO + NaOH → NaClO + H2O de sódio D) HIO4 + KOH → KIO4 + H2O de potasio E) H3PO4 + Fe(OH)3 → FePO4 + H2O férrico hipoclorito peryodato A) B) C) D) E) II) SnH4 III) CrH2 V) PbCl4 Tetracloruro de plomo hidruro de calcio Tetrahidruro de estaño hidruro de cobre Dihidruro de cromo hidruro cúprico Tetracloruro de plomo dihidruro de calcio Tetrahidruro de estaño hidruro cuproso 9. Indique el nombre común de la alternativa que contenga un hidrácido y un ácido hidrácido respectivamente. A) H2Se(ac) HCl(g) B) HI(g) H2S(g) C) SnH2(s) H2S(ac) D) Na2S(s) HCl(ac) E) HCl(g) H2Se(ac) ácido selenhídrico cloruro de hidrógeno yoduro de hidrógeno sulfuro de hidrógeno hidruro estannoso ácido sulfhídrico sulfuro de sodio ácido clorhídrico cloruro de hidrógeno ácido selenhídrico A) HCl (g) + H2O(l) → HCl (ac) ácido hidrácido. B) Ca (s) + H2(g) → CaH2(s) hidruro metálico. C) SO2(g) + H2O(l) → H2SO3(ac) ácido oxácido. D) LiOH(ac) + HCl(ac) → LiCl(s) + H2O(l) sal haloidea. E) 4Na(s) + O2(g) → 2 Na2O(s) óxido ácido. 13. Señale la alternativa que relacione formula – nombre INCORRECTO. A) B) C) D) E) Ag2O : óxido de plata (I) Cl2O7 : anhidrido perclórico Ni(NO3)2 : dinitrato de níquel CoBr3 : bromuro de cobalto (III) Ni2(TeO4)3 : telurito niquélico 14. Complete y marque la alternativa que representa la formación del ácido peryódico. I2O3 + H2O → --------------I2O5 + H2O → --------------I2O7 + H2O → --------------I2O + H2O → --------------HI(g) + H2O → --------------- 15. La fórmula , el nombre común y IUPAC, respectivamente, del producto formado I. La fórmula del bromuro de plata es AgBr. II. El ácido bromhídrico es un ácido oxácido. III. La ecuación correspondiente es: 2 Ag(s) + 2 HBr(ac) → 2AgBr(s) + H2(g) B) VFV E) 0, +6, +4, +2 12. Señale la alternativa INCORRECTA respecto a la formación de compuestos. A) B) C) D) E) 10. El bromuro de plata es una sal haloidea que se utiliza en el revelado de fotografías. Se puede obtener a partir del ácido bromhídrico y plata metálica. Al respecto marque la secuencia de verdad (V) o falsedad (F), según corresponda. A) VFF D) FFV B) +2, +2, +6, – 2 fosfito 8. Indique la alternativa que contenga el nombre IUPAC del hidruro donde el metal presenta el mayor número de oxidación, y el nombre común del compuesto donde el metal presenta el menor número de oxidación respectivamente I) CaH2 IV) CuH A) 0, +4, +6, +2 C) 0, +4, +6, – 2 D) +4, +4, +6, +2 3H2S(ac) + 2 Co(OH)3(ac) → …………..+ 6 H2O es A) B) C) D) CoSO3 ; sulfito cobaltoso ; sulfito de cobalto CoSO4 ; sulfato cobaltoso ; sulfato de cobalto CoS ; sulfuro de cobalto; sulfuro cobaltoso Co2(SO4)3 ; sulfato cobaltico; sulfato de cobalto(II) E) Co2S3 sulfuro cobaltico; trisulfuro de dicobalto C) VVV E) FVF 11. El estado de oxidación del azufre en las especies, respectivamente, es I. S8 II. NaHSO3 III. (SO4)2 – IV. SrS Página | 3 “Año de la Diversificación Productiva y del Fortalecimiento de la Educación” Básicos = M+2O2 = M2O2 Óxidos NOMENCLATURA INORGÁNICA Ácidos = x–4O2 = x2O2 M–a(OH)–1 – M(OH)2 Hidróxidos Bases Metálicos = M+aH–2 = MH2 Hidruros No metálicos = H–1x–3 VIA, VIIA Después II. IV . VA H antes NOMENCLATURA INORGÁNICA II Metal No Metal Oxígeno Combinaciones binarias del oxígeno Óxido Básico Óxido Ácido Agua Hidróxido Oxácido Oxisal Haloidea Hidrácido Neutras Ácidas Básica Dobles, mixtas Hidruro Hidrógeno No metal Metal PROBLEMAS RESUELTOS Problema 1 Formular el fosfato de bario. A) Ba3P2 B) Ba3(PO4)2 C) Ba3(PO3)2 D) BaO Problema 2 Determine el número de oxidación del plomo y cobre respectivamente en: PbO2; CuSO4. A) +2, +2 E) BaO2 B) –2; –2 NIVEL FÁCIL Resolución: 3– PO 4 2+ Ba 2+ Ba C) +4; +2 D) –2; +4 fosfato bario 3– (PO4) Ba3 (PO4)2 144424443 fosfato de calcio Respuesta: Ba3(PO4)2 Problema 3 Determine la atomicidad del ácido bórico. A) 1 B) 2 C) 3 D) 4 E) 7 NIVEL INTERMEDIO E) +4; –1 NIVEL INTERMEDIO Resolución: +4 –2 PbO2 Resolución: Ácido bórico H3BO3 Atomicidad = 3 + 1 + 3 +4 –2 +2 +6 –2 Atomicidad = 7 CuSO4 Respuesta: +4; +2 Respuesta: 7 Página | 4 “Año de la Diversificación Productiva y del Fortalecimiento de la Educación” PRÁCTICA DOMICILIARIA 1. El nombre de los compuestos en los sistemas de nomenclatura: • Mg(OH)2 STOCK • Fe(OH)3 • Pb(OH)4 IUPAC STOCK Correspondiente son A) Hidróxido de magnesio; hidróxido ferroso; hidróxido plumboso. B) Hidróxido magnésico; hidróxido férrico; hidróxido plúmbico. C) Hidróxido magnésico; trihidróxido de hierro; hidróxido de plomo. D) Hidróxido de magnesio; trihidróxido de hierro; hidróxido de plomo (IV). E) Hidróxido de magnesio; hidróxido ferroso, hidróxido de plomo (IV). 2. Un ácido hidrácido es: A) H2S B) HF C) CH4 D) HBr E) H2Se(ac) 7. Indique la sal que presenta mayor atomicidad: A) Carnoato de zinc B) Nitrato cúprico C) Sulfato de aluminio D) Fosfato de sodio E) Nitrito férrico 8. Es una sal oxisal y haloidea respectivamente: A) NaH – KO B) Li2O – HgO C) MgO – N2O3 D) Na2CO3 – NaCl E) NaOH – Al2O3 9. La relación correcta es: I K2O a. Oxisal II. Cl2O7 b. Óxido básico III. NaClO c. öxido ácido A) Ib – IIa – IIIc B) Ia – IIb – IIIc C) Ia – IIc – IIIb D) Ib – IIc – IIIa E) Ic – IIb – IIIa 3. Marque las fórmulas que corresponden a la secuencia: sal haloidea – hidróxido – óxido – hidruro A) NaCl – KOH – N2O3 – AsH3 B) MgBr – Al(OH)3 – Cu2O – CCl4 C) Al2S3 – H2SO4 – CO2 – HCl D) K2SO3 – Cr(OH)3 – Sb2O3 –CaH2 E) (NH4)NO3 –Mg(OH)2 – BaO – CaH2 4. Marque las fórmulas que corresponden a la secuencia: ácido oxácido – anhídrido – sal haloidea – hidróxido A) H2SO4 – COO – NaBr – NaOH B) H2SO3 – CO – NaCl –Ca(OH)2 C) H2SO – Na2O – Nal – KOH D) H2S – N2O5 – K2SO4 – Mg(OH)2 E) H2SO4 – P2O5 – K2SO4 – Ba(OH)2 5. La relación fórmula nombre correcta es: A) Sb2O3: óxido antimonioso B) AsO5; anhídrido arsenioso C) CO: óxido carbónico D) SO2: dióxido de azufre E) P2O3: anhídrido fosfórico 6. La relación fórmula - nombre correcta es: A) CaCO3 – carbonato de sodio B) BaSO4 – sulfato de bario (1) C) AgCl – hipoclorito de plata D) Na2S – sulfuro de sodio E) Na2SO3 – sulfato de sodio 10. La relación correcta es: A) KCl: Cloruro de potasio (II) B) H2SO4: ácido sulfúrico C) NaHSO3: hidrógeno sulfato de sodio D) NaClO: hipoclorito de sodio E) NH 4 Cl: tetrahidrógeno cloruro de nitrógeno 11. La A) C) E) fórmula de cloruro de cobre (II) es: CuCl B) Cu2Cl ClCu2 D) CuCl2 Cu2Cl3 12. Si la fórmula del ácido nítrico es HNO3, la fórmula del nitrato de cobre (I) es: A) CuNO3 B) Cu2NO3 C) Cu(NO3)2 D) NO3Cu2 E) Cu2(NO3)2 13. Respecto al sulfato de sodio Na 2SO 4 indique verdadero (V) o falso (F): ( ) Es una sal haloidea ( ) La carga del anión es –1 ( ) ( ) Ca2SO4 resulta de susistir al sodio Está formado de redes iónicas A) FFFF C) FVVV E) FFFV B) FFVV D) VFFV 14. Si la fórmula del ácido nítrico es HNO3, la fórmula del nitrato de hierro (III) es: A) F2(NO3)3 C) Fe(NO2)3 E) FeNO3 B) Fe(NO3)3 D) Fe3NO3 15. La relación fórmula–nombre correcto es: A) H2S: hidruro metálico B) Kl: sal oxisal C) HNO3: sal haloidea D) H2CO3: ácido oxácido E) Fe2O3: anhídrido 16. ¿ C u á l d e l a s s i g u i e n t e s f ó r m u l a s corresponde al permanganato de potasio? A) KMnO3 B) KMn2O8 C) KMn4O7 D) KMn4O8 E) KMnO4 17. El catión férrico es Fe 3+ y el anión dicromato es (Cr 2 O 7 ) 2– . Entonces la fórmula del dicromato férrico es: A) (Cr2O7)3Fe2 B) Cr2O7Fe C) Fe3(Cr2O7)2 D) Fe2(Cr2O7)3 E) Fe3Cr2O7 18. Hallar la atomicidad de los compuestos: ácido brómico – ácido fosfórico. A) 5 – 6 B) 5 – 7 C) 5 – 8 D) 5 – 9 E) 6 – 7 19. ¿Cuál de los siguientes compuestos presenta mayor atomicidad? A) B) C) D) E) perclorato de sodio Nitrato cuproso Sulfato de calcio Carbonato de sodio Hioclorito plúmbico 20. Nombrar: HClO A) ácido hipocloroso B) ácido cloroso C) ácido clórico D) ácido perclórico E) ácido clorhídrico 21. El hidróxido del metal "R" es pentatómico, entonces la fórmula de oxígeno correspondiente es: B) RO2 A) R2O3 C) R2O D) RO E) R2O2 22. El hidróxido de un metal presenta 7 átomos por moléculas. ¿Cuántos átomos de oxígeno presenta una molécula de su fosfato metálico, en donde el metal actúa con la misma valencia? A) 4 B) 5 C) 6 D) 7 E) 8 Página | 5




