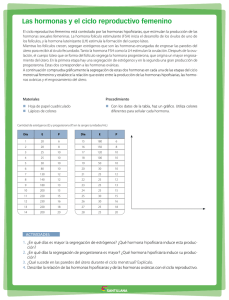
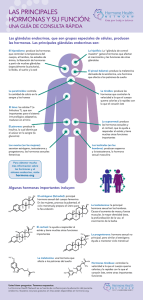
descargar documento - Ministerio de Ciencia, Tecnología e
Anuncio

DE LA PROBETA A LOS GENES Hormona de crecimiento, una epopeya científica argentina Descripción científica Juan M. Dellacha Y José A. Santomé. Nora Bär índice Prólogo 7 Frigoríficos y mecheros de Bunsen 10 Carrera contra el tiempo 17 La “fabriquita” 23 De la mesada al consultorio 29 Cambio de rumbo 37 Una palabra que todavía no estaba de moda 40 Una oveja llamada Dolly 46 La ingeniería de la vida 53 La farmacia en el tambo 63 Broche de oro 67 Epílogo 74 Los protagonistas 80 5 6 DESCRIPCIÓN CIENTÍFICO- TÉCNICA. HORMONA DE CRECIMIENTO. | Estudios realizados en Argentina. Juan M. Dellacha - José A. Santomé. 85 Sumario 86 Formación del grupo de trabajo para: el estudio de la hormona de crecimiento / Creación del Centro para el Estudio de las Hormonas Hipofisarias (CEHIP) 91 Investigaciones sobre hormonas del crecimiento del período 1963-1976 98 Investigaciones sobre hormonas del crecimiento posteriores a 1976. División del Grupo de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA 111 Colaboración con la industria de investigadores de hormonas de crecimiento 136 Anexo A. Estructura de proteínas 142 Anexo B. Breve descripción de los fundamentos y metodología empleada para determinar la estructura primaria de la hormona de crecimiento bovina 143 Anexo C. Evolución de las metodologías para determinar la estructura primaria de proteínas 148 Anexo D. Resumen de los conocimientos estructurales actuales sobre hormonas de crecimiento 150 Anexo E. Receptores hormonales 152 Registro fotográfico 153 PRÓLOGO A los nueve años, después de perder a su papá, Jóseph Boruwlaski fue entregado por su madre como acompañante y entretenimiento de aristócratas. Jóseph había nacido apenas nueve años antes, en Polonia, y de allí en más se dedicó a recorrer las cortes de París, Viena y Londres, deslumbró a príncipes y reyes, y hasta escribió un libro sobre sus aventuras y experiencias. Es más, su celebridad le valió una entrada de la célebre Enciclopedia Diderot. Allí aparece citado en la definición de “enano”: según las crónicas de la época y sus propios recuerdos, no llegó a superar el metro de altura. Se calcula que uno de cada cinco o seis mil de los bebés que nacen diariamente en el mundo pueden padecer esta dolencia causada en la mayoría de los casos por un déficit hormonal que, sin atención médica, les impedirá alcanzar una altura considerada normal. Su hipófisis, una glándula de forma ovalada situada en la base del cráneo, que mide milímetros, y pesa entre 500 y 700 miligramos, produce una proteína vital para que los tejidos se desarrollen, entre otras numerosas funciones: la hormona de crecimiento. Su carencia no sólo se traduce en baja estatura, sino también en una irregular acumulación de grasa, particularmente en el tronco, hipersensibilidad a la insulina, rasgos infantiles, fragilidad ósea. En el 7 recién nacido, puede ocasionar hipoglucemias graves, que a su vez pueden dejar secuelas cognitivas. Hasta hace cuatro décadas, los chicos nacidos con el mismo déficit que padeció Jóseph Boruwlaski (y dos de sus cinco hermanos) no podían aspirar más que a una vida de “fenómenos”. Las sociedades humanas, se sabe, no perdonan a los que no caben en el molde de lo previsto. Hoy, detectado a tiempo, el enanismo hipofisario puede evitarse reemplazando la hormona faltante por una versión prácticamente idéntica… fabricada en el laboratorio. Basta con realizar el tratamiento adecuado durante la adolescencia para suplir lo que la naturaleza niega. Este consiste en administrar una inyección subcutánea de la hormona biosintética tres veces por semana durante ocho a diez años. El resultado es notable: los chicos que responden bien pasan de crecer tres centímetros anuales a doce, y ganan en total unos treinta. Es la diferencia entre llegar –o no– a presionar los pedales del automóvil, alcanzar los pasamanos de los colectivos y subtes, poder mirar por sobre el mostrador del banco, tener derecho a unas fichas en la “lotería del amor”, o poder presentarse a una entrevista de trabajo sin escuchar un “no” antes de siquiera abrir la boca. Esos 30 centímetros marcan la distancia, en suma, entre insertarse en la trama social o quedar relegado a los márgenes. La historia de la decodificación, el desarrollo y la producción industrial de la hormona de crecimiento humana abarcó más de tres décadas del último siglo. Como muchos otros logros humanos, fue una historia de tenacidad, pasión, inteligencia y mucho, mucho traba8 jo. Pero lo más singular, para los que vivimos en esta parte del mundo, es que tuvo como protagonistas a dos generaciones de científicos argentinos que, aunque muchas veces competían con equipamiento casero y menos recursos que sus colegas del hemisferio norte, marcaron hitos científicos que ya forman parte sustancial de la gran novela de la ciencia mundial. Hombres y mujeres que trabajaron sin descanso para desentrañar uno a uno los 191 ladrillos (aminoácidos) que componen la estructura de la hormona sintetizada, almacenada, y secretada por las células somatotropas de la hipófisis no sólo investigaron en las fronteras del conocimiento de su época y publicaron sus trabajos en algunas de las revistas más prestigiosas del mundo científico, sino que al mismo tiempo hicieron posible que decenas de chicos hasta ese momento excluidos –u ocultados por sus propias familias– recibieran un tratamiento médico que les cambió la vida. Luego, fueron algunos de sus alumnos de la Universidad de Buenos Aires, que ya habían abandonado las aulas y perseguían otros horizontes, los que tomaron la posta y siguieron avanzando para producir la hormona no ya manipulando probetas… sino insertando genes humanos en bacterias ¡y hasta desarrollando animales transgénicos capaces de producir en sus células la hormona humana!, una tecnología que dominan sólo un puñado de países. De esa aventura que tuvo ribetes de epopeya trata este libro. 9 FRIGORÍFICOS Y MECHEROS DE BUNSEN Corre 1958. El célebre Domenico Modugno se consagra en el Festival de San Remo y en la Argentina, Arturo Frondizi acaba de asumir la presidencia después de haber sido elegido en elecciones en las que está proscrito el peronismo. Es el Año Geofísico Internacional, y más de 30.000 científicos y técnicos de 66 países se unen para realizar observaciones sobre la Tierra y sus alrededores cósmicos. Impulsada por la tecnología, la humanidad avanza a grandes pasos, tanto a ras del suelo como en el espacio. La expedición neozelandesa dirigida por Edmund Hillary llega al Polo Sur. Rusos y norteamericanos hacen sus primeros intentos de enviar satélites fuera de la atmósfera y confirman que no es tarea sencilla. El Sputnik 1 se desintegra a poco de ser lanzado y el cohete Atlas estalla en la plataforma de lanzamiento de Cabo Cañaveral; es el quinto fracaso de siete intentos de lanzamiento. James Van Allen descubre los “cinturones” que llevan su nombre, dos zonas de radiación de alta energía que circundan la Tierra, probablemente donde el viento solar y los rayos cósmicos interactúan con los átomos de la atmósfera. Son los primeros días de la NASA, cuando se pone en órbita el primer satélite de comunicaciones de la historia. 10 La ciencia empieza a estar cada vez más presente en los titulares de la prensa. Por el Decreto Ley 1291, promulgado el 5 de febrero, ese año nace en la Argentina el Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). El doctor Bernardo Houssay, que en 1947 había ganado el Premio Nobel de Fisiología y Medicina por su trabajo sobre la influencia del lóbulo anterior de la hipófisis en la distribución de la glucosa en el organismo –o, dicho de otro modo, por demostrar que la hormona de crecimiento es antiinsulínica–, es elegido presidente, y el meteorólogo Rolando García, vicepresidente, ambos por unanimidad. Según cuentan Diego Hurtado y Adriana Felds en un artículo para la revista Nómada, sólo dos años más tarde se crea la llamada “carrera del investigador”, que por primera vez permitiría a científicos argentinos dedicarse por completo a la investigación y la docencia. También se ponen en marcha un programa de becas destinadas a la formación de recursos humanos tanto en el país como en el extranjero, y un programa de subsidios para investigaciones específicas, y adquisición de equipos e instrumental, repatriación, contratación de investigadores extranjeros y viajes al exterior. En la entonces Facultad de Ciencias Médicas de la Universidad de Buenos Aires, en el Instituto de Histología y Embriología, dirigido por el doctor Eduardo De Robertis, integrante del primer directorio del CONICET, el profesor Carlos Gómez, Juan Dellacha y Roberto Mancini empiezan a estudiar la distribución de ciertas proteínas en los tejidos marcándolas con moléculas fluorescentes, una técnica que estaba comenzando a utilizarse en el mundo. Lo que hacían era inyectarles a roedores proteínas marcadas con un colorante que tiene la particularidad de emitir fluorescencia rojiza cuando se lo excita con luz ultravioleta, la lisamina rodamina B 200. Después las sacrificaban en distintos momentos y procesa11 ban los tejidos que resultaban de interés para estudiarlos bajo el microscopio. Haciendo cortes muy delgados, los científicos podían observar dónde se ubicaba la proteína, técnica esencial para saber cómo actúa una hormona. En esos años prevalecía la idea que las hormonas no penetraban en las células, pero Dellacha y Mancini, trabajando con la tirotrofina (TSH, según sus siglas en inglés), que es secretada por el lóbulo anterior de la hipófisis y que le indica a la tiroides que debe aumentar su producción de tiroxina y triodotironina, la inyectaron en ratas de laboratorio y a los pocos minutos la localizaron en la membrana celular de la tiroides. Instantes más tarde, la fluorescencia desaparecía de la membrana y aparecía en el interior de la célula, lo que constituyó una elegante demostración de que la hormona sí ingresaba en el citoplasma celular, donde produce su efecto característico. Estos experimentos refutaron un dogma de la época, se publicaron en Nature y fueron los primeros en demostrar que las hormonas penetran en la célula blanco a los pocos minutos de ser inyectada. Más tarde, Dellacha y Mancini marcarían con la proteína fluorescente la hormona de crecimiento, y también probarían el mismo efecto. Dellacha era entonces un joven científico que, gracias a esos trabajos, obtuvo la única beca que ofrecían los Institutos Nacionales de Salud de los Estados Unidos a la Argentina para formarse en el Instituto Sloan-Kettering de Investigación del Cáncer bajo la dirección del doctor Martin Sonenberg. Había nacido en el barrio porteño de Caballito, sobre la avenida Juan Bautista Alberdi, salpicada de plazoletas, polvo de ladrillo, canteros y grandes jarrones con plantas, y bordeada de casas bajas. Hijo de un empresario textil que había comenzado a trabajar des12 de muy joven como artesano en herrería y que junto con dos hermanos había hecho parte de la verja de la Catedral de La Plata, Dellacha sospecha que recibió de su padre parte de su curiosidad e ingenio técnico. “No era científico, pero tenía una gran inclinación técnica –recuerda–. Le doy un ejemplo: tanto mi padre como mis dos tíos solían guardar en una caja las agujas que se usaban en las máquinas textiles que se rompían por arriba y en otra, las que se rompían por abajo. Cuando estalló la Segunda Guerra Mundial, las agujas, que eran de fabricación británica, dejaron de llegar al país y muchas fábricas tuvieron que cerrar. Pero ellos inventaron un sistema para unir ambas partes, las soldaban con bronce, y así pudieron mantener la producción.” Dellacha había egresado como maestro de la escuela Mariano Acosta. Pero dado que se habían eliminado las equivalencias entre el magisterio y el bachillerato, para dar el ingreso a la Escuela de Farmacia y Bioquímica de la Facultad de Ciencias Médicas de la Universidad de Buenos Aires, rindió todas las materias de cuarto año entre diciembre y marzo, y cursó quinto en el Urquiza, de Carabobo y Pedro Goyena. Como practicante en la farmacia del Hospital de Niños, fue compañero del legendario Carlos Gianantonio. Si bien en esos días la carrera de científico era algo así como una excentricidad, una anécdota deja ver que ya lo dominaba la pasión del investigador. “Al hospital llegaban muchos chicos deshidratados –cuenta–. Yo me había comprado el libro Bioquímica de la Enfermedad, de Bodansky y Bodansky, que en uno de sus capítulos desarrollaba el tema de la deshidratación infantil, y establecía la importancia de la determinación de la reserva alcalina para su tratamiento. Así que fuimos con Gianantonio al laboratorio de infantes, que era el de los chicos más chiquitos, 13 y le pedimos al director que en nuestros días de guardia nos dejara hacer el análisis de las reservas alcalinas de esos chicos para poder formular un pronóstico. Ahí ya estábamos empezando a investigar...” Otro día, llegó un chico con síntomas que los médicos no alcanzaban a reconocer. Finalmente, les pareció que estaban ante un caso de escorbuto, algo excepcional en esta parte del mundo. Pero no había cómo probarlo. A Dellacha se le ocurrió que los laboratorios Roche debían tener un reactivo para detectar la deficiencia de vitamina C y les pidió que se lo proporcionaran. “Hicimos el análisis y se confirmó, tenía una carencia absoluta”, recuerda. En 1962, Alejandro Paladini, profesor titular de Química Biológica I en la Facultad de Farmacia y Bioquímica, que había intervenido en los trabajos que le valieron el Nobel a Luis Federico Leloir y el único que en ese momento hacía investigación desde el punto de vista metabólico, lo invitó junto con otro joven investigador, José Santomé, a un concurso de profesores adjuntos en el Departamento de Química Biológica. Paladini recuerda haberle propuesto a Dellacha regresar desde Nueva York para incorporarse a su grupo. “No tenía otro lugar de trabajo, salvo el Hospital de Niños, pero allí no tendría ninguna posibilidad de continuar con sus investigaciones –dice–. Nosotros teníamos un instituto que habíamos armado para estudiar proteínas. Además teníamos algún instrumental caro, como una ultracentrífuga analítica, que ya no usaba nadie. Con esa centrífuga probó que las dos hormonas de crecimiento, la humana y la bovina, tenían el mismo peso aproximadamente.” Santomé había nacido en Parque Patricios y, a pesar de que su padre tenía inclinación por la literatura, desde chico se sintió deslumbra14 do frente al mundo natural. “Teníamos todo tipo de animales: pavos, patos, palomas, y un año llegamos a criar 53 pollos –recuerda, divertido–. Yo estudiaba qué comían, cómo iban creciendo. Me interesaba cómo vivían.” Nunca se había imaginado que podía dedicarse a la ciencia, pero en la escuela secundaria Bernardino Rivadavia, después de haber pasado por un colegio religioso, se interesó por la química y las ciencias exactas. “Me atraía mucho la evolución; de hecho, trabajé durante varios años en la evolución de la proteína transportadora de ácidos grasos”, cuenta. Cuando llegó el momento de ingresar a la facultad, se decidió por la bioquímica, una carrera que debió cursar mientras desempeñaba diversos trabajos, porque su padre falleció mientras comenzaba sus estudios universitarios. “Llegué a trabajar en cinco lugares diferentes al mismo tiempo –exclama–: en una clínica oncológica, en los laboratorios Dupont, realizando análisis clínicos en un laboratorio... Y en todos lados introducía una modificación en los métodos existentes. Mis compañeros siempre me decían que tenía que dedicarme a la investigación.” Uno de los temas del laboratorio de Sonenberg era la hormona de crecimiento. En esos tiempos era común utilizar insulina de origen animal para el tratamiento de la diabetes en personas. Dado que es casi idéntica a la humana, se la extraía del páncreas de la vaca, el caballo, el cerdo y hasta de ciertos pescados, aunque en algunos casos producía alergia por deficiencias en su purificación. De allí surgió la idea de estudiar la posibilidad de utilizar la hormona de crecimiento bovina para tratar la deficiencia de la misma proteína en chicos, recuerdan hoy los investigadores. Sin embargo, entre muchos otros obstáculos derivados de la tecnología disponible 15 para estudiarla, había uno fundamental: la hormona de crecimiento distaba mucho de ser homogénea; es decir, estaba acompañada de otros elementos. Lo sabían porque cuando la analizaban por centrifugación, la velocidad de sedimentación indicaba que estaban ante varias sustancias. Y lo mismo ocurría cuando la sometían a electroforesis libre, una técnica para separar moléculas de acuerdo con su movilidad en un campo eléctrico. El procedimiento se realizaba sobre un acetato o a través de una matriz porosa donde se ubican en distintos lugares de acuerdo con su carga. Dellacha propuso entonces elaborar un método para preparar, a partir de hipófisis bovinas, hormona de crecimiento homogénea para emplearla en forma terapéutica. Aunque lo lograron al cabo de un par de meses, luego se vio que la idea inicial sería impracticable porque sólo la hormona de crecimiento humana y de simio eran activas en las personas, por lo que sería imposible usar hormonas de crecimiento de otros mamíferos en la clínica médica. Entre otras causas, se especuló con que no actuaban debido a su tamaño molecular, ya que se creía que en las hormonas humana y de simio era aproximadamente la mitad del de otras especies animales. De hecho, algunos laboratorios en el mundo intentaron modificarlo mediante digestiones enzimáticas controladas para obtener un producto activo en humanos a partir de hormonas animales. Esas manipulaciones permitieron comprobar efectos metabólicos y anabólicos (promotores del crecimiento muscular). Se descubrió, por ejemplo, que producían retención de nitrógeno, una señal de que había síntesis de proteína. “Es decir, había cierta acción, pero no la acción. No hacían crecer”, recuerda Santomé. 16 Carrera contra el tiempo A pesar de las dificultades, a su regreso de los Estados Unidos Dellacha siguió dispuesto a continuar en el tema e invitó a Paladini y Santomé a formar un equipo de trabajo para así poder atacar el problema de la hormona de crecimiento bovina desde varios ángulos simultáneamente. El proyecto estaba “en la cresta de la ola” y poseía el atractivo agregado de que podía ayudar a aclarar porqué esa proteína no actuaba en seres humanos y, tal vez, permitir su modificación estructural para que sí lo hiciera. Además, pensaron los científicos, también podría contribuir al tratamiento de chicos con retardo de crecimiento de origen hipofisario mediante la obtención de hormona a partir de hipófisis humanas cadavéricas. Esta decisión los llevó a ser protagonistas de una competencia internacional en la que tendrían que medirse con científicos del mundo desarrollado que estaban tras la misma meta. Según cuenta en Días de Ciencia (Eudeba, 2010), Paladini venía de trabajar en el Instituto Rockefeller, de Nueva York, con Lyman Craig, en la purificación de mezclas complejas con la técnica de distribución en contracorriente, y con Moore y Stein, en la determinación de 17 la composición en aminoácidos de las proteínas por cromatografía, que consiste en filtrar una solución de la mezcla que se desea analizar a través de un medio poroso. Dellacha y Santomé recuerdan que el departamento de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA tenía en ese entonces una buena cámara frigorífica que había hecho construir precisamente Paladini. “Él la necesitaba porque trabajaba en angiotensina de origen bovino”, cuentan. La angiotensina, hormona que eleva la presión sanguínea y de la que hoy se sabe que hay tres versiones, había sido descubierta por el fisiólogo argentino Eduardo Braun-Menéndez y su grupo hacia 1939. Toda proteína, y las hormonas lo son, es una cadena lineal de aminoácidos. Para poder catalogarlos, un paso ineludible para lograr el objetivo que se habían planteado, Dellacha y Santomé se enfrentaban al desafío de producir y conservar cantidades importantes de hormona de crecimiento bovina. Y como para poder extraerla es indispensable mantener el tejido a una temperatura constante de entre cero y cinco grados centígrados, esa cámara frigorífica resultaba un recurso ideal para montar una pequeña fábrica. Lejos del glamour con que hoy los retrata el cine, los científicos de esos tiempos estaban obligados a asumir también el papel de artesanos. El propio Paladini cuenta en su autobiografía que, tal vez por las vivencias que le había transmitido su padre escultor, tenía una inclinación marcada por las artes manuales y que lo deslumbraba la tarea de los vidrieros científicos. Ellos transformaban “sencillos tubos en complicados aparatos”, dice, que luego se usaban en los laboratorios. Pero en el proyecto que iban a acometer, los científicos y técnicos que participaron no sólo tendrían que “meter las manos en la masa”, 18 sino que además terminarían enfrentándose a una tarea titánica. La historia, reconstruida hoy por Dellacha y Santomé, había comenzado con una propuesta de Paladini, que consideró que el primer aporte que el grupo podría hacer sería la separación de las tres bandas que aparecían cuando se la sometía a electroforesis en geles de poliacrilamida, lo que les permitiría verificar la homogeneidad de la hormona de crecimiento bovina. Para esto, el laboratorio disponía de un moderno equipo de distribución en contracorriente de 1.000 tubos, sistema que había demostrado un elevado poder de resolución de mezclas complejas, incluyendo polipéptidos (moléculas de más de diez aminoácidos), pero que no se había probado en proteínas. La distribución en contracorriente es una técnica que había sido desarrollada por Lyman Craig para resolver las dificultades que exigía establecer la pureza química exacta de las drogas complejas para prevenir y tratar la malaria, de elevado peso molecular e inestabilidad química, que se introdujeron en la Segunda Guerra Mundial. “Craig transformó una operación clásica en química, como es el reparto de una substancia entre dos solventes no miscibles, en un método de purificación de mezclas complejas, cuya potencialidad es, teóricamente, ilimitada”, escribe Paladini en Días de Ciencia. Según explica el investigador, la operación era increíblemente trabajosa. Consistía en introducir una sustancia pura en la primera ampolla de la serie de 1.000, junto con volúmenes iguales de dos líquidos que no se mezclan, como el éter y el agua. Se agitaba la ampolla durante un tiempo, hasta que se distribuía la sustancia entre los dos líquidos, y luego se pasaba la fase superior a la ampolla siguiente, que solo contenía agua. Luego se agitaban ambas ampollas, y se pasaba el líquido de la primera a la segunda, y se reponía la sustancia pura en la primera. Este proceso se repetía cada vez con una nueva ampolla, de modo que la sustancia se iba distribuyendo entre dos ca19 pas de líquidos no miscibles que circulaban en direcciones opuestas. Uno de los primeros frutos de esta técnica fue la purificación química de la penicilina en la Universidad de Cornell, en Nueva York. En Buenos Aires, Paladini, Dellacha y Santomé trabajaron varios meses con ese equipo y enviaron las distintas fracciones que obtenían al laboratorio de Sonenberg, en Estados Unidos, para la determinación de su actividad biológica. Con gran decepción, comprobaron que la distribución en contracorriente desnaturalizaba la molécula de la hormona y la inactivaba. Por esos días, Dellacha recibió un subsidio de 4.000 dólares de los Institutos Nacionales de Salud de los Estados Unidos. Los aportó a todo el grupo y de ese modo pudieron sumar dos nuevos dispositivos que resultaron fundamentales: un destilador y una centrífuga refrigerada, que todavía se guardan entre los equipos del laboratorio. Con estos insumos, los tres investigadores resolvieron que cada uno se ocupara de un aspecto distinto del estudio de la hormona bovina para acelerar la tarea. Así, cada uno avanzaría en su línea de trabajo y luego discutirían en conjunto los resultados para seguir adelante. “A fines de la década de 1960 se había descubierto que las hormonas de crecimiento constituían un grupo de proteínas estrechamente relacionadas, pero con una peculiar especificidad de especie en su actividad biológica. Quiere decir que las hormonas de otros mamíferos no eran activas en primates –dice Santomé–. Estas características decidieron a varios investigadores a intentar modificaciones en distintas hormonas de crecimiento para hacerlas activas en humanos. Pero para aspirar a tener éxito en esa tarea, era muy importante conocer los engranajes moleculares que explicaban ese comportamiento. Con el objetivo de contribuir a la solución del problema, el 20 subgrupo de Paladini exploró algunas características diferenciales de la estructura tridimensional de las hormonas de crecimiento humana, bovina, ovina, porcina y equina.” Con una participación protagónica del rosarino César Cambiaso, que estaba haciendo su tesis de doctorado, pudieron comprobar, por ejemplo, que la hormona de crecimiento humana es de dos a diez veces más permeable al solvente que las otras. También probaron que existen diferencias de especie en la interacción de las hormonas de crecimiento con la membrana de los glóbulos rojos de la sangre (eritrocitos). El subgrupo de Dellacha, por su parte, decidió verificar si era cierta la asignación de un peso molecular de 46.000 a la hormona de crecimiento bovina, aproximadamente el doble del correspondiente a las hormonas de origen humano y de simio. Los resultados, obtenidos con el único equipo que tenía la UBA para determinar el peso molecular de proteínas mediante la técnica de centrifugación analítica, que consistía en medir el desplazamiento de una proteína en solución en un campo gravitacional intenso, les permitieron determinar que rondaba los 22.000, similar al de la hormona humana. Mientras tanto, Santomé y la bioquímica Carlota Wolfenstein incubaron la hormona de crecimiento bovina con diversas enzimas para determinar la secuencia de los aminoácidos del extremo C-terminal de la hormona. Y hasta tuvieron que destilar, con grandes precauciones, hidracina altamente explosiva (es un compuesto químico frecuentemente utilizado como precursor de catalizadores de polimerización y fármacos, pero que también se usa como combustible para cohetes espaciales y satélites). Estos experimentos confirmaron los resultados de Dellacha, que el peso molecular era cercano a 20.000, y rectificaron los datos de otros autores. 21 Wolfenstein recuerda que en esa época era muy tímida, pero fue invitada a integrar la cátedra de Química Biológica porque había dado un examen excelente. “A veces creo que el destino decide por uno lo que va a hacer –confiesa–. A mí me gustaba la medicina, pero me resultaba demasiada la responsabilidad de tener una vida humana en mis manos. La química me gustó en cuanto la cursé. Esa materia era lo máximo para nosotros.” Un dato curioso ayuda a imaginar esos días en los que nacía la ciencia local: las integrantes del grupo de Santomé eran todas mujeres. “El doctor Houssay decía que si uno no tenía un ingreso independiente no podía dedicarse a la investigación, porque de eso no se podía vivir –cuenta Wolfenstein–. Los hombres, que tenían que mantener una familia no podían darse el lujo de trabajar en ciencia.” Y agrega: “Cuando yo empecé, éramos dos becarias, una por Dellacha y otra por Santomé. Empezábamos por preparar la hormona. Recibíamos las hipófisis congeladas, que venían con cartílago, entonces teníamos que entrar en la cámara fría bien abrigadas y cortarlos con tijera para ir pelando las glándulas. Después seguía todo el proceso de preparación que hacíamos en la cámara fría. Era muy trabajoso. Pero el doctor Santomé era la persona más maravillosa que se pueda imaginar: a él le debo todo lo que soy. Me acostumbró a opinar y me dio más confianza. Tiene una personalidad maravillosa, siempre tuvo un trato muy cálido con todos. Cuando trabajábamos con la hidracina o con soplete, porque todo se hacía a mano, siempre me alejaba porque no quería que corriera peligro.” 22 La “fabriquita” Una vez más, el trabajo era lento y agotador. “Primero –detallan Dellacha y Santomé–, había que hacerse de las hipófisis, una tarea que, contrariamente a lo que podría pensarse, no iba a resultar nada sencilla. Decidieron comprar las glándulas bovinas en frigoríficos y procesarlas de a dos kilos por vez, utilizando enormes ollas de acero inoxidable de 20 litros.” Allí las trituraban y comenzaba el trabajoso proceso de extracción. “El tejido se dejaba macerar con agitación continua durante doce horas para que las sustancias proteicas se solubilizaran. Se obtenía un líquido espeso y rojizo, que luego se centrifugaba –cuentan–. Lo que no quedaba en solución, se iba al fondo del recipiente. Se retiraba el sobrenadante, se le agregaban sulfato de amonio y otras sales, y se hacía un fraccionamiento para sacar las proteínas más pesadas, que son las que primero se precipitan. Se volvía a centrifugar, se retiraba lo que quedaba en el fondo y comenzaba todo nuevamente. El mismo proceso se repetía varias veces hasta que se hacía un tratamiento con alcohol en muy baja concentración para llegar al precipitado final, que era el que contenía la hormona.” 23 Eso se liofilizaba (es decir, el agua pasaba del estado sólido al gaseoso sin pasar por el líquido) y se obtenían aproximadamente tres gramos de proteína, que se purificaban colocándolos en columnas de alrededor de un metro de largo de un polímero con esferitas esponjosas que se conocía con el nombre de Sephadex. De cada partida obtenían ¡entre un gramo, y un gramo y medio de hormona! “El Sephadex es un polímero que tiene una trama especial hecha de esferitas esponjosas –explican los científicos–. Uno tiene millones de ésas, y cuando pone sustancias de distinto peso molecular, algunas van a pasar por afuera porque no entran en los agujeritos, y otras se deslizan a distinta velocidad según puedan atravesar agujeritos más grandes o más chicos. Por el extremo inferior de la columna van saliendo las proteínas, comenzando por las más pesadas.” Gracias a un registro muy meticuloso, los científicos podían descubrir por dónde salía la hormona que tenía actividad biológica. “Tomábamos esa fracción y, ahí sí, la volvíamos a dializar, volvíamos a liofilizarla y obteníamos un polvito”, recuerdan. Como todas las proteínas, la hormona de crecimiento está formada por una cadena de aminoácidos, cada uno de los cuales tiene un grupo carboxilo y un grupo amino, y es capaz de unirse a otro para formar una cadena mediante una reacción entre el grupo amino de un aminoácido (N-terminal) y el grupo carboxilo (C-terminal) del siguiente. Las proteínas son sintetizadas en los ribosomas celulares desde el extremo N-terminal hasta el C-terminal. Después de llegar a determinar la secuencia del extremo C-terminal, Paladini y Dellacha estimularon a Santomé para que se lanzara a revelar la estructura primaria total de la bGH, ofreciéndole el apo24 yo de todos los integrantes del laboratorio, como así también la posibilidad de usar los locales y equipos con que contaban. A la distancia, los científicos confiesan que por esos años verdaderamente parecía un despropósito encarar en nuestro país el problema de comparar las estructuras primarias (la secuencia en que se unen 20 diferentes aminoácidos para formar la cadena característica) de las hormonas de crecimiento humana y bovina, e intentar determinar las razones moleculares de la falta de actividad de la bovina en humanos. Santomé había iniciado el estudio de la estructura del extremo Cterminal de la hormona de crecimiento bovina en 1963, cuando se conocía la estructura primaria de muy pocas proteínas, diez años después de que Sanger y Thomson publicaran la estructura primaria de la primera proteína en ser secuenciada, la insulina, y tres después de que Moore y Stein dieran a conocer la de la ribonucleasa, que fue la segunda proteína cuya estructura se develaba. Choh Hao Li estaba determinando la de la hormona de crecimiento humana, tarea que le llevaría 10 años. Hicieron una evaluación del equipamiento que poseían, del número de colaboradores con que contaban, de la provisión de hormona de crecimiento bovina y los subsidios disponibles, y resolvieron encarar el trabajo a pesar de que a primera vista parecía de una magnitud descomunal. Según dijo Paladini en su introducción al Premio de la Academia Nacional de Ciencias a Santomé por toda su trayectoria, “el problema químico que implicaba determinar la secuencia de los aminoácidos que integran la hormona era formidable para la época”. Si bien no estaban a la altura de los centros de primer nivel, tenían 25 un autoanalizador Technicon, donado a Paladini por la Fundación Rockefeller y al que, junto con su tesista Néstor González Cadavid, habían dotado de nuevos módulos y adaptado al análisis automático de aminoácidos. También contaban con resinas para el armado de columnas cromatográficas destinadas a la separación de péptidos resultantes de la digestión enzimática de proteínas, un equipo de electroforesis de alto voltaje para la purificación de péptidos y cubas para la cromatografía en papel. Con respecto a la cantidad de hormona necesaria, Moore y Stein afirmaban que para determinar la estructura primaria de una proteína se requería disponer de 1g mensual, cantidad que esperaban obtener para la hormona de crecimiento bovina (bGH). Así las cosas, Dellacha montó una especie de “fabriquita” para preparar de un gramo a un gramo y medio de la hormona, de los cuales 300 miligramos mensuales de bGH se destinaban a determinar la estructura primaria a partir de decenas de kilos de hipófisis bovinas adquiridas en frigoríficos que eran congeladas individualmente, inmediatamente después de extraídas del animal. Para realizar las innumerables operaciones necesarias, se incorporaron al grupo de Santomé y Carlota Wolfenstein, Mirtha Biscoglio, Clara Peña, Edgardo Poskus y Silvia Daurat. También Zulema Mazzani, Verónica Fontanive y la técnica Dora Beatti. Con el primer analizador automático de aminoácidos, podían obtener la composición de un péptido cada 26 horas, pero gracias a la renovación de los equipos, con el pasar de los años ese tiempo se fue reduciendo hasta poco más de un hora. Como se dijo, eran tiempos de ciencia artesanal, en los que los investigadores no sólo debían estar al tanto de lo que se publicaba y del 26 trabajo de otros grupos en el mundo, sino también tener habilidad manual y conocimientos técnicos que les permitieran lidiar con aparatos únicos en el país. Paladini y Dellacha se ocupaban personalmente de su actualización, pero pronto estos dispositivos fueron superados cuando, en 1967, Pehr Edman dio a conocer un equipo al que no podía aspirar el grupo de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA: el primer secuenciador automático de aminoácidos. Era capaz de determinar la secuencia N-terminal de 15 aminoácidos en 24 horas con una ínfima cantidad de la proteína (250 nanomoles). A poco de iniciado el proyecto, los argentinos se enteraron de que había otros dos grupos que también estaban determinando la estructura primaria de la hormona de crecimiento bovina: uno de la Universidad de Sussex, en Gran Bretaña, y otro del Centro Médico de la Universidad de Duke, en los Estados Unidos. “Sin quererlo, el Departamento de Química Biológica tuvo que competir con esos dos equipos, tratando de llegar antes a la meta para no perder un trabajo de semejante magnitud si ellos daban a conocer antes sus resultados”, cuentan Santomé y Dellacha. Y a pesar de las dificultades, los científicos de la UBA fueron los primeros en publicar el trabajo completo. Tardaron siete años en completar la estructura primaria de la hormona de crecimiento bovina, un hito mundial si se tiene en cuenta que hasta ese momento sólo se habían podido secuenciar pocas proteínas. Ese mismo año, Wallis, de Sussex, presentó sus resultados en una revista de publicaciones rápidas. El esfuerzo rindió sus frutos. Aprovechando la experiencia adquirida y con la activa participación de nuevos integrantes –Horacio Fer27 nández, Mario Zakin y Pascual Ferrara–, los científicos siguieron adelante y pudieron determinar mucho más rápidamente la estructura primaria de las hormonas de crecimiento ovina y equina. Detrás de estos estudios en distintos mamíferos estaba la necesidad de responder una pregunta que los inquietaba: porqué las hormonas bovina, ovina y equina no son activas en humanos, a diferencia de lo que ocurre con la insulina bovina y la porcina, que se utilizaban en el tratamiento de la diabetes. Pensaron que la comparación de sus estructuras primarias permitiría aclararlo e intentar modificaciones estructurales en la proteína para obtener un derivado activo en humanos. La historia de estos estudios está salpicada de anécdotas que revelan cómo la cotidianeidad y la trascendencia se entretejen en la vida del científico. Una de ellas tiene ribetes entre cómicos e irreverentes. A esta altura de las investigaciones, Li había finalizado la determinación de la estructura de la hormona de crecimiento humana y el grupo argentino las de origen bovino, ovino y equino. El estudio comparativo mostró un alto grado de homología entre ellas y no reveló diferencias a las que pudiera atribuirse la falta de actividad en humanos de las hormonas de otras especies. La pregunta seguía sin respuesta. 28 De la mesada, al consultorio Antes de convertirse en investigador del recientemente creado CONICET, Dellacha había sido practicante en la farmacia del Hospital de Niños “Dr. Ricardo Gutiérrez”. A su regreso de los Estados Unidos, había sido invitado a exponer sus estudios en el servicio de Endocrinología Infantil dirigido por Martín Cullen. Allí trabajaba César Bergadá, pionero de esta disciplina en el país, pero que se había especializado en endocrinología infantil en los Estados Unidos, particularmente en el tratamiento de niños con graves trastornos de crecimiento. De ese encuentro, surgió la idea de obtener hormona de crecimiento a partir de hipófisis humanas. Estudiaron la propuesta con Cullen y Paladini, y decidieron ir a ver a Bernardo Houssay para solicitarle el apoyo del CONICET. “Empezamos a conversar con Bergadá y con Juan Heinrich a través de Dellacha –recuerda Paladini–. Ellos estaban estudiando a chicos deficitarios en la hormona; entonces ahí surgió la idea de armar, con ayuda del CONICET, un grupo para analizar la hormona con la finalidad de utilizarla en el tratamiento de esos chicos. Al principio, Houssay no quiso. El pensaba que el CONICET no tenía que dedicarse a hacer investigación aplicada, decía que tenía que hacer investi29 gación básica. El que volcó la balanza para que se creara un centro fue Cullen. Lo conocía a Don Bernardo, no sé de dónde, pero lo trataba con mucha familiaridad y tenía una presencia muy imponente. Este Cullen se lo llevó por delante... Tanto, que salimos con la promesa de que lo iba a pensar. Y al final se convenció de que estábamos en condiciones de hacerlo. Así que pusimos en marcha el sistema. Porque la preparación de la hormona empezaba por conseguir la glándula humana, que no era fácil.” Así nació el Centro para el Estudio de Hormonas Hipofisarias (Cehip), que integraron Paladini, Santomé y Dellacha, del Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica; Cullen, Bergadá y Juan J. Heinrich, del Servicio de Endocrinología del Hospital de Niños, y José Manuel Domínguez, del Instituto de Investigaciones Médicas de la Facultad de Medicina de la UBA. El Cehip contó desde su creación con subsidios del CONICET y apoyo económico de la Fundación de Endocrinología Infantil, conocida en el ambiente pediátrico con el acrónimo FEI. Tenía dos sedes: una en el Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica, y la otra, ubicada en el Servicio de Endocrinología del Hospital de Niños. La de la Facultad tenía como misión preparar la hormona de crecimiento humana (hGH) y realizar los ensayos y análisis necesarios para asegurar su actividad biológica y su esterilidad. En el FEI se les hacían los estudios clínicos a los chicos que asistían al hospital por trastornos de crecimiento, especialmente a los que por su nivel de deficiencia hipofisaria debían ser sometidos a tratamientos prolongados con hormona de crecimiento. Heinrich tenía en ese momento 29 años. Se había formado en Suiza con Andrea Prader, uno de los más grandes endocrinólogos infanti30 les de la época, y había regresado a trabajar con Cullen y Bergadá. La causa de consulta más frecuente para los especialistas de esos días era la baja estatura. Cuando se debía a la deficiencia de la hormona, “no teníamos respuesta –comenta Heinrich, hoy, un nombre de referencia en la especialidad–. Se les daba hormona tiroidea, cuando también faltaba, o cortisona, si les fallaba la suprarrenal. Se usaban extractos de hipófisis de vaca, por ejemplo, pero no hacían crecer.” Dellacha se puso al frente de la obtención de hormona de crecimiento humana en el Departamento de Química Biológica de la UBA, para lo cual tuvo que organizar un sistema de recolección de hipófisis humanas que permitiera contar con un número adecuado para la purificación de la hormona, y que asegurara una provisión constante de glándulas para atender los planes asistenciales y de investigación. Claro que, como suele suceder, el plan era más fácil de enunciar que de llevar a la práctica. “Lo primero que hizo falta fue un auto –recuerda Paladini–. Compramos un Citroën de tercera mano. Con esas latas, ese Citroën, una persona que se llamaba Roberto Rodríguez, recorría los hospitales y la morgue judicial.” Rodríguez, frecuentemente con Heinrich, visitaba los hospitales Álvarez, Argerich, Cetrángolo, de Niños Ricardo Gutiérrez, Durand, Elizalde, Fernández, Fiorito, Muñiz, Policlínico Alejandro Posadas, Policlínico de Avellaneda, Policlínico de Lanús, Ramos Mejía y Rawson, y hablaba del proyecto con los jefes de los departamentos de anatomía patológica, recuerdan Santomé y Dellacha. “Hay que subrayar que todos ellos se mostraron dispuestos a colaborar de forma totalmente desinteresada –subrayan–. Participó también la Cátedra de Patología de la Universidad de Buenos Aires. ¡Y hasta obtuvimos una acordada de la Suprema Corte de Justicia de la Nación para poder retirar las hipófisis de los cadáveres de la Morgue Judicial.” 31 Entre 1970 y 1985, esta red informal permitió recolectar nada menos que 66.000 hipófisis, que se conservaban en termos con nieve carbónica o hielo seco. Una vez por semana, eran retirados y las glándulas se transferían a una congeladora que se mantenía a una temperatura de -60º C hasta su procesamiento. Uno de los problemas que tuvieron que analizar fue qué método se aplicaría para extraer la hormona de la glándula y qué procedimiento de purificación se adoptaría. En esa época había otros dos países que lo tenían resuelto. Uno era Estados Unidos. Ellos utilizaban un método que más tarde les traería serias complicaciones. En Inglaterra y Francia también se registraron casos similares. Los investigadores argentinos ensayaron varios métodos descriptos en la literatura, pero rápidamente los abandonaron porque obtenían productos heterogéneos. Finalmente seleccionaron uno que permitió producir una proteína apta para tratamientos clínicos. Un “colector de fracciones”, donado al FEI por la Embajada de Suecia, permitió separar del gel la fracción proteica con actividad hormonal. La hormona liofilizada se esterilizaba y se fraccionaba en frascos multidosis de 5 mg de hormona en forma totalmente gratuita, en los Laboratorios Carlo Erba de Buenos Aires y posteriormente, por gentileza del doctor Zenón Lugones, en el Laboratorio Roux-Ocefa S.A. En el Servicio de Endocrinología del Hospital de Niños, esta hormona era aplicada en forma de inyecciones subcutáneas, tres veces por semana, a niños con graves trastornos de crecimiento, que habían sido seleccionados después de un riguroso estudio para obtener el máximo beneficio terapéutico. 32 Para determinar si la hormona que se preparaba en el laboratorio tenía actividad biológica, también tuvieron que poner a punto la técnica de la hipofisectomía (extracción quirúgica de la hipófisis) en ratas criadas en el Bioterio Central de la Facultad de Farmacia y Bioquímica. A lo largo de más de quince años, el Cehip obtuvo en la Facultad de Farmacia y Bioquímica alrededor de 130 g de hormona de crecimiento humana, con un alto grado de pureza química y antigénica que permitió su uso para los estudios estructurales, fisicoquímicos e inmunológicos. “Corría la década del setenta cuando tuvimos que explicar cuáles eran los beneficios de las investigaciones que encarábamos –cuenta Dellacha–. Por eso, calculamos aproximadamente cuánta hormona habíamos hecho y cuál hubiera sido su costo internacional.” El resultado de esa estimación es apabullante: ¡con esos métodos agotadores y trabajando de lunes a lunes, los científicos y sus equipos habían fabricado 130.000 dosis de hormona de crecimiento. “Se calculaban dos hipófisis por semana y por chico –agrega Santomé–. Y se trataban grupos de treinta chicos.” Eran tiempos convulsionados, de huelgas, toma de cátedras y facultades. “A veces teníamos que subir desde la planta baja al sexto piso… ¡con bolsas de veinte kilos por la escalera!, que era la comida para alimentar a los animales del bioterio. En 1985, en los Estados Unidos, en Gran Bretaña y posteriormente en Francia, fallecieron jóvenes de la enfermedad de Creutzfeldt-Jacob, un desorden neurológico mortal cuyos primeros síntomas son 33 fallas de memoria y cambios de comportamiento, pero que a medida que progresa puede presentar movimientos involuntarios, ceguera, debilidad de las extremidades y coma. Todos ellos tenían en común que habían sido tratados en su niñez con hormona de crecimiento humana. “Los directores del Cehip recibieron una llamada telefónica de la Organización Mundial de la Salud poniéndolos sobre aviso de lo sucedido y sugiriéndoles suspender la producción de hormona a partir de hipófisis humanas hasta tanto se averiguara el motivo de esos decesos”, recuerdan hoy los científicos. También suspendieron la provisión de hormona la National Pituitary Agency y el Instituto Nacional de la Salud, ambos de los Estados Unidos, y los laboratorios de Inglaterra, Francia y Suecia que la producían. Si bien nunca se tuvo evidencia directa acerca del origen del problema se supuso que estos casos fatales recibieron hormona de hipófisis provenientes de pacientes con Creutzfeldt-Jacob y que el método de purificación utilizado no permitió eliminar los priones de la preparación. En la Argentina, sin embargo, no se registró ningún caso. Posteriormente se comprobó que el método de filtrado por columnas de Sephadex que utilizaron los científicos argentinos eliminó el riesgo, porque los priones quedaban retenidos en esa estructura. El esfuerzo realizado durante más de dos décadas no sólo benefició a 70 chicos hasta entonces marginados y sin posibilidad de tratamiento, sino que contribuyó a la formación de numerosos investigadores, y dio lugar a 28 trabajos de investigación clínica (ver anexo) y a innumerables tesis doctorales. Hasta 1976, Paladini, Dellacha y Santomé trabajaron en colabora34 ción, compartieron subsidios y equipos, y también sus resultados en pos de un objetivo común. Pero como cada uno de los subgrupos que dirigían encaraba problemas tan distintos, las ideas no siempre coincidían y comenzó a resultarles difícil conducir en conjunto todas la líneas de trabajo. Había llegado el momento de que cada uno dirigiera su grupo en forma independiente y redistribuyeron a los colaboradores para que cada uno tuviera a su cargo un número equivalente de investigadores. El grupo de Paladini se consagró principalmente a las hormonas de crecimiento y la detección de sus receptores celulares. Sintetizó fragmentos hormonales y estudió las características de la hormona marcada con yodo radiactivo. En particular, estudiaron los epitopes de la proteína; es decir, las regiones moleculares antigénicas, las que producen anticuerpos. “Plantearon la hipótesis de que cuando se le da hormona de crecimiento a un chico, éste puede producir anticuerpos, porque es desconocida, aunque sea humana –cuenta Santomé–. Algunos la reconocen como propia y no la destruyen, pero para otros es una sustancia extraña y por eso a veces el tratamiento no surtía efecto. No siempre se elaboran anticuerpos, pero puede suceder.” El equipo de Dellacha aplicó técnicas de marcación de las hormonas humana y bovina para analizar cómo se unen a receptores, tanto in vitro como in vivo, y así confirmaron que el hígado tiene receptores para la hormona de crecimiento. Como todavía se desconocía la estructura terciaria de las hormonas de crecimiento, el grupo de Santomé contribuyó al conocimiento de la conformación molecular mediante modificaciones químicas de 35 distintos aminoácidos para establecer el acceso al solvente de cada uno de ellos y su participación en el reconocimiento de los receptores en la actividad biológica. Con apoyo del Programa de las Naciones Unidas para el Desarrollo, Santomé estudió la hormona de crecimiento de la alpaca, un camélido que vive en los Andes, a entre 4.500 y 5.500 metros de altura. “El problema principal era conseguir las hipófisis –recuerda Santomé–. Como era una colaboración con científicos peruanos, ellos se comprometieron a obtenerlas. Aparentemente, en Cuzco la hipófisis es comestible, como la carne. En una oportunidad, estaba esperando veinte hipófisis de alpaca y fue una becaria peruana para recolectarlas. Cuando volvió a nuestro país, voy a buscarla a Ezeiza para que la dejen pasar, porque traía material biológico. Cuando subimos al auto, la becaria me confiesa que había habido un problema y no había podido traer las hipófisis: las había puesto en el freezer de la familia del investigador; ellos las habían confundido y se las habían comido...” 36 Cambio de rumbo En 1985, primero en los Estados Unidos y luego en Gran Bretaña y Francia, empezaron a llegar a los consultorios médicos individuos de entre 25 y 30 años con signos que correspondían a los de la “enfermedad de la vaca loca”. Al estudiar las causas de seis muertes, que fueron simultáneas, encontraron que todos ellos habían recibido hormona de crecimiento humana. La Organización Mundial de la Salud emitió inmediatamente un llamado de alerta. Pero a diferencia de lo que ocurrió en los países europeos, en la Argentina nunca se registraron complicaciones por la aplicación de la hormona de crecimiento humana producida en los laboratorios del grupo de Química Biológica. “Recuerdo que estábamos en el laboratorio y nos llamaron de la Organización Mundial de la Salud –dice Dellacha–. Nos comunicaron que consideraban apropiado detener la producción o al menos dejar de aplicar la hormona hasta determinar lo que estaba pasando. Tres años después se supo que en Francia hubo 90 muertos. La hormona había sido mal purificada o se había extraído de personas que habrían tenido la enfermedad de Creutzfeldt-Jacob. En una invitación que tuve en la Universidad de Oxford, Inglaterra, supe que al revisar el caso se encontraron con que, si inyectaban en ratas la hormona enriquecida que quedaba en la parte superior de la columna du37 rante la producción, los animales desarrollaban la enfermedad de Creutzfeldt–Jacob. Entonces, dejamos de producir, aunque nosotros hacíamos una segunda etapa de purificación. Lo que quedaba arriba (hemoglobina y soluciones) se descartaba y usábamos sólo la parte de abajo. Por eso, nunca tuvimos problemas.” En este contexto internacional, entre 1983 y 1992, Paladini, Dellacha y Santomé dejaron de investigar sobre hormonas de crecimiento para dedicarse a otros temas. Además de la advertencia de la Organización Mundial de la Salud, se había producido un avance determinante: se confiaba su producción, en grandes tanques con medios de cultivo, a bacterias que habían sido modificadas para introducirles el gen humano que dirige su síntesis en el organismo. En 1987, importantes avances internacionales imprimieron un cambio de rumbo en las investigaciones: en los Estados Unidos, Sherin S. Abdel-Meguid y colegas dieron a conocer la estructura tridimensional (el plegamiento de la cadena de aminoácidos en el espacio) de la hormona porcina recombinante; es decir, producida por ingeniería genética. “Cuando se conoce bien la estructura tridimensional se puede ver qué parte de la molécula interactúa con los receptores; es decir, con las distintas regiones que van a producir un efecto biológico –explica Wolfenstein–. A veces, los grupos que están lejos en la estructura lineal, cuando la proteína se pliega de cierta manera pueden quedar cerca. Por eso las proteínas mal plegadas pueden tener otro efecto biológico.” “En ese momento hubo una revolución metodológica y tecnológica a partir de la aparición de la biología molecular, que permitió determinar la estructura primaria de una proteína en un tiempo muchísimo más breve –explica Santomé–. Si se aislaba un gen cuyo ADN 38 tenía una secuencia de bases determinada a partir de la cual se podía deducir toda la secuencia de aminoácidos de una proteína; es decir, su estructura primaria. ¡Lo que a nosotros nos había llevado diez años, se podía determinar en unos días! Pero además, la biología molecular trajo otra cosa extraordinaria: se pudo expresar ese gen introduciéndolo en una bacteria, como la Escherichia coli, por ejemplo. De allí en más pudieron producirse enormes cantidades de proteínas. En el Laboratorio Nacional de Investigación y Servicios en Química de Proteínas (LANAIS-PRO), que yo dirigía, podíamos determinar la secuencia de las proteínas con gran rapidez. Utilizábamos métodos automáticos muy precisos.” “Al tener la hormona pura, pudieron cristalizarla –explica Dellacha–. Y por eso pudieron determinar, en 1987, la estructura tridimensional de la hormona porcina recombinante, de la hormona humana recombinante y la del complejo que forma con las dos moléculas del receptor, en 1992.” Se iniciaba una nueva era, pero la tarea de los científicos del grupo de Química Biológica había sido literalmente impagable: explorando en las fronteras del conocimiento habían producido hormona de crecimiento humana por un valor de... ¡cuatro millones de dólares de esos años! 39 Una palabra que todavía no estaba de moda A tono con el entusiasmo que produjo el retorno de la democracia al país en 1983, un hecho del mundo científico local acaparó la atención de los diarios porteños: un grupo de investigadores del CONICET abandonaba el sistema público para trabajar en una empresa privada. Era una movida inédita para la Argentina. Para muchos de sus colegas, los investigaodores se habían “vendido” al capital privado. Para otros, eran la punta de lanza de una tendencia que ganaba adeptos en todo el mundo: agregar valor (tecnología) a los productos para mejorar la competitividad. Varios de los protagonistas de esta iniciativa sin precedente habían sido alumnos de los integrantes del grupo de química biológica de la UBA. La compañía Sidus, una tradicional firma familiar que participaba del mercado farmacéutico local, planeaba desarrollar proyectos en un área cuyo nombre sonaba poco conocido: la biotecnología. “Ni siquiera estaba de moda la palabra –recuerda Marcelo Criscuolo, hoy director ejecutivo de Biosidus S.A.–. La idea era poder poner a punto la tecnología recombinante para la expresión de proteínas humanas en bacterias o células de mamíferos.” 40 Los investigadores del Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA cumplieron un importante papel en el desarrollo de la hormona de crecimiento recombinante por su experiencia en la purificación, estabilidad y control de calidad de la hormona obtenida a partir de Escherichia coli. En reuniones semanales, Juan Dellacha, se convirtió en asesor científico de Biosidus S.A. No sólo discutía la producción de la hormona, sino que aportaba su experiencia a los trabajos que los investigadores estaban realizando para conocer las propiedades químicas, fisicoquímicas y biológicas de las hormonas de crecimiento que le conferían una mayor estabilidad en determinadas condiciones experimentales. “El grupo de Biosidus S.A. intentaba obtenerla por la bacteria Escherichia coli, pero se descomponía, se alteraba –explica Dellacha–, por eso, buscaron a quien conociera su funcionamiento y estabilidad.” A partir de estas experiencias y de común acuerdo, introdujeron modificaciones en ciertos procedimientos y diseñaron nuevos experimentos. El doctor Santomé se hizo cargo del estudio estructural, la secuenciación de aminoácidos y la determinación de la masa molecular. Así, pudieron comprobar que la proteína recombinante de Biosidus S.A. (codificada como HCB-P001) tenía “idéntica secuencia de aminoácidos y puentes disulfuro que la hormona de crecimiento humana natural”. También comparó, con participación de otros investigadores, la inmunorreactividad (su actividad frente a varios anticuerpos y su reconocimiento por receptores celulares específicos, así como la respuesta a cambios conformacionales producidos por anticuerpos) de la hormona recombinante con la de origen hipofisario y otra de origen recombinante producida por Genentech en los Estados Unidos. 41 Encontró una total identidad inmunológica entre las tres. Santomé luego asesoraría estudios similares para probar la actividad biológica de la hormona de crecimiento humana producida en leche de vacas transgénicas. Después de más de un lustro de intentos, Biosidus S.A. alcanza su primer hito en 1990, cuando lanza al mercado la eritropoyetina recombinante, una hormona que estimula la producción de glóbulos rojos, producida a partir del cultivo de células en las que se había insertado un gen humano. El siguiente paso fue el interferón alfa, un medicamento que se utiliza para evitar la proliferación de células tumorales y virus. Entre 1993 y 1994, estos productos empezaron a exportarse a Brasil y Biosidus S.A. se independizó de su empresa madre. Santomé determinó la estructura primaria de todas esas proteínas recombinantes. En 1995, lanzaron una droga para combatir las neutropenias (deficiencia de un tipo de glóbulos sanguíneos llamados granulocitos) generadas por los tratamientos citostáticos en cáncer o radioterapia: el “factor estimulante de colonias de granulocitos”. Al mismo tiempo, ponían a punto la producción de hormona de crecimiento humana fabricada por bacterias recombinantes (modificadas genéticamente). Fue una decisión empresaria que requería una dosis de audacia. Marcelo Argüelles, entonces al mando de la compañía, confiesa que, ante el desafío, no le faltaron momentos de duda. “Las dudas lo asaltan a uno todas las noches –afirma–. Como decía Steve Jobs, la innovación no es perfecta al inicio, se hace camino al andar. Los datos con los que uno inicia el trabajo no son 100% efectivos. No es lo mismo calcular un puente o una usina nuclear, que una hormona recombinante; cuando se manejan datos biológicos, las variaciones que surgen pueden ser la diferencia entre la posibilidad y la imposibilidad de desarrollar un producto.” 42 Al recordar esa época, Criscuolo revive los infinitos contratiempos que hubo que sortear. “Cuando uno tiene que encarar el desarrollo de un producto, no sólo se trata de dominar la tecnología –subraya–, saber cómo es el gen, cómo lo ponemos en un plásmido (ADN extracromosómico), cómo lo ponemos en un clon de bacterias productoras, cómo mejoramos el mecanismo de fermentación para que sea rentable para la industria farmacéutica, cómo es el mecanismo de purificación y su posterior envase. Sino también de entender un poco la fisiología de la hormona de crecimiento, cómo debe ser su aplicación clínica, a qué blanco debe dirigirse, cómo funciona. Y en eso recurrimos a los académicos más adecuados para que asesoraran a la empresa: al grupo de Santomé y de Dellacha. Más allá de su conocimiento y su probada eficiencia técnica, eran los que más conocían la proteína. Pero además, había un factor humano crucial: la mayoría de los integrantes de Biosidus S.A. habían sido alumnos de los científicos en la Facultad de Farmacia y Bioquímica. “Era un honor, llegar, recibirse, estar en una empresa, hacer biotecnología, y además, volver a los profesores que nos habían formado y traerlos como asesores del grupo de desarrollo”, dice Criscuolo. Entre las anécdotas de esos años, figura una que recuerda con una gran emoción. “Cuando uno tiene que manejar un grupo de gente trabajando en un tema, algunos más preocupados por el aislamiento de los clones, otros por producir el número más alto de copias, el mejor sistema de expresión, otros, el sistema de fermentación o la pureza, etcétera, etcétera, y todos ellos universitarios (que no sólo trabajan para saber hacer, sino que tienen que saber para qué trabajan, cómo funciona lo que están haciendo), el doctor Dellacha, que siempre fue un hombre y un profesor de carácter, imponía orden y respeto. Solía decir: yo el miércoles a las diez estoy ahí, vengan todos que voy a mostrar el avance de los trabajos, el seguimiento. Y a las las diez cero uno, Dellacha abría la reunión y el que no estaba, no estaba. Y –aclara– no era fácil no estar... Realmente su seguimiento 43 de todo el grupo de desarrollo fue muy importante, no solo desde lo técnico, sino también desde el punto de vista humano. Y con Santomé también había una relación especial, porque estaba al frente del LANAIS-PRO, que tenía equipos importantes como el secuenciador de proteínas, que nos permitió hacer esa operación en el país. Fue un placer y un honor que precisamente el doctor Santomé, manejando ese laboratorio, hiciera para nosotros en la Argentina la secuencia completa de la hormona de crecimiento.” La prueba de fuego llegó tras los estudios clínicos y una vez aprobada por la ANMAT, cuando el grupo de Bio Sidus presentó la hormona de crecimiento recombinante ante la plana mayor del servicio de Endocrinología del Hospital de Niños. Allí venían a entrenarse médicos de todos los países del mundo. Ellos habían participado de la epopeya de Dellacha, Santomé y Paladini. “Nos miraban con un poquito de… recelo –recuerda Criscuolo–. Estaban acostumbrados a trabajar con productos de firmas importantes, de muchísima calidad y nosotros éramos un grupo de jóvenes que les estábamos trayendo una hormona fabricada con bacterias recombinantes… Hasta que pasó algo en las presentaciones. Teníamos al lado nuestro a Dellacha y Santomé como asesores y, bueno, se armó debate y alguna controversia, sobre cómo asegurábamos la calidad. Porque de alguna manera los bioquímicos teníamos nuestros geles, nuestras corridas, nuestros cromatogramas, que era un lenguaje que los médicos no podían entender. Y ellos nos hablaban de los niños, de lo que pasaba, del riesgo, era casi un diálogo de sordos. Había que romper eso. Entonces, toman la palabra Dellacha y Santomé, y les dicen: “Miren, ustedes hace veinte años confiaron en lo que nosotros hacíamos con nuestras manos. Y trabajamos con este producto que tuvo mucho éxito. Ahora les pedimos que confíen en lo que hacen nuestros alumnos.” De una manera u otra las barreras cayeron. Empezó un diálogo distinto. La palabra de Dellacha y de Santomé fue muy especial, absolutamente espontánea, pero muy bien dirigida. 44 Fue una emoción tremenda... Nos sorprendieron. Había una larga historia de gente de Bio Sidus que había trabajado en la cátedra con ellos y que también había conocido el trabajo en la hormona de crecimiento. Fue como tomar la posta...” Era 1997. 45 Una oveja llamada Dolly En 1984 había regresado al país después de una temporada en los Estados Unidos el doctor Lino Barañao, un químico de intereses que abarcaban desde la antropología hasta las neurociencias y el comportamiento animal, y que jugaría un rol decisivo en esta historia y en la de la ciencia nacional. Hijo de una maestra y de un empleado de Vialidad, Barañao confiesa que siempre fue muy curioso y que estaba fascinado por la ciencia: “Heredé esa curiosidad de mi padre –afirma–, que la conservó hasta su muerte, a los 89. Alrededor de los 11 años, leí las obras completas de Julio Verne, donde el héroe siempre era un científico. Después devoré la colección de libros de ciencia de Eudeba, en particular las de comportamiento animal, tema que todavía me apasiona”. Aunque la vida es imprevisible, a la distancia, Barañao parece haber estado predestinado a participar en el desarrollo de la hormona de crecimiento y en el de vacas transgénicas. “Mi padre tuvo 11 hermanos –cuenta–. Uno de ellos, mi padrino Arcadio Barañao, era químico y trabajaba en hormonas. Fue el primero en hacer bioensayos en el país. Siempre trabajó en el ámbito privado. Otro de mis tíos, Teófilo Barañao, era profesor de Maquinaria 46 Agrícola en la Facultad de Agronomia de la UBA (hasta hace poco había un aula que llevaba su nombre). Mi padre en su juventud tuvo un tambo. O sea que no es de extrañar que yo haya terminado haciendo vacas que producen hormonas en su leche.” Dada la pluralidad de intereses que lo motivaban, el aspirante a científico se decidió por la química, porque la consideraba la disciplina “más abarcadora”. «Cursó desde mecánica cuántica hasta anatomía humana, “con cadáveres y todo”. Su anhelo era contribuir a desarrollar “una ciencia orientada al uso”, como decía Pasteur. El sabio francés del siglo XIX realizó algunas de sus contribuciones más importantes mientras trataba de contestar preguntas que le planteaban los viñateros de su país. “De chico –cuenta Barañao–, mi padre me dió la Vida de Pasteur, la biografía escrita por [su nieto], Vallery Radot. Y mi tío tenía en su escritorio la frase de Pasteur que decía: «Vivid en la paz serena de los laboratorios y bibliotecas. Allí no hallarás siempre la gloria, jamás hallarás la fortuna, pero en su seno sentirás la dulzura de ser cada día más que el anterior y de haber aportado al mundo tu parte de verdad». Eso me marcó.” Desde su regreso al país, Barañao tuvo la idea de que había que hacer algo “con biotecnología animal”. Se incorporó al Instituto de Biología y Medicina Experimental, que comparte edificio con el Instituto de Ingeniería Genética y Biología Molecular (INGEBI), donde también trabajaban Héctor Torres, su primer director, y Marcelo Rubinstein, que había logrado el primer ratón transgénico. “Torres fue el que tuvo la idea de empezar con los animales transgénicos”, recuerda. Ya era 1994 cuando decide hablar con Argüelles y Criscuolo, y les propone hacer un bovino transgénico capaz de pro47 ducir hormona de crecimiento en la leche. “Ellos ya estaban produciendo hormona con bacterias –aclara Barañao–. En realidad, no sabíamos si convendría una hormona de crecimiento u otra proteína recombinante. La primera en la que se pensó fue el activador tisular de plasminógeno (TPA), que se usa para combatir los infartos, una enzima que destruye el coágulo.” Había que hacer la construcción [del segmento de ADN], e infiltrarlo con un promotor en la glándula mamaria. “Ya se había demostrado en algunos casos que si se le ponía un gen a un promotor de la caseína, la sustancia codificada por ese gen se segregaba en la leche de la vaca”, agrega. Inicialmente, presentaron el proyecto de poner una proteína de interés en la glándula mamaria de vacas al Fondo Tecnológico Argentino (FONTAR) de la Agencia Nacional de Promoción Científica y Tecnológica, que ofrecía créditos de devolución “contingente”: si todo iba bien había que devolverlos y si no funcionaba, no se devolvía nada. Pero como la conclusión del proyecto debía respetar los plazos del crédito, se inclinaron por probarlo en cabras, cuya gestación dura cinco meses. Ese tiempo, más lo necesario para esperar a la madurez, un lapso que sumaba aproximadamente tres años, coincidía con el período máximo estipulado en el crédito. Mientras tanto, Barañao y Daniel Salamone, un veterinario graduado en la UBA y apasionado por los desafíos ambiciosos, habían logrado los primeros terneros por fecundación in vitro. “Lo hicimos trayendo ovarios de mataderos, fecundándolos en una cápsula de Petri y luego implantándolos en vacas”, comenta el primero. “Cuando se conoció que había nacido el primer bovino producido in vitro [Brackett et al. 1982] dije “Guau, ésta es nuestra oportuni48 dad” –recuerda hoy Salamone–. Tuve la suerte de recibir una beca de la Agencia Internacional de Japón (JICA) para viajar a ese país y aprender a hacer terneros in vitro. Al volver, en 1983, puse en práctica el método y cuando quise darme cuenta ¡había producido más de 60.000 [embriones] vacas en un mes! Por supuesto que no todos los embriones podían implantarse, pero habíamos hecho la prueba de concepto.” Pero... ¿para qué hacer fertilización in vitro de bovinos? Entre otras cosas, en ese momento se pensaba que era una manera de mejorar genéticamente el ganado. “Como en la Argentina se faenaban vacas de calidad relativamente buena, se podían producir embriones de alta calidad y los costos eran ínfimos comparados con los que exigía fecundar una vaca a la manera tradicional –detalla Barañao–. Uno producía cientos de embriones, y aunque después se vio que éstos bajaban de precio y finalmente las cuentas no «cerraban», era bueno dominar esa tecnología.” Los terneros nacidos en la Argentina fueron los primeros de América latina, y para los científicos tenían una doble utilidad: por un lado, les permitían desarrollar una aplicación biotecnológica, y por el otro, estudiar los procesos de maduración y fertilización de ovocitos en una especie distinta del ratón, con características más parecidas al ser humano. Y ya que lo hacían en cabras... ¿por qué no probarlo simultáneamente en vacas? “Era un desafío ambicioso, entre otras cosas, porque había que diseñar toda la logística, desde la biología molecular, hasta la biología celular, la veterinaria –explica Barañao–… Había que comprar cabras criollas, un chivo de una raza lechera... Además, el chivo sólo se reproduce en determinada época del año. Un detalle colorido es que tuvimos que alojarlo en Veterinaria, reparar un co49 rral... Los investigadores teníamos que hacer de todo: desde arreglar un alambrado, hasta bajar los fardos de pasto y preparar los medios de cultivo. Era divertido, pero...” El Fondo Tecnológico Argentino (FONTAR) les dio cerca de 800.000 dólares con los cuales montaron el laboratorio de Marcelo Rubinstein en el Ingebi y también arreglaron gran parte del resto del Instituto. Pero el camino que habían decidido tomar no carecía de obstáculos. Había que sincronizar el celo de las hembras, fertilizarlas por laparoscopía, esperar 48 horas hasta que estuviera fecundado el óvulo, hacer la cirugía, lavar la trompa (de Falopio), y recoger los huevos fecundados. “Después de colocarlos en un tubito, había que correr de la veterinaria al laboratorio, donde Rubinstein los esperaba con su microscopio, los examinaba y decía: «No, están pasados»”, ilustra Barañao. Y así todas las semanas. Las vacas eran un poco más previsibles... Pero una vez que los embriones llegaban a la etapa de blastocistos [embriones que se desarrollaron durante 5 o 6 días], había que llevarlos al campo, en Baradero, donde tenían que esperar al equipo encargado de realizar la “transferencia”; es decir, de insertarlos en el útero de las vacas portadoras. Eso implicaba sincronizar el día en que había que ir al matadero a conseguir los óvulos, con el momento en que se trataba a las vacas en el campo con (hormonas) prostaglandinas para que estuvieran listas para cuando llegara la camioneta con el embrión. “Me acuerdo de un día que teníamos listos unos animales buenísimos y pararon a la camioneta en la Aduana, viniendo de Uruguay, porque tenía una lupa que no estaba registrada o algo así –rememora Barañao con una sonrisa–. Y mientras tanto, el tiempo pasaba y pasaba...” 50 Finalmente, hicieron decenas de transferencias de embriones de cabras y dos transferencias de vacas. De ellas, nacieron tres cabritos y dos terneras. “Con Lino queríamos producir animales con material de matadero, pero esas vacas no eran muy atractivas porque no contaban con un material genético especial –dice Salamone–. En cambio, si a esas vacas se les sumaba valor agregado, algo que las hiciera únicas, el embrión resultaría mucho más valioso.” Así fue como Barañao empezó a intentar la transgénesis para convertirlas en fábricas de proteínas de interés farmacológico. Los primeros animales podían o no ser transgénicos. Había que inyectar 2.500 ovocitos, de los cuales, una vez fecundados solo sobrevivía un 10 %. De éstos se implantaba un 20%, y de ésos había chances de que un animal fuera transgénico. “Pero transgénico en el sentido de que tuviese el gen, porque aún así podía no expresar la proteína de interés, ya que si el gen que insertábamos no llegaba al tejido o al órgano correspondiente...”, detalla el científico. Suele decirse que la ciencia es un largo camino de fracasos salpicado por un éxito de tanto en tanto. Esta aventura no fue la excepción. Exigió un período de muchísimo trabajo, en el que nacían los animales, pero no lograban lo que habían planeado y parecía que no iban a llegar a la meta. Finalmente, Biosidus S.A. decidió seguir adelante con otra metodología, la clonación, no obstante lo cual devolvió el subsidio como si el proyecto hubiera sido exitoso, porque se había desarrollado tecnología y se habían formado recursos humanos. Nació sí, un toro Aberdeen Angus de alta calidad, que se usó como caso control. A mediados de 1996, la idea original comenzó a languidecer. Para entonces, Salamone estaba deseoso de volver al campo para empa51 parse de los problemas propios de los animales y de la logística de la explotación ganadera, y decidió viajar al exterior a hacer un posgrado. Luego de algún tiempo, “había estado trabajando mucho y no sabía muy bien cuál iba a ser mi próximo paso, cuando viajo a Niza para participar en un congreso –cuenta–. Deambulando por los pasillos, escucho [al científico argentino] José Cibelli. Exclamaba: “¡Lo logró! ¡Qué maldito! ¡Y encima es buena persona!”. Los diarios del mundo habían anunciado el nacimiento del primer mamífero clonado de células adultas de la historia, la oveja Dolly. “Ahí me dije: yo tengo que trabajar en esto”, dice Salamone. Un año y medio más tarde, en enero de 1998, precisamente Cibelli lograría el nacimiento de los primeros terneros clonados transgénicos del mundo. 52 La ingeniería de la vida Dolly nació al caer la tarde, el 5 de julio de 1996, cerca de Edimburgo, Escocia. Tenía la apariencia de una típica oveja de raza FinnDorset, pero lo cierto es que era absolutamente extraordinadria: Ian Wilmut, un embriólogo inglés (y marinero frustrado), y Keith Campbell, un biólogo de 42 años de la misma nacionalidad, la habían creado aplicándole una diminuta descarga eléctrica a una célula de ubre de una oveja ya muerta y a un óvulo sin fertilizar desprovisto de sus cromosomas. Si bien su embrión había sido implantado en el útero de otra oveja, en rigor, no tenía ni madre ni padre: fue una hermana gemela de la oveja donante del material genético. A pesar de que evoca argumentos de ciencia ficción, la clonación es una maniobra aparentemente sencilla. Una aguja penetra a través de la membrana exterior de un óvulo. Con una maniobra diestra, un técnico extrae su núcleo y luego utiliza una segunda aguja para inyectar en su lugar otro núcleo, extraído esta vez de una célula diferenciada (con un juego completo de cromosomas). Una descarga eléctrica los fusiona. Y el embrión empieza a dividirse... Muy pronto, la comunidad científica vislumbró las potencialidades de este desarrollo que, tras repetidos fracasos durante un cuarto de siglo, pocos habían creído posible. El artículo que lo describía fue 53 publicado en Nature el 7 de marzo de 1996, y una semana más tarde un editorial advertía que “el poder creciente de la genética molecular nos enfrenta a la perspectiva futura de ser capaces de cambiar la naturaleza de nuestra especie” y plantea cuestiones que afectarán a la humanidad. Para apreciar el impacto que este avance tuvo en todo el mundo baste con recordar que, poco tiempo después, el presidente norteamericano Bill Clinton recomendó adoptar una mora en las investigaciones y prohibió el empleo de fondos federales para la experimentación con embriones humanos. Varios países europeos hicieron lo mismo. La Iglesia condenó el uso inescrupuloso del cuerpo humano, y hasta los mismos Wilmut y Campbell se opusieron al uso de la clonación con fines reproductivos: “Todo tipo de manipulación de embriones humanos debería ser prohibida”, declararon. Los investigadores estaban asombrados porque veinticinco años de intentos los habían convencido de que, una vez que las células habían comenzado a diferenciarse hacia sus roles de adultas en el embrión temprano, no podían volver atrás. Dolly demostró lo contrario (después de 276 intentos fallidos) y abrió la puerta a un sinnúmero de innovaciones biotecnológicas. Una, en particular, acaparó el interés de los científicos: los clones transgénicos presentaban la posibilidad de convertirse en fábricas de medicamentos. Como la hormona de crecimiento... Richard Palmiter, de la Universidad de Washington, y Ralph Brinster, de la de Pensilvania, habían obtenido el primer animal transgénico en 1983. Los científicos crearon un ratón gigante implantando el gen responsable de la hormona de crecimiento humana en óvulos de ratón fertilizados. Luego transfirieron los huevos a hembras portadoras y documentaron que el gen funcionaba en varias de sus 54 crías. También demostraron que el gen podía transmitirse de generación en generación. Los transgénicos podían producirse insertándoles o suprimiéndoles un gen por medio de la tecnología de recombinación del ADN. Esas modificaciones pueden agregar o suprimir una función. El gen podía insertarse por microinyección en el pronúcleo de un cigoto (célula resultante de la unión de los gametos femenino y masculino), utilizando un vector retroviral o transformando células embrionarias. “En 1996 viene a la Argentina Alan Trounson, líder de la fertilización in vitro en Australia, un pope, y nos dice que ya no se hace más microinyección, que lo que deberíamos estar haciendo era clonación”, cuenta Barañao. Pero “cambiar de caballo en medio del río” no era sencillo. Entonces, a fines de 2000, Salamone, que había estado trabajando en el ciclo reproductivo de bovinos en Canadá y luego había pasado a trabajar con Jim Robl, otro referente en clonación en cuyo laboratorio precisamente el argentino José Cibelli había producido las primeras vacas transgénicas, le escribe a Barañao diciendo que quiere volver a la Argentina. En los Estados Unidos, Salamone había aprendido una técnica que consistía no en microinyectar óvulos, sino en tomar fibroblastos de feto (las células más comunes y menos especializadas del tejido conjuntivo), transfectarlos con (introducirles) un gen de resistencia a los antibióticos, seleccionar las células transgénicas y luego hacer el transplante nuclear. Así se tienen altas probabilidades de obtener embriones transgénicos. 55 “Esa tecnología era un boom que incluso había dado lugar a la creación de una empresa, Advanced Cell Technologies –precisa Barañao–. Así que volví a Biosidus S.A. y les dije: «Vamos por esto».” Y allí fueron. Según cuenta Salamone, él volvió en enero, consiguió el equipo en julio, al mes tenía los primeros clones y cinco meses más tarde los primeros transgénicos. Desde su regreso al país, Barañao había tenido la idea de que era prioritario desarrollar la biotecnología animal. “Los bioquímicos preferían trabajar con plantas, porque eran más sencillas y las tenían en la maceta, pero yo quería trabajar en transgénesis con vacas... aunque la verdad es que no tenía mucha idea”, confiesa. Había desarrollado un método para valorar de actividad biológica de las hormonas que se usan para superovular, había trabajado con estas proteínas para inducir la superovulación en yeguas y también había intentado trabajar con las empresas aportando elementos para la producción animal, aunque sin mucho éxito. “Era tal la oscilación de la economía, que nadie quería embarcarse en proyectos de riesgo”, apunta. Entonces, decidió escribir un proyecto de dos carillas en el que establecía que no iban a desarrollar ratones, ni cabras: harían la prueba de concepto en cultivos de glándula mamaria de vaca. No sería necesario afrontar un proceso largo y costoso para crear un ratón transgénico que permitiera probar si la construcción funcionaba o no. Lo probarían in vitro. Y con la hormona de crecimiento. Barañao seleccionó un reducido grupo de trabajo integrado por Leonardo Bussman, que se ocuparía de las transfecciones (la inserción de genes) y el cultivo de los fibroblastos, Daniel Salamone, para el trasplante nuclear, y la empresa Munar y Asociados, para la transferencia de embriones. 56 La entretela de esta historia no carece de suspenso y hasta de condimentos humorísticos. “Mientras Salamone todavía estaba en los Estados Unidos, mandaron a un abogado a que lo convenciera de volver –cuenta Barañao–. Me acuerdo que ese verano yo estaba en Mar del Plata con mis hijos, en [los juegos de] Sacoa y, ante la suspicacia de los chicos, usaba las fichas para mandarle mails a Salamone que cada tanto se arrepentía...” Finalmente, en diciembre de 2001, empezaron a trabajar. “¡El país se caía a pedazos y nosotros lanzándonos a esta aventura!”, recuerda. Para los primeros intentos, utilizaron tejido de una oreja del toro que había resultado del embrión implantado en el experimento de años antes. “La primera vez se dejó sacar la muestra dócilmente –comenta–, la segunda ya miraba con desconfianza, y después empezaba a raspar el suelo con la pata con ánimo amenazante en cuanto veía al técnico que se acercaba con el sacabocado como si le dijera: «Acá no te acercás».” Sin embargo, de esas células bovinas se logró el primer embrión clonado. Al mes y medio de transferido e implantado en el útero de la vaca portadora, una ecografía mostraba la imagen del ternerito en gestación. “Fue maravilloso –comenta Barañao–: nunca había puesto ecografías de mis hijos en la pantalla de la computadora, pero todo el grupo tenía la imagen del ternerito en sus máquinas.” Lógicamente, la noticia provocó una enorme algarabía, entre otras cosas, por la celeridad con que se obtuvo un resultado positivo, si se lo compara con los casi 280 intentos que había requerido clonar a la oveja Dolly, el primer mamífero obtenido por esta técnica de la historia. 57 El parto estaba previsto para los primeros días de marzo de 2002. La vaca, que pastaba en medio del campo rigurosamente vigilada, había sido revisada por un “batallón” de especialistas en neonatología bovina y se encontraba en óptimas condiciones para dar a luz. Pero (siempre hay un “pero”) un par de semanas antes de la fecha indicada, Quelo Gómez, el encargado del campo, les advirtió que según su experiencia el parto se adelantaría. “Me acuerdo que dijo: «Esta vaca pare en una semana»”, asegura Barañao. Con la autosuficiencia que otorga una carrera universitaria, los investigadores, por supuesto, confiaron más en sus propios cálculos que en la intuición y la experiencia de Quelo e hicieron caso omiso de sus advertencias. “El sábado siguiente, sin ningún integrante del equipo científico presente, la vaca entró en trabajo de parto –cuenta–. Cuando llegó el primero de nosotros, el ternero estaba atascado en el canal de parto. Para cuando lograron sacarlo, ya había muerto. Para colmo, sabíamos que en Balcarce había vacas preñadas por clonación y en Brasil también se estaba intentando. Finalmente, todas abortaron.” Un artículo de La Nación dio a conocer la noticia de este modo: “Inesperadamente, a fines de enero de 2002, el equipo de investigación de Biosidus S.A., que algo más de nueve meses antes había logrado clonar terneros a partir de células adultas por primera vez en América latina, tuvo que trasladarse de urgencia al campo. “La vaca de raza Jersey que se encontraba en más avanzado estado de gravidez había comenzado a tener síntomas de parto inminente, dos semanas antes de la fecha prevista, que era el 11 de febrero. “Como se había convenido de antemano, fue sometida a una cesárea, pero, a pesar de los esfuerzos de reanimación y de que estaba 58 completamente formado, el ternerito falleció durante el parto, que se había producido el 28 de enero. De todos modos, y más allá de la frustración lógica, el equipo hizo un balance positivo de la experiencia: en apenas un año de trabajo habían logrado dominar la técnica de la clonación y cumplir todos los pasos que permiten producir un animal totalmente formado. Y ya estaban preparados para seguir adelante. “El ternerito clonado se había producido insertando el núcleo de una célula del toro Aberdeen Angus (un fibroblasto de la oreja) en un óvulo bovino. El embrión resultante fue incubado durante algo más de una semana antes de transferirlo a la vaca portadora. “Se gestó como corresponde y llegó a tener todos sus órganos y tejidos –explicó en esa oportunidad Carlos Melo, de Biosidus S.A., a La Nación–. Después del nacimiento, se realizaron los estudios genéticos e histopatológicos. Era normal, anatómica y fisiológicamente. Sólo tenía lo que se conoce como hígado graso, algo también habitual en estos animales. Las pruebas muestran de manera indudable que era un clon. Mandamos muestras con varias trampas cruzadas (una muestra del toro original, dos del ternero, dos de la madre nodriza y una del hijo biológico del toro) para tener la certeza, y los resultados fueron irreprochables. Indican una identidad del 99,95% (el 100% es imposible). Sobre 16 regiones del ADN que se estudiaron, las 16 coinciden. Es decir, la probabilidad de que por casualidad haya habido un error es de 5 en 10.000.” Pero el plan seguiría como estaba previsto. La meta era clonar vacas transgénicas capaces de producir hormona de crecimiento humana, y el equipo ya tenía otra decena de preñeces en marcha. Si tenían éxito, las vacas clonadas y modificadas genéticamente serían capaces de producir entre 15 y 20 litros de leche diarios. Cada li59 tro de esta leche podría contener hasta cinco gramos de hormona de crecimiento, lo que daría entre 75 y 100 gramos diarios. Bastarían dos o tres vacas para abastecer la demanda mundial de hormona de crecimiento. “Es decir, que entre una vaca que produce una proteína recombinante y una gallina que produce huevos de oro, es más conveniente la vaca”, bromeó en ese momento Barañao. “Esta fue una prueba de que nuestra receta funcionaba... y llegamos al parto. La moneda cayó del otro lado, pero es chance. Significa que dominamos la tecnología, lo que es notablemente exitoso. Ahora es cuestión de repetir. Estamos en un nivel avanzado. Pero tenemos que ir paso a paso”, agregó. Una vez superada la frustración, decidieron seguir adelante, pero esta vez con fibroblastos fetales de raza jersey, de menor tamaño, para evitar los riesgos asociados a la particularidad de los terneros clonados de ser más grandes que los nacidos de forma natural. Por fin, de las primeras células nace exitosamente Pampa, la primera ternera clonada en la Argentina. Para no dejar nada librado al azar se había instalado un verdadero quirófano en medio del campo y el equipo encargado del parto incluía a ocho personas. De allí en más, “casi semana por medio se hacía un asado para asistir al nacimiento de un ternero clonado –recuerda Barañao–. Y aunque eran partos de alto riesgo, salían bien...” Con diferencia de meses nacen dos descendientes de esa dinastía, con un valor agregado: son transgénicas. Las llaman Pampa Mansa y Pampa Clara. Se les toman muestras de ADN y todas tienen el transgen, pero la que arroja una señal más potente es la primera. 60 El éxito fue motivo de otro festejo cuyo registro fue una foto Polaroid de la “bandita” de barras oscuras y claras que mostraba la presencia del gen humano en medio del genoma bovino. En cuanto la vaca llegó a la madurez, sus ubres comenzaron a dar leche que contenía la hormona humana, dato que se probó por radioinmunensayo. “De todas maneras, había que probar que era exactamente igual a la que ya producía Biosidus S.A. y se hizo: era bioquímicamente idéntica y biológicamente activa”, dice Barañao. Y acota que, más allá del logro científico, fue una muestra notable de cómo dos docenas de científicos, empresarios, veterinarios y gente de campo argentinos pudieron trabajar juntos en pos de un objetivo común. Era la primera vez que se establecía una asociación tan directa entre la ciencia y la empresa. Cinco años después de que hubiera nacido el primer animal clonado de la historia, había apenas cuatro o cinco grupos en el mundo que dominaban esta tecnología y habían desarrollado el conocimiento haciendo grandes inversiones. “No hay muchas tecnologías que cinco años después de ser desarrolladas ya se dominen en el país –dice Barañao–. Para entender la trascendencia de este logro podría decirse que es como si científicos espaciales argentinos hubieran podido lanzar el Sputnik en 1962.” El proyecto también resultó ejemplar para comprender el valor de la inversión en innovación, si se tiene en cuenta que, al crear una importante plataforma tecnológica, Biosidus S.A. no tuvo problemas para gestionar financiación ni siquiera en plena crisis. 61 “Para mí fue una experiencia muy importante –dice Barañao–, la coronación de más de 18 años de esfuerzo. Siempre tuve un tiempo de mi laboratorio dedicado a esto. Y pudimos mostrar cómo una asociación de fracasos puede conducir al éxito. Como dice Pasteur: la casualidad sólo favorece a espíritus preparados.” 62 La farmacia en el tambo Entre el 10 y el 24 de septiembre de 2002 nacieron en un campo de la provincia de Buenos Aires tres terneritas de raza Jersey que hicieron historia: Clara, Dulce y Mansa, los primeros bovinos clonados transgénicos del país. El logro ubicó a la ciencia argentina en la vanguardia de la biotecnología mundial. Las tres fueron la copia fiel de Pampa, la primera ternerita clonada en la Argentina, que había nacido dos meses antes. Pero diferían en un detalle fundamental: sus células poseen el gen de la hormona de crecimiento humana, por lo que se espera que sean capaces de producir grandes cantidades de esa proteína de uso terapéutico que resulta imprescindible para los chicos que sufren de enanismo hipofisario, y a la que día a día se le encuentran nuevos usos. En el programa de clonación de vacas transgénicas que había lanzado un lustro antes la empresa de biotecnología local Biosidus S.A. intervinieron científicos de distintos grupos de investigación del CONICET, la UBA y el Instituto Nacional de Tecnología Agropecuaria (INTA). Las proteínas humanas de interés farmacológico se venían clonando desde alrededor de dos décadas antes. Pero no en mamíferos superiores, sino en bacterias y células. 63 “Así se habían podido fabricar fármacos como el interferón, la eritropoyetina o la insulina, que antes había que obtener por métodos extractivos. Pero hay un problema: existen proteínas de las que se requiere mucha masa para que ejerzan su efecto terapéutico. Por ejemplo, en una ampolla de interferón hay entre 10 y 20 microgramos de la sustancia de interés; en una de insulina, entre 30 y 40 miligramos. O sea, que con el mismo fermentador se pueden producir 2.000 veces más ampollas de interferón que de insulina. Evidentemente, los métodos que resultaban tan fascinantes en 1980 no son adecuados para satisfacer las necesidades actuales”, explicó Criscuolo en declaraciones para el diario La Nación. El nuevo avance introduciría posibilidades industriales revolucionarias. Por ejemplo, el fermentador de la planta de Biosidus S.A. del barrio de Boedo tiene 250 litros de capacidad. La relación terapéutica entre el interferón, por ejemplo, y la hormona de crecimiento es de 100 a uno. “Es decir –explica Criscuolo–, que si uno puede abastecer un mercado de interferón con ese fermentador, para producir la misma cantidad de hormona necesitaría un tanque de 25.000 litros. Y no sólo hay que pensar en el tamaño del tanque, sino en todas las complicaciones asociadas: en lugar de agregar dos kilos y medio de glucosa, voy a tener que agregarle una tonelada; además, tendré que disponer de una planta de tratamiento capaz de purificar miles de litros de cultivo... En cambio, si yo reemplazo todo eso por un tambo, y en cada litro de leche obtengo cinco gramos de hormona, tengo cinco mil dosis por litro. Una vaca me da veinte litros por día... Los números son asombrosos.” En el plano estrictamente económico, la inversión necesaria para instalar una planta ronda los cincuenta millones de dólares; un tambo, los cuatrocientos mil. “Y hay otro tema –agrega Criscuolo–: la flexibilidad. Cuando se hace una planta de producción, se corre un gran riesgo porque hay que evaluar muy bien el mercado. Si la pre64 paro para producir una cierta cantidad, tengo que vender por lo menos el 70% de esa cifra. Si la demanda es mayor, puedo invertir cincuenta millones de dólares y no alcanzar a abastecer el mercado. Pero si me queda muy grande, también es complicado, porque el lucro cesante va al costo del producto y lo encarece. En el caso del tambo farmacéutico, es muy fácil: ordeño una vaca y si no me alcanza, pongo dos. O tres. Tengo una forma mucho más flexible de acomodarme al mercado. Además, el tiempo de ordeñe de una vaca es de tres minutos. Puedo ordeñar veinte vacas en una hora. También es posible amoldar la purificación de acuerdo al tamaño del lote que se necesite. Y no hay que comprar medios de cultivo, los pone la vaca. O sea, vemos una cantidad enorme de ventajas. La vaca transforma pasto, agua y un poco de maíz en un producto farmacéutico.” Proyecciones internacionales estiman que la demanda de productos biotecnológicos superará ampliamente la capacidad instalada global. Las bacterias –es decir, los reactores biológicos para los que ya hay aprobación de las autoridades sanitarias argentinas– tienen una capacidad de producción limitada. Era necesario pasar a otra dimensión y los bovinos ofrecían una salida inmejorable: basta una sola vaca transgénica para abastecer la necesidad local de hormona de crecimiento. Era la oportunidad ideal para conjugar dos de las riquezas que el país –a pesar de las crisis– posee en abundancia: know-how científico de alto nivel y tecnología ganadera de avanzada, ambos saberes cultivados a lo largo de décadas. Melo se encargó de subrayarlo en sus declaraciones a periodistas interesados por el anuncio de la clonación de la dinastía Pampa. “Todo esto no solo requiere dominio de ciencia básica, sino también un complejo trabajo de coordinación en el campo mismo –dijo–. Allí 65 mantenemos constantemente 200 vacas nodrizas preparadas para ser implantadas con los embriones. Semanalmente se van poniendo en fase 15 o 20, lo que requiere un trabajo muy delicado para que los animales estén preparados en tiempo y forma. Por otro lado, los individuos clonados requieren cuidados especiales, y en esto los peones de campo cumplen una tarea fundamental, con guardias de 24 horas para que no les falte atención ni un instante.” Igual que Pampa, Clara, Dulce y Mansa fueron creadas a partir de una célula fetal de raza Jersey y de un óvulo de descarte. Ambas células se cultivaron y se fundieron in vitro, y en ese cultivo se introdujo el gen humano de la hormona de crecimiento disfrazado de otro que se expresa normalmente en la glándula mamaria bovina, el de la betacaseína vacuna. “De ese modo, nos aseguramos de que se expresara precisamente en el lugar que queríamos”, explica Salamone. A los seis meses, las terneritas fueron estimuladas hormonalmente para que produjeran leche, lo que permitió verificar si el gen humano cumplía con su función. Dos años más tarde, cuando estuvieron en condiciones de ser preñadas y tener descendencia, comenzaron a producir leche con la hormona medicinal. 66 Broche de oro Dos años más tarde, Biosidus S.A. le puso el broche de oro a su programa “tambo farmacéutico del tercer milenio”: en el corral aséptico que la compañía posee en la provincia de Buenos Aires, nació Pampero, el primer bovino de sexo masculino cuyo ADN contiene el gen humano de la hormona de crecimiento. Pampero es el macho que asegura la perpetuación de la estirpe transgénica y un logro que volvió a poner a la Argentina en la primera línea de la investigación mundial en este tema. De color miel y con los ojos dulces de su madre biológica, Pampa Mansa, difería como el día de la noche de la vaca que lo había gestado en su útero durante 39 semanas. Se trató de un ternero absolutamente extraordinario: al madurar, cada uno de sus espermatozoides tendría el gen humano de la hormona de crecimiento, que su progenie heredaría de acuerdo con la rigurosa lógica de las leyes de Mendel. Con un programa constante de obtención de semen, que puede guardarse congelado en nitrógeno líquido, se aseguraba la conservación de la estirpe. 67 La ecuación tecnológica había sido impecable. El producto de una eyaculación de Pampero alcanzaría para inseminar entre doscientas y trescientas vacas “normales” con las técnicas de rutina. La mitad de los hijos serían transgénicos. De éstos, la mitad sería de sexo femenino; es decir, vacas productoras de grandes cantidades de hormona de crecimiento humana en su leche. Avanzar en el conocimiento de cómo manipular los engranajes de la naturaleza resultaba infinitamente más rendidor que ensamblar los de la ingeniería tradicional. Mientras que una vaca puede dar hasta tres kilos de hormona sin purificar por mes, un fermentador de 500 litros, trabajando seis días por semana, puede producir como mucho sesenta gramos. Con unas 14 vacas, se puede abastecer el mercado mundial de esta proteína. Con esta producción, la Argentina podría ser el primer fabricante mundial de hormona de crecimiento. “Nosotros teníamos un sistema muy eficiente, pero costoso, basado en la clonación, la generación de embriones, la transferencia embrionaria, el parto por cesárea... Ahora, para este fármaco no necesitamos seguir produciendo vacas por clonación, porque el semen de Pampero puede generar todas las vaquitas transgénicas que uno quiera, con la identidad genética asegurada y por el método más económico que pueda pensarse, que es la inseminación”, explica Criscuolo. El nacimiento de Pampero representó la culminación de un programa que se había iniciado siete años antes, poco después de que la oveja Dolly se convirtiera en el primer mamífero de la historia obtenido a través de la clonación de un animal adulto. El 6 de agosto de 2001 había nacido Pampa, la primera vaca clonada del país; en 2002, Pampa Mansa, primera vaca clonada transgénica; 68 el 5 de enero de 2004 nacieron Pampa Mansa I y II, y el 7 de diciembre nació Pampero. Todos los animales se mantuvieron en perfecto estado de salud y aunque nacen en condiciones de estricta asepsia se criaron de una forma lo más parecida posible a la habitual. “Con el nacimiento del macho transgénico perpetuador casi todas las posibilidades que tiene esta tecnología fueron exploradas con éxito”, subraya Criscuolo. Para Marcelo Argüelles, en ese momento presidente de BioSidus, el logro no sólo se debió al nivel científico de los investigadores locales, sino también a la pericia y experiencia del personal de campo, que tenía un entrenamiento “fenomenal”. Por ejemplo, el doctor Roberto Salaberry, que hacía las cesáreas, era capaz de «sacar» al ternero en menos de tres minutos. Para evitar riesgos, el equipo había trabajado en un corral aséptico, con veterinarios vestidos con traje de astronauta y paisanos de guardapolvo blanco. También había participado un neonatólogo y había hasta un desfibrilador disponible. Cuando en el laboratorio se preparan embriones para ser implantados, no hay mucho tiempo, de modo que los científicos mantenían más de doscientas madres receptoras «en ciclo», listas para ser utilizadas y bajo el control de los encargados que las revisaban dos veces por día. “Cuando Salaberry vio el primer ternero clonado –dice Argüelles–, un bichito color beige de una madre negra, lo primero que dijo fue “¡Es hembra!”, y lo segundo, “¡Es [raza] Jersey!”, con lo cual se cumplían las dos premisas que confirmaban que habíamos logrado lo que nos habíamos propuesto y que se trataba efectivamente de un animal clonado.” 69 Llegar a la meta exigió compatibilizar dos culturas y conocimientos muy diferentes: los del campo y los del laboratorio, unos tan importante como los otros. “La gran experiencia de nuestra gente de campo fue vital para poder estimular la superovulación en las vacas, lavarles el útero, extraer los óvulos e insertar los embriones clonados en las hembras receptoras”, subraya Criscuolo. Para Barañao, la experiencia dejó mucho más que un rédito científico y tecnológico. “Esto muestra lo que es posible hacer en la Argentina y también que podemos participar en la nueva manera de hacer ciencia que se está viendo en los países desarrollados –afirma–. Pasamos de la investigación fundamentalmente académica, con financiamiento exclusivamente estatal, a un trabajo grupal. Proyectos tan ambiciosos como éste sólo son posibles con la participación de grupos multidisciplinarios capacitados para resolver cada una de las etapas del proceso. Además de aumentar el conocimiento básico, tienen como objetivo la obtención de un producto concreto. Paradójicamente, si bien ésta es la nueva manera de hacer ciencia, es también volver a Pasteur, que sentó las bases de la microbiología, pero resolviendo problemas de los productores.” Y agrega: “Armonizar grupos de trabajo y evitar el tradicional individualismo argentino en función de un proyecto común es un hecho inusual y promisorio... Y un logro tanto o más importante que obtener vacas transgénicas”. Después de cerrar el ciclo de la hormona de crecimiento, el equipo de Biosidus S.A. siguió adelante con su proyecto de «tambo farmacéutico», y desarrolló la dinastía Patagonia, que produce insulina [para el tratamiento de la diabetes], y presentó a Porteña, la primera ternera del mundo capaz de producir hormona de crecimiento bovina en su leche; es decir, le agregaron una construcción genética (un fragmento de ADN) para que esta hormona se exprese en un lugar 70 en el que no lo hace naturalmente, la glándula mamaria de las vacas. La hormona de crecimiento bovino, aprobada por la Food and Drug Administration de los Estados Unidos (FDA) en 1994, se utiliza para estimular la producción de leche en el ganado. Se sabe que puede aumentarla alrededor de un 25%. La utilizan Estados Unidos, México y Brasil, y probablemente lo harán países como Venezuela, Perú y Chile. El mercado mundial ronda los 500 millones de dólares. Y hasta ahora hay sólo dos compañías que la fabrican. Poco a poco, y con todo los recaudos que corresponden, el mundo les está abriendo las puertas a las nuevas tecnologías. Las autoridades sanitarias europeas ya aprobaron el primer producto transgénico para uso en seres humanos producido en la leche de cabras. Y la FDA, en los Estados Unidos, publicó una guía para la aprobación de drogas y alimentos producidos también por animales transgénicos, y los lineamientos que deben observarse para su cuidado, tratamiento, conservación y regulación. Pero los comienzos fueron diferentes. El equipo de Biosidus S.A. debió enfrentar cuestionamientos que muchas veces se pasan por alto cuando se trata de juzgar productos importados. “Tuvimos que dar muchos exámenes –cuenta Criscuolo–. Cuando presentamos la hormona recombinante [producida en bacterias] el cuerpo médico nos exigió mucho más por el prejuicio de que «si es importado, tiene que ser mejor». ¿Cómo estos muchachos de Almagro, a tres cuadras de la ex cancha de San Lorenzo, íbamos a tener la proteína recombinante?” La hormona de crecimiento está indicada para niños que no crecen en altura en los ritmos considerados normales. El déficit se puede comprobar con facilidad: bastaría con que los maestros midieran a sus chicos cada tres o seis meses en los colegios, algo que ayudaría a la detección precoz. 71 “Sería importantísimo, porque solo hay tiempo para tratarlos hasta que termina la adolescencia. Y si se los individualiza tardíamente no alcanzan su altura potencial. Si uno detecta a un chico afectado de enanismo hipofisario a los 12 años, tiene seis más para tratarlo. En cambio, si lo detecta a los quince, tiene tres”, afirma. Pero esta proteína no solo podría utilizarse para estos cuadros. Entre otros usos, también se estudia en la vejez para generar músculo, en los casos en que hay deficiencia comprobada de hormona. “Muchas veces, hay viejitos que se caen y se fracturan, porque la cola también es el colchón para no fracturarse, entonces cuanto menos músculo, menos colchón. Con un buen colchón, disminuimos el nivel de caídas y de fracturas.” Internacionalmente también está aprobado su uso en casos de disminución de estatura que pueden llevar a la discriminación, como cuando una persona tiene una talla que no le permite alcanzar las manijas del subte o la altura de los mostradores para trámites. “La discriminación puede llevar a una enfermedad por la angustia que causa –agrega–. Entonces, con aprobación de los padres, el médico puede tratar estos casos para agregar varios centímetros de altura.” Un chico tratado con hormona de crecimiento gana alrededor de cinco centímetros por año, dependiendo de su respuesta al tratamiento. En la Argentina, se venden actualmente más de seis marcas de hormona de crecimiento. El Estado atiende a los niños hasta los veinte años, que es cuando, se calcula, se cierran las epífisis (cada uno de los extremos) de los huesos largos y ya no crecen más. “Sin embargo, hay que tener en cuenta que desde el punto de vista fisiológi72 co, si una persona tiene deficiencia de hormona de crecimiento, sigue siendo deficiente aunque tenga veinte años –aclara Criscuolo–. La proteína no sirve sólo para los huesos. Quien es hormonodeficiente empieza a aumentar de peso, sufre cambios en la forma del cuerpo y la distribución de la grasa. Esto permite anticipar que habrá un grupo de niños que fueron tratados y salvados del problema de estatura, pero luego enfrentan otro. Por eso, se espera que en algún momento la ley cambie y permita prolongar el tratamiento cuando sea necesario.” 73 Epílogo Por esa curiosa trama de hechos, personas y acontecimientos que suelen entretejerse en la vida de un país, desde hace medio siglo la epopeya de la hormona de crecimiento no solo permitió destilar el talento de investigadores brillantes y audaces, sino también desarrollar tecnologías para la salud que permiten mejorar la calidad de vida, crear puestos de trabajo y competir en el mercado internacional. Bastan un par de cifras para comprender la diferencia entre tener o no el conocimiento desarrollado a lo largo de estas décadas. El tratamiento de un chico con enanismo hipofisario con hormona de crecimiento importada cuesta alrededor de tres mil dólares mensuales; con la producida localmente, dos mil pesos por mes. La dosis estándar es de un miligramo y medio diario. Solo para esta indicación, el mercado mundial ronda los mil millones de dólares, o aproximadamente 70 kilos anuales... La hormona producida por vacas transgénicas podría bajar alrededor del treinta por ciento el costo del producto. Existe además un mercado potencial en crecimiento por la suma de nuevas indicaciones: baja talla, síndrome de deficiencia de hormona de crecimiento en mayores de 65 años, prevención del envejecimiento. Concluidos los exámenes preclínicos que mostraron que la proteí74 na producida por las vacas transgénicas es estructural y funcionalmente idéntica a la producida por bacterias recombinantes, en 2012 comenzarían los ensayos clínicos finales y comparativos con un producto de referencia para su aprobación por las autoridades regulatorias. “Esto exige un enorme esfuerzo –dice Criscuolo–. Sólo comprarle el fármaco a la competencia implica una inversión de un millón de dólares.” A la distancia, resulta fascinante comprobar cómo el azar y la necesidad fueron encadenando las diferentes etapas que llevaron desde el interés por desentrañar la estructura íntima de una proteína, con los medios precarios con que contaba la bioquímica de la época de las probetas, hasta su producción mediante la manipulación del genoma de animales superiores. “En realidad, íbamos a hacer activador tisular del plasminógeno (TPA, según sus siglas en inglés, una proteína trombolítica) en cabras y terminamos haciendo hormona de crecimiento en vacas –dice Criscuolo, como si observara en perspectiva las insondables vueltas del camino recorrido–. Cuando parecía imposible producirla con células, porque hubiera sido necesario tener una fábrica inmensa y hubiera involucrado costos muy altos, nos dimos cuenta de que teníamos lo más importante para desarrollar la hormona de crecimiento: todo el conocimiento de nuestros maestros y de la gente de campo. De alguna manera se alinearon los planetas.” Así, mientras los bovinos clonados ocupaban las primeras planas de los diarios e inspiraban la imaginación –y frecuentemente los temores del público–, detrás de escena los científicos podían contestar las preguntas que los atormentaban. Por ejemplo, si los clones tienen descendencia, si los animales transgénicos también pueden reproducirse, si los últimos individuos de la estirpe tienen más errores genéticos que los primeros, si los clones nacen con la edad de la cé75 lula adulta de la que provienen sus dos juegos de cromosomas y se mueren antes... “Cuando decidimos avanzar en ese camino, Santomé y Dellacha fueron nuestros asesores y cumplieron un papel fundamental –subraya–. Nosotros teníamos que entender cómo funcionaba la mama, la betacaseína, si nos servía usar un promotor de esa materia blanca de la leche, sus interacciones... Ellos nos ayudaron en cada nuevo intento e inspiraron mucho respeto entre los jóvenes.” Acaban de cumplirse 100 años de la publicación, en 1911, de la tesis doctoral de Bernardo Houssay, considerada la piedra basal de la endocrinología en el país. Por una curiosa pirueta del destino, la investigación del primer Premio Nobel argentino versaba sobre la glándula hipófisis, encargada de producir nada menos que la hormona de crecimiento. Se llamó “Estudios sobre la acción de los extractos hipofisarios. Ensayos sobre la fisiología del lóbulo posterior de la hipófisis”. Acerca de su trabajo Houssay, que entonces tenía 23 años, escribió un texto que sorprende por su clarividencia: “Desde el año 1907 formé el propósito de ocuparme del estudio de las funciones de la hipófisis, tema que atrajo mi interés por las grandes lagunas de nuestros conocimientos al respecto. Mi propósito fue aplaudido y alentado por mi maestro doctor H. G. Piñero, quien luchando desde hace largos años ha hecho comprender, respetar y estimar entre nosotros los estudios fisiológicos habiendo conseguido instalar un buen laboratorio y puesto su cátedra a tal altura que es sin disputa una de las más brillantes de la escuela. Habiendo dedicado a los estudios de fisiología la mejor parte de mi tiempo a su lado, me ha parecido justo escribir mi tesis inaugural sobre algún asunto de esta materia. La casi totalidad de experiencias de este estudio 76 han sido realizadas por el Laboratorio de Fisiología de la Facultad de Agronomía y Veterinaria cuya dirección, junto con la cátedra, fuéronme encargadas interinamente. “Este trabajo, en realidad, representa una de las direcciones de mi labor experimental. Pudiérasele con justicia considerar como un estudio parcial sobre las funciones de la hipófisis, ya que se ocupa casi únicamente de las del lóbulo nervioso, que hasta hace poco se tenía por órgano rudimentario. (...) los estudios de Histología y Fisiología comparadas; el rol de esta glándula en la acromegalia, gigantismo, distrofia adiposo-genital, etc.; su papel en las toxiinfecciones; los síndromes de hiper e hipofunción y las aplicaciones terapéuticas de los preparados opoterápicos, etc., son temas que motivaron mi interés, habiendo sido, alguno de ellos, objeto de mis investigaciones. He preferido, sin embargo, no hacer mención de ellos hasta obtener resultados bien seguros, convencido como estoy de la nocuidad de las publicaciones prematuras que no han sido siempre bastante meditadas, que casi siempre están sembradas de errores y cuyo material principal está a menudo formado por una abundante copia, no siempre prolija, de materiales ajenos. Como esto sucede entre nosotros con tal frecuencia, que pudiera decírsele el principal defecto de nuestra literatura médica nacional, he creído prudente salvar el escollo en lo posible. La abundante bibliografía, bastante completa, que acompaña a cada tema aquí tratado, se justifica por el carácter de monografía de este estudio; por la utilidad de contraponer opiniones unas veces encontradas y otras complementarias, etc.; además por la facilidad que reportará a quienes deseen estudiar estos temas, evitándoles el largo y pesado trabajo de buscar uno por uno los datos bibliográficos. “Las dificultades materiales con que he debido luchar para proseguir estos estudios han sido muchas, queriendo dejar aquí anotada sólo una: la falta de perros en 1908-09, y comienzos de 1910, cuan77 do por una medida inconsulta, nos lo negaba la perrera municipal. Tengo además la satisfacción personal de haber costeado estos estudios con mis recursos personales. “La creación de institutos científicos de investigación no puede hacerse bruscamente como por obra de magia, se impondrá seguramente cuando por el persistente esfuerzo de nuestros investigadores, que felizmente los tenemos buenos y decididos, se imponga claramente su necesidad, y cuando haya verdaderos espíritus disciplinados y con ideal nacional, capaces de dirigirlos consciente y fructíferamente. Hoy que nuestro país ha alcanzado ya una posición económica brillante y está destinada a mejorarla constante y rápidamente por su prodigiosa potencialidad productora, es necesario que nuestro progreso científico, que no está aún a la par con el material, merezca una atención preferente del Estado y de las grandes fortunas particulares. Estas encontrarían mejor empleo para sus excedentes, destinándolos a sostener institutos de investigación o de beneficencia social bien entendida, que empleándolos como sucede hoy en numerosas obras infinitamente menos provechosas para el adelanto material e intelectual del país y que no pueden proporcionar iguales satisfacciones a espíritus verdaderamente cultos. En rigor más que una caridad sería a mi juicio un acto de justicia social. (...) “Hago pues votos porque pronto se consiga mejorar las condiciones pecuniarias de los Laboratorios y que las mejores remuneraciones permitan a los profesores de ciencias experimentales dedicarse exclusivamente a ellas, sin necesidad de ejercer la profesión médica que forzosamente resta la mayor parte del tiempo, en materias que por su índole exigen una labor constante y de todos los momentos.” Décadas más tarde, sus alumnos tomarían la antorcha para seguir avanzando precisamente en el conocimiento de los más íntimos engranajes de la glándula que lo había intrigado: no sólo desentraña78 ron la estructura de una de las hormonas que secreta y que resulta vital para el desarrollo del organismo, sino que además lograron producirla en bacterias genéticamente modificadas y luego en vacas transgénicas. Aquel día en que Alejandro Paladini invitó a Juan Dellacha y a José Santomé a sumarse a su cátedra de la Facultad de Farmacia y Bioquímica de la UBA y les ofreció un “laboratorio”, una cámara helada sin otro mobiliario que una mesada y un mechero de Bunsen, pocos hubieran sospechado que llegarían tan lejos. 79 Los protagonistas • José A. Santomé Durante más de cuarenta años, se dedicó al estudio de las proteínas, a la enseñanza de la bioquímica y a la formación de decenas de discípulos. Hoy, es profesor emérito de la Universidad de Buenos Aires, ex Coordinador del Laboratorio Nacional de Investigación y Servicios en Química de Proteínas (LANAIS-PRO), miembro de la Academia Nacional de Farmacia y Bioquímica, la Academia de Ciencias de Buenos Aires, la Academia de Ciencias del Mundo en Desarrollo (TWAS), en Trieste, y la Academia Latinoamericana de Ciencias, en Caracas. También es aficionado a la náutica, a recorrer el país en automóvil y a la observacion de pájaros. • Juan M. Dellacha Fue durante décadas investigador del CONICET profesor titular del Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica. Profesor Honorario de la Universidad de Buenos Aires, miembro de la Academia Latinoamericana de Ciencias, en Caracas. Integró el directorio de la Agencia Nacional de Promoción Científica y Tecnológica y de la Comisión de Investigaciónes Científicas de la Pcia de Buenos Aires. A su retiro, se 80 convirtió en Director Científico del Foro Argentino de Biotecnología, creado en 1986, veinte años después de la primera aplicación de la hormona de crecimiento a un chiquito argentino afectado de enanismo en el Cehip, puesto que ocupa hasta hoy. • Alejandro C. Paladini Fue farmacéutico (recibido con medalla de oro), bioquímico y profesor de matemática. Trabajó con Leloir, Braun Menéndez y Houssay. Después de recibir numerosos premios y de una vida dedicada a la ciencia, estuvo hasta su fallecimiento (15/09/2012), a cargo de la organización del Museo Bernardo Houssay de la Facultad de Farmacia y Bioquímica de la UBA. • Carlota Wolfenstein Nació en Checoslovaquia, pero llegó a la Argentina a los dos años. Se declara “más argentina que los argentinos”, a pesar de que vivió 13 años en Nueva York, donde se casó y tuvo una hija. Fue la primera becaria que integró el grupo de Santomé, apodado cariñosamente por sus colegas “Las Santomé´s Girls”, dado que estaba conformado sólo por mujeres. Hoy, ya jubilada, es investigadora ad honorem del CONICET en el Laboratorio Nacional de Investigación y Servicios en Péptidos y Proteínas (LANAIS-PRO) en el Instituto de Química y Físicoquímica Biológicas de la Facultad de Farmacia y Bioquímica de la UBA. • Mirtha Biscoglio La intrigaban la música y la investigación. Quiso ser concertista de piano, pero se decidió por la ciencia para no tener que emigrar a Europa para proseguir su carrera. Se recibió en Rosario y llegó a Buenos Aires con la ilusión de trabajar con 81 Agustín Marenzi, autor del libro con el que en su época estudiaban química biológica. Cuando se encontró con él, el científico le dijo que ya estaba muy mayor y abandonando el cargo, pero le sugirió ir a verlos a Paladini, Leloir o Stoppani. Fue así como se integró a la cátedra de Química Biológica. “Primero entré con una beca Biscoglio, porque me sostenía mi papá –recuerda–. Pero después tuve la suerte de trabajar con Santomé y Paladini, y fue algo que agradecí toda mi vida. Yo llegué a vivir en la facultad: fui la primera mujer que ocupó el departamento de residentes. Siempre amé lo que hago con pasión.” Dirigió 16 tesis doctorales. Actualmente, es coordinadora del Laboratorio Nacional de Investigación y Servicios en Péptidos y Proteínas (LANAIS-PRO) en el Instituto de Química y Físicoquímica Biológicas de la Facultad de Farmacia y Bioquímica de la UBA. • Daniel Salamone Se define como un gran provocador al que le gusta internarse en caminos que no fueron recorridos. “Una vez hablé con un antiguo amigo que había estudiado en la Universidad de Cornell y cuando le planteé lo que iba a hacer en clonación, me contestó que eso no era para la Argentina, sino para Gran Bretaña o los Estados Unidos –afirma–. Esto siempre fue como un sueño. Sin embargo, a veces me cuesta convencer a los estudiantes de que hay que soñar con lo imposible.” Hoy es profesor de la Facultad de Agronomía de la UBA e investigador independiente del CONICET. • Lino Barañao Parece haber estado predestinado a participar en esta historia. Su padre le hablaba de Alexis Carrell, el médico, biólogo y Premio Nobel francés que desarrolló los primeros medios de cultivo y logró mantener un corazón de pollo latiendo durante meses. Carrell mantenía correspondencia con el tío de Barañao 82 y su viuda le legó los trabajos. El científico argentino se dedicó al desarrollo de medios de cultivo y en 2007 una becaria suya, que había trabajado en Francia, logró obtener los primeros cardiomiocitos (células cardíacas) diferenciados a partir de células madre embrionarias que latían en una placa de cultivo. Barañao reconoce, sin embargo, que además de la influencia positivista de estos dos tíos, fue sensible a la influencia de un tío político llamado Honorio Serrano, salteño y coya, conocido como “El brujo”, que leía las manos y adivinaba el futuro. “Desde los ocho años, él me repetía que me veía hablando en público y que tenía que prepararme leyendo a Demóstenes”, afirma. Su profecía se cumplió: aunque todavía no leyó a Demóstenes, habla en público casi todos los días. Hoy es el primer Ministro de Ciencia, Tecnología e Innovación Productiva de la República Argentina. • Marcelo Criscuolo Se interesó en la investigación mientras cuidaba a su padre en la sección Hipertensión del Instituto Lanari. Allí integró un grupo que intentaba fabricar interferón leucocitario y se vinculó con la compañía Sidus. Junto con Alberto Díaz, lanzó la rama biotecnológica de la empresa, Biosidus S.A., que en menos de dos décadas logró dominar la manipulación de genes de utilidad en salud humana, y la clonación animal y vegetal, y aplicar esas técnicas a la producción de fármacos y especies vegetales. Hoy es su director ejecutivo. ...Y decenas de científicos, estudiantes avanzados, tecnólogos, médicos, empresarios y gente de campo que sumaron su esfuerzo y conocimiento para llegar a la meta... 83 DESCRIPCIÓN CIENTÍFICO - TÉCNICA HORMONA DE CRECIMIENTO Estudios realizados en Argentina Juan M. Dellacha ¬ José A. Santomé 85 SUMARIO I • FORMACIÓN DEL GRUPO DE TRABAJO PARA: el estudio de la hormona de crecimiento / creación del centro para el estudio de las hormonas hipofisarias (cehip) 1. Antecedentes 2. Orígenes del grupo de trabajo del Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA 3. Creación del Centro para el Estudio de las Hormonas Hipofisarias 3.1 Características del CEHIP Publicaciones • Trabajos publicados con el grupo de Mancini • Trabajos publicados con Sonenberg • Trabajos de investigación clínica II • INVESTIGACIONES SOBRE HORMONAS DE CRECIMIENTO DEL PERÍODO 1963-1976 a) Primeras experiencias b) Formación de subgrupos de trabajo 1. ESTUDIOS SOBRE CONFORMACIÓN MOLECULAR 1.1 Intercambio de hidrógeno 1.2 Predicción de estructura secundaria 2. RESIDUO N-TERMINAL Y ESTUDIOS FISICOQUÍMICOS 2.1 Determinación del residuo N-terminal 2.2 Estudios fisicoquímicos 2.2.1 Agregación y disociación de la bGH. Determinación del peso molecular 2.2.2 Purificación y caracterización de hormonas de crecimiento de otras especies 2.2.3 Marcación de hormonas de crecimiento con radioactivos 86 3. ESTUDIOS SOBRE ESTRUCTURA PRIMARIA (SANTOMÉ) 3.1 Características moleculares de las hormonas de crecimiento humana y bovina, conocidas cuando el grupo de química biológica inició sus investigaciones 3.2 Extremo C-terminal 3.3 Composición en minoácidos 3.4 Determinación de la estructura primaria completa de la hormona de la bGH 3.4.1 Técnica utilizada para la determinar la estructura primaria de la bGH 3.5 Estructura primaria de las hormonas de crecimiento ovina y equina 3.6 Influencia de la modificación química de residuos de amino ácidos de las distintas hormonas de crecimiento sobre su comportamiento inmunológico Publicaciones • Conformación molecular • Predicción de estructura secundaria • Determinación del residuo N-terminal • Estudios fisicoquímicos • Obtención de hormonas • Extremo C-termina • Estructura primaria de la bGH • Estructura primaria de la oGH and eGH • Estudios inmunológicos TESIS DOCTORALES • Estudios conformacionales • Estudios fisicoquímicos y purificación de hormonas • Estructura primaria CONFERENCIAS INTERNACIONALES III • INVESTIGACIONES POSTERIORES A 1976 División del grupo de Química Biológica de la UBA 1. GRUPO DIRIGIDO POR PALADINI 1.1 Estudios inmunológicos 1.1.1 Detección de zonas inmunológicas en las hormonas de crecimiento humana, bovina y equina 1.1.2 Detección de anticuerpos contra hormonas de crecimiento humana, bovina y equina en pacientes tratados con hGH 1.1.3 Obtención de anticuerpos monoclonales y su aplicación 1.2 Receptores Publicaciones • Estudios inmunológicos • Receptores • Otros estudios 2. GRUPO DIRIGIDO POR DELLACHA 2.1 Marcación de las hormonas de crecimiento 2.2 Receptores 87 Publicaciones • Marcación de hormonas de crecimiento con radioactivos • Receptores TESIS DOCTORALES 3. GRUPO DIRIGIDO POR SANTOMÉ 3.1 Hormona de crecimiento de alpaca 3.2 Aportes al conocimiento de la conformación molecular 3.2.1 Modificación química de aminoácidos 3.2.1.1 Identificación de los residuos modificados y porcentaje de modificación 3.2.1.2 Modificación química de aminoácidos y actividad biológica 3.3 Modificación química de distintos residuos 3.3.1 Formación de subgrupos de investigación 3.3.2 Modificación química de lisinas 3.3.3 Modificación de tirosinas y triptofano 3.3.4 Modificación de metioninas 3.3.5 Modificación de histidinas 3.3.6 Modificación de grupos carboxilo 3.3.7 Modificación de argininas 3.4 Introducción de haptenos en el estudio de estructura y función 3.5 Determinación de la proximidad de residuos con reactivos químicos 3.6 Finalización de los estudios estructurales que realizaba el grupo de Santomé Publicaciones • Hormona de crecimiento de alpaca • Modificaciones químicas 4. APORTES DE OTROS GRUPOS SIN INTERVENCIÓN DE PALADINI, DELLACHA O SANTOMÉ 4.1 Biscoglio- Cascone 4.2 Fernández- Delfino 4.3 Peña 4.4 Poskus 4.5 Retegui 4.6 Turyn Publicaciones • Biscoglio-Cascone • Fernández-Delfino • Poskus • Retegui • Turyn 88 IV • COLABORACIÓN CON LA INDUSTRIA 1. HORMONA DE CRECIMIENTO HUMANA RECOMBINANTE 1.1 Asesoría de Dellacha 1.2 Asesoría de Santomé 1.2.1 Convenios epecíficos de prestación de servicios con la Facultad de Farmacia y Bioquímica de la UBA 1.2.1.1 Determinación de la estructura primaria completa de la hormona hGH recombinante Biosidus S.A. (1996) 1.2.1.2 Estudio inmunoquímico comparativo entre hGH recombinante producida por Biosidus S.A. y otras de diferente origen. (1995) 2. HORMONA DE CRECIMIENTO HUMANA DE LECHE DE VACAS TRANSGÉNICAS 2.1 Convenios específicos de prestación de servicios con la Facultad de Farmacia y Bioquímica de la UBA 2.1.1 Determinación de la estructura primaria completa de la hGH de leche de vacas transgénicas. BIO-SIDUS S. A. (2003) 2.1.2 Estudio inmunoquímico comparativo entre la hGH obtenida por Biosidus S.A. de leche de vacas transgénicas y hormonas de diferente origen. Actividad de las mismas frente a receptores de origen humano y sobre la proliferación de células Nb2 (2004) 2.1.3 Determinar la capacidad de la hGH de leche de vacas transgénicas de iniciar la transducción de señales (2004) 2.1.4 Estudio comparativo por dicroismo circular y fluorescencia entre la hGH (Biosidus S.A.), de leche de vacas transgénicas y hormonas de diferentes orígenes. Análisis de la estabilidad conformacional 2.1.5 Obtención de sueros en conejos hiperinmunes hacia sistemas antigénicos complejos (2006) ANEXO O ADDENDA A. Estructura de proteínas B. Breve descripción de los fundamentos y metodología empleada para determinar la estructura primaria de la hormona de crecimiento bovina C. Evolución de las metodologías para determinar la estructura primaria de proteínas D. Resumen de los conocimientos estructurales actuales sobre hormonas de crecimiento E. Receptores hormonales 89 I • FORMACIÓN DEL GRUPO DE TRABAJO PARA: el estudio de la hormona de crecimiento / creación del centro para el estudio de las hormonas hipofisarias (cehip) 1. Antecedentes En 1958, el Instituto de Histología y Embriología de la Facultad de Ciencias Médicas de la UBA, dirigido por el Dr. Eduardo De Robertis, estaba interesado en estudiar la distribución tisular de ciertas proteínas, cuando éstas eran marcadas con moléculas fluorescentes. Dellacha comenzó a trabajar en el Laboratorio que el Dr. Roberto Mancini, perteneciente a dicho Instituto, quién contaba con un microscopio de fluorescencia apto para este tipo de estudios. Utilizaron el colorante Lisamina Rodamina B 200 que tiene la particularidad de emitir fluorescencia rojiza cuando se lo excita con luz ultravioleta. Las proteínas marcadas se inyectaban a ratas las que eran sacrificadas en distintos tiempos y los tejidos de interés eran procesados histológicamente y observados con el microscopio de fluorescencia. Por este procedimiento estudiaron la distribución tisular de la hormona tirotrófica (TSH). A los pocos minutos de inyectada la localizaron en la membrana celular de la tiroides y minutos más tarde la fluorescencia desaparecía de la membrana y aparecía en el interior de la célula. Estos experimentos fueron publicados en Nature, 184, 1788 (1959) y fueron los primeros en demostrar que las hormonas penetran en la célula blanco a los pocos minutos de ser inyectado el animal. En esos años prevalecía la idea que las hormonas no penetraban en las células. Dellacha y Mancini también marcaron la hormona de crecimiento. Posteriormente Dellacha trabajó con una beca del National Institutes of Health (NIH) en el Sloan-Kettering Institute for Cancer Research bajo la Dirección de Martin Sonenberg. Estudiaban porqué la hormona de crecimiento acetilada era un inhibidor de dicha hormona. Sin embargo, la hormona de crecimiento bovina que habían obtenido de un prestigioso laboratorio distaba mucho de ser homogénea. Ante esta situación Dellacha propuso elaborar un método para preparar, a partir de hipófisis bovina, hormona de crecimiento homogénea. Después de un par de meses lograron obtener hormona homogénea analizada por ultracentrifugación analítica y electroforesis libre. En ese tiempo se sabía que sólo la hormona de origen humano y de simio son biológicamente activas en el humano. El dogma de la época indicaba que se debía a su tamaño molecular, ya que se creía que las hormonas humana y de simio tenían un peso molecular que era aproximadamente la mitad del de las otras especies animales. La falta de actividad de las hormonas de crecimiento de otros mamíferos en el humano, no permitía utilizarlas en clínica médica, como se hacía con la insulina. Ante esta li90 mitación algunos laboratorios en el mundo intentaron, mediante digestiones enzimáticas controladas, obtener a partir de hormonas animales un producto activo en humanos. Dellacha y Sonenberg intentaron, con la hormona bovina homogénea que habían obtenido, digestiones enzimáticas controladas. Obtuvieron en humanos algunos efectos metabólicos y anabólicos. Ninguno de estos estudios permitió obtener productos capaces de reemplazar a la hormona de crecimiento humana en el tratamiento de niños, por lo tanto este abordaje se abandonó. 2. ORÍGENES DEL GRUPO DE TRABAJO DEL DEPARTAMENTO DE QUÍMICA BIOLÓGICA DE LA UBA En 1962 Paladini, Profesor Titular de Química Biológica I de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires, invitó a Dellacha y Santomé a presentarse a un concurso de profesores adjuntos en el Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica, concurso que ganaron y fueron designados en 1963. Dellacha recién había regresado de trabajar en Estados Unidos con hormona de crecimiento bovina (bGH) y estaba dispuesto a continuar en Buenos Aires con ese tema de investigación. Invitó a Paladini y Santomé a formar un equipo para trabajar con esa hormona. El tema, de gran actualidad en ese momento, era muy interesante porque la hormona bovina no es activa en humanos, a diferencia de lo que ocurre con la insulina bovina y porcina que son activas en humanos y muy utilizadas en el tratamiento de la diabetes. La investigación científica sobre hormona de crecimiento bovina podría aclarar ese comportamiento y posiblemente permitir su modificación estructural para hacerla activa en humanos. El grupo de trabajo formado, como complemento de su actividad científica, resolvió contribuir al tratamiento de los niños con retardo de crecimiento de origen hipofisario, mediante la obtención de la hormona a partir de hipófisis humanas de cadáveres. Antes de describir los aportes científicos al conocimiento de las hormonas de crecimiento, realizados por el grupo constituido en la Facultad de Farmacia y Bioquímica, se hará una breve descripción de las tareas realizadas para cumplir con el objetivo social mencionado. 3. CREACIÓN DEL CENTRO PARA EL ESTUDIO DE LAS HORMONAS HIPOFISARIAS (CEHIP) Dellacha había hecho su carrera de practicantado en Farmacia en el Hospital de Niños “Dr. Ricardo Gutierrez”. Allí conoció, en 1963, a César Bergadá que acababa de llegar de Estados Unidos después de haberse especializado en endocrinología infantil, especialmente en el tratamiento de niños con severos trastornos de crecimien- 91 to. Bergadá se había incorporado al Servicio de Endocrinología Infantil dirigido por Martín Cullen. Dellacha fue invitado a contar sus investigaciones en dicho Servicio y allí surgió la idea de obtener hormona de crecimiento a partir de hipófisis humanas. Estudiaron la propuesta con Cullen y Paladini y decidieron entrevistar a Bernardo Houssay para solicitarle el apoyo del CONICET. Así nació el Centro para el Estudio de Hormonas Hipofisarias, que integraron Paladini, Santomé y Dellacha, del Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica; Cullen, Bergadá y Juan J. Heinrich, del Servicio de Endocrinología del Hospital de Niños y José Manuel Domínguez, del Instituto de Investigaciones Médicas de la Facultad de Medicina de la UBA. 3.1 Características del CEHIP El Centro para el Estudio de Hormonas Hipofisarias contó desde su creación con subsidios del CONICET y apoyo económico de la Fundación de Endocrinología Infantil, conocida en el ambiente pediátrico con el acrónimo FEI. El CEHIP tenía dos sectores bien diferenciados. Uno de ellos ubicado en el Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA y el otro con asiento en el FEI ubicado en el Servicio de Endocrinología del Hospital de Niños “Dr. Ricardo Gutiérrez”. El establecido en la Facultad tenía como misión la preparación de la hormona de crecimiento humana (hGH) y los ensayos y análisis necesarios para asegurar su actividad biológica y la esterilidad del producto. En el FEI se realizaban los estudios clínicos en los niños que asistían al Hospital por trastornos relacionados con su anormal crecimiento, seleccionando aquellos que por su nivel de deficiencia hipofisaria debían ser sometidos a tratamientos prolongados con hormona de crecimiento. La obtención de hGH en el Departamento de Química Biológica, cuyo principal responsable fue Dellacha, demandó organizar un sistema de recolección de hipófisis humanas que asegurara contar con un número adecuado y una provisión constante de glándulas para atender los planes asistenciales y de investigación. En primer término visitaron numerosos hospitales y se interesó a los jefes de los departamentos de anatomía patológica del alcance del proyecto. Además se obtuvo una acordada de la Suprema Corte de Justicia de la Nación para retirar las hipófisis de los cadáveres de la Morgue Judicial. Así obtuvieron la colaboración desinteresada que brindaron la Morgue Judicial y los Servicios de Anatomía Patológica de los Hospitales: Alvarez, Argerich, Cetrángolo, de Niños Ricardo Gutiérrez, Durand, Elizalde, Fernández, Fiorito, Muñiz, Policlínico Alejandro Posadas, Policlínico de Avellaneda, Policlínico de Lanús, Ramos Mejía, Rawson y la Cátedra de Patología de la Universidad de Buenos Aires. Las hipófisis se conservaban en termos que contenían nieve carbónica y una vez por semana eran retirados y las glándulas se transferían a una congeladora a -60º C hasta su procesamiento. Desde 1970 a 1985 se recolectaron alrededor de 66.000 hipófisis. 92 Un aspecto a destacar fue estudiar qué método se aplicaría para extraer la hormona de la glándula y qué procedimiento de purificación se adoptaría. Ensayaron varios métodos descriptos en la literatura (Raben, Wilhelmi, etc) que abandonaron por dar productos heterogéneos. Finalmente seleccionaron el método de Roos al que le añadieron una filtración por gel, que permitió obtener una proteína apta para tratamientos clínicos. Un colector de fracciones, donado al FEI por la Embajada de Suecia, transferido al laboratorio de Química Biológica, permitió separar del gel, la fracción proteica con actividad hormonal. La hormona liofilizada se esterilizaba y fraccionaba en frascos multidosis conteniendo 5 mg de hGH. Este procedimiento se llevó a cabo en forma gratuita, en los Laboratorios Carlo Erba de Buenos Aires y posteriormente por gentileza del Dr. Zenón Lugones en el Laboratorio Roux-Ocefa S.A. En el FEI ubicado en el Servicio de Endocrinología del Hospital de Niños, esta hormona era aplicada a niños con severos trastornos de crecimiento, que habían sido seleccionados después de un riguroso estudio, para obtener el máximo beneficio terapéutico, al suministrar la hormona extraída de hipófisis humanas. Otro aspecto de importancia fue poner a punto en ratas Sprague Doley, provenientes de una colonia cerrada criadas en el Bioterio Central de la Facultad de Farmacia y Bioquímica, la técnica de hipofisectomía e instalar en el Departamento un bioterio especializado, donde un técnico realizaba esta operación y era el encargado del cuidado de estos animales. Era imprescindible contar con ratas hembras hipofisoprivas para determinar la actividad biológica de la hormona producida en el laboratorio. En el CEHIP de la Facultad de Farmacia y Bioquímica se obtuvo alrededor de 130 g de hGH durante un período de 15 años aproximadamente. La hormona preparada en el CEHIP cumplía con un alto grado de pureza química y antigénica que posibilitó su utilización para los estudios estructurales, fisicoquímicos e inmunológicos realizados en el Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica. En 1985, en Estados Unidos, Reino Unido y posteriormente en Francia, fallecieron jóvenes de la enfermedad de Creutzfeldt - Jacob. Todos ellos tenían en común haber sido inyectados en un período de su niñez con hormona de crecimiento humana. El CEHIP recibió un llamado telefónico de la WHO que le advirtió de lo sucedido y le sugirió suspender la producción de hormona a partir de hipófisis humanas hasta tanto se supiera el motivo de esos decesos. También suspendieron la provisión de hGH la National Pituitary Agency y el Instituto Nacional de la Salud de los Estados Unidos de Norteamérica y los laboratorios de Inglaterra, Francia y Suecia que la producían. Si bien nunca se tuvo evidencia directa acerca del origen del problema se supuso que estos casos fatales recibieron hormona de hipófisis provenientes de pacientes con Creutzfeldt - Jacob y que el método de purificación utilizado no permitió eliminar de la preparación los priones presentes. Posteriormente a este hecho se comprobó que los priones eran retenidos en una columna de gel filtración como la utilizada en Buenos Aires. Afortunadamente se puede asegurar que en nuestro país no se registraron casos de esta enfermedad, relacionados al uso de la hGH de origen pituitario. 93 Publicaciones. Trabajos publicados con el grupo de Mancini: • Histological study of distribution of fluorescent serum proteins in connective tissue. Mancini RE, Vilar O, Gómez C, Dellacha JM, Davidson OW, Castro A. J Histochem Cytochem 9:356-62 (1961). • Histological localization in rat tissues of intravenously injected thyrotrophin labeled with a fluorescent dye , Vilar O, Dellacha JM, Davidson OW, Castro A. J Histochem Cytochem 9:271-7 (1961). • Localization of fluorescent proteins in the follicles during growth of the rat ovary Heinrich J. Davidson OW, Vilar O, Dellacha JM, Mancini RE. Rev Soc Argent Biol 37:63-4 (1961). • Participation of the kidney in the incorporation of fluorescent proteins and pituitary hormones. Mancini RE, Dellacha JM, Davidson OW, Alvarez BJ. . J Histochem Cytochem 9:614- (1961) Trabajos publicados con Sonenberg: • Purification of bovine growth hormone. Dellacha JM, Sonenberg M J. Biol. Chem., 239, 1515 (1964). • The metabolic effects in man of bovine growth hormone digested with tripsyn. Sonenberg M, Free CA, Dellacha JM, Bonadonna G, Haymowitz A. Naddler AC. Metabolism. 14, 1189-213 (1965). • Anabolic effect in man of papain digests of bovine growth hormone. Sonenberg M, Dellacha JM. J. Clin. Endocrinology and Metabolism. 27, 1035-40 (1967). • Chemical Analysis of acetylated bovine growth hormone, a growth hormone inhibitor. Oikawa A, Dellacha JM, Sonenberg M. Biochem. J. 104:947 (1967). • Chemical and biological characterization of clinically active tryptic digest of bovine growth hormone. Sonenberg M, Kikutani M, Free CA, Nadler AC, Dellacha JM. Ann. New York Acad. Sci., 148, 532-58 (1968) • Growth hormone activity in man of chymotryptic digest of bovine growth hormone. Sonenberg M, Dellacha JM, Free CA, Nadler AC. J. Endocr. 44, 255-65 (1969). Trabajos de investigación clínica: • Growth hormone treatment in younger than six years of age short children born small for gestational age. Bergadá I, Blanco M, Keselman A, Domené HM, Bergadá C. Arch Argent Pediatr. 2009; 107:410-6. Spanish. • Growth hormone insensitivity associated with a STAT5b mutation. Kofoed EM, Hwa V, Little B, Woods KA, Buckway CK, Tsubaki J, Pratt KL, Bezrodnik L, Jasper H, Tepper A, Heinrich JJ, Rosenfeld RG. N Engl J Med. 2003; 349:1139-47. • Estrogen priming effect on growth hormone (GH) provocative test: a useful tool for the diagnosis of GH deficiency. Martínez AS, Domené HM, Ropelato MG, Jasper HG, Pennisi 94 PA, Escobar ME, Heinrich JJ. J Clin Endocrinol Metab. 2000; 85:4168-72. • Psychosocial outcome in growth hormone deficient patients diagnosed during childhood. Keselman A, Martínez A, Pantano L, Bergadá C, Heinrich JJ. J Pediatr Endocrinol Metab. 2000; 13:409-16. • Reproducibility and comparison of growth hormone secretion tests. Ropelato MG, Martínez A, Heinrich JJ, Bergadá C. J Pediatr Endocrinol Metab. 1996;9:41-50. • Growth of Argentinian girls with Turner syndrome. Garcia Rudaz C, Martínez AS, Heinrich JJ, Lejarraga H, Keselman A, Laspiur M, Bergadá C. Ann Hum Biol. 1995; 22:533-44. • Heterologous humoral immune response in patients treated with human growth hormone from different sources. Cardoso AI, Llera AS, Iacono RF, Domené HM, Martínez AS, Heinrich JJ, Peña C, Poskus E. Acta Endocrinol (Copenh). 1993; 129:20-5. • Detection of autoantibodies against hGH in sera of idiopathic hypopituitary children. Llera AS, Cardoso AI, Stumpo RR, Martinez AS, Heinrich JJ, Poskus E. Clin Immunol Immunopathol. 1993;66:114-9. • High serum sex hormone-binding globulin (SHBG) and low serum non-SHBG-bound testosterone in boys with idiopathic hypopituitarism: effect of recombinant human growth hormone treatment. Belgorosky A, Martinez A, Domene H, Heinrich JJ, Bergada C, Rivarola MA. J Clin Endocrinol Metab. 1987; 65:1107-11. • High incidence of thyroid disturbances in 49 children with Turner syndrome. Gruñeiro de Papendieck L, Iorcansky S, Coco R, Rivarola MA, Bergadá C. J Pediatr. 1987; 111:258-61. • Etiology and association of growth hormone deficiency. Heinrich JJ, Martinez AS, Bergada C. Acta Endocrinol Suppl (Copenh). 1986; 279:113-7. • Pubertal development in male hypopituitarism. Martínez AS, Heinrich JJ, Rivarola MA, Bergadá C. Eur J Pediatr. 1986; 145:384-8. • Antibodies against animal growth hormones appearing in patients treated with human growth hormone: their specificities and influence on growth velocity. Pérez AR, Peña C, Poskus E, Paladini AC, Domené HM, Martínez AS, Heinrich JJ. Acta Endocrinol (Copenh). 1985; 110:24-31. • Comparison of single and combined tests for the evaluation of plasma growth hormone secretion in normal short children. Bazán MC, Domené H, Heinrich JJ, Barontini M, Bergadá C.J Endocrinol Invest. 1984; 7:295-8. • Phenotypic heterogeneity in familial isolated growth hormone deficiency type I-A. Rivarola MA, Phillips JA 3rd, Migeon CJ, Heinrich JJ, Hjelle BJ. J Clin Endocrinol Metab. 1984; 59:34-40. • Somatomedin activity in patients with short stature due to hypopituitarism or constitutional-familial growth retardation. Jasper HG, Martínez A, Heinrich JJ. Medicina (B Aires). 1983; 43:308-14. Spanish. • Human, bovine, and equine growth hormone antibodies in patients treated with human growth hormone. Poskus E, Peña C, Pérez AR, Vita N, Heinrich JJ, Paladini AC. J 95 Clin Endocrinol Metab. 1982; 55:13-7. • Patterns of TSH response to TRH in children with hypopituitarism. Gruñeiro de Papendieck L, Iorcansky S, Rivarola MA, Heinrich JJ, Bergadá C. J Pediatr. 1982; 100:387-92. • Evaluation of short stature in children. Martínez A, Coianis L, Heinrich JJ, Rodríguez A, Bergadá C. Helv Paediatr Acta. 1982; 37:563-70. • Body growth and lymphocyte DNA polymerase activity in patients with hypopituitarism. Jasper HG, Bergadá C. Medicina (B Aires). 1982; 42:238-42. • Effects of alpha-bromoergocryptine on pituitary hormone secretion in children. Bazán MC, Barontini M, Domené H, Stefano FJ, Bergadá C. J Clin Endocrinol Metab. 1981; 52:314-8. • The renin-angiotensin system in chronic idiopathic pituitary insufficiency. Levin GM, Moyano MB, Bergadá C. Medicina (B Aires). 1978; 38:519-23. Spanish. • Ovarian differentiation in Turner’s syndrome. Rivelis CF, Coco R, Bergada C. J Genet Hum. 1978; 26:69-83. • Cytogenetic findings in 125 patients with Turner’s syndrome and abnormal karyotypes. Coco R, Bergada C. J Genet Hum. 1977; 25:95-107. • Levels of plasma growth hormone in children with congenital heart disease. Fahrer M, Gruñeiro L, Rivarola M, Bergadá C. Acta Endocrinol (Copenh). 1974; 77:451-9. • Effect of hypopituitarism and ACTH on the urinary excretion of norepinephrine in man.Moyano MB, Hauger-Klevene J, Soto RJ, Bergada C. J Clin Endocrinol Metab. 1973; 37:1-5. • Abnormal sex chromatin pattern in cryptorchidism, girls with short stature and other endocrine patients. Bergadá C, Farias NE, Romero de Behar BM, Cullen M. Helv Paediatr Acta. 1969; 24:372-7. • Congenital anterior pituitary insufficiency with absence of the corpus callosum. Response to human somatotropin. Bergada C, Heinrich JJ, Cullen M. Medicina (B Aires). 1969; 29:269-73. Spanish. 96 II • INVESTIGACIONES SOBRE HORMONAS DE CRECIMIENTO del PERÍODO 1963-1976 a) Primeras experiencias Dellacha puso en marcha su método de obtención de la bGH a partir de hipófisis bovinas suministradas por frigoríficos que las habían sometido a un congelamiento rápido e individual, inmediatamente después extraídas. Paladini consideró que el primer aporte que el grupo podía encarar era verificar la homogeneidad de la hormona intentando separar ambas cadenas y eliminando las impurezas que podrían contener las preparaciones de bGH. Para ello el laboratorio disponía de un moderno equipo de Distribución en Contra Corriente de 1.000 tubos, sistema que había demostrado un elevado poder de resolución de mezclas complejas, incluyendo polipéptidos, pero que no se había probado en proteínas. Paladini, Dellacha y Santomé trabajaron varios meses con ese equipo y enviaron las distintas fracciones que obtenían al laboratorio de Sonenberg, en Estados Unidos, para la determinación de la actividad biológica de las fracciones obtenidas. Con gran decepción comprobaron que la distribución en contra corriente desnaturalizaba la molécula de la hormona con la consiguiente pérdida de actividad. b) Formación de subgrupos Frente a los resultados descriptos, los tres investigadores resolvieron que cada uno se ocupara de un aspecto distinto del estudio de la bGH y discutir en conjunto la planificación y estado de avance de los experimentos. Encararon los siguientes temas: 1. Subgrupo de Paladini: Estudios sobre conformación molecular. 2. Subgrupo de Dellacha: Determinación del residuo N-terminal y estudios fisicoquímicos que incluían la determinación del peso molecular en la ultracentrífuga analítica y la electroforesis libre en el aparato de Tiselius. 3. Subgrupo de Santomé: Determinación de la secuencia de aminoácidos del extremo C-terminal y de la composición en aminoácidos de la bGH. 1. ESTUDIOS SOBRE CONFORMACIÓN MOLECULAR (PALADINI) 1.1 Intercambio de hidrógeno. A fines de la década de 1960 se conocía que las hormonas de crecimiento constituían un grupo de proteínas estrechamente relacionadas pero con una peculiar especificidad de especie en su actividad biológica. Así, por ejemplo, las hormonas de otros mamíferos no eran activas en primates. Estas características indujeron a distintos investigadores a intentar modificaciones en distintas hormonas de crecimiento de mamíferos con la intención de hacerlas activas en humanos. Para lograrlo era muy 97 importante conocer las razones moleculares de ese comportamiento. El subgrupo de Paladini con el objetivo de contribuir a la solución del problema exploró algunas características diferenciales de la estructura terciaria de varias hormonas de mamíferos midiendo la cinética del intercambio de H, en varias condiciones experimentales, en las hormonas de crecimiento humana, bovina, ovina, porcina y equina. Para realizar estos estudios utilizaron la técnica de diálisis inventada por Craig, la cual permite realizar la diálisis en forma continua y en contracorriente. Con especial participación del tesista rosarino César Cambiaso realizaron interesantes observaciones sobre los cambios conformacionales que ocurren en esas hormonas, midiendo la cinética de intercambio de hidrógeno por tritio. Comprobaron que la hormona de crecimiento humana es de dos a diez veces más permeable al solvente que las otras hormonas, justificando que sea la única activa en humanos. Midiendo la velocidad de intercambio de tritio, también comprobaron que existe especificidad de especie en la interacción de las hormonas de crecimiento con membranas de eritrocitos. 1.2 Predicción de estructura secundaria. En colaboración con John M. Stewart aplicaron el método de Chou y Fasman para predecir la estructura secundaria de las hormonas de crecimiento humana, bovina y equina, del lactógeno placentario humano y de la prolactina ovina. 2. RESIDUO N-TERMINAL Y ESTUDIOS FISICOQUÍMICOS (DELLACHA) 2.1 Determinación del residuo N-terminal. Determinaron por métodos químicos que la mitad de las moléculas de bGH tiene alanina en el extremo N-terminal y en la otra mitad fenilalanina. 2.2 Estudios fisicoquímicos. 2.2.1 Agregación y disociación de la bGH. Determinación del peso molecular. El subgrupo de Dellacha encaró estas investigaciones para verificar si era cierta la asignación de un peso molecular de 46.000 a la bGH, aproximadamente el doble del correspondiente a las hormonas de origen humano y de simio. Comprobaron por filtraciones a través de geles de Sephadex G-100, en medio neutro, que la hormona de crecimiento bovina (bGH) se comporta con un perfil de elución correspondiente a un peso molecular (PM) de 22.000 aproximadamente. El Departamento de Química Biológica contaba con el único equipo existente en la UBA para determinar el peso molecular de proteínas mediante la técnica de centrifugación analítica, consistente en medir el desplazamiento de una proteína en solución en un campo gravitacional intenso. Con ese equipo determinaron el PM de la bGH en una solución reguladora donde la hormona no se agregaba. Determinaron 98 que el PM era similar a la de la hGH, confirmando el resultado obtenido por filtración en Sephadex. Para determinar las razones que indujeron a atribuir un peso molecular erroneo a la bGH, realizaron numerosos estudios fisicoquímicos que permitieron establecer la influencia de ciertos aniones en los procesos de agregación-disociación de la bGH. Utilizaron las técnicas de ultracentrifugación analítica, gel filtración, viscosidad y difusión a través de membranas porosas. 2.2.2 Purificación y caracterización de proteínas de la familia de las hormonas de crecimiento. Dellacha fue el principal responsable del aislamiento, purificación y caracterización de las hormonas de crecimiento ovina y equina. 2.2.3 Marcación de hormonas de crecimiento con radioactivos. A mediados de los 70, pusieron a punto las técnicas de marcación de hGH y bGH con moléculas radiactivas. Marcaron la bGH con C14 mediante una reacción química con O-metilisourea C14, consistente en transformar los residuos de lisina en homoarginina, conservando la hormona su actividad biológica. Con ella estudiaron su distribución tisular en ratas, midiendo la concentración y los productos de digestión radiactivos en diferentes tejidos. 3. ESTUDIOS SOBRE ESTRUCTURA PRIMARIA (SANTOMÉ) En este libro se utilizan una serie de términos vinculados a estructura de proteínas y material genético que para algunos lectores puede ser conveniente recordar. Se describen en forma muy reducida en el Anexo A. 3.1 Características moleculares de las hormonas de crecimiento humana y bovina, conocidas cuando el grupo de química biológica inició sus investigaciones. Hormona PM Residuo N-terminal Residuo C-terminal hGHPhePhe bGH 46.000 (Li y Pedersen, 1953)Phe, AlaPhe 20.000 (Andrews y Folley, 1963)Ala También se habían realizado determinaciones sobre la secuencia de aminoácidos del extremo C-terminal (Harris et al. 1954, Li, 1956) de acuerdo con las cuales se había sugerido la secuencia: (Val, Thr, Ser) Leu-Ala-Phe-Phe, considerando el peso molecular 46.000. 99 La presencia de dos residuos N-terminales en la bGH, cuando se le atribuía un peso molecular de 46.000, hizo suponer la presencia de una cadena ramificada de aminoácidos, pero cuando se informó un peso molecular de 20.000 se pensó en la existencia de dos cadenas, una de ellas con Phe N-terminal y la otra con Ala. Estos conocimientos escasos y confusos sobre la molécula de bGH ponían de manifiesto la necesidad de nuevos estudios. El laboratorio de Química Biológica estaba en condiciones para encarar estos temas por disponer del Autoanalizador Technicon con el que Gonzáles Cadavid y Paladini habían elaborado un método de análisis automático de amino ácidos (Gonzalez Cadavid N. and Paladini AC. Automatic amino acid analysis: Reagent and instrumental improvements. Analytical Biochemistry. 9: 170-174, 1964). 3.2 Determinación de la secuencia C-terminal de la bGH. Santomé y la bioquímica Carlota Wolfenstein, incubando la bGH durante 20 horas con carboxipeptidasas (enzimas que liberan en forma sucesiva los residuos C- terminales) sólo consiguieron liberar un residuo de fenilalanina por mol de hormona, atribuyendo a ésta un peso molecular de 20.000. Llamó la atención que las carboxipeptidasas solo liberaran la fenilalanina y no continuaran con los siguientes residuos. Ante la posibilidad de que la conformación molecular de la bGH impidiera el acceso del extremo C-terminal a las carboxipeptidas, repitieron el experimento en presencia de 0,1 % de dodecil sulfato de sodio, detergente que no había sido utilizado previamente para facilitar el ataque enzimático a proteínas. La carboxipeptidasa-A liberó rápidamente y en forma sucesiva fenilalanina y alanina del extremo Cterminal. Resultados que se confirmaron con un método químico, la hidrazinolisis, que se practicó sobre la bGH nativa y sobre la bGH previamente desprovista de la fenilalanina C-terminal por acción de la carboxipeptida-A. Tuvieron que destilar, con grandes precauciones, hidrazina altamente explosiva. Por hidrazinolisis de la bGH desprovista de la alanina y de la fenilalanina C-terminales y oxidada con ácido perfórmico, comprobaron que el tercer residuo es una media cistina. Estos resultados constituyeron una fuerte evidencia del PM cercano a 20.000, que Dellacha había determinado experimentalmente, y rectificaron los datos de otros autores. En el siguiente trabajo determinaron la secuencia del péptido C-terminal: Phe-(GluGly)-Ala-Ser-Cys-Ala-Phe, al que aislaron por electroforesis en papel a partir de la bGH oxidada y digerida con tripsina. Planificaron su obtención considerando que es el único péptido tríptico carente de arginina y/o lisina y que tiene carga fuertemente negativa por poseer, además del carboxilo C-terminal, ácidos cisteico y glutámico. 3.3 Determinación de la composición en aminoácidos. Determinaron la composición en aminoácidos de la bGH preparada por el método de Dellacha y Sonenberg y la expresaron considerando el peso molecular 20.800. 100 3.4 Determinación de la estructura primaria completa de la hormona de crecimiento bovina. Después de los éxitos en la determinación de la secuencia del extremo C-terminal, Paladini y Dellacha estimularon a Santomé para que encarara la determinación de la estructura primaria total de la bGH, ofreciéndole el apoyo de todos los integrantes del laboratorio, como así también de la utilización de los locales y equipos existentes. Parecía un despropósito encarar tal problema en nuestro país, pero era demasiado tentador poder comparar las estructuras primarias de las hormonas de crecimiento humana y bovina e intentar determinar las razones moleculares de la falta de actividad de la bovina en humanos. Wolfenstein y Santomé habían iniciado el estudio de la estructura del extremo Cterminal, en 1963, cuando se conocía la estructura primaria de muy pocas proteínas, diez años después de que Sanger y Thomson publicaron la estructura primaria de la primera proteína, la insulina, y tres después de que Moore y Stein dieran a conocer la de la ribonucleasa, la segunda. Li estaba determinando la de la hormona de crecimiento humana, tarea que le llevó 10 años. Resolvieron encarar un trabajo de tal magnitud considerando que se podría afrontar con el equipamiento, el número de colaboradores, la provisión de bGH y los subsidios disponibles. El equipamiento de Química Biológica de la Facultad de Farmacia y Bioquímica, si bien no estaba a la altura del de los laboratorios internacionales de la especialidad, hacía posible encarar el problema por disponer de: • Un autoanalizador Technicon (donado a Paladini por una fundación norteamericana). Recientemente, Paladini y su tesista N. González Cadavid habían armado sus numerosos módulos adaptándolos al análisis automático de aminoácidos. • Resinas para el armado de columnas cromatográficas destinadas a la separación de péptidos resultantes de la digestión enzimática de proteínas. • Un equipo de electroforesis de alto voltaje para la purificación de péptidos. • Cubas para cromatografia en papel. Con respecto a la cantidad de hormona necesaria, Moore y Stein afirmaban que para determinar la estructura primaria de una proteína se requería disponer de 1 g mensual de esa proteína, cantidad que esperaban producir para la bGH. Dellacha montó una especie de “fabriquita” para preparar 300 milígramos mensuales de bGH a partir de kilogramos de hipófisis bovinas adquiridas en frigoríficos que las congelaban individualmente, inmediatamente después de extraídas del animal. Para realizar las innumerables operaciones técnicas necesarias se incorporaron para trabajar con Santomé y Carlota Wolfenstein: Mirtha Biscoglio, que se ocupó principalmente de las degradaciones de Edman, Clara Peña del extremo N-terminal de la molécula, Edgardo Poskus de la determinación de los puentes disulfuro y Silvia Daurat, del estudio de los péptidos hidrofóbicos, poco solubles en los solventes conven- 101 cionales. Además, todo el grupo, incluyendo a Zulema Mazzani y Verónica Fontanive, que trabajaban hasta ese momento con Paladini y Dellacha, participó en la realización de las electroforesis, cromatografías, digestiones enzimáticas y de todas las otras técnicas requeridas diariamente. En las determinaciones de la composición en aminoácidos contaban con la valiosa colaboración técnica de Dora Beatti, ya fallecida. En el transcurso del trabajo la metodología fue perfeccionándose. El primer analizador automático de aminoácidos permitía tener la composición de un péptido cada 26 horas, tiempo que se fue reduciendo hasta poco más de 1 hora, gracias a que la casa Technicon reemplazó el primer modelo por otro más perfeccionado y finalmente con la incorporación de un equipo Beckman. Paladini y Dellacha se ocupaban del mejoramiento de los equipos. Sin embargo, este equipamiento fue superado internacionalmente por la aparición del primer secuenciador automático de aminoácidos presentado en 1967 por Edman, capaz de determinar la secuencia N-terminal de 15 aminoácidos en 24 horas con 250 nanomoles de proteína. Equipo al que no podía aspirar el grupo de Química Biológica de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. Poco después de iniciado el proyecto se conoció la existencia de otros 2 grupos que estaban determinando la estructura primaria de la BGH: • Wallis, M. y col. Biochemistry Laboratory, School of Biological Sciences, University of Sussex, Falmer, Brighton, U.K. • Robert E., Fellows, Jr. y Alan D. Rogol. Department of Physiology and Pharmacology, Duke University Medical Center, Durham, North. Carolina. Sin quererlo, el Departamento de Química Biológica tuvo que competir con esos dos grupos, procurando finalizar primero para no perder un trabajo de tal magnitud, en el caso que los otros grupos lo publicaran antes, y las revistas no aceptaran el realizado en Buenos Aires. El grupo de Química Biológica de la Facultad de Farmacia y Bioquímica tardó 7 años en completar la estructura primaria y fue el primero en publicar el trabajo completo en 1973. Ese mismo año Wallis presentó sus resultados en una revista de publicaciones rápidas: “The primary structure of bovine growth hormone”. Wallis, M.FEBS Lett. 35:11-14(1973). 3.4.1. Técnica utilizada para la determinación de la estructura primaria de la hormona de crecimiento bovina. En el Anexo B se describen brevemente: • La metodología accesible en esa época, para determinar la estructura primaria de una proteína. • La metodología empleada para determinar la estructura primaria completa de la bGH. En el Anexo C: • La evolución que experimentaron posteriormente esas metodologías. 102 3.5 Estructura primaria de las hormonas de crecimiento ovina y equina. Aprovechando la experiencia adquirida y con la activa participación de nuevos integrantes del grupo: Horacio Fernández, lamentablemente fallecido, Dr. Mario Zakin, proveniente del Instituto Pasteur de París y Pascual Ferrara, que posteriormente hizo su tesis con Paladini, el grupo de química biológica determinó la estructura primaria de las hormonas de crecimiento ovina y equina en un tiempo mucho más breve. Los estudios estructurales se realizaron con las hormonas de crecimiento ovina y equina preparadas por los métodos de Dellacha y colaboradores, que permitieron tener proteínas homogéneas, a diferencia de las resultantes de los métodos precedentes. Una de las razones que motivaron el estudio de la estructura primaria de las hormonas de crecimiento de distintos mamíferos fue procurar aclarar porque las hormonas bovina, ovina y equina no son activas en humanos, a diferencia de lo que ocurre con la insulina bovina y la porcina, que se utilizan en el tratamiento de la diabetes. Pensaron en la posibilidad de que la comparación de sus estructuras primarias podría aclarar ese comportamiento y en intentar realizar modificaciones estructurales para obtener un derivado activo en humanos. A esta altura de las investigaciones C. H. Li había finalizado la determinación de la humana y el grupo de Química Biológica las de origen bovino, ovino y equino. El estudio comparativo mostró un alto grado de homología entre ellas y no reveló diferencias a las que pudiera atribuirse la falta de actividad en humanos de las hormonas bovina, ovina y equina. hGH:XFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQT bGH:A––AMS––G––A––V–––QH–––––A––FK–––RT–––EG–R––IX––T–V oGH:A––AMS––G––A––V–––QH–––––A––FK–––RT–––EG–R––IX––T–V eGh:X––AMP––S––A––V–––QH–––––A–––K–––R––––EG–R––IX––A–A hGH:SLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANS bGH:AF––––T––A–TGKN–A–E––D–––––––––––––––Q–XG–––X––T–– oGH:AF––––T––A–TGKN–A–E––D–––––––––––––––Q–XG–––X––T–– eGH:AF––––T–PA–TGKN–A––R–DME–––F–––––––––G–––L––X––T–– hGH:LVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNS bGH:––F–T––RX––EK––––––––LA––RE––––T––A–––L––––D–––––M oGH:––F–T––RX––EK––––––––LA––RE––––V––A–––L––––D–––––M eGH:––F–T––RX––EK–R–––––––A––RE––––––RA–––L––––D–––––L hGH:HNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRXSVEGSCGF bGH:RS–––––––––––S–––––LH–T––Y––VMK–RRFG–A––A– oGH:RS–––––––––––S–––––LH–T––Y––VMK–RRFG–A––A– eGH:RS–––––––––––S––KK–LH–A––Y––VMK–RRF––SS–A– Los residuos idénticos se indican con guiones y los residuos faltantes con X. 103 3.6 Influencia de la modificación química de algunos residuos de las distintas hormonas de crecimiento sobre su comportamiento inmunológico. La incorporación de Zakin, inmunólogo proveniente del Instituto Pasteur de París, motivó la aplicación de esa disciplina al estudio de las diferencias entre las hormonas estudiadas. Se comprobó que la modificación de cisteína, metionina, triptófano y tirosina, en las hormonas humana y equina, tienen poca influencia sobre la respuesta inmunológica al suero de conejo, en cambio, la bovina es muy sensible a la modificación de cisteína, metionina y triptófano, pero no así a la de tirosina. Publicaciones Conformación molecular • “H-exchange behaviour and extent of reversible conformation changes in human, bovine, ovine, porcine and equine growth hormones”. C.L. Cambiaso, L.A. Retegui, J.M. Dellacha, J.A. Santomé, A. C. Paladini. Biochim. Biophys. Acta, 221: 290 (1970). • “Species-specific interaction of growth hormone with erythrocyte membrane”. C.L. Cambiaso, J.M. Dellacha, A.C. Paladini, J.A. Santomé. FEBS Lett., 12: 236 (1971). Predicción de estructura secundaria • “Conformational analysis of growth hormones and synthesis of a fragment of human growth hormone”. C. Peña, J.M. Stewart, A.C. Paladini, J.M. Dellacha, J. A. Santomé. Peptides: Chemistry, Structure and biology (R. Walter and J. Malenhofer eds.). Proc. Fourth American Peptide Symposium, Ann. Arbor, Science Publishes, Mich. p. 523-528 (1975). Determinación del residuo N-terminal: Thin layer • “Quantitative N-Terminal amino acid analysis by thinlayer chromatography”. J.M Dellacha, V. Fontanive. Experientia, 21:351-2 (1965) Estudios fisicoquímicos • Molecular weight of bovine growth hormone. Dellacha, JM, Enero, MA, Faiferman, I., Experientia, 22, 16-7 (1966). • Physicochemical behaviour and biological activity of bovine growth hormone in acidic solution. Dellacha JM, Enero MA, Paladini AC. Biochim Biophys Acta 168::95-105 (1968). • Physicochemical and structural sudies of bovine growth hormone. Dellacha JM, Santomé JA, Paladini AC, Ann. New York Acad. Sci. 148:313-27 (1968). 104 Obtención de hormonas • Isolation, characterization and C-terminal sequence of ovine growth hormone. Dellacha JM, Enero MA, Santomé JA, Paladini AC. Eur J Biochem12:289-95 (1970). • Isolation, purification and characterization of equine growth hormone. Conde RD, Paladini AC, Santomé JA, Dellacha JM. Eur J Biochem 37:164-170 (1973). Extremo C-terminal • “C-terminal sequence of amino acids in bovine growth hormone”. J.A Santomé, C.E.M. Wolfenstein, A. C. Paladini. Biochem. Biophys. Res. Commun., 20: 482 (1965). • “Partial sequences of the first nine amino acids from the C-terminal end in bovine growth hormone”. J. A. Santomé, C.E.M. Wolfenstein, A.C. Paladini. Biochim. Biophys. Acta, 111: 342 (1965). Estructura primaria de la bGH • “Amino acid composition of purified bovine growth hormone”. C.E.M. Wolfenstein, J.A. Santomé, A.C. Paladini. Acta Physiol. Lat. amer., 16: 194 (1966). • “Sequence of thirteen amino acids in the C-terminal end of bovine growth hormone and localization of a disulfide bridge”. J.A. Santomé, C.E.M. Wolfenstein, M.J. Biscoglio, A.C. Paladini. Arch. Biochim. Biophys., 116: 19 (1966). • “Disc electrophoresis of proteins in the presence of sodium dodecyl sulphate”. E. De Vito, J.A. Santomé. Experientia, 22: 124 (1966). • “Physicochemical and structural studies on bovine growth hormone”. J.M. Dellacha, J.A. Santomé, A.C. Paladini. Ann. New York Acad. Sci., 148: 313 (1968). • “Structural studies on bovine growth hormone”. J.A. Santomé, J.M. Dellacha, A.C. Paladini.Biochim. Applicata, 14: 359 (1967). • “Evidence for non-allelic origin of the two chains in ox growth hormone”. C. Peña, A.C. Paladini, J.M. Dellacha, J.A. Santomé. Biochim. Biophys. Acta, 194: 320 (1969). • “Growth hormone. Bovine (fragments)”. J.A. Santomé, J. M. Dellacha, A.C. Paladini, C.E.M. Wolfenstein, C. Peña, E. Poskus, S.T. Daurat, Z.M.M. Sesé, A.V.F. Sanguesa, M. J. Biscoglio. Atlas of Protein Sequence and Structure, 4: D-159(1969). • “Biochemical and conformational studies on growth hormones”. A.C. Paladini, J. M. Dellacha, J.A. Santomé. Miami Winter Symposia, I (1970) 270 North-Holland Publishing Co., Amsterdam (Holanda). • “Growth hormone. Bovine”. J.A. Santomé, J.M. Dellacha, A.C. Paladini,C.E.M. Wolfenstein, C. Peña, E. Poskus, S.T. Daurat, M.J. Biscoglio, Z.M.M. Sesé, A.V.F. Sanguesa, H.N. Fernández. Atlas of Protein Sequence and Structure, Vol. 5: D-203. (1970/71). • “Amino acid sequence of bovine growth hormone”. J.A. Santomé, J.M. Dellacha, A.C. Paladini, C.E.M Wolfenstein, C.Peña, E. Poskus, S.T. Daurat, M.J. Biscoglio, Z.M.M. Sesé, A.V.F. Sanguesa. FEBS Lett., 16: 198 (1971). • “Localization of a microheterogeneity in the amino acid sequence of bovine growth hormone”. H. N. Fernández, S.T. Daurat, C. Peña, J.M. Dellacha, J.A. Santomé, A.C. 105 Paladini. FEBS Lett., 18: 53 (1971). • “Chemistry of growth hormones: structure-biological activity relationships”. J.M. Dellacha, J.A. Santomé, A.C. Paladini. In Endocrinology Proc. Fourth International Congress of Endocrinology (Washington, 1972) Excerpta Medica. ICS No. 273 p. 636-641. • “Primary structure of bovine growth hormone”. J.A. Santomé, J.M. Dellacha, A.C. Paladini, C. Peña, M.J. Biscoglio, S.T. Daurat, E. Poskus, C.E.M. Wolfenstein. Eur. J. Biochem., 37: 164 (1973). • “Studies on growth hormones”. A.C. Paladini, J.M. Dellacha, J. A. Santomé. Molecular and Cellular Biochem., 2: 153 (1973). • “Chemistry of growth hormones”, J.A. Santomé, J.M. Dellacha, A.C. Paladini. Pharmac. Therap.B. 2: 571:590 (1976). • “Somatotropin-bovine”. J.A. Santomé, J.M. Dellacha, A.C. Paladini, C. Peña, M.J. Biscoglio, S.T. Daurat, E. Poskus, C.E.M. Wolfenstein. Atlas of Protein Sequence and Structure, Vol. 5, Suppl.2, p.139 (1976). • “Structure activity relationships of growth hormones”. A.C. Paladini, J.M. Dellacha, J.A. Santomé. In Growth Hormone and other biologically active peptides. Excerpta Medica, Amsterdam ICS 495, p.37-44 (1980). Estructura primaria de la oGH and eGH • “Isolation, characterization and C-terminal sequence of ovine growth hormone”. J.M. Dellacha, M.A. Enero, J.A. Santomé, A.C. Paladini. Eur. J. Biochem., 12: 289 (1970). • “Structural studies on ovine growth hormone. Cyanogen bromide fragments; N-and C-terminal sequences.” C. Peña, A.C. Paladini, J.M. Dellacha, J.A. Santomé. Eur. J. Biochem., 17: 27 (1970). • “Growth hormone. Ovine (fragments)”. C. Peña, A.C. Paladini, J.M. Dellacha, J.A. Santomé. Atlas of Protein Sequence and Structure, Vol. 5: D-204 (1970/71). • “Structural studies on ovine growth hormone. Sequence of a cyanogen bromide fragment”. H.N. Fernández, A.C. Paladini, J. M. Dellacha, J.A. Santomé. FEBS Lett., 17:17 (1971). • “Structural studies on ovine growth hormone: Complete amino acid sequence, partially based on homology with bovine growth hormone”. H.N. Fernández, C. Peña, E. Poskus, M.J. Biscoglio, A.C. Paladini, J.M. Dellacha, J. A. Santomé. FEBS Lett., 25: 265 (1972). • “Growth hormone: Sheep”. H.N. Fernández, C. Peña, E. Poskus, M.J. Biscoglio, A.C. Paladini, J.M. Dellacha. J.A. Santomé. Atlas of Protein Sequence and Structure, Vol. 5, Suppl. I p. 50 (1973). • “Amino acid sequences around the cystine residues in equine growth hormone”. M.M. Zakin, E. Poskus, J.M. Dellacha, A.C. Paladini, J.A. Santomé. FEBS Lett., 25: 77 (1972). • “Isolation, purification and characterization of equine growth hormone”. R.D. Conde, A.C. Paladini, J. A. Santomé, J.M. Dellacha. Eur. J. Biochem., 32: 563 (1973). • “The amino acid sequence of equine growth hormone”. M.M. Zakin, E. Poskus, J.M. Dellacha, A.C. Paladini, J.A. Santomé. FEBS Lett., 34: 353 (1973). 106 • “Primary structure of equine growth hormone”. M.M. Zakin, E. Poskus, A.A. Langton, P. Ferrara, J.A. Santomé, J.M. Dellacha, A.C. Paladini. Intl. J. Peptide Protein Res. Vol. 8: 35-444 (1976). • “Somatotropin-horse”. M.M. Zakin, E. Poskus, A.A. Langton, P. Ferrara, J.A. Santomé, J.M. Dellacha, A.C. Paladini. Atlas of Protein Sequence and Structure, Vol.5, Suppl.2, p. 138 (1976). • “An Equine growth hormone molecular species lacking the 76-92 peptidic fragment” O. Cascone, J.G. Fukushima, V. Mihajlovich, J.A. Santomé and M. Biscoglio. Int. J. Peptide Protein Res. 39:397-400 (1992). Estudios inmunológicos • “Influence of some chemical treatments on the inmunological properties of various mammalians growth hormones”. M.M. Zakin, E. Poskus, A.C. Paladini, J.M. Dellacha, J.A. Santomé. Inmunochemistry 12: 125-129 (1975). TESIS DOCTORALES Estudios conformacionales • “ESTUDIO SOBRE LA HORMONA DE CRECIMIENTO BOVINA”. Isidoro Faiferman, 1967. Director Alejandro C. Paladini. Calificación: Sobresaliente • ”LA MEDIDA DEL INTERCAMBIO DE HIDRÓGENOS EN DISTINTAS HORMONAS DE CRECIMIENTO Y LA RELACIÓN ENTRE LA ESPECIFICIDAD DE ESPECIE Y LA CONFORMACIÓN DE SUS PROTEÍNAS”. César L. Cambiaso. 1971. Director Alejandro C. Paladini. Calificación: Sobresaliente. Estudios fisicoquímicos y purificación de hormonas • “AISLAMIENTO Y CARACTERIZACIÓN DE LA HORMONA DE CRECIMIENTO OVINA”. María Amelia Enero. 1971. Director Juan M. Dellacha. Calificación: Sobresaliente. • “AISLAMIENTO, PURIFICACIÓN Y CARACTERIZACIÓN DE LA PROLACTINA OVINA” Rubén D. Conde. 1972. Director Juan M. Dellacha. Calificación: Sobresaliente. Estructura primaria • “ESTUDIO QUÍMICO Y ESTRUCTURAL DE LA HORMONA DE CRECIMIENTO BOVINA”. Carlota E.M. Wolfenstein, 1967. Director José A. Santomé. Calificación Sobresaliente. • “ESTUDIO DE LA ESTRUCTURA DEL EXTREMO AMINO-TERMINAL DE LA HORMONA DE CRECIMIENTO BOVINA”. Clara Peña, 1972. Director: José Alberto Santomé. Calificación Sobresaliente • “LOCALIZACIÓN E IMPORTANCIA BIOLÓGICA DEL RESIDUO DE TRIPTOFANO PRESENTE EN LA HORMONA DE CRECIMIENTO BOVINA”. Mirtha J. Biscoglio, 1972. Director: José Alberto Santomé. Calificación Sobresaliente. 107 • “ESTRUCTURA PRIMARIA DE LA HORMONA DE CRECIMIENTO BOVINA. ESTUDIOS SOBRE UNO DE SUS PUENTES DISULFURO”. Edgardo Poskus, 1972. Director: José Alberto Santomé. Calificación Sobresaliente. • “ESTRUCTURA PRIMARIA DE LA HORMONA DE CRECIMIENTO BOVINA: ESTUDIO DE LOS PÉPTIDOS POCO SOLUBLES EN LOS SOLVENTES CONVENCIONALES”. Silvia Teresa Daurat, 1974. Director: José Alberto Santomé. Calificación Sobresaliente. • “ESTUDIOS ESTRUCTURALES SOBRE LA HORMONA DE CRECIMIENTO OVINA. SECUENCIA DE AMINOACIDOS”. Horacio N. Fernández, 1974. Director J.A. Santomé. Calificación Sobresaliente. • “APLICACIÓN DE ANTICUERPOS ANTI-HAPTENES EN EL ESTUDIO DE LA ESTRUCTURA Y FUNCIÓN DE LA HORMONA DE CRECIMIENTO BOVINA”. Cristina Nowicki, 1981. Director: José Alberto Santomé. Calificación Sobresaliente. CONFERENCIAS INTERNACIONALES SOBRE bGH DICTADAS POR EL GRUPO DE 108 QUÍMICA BIOLÓGICA DE BUENOS AIRES. Año 1965 Orador J.M. Dellacha Lugar VI Congreso Panamericano de Endocrinología. México 1966 J.M.Dellacha New York Academy of Sciences. New York, USA 1967 J.A. Santomé 1967 J.A. Santomé 1967 J.A. Santomé 1967 J.A. Santomé 1967 J.A. Santomé 1967 J.A. Santomé 1970 A.C. Paladini Instituto G. Marañon. Madrid, España Instituto de Química Biológica. Univ. de Nápoles. Nápoles. Italia Universidad Rockefeller. Nueva York, USA Laboratorio de Investigaciones Monsanto. St. Louis, USA Departamento de BioquímicaUniv. de Emory. Atlanta, USA Inst. de Química Biológica. Fac de Ciencias. Marsella. Francia Miami Winter Symposia 1971 J.A. Santomé 1971 J.A. Santomé 1972 J.A Santomé 1972 J.M. Dellacha 1972 J.M. Dellacha 1973 J.A. Santomé 1978 J.M. Dellacha 1979 J.M. Dellacha 1981 J.A. Santomé Fac. de Química y Farmacia Univ. Nac. de Asunción. Paraguay Inst. de Ciencias U. N. de Asunción. Paraguay II International Symposium on Growth Hormone. Milán. Italia IV International Congress of Endocrinology. Washington, USA Laboratorio de I & D Upjohn Kalamazoo. USA. Dep.de Bioq. y Fisiología. U. N Mayor de San Marcos. Lima. Perú 1ª Jornada de la Soc. Argentino Hispánica de Medicina y Ciencias Afines. Madrid, España VII Congreso Latinoamericano de Soc. de Biol. y Med. Nuclear Viñas del Mar, Chile III Reunión Regional de PAABS Cono Sur. Caxambú. Brasil Título Estudios fisicoquímicos sobre la hormona de crecimiento bovina. Physicochemical and structural studies on bovine groth hormone. Estructura y función de proteínas. Structural studies on bovine growth hormone. Structural studies on bovine growth hormone. Structural studies on bovine growth hormone. Structural studies on bovine growth hormone. Structural studies on bovine growth hormone. Biochemical and conformational studies on growth hormones. Estructura y función de proteínas. Estructura de proteínas. Hormona de Crecimiento. Structural studies on bovine growth hormone. Structural studies on bovine growth hormone. Physicochemical studios on bovine growth hormone. Estructura primaria de la hormona de crecimiento bovina. Unión específica “in vivo” de 125 I Hormonas de Crecimiento Bovinas. Estudios Estructurales de 125 I Hormona de Crecimiento Bovina Hormona de Crecimiento Relación entre estructura y función 109 III • INVESTIGACIONES SOBRE HORMONAS DE CRECIMIENTO POSTERIORES A 1976 | División del grupo de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA Hasta 1976, los profesores titulares de los tres cursos de Química Biológica, Paladini, Dellacha y Santomé, trabajaron en colaboración, pero en esa fecha, cada uno de los subgrupos que dirigían encaraba problemas tan distintos del estudio de las hormonas de crecimiento, que resultaba difícil conducir en conjunto todas la líneas de trabajo y las ideas no siempre coincidían. Por tal motivo, consideraron conveniente que cada uno de los profesores dirigiera a su grupo en forma independiente. Convinieron redistribuir a los colaboradores para que cada uno tuviera a su cargo un número equivalente. A los colaboradores C. Peña, E. Poskus y M. Zakin, les correspondió trabajar con Paladini; mientras que H. Fernández y D. Turyn colaborarían con Dellacha, además, Fernández continuaría los trabajos que estaba realizando con Santomé. 1. GRUPO DIRIGIDO POR PALADINI Trabajó principalmente en inmunología de las hormonas de crecimiento y en la detección de sus receptores celulares. Además sintetizó fragmentos hormonales y estudió las características de la hormona marcada con yodo radioactivo. 1.1 Estudios inmunológicos 1.1.1 Detección de zonas inmunológicas en las hormonas de crecimiento humana, bovina y equina. Mario Zakin con el propósito de adquirir experiencia en química de proteínas había participado activamente en la determinación de la estructura primaria de la eGH e iniciado la aplicación de sus conocimientos inmunológicos al estudio de las hormonas de crecimiento. Cuando a partir de 1976 se incorporó al grupo de Paladini, junto con Edgado Poskus, continúo hasta su regreso al Instituto Pasteur con esa línea de trabajo, asociada con química proteica. Con el grupo de Paladini obtuvo fragmentos peptídicos de la eGH mediante su escisión con bromuro de cianógeno y determinó la actividad inmunológica de los fragmentos frente a antisuero de conejo contra la hormona nativa. Comprobaron que la mayor actividad antigénica correspondía al fragmento 73-123, por ellos purificado, homólogo al 86-123 de la oGH y al fragmento 73-123 de la hGH. Comprobaron que los tres segmentos peptídicos poseen actividad inmunológica equivalente frente a antisueros contra hGH. Con este hallazgo 110 comprobaron la reactividad inmunológica cruzada de las tres hormonas, e incluso, del fragmento 87-124 de la bGH. 1.1.2. Detección de anticuerpos contra hormonas de crecimiento humana, bovina y equina en pacientes tratados con hGH. La inmunidad cruzada que revelaron fragmentos equivalentes de las cuatro hormonas de crecimiento mencionadas, frente a antisueros contra la humana, indujo a sospechar que el suero de los niños tratados con hGH podían poseer anticuerpos capaces de reaccionar con bGH, oGH y eGH. 1.1.3 Obtención de anticuerpos monoclonales y su aplicación. El grupo de Paladini obtuvo anticuerpos monoclonales contra hGH y bGH los cuales también mostraron reacción cruzada con distintas hormonas de crecimiento. 1.2 Receptores En el anexo E se describen algunos conceptos sobre receptores. En 1977 los grupos de Paladini y Dellacha inyectaron ratas con hormona marcada con C14 para medir su localización en los distintos tejidos y comprobaron que se fijaba preferentemente en hígado y riñón. Al año siguiente el grupo de Paladini aisló de microsomas de hígado de rata, la hGH marcada con I125 unida a un receptor. Estudió las características del complejo y comprobó que la unión es inhibida por hormonas lactogénicas (estimulantes de la producción de leche) pero no por las somatogénicas (estimulantes del crecimiento). Por consiguiente la bGH que solo tiene actividad somatogénica no compite en esas condiciones con la hGH que posee ambas. No detectaron receptores somatogénicos. También comprobaron que la hGH marcada se une a microsomas de riñón de coneja. No detectaron correlación entre la actividad de crecimiento de la bGH, en ratas hipofisoprivas y la capacidad de esta hormona de unirse in vitro a receptores hepáticos, posiblemente porque en esas condiciones de reacción solo detectaban receptores lactogénicos. Publicaciones Estudios inmunológicos • “Detection of immunologically active zones in equine growth hormone”. Poskus E, Zakin MM, Fernández HN, Paladini AC. Eur J Immunol. 6:409-17(1976). • “Immunological properties of two related fragments from human and equine growth hormones”. Zakin MM, Peña C, Poskus E, Stewart JM, Paladini AC. Eur J Immunol. 7:701-4 (1977). 111 • “Immunologically active zones in bovine growth hormone”. Ferrara P, Zakin MM, Peña C, Paladini AC. Eur J Immunol. 9:1020-3 (1979). • “A relevant antigenic site in human growth hormone localized in sequence 98-128”. Peña C, Poskus E, Paladini AC. Mol Immunol. 17:1487-91 (1980). • “Preparation of 125I-labeled human growth hormone of high quality binding properties endowed with long-term stability”. Biscayart PL, Paladini AC, Vita N, Roguin LP. J Immunoassay. 10:37-56 (1989). • “Human, bovine, and equine growth hormone antibodies in patients treated with human growth hormone”. Poskus E, Peña C, Pérez AR, Vita N, Heinrich JJ, Paladini AC. J Clin Endocrinol Metab. 55:13-7(1982). • “Specificities of antibodies to human growth hormone (hGH) in patients treated with hGH: longitudinal study and comparison with the specificities of animal antisera”. Retegui LA, Masson PL, Paladini AC. J Clin Endocrinol Metab.60:184-90 (1985). • “Antibodies against animal growth hormones appearing in patients treated with human growth hormone: their specificities and influence on growth velocity”. Pérez AR, Peña C, Poskus E, Paladini AC, Domené HM, Martínez AS, Heinrich JJ. Acta Endocrinol (Copenh).110:24-31(1985). • “Epitopes in human growth hormone and chorionic somatomammotropin studied with monoclonal antibodies”. Vita N, Poskus E, Peña C, Pérez AR, Paladini AC. Arch Biochem Biophys. 225:436-45(1983). • “Heteroclitic behaviour of some monoclonal antibodies against bovine growth hormone. Retegui LA, Paladini AC. Mol Immunol. 23:119-2(1986). • Stochastic humoral expression of human growth hormone epitopes. Etcheverrigaray M, Paladini AC, Retegui LA. Immunology. 63:595-601(1988). Receptores • “Rate of concentration and digestion of radioactive growth hormone preparations injected in rats, as measured by the amount and nature of radioactivity in the tissues”. Retegui-Sardou LA, Scaramal LO, Dellacha JM, Paladini AC. Mol Cell Biochem. 16:8796 (1977). • “Solubilization of the lactogenic receptors from rat liver microsomes”. Bonifacino JS, Sánchez SH, Paladini AC. Biochem Biophys Res Commun. 85:62-9 (1978). • “Characterization of human somatotropin binding to detergent-solubilized lactogenic receptors from rat liver”. Bonifacino JS, Sánchez SH, Paladini AC. Biochem J. 194:385-94 (1981). • “Human somatotropin binding to rabbit kidney microsomal fraction”. Roguin LP, Sánchez SH, Bonifacino JS, Paladini AC. Biochem J. 200:257-64(1981). • “Effect of the incomplete separation of bound and free ligand on binding measurements”. Bonifacino JS, Paladini AC. Anal Biochem. 1981 Dec;118(2):213-20 (1981). • “Formation of complexes between 125I-labelled human or bovine somatotropins and binding proteins in vivo in rat liver and kidney”. Bonifacino JS, Roguin LP, Paladini AC. Biochem J. 214:121-32(1983). 112 • “Properties of human growth hormone binding sites solubilized from female rabbit kidney”. Roguin LP, Bonifacino JS, Paladini AC. Biochim Biophys Acta. 715:2229 (1982). • “Specificity of covalently stabilized complexes of 125I-labeled human somatotropin and components of the lactogenic binding sites of rat liver”. Caamaño CA, Fernandez HN, Paladini AC. Biochem Biophys Res Commun. 115:29-37 (1983). • “Binding in vitro to rat liver receptors does not correlate with activities in vivo of bovine somatotropin. Use of chemically modified derivatives as probes”. Roguin LP, Delfino JM, Vita N, Paladini AC. Biochem J.224:535-40 (1984). Otros estudios: • “Human growth hormone active site for membrane cooperative enzymes”. Farías RN, Uñates LE, Moreno H, Peña C, Paladini AC. Biochem Biophys Res Commun. 85:85-91 (1978). • “Synthesis and properties of human growth hormone fragments”. Peña C, Stewart JM, Ferrara P, Paladini AC. Int J Pept Protein Res.18:289-96 (1981). • “Molecular biology of growth hormone”. Paladini AC, Peña C, Poskus E. CRC Crit Rev Biochem.15:25-56 (1983). • “Proteolytic modification of growth hormone by a rat kidney lysosomal protease” Retegui LA, Scaramal LO, Paladini AC. Acta Physiol Pharmacol Latinoam. 37:521-32 (1987). 2. GRUPO DIRIGIDO POR DELLACHA 2.1 Marcación de hormonas de crecimiento con radioactivos. Aplicaron las técnicas de marcación de hGH y bGH con moléculas radiactivas que pusieron a punto a mediados de los 70. Con la bGH marcada con C14 estudiaron su distribución tisular en ratas, midiendo la concentración y los productos de digestión radiactivos en diferentes tejidos. Utilizaron las hormonas humana y bovina marcadas con I125 para radio-inmunoensayos y para realizar estudios de unión a receptores, tanto in vitro como in vivo. 2.2 Receptores Al referirnos a los trabajos del grupo de Paladini mencionamos que junto con Dellacha, en 1977, comprobaron que inoculando ratas con hGH marcada con carbono radioactivo, la radioactividad se detecta principalmente en hígado y riñón, y que, además, que el grupo de Paladini demostró que los receptores mitocondríales de hígado son de naturaleza lactogénica en las condiciones de la experiencia. En 1983, el grupo dirigido por Dellacha demostró que el hígado de rata también tiene receptores somatogénicos porque fija bGH marcada con I125 y que esa fijación se reduce significativamente cuando compite con un exceso de bGH sin marcar, hor- 113 mona que solo tiene actividad de crecimiento. En 1985 confirmó, en hepatocitos aislados de ratones macho, que la hGH marcada con yodo radioactivo se une específicamente a receptores lactogénicos y somatogénicos y que los primeros se revelan en un medio conteniendo iones calcio y magnesio, mientras que los segundos se detectan en ausencia de esos iones. El grupo realizó, además, estudios estructurales y de caracterización biológica e inmunológica de las proteínas asociadas a los receptores. Dellacha desde 1976 hasta 1990, en calidad de Profesor Visitante en el Departamento de Fisiología del Instituto de Biociencias de la Universidad Federal de Rio Grande do Sul, Porto Alegre, Brasil, dictó clases y realizó investigaciones con la Prof. María Marques y sus colaboradores. Producto de esta interacción publicaron 10 trabajos de investigación, 2 de ellos sobre hGH y el resto sobre insulina, tema que Dellacha incluyó en sus investigaciones pero cuyas publicaciones y tesis dirigidas no figuran en este libro. Invitado por el investigador R.S. Bartke de la Southern Illinois University de Estados Unidos realizó, en colaboración, investigaciones sobre receptores somatotrópicos y lactotrópicos de hormona de crecimiento en ratones transgénicos. Publicaciones Marcación de hormonas de crecimiento con radioactivos. • “Specific binding of human and bovine growth hormones to hypophysectomized rat hepatocytes”. Turyn D, Santomé JA, Dellacha JM, Stringa de Muzzio IG, Domergasso CS. Acta Phys. Lat. 26: 395-402 (1976). • “Rate of concentration and digestión of radioactive growth hormone preparations injected in rats, as mesured by de amount and nature of radioactivity in tisssues”. Retegui-Sardou LA, Scaramal IO, Dellacha JM, Paladini AC. Mol. Cell Biochem. 16: 87-96 (1977). Receptores • “Specific binding of iodinated growth hormone to rat liver in vivo”. Turyn D, Dellacha JM. Endocrinology 103:1190-5 (1978). • “Structural characterization of iodinated bovine growth hormone”. Matera R, Turyn D, Fernández HN, Dellacha JM. Intl. J. Peptide Prot. Res. 19: i72-80 (1982). • “Biological and immunological characterization of iodinated bovine groth hormone”. Matera R, Dellacha JM, Intl. J. Peptide Prot. Res. 19, 181-6 (1982). • “Influence of divalent cations on the detection of somatogenic and lactogenic binding sites in the Mouse liver cells”. Ciccia-Torres GN, Dellacha JM. Biochem. J. 228: 761-4 (1985). • “Proteins associated with somatogenic and lactogenic receptors in microsomal mem- 114 branes and intact rat hepatocytes”. Robetto EJ, Caamaño CA, Fernández HN, Dellacha JM. Biochim. Biophys. Acta 1013: 223-30 (1989). • Distribution and specific binding “in vivo” of iodinated growth hormones in the turtle Chrysemys dorbigni. Marques M, Silva RS, Turyn D, Dellacha JM. Gen Comp Endocrinol, 37:487-92 (1979). • In vivo effect of temperature on the specific liver uptake and renal degradation of labeled human growth hormone in turtle Chrysemys dorbigni.Turyn D, Marques M, Dellacha JM. Gen Comp Endocrinol. 44: 171-6 (1981). • Somatotropic and lactotropic receptors in transgenic mice expressing human or bovine growth hormone genes. Aguilar RC, Fernández HN, Dellacha JN, Calandra RS, Bartke A, Ghosh PK, Turyn D. Transgenic Res 1:221-7 (1992). • Identification of somatogenic binding sites in liver microsomes from normal mice and trangenic mice expressing human growth hormone gene. Aguilar RC, Fernández HN, Dellacha JN, Calandra RS, Bartke A, Turyn D. Life Sci 50:615-20 (1992). TESIS DOCTORALES • “ESTUDIO ESTRUCTURAL Y FUNCIONAL DE LA IODO HORMONA DE CRECIMIENTO BOVINA”. Rafael Matera, 1982. Director: J.M. Dellacha. Calificación: Sobresaliente. • “SITIOS DE UNIÓN ESPECÍFICOS PARA LA HORMONA DE CRECIMIENTO HUMANA EN HÍGADO DE RATÓN.” Graciela Ciccia-Torres, 1985. Director: J.M. Dellacha. Calificación: Sobresaliente. • “CARACTERIZACIÓN DE LOS RECEPTORES LACTOGÉNICOS Y SOMATOGÉNICOS DE HEPATOCITOS AISLADOS DE RATA MEDIANTE UN DERIVADO FOTO-REACTIVO DE SOMATOTROFINA HUMANA” Eduardo Robetto, 1989. Director: J.M. Dellacha. Calificación: Bueno. 3. GRUPO DIRIGIDO POR SANTOMÉ 3.1 Hormona de crecimiento de alpaca. Los estudios sobre la estructura primaria de esta hormona se realizaron con el apoyo de un Programa PNUD/UNESCO destinado a fomentar la relación entre investigadores latinoamericanos. Participaron los siguientes laboratorios: • Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. Investigadores J.A. Santomé, M.J. Biscoglio, O. Cascone, C. Peña y P. Ferrrara. • Instituto de Bioquímica y Nutrición de la Universidad Nacional Mayor de San Marcos, Lima, Perú. Investigadores M. Villavicencio, I.F. Arnao de Nué, D. Sánchez, R. Oré, y J. Capdevielle. La hormona se obtuvo de hipófisis de alpaca (Lama pacos) el primer miembro del 115 infraorden Tylopoda. Vive en la Cordillera de los Andes entre 4.500 y 5.500 metros de altura. 3.2 Aportes al conocimiento de la conformación molecular y determinación de la importancia biológica de los distintos aminoácidos de las hormonas de crecimiento. 3.2.1 Modificación química de aminoácidos. Durante varios años, investigadores de distintos laboratorios internacionales intentaron cristalizar las hormonas de crecimiento obtenidas de hipófisis sin conseguirlo; posiblemente, debido a que las hormonas aisladas no eran totalmente homogéneas por poseer cierto porcentaje de moléculas que diferían de las restantes por la falta de algún residuo de aminoácido o por su reemplazo por otro. Como ejemplo mencionaremos que en la mitad de las moléculas nativas de las hormonas bovina y ovina falta la alanina N-terminal y que el grupo de Química Biológica demostró que el 30 % de las moléculas de bGH tiene valina en lugar de leucina en la posición 125. Ante el desconocimiento de la estructura terciaria de las hormonas de crecimiento, el grupo de Santomé, con la colaboración de M. Biscoglio, S. Daurat, H. Fernández y C. Wolfenstein, y la incorporación de Osvaldo Cascone, Cristina Nowicki, José María Delfino, Mario Ermácora y Perla Kaliman, decidió contribuir al conocimiento de la conformación molecular de esas hormonas, mediante modificaciones químicas. Para ello tuvieron en cuenta que varios residuos de aminoácidos de las proteínas poseen grupos químicos susceptibles de reaccionar frente a reactivos específicos y que esas reacciones son posibles cuando esos residuos están ubicados en regiones moleculares a las que pueden llegar esos reactivos. Por consiguiente, los residuos de mayor accesibilidad son los que sufren un mayor grado de reacción, es decir los que se modifican en mayor porcentaje. En realidad, esto es válido cuando los reactivos son hidrofílicos y no se cumple con los hidrofóbicos, capaces de penetrar en regiones moleculares no accesibles a los solventes acuosos. Lógicamente, es fundamental que las condiciones de las reacciones químicas no alteren la conformación de las moléculas. Los siguientes son los residuos de aminoácidos susceptibles de ser modificados químicamente: N-terminal, C-terminal, Tirosina, Ácido aspártico, Ácido glutámico, Lisina, Arginina, Metionina, Histidina y Cisteína. 3.2.1.1 Identificación de los residuos modificados y determinación del porcentaje de modificación. En general, con el objeto de lograr una modificación gradual de cada residuo, hicieron reaccionar las hormonas de crecimiento con los reactivos específicos, variando el tiempo de reacción o la concentración del reactivo. Para identificar los residuos modificados en cada caso, digerían con enzimas proteolíticas a las proteínas modificadas y aislaban cada uno de los péptidos obtenidos. La determinación de la compo- 116 sición en aminoácidos de los péptidos resultantes les permitía establecer su posición en la molécula de la hormona y, en aquellos péptidos que contenían los residuos modificables, establecer el porcentaje de modificación. 3.2.1.2 Modificación química de aminoácidos y actividad biológica. La obtención de hormonas de crecimiento con distintos grados de modificación química, les permitió determinar si los distintos aminoácidos modificados alteraban el reconocimiento de los receptores celulares y la expresión de la actividad biológica. Lógicamente, para dar validez a los resultados obtenidos, tenían que asegurarse que las condiciones de reacción no alteraban la conformación molecular. Recurrían para ello a procedimientos tales como las medidas de dicroísmo circular en el ultravioleta lejano y cercano, capaz de detectar variaciones en hélices-α, cadenas-β y estructura terciaria. 3.3 Modificación química de distintos residuos. 3.3.1 Formación de subgrupos de investigación. A esta altura de las investigaciones, Biscoglio, Daurat, Fernández y Wolfenstein, habían aprobado sus tesis doctorales y estaban en condiciones de co-dirigir líneas de investigación. Se les asignó la realización de las siguientes modificaciones químicas: • Lisinas: M. Biscoglio. • Tirosinas y triptófano: S. Daurat. • Ácidos glutámicos y aspárticos: H. Fernández. • Argininas: C. Wolfenstein. Posteriormente otros colaboradores también adquirieron la experiencia requerida para co-dirigir investigaciones, por lo cual se les asignó responsabilidad en la realización de otras modificaciones químicas: • Introducción de haptenos y obtención de anticuerpos: C. Nowicki. • Metioninas: O. Cascone, colaborando con M. Biscoglio. • Histidinas: O. Cascone, colaborando con M. Biscoglio. • Determinación de la proximidad de residuos uniéndolos con reactivos químicos bifuncionales: C. Nowicki, M. Ermácora y C. Wolfenstein. La determinación de la accesibilidad de los distintos aminoácidos a los reactivos específicos permitió que el grupo elaborara modelos de conformación molecular de las hormonas de crecimiento. NOTA ACLARATORIA. A continuación de la descripción de cada una de las modificaciones químicas realizadas en el Departamento de Química Biológica, se harán comentarios sobre la validez de los resultados frente a los conocimientos estructurales actuales. Para facilitar la comprensión de esos comentarios, en el anexo D se describen brevemente los conocimientos actuales. 117 3.3.2 Modificación química de lisinas Biscoglio y colaboradores comenzaron con hormona de crecimiento equina. Utilizaron ácido 2,4,6-trinitrobenceno sulfónico que reacciona con el grupo α-amino del residuo N- terminal y con los grupos ε-amino de las lisinas. Utilizaron distintos tiempos de reacción para estudiar el efecto de la modificación gradual de esos residuos sobre el crecimiento de ratas hipofisoprivas y sobre la conformación molecular controlada por dicroismo circular. El residuo N-terminal fue el que mostró mayor reactividad, seguido por las lisinas 179, 156, 143, 63 y 165. No pudieron establecer una correlación entre la modificación de cada residuo y la pérdida de actividad biológica debido a que ésta se pierde por la nitración parcial del conjunto de residuos. No obstante, dedujeron que el residuo N-terminal y la lisina 179 no son importantes para la actividad biológica. En cambio, observaron una cierta correlación entre la nitración de la lisina 156 y la perdida de actividad de crecimiento. Con la intención de aclarar la participación de la lisina 156 resolvieron estudiar el efecto de la trinitrofenilación en la hormona de crecimiento bovina. El residuo Nterminal también fue el más reactivo, seguido en orden decreciente por las lisinas 178, 142, 64, 112, 169 y 165. Estos resultados coincidieron con los de la hormona de crecimiento equina, excepto que la lisina 156 no se trinitrofenila en la hormona bovina. Nowicki contribuyó a estudiar los efectos de la modificación de los grupos amino, carbamilando la hormona de crecimiento bovina en condiciones de asegurar la total reacción del grupo N-terminal. También se produjo la carbamilación del 28% de la lisina 179 y del 7 % de la lisina 143. La hormona así modificada retuvo una importante actividad de crecimiento y fue tan activa como la nativa en el ensayo de competición “in vivo” por los receptores de hígado de rata. Sin embargo, tuvo que producirse algún cambio conformacional porque la lisina 69 que habitualmente reaccionaba poco con el ácido trinitrobenceno sulfónico, lo hizo fácilmente en la hormona carbamilada, con total destrucción de la capacidad de unión a los receptores celulares y de la actividad promotora de crecimiento. Este resultado sugirió la importancia de la lisina 69 en la actividad biológica. Discusión de los resultados aplicando los conocimientos actuales. La determinación de la estructura terciaria de las hormonas de crecimiento (ver cuadro de interacción de cadenas laterales y esquema de estructura terciaria) confirmó que: • El residuo N-terminal y las lisinas 63 y 143 de la eGH, 64, 70 y 142 de la bGH están expuestas al solvente, sin integrar las hélices-α. • La lisina 69, sugerida como importante para la actividad biológica, está ubicada en el extremo del sitio 1 de reconocimiento del receptor, al cual debe alterar cuando se trinitrofenila. 118 • Las lisinas 63, 165 y 179 de la eGH, 112, 165, 169 y 178 de la bGH, también se trinitrofenilaron, aunque en menor grado, a pesar de integrar hélices-α, porque éstas, si bien tienen una cara hidrofóbica con residuos que interactúan fuertemente entre sí formando el núcleo hidrofóbico de la molécula, esas lisinas están ubicadas en la cara hidrofílica, en contacto con el solvente. • La trinitrofenilación parcial de las lisinas 156, 165 y 179 de la eGH, en conjunto, justifica la pérdida de actividad biológica por que están ubicadas en el sitio 1 de unión de la hormona al receptor. Sitio 1 Sitio 2 Diagrama de la estructura de la hGH señalando los sitios I y II de unión al receptor. N: Residuo N-terminal; C: Residuo C-terminal; I, II, III y IV: Hélices α. Están indicados los residuos iniciales y terminales de cada hélice. 3.3.3 Modificación de tirosinas y triptófano. Los primeros estudios que realizó el grupo de Santomé sobre la modificación e importancia biológica de esos residuos se realizaron con la principal participación de Daurat y Moya Portuguez, pasante de la Ciudad Universitaria “Rodrigo Facio” de Honduras. Las hormonas de crecimiento bovina y equina tienen el triptófano en posición 85 y las tirosinas en las posiciones: 35, 42, 109, 141, 158 y 174. Con tetranitrometano modificaron el 55-60 % del triptófano, el 38-100 % de la tirosinas 35, 42, 109, 141 y 174 sin alterar la actividad de crecimiento ni la capacidad antigénica. La inaccesibilidad de las tirosinas 28 y 158 al tetranitrometano no permitieron determinar su importancia en la actividad biológica. Teniendo en cuenta que el tetranitrometano, por su naturaleza hidrofóbica no es un reactivo adecuado para determinar la accesibilidad de las tirosinas, la becaria Blumgrund acetiló las tirosinas de la bGH con N-acetilimidazol, previa protección de las lisinas mediante su amidinación. Todas las tirosinas se acetilaron, incluso la 158, en un porcentaje que varió entre 24 y el 81%. Estos resultados y los anteriores permitieron postular que todas las tirosinas son accesibles al solvente y que la integridad de las mismas no es indispensable para la actividad promotora de crecimiento de las hormonas bovina y equina. Otros autores (Ma L., Brovetto-Cruz J. y Li, C.H., 1971, Biochem. Biophys. Acta 229, 444-450; Kawauchi, H. y Li, C.H. Arch. Biochem. Biophys. 165: 255-262) habían in- 119 formado que la modificación de las tirosinas de la hGH disminuye su actividad promotora de crecimiento pero no determinaron que tirosina era responsable. El grupo de Santomé confirmó esa información y propuso que la disminución de la actividad en la hGH se debía a la modificación de las tirosinas 160 y/o 164. Esta última no está presente en las hormonas bovina, ovina y equina. Discusión de los resultados aplicando los conocimientos actuales La determinación de la estructura terciaria de las hormonas de crecimiento (ver cuadro de interacción de cadenas laterales y esquema de estructura terciaria) confirmó que: • Todas las tirosinas son accesibles al solvente porque la mayoría está ubicada fuera de las hélices-α o en el extremo de éstas. Las que integran la hélice IV no forman parte de los residuos que interaccionan para formar el “core” hidrofóbico. • La tirosina 164 de la hGH, debe ser la responsable de la pérdida por acetilación de su capacidad de reconocer los receptores, porque sólo está presente en esa hormona y está ubicada en el sitio 1 de reconocimiento del receptor. Las tirosinas de las hormonas bovina y equina no son importantes para la actividad biológica. 3.3.4 Modificación de metioninas. Cuando se inició el estudio de la modificación de los residuos de metionina de la hGH, con la principal participación de Cascone y Biscoglio, no existían datos concluyentes en la literatura. En 1972 Wallis (Wallis M., 1972, FEBS Lett. 21: 118-122) había informado que la carboxilación de las 4 metioninas de la bGH producía un derivado prácticamente inactivo y el grupo de Li (Glaser C.B. y Li C.H. 1974. Biochemistry 13: 1044-1047) oxidó a metionilsulfóxido las metioninas 4, 123 y 148 sin alteración de la actividad biológica, pero cuando modificaba la 178 en presencia de urea, se producía una significativa pérdida de actividad. El laboratorio de Buenos Aires seleccionó cloramina-T para oxidar las metioninas debido a su alta especificidad en ausencia de grupos sulfidrílos y a su capacidad de ingresar en regiones hidrofóbicas en ausencia de agentes desnaturalizantes como la urea utilizada por Glaser y Li. El grupo argentino, contradiciendo los trabajos de otros autores, demostró que la integridad de las metioninas no es indispensable para la actividad biológica de la hormona. Consiguieron oxidar las 4 metioninas sin alterar la actividad promotora de crecimiento. 3.3.5 Modificación de histidinas. El principal ejecutor de esta investigación fue el becario Fukushima que trabajó en colaboración con Biscoglio y Cascone. Comenzaron determinando la reactividad de las 3 histidinas de la bGH frente al anhídrido etoxifórmico y establecieron que las histidinas 20 y 22 tenían una cinética rápida de reacción, mientras que la 168 lo ha- 120 cía con lentitud. La etoxiformilación de las 3 histidinas condujo a la pérdida total de la capacidad de la hormona para competir con la hGH, marcada con iodo 125, por los receptores de hígado de rata y que la modificación de aproximadamente la mitad de las histidinas de reacción rápida producía una importante disminución de esa capacidad. Este resultado permitió sugerir que una de ellas, o las dos, eran las responsable de la pérdida. La modificación de las histidinas no produjo cambios conformacionales detectables por dicroísmo circular y la hormona etoxiformilada recuperó la capacidad de reconocer los receptores de hígado, cuando se revirtió la modificación por tratamiento con hidroxilamida. Análogos resultados obtuvieron por etoxiformilación de la eGH. Con la intención de determinar cual de las dos histidinas es importante para la actividad biológica realizaron un estudio semejante con hGH, considerando que ésta tiene dos de sus histidinas con distinta ubicación que las de origen bovino y equino. La histidina más accesible al reactivo fué la 151 que ocupa una posición molecular distinta a la que ocupan esos residuos de aminoácidos en las hormonas de origen bovino, ovino y equino. La segunda fue la 18 ubicada en la hélice-1 a semejanza de las histidinas 20 y 22 de la bGH y 19 y 21 de la eGH. La histidina 21 de la hGH no reaccionó en las condiciones de la reacción. La histidina 151, exclusiva de la hGH, no parece importante para el reconocimiento de los receptores de hígado porque cuando se etoxiformiló totalmente, la hGH conservó el 53 % de su capacidad de reconocer esos receptores. La histidina 18 tampoco parece indispensable porque después de su modificación total la hormona conservó el 35 % de su capacidad de unión al receptor. Este último resultado llamó la atención por que la histidina 18, aunque reemplazada por glutamina en las hormonas bovina, ovina y equina, se encuentra en el mismo segmento molecular que las histidinas 20 y 22 de la bGH y sus equivalentes 19 y 21 de la eGH, una o ambas importantes para reconocer al receptor. Discusión de los resultados aplicando los conocimientos actuales La determinación de la estructura terciaria de las hormonas de crecimiento (ver cuadro de interacción de cadenas laterales y esquema de estructura terciaria) confirmó que: • La histidina 151 de la hGH es muy accesible al solvente porque está ubicada en una región molecular muy expuesta. Está reemplazada por una arginina en las otras tres hormonas y es evidente su irrelevancia en la actividad biológica. • Las cuatro hormonas tienen dos histidinas muy próximas en la hélice-I. El grupo de Argentina demostró que las ubicadas en posición 20 y/o 22 de la bGH y las 19 y/o 21 de la eGH son importantes para la actividad biológica y que la 18 de la hGH, reemplazada por glutamina en las otras hormonas, no es indispensable. Es probable que la histidina 22 de la bGH y la 21 de la eGH sean las que intervienen en la unión con los receptores, porque ocupan posiciones equivalentes 121 y en esa misma posición está la histidina 24 de la hGH. No pudieron demostrar su importancia porque no pudo ser modificada. Puede llamar la atención que estas histidinas se encuentran en la hélice-I, que forma parte del Sitio I de reconocimiento del receptor y que haya variaciones en la secuencia de las hormonas de distintas especies, pero debe considerarse lógico porque las hormonas de otros mamíferos no reconocen los receptores humanos. 3.3.6 Modificación de grupos carboxilo. La ejecución de los estudios realizados sobre esta modificación química estuvo a cargo de Fernández y el becario J. M. Delfino. Estudiaron la reactividad de los grupos carboxilos haciéndolos reaccionar con 1-etil3-(3 dimetilamino propil) carbodiimida en presencia de glicinametilester para obtener las amidas de los amino ácidos con carboxilos libres. Los grupos carboxilo que se modificaron con mayor velocidad fueron los correspondientes a Glu 30, Glu 124, Glu 126 y Asp 127, seguidos por Glu 66, Asp 105, Asp 150, Asp 151, Glu 184 y Phe C-terminal. La modificación de aproximadamente el 20 % de los grupos carboxilos condujo a una importante disminución de la actividad promotora de crecimiento en ratas hipofisoprivas y de la capacidad de competir con hormona marcada con I-125 por los receptores de hígado de rata, tanto “in vivo” como en hepatocitos aislados. Estos investigadores sugirieron que la modificación de la carga es la responsable porque recuperaron la mayor parte de la actividad biológica por desmetoxilación, reacción que deja los glutámicos y aspárticos unidos a glicina con el carboxilo libre. Los derivados que contenían 1.5 a 2.6 carboxilos modificados conservaron la mayor parte de la actividad biológica, mientras que los que tenían un promedio de aproximadamente 5 residuos experimentaron una brusca reducción de la actividad. Estos resultados indicaron que los residuos responsables están dentro de los de reacción rápida. Realizaron un estudio cinético de las curvas experimentales y llegaron a la conclusión que la pérdida es la consecuencia del efecto de la modificación acumulativa de 2 o 3 carboxilos de un conjunto de 3 a 8 residuos relevantes. Discusión de los resultados aplicando los conocimientos actuales. La determinación de la estructura terciaria de las hormonas de crecimiento (ver cuadro de interacción de cadenas laterales y esquema de estructura terciaria) confirmó que: • Los posibles residuos relevantes pueden ser el glutámico 184 y la fenilalanina C-terminal pertenecientes al sitio-1 de reconocimiento del receptor y los glutámicos 124 y 126 del sitio-2. 3.3.7 Modificación de argininas. C. Wolfenstein fue la principal responsable de la modificación de estos residuos. Es- 122 tudiaron los efectos de la modificación de los residuos de arginina de las hormonas de crecimiento bovina y humana. Tal como corresponde a residuos hidrofílicos, generalmente expuestos al solvente, lograron modificar por tratamiento con 1.2 ciclohexanediona la totalidad de los residuos de arginina, con excepción de la 183 de la hGH y 180 de la bGH. La modificación produjo la pérdida total de la capacidad de unirse a los receptores de hígado de rata. La hormona humana, capaz de reconocer receptores lactogénicos, además de los de crecimiento, dejó de reconocer a ambos. El dicroísmo circular no evidenció cambios conformacionales y la actividad biológica se recuperó eliminando los grupos unidos a las argininas. Dedujeron que la modificación de dos argininas provocó la pérdida de actividad. Discusión de los resultados aplicando los conocimientos actuales. Evidentemente las argininas cuya modificación provocó la pérdida de capacidad de unión a los receptores deben estar en el sitio-1 o en el sitio-2. Es interesante señalar que en ambas hormonas, el residuo que no se modifica se encuentra en el sitio-1. 3.4 Introducción de haptenos en el estudio de estructura y función. La principal ejecutora de este proyecto fue la tesista C. Nowicki. El objetivo del estudio fue la introducción de haptenos en un único residuo de la hormona y unirlo a anticuerpos antihaptenos, previamente obtenidos, para investigar la importancia de la región molecular bloqueada, en la actividad biológica. Obtuvieron bGH con su residuo N-terminal bloqueado con un grupo trinitrofenilo, al que unieron anticuerpos específicos para ese hapteno. El derivado obtenido conservó la actividad promotora de crecimiento de la hormona y su capacidad de reconocer los receptores celulares. Este resultado indicó que el residuo N-terminal no es fundamental para la actividad biológica como así tampoco la región hormonal en contacto con el anticuerpo. Interpretación de los resultados aplicando los conocimientos actuales. A pesar de que los primeros residuos de la hélice-I, que comienza en el residuo 6, forman parte del sitio-1 de reconocimiento del receptor, el anticuerpo unido al residuo N-terminal no alteró la actividad biológica. Posiblemente, la flexibilidad del segmento constituido por los cinco primeros residuos de la hormona impidió el bloqueo del sitio-1. 3.5 Determinación de la proximidad de residuos uniéndolos con reactivos químicos. Los principales responsables de la ejecución de estas investigaciones fueron Nowicki, Ermácora y Wolfenstein. La idea del proyecto consistió en la utilización de reactivos bifuncionales, que otros autores habían utilizado en distintas moléculas para 123 determinar que grupos estaban estericamente cercanos. Su utilización en las hormonas de crecimiento permitía obtener información relacionada con la conformación molecular, desconocida hasta entonces. Escogieron como reactivo bifuncional al 1,5-difluoro-2,4-dinitrobenceno con el que lograron obtener bGH con la tirosina 173 unida a la lisina 110 por un puente constituido por el grupo químico dinitrofenileno. Este resultado indicó que la distancia que separa esos dos residuos en la molécula es aproximadamente la de la longitud del dinitrofenilo (3 a 5 Aº). Repitieron la experiencia variando las condiciones experimentales y comprobaron que la tirosina 173 también se unió con un puente dinitrofenileno a las lisinas 30 y 169. Estos resultados les permitieron inferir que las lisinas 110, 30 y 169 están localizadas a una distancia de aproximadamente 5 Aº de la tirosina 173. Discusión de los resultados aplicando los conocimientos actuales. Los resultados obtenidos son correctos si se tiene en cuenta que la tirosina 173 de la hGH está ubicada en la hélice-IV, próxima a la lisina 169 de la misma hélice, cercanas a la lisina 30 de la hélice-I, la cual integra con la IV, el Sitio-1 de reconocimiento del receptor. El puente entre la tirosina 173 y la lisina 110, también es posible si se considera que está ubicada en el segmento de estructura poco rígida que une las hélices II y III. 3.6 Finalización de los estudios sobre hormonas de crecimiento que realizaba el grupo de Santomé. Los trabajos mencionados, conducentes a obtener información sobre la conformación de la molécula de la hormona, dejaron de tener significado a partir de 1987 cuando Abdel-Meguid y col. dieron a conocer la estructura tridimensional de la hormona porcina recombinante y en 1992 de Vos y col. la estructura cristalina de la hGH unida al dominio extracelular de su receptor. Publicaciones Hormona de crecimiento de alpaca • "Isolation and characterization of alpaca growth hormone". M.J. Biscoglio, O. Cascone, I.F. Arnao de Nue, J.A. Santomé, D. Sánchez, R. Oré, M. Villavicencio. Intl. J. Peptide Protein Res, 17: 374-379 (1981). • "Amino acid sequence around the cystine residues in alpaca growth hormone" Cascone O., Biscoglio de Jimenez Bonino M.J., Peña C., Santomé J.A. Acta Physiol. Pharmacol. Latinoam. 34: 123-130 (1984). • "Primary Structure of Alpaca Growth Hormone". M. J. Biscoglio de Jiménez Bonino, I. Arnao de Nué, R. Oré, D. Sánchez, P. Ferrrara, J. Capdevielle and O. Cascone (1991) 124 Int. J. Peptide Prot. Res. 38, 193-197. Modificaciones químicas. • "Trinitrophenylation of Equine Growth Hormone". O. Cascone, M. J. Biscoglio de Jiménez Bonino, A. C. Paladini, J. A. Santomé (1977) Arch. Biochem. Biophys. 180, 303309. • "Trinitrophenylation of Bovine Growth Hormone". M. J. Biscoglio de Jiménez Bonino, O. Cascone, J. A. Santomé (1979) Int. J. Peptide Prot. Res. 14, 107-112. • "Modification of Lysine 69 reactivity in bovine growth hormone by carbamylation of its N-terminal group". C. Nowicki, J.A. Santomé. Intl. J. Peptide Protein Res., 18: 5260 (1981). • "Reaction of bovine and equine growth hormones with tetranitromethane". S.T. Daurat-Larroque, M.E. Moya Portuguez and J.A. Santomé. Intl. J. Peptide Protein Res. 9: 119-128 (1977). • "Acetylation of bovine growth hormone by N-acetyl-imidazol". V. Blumgrund de Satz, J.A. Santomé. Intl. J. Peptide Protein Res., 18: 492-499 (1981). • "Chemical Modification of human growth hormone with N-acetylimidazole: Effect on binding capacity to lactogenic and somatogenic receptors".Kaliman P., Ermácora M.R., Nowicki C., Wolfenstein-Todel, C. and Santomé J.A. Int. J. Peptide Protein Res. 38: 38-46. (1991). • "Oxidation of Methionine Residues in Bovine Growth Hormone". O. Cascone, M. J. Biscoglio de Jiménez Bonino, J. A. Santomé (1980) Int. J. Peptide Prot. Res. 16, 299305. • "Ethoxyformylation of Bovine Growth Hormone". Fukushima, J. G., M. J. Biscoglio de Jiménez Bonino, O. Cascone, J. A. Santomé (1983) Int. J. Peptide Prot. Res. 21, 451-457. • "Ethoxy formylation of histidine residues in equine growth hormone" Fukushima J.G., Cascone O., Santomé J.A. and Biscoglio de Jimenez Bonino M.J. Int. J. Peptide Protein Res. 30: 365-370 (1987). • "Role of histidine residues in the binding mechanism of the growth hormone family" Fukushima H.A., Biscoglio de Jimenez Bonino M.J., Cascone O. and Santomé J.A.Comp. Biochem. Physiol. 95:797-802 (1990). • "Specific modification of carboxil-groups in bovine growth hormone by a soluble carbodiimide and glycine-methylester". J.M. Delfino, H.N. Fernández, J.A. Santomé. Intl. J. Peptide Protein Res., 21: 440-450 (1983). • "Carboxilate groups in bovine somatotropin involved in growth promoting activity" Delfino J.M., Fernández H.N. and Santomé J.A. Int. J. Peptide Protein Res. 28: 307314 (1986). • "Modification of arginines in bovine growth hormone". C. Wolfenstein-Todel, J.A. Santomé. Int. J. Peptide Protein Res. 22: 611-616 (1983). • "Modification of arginine residues in human growth hormone by 1-2 clohexanedione. Effects on the binding capacity to lactogenic and somatogenic receptors" Atlasovich F.M., Caridad J.J., Nowicki C., Santomé J.A., and Wolfenstein - Todel C., Arch. Bio- 125 chem. Biophys. 281: 1-5 (1990). • "Antibodies against haptens in the study of structure and biological activity of growth hormone", C. Nowicki, J.A. Santomé. Int. J. Peptide Protein Res. 13: 379-384 (1979). • "Evidence for the steric proximity of Tyr 174 and Lys 11 in bovine growth hormone." Nowicki C., Wolfenstein-Todel C.E.M., Santomé J.A. Intl. J. Peptide Protein Res. 26: 568-574 (1985). • "Identification of intramolecular crosslinks in bovine growth hormone after two-step modification with 1,5 - difluoro - 2,4 - dinitrobenzene" Ermácora M.R., Nowicki C., Wolfenstein-Todel C. and Santomé J.A. Int. J. Peptide Protein Res. 30: 423-430 (1987). • "An approach to the three-dimensional structure of bovine growth hormone based on chemical modification and secondary structure prediction". • Ermácora M., Cascone O., Wolfenstein-Todel C., Biscoglio de Jimenez Bonino M.J., Nowicki C., Rivero J.L. and Santomé J.A. Arch. Biol. Med. Exp. 21 109-115 (1988). TESIS DOCTORALES • “ESTUDIO DE LA REACTIVIDAD DE LOS AMINOGRUPOS EN LA HORMONA DE CRECIMIENTO EQUINA Y DE SU IMPORTANCIA EN LA ACTIVIDAD BIOLÓGICA”. Osvaldo Cascone. Director José Alberto Santomé. • “ACETILACIÓN DE RESIDUOS DE TIROSINA DE LA HORMONA DE CRECIMIENTO HUMANA. SU EFECTO SOBRE LA CAPACIDAD DE UNIÓN A RECEPTORES LACTOGÉNICOS Y SOMATOGÉNICOS”. PERLA KALIMAN, 1990. Director: José Alberto Santomé. • “ESTUDIO COMPARATIVO DE LA REACTIVIDAD DE LAS TIROSINAS DE LAS HORMONAS DE CRECIMIENTO BOVINA Y EQUINA HACIA EL TETRANITROMETRANO.” TESIS DE LICENCIATURA EN QUÍMICA. Manuel Enrique Moya Portuguez. Ciudad Universitaria “Rodrigo Facio”. Honduras. Director: José Alberto Santomé. • “ESTUDIO DE LA REACTIVIDAD DE LOS RESIDUOS DE HISTIDINA DE LAS HORMONAS DE CRECIMIENTO DE MAMÍFEROS Y DE SU IMPORTANCIA EN LA ACTIVIDAD BIOLÓGICA DE ESAS PROTEÍNAS”. Jorge Guillermo Fukushima, 1986. Directora: Mirtha Biscoglio. • “MODIFICACIÓN QUÍMICA ESPECÍFICA DE LOS GRUPOS CARBOXILATOS DE LA SOMATOTROFINA BOVINA”. José María Delfino, 1985. Calificación: Sobresaliente. Director: José Alberto Santomé. • APLICACIÓN DE ANTICUERPOS ANTI-HAPTENES EN EL ESTUDIO DE LA ESTRUCTURA Y FUNCIÓN DE LA HORMONA DE CRECIMIENTO BOVINA. Cristina Nowicki, 1981. Director: José Alberto Santomé. 126 4. APORTES DE OTROS GRUPOS SIN INTERVENCIÓN DE PALADINI, DELLACHA Y SANTOMÉ En las últimas etapas de los trabajos dirigidos por Paladini, Dellacha y Santomé, se fueron formando, entre sus colaboradores, nuevos grupos de investigación, algunos de los cuales continuaron trabajando en temas relacionados con las hormonas de crecimiento. A continuación se resumen los aportes que realizaron. 4.1 Biscoglio-Cascone Cuando Santomé dejó de trabajar en hormonas de crecimiento, Biscoglio y Cascone constituyeron un grupo independiente que en los comienzos de su actividad continuó trabajando sobre hormonas de crecimiento. Realizaron los siguientes aportes en ese campo. • Crearon un método de purificación de péptidos que contienen histidina basado en la modificación de esos residuos con anhídrido etoxifórmico, reactivo que habían utilizado en la modificación de las histidinas en hormonas de crecimiento. • Utilizaron un método de predicción de homología conformacional que permitió postular al fragmento 42-49 como vinculado a la especificidad de especie en la familia de las hormonas de crecimiento. • Continuaron trabajando en la determinación de la estructura primaria de la hormona de crecimiento de alpaca. Estudiaron los péptidos trípticos de la hormona reducida y carbamido-metilada. Con los datos obtenidos y los resultados anteriores propusieron la estructura primaria total, parcialmente basada en su homología con la hormona equina. • Estudiaron la reactividad de las metioninas de la eGH frente a cloramina-T y comprobaron que es semejante a la de la bGH. • En colaboración con el grupo de Retegui detectaron regiones moleculares de la hGH reconocidas por anticuerpos monoclonales. Determinaron, además, qué anticuerpos monoclonales interferían en la unión de la hGH con receptores lactogénicos. 4.2 Fernández- Delfino En trabajos realizados sin la participación de Dellacha, Paladini y/o Santomé estudiaron el equilibrio monómero-dímero de la bGH. En otros experimentos unieron el receptor lactogénico de hígado de rata con un derivado fotoactivable de hGH. Comprobaron que: • La tirosina 142 está involucrada en el área de contacto. • La estabilización covalente del dímero diminuye fuertemente la actividad promotora de crecimiento y la unión a receptores en hígado de rata in vivo y en microsomas de hígado de conejo. 127 • Aportaron evidencias de que los grupos amino involucrados en la unión covalente no son relevantes para la actividad biológica. • La estabilización covalente del dímero no altera la actividad inmunológica medida por radioinmunoensayo. • Determinaron la presencia de una proteína asociada al receptor lactogénico. 4.3 Peña Se dedicó principalmente a investigaciones que involucraban la síntesis de péptidos, convirtiéndose en una reconocida especialista de nuestro país en ese tema. Su participación en los estudios sobre hormonas de crecimiento se limitó a los trabajos en colaboración con otros grupos. 4.4 Poskus Cuando integraba el grupo de Paladini, detectó anticuerpos contra hormonas de crecimiento humana, bovina y equina en pacientes tratados con hGH. Al constituir su propio grupo de trabajo continúo trabajando en el tema, al mismo tiempo que encaraba otros problemas inmunológicos y estructurales. El grupo de Poskus comprobó que mientras que los pacientes tratados con hGH producían un elevado tenor de anticuerpos, el tratamiento con la hormona recombinante no los producía. Consideró muy factible que la obtención de la hormona de hipófisis y su purificación podían alterar su estructura molecular desencadenando una respuesta inmune heteróloga. 4.5 Reteghi Anticuerpos monoclonales Durante su estadía en el laboratorio de PL Masson en la “Unit of Experimental Medicine, de Duve Institute (ex Institute of Cellular and Molecular Pathology, ICP), Université Catholique de Louvain, Bruxelles, Belgique, Retegui adquirió experiencia en la obtención y estudio de anticuerpos monoclonales, en especial contra las hormonas de crecimiento. Obtuvieron en ratones cinco anticuerpos monoclonales contra la hGH que también reaccionaron con el lactógeno placentario humano y tres de ellos con prolactina humana. Cuatro de los 5 anticuerpos no reconocieron a la bGH. Comprobaron que: • Los anticuerpos monoclonales reconocen una región antigénica principal. • La secuencia 98-129 está involucrada en el reconocimiento de los receptores. • La misma región de la hGH está involucrada en la unión a los receptores de hígado de conejo y de linfocitos humanos. A su regreso al país continuó trabajando en ese tema, al principio con el grupo de Paladini (Ver investigaciones posteriores a 1976) y poco después con su propio grupo de trabajo. Realizó colaboraciones con los doctores Mirtha Biscoglio, Leonor P. Roguin y Natalio Vita, todos miembros del Departamento de Química Biológica. Las 128 principales contribuciones fueron las siguientes: • Utilizó 20 anticuerpos monoclonales contra hGH, que cubrían la totalidad de la molécula, para establecer la topografía antigénica de la hormona. Obtuvo esa información midiendo la habilidad de pares de anticuerpos monoclonales para unirse simultáneamente o no a la hGH marcada con yodo radioactivo. Los resultados indicaron que los epitopes estudiados ocupaban toda la superficie de la hormona. • La unión de algunos anticuerpos monoclonales a la hormona le induce cambios conformacionales. • Establecieron qué monoclonales se unen a la región de reconocimiento del receptor y cuales no están involucrados en la unión. • Cada una de las tres hormonas lactogénicas: hGH, prolactina ovina y lactógeno placentario humano al unirse al receptor prolactínico de hígado de rata o de células Nb2 (provenientes de un linfoma de rata que prolifera en presencia de hormonas lactogénicas) impide la unión de las otras dos. Sin embargo, comprobaron que los sitios de unión no son exactamente los mismos. Ubicación molecular del sitio de unión de los anticuerpos monoclonales En colaboración con Peña: • Examinó el comportamiento inmunológico de fragmentos de hGH, obtenidos por escisiones enzimáticas y químicas y purificados por HPLC, frente a anticuerpos monoclonales dirigidos contra la hormona nativa. Comprobaron inmunocidad en los dos tercios N-terminales de la molécula y falta de ella en la secuencia 135-191. • Estudiaron el comportamiento de fragmentos de la eGH frente a distintos anticuerpos y comprobaron que las zonas antigénicas de la hormona se encuentra en las posiciones 5-72 y 73-123 y que algunos anticuerpos reconocen pequeños péptidos tales como 52-72 y 110-123. 4.6 Turyn En 1990, Dellacha fue invitado por el investigador norteamericano R.S. Barke de la Southern Illinois University de Estados Unidos para realizar trabajos, en colaboración, sobre receptores somatotrópicos y lactotrópicos de hormona de crecimiento en ratones transgénicos. Turyn, tuvo una predominante participación en los dos trabajos que se publicaron (Ver Grupo dirigido por Dellacha). En relación con esa colaboración Turyn se asoció con Bartke para acceder a modelos de animales transgénicos que le permitían estudiar los efectos de altas concentraciones de hormonas de crecimiento sobre sus efectos en el animal y sobre la actividad de la insulina. Los ratones deficientes en hormona de crecimiento o en su receptor son enanos y más sensibles a la acción de la insulina, mientras que los ratones que sobreexpresan hormona de crecimiento tienen mayor tamaño corporal que los controles y son insulinorresistentes. Sin embargo, el aumento de tamaño corporal no es tan marcado, lo 129 que sugiere que existen mecanismos que atenúan el exceso de hormona. Turyn resolvió estudiar esos mecanismos. Antes de mencionar sus aportes debemos recordar que la hormona de crecimiento se une a su receptor de membrana (GHR) para desencadenar una respuesta y que la hormona circulante, en parte, se une con alta especificidad a una proteína transportadora de la hormona, la GHBP, cuya estructura coincide con la porción extracelular del receptor. La GHBP funciona como modulador de la actividad de la GH y disminuye la tasa de eliminación de la hormona, aumentando su vida media. La GHBP también se encuentra asociada a membranas microsomales hepáticas (MA-GHBP) donde funcionaría como competidor del receptor. El grupo de Turyn estudió la fisiopatología del sistema GHR, GHBP y MA-GHBP frente a elevadas concentraciones de hormona, para determinar cómo son compensados esos altos niveles de hormona circulante. Realizó los aportes siguientes: • En los modelos de sobreexpresión de GH se observa mayores niveles de GHR, MA-GHBP, GHBP circulante y mayor capacidad de unión de la hormona a membranas hepáticas. Esto implica que en estos modelos hay mayor cantidad de receptores que en los animales normales, lo que indica que la hormona induce la síntesis de su propio receptor. • Ratones enanos que no expresan hormona de crecimiento, tienen proteína transportadora, lo que sugiere que su síntesis no es totalmente regulada por la hormona. • Comprobó que el aumento de las concentraciones de GHBP sérica y de la asociada a membranas constituye un mecanismo compensador para contrarrestar las altas concentraciones de GH circulante ya que disminuyen la disponibilidad de la hormona para su unión al receptor. Sin embargo, a pesar de esa disminución de la hormona libre, los niveles de GH circulante siguen siendo muy elevados en los animales que la expresan en grandes cantidades, por lo cual consideró probable que también existan otros mecanismos intracelulares que contribuyan a atenuar las consecuencias de la alta concentración. Para investigar dicha posibilidad, el grupo tuvo en cuenta que la hormona de crecimiento pertenece al tipo de hormonas que al unirse al receptor, le induce un cambio conformacional que activa las quinasas denominadas JAK, las que a su vez activan factores de transcripción citoplasmáticos denominados STATs y que éstos son los que activan en el núcleo celular la transcripción de genes específicos, responsables de la actividad hormonal. El grupo de Turyn evaluó, en modelos que expresan distintas concentraciones de hormona como responde la principal vía de señalización JAK2/STAT5. Comprobó que: • La sobreexpresión de hormona se asocia con la desensibilización de la señal, mientras que su deficiencia aumenta su sensibilidad. • Al evaluar los posibles mecanismos implicados, detectó que la proteína supresora de la señal de citoquinas CIS aumenta ante el exceso de hormona pero disminuye en su ausencia. 130 Finalmente, realizó estudios sobre los efectos adversos que resultan de niveles crónicamente elevados de la hormona, entre los cuales se encuentra el desarrollo de tumores, como el hepatocarcinoma. • Describió que el hígado de ratones transgénicos que sobreexpresan GH presenta lesiones preneoplásicas que se asocian a la expresión de diversas proteínas involucradas en proliferación y supervivencia celular Publicaciones Biscoglio-Cascone • "Hydrofobicity Modulation as a Tool for the Purification of Histidyl Peptides". M. Biscoglio de Jiménez Bonino, J. Fukushima, O. Cascone. Analyt. Biochem. 157, 8-11(1986). • "Conformational Comparison in the Growth Hormone Family". José L. Rivero, O. Cascone and M J Biscoglio de Jiménez Bonino. Comp. Biochem. Physiol. 95, 229232(1990). • "Relationship between the Antigenic Topography and the Structure of Human Growth Hormone". Mazza MM, Gobet MG, Biscoglio MJ, Mihajlovich V, Guillemot JC, Vita N, Ferrara P and Retegui LA. Endocrinology 127, 1002-1008 (1990). • "Primary Structure of Alpaca Growth Hormone" MJ Biscoglio de Jiménez Bonino, I Arnao de Nué, R Oré, D Sánchez, P Ferrrara, J Capdevielle and O Cascone. Int. J. Peptide Prot. Res. 38, 193-197(1991). • "Oxidation of Methionine Residues in Equine Growth Hormone by Chloramine-T". V Mihajlovic, O Cascone, M J Biscoglio. Int. J. Peptide Prot. Res. 25, 1189-1193(1993). Fernández-Delfino • “Covalent cross-linking of the bovine somatotropin dimer. Effects on growth promoting receptor-binding and immunological activities and preliminary characterization of the self-association”. Fernández HN and Delfino JM Biochem. J. 209:107-115 (1983). • “Contact area of bovine somatotropin dimer: involvement of tyrosine 142”. Oppezzo OJ, Fernandez HN. Int J Pept Protein Res. 37:277-82 (1991). • “A new photoactivatable reagent capable of transferring a radiolabel to target proteins. Application to the human growth hormone-rat liver prolactin receptor interaction”. Masckauchán NT, Delfino JM, Fernández HN. Bioconjug Chem. 9:507-11(1998). • “A membrane protein associated with the prolactin receptor. Studies with a photoactivatable human growth hormone derivative”. Masckauchán NT, Delfino JM, Fernández HN. Life Sci.62(12):1069-79 (1998). Poskus • “Growth Hormone Radioimmunoassay Using Monoclonal Antibodies: A Useful Method to Avoid Human Chorionic Somatomammotropin Interference in Serum Sam- 131 ples”. N. Vita, E. Poskus. Acta Physiol. Pharmacol. Latinoam. 34: 207-213 (1984). • “Human Growth Hormone. Characterization of Polypeptide Fragments Purified by Reversed Phase-High Performance Liquid Chromatography”. B. Mollerach-Gobbi, N. Vita, E. Poskus, C. Peña. Int. J. Peptide Prot. Res. 29 : 692-698 (1987) . • “Reacciones Inmunológicas a las Hormonas de Crecimiento. (Artículo de divulgación, por invitación de los editores)”. E. Poskus.). Publicación de la Academia Nacional de Ciencias de Buenos Aires. Fisiopatología y Clínica de las Hormonas de Crecimiento, pp. 79-98 (1988). • “Detection of Autoantibodies Against hGH in Sera of Idiopathic Hypopituitary Childen”. A.S. Llera, A.I. Cardoso, R. del R. Stumpo, A.S. Martínez, J.J. Heinrich, E. Poskus. Clin. Immunol. Immunopathol. 66:114-119 (1993). • “Heterologous Humoral Immune Response in Patients Treated with Human Growth Hormone from Different Sources”. A.I. Cardoso, A.S. Llera, R.F. Iacono, H.M. Domemé, A.S. Martínez, J.J. Heinrich, C. Peña, E. Poskus. Acta Endocrinologica 129:20-5 (1993). Retegui • “The recognition by monoclonal antibodies of various portions of a major antigenic site of human growth hormone”. Retegui LA, Milne RW, Cambiaso CL, Masson PL. Mol Immunol.19:865-75 (1982). • “The same region of human growth hormone is involved in its binding to various receptors”. Retegui LA, De Meyts P, Peña C, Masson PL. Endocrinology. 111:668-76 (1982). • “Particle-counting immunoassay of humanomatotropin”. Castracane CE, Cambiaso CL, Retegui LA, Gilbert I, Ketelslegers JM, Masson PL. Clin Chem. 30:672-6 (1984). • “Monoclonal antibodies and specific cell surface receptors do not discriminate between human growth hormone prepared by DNA recombinant techniques and the native hormone”. Retegui LA, Keefer LM, Fryklund L, DeMeyts P. Acta Physiol Pharmacol Latinoam.34:193-7 (1984). • “Relative distribution of various antigenic determinants on the human growth hormone surface”. Vita N, Etcheverrigaray M, Biscayart PL, Retegui LA. Mol Immunol. 23:619-24 (1986). • “The antigenic topography of human growth hormone and the humoral expression of its various epitopes”. Mazza MM, Etcheverrigaray M, Retegui LA. Medicina (B Aires).49:155-61 (1989). • “The antigenic topography of human growth hormone”. Mazza MM, Retegui LA. Mol Immunol.26:231-40 (1989). • “Monoclonal antibodies to human growth hormone induce an allosteric conformational change in the antigen”. Mazza MM, Retegui LA. Immunology. 67:148-53 (1989). • “Monoclonal antibodies as probes to study the human growth hormone-binding domain to lactogenic rat liver receptors”. Roguin LP, Cohen CE, Retegui LA. Endocrinology.127:1009-15 (1990). 132 • “Relationship between the antigenic topography and the structure of human growth hormone”. Mazza MM, Gobet MG, Biscoglio MJ, Mihajlovich V, Guillemot JC, Vita N, Ferrara P, Retegui LA. Endocrinology. 127:1002-8 (1990). • “Allosteric effects of monoclonal antibodies on human growth hormone”. Aguilar RC, Retegui LA, Postel-Vinay MC, Roguin LP. Mol Cell Biochem. 136:35-42 (1994). • “Monoclonal antibodies to human growth hormone modulate its biological properties”. Roguin LP, Aguilar RC, Retegui LA. Mol Immunol.32:399-405 (1995). • “A monoclonal antibody recognizing an epitope shared by receptors for growth hormone, prolactin, interleukin 2 and interleukin 6”. Longhi SA, Miranda ME, Gobet MG, Retegui LA. Mol Cell Biochem.195:235-43 (1999). • “Ovine placental lactogen and human growth hormone bind to different regions of the same receptors”. Longhi SA, Wolfenstein-Todel C, Gómez KA, Miranda ME, Retegui LA. Growth Horm IGF Res. 9(3):157-64 (1999). • “Positive cooperative effects between receptors induced by an anti-human growth hormone allosteric monoclonal antibody”. Aguilar RC, Blank VC, Retegui LA, Roguin LP. Life Sci. 6:1021-3 (2000). • “Relative localization of the prolactin receptor binding sites for lactogenic hormones”. Longhi SA, Blank VC, Roguin LP, Cristodero M, Retegui LA. Growth Horm IGF Res. 11:324-8 (2001). • “22- and 20 kDa-human growth hormones bind to different sites within certain cellular receptors”. Longhi SA, Cortés MM, Retegui LA. Growth Horm IGF Res. 13:35360 (2003). • “Properties of cryptic epitopes and their corresponding antibodies as indicated by the study of human and ovine growth hormones”. Loureiro ME, Marino VJ, Mathieu PA, Duhalde M, Roguin LP, Peña C, Retegui LA. Immunol Invest. 36:159-74(2007). • “Human growth hormone. Immunochemical characterization of polypeptide fragments purified by reversed phase-high performance liquid chromatography” Mollerach-Gobbi B, Vita N, Poskus E, Peña C. Int J Pept Protein Res. 29:692-8 (1987). • “Equine growth hormone. Detection of immunoreactive sequences using poly- and monoclonal antibodies”. Mollerach-Gobbi B, Retegui LA, Peña C. Int J Pept Protein Res. 35:105-10 (1990). Turyn • “Growth hormone binding protein (GHBP) in normal mice and transgenic mice expressing growth hormone (GH) gene”. Sotelo A, Dominici F, Engbers C, Bartke A, Talamantes F, Turyn D. Am J Physiol, 31: E745-E751 (1995). • “Concentration of free growth hormone binding protein in the serum of mice is not regulated by growth hormone”. Sotelo AI, Dominici FP, Bartke A, Turyn D. J Endocrinol 153: 319-326 (1997). • “Growth hormone (GH) receptors and binding proteins and IGF-I concentrations in the serum of transgenic mices expressing bovine GH agonist or antagonist”. Sotelo AI, 133 Bartke A, Kopchick JJ, Knapp JR, Turyn D. J Endocrinology 158: 53-59 (1998). • “Loss of sensitivity to insulin at early events of the insulin signaling pathway in the liver of growth hormone-transgenic mice”. Dominici FP, Cifone D, Bartke A, Turyn D. J Endocrinol. 161:383-92 (1999). • “Up-regulation of growth hormone (GH) binding protein by mouse GH in transgenic mice overexpressing GH releasing hormone”. González L, Sotelo AI, Bartke A, Turyn D. J Endocrinology 163:299-307 (1999). • “Compensatory alterations of insulin signal transduction in liver of growth hormone receptor knockout mice”. Dominici FP, Arostegui Diaz G, Bartke A, Kopchick JJ, Turyn D. J Endocrinol. 166:579-90 (2000). • “Growth hormone (GH) and estradiol regulation of membrane-associated GH binding protein and GH receptors in GH releasing hormone transgenic mice”. González L, Sotelo AI, Bartke A, Turyn D. GH & IGF Res 11: 34-40 (2001). • “CIS up-regulation is associated with desensitization of growth hormone (GH) signaling in GH releasing hormone transgenic mice”. González L, Miquet JG, Sotelo AI, Bartke A, Turyn D. Endocrinology, 143:386-94 (2002). • “Increased insulin sensitivity and upregulation of insulin receptor, insulin receptor substrate (IRS)-1 and IRS-2 in liver of Ames dwarf mice”. Dominici FP, Hauck S, Argentino DP, Bartke A, Turyn D. J Endocrinol. 173:81-94 (2002). • “Suppression of growth hormone (GH) JAK2/STAT5 signaling pathway in transgenic mice overexpressing bovine GH”. Miquet JG, Sotelo AI, Bartke A, Turyn D. Endocrinology 145:2824-2832 (2004). • “Increased sensitivity to GH in liver of Ames dwarf (Prop1df/ Prop1df) mice related to diminished CIS abundance”. Miquet JG, Sotelo AI, Dominici FP, Bonkowski MS, Bartke A, Turyn D. J Endocrinol 187:387-397 (2005). • “Differential regulation of membrane associated-growth hormone binding protein (MA-GHBP) and growth hormone receptor (GHR) expression by growth hormone (GH) in mouse liver”. González L, Curto LM, Miquet JG, Bartke A, Turyn D, Sotelo AI. GH & IGF Res 17:104-12 (2007). • “Transgenic mice overexpressing GH exhibit hepatic upregulation of GH-signaling mediators involved in cell proliferation”. Miquet J, González L, Matos M, Hansen C, Louis A, Bartke A, Turyn D, Sotelo A. J Endocrinol. 198: 317-330 (2008). • “Growth hormone (GH) modulates hepatic epidermal growth factor (EGF) signaling in the mouse”. González L, Díaz ME, Miquet JG, Sotelo AI, Dominici FP, Bartke A, Turyn D. J Endocrinol, 204:299-309 (2010). 134 IV • COLABORACIÓN CON LA INDUSTRIA DE INVESTIGADORES DE HORMONAS DE CRECIMIENTO Los investigadores del Departamento de Química Biológica de la Facultad de Farmacia y Bioquímica de la UBA fueron requeridos por la industria biotecnológica (Biosidus S.A.) para aplicar su experiencia en la purificación, estabilidad y control de calidad de la hormona de crecimiento humana recombinante, obtenida a partir de E. coli y de la proveniente de leche de vacas transgénicas. La colaboración se brindó a través de asesorías (Dellacha y Santomé) y de convenios con jefes de grupo, en los que intervenían los respectivos colaboradores. Mencionaremos las siguientes: 1. HORMONA DE CRECIMIENTO HUMANA RECOMBINANTE 1.1 Asesoría de Dellacha. Participó en calidad de Asesor Científico de Biosidus S.A. con el equipo de profesionales a cargo de la obtención de la hormona de crecimiento recombinante en E. coli (hGHr), en las etapas de purificación y estabilidad de la mencionada hormona. En reuniones semanales se discutía la experiencia que los investigadores del Departamento de Química Biológica habían adquirido en la purificación de la hGH proveniente de hipófisis humanas, en trabajos subsidiados por el CONICET, la Fundación de Endocrinología Infantil y la Facultad de Farmacia y Bioquímica de la UBA. Además, se volcó la experiencia resultante de una serie de trabajos que dichos investigadores estaban realizando acerca de las propiedades químicas, fisicoquímicas y biológicas de las hormonas de crecimiento, que hacían a su mayor estabilidad en determinadas condiciones experimentales. En función de estas experiencias y de común acuerdo, se introdujeron modificaciones en ciertos procedimientos y se diseñaron nuevos experimentos, cuyos resultados fueron discutidos en las reuniones semanales. De ellas surgieron conocimientos que contribuyeron a concretar la formulación farmacéutica de la hGHr. 1.2 Asesoría de Santomé 1.2.1 Convenios específicos de prestación de servicios con la Facultad de Farmacia y Bioquímica de la UBA 1.2.1.1 Determinación de la estructura primaria completa de la Hgh recombinante (HCB-P001) producida por Biosidus S.A. (1996) La responsabilidad técnica estuvo a cargo del Dr. José Alberto Santomé. Profesor Emérito de la Universidad de Buenos Aires y Coordinador del Laboratorio Nacional 135 de Investigación y Servicios en Química de Proteínas (LANAIS-PRO). El objeto del convenio fue realizar el estudio estructural y secuencia de aminoácidos de proteínas obtenidas por la técnica de ADN recombinante, consistente en escindirlas con distintas enzimas y reactivos químicos, purificar los fragmentos resultantes, determinar las correspondientes secuencias de amino ácidos, masa molecular y composiciones de aminoácidos. Con los datos obtenidos establecer si la secuencia de aminoácidos de la proteína estudiada era correcta. Los análisis de composición de aminoácidos y de microsecuenciación de péptidos se entregaban al LANAIS-PRO para su realización. Colaboradores: Lic. Susana Linskens Bioq. Evangelina Dacci Ayudante ad-honorem Brian Cavagnari Ayudante ad-honorem Santiago Di Pietro Comprobaron que la proteína recombinante codificada por Biosidus S.A. como HCBP001 tiene idéntica secuencia de aminoácidos y puentes disulfuro que la hormona de crecimiento humana natural. (Hans Flodh, Acta Pediatr. Scand. Supp. 1986). 1.2.1.2 Estudio inmunoquímico comparativo entre la hGH recombinante producida por Biosidus S.A. y otras de diferente origen. Control de calidad mediante el uso de anticuerpos y receptores biológicos. (1995) 1.2.1.3 La responsabilidad técnica estuvo a cargo de la Dra. Lilia A. Retegui. Profesora Asociada de Química Biológica. Investigador Independiente del CONICET. Colaboradores: Bioq. Viviana C. Blank. Bioq. Karina A. Gómez. Silvia A. Longhi. El objetivo del trabajo fue estudiar en forma comparativa la inmunoreactividad de la hormona de crecimiento humana recombinante producida por Biosidus S.A. con respecto a la hormona de crecimiento humana de origen hipofisario (hGH-NIH lote AFP-9775A) y la hGH Genotropin (hGH-KABI) de origen recombinante producida en Estados Unidos por Genentech. El estudio consistió en evaluar la reactividad de las diferentes hormonas frente a varios anticuerpos poli y monoclonales, su reconocimiento por receptores celulares específicos y la respuesta a cambios conformacionales producidos por anticuerpos. El estudio realizado demostró total identidad inmunológica entre la hormona de crecimiento humana recombinante producida por Biosidus S.A. y sus similares de origen hipofisario (estándar) y recombinante (Genotropin). La capacidad de unirse a los receptores celulares fue idéntica en las tres hormonas. 136 2. HORMONA DE CRECIMIENTO HUMANA DE LECHE DE VACAS TRANSGÉNICAS 2.1 Convenios específicos de prestación de servicios con la Facultad de Farmacia y Bioquímica DE LA UBA El Dr. Santomé, en calidad de asesor, participó con la Dra. Susana Dabsys de Biosidus S.A. en la elaboración de los proyectos y en el control de la marcha de los siguientes convenios con la Facultad de Farmacia y Bioquímica de la UBA, en los cuales la responsabilidad técnica estuvo a cargo de: 1. Dr. José Alberto Santomé (2003). 2. Dras. Lilia Retegui y Leonor Roguin (2004). 3. Dr. Daniel Turyn (2004). 4. Dr. José María Delfino (2004) 5. Dr. Edgardo Poskus (2006). 2.1.1 Determinación de la estructura primaria completa de la hormona de crecimiento humana de leche de vacas transgénicas (proteína HCL-E 02), obtenida en Biosidus S.A. (2003). La responsabilidad técnica estuvo a cargo del Dr. José Alberto Santomé. El objeto del convenio fue realizar el estudio estructural y secuencia de aminoácidos de la hormona de crecimiento humana obtenida por Biosidus S.A. de leche de vacas transgénicas. Dicho estudio consistió en escindir las hormonas con distintas enzimas y reactivos químicos, purificar los fragmentos resultantes, determinar las correspondientes secuencias de aminoácidos, masa molecular y composición en aminoácidos. Con los datos obtenidos establecer si la secuencia de aminoácidos de la proteína estudiada era correcta (los análisis de composición de aminoácidos, de microsecuenciación y de espectrometría de masa se entregaban al LANAIS-PRO para su realización). El Dr. Santomé designaba los colaboradores necesarios para cada caso. Comprobaron que la hormona de crecimiento humana proveniente de leche de vacas transgénicas, codificada por Biosidus S.A. como HCL-E 02, tiene idéntica secuencia de aminoácidos y ubicación de los puentes disulfuro que la hormona de crecimiento humana natural. (Hans Flodh, Acta Pediatr. Scand. Supp. 1986). 2.1.2 Estudio inmunoquímico comparativo entre la hormona de crecimiento humana obtenida por Biosidus S.A. de leche de vacas transgénicas y hormonas de diferente origen. Actividad de las mismas frente a receptores de origen humano y sobre la proliferación de células Nb2 (2004) La responsabilidad técnica estuvo a cargo de la Dra. Lilia Retegui, Profesora Asociada de Química Biológica, Investigador Independiente del CONICET y la Dra. Leonor Roguin, Profesora Adjunta, Investigador Asistente del CONICET. Previamente am- 137 bas investigadoras habían establecido con anticuerpos monoclonales la topografía antigénica de la hGH y habían obtenido 20 de esos anticuerpos que cubrían la totalidad de la molécula de la hormona. El objetivo del convenio fue: • Medir la reactividad de la hGH, obtenida de vacas transgénicas, en forma comparativa con el estándar europeo de la proteína recombinante y con el producto comercial obtenido por Biosidus S.A., frente a varios anticuerpos monoclonales dirigidos contra diferentes regiones de la superficie molecular. • Medir la reactividad de las mismas frente a receptores de origen humano. • Determinar el efecto de distintas concentraciones de la proteína y de los dos estándares sobre la proliferación de células Nb2, provenientes de un linfoma de rata que prolifera en presencia de hormonas lactogénicas (hGH, lactógeno placentario y prolactinas). Participaron los siguientes investigadores: Bioq. Viviana C. Blank, Ayudante 1º D.E. Bioq. Verónica J. Marino, Ayudante 1º D.E. Bioq. Patricia A. Mathieu, Ayudante 1º D.E. Bioq. María E. Loudeiro, Ayudante 1º D.E. Comprobaron que el estándar europeo de la proteína recombinante, el obtenido por Biosidus S.A. y la hGH obtenida por Biosidus S.A. de leche de vacas transgénicas (HCL-E 02) son esencialmente idénticos en su capacidad de ser reconocidas por los anticuerpos monoclonales 3C11, 10D6 y AC8 (Mazza y Retegui, Mol Immunol 26:231-239, 1989). Las tres hormonas tuvieron un comportamiento esencialmente idéntico en su capacidad de estimular el crecimiento de las células Nb2, por lo cual concluyeron que la actividad biológica de las tres hormonas ensayadas es similar. 2.1.3 Determinar la capacidad de la hGH de leche de vacas transgénicas de iniciar la transducción de señales (2004). La responsabilidad técnica estuvo a cargo del Dr. Daniel Turyn. Profesor Asociado D.E. Su grupo de trabajo tenía experiencia en la transducción de la señal de la hormona de crecimiento conducente a la transcripción de los genes responsables de las actividades estimulante del crecimiento y metabólica de la hormona. Es decir, en la unión de la hormona a su receptor y la dimerización del mismo, la cual inicia la serie de fosforilaciones de proteínas que resultan en la activación de enzimas y factores de transcripción. La quinasa JAK2, activada luego de la dimerización del receptor, fosforila a las proteínas activadoras de la transcripción y transductoras de señales (STATs), que son varias. Las STATs penetran en el núcleo y activan a distintos genes. El objetivo del convenio fue evaluar, en forma comparativa con el estándar europeo de la proteína recombinante y con el obtenido por Biosidus S.A., la capacidad de la hGH de vacas transgénicas de iniciar la transducción de señales midiendo la fosforilación en tirosina del STAT5. 138 Participaron los siguientes investigadores: Dra. Ana Sotelo, Jefe de trabajos Prácticos. D.E. Bioq. Johanna Miquet: Ayudante de Primera. D.E. Las tres hormonas tuvieron un comportamiento esencialmente idéntico en su capacidad de estimular la fosforilación en tirosinas del STAT5, por lo cual concluyeron que la actividad biológica de las tres hormonas ensayadas es similar. 2.1.4 Estudio comparativo por dicroísmo circular y fluorescencia entre la hormona de crecimiento humana obtenida por Biosidus S.A. de leche de vacas transgénicas y hormonas de diferentes orígenes. Análisis de la estabilidad conformacional (2004). La responsabilidad técnica estuvo a cargo del Dr. José María Delfino. Prof. Asoc. Reg. D.E. Investigador con experiencia en conformación de proteínas, especialmente en la metodología requerida para detectar cambios conformacionales. El objetivo del convenio fue comparar la conformación de la hGH obtenida de leche de vacas transgénicas con la del estándar europeo de la proteína recombinante y la del obtenido por Biosidus S.A., por espectroscopía CD (UV lejano y UV cercano) y por fluorescencia intrínseca (espectro de emisión), y evaluar la estabilidad conformacional de las muestras mediante curvas de desnaturalización por efecto de urea o cloruro de guanidinio. Participaron los siguientes investigadores: Dr. Juan Pablo F.C. Rossi. Prof. Asoc. Reg. D.E. Bioq. Lucrecia María Curto. Ayud. 1º/Becaria. Bioq. Gabriela Elena Gómez. Ayud. 2º/Becaria. Realizaron medidas espectroscópicas de dicroísmo circular en las zonas UV lejana y cercana con el propósito de evaluar el contenido de estructura secundaria y la integridad de la estructura terciaria. Asimismo, colectaron los espectros de emisión de fluorescencia a fin de comparar el entorno de los residuos de triptófano. Por ambas espectroscopias las muestras resultaron indistinguibles unas de otras y compatibles con datos bibliográficos. Resultó particularmente significativa la coincidencia entre los espectros de CD en la zona UV cercana, de lo que se deduce un entorno idéntico para los residuos aromáticos. Del mismo modo, comprobaron similitud en el valor de longitud de onda máxima de emisión de fluorescencia: 335 nm, que coincide con el valor publicado. Siguieron el proceso de desnaturalización a través de la medición de la intensidad de fluorescencia a 370 nm y de la posición del centro de masa espectral. De acuerdo con los datos informados, las tres muestras resultaron indistinguibles entre sí y coherentes con los datos correspondientes a la hormona de crecimiento humana informados en la literatura. 139 2.1.5 Obtención de sueros en conejos hiperinmunes hacia sistemas antigénicos complejos (2006). La responsabilidad técnica estuvo a cargo del Dr. Edgardo Poskus. Investigador Principal CONICET. Director Interino del Instituto de Estudios de la Inmunidad Humoral Profesor Ricardo A. Margni (IDEHU CONICET-UBA). Objetivo del convenio: realización de los procedimientos necesarios para el desarrollo de sueros en conejos hiperinmunes hacia tres sistemas antigénicos complejos de proteínas extractivas, con ejecución de los respectivos análisis de titulación. Participaron los siguientes investigadores: Dr. Rubén F. Iacono. Profesional Principal, CONICET. Dra. Silvia Noemí Valdez. Docente Auxiliar. Investigador Asistente CONICET Bioterista María Dolores Campos: Técnica Asistente, CONICET. 140 ANEXO A ESTRUCTURA DE PROTEÍNAS Las proteínas son biopolímeros que se originan por la combinación repetida de aproximadamente 20 aminoácidos diferentes. En la cadena polipeptídica formada (alrededor de 190 en las hormonas de crecimiento), los aminoácidos están enlazados por la llamada “unión peptídica” entre los grupos α-amino y α-carboxilos de aminoácidos adyacentes. El primer aminoácido de la secuencia tiene el grupo α-amino libre y se denomina “extremo N-terminal” y el último llamado “extremo Cterminal” tiene el grupo α-carboxilo libre. Las proteínas suelen tener “puentes disulfuro”, también llamados “puentes azufre”, constituidos por la unión de los grupos sulfidrilos de cisteínas, no adyacentes en la secuencia pero próximos en el espacio. Hasta aquí se ha descripto la llamada estructura primaria. Estructura secundaria es la distribución regular y periódica que adopta en el espacio esa cadena de aminoácidos (hélice-α, estructura-β…) y estructura terciaria al plegamiento de la cadena en el espacio, para adquirir la forma globular, de estas proteínas. La información genética para la síntesis de las proteínas en la mayoría de los organismos, está contenida en forma codificada en las moléculas de ácido desoxirribonucleico (DNA) que se presenta en una estructura de doble cadena. La información contenida se copia bajo la forma de RNA de cadena única. Los productos de esta transcripción son el RNA ribosómico, de transferencia y el mensajero. La traducción del RNA mensajero conduce a las proteínas. Se muestran, a continuación, los dos tipos de abreviaturas que se utilizan para los 20 aminoácidos: Glutamina Alanina Arginina Ac.aspártico Ác. Glutámico Asparragina Cistina Ala Arg Asp Glu Asn Cys Gln A R D E N C Q Glicina Histidina Iso leucina Leucina Lisina Metionina Fenilalanina Gly His Ile Leu Lys Met Phe G H I L K M F Prolina Serina Treonina Triptofano Tirosina Valina Pro Ser Thr Trp Tyr Val P S T W Y V 141 ANEXO B BREVE DESCRIPCIÓN DE LOS FUNDAMENTOS Y METODOLOGÍA EMPLEADA PARA DETERMINAR LA ESTRUCTURA PRIMARIA DE LA HORMONA DE CRECIMIENTO BOVINA El objetivo de este anexo es explicar a quienes no son especialistas en el tema, las razones por los cuales Li necesitó en la Universidad de California, 10 años para determinar la estructura primaria de la hormona de crecimiento humana y el grupo de la Facultad de Farmacia y Bioquímica siete años para determinar la de la hormona bovina. En primer lugar daremos una idea del proceso de determinación que podía llevarse a cabo, con la metodología en esa época, para determinar la estructura primaria de una proteína. Tomaremos, como ejemplo, una proteína teórica pequeña, representada en el siguiente esquema como una línea recta en la que aparecen los residuos de aminoácidos como guiones, con excepción de los básicos: arginina y lisina, que se representan con sus símbolos: R y K. 1 2 3 4 5 H2N-------------R---------R---------K---------------R------6 ---K----------COOH Etapas posibles de la determinación: 1. El primer paso para la determinación de la estructura primaria de esta proteína teórica, podía ser su fraccionamiento por incubación con una enzima proteolítica, la tripsina por ejemplo, la cual escinde las uniones peptídicas en las que participa el grupo carboxilo de las argininas y lisinas. Se obtendrían los siguientes fragmentos o péptidos: 1 H2N-------------R 4 ---------------R 2 ---------R 5 ----------K 3 ---------K 6 ----------COOH 2. Los 6 péptidos resultantes podrían separarse mediante columnas de intercambio iónico especialmente preparadas para esas funciones. 3. Comprobada la pureza de los péptidos podría determinarse la secuencia de ami142 noácidos de cada uno de ellos, para lo cual los aminoácidos se liberarán uno a uno a partir del extremo N-terminal, mediante el proceso químico conocido como degradación de Edman. Los aminoácidos liberados en cada degradación podrían caracterizarse en un analizador automático de aminoácidos o por cromatografía, generalmente en capa delgada. Con estas degradaciones de Edman manuales solo era posible establecer la secuencia de pocos residuos de aminoácidos. Para determinar la secuencia a partir del extremo C-terminal podía recurrirse a las carboxipeptidasas, enzimas que liberan uno a uno los residuos de aminoácidos; eran necesarios distintos tiempos de incubación para determinar el orden de liberación y caracterizar los aminoácidos liberados en cada etapa. Frecuentemente, la longitud del péptido, no permitía tener su secuencia total utilizando los procedimientos indicados; en estos casos el péptido debía escindirse con otra enzima, separar los péptidos resultantes y determinar la secuencia de cada uno de ellos. 4. Obtenida la secuencia de aminoácidos de los 6 péptidos trípticos de esta proteína teórica, sería necesario determinar su ubicación en la molécula proteica, para lo cual se escindía la proteína con enzimas que rompan las uniones peptídicas de residuos distintos a los de la tripsina, por ejemplo, en los puntos señalados en el esquema, dando lugar a los péptidos que designamos con letras. 1 2 3 4 H2N---/ ------/ ----R----/ -----R---------K---/ ------/ ---a b c d e 5 6 --R------/ ----K-------/ ---COOH f g h Los nuevos péptidos también debían separarse en columnas de resinas, purificarlos y determinar su secuencia de aminoácidos. Los residuos comunes a los péptidos numerados y los indicados con letras permitirían establecer la ubicación de los 6 péptidos en la proteína. Este ejemplo teórico de determinación de estructura primaria es muy sencillo; las proteínas reales son de mayor peso molecular y suelen tener puentes disulfuro y regiones hidrofóbicas que dan origen a péptidos de difícil purificación. Generalmente era necesario, además de emplear distintas enzimas proteolíticas, recurrir a escisiones químicas. Determinación de la estructura primaria completa de la hormona de crecimiento bovina La bGH tiene una molécula mucho más compleja que la correspondiente al ejemplo teórico descrito en el Anexo B. Como veremos más adelante, es una mezcla de cantidades semejantes de dos cadenas polipeptídicas que sólo difieren en que a una de 143 ellas le falta la alanina del extremo N-terminal. Para la numeración de los residuos y demás descripciones moleculares nos referiremos a la molécula provista de esa alanina, también existente en algunas hormonas de crecimiento de otras especies La bGH posee: • 189 residuos de aminoácidos. • 21.617 de masa molecular. • 2 puentes disulfuro. • 13 argininas y 11 lisinas Con el objetivo de hacer una breve descripción de la determinación de la estructura primaria de la bGH, omitiremos la descripción de los solventes utilizados, su pH y concentración, como así otras condiciones experimentales que no sean indispensables para entender este somero resumen. Seguiremos los pasos indicados en el ejemplo teórico: 1. Digestión con tripsina. De acuerdo con el número de residuos básicos se obtendrían 25 péptidos trípticos, pero en realidad el número fue mayor porque cuando no se rompe el 100% de una unión peptídica de arginina o lisina se originan productos con dos péptidos trípticos unidos. Para encarar el aislamiento, purificación y posterior estudio de cada uno de los péptidos, utilizaron en cada digestión, 200 mg de hormona, previamente oxidada con ácido perfórmico, cantidad de bGH que junto con la utilizada en otros procedimientos justificó la necesidad de disponer de suficiente producción de hormona pura. 2. Aislamiento de los péptidos trípticos. Liofilizaron el digerido tríptico y lo extrajeron con una solución de acetato de piridina. Sembraron la fracción soluble en una columna de resina sulfónica Aminex AG 50W-X2 (0,9cm X 1,80cm) termostatizada a 40 ºC, y convenientemente preparada. A continuación, hicieron pasar a través de la columna 1.600 ml de un gradiente de solventes, con un flujo de 11 ml/hora. Recogieron fracciones numeradas, de 1,60 ml cada una, utilizando un colector automático. Los distintos péptidos trípticos tuvieron distintos grados de retención en la columna, por lo cual fueron eluyendo a distintos tiempos, permitiendo así, el aislamiento de cada uno de ellos. Detectaron la presencia del material peptídico por reacciones químicas, en alícuotas de las fracciones. Unieron las fracciones que aparentemente correspondían a cada péptido y examinaron su complejidad por electroforesis de alto voltaje en papel Whatman 3MM, a pH 6.45 en un sentido y a pH 2.00 en el normal. Las fracciones que por este procedimiento presentaron un solo componente, las purificaron por electroforesis de alto voltaje en las condiciones mencionadas. La siembra en el papel la hicieron en línea y después de la electroforesis revelaron una tira del papel para detectar la ubicación del material y proceder a su elución con solventes y posterior análisis de aminoácidos en el analizador automático. Si el resultado indicaba que el péptido no estaba puro, lo sometían a una cromatografía en papel durante 14 horas. Por este procedimiento aislaron y purificaron a homogeneidad, 22 péptidos solubles del digerido tríptico de la bGH. 144 3. Determinación de la secuencia de aminoácidos de los péptidos trípticos solubles. Tal como se describió al tomar como ejemplo una proteína teórica, liberaron uno a uno los aminoácidos del extremo N-terminal como feniltiohidantoínas, mediante degradaciones de Edman y las caracterizaron por cromatografía en capa delgada. Para determinar la secuencia a partir del extremo C-terminal, utilizaron carboxipeptidasas. Así lograron determinar la secuencia total o parcial de los péptidos trípticos mencionados. 4. Digestión con otras enzimas de la bGH nativa o químicamente modificada. Después de determinar la secuencia total o parcial de los péptidos trípticos solubles, debían: • Aislar y determinar la secuencia del resto de los péptidos trípticos. • Digerir la hormona con otras enzimas proteolíticas, o con métodos químicos, y aislar y determinar la secuencia de aminoácidos de los péptidos resultantes. • Determinar la ubicación de los puentes disulfuro. • Con la secuencia parcial o total de todos los péptidos obtenidos establecer la estructura primaria de la bGH mediante el solapado de los residuos comunes de esos péptidos. Para cumplir con ese programa de trabajo, escogieron la quimotripsina como segunda enzima proteolítica a utilizar. Aplicaron el procedimiento utilizado para la tripsina, adaptado a las características de la nueva enzima. Lograron determinar la secuencia total o parcial de 26 péptidos quimotrípticos solubles. Toda la información obtenida de los péptidos trípticos y quimotrípticos solubles les permitió determinar la secuencia de 139 aminoácidos. Para determinar la secuencia de los 50 restantes siguieron varios caminos: En primer lugar digirieron el material insoluble de los digeridos trípticos y quimotrípticos con Pepsina, enzima proteolítica que escinde un considerable número de uniones peptídicas. Los péptidos resultantes se trataron en igual forma que los digeridos solubles de tripsina y quimotripsina. Determinaron así, la secuencia total o parcial de 19 péptidos, la mitad de los aminoácidos faltantes. El mayor problema a resolver lo constituyó la insolubilidad de varios péptidos trípticos que por su hidrofobicidad se agregaban fácilmente. Para solucionarlo repitieron la digestión con tripsina utilizando bGH químicamente modificada para evitar la insolubilidad de los péptidos. Se recurrió alternativamente a digerir hormona reducida, carbamidometilada y maleinizada. El estudio de los péptidos resultantes y el empleo de técnicas especiales para determinar los puentes disulfuro y la ubicación del único residuo de triptófano y de las 4 metioninas, permitieron la determinación de la estructura primaria completa de la bGH. Magnitud del trabajo. Esta resumida descripción de los procedimientos utilizados para determinar la secuencia de aminoácidos de la bGH, explica porque el grupo de Buenos Aires necesitó 7 años para completarla y porque C.H. Li demoró 10 años con la humana. Dijimos que la bGH nativa o químicamente modificada se sometió a varias digestio- 145 nes enzimáticas y químicas. Los péptidos resultantes se sometieron a un complejo procedimiento para su aislamiento y purificación, incluyendo resinas de intercambio, electroforesis de alto voltaje y cromatografía en papel. Las numerosas fracciones provenientes de las resinas contenían péptidos o mezcla de péptidos muy diluidos, por lo cual se requería su concentración en evaporadores rotatorio antes de sembrarlos en los papeles Whatman 3 MM y someterlos a electroforesis de alto voltaje. Las nuevas fracciones obtenidas tenían que eluirse del papel, concentrarse y determinar la composición en aminoácidos en una alícuota para averiguar si se trataba de un péptido puro, en caso contrario lo sometían a otra electroforesis de altovoltaje a distinto pH, cada una de las nuevas fracciones obtenidas debían someterse a análisis automático de aminoácidos para establecer si era un péptido puro, un componente desechable o una mezcla que justificaba ser eluída, concentrarse y someterse a un fraccionamiento por cromatografía en papel. De los centenares de fracciones estudiadas seleccionaron 124 péptidos para determinar sus secuencias en aminoácidos. "Primary structure of bovine growth hormone". J.A. Santomé, J.M. Dellacha, A.C. Paladini, C. Peña, M.J. Biscoglio, S.T. Daurat, E. Poskus, C.E.M. Wolfenstein. Eur. J. Biochem., 37: 164 (1973). La metodología utilizada para determinar la estructura primaria de las proteínas, experimentó desde entonces una intensa evolución, como puede apreciarse en el Anexo C. 146 ANEXO C EVOLUCIÓN DE LAS METODOLOGÍAS PARA DETERMINAR LA ESTRUCTURA PRIMARIA DE PROTEÍNAS Mencionamos que en 1967, Edman había presentado el primer secuenciador automático de aminoácidos, capaz de determinar la secuencia N-terminal de 15 aminoácidos en 24 horas con 250 nanomoles de péptidos o proteínas, cantidad muy pequeña para la metodología de la época. Ese aparato redujo considerablemente el tiempo y la cantidad de proteína necesaria para determinar la estructura primaria. Hizo posible determinar la secuencia de un número elevado de residuos del extremo N-terminal y secuenciar péptidos de mayor tamaño molecular, reduciendo la necesidad de fragmentar péptidos y proteínas con enzimas productoras de fragmentos pequeños. En la misma década tuvieron lugar una serie de descubrimientos en un campo muy distinto al de la secuenciación de proteínas, pero que permitieron deducir numerosas estructuras primarias a partir del DNA o del RNA mensajeros. En 1960 Nirenberg, Khorana y Ochoa describieron el código genético; ese mismo año Sanger creó un método rápido para secuenciar RNA y, en 1975, el primer método para secuenciar DNA; en 1977 Maxan y Gilbert presentaron un método para secuenciar DNA por degradación química y Sanger un nuevo método para secuenciar DNA, que lo hizo acreedor de su segundo premio Nobel. Además, entre 1976 y 1980 aparecieron métodos rápidos para sintetizar oligonucleótidos. Estos descubrimientos hicieron más rápido deducir la secuencia de aminoácidos de una proteína determinando la del DNA, que secuenciando la proteína directamente (semanas en lugar de meses o años). Sin embargo, en sus comienzos, este procedimiento enfrentó el problema de requerir el aislamiento del DNA genético o el RNA mensajero, generalmente presentes en mezclas muy complejas. La solución del problema surgió en 1980 cuando Fiddes y Goodman a partir de la secuencia de 5 aminoácidos de la subunidad b de la gonadotropina coriónica humana obtuvieron su DNA complementario. Por consiguiente, a partir de la secuencia de un fragmento de la proteína fue posible sintetizar oligonucleótidos utilizables como: • una sonda especifica para detectar el RNA mensajero de la proteína. • un iniciador (“primer”) para sintetizar el DNA complementario. • una sonda para detectar el gen de una proteína a partir de una genoteca. En 1981, Hankapiller y col. crearon un secuenciador de aminoácidos en fase gaseosa, capaz de determinar por degradaciones de Edman, la secuencia de numerosos residuos de aminoácidos con solo picomoles de proteína. Es decir, con una cantidad que puede obtenerse por elución de una bandita de un gel de poliacrilamida. Este aparato provocó un regreso a la secuenciación química. El costo elevado de adquisi147 ción y mantenimiento del aparato y la necesidad de personal técnico especializado, hizo conveniente que este secuenciador estuviera a cargo de un grupo de investigación en química de proteínas. Para solucionar este problema numerosas universidades y centros de investigación crearon laboratorios especializados para ofrecer servicios en una o más de las siguientes determinaciones: • Composición en aminoácidos. • Secuenciación de péptidos y proteínas. • Síntesis de péptidos. • Síntesis de polinucleótidos. • Secuenciación de DNA. • Espectrometria de masa. En nuestro país, el CONICET, con un préstamo del BID, creó en 1990 el Laboratorio Nacional de Investigación y Servicios en proteínas (LANAIS-PRO), cuyo organizador y Coordinador fue Santomé, que estuvo a su cargo hasta su designación como Coordinador Honorario en 2003. Como todo LANAIS debía brindar sus servicios a todos los investigadores y a la industria. Entre otros equipos fue provisto de un secuenciador derivado del creado por Hankapiller. El LANAIS-PRO continúa prestando sus servicios a numerosos investigadores y a la industria biotecnológica. La prestación de servicios por el LANAIS-PRO, por ejemplo, permitieron a Santomé y sus colaboradores (Santiago Di Pietro, Christian Schleicher, Osvaldo Córdoba, Esteban Dell´Angélica, Mario Ermácora y Brian Cavagnari) aislar y determinar la estructura primaria total o casi total de: 23 proteínas transportadoras de ácidos grasos, 4 proteínas ligadoras de calcio y 1 puente disulfuro isomerasa. Además de otras 3 proteínas en colaboración con otros grupos. Con respecto a las hormonas de crecimiento obtenidas por la industria biotecnológica, Santomé determinó, por convenio con Biosidus S.A., la estructura primaria completa de la hormona de crecimiento humana obtenida por la técnica de DNA recombinante y la de dicha hormona obtenida en leche de vacas transgénicas. En los últimos años los métodos basados en las degradaciones de Edman están siendo reemplazados por los que utilizan espectrometría de masa. 148 ANEXO D RESUMEN DE LOS CONOCIMIENTOS ESTRUCTURALES ACTUALES SOBRE HORMONAS DE CRECIMIENTO La molécula de las hormonas de crecimiento contiene 4 hélices-α de 21 a 30 residuos cada una. Forman un manojo con las dos primeras hélices paralelas entre sí y antiparalelas con las otras dos. Para que esta conformación sea posible las cadenas de amino ácidos que unen las cadenas laterales son largas, mientras que la que une las hélices antiparalelas es corta. La hormona de crecimiento se une a las dos moléculas de receptor en forma secuencial. A través del sitio 1 de la hormona (ver gráfico) se une a la primera molécula de receptor y por el sitio 2 a la segunda. Sitio 1 Sitio 2 Diagrama de la estructura de la hGH señalando los sitios I y II de unión al receptor. N: Residuo N-terminal; C: Residuo C-terminal; I, II, III y IV: Hélices α. Están indicados los residuos iniciales y terminales de cada hélice Residuos de las hormonas de crecimiento involucrados en la unión a los receptores Cunningham y Wells, en 1989, utilizaron la técnica conocida como “alanine-scanning mutagenesis” para identificar los residuos de aminoácidos de la hGH recombinante que se unen al receptor. Mutaron por alanina cada residuo contenido en los tres segmentos discontinuos de la hGH considerados implicados en el reconocimiento del receptor: residuos 2 a 19, 54 a 74 y 167 a 191. El trabajo reveló la importancia de doce residuos de cadena lateral larga. Muchos de esos residuos están cambiados en las prolactinas y lactógenos placentarios, hormonas homólogas que no reconocen el receptor de la hGH. Los residuos mencionados pertenecen al sitio 1, el cual se une a la primera molécula del receptor, pero la unión de la hormona a la segunda molécula del receptor se hace a través del sitio 2. El sitio 1 involucra la región N-terminal de la hélice 1, los residuos 54-68 y el extremo carboxilo terminal de la hélice 4. El sitio 2, adyacente al primero comprende la región N-terminal y central de la hélice 3 (Wells y de Vos, 1993) 149 Interacción de cadenas laterales de aminoácidos El “core” de las 4 hélices de la hGH está constituido por los residuos L6, F10,A13, A17, L20, A24, T27 y F31 de la hélice 1, N72, L76, S79, I83, W86 y V90 de la hélice 2, V110, L114, L117, I121, L124 y L128 de la hélice 3, y N159, L163, F166, M170, V173, L177, V180 y S184 de la hélice 4 (Ultsch et al, 1994). Señalados en negrita. X representa los residuos faltantes. Hélice I . 6 10 13 17 20 24 27 30 hGH:XFPTIPLSRLFDNAMLRAHRLHQLAFDTYQEFEEAYIPKEQKYSFLQNPQT bGH:A--AMS--G--A--V---QH-----A--FK---RT---EG-R--IX--T-V oGH:A--AMS--G--A--V---QH-----A--FK---RT---EG-R--IX--T-V eGh:X--AMP--S--A--V---QH-----A---K---R----EG-R--IX--A-A Hélice II . 72 76 79 83 86 90 hGH:SLCFSESIPTPSNREETQQKSNLELLRISLLLIQSWLEPVQFLRSVFANS bGH:AF----T--A-TGKN-A-E--D---------------Q-XG---X--T-oGH:AF----T--A-TGKN-A-E--D---------------Q-XG---X--T-eGH:AF----T-PA-TGKN-A--R-DME---F---------G---L--X--T-. Hélice III . 110 114 117 121 124 128 hGH:LVYGASDSNVYDLLKDLEEGIQTLMGRLEDGSPRTGQIFKQTYSKFDTNS bGH:--F-T--RX--EK--------LA--RE----T—-A---L----D-----M oGH:--F-T--RX--EK--------LA--RE----V--A---L----D-----M eGH:--F-T--RX--EK-R-------A--RE------RA---L----D-----L . Hélice IV . 159 163 166 170 173 177180 184 hGH:HNDDALLKNYGLLYCFRKDMDKVETFLRIVQCRXSVEGSCGF bGH:RS-----------S-----LH-T--Y--VMK-RRFG-A--AoGH:RS-----------S-----LH-T--Y--VMK-RRFG-A--AeGH:RS-----------S--KK-LH-A--Y--VMK-RRF--SS-A- 150 ANEXO E RECEPTORES HORMONALES Las hormonas del sistema endocrino se pueden clasificar de acuerdo a su solubilidad en dos grandes grupos: las solubles en lípidos y las que no lo son. Para ejercer su acción, las hormonas solubles en lípidos se desplazan libremente a través de la membrana celular externa, mientras que las hormonas insolubles no la atraviesan, sino que necesitan de una estructura compleja, constituida mayoritariamente por proteínas o glicoproteínas ubicadas en la membrana plasmática, denominada receptor endocrino. Para iniciar su acción las hormonas interaccionan específicamente con el receptor, desencadenando en el interior de la célula una cascada de reacciones (activación de enzimas o factores, modificación en la permeabilidad de la membrana, transcripción, etc) que definen su respuesta biológica. Los receptores transmembrana son aquellos que atraviesan todo el espesor de la membrana plasmática de la célula, conservando un extremo libre en la cara externa de la membrana plasmática (dominio extracelular) y otro ubicado en la cara interna (dominio intracelular). Existen distintos tipos de receptores transmembrana a saber: receptores asociados a proteínas G, receptores con actividad tirosina quinasa intrínseca, receptores que no presentan actividad intrínseca y activan quinasas. Cuando el dominio extracelular de este último tipo de receptores interacciona con citoquinas, interferones, eritropoyetina, hormona de crecimiento o prolactina, el receptor sufre un cambio conformacional que afecta al dominio intracelular, lo que provoca la activación de miembros de la familia de las quinasas denominadas Janus quinasas JAK (por su sigla en inglés Janus Activation Kinases), las que a su vez activan factores de transcripción citoplasmáticos denominados STATs (por su sigla en inglés signal transducers and activation of transcription) responsables en el núcleo de activar la transcripción de genes específicos. En otros casos estos receptores activan la cascada de las MAP quinasas (por su sigla en inglés mitogen-activated proteín). 151 REGISTRO FOTOGRÁFICO 153 154 Una de las vaquitas clonadas en el programa de "tambo farmacéutico" es alimentada por su cuidador. En la página opuesta, una nota aparecida en La Prensa describe los esfuerzos para sintetizar la hormona en la Facultad de Farmacia y Bioquímica. 155 156 Los doctores José Santomé, Juan Dellacha y Alejandro Paladini, reunidos varios años después de los sucesos que cuenta este libro. En la página opuesta, foto superior. El equipo que trabajó en la producción biotecnológica de la hormona de crecimiento. De izquierda a derecha: Aída Prync, María Teresa Pellerano, Juan Zimmermann, Miguel Carcagno, César Carbonetto, Susana Dabsys, Miriam Denegri, Humberto De Pasquale, y Marcelo Criscuolo. En la página opuesta, foto inferior. Protagonistas del desarrollo de la hormona de crecimiento aplicando biotecnología: de izquierda a derecha, doctor Daniel Salamone, ingeniero Carlos Werning, doctor Claudio Santos y doctor Carlos Melo. 157 158