1 - Campus Virtual
Anuncio
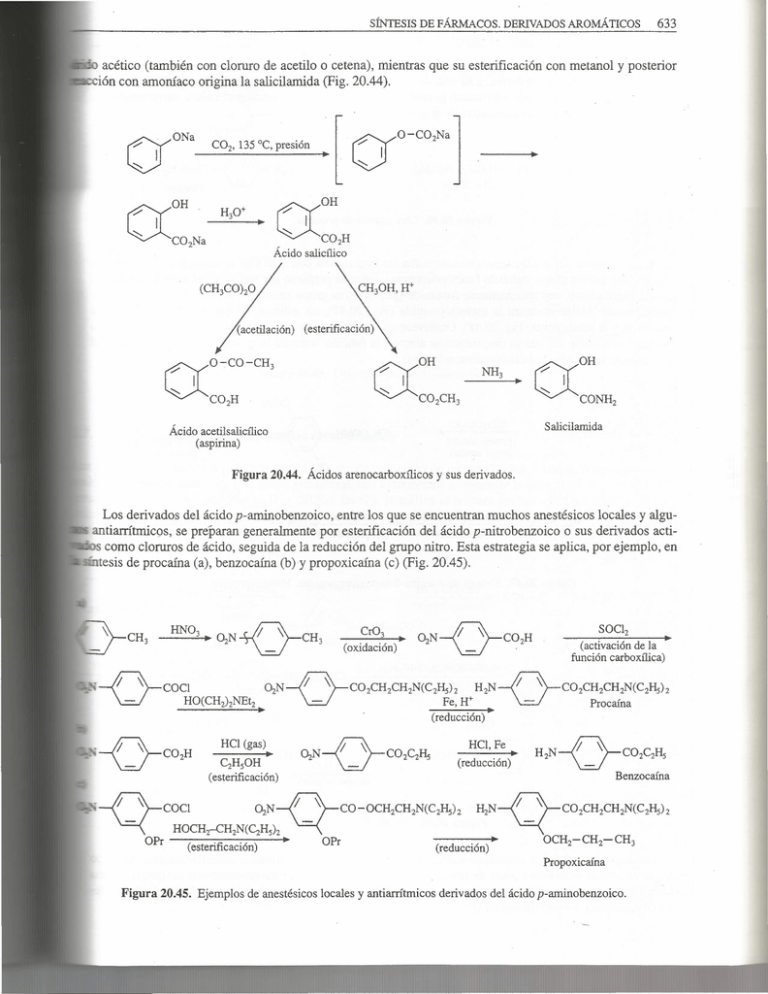
SíNTESIS DE FÁRMACOS. DERIVADOS AROMÁTICOS 633 ·n acético (también con cloruro de acetilo o cetena), mientras que su esterificación con metanol y posterior .ión con amoníaco origina la salicilamida (Fig. 20.44). V ~ONa C02, 135 ºC, presión 0 [ . ~O-C02Na] OH CXCO,H Ácido salicílico (acetilación) (esterificación) NH3 Salicilamida Ácido acetilsalicílico (aspirina) Figura 20.44. Ácidos arenocarboxílicos y sus derivados. llli Los derivados del ácido p-aminobenzoico, entre los que se encuentran muchos anestésicos locales y alguantiarrítmicos, se préparan generalmente por esterificación del ácido p-nitrobenzoico o sus derivados acticomo cloruros de ácido, seguida de la reducción del grupo nitro. Esta estrategia se aplica, por ejemplo, en ' tesis de procaína (a), benzocaína (b) y propoxicaína (e) (Fig. 20.45). OiN HCl (gas) CiHsOH (esterificación) -0- \ -o-o- (activación de la función carboxílica) (oxidación) C02CH2CH2N(C2I-J5)i H2N Fe, H+ (reducción) HCl, Fe (reducción) C02CH2CH2N(C2I-J5)i Procaína - H2N C02C2H5 Benzocaína Propoxicaína Figura 20.45. Ejemplos de anestésicos locales y antiarrítmicos derivados del ácido p-aminobenzoico. 632 INTRODUCCIÓN A LA QUÍMICA FARMACÉUTICA (0-alquilación) Feniltoloxamina Figura 20.41. Síntesis de feniltoloxamina. OH 1 CICH2-CH -CH20H D ., _esconexion OCH3 / ó· \_ (O - alBase ., ) qu il acion · - · o-\ .. _ O~CH2-CH-CH 20H 1 OH COC12 (cloroformilación) OCH3 - OCH2-CH-CH 20COC 1 OH OCH3 n (amonolisis) ~ OCH2 -~H OH CH 0CONHi 2 Metocarbamol Figura 20.42. Síntesis de metocarbamol. Como ejemplos de ácidos ariloxiacéticos, comentaremos la obtención de ácido 'etacrfnico (diuréti gura 20.43), que tiene la estructura de ácido ariloxiacético. Para su síntesis, se utiliza también como est:r--c.:::·g;!llllli. común la reacción de 0-alquilación de fenoles. Cl 1) ClCH2C02Et b-OH Base 2) KOH, H20 (alquilación e hidrólisis) Cl u- / Cl Cl '/ \ _ Desconexión Cl CH~?,NH(CH3?2 (reacción de Manmch) Cl CH3(CHz)2COCl O~ CH COOH Cl3Al ., 2. (acilación de Friedel. . Crafts) CzHs-CH-CO~\ 1 Cl C,H,CO -0--oCH,-oo- . Cl OCH-COOH 2 CH2N(CH3)i - Cl Cl CzHs-c-co-Ü-" . t!:. (o álcalis) -NH(CH3)2 (eliminación) OCH-2 11 CH2 )¡;;; - Ácido etacrínico Figura 20.43. Síntesis de ácidos ariloxiacéticos por 0-alquilación de fenoles. 2.6. Ácidos arenocarboxílicos y sus derivados La estructura del ácido benzoico y sus derivados se encuentra en muchos fármacos. Entre ellos, podernos ci::=:-¡¡¡: los derivados del ácido salicílico (o-hidroxibenzoico), interesantes como antiinflamatorios y analgésicos, y a..::111i de los ácidos p- y o-aminobenzoico (ácido antraru1ico). El ácido salicílico se prepara por carboxilación del fenóxido sódico. El ácido acetilsalicílico (aspirina) se obtiene a partir de dicho ácido por calentamiento con anti- Pemolina Figura 21.22. Síntesis de pemolina. FÁRMACOS CON ESTRUCTURA DE PIRAZOL, IMIDAZOL Y HETEROCICLOS RELACIONADOS 1. 1 Dentro de los heterociclos de tipo pirazólico, los fármacos más importantes pertenecen a las familias de as 5-pirazolonas y las 3,5-pirazolidinadionas. Suelen utilizarse como analgésicos, antipiréticos, y antiinflama·os o antirreumáticos. Aunque a partir de 1977 fueron prohibidos en EEUU, al comprobar efectos secundatales como agranulocitosis y anemia aplásica, entre otros, algunos siguen empleándose en Europa bajo es~ o control médico. En el grupo de las 3-pirazolin-5-onas, destaca el metamizol magnésico (Nolotil®),desarrollado por los latorios Hoechst a partir de la antipirina (1-fenil-2,3-dimetil-3-pirazolin-5-ona). Las 3-pirazolin-5-onas se an en una reacción general entre ~-cetoésteres e hidrazinas, conocida como reacción de Knorr. La elaborade la antipirina hasta metamizol (Fig. 21.23) se lleva a cabo a través de una serie de pasos consecutivos, permiten nitrosar la posición 4 del anillo heterocíclico y reducir a grupo amino. La monometilación de digrupo amino se produce a través de la base de Schiff con benzaldehído y, finalmente, la reacción de la amiJJ:asecundaria así formada con HCHO/NaHS03 permite introducir el grupo metanosulfonato sódico, con formadel metarnizol. # l ~CH3 =\ ·o + Ph-NH-NH2 O Et Antipirina CH3 el Ph-CH=nN 1) PhCHO CH3 . 2) MeiS04 O N" N--CH3 1 Ph CH30S03 e CH2S03Na CH3 CH3 1 1 1 H3C-N CH3 N-CH2-S03-Mg-S03-CH2-N H3C ol:}-CH,Mg'~c-~o 1 Ph ol:}-CH, 1 1 Ph Ph Metamizol sódico Figura 21.23. Síntesis de metamizol. CH3 Metamizol magnésico 664 INTRODUCCIÓNA LA QUÍMICA FARMACÉUTICA Otra gran familia de derivados pirimidínicos activos está formada por los ácidos barbitúricos, mu; mmüllli zados hace años como hipnóticos-sedantes o anticonvulsivos. Su síntesis está representada en el proceso ~l1lllUBlosintético de la Figura 21.39a. Se obtienen condensando ~-diésteres o productos relacionados (malonato de dietilo, malonodinitril nacetato de etilo) con derivados del ácido carbólico (urea, tiourea, guanidina, N-metilurea o cianoguani 11JJJllll)¡¡,., Los sustituyentes en C-5 se introducen normalmente sobre el malonato de dietilo mediante alquilaciones vas (Fig. 21.39b). A pesar de la sencillez del método, pueden presentarse complicaciones cuando el alquilo es secu::i::mnm11lllllln~ por la competencia entre las reacciones de sustitución nucleófila y de eliminación. En estos casos, la rru lución es utilizar la síntesis de Knoevenagel, como se refleja en la Figura 21.39c, que esquematiza lación de aprobarbital. La reacción de Knoevenagel entre malonato de dietilo y acetona, seguida de hidrogei;¡::;au:::; catalítica, conduce al isopropilmalonato de dietilo. El sustituyente alilo puede introducirse a continuacios , modo habitual. 1 11 a) R y R' Xy Y=C02Et, b) ºY"?º OEt /C02Et + CH2 OEt RX EtONa H2N + X X=O,S,NH CN R ºnº OEt NH-R" n R OEt R'X EtONa R' ºnº OEt OEt EtONa CICH2CH=CH:: 'C02Et EtONa Aprobarbital Figura 21.39. Síntesis de barbitúricos. Aprobarbital. La introducción de arilos también es un problema interesante, ya que no puede aplicarse ni la alq directa ni la reacción de Knoevenagel. Por ello, la estrategia consiste en partir de un éster malónico que contenga dicho sustituyente, puede verse en la síntesis de fenobarbital (Fig. 21.40). El fenilmalonato de dietilo se prepara a partir del lacetonitrilo. Su alquilación con bromuro de etilo y posterior condensación con urea conduce al com deseado. SÍNTESIS DE FÁRMACOS CON ESTRUCTURA HETEROCÍCLICA 1) EtONa NO CONDENSADA / 0- CN EtOH H+ CH .XCo -C0 Et BrEt EtONa 2 PhtO NH Et NH 665 · )=o o Fenobarbital Figura 21.40. Síntesis de fenobarbital. También se utiliza un método indirecto para la introducción, en el éster malónico, de sustituyentes insaturados, como sucede en la preparación del hexobarbital (Fig. 21.41), en la que la condensacióri de Knoevenagel ciclohexanona y cianoacetato de etilo conduce a un derivado que contiene un doble enlace endocíclico. Es teresante destacar que el empleo de cianoguanidina, en lugar de urea o guanidina, permite sintetizar el anillo oon uno de los átomos de nitrógeno bloqueado por el grupo ciano, lo que posibilita la metilación selectiva del otro átomo de nitrógeno. ºº EtONa + / HN=C NH2 -,NH-CN 1) MeiS04 2) H2S04 Hexobarbital Figura 21.41. Síntesis de hexobarbital. El minoxidilo es un antihipertensivo que, por su toxicidad, se derivó a una aplicación tópica en el tratamiento de la alopecia androgénica. Su precursor es el ácido barbitúrico no sustituido, cuyo tratamiento con POC13 da lugar a la 2,4,6-triloropirimidina (Fig. 21.42). El átomo de cloro en 2 es más reactivo que los situados en las posiciones 4 ó 6, y por ello es posible llevar a cabo sustituciones nucleófilas sucesivas de dichos átomos. . ~~~~~"'S~t>nn.1cos ' CONDENSADOS CON BENCENO 687 a) NH-CH I ü=C Base 3 + \ NHCH3 HCOOH Teofilina b) 1) H2NCOCH2C02Et, Base 21 HONO • base, MeI (exceso) Cafeína Figura 22.36. a) Síntesis de teofilina. b) Síntesis de cafeína. La verofilina, un broncodilatador utilizado en terapéutica, se prepara por condensación del ácido ciano·mco y la N-metil-N'-(2-metil)butilurea (preparada por adición de la correspondiente amina al isocianato de o, Fig. 22.37). La delación posterior, nitrosación, reducción y condensación con anhídrido acético permite er el producto deseado. H2N-CH2-CH-CH2-CH3 1 - ··-N=C=O CH3 Figura 22.37. Síntesis de verofilina. 688 INTRODUCCIÓN A LA QUÍMICA FARMACÉl!TICA 4.4. Benzotiazinas y fenotiazinas Un ejemplo de fármaco con síntesis se realiza a partir de del anillo de dihidroisotiazol duro de metilo y tratamiento estructura de benzotiazina es el piroxicam, un antiinflamatorio no esteroide la sacarina (Fig. 22.38), por reacción de ésta con cloroacetato de metilo, e::;illHIDlllill a dihidro-1,2-tiazina con metóxido sódico en dimetilsulfóxido, metilacié con 2-aminopiridina. o o 's/. o=; 'Ne Na@Cl-CH2-COOCH3 o Sacarina o o '' S~ // .. ,, CH 3 N -lCOOCH 3 o Piroxicam Figura 22.38. Síntesis de piroxicam. La clorpromazina pertenece al grupo de los neurolépticos derivados de la fenotiazina, que clási:::~ se sintetizan a partir de difenilaminas (3-clorodifenilamina, en este caso), por calefacción con azufre do iodo como catalizador (reacción de Bemthsen) (Fig, 22.39). La alquilación posterior del grupo "'::mlllDlllll'I isómero mayoritario en presencia de amiduro sódico, conduce a la clorpromazina. + C(:Cr° 1 1 H H Clorpromazina Figura 22.39. Síntesis de clorpromazina. Son muy numerosas las modificaciones que se han realizado de la cadena lateral, las cuales pro muchos casos cambios drásticos en la actividad biológica. Así, la etmozina es un antipalúdico que no ti, tructura de quinolina, sino de fenotiazina. Su síntesis, muy semejante a la que se ha comentado anteriOilmlllllillll:;,, se refleja en la Figura 22.40. SÍNTESIS DE SISTEMAS HETEROCÍCLICOS CONDENSADOS CON BENCENO 691 .2. Benzodiazepinas --~uchos de estos derivados se introdujeron en terapéutica como ansiolíticos, sedantes y anticonvulsivos. El diaam, por ejemplo, se prepara a partir de la p-cloroanilina. Ésta se condensa con cloruro de benzoilo, para dar to con el producto de N-benzoilación) un intermedio cíclico, que posteriormente se hidroliza para dar· nzoil-p-cloroanilina (este proceso es muy complejo en su mecanismo, pero es muy eficaz, Fig. 22.44). La eerona se convierte en oxima, y el grupo amino se metila primero con sulfato de metilo y luego se acila con clode cloroacetilo. La condensación con hidróxido sódico del producto así formado, seguida de la reducción 1>-1 N-óxido, origina el diazepam. 1 1) NH20H 2) (CH3)2 S04 NaOH 3) ClCH2COCl red. Figura 22.44. Síntesis de diazepam. Dos análogos, en los que el anillo de benceno se ha sustituido por pirazol, son la zometapina y el ripaze-;am. La primera se prepara utilizando un anillo de pirazol convenientemente sustituido, como se indica en la Fi:::~a 22.45, a través de una acilación Friedel-Crafts, seguida de tratamiento con etilenodiamina (lo que implica a reacción de condensación a imina y una sustitución nucleófila). Cl CH3 1 N t'( irCl µ frcoc1 Friedel-Crafts CH3 Zometapina Figura 22.45. Síntesis de zometapina. Cl SÍNTESIS DE FÁRMACOS. DERIVADOS AROMÁTICOS 621 Desconexión H2/C-Pd PhCH2COCH3 H2/C-Pd ., ! * ~ NHCH2CH2CHPh2 PhCH2CH 1 CH3 Prenilamina (racémica) i''•m1ra 1 20.17. Síntesis de fármacos con estructura de 3-arilpropilarnina por reducción de nitrilos (aminas primarias). Los análogos de la metadona (Fig. 20.18b) son arilpropilaminas que se obtienen, en general, por reacción carbanión bencílico estabilizado con una ~-haloalquilamina (muy reactiva a través de su estructura de cazeírídínío, como se ha visto para las mostazas nitrogenadas en el Capítulo 18) (Fig. 20.18). a) n=2 ===;> Ar -CH +<CHz)nNR1R2 1 [ Ar-~H] R R + [ X+ ] X R1 R2 NaNH2, IBuOK ., Ácido (+) -tartárico (Resolución) Levometadona (Racémico) Figura 20.18. a) Alquilación de carbaniones bencílicos estabilizados. b) Síntesis de fármacos con estructura de 3-arilpropilarnina. La alquilación de aniones bencílicos estabilizados también puede utilizarse para obtener 4-fenilbutilamie las que se encuentra el bloqueante de los canales de calcio verapamilo (Fig. 20.19). (Alquilación del carbanión del nitrilo) Verapamilo Figura 20.19. Síntesis de verapamilo. 1·'' •• i1 . .t:.l.1 111;.dihllll11llll 1111:11!111111íilliilllll!Umthllllllü 622 INTRODUCCIÓN A LA QUÍMICA FARMACéUTICA Siguiendo una reacción de Mannich (Fig. 20.20), se obtiene el agente hipnoanalgésico propo~~ tir de propiofenona. El radical bencilo se introduce por adición nucleófila diastereoselectiva al carbonilo cetónico , bromuro de bencilmagnesio y, finalmente, se esterifica el alcohol así formado. a) b) 1) CH20/Mei_NH, HCI 2) Ácido (-)-dibenzoiltartárico (R. de Mannich y resolución) Desconexión 1) BrMgBn 2) H3ü+ º I 3) (EtCO)zO PhYNMe2 H CH3 Figura 20.20. Síntesis de fármacos con estructura de 4-fenibutilamina a través de reacciones de M Los psicofármacos derivados de la 4,4-difenilbutilamina pueden utilizarse también como ~ tructuras que poseen un grupo amino separado de un anillo bencénico por cuatro eslabones carbo · La síntesis de haloperidol, indicada en la Figura 20.21, se basa en la alquilación de una pipoodiIDIDllllll tuida en la posición C-4, utilizando la y-clorobutirofenona correspondiente que, a su vez, se lación de Friedel-Crafts. (acilación de Friedel-Crafts) y-Cloro-p-fluorobutirofenona Desconexión ~OH~ HN\_/ O ~Cl (N-alquilación) /~OH~ \d-Cl F~N\_/ Haloperidol Figura 20.21. Otras estrategias de síntesis de fármacos con estructura de 4-fenilbutilamina. Hal La alquilación de una piperidina 4,4-disustituida es también la reacción utilizada en la sím léptico fluspirileno (Fig. 20.22). La novedad estriba en que, con anterioridad a la formación del~ nico, hay que proteger al nitrógeno piperidínico como N-bencilderivado y, antes de la alquilacid minar dicha desprotección por hidrogenolisis. SÍNTESIS DE FÁRMACOS. DERIVADOS AROMÁTICOS -o\ ll CH3 fH-CH2 CH3 - CH20,HCl,ZnC12 (clorometilación) titu cion ., (SUSKCN nucleófila) -0- ~H-S-co 2 H NaOH,H20 (hidrólisis) i-Bu -0- * CH -e =N 2) Me! CH3 CH3~ Desconexiones Ibuprofeno i-Bu (alquilación del carbanión) 1 _ CH2 -C =N (hidrólisis) . NaOH . 1) NaH o NaNH2 '-b -' -0-'-1 -0- z-Bu . 625 '/ \ CH2 -COOH - Ibufenaco F CO(OEt)2, EtONa (activación) ~CH,CO,Et (alquilación del carbanión) F 1) NaOH, H20 2) H30+ (hidrólisis y descarboxilación) o--0-S!i~cooH CH3~ F1urbiprofeno * * - COOCH3 CH ~-...;:'-/'"">_, 1 1 (alquilación del carbanión) H3CO' <;»: ~ ~ CH3 NaOH _ (hidrólisis) Desconexiones H3CO :::-... CH -5-COOH ~ CH..3~ . Desconexiones Naproxeno Figura 20.25. Síntesis de ácidos arilacéticos a-sustituidos por alquilación de carbaniones estabilizados. Si se parte de fenonas, a través de su reducción a alcoholes bencílicos y sustitución del hidroxilo por ha, se obtienen 2-arilpropionitrilos. Véase como ejemplo la síntesis de fenoprofeno, en la Figura 20.26. Q-co-CH, - º' O-o o (reducción) - o - 0-?<-CH, Desconexión \cN NaOH (hidrólisis) 0-o OH - b--i-CH, *1 C-CH3 H O-oh. COOH - Br ()-~H-CH3 Fenoprofeno Figura 20.26. Síntesis de ácidos arilacéticos a partir de fenonas. Fenoprofeno. 634 INTRODUCCIÓN A LA QUÍMICA FARMACÉUTICA El ácido p-nitrobenzoico deriva, a su vez, de la oxidación de 4-nitrotolueno, como puede verse en L:: tesis de procaína. También puede verificarse la esterificación con la sal del ácido y el haluro correspon&nnun=:, como semuestra en una síntesis alternativa de procaína (Fig. 20.46). (esterificación) Figura 20.46. Otra síntesis de procaína. Otros derivados del ácido p-aminobenzoico son las benzarnidas con actividad neuroléptica sustitur::::~· la posición orto por un grupo metoxilo («ortoprarnidas»). Éstas se preparan por reacción del éster o clo ácido 4-aminobenzoico, convenientemente sustituido (protegido su grupo amino por acetilación), con la e~ pondiente amina. Así se obtienen la metocloprarnida (Fig. 20.47), un antiemético que en dosis altas ::'e:m1 antipsicótico, y la bromoprida (Fig. 20.48). Obsérvese que la acetilación como método de protección dcl _g:: amino puede realizarse.sin que su desprotección afecte a la función benzarnida, gracias a la mayor reaccvu de la acetarnidasustituida (hidrólisis quirnioselectiva). OCH3 (CH3C0)20 (protección del grupo amino) SOC12 CH,CONH-ó-CO,H C1 Desconexi OCH3 H2N- CH2CH2N(C2Hsh Aminolisis Hp+ :HiN___¡¡-\___ CO~NH(CH:J -- F (desprotección) I Metoclopramida Cl Figura 20.47. Síntesis de 4-amino-2-metoxibenzamidas. Metoclopramida. Descone, ·• OCH3 -e)- H2N-CH2-CH2-N(CiHsh (aminólisis) CH,CO-NH OCH3 Br2, CH3C02H (sustitución aromática) CH3CONH-ó-\ Br CO~NH(C!I~,'- OCH3 CONH(CH:J2N(C2lfs)i - I . HCl,H20 (desprotección) F :HiN___¡¡-\__CONH(CH¡)~B r - Bromoprí Figura 20.48. Síntesis de bromoprida Los derivados del ácido antranílico llamados ácidos fenámicos son fármacos antiinflamatorios, 3 arilamino en orto se introduce a partir de ácido o-halobenzoico y la anilina convenientemente sustitun reacción catalizada por cobre denominada reacción de Ullmann. Así se preparan, por ejemplo, los ácin:-.~ námico, flufenámicoy meclofenámico (Fig. 20.49). SÍNTESIS DE FÁRMACOS. DERIVADOS AROMÁTICOS 635 Desconexión Q-co,H (reacción de Ullmann) X A = B = H; C = CF3; ácido flufenámico A = B = Cl; C = CH3; ácido meclofenámico X= Cl, I Desconexión (H3CC02)iCu (reacción de Ullmann) Ácido mefenámico Figura 20.49. Derivados del ácido antram1ico . .7. Anilinas, anilidas y compuestos relacionados arilaminas se obtienen prácticamente siempre por reducción de nitroderivados. Aunque podríamos incluir 'ples fármacos dentro de este grupo estructural, nos limitaremos a comentar la síntesis de la mostaza nitroda antineoplásica clorambucilo (Fig. 20.50). En ella, la anilina se prepara por nitración del ácido 4-fenilbu- , esterificación posterior y reducción catalítica. La N-alquilación con óxido de etileno, el intercambio de ~~ funcional OH por Cl y la hidrólisis del éster, completan la secuencia. (HO-CH,-CH~ --~ucción) (N-alquilación) (intercambio de grupo funcional) (hidrólisis) Clorambucilo Figura 20.50. Síntesis de clorambucilo. 638 . INTRODUCCIÓN A LA QUÍMICA FARMACÉUTICA CH3CONH-o-S02Cl (clorosulfonación) (aminolisis) Acetanilida Desconexión -0- CH3CONH ¡ NaOH (desprotección) S02~NHR Sulfonamida Figura 20.54. Sulfonamidas antibacterianas. Proceso general de síntesis. Desde el punto de vista sintético, el problema suele residir en la preparación de la amina, generan .•••..•.••••. heterocíclica, que se utiliza en la aminolisis. Así, en la síntesis de sulfazamet (Fig. 20.55), la amina se obw::ll!at!!: por reacción de fenilhidrazina y cianoacetona; en la de sulfatiazol (Fig. 20.56), por reacción de tiourea y el cetaldehído; en la de sulfadiazina (Fig. 20.57), por reacción de guanidina y ácido 3-o:X:opropanoicoo dietil de 3-metoxiacroleína; y en la de sulfametoxipiridazina (Fig. 20.58), por reacción de la hidrazina con eléster Jiimetílico del ácido maleico. /'-.,..rCH3 NC 11 o Ph-HN-NH2 Figura 20.55. Síntesis de sulfazamet. N) NH 11 H2N-C-SH +CICH2-CHO- ! HN-1(_ 2 \ s Sulfatiazol Figura 20.56. Síntesis de sulfatiazol. C02H .HiN-C-NH2 + 11 NH / CH2 \ CHO -t J N~ H2N OH Varios pasos Sulfadiazina Figura 20.57. Síntesis de sulfadiazina. 640 INTRODUCCIÓN A LA QUÍMICA FARMACÉUTICA (acilación de Friedel-Crafts) NH3, a presión (N-arilación) H2N-O-S02-0-NH2 Dapscina r -: NaOH H3C-CONH~So2Q-NHcocH3 _ r Cl3Al _ _(2 equivalentes )2H3C - CONH -O + S02Cl2 Figura 20.60. Síntesis de dapsona. 3. COMPUESTOS AROMÁTICOS POLICÍCLICOS CONDENSADOS 3.1. Derivados del benceno. Dibenzocicloheptenos Los antidepresivos tricíclicos se obtienen a partir de la dibenzosuberona (10,11-dihidro-5H-dibenzo[a,d) hepatatrien-S-ona), su derivado 10,11-deshidrogenadoo el producto de reducción del carbonilo cetónico e, po metileno. La dibenzosuberona se obtiene por condensación del anhídrido ftálico con ácido fenilacético tura reductora del éster de enol así originado a ácido 2-fenetilbenzoico y ciclación de éste con ~· polifosfórico (PPA,Fig. 20.61). o 'c-cH-0" I o= co, -º có PPA, 170 ºC (ciclación) -H20 2 HO - HI,P (reducción) -C02,-H20 (condensación) CO' ~ NBS (bromación bencílica) -c>:::afü ~ \ __ / CO ~ - (CzHs),N, . -HBr (deshidrohalogenación) cQo1 -"-:: -- \ - O Dibenzosuberona Figura 20.61. Síntesis de dibenzoheptatrienos. Antidepresivos tricíclicos. En la síntesis de la amitriptilina y la ciproheptadina, puede observarse que las dos cetonas indicadas nan, con los correspondientes reactivos de Grignard, alcoholes terciarios, cuya deshidratación con ácidos "' tes conduce al compuesto deseado (Fig. 20.62). SÍNTESIS DE FÁRMACOS. DERIVADOS AROMÁTICOS 641 HCl c;o O 1) CH3-N~ Hp+ \___/ 2) MgCl (reacción de Gngnard) . Ciproheptadina Figura 20.62. Síntesis de amitriptilina y ciproheptadina. el caso de la nortriptilina (Fig. 20.63), dado que no puede obtenerse el reactivo de Grignard por poseer alquílica un grupo NH libre, se recurre al uso de bromuro de ciclopropilmagnesio. El alcohol terciario :g:3ladoda lugar, por deshidratación y reacomodación homoalílica en presencia de ácido bromhídrico, al ropilidenderivado, que reacciona posteriormente con metilamina, para la obtención de nortriptilina, y tilamina, para la obtención de amitriptilina. (reacción de Grignard) HBr d)o CHCH2CH2Br d)o CH -CH2CH2NHCH3 Nortriptilina l(CH,),NH Amitriptilina Figura 20.63. Síntesis de arnitriptilina y nortriptilina. ....a noxiptilina (Fig. 20.64) se obtiene por 0-alquilación de la oxima de la dibenzosuberona, y la protripti~g. 20.65) por alquilación, en medio básico, del dibenzo[a,d]cicloheptatrieno. En este ejemplo, el agente . te tiene el grupo NH protegido como formilderivado, y posteriormente se libera por hidrólisis alcalina. ~~---SÍNTESIS DE FÁRMACOS CON ESTRUCTURAHETEROCÍCLICANO CONDENSADA 659 La clonidina es una 2-aminoimidazolina que posee una actividad agonista a2 y que se emplea como hipo. o. En su síntesis, se utiliza un método de valor general para la preparación de 2-<wllnoimidazolinas,mude las cuales son agonistas a1• Como puede observarse en la Figura 21.26, el anillo imidazólico se prepara - del sustituyente amino del derivado bencénico de partida. En primer lugar, se prepara la tioamidina, y iffiteriormente se condensa con etilenodiamina. Cl Q-NH, + 11.,NSCN Cl Cl ~ Cl SCH3 ~ Q-NH-iJ H2N-(CH2h-NH2 NH-iNH N -HSCH3, -NH3 Cl Cl Clonidina Figura 21.26. Síntesis de clonidina. Las irnidazolidina-2,4-dionas, conocidas como hidantoínas, tienen una fuerte actividad anticonvulsiva y • efecto hipnótico menor que los barbitúricos. Para estos fármacos, se han desarrollado muchos métodos de as, algunos de los cuales se comentan a continuación. En la etotoína (Fig. 21.27), el anillo heterocíclicose ¡pllll1epara por ciclación de a-aminofenilacetonitrilo con cianato potásico. El aminonitrilo se obtiene por un métogeneral, denominado síntesis de Strecker, que consiste en la condensación entre un aldehído o cetona y una a, seguida de la adición de HCN. CN / Ph-CHO NaCN/Ir KOCN Ph-CH \ NH2 1) HCI 2) Etl (Base) Etotoína Figura 21.27. Síntesis de etotoína. En la mefitoína (Fig. 21.28), se emplea la reacción de Bucherer, en la que un compuesto carbonílico se con KCN y (NIL)zC03 en etanol-agua (el proceso es bastante complejo). o Ph )=o Et KCN Ph~tO Et ~ H Figura 21.28. Síntesis de mefitoína. O 1Me N Ph Et~ N~O 1 H Mefitoína 686 INTRODUCCIÓN A LA QUÍMICA FARMACÉUTICA ,::CNlfN1, JV< C6~ N~ NH2 Triamtereno Figura 22.34. Síntesis de triamtereno. El dipiridamol es un importante fármaco, preparado originalmente como vasodilatador coro inhibidor de la enzima fosfodiesterasa y, por tanto, responsable de la elevación de los niveles de AM?·:... timula la formación de prostaciclina e inhibe la agregación plaquetaria. La síntesis que se refleja ra 22.35 se realiza a partir de una tetrahidroxipirimidopirimidina que, por tratamiento con oxiclo cloruro de fósforo, da un tetracloroderivado. La distinta reactividad de las posiciones halogenadas C-4 y C-8) permite una primera sustitución con piperidina y una segunda con dietanolarnina. Dípiridamol Figura 22.35. Síntesis de dipiridamol. Las xantinas, muchos de cuyos derivados han demostrado utilidad terapéutica, son derivadas rina, un sistema en el que se condensa una pirimidina con un irnidazol. La estrategia más utili-;,¡¡¡¡j¡¡¡¡¡¡ síntesis parte de las 4,5-diarninopirimidinas, que se condensan con ácido fórmico o sus deriva teofilina (Fig. 22.36a), el carbamoilacetato de etilo y la N ,N' -dimetilurea se condensan en medio ::i11 derivado de aminopirimidina que, por nitros ación y reducción posterior, da la diarninopirimi ·· diente. Ésta se condensa finalmente con ácido fórmico. Igualmente, a partir de la N-metilurea, feína (Fig. 22.36b).









