biomoléculas: proteínas
Anuncio

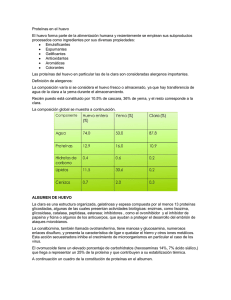
BIOMOLÉCULAS: PROTEÍNAS FICHA PARA EL DOCENTE Objetivos ● Introducir al alumno en los conceptos de aminoácidos y proteínas. ● Detallar los diferentes tipos de aminoácidos, sus funciones e importancia. ● Discutir nociones básicas acerca de los niveles de organización de las proteínas. ● Desarrollar el concepto de desnaturalización y su presencia en la vida cotidiana. ● Relacionar las experiencias prácticas con los principios teóricos. ACTIVIDAD 1: ¿Qué son las proteínas? Claves para el Desarrollo Teórico ● Las proteínas son biomoléculas ● Están compuestas principalmente por carbono, hidrógeno, oxígeno y nitrógeno. En ocasiones contienen trazas de azufre, fósforo y otros elementos. ● Son moléculas extraordinariamente complejas que podemos encontrar en plantas y animales y cumplen diversas funciones en los organismos como ser estructurales, metabólicas, de transporte, inmunológicas, enzimáticas, etc. Metodología 1. Preguntar a los alumnos si recuerdan lo que es una biomolécula y qué tipo de biomoléculas conocen. Establecer el concepto de proteína. 2. Pedirles ejemplos de diferentes proteínas que les sean familiares. ¿Qué funciones cumplen? ¿Dónde se encuentran? ¿Son todas iguales o parecidas? 3. Discutir qué hace diferente a cada proteína. ¿Es su forma? ¿Su composición? ¿Ambas cosas? 4. Preguntar a los alumnos cómo se forman las proteínas. Establecer el concepto de aminoácido. 1 BIOMOLÉCULAS: PROTEÍNAS 5. Distinguir aminoácidos esenciales y no esenciales. ¿Por qué es importante tener una dieta variada y equilibrada? ACTIVIDAD 2: ¿Qué estructuras presentan las proteínas? Claves para el Desarrollo Teórico • La complejidad del encadenamiento de los aminoácidos es extraordinaria y las proteínas presentan cuatro niveles estructurales de organización. • La estructura primaria, presente en todas las proteínas, consiste simplemente en la secuencia de aminoácidos unidos. • La estructura secundaria se organiza en función de las interacciones de los aminoácidos que están cercanos entre sí. Así, se observan dos disposiciones espaciales predominantes: cadenas enrolladas en forma de hélice (llamadas α hélice) o dobladas como una hoja de papel plegada (denominadas β hoja plegada). • Además, los aminoácidos alejados entre sí también pueden interactuar formando la estructura terciaria y dando lugar a proteínas estructurales en las que las cadenas de aminoácidos se acomodan paralelamente en forma de fibras o bien a proteínas globulares, en las que las cadenas están enredadas como glóbulos. • La estructura cuaternariabno está presente en todas las proteínas sino que tiene lugar cuando hay interacciones entre distintas cadenas de aminoácidos e, incluso, con otros grupos como en la hemoglobina con hierro. Metodología 1. Proponer a los alumnos que imaginen que cada uno de ellos es un aminoácido y se tomen de las manos formando una “estructura primaria”. ¿Cómo formarían una estructura secundaria? ¿Y una terciaria? ¿Qué necesitarían para una estructura cuaternaria? 2 BIOMOLÉCULAS: PROTEÍNAS ACTIVIDAD 3: ¿Qué es la desnaturalización? Claves para el Desarrollo Teórico • La compleja configuración de una proteína es muy delicada y puede modificarse por agentes químicos o por medios físicos. A este cambio se le llama "desnaturalización" y se puede lograr con calor, movimiento mecánico como el batido o cambiando la acidez del medio, entre otras opciones. • En este cambio estructural, las proteínas pierden su forma nativa. Metodología 1. Preguntarles a los alumnos qué creen que ocurre cuando se “corta” la leche. 2. Establecer el concepto de desnaturalización. 3. Pedirles a los alumnos ejemplos cotidianos de desnaturalización de proteínas en la cocina. Hacer una lista. ¿Son todas desnaturalizaciones que ocurren por el mismo agente físico o químico? ¿Qué diferencias pueden descubrir? ACTIVIDAD 4: Experimentos CURIOSIDAD OVAL Dificultad: 2/5 Tiempo: 30 minutos Materiales ● ● ● ● 3 Huevos crudos Agua Cacerola Hornalla/ Manta calefactora 3 BIOMOLÉCULAS: PROTEÍNAS Metodología 1. 2. 3. 4. 5. 6. Rotular los tres huevos con un marcador: 10, 15 y 20 minutos. Ponerlos en agua fría y prendé la manta calefactora. A partir del momento en que hierve el agua comenzar a tomar el tiempo. Retirar cada huevo en el minuto correspondiente. Dejarlos enfriar, pelarlos y cortarlos al medio. Observar el color de la yema. Claves para el Desarrollo Teórico • Cuando un huevo se cocina en agua caliente por 15 minutos o más la yema puede empezar a ponerse de color verde oscuro. • La yema contiene la mayor parte del hierro del huevo, aproximadamente 85 veces más que la clara. Y el contenido de azufre en la clara es ligeramente mayor que en la yema de huevo (0,214% vs 0,208%). Este azufre proviene esencialmente de dos aminoácidos: la cisteína y la metionina. • El azufre de la clara es más lábil, eso quiere decir que es menos estable y se libera fácilmente con el calentamiento prolongado en forma de sulfuro de hidrógeno. • El color se debe a la reacción del hierro con el sulfuro de hidrógeno para dar compuestos verde-grisáceos, en la superficie de la yema. Preguntas complementarias 1. ¿Cómo influye el tiempo de cocción en la coloración de la yema? 2. ¿Pierde calidad nutricional el huevo si ocurre la aparición de color verde? 3. ¿Qué agente está causando la desnaturalización de las proteínas durante la cocción del huevo? GELATINA IMPOSIBLE Dificultad: 3/5 Tiempo: 30 minutos en dos clases 4 BIOMOLÉCULAS: PROTEÍNAS Materiales: ● ● ● ● ● ● Agua caliente y fría Recipientes Gelatina Rodajas de kiwi o ananá natural Rodajas de ananá en lata Jugo de limón Metodología 1. Preparar gelatina comercial y dividirla en cuatro porciones. 2. Antes de llevar a la heladera, a una de ellas agregar las rodajas de kiwi o ananá natural 3. A otra porción agregar el ananá de lata 4. A la tercera agregarle dos cucharadas de jugo de limón 5. Llevar a la heladera por 6 horas. 6. Registrar la consistencia. Claves para el Desarrollo Teórico • Algunas frutas como el ananá, el kiwi y la papaya tienen enzimas proteolíticas. Esto hace que las cadenas de proteína presentes en la gelatina se empiecen a acortar y ya no puedan formar la red que sostiene el agua y da lugar al gel. • Para utilizar esas frutas, es necesario blanquearlas o aprovechar las que vienen enlatadas ya que al ser sometidas a un tratamiento térmico las enzimas están inactivas porque se han desnaturalizado. • Por otro lado, la gelatina cuaja bien en un rango de pH de 3,5 a 10. Cuando se usan frutas muy ácidas, la gelificación ocurre más lentamente y da geles menos firmes. Para compensar este problema se puede regular la acidez con un poco de bicarbonato de sodio. Preguntas complementarias 1. ¿Por qué en algunos casos la gelatina no gelificó? 5 BIOMOLÉCULAS: PROTEÍNAS 2. ¿Qué diferencia hay entre la fruta enlatada y la natural? 3. ¿Podría mejorarse la consistencia de la gelatina que contiene jugo de limón de alguna manera? ¿COCINAR SIN FUEGO? Dificultad: 1/5 Tiempo: 30-40 minutos Materiales ● Huevo ● Plato ● Alcohol de farmacia Metodología 1. Romper el huevo dentro del plato 2. Cubrir con el alcohol. Esperar e ir registrando los cambios observados. Claves para el Desarrollo Teórico • Las cadenas de proteínas que hay en la clara de huevo se encuentran enrolladas adoptando una forma esférica. • Al freír o cocer un huevo, el calor hace que las cadenas de proteína se desenrollen y se formen enlaces que unen unas cadenas con otras. Este cambio de estructura da a la clara de huevo la consistencia y color que se observa en un huevo cocinado. • Este proceso de desnaturalización se puede producir de muy diversas maneras, entre ellas, por medio de agentes químicos como alcohol, sal y un medio ácido. Preguntas complementarias 1. ¿Es importante que el huevo quede cubierto por completo? 2. ¿Qué ocurriría si en lugar de alcohol se utilizara vinagre? ¿Y si se empleara sal de cocina? 6 BIOMOLÉCULAS: PROTEÍNAS LECHE CORTADA Dificultad: 1/5 Tiempo: 15 minutos Materiales ● Leche ● Dos vasos ● Vinagre Metodología 1. Colocar un fondo de leche en cada vaso 2. Agregar el vinagre en uno de ellos 3. Mezclar, esperar unos minutos y registrar los cambios Claves para el Desarrollo Teórico • De forma similar a lo que ocurre en el experimento anterior, el ácido presente en el vinagre (ácido acético) o en el limón (ácido cítrico) es capaz de producir la desnaturalización de la caseína de la leche. • Esto da lugar a la separación del suero y el cuajo, el característico aspecto de la leche “cortada”. Preguntas complementarias 1. ¿Hubiera ocurrido lo mismo con jugo de limón? 2. ¿Por qué la leche abierta sin consumir al cabo de un tiempo se corta? 3. ¿Si pudiéramos analizarlo, qué encontraríamos en el cuajo? ¿Y en el suero? 7