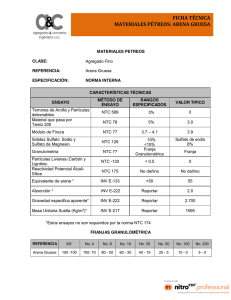
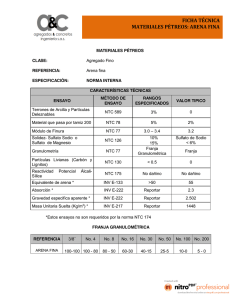
SínteSiS y caracterización de compoSitoS de quitoSana y/o
Anuncio

Síntesis y caracterización de compositos de quitosana y/o DLPLG reforzados con nanotubos de carbono para su aplicación en ingeniería tisular UNIVERSIDAD AUTÓNOMA DE CIUDAD JUÁREZ Ricardo Duarte Jáquez Rector David Ramírez Perea Secretario General Manuel Loera de la Rosa Secretario Académico Juan Ignacio Camargo Nassar Director del Instituto de Ciencias Sociales y Administración Luis Enrique Gutiérrez Casas Coordinador General de Investigación y Posgrado Ramón Chavira Chavira Director General de Difusión Cultural y Divulgación Científica Universidad Autónoma de Ciudad Juárez Síntesis y caracterización de compositos de quitosana y/o DLPLG reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Imelda Olivas Armendáriz Carlos Alberto Martínez Pérez Florinda Jiménez Vega Claudia Lucía Vargas Requena Santos Adriana Martell Estrada María Concepción Chavarría Gaytán Ingeniería y Tecnología Coordinación General de Investigación y Posgrado Lisbeily Domínguez Ruvalcaba Coordinadora de la colección Olivas Armendáriz, Imelda; Martínez Pérez, Carlos Alberto; Jiménez Vega, Florinda; Vargas Requena, Claudia Lucía; Martell Estrada, Santos Adriana; Chavarría Gaytán, María Concepción. Síntesis y caracterización de compositos de quitosana y/o DLPLG reforzados con nanotubos de carbono para su aplicación en ingeniería tisular / Imelda Olivas Armendáriz, Carlos Alberto Martínez Pérez, Florinda Jiménez Vega, Claudia Lucía Vargas Requena, Santos Adriana Martell Estrada, María Concepción Chavarría Gaytán. Ciudad Juárez, Chih. : Universidad Autónoma de Ciudad Juárez, 2013. (Colección Textos Universitarios, Serie Investigación) 64 p.; 30 cm. Incluye bibliografía Colección Reportes Técnicos de Investigación Isbn: 978-607-7953-80-7 Serie IIT, Vol. 8. isBn: 978-607-520-016-3 Contenido: 1.– Introducción. 2.– Planteamiento. 3.– Metodología. 4.– Resultados. 5.– Conclusiones. D. R. © Olivas Armendáriz, Imelda; Martínez Pérez, Carlos Alberto; Jiménez Vega, Florinda; Vargas Requena, Claudia Lucía; Martell Estrada, Santos Adriana; Chavarría Gaytán, María Concepción. La edición, diseño y producción editorial de este documento estuvo a cargo de la Dirección General de Difusión Cultural y Divulgación Científica, a través de la Subdirección de Publicaciones. Índice Resumen Abstract Palabras clave Usuarios potenciales Reconocimientos 9 11 11 11 11 I. Introducción II. Planteamiento Antecedentes Tejido óseo Osteoblastos Osteoclastos Osteocitos Matriz extracelular Factores de crecimiento Mecanismos de osificación y remodelado Injertos de hueso Biomateriales Quitosana Ácido poli-L-láctico Nanotubos de carbono Biomateriales compuestos 17 17 17 18 18 18 19 19 20 20 21 22 22 23 III. Metodología Materiales Síntesis de soportes poliméricos Análisis estructural Análisis térmico Análisis de propiedades mecánica Criterios de inclusión para cultivos celulares Obtención de las muestras Cultivo celular Recuento celular Siembra de osteoblastos en los compositos Biocompatibilidad Adhesión celular Proliferación celular Citotoxicidad Valoración de morfología y calcificación celular Producción de matriz y mineralización Análisis de expresión de marcadores moleculares Análisis estadístico 25 25 26 26 27 27 27 28 28 29 29 29 29 30 30 30 31 31 IV. Resultados Morfología de los compositos Análisis de las propiedades mecánicas Resultados de análisis génicos Caracterización morfológica de los osteoblastos aislados Curva patrón Adhesión celular Proliferación Cebadores estandarizados Expresión génica Adhesión celular Proliferación celular Discusión Referencias V. Conclusiones 33 38 41 41 45 46 47 50 50 52 53 54 Resumen S e fabricaron compositos de quitosana, ácido poli-L-láctico y nanotubos de carbón de pared múltiple por separación de fases inducida térmicamente para su uso en ingeniería tisular. Obteniendo como resultados que las propiedades mecánicas de la quitosana/PLLA son mejoradas con la adición de pequeñas cantidades de nanotubos de carbono y que la morfología entrecruzada presenta tamaños de poros adecuados para la adhesión y proliferación celular. El análisis de proliferación osteoblástica muestra una proliferación mayor a los 14 días de cultivo. 9 Abstract P orous composites scaffolds of chitosan/poly(D,L-lactide-co-glycolide) were fabricated for tissue engineering applications by thermally induced phase separation and lyophilization techniques. The cumulative results suggest that mechanical properties of the composites increase with small percentage of carbon nanotubes, morphology and pore size is adequate for cell adhesion and proliferation, and that osteoblast proliferation assay was significantly greater at day 14 of cell culture. Palabras clave Quitosana, PLLA y nanotubos de carbono. Usuarios potenciales Personas con pérdida de tejido óseo considerable, en el cual las técnicas tradicionales pueden llevar a cabo una regeneración de tejido deficiente. Reconocimientos Se agradece el apoyo financiero al Programa de mejoramiento del Profesorado (PROMEP) para la realización del proyecto. Se agradece a los estudiantes de maestría Manuel Alejandro Hernández y Aurora de la Paz, así como a los Institutos de Ingeniería y Tecnología y Ciencias Biomédicas. 11 I. Introducción E l daño estructural del hueso producido por traumatismo o enfermedades óseas es la principal causa de dolor crónico, discapacidad y pérdida de la función del tejido; este problema requiere de medicamentos, rehabilitación física y tratamiento quirúrgico que conlleva a un costo elevado en la salud. El hueso como soporte del cuerpo, se distingue por su rigidez y resistencia, cuando se ve afectado por traumatismos o enfermedades degenerativas, inicia los procesos de regeneración ósea para recuperar el tejido perdido; este mecanismo es útil cuando existe un daño parcial, pero cuando la pérdida del tejido es considerable la regeneración puede ser deficiente. En esta situación, se requiere de la aplicación de un injerto para completar la regeneración ósea, las opciones disponibles son el autoinjerto, tomar hueso del mismo paciente e injertarlo a la parte afectada, el aloinjerto, toma y procesamiento del hueso de un cadáver y trasplantarlo al paciente, o el xenoinjerto, fragmentos de hueso obtenidos de animales de diferente especie. Sin embargo el autoinjerto no es factible de realizar en sitios donde la perdida de hueso es considerable o no se cuenta con suficiente zona donadora de tejido óseo, mientras que en el aloinjerto la respuesta puede ser escasa debido a la ausencia de células generadoras de hueso o por riesgo de rechazo debido a la incompatibilidad entre el donante y el receptor; el xenoinjerto por ser una especie diferente tiene una probabilidad elevada de producir rechazo por incompatibilidad, para disminuir este riesgo se están realizando estudios para obtener animales genéticamente modificados, pero esta fase aún se encuentra en etapa de experimentación (Yélamos et al., 2000; Estrada et al., 2006). Como una alternativa a este problema surge la ingeniería tisular, una ciencia interdisciplinaria, que aplica principios de ingeniería y las ciencias de la vida para crear sustitutos biológicos que restauren o mantengan la función de un tejido que ha sido afectado (Estrada et al., 2006; Rincón et al., 2007). La ingeniería tisular está desarrollando implantes de materiales artificiales con actividad osteogénica, que pueden mejorar la calidad de vida de aquellas personas que han perdido masa ósea, y que no es posible recuperar el tejido mediante la aplicación de autoinjerto, aloinjerto o xenoinjerto. Los biomateriales pueden ser de polímeros, metales, cerámicas, de ori- 13 14 gen natural (microbiano, vegetal o animal), y compositos que son la combinación de dos o más de los anteriores (Yilgor et al., 2010). Actualmente las matrices porosas fabricadas por técnicas diversas, han permitido el procesamiento de materiales metálicos, cerámicos, poliméricos de origen natural como la quitosana, o sintéticos que incluyen a los polihidroxiácidos, como el ácido poli-L-láctico (PLLA), que se han utilizado en ingeniería tisular por sus ventajas de amplia disponibilidad, facilidad de procesamiento, degradación ajustable y baja respuesta inflamatoria (Estrada et al., 2006; He et al., 2009). La quitosana, es un biopolímero ampliamente distribuido en la naturaleza, se obtiene por desacetilación de la quitina, es producida por crustáceos, moluscos, insectos y hongos, su fuente habitual son los desechos de caparazones de crustáceos y conchas de moluscos (Kim et al., 2008). Una de las características importantes de la quitosana es la relación entre el grado de desacetilación y su biocompatibilidad, estudios realizados por Tomihata e Ikada (1997) han demostrado que a mayor grado de desacetilación mayor biocompatibilidad, las membranas de quitosana con un grado de desacetilación entre 65 y 80% favorecen la osteogénesis, además la quitosana tiene una superficie hidrofílica que promueve la adhesión, proliferación y diferenciación celular (Hidaka et al., 1999). Los nanotubos de carbono (NTC) tienen un futuro promisorio en el campo médico, actualmente se valora utilizarlos como una vía para encapsular medicamentos en su interior, y transportarlo por la circulación sanguínea hasta el sitio objetivo, también se busca utilizarlos como sensores inteligentes en instrumental quirúrgico; en estudios de imagen por resonancia magnética se usa como portador de carbono-13. En relación a nuestro objetivo de estudio los NTC se están probando como refuerzo mecánico en un soporte para la regeneración ósea y a la vez puedan inducir el crecimiento de cristales de hidroxiapatita (Rivas et al., 2007). Dado que las células son sensibles a su entorno, el comportamiento de los biomateriales depende en gran medida de su interacción con el ambiente biológico, por lo tanto entender los mecanismos por el cual las células detectan y responden a las señales de la superficie de estos compuestos, facilitará el desarrollo de nuevos biomateriales para el control del comportamiento de las células (Okada et al., 2010). En los últimos años los avances en la investigación, de ingeniería tisular, de estructuras poliméricas artificiales que conduzcan a la construcción y regeneración de células y tejidos ha tenido grandes avances, sin embargo esto continúa siendo un gran reto, ya que estas estructuras aun no presentan las propiedades mecánicas ideales para no colapsar durante el tratamiento ni durante las actividades normales del paciente. Atendiendo esta problemática en este proyecto se propone el desarrollo de un composito que contenga Nanotubos de carbono (NTC), siendo estos las nanopartículas más utilizadas en el refuerzo mecánico de matrices poliméricas. Aunque existen investigaciones previas con polímeros biodegradables, como la quitosana, Poli (DL, láctido) y el Poli(láctico-co-glicólico), hasta el momento no se ha encontrado el soporte adecuado ni estudiado a profundidad su interacción con NTC y células óseas. Ya Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular que los estudios publicados se basan en observaciones histológicas y citoquímicas sin embargo el contar con un patrón de expresión génica permitirá tener un alcance más completo de los procesos fisiológicos que se están regenerando en el tejido. Por ello, la combinación óptima de los polímeros y los NTC así como el estudio de la expresión génica a través de cultivos in vitro permitirá diseñar y fabricar un biomaterial con propiedades más adecuadas. La elaboración y el desarrollo de la metodología de estos biomateriales de soporte serán de suma importancia para establecer mecanismos adecuados para su producción y utilización Por lo anterior, el propósito de este estudio será caracterizar las propiedades morfológicas, mecánicas y con técnicas de cultivo celular, los compositos de quitosana/ PLLA reforzados con nanotubos de carbono probados en células osteoblásticas de Calvaria rata, evaluando la adhesión celular, proliferación celular, perfiles de expresión génica y cuantificación de calcio durante la consolidación ósea. I. Introducción 15 II. Planteamiento Antecedentes Tejido óseo E l tejido óseo es un tipo especializado de tejido conectivo, que se caracteriza por su rigidez y su resistencia, tanto a la tracción como a la compresión. Está formado por los osteoblastos y osteocitos, que son las células de sostén; por el osteoide, una matriz no mineral de colágeno y de glucosaminoglicanos, por sales minerales inorgánicas depositadas en la matriz y por los osteoclastos, las células de remodelación (Stevens y Lowe, 2006). Las células óseas se encuentran dentro del propio tejido óseo, o en el estroma conjuntivo de la médula ósea, esta última, es el reservorio de las células mesenquimales pluripotenciales indiferenciadas (las células osteoprogenitoras), que dan origen a los linajes condrogénico y osteogénico, en respuesta a señales moleculares, que van a activar diferentes genes específicos. El linaje condrogénico da origen en el cartílago a los condrocitos y el osteogénico a los osteoblastos y osteoclastos en el hueso (Fernández-Tresguerres et al., 2006). Osteoblastos Producen la mayor parte de las proteínas presentes en el hueso de la matriz extracelular (MEC) su función más importante es formar huesos mineralizados, definiéndose entonces como la célula formadora de hueso. Sintetizan la matriz orgánica o sustancia osteoide 2 a 3 µm por día, sintetizan proteínas colágenas y no colágenas de la matriz orgánica del hueso y contribuyen a la mineralización de la sustancia osteoide en conjunto con la fosfatasa alcalina. Pueden expresar los marcadores como sialoproteína ósea, osteopontina, osteonectina y fosfatasa alcalina (Yamaguchi et al., 2000; Fernández-Tresguerres et al., 2006). 17 18 Osteoclastos Se encargan de reabsorber o eliminar la materia ósea, contienen fosfatasa ácidatartrato resistente, que permite la desfosforilación de las proteínas, cuya actividad es aprovechada para su identificación. Los osteoclastos se encuentran adheridos a la superficie ósea en zonas de resorción ósea activa o en depresiones que ellos mismos excavan en el hueso llamadas lagunas de Howship. Tienen un borde en cepillo en donde se lleva a cabo la reabsorción y una zona clara, rica en microfilamentos, con integrinas que sirven de anclaje a la matriz. (Fernández-Tresguerres et al., 2006; Stevens y Lowe, 2006) Osteocitos Constituyen el estadio final, son las células osteoblásticas maduras, cuando la matriz es mineralizada algunos osteoblastos quedan atrapados adentro, convirtiéndose en osteocitos, las células más abundantes en el hueso, incapaces de renovarse. Participan en la síntesis y mineralización de la matriz osteoide, pero su función principal es controlar el remodelado óseo (Stevens y Lowe, 2006). Matriz extracelular La matriz ósea o sustancia osteoide constituye una tercera parte del peso del hueso, se sintetiza por los osteoblastos. Esta formada de un componente orgánico, el colágeno, del cual el tipo I representa >95% y el tipo V <5%, que le dan forma y capacidad al hueso para resistir las tensiones, y un componente inorgánico o mineral que le da su rigidez característica y resistencia a la compresión (Fernández-Tresguerres et al., 2006; Stevens y Lowe, 2006). El 90% de la MEC está constituida por colágeno y el 10% de glicoproteínas no colágenas como la osteocalcina, que influye en la organización de la matriz y la mineralización del hueso, la osteonectina implicada en la adhesión celular y la sialoproteína del hueso. La MEC también tiene los factores de crecimiento, Interlecucinas 1 y 6 y las proteínas morfogenéticas óseas (Yamaguchi et al., 2000). La dureza y rigidez del hueso se debe a la presencia de un complejo cristalino de calcio y de hidróxidos de fosfato (hidroxiapatita). Para que se produzca la mineralización deben existir concentraciones de Ca+ y PO4- por arriba de su umbral, la osteocalcina fija iones de Ca+ extracelulares aumentando su concentración y la enzima fosfatasa alcalina aumenta las concentraciones locales de iones de Ca+ e iones de PO4-, los osteoblastos producen vesículas de matriz que pueden acumular estos iones. Las vesículas de matriz durante la formación del osteoide se separan del osteoblasto por gemación y pasan a la matriz donde forman el sitio de precipitación de la hidroxiapatita (Stevens y Lowe, 2006). Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular 19 Factores de crecimiento Los factores de crecimiento regulan la migración y proliferación celular, teniendo un rol importante en la regeneración ósea. Los factores de crecimiento más relacionados con la osteogénesis y la formación de hueso, motivo de investigación en este trabajo, son las proteínas morfogenéticas óseas (bone morphogenetic protein BMP), factores de crecimiento similar a la insulina (insulin-like growth factor IGF), IGF 1 y el factor transformador del crecimiento de tipo β TGF-β (Transforming Growth Factor β) sintetizado por las plaquetas y macrófagos el cual estimula la producción de colágeno y fibronectina (Yamaguchi et al., 2000; Fernández-Tresguerres et al., 2006; Estrada et al., 2006). Las BMP son las reguladoras más potentes de la diferenciación de los osteoblastos, los primeros 4 clones obtenidos de cADN de BMP humano fueron BMP-1, BMP-2A (BMP-2), BMP-2B (BMP-4) y BMP-3. En la actualidad al menos 15 subtipos de BMP se han clonado a excepción de BMP-1 que corresponde a la subfamilia de TGF-β (Yamaguchi et al., 2000). Mecanismos de osificación y remodelado Son los mecanismos por los cuales el tejido conjuntivo se transforma en hueso, incluye la proliferación de elementos vasculares para nutrir al tejido conectivo, la diferenciación de los osteoblastos a partir de los fibroblastos de tejido y la formación de los elementos intercelulares para permitir el depósito de sales de calcio. En el embrión la formación de hueso puede ser por dos mecanismos, osificación intramembranosa y osificación endocondral. La primera es la condensación celular a partir de láminas mesenquimales primitivas, que actúan como membranas formadoras de hueso, diferenciándose en osteoclastos, la segunda sucede a partir de un molde de cartílago, las células mesenquimales se diferencian en condroblastos que a su vez producen la matriz cartilaginosa (Stevens y Lowe, 2006) El proceso de renovación del hueso se conoce como remodelado, este permite mantener un equilibrio entre las fuerzas mecánicas del hueso, previniendo la aparición de lesiones por fatiga y asegura el abastecimiento de hueso nuevo. Se produce por la reabsorción de una cantidad determinada de tejido óseo llevada a cabo por los osteoclastos quienes excavan un túnel en el tejido, para renovar su composición, los osteoblastos forman la matriz osteoide para su posterior mineralización y reconstrucción de un hueso nuevo (Garzón et al., 2004). El remodelado permite en condiciones normales la renovación de un 5 a 15 % del tejido óseo total al año, para fin de garantizar su integridad (Fernández-Tresguerres et al., 2006). Injertos de hueso Generalmente la dinámica del remodelado óseo es suficiente para reparar una fractura y reconstruir defectos comunes o mínimos, sin embargo en casos de desII. Planteamiento 20 trucción masiva del hueso, como las encontradas en tumores, traumatismos graves, infecciones o defectos congénitos, el tejido dañado no es capaz de regenerase por si mismo. En estos casos se requiere un injerto o un sustituto de hueso para subsanar la deficiencia del tejido óseo. Hoy en día el material más utilizado, es el tejido del propio paciente, por sus propiedades osteoconductivas, que proveen una matriz para que las células puedan proliferar, osteoinductivas, debido a que inducen la proliferación de células indiferenciadas a osteoblastos, y osteogénicas, porque son un deposito de células con capacidad de formar hueso nuevo (Estrada et al., 2006). Este tipo de tratamiento tiene una tasa elevada de éxito, pero su gran limitante, es la escasa cantidad de tejido donador que puede ser tomado, y las dificultades técnicas que pudieran presentarse durante su extracción, así como el riesgo de infección, y fracturas. El uso de donantes para la obtención de tejidos, como el aloinjerto, que implica procesar el hueso de un cadáver, o el xenoinjerto, en donde se utiliza un fragmento de hueso, obtenido de animales de diferente especie, se restringe por la escasez de fuentes donadoras, la transmisión de enfermedades, los problemas de rechazo por histocompatibilidad, y en el caso del xenoinjerto, por la carencia de células generadoras de hueso y por los problemas en función de la filogenia (Yélamos et al., 2000; Rivera et al., 2004; Rincón et al., 2007). Biomateriales Tratar la pérdida excesiva de hueso, ha sido uno de los mayores retos de los investigadores, cuando no es factible utilizar injertos para recuperar el hueso dañado, la ingeniería tisular viene a plantear la posibilidad de utilizar células y materiales diversos, desarrollando biomateriales como sustitutos biológicos y como alternativa para regenerar, mantener o mejorar la función del tejido perdido (Estrada et al., 2006; Rincón et al., 2007). Por otra parte, el sustituto óseo ideal debe ser estéril, no tóxico, osteoconductivo, biocompatible, bioabsorbible, disponible en cantidades suficientes, capaz de inducir la diferenciación de las células osteoblásticas y al mismo tiempo que proporcione un andamio conductivo, gradualmente reabsorbible para la formación de hueso nuevo (Rivera et al., 2004; Rincón et al., 2007; Jones et al., 2009; Vachirajov et al., 2009). La ingeniería tisular se ha venido desarrollando en las últimas dos décadas, realizando cultivos de osteoblastos en un material degradable, antes de implantarlo al paciente, con la finalidad de obtener matrices que proporcionen estabilidad al hueso, favorezcan la adhesión, proliferación y diferenciación celular (Jones et al., 2009; Vachirajov et al., 2009). La demanda de materiales sintéticos se ha incrementado, debido a su capacidad de regeneración de tejidos; con el fin de crear nuevos sistemas de materiales con propiedades superiores, diversas nanopartículas se han utilizado como cargas de refuerzo en matrices elastoméricas (Bokobza, 2007). Entre los materiales sintéticos Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular más utilizados están los de las prótesis de dióxido de titanio y sus aleaciones, que son empleados en prótesis dentales; empero en el organismo humano, se requieren de materiales que sean flexibles y resistentes a la fatiga (Gutiérrez, 2009; Parada et al., 2009). Esta necesidad ha llevado a la búsqueda de nuevas alternativas, las vías de investigación en biomateriales se han encaminado a tres grupos; cerámicas e hidroxiapatita, quitosana, y las matrices de nanotubos de carbono, estos biomateriales se han estudiado tanto in vitro como en experimentación animal. Quitosana La quitosana es un polisacárido obtenido de la desacetilación de la quitina natural, su estructura es análoga al glucosaminoglicano del hueso, y, por tanto, podría ser utilizado como material de sustitución ósea. Ha llamado la atención por sus características biológicas favorables; ya que posee una alta densidad de carga, que le permite adherirse a superficies cargadas negativamente, es un biopolímero que puede biodegradarse en el cuerpo humano, es biocompatible, bioabsorbible, no tóxico, no antigénico, y tiene propiedades antibacterianas en heridas (Li et al., 2005; Kim et al., 2008). La superficie del polímero quitosana es hidrófila y por lo tanto promueve la adhesión celular, proliferación y diferenciación, forman capas de fosfato de calcio en la superficie, con una mínima reacción de cuerpo extraño al implantarse (Manjubala et al., 2007; Jayakumar et al., 2009;), además ayuda al crecimiento de osteoblastos y osteoclastos, con cambios mínimos de degradación del material en etapas tempranas (Jones et al., 2009).Los andamios híbridos de quitosana con un grado de desacetilación bajo promueven la osteoconductividad (Vachirajov et al., 2009). Sin embargo, a pesar de su aceptación como un material biocompatible, los biomateriales de quitosana son mecánicamente débiles e inestables y son incapaces de mantener una forma predefinida para el trasplante, como resultado de la hinchazón (Li et al., 2005). La quitosana se ha estudiado como composito con NTC, en donde se ha visto que el rendimiento y las propiedades de los nanocompuestos son afectados por la compatibilidad interfacial entre el polímero y el nano relleno, es por ello que se necesita modificar su preparación para mejorar la compatibilidad del composito (Liu et al., 2009). Ácido poli-L-láctico El ácido poli-L-láctico (PLLA) es un polímero sintético, semicristalino que se sintetiza mediante la polimerización producida por la apertura del anillo diéster cíclico del ácido láctico. Este polímero biodegradable y el ácido poliglicólico, se han utilizado como materiales para implantes óseos (Estrada et al., 2006; He et al., 2009). El PLLA se utiliza ampliamente en material de suturas, e implantes bioabsorbibles por su capacidad de permitir el crecimiento controlado del tejido biológico durante su biodegradación controlada, esto abre la posibilidad de utilizarlo en múltiples aplicaciones médicas una de ellas es mejorar la adaptación de los implantes metálicos para II. Planteamiento 21 22 reducir el tiempo de osteointegración y por su capacidad de bioabsorción evitar una segunda cirugía para extraer el implante (Parada et al., 2009). Diversos polímeros naturales y sintéticos están disponibles para aplicarse en ingeniería tisular, pero pueden carecer de integridad mecánica. En los últimos años, se ha destacado la importancia de los nanotubos de carbono para apoyar el crecimiento del hueso (Sahithi et al., 2010). Nanotubos de carbono Por su parte los nanotubos de carbono (NTC) están entre los materiales más fuertes, y más duros, son materiales con propiedades mecánicas, eléctricas (Gopalan et al., 2006; Sahithi et al., 2010), ópticas, térmicas y químicas (Feng et al., 2009). La combinación de estas propiedades ha despertado el interés para usarlos como material de relleno para compuestos de polímeros para mejorar las propiedades de los materiales (Bokobza, 2007). La producción, caracterización y aplicación de NTC ha sido motivo de diversas investigaciones en la última década (Loos et al., 2007; Feng et al., 2009) desde su descubrimiento por Iijima Sumio (Iijima, 1991). Los biomateriales que contienen polímeros naturales o sintéticos frecuentemente son colocados adyacentes al hueso, actualmente se analiza el uso de NTC en estos biomateriales aplicados al hueso, principalmente para mejorar sus propiedades mecánicas y se espera que actúen como andamios para promover y guiar la regeneración del tejido óseo. Los NTC pueden apoyar el crecimiento de las células osteoblásticas, dado que no son biodegradables, se comportan como una matriz inerte en el que las células pueden proliferar y depositar nuevo tejido celular, que se convierte en hueso funcional (Sahithi et al., 2010). Los NTC están constituidos por átomos de carbono dispuestos en una red hexagonal cilíndrica, sus extremos pueden estar abiertos o pueden estar cerrados por media esfera de fulereno, están unidos por fuerzas de Van der Waals, o mezclándose con otros materiales para formar nanocompuestos. Debido a que el tejido óseo está compuesto de fibras de colágeno e hidroxiapatita, los NTC inducen el crecimiento de los cristales de hidroxiapatita y posiblemente atraen los iones de calcio para promover el proceso de cristalización, dando una mayor resistencia, flexibilidad y biocompatibilidad (Rivas et al., 2007), por lo tanto tienen un gran potencial para ser utilizados en ingeniería tisular para la regeneración ósea. La combinación de NTC y biopolímeros para producir materiales compuestos con propiedades superiores ha sido de gran interés. Hasta la fecha, los desafíos son lograr la dispersión homogénea de los NTC en una matriz polimérica y una excelente adhesión de interface entre dos componentes. Las estrategias incluyen el uso de nanotubos de carbono de pared múltiple (MWNT) como relleno conductor en el aislamiento de matrices poliméricas y como refuerzos en materiales estructurales (Feng et al., 2009). Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular 23 Biomateriales compuestos En los compositos de polímeros, la dispersión de relleno, y las interacciones interfaciales son los parámetros cruciales para mejorar las propiedades mecánicas, la escasa dispersión y unión interfacial limitan la plena utilización de NTC para reforzar los polímeros, haciendo necesario optimizar las condiciones de transformación para lograr una buena dispersión y buenas interacciones con las cadenas del polímero, esto podría hacerse mediante la introducción de un agente de acoplamiento capaz de reaccionar con las dos fases (Bokobza, 2007). El uso de biopolímeros, reforzados con nanotubos de carbono, ha sido un desafío, debido a las dificultades para lograr una buena dispersión y transferencia de carga. Para mejorar esta dispersión se han intentado varias técnicas, entre ellas el uso de surfactantes, sonicación (Xie et al., 2004; Ramanathan et al., 2005), coagulación, oxidación o funcionalización química de la superficie del tubo (Bokobza, 2007). Uno de los mayores retos es obtener una dispersión homogénea de los nanotubos de carbono en una matriz polimérica, porque las interacciones de Van der Waals entre los tubos individuales a menudo conducen a una significativa gregación o aglomeración. Hasta la fecha, a pesar de que se ha avanzado en las técnicas de procesamiento, la mejora mecánica provocada por la incorporación de nanotubos sigue siendo menor, con respecto a los potenciales en sí de las propiedades de los nanotubos (Bokobza, 2007). Es de particular interés en la medicina regenerativa, y en la ingeniería tisular, el desarrollar un material poroso útil como andamio, que imite las propiedades naturales de la matriz extracelular, en términos de estructura, composición química y mecánica, además que favorezca el crecimiento sostenido de las células osteoblásticas (Abarrategi et al., 2008; Sahithi et al., 2010), y que puedan mejorar la absorción de proteínas y subsecuentemente la adhesión celular. Además, los condrocitos tienden a la desdiferenciación, presentando cambios fenotípicos durante su crecimiento in vitro, por lo tanto, el mantenimiento de un fenotipo condrocítico es realmente difícil (He et al., 2009). Las matrices de nano polímeros desempeñan un papel fundamental en proveer apoyo y anclaje para las células, manteniendo el fenotipo de condrocitos, fomentando su crecimiento así como la síntesis de la matriz. El éxito de la ingeniería tisular depende de la formación de éstas matrices que permitan el soporte necesario a las células para que proliferen y mantengan sus funciones y señales biológicas requeridas para conservar y expresar los genes específicos en el tejido óseo (Rincón et al., 2007; He et al., 2009). Por ello, este estudio se enfoca en la caracterización mecánica , morfológica y de compatibilidad de los compositos de quitosana/ácido poli-L-láctico reforzados con nanotubos de carbono, mediante el análisis de expresión génica de los factores de crecimiento y valoración de la correcta integración del biomaterial, de tal manera que permita regenerar y mantener el tejido óseo. II. Planteamiento 24 Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular III. Metodología L Materiales a técnica para trabajar en el laboratorio será en condiciones completamente estériles, utilizando alcohol al 70% como desinfectante de las superficies de contacto, además de usar bata, guantes y cubre bocas. El instrumental (pinzas, bisturí, pipetas, puntas de pipetas) medios de cultivo y recipientes (placas de petri, multiplacas, tubos) serán esterilizados por autoclave (Harvey). Se trabajará bajo campana de flujo laminar horizontal (Fisher Hamilton Type II A1, modelo 541924), para asegurar condiciones de asepsia, manteniendo un ambiente estéril, libre de partículas y posibles contaminantes (bacterias o levaduras) que pudieran introducirse a las células cultivadas. El medio para cultivar los osteoblastos será α-MEM (Alpha Minimum Essential Medium) que contiene ribonucleótidos, desoxirribonucleótidos y L-Glutamina, al cual se le adicionará suero fetal bovino (FBS) al 10%, gentamicina-penicilina al 3% como antibiótico, β-glycerolfosfato 3mM y 10 µg/mL de ácido ascórbico. Síntesis de soportes poliméricos Los MWCNTs fueron obtenidos por pirolisis de una mezcla de ferroceno/benceno dentro de un tubo de cuarzo en el centro de estudios de materiales avanzados, CIMAV (Chihuahua, México) por Aguilera y col. (2006). Ahora bien, material compuesto al que se le añadió un porcentaje de MWNTs fue fabricado a partir de una matriz de chitosan/PLLA, La matriz es obtenida por la técnica de separación de fases térmicamente inducida (por sus siglas en ingles TIPS) Dicha matriz se ha obtenido por cuatro etapas. El primer paso, se prepararon los reactivos de chitosan y PLLA disolviéndolos, ácido acético al 2% y cloroformo respectivamente, posteriormente se adiciono los MWNTs a la solución de chitosan, ahora se procede a la integración de dichas soluciones, el PLLA se agrega en cantidades de 0.5 ml cada 3 min. hasta integrar bien ambas fases. En segundo paso, se somete a congelación 25 26 por 2hrs (-78 oC) y liofilización (-80 oC) por 48hrs. El tercer paso, se procede a la neutralización del soporte agregando una mezcla de solución acuosa de NaOH - CH3CH2OH (80% etanol con 0.5 % en peso de NaOH) a -20oC por 12 horas. El cuarto pasó, se procede hacer lavados en agua destilada y posteriormente deshidratado por liofilización. Análisis estructural La morfología fue analizada en un microscopio de escaneo de electrones por emisión de campo (FESEM) JEOL JSM-7000F; las muestras fueron secadas previamente por 3 días a temperatura ambiente en una estufa de vacío (-677 mbar). El tamaño de poro y la distribución de poro fueron medidas usando Scandium Universal SEM Imaging Platform software (Soft Imaging System) desde las imágenes FESEM en magnificación original. Se utilizaron tres diferentes secciones transversales de los soportes para estimar el tamaño de poro y al menos se midieron 120 poros para estimar la distribución. Los compositos secos fueron congelados en nitrógeno líquido y cortados en pequeñas piezas (5 mm x 5 mm x 10 mm) con una navaja para obtener la sección transversal para su análisis en FESEM. El voltaje eléctrico fue controlado a 1.0 kV. Análisis térmico El análisis termogravimétrico (TGA) de los compositos de quitosana/PLLA y quitosana/PLLA/NTC fue desarrollado en un instrumento SDT Q600 de TA Instruments (Estados Unidos). Las muestras secas fueron calentadas desde temperatura ambiente hasta 750o C a 5oC/min en una atmósfera de nitrógeno a una velocidad de flujo de 160mL/min. La primer derivada del cambio de masa con respecto al tiempo (DTG) fue calculada y graficada como una función de la temperatura. Las mediciones por escaneo calorimétrico diferencial fueron llevadas a cabo en un instrumento Netzsch DSC 200 PC (Alemania). Con la finalidad de borrar el historial térmico de todas las muestras primeramente fueron calentadas desde temperatura ambiente hasta 260º C a 20oC/min. Posteriormente, fueron enfriadas desde 260oC hasta -20oC a la misma temperatura a una velocidad de 20o C/min. Finalmente, fueron calentadas desde -20o C hasta 260o C a 10o C/min en una atmósfera de nitrógeno. El instrumento de análisis reométrico RSA III (Rheometrics Analyzes System) TA fue utilizado para hacer un barrido de temperatura a una frecuencia de 6.2832 rad/s y en un rango de temperatura de 35.0o C hasta 300o C, para todas las muestras. Discos de aproximadamente 5 mm de espesor y 15 mm de diámetro fueron utilizados en todos los experimentos. Las muestras fueron montadas en una prensa de compresión. Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Análisis de propiedades mecánica La resistencia a la comprensión mecánica y el modulo de los soportes serán obtenidos mediante pruebas de esfuerzo-deformación realizadas a 40ºC a una velocidad de comprensión de 0.001mm/s. hasta alcanzar un 30% de su altura original. Las probetas tendrán una medida estándar de 13mm de diámetro por 12 mm de altura. El equipo es un instrumento RSA III (Rheometrics System Analyzes) TA. En un rango de frecuencia de 1X10-6 a 80 Hz. P. Criterios de inclusión para cultivos celulares Se utilizarán para la extracción de tejido óseo, crías de rata de cepa Sprague Dawley en estadio neonatal de 14 días de nacidas, debido a que tienen una capacidad proliferativa elevada, las ratas provendrán de hembras en edad reproductiva, del bioterio de la UACJ. Utilizaremos la calvaria para extraer los osteoblastos, y realizar los cultivos primarios, específicamente del hueso frontal y ambos huesos parietales, que se encuentran cubriendo la porción superior y lateral de la calvaria. Obtención de las muestras Las ratas serán sacrificadas por decapitación siguiendo las especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio de la Norma Oficial Mexicana. NOM-062-ZOO-1999 (SAGARPA 2001), solicitando además la autorización del comité de bioética para el uso de animales de investigación de la UACJ. Las crías de rata serán anestesiadas colocándolas en un frasco conteniendo algodón impregnado con cloroformo, posterior al efecto anestésico serán decapitadas y con una hoja de bisturí se realizará una incisión media sobre la piel de la cabeza desde el hueso frontal hasta la base del cráneo, retirando la piel, posteriormente se realizará una incisión con unas tijeras, circundando el hueso frontal y los parietales para extraer la calvaria, una vez extraída será depositada en una caja de petri con abundante solución PBS 1X y con la ayuda de pinzas de disección se limpiará la calvaria retirando el periostio sin salir de la solución PBS 1X ni de la campana de flujo laminar, una vez limpia la calvaria se le harán múltiples cortes longitudinales y horizontales para disminuir su tamaño. Cultivo celular Para el aislamiento y cultivo de osteoblastos de calvaria de rata, se utilizará la metodología desarrollada en el Instituto de Ciencias Biomédicas de la UACJ (Gutiérrez, 2009). A los fragmentos obtenidos de la calvaria se le realizarán lavados con solución III. Metodología 27 28 PBS 1X, tantas veces como sea necesario, para eliminar células sanguíneas, tejido conectivo y otras células diferentes a las del tejido óseo. Posteriormente se hará la digestión con enzimas utilizando una solución previamente esterilizada y oxigenada de colagenasa tipo I en PBS (2.5mg/mL), al terminar la digestión se llevará a cabo la disgregación celular mecánicamente mediante pipeteo y maceración de las piezas de hueso. Se hará una centrifugación del contenido de la extracción a 200 g por 5 minutos a 35oC, recolectando el sobrenadante en un matraz de Falcon y agregando dos volúmenes de medio α-MEM adicionado con FBS y penicilina-estreptomicina colocándolo en un matraz de Falcon y se dejará incubar. Una vez incubado el precipitado tendrá otro proceso de disgregación y posteriormente pasará a una centrifugación a 200 g por 15 minutos, retirando el sobrenadante y el precipitado será resuspendido en 5mL de medio α-MEM (adicionado con FBS, penicilina-estreptomicina, ácido ascórbico y β-glicerofosfato), colocándolo en un frasco de cultivo y se incubará a 37oC con 5% de CO2 y 95% de O2. Para el mantenimiento del cultivo primario de los osteoblastos se realizará recambio de medio cada tercer día, retirando 100 μL de la parte más superficial y agregando 100 μL de medio fresco. Los cambios de medio de cultivo se realizarán en campana de flujo laminar bajo condiciones de asepsia. Recuento celular Las células osteoblásticas serán observados en el microscopio invertido a 400x, utilizando el método de recuento en la cámara de Neubauer. Las células serán transferidas con una micropipeta penetrando por acción capilar. Primero se ubicará la cuadricula central para poder visualizar enseguida los 25 cuadros a 400x, se contarán las células presentes en 5 campos aleatorios, cuadro por cuadro, delimitados por tres líneas, que son fundamentales en el momento del conteo pues definen cuales células son contables o cuales están fuera del campo de conteo. Las células que no tocan la segunda línea se contarán, si la tocan o están encima de ella no se incluyen. Después de contar las células se calculará el número de células por unidad de volumen. Se promediará el número de células de la cámara de arriba con la de abajo, se multiplicará por el factor de dilución y por un factor F igual a 104, este valor se multiplica por la cantidad de mililitros de medio, esta cantidad se expresa en µL. Cantidad de células = (10,000) (Factor de dilución) (células contadas) Siembra de osteoblastos en los compositos Los soportes se esterilizarán con etanol al 70% por 30 minutos y con luz UV por 30 minutos seguido de secado en condiciones estériles a temperatura ambiente por 2 horas. Cada andamio se sembrará con los osteoblastos y se observará la proliferación. Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular A los 10 días de cultivo se agregará un coctel osteogénico que contiene dexametasona, ácido ascórbico y β-glicerofosfato para inducir la osteogénesis. Biocompatibilidad El análisis de biocompatibilidad in vitro del material tiene por objetivo evaluar la adhesión y proliferación celular y citotoxicidad en los compositos. La adhesión y la proliferación son comportamientos celulares indicadores de la funcionalidad celular. Adhesión celular La adhesión a la superficie es un factor crítico en la respuesta celular, porque determina que células poblaran la superficie, proveyendo un conjunto de células para la proliferación, que influirá en la morfología y diferenciación de osteoblastos. Para estudiar el grado de adhesión celular, las células adheridas se desprenderán con tripsina, una enzima que rompe los enlaces entre la membrana celular y la superficie de crecimiento que permite separar las células de su soporte y entre sí y las células se contaran utilizando la cámara de Neubauer. El número de células adheridas a la superficie del polímero se expresará como el porcentaje del total de células que originalmente se sembraron en cada una de las muestras. La adhesión celular se evaluará a través del recuento de las células que permanezcan en la superficie del composito a 1 y 4 horas de cultivo celular. Proliferación celular Para cuantificar la proliferación celular sobre la superficie de los polímeros, se aplica un método espectrofotométrico utilizando el reactivo azul de Alamar, la cuantificación se hará al día 3, 7, 14 y 21 de cultivo celular. El grado de proliferación se determinó mediante la medida de absorbancia a longitud de onda de 570 nm correspondiente a la densidad óptica de la forma reducida del reactivo azul de Alamar. Este reactivo mide la actividad metabólica celular por reacción colorimétrica producida por el metabolismo de oxido-reducción, el reactivo cambia de color en respuesta a una reducción química de medio por el crecimiento celular. Cuando las células están en crecimiento, su actividad metabólica resulta en una reducción del reactivo alamar Blue (color rojo), mientras que una inhibición de la proliferación celular mantiene al reactivo en su forma oxidada (azul). Citotoxicidad Se evaluará si los monómeros empleados para la síntesis de los distintos biomateriales, son tóxicos para las células osteoblásticas, debido a la posible liberación de III. Metodología 29 30 componentes nocivos que puedan afectar cuantitativa o cualitativamente al cultivo celular u ocasionar la muerte de las células que lo constituyen. La citotoxicidad será evaluada por el ensayo MTT, una sal de tetrazolio que mide la actividad de la enzima mitocondrial succinato deshidrogenasa en la reducción del compuesto MTT (colorante amarillo pálido, soluble en agua), reducido a un precipitado púrpura de cristales de formazán en la mitocondria de células vivas (cristales azul violeta, insoluble en agua). Este ensayo está directamente relacionado con el número de células viables metabólicamente activas dentro del cultivo, por lo que midiendo el aumento de absorbancia debida a la formación de dicho compuesto se puede monitorizar la viabilidad y actividad bioquímica de un cultivo. Se cuantificará espectrofotométricamente a 570 nm. Como control positivo se añadirá al medio 0,02%v/v de SDS (dodecil sulfato de sodio) que es una sustancia tóxica y representa el 100% de mortalidad de las células. Para el control negativo se usará el medio de cultivo. Valoración de morfología y calcificación celular Para evaluar la morfología de los osteoblastos a los 3, 7, 14 y 21 y la calcificación a los 21 días del cultivo celular, mediante el uso de microscopía electrónica de barrido SEM (Joel JSM7000F), utilizando los detectores de electrones EDS (espectrómetro de dispersión de energía) y BSE (detector de retrodispersión de electrones). Las células del cultivo serán fijadas a temperatura ambiente con 1% y 3% de glutaraldehido (fijador celular) por 1 y 24 horas, respectivamente, posteriormente los matraces que contengan las células, serán deshidratados secuencialmente utilizando series de etanol de 50, 70, 90, 95 y 100% por 10 minutos cada uno, se dejará secar toda la noche y se visualizarán por SEM. Producción de matriz y mineralización Para investigar la capacidad osteogénica de los compositos se evaluará a los 21 días de cultivo la producción de matriz extracelular y la mineralización, midiendo la formación de nódulos óseos mineralizados y depósitos de calcio. Esto será realizado, reemplazando el medio de cultivo con 1 ml de medio sin suero, con albúmina al 1%, suplementado con 1,25-dihidroxivitamina D3 (vitamina D3 ®10-9 M (Sigma) y vitamina K (Konakion ®10­-8 M), para disolver la vitamina D3 se usará etanol. Los cultivos serán incubados durante 48 horas y posteriormente almacenado a –80 °C hasta llevar a cabo el ensayo. (Messeguer-Olmo, et al., 2006). Se utilizara la tinción con rojo de alizarina, después de un tratamiento con vitamina D3. La mineralización se observará en microscopio invertido (400x) por una coloración roja intensa. Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Análisis de expresión de marcadores moleculares Para cuantificar los niveles de expresión de los genes y establecer la asociación de los genes estimulados en la regeneración tisular, se tomarán células mantenidas en el control y en los composito, que serán cosechadas en diferentes intervalos de tiempo, mediante el análisis semicuantitativo de reacción en cadena de la polimerasa (PCR). Evaluando la actividad de la fosfatasa alcalina al día 7, 14, y 21 del cultivo celular, además de los perfiles de expresión de mRNA del factor de crecimiento transformante β (TGF-β), osteonectina (SPARC), osteocalcina (BGLAP), sialoproteína (BSP) y colagenasa tipo 1 (COL1A1). Los niveles de expresión de los genes se normalizaran a la expresión del gen constitutivo gliceraldehído 3-fosfato deshidrogenasa (GAPDH) Análisis estadístico Las mediciones se harán por triplicado expresando la media ± desviación estándar, se hará el análisis de varianza ANOVA para comparar los promedios entre los grupos. Para evaluar la significancia del efecto de la densidad de la siembra celular sobre el porcentaje de adhesión celular después del cultivo celular se utilizará el método de t-student, considerando como significativo un valor de p <0,05. III. Metodología 31 IV. Resultados L Morfología de los compositos a Figura 1 muestra la morfología de los compositos liofilizados y neutralizados, donde se puede apreciar una estructura porosa presente principalmente en los planos profundos del soporte y pequeños poros en la superficie. A altas magnificaciones se puede ver una estructura poroso con una alta interconexión (poros <10 µm). Los mesoporos son importantes para proveer un medio que estabilice las actividades enzimáticas por largos periodos de tiempo (Cooney, et al., 2008). Al menos 20 % de los poros deben ser más pequeños de 20 µm, debido a que una estructura porosa de menos de 1 µm de diámetro es importante para la interacción de proteínas y la bioactividad, y estructuras porosas de 1 µm-20 µm para el desarrollo celular, tipos de células atraídas y orientación y direccionalidad del crecimiento celular (Sánchez-Salcedo, et al., 2008). La Figura 2 muestra este tipo de porosidad interna en los compositos Quitosana/PLLA/NTC. Aunque otras investigaciones han tratado de combinar quitosana y un láctido en una mezcla, la morfología muestra una separación de fase visible microscópicamente entre las sustancias, mostrando un gran número de pequeñas esferas de láctido dispersas en la matriz continua de quitosana (Wan, Wu, et al., 2007; Wan, Fang, et al., 2007). En este trabajo no hay una separación de fase visible entre el láctido y la quitosana. Las condiciones de proceso son elementales para controlar la separación de fases. Además, la temperatura de enfriamiento define el tamaño de poro. Se pueden preparar fácilmente soluciones de quitosana del 0.5% al 2.0 wt% c usando ácido acético en solución acuosa al 1.0 % (v/v) y ser congeladas en un amplio rango de temperaturas de al menos 10º C. Sin embargo, cuando la quitosana es mezclada con la solución de PLLA-cloroformo, la temperatura de fusión se restringe. Primeramente, las muestras no pueden ser congeladas usando temperaturas más altas de -70o C debido a la combinación de las concentraciones y al punto de fusión del cloroformo (-63.5o C). Si las mezclas no son congeladas inmediatamente después de preparadas, los componentes se precipitan durante el proceso de congelamiento. Por estas razones, se utilizó hielo seco para evitar estos problemas. Durante los experimentos, se utilizó 33 34 nitrógeno líquido para analizar el efecto de las bajas temperaturas en la porosidad. Sin embargo, debido a los problemas de la concentración del polímero, el proceso se ubicó en la región metaestable de bajas concentraciones de polímero y pequeñas gotas de polímero de la fase rica en polímero se formaron y dispersaron en la matriz de baja concentración del polímero, lo que resultó que al remover el solvente, se crearan pequeñas esferas poliméricas. Consecuentemente, no fue posible controlar la porosidad a través de la temperatura. La morfología de los soportes, depende de la manera en la cual la separación entre los solventes y los polímeros tiene lugar. En este sistema, bajo las condiciones descritas, se formó una separación líquido-sólido. El cloroformo es miscible en ácido acético, pero no en agua. En la mezcla el mayor componente corresponde a agua, entonces es posible que el agua tenga una gran influencia en la forma de los cristales. Mientras el cloroformo y el ácido acético se mezclan, a temperaturas de congelamiento el agua se separa de la quitosana formando cristales alrededor de los cuales se precipita el polímero. Durante los experimentos, se observó que la solución ácido acético-agua-cloroformo-polímeros tenía un punto de fusión más alto que la solución PLLA-cloroformo, debido a que los compositos podían ser congelados a -78º C mientras que la solución láctido-cloroformo no. Además, el ácido acético causa un descenso en la temperatura de fusión del agua, lo que provoca que también el gradiente de temperatura y la velocidad de crecimiento de cristales disminuya (Cooney, et al., 2008). La forma de los cristales definirá el tipo de porosidad y el tamaño de poro obtenido; es decir, la estructura porosa interna será similar a la geometría de los cristales del agua cuando hayan sido totalmente sublimados. En este proceso, es muy importante definir el proceso de separación térmica dominante, para entender cómo crecerán los cristales. Esto es, si el proceso es dominado por masa o transferencia de calor. En este sentido, ha sido reportado que debajo de -50o C el proceso dominante para sistemas acuosos de quitosana es transferencia de calor (Roh & Kwon, 2002; Cooney, et al., 2008). La principal diferencia entre estos procesos está relacionada con el tipo de porosidad que es producida. Cuando el proceso dominante es transferencia de masa, el crecimiento de los cristales es definido por procesos difusionales, por lo que el crecimiento será direccionalmente homogéneo y los cristales formarán esferas. Por otro lado, cuando el proceso dominante es transferencia de calor, el gradiente térmico es grande y si es direccional, la velocidad difusional de las moléculas de agua de los cristales de hielo será más grande en dirección de los gradientes térmicos. Como resultado de este proceso, el tipo de cristales serán hojas delgadas en capas de hielo con la dirección del gradiente térmico aplicado. Sin embargo, como se muestra claramente en la Figura 3 f, la porosidad podría ser alcanzada, pero alargada en la dirección del gradiente térmico. Por otro lado, también el gradiente térmico afecta la forma de los cristales desde la superficie hasta partes internas del composito. Usualmente los cristales crecen de la superficie al centro. Esta idea fue probada, midiendo el tamaño de poros a diferentes profundidades de la superficie al centro. Se encontró un tamaño de poro más Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular uniforme y más grande en el centro que en la superficie como lo muestra la Figura 1 para la quitosana y los compositos quitosana/PLLA. Es importante recordar que una limitación de este estudio fue que la velocidad de enfriamiento fue relativamente grande, debido a que las muestras fueron fabricadas a 40º C aproximadamente, y después de su punto de gelación se congelaron con hielo seco. Como consecuencia, los cristales fueron de un tamaño muy pequeño, debido a que la velocidad de congelamiento es inversamente proporcional al tamaño de poro obtenido (Hsieh, et al., 2007; Yuan, et al., 2009). IV. Resultados 35 36 Figura 1. Imágenes de SEM de (a) quitosana al 2 % wt% en solución acuosa de ácido acético al 1% y compositos Ch/PLLA (b) 1% NTC, (c) 2% NTC y (d) 3%NTC en concentraciones 2%/5% en solución acuosa de ácido acético y cloroformo, respectivamente. a b e c f d g Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Figura 2. Compositos Ch/PLLA (a) 1%NTC y (b) 5%NTC a concentraciones de 2%/5% en solución acuosa de ácido acético y cloroformo respectivamente. a b Figura 3. Imágenes de SEM de (a, b, c) quitosana al 2 % en solución acuosa de ácido acético y (d, e, f) composito C h/PLLA 1%NTC y (g, h, i) 5% NTC Ch/PLLA a concentraciones del 2%/6% en solución acuosa de ácido acético y cloroformo respectivamente en la superficie, con cortes transversales a un cuarto de la superficie y a una mitad de la superficie. a b c d e f g h i IV. Resultados 37 El tamaño de poro fue calculado midiéndolos en las imágenes de SEM. Cada soporte fue cortado en tres secciones transversales para observar la superficie, y a un cuarto y una mitad de distancia de la superficie para analizar los rangos de los tamaños de poros. La Tabla 1 muestra los tamaños de poros que fueron medidos usando las imágenes de SEM en magnificación original. No se obtuvo un promedio de tamaño de poro, debido a que la dispersión era muy grande entre ellos. La forma típica de esponja después de liofilizar a un composito de quitosana y PLLA se muestra en la Figura 4. La figura muestra un composito redondo obtenido, pero con un corte en una de sus orillas. Figura 4. Forma de composito típico de quitosana y PLLA después de la liofilización. Tabla 1. Porosidad y distribución del tamaño de poro para los compositos quitosana/DL PLG con una concentración del 2 % wt % de quitosana en una solución acuosa de ácido acético y 5 % (%w/v) de DLPLG en cloroformo. Rango del tamaño de poro (μm) Composito (Ch/PLLA) Quitosana - Ch/PLLA/NTC 0.64-57.97 Porosidad 38 Distribución del tamaño de poro 1≤ (μm) 1-5 (μm) 5-10 (μm) 10-50 (μm) 50-100 (μm) >100 (μm) 0.48-506.03 1.45-279.24 81% 0.00% 13.11% 9.84% 28.69% 15.57% 32.79% 0.70-573.20 0.47-517.95 73% 13.33% 37.33% 4.67% 22.00% 12.00% 10.67% Análisis de las propiedades mecánicas Las pruebas de esfuerzo de tensión miden la resistencia de un material a la aplicación de una fuerza estática o gradualmente aplicada. Esta prueba se efectúa aplicando una carga F a una probeta del material con la finalidad de medir el alargamiento o deformación causado en el material por la aplicación de dicha fuerza (Askeland, 1998). Las pruebas de esfuerzo-deformación a compresión son muy similares a la Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular anterior, excepto que la fuerza es de naturaleza compresiva y la muestra se contrae en la dirección del esfuerzo. Estas pruebas son utilizadas cuando el material tenga un comportamiento de deformaciones grandes y permanentes, como son aplicaciones de manufactura o cuando el material es muy quebradizo a tensión (Callister, 2007) El esfuerzo de compresión ingenieril (σ) se define como: σ= F Ao Donde F es la carga aplicada instantánea aplicada perpendicular a la muestra en newtons (N) y Ao es el área transversal de la muestra antes de que cualquier carga haya sido aplicada en metros cuadrados (m2). Las unidades del esfuerzo de ingeniería son megapascales (MPa), en el sistema internacional (Callister, 2007). Por otro lado, la deformación ingenieril (ε)se define como: ε= li - lo lo = ∆l lo En donde lo es la longitud original antes de que cualquier carga haya sido aplicada, li es la longitud instantánea. ∆l es la deformación o cambio de longitud en un instante. La deformación usualmente se expresa como un porcentaje (Callister, 2007). El módulo está íntimamente ligado con la energía de enlace de los átomos. Una pendiente muy acentuada o abrupta indica que se requieren grandes fuerzas para separar a los átomos y hacer que el material se deforme elásticamente. El módulo es una medida de la rigidez del material. Un material rígido, con un alto módulo de elasticidad, conserva su tamaño y forma incluso al ser sometido a una carga en la región elástica (Askeland, 1998). Para el análisis de las pruebas mecánicas se utilizó un instrumento RSA III (Rheometrics System Analyses) TA en modo estático. Cada muestra fue colocada en el plato inferior, mientras que el superior fue puesto sobre la muestra para darle una ligera compresión y ser asegurada en el lugar. Las gráficas esfuerzo-deformación fueron obtenidas a través de este procedimiento. El análisis de esfuerzo de compresión fue efectuado a 37º C a una velocidad de deformación de 0.005 mm/s. Los compositos fueron cortados en piezas circulares con 25 mm de diámetro y alrededor de 10.0 mm de espesor. Al menos dos muestras de cada composición fueron medidas y los resultados fueron promediados. El modulo de compresión fue definido como el modulo lineal inicial, que da la elasticidad inherente del material, y el esfuerzo de compresión a una deformación del 10 % fue registrado como σ10. Para la realización de este estudio, se utilizó un instrumento de análisis mecánicodinámico (DMA). Las técnicas DMA son un útil complemento para los métodos mi- IV. Resultados 39 40 croscópicos para morfología y las investigaciones de microestructura para los polímeros compuestos (Liu, et al., 2004). El PLA, incluyendo Poli(D,L,láctido) (PDLLA) y Poli(L,láctido) (PLLA) tiene altas propiedades mecánicas con una completa biodegradabilidad y biocompatibilidad que los hacen adecuados para utilizarse en aplicaciones biomédicas, de agricultura y empaque. No obstante, la fragilidad y rigidez del PLA restringen su uso. El comportamiento cristalino de este material influencia las propiedades mecánicas de estas sustancias. Por ejemplo, las propiedades mecánicas del PDLLA restringen su aplicación en la regeneración de nervios, debido a que es más rígido y quebradizo que los tejidos nerviosos. Las propiedades mecánicas a compresión de los soportes porosos utilizados en ingeniería tisular son de particular importancia debido a que están ligados a una persistencia en la forma y durabilidad en aplicaciones prácticas. La Figura 5 muestra las curvas esfuerzo-deformación para la quitosana y los compositos Ch/PLLA/NTC. La información obtenida de estas curvas es mostrada en la Tabla No. 2. El composito conteniendo 10% de NTC mostró un módulo grande indicando que es un material más resistente que el composito Ch/PLLA y los compositos conteniendo menores porcentajes de NTC. Figura 5. Gráfica esfuerzo-deformación para los compositos Ch/PLLA/NTC. Con el aumento de contenido de NTC en los compositos Ch/PLLA/NTC, el módulo elástico varía desde 42232 hasta 109574 Pa Estos resultados muestran que las propiedades mecánicas de la quitosana, en cuanto a la regeneración de hueso, son mejoradas con la mezcla de Ch/PLLA/NTC La mezcla con el menor módulo elástico fue la Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Ch/PLLA/2%NTC, pero incluso así fue más alto que el de la Ch/PLLA. Estos resultados muestran que los compositos podrían ser útiles para la ingeniería tisular. Tabla No. 2 Propiedades mecánicas de los compositos Ch/PLLA/NTC Composito Módulo elástico (E) (Pa) Ch/PLLA Ch/PLLA/2%NTC Ch/PLLA/5%NTC Ch/PLLA/10%NTC 30,562 44,250 42,232 109,574 Esfuerzo de compresión (Pa) 5.89 x 105 7.28 x 105 6.68 x 105 7.33 x 105 Deformación al esfuerzo máximo % 22.985 21.542 20.239 10.247 σ10 (Pa) 1.77 x 105 1.07 x 105 1.73 x 105 7.33 x 105 Resultados de análisis génicos Caracterización morfológica de los osteoblastos aislados Para la caracterización morfológica de osteoblastos, se observaron los platos petri que contenían los resultados del aislamiento en un microscopio de fase invertida. Inicialmente, la célula flota en la solución de cultivo y posteriormente se hunde y se extiende. Después de 24 h, muchas células se han adherido al fondo del plato de cultivo, mostrando su forma de triángulo o polígono (Figura 5). Cuando las células son confluentes, pueden crecer juntas y sobreponerse formando nódulos semejantes a una piedrita. Después de 2 semanas, con el depósito de calcio y colágeno, los nódulos de las células se vuelven fotosensibles (Alberts, 2002). De igual manera, en las imágenes se pudo apreciar al núcleo celular con citoplasma que muestra las clásicas extensiones de estas células denominadas filopodios. Figura 5. Caracterización morfológica de los osteoblastos de cráneo de Rattus Norvegicus Albina obtenidos por cultivo primario a 40X. a b IV. Resultados 41 42 A través del uso de la fosfatasa alcalina, se pudo constatar de la misma manera que los osteoblastos se estaban diferenciando, adquiriendo un color amarillo muy oscuro al reaccionar con el reactivo al detectar la presencia de la enzima. Esto se puede ver en la Figura 6. A través del uso de este indicador, se observó la membrana celular, con un color más oscuro. Figura 6. La figura muestra los osteoblastos que han iniciado su proceso de diferenciación a osteocitos (puntos de un amarillo oscuro que tiende a café) a los 14 días de cultivo. Las imágenes fueron tomadas a 10X. a b c De igual manera, a través del uso del reactivo denominado rojo de alizarin, se pudo verificar la existencia de nódulos de calcificaciones a los 21 días de cultivo de los osteoblastos, lo que indica que algunos de ellos ya se encontraban en fase de mineralización de la matriz extracelular. Estos resultados se pueden ver en la Figura 7. En esta figura es posible observar nódulos muy rojos que indican la existencia de calcio. Mientras la parte a y b muestran las calcificaciones existentes en los cultivos a los 21 días, a una mayor ampliación (Figura 7c) se pueden ver las mismas calcificaciones, así como la manera en que las células se van uniendo con pequeñas fibras de colágeno, empezando formar la matriz extracelular. Figura 7. Calcificación en los cultivos primarios de osteoblastos. Las imágenes a y b se muestran a 10X y la c a 40X. a b Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Es importante mencionar, que con el propósito de inducir la mineralización, los medios de cultivo fueron enriquecidos con β-glicerol fosfato y ácido ascórbico (Ciapetti, 2003). Se sabe que aunque haya cultivos en donde la mineralización ya esté presente, el β-glicerol fosfato no sólo la induce, sino que la acelera (Anagnostou, et al., 1996). No obstante, el rol exacto de los fosfatos inorgánicos no se conoce hasta el momento (Ciapetti, 2003). Otro de los métodos utilizados para la caracterización morfológica de los osteoblastos, fue a través del uso del microscopio electrónico de barrido (SEM). Este procedimiento permitió confirmar tanto la existencia de los osteoblastos, como de las calcificaciones producidas por los mismos (Figura 8). De igual manera, este procedimiento permitió observar la morfología de las células individuales (Figura 9 ). La Figura 9 también muestra la morfología de los osteoblastos en los platos de cultivo en diferentes tiempos. Figura 8. Células individuales observadas en microscopio electrónico de barrido (SEM). IV. Resultados 43 44 Figura 9. Imágenes de los cultivos en platos de cultivo de los osteoblastos a a) y b) 3 días, c) y d) 7 días, e) y f) 14 días y g) y h) 21 días. a) b) c) d) e) f) g) h) Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Curva patrón 45 Para medir la proliferación se utilizó una curva de calibración a 570nm; explicando con un 95.29% de coeficiente de correlación, las concentraciones de osteoblastos en el biomaterial, por una relación lineal con la absorbancia obtenida en la lectura. En la tabla 1 y figura 1 se representa la recta patrón para cuantificar el número de células proliferadas. Tabla 1. Lectura espectrofotométrica a longitud de onda de 570 nm, del pozo en blanco y a diferentes concentraciones celulares (Benchmark Plus, Microplate spectrophotometer). Blanco 0.902 0.902 0.902 Promedio 0.902 100,000 células 1.05 0.986 0.953 0.996333 200,000 células 1.046 1.031 0.976 1.017667 300,000 células 1.123 1.088 1.062 1.091 500,000 células 1.133 1.137 1.113 1.127667 1´000,000 células 1.251 1.247 1.246 1.2485 1´500,000 células 1.375 1.278 1.249 1.3065 Figura 1. Recta patrón, en el eje de las Y observamos la absorbancia a 570nm y en el eje de las X el número de células sembradas. 1.4 Recta patrón 1.2 1 y= 2E-07x + 0.997 R2=0.952 0.8 0.6 Absorbancia 0.4 Lineal (absorbancia) 0.2 0 0 500 000 1000 000 1500 000 2000 000 IV. Resultados Adhesión celular 46 El cálculo de células adheridas se llevó a cabo determinado la media del conteo celular en la cámara de Neubauer bajo visión microscópica a 1 y 4 horas de cultivo celular y desarrollando la formula: 10,000 x 0.4 ml (FD) x células contadas (tabla 2, figura 2). Encontrando un porcentaje de adhesión en composito con 1% de NTC de 29.4% y 9.6% respectivamente, para 2% de NTC una adhesión de 13.1% y 13.8%, para 5% de NTC 11.2% y 15.6%, para 10% de NTC células adheridas 14.47% y 19.8%, mientras que para el grupo control la adhesión fue de 12.8% y 8.13% respectivamente. Tabla 2. Porcentaje de adhesión celular en los diferentes compositos a una hora y cuatro horas de incubación, evaluado por el método de tripsina y contabilizado bajo visión microscópica en cámara de Neubauer. Tiempo de cultivo celular Biomaterial 1 hora 4 horas 1% NTC 29.4 9.6 2% NTC 13.1 13.8 5% NTC 11.2 15.6 10% NTC 14.47 19.8 Quitosana 12.8 8.13 Figura 2. En el eje de las x se observa el biomaterial conteniendo diferentes concentraciones en peso de NTC y del control con quitosana. En el eje de las Y el porcentaje de proliferación celular a 1 y 4 horas de cultivo celular, * p <0.05 Adhesión celular Porcentaje de adhesión 35 30 25 * 20 15 1 hora 4 horas 10 5 0 1%NTC 2%NTC 5%NTC 10%NTC Quitosana Biomateriales Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Proliferación 47 Para el cálculo de la cantidad de células proliferadas en los compositos y en el control a los 3, 7, 14 y 21 días, se reportan los resultados obtenidos por cuadriplicado y el promedio de cantidad celular obtenida por la lectura de absorbancia y utilizando los datos de la curva patrón x = 2E-07x + 0.9975 (tabla 3-6). Tabla 3. Observamos la lectura espectrofotométrica a 570 nm (Benchmark Plus. Microplate spectrophotometer) de las células cultivadas sembradas en los biomateriales y en el control, a los 3 días del cultivo. En el último recuadro se establece el promedio de la lectura. Proliferación a los 3 días de cultivo celular Promedio 1% 759501 753378 946691 956313.6 853970.9 2% 751629 724512 1465400 735884 919356.3 5% 635291 657159 644913 637915 643819.5 10% 591555 560065 583682.8 506707.5 560502.6 Control 692148 684275.6 480465.9 617796.9 618671.6 Tabla 4. Observamos la lectura espectrofotométrica a 570 nm (Benchmark Plus. Microplate spectrophotometer) de las células cultivadas sembradas en los biomateriales y en el control, a los 7 días del cultivo. En el último recuadro se establece el promedio de la lectura. Proliferación a los 7 días de cultivo celular Promedio 1% 3152500 3232500 3302500 3237500 3231250 2% 3027500 3312500 3187500 3452500 3245000 5% 2872500 3412500 3582500 4027500 3473750 10% 3077500 3097500 3027500 3232500 3108750 Control 2077500 2322500 2697500 2427500 2381250 IV. Resultados 48 Tabla 5. Lectura espectrofotométrica a 570 nm (Benchmark Plus. Microplate spectrophotometer) a los 14 días del cultivo celular en biomaterial y control. En el último recuadro se establece el promedio de la lectura. Proliferación a los 14 días de cultivo celular Promedio 1% 3447500 3222500 3567500 4407500 3661250 2% 4167500 5882500 4392500 4832500 4818750 5% 4762500 4682500 4997500 5622500 5016250 10% 3097500 4477500 4492500 5002500 4267500 Control 4002500 4362500 5172500 6212500 4937500 Tabla 6. Lectura espectrofotométrica a 570 nm (Benchmark Plus. Microplate spectrophotometer) a los 21 días del cultivo celular en biomaterial y del control. En el último recuadro se establece el promedio de la lectura. Proliferación a los 21 días de cultivo celular Promedio 1% 697396.4 701770 705268.9 621295.8 681432.8 2% 621295.8 614298 599427.8 619546.4 613642 5% 676403.2 616922.2 616047.5 556566.5 616484.8 10% 563564.3 563564.3 571436.8 566188.4 566188.4 Control 622170.5 657159.3 657159.3 600302.5 634197.9 En la tabla 7 se observa el promedio de proliferación celular para cada uno de los biomateriales y del control a los 3, 7, 14 y 21 días de cultivo, encontrando para el composito con 1% de NTC una proliferación celular de 853,970.9, 3'231,250, 3'661,250 y 681,432.8 células respectivamente, para el composito de 2% la proliferación obtenida fue de 919,356.3, 3'245,000, 4,818,750 y 613,642, para el composito con 5% de NTC las células proliferadas fueron 643,819.5, 3'473,750, 5'016,250 y 616,484.8, para el composito con 10% de NTC la proliferación celular fue de 560,502.6, 3'108,750, 4'267,500 y 566,188.4 mientras que para el control de quitosana la proliferación fue de 618,671.6, 2'381,250, 4'937,500 y 634,179.9. Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Tabla 7. Mediante el uso de la ecuación de la recta observamos la cantidad promedio de células proliferadas a los 3, 7, 14 y 21 días de cultivo celular, en los diferentes composito y en el control de acuerdo a la formula desarrollada x = 2E-07x + 0.9975 Número de Células Biomaterial 3 días de cultivo 7 días de cultivo 14 días de cultivo 21 días de cultivo 1% 853,970.9 3´231,250 3´661,250 681,432.8 2% 919,356.3 3´245,000 4´818,750 613,642 5% 643,819.5 3´473,750 5´016,250 616,484.8 10% 560,502.6 3´108,750 4´267,500 566,188.4 Quitosana 618,671.6 2´381,250 4´937,500 634,197.9 Utilizando la curva de calibración a 570nm y explicando con un coeficiente de correlación de 95.29%, encontramos que todos los biomateriales mostraron una tendencia creciente de proliferación celular (figura 3), con una velocidad de proliferación mayor entre el día 7 y 14 de cultivo del biomaterial con 2% y 5% de NTC, sin embargo los compositos con 1% y 10% de NTC tuvieron una proliferación baja al día 14 del bioensayo con respecto al control. El soporte conteniendo 5% de NTC obtuvo una proliferación mayor que el control a los 3, 7 y 14 días de cultivo celular. A los 21 días del ensayo se observó una disminución significativa de la velocidad de proliferación siendo similares tanto en el control como en los biomateriales con diferentes porcentajes en peso de NTC, esto es coincidente cuando el osteoblasto termina su diferenciación y se convierte en osteocito el cual es incapaz de seguir proliferando. Figura 3. Proliferación celular a 3, 7, 14 y 21 días de cultivo celular. En el eje de las X se observan el biomaterial con diferentes concentraciones en peso de NTC y el grupo control con quitosana, en el eje de las Y la cantidad de células proliferadas. * p<0.05 3d 7d 14d 21d 6000 000 Número de células 5000 000 * 4000 000 * * * 3000 000 2000 000 1000 000 * 0 1% 2% 5% Composito IV. Resultados 10% quitosana 49 50 Cebadores estandarizados La figura 4 representa los productos de amplificación de PCR para cada uno de los genes estandarizados, observando la amplificación de una sola banda, indicando que el cebador es especifico. Figura 4. Productos de amplificación por PCR. Observando una banda amplificada para cada gen, demostrando que los cebadores son especificos para cada uno de ellos: GADPH, fosfatasa alcalina, osteonectina osteocalcina, colagenasa tipo 1 (Col1), sialoproteína y factor de crecimiento transformante β1 (TGF- β1) Expresión génica Para los análisis de expresión génica hasta el momento se ha obtenido el RNA de los osteoblastos en el día 0 y de aquellos cultivados en los biomateriales y en el control a diferentes días del cultivo celular, utilizando el método de Trizol modificado. La tabla 8 muestra la concentración y calidad de RNA obtenido mediante lectura de absorbancia a 260/280 nm. Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Tabla 8. Extracción de RNA de las células cultivadas en el biomaterial del control, se muestran los valores obtenidos mediante lectura de absorbancia en nanodrop (Thermo Scientific). Biomaterial Concentración RNA A260 A280 260/280 DIA 3 Quitosana/PLLA + NTC 1% 259 ng/μL 6.476 3.954 1.64 Quitosana/PLLA + NTC 2% 98.4 ng/μL 2.461 1.573 1.56 Quitosana/PLLA + NTC 5% 158.3 ng/μL 3.958 2.445 1.62 Quitosana/PLLA +NTC 10% 50.7 ng/μL 1.267 0.83 1.53 Control 363.1 ng/μL 9.078 6.174 1.47 DIA 7 Quitosana/PLLA + NTC 1% 58.7 ng/μL 1.468 0.979 1.5 Quitosana/PLLA + NTC 2% 153.1 ng/μL 3.827 2.367 1.62 Quitosana/PLLA +NTC 5% 35.1 ng/μL 0.877 0.583 1.5 Quitosana/PLLA + NTC 10% 140.1 ng/μL 3.502 2.172 1.61 Control 124.7 ng/μL 3.119 1.962 1.59 DIA 14 Quitosana/PLLA + NTC 1% 22.6 ng/μL 0.566 0.353 1.6 Quitosana/PLLA + NTC 2% 6.1 ng/μL 0.153 0.103 1.49 Quitosana/PLLA + NTC 5% 252.1 ng/μL 6.304 3.542 1.78 Quitosana/PLLA + NTC 10% 297 ng/μL 7.424 4.212 1.76 Control 293.1 ng/μL 7.327 5.1 1.44 3.713 2.045 1.82 DIA 0 Osteoblasto 148.5 ng/μL Análisis estadísticos Todos los ensayos realizados se repitieron al menos tres veces, los datos obtenidos fueron analizados en el paquete estadístico Minitab 16 para Windows XP. Los resultados de las variables analizadas se expresaron como la media ± desviación estándar y las diferencias estadísticas entre los cuatro grupos estudiados y del control se evaluaron mediante el uso de la prueba de t-Student, tomando como valor significativo una p <0.05. IV. Resultados 51 52 Adhesión celular Para el análisis de adhesión celular se realizó la prueba de t-student de muestras independientes, evaluando la diferencia de las medias de 1 y de 4 horas de cultivo celular por biomaterial comparados con el control, no encontrando diferencias estadísticamente significativas a 1 hora de cultivo celular, obteniendo un valor de p>0.05, sin embargo a las 4 horas de cultivo celular el composito con 1% de NTC obtuvo un porcentaje de adhesión mayor con respecto al control con un valor de p 0.038 (tabla 11). Para analizar la proliferación celular de forma independiente para cada uno de los biomateriales y del control, se aplicó la prueba de t-Student de muestras pareadas a 1 y 4 horas, encontrando una diferencia significativa en el composito con quitosana/ PLLA y 10% de NTC con un valor de p 0.008, mientras que para los demás biomateriales incluyendo al control no hubo significancia estadística p>0.05 (tabla 12). Tabla 11. Análisis estadístico t-student para dos muestras independientes asumiendo varianzas iguales, realizado en el programa Minitab 16 para Windows XP, evaluando la adhesión celular a 1 y 4 horas de cultivo en cada uno de los biomateriales comparados con el control de quitosana tomando como significativo un valor de p < 0.05. BIOMATERIAL Hora de cultivo celular Prueba de t para dos muestras independientes Diferencia de la Media 95% IC de confianza Valor de t Grados de libertad Valor de p Quitosana/PLLA + 1% NTC 1 -16.6 (-118.8 a 85.5) -0.7 2 0.557 Quitosana/PLLA + 2% NTC 1 -0.27 (-27.02 a 26.49) -0.03 3 0.977 Quitosana/PLLA + 5% NTC 1 1.6 (-14.64 a 17.84) 0.31 3 0.774 Quitosana/PLLA + 10% NTC 1 -1.67 (-17.67 a 14.34) -0.33 3 0.762 Quitosana/PLLA + 1% NTC 4 -1.47 (-17.13 a 14.19) -0.4 2 0.726 Quitosana/PLLA + 2% NTC 4 -5.67 (-22.27 a 10.93) -1.47 2 0.28 Quitosana/PLLA + 5% NTC 4 -7.47 (-26.46 a 11.53) -1.69 2 0.233 Quitosana/PLLA + 10% NTC 4 -11.67 (-22.17 a -1.17) -3.54 3 0.038 Tabla 12. Análisis estadístico t-student de muestras pareadas asumiendo varianzas iguales, realizado en el programa Minitab 16 para Windows XP, evaluando la adhesión celular a 1 y 4 horas de cultivo en cada uno de los biomateriales, tomando como significativo un valor de p < 0.05. Prueba de t pareada BIOMATERIAL Diferencia de la Media Desviación estándar Error estándar de la media Valor de t Valor de p Quitosana/PLLA + 1% NTC 19.8 34.8 20.1 0.99 0.786 Quitosana/PLLA + 2% NTC -0.73 13.57 7.83 -0.09 0.467 Quitosana/PLLA + 5% NTC -4.4 3.12 1.8 -2.44 0.067 Quitosana/PLLA + 10% NTC -5.333 1.172 0.677 -7.88 0.008 Quitosana 4.67 7.72 4.46 1.05 0.798 Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Proliferación celular 53 Para evaluar si las diferencias entre los valores medios obtenidos eran estadísticamente significativas con respecto al control a 3, 7, 14 y 21 días de cultivo celular, se calculo la t de Student para dos muestras independientes asumiendo varianzas iguales (tabla 13). El composito con 1% de NTC fue el único que mostró un valor significativamente diferente con respecto al control a los 3 días de cultivo celular (p<0.05), a los 7 días de cultivo celular todos los biomateriales con los diferentes concentraciones de NTC mostraron una proliferación significativamente mayor que el control, sin embargo a los 21 días del cultivo celular la proliferación celular no tuvo diferencias significativas. Tabla 13. Análisis estadístico t-student de muestras independientes asumiendo varianzas iguales, realizado en el programa Minitab 16 para Windows XP, evaluando la proliferación celular a 3, 7, 14 y 21 días de cultivo en cada uno de los biomateriales comparados con el control, tomando como significativo un valor de p < 0.05. Prueba de t para la igualdad de medias Día de cultivo celular Biomaterial Media Desviación estándar Error estándar de la media 95% de intervalo de confianza de la diferencia Límite inferior Límite superior Valor de t Grados Valor de de p 2 colas libertad 3 Quitosana/PLLA 853971 + 1% NTC 112716 56358 -235299 -84823 -3.15 5 0.013 Quitosana/PLLA 919356 + 2% NTC 364199 182099 -300685 143101 -1.59 3 0.105 Quitosana/PLLA 643820 + 5% NTC 9776 4888 -25148 90724 -0.51 3 0.322 Quitosana/PLLA 560503 + 10% NTC 38278 19139 58169 181954 1.11 3 0.825 7 Quitosana/PLLA 3231250 + 1% NTC 61424 30712 -850000 -539282 -6.44 3 0.004 Quitosana/PLLA 3245000 + 2% NTC 180947 90473 -863750 -547224 -5.5 5 0.001 Quitosana/PLLA 3473750 + 5% NTC 477395 238698 -1092500 -514673 -4.03 4 0.008 Quitosana/PLLA 3108750 + 10% NTC 87595 43798 -727500 -408211 -5.36 3 0.006 14 Quitosana/PLLA 3661250 + 1% NTC 517645 258822 1276250 2458347 2.3 4 0.959 Quitosana/PLLA 4818750 + 2% NTC 761045 380523 118750 1369497 0.19 5 0.572 Quitosana/PLLA 5016250 + 5% NTC 425703 212851 -78750 1060903 -0.15 4 0.445 (continúa...) IV. Resultados 54 Prueba de t para la igualdad de medias Día de cultivo celular Biomaterial Media Desviación estándar Error estándar de la media 95% de intervalo de confianza de la diferencia Límite inferior Límite superior Valor de t Grados Valor de de p 2 colas libertad Quitosana/PLLA 4267500 + 10% NTC 817282 408641 670000 1956262 1.05 5 0.829 21 Quitosana/PLLA 681433 + 1% NTC 40220 20110 -47235 2127 -1.93 5 0.056 Quitosana/PLLA 613642 + 2% NTC 9932 4966 20556 55488 1.38 3 0.87 Quitosana/PLLA 616485 + 5% NTC 48924 24462 17713 77787 0.63 4 0.718 Quitosana/PLLA 566188 + 10% NTC 3711 1856 68009 101217 4.82 3 0.991 Discusión El composito con 1% de NTC favoreció la adhesión de los osteoblastos en la primera hora de cultivo celular, aunque estadísticamente no fue significativo, sin embargo, la proliferación a los 3 y 7 días de cultivo celular fue significativamente mayor. Por otro lado, todos los soportes conteniendo diferentes porcentajes en peso de NTC, mostraron una proliferación significativamente mayor al séptimo día comparados con el control, datos coincidentes con los reportados por Chor y cols. (Chor, 2010), a los 14 días del ensayo el composito con 1% de NTC fue el material con menos células proliferadas sin establecer significancia estadística, esta disminución nos lleva a pensar que, quizá debido a la fuerte adhesión de los osteoblastos a la superficie pierden movilidad, lo que dificultaría su expansión ocasionando una proliferación más lenta, o que la extracción de las células se vería dificultada por la fuerte fijación entre las células y la superficie o que la técnica empleada para la extracción de los osteoblastos, mediante el uso de tripsina, no sería lo suficientemente efectiva en este caso para llevar a cabo la desunión célula-superficie (Pino, 2008). Por otro lado a los 21 días de cultivo celular se observa una disminución en la proliferación celular en todos los biomateriales incluyendo al control sin diferencias significativas entre cada uno de ellos, ésta disminución de la velocidad de proliferación celular se explica porque las células han alcanzado la confluencia, dejan de proliferar para entrar en la etapa de diferenciación y el osteoblasto queda atrapado en la matriz extracelular mineralizada, diferenciándose a osteocito (Kierszenbaum, 2008) , esto es coincidente con estudios previos reportados en la literatura analizando la proliferación osteoblástica en biomaterial de ácido poliláctico (Navarro-Toro, 2005); y en ensayos con biofilmes con nanotubos de carbono cultivados en células Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular mesenquimales (Chor, 2010), el autor observó una disminución en la proliferación de 61% y 75% con respecto al biomaterial y a su control al día 21 de cultivo celular. En esta última observación se requiere confirmar el fenotipo osteoblástico mediante los análisis de expresión génica, en búsqueda de un incremento en la expresión de osteocalcina, lo que sugeriría que la matriz extracelular contribuye al cese de la proliferación celular (Owen, 1990) este análisis de expresión génica en nuestro estudio aún está en proceso experimental. Por otro lado, en un estudio realizado por Meike (Meike, 2010) evaluando la proliferación de osteoblastos en un biomaterial compuestos de ácido poliláctico, microhidroxiapatita y nanotubos de carbono con porcentajes en peso del 1% al 10%, encontró que la mejor opción para inducir la proliferación celular se encontraba en los compositos con 1% de NTC, esto es coincidente con los resultados obtenidos en nuestro ensayo. Narita y cols., reporta que los NTC inhiben la resorción del hueso in vivo, sugiriendo que NTC tienen efectos benéficos en el hueso cuando se usa como biomaterial (Narita, 2009). Finalmente los nanocompuestos se han propuesto para mejorar las propiedades funcionales y estructurales de los polímeros abriendo una perspectiva para aplicaciones biomédicas (Armentano, 2010), hasta el momento hemos encontrado que los biomateriales sujetos a ensayo permiten la proliferación osteoblástica significativamente mayor al día 14 de cultivo celular, para después empezar el proceso de diferenciación a osteocito, dato que aún falta por sustentarlo mediante análisis de expresión génica. Finalmente, se puede observar una tendencia proliferativa y de diferenciación de los osteoblastos. IV. Resultados 55 V. Conclusiones L as propiedades mecánicas de la quitosana/PLLA son mejoradas con la adición de pequeñas cantidades de nanotubos de carbono y que la morfología entrecruzada presenta tamaños de poros adecuados para la adhesión y proliferación celular. El análisis de proliferación osteoblástica muestra una proliferación mayor a los 14 días de cultivo. Hasta el momento hemos encontrado que los biomateriales sujetos a ensayo permiten la proliferación osteoblástica significativamente mayor al día 14 de cultivo celular, para después empezar el proceso de diferenciación a osteocito, dato que aún falta por sustentarlo mediante análisis de expresión génica. Finalmente, se puede observar una tendencia proliferativa y de diferenciación de los osteoblastos. 57 Referencias Abarrategi A., Gutiérrez M.C., Moreno-Vicente, C., Hortigüela M.J., Ramos V., López-Lacomba J.L., Ferrer M.L., del Monte F. (2008). Multiwall carbon nanotube scaffolds for tissue engineering purposes. Biomater 29: 94-102 Armentano I., Dottori M., Fortunati E., Matioli S., Kenny J.M. (2010). Byodegradable polymer matrix nanocomposites for tissue engineering: A review. Polymer degradation and stability (95):2126-2146. Askeland, D. (1998). Ciencia e ingeniería de los materiales. International Thomson Editores. Pp. 552. Bokobza L. (2008). Multiwall carbon nanotube elastomeric composites: A review. Polymer 48: 4907-4920 Chen D., Zhao M., Mundy GR. (2004). Bone morphogenetic proteins. Growth Factors 2004 Dec; 22(4):233-41 Chor Y.T., Haingang G., Wen S.L., Haiyang Y., Hua Q.L., Boon Ch.H., Hosea T., y cols. (2010). Cellular behavior of human mesenchymal stem cells cultured on single-walled carbon nanotube film. Carbon (48):1095-1104 Cooney, M. J., Lau, C., Windmeisser, M., Liaw, B. Y., Klotzbach, T., & Minteer, S. D. (2008). Design of chitosan gel pore structure: towards enzyme catalyzed flowthrough electrodes. Journal of Materials Chemistry. 18: 667 Ducy P., Zhang R., Geoffroy V., Ridall A.L., Karsenty G. (1997). Cbfa1/Osf2: a transcriptional activator of Osteoblast differentiation. Cell. 89(5): 747-754. Estrada C., Paz A.C., López L.E. (2006). Ingeniería de tejido óseo: Consideraciones básicas. Revista EIA, 5: 93-100. Feng X., Liao G., He W., Sun Q., Jian X., Du J. (2009). Preparation and Characterization of Functionalized Carbon Nanotubes/Poly(phthalazinone ether sulfone ketone)s Composites. Polymer Composites, 30: 365-373 59 60 Fernández-Tresguerres Hernández-Gil I., Alobera Gracia M.A., del Canto Pingarón M., Blanco Jerez L. (2006). Bases fisiológicas de la regeneración ósea I. Histología y fisiología del tejido óseo. Med Oral Patol Oral Cir Bucal 11: E47-51 Fernández-Tresguerres Hernández-Gil I., Alobera Gracia M.A., del Canto Pingarón M., Blanco Jerez L. (2006). Bases fisiológicas de la regeneración ósea II. El proceso de remodelado. Med Oral Patol Oral Cir Bucal, 2006; 11:E151-7 Garzón Alvarado D.A., Roa Garzón M.A., Cortés Rodríguez C.L. (2004). Análisis por elementos finitos del proceso de regeneración ósea: Editorial Universidad Nacional de Colombia. Bogotá, Colombia. 252 páginas. Gopalan A.I., Lee K.P., Santhosh P., Kim K.S., Nho Y.C. (2006). Different types of molecular interactions in carbon nanotube/conducting polymer composites – A close analysis. Compos Sci Technology 67: 900–905 Gutiérrez H. (2010). Establecimiento de un método de cultivo celular primario de osteoblastos a partir de calvaria de rata (rattus norvegicus). Tesis de Licenciatura en Química. Instituto de Ciencias Biomédicas, Universidad Autónoma de Ciudad Juárez. He L., Liu B., Xipeng G., Xie G., Liao S., Quan D., Cai D., Lu J., Ramakrishna S. (2009). Microstructure and properties of nano-fibrous PCL-b-PLLA scaffolds for cartilage tissue engineering. Eur Cell Mater. 18: 63-74 Hidaka Y., Ito M., Mori K., Yagasaki H., Kafrawy A. H. (1999). Histopathological and immunohistochemical studies of membranes of deacetylated chitin derivatives implanted over rat calvaria. J Biomed Mater Res. 46(3): 418-423. Hsieh, C., Tsai, S., Ho, M., Wang, D., Liu, C., Tseng, H., Hsieh, H.J. (2007). Analysis of freeze-gelation and cross-linking processes for preparing porous chitosan scaffolds. Carbohydrate Polymers. 67:124-132. Iijima S. (1991). Helical microtubules of graphitic carbon. Nature 354: 56–58 Jayakumar R., Divya Rani V.V., Shalumon K.T., P.T. Sudheesh Kumar P.T., Nair S.V., Furuike T., Tamura H. (2009) Bioactive and osteoblast cell attachment studies of novel α- and β-chitin membranes for tissue-engineering applications. . Int. J. Biol. Macromol 45(3): 260-4 Jones G. L., Motta A., Marshall M.J., El Haj A.J., Cartmell S.H. (2009). Osteoblast: Osteoclast co-cultures on silk fibroin, chitosan and PLLA films. Biomaterials. 29: 5376 – 84 Kierszenbaum A. (2008). Histología y biología celular. Elsevier España. 2da. Edición. 671 páginas Kim I.Y., Seo S.J., Moon H.S., Yoo M.K., Park I.Y., Kim B.C., Cho C.S. (2008). Chitosan and its derivatives for tissue engineering applications. Biotechnol Adv 26(1): 1-21 Kumar R., Prakash K.H., Cheang P., Gower L., Khor K.A. (2008). Chitosan-mediated crystallization and assembly of hydroxyapatite nanoparticles into hybrid nanostructured films. J. R. Soc. Interface. 5(21): 427–439 Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Lapunzina P., Aglan M., Temtamy S., Caparrós-Martín J.A., Valencia M., Letón M., Martínez-Glez V., Elhossini R., Amr K., Vilaboa N., Ruiz-Perez V.L. (2010). Identification of a Frameshift Mutation in Osterix in a Patient with Recessive Osteogenesis Imperfecta. Am. J. Hum. Genet. 87: 1-5, 2010. Larena A., Cácres D.A., De la Piedra C., Montero M., Vicario C., Fuentes A., Ibarzábal A., Bernabéu E., Ribelles P. (2004). Preparación de biomateriales basados en quitosano y estudios como portadores de osteoblastos en cultivo. Patología del aparato locomotor, 2005; 3 (1): 55-63 Lee J.T. Tsang W.H., Chow K.L. (2011). Simple modifications to standard Trizol Protocol allow high-yield RNA extraction from cells on resorbable materials. JBNB, 2011 (2):41-48 Li, H. J. Lu, W. G. Li, J. J. Bai, X. D. and Gu, C. Z (2005). Multichannel Ballistic Transport in Multiwall Carbon Nanotubes. Phys Rev Lett. 2005 Aug 19; 95 (8): 086601 Liu Y., Chen W., Chang Y. (2009). Preparation and properties of chitosan/carbon nanotube nanocomposites using poly(styrene sulfonic acid)-modified CNTs. Carbohydrate Polymers 76: 232–238 Loos J., Grossiord N., Koning C.E., Regev O. (2007). On the fate of carbon nanotubes: Morphological characterizations. Compos Scie Technology 67(5): 783-788. Manjubala I., Ponomarev I., Wilke I., Jandt K.D. (2007). Growth of Osteoblast-Like Cells on Biomimetic Apatite-Coated Chitosan Scaffolds. J Biomed Mater Res B: Appl Biomater. 84(1): 7-16. Martel-Estrada, S.A., Martínez-Pérez C.A., Chacón-Nava J.G., García-Casillas P.E., Olivas–Armendáriz I. (2010). In vitro bioactivity of chitosan/poly (D,L-lactideco-glycolide) composites. Materials Letters 65 (2010) 137–141 Martel-Estrada S.A., Martínez-Pérez C.A., Chacón-Nava J.G., García-Casillas P.E., Olivas-Armendariz I. (2010). Synthesis and thermo-physical properties of chitosan/poly(dl-lactide-co-glycolide) composites prepared by thermally induced phase separation. Carbohydrate Polymers 81 (2010) 775–783 Meike V.Z., Walboomers X.F., Brannvall M., Olalde B., Jurado M.J. Alava J.I. Jansen J.A. (2010). Genetic profiling of osteoblast-like cells cultured on a novel bone reconstructive material, consisting of poly-L-lactide, carbon nanotubes and microhydroxyapatite, in the presence of bone morphogenetic protein-2. Acta Biomaterialia (6):4352-4360 Narita N., Kobayashi Y., Nakamura H., Maeda K., Ishihara A., Mizoguchi T., Usui Y., y cols. (2009). Multiwalled carbon nanotubes specifically inhibit osteoclast differentiation and function. Nano Lett (4):1406-13 Navarro-Toro M.E. (2005). Desarrollo y caracterización de materiales biodegradables para regeneración ósea. Memoria de tesis presentada para optar al grado de Doctor en Ciencias. Especialidad Ingeniería Química por la Universitat Politécnica de Catalunya Referencias 61 62 Nolla J. (1997). Enfermedades óseas, Sociedad Española de Reumatología. Elsevier España, 1997, 453 páginas Okada S., Ito H, Nagai A., Komotori J., Imai H. (2010). Adhesion of osteoblast-like cells on nanostructured hydroxyapatite. Acta Biomater 6(2): 591–7 Olivas-Armendáriz I., García-Casillas P., Martínez-Villafañe A., Martínez-Pérez C. (2010). Chitosan/MWCNT composites prepared by termal induced phase separation. J alloys compounds 495(2): 592-595 Owen T.A., Aronow M., Shalhoub V., Barone L.M., Wilming L., Tassinari M.S., y cols. (1990). Progressive development of the rat osteoblast phenotype in vitro: reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix. J. Cell Physiol 143(3):420-30 Parada Quinayá D.C., Estupiñan Durán H.A., Peña Ballesteros D.Y., Vásquez Quintero C., Laverde Cataño D. (2009). Obtención, electrodeposición y caracterización de un recubrimiento polimérico bioabsorbible a partir de acido L-láctico para aplicaciones biomédicas. Ingeniare. Revista Chilena de Ingeniería 17(3): 365-374. Peris J.L., Prat J., Dejoz R., Comin M., Atienza C., Barreda J.S., Roger I., Reig C., Vera P. (1996). Proteínas morfogenéticas óseas (BMPs): Efecto de la proteína osteogénica-1 (OP-1/BMP-7) en la condrogénesis y osteogénesis. Rev Esp Cir Osteoart 1996; 31:37-48 Pino M.J. (2008). Estudio nanométrico de biocompatibilidad y adhesividad celular a biomateriales utilizados en cirugía ortopédica. Tesis Doctoral, Universidad Santiago de Compostela. Prezioso V.R. (2006). en “General Notes on Primer Design in PCR”. Encyclopedia (2006) 2: 022012-37 Ed. H.G. Griffin and A. M. Griffin CRC Press, Boca Raton. Ramanathan T., Liu H., Brinson L.C. (2005). Functionalized SWNT/Polymer Nanocomposites for Dramatic Property Improvement. J Polym Sci 43: 2269-2279 Riera-Espinoza G. (2009). Epidemiología de la osteoporosis en Latino América. Salud Publica Mex 2009;51 supl 1:S52-S55 Rincón M., Rodríguez A., Londoño M.A., Echavarría A. (2007). Fabricación y caracterización de una matriz tridimensional de hidroxiapatita macroporosa para aplicación en ingeniería de tejidos óseos. Revista EIA, 7: 87-95. Rivas-Martínez M., Román Ganzer J., Cosme Huertas M.L. (2007). Informe de vigilancia tecnológica Madrid. Aplicaciones actuales y futuras de los nanotubos de carbono. Edita Fundación Madrid para el conocimiento Velázquez, 76. E-28001 Madrid. Rivera J.A., Riaño C.H., Echavarría A., Monsalve P.A., Alzate G.J., Restrepo L.F., Jaramillo C.D. (2004). Injertos óseos - Nueva alternativa. Fase III. Obtención, caracterización y evaluación de Hidroxiapatita Sintética y el compuesto de Hidroxiapatita Sintética porosa – Proteínas Morfogenéticas Óseas en un modelo experimental Lapino. Rev Col Cienc Pec 17(1): 20-28 Síntesis y caracterización de compositos de quitosana y/o dlplg reforzados con nanotubos de carbono para su aplicación en ingeniería tisular Roh, I. & Kwon, I. (2002). Fabrication of a pure porous chitosan bead matrix: influences of phase separation on the microstructure. Journal of biomaterials Science Polymer Edition. 13: 769-782. Ross M., Wojciech P. (2007). Histología, Texto y atlas color con biología celular y molecular. Editorial medica panamericana. 5ª. Edición, 992 páginas. Sahithi K., Swetha M., Ramasamy K., Srinivasan N., Selvamurugan N. (2010). Polymeric composites containing carbon nanotubes for bone tissue engineering. Int. J. Biol. Macromol 46: 281-283 Sánchez-Salcedo, S., Nieto, A., & Vallet-Regí, M. 2008. Hydroxyapatite/β-tricalcium phosphate/agarose macroporous scaffolds for bone tissue engineering. Chemical Engineering Journal. 137: 62-71 Stevens A., Lowe J. (2006). Histología humana. Sistema musculo esquelético. Editorial Elsevier España S.A. 3ra. Edición. Madrid, España. 464 páginas Tsigkou O., Jones J.R., Polak J.M., Stevens M.M. (2009). Differentiation of fetal osteoblasts and formation of mineralized bone nodules by 45S5 Bioglass conditioned medium in the absence of osteogenic supplements. Biomaterials 30 (2009) 3542–3550. Vachiraroj N., Ratanavaraporn J., Damrongsakkul S, Pichyangkura R., Banaprasert T., Kanokpanont S. A comparison of Thai silk fibroin-based and chitosanbased materials on in vitro biocompatibility for bone substitutes. Int. J. Biol. Macromol 45(5): 470-477 Wan, Y., Fang, Y., Wu, H., & Cao, X. (2007). Porous polylactide/chitosan scaffolds for tissue engineering. Journal of Biomedical Materials Research Part A, 80A(4), 776-789. Wan, Y., Wu, H., Yu, A., Wen, D. (2006). Biodegradable Polylactide-Chitosan Blend Membranes. Biomacromolecules. 7: 1362-1372. Wang G., Meng F., Ding C., Chu P.K. Liu X. (2010). Microstructure, bioactivity and osteoblast behavior of monoclinic zirconia coating with nanostructured surface. Acta Biomater 3: 990–1000. Xie H., Liu B., Yuan Z., Shen J. Cheng R. (2004). Cure Kinetics of carbon nanotube/ tetrafunctional epoxy nanocomposites by isothermal differential scanning calorimetry. J. Polym Sci Part B: Polym Phys 42: 3701-3712 Yamaguchi A., Komori T., Suda T. (2000). Regulation of Osteoblast Differentiation Mediated by Bone Morphogenetic Proteins, Hedgehogs, and Cbfa1. Endocr Rev. 21(4): 393-411 Yamaguchi A., Komori T., Suda T. (2000). Regulation of Osteoblast Differentiation Mediated by Bone Morphogenetic Proteins, Hedgehogs, and Cbfa1. Endocr Rev. 21(4): 393-411 Yélamos J., Ramírez P., Parrilla P. (2000). Animales modificados genéticamente como donantes de órganos en xenotrasplante. Med Clin 114: 342-8 Referencias 63 Yilgor P., Sousa R.A., Reis R.L., Hasirci N., Hasirci V. (2010). Effect of scaffold architecture and BMP-2/BMP-7 delivery on in vitro bone regeneration. J Mater Sci: Mater Med doi: 10.1007/s10856-010-4150-1. Yuan, N.-Y., Lin, Y.-A., Ho, M.-H., Wang, D.-M., Lai, J.-Y., & Hsieh, H.-J. (2009). Effects of the cooling mode on the structure and strength of porous scaffolds made of chitosan, alginate, and carboxymethyl cellulose by the freeze-gelation method. Carbohydrate Polymers. 78: 349-356.