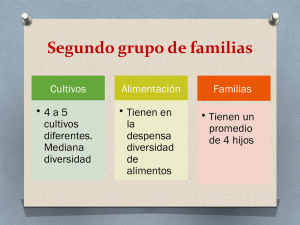
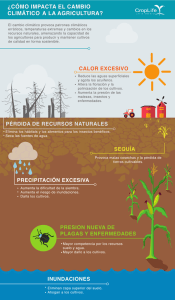
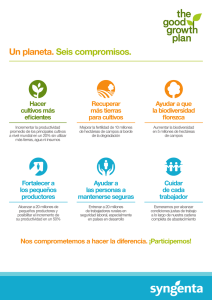
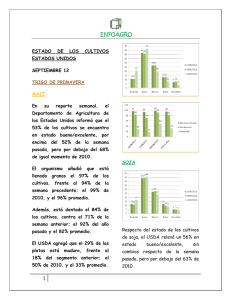
Ver/Abrir - Biblioteca digital INIFAP
Anuncio

Enfermedades Importantes de Algunos Cultivos de México MC. José Grageda Grageda1 Dr. José Ariel Ruiz Corral2 MC. Pedro Félix Valencia3 Dr. Emilio Jiménez García4 Dr. Alejandro Jiménez Lagunes5 1,2,3. Investigadores del Programa de Agrometeorología y Modelaje del INIFAP en Hermosillo, Sonora; Guadalajara, Jalisco y Ciudad Obregón, Sonora respectivamente. 4. Ex -Investigador en Fitopatología. INIFAP-CECH. Hermosillo, Sonora. 5. Técnico. Comité Estatal de Sanidad Vegetal de Sonora. Hermosillo, Son. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Centro de Investigación Regional del Noroeste Campo Experimental Costa de Hermosillo Hermosillo, Sonora. Noviembre de 2013 Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias Progreso No. 5, Barrio de Santa Catarina Delegación Coyoacán C.P. 04010. México, D.F. Teléfono: (55) 3871-8700 ISBN: 978-607-37-0161-7 Primera Edición 2013 La presente publicación se terminó de imprimir en el mes de noviembre de 2013 en los Talleres Gráficos de Prometeo Editores, S.A. de C.V. Libertad No. 1457, Col. Americana. C.P. 44160, Guadalajara, Jalisco. Tel. (33) 3826-2726 y 82 [email protected] El tiraje consta de 1,000 ejemplares. No está permitida la reproducción parcial o total de ésta publicación, ni la transmisión de ninguna forma o por cualquier medio, ya sea electrónico, mecánico, fotocopia, por registro u otros medios, sin el permiso previo y por escrito de la institución. FOTOS DE LA PORTADA: 1.Arriba a la izquierda: Roya en cafeto. Cortesía de Zenón Iturbide Silverio. SENASICA. 2.Arriba a a derecha: Mildiu velloso en melón chino. Cortesía de Rodolfo Sabori Palma. INIFAP-CECH. 3. Abajo a la izquierda: Cenicilla en calabaza. Cortesía de Rodolfo Sabori Palma. INIFAP-CECH. 4. Abajo a la derecha: Roya de la hoja del trigo. Cortesía de Javier Valenzuela Lagarda. CESAVE-Sonora. CONTENIDO Página Prólogo 7 Influencia de la temperatura y humedad en el 9 desarrollo de enfermedades Fichas descriptivas de las enfermedades 13 CULTIVOS PARA GRANO Roya de la hoja del trigo Carbón parcial del trigo Roya lineal o amarilla del trigo Roya del tallo del trigo Carbón del maíz (“huitlacoche”) Mancha foliar del maíz Ergot del sorgo Roya del sorgo Carbón cubierto del sorgo Antracnosis del frijol Roya o “chahuixtle” del frijol Tizón bacteriano del frijol Tizón del halo del frijol Rabia del garbanzo Estudio de caso (Patógeno-ambiente): Escenarios de Puccinia triticina Erikson y P. striiformis f. sp. tritici en trigo en el Sur de Sonora debido al cambio climático. CULTIVOS INDUSTRIALES Roya anaranjada de la caña de azúcar Roya del cártamo Mancha de la hoja del cártamo Falsa cenicilla del cártamo 5 15 19 23 27 29 33 37 41 45 49 53 57 61 63 67 73 77 81 83 HORTALIZAS Mancha bacteriana del chile y tomate Cenicilla del chile y tomate Cenicilla de las cucurbitáceas Mildiu velloso de las cucurbitáceas Tizón temprano de la papa y tomate Tizón tardío de la papa y tomate Mildiu velloso de la lechuga Roya del espárrago 87 91 95 99 103 107 111 115 FRUTALES Roya del cafeto Antracnosis del mango Cenicilla del mango Malformación del mango “Escoba de Bruja” Antracnosis del aguacate Roña del aguacate Tristeza del aguacate Mancha negra de la papaya Sigatoka negra del plátano 119 123 127 131 135 139 143 147 151 Literatura citada 155 Glosario 177 6 Prólogo Las enfermedades de las plantas han sido de los principales problemas que afectan la actividad agrícola desde sus orígenes, porque reducen el rendimiento y también la calidad de los productos, además de que llegan a incrementar significativamente los costos de producción, por lo que la rentabilidad de la empresa agrícola puede verse afectada. Para los pequeños agricultores que explotan el minifundio tradicional, este problema puede afectar significativamente su calidad de vida. En la actualidad, especialmente en los cultivos horto-frutícolas, es muy importante producir con buenas prácticas agrícolas con el fin de reducir la presencia de residuos de agroquímicos por exigencias propias del mercado, incluso se obtienen pagos diferenciados por tolerancia cero, como en el caso de los productos orgánicos. La presente publicación puede convertirse en una valiosa herramienta, que ayude a conocer mejor el proceso de desarrollo de enfermedades importantes de algunos cultivos de México, tanto a los productores como a los agentes de cambio involucrados en la sanidad vegetal, para contribuir a la toma de mejores decisiones en su manejo y control. ING. JAVIER VALENZUELA LAGARDA Gerente del Comité Estatal de Sanidad Vegetal de Sonora 7 Influencia de la temperatura y humedad en el desarrollo de enfermedades Desde tiempos inmemoriales se sabe de la influencia de las variables del clima en el desarrollo de las enfermedades de las plantas cultivadas, pero realmente durante el siglo XX se iniciaron los estudios en forma más cuantitativa. Derivado del mejor conocimiento del ciclo biológico de los patógenos, los avances trascendentales de la fisiología vegetal y el desarrollo de dispositivos de medición de mejor precisión, por lo que se conoce de mejor manera la interacción planta-ambiente. Los efectos de la temperatura y humedad sobre las enfermedades de las plantas son complejos, debido a que inciden sobre el comportamiento de la planta, el patógeno y sus interacciones (Lucas et al., 2001), lo cual se ha tratado de simplificar en un esquema interactivo llamado triángulo de las enfermedades, que se detalla en el Cuadro 1. Temperatura. Las plantas al igual que los patógenos requieren ciertos rangos óptimos de temperatura, siendo este el factor más importante, que determina la presencia o ausencia de las enfermedades, así mismo esta afecta la incubación (tiempo entre la infección y la aparición de síntomas de la enfermedad), el tiempo de infección (periodo entre la infección y esporulación), y el periodo reproductivo (tiempo en que el patógeno mantiene la producción de propágulos). El ciclo de las enfermedades se acelera a mayor temperatura, provocando un desarrollo más rápido de las epidemias, aunque también depende en gran parte de las interacciones que se den entre planta-patógeno (Gupta, 2004; Fry, 1982; Khan, 2001). 9 Enfermedades Importantes de Algunos Cultivos de México Cuadro 1. Factores que determinan el desarrollo de las enfermedades de las plantas. Patógeno Presencia Patogenicidad Hospedera Susceptibilidad Estado de desarrollo Adaptabilidad Arreglo topológico y densidad de población Sanidad del cultivo Eficiencia de dispersión Eficiencia de sobrevivencia Aptitud reproductiva Ambiente Variables clima Temperatura, humedad (humedad relativa, lluvia, punto de rocío) Duración del período húmedo de la hoja Características del suelo Velocidad y dirección del viento http://bugs.bio.usyd.edu.au La humedad de la hoja y la temperatura ambiental, pueden predecir brotes de algunas enfermedades (períodos de infección) y puede utilizarse para tratamientos preventivos. Un aspecto recientemente reconocido del ambiente que puede influir en el desarrollo de una enfermedad en las plantas es la contaminación del aire, ya que una alta concentración de contaminantes puede afectar el desarrollo de la enfermedad y, en casos extremos, dañar las plantas como es el caso de la lluvia ácida. Humedad relativa. Otro de los factores principales para el desarrollo de la mayoría de las enfermedades especialmente en hongos y bacterias es la humedad relativa, la cual influye significativamente en la epidemiología de los patógenos, desde la esporulación, infección y diseminación, existiendo grupos 10 Enfermedades Importantes de Algunos Cultivos de México de patógenos que son extremadamente dependientes del contenido de humedad del ambiente (Agrios, 2005; Huber y Gillespie, 1992). 11 FICHAS DESCRIPTIVAS Enfermedades Importantes de Algunos Cultivos de México Roya de la hoja del trigo Puccinia triticina Erikson Sinónimos: (Puccinia dispersa f. sp. tritici Erikss. & E.Henn. 1894); Puccinia recondita f. sp. tritici (Eriks. & E.Henn.) D.M.Henderson. Javier Valenzuela Lagarda. CESAVE-Sonora Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Puccinia Especie triticina HOSPEDEROS: Es una enfermedad fungosa que afecta los tallos y hojas en los cultivos de trigo, triticale, cebada y centeno. 15 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: Es una de las enfermedades más destructivas y ampliamente distribuida del trigo. Si la infección es severa afecta la calidad del grano al bajar el contenido de proteína (Burleigh et al., 1972). Se dice que puede llegar a afectar hasta el 20% del rendimiento, pero si coinciden condiciones ambientales favorables y el uso de una variedad susceptible, los daños pueden ser mayores (50%). SINTOMAS: La enfermedad puede aparecer en cualquier etapa del cultivo y se caracteriza por la presencia de pústulas pequeñas de color café-rojizo, las cuales aparecen principalmente en las hojas. Bajo condiciones ambientales extremadamente favorables, las pústulas pueden observarse en aristas, glumas, pedúnculos y entrenudos. Las uredias pueden desarrollar en ambas caras de las hojas, pero generalmente son más numerosas en el haz y a medida que la planta madura van siendo más numerosas en la hoja bandera; al mismo tiempo, las uredias van siendo reemplazadas por las telias. En infecciones fuertes las hojas se tornan amarillas y se secan. Si la infección es muy severa durante el amacollamiento, la planta puede morir sin producir espiga. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Invernación: En el norte de México lo hace en forma de urediosporas o micelio en letargo sobre trigos. Las infecciones que ocurren a partir de las formas invernantes que empiezan a aparecer generalmente durante febrero hasta principios de marzo Cinco tipos de esporas se forman en el ciclo de vida, urediosporas, teliosporas y basidiosporas en las plantas de trigo y picniosporas y aeciosporas en las hospederas alternantes. El hongo produce basidiosporas a partir de las teliosporas y estas infectan a la hospedera alternante Thalictrum spp. y como resultado se producen las picnias en la parte superior de las hojas. En las picnias aparece un exudado gomoso el cual contiene picniosporas (+) y (-). Los insectos pueden transferir picniosporas (+) a picnias (-) y se realiza la unión sexual. Por 16 Enfermedades Importantes de Algunos Cultivos de México debajo de las picnias se desarrollan las aecias (estado I) la cuales son binucleadas. Las aeciosporas son diseminados por el viento e infectan a la planta de trigo, produciéndose posteriormente las uredias (estado II). En estas estructuras se forman las urediosporas las cuales reinfectan al trigo y se encargan de diseminar la enfermedad en el cultivo. Al madurar la planta, las uredias son reemplazadas por las telias (estado III) las cuales aparecen en las hojas y en la paja en el mismo lugar en que estaban las uredias. Las teliosporas son biceluladas y es el hibernante, estos después de estar expuestos al frio producen un basidio corto sobre el cual se producen las basidiosporas. Diseminación: Su diseminación es por el viento en forma de urediospora y puede ser muy rápida cuando las condiciones ambientales son favorables. Un solo uredinio puede producir unas 3,000 esporas al día durante un período de 20 días (Stubbs et al., 1986), después del período inicial de latencia de 7-10 días. La diseminación a larga distancia de las urediosporas está influenciada por la latitud y los patrones de viento respectivos. En general, las esporas se mueven al oeste debido a que los vientos resultan de la rotación de la tierra. A mayores latitudes los vientos tienden a ser dominantes hacia el sur en el hemisferio norte y al norte en el hemisferio sur (Singh et al., 2002). Los estudios realizados en Estados Unidos (Roelfs, 1985) muestran que los movimientos de esporas van del suroeste hacia el noreste, al norte de la latitud de los 30 °N. Penetración: Las urediosporas germinan formando un apresorio y penetran a través de los estomas. Posteriormente se forman haustorios los cuales se localizan en las células del parénquima, formando micelio. La infección a partir de las urediosporas puede ocurrir en 4 ó 6 horas, produciendo las pústulas en un lapso de 7 a 10 días (Ávila, 1983). 17 Enfermedades Importantes de Algunos Cultivos de México Condiciones favorables: La humedad es un factor indispensable para la germinación de las urediosporas y la infección, lo cual se da mejor con rocío (>80% de humedad relativa), además de temperaturas frías y el rocío asociado a noches de temperaturas frescas (promedio de 15-22 ºC) (Jiménez, 2008). La germinación de las urediosporas ocurre a temperaturas de 2 a 30°C con un óptimo de 20°C (Roelfs et al., 1992). La producción de urediosporas a partir de un sitio de infección ocurre en 6 días si la temperatura está en un rango de 22 a 28°C. DISTRIBUCION GEOGRÁFICA: Generalmente ocurre en cualquier área donde se siembre trigo, pero su incidencia y severidad está regulada por la susceptibilidad de las variedades y las condiciones ambientales. En México, los estados que siembran mayores superficies de trigo son Sonora, Baja California, Chihuahua, Guanajuato y Jalisco (SNIDRUS, 2012). 18 Enfermedades Importantes de Algunos Cultivos de México Carbón parcial del trigo Tilletia indica (Mitra, 1931) Sinónimos: Neovossia indica (Mitra) Mundkur Guillermo Fuentes Dávila. INIFAP-CENEB Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Ustilaginales Familia Tilletiaceae Género Tilletia Especie indica HOSPEDEROS: Trigo, centeno y triticale. IMPORTANCIA ECONÓMICA: Típicamente el hongo infecta sólo algunos granos por espiga y la enfermedad solamente se 19 Enfermedades Importantes de Algunos Cultivos de México desarrolla en una parte de los granos infectados por lo que de ahí se deriva su nombre. La enfermedad también se conoce como el carbón de Carnal (hoy Punjab), ya que en esa localidad de la India fue descubierto en 1935 (Wiese, 1977). Posteriormente se ha encontrado en amplias zonas del norte de la India, Pakistán, Nepal, Irán y en algunas partes de México (Duran, 1972) y del Sur de los Estados Unidos. Aunque el daño directo sobre el rendimiento y la calidad es mínimo, se estimó en 1990 que la presencia de la enfermedad en nuestro país ocasionaba pérdidas de alrededor de 7.2 millones de dólares anuales, mayormente derivadas de las cuarentenas que evitaban la exportación del grano (Figueroa, 2004), ya que es inaceptable para alimento humano, cuando la infección supera el 3%, pues afecta las características organolépticas de la harina (Peña et al., 1992). SÍNTOMAS: Los síntomas únicamente se pueden observar en el grano por lo que esta enfermedad solo puede detectarse hasta etapas cercanas a la cosecha (después del grano masoso) (Castro et al., 2005). Las infecciones en las diferentes espigas de la planta son independientes entre sí, por lo que generalmente no todas las espigas ni todos los granos de la espiga son afectadas, es decir están distribuidos al azar (Fuentes, 1997). Un síntoma, no muy consistente es que las espigas de plantas infectadas tienen un tamaño reducido y un número menor de espiguillas. Los síntomas raramente son visibles en la espiga, por lo que es necesario trillarla para saber si hay gran infectado. Los granos infectados se detectan mediante una inspección visual, aunque en apariencia están normales. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: El hongo hiberna en forma de teliospora, siendo esta la primer fuente de la enfermedad, dichas esporas llegan al trigo al momento de la floración, provocando la infección inicial. 20 Enfermedades Importantes de Algunos Cultivos de México Penetración: Se inicia cerca del embrión del grano, extendiéndose por la sutura, dependiendo del grado de infección, pero dejando al pericarpio parcialmente intacto. El embrión solo se daña cuando el nivel de infección en el grano es severo. La porción afectada del grano se sustituye por la teliospora del hongo, dándole a la lesión un color de café oscuro a negro. El nivel de daño puede variar desde una infección apenas apreciable alrededor del embrión hasta la destrucción casi total del grano, y no avanza después de que el grano madura. Diseminación: La diseminación de teliosporas puede suceder a través de la semilla o grano infectado, suelo, maquinaria o vehículos infectados, o a través del viento. Aunque el tamaño y forma de estas teliosporas sugiere que la capacidad de dispersión por el viento es limitada, se han encontrado teliosporas hasta 3,000 metros de altura de campos donde se quema la paja después de la cosecha. Un medio de diseminación adicional puede ser a través de los animales, pues se ha observado que las teliosporas germinan aun después de ser ingeridas por chapulines y ganado. Invernación: Las teliosporas que se producen en el grano infectado son estructuras de sobrevivencia del hongo. Toman su coloración café oscura conforme maduran, por lo que las esporas inmaduras son desde incoloras, amarillentas hasta café claro. Su forma es generalmente esférica, pero las hay también ligeramente ovales, y las inmaduras varían desde esféricas a angulares, su tamaño varía entre 27 y 60 micras. Las teliosporas germinan después de un periodo dormancia, ocurriendo la mayor tasa de germinación en teliosporas de un año de edad. Se ha determinado que las teliosporas han permanecido viables en condiciones de laboratorio hasta por 5 a 7 años. Persisten en el suelo y sobre la semilla. Son resistentes a temperaturas extremas y tratamientos químicos, y pueden sobrevivir hasta más de 3 años en el suelo, lo que dificulta su control (Fuentes, 1992; Krishna y Singh, 1983). 21 Enfermedades Importantes de Algunos Cultivos de México Condiciones favorables: Las teliosporas germinan en respuesta a la humedad ambiental de febrero y marzo, específicamente en el período de espigamiento-floración. La germinación de las teliosporas requiere de temperaturas entre 5 y 30 °C, siendo las óptimas entre 15 y 25 °C. La germinación de las teliosporas requiere al menos 82% de humedad relativa (agua libre), condición que se observa con días frecuentes de rocío, por al menos 2 a 3 semanas, en que el cultivo de trigo está en la etapa de floración (Aujla et al., 1977). La gran variabilidad entre años de la incidencia de la enfermedad en el Sur de Sonora, se explica en gran medida por la presencia o ausencia de estas condiciones meteorológicas. DISTRIBUCION GEOGRÁFICA: En México la presencia del carbón parcial del trigo se detectó por primera vez en el Valle del Yaqui, Sonora, a finales de los años 60´s, sin embargo la primera epifitia que llamó la atención ocurrió en 1983 (Fischer, 1992). La identificación del agente causal se realizó hasta 1972, y no se le consideró de importancia económica hasta la década de los ochentas cuando empezó a alcanzar niveles epidémicos en el Sur de Sonora. Durante la cosecha del ciclo 1981-82 se realizaron los primeros muestreos masivos de grano de trigo en centros de acopio en los Valles del Yaqui y Mayo, muestreos que se continúan haciendo anualmente. En el ciclo 1983-1984, se detectó la enfermedad por primera vez en el norte de Sinaloa y en Baja California Sur. En México fuera del estado de Sonora, Sinaloa y Baja California Sur se han registrado brotes de la enfermedad en el estado de México y el Bajío. 22 Enfermedades Importantes de Algunos Cultivos de México Roya lineal o amarilla del trigo Puccinia striiformis f.sp. tritici Sinónimos: Puccinia striiformis var. striiformis Westend. (1854); Puccinia glumarum; Puccinia straminis; Trichobasis glumarum http://en.wikipedia.org Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Familia Género Especie Uredinales Pucciniaceae Puccinia striiformis f.sp.tritici HOSPEDEROS: Es una enfermedad muy importante en trigo y cebada, que afecta moderadamente a triticale y centeno (Zillinsky, 1983). 23 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Las pérdidas económicas de esta enfermedad son del orden del 30% de la cosecha (Bux, 2012), pero si durante un mes existen condiciones favorables y se conjunta con cultivares susceptibles, los daños pueden ser hasta del 100% (Singh et al., 2002; Chen, 2005). SÍNTOMAS: En las hojas jóvenes, antes del amacollamiento, las pústulas se disponen sobre la lámina sin orden, semejándose mucho a las de P. triticina, pero después de este periodo las lesiones son inconfundibles; sobre la lámina aparecen manchas pálidas o cloróticas alargadas, que se muestran como las nervaduras, sobre las que se destacan luego, pequeñas pústulas globosas u ovales, que se disponen en series continuas y paralelas entre sí, dominando especialmente la cara inferior de la hoja. La epidermis se rompe y dejan escapar un polvo amarillento. Sobre las vainas y tallos se observan las mismas pústulas con la misma disposición pero en menor número. En ataques graves afecta a la espiga que adopta una coloración amarillo oro que las distingue de las sanas. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Las urediosporas son la única fuente de infección conocida para el trigo y germinan e infectan a temperaturas frescas; la temperatura óptima se sitúa entre los 9 y 13°C (Roelfs et al., 1992; Singh et al., 2002). En promedio, estas temperaturas son unos 10 ºC más bajas que las que requiere la roya de la hoja; por consiguiente, la roya lineal es una enfermedad de latitudes más septentrionales o meridionales y de zonas altas. Las uredias esporulantes sobreviven a una temperatura de -4°C y las infecciones incipientes pueden persistir mientras perdure la hoja hospedante. Pueden presentarse infecciones con temperaturas cercanas al punto de congelación o por debajo de éste (Hogg et al., 1969). La esporulación y la infección se producen cuando las 24 Enfermedades Importantes de Algunos Cultivos de México temperaturas diurnas llegan a los 5°C (Zadoks et al., 1985). P. striiformis parece ser más sensible a la luz ultravioleta y la contaminación atmosférica que las otras royas (Sharp, 1967; Stubbs, 1985). Las urediosporas son de color amarillo a naranja, de forma más o menos esféricas con 28 a 34 µm de diámetro. Estrechas franjas negras se forman en las hojas durante el desarrollo telial. Las teliosporas son de color marrón oscuro de dos células y similar en tamaño y forma a los de P. triticina. Las poblaciones pueden cambiar en virulencia y provocar epidemias independientemente de un hospedero alternativo. Condiciones favorables: En concordancia con la información de Zadoks et al., (1985), en cuanto a los requerimientos de temperatura para el desarrollo del hongo, estudios realizados por Jiménez (2008) del Sistema de Alerta Fitosanitaria del Estado de Sonora, señalan que relacionó las infecciones de ésta enfermedad con las variables del clima (temperatura y humedad), encontrando una alta correlación con datos menores a 6ºC en conjunto con humedad relativa mayor a 80% durante 4 horas continuas. DISTRIBUCIÓN GEOGRÁFICA: La roya amarilla es más común en terrenos de gran altitud, de clima fresco y regiones templadas donde se produce trigo (Johnson, 1992; Boyd, 2005), pero en Norteamérica se presenta anualmente en las montañas y valles del oeste de Canadá y México, pero no es frecuente en las planicies centrales (Wiese, 1977). Algunos autores señalan que en México es común en Sonora y Guanajuato. 25 Enfermedades Importantes de Algunos Cultivos de México Roya del tallo del trigo Puccinia graminis f.sp. tritici (Erikson y Henning) Sinónimos: Puccinia graminis Pers., (1794) Puccinia cerealis; Puccinia albigensis; Puccinia linearis; Dicaeoma anthistiriae Yue Jin. USDA-ARS. USA. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Puccinia Especie graminis tritici HOSPEDEROS: El trigo, cebada y triticale, además de algunas cebadas nativas (Wiese, 1977). Como en otras especies de Puccinia, es un biotrófico obligado y tiene un complejo ciclo de vida con alternancia de generaciones. El hongo es heteroico, requiriendo de dos hospederas para completar su ciclo de vida. Las principales hospederas alternantes son el agracejo Berberis vulgaris, Mahonia spp., y Mahoberberis spp. (Roelfs, 1985). 27 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIAECONÓMICA: Sus daños han sido históricamente importantes, alcanzando hasta el 90 % en algunas regiones de Estados Unidos. SÍNTOMAS: Se caracteriza por pústulas alineadas que se elevan de la epidermis del tallo del trigo y base de las hojas principalmente. Inicialmente son de color rojo ladrillo (uredias) y posteriormente son de color negro (telias). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Las aeciosporas y urediosporas germinan y penetran el trigo a través de los estomas. Las urediosporas germinan 30 minutos después del contacto con el agua del rocío a temperaturas de 15° a 25°C (Rowell, 1981, 1982). Las basidiosporas penetran por la cutícula al agracejo. Las esporas son diseminadas por el viento, teniendo mayor capacidad de diseminación las urediosporas que llegan a desplazarse a miles kilómetros (Ávila, 1983). Las teliosporas sobreviven en la paja de trigo durante el invierno en Canadá y E.U. Condiciones favorables: Dentro de los factores del clima que favorecen la germinación de las esporas están temperaturas entre 2 y 30 ºC con óptimo de 15 a 24 ºC (Singh et al., 2002; Hogg et al., 1969), siendo esencial la presencia de agua libre (humedad relativa >80%). La roya del tallo difiere de la roya de la hoja en requerir un período más largo de rocío (seis a ocho horas es necesario). Además, la penetración de los ganchos de los apresorios no se desarrolla a menos que sea estimulada por intensidad de luz superior a 10 mil luxes durante un periodo de tres horas. La máxima infección se obtiene con 8 a 12 horas de rocío a 18 °C seguido de intensidades de luz superiores a 10 mil luxes (Rowell, 1982). DISTRIBUCIÓN GEOGRÁFICA: La enfermedad se presenta en todas las regiones trigueras de México, siendo más importante en los sitios moderadamente lluviosos y en regiones secas en los años lluviosos. 28 Enfermedades Importantes de Algunos Cultivos de México Carbón del maíz (“huitlacoche”) Ustilago maydis (DC) Corda 1842. Sinónimo: Ustilago maydis (Persoon) Roussel; Ustilago zeae Mariana Kandus. Universidad de Buenos Aires, Argentina. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Ustilaginales Familia Ustilaginaceae Género Ustilago Especie maydis 29 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: Maíz (Zea mays L.) y Teosinte (Zea mays ssp parviglumis). IMPORTANCIA ECONÓMICA: La reducción de las cosechas depende de la intensidad de la infección. Las pérdidas han sido mayores en regiones secas y de clima caliente. Normalmente infecta entre 1 y 5 % de las plantas de un cultivo (Ruiz, 2008). En general, las pérdidas oscilan entre 2 y 15%. El daño puede ser más fuerte en maíces dulces, para consumo en fresco. SÍNTOMAS: Los síntomas corresponden a tumores o agallas, que representan los signos del hongo, los cuales varían en tamaño desde menos de 1 cm hasta más de 30 cm de diámetro. Todos los tejidos meristemáticos son susceptibles a la infección. Las agallas se encuentran con mayor frecuencia en las mazorcas, tallos, espigas, yemas axilares y en medio de nervaduras de las hojas (Aldrich et. al., 1975). A pesar de que pueden formar agallas en muchas de las partes aéreas de la planta, la infección es local (es decir, el anfitrión no es colonizado sistémicamente). En ocasiones, las agallas se desarrollan debajo de la superficie del suelo cuando el meristemo apical de una planta joven está infectado (Pataky y Snetselaar, 2006). Al inicio las agallas son de color blanco con una cubierta de peridermo brillante. Conforme las agallas maduran, el tejido interior se convierte semicarnoso, con cavidades de tejidos negros que contienen las teliosporas que se empiezan a formar. Al madurar las agallas, el tejido se convierte en una masa de teliosporas polvorienta (color negro) y las rupturas del peridermo provocan la liberación de esporas (21 a 23 días después de la infección). Las agallas generalmente son evidentes dentro de 10 a 14 días después de la infección. En las mazorcas las agallas maduran de una a tres semanas después de que los ovarios están infectados. 30 Enfermedades Importantes de Algunos Cultivos de México CICLO DE LA ENFERMEDAD Y EDPIDEMIOLOGÍA: El ciclo biológico del hongo se inicia al germinar las teliosporas que son equinuladas, esféricas y negras, produciendo un promicelio tabicado portador de esporidios (basidiosporas) unicelulados y uninucleados. Al fusionarse dos esporidios compatibles, producen un micelio binucleado que es el que penetrará a la hospedera. En ocasiones la formación del micelio binucleado se retrasa, hasta después de la penetración a la hospedera de dos hifas uninucleadas procedentes de esporidios simples, que se fusionarán dentro del huésped. La producción del micelio binucleado es esencial para el avance del hongo generalmente en forma intercelular, formándose las teliosporas dentro de los tabiques del micelio (por esta característica las teliosporas son llamadas clamidosporas, pero es incorrecto, porque las clamidosporas son esporas asexuales). Se han reportado numerosas razas fisiológicas del patógeno (Ávila, 1983). Penetración: El patógeno penetra a los tejidos directamente o a través de heridas. Diseminación: La diseminación es realizada por viento y agua que acarrean las basidiosporas procedentes de plantas infectadas. El hongo puede también diseminarse a través de suelo contaminado o por el estiércol, por la característica de poder adaptarse a la vida saprofítica. Invernación: El hongo inverna como teliosora diploide en residuos de cosecha en el suelo. Christensen (1963) estimó que una agalla de tamaño medio, puede contener hasta 200 mil millones de esporas. Condiciones favorables: Para la germinación de teliosporas y basidiosporas, así como para la infección, un clima seco con temperaturas entre 26 y 34°C se considera adecuado (IPM, 31 Enfermedades Importantes de Algunos Cultivos de México 2012). Suelos con alto contenido de nitrógeno, favorecen también su desarrollo. Las condiciones de humedad apropiadas para la producción de maíz, son suficientes para la germinación de esporas y la infección. DISTRIBUCION GEOGRÁFICA: La enfermedad distribución mundial a excepción de Australia. 32 es de Enfermedades Importantes de Algunos Cultivos de México Mancha foliar del maíz Setosphaeria turcica (Luttr.) K.J. Leonard & Suggs, (1974) Sinónimos: Bipolaris turcica (Pass.) Shoemaker, (1959); Drechslera turcica (Pass.) Subram. & B.L. Jain, (1966); Helmintosporium turcicum Pass., (1876) Helminthosporium inconspicuum Cooke & Ellis, (1878) Keissleriella turcica (Luttr.) Arx, Gen. (1970) M.A. Apodaca.UAS-Los Mochis, Sinaloa. Clasificación científica División Eumycota Subdivisión Ascomycotina Clase Loculoascomycetes Orden Pleosporales Familia Pleosporaceae Género Setosphaeria Especie turcica 33 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: También afecta al maíz dulce, sorgo, zacate Johnson, teosinte y zacate sudán, zacate bermuda (Elliott y Harmon, 2011). IMPORTANCIA ECONOMICA: La reducción del rendimiento depende de la intensidad de la infección, pero se han identificado daños del orden del 70% (CIMMYT, 2004), especialmente cuando se presenta antes de la emisión de los estigmas. SÍNTOMAS: Los primeros síntomas se presentan como manchas ovaladas y acuosas en las hojas inferiores y avanza gradualmente hacia las superiores (Paliwai et al., 2001). En las hojas maduras las lesiones se asemejan a quemaduras por cigarro de 3 a 15 cm de largo, son de forma elíptica y de color canela, el desarrollo de distintas áreas oscuras a medida que maduran están asociados con la esporulación fúngica (Lipps y Mills, 2002). Las lesiones generalmente aparecen primero en las hojas inferiores, extendiéndose a las hojas superiores y las vainas de las mazorcas a medida que el cultivo madura. En infecciones graves, las lesiones pueden dañar la hoja entera (CIMMYT, 2004). Las lesiones pueden variar ligeramente en función del estado de resistencia del huésped. El desarrollo de lesiones en algunos híbridos con genes de resistencia puede incluir estrías cloróticas largos, que pueden confundirse con otras enfermedades como la marchitez de Stewart. El agente causal produce tallos diminutos que surgen de los estomas situados dentro del área de la lesión para dar lugar a esporas largas y multicelulares (Raid y Kucharek, 2006). Estos pueden ser observados con una lupa manual después de periodos de alta humedad. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: H. turcicum pasa el invierno como micelio y clamidosporas en los residuos de plantas infectadas. En el inicio de la temporada siguiente, los hongos 34 Enfermedades Importantes de Algunos Cultivos de México en los residuos de cultivos anteriores comienzan a esporular en respuesta a temperaturas más elevadas y la humedad. Las esporas (conidios) son entonces diseminadas por el viento y las salpicaduras de lluvia hacia el maíz recién sembrado. Los conidios se pueden llevar a grandes distancias por el viento, germinan a temperaturas de entre 17 a 27 °C y durante extensos períodos de humedad de la hoja (6 a 18 horas), infectan el tejido del huésped.La germinación de los conidios, penetración e infección se cumple en un lapso de 6 a 18 horas. Las manchas aparecen 8 a 12 días después de la infección, formándose en ellas los conidióforos y conidios para continuar el ciclo (Malaguti, 2000). Ciclos secundarios de la enfermedad se producen cuando los conidios de las lesiones de la enfermedad se diseminan en la cosecha y en otros campos por salpicaduras de la lluvia y el viento (CIMMYT, 2004). Condiciones favorables: Para el desarrollo de la enfermedad le son favorables alta humedad relativa (rocío o agua libre) y temperaturas entre 17 y 27 ºC. Por otra parte, la mínima labranza y no rotar cultivos con el maíz también favorecen a la enfermedad (Ruhl, 2007). DISTRIBUCION GEOGRÁFICA: Se presenta en casi todas las áreas productoras de maíz, aunque especialmente en climas fríos y tierras altas del trópico. 35 Enfermedades Importantes de Algunos Cultivos de México Ergot del sorgo Claviceps africana (Frederickson, Mantle and de Milliano) Sinónimo: Claviceps sorghi B.G.P. Kulk., (1976); Sphacelia sorghi McRae, (1917) www.daff.qld.gov.au Clasificación científica División Eumycota Subdivisión Ascomycotina Clase Pirinomycetos Orden Hypocreales Familia Clavicipetaceae Género Claviceps Especie africana HOSPEDERAS: Sorgo y zacate johnson. 37 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Bajo condiciones favorables puede afectarse hasta el 100% de la producción. SÍNTOMAS: La infección ocurre durante la floración, cuando el micelio de una espora invade el ovario de la florecilla y no permite la formación del grano, en su lugar se desarrollan las hifas que emergen de la superficie del ovario en masas brillantes, produciendo una secreción como mielecilla la cual a menudo se torna de color rosada y es conspicua en panículas infectadas, como gotitas pegajosas. Una flor fertilizada es inmune a la enfermedad (Workneh y Rush, 2002). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: El hongo sobrevive todo el año en el zacate johnson, plantas voluntarias del mismo sorgo, y en el sorgo forrajero. Las esporas se diseminan principalmente por el viento, pero también se dispersan a través de insectos, animales, seres humanos y maquinaria. La labranza del suelo, quema de rastrojos y rotación de cultivos tienen poco efecto sobre la supervivencia (Ryley, 2011). El ergot es una enfermedad causada por un hongo que infecta los ovarios de las flores del sorgo y los convierte a menudo en una masa blanca de hongos (esfacelio). El síntoma más evidente de infección es externo, al observarse una exudación abundante de flores infectadas de un color ámbar, semejante a un líquido pegajoso (“enmielado”) que a menudo gotea sobre las hojas y el suelo. Las esporas del hongo (conidias) se encuentran dentro de la melaza, y cuando éstas germinan, producen esporas secundarias en la superficie de la melaza, dándole un color blanco espuma de aspecto pulverulento. El viento propaga rápidamente estas esporas secundarias a largas distancias. El hongo puede ser también diseminado por semillas contaminadas con esfacelio o melaza. Bajo ciertas condiciones, C. africana produce unas estructuras fúngicas 38 Enfermedades Importantes de Algunos Cultivos de México muy compactas y duraderas llamado esclerocios (Krausz y Isakeit, 1998). Temperaturas frescas (promedio mínimo diario < 12.8 ºC) que se presenten 3 a 4 semanas antes floración pueden inhibir el desarrollo del polen, mientras que las temperaturas frías que se presentan durante la floración hasta 5 días a partir de entonces, pueden retrasar la fertilización por la desaceleración del crecimiento del tubo polínico. Por lo tanto, los sorgos que se están madurando durante temperaturas frías del otoño, están en mayor riesgo de infectarse que aquellos que lo hacen en verano (Krausz y Isakeit, 1998). Condiciones favorables: La infección solo puede ocurrir si se presentan tres condiciones a la vez: la floración del sorgo, temperaturas templadas entre 19 y 21º C y una humedad relativa mayor a 70% (INIFAP, s/f). Si llueve durante la floración, debe revisarse la plantación de sorgo 10-14 días después, para comprobar si hay alguna infección, revisar particularmente en la periferia del terreno y al final del cultivo de frente a los vientos dominantes (Ryley, 2011). Otros autores señalan que el patógeno requiere cerca de 100% de humedad relativa durante 24 horas a 19.5 ° C para la infección óptima (Futrell y Webster, 1966; McLaren y Wehner, 1990) y se dice que el desarrollo de la enfermedad es insignificante por encima de 28 a 30 °C. DISTRIBUCIÓN GEOGRÁFICA: El ergot ha existido en África durante décadas. Apareció en Brasil en 1995, y desde entonces se extendió rápidamente por todas las zonas sorgueras de América. Fue detectado por primera vez en Texas, E.U., en 1997, y durante ésa temporada, se propagó desde el Valle Bajo del Río Grande a las altas planicies de Texas, Kansas, Nebraska, Nuevo México y Georgia (Krausz y Isakeit, 1998). 39 Enfermedades Importantes de Algunos Cultivos de México En México en el área de El Bajío (Guanajuato, Querétaro, Michoacán y Jalisco) se presentó en siembras comerciales durante los meses de agosto y septiembre de 1997 (Torres y Montes, 1999 citados por Hernández-Martínez et al., 2001). 40 Enfermedades Importantes de Algunos Cultivos de México Roya del sorgo Puccinia purpurea Cooke, (1876) Sinónimos: Dicaeoma prunicolor (Syd., P. Syd. & E.J. Butler) Syd., (1922); Dicaeoma purpureum (Cooke) Kuntze, (1898); Puccinia andropogonis-hirti (Maire) Beltrán, (1921) Puccinia prunicolor Syd., P. Syd. & E.J. Butler, (1906); Puccinia sanguinea Dietel, (1897); Puccinia sorghi-halepensis (Pat.) Speg., (1914). Luciano Viana Cota. EMBRAPA. Brasil. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Puccinia Especie purpurea 41 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: Además del sorgo y maíz para grano, el zacate johnson. En Estados Unidos se presenta en el zacate citronela (Cymbopogon citratus), Oxalis corniculata, algunos zacates de la familia Poaceae, el zacate columbus (Sorghum almum) y también en el zacate sudán (S. sudanense). IMPORTANCIA ECONÓMICA: La roya causada por Puccinia purpurea bajo condiciones ambientales favorables produce panículas y granos de mala calidad, ocasionando pérdidas hasta del 65% (Díaz, 2009). SÍNTOMAS: Los síntomas típicos de roya se expresan en plantas de 1.5 a 3 meses de edad, sobre ambas superficies de la hoja aparecen manchas púrpura o rojas, el color depende de la pigmentación de la variedad. Hay cultivares que responden con reacciones de hipersensibilidad pero en aquellos más susceptibles los puntos se agrandan para formar pústulas rojizas oscuras que yacen paralela y entre las nervaduras (Díaz, 2009; Plantwise, s/f). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Las esporas de P. purpurea tienen corta vida ante la ausencia del hospedante vivo. Varios hospedantes perennes y plantas de sorgo voluntarias proveen las urediosporas, algunas veces provienen de grandes distancias que funcionan como inicial. Es una roya heteróica cuyo hospedante alternativo es Oxalis corniculata (Díaz, 2009). Los uredinios se desarrollan como estructuras pequeñas y elevadas y cubiertas por la capa epidérmica de color marrón que se rompe para exponer el color rojizo a castaño oscuro, de la masa pulverulenta de urediosporas, que son arrastradas por las corrientes de aire. Los uredinios son elípticos, similares a una ampolla de hasta 2 mm de largo, y son paralelas a la nervadura (Pavgi, 1972). A medida que la enfermedad progresa, algunos uredinios se convierten en telias y desarrollan las teliosporas. Nuevas telias 42 Enfermedades Importantes de Algunos Cultivos de México se forman aisladas y se producen en ambas superficies foliares, especialmente en la superficie inferior. Las telias son negruzcas y son elíptico-oblongas a lineares de hasta 3 mm de largo (Plantwise, s/f). Condiciones favorables: Le favorecen el ambiente húmedo y fresco. DISTRIBUCIÓN GEOGRÁFICA: Se encuentra en todas las áreas productoras de sorgo del mundo, especialmente en las húmedas y frescas. 43 Enfermedades Importantes de Algunos Cultivos de México Carbón cubierto del sorgo Sphacelotheca sorghi (Link) Clinton Sinónimos: Sporisorium sorghi; Cintractia sorghi-vulgaris (Tul. & C.Tul.) G.P.Clinton (1897); Tilletia sorghi-vulgaris Tul. & C.Tul. (1847) Mallikarjun Kenganal.Karnataka, India. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Ustilaginales Familia Ustilaginaceae Género Sphacelotheca Especie sorghi 45 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: Ataca a todos los grupos del sorgo, incluyendo el zacate johnson y zacate sudan. IMPORTANCIA ECONOMICA: Actualmente esta enfermedad no está muy generalizada, sin embargo puede ocasionar daños severos en casos particulares. En general se dice que puede haber pérdidas hasta del 60% bajo condiciones adecuadas de desarrollo para el patógeno (Smith et al., 1988). De acuerdo a Tisdale et al., (1927) y Melchers et al., (1935) citados por Reed (1935) existen entre 2 y 5 razas del hongo. SÍNTOMAS: La enfermedad está confinada únicamente a la panoja. Generalmente, los daños no abarcan a la totalidad de los granos pudiéndose tener granos sanos en una panoja dañada. El síntoma característico de la enfermedad es la presencia de agallas (sori) las cuales reemplazan a los granos. Las agallas están cubiertas por una membrana delgada de color gris observándose en su interior un gran número de esporas (teliosporas y clamidosporas) (Univ. de Illinois, 1990). Al momento de la cosecha, se rompen las agallas y diseminan a la teliosporas, las cuales infestan a la semilla sana. En una misma panoja se pueden tener granos sanos y granos infectados. Las panojas principales pueden no tener la enfermedad, si las células superiores del meristemo apical no fueron invadidas (Tarr, 1962). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: Es efectuada por las hifas de los esporidios a través del coleoptilo al germinar la semilla. Diseminación: Las teliosporas infestan a la semilla durante la cosecha y de esta manera el hongo es diseminado a largas distancias. Igualmente las teliosporas son diseminadas por el viento. Cuando se siembra una semilla infestada, las teliosporas (4-7 micras de diámetro) germinan generando un promicelio que cubre la semilla y forma un esporidio que infecta la pequeña plántula. 46 Enfermedades Importantes de Algunos Cultivos de México Invernación: Las teliosporas invernan en la superficie de la semilla. Las teliosporas que permanecen en el suelo no son de importancia en el desarrollo de la enfermedad. Condiciones favorables: El hongo vive sobre la semilla en forma de teliospora. Cuando la semilla se siembra, la teliospora germina y forma un basidio que da lugar a los esporidios distribuyéndose el micelio interiormente. Posteriormente el hongo se disemina sistémicamente, invadiendo a las flores al momento de su formación, por lo que los granos son reemplazados por pequeñas agallas llenas de esporas (teliosporas). En general la temperatura óptima es de 10 a 32 ºC, pero la germinación de las esporas varía morfológicamente bajo un óptimo de 20 a 23 ºC y permanecen viables hasta por 4 años en condiciones secas (Kranz et al., 1977, Paul, 1980 citados por Sisay et al., 2012). La enfermedad es muy agresiva durante la germinación y emergencia de plántulas, por lo que temperaturas de 20 a 25ºC son fatales para el cultivo (Smith et al., 1988). DISTRIBUCION GEOGRÁFICA: Puede presentarse en cualquier área dedicada al cultivo del sorgo. 47 Enfermedades Importantes de Algunos Cultivos de México Antracnosis del frijol Colletotrichum lindemuthianum (Sacc. & Magnus) Briosi & Cavara, (1889). Sinónimos: Gloeosporium lindemuthianum Sacc. & Magnus, (1878); Glomerella cingulata f.sp. phaseoli; Glomerella lindemuthiana Shear [como ‘lindemuthianum’] (1913). Gerald Holmes. Valent USA Corporation Clasificación científica División Eumycota Subdivisión Deuteromycotina Clase Coelomycetos Orden Melanconiales Familia Melanconiaceae Género Collectotrichum Especie lindemuthianum 49 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: Además del frijol (Phaseolus vulgaris), ataca al frijol lima (P. lunatus), chícharo de vaca (Vigna sinensis), frijol tépari (P. auctifolius var. Latifolius), P. coccineus y P. aureus entre otras (Ávila, 1983; Dillard, 1988). IMPORTANCIA ECONOMICA: En la mayor parte de las zonas productoras de frijol de México, se le considera como la enfermedad más importante, estando favorecida por condiciones de humedad relativa alta y temperatura baja. Se ha observado en la mesa Central, Bajío, Chihuahua, Durango y Zacatecas. Si no se maneja adecuadamente la enfermedad, pueden producirse pérdidas del 100% de cultivo (Edmunds y Holmes, 2007), especialmente si no se utiliza semilla sana (Schwartz, 1991). SINTOMAS: La enfermedad aparece en cualquiera de los órganos aéreos de la planta, aunque es más notoria en las vainas, observándose en sus inicios como lesiones color naranja, que se transforman en cánceres hundidos limitados por un anillo negro de hasta 1 cm de diámetro (Ávila, 1983), alcanzando la lesión hasta 1.2 cm de diámetro (Bush, 2009). Las semillas atacadas presentan lesiones teñidas en distintos tonos y en las plantas procedentes de estas semillas afectadas aparecen lesiones en los cotiledones. En presencia de humedad, en el centro de las lesiones puede observarse una masa de coloración rosa constituida por el micelio y esporas del hongo. El hongo produce micelio ramificado, tabicado y hialino cuando joven, volviéndose de color oscuro con la edad. La conidias son producidas en un acérvulo, son unicelulares, hialinas, cilíndricas, con extremos redondeados y miden 5 x 15 micras. La presencia del estado perfecto no ha sido confirmada. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Cuando germinan las semillas infectadas, las lesiones que aparecen sobre los cotiledones sirven como fuente de inóculo secundario. 50 Enfermedades Importantes de Algunos Cultivos de México Penetración: Mediante presión mecánica a través de la cutícula al quedar en contacto el patógeno con la hospedera. Durante el proceso de infección, el hongo atraviesa las células causando desintegración de los protoplastos. Diseminación: Es efectuada al llevar a cabo prácticas culturales en el cultivo bajo condiciones húmedas. La lluvia acompañada de vientos acarrea esporas distribuyendo la enfermedad. Los animales, insectos y el roce de las hojas, son otros factores de diseminación. El hongo se disemina a través de las semillas, el cual es un mecanismo muy eficiente (Dillard y Cobb, 1993), aunque también por aire y el agua (Schwartz, 1991). Invernación: El patógeno, subsiste como micelio en la semilla, en los restos de plantas infectadas que quedan en el terreno, pero no en el suelo (Yesuf y Sangchote, 2007). Condiciones favorables: Los factores ambientales que favorecen a la enfermedad son una humedad relativa superior al 92%, lo cual se da con lluvias moderadas frecuentes. De acuerdo a Mena y Velásquez (2010) la temperatura óptima es de 13 a 26°C, sin embargo, otros autores señalan como óptima entre 17 y 24 ºC [Lauritzen (1919) citado por Pastor,1989) ]. A temperaturas mayores de 33°C la infección no se realiza y temperaturas de 7°C reducen al mínimo el ataque (Mena y Velásquez, 2010). DISTRIBUCION GEOGRÁFICA: Posee casi distribución mundial, causando los daños más grandes en regiones de clima templado y zonas subtropicales. Se le considera como la enfermedad del frijol más importante en México por su severidad y su amplia distribución. En México, esta enfermedad ocurre en todas las regiones productoras de frijol, con excepción de regiones donde se cultiva bajo condiciones de riego durante la época seca en el invierno, como en la costa del Pacífico y las siembras de febrero en El Bajío (Rodríguez-Guerra et al., 2006). 51 Enfermedades Importantes de Algunos Cultivos de México Roya o “chahuixtle” del frijol Uromyces appendiculatus (Pers.) Unger var. appendiculatus Sinónimo: Uromyces phaseoli (Reben) Wint. Gerald Holmes. Valent USA Corporation. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Uromyces Especie appendiculatus HOSPEDERAS: Además de atacar al frijol (Phaseolus vulgaris) se ha reportado en el frijol lima (P. lunatus). 53 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Es una enfermedad considerada de importancia económica para este cultivo, especialmente cuando la infección se presenta en etapas tempranas, ya que las pérdidas pueden ser hasta del 100% (Mena y Velásquez, 2010), aunque algunos autores la consideran más agresiva en prefloración y floración (Stavely y Pastor-Corrales, 1989; CrispínMedina et al., 1976; Yoshii y Gálvez, 1975). SINTOMAS: Ataca principalmente a las hojas, pero también llega a infectar vainas, tallos y pecíolos (Stavely, 1991). Los síntomas se manifiestan inicialmente en el envés de las hojas como pequeñas manchas casi blancas y ligeramente elevadas en forma de pústulas (estado uredial). Bajo condiciones favorables estas manchas hacen erupción y forman un polvillo de color rojo ladrillo de 1 a 2 mm de diámetro, formando las pústulas características de la enfermedad. A medida que la enfermedad avanza, las pústulas iniciales cambian gradualmente a color negro correspondiéndole esta última fase a la producción de teliosporas que han reemplazado a la urediosporas. Es un hongo autoico, es decir, completa su ciclo biológico en una sola hospedera. La infección inicial es por medio de basidiosporas, las cuales fueron producidas al germinar las teliosporas. El estado aecial es raro en muchas regiones, pero cuando esto ocurre, el micelio emitido por las aeciosporas penetra a través de los estomas y desarrolla intercelularmente, enviando haustorios a las células parenquimatosas. Bajo condiciones favorables, el ciclo uredospórico se completa en 10 a 15 días. Las teliosporas son de color café oscuro, unicelulares y con paredes gruesas. Se conocen razas fisiológicas del hongo, considerándose que en México existen 31 razas identificadas (Ávila, 1983). 54 Enfermedades Importantes de Algunos Cultivos de México CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: Las basiodiosporas germinan y penetran directamente a través de la cutícula. Las aeciosporas y urediosporas germinan y penetran a la hospedera por los estomas. Diseminación: Al romperse la epidermis de una hoja infectada se liberan las urediosporas que son acarreadas por el viento o distribuidos por medio de los implementos agrícolas y por el hombre. El hongo no se transmite a través de la semilla. Invernación: El hongo subsiste de un ciclo a otro como urediosporas en regiones de invierno benigno y como teliosporas en las de invierno riguroso. Condiciones favorables: Dentro de los factores ambientales que favorecen a la enfermedad están temperaturas entre 17 y 27 ºC, y humedad relativa superior al 95% por un período de 10 a 18 horas (Augustin et al., 1972). Las temperaturas menores de 15 ºC retardan el desarrollo del hongo mientras que temperaturas mayores de 32 ºC pueden eliminarlo (Stavely y Pastor-Corrales, 1989). DISTRIBUCION GEOGRÁFICA: Ha sido encontrada en casi todas las partes del mundo. Posee amplia distribución causando serios problemas especialmente en lugares con humedad relativa alta. En México, algunos investigadores la consideran como una de las enfermedades más destructivas de este cultivo, habiéndose reportado en Chihuahua, Sonora, Coahuila, Tamaulipas, Durango, Sinaloa y Nayarit. 55 Enfermedades Importantes de Algunos Cultivos de México Tizón bacteriano del frijol Xanthomonas campestris pv. phaseoli (Smith) Dye Sinónimos: Xanthomonas axonopodis pv. Phaseoli (Smith) Vauterin et al; Xanthomonas fuscans (Burkholder) Burkholder; R.W. Samson. Purdue University. Bugwood.org Clasificación científica División Subdivisión Clase Orden Familia Género Especie Bacterias Gracillicutes Proteobacterias Pseudomonadales Pseudomonadaceae Xanthomonas campestris pv. phaseoli HOSPEDERAS: Además de Phaseolus vulgaris, P. mungo y P. aureus, también la soya (Glycine max). 57 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: La importancia de este tizón queda subrayada por la epidemia que durante 1967 afectó más de 200 mil hectáreas en el estado de Michigan, EUA, causando pérdidas de rendimiento entre 10 y 20% (Mena y Velásquez, 2010). SÍNTOMAS: Se presentan en hojas, tallo y vainas. Los primeros síntomas son pequeñas áreas acuosas, que gradualmente se alargan y se vuelven flácidas y posteriormente necróticas, que a menudo son rodeadas por un anillo color amarillo limón (Saettler, 1991). Posteriormente estas manchas se agrandan volviéndose de forma irregular, midiendo desde medio centímetro a más de dos centímetros. Los ejotes o vainas infectados presentan lesiones secas, hundidas de color rojizo. Las semillas pueden ser también infectadas, quedando de menor tamaño y arrugadas. Durante la germinación de la semilla, la bacteria invade el hipocotilo y se aloja en el tejido conductor, causando marchitez y muerte de las plántulas. Durante clima húmedo, pueden observarse exudados bacterianos de color amarillento sobre la superficie de las lesiones (Ávila, 1983). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: La bacteria puede penetrar al tallo de tres maneras distintas. A través de los estomas del hipocotilo y epicotilo; a través de los elementos vasculares que comunican con las hojas y a través del funículo, rafa e inclusive por el micrópilo. Si la bacteria invade el xilema, puede ser llevada hasta las hojas donde aparecen las manchas características de la enfermedad. En otras ocasiones, la bacteria puede penetrar a través de los estomas, se multiplica en la cavidad subestomática y produce enzimas pectolíticas que atacan al parénquima, disuelven la lámina media de las células produciéndose la maceración de tejido en esas porciones (Ávila, 1983). 58 Enfermedades Importantes de Algunos Cultivos de México Diseminación: La semilla contaminada constituye la mayor fuente de diseminación. Otros medios de diseminación son las partículas de suelo levantadas por el viento, el agua de riego, trabajadores, animales e insectos (moscas blancas y minadores). Algunas malas hierbas como los quelites pueden albergar a la bacteria y de allí los vectores pasarla a las plantas de frijol (Mena y Velásquez, 2010) . Invernación: La bacteria persiste de un ciclo de cultivo a otro, sobre y dentro de la semilla y en residuos de cosecha. Condiciones favorables: Le favorecen temperaturas entre 28 y 32 ºC, con humedad relativa superior al 95% (Saettler, 1987), pero en general las temperaturas y humedad relativa altas le favorecen (Sutton y Wallen, 1970). DISTRIBUCION GEOGRÁFICA: Ha sido reportada en México, Australia, Canadá, China, Francia, Hungria, Japón, Rusia, España, África del Sur y Uruguay. En los Estados Unidos prevalece en los estados al este de la Montañas Rocallosas, considerándose que en la región situada al oeste de las Montañas Rocallosas la bacteria no está establecida. 59 Enfermedades Importantes de Algunos Cultivos de México Tizón del halo del frijol Pseudomonas syringae pv. phaseolicola (Burkholder) Robert M. Harveson, University of Nebraska. USA. Clasificación científica División Subdivisión Clase Orden Familia Género Especie Bacterias Gracillicutes Proteobacterias Pseudomonadales Pseudomonadaceae Pseudomonas syringae pv. phaseolicola HOSPEDERAS: Es más común en frijol (Phaseolus vulgaris), pero también se ha observado en otros miembros de la tribu Phaseolaceae (Arnold et al., 2011). 61 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Se han reportado pérdidas en rendimiento de 23 hasta 43% en algunos lugares de E.U. como el estado de Michigan (Schwartz, 1989). SÍNTOMAS: Los síntomas foliares aparecen 3-5 días después de la infección, y se observan como pequeñas manchas acuosas en hojas, tallos, pecíolo y vainas, que posteriormente se vuelven oscuras, presentando una especie de anillo amarillo-verdoso (halo) alrededor de los puntos de infección, llegando a alcanzar los 12 mm de diámetro (Schwartz,1989; Saettler, 1991; Mena y Velásquez, 2010). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: La bacteria sobrevive en semilla infectada y residuos de cosecha que se encuentran en la superficie del suelo (Schuster y Coyne, 1975), y es diseminada a partir de los exudados a través del golpe de agua y viento que ocurren durante la lluvia. La bacteria penetra a través de heridas y estomas, en períodos de alta humedad relativa o agua libre (Saettler y Potter, 1970). Hospederos alternativos como la maleza y plantas voluntarias de inicio de ciclo, también pueden alojar a la bacteria (Legard y Schwartz, 1987). La bacteria se multiplica rápidamente cuando hay agua libre en la superficie del follaje con o sin la presencia de lesiones (Stadt y Saettler, 1981). Condiciones favorables: Las temperaturas que más le favorecen son aquellas que oscilan entre 16 y 20 ºC (Patel and Walker, 1963, citados por Schwartz, 1989), pero no desarrolla por arriba de 28 ºC, aunque se observen lesiones pequeñas y numerosas (Zaumeyer y Thomas, 1957 citados por Schwartz, 1989). DISTRIBUCION GEOGRÁFICA: Tiene una distribución mundial, pero especialmente en regiones que tienen temperaturas moderadas (16-23 ºC) y alta humedad ambiental (>90%). 62 Enfermedades Importantes de Algunos Cultivos de México Rabia del garbanzo Fusarium oxysporum Matuo & K. Sato (1962); F. solani Mart. Sinónimos: Fusarium lateritium f. ciceris (Padwick) Erwin [as ‘ciceri’], (1958); Fusarium merismoides f. ciceris (Padwick) Subram. [as ‘ciceri’], (1971); Fusarium orthoceras var. ciceris Padwick [as ‘ciceri’], (1940). Archivo técnico. CECH - INIFAP. Clasificación científica: División Eumycota Subdivisión Deuteromycotina Clase Hiphomycetos Orden Moniliales Familia Moniliaceae Género Fusarium Especies oxysporum, solani 63 Enfermedades Importantes de Algunos Cultivos de México HOSPEDEROS: La marchitez o “rabia” del garbanzo es ocasionada por el hongo F. oxysporum f.sp. ciceris aunque también por F. solani (Guerrero, 1980). El caso de F. solani ataca una gran diversidad de cultivos a nivel mundial. Los hongos del género Fusarium tienen una amplia distribución en el mundo y una gran importancia desde el punto de vista agrícola y económico (Arbeláez, 2000). IMPORTANCIA ECONÓMICA: Las especies de Fusarium son responsables de muchas enfermedades de los cereales de importancia económica dando lugar a severas reducciones en los rendimientos de los cultivos hasta en un 40% (Chehri et al., 2010), aunque otros autores señalan que se puede perder entre el 10 y 90% de la producción (Dev Sharma y Muehlbauer, 2007). Síntomas: Los síntomas de la enfermedad dependen de la especie del hongo y se pueden diferenciar en el campo: F. oxysporum f. sp. ciceri: Se le llega a conocer como marchitez ascendente, puede aparecer en cualquier etapa del cultivo, presentándose primero un marchitamiento en las partes apicales de la planta, que cambian de color verde a opaco grisáceo, secándose rápidamente por lo que toman un color pajizo. Puede afectar parcial o totalmente la planta, y puede trasmitirse por semilla. F. solani: Llamada marchitez descendente, que a diferencia de la anterior, no se transmite por semilla. Se presenta con altos niveles de humedad y poca aireación del suelo. Inicia con un amarillamiento o clorosis progresiva del follaje de arriba hacia abajo. Con la presencia de lluvias o riegos excesivos, aún en variedades resistentes se llega a presentar la enfermedad, con la clorosis típica, pero en las variedades susceptibles la planta se puede secar completamente (Morales et al., 2004). 64 Enfermedades Importantes de Algunos Cultivos de México CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGIA: Fusarium puede sobrevivir durante varios años en el suelo de campo, pero el primario es generalmente trasmitido por semilla, en el caso de la especie oxysporum. La forma y tamaño de las esporas es la característica principal para el reconocimiento del hongo. Las esporas están dispersas en el micelio aéreo o en esporodoquios o masas limosas (pionotos). Los macroconidios son curvados, pluriseptados, con una célula apical más o menos puntiaguda y en muchas especies con una célula basal en forma de pie. Los microconidios son comúnmente unicelulares, elipsoidales, fusiformes, claviformes, piriformes o sub globosos, similares en ancho a los macro conidios, con una base redondeada o truncada, por lo general formando cabezuelas mucosas, pero en algunas especies forman cadenas basípetas (Carrillo, 2003). En ausencia de un huésped vivo, Fusarium perdura saprofíticamente, como clamidosporas, o como hifas o esporas resistentes. Las clamidosporas se forman típicamente dentro o sobre la superficie de los tejidos infectados de la planta. Las macronidias llegadas al suelo y se transforman también en clamidosporas. La formación de clamidosporas es estimulada por exudados de las raíces de la planta y de semillas en germinación (Daughtery et al., 2001). Condiciones favorables: Las clamidosporas y esporas germinan en una amplia gama de pH, y la temperatura óptima es 25 a 28°C. Fusarium sobrevive más tiempo en suelos secos que en suelos húmedos. Las esporas son diseminadas por el movimiento del aire, insectos, transporte de plantas enfermas y salpicaduras por agua de riego (Daughtery et al., 2001). Otros autores indican que las condiciones ideales para la infección son una temperatura de 25°C y una densidad que oscila entre 104 a 105 micro o macro-conidias (Bhatti y Kraft, 1992; NavasCortés et al., 1998; Landa et al., 2001, citados por Dev Sharma y Muehlbauer, 2007). 65 Enfermedades Importantes de Algunos Cultivos de México DISTRIBUCIÓN GEOGRÁFICA: El marchitamiento por Fusarium es común desde que fue encontrada en frijol en otras regiones de producción en el mundo, incluyendo Brasil, Colombia, Perú, Costa Rica, Italia, España, Grecia, Países Bajos y África Central [(Hirano y Arie, 2009; Ramos et al., 2007; Cramer et al., 2003; Buruchara y Camacho, 2000; Alves-Santos et al., 1999; DiazMinguez et al., 1996; Pastor-Corrales y Abawi, 1987; Ribeiro y Hagedorn, 1979 a,b; Kendrick y Snyder, 1942 todos citados por Karimian et al, 2010.), sin embargo, ataca al garbanzo en todo el mundo. 66 Enfermedades Importantes de Algunos Cultivos de México Estudio de caso (Patógeno-ambiente): Escenarios de Puccinia triticina Erikson y P. striiformis f. sp. tritici en trigo en el Sur de Sonora debido al cambio climático Introducción El calentamiento del sistema climático es inequívoco, como evidencian ya los aumentos observados del promedio mundial de la temperatura del aire y del océano, el deshielo generalizado y el aumento del promedio mundial del nivel del mar. En el período de los años 1995 a 2006, once figuran entre los más cálidos en los registros instrumentales de la temperatura de la superficie mundial (desde 1850). La tendencia lineal a 100 años (1906-2005), cifrada en 0.74°C (entre 0.56°C y 0.92°C) es superior a la tendencia correspondiente de 0.6ºC (entre 0.4ºC y 0.8ºC) (1901-2000). Este aumento de temperatura está distribuido por todo el planeta y es más acentuado en las latitudes septentrionales superiores. Las regiones terrestres se han calentado más aprisa que los océanos (IPCC, 2007). Los cultivos por un lado pueden verse favorecidos por los aumentos de bióxido de carbono atmosférico, que ayudan a eficientar el proceso fotosintético, sin embargo, el aumento de la temperatura incrementará las demandas hídricas de los mismos, elemento que ha disminuido su disponibilidad en forma dramática, pero el productor también enfrenta riesgos ya que las condiciones para muchas plagas y enfermedades se verá favorecida. Las enfermedades de las plantas son un componente importante de la producción agrícola porque tienen el potencial de reducir significativamente el rendimiento alcanzable de los cultivos, en extensión que es determinada por su naturaleza y etiología así como por la fisiología y ecología de aquéllos. Estimaciones recientes indican que dicha reducción alcanza consistentemente una media anual del 12 a 13% de la cosecha alcanzable en los 67 Enfermedades Importantes de Algunos Cultivos de México ocho cultivos de mayor importancia para la alimentación y la industria, que conjuntamente ocupan más de la mitad de la superficie cultivada en el mundo. Además, algunas enfermedades re-emergentes han causado ataques devastadores asociados con determinados cambios ambientales y tecnológicos en la producción de cultivos durante la última década, incluso en países poseedores de la mejor tecnología agrícola (Jiménez-Díaz, 2008). Por lo anterior, el objetivo del presente estudio fue caracterizar y cuantificar el cambio climático y su impacto sobre las condiciones favorables para la infección de las royas de la hoja y lineal del trigo. Materiales y métodos Se utilizaron la base de datos que facilita el grupo interdisciplinario que conforman el Laboratorio Nacional Lawrence Livermore, el Programa de Aplicaciones California Nevada, la Central Climática y la Universidad de Santa Clara en Estados Unidos (http:// gdo-dcp.ucllnl.org/). Para la obtención de resultados se utilizaron las salidas de los años 2020 y 2050 para uno de los modelos de circulación general (http://www.ipcc-data.org/ar4/model-CCCMA-CGCM3_1-T47- change.html) de la atmósfera conocidos como ECHAM (2006), específicamente el cccma_cgcm3_1. Las salidas se almacenan en un archivo NetCDF (Network Common Data Form) un tipo de archivo estándar de datos científicos. Se bajaron las salidas de temperatura promedio mensual para el período 2000-2050 para todo el conjunto de coordenadas geográficas incluidas dentro del territorio sonorense. Sin embargo fue necesario construir aplicaciones externas para delimitar la zona agrícola del Sur de Sonora (Valles del Yaqui y Mayo). Las aplicaciones fueron hechas en Matlab® (http://www.mathworks.com/products/matlab/), toda vez que existen librerías que permiten la manipulación de este tipo de ficheros, así como la manipulación de datos y el mapeo de los resultados. Cabe 68 Enfermedades Importantes de Algunos Cultivos de México mencionar que los datos una vez organizados fueron resguardados en una base de datos relacional MySQL, esto para facilitar su acceso y poder utilizarlos posteriormente para distintos proyectos y/o investigaciones. Los pares ordenados (latitud, longitud) llamados nodos, ascienden en Sonora a un total de 1,076 (mil setenta y seis). Las royas del trigo son importantes en el sur de Sonora (Valle del Yaqui y Valle del Mayo), en especial las de la hoja y lineal, por eso con las salidas de temperatura del modelo se procedió a evaluar el posible cambio en las condiciones favorables para su incidencia. En la roya de la hoja Puccinia triticina Erikson, se utilizaron temperaturas promedio entre 15° y 22°C mientras que para la roya lineal o amarilla Puccinia striiformis f. sp. tritici, se utilizaron las temperaturas entre 9 y 11 °C, consideradas como óptimas. En ambos casos se consideró una humedad relativa mayor o igual al 80% en un período mayor a 4 horas por día en el período de las 06:00 h a las 12:00 h (Jiménez, 2008). Se consideró el período de diciembre a marzo. Se utilizaron un total de 24 nodos para la región sur de Sonora. Las temperaturas mensuales promedio de los escenarios y mediante la técnica de cuadrados mínimos se obtuvieron modelos de regresión entre las estaciones y los nodos. Se utilizaron los datos de cinco años para obtener los parámetros de los modelos de regresión y con estos se calcularon las temperaturas horarias de los nodos en el año 2020 y 2050, esto bajo la suposición de que la oscilación térmica se mantendrá. Esta suposición se vuelve primordial toda vez que para calcular la Humedad Relativa (HR) horaria se hizo una regresión entre los datos de temperatura y HR, a diferentes desfases. Los desfases elegidos fueron aquellos donde se encontró la máxima correlación positiva. Para los mapas de 2010 se utilizaron los datos de las estaciones meteorológicas de la red AgroSon (www.agroson.org.mx) en las zonas agrícolas de interés. Con 69 Enfermedades Importantes de Algunos Cultivos de México los datos de los escenarios y con la metodología ya descrita, se generaron los mapas del número de días con condiciones favorables para roya de la hoja y roya lineal del trigo para los años 2020 y 2050. Resultados y discusión Roya de la hoja (P. triticina) De acuerdo a los resultados obtenidos en cuanto a los días de condiciones favorables para la infección por ésta enfermedad, puede observarse que de acuerdo las gráficas con isolíneas que se muestra en la Figura 1, que se refiere a la situación reciente (2010), estos oscilan entre 30 y 90 días, siendo menores en las áreas trigueras del norte más cercanas a la zona urbana de Ciudad Obregón, mientras que los mayores riesgos se presentan en la zona costera especialmente hacia el Valle del Mayo, sobre lo cual influyen mucho las corrientes húmedas del mar, además de que son partes bajas que presentan mejores condiciones de bajas temperaturas que favorecen el desarrollo del hongo. También es claro, que la región del Valle del Mayo en general presenta mejores condiciones favorables para la enfermedad, y es muy común que en ésta área se inicien las infecciones para el área Sur de Sonora. En el 2020 (Figura 1) se observa que los días de condiciones favorables oscilan entre 10 y 110, destacando el hecho de que en las áreas cercanas a Ciudad Obregón como San José de Bácum y Cócorit, así como la parte costera, el número con condiciones favorables se reduce, esto como un efecto del incremento de las temperaturas, situación que desfavorece el desarrollo del hongo. Similar a lo anterior, es notable el incremento de éste valor en la región del Valle del Mayo; aumento de la mancha de color rojizo, que indica un mayor número de días de condiciones favorables. Por otra parte, en cuanto al escenario 2050 muestra una tendencia similar al 2020, oscilando los días favorables entre 10 y 110, pero existe una redistribución geográfica para 70 Enfermedades Importantes de Algunos Cultivos de México los diferentes niveles de riesgo, ya que incluso hay una pequeña reducción de ésas áreas en el Valle del Mayo (Figura 2). Roya lineal (P. striiformis f. sp. tritici) En lo que se refiere a esta enfermedad, las condiciones favorables en días para la situación reciente se presentan en la Figura 3 (escenario 2010), donde puede observarse que el rango oscila entre 10 y 45, destacando que las áreas de mayor riesgo son las ubicadas en las costas del Valle de Huatabampo y la Región del Júpare. En lo que se refiere al Valle del Yaqui, existen mayores condiciones en las regiones de San Ignacio Rio Muerto y San José de Bácum. Las áreas aledañas a Ciudad Obregón, tienen bajo riesgo. Debido a que para los años 2020 y 2050 no existen días con condiciones favorables para la presencia de ésta enfermedad, los mapas por razones obvias no se presentan, lo cual puede ser reflejo de que las temperaturas se estarán incrementando. Lo anterior es congruente con lo expresado por autores como Magaña (2007) que menciona que habrá un aumento de la temperatura media anual de Sonora que oscila entre 1 y 2 °C en el 2020 y de 1.5 a 3°C para 2050. N N Figura 1. Mapas de los números de días con condiciones favorables para infección de la roya de la hoja del trigo en el Sur de Sonora. Escenarios 2010 y 2020 en forma respectiva. 71 Enfermedades Importantes de Algunos Cultivos de México N Figura 2. Mapa de los números de días con condiciones favorables para infección de la roya de la hoja del trigo. Sur de Sonora. Escenario 2050. N Figura 3. Mapa de los números de días con condiciones favorables para infección de la roya lineal del trigo. Sur de Sonora. Situación reciente. 2010. Conclusiones Se observa un incremento en los días con condiciones favorables para la roya de la hoja (60 a 120), que podría provocar que las aplicaciones fungicidas permanezcan como un método económico de control, especialmente en variedades que no tienen buen nivel de tolerancia a la enfermedad, pero que por su alta productividad, todavía se utilizan. La roya lineal, debido a las condiciones que necesita para su desarrollo, es un caso que no será problema en el futuro debido al posible incremento de las temperaturas. 72 Enfermedades Importantes de Algunos Cultivos de México Roya anaranjada de la caña de azúcar Puccinia kuehnii (W. Kruger) E.J. Butler, 1914. Sinónimos: Uredo kuehnii Wakker & Went, (1898); Uromyces kuehnii W. Krüger, (1890) Marcial Leossi. SENASICA. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Puccinia Especie kuehnii HOSPEDERAS: Caña de azúcar. 73 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: P. kuehnii representa un inminente peligro para la agroindustria azucarera mexicana, por la alta probabilidad de que un brote explosivo del patógeno pueda causar pérdidas catastróficas, ya que tanto en Costa Rica como en Guatemala, la variedad CP72-2086, segunda variedad comercial en México, es una de las más infectadas (SENASICA, 2011). SÍNTOMAS: Los síntomas asociados a P. kuehnii, son puntos minúsculos de color amarillo que se agrandan y desarrollan halos de color amarillo-verdoso pálido. Sin embargo, el color de la lesión en el estado de madurez cambia del naranja al naranja marrón, dependiendo de la variedad que se cultive (Magarey, 2000; Raid et al., 2000 citados por Infante et al., 2009)). Las pústulas aparecen principalmente en la superficie inferior de la hoja, tienden a estar agrupadas y son generalmente más numerosas en la mitad inferior de las hojas que en el ápice (Ryan y Egan, 1989). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA Ciclo de la enfermedad: P. kuehnii se caracteriza por presentar urediosporas anchas y pálidas; varían en tamaño 25-57 x 17-34 μm, que presentan paredes gruesas en el ápice, sus parafisos son poco numerosos, mal definidos y raramente produce teliosporas; las espinas dorsales son distantes de 3 a 4 mm, dispuestas de forma irregular sin ninguna concentración alrededor de las esporas (DGSV, 2011). Las esporas se diseminan por el viento, lluvia, insectos y la ropa de la gente (SENASICA, 2011). Condiciones favorables: La temperatura óptima para su desarrollo es de 18 ºC con 97% de humedad relativa (SENASICA, 2011). La germinación de las urediosporas es de 20-25° C. La mejor esporulación se da en un rango de 25–30° C, siendo de 26° C, la temperatura óptima y la máxima esporulación ocurre a los 11 días de haberse formado el uredo. Las infecciones por P. kuehnii, son favorecida por condiciones cálidas y húmedas durante el verano, así como condiciones húmedas, pero suaves 74 Enfermedades Importantes de Algunos Cultivos de México a frescas en otoño. Las fases más vulnerables de la planta, se extienden a mitad del periodo entre el crecimiento y la madurez. La enfermedad raramente se presenta en caña joven (CABI, 2011 citado por DGSV, 2011). DISTRIBUCIÓN GEOGRÁFICA: Durante 2008 se observaron brotes sospechosos de P. kuehnii en Tapachula, Chiapas, y fue considerado el primer reporte del patógeno en México. Posteriormente se ha detectado en otros municipios de Chiapas, así como en Quintana Roo y Veracruz (SENASICA, 2011). 75 Enfermedades Importantes de Algunos Cultivos de México Roya del cártamo Puccinia carthami (Hutz.) Corda (1840) Sinónimos: Bullaria carthami (Corda) Arthur & Mains, (1922); Puccinia calcitrapae var. centaureae (DC.) Cummins, (1977); Puccinia centaureae DC., (1815) Xochilt M. Ochoa. INIFAP-CENEB. Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Puccinia Especie carthami HOSPEDERAS: Algunas especies de Carthamus, Carduncellus caerulenses (L). Lees, Kentrophyllum creticum y Kentrophyllum syriacum. 77 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: Esta enfermedad al atacar a las plántulas recién emergida puede matarlas y consecuentemente hay necesidad de efectuar resiembras. Esta operación da como resultado un aumento en los costos debido a resiembras, riegos extras, uso de maquinaria, etc. En áreas de clima húmedo como en el estado de Sinaloa, los daños ocasionados en plantas grandes pueden disminuir significativamente la producción. En regiones áridas, las infecciones que ocurren en planta grande, generalmente se realizan después de la floración y sobre todo en las hojas más viejas; por esta razón, se considera que estas infecciones no afectan mucho el rendimiento. SÍNTOMAS: La infección del cultivo puede ocurrir en dos fases o etapas: La primer fase ocurre en estado de plántula y es común en áreas en las cuales se utilizan semilla infestada no tratada con fungicidas o bien siembras hechas en lotes en los anteriormente se han tenido incidencias de roya. Los ataques en estado de plántula son los más dañinos, ya que pueden ocasionar su muerte. Pueden morir sin mostrar síntomas de la enfermedad en la parte aérea, aunque otras pueden presentar pústulas de color anaranjado oscuro en los cotiledones y en el hipocotilo. Los síntomas típicos iniciales de la enfermedad son como pequeñas manchas blancas en la hoja, que después se tornan de café claro y terminar de un color café oscuro (marrón), ya que se desarrollan urediosporas y teliosporas (Park y Lee, 2005; Saharan et al., 2005) La segunda fase ocurre en el follaje de plantas grandes y se caracteriza por la presencia de pústulas pequeñas de color café castaño en el tallo, hojas brácteas florales. El tamaño y número de pústulas depende de la susceptibilidad de la variedad. En las variedades susceptibles las pústulas son de 1-2 mm de diámetro. En las variedades resistentes únicamente se observan pequeños puntos cloróticos sin esporulación. Es muy frecuente 78 Enfermedades Importantes de Algunos Cultivos de México el agrietamiento longitudinal de la parte inferior del tallo y del cuello, lo que ocasiona a menudo la caída de la planta. Se conocen algunas razas de este hongo, sin embargo, en Norteamérica solo se han identificado 4. El hongo permanece en el suelo o en la semilla del cártamo en forma de teliosporas por 12 meses bajo condiciones de campo. Posteriormente germinan y forman las basidiosporas las cuales infectan a las plántulas en germinación. Las basidiosporas dan origen a las aeciosporas y al ser llevadas por el viento y el agua del riego, infectan el follaje, originándose las urediosporas. Al llegar el cultivo a la maduración las urediosporas se convierten en teliosporas. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: A las plántulas por medio de las basidiosporas y al follaje por medio de aeciosporas y urediosporas. Diseminación: Por el viento, el agua de riego y la semilla. Invernación: En el suelo y sobre la semilla en forma de teliosporas. Condiciones favorables: La temperatura óptima para el desarrollo de la enfermedad está entre 15-25°C. Las temperaturas menores de 10°C y mayores de 30°C no favorecen a la enfermedad (Ávila, 1983). Otros autores indican que el rango óptimo de temperatura para el desarrollo de la enfermedad va de 12-18 ºC (Smith, 1991). DISTRIBUCIÓN GEOGRÁFICA: Australia, E. U., Canadá, Japón e India. En México se localiza en Baja California, Sonora y Sinaloa, sin embargo, se considera que puede en cualquier área en que se cultive cártamo. 79 Enfermedades Importantes de Algunos Cultivos de México Mancha de la hoja del cártamo Alternaria carthami S. Chowdhury (1944) Sinónimos: Macrosporium carthami Savul., (1943) Xochilt M. Ochoa. INIFAP-CENEB Clasificación científica División Eumycota Subdivisión Deuteromycotina Clase Hyphomycetos Orden Moniliales Familia Dematiaceae Género Alternaria Especie carthami HOSPEDERAS: Este hongo ataca únicamente al cártamo. IMPORTANCIA ECONÓMICA: Esta enfermedad es de poca importancia en regiones de escasa precipitación, pero se considera que en áreas de alta humedad puede causar daños muy severos. En Australia han contabilizado pérdidas de hasta el 50% (Jackson y Berthelsen, 1986). 81 Enfermedades Importantes de Algunos Cultivos de México SÍNTOMAS: La enfermedad puede presentarse en cualquier etapa de desarrollo de la planta. El hongo decolora la semilla y puede causar su pudrición así como secadera de plántulas. Las plantas atacadas presentan manchas grandes irregulares concéntricas de color café en las hojas y brácteas florales. La enfermedad es menos severa en el tallo y en los pecíolos. EL hongo produce micelio tabicado y ramificado el cual se oscurece con la edad. Las conidias son de 12-28 micras de ancho por 36-99 micras de largo (sin tallo). El hongo no penetra la semilla sino que infecta solo la superficie. La espora es lisa, aunque a veces puede presentar una apariencia granular. Las conidias contienen de 3-11 células con septas longitudinales (Ávila, 1983). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: El hongo penetra directamente a la hospedera mediante la germinación de las esporas. Diseminación: Es llevada a cabo principalmente por el viento y a través de la semilla. Invernación: Como micelio y conidias en residuos de plantas y sobre la semilla. Condiciones favorables: La temperatura óptima para el desarrollo del hongo oscila entre 25 y 30°C y alta humedad relativa por largos períodos son necesarias para una producción abundante de esporas. Otros autores como Murumkar et al., (2008) señalan que humedad relativa superior al 80% y temperaturas en el rango de 21 a 33 ºC favorecen el desarrollo de la enfermedad. DISTRIBUCION GEOGRÁFICA: Puede presentarse en todas las regiones donde se cultiva cártamo. 82 Enfermedades Importantes de Algunos Cultivos de México Falsa cenicilla del cártamo Ramularia carthami Sacc. Lope Montoya C. INIFAP-CENEB. Clasificación científica División Eumycota Subdivisión Deuteromycotina Clase Hyphomycetos Orden Moniliales Familia Dematiaceae Género Ramularia Especie carthami HOSPEDEROS: Cártamo (Macías et al., 2010) (Ramírez et al., 2011). IMPORTANCIA ECONÓMICA: Esta enfermedad se presenta como una amenaza permanente que puede limitar la producción y la vida útil de ese cultivo. Cuando las condiciones ambientales son 83 Enfermedades Importantes de Algunos Cultivos de México favorables y no hay control químico, puede reducir el rendimiento hasta un 100 %, (Ramírez et al., 2011). En la región sur de Sonora, solo ha mostrado una reducción del rendimiento alrededor del 30%, durante aquellos ciclos cuando ha aparecido la enfermedad. SÍNTOMAS: Esta enfermedad generalmente inicia en el estrato inferior de la planta, aunque puede iniciarse en cualquier parte del follaje. Se observa infectando hojas, pecíolos, brácteas y algunas partes del tallo, formando manchas circulares necróticas de hasta 1.5 cm de diámetro, de color café claro con aspecto blanquecino por el haz y envés de las hojas, que corresponde a las esporas hialinas del hongo R. carthami. Conforme avanza el desarrollo de la enfermedad, aparece un halo clorótico que posteriormente se hace amarillo, y el tejido del centro de la lesión adquiere un color café claro. La parte central de estas lesiones, al ir envejeciendo se tornan blanquecinas y con apariencia de un polvillo granuloso, que son las estructuras del patógeno. Las manchas al crecer se unen hasta secar gran parte de la hoja, con lo que adquiere una apariencia atizonada. Pueden llegar a cubrir totalmente las brácteas y parte del capítulo, afectándolo su crecimiento normal y al desarrollo y llenado del grano (Montoya, 2010; Ramírez et al., 2012). Las manchas circulares se pueden encontrar en ambos lados de las estructuras foliares. El avance es ascendente y rápido, debido a que el período desde que el hongo penetra hasta que se observan los primeros síntomas no rebasa los 10 días, de tal manera que cuando se observan los primeros síntomas el hongo ya ha infectado las hojas superiores y su desarrollo es en cadena. Esta enfermedad ataca a todas las variedades comerciales y se presenta en todas las fechas y densidades de siembra recomendadas. Sin embargo, con el fin de que la planta se exponga el menor tiempo posible a esta enfermedad, se sugiere atender las recomendaciones preventivas y su control químico (Montoya et al., 2008). 84 Enfermedades Importantes de Algunos Cultivos de México CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: La falsa cenicilla es causada por el hongo R. carthami Sacc., cuya característica principal es que presenta conidias hialinos, en forma de cilindro, típicamente de dos células, pero pueden observarse muchas de una y más pocas de tres células. Los conidióforos generalmente se encuentran agrupados, éstos son cortos, y pueden ser hialinos o subhialinos; simples, curvos o doblados, con una cicatriz prominente en un extremo. (Pérez et al., 2004). R. carthami fue identificada como conidióforos aseptados de paredes delgadas (2.6 a 4.3 x 28.8 a 72.0 micras) que se producen fascículos en forma de abanico a cargo de estromas semiesféricos (21.6 a 31.2 x 24.0 a 36.0 micras), las colonias de los hongos son blancas con bordes irregulares (Hostert et al., 2006). Condiciones favorables: Las temperaturas mayores a 9.2 ºC y humedad relativa promedio superior a 73 % son suficientes para que la epidemia se desarrolle una a dos semanas después de presentarse estas condiciones (Ramírez et al., 2012). El hongo sobrevive en el suelo y en restos de la cosecha anterior, en forma de seudo esclerocios, hasta por un periodo de dos años. La humedad relativa superior a 70% y temperaturas entre 5 a 25 °C, con un óptimo de 16 a 17 °C, favorecen la formación de las estructuras reproductivas del patógeno. La germinación y penetración del hongo a la hoja puede tardar de dos a tres días, con una humedad relativa superior a 95%; apareciendo los síntomas entre 10 y 15 días posteriores a la infección (Montoya, 2010). DISTRIBUCIÓN GEOGRÁFICA: Este patógeno es poco conocido en el mundo, y se presenta todos los años en el sur de Sonora y norte de Sinaloa. Está consignado como agente causal de la mancha foliar del cártamo en la India, Israel, Pakistán y recientemente en California, EUA. 85 Enfermedades Importantes de Algunos Cultivos de México Mancha bacteriana del chile y tomate Xanthomonas campestris pv. vesicatoria [(Doidge) Dye (Pammel,1895) Dowson,1939] Sinónimos: Bacillus campestris Pammel 1895; Pseudomonas campestris (Pammel 1895) Smith 1897; Bacterium campestris (Pammel 1895) Smith 1897; Phytomonas campestris (Pammel 1895) Bergey et al. 1923 www.ces.ncsu.edu http://www.omafra.gov.on.ca Clasificación científica División Bacterias Subdivisión Gracillicutes Clase Proteobacterias Orden pseudomonadales Familia Pseudomonadaceae Género Xanthomonas Especie campestris pv. vesicatoria HOSPEDERAS: Chile y tomate (Swanson et al., 1987). Se dice que también puede atacar tabaco. IMPORTANCIA ECONOMICA: Afecta la calidad de los frutos, los cuales no pueden ser comercializados, además de que su 87 Enfermedades Importantes de Algunos Cultivos de México control químico se vuelve caro por los costos de agroquímicos, sobre todo si las condiciones de alta humedad (lluvia ligera a fuerte) persisten, lo que hace muy difícil su control (Zitter, 1985). SÍNTOMAS: Se observan como manchas necróticas en hojas, tallos y frutos. Los síntomas foliares aparecen primero en el envés de las hojas como pequeñas zonas acuosas. Estas manchas se agrandan hasta ¼ de pulgada de diámetro, son de color café oscuro y se elevan ligeramente. En la superficie superior de la hoja los puntos están deprimidos con un borde café alrededor de un centro de color beige. Varias lesiones pueden unirse, lo que resulta en grandes áreas necróticas, y un gran número de lesiones puede ocurrir en márgenes y puntas de las hojas que es donde se acumula la humedad. Con el tiempo las hojas se vuelven amarillas y se caen, aumentando la posibilidad de quemaduras de frutos por el sol. Las manchas en las frutas pueden crecer hasta 1/5 de pulgada, se forman como áreas corchosas (roña) que hacen que el producto no sea comercializable (Zitter, 1985; Ritchie, 2000). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: El patógeno puede sobrevivir dentro y fuera de la semilla. Si se usa semilla infectada externamente, los cotiledones se pueden contagiar al entrar en contacto con la cubierta de la semilla y las lesiones se muestra pronto después de emerger del suelo. Las bacterias son entonces fácilmente diseminadas al nuevo follaje y a otras plantas. La enfermedad es una amenaza en particular en la producción de plántulas, ya que las camas con alta densidad de plantas favorecen el desarrollo de la enfermedad, al aplicarse riegos frecuentes por lo que el ambiente húmedo es alto. En un período de 24 horas, las bacterias pueden multiplicarse rápidamente y producir millones de células. Aunque la mancha bacteriana es una enfermedad de las regiones cálidas y húmedas, se puede desarrollar en regiones áridas 88 Enfermedades Importantes de Algunos Cultivos de México con riego. La bacteria se puede transmitir por lluvia o riego por aspersión. Las bacterias también se pueden propagar en las gotitas de agua cuando se realizan aspersiones de agroquímicos con equipos de alta presión. Las bacterias entran a través de estomas en la superficie de las hojas y a través de heridas en las hojas y frutas, tales como los causados por la abrasión de las partículas de arena y el viento. Los períodos prolongados de alta humedad relativa favorecen la infección y desarrollo de la enfermedad. El desarrollo de síntomas se retrasa o se elimina cuando la humedad relativa se mantiene baja durante varios días después de la infección (Ritchie, 2000). Es importante tener una película protectora de fungicida (ej. Cobre) en la superficie de la planta para que las células bacterianas mueran antes de poder entrar en la hoja o el fruto. Las aspersiones deben realizarse antes y durante los períodos de lluvia y humedad, pues no son efectivas contra las bacterias dentro de los tejidos. Las fuentes más importantes para la mancha bacteriana son la semilla y/o plántulas enfermas. Además, el patógeno es transportado por el suelo tanto en los residuos vegetales secos y, posiblemente en el propio suelo durante al menos 1 año (Zitter, 1985). La infección de los verticilos florales, a menudo causa un gran desprendimiento de inflorescencias (Bashan y Okon 1986 citados por Carrillo et al., 2001). Los síntomas pueden desarrollarse de 5 a 15 días posteriores a la inoculación (Sherf y Macnab, 1986). Condiciones favorables: La enfermedad es favorecida con largos periodos de alta humedad relativa y agua libre sobre las hojas. Cuando las plantas infectadas se exponen a humedad relativa alta (> 85%) durante pocas horas, en 1-2 días, el patógeno puede producir síntomas de la enfermedad. Las bacterias se 89 Enfermedades Importantes de Algunos Cultivos de México transmiten de una planta a otra por salpicaduras de lluvia y al tocar y manipular las plantas húmedas. Algunos autores señalan que las condiciones propicias de temperatura son de alrededor de 27ºC (Nuez et al., 2003). DISTRIBUCIÓN GEOGRÁFICA: Técnicamente, el patógeno se divide en tres razas: una de tomate que ataca a todos los chiles y provoca reacciones de hipersensibilidad (se limita solo a lesiones necróticas). En chile se han identificado dos razas (1 y 2), la 1 infecta a todos los pimientos, y la raza 2 que causa reacción de hipersensibilidad en genotipos que poseen un gen específico de resistencia. Las cepas de tomate y chile raza 1 se distribuyen en todo el mundo, pero la raza 2 de chile se limita a Florida, E.U., y el Caribe (Zitter, 1985). 90 Enfermedades Importantes de Algunos Cultivos de México Cenicilla del chile y tomate Leveillula taurica (Lév.) G. Arnaud, (1921) Sinónimos: Erysiphe taurica; Oidiopsis taurica; Leveillula solanacearum; Oidiopsis sicula Gerald Holmes, Valent USA Corporation, Bugwood.org Clasificación científica División Eumycota Subdivisión Ascomycotina Clase Plectomycetos Orden Erysiphales Familia Erysiphaceae Género Leveillula Especie taurica HOSPEDERAS: Chiles, tomates, algodón, berenjena, alcachofa, cebolla y algunas malezas. 91 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: Tan solo en Norteamérica las pérdidas que llega ocasionar en invernaderos son del 1015% (Sabaratnam, 2012). No existen variedades resistentes al problema en la actualidad. SÍNTOMAS: En general, los cultivos de chile se vuelven más susceptibles a la cenicilla a medida que maduran. Los síntomas en las plantas viejas y en las hojas inferiores aparecen primero. Este hongo necesita tejido vivo de la planta huésped para crecer y sobrevivir. Para encontrarlo solo hay que buscar manchas blanquecinas de polvo en el envés de las hojas; con el tiempo estas manchas cambian a color café. La superficie superior de la hoja puede parecer normal o con manchas difusas, de color amarillo, que corresponden a las colonias de moho en la superficie inferior. Las primeras infecciones se pueden ver más fácilmente poniendo la hoja contra la luz y buscando el desarrollo de colonias. Las hojas muy infectadas se secan, caen y pueden causar la muerte de la planta. Las orillas de las hojas se enrollan hacia arriba dejando al descubierto las colonias de hongos (polvillo blanco) (Mendoza y Pinto, 1985; Sabaratnam, 2012; Mendoza, 1999 citado por Chew et al., 2008). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Esta cenicilla difiere de otras en que sus hifas crecen directamente dentro del tejido foliar, hasta que produce esporas, específicamente en el lado de abajo de las hojas (Sherf y Macnab, 1986; Tuttle, 2001). El ciclo de la enfermedad inicia cuando las esporas (conidios), germinan (similar a una semilla) y empiezan a crecer en la hoja. El hongo crece inicialmente invisible dentro de la hoja con un período de latencia de 18-21 días, posteriormente el patógeno crece fuera de los estomas, en la superficie inferior de la hoja, produciendo conidiosporas que son portadoras individuales de numerosas fibras finas o tallos llamadas conidióforos. Estos 92 Enfermedades Importantes de Algunos Cultivos de México filamentos fúngicos se hacen visibles como manchas blancas (colonias) en la superficie inferior de la hoja. Las corrientes de aire diseminan las esporas hacia otras plantas, pero también a través de la ropa de los trabajadores. Generaciones repetidas del hongo pueden inducir brotes severos de la enfermedad, que dañan el cultivo (Sabaratnam, 2012). Condiciones favorables: Le favorecen temperaturas de 16 a 27 ºC, con humedad relativa > 85%. Bajo condiciones favorables el hongo se reproduce rápidamente y las esporas pueden germinar e infectar una planta en menos de 48 horas (Goldberg, 2009). DISTRIBUCIÓN GEOGRÁFICA: Se distribuye en casi todas las zonas productoras de chile del mundo, tanto a cielo abierto como en ambiente protegido (Sabaratnam, 2012). 93 Enfermedades Importantes de Algunos Cultivos de México Cenicilla de las cucurbitáceas Sphaerotheca fuliginea (Schltdl.) Pollacci, (1913) Sinónimos: Acrosporium erysiphoides (Fr.) Subram., (1971) Alphitomorpha fuliginea Schltdl., (1819); Sphaerotheca macularis var.fuliginea (Schltdl.) W.B. Cooke, (1952). Jason Brock. University of Georgia.Bugwood.org Clasificación científica División Subdivisión Clase Orden Familia Género Especie Eumycota Ascomycotina Leotiomycetos Erysiphales Erysiphaceae Sphaerotheca fuliginea 95 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: Principalmente plantas de la familia de las cucurbitáceas como pepino, melón y calabaza y el bule (Lagenaria siceraria). En calabazas, pepinos, melones y sandía también puede ser causada por Podosphaera xanthii (=Sphaerotheca fuliginea) (Pernezny et al., 2008; Félix et al., 2005). IMPORTANCIA ECONÓMICA: Aunque E. cichoracearum fue la especie dominante de cenicilla de las cucurbitáceas en casi todo el mundo, en la actualidad ha sido desplazada por S. fuliginea. Cuando ocurre defoliación, los frutos producidos son de baja calidad debido a la presencia de quemaduras de sol y bajo contenido de azúcar. SINTOMAS: Los primeros síntomas se observan en el envés de las hojas como manchas cloróticas, desarrollando por el haz el micelio y esporas del hongo. El micelio puede cubrir posteriormente el envés y el haz de las hojas, extendiéndose posteriormente a los pecíolos y tallos. Las hojas infectadas severamente se ponen amarillas, después se vuelven de color café, se arrugan y finalmente se caen de la planta. La presencia de micelio y esporas en las partes infectadas les confiere un aspecto harinoso (Ávila, 1983). El tejido afectado con frecuencia es atrofiado, distorsionado, descolorido y con la presencia de cicatrices (Glawe y Grove, 2010). Las plantas con tallos dañados se vuelven cloróticas, achaparradas y por último mueren. Los frutos no son atacados, pero generalmente presentan quemaduras de sol por falta de follaje. Como el hongo puede producir un gran número de esporas en muy corto tiempo, un lote completo puede presentar una coloración blanca en una semana. La enfermedad se encuentra principalmente en hojas y tallos viejos. Los frutos de las plantas infectadas tienden a ser más pequeños y se modifica su sabor negativamente, al tener menos azúcares y sólidos solubles (Trigiano et al., 2008). 96 Enfermedades Importantes de Algunos Cultivos de México El hongo produce conidias elípticas, hialinas, que nacen en conidióforos no ramificados. Los peritecios aparecen en la superficie de las hojas durante el invierno en regiones frías, y ascas de dos esporas (característica distintiva de la especie). Este hongo presenta varias razas fisiológicas. Los peritecios no han sido observados en el Noroeste de México. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: Desde malezas o plantas voluntarias donde sobrevive, los conidios son llevados por el viento hacia los cultivos susceptibles; ahí germinan, se desarrolla un tubo germinativo corto cuya punta se convierte en un apresorio que penetra la cutícula de la hoja. En la pared celular se forma una papila, pero esta es finalmente penetrada por el hongo. Una vez dentro de la célula el hongo se alarga y forma haustorios en forma de balón que invaginan el citoplasma y así obtienen su alimento. Las células parasitadas no mueren, si no que continúan alimentando al hongo por varios días. Aproximadamente 7 días después de la penetración pueden observarse los síntomas de la enfermedad (Pérez-González et al., 2006). Diseminación: Las esporas son diseminadas por el viento; sin embargo, el hongo se puede llevar de hoja a otra o de una planta a otra por medio de los insectos, humanos, maquinaria, etc. Invernación: Sobre material infectado y hierbas hospederas en forma de micelio y conidias. El hongo generalmente no inverna en el estado de peritecio en nuestras condiciones, y al ser un parásito obligado no puede sobrevivir en ausencia de plantas huéspedes vivas, excepto como cleistotecios. Posibles fuentes de inóculo inicial incluyen conidias de cucurbitáceas cultivadas en invernaderos, cleistotecios y hospederos alternativos (Tuttle, 2011). Condiciones favorables: Los síntomas aparecen de 3-7 días después de la infección, si las condiciones son favorables. El micelio crece rápidamente durante los meses cálidos del verano, 97 Enfermedades Importantes de Algunos Cultivos de México especialmente si existe un crecimiento excesivo de la planta y baja intensidad de luz. Para la infección es necesaria una humedad relativa desde 50%, mientras que la lluvia y la presencia de agua libre no contribuyen en su desarrollo. La temperatura óptima para la infección es de 20-27°C, aunque se puede presentar en el rango de 10-32 ºC, deteniéndose cuando se presentan los 38 ºC. Las hojas tiernas (2-3 semanas de edad) son más susceptibles a la enfermedad, observándose su presencia hasta que hay amarre o “cuajado” de frutos (Tuttle, 2011). DISTRIBUCION GEOGRÁFICA: Esta enfermedad está ampliamente distribuida en todas las zonas dedicadas al cultivo de cucurbitáceas a nivel mundial. 98 Enfermedades Importantes de Algunos Cultivos de México Mildiu velloso de las cucurbitáceas Pseudoperonospora cubensis [(Berkeley & M. A. Curtis) Rostovzev] Jason Brock. University of Georgia. Bugwood.org Clasificación científica División Subdivisión Clase Orden Familia Género Especie Eumycota Mastigomycotina Oomycetos Peronosporales Peronosporaceae Pseudoperonospora cubensis HOSPEDERAS: Melón, pepino, calabaza, sandía y otras especies de cucurbitáceas. 99 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Los daños que puede ocasionar esta enfermedad son muy grandes, ya que si hay condiciones favorables para su desarrollo puede destruir por completo el cultivo. Además, la presencia de poblaciones de patógenos resistentes a los fungicidas comúnmente usados, limita la viabilidad a largo plazo del control químico (Savory et al., 2011). SÍNTOMAS: Pueden aparecer en cualquier etapa de desarrollo del cultivo y únicamente en las hojas. Los frutos normalmente no son atacados. Las hojas afectadas muestran en el haz manchas amarillentas, irregulares, las cuales se tornan de color café-rojizo. Por debajo de las manchas (en el envés de las hojas) se puede observar el micelio del hongo de color púrpura, sobre todo si hay condiciones de humedad alta. Las manchas pueden unirse y secar parcial o totalmente las hojas. La falta de follaje afecta el desarrollo de flores y frutos. Los frutos maduros presentan mala coloración y quemaduras de sol y tienen mal sabor. Se desconoce su estado sexual. El hongo es un parásito obligado, con micelio cenocítico. Los esporangióforos ramifican dicotómicamente en ángulos agudos, dando origen en su parte terminal a los esporangios o conidias. Los esporangios dan origen a zoosporas biflageladas. Las oosporas son cristalinas de 25-32 x 25-31 micras. Tan solo en E.U. se han identificado 5 patotipos de P. cubensis (Thomas et al., 1987; Thomas, 1986). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: El hongo penetra a través de los estomas desarrollando haustorios dentro de los tejidos con los cuales se alimenta de las células. Una semana después de la infección aparecen las esporas o conidias. Los esporangios germinan produciendo zoosporas biflageladas, las cuales realizan la penetración (Ávila, 1983). Diseminación: El viento y los insectos, principalmente diabróticas, diseminan los esporangios. 100 Enfermedades Importantes de Algunos Cultivos de México Invernación: El hongo subsiste de un ciclo a otro en forma de micelio y de esporas en plantas hospederas (plantas vivas). No puede sobrevivir en los residuos de cosecha (Ferguson et al., 2009). Condiciones favorables: La temperatura óptima para la germinación y formación de esporas, así como para la infección es de 16 a 22 ºC, con un rango de 5 a 30ºC, esta última sobre todo si hay alta humedad ambiental (Babadoost, 2001). DISTRIBUCION GEOGRÁFICA: Se considera de distribución mundial, principalmente en aquellas regiones de clima cálido y con alta humedad ambiental. 101 Enfermedades Importantes de Algunos Cultivos de México Tizón temprano de la papa y tomate Alternaria solani [Sorauer (1896)] Sinónimos: Alternaria allii Nolla (1927); Alternaria porri f.sp. solani Neerg.(1945); Alternaria solani (Ellis & G. Martin) L.R. Jones & Grout (1896); Macrosporium solani Ellis & G. Martin, (1882) Howard F. Schwartz. Colorado State University. Bugwood.org Clasificación científica División Subdivisión Clase Orden Familia Género Especie Eumycota Deuteromycotina Hyphomycetos Moniliales Dematiaceae Alternaria solani 103 Enfermedades Importantes de Algunos Cultivos de México HOSPEDERAS: Además de tomate y papa, también ataca berenjena, chiles y otras solanáceas (Rueda y Shelton, 1995). IMPORTANCIA ECONÓMICA: El tizón temprano es la enfermedad más destructiva del tomate en las regiones tropicales y subtropicales. Cada aumento de 1% en la intensidad puede reducir el rendimiento del 1.36%, y el fracaso total de la cosecha puede ocurrir cuando la enfermedad es más grave (Pandey et al., 2003). Las pérdidas de rendimiento de hasta el 79% han sido reportados en los EE.UU., de los cuales el 20-40% es debido a las pérdidas de plántulas en el campo (Chaerani y Voorrips, 2006). A. solani es también uno de los patógenos foliares más importantes de la papa. En los E.U., las estimaciones de pérdida de rendimiento atribuidos al daño foliar, que se traduce en disminución de la calidad del tubérculo y la reducción del rendimiento, puede alcanzar 20-30% (Olanya et al., 2009). SÍNTOMAS: Se observa principalmente en hojas, tallos y frutos. Las lesiones aparecen inicialmente como manchas circulares de color oscuro a negro que pronto se vuelven a manera de anillo concéntricos característicos. Los síntomas aparecen primero en las hojas maduras, las cuales si tienen un gran número de estas lesiones mueren y caen. Los síntomas distintivos de A. solani incluyen mancha foliar y la defoliación, que son más pronunciados en la parte baja del dosel, causando algunas veces muerte de plántulas (Hansen, 2009). Las lesiones en el tallo frecuentemente estrangulan a la planta. El fruto puede ser atacado en estado verde y maduro, siendo la enfermedad más severa en frutos maduros. Los síntomas en el follaje de la papa son muy parecidos a los descritos en el tomate. En los tubérculos las regiones afectadas son oscuras contrastando con la parte sana y las lesiones inmediatamente se secan desarrollando áreas con apariencia corchosa. 104 Enfermedades Importantes de Algunos Cultivos de México El hongo produce micelio tabicado, ramificado, el cual se oscurece con la edad. Las conidias se caracterizan por tener divisiones en sentido longitudinal y transversal. Las dimensiones de las conidias son de 12 a 20 micras por 120 a 296 micras. No se conoce al estado perfecto del hongo (Ávila, 1983). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: El hongo penetra directamente, pero también a través de heridas o estomas a las hospederas. Diseminación: La diseminación es principalmente efectuada por el viento y el agua. Cada parte de la planta puede ser infectada y formar lesiones. Esto es especialmente importante cuando frutos o tubérculos están infectados, ya que son una fuente de diseminación de la enfermedad (Wharton y Kirk, 2007). Invernación: La invernación puede darse como micelio y conidias, que subsisten en residuos de plantas y en ocasiones sobre semilla en el caso del tomate. Condiciones favorables: Las esporas de A. solani germinan en dos horas en un amplio rango de temperaturas, pero entre 27 y 29 ºC pueden hacerlo en ½ hora. La mejor esporulación se da a 27 ºC con la presencia de abundante humedad (rocío, riego, neblina etc.). Las plantas con mala nutrición o estresadas son más susceptibles (University of Maine, 2010). Asimismo, el agua libre sobre el follaje, se necesita para una producción abundante de esporas, las cuales serán capaces de infectar a una hoja seca (Kemmit, 2002). DISTRIBUCION GEOGRÁFICA: Su área de distribución coincide con éstos cultivos y la influencia de las condiciones climatológicas sobre ella es mucho menor que en el caso de otras enfermedades como los mildius. Es importante en todo México. 105 Enfermedades Importantes de Algunos Cultivos de México Tizón tardío de la papa y tomate Phytophthora infestans (Mont.) de Bary 1876 Gerald Holmes, Valent USA Corporation, Bugwood.org Clasificación científica División Subdivisión Clase Orden Familia Género Especie Eumycota Mastigomycotina Oomycetos Pythiales Pythiaceae Phytophthora infestans HOSPEDERAS: Se reportan un gran número de plantas dentro de las solanáceas, pero los principales huéspedes entre los cultivos de importancia socio-económica destacan la papa y el tomate. 107 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: El tizón tardío tiene historial en cuanto a los trastornos que ha ocasionado a la humanidad. Se tienen datos de grandes migraciones de gente a causa de esta enfermedad tal y como ocurrió en Irlanda en el año de 1845, en que el hongo acabó prácticamente con el cultivo de la papa, alimento básico en aquel entonces de esos lugares (Jaramillo, 2003). Es una enfermedad íntimamente influenciada por condiciones ambientales. Se considera que cada 5 -10 años existen condiciones favorables para que la enfermedad se exprese con toda severidad en la mayoría de las áreas dedicadas al cultivo de la papa. En la actualidad, no obstante las variedades resistentes que se han producido, se tienen daños muy severos y en otros casos se requiere la aplicación de fungicidas que representa un gasto adicional para el agricultor. Puede llegar a causar hasta el 100% de pérdidas del rendimiento (Nowicki et al., 2012). SÍNTOMAS: En las hojas las manchas son de color marrón claro a oscuro, de apariencia húmeda, de forma irregular, algunas veces rodeadas por un halo amarillento, no están limitadas por las nervaduras de las hojas. Estos síntomas se presentan inicialmente en los bordes y puntas de las hojas. Bajo condiciones de alta humedad, se forman en la cara inferior (envés) de las hojas unas vellosidades blanquecinas que constituyen las estructuras del patógeno (esporangióforos y esporangios). Bajo condiciones de alta humedad, las lesiones desarrollan rápidamente y producen una marchitez general. En el envés, aparece una vellosidad blanca (esporangióforos y esporangios). En los campos atacados es fácil percibir un olor desagradable característico debido a la rápida descomposición del tejido foliar (Pérez y Forbes, 2008). En tiempo seco, los síntomas iniciales permanecen localizados. En los tubérculos de la papa, aparecen áreas hundidas, acuosas, las cuales posteriormente se necrosan y se tornan de color café. 108 Enfermedades Importantes de Algunos Cultivos de México En ausencia de organismos secundarios, una pudrición seca es característica. En el caso de los frutos del tomate, estos pueden ser atacados en cualquier estado de madurez, apareciendo los síntomas como lesiones hundidas, irregulares de color café. Es un saprófito facultativo. Posee micelio cenocítico, es decir no presenta septas o tabiques que separen el micelio; los esporangios son ovoides, elipsoidales a limoniformes, ahusados en la base, caducos, con un pedicelo menor de 3 mm y semipapilados (Pérez y Forbes, 2008). En condiciones de humedad alta, el hongo ramifica en estructuras que pueden ser esporangióforos o conidióforos, por medio de los cuales penetra a los tallos y las hojas. Adheridos a dichas estructuras, están los zoosporangios o conidias según las condiciones de temperatura. Así, temperaturas menores de 18°C, se forman zoosporangios, los cuales contienen de 2-8 zoosporas biflagelas que quedan en libertad al germinar los zoosporangios. Bajo condiciones de temperatura más elevada, 22 a 32°C, se producen conidias las cuales directamente emiten un tubo germinativo. El estado sexual del hongo (perfecto), ha sido observado únicamente en México. La razón es que para que se realice la fusión sexual y se formen oosporas se requieren 2 tallos, A1 y A2, los cuales existen únicamente en México. La fusión del oogonio y anteridio da como resultado la formación de oosporas (esporas sexuales) las que emiten tubos germinativos los cuales generalmente llevan zoosporangios y al germinar éstos, liberan a las zoosporas (Ávila, 1983). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Penetración: En presencia de una película de agua las zoosporas y conidias germinan. Los tubos germinativos producidos por las zoosporas o conidias forman un apresorio (protuberancia de las hifas que le permiten adherirse al huésped) y penetran 109 Enfermedades Importantes de Algunos Cultivos de México directamente por la cutícula y ocasionalmente a través de los estomas o lenticelas. Diseminación: Los zoosporangios y conidias, son diseminados por la lluvia, viento o insectos. El hongo puede ser diseminado por medio de tubérculos de papa o frutos de tomate. Invernación: Las esporas del hongo hibernan en tubérculos infestados, especialmente los que quedan en los residuos de cosecha del ciclo anterior y se diseminan rápidamente bajo condiciones húmedas y cálidas (Koepsell y Jay, 1994), El patógeno permanece activo durante el invierno en lugares en que cultiven tomate en esa época del año. En México, las oosporas representan la fase de invernación del hongo, mientras que en los Estados Unidos, este tipo de espora (oospora), probablemente no desarrolla naturalmente. Las oosporas persisten en el suelo en los residuos de cosecha. Condiciones favorables: Le favorecen temperaturas entre 15.6 y 26.7 ºC y alta humedad relativa que haga que se presente humedad en la hoja durante 12 horas continuas. Puede desarrollar incluso en condiciones más cálidas (35ºC) si se presentan condiciones de muy alta humedad relativa y temperaturas nocturnas de 15.6 a 24 ºC (Fry, 1998). Otros autores señalan que son ideales temperaturas nocturnas de 10 ºC y diurnas de 21 ºC acompañadas por lluvia, neblina o rocío (Ivors, 2008). DISTRIBUCIÓN GEOGRÁFICA: Posee distribución mundial. En Estados Unidos fue observada en Florida en 1903; en California en 1904; en Texas en 1936 y en Colorado en 1941. En México es una de las enfermedades más importantes de estos 2 cultivos. 110 Enfermedades Importantes de Algunos Cultivos de México Mildiú velloso de la lechuga Bremia lactucae Regel Sinónimos: Botrytis gangliformis Berk.; Bremia centaureae Syd., (1923); Peronospora gangliformis (Berk.) de Bary, (1863). Gerald Holmes. Valent USA Corporation. Bugwood.org Clasificación científica División Eumycota Subdivisión Mastigomycotina Clase Oomycetos Orden Peronosporales Familia Peronosporaceae Género Bremia Especie lactucae HOSPEDEROS: Hay 230 especies de plantas suceptibles a esta enfermedad y la mayoría de ellas son malas hierbas entre las que destaca la lechuga espinosa. Además de la lechuga, 111 Enfermedades Importantes de Algunos Cultivos de México otros vegetales que son atacados son alcachofa, escarola y la achicoria. La lechuga salvaje (Lactuca saligna) es resistente a todas las razas de mildiú velloso y puede ser considerada como un huésped de B. lactucae (Dimnsey, 2007). IMPORTANCIA ECONÓMICA: Las pérdidas económicas por el mildiú varían de forma considerable, oscilando entre 30 y 50% en lechuga (Smith et al., 1992). SÍNTOMAS: Los primeros síntomas pueden observarse sobre las plántulas que, una vez infectadas, amarillean, se secan y se mueren prematuramente. En fases más avanzadas del cultivo, los ataques comienzan a partir de la formación del cogollo, apareciendo primero en las hojas externas. Los daños pueden ser ya graves en el semillero, donde se forman manchones de infección, sobre todo si la densidad de planta es excesiva. Durante el desarrollo del cultivo, causa daños importantes en las hojas exteriores, debiéndose eliminar para su comercialización y evitar podredumbres posteriores (Tayupanta, 2012). Las plantas jóvenes son especialmente sensibles al mildiu. B. lactucae se desarrolla muy rápidamente sobre los cotiledones a los que recubre con sus numerosas fructificaciones blancas. Invade los tejidos foliares que se decoloran, algunas hojas jóvenes tienen su limbo enrollado en el borde. Ocasiona también el raquitismo de las plántulas y provoca su muerte. Sobre plantas de más edad, se desarrolla al principio sobre las hojas de la corona, provocando manchas grandes de color verde pálido a amarillas, delimitadas por las nervaduras. Al avanzar la enfermedad se desarrollan manchas sobre las hojas internas del follaje. En las hojas, por el haz aparecen manchas decoloradas que van desde un verde claro a amarillo, llegando en estados más avanzados a necrosarse. Por el envés se aprecian las fructificaciones del hongo, con aspecto polvoriento, de coloración blanca. Las manchas suelen estar delimitadas por 112 Enfermedades Importantes de Algunos Cultivos de México las nervaduras de las hojas. A veces se producen infecciones sistematicas y son visibles cuando oscurecen los tejidos internos del tallo y de la base de las hojas (Blancard et al., 2005; Cambra y Bernal, 1996). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGIA: B. lactucae es un patógeno oomyceto obligado perteneciente a los Peronosporales. El viento también puede influir en la esporulación al afectar la humedad relativa en la capa límite de la superficie de la hoja. (Lebeda et al., 2008) Las infecciones se inician cuando las esporas germinan sobre la superficie de la hoja y penetran directamente en ella a través de la epidermis, la colonización se produce cuando el micelio intercelular crece y penetra en las células de las hojas, utilizando los nutrientes crece y se expande a toda la hoja, de manera muy rápida. Cuando las condiciones meteorológicas son apropiadas, los conidióforos emergen a través de los estomas y liberan las conidias, las cuales son diseminadas por el viento. Este hongo es capaz de infectar cualquier etapa de crecimiento de las plántulas de lechuga. Aunque el mildiú velloso es generalmente más severo en las hojas exteriores maduras, la enfermedad puede llegar a ser sistémica con el tiempo, infectando el interior de las cabezas de lechuga y colonizando las raíces. Las lesiones pueden servir como punto de entrada para invasores secundarios, tales como el hongo Botrytis cinerea. B. lactucae produce esporangios que poseen de 4 a 6 ramificaciones dicotómicas, los esporangios generalmente miden cerca de 430-990 x 7-16 µm, terminando en extremidades dilatadas en forma de taza, cada una conteniendo 4-5 esterigmas donde los esporangios son formados. Condiciones favorables: Los conidios requieren agua libre sobre la superficie de la hoja para la germinación e infección. 113 Enfermedades Importantes de Algunos Cultivos de México La colonización inicia cuando las temperaturas son alrededor de 21°C. La esporulación requiere de alta humedad relativa (Padgett y Laemmlen, 2003). La humedad atmosférica es uno de los factores ambientales más importantes que afectan la esporulación del mildiú velloso. La humedad relativa mínima requerida para la esporulación del mildiú velloso oscila entre el 90 y 98%. La esporulación de B. lactucae requiere al menos 80% de humedad relativa. (Su et al., 2003). DISTRIBUCIÓN GEOGRÁFICA: Es un patógeno de importancia económica en todo el mundo. Las pérdidas económicas por la enfermedad varían dependiendo de la región geográfica, la época del año y el tipo de lechuga (Salazar, 2011). 114 Enfermedades Importantes de Algunos Cultivos de México Roya del espárrago Puccinia asparagi DC Sinónimos: Aecidium asparagi Lasch, (1848); Dicaeoma sparagi (DC.) Kuntze, (1898); Persooniella asparagi (DC.) Syd., (1922); Puccinia discoidearum var. asparagi (DC.) Wallr., (1833); Uredo asparagi Lasch, (1848) Manuel de Jesús Valenzuela Ruiz. INIFAP-SECAB Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Puccinia Especie asparagi 115 Enfermedades Importantes de Algunos Cultivos de México HOSPEDEROS: Solo el espárrago comestible y las especies ornamentales (Persley et al., 2010). IMPORTANCIA ECONÓMICA: En zonas áridas como el Valle Imperial de California han reportado daños en muchos campos con un 100% de las plantas infectadas (Blanchete et al., 1982). Síntomas: Los síntomas de esta enfermedad en los tallos maduros son lesiones alargadas que contienen pequeñas pústulas de color naranja-rojo ordenados en anillos concéntricos. La enfermedad puede disminuir el vigor de la planta y reducir la calidad de los espárragos cosechados. En casos graves, puede causar la senescencia prematura y la muerte de las plantas (Viljanen et al., 2006). Las infecciones comienzan durante la primavera a partir de la hibernación de esporas en los restos de cultivos. La roya tiene varias etapas visuales conocidas como las etapas de esporas de color naranja, rojo y negro. Los síntomas visuales de la infección comienzan con pústulas de color verde claro sobre nuevos espárragos, que maduran en pústulas amarillo anaranjado o amarillo pálido; en esta estación aparece la enfermedad con basidiosporas; que consiste en unas lesiones de forma oval, de color verde claro en cuyo centro aparece un punto minúsculo de color amarillento-dorado, con un tamaño de 6 a 15 milímetros. Esta infección ocurre en primavera por lo que solo puede atacar en el vivero y en los años donde el cultivo no se cosechó. A principios y mediados de verano, cuando las condiciones son cálidas y húmedas, las esporas de color naranja se extienden a nuevos brotes de espárrago produciendo pústulas de color ladrillo a rojo en los tallos, las ramas y las hojas. El espárrago infectado comienza a deshojar y morir antes de tiempo. A finales del otoño e invierno las pústulas de color rojo empiezan a producir esporas negras y poco a poco convertirse en apariencia a una masa pulverulenta de esporas de color negro azabache. Esta es 116 Enfermedades Importantes de Algunos Cultivos de México la etapa de hibernación del hongo y la fuente para la siguiente temporada de infección (Serrano, 2004; Dimsey, 2003). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGIA: P. asparagi, es un hongo macrocíclico es decir, presenta todas las fases de una roya: Fase picnea, aecia, uredia, telia y basidia. Por lo general, los síntomas se perciben primero en los brotes que crecen en primavera/verano, con un período de latencia de 8 a 12 días (Liberato et al., 2006). Una vez finalizada la cosecha del espárrago, los nuevos brotes se desarrollan y forman el follaje del año. La roya infecta este follaje y produce pústulas de color rojo en los tallos y las agujas. La roya puede propagarse rápidamente, causando grandes infecciones del follaje. Más adelante, las pústulas pueden llegar a ser de color café a negras como teliosporas. La infección severa debilita las plantas y reduce el rendimiento. Al igual que la mayoría de los hongos, el ciclo de vida es complejo. La enfermedad es a menudo iniciada por teliosporas que germinan para producir tipos de esporas intermedios que finalmente forman ecidias. Las aecidiosporas penetran en el huésped y producen uredinios y urediosporas durante el verano. Las teliosporas se reproducen en forma exponencial hacia el final de la temporada (Koike et al., 2007). Las teleutosporas oblongas, con el ápice algo engrosado y el pedicelo hialino persistente y casi tan largo como las esporas, que llegan a medir normalmente 52 x 26 µ. Los pedicelos llegan con frecuencia a medir 60 µ, es decir, son más largos que la parte esporífera (González, 1924). A finales del verano o el otoño, la producción de uredosporas se sustituye gradualmente por la formación de grandes paredes gruesas, teliosporas negras, ya sea en uredias existentes o pústulas recién formadas. Estas lesiones de color café negruzco, llamado telia, dan un aspecto oscuro a las partes superiores de las plantas. Las teliosporas se mantienen unidas en las pústulas en secciones de la planta de espárrago o en restos vegetales 117 Enfermedades Importantes de Algunos Cultivos de México durante el resto de la temporada y durante todo el invierno. En la primavera, cuando surgen los brotes jóvenes, las teliosporas, hibernadas en el tallo viejo o rastrojos, germinan para producir esporidios (a menudo llamado basidiosporas). Los esporidios pueden infectar los brotes nuevos. Las nuevas infecciones producen estructuras fructíferas llamadas picnios que producen picniosporas. Poco después, el aecio y aeciosporas desarrollan el ciclo completo de la enfermedad. Condiciones favorables: Se desarrolla en un rango bastante amplio de temperatura, siendo particularmente más agresiva durante los veranos más cálidos con una esporulación óptima entre 25 y 30 ºC. Las urediosporas germinan mejor entre 10 y 15 °C, con un período de humectación de 3 horas continuas, suficiente para su germinación a 15 ºC. Las bajas temperaturas nocturnas favorecen el desarrollo de uredinios y son las condiciones ideales para las epidemias de Puccinia asparagi (Smith et al., 1988). DISTRIBUCIÓN GEOGRÁFICA: En toda región que se cultiva esta especie. 118 Enfermedades Importantes de Algunos Cultivos de México Roya del cafeto Hemileia vastatrix Berk. & Broome (1869) Sinónimos: Wardia vastatrix J.F.Hennen & M.M.Hennen (2003) Zenón Iturbide Silverio. SENASICA Clasificación científica División Eumycota Subdivisión Basidiomycotina Clase Teliomycetos Orden Uredinales Familia Pucciniaceae Género Hemileia Especie vastatrix HOSPEDERAS: A la fecha solo se ha demostrado en este cultivo, aunque se han postulado otras especies, no ha sido confirmado (Arneson, 2000). 119 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: La roya es la enfermedad del cafeto de mayor importancia económica en el mundo, y en valor monetario, ya que es el producto agrícola más importante en el comercio internacional. SÍNTOMAS: Las infecciones se producen en las hojas y rara vez se les encuentra en tallos jóvenes y frutos (Ferreira y Boley, 1991). Los síntomas iniciales son pequeñas manchas de color amarillo pálido en las superficies superiores de las hojas, las cuales aumentan gradualmente en diámetro y aparecen masas de urediosporas color naranja en el lado inferior de las hojas (Lucas et al., 2001). El hongo esporula a través de los estomas en lugar de la epidermis como la mayoría de las royas lo hacen, por lo que no se forman las pústulas típicas de muchas royas. Las lesiones polvosas en el envés de las hojas pueden ser de color naranja-amarillo al rojo-anaranjado en color, y existe una variación considerable de una región a otra. Aunque las lesiones pueden desarrollarse en cualquier parte de la hoja, tienden a concentrarse alrededor de los márgenes, donde se concentran las gotas de rocío y lluvia. El centro de las manchas eventualmente se seca y se vuelve color marrón, mientras que los márgenes de las lesiones continúan expandiéndose y producen urediosporas. A principios de la temporada, las lesiones suelen aparecer primero en las hojas más bajas, y la infección progresa lentamente hacia arriba en el árbol. Las hojas infectadas caen prematuramente, dejando largas extensiones de ramas desprovistas de hojas (Arneson, 2000). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: H. vastatrix sobrevive principalmente como micelio en los tejidos vivos del huésped, y puesto que las hojas infectadas caen prematuramente, esto ayuda a eliminar eficazmente una gran cantidad de potencial de la epidemia. Sin embargo, algunas hojas verdes siempre persisten hasta la temporada seca, y urediosporas secas pueden sobrevivir alrededor de 6 semanas, por lo que siempre hay algo 120 Enfermedades Importantes de Algunos Cultivos de México de inóculo viable para infectar las hojas recién formadas al inicio de la próxima temporada de lluvias. Las urediosporas son dispersadas por el viento y la lluvia. Mediante la observación de patrones de infección en hojas individuales y entre las hojas dentro del dosel, está claro que las salpicaduras de lluvia es un modo importante de dispersión local. Los patrones de infección a escala regional, sobre todo en aquellas zonas donde se introdujo el hongo recientemente, han demostrado que la dispersión a larga distancia es principalmente por el viento. Una pequeña cantidad, quizá epidemiológicamente insignificante de dispersión (urediosporas) es por trips, moscas, avispas y otros insectos. El movimiento a través de océanos, desiertos y cordilleras muy probablemente hayan sido causados por la intervención humana (Arneson, 2000). Condiciones favorables: La temperatura es el factor importante en la incidencia de la enfermedad, ya que las esporas de H. vastatrix germinan mejor a 22°C, pero no ocurre germinación a 15.5°C y menos a 28°C o más. Según trabajos realizados, la temperatura óptima para la germinación de las urediosporas es de 23.7°C. La temperatura también afecta el período de incubación del hongo, después de iniciada la infección. El mayor número de pústulas por hoja está relacionado con el porcentaje de germinación a la temperatura óptima (Osorio, 1983). Las urediosporas germinan sólo en presencia de agua libre (lluvia o rocío fuertes), ya que la humedad alta por sí sola no es suficiente. Todo el proceso de la infección requiere de 24 a 48 horas de humedad libre continua, por lo que mientras un fuerte rocío es suficiente para estimular la germinación de las urediosporas, la infección suele producirse sólo durante la temporada de lluvias. La variación estacional en la incidencia de la enfermedad se debe principalmente a la variación en las precipitaciones. Cuando haya dos estaciones lluviosas por año, hay dos picos en la severidad de la roya del cafeto. La infección 121 Enfermedades Importantes de Algunos Cultivos de México se produce en un amplio intervalo de temperaturas (mínimo 15 °C, óptima 22 °C y máximo 28 °C). La infección se produce sólo a través de los estomas en el envés de la hoja (Arneson, 2000). DISTRIBUCIÓN GEOGRÁFICA: Se encuentra en todas las plantaciones de cafeto a nivel mundial. 122 Enfermedades Importantes de Algunos Cultivos de México Antracnosis del mango Glomerella cingulata (Stoneman) Spauld. & H. Schrenk Sinónimos: Colletotrichum gloesporiodes Penz.) Penz. and Sacc.; Gloeosporium olivarum. Scot C. Nelson. Hawaii, USA. Clasificación científica División Eumycota Subdivisión Ascomycotina Clase Pirinomyctos Orden Sphaeriales Familia Glomerellaceaea Género Glomerella Especie cingulata HOSPEDERAS: Principalmente en mango y aguacate (Téliz, 2000). 123 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: La antracnosis es la principal enfermedad pre y postcosecha del mango, causando pérdidas directas de rendimiento en el campo, después de la cosecha en las plantas de empaque, así como en la calidad del fruto y su comercialización posterior (Arauz, 2000; Ploetz, s/f). Aunque se producen pérdidas en el campo, las pérdidas postcosecha son las más significativas, por lo que la antracnosis representa grandes desafíos para quienes están involucrados en el comercio internacional de este fruto. En general las pérdidas son del 3% de la producción, pero cuando las condiciones ambientales existentes en la floración son óptimas para su desarrollo los daños pueden llegar hasta el 60% (Gobierno del Estado de Colima, 2005). SÍNTOMAS: El inicio del problema suele presentarse en tejidos jóvenes, flores y frutos tanto de árboles en desarrollo como en producción. En ramas y hojas se presenta en forma de manchas pequeñas de color negro, cuando la enfermedad es muy severa los racimos de flores se marchitan, ocasionando que no haya polinización. Los frutos pueden ser infectados en cualquier etapa de crecimiento. Los frutos jóvenes afectados se desprenden y caen; en los maduros se forman manchas negras concéntricas y pequeñas que aumentan su tamaño a medida que madura el fruto. Cuando el ataque es severo son insípidos e incluso amargos, y pueden ser invadidos por hongos y bacterias de la pudrición blanda que penetran a través de la superficie maltratada (Gobierno del Estado de Colima, 2005). Si el clima húmedo se produce durante la floración, la antracnosis causa un fuerte tizón en las flores que puede destruir las inflorescencias (racimo floral) y evitar el amarre de frutos (Stovold y Dirou, 2004). 124 Enfermedades Importantes de Algunos Cultivos de México Los frutos pequeños pueden desarrollar diminutas manchas oscuras y abortar si la infección ocurre en la etapa inicial de su desarrollo. Una vez que se forma el apresorio y el fruto excede los 4-5 cm de diámetro, cesa el desarrollo de la infección. Infecciones quiescentes renuevan su desarrollo una vez que los inhibidores fúngicos en el fruto disminuyen durante el proceso de maduración. En frutos grandes (maduros), las lesiones pueden formarse en cualquier parte, aunque son comunes manchas que irradian desde el final del tallo hacia el ápice del fruto. Las lesiones en el fruto son superficiales y se extienden a la masa solo después que una gran porción del fruto ha sido afectada. Sin embargo, incluso el desarrollo superficial de la enfermedad produce daños estéticos serios y el rechazo del fruto a lo largo de la cadena de comercialización. CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Las condiciones húmedas y la alta humedad relativa constituyen factores primarios en la dispersión y desarrollo de la antracnosis. Los conidios producidos en ramas terminales, inflorescencias momificadas, brácteas florales y hojas (más importante) son fuentes significativas de infección (Dodd et al., 1991; Fitzell y Peak, 1984) y se producen más abundantemente donde existe superficies húmedas, aunque también a humedades relativas de al menos 95%. Los conidios se dispersan a través de salpicaduras de agua de lluvia y la infección requiere de condiciones húmedas (Jeffries et al., 1990). Los apresorios se melanizan, fortaleciéndose y facilitando su penetración en la cutícula a través de sus ganchos de infección. La presencia y prevalencia de apresorios melanizados han sido utilizadas para predecir la infección por antracnosis y cuando se necesitan medidas para su control (Dodd et al., 1991; Fitzell y Peak, 1984). 125 Enfermedades Importantes de Algunos Cultivos de México Condiciones favorables: La infección de las flores depende de la temperatura y la duración de la humedad de la superficie foliar. A menores temperaturas (10 -13 ºC) se requieren períodos más largos de humedad que a mayores temperaturas (22 º -25 º C) (Stovold y Dirou, 2004). Otros autores señalan que las esporas se producen en un rango de temperatura de 10 a 30 ºC, pero su ideal lo alcanzan entre 17 y 20ºC, con una humedad relativa superior a 95% (Becerra y Rosas, s/f). DISTRIBUCIÓN GEOGRÁFICA: En México se encuentra distribuida en todos los Estados productores de mango, sin embargo, en Tabasco se han detectado ataques fuertes y más destructivos en las etapas de floración (Becerra y Rosas, s/f). 126 Enfermedades Importantes de Algunos Cultivos de México Cenicilla del mango Oidium mangiferae Berthet (1914) Sinónimos: Acrosporium mangiferae (Berthet) Subram., (1971); Oidium erysiphoides f. mangiferae (Berthet) J.M. Yen & Chin C. Wang (1973). Scot C. Nelson. Hawaii, USA. Clasificación científica División Eumycota Subdivisión Deuteromycotina Clase Hiphomycetos Orden Moniliales Familia Moniliaceae Género Oidium Especie mangiferae HOSPEDERAS: Solamente en mango. 127 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: Es una de las enfermedades más comunes y perjudiciales de este cultivo, y es causada por Oidium mangiferae, con pérdidas de rendimiento entre 20 y 90 % en varias regiones debido a las infecciones del hongo (Verma y Sharma, 1999). SÍNTOMAS: El daño principal por este hongo se observa en las panículas, durante la floración. Sobre éstas se presenta un polvo blanco, que seca las flores, con lo que origina bajo prendimiento de frutos, que también pueden ser afectados con el mismo polvillo blanco. El hongo se puede presentar en follaje tierno, donde afecta el envés de las hojas, si el ataque es severo provoca distorsión, tanto a nivel de vivero como en plantaciones establecidas. Al avanzar la infección, las áreas cubiertas por el polvillo blanco se secan, lo que puede ocasionar defoliación. Este hongo también puede afectar frutos tiernos. En algunos casos, el efecto de esta enfermedad en el fruto se confunde con el de la roña, debido a la presencia de escarificaciones (Becerra y Rosas, s/f). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: El hongo persiste en hojas viejas y ataca al aparecer, el tejido joven. Puede presentarse bajo condiciones de 22ºC de temperatura y 100% de humedad relativa (HR). Si la temperatura aumenta, la esporulación disminuye. La HR no es tan necesaria para que esta condición se presente (Becerra y Rosas, s/f). La enfermedad es altamente policíclica con el ciclo de vida del patógeno desde la germinación hasta conidiación de sólo 9 días, y los conidios infectan los tejidos de las plantas de 5-7 horas después de la germinación (Akhtar y Alam, 2002). Las temperaturas cálidas con cobertura de nubes y el rocío pesado promueven la infección, pero a pesar de la sequía favorecen el desarrollo la enfermedad (Rawal, 1997). El hongo pasa el invierno en las hojas e inflorescencias infectadas en forma de micelio latente, conidióforo o conidia (Gupta, 1985). 128 Enfermedades Importantes de Algunos Cultivos de México Este hongo es ectofítico, ya que existe principalmente en la superficie de los tejidos vegetales. Se nutre de la planta por medio de haustorios que penetran en la capa epidérmica (Rawal, 1997). Este patógeno es también biotrófico, sobreviviendo sólo en tejidos vegetales vivos. Cuando el crecimiento del patógeno cesa, el tejido se necrosa (Akhtar et al., 2000). Los conidios germinan en un rango de temperatura de 9 a 30.5 ºC con óptima de 22 ºC. La enfermedad se disemina a través del viento, infectando las conidias entre o intra plantas del frutal. Condiciones favorables: Las epidemias generalmente suceden con humedades relativas altas (>90%) y temperaturas de 20 a 25ºC (Becerra y Rosas, s/f), en las etapas de elongación de la inflorescencia (todavía protegida por brácteas) hasta el amarre de frutos pequeños de 8 mm [Schoeman y Manicom (1995) citados por Nelson, 2008]. Otros autores señalan que las mejores condiciones de clima son temperaturas de 30 ºC en el día y 10 ºC en la noche, con humedad relativa entre 60 y 90 % (Galán, 1999). DISTRIBUCIÓN GEOGRÁFICA: Ocurre en muchos países que se encuentran en latitudes de 40º al norte y sur del Ecuador, algunos de ellos en Asia (Pakistán, India, Ceilán, Nepal e Israel), África (Egipto, Etiopía, Kenia y Rhodesia), América (Estados Unidos, México, Perú y Brasil) y en Australia (Nueva Gales del Sur) (Becerra y Rosas, s/f). 129 Enfermedades Importantes de Algunos Cultivos de México Malformación del mango “escoba de bruja” [[Fusarium subglutinans [Wollenw. & Reinking) (1983) y F. oxysporum Schlecht. Emend. Snyder & Hansen]] Sinónimos: [F. moniliforme var. subglutinans Wollenw. & Reinking, (1925)]; [F. neoceras var. subglutinans (Wollenw. & Reinking) Raillo, (1950)]; [F. sacchari var. subglutinans (Wollenw. & Reinking) Nirenberg, (1976); Gibberella fujikuroi var. subglutinans] zapopan.olx.com.mx Clasificación científica División Eumycota Subdivisión Deuteromycotina Clase Hiphomycetos Orden Moniliales Familia Moniliaceae Género Fusarium Especie subglutinans HOSPEDERAS: Además del mango, puede atacar maíz. 131 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: Puede llegar a causar pérdidas hasta del 40% (Noriega, 1996). SÍNTOMAS: Las panículas infectadas presentan proliferación excesiva de miles de flores estériles, con engrosamiento, acortamiento de entrenudos y necrosamiento del raquis. Las inflorescencias tienen apariencia arrosetada y compacta, pueden desarrollar virescencia y filodia, se marchitan hasta el final de cosecha y persisten como masas carbonosas sobre los árboles hasta el ciclo siguiente (Covarruvias, 1978; Díaz, 1979; Olivas, 1979). En brotes vegetativos se observan síntomas de proliferación causados por la pérdida de dominancia apical y entrenudos cortos que causan achaparramiento de los tallos y les dan un aspecto roseteado (Covarruvias, 1978 citado por Mora et al., 2003). Es más común en las inflorescencias, aunque también se puede observar en los brotes vegetativos y en las hojas, además de que se puede dar en árboles adultos y jóvenes aún de vivero (Varma et al., 1969 citado por Covarrubias, 1988). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: El hongo dominante en las infecciones por esta enfermedad es F. subglutinans (Haggag, 2010). Se ha estudiado poco a nivel mundial, aunque existen evidencias de que la temperatura y humedad son factores importantes en el desarrollo de la infección. Se ha observado que el ácaro Aceria mangiferae puede acarrear esporas y micelio de las dos especies de hongo sobre su cuerpo (Crookes y Rijkenberg, 1985; Noriega, 1996 citados por Mora et al., 2003). La relación del ácaro de las yemas con la incidencia de la enfermedad ha sido inconsistente, ya que se han encontrado altas poblaciones en árboles sanos (Covarruvias, 1978 citado por Mora et al., 2003), además de que el uso de acaricidas para su control, fallaron en la corrección del problema (Yadav, 1999). 132 Enfermedades Importantes de Algunos Cultivos de México Condiciones favorables: En un monitoreo poblacional de F. subglutinans la mayor densidad de esporas coincidió con temperaturas entre 8 y 27 ºC y humedad relativa superior al 85%, habiendo declinado cuando se presentaron en períodos calientes y secos (Kummar et al., 1993). En Guerrero, México, Noriega et al., (1999) encontraron que la enfermedad prosperó con temperaturas < 25ºC y humedad relativa ≥ 60%, presentándose la mayor densidad de poblaciones de conidias durante la temporada de lluvias. DISTRIBUCIÓN GEOGRÁFICA: La enfermedad se observó por primera vez en México en 1958 (Morales y Rodríguez, 1961). Se distribuye más especialmente en la cuenca del Pacífico y trópico seco del país (Mora et al., 2003), los daños más severos se detectan en plantaciones cuya altitud oscila entre 200 y 75 msnm (Michel, 2001). 133 Enfermedades Importantes de Algunos Cultivos de México Antracnosis del aguacate Colletotrichum gloesporiodes (Penz.) Penz. and Sacc. Sinónimos: Glomerella cingulata (Stoneman) Spauld. & H. Schrenk, (1903); Gloeosporium olivarum growables.org Clasificación científica División Eumycota Subdivisión Deuteromycotina Clase Coelomycetos Orden Melanconiales Familia Melanconiaceae Género Collectotrichum Especie gloeosporioides HOSPEDERAS: Además del aguacate, también afecta al mango (Téliz, 2000). Puede afectar a los cítricos. 135 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Aunque los frutos afectados se pueden consumir, su sabor desagradable afecta la calidad y demanda del consumidor, por lo que se reduce su comercialización, además de que se reduce fuertemente su vida de anaquel. SÍNTOMAS: Lesiones de varios tamaños pueden presentarse en cualquier lugar del fruto, son de color oscuro y de rápida expansión en el tamaño, afectando tanto a la piel como la pulpa. Los síntomas pueden aparecer tan solo en 1 ó 2 días, en frutas que parecían sanas al momento de la cosecha. En algunos casos, los síntomas pueden formarse en los frutos verdes que todavía están en el árbol. Las manchas que causa el hongo, son más difíciles de detectar en los cultivares de piel oscura, y pueden estar relacionados con daños realizados durante la cosecha. Las frutas que presentan síntomas antes de la maduración pueden caer prematuramente. Las lesiones varían en tamaño de milímetros a centímetros de diámetro y pueden diferir entre los cultivares de aguacate. Las lesiones en la piel de la fruta inicialmente son pequeñas, de color marrón claro, y circular, más tarde ampliar y volviéndose ligeramente hundido en sus centros, mientras que su color cambia a marrón oscuro o negro. Los síntomas en hojas y tallos (tizón) rara vez aparecen, excepto cuando hay condiciones muy húmedas. Por lo general, masas de esporas del patógeno de un distintivo color rojo salmón aparecen en los centros de las lesiones de la fruta de mayor tamaño (Nelson, 2008). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Las conidias del hongo se diseminan principalmente por las salpicaduras causadas por el impacto de las gotas de lluvia, que se mueven a partir de ramas u hojas infectadas (vivas o muertas) a la fruta. Las conidias germinan en 7 horas cuando los frutos 136 Enfermedades Importantes de Algunos Cultivos de México están húmedos, siendo la temperatura óptima para la infección de aproximadamente 28 °C. Los frutos en cualquier etapa de crecimiento son susceptibles a la infección, especialmente durante largos períodos de lluvia y / o humedad relativa alta. Después de que el hongo penetra la piel del fruto, se mantiene inactivo hasta que la fruta madura. Si se aplican fungicidas preventivos puede reducirse el desarrollo del hongo. El desarrollo de síntomas puede ocurrir rápidamente después de la cosecha, especialmente bajo condiciones de calor y humedad de almacenamiento. El patógeno puede causar un daño significativo a la apariencia de la fruta, calidad y sabor en sólo 2 días después de la maduración. El hongo sobrevive entre los ciclos de fructificación, ya sea en el dosel de la planta o en el suelo, además de otras hospederas como el plátano (Musa spp.) o cafeto (Coffea arabica), o como saprófito en la materia orgánica muerta (Nelson, 2008). Condiciones favorables: Téliz (2000) y Pérez-Jiménez (2008) señalan como condiciones favorables para el desarrollo de la enfermedad temperaturas entre 18 y 26 ºC, y humedad relativa >80%. Una vez que la fruta infectada empieza a madurar, temperaturas superiores a 23.9 ºC acelerarán el desarrollo de la enfermedad, mientras que temperaturas por debajo de 15 ºC retardan su desarrollo (Faber et al., 2008). Plantaciones muy estrechas, con vigor excesivo inhiben el movimiento del aire y fomentan la infección (Allen, 1985). DISTRIBUCIÓN GEOGRÁFICA: Se considera de distribución mundial en plantaciones de aguacate. 137 Enfermedades Importantes de Algunos Cultivos de México Roña del aguacate Sphaceloma perseae Jenkins (1934) César Calderón. USDA APHIS PPQ. Bugwood.org Clasificación científica División Eumycota Subdivisión Ascomycotina Clase Loculoascomycetos Orden Myriangiales Familia Elsinoeaceae Género Sphaceloma Especie perseae HOSPEDERAS: Este hongo solo es patogénico en aguacate. 139 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONOMICA: La roña del aguacate es considerada como un defecto cosmético superficial, que reduce la calidad del 40% de la fruta y su precio disminuye su precio entre el 27 y 53% (Vidales et al., 2005). El costo del control es el principal impacto en las regiones afectadas como Michoacán, donde es de las enfermedades que requiere más aplicaciones de agroquímicos (Gallegos, 1983). SÍNTOMAS: El hongo S. perseae ataca al fruto, hojas y ramas jóvenes; en los frutos, desde recién polinizados hasta completamente formados presentan lesiones de color café, de aspecto corchosos de forma inicial redonda o irregular (Ploetz et al., 1994), que al unirse pueden cubrir parte del fruto o el fruto completo, dándole un aspecto de mamey, pudiendo causar agrietamiento en hojas y ramas. En las hojas se presentan como pequeñas manchas individuales de color café oscuro de menos de tres milímetros de diámetro cuando el ataque es severo, se distorsionan las nervaduras y se deforman las hojas; en los peciolos, nervaduras o corteza de ramas verdes, las lesiones son alargadas y ligeramente prominentes. En el fruto los daños son exclusivos del pericarpio y no de la pulpa, aunque las lesiones pueden ser la entrada de otros organismos (McMillan, 1976 y Gallegos, 1983 citados por Marroquín, 1999). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGÍA: Micelio aéreo liso y fieltro o en mexhón asociado con conidióforos. El tamaño de los conidios van de 2-30 x 2.5 μm. La forma de los conidios es cilíndrica a elíptica y falcados o lunados. Las colonias de S. perseae varían de blanco grisáceo a gris oscuro, al reverso son de color blanco a gris oscureciéndose con la edad, en contraste con las colonias de Colletotrichum que cuando se presenta la formación de conidios en Colletotrichum son de color salmón y en Sphaceloma son de color obscuro, al realizar una preparación de S. perseae no existen setas (Marroquín, 1999). 140 Enfermedades Importantes de Algunos Cultivos de México El desarrollo de las lesiones necesita altas temperaturas y humedad. Las conidias pueden formarse durante todo el año aunque son más abundantes al final del período de infección, diseminándose a través del viento, agua de lluvia o insectos. En México correlacionan positivamente con las poblaciones de thrips (Thysanoptera), puesto que las heridas que estos ocasionan son punto de entrada para el patógeno (Téliz, 2000 citado por Pérez-Jiménez, 2008). Los frutos jóvenes y el follaje tierno son susceptibles mientras que los maduros son resistentes (Ploetz et al., 1994 citados por Pérez-Jiménez, 2008). Condiciones favorables: De acuerdo con Marroquín (2000) las temperaturas que favorecen el desarrollo del hongo van de 18 a 20 ºC, con humedad relativa >80%, mientras que Vidales et al.,(2005) señalan como rango óptimo de temperatura aquellas que oscilan entre 22 y 26 ºC, pero además plantaciones muy cerradas que provocan sombreo. DISTRIBUCIÓN GEOGRÁFICA: Se presenta en casi todas las regiones productoras de aguacate. 141 Enfermedades Importantes de Algunos Cultivos de México Tristeza del aguacate Phytophthora cinnamomi (Rands) California Avocado Commission Clasificación científica: División Eumycota Subdivisión Mastigomycotina Clase Oomycetos Orden Pythiales Familia Pythiaceae Género Phytophthora Especie cinnamomi 143 Enfermedades Importantes de Algunos Cultivos de México HOSPEDEROS: Nuez de macadamia. Phytophthora cinnamomi ataca a más de 950 especies y cultivares, principalmente de plantas leñosas. Muchas de éstas se cultivan en Europa como árboles y arbustos ornamentales o como árboles para madera o fruta (Smith et al., 1992). IMPORTANCIA ECONÓMICA: Es una enfermedad devastadora. En la actualidad se conocen más de 1000 especies de plantas susceptibles a este fitopatógeno, y se cree que este número actualmente se ha incrementado. Las pérdidas por concepto de esta enfermedad son graves en California, E.U. donde se estima que afecta entre un 60-75 % de los huertos (Coffey, 1991). SÍNTOMAS: P. cinnamomi, es principalmente un patógeno de las raíces en especies leñosas; ataca a las raíces absorbentes jóvenes causando una podredumbre que puede extenderse hasta la base del tallo formando una lesión parda que puede observarse al retirar la corteza. Si se salpican propágulos hasta las partes áreas del huésped pueden infectar los troncos, ramas, hojas y frutos. Las numerosas enfermedades causadas se describen como podredumbres de raíz o pie, podredumbres de cuello o copa o chancros (Smith et al., 1992). Ocasionalmente el hongo coloniza raíces gruesas, necesitando una herida para penetrar. Raras veces causa chancros o cáncer en la base del tronco. Los síntomas en el follaje son originados por la reducción de la absorción de nutrientes y agua y su transporte ascendente. El árbol pierde más agua por transpiración que la absorbida por un sistema radicular podrido por el hongo. La falta de agua también reduce la capacidad de las hojas para producir clorofila, que le da el color verde a las hojas y esto les causa la clorosis o amarillamiento (Jorge y Medina, 2000). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGIA: Son muchos los autores que concuerdan que los factores que predisponen a los frutales, como cítricos entre otros, a una 144 Enfermedades Importantes de Algunos Cultivos de México infección por especies del género Phytophthora, tiene relación con el exceso de humedad en el suelo. Esta condición se puede presentar por una mala práctica de riego, por presencia de niveles freáticos altos, o bien por el uso de suelos de textura pesada, con drenaje deficiente. Otros factores importantes son las lesiones o heridas en el tronco o raíces, ya sea por el uso de maquinaria u otra herramienta, pues a pesar que Phytophthora es capaz de penetrar directamente, su acción se ve facilitada, aumentado el riesgo de la infección. Otro factor significativo es la acumulación de guano junto al tronco, pues este sustrato rico en nutrientes es ideal para el desarrollo de hongos, los cuales al tener un huésped susceptible y condiciones ambientales favorables, inicia el proceso infeccioso (Rojas, 2004). La infección de plantas por P. cinnamomi se ve favorecida por el agua libre en el suelo o acumulación de agua en la superficie del suelo. Los suelos húmedos y cálidos, especialmente aquellos con dificultades de drenaje, favorecen la germinación de clamidosporas. Estas esporas también se propagan a larga distancia ya que se pueden mover por tierra contaminada o el material vegetal muerto. Como las raíces de la planta mueren, las clamidosporas son resistentes y se reproducen nuevamente. Esto proporciona una fuente para la futura reinfección de las plántulas en la zona. P. cinnamomi se puede propagar por tierra contaminada que es arrastrada por corrientes superficiales y el flujo de agua subterránea. Los oogonios miden en promedio cerca de 40 μm de diámetro, con anteridios anfígenos (18 μm de ancho a 20 μm de largo), algunos anteridios pueden ser bicelulares, y muchas de las oosporas son pleróticas de 35 μm. El retrocruzamiento de los dos tipos de compatibilidad produce micelio que se caracteriza por tener abundantes hinchamientos hifales o vesiculares. La temperatura máxima de crecimiento colonial es cerca de 33°C. 145 Enfermedades Importantes de Algunos Cultivos de México Los esporangios no son papilados y no son caducos con formas comúnmente elipsoides a ovoides. Los esporangios ovoides miden cerca de 60 x 34 μm y los elípticos miden cerca de 85X35 μm, que se forman en extractos de suelo no esterilizado. Los dos caracteres de diagnóstico de los estados asexuales son la abundancia de hifas coraloides y los agrupamientos en forma de racimos de clamidosporas (Andrade, 2012). Condiciones favorables: P. cinnamomi se propaga como zoosporas y/o clamidosporas en el suelo y el agua, principalmente a temperaturas entre 12 y 30°C y en condiciones de alta humedad. Se puede propagar el micelio de raíz a raíz y el contacto a través de la dispersión de zoosporas activo para las distancias cortas, o pasivamente a través de desplazamiento cuesta abajo en el flujo del subsuelo o de la superficie de agua (St. J. Hardy et al., 2001). DISTRIBUCIÓN GEOGRÁFICA: Es observada en Sur de África, India, Australia, Nueva Zelanda, EE.UU. (California) y Sudáfrica (Pearson y Goheen, 2001). Islas de Indonesia, Nueva Guinea, América, Europa, Asia, Francia, España, Italia y Portugal (Jorge y Medina, 2000). 146 Enfermedades Importantes de Algunos Cultivos de México Mancha negra de la papaya Colletotrichum gloeosporioides (Penz.) Penz y Sacc Wayne Nishijima. Coppermine Photo Gallery. Clasificación científica: División Eumycota Subdivisión Deuteromycotina Clase Coelomycetos Orden Melanconiales Familia Melanconiaceae Género Collectotrichum Especie gloeosporioides HOSPEDEROS: Papaya, pérsimo, manzanas, aguacate, cítricos, mango y fresa (Mena y Pesántez, 2009). Nopal (Quezada et al., 2006). 147 Enfermedades Importantes de Algunos Cultivos de México IMPORTANCIA ECONÓMICA: Es la principal causa de la baja productividad y de la pérdida total en muchas huertas, sobre todo de las ubicadas en las partes más altas y con mal manejo (Quezada et al., 2006) Síntomas: La enfermedad se manifiesta en forma severa en las hojas tiernas en árboles y puede destruir las flores y frutos tiernos durante períodos húmedos. La infección de frutos puede causar su caída prematura; sin embargo, las pérdidas más importantes se presentan en la fase de maduración de los frutos, en los cuales se desarrollan lesiones irregulares de color café oscuro a negro (Carrillo et al., 2005). En las hojas provoca pequeñas manchas necróticas de color marrón que van aumentando de tamaño y uniéndose formando áreas amplias e irregulares, rodeadas de un halo amarillo pálido con centros de color café claro característico. En condiciones de elevada humedad relativa se produce gran cantidad de esporas, pero tras un periodo seco las lesiones se desecan y al desprenderse el tejido aparecen agujeros en las hojas (Agustí y Agustí, 2010). En inflorescencias aparecen manchas negras diminutas que provocan necrosis extensiva (tizón) de flores y frutos pequeños que se desprenden fácilmente por el viento o lluvia dejando únicamente el raquis adherido al árbol. En tallos vegetativos tiernos, el hongo causa manchas necróticas hundidas o cancros (Monteón, 2012). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGIA: C. gloeosporioides es un microorganismo que en la naturaleza vive de la materia orgánica y en ocasiones especiales tiene la capacidad de volverse patógeno, prefiriendo atacar tejidos muy jóvenes o tejidos muy viejos y físicamente débiles. Las fuentes de inóculo se encuentran en las hojas, ramas, inflorescencias, 148 Enfermedades Importantes de Algunos Cultivos de México brácteas de las flores y en los frutos, en términos generales en todo el árbol (Alarcón y Chavarriaga, 2007). El inóculo del microorganismo que ha sobrevivido en hojas, frutos y ramas afectadas causa las infecciones de los frutos por la dispersión de las conidias transportadas en el agua. Una vez dispersas las conidias se adhieren a la superficie del hospedero y germinan en un periodo de 12 a 24 horas y luego produce tubo germinal que penetra la cutícula directamente. Las fuentes de inóculo son las conidias producidas en acérvulos o las ascosporas producidas y liberadas en el peritecio (Parra, 2008). La parte inferior de las colonias varía de blanco a verde oscuro o marrón, cada vez más oscuro con la edad. Las conidias se producen generalmente como masas pálidas salmón en acérvulos, más a menudo setosos, pero a veces glabras y hasta 500 µm de diámetro. Los conidios son rectos, hialinos, normalmente uninucleados, muy variables en longitud (9-24 µm), por lo general de 3 a 4.5 µm de ancho hasta 6 micras, y presentan una proporción variable de ápices obtusos. Los apresorios son de 6-20 a 4-12 µm, ovoides a claviformes, a veces lobulados. Los conidios germinan y forman apresorios en uno o ambos extremos, en el extremo de hifas muy corto o largo (Gama et al., 2007). Condiciones favorables: El hongo puede infectar entre los 20 a 28°C, pero su temperatura óptima de crecimiento es de 27 ± 1°C en ambientes con humedad relativa de 80 a 100% (Rodríguez et al., 2009). DISTRIBUCIÓN GEOGRÁFICA: Tiene distribución mundial, donde las condiciones son favorables especialmente en áreas húmedas y cálidas (Baños et al., 2004) 149 Enfermedades Importantes de Algunos Cultivos de México Sigatoka negra del plátano Mycosphaerella fijiensis Morelet Scot C. Nelson. Hawaii.USA. Clasificación científica: División Eumycota Subdivisión Ascomycotina Clase Loculoascomycetes Orden Mycosphaerellales Familia Mycosphaerellaceae Género Mycosphaerella Especie fijiensis HOSPEDEROS: Plátano (Hidalgo et al., 2006). IMPORTANCIA ECONÓMICA: En ausencia de medidas de combate, la enfermedad puede reducir hasta en un 50% el peso del racimo y causar pérdidas del 100% de la producción debido 151 Enfermedades Importantes de Algunos Cultivos de México al deterioro en la calidad (longitud y grosor del fruto) (Martínez et al., 2011). SÍNTOMAS: El primer síntoma de sigatoka negra son manchas pequeñas, cloróticas que aparecen debajo de la superficie de la tercera y cuarta hoja. Las hojas desarrollan rayas oxidadas cafés (2 mm de ancho y 20 mm de largo). Durante las primeras etapas, las rayas son visibles solamente desde la superficie inferior. El color de las rayas se intensifica de rojo, café o negro, a veces con un tinte morado. La distribución de las rayas puede ser muy variable: hacia el ápice, en ambos lados de la lámina, y a lo largo de toda la vena central de la hoja. Las rayas se agrandan, se hacen más anchas y adquieren forma elíptica, rodeándose de un borde café claro alrededor de la mancha. Las pérdidas del peso en el fruto es ocasionado por la reducción en el área verde de la hoja o pérdida fotosintética en la hoja. Los centros de las manchas secas se ponen de color gris claro y son rodeados por un anillo negro bien definido, el cual también es rodeado por un halo amarillo (Stansbury et al., 2000; Aguilar, 2006; Manzo, 2001). CICLO DE LA ENFERMEDAD Y EPIDEMIOLOGIA: M. fijiensis, se reproduce en forma asexual y sexual. La reproducción asexual se presenta en lesiones jóvenes de la enfermedad. Los conidios aparecen en conidióforos sencillos que emergen de los estomas, principalmente por la superficie de abajo de las hojas. La diseminación de la enfermedad a grandes distancias se debe a que las ascosporas son esparcidas por el viento, mientras que las conidias son los medios más importantes de propagación local, ya que su liberación es principalmente efectuada por el agua en forma de lluvia o rocío. La fase sexual, de mayor importancia en el desarrollo de la enfermedad, se produce en las lesiones maduras, en estructuras denominadas pseudotecios, en cuyo interior se encuentran las ascosporas, las cuales son liberadas al ambiente en períodos de alta humedad para ser 152 Enfermedades Importantes de Algunos Cultivos de México dispersadas hasta largas distancias por las corrientes de aire (Martínez et al., 2011; Viveros y Castaño, 2006). Condiciones favorables: Las esporas (conidios y ascosporas) germinan de 2 a 3 horas después del contacto con una superficie húmeda. En condiciones artificiales, el agua libre es necesaria para una infección por ascosporas. Las temperaturas mínima, óptima y máxima para el establecimiento del proceso de infección son: 12°C, 27°C y 37°C, respectivamente. No hay desarrollo por debajo de 11°C ni por arriba de 38°C (Mourichon, 2003). Por otra parte, Bornacelly (2009), menciona que los procesos de germinación y penetración, solo ocurren cuando hay condiciones favorables con humedad relativa entre 90 a 100%, con una temperaturas de 26 a 28°C, sobre todo con presencia de agua libre sobre las hojas. DISTRIBUCIÓN GEOGRÁFICA: Asia, México y América central (Pineda et al., 1997). 153 Enfermedades Importantes de Algunos Cultivos de México Literatura citada Agrios, G.N. 2005. Plant pathology. Fifth edition. Elsevier Academic Press. Burlington, MA. USA. pp. 282-283. Aguilar, R. X. 2006. Optimización del protocolo de extracción de ADN de Mycosphaerella fijiensis. Corporación Bananera Nacional S. A. Instituto Tecnológico de Costa Rica. Tesis de Licenciatura. p. 10. Agustí, M. y M. Agustí F. 2010. Fruticultura. Mundi-Prensa libros. Segunda Edición. p. 480. Akhtar, K. P., and S. S. Alam. 2000. “Powdery mildew of mango: A review.” Pakistan Journal of Biological Sciences 3 [7]: 1119-1122. Akhtar, K.P. and S. S. Alam. 2002. Assessment key for some important disease of mango. Pakistan Journal of Biological Sciences 5 (2): 246-250. Alarcón, R. J. J. y M. W. Chavarriaga. 2007. Diagnóstico precoz de la antracnosis Colletotrichum gloeosporioides (Penz) Penz &Sacc., en tomate de árbol, mediante el empleo de infecciones quiescentes. Agron. 15(1): 89 - 102. Aldrich, R. W. O. Scott and E.R. Leng. 1975. Modern crop production. Second edition. Champaign Il. USA. p. 284. Allen, R. N. 1985. Avocado diseases. New South Wales Department of Agriculture. Agfact H6.AB.5. Andrade, H. P. 2012. Selección de portainjertos de aguacate para tolerancia-resistencia a Phytophthora cinnamomi (Rands). Colegio de Postgraduados. Institución de Enseñanza e Investigación en Ciencias Agrícolas. Tesis de doctorado. p. 27. Arauz, L. F. 2000. Mango anthracnose: Economic impact and current options for integrated management. Plant Disease 84:600-611. Arbeláez, G. 2000. Algunos aspectos de los hongos del genero Fusarium y de la especie Fusarium oxysporum. Agronomía Colombiana. Vol. (17): 11-22. Arneson, P. A. 2000. Coffee rust. American Phytopathological Society. APS-Net. The Plant Health Instructor. DOI: 10.1094/ PHI-I-2000-0718-02 Updated 2011. Arnold, D. L., H. C. Lovell, R. W. Jackson and J. W. Mansfield. 2011. Pseudomonas syringae pv. phaseolicola: from ‘has bean’ to supermodel. Mol Plant Pathol. 2011 Sep;12(7): 617-27. doi: 10.1111/j.1364-3703.2010.00697.x. Epub 2011 Feb 17. 155 Enfermedades Importantes de Algunos Cultivos de México Augustin, E., D. Coyne and M.L. Schuster. 1972. Inheritance of resistance in Phaseolus vulgaris to Uromyces phaseoli typica brazilian rust race B11 and of plant habit. J. Am. Soc. Hortic. Sci. 97(4): 526-529. Aujla, S. S., Y. R. Sharma, K. Chand and S. S. Sawney. 1977. Influence of weather factors on the incidence and epidemiology of karnal bunt disease of wheat in the Punjab. Indian J. Ecol. 4:71. Ávila, S. J. 1983. Notas del curso de enfermedades de cultivos. Escuela Superior de Agricultura y Ganadería. Universidad de Sonora. Documento mimeografiado. pp. 31, 32, 36, 49, 83, 87, 90, 136. Babadoost, M. 2001. Downy mildew of cucurbits. Report on plant disease. University of Illinois. Dep. Crop Sciences. RPD No. 927. April 2001. 3 p. Bahar K., J-N. Mohammad, A. Mehrdad y G. Keyvan. 2010. Genetic diversity of Fusarium oxysporum isolates from common bean and distribution of mating type alleles. Iranian Journal of Biotechnology. Vol. 8 No. 2. Baños, G., P. E., E. Zavaleta M., M.T. Colinas L., I. Luna R., y J.G. Gutiérrez A. 2004. Control biológico de Colletotrichum gloeosporioides (Penz.) Penz y Sacc. en papaya maradol roja (Carica papaya L.) y fisiología post cosecha de frutos infectados. Revista Mexicana de Fitopatología 22:198-205. Becerra, L. E. N. y G. X. Rosas. s/f. IV Jornada de transferencia de tecnología en el cultivo del mango. Memoria. Manejo de enfermedades en floración y amarre de frutos. Fudación Produce Sinaloa. p.7. Blancard, D., H. Lot, y B. Maisonneuve. 2005. Enfermedades de las lechugas: identificar, conocer, controlar. Mundi-Prensa Libros. Madrid, España. p. 23. Blanchette, B. L., J. V. Groth and J. L. Waters. 1982. Evaluation of aspargus for resistence to Puccinia asparagi. Univ. Minnesota, St. Paul, USA. Vol. 66, No.10. pp. 904-906. Bornacelly, H. R. 2009. Estudio del ciclo de vida de Mycosphaerella fijiensis en tres clones de banano (Musa AAA) en tres regiones de la zona bananera del Magdalena. Universidad Nacional de Colombia. Tesis de Maestría. p. 26. 156 Enfermedades Importantes de Algunos Cultivos de México Boyd, L. A. 2005. Centenary review: Can robigus defeat an old enemy? – Yellow rust of wheat. J. Agric. Sci.: 143:1–11. Burleigh, J. R., M. G. Eversmeyer and A. P. Roelfs 1972. Estimating damage to wheat caused by Puccinia recondita tritici. Phytopathology 62:944-946. Bush, E. 2009. Anthracnose on snap beans. Virginia pest management guide for home grounds and animals. Virginia Cooperative Extension. Publication 450-719. Bux, H., M. Ashraf, F. Hussain, A. Rattu and M. Fayyaz. 2012. Characterization of wheat germplasm for stripe rust (Puccini striiformis f. sp. tritici) resistance. Australian Journal of Crop Science 6(1): 116-120. Cambra, M. y I. Bernal.1996. Bremia lactucae Regel. Grupo de trabajo de laboratorios de diagnóstico. Centro de Protección Vegetal, C. A. de Aragón. España. Ficha 27. Carrillo, L. 2003. Los hongos de los alimentos y forrajes. Cap. VI, Universidad Nacional de Salta. Argentina. p. 70. Carrillo, F. J. A., L. Sánchez B., R.S. García E., R. Allende M. y I. Márquez Z. 2001. Razas de Xanthomonas campestris pv. vesicatoria (Doidge) Dye presentes en el estado de Sinaloa, México. Revista Mexicana de Fitopatología. Soc. Mex. De Fitopatología. Vol. 19 (2): 248-250. Carrillo, F. J. A.; R. S. García E.; M. D. Muy R; A. Sañudo B.; I. Márquez Z.; R. Allende M.; Z. De la Garza R.; M. Patiño V. y E. Galindo F. 2005. Control biológico de antracnosis Colletotrichum gloeosporioides (Penz.) Penz y Sacc. y su efecto en la calidad post cosecha del mango (Mangifera indica L.) en Sinaloa, México. Revista Mexicana de Fitopatología. Volumen 23 (1): 24. Castro, D. A. V., G. Fuentes D., y P. Figueroa L. 2005. Viabilidad de teliosporas de Tilletia indica (Mitra) después de ser ingeridas por diferentes tipos de aves comunes en el sur de Sonora, México. Revista Mexicana de Fitopatología 23:1 p.19. Chaerani, R. and R.E. Voorrips. 2006. Tomato early blight (Alternaria solani): the pathogen, genetics, and breeding for resistance.. J. of Gen. Plant Pathology: 72: 335-347. 157 Enfermedades Importantes de Algunos Cultivos de México Chen, X. M. 2005. Epidemiology and control of stripe rust on wheat [Puccinia striiformis f. sp. tritici] on wheat. Can. J. Plant Pathol 27: 314-337. Chehri, K., S. T. Jahromi, K. R. N. Reddy, S. Abbasi y B. Salleh. 2010. Occurrence of Fusarium spp. and Fumonisins in stored wheat grains marketed in Iran. Vol. (2): 2816-2823. Chew, M. Y. I., A. Vega P., M. Palomo R. y F. Jiménez D. 2008. Principales enfermedades del chile (Capsicum annum L.). SAGARPA-INIFAPCIRNOC. Campo Experimental La Laguna. Matamoros, Coahuila. Folleto Técnico No. 15. p. 13. Christensen, J. J. 1963. Corn smut caused by Ustilago maydis. American Phytopathological Society Monograph 2. 41 p. CIMMYT Maize Program. 2004. Maize diseases: A guide for field identification. CIMMYT. 4th edition. Mexico, D.F. Coffey, M. 1991. Cause and diagnosis avocado root rot. California Grower 15(3): 17, 22-23. Covarruvias, A. R. 1978. Deformación floral y vegetativa del mango. CONAFRUT 44: 84-52. Covarrubias, C. C. 1988. Estudio de Fusarium sp. como agente etiológico de la “Escoba de Bruja” del Mango (Mangifera indica L.). Tesis M.C. Facultad de Ciencias Biológicas y Agropecuarias. Universidad de Colima. 52 p. Crispín-Medina, A., J. A. Sifuentes-A., y J. Campos-Avila.1976. Enfermedades y plagas del frijol en México. Folleto de divulgación No. 39. INIA-SAG. México, D.F. pp. 6-9. Daughtery, M. L., R. L. Wick y J. L. Peterson. 2001. Plagas y enfermedades de las plantas en maceta con flores. Mundi-Prensa Libros. Madrid, España. p. 45. Dev Sharma, K., y F. J. Muehlbauer. 2007. Fusarium wilt of chickpea: Physiological specialization, genetics of resistance and resistance gene tagging. Euphytica 157: 1-14. Díaz, B. V. 1979. Etiología de la deformación o escoba de bruja del mango en el estado de Morelos. Tesis Maestría en Fitopatología. UACH-C.P. Chapingo, México. 54 p. Díaz, C. G. 2009. Enfermedades foliares en diferentes materiales de sorgo. Cátedra de Fitopatología. FAZ –UNT. Argentina. cegdiaz@ gmail.com. 158 Enfermedades Importantes de Algunos Cultivos de México Dillard, H. R. 1988. Bean anthracnose. Department of plant pathology. New York State Agricultural Experiment Station, Geneva Cornell University Cooperative Extension • New York State • Cornell University. Fact Sheet Page 729.40 Date 6–1988. Dillard, H. R. and A. C. Cobb. 1993. Survival of Colletotrichum lindemuthianum in bean debris in New York State. Plant Dis. 77: 1233-1238. Dimsey, R. 2004. Asparagus rust (Puccinia asparagi). Department of Primary Industries. Vegetable Matters-of-Facts. Number 12, February 2004. Dimnsey, R. 2007. Lettuce downy mildew (Bremia lactucae). Department of Primary industries. Vegetable Matters of Facts. Número 47, Agosto 2007. Dirección General de Sanidad Vegetal-Centro Nacional de Referencia Fitosanitaria (DGSV-CNRF). 2011. Roya anaranjada de la caña de azúcar (Puccinia kuehnii Kruguer) SAGARPA-SENASICA México, D.F. 5 p. Dodd, J. C., A. B. Estrada, J. Matcham, J., Jeffries P., and M. J. Jeger. 1991. The effect of climatic factors on Colletotrichum gloeosporioides, causal agent of mango anthracnose in the Philippines. Plant Pathology 40:568-575. Duran, R. 1972. Further aspects of teliospore germination in North American smut fungi. II. Can. J. Bot., 50: 2569-2573. ECHAM. 2006. Max-Planck-Institut fur Meteorologie. Hamburg. En Internet: http://www.mpimet.mpg.de/ en/wissenschaft/modelle/ echam.html. Edmunds, B. A. and G. J. Holmes. 2007. Bean, green antrachnose. North Carolina State University. Raleigh, North Carolina. http://www. cals.ncsu.edu/plantpath/ extension/fact_sheets/Bean_Green_-_ Anthracnose. htm. Elliott, M. L. and P. F. Harmon. 2011. Helminthosporium leaf spot. Plant Pathology Department, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. Publication #SS-PLP-9. Faber, B.A., A. Eskalen and G. S. Bender. 2008. Avocado anthracnose. UC IPM Online. UC Pest Management Guidelines. Statewide IPM Program, Agriculture and Natural Resources, Univ. of California. http://www.ipm.ucdavis.edu/PMG/r8100711.html 159 Enfermedades Importantes de Algunos Cultivos de México Félix, G. R., M. A. Apodaca S., M. C. Martínez V., y S. Espinosa M. 2005. Podosphaera (Sect Sphaerotheca) xanthii (Castagne) U. Brawn y N. Shishkoff en cucurbitáceas en el norte de Sinaloa, México. Revista Mexicana de Fitopatología. Soc. Mex. de Fitopatología. Julio-Diciembre. 23(2):162-168. Ferguson, G., R. Cerkauskas and M. Celetti. 2009. Downy mildew of greenhouse cucumber. Ministry of Agriculture, Food and Rural Affairs. Ontario, Canada. FactSheet Order No. 09-013W AGDEX 292/631 March 2009. Ferreira, S. A. and R. A. Boley. 1991. Hemileia vastatrix. http://www. extento.hawaii.edu/kbase/crop/Type/h_vasta.htm Figueroa, L. P. 2004. Pronóstico de la incidencia del carbón parcial del trigo en el Valle del Yaqui para los años 2003 y 2004. INIFAP-CEVY. Memoria del día del agricultor 2004. p.92. Fischer, R. A. 1992. Perspectivas sobre el problema del carbón parcial: El CIMMYT, México y E.U.A. En: G. Fuentes-Dávila y G.P. Hettel (eds.). Estado actual de la investigación sobre el carbón parcial en México. CIMMYT. Reporte especial de trigo. No. 7. México, D.F. 41 p. Fitzell, R. D. and C. M. Peak. 1984. The epidemiology of anthracnose disease of mango: Inoculum sources, spore production and dispersal. Annals of Applied Biology 104:53-59. Fry, W. E. 1982. Principles of plant disease management. Academic Press. New York, NY. 378 p. Fry, W. E. 1998. Late blight of potatoes and tomatoes. Cooperative Extension • New York State • Cornell University. Fact Sheet Page: 726.20. Fuentes, D. G. 1992. Identificación de fuentes de resistencia a Tilletia indica. En: G. Fuentes-Dávila y G.P. Hettel (eds.). Estado actual de la investigación sobre el carbón parcial en México. CIMMYT. Reporte especial de trigo. No. 7. México, D.F. 41 p. Fuentes, D. G. 1997. Carbón parcial del trigo: situación actual y perspectivas. En: Memorias del primer simposio internacional de trigo. Cd. Obregón, Sonora, México. p.105. Futrell, M. C., and O. J. Webster. 1966. Host range and epidemiology of the sorghum ergot organism. Plant Dis. Rep. 50:828-831. 160 Enfermedades Importantes de Algunos Cultivos de México Galán, S. V. 1999. El cultivo del mango. Enfermedades, plagas y desórdenes no patogénicos. Editorial MundiPrensa. México, D.F. p. 224. Gallegos, E. R. 1983. Aspectos del aguacate y su producción en Michoacán. Ed. Patronato Univesitario, Universidad Autónoma Chapingo. Chapingo, Edo. de Méx., México. 317 p. Gama-López, S., F. Munaut, J. Vander Stappen, X. Scheldeman and V. Van Damme. 2007. Diversity studies in the interaction between the anthracnose fungus Colletotrichum gloeosporioides and its host plant Stylosanthes spp. in Mexico. Reporte técnico de Bioversity International. p. 8. Glawe, D. A. and G. G. Grove. 2010. Powdery mildew diseases. http:// plant-disease. ippc. orst. edu/articles. cfm?article_id=30 Gobierno del Estado de Colima, 2005. Paquetes tecnológicos para cultivos agrícolas en el estado de Colima. No. 3. Documento electrónico. p.24. Goldberg, N. 2009. Powdery mildew on chile peppers. NMSU. Las Cruces, NM. USA. Guide H-248. p.1. González F. R. 1924. Flora de la península ibérica. Uredinaceae. Tomo I. Género Puccinia. Museo Nacional de Ciencias Naturales, Madrid, España. p. 29. Guerrero, R. C. 1980. Evaluación de la tolerancia a “rabia” (Fusarium spp.) de tres variedades de garbanzo. Avances de Investigación CIANO No. 5. 61 p. Gupta, J. H., 1985. Perpetuation and epidemiology of powdery mildew of mango. II International Symposium on Mango 231: 528-533. Gupta, G. P. 2004. Text book of plant diseases. Discovery Publishing House. New Dehli, India. 331 p. Haggag, W. M., M. Hazza, A. Sehab, M. and Abd El-Wahab. 2010. Epidemiology and the association of the Fusarium species with the mango malformation disease in Egypt. Nature and Science 8:4. Hansen, M. A. 2009. Early blight of tomatoes. Extension Plant Pathologist, Department of Plant Pathology, Physiology and Weed Science, Virginia Tech. publication 450-708. Hernández-Martínez M., E. Cárdenas-Soriano, L. E. Mendoza-Onofre, S. Osada-Kawasoe, P. Ramírez-Vallejo y F. Zavala-García. 2001. Patogénesis de Claviceps africana en ovarios de sorgo. Colegio de Postgraduados. Agrociencia 35: 535-542. 2001. 161 Enfermedades Importantes de Algunos Cultivos de México Hidalgo, M., A. Tapia, W. Rodríguez y E. Serrano. 2006. Efecto de la sigatoka negra (Mycosphaerella fijiensis) sobre la fotosíntesis y transpiración foliar del banano (Musa sp. AAA, cv. Valery). Agronomía Costarricense, 30(1): 35-41. ISSN: 0377-9424 / 2006. Hogg, W. H., C. E. Hounam, A. K. Mallik and J. C. Zadoks. 1969. Meteorological factors affecting the epidemiology of wheat rusts. WMO Tech. Note No. 99. 143 p. Hostert, N. D., S. L. Thomas, D. G. Fogle and R. M. Davias. 2006. First report of Ramularia carthami, causal agent of Ramularia leaf spot of Safflower in California. Department of Plant Pathology, University of California. Plant Disease 90:1260. Huber , L. and T. J. Gillespie. 1992. Modeling leaf wetness in relation to plant disease epidemiology. Annual Review of Phytopathology. Vol. 30: 553-577. Infante, D., B. Martínez, E. González y N. González. 2009. Puccinia kuehnii (Krüger) Butler y Puccinia melanocephala H. Sydow Y P. Sydow, en el cultivo de la caña de azúcar. Departamento de Fitopatología, Dirección de Protección de Plantas. Centro Nacional de Sanidad Agropecuaria. La Habana, Cuba. Rev. Protección Veg. Vol. 24 No.1 Jan.-Apr. 2009. pp. 22-28. INIFAP. s/f. Tecnología de producción para el cultivo de sorgo grano de riego en la huasteca de San Luis Potosí. Tecnologia No. 16. Campo Experimental Ébano. S.L.P. IPCC. 2007. Cambio climático 2007: Informe de síntesis. Contribución de los grupos de trabajo I, II y III al cuarto informe de evaluación del grupo intergubernamental de expertos sobre el cambio climático. p.2. Ginebra, Suiza. IPM. 2012. UC IPM pest management guidelines: Corn. UC ANR Publication 3443. Diseases. R. M. Davis, Plant Pathology, UC Davis, CA. USA. Ivors, K. L. 2008. Tomato late blight. N.C. State University. Fact Sheet. Jackson, K. J. and Berthelsen, J. E. 1986. Production of safflower Carthamus tinctorius L. in Queensland. Journal of the Australian Institute of Agricultural Science. 52 (2): 63-72. Jaramillo, V. S. 2003. Monografía sobre Phytopthora infestans (Mont.) de Bary. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. p.1. 162 Enfermedades Importantes de Algunos Cultivos de México Jeffries, P., J. C. Dodd, M. J. Jeger and R. A. Plumbley. 1990. The biology and control of Colletotrichum species on tropical fruit crops. Plant Pathology 39:343-366. Jiménez-Díaz, R. M. 2008. Impactos potenciales del cambio climático sobre las enfermedades de los cultivos. Phytoma España: La revista profesional de sanidad vegetal. ISSN 1131-8988, Nº 203, 2008. pp. 64-69. Jiménez, L. A. 2008. El sistema de alerta fitosanitaria de Sonora. Informe técnico (En prensa). Comité Estatal de Sanidad Vegetal de Sonora. Hermosillo, Sonora. Johnson R. 1992. Past, present and future opportunities in breeding for disease resistance, with examples from wheat. Euphytica, 63:3-22. Jorge, P. E. y C. A. Medina. 2000. Pudrición radicular o muerte descendente (Phytophthora cinnamomi Rands) en plantaciones de aguacate (Persea americana Mill). Red de desarrollo tecnológico de frutales. Hoja divulgativa N°4. Kemmit, G. 2002. Early blight of potato and tomato. APS Net. The Plant Health Instructor. DOI: 10.1094/PHI-I-2002-0809-01. Khan, A. 2001. Plant diseases. Kalpaz Publications. New Dehli, India. p. 285. Koepsell, P. A., and P. W. Jay.1994. Pacific northwest plant disease control handbook. Corvallis: Oregon State University Press, p. 165. Koike, S. T., P. Gladders, and A. O. Paulus. 2007. Vegetables Diseases (A color handbook). Academic Press, USA. 448 pp. Krausz J. and T. Isakeit. 1998. Sorghum ergot: New disease threat to the sorghum industry. Texas Agriculture Extension Service. L-5179 pp. 6-98. Krishna, A. and R. A. Singh. 1983. Longevity of teliospores of Neovossia indica causing karnal bunt of wheat. Indian Journal of Mycology and Plant Pathology 13: 97-98. Kummar, J., U. S. Singh and S.P.S. Beniwal. 1993. Mango malformation: one hundred years of research. Annual Review of Phytopathology 31: 217-232. Lebeda, A., I. Petrzelová., and Z. Maryska. 2008. Structure and variation in the wild-plant pathosystem: Lactuca serriola Bremia lactucae. The Downy Mildews - Genetics, Molecular Biology and Control. Eur. J. Plant Pathol. pp 127-146. 163 Enfermedades Importantes de Algunos Cultivos de México Legard, D. E. and H. F. Schwartz. 1987. Sources and management of Pseudomonas syringae pv phaseolicola and Pseudomonas syringae pv syringae epiphytes on dry beans in Colorado. Phytopathology 77(11): 1503-1509. Liberato, J. R., D. Beasley y R. G. Shivas. 2006. Asparagus rust (Puccinia asparagi). Ficha de especies. PaDIL. p. 6. Lipps, P.E. and D. Mills. 2002. Northern corn leaf blight. Extension Fact Sheet AC-20-02. Columbus: Ohio State University. Lucas, G. B., C. L. Campbell and L. T. Lucas. 2001. Introduction to plant diseases. Identification and management. 2d. Edition. Libro. Kluwer Acad. Publishers. Norwell, MS. USA. P. 200. Macías C, J., A. Borbón G., X. M. Ochoa E., y L. Montoya C. 2010. Validación de la variedad de cártamo RC-1033-l resistente a Ramularia carthami en el estado de Sinaloa, México. V Reunión Nacional de Innovación Agrícola en Campeche. Memoria. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. p. 193. Magarey, R. C. 2000. Orange rust. In: Rott P., R.A. Bailey, J.C. Comstock, B.J. Croft y A.S. Saumtally (eds). 2000. A guide to sugarcane diseases. CIRAD y ISSCT. Magaña, V. 2007. ttp://www.biodiversityreporting.org/article.sub?docId= 26118&c = Mexico-Gulf%20of%20California&cRef=Mexico-Gulf%20 of%20California&year=2007&date= May%20 2007. Malaguti, G. 2000. Enfermedades del maíz en Venezuela. In: Maíz en Venezuela. Universidad Central de Venezuela. Maracay, Venezuela. p.10. Manzo S. G. 2001. Diversidad genética de Mycosphaerella fijiensis Morelet en plátano enano gigante (Musa acuminata AAA), cultivado con diferente manejo. Universidad de Colima, México. Tesis de maestría. p. 26. Marroquín, P. F. J. 1999. Factores que favorecen la incidencia de roña (Sphaceloma perseae Jenk.) en el cultivo del aguacate (Persea americana Mill.) “Hass” en tres regiones agroclimáticas de Michoacán, México. Revista Chapingo, Serie Horticultura 5:309-312. Marroquín, P. F. J. 2000. La roña del aguacate. In: El aguacate y su manejo integrado. Enfermedades del fruto. Ediciones MundiPrensa. México, D.F. p.147. 164 Enfermedades Importantes de Algunos Cultivos de México Martínez, I., R. Villalta, E. Soto, G. Murillo M. y Guzmán. 2011. Manejo de la sigatoka negra en el cultivo del banano. Proyecto demostrativo con implementación de BPA en el cultivo del banano. CORBANA. Costa Rica. Hoja Divulgativa No. 2. McLaren, N. W., and F. C. Wehner. 1990. Relationship between climatic variables during early flowering of sorghum and the incidence of sugary disease caused by Sphacelia sorghi. J. Phytopathol. 130:82-88. Mena, C. J. y R. V. Velázquez. 2010. Manejo integrado de plagas y enfermedades de frijol en Zacatecas. Folleto Técnico No. 24. Campo Experimental Zacatecas. CIRNOC-INIFAP. 83 p. Mena, O. E. y E. Pesántez V. 2009. Evaluación de alternativas de control de antracnosis (Colletotrichum gloeosporiodies) en tomate de árbol. Comunidad Pelileo, Pillaro, Tunguarahua. Facultad de Ingeniería de Ciencias Agropecuarias. ESPE-IASA I. Sede El Prado. Tesis de Licenciatura. p. 40. Mendoza, Z. C. y B. Pinto C. 1985. Principios de fitopatología y enfermedades causadas por hongos. Universidad Autónoma Chapingo. Departamento de Parasitología Agrícola. Chapingo, Edo. México. Pp. 153,248,286. Michel, A. A. C. 2001. Cepas nativas de Trichoderma spp. Euascomycetes:Hypocreales, su antibiosis y micoparasitismo sobre Fusarium subglutinans y F. oxysporum (Hyphomycetes:Hyphales). Tesis Doctoral. Universidad de Colima. 163 p. Monteón, O. A. 2012. Epidemiología y manejo químico de la antracnosis (Colletotrichum gloeosporioides Penz.) y cenicilla (Oidium mangiferae Berth et) en mango (Mangifera indica L.) cv. Manila en el trópico subhúmedo de Guerrero, México. Colegio De Postgraduados. Tesis de Maestría. p. 18. Montoya, C. L., C. Armenta C., J. A. Ramírez A., J. R. Valenzuela B., I. Armenta C., F. Cabrera, C., M. J. Beltrán F., R. A. Lagarda, G., A. Borbón G., y X. M. Ochoa E. 2008. Guía para producir cártamo en Sonora. INIFAP-CIRNO-CENEB. Folleto No. 38. p. 21. Montoya, C. L. 2010. El cultivo de cártamo (Carthamus tinctorius L.) en México. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Centro de Investigación Regional del Noroeste. Campo Experimental Norman E. Borlaug. Libro técnico No. 5. pp. 80-83. 165 Enfermedades Importantes de Algunos Cultivos de México Mora A. A., D. Téliz O., G. Mora A., P. Sánchez G., J. Javier M. 2003. Progreso temporal de “Escoba de bruja” (Fusarium oxysporum y F. subglutinans) en huertos de mango (Mangifera indica L.) cv. Haden en Michoacán, México. Revista Mexicana de Fitopatología. Soc Mex. De Fitopatología, A.C. Vol. 21 No. 001. Cd. Obregón, México. pp. 1-12. Morales, E., y H. Rodríguez. 1961. Breves anotaciones sobre una nueva plaga en árboles de mango. México. Fitófilo 1: 7-11. Morales, G. J. A., L. J. Durón N., G. Martínez D., J. H. Núñez M. y A. A. Fu C. 2004. El cultivo de garbanzo blanco en Sonora. Libro técnico No. 6. INIFAP-CIRNO-CECH. Hermosillo, Sonora. p. 226. Mourichon, X. 2003. Analyse du risque phytosanitaire (ARP). Mycosphaerella fijiensis. Centre de coopération internationale en recherche agronomique pour le développement (CIRAD). Francia. BAN-c2. p. 11. Murumkar D. R., M. A. Gud, D. V. Indi, S. K. Shinde and J. R. Kadam. 2008. Development of leaf spot of safflower (Alternaria carthami) in relation to weather parameters. Journal of plant disease science. Vol. 3. No. 2. P. 201-205 (abstract). Nelson, S. 2008. Anthracnose of avocado. Cooperative Extension Service. University of Hawaii at Mánoa. Plant Disease Nov. 58. Nelson, S. C. 2008. Mango powdery mildew. Cooperative Extension Service. University of Hawaii at Mánoa. Plant Disease 46: 3. Noriega, C. D. 1996. “Escoba de Bruja” del mango: etiología, histopatología, epidemiología y manejo integrado. Tesis doctoral en ciencias agrícolas. Instituto de Fitosanidad del Colegio de postgraduados. Montecillo. Estado de México. 72 p. Noriega C. D.H., D. Téliz O., D., Mora A., G. Rodríguez A., E. Zavaleta M., G. Otero C. and C. L. Campbell. 1999. Epidemiology of mango malformation in Guerrero, Mexico, with traditional and integrated management. Plant Disease 83:223–228. Nowicki, M., M. R. Foolad, M. Nowakowska and E.U. Kozik. 2012. Potato and tomato late blight caused by Phytophthora infestans: An overview of pathology and resistance breeding. Plant disease. Volume 96 (1): 4-17 Nuez, V. F.; O. R. Gil y G. J. Costa. 2003. El cultivo de pimientos, chiles y ajíes. Mundi-Prensa. Madrid. España. 607 p. 166 Enfermedades Importantes de Algunos Cultivos de México Olanya, O. M., C. W. Honeycutt, R. P. Larkin, T. S. Griffin, Z. He and J. M. Halloran. 2009. The effect of cropping systems and irrigation management on development of potato early blight. J. of Gen. Plant Pathology: 75: 267-275. Olivas, E. 1979. Identificación del agente causal de la deformación floral y vegetativa del mango en México. Fruticultura Mexicana. CONAFRUT 1: 13-16. Osorio, J. A. 1983. La información epidemiológica para el control químico de la roya del cafeto. FONAIAP DIVULGA No. 09. MarzoAbril de 1983. Padgett-Johnson, M. and F. Laemmlen. 2003. Downy mildew of lettuce (Bremia lactucae): Biology, disease symptoms and damage. Using the downy mildew index model for disease management. Univesity of California Cooperative extension. p. 2. Paliwai, R. L., G. Granados, H. R. Laffite, A. D. Violic y J. P. Marathée. 2001. El maíz en los trópicos: Mejoramiento y producción. Libro ONU-FAO. Roma, Italia. p.65. Pandey, K. K., P. K. Pandey, G. Kalloo and M. K.Banerjee. 2003. Resistance to early blight of tomato with respect to various parameters of disease epidemics. J. of Gen. Plant Pathology 69: 364-371. Park, K. and S. Lee. 2005. Rust of safflower (Carthamus tinctorius) caused by Puccinia carthami. Korean society of plant pathology. Vol.9 (3): 128 – 130. Parra A. L. 2008. Relación entre infecciones quiescentes de Colletotrichum gloeosporioides (Penz) y los diferentes estados fenológicos del fruto de mango (Magnifera indica L) variedad hilacha. Pontificia Universidad Javeriana. Facultad de Ciencias Básicas. Bogotá, Colombia. Tesis de Licenciatura. p. 21. Pastor-Corrales, M. A. and J. C. Tu. 1989. Anthracnose. In: Bean production problems in the tropics (2a Ed.). CIAT. Cali, Colombia. p.81. Pataky, J. K., and K. M. Snetselaar. 2006. Common smut of corn. The Plant Health Instructor. DOI:10.1094/PHI-I-2006-0927-01. Pavgi, M. S. 1972. Morphology and taxonomy of the Puccinia species on corn and sorghum. Mycopathologia et Mycologia applicata. Vol. 47 (3): 207-220. 167 Enfermedades Importantes de Algunos Cultivos de México Pearson, R. C. y Goheen, A. C. 2001. Plagas y enfermedades de la vid. The American Phytopathological Society. Ediciones Mundi-Prensa. Madrid, España. p. 39. Peña, R. J., A. Amaya y E. del Toro. 1992. Efecto del almacenamiento y del lavado de grano en las características de calidad de muestras de trigo (variedad Seri M82), con diferentes niveles de carbón parcial (Tilletia indica). Pp.24.32. En: G. Fuentes-Dávila y G.P. Hettel (eds.). Estado actual de la investigación sobre el carbón parcial en México. CIMMYT. Reporte especial de trigo. No. 7. México, D.F. 41 p. Pérez, W. y G. Forbes. 2008. El tizón tardío de la papa. Manual técnico. Centro Internacional de la Papa (CIP). Lima, Perú. 39 p. Pérez-González, A., P. Posos-Ponce, J. L. Martínez-Ramírez, R. Rodríguez-Ruvalcaba, C.M. Duran-Martínez, V.A. Aceves-Nuñez. 2006. Efectividad biológica de Azoxistrobin + Poly-I-Menteno vs. cenicilla polvorienta (Erysiphe cichoracearum) en calabacita. Avances en la Investigación Científica en el CUCBA. Universidad de Guadalajara. Nextipac, Jalisco. p. 139. Pérez-Jiménez, R. M. 2008. Significant avocado diseases caused by fungi and oomycetes. The European Journal of Plant Sci. and Biotechnology 2(1): 1-24. Pérez V. J. J., M. C. Avilés G., J. J. Wong P., J. Arrellano S., J. A. Garzón Tiznado y R. D. García P. 2004. Falsa cenicilla (Ramularia carthami Sacc.) enfermedad de alto impacto en el cultivo de cártamo. INIFAPCIRNO-CEVACU. Folleto No. 51. p.3. Pernezny K., D. Maynard, and W. M. Stall. 2008. Powdery mildew of vegetables. Plant Pathology Department, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. Publication #PP-14. Persley, D., T. Cooke y S. House. 2010. Diseases of vegetable crops in Australia. CSIRO Publishing. p.49. Pineda, J. B., A. Carrasco, R. Cardona, R. y Cooz, R. 1997. Presencia de la sigatoka negra (Mycosphaerella fijiensis) en las principales zonas plataneras de Venezuela. Bioagro 9(2): 52-60. Ploetz, R. s/f. Antracnosis en mango: Manejo de la enfermedad más importante pre y postcosecha: (Reporte mimeografiado). Universidad de la Florida, TREC Homestead Departamento de Fitopatología. 11 pp. 168 Enfermedades Importantes de Algunos Cultivos de México Plantwise s/f. http://www.plantwise. org/knowledgebank/ datasheet. aspx?dsid=45848. Ploetz R. C., G. A. Zentmyer, W. T. Nishijima, K. G. Rohrbach and H.D. Ohr. 1994. Compendium of tropical fruit diseases. APS Press. St. Paul Minnesota. USA. 118 p. Quezada-Salinas, A., J. S. Sandoval-Islas,; D. Alvarado-Rosales y E. Cárdenas-Soriano. 2006. Etiología de la mancha negra del nopal (Opuntia ficus-indica Mill) en Tlalnepantla, Morelos, México. Agrociencia 40: 641-653. Raid, R., and T. Kucharek. 2006. Florida plant disease management guide: Sweet corn. Department of Plant Pathology, Florida Cooperative Extension Service, Institute of Food and Agricultural Sciences, University of Florida. Publication #PDMG-V3-51. Ramírez A. J. A., C. M. Armenta C., L. Montoya C., F. Cabrera C., y J. R. Valenzuela B. 2011. Epidemiología de la falsa cenicilla del cártamo (Ramularia carthami) en el sur de Sonora. INIFAP-CIRNOCENEB. Folleto No. 82. p. 6. Ramírez A. J. A., C. M. Armenta C., L. Montoya C., F. Cabrera C., y J. R. Valenzuela B. 2012. Niveles de infección e intervalos para aplicaciones en el control de la falsa cenicilla del cártamo (Ramularia carthami). INIFAP-CIRNO-CENEB. Folleto Técnico s/n. p. 5. Rawal, R. D. 1997. Management of fungal diseases in tropical fruits. Proceedings of the IPGRI-ICAR-UTFANET regional training course on the Conservation and Use of Germplasm of Tropical Fruits in Asia at the Indian Institute of Horticultural Res. pp. 18-31. Reed, G. M. 1935. Physiologic specialization of the parasitic fungi. The botanical review. Vol I (4):124. Ritchie, D. F. 2007. Bacterial spot of pepper and tomato. APS net. The Plant Health Instructor. DOI:10.1094/PHI-I-2000-1027-01. Rodríguez–Guerra, R., J. A. Acosta–Gallegos, M. M. González–Chavira y J. Simpson. 2006. Patotipos de Colletotrichum lindemuthianum y su implicación en la generación de cultivares resistentes de frijol. Ensayo. Agric. Téc. Méx 32 (1). México. Rodríguez-López, E. S, J. M. González-Prieto y N. Mayek-Pérez. 2009. La infección de Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. en aguacatero (Persea americana Mill.): Aspectos bioquímicos y genéticos. Revista Mexicana de Fitopatología No. 27:53-63. 169 Enfermedades Importantes de Algunos Cultivos de México Roelfs, A. P. 1985. Epidemiology in north america. In A.P. Roelfs & W.R. Bushnell (Eds.). The cereal rusts. Vol. (2): 403-434. Diseases, distribution, epidemiology and control. Orlando, FL, USA, Academic Press. Roelfs, A. P. 1985. Wheat and rye stem rust. Pp. 3-37 de A.P. Roelfs y W.R. Bushnell, eds. The Cereal Rusts Vol. 11: Diseases, Distribution, Epidemiology, and Control. Academic Press, Orlando. Roelfs, A. P., R. P. Singh y E. E. Saari. 1992. Las royas del trigo: Conceptos y métodos para el manejo de esas enfermedades. México, D.F.: CIMMYT. 81 p. Rojas, I. 2004. Estudio de la interacción entre tristeza del palto (Phytophthora cinnamomi) y cancrosis de ramillas (Fusicoccum aesculi) en plantas de palto var. Hass. Ponticia Universidad Católica de Valparaíso.Tesis de Licenciatura. p. 10. Rowell, J. B. 1981. Relation of postpenetration events in Idaed 59 wheat seedling to low receptivity to infection by Puccinia graminis f. sp. tritici. Phytopathology 71: 732-736. Rowell, J. B. 1982. Control of wheat stem rust by low receptivity to infection conditioned by a single dominant gene. Phytopathology 72: 297-299. Rueda, A. and A. M. Shelton. 1995. Early blight of tomatoes. CIIFAD, Cornell University. FactSheet. New York State University. Geneva, NY.USA. Ruhl, G. 2007. Crop diseases in corn, soybean and wheat. Department of Botany and Plant Pathology Purdue University West Lafayette, IN. USA. http://www.btny.purdue.edu/extension/pathology/ cropdiseases/corn/corn1.html#northerncornleafblight. Ruiz, H. J. 2008. Ustilago maydis: Ascenso de un hongo mexicano de la gastronomía local al mundo científico Revista Electrónica Nova Scientia. Vol. 1 (118-135). Ryan, C. C. and B. T. Egan. 1989. Rust. In: Ricaud, C., B.T. Egan, A.G. Gillaspie y C.G. Hughes (Eds.). Diseases of sugarcane. Major diseases. Elsevier Science Publisher B.V., Amsterdam, The Netherlands. pp.189-210. Ryley, M. 2011. Sorghum: Disease management. Australia. Queensland Government. Department of Agriculture, Fisheries and Forestry. http://www.daff.qld.gov.au/26_4738.htm. 170 Enfermedades Importantes de Algunos Cultivos de México Sabaratnam, S. 2012. Powdery mildew of greenhouse peppers. Plant Pathologist B.C. Ministry of Agriculture. B.C. Ministry of Agriculture. Canada. http://www.agf.gov.bc.ca/cropprot/peppermildew.htm Saettler, A. W. and H. S. Potter. 1970. Chemical control of halo bacterial blight in field beans. Research report No. 98. Agr. Exp. Station. Michigan State Univ. East Lansing, MI. USA. 8 p. Saettler, A. W. 1987. Common bacterial blight. In: CIAT. Bean production problems in the tropics (2a Ed.). Cali, Colombia. pp.261-283. Saettler, A. W. 1991. Diseases caused by bacteria. Common bacterial blight. In: Compendium of bean diseases. R. Hall (ed.). The American Phytopathological Society. St. Paul, MN. USA. p. 29. Saettler, A. W. 1991. Diseases caused by bacteria. Halo blight. In: Compendium of bean diseases. R. Hall (ed.). The American Phytopathological Society. St. Paul, MN. USA. p. 30. Saharan, G. S., N. Mehta and M. S. Sangwan. 2005. Diseases of oilseed crops. Industry Publishing Co. Nueva Delhi. pp. 248-249. Salazar O. L. 2011. Identificación de razas de Bremia lactucae y caracterización de variedades de lechuga. Tesis de Maestría. Colegio de Postgraduados, México. p. 12. Savory, E. A., L. L. Granke, L. M. Quesada-Ocampo, M. Varbanova, M. K. Hausbeck and B. Day. 2011. The cucurbit downy mildew pathogen Pseudoperonospora cubensis. Wiley on line library. Molecular Plant Pathology. Volume 12 (3): 217–226. Schwartz, H. F. 1989. Halo blight. In: Bean production problems in the tropics (2a Ed.). CIAT. Cali, Colombia. p.285. Schwartz, H. F. 1991. Antrachnose. In: Compendium of bean diseases. R. Hall (ed.). The American Phytopathological Society. St. Paul, MN. USA. p. 16. SENASICA. 2011. Roya anaranjada de la caña de azúcar Puccinia kuehnii (W. Kruger) E.J. Butler. Vigilancia epidemiológica fitosanitaria. DGSV. Tríptico informativo. Serrano C. Z. 2003. Espárrago: Técnicas de producción. Madrid, España. 215 p. Sharp, E. L. 1967. Atmospheric ions and germination of urediospores of Puccinia striiformis. Science 56: 1359-1360. Sherf, A. F. and A. A. Macnab. 1986. Vegetable diseases and their control. 2nd. Ed. John Wiley and Sons. USA. pp. 503, 663. 171 Enfermedades Importantes de Algunos Cultivos de México Schuster M.L. and D.P. Coyne. 1975. Genetic variation in bean bacterial pathogens. Euphytic 24: 143-147. Singh R. P. J. Huerta-Espino y A. P. Roelfs. 2002. The wheat rusts. In: Bread wheat. Improvement and production. FAO. Plant production and protection. Series No. 30. Rome, Italy. Sisay A., F. Abebe and K. Wako. 2012. Evaluation of three potential botanicals against sorghum covered smut (Sphacelotheca sorghi) at Bako, Western Oromia Ethiopia. African Journal of Plant Science Vol. 6(8): 226-231. Smith, I. M., J. Dunez, R. A. Lelliott, D. H. Phillips y S. A. Archer. 1988. Manual de las enfermedades de las plantas. Ediciones MundiPrensa. Bilbao, España. p. 525. Smith, J. R. 1991. Disease and pest research. In: Safflower. AOCS Press USA. p. 161. Smith, I. M., J. Dunez, D. H. Phillips, R. A. Lelliott, y S. A. Archer. 1992. Manual de enfermedades de las plantas. The American Phytopathological Society. Ediciones Mundi-Prensa. p. 265. SNIDRUS. 2012. Sistema Nacional de Información para el desarrollo rural sustentable. Estadística Agrícola Básica. Anuarios por cultivo. http://www.oeidrus-sonora.gob.mx/. Stansbury, C., S. McKirdy and G. Power. 2000. Black sigatoka Mycosphaerella fijiensis exotic threat to western. Agriculture Western Australia. p. 2. Stadt, S. J. y A. W. Saettler. 1981. Effect of host genotype on multiplication of Pseudomonas phaseolicola. Phytopathology 71(12): 1307-1310. Stavely, J. R. y M. A. Pastor-Corrales. 1989. Rust. In: Bean production problems in the tropics (2a Ed.). CIAT. Cali, Colombia. p.160. St. J. Hardy, G. E., I. J. Colquhoun, B. L. Shearer and I. Tommerup. 2001. The impact and control of Phytophthora cinnamomi in native and rehabilitated forest ecosystems in western Australia. For, Snow Landsc. Res. 76(3): 337–343. Stavley, J. R. 1991. Rust. In: Compendium of bean diseases. R. Hall (ed.). The American Phytopathological Society. St. Paul, MN. USA. p. 24. Stovold G. E. and J. F. Dirou. 2004. Blight diseases in mangoes. New South Wales NSW Department of Primary Industries. 3 p. 172 Enfermedades Importantes de Algunos Cultivos de México Stubbs, R. W. 1985. Stripe rust. Pp. 61-101 de A.P. Roelfs y W.R. Bushnell (Eds.). The cereal rusts Vol. II; Diseases, distribution, epidemiology, and control. Academic Press, Orlando. Stubbs, R. W., J. M. Prescoll, E. E Saari and H. J. Dubin. 1986. Cereal Disease Methodology Manual. CIMMYT: México, D.F. 46 p. Su, H., A. H. C. van Bruggen, K. V. Subbarao and K. V. Scherm. 2004. Sporulation of Bremia lactucae affected by temperature, relative humidity and wind in controlled conditions. The American Phytopathological Society. Phytopathology. Vol. 94 (4): 396-401. Sutton, M. D. and V. R. Wallen. 1970. Epidemiological and ecological relations of Xanthomonas phaseoli and Xanthomonas phaseoli var. fuscans on beans in southwestern Ontario, 1961-1968. Can. Jo. Bot. 48(7): 1329-1334. Swanson, J., B. Kearney, D. Dahlbeck and B. Staskawicz. 1987. Cloned avirulence of Xanthomonas campestris pv. vesicatoria complements spontaneous race-change mutants. Molecular PlantMicrobe Interactions. APS. Vol. 1 (1): 5-8. Tarr, S. A. J. 1962. Diseases of sorghum, sudan grass and broomcorn. The commonwealth mycological institute kew, Surrey. Oxford University Press, UK. pp. 196-218. Tayupanta R. V. V. 2012. Control in vitro de botrytis (Botrytis cinerea), mildiu (Bremia lactucae) y esclerotinia (Sclerotinia sclerotiorum) en lechuga (Lactuca sativa), usando extractos de cola de caballo (Equisetum arvense), ortiga (Urtica dioica L.), ruda (Ruta graveolens) y tomillo (Thymus vulgaris). Universidad Politécnica Salesiana, Sede Quito, Ecuador. Tesis de Licenciatura. p. 33. Téliz, D. 2000. El aguacate y su manejo integrado. Enfermedades del fruto. Ediciones MundiPrensa. México, D.F. p.145. Thomas C. E., T. Inaba and Y. Cohen. 1987. Physiological specialization in Pseudoperonospora cubensis. Phytopathology 77:1621-1624. Thomas C. E. 1996. Downy mildew. In: Zitter T.A., D.L. Hopkins y C.E. Thomas (eds.). Compendium of cucurbit diseases. APS Press, St. Paul, Minnesota. pp. 25-27. Trigiano, R. N., W. T. Windham and M. T., Windham. 2008. Plant pathology: Concepts and laboratory exercises 2nd Edition. CRC Press. 173 Enfermedades Importantes de Algunos Cultivos de México Tuttle, M. T. 2001. Powdery mildew of pepper: A new disease to keep an eye out for in the Northeast. Cornell University. Department of Plant Pathology. Ithaca, NY. http://vegetablemdonline.ppath.cornell. edu/NewsArticles/PepperyPowdery.htm Tuttle, M. M. 2011. Powdery mildew of cucurbits. Department of Plant Pathology and Plant-Microbe Biology, Long Island Horticultural Research and Extension Center Cooperative Extension • New York State • Cornell University. Fact Sheet Page: 732.30. University of Maine. 2010. Early blight of tomato. Cooperative Extension: Insect, Pest & Plant Diseases. Pest Management Fact Sheet #5087. University of Illinois. 1990. Sorghum smuts. RPD No. 208. December 1990. Department Of Crop Sciences. University of Illinois at UrbanaChampaign. p.1. Verma, L.R., and R.C. Sharma. 1999. Diseases of horticultural crops vegetables, ornamentals and mushrooms. 1st ed. Indus Publishing Company. pp. 430-43. Vidales, F. J. A., J. Anguiano C., V. M. Coria A. y J. J. Alcántar R. 2005. Control de la roña del aguacate. SAGARPA-INIFAP-CIRPAC. Campo Experimental Uruapan. Desplegable para productores. Uruapan, Michoacán, México. Viljanen-Rollinson, S. L. H., Y. Deng, M. V. Marroni and L. H. Cheah. 2006. The potential occurrence of Puccinia asparagi in New Zealand. New Zealand Plant Protection 59:137-140. Viveros F. J. y J. Castaño Z. 2006. Evaluación In vitro de extractos vegetales sobre Mycosphaerella fijiensis Morelet. Agron. 14(1): 3750. Warthon, P. and W. Kirk. 2007. Michigan potato diseases. Early blight. Dep. Plant Path. Michigan State Univ. Extension Bulletin E-2991. Wiese, M. V. 1977. Compendium of wheat diseases. The American Phytopathological Society. St. Paul, MN. USA. pp: 21, 38-74. Workneh, F., and C. M. Rush. 2002. Evaluation of relationships between weather patterns and prevalence of sorghum ergot in the Texas Panhandle. Phytopathology 92: 659-666. Yadav, V. K. 1999. Mango malformation: A review. Journal Appl. Hort. Vol.(1): 70-78. Yesuf, M. and S. Sangchote. 2007. Survival and transmission of Colletotrichum lindemuthianum from naturally infected common 174 Enfermedades Importantes de Algunos Cultivos de México bean seeds to the seedlings. Tropical Science 47(2): 96–103. Yoshii, K. and G. E. Gálvez. 1975. Effect of rust on yield components of dry beans (Phaseolus vulgaris). Proc. Am. Phytopathol. Soc. 2:80. (abstract). Zadoks, J. C. and J. J. Bouwman. 1985. Epidemiology in europe. A. P. Roelfs y W. R. Bushnell (Eds). The cereal rusts Vol. 11: Diseases, distribution, epidemiology and control. Academic Press, Orlando. pp. 329-369 Zillinsky, F. J. 1983. Common diseases of small grain cereals: A guide to identification.CIMMYT. México, D.F. p.17. Zitter, T. A. 1985. Vegetable crops. Bacterial spot of pepper. Department of Plant Pathology, Cornell University. Cooperative Extension. New York State. Cornell University. Fact Sheet p. 736. 175 Enfermedades Importantes de Algunos Cultivos de México Glosario Aecias. Cuerpo fructífero en forma de copa invertida, de las royas las cuales producen las aeciosporas. Antracnosis. Enfermedad que se manifiesta como lesiones negras profundas de la hoja, tallo o fruto y que es causada por hongos que producen sus esporas asexuales en un acérvulo. Apresorio. Extremo hinchado de una hifa o tubo germinativo que facilita la fijación y penetración de un hongo en su hospedante. Asca. Hifa en forma de saco que contiene ascosporas( por lo general, ocho). Ascocarpo. Cuerpo fructífero que contiene las ascas. Ascospora. Espora sexual que se produce dentro de una asca. Autoico. En los uredinales cuando el ciclo biológico del hongo se completa en la misma planta. Basidio. Estructura en forma de maza que soporta a las basidiosporas. Basidiospora. Espora producida de manera sexual y localizada sobre un basidio. Estroma. Hifas entrelazadas que semejan un tejido parenquimático. Heteroico. Que requiere de dos tipos distintos de hospedante para completar su ciclo de vida; por lo común esta condición se presenta en las royas. Clamidospora. Espora asexual de pared gruesa que se forma por la modificación de una célula de las hifas de un hongo. Cleistotecio. Ascocarpo totalmente cerrado. Conidio (a). Espora asexual de un hongo formada en el extremo de un conidióforo. Equinulada. Se refiere a células fúngicas que poseen ornamentos en forma de pequeñas espinas o protuberancias. Esclerocio. Masa compacta de hifas, por lo general con una cubierta oscura y capaz de sobrevivir bajo condiciones ambientales desfavorables. Escoba de bruja. Crecimiento en forma de escoba o proliferación en masa a partir de una yema, en ramas de plantas leñosas. Espora. Unidad reproductiva de los hongos, constituida por una o varias células. Esporidio. Espora de segunda generación. 177 Enfermedades Importantes de Algunos Cultivos de México Estado imperfecto. Parte del ciclo de vida de un hongo en el cual no se producen esporas sexuales. Estado perfecto. Fase sexual en el ciclo biológico de un hongo. Filodio (a). Es un órgano laminar que parece ser una hoja, pero que por su origen evolutivo, su ontogénesis (su proceso de desarrollo) y su anatomía interna resulta no serlo. En general se trata de tallos o peciolos dilatados que cumplen en algunas plantas la función fotosintética que normalmente corresponde a las hojas, a las que funcionalmente sustituyen. Forma especial (f.sp.). Se dice de los parásitos que sin presentar diferencias morfológicas aparecen bien caracterizados biológicamente por estar adaptados a cierto género o especie de hospedante. Haustorio. Extremo de las hifas de un hongo parásito, simbionte o de la raíz modificada de una planta parásita que penetra en el tejido del anfitrión, pero permanece fuera de la membrana de la célula huésped. Hialino. Incoloro, transparente. Melanizar. Es el proceso responsable de la coloración oscura, más o menos negra, que adquieren algunos cuerpos. Micrómetro (μm). Unidad de longitud que equivale a una milésima parte de un milímetro. Necrosis: Síntoma de enfermedad en las plantas caracterizado por la muerte prematura de las células de un tejido u órgano. Paráfisis. Hifa estéril que se encuentra en algunos cuerpos fructíferos de los hongos. Peritecio. Ascocarpo en forma de botella o globular que tiene una abertura o poro. Promicelio. Hifa corta que se produce por la germinación de una teliospora formando un basidio. Pústula. Pequeña elevación formada por la aglomeración de esporas, que sobresalen del tejido epidérmico. Quiescente. Que está quieto pudiendo tener movimiento propio. Roya. Enfermedad causada por un grupo de hongos que dan una apariencia rojiza a las plantas. Telias. Fructificación en las que se forman las teliosporas de las royas. Teliosporas. Espora sexual y de resistencia de los carbones y las royas. 178 Enfermedades Importantes de Algunos Cultivos de México Tizón. Enfermedad que se caracteriza por la destrucción rápida y generalizada de hojas, flores y tallos. Uredias. Cuerpo donde se forman esporas comúnmente llamadas uredosporas. 179 La presente publicación se realizó gracias a los recursos económicos aportados por el proyecto INIFAP FONDOS FISCALES 2011-2013 de nombre: Cambio Climático y su Impacto sobre el Potencial Productivo Agrícola, Forrajero y Forestal en México. Directorio del Personal Investigador Sitio Experimental Costa de Hermosillo Nombre y programa de Investigación Correo electrónico Dr. Gerardo Martínez Díaz [email protected] Frutales - Jefe de Campo Ing. Gustavo Adolfo Fierros Leyva [email protected] Frijol y garbanzo MC. Ana Aurora Fontes Puebla [email protected] Sanidad forestal y agricola MC. Agustín Alberto Fú Castillo [email protected] Sanidad forestal y agricola MC. José Grageda Grageda [email protected] Agrometeorologia y modelaje Ing. Luis Armando Maldonado Navarro [email protected] Frutales MC. José Luis Miranda Blanco [email protected] Frutales MS. Pedro Fco. Ortega Murrieta [email protected] Frijol y garbanzo MC. Rodolfo Sabori Palma [email protected] Hortalizas MC. Benjamín Valdez Gascón [email protected] Ingeniero de riego MC. Wilfrido Verdugo Zamorano [email protected] Biotecnologia MC. Fernando A. Vieira de Figueiredo [email protected] Agrometeorologia y modelaje Sitio Experimental Carbó MC. Miguel Ángel Zapata Moreno [email protected] Pastizales y cultivos forrajeros–Jefe de Sitio Dr. Rubén Cabanillas Cruz [email protected] Pastizales y cultivos forrajeros MC. Teodoro Cervantes Mendívil [email protected] Plantaciones y sistemas agroforestales Dr. Félix Roberto Burboa Cabrera [email protected] Carne de rumiantes MC. Gustavo David Ibarra Daniel [email protected] Leche MC. Miguel Antonio Parra Galindo [email protected] Pastizales y cultivos forrajeros MC. César Ortega García [email protected] Pastizales y cultivos forrajeros MC. Martín Fernando Silva Olivas [email protected] Pastizales y cultivos forrajeros Sitio Experimental Caborca MC. Manuel de Jesús Valenzuela Ruíz [email protected] Frutales – Jefe de Sitio MC. Raúl Leonel Grijalva Contreras [email protected] Frutales MC. Arturo López Carvajal [email protected] Frutales MC. Rubén Macías Duarte [email protected] Hortalizas MI. Fabián Robles Contreras [email protected] Ingenería de riego Dr. Adan Fimbres Fontes [email protected] Ingeniería de riego ENFERMEDADES IMPORTANTES DE ALGUNOS CULTIVOS DE MÉXICO La presente publicación se terminó de imprimir en el mes de noviembre de 2013 en los Talleres Gráficos de Prometeo Editores, S.A. de C.V. Libertad No. 1457, Col. Americana. C.P. 44160, Guadalajara Jalisco Tel. (33) 3826-2726 y 82 [email protected] Su tiraje consta de 1,000 ejemplares Impreso en México | Printed in Mexico