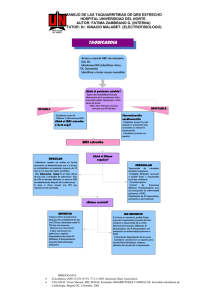
ARRITMIAS EN UNIDADES DE CUIDADOS INTENSIVOS
Anuncio

ARRITMIAS EN UNIDADES DE CUIDADOS INTENSIVOS El presente artículo es una actualización al mes de octubre del 2006 del Capítulo de los Dres. Alfredo Del Río (h) y Jorge González Zuelgaray del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos Aires (2001) INTRODUCCIÓN Las arritmias constituyen una importante causa de internación en Unidades de Cuidados Intensivos y en Unidades Coronarias, siendo el segundo motivo de ingreso cardiológico, luego de la cardiopatía isquémica. En un relevamiento de datos de Unidades Coronarias de la Ciudad de Rosario se comprobó que de 764 pacientes internados, el 23% presentó alguna clase de arritmia como motivo de internación. Sobre el total de pacientes internados por arritmias, el 66% presentó taquicardias supraventriculares, de las cuales el 60% fueron fibrilaciones auriculares, el 20% aleteos auriculares y el 20% taquicardias paroxísticas supraventriculares; el 22% presentó bradiarritmias, y el 12% arritmias ventriculares. Para el analisis de cualquier arritmia, es conveniente seguir una secuencia ordenada de estudio, según lo indicado en la Tabla 1. Tabla 1.- Reconocimiento de una arritmia. 1.- Localizar la onda P: Es visible? Frecuencia Morfología 2.- Relación P-QRS: 1:1 Más P que QRS Más QRS que P P antes que QRS: análisis del PR QRS antes que P: evaluar constante R-P 3.- Analizar el QRS: Fino: supraventricular Grueso: supraventricular con conducción aberrante ventricular 4.- Otras claves: Respuesta al masaje del seno carotideo Latidos de captura o de fusión Respuesta QRS regular o irregular Latidos agregados 5.- Contexto clínico: Infarto de miocardio Paciente joven con taquicardia compleja Para simplificar el estudio de los trastornos del ritmo, es conveniente agruparlos en arritmias lentas o bradiarritmias y arritmias rápidas o taquiarritmias. BRADIARRITMIAS Se denomina bradicardia a todo ritmo menor de 60 latidos por minuto. Las bradiarritmias pueden deberse a un funcionamiento anormal del nódulo sinusal o a la existencia de un bloqueo a nivel del nódulo aurículo ventricular. DISFUNCIÓN DEL NÓDULO SINUSAL Corresponde habitualmente a una patología degenerativa del nódulo sinusal que se asocia con una hipofunción del mismo. La cardiopatía isquémica se asocia frecuentemente con esta enfermedad. Las causas farmacológicas incluyen el uso de drogas con efecto cronotrópico negativo, tales como βbloqueantes, antagonistas del calcio, amiodarona, digital, etc. El hipotiroidismo y ciertas patologías abdominales que incrementan el tono vagal constituyen causas secundarias. Los pacientes pueden permanecer asintomáticos durante períodos prolongados, sobre todo cuando la disfunción no es severa. Los síntomas más comunes son fatiga, astenia, pérdida de la capacidad funcional, disnea de esfuerzo, bradipsiquia, insomnio, irritabilidad, pérdida de la memoria; también es frecuente la presencia de palpitaciones. En algunos casos el bajo gasto cardiaco y la isquemia cerebral resultante se pueden asociar con mareos, presíncope y síncope. Electrocardiográficamente es característico el hallazgo de bradicardia sinusal extrema y de bloqueos sinoauriculares que se expresan en el electrocardiograma como pausas o paros sinusales (Fig. 1 A). El bloqueo sinoauricular tipo Mobitz I se caracteriza por el acortamiento gradual de los intervalos P-P en los ciclos que preceden a una pausa. El bloqueo sinoauricular Mobitz II se caracteriza por la falta inesperada de una onda P. También es frecuente el hallazgo de extrasístoles auriculares mono o polifocales, y colgajos de taquicardias auriculares que generan el síndrome taquicárdico–bradicárdico (taqui-bradi). Muchas veces el ritmo sinusal es reemplazado por algún ritmo subsidiario auricular bajo o de la unión aurículo-ventricular. En un 10 a 15% de los casos se asocian bloqueos en la conducción a nivel del haz de His y sus ramas. Estos hallazgos electrocardiográficos son variables y no son permanentes. A medida que la enfermedad progresa los mismos se hacen más constantes. En el 5 al 10% de los pacientes se produce una progresión hacia un bloqueo A-V de alto grado. Fig. 1 A. Pausa sinusal en paciente con disfunción del nódulo sinusal. El agrandamiento de la aurícula izquierda, los episodios de taquiarritmias auriculares y de fibrilación auricular paroxística son los predictores más sensibles de la evolución hacia la fibrilación auricular crónica, cuya prevalencia es del 3% por año. El manejo farmacológico de la fibrilación auricular paroxística es a menudo difícil debido al agravamiento de la bradicardia que producen las drogas antiarrítmicas. Es frecuente que la disfunción del nódulo sinusal se halle asociada a un componente de hipersensibilidad del seno carotídeo. Mediante la compresión carotídea pueden desenmascararse paros y pausas sinusales que de otra manera pasarían desapercibidos. El monitoreo electrocardiográfico Holter de 24 horas es el estudio que tiene el mayor rendimiento diagnóstico en esta enfermedad. La presencia de pausas de más de tres segundos debido a paros o pausas sinusales es típico, siendo también frecuente hallar extrasístoles auriculares y colgajos de taquicardia auricular. En general existe bradicardia sinusal durante todo el registro y se evidencia un déficit cronotrópico. La prueba ergométrica es otro test que está indicado para establecer el diagnóstico de insuficiencia cronotrópica. La incapacidad de superar frecuencias de 100 lpm es un dato indicativo valioso de insuficiencia cronotrópica. Siempre es importante establecer si la bradicardia no es a consecuencia del entrenamiento físico intenso, como ocurre en los atletas (Fig. 1B). Fig. 1 B.- Bradicardia sinusal en sujeto sano sobreentrenado. El estudio electrofisiológico tiene una alta especificidad para el diagnóstico de este trastorno, pero su sensibilidad es intermedia. Para mejorar el rendimiento algunos autores han propuesto la sensibilización farmacológica con bloqueantes cálcicos (verapamilo) pero esto puede llevar a resultados falsos positivos. Lo que se realiza es el estudio del tiempo de recuperación del nódulo sinusal. El pronóstico de la enfermedad del nódulo sinusal es bueno. En general altera más la calidad de vida de los pacientes que la sobrevida. Con respecto a la terapéutica, el implante de un marcapasos definitivo logra un alivio completo de los síntomas. En esta enfermedad deben implantarse marcapasos AAIR, es decir dispositivos que estimulen y sensen la aurícula y que además brinden respuesta cronotrópica ante el ejercicio. La estimulación auricular no sólo conserva la sincronía aurículo-ventricular sino que también disminuye la incidencia de fibrilación auricular. También pueden estar indicados marcapasos DDDR que tienen la ventaja de estimular y sensar tanto la aurícula como el ventrículo, y también brindan soporte cronotrópico durante el ejercicio. Los marcapasos VVI o VVIR parecen aumentar la mortalidad de esta enfermedad benigna. Esto se debe a que la estimulación ventricular produce una disociación ventrículo-auricular que sobrecarga las cámaras auriculares induciendo fibrilación auricular, entidad mórbida que se asocia con la producción de accidentes cerebrovasculares embólicos. BLOQUEOS AURÍCULO – VENTRICULARES Bloqueo A-V de primer grado. El bloqueo A-V de primer grado no ocasiona bradicardia, es símplemente un retardo en la conducción del impulso desde el nódulo sinusal hasta el miocardio ventricular. Todos los impulsos auriculares son conducidos al ventrículo, es decir todas las ondas P son seguidas por un complejo QRS. Electrocardiográficamente se evidencia por la presencia de un intervalo PR prolongado (mayor de 200 mseg.) (Fig. 2). El enlentecimiento de la conducción puede producirse en la aurícula (trastorno de conducción intraauricular), en el nódulo A-V que es lo más frecuente cuando el QRS es angosto, o en el sistema His-Purkinje, en general asociado a un QRS ancho. Los P-R más largos en general se asocian con retardos en la conducción a nivel del nódulo A-V. Bloqueo A-V de segundo grado. En este grado de bloqueo sólo algunas ondas P son seguidas por un complejo QRS, es decir que algunos impulsos auriculares son conducidos al ventrículo y otros no. El bloqueo A-V de segundo grado puede ser de dos tipos: Mobitz I y Mobitz II. Bloqueo A-V de segundo grado tipo Mobitz I. Este bloqueo, también llamado tipo Wenckebach, se caracteriza por el alargamiento progresivo del intervalo P-R, hasta que un impulso auricular se bloquea y no va seguido de despolarización ventricular. Electrocardiográficamente se observa que las ondas P son conducidas con intervalos P-R cada vez más prolongados hasta que una onda P se bloquea y no va seguida de QRS (Fig. 3). Fig. 2.- Bloqueo A-V de primer grado. Figura 3: Bloqueo A-V de segundo grado tipo Wenckebach. Se observa desde arriba hacia abajo: electrocardiograma de superficie, derivaciones D1, D2 y V1; seguidos de registro endocavitario de la actividad del haz de His. A: potencial auricular, V potencial ventricular y H potencial del His. Observese como el intervalo P-R se va prolongando hasta que una onda P no conduce. El alargamiento del intervalo P-R se hace a expensas del intervalo A-H (conducción nodal A-V). Con respecto al nivel del bloqueo, el Mobitz I en general es suprahisiano, es decir que ocurre por lo común a nivel del nódulo A-V. En raras ocasiones puede ocurrir en el sistema HisPurkinje, en general en estos casos la conducción hacia el ventrículo se hace con aberrancia de rama, es decir que se acompaña de un QRS ancho. En los casos de Wenckebach infrahisiano la prolongación del P-R muchas veces es poco evidente por lo que es necesario una medición minuciosa de los intervalos P-R en el ECG. En el bloqueo A-V de tipo Wenckebach es común que se observe una relación A/V 3:2 o 4:3, relaciones 6/5 o mayores son menos frecuentes. Bloqueo A-V de segundo grado tipo Mobitz II. Se caracteriza por el súbito bloqueo de una o más ondas P, sin que medien alargamientos progresivos de los intervalos P-R. Este tipo de bloqueo no existe en el nódulo A-V, por lo que el nivel de bloqueo es siempre distal a esta estructura, es decir intra o infrahisiano. El pronóstico de este bloqueo es peor que el anterior ya que la evolución a bloqueo A-V completo es frecuente e inesperada (Fig. 4). En general se asocia a bloqueos de rama previos. La confirmación diagnóstica de este tipo de bloqueo es indicación de implantar un marcapasos definitivo. El estudio electrofisiológico es de gran utilidad para certificar el nivel de bloqueo y confirmar la necesidad o no del implante de un marcapasos definitivo. Figura 4: Bloqueo A-V de segundo grado tipo Mobitz II. Se observan registros de electrocardiograma de superficie, derivaciones D1, D2 y V1. El registro de abajo corresponde a la activación del haz de His (A: potencial auricular, V: potencial ventricular y H: potencial del His). La onda P se bloquea después de la activación del His. Bloqueo infranodal. Bloqueo A-V 2:1. En este caso se observa que alternadamente una onda P conduce mientras que la siguiente se bloquea (Fig. 5). En estos casos no se puede precisar si el bloqueo es Mobitz I o II porque no hay secuencia para observar si los P-R se van alargando o si existe un súbito bloqueo de una onda P. El masaje del seno carotídeo puede desenmascarar un bloqueo a nivel nodal cuando aumenta el grado de bloqueo y se observan varias ondas P que no son conducidas, o un nivel infrahisiano cuando se produce una mejoría en la conducción, es decir que conduce 1 a 1. Fig. 5.- Bloqueo A-V 2:1. Bloqueo A-V de tercer grado o completo. Se caracteriza por la ausencia de conducción de los estímulos auriculares hacia el miocardio ventricular, es decir que ninguna onda P va seguida de QRS conducido. Electrocardiográficamente se observa una disociación aurículoventricular en la que los intervalos P-P y los R-R no guardan relación entre sí. Cada cámara late independientemente (Fig. 6). Fig. 6.- Bloqueo A-V completo. Las causas que pueden producir este tipo de bloqueo incluyen: 1) la calcificación del anillo mitral y del esqueleto conectivo cardíaco o enfermedad de Lev, 2) la fibrosis idiopática del His-Purkinje o enfermedad de Lenegre, 3) causas inflamatorias como las miocarditis, 4) hipertono vagal, 5) la isquemia rara vez es causa de bloqueo A-V completo. Para adjudicarle causalidad debe haber relación directa entre los fenómenos isquémicos y la producción del bloqueo (Ej: alteraciones del segmento ST en el ECG en el momento del bloqueo), 6) bloqueo A-V inducido por radiofrecuencia. Si el nivel del bloqueo es infrahisiano los QRS en general son anchos y ectópicos. Al haber un bloqueo total de la conducción a nivel del His-Purkinje, toma el comando de la activación ventricular un ritmo idioventricular muy lento (30 a 40 lpm) que se origina en la red de Purkinje o en el propio miocardio ventricular. Este es un ritmo inestable que puede evolucionar al agotamiento y a la asistolia. Si el nivel de bloqueo es nodal, puede tomar el comando ventricular un ritmo hisiano o fascicular que logra una frecuencia cardíaca mayor (50 o 60 lpm). En estos casos el QRS puede ser angosto o tener apariencia de aberrancia de rama; estos ritmos son más estables. En los bloqueos A-V completos con ritmos de escape altos, puede emplearse una infusión endovenosa de isoproterenol, que en general es efectiva para aumentar la frecuencia cardíaca y estabilizar al paciente. Está indicado el implante de un marcapasos transitorio en todo bloqueo A-V completo con ritmo de escape idioventricular. Aunque el paciente esté estable la bradicardia extrema es causa de prolongación de la repolarización ventricular y torsión de punta con el consiguiente riesgo de fibrilación ventricular y muerte. En estos casos, el isoproterenol en general no produce un aumento de la frecuencia cardíaca y puede ocasionar arritmia ventricular. El marcapaseo transitorio debe ser utilizado por poco tiempo, lo ideal son horas, hasta tanto se consiga implantar el marcapasos definitivo. El marcapaseo transitorio prolongado puede asociarse con importantes complicaciones, como ser el desplazamiento del catéter con producción de asistolia por supresión por sobreestimulación del foco de escape, inducción de arritmia ventricular irritativa y bacteriemia en un paciente que va a recibir una prótesis endovascular. El bloqueo A-V completo se produce en el 20% de los casos de infarto agudo de cara inferior, sobre todo en las primeras 24 a 48 horas. En general su duración es menor de 12 horas y la progresión a bloqueo A-V completo persistente es excepcional. En estos casos puede utilizarse una infusión de aminofilina que antagoniza el efecto de la adenosina, sustancia que interviene en la fisiopatología de este tipo de bloqueo. Esta arritmia también puede responder a la administración de atropina, cuando la causa es un hipertono vagal. BLOQUEOS FASCICULARES El análisis de los bloqueos fasciculares no se desarrollará en este capítulo. Se debe destacar que la coexistencia de deterioro en la conducción en dos ramas del haz de His hace más probable la progresión a bloqueo A-V completo. Así, la presencia de bloqueo de rama derecha más hemibloqueo posterior tiene gran valor predictivo en tal sentido. En el bloqueo de rama alternante (derecha e izquierda) la progresión a bloqueo A-V completo es tan frecuente que está indicado el implante de un marcapasos definitivo sin mediar otros estudios. En el bloqueo de rama derecha asociado a hemibloqueo anterior lo mismo que en el bloqueo de rama izquierda de alto grado la progresión a bloqueo A-V completo es del 3 a 5% por año. El intervalo PR no es un indicador confiable para predecir la progresión a un bloqueo A-V completo. BRADICARDIAS EN EL INFARTO AGUDO DE MIOCARDIO En el infarto agudo de miocardio son comunes distintas formas de bradicardia, en particular en asociación con lesiones de la arteria coronaria derecha. La bradicardia sinusal se produce en el 30 a 40% de los casos, el bloqueo AV Mobitz I en el 4 al 10%, y el bloqueo AV de tercer grado en el 5 al 8%. En los infartos de cara inferior, estas bradiarritmias parecen ser primariamente debidas a un aumento del tono vagal y a la liberación local de adenosina más que al daño celular del sistema de conducción. Como tal, el tratamiento con atropina o aminofilina habitualmente es efectivo. Como regla general, excepto que sean sintomáticas, las bradicardias en el contexto del infarto agudo de miocardio no son una indicación para marcapaso transvenoso, en la medida en que el QRS permanezca estrecho. Un complejo QRS ancho implica una lesión del sistema de conducción por debajo del nódulo AV y puede reflejar ya sea una lesión previa del sistema de conducción o un infarto extenso. En la Tabla 2 se indican recomendaciones generales para el tratamiento de la bradicardia asintomática en el IAM. Tabla 2.-Indicaciones de marcapaso temporario profiláctico en el infarto agudo de miocardio. Ritmo Bradicardia sinusal asintomática Bloqueo AV de primer grado Mobitz I asintomático Mobitz II asintomático con QRS estrecho Mobitz II asintomático con QRS ancho Bloqueo AV de tercer grado asintomático con QRS estrecho en infarto inferior Bloqueo AV de tercer grado con QRS ancho en infarto anterior Indicado No indicado X X X X X X X EMPLEO DE MARCAPASOS Tipos de marcapasos Existen diferentes tipos de marcapasos de acuerdo a la cámara que sensan o estimulan. En el año 1974 se propuso un código de 3 letras con el fin de clasificar los distintos tipos de marcapasos. La primera letra indica la o las cámaras estimuladas: V para el ventrículo, A para la aurícula y D para ambas. La segunda letra señala la o las cámaras sensadas, A cuando es capaz de sensar la actividad aurícular, V cuando sensa la actividad ventricular y D cuando sensa en ambas cámaras. Finalmente la última letra brinda información respecto a la respuesta al sensado, I cuando al sensar actividad en una cámara inhibe la descarga de espiga, O cuando no sensa actividad (siempre descarga espiga), T cuando al sensar actividad emite una espiga y D cuando al sensar una actividad en la aurícula se inhibe en esta cámara y emite una espiga en la cámara ventricular después de una demora o intervalo A-V. Este código ha tenido varias ampliaciones por el aumento en la complejidad de los marcapasos, pero su análisis está fuera de los alcances de este capítulo. Indicaciones de marcapasos definitivo En bloqueos aurículo - ventriculares adquiridos: 1) Bloqueo A-V completo en cualquier nivel anatómico. Sobre todo si existen síntomas, o pausas mayores de 3 segundos o ritmo de escape menor de 40 lpm, o si el paciente debe recibir drogas antiarrítmicas por arritmia ventricular. 2) Bloqueos A-V de segundo grado asociado a bradicardia sintomática. 3) Bloqueos A-V de segundo grado asintomático tipo Mobitz II. 4) Bloqueos A-V de segundo grado asintomático tipo Mobitz I infrahisiano. En bloqueos bifasciculares o trifasciculares: 1) Cuando hay asociado un bloqueo A-V completo intermitente. 2) Cuando se asocia un bloqueo A-V de segundo grado infrahisiano. 3) Cuando existe intervalo H-V (en el estudio electrofisiológico) mayor a 100 mseg. En disfunción sinusal: 1) Asociada a bradicardia sintomática. 2) Incompetencia cronotrópica sintomática. 3) Disfunción sinusal secundaria a drogas que son necesarias, asociada a bradicardia sintomática. En hipersensibilidad del seno carotídeo: 1) Asociada a síncope recurrente que puede ser reproducido por compresión carotídea que induce pausa mayor de 3 segundos. En síncope neurocardiogénico: 1) Respuesta cardioinhibitoria asociada a síncope recurrente que se pone de manifiesto en el estudio de Tilt Test (Fig. 7). Fig. 7.- Respuesta cardioinhibitoria durante un estudio de Tilt Test. Elección del tipo de marcapasos y del modo de estimulación Una vez que se ha tomado la decisión de implantar un marcapasos el médico debe elegir de una larga lista de generadores de marcapasos y catéteres-electrodos. La elección del generador incluye modelos uni o bicamerales, configuraciones uni o bipolares, presencia o no de respuesta en frecuencia, tipo de sensor utilizado y funciones avanzadas como cambio automático de modo, tamaño del generador, capacidad de la batería y costo. La elección de los catétereselectrodos incluye polaridad, tipo de material, mecanismo de fijación y presencia o no de impedancia. Se deben tener en cuenta todas esta variables, sumadas a los parámetros programables del dispositivo para seleccionar el marcapasos que se adapta a cada paciente. Para seleccionar el modo de estimulación se debe conocer el estado de la conducción AV y la función del nódulo sinusal: 1) Si el paciente tiene un bloqueo A-V se debe conocer si la aurícula está o no en ritmo sinusal y si existen arritmias auriculares recurrentes: • Si está en ritmo sinusal y no hay disfunción del nódulo se debe implantar un marcapasos DDD o un VDD. • Si está en ritmo sinusal pero existe disfunción cronotrópica se recomienda un marcapasos DDDR. • Si la aurícula está fibrilada en forma crónica se recomienda un VVIR. • Si existen taquiarritmias auriculares recurrentes conviene implantar un DDD más CAM (cambio automático de modo). 2) Si el paciente padece una disfunción del nódulo sinusal se debe conocer el estado de la conducción A-V: • Si la conducción A-V es normal se recomienda un marcapasos AAIR o DDDR. • Si existe algún trastorno en la conducción A-V lo más lógico es implantar un marcapasos DDDR. Si además existen taquiarritmias auriculares recurrentes se recomienda un DDDR más CAM. Dada la complejidad creciente de los marcapasos en cuanto a modelos y funciones, la indicación, elección e implante del marcapasos óptimo debe ser realizada por profesionales con conocimiento y entrenamiento apropiados para lograr los mejores resultados con una efectividad fisiológica óptima. Posterior al implante el paciente con marcapasos requiere un cuidadoso seguimiento. Una óptima programación de los voltajes de salida, anchos de pulso e intervalos AV disminuye marcadamente el gasto de batería y prolonga la vida del dispositivo. Complicaciones de la estimulación cardíaca Síndrome de marcapasos. Se trata de un conjunto de síntomas y signos que sobrevienen como consecuencia de una mala selección del tipo de marcapasos definitivo o de una inapropiada programación. En general se asocia a estimulación VVI con retroconducción ventrículo-auricular, en cuyo caso se produce primero la sístole ventricular e inmediatamente después la auricular. Esto genera un comportamiento hemodinámico antifisiológico que altera el correcto llenado de las cámaras cardíacas con la consiguiente producción de insuficiencia cardíaca. También se puede observar este síndrome en la estimulación AAI con intervalo P-R prolongado e incluso en la estimulación DDD cuando existen trastornos de la conducción interauricular. Ocurre entre el 10 al 20% de los pacientes con marcapasos VVI. Los síntomas incluyen hipotensión, mareos, edemas en miembros inferiores, disnea por congestión pulmonar, fatiga, pulsaciones en el cuello, cefalea, dolor torácico, presíncope y síncope. El tratamiento debe estar dirigido a optimizar el modo de estimulación para el paciente en particular, y en los casos de marcapasos DDD a la reprogramación utilizando ecocardiografía Doppler para seleccionar los parámetros que se asocien al mejor comportamiento hemodinámico. Endless Loop Taquicardia. Se trata de una taquiarritmia mediada por marcapasos DDD o VDD cuyos complejos QRS son estimulados, es decir, tienen espiga (Fig. 8). Generalmente ocurre como resultado de la retroconducción de una extrasístole ventricular hacia la aurícula en un momento que el canal auricular del marcapasos puede sensarla. Esto gatilla una espiga ventricular que si vuelve a retroconducir hacia la aurícula vuelve a ser sensada y mantiene la taquicardia. También pueden desencadenarla extrasístoles auriculares, estimulación auricular subumbral, programación de intervalos A-V muy largos, programación VDD con frecuencias mínimas superiores a la sinusal, etc. Colocando un imán sobre la carcaza del marcapasos se logra interrumpir la taquicardia. El tratamiento definitivo debe realizarse reprogramando el dispositivo. Fig. 8.- Endless Loop taquicardia inducida por marcapasos. Paciente con marcapasos doble cámara que consulta por palpitaciones. TAQUIARRITMIAS Se denomina taquicardia a todo ritmo cardiaco cuya frecuencia supera los 100 latidos por minuto. Una forma útil de clasificar a las taquiarritmias es en función de la duración del QRS. Si el QRS dura más o menos de 120 mseg se las puede clasificar en taquicardias con QRS angosto o con QRS ancho. TAQUICARDIAS CON QRS ANGOSTO Las taquicardias cuyos QRS duran menos de 120 mseg siempre tienen un origen supraventricular, es decir que se pueden originar en las aurículas, en el nódulo A-V o en el haz de His. Las mismas pueden ser regulares o irregulares. Fibrilación auricular La fibrilación auricular es la arritmia cardiaca sostenida más frecuente, con una prevalencia elevada en la población de edad avanzada. Aunque es responsable de aproximadamente el 34% de las hospitalizaciones relacionadas con arritmias en EE.UU., es particularmente problemática en el postoperatorio, ya que retarda la descarga, con importantes implicancias en los costos y en el uso de los recursos. Es especialmente frecuente luego de la cirugía cardiaca, ocurriendo en alrededor del 26,7% de los casos. La fibrilación auricular se caracteriza electrocardiográficamente por la ausencia de ondas P, tremulación de la línea de base e intervalos RR irregulares (Fig. 9). Generalmente se acompaña de una frecuencia ventricular rápida, pero en determinadas ocasiones, tales como la intoxicación digitálica o la asociación con βbloqueantes o bloqueantes cálcicos, la frecuencia ventricular puede ser lenta. Fig. 9.- Fibrilación auricular. Su fisiopatología corresponde a la presencia de múltiples circuitos reentrantes del tipo leading circle, en los que la cola de repolarización está casi en contacto con la cabeza de despolarización. Para que se inicie una fibrilación auricular Moe propuso que deben coexistir al menos seis a ocho circuitos reentrantes dentro de las aurículas, estas ondas van dando origen a ondas hijas y así se originan múltiples circuitos reentrantes intraauriculares que sostienen la arritmia. La longitud de onda de un circuito o tejido se puede definir como el producto entre la velocidad de conducción por ese tejido y la longitud del frente de onda. Mientras menor sea la longitud de onda del tejido mayor será la probabilidad de que se generen múltiples circuitos reentrantes que originen una fibrilación auricular. Los fármacos que tienden a revertir la fibrilación auricular actúan aumentando la longitud del frente de onda, prolongando el período refractario auricular. Otro concepto importante es que la fibrilación auricular engendra o mantiene a la fibrilación auricular, esto obedece a un remodelamiento electrofisiológico de las cámaras auriculares, lo que hace más difícil revertir una fibrilación auricular cuanto más antigua sea. La fibrilación auricular puede estar o no asociada a una cardiopatía. Puede ser la manifestación de enfermedades sistémicas como el hipertiroidismo, puede estar asociada al uso de drogas o producirse en el postoperatorio de la cirugía cardíaca. Su incidencia aumenta con la edad y con la presencia de cardiopatía. La fibrilación auricular es una entidad con importante morbimortalidad, fundamentalmente por formación de trombos en el interior de las aurículas que pueden producir embolias y por el remodelamiento miocárdico que puede conducir a la dilatación de las cámaras cardíacas. El diagnóstico de la fibrilación auricular requiere la documentación de la arritmia en el ECG. En pacientes con sospecha de episodios paroxísticos, es recomendable la realización de un monitoreo Holter para el diagnóstico. Muchos cardiólogos realizan un ecocardiograma como parte de la evaluación de los pacientes con fibrilación auricular, habitualmente para el diagnóstico de una enfermedad cardiaca estructural de base. El ecocardiograma también es útil para reconocer la presencia o ausencia de factores embolígenos y establecer la conducta apropiada de anticoagulación. Con respecto a su evolución, la fibrilación auricular puede ser aguda, crónica o recurrente. Se considera fibrilación auricular aguda a la que tiene menos de 48 horas de evolución. La fibrilación auricular recurrente se produce cuando un paciente desarrolla dos o más episodios de fibrilación auricular, que pueden ser paroxísticos o persistentes. La fibrilación auricular paroxística se diagnostica si el episodio termina en forma espontanea dentro de los siete días, pero se considera persistente si se requiere la cardioversión eléctrica o farmacológica para terminar la arritmia. La fibrilación auricular crónica o permanente se produce cuando el paciente persiste en fibrilación auricular, cuando la cardioversión no es exitosa o es inapropiada, por ejemplo, debido a la persistencia de la arritmia por más de 12 meses. Independientemente de la clasificación temporal, el manejo de los pacientes con fibrilación auricular debe ser guiado por los síntomas, la presencia o ausencia de compromiso hemodinámico, y las comorbilidades asociadas (Fig. 10). Sin embargo, los subtipos permiten definir los objetivos del manejo y las estrategias terapéuticas. Por ejemplo, el objetivo del manejo en la fibrilación auricular paroxística es la reducción de los paroxismos y el mantenimiento prolongado del ritmo sinusal, y para ello se deben utilizar drogas antiarrítmicas o un método no farmacológico. En la fibrilación auricular persistente, el objetivo del manejo es la restauración del ritmo sinusal y por ende se debe intentar la cardioversión (farmacológica o eléctrica). En la fibrilación auricular permanente, el objetivo será el control de la frecuencia cardiaca, y por lo tanto se deberán utilizar drogas con este fin. En todos los pacientes con fibrilación auricular es mandatorio utilizar un tratamiento antitrombótico apropiado, en base a los factores de riesgo para accidente cerebrovascular y tromboembolismo. Fibrilación auricular de reciente comienzo Evaluación hemodinámica Estable Inestable Cardioversión Iniciar anticoagulación Evaluar control del ritmo o de la frecuencia Control del ritmo Duración < 48 horas Cardioversión Eléctrica Farmacológica Ibutilide IV Procainamida IV Control de la frecuencia Duración > 48 horas Control de la frecuencia y adecuada anticoagulación (INR 2-3 por tres semanas) Bloqueantes cálcicos Digital βbloqueantes Ecocardiograma transesofágico Coágulos en AI Sin coágulos en AI Fig. 10.- Algoritmo sugerido para el manejo de la fibrilación auricular de reciente comienzo. Control del ritmo cardiaco Las razones para revertir una fibrilación auricular a ritmo sinusal son: 1) evitar las complicaciones relacionadas con la formación de trombos intracavitarios (embolias), 2) preservar al ventrículo izquierdo de altas frecuencias cardíacas y de ciclos irregulares que producen daño miocárdico, 3) evitar el remodelamiento electrofisiológico auricular que tiende a agrandar la cavidad y a perpetuar la arritmia, y 4) preservar la sincronía A-V para que la sístole auricular logre un óptimo llenado ventricular. Se sabe que la prevalencia de trombos intracavitarios en cuadros agudos es muy baja, por lo que en la fibrilación auricular de menos de 48 horas de duración se puede intentar la reversión a ritmo sinusal sin mediar tratamiento anticoagulante previo. Es aconsejable realizar tratamiento anticoagulante con heparina por 48 a 72 horas luego de la cardioversión, para evitar la producción de coágulos durante el periodo de atontamiento auricular post-cardioversión. En la fibrilación auricular que tiene más de 48 horas de evolución, el hallazgo de trombos intracavitarios es más frecuente, lo mismo que el agrandamiento de la cavidad auricular. Si el tamaño auricular no está severamente aumentado, por encima de los 50 a 60 mm, es preferible revertir la arritmia a ritmo sinusal en vez de controlar la frecuencia ventricular. Para esto se debe anticoagular al paciente por tres o cuatro semanas con cumarínicos manteniendo un INR > 2,5 y proceder a la cardioversión, la que puede ser farmacológica o eléctrica, esta última con choque de 200 a 300 Joules sincronizado con la onda R. Posteriormente se debe continuar la anticoagulación por otras tres o cuatro semanas. Una forma más rápida, ya que se evita la anticoagulación previa, es utilizando ecocardiografía transesofágica previo a revertir fibrilaciones auriculares crónicas. Si se descarta la presencia de trombos intracavitarios con esta técnica, se puede intentar la cardioversión sin tratamiento anticoagulante previo, pero debe tratarse al paciente con anticoagulantes durante las tres o cuatro semanas posteriores. Cuanto mayor es la cronicidad de la arritmia y mayor es el tamaño auricular, menores serán las probabilidades de lograr instaurar nuevamente el ritmo sinusal. Así, en las fibrilaciones auriculares de más de un año sólo el 50% de los pacientes mantiene el ritmo sinusal a los seis meses post reversión; en cambio en las fibrilaciones auriculares de menos de tres meses de evolución, más del 80% permanece en ritmo sinusal a los seis meses. Para revertir una fibrilación auricular a ritmo sinusal se han ensayado numerosos esquemas farmacológicos. En el Centro de uno de los autores (A.del R.) se tiene gran experiencia con el uso de quinidina por vía oral. En general se utiliza primeramente digital o verapamilo intravenoso para contrarrestar el efecto vagolítico que puede presentar la quinidina sobre el nódulo aurículo-ventricular; a continuación se administran 400 mg de quinidina por vía oral. Al cabo de dos horas, si no se consiguió la reversión se administra una nueva dosis de 400 mg y al cumplirse dos horas más de no haber reversión otros 400 mg. La dosis máxima de quinidina que se utiliza es de 1.200 mg. Otra opción interesante es la propafenona por vía oral. Se utilizan 600 mg en una sola toma. Otros esquemas contemplan el uso de flecainida por vía oral o endovenosa, propafenona endovenosa, amiodarona endovenosa o por vía oral. La ibutilida, droga antiarrítmica de clase III, logra la reversión en el 60% de los casos en los primeros 20 minutos y es muy útil también para revertir aleteos auriculares. Su principal efecto colateral es la producción de torsión de punta asociada a prolongación del intervalo QT, sobre todo en pacientes con cardiopatía. En la Argentina es común el empleo de la amiodarona por vía endovenosa para lograr la reversión a ritmo sinusal. Esta droga logra la reversión en un 65% en las primeras seis horas, el tiempo que tarda en revertir es mayor que con otros esquemas y es frecuente la producción de flebitis. Se debe tener en cuenta que en las series publicadas el índice de reversión en los grupos tratados con placebo fue del 50 al 60% en las primeras seis horas. Por tales motivos la amiodarona no es recomendable como droga de primera elección. El esquema de posología de la amiodarona incluye la administración de 150 mg de la droga intravenosa en 10 minutos, seguida por una infusión de 1 mg/min durante seis horas, y luego 0,5 mg/min como infusión de mantenimiento durante 18 horas. Se pueden utilizar infusiones suplementarias de 150 mg cada 10 minutos para arritmias recurrentes o resistentes, hasta una dosis máxima recomendada por los productores de 2,2 gramos por día. Los efectos adversos mayores de la amiodarona son la hipotensión y la bradicardia, que se pueden prevenir disminuyendo la velocidad de infusión. Recientemente se han descrito un número creciente de pacientes con toxicidad pulmonar aguda por amiodarona, por lo que se recomienda no exceder una duración de terapéutica de 24 a 48 horas, excepto que sea absolutamente necesario. La conversión de la fibrilación auricular de reciente comienzo a ritmo sinusal con ibutilide (1 mg IV, en el caso de persistencia de la arritmia y peso corporal mayor de 70 kg se puede administrar una dosis adicional de 1 mg luego de 30 minutos) varía entre el 50 y el 70%, y la droga puede tener éxito aun en pacientes que no han respondido a la administración de amiodarona. Posterior a la cardioversión, si la fibrilación auricular era crónica o recurrente conviene iniciar tratamiento antiarrítmico con el objeto de prevenir las recurrencias. Las drogas de clase IA, 1C o 3 son la de mayor utilidad para mantener el ritmo sinusal post reversión. En un metaanálisis de seis trabajos con quinidina, Coplen y cols. demostraron que la quinidina es una droga eficaz para mantener el ritmo sinusal pero triplica la mortalidad. Un subestudio del SPAF sugiere que los pacientes con fibrilación auricular e insuficiencia cardíaca tratados con drogas antiarrítmicas tienen mayor mortalidad que los no tratados. Control de la frecuencia cardiaca Aproximadamente un 40 a 50% de los pacientes quedarán con fibrilación auricular por cardioversiones no exitosas, recurrencias, abandono de tratamiento, etc. Si se opta por dejar fibrilado al paciente se debe controlar la frecuencia ventricular e iniciar anticoagulación crónica. Se obtienen buenos resultados combinando la digital con calcio antagonistas o con β bloqueantes. Los βbloqueantes y los calcio antagonistas solos también logran un buen control de la frecuencia cardíaca. La digital como fármaco único tiene el inconveniente de que no controla adecuadamente la frecuencia cardíaca durante el ejercicio y en estados hiperadrenérgicos, tales como la tiroxicosis, fiebre, pérdida aguda de volumen y el posoperatorio. Esta droga es de primera elección en el paciente con miocardiopatía dilatada e insuficiencia cardíaca. Cuando se requiere un control farmacológico rápido de la frecuencia cardiaca, el tratamiento intravenoso indicado incluye βbloqueantes (esmolol o metoprolol) o antagonistas cálcicos (verapamilo). La amiodarona intravenosa (300 mg en bolo seguida por 45 mg/h durante 24 hs) también es una alternativa útil, en particular en pacientes con compromiso hemodinámico severo. En la Tabla 3, modificada de Li y col., se indican las drogas que pueden ser utilizadas por vía intravenosa para controlar la frecuencia cardiaca en la fibrilación auricular. Tabla 3. Drogas intravenosas comunmente utilizadas para controlar la frecuencia cardiaca en la fibrilación auricular. Nombre Diltiazem Verapamil Metoprolol Propranolol Esmolol Digoxina Amiodarona Dosis de carga 15-20 mg en 2 minutos, 20 mg 15 minutos después de la dosis inicial si la respuesta es inadecuada 5-10 mg en 2 minutos, 10 mg 30 minutos después de la dosis inicial si la respuesta es inadecuada 5-10 mg en 2 minutos 1 mg en 2 minutos, repetir 1 mg a intervalos de 5 minutos, hasta una dosis total de 5 mg 500 µg/kg en 1 minuto 0,5 mg-0,25 mg cada 6 horas por 2 dosis 300 mg en bolo Dosis de mantenimiento 10-15 mg/hora en infusión Debe ser individualizada Debe ser individualizada 1-3 mg cada 4 horas 50-300 µg/kg/min 0,125-0,250 mg/24 horas 45 mg/hora por 24 horas Una pregunta frecuente ante pacientes con fibrilación auricular en terapia intensiva es si conviene revertir la arritmia o controlar la frecuencia cardiaca. Hasta hace unos años, la cardioversión a ritmo sinusal fue el objetivo de tratamiento en estos pacientes. Sin embargo, dos estudios recientes, el AFFIRM y el RACE (Van Gelder y col.), han puesto en dudas esta premisa. En el estudio AFFIRM, se comprobó que el manejo de la fibrilación auricular con la estrategia de control del ritmo no ofrece ventajas en términos de sobrevida sobre el régimen de control de la frecuencia. En el estudio RACE, por su parte, se muestra que el control del ritmo no es superior para la prevención de la muerte y la morbilidad por eventos cardiovascular. Por ende, el control de la frecuencia puede ser una terapéutica apropiada en pacientes con recurrencia de la fibrilación auricular luego de la cardioversión eléctrica. Testa y col., por su parte, realizaron un metaanálisis para evaluar en forma sistemática la relación riesgo/beneficio de la estrategia de control de la frecuencia versus la estrategia de control del ritmo en pacientes con fibrilación auricular de reciente comienzo o recurrente, y comprobaron que la estrategia de control de la frecuencia se asocia con mejor pronóstico, en términos de sobrevida y de accidentes cerebrovasculares. La fibrilación auricular recurrente paroxística es aquella que se instala bruscamente, tiene una duración variable desde minutos a horas y revierte espontaneamente o con el uso de drogas. Los pacientes relatan una historia de algunos o muchos episodios. En estos casos es importante establecer mediante un buen interrogatorio si la fibrilación auricular se instala siempre ante situaciones de alto tono adrenérgico o en situaciones vagotónicas, porque de esto dependerá la terapéutica. En este sentido, las estrategias propuestas son de “no tratamiento farmacológico“ o de “pill in-the-pocket“, es decir, tratamiento exclusivamente ante el evento. Esta última estrategia es útil en pacientes sin historia de disfunción ventricular izquierda o enfermedad valvular o isquémica cardiaca, pero que presenten una historia de episodios sintomáticos infrecuentes, una presión arterial sistólica mayor de 100 mm Hg y una frecuencia cardiaca en reposo mayor de 70 por minuto, y que tienen la capacidad de entender como y cuando tomar la medicación. Prevención del tromboembolismo En numerosos trabajos científicos ha sido evaluado el tratamiento para prevenir el tromboembolismo en los pacientes con fibrilación auricular. Estos pacientes están en mayor riesgo de presentar accidentes cerebrovasculares embólicos. Los pacientes con fibrilación auricular secundaria a patología valvular tienen un riesgo de embolias del 15 al 20% por año, por lo que deben ser anticoagulados con anticoagulantes orales manteniendo un INR entre 2 y 3. Los pacientes con fibrilación auricular en los que se asocia hipertensión arterial, diabetes, insuficiencia cardíaca, edad mayor de 65 años, antecedentes de ACV o AIT previos, tienen una incidencia de embolias de 6 a 8% anual, por lo que deben recibir anticoagulantes orales y mantener un INR entre 2 y 3. Con esta terapia la incidencia de embolias disminuye al 1% por año, que es la misma tasa que presentan individuos sin fibrilación auricular de igual edad. En los mayores de 75 años, la incidencia de sangrados secundarios a la anticoagulación aumenta, por lo que se puede optar por disminuir el nivel de anticoagulación o realizar tratamiento antiagregante con 325 mg diarios de AAS. En la fibrilación auricular que se produce en sujetos con corazón sano, la tasa de embolias es del 2 al 3% por año, por lo que en menores de 65 años está indicada la terapia con 325 mg de AAS diarios. Recientemente se ha propuesto y validado el esquema de estratificación denominado CHADS2 (CHADS2 es un acrónimo para insuficiencia cardiaca congestiva, hipertensión, edad > 75 años, diabetes mellitus, y ACV o TIA previo) (Gage B. y col.). El escore otorga un punto para los primeros cuatro parámetros, y dos puntos para un ACV o TIA previo. Aplicando este escore, se puede predecir que los pacientes con fibrilación auricular presentan un riesgo bajo (1%/año, escore CHADS2 = 0 a 1, alrededor del 50% de los pacientes), moderado (2,5%/año, escore CHADS2 =2, 25% de los pacientes), o alto (>5%/año, escore CHADS2 ≥3, 25%) de presentar un accidente cerebrovascular. Una aparente limitación del CHADS2 son los pacientes con ACV o TIA previo sin otros factores de riesgo, que si bien son raros, presentan un riesgo elevado de presentar ACV en el tiempo próximo (10,8/100 pacientes/año). Para el grupo de bajo riesgo, se recomienda emplear aspirina (81-325 mg/día), para el grupo de riesgo moderado y alto warfarina para mantener un INR entre 2 y 3. En las guías del 2006 del ACC/AHA/ESC para el tratamiento de pacientes con fibrilación auricular, se propone una categoría de riesgo y recomendaciones para la anticoagulación, tal como se indica en la Tabla 4. Tabla 4.- Terapéutica antitrombótica en pacientes con fibrilación auricular Categoría de riesgo Sin factores de riesgo Un factor de riesgo moderado Cualquier factor de riesgo alto o más de un factor de riesgo moderado Factores de riesgo débiles Sexo femenino Edad 65 a 74 años Enfermedad arterial coronaria Tirotoxicosis Terapéutica recomendada Aspirina, 81 a 325 mg día Aspirina, 81 a 325 mg día, o warfarina (INR 2,0 a 3,0) Warfarina (INR 2,0 a 3,0, target 2,5) Factores de riesgo moderado Edad mayor o igual a 75 años Hipertensión Insuficiencia cardiaca Fracción de eyección 35% o menor Diabetes mellitus Factores de riesgo elevado ACV previo, AIT o embolismo Estenosis mitral Válvula cardiaca protésica Aleteo auricular Aleteo auricular tipo I. Se lo reconoce electrocardiográficamente por ondas en serrucho en las derivaciones de cara inferior (DII, DIII y avF). Estan ondas son llamadas F por “flutter”. El intervalo F-F en el aleteo auricular típico es mayor o igual a 200 mseg, es decir que la frecuencia auricular es de 300 latidos por minuto o menor (Fig. 11 A). En general la conducción hacia el ventrículo se hace con un bloqueo A-V 2:1 por lo que es frecuente que se presente con una frecuencia cardíaca de 150 latidos por minuto. Fig. 11A. Parte superior: aleteo auricular tipo I antihorario con conduccion A-V 2-1. Parte inferior: efecto del masaje del seno carotideo. El aleteo auricular tipo I es una arritmia que posee todo su circuito reentrante dentro de la aurícula derecha. Utiliza como zona de conducción lenta el istmo cavo-tricuspídeo, esto permite que el resto de las estructuras auriculares recobren la capacidad para conducir el estímulo y estén aptas para mantener el circuito reentrante. El sentido de la despolarización auricular puede ser antihorario cuando a partir del istmo cavo-tricuspídeo asciende por el septum interauricular, despolariza el techo de la aurícula derecha, baja por la pared lateral para volver a entrar en la zona del piso de la aurícula derecha comprendida entre la vena cava inferior y la válvula tricúspide. Menos frecuentemente el sentido de despolarización del aleteo auricular tipo I es horario, es decir que asciende por la pared lateral, despolariza el techo y desciende por el septum interauricular. Cuando el sentido es horario las ondas F en las derivaciones electrocardiográficas de cara inferior tienen polaridad positiva (Fig. 11 B), en cambio cuando es antihorario las mismas son negativas. Fig. 11B. Aleteo auricular tipo I horario. Se observan las ondas F positivas en cara inferior. Esta arritmia tiene la característica de ser muy estable y sumamente recurrente. En general tiene poca respuesta al tratamiento farmacológico, aunque últimamente se han reportado buenos resultados utilizando ibutilide. La cardioversión eléctrica con baja energía (50 a 100 Joules) logra la reversión a ritmo sinusal en la mayoría de los casos. También puede revertirse utilizando la sobreestimulación auricular con un electrodo endocavitario ubicado en la aurícula derecha o a través de un electrodo intraesofágico. Utilizando la sobreestimulación se obtiene la reversión en un 70% de los casos; en un 20% se puede generar una fibrilación auricular; y en un 10% se debe recurrir a la cardioversión eléctrica. Cuando el aleteo auricular es recurrente la ablación por radiofrecuencia logra buenos resultados. Se reinstala el ritmo sinusal en el 95% de los pacientes, los cuales lo mantienen en el 70 al 80% de los casos al cabo de un año. La técnica consiste en realizar una línea de lesiones por radiofrecuencia que producen un bloqueo a la conducción del estímulo a nivel del istmo cavo tricuspídeo. Este procedimiento aporta una solución definitiva para los aleteos recurrentes y el índice de complicaciones es muy bajo. Aleteo auricular tipo II. Esta arritmia tiene una frecuencia auricular más rápida, con ciclos F-F menores a los 200 mseg. Se la reconoce electrocardiográficamente por la presencia de ondas en serrucho en las que no es posible determinar la polaridad. La conducción hacia el ventrículo en general se hace con un bloqueo 3:1 o mayor o con bloqueo variable, lo que origina ciclos ventriculares irregulares que semejan una fibrilación auricular. Se asocia frecuentemente con agrandamiento auricular y con enfermedad pulmonar obstructiva crónica. Desde el punto de vista terapéutico conviene considerarlo una fibrilación auricular y tratarlo de la misma manera que ésta. En general no es posible lograr la reversión por sobreestimulación. Taquicardias paroxísticas supraventriculares El término “taquicardia supraventricular“ hace referencia a taquiarritmias paroxísticas que requieren de la presencia de tejido nodal atrial o atrioventricular, o ambos, para su iniciación y mantenimiento. La incidencia de taquicardia supraventricular es de alrededor de 35 casos por 100.000 personas por año, y la prevalencia es de alrededor de 2,25 por 1.000, excluyendo la fibrilación auricular, el aleteo auricular y la taquicardia auricular multifocal. Las taquicardias supraventriculares habitualmente son recurrentes y ocasionalmente persistentes. Las taquicardias supraventriculares habitualmente no se asocian con una enfermedad estructural del corazón, aunque existen excepciones (presencia de vías accesorias asociadas con la cardiomiopatía hipertrófica o la anomalía de Ebstein y taquicardias auriculares en pacientes con enfermedades cardiacas congénitas o adquiridas). Las arritmias por reentrada habitualmente son inducidas por un latido ectópico auricular o ventricular, y factores precipitantes tales como la ingesta excesiva de cafeína, alcohol o drogas recreacionales, o hipertiroidismo o estrés, pueden aumentar el riesgo de recurrencia. Dentro de este grupo se incluyen a todas las taquicardias de ciclos regulares con QRS angosto en las que no es posible por la observación del electrocardiograma hacer diagnóstico de aleteo auricular. En estas taquicardias la clave para realizar un correcto diagnóstico reside en visualizar la actividad auricular u onda p’. Si no se visualizan ondas p’ o si estas se ubican inmediatamente antes o después del complejo QRS, el diagnóstico más probable es el de una reentrada nodal A-V común. En el aleteo auricular tipo I, las ondas F pueden estar enmascaradas por el segmento ST-T y no ser muy evidentes; cuando esto ocurre se debe descartar el diagnóstico de aleteo auricular, sobre todo cuando la frecuencia de la taquicardia es cercana a 150 latidos por minuto. Una maniobra útil en estos casos es el masaje del seno carotídeo que a veces logra provocar, en el caso del aleteo auricular, un bloqueo mayor en la conducción de los impulsos auriculares hacia el ventrículo. En este caso, al haber varias ondas F que no conducen hacia el ventrículo se logra visualizarlas sin inconvenientes. Si las ondas p’ se ubican antes de los complejos QRS, de tal manera que el intervalo PR es menor que el RP (PR/RP < 1) existen tres posibilidades diagnósticas: A) taquicardia auricular, B) reentrada nodal A-V no común y C) taquicardia ortodrómica que utiliza una vía accesoria con propiedades decrementales o taquicardia de Courmel. Por último, si las ondas p’ se ubican por detrás de los complejos QRS a más de 80 mseg, de tal manera que el intervalo PR es mayor que el RP (PR/RP > 1) las probabilidades diagnósticas están a favor de las taquicardias ortodrómicas, que son las que utilizan una vía accesoria aurículo-ventricular como brazo retrógrado del circuito reentrante. Reentrada nodal A-V común o taquicardia A-V nodal recíproca (AVNRT) Esta es la más común de las taquicardias paroxísticas supraventriculares. Ocurre más frecuentemente en mujeres que en hombres y generalmente se presenta en mayores de 30 años. El sustrato fisiopatológico para esta taquicardia es la disociación longitudinal del nódulo aurículo-ventricular. En estas circunstancias, la activación auricular (ondas P´) y la ventricular (ondas R), ocurren simultáneamente. Por esta razón a esta taquicardia se la denomina también lenta-rápida ya que los estímulos descienden hasta el ventrículo por una vía lenta y ascienden hacia la aurícula a través de una vía rápida. En el electrocardiograma característicamente no se evidencian las ondas P´ (Fig. 12). Esta arritmia puede ocurrir en situaciones de alto tono adrenérgico pero también puede ocurrir en reposo. Habitualmente la desencadenan las extrasístoles auriculares. Para el tratamiento de la crisis de taquicardia la droga de primera elección es la adenosina en dosis de 6 a 12 mg EV en bolo. Esta logra un bloqueo A-V transitorio de alto grado de segundos de duración y revierte la taquicardia a ritmo sinusal en más del 90% de las casos (Fig. 13). Fig. 12.- Taquicardia por reentrada nodal A-V común. Fig. 13.- Reversión de una taquicardia por reentrada nodal A-V con adenosina. El registro de las ondas P se logró utilizando un electrodo intraesofágico. Otras drogas que pueden ser utilizadas son el verapamilo en dosis de 5 mg EV en dos a tres minutos, el diltiazem EV, o βbloqueantes EV como el atenolol, propanolol o esmolol. Conviene siempre intentar realizar maniobras vagales, tales como el masaje del seno carotídeo, previo al tratamiento farmacológico o inmediatamente después en caso de no revertir la arritmia. La maniobra vagal actúa enlenteciendo la conducción por las vías nodales pudiendo revertir la taquicardia.Existen dos tipos de tratamientos para evitar las recurrencias: el farmacológico y el no farmacológico. Con el primero se trata de actuar sobre los períodos refractarios del nódulo AV. Drogas como los βbloqueantes o los antagonistas del calcio pueden ser eficaces en reducir el número y la duración de los episodios. También se puede actuar con drogas que eliminen las extrasístoles auriculares como la flecainida o la propafenona que también tienen acción sobre el nódulo A-V. Cuando estas taquicardias recurren a pesar de la medicación, cuando son muy sintomáticas o cuando simplemente se quiere curar definitivamente la arritmia y evitar que el paciente tome drogas antiarrítmicas durante años se puede recurrir al tratamiento no farmacológico o ablación por radiofrecuencia de la vía lenta nodal A-V, también llamado “modificación del nódulo A-V”. Consiste en bloquear la conducción a través de la vía lenta utilizando calor (60 a 70ºC aplicados durante 1 minuto) liberado por un catéter emisor de ondas de radiofrecuencia. Este tratamiento logra la curación en el 95 al 100% de los pacientes con una muy baja tasa de complicaciones (Fig. 14 A y B). La complicación más temida es la producción de un bloqueo a nivel del nódulo A-V. Figura 14 A.- Ablación por radiofrecuencia de la reentrada nodal A-V. Inducción durante el estudio electrofisiológico de una reentrada nodal A-V común. Se observa el clásico “salto de vía” posterior al extraestímulo S2: El intervalo A-H se prolonga y se inicia la taquicardia. (De arriba hacia abajo: derivaciones de superficie D1, D2 y V1, electrograma del His y electrogramas del seno coronario proximal, medio y distal) A: activación auricular, H: activación del His, V: activación ventricular. Fig. 14 B.- Emisión de radiofrecuencia en la zona de la vía lenta nodal. Obsérvese como al comenzar la aplicación se inicia un ritmo hisiano con retroconducción hacia la aurícula. De arriba hacia abajo: derivaciones de superficie D1, D2 y V1; electrograma registrado por el catéter de ablación – RF, electrograma de la aurícula derecha – A y electrograma del haz de His). A: activación auricular, V: activación ventricular y H: activación del His. Taquicardias auriculares Estas taquicardias se originan en el tejido auricular, lo más frecuente es que se encuentren en relación a la crista terminalis de la aurícula derecha o a nivel de las venas pulmonares en la aurícula izquierda. Con respecto a su mecanismo de producción, pueden ser reentrantes, automáticas o generadas por actividad gatillada. Las taquicardias auriculares automáticas tienen clásicamente fenómeno de calentamiento y de enfriamiento, es decir que la frecuencia de la taquicardia se acelera y desacelera. Muchas veces se asocian a problemas metabólicos y es común encontrarlas relacionadas a la enfermedad pulmonar obstructiva crónica. Las reentrantes pueden ser paroxísticas o permanentes. Estas últimas pueden producir taquicardiomiopatías. Electrocardiográficamente se las distingue por poseer relación P’-R menor que el R-P’ (Fig. 15). El masaje del seno carotídeo puede revertirlas o bien ocasionar un bloqueo A-V de segundo grado o mayor que deja visibles varias ondas P’ que no conducen al ventrículo. Fig. 15.- Taquicardia auricular. El tratamiento puede ser farmacológico con drogas βbloqueantes, fármacos del grupo IC como la flecainida o la propafenona, o del grupo III como la amiodarona o el sotalol. El tratamiento no farmacológico utilizando calor liberado por un catéter emisor de radiofrecuencia logra la curación de estas taquicardias en un alto porcentaje. Taquicardias por reentrada nodal A-V no común Al igual que la reentrada nodal A-V común, el sustrato fisiopatológico de esta arritmia es la disociación longitudinal del nódulo aurículo ventricular. La diferencia está en el sentido de la reentrada. Mientras la reentrada nodal no común es lenta-rápida, esta es rápida-lenta. Es decir que durante la taquicardia los impulsos auriculares bajan al ventrículo por una vía nodal rápida y suben nuevamente a las aurículas por una vía lenta. Electrocardiográficamente la taquicardia tiene un intervalo P’-R menor que el R-P’. La terapéutica es similar que para la reentrada nodal A-V común ya que el sustrato es el mismo. Taquicardias relacionadas a vías accesorias con propiedades decrementales Estas taquicardias están relacionadas a haces anómalos atrio-ventriculares que tienen propiedades decrementales. Son estructuras similares al nódulo aurículo ventricular capaces de conducir el impulso en forma retrógrada (desde el ventrículo hacia la aurícula con cierto decremento). La localización más habitual es cercana al ostium del seno coronario. Típicamente estas taquicardias tienen una relación P-R menor que el R-P y ondas P’ negativas en derivaciones de cara inferior, también son llamadas taquicardias reciprocantes unionales permanentes (Fig. 16). Otra característica distintiva es que son incesantes, es decir que el paciente entra y sale constantemente de ritmo sinusal, esta característica hace que pueda desarrollar taquicardiomiopatías. El tratamiento de elección es la ablación por radiofrecuencia del haz anómalo. El tratamiento farmacológico es poco efectivo. Fig. 16.- Taquicardia de Coumel, mediada por haz anómalo con conducción decremental. Taquicardias reentrantes aurículo-ventriculares ortodrómicas Son taquicardias que utilizan un haz accesorio aurículo-ventricular o haz de Kent como brazo retrógrado del circuito reentrante. Dicho circuito está integrado cronológicamente por las aurículas, el nódulo aurículo-ventricular, el sistema His-Purkinje, los ventrículos y la vía accesoria. A través de la vía accesoria el estímulo es conducido nuevamente desde los ventrículos hasta las aurículas repitiéndose el circuito. Estas taquicardias constituyen el 40% del total de las taquicardias regulares con QRS angosto. Junto a la reentrada nodal A-V común constituyen el 90% de las taquicardias regulares con QRS angosto. En general se presentan en gente joven, pueden comenzar en la adolescencia o en la infancia y ocurren con igual proporción en hombres y en mujeres. Electrocardiográficamente estas taquicardias se caracterizan por poseer un intervalo P-R´ mayor que el intervalo R-P´, y el intervalo R-P´ mayor a 80 mseg. La inscripción de la onda P ´por detrás del QRS obedece al tiempo que transcurre desde que se produce la activación ventricular hasta que el estímulo arriba a la vía accesoria, penetra en ella y activa la aurícula (Fig. 17). Fig. 17- Taquicardia reentrante A-V ortodrómica. El tratamiento de la crisis aguda se puede realizar con adenosina en dosis de 6 a 12 mg EV en bolo (Fig. 18), verapamilo EV 5 mg en dos a tres minutos, atenolol EV 5 mg en tres minutos, diltiazem EV o esmolol EV. Pueden ser de gran utilidad las maniobras vagales como el masaje del seno carotídeo, que actúan enlenteciendo la conducción a nivel del nódulo aurículoventricular, ya que pueden revertir las crisis hasta en el 50% de los casos. Fig. 18.- Reversión de una taquicardia A-V ortodrómica utilizando adenosina. Al igual que en las otras taquicardias el tratamiento crónico puede ser farmacológico o no farmacológico. Las drogas indicadas para el tratamiento de estas arritmias son los β bloqueantes o los calcio antagonistas (atenolol en dosis de 25 a 50 mg c/12 hs o diltiazem 60 mg cada ocho horas). Para casos refractarios se puede utilizar propafenona o flecainida que tienen acción sobre la vía accesoria y sobre el nódulo aurículo-ventricular. El tratamiento no farmacológico o “ablación por radiofrecuencia” del haz accesorio es altamente efectivo para lograr la curación. Síndromes de preexcitación Ocurre preexcitación ventricular cuando un estímulo auricular sinusal despolariza el ventrículo antes de lo que ocurriría si descendiera por las vías de conducción normales. Las vías accesorias auriculo-ventriculares o haces de Kent son los principales responsables de los cuadros de preexcitación ventricular. Una pequeña proporción de casos ocurre por haces tipo Mahaim, atrio-fasciculares o nodo-ventriculares. En este síndrome, la activación ventricular depende de dos frentes de onda originados en la vía accesoria y en el sistema de conducción normal; esto genera un latido de fusión en el cual el grado de preexcitación depende de la contribución relativa de cada uno de los frentes de activación. Los síndromes de preexcitación pueden asociarse a miocardiopatía hipertrófica, prolapso de válvula mitral o enfermedad de Ebstein. La asociación con bloqueo A-V congénito es sumamente infrecuente. Electrocardiográficamente estos síndromes se caracterizan por presentar P-R corto, onda delta y alteraciones en la repolarización ventricular (patente de Wolff-Parkinson-White) (Fig. 19). Los pacientes con síndrome de Wolff Parkinson White pueden presentar taquicardias ortodrómicas (la vía accesoria actúa conduciendo el estímulo de ventrículos a aurículas) o taquicardias preexcitadas. En general son taquicardias muy rápidas con QRS ancho que pueden descompensar hemodinámicamente al paciente, siendo dificultoso el diagnóstico diferencial con la taquicardia ventricular. La más peligrosa de estas arritmias es la fibrilación auricular preexcitada (Fig. 20), que se presenta frecuentemente en los pacientes con WPW. En estos casos, si la vía anómala posee período refractario corto (<220 mseg) puede ser causa de muerte súbita. Hasta en el 20% de los pacientes con Wolff Parkinson White la fibrilación auricular preexcitada puede ser la presentación inicial de la enfermedad. Fig. 19. Síndrome de Wolff Parkinson White. Paciente con crisis frecuentes de palpitaciones paroxísticas. Fig. 20.- Fibrilación auricular preexcitada. El verapamilo y la digoxina están contraindicados en pacientes con síndrome de WolffParkinson-White, excepto que la vía accesoria tenga un periodo refractario largo (mayor de 300 mseg), debido a que estas drogas pueden aumentar el riesgo de respuesta ventricular rápida, causando una fibrilación ventricular en pacientes con fibrilación auricular. Aunque la ablación con catéter es considerado el tratamiento de elección para estos pacientes, tanto la flecainida como la propafenona son efectivas y han sido aprobadas recientemente para la prevención de las taquicardias paroxísticas supraventriculares mediadas por una vía accesoria, con o sin conducción anterógrada. El tratamiento de elección en los casos de fibrilación auricular preexcitada es la cardioversión eléctrica. Lo mismo conviene realizar en el resto de las taquicardias preexcitadas, ya que la administración de fármacos que depriman la conducción por el nódulo A-V puede aumentar la frecuencia ventricular de la arritmia. Fig. 21. Curación del síndrome de preexcitación mediante ablación por radiofrecuencia. De arriba hacia abajo: derivaciones de superficie D1, D2 y V1, electrogramas endocavitarios de His, seno coronario proximal, medio, distal y catéter de ablación. A los 4 latidos de comenzar la aplicación de radiofrecuencia se observa desaparición de la preexcitación, señal que la conducción por la vía accesoria desaparece. Electrodos de dispersión Generador de corriente de alta frecuencia Catéter ablativo Fig. 22.- Sistema de ablación por radiofrecuencia. En los pacientes portadores de síndrome de Wolff-Parkinson-White que han padecido una taquicardia preexcitada es de primera elección la realización de una ablación por radiofrecuencia del haz accesorio con el objeto de curar definitivamente el trastorno (Fig. 21 y 22). Para los pacientes de bajo riesgo pueden indicarse βbloqueantes o calcio antagonistas para reducir el número de episodios. Para los de alto riesgo o para pacientes que no responden a la medicación, deportistas competitivos, profesiones de riesgo (trabajo en las alturas, etc) o que pueden poner en riesgo la vida de terceros (pilotos de aviones, choferes de autos o colectivos, etc.) se recomienda la ablación por radiofrecuencia del haz anómalo. Diagnóstico diferencial de las taquicardias con complejo QRS angosto Si el complejo ventricular (QRS) es angosto (menor de 120 mseg), la taquicardia será casi siempre supraventricular y el diagnóstico diferencial estará relacionado con su mecanismo (Fig. 23). Taquicardia con QRS angosto (Duración del QRS menos de 120 mseg) Taquicardia regular? Si No No Ondas P visibles? Fibrilación auricular Taquicardia auricular Aleteo con conducción AV variable Taquicardia auricular multifocal Si Frecuencia auricular mayor que frecuencia ventricular? Si No Aleteo auricular o taquicardia auricular Analizar intervalo RP Corto RP más corto que PR RP más corto de 70 mseg AVNRT RP más largo de 70 mseg Largo RP más largo que PR Taquicardia auricular PJRT AVNRT atípica AVRT AVNRT Taquicardia auricular AVNRT: taquicardia auriculoventricular nodal recíproca; AVRT: taquicardia auriculoventricular recíproca; PJRT: forma permanente de una taquicardia recíproca de la unión Fig. 23.- Diagnóstico diferencial de la taquicardia con QRS angosto. Si no se reconocen ondas P o evidencia de actividad auricular, y el intervalo RR es regular, el mecanismo más frecuente será la taquicardia aauriculoventricular nodal recíproca (AVNRT). La actividad de la onda P en la AVNRT puede estar parcialmente oculta dentro del complejo QRS y puede deformarlo para generar una pseudo-R en V1 y/o una pseudo-S en las derivaciones inferiores. Si se observa una onda P en el segmento ST y está separada del QRS por 70 mseg, el diagnóstico más probable es taquicardia atrioventricular recíproca (AVRT). Si la taquicardia es con RP mayor que el PR, el diagnóstico más probable es AVNRT atípica, forma permanente de una taquicardia recíproca de la unión, o una taquicardia auricular. La respuesta de las taquicardias con QRS angosto a la adenosina o al masaje carotideo puede ayudar en el diagnóstico diferencial. Es conveniente realizar un ECG de 12 canales durante la administración de adenosina o el masaje carotideo. Si no se observan ondas P, se puede utilizar un electrodo esofágico. Tratamiento de las taquiarritmias supraventriculares En la Tabla 5 se indican los agentes farmacológicos utilizados para el tratamiento agudo de las taquicardias supraventriculares, mientras que en la Tabla 6 se describen los agentes utilizados para el tratamiento profiláctico de las mismas. Tabla 5.- Agentes farmacológicos para el tratamiento de corto tiempo de las taquicardias supraventriculares (TSV). Droga Dosis intravenosa usual Efectos colaterales mayores Taquicardia regular con complejo QRS angosto Agentes de primera línea Adenosina 6 mg en bolo, si no hay Enrojecimiento facial, dorespuesta en 1 a 2 min., lor precordial e hipotenadministrar 12 mg en bolo sión, posible asistolia de pocos segundos Broncoespasmo, fibrilación auricular (en pacientes con WPW posible fibrilación ventricular) Verapamilo 5 mg cada 3 a 5 min, hasta Hipotensión, bloqueo un máximo de 15 mg cardiaco, efecto inótropo negativo Agentes alternativos Diltiazem 0,25 mg/kg en dos mi- Hipotensión, bloqueo nutos. Si no hay respuesta cardiaco, efecto inótropo dosis adicional de 0,35 negativo mg/kg. Infusión de mantenimiento de 5-15 mg/h Metoprolol 5 mg en 2 min; hasta 3 Hipotensión, bloqueo dosis en 15 min cardiaco, bradicardia, broncoespasmo Esmolol bloqueo 250-500 µg/kg en 1 min., Hipotensión, bradicardia, seguido por infusión de 50- cardiaco, broncoespasmo 200 µg/kg/min Propranolol 0,15 mg/kg en 2 min Hipotensión, bloqueo cardiaco, bradicardia, broncoespasmo TSV y FA con preexitación y TSF refractaria a otras drogas Procainamida 30 mg/min en infusión Hipotensión, complejos continua hasta una dosis QRS anchos, torsades de máxima de 17/mg/kg pointes (dosis de mantenimiento de 2-4 mg/min) Flecainida 2 mg/kg en 10 min Efecto inotrópico negativo, aleteo auricular rápido, QRS ancho Propafenona 2 mg/kg en 10 min Ibutilide 1 mg en 10 min, repetir si Prolongación intervalo QT, no hay respuesta una vez torsades de pointes Precauciones, contraindicaciones Contraindicada en pacientes con trasplante cardiaco debido al riesgo de asistolia prolongada. Empleo cauteloso en pacientes con broncoespasmo No exceder dosis de 1 mg/min, para evitar bradicardia e hipotensión Suspender la infusión si desaparece la arritmia, aparecen complejos QRS anchos o hipotensión Contraindicada en pacientes con hipokalemia Tabla 6.- Agentes farmacológicos para el tratamiento profiláctico de las taquicardias supraventriculares (TSV). Droga Dosis usual de mantenimiento Efectos colaterales Precauciones, contraindicaciones TSV sin preexcitación Metoprolol 50-200 mg día Bisoprolol Atenolol Propranolol Diltiazem 2,5-10 mg día 50-100 mg día 80-240 mg día 180-360 mg día Asma, insuficiencia cardiaca congestiva Idem Idem Idem Verapamilo Digoxina 120-480 mg día 0,125-0,375 mg día Hipotensión, bloqueo cardiaco, bradicardia Idem Idem Idem Hipotension, bloqueo cardiaco, efecto inotropo negativo Interaccion con digoxina Bradicardia, efectos tóxicos de la digital TSV con preexcitación y TSV refractarias a drogas anteriores Flecainida 100-300 mg día Propafenona 450-900 mg día Amiodarona 200 mg día Sotalol 160-320 mg día Evaluar niveles séricos Taquicardia ventricular, aumento conducción AV, efecto inótropo negativo, interacción con digoxina Acumulacion de droga en pacientes con deficiencia de citocromo P-450 Decoloración de la piel, trastornos tiroides, efecto hepatotóxico, depósitos corneanos, toxicidad pulmonar Hipotensión, bloqueo Asma, insuficiencia cardiaco, bradicardia, cardiaca congestiva, torsades de pointes ancianos con insuficiencia renal TAQUICARDIAS CON QRS ANCHO Introducción Una taquicardia tiene QRS ancho cuando los complejos QRS duran 120 mseg. o más. Este ensanchamiento puede corresponder a tres causas: a) conducción intraventricular aberrante de latidos supraventriculares -taquicardias con bloqueo de rama-; b) taquicardia ventricular (TV); o c) taquicardia supraventricular con conducción por una vía accesoria. a. Taquicardia supraventricular con bloqueo de rama. El bloqueo de rama puede ser preexistente o puede ocurrir sólo durante la taquicardia cuando una de las ramas es refractaria debido a la frecuencia rápida. Muchos bloqueos de rama no sólo están relacionados con la frecuencia sino también con la secuencia de iniciación. El bloqueo de rama puede ocurrir con cualquier arritmia supraventricular. Si se produce un bloqueo de rama relacionado con la frecuencia durante una taquicardia auriculoventricular recíproca ortodrómica, la frecuencia de la taquicardia puede disminuir si el bloqueo de rama es ipsilateral a la localización del haz anómalo. b. Taquicardia supraventricular con conducción auriculoventricular por una vía accesoria. La taquicardia supraventricular con conducción AV por una vía accesoria puede producirse durante la taquicardia auricular, el aleteo auricular, la fibrilación auricular, la taquicardia auriculoventricular recíproca ortodrómica o la taquicardia atrioventricular nodal recíproca. c. Taquicardia ventricular. Varios criterios ECG se han descripto para diferenciar el mecanismo de base de una taquicardia con complejo QRS ancho, incluyendo la presencia de una disociación aurículo-ventricular con frecuencia rápida, el ancho del complejo QRS (>140 mseg), y la configuración del QRS durante la taquicardia. Todos estos criterios, sin embargo, son poco específicos para definir el origen de la taquiarritmia. La primera aproximación para el diagnóstico diferencial entre estas distintas posibilidades debe ser clínica. Así, frente a una taquicardia con QRS ancho en un niño se debe consider que se trata de una TV hasta que se demuestre lo contrario. En los adultos, aproximadamente el 80% de las taquicardias con QRS ancho tienen origen ventricular, especialmente si existe el antecedente de infarto de miocardio, independientemente de su antigüedad. El tratar de establecer el tipo de arritmia en función de la repercusión clínica frente a una taquicardia con QRS ancho puede inducir a errores ya que, si bien se considera que una arritmia bien tolerada probablemente tiene origen supraventricular, también esto se observa en muchas TV. No es excepcional que la administración de verapamilo o diltiazem por vía endovenosa provoque un severo deterioro hemodinámico como consecuencia de este error. No debe olvidarse que la presencia de ondas a “en cañón“ en el pulso venoso yugular indica la existencia de una disociación A-V, resultando éste un elemento de fácil observación. Desde el punto de vista electrocardiográfico, el diagnóstico diferencial entre ectopía ventricular y preexcitación resulta sumamente difícil, a menos que se conozca previamente la existencia de un síndrome de Wolff-Parkinson-White. En cambio, existen criterios que ayudan a distinguir entre TV y taquicardia supraventricular con conducción aberrante. Para ello, y siempre que el estado hemodinámico del paciente lo permita, es conveniente obtener un registro completo de 12 derivaciones con una adecuada calidad. Por otra parte, en la era actual de las ablaciones por radiofrecuencia, la documentación de la morfología de la taquicardia constituye una valiosa ayuda para un mapeo ulterior. Criterios electrocardiográficos para el diagnóstico de TV Se han elaborado diferentes aproximaciones para establecer el diagnóstico diferencial entre ectopía o TV, y aberrancia. Resulta de utilidad el algoritmo propuesto por Brugada y col., que plantea interrogantes cuya respuesta afirmativa permite establecer con elevada sensibilidad y especificidad el diagnóstico de ectopía (Tabla 7). Los autores han encontrado de utilidad dicho algoritmo particularmente en pacientes que reciben fármacos que aumentan la duración del complejo QRS (flecainida o propafenona). Tabla 7. Algoritmo de Brugada para el diagnóstico diferencial de las taquicardias con QRS ancho. 1. Hay ausencia de complejos R-S en todas las derivaciones precordiales? 2. La duración desde el comienzo de R hasta el nadir de S mide más de 100 mseg? 3. Hay disociación A-V? 4. Existen criterios morfológicos para ectopía. En la Fig. 24 se describe el algoritmo propuesto por las Guías del ACC/AHA/ESC para el manejo de pacientes con arritmias supraventriculares. Además de los criterios propuestos en diferentes algoritmos, hay otros elementos que ayudan a establecer el diagnóstico. Así, frente a un bloqueo de rama preexistente, la imagen de bloqueo de rama homolateral durante la taquicardia apoya fuertemente el diagnóstico de aberrancia (Fig. 25 y 26). Taquicardia con complejos QRS anchos (duración del QRS >120 mseg) Regular o irregular? Regular Irregular El QRS es idéntico que durante el ritmo sinusal? Si es sí; considerar: TSV con BR Taquicardia recíproca aurículo-ventricular Maniobra vagal o adenosina Fibrilación auricular Aleteo/taquicardia auricular con conducción variable y: BR o conducción anterógrada por una vía anómala Infarto de miocardio previo o enfermedad cardiaca estructural? Si es sí: posible taquicardia ventricular Relación AV 1 a 1? Si o desconocido No Ritmo ventricular mayor que ritmo auricular Morfología QRS en precordiales BCRD o BCRI típico TSV Derivaciones precordiales . Concordante . No patente R/S . Comienzo de R al nadir mayor de 100 ms TV Ritmo auricular mayor que ritmo ventricular TV Taquicardia auricular Aleteo auricular Patente BCRD . qR, Rs o Rr1 en V1 . Rango del eje en el plano frontal entre + 90° a - 90° TV Patente BCRI . R en V1 más 30 mseg . R al nadir de S en V1 > 60 mseg . qR o qS en V6 TV TSV: taquicardia supraventricular; BR: bloqueo de rama; TV: taquicardia ventricular; BCRD: bloqueo completo de rama derecha; BCRI: bloqueo completo de rama izquierda Fig. 24.- Diagnóstico diferencial de la taquicardia con complejos QRS anchos (mayores de 120 mseg). Fig. 25: Taquicardia con QRS ancho e imagen de bloqueo de rama derecha en un paciente de 20 años sin cardiopatía estructural. Fig. 26: El trazado corresponde al paciente de la figura 30/24. En ritmo sinusal, se observa una configuración del QRS prácticamente idéntica a la observada durante la taquicardia, que en el estudio electrofisiológico resultó ser una reentrada A-V por participación de una vía accesoria oculta. La morfología del complejo QRS presenta características específicas de ectopía o aberrancia. Cuando las deflexiones son predominantemente positivas en la derivación V1 (imagen de bloqueo de rama derecha), un complejo monofásico o bifásico sugiere TV. Igualmente, un patrón concordante positivo en las derivaciones precordiales (complejos predominantemente positivos desde V1 hasta V6) es altamente indicativo de ectopía (figura 27). Fig. 27: Taquicardia ventricular con imagen de bloqueo de rama derecha. Se observan la onda R monofásica en V1, el patrón concordante positivo y la ausencia de R/S en las derivaciones precordiales, característico de ectopía. Frente a una taquicardia con imagen de bloqueo de rama izquierda (complejos predominantemente negativos en la derivación V1), la presencia de una “r“ ancha en V1 o V2 (duración mayor o igual a 30 mseg) y la existencia de una patente qR o qR en V 6 constituyen criterios altamente confiables para el diagnóstico de TV (Fig. 28). Fig. 28.- Taquicardia ventricular con imagen de bloqueo de rama izquierda. La onda R ancha en V1 es altamente sugestiva de ectopía. La disociación A-V constituye un hallazgo sumamente específico de ectopía, ya que sólo puede observarse en otras dos situaciones extremadamente raras: a) taquicardia de la unión con ausencia de retroconducción hacia la aurícula, o b) reentrada mediada por una vía nodofascicular o nodoventricular. Sin embargo, la disociación no es fácil de confirmar en el ECG ya que la gran amplitud de los complejos QRS y la ausencia de un intervalo diastólico suficientemente prolongado impiden la visualización de la onda P en tres de cada cuatro pacientes con TV. En este sentido, pueden ser de valor los registros intraesofágicos, pero debe recordarse que esta técnica ocasiona molestias al paciente, y en lo posible debe evitarse su utilización. Tampoco la ausencia de disociación excluye el diagnóstico de TV ya que en el 50% de los casos de ectopía hay retroconducción 1:1 hacia las aurículas, en particular si la frecuencia de la taquicardia es menor. Estudio electrofisiológico En algunos casos es necesario llegar al estudio electrofisiológico para distinguir entre ectopía y aberrancia. A modo de síntesis, reseñaremos los criterios que confirman el diagnóstico de TV en los registros endocavitarios: 1. Presencia de disociación A-V durante la taquicardia. 2. Inducción de la arritmia mediante estimulación ventricular programada. 3. Intervalo H-V menor al que se observa durante ritmo sinusal, intervalo H-V negativo (activación ventricular precediendo al electrograma del haz de His) (Fig. 29), o ausencia de electrograma del haz de His, cuando debido a la retroconducción rápida desde los ventrículos, la deflexión hisiana queda oscurecida por el electrograma ventricular. Fig. 29: De arriba hacia abajo, se observan las derivaciones de superficie 1, 2 y V1 y los registros de un catéter esofágico (ES) y del haz de His (HBE) proximal y distal. Durante una taquicardia ventricular con imagen de bloqueo derecha y eje superior, se aprecia retroconducción ventrículo-auricular 2 a 1 y el electrograma del haz de His (H) que es precedido por la activación ventricular. Las taquicardias ventriculares Según la configuracion electrocardiografica, existen dos grandes categorias de taquicardias ventriculares: a) taquicardia ventricular monomorfa, y b) taquicardia ventricular polimorfa (Tabla 8) Tabla 8.- Clasificación de las taquicardias ventriculares. TV monomorfa: a) Con cardiopatía: - Reentrada intramiocárdica (enfermedad coronaria, Chagas, displasia del ventrículo derecho) - Reentrada entre ramas. - Misceláneas. b) Sin cardiopatía: - Imagen de bloqueo de rama derecha (sensible al verapamilo). - Imagen de bloqueo de rama izquierda (sensible a la adenosina). TV polimorfa: a) QT normal: - Isquemia, miocardiopatía hipertrófica. b) QT prolongado: -Congénito (“adrenérgico-dependiente“). - Adquirido (“pausa-dependiente“). Es importante observar las 12 derivaciones del ECG antes de ubicar a una arritmia en uno u otro grupo, ya que basta que en una derivación existan cambios en la configuración del QRS para definir a una TV como polimorfa. Sin embargo, no hay acuerdo unánime en cuanto al criterio para establecer la presencia de polimorfismo: algunos consideran que es necesario un cambio mayor de 60º en el eje del QRS entre las diferentes configuraciones, mientras que para otros alcanza con que no todos los complejos QRS sean idénticos. Taquicardia ventricular monomorfa En este grupo cabe considerar dos situaciones, según el paciente tenga o no cardiopatía estructural. a) TV monomorfa con cardiopatía estructural: esta arritmia reconoce diferentes etiologías: infarto de miocardio, displasia del ventrículo derecho, miocardiopatía chagásica, etcétera. En pacientes con enfermedad coronaria no se debe atribuir la TV monomorfa a isquemia ya que, si bien ésta puede constituir un factor modulador, no provee el circuito estable para la ocurrencia de la arritmia. En cambio, la existencia de un infarto previo, independientemente de su antigüedad, constituye un modelo clásico para la reentrada, tanto en condiciones experimentales como en la clínica. La reentrada habitualmente tiene lugar dentro del miocardio ventricular y mediante marcapaseo se ha demostrado la ocurrencia de entrainment (reciclado continuo de la arritmia durante sobreestimulación). Aunque el análisis de este fenómeno excede los objetivos de este capítulo, es conveniente señalar que su presencia ayuda a seleccionar el sitio adecuado para emitir radiofrecuencia cuando se intenta la ablación de estos circuitos. El éxito del tratamiento ablativo de las TV asociadas a enfermedad coronaria llega al 67% en los mejores centros. En la miocardiopatía chagásica las arritmias se originan en el ventrículo izquierdo y, más comúnmente, en la pared inferior próxima al septum interventricular. Habría una localización predominante de estos circuitos en regiones subepicárdicas, lo que ha dado lugar al desarrollo de técnicas de “mapeo epicárdico“ para intentar su ablación mediante radiofrecuencia. Existen algunas TV monomorfas en pacientes con cardiopatía estructural que tienen características patognomónicas. Una de ellas es la TV con imagen de bloqueo de rama derecha y complejos QRS “poco anchos“ que se observa en pacientes con intoxicación digitálica. Esta arritmia tendría un origen probablemente fascicular ya que provendría del tronco de la rama izquierda o de las hemirramas. También es muy característica la TV que se observa en la intoxicación con drogas de clase 1C (particularmente con flecainida), con complejos QRS extremadamente anchos y comportamiento incesante (Fig. 30). Su tratamiento es específico y consiste, además de la suspensión del fármaco, en la administración de bicarbonato o lactato para alcalinizar el pH, lo que produciría una disociación entre la droga y el receptor. Fig. 30.- Taquicardia ventricular con complejos QRS extremadamente anchos en una paciente intoxicada con flecainida. Hay un mecanismo particular de TV que se observa hasta en el 40% de los pacientes con miocardiopatía dilatada, conocida como “reentrada entre ramas“. Estas arritmias son sumamente rápidas ya que el impulso circula por el sistema de conducción especializado. Por el mismo motivo, los complejos QRS tienen una apariencia “aberrante“, más comúnmente con imagen de bloqueo de rama izquierda, como resultado del sentido de progresión de la activación (anterógrado por la rama derecha y, luego de conducción transeptal, retrógrado por la rama izquierda). El circuito puede invertirse en algunas situaciones, dando lugar a complejos con imagen de bloqueo de rama derecha. Es unánime el hallazgo de intervalo HV prolongado durante los registros en ritmo sinusal. Característicamente, en el estudio electrofisiológico la TV por reentrada entre ramas muestra deflexiones hisianas precediendo a cada activación ventricular y la presencia asociada de disociación A-V prácticamente confirma el diagnóstico (Fig. 31). Esta arritmia tiene un tratamiento específico que consiste en la ablación de la rama derecha, lo que permite interrumpir definitivamente el circuito (Fig. 32). Fig. 31.- De arriba hacia abajo, derivaciones de superficie 1, 2 y V1 y electrograma del haz de His (EHH). Se observa una reentrada entre ramas con imagen de bloqueo de rama izquierda, disociación A-V y el electrograma del haz de His que precede a cada complejo ventricular. Fig. 32.- Ablación por radiofrecuencia de la rama derecha en un paciente con TV por reentrada entre ramas. Durante la lesión se observa aleteo auricular con conducción 2 a 1. A los 7 segundos del comienzo de la radiofrecuencia se observa el bloqueo de rama derecha (últimos dos latidos). Las flechas señalan el potencial de la rama derecha (RD) registrado con el par distal del catéter de ablación (reprod. de González Zuelgaray J: Estudios electrofisiológicos y ablación por radiofrecuencia. En Bertolasi CA (ed.): Cardiología 2000. Buenos Aires, Ed. Méd. Panamericana, 1998, con autorización). b) TV monomorfa en corazones estructuralmente sanos: en pacientes sin cardiopatía (más frecuentemente varones) es posible observar TV sostenidas con imagen de bloqueo de rama derecha y eje de hemibloqueo anterior (figura 33). Su tolerancia hemodinámica es excelente y responden a la administración de verapamilo por vía endovenosa. Para prevenir sus recurrencias puede utilizarse el diltiazem por vía oral o, como tratamiento definitivo, la ablación por radiofrecuencia. Fig. 33.- Taquicardia ventricular sensible al verapamilo. Más comúnmente se presenta una TV con imagen de bloqueo de rama izquierda y eje inferior, cuyo origen se encuentra en el tracto de salida del ventrículo derecho. Estas arritmias, típicamente dependientes del tono adrenérgico y que pueden ser abolidas por la adenosina, pueden presentarse en salvas autolimitadas (Fig. 34) o llegan a ser sostenidas. Su tratamiento farmacológico puede intentarse con los beta-bloqueantes y, como curación definitiva, debe recordarse que la ablación por catéter se acompaña de un éxito superior al 90 por ciento. Fig. 34.- Taquicardia incesante monomorfa repetitiva (reprod. de González Zuelgaray J: Estudios electrofisiológicos y ablación por radiofrecuencia. En Bertolasi CA (ed.): Cardiología 2000. Buenos Aires, Ed. Méd. Panamericana, 1998, con autorización). En individuos sin cardiopatía, excepcionalmente se encuentran TV del tracto de salida del ventrículo izquierdo (que presentan imagen de bloqueo de rama derecha y eje inferior. Taquicardia ventricular polimorfa y alteraciones del intervalo QT En primer lugar debe analizarse la duración del intervalo QT durante el ritmo de base. En presencia de QT normal, la isquemia es la causa más común, y su resolución permite la eliminación de la arritmia. También la TV polimorfa es característica de la miocardiopatía hipertrófica. La TV polimorfa asociada a QT prolongado se conoce como torsades de pointes. Debe diferenciarse si la prolongación del intervalo QT es congénita o adquirida. En el primer caso, las arritmias ventriculares son “adrenérgico-dependientes“, por lo que debe evitarse la estimulación simpática y el tratamiento específico consiste en la administración de βbloqueantes. La prolongación congénita del QT puede responder a una trasmisión autosómica recesiva (síndrome de Romano-Ward) o autosómica dominante (síndrome de Lange y Jarvell-Nielsen, menos frecuente y asociado con sordera). Se debe considerar la implantacion de un cardioversor-defibrilador implantable profiláctico en pacientes con síncope a pesar del tratamiento con βbloqueantes y en pacientes con síncope e historia familiar de muerte súbita. Cuando la prolongación del intervalo QT es adquirida, la torsades de pointes es “pausadependiente“, por lo que deben evitarse las bradiarritmias mediante marcapaseo transitorio. En pacientes con formas agudas de la arritmia se deben retirar las drogas que puedan condicionarla y corregir las anormalidades electrolíticas. Resulta muy efectiva la administración de sulfato de magnesio por vía endovenosa. En la Tabla 9 se enumeran las causas asociadas con torsades de pointes adquirida. Tabla 9.- Causas de intervalo QT prolongado adquirido. A. Fármacos - Antiarrítmicos . Clase 1 A: disopiramida, procainamida, quinidina . Clase 3: sotalol, amiodarona, N-acetilprocainamida, dofetilida, bretilio. - Antibióticos: eritromicina, trimetoprima-sulfametoxazol, pentamidina. - Hipolipemiantes: probucol. - Intoxicación por insecticidas organofosforados. - Agentes promotilidad (cisaprida). - Antimicóticos (ketoconazol, fluconazol). - Hipoglucemiantes orales (glibenclamida). - Antihistamínicos (terfenadina, astemizol). - Antidepresivos tricíclicos (amitriptilina). - Antipsicóticos (haloperidol) B. Trastornos electrolíticos - Hipopotasemia - Hipomagnesemia - Hipocalcemia C. Bradiarritmias - Bradicardia sinusal - Bloqueo A-V completo - Pausas post-extrasistólicas D. Alteraciones neurológicas - Hemorragia subdural, subaracnoidea, intracerebral - Encefalitis E. Alteraciones endocrinas - Hiperparatiroidismo - Hipotiroidismo - Feocromocitoma F. Nutricionales - Anorexia nerviosa - Desnutrición - Dietas proteicas líquidas - Alcoholismo MANEJO AGUDO DE LOS PACIENTES CON TAQUICARDIA En la Fig. 35 se muestra un algoritmo para el manejo agudo de los pacientes con taquicardia regular que están hemodinámicamente estables. Taquicardia regular en paciente hemodinámicamente estable QRS estrecho QRS ancho TSV + BR TSV TSF definitiva TV de origen desconocido TSV preexcitada Procainamida IV Sotalol IV Lidocaina IV Amiodarona IV Maniobras vagales Adenosina IV Verapamilo/diltiazem IV Beta bloqueantes IV Terminación Si Terminación No, persistencia de la taquicardia con bloqueo AV Si No Cardioversión Ibutilide IV Procainamida IV Flecainida IV + agentes bloqueantes del nódulo AV o Marcapaseo de sobrestimulación/cardioversión, y/o control de la frecuencia Fig. 35.- Manejo agudo de los pacientes con taquicardia regular hemodinámicamente estables. BIBLIOGRAFÍA ACC/AHA Task Force Report. Guidelines for clinical intracardiac electrophysiological and catheter ablation procedures. Circulation 92: 673-1995 ACC/AHA Task Force Report. Guidelines for implantation of cardiac pacemaker and antiarrhythmia devices. Circulation 97:1325-1998 ACC/AHA/ESC Guidelines for the management of patients with supraventricular arrhythmias. Circulation 108:1871-2003 ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation: executive summary. Europ Heart J 27:1979-2006 ACC/AHA/ESC 2006 Guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Europ Heart J 27:2099-2006 AHA/ASA Guideline: Primary prevention of schemic stroke. Circulation 113:e873-2006 Akhtar M., Shenasa M., Jazayeri M.: Wide QRS complex tachycardia. Reappraisal of a common clinical problem. Ann Intern Med 109:905-1988 Alpert M.: Medical cardioversion of atrial fibrillation. Chest 117:1529-2000 Atiga Walter L., Rowe P., Calkins H.: Management of vasovagal syncope. J Cardiovasc Electrophysiol 10,874-1999 Bar F., Brugada P., Dassen W.: Differential diagnosis of tachycardia with narrow QRS complex (shorter than 0.12 seconds). Am J Cardiol 54:555-1984 Blanck Z., Dhala A., Deshpande S.: Bundle branch reentrant ventricular tachycardia: Cummulative experience in 48 patients. J Cardiovasc Electrophysiol 4:253-1993 Brugada P., Brugada J., Mont L.: A new approach to the differential diagnosis of a regular tachycardia with a wide QRS complex. Circulation 83:1649-1991 Buxton A., Josephson M., Marchlinski F.: Polymorphic ventricular tachycardia induced by programmed stimulation: Response to procainamide. J Am Coll Cardiol 21:90-1993 Calkins H., Langberg J., Sousa J.: .Radiofrecuency catheter ablation of accesory atrioventricular connections in 250 patients. Circulation 85:1337-1992 Chaudhry G., Haffajee C.: Algorithms useful in the treatment of atrial fibrillation. Curr Opin Cardiol 17:52-2002 Del Río A. (h), González Zuelgaray J., Scazzuso F.: Modificación del nódulo A-V en pacientes con reentrada nodal: comparación entre la aproximación anatómica o la guiada por registro del potencial de la vía lenta. Rev Fed Arg Cardiol 25:305-1996 Del Rio A. (h), Mamelucco G., Monti R.: Ablación por radiofrecuencia de la reentrada nodal AV común: comparación de dos técnicas. (Resumen) Rev. Fed. Arg. Cardiol 28, Supl 1-1999 Del Río A. (h), Mamelucco G., Monti R.: Tratamiento agudo de las taquicardias supraventriculares con adenosina. Rev Fed Arg Cardiol 25:445-1996 Del Río A. (h), Socas A., González Zuelgaray J.: Ablación por radiofrecuencia de vías accesoria en una sesión única. Rev Fed Arg Cardiol 25:78-1995 Del Río A. (h), Zapata G., Cadoppi D.: Propafenona versus quinidina, eficacia y seguridad en la reversión de la fibrilación auricular aguda. XVII Congreso Nacional de Cardiología (1999) (Resumen). Rev Fed Arg Cardiol 28, supl 1-1999 Delacretaz E.: Supraventricular tachycardia. N Engl J Med 354:1039-2006 Eckardt L., Breithardt G., Kirchhof P.: Approach to wide complex tachycardias in patients without structural heart disease. Heart 92:704-2006 Ellenbogen K., Kay N., Wilkoff B.: Clinical Cardiac Pacing. W. B. Saunders Company,1995 Elizari M., Chiale P. Arritmias Cardíacas. Bases Celulares y moleculares, diagnóstico y tratamiento.. Propulsora Literaria SRL. 1998 Gage B., Waterman A., Shannon W.: Validation of clinical classification schemes for predicting stroke: results from the National Registry of Atrial Fibrillation. JAMA 285:2864-2001 Gallagher J., Pritchett E., Sealy W.: The preexcitation syndromes. Prog Cardiovasc Dis 20: 2851978 Ganz L., Friedman P.: Supraventricular tachycardia. N Engl J Med 332:162-1995 González Zuelgaray J.: Arritmias Cardíacas Inter-Médica,Buenos Aires. 1996 Jazayeri M., Hempe S., Sra J.: Selective transcatheter ablation of the fast and slow pathways using radiofrequency energy in patients with atrioventricular nodal reentrant tachycardia. Circulation 85: 1318-1992 Josephson M.: Clinical cardiac electrophysiology: techniques and interpretations. Lea & Febiger, 2nd ed, Philadelphia 1993 Kanter R., Del Río A.(h), Miretti C.: Coexisting Preexcitation syndrome and intermittent heart block presenting as neonatal seizures. J Cardiovasc Electrophysiol 10: 736-1999 Kindwall E., Brown J., Josephson M.: Electrocardiographic criteria for ventricular tachycardia in wide complex left bundle branch block morphology tachycardias. Am J Cardiol 61:1279-1988 Laupaucis A., Albers G., Dalen J.: Antithrombotic therapy in atrial fibrillation. Chest 108:352S1995 Leonardi M., Bissett J.: Prevention of atrial fibrillation. Curr Opin Cardiol 20:417.2005 Lelorier P., Klein G.: Prevention and management of postoperative atrial fibrillation. Curr Probl Cardiol 27:367-2002 Lerman B.: Response of nonreentrant catecholamine-mediated ventricular tachycardia to endogenous adenosine and acetylcholine. Circulation 87:382-1993 Li H., Easley A., Barrington W.: Evaluation and management of atrial fibrillation in the emergency department. Emerg Med Clin North Amer 16:389-1998 Lip G., Tello-Montoliu A.: Management of atrial fibrillation. Heart 92:1177-2006 Lip G., Boos C.: Antithrombotic treatment in atrial fibrillation. Heart 92:155-2006 Marriott H.: Differential diagnosis of supraventricular and ventricular tachycardias. Geriatrics 25:91-1970 Morady F., Baerman J., DiCarlo L.: A prevalent misconception regarding wide complex tachycardias. JAMA 254:2790-1985 Morady F., Harvey M., Kalbfleisch S.: Radiofrequency catheter ablation of ventricular tachycardia in patients with coronary artery disease. Circulation 87:363-1993 Morady F.: Radio-frequency ablation as treatment of cardiac arrhythmias. N Engl J Med 340:5341999 Nannini D., Zapata G.: Relevamiento de datos de Unidades Coronarias de Rosario. Revista de la Sociedad de Cardiología de Rosario, 1998 Roden D.: Antiarrhythmic drugs: from mechanisms to clinical practice. Heart 84:339-2000 Shah C., Thakur R., Xie B.: Clinical approach to wide QRS complex tachycardias. Emerg Med Clin North Amer 16:331-1998 Stewart R., Bardi B., Greene H.: Wide complex tachycardia: Misdiagnosis and outcome after emergent therapy. Ann Intern Med 104:766-1986 Tchou P., Young P., Mahmud R.: Useful clinical criteria for the diagnosis of ventricular tachycardia. Am J Med 84:53-1988 Testa L., Biondi Zoccai G., Dello Russo A.: Rate-control vs. rhythm-control in patients with atrial fibrillation: a meta-analysis. Europ Heart J 26:2000-2005 The Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators: A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 347:18252002 Trappe H., Brandts B., Weismueller P.: Arrhythmias in the intensive care patient. Curr Opin Crit Care 9:345-2003 Van Gelder I., Hagens V., Bosker H.: Crinhs HJGM for the rate control versus electrical cardioversion for persistent atrial fibrillation study group: A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 347:1834-2002 Wellens H., Bar F., Lie K.: The value of the electrocardiogram in the differential diagnosis of a tachycardia with a widened QRS complex. Am J Med 64:27-1978 Zipes D., Jalife J.: Cardiac electrophysiology. From Cell to bedside. WB Saunders Co, 1995. Filadelfia Zipes Douglas P.: Optimal management of atrial fibrillation: a case etudy approach. J Cardiovasc Electrophysiol 10:425-1999