Hipotèrmia1.2-DEF [es]castellà
Anuncio
![Hipotèrmia1.2-DEF [es]castellà](http://s2.studylib.es/store/data/007795254_1-23d5520ae9d97d9af4908e9d93a501af-768x994.png)
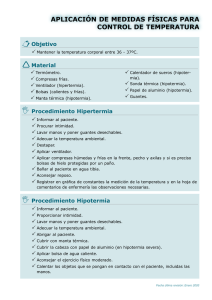
MANEJO DE LA HIPOTERMIA ACCIDENTAL SEVERA. Antoni Ricart, Manuel Avellanas, Javier Botella, Frank Mengelle, Íñigo Soteras, Toni Veres, Miquel Vidal. Introducción Los médicos que trabajan en medicina crítica y de emergencias, en atención prehospitalaria, en cirugía cardiaca o con programas de circulación extracorpórea (ECMO - Extracorporeal Membrane Oxygenator) se pueden encontrar con la necesidad de tener que asistir a víctimas de hipotermia accidental severa. Es importante fijarse en la elección de los pacientes hipotérmicos que, potencialmente, se pueden beneficiar del traslado a un hospital terciario. A menudo las decisiones tomadas en la primera asistencia hacen que un paciente sea sometido a un largo traslado a un hospital que no disponga de los medios adecuados para la asistencia de una hipotermia severa. La International Commision for Alpine Rescue (http://www.ikarcisa.org), International Society for Mountain Medicine (http://www.ismmed.org) y el comité médico de la Union Internationale des Associations d'Alpinisme (http://www.uiaa.ch) han promocionado la obtención de datos y la publicación de protocolos pre hospitalarios de clasificación y manejo de las víctimas de hipotermia severa en las montañas (1). Los principios básicos de clasificación, reanimación y manejo de las víctimas de hipotermia accidental, son los mismos tanto en ambiente marítimo, en las montañas, como en ambiente urbano (2). Definición Se define hipotermia como temperatura corporal central (TCC) por debajo de 35ºC. Se clasifica como ligera (TCC 35-32ºC), media (TCC 32-30ºC) y severa (inferior a 30ºC). Patofisiología La hipotermia, normalmente es el resultado de: • Una lesión inmovilizadora en un entorno frío. • Exposición a un entorno especialmente frío sin protección. • Inmersión en agua fría. La actividad muscular y los procesos catabólicos del organismo, producen calor; el calor se pierde por radiación, convección, conducción y evaporación, particularmente del vapor de agua procedente de la piel y de los pulmones. La termorregulación es el equilibrio entre la producción de calor (termogénesis) y la eliminación de calor (termólisis). Es un equilibrio activo para mantener la temperatura corporal la más próxima posible en 37ºC para permitir a los sistemas enzimáticos funcionar. El margen de temperaturas de funcionamiento metabólico óptimo es estrecho. En situación de hipotermia ligera, los mecanismos de termorregulación funcionan al máximo en un intento de combatir la pérdida de calor. Si la situación empeora y la temperatura central continúa bajando, el sistema termorregulador se agota y se llega a la muerte por fallo cardiorespiratorio. La hipotermia produce: Hemodinámica. Cambios característicos en el electrocardiograma (onda J de Osborn). Si es severa tanto puede producir disrítmia cardíaca letal o asistolia. La secuencia típica es la progresión desde la bradicardia sinusal, pasando por la fibrilación auricular, hasta la fibrilación ventricular y la asistolia. El manejo chapucero del paciente o los cambios repentinos de la posición pueden provocar fibrilación ventricular repentina en cualquier momento. Respiratorio. La taquipnea inicial es reemplazada por disminución del volumen corriente y de la frecuencia respiratoria; la broncorrea predispone a la neumonía por retención de secreciones. La curva de disociación de la hemoglobina se desplaza a la izquierda comprometiendo la liberación de oxígeno en los tejidos. Acidosis respiratoria por depresión respiratoria de origen neurológico e hipercapnia. Sistema nervioso. El sistema nervioso central se deprime progresivamente con la correspondiente disminución de la conciencia. La ligera descoordinación inicial progresa, pasando por la irritabilidad y la agitación, hasta la letárgia y el coma. En hipotermia, la disminución de los requerimientos de oxígeno del cerebro, lo puede proteger de la lesión anóxica o isquémica en caso de paro cardiorrespiratorio (3). Función renal. La conocida diuresis por frío se debe a la adrenergia inicial con aumento del gasto cardíaco, a malfuncionamiento de la capacidad tubular renal de concentración de la orina y al aumento del volumen plasmático central debido a la vasoconstricción periférica. La pérdida de líquido puede ser tan importante como para necesitar reanimación hídrica en el tratamiento de las víctimas de hipotermia. El paciente hipotérmico inmóvil es propenso a presentar rabdomiolisis, mioglobinúria y necrosis tubular aguda. Endocrinología y metabolismo. Los receptores adrenérgicos se alteran en la hipotermia severa, por lo que las drogas vaso activas (noradrenalina, dobutamina, dopamina, etc.) pueden no ser efectivas, acumulándose hasta niveles tóxicos y produciendo efectos no deseados cuando el paciente se recalienta (4). Aparece salida de plasma del espacio vascular al espacio intersticial y la consecuente hemoconcentración con disfunciones plasmáticas y endocrinológicas. Inicialmente, el aumento de la secreción de insulina y la glucogenolisis, movilizan las reservas de glucosa, pero aparece hipoglicemia cuando las reservas se agotan. Acidosis por aumento de la producción de ácido láctico por el temblor y la contractura muscular de tejidos con mala perfusión. Coagulación. Aparición de trastornos como la coagulación intravascular diseminada y a fenómenos hemorrágicos. Además hay alteraciones de la coagulación por disfunción plaquetar y alargamiento del tiempo de coagulación por alteración de la vía extrínseca (5,6). Función hepática. La función hepática está deprimida, llevando a la acumulación de drogas no metabolizadas y a la dificultad en la metabolización de diversos metabolitos, como el mencionado ácido láctico. Extremidades. Las extremidades son vulnerables a la congelación como resultado de la vasoconstricción, de la hipoperfusión y de la hemoconcentración. Consecuencias de la hipotermia en los pacientes traumáticos. Hasta bien adentrada la década de los 80 del siglo pasado se consideraba que la "tríada letal" formada por hipotermia, acidosis y coagulopatía, era la mayor causa de mortalidad de los heridos en situación crítica. Los pacientes tenían más probabilidad de acabar muriendo en las unidades de Medicina Intensiva por acidosis persistente o coagulopatía no resuelta, que en la fase inicial en el quirófano durante las intervenciones para reparar perforaciones viscerales u osteosíntesis de fracturas graves. Incluso en ambientes urbanos cuando el tiempo de transporte en el hospital más próximo es inferior a 15 minutos, más del 50% de los pacientes con lesiones penetrantes son hipotérmicos al ingresar en el servicio de Urgencias. Naturalmente que el clima y la temperatura ambiente influyen en esta cifra (7). Comparada con la de los pacientes normotérmicos, la mortalidad aumenta hasta 50% más en los pacientes hipotérmicos según diversos estudios hechos en traumáticos (8). Los pacientes muy jóvenes o muy viejos, los que presentan quemaduras, traumatismos craneoencefálicos (los mecanismos de termorregulación hipotalámicos se pueden ver alterados) y los pacientes con lesión de la médula espinal alta que afecten a la cadena simpática, son especialmente propensos a la hipotermia. Estos pacientes se tienen que considerar poiquilotèrmicos o con escasa respuesta de defensa frente a la pérdida de calor. La prevención para minimizar la pérdida de calor y, si está indicado, el recalentamiento activo, son componentes esenciales para una buena asistencia a los heridos (9). Clasificación etiológica de la hipotermia Hipotermia aguda La hipotermia aparece por exposición aguda al frío intenso que sobrepasa las posibilidades de termorregulación. Antes de esto, sin embargo, las reservas de glucógeno se han agotado con el temblor y se han producido los cambios en los fluidos corporales mencionados anteriormente. Este tipo de hipotermia se da por ejemplo en las víctimas de avalancha o en la inmersión en agua fría. En estos casos la respuesta al frío aparece en los primeros 4-5 minutos. Empieza por una fase adrenérgica con vasoconstricción periférica, hiperventilación y taquicardia, pudiendo llegar en un primer momento de la inmersión y el ahogo o al paro cardiorrespiratorio, por reflejo vagal y espasmo de glotis. En los supervivientes de este primer choque por frío, la hipotermia puede tardar unos 30 minutos a establecerse (10). El tiempo de supervivencia dependerá del balance entre la eficacia de la respuesta termoregulatoria posible, la ropa de abrigo y el aislamiento y la temperatura del aire o del agua (11). Hipotermia subaguda Puede afectar a un alpinista aislado en la montaña. Hay una lenta, pero continúa, pérdida de calor y deplección progresiva de las reservas energéticas. La tasa de supervivencia se relaciona con la situación física y mental del sujeto, su equipamiento aislante y la severidad de las condiciones ambientales. Aparecen los trasvases de líquidos entre los diferentes compartimentos corporales y la hipovolemia, mencionados anteriormente, con necesidad de reanimación con líquidos endovenosos en el recalentamiento. Hipotermia subcrónica. El ejemplo clásico es el del paciente anciano, inmovilizado por fractura del cuello del fémur por una caída en su casa. La hipotermia es de inicio insidioso y lento pero complicado por la deplección de las reservas de energía, rabdomiolisis, insuficiencia renal aguda, acidosis metabólica e hipovolemia debida a los cambios en la distribución de los líquidos ya descrita. La reanimación es compleja por la inestabilidad hemodinámica, las comorbilidades de los ancianos y las frecuentes complicaciones como las infecciones del tracto respiratorio y la isquemia miocárdica o de las extremidades, por lo que la mortalidad es elevada. El recalentamiento tiene que ser lento y muy esmerado en estos pacientes tan frágiles. Asistencia prehospitalaria. En la primera asistencia al lugar del accidente, se tiene que utilizar un termómetro epitimpànico que llegue a temperaturas bajas (1) para medir la temperatura central. Clasificación y estadiaje de la hipotermia en la primera asistencia según la situación clínica. La Sociedad Suiza de Medicina de Montaña ha propuesto el método más práctico y el más utilizado, de lo que se basa tan sólo en la temperatura central y que se puede llevar a cabo por personal no médico con mínimo entrenamiento (1): • Grado I. Paciente consciente y temblando (35-32ºC). • Grado II. Paciente somnoliento que no tiembla (32-28ºC). • Grado III. Paciente inconsciente pero con signos vitales presentes (28-24ºC). • Grado IV. Ausencia de signos vitales; muerto aparente (24-13ºC). • Grado V. Muerto por hipotermia irreversible (temperatura central inferior a 13ºC). Pacientes severamente hipotérmicos se han reanimado con éxito después de diversas horas en asistolia. El caso descrito con la temperatura central más baja que se pudo reanimar sin lesiones neurológicas fue en 13,7ºC (12). Obviamente, el mayor reto por los clínicos es la diferencia entre los grados IV y V de la víctima. Los datos que diferencian el grado V son: 1. - El tórax y el abdomen no son compresibles. 2. - El corazón siempre está en asistolia (en el grado IV puede haber asistolia o fibrilación ventricular). 3. - La temperatura central es inferior a 13ºC. 4. - El potasio sérico es superior a 12 mEq/L. Naturalmente que no se puede reanimar en todas a las víctimas con hipotermia; la hipotermia puede ser la consecuencia y no la causa de la muerte y por lo tanto no es adecuado reanimar ni recalentar a estos pacientes. Es importante recordar que unas heridas letales son contraindicación para la reanimación. A las víctimas de avalanchas el tiempo de entierro en la nieve y la presencia de una bolsa de aire cerca de las vías respiratorias son factores pronósticos. Las víctimas enterradas más de 35 minutos sin bolsa de aire no sobreviven. A pesar de todo, con un tiempo de enterramiento superior a 35 minutos pero con bolsa de aire, tratar la hipotermia puede ser la clave de la supervivencia de la víctima después de la extracción. La extracción tiene que ser esmerada y suave ya que un manejo descuidado puede producir fibrilación ventricular o asistolia. En ausencia de signos vitales, cuando se supone que la víctima está en asistolia y la temperatura central es superior a 32ºC, a la reanimación se añadirá el soporte vital avanzado según protocolo habitual. Si se tiene éxito, el paciente se transportará a un centro hospitalario con posibilidades de asistencia intensiva. Si no se tiene éxito después de 20 minutos de reanimación se puede considerar al paciente muerto. En el caso de enterramiento prolongado, si la temperatura central es inferior a 32ºC presencia de bolsa de aire y sin obstrucción de las vías respiratorias por nieve o por vómito, se asumirá que se trata de hipotermia severa grado IV; en este caso se comenzará soporte vital avanzado y recalentamiento. A pesar de esto, si la vía aérea se muestra obstruida, la víctima se considerará no reanimable. Algoritmo de la asistencia prehospitalaria del paciente con hipotermia accidental severa. Algoritmo 1. (Leyenda: SVA: soporte vital avanzado. RCP: reanimación cardiopulmonar. PIAR: protocolo de inducción anestésica rápida. UCI: unidad de cuidados intensivos. CEC: circulación extracorpórea. 1era. Exploración Si Reactivo? No Tremola? Lesiones mortales Si No Si Declarar muerte No Respira? No Si. Cabal cardiaco suficiente. PIAR, intubación y ventilación Sacar ropa mojada. Aislamiento térmico Comer y beber caliente si puede tragarse. Recalentamiento pasivo Hay pulso central? Si No SVA Máximo 3 desfibrilaciones Drogas vaso activas RCP solamente si puede mantener continuamente Sacar ropa mojada Aislar Manejo acurrado Intubar Ventilar Recalentamiento externo o con aire caliento Recalentamiento activo opcional Considerar traslado en el hospital en caso de lesiones Recalentamiento externo o con aire caliente Traslado debajo soporte vital en hospital con UCI i CEC Guías de reanimación según el grado de hipotermia. Grado I. Proporcionar abrigo y aislar del viento, de la lluvia y de la nieve. Dar bebida caliente y azucarada y comida. Animar a temblar o a hacer ejercicio, en la medida en que sea posible, para generar calor. Se tiene que considerar la posibilidad de evacuación si se sospecha una lesión oculta o alguna comorbilidad existente que pueda haber precipitado la hipotermia, como por ejemplo la ingesta de alcohol u otros tóxicos. Grado II. El paciente no tiembla y es vulnerable a los trastornos del ritmo por un manejo inadecuado. Se tiene que asistir en decúbito lateral para proteger la vía aérea (excepto, obviamente, en el caso de sospecha de lesión de la columna vertebral) y se debe recalentar con los medios de que se disponga. Si mantiene el reflejo nauseoso y es capaz de tragarse sin riesgo de broncoaspiración, se deben administrar bebidas calientes y azucaradas y comida. Evacuar a un hospital con posibilidad de cuidados intensivos. Las víctimas de avalancha o de accidentes acuáticos que han sido enterrados en la nieve o sumergidos pero que hayan sobrevivido, tienen elevado riesgo de complicaciones respiratorias tardías como edema pulmonar, distrés respiratorio o neumonitis por broncoaspiración (13). Grado III. El paciente presenta disminución de la conciencia y se debe considerar a un paso de la fibrilación ventricular o de la asistolia si se maneja de forma inapropiada. Se considera prudente proceder a intubación oro traqueal y conexión a ventilación mecánica de forma que se proteja la vía aérea y se optimice la ventilación, pero sólo si se puede mantener este tratamiento durante el transporte. Obtener una vía venosa puede ser difícil por la vasoconstricción y por las condiciones ambientales pero es esencial para una secuencia rápida de inducción anestésica y de intubación. Hay riesgo de que la laringoscopia y la intubación precipiten la fibrilación ventricular o la asistolia y de que el tiempo necesario para la maniobra prolonguen excesivamente el tiempo de extracción y de evacuación, por lo que cada caso tiene que ser valorado individualmente. Se pondrán en marcha medidas de aislamiento y de recalentamiento para minimizar ulteriores pérdidas de calor. Evacuación en un hospital terciario con posibilidades de recalentamiento central mediante BCE (bomba circulación extracorpórea) o ECMO (ExtraCorporeal Membrane Oxigenator). Grado IV. Paciente severamente hipotérmico y aparentemente muerto. Reflejos tendinosos ausentes, pupilas midriáticas y no reactivas a la luz. Se tiene que empezar la reanimación cardiopulmonar (RCP) inmediatamente con la condición de que, una vez se haya empezado se pueda continuar hasta llegar al hospital de referencia (14, 15). Esta afirmación se explica porque en hipotermia severa puede ser muy difícil confirmar la presencia de ritmo cardíaco o de ventilación espontánea y que la RCP puede desencadenar, por sí misma, la aparición de fibrilación ventricular, por lo que detenerla puede ser mortal para el paciente. Estas víctimas se tienen que transportar inmediatamente a un hospital terciario con posibilidades de CEC o ECMO; trasladarlas inicialmente a un hospital sin estas posibilidades puede hacer perder un tiempo precioso para la supervivencia del paciente. En situaciones más aisladas o remotas, sin un hospital terciario en muchos kilómetros se pueden utilizar otroa guías de tratamiento (16). Soporte vital avanzado en hipotermia. Intubación oro traqueal y conexión a ventilación mecánica con estrategia ventiladora protectora (Presión final de espiración positiva elevada [PEEP], volumen corriente bajo). Palpar el pulso carotideo o, si es posible, observar la curva del electrocardiograma durante más de 60 segundos antes de concluir que hay asistolia y ausencia de gasto cardíaco. Si la víctima no tiene pulso carotideo o hay dudas, empezar reanimación cardiopulmonar inmediatamente (recordar la observación anterior mencionada: sólo en el caso de que se pueda mantener continuamente hasta la llegada al hospital). La relación masaje cardíaco / ventilación tiene que ser la misma que en el paciente normotèrmico: 60 compresiones y 15 inspiraciones por minuto. Los líquidos endovenosos tienen que ser cálidos / templados y no a temperatura ambiente. Las soluciones con lactato (Ringer, Hartmann) no se deben utilizar por que en hipotermia la metabolización hepática del lactato puede estar afectada, habiendo lactoacidosis plasmática franca (17). Se ha demostrado que la adrenalina mejora la perfusión coronaria en asistolia por hipotermia, pero no aumenta la supervivencia, en experimentos hechos en cerdos (18, 19). La adrenalina y otras drogas vaso activas se deben administrar con mucha prudencia y bajo conocimiento de experto cuando la temperatura central es inferior a 30ºC por dos motivos: a) los receptores adrenérgicos responden mal a bajas temperaturas y b) la disminución del metabolismo de las drogas puede llevar a concentraciones plasmáticas potencialmente toxicas de una droga administrada repetidamente, que pueden producir efectos no deseados cuando aumenta la temperatura central. La amiodarona presenta los mismos problemas (20). Cuando la temperatura central, con el recalentamiento, supere los 30ºC, los intervalos entre las sucesivas dosis de los fármacos se deben multiplicar por dos hasta que la temperatura central sea próxima a la normal; a partir de aquí las dosis pueden ser las habituales en cualquier reanimación. Los trastornos del ritmo que aparecen en hipotermia, excepto la fibrilación ventricular, tienden a resolverse espontáneamente cuando la temperatura central se normaliza. La bradicardia sinusal se puede considerar fisiológica y no hace falta utilizar marcapasos excepto que persista después del recalentamiento. La desfibrilación se puede utilizar antes de la llegada al hospital, pero no en más de tres ocasiones si no es efectiva, aunque la fibrilación ventricular o la taquicardia ventricular persistan después de tres descargas,reintentar cuando la temperatura central supere los 30ºC (21, 22). Efecto de recaída (Afterdrop). Se llama efecto recaída o "afterdrop" al descenso continuado de la temperatura central cuando ya se ha protegido a la víctima del frío y que aparece durante el recalentamiento, tanto externo como interno. Es importante tenerlo en cuenta porqué el descenso de la temperatura central puede llegar a provocar fibrilación ventricular a pesar de haber empezado el recalentamiento (23). Se considera debido a la redistribución de sangre procedente de territorios fríos que devuelve al núcleo central cuando reaparece el gasto cardíaco por las maniobras de reanimación o de recalentamiento (24, 25, 26). Colapso peri-rescate. Hay muchos ejemplos de víctimas que siendo rescatadas, aparentemente estables y conscientes, presentan una situación de shock con síntomas que van desde el síncope hasta la fibrilación ventricular y la asistolia (27). Se han descrito muertes inmediatamente antes, durante o inmediatamente después del rescate; también 24 horas más tarde (28-30). La extracción vertical de la víctima puede aumentar este riesgo por mayor pérdida de líquidos (27); se puede prevenir manteniendo horizontal a la víctima. Aislamiento y recalentamiento. Las medidas generales incluyen proteger del frío, manejo esmerado del paciente, retirar toda la ropa mojada, normalmente cortándola. La víctima se tiene que aislar del suelo y proteger del viento, la lluvia o la nieve. El recalentamiento puede ser: A) Endógeno (animando al paciente a temblar o a hacer ejercicio y producir su propio calor). B) Externo pasivo (mantas en ambiente cálido, permitiendo que la producción endógena de calor caliente gradualmente al paciente. Es un método que sólo se puede utilizar en pacientes conscientes con hipotermia moderada). C) Externo activos (aplicación de calor con bolsas químicas o de agua caliente o con esteras eléctricas). D) Interno activo (infusión de líquidos endovenosos calientes, aire inspirado humidificado, lavados con suero caliente de estómago, cavidad pleural, peritoneal o vesical. En último lugar el recalentamiento con circulación extracorpórea. Recalentamiento pre hospitalario. En la primera asistencia, lo más importante es evitar que la víctima continúe perdiendo calor y por lo tanto, que continúe bajando la temperatura central y que aumente el riesgo de fibrilación ventricular. El recalentamiento activo tiene que empezar durando la primera asistencia entendiendo que el manejo del paciente rescatado ya es seguro y bajo control. El método más práctico y fácil para recalentar es colocar bolsas de agua caliente o similar sobre la piel en zonas donde pasan grandes vasos (cuello, sobacos, tórax, abdomen e ingles)(31). Administrar aire u oxígeno humidificado y caliente tiene alguna ventaja, si se dispone de la tecnología necesaria (32, 33). La técnica nombrada de los “shunts arteriovenosos" puede tener utilidad en un campamento base o en un navío en alto mar: se sumergen los brazos y/o las piernas en agua en 42-45ºC consiguiendo recalentamientos entre 6,1 y 9,9ºC por hora respectivamente (35). Las anastomosis arteriovenosas de las manos y de los pies actúan como intercambiadores de calor en esta técnica tan elegante. La inmersión completa del cuerpo en agua caliente se contraindica porqué el rápido recalentamiento de la superficie puede producir vasodilatación masiva, hipotensión, arrítmias y colapso cardiovascular. Cuidados intensivos hospitalarios. Algoritmo 2. Curas intensivas Manejo del los traumatismos y hemorragias Recalentamiento simultaneo Hemodinámica estable “Ritmo de perfusión” Hemodinámica inestable “Sin ritmo de perfusión” Recalentamiento lento 1-2ºC per hora Recalentamiento rápido más de 2ºC por hora Bolsas calientas Ventilación con aire caliente Recalentamiento externo Circulación extracorpórea limpieza pleural o vesical ECMO. Corrección simultánea de trastornos metabólicos Algoritmo 3. Manejo a Unidad de Curas Intensivas de Hospitales de 2º y 3º nivel Evaluación Inicial Monitorización Hª Clínica. Etiología de la hipotermia. Presencia de asistòlia. ECG. Temperatura central. Exploración clínica. Rx Tórax. Análisis: urea, glucosa, iones, equilibrio ácido-base, gasometría, hemograma, coagulación. ECG. Tª central. TA. PVC. Diuresis. Iones. Glucosa. Equilibrio ácido-base. Hemograma. Coagulación. Si asistolia: soporte vital avanzar hasta Tª Central>32º C Elección de la técnica de recalentamiento . Potasio . Fosforo Si Tª > 30ºC-32ºC - Desfibrilación - Marcapasos - Anti arrítmicos Lesiones traumáticas asociadas Situación clínica de la víctima. Técnicas disponibles. Patología asociada Experiencia del equipo reanimador. Manejos acurrados de la víctima Control electrolítico Exploración y diagnóstico Según Tª central. Control arritmias. TA 70- 100 mmHg. Recalentamiento adecúato Se recomienda: SpO2, SVCO2, cabal cardiaco (sin cateterizaría pulmonar). Glucemia 110-180 mg/dL/6-10 mmol/L. Otras mesuras SaO2 94-96% Volemia adecuada: Asegurar: PVC 7-12 mmHg Ventilación Reposar con SF caliento 37- 40ºC Oxigenación - 500 mL en 5-10 min cada 20 min V. Mecánica Control frecuente de la glucemia Control Coagulación Hb ≥ 9 g/dl Tratamiento etiología de la hipotermia - 30 mL/kg en 30 min Si Tª > 30ºC i TAM <70, Valorar: - Noradrenalina - Dopamina - Dobutamina El manejo hospitalario de la hipotermia debe ser la continuación de la primera asistencia (extracción, evaluación, protección, reanimación) y del segundo paso asistencial (vigilancia, recalentamiento, reanimación, transporte). La estabilidad cardiovascular, sólo llega cuando la temperatura central deja de bajar y ha empezado el recalentamiento. Las correcciones metabólicas y de los trastornos hidroelectrolíticos y la reposición de los líquidos intravasculares se deben hacer paralelamente. En el hospital, la medida de la temperatura esofágica o vesical es más demostrativa de la realidad que la rectal. Ni el método ni la velocidad de recalentamiento dependen de la temperatura central. La decisión dependerá de la presencia o ausencia de ritmo cardíaco que permita (o no) buena perfusión periférica. Los pacientes con hipotermia severa pero con ritmo cardíaco y adecuada perfusión se pueden recalentar con aire caliente; este método se ha mostrado efectivo permitiendo una buena recuperación funcional (36, 37). No obstante, en presencia de asistolia e hipotermia severas, la prioridad es restaurar el ritmo cardíaco eficaz. El recalentamiento debe ser rápido (más de 2ºC por hora) utilizando métodos invasivos. En un hospital que no disponga de sistemas con bomba de circulación extracorpórea (BCE) o oxigenador extracorpóreo de membrana (Extra Corporeal Membrane Oxigenator; ECMO) el recalentamiento sólo se puede hacer por hemofiltració venovenosa o arteriovenosa (38, 39) o por lavado de las cavidades pleural, peritonial o vesical con suero caliente lo que permite calentar el corazón y los grandes vasos. Se han descrito algunos casos de isquemia mesentérica con resultado fatal, después de recalentamiento con lavado peritonial, por lo que este método es cuestionado. En el momento de la elección y clasificación de estos pacientes en el lugar del accidente, no tiene sentido evacuar pacientes hipotérmicos en asistolia o fibrilación ventricular en un hospital sin BCE o ECMO ya que estas técnicas son las que se han mostrado más adecuadas para el recalentamiento de los pacientes en asistolia (40-43). Cuando se haya recuperado la estabilidad hemodinámica, es recomendable continuar con el tratamiento estándar de reanimación y mantenimiento, por lo que continuará siendo necesaria la estancia en una unidad de pacientes críticos de un hospital de 2º o 3º. Nivel. No hay datos que den soporte a la administración de cortico esteroides o de antibióticos, excepto en el caso de problema infeccioso añadido (44). Una alternativa de organización de la asistencia a las víctimas de hipotermia accidental a más largo plazo, sería potenciar la utilización de los sistemas de hemofiltración venovenosa o arteriovenosa en los hospitales de segundo nivel, lo que representaría dos ventajas: • Es una técnica más asequible, más barata y seguramente más próxima al accidente que los sistemas BCE o ECMO, de los hospitales terciarios, aunque no se haya demostrado tan efectiva en los pacientes con asistolia o fibrilación ventricular. • Este sistema tiene la ventaja añadida de que el circuito puede funcionar sin heparina, por lo que puede ser útil en aquellos pacientes con traumatismos que contraindiquen el recalentamiento con BCE o ECMO. De esta manera se podrían ahorrar el traslado a un hospital terciario, normalmente más alejado. Bases del recalentamiento extracorpóreo. La velocidad de recalentamiento puede ser tan elevada como 10ºC por hora. La recuperación completa sin lesión neurológica es posible incluso después de 2 horas en asistolia. El índice de supervivencia puede ser del 64% en aquellos pacientes que no presentaban asfixia previa a la hipotermia. En cambio, aquellos pacientes hipotérmicos por inmersión o enterrados por un alud antes de la hipotermia, tienen mucho peor pronóstico (45) por asfixia previa a la hipotermia. La velocidad de recalentamiento depende de la relación entre la temperatura de la sangre y el flujo que permita la bomba extracorpórea. En cirugía cardiaca electiva es conocido que gradientes de temperatura elevados entre la sangre del circuito y la temperatura central del paciente se relacionan con peor pronóstico neurológico (46). Normalmente se utiliza la bomba con un gradiente circuito/paciente entre 5 y 10ºC que permite el recalentamiento interno y externo al mismo tiempo, minimizando el efecto "afterdrop". La temperatura de la sangre no reintroducida nunca tiene que superar los 40ºC ya que temperaturas más elevadas producen desnaturalización celular y humoral de los componentes de la sangre. Con el cambio de temperatura también cambia la solubilidad del CO2 y el pH de la sangre, por lo que las gasometrías de sangre arterial, que se hacen con la muestra en 37ºC, pueden no reflejar fielmente la realidad del paciente. Clínicamente, con el recalentamiento, aparece alcalosis respiratoria, más o menos artefactada por otras variables como la acidosis metabólica previa. Todavía hay debate sobre cuál es la mejor forma para manejar el pH y la ventilación del paciente en este momento. El manejo en la forma "pH-stat" mantiene el pH estable aportando CO2 extra a la ventilación del paciente. El manejo en la forma "Alfa-stat" se basa en disminuir la ventilación para mantener el pH estable en 7,40. El comité de expertos de las asociaciones mencionadas recomienda el método "Alfa-stat". Aparatos para el recalentamiento extracorpóreo. Podemos clasificar las indicaciones en dos situaciones: 1) Pacientes con gasto cardíaco presente y suficiente y 2) Pacientes con gasto cardíaco inexistente o insuficiente. Pacientes con gasto cardíaco suficiente. 1) Circuito de recalentamiento venovenoso. Es un circuito simple que consiste en una tubuladura ancha (30 French = 0,38 pulgadas = 9,5 mm), una bomba centrífuga y un intercambiador de calor (por ejemplo el modelo ECMO - Extracorpórea Membrana Oxygenator- Therm (Medtronic). El acceso es percutáneo, preferentemente en una vena femoral. El circuito puede funcionar sin heparina lo que representa un beneficio evidente para los pacientes con traumatismos. La colocación de catéteres femorales de este grueso obliga a disección vascular (Colaboración de cirujano vascular o de cirujano cardíaco). 2) Hemofiltración venovenosa continúa. Sistema similar al anterior pero con la posibilidad de diálisis en caso de insuficiencia renal. Desafortunadamente, este sistema tiene una capacidad de flujo limitada a 500 mL/minuto (Multifiltrate, Fresenius) ò 450 mL/minuto (Prisma Flex, Hospal ò Aquarius RCA, Edwards) lo que limita la capacidad de recalentamiento. Los dos sistemas se pueden utilizar en pacientes en asistolia en la medida que se mantenga contínuamente el masaje cardíaco y la reanimación cardiopulmonar completa. A pesar de todo, el recalentamiento tiene que ser extremadamente lento, ya que el recalentamiento no tiene que ser superior al gasto cardíaco que se puede obtener con el masaje cardíaco externo (aproximadamente un 20% del normal) (39) para no desequilibrar el balance entre el aporte y el consumo de oxígeno en los tejidos. Pacientes en asistolia o fibrilación ventricular. 1. - Bomba de circulación extracorpórea (BCE): es el sistema clásico utilizado en las unidades de cirugía cardiaca. Se puede utilizar un circuito para adultos para todo paciente con un peso superior a 40 kg. Los pacientes con un peso inferior necesitarán de un equipo de los que sólo disponen las unidades de cirugía cardiaca pediátrica. Los flujos que garantizan el mejor soporte de intercambio de gases y de caudal cardíaco son a partir de 2,4 L/m2/minut. En cirugía cardiaca, la sangre proveniente de la vena cava se deriva en un reservorio venoso y de aquí a una bomba (centrífuga o de rodillos). La bomba impulsa la sangre a un oxigenador de membrana (hecho con fibra vacía de polipropileno) con intercambiador de calor. Normalmente hay un filtro en la línea arterial que retira las posibles impurezas antes del retorno al sistema arterial (aorta). También dispone de un sistema de succión que recupera la sangre tirada durante las maniobras quirúrgicas y la devuelve al lecho vascular. Con el circuito en marcha se puede practicar cardioplejia y cardiotomía, lo que no será útil en la mayoría de los pacientes en hipotermia. Este circuito tiene diversas zonas en las que la sangre se encuentra estacionaria, por lo que requiere heparinización completa (3 mg/hora por kg de peso) lo que es, obviamente una contraindicación en pacientes con traumatismos graves, especialmente craneoencefálicos. El circuito tiene un manejo relativamente complejo y requiere de una persona experta (perfusionista). También es necesario un equipo quirúrgico especializado ya que se accede a la canulación de vena cava y de arteria aorta por esternotomia media. Esta técnica tiene la ventaja de que es rápida para un equipo experto y de que permite la descompresión directa del ventrículo izquierdo que puede ser dilatado especialmente en situación de fibrilación ventricular (cánula de descompresión en aurícula izquierda; normalmente, la fibrilación ventricular revierte a ritmo sinusal con la descompresión). La otra ventaja de este sistema es en el tratamiento de niños, en que los vasos femorales no se pueden utilizar por su escaso calibre. En estos niños se acostumbraba a canular la vena yugular y la arteria carótida. La ligadura temporal de estas vasijas hizo que aumentara la frecuencia de lesiones cerebrales (48). Por este motivo, actualmente se prefiere el mencionado sistema de esternotomia para conectar la BCE en los niños pequeños. En niños más mayores o en adultos es posible la canulación de los vasos femorales, ya sea por técnica percutánea o por disección (49). Las medidas habituales de los catéteres son de 28-30 French por la vena y de 21-23 por la línea de retorno arterial; de esta manera los extremos distales de ambos catéteres quedan aproximadamente a nivel diafragmático. Incluso pacientes con temperatura central inferior a 14ºC se pueden recalentar en 1-2 horas con el sistema de BCE. El recalentamiento completo se confirmará con la medida continúa de la temperatura (vesical, esofágica). Se tiene que llegar, al menos, a una temperatura central no inferior a los 35ºC antes de pensar en retirar la BCE. Después de la desconexión de la BCE, la heparina se antagoniza con protamina y la coagulopatia se corrige con transfusión de plaquetas, plasma y crioprecipitados según convenga. Los antifibrinolíticos (ácido tranexámico, aprotinina) pueden ser útiles en caso de hemorragia post-BCE, así como el factor VII activado recombinado (Novoseven, Novo-Nordisk). 2. - Oxigenador de membrana extracorpórea (ECMO): este sistema utiliza una tecnología similar a la de la BCE para proporcionar soporte cardiorespiratorio prolongado en las unidades de medicina intensiva. Tiene algunas ventajas sobre la BCE para la reanimación de los pacientes con hipotermia accidental severa. • El circuito ya está diseñado para evitar las áreas de éstasis de la sangre, por lo que no hay reservorio venoso ni sistema de succión de la sangre tirada en las maniobras quirúrgicas. Este sistema permite que la descoagulación se haga con dosis de heparina muy inferiores a las utilizadas al sistema BCE. Sólo se administran 1 mg/kg antes de la canulación y el mantenimiento con 0,3-0,6 mg/kg/hora (negociar según el índice de coagulación que se utilice en el hospital en cuestión para mantener el tiempo de coagulación al doble del normal). En caso de traumatismos o de sangrado, se pueden utilizar micro dosis de heparina (0,1 mg/kg) o utilizar ECMO sin heparina por cortos periodos como tiempo (48). La infusión de aprotinina puede ser útil para reducir el sangrado mientras el paciente es conectado a ECMO. • El sistema ECMO se puede usar para dar oxigenación suplementaria prolongada en caso de insuficiencia respiratoria por edema pulmonar o por distrés respiratorio. En los pacientes con traumatismo torácico o las víctimas de inmersión puede haber lesión pulmonar o insuficiencia respiratoria que requiera oxigenación suplementaria después del recalentamiento. • El sistema ECMO produce una respuesta inflamatoria sistémica muy inferior al sistema BCE (50). En los pacientes hipotérmicos en asistolia o fibrilación ventricular, lo más normal es optar por conectar ECMO de forma arteriovenosa por vía femoral. De esta manera, con las cánulas (30 cm) a poca distancia del corazón se puede mantener un caudal cardíaco suficiente. De todas maneras, teóricamente es posible conectarlo de forma venovenosa, siempre y cuando se mantenga el masaje cardiaco (43). Se tiene que tener mucho cuidado de que no entre aire en el circuito, ya que el sistema ECMO no está preparado para contener aire (no dispone de trampas de burbujas), de manera que puede fácilmente introducir burbujas de aire al paciente con la correspondiente posibilidad de lesiones neurológicas. Los actuales oxigenadores de membrana están hechos de polimetilpentenos (PMP) cubiertos con heparina, por lo que se pueden utilizar durante períodos cortos sin heparina endovenosa, particularmente en presencia de coagulopatía. Los circuitos más antiguos están hechos con membranas de silicona y necesitan mayor volumen de sangre para cebarlos y causan mayor respuesta inflamatoria que los de PMP (51). La estrategia de recalentamiento es la misma que en la BCE, manteniendo el gradiente de temperatura entre la sangre y la temperatura central entre 5 y 10ºC sin permitir que la temperatura de la sangre sea más elevada de 40ºC. Esta estrategia permite un recalentamiento de 5-10ºC por hora. Puede ser útil intentar la desfibrilación una sola vez cuando se ha empezado el recalentamiento, particularmente cuando se ha practicado descompresión cardiaca cómo se ha mencionado antes. De todas formas, si la primera desfibrilación no fuera efectiva, se tienen que posponer los siguientes intentos hasta que la temperatura central sea superior a 30ºC. Si la fibrilación ventricular se mantiene resistente a esta temperatura, la administración de magnesio o de amiodarona puede facilitar la cardioversión. Conclusiones. Para los médicos que trabajan en el tratamiento de pacientes hipotérmicos, sea en la tarea de rescatarlos o sea en un hospital, el reto más importante es identificar a aquellos pacientes que se pueden beneficiar de ser trasladado directamente a un hospital de alta tecnología. Ésta es la forma de reducir drásticamente el retraso en la asistencia definitiva, evitando un segundo traslado secundario. Es recomendable que los hospitales sin posibilidades de bomba de circulación extracorpórea (BCE) o de oxigenador de membrana extracorpórea (ECMO) animen a los médicos de rescate a transportar al paciente directamente en un hospital terciario. Obviamente, en esta decisión se tienen que evaluar riesgos y beneficios teniendo presentes los siguientes factores: • Tiempo estimado de traslado a un hospital terciario desde el punto de la primera asistencia. Si el paciente está en asistolia no hay opción y hace falta que sea trasladado, bajo soporte vital, a un hospital terciario. La confección del mapa de las isocronas de traslado de la red hospitalaria del país facilitaría la tarea de los médicos asistenciales. • Evaluar la posibilidad de traslado a hospital de 2º nivel que disponga de tecnología por hemofiltración venovenosa o arteriovenosa continúa si el paciente mantiene caudal cardiaco mínimo. • El riesgo del efecto recaída (Afterdrop) o de colapso peri-rescate que puede hacer el rescate y la reanimación inútiles. Este riesgo, siempre presente, no puede llevar a una decisión que obligue a trasladar secundariamente de un hospital primario a uno terciario. En este caso se retrasaría el tratamiento definitivo y aumentarían los riesgos de traslado. • La vulnerabilidad del paciente según la suma de todas las lesiones, especialmente las traumáticas, diagnosticadas. • Las ventajas técnicas que puede ofrecer un hospital terciario. El antiguo adagio que dice "Ningún hipotérmico está muerto hasta que está caliente y muerto" continúa siendo cierto. La recomendación final es la de trasladar con la mayor urgencia a hospitales con capacidad tecnológica a los pacientes hipotérmicos en asistolia o fibrilación ventricular. Bibliografía. 1. Elsensohn F (2001) Consensus Guidelines on Mountain Emergency Medicine and Risk Reduction. Casa Editrice Stefanoni, Lecco 2. Soar J, Deakin CD, Nolan JP, et al(2005) European Resuscitation Council Guidelines for Resuscitation. Section 7d. Hypothermia. Resuscitation 67 (S1):S144-146 3. Holzer M, Behringer W, Schorkhuber W, te en el (1997) Mild hypothermia and outcome after CPR. Hypothermia for Cardiac Arrest (JACA) Study Group. Acta Anaesthesiol Scand Suppl 111:55-58 4. Reuler JB (1978) Hypothermia: pathophysiology, clinical settings, and management. Ann Intern Med 89:519-527 5. Valeri CR, Cassidy G, Khuri S, et al(1987) Hypothermia induced reversible platelet dysfunction. Ann Surg 205:175-181 6. Staab DB, Sorensen VJ, Fath JJ, et al(1994) Coagulation defects resulting from ambiente temperature-induced hypothermia. J Trauma 36:634-638 7. Johnson JW, Gracias VH, Schwab CW, et al(2001) Evolution in damage control for exsanguinating penetrating abdominal injury. J Trauma 51:261-271 8. Steineman S, Shackford SR, Davis JW (1990). Implications of admission hypothermia in trauma patients. J Trauma 30:200-202 9. Rousseau JM, Marsigny B, Cauchy E, et al(1997). Hypothermie en traumatologie. Ann Fr Anesth R'eanim 16:885-894 10. Giesbrecht GG (2001) Prehospital treatment of hypothermia. Wilderness Environ Med 12: 24-31 11. Tikuisis P (1997) Prediction of survival time at sea based upon observed body cooling ratas. Pronto Space Environ Med 68:441-448 12. Gilbert M, Busund R, Skagseth A, et al(2000) Resuscitation from accidental hypothermia of 13.7 °C with circulatory arrest. Lancet 355:375-376 13. Brugger H, Falk M, Adler-Kastner L (1997) Avalanche emergency. New aspects of the pathophysiology and therapy of buried avalanche victims. Wien Klin Wochenschr 109:145-159 14. Giesbrecht GG (2000) Cold stress, near drowning and accidental hypothermia: en review. Pronto Space Environ Med 71:733-752 15. Steinman AM (1986) Cardiopulmonary resuscitation and hypothermia. Circulation 74:IV29-32 16. Department of Health and Social Services, Division of Public Health, Section of Community Health and EMS, State of Alaska. Cold Injuries Guidelines 2003. Available at: http://www.chems.alaska.gov/EMS/documents/AKColdInj2005.pdf. Accessed Dec 2007 17. Aun CST (1997) Thermal disorders. In: Oh TE (ed) Intensive Care Medicine 4th edn. Butterworth Heinemann, Oxford 18. Krismer AC, Lindner KH, Kornberger R, et al(2000) Cardiopulmonary resuscitation during severe hypothermia in pigs: ¿does epinephrine or vasopressin increase coronary perfusion pressure? Anesth Analg 90:69-73 19. Kornberger E, Lindner KH, Mayr VD, et alel (2001) Effects of epinephrine in en pig models of hypothermic cardiac arrest and closed-chest cardiopulmonary resuscitation combined with active rewarming. Resuscitation 50:301-308 20. Stoner J, Martin G, O'Mara K, et al(2003) Amiodarone and bretylium in the treatment of hypothermic ventricular fibrillation in en canine models. Acad Emerg Med 10:187191 21. Southwick FS, Dalglish SPH Jr (1980) Recovery after prolonged asystolic cardiac arrest in profound hypothermia: en case report and literature review. JAMA 243:1250-1253 22. Ujhelyi MR, Sims JJ, Dubin SA, et al(2001) Defibrillation energy requirements and electrical heterogeneity during total body hypothermia. Crit Care Med 29:1006-1011 23. Covino BG, Beavers WR (1957) Effect of hypothermia on ventricular fibrillatory threshold. Proc Soc Exp Biol Med 95:631-634 24. Golden FS, Hervey GR (1977) The mechanism of the after-drop following immersion hypothermia in pigs. J Physiol 272:26P-27P 25. Webb P (1986) Afterdrop of body temperature during rewarming: an alternative explanation. J App Physiol 60:385-390 26. Giesbrecht GG, Bristow GK (1992) En second post cooling afterdrop: more evidence for a convective mechanism. J Appl Physiol 73:1253-1258 27. Golden FS, Hervey GR, Tipton MJ (1991) Circum-rescue collapse: collapse, sometimes fatal, associated with rescue of immersion victims. J Roy Nav Med Serv 77:139-149 28. Crisfill JW, McCance RA, Ungley CC, Widdowson EM (1956) The hazards to men in ships lost at sea, 1940-44. Spec Rep Ser Med Res Counc (GB) 32:1-44 29. Keatinge WR (1965) Death after shipwreck. BMJ 25:1537-1541 30. Golden F St C (1973) Death after rescue from immersion in cold water. J R Nav Med Serv 59:5-7 31. Hamilton RS, Paton BC (1996) The diagnosis and treatment of hypothermia by mountain rescue teams: en survey. Wilderness Environ Med 7:28-37 32. Mekjavic IB, Eiken O (1995) Inhalation rewarming from hypothermia: an evaluation in 20 °C simulated field conditions. Pronto Space Environ Med 66:424-429 33. Ducharme MB, Kenny GP, Johnston CE, te en el (1996) Efficacy of forced-air and inhalation rewarming in humans during mild (Tco = 33.9 °C) hypothermia. In: Shapiro Y, Moran DS, Epstein Y (eds) Environmental Ergonomics: Recents Progress and New Frontiers. Freund Publishing Co, London, pp 147-150 34. Vanggaard L, Gjerloff CC (1979) A new simple technique of rewarming in hypothermia. Int Rev Army Navy Air Force Med Serv 52:427-430 35. Vanggaard L, Eyolfson D, Xu X et al(1999) Immersion of distal arms and legs in warm water (AVA rewarming) effectively rewarms hypothermic humans. Aviat Space Environ Med 70: 1081-1088 36. Kornberger E, Schwarz B, Lindner KH, et al (1999) Forced air surface rewarming in patients with severe accidental hypothermia. Resuscitation 41:105-111 37. Roggla M, Frossard M, Wagner A, et al(2002) Severe accidental hypothermia with oro without hemodynamic instability: rewarming without the use of extracorporeal circulation. Wien Klin Wochenschr 114:315-320 38. Spooner K, Hassani A (2000) Extracorporeal rewarming in en severely hypothermic patient using veno-venous haemofiltration in the accident and emergency department. J Accid Emerg Med 17:422-424 39. Hughes A, Riou P, Day P (2007) Full neurological recovery from profound (18.0 °C) acute accidental hypothermia: successful resuscitation using active invasive rewarming techniques. Emerg Med J 24:511-512 40. Walpoth BH, Walpoth-Aslan BN, Mattle HP, et al(1997) Outcome of survivors of accidental deep hypothermia and circulatory arrest treated with extracorporeal blood warming. N Engl J Med 337:1500-1505 41. Silfvast T, Pettila V (2003) Outcome from severe accidental hypothermia in Southern Finland - en 10-year review. Resuscitation 59:285-290 42. Moser B, Voelckel W, Gardetto A, te en el (2005) One night in en snowbank: a case report of severe hypothermia and cardiac arrest. Resuscitation 65:365-368 43. Tiruvoipati R, Balasubramanian SK, Khoshbin E, et al(2005) Successful use of venovenous extracorporeal membrane oxygenation in accidental hypothermic cardiac arrest. ASAIO J 51:474-476 44. Safar P (1993) Cerebral resuscitation after cardiac arrest: research initiatives and future directions. Ann Emerg Med 22:324-349 45. Farstad M, Anderson KS, Koller ME, te en el (2001) Rewarming from accidental hypothermia by extracorporeal circulation. En retrospective study. Eur J Cardiothorac Surg 20:58-64 46. Grigore AM, Grocott HP, Mathew JP, et al(2002) The rewarming rate and increased peak temperature alter neurocognitive outcome after cardiac surgery. Anesth Analg 94: 4-10 47. Kirkpatrick AW, Garraway N, Brown DR, et al(2003) Use of en centrifugal vortex blood pump and heparin-bonded circuit for extracorporeal rewarming of severe hypothermia in acutely injured and coagulopathic patients. J Trauma 55:407-412 48. Peek GJ, Firmin RK (2000) Cannulation for Extracorporeal Organ Support. In: Zwischenberger J, Steinhorn RH, Bartlett RH (eds) Extracorporeal Life Support in Cardio-pulmonary Critical Care, 2nd Edition. Extracorporeal Life Support Organisation, Ann Arbor, pp 253-265 49. Van Meurs K, Lally KP, Peek GJ, Zwischenberger JB (2005) Extracorporeal Life Support in Cardio-pulmonary Critical Care, 3rd Edition. Extracorporeal Life Support Organisation, Ann Arbor 50. Peek GJ, Firmin RK (1999) The inflammatory and coagulative response to prolonged extracorporeal membrane oxygenation, en review. ASAIO J 45:250-263 51. Khoshbin E, Roberts N, Harvey C, te al (2005) Poly-methyl pentene oxygenators have improved gas exchange capability and reduced transfusion requirements in adult extracorporeal membrane oxygenation. ASAIO J 51:281-287