MODULO QUIMICA CICLO IV GRADO NOVENO
Anuncio

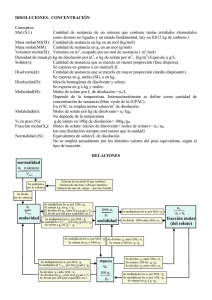
1 I.E. CÁRDENAS CENTRO MÓDULO DE QUÍMICA CICLO IV GRADO NOVENO 2 TABLA DE CONTENIDO pág. 1. 1.1. CONCEPTO DE MOL RELACIÓN ENTRE EL CONCEPTO DE MOL Y PESO ATÓMICO O PESO MOLECULAR 4 4 2. 2.1. 6 2.1.1. 2.1.2. 2.1.3. 2.1.4. ESTEQUIOMETRÍA RELACIONES CUANTITATIVAS ENTRE LOS REACCIONANTES Y PRODUCTOS EN UNA REACCIÓN QUÍMICA RELACIONES MOL-MOL RELACIONES MOL-GRAMOS RELACIÓN GRAMOS-GRAMOS CÁLCULOS CON VOLUMEN 6 7 8 9 10 3. 3.1.1. 3.1.2. SOLUCIONES CONCENTRACIÓN DE LAS SOLUCIONES Unidades químicas de concentración 12 14 15 4. 4.1. ACIDEZ INFLUENCIA DEL PH EN LOS SERES VIVOS 15 17 EVALUACIÓN DE COMPETENCIAS 19 5. 5.1. 21 21 SISTEMAS TERMODINÁMICOS VARIABLES DE ESTADO EVALUACIÓN DE COMPETENCIAS 22 BIBLIOGRAFÍA 25 3 1. CONCEPTO DE MOL hipótesis y prácticas. Antes de que Lavoisier utilizara la balanza como instrumento de investigación fundamental, la química se consideraba como un saber empírico y especulativo. Hoy en día, la química se considera como la ciencia que nos proporciona información sobre los elementos que forman una sustancia, los productos que resultan de una reacción, los efectos que tiene la variación de la presión y la temperatura en un gas, o qué ocurre cuando una sal se disuelve en agua. Pero como en cualquier otra ciencia, deben llevarse a cabo mediciones precisas de las magnitudes que caracterizan los fenómenos que estudia, ya que de estas mediciones dependen la verificación de la posibilidad de aplicaciones Así como expresamos la medida de la masa de una sustancia en gramos, o la capacidad de un recipiente en litros, en química utilizamos el mol para medir la cantidad de productos o de reactivos que participan en una reacción química. A partir de esta unidad, podremos averiguar la cantidad de átomos o de moléculas presentes en una determinada masa de sustancia y relacionarlos, a la vez, con su fórmula química. 1.1. RELACIÓN ENTRE EL CONCEPTO DE MOL Y PESO ATÓMICO O PESO MOLECULAR En química, para determinar un número grande de partículas muy pequeñas que conforman una sustancia química, fue necesario definir un nuevo término denominado mol (unidad fundamental de cantidad de materia), que se utiliza para contar partículas muy pequeñas, como átomos, moléculas, iones y electrones, en una muestra, y equivale a su masa atómica o a su masa molecular. Un mol tiene 6,022 x 1023 unidades, lo cual se conoce como el número de Avogadro en honor al físico italiano Amadeo Avogadro. Todos los elementos contienen, en un mol, el mismo número de átomos. Ejemplos: Un mol de sodio contiene 6,0 22 x 10 23 átomos de sodio 4 Un mol de carbono Un mol de hierro contiene contiene 22 23 6,0 x 10 átomos de carbono 22 23 6,0 x 10 átomos de hierro Todos los compuestos contienen, en un mol, el mismo número de molécu moléculas las y de iones. Ejemplos: 23 Un mol de amoníaco (NH3) contiene 6,022 x 10 moléculas de NH3 Un mol de cloruro de sodio (NaCl) contiene 6,022 x 1023 iones de Na+1 y de CH Medimos las cantidades en moles, en las operaciones que realizamos en química; por ello, el concepto de mol es fundamental, ya que se emplea en la mayoría de cálculos químicos. bien sencilla: la masa de un mol de un elemento se denomina mol-átomo átomo y corresponde a la cantidad de elemento cuya masa en gramos es numéricamente igual a su masa atómica. Por ejemplo, el hierro (Fe) tiene una masa atómica de 55,84 urna que corresponden a 6,022 x 1023 átomos de hierro. El problema para medir moles reside en su propio concepto: no podemos determinar un mol de una sustancia a base de contar átomos, por la magnitud tan grande del número de Avogadro y el hecho de que es imposible "coger" un átomo. Por eso, en el laboratorio, para realizar cálculos necesitamos encontrar una relación entre el mol y otra magnitud más fácil de medir: la masa. Así, podemos med medir la masa equivalente a los moles de una determinada sustancia, usando una balanza; esta relación es La masa de un mol de cualquier compuesto se denomina mol-molécula molécula y corresponde a la masa molecular del compuesto expresada expresad en gramos. Por ejemplo, el gas carbónico (CO2) tiene una masa molecular de 44 g que corresponden a 6,022 X1023 moléculas de gas carbónico. 5 EJERCICIOS Aplica tus conocimientos Comprueba que las masas moleculares de los siguientes compuestos sí corresponden al valor dado. a. Ácido fosfórico: 98,0 g. b. Ozono: 48,0 g. c. Bromo: 159,8 g. d. Ácido hipocloroso: 52,5 g. e. Sulfato de aluminio: 342 g 2. ESTEQUIOMETRÍA Es la parte de la química que tiene por objeto calcular las cantidades en masa y volumen de las sustancias reaccionantes y los productos de una reacción química. Se deriva del griego “Stoicheion” que significa elemento y “Metrón” que significa medir. Entre la estequiometria vamos a encontrar lo siguiente: Composición porcentual y molar, Nomenclatura, Leyes químicas, Reacciones químicas, Balanceo de ecuaciones. reacciones hipotética; A+B químicas. Para una reacción C+D Hace referencia al número relativo de átomos de varios elementos encontrados en una sustancia química y a menudo resulta útil en la calificación de una reacción química, en otras palabras se puede definir como: "la parte de la Química que trata sobre las relaciones cuantitativas entre los elementos y los compuestos en reacciones químicas". La estequiometría se refiere a las cantidades de reaccionantes y productos comprendidos en las 2.1. RELACIONES CUANTITATIVAS ENTRE LOS REACCIONANTES Y PRODUCTOS EN UNA REACCIÓN QUÍMICA Estas relaciones pueden ser. mol-mol mol-gramos gramos-gramos mol-volumen volumen-gramos volumen-volumen La parte central de un problema estequiométrico es el FACTOR MOLAR cuya fórmula se muestra a continuación. MOLES DE LA SUSTANCIA DESEADA factor molar = MOLES DE LA SUSTANCIA DE PARTIDA Los datos para el factor molar se obtienen de los COEFICIENTES DE LA ECUACIÓN BALANCEADA. 6 Para diferenciar el factor molar de los factores de conversión, se utilizan [corchetes] para indicar el factor molar y (paréntesis) para los factores de conversión. 2.1.1. RELACIONES MOL-MOL Para la siguiente ecuación balanceada: ¿Cuántas moles de O2 reaccionan con 3.17 moles de Al? PASO 1 BALANCEAR LA ECUACIÓN Como en el problema propuesto la ecuación está ya balanceada, este paso se omite. PASO 2 Identificar la sustancia deseada y la sustancia de partida. La sustancia deseada es aquélla sobre la cual se pregunta un dato, y la de partida, es de la que nos dan el dato. Junto a la sustancia deseada se pone lo que me piden: moles, gramos o litros y junto a la de partida el dato. Para el problema propuesto: SUSTANCIA DESEADA: O2 ? moles SUSTANCIA DE PARTIDA: Al 3.17 moles PASO 3 Convertir la sustancia de partida a moles. Si el dato, como en este problema, es en moles, omitimos este paso. PASO 4 Aplicar el factor molar 3.17 moles Al [ 3 moles de O2 4 moles de Al ] = 2.38 moles de O2 3.17 x 3 4 La operación realizada fue 7 PASO 5 Convertir el dato a la unidad requerida. Como en este caso lo que me piden son moles de oxígeno el resultado final es 2.38 moles de O2. RESUELVE… A partir de 8.25 moles de O2, ¿cuántas moles de Al2O3 (óxido de aluminio) se producen? 2.1.2. RELACIONES MOL-GRAMOS La siguiente ecuación muestra una reacción de combustión y está balanceada: ¿Cuántos gramos de C8H18 (octano) son necesarios para obtener 5.70 moles de CO2 (bióxido de carbono)? PASO 1: La ecuación ya está balanceada. PASO 2: SUSTANCIA DESEADA: C8H18 ? gramos SUSTANCIA DE PARTIDA: CO2 5.70 moles PASO 3: El dato está ya en moles PASO 4: 2 moles C8H18 16 5.70 mol co2 = 0.713 moles C8H18 moles CO2 PASO 5: El problema pide gramos de C8H18 y nosotros tenemos moles, entonces usamos un factor de conversión utilizando la masa molecular del C8H18. C 8 x12.01 = H 18 x 1.01 = 96.08 18.18 +114.26 g 114.26g 0.713 moles C8H18 = 81.47 g de C8 H18 1 mol 8 RESUELVE… Si se obtienen 55.0 g de vapor de agua, ¿cuántas moles de O2 se utilizaron? 2.1.3. RELACIÓN GRAMOS-GRAMOS ¿Cuántos gramos de HNO3 son necesarios para obtener 100 g de Zn(NO3)2 en base a la siguiente ecuación balanceada? 4 Zn (s) + 10 HNO3 (ac) 4 Zn(NO3)2 (ac) + N2O (g) + 5 H2O (l) PASO 1: La ecuación ya está balanceada. PASO 2: SUSTANCIA DESEADA: HNO3 ? gramos SUSTANCIA DE PARTIDA: Zn(NO3)2 100.0 gramos PASO 3: El dato está en gramos, por lo tanto tenemos que realizar una conversión a moles con la masa molar del Zn(NO3)2. Zn(NO3)2 Zn 1 x 65.39 = 65.39 N 2 x 14.01 = 28.02 O 6 x 16 = 96 + 189.41 1 mol 100.0 g Zn(NO3 )2 = 0.530 molZn ( NO3 )2 189.41g PASO 4: 10 mol HNO3 0.530 molZn ( NO3 )2 = 1.33 mol HNO3 4 mol Zn(NO3 )2 PASO 5: El problema pide gramos de HNO3, y nosotros tenemos moles. Utilizamos un factor de conversión con la masa molar de HNO3. 9 HNO3, 1.01 H 1 x 1.01 = N 1 x 14.01 = 14.01 O 3 x 16.00 = 48.00 + 63.02 g 63.02g 1.33 mol HNO3 = 83.82g HNO3 1mol 2.1.4. CÁLCULOS CON VOLUMEN Para realizar cálculos estequiométricos con volumen, es necesario cumplir con tres requisitos: 1) Que la sustancia intervenga en la reacción en estado gaseoso. 2) Que la reacción se lleve a cabo en condiciones normales de temperatura y presión (T = 0°C = 273°K, P = 1 atm). 3) Utilizar el volumen molar de un gas, cuyo valor es 22.4 L/mol. Volumen molar de un gas.- Es el volumen que ocupa una mol de un gas a condiciones normales de temperatura y presión. Este dato del volumen molar nos permite establecer el factor de conversión de litros a moles. 1 MOL = 22.4 Litros La siguiente ecuación balanceada, muestra la reacción de combustión del etano. 2 C2H6 (g) + 7 2 (g) 4 CO2 (g) + 6 H2O (g) Calcule: a) ¿Cuántos litros de oxígeno reaccionan con 3.17 moles de C2H6 (etano)? PASO 1 : La ecuación se muestra ya balanceada. PASO 2 : 10 SUSTANCIA DESEADA: O2 litros SUSTANCIA DE PARTIDA: C2H6 3.17 moles PASO 3: El dato de la sustancia de partida ya está en moles. PASO 4: Aplicar el factor molar. 7 moles de O2 3.27 moles C2H6 = 11.45 moles de O2 2 moles de C2H6 PASO 5: El problema pide litros de oxígeno, por tanto aplicamos el volumen molar para establecer el factor de conversión. 22.4L 11.45 moles de O2 = 256.48 L O2 1mol RESUELVE… ¿Cuántas moles de CO2 (bióxido de carbono) se producen si se obtiene 13. 5 litros de vapor de agua? PARA RECORDAR Ideas • • • • • • • • • • • • Los elementos san las sustancias más sencillas que existen en la naturaleza. Los compuestos se forman por la unión de dos o más elementos. Los elementos químicos se unen entre sí para lograr su estabilidad completando ocho electrones en su último nivel de valencia. Los enlaces químicos son las fuerzas de atracción que mantienen unidos a los átomos. Las estructuras de Lewis muestran el tipo de enlace que se forma entre los átomos. Los enlaces químicos se forman por transferencia de electrones. En los enlaces iónicos se forman los cationes por pérdida de electrones, y los aniones, por ganancia de electrones. Los hidróxidos se forman por la combinación de un óxido básico con agua. Los ácidos oxácidos se forman al reaccionar un óxido ácido con el agua. Los ácidos hidrácidos se obtienen al reaccionar el hidrógeno y algunos elementos no metales de los grupos 16 y 17. La acción de los ácidos en algunos materiales ocasiona la corrosión. Las sales se obtienen mediante la combinación de un ácido con una base. 11 3. SOLUCIONES Soluciones sólidas Como recordarás, la materia puede existir en forma de elementos, compuestos y mezclas. Los elementos son las sustancias más sencillas que existen en la naturaleza, por ejemplo, el oro, el oxígeno y el calcio, entre otros. Los compuestos son sustancias que se forman mediante la unión de dos o más elementos de diferente clase, como el agua, la glucosa y la sal. Las mezclas se forman por la unión de dos o más sustancias que se hallan en proporciones variables. Sus componentes conservan sus propiedades físicas y químicas, lo que permite que se puedan separar mediante métodos físicos como evaporación, cristalización, destilación, cromatografía, filtración, centrifugación o decantación, entre otros. Las soluciones sólidas están formadas por sólidos en los cuales un componente está disperso al azar en otro componente. Estas soluciones son de gran importancia en la industria, las aleaciones pertenecen a estas soluciones. Por ejemplo, el bronce está constituido por cobre y estaño, el latón está formado por cobre y zinc, y el acero está formado por hierro y carbono. Soluciones líquidas Las soluciones líquidas se pueden obtener al disolver una sustancia sólida, líquida o gaseosa en un líquido. Las partículas del soluto se encuentran distribuidas al azar en toda la solución, por ejemplo, una mezcla de agua y alcohol. Las mezclas pueden ser homogéneas o heterogéneas. Las mezclas heterogéneas son aquellas en las que algunos de sus componentes se pueden diferenciar a simple vista y presentan dos o más fases. Por ejemplo, en el agua con aceite se observan dos fases, ambas líquidas y, al mezclar arena con agua, se evidencian dos fases, una en estado líquido y otra en estado sólido. Las mezclas homogéneas son aquellas que forman una sola fase, su aspecto es uniforme, de manera que sus componentes no se pueden diferenciar. Por ejemplo, al disolver una cucharadita de azúcar en un vaso de agua, se observa una sola fase en estado líquido, o, al preparar un café con leche, se identifica una sola fase líquida. A las mezclas homogéneas se les denomina soluciones. Soluciones gaseosas En las soluciones gaseosas los gases se mezclan en todas las proporciones, formando siempre mezclas homogéneas. Por ejemplo, una mezcla de oxígeno y nitrógeno. Cuando un líquido se disuelve en otro y forman una solución, se dice que son solubles o miscibles. Pero, si al mezclarse se forma más de una fase, se dice que son insolubles o inmiscibles. Por ejemplo, el alcohol es miscible o soluble en agua y el aceite es inmiscible o insoluble en agua. La naturaleza del soluto y del solvente Una solución está formada por dos componentes: el soluto y el solvente. El soluto es la sustancia que se disuelve y se encuentra distribuida uniformemente en el solvente. El solvente es la sustancia que disuelve y generalmente está en mayor proporción. Por ejemplo, cuando disuelves un poco de sal en agua, la sal es el soluto y el agua es el solvente o disolvente. Las soluciones en las cuales el solvente es agua se denominan acuosas. Existen varias clases de soluciones: sólidas, líquidas y gaseosas. Para que un soluto se disuelva debe presentar propiedades similares al solvente. Es decir, la solubilidad aumenta si las moléculas que entran en contacto tienen propiedades eléctricas y estructurales semejantes. Por esta razón, el agua, que es una molécula polar, disuelve a cientos de sustancias polares, como las sales inorgánicas; y no disuelve a sustancias no polares, como los aceites y las grasas. Los solutos no polares forman soluciones con solventes no polares, como el éter, el cloroformo y el tetracloruro de carbono. 12 En las soluciones de líquidos o de sólidos disueltos en líquidos debe haber atracción entre el soluto y el solvente para que se forme una solución. Si no hay atracción entre el soluto y el solvente, las partículas de soluto permanecen unidas y no se mezclan con las del solvente. pueden escapar de la solución cuando alcanzan la superficie del líquido en un recipiente abierto. La presión La presión influye especialmente en la solubilidad de las sustancias gaseosas en los líquidos. Al aumentar la presión, aumenta la solubilidad de los gases en los solventes. La presión poco efecto tiene en la solubilidad de los líquidos y los sólidos, ya que son sustancias que se comprimen muy poco. La temperatura Generalmente al aumentar la temperatura aumenta la solubilidad. Esto ocurre porque la temperatura incrementa el movimiento de las partículas, ya sean moléculas o iones. Por ejemplo, si agregas azúcar a un vaso de agua caliente, ésta se disolverá más rápido que enagua fría. El tamaño de las partículas Esta propiedad se refiere al estado de subdivisión de las partículas que conforman el soluto, es decir, a su tamaño. Tiene una gran influencia en las soluciones formadas por sustancias sólidas disueltas en líquidos. Entre más pequeñas sean las partículas del sólido, habrá mayor superficie de contacto entre las moléculas de soluto y de solvente, lo cual facilita el proceso de disolución. Sin embargo, la solubilidad de un gas en un líquido y de un gas en sólido, disminuye al aumentar la temperatura. Esto se debe a que, al aumentar la temperatura, aumenta el movimiento de las partículas de soluto y de solvente. Por tanto, las moléculas gaseosas Las moléculas polares del agua atraen los iones Na+y Cl- , los iones se desprenden del soluto y pasan a la solución en donde se hidratan. 13 3.1. CONCENTRACIÓN DE LAS SOLUCIONES Para establecer la relación cuantitativa entre los componentes de una solución se utilizan las unidades físicas y las unidades químicas de concentración. La concentración es una medida de la cantidad de soluto presente en una cierta cantidad de solución. Como ya sabes, una solución está formada por un soluto y un solvente. En ocasiones podemos tener soluciones donde la cantidad de soluto es pequeña. Éstas se denominan diluidas. En otras soluciones, la cantidad de soluto es relativamente alta y se denominan concentradas. Si la solución contiene la cantidad máxima que el soluto puede disolver a una temperatura dada, se llama saturada. Si la solución contiene más soluto que la cantidad máxima a una temperatura dada, se denomina sobresaturada; y si la cantidad de soluto es menor que la máxima que el solvente puede disolver, se llama insaturada. • Porcentaje en masa (% m/m): relaciona los gramos de soluto presentes en 100 gramos de solución. Su expresión matemática es: % • 3.1.1. Unidades físicas de concentración. El valor de éstas no depende de la naturaleza de las sustancias que forman la solución. Se expresan en términos de unidades de volumen o unidades de masa. m masa de soluto x 100 = m masa de solucion Porcentaje en volumen (% v/v): relaciona el volumen de soluto por cada 100 ml de solución. Su expresión matemática es: v volumen de soluto x 100 % = v volumen de solucion • Porcentaje masa-volumen (% m/v): se refiere a la masa de soluto por cada 100 unidades de volumen de solución. Su expresión matemática es: % • m masa de soluto x 100 = v volumen de solucion Partes por millón (ppm): su expresión matemática es: ppm= miligramos de soluto litro de solucion 14 3.1.2. Unidades químicas de concentración. Para expresar de otra manera la concentración de las soluciones se utilizan las unidades químicas. Estas unidades dependen de la clase de sustancias que forman la solución. • • • Molaridad o concentración molar (M): M= numero de moles de soluto litro de solución m= número de moles de soluto kilogramo de solvente Molalidad (m): Normalidad (N): N= número de pesos equivalentes gramo de soluto litro de solución se abrevia así: N= número de eq-g gramo de soluto litro de solución Fracción molar (X): indica la relación entre el número de moles de un componente de la solución, con el número de moles totales de la solución. La fracción molar de la sustancia A, soluto en la solución, se define como el número de moles de la sustancia A, dividido entre el número de moles totales de la solución (moles de soluto + moles de solvente). XA = número de moles A número de moles totales de la solución 4. ACIDEZ En nuestra vida diaria utilizamos cientos de sustancias que se pueden clasificar de acuerdo con su grado de acidez en acidas, básicas o neutras. Estas sustancias tienen la propiedad de cambiar el color de otras sustancias llamadas indicadores. Por ejemplo, la fenolftaleína se torna fucsia al reaccionar con los hidróxidos y permanece incolora con los ácidos. El papel tornasol rojo vira a azul y el papel tornasol azul vira a rojo con los ácidos. Los ácidos y las bases presentan propiedades químicas diferentes. Existen algunas teorías que explican el proceso por el cual las reacciones ácido-base se llevan a cabo. 15 Teoría de Svante Arrhenius Esta teoría plantea que un ácido es un compuesto que, al ser disuelto en agua, aumenta aum la concentración + de hidrogeniones, H ; y una base es un compuesto que, al ser disuelto en agua, incrementa la concentración de iones hidroxilo, OH . Los indicadores de pH son sustancias orgánicas que cambian de color al contacto con sustancias acidas, básicas o neutras. Consulta cómo se elaboran los indicadores de pH a partir de vegetales. Teoría de Bronsted-Lowry La teoría de Bronsted-Lowry Lowry plantea que un ácido es una sustancia que cede protones, H+, originando una base se conjugada; y una base es una sustancia que acepta estos protones, originando un ácido conjugado. Por ejemplo: HC1 + H 2 O → H 3O + + Cl- ácido + base → ácido conjugado + base ba conjugada Teoría de Lewis Gilbert Lewis estableció que un ácido es aquella sustancia que acepta pares de electrones, y una base es la sustancia que cede pares de electrones. Por ejemplo: Las teorías anteriores explican el proceso por el cual las reacciones ácido-base base se llevan a cabo. Es importante tener en cuenta que, en una + solución acida acuosa, a, la concentración de H 1es mayor que la concentración de OH ; en una solución básica acuosa, la concentración de 1+ OH es mayor que la concentración de H , y en una solución neutra, estas concentraciones son iguales. Para medir la acidez, el bioquímico Sören Sörensen inventó la escala de pH (potencial de hidrogeniones). Esta escala está entre los valores de 0 a 14. Las sustancias que presentan un pH entre 0 y 6,4 son acidas, como los cítricos y los jugos gástricos. Aquellas que tienen un pH entre 7,4 y 14 4 son básicas, como los detergentes y la leche de magnesia. Las que presentan un pH entre 6,5 y 7,3 son neutras, como el agua y la sangre humana. 16 La expresión matemática para determinar el pH de una sustancia, teniendo en cuenta la + concentración de iones H , es: Por ejemplo, para una sustancia cuya + -5 concentración de H es de 1 x 10 M, su pH es: pH = − log 1 x 10-5 pH = 5 1 pH = log H + o pH = − log H + 4.1. INFLUENCIA DEL PH EN LOS SERES VIVOS carbónico, CO2. El pH cambia a medida que aumenta la profundidad, hasta estabilizarse en un valor aproximado de 8,5. El agua de mar es uno de los principales sistemas homogéneos que encontramos en la naturaleza. En él se desarrollan cientos de especies animales y vegetales, y en sus profundidades existe la posibilidad de que se encuentren seres vivos que el ser humano todavía no ha descubierto. En su composición hay una gran cantidad de sólidos y gases, por lo que se podría afirmar que los elementos químicos presentes en la tierra, están presentes en los mares. La proporción en la cual existe cada uno de ellos es diferente y depende de la zona donde esté ubicado este sistema. La actividad biológica de las especies marinas se ve influida por el pH. Simultáneamente, el pH se afecta por la fotosíntesis y el proceso de respiración de los seres vivos que se desarrollan en los mares. El pH condiciona numerosas reacciones químicas que solubilizan o precipitan las sales, que en definitiva son los compuestos, que mantienen los ecosistemas marinos. Además, el pH influye en las migraciones de las especies, factor determinante en las características de los medios marinos. Algunos elementos son de difícil cuantificación, ya que sus porcentajes son extremadamente bajos. Por ejemplo, para obtener 1 g de radio, Ra, se necesitan 5000 litros de agua de mar. Otros elementos requieren de técnicas analíticas muy finas. Sin embargo, en los animales la presencia de otros elementos es cuantificable, como el caso del cobre que se necesita para la formación de hemocianina en los moluscos y otros crustáceos. Así como el pH influye en la vida marina, influye también en la vida terrestre. Por esta razón, es importante conocer las características del suelo o del terreno antes de sembrar vegetales, pues las plantas necesitan suelos con diferentes grados de acidez. Algunas requieren de pequeñas variaciones de pH y otras necesitan suelos básicos para su crecimiento normal. El pH del suelo afecta principalmente la disponibilidad de nutrientes, como fósforo, potasio, hierro, cobre y boro, entre otros, que las plantas deben tomar. El pH de la mayor parte de los suelos varía entre 4 y 8, pero varios se salen de este rango. En algunos bosques varía entre 2,8 y 3,9, es decir, es muy ácido, pero en suelos salinos es mayor a 8,5. El rango óptimo del pH de un suelo para un adecuado crecimiento de la mayor parte de las plantas es de 6,0 a 7,0. La mayoría de las sustancias nutritivas de las plantas están disponibles en este intervalo. En cuanto a la acidez, los valores de pH del agua de mar oscilan entre 7,1 y 8,3, por lo que se puede afirmar que el mar es ligeramente alcalino. También se ha establecido que, en ocasiones, el rango depH está entre 8,1 y 8,3, ya que la salinidad, la fotosíntesis, la concentración de dióxido de carbono y la temperatura pueden influir. El pH varía de acuerdo con la profundidad. A los 50 m los valores de pH oscilan entre 7,1 y 7,3, ya que hay baja concentración de oxígeno gaseoso, O2, y elevada concentración de gas 17 Los mares y los océanos están entre los principales sistemas homogéneos de la naturaleza. Ideas • • • • • • • • • Los componentes de una solución son soluto y solvente. El soluto es la sustancia que se disuelve, y el solvente es la sustancia que disuelve al soluto. La solubilidad de una sustancia depende de factores como la temperatura, la presión, la naturaleza del soluto y del solvente, el tamaño de las partículas y el grado de agitación. La relación cuantitativa entre el soluto y el solvente se denomina concentración y se puede medir mediante las unidades físicas y las unidades químicas de concentración. El pH determina el grado de acidez de las sustancias. Su valor depende de la concentración de + iones hidronio, H . En la vida diaria utilizamos sustancias acidas, básicas y neutras. Ellas están presentes en nuestro cuerpo y en nuestro entorno. Los indicadores de pH son sustancias que se elaboran a partir de extractos vegetales, que cambian de color al contacto con los ácidos, las bases y las sustancias neutras. En una solución acida la concentración de hidrogeniones es mayor que la concentración de iones hidroxilo. En una solución básica la concentración de hidroxilos es mayor que la concentración de iones hidronio. El proceso por el cual se combinan un ácido y una base se denomina neutralización. 18 EVALÚA TUS COMPETENCIAS Explica 1. La siguiente tabla muestra los valores de pH de varias sustancias. Haz una gráfica con estos datos y responde las preguntas que están a continuación. Sustancias pH Tomates 4,2 Huevos frescos 7,8 Leche de vaca 6,4 Saliva 6,6 Jugo de naranja 3,5 Lluvia acida 5,6 Amoníaco casero 11,5 a. ¿Cuáles sustancias son acidas? + b. ¿Qué sustancia presenta la mayor concentración de iones hidronio, H1 ? c. ¿Qué sustancias son ligeramente básicas? d. ¿Cuál es la diferencia de pH entre los tomates y el jugo de naranja? e. ¿Qué se podría hacer para disminuir el pH del amoníaco casero? 2. La siguiente gráfica muestra la influencia de la temperatura en la solubilidad de algunos compuestos. Responde las siguientes preguntas con base en la información que suministra esta gráfica a. ¿Qué sustancia presenta más variación en la solubilidad? b. ¿Cuántos gramos de hidróxido de sodio, NaOH, se disuelven a 20 °C? c. ¿Cómo es la solubilidad del cloruro de sodio, NaCl, comparada con la solubilidad delas otras sustancias? 19 d. ¿Cuál es la sustancia de mayor solubilidad? Explica tu respuesta. e. ¿Qué temperatura se necesita para disolver 60 g de nitrato de Pb(II), Pb(NO3)2? f. ¿Qué cantidad de KNO3 debe disolverse en 100 g de agua para obtener una solución sobresaturada? Indaga 3. En el laboratorio encuentras tres frascos en cuyas etiquetas aparece el nombre de la sustancia y la concentración: a. ¿Cuál frasco contiene la solución de mayor concentración? b. ¿Qué significa HCl 0,1 M? c. ¿Cuál es la concentración normal del bromuro de potasio, KBr? d. ¿Qué procedimiento realizarías para aumentar la concentración de NaOH? e. ¿Qué relación existe entre la molaridad y la normalidad de una solución? 20 5. SISTEMAS TERMODINÁMICOS Un sistema termodinámico (también denominado sustancia de trabajo) se define como la parte del universo objeto de estudio. Un sistema termodinámico puede ser una célula, una persona, el vapor de una máquina de vapor, la mezcla de gasolina y aire en un motor térmico, la atmósfera terrestre, etc. Los sistemas termodinámicos ser aislados, cerrados o abiertos. El sistema termodinámico puede estar separado del resto del universo (denominado alrededores del sistema) por paredes reales o imaginarias. En este último caso, el sistema objeto de estudio sería, por ejemplo, una parte de un sistema más grande. Las paredes que separan un sistema de sus alrededores pueden ser aislantes (llamadas paredes adiabáticas) o permitir el flujo de calor (diatérmicas). pueden • Sistema aislado: es aquél que no intercambia ni materia ni energía con los alrededores. • Sistema cerrado: es aquél que intercambia energía (calor y trabajo) pero no materia con los alrededores (su masa permanece constante). • Sistema abierto: es aquél que intercambia energía y materia con los alrededores. En la siguiente figura se han representado los distintos tipos de sistemas termodinámicos. 5.1. VARIABLES DE ESTADO tendrá el mismo valor en ambos sistemas con independencia del valor de las variables en instantes anteriores. En general, los sistemas fuera del equilibrio no pueden ser representados por un número finito de grados de libertad, y su descripción es mucho más compleja. En termodinámica, una función de estado o variable de estado es una magnitud física macroscópica que caracteriza el estado de un sistema en equilibrio. Dado un sistema termodinámico en equilibrio puede escogerse un número finito de variables de estado, tal que sus valores determinan unívocamente el estado del sistema. Algunas variables de estado de un sistema en equilibrio son: la energía interna la presión. la temperatura. el volumen la entalpía la entropía la densidad la polarización. El valor de una función de estado sólo depende del estado termodinámico actual en que se encuentre el sistema, sin importar cómo llegó a él. Esto significa que si, en un instante dado, tenemos dos sistemas termodinámicos en equilibrio con n grados de libertad y medimos un mismo valor de n funciones de estado independientes, cualquier otra función de estado 21 EVALUACIÓN DE COMPETENCIAS 4. Se compara un mol de los compuestos covalentes X y J, tal como lo muestra la ilustración: NÚCLEO COMÚN Contesta las preguntas 1 a 3 de acuerdo con la siguiente información: El sulfato de amonio es un compuesto que tiene amplio uso como fertilizante. Su fórmula molecular es (NH4)2SO4. En la tabla encuentras la masa atómica de los elementos que lo componen. Elemento Masa atómica o molar (g/mol) N 14 H 1 S 32 O 16 Según lo anterior, es válido afirmar que un mol del compuesto a) J contiene menos moléculas que un mol del compuesto X. b) J contiene igual cantidad de moléculas que un mol del compuesto X. c) X contiene igual cantidad de unidades formule que un mol del compuesto J. d) X contiene mayor cantidad de unidades fórmula que un mol del compuesto J. 5. El catión presente en el Cu3(PO4)2 es: 1. De acuerdo con la información anterior, es correcto afirmar que en la fórmula del sulfato de amonio hay: a) Cuatro moléculas de hidrógeno. b) Un átomo de nitrógeno. c) Ocho átomos de hidrógeno. d) Cuatro moléculas de oxígeno. a) b) c) d) +2 Cu . -2 PO4 . +3 Cu . -3 PO4 . Contesta las preguntas 6 a 9, teniendo en cuenta la siguiente información: 2. De acuerdo con la fórmula, podemos afirmar que el sulfato de amonio es una sal: a) Doble. b) Neutra. c) Haloide d) Acida. 6. Algunas reacciones del material T se presentan en los siguientes esquemas de reacción: 3. Si en un cultivo se utilizan diariamente 66 g de sulfato de amonio, es correcto afirmar que, en tres días, el número de moles de la sal empleada es: a) 1,5. b) 2,0. c) 1,0. d) 3,0. → A T + O2 A + H 2O → H 2 TO3 H 2TO3 + B → X 2TO3 De acuerdo con la información anterior, es correcto afirmar que el material T es un: a) b) c) d) 22 Óxido ácido. Elemento metálico. Óxido básico. Elemento no metal. 7. Según la información anterior, podemos afirmar que el estado de oxidación del material T es: a) b) c) d) 11. De acuerdo con la información anterior, es muy probable que en la muestra 3 se encuentren las sales: -2. +4. -1. +6. a) b) c) d) 8. De acuerdo con la información anterior, es válido afirmar que la fórmula más probable para el compuesto A es: a) b) c) d) Profundización Contesta las preguntas 12 a 14 de acuerdo con la siguiente información: TO2. TO. TO3. T2O. La tabla siguiente muestra la composición porcentual de los compuestos W y Q, que contienen carbono, hidrógeno y oxígeno, respectivamente. 9. De acuerdo con la información anterior, la fórmula más probable del compuesto B es: TO3. XOH. H2TO3. XH. a) b) c) d) COMPUESTO Q Contesta las preguntas 10 y 11 de acuerdo con la siguiente información: Se realizó un análisis para determinar la composición iónica de tres muestras de suelo. Los resultados del análisis se presentan en la siguiente tabla. MUESTRA 1 Na + MUESTRA 2 Ca +2 NH4+ K -2 SO4 NO3 + K CaCI2, Ca3(PO4)2 y Na2Ca. NaCI, CaCI2, Na3PO4, y Ca3(PO4)2. Na2Ca, CaCI2, Na3PO4, y Ca3(PO4)2. NaCI, Na(PO4)3, y Ca3(PO4)2. + - F Elemento Porcentaje Elemento Porcentaje Carbono 54,5% Carbono 68,8% Oxígeno 36,3% Oxígeno 26,2% Hidrógeno 9,2% Hidrógeno 5,0% MUESTRA C Cl - 12. De acuerdo con la información anterior, la fórmula mínima del compuesto W es: a) C6H7O. b) C3H7O. c) C7H6O2. d) C5H4O. PO4-3 - COMPUESTO W Ca +2 Na + 13. Si la masa molecular del compuesto Q es 44 g/mol, la fórmula molecular más probable para el compuesto Q es: a) C5H4O. b) C4H5O2. c) C7H6O2. d) C2H4O. 10. De acuerdo con la información de la tabla, es muy probable encontrar sulfato de amonio en: a) Las muestras 2 y 3. b) La muestra 3. c) Las muestras 1 y 2. d) La muestra 1. 23 14. Si se comparan dos muestras 1 y 2, de 100 g y 50 g del compuesto W, respectivamente, es muy probable que la composición porcentual del: a) Carbono sea mayor en la muestra 1. b) Hidrógeno sea menor en la muestra 2. c) Carbono sea igual en las muestras 1 y 2. d) Hidrógeno sea mayor en la muestra 2. Elemento Masa atómica o molar (g/mol) C 12 N 14 O 16 Contesta las preguntas 15 y 16 de acuerdo con la siguiente información: H 1 Por medio de un análisis, se determinó la composición porcentual del compuesto H. Los resultados del análisis se presentan en la siguiente gráfica: 15. De acuerdo con la información anterior, es correcto afirmar que en 150 g del compuesto H hay: a) 5,0 moles de N. b) 8,5 moles de C. c) 3,0 moles de O. d) 1,0 mol de H. 16. Un análisis adicional permitió determinar que la masa molecular del compuesto H es 176 g/mol. De acuerdo con lo anterior, la fórmula molecular del compuesto H es: a) C10NOH12. b) C5NOH12. c) C10N2OH12. d) C10N2OH10. 24 BIBLIOGRAFÍA http://es.scribd.com/doc/48851392/que-es-la-estequiometria http://genesis.uag.mx/edmedia/material/qino/t8.cfm http://acer.forestales.upm.es/basicas/udfisica/asignaturas/fisica/termo1p/sistema.html http://es.wikipedia.org/wiki/Funci%C3%B3n_de_estado 25