Libro Termodinamica Cap 11 Segunda Ley Hadzich
Anuncio

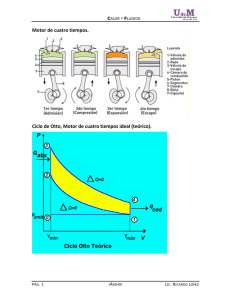
Termodinámica para ingenieros PUCP Cap. 11 Segunda Ley INTRODUCCIÓN Todo lo que hemos estudiado hasta ahora radica en la Conservaciòn de la Energìa = Primera Ley de la Termodinàmica; esta ley nos habla sobre la CANTIDAD de energìa que tiene un sistema, un proceso o un ciclo. Gracias a la Primera Ley podemos “contar” y evaluar los calores, trabajos, energìas internas, entalpìas, etc y porque nos proporciona una ecuaciòn matemàtica que involucra una igualdad dQ = dU +W. Pero aplicar la Primera Ley NO NOS ASEGURA que el proceso pueda cumplirse, pues debe cumplir tambièn con otras leyes elementales (Enunciado de Clausis y Kelvin -Planck) para que el fenòmeno o proceso pueda llevarse a cabo con èxito. Como siempre existen IRREVERSIBILIDADES que influyen en los procesos, se aplicarà la Segunda Ley de la Termodinàmica, la cual involucra el concepto de CALIDAD de la energìa. Cualquier proceso sòlo serà posible cuando se cumplan la Primera y la Segunda Leyes de la Termodinàmica. Cualquier màquina que no cumpla con estas leyes es llamada “màquina de movimiento perpetuo”, sueño de todo ingeniero, pero que es imposible de lograr. Quizàs alguno de Uds. pùeda intentarlo,con èxito ?. En este capìtulo estudiaremos el ciclo de Carnot y la Entropìa que son las estrategias que seguiremos para “cuantificar” la calidad de los sistemas y procesos. Cap 11 Segunda Ley - Pág. 1 MAQUINA DE MOVIMIENTO PERPETUO Funcionará esta máquina ? Cuál es el Combustible? Cuál es el portador de energías? Comente sus respuestas con la Primera y Segunda Ley de la Termodinámica. Cap 11 Segunda Ley - Pág. 2 Termodinámica para ingenieros PUCP 11.1 Segunda Ley de la Termodinámica SEGUNDA LEY DE LA TERMODINÁMICA “LA ENTROPÍA SIEMPRE AUMENTA” “S>=0 Además: A 0°K (cero absoluto) la entropía es cero. Máximo ordenamiento de las moléculas.(3era Ley) La 2da Ley nos da las restricciones de la 1era Ley, la cual es insensible a la dirección del proceso. Un ciclo sólo ocurrirá si satisface la 1era. y 2da. Ley de la Termodinámica. En general, podemos decir màs concretamente que la Segunda Ley es la Flecha del Tiempo, pues el tiempo va en una direcciòn y ciertos eventos o sucesos estàn ordenados, es decir van de un lado a otro y no pueden regresar; por ejemplo, cuando un plato se rompe, ha visto Ud. que las piezas se vuelvan a juntar y el plato se vuelva irrompible ? o podemos regresar a ser jóvenes otra vez ? La primera ley es solamente una igualdad que NO NOS ENSEÑA el sentido, por ser precisamente una ecuaciòn matemàtica que puede invertirse, es decir 1 + 1 = 2 es lo mismo que 2 = 1 + 1, no ? Pero en la vida real tambièn existirà un sentido o direcciòn que nos diga si ese proceso puede ser producido o no, si ese proceso es real o no, y eso es lo que nos enseña la Segunda Ley. Pueden existir diversas trayectorias o sentidos para un mismo evento, y cada una de ellas puede ser diferente, por ejemplo si queremos calentar agua de 20 ºC a 30 ºC, podemos hacerlo de diferentes formas pero el cambio de energìa interna dU serà el mismo en : a) Agregando 50 J de calor dU = Q - W = 50 - 0 = 50 b) Dàndole los 50 J pero en forma de trabajo mecànico agitando en agua con una paleta o agregando trabajo elèctrico dU = 0 -(-50) = 50 c) Podemos realizar 70 J de trabajo sobre el sistema y eliminar 20 J de calor dU = -20 -(-70) = 50 Pero en cada uno de los tres caso la trayectoria serà diferente !!!, es por eso que usaremos el concepto de ENTROPIA para evaluar la factibilidad de estos procesos. Si el aumento de entropia en un proceso es mayor que cero (positivo) el proceso podrà realizarse, caso contraio serà imposible, aun cuando la primera ley pueda calcularlo muy bien. El plato se enfría por sì solo, pero puede calentarse por sì solo? Direcciòn, direcciòn, direcciòn... Cap 11 Segunda Ley - Pág. 3 Cosas que no pueden suceder.... Un objeto que cae se calentará al golpear el suelo (1), pero se ha visto que el objeto que al calentarse salte? Una batería se descarga a través de una resistencia, con desprendimiento de cierta cantidad de energía, pero no puede realizarse el fenómeno a la inversa, es decir, suministra energía a la resistencia por calentamiento a fin de producir la carga de la batería. La taza se enfrìa por sì sola, pero no puede calentarse de un momento a otro !! El Oxígeno y el Hidrógeno reaccionan para formar el agua, pero ¿quién ha visto que el agua se separe espontáneamente en sus dos elementos básicos? H2 + ½ O2 H2O H2O (sí) H2 + ½ O2 (no) Cap 11 Segunda Ley - Pág. 4 Termodinámica para ingenieros PUCP 11.2.- IRREVERSIBILIDAD FACTORES QUE CONVIERTEN EN IRREVERSIBLE A UN PROCESO La mayorìa de las irreversibilidades caen dentro de la categorìa de la experiencia comùn, e incluye : 1. Fricción Nota: A partir de ahora cuando hablemos de calor también tenemos que incluuir el calor de fricción, es decir CALOR = Q12 + /Qw12/ Este valor de /Qw12/ solo será CERO cuando digamos que el proceso es reversible o ideal. 2. Resistencia eléctrica 3. Expansión ilimitada o expansión libre 4. Mezcla de dos sustancias diferentes 5. Deformaciòn inelàstica 6. Corriente viscosa de un fluido 7. Fricciòn Sólido - Sòlido 8. Efectos de histèresis 9. Ondas de choque 10. Amortiguaciòn de un sistema vibrante 11. Estrangulamiento en vàlvulas 12. Osmosis 13. Mezcla de fluidos idènticos a diferentes presiones y temperaturas NOTA: Las figuras de este capítulo son del Software “Cómo funcionan las cosas” que sería muy interesante que los alumnos lo puedan adquirir. Cap 11 Segunda Ley - Pág. 5 14. Transmisión de calor a través de una diferencia finita de temperatura El calor se ha definido como la energía transmitida debida a una diferencia de temperatura 15. Expansión ilimitada o expansión libre 16. Mezcla de dos sustancias diferentes 17. Proceso de combustión CH4 + 2 O2 ---CO 2 + 2 H20 La combustión siempre es con la presencia de oxígeno Una vez que ya se quemó la leña o cualquier combustible, ya no se puede regresar....se convierte en gas y vapor de agua Cap 11 Segunda Ley - Pág. 6 Termodinámica para ingenieros PUCP 11.3 Ciclo de Carnot 7.2 CICLO DE CARNOT Sadi Carnot observó que cuanto más elevada es la temperatura que entra en una máquina motriz (de cilindro y émbolo), y cuanto mas baja es la temperatura del vapor que sahe de la misma, tanto mayor será el trabajo de salida generado por dicha máquina. Este científico imaginó una “máquina de vapor” que podría funcionar con base de un ciclo cerrado; recibiría calor a una cierta temperatura constante, y cedería igualmente calor a una temperatura igualmente constante. La evaporación del agua y la condensación del vapor se llevarían a cabo a una temperatura casi invariable. La máquina tendría que encontrarse perfectamente aislada, y el trabajo se realizaría de manera reversible. Por tanto, habría una expansión adiabática reversible en la máquina para producir trabajo, seguida de una comprensión adiabática reversible para completar el ciclo. En conclusión, un CICLO DE CARNOT está compuesto por los siguientes procesos: (1-2) (2-3) (3-4) (4-1) expansión isotérmica reversible expansión adiabática reversible compresión isotérmica reversible compresión adiabática reversible Trabajo producido por un motor Carnot: En el diagrama P-v podemos observar un área neta equivalente al trabajo neto producido, pero este no proporciona una apreciación física del trabajo realizado. Si la máquina pudiera hacer girar un eje, de la misma manera que un motor de combustión interna hace girar el cigüeñal de un auto, entonces se podría asignar una apreciación física al diagrama P-v. Cap 11 Segunda Ley - Pág. 7 Consideremos un motor Carnot como el siguiente: Esta máquina puede suministrar el trabajo necesario para hacer girar el eje indicado. Sigamos al motor a través de un ciclo y comparemos el movimiento del émbolo con el recorrido por los puntos del diagrama P-v del ciclo. El sistema termomecánico está inicialmente con el fluido en el estado 1. Después se interpone un conductor térmico perfecto entre la máquina y la fuente de calor y esta energía se transfiere en forma constante hasta que el fluido alcanza el estado 2. Luego se coloca un aislante ideal entre el depósito térmico y el motor y continua el proceso hasta llegar al estado 3. Se inserta ahora un conductor térmico perfecto entre la máquina y el resumidero de calor, para que la energía térmica sea cedida a temperatura constante, llevando a la máquina al estado 4. A fin de hacer regresar el fluido al estado 1 parte de la energía desarrollada como trabajo, cuando se pasa de 1 a 3, tiene que devolverse a la máquina mediante la compresión del fluido del estado 4 al estado 1. Esta compresión debe ser adiabática reversible, de modo que entre la máquina y los depósitos térmicos se interpone un aislante térmico perfecto, y el fluido es comprimido hasta alcanzar el estado 1. El ciclo culmina cuando la máquina regresa al punto de partida, habiéndose desarrollado trabajo. Puede existir una máquina con mejor rendimiento que el de Carnot? Cap 11 Segunda Ley - Pág. 8 Termodinámica para ingenieros PUCP Importancia de la Máquina Ideal de Carnot: Permite convertir (teóricamente) la energía térmica suministrada (calor), en la máxima cantidad de energía mecánica posible (trabajo). Ningún otro motor o dispositivo termomecánico funciona con más eficiencia entre dos depósitos térmicos de temperatura constante, aún cuando puede ser posible diseñar máquinas con la misma eficiencia que el motor Carnot. Es deseable obtener una expresión para la eficiencia térmica o termodinámica de un motor , y ver qué factores influyen en ella. Bastan dos temperaturas diferentes para que pueda existir una màquina termodinàmica. El rendimiento máximo es n = 1 - TB/TA Carnot es la màquina màs perfecta que existe, no puede haber algo mejor que ella. Aprovecharemos èsto para comparar nuestros diseños con Carnot, si los rendimientos salen mayor entonces es imposible que funcione nuestra màquina www.soton.ac.uk Si el ser humano fuera la fuente caliente de energía, con qué rendimiento podría funcionar un corazón articial? Motor Stirling Cuál sería el rendimiento de una Central Geotérmica o del Fondo del mar si las temperaturas son : TA TB Cap 11 Segunda Ley - Pág. 9 Cap 11 Segunda Ley - Pág. 10 Termodinámica para ingenieros PUCP 11.4 Ciclo Carnot negativo CICLO INVERTIDO DE CARNOT: (REFRIGERADOR CARNOT) El motor Carnot es una máquina productora de potencia que recibe calor como energía entrante y entrega trabajo mecánico como energía saliente. Cuando se invierte el ciclo de Carnot, ello significa que el trabajo mecánico es ahora energía de entrada y que puede hacer fluir calor de un cierto nivel de energía (temperatura) a otro. Un ejemplo de eso son las refrigeradoras, las cuales funcionan de la siguiente manera: La energía mecánica la suministra un motor eléctrico que impulsa un compresor, y el refrigerante (la sustancia de trabajo) absorbe o toma calor del interior del espacio refrigerado, a temperatura baja, y lo entrega o descarga a temperatura alta en los serpentines de condensación colocados en la parte externa del sistema frigorífico. Este ciclo termodinámico inverso presenta exactamente los mismos procesos que el ciclo de Carnot directo (o de potencia), sólo que ahora el ciclo se efectúa en sentido antihorario. (TB) (TA) (1-2): (2-3): expansión adiabática reversible expansión isotérmica reversible (3-4): (4-1): compresión adiabática reversible compresión isotérmica reversible El propósito de una máquina de Carnot de ciclo inverso consiste en retirar o extraer cierta cantidad de calor a baja No te olvides que las temperaturas deben de ser absolutas, o sea en grados Kelvin Cap 11 Segunda Ley - Pág. 11 11a. 5.- ENUNCIADOS DE LA SEGUNDA LEY : La segunda ley así como la primera, es una consecuencia de la experiencia y la lógica. Se funda en el trabajo de Carnot. Nunca se ha formado un fenómeno macroscópico que no cumpla la segunda ley. 1. KELVIN-PLANCK Es imposible construir un dispositivo termodinámico (máquina con un depósito de calor) que operando cíclicamente, transforme íntegramente el calor que recibe de una fuente de temperatura uniforme (depósito de calor), en trabajo. Esta tiene que descargar o ceder parte de su calor. Debido a esto, la segunda ley generalmente es conocida como: Ley de la Degradación de la Energía. Ejm: Central Térmica a Vapor Lo contrario, es decir el trabajo se puede transformar enteramente en calor (trabajo de fricción) Ejm: Central Térmica a Gas. Una màquina puede servir como ciclo positivo como negativo, es el caso de una refrigeradora para calefacciòn Cap 11 Segunda Ley - Pág. 12 Termodinámica para ingenieros PUCP 2. CLAUSIUS Es imposible que el calor pase, por si sólo, desde una región de menor temperatura hasta otra de mayor temperatura. Lo contrario si puede suceder. El calor se transfiere por si mismo de un lugar con una T más alta a un lugar con un T más baja. NOTA: Los enunciados se basan en la experiencia y no pueden demostrarse. Esta ecuación teórica no será utilizada en este curso; sólo usaremos fórmulas prácticas para el cálculo de la Segunda Ley. Ejemplos de esquemas que pueden funcionar o no. Mayor explicación en el libro de Levenspiel [ref 2]. NOTA: De no cumplirse la desigualdad de Clausius, significa que no se cumple la Segunda Ley de la Termodinámica, entonces no es posible realizar el ciclo. Cap 11 Segunda Ley - Pág. 13 COROLARIOS DE LA SEGUNDA LEY: PRIMER COLORARIO: Es imposible construir una máquina que funcione entre dos depósitos térmicos, con temperaturas distintas y uniformes, y que supere la eficiencia de una máquina reversible ideal que opere entre tales depósitos. Carnot. la demostracion de cada uno de estos corolarios es por el absurdo el calor no puede pasar de una temperatura baja a una alta !!..... va en contra de la segunda ley SEGUNDO COROLARIO: Todas las máquinas reversibles presentarán la misma eficiencia cuando operen entre los mismos dos depósitos térmicos de temperaturas constantes. aquí tampoco el calor puede subir desde una temperatura baja !! Cap 11 Segunda Ley - Pág. 14 Termodinámica para ingenieros PUCP 11.5 Entropía ENTROPIA 1. Todo sistema tiene entropía, mide el grado de desorganización microscópica, es decir muestra incertidumbre acerca del estado microscópico. 2. La entropía es una propiedad extensiva; la entropía de un sistema complejo es la suma de las entropías de sus partes. S = m×s 3. La entropía puede producirse, pero nunca destruirse. En consecuencia la entropía de un sistema aislado adiabático nunca puede disminuir. ∆Suniverso = ∆S sistema + ∆S ambiente ≥ 0 4. La entropía de un sistema que existe siempre en estado microscópico único es igual a cero. (0°K) s = 0, a 0°K (ésta se considera la Tercera Además: - - Ley de la Termodinámica) Proceso reversible : es aquel que no produce entropía. Proceso irreversible : es aquel que produce entropía. S = f(U,V) Cap 11 Segunda Ley - Pág. 15 11.6.- Cambio de Entropía en el Universo: ∆Ssistema + ∆Sambiente ≥ 0 ∆Ssistema = ∆SA + ∆SB Donde: d Q Siempre: TA > TB TA TB ∆SA = d Q d Q A = − TA TA ∆SB = d Q d Q B = TB TB d Q d Q 1 1 ≥ 0 Q = d − TA TB TB TA ∆ST = ∆SA + ∆SB = ∆Ssistema + ∆Sambiente ≥ 0 ∆ST = − + Si es adiabático: Si NO es adiabático ∆S ambiente = 0 S = dQ/ To AP −V = W Además: Qué sucede con la entropía cuando TA es igual a TB ? Qué pasará con la entropía en el fin del mundo (?) AT − S = Q ∑W = ∑Q En un ciclo: AP −V = AT − S dQ = T dS dq = T ds dQ = m T ds Cap 11 Segunda Ley - Pág. 16 Termodinámica para ingenieros PUCP Diagrama T-s H2 0 H20 Diagrama h - s Mollier Cap 11 Segunda Ley - Pág. 17 - d u Para Gases Ideales: T = cv d d h T = c pd P v = R T d q = d u + Pdv = Tds Tds = c v d T + Pdv d T P v + d T T d T d v d s = cv +R T v Luego tenemos: d s = cv T s 2 − s1 = c v L n 2 T1 v + RLn 2 v1 Si v = cte (líquido incompresible) T s 2 − s1 = c v L n 2 T1 Además: d q =d h − vdP = Tds Tds = c p d T − vdP T v d d s = cp P − d T T Además : P v =R T T P d d d s = cp − R T P Luego tenemos: T P s 2 − s1 = c p L n 2 − RLn 2 T1 P1 Si P = cte T s 2 − s1 = c p L n 2 T1 Cómo se calcula el Calor y el Trabajo en este diagrama T -S ? Este es el diagrama T -s de un ciclo de carnot, un rectangulo Cap 11 Segunda Ley - Pág. 18 Termodinámica para ingenieros PUCP 11.8 Problemas Ejemplo: Carlos dice que ha construido un compresor adiabático que comprime aire desde las siguientes condiciones iniciales: P1 = 1bar, T1 = 25° C hasta P2 = 10 bar, T2 = 100° C. ¿Está loco o no? ¿Funciona o no?. Considere el aire como gas ideal. ∆S ≥ 0 Adiabático : ∆S ambiente = Q1 − 2 T0 ¿ ∆ST = ∆S sistema + ∆S ambiente ≥ 0 ? T s 2 − s1 = c p L n 2 T1 s2 P − RLn 2 P1 0 373 1 − s1 = 1.0035 L n n − 0.287 L 298 1 s 2 − s1 = −0.435 kJ / kg °K < 0 Sí está loco. La entropía no puede disminuir. ¿Cuál debe ser la presión y temperatura máxima para que empiece a funcionar? Cap 11 Segunda Ley - Pág. 19 ∆Ssistema + ∆Sambiente ≥ 0 ∆Ssistema = ∆SA + ∆SB error? -0.06 kJ/kg < 0 Cap 11 Segunda Ley - Pág. 20 Termodinámica para ingenieros PUCP 11.9.- Rendimiento Isoentrópico ( o adiabático) Es una medida de la eficiencia de alguna máquina que no opera cíclicamente; es decir, siguiendo un proceso adiabático. a) Máquinas Propulsoras: las que proporcionan trabajo técnico. Wt (+) Turbina a Vapor: Sustancia Pura:Vapor de H2O Turbina adiabática: Q 1 − 2 = 0 = cte m Cómo se halla el punto 2 ‘ en un diagrama T -s ? y en un diagrama de Mollier h -s ? Es verdadero o falso que P2 = P2´ ? Los valores del Rendimiento isoentrópico son DATOS cuando las máquinas ya están construídas. Esto se halla de libros técnicos como el Maual del Ing. mecánico (MARKS,HUTTE, DUBBEL) ó el manual del Ing. Químico de PERRY. Estos libros se encuentran en la Biblioteca FACI. Cap 11 Segunda Ley - Pág. 21 Si ya no tengo el diagrama T-s ó h-s, cómo entonces puedo trazar la recta vertical de 1 a 2 ´ ? Cap 11 Segunda Ley - Pág. 22 Termodinámica para ingenieros PUCP Wt (-) Verdadero o Falso las siguientes analogías Gases = Compresores Líquidos = Bombas Compresores = Poisson Turbinas = Poisson Cap 11 Segunda Ley - Pág. 23