Presentación de PowerPoint - U
Anuncio

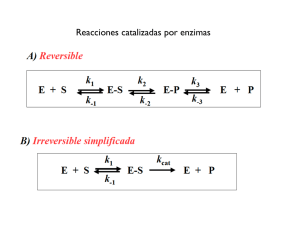
Clase 2: Termodinámica Catálisis Enzimática Prof: Angélica Reyes J PhD. Viernes 30 de marzo de 2012 Organización de la clase • • • • • • Concepto de Energía → Metabolismo. Leyes de la Termodinámica El ATP y procesos energéticos celulares. Reacciones acopladas Catálisis enzimática Importancia de las enzimas VIDA • La vida puede ser visto como un flujo constante de energía de los organismos para realizar el trabajo de: vivir, crecer, reproducirce, respuesta a estímulos y regulación interna. Metabolismo El conjunto de reacciones bioquímicas y procesos físico-químicos llevados a cabo por los sistemas vivos por el cual adquieren y utilizan la energía para llevar a cabo sus funciones: reproducirse, desarrollarse, mantener sus estructuras y crecer, Metabolismo Metabolismo: todas las reacciones químicas llevadas a cabo en el organismo Anabolismo: reacción química que requiere de energía Catabolismo: reacción química que libera energía Metabolismo Metabolismo: todas las reacciones químicas llevadas a cabo en el organismo La Energía: Anabolismo: reacción química ¿Qué es?que requiere de energía ¿Cómo los organismos la capturan, la almacenan y la usan? Catabolismo: reacción química que libera energía Concepto de Energía Energía: La capacidad de hacer un trabajo -energía cinética: la energía del movimiento -energía potencial: la energía almacenada Energía puede tomar diferentes formas: mecánica calor corriente eléctrica luz 7 Cómo se obtiene la Energía? La energía fluye en el mundo biológico desde el sol, el cual ilumina constantemente la tierra. • Plantas, algas y algunas bacterias capturan una fracción de esta energía a través de la fotosíntesis • La fotosíntesis, es la energía solar usada para combinar pequeñas moléculas (H2O, CO2) y producir moléculas más complejas (azúcares) • La energía es almacenada como energía potencial en los enlaces covalentes entre los átomos en las moléculas de azúcar • Flujo de Energía La energía Potencial almacenada en los enlaces químicos puede ser transferida desde una molécula a otra mediante flujo de electrones. Oxidación: pérdida de electrones Reducción: ganancia de electrones Reacciones redox: ambas son acopladas. Reacción Redox Pérdida de electrones (oxidación) Ganancia de electrones (reducción) Reacciones redox y Sistemas biológicos Las reacciones de óxido reducción desempeñan un papel clave en el flujo de la energía a través de los sistemas biológicos, porque los electrones pasan de un átomo a otro llevando energía con ellos • Las transformaciones de energía están sujetas a las leyes de la Termodinámica Leyes de la Termodinámica Primera Ley de la Termodinámica – La energía del universo no puede ser creada ni destruída (se mantiene constante) -La energía sólo puede ser convertida desde una forma a otra. Por ejemplo: Energía solar Energía química fotosíntesis 13 Leyes de la Termodinámica Segunda Ley de la Termodinámica: el desorden es mas probable que el orden (el universo tiende al desorden o caos) Entropía: desorden en el universo La 2nd Ley de la Termodinámica establece que la entropía está siempre aumentando. 14 15 Leyes de la Termodinámica Energía Libre: es la energía disponible para hacer un trabajo -Se denota por el símbolo G (Energía libre de Gibb’s) Entalpía: energía contenida en los enlaces químicos de una molécula Energía Libre = entalpía – (temp. x entropía) G = H - TS La energía Libre • • • • • • Indica la máxima cantidad de energía de un sistema que está disponible para hacer el trabajo. Indica si una reacción se producirá espontáneamente o no. Una reacción espontánea es aquella que se producirá sin energía adicional. En un proceso espontáneo, hay una disminución global de la energía libre. Una temperatura más elevada aumenta el cambio. Una mayor energía cinética de las moléculas tiende a perturbar el orden como las posibilidades de incremento de colisiones al azar. Los sistemas de alta energía, incluyendo sistemas de alta energía química, son inestables y tienden a cambiar a un estado más estable con una menor energía libre. Energía Libre y Metabolismo Las reacciones químicas pueden ser descritas por la transferencia de la energía que ocurre: Reacción endergónica: una reacción requiere un input de energía - ∆G es positivo Reacción exergónica: una reacción que libera energía. - ∆G es negativo 18 Reacción Endergónica Los productos almacenan mas energía libre que los reactante La reacción es energéticamente cuesta arriba Reacción no espontánea (requiere aporte de energía) Reacción Exergónica Los productos almacenan menos energía libre que los reactante La reacción es energéticamente cuesta abajo Reacción espontánea (no requiere aporte de energía) ATP: Fuente de energía celular • El ATP es la fuente inmediata de energía que impulsa el mayor trabajo celular, incluye: – Trabajo mecánico: como el latido de los cilios, la contracción muscular, el flujo citoplasmático, y movimiento de los cromosomas durante la mitosis y la meiosis. – Trabajo de transporte: tales como el bombeo de sustancias a través de membranas. – Trabajo químico: tales como procesos endergónicos de polimerización. Energía almacenada en las células ATP = adenosina trifosfato -es la energía “almacenada” de las células Estructura del ATP : -ribose, una azúcar de 5-carbonos -adenina -tres fosfatos Energía almacenada en las células ATP almacena energía en los enlaces entre los fosfatos . Fosfatos son moléculas altamente negativas, entonces: -Los fosfatos se repelen cada uno de otro. -Mucha energía es requerida para mantener los fosfatos unidos uno al otro. -Mucha energía es liberada cuando los enlaces entre los fosfatos se rompen. Energía almacenada en las células Cuando el enlace entre los fosfatos se rompe : ATP ADP + Pi energía es liberada ADP = adenosina difosfato Pi = fosfato inorganico Esta reacción es reversible. Cómo el ATP realiza el trabajo • La hidrólisis exergónica del ATP se acopla con los procesos endergónicos mediante la transferencia de un grupo fosfato a otra molécula. • La transferencia deelfosfato controlada enzimáticamente. El ATP es poderestá celular de trabajo mediante el • La molécula de la adquisición fosfato (fosforilado acoplamiento de del reacciones exergónicasoyintermediario activo) se convierte en más reactivo. endergónicas • La célula utiliza la energía química de las moléculas. • Mediante el mecanismo de las reacciones acopladas, la célula puede realizar procesos endergónicos con excedente de energía. • El metabolismo intermediario aprovecha las reacciones exergónicas para realizar procesos endergónicos. • Los procesos de oxido-reducción también pueden aportar energía utilizable metabolicamente. • Evolutivamente el ATP es la “moneda” de intercambio energético en todos los seres vivos • Alternativamente el GTP también puede aportar energía a procesos endergónicos Reacciones acopladas En la célula, la energía liberada o que se hace disponible en una reacción exergónica (que libera energía), es utilizada para mover otras reacciones endergónicas ( que consumen energía), en otras palabras la energía es utilizada para realizar trabajo. Leyes de la Termodinámica: cómo se lleva a cabo una reacción La mayoría de las reacciones requiere de energía para comenzar. Energía de activación : energía extra necesaria para que la reacción comience -desestabiliza los enlaces químicos existentes -es requerido incluso para reacciones exergónicas Catalizador : substancias que disminuyen la energía de activación de una reacción. - Reducción de entropía - Desolvatación - Se compensa tensión o distorsión del sustrato - Consigue alineamiento entre grupos funcionales catalíticos de la enzima (E) y el sustrato (S). 28 Vías de una reacción 30 Qué hacer para que una reacción vaya mas rápida • El aumento de la temperatura, hace que las moléculas se mueven más rápido. • Los sistemas biológicos son muy sensibles a los cambios de temperatura. • Las enzimas pueden aumentar la velocidad de las reacciones, sin aumentar la temperatura. • Las enzimas lo hacen mediante la reducción de la energía de activación. • Crean un nuevo camino de reacción "un atajo" Catálisis Enzimática La CATÁLISIS ENZIMÁTICA es esencial para los sistemas vivos. La mayoría de las Reacciones Químicas ocurrirían muy lento en condiciones biológicamente significativas. • Hace posible que en condiciones fisiológicas tengan lugar reacciones que sin catalizador requerirían condiciones extremas de presión, temperatura o pH. • Las biomoléculas son muy estables a pH neutro, temperatura suave y ambiente acuoso • • Qué es una enzima? Enzimas: son moléculas que catalizan reacciones en células vivas. - Es una proteina * con actividad catalítica debido a su poder específico de activación - Menor energía de activación es necesaria para llevar a cabo una reacción - No son modificadas o consumidas por la reacción. 33 Las enzimas aceleran las reacciones decreciendo la energía de activación (Go‡ o Ea) Enzima Las reacciones controladas por enzimas ocurrirán 108 a 1011 veces más rápido que las correspondientes reacciones no enzimáticas. Estructura de las enzimas • Las enzimas son proteínas* • Tienen una forma globular • Forma un complejo de estructura 3-D • Si se desnaturaliza o disocia subunidades pierde su actividad. • Estructuras 1°, 2°, 3° y 4° son esenciales en Amilasa pancreática humana El sitio activo © H.PELLETIER, M.R.SAWAYA ProNuC Database • Una parte de una enzima, el sitio activo, es particularmente importante. • Por lo general se encuentran en las hendiduras y grietas de la proteína. Evitando disolventes que de otro modo podrían reducir la actividad catalítica de la enzima. • La forma y el entorno químico dentro del sitio activo permite que una reacción química proceda con mayor facilidad • Los aminoácidos y cofactores se mantienen en disposición precisa con respecto a la estructura del sustrato. Co factores Enzima nitrogenasa con los co-factores: Fe, Mo y ADP Jmol from a RCSB PDB file © 2007 Steve Cook H.SCHINDELIN, C.KISKER, J.L.SCHLESSMAN, J.B.HOWARD, D.C.REES STRUCTURE OF ADP X ALF4(-)-STABILIZED NITROGENASE COMPLEX AND ITS IMPLICATIONS FOR SIGNAL TRANSDUCTION; NATURE 387:370 (1997) • Un molécula adicional (no proteína) necesaria para ayudar a algunas enzimas a llevar a cabo la reacción. • Cofactores fuertemente unidos se llaman grupos prostéticos • Cuando el cofactor es una molécula orgánica se llama coenzima (cofactores que se unen y se liberan fácilmente) • Muchas vitaminas son coenzimas Cofactores - Coenzimas • Muchas de estas coenzimas se sintetizan a partir de vitaminas. • Cuando los cofactores y las coenzimas se encuentran unidos covalentemente a la enzima se llaman grupos prostéticos. • La forma catalíticamente activa del enzima, es decir, el enzima unida a su grupo prostético, se llama holoenzima. La parte proteica de un holoenzima (inactiva) se llama apoenzima, de forma que: apoenzima + grupo prostético= holoenzima Cofactores enzimáticos Coenzimas: NAD+, NADP+, NADH, NADPH, FAD, FADH+, FADH2,FMN, FMNH+, FMNH2, PIRIDOXAL FOSFATO, TIAMINA PIROFOSFATO, ACIDO ASCORBICO, ACIDO PANTOTENICO • Metales y iones: HIERRO, ZINC, COBRE, NIQUEL, SELENIO, CALCIO, MAGNESIO, MANGANESO, SODIO, POTASIO, CLORURO, IODURO, • Coenzima: NAD+ Deriva de la Vitamina B5 (ácido nicotínico) Los Sustratos • El sustrato de una enzima son los reactivos que se activan por la enzima. • Las enzimas son específicas para sus sustratos. • La especificidad está determinada por el sitio activo El ciclo catalítico de la enzima sucrasa que degrada el azúcar (sucrosa) en glucosa y fructosa I. Cómo se une el sustrato al sitio catalítico Hipótesis de llave y cerradura • El ajuste entre el sustrato y el sitio activo de la enzima es exacto. • Al igual que una llave encaja en una cerradura de forma muy precisa. • La clave es análoga a la enzima y el sustrato análoga a la cerradura. • La estructura temporal formada es llamada el complejo enzima-sustrato. • Los productos son diferentes al sustrato, una vez formados, son liberados desde el sitio activo, dejándolo libre para apegarse a otro substrato Modelo de unión Enzima-Sustrato de llave cerradura Hipótesis de llave y cerradura S Esto explica: • La especificidad de las enzimas. • La pérdida de actividad cuando las enzimas son denaturadas. E E E Complejo enzimasustrato Enzima puede ser usada nuevamente P P Reaction coordinate Coordenada de reacción II. Cómo se une el sustrato al sitio catalítico La hipótesis del ajuste inducido • Algunas proteínas pueden cambiar su forma (conformación). • Cuando un sustrato se une a una enzima, esto induce un cambio en la conformación de la enzima. • El sitio activo es entonces moldeado dentro de una precisa conformación. • Este cambio favorece un entorno químico adecuado para la reacción. • La unión del sustrato a la enzima es estrecha, lo que facilita la reacción (baja energía de activación). Modelo de unión Enzima-Sustrato de anclaje inducido Concepto de sitio activo según hipótesis del anclaje inducido Hexokinasa (a) sin (b) con el substrato glucosa http://www.biochem.arizona.edu/classes/bioc462/462a/NOTES/ENZYMES/enzyme_mechanism.html Esto explica que las enzimas pueden reaccionar con una variedad de sustratos de similar tipo. Nomenclatura Hay varias formas de nombrar una enzima: • nombres particulares • nombre sistemático • código de la comisión enzimática (enzyme comission) Clasificación Internacional de las enzimas Clases de enzimas: 1. OXIDOREDUCTASAS transferencia de electrones (Ox-red) 2. TRANSFERASAS transferencia de grupos químicos 3. HIDROLASAS reacciones de hidrolisis 4. LIASAS adición a dobles enlaces 5. ISOMERASAS transforman isomeros 6. LIGASAS formación de enlaces covalentes (gasto de ATP) El nombre de la enzima tiene 2 partes la 1ª es el nombre de el o los substratos la 2ª con terminación asa indica el tipo de reacción que cataliza. Nombres de enzimas • Ureasa (hidrólisis de urea). • Transaminasa (transiere grupos amino desde una molécula a otra). • RNA polimerasa (formación de RNA por polimerización). • Pero también hay enzimas que han sido nombradas previo a este regla, por ejemplo: pepsina y tripsina. Cinética Enzimática • La cinética enzimática estudia la velocidad de las reacciones catalizadas por enzimas. • Estos estudios proporcionan información directa acerca del mecanismo de la reacción catalítica y de la especifidad del enzima. • La velocidad de una reacción catalizada por un enzima puede medirse con relativa facilidad, ya que en muchos casos no es necesario purificar o aislar el enzima. La medida se realiza siempre en las condiciones óptimas de pH, temperatura, presencia de cofactores, etc, y se utilizan concentraciones saturantes de sustrato. • En estas condiciones, la velocidad de reacción observada es la velocidad máxima (Vmax). • La velocidad puede determinarse bien midiendo la aparición de los productos o la desaparición de los reactivos. Catálisis enzimática • • La enzima disminuye la barrera de activación en comparación con la reacción acuosa no catalizada En la mayoría de casos, la interacción inicial es no covalente (ES): formación de puentes de hidrógeno, interacciones electrostáticas, hydrofóbicas y la fuerza de van der Waals. ES: el grupo catalítico una parte integral de la misma molécula, la reacción de enzima unido a sustrato seguirá una cinética de primer orden mas que una cinética de segundo orden. E + S --> ES --> [EX*] --> EP --> E + P (weak) Complejo activado Cómo funcionan los catalizadores • Los enzimas disminuyen la energía de activación de las reacciones a) Reacción Energía de activación (Kcal*mol-1) el peróxido de hidrógeno se descompone en: H2 O2 H2 O + O2 18 b) el hierro catalítico (Fe) realiza la reacción 13 H2O2 H2 O + O2 c) el platino catalítico (Pt) realiza la reacción : H2O2 H2 O + O2 d) la catalasa una enzima hepática la realiza H2O2 12 H2O + O2 5 Catálisis enzimática • Cambios en la energía libre ∆GB. Favorable interacción entre la enzima y substrato resulta en una energía intrínseca favorable . • Entropía es perdida cuando el substrato se une a la enzima. (a) Dos entidades llegan a ser una. (b) El sustrato es menos capaz de rotar. (c) El sustrato está mas ordenado. • La interacción débil entre enzimasustrato es optimizada y estabilizada en el estado de transición. E + S --> ES --> [EX*] --> EP --> E + P (weak) (stronger) MODELO CINÉTICO DE MICHAELIS-MENTEN v = v3 = k3 [ES] = La velocidad V indica el número de reacciones por unidad de tiempo que son catalizadas por la enzima. MODELO CINÉTICO DE MICHAELIS-MENTEN CÁLCULO DE LA KM Y DE LA Vmax DE UN ENZIMA V = velocidad de la reacción catalizada por la enzima MODELO CINÉTICO DE MICHAELIS-MENTEN CÁLCULO DE LA KM Y DE LA Vmax DE UN ENZIMA La representación gráfica de la ecuación de Michaelis-Menten es una hipérbola. La Vmax corresponde al valor máximo al que tiende la curva experimental, y la KM corresponde a la concentración de sustrato a la cual la velocidad de la reacción es la mitad de la Vmax. MODELO CINÉTICO DE MICHAELIS-MENTEN CÁLCULO DE LA KM Y DE LA Vmax DE UN ENZIMA Para determinar gráficamente los valores de KM y Vmax es más sencillo utilizar la representación doble recíproca (1/v0 frente a 1/[S]0), ya que es una línea recta. Esta representación doble recíproca recibe el nombre de representación de Lineweaver-Burk Cinética de la Catálisis Enzimática Significado de KM KM es la concentración de sustrato para la cual la velocidad de reacción es la mitad de la velocidad máxima. El valor de KM da idea de la afinidad del enzima por el sustrato: a menor KM, mayor afinidad del enzima por el sustrato, y a mayor KM, menor afinidad. Cinética de la Catálisis Enzimática Factores que afectan la velocidad de reacción • • • • • Concentración de enzima Concentración de sustrato pH Temperatura Inhibidores Efecto de la variación de la concentración de la enzima En condiciones de concentración de S hasta la saturación, pH y temperatura constante se observa que • En reacciones no enzimáticas, la velocidad de reacción es proporcional a la concentración de sustrato Veloc de reacción Concentración de sustrato Conc de sustrato • En reacciones enzimáticas, la velocidad inicial es rápida pero alcanza un punto de saturación cuando todas las moléculas de enzimas están ocupadas Si se altera la concentración de la enzima, entonces la velocidad máxima cambiará. Vmax Veloc reacción • Conc de sustrato El efecto del pH pH extremos pueden producir denaturación de las enzimas (Las enzimas poseen grupos químicos ionizables en las cadenas laterales de sus aminoácidos: carboxilos -COOH; amino -NH2; tiol -SH; imidazol, etc.) • La estructura de la enzima es modificada • El sitio activo es distorcionado y las moléculas de sustrato no se unirán fuertemente a el. • A valores de pH ligeramente diferente del valor óptimo de la enzima, se pueden producir pequeños cambios en la carga de a enzima y su sustrato . Este cambio en la ionización afectará a la unión del sustrato con el sitio activo. • El efecto del pH Actividad enzimática Valores de pH óptimos Tripsina Pepsina 1 3 5 7 pH 9 11 Ejemplos de pH óptimo pH Optimum Enzima pepsin sucrase catalase arginase alkaline phosphatase Fuente pH gastric mucosa intestine liver beef liver bone 1.5 6.2 7.3 9.0 9.5 El efecto de la temperatura Q10 (coeficiente de temperatura) = el incremento en la velocidad de reacción al aumentar 10°C la temperatura. • Las reacciones químicas tienen un Q10 = 2 a 3 (la velocidad de reacción se duplica o triplica con un aumento de 10°C en temperatura) • Las reacciones controladas por enzimas siguen esta regla como las reacciones químicas • Sin embargo, a temperaturas altas las enzimas se denaturan. • La temperatura óptima para una enzima, se define como el balance entre el Q10 y la denaturación. • Actividad enzimática El efecto de la temperatura Q10 0 10 20 30 40 Temperatura / °C Denaturación 50 El efecto de la temperatura • Para la mayoría de las enzimas, la temperatura óptima es alrededor de los 30°C • Para muchas la temperatura óptima es más baja Ej. los peces de agua fría va a morir a 30 ° C, ya que sus enzimas se desnaturalizan. • Algunas bacterias tienen enzimas que pueden soportar temperaturas muy altas de hasta 100 ° C. • La mayoría de las enzimas son, sin embargo, totalmente desnaturalizadas a 70 ° C. Inhibidores • Los inhibidores son sustancias químicas que reducen la velocidad de las reacciones enzimáticas. • Suelen ser específicos y trabajan a bajas concentraciones. • Bloquean la enzima, pero por lo general no la destruyen. • Muchos fármacos y venenos son inhibidores de enzimas en el sistema nervioso. Inhibidores competitivos Inhibidores no competitivos Inhibidor competitivo Los inhibidores competitivos se unen a la enzima en el mismo sitio donde se une el sustrato compitiendo por el sitio activo • Dada cualquier concentración de inhibidor la inhibición puede ser disminuida incrementando la concentración del sustrato • Inhibidor no competitivo Los inhibidores no competitivos se unen a la enzima en un sitio diferente al sitio activo • Alteran la forma de la enzima y reducen su afinidad por el sustrato • La inhibición es independiente de la concentración de sustrato • Regulación de la actividad enzimática • Las enzimas son reguladas por las células • Las células usan diversos métodos para controlar cómo y cuándo trabaja una enzima. – Regulación alostérica: la unión del ligando modula la unión del sustrato y la catálisis – Modificaciones covalentes - Reversible: Fosforilación, nucleótidos, lípidos anclados. – Retroalimentación (feedback): regula las vías metabólicas – La proteólisis convierte a proteínas inactivas en activas Regulación: Metabolismo y Catálisis enzimática • Vias Bioquímicas son una serie de reacciones en las cuales el producto de una reacción llega a ser el sustrato para la reacción siguiente. • Las Vías Bioquímicas son a menudo reguladas por una inhibición por retroalimentación (feedback negativo) en el cual, el producto terminal de la vía es un inhibidor alostérico de una enzima temprana que participa en la vía. Proenzimas (Zimógenos) • Enzimas fabricadas en forma inactiva Se activan cuando una pequeña parte de la cadena polipéptidica es removida. Hormonas, Enzimas digestivas, Enz de coagulación de la sangre Enzimas intracelulares (∼3000) Enzimas Extracelulares (∼200) Isoenzimas • Diferentes enzimas que realizan el mismo tipo de función en diferentes tejidos u órganos. El estudio de las enzimas tiene una gran importancia práctica • Muchas enfermedades genéticas son causadas por una deficiencia o la ausencia total de una o más enzimas. Por ejemplo: la fenilcetonuria-PKU (carencia de la enzima fenilalanina hidroxilasa). • Las mediciones de las actividades de las enzimas (en la sangre o tejidos) son importantes en el diagnóstico de ciertas enfermedades . Por ejemplo, las transaminasas y daño hepático. • Las enzimas son objetivos importantes de drogas . La aspirina inhibe la ciclooxigenasa de la biosíntesis de prostaglandinas. • Las enzimas se utilizan ampliamente en la industria química y procesamiento de alimentos.