ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA
Anuncio

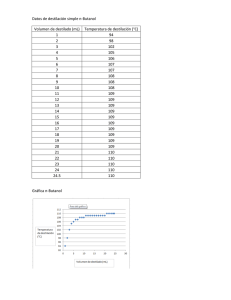
ASIGNATURA: QUIMICA AGROPECUARIA (RB8002) GUÍA N°1: “DESTILACION DE DISOLUCIONES” I. Presentación de la guía: Competencia: El alumno será capaz de ejecutar una técnica de separación y purificación de soluciones que se utiliza frecuentemente en los laboratorios de química y en la industria de licores destilados y en la separación de numerosos compuestos orgánicos. Evaluación: La evaluación de esta guía tiene carácter formativo lo que permitirá detectar el dominio de los objetivos planteados. Metodología: El docente organizará grupos de trabajo para desarrollar las actividades propuestas. Posteriormente el alumno confeccionará un informe de los resultados obtenidos que será adjuntado en el portafolio semestral. II. Resumen Teórico: Una mezcla es una muestra de materia que contiene más de una sustancia y sus componentes pueden presentarse en variadas proporciones relativas. Si la mezcla consiste de una fase, es decir, presenta uniformidad en toda su extensión, estamos frente a una mezcla homogénea o disolución, por ejemplo, el aire es una mezcla homogénea formada por varios gases, y una mezcla de azúcar y agua es una disolución. Si la mezcla presenta más de una fase se denomina mezcla heterogénea. La mayoría de las rocas y minerales en la corteza terrestre son mezclas heterogéneas complejas de muchas sustancias químicas diferentes. El objetivo de las separaciones analíticas es aislar la sustancia de interés analítico, analito, de otras sustancias acompañantes denominadas interferentes, los que pueden estar presentes tanto en mezclas homogéneas como heterogéneas. Con frecuencia para lograr este objetivo es necesario aplicar más de una técnica de separación. La elección de una de ellas depende de las propiedades físicas y/o químicas que presenten los componentes de la mezcla. Las técnicas de separación mecánicas se fundamentan en diferencias entre las propiedades físicas de los componentes de una mezcla, tales como: Punto de ebullición, densidad, presión de vapor, punto de fusión y solubilidad. Los métodos más conocidos son: Filtración Decantación Extracción Sublimación Destilación Una mezcla de líquidos con distintos puntos de ebullición, puede separarse de sus componentes, por destilación. Está técnica consiste en calentar lentamente la mezcla en un balón de destilación conectado a un tubo refrigerante hasta una temperatura donde el componente más volátil (el de menor punto de ebullición) comienza a evaporarse; si es un líquido cuando alcance nuevamente la temperatura ambiente al pasar a través de la columna fría condensara y puede ser recibido en un recipiente a parte. Destilación de disoluciones (RB8002). Documento preparado por Marcela Urrutia Castro. Docente Sede La Serena. Página 1 de 6 Durante todo este proceso la temperatura permanece sin grandes variaciones en el punto de ebullición de este líquido, y cambiara rápidamente a otro valor superior (la temperatura de ebullición del otro líquido) donde vuelve a permanecer fija si existe un segundo componente volátil. En estas condiciones destila el otro componente de la mezcla. Las sustancias no volátiles, permanecen en el líquido del balón de destilación sin alcanzar la ebullición y quedan como residuo. La eficacia de este método dependerá de la diferencia de puntos de ebullición entre los componentes de la mezcla. La temperatura de destilación es constante para cada compuesto puro. La destilación se fundamenta en los procesos físicos de evaporación, condensación, presión de vapor y ebullición. Evaporación: La evaporación o vaporización es el proceso por el cual las moléculas de la superficie del líquido se separan y pasan a la fase gaseosa. Para que las moléculas se separen deben poseer una energía cinética mínima. Mientras más alta es la temperatura, mayor es la fracción de moléculas que poseen esa energía mínima. La velocidad de evaporación depende de la volatilidad del líquido, de la superficie de evaporación y de la temperatura. Un aumento en la temperatura genera un aumento en la velocidad de evaporación. Algunas moléculas que pasaron a la fase vapor, pueden aun colisionar con la superficie líquida y ser capturadas. Este proceso, que es inverso de la evaporación, se denomina condensación, y es otro de los procesos físicos que fundamenta la destilación. Si la evaporación ocurre en un recipiente cerrado y a temperatura constante, el volumen del líquido disminuye y el número de moléculas gaseosas en la superficie aumenta. Presión de vapor o Tensión de vapor: Las moléculas de la fase vapor no pueden escapar cuando la vaporización ocurre en un recipiente cerrado. A medida que las moléculas abandonan la superficie del líquido, más moléculas de la fase gaseosa chocan con las paredes del recipiente y con la superficie del líquido, produciendo un aumento en la condensación. La presión parcial de las moléculas de vapor sobre la superficie de un líquido en equilibrio se llama presión de vapor del líquido. Debido a que generalmente la velocidad de evaporación aumenta y la velocidad de condensación disminuye a medida que aumenta la temperatura, la presión de vapor de los líquidos siempre aumenta cuando la temperatura se incrementa. A una misma temperatura, líquidos diferentes presentan presiones de vapor diferentes. Ebullición: Cuando se entrega calor a un líquido, aumenta la energía cinética de las moléculas y lo que se manifiesta es un aumento de la temperatura excepto en el punto de ebullición. La acción cuando un líquido se calienta a temperaturas suficientemente altas y a presión constante, las burbujas de vapor comienzan a subir a la superficie, y escapan pasando a la fase gaseosa en forma violenta. Este proceso de denomina ebullición y es fundamentalmente diferente de la evaporación. Si la presión de vapor es menor que la aplicada en la superficie del líquido, no se forman burbujas y la ebullición no ocurre. En toda destilación existen al menos tres fracciones distintas: Cabeza: corresponde a la fracción líquida que destila antes de llegar al punto de ebullición del líquido más volátil de la mezcla. Esta corresponde a una porción líquida con gran contenido de impurezas volátiles, incluso gases disueltos. Cuerpo: es la fracción de mayor interés y se recoge en un recipiente limpio, ya que corresponde a la porción de mayor volumen, donde la variación de temperatura del termómetro no puede superar los dos grados. Cola: es la fracción líquida que queda en el balón de destilación. Destilación de disoluciones (RB8002). Documento preparado por Marcela Urrutia Castro. Docente Sede La Serena. Página 2 de 6 Dependiendo de las propiedades de la mezcla a destilar y de los objetivos perseguidos existen varios tipos de destilación, entre las más utilizadas se encuentran: Destilación Simple. Destilación Fraccionada. Destilación por arrastre de vapor. Destilación Simple: El proceso de destilación se lleva en una sola etapa, es decir, se evapora el líquido de punto de ebullición más bajo y condensa por medio de un refrigerante. Este tipo de destilación se utiliza cuando la diferencia entre los puntos de ebullición de los componentes es grande, o cuando las impurezas son sólidos disueltos en el líquido a purificar. Es el método más utilizado en los trabajos experimentales de laboratorio y consiste en: un balón de destilación, adaptador, termómetro, refrigerante y un matraz erlenmeyer para recibir el destilado (ver figura N°1). Los objetivos perseguidos destilación simple son: por una - Separación de un líquido de otro. - Purificación de un líquido que contiene materias disueltas que lo colorean o enturbian. - Recuperación de solventes. - Determinación del punto de ebullición. Figura N°1: Equipo para destilación simple Destilación Fraccionada: La destilación fraccionada es una serie de destilaciones simples, que utiliza una columna fraccionadora, que permite separar líquidos con punto ebullición muy cercanos. La columna fraccionadora es un pre-condensador, ubicado entre el balón de destilación y el refrigerante. Su función es producir una segregación paulatina entre los componentes más volátiles y los menos volátiles de una mezcla de vapores, observándose una condensación parcial o fraccionada durante la trayectoria de los vapores por el interior de la columna. Es conveniente tener algún patrón para comparar las columnas de fraccionamiento, y esto es lo que generalmente se denomina plato teórico que es sencillamente, el efecto de una destilación simple. Si una columna efectúa una separación equivalente a seis destilaciones simples, se dice que tiene seis platos teóricos (ver figura N°2). En cada plato teórico se produce un equilibrio de vaporización-condensación. Destilación de disoluciones (RB8002). Documento preparado por Marcela Urrutia Castro. Docente Sede La Serena. Página 3 de 6 Figura N°2: Equipo para destilación fraccionada Destilación para arrastre de vapor: corresponde a la circulación de una corriente de vapor a través de la mezcla de reacción y los componentes que son solubles en el vapor son separados. Cuando dos líquidos son inmiscibles entre sí, esto es, insoluble el uno con el otro, las moléculas del líquido no están homogéneamente dispersas entre las moléculas del otro líquido. III. Actividad práctica: Destilación de vino. Determinación del grado alcohólico. IV. Objetivos: Obtención de sustancias puras por destilación. Estudiar los procesos involucrados en la destilación. Determinar el grado alcohólico de una muestra de vino. V. Materiales y reactivos: Equipo de destilación simple. Picnómetro. Fuente de calentamiento (mechero, plancha calefactora o manto calefactor) Soporte universal Pinzas de balón, garra y nuez. Mangueras Matraz de aforo 100 mL Balanza analítica o semianalitica Vaso de precipitado de 250 mL Varilla de agitación de vidrio Probeta de 100 mL Agua desionizada Vino, cerveza u otra bebida alcohólica Destilación de disoluciones (RB8002). Documento preparado por Marcela Urrutia Castro. Docente Sede La Serena. Página 4 de 6 VI. Procedimiento experimental Eliminar previamente el contenido de CO2 libre con agitación constante a través de una varilla de agitación. Adicionar 100 mL de la bebida alcohólica al balón de destilación y agregar 150 mL de agua desionizada. Añadir trozos de porcelana porosa, para evitar que la ebullición se realice violentamente. Instalar el equipo de destilación de la figura N°1. Comenzar la calefacción para producir una destilación lenta, pero sin interrupciones. Registrar la temperatura cuando comienza a destilar el alcohol. El destilado se recibe en un matraz de aforo de 100 mL, hasta que la temperatura de destilación cambia. El matraz de aforo, se enrasa con agua desionizada y se agita. Pesar el picnómetro vacio y seco. Completar el picnómetro con agua desionizada y se pesa. Completar el picnómetro con la disolución alcohólica destilada y se pesa. Registrar los datos en la tabla de resultados. VII. Cálculos: El peso específico del destilado será: Pesoespecíficodeldestilado = pesodeldestiladoen el picnómetro pesodelagua en el picnómetro Comparar el resultado de peso específico calculado, con la tabla alcoholimétrica y determine el grado alcohólico de la bebida alcohólica analizada. Destilación de disoluciones (RB8002). Documento preparado por Marcela Urrutia Castro. Docente Sede La Serena. Página 5 de 6 VIII. Resultados Registrar los datos obtenidos durante el procedimiento experimental en la siguiente tabla. Temperatura de destilación (°C) Peso del picnómetro vacio (g) Peso del picnómetro con agua desionizada (g) Peso del picnómetro con la disolución alcohólica destilada (g) Grado alcohólico de la bebida analizada IX. X. Post-Laboratorio: - Redactar un informe de los resultados obtenidos según pauta de evaluación de informes que aparece en la guía para el éxito académico 2009. Universidad tecnológica de ChileInacap. Sede la Serena. Pagina 54. - Investigue la aplicación de la técnica de destilación en la industria de bebidas alcohólicas nacionales. Bibliografía Química Ciencia Central, Brown, LwMay Bursten, Novena Edición. Editorial Pearson 2004. Química General, Raymond Chang, séptima edición. Editorial Mc Graw Hill 2002. http://www.panreac.com/new/esp/productos/practicas/practicas22.htm http://www.quimicaorganica.net/laboratorios/destilacion/destilacion.htm Destilación de disoluciones (RB8002). Documento preparado por Marcela Urrutia Castro. Docente Sede La Serena. Página 6 de 6

![practica 5[1]](http://s2.studylib.es/store/data/007425075_1-61f96af50a4c20310ac423e2aba15d52-300x300.png)