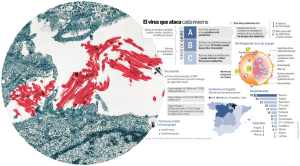
EVALUACIÓN DEL POTENCIAL DE CONTROL BIOLÓGICO
Anuncio

REPÚBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS DIVISIÓN DE ESTUDIOS PARA GRADUADOS MAESTRÍA EN MICROBIOLOGÍA EVALUACIÓN DEL POTENCIAL DE CONTROL BIOLÓGICO DE Xenorhabdus Y Photorhabdus SOBRE LA MONILIASIS DEL CACAO (Moniliopthora roreri) Trabajo de Grado Presentado como requisito para optar al grado de Magíster Scientiarum en Microbiología Autora: Lcda. Zuhey del Carmen Carrillo Villalobos Tutor. Dr. Ernesto San Blas Maracaibo, septiembre de 2014 AGRADECIMIENTOS A mi Señor, Jesús, quien me dio la fe, la fortaleza, la salud y la esperanza para terminar este trabajo. A mi padre y especialmente a mi madre, quienes me enseñaron desde pequeña a luchar para alcanzar mis metas. Mi triunfo es el de ustedes, ¡los amo! por estar ahí conmigo en todo momento apoyándome. No pude ser más bendecida. Sé que no es suficiente, pero !GRACIAS! A mi tutor Dr. Ernesto por su confianza, apoyo, paciencia, y responsabilidad. A los que nunca dudaron que lograría este triunfo: mis hermanos, sobrino, cuñadas y mi cuñado. Familia los amo y gracias por confiar en mí. A ti Yennis mi hermana tal vez no de sangre pero si de vida, amiga gracias por estar siempre a mi lado en las buenas y malas recorriendo este camino. A mi amigo Ríqui por su solidaridad y presencia en esos días y noches tan largos en el laboratorio. Dios te bendiga y te permita seguir siendo ese humilde servidor. Te quiero mucho. A Gísela Fuenmayor y Gisela Colina por ser excelentes guías, por su apoyo, confianza y amistad. Espero seguir contando con cada una de esas virtudes que poseen por mucho tiempo. Gracias por ayudarme a que esos días fueran más llevaderos. Octo a ti por llegar en los momentos más duros de soledad en el laboratorio y ser el amigo que siempre buscaba la solución a las dudas, gracias por ser el hombre de la casa como solíamos llamarte. A mi gran amigo Lester por su valiosa y gran ayuda. A todos y cada una de las personas que integran los Laboratorios de UIMA y el CAP especialmente al profe Jorge por su gran apoyo e importantes aportes y sugerencias durante el desarrollo de la metodología. A la Ing. Raisa Rumbos del laboratorio de fitopatología del INIA – Zulia estación Chama por su recepción y colaboración en el centro, para la obtención de los frutos para el aislamiento del hongo. Al Profesor Ysaias Alvarado y todo el personal del Laboratorio Electrónica Molecular por permitir realizar en sus instalaciones algunas de los experimentos. Chicos gracias a todos. A mis amichis Mayre y Nancy por todo su apoyo, colaboración y sugerencias durante la última pero no menos importante fase de la preparación, entrega final de los manuscritos y presentación del trabajo. A mi amiga Diomara, gracias mil gracias por apoyarme con la laptop sin esa herramienta mi labor hubiera sido titánica. Dios te bendiga. A todos las personas, que no resalto pero que llevo en mi corazón porque me han apoyado incondicionalmente. Zuhey Carrillo Villalobos. ÍNDICE DE CONTENIDO RESUMEN ABSTRACT INDICE DE FIGURAS INDICE DE TABLAS INTRODUCCIÓN 17 Ciclo de vida 19 Sintomatología 20 Manejo de la moniliasis del cacao 22 Xenorhabdus y Photorhabdus spp 25 Características de variantes de fases 26 Metabolitos producidos por Xenorhabdus y Photorhabdus spp 27 OBJETIVOS 28 METODOLOGÍA 29 Preparación de placas NBTA 30 Preparación de larvas Galleria mellonella para el aislamiento y cultivos de las bacterias 30 Preparación de curvas de crecimiento de Xenorhabdus y Photorhabdus 30 Preparación de Inóculos bacterianos y extractos libres de bacterias, método para Xenorhabdus y Photorhabdus 32 Aislamiento del patógeno Moniliophthora roreri 34 Índice antifúngico 34 Método para contar conidios 35 Efecto de las concentraciónes evaluadas de los Inóculos bacterianos y exudados sobre el crecimiento micelial de Moniliophthora roreri 35 Inhibición de crecimiento de Moniliophthora roreri en medio líquido 36 Análisis Estadístico 37 RESULTADOS Y DISCUSION 38 Curvas de Crecimiento 38 Índice antifúngico 42 Esporulación de Moniliophthora roreri 46 Efecto de las Concentraciones evaluadas de los inóculos bacterianos y exudados sobre el Crecimiento micelial de Moniliophthora roreri 48 Inhibición del crecimiento de Moniliophthora roreri en medio líquido 60 CONCLUSIONES 66 RECOMENDACIONES 67 INDICES DE REFERENCIAS 68 ANEXOS 72 INDICE DE FIGURAS No. Título Pág. 1 Curvas de crecimiento de la bacteria Xenorhabdus sp. (Cepa Cachiri) en condiciones de laboratorio durante 51 h de cultivo continuo 38 2 Curvas de crecimiento de la bacteria Xenorhabdus nematophila en condiciones de laboratorio durante 51 h de cultivo continuo 39 3 Curvas de crecimiento de la bacteriaPhotorhabdus sp. (Cepa INZIT) en condiciones de laboratorio durante 51 h de cultivo continuo 40 4 Curvas de crecimiento de la bacteria Photorhabdus sp. (Cepa frutícola) en condiciones de laboratorio durante 30 h de cultivo continuo 41 5 Curvas de crecimiento de la bacteria Xenorhabdus innexi en condiciones de laboratorio durante 42 h de cultivo continuo 42 6 Crecimiento del hongo en los distintos tratamientos de inóculos bacterianos durante todo el periodo de experimento (312 h). Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 43 7 Crecimiento del hongo en los distintos tratamientos de exudados bacterianos durante todo el periodo de experimento (312 h). Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 44 8 Índice antifúngico de los distintos tratamientos durante todo el periodo de experimento (312 h). Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne) 45 9 Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus sp. (Cepa Cachirí) sobre el crecimiento micelial de Moniliophthora roreri A: Inóculo 72 h; B: Inóculo 120 h; C: Exudado 72 h; D: exudado 120 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 49 10 Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus cabanillasii sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 72 h; B: Inóculo 120 h; C: Exudado 72 h; D: exudado 120 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 50 11 Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus nematophila sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 72 h; B: Inóculo 120 h; C: Exudado 72 h; D: exudado 120 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 51 12 Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus poinarii sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 116 h; C: Exudado 96 h; D: exudado 116 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 52 13 Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus bovienii sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 168 h; C: Exudado 96 h; D: exudado 168 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 53 14 Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus sp.. (Cepa INZIT) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 116 h; C: Exudado 96 h; D: exudado 116 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 54 15 Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus sp. (Cepa frutícola) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 72h; B: Inóculo 120h; C: Exudado 72h; D: exudado 120h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 55 16 Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus luminiscens (Cepa bacteriophora) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 168 h; C: Exudado 96 h; D: exudado 168 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 56 17 Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus luminiscens (Cepa indica) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 168 h; C: Exudado 96 h; D: exudado 168 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 57 18 Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus innexi sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 116 h; C: Exudado 96 h; D: exudado 116 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) 58 19 Efecto de los cultivos bacterianos sobre el peso seco de Moniliophthora roreri a las 48 h de evaluación. Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 61 20 Efecto de los exudados sobre el peso seco de Moniliophthora roreri a las 48 h de evaluación. Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 62 IDICE DE TABLAS No. Título Pág. 1 Especies de bacterias con potencial antagónico asociadas a nematodos entomopatogénos de la Familia Steinernematidae. 29 2 Especies de bacterias con potencial antagónico asociadas a nematodos entomopatogénos de la Familia Heterorhabditidae. 29 3 Temperatura y tiempo de incubación utilizados para la elaboración de las curvas de crecimiento de las cepas de bacterias evaluadas. 31 4 Temperaturas y Tiempos de Incubación establecidas como óptimas para la evaluación de las bacterias en las pruebas in vitro. 33 5 Esporulación promedio del hongo de Moniliophthora roreri ante el efecto de las distintas cepas bacterianas (inóculos y exudados) evaluados. Letras diferentes muestran diferencias significativas α=0,05. 47 ÍNDICE DE ANEXOS N° Título 1 Peso seco del hongo Moniliopthora roreri (g) ante el efecto de los exudados en medio Líquido. 72 2 Peso seco del hongo Moniliopthora roreri (g) ante el efecto de los inóculos bacterianos en medio Líquido. 73 Pág. Carrillo Zuhey. “Evaluación del potencial de control biológico de Xenorhabdus y Photorhabdus sobre la moniliasis del cacao (Moniliopthora roreri)”. Trabajo de Grado. Universidad del Zulia. Facultad Experimental de Ciencias. Maracaibo, Venezuela. 2014. 73p. RESUMEN El cacao está sometido a la acción de patógenos causantes de efectos negativos en términos de producción, destacando que en Sudamérica una de las enfermedades más comunes es la moniliasis causada por el hongo Moniliophthora roreri. Con el objetivo de evaluar el potencial control biológico de las bacterias Xenorhabdus y Photorhabdus sobre el crecimiento in vitro de Moniliophthora roreri se determinó el efecto de la concentración de inóculos bacterianos y sus exudados sobre el hongo, donde se extrajo un plug de micelio con esporas del hongo y se sumergió en los cultivos bacterianos y exudados a diferentes concentraciones (10, 25, 50, 75 y 100%). Igualmente se determinó el índice antifúngico de cada bacteria, tomando 100 µl del cultivo de bacterias y se esparcieron en una placa de Petri con medio de cultivo TSA+ Chocolate al 7%, con cuatro plug de 0,5 cm, así como placas control (sin bacterias o filtrado); midiendo el crecimiento del micelio y contando las esporas durante 15 días. Para observar el crecimiento en el medio de líquido se inoculó con bacterias o exudados, con 1 plug de micelio con esporas del hongo, para luego determinar el peso seco del hongo. Los resultados indican que existe un marcado efecto inhibitorio del crecimiento del hongo por parte de algunas de las bacterias empleadas, donde incluso a las concentraciones más bajas no se observó crecimiento. Los índices antifúngicos de los inóculos resultaron en más del 90% la gran mayoría de ellos, mientras que los exudados de Xenorhabdus sp., X. poinarii y X. cabanillasii presentaron índices de 97,4%, 80,4% y 76,3% para ser los màs efectivos. El tratamiento de inóculo de P. luminiscens (Cepa bacteriophora) resultó ser el màs efectivo en medio lìquido, mientras que X. bovienii se mostró más efectiva en el tratamiento de exudados. Palabras clave: Xenorhabdus, Photorhabdus, moniliasis del cacao, inhibición de crecimiento, Índice antifúngico. E-mail: [email protected] Carrillo Zuhey “Evaluation of biological control potential of Xenorhabdus and Photorhabdus in the cocoa moniliasis (Moniliopthora roreri)” Trabajo de Grado. La Universidad del Zulia. Facultad Experimental de Ciencias. Maracaibo, Venezuela. 2014. 73p ABSTRACT Cocoa is subjected to the action of pathogens agents that cause negative effects in the production of this fruit, emphasizing that in South America. Moniliasis is the most common cocoa disease caused by Moniliopthora roreri. The main objective was to evaluate the biological control potential of Xenorhabdus and Photorhabdus on Moniliopthora roreri growth, measuring the effect of concentration of bacteria and their exudates on the fungus, by extracting one piece of mycelia with spores of the fungus and submerging it in bacterial culture and exudates at different concentrations (10, 25, 50, 75 y 100%). Also the antifungal index of all bacteria was measured, by taking 100 microlitres of the bacterial broth or exudates and spreading them on TSA+Chocolate (at 7%) plates, a plug of growing mycelia of M. roreri (0,6 cm) was placed at the centre of the plates. The mycelia growth was measured every 24 h (two directions) for 15 days. For the observation of growth in the liquid media, one plug of M. roreri mycelia was placed in inoculated media with bacteria or exudates, and later, the dry weight of the fungus was determined. The results demonstrated a significant inhibitory effect in the fungus growth for some bacteria, even at low concentrations. The antifungal index of bacteria resulted in more than 90% of inhibition in the majority of them, whereas between exudates, Xenorhabdus sp, X. poinarii and X. cabanillasii were the most effective. P. luminiscens (from H. bacteriophora) bacteria were the most effective in the liquid media; whereas X. bovienii was the most efficient among exudates. Keywords: Xenorhabdus, Photorhabdus, cocoa moniliasis, growth inhibition, antifungal index. E-mail: [email protected] INTRODUCCIÓN El cacao, como todas las plantas, está sometido a la acción de patógenos que causan efectos negativos en términos de la productividad, deteriorando los órganos de planta y ocasionando la muerte de la misma. Las enfermedades son las patologías que ocasionan más pérdidas económicas al cacaocultor, cuando no se les realiza el manejo adecuado (Pinzón y col., 2008). En Venezuela el cacao (Theobroma cacao L.) es un cultivo tradicional, que ha tenido un papel fundamental en su historia y economía. La ventaja como país productor se debe más a la calidad, que a los volúmenes de producción, sin embargo, se ha venido perdiendo la calidad, debido a la hibridación natural del cacao criollo puro con materiales de inferior calidad (Parra y col., 2005). Estos cultivos están íntimamente ligados a la cultura Venezolana, tanto por su origen, como por su gran importancia en el desarrollo económico y social del país durante la época colonial, suponiendo ser para esa época, la principal fuente de ingreso del país hasta la aparición de la industria petrolera. Tradicionalmente Venezuela ha sido considerada como un productor de cacao fino y de aroma de alta calidad. Sin embargo, en 1933 fue rebajada a la condición de productor parcial de cacao fino y de aroma debido a la proliferación de otras variedades de árboles (Forasteros), que han sido introducidas al país para de lograr una mayor resistencia a plagas y enfermedades (Ministerio del Poder Popular para Ciencia y Tecnología y col., 2007). Las enfermedades fúngicas, son el factor más limitante de la producción de cacao en América (Krauss y Soberanis, 2001), las cuales se estiman que causan casi el 30% de la pérdida de la producción de granos de cacao (Aneja y col., 2005). En Centro y Sur América, las enfermedades más comunes son las causadas por Moniliophthora roreri (moniliasis), Moniliopthora perniciosa (escoba de bruja) y Phytophthora palmivora (mazorca negra) (Leach y col., 2002). 18 El hongo Moniliopthora roreri, es el microorganismo causal de la moniliasis del cacao, era perteneciente a la clase Deuteromicete, Orden Moniliales, familia Moniliaceae hasta el año 1978, cuando fue reclasificado como un Basidiomiceto del género Moniliophthora perteneciente a la familia Marasmiaceae que afecta a los frutos de las especies Herrania y Theobroma (PhillipsMora y col., 2007). Este hongo produce conidios ovalados, de color claro, micelio hialino, sobre los que se forman conidióforos simples (Moreno, 2004). Sobre las mazorcas en campo se pueden apreciar el desarrollo de gran cantidad de conidios que le dan el color y aspecto característico a la moniliasis. Es de tamaño microscópico visible siempre y cuando se multiplique de manera masiva (Pinzón y col., 2008), sólo ha sido encontrado afectando los frutos de los géneros Theobroma y Herrania (Phillips-Mora y col., 2007), en todos los estados de desarrollo desde los frutos recién formados, hasta los que se encuentran a punto de maduración (Pinzón y col., 2008). La moniliasis del cacao, se presenta en el campo cuando la humedad relativa es de 80 - 90 % y el rango de temperaturas esta en 25 - 27 °C, favorecidos por las lluvias frecuentes (Rumbos y col., 2005). La moniliasis fue identificada por primera vez en Ecuador en el año 1916 y es considerada la enfermedad más destructiva del cultivo en Latinoamérica (Parra y Sánchez, 2005), pero desde entonces se ha extendido y abarca rangos desde el sur de Perú hasta Honduras. En Costa Rica, las pérdidas de producción se han estimado en rangos que van desde 50% a 90% (Hidalgo y col., 2003). En Venezuela fue detectada en 1941 en la zona del río Catatumbo, estado Zulia. Se presenta en las riberas del río Escalante, en los estados Mérida y Táchira; se extiende hacia las plantaciones de Auraquita (Colombia) y la Victoria en el estado Apure. En 1997 se observó en la localidad de Pedraza (estado Barinas) y actualmente la enfermedad está restringida al occidente del país (Rumbos y col., 2005), entidades en las cuales ocasiona pérdidas de cosechas que oscilan entre 20 y 80% de la producción, según el manejo agronómico que se realice en la plantación. Encontrándose con carácter endémico en los estados Mérida, Zulia, Táchira, Apure y Barinas. Por esta razón, el traslado de material de cacao (excepto almendras beneficiadas) hacia los estados del centro y oriente del país está prohibido (Parra y co.l, 2005). 19 Ciclo de Vida Los conidios del hongo sobreviven en las mazorcas infectadas (Enríquez, 1985) las cuales son las únicas estructuras de infestación reportadas, una vez que germinan, penetran directamente a través del epicarpio (Moreno, 2004), siendo la temperatura óptima para su germinación 22 °C (Enríquez, 1985). Una vez que el hongo penetra la invasión de los tejidos es de tipo intracelular, y se comienzan a manifestar los síntomas de la enfermedad en forma de marchitez, necrosamiento y deformaciones de mazorcas tiernas, o como hidrosis (madurez irregular y prematura en mazorcas más desarrolladas), las cuales terminan como tejidos macerados y podridos. Finalmente, a través de los estomas emergen hifas que forman conidióforos simples y una gran cantidad de conidios. El estado sexual del organismo no ha sido encontrado en el campo o producido in vitro; sólo se le conoce en el estado asexual o anamòrfico (conidios) (Enríquez, 1985). El ciclo de vida dura alrededor de tres meses; siendo más rápido en climas cuyas temperaturas son más elevadas. Así que la enfermedad es menos agresiva en altitudes cercanas a 1.200 m.s.n.m. La humedad ambiental, también tiene que ver con la severidad de la enfermedad y con el desarrollo del patógeno de manera más activa, así que en las zonas más cálidas y húmedas deberá tenerse más cuidado con el manejo de la moniliasis. En áreas más frescas de cultivo, el fruto del cacao alcanza la madurez en seis meses, contados desde el momento de la fecundación. En estos climas la enfermedad presenta los primeros síntomas un mes después de haber sido inoculada y 106 días para completar el ciclo. En las regiones más cálidas y húmedas la maduración de la mazorca toma 5 meses y medio, el ciclo de la enfermedad es de 61 días, de los cuales 30 días corresponden al tiempo requerido para la aparición de los primeros síntomas y hasta 49 para la aparición de la mancha color chocolate (Pinzón y col., 2008). El viento, la lluvia y el hombre son considerados como los principales agentes de diseminación (Moreno, 2004). Los conidios que se producen sobre mazorcas enfermas son fácilmente transportadas por el viento y otros agentes, incluido el hombre, hacia otras mazorcas, 20 donde reproducen la infección. Aunque no se ha descartado la posible existencia de una fase sexual o un huésped alterno, estudios recientes han establecido que los conidios que permanecen en los frutos momificados, pendientes de los árboles, conservan su viabilidad hasta ocho meses después, por lo que se considera la principal fuente de inòculo primario (Enríquez, 1985). Por esta razón, el traslado de material de cacao (excepto almendras beneficiadas) hacia los estados del centro y oriente del país está prohibido. Esta restricción se debe a que las esporas persisten viables en el follaje, tronco, cojines florales y musgos (Parra y Sánchez, 2005). Sintomatología La manifestación de los síntomas de la enfermedad varía de acuerdo con la edad del fruto, la susceptibilidad de la planta y a las condiciones ambientales del lugar. Las evidencias indican que la infección ocurre principalmente en las primeras etapas del crecimiento de las mazorcas y que estas se vuelven progresivamente más resistentes, conforme avanza su desarrollo. Cuando logra entrar en las etapas iniciales del crecimiento, el hongo parece capaz de invadir el interior de la mazorca, mientras esta continúa su crecimiento, sin que en su exterior aparezca ningún síntoma de la enfermedad. A menudo hay mazorcas con esas infecciones ocultas que casi alcanzan su desarrollo completo, dando la impresión de estar sanas, pero repentinamente aparecen en su superficie las manchas características de la enfermedad (Enríquez, 1985). La primera señal de infección oculta es la aparición de puntos o pequeñas manchas de un color que sugiere una maduración prematura en mazorcas que aún no han alcanzado su desarrollo completo (manchas amarillas en mazorcas verdes y manchas anaranjadas en mazorcas rojas). A menudo las mazorcas con infecciones ocultas presentan tumefacciones (Enríquez, 1985). Cuando tales mazorcas se abren, se encuentran parcialmente podridas en su interior y parecen más pesadas que las mazorcas sanas de igual tamaño. Con el tiempo aparece en la superficie de la mazorca una mancha parda, rodeada por una zona de transición de color amarillento. Tal mancha puede crecer hasta llegar a cubrir una parte considerable y hasta la 21 totalidad de la superficie de la mazorca. Bajo condiciones húmedas crece sobre la superficie de la mancha una especie de felpa dura y blanca de micelios de M. roreri, pudiendo llegar a cubrir la totalidad de la mancha, y sobre la cual el hongo produce gran cantidad de conidios que dan al crecimiento un color crema o café claro (Enríquez, 1985). Los primeros síntomas aparecen después de 30 a 70 días de la penetración conidial en las mazorcas; 4 a 5 días después aparecen los conidios sobre la mancha café. Los frutos tiernos, de 8 cm de longitud, y los medianos, de 8 a 15 cm, son los más susceptibles, lo cual se ve favorecido por un ambiente de alta humedad relativa. Las altas temperaturas y humedad relativa baja son los factores ambientales que condicionan la liberación de los conidios al aire y su transporte, lo cual ocurre en el trascurso del día, causando infección en una distancia de hasta 20 m en contra de la dirección del viento y 30 m en dirección del mismo (Moreno, 2004). La densidad de siembra, así como las características de color, rugosidad y dureza del mesocarpo de las mazorcas, no presentan ninguna correlación con la severidad interna y externa de la incidencia de la moniliasis. La esporulación del hongo en los frutos infectados es de gran magnitud, pudiendo haber millones de esporas en un centímetro cuadrado, con capacidad de infectar nuevos frutos sanos. En los frutos cosechados y dejados en el suelo, el periodo de vida de las esporas se reduce drásticamente a sólo tres meses. La esporulación es alta durante las primeras ocho o nueve semanas, decayendo a niveles insignificantes en la décima semana (Moreno, 2004). La presencia de la enfermedad en el árbol de cacao tiene devastadores efectos sobre el rendimiento de los cultivos y la viabilidad económica se ha visto comprometida. En diferentes países de América Latina las pérdidas atribuibles a la enfermedad han sido tan graves que las plantaciones ha sido abandonado en zonas enteras (Phillips-Mora y col., 2007). 22 Manejo de la Moniliasis del Cacao En la actualidad las estrategias de manejo de la enfermedad están basadas en la aplicación de prácticas agronómicas o culturales según el ciclo anual de la floración a cosecha. El control cultural consiste, principalmente, en la poda fitosanitaria (extracción) de los frutos enfermos, que muestran visualmente los primeros síntomas, como manchas aceitosas y jorobas en frutos jóvenes o manchas café en los maduros, sin la presencia del micelio blancuzco ni de los conidios. La poda fitosanitaria de los frutos enfermos debe realizarse cada 5 a 7 días, de manera sistemática, partiendo del punto de máximo cuajamiento de los frutos (correspondiente a una fecundación floral entre 70 a 80 %). Esta práctica debe prolongarse hasta el fin de la cosecha (Moreno, 2004). En las diferentes zonas cacaoteras del país que presentan un sólo pico de cosecha, la práctica debe iniciarse a los 45 días aproximados de la entrada de las lluvias y prolongarse hasta el fin de la cosecha. En las regiones que presentan dos picos de cosecha, el manejo debe basarse en el ciclo anual de floración o cosecha correspondiente a cada zona y tomando en cuenta que los frutos jóvenes, hasta los 100 días de edad son los más susceptibles (Moreno, 2004). El manejo es más eficiente y económico en plantaciones con árboles de poca altura, no más altos de 4 metros, con podas fitosanitarias de frutos donde el hongo no ha esporulado, dejando los frutos enfermos sobre el suelo, cubiertos en lo posible con hojarascas, sin provocar sobre ellos mayor disturbio al momento de la poda; las mazorcas con esporulación deben podarse en las primeras horas de la mañana, donde la humedad es más alta y así evitar su dispersión. Los montones de frutos enfermos o los residuos de cosechas (cáscaras) deben tratarse espolvoreándoles cal agrícola o asperjándoles urea al 10 o 15 % (Moreno, 2004). Además del manejo fitosanitario con prácticas culturales, dentro de las cuales se destacan los cultivos mixtos, sistemas agroforestales y control con el saneamiento dentro del cacaotal, 23 existen otras medidas complementarias que son necesarias en el control de las enfermedades del cacao entre las que se contempla: La regulación de la sombra permanente (podas de sombrío) con la finalidad de permitir el paso de la luz y aireación de la plantación, la reducción del exceso de humedad del suelo mediante drenajes superficiales y la utilización de clones o híbridos mejorados y resistentes como material de siembra, así como la eliminación de árboles altamente susceptibles (Moreno, 2004). El uso de químicos, los cuales muestran desventajas debido a sus altos costos y a los efectos que pueda ocasionar en el ambiente y la resistencia que se genera en el patógeno (Arciniegas, 2005). Este método solo es recomendado en plantaciones tecnificadas, con rendimientos no menores a 1.000 kg de cacao fermentado y seco por hectárea (ha), pudiéndose utilizar productos a base de oxido cuproso como fungicidas preventivos, en dosis y frecuencias de 2 kg/ha cada 20 días, para tres aplicaciones por ciclo de producción anual, o productos sistémicos como Triadimefon + Caftafol (Bayleton), Bayfidan (Triadimefon), Mertec ( Tiabemdazol), en dosis de 1,5 l/ha, cada 20 días en dos aplicaciones, realizando la primera en la época de máximo cuajamiento de los frutos (Moreno, 2004). Resistencia Genética, que tiene como finalidad incluir en fincas la renovación del material genético, incorporando características deseables como: la tolerancia a enfermedades, rendimiento, calidad y producción. Todas estas estrategias son una alternativa para disminuir la presión de la enfermedad y aumentar la producción (Arciniegas, 2005). Estrategias biológicas; estas son nuevas alternativas, pero que requieren un poco más de investigación, dentro de los cuales se ha desarrollado el uso de los micoparásitos, inducción de resistencia, entre otras (Arciniegas, 2005). Se deben utilizar como complemento a la remoción de los frutos enfermos aplicando aspersiones con sustratos de bacterias y hongos antagónicos, de los tipos Bacillus, Oedocefalulm, Verticillum para prevenir el desarrollo y diseminación de los conidios de la Monilia (Moreno, 2004). 24 En Perú se han utilizado micoparásitos de amplio rango de hospedadores como Clonostachys rosea, Trichoderma sp., Trichoderma cf. longipilis y Trichoderma virenes (Krauss y Soberanis, 2001) que han funcionado efectivamente como biocontroladores de Phytophthora palmivora y Moniliophthora roreri (Krauss y col., 2006). En otras enfermedades fúngicas producidas por Phytophthora boehmeriae causante de la putrefacción de la cápsula del algodón, P. infestans agente causal del tizón tardío de la papa y P. sojae agente causal de podredumbres de tallos y raíces de la soya, se han utilizado como agentes de control biológico las bacterias (y sus metabolitos) de los géneros Xenorhabdus y Photorhabdus (Kaya y col., 2006). Estos organismos viven en simbiosis con nematodos entomopatogénos de las familias Steinernematidae y Heterorhabditidae, respectivamente (Rosales y col., 1999). La utilización de estas bacterias se debe a la capacidad que tienen de producir antibióticos, antimicóticos, enzimas y otros metabolitos con usos potenciales en la agricultura. López-Robles y col. (1997), evaluaron el efecto del complejo Steinernema feltiae/Xenorhabdus bovienii contra el ahogamiento del hongo Phoma betae en remolacha azucarera. Encontrando que la bacteria simbiótica inhibía el crecimiento del hongo patógeno. Además se comprobó una inhibición (in vitro) del crecimiento micelial de los hongos Botrytis cinerea, Ceratocystis ulmi y Pythium coloratum. Debido a que en nuestro país en la actualidad no se han desarrollado métodos de control biológico que permitan minimizar o manejar la moniliasis en el cultivo de cacao, se plantea el uso de bacterias como un biopesticida alternativo, ya que se conoce la capacidad de producción de compuestos antimicrobianos de Xenorhabdus y Photorhabdus. Estas bacterias producen una gran cantidad de metabolitos con propiedades biocidas, que han sido probadas con éxito para algunas enfermedades de origen fúngico y bacteriano de interés agrícola y veterinario. Debido al potencial que tienen para producir estos compuestos que podrían ser utilizados como antimicóticos, hemos considerado evaluar la influencia de estas 25 bacterias como fungicida para controlar el crecimiento y esporulación del hongo Moniliopthora roreri. Xenorhabdus y Photorhabdus spp. Tanto Xenorhabdus y Photorhabdus spp. son bacilos Gram negativos anaerobios facultativos, no esporulantes, heterótrofos quimioorganotróficos, oxidasa negativos con metabolismos fermentativos y respiratorios. Ellos son incluidos en la familia Enterobacteriaceae, pertenecientes al grupo 5 y al subgrupo I, casi todas las especies de Xenorhabdus y Photorhabdus son entomopatogénicas (Forst y col., 1997). Estas bacterias llevan una vida de simbiontes en el intestino de la etapa juvenil infecciosa de los nemátodos entomopatogénos pertenecientes a las familias Steinernematidae (Xenorhabdus) y Heterorhabditidae (Photorhabdus). El ciclo de vida es complejo, con una etapa simbiótica, en la cual las bacterias son transportadas en el intestino de los nemátodos y una etapa patogénica, en la que los insectos atacados son eliminados por la acción combinada del nematodo y la bacteria (Forst y col., 1997). Los rasgos generales de los ciclos de vida son similares, llevan una vida de simbiontes en el intestino de la etapa juvenil infecciosa de los nematodos (Forst y col., 1997), estos entran al tracto digestivo del insecto a través de la boca, ano y en ocasiones pueden penetrar a través de las áreas intersegmentales (Bedding y Molineux., 1982; Peters y Ehlers, 1994) hasta llegar al hemocele del hospedador. Dentro del hemocele, los nematodos liberan la bacteria; estas se multiplican y matan al insecto por septicemia. Las bacterias comienzan a producir una serie de metabolitos con diferentes funciones que hacen que se establezcan condiciones adecuadas para la reproducción del nematodo proveyendo nutrientes e inhibiendo el crecimiento de otros microorganismos que 26 puedan competir por el recurso (Akhurst, 1983). Las bacterias secretan varios productos extracelulares incluyendo lipasas, fosfolipasas, proteasas, antibióticos de amplio espectro e inclusiones citoplasmáticas compuestas de proteínas cristalinas (Forst y col., 1997). Características de Variantes de Fases Las especies de Xenorhabdus y Photorhabdus dependiendo de las condiciones pueden variar tanto en su morfología como en su fisiología, estas variaciones son comúnmente definidas como fase primaria (I) y fase secundaria (II) (Han y Ehlers, 1999). La forma de la bacteria que es normalmente aislada del nematodo simbiótico es referido como fase I, (Volgyi y col., 1998) esta produce diferentes antibióticos no proteínicos, algunos de los cuales han sido identificados como derivativos del indol, trans-estilbenos, xenorhabdinas y xenocumacinas (Han y Ehlers, 1999). Un rasgo característico de esta fase, es la habilidad para unirse a colorantes específicos como, el azul de bromotimol durante el crecimiento de la bacteria (Volgyi y col., 1998) Las células en fase II pueden formarse espontáneamente bajo condiciones de fase estacionaria, las células durante esta fase de crecimiento no se unen a colorantes y producen niveles reducidamente marcados de productos metabólicos. Además carecen de cuerpos de inclusión intracelular y de la producción de proteínas cristalinas (Volgyi y col., 1998). Esta fase puede ser inducida entre muchas otras cosas, por las bajas condiciones de sal en el intestino del nematodo y está mejor adaptado a las condiciones de inanición de este ambiente, mientras que la fase I es probablemente mantenida en un medio rico en nutrientes y sal del hemocele del insecto (Forst y col., 1997). Xenorhabdus y Photorhabdus spp. son similares en numerosas características, pero también difieren en otras, por ejemplo, Xenorhabdus es específicamente encontrado asociado con nemátodos entomopatógenos de la familia Steinernematidae, mientras que Photorhabdus sólo se asocia con la familia Heterorhabditidae. Una propiedad primaria que distingue Photorhabdus de Xenorhabdus es la habilidad de emitir luz bajo condiciones de cultivo en fase estacionaria dentro 27 del insecto hospedero. Por otro lado, Xenorhabdus es catalasa negativo, lo cual es una propiedad inusual para bacterias de la familia Enterobacteriaceae (Forst y col., 1997). Metabolitos Producidos por Xenorhabdus y Photorhabdus spp. Xenorhabdus y Photorhabdus producen metabolitos secundarios que tienen actividad antibiótica contra un número de microorganismos (Kaya y col., 2006). Las bacterias Xenorhabdus bovienii y Photorhabdus luminescens producen indol y derivados de éste. Xenorhabdus sp, Xenorhabdus bovienii y Xenorhabdus nematophilus producen ditiolopyrrolonas solubles, xenorhabdinas, derivados del benzopyran, y xenocumacinas (Maxwell y col., 1994). En los últimos años se ha probado que Xenorhabdus nematophila produce metabolitos contra varias especies patógenas de Phytophthora. Centrando sus evaluaciones en el filtrado de la fermentación de la bacteria (metabolitos producidos por las células bacterianas) para inhibir el crecimiento de Phytophthora boehmeriae Sawada (agente causal de la putrefacción de la cápsula del algodón), P. infestans Mont de Bary (agente causal del tizón tardío de la papa) y P. sojae Kaufmann y Gerdemann (agente causal de la podredumbre del tallo y raíces de la soya) (Kaya y col., 2006). También se ha comprobado la actividad inhibitoria de los subproductos de 38 cepas de Xenorhabdus contra los hongos patógenos del arroz, Rhizoctonia solani Kühn y Pyricularia grisea Sacc. La filtración de la fermentación bacteriana demostró altas actividades inhibitorias contra crecimiento micelial y esclerótico y germinación conidial de ambos patógenos. Estos estudios demostraron que el uso de metabolitos bacterianos de Xenorhabdus contra varios patógenos de plantas, tienen un gran potencial para ser empleados como tratamiento de las enfermedades de vegetales como control en sistemas agrícolas (Kaya y col., 2006). De esta manera el presente trabajo plantea la hipótesis que “Xenorhabdus y Photorhabdus tienen propiedades fungicidas sobre Moniliopthora roreri”. OBJETIVOS Objetivo General Evaluar el potencial de control biológico de Xenorhabdus y Photorhabdus sobre la moniliasis del cacao (Moniliopthora roreri). Objetivos Específicos Elaborar curvas de crecimiento de algunas especies de bacterias de los géneros Xenorhabdus y Photorhabdus. Evaluar el efecto de Xenorhabdus y Photorhabdus sobre el crecimiento y esporulación de Moniliopthora roreri. Determinar la influencia de los exudados de Xenorhabdus y Photorhabdus sobre crecimiento y esporulación de Moniliopthora roreri. el METODOLOGÍA Las bacterias, fueron aisladas de larvas de Galleria mellonella (Lepidoptera: Pyralidae) previamente infectadas con nematodos entomopatógenos de los géneros Steinernema (Tabla 1) y Heterorhabditis (Tabla 2) suministrados por el Laboratorio de Protección Vegetal del Centro de Estudios Botánicos y Agroforestales del Instituto Venezolano de Investigaciones Científicas (IVIC) NEMATODOS BACTERIAS Steinernema feltiae Xenorhabdus bovienii Steinernema carpocapsae Xenorhabdus nematophila Steinernema riobrave Xenorhabdus cabanillasii Steinernema glaseri Xenorhabdus poinarii Steinernema sp. (cepa Cachirí) Xenorhabdus sp. Steinernema scapterisci Xenorhabdus innexi Tabla 1. Especies de bacterias con potencial antagónico asociadas a nematodos entomopatogénos de la Familia Steinernematidae (Carrillo, 2014). NEMATODOS BACTERIAS Heterorhabditis indica Photorhabdus luminiscens Heterorhabditis bacteriophora Photorhabdus luminiscens Heterorhabditis sp. (cepa frutícola) Photorhabdus sp. Heterorhabditis sp. (cepa INZIT) Photorhabdus sp. Tabla 2. Especies de bacterias con potencial antagónico asociadas a nematodos entomopatogénos de la Familia Heterorhabditidae (Carrillo, 2014). 30 Preparación de Placas NBTA Se tomaron 37 g de agar nutritivo, 25 mg de azul de bromotimol en 1.000 mL de agua destilada, se hirvió y agitó hasta que el agar se clarificara, posterior a esto se esterilizó a 121°C por 15 minutos y 115 libras de presión, luego se le agregó 4 mL de 2-3-5 triphenyl-tetrerzolium chloride al 0,004%, esterilizado previamente por filtración y se colocó el agar en un baño de María a 45 ºC para atemperarlo y luego ser vertido en placas de Petri esteril. (Akhurst, 1980) Preparación de larvas Galleria mellonella para el aislamiento y cultivo de las bacterias Las bacterias se aislaron 48 horas después de exponer las larvas de las larvas de G. mellonella a sus respectivos nematodos entomopatógenos. Las larvas fueron lavadas dos veces con agua destilada, luego se colocaron en una solución que contenía agua destilada e hipoclorito de sodio al 5% para desinfectarlas, por 10 min. Se repitió nuevamente el proceso de lavado con agua destilada con el objetivo de retirar el exceso del cloro posteriormente se colocaron sobre la superficie de un portaobjeto estéril y se procedió a abrirla con la ayuda de un bisturí y pinza estéril para liberar las bacterias que se sembraron en una placa de NBTA con la ayuda de un aza bacteriológica, e incubaron bajo las condiciones de temperatura más idóneas para su crecimiento (32-38°C). Preparación de curvas de crecimiento de Xenorhabdus y Photorhabdus En este experimento se evaluó el crecimiento bacteriano de cinco cepas hasta la fase estacionaria, sometidas a cuatro temperaturas diferentes (Tabla 3), las otras cinco bacterias fueron evaluadas aparte y los datos fueron anexados (Parra, comunicación personal). 31 Bacterias Temperatura (ºC) Tiempo (h) 34 48 Xenorhabdus sp. (Cepa Cachirí) 36 36 38 15 40 30 34 39 Xenorhabdus nematophila 36 18 9 38 40 15 32 33 Photorhabdus sp.. (Cepa INZIT) 34 24 36 15 38 18 34 18 Photorhabdus sp.. (Cepa frutícola) 36 15 38 12 40 13 32 39 34 27 Xenorhabdus innexi 36 27 38 27 Tabla 3. Temperatura y tiempo de incubación utilizados para la elaboración de las curvas de crecimiento de las cepas de bacterias evaluadas (Carrillo, 2014). Se tomó una colonia de las placas de NBTA con la ayuda de un aplicador de madera estéril el cual se inoculó en un tubo de ensayo que contenía 3 mL de tripticasa de soya (TSB) tratando de tocar con el aplicador las paredes del tubo para dispersar la muestra, luego se llevó al vortex (homogenización). Se transfirió 1 mL de la muestra a un erlenmeyer TSB incubándolo por el tiempo y temperatura correspondiente (Tabla 3) en oscuridad en un agitador orbital (Lab. Orbital Shakerbath) a 150 rpm. Cada 3 horas se tomaron 3 mL de las muestra de los erlenmeyer inoculados para leer la absorbancia en el espectrofotómetro, que se calibró a 600 nm usando el medio de cultivo estéril como blanco. Así mismo se tomó una alícuota de 1 mL del medio de cultivo y se diluyó en 9 mL de agua destilada estéril. 32 Luego se inocularon por duplicado estas diluciones en placas de Petri con Agar Tripticasa de Soya (TSA). Las placas inoculadas se incubaron en la oscuridad por 24-48 horas a las temperaturas correspondientes según puede observarse en la tabla 3. Una vez transcurrido el tiempo de incubación se contaron el número de colonias por placa y se calculó el contenido de bacterias por mL de caldo de cultivo. Todo el procedimiento se hizo por triplicado. Finalmente se construyó la curva de crecimiento bacteriano tomando en cuenta el tiempo de incubación y el número de bacterias. El dato obtenido de la absorbancia fue utilizado para construir la curva de calibración del contenido bacteriano en el medio de cultivo. Los datos de la curva de calibración fueron comparados entre sí usando ANOVA para determinar las diferencias o no entre las muestras a un mismo tiempo de incubación, mientras que los datos de absorbancia y contenido celular se analizados mediante análisis de regresión lineal. Preparación de Inóculos Bacterianos y Extractos Libres de Bacterias, Método para Xenorhabdus y Photorhabdus. Se tomó una colonia de las placas de Petri con NBTA con bacterias ya incubadas, y se inoculó en 3 mL de caldo TBS, el cual se incubó por 24 horas y posteriormente se transfirieron a los erlenmeyer que contenían 150 mL de TSB cubiertos con tapones de algodón estériles. Los Erlenmeyer fueron colocados en una incubadora orbital a 150 rpm por el tiempo y la temperatura descrita en la tabla 4. (Hu y col., 1999). 33 Temperatura (ºC) Tiempo (h) 32 31 32 24 Xenorhabdus bovienii 32 25 Xenorhabdus innexi 36 33 Photorhabdus sp. (Cepa INZIT) 36 24 Xenorhabdus poinarii 36 30 Photorhabdus sp. (Cepa frutícola) 38 24 Xenorhabdus nematophila 38 24 Xenorhabdus cabanillasii 38 24 Xenorhabdus sp. (Cepa Cachirí) 38 24 Bacterias Photorhabdus luminiscens (proveniente de H. indica) Photorhabdus luminiscens (proveniente de H. bacteriophora) Tabla 4. Temperaturas y Tiempos de Incubación establecidas como óptimas para la evaluación de las bacterias en las pruebas in vitro (Carrillo, 2014). La concentración de la carga bacteriana en los caldos de cultivo se determinó midiendo la densidad óptica en el espectrofotómetro ajustando la longitud de onda a 600 nm como se explico anteriormente Para obtener las suspensiones libres de bacterias se tomó el caldo de cultivo y se centrifugó a 1000 rpm durante 20 minutos, procedimiento que se repitió 3 veces y luego el sobrenadante fue pasado por un filtro para bacterias de 0,22 µm de tamaño de poro. Una vez filtrado el extracto, se inoculó una placa de agar-NBTA para confirmar la ausencia de bacterias en la suspensión. 34 Aislamiento del Patógeno Moniliophthora roreri Las muestras del hongo Moniliophthora roreri fueron tomadas en el Instituto Nacional de Investigaciones Agronómicas-Zulia (INIA-Zulia) Estación Local Chama, en el Km 41 ubicado en la carretera Santa Bárbara- El Vigía estado Mérida Venezuela. Se utilizaron mazorcas que presentaron síntomas típicos de la enfermedad (mancha chocolate) para realizar los aislamientos. Se lavaron bien con agua de chorro, se desinfectaron superficialmente con alcohol isopropílico al 90 %. Posteriormente se corto la cascara en la zona lindante entre el tejido enfermo y el sano, con un bisturí esterilizado, y se extrajeron, de la parte interna trozos de muestras de 1 a 2 cm y se colocaron en forma aséptica en cápsula de Petri con el medio Papa Dextrosa Agar (PDA), las càpsulas se identificaron y se incubaron a 26 ± 2 ºC en condiciones de luz continua con luz fluorescente emitida por un tubo de 20 w colocados a 60 cm de las cápsulas, para estimular el crecimiento de las colonias. Cuando se desarrollaron las colonias del hongo se procedió a repicar en càpsulas de Petri que contenían el medio (TSA) suplementado con chocolate de taza Savoy® al 7% e incubándolas en las condiciones antes descritas, con la finalidad de inducir o acelerar el crecimiento del inóculo. Índice Antifúngico Se tomaron 100 µL del cultivo de las bacterias en caldo TSB o del filtrado (al tiempo y temperatura óptima de crecimiento de cada una) y fueron esparcidos en una placa de Petri con 25 mL de medio de cultivo TSA+ Chocolate al 7%. Posteriormente se colocaron cuatro discos de 0,5 cm del micelio seleccionados al azar del borde del hongo de una placa con 8 días de crecimiento y colocados en las placas de Petri con las bacterias o el filtrado y en placas control (sin bacterias o filtrado). Las placas de Petri con los discos se incubaron a 26 ± 2 ºC en condiciones de luz continua, donde se midió el crecimiento del micelio tomando 2 medidas en direcciones perpendiculares durante 15 días. 35 El experimento se realizó cuatro veces. El cálculo del índice antifúngico se hizo por la siguiente ecuación (Mu, 2000 citado por Wang y col., 2009): (Método de Leroux y col., 2002) Índice Antifúngico (%) = [1-(Da-0,5)/(Db-0,5)] x 100 Donde (Da) es el diámetro de la zona de crecimiento del hongo con el medio tratado y (Db) es el diámetro de la zona de crecimiento del hongo en medio control. Al mismo tiempo fueron observadas las hifas del hongo y contada la producción de conidios Método para contar conidios El conteo de esporas se realizo utilizando las placas con crecimiento del hongo del experimento para el cálculo del índice antifúngico. Para obtener las esporas, se tomó un disco con un diámetro de 0,5 cm y se resuspendió en 1 mL de una solución que contenía 1 mL de Twin 80 + 9 mL de agua destilada estéril, con la ayuda de un aplicador de madera se separaron las esporas y luego se homogenizó en el vortex. Los conidios se contaron en un hemocitometro estándar. Efecto de las Concentraciones evaluadas de los inóculos bacterianos y exudados sobre el Crecimiento micelial de Moniliophthora roreri Se extrajo un disco de micelio con esporas de Moniliophthora roreri de 0,5 cm de diámetro y se sumergió durante 10 segundos en los inóculos bacterianos y los extractos libres de bacterias (exudados) a diferentes concentraciones (10, 25, 50, 75 y 100%). 36 Estos fueron sembrados en placas con medio de TSA+ chocolate al 7%, además se colocó por placa un disco que previamente fue sumergido en un fungicida de origen químico como control positivo (Mancozib+ oxicloruro de cobre al 100%) y otro con agua destilada estéril (control negativo). Los halos de crecimientos fueron medidos en dos direcciones (vertical y horizontal) a las 72 y 120 horas, repitiendo este experimento 4 veces. (Adaptado Hernández y col., 1999) Inhibición de crecimiento de Moniliophthora roreri en medio líquido. Para el crecimiento en el medio líquido se utilizó V8MA (175 mL Jugo V8- 14 gr Maltosa7gr Asparagina) + 525 mL Caldo de cultivo Papa Dextrosa (PDB)+ 21 gr TSB. Esta mezcla se dispensó en tubos de doble concentración y se esterilizó. Luego se agregaron 50 µL de bacterias o extracto libre de bacterias, al mismo tiempo se inoculó con 1 disco de micelio con esporas del hongo M. roreri, los tubos fueron incubados a 26 °C en la oscuridad en un orbital a 120 rpm por 8 días. Una vez pasado el tiempo de incubación, se filtró el contenido de los tubos a través de un papel de prefiltro Whatman de 0,45 µL previamente lavado con agua destilada estéril y secado en la estufa por 24 horas antes de pesarlo, con la finalidad de eliminar partículas. Una vez pesado el papel, se filtraron las muestras para luego ser secadas a una temperatura de 80 °C, y se pesaron a las 24 horas con una segunda medición de peso a las 48 horas. Finalmente para obtener el peso seco del hongo, se restó el peso final versus el peso inicial del papel. Así mismo, para mayor confiabilidad, las pruebas se realizaron utilizando como control caldo de cultivo estéril. por triplicado 37 Análisis Estadísticos Para todos los experimentos se realizaron pruebas de ANOVA para observar si existían diferencias significativas entre los diferentes tratamientos bacterianos y los tratamientos control a un tiempo determinado, cuando estas diferencias existían se realizó una prueba de múltiples rangos de Tukey para observar donde se encontraban las diferencias. Todas las pruebas se realizaron con un nivel de confianza de 95%. El software estadístico utilizado para el análisis de las muestras fue Minitab versión 16 RESULTADOS Y DISCUSIÓN Curvas de Crecimiento Las temperaturas y tiempos de incubación para el crecimiento de las bacterias se muestran en la tabla 4, esto como resultado de la elaboración de curvas de crecimiento para cada bacteria estudiada (Figuras 1-5) El tiempo de incubación máximo de Xenorhabdus sp. fue de 24 h a una temperatura de 38 oC, en vista de que a estas condiciones se observó una fase estacionaria mucho más estable (Figura 1) y que fue alcanzada más rápidamente con un promedio de 14x106 ± 17,3x105 UFC. El resto de las temperaturas evaluadas permitieron crecimiento exponencial aún a las 24 h de incubación. Figura 1. Curvas de crecimiento de la bacteria Xenorhabdus sp. (Cepa Cachiri) en condiciones de laboratorio durante 51 h de cultivo continuo (Carrillo, 2014). 39 X. nematophila también mostró un tiempo de incubación y temperatura de 24 h y 38 oC respectivamente, la fase estacionaria se alcanzo entre 9 y 15 h de transcurrido el cultivo (Figura 2) con un promedio de 2,50x109 ± 60,9x107 UFC y 3x1011 ± 2x1011 UFC, respectivamente, después de este tiempo se observó que la población bacteriana declino. Figura 2. Curvas de crecimiento de la bacteria Xenorhabdus nematophila en condiciones de laboratorio durante 51 h de cultivo continuo (Carrillo, 2014). La temperatura optima y tiempo máximo de incubación para Photorhabdus sp. (Cepa INZIT fueron de 36oC y 24 h respectivamente, la bacteria alcanzó una fase estacionaria constante . 40 ya a las 18 h aproximadamente (2,03x1011 ± 6,35x1010 UFC), en promedio las UFC comienzan a declinar a la fase de muerte después de las 21 h (Figura 3). Figura 3.Curvas de crecimiento de la bacteria Photorhabdus sp. (Cepa INZIT) en condiciones de laboratorio durante 51 h de cultivo continuo (Carrillo, 2014). Por su parte Photorhabdus sp. (Cepa frutícola), mostró un tiempo de incubación favorable de 24 h a una temperatura de 38 oC. La densidad óptica mostró que llega a la fase estacionaria alrededor de las 15 h, mientras que las UFC mostraron la fase de muerte después de las 24 h, alcanzado un promedio de 2x1011 ± 0 UFC (Figura 4). . 41 Figura 4. Curvas de crecimiento de la bacteria Photorhabdus sp. (Cepa frutícola) condiciones de laboratorio durante 30 h de cultivo continuo (Carrillo, 2014). en Xenorhabdus innexi presentó un crecimiento a una temperatura óptima de 36 oC para un tiempo de 24 h en incubación, alcanzando un promedio de 3,57x1010 ± 3,04x1010 UFC, después de este tiempo y a dicha temperatura el cultivo de esta especie evidenció una fase estacionaria estable. Para la interpretación de las curvas fue más importante evaluar el crecimiento por medio de la densidad óptica, por lo que el conteo de UFC se utilizó principalmente para observar todas las fases de la curva de crecimiento como tal, permitiendo observar el final de la fase estacionaria y comienzo de la fase de muerte (Figura 5). . 42 Figura 5. Curvas de crecimiento de la bacteria Xenorhabdus innexi en condiciones de laboratorio durante 42 h de cultivo continuo (Carrillo, 2014). El criterio aplicado fue el de obtener una fase estacionaria más estable en el menor tiempo posible, a una temperatura dada, para así usar tales condiciones en la toma de un número significativo de bacterias al momento de realizar los experimentos. Índice antifúngico El crecimiento micelial del hongo Moniliophthora roreri fue marcadamente inhibido por los inóculos bacterianos, obteniendo sólo ligeros incrementos en los tratamientos de las bacterias X. poinarii, X. cabanillasii y Xenorhabdus sp. (Figura 6), siendo todos significativamente . 43 diferentes del tratamiento control (F= 205,07; p< 0,001; α =0,05) con valores por debajo del crecimiento promedio del control que fue de 4,16 ± 0,75 cm. Figura 6. Crecimiento del hongo en los distintos tratamientos de inóculos bacterianos durante todo el periodo de experimento (312 h). Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 (Carrillo, 2014). Mientras que los exudados no se mostraron tan efectivos como los inóculos, es importante destacar que se observó un menor crecimiento de Moniliophthora roreri en los exudados de las bacterias X. poinarii, X. cabanillasii y Xenorhabdus sp. precisamente estas mismas bacterias fueron las que tuvieron un ligero crecimiento en los experimentos con inóculos (Figura 7), mostrando diferencias significativas con respecto al tratamiento control (F= 98,55; p< 0,001; α . 44 =0,05), siendo diferentes todos aquellos por debajo del valor promedio de 3,31 ± 0,91 cm correspondiente a P. luminicens cepa bacteriophora. Figura 7. Crecimiento del hongo en los distintos tratamientos de exudados bacterianos durante todo el periodo de experimento (312 h). Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 (Carrillo, 2014). Los inóculos bacterianos resultaron más efectivos que los exudados al obtenerse mayores índices antifúngicos (Figura 8), mostrando una inhibición por encima del 90% del crecimiento del hongo con excepción de X. poinarii. Por su parte los exudados de X. poinarii, X. cabanillasii y Xenorhabdus sp. se mostraron con mayor efectividad siendo sus índices antifúngicos los más altos con 97,4%, 80,4% y 76,3%, respectivamente; el resto de los tratamientos de exudados estuvo por debajo del 40%. . 45 Figura 8. Índice antifúngico de los distintos tratamientos durante todo el periodo de experimento (312 h). Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne) (Carrillo, 2014). Es importante el hecho de que las bacterias Xenorhabdus y Photorhabdus en líneas generales presentaron un efecto inhibitorio sobre el hongo. Destacando que el antagonismo bacteria-hongo ya ha sido evaluado (Wang y col., 2009), la mayoría de los estudios de agentes de biocontrol microbianos muestran el antagonismo hongo-hongo (Hoopen y col., 2003; Bailey y col., 2008). En este caso se demostró el potencial de las bacterias Xenorhabdus y Photorhabdus para ser utilizadas como biocontroladores del hongo la Moniliophthora roreri, enfatizando que la posibilidad de usar bacterias para el manejo de enfermedades causadas por hongos ya se ha sugerido, tal como fue demostrado con Bacillus licheniformis, la cual pudo inhibir el crecimiento . 46 miceliar in vitro de Fusarium oxysporum, Rhizoctonia solani, Botrytis cinereapers, Gibberella zeae, Dothiorella gregaria y Collectotrichum gossypii; además de actuar como un protector potencial de plantas de maíz (zea mays) contra la infección por Bipolaris maydis y a la habichuela (Vicia faba ) de la infección por R. solani en condiciones in vivo. (Wang y col., 2009). Los microorganismos que mostraron una mayor efectividad a nivel de exudados fueron X. poinarii, X. cabanillasii y Xenorhabdus sp. probablemente por que las condiciones particulares de sus metabolitos favorecieron la interacción antagónica exudado-hongo; sin embargo los exudados de X. cabanillasii y Xenorhabdus sp. expusieron una efectividad por encima del 60%, mientras que el extracto de X. poinarii mostró un índice de 97,4%. Otros autores coinciden con lo mencionado anteriormente reportando, que Bacillus. licheniformis mostraban mayores índices antifúngicos en extractos no esterilizados (34,62 ± 73,53) en comparación con los esterilizados (17,65 ± 54,84) sobre el crecimiento de F. oxysporum, R. solani, B. cinereapers, G. zeae, D. gregaria y C. gossypii (Wang y col. 2009). Esporulación de Moniliophthora roreri En la tabla 5 se puede apreciar que sólo dos especies de las bacterias evaluadas: X. poinarii y X. bovienii permitieron la esporulación de Moniliophthora roreri en los tratamientos con inóculos directos, siendo estas aun así el número promedio de esporas de los tratamientos bacterianos significativamente menor al de los tratamientos control (F= 25,73; p< 0,001; α =0,05). Mientras que los exudados en su mayoría permitieron la esporulación, con excepción de X. poinarii y Photorhabdus sp. (Cepa frutícola). Cabe destacar, que todos los tratamientos donde se observó producción de esporas, presentaron promedios menores a los tratamientos control (Tabla 5), presentando todos . 47 diferencias significativas con respecto a estos (F= 25,73; p< 0,001; α =0,05), con excepción del extracto de X. innexi que fue estadísticamente igual al tratamiento control a 32 oC. TEMPERATURA (ºC) BACTERIA ESPORAS 38 Control (Agua destilada) 1.2166 a 36 Control (Agua destilada) 8.390 b 32 Control (Agua destilada) 5.971,50 cd 32 Exudado X. innexi 3.794 de 32 Exudado X. bovienii 2.048,50 ef 38 Exudado X. nematophila 2.035 ef 38 Exudado X. sp 1.744 ef 32 Exudado P. luminiscens (bacteriophora) 1.730,50 ef 32 Exudado P. luminiscens (indica) 1.693,33 ef 36 Exudado Photorhabdus sp. (INZIT) 1.587 ef 38 Exudado X. cabanillasii 1.478,50 ef 36 X. poinarii 1.157 ef 32 X. bovienii 820 ef Tabla 5. Esporulación promedio del hongo de Moniliophthora roreri ante el efecto de las distintas cepas bacterianas (inóculos y exudados) evaluados. Letras diferentes muestran diferencias significativas α=0,05 (Carrillo, 2014). La esporulación del hongo también es afectada por los tratamientos empleados, destacando igualmente que los inóculos son más efectivos que los extractos libres de bacterias; en el caso de las bacterias solo X. poinarii y X. bovienii permitieron la esporulación de M. roreri. Por otra parte, los exudados de X. poinarii y Photorhabdus sp. (Cepa frutícola) fueron los únicos que no mostraron esporulación. Particularmente X. poinarii es la especie que mostró más efectividad en sus exudados en contraste con sus inóculos. Una luz para entender esto sería la plasticidad que presentan las bacterias Xenorhabdus y Photorhabdus a nivel metabólico, que les permite adaptarse a diferentes nichos (Forst y col., 1997), por lo que en este caso particular podría mostrarse diferente en . 48 presencia del hongo, en comparación a estar en ausencia del mismo, es decir, una posible producción de metabolitos distintos en presencia del hongo, los cuales no afectan negativamente su crecimiento, sin embargo esta hipótesis tendría que demostrarse. Estudios realizados por Shapiro- Ilan y col., 2009 reportaron que los tratamientos de metabolitos derivados de X. bovienii y P. luminescens también tuvieron efectos supresores sobre la esporulación de F. effusum en los brotes de nuez (85%), dicha reducción fue igual o mayor a los tratamientos con fungicidas de origen químico (dodina y fenbuconazol). Efecto de las Concentraciones evaluadas de los inóculos bacterianos y exudados sobre el Crecimiento micelial de Moniliophthora roreri Los inóculos directos de Xenorhabdus sp. (Cepa Cachirí), mostraron una gran efectividad a una concentración del 100% a las 72 h, con respecto a los tratamientos control (0,60 ± 0 cm y 0,94 ± 0,10 cm, respectivamente; Figura 9) mostrando diferencias significativas (F= 12,14; p<0,001, α=0,05). Igualmente para las 120 h todas las concentraciones del inóculo mostraron ser diferentes de manera significativa (F= 13,23; p< 0,001; α=0,05) con respecto a los tratamientos control. Los exudados de Xenorhabdus sp. (Cepa Cachirí), no mostraron ser efectivos para la inhibición de crecimiento del hongo, dado que a las 72 h de experimento los tratamiento control manifestaron menor crecimiento del hongo que las distintas concentraciones de exudado utilizadas (1,06 ± 0,11 cm la concentración de 10% vs 0,91 ± 0,08 cm del control negativo), con diferencias significativas (F= 11,34; p<0,000; α=0,05) entre las concentraciones de 50% y 75% con respecto a los controles (1,11 ± 0,17 cm, 1,26 ± 0,18 cm y 0,91 ± 0,08 cm, respectivamente). Para las 120 h de experimento no se observaron diferencias significativas entre los tratamientos. . 49 Figura 9. Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus sp. (Cepa Cachirí) sobre el crecimiento micelial de Moniliophthora roreri A: Inóculo 72 h; B: Inóculo 120 h; C: Exudado 72 h; D: exudado 120 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). En los inóculos de Xenorhabdus cabanillasii la concentración más efectiva fue la de 100% tanto a las 72 h (0,88 ± 0,06 cm) como a las 120 h (1,72 ± 0,74 cm), mostrando diferencias significativas con respecto a los controles, (2,69 ± 0,27cm control negativo y 2,18 ± 0,36 cm control positivo) a las 120 h (F= 8; p< 0,001; α =0,05). Los exudados de esta bacteria no mostraron ser efectivos para inhibir el crecimiento del hongo, a las 72 h los controles mostraron menor crecimiento que las distintas concentraciones de exudados (1 ± 0,10 cm concentración 10%), aunque para las 120 h se observó que la concentración del 100% fue en promedio menor, no se observaron diferencias significativas entre ésta y los controles (Figura 10). . 50 Figura 10. Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus cabanillasii sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 72 h; B: Inóculo 120 h; C: Exudado 72 h; D: exudado 120 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). Por otra parte Xenorhabdus nematophila mostró ser mucho más efectiva que Xenorhabdus sp. (Cepa Cachirí) y Xenorhabdus cabanillasii, para los inóculos efectuando una mayor inhibición del crecimiento del hongo (Figura 11), observándose en todas las concentraciones bacterianas una total inhibición del crecimiento (0,8 ± 0 cm) en comparación a los controles (1,05 ± 0,17 cm control negativo y 1,13 ± 0,16 cm control positivo) tanto a las 72 h como a las 120 h con diferencias significativas (F=20,18/F=149,59; p< 0,001; α =0,05). Para el caso de los exudados de esta bacteria en particular, se observó que para las 72 h sólo la concentración del 100% (0,90 ± 0,0 cm) fue significativamente menor (F= 3,19; p< 0,001; α =0,05) a los tratamientos control (1,18 ± 0,11 cm control negativo y 1,13 ± 0,10 cm control . 51 positivo), y para las 120 h no se observaron diferencias significativas (F= 0,47; p= 0,827; α =0,05) entre los tratamientos, encontrándose inclusive los tratamientos control entre los tres menores promedios. Figura 11. Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus nematophila sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 72 h; B: Inóculo 120 h; C: Exudado 72 h; D: exudado 120 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). El inoculo de Xenorhabdus poinarii fue altamente efectiva para la inhibición del hongo Moniliophthora roreri (Figura 12), donde se pudo observar que los crecimientos son menores a los tratamientos control tanto a las 96 h como a las 116 h, mostrando diferencias significativas (F=186,02/F=4039; p< 0,001; α =0,05), para este último tiempo ninguno de los tratamientos bacterianos no mostraron crecimiento (0,5 ± 0,0 cm), mientras que los tratamiento control si dicho aumento estuvo por encima de 1 cm. Al igual que los inóculos, los exudados se mostraron . 52 altamente efectivos, solo que se observó inhibiendo al hongo principalmente a las 96 h, siendo menor la efectividad de todas las concentraciones de exudado en comparación con los tratamientos control mostrando también diferencias significativas (F= 56,90; p< 0,001; α =0,05), mientras que a las 116 h las concentraciones de 75 y 100% (1,53 ± 0,19 cm y 1,07 ± 0,08 cm respectivamente) mostraron la mayor efectividad inhibitoria, en comparación con el tratamiento control que fue superior de 2,50 cm. Figura 12. Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus poinarii sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 116 h; C: Exudado 96 h; D: exudado 116 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). . 53 Xenorhabdus bovienii presentó una ligera efectividad (Figura 13) que sólo mostró diferencias significativas (F= 11,65; p< 0,001; α =0,05) entre el control positivo (1,29 ± 0,41 cm) y el resto de los tratamientos a las 96 h (0,75 ± 0,28 cm el tratamiento bacteriano de mayor crecimiento fúngico correspondiente al 25%); mientras que para las 168 h no se observó una diferencia de crecimiento notable, de hecho el menor promedio de crecimiento se presentó en el control negativo (1,76 ± 0,29 cm), siendo este significativamente diferente al resto de los tratamientos (F= 10,73; p< 0,001; α =0,05). Los exudados de esta especie a las 96 h no mostraron una efectividad de inhibición notable siendo el control negativo el que presentó el menor promedio de crecimiento (0,87 ± 0,15 cm), sin embargo a las 116 h las concentraciones de 10% (0,97 ± 0,19 cm), 75% (0,85 ± 0,13 cm) y 100% (0,87 ± 0,13 cm) se mostraron con menor crecimiento del hongo, siendo significativamente diferentes (F= 16,93; p< 0,001; α =0,05) de los tratamientos control (1,53 ± 0,33 cm control negativo y 2,12 ± 0,52 cm control positivo). Figura. 13. Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus bovienii sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 168 h; C: Exudado 96 h; D: exudado 168 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). . 54 La bacteria Photorhabdus sp. (Cepa INZIT) mostró una total inhibición de crecimiento del hongo, tanto a las 96 h como a las 116 h (0,5 ± 0,0 cm en todos los tratamientos bacterianos), para ser altamente efectiva a nivel de los inóculos directos (Figura 14), al no obtener crecimiento estos fueron significativamente diferentes (p< 0,001; α =0,05) de los tratamientos control (2,66 ± 0,39 control negativo y 2,85 ± 0,32 control positivo para las 116 h). En los exudados la efectividad fue menor con respecto a los inóculos, ya que para las 96 h sólo los tratamientos de 75% (1,05 ± 0,16 ) y 100% (0,86 ± 0,05 cm) fueron los que mostraron menor crecimiento con respecto al control con diferencias significativas (F= 196,60; p< 0,001; α =0,05), mientras que para las 116 h los resultados muestran que sólo la concentración de 100% fue significativamente menor a los controles (F= 18,20; p< 0,001; α =0,05). Figura 14. Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus sp.. (Cepa INZIT) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 116 h; C: Exudado 96 h; D: exudado 116 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). . 55 Los inóculos de Photorhabdus sp. (Cepa frutícola) se mostraron altamente efectivos para inhibir el crecimiento de Moniliophthora roreri a las 72 h (Figura 15), donde los tratamientos bacterianos no mostraron crecimiento (0,5 ± 0,0 cm), para ser significativamente diferentes (F= 147,63; p< 0,001; α =0,05) de los tratamientos control (0,86 ± 0,06 control negativo y 0,88 ± 0,05 cm control positivo), mientras que a las 120 h todos los tratamientos de concentrados bacterianos con excepción de la concentración 10% (1,48 ± 0,13 cm) se mantuvieron sin crecimiento del hongo, siendo aun estadísticamente diferentes de los tratamientos control (F= 257,79; p< 0,001; α =0,05). Por otra parte los exudados se mostraron muy efectivos inhibiendo el crecimiento del hongo a las 72 h (0,70 ± 0,0 cm todos los tratamientos) siendo estos significativamente menores (F= 314,28; p< 0,001; α =0,05) que los tratamiento control (0,90 ± 0,02 cm control negativo y 0,91 ± 0,03 cm control positivo), y para las 120 h solo las concentraciones de 50% y 100% fueron significativamente menores a los controles (F= 9,75; p< 0,001; α =0,05). Figura 15. Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus sp. (Cepa frutícola) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 72h; B: Inóculo 120h; C: Exudado 72h; D: exudado 120h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). . 56 Los inóculos directos de Photorhabdus luminiscens (Cepa bacteriophora) inhibieron el crecimiento micelial de Moniliophthora roreri, tanto para las 96 h como para las 168 h (Figura 16), los tratamientos fueron significativamente menores a los controles (F=8,01/F=34,16; p< 0,001; α =0,05). Los exudados mostraron a las 96 h que solo las concentraciones de 75% y 100% (0,5 ± 0,0 cm ambas) fueron significativamente menores (F= 14,05; p< 0,001; α =0,05) a los controles (0,93 ± 0,15 cm control negativo y 1,10 ± 0,32 cm control positivo) inhibiendo por completo el crecimiento fúngico, mientras que a las 168 h no hubo diferencias significativas de crecimiento con excepción del control negativo que presentó el menor crecimiento promedio (1,58 ± 0,24 cm), por lo que a este tiempo los exudados no mostraron una efectividad aceptable para inhibir el crecimiento del hongo. Figura 16. Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus luminiscens (Cepa bacteriophora) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 168 h; C: Exudado 96 h; D: exudado 168 h. C + (fungicida), C – (agua). . 57 Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). Los concentrados de Photorhabdus luminiscens (Cepa indica) mostraron inhibición de crecimiento del hongo (Figura 17), exponiendo los menores promedios de crecimiento a las 96 h aunque sólo fueron significativamente menores al control positivo (F= 15,97; p< 0,001; α =0,05); para las 168 h todos los concentrados bacterianos excepto el de 10% (1,13 ± 0,23 cm) mostraron un crecimiento del hongo significativamente menor (F= 52,99; p< 0,001; α =0,05) con respecto a los tratamiento control (1,40 ± 0,24 cm control negativo y 2,03 ± 0,44 cm control positivo). Los exudados por su parte no mostraron una efectividad relevante, de hecho el control negativo mostró el menor crecimiento a las 96 h (0,71 ± 0,21 cm), ya para las 168 h no se observaron diferencias significativas entre los tratamientos. Figura 17. Efecto de la concentración de los inóculos bacterianos y exudados de Photorhabdus luminiscens (Cepa indica) sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 168 h; C: Exudado 96 h; D: exudado 168 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). . 58 Por otra parte, los inóculos de Xenorhabdus innexi mostraron gran efectividad en la inhibición del crecimiento del hongo (Figura 18), tanto a las 96 h como a las 116 h, los tratamientos de concentrados bacterianos (0,6 ± 0,0 cm todos los tratamientos) fueron significativamente menores (F= 88,11/F= 23,75; p< 0,001; α =0,05) a los controles que estuvieron por encima de 1 cm para las 96 h y por encima de 2 cm para las 116 h. Los exudados de esta bacteria mostraron ser muy efectivos a las 96 h mostrando un crecimiento significativamente menor de todos los concentrados con respecto a los tratamientos control, aunque para las 116 h solo los tratamientos de 75% (2,60± 0,13 cm) y 100% (2,10 ± 0,10 cm) resultaron en un crecimiento significativamente menor (F= 23,75; p< 0,001; α =0,05) que en los controles (3,01 ± 0,37 cm control negativo y 2,99 ± 0,20 control positivo). Figura 18. Efecto de la concentración de los inóculos bacterianos y exudados de Xenorhabdus innexi sobre el crecimiento micelial de Moniliophthora roreri. A: Inóculo 96 h; B: Inóculo 116 h; C: Exudado 96 h; D: exudado 116 h. C + (fungicida), C – (agua). Cajas que compartan una misma letra no presentan diferencias significativas (α = 0,05) (Carrillo, 2014). . 59 En líneas generales los inóculos bacterianos mostraron mayor efectividad en la inhibición del crecimiento de Moniliophthora roreri que los exudados bacterianos, aunque algunos de estos últimos también mostraron una buena inhibición en algunos casos particulares. Era de esperarse que a mayor concentración tanto de inóculos como de exudados se observara un mayor efecto inhibitorio. Esto puede deberse a que en el transcurso del tiempo de experimentación la interacción bacteria-hongo era capaz de afectar en mayor grado el crecimiento de M. roreri, mientras que la interacción exudado-hongo no es continua en el tiempo y depende en mayor parte de la concentración, e inclusive de la temperatura, en esta última se ha demostrado que la actividad antibiótica de extractos de Xenorhabdus nematophilus disminuyó significativamente con el aumento de la temperatura (Maxwell y col., 1994), por lo que este factor pudo afectar la efectividad de los extractos en algunas de las especies utilizadas. Sin embargo para los casos particulares de las bacterias Xenorhabdus poinarii, Xenorhabdus bovienii y Photorhabdus sp. (Cepa frutícola), se observó que los exudados fueron tan efectivos como los inóculos bacterianos; mucho mas en X. poinarii que en las otras. Lo reportado por Bayle y col. 2008 coincide, para algunos extractos de especies de Trichoderma, donde unos mostraron mayor efectividad que otros. Esto se explica por la diferencia de productos metabólicos de las diferentes bacterias empleadas (Kaya y col., 2006), así como la fase en la que se encuentra en determinado momento del crecimiento (Han y Ehlers, 1999). La concentración de inóculos mostró ser muy efectiva en algunas de las bacterias utilizadas, donde inclusive a un 10% en los tratamientos de inóculos bacterianos, Xenorhabdus innexi, Photorhabdus sp. (Cepa frutícola), Photorhabdus sp. (Cepa INZIT), y Xenorhabdus nematophila inhibieron por completo el crecimiento de Moniliopthora roreri. Mientras que en los exudados solo Xenorhabdus poinarii mostró una inhibición del hongo a las 96 h en todas las concentraciones. . 60 Resultados similares observaron Shapiro- Ilan y col., 2009 reportando que diluciones entre 6 y 12 % de los metabolitos de X. bovienii y P. luminiscens producen hasta un 90 - 100% de supresión de las lesiones de Phytophhthora. cactorum sobre hojas de nuez. Particularmente el factor tiempo es de suma importancia si se quiere aplicar este tipo de tratamiento como biocontrol de la Moniliopthora roreri, ya que se observó que en algunos casos, a la mitad del tiempo de experimentación (72-96 h), el crecimiento fue nulo comparándolo con los tratamientos control, mientras que para el total del tiempo de experimentación (116-120 h) el crecimiento era notorio, aun cuando fuese mas bajo que los controles. Esto indica una reducción de efectividad en el transcurso del tiempo, fenómeno que es más notorio en los exudados que en los inóculos, pudiéndose explicar esto quizás por el agotamiento de los metabolitos en este tipo de tratamiento por efectos de reacción de estos con otras moléculas pertenecientes al hongo, como demuestran otros estudios (Coleman y col., 2011) . Por lo anteriormente expuesto se destaca la importancia de la frecuencia de uso de un agente de biocontrol, Krauss y Soberanis (2002), demostraron el valor de este factor al encontrar menor incidencia de enfermedades asociadas al cacao al aumentar la frecuencia de aplicación de biocontroles, aunque por supuesto el factor económico es algo a considerar también en estos casos. Inhibición del crecimiento de Moniliophthora roreri en medio líquido. Todos los cultivos bacterianos mostraron una inhibición del crecimiento del hongo (para las 48 h), lo cual es evidente al contrastar el crecimiento de estos tratamientos con respecto al control, siendo todos significativamente menores que este (F= 30,97; p< 0,001; α =0,05), cabe destacar que la bacteria que muestra mayor efectividad de inhibición es P. luminiscens (Cepa bacteriophora) con un peso fúngico promedio de 0,03 ± 0,001g mientras el control presentó el mayor peso promedio con 0,12 ± 0,02 g. (Figura 19) . 61 Figura 19. Efecto de los cultivos bacterianos sobre el peso seco de Moniliophthora roreri a las 48 h de evaluación. Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 (Carrillo, 2014). Por otra parte los exudados mostraron ser menos efectivos que los cultivos, el menor promedio lo obtuvo X. bovienii (0,076 ± 0,04 g) el cual presentó un crecimiento menor en comparación al control (0,12 ± 0,02 g), le sigue P. luminiscens Cepa bacteriophora (0,088 ± 0,008 g), aunque ningún tratamiento presentó diferencia significativa con respecto al control (Figura 20). Para este tipo de experimento los cultivos bacterianos directos mostraron también una tendencia de mayor efectividad para inhibir el crecimiento del hongo Moniliophthora roreri en comparación con los exudados. . 62 Figura 20. Efecto de los exudados sobre el peso seco de Moniliophthora roreri a las 48 h de evaluación. Xenorhabdus sp. (X. sp), Xenorhabdus cabanillasii (X. caba), Xenorhabdus nematophila (X.nema), Xenorhabdus poinarii (X. poina), Xenorhabdus bovienii (X. bovi), Photorhabdus sp. Cepa INZIT (P. sp Inz), Photorhabdus sp. Cepa frutícola (P. sp fr), Photorhabdus luminescens Cepa bacteriophora (P. lum CB), Photorhabdus luminescens Cepa indica (P. lum CI), y Xenorhabdus innexi (X. inne). Letras diferentes muestran diferencias significativas α=0,05 (Carrillo, 2014). Es importante destacar que las bacterias mas efectivas no son las mismas que en el experimento de índice antifúngico, en este caso P. luminiscens (Cepa bacteriophora) fue mas efectiva en los inóculos directos, mientras que X. bovienii fue la que mostró una tendencia a mayor efectividad en cuanto a los exudados. Por ende quizás el cambio de condiciones favoreció más el efecto antagónico en unas especies que en otras, debido a posibles cambios de fase (Forst y col., 1997), u otros factores. Precisamente es este tipo de medio el que es más viable para utilizar como biocontrol a nivel de cultivos de cacao, por lo que X. bovienii mostró su potencial como biocontrol, destacando además que se ha demostrado que su quitinasa parcialmente purificada presenta una actividad antimicótica significativa sobre Botrytis cinerea (Chen y col., 1996), por lo que este tipo de enzima entre otros metabolitos podrían también afectar a M. roreri. . 63 La mayoría de las bacterias empleadas en el presente trabajo mostraron una alta capacidad antagónica con el hongo M. roreri, en vista de que no solo fueron capaces de inhibir el crecimiento del mismo, sino también actuaron sobre la esporulación de este patógeno. Otros trabajos han reportado efectos antagónicos similares, en donde destaca el realizado por Villamil y col. (2012), enfatizando la acción de un hongo del genero Trichoderma que fue capaz de afectar a M. roreri tanto en crecimiento como en esporulación, también encontrando y confirmando el antagonismo por parte de una bacteria del genero Bacillus. Igualmente Shapiro y col en el año 2009 determinaron la habilidad inhibitoria que tienen los metabolitos derivados de Xenorhabdus y Photorhabdus sobre Glomerella cingulata, Phomopsis sp, Phytotphthora cactorum y Fusicladosporium effusum los cuales son patógenos de origen fúngicos que afectan a la nuez y Monilia frutícola que causa daños al melocotón. Es importante destacar que los resultados representan una opción viable para el biocontrol de la Moniliopthora roreri, donde en el caso de Venezuela, el control químico y cultural son los adoptados como los principales métodos para evitar que este patógeno afecte la producción del cultivo (Sánchez y col. 2003). Las especies que mostraron mayor potencial como biocontrol son X. poinarii, Photorhabdus sp (Cepa Inzit), Photorhabdus sp (Cepa Fruticola) y P. luminiscens (Cepa Bacteriophora), ya que sus inóculos, y exudados presentaron propiedades antifungicas contra M. roreri; a su vez mostrándose con mayor capacidad inhibitoria que el agente químico usado en los tratamientos de control positivo (+). Hidalgo y col. (2003), destacaron que el hidróxido de cobre fue más efectivo que los tratamientos biológicos empleados (Clonostachys rosea) por ellos para inhibir el crecimiento de Moniliopthora roreri; de aquí destaca la importancia de buscar otros microorganismos con potencial antagónico en determinados agentes patógenos, tal como se destaca en este trabajo. Esto tomando en cuenta que existe una diversidad establecida en cuanto a este hongo en la zona tropical de América (Phillips-Mora y col., 2007), y que los presentes resultados quizás están solo limitados a la cepa utilizada de Moniliophthora roreri. . 64 Estudios realizados por Mejias y col en el 2008, probaron en condiciones in vitro hongos endófitos como agentes de biocontrol de patógenos aislados de tejidos sanos de Theobroma cacao y observaron un antagonismo del 40% para Moniliophthora roreri, un 65% frente a Phytophthora palmivora y 27% y Moniliophthora perniciosa; siendo el mecanismo de acción simple competencia por el sustrato sin embargo mostraron una clara antibiosis contra Moniliophthora roreri (13%), Phytophthora palmivora(21%) y Moniliophthora perniciosa (0%) sugiriendo que existe una inherente compensación entre el rápido crecimiento, alta colonización y la producción de químicos que ocasionan una reacción de antibiosis, debido a que las especies endofiticas que son comunes en sus plantas hospedantes bajo condiciones naturales a menudo son buenas colonizadoras y crecer rápidamente in vitro mientras que los productores de antibiosis son usualmente raros en la naturaleza con tendencia a crecer lentamente en condiciones in vitro y que a menudo no son buenas colonizadores. La efectividad de estos organismos podría estar sujeta a tres factores de acción importantes; desde el punto de vista de los inóculos, el parasitismo y la competencia que pueden ejercerse en la interacción bacteria-hongo, podrían estar a favor de la bacteria la cual desplaza y afecta al hongo (Villamil y col., 2012), y en el caso de los exudados, la acción antibiótica de ciertos metabolitos que inhiben el crecimiento del hongo (Akhurst, 1980; Maxwell y col., 1994). Aun más importante es quizás el posible efecto combinado de estos factores, ya sea ParasitismoAntibiosis o Competencia-Antibiosis, en algunas de las especies utilizadas. Desde el punto de vista de aplicabilidad de estos organismos como biocontrol, es importante destacar que de los 10 organismos empleados, solo tres son cepas autóctonas de Venezuela, y no representan cepas de nematodos asociados a larvas provenientes de campos de producción de cacao. Las cepas aisladas en Venezuela son Xenorhabdus sp., Photorhabdus sp. (Cepa INZIT) y Photorhabdus sp. (Cepa frutícola). Mientras que las otras cepas provienen de otras regiones, destacando por ejemplo que se ha reportado aislamiento de X. innexi del nematodo Steinernema serratum al Sur de China (Lengyel y col., 2005). Las implicaciones del uso directo de estas bacterias a nivel ecológico deben ser estudiadas, por lo que su aplicabilidad en el biocontrol en determinadas regiones debería limitarse al uso de extractos estériles. Esto sin . 65 mencionar, que aun es necesario realizar ensayos a nivel de campo, para comprobar la efectividad de estas cepas como biocontrol de la enfermedad, ya que en el campo la abundancia del patógeno por lo general es mayor que la del biocontrol (Villamil, 2012). . CONCLUSIONES Los géneros Xenorhabdus y Photorhabdus pueden inhibir el crecimiento y esporulación del hongo Moniliopthora roreri, presentando propiedades fungicidas que las convierte en agentes con un alto potencial para ser usados como control biológico de la moniliasis del cacao. Los parámetros utilizados para obtener una fase estacionaria mas estable de las bacterias de los géneros Xenorhabdus y Photorhabdus en el menor tiempo posible oxilan entre un rango de temperatura de 32±38 °C y un tiempo de incubación de 24±31 horas. Los inóculos bacterianos directos fueron más efectivos tanto en la inhibición de crecimiento del hongo, como en la esporulación del mismo, en comparación con los extractos libres de bacterias (exudados). Las especies que mostraron mayor potencial de biocontrol hacia el hongo Moniliophthora roreri son X. poinarii, Photorhabdus sp (Cepa Inzit), Photorhabdus sp (Cepa Fruticola) y P. luminiscens (Cepa Bacteriophora), tanto a nivel de inóculos directos, como de exudados. RECOMENDACIONES Realizar ensayos en campo para observar la efectividad directa de estos organismos como biocontroladores de la moniliasis, empleando las cepas que mostraron mayor efectividad y evaluando las mejores opciones para su uso. En caso de usar directamente las bacterias como agente de biocontrol darle mayor relevancia a las cepas autóctonas de Venezuela, y estudiar las implicaciones ecológicas que pudiera causar esto, como por ejemplo una patogenicidad no deseada hacia insectos u otros organismos del entorno. . ÍNDICE DE REFERENCIAS Akhurst, R. (1980). Antibiotic activity of Xenorhabdus spp., bacteria symbiotically associated with insect pathogenic nematodes of the families Heterorhabditidae and Steinernematidae. Journal of General Microbiology 128:3061–3065. Akhurst, R. (1983). Neoaplectana species: specificity of association with bacteria of the genus Xenorhabdus. Experimental Parasitology 55: 258-263. Aneja, M., Gianfagna, T. y Hebbar, P. (2005). Trichoderma harzianum produces nonanoic acid, an inhibitor of spore germination and mycelial growth of two cacao pathogens. Physiological and Molecular Plant Pathology 67:304-307. Arciniegas, L. (2005). Caracterización de árboles superiores de cacao (Theobroma cacao L.) seleccionados por el programa de mejoramiento genético del CATIE. CATIE, Turrialba, Costa Rica. Tesis M.Sc. pp. 125. Bailey B., Bae H., Strem M., Crozier J., Thomas S., Samuels G., Vinyard B., & K. y Holmes. (2008). Antibiosis, mycoparasitism, and colonization success for endophytic Trychoderma isolates with biological control potential in Theobroma cacao. Biological Control 46: 24-35. Bedding, R. y Molyneux, A. (1982).Penetracion of cuticle by infective juveniles of Heterorhabditis spp. (Heterorhabditidae: Nematoda). Nematologica 28:354-359. Chen G., Zhang Y., Li J., Dunphy G. Punja Z., y Webster, J. (1996). Chitinasa activity of Xenorhabdus and Photorhabdus Species, Bacterial Associates of Entomopathogenic Nematodes. Journal of Invertebrate Pathology 68: 101-108. Coleman J., Ghosh S., Okoli I. y Mylonakis E. (2011). Antifungal Activity of Microbial Secondary Metabolites. PLoS ONE 6(9): e25321. doi:10.1371/ journal.pone.0025321. Enríquez, G. (1985). Curso sobre el cultivo del cacao. Centro Agronómico Tropical de Investigación y Enseñanza, CATIE. Costa Rica. 239p. . Forst, S., Dowds, B., Boemare, N. y Stackebrandt, E. (1997). Xenorhabdus and Photorhabdus spp.: Bugs that kill bugs. Annual Review of Microbiology 51: 47-72. Han, R., y Ehlers,R-U. (1999). Trans-specific nematicidal activity of Photorhabdus luminescens. Nematology 1: 687-693. Hernández J., Arcia M., y Ramírez R. (1999). Comparación in vitro del control químico y biológico de Dothiorella sp., causante de la pudrición apical de la guayaba (Psidium guajava L.) Revista de la Facultad de Agronomía (LUZ) 16: 49-55. Hidalgo, E., Bateman, R., Krauss, U., Hoopen, M. y Martíjn, A. (2003). A field investigation into delivery systems for agents to control Moniliophthora roreri. European Journal of Plant Pathology 109: 953-961. Hoopen G., Rees R., Aisa P., Stirrup T. y Krauss U. (2003). Population dynamics of the epiphytic mycoparasites of the genera Clonostachys and Fusarium for the biocontrol of black pod (Phytophhthora palmivora) and moniliasis (Moniliophthora roreri) on cocoa (Theobroma cacao). Mycology Research 107 (5): 587-596. Hu K., Li J. y Webster, J. (1999). Nematicidal metabolites produced by Photorhabdus luminiscens (Enterobacteriaceae), bacterial symbiont of entomopathogenic nematodes. Nematology 1:457469. Kaya, H., Aguillera, M., Alumai, A., Choo, H., Torre, M., Fodor, A., Ganguly, S., Hazir, S., Lakatos, T., Pye, A., Wilson, M., Yamanaka, S., Huaiwan, Y. y Ehlers, R.U. (2006). Status of entomopathogenic nematodes and their symbiotic bacteria from selected countries or regions of the world. Biological Control 38:134-155. Krauss, U. y Soberanis, W. (2001). Biocontrol of Cocoa Pod Diseases with Mycoparasite Mixtures. Biological Control 22:149-158. Krauss, U., Hoopen, G., Hidalgo, E., Martinez, A., Stirrup, T. Arroyo, C., Garcia, J. y Palacios, M. (2006). The effect of cane molasses amendment on biocontrol of frosty pod rot (Moniliophthora roreri) and black pod (Phytophthora spp.) of cocoa (Theobroma cacao) in Panama. Biological Control 39: 232–239. . Leach, A., Mumford, J. y Krauss, U. (2002). Modelling Moniliophthora roreri in Costa Rica. Crop Protection. 21: 317-326. Lengyel K., Lang E. Fodor A., Szállás E., Schumann P. y E. Stackebrandt. (2005). Description of four novel species of Xenorhabdus, family Enterobactereriaceae: Xenorhabdus budapensis sp. nov., Xenorhabdus ehlersii sp. nov., Xenorhabdus innexi sp. nov., and Xenorhabdus szentirmaii sp. nov. Systematic and Applied Microbiology 28: 115-122. Leroux, P., Chapeland, F., Desbrosses, D. y Gredt, M. (2002). Patterns of cross-resistance to fungicide in Botryotinia fuckeliana (Botrytis cinerea) isolates from French vineyards. Crop Protection 18:687–692. López-Robles, J., Otto, A.A. y Hague, N.G.M. (1997). Evaluation of the Steinernema feltiae/Xenorhabdus bovienii complex against the fungus phoma betae on sugar beet seedlings. Test of Agrochemicals and Cultivars. 18:48-49. Maxwell, P., Chen, P., Webster, J. y Dunphy, G. (1994). Stability and activities of antibiotics produced during infection of the insect Galleria mellonella by two isolates of Xenorhabdus nematophilus. Applied and Environmental Microbiology 60:715-721. Mejías, L., Rojas, E., Maynard, Z., Bael, S., Arnold, E., Hebbar, P., Gary, J., Robbins,N. y Herre, E. (2008). Endophytic fungi as biocontrol agents of Theobroma cacao pathogens. Biological Control 46: 4–14 Ministerio del Poder Popular para Ciencia y Tecnología. Fundación para el desarrollo de la Ciencia y la Tecnología en el estado Zulia. Misión Ciencias. (2007).1er Encuentro de la Ruta del Chocolate. Maracaibo, Estado Zulia, Venezuela 7p. Moreno, M. (2004). El cultivo del Cacaotero en Venezuela. Colección: Docencia Universitaria. Ediciones de la Universidad Ezequiel Zamora. Barinas, Venezuela. 279p. Parra, D. y Sánchez, L. (2005). El control de la moniliasis en el cacao. INIA Divulga 67: 23-26 Peters, A., y Ehlers, R.-U. (1994). Susceptibility of leatherjackets (Tipula paludosa and T. oleracea; Tipulidae: Nematocera) to the entomopathogenic nemadode Steinernema feltiae. Journal of Invertebrate Pathology 63: 163–171. . Phillips-Mora, W., Aime, M. y Wilkinson, J. (2007). Biodiversity and biogeography of the cacao (Theobroma cacao) pathogen Moniliophthora roreri in tropical America. Plant Pathology, 56: 911–922. Pinzón, J., Rojas, J. y Rojas, F. (2008). Guía Técnica para el Cultivo del Cacao. ed. Tercera, Federación Nacional de Cacaoteros. Bogotá D.C.pp.112-117. Rosales, L. Suarez, Z. Nava, R. y Tellechea, V. (1999). Nematodos entomopatogénos. FONAIAP Divulga. 63. Rumbos, R., Ramos, G. y Gómez, A. (2005).La monilliasis en el cacao. INIA Divulga, 5:11-12. Sánchez, L., Gamboa, E. y Rincón, J. (2003). Control químico y cultural de la moniliasis (Moniliophthora roreri Cif & Par) del cacao (Theobroma cacao L) en el estado Barinas. Revista de la Facultad de Agronomía UCV 20:188-194. Shapiro-Ilan,D., Reilly, C. y Hotchkiss, M. (2009). Suppressive effects of metabolites from Photorhabdus and Xenorhabdus spp. on phytopathogens of peach and pecan. Taylor & Francis, 42(8): 715–728 Villamil J., Blanco J. y Viteri S. 2012. Evaluación in Vitro de Microorganismos Nativos por su Antagonismo a Moniliophthora roreri Cif & Par en Cacao (theobroma cacao L). Revista de la Facultad Nacional de Agronomía de Medellín 65 (1): 6305-6315. Volgyi, A., Fodor, A., Szentirmai, A. y Forst, S. (1998). Phase Variation in Xenorhabdus nematophilus. Applied and Environmental Microbiology, 64: 1188–1193. Wang, H., Wen, K., Zhao, X., Wang, X., Li, A. y Hong, H. (2009). The inhibitory activity of endophytic Bacillus sp. strain CHM1 against plant pathogenic fungi and its plant growthpromoting effect. Crop Protection 28:634-639. . ANEXOS Anexo 1. Peso seco del hongo Moniliopthora roreri (g) ante el efecto de los exudados en medio Líquido. (Carrillo, 2014) Exudados 24 horas 48 horas Replica Replica Replica 1 2 3 Replica Replica Replica 1 2 3 X. sp. (Cepa Cachirí) 0,114 0,108 0,136 0,099 0,095 0,119 X. cabanillasii 0,106 0,119 0,123 0,093 0,104 0,109 X. nematophila 0,146 0,15 0,118 0,132 0,139 0,106 X. poinarii 0,111 0,134 0,116 0,097 0,118 0,105 X. bovienii 0,051 0,133 0,091 0,036 0,118 0,075 P. sp. (C. INZIT) 0,112 0,096 0,143 0,095 0,085 0,13 P. sp. (C. frutícola) 0,112 0,117 0,108 0,103 0,106 0,095 P. luminiscens (C. bacteriophora) 0,092 0,105 0,105 0,079 0,096 0,09 0,162 0,148 0,135 0,15 0,138 0,125 X. innexi 0,151 0,167 0,154 0,138 0,156 0,142 Control 0,111 0,15 0,102 0,138 P. luminiscens (C. indica) Anexo 2. Peso seco del hongo Moniliopthora roreri (g) ante el efecto de los Inóculos bacterianos en medio Líquido. (Carrillo, 2014) Bacterias 24 horas 48 horas Replica Replica Replica 1 2 3 Replica Replica Replica 1 2 3 X. sp. (Cepa Cachirí) 0,007 0,058 0,007 0,051 0,044 0,056 X. cabanillasii 0,073 0,074 0,051 0,06 0,058 0,051 X. nematophila 0,069 0,08 0,07 0,054 0,069 0,058 X. poinarii 0,083 0,087 0,08 0,071 0,072 0,064 X. bovienii 0,067 0,076 0,074 0,053 0,061 0,062 P. sp. (C. INZIT) 0,069 0,045 0,073 0,056 0,035 0,061 P. sp. (C. frutícola) 0,119 0,108 0,111 0,104 0,096 0,1 P. luminiscens (C. bacteriophora) 0,047 0,043 0,048 0,034 0,031 0,034 0,048 0,064 0,069 0,035 0,052 0,054 X. innexi 0,07 0,073 0,077 0,058 0,063 0,066 Control 0,111 0,15 0,102 0,138 P. luminiscens (C. indica) .