Dispositivos Cilindro-Pistón
Anuncio
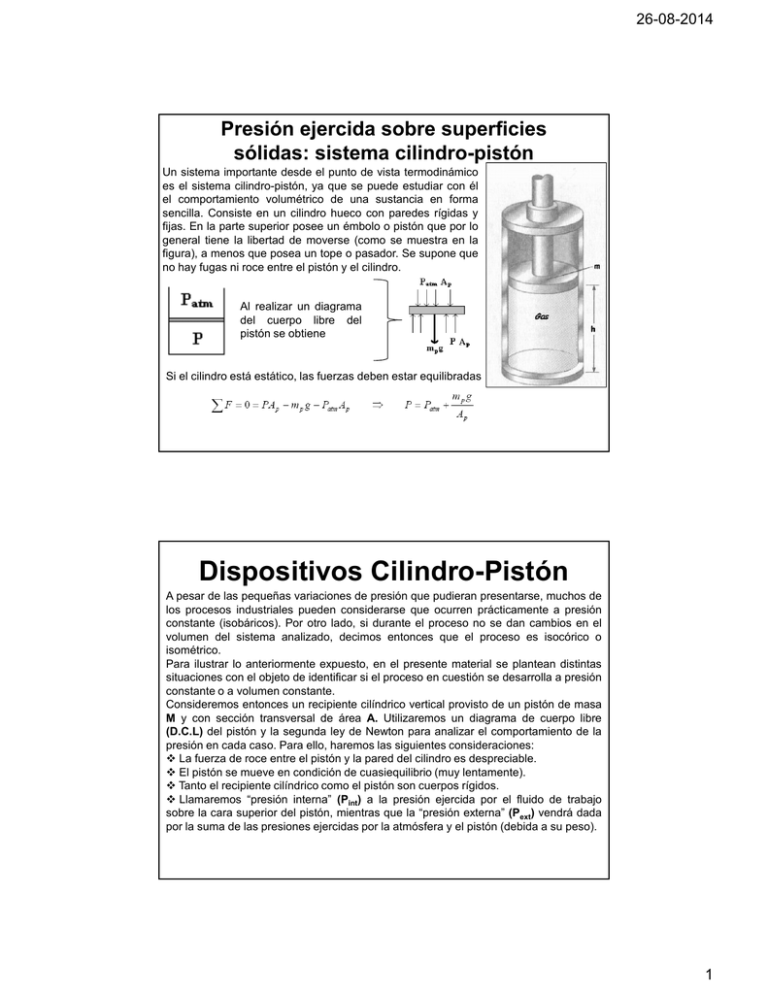
26-08-2014 Presión ejercida sobre superficies sólidas: sistema cilindro-pistón Un sistema importante desde el punto de vista termodinámico es el sistema cilindro-pistón, ya que se puede estudiar con él el comportamiento volumétrico de una sustancia en forma sencilla. Consiste en un cilindro hueco con paredes rígidas y fijas. En la parte superior posee un émbolo o pistón que por lo general tiene la libertad de moverse (como se muestra en la figura), a menos que posea un tope o pasador. Se supone que no hay fugas ni roce entre el pistón y el cilindro. Al realizar un diagrama del cuerpo libre del pistón se obtiene Si el cilindro está estático, las fuerzas deben estar equilibradas Dispositivos Cilindro-Pistón A pesar de las pequeñas variaciones de presión que pudieran presentarse, muchos de los procesos industriales pueden considerarse que ocurren prácticamente a presión constante (isobáricos). Por otro lado, si durante el proceso no se dan cambios en el volumen del sistema analizado, decimos entonces que el proceso es isocórico o isométrico. Para ilustrar lo anteriormente expuesto, en el presente material se plantean distintas situaciones con el objeto de identificar si el proceso en cuestión se desarrolla a presión constante o a volumen constante. Consideremos entonces un recipiente cilíndrico vertical provisto de un pistón de masa M y con sección transversal de área A. Utilizaremos un diagrama de cuerpo libre (D.C.L) del pistón y la segunda ley de Newton para analizar el comportamiento de la presión en cada caso. Para ello, haremos las siguientes consideraciones: La fuerza de roce entre el pistón y la pared del cilindro es despreciable. El pistón se mueve en condición de cuasiequilibrio (muy lentamente). Tanto el recipiente cilíndrico como el pistón son cuerpos rígidos. Llamaremos “presión interna” (Pint) a la presión ejercida por el fluido de trabajo sobre la cara superior del pistón, mientras que la “presión externa” (Pext) vendrá dada por la suma de las presiones ejercidas por la atmósfera y el pistón (debida a su peso). 1 26-08-2014 Dispositivos Cilindro-Pistón 1er caso: el pistón se encuentra inicialmente en equilibrio en el estado inicial (1). Se transfiere calor al fluido y el pistón se eleva lentamente hasta llegar al estado final (2). El D.C.L. es el mismo en la posición inicial (1), en la posición final (2) y en cualquier posición intermedia del pistón, siendo la presión interna igual a la presión externa (ec.I). En vista que ni la presión atmosférica ni el peso del pistón varían durante el proceso y que el pistón se mueve en condición de cuasiequilibrio, se puede decir que el proceso ocurre a presión constante. Dispositivos Cilindro-Pistón 2do caso: el pistón se encuentra inicialmente descansando sobre unos topes inferiores en el estado inicial (1). Se transfiere calor al fluido y el pistón se eleva lentamente hasta llegar al estado final (2). 2 26-08-2014 Dispositivos Cilindro-Pistón Según la ec. II, la presión interna inicial es menor que la presión externa (constante), por lo cual el pistón no comenzará de inmediato a moverse. A medida que la presión interna aumente, la presión ejercida por los topes (Ptopes) irá disminuyendo debido a la tendencia del pistón a despegarse de los mismos. En el momento en que el pistón se ha separado infinitesimalmente de los topes (Ptopes = 0), el D.C.L. de éste será exactamente igual al obtenido para el 1er caso, por lo cual de ahí en adelante el movimiento del pistón será idéntico al ya explicado anteriormente. Dispositivos Cilindro-Pistón 3er caso: el pistón se encuentra inicialmente en equilibrio en el estado inicial (1). Se transfiere calor al fluido y el pistón se eleva lentamente hasta que toca los topes superiores. Se sigue calentando hasta que el fluido llega al estado final (2). En la ec. III se observa que el pistón en el estado inicial (1) comenzará de una vez a moverse ya que las presiones interna y externa son iguales entre sí. Tal como se explicó para el 1er caso, el pistón se desplazará a presión constante hasta encontrarse a una separación infinitesimal de los topes superiores (Ptopes = 0). Al seguir calentando, la presión interna aumentará por lo que los topes deben ejercer presión sobre el pistón para que éste se mantenga en la misma posición. 3 26-08-2014 Dispositivos Cilindro-Pistón 3er caso: Según la ec. IV, la presión interna final es mayor que la presión externa (constante), por lo cual el pistón una vez que haya tocado los topes experimentará un proceso a volumen constante. Obviamente esta condición se mantendrá hasta que los topes alcancen su presión máxima posible, en cuyo caso éstos podrían romperse al cabo de cierto tiempo. Resumen A continuación se presentan los casos típicos que se encuentran en un sistema cilindro-pistón: b) Intercambio de calor (velocidad del pistón constante) a) pistón sin movimiento c) Topes inferiores e) Resorte d) Topes superiores f) horizontal 4 26-08-2014 Las variables termodinámicas o variables de estado • Temperatura (T): es una medida del calor o energía térmica de las partículas en una sustancia y no depende del tamaño o tipo de objeto. Cuando trabajemos con relaciones de temperatura, por ejemplo, T1/T2 estas siempre deben estar en escala absoluta, es decir, en Kelvin o Rankine. En el caso de restas, pueden ser en cualquier escala. Ejemplo: Entre 25°C y 80°C, determine la relación de temperaturas T 1/T2 y la variación T2 - T1 Escala de temperatura Para establecer una escala de temperatura, se seleccionan dos puntos de referencia: El punto de congelación, la temperatura a la que se encuentran en equilibrio una mezcla de hielo y agua saturada de aire, bajo una presión de 1 atm. El punto de ebullición, la temperatura de equilibrio para el agua pura y su valor, bajo una presión de 1 atm. Existen dos escalas de temperaturas de uso generalizado: Escala Celsius: asigna una valor de 0°C al punto de congelación del agua saturada con aire a presión atmosférica estándar y de 100°C a l punto de ebullición del agua pura a presión atmosférica estándar. Escala Fahrenheit: asigna una valor de 32°F al punto de fusión de una mezcla de sales con hielo (0°F) y de 212 °F al punto de ebullici ón del agua T ( ° F ) = 1 , 8 T ( ° C ) + 32 T ( ° F ) = T ( ° R ) − 459 , 67 5 26-08-2014 Escala absoluta de temperatura Existen dos escalas absolutas de temperaturas de uso generalizado: Escala Kelvin: se basa en los principios de la termodinámica en los que predice la existencia de una temperatura mínima, en la cual, las partículas de un sistema carecen de energía térmica. La temperatura en la cual las partículas carecen de movimiento se conoce como cero absoluto (0°K) Escala Rankine: se define midiendo en grados Fahrenheit sobre el cero absoluto, por lo que se carece de valores negativos T ( ° K ) = T ( ° C ) + 273 ,15 T ( ° R ) = T ( ° F ) + 459 , 67 T ( ° R ) = 1 ,8 T ( ° K ) Equilibrio Térmico Es el estado en el que se igualan las temperaturas de dos cuerpos que inicialmente tenían diferentes temperaturas. Al igualarse las temperaturas se suspende el flujo de calor, y el sistema formados por esos cuerpos llega a su equilibrio térmico. Por ejemplo, si pone tienes un recipiente con agua caliente, y otro con agua fría, a través de sus paredes se establecerá un flujo de energía calorífica, pasado un tiempo, la temperatura del agua en ambos recipientes se igualará (por obra de las transferencias de calor, en este caso del agua más caliente a la más fría, también por contacto con el aire del medio ambiente y por evaporación), pero el equilibrio térmico lo alcanzarán cuando ambas masas de agua estén a la misma temperatura. 6 26-08-2014 Ley cero de la termodinámica La ley cero esta basada en la existencia de dos cuerpos, uno caliente y uno frio, ambos se ponen en contacto. Si además se aíslan del entorno, el cuerpo caliente se enfría, mientras que el frio se calienta. Así las propiedades se mantiene invariables con el tiempo, al alcanzar el equilibrio térmico. Por otro lado si un tercer cuerpo se pone en contacto térmico con cualquiera de ellos y todas sus propiedades permanecen sin cambiar, se dice que los tres cuerpos están en equilibrio térmico entre si. “Si dos cuerpos están en equilibrio térmico con un tercero, los tres están en equilibro térmico entre si” Ejemplo: estufa de los pobres GASES GASES IDEALES 7 26-08-2014 GAS Los gases son sustancias que se caracterizan porque sus moléculas se mantienen en desorden, dotadas de alta energía (están en constante movimiento) y separadas por “grandes” distancias donde la interacción intermolecular es casi nula. Los gases no poseen volumen ni forma determinada, es decir, que a diferencia de los sólidos y los líquidos, ocupan todo el volumen del recipiente que los contiene, adopta la del recipiente que lo contiene Variables del gas La temperatura es un propiedad física de los gases. A temperaturas altas sus moléculas se mueven más rápido. La temperatura se debe expresar en Kelvin K = °C + 273. El Volumen (V) es el espacio ocupado por un gas. El gas es compresible y su volumen estará determinado por el espacio ocupado. Si un gas se comprime, su presión y volumen se modificarán de acuerdo a las leyes de los gases. es una fuerza que se ejerce sobre una superficie. La presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor. 8 26-08-2014 Variables del gas Su unidad es el mol. Un mol es la cantidad de sustancia que contiene tantos átomos o moléculas como hay precisamente en 12 g. de Carbono 12, o bien un mol es aquel numero de gramos de una sustancia numéricamente igual a la masa molecular de la sustancia. La relación entre temperatura, presión, volumen y la cantidad de gas expresado en moles, se las conoce como LEYES DE LOS GASES estas se basan en cuatro variables para definir la condición física o estado del gas tales son: temperatura, presión, volumen y cantidad de gas expresado en moles VOLUMEN (L) CANTIDAD DE MOLES (n) GASES TEMPERATURA (T) PRESION (P) GAS IDEAL Un gas ideal es aquel constituido por un número grande de moléculas puntuales que están en movimiento aleatorio y a distancias suficientemente grandes para que interaccionen únicamente durante los choques. Los choques de las moléculas se consideran perfectamente elásticos. A muy bajas presiones (menores a 10 atmlos gases se aproximan al comportamiento ideal (sin importar la temperatura). Los gases se desvían del comportamiento de gas ideal principalmente cuando están cercanos al punto crítico (Es el estado donde las fases líquida y gaseosa se confunden) Los gases ideales se rigen por la ecuación de los gases ideales. 9 26-08-2014 Existen 4 leyes de los gases ideales Ley de Boyle Ley de Gay-Lussac Formulada por Robert Boyle y Edme Mariotte Ley de Charles Formulada por Jacques Alexandre César Charles Formulada por JosephLouis GayLussac Ley de Avogadro Formulada por Lorenzo Romano Amedeo Carlo Avogadro Ley de Boyle (Isotérmica) Cuando el volumen y la presión de una cierta cantidad de gas es mantenida a temperatura constante, el volumen será inversamente proporcional a la presión A Menor presión, mayor volumen. A Mayor presión, menor volumen. 10 26-08-2014 Ley de Charles (Isométrica) El volumen de una cantidad fija de gas mantenida a presión constante es directamente proporcional a su temperatura absoluta. A mayor temperatura, mayor volumen. Ley de GayGay-Lussac (Isobárica) La presión de un gas que se mantiene a volumen constante, es directamente proporcional a la temperatura Cuando sometemos un gas a un calentamiento y lo dejamos que se expanda libremente, el volumen se incrementara proporcionalmente con el incremento de la temperatura, pero su presión no se altera, pues siempre será ejercida por la atmosfera y por el objeto o por la sustancia que funcione como tapón hermético. A mayor temperatura, mayor presión. 11 26-08-2014 Ley de Avogadro El físico italiano Amadeo Avogadro, formuló en 1811 una hipótesis para el numero de moléculas de un gas confinado en un recipiente; para demostrarlo, se toman dos porciones de gases diferentes y se colocan en dos recipientes de igual volumen a la misma temperatura y presión y el numero de moléculas de cada recipiente debe ser el mismo. “Volúmenes iguales de gases diferentes a la misma presión y temperatura, contienen el mismo numero de moléculas” Numero de avogadro Para volúmenes iguales de gases diferentes en condiciones normales de presión y temperatura (1atm y 273K) , el numero de molécula es 23x1023 por cada mol de cualquier gas. p T n V Boyle aumenta constante constante disminuye V α 1/p Charles constante aumenta constante aumenta TαV Avogadro constante constante aumenta aumenta nαV 12 26-08-2014 Ecuación de estado para un gas ideal Ecuación de estado, es la relación que existe entre dos o más propiedades termodinámicas. Cuando en los gases la presión es baja o la temperatura es alta, se consideran sistemas gaseosos de baja densidad, en estas condiciones los gases se rigen con las leyes de los gases ideales. Todos los gases a presiones relativamente baja (menores a 10 atm) obedecen a la ecuación de gas ideal, en estas condiciones, la presión, el volumen especifico, y la temperatura se relacionan por la siguiente ecuación: n = número de moles P = presión en atmósferas (atm) V = volumen ( lts ) v=volumen especifico T = temperatura ( ºK) R=constante universal de los gases M=Masa molar R= Ru M PV = nRuT Pv = RT En ocasiones la ecuación del gas ideal con frecuencia se utiliza con las unidades de masa, en estos casos la ecuación del gas ideal se emplea una constante especifica del gas R en vez de Ru Ejemplo Un neumático de automóvil que posee un volumen de 0.6 (m3), es inflado hasta una presión manométrica de 200 (kPa). Calcule la masa de aire en el neumático si la temperatura es de 20 (ºC) y Raire=0,287 [kJ/kg*K] R: Se asume que el aire se comporta como un gas ideal a las condiciones del ejemplo. En la ecuación de gas ideal, PV = nRT, debemos utilizar la temperatura y presión absoluta. Entonces usando Patm = 100 (kPa). P = 200+ 100 = 300(kPa) y T = 20 + 273 = 293(K ) La masa puede ser calculada de la siguiente forma: N 300000 (0 . 6 m 3 ) PV m2 m = = = 2 . 14 (kg ) RT N ⋅m 287 (293 K ) kg 13