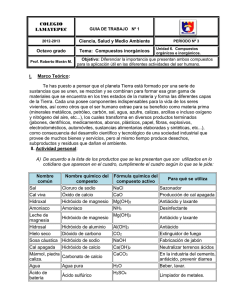
ÓXIDOS (BÁSICOS Y ÁCIDOS): Óxido de Calcio: CaO Propiedad
Anuncio

ÓXIDOS (BÁSICOS Y ÁCIDOS): Óxido de Calcio: CaO Propiedad: Se la denomina CAL VIVA. El óxido de calcio reacciona violentamente con el agua, haciendo que ésta alcance los 90 °C. Se forma entonces hidróxido de calcio, también llamado cal apagada, o Ca (OH)2. Óxido de Sodio: Na2O Propiedad: El óxido de sodio es un componente importante de cristales y vidrios aunque es añadido en forma de "soda" (carbonato sódico). El óxido de sodio no se encuentra explícitamente como tal en los cristales modernos, ya que los mismos son polímeros complejos interconectados. El cristal generalmente contiene un 15% de óxido de sodio, 70% de silicio (dióxido de silicio) y un 9% de cal (óxido cálcico). El carbonato de sodio "soda" sirve como fundente que permite disminuir la temperatura a la cual se funde el silicio. Óxido Férrico: Fe2O3 Propiedad: No posee brillo metálico. No conduce la electricidad debido a la localización electrónica que existe en el centro metálico. La variedad de colores del óxido de hierro (III) (azul, verde y violeta) que simula el atardecer, se debe principalmente a la habilidad del hierro de cambiar sus electrones en el penúltimo nivel de energía con modificación en el spin. De esto se intuye, que el camuflaje de los camaleones se debe a la inclusión de este elemento sobre su piel. Dióxido de Carbono: CO2 Propiedad: una de sus propiedades es que tiene un papel muy importante en la Fotosíntesis. Es decir las plantas absorben durante el día este gas para producir alimento y energía, y liberan al medio Oxígeno (O2). Anhídrido Sulfuroso o Dióxido de Azufre: SO2. Propiedad: Es un gas incoloro con un característico olor asfixiante. Se trata de una sustancia reductora que, con el tiempo, el contacto con el aire y la humedad, se convierte en trióxido de azufre. La velocidad de esta reacción en condiciones normales es baja. En agua se disuelve formando una disolución ácida. Es muy utilizado en la industria Vitivinícola como Antiséptico. HIDROXIDOS: Hidróxido de Sodio. NaOH. Propiedad: también conocido como soda cáustica, es un hidróxido cáustico usado en la industria (principalmente como una base química) en la fabricación de papel, tejidos, y detergentes. Además es usado en la Industria Petrolera en la elaboración de Lodos de Perforación base Agua. A temperatura ambiente, el hidróxido de sodio es un sólido blanco cristalino sin olor que adsorbe humedad del aire (higroscópico). Es una sustancia manufacturada. Cuando se disuelve en agua o se neutraliza con un ácido libera una gran cantidad de calor que puede ser suficiente como para encender materiales combustibles. El hidróxido de sodio es muy corrosivo. Hidróxido de Calcio. Ca(OH)2. Propiedad: también llamada cal apagada, es un hidróxido cáustico. Es un cristal incoloro o polvo blanco, obtenido al reaccionar óxido de calcio con agua. Puede también precipitarse mezclando una solución de cloruro de calcio con una de hidróxido de sodio. Si se calienta a 512 °C,[1] el hidróxido de calcio se descompone en óxido de calcio y agua. La solución de hidróxido de calcio en agua es una base fuerte que reacciona violentamente con ácidos y ataca varios metales. Hidróxido de Potasio KOH. Propiedad: es higroscópico absorbiendo agua de la atmósfera. Su disolución en agua es altamente exotérmica, con lo que la temperatura de la disolución aumenta, llegando incluso, a veces, al punto de ebullición. Hidróxido de Aluminio. Al(OH)3. Propiedad: El hidróxido de aluminio es anfotérico. En condiciones fuertemente ácidas, se forma Al(OH)2+ y en condiciones fuertemente básicas, se forma Al(OH)4-. Éstos son los principales iones en soluciones diluidas; en soluciones concentradas, se forman los iones poliméricos que pueden ser bastante complejos. Las sales del anión Al(OH)4- o similar, por ejemplo AlO2-, a veces son llamadas aluminatos. Hidróxido de Litio. LiOH. Propiedad: Es soluble en Agua, y ligeramente soluble en etanol. Es usado en la purificación de gases (como absorbente del dióxido de carbono), como medio para la transferencia de calor, y como almacenamiento de electrolito de baterías. ÁCIDOS: Ácido Sulfúrico. H2SO4. Propiedad: es altamente corrosivo. Se encuentran en la refinación del petróleo, producción de pigmentos, tratamiento del acero, extracción de metales no ferrosos, manufactura de explosivos, detergentes, plásticos y fibras. Ácido Clorhídrico. HCl. Propiedad: Es un compuesto tóxico, corrosivo, de olor picante y sofocante. En su forma anhidra, no ataca metales ni aleaciones. Pero en presencia de humedad produce vapores de ácidos que atacan a la mayoría de los metales exceptuando la plata, el oro, el platino y el tantalio. Ácido Fluorhídrico. HF. Propiedad: No debe ponerse en contacto con elementos de vidrio ya que puede corroerlo. El fluorhídrico se utiliza en química orgánica en la obtención de compuestos orgánicos fluorados. Ácido Nítrico. HNO3. Propiedad: El ácido nítrico puro es un líquido viscoso, incoloro e inodoro. A menudo, distintas impurezas lo colorean de amarillo-marrón. A temperatura ambiente libera humos rojos o amarillos. El ácido nítrico concentrado tiñe la piel humana de amarillo al contacto. es un líquido corrosivo y tóxico que puede ocasionar graves quemaduras. Es utilizado comúnmente como un reactivo de laboratorio, se utiliza para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT). Ácido Ortofosfórico. H3PO4. Propiedad: Este ácido tiene un aspecto líquido transparente, ligeramente amarillento. Este ácido tiene un aspecto líquido transparente, ligeramente amarillento. Es muy útil en el laboratorio debido a su resistencia a la oxidación, a la reducción y a la evaporación. Entre otras aplicaciones, el ácido fosfórico se emplea como ingrediente de bebidas no alcohólicas como por ejemplo de la Gaseosa. SALES: Carbonato de Litio. Li2CO3. Propiedad: Polvo blanco higroscópico. La sustancia se descompone al calentarla intensamente, produciendo monóxido de carbono y dióxido de carbono. La disolución en agua es una base fuerte reacciona violentamente con ácidos y es corrosiva para el aluminio y cinc. Reacciona violentamente con flúor. Nitrato de Sodio. NaNO3. Propiedad: Se trata de una sustancia incolora, ligeramente higroscópica y altamente oxidante. Mezclado con sustancias orgánicas puede provocar explosiones. El nitrato es sólo ligeramente tóxico. Sulfato de aluminio. Al2(SO4)3. Propiedad floculante. Cuando el pH del agua es alto (mayor de 7), el aluminio precipita arrastrando las partículas en suspensión, dejando el agua transparente. Esta propiedad es comúnmente usada en piscinas y para tratamiento de aguas industriales para evitar formación de gérmenes y algas. Cloruro de Potasio. KCL. Propiedad: El compuesto químico cloruro de potasio (KCl) es un haluro metálico compuesto de potasio y cloro. En su estado puro es inodoro. Se presenta como un cristal vítreo de blanco a incoloro, con una estructura cristalina cúbica centrada en las caras que se fractura fácilmente en tres direcciones. El cloruro de potasio es utilizado en medicina, aplicaciones científicas, procesamiento de alimentos y en ejecución legal por medio de inyección letal. Se presenta naturalmente como el mineral silvita y en combinación con cloruro de sodio como silvinita. Cloruro de Plata. AgCl. Propiedad: Este sólido cristalino es bien conocido por su baja solubilidad en agua. Al ser sometido a luz o calor, el cloruro de plata reacciona y produce plata y cloro gaseoso. El cloruro de plata se encuentra en el mineral clorargirita. La alta insolubilidad del cloruro de plata, se usa en laboratorios de química analítica tanto en el análisis gravimétrico como en el análisis volumétrico de la cantidad de plata de una muestra. TABLA PERIÓDICA: La tabla periódica de los elementos se puede dividir en: 7 periodos. 18 grupos. Los elementos están ubicados en la misma de mayor a menor según su peso molecular. Otra división puede ser: metales alcalinos, alcalinos térreos, metales de transición, no metales, gases nobles, lantánidos y actínidos.