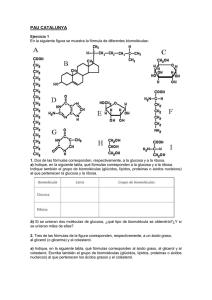
Guía de alimentación cardiosaludable en atención
Anuncio

Editores: José Félix Meco y Vicente Pascual Advance Medical, Barcelona Centro de Salud de Palleter, Castellón Reservados todos los derechos. Ninguna parte de esta publicación puede ser reproducida, tansmitida en ninguna forma o medio alguno, electrónico o mecánico, incluyendo las fotocopias, grabaciones o cualquier sistema de almacenamiento de información sin el permiso escrito de los titulares del Copyright. © 2007 Vicente Pascual Fuster, José Félix Meco López © 2007 Unilever Foods S.A. Edición: innuo s.l. Diseño de la portada: David Caparrós Dep. legal: B-30100-2007 ISBN: 978-84-611-7567-3 Impreso en España GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Autores José Félix Meco López Advance Medical, Barcelona Vicente Pascual Fuster Centro de Salud Palleter, Castellón Lidón Llau Arcusa Centro de Salud Palleter, Castellón María Dolores Pachés Porcar Centro de Salud Grao, Castellón Ana Palencia García Instituto Flora, Barcelona Francisco Pérez Jiménez Unidad de Lípidos y Arteriosclerosis, Servicio de Medicina Interna, Hospital Universitario Reina Sofía, Córdoba Xavier Pintó Sala Unidad de Lípidos y Arteriosclerosis, Servicio de Medicina Interna, Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat, Barcelona Emili Ros Rahola Unidad de Lípidos, Servicio de Endocrinología y Nutrición, Hospital Clínico y Provincial, Barcelona Rosa Solà Alberich Unidad de Lípidos y Arteriosclerosis, Servicio de Medicina Interna, Hospital Universitario de Sant Joan, Reus, Tarragona GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Agradecimientos Al concluir la labor que ha llevado a la publicación de la segunda edición de la Guía de Alimentación Cardiosaludable en Atención Primaria, no podemos dejar de reseñar el agradecimiento a Manuel Sarrión por su labor desinteresada en la estructura de la Guía, a Dolores Corella, Marta Miralles, Ana Pérez-Heras y Mercè Serra por su valoración y acertadas recomendaciones, y a Antonio Maiques, que ha aceptado prologar la obra; sin olvidar tampoco el apoyo brindado por el Instituto Flora que, en definitiva, ha hecho posible que esta Guía vea la luz, en ésta su segunda edición, y pueda ser de ayuda en nuestro quehacer cotidiano. José Félix Meco López Vicente Pascual Fuster GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA “A casa venía todos los años por primavera una mujer de Artana..., vestida de negro, con el pañuelo de luto en la cabeza. Traía la provisión de aceite de cada temporada y en aquella despensa oscura donde el inicio de mi conciencia se confundió con el terror, después yo veía, siendo niño, una lengua luminosa con reflejos verdes que esa mujer vertía en una gran barrica de loza esmaltada.” Manuel Vicent (Villavieja, Castellón, 1936) GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA ÍNDICE PRÓLOGO....................................................................................................................... 9 1. INTRODUCCIÓN..................................................................................................... 11 2. ALIMENTACIÓN CARDIOSALUDABLE . Y PRINCIPIOS INMEDIATOS............................................................................... 2.1. HIDRATOS DE CARBONO.................................................................................................. 2.2. LÍPIDOS...................................................................................................................................... 2.3. PROTEÍNAS............................................................................................................................... 15 15 24 39 3. ESTUDIOS DE INTERVENCIÓN DIETÉTICA. . EVIDENCIAS DISPONIBLES................................................................................ 3.1. ALIMENTACIÓN Y DISMINUCIÓN DEL RIESGO CARDIOVASCULAR................. 3.2. ALIMENTACIÓN CARDIOSALUDABLE E HIPERTENSIÓN ARTERIAL................... 3.3. ALIMENTACIÓN CARDIOSALUDABLE Y DIABETES MELLITUS.............................. 43 43 49 57 4. COLESTEROL ALIMENTARIO............................................................................ 63 5. INFLUENCIA DE LOS ALIMENTOS . EN EL RIESGO CARDIOVASCULAR.................................................................. 5.1. CARNE........................................................................................................................................ 5.2. PESCADO.................................................................................................................................. 5.3. ALCOHOL.................................................................................................................................. 5.4. CAFÉ............................................................................................................................................ 5.5. TÉ.................................................................................................................................................. 5.6. FRUTOS SECOS....................................................................................................................... 69 69 71 74 78 80 81 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 5.7. ACEITE DE OLIVA.................................................................................................................... 5.8. AJO............................................................................................................................................... 5.9. CHOCOLATE............................................................................................................................ 5.10. FRUTAS Y VERDURAS......................................................................................................... 5.11. HUEVOS................................................................................................................................. 83 86 88 90 94 6. ALIMENTOS FUNCIONALES.............................................................................. 99 6.1. FIBRA VEGETAL....................................................................................................................... 100 6.2. PROTEÍNA DE SOJA............................................................................................................... 106 6.3. ESTEROLES VEGETALES....................................................................................................... 108 6.4. ÁCIDOS GRASOS OMEGA 3.............................................................................................. 113 6.5. ANTIOXIDANTES.................................................................................................................... 114 6.6. ÁCIDO FÓLICO....................................................................................................................... 119 6.7. L-ARGININA............................................................................................................................. 125 6.8. L-CARNITINA........................................................................................................................... 125 7. ALIMENTOS TRANSGÉNICOS...........................................................................129 8. NUTRICIÓN Y GENÉTICA...................................................................................131 9. RECOMENDACIONES DIETÉTICAS.................................................................137 10. PROMOCIÓN DE LA ALIMENTACIÓN CARDIOSALUDABLE..............149 10.1. ESTRATEGIA NAOS............................................................................................................. 149 10.2. ACTIVIDADES QUE SE PUEDEN LLEVAR A CABO DESDE LA ATENCIÓN PRIMARIA....................................................................................155 11. INTERNET Y ALIMENTACIÓN.........................................................................159 12. ANEXOS.....................................................................................................................165 I. E NCUESTAS DIETÉTICAS...........................................................................................................165 II. CUESTIONARIO PARA EVALUAR EL ESTILO DE VIDA.................................................. 172 13. BIBLIOGRAFÍA........................................................................................................173 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA PRÓLOGO La segunda edición de la Guía de Alimentación Cardiosaludable en Atención Primaria representa una visión exhaustiva, práctica y necesaria para el profesional sanitario que trabaja en atención primaria, fundamentalmente médicos y personal de enfermería. La alimentación, tal como comentan sus autores, “la base sobre la que se sustenta la buena salud de los individuos”, junto con la práctica regular de actividad física y el abandono del tabaquismo, constituyen los tres pilares para la prevención de las enfermedades cardiovasculares. En los pacientes de alto riesgo o que ya han padecido una enfermedad cardiovascular, las medidas de educación sanitaria se complementan con el tratamiento con fármacos hipolipemiantes, antihipertensivos, antidiabéticos o antiagregantes. La Guía ofrece la información y las herramientas necesarias para realizar una intervención individual o grupal que permita alcanzar los objetivos de una alimentación saludable. La orientación práctica impregna todo el documento; en este sentido, cabe destacar la parte final, dedicada al plan de actuación individualizado y en el que se describe el contenido pormenorizado y el número de visitas recomendadas. Estas consultas dedicadas a averiguar las características de la alimentación del paciente y a la modificación de los hábitos dietéticos deberían formar parte de todos los programas de control de los factores de riesgo cardiovascular. Son múltiples los ejemplos de programas unifactoriales, es decir, orientados únicamente hacia el control de la hipertensión arterial o la dislipemia que, focalizados en los milímetros de mercurio de la presión arterial o en los miligramos de colesterol, olvidan la práctica de una intervención dietética y los objetivos de una alimentación saludable. Para llegar a esta parte final de un plan individualizado para un determinado paciente, la Guía ofrece la ayuda necesaria a partir de un apartado general dedicado a los principios inmediatos; posteriormente, cita los resultados de los estudios de intervención dietética y, por último, describe la influencia de los alimentos en el riesgo cardiovascular y el papel de los alimentos funcionales. Como novedad con respecto a la anterior edición, la Guía presenta un capítulo sobre la repercusión en la salud de los alimentos transgénicos y otro sobre nutrición y genética. GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Doctor, soy hipertenso: ¿puedo tomar café?, ¿y chocolate?; tengo el colesterol alto: ¿cuántos huevos puedo tomar a la semana?, ¿es verdad que el ajo reduce el colesterol? Como médico, ¿recomendaría a mis pacientes con dislipemia que tomen nueces?, ¿existen algunas alternativas o complementos al tratamiento con estatinas, por ejemplo, la fibra o los esteroles vegetales?, ¿es importante recomendar los lácteos enriquecidos con ácidos grasos omega 3?, ¿hay que suprimir algunas frutas en la alimentación del diabético? Todas estas preguntas surgen en la consulta del médico o del personal de enfermería, y en la mayoría de las ocasiones disponemos de escasa información fiable para contestarlas. La Guía proporciona las claves para responderlas, basadas en pruebas científicas y apoyadas en una bibliografía adecuada. Si quiere saber la contestación, sólo lea las siguientes páginas. Animo a los profesionales que trabajamos en atención primaria a convertirnos también en una “polidieta”, no sólo en una “polipíldora”, aprovechando este excelente trabajo que he tenido el honor de prologar. Antonio Maiques Galán Médico de familia del Centro de Salud de Manises, Valencia 10 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 1. INTRODUCCIÓN La guía que presentamos incluye, en esta segunda edición, las últimas evidencias en el campo de la nutrición y el riesgo cardiovascular, y tiene por objeto ser una herramienta útil que permita, desde la atención primaria, dar un asesoramiento dietético para mejorar la salud cardiovascular de nuestros pacientes, tanto de aquéllos con factores de riesgo como de los que aún no los presentan. Las enfermedades cardiovasculares son la causa de casi el 50% de las muertes en los países industrializados, y pueden ser prevenidas con modificaciones dietéticas y de estilo de vida. Para ello, es necesario una política de salud pública que permita trasladar el beneficio de estas intervenciones al conjunto de los ciudadanos y, en especial, a los grupos de alto riesgo (hipertensos, diabéticos, dislipémicos, etc.), para lo que la atención primaria es el marco adecuado, dadas sus condiciones de accesibilidad y continuidad asistencial (1). Hemos de entender que la alimentación es la base sobre la que se sustenta la buena salud de los individuos, y que el promover cambios dietéticos cardiosaludables en la población redundará en un beneficio que permitirá facilitar la prevención de la enfermedad aterotrombótica y, en muchos casos, evitar un tratamiento farmacológico altamente costoso desde el punto de vista sociosanitario. En Finlandia, país con una mortalidad cardiovascular muy elevada, se inició, en los años 70 del siglo XX, el proyecto Nort Karelia, con el objeto de lograr su reducción mediante la promoción de cambios de hábitos en la población, fundamentalmente la disminución del elevado consumo de grasa saturada de la alimentación. Entre 1971 y 1995 se consiguió un mejor control de factores de riesgo tales como la hipertensión y la hipercolesterolemia, lo que llevó a que la mortalidad por cardiopatía isquémica se redujera un 73% en la población en edad laboral (2). Otros países, como Irlanda, han visto declinar un 47% la mortalidad cardiovascular entre los años 1985 y 2000, hecho atribuible en gran parte al mejor control de los factores de riesgo (especialmente la hipercolesterolemia y el tabaquismo), y para alcanzar este logro se ha juzgado fundamental la promoción de una alimentación cardiosaludable (3). 11 1 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA No obstante, la nutrición, como todas las ciencias, está sujeta a modificaciones debido a la aparición de nuevas evidencias científicas, y las verdades de hoy pueden ser cuestionadas en un futuro. Así, se han llevado a cabo cambios de postura en las últimas décadas respecto de la consideración que merecen diferentes alimentos (aceite de oliva, margarinas, pescado azul, cerdo, marisco, café o chocolate) en el contexto de una alimentación saludable, y actualmente es motivo de debate el papel de determinados componentes de los alimentos (ácido fólico, arginina, flavonoides, ácido alfa linolénico, vitaminas A y E...) en la mejora del riesgo cardiovascular. No hemos de olvidar que la respuesta interindividual a la misma alimentación es variable, ya que es mediada por marcadores genéticos (4), que pueden servir para identificar a los individuos más susceptibles de verse beneficiados por las intervenciones dietéticas. Las líneas maestras y los actuales fundamentos científicos de una alimentación cardiosaludable, con consejos prácticos al respecto, pasan a detallarse a continuación, y así, esperamos que puedan ser de utilidad en la práctica clínica diaria. Las enfermedades cardiovasculares causan el 40% de las muertes en España (5). Un metaanálisis reciente que ha evaluado la prevalencia de los factores de riesgo cardiovascular en la población general española ha encontrado que el 23% tiene concentraciones de colesterol total por encima de 250 mg/dl; el 33% son fumadores (41,1% de los hombres y 24% de las mujeres); el 34% padece hipertensión, porcentaje que alcanza el 66,7% en los ancianos; tienen diabetes el 8% de las mujeres y el 12% de los hombres; y presentan obesidad un 20% (18% de los hombres y 23% de las mujeres) (6), cuya prevalencia se incrementa con la edad, tanto en mujeres como en hombres (7). Aun así, y aunque en España la mortalidad coronaria es la primera causa de muerte en varones y la segunda en mujeres, sigue siendo inferior a la de la mayoría de los países occidentales. En los últimos años se ha detectado un aumento de las tasas de morbilidad en ambos sexos, hecho que, junto a una reducción de las tasas de mortalidad, implica que cada vez hay más pacientes con enfermedad isquémica crónica. A ello ha contribuido la mayor esperanza de vida de la población, dado el mejor control de los factores de riesgo y la mejor respuesta a la intensificación de los tratamientos médico-quirúrgicos. Las recomendaciones dietéticas deberán tener en cuenta la presencia de los factores de riesgo cardiovascular (8, 9) (Tabla 1), y orientarse hacia su control, ya que se ha demostrado que están relacionados con un aumento de la morbimortalidad aterotrombótica. Pero también las recomendaciones deberán actuar de una forma preventiva para evitar la aparición de tales factores de riesgo. En España, la atención primaria se muestra insuficiente en el control de estos factores de riesgo (10). Los resultados del estudio PRESCAP 2002 han demostrado que sólo cuatro de cada diez hipertensos tratados farmacológicamente tienen un control óptimo de la presión arterial (11). Otros estudios recientes realizados en España demuestran que sólo un 6,9% de 12 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INTRODUCCIÓN EN ATENCIÓN PRIMARIA TABLA 1. Factores de riesgo cardiovascular. Principales factores de riesgo cardiovascular • Edad >45 años en hombre • Edad >55 años en mujeres, o menopausia precoz sin tratamiento hormonal sustitutivo • Historia familiar de enfermedad coronaria precoz: <55 años en el padre o hermanos y <65 años en la madre o hermanas • Tabaquismo • Hipertensión arterial (hipertensión no controlada o tratamiento antihipertensivo) • Diabetes mellitus • Valores elevados de colesterol LDL • Valores bajos de colesterol HDL (<40 mg/dl) Otros factores de riesgo cardiovascular que se deben considerar en el tratamiento dietético/farmacológico • Obesidad • Sedentarismo • Resistencia a la insulina • Hipertrofia ventricular izquierda • Valores elevados del fibrinógeno y de la proteína C reactiva • Valores elevados de la lipoproteína (a) • Microalbuminuria • Hiperhomocisteinemia • Hipertrigliceridemia los pacientes ambulatorios con riesgo cardiovascular alto o muy alto tienen sus principales factores de riesgo bajo control (12), y que en la población anciana el control y el tratamiento de la hipercolesterolemia dista de ser el óptimo (13). Al margen del tratamiento farmacológico de estos factores de riesgo, es interesante dirigir la alimentación y el estilo de vida de la población a crear y mantener unos hábitos que nos permitan su adecuado control, así como una mejora en la salud cardiovascular de la población y una menor incidencia de nuevos episodios isquémicos. Los beneficios de la dieta mediterránea sobre la salud han sido analizados en una revisión sistemática reciente de 35 estudios diferentes, y se han encontrado efectos favorables sobre las lipoproteínas plasmáticas, la función endotelial, la resistencia a la insulina, el síndrome metabólico, la capacidad antioxidante y la mortalidad cardiovascular (14). Los cambios dietéticos deben estar integrados en programas de salud y actuaciones comunitarias que, mediante el impulso de un plan de vida saludable, se ha probado que mejoran el control de los factores de riesgo (15, 16). En nuestro ámbito asistencial, una intervención intensiva con el objeto de promover modificaciones del estilo de vida tales como el abandono del hábito tabáquico, el incremento de la actividad física y, en caso de obesidad o sobrepeso, el seguimiento de una alimentación hipocalórica, se ha mostrado que es capaz de reducir el riesgo cardiovascular (17). 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 2. ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS 2.1. HIDRATOS DE CARBONO Los hidratos de carbono, carbohidratos o glúcidos son la principal fuente de energía de cualquier dieta. Cada gramo de carbohidratos aporta a la dieta 4 kcal. Además, dan sabor, textura y variedad a la comida. Su principal función es aportar energía al organismo, aunque también los empleamos para formar estructuras, como los mucopolisacáridos, las glucoproteínas, los glucolípidos, los glucosaminoglucanos y los proteoglucanos, y como elementos estructurales de los ácidos nucleicos. Absolutamente todos los tejidos emplean los carbohidratos (en forma de glucosa) para obtener la energía inmediata que necesitan, aunque también pueden utilizar otros nutrientes. Sin embargo, los hematíes y el sistema nervioso solamente utilizan la glucosa como fuente de energía. La fórmula química general de un carbohidrato es (CH2O)n, donde oxígeno e hidrógeno se encuentran en la misma proporción que en el agua, de ahí el nombre de “hidratos de carbono”, aunque su composición y sus propiedades no se corresponden en absoluto con esta denominación. El subíndice n indica la cantidad de carbonos que forman la cadena hidrocarbonada. El número de carbonos es variable, pero sólo las hexosas (con seis carbonos, n = 6) y sus polímeros (unión de numerosos carbonos) son nutricionalmente importantes. Los carbohidratos de la dieta se pueden clasificar en función de su estructura química, su contenido en fibra, o sus diferentes métodos de procesamiento (Tabla 2). El monosacárido es la unidad estructural básica, y la mayor parte de monosacáridos tienen sabor dulce. La glucosa (también llamada dextrosa) es el monosacárido más abundante en la naturaleza (en vegetales); sin embargo, no suele encontrarse en los alimentos en estado 15 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 2. Clasificación de los hidratos de carbono. Según su estructura química a) Simples 1. Monosacáridos: glucosa, fructosa, galactosa 2. Disacáridos: sacarosa, lactosa, maltosa b) Complejos 1. Oligosacáridos: rafinosa, melicitosa y otros (genéricamente denominados fructooligosacáridos y galactooligosacáridos) 2. Polisacáridos: almidón, celulosa, glucógeno y otros (dextrina, hemicelulosa, pectina) Según su contenido en fibra a) Digeribles b) No digeribles Según su método de procesamiento a) Integrales b) Refinados o procesados libre como monosacárido, salvo en la miel y en algunas frutas, sino que forma parte de disacáridos o de polisacáridos (almidón, celulosa); y es, además, el principal combustible de nuestro organismo (donde se almacena como glucógeno). Dos monosacáridos unidos entre sí forman un disacárido. Por otro lado, varias (entre tres y diez) unidades de monosacáridos unidas entre sí forman un oligosacárido; así, tenemos disacáridos como la sacarosa (glucosa + fructosa), la maltosa (glucosa + glucosa) o la lactosa (glucosa + galactosa), y trisacáridos como la rafinosa (glucosa + fructosa + galactosa) o la melicitosa (fructosa + glucosa + glucosa). Más de diez monosacáridos unidos entre sí constituyen un polisacárido. El glucógeno es el principal polisacárido de reserva en nuestro organismo, y el almidón y la celulosa son los principales polisacáridos estructurales y de reserva en las plantas. Las fuentes alimentarias de los carbohidratos son variadas y, aunque pueden proceder tanto del reino vegetal como del animal, la gran mayoría de los carbohidratos que se consumen provienen de los vegetales. Entre los productos de origen animal que son fuente de carbohidratos destaca la leche y sus derivados que, por otra parte, son fuentes únicas de lactosa. El glucógeno es otro carbohidrato procedente de animales terrestres y marinos, donde es almacenado en el músculo (chuletas, filetes) y en el hígado; sin embargo, la ingestión de carnes y pescados sólo aporta pequeñas cantidades de este carbohidrato en el total de azúcares de la dieta. 16 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 Como monosacáridos, la glucosa y la fructosa se encuentran en la miel y en las frutas. La galactosa no se encuentra libre en la naturaleza; está en la leche de mamíferos y derivados (pero en forma de lactosa, nunca como monosacárido) y también en la remolacha. Como disacárido, la sacarosa está en el azúcar que ingerimos habitualmente (azúcar que se extrae de la caña de azúcar y de la remolacha azucarera). La lactosa, como se ha dicho, se encuentra en la leche de mamíferos y en sus derivados. La maltosa no se encuentra libre en la naturaleza; la podemos encontrar en productos malteados y en algunos cereales, como la cebada; también constituye un producto intermedio de la digestión del almidón. Los oligosacáridos están en la soja y en las hortalizas. Los polisacáridos de interés en nutrición son uniones de moléculas de glucosa. El glucógeno se encuentra en la carne y el pescado, y el almidón en los cereales (arroz, pan o pasta), las legumbres, los frutos secos, las patatas y en todas las frutas y las verduras. Por ello, el almidón es la forma más corriente de aporte de carbohidratos en nuestra alimentación. La celulosa no es una fuente nutricional para el ser humano, pero le es útil para conseguir fibra. Según su contenido en fibra, podemos diferenciar los carbohidratos en: digeribles, entre los que están incluidos el glucógeno, el almidón y los azúcares simples, y se pueden utilizar como fuente de energía; y los no digeribles, que forman la fibra alimentaria (celulosa, hemicelulosa, pectinas, gomas y otros) (véase Capítulo 6.1). Podemos también clasificar los carbohidratos según el método de procesamiento en: integrales, y refinados o procesados. En esta clasificación nos referimos básicamente a los hidratos de carbono contenidos en granos. Los cereales integrales son aquellos que contienen el grano completo, es decir: la cáscara, la semilla y el saco embrionario (Figura 1). En el proceso de refinamiento, los cereales se muelen, lo que les elimina la semilla y la cáscara. Con esto se logra una textura más fina (son más fáciles de digerir) y que sean menos perecederos, pero en el proceso pierden la fibra y muchas sustancias, como vitaminas, minerales y otros antioxidantes. Desde un punto de vista estrictamente nutricional, también podemos considerar como refinados los alimentos que contienen carbohidratos simples (azúcares); estos compuestos suministran calorías, pero carecen de vitaminas, minerales y fibra, por eso se llaman “calorías vacías” y, en contraposición a los cereales integrales y a las legumbres, un incremento de su ingestión puede, además, de contribuir al desarrollo de sobrepeso y obesidad, aumentar el riesgo cardiovascular (18). Las dietas ricas en hidratos de carbono pueden incrementar las concentraciones séricas de triglicéridos, reducir el colesterol HDL, aumentar las lipoproteínas remanentes ricas en triglicéridos, producir un patrón de LDL densas y aumentar la glucosa en sangre (19-25), efectos que se asocian a un incremento del riesgo de enfermedad cardiovascular (24, 26-28). En este sentido, sin embargo, no todos los carbohidratos se comportan de igual forma (24). Por eso, para valorar los efectos de los distintos carbohidratos sobre el metabolismo lipídico 17 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Cubierta externa (cascarilla) Cubierta interna (salvado) Capa de aleurona Almendra harinosa Germen o embrión FIGURA 1. Componentes del grano completo y glucídico, parece más útil contemplar su influencia sobre la glucemia posprandial que partir de esquemas basados solamente en su estructura química o en otras de sus propiedades (29). El índice glucémico valora los alimentos por su capacidad para influir, tras su ingestión, en las concentraciones de glucosa en sangre, comparando su curva glucémica con la originada por la misma cantidad de un alimento patrón (pan blanco o glucosa) (30, 31) (Tablas 3 y 4). Los alimentos con un valor bajo de índice glucémico (por ejemplo, las judías verdes) producen una lenta y prolongada elevación del azúcar sanguíneo sin repercusión sobre el metabolismo lipídico (32), mientras que aquéllos con índice glucémico alto (por ejemplo, el pan de harina blanca refinada) producen un aumento de glucosa en sangre más rápido y corto en el tiempo y un empeoramiento del perfil lipídico (con aumento de la trigliceridemia y un descenso de la concentración de colesterol HDL) (33, 34), a la vez que se incrementan las necesidades de insulina (35); por todo ello, producen un empeoramiento del síndrome metabólico (36). Usando la glucosa como referencia (índice glucémico 100), se consideran alimentos con un índice glucémico alto los que superan 70; con índice glucémico moderado, entre 55 y 69; y con índice glucémico bajo, por debajo de 55 (37). El conocimiento del índice glucémico de los alimentos puede ser de utilidad para personas con diabetes que necesitan controlar sus concentraciones de glucosa en sangre. Una reducción de 15 puntos en el índice glucémico es suficiente, aun con el mismo aporte hidrocarbonado respecto al valor calórico total, para producir mejorías significativas en el control glucémico de personas diabéticas (38, 39). Se define la carga glucémica como el producto del valor del índice glucémico de un alimento y su contenido en carbohidratos (carga glucémica = índice glucémico x gramos 18 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 de carbohidratos contenidos en la ración servida). El índice glucémico representaría sólo la calidad de los carbohidratos consumidos, mientras que la carga glucémica representaría la calidad y la cantidad de los carbohidratos ingeridos (40). La carga glucémica se relaciona más directamente con los cambios lipídicos asociados a la ingestión de carbohidratos (como el aumento de triglicéridos y el descenso del colesterol HDL) que el índice glucémico (41) (Figura 2). Se ha demostrado la relación de la carga glucémica con la aparición de diabetes en mujeres posmenopáusicas (42) y en hombres (43). Asimismo, existe una fuerte y positiva relación entre la carga glucémica y el riesgo de enfermedad cardiovascular, como se pudo observar en 75.521 mujeres que fueron seguidas durante diez años en el Nurses’ Health Study (44). En este estudio, se describió que las dietas con carga o índice glucémico alto incrementaban el riesgo cardiovascular (44); en cambio, la ingestión de cereales (carga o índice glucémico bajo) se relacionaba en el mismo estudio con una reducción del riesgo de ictus (45). Un metaanálisis del año 2004 evidencia que las dietas con baja carga glucémica total pueden ser beneficiosas en la prevención de la diabetes de inicio tardío y de enfermedad coronaria, posiblemente debido a que pueden disminuir la demanda de insulina y mejorar el perfil lipídico en sangre (39). Todo ello se puede explicar debido a que una alimentación con carga o índice glucémico bajo se asocia a unas concentraciones séricas elevadas de colesterol HDL, bajas de triglicéridos y a una mejora de la sensibilidad insulínica (39, 41, 46, 47). Índice glucémico (p=0,03) Carbohidratos ingeridos (p=0,005) Carga glucémica (p<0,001) Triglicéridos en ayunas (mg/dl) 160 150 140 130 120 110 100 90 80 1 2 3 4 5 Quintiles FIGURA 2. Concentración plasmática de triglicéridos según la ingestión de carbohidratos, el índice glucémico y la carga glucémica en mujeres posmenopáusicas (41) 19 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 3. Índice glucémico de distintos alimentos (se ajusta dando al pan blanco el valor de 100) (30, 31). Alimento Índice glucémico* Cereales Alimento Índice glucémico* Legumbres Pan blanco (trigo) 100 Guisantes secos 47-65 Macarrones 64 Guisantes enlatados 50-60 Espaguetis 67 Lentejas 36 Pasta (trigo) 54 Garbanzos 47 Arroz 54-81 Judías secas 60-65 Cereales desayuno 74-132 Frutas Galletas 78-100 Manzana 52 Plátano 84 Azúcares Fructosa 26 Naranja 59 Glucosa 138 Zumo de naranja 71 Miel (sus azúcares) 126 Pasas 93 Lactosa 57 Lácteos Maltosa 152 Leche entera 44 Sacarosa 83 Leche desnatada 46 Yogur 52 Tentempiés Patatas fritas 77 Tubérculos Palomitas 99 Patatas 80-98 *En este caso, el índice glucémico viene definido como la modificación de la glucemia que se produce por el consumo de 50 g de carbohidratos presentes en un alimento, en comparación con la modificación observada por el consumo de una cantidad similar de carbohidratos presentes en el pan blanco. Por otra parte, la sustitución isocalórica de los ácidos grasos saturados por ácidos grasos monoinsaturados en una dieta moderadamente alta en grasa se asocia a un equilibrio favorable de colesterol HDL y triglicéridos, en comparación con dietas de elevado aporte hidrocarbonado (48-50). En el último informe (ATP III) del Programa Nacional de Educación sobre el Colesterol (NCEP) para la prevención y el tratamiento de la hipercolesterolemia en adultos de EE.UU. (51) y su modificación posterior (52), se pone especial énfasis en la importancia de las concentraciones bajas de colesterol HDL (<40 mg/dl) como factor de riesgo. Las medidas no farmacoló20 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA TABLA 4. Índice glucémico de distintos alimentos (se ajusta dando a la glucosa el valor de 100) (30, 31). Alimento Índice glucémico* Cereales Alimento Índice glucémico* Vegetales Pan blanco (trigo) 69 Zanahorias 92 Arroz 72 Patatas 70 Pasta (trigo) 50 Nabos 72 Bizcochos 59 Remolachas 64 Azúcares Legumbres Fructosa 20 Judías secas 31 Glucosa 100 Guisantes 33 Maltosa 105 Lentejas 29 Sacarosa 59 Garbanzos 33 Lácteos Frutas Leche 34 Manzana 39 Yogur 36 Plátano 62 Naranja 40 Uva 64 *En este caso, el índice glucémico viene definido como la modificación de la glucemia que se produce por el consumo de 50 g de carbohidratos presentes en un alimento, en comparación con la modificación observada por el consumo de una cantidad similar de carbohidratos presentes en la glucosa. gicas con objeto de incrementar el colesterol HDL, entre las que se encuentran las dietas con un índice glucémico bajo, se resumen en la Tabla 5 (53, 54). Las concentraciones elevadas de glucosa basal en individuos diabéticos se asocian a un mayor riesgo cardiovascular en comparación con no diabéticos (55-57), y su control disminuye las complicaciones de la arteriosclerosis (58). En un metaanálisis de 38 estudios prospectivos, Levitan y cols. (59) encuentran que la hiperglucemia en individuos no diabéticos (excluyendo sujetos con diabetes no conocida) también aumenta el riesgo cardiovascular, tanto en adultos como en ancianos. La hiperglucemia posprandial también es un factor de riesgo cardiovascular per se, como se ha observado en estudios como el DECODE (60), independientemente de las cifras de glucemia basal, lo que confiere una gran importancia a los esfuerzos terapéuticos, tanto dietéticos como farmacológicos, dirigidos a controlar los picos hiperglucémicos posprandiales en 21 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 5. Medidas no farmacológicas que incrementan las concentraciones plasmáticas de colesterol HDL (53, 54). Dietas con: • Alimentos con suficiente contenido en grasa, predominantemente monoinsaturada* • Alimentos con índice glucémico bajo • Cantidades moderadas de alcohol Abstención de fumar Reducción de peso corporal y de masa grasa (adiposidad) Práctica regular de actividad física *Las grasas saturadas son las que más incrementan el colesterol HDL, aunque también incrementan el colesterol LDL. pacientes diabéticos. Pero también se ha reconocido como factor de riesgo en la población general (61-64). Por ello, las recomendaciones dietéticas para minimizar este factor de riesgo tienen que encaminarse a incrementar la ingestión de hidratos de carbono de carga o índice glucémico bajo (legumbres, cereales integrales), a expensas de la reducción de aquellos otros con una carga o índice glucémico alto y, por tanto, con una mayor capacidad hiperglucemiante posprandial y de modificación lipídica. Ello adquiere mayor relevancia en los pacientes diabéticos tipo 2, en los cuales existe un deterioro en la secreción precoz de insulina pancreática tras la ingestión, lo que conlleva una mayor dificultad para revertir los picos hiperglucémicos posprandiales inducidos por alimentos con un índice glucémico o una carga glucémica más elevados. Hasta ahora hemos considerado los carbohidratos como un principio inmediato aislado. No obstante, cuando comemos no ingerimos normalmente un solo nutriente, sino una combinación de ellos. Por ejemplo, el pan puede comerse con mantequilla, y las patatas, con aceite, se comen con carne o con vegetales. Y esto tiene un impacto sobre el perfil glucémico y lipídico (triglicéridos, colesterol HDL, partículas remanentes) en sangre probablemente diferente al que nos brinda el índice glucémico o la carga glucémica (65, 66). En efecto, la carga o el índice glucémicos se ven influidos por las interacciones de los hidratos de carbono con esos otros nutrientes (65). La presencia de proteínas y, sobre todo, de lípidos en la alimentación retrasan el vaciado gástrico, haciendo que el glúcido ingerido presente un índice glucémico más bajo al que se obtiene si se ingiere solo. También la fibra prolonga el tiempo de absorción de los glúcidos, por lo que modifica a la baja el índice glucémico (67) (Figura 3). En definitiva, parece conveniente que formen parte de la dieta hidratos de carbono con índice glucémico o carga glucémica bajos, y que se potencie la ingestión de fibra (legumbres, cereales integrales), en el contexto de una alimentación globalmente adecuada o saludable. Aun así, una reciente revisión crítica considera prematuro extender al conjunto de la población 22 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 la recomendación de eludir la ingestión de alimentos con un índice glucémico elevado (40), ya que no se demuestra la relación de dietas ricas en carbohidratos de bajo índice glucémico con una reducción de la morbimortalidad cardiovascular (34, 68, 69). Por otra parte, y a pesar de estar bien definidos los conceptos de índice glucémico y de carga glucémica de los alimentos, existen problemas metodológicos en su aplicación: pobre estandarización, mala reproducibilidad y alta variabilidad, que hacen que no exista un consenso amplio sobre su papel en el control dietético de la diabetes (70). Así, las últimas recomendaciones nutricionales de la American Diabetes Association (ADA) para los pacientes diabéticos no aconsejan que se tenga en cuenta el índice glucémico de los alimentos en el diseño de dietas antidiabéticas (71). Sin embargo, otras sociedades sí reconocen el papel del índice glucémico en el control de la dieta del paciente diabético (34). Test Glucosa en sangre (mmol/l) 20 Control 15 10 5 0 0 10 30 45 60 90 120 150 180 Tiempo (minutos) Test Insulina sérica (mU/l) 60 Control 50 40 30 20 10 0 0 10 30 45 60 90 120 150 180 Tiempo (minutos) FIGURA 3. Efecto de la fibra de la alimentación sobre las concentraciones de glucosa sanguínea e insulina sérica (67) 23 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 2.2. LÍPIDOS Los lípidos (aceites y grasas, en lenguaje coloquial) incluyen muchas sustancias. Lo que denominamos grasa (o grasa dietética) es un conjunto de sustancias compuestas fundamentalmente por triglicéridos (es decir, ácidos grasos), pero también por colesterol y por otros elementos que ingerimos con los alimentos como, por ejemplo, los esteroles o los fosfolípidos (diacilglicerofosfatos) (Figura 4). Todos ellos tienen en común (y es lo único que comparten) que son insolubles en solventes acuosos y solubles en solventes orgánicos. En este capítulo nos referiremos sólo a los ácidos grasos. Del colesterol se hablará en el Capítulo 4 y de los esteroles en el Capítulo 6.3. Los lípidos o grasas cumplen funciones diversas en los seres vivos. Algunos lípidos sirven como combustible para almacenar energía (en el tejido adiposo) y para producirla (en el tejido muscular). Otros son constituyentes estructurales: forman parte de las vainas de mielina, de las lipoproteínas plasmáticas o integran las membranas de las células. Hay lípidos que participan en la síntesis de sustancias: hormonas y ácidos biliares. Por último, algunos participan en la agregación de las plaquetas y en la activación de la cascada de la coagulación. Por lo tanto, una alimentación (equilibrada) debe incluir lípidos en su composición, pero no de cualquier tipo ni en cualquier cantidad. Se recomienda que del total de energía que se incorpora con los alimentos, alrededor del 30%-35% provenga de las grasas: <10% en forma COLESTEROL OH TRIACILGLICEROL P+ FOSFOLÍPIDO ÁCIDO GRASO FIGURA 4. Principales lípidos en la alimentación humana (no se incluyen los esteroles) 24 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 de grasas saturadas, <7% como grasa poliinsaturada, y un 15%-20% como monoinsaturada (véanse las recomendaciones dietéticas al respecto en el Capítulo 9). Algunos tipos de lípidos contienen en su composición moléculas de ácidos grasos, como los triglicéridos y los fosfolípidos. Otros, como el colesterol, están formados por estructuras de anillos fusionados. El colesterol no contiene ácidos grasos en su estructura. Los triglicéridos (o triacilgliceroles) contienen una molécula de glicerol a la que se unen tres ácidos grasos (Figura 4). Existen una gran variedad de ácidos grasos y, en consecuencia, de triglicéridos. Los ácidos grasos del triglicérido pueden ser iguales o distintos entre ellos. Se encuentran tanto en alimentos vegetales como animales. Si el glicerol se une a un solo ácido graso es un monoglicérido (monoacilglicerol), y si lo hace a dos ácidos grasos es un diglicérido (diacilglicerol). Los triglicéridos son los ésteres más abundantes en la dieta, y su principal función es la de reserva energética. Cada gramo aporta 9 kcal de energía a la dieta. Los ácidos grasos son moléculas formadas por una larga cadena de átomos de carbono y de hidrógeno, de estructura lineal, con un número par de átomos de carbono, y en un extremo un grupo carboxilo. Su fórmula química general es CH3(CH2)nCOOH, donde n indica la cantidad de átomos de carbono que forman la cadena hidrocarbonada. Los ácidos grasos difieren entre sí por su longitud y por el número y las posiciones de enlaces dobles entre carbonos consecutivos (C=C). Esto permite clasificarlos en tres tipos (Tabla 6): ● Ácidos grasos saturados: no contienen ningún doble enlace en su cadena. ● Ácidos grasos monoinsaturados: contienen un doble enlace. – Ácidos omega 9 (n-9): su doble enlace está en el carbono número 9. ● Ácidos grasos poliinsaturados: contienen dos o más dobles enlaces; a su vez, se clasifican en: – Ácidos omega 6 (n-6): su primer doble enlace está en el carbono número 6. – Ácidos omega 3 (n-3): su primer doble enlace está en el carbono número 3. El ser humano no puede sintetizar los ácidos grasos de la familia n-6 y n-3, por lo que deben incorporarse en la dieta. Por ello se los denomina ácidos grasos esenciales. Entre ellos están el ácido linoleico, el ácido araquidónico y el ácido linolénico (Tabla 6). Estos ácidos grasos provienen de los vegetales, que sí los pueden sintetizar. Podemos clasificar las grasas dietéticas de otras formas: ● Según su estado a temperatura ambiente: grasas sólidas y aceites. ● Según su procedencia: grasas animales y grasas vegetales. ● Según su grado de manipulación: grasas naturales y grasas transformadas. 25 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 6. Clasificación de los ácidos grasos según su grado de saturación y sus fuentes alimentarias. Grupo* AGS AGM Posición del primer doble enlace Nombre** Fuentes alimentarias Ácido láurico (12:0) Aceite de coco Ácido mirístico (14:0) Lácteos y derivados Ácido palmítico (16:0) Grasa animal, aceite de palma Ácido esteárico (18:0) Grasa animal, cacao Ácido oleico (18:1) Aceite de oliva, frutos secos, grasa animal Ácido elaídico (18:trans 1) Margarinas Ácido linoleico (18:2) Aceites vegetales (girasol, maíz, soja), frutos secos Ácido linolénico (18:3) Aceites vegetales, verduras Ácido eicosapentaenoico (20:5) Pescado azul, marisco Ácido docosahexaenoico (22:6) Pescado azul, marisco – n-9 n-6 AGP n-3 *AGS: ácidos grasos saturados; AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados. **Ejemplo: 12:0, donde 12 = número de átomos de carbono, 0 = número de dobles enlaces. El origen de las grasas de la dieta es tanto el reino animal como el vegetal (Tabla 7). Las grasas animales son sólidas a temperatura ambiente, mientras que los aceites (grasas vegetales) son líquidos; la diferencia entre ambos radica en los ácidos grasos que los componen. La longitud de la cadena carbonada y la cantidad de enlaces dobles (o grado de saturación) de los ácidos grasos influyen en el punto de fusión de las grasas o aceites. Esto determina que el lípido sea sólido (sebo, manteca, mantequilla) o líquido (aceite). Los ácidos grasos saturados se disponen muy juntos, y forman una estructura sólida a temperatura ambiente. Sin embargo, los dobles enlaces permiten la flexibilidad de la cadena de ácidos grasos, por lo que se mantienen separados a temperatura ambiente, formando una estructura líquida. Las grasas vegetales suelen contener más ácidos grasos insaturados, mientras que las grasas animales son ricas en ácidos grasos saturados (Tablas 8 y 9). Las grasas pueden tener un origen natural: como las mantecas y los aceites comentados. Sin embargo, también existen grasas modificadas por el hombre, como las mantecas o las margarinas hidrogenadas. De estas grasas hidrogenadas (trans) nos ocuparemos más adelante. 26 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA TABLA 7. Origen de las grasas de la dieta. Grasas animales: 1. El tejido adiposo de los animales (sebo de bovinos y ovinos, grasa de cerdo y manteca de cerdo) 2. Las mantequillas (producto industrial sintetizado a partir de los lácteos) 3. La grasa no visible o escondida (no aparente por el aspecto y textura del alimento), que acompaña al músculo en carnes o pescados, y en lácteos (no desnatados) Grasas vegetales (aceites): 1. Las semillas de algunas plantas (girasol, soja, canola, maíz, lino, sésamo, etc.) 2. Los frutos de algunas plantas (aceituna, coco, palma) 3. Las margarinas (producto industrial preparado a partir de aceites vegetales). TABLA 8. Contenido en energía y tipo de ácidos grasos de diversos aceites y grasas comestibles (72). Energía (kcal/100 g) Lípidos (g/100 g) AGS** (g/100 g) AGM** (g/100 g) AGP** (g/100 g) Colesterol (mg/100 g) Aceite de coco 8,99 99,9 85,2 6,6 1,7 0 Aceite de soja 8,99 99,9 13,5 22,4 59,2 0 Aceite de oliva* 8,99 99,9 14,0 69,7 11,2 0 Aceite de maíz 8,99 99,9 12,3 26,6 56,7 0 Aceite de girasol 8,99 99,9 11,6 22,5 61,4 0 Grasa comestible *El aceite de oliva virgen tiene menos porcentaje graso que el aceite de oliva refinado. **AGS: ácidos grasos saturados; AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados. TABLA 9. Composición en ácidos grasos de diversas grasas de la dieta* (73). C12:0 C14:0 C16:0 C18:0 C18:1 C18:2 C18:3 Total Láurico Mirístico Palmítico Esteárico Saturadas Oleico Linoleico Linolénico Aceite de coco 48,5 17,6 8,4 2,5 77 6,5 1,5 0 0 0,1 25,8 34,5 60,4 35,3 2,9 0 Carne de pollo 0,2 1,3 23,2 6,4 31,1 41,6 18,9 1,3 Carne de ternera 0,1 3,3 25,5 21,6 50,5 38,7 2,2 0,5 Carne de cerdo 0,1 1,5 24,8 12,3 38,7 45,5 9,9 1 Mantequilla 3,1 17,7 26,2 12,5 59,5 28,2 2,9 0,5 Manteca de cacao *Los parámetros se expresan en g/100 g. 27 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Las grasas con mayor poder de aumento del colesterol plasmático, más aún incluso que la mayoría de mantecas hidrogenadas, son la mantequilla y los llamados aceites tropicales vegetales (coco, palma y palmiste), ricos en ácidos grasos saturados. Las mantecas hidrogenadas tienen aproximadamente el mismo potencial que la grasa natural de vaca, mientras que las margarinas blandas no tienen más que una modesta capacidad para elevar el colesterol. En la Tabla 10 se resumen los efectos de las distintas familias de grasas (ácidos grasos) de los alimentos sobre el perfil lipídico (25, 74, 75). Véase también la Figura 5 (76). Los ácidos grasos saturados (es decir, las grasas que contienen ácidos grasos saturados) aumentan la colesterolemia, mientras que las que contienen ácidos grasos poliinsaturados n-6 tienen un efecto hipocolesterolemiante debido no sólo a una reducción del colesterol LDL sino también del colesterol HDL (77). Cuando los hidratos de carbono de la dieta se sustituyen isocalóricamente por grasas, se elevan tanto el colesterol LDL como el colesterol HDL, si bien el incremento de colesterol LDL que se produce es mayor con la grasa saturada, mientras que el descenso del colesterol HDL es superior con la grasa poliinsaturada (78). Por último, los ácidos grasos poliinsaturados n-3 producen una inhibición de la síntesis hepática de las VLDL, que implica una reducción de la concentración plasmática de triglicéridos (79), además de tener otros efectos positivos en la prevención cardiovascular. Existe evidencia científica de la implicación de la calidad y la cantidad de grasas consumidas en la salud humana, ya sea en el desarrollo (ácidos grasos saturados y ácidos trans) o en la prevención (ácidos monoinsaturados y ácidos omega3) de las enfermedades cardiovasculares (80), aspectos que se comentarán más adelante. No podemos olvidar la importancia que tiene el proceso de cocinado sobre el contenido lipídico de los alimentos, de forma que se modifica su composición debido al intercambio de ácidos grasos que se produce con la intervención culinaria (81). TABLA 10. Efecto de diferentes componentes de la dieta sobre los lípidos y las lipoproteínas plasmáticas (25, 74, 75). Nutriente* Colesterol total Colesterol LDL Colesterol HDL Triglicéridos AGS ↑↑↑ ↑↑↑ ↑ AGM ↓ ↓ ↑o AG trans ↑↑↑ ↑↑↑ ↓ AGP n-6 ↓↓ ↓↓ ↓o ↓ AGP n-3 ↓ ↓↓ Colesterol ↑↑ ↑ ↑ Carbohidratos ↓ ↑ *AGS: ácidos grasos saturados; AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados. 28 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 0,02 0,00 –0,02 Δ colesterol HDL (mmol/l) Δ colesterol LDL (mmol/l) 0,04 –0,04 FIGURA 5. Efecto de los diferentes tipos de ácidos grasos de la dieta sobre el colesterol LDL y el colesterol HDL (76) Ácidos grasos saturados Los ácidos grasos saturados poseen un enlace simple entre cada par de átomos de carbono (C-C-C-C), y todos los átomos de carbono (menos el terminal) están unidos a dos átomos de hidrógeno; es decir, están “saturados” de hidrógeno. Los ácidos grasos saturados (ácidos palmítico, mirístico, láurico, esteárico, butírico) están presentes en las grasas de origen animal (carne, embutidos, leche entera, mantequilla, queso, nata) y, de ellas, las que aportan un menor contenido en ácidos grasos saturados son las procedentes de pollo, pavo y conejo (sin piel) y las carnes magras porcinas (82). Otras fuentes dietéticas de estos ácidos grasos son algunos aceites vegetales, como el de coco y el de palma (Tablas 8 y 9), muy utilizados en pastelería y bollería industrial y también presentes en algunos alimentos precocinados. La ingestión de ácidos grasos saturados induce un aumento del colesterol total, a expensas del colesterol LDL, tanto en lo que respecta al ácido láurico, presente en el aceite de coco, como al ácido mirístico, presente en los productos lácteos no desnatados, y al ácido palmítico, 29 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA presente en la grasa de la carne y en el aceite de palma o palmiste. En cambio, el ácido esteárico, dada su rápida metabolización en el organismo a ácido oleico (monoinsaturado), hace descender las cifras de colesterol LDL en comparación con el ácido palmítico (83). Los cambios producidos por los diferentes ácidos grasos saturados sobre el colesterol LDL y el colesterol HDL aparecen en la Figura 6 (76). Otros efectos negativos de los ácidos grasos saturados son la mayor oxidación de las LDL, la tendencia a aumentar la tensión arterial, y el mayor riesgo de trombosis, lo que comporta un riesgo elevado de enfermedad aterotrombótica (74). Para disminuir el consumo de ácidos grasos saturados, no hay que restringir sólo las grasas de origen animal, ya que hay un aporte de estos ácidos grasos nada desdeñable, en forma de “grasa oculta”, en productos de pastelería, bollería industrial y fritos comerciales (fritos de productos tipo aperitivo). En el etiquetado de estos productos se detalla, dentro de la composición, su elaboración con grasas vegetales (por ejemplo, aceites de coco y de palma), lo que hace que el consumidor crea que son cardiosaludables cuando, en realidad, el aporte de grasa saturada de estos alimentos puede ser elevado. Por ello, el etiquetado de los alimentos elaborados que indica “contiene grasa vegetal” no presupone que ésta sea saludable. Así pues, deben evitarse los aceites vegetales derivados del coco y de la palma. 0,02 0,00 –0,02 Δ colesterol HDL (mmol/l) Δ colesterol LDL (mmol/l) 0,04 –0,04 FIGURA 6. Efecto de los ácidos grasos saturados sobre el colesterol LDL y el colesterol HDL (76) 30 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 Ácidos grasos insaturados Los ácidos grasos insaturados poseen dobles enlaces en uno o más pares de átomos de carbono (C=C), y no todos los átomos de carbono están unidos a dos átomos de hidrógeno. Al ser insaturados, son capaces de fijar más hidrógeno. Pueden ser monoinsaturados o poliinsaturados, según si tienen un único enlace doble o más de uno, respectivamente. Ácidos grasos monoinsaturados La principal fuente en nuestra alimentación de ácidos grasos monoinsaturados n-9 (ácido oleico) es el aceite de oliva. La mayoría de los frutos secos, sobre todo las almendras y las avellanas, de consumo habitual en los países mediterráneos, también son fuentes importantes de ácido oleico. Lo mismo sucede con los cacahuetes, una legumbre que se identifica con los frutos secos por su alto contenido en grasa. Los efectos beneficiosos de estos ácidos grasos se resumen en la Tabla 11. TABLA 11. Efectos beneficiosos de los ácidos grasos monoinsaturados. a) En la población general (84): – Disminución del colesterol total y del colesterol LDL cuando sustituyen a ácidos grasos saturados – Reducción de los triglicéridos y aumento del colesterol HDL cuando sustituyen a carbohidratos – Mantenimiento o aumento de las concentraciones de colesterol HDL en comparación con los ácidos grasos poliinsaturados – Menor aterogenicidad de las LDL por disminución de su oxidación – Probable efecto antihipertensivo – Probable efecto antitrombótico – Probable efecto antiinflamatorio – Probable mejora de la función endotelial – Inocuidad establecida durante siglos – Prevención de la enfermedad cardiovascular b) En población con diabetes o con síndrome metabólico (85): – Reducción de los triglicéridos y aumento del colesterol HDL cuando sustituyen a los hidratos de carbono – Reducción del colesterol LDL cuando sustituyen a ácidos grasos saturados – Mantienen o elevan las concentraciones de colesterol HDL en comparación con los ácidos grasos poliinsaturados – Mejoran el control metabólico de la diabetes tipo 2 en comparación con dietas altas en carbohidratos – Protegen de la aterogenicidad de las partículas LDL (disminución de su oxidación) – Probable efecto antihipertensivo – Probable efecto antitrombótico – Probable efecto antiinflamatorio 31 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA La sustitución isoenergética de ácidos grasos saturados por monoinsaturados reduce las cifras de colesterol total y colesterol LDL del mismo modo que los poliinsaturados (78). En comparación con las dietas ricas en carbohidratos, las que contienen abundantes ácidos grasos monoinsaturados, ya sea a base de aceite de oliva o de cacahuetes, reducen los triglicéridos y aumentan el colesterol HDL (86). Además, Mattson y Grundy (75) ya demostraron que, cuando los ácidos grasos saturados de la dieta se reemplazaban por un porcentaje similar de ácidos grasos poliinsaturados, había una reducción del colesterol HDL sanguíneo, lo cual no ocurría con los monoinsaturados. Junto con estos efectos lipídicos beneficiosos, el hecho de que una alimentación natural pueda contener hasta el 30% de la energía en forma de ácidos grasos monoinsaturados (por ejemplo, la dieta mediterránea), pero no más del 15% en forma de ácidos grasos poliinsaturados, ha determinado en la última década que las dietas ricas en ácido oleico sean tanto o más recomendables para el control metabólico de la diabetes que las más tradicionales dietas bajas en grasa y altas en carbohidratos (48, 49, 71, 87). Un estudio del año 2000 (77) comparó los efectos sobre el perfil lipídico de una dieta rica en ácidos grasos monoinsaturados (35% de grasa, de la cual: 9% es saturada, 6% poliinsaturada y 20% monoinsaturada), frente a una dieta típica estadounidense, rica en grasa saturada (35% de grasa: 14% saturada, 9% poliinsaturada y 12% monoinsaturada), y a la dieta recomendada por la American Heart Association (AHA), más restrictiva en contenido graso total (30% de grasa: 8% saturada, 7% poliinsaturada y 15% monoinsaturada). Se encontró que tanto la dieta pobre en grasa como la rica en ácidos grasos monoinsaturados reducían significativamente las concentraciones de colesterol total, colesterol HDL y colesterol LDL, comparado con la dieta típica estadounidense; no obstante, se vio que la dieta más pobre en grasa total incrementaba los triglicéridos. Un efecto beneficioso adicional de los ácidos grasos monoinsaturados en comparación con los poliinsaturados es la mayor resistencia a la oxidación de las LDL y, por tanto, una menor aterogenicidad de las lipoproteínas enriquecidas en ácido oleico (88, 89). También existen evidencias limitadas de un efecto beneficioso de los ácidos grasos monoinsaturados sobre la presión arterial (90), la tendencia a la trombosis (91, 92), la inflamación y la activación endotelial (89, 93, 94) (Tabla 11). Una dieta rica en ácidos grasos monoinsaturados es útil en el control de los diabéticos tipo 2 frente a otra más rica en hidratos de carbono (48, 95), por su acción sobre los triglicéridos y el colesterol LDL y su probable mejora de la resistencia insulínica. La Sociedad Española de Arteriosclerosis (SEA) recomienda un porcentaje de grasa de un 30%-35% sobre el aporte calórico total, de la cual entre un 15% y un 20% debe ser de ácidos grasos monoinsaturados (96). Estas recomendaciones están basadas en que una dieta restrictiva en grasas (25% del valor calórico total) disminuye la concentración de colesterol LDL, pero también reduce el colesterol HDL en torno al 7% (97). Esta dieta recomendada por la SEA es 32 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 una alternativa factible que dota a la alimentación de una buena palatabilidad, sin necesidad de incrementar el aporte de sal, consumo al que frecuentemente recurren las personas con una alimentación pobre en grasas para hacerla más palatable y, por tanto, más llevadera. Ácidos grasos poliinsaturados Ácidos grasos poliinsaturados n-6 Los ácidos grasos poliinsaturados n-6 se encuentran en los aceites vegetales como el de girasol, de soja o de maíz, y también en frutos secos (Tablas 8 y 9). Su principal representante es el ácido linoleico, que es un ácido graso esencial, es decir, que el organismo no puede sintetizarlo y sólo puede aportarlo la alimentación. Clásicamente, los ácidos grasos n-6 se habían considerado los sustitutos ideales de los ácidos grasos saturados de la dieta para dotarla de un perfil más cardiosaludable; no obstante, hay argumentos en contra de esta teoría, como el de que una dieta rica en ácido linoleico produce unas LDL más susceptibles a la oxidación y, por tanto, más aterogénicas que una dieta rica en ácido oleico, además de su efecto de descenso de la concentración de colesterol HDL (75, 88). El Nurses’ Health Study se llevó a cabo en más de 80.000 mujeres, que tuvieron un seguimiento durante 14 años. En este estudio se observó que la sustitución del 5% del valor calórico total procedente de los ácidos grasos saturados por insaturados reducía el riesgo coronario en un 42% (98). Ácidos grasos poliinsaturados n-3 Los ácidos grasos poliinsaturados n-3 tienen como principales representantes al ácido alfa linolénico, el ácido eicosapentaenoico (EPA) y el ácido docosahexaenoico (DHA). El ácido linolénico es un ácido graso esencial cuyas fuentes alimentarias principales son los aceites de soja y de canola-colza, las hortalizas de hoja verde y las nueces (Tablas 8 y 9). El ácido linolénico es el único n-3 que se encuentra en los vegetales. Los ácidos EPA y DHA son aportados a la dieta fundamentalmente mediante el pescado, especialmente el azul (sardina, anchoa, arenque, caballa, salmón, trucha, etc.), y el marisco. Hay evidencias concluyentes de que una dieta enriquecida en ácidos grasos n-3 reduce la concentración sérica de triglicéridos y la lipemia posprandial (79, 99, 100), la incidencia de arritmias ventriculares postinfarto (101, 102), y el riesgo de muerte súbita en individuos previamente sanos (103), y logra, además, una ligera reducción de la presión arterial (104, 105) y una mejora de elasticidad arterial (106); asimismo, son antiagregantes plaquetarios debido a que producen aumento de prostaciclinas (105). Los efectos beneficiosos de estos ácidos grasos se resumen en la Tabla 12. 33 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 12. Efectos beneficiosos de los ácidos omega 3. a) En la población general (107): – Reducción de la concentración plasmática de triglicéridos – Reducción de la incidencia de arritmias ventriculares – Reducción del riesgo de muerte súbita en individuos previamente sanos – Ligera reducción de la presión arterial – Mejora de la elasticidad arterial – Efecto antiagregante plaquetario – Descenso importante de la lipemia posprandial – Disminución de LDL pequeñas y densas, y aparición de LDL grandes y ricas en colesterol – Prevención de la enfermedad cardiovascular b) En población con diabetes o con síndrome metabólico (108, 109): – Igual respuesta lipídica en pacientes diabéticos que en individuos no diabéticos (110) – Probablemente, las respuestas no lipídicas son similares a las de la población no diabética También son interesantes las observaciones realizadas en esquimales de Groenlandia –­ que pertenece administrativamente a Dinamarca–, que tienen una ingesta muy rica en ácidos grasos n-3 procedentes de su elevado consumo de pescado y mamíferos marinos (111). La mortalidad de los esquimales por cardiopatía isquémica es baja pero, como en otros casos de población emigrante, deviene similar a la del país de adopción cuando adquieren los hábitos dietéticos daneses tras emigrar (112). La relevancia del papel del ácido graso poliinsaturado n-3 alfa linolénico ha sido evidenciada por el estudio de Lyon (113) y por otros estudios llevados a cabo en pacientes coronarios (114), que relacionan el incremento de su ingestión con la reducción del riesgo de reinfarto y, sobre todo, de muerte por causa cardiovascular. Otro estudio (115) ha comparado la composición de las concentraciones en suero de ácidos grasos en dos poblaciones, una de Creta y otra de Zupthen (Holanda). Este estudio encontró en la población cretense (de menor riesgo cardiovascular) altas concentraciones de ácido oleico (monoinsaturado), bajas en ácido linoleico (n-6), pero inesperadamente elevadas en ácido alfa linolénico (n-3). El papel del ácido alfa linolénico en la prevención del riesgo cardiovascular también está avalado por observaciones llevadas a cabo en la población japonesa de la isla de Kohama (116). Los habitantes de esta isla presentan la mayor expectativa de vida del mundo, y en ella también existe una muy baja mortalidad por causas cardiovasculares; mantienen una ingesta con una proporción elevada de pescado, que puede ser la causa de las también elevadas concentraciones plasmáticas de ácido alfa linolénico (n-3) encontradas. En la actualidad se recomienda que la relación existente entre los ácidos grasos poliinsaturados n-3 (alfa linolénico) y n-6 (linoleico) en la alimentación sea aproximadamente de 34 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 1:3 a 5 (82); no obstante, se necesitan más estudios clínicos para corroborar su beneficio clínico. En todo caso, el ATP III (51) y las recomendaciones recientes de la American Heart Association (117) plantean la posibilidad de reducir el riesgo cardiovascular con una ingesta dietética alta en ácidos grasos poliinsaturados n-3 provenientes del pescado o de aceites vegetales. Ácidos grasos ‘trans’ Los ácidos grasos que encontramos en la naturaleza tienen una configuración espacial cis, es decir, con los átomos de hidrógeno orientados hacia el mismo lado de la molécula (Figura 7). En algunos alimentos encontramos ácidos grasos trans, como el ácido elaídico, que es un ácido graso monoinsaturado conseguido por la hidrogenación parcial del ácido oleico. La hidrogenación produce el cambio de la posición espacial del doble enlace del ácido oleico (que pasa de cis a trans) (Figura 7). Este cambio hace que tanto las características organolépticas como el beneficio cardiovascular que presenta el ácido oleico se modifiquen radicalmente. Los ácidos grasos trans son ácidos grasos insaturados que tienen al menos un doble enlace en configuración trans. Los ácidos trans más frecuentes son los monoinsaturados, pero también pueden sintetizarse a partir de ácidos grasos poliinsaturados. La hidrogenación consiste en añadir, a altas temperaturas, átomos de hidrógeno a los ácidos grasos insaturados. Esta conformación espacial de los ácidos grasos hacia formas trans consigue una grasa más sólida, necesaria en la bollería industrial y en la producción de margarinas de consistencia dura, pero tiene unos efectos deletéreos sobre el perfil lipídico, de forma que aumenta las concentraciones de colesterol LDL y reduce las de colesterol HDL cuando sustituye en la dieta a ácidos O C Doble enlace en posición trans: ácido elaídico OH O C Doble enlace en posición cis: ácido oleico OH FIGURA 7. Configuración cis y trans de los ácidos grasos insaturados 35 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA grasos cis (118-120) (Figuras 8 y 9). Un metaanálisis llevado a cabo sobre 60 estudios controlados, que ha analizado los efectos de los diferentes ácidos grasos sobre los lípidos séricos, corrobora estos efectos (76) (Figura 10). Por otra parte, los ácidos grasos trans aumentan también las concentraciones de otros lípidos aterogénicos, los triglicéridos y la lipoproteína (a), por lo que sus efectos son perjudiciales sobre todas las fracciones lipídicas (118); asimismo, deterioran la función endotelial (121) e incrementan la producción de citocinas inflamatorias (122). En definitiva, los ácidos grasos trans se comportan de forma similar a los ácidos grasos saturados. Finalmente, se conoce que una ingesta alta en ácidos grasos trans puede promover resistencia insulínica (123) e incrementar el riesgo de que se desarrolle una diabetes tipo 2 (124). En el gran estudio prospectivo Nurses’ Health Study (98), el consumo de ácidos grasos trans se relacionó directamente con el riesgo de enfermedad coronaria, ya que se demostró que la sustitución de un 2% de la energía procedente de ácidos grasos trans por ácidos grasos insaturados reducía el riesgo coronario en un 53%. Otros datos, tanto del mismo estudio epidemiológico como de otras investigaciones, sugieren que su ingestión aumenta el riesgo de que se desarrolle una diabetes tipo 2 (124). La hidrogenación de los ácidos grasos se utiliza en la industria alimentaria. La hidrogenación busca dos efectos: por una parte, solidificar los aceites vegetales; de esta manera se transforma el aceite vegetal líquido en margarina, una grasa más sólida; y, por otra parte, se 0,5 15 LDL 0,4 10 0,2 5 0,1 0 mg/dl mmol/l 0,3 0 HDL –0,1 –5 –0,2 0 2 4 6 8 10 12 Porcentaje de aporte calórico como trans-c18:1 FIGURA 8. Efecto de la sustitución de ácidos grasos cis por trans en ensayos controlados en función de la cantidad ingerida (119) 36 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA Mensink y Katan Zock y Katan Nestel y cols. Judd y cols. Judd y cols. Lichtenstein y cols. Aro y cols. Sundram y cols. Lichtenstein y cols. Cambio en el cociente de colesterol LDL/colesterol HDL 1,2 1,0 0,8 2 p<0,05 p<0,001 p<0,001 0,6 p<0,001 0,4 0,2 p<0,001 0,0 p<0,005 –0,2 0 1 2 3 4 5 6 7 8 9 10 Porcentaje de grasa del aporte energético FIGURA 9. Resultados de estudios de distribución aleatoria de los efectos de una alimentación alta en ácidos grasos trans (círculos) o de ácidos grasos saturados (cuadrados) en el cociente de colesterol LDL/colesterol HDL (120) consigue prolongar la vida de los aceites vegetales y potenciar su sabor (que duren más y mantengan por más tiempo la consistencia deseada de los productos alimentarios). Los ácidos grasos trans se encuentran en margarinas producidas por hidrogenación de los ácidos grasos (margarinas hidrogenadas), en bollería industrial y en alimentos fritos (productos fritos tipo aperitivo). Un estudio (125) encuentra que la relación entre colesterol total y colesterol HDL es desfavorable para la mantequilla y las margarinas duras frente a la ingestión de margarinas blandas. Conscientes de los efectos adversos de los ácidos grasos trans, los fabricantes de grasas comestibles están produciendo margarinas y productos para untar con un menor contenido de ellos. En todo caso, el consumo de ácidos grasos trans mediante las margarinas ha sido siempre minoritario en España. En el estudio TRANSFAIR (Valoración de la ingestión de ácidos grasos ‘trans’ y su relación con los factores de riesgo cardiovascular en países europeos) se analizó el contenido de ácidos grasos, incluyendo los trans, en los alimentos (126) (Tabla 13). Los contenidos más altos de ácidos grasos trans se observaron en las patatas fritas de establecimientos de comida rápida (el 34% de los ácidos grasos totales), las croquetas congeladas (26%), el pan de molde (17%), los pasteles (15%), la pasta de hojaldre congelada 37 2 0,04 Δ colesterol HDL (mmol/l) Δ colesterol LDL (mmol/l) GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 0,02 0,00 –0,02 –0,04 FIGURA 10. Efecto de los ácidos grasos dietéticos sobre las concentraciones séricas de colesterol HDL y de colesterol LDL en un metaanálisis de 60 estudios controlados (76) TABLA 13. Ingestión media diaria de lípidos y fracciones (g/día) en España (126). g/día g/día Lípidos totales 124,5 C18:2 t 0,25 AGS 35,2 C18:3 t + C20:1 t 0,06 AGM 50,7 C20:2 t11,14 AGP 23,3 C22:1 t3 0,03 C12:0 (ácido láurico) + C14:0 (ácido mirístico) + C16:0 (ácido palmítico) 22,9 AG insaturados cis 71,9 C18:0 (ácido esteárico) 7,8 AGM cis 48,9 Ácidos grasos trans 2,1 AGP cis 22,9 C14:1 t9 0,1 C18:1 c9 (ácido oleico) 36,9 C16:1 t9 0,17 C18:2 c9,12 (ácido linoleico) 21,6 C18:1 t (ácido elaídico) 1,4 C18:3 c9,12,15 (ácido linolénico) 0,81 AGS: ácidos grasos saturados; AGM: ácidos grasos monoinsaturadas; AGP: ácidos grasos poliinsaturados. 38 0,015 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 (12%), la pizza congelada (10%), la margarina vegetal (17%) y la pasta de chocolate y avellanas (12%). Los alimentos con una mayor contribución a los ácidos grasos trans fueron: vacuno (el 29,8% de los ácidos grasos totales), lácteos (31,3% –queso: 7,5%–), pan de molde, pasteles, pastas y dulces (13,3%) y margarina (9%). 2.3. PROTEÍNAS La principal función de las proteínas es la estructural. Las proteínas constan de una o varias cadenas largas de aminoácidos, que están unidos en una secuencia característica y propia para cada proteína. Cada gramo de proteínas aporta 4 kcal. Son fuentes de proteínas tanto los alimentos de origen animal (carnes, pescados y leche), como los de origen vegetal (legumbres, arroz, patata, soja). Es importante seleccionar aquellos alimentos con proteínas de alto valor biológico, que son las que aportan aminoácidos esenciales que el organismo no puede sintetizar (Tabla 14 y Figura 11). De los veinte aminoácidos de las proteínas, nueve son esenciales; por tanto, son necesarios en la alimentación humana. Los aminoácidos esenciales en el ser humano son: arginina, histidina, lisina, treonina, metionina, isoleucina, valina, fenilalanina y triptófano. El contenido proteico adecuado de la dieta está establecido en el 15% aproximadamente del valor calórico total (96). Las carnes y los pescados aportan proteínas de alto valor biológico. En cambio, las legumbres son deficitarias en un aminoácido esencial, la metionina; así pues, para conseguir una buena calidad proteica es necesario que este aminoácido sea aportado TABLA 14. Necesidades de aminoácidos esenciales en mg/kg de peso corporal. Necesidades Adulto Fenilalanina y tirosina 14 Histidina * Isoleucina 10 Leucina 14 Lisina 12 Metionina y cistina 13 Treonina 7 Triptófano 3 Valina 13 Total aminoácidos esenciales (excluida la histidina) 86 *La histidina es esencial sólo en lactantes, cuyas necesidades son de 29 mg/kg. 39 2 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA La medida en que una proteína coincide con la composición de los tejidos animales determina su valor biológico Valor biológico 100 90 60 40 FIGURA 11. Valor biológico de las proteínas a la dieta por otro alimento. Una buena combinación es la de legumbres con arroz o patata, alimentos que sí aportan metionina, pese a que son carentes en otros aminoácidos, como la lisina, que son aportados por las legumbres. El papel de las proteínas en relación con el riesgo cardiovascular estaría mediado por sus diferentes características. Así, los estudios epidemiológicos han sugerido una correlación entre el consumo de proteínas de origen animal y la mortalidad por cardiopatía isquémica. En el estudio CLAS (127) se observó que cuando las proteínas sustituían a la grasa de la dieta existía una reducción de las lesiones coronarias. Parece, entonces, que el papel aterogénico de la carne roja va más ligado a su contenido graso que al proteico, dado su elevado aporte tanto de grasa saturada como de colesterol. Las proteínas de origen vegetal, especialmente la soja, parecen estar ligadas a un menor riesgo cardiovascular. En estudios en los que se comparaba una población que seguía una alimentación vegetariana con otra con un consumo diario de carne roja, se encontró una reducción del 60% en la mortalidad cardiovascular de la población vegetariana (128), aunque también hay que valorar la distorsión que puede producir en los resultados el estilo de vida más saludable que seguía la población vegetariana. En el Western Electric Study se encontró que las proteínas vegetales, y no así las de origen animal, se relacionaban con cifras más bajas de presión arterial sistólica. Aunque las hipótesis que explican las causas de este efecto son actualmente objeto de estudio, parece que diferentes aminoácidos (triptófano, metionina) poseen propiedades hipotensoras, mediando neurotransmisores cerebrales o sustancias humorales que regulan la respuesta vasopresora (129). 40 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE Y PRINCIPIOS INMEDIATOS EN ATENCIÓN PRIMARIA 2 La fracción proteica de la leche contiene péptidos (isoleucina-prolina-prolina; valina-prolina-prolina) que pueden tener efectos beneficiosos en la presión arterial y la trombogénesis (130). La leche es la principal fuente de calcio, y existen evidencias de que el calcio presenta un efecto hipocolesterolemiante: una dieta enriquecida con un aporte diario de 2.200 mg de calcio reduce el colesterol LDL en un 11%, comparada con otra con un bajo aporte cálcico (131). En algunos estudios se ha observado que los derivados lácteos fermentados producen reducciones significativas del colesterol total y del colesterol LDL (132). Sin embargo, a pesar de sus efectos positivos sobre el metabolismo lipídico en animales de experimentación, no existen evidencias claras de que los lácteos fermentados (probióticos) o aquellos que contienen oligosacáridos fermentables (prebióticos) tengan un efecto valorable sobre los lípidos séricos en los humanos (133). En todo caso, la leche entera aporta grasa saturada (nata) por lo que, en el contexto de una alimentación cardiosaludable, resulta más adecuado el consumo de productos lácteos pobres en esta grasa (desnatados) o con la grasa sustituida por grasas insaturadas. 41 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 3. ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES 3.1. ALIMENTACIÓN Y DISMINUCIÓN . DEL RIESGO CARDIOVASCULAR El papel de la alimentación es fundamental y prioritario en el control del riesgo cardiovascular global. Ya el estudio de los Siete Países (134) identificó la relación entre el incremento del riesgo cardiovascular y el porcentaje de grasa saturada de la alimentación (Figuras 12 y 13). Así pues, en poblaciones con una ingesta de cantidades similares de grasa total en relación con el valor calórico total de la dieta, eran las características de la grasa ingerida las determinantes de la diferencia de la morbimortalidad cardiovascular. Así, en la población del norte de Europa, la ingesta de cantidades elevadas de ácidos grasos saturados hace que el riesgo sea más elevado que en los países mediterráneos, cuyo aporte de grasa es mayoritariamente en forma de ácidos grasos monoinsaturados (aceite de oliva). Hay evidencias más recientes que abogan por la utilidad de la dieta como herramienta terapéutica en la prevención y el tratamiento de las enfermedades cardiovasculares. Distintos estudios prospectivos de cohortes muestran los beneficios de la dieta mediterránea en la prevención de enfermedades cardiovasculares y en la reducción de las tasas de mortalidad por causa cardiovascular (Tabla 15). Así, en una cohorte de 74.607 hombres y mujeres mayores de 60 años, sin enfermedad cardiovascular, ictus o cáncer, de nueve países europeos, durante un seguimiento de 89 meses, se demostró que, por cada incremento en dos puntos en una escala que valora el cumplimiento de la dieta mediterránea, había una disminución del 8% de todas las causas de mortalidad (137). Asimismo, en estudios clínicos de distribución aleatoria con una dieta de tipo mediterráneo en pacientes de alto riesgo, se ha observado que, en prevención secundaria, también 43 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Grecia 0,5 1,1 Italia 3,4 Finlandia 4,6 Ferroviarios EE.UU. 0 1 2 3 4 Prevalencia de individuos (por mil) con cardiopatía isquémica 5 FIGURA 12. Prevalencia de enfermedad coronaria al inicio, estudio de los Siete Países (134) Finlandia 45,5 Ferroviarios EE.UU. 42,4 Holanda Italia 46,8 31,7 74,7 20,3 82,3 Yugoslavia 14,3 Grecia 6,6 Japón 6 67,1 65,3 48,4 93,4 FIGURA 13. Tasas de mortalidad por enfermedad coronaria y mortalidad total (134) (Las tasas de mortalidad se han estandarizado según la edad que corresponde a 10.000 participantes durante 10 años.) existen evidencias del beneficio de la dieta en la disminución del riesgo de enfermedades cardiovasculares y de la mortalidad de causa cardiovascular, independientemente de la disminución del colesterol total y del colesterol LDL (Tabla 16 y Figura 14). 44 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA TABLA 15. Estudios prospectivos de cohortes sobre los efectos de la dieta mediterránea. Estudio Seguimiento Efectos en enfermedad cardiovascular y muerte Nurses´ Health Study (135) 16 años Elevado consumo de pescado disminuye el riesgo de muerte por enfermedad cardiovascular en un 45% Physicians’ Health Study (103) 17 años Menor riesgo relativo de muerte súbita con altas concentraciones en sangre de omega 3 Cardiovascular Health Study (136) 7 años Altas concentraciones de EPA, DHA, ALA* se asocian a un menor riesgo de infarto fatal EPIC-Elderly Prospective Cohort Study (137) 89 meses Aumento de dos puntos en la escala de cumplimiento disminuye en un 8% la mortalidad total *EPA: ácido eicosapentaenoico; DHA: ácido docosahexaenoico; ALA: ácido linolénico. TABLA 16. Estudios de intervención sobre los efectos de la dieta mediterránea. Estudio Dieta intervención Resultados en enfermedad cardiovascular y muerte DART (138) Pescado 2 veces/semana con 500-800 mg/día de omega 3 29% de reducción en mortalidad por todas las causas; 27% en infarto fatal Lyon Diet Heart Study (113) Suplementos de EPA* o de omega 3 Descenso del 68% en muerte de origen cardiaco e infarto no fatal GISSI-Prevenzione Trial (139) Suplemento de 1 g/día de omega 3 Disminución del 20% de la mortalidad total, del 30% en la mortalidad de causa cardiovascular y del 46% en la muerte súbita *EPA: ácido eicosapentaenoico. En el Lyon Diet Heart Study (113), un estudio de prevención secundaria, se utilizó una dieta de tipo mediterráneo, pero con características singulares: la fuente principal de grasa no fue el aceite de oliva, sino una margarina a base de aceite de colza rica en ácidos grasos monoinsaturados pero con un contenido del 8% de ácido alfa linolénico. El estudio demostró que se producía una disminución de las recurrencias después del primer infarto, cifrada en un 70% de mortalidad y morbilidad cardiovascular, en comparación con el grupo de pacientes de control que, con similar tratamiento farmacológico, recibió dieta y cuidados convencionales. Estos beneficios son más importantes, si cabe, dado que en ambos grupos no había diferencias significativas en los lípidos séricos, lo que viene a corroborar el efecto protector de la dieta per se, independientemente de la reducción de la concentración de colesterol, una disminución del riesgo que es incluso superior a la lograda en los estudios de prevención secundaria con estatinas (CARE, LIPID, 4S), en los que sí había una reducción importante del colesterol (Figura 14). Los autores del Lyon 45 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Diet Heart Study atribuyen el espectacular beneficio de la intervención dietética al aumento del consumo de ácido linolénico (ácido graso poliinsaturado n-3), ácido oleico (monoinsaturado) y ácido eicosapentaenoico (poliinsaturado n-3), y de antioxidantes (alfa tocoferol, vitamina E y vitamina C), así como a la disminución de ácido linoleico (poliinsaturado n-6) y de ácidos grasos saturados, en el grupo de intervención respecto al grupo de control, tal como se reflejó en los cambios en las concentraciones plasmáticas de estos nutrientes (143). En otro importante estudio clínico de distribución aleatoria, el GISSI Prevenzione Trial (139), realizado en 11.000 pacientes tras un episodio de infarto agudo de miocardio a los que se les hizo un seguimiento de 3,5 años, se demostró que había una reducción del 40% de las muertes de origen cardiaco y de un 20% de la mortalidad total en los pacientes que recibían cápsulas de aceite de pescado rico en ácidos grasos n-3 (ácido eicosapentaenoico y ácido docosahexaenoico). Además, al igual que en el Lyon Diet Heart Study, la notable reducción del riesgo cardiovascular no se acompañó de diferencias significativas en las cifras de colesterol LDL o de presión arterial (Figura 14). Si bien es el más importante efectuado hasta la fecha, el GISSI no es el único estudio clínico que ha demostrado el beneficio cardiovascular de los suplementos de aceites de pescado en pacientes con enfermedad coronaria (144). El estudio DART (138), también de prevención secundaria, demostró que un elevado consumo de pescado (que supone un aporte elevado de ácidos grasos n-3) se asociaba a una reducción de la mortalidad total del 29%, del infarto de miocardio fatal de un 27% (145), y del total de muertes de origen cardiovascular del 16%, con una reducción de los episodios coronarios a pesar de que no se observó ningún cambio de la colesterolemia (véase también Figura 14). Las dietas de STEP I y II (97), caracterizadas por su restricción en cuanto al contenido graso del valor calórico total, han mostrado una reducción del LDL circulante, respectivamente, del 12% y del 16% (Tabla 17), pero con una reducción del colesterol HDL en torno al 7%; y han presentado unos beneficios estimados menores que los reseñados en otros estudios de intervención dietética y farmacológica (estatinas) (Figura 14). Otras evidencias sugieren que una dieta de tipo mediterráneo tiene efectos superiores a los observados con una dieta pobre en grasa (dieta STEP I) para el control del riesgo cardiovascular en población sana (86) y en pacientes diabéticos (146). En un estudio de Fuentes y cols. (147) se observó una mejoría en la disfunción endotelial mediante la comparación de una dieta de control alta en grasa con una dieta de tipo mediterráneo y con una baja en grasa durante 28 días, y se logró un incremento de la vasodilatación arterial dependiente del endotelio de un 36% con la dieta mediterránea y sólo de un 12% con la dieta baja en grasas en relación con la dieta de control. También en el Greecs Study se ha visto que el cumplimiento de la dieta de tipo mediterráneo está asociada a una menor gravedad y un mejor pronóstico de los síndromes coronarios agudos (148). 46 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA Reducción del riesgo coronario (%) 0 Pravastatina Simvastatina LIPID (140) CARE (141) 4S (142) 3 Dieta* Dieta* DART (138) GISSI-P (139) STEP I (97) STEP II (97) (pescado) (EPA+DHA) LYON (113) –10 –20 –30 Reducción colesterol con dieta baja en grasa –40 –50 Reducción colesterol con estatinas –60 –70 *Estimación de la reducción del riesgo cardiovascular (descenso de 1% de riesgo cardiovascular por cada reducción del 1% del colesterol LDL) –80 Sin reducción colesterol sérico EPA: ácido eicosapentaenoico; DHA: ácido docosahexaenoico FIGURA 14. Reducción del colesterol circulante y del riesgo coronario en diversos estudios por efecto de la dieta y de los fármacos hipolipemiantes (estatinas) TABLA 17. Reducción del colesterol LDL (porcentaje) conseguido mediante distintas intervenciones. Estatinas: • Estudio LIPID (140): -25% • Estudio CARE (141): -28% • Estudio 4S (142): -38% Dieta baja en grasa: • Dieta NCEP Step I (97): -12% • Dieta NCEP Step II (97): -16% Dieta sin reducción de colesterol: • Estudio DART (pescado) (138): 0% • Estudio GISSI- Prevenzione (n-3 poliinsaturados) (139): 0% • Dieta estudio Lyon (113): 0% 47 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Existen, pues, numerosas evidencias en prevención secundaria de los beneficios que se pueden obtener con un estilo de vida saludable y una dieta mediterránea en la disminución del riesgo de padecer enfermedades cardiovasculares (Tabla 16), pero es necesario valorar si en prevención primaria ocurre lo mismo. Para ello se está realizando, en nuestro país, un estudio de intervención dietética (estudio PREDIMED) para evaluar los efectos de la dieta mediterránea en la prevención primaria cardiovascular en pacientes de alto riesgo. A los pacientes, además de ofrecerles educación nutricional, se les añade aceite de oliva a un subgrupo del grupo de intervención y frutos secos a otro, y se compara con un grupo de control al que se le recomienda una dieta baja en grasas. Se han evaluado los cambios a los tres meses del inicio sobre marcadores de riesgo cardiovascular -como: peso, glucemia, y lípidos- y sobre los marcadores de inflamación; los resultados han resultado favorables a la dieta mediterránea, con una disminución de la presión sistólica y de las concentraciones de glucosa, y un aumento del colesterol HDL en el grupo al que se le añadió aceite de oliva, grupo en el que también se ha reducido la proteína C reactiva en comparación con el grupo de la dieta baja en grasas (149). También en el HALE Project se ha estudiado la mortalidad por enfermedades cardiovasculares, enfermedad coronaria y cáncer durante 10 años en una cohorte de 832 mujeres y 1.507 hombres sanos con edades de entre 70 y 90 años, para ver cómo se asocia la dieta y un estilo de vida saludable a la mortalidad específica por cada causa y la mortalidad total. Se ha visto que el cumplimiento de la dieta mediterránea y un estilo de vida saludable (ejercicio físico, moderado consumo de alcohol y abstención del tabaquismo) estaba asociada a una disminución de más del 50% de la tasa de mortalidad total y de mortalidad específica (150). Un total de 48.835 mujeres posmenopáusicas de entre 50 y 79 años de edad participaron en el estudio Women’s Health Initiative Dietary Modification Trial. En el grupo de estudio se llevó a cabo una intervención dietética para lograr una disminución del consumo de grasas saturadas, así como un aumento del consumo de frutas, verduras y cereales, en comparación con el grupo de control. Tras ocho años de seguimiento no se logró una reducción significativa del riesgo de enfermedad cardiovascular total, enfermedad coronaria o ictus, y sólo se consiguió una modesta reducción de los factores de riesgo de enfermedad cardiovascular (151). Es necesario, pues, seguir investigando el papel que tiene la dieta tanto en la disminución de los factores de riesgo cardiovascular como en la reducción de la morbimortalidad por esta causa. En el momento actual, aun con los tratamientos farmacológicos de los que disponemos (estatinas, resinas, ácido nicotínico, fibratos, ezetimiba), la dieta demuestra reducciones adicionales del colesterol LDL y de los triglicéridos cifradas en un 5%-20% (152). La dieta es la piedra angular en la que se sustenta la prevención y el tratamiento de las enfermedades cardiovasculares, junto a la práctica de un estilo de vida saludable, que reducirá el coste del tratamiento farmacológico y el número de individuos que lo requieren (153). En contraposición a la “polipíldora” (polipil), propuesta en 2003 (154), en términos de beneficio sobre el 48 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA 3 riesgo cardiovascular, Franco y cols. presentan la “polidieta” (polimeal) como una alternativa dietética a la reducción del riesgo cardiovascular que se puede conseguir con intervenciones farmacológicas, a un menor coste y sin el riesgo de los posibles efectos secundarios derivados del consumo de fármacos. Con los ingredientes de la polidieta (que incluye consumo moderado de vino, pescado, cacao, frutas, vegetales, ajo y almendras), se calcula una potencial reducción del 76% aproximadamente de los episodios cardiovasculares; asimismo, se calcula un aumento de su esperanza de vida de 6,6 años y un aumento de la expectativa de vida libre de enfermedades cardiovasculares de 9 años en el caso de los hombres, y de 4,8 y de 8,1 años, respectivamente, en el de las mujeres (155) (Figura 15). Así pues, la polidieta puede ser efectiva, segura, barata, y una sabrosa opción para reducir la morbilidad cardiovascular y aumentar la esperanza de vida en la población. 3.2. ALIMENTACIÓN CARDIOSALUDABLE . E HIPERTENSIÓN ARTERIAL La dieta también desempeña un papel importante en la prevención y el tratamiento de la hipertensión arterial. Un estudio observacional prospectivo documenta que una dieta rica en sal está asociada a un incremento de la mortalidad cardiovascular (156). La reducción del sodio dietético puede prevenir la hipertensión en personas con riesgo elevado, de forma que disminuye su incidencia en un 20% y la necesidad del empleo de antihipertensivos en personas ancianas (157). Durante el procesamiento de los alimentos pueden añadirse ingredientes con el objeto de mejorar su sabor y ayudar a su conservación (Tabla 18). Ésta es una fuente importante de aporte sódico a la dieta, especialmente por parte de los alimentos precocinados dispuestos Ingredientes Reducción riesgo cardiovascular (%) (IC95%) Vino (150 ml/día) 32 (23 a 41) Pescado (114 g 4 veces/semana) 14 (8 a 19) Chocolate negro (100 g/día) 21 (14 a 27) Fruta y verduras (400 g/día) 21 (14 a 27) Ajo (2,7 g/día) 25 (21 a 27) Almendras (68 g/día) 12,5 (10,5 a 13,7) Efectos combinados 76 (63 a 84) FIGURA 15. Efecto de los ingredientes de la polidieta en la reducción del riesgo cardiovascular (155) 49 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA para su consumo inmediato, pues con frecuencia contienen citrato sódico, propionato sódico, nitrato sódico, etc. Asimismo, las sopas concentradas y los cubitos para preparar caldo contienen glutamato sódico, añadido para potenciar su sabor. También hay otros alimentos, poco relacionados aparentemente con un aporte adicional de sodio a la dieta, que pueden proporcionar cantidades no despreciables. Así, los caramelos, los productos de bollería, los helados y la goma de mascar llevan ascorbato sódico (E-301), en los turrones suele haber benzoato sódico (E-211), y en las galletas y los mazapanes, sorbato sódico (E-201). En la Tabla 19 se citan condimentos con bajo contenido en sodio, y que, por tanto, pueden suplir a la sal común en la elaboración culinaria de los alimentos, y ayudar a mejorar su palatabilidad. Las características de la grasa dietética también influyen en la presión arterial. Un estudio reciente (158) ha evaluado la influencia cuantitativa y cualitativa de la composición de la grasa de la dieta sobre los valores de la presión arterial en sujetos sanos. Si se cambian las proporciones de la grasa dietética de forma que se sustituya de forma isocalórica la grasa saturada por monoinsaturada, puede reducirse la presión arterial. Estos efectos beneficiosos inducidos por cambios cualitativos en la composición grasa de la dieta desaparecen con el consumo de una ingestión de grasa total elevada (superior al 37% del aporte energético), mientras que añadir un suplemento de ácidos grasos n-3 a la dieta no tiene influencia sobre las cifras de presión arterial (158). TABLA 18. Aditivos alimentarios autorizados con sodio en su composición. CONSERVANTES POTENCIADORES DEL SABOR Sorbato sódico (E-201) Benzoato sódico (E-211) Sulfito sódico (E-221) Disulfito sódico (E-223) Nitrito sódico (E-250) Diacetato sódico (E-262) Propionato sódico (E-281) Glutamato sódico (H-5805) Guanilato sódico (H-5813) Inosinato sódico (H-5816) ANTIOXIDANTES EDULCORANTES ARTIFICIALES L-ascorbato sódico (E-301) Citrato sódico (E-331) Tartrato sódico (E-335) Ortofosfato sódico (E-339) Ciclamato sódico (H-6882) Sacarina sódica (H-6886) ESTABILIZANTES, EMULGENTES, ESPESANTES Y GELIFICANTES ANTIAPELMAZANTES Alginato sódico (E-401) Difosfato sódico (E-450) Caseinato sódico (H-4512) Silicato sódico (H-7177) Ferrocianuro sódico (H-7199) Hidróxido sódico (H-8006) 50 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA 3 TABLA 19. Contenido en sodio de los condimentos. CON ALTO CONTENIDO CON BAJO CONTENIDO Sal común Aceitunas Pepinillos Salsa ketchup Mostaza envasada Mayonesa comercial Extracto de carne, cubitos Sal de ajo o de cebolla Hojas, semillas o sal de apio Hojas secas de perejil Pimienta y pimentón Hierbabuena Nuez moscada Perejil Azafrán Extracto de vainilla Cebolla fresca Clavo Ajos Limón Mayonesa/mostaza casera sin sal Pimientos frescos Romero, tomillo, orégano, laurel Vinagre Canela Otras evidencias en hipertensos con sobrepeso sugieren que el consumo habitual de pescado puede reducir la presión arterial, de forma que su efecto es adicional al logrado con la reducción de peso (159). El aceite de oliva, rico en ácidos grasos monoinsaturados (concretamente, en ácido oleico), también ha sido estudiado. Se ha encontrado que su consumo tiene un efecto reductor de la presión arterial (160) y de la necesidad de fármacos antihipertensivos (90) (véase también el Capítulo 5.7). En el estudio OMNIHEART se compararon los efectos sobre la presión arterial de tres dietas distintas: una rica en carbohidratos, otra rica en proteínas (casi la mitad de las cuales eran de origen vegetal), y otra rica en grasa insaturada de predominio monoinsaturada (Tabla 20). Se encontró que, en relación con la dieta basal, la presión arterial había disminuido con las tres intervenciones dietéticas aunque, cuando se compararon entre sí, se concluyó que, en el contexto de una alimentación saludable baja en grasa saturada, una sustitución de carbohidratos por proteínas o grasa monoinsaturada puede reducir la presión arterial y mejorar el perfil lipídico (161) (Tabla 21 y Figura 16). Otros resultados refuerzan el concepto de que una modesta sustitución de alimentos ricos en carbohidratos por otros ricos en proteínas puede disminuir la presión arterial en hipertensos (162). El riesgo de hipertensión arterial está directamente relacionado con la ingesta rica en carne roja y comida procesada e inversamente con la de la rica en fruta, cereales integrales, frutos secos y leche, resultados congruentes con el efecto beneficioso de la ingestión de 51 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 20. Características de las dietas empleadas en el estudio Omniheart: porcentaje de principios inmediatos sobre el valor calórico total y promedio de raciones de alimentos para una dieta de 2.100 kcal (161). Dieta Carbohidratos* Proteínas Grasas insaturadas 27 27 37 Saturadas 6 6 6 Monoinsaturadas 13 13 21 Poliinsaturadas 8 8 10 Carbohidratos 58 48 48 Proteínas 15 25 15 Carne 5,5 9 5,5 Objetivos por nutriente, kcal %† Grasas ‡ Lácteos 4 4 4 5,5 12 5,5 Fruta y zumos 6,6 3,8 4,8 Hortalizas 4,4 5,4 6,3 Cereales 5,3 5 4,3 Productos lácteos pobres en grasas 1,4 2,3 1,6 Productos lácteos ricos en grasas 0,7 0,2 0,3 Legumbres, frutos secos, semillas y otras proteínas vegetales 1,3 3 1,2 Carne de ternera, cerdo y jamón 0,9 1,1 1 Carne de ave 1,6 2,6 1,8 Pescado 1,1 1,3 1 Sucedáneos de huevo 0,2 1,1 0,1 Postres y dulces 4,6 2,5 1,7 Grasas y aceites 6 3,5 12 Vegetales§ Grupos de alimentos, raciones/día * La dieta basada en carbohidratos reprodujo el perfil de nutrientes del estudio dietético DASH (Dietary Approaches to Stop Hypertension), a excepción del porcentaje de kilocalorías de proteínas y carbohidratos, que en el DASH fue del 18% y 55%, respectivamente. † Los siguientes objetivos nutritivos fueron similares en todas las dietas: colesterol inferior a 150 mg/día; fibra superior a 30 g/día; sodio 2.300 mg/día; potasio 4.700 mg/día; magnesio 500 mg/día y calcio 1.200 mg/día. ‡ El índice glucémico total de las tres dietas fue moderado y similar (68 en la dieta de carbohidratos, 71 en la de proteínas y 75 en la de grasas insaturadas). § El promedio de consumo diario de proteína de soja fue de 0,5 g en la dieta de carbohidratos, de 7,3 g en la de proteínas y de 0,5 g en la de grasas insaturadas. 52 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA TABLA 21. Estudio Omniheart: valores basales de presión arterial (en mmHg) . y cambios conseguidos con las intervenciones dietéticas (161). Medias de la evolución (IC95%) de los valores basales después de la dieta n Media (DE) de los valores basales Carbohidratos Proteínas Grasas insaturadas 164 131,2 (9,4) -8,2 (-9,6 a -6,8) -9,5 (-10,9 a -8,2) -8,2 (-9,6 a -6,8) Estadio 1 hipertensión 32 146,5 (5,7) Prehipertensión 132 127,5 (5,7) -7,0 (-8,5 a -5,6) Total 164 77,0 (8,2) -4,1 (-5,0 a -3,3) -5,2 (-6,1 a -4,4) -4,8 (-5,6 a -4,0) Estadio 1 hipertensión 32 84,2 (7,8) -6,3 (-8,4 a -4,3) -8,6 (-10,9 a -6,4) -8,2 (-10,4 a -6,0) Prehipertensión 132 75,3 (7,4) -3,6 (-4,5 a -2,7) -4,4 (-5,3 a -3,6) -3,9 (-4,7 a -3,2) Presión arterial, mmHg† Sistólica Total -12,9 (-16,6 a -9,2) -16,1 (-19,7 a -12,5) -15,8 (-19,4 a -12,3) -8,0 (-9,3 a -6,6) -7,7 (-8,9 a -6,4) Diastólica † La prehipertensión se define como una presión arterial (PA) sistólica = 120-139 o una PA diastólica 80-89; el estadio 1 de hipertensión se define por una PA sistólica = 140-159 o una PA diastólica = 90-99 alimentos vegetales y con el efecto adverso de la ingestión de carne sobre la presión arterial (163). El estudio DASH (164) ha demostrado que una modificación de los hábitos dietéticos, con un incremento de la ingestión de frutas, vegetales, pescado azul, cereales integrales y frutos secos, y con una reducción de la de grasa, carne roja y dulces, es capaz de disminuir la presión arterial en pacientes normotensos, y de forma similar a la que se logra con una monoterapia antihipertensiva en pacientes hipertensos (165). Una modificación del estilo de vida multifactorial, que incluya una dieta tipo la del estudio DASH, mejora el control de la presión arterial (166) en comparación con otra baja en grasa; y para una misma disminución de peso, aquélla consigue una mayor reducción de la presión arterial (167). Los beneficios de esta dieta tipo DASH sobre la salud podrían atribuirse a su riqueza en calcio y en potasio, y también al elevado contenido de compuestos fitoquímicos (flavonoides, betacarotenos, licopeno, fitoesteroles, etc.) aportados por su riqueza en frutas y verduras (168). Una ingesta rica en frutas y verduras, en el contexto de un elevado consumo de grasa (37% del valor calórico total) en el seguimiento de una cohorte española, está inversamente relacionada con las cifras de presión arterial (169). El estudio INTERSALT, realizado en más de 10.000 personas de 32 países diferentes, demostró una clara relación entre el consumo de sal y la presión arterial, mucho más manifiesta en la presión sistólica (170). Este hecho ha llevado a recomendar la limitación del consumo de sal (cloruro sódico) a 6 g/día, el equivalente de 100 mmol (2.400 mg) de sodio por día (171). 53 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA A. Presión arterial sistólica 2 General Prehipertensión Hipertensión Diferencia media (mmHg) 1 0 –1 –2 –3 –4 –5 –6 Proteínas frente a carbohidratos Grasas insaturadas frente a carbohidratos B. Presión arterial diastólica 2 Proteínas frente a grasas insaturadas General Prehipertensión Hipertensión Diferencia media (mmHg) 1 0 –1 –2 –3 –4 –5 –6 Proteínas frente a carbohidratos Grasas insaturadas frente a carbohidratos Proteínas frente a grasas insaturadas FIGURA 16. Estudio Omniheart: comparación de las intervenciones dietéticas sobre el control de la presión arterial, sistólica y diastólica, a las seis semanas desde el inicio (161) 54 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN PRIMARIA 3. ESTUDIOS DE ATENCIÓN INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES Para lograrlo, no tan sólo hay que vigilar la cantidad de sal que se añade a la comida, sino que hay que procurar dirigir los hábitos dietéticos a alimentos de bajo contenido en sodio, restringiendo alimentos precocinados, fiambres, salazones y conservas, que se caracterizan por su riqueza sódica (Tabla 22). Otras medidas dirigidas a regular el control de la presión arterial (171) son: ● El mantenimiento de un peso adecuado, ya que existe una relación directa entre los cambios de peso y de presión arterial (173). Reducciones ponderales modestas, si se mantienen, producen un gran beneficio metabólico y en el control de la presión arterial (174). ● La moderación del consumo de alcohol (175): no más de dos bebidas de baja graduación (copas de vino, cerveza) por día en hombres y una bebida al día en mujeres (176). ● Incremento del potasio que se ingiere. En este sentido, es preferible la estrategia de aumentar el consumo de alimentos ricos en potasio (como las frutas) (177) (Tabla 23) y no tanto el empleo de suplementos de potasio. ● Una dieta con un alto contenido en vegetales, ya que el consumo de proteínas de origen vegetal está inversamente relacionado con la presión arterial (178). TABLA 22. Contenido en sodio de algunos alimentos (172). Alimento Contenido en sodio g/100 g Alimento Contenido en sodio g/100 g Anchoas de lata en aceite 3,930 Sardinas de lata en aceite 0,350 Olivas verdes saladas 2,250 Atún de lata en aceite 0,290 Beicon plancha 2,020 Zumo de tomate 0,230 Salmón ahumado 1,880 Mejillones al vapor 0,210 Salami 1,850 Pasta tipo Donuts 0,180 Gambas hervidas 1,590 Huevo duro 0,140 Jamón de York 1,250 Chocolate con leche 0,120 Cereales para desayuno 1,110 Espinacas al vapor 0,120 Quesos secos 1,050 Merluza al vapor 0,120 Cacao en polvo 0,950 Carnes (buey, pollo, cerdo) <0,1 Paté de hígado 0,790 Lácteos (yogur, leche, requesón) <0,1 Cacahuetes tostados 0,790 Verduras y frutas <0,03 Pan blanco 0,520 Bacalao salado al vapor 0,400 Frutos secos (almendras, avellanas...) <0,02 55 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 23. Contenido en potasio de algunos alimentos (172). Alimento Contenido potasio (g/100 g) Alimento Contenido potasio (g/100 g) Pimentón rojo (páprika) 2,34 Merluza al vapor 0,32 Cacao en polvo 1,50 Judías cocidas 0,32 Pasas 1,02 Beicon plancha 0,29 Frutos secos 0,73-0,78 Patatas hervidas 0,28 Ahumados (salmón, arenque) 0,42-0,52 Jamón de York 0,28 Sardinas de lata en aceite 0,43 Atún de lata en aceite 0,26 Chocolate con leche 0,42 Gambas hervidas 0,26 Hígado de ternera frito 0,41 Lácteos (leche, yogur, requesón) <0,25 Plátano 0,40 Naranja, pera, sandía, ciruela <0,25 Crema de cacao con avellanas 0,39 Lechuga 0,22 Bacalao fresco a la plancha 0,38 Zanahorias 0,17 Carnes (buey, cerdo, pollo) 0,30-0,38 Huevo duro 0,13 0,34 Pan blanco 0,11 Champiñones fritos Un informe reciente de la American Heart Association (179) resalta el papel de la alimentación para el control de la hipertensión, con medidas como las que se han expuesto anteriormente; asimismo, el Joint National Committee (JNC) VII Report cuantifica la reducción de las cifras de presión arterial de diferentes recomendaciones dietéticas y de actividad física (171) (Tabla 24). Los beneficios derivados de estas medidas dependerán del mantenimiento de las modificaciones en los hábitos dietéticos a largo plazo y de la disponibilidad de alimentos con bajo contenido en sodio. Pero, aunque la reducción del consumo de sodio es fácil de recomendar, en trabajos que evalúan su seguimiento se ha demostrado la dificultad para que se mantenga (180, 181); además, la opinión del paciente al respecto tiende a ser optimista, por lo que para su apreciación exacta hay que determinar el sodio en orina de 24 horas. En conclusión, citando textualmente a Luque Otero en un artículo sobre el contenido de sodio de la dieta y las enfermedades cardiovasculares (182), “no hay, de acuerdo con las evidencias disponibles, razones para recomendar ni a la población general ni a los pacientes hipertensos nada más que moderación, que no restricción, en la ingesta de sal”. 56 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA TABLA 24. Modificaciones del estilo de vida para el control de la hipertensión . arterial (171). Modificación Recomendación Reducción de la presión arterial sistólica (rango) Reducción de peso Mantener un peso corporal adecuado (índice de masa corporal = de 18,5 a 24,9 kg/m²) 5-20 mmHg/10 kg de peso perdido Adoptar el plan alimentario DASH Consumir una dieta diaria rica en fruta, vegetales y productos bajos en grasas, con un contenido limitado de grasas saturadas y grasas totales 8-14 mmHg Reducción del sodio de la dieta Reducir el consumo de sodio a menos de 100 mmol diarios (2,4 g de sodio o 6 g de cloruro sódico) 2-8 mmHg Actividad física Realizar una actividad física aeróbica regular, como andar vigorosamente (al menos 30 min diarios, la mayoría de los días de la semana) 4-9 mmHg Moderación en el consumo de alcohol Limitar el consumo a no más de dos bebidas diarias (30 ml de etanol; que son unos 720 ml de cerveza, 300 ml de vino o 90 ml de whisky) en la mayoría de varones y no más de una bebida diaria en mujeres y personas delgadas 2-4 mmHg 3.3. ALIMENTACIÓN CARDIOSALUDABLE . Y DIABETES MELLITUS La dieta en la población diabética es un aspecto esencial del tratamiento. Lo adecuado es establecer un plan de alimentación, consensuado con el paciente, en el que se tenga en cuenta que se debe mantener un horario uniforme de las comidas, se eviten aquellos alimentos con índice glucémico alto y se reparta el consumo diario de hidrocarbonos en 5 o 6 tomas, de tal manera que se limiten en la medida de lo posible los picos hiperglucémicos posprandiales. En el estudio DECODE (60) se muestra que el riesgo relativo de mortalidad cardiovascular se incrementa con el aumento de las concentraciones de glucemia posprandial a las dos horas, independientemente de las concentraciones de glucemia basal (Figura 17). Otro estudio retrospectivo valora el papel de la incorporación de hidratos de carbono de bajo índice glucémico en el plan dietético de los pacientes diabéticos, como una medida conductual efectiva que mejora el control de la glucemia y del peso en estos pacientes (183). También una modificación dietética modesta, consistente en un incremento del contenido de fibra dietética y una reducción del índice glucémico de un alimento tan común como es el pan, mejora la sensibilidad insulínica en mujeres con intolerancia a la glucosa e historia de diabetes gestacional (184). Un metaanálisis 57 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Riesgo relativo mortalidad cardiovascular de estudios de distribución aleatoria llevados a cabo en pacientes con dislipemia, diabetes o sobrepeso estima el efecto de dietas con un bajo índice glucémico sobre la cardiopatía isquémica. Este trabajo no encuentra que reporten beneficios sobre la morbimortalidad cardiovascular (68). Por todo ello, y como se comentó en el Capítulo 2.1, no existe un consenso amplio sobre el papel del índice glucémico en el control dietético de la diabetes (70). Existe cierta controversia por lo que respecta a la dieta más adecuada para su aplicación en la diabetes tipo 2. Por un lado, está la dieta antidiabética tradicional, rica en hidratos de carbono y baja en grasa –dieta recomendada por la American Heart Association (71)– y, por otro, una dieta con un contenido mayor de ácidos grasos monoinsaturados (ácido oleico) y un menor aporte hidrocarbonado. Ambas dietas consiguen un control similar del colesterol LDL, pero la dieta recomendada por la American Heart Association se asocia a un aumento de los triglicéridos y una disminución del colesterol HDL (24, 185), mientras que estos cambios no ocurren con la dieta rica en ácido oleico (86). En un metaanálisis (186) y en una revisión más reciente (187), la dieta más rica en ácidos grasos monoinsaturados y más pobre en carbohidratos demuestra reducir la glucemia basal y la posprandial y, en esencia, mejorar el control metabólico de los pacientes diabéticos, consiguiendo también una excelente palatabilidad que, como demuestra un estudio realizado en nuestro medio (188), incrementa el grado de satisfacción del paciente y de cumplimiento de la dieta. En cambio, las dietas ricas en hidratos de carbono y pobres en grasa son menos palatables y peor aceptadas, y pueden comportar un mayor consumo de sal para hacer la dieta más agradable. 2,5 2 1,5 1 0,5 0 <110 110-125 126-140 >140 Glucosa en ayunas (mg/dl) FIGURA 17. Estudio DECODE: glucemia posprandial y riesgo de mortalidad cardiovascular (60) 58 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA 3 También en diabéticos tipo 1 se encuentran efectos favorables sobre el perfil lipídico cuando se comparan una dieta rica en ácidos grasos monoinsaturados (contenido graso total entre un 37% y un 40% del valor calórico; de 17% a 20% de ácidos grasos monoinsaturados) y pobre en hidratos de carbono (entre un 43% y un 46% del total de las calorías) con otra dieta rica en hidratos de carbono (contenido entre un 54% y un 57%) y pobre en grasa (entre un 27% y un 30% de grasa total; de 10% a 13% de grasa monoinsaturada) (189). No obstante, no hay que olvidar que alrededor del 80% de los diabéticos tipo 2 son obesos, y la obesidad se considera per se un factor de riesgo cardiovascular (190), especialmente si se asocia a una distribución de la grasa corporal de tipo central o abdominal y a resistencia a la insulina. Por tanto, en diabéticos obesos lo más importante es el empleo de una dieta hipocalórica (191) que, al reducir el peso, mejore el control metabólico; un descenso moderado del aporte calórico (500-1000 kcal/día) se traducirá en una lenta pero progresiva pérdida de peso (0,5-1 kg/semana) (192). En el mismo sentido del beneficio de las dietas ricas en ácidos grasos monoinsaturados, el estudio de McManus y cols. (193), llevado a cabo en pacientes obesos, demuestra que una dieta hipocalórica con un contenido alto en grasa (35% de la energía) a base de ácidos grasos monoinsaturados presenta un mayor cumplimiento y es más eficaz para perder peso que una dieta de contenido calórico similar pero baja en grasa (20% de la energía). Esto se debe a la mayor palatabilidad de la dieta alta en grasa que, en el estudio, contenía porciones diarias de alimentos que no se consideran tradicionalmente aptos para dietas adelgazantes, como aceite de oliva, cacahuetes y frutos secos. Otros estudios han evidenciado también los beneficios de los cambios de estilo de vida (194-196), de forma que los cambios conductuales han conseguido prevenir la aparición de diabetes incluso con resultados superiores a los observados con fármacos que también la previenen (196-200) (Tabla 25). Así, para la prevención de la diabetes se recomienda: combatir la obesidad abdominal; que el peso y la actividad física regular se mantengan a lo largo de la edad adulta (un índice de masa corporal en el rango de 21 a 23 kg/m2 va ligado a un riesgo menor de que se desarrolle diabetes); y que el consumo de grasa saturada sea inferior al 7% del valor calórico total (201). Un estudio, que incluyó a 7.720 hombres y 10.371 mujeres, evaluó y comparó la asociación entre el riesgo de que se desarrollara diabetes tipo 2 y los cambios de peso durante dos períodos diferentes de la vida adulta. Se encontró que el riesgo relativo estimado de que se desarrollara diabetes, para el mismo aumento de peso, era ligeramente más alto en el grupo etario de entre 25 y 40 años que en el de 40 a 55 años de edad, tanto en hombres como en mujeres (202). En un importante estudio, que llevó a cabo un seguimiento de más de tres años de 522 individuos con una tolerancia alterada a la glucosa, los cambios en el estilo de vida (disminución de peso, reducción del consumo de grasas saturadas y aumento del de fibra y de la activi59 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 25. Estudios de prevención del desarrollo de diabetes mellitus. Reducción del riesgo de desarrollo de diabetes Estudio Intervención Da Quing Study (194) Cambios estilo de vida 31%-40% Finnish Diabetes Prevention Study (195) Cambios estilo de vida 58% Cambios estilo de vida 58% Metformina 31% TRIPOD (197) Troglitazona 55% STOP-NIDDM Trial (198) Acarbosa 25%-36% XENDOS (199) Orlistat 35% DREAM (200) Rosiglitazona 60%* Diabetes Prevention Program (196) *La reducción de riesgo relativo se refiere al objetivo primario conjunto (desarrollo de nuevos casos de diabetes y muerte). dad física) fueron capaces de prevenir el desarrollo de diabetes tipo 2 (195). Durante el ensayo, el riesgo de diabetes se redujo en un 58% en el grupo de intervención, y la incidencia acumulada del paso de intolerancia a la glucosa a diabetes fue del 11% en el grupo de intervención y del 23% en el grupo de control (Tabla 26 y Figura 18). Estos resultados son indicativos de que los cambios dietéticos, junto a la práctica de ejercicio físico, pueden prevenir el desarrollo de diabetes tipo 2 en pacientes con intolerancia a la glucosa. TABLA 26. Éxito en la consecución de los objetivos de la intervención al cabo de un año según el grupo de tratamiento en el estudio Finnish Diabetes Prevention Study* (195). Sujetos (%) Grupo de intervención Grupo de control Valor de p** Reducción peso >5% 43 13 0,001 Ingestión de grasa <30% del aporte de energía 47 26 0,001 Ingestión grasas saturadas <10% del aporte de energía 26 11 0,001 Ingestión de fibra >15 g/1000 cal 25 12 0,001 Ejercicio >4 horas/semana 86 71 0,001 Cambios estilo de vida *La ingestión de nutrientes se calculó a partir de los registros alimentarios de tres días. **Los valores de p se determinaron mediante la prueba de chi-cuadrado para establecer la diferencia entre los grupos. 60 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ESTUDIOS DE INTERVENCIÓN DIETÉTICA. EVIDENCIAS DISPONIBLES EN ATENCIÓN PRIMARIA Grupo de intervención Grupo de control 1 Probabilidad acumulativa de seguir sin diabetes 3 0,9 0,8 0,7 0,6 0,5 0,4 0 1 2 3 4 5 6 Años de estudio FIGURA 18. Proporción de individuos sin diabetes durante el desarrollo del estudio Finnish Diabetes Prevention Study (195) De otro estudio (196) se extraen similares conclusiones: un programa de modificación intensiva de hábitos dirigido a pacientes con intolerancia a la glucosa mostró que era capaz de reducir la incidencia de diabetes tipo 2 en un 58% de los pacientes, comparado con placebo, de forma que previno un caso de diabetes por cada siete personas tratadas durante tres años, mejorando así los resultados del grupo con intervención farmacológica (metformina). Los objetivos para los pacientes asignados al grupo de modificación intensiva del estilo de vida eran conseguir y mantener una reducción del 7% del peso inicial mediante una dieta hipocalórica pobre en grasas y una actividad física moderada (caminar rápido al menos 150 minutos a la semana), con asesoramiento personalizado y sesiones grupales para reforzar los cambios realizados. También se ha evaluado el impacto de las diferentes intervenciones de este estudio sobre la hipertensión, la dislipemia y los episodios cardiovasculares. La hipertensión estaba presente en un 30% de los participantes al inicio del estudio y aumentó en el grupo placebo y en el de metformina, mientras que disminuyó significativamente con la modificación intensiva de estilo de vida. En cuanto al perfil lipídico, la trigliceridemia se redujo con todas las intervenciones, pero la reducción fue significativamente mayor con la intervención intensiva del estilo de vida, que también aumentó de forma considerable las concentraciones plasmáticas de colesterol HDL. Todo ello influyó en que este grupo presentase un menor requerimiento farmacológico para lograr los objetivos establecidos, tanto para el tratamiento de la hipertensión como de la dislipemia. Las conclusiones fueron que los cambios de estilo de vida mejo61 3 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA ran el riesgo cardiovascular comparado tanto con el grupo de placebo como con el grupo de metformina y, aunque no hubo diferencias en los episodios cardiovasculares después de tres años, las modificaciones logradas en los factores de riesgo sugieren que una intervención más prolongada puede reducirlos (203). En el seguimiento de una cohorte poblacional, se ha encontrado que la práctica de actividad física de forma habitual se asocia inversamente con la mortalidad total entre los diabéticos (204). La actividad física se debe distribuir en, al menos, tres días a la semana, y no deben transcurrir más de dos días sin que se realice. El ejercicio físico de tipo aeróbico, de intensidad moderada-intensa, mejora los valores de hemoglobina glucosilada. También se aconseja, si no existe contraindicación, el ejercicio de resistencia en adultos con diabetes tipo 2, ya que éste mejora la sensibilidad a la insulina casi en la misma medida que el ejercicio aeróbico (192). En definitiva, junto a la práctica de ejercicio, la terapia nutricional es importante para lograr los objetivos de control en los diabéticos; en aquellos que requieren insulinoterapia, la prioridad es integrar el régimen insulínico en el estilo de vida del paciente, teniendo presente los aportes hidrocarbonatos de su dieta; para los diabéticos tipo 2, los cambios conductuales son prioritarios, y la asunción de modificaciones en la dieta, no temporales sino definitivas, son la base sobre la que se sustenta su tratamiento, y de esta forma se reduce el coste del tratamiento farmacológico (205) y el número de individuos que lo requieren (203). Para ello, precisan recibir un asesoramiento nutricional y una educación continuada, que sea fácilmente entendible, que pueda aplicarse en su vida cotidiana y que se apoye en las evidencias científicas existentes (206). 62 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 3 4. COLESTEROL ALIMENTARIO El colesterol es un elemento esencial en la biología animal, ya que es un componente estructural de las membranas celulares y, por otra parte, está implicado en la síntesis de hormonas, de vitamina D y de ácidos biliares. Su estructura química se muestra en la Figura 4. El colesterol se transporta por el torrente sanguíneo en las lipoproteínas (mayoritariamente en las LDL) para llegar a los tejidos que lo necesitan. El colesterol es un componente de los alimentos (Tabla 27) pero también es sintetizado por el hígado (Figura 19). De hecho, la mayor parte del colesterol de nuestro organismo procede de la síntesis hepática. El colesterol de la dieta aumenta la concentración plasmática de colesterol LDL y causa aterosclerosis en numerosos modelos animales y en el ser humano (208). En estudios metabólicos controlados en humanos, el colesterol de la dieta aumenta las concentraciones Acetil-CoA + Acetoacetil CoA HMG-CoA sintasa HMG = Hidroxilmetilglutaril CoA = Coenzima A HMG-CoA HMG-CoA reductasa Mevalonato Colesterol FIGURA 19. Síntesis del colesterol en el hígado humano 63 4 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 27. Contenido de colesterol de algunos alimentos (mg/100 gramos) (72, 207). Colesterol (mg/100 g) Alimentos Colesterol (mg/100 g) Sesos 2000 Berberechos 41 Yema de huevo 1100 Mejillones 74 Huevo entero 400 Ostras 53 Foie-gras 380 Lubina 76 96-134 Rape crudo 17 Hígado de ave 500 Atún crudo 28 Hígado de ternera 335 Pollo sin piel 75 Riñones de ternera 375 Pavo 78 Riñones de cerdo 410 Conejo 58 Sebo 95 Ternera (redondo) 70 Mantequilla 250 Lomo de cerdo 64 Bollería industrial (magdalenas) 101 Morcilla (cerdo) 130 Chorizo 66 Alimentos Patés Merengue 0 Langosta 105 Jamón cocido 47 Langostino 185 Jamón curado con grasa 70 Anguila 150 Queso fresco 0 Calamar 187 Queso gruyère 120 Sepia 151 Leche entera 14 Pulpo 88 de colesterol total y de colesterol LDL en sangre (209, 210), pero estos efectos son relativamente pequeños, especialmente si los comparamos con los producidos por los ácidos grasos saturados y los ácidos grasos trans (211, 212). A pesar de los modestos cambios medios del colesterol plasmático producidos por el colesterol dietético, hay una amplia variabilidad en esta respuesta (213-218); mientras que algunos individuos son grandes respondedores a modificaciones en el colesterol de la dieta, otros son no respondedores. Las razones de esta variabilidad interindividual son varias (215, 219). En primer lugar, la eficacia de la absorción intestinal de colesterol muestra una amplia variación en humanos (220). Además, la capacidad de absorción intestinal del colesterol está limitada en el global de individuos a un 55%-60% de lo ingerido, aunque también con diferencias interindividuales (221). Por otro lado, parece 64 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE COLESTEROL ALIMENTARIO EN ATENCIÓN PRIMARIA 4 Cambio en colesterolemia (mg/dl) existir un dintel, cifrado en torno a los 500 mg/día de colesterol, a partir del cual el exceso ingerido no se acompaña de una mayor absorción (222) (Figura 20), de forma que se degrada a coprostanol por la flora bacteriana colónica y se excreta por las heces (223). Por tanto, a partir de esa cantidad basal de ingestión diaria, los incrementos en el colesterol de la dieta no se acompañarán de un aumento de la colesterolemia. Por otra parte, los estudios prospectivos que han evaluado la relación del colesterol de la dieta con el riesgo de enfermedad coronaria no han sido consecuentes con una asociación significativa encontrada en algunos pero no en todos los estudios (207, 219). Como curiosidad, basta recordar el caso del anciano de 88 años que consumía la nada despreciable cantidad de 25 huevos diarios. Este caso fue objeto de un estudio metabólico detallado, y se publicaron sus resultados (224). Se encontró que su concentración sérica de colesterol era normal porque compensaba el exceso del aporte con la dieta mediante una pobre absorción intestinal del colesterol de origen alimentario y un aumento de la síntesis hepática de ácidos biliares a partir del colesterol. En la absorción intestinal del colesterol pueden influir factores genéticos, relacionados con la eficiencia de la absorción (225, 226) o con la respuesta compensatoria hepática (reducción de la síntesis de colesterol y aumento de la síntesis de ácidos biliares), que hacen que entre un 15% y un 20% de la población responda con incrementos importantes del colesterol sérico ante un aumento del consumo de colesterol en la dieta (207, 215, 227, 228). También hay factores fisiológicos que influyen sobre la absorción del colesterol, como la velocidad del tránsito intestinal, la capacidad detersoria de los ácidos biliares o la obesidad (la obesidad aumenta la cantidad de colesterol excretado en la bilis) (207, 228). 60 50 techo 40 30 20 10 umbral 0 0 70 100 350 370 500 600 700 800 Colesterol alimentario (mg/día) FIGURA 20. Efectos del colesterol alimentario sobre la colesterolemia en humanos (222) 65 4 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Asimismo, las características de la dieta (independientemente del contenido absoluto de colesterol en el alimento) van a influir en la absorción intestinal de colesterol (207, 228) (Figura 21). Así, su ingestión con una comida rica en grasa aumenta la solubilidad del colesterol en las micelas de los ácidos biliares, con lo que se favorecerá su absorción (229). Hay componentes en los alimentos, como los fitoesteroles en los aceites vegetales no refinados, en las semillas y en las legumbres (230) y los esteroles marinos en el marisco (231), que compiten con el colesterol en su absorción intestinal, disminuyéndola. Por ello, no parece razonable limitar el consumo de marisco de forma indiscriminada dado que, a pesar de su riqueza en colesterol, de su ingestión no se derivan cambios en la colesterolemia. Además, es un alimento rico en proteínas y pobre en grasa saturada, y su consumo es sólo ocasional en la mayoría de la población. Cabe destacar la conclusión de Ros en un artículo que trata el papel del colesterol de la dieta sobre la colesterolemia y el riesgo cardiovascular (207): ”En definitiva, sean cuales sean las cifras de colesterol de nuestros pacientes, no parece haber ninguna evidencia para prohibirles comer tortilla de camarones”. Las legumbres, los cereales integrales, las frutas y las verduras constituyen la principal fuente de fibra dietética, que también interfiere en la solubilización de colesterol en el aparato digestivo, de tal forma que también se reduce de modo marginal su absorción y sus concentraciones séricas (207, 228). En el caso de las legumbres (garbanzos, lentejas, judías secas, etc.), hay que añadir a este efecto el derivado de los esteroles que contienen. El colesterol se encuentra únicamente en alimentos de origen animal, como carnes, vísceras, embutidos, lácteos enteros (leche, queso, mantequilla), huevos, pescado y marisco (Tabla 27). Puesto que muchos de estos alimentos también contienen grasas saturadas en su com- Alto contenido de grasa Mayor eficiencia de la solubilización micelar y de la absorción final Mayor absorción Esteroles vegetales (fitoesteroles) Competencia con la solubilización micelar y/o la absorción intestinal Menor absorción Esteroles marinos Competencia con la solubilización micelar y/o la absorción intestinal Menor absorción Fibra soluble Menor solubilización micelar Menor absorción FIGURA 21. Factores dietéticos que influyen en la absorción intestinal de colesterol (207, 228) 66 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE COLESTEROL ALIMENTARIO EN ATENCIÓN PRIMARIA 4 posición (véase el Capítulo 2.2), no es aconsejable consumirlos en exceso. Por otro lado, es importante destacar que la indicación que hallamos con frecuencia en productos elaborados de “no contiene colesterol” tampoco presupone que sean saludables, pues pueden contener grasas saturadas. Carnes y aves. Las carnes blancas, como las de las aves de corral (pollo, pato, pavo), conejo y aves de caza como la perdiz, el pichón y la codorniz, tienen poco colesterol. Las carnes rojas, como la de la ternera, el buey, el caballo, el toro o el cerdo, tienen un mayor contenido en colesterol, y su aporte más reducido está en los cortes magros. Las carnes de caza mayor, como el jabalí y el ciervo, también tienen una cantidad moderada de colesterol. Los embutidos derivados del cerdo y, especialmente, las vísceras y los patés, son muy ricos en colesterol. El embutido de pavo y el jamón de York bajo en grasa tienen poco colesterol, al igual que el jamón serrano. Pescado. La composición de la grasa en la carne de pescado varía cuantitativa y cualitativamente. El contenido de grasas oscila entre el 1% y el 25% y, de ellas, el colesterol representa un porcentaje mínimo. Marisco. Contiene cantidades no despreciables de colesterol (Tabla 28). Sin embargo, la absorción intestinal del colesterol que tienen es prácticamente nula por la interferencia TABLA 28. Composición en nutrientes del marisco (72). Marisco Energía Agua (kcal/100 g) (g/100 g) Proteínas (g/100 g) Glúcidos (g/100 g) Grasas Colesterol (g/100 g) (mg/100 g) Langosta hervida 119 72,4 22,1 0 3,4 150 Camarones hervidos 107 70 22,6 0 1,8 81 Gambas quisquilla congeladas 74 81,2 16,5 Trazas 0,9 130 Bogavante hervido 103 74,3 22,1 Trazas 1,6 110 Cangrejo en conserva 97 76,9 19,7 1,0 1,6 100 Mejillones hervidos 111 72,9 18,4 3,2 2,7 54 Vieira cruda 78 80,5 12,5 2,8 1,9 79 Ostras crudas 64 84,1 8,1 2,8 2,2 53,5 Berberecho enlatado al natural 73 82,7 17,4 0 0,4 1 Calamar congelado 66 84,2 13,1 0 1,5 250 Calamar frito 172 64,2 22,0 4,0 7,5 220 Pulpo crudo 70 83,2 15,4 Trazas 0,9 88 67 4 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA de otros componentes naturales del propio marisco (esteroles marinos), razón por la que se puede consumir sin grandes limitaciones. Además, el marisco tiene, en general, un muy bajo contenido en grasas saturadas. Huevos. Son la principal fuente de colesterol alimentario. Su contenido en la yema es elevado (Tabla 27). No obstante, los estudios clínicos realizados en personas sometidas a un exceso de colesterol ingerido añadiendo huevos a su dieta revelan sólo cambios modestos en la colesterolemia (232). Sin embargo, existen individuos “hiperrespondedores” a las variaciones de la cantidad de huevos incorporados en su alimentación (216, 233). El papel de los huevos en el riesgo cardiovascular se comenta en el Capítulo 5.11. Actualmente se mantienen las recomendaciones en cuanto a limitar el colesterol ingerido a 300 mg/día aunque, por lo que respecta al marisco y a los huevos, quizá podamos ser menos exigentes y en cambio sí lo tengamos que ser con el resto de alimentos ricos en colesterol y grasa saturada (Tabla 27). Los alimentos vegetales (frutas, verduras, hortalizas y legumbres) no contienen colesterol. En cambio, contienen cantidades apreciables de esteroles vegetales (o fitoesteroles), que compiten con la absorción del colesterol en el intestino y ayudan a reducir sus cifras en sangre (véase Capítulo 6). Podemos indicar las siguientes medidas dietéticas para reducir el colesterol que se absorbe de la dieta: ● Consumir productos que contienen abundante fibra soluble, tanto en forma de alimentos naturales (gachas de avena, manzanas) como de derivados (cutícula de semillas de Plantago ovata o psyllium). ● Consumir productos enriquecidos con esteroles vegetales. ● Sustituir las carnes, especialmente las rojas, por pescado. 68 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 4 5. INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR 5.1. CARNE Las carnes son alimentos ricos en proteínas de alto valor biológico que deben formar parte de una dieta sana y equilibrada. Pero no todas las carnes presentan la misma composición grasa: la carne de pollo, sin la piel, presenta un 13%-15% de contenido graso del peso fresco, mientras que la de cerdo y la de ternera contienen un 22%-26% (234). Su calidad, en el mismo tipo de carne, está influida por factores genéticos, nutricionales y de procesado (235). Así, en el cerdo, en los últimos años, y mediante técnicas modernas de selección genética, se ha conseguido una reducción del contenido graso de su carne. También en función del tipo de músculo, según si es de tipo oxidativo o glucolítico, hará que la carne presente una mayor o menor insaturación, respectivamente. La alimentación, e incluso la actividad física que haya seguido el animal, son factores determinantes en la composición grasa de su carne. Así pues, va a ser más insaturada la grasa del cerdo que pace libremente por la dehesa comiendo bellotas que la del cerdo que come pienso en un corral de reducido espacio (236). Se han realizado estudios al respecto que evidencian que si se suplementa la alimentación de los cerdos con una grasa rica en ácidos grasos monoinsaturados, como el aceite de oliva, se consigue una menor proporción de ácidos grasos saturados en sus tejidos grasos, tanto frente al animal con una alimentación convencional como a una más rica en ácidos grasos poliinsaturados aportados por un suplemento de aceite de soja (237). Se consiguen resultados similares mediante un suplemento de aceite de colza (rico en ácidos grasos monoinsaturados), que le confiere, con relación a la carne de otros cerdos, un perfil de mayor cardiosaludabilidad y un potencial reductor de la colesterolemia (238), como también evidencia otro estudio en el que, frente al consumo de carne de cerdo convencional, otra con alto contenido en ácidos grasos poliinsaturados y más baja en grasa saturada es capaz de reducir el colesterol LDL plasmático (239). 69 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Las consecuencias cualitativas y cuantitativas de modificar la composición de los alimentos de los animales sobre la composición de su carne son más señalados en animales con estómago único y en aves que en rumiantes, ya que la acción microbiana en el rumen convierte los ácidos grasos insaturados de la dieta en saturados. Un análisis de los resultados publicados demuestra que, si se enriquece la dieta de los animales con alimentos ricos en ácido alfa linolénico (extractos de linaza o semillas de colza), se multiplica el contenido de este ácido graso poliinsaturado n-3 en los productos cárnicos derivados: en el caso del pollo por diez veces, por seis veces en el caso del cerdo y menos de dos veces en el caso de la ternera (240). Asimismo, alimentando a los animales con extractos de algas ricos en ácido docosahexaenoico, un n-3 de cadena larga, se incrementa el contenido en su carne: siete veces en el caso del pollo y menos de dos veces en el caso de la ternera (241). También en el cordero los cambios de la composición de su carne con modificaciones de su alimentación son ligeros con relación a otros no rumiantes (242). Así pues, conseguir incrementar el contenido de ácidos grasos insaturados y reducir el contenido de grasa saturada es un objetivo importante en términos de mejora del valor nutricional de las carnes para el consumidor. Con el objeto de dotar a la carne de un perfil más cardiosaludable, se han utilizado como suplementos de la dieta de los rumiantes protectores lipídicos (ricos en ácidos grasos poliinsaturados), que confieren un alto grado de protección de la acción hidrogenante de los microorganismos del rumen; de esta manera se provee a la carne de ternera de un menor contenido de grasa total, con una menor proporción de grasa saturada y una mayor de poliinsaturada (243). Las carnes rojas aportan, además de proteínas, una cantidad nada desdeñable de calorías y de ácidos grasos saturados, por lo que debemos ser prudentes en su consumo. Un estudio demuestra que una alimentación con un consumo elevado de carnes rojas y/o procesadas incrementa el riesgo de ictus, mientras que una dieta rica en frutas y verduras ejerce un papel protector (244). También se ha probado que el riesgo de hipertensión arterial está positivamente asociado con el consumo de carne roja (163). Conviene destacar que existen dos tipos de grasa en la carne: por una parte, la grasa infiltrada en el músculo, que denominamos intramuscular y que es inseparable de éste, y forma parte, por tanto, de la carne magra; por otra parte, tenemos la grasa externa o intermuscular, que es fácilmente separable y que debemos retirar antes de cocinar. Consideración especial merece la carne magra de cerdo (245), en cuya composición aparece un elevado porcentaje de ácidos grasos monoinsaturados (ácido oleico) (Tabla 9). Tiene una relevancia mayor aún su presencia en la carne del cerdo ibérico alimentado con bellota (eufemísticamente, se ha llegado a decir que este cerdo es “un olivo con patas”), tanto en relación con la misma raza alimentada con pienso como a la raza de cerdo blanco (en cuya carne aparece la menor proporción de ácido oleico) (236) (Tabla 29). Esto parece avalar que no tan sólo la genética, sino también el tipo de alimentación de los cerdos, influyen en las variaciones 70 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA TABLA 29. Composición de la grasa subcutánea del jamón de distintas razas de cerdo alimentados con diferentes dietas (236). Ácidos grasos (g/100 g) Cerdo ibérico/bellota (g/100 g) Cerdo ibérico/pienso (g/100 g) Cerdo blanco/pienso (g/100 g) Mirístico (14:0) 1,7 1,8 1,3 Palmítico (16:0) 22 26 27,5 Esteárico (18:0) 8,8 10,2 10,3 Oleico (18:1) 55,5 51 44,2 Linoleico (18:2) 6,1 6,8 13,5 de la composición de la grasa de su carne. Así, la carne magra de cerdo tiene un mayor contenido de ácido oleico que carnes como las de cordero y ternera (245), y el jamón ibérico de bellota es una fuente de ácidos grasos monoinsaturados superior a la de otros jamones (246). En un estudio realizado en España en ancianos (247), en el que se sustituyó una dosis de 120 g de carne de su dieta por la misma cantidad de jamón de cerdo ibérico alimentado con bellota, se consiguió un efecto antioxidante y una reducción de la peroxidación lipídica, de forma que se logró una mejora en la aterogenicidad. Por otra parte, los embutidos derivados del cerdo (chorizos, longanizas, morcillas, salchichón, etc.), por su elevado aporte graso y calórico, no pueden recomendarse nunca, y su consumo debe ser excepcional (96). Una dieta con un consumo elevado de carne procesada puede incrementar el riesgo de aparición de una diabetes tipo 2 (248-250). Por tanto, al margen de los embutidos, si bien es verdad que el cerdo no es la mejor fuente proteica de la dieta ni la mejor carne, su consumo sí puede formar parte, si se consume con moderación, de una dieta sana y equilibrada (251). Las carnes con un menor aporte graso y, por tanto, más recomendables son las de pollo, pavo y conejo (5, 96). 5.2. PESCADO La relación inversa entre el consumo de pescado y los episodios cardiovasculares (252) queda manifiesta en poblaciones como la de los esquimales de Groenlandia (253), los japoneses (254) o los individuos cuyo perfil plasmático de ácidos grasos se caracteriza por una alta proporción de ácidos grasos n-3 de origen marino (ácidos eicosapentaenoico y docosahexaenoico) (103). Estas poblaciones presentan una baja incidencia de cardiopatía isquémica asociada a un consumo elevado de pescado. El pescado les aporta una cantidad importante de ácidos grasos poliinsaturados n-3, cuyos beneficios sobre el perfil lipídico y la protección cardiovascu71 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA lar ya han sido comentados en el Capítulo 2.2. El pescado azul (sardina, salmón, atún, caballa, jurel, etc.) es el más rico en este tipo de ácidos grasos (255). La alimentación en las piscifactorías puede influir en la riqueza de ácidos grasos n-3 de la carne del pescado. Así, en el salmón atlántico, un suplemento con aceites derivados de pescado consigue unos filetes de mayor contenido en n-3 cuando se compara con los de salmones que han sido alimentados con otros aceites vegetales (256). Otro aspecto que se debe considerar es la presencia, en algunos peces, de contaminantes mercuriales, presentes en mares y océanos, que se incorporan a la cadena alimentaria marina de tal forma que su concentración es más elevada en los peces de mayor tamaño y en predadores; incluso se ha especulado que este hecho puede disminuir los beneficios sobre la salud cardiovascular conferidos por los ácidos grasos poliinsaturados n-3 que contienen (257). Un estudio demuestra una relación directa entre el riesgo de infarto agudo de miocardio y las concentraciones elevadas de mercurio en uñas, e inversa con la concentración en tejido adiposo del ácido docosahexaenoico (258). Estos derivados mercuriales pueden afectar el desarrollo fetal, por lo que se recomienda a las mujeres embarazadas que eliminen de sus dietas, entre otros, el pez espada y el tiburón, y que limiten el consumo de otros pescados a tres o cuatro raciones semanales para minimizar la exposición a este contaminante; ello no es extensible al resto de la población, ya que el efecto de una restricción de su consumo, desde una perspectiva de salud pública sería negativo (259). En un estudio prospectivo, el Chicago Western Electric Study, se estudió el efecto del consumo de pescado en 1.822 varones norteamericanos entre 40 y 55 años de edad, sin enfermedad cardiovascular al inicio del estudio. El estudio mostró una relación inversa entre el consumo de pescado y la mortalidad coronaria (260): su ingestión una o dos veces por semana redujo en alrededor de un tercio el riesgo de muerte por cardiopatía isquémica. Un metaanálisis de 13 cohortes en las que se incluyó a más de 220.000 individuos evidenció también la relación inversa entre el consumo de pescado y la cardiopatía isquémica (261). En otro gran estudio prospectivo, llevado a cabo en varones sanos a los que se hizo un seguimiento durante once años, el Physicians’ Health Study (262), un consumo de pescado similar se asoció a una reducción del 50% de muerte súbita. Otros datos recientes confirman los beneficios del consumo de pescado sobre la salud cardiovascular. Así, en un estudio de una cohorte japonesa, un consumo de pescado de ocho veces a la semana (una media de 180 g al día), frente al de una sola vez a la semana (23 g al día de media), se asoció a una reducción del riesgo coronario (263). El mismo efecto se observó en una población mediterránea, en la que el consumo de pescado se relacionó de forma independiente con una disminución del riesgo de aparición de un síndrome coronario agudo (264). Asimismo, en un análisis cuantitativo, el consumo de pequeñas cantidades de pescado se asoció a un 17% de reducción del riesgo de mortalidad por causa coronaria, con una disminución adicional de un 3,9% por cada ración de pescado añadida semanalmente (265). Un metaanálisis de estudios de cohortes, que incluye72 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 ron a un total de 222.136 individuos, a los que se hizo un seguimiento medio de 11,8 años, corroboró la importancia del consumo de pescado como herramienta para la prevención de la cardiopatía isquémica (261). El consumo de pescado una vez a la semana, frente al de menos de una vez al mes, está asociado con un riesgo de mortalidad por causa coronaria un 15% menor (intervalo de confianza del 95%: 4%-24%) (261) (Figuras 22 y 23). Por lo que respecta a la relación entre el riesgo de ictus y el consumo de pescado, en el Nurses’ Health Study (266) se observó una relación inversa entre el consumo de pescado y el riesgo de ictus isquémico, conclusión a la que se llega también en un análisis cuantitativo de un estudio reciente (267). Los beneficios son extensibles a las poblaciones de más de 65 años sin antecedentes de enfermedad vascular cerebral: en un seguimiento durante doce años se demostró que el consumo de pescado estaba inversamente relacionado con el ictus total y con el isquémico, y no afectó al ictus hemorrágico. Se encontró una reducción del 27% de la incidencia de ictus isquémico en aquellas personas que habían consumido pescado entre una y cuatro veces por semana, y una reducción del 30% en los consumidores de cinco o más veces por semana, comparado con los que habían tomado pescado menos de una vez a la semana. En cambio, el consumo de derivados comerciales de pescado se asoció a un aumento del riesgo de ictus (268). Estudio RR (IC95%) Kromhout (1985) Fraser (1992) Ascherio (1995) Daviglus (1995) Mann (1997) Albert (1998) Oomen_Finland (2000) Oomen_Italy (2000) Oomen_Netherland (2000) Yuan (2001) Hu (2002) Mozaffarian (2003) Osler (2003) 0,56 (0,27-1,16) 0,74 (0,42-1,32) 0,86 (0,50-1,47) 0,84 (0,61-1,16) 1,23 (0,70-2,17) 0,82 (0,45-1,50) 0,97 (0,68-1,38) 0,93 (0,53-1,63) 1,10 (0,68-1,78) 0,68 (0,49-0,94) 0,65 (0,46-0,91) 1,07 (0,72-1,60) 0,92 (0,66-1,29) RR común 0,85 (0,76-0,96) 0,25 0,50 1,0 1,5 2,0 2,5 Riesgo relativo FIGURA 22. Relación entre consumo de pescado y cardiopatía coronaria (261) 73 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Menos de 1/mes 1 1-3/mes 0,87 (0,79-1,01) 1/semana 0,85 (0,76-0,96) 2-4/semana 0,77 (0,66-0,89) Más de 5/semana 0,62 (0,46-0,82) 0,2 0,4 0,6 0,8 1,0 1,2 1,4 FIGURA 23. Consumo de pescado y reducción del riesgo relativo de mortalidad por cardiopatía isquémica (modificado de referencia 261) Otro hallazgo significativo de un estudio transversal (269) es la asociación del consumo de pescado a una frecuencia cardiaca menor ­–un factor protector frente a la muerte súbita de origen cardiaco–, aspecto que también se vio que estaba relacionado con valores inferiores de marcadores inflamatorios (270) y con la mejora de parámetros hemodinámicos cardiacos, a diferencia de lo que sucede con los preparados comerciales de pescado, que pueden contener ácidos grasos trans y de cuyo consumo se derivan anomalías estructurales cardiacas indicativas de disfunción sistólica (271). Un beneficio no desdeñable de comer pescado podría ser que su consumo sustituye al de carne como plato principal en las comidas, como sugieren los hallazgos de un estudio, en el que se observó una mortalidad por enfermedad isquémica un 34% inferior en individuos que consumían pescado frente a los que consumían carne (272). La revisión de Alonso y cols. (107) resume otras evidencias clínicas y epidemiológicas de la relación entre consumo de pescado y riesgo de enfermedad coronaria. Estos datos apoyan las recomendaciones de la American Heart Association (117) de incluir en la alimentación al menos dos raciones semanales de pescado, especialmente azul, lo que sería un componente importante de las modificaciones de estilo de vida para la prevención de las enfermedades cardiovasculares. 5.3. ALCOHOL Desde la observación epidemiológica de la llamada “paradoja francesa” (baja mortalidad coronaria en Francia, a pesar de un consumo relativamente alto de grasa saturada, principalmente derivada de productos lácteos, y unas cifras medias de colesterol en la población similares a 74 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 las observadas en EE.UU.), se conjeturó con la posibilidad de que fuese el consumo regular y moderado de vino tinto, tan característico de esa población, el causante de esta aparente contradicción (273). De los múltiples componentes del vino, el más estudiado ha sido el alcohol (etanol). En los últimos 20 años, numerosos estudios epidemiológicos en distintas poblaciones o en cohortes dentro de una población han revelado una reducción del riesgo coronario en bebedores moderados de alcohol (10-30 g diarios), que se ha atribuido a su efecto inductor de concentraciones de colesterol HDL superiores a las de los abstemios (274). También se ha observado que, a cantidades equivalentes de alcohol, el vino parece tener un mejor efecto protector del desarrollo de enfermedad coronaria que otras bebidas, probablemente por su riqueza en ciertos componentes no alcohólicos derivados de la piel y las semillas de la uva, particularmente abundantes en el vino tinto y mucho menos en el vino blanco o las bebidas destiladas: los flavonoides, como la quercetina, un tipo de polifenoles con propiedades antioxidantes y antitrombóticas (275). Un estudio demostró la mejora que ejercen los polifenoles del vino tinto administrados de forma aislada sobre la microcirculación coronaria (276). Un metaanálisis de Di Castelnuovo y cols. (277) concluye que hay un beneficio significativo en la reducción del riesgo vascular tanto con el vino como con la cerveza. En la cerveza este efecto protector puede no ser debido exclusivamente a su contenido de etanol sino, como en el caso del vino, a la presencia de otros componentes que han demostrado ser capaces de inhibir significativamente la actividad trombogénica, tanto en la cerveza con alcohol como en la sin alcohol (278). A pesar de ello, otros estudios recientes demuestran que los beneficios de las bebidas alcohólicas parecen mediados más por el contenido de alcohol que por el tipo de bebida y su contenido de componentes no alcohólicos (279, 280). Además de su acción sobre el perfil lipídico, también se ha propuesto que los efectos antiinflamatorios del consumo moderado de alcohol podían explicar el bajo riesgo coronario de los bebedores moderados. Se han estudiado los marcadores inflamatorios sistémicos en tres áreas de Europa con relación al consumo de vino, de cerveza y de alcohol total, y se ha sugerido que la causa de los efectos antiinflamatorios de estas bebidas es el etanol (281). Un metaanálisis realizado por la Escuela de Salud Pública de Harvard (282) llega a la conclusión de que no se puede establecer que un tipo de bebida alcohólica sea mejor que otra, pero sí parece haber acuerdo absoluto, avalado por más de 35 estudios prospectivos de 20 países (283), en que el consumo moderado de bebidas con alcohol va ligado a una disminución del riesgo cardiovascular, si lo comparamos tanto con abstemios como con bebedores de grandes cantidades de bebidas alcohólicas. Otro estudio, llevado a cabo en una población de edad superior a 65 años, evidenció que los bebedores, en comparación con los abstemios, presentaban un menor riesgo coronario, con unos beneficios similares con vino, cerveza y licores (284). 75 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Por otra parte, también se ha examinado la relación entre el consumo total de alcohol, el tipo específico de bebida consumida y la prevalencia de síndrome metabólico; se ha encontrado que el consumo moderado de alcohol está asociado a una prevalencia baja, independientemente del tipo de bebida que se consuma (285). Se ha investigado la relación entre el consumo de alcohol y la diabetes tipo 2 en el estudio EPIC, llevado a cabo en una cohorte de mujeres a las que se hizo un seguimiento durante seis años, y se encontró que había una reducción del riesgo con un moderado consumo de alcohol (286). Un metaanálisis que evaluó las pruebas aportadas por estudios observacionales encontró un 30% de reducción de riesgo de diabetes tipo 2 en bebedores moderados frente a abstemios, reducción que se pierde con consumos más elevados (48 g/día) (287). Aunque existen pocas dudas sobre el efecto cardiosaludable de la ingestión regular pero moderada de vino u otras bebidas alcohólicas, está bien establecido que existe una relación en forma de U entre su consumo y la mortalidad por diversas causas, de forma que es difícil establecer la dosis de vino con una mejor relación riesgo/beneficio (288). Hay pruebas de que el consumo de bebidas alcohólicas resulta beneficioso para la salud, ya que muestra una reducción sobre la mortalidad total, a expensas de la reducción del riesgo de cardiopatía isquémica (en torno al 40%) y de accidentes vasculares cerebrales (en torno al 40%-50%) (289-292) en bebedores de cantidades moderadas (de 3 a 30 g/día de etanol en mujeres y de 12 a 60 g/día de etanol en hombres), equivalentes al consumo de dos copas de vino de 12º en hombres y de una de vino de 12º en mujeres (Tabla 30). En cambio, los abstemios tendrían una mayor mortalidad (294), superada con creces por la de los bebedores de mayores cantidades de bebidas alcohólicas (295). En la Tabla 31 se muestran los resultados de estudios prospectivos que relacionan el consumo de alcohol con la reducción de riesgo cardiovascular. TABLA 30. Cantidad de diferentes bebidas alcohólicas que suministran 20 g y 30 g de alcohol (modificado de la referencia 293). Bebida alcohólica 20 g 30 g 500 ml 750 ml Sidra 568,2 ml 852,3 ml Cava 217,4 ml 326,1 ml Vino tinto 201,6 ml 302,4 ml Vino fino 149,7 ml 224,5 ml Licores 108,7 ml 163,1 ml 62,5-66,6 ml 93,7-100 ml 58,1 ml 87,2 ml Cerveza Whisky, coñac, ginebra Anises 76 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA Por tanto, no es apropiado aconsejar a los abstemios que beban vino, pero no hay ningún motivo para prohibírselo a los adultos con buena salud que suelan consumirlo ya con moderación, con la salvedad de las personas con obesidad o sobrepeso, pues todas las bebidas alcohólicas tienen una alta densidad energética (303) (Tabla 32). Además, como otras fuentes TABLA 31. Resultados de estudios prospectivos de consumo de alcohol y enfermedad cardiovascular. Asociación del consumo moderado (comparado con abstemios) Estudio Población Duración Health Professionals Follow-up Study (296) 38.077 profesionales sanitarios varones Edades: 40-75 años 12 años Eastern France Cohort (297) 34.014 hombres y mujeres 10-15 años 25%-30% reducción de riesgo de muerte de causa cardiovascular Kaiser Permanente Cohort (298) 123.840 hombres y mujeres Edades: >30 años 10 años 40% reducción en infarto de miocardio fatal; 20% reducción en mortalidad de causa cardiovascular American Cancer Society Cohort (299) 489.626 hombres y mujeres Edades: 30-104 años 9 años 30%-40% reducción de riesgo de muerte de causa cardiovascular Physicians’ Health Study (300, 301) 22.071 médicos varones. Edades: 40-84 años 11 años 30%-35% reducción de riesgo de angina e infarto de miocardio; 20%-30% reducción de riesgo de muerte cardiovascular Nurses’ Health Study (289, 302) 85.709 enfermeras. Edades: 34-59 años 12 años 17% reducción de riesgo de mortalidad total; 40% reducción de riesgo coronario; 70% reducción de riesgo de ictus isquémico 35% reducción de riesgo de infarto de miocardio TABLA 32. Perfil más aconsejable de consumo de bebidas alcohólicas (303). CONSUMO DIARIO EN PEQUEÑAS O MODERADAS CANTIDADES, nunca su consumo compulsivo ocasional (fines de semana), que va ligado a un aumento de accidentes y a una mayor incidencia de pancreatitis. CONSUMO ACOMPAÑADO DE ALIMENTO, mejor durante las comidas, con tiempo para beber espaciadamente, frente a la consumición rápida, en ayunas, itinerante. PERSONAS ADULTAS (HOMBRES A PARTIR DE LOS 40 AÑOS, MUJERES A PARTIR DE LOS 50 AÑOS) SIN TRASTORNOS FÍSICOS NI PSÍQUICOS que empeoren con el alcohol. En personas jóvenes, el riesgo cardiovascular es muy bajo y el consumo etílico aumenta la mortalidad total, pues la posible protección cardiovascular se ve superada por el incremento del riesgo de accidentes. 77 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA de carbohidratos, el alcohol puede incrementar los triglicéridos séricos; este efecto puede ser importante en pacientes con hipertrigliceridemia, por lo que las bebidas alcohólicas están contraindicadas en esa circunstancia (288). 5.4. CAFÉ El café sin filtrar contiene diterpenos tipo cafestol y kahweol, que pueden elevar el colesterol total y el colesterol LDL. El café que se consume habitualmente en España es filtrado, tipo expreso o instantáneo, que, al no aportar diterpenos, no influye en la concentración sérica de colesterol (304). Una publicación de una cohorte de población holandesa de más de 17.000 personas sin diabetes al inicio del estudio, relacionó el consumo de café con el riesgo de que apareciera una diabetes durante el seguimiento. El riesgo ajustado de diabetes de los individuos que bebían siete o más tazas de café al día fue un 50% menor que el de los que consumían dos o menos tazas al día (305). Así pues, el café tiene un efecto protector a pesar de que la cafeína reduce la sensibilidad a la insulina (306). Se especula que este efecto beneficioso puede deberse a los compuestos fenólicos que contiene, especialmente el ácido clorogénico, que antagoniza con el transportador de glucosa, disminuyendo su absorción intestinal (307) y modulando así la hiperglucemia posprandial. Además, contribuye a preservar la función de la célula beta pancreática al incrementar la incretina, una hormona glucagon-like peptide-1 (GLP-1) (308). También, en un estudio en pacientes hipertensos, una dosis diaria de 140 mg de ácido clorogénico del café se ha demostrado, frente a placebo, ser capaz de disminuir significativamente la presión arterial (309). Hay datos que sugieren que el café podría tener una reducción potencial de la insulinosecreción en las mujeres, de forma que el consumo de café, tanto del descafeinado como del café con cafeína, estaría inversamente asociada a la concentración de péptido C (marcador de insulinosecreción); de manera que esta relación parece deberse a otros componentes del café diferentes de la cafeína (310). Hay otros datos epidemiológicos que indican que el consumo habitual de café puede reducir el riesgo de diabetes tipo 2. En un estudio prospectivo llevado a cabo en más de 125.000 individuos se pone de manifiesto esta relación, tanto en hombres como en mujeres (311). Van Dam y cols. (312) analizan en un estudio reciente de una cohorte de mujeres estadounidenses de entre 26 y 46 años de edad, la relación entre el consumo de café y el riesgo de diabetes tipo 2, y encuentran propiedades protectoras similares en el café con cafeína y en el descafeinado, y en el café filtrado y en el instantáneo. Estos resultados sugieren que la ingestión tanto de café con cafeína como de café descafeinado se asocia a un menor riesgo de diabetes tipo 2, avalando la hipótesis de que otros constituyentes del café diferentes de la cafeína pueden afectar 78 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA el desarrollo de diabetes tipo 2 (312) (Figuras 24 y 25). Otro análisis prospectivo reciente, que hizo un seguimiento durante once años de una cohorte de mujeres del Iowa Women’s Health Study (313), y que incluyó a 28.812 mujeres posmenopáusicas sin diabetes ni enfermedad cardiovascular, confirman la misma conclusión: el consumo de café y, especialmente, el de café descafeinado, se relacionó inversamente con el riesgo de aparición de diabetes tipo 2. También en una revisión sistemática que analizó nueve estudios de cohortes se comprobó que el consumo de café estaba asociado a una prevalencia baja de nuevos casos detectados de diabetes tipo 2, y se vio que influía especialmente sobre la hiperglucemia posprandial (314). Por su contenido en cafeína, el café es un estimulante del sistema nervioso central, por lo que es potencialmente ansiógeno. El consumo agudo de cafeína incrementa la presión ar- Café con cafeína 0,87 (0,83-0,91) Café descafeinado 0,81 (0,73-0,90) Café filtrado 0,86 (0,82-0,90) Café instantáneo 0,83 (0,74-0,93) 0,6 0,7 0,8 0,9 1,0 1,1 1,2 FIGURA 24. Asociación entre el consumo de diferentes tipos de café y el riesgo relativo (intervalo de confianza del 95%) de aparición de diabetes (para un incremento de una taza diaria) (modificado de la referencia 312) 1 taza diaria 0,87 (0,73-1,03) 2-3 tazas diarias 0,58 (0,49-0,68) Más de 3 tazas diarias 0,53 (0,41-0,68) 0,2 0,4 0,6 0,8 1,0 1,2 1,4 FIGURA 25. Consumo de café y riesgo relativo (intervalo de confianza del 95%) de aparición de diabetes tipo 2, con relación a no consumidores (modificado de la referencia 312) 79 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA terial; sin embargo, cuando se ingiere mediante el café, el efecto sobre la presión arterial es reducido (315). En el estudio de la cohorte Nurses’ Health Study se valoró la asociación del consumo de diferentes clases de bebidas que contienen cafeína con la hipertensión arterial; al final del estudio no se había encontrado que hubiera asociación entre el café y un incremento del riesgo de hipertensión, a diferencia de los resultados sobre el consumo de bebidas de cola, tanto azucaradas como dietéticas (316). Otro estudio prospectivo examinó la relación entre el consumo habitual de café y el riesgo coronario, y no se encontraron hallazgos de que afecte a éste (317). Una revisión de las últimas investigaciones tampoco observa ningún incremento del riesgo cardiovascular con el consumo de café (304); incluso en la publicación reciente de los resultados del seguimiento de la cohorte de mujeres posmenopáusicas (con edades entre los 55 y los 69 años) del Iowa Women’s Health Study se concluye que el consumo de café puede reducir el riesgo cardiovascular (318) (Figura 26). 1-3 tazas diarias 0,76 (0,64-0,91) 4-5 tazas diarias 0,81 (0,66-0,99) Más de 6 tazas diarias 0,87 (0,69-1,09) 0,6 0,7 0,8 0,9 1,0 1,1 1,2 FIGURA 26. Relación entre el consumo de café y la mortalidad de causa cardiovascular en el Iowa Women’s Health Study (318) 5.5. TÉ Hay datos que apuntan a que el consumo de té puede estar relacionado con una disminución del riesgo cardiovascular (319). Sus efectos beneficiosos parecen estar mediados por su riqueza en flavonoides, que actúan como antioxidantes (de forma que inhiben la oxidación de las LDL), con el consiguiente efecto antiaterogénico. Así, su consumo puede mejorar la disfunción endotelial en pacientes con cardiopatía isquémica (320). En el Zupthen Elderly Study (321), se mostró que el consumo de flavonoides estaba inversamente relacionado, de forma dependiente de la dosis, con la incidencia de infarto agudo de miocardio. De sus diferentes variedades, es el té verde el de mayor contenido en flavonoides, en concreto de catequinas (322). En un estudio 80 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 en población japonesa, el consumo de té verde se asoció a una baja incidencia de cardiopatía isquémica (323). Y en otro estudio reciente, la ingestión de té verde, y no la de té negro, se relacionó de forma inversa con el riesgo de que se desarrollara una diabetes (324). Van Dam y cols. (312), en el seguimiento de una cohorte de mujeres americanas de entre 26 y 46 años de edad, estudiaron la relación entre el consumo de té y el riesgo de diabetes tipo 2, y encontraron que no estaba sustancialmente asociado al riesgo de diabetes tipo 2 en el caso de un consumo de cuatro o más tazas diarias de té frente al no consumo. Otros estudios vienen a considerar la utilidad del consumo de té para la prevención cardiovascular. Así, el Boston Area Health Study (325) muestra en 340 individuos que el consumo diario de una o más tazas de té reduce el riesgo de infarto agudo de miocardio en un 44% comparado con una población de control no bebedora de té. De la misma manera, el Scottish Heart Health Study (326), llevado a cabo en una población de 11.000 hombres y mujeres, encontró una relación inversa entre el consumo de té y la mortalidad de causa coronaria. Asimismo, en el estudio de Rotterdam (327) se ha encontrado que el té puede proteger frente a la arteriosclerosis aórtica. 5.6. FRUTOS SECOS Los frutos secos son un grupo de alimentos que suelen contribuir poco al aporte calórico total diario. Sin embargo, su consumo habitual en pequeñas cantidades se ha asociado a una menor morbilidad y mortalidad por enfermedades cardiovasculares en varios estudios epidemiológicos (328), y a una reducción de la colesterolemia en diversos estudios clínicos controlados (329), por lo que existe un creciente interés por este tipo de alimento en epidemiología nutricional y salud pública (330, 331). Además, la mayoría de organismos oficiales y sociedades científicas reconocen la importancia de su consumo para la salud cardiovascular. Así, la Food and Drug Administration (FDA) de Estados Unidos aprobó en julio de 2003, en sendos informes favorables, el consumo de 1,5 onzas (unos 50 g) al día de frutos secos en general, o de nueces en particular, como alimentos posiblemente beneficiosos para la prevención de la cardiopatía isquémica (332). Es la primera vez que este tipo de certificación de “alimento funcional” se ha aplicado a alimentos completos y no a extractos, suplementos o productos alimentarios reforzados (véase el Capítulo 6), lo cual confirma la solvencia de la bibliografía científica sobre los frutos secos y el riesgo cardiovascular. Desde el punto de vista botánico, los frutos secos son frutos de árbol que contienen una única semilla, cuya envoltura externa se endurece al madurar. Los frutos secos comestibles más populares son: las almendras, los anacardos, las avellanas, las macadamias, las nueces, las nueces de Brasil, las pecanas, los piñones y los pistachos (330). Dentro del grupo se incluyen los 81 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA cacahuetes, que son legumbres pero tienen un perfil nutricional similar al de los frutos secos. Por el contrario, las castañas son frutos de árbol, pero difieren de otros frutos secos porque son muy ricas en almidón y pobres en grasa, por lo que no suelen incluirse en este grupo de alimentos. Las propiedades cardiosaludables de los frutos secos se han atribuido a diversos de sus componentes. Se trata de alimentos con un alto valor calórico, puesto que contienen grandes cantidades de grasa (en general, más del 50% de su peso), pero ésta está constituida en su mayor parte por ácidos grasos insaturados (Tabla 33), con efectos reductores de la colesterolemia cuando sustituyen a ácidos grasos saturados (334). La reducción del colesterol total y del colesterol LDL de unos 10 mg/dl efecto que se ha observado en la mayoría de los estudios que han comparado el consumo diario de cantidades razonables de frutos secos, dentro de una alimentación saludable, con dietas equivalentes sin frutos secos seguramente contribuye al efecto cardioprotector (329). Los frutos secos también contienen cantidades apreciables de proteínas de alto valor biológico, especialmente arginina, el aminoácido precursor del óxido nítrico o vasodilatador endógeno, lo cual puede explicar en parte que su consumo mejore la disfunción endotelial asociada a la hipercolesterolemia más allá de la reducción del colesterol, como se ha comprobado con una dieta enriquecida en nueces (335). Por otra parte, los frutos secos también son ricos en fibra, vitaminas (ácido fólico, vitamina E, vitamina B6), minerales (calcio, magnesio, potasio, zinc) y muchos otros componentes bioactivos, como antioxidantes, fitoesteroles y otros compuestos fitoquímicos con propiedades beneficiosas para la salud (336-338). En un estudio reciente, una intervención conductual con dieta mediterránea suplementada con 30 g de frutos secos al día durante tres meses en personas de alto riesgo cardiovascular tuvo un notable efecto beneficioso sobre diversos marcadores de riesgo, incluyendo la presión arterial, la resistencia a la insulina, el perfil lipídico y diversas moléculas inflamatorias (149). Debido al elevado aporte de energía de los frutos secos, existe el temor de que su consumo habitual haga engordar. Sin embargo, en estudios a medio plazo con suplementos diarios de frutos secos proporcionados a personas sanas sin ningún consejo dietético (es decir, sin recomendarles que los frutos secos sustituyan a otras fuentes de energía), no se ha observado ningún incremento de peso apreciable (149, 339). Esto se ha atribuido, en gran parte, a la compensación del aporte de energía procedente de los frutos secos, de forma que se han dejado de comer espontáneamente otros alimentos ricos en energía (por su efecto saciante) y, en menor medida, a una malabsorción de la grasa contenida en ellos, menos biodisponible que otras grasas debido a que se halla contenida dentro de membranas celulares, sobre todo si los frutos secos no se mastican bien (339). Por su excepcional composición nutricional, sus efectos beneficiosos sobre la salud cardiovascular y la seguridad de su consumo respecto a un posible aumento de peso, los frutos 82 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA TABLA 33. Composición en ácidos grasos de los frutos secos (g/100 g de alimento)* (333). Grasa total AGS AGM AGP 18:2 n-6 18:3 n-3 Almendras 51 4 32 12 12 0 Anacardos 46 9 7 8 7,7 0,2 Avellanas 61 74 46 8 7,8 0,1 Cacahuetes 50 7 25 16 16 0 Macadamias 76 12 59 1,5 1,3 0,2 Nueces 65 6 9 47 38 9 Nueces de Brasil 66 16 23 24 23,9 0,1 Pecanas 72 6 41 22 21 1 Piñones 51 8 19 22 21 1 Pistachos 46 6 24 14 13,6 0,3 *AGS: ácidos grasos saturados; AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados; 18:2 n-6: ácido linoleico; 18:3 n-3: ácido alfa-linolénico. secos pueden recomendarse para su consumo habitual en todos los colectivos de riesgo, incluyendo, además de personas con hipercolesterolemia o hipertensión arterial, aquéllas con obesidad o diabetes tipo 2. La única precaución que se debe tener en cuenta es la de descartar la existencia, por otro lado infrecuente, de una alergia a los frutos secos (340). 5.7. ACEITE DE OLIVA El aceite de oliva ha sido durante siglos el alimento con un mayor contenido en ácidos grasos monoinsaturados (ácido oleico); sin embargo, en los últimos años se han introducido aceites de semillas modificadas genéticamente con una composición grasa similar, como los de colza, soja y girasol. No obstante, en los aceites tradicionales de esas semillas y en la margarina predominan los ácidos grasos poliinsaturados, mientras que en la mantequilla abundan los ácidos grasos saturados (82) (Figura 27). En el comercio existen distintos aceites procedentes de la aceituna: los denominados ”virgen” y “virgen extra”, que son auténticos zumos extraídos en frío, sin proceso químico adicional, y el que se comercializa como “aceite de oliva”, que proviene de la mezcla de aceite virgen o virgen extra con otro aceite que, por su mala calidad (aceites de oliva lampantes), no pueden ser consumidos directamente y deben ser sometidos a un proceso de refinado. Final83 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Aceite canola Aceite girasol Aceite maíz Aceite oliva Aceite soja Grasa pollo Grasa cerdo Grasa ternera Mantequilla Margarina canola 0 25 50 75 100 FIGURA 27. Composición porcentual en ácidos grasos de diferentes grasas y aceites mente, el “aceite de orujo” se elabora a partir de los restos que quedan en la almazara tras la molturación de la aceituna (pulpa, piel y hueso), y necesita sufrir un proceso de refinado más complejo que el aceite lampante; en su caso, se comercializa sin adición de aceite virgen. Todos los aceites refinados, incluyendo los de semillas, pierden durante dicho proceso la mayoría de sus microcomponentes, en especial los antioxidantes, por lo que estos nutrientes sólo abundan en los aceites virgen y virgen extra y, en mucha menor cantidad, y debido a la pequeña fracción de aceite virgen que contiene, en el que se comercializa como aceite de oliva. La presencia de microcomponentes no grasos en el aceite de oliva virgen lo diferencia de modo sustancial de otras grasas comestibles, en especial de las procedentes de semillas (341, 342) (Figura 28). Tales sustancias poseen múltiples efectos biológicos, algunos de los cuales se indican en la Figura 29. Entre este tipo de componentes del aceite de oliva destacan: ● Fitoesteroles: compuestos que inhiben la absorción del colesterol exógeno y la reabsorción del colesterol endógeno en el intestino (345) ● 84 Antioxidantes: – Compuestos fenólicos – Alfatocoferol (vitamina E), de mayor riqueza en el aceite de oliva – Carotenoides GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 Composición del aceite de oliva Fracción oleosa 98%-99% Fracción no oleosa 1,5% 73 15 10 Ácidos grasos Ácidos grasos Ácidos grasos saturados monoinsaturados poliinsaturados Compuestos Funciones Terpenos Escualeno Carotenos Tocoferoles α-tocoferol β y γ-tocoferol δ-tocoferol Esteroles β-sitosterol Campesterol Estigmasterol Compuestos fenólicos Otros Clorofila, alcoholes, éteres, ésteres, derivados furánicos, etc. Provitamina A Vitamina E Antioxidantes Hipocolesterolemiante Antioxidantes Propiedades organolépticas Aroma y color FIGURA 28. Composición del aceite de oliva virgen (modificado de la referencia 343) Prevención riesgo cardiovascular (344) Disminuye colesterol LDL (78) Mantiene o eleva colesterol HDL (75) Mejora perfil trombótico (91, 92) Reduce oxidación LDL (75) Fina palatabilidad Aceite de oliva Elevado contenido en ácidos grasos monoinsaturados Reduce presión arterial (90) Civilización del olivo Ingestión milenaria Reduce adhesión monocitos (89) Mejoría del control metabólico en la diabetes (48, 187) FIGURA 29. Efectos beneficiosos del aceite de oliva sobre la salud (48, 75, 78, 88-92, 186, 187, 344) 85 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Los beneficios relacionados con la dieta mediterránea dependen, en gran medida, del efecto del aceite de oliva. En un estudio de casos y controles, efectuado en España, se ha encontrado que un consumo medio diario de aceite de oliva de 54 g se asocia a una reducción del 74% en el riesgo de sufrir un primer infarto de miocardio (344). Existen otros muchos estudios observacionales que han llegado a conclusiones similares, pero se carece hasta el momento de un estudio de intervención. Por ello, resulta de gran valor el proyecto iniciado recientemente en España (estudio PREDIMED), en el que se estudia de modo controlado el efecto preventivo de la dieta mediterránea, enriquecida con aceite de oliva o con frutos secos, y cuyos resultados sobre distintos marcadores de arteriosclerosis se han publicado recientemente (149). El aceite de oliva también se ha estudiado por su efecto sobre la presión arterial, y se ha encontrado que tanto su consumo per se como la adopción de una dieta de tipo mediterráneo están inversamente relacionados con las cifras de presión arterial (160). En otro estudio se observó que su consumo se había asociado a una menor necesidad de antihipertensivos y a una reducción de las cifras de presión arterial sistólica de 8 mmHg y diastólica de 6 mmHg (88). Pero, además de los datos clínicos, son muchos los beneficios relacionados con el aceite de oliva, tal como se sintetiza de forma esquemática en la Figura 29. Muchos de ellos dependen de su riqueza en grasa monoinsaturada, e incluyen desde el metabolismo lipídico a otras muchas acciones biológicas (346). Tales beneficios serían también posibles con el consumo de otras grasas ricas en ácido oleico, por lo que actualmente tiene gran interés la hipótesis de que los microcomponentes genuinos del aceite de oliva modifican muchos de los fenómenos que conducen a la formación y la progresión de la placa de ateroma. Entre los que ya se conocen se incluyen su efecto antioxidante, su acción antitrombótica, su acción antiinflamatoria o su capacidad para favorecer la respuesta vasodilatadora dependiente del endotelio (84). Pero, además, por su riqueza en antioxidantes, el aceite de oliva virgen y virgen extra se alteran menos que otros aceites comestibles ante el deterioro oxidativo que se desarrolla durante la fritura (347). Esta técnica culinaria está muy extendida en los países mediterráneos, pero, debido a que se alcanzan temperaturas elevadas, se induce la desnaturalización de las grasas, de forma que se generan compuestos polares que pueden favorecer el riesgo cardiovascular (348). Por ello, el aceite de oliva es un alimento insustituible de la dieta mediterránea ya que, además de ser fuente de nutrientes de alto valor biológico, es un aliño que ayuda a mejorar las propiedades organolépticas de la comida, y de esta forma mejora su sabor y permite una reducción del consumo de sal. 5.8. AJO En nuestra dieta tradicional la utilización culinaria del ajo (Allium sativum) está ampliamente extendida, bien como base para la elaboración de salsas, bien como ingrediente en sofritos 86 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 que acompañan a carnes, pescados y verduras. Al ajo se le han atribuido beneficios en el sistema cardiovascular, mediante mecanismos como: la inhibición de la peroxidación lipídica y de la agregación plaquetaria, la disminución de la homocisteinemia y de la colesterolemia (mediante la inhibición de la 3-hydroxi-3-metilglutaril coenzima A reductasa, véase Figura 20), y la reducción de la presión arterial (349). Los componentes activos del ajo implicados principalmente en estos beneficios parecen ser los de tipo sulfurado. Uno de ellos es la alicina (350), de la cual se ha evaluado su acción sobre la aterogénesis en animales de experimentación, y se ha podido comprobar que un suplemento dietético de alicina pura es capaz de reducir la placa de ateroma (351). Un estudio en humanos ha demostrado que la ingestión de ajo incrementa la resistencia a la oxidación de las LDL, y los datos que ha aportado sugieren que esta acción sobre la oxidación lipídica puede ser uno de los mecanismos que expliquen los beneficios sobre la salud cardiovascular atribuibles al ajo (352). Otro estudio investigó el efecto de aportar un suplemento de ajo durante dos meses en pacientes hipertensos, y se encontró una reducción significativa en la presión arterial sistólica y diastólica, así como en el estrés oxidativo (353). También el ajo ha despertado mucho interés como potencial agente hipocolesterolemiante a partir de numerosos estudios clínicos en los que se usaron cantidades variables de ajos enteros o de extractos de ajo. Dos metaanálisis publicados hace algo más de diez años sugerían que el consumo de ajo, a dosis tan pequeñas como un diente al día, reducía ligeramente la colesterolemia; no obstante, muchos de los estudios analizados presentaban problemas metodológicos (354, 355). Un metaanálisis más reciente de 45 estudios concluía que el ajo reducía el colesterol unos 15 mg/dl tras 8-12 semanas de tratamiento, pero a las 20-24 semanas no se observaban cambios, lo que hacía pensar que el efecto era transitorio (356). En los últimos años se han llevado a cabo varios estudios bien diseñados que, en general, no han podido confirmar ningún efecto lipídico destacable del consumo de ajos (revisados en la referencia 357). Una revisión crítica reciente (358) pone de manifiesto que, desde 1993, menos de la mitad de los estudios clínicos analizados han sido indicativos de una capacidad hipocolesterolemiante del ajo, y sus efectos sobre la presión arterial y la reducción del estrés oxidativo han sido variables; en cambio, hay más evidencias de una capacidad modesta del ajo como antiagregante plaquetario. Se ha postulado que estos resultados negativos que han obtenido algunos trabajos pueden deberse tanto al empleo de diferentes preparaciones de ajo con componentes variables, como a una distribución aleatoria inadecuada y a una duración demasiado breve de los estudios; además, hay que tener en cuenta la labilidad de algunos de los compuestos que contiene el ajo así como la falta de un conocimiento completo sobre sus constituyentes activos. De todos modos, los vegetales del género Allium (ajo, cebolla, puerros, etc.) tienen un alto contenido en flavonoides, saponinas, compuestos organosulfurados (que son los que originan el olor y el sabor característicos de estas plantas) y otros fitoquímicos con propiedades an87 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA tioxidantes y anticarcinógenas, por lo que, independientemente de su discutible efecto hipocolesterolemiante, es probable que su consumo sea beneficioso para la salud en general. La publicación de 37 artículos de una conferencia internacional sobre los efectos nutricionales del ajo indica el interés actual por este alimento usado tradicionalmente como remedio contra males diversos (359). 5.9. CHOCOLATE Tenido por el placer más dulce del mundo, durante años el consumo de chocolate ha sido objeto de un sinfín de acusaciones, desde ser el origen de caries infantiles hasta causar adicciones incontrolables, problemas metabólicos, cefaleas, acné o ser causa de sobrepeso. Sin embargo, comer o beber chocolate puede convertirse pronto en un ejercicio de alimentación funcional, ya que cada vez existen más pruebas de que el consumo de chocolate negro podría aportar un efecto beneficioso en el sistema cardiovascular. Así, en una revisión de 136 publicaciones de estudios tanto observacionales como experimentales, en las que se valoraba la relación del consumo de cacao y el riesgo de padecer enfermedades cardiovasculares, se concluye que el consumo de chocolate negro puede actuar como protector y puede ser capaz de disminuir el riesgo cardiovascular debido a su contenido en flavonoides (360) y a las características de la fracción grasa del cacao o manteca de cacao. La composición de la manteca de cacao es de un 34% de ácido oleico, un 35% de ácido esteárico y un 26% de ácido palmítico, con la particularidad de que, aunque el ácido esteárico es una grasa saturada, en el organismo se desatura a ácido oleico, por lo que sus efectos son similares a los de las grasas monoinsaturadas (361). También el cacao posee en su composición esteroles vegetales que inhiben de forma competitiva la absorción intestinal de colesterol, por lo que también presentaría una capacidad hipocolesterolemiante. La concentración de flavonoides en el chocolate negro es de 170 mg/100 g, aunque es variable en función tanto del contenido de la planta de cacao como del proceso de transformación en chocolate. El contenido en flavonoides del cacao puro es de hasta 1400 mg/100 g y es mucho más escaso en el chocolate con leche, que tiene alrededor de 70 mg/100 g (362). El chocolate con leche está hecho de pasta y manteca de cacao (los componentes del chocolate negro) pero, además, se añade leche (en polvo o condensada); en cambio, el chocolate blanco carece de la pasta de cacao y se elabora exclusivamente con la fracción grasa (manteca de cacao) y la leche. Los flavonoides son una clase de polifenoles que se encuentran en algunas plantas (363). Por su abundancia en los derivados del cacao, son objeto de atención respecto a la salud cardiovascular un tipo de flavonoides, los flavonoles, entre los que se encuentran la catequina, la 88 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 epicatequina y unos oligómeros de estas moléculas llamados procianidinas (364, 365). Numerosos estudios de intervención dietética en humanos y animales indican que los alimentos ricos en flavonoles pueden ejercer un efecto cardioprotector (366) mediante efectos vasodilatadores, antioxidantes, antiagregantes, antiinflamatorios y de disminución de la presión arterial (367). Un estudio ha demostrado que un suplemento de la dieta con flavonoides del cacao durante 28 días incrementa la concentración plasmática de catequina y epicatequina e inhibe la agregación plaquetaria (368). También se han estudiado los efectos antiinflamatorios inherentes al consumo de chocolate rico en flavonoides. Se ha concluido que uno de los mecanismos por los que se alcanza este efecto es por el aporte de epicatequina y otros flavonoles del cacao, que pueden inhibir la 5-lipooxigenasa, enzima clave en la síntesis de leucotrienos, y de esta forma contribuirían a disminuir las concentraciones plasmáticas de estos marcadores inflamatorios (369). Según un estudio reciente de Grassi y cols. (370), el consumo de chocolate negro, pero no el de chocolate blanco, puede disminuir la presión arterial y la resistencia a la insulina en sujetos sanos; se han encontrado estos mismos efectos en pacientes con hipertensión esencial, por lo que, mientras se mantenga un consumo adecuado de calorías, el consumo de chocolate negro en el contexto de una dieta sana puede aportar beneficios en pacientes hipertensos. Otro estudio concluye que el consumo de chocolate negro puede ejercer efectos beneficiosos sobre la función endotelial en adultos sanos (371). En la misma línea, en una cohorte de 470 hombres sanos que participaron en el Zutphen Elderly Study (372), se observó que el consumo de chocolate estaba inversamente relacionado con la presión arterial y con la mortalidad de causa cardiovascular total. También la baja prevalencia de hipertensión y de enfermedades cardiovasculares que presentan los indios Kuna se ha relacionado con su elevado consumo de derivados del cacao; aunque esta prevalencia está modificándose debido a su migración a áreas urbanas de Panamá y con la adopción de otros hábitos. Se ha estudiado la alimentación en sus áreas de origen en comparación con la que siguen habitualmente tras la migración, y se ha encontrado que, sin que haya diferencias significativas en el aporte de sal, su dieta tradicional presenta una ingesta más rica en pescado y frutas, y un consumo de bebidas con cacao diez veces superior, de forma que se ha valorado este consumo de derivados del cacao como un potencial factor protector cardiovascular (373). Como posibles explicaciones de estos efectos beneficiosos (365) se postula que podrían deberse tanto a la acción de los flavonoides del cacao sobre la regulación de la producción de óxido nítrico (374), como a la modulación sobre el estrés oxidativo; se ha propuesto un tercer mecanismo, que implicaría el sistema renina-angiotensina mediante la inhibición del enzima convertidor de la angiotensina (375). También concentraciones micromolares de epicatequina u otros flavonoides presentes en el cacao son capaces de inhibir la mieloperoxidasa, un enzima proaterogénico y proinflamatorio que actúa como mediador en el proceso de modificación oxidativa de las partículas LDL (369). 89 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA No obstante, la mayoría de los productos derivados del cacao no tienen más de un 50% de cacao puro, con lo que su efecto antioxidante disminuye por la menor riqueza en flavonoides; además, la absorción de la epicatequina se ve dificultada en los chocolates con leche añadida (376). En definitiva, hay que tener cuidado con el consumo de chocolate, ya que sus efectos beneficiosos están presentes especialmente en el que tiene una concentración de cacao elevada (más del 75%); además, la mayoría de los productos derivados del cacao que se encuentran en el mercado presentan añadidos, entre otros, azúcares simples y aceites vegetales (que pueden adicionar a su composición grasas saturadas y parcialmente hidrogenadas que hayan generado ácidos grasos trans), con el resultado de que el chocolate puede convertirse más en un problema que en un beneficio cardiosaludable, a pesar de las bondades que se han descrito del cacao. El chocolate, pues, hay que consumirlo en el contexto de una alimentación sana, con moderación y con la mayor concentración de cacao puro posible. 5.10. FRUTAS Y VERDURAS Las frutas y las verduras son alimentos bajos en grasa y ricos en nutrientes y fibra. Las frutas, por lo general, son más ricas en hidratos de carbono que las verduras, aunque las hay de mayor riqueza grasa, como el aguacate, que tiene una elevada proporción de grasa monoinsaturada en relación con el valor calórico total, y el coco, una fruta poco recomendable desde el punto de vista de su cardiosaludabilidad por su riqueza en grasa saturada. También, tanto las frutas como las verduras, tienen un alto contenido en agua, lo que les confiere una baja densidad energética que ha hecho que, clásicamente, sean útiles en la elaboración de dietas hipocalóricas para el tratamiento de la obesidad. Es conocido que una elevada ingesta de frutas y verduras ayuda a prevenir las enfermedades cardiovasculares. Este beneficio potencial puede derivarse de su compleja composición y de la riqueza en sustancias que contienen, como son: fibra soluble e insoluble, esteroles, indoles, carotenoides (licopeno, luteína, betacaroteno, etc.), vitamina C, flavonoides, folatos, magnesio y potasio. Los mecanismos biológicos por los que ejercen este papel protector no están completamente aclarados. Muchos nutrientes y fitoquímicos presentes en frutas y verduras pueden ser componentes bioactivos que ocasionen una reducción de riesgo cardiovascular (377). Así, se ha examinado la relación existente entre el consumo de magnesio y el riesgo de diabetes tipo 2, y se ha encontrado una relación inversa significativa, lo que da soporte a las recomendaciones de incrementar las dosis de las mayores fuentes dietéticas de magnesio, como son los vegetales de hoja verde (378). Otra hipótesis que intenta explicar la asociación entre una dieta rica en frutas y verduras y el bajo riesgo de enfermedad cardiovascular atribuye el efecto beneficioso al alto contenido de nitrato inorgánico de los vegetales, el cual, por acción 90 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 de la flora bacteriana oral, se convierte en nitritos, precursores del óxido nítrico, que es una sustancia de reconocida capacidad vasodilatadora y antiaterogénica (379). Otros aspectos que se deben considerar y que pueden desempeñar un papel importante en cuanto a formar parte de los beneficios inherentes del consumo de frutas y verduras son su bajo índice glucémico, su reducida densidad energética (377) y su escaso contenido en grasa saturada, que redunda en su relación inversa con las concentraciones de colesterol LDL en el plasma sanguíneo (380). Así, se ha propuesto que son precisamente los efectos sinérgicos de los nutrientes y los fitoquímicos que contienen la causa de su potente actividad antioxidante de las LDL y su acción antiaterogénica, y que el beneficio de una alimentación rica en frutas y verduras sobre la salud es atribuible a la compleja mezcla de componentes bioactivos presentes en ellas, y no al consumo de uno de ellos de forma aislada (381). Globalmente, pues, se considera beneficioso el consumo, en general, de frutas y verduras (382). Las pruebas disponibles indican que las personas que consumen más frutas y verduras tienen una menor prevalencia de factores de riesgo cardiovascular, entre los que encontramos hipertensión, obesidad y diabetes tipo 2 (377). Así, un estudio realizado en nuestro país ha demostrado, en el contexto de una alimentación con alto contenido en grasa, la relación inversa que hay entre el consumo de frutas y verduras y los valores de presión arterial (169). En la pasada década, una dieta tipo DASH, rica en verduras y frutas, así como el incremento de la ingestión de potasio, han emergido como estrategias efectivas para el control de la hipertensión (179), tal como enfatizan las recomendaciones de la American Heart Association. Estas sugerencias proponen el consumo de una alimentación que incluya una amplia variedad de frutas y verduras (de 5 a 9 raciones al día) y productos lácteos desnatados; esta dieta es rica en magnesio, potasio y calcio, y confiere beneficios en el control de la hipertensión arterial y para la salud cardiovascular (383). Existe relación entre un consumo elevado de frutas y verduras y un riesgo bajo de enfermedad coronaria e ictus, y algunas observaciones llegan a la conclusión de que puede ayudar en la prevención de la enfermedad cardiovascular, hecho que daría soporte a las recomendaciones de las guías de incrementar su consumo (384). Hay estudios de cohortes que han confirmado el impacto de los hábitos dietéticos de los individuos vegetarianos sobre la cardiopatía isquémica, de forma que han demostrado que presentan una menor mortalidad de origen coronario que las personas que consumen carne de forma habitual (385). En un metaanálisis de estudios de cohortes se observa que las personas en el percentil 90, cuyo consumo de fruta era cuatro veces superior y de verdura dos veces superior a las del percentil 10, tenían un riesgo de enfermedad coronaria un 15% inferior (386). En otro estudio se evaluó una ingestión baja de grasa saturada y una alta de frutas y verduras como factores protectores frente a la enfermedad coronaria, y se encontró que el consumo diario de más de cinco raciones de fruta y verduras, y un máximo de un 12% de grasa saturada sobre el valor calórico total reducían 91 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA la mortalidad de origen coronario en un 76% (387). También el bajo consumo de frutas y verduras se muestra en un análisis multivariante en mujeres como un factor de riesgo coronario en sí mismo, adicional e independiente de los factores de riesgo convencionales (388). En el seguimiento de dos cohortes, el Nurses’ Health Study y el Health Professionals’ Follow-Up Study, con una participación de 84.251 mujeres de 34 a 59 años de edad, a las que se les efectuó un seguimiento durante 14 años, y de 42.148 hombres de entre 40 y 75 años de edad y con un seguimiento de 8 años, se evidenció que las personas en el quintil más alto de consumo de frutas y verduras tenían un riesgo relativo coronario de 0,80 comparado con las personas del quintil de menor consumo, y cada ración de incremento en su ingesta se asociaba a una reducción de un 4% del riesgo de enfermedad coronaria (389) (Figura 30). En definitiva, podemos afirmar que el consumo de frutas y verduras tiene un efecto protector frente a la cardiopatía isquémica. Por otra parte, un incremento del consumo de verduras y frutas puede reducir el riesgo de ictus isquémico (390). Un metaanálisis reciente de estudios de cohortes demuestra que el aumento del consumo está asociado a una reducción del riesgo de ictus tanto isquémico como hemorrágico (391) (Figura 31). Otro metaanálisis de siete estudios prospectivos observacionales encontró que el riesgo de ictus decrecía un 11% por cada ración adicional diaria de fruta, y un 3% por cada ración de verduras, de tal forma que la asociación lineal sugería que había una relación dosis-respuesta (392). También Joshipura y cols. (393) demostraron que el incremento de una ración al día estaba asociado a una reducción del riesgo de ictus isquémico Riesgo relativo de enfermedad cardiovascular (IC95%) 1,2 1 0,8 0,6 0,4 0,2 0 <3 3-3,9 4-4,9 5-5,9 6-7,9 8+ Consumo de frutas y verduras (raciones/día) * Se considera significación si p<0,01 FIGURA 30. Ingestión de frutas y verduras y riesgo coronario en el Nurses’ Health Study y el Health Professionals’ Follow-Up Study (389) 92 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 de un 6%, trabajo que confirmaría la relación protectora entre el consumo de frutas y verduras y el riesgo de ictus isquémico (Figura 32). Una publicación de la Organización Mundial de la Salud concluye que el aumento del consumo individual de frutas y verduras hasta 600 g/diarios repercutiría en una reducción de la carga de morbilidad por cardiopatía isquémica y por ictus isquémico de un 31% y un 19%, respectivamente (394). El aumento de la ingestión de frutas y verduras tendría un gran impacto como medida de salud pública para reducir la incidencia de numerosas enfermedades no transmisibles, entre ellas las enfermedades cardiovasculares (394). El consumo mínimo diario de frutas y verduras recomendado en diferentes guías es de tres raciones de verduras y dos Menos de 3 raciones/día 1 3-5 raciones/día 0,89 (0,83-0,97) Más de 5 raciones/día 0,74 (0,69-0,79) 0,6 0,7 0,8 0,9 1,0 1,1 1,2 FIGURA 31. Relación entre consumo de frutas y verduras e incidencia de ictus (hemorrágico e isquémico) en un metaanálisis de estudios de cohortes (391) Riesgo relativo de ictus isquémico (IC95%) 1,2 1 0,8 0,6 0,4 0,2 0 <3 3-4 4-5 5-6 6-8 ≥8 Raciones/día de frutas y verduras FIGURA 32. Consumo de frutas y verduras y riesgo de ictus isquémico (393) 93 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA de frutas, con un aporte combinado, como mínimo, de 400 g por persona y día. En un estudio reciente se observó que sólo en los países mediterráneos se seguía una dieta con el aporte de frutas y verduras propuesto en estas guías (395). El estudio EPIC de España, con datos de los años 90 del siglo XX extraídos a partir de una completa encuesta sobre la frecuencia de consumo de alimentos realizada a 41.448 adultos de cinco comunidades, constata que el 74% de los individuos consumen 400 g o más de verduras y frutas al día (396). La atención primaria es el ámbito ideal para promover el incremento del consumo de verduras y frutas, secundando las recomendaciones de que los adultos consuman un mínimo de cinco raciones diarias (una ración de fruta equivale a una pieza de tamaño mediano, una ración de verdura a una taza de verdura, cruda o cocida, y una ración de zumo de frutas a media taza) (397), acción que se enmarcaría en el contexto de las actividades de promoción de la salud (398). El mensaje que se debe transmitir es el de “al menos cinco al día”, de especial relevancia para personas con un consumo reducido de frutas y verduras, en las que se ha visto que, para incrementar el aporte, es más importante insistir en la frecuencia de su consumo que en el tamaño de la ración (399). En este sentido, el asesoramiento conductual que se ofrece desde las consultas de enfermería en atención primaria puede producir un incremento en el consumo superior al que se obtiene con un consejo dietético breve (400). Otro aspecto que se debe considerar desde el punto de vista de la gestión de los recursos sanitarios es que un consumo elevado de frutas y verduras ha demostrado disminuir las cargas asistenciales médicas y los costes derivados de cargas anuales relacionadas con enfermedades cardiovasculares en ancianos (401). 5.11. HUEVOS Los huevos, un alimento de especial significación cultural y gastronómica, constituyen la base de platos emblemáticos de nuestra cultura mediterránea. Buenos ejemplos de ello son la tortilla de patatas o los huevos fritos con aceite de oliva. El huevo consiste en el cuerpo germinativo producido por las aves, en su proceso de reproducción, e incluye el germen del nuevo ser junto al material nutricio imprescindible para permitir su desarrollo. El huevo de gallina, el que es típico de nuestra dieta, pesa unos 65 g, de los que 6 g son de cáscara, 39 g de clara y 20 g de yema. Se trata de un alimento de gran valor nutritivo por su riqueza en minerales (selenio, fósforo, yodo y zinc) y vitaminas (A, D y B2, B12, ácido pantoténico y niacina). En los últimos tiempos se está destacando, además, su riqueza en ciertos carotenos de gran potencial para la salud. Pero, además, los huevos, pobres en hidratos de carbono, contienen proteínas de gran valor nutricional, ya que incluyen todos los aminoácidos esenciales. Con respecto a las grasas, suponen un 11% de la parte comestible y están presenten en la yema; 94 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA 5 encontramos fosfolípidos, en torno a 5 g de ácido oleico/100 g de huevo entero, 3 g/100 g de grasa saturada y 1,2 g/100 g de grasa poliinsaturada, incluyendo el ácido graso esencial linoleico. Pero desde el punto de vista de la prevención cardiovascular, lo más relevante es su contenido en colesterol, que llega a ser de 350-385 mg/100 g de huevo entero, lo que supone 200-230 mg de colesterol por unidad, que se encuentra en su totalidad en la yema (402). Debido a ello, este alimento ha sido tradicionalmente anatemizado, ya que se ha considerado un alimento insano por su potencial capacidad para incrementar el colesterol LDL plasmático. Este concepto no sólo ha estado presente en la mentalidad popular, sino que las guías médicas lo han fomentado, sin que haya pruebas contundentes que confirmen esta hipótesis, como seguidamente veremos. Huevos y colesterol plasmático El efecto del consumo de huevos sobre el colesterol plasmático ha sido estudiado en nuestro país por Blanco y cols. (403). Estos investigadores han analizado las consecuencias de la ingestión de dos huevos diarios sobre el metabolismo lipídico en personas sanas; para ello compararon dos dietas basales de distintos contenidos en grasa. Los datos resultantes mostraron que se producían pequeños incrementos de los valores plasmáticos de colesterol LDL y HDL, pero el consumo no afectó al cociente aterogénico colesterol/HDL (403). En esa misma línea, un metaanálisis sobre 17 estudios, en los que se había incluido a 556 participantes, reveló que un huevo diario (que supone un contenido en torno a los 200 mg de colesterol) incrementaría 3,9 mg el colesterol LDL y 0,6 mg el colesterol HDL. Este efecto hipercolesterolemiante sería menor cuando la persona sigue una dieta pobre en grasa saturada (404). Además, existe una gran variabilidad interpersonal en la absorción y en el incremento de las concentraciones plasmáticas, que se debe a una compleja base genética no del todo conocida (405). En conjunto, se calcula que sólo un tercio de los individuos experimentarían un incremento de ambas fracciones, LDL y HDL, constituyendo lo que se denomina el grupo de los hiperrespondedores (216, 233); además, en este grupo no se modificaría el cociente colesterol LDL/HDL. Todo ello explica que en algunos países, como Canadá, no se apoye la recomendación de considerar 300 mg el límite superior diario de consumo de colesterol recomendable para la población sana, sino que sus recomendaciones se centran en disminuir la ingestión de grasa saturada y grasa trans (406). Otro hecho relevante, que justificaría las dudas acerca de la recomendación de limitar la ingestión de huevos, deriva de un estudio hecho en niños: a los participantes se les administraron dos huevos diarios. En la tercera parte de los casos en que se elevó el colesterol, sin cambios en el cociente aterogénico, las partículas LDL fueron más grandes, características del denominado patrón A. Es bien sabido que el patrón B de LDL es aterogénico, y su sustitu95 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA ción por el patrón A, inducido por el consumo de huevos, habría que interpretarlo como un cambio protector. Este mismo hecho ha sido puesto en evidencia en un estudio llevado a cabo en una población de adultos, hombres y mujeres, normolipémicos (407), lo que hace dudar de la aterogenicidad de los huevos y pone en entredicho la recomendación de limitar su presencia diaria en la dieta, especialmente en personas sanas (408). El síndrome metabólico consiste en una constelación de manifestaciones clínicas y bioquímicas cuya presencia aumenta el riesgo de sufrir diabetes y enfermedades cardiovasculares. Dada la importancia del colesterol plasmático por su valor pronóstico de riesgo cardiovascular en estas situaciones, resulta interesante el estudio realizado en 197 participantes, que se clasificaron en función de si eran resistentes a la insulina (n = 75), sensibles a la insulina (n = 65) u obesos resistentes a la insulina (n = 58). Se comparó el consumo de dos huevos al día, cuatro huevos al día o ninguno. En el grupo de los obesos no se detectó ningún cambio en el colesterol LDL en ninguna situación experimental, mientras que sólo el consumo de cuatro huevos incrementó el colesterol LDL en un 7,8% de los participantes con resistencia a la insulina y un 3% en los sensibles (409). En todos hubo un aumento de colesterol HDL, lo que obliga a insistir más en la restricción de las grasas aterogénicas que en la de los propios huevos. Huevos y riesgo cardiovascular Además del riesgo cardiovascular, evaluado por su efecto sobre el metabolismo lipídico, existe una amplia investigación, de base poblacional, que ha evaluado el valor pronóstico de la ingestión de huevos sobre la aparición de episodios cardiovasculares. En su conjunto, se puede afirmar que no hay argumentos que permitan afirmar que existe esa relación. En una revisión de múltiples estudios de casos y controles no se evidenció asociación alguna (212). La misma conclusión se recogió en el Lipid Research Clinics Prevalence Follow-up Study, llevado a cabo en 4.546 participantes, tanto hombres como mujeres (410): del mismo modo, falló la asociación cuando se estudió el consumo de huevos como factor de predicción de la incidencia de enfermedad coronaria en una población amplia (411). En otros trabajos (412-414), en los que se analizó el consumo de huevos y el riesgo cardiovascular, tampoco se demostró ninguna relación (Tabla 34). Existe, sin embargo, un estudio realizado en una población japonesa en el que se concluyó, tras un seguimiento de 14 años, que, aunque no existía relación entre el consumo de huevos y mortalidad en hombres, los datos fueron positivos en mujeres (416). Este hecho se puede considerar aislado, pues en el estudio de las cohortes Health Professionals Follow-up Study y Nurses’ Health Study no se confirmó relación alguna ni en hombres ni en mujeres (415), aunque sí hubo una asociación positiva en diabéticos de ambos sexos, aunque este dato resultó de un análisis de subgrupos y, por tanto, es de una consistencia limitada. 96 5 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INFLUENCIA DE LOS ALIMENTOS EN EL RIESGO CARDIOVASCULAR EN ATENCIÓN PRIMARIA TABLA 34. Estudios prospectivos de grandes cohortes sobre el consumo de huevos y . el riesgo de enfermedad cardiovascular. Estudio Año Riesgo relativo categoría superior frente a categoría inferior Framingham (412) 1982 Sin riesgo Gramenzi y cols. (mujeres) (413) 1990 0,80 Adventistas de California (414) 1994 1,01 Health Professionals (varones) (415) 1999 1,08 Nurses´ Health (mujeres) (415) 1999 0,82 Huevos y carotenoides. Un tema que últimamente está despertando un especial interés es el de la riqueza en los huevos de dos carotenoides, la luteína y su isómero, la zeaxantina, ambos con capacidad para prevenir la degeneración macular asociada a la edad y la aparición de cataratas. Estos componentes son antioxidantes potentes, se transportan en el plasma unidos a las HDL y podrían evitar la oxidación de las lipoproteínas, incluidas las LDL, lo que sería de gran valor en la prevención del inicio de la aterogénesis (417). Aunque la luteína es más abundante en las espinacas que en los huevos, parece que su biodisponibilidad es mayor cuando procede de éstos últimos, lo que acrecienta el interés por la presencia de huevos en la dieta. Los estudios realizados en voluntarios muestran que el efecto de los huevos de producir un incremento de las concentraciones plasmáticas de carotenoides es mayor en los considerados hiperrespondedores para el colesterol (418). Se ha sugerido, además, que el sexo podría influir en esa respuesta, con un mayor incremento en las mujeres; aunque esta característica podría ser más propia de los betacarotenos que de la luteína (419). En resumen, la revisión de los estudios más recientes en los que se han utilizado los huevos como fuente principal de colesterol de la dieta, muestran que su efecto hipercolesterolemiante es escaso, que incrementaría tanto las LDL como las HDL, sólo afectaría a un tercio de la población y favorecería la aparición de partículas LDL de patrón A, menos aterogénicas. Tales estudios se han realizado en múltiples poblaciones, hombres y mujeres, niños y ancianos. Por otra parte, su efecto en cuanto al incremento de las concentraciones de luteína y de zeaxantina, de potente efecto antioxidante y preventivo de enfermedades oculares, podría tener interés en la reducción del riesgo cardiovascular, evitando la oxidación de las lipoproteínas. Por tanto, se puede afirmar que las poblaciones sanas se benefician del consumo de huevos y no hay razones para restringirlos con el argumento de una posible reducción de la incidencia de cardiopatía isquémica. 97 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 6. ALIMENTOS FUNCIONALES La ciencia contemporánea de la nutrición ha acuñado el término de “alimentos funcionales” para designar aquellos productos alimentarios, naturales o elaborados, que proporcionan un beneficio más allá del olor, el sabor, la textura o el valor nutricional propios, y que influyen sobre funciones fisiológicas de un modo mensurable en términos de prevención de enfermedad o promoción de la salud (420-422). En los países anglosajones también se denominan “nutracéuticos”, término que denota a la vez su origen alimentario y su similitud de función con los productos farmacéuticos. Los alimentos funcionales contienen uno o más ingredientes que afectan positivamente determinadas funciones del organismo; éstos pueden ser macronutrientes (como los ácidos grasos insaturados de los aceites de oliva y de semillas), micronutrientes (como las vitaminas) o compuestos sin valor nutritivo (como los flavonoides), pero siempre son componentes naturales que están presentes en el propio alimento no elaborado (por ejemplo, ácidos grasos n-3 en el pescado azul, vitamina C en los cítricos) o añadidos como refuerzo (por ejemplo, calcio y vitamina D en la leche o ácido fólico en los cereales). Independientemente de los beneficios atribuidos a los alimentos funcionales, éstos nunca suplen, sino que complementan unos hábitos dietéticos saludables. Asimismo, no deben utilizarse por encima de unas determinadas cantidades. No obstante, no existen recomendaciones precisas sobre las concentraciones óptimas y las cantidades recomendadas de los alimentos funcionales, aunque hay estudios clínicos que orientan a este respecto. Los procedimientos para obtener alimentos funcionales son diversos, desde la simple adición de un componente hasta la modificación del proceso de obtención o la aplicación de técnicas de mejora genética. El campo de la alimentación es un mercado creciente en el que se conjugan tres elementos: los avances científicos y técnicos en nutrición, su incorporación por parte de la industria alimentaria a una amplia gama de productos de consumo y, finalmente, una población cada vez más preocupada por la salud. Y en este terreno, la industria alimentaria va generalmente por delante de la legislación al respecto. Por todo ello, 99 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA es importante recabar de la administración sanitaria y de la propia industria la existencia de un etiquetado correcto y claro, y que especifique la presencia de las ventajas de los alimentos funcionales, siempre con el aval de estudios científicos cualificados. En este sentido, es muy importante subrayar que las recomendaciones de los alimentos funcionales deben tener como condición básica que haya una evidencia científica sólida sobre sus beneficios adicionales en la salud humana. Entre las dianas terapéuticas de los alimentos funcionales, el sistema cardiovascular es tal vez la más importante (423). De los que tienen funcionalidad cardiovascular, destacan los alimentos naturales o elaborados que modifican favorablemente el perfil lipídico por su riqueza en compuestos bioactivos, del tipo de la fibra soluble, los esteroles vegetales (fitoesteroles) y los ácidos grasos n-3. Por el reconocido efecto hipocolesterolemiante de su consumo frecuente, hay que destacar también unos alimentos naturales que contienen a la vez varios de los nutrientes mencionados, los frutos secos, ya descritos en el Capítulo 5.6. Entre los alimentos naturales o enriquecidos con estas sustancias, tienen un efecto reductor del colesterol los frutos secos, los nutracéuticos enriquecidos en fibra soluble (424) y los fitoesteroles (425), efecto que está avalado por un cuerpo de evidencia científica abundante y sólida (Tabla 35). Las dosis relativamente altas de ácidos grasos n-3 tienen un efecto hipotrigliceridemiante importante (426). El consumo habitual y con moderación de bebidas alcohólicas se asocia a cifras más altas de colesterol HDL que la abstención de alcohol (274), por lo cual, aunque el concepto tal vez peque de heterodoxo, las bebidas alcohólicas también podrían considerarse nutracéuticos con funcionalidad lipídica. Tradicionalmente se han atribuido efectos hipocolesterolemiantes a otros alimentos completos, componentes alimentarios o suplementos dietéticos, como el ajo, la proteína de soja, el betaglucano y la lecitina, pero las pruebas sobre su eficacia son poco convincentes (357) (Tabla 35). En las siguientes páginas se revisan los alimentos funcionales con efectos beneficiosos en el sistema cardiovascular, sin olvidar que la adición de todos ellos a una alimentación saludable en un patrón alimentario “funcional” es la opción idónea para mejorar el perfil lipídico y reducir el riesgo cardiovascular, tanto en la población general como en las personas de alto riesgo. 6.1. FIBRA VEGETAL La fibra llamada dietética o alimentaria se compone de un conjunto de sustancias de origen vegetal, en su mayor parte hidratos de carbono, resistentes a la hidrólisis de los enzimas digestivos humanos, pero parcialmente fermentables por las bacterias colónicas. Se trata de un componente importante de una alimentación abundante en vegetales, y su influencia 100 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA TABLA 35. Alimentos funcionales sobre el perfil lipídico. ↓ C-LDL ↑ C-HDL ↓ Triglicéridos Fibra soluble ++* – – Esteroles vegetales ++ – – Frutos secos ++ – – – ++ ↑** ↑*** – ++*** Proteína de soja ± – ± Lecitina de soja ± – – Betaglucanos ± – – Fructanos ± – – Ajo ± – ± Alimentos/componentes alimentarios Evidencias científicas sólidas Bebidas alcohólicas Ácidos grasos n-3 Pruebas no concluyentes *Las pruebas sobre los efectos hipocolesterolemiantes de algunos subtipos de fibra soluble, como los betaglucanos y los fructanos, son menos claras. **Pueden aumentar en personas susceptibles aun con dosis moderadas de alcohol. ***Sólo con dosis “farmacológicas” a partir de 2 g/día, con las cuales se han descrito aumentos leves del colesterol LDL, recíprocos al descenso de triglicéridos (véase también la Tabla 12). sobre la fisiología digestiva, el metabolismo del colesterol y el estado de salud en general ha suscitado un gran interés desde que, en 1974, Burkitt y cols. (427) expusieran la hipótesis de que la deficiencia de su consumo en las sociedades ricas de Occidente era un factor causal del aumento de la incidencia de diversas enfermedades ligadas al progreso, como la obesidad, la diabetes mellitus, la litiasis biliar, la cardiopatía isquémica, la enfermedad diverticular y el cáncer de colon y recto. Existen dos tipos distintos de fibra alimentaria definidos por su comportamiento físico en el agua: 1) la fibra insoluble, como la celulosa, la lignina y algunas hemicelulosas, que es abundante en los cereales integrales (el salvado de trigo es particularmente rico en este tipo de fibra); y 2) la fibra soluble, como las gomas, los mucílagos y las pectinas, que podemos encontrar sobre todo en legumbres, verduras y frutas, y los betaglucanos, presentes en la avena, la cebada y algunas levaduras (428). Una variedad particular de fibra soluble es el psyllium, un coloide hidrófilo procedente de la corteza del arbusto zaragatona (Ispaghula), utilizado como laxante no catártico por aumento del bolo fecal y como agente reductor del colesterol en pacientes con hipercolesterolemia moderada (429). También pueden incluirse dentro de las fibras solubles los polisacáridos no 101 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 36. Principales alimentos ricos en fibra dietética (431). Alimentos Contenido en g/100 g de porción comestible Cereales integrales 15-30 Frutos secos 5-10 Legumbres 3-6 Pan integral 5 Pasas 4 Pan blanco 2-3,5 Vegetales de hojas y frutas 1,5-4 Patatas y otros tubérculos 1-3 Hortalizas 0,5-3 Arroz blanco y pasta 0,5-2 digeribles de cadena corta llamados fructooligosacáridos o fructanos, que son básicamente dos moléculas: la inulina y la oligofructosa (430). En la Tabla 36 se muestra una lista de alimentos según su contenido en fibra total (431). La mayoría de los productos vegetales contienen una mezcla de fibra soluble e insoluble en una proporción aproximada de 1:3. Sin embargo, la avena (particularmente, el salvado de avena), la cebada, las legumbres, las manzanas y los cítricos contienen mayores cantidades de fibra soluble, mientras que el salvado de trigo, el pan y los cereales integrales contienen, sobre todo, fibra insoluble. En nuestra dieta, las fuentes principales de fibra son las verduras, las frutas y los cereales. Actualmente se puede afirmar con seguridad que una dieta rica en fibra reduce el riesgo cardiovascular. Un metaanálisis reciente de diez grandes estudios prospectivos concluye que, por cada 10 g de incremento en la ingestión de fibra, el riesgo coronario global se reduce un 14%, mientras que el riesgo de muerte por causa coronaria disminuye un 27% tras ajustar por diversos factores de confusión (432). De modo notable, la fibra procedente de los cereales y las frutas tiene un efecto protector, pero no la que se ingiere con las verduras (véase más adelante). En varios estudios epidemiológicos también se ha demostrado una relación inversa entre el consumo de fibra (sobre todo a partir de cereales integrales, la principal fuente dietética de fibra) y la incidencia de diabetes (433). Efectos metabólicos de la fibra soluble. Hay diversos mecanismos mediante los que la fibra alimentaria reduce el riesgo cardiovascular y de diabetes. Se han descrito varios efectos metabólicos, prácticamente exclusivos de la fibra soluble: hipocolesterolemiante, modulador de la glucemia posprandial y de la insulinemia, antihipertensivo y antitrombótico. 102 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 Sólo la fibra soluble tiene el efecto de reducir las cifras de colesterol, al secuestrar ácidos biliares en el intestino y favorecer su eliminación fecal, de forma que se estimula el catabolismo del colesterol de modo similar a cómo lo hacen las resinas de intercambio aniónico, como la colestiramina, si bien con un efecto más débil (228, 434). Otro mecanismo implicado es la fermentación de la fibra en el intestino grueso mediante la acción de las bacterias colónicas, lo que produce ácidos grasos de cadena corta (acetato y propionato) que entran en la circulación portal e inhiben la síntesis hepática de colesterol; se trata de un mecanismo demostrado en animales de experimentación, pero no en humanos (435). Un tercer sistema deriva de la capacidad de algunas fibras solubles (fibras viscosas) de formar geles viscosos con el bolo alimentario en el intestino, y de esta forma actúan a modo de barrera física para la absorción de ácidos biliares, colesterol y nutrientes (424). La contribución del aumento de la fibra soluble al efecto reductor del colesterol de la dieta es discreto: se estima que se produce un descenso del colesterol total y del colesterol LDL de unos 2 mg/dl por cada gramo de fibra soluble añadido a la dieta (436). Por ejemplo, comer dos manzanas al día supone 2 g de pectina, por lo que puede esperarse que se reduzca el colesterol LDL unos 4 mg/dl mientras se mantenga el consumo. Por otra parte, la ingestión de 10 g de psyllium al día a modo de suplemento en personas con hipercolesterolemia moderada reduce el colesterol LDL en un 7% de promedio (429). En todo caso, el hecho de que la FDA aprobara las alegaciones de salud respecto a la reducción del colesterol de los productos ricos en avena (salvado, gachas y harina) en 1997 y del psyllium en 1998 representó un estímulo para la industria alimentaria para desarrollar una gran variedad de alimentos ricos en fibra, como cereales para el desayuno, galletas y otros productos que se comercializan con el reclamo de complementar la dieta para que ésta sea más saludable. Desde la década de 1970 se conoce que la ingestión de carbohidratos no digeribles en forma de fibra soluble, como la goma de guar (obtenida a partir de legumbres del tipo de las alubias) y la pectina, modifican la cinética de absorción de la glucosa, reduciendo los picos posprandiales de glucemia e insulinemia (437, 438), por lo que su consumo en las comidas es útil en el tratamiento de la diabetes (439, 440). La reducción de la glucemia también se relaciona con la viscosidad, tanto por un retraso del vaciado gástrico y por una llegada más lenta de glucosa al yeyuno como porque queda atrapada en el lumen y presenta una mayor dificultad en su difusión hasta las microvellosidades intestinales (424). Aparte de producir picos posprandiales de glucosa más bajos, esto tiene como resultado una menor estimulación de la producción de insulina (438). En el estudio prospectivo CARDIA, llevado a cabo en adultos jóvenes (441), la asociación inversa observada a los diez años de seguimiento entre la ingestión de fibra y el peso corporal, el perímetro de cintura, la insulinemia y otros factores de riesgo era atribuible a la reducción de la resistencia a la insulina. De hecho, la administración de alimentos ricos en fibra soluble forma parte de las recomendaciones dietéticas propuestas por la Organización Mundial de la Salud para el tratamiento de la diabetes. 103 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Una dieta rica en vegetales y fibra también se ha asociado, en estudios prospectivos, a un riesgo menor de hipertensión, así como a una reducción de las cifras de presión arterial en estudios clínicos, especialmente en individuos hipertensos (179, 442). Los mecanismos por los que la fibra (sobre todo la soluble) ejerce este efecto serían la reducción de la insulinemia y la mejora inherente de la función endotelial. La hiperinsulinemia produce un estímulo simpático y un incremento de la reabsorción renal de sodio, con el consiguiente aumento del volumen plasmático, que puede inducir hipertensión arterial (443); la fibra antagonizaría este mecanismo al reducir las cifras de insulina. Al efecto antihipertensivo de la fibra puede contribuir también la riqueza en potasio y magnesio de los productos vegetales ricos en fibra. Las dietas hipocalóricas con un alto contenido en fibra se han utilizado en el tratamiento de la obesidad. Los mecanismos por los cuales una dieta rica en fibra contribuiría a reducir la adiposidad son, por un lado, la capacidad de la fibra para retener agua e incrementar el volumen del bolo alimentario en el estómago, lo que reduce la velocidad del vaciado gástrico y aumenta la sensación de saciedad. Por otro lado, los alimentos con fibra necesitan una mayor masticación, lo que lleva a prolongar el tiempo que requiere su ingestión. En el ya citado estudio CARDIA (441), los adolescentes que ingirieron una menor cantidad de fibra experimentaron un mayor incremento ponderal. Los resultados posteriores de este importante estudio prospectivo indican cómo una mayor frecuencia del consumo de las denominadas “comidas rápidas” (que son pobres en fibra) se asocia directamente a aumento de peso y a la aparición de resistencia a la insulina (444). Efectos protectores sobre el sistema cardiovascular de la fibra insoluble. En principio parecería que los efectos metabólicos beneficiosos de la fibra soluble explicarían por qué las poblaciones que siguen una dieta rica en fibra presentan una menor incidencia de enfermedad coronaria (432) y diabetes (433). Sin embargo, en estos estudios se observó una asociación más fuerte con la protección cardiovascular o la prevención de la diabetes si se ingería la fibra de los cereales, sobre todo de los cereales integrales, y, en segundo lugar, con la de las frutas, pero no con la fibra de las verduras. La aparente paradoja de que el consumo de cereales integrales, fuente de salvado (fibra insoluble, metabólicamente inerte), se asocie a una mayor protección frente a la aparición de enfermedad cardiaca coronaria y diabetes que el consumo de vegetales y frutas (ricos en fibra soluble, con efectos metabólicos positivos) puede resolverse si se tiene en cuenta que, aparte del salvado de la cáscara, los cereales integrales conservan el germen, y tanto éste como la cáscara contienen una multitud de compuestos fitoquímicos bioactivos, incluyendo micronutrientes antioxidantes (424, 433, 445). Estas moléculas protectoras abundan en la piel y en el germen de todas las semillas (cereales, legumbres, frutos secos), donde la naturaleza las ha situado para proteger el ADN y, por tanto, el potencial de conservación de cada especie. 104 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 También las hay en las frutas, que después de todo contienen semillas, pero mucho menos en las verduras, donde no hay ADN que proteger. Es evidente que la fibra de cualquier tipo se encuentra en alimentos vegetales que también contienen otras moléculas bioactivas y con efectos beneficiosos sobre la salud, por lo que no importa tanto el consejo específico sobre la fibra, sino que lo saludable es comer muchos productos vegetales en su estado más natural posible. En el caso de los cereales, el proceso habitual de refinado les hace perder tanto la fibra como la mayoría de los compuestos fitoquímicos, por lo que es deseable que se consuman integrales y no refinados. Por ejemplo, la capacidad antioxidante del salvado de trigo es 20 veces superior a la de la harina refinada de trigo (446). En la Tabla 37 se resumen los efectos metabólicos y de protección cardiovascular de la fibra soluble y la insoluble. TABLA 37. Efectos metabólicos de la fibra. Soluble Insoluble ↓ Colesterol + – ↓ Glucosa + – ↓ Insulina + – ↑ Masa fecal – + ↑ Fermentación + –/+ ↓ Riesgo diabetes – + ↓ Riesgo enfermedad coronaria – + Recomendaciones sobre el consumo de fibra. Las recomendaciones actuales sobre el consumo de fibra que se necesita para mantener una buena salud, propuestas por el US Dietary Reference Intake (447), son de 38 g/día en varones y 25 g/día en mujeres. Estas cifras son compatibles con las recomendaciones recientes de varias sociedades científicas, que proponen cantidades entre 25 y 35 g/día (entre 10 y 13 g por 1000 kcal). Por tanto, una dieta de 2000 kcal debería contener aproximadamente 25 g de fibra al día, y una de 2500 kcal, unos 30 g. La proporción recomendada entre los dos tipos de fibra, la insoluble y la soluble, cuando la dieta es variada y contiene cereales integrales, frutos secos, legumbres, frutas y otros vegetales, es de 3:1, que es, asimismo, la contenida en la mayoría de plantas comestibles. Para conseguir estos objetivos es útil seguir los consejos dietéticos que se exponen en la Tabla 38. 105 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 38. Consejos dietéticos sobre el consumo de fibra. Consumir de dos a tres raciones de verduras o ensalada al día. Ingerir frutos secos con cierta regularidad. Están contraindicados los frutos secos salados en los hipertensos. Una buena recomendación sería un consumo de entre una y cinco raciones de frutos secos por semana (una ración son 25 g, peso neto, sin cáscara). Incorporar cereales y derivados a la dieta, preferentemente integrales (semilla entera) o enriquecidos con fibra (pan, galletas, arroz, pasta, cereales de desayuno, etc.), al menos dos o tres veces al día. Consumir de dos a tres piezas de fruta al día, mejor enteras que en zumo. No olvidemos que la pulpa, más rica en fibra, se queda en el exprimidor. Consumir legumbres (alubias, garbanzos, lentejas, etc.) al menos dos veces por semana. 6.2. PROTEÍNA DE SOJA La soja, una legumbre muy consumida en los países asiáticos, ha sido muy estudiada en las dos últimas décadas por unos presuntos efectos beneficiosos sobre la salud, que abarcan desde la reducción del colesterol (357) al alivio de los síntomas que experimentan las mujeres con la menopausia (448). La popularidad de la soja y sus derivados (en forma de aceite, salsa, tofu, miso, etc.) en Occidente en los últimos años deriva tanto de la difusión de sus componentes beneficiosos como de la suposición de que el consumo elevado de soja en países como Japón está en la base de su reducida prevalencia tanto de enfermedad coronaria como de síntomas climatéricos en las mujeres. También ha contribuido a ello el hecho de que la FDA aprobara, en octubre de 1999, la proteína de soja como un suplemento alimentario eficaz en la reducción del riesgo cardiovascular por sus efectos hipolipemiantes; la agencia del medicamento estadounidense estableció el consumo recomendado en 25 g/día como parte de una dieta baja en grasas saturadas y colesterol. Diversos estudios clínicos demuestran que hay una relación inversa entre el consumo de soja y las concentraciones de colesterol sérico (129). Anderson y cols. (449) llevaron a cabo un metaanálisis de 38 estudios clínicos que investigaban el efecto de la proteína de soja sobre los lípidos; concluyeron que, en humanos, el consumo de proteína de soja en lugar de proteína de origen animal disminuía el colesterol total, el colesterol LDL y los triglicéridos, sin afectar el colesterol HDL. También encontraron que el consumo de 25 g/día de proteína de soja disminuía el colesterol 8,9 mg/dl y que 50 g/día lo reducía 17,4 mg/dl; asimismo, observaron que el efecto hipolipemiante era más llamativo en individuos hipercolesterolémicos que en aquéllos normolipémicos. Estos autores (449) sugirieron que los fitoestrógenos de la soja eran la principal causa de los efectos lipídicos. Dos metaanálisis publicados recientemente también 106 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 examinan el efecto de la proteína de soja sobre el perfil lipídico de sujetos adultos. Uno de ellos (450) evalúa un total de 41 ensayos controlados de distribución aleatoria y concluye que el suplemento de proteína de soja se asocia a una reducción modesta pero significativa en el colesterol total sérico (5,26 mg/dl), colesterol LDL (4,25 mg/dl), y triglicéridos (6,26 mg/dl) y a un aumento significativo del colesterol HDL (0,77 mg/dl). Otro metaanálisis (451), que incluye 23 estudios publicados desde 1995 a 2002, encuentra que el suplemento de proteína de soja que contiene isoflavonas reduce el colesterol total sérico un 3,77%, el colesterol LDL un 5,25% y los triglicéridos un 7,27%, e incrementa el colesterol HDL un 3,03%; estos cambios están relacionados tanto con la duración del período del consumo como con las concentraciones lipídicas iniciales de los sujetos incluidos en los estudios. En cambio, los comprimidos que contienen extractos de isoflavonas de soja no presentan un efecto significativo sobre la reducción del colesterol total. Estos resultados son indicativos de que el suplemento de proteína de soja puede reducir modestamente los lípidos séricos entre los adultos con hipercolesterolemia o sin ella. Los principales fitoestrógenos de la soja son las isoflavonas (genisteína y daidzeína), moléculas químicamente similares a los estrógenos humanos y, por ello, con capacidad de unirse a los receptores estrogénicos, si bien presentan una actividad estrogénica débil (448). En consecuencia, y aun sin ser hormonas, presentan efectos hormonales similares a los estrógenos, y podrían producir efectos estrogénicos capaces de mejorar los síntomas climatéricos. Sin embargo, otros estudios sugieren que las isoflavonas podrían ejercer un efecto estrogénico en mujeres posmenopáusicas y, por el contrario, actuarían produciendo una actividad antiestrogénica en un entorno altamente estrogénico, como el presente en las mujeres premenopáusicas. Esta actividad estrogénica de las isoflavonas justificaría su efecto hipocolesterolemiante, similar al de los estrógenos naturales o sintéticos. De todos modos, otros estudios en los que se administraba proteína de soja sin isoflavonas o con cantidades variables de éstas, o bien isoflavonas aisladas de la soja o del trébol rojo (otra planta rica en fitoestrógenos), ponen en duda que los efectos lipídicos se deban a las isoflavonas (129, 357, 452). Del mismo modo que otras legumbres menos vistosas (y con menores cantidades de fitoestrógenos), como las alubias, la soja contiene muchas moléculas bioactivas (fibra, saponinas, fitoesteroles, ácido fólico, antioxidantes, etc.), que pueden tener efectos favorables sobre los lípidos y el riesgo cardiovascular (453). Después de todo, y aunque se le ha prestado menos atención, las alubias también tiene efecto hipocolesterolemiante (454-456) y, lo que es más importante, hay datos de grandes estudios prospectivos que indican que el consumo frecuente de legumbres de cualquier tipo previene la aparición de una enfermedad coronaria (457). Probablemente debido a su actividad estrogénica, las isoflavonas poseen otros efectos beneficiosos sobre la salud cardiovascular (452). Un efecto en el que coinciden varios estudios realizados en humanos es la capacidad vasodilatadora arterial y de mejoría de la función 107 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA endotelial; aunque hay menos datos, también se ha descrito un efecto antioxidante. Ya que la disfunción endotelial y la oxidación lipídica son procesos fundamentales en el inicio y en el mantenimiento de la aterosclerosis, es evidente que las isoflavonas tienen un papel prometedor en la prevención cardiovascular. Recientemente, los resultados de un estudio (458) no han coincidido con la hipótesis de que, en adultos con hipercolesterolemia moderada, la proteína de la soja con isoflavonas tenga un efecto hipolipemiante si se compara con las proteínas lácteas; asimismo, desde una perspectiva clínica, una revisión publicada en 2006 (459) es crítica con el papel potencial de los suplementos de proteína de soja e isoflavonas sobre el perfil lipídico y la prevención cardiovascular. También la American Heart Association ha publicado en enero de 2006 un asesoramiento científico (460) en el que evaluaba los estudios más recientes en relación con la proteína de la soja y sus componentes, las isoflavonas: la publicación sugería que pueden haberse sobreestimado sus ventajas, ya que no se ha podido confirmar que la proteína de soja tenga efectos favorables importantes sobre la salud cardiovascular. En la mayoría de los 22 ensayos de distribución aleatoria analizados, una cantidad elevada de proteína de soja (con un promedio de 50 g) disminuyó el colesterol LDL una media de un 3% cuando sustituía a la proteína de la leche o a una mezcla de proteínas animales; no se encontraron ventajas significativas sobre el colesterol HDL, los triglicéridos o la presión arterial. Las pruebas son menos favorables con las isoflavonas de soja, que tampoco mostraron ser útiles para reducir los síntomas vasomotores menopáusicos. Por esta razón, la American Heart Association manifiesta que no se deben recomendar los suplementos de isoflavonas en alimentos o en píldoras. En cambio, los productos derivados de la soja, tales como el tofu o queso de soja, la mantequilla de soja o las hamburguesas de soja (poco consumidos en nuestro medio), pueden ser beneficiosos para el sistema cardiovascular cuando sustituyen a alimentos como hamburguesas de origen animal, queso u otras fuentes de grasa saturada o grasa trans. De todos modos, la única recomendación aceptable en la actualidad para la población es la de consumir con frecuencia legumbres de todo tipo en la dieta habitual. 6.3. ESTEROLES VEGETALES Los esteroles vegetales o fitoesteroles (beta-sitosterol, campesterol, estigmasterol y otros) son componentes estructurales y funcionales en las membranas celulares de las plantas, de forma análoga al colesterol en los mamíferos. La estructura química de los fitoesteroles también es similar a la del colesterol: se diferencian únicamente en la estructura de la cadena lateral (Figura 33). El hombre no puede sintetizar estos compuestos, y su absorción intestinal es notablemente menos eficiente que la del colesterol (228, 357, 461, 462). En efecto, a pesar 108 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA HO COLESTEROL [Δ5-colesten-3β-ol] HO HO H 6 SITOSTANOL [24-etil-Δ5-colestan-3β-ol] SITOSTEROL [24-etil-Δ5-colesten-3β-ol] FIGURA 33. Estructura química de los esteroles vegetales de que su estructura es casi idéntica, el colesterol y los esteroles vegetales se metabolizan de modo distinto. La absorción del colesterol en el intestino humano es de un promedio del 50%, mientras que la absorción de los esteroles vegetales no supera el 5% y, una vez absorbidos, son rápidamente excretados en la bilis (228). En general, los aceites vegetales de maíz, girasol y oliva, en este orden, son la fuente principal de esteroles vegetales, seguidos por los frutos secos, las legumbres y los cereales, también en este orden. El aporte diario de esteroles vegetales depende del tipo de alimentación: la dieta occidental habitual puede contener entre unos 150-400 mg/día de esteroles vegetales, entre los cuales destaca por su frecuencia el beta-sitosterol; mientras que una alimentación vegetariana puede llegar hasta 1 g/día (461, 463). Desde hace décadas se conoce que la administración oral de cantidades considerables (gramos) del principal esterol vegetal, el beta-sitosterol, reduce la colesterolemia debido a que causa una inhibición de la absorción intestinal del colesterol. La deficiente absorción de los fitoesteroles sugería que sus efectos se llevaban a cabo en el lumen intestinal y, efectivamente, se ha comprobado que interfieren en la solubilización micelar del colesterol, tanto por una mayor afinidad para las micelas como por pura competición física en ellas (228, 461, 462, 464) (Figura 34). Y ello afecta tanto al colesterol procedente de la dieta como al de origen biliar. El colesterol no absorbido debido al bloqueo de los fitoesteroles se elimina por las heces. Debido 109 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Colesterol dietético 250-500 mg/día Colesterol biliar 600-1000 mg/día Fitoesteroles 1,6-3g/día + Colesterol dietético 250-500 mg/día Absorción 50% Intestino delgado Excreción 50% NORMAL Colesterol biliar 600-1000 mg/día Absorción 25% Intestino delgado Excreción 75% FITOESTEROLES FIGURA 34. Mecanismo de acción de los fitoesteroles (464) al mecanismo de acción de los esteroles vegetales, es aconsejable recomendar su consumo junto con las principales comidas, ya que de esta manera se observa una mayor reducción de las concentraciones de colesterol sérico (465). La reducción de la absorción de colesterol determina que llegue menos colesterol al hígado, lo cual tiene dos efectos compensatorios: por un lado, produce un aumento de la síntesis; por otro, un incremento de la expresión de los receptores de las LDL (228). Pero el efecto neto es la reducción de las cifras de colesterol total y de colesterol LDL del suero. La mejora del sabor y la biodisponibilidad de los fitoesteroles, mediante esterificación o por su transformación en estanoles por saturación del doble enlace en C:5 y una subsiguiente esterificación, han conseguido una buena eficacia hipocolesterolemiante a dosis inferiores, al mismo tiempo que han simplificado notablemente su administración (466). Se han podido observar los efectos lipídicos beneficiosos de los esteroles y los estanoles vegetales en numerosos estudios (228, 357, 425, 461, 464, 467) (Figura 35). Las dosis de entre 2 y 3 g al día de esteroles o estanoles descienden las concentraciones de colesterol total un 5%-10%, y las de colesterol LDL un 10%-15%, sin afectar los triglicéridos o el colesterol HDL (467). Estos efectos se producen de una forma dependiente de la dosis; no obstante, consumos de cantidades superiores a 2-3 g al día no producen un descenso mayor del colesterol (467, 468). Sin embargo, existe una considerable variabilidad en la respuesta entre los individuos que se atribuye a diferencias intrínsecas en la eficiencia de la absorción del colesterol (las personas con una tasa de absorción baja tendrán menor respuesta, y ocurrirá lo contrario en las que absorben eficientemente el 110 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 18 Porcentaje de reducción 16 Colesterol LDL 14 12 10 Colesterol total 8 6 4 2 0 0 0,5 1 1,5 2 2,5 3 3,5 4 4,5 Dosis de ésteres de fitoesteroles (o estanoles) (g/día) FIGURA 35. Relación dosis-respuesta entre esteroles vegetales y colesterolemia colesterol) y en la compensación hepática (si el hígado tiene una hiperrespuesta en la síntesis de colesterol, se reduce menos el colesterol LDL, y viceversa) (228, 469). Por su efecto reductor del colesterol, además de por su bajo coste, su inocuidad y su acción limitada al tubo digestivo, estos compuestos se han incorporado a margarinas y otros productos dietéticos, y se han introducido en la cadena alimentaria como verdaderos alimentos funcionales. Los alimentos enriquecidos en esteroles/estanoles son los que ofrecen más pruebas científicas que apoyan su funcionalidad. La escasa hidrosolubilidad de los esteroles y los estanoles ha determinado que se incorporen habitualmente a alimentos grasos, como las margarinas; no obstante, recientemente se ha comprobado que también son biodisponibles, e igualmente eficaces para reducir el colesterol, si se administran con alimentos bajos en grasa (470-474). El efecto hipocolesterolemiante se ha demostrado en poblaciones diversas, como niños y adultos, personas sanas o con enfermedad coronaria previa o diabetes, así como en pacientes con hipercolesterolemia moderada o grave (425, 467, 468, 475-477). Merece destacarse la eficacia de los fitoesteroles en niños con hipercolesterolemia familiar heterocigota, pues se trata de una terapia inocua y bien tolerada, que puede administrarse sin problemas en una población (niños < 12 años) en la que hay una cierta incertidumbre sobre la seguridad de las estatinas (475, 478, 479). También es importante señalar que, debido a la gran aportación de colesterol endógeno procedente de la bilis al intestino, el efecto hipocolesterolemiante de los fitoesteroles/estanoles se mantiene aunque la dieta sea baja en colesterol. Las margarinas que 111 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA contienen esteroles/estanoles vegetales, que se comercializaron por primera vez en Finlandia en 1995, son el primer alimento funcional con acción hipocolesterolemiante que fue aprobado de acuerdo al Reglamento de Nuevos Alimentos de la Unión Europea 258/97 en el año 2000. La FDA también las aprobó en septiembre de 2000. Posteriormente, en el año 2004, se aprobó el resto de la gama de productos lácteos enriquecidos con esteroles: la bebida láctea y el yogur bebible (leche fermentada) que se comercializan en nuestro país desde entonces. También es importante mencionar que el tratamiento con esteroles vegetales tiene un efecto hipocolesterolemiante sinérgico con el de las estatinas (480-484) (Tabla 39). Esto se debe a que los mecanismos de acción de ambos compuestos son complementarios por la inhibición simultánea de la absorción y de la síntesis del colesterol. Recientemente se ha ampliado el número de alternativas al tratamiento de la hipercolesterolemia con la aparición de un nuevo fármaco hipocolesterolemiante, la ezetimiba, que actúa reduciendo la absorción intestinal de colesterol; no obstante, su acción no se produce en las micelas del lumen intestinal, como en el caso de los esteroles, sino en el borde en cepillo de las células de la mucosa del intestino delgado. Sin embargo, una terapia combinada entre esteroles vegetales y ezetimiba no tiene como consecuencia un mayor beneficio terapéutico, aun a pesar de sus diferentes mecanismos de acción sobre la absorción intestinal de colesterol (485). TABLA 39. Estudios clínicos controlados sobre la eficacia de los esteroles vegetales en pacientes tratados con estatinas. Estudio Individuos Gylling y cols. Mujeres (480) posmenopáusicas con EAC* (n = 10) Estatina Tratamiento Duración Cambio adicional del C-LDL Simvastatina 10-20 mg/día Estanoles 3 g/día 12 semanas -16% Blair y cols. (481) Hipercolesterolemia (n = 148) Varias Estanoles 3 g/día 8 semanas -10% Neil y cols. (482) Hipercolesterolemia familiar (n = 30) Varias Esteroles, 2,5 g/día 8 semanas -11% O’Neill y cols. Hipercolesterolemia (483) familiar (n = 25) Varias Estanoles, 2,6 g/día 8 semanas -7% Cater y cols. (484) Varias Estanoles 3 g/día 8 semanas -15% Simvastatina 10 mg/día Estanoles 3 g/día 6 semanas -13% EAC* (n = 10) Hipercolesterolemia (n = 13) *EAC: enfermedad arterial coronaria. 112 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 La administración de los fitoesteroles/estanoles a las dosis indicadas es inocua. Ya se ha comentado que se absorben muy poco y se excretan rápidamente por la bilis, por lo que no hay riesgo de acumulación en el organismo. El único efecto adverso de estos compuestos es una discreta malabsorción y reducción subsiguiente de las concentraciones séricas de vitaminas liposolubles, como los betacarotenos, el licopeno y otras (425, 464, 467, 468, 486), derivada del mecanismo de acción, aunque sin repercusión clínica. Su significación fisiológica no está aún clara, y quizás sea prudente un control de estas vitaminas en individuos con riesgo, como, por ejemplo, en los ancianos, en el embarazo o en la lactancia. Sin embargo, la recomendación de incrementar el consumo de frutas y hortalizas durante el tratamiento con esteroles vegetales es fundamental, ya que se ha observado una prevención de la reducción de las concentraciones plasmáticas de carotenoides al aumentar el consumo de vegetales (487, 488). La única contraindicación estricta a la administración de estos compuestos es la existencia de un defecto metabólico raro, la sitosterolemia, que presenta una hiperabsorción intestinal de todos los esteroles asociada a aterosclerosis acelerada (489). Por otro lado, nuevos acercamientos dietéticos donde se combinan diferentes alimentos con acción hipolipemiante pueden ofrecer otras opciones dentro de la terapia hipocolesterolemiante. El efecto de una “dieta portfolio”, en la que, además de pocas grasas saturadas, están presentes de forma significativa los esteroles vegetales, la proteína de soja, los frutos secos y la fibra soluble, no difiere de las estatinas de primera generación en lo que a la obtención de los objetivos lipídicos se refiere (490, 491). En resumen, la inhibición de la absorción intestinal del colesterol con fitoesteroles/estanoles es una manera eficaz de reducir la colesterolemia que es adicional a la conseguida mediante una dieta baja en grasa saturada y colesterol. 6.4. ÁCIDOS GRASOS OMEGA 3 Los efectos biológicos de los ácidos grasos n-3, muchos de ellos relacionados con la salud cardiovascular, se han comentado con anterioridad en referencia a las grasas poliinsaturadas y al papel beneficioso del consumo de pescado (rico en los ácidos grasos n-3 eicosapentaenoico y docosahexaenoico) o de alimentos enriquecidos en ácido alfa-linolénico, el n-3 vegetal (véanse Capítulos 2.2, 3.1 y 5.2). Entre sus efectos, encontramos el descenso de los triglicéridos, la reducción de la agregación plaquetaria, su efecto antiinflamatorio o la protección del endotelio. Todo ello ha movido a la industria alimentaria a comercializar alimentos (generalmente lácteos) enriquecidos en tales nutrientes, en especial en ácido eicosapentaenoico (EPA) y en ácido docosahexaenoico (DHA), con la pretensión de mejorar la protección del sistema cardiovascular, ayudando a cubrir el consumo recomendado de 0,6-0,9 g al día (0,3% del valor caló113 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA rico total) (492). Sin embargo, sus concentraciones en esos alimentos son muy bajas: oscilan entre los 30 y los 60 mg de EPA y DHA por 100 g de bebida láctea de diferentes marcas; es decir, la ingestión de un vaso aportaría entre 60 y 120 mg, cantidad muy lejana al requerimiento diario. Aunque estudios aislados sugieren que este tipo de alimentos pueden influir sobre el colesterol LDL, no existen evidencias clínicas de que reduzcan el riesgo cardiovascular. El estudio GISSI-Prevenzione demostró que el consumo de aceite de pescado reduce la incidencia de nuevos episodios cardiovasculares y de muerte súbita en pacientes con antecedentes de infarto de miocardio (139). No obstante, trabajos más recientes, analizados en una revisión que incluyó tanto estudios observacionales como de intervención, concluyeron que el efecto cardiovascular de los omega 3 es nulo (493). Sin embargo, un trabajo posterior, en el que se analizaron distintas fuentes de omega 3 en distintas situaciones clínicas, ha concluido que el aporte de EPA y DHA, procedentes de pescado entero o de suplementos de pescado, reduce todas las causas de mortalidad, la muerte de origen cardiaco, la muerte súbita y, posiblemente, el ictus (494). Las pruebas son más potentes en el caso de la prevención secundaria que en el de la primaria, efecto que no pudo constatarse cuando se evaluó el consumo de ácido alfalinolénico (494). Por tanto, parece razonable recomendar pescado azul y suplementos de pescado en personas con arteriosclerosis previa, mientras que, en personas sanas, la recomendación debe circunscribirse al consumo de alimentos enteros, ricos en omega 3. 6.5. ANTIOXIDANTES En la actualidad, a los antioxidantes se les atribuye un potencial papel protector respecto a enfermedades en las que existe un incremento del estrés oxidativo y de la producción de radicales libres, como la arteriosclerosis, el infarto de miocardio y los procesos de isquemia/ reperfusión, entre otros. Los antioxidantes pueden ser sintetizados por el organismo o pueden ser aportados por la dieta. Los más importantes son la vitamina C, los carotenoides (principalmente el licopeno y el betacaroteno), la vitamina E y los flavonoides (Tabla 40). La vitamina C es uno de los más potentes antioxidantes en fase acuosa, y su fuente principal son las frutas, las verduras y las hortalizas (cítricos, fresas, kiwi, melón, tomate, pimiento, col, coliflor, etc.) y, entre los alimentos de origen animal, cabe destacar el hígado. Los carotenoides son moléculas liposolubles pero con una parte hidrófila y otra lipofílica, lo que les permite estar situados en las membranas celulares y en la parte externa de las lipoproteínas; existen más de seiscientos distintos, de los cuales, más de 50 son precursores de la vitamina A o retinol. La vitamina A se encuentra mayoritariamente en la materia grasa de ciertos alimentos de origen animal, como carnes, hígado, huevos, leche, nata, queso y mantequilla. Son ricos en betacarotenos los alimentos de origen vegetal, como frutas, verduras y hortalizas (especialmente zanahorias, 114 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA TABLA 40. Tipos y fuentes naturales de antioxidantes. ANTIOXIDANTES FUENTES NATURALES VITAMINAS Alfatocoferol Aceites de semillas, frutos secos, zanahorias, espinacas, brécol Vitamina C Cítricos Vitamina E Aceite vegetal, frutos secos CAROTENOIDES Betacaroteno Zanahoria, tomate Licopeno Tomate FLAVONOIDES Flavonoides (quercitina) Cebolla, manzanas, té, brócoli Flavanoles (catequina, epicatequina) Té, cacao, manzana, uva Antocianidinas Bayas, uva roja, cereza Flavanonas Cítricos Otros Apio, brécol, endivias, aceite de oliva, puerros, mosto, vino tinto, hierbas aromáticas tomate, cítricos, calabaza, melón, albaricoque y las hojas verdes de verduras como las espinacas). Con el nombre de vitamina E nos referimos genéricamente a todos los tocoferoles y los tocotrienoles, entre los que destaca el alfatocoferol como antioxidante natural más efectivo en fase lipídica. La absorción de la vitamina E está ligada a la absorción y la digestión de las grasas, y su principal fuente son las grasas vegetales y sus derivados, los granos de cereales, el germen de trigo, las judías secas y los frutos secos, entre otros. Numerosos estudios epidemiológicos sugieren que las poblaciones que consumen una dieta rica en antioxidantes naturales (betacarotenos, licopeno, terpenos, vitaminas E y C, flavonoides) tienen una menor incidencia de episodios cardiovasculares (321, 495-497). Ya que los alimentos vegetales suelen ser los más ricos en antioxidantes, son coherentes las observaciones de estudios prospectivos de que las personas con un consumo elevado de frutas y verduras tienen una reducción del 20%-40% del riesgo de enfermedad coronaria y vascular cerebral (384, 393, 498, 499). Dos grandes estudios prospectivos confirman la protección cardiovascular y muestran, al mismo tiempo, una menor mortalidad por cualquier causa en las cohortes con mayor consumo de vegetales (500, 501). Estos datos se suman a los ya comentados en capítulos anteriores acerca del beneficio de las dietas ricas en cereales integrales, frutos secos y legumbres sobre la incidencia de enfermedad coronaria o diabetes, y permite 115 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA definir una dieta rica en todo tipo de estos productos vegetales como óptima en la prevención cardiovascular (69). Dentro de los vegetales, hay una riqueza variable en antioxidantes. En un estudio que evaluó la capacidad antioxidante de los alimentos vegetales más comunes en la dieta occidental, se encontró que las bayas (arándanos, fresas, moras, etc.), seguidas de las nueces, eran los alimentos con mayor potencial antioxidante (502). Las hierbas aromáticas y especias características de tantas recetas mediterráneas (perejil, laurel, tomillo, orégano, pimentón, etc.) también contienen abundantes compuestos fitoquímicos, cuyos potentes efectos antioxidantes y probablemente protectores ante la aparición de aterosclerosis, cáncer y otras enfermedades crónicas, están sólo empezando a investigarse (496, 503). Otros aspectos muy importantes y, con frecuencia, no citados de los antioxidantes son el mantenimiento o no de su integridad y los cambios en su biodisponibilidad al manipular y cocinar los alimentos que los contienen. Así, que un alimento contenga compuestos altamente bioactivos no significa que estén biodisponibles cuando éste se consume en crudo, como demuestra el licopeno del tomate, que se absorbe mejor a partir de la salsa de tomate que del tomate crudo (504), y aún está más biodisponible si la salsa de tomate se fríe en aceite (505). Esto sucede porque el licopeno está contenido en membranas celulares que se rompen al hacer la pasta de tomate, y porque se trata de una molécula hidrófoba que es solubilizada por el aceite. Sin embargo, los antioxidantes del propio aceite probablemente se desnaturalizan al calentarlo, especialmente si se trata de aceites poliinsaturados (506). Este ejemplo ilustra la complejidad de la ciencia de la nutrición, en la que pocas veces se tienen en cuenta las profundas transformaciones que pueden sufrir los alimentos y los nutrientes que contienen con el cocinado. En diversos estudios epidemiológicos se demuestra que existe una relación inversa entre el consumo de polifenoles y el riesgo de padecer una enfermedad cardiovascular, ya que entre sus efectos antioxidantes encontramos que origina un aumento en la producción de factores vasodilatadores (óxido nítrico, prostaciclinas) y una disminución de la síntesis de vasoconstrictores en el endotelio, lo que causa efectos vasoprotectores, antiaterogénicos, vasorrelajantes y antihipertensivos cuando se consumen de forma natural (507). Ciertos marcadores inflamatorios, como la proteína C reactiva -que aparece como un emergente factor de riesgo cardiovascular-, se asocia directamente a las concentraciones reducidas en plasma de vitaminas antioxidantes. Así, se ha visto que la capacidad antioxidante de la dieta está relacionada, de forma inversamente proporcional e independiente, con las concentraciones de proteína C reactiva, y éste podría ser uno de los mecanismos que expliquen el efecto protector contra enfermedades cardiovasculares de una dieta rica en alimentos antioxidantes, como frutas, cereales enteros, vino, etc. (508). En nuestro medio, en pacientes de alto riesgo cardiovascular, una dieta mediterránea rica en antioxidantes, en la que la grasa culinaria es un aceite de oliva 116 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 virgen, es capaz de reducir la concentración de proteína C reactiva 0,54 mg/l en relación con otra dieta baja en grasa (149). En los últimos años ha cobrado un especial interés la capacidad antioxidante que presentan determinados polifenoles, especialmente los flavonoides, presentes en diferentes vegetales. Hoy en día se conocen más de 5.000 flavonoides diferentes y, entre los más importantes, encontramos los siguientes: flavonoles (quercitina y rutina), flavanoles (catequina y epicatequina), antocianidinas, flavonas y flavanonas. En general, se encuentran en los aceites, las frutas y los vegetales, así como en bebidas como la cerveza y el vino, que se obtienen por fermentación a partir de la cebada y el lúpulo -en el caso de la cerveza-, y de la uva -en el del vino-. El resveratrol es un tipo de polifenol que se encuentra en más de 70 alimentos de origen vegetal, como uvas, bayas y cacahuetes. Actúa como potente antioxidante y antiinflamatorio en el sistema vascular (509). Mediante mecanismos que proporcionan defensa contra la lesión isquémica, a la vez que promueven la vasodilatación, ayudan a mantener intacto el endotelio, inhiben la oxidación de las LDL, disminuyen la agregación plaquetaria y presentan propiedades estrogénicas (510), el resveratrol protege el sistema cardiovascular. Estos efectos cardioprotectores que se atribuyen al resveratrol y al consumo de algunos alimentos y bebidas, como el vino tinto, que son ricos en él, pueden estar mediados por la estimulación de la expresión de la óxido nítrico sintetasa (511, 512), como se ha demostrado en estudios llevados a cabo en humanos, en los que el resveratrol produce una vasodilatación en la arteria mamaria interna, principalmente dependiente del endotelio y mediada por el óxido nítrico (513). También se han evaluado los diferentes componentes fenólicos del vino tinto en su capacidad para estimular la expresión de la oxido nítrico sintetasa, y se ha encontrado que, de los componentes testados, el resveratrol es el más eficaz, aunque en el efecto antioxidante del vino tinto también están involucrados otros polifenoles (514). En otro estudio (515), un extracto de los componentes polifenólicos de las uvas, entre los que podemos encontrar epicatequina, catequina, resveratrol y quercitina, mejora la función endotelial en pacientes con cardiopatía isquémica. De todo ello podemos inferir que un consumo elevado de polifenoles puede tener efectos beneficiosos sobre el sistema cardiovascular. Recientemente se ha analizado el papel de los antioxidantes de los alimentos en la prevención de la arteriosclerosis (516), y se ha considerado que, con el conocimiento de los factores genéticos relacionados con la oxidación, pueden tener una potencial utilidad futura en el desarrollo de estrategias de intervención dietética preventivas capaces de actuar sobre la actividad de factores de transcripción, como dianas finales en la regulación genética, y que podrían dirigirse a personas identificadas como genéticamente susceptibles de presentar un mayor riesgo cardiovascular. A diferencia de los alimentos naturales ricos en vitaminas antioxidantes, los suplementos vitamínicos sintéticos administrados durante períodos prolongados a pacientes coronarios o de alto riesgo, según se ha observado en estudios clínicos de distribución aleatoria, no han 117 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA demostrado beneficio alguno en prevención cardiovascular. En el estudio GISSI (139), en el que se incluyó a más de 11.000 pacientes que ya habían sufrido un infarto agudo de miocardio, la vitamina E a una dosis de 300 mg/día no produjo cambios significativos en la morbimortalidad cardiovascular. Los mismos resultados nulos se observaron en el estudio HOPE (517), con dosis de vitamina E de 400 mg/día, y en el Heart Protection Study (518), un estudio efectuado en 20.536 individuos de alto riesgo, con la administración de una combinación de vitaminas antioxidantes (600 mg de vitamina E, 250 mg de vitamina C y 20 mg de betacaroteno al día). En el Women’s Health Study se administró a 39.876 mujeres aparentemente sanas un suplemento de 600 UI de vitamina E a días alternos y, en comparación con la administración de placebo, no se obtuvieron diferencias significativas en la mortalidad total ni en la aparición de episodios cardiovasculares (519). También se ha estudiado la relación entre el consumo de vitamina C, que es un potente antioxidante, y la mortalidad por enfermedad cardiovascular total, por enfermedad coronaria y por ictus en mujeres posmenopáusicas diabéticas (520). Cuando se analizó la fuente de vitamina C de los alimentos y de los suplementos de forma separada, sólo el suplemento mostró una relación positiva con el incremento de mortalidad por enfermedad cardiovascular en estas pacientes. Otros grandes estudios clínicos con administración de suplementos de vitaminas antioxidantes han tenido resultados igualmente decepcionantes (revisados en la referencia 521). Así, el Physicians’ Health Study (522), que llevó a cabo un seguimiento durante 12 años de 22.000 varones sanos, no encontró diferencias en la incidencia de enfermedad cardiovascular entre el grupo que recibió placebo y el que recibió suplementos de vitamina A (betacaroteno). Del mismo modo, en el estudio Alpha-Tocopherol, Beta Carotene Cancer Prevention (523), con un seguimiento de entre cinco y ocho años de más de 29.000 varones fumadores de entre 50 y 69 años, que fueron distribuidos aleatoriamente en grupos a los que se administró vitamina E (50 mg diarios de alfatocoferol), vitamina A (20 mg diarios de betacaroteno), ambas vitaminas o placebo, no se encontraron diferencias significativas en cuanto a reducción del riesgo cardiovascular. En definitiva, existen numerosas evidencias que prueban que el consumo de antioxidantes en forma de suplemento no está asociado a la reducción de la morbimortalidad cardiovascular; de ello se deduce que no es recomendable ni existe justificación actual para la administración de suplementos de vitaminas antioxidantes en la prevención del riesgo cardiovascular (524). Lo que sí es altamente recomendable es el consumo de una dieta rica en alimentos con anti­ oxidantes naturales (frutas y verduras), que ha demostrado de modo contundente su potencial de prevención cardiovascular en todos los grandes estudios de cohortes, además de lograr un aumento de la capacidad antioxidante del suero, protegiendo el colesterol LDL de la oxidación (525), modulando la función endotelial y ejerciendo cardioprotección (526, 527). 118 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 6.6. ÁCIDO FÓLICO El aumento de la homocisteína en sangre, íntimamente asociada a un descenso en la disponibilidad de ácido fólico, es un factor de riesgo de trombosis venosa profunda y de enfermedad cardiovascular precoz en sus diferentes manifestaciones clínicas: enfermedad arterial coronaria, enfermedad vascular cerebral y enfermedad vascular periférica (528-531). La relación entre la concentración de homocisteína y el riesgo cardiovascular es gradual, continua, y no existe un valor umbral a partir del cual se inicie o desaparezca el riesgo. Un metaanálisis de 27 estudios mostró que un incremento en la homocisteína plasmática de 5 mmol/l aumentaba el riesgo de enfermedad coronaria de forma similar al de un incremento de 20 mg/dl en el colesterol sérico (532). También en el seguimiento de 32.826 mujeres del Nurses’ Health Study, la hiperhomocisteinemia aparece como un factor pronóstico independiente de riesgo cardiovascular, y se relaciona de forma inversa con la ingestión de ácido fólico (533). En los pacientes con enfermedad coronaria prematura de nuestro medio, la prevalencia de hiperhomocisteinemia, definida como la concentración de homocisteína por encima del percentil 90 de la población sana, es del 22% (531). VÍAS METABÓLICAS DE LA HOMOCISTEÍNA Aceptor de metilos Aceptor metilado S-adenosil metionina CICLO DE LA REMETILACIÓN Dimetilglicina Metionina BHMT S-adenosil homocisteína MS Ácido fólico Tetrahidrofolato Vit. B12 Betaína Homocisteína CBS 5 metil tetrahidrofolato 5 metilen tetrahidrofolato MTHFR Vit. B12 Vit. B6 Cistationina CICLO DE LA TRANSULFURACIÓN Vit. B6 Cisteína Sulfato MS: Metionina sintasa MTHFR: Metilen tetrahidrofolato reductasa CBS: Cistationina betasintasa BHMT: Betaína homocisteína metiltransferasa FIGURA 36. Metabolismo de la homocisteína 119 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA El metabolismo normal de la homocisteína requiere la participación del ácido fólico y las vitaminas B6 y B12 como cofactores (Figura 36). Las concentraciones plasmáticas de estas vitaminas se correlacionan inversamente con las concentraciones de homocisteína, y un consumo deficiente de ellas puede contribuir a un aumento de la homocisteinemia y a un consiguiente incremento del riesgo cardiovascular. Una alimentación rica en ácido fólico es capaz de disminuir las concentraciones de homocisteína sérica, y de esta forma mejorar el perfil cardiosaludable de la dieta. El Framingham Offspring Study demostró que el ácido fólico era uno de los determinantes principales de la concentración de homocisteína plasmática (534). También se ha demostrado que las concentraciones elevadas de homocisteína están inversamente relacionadas con las concentraciones plasmáticas de vitaminas B6, B12 y ácido fólico, y que están asociadas a un aumento de la mortalidad cardiovascular y de la incidencia de ictus (535). Además de su relación con las concentraciones de homocisteína, el ácido fólico y la vitamina B6 se han relacionado con un mayor riesgo cardiovascular de una forma independiente a las concentraciones elevadas de homocisteína (536). El mayor riesgo cardiovascular asociado a la hiperhomocisteinemia estaría mediado por mecanismos en los que parecen estar implicados el efecto citotóxico de la homocisteína sobre las células endoteliales, el aumento de la adhesividad y agregabilidad plaquetarias, diversas alteraciones de los factores de la coagulación, y fenómenos prooxidativos del colesterol LDL (537, 538). El tratamiento de la hiperhomocisteinemia varía según el trastorno causal subyacente, pero generalmente implica una suplementación con ácido fólico y, en ocasiones, también con vitaminas B6 y B12. Un metaanálisis de ensayos de reducción de la homocisteína, llevado a cabo en 1.114 individuos a los que se administraron vitaminas del grupo B, ha indicado que la adi­ ción de un suplemento de folatos de 0,5-5 mg/día reduciría las concentraciones de homocisteína en un 25%, y si se añadieran 0,5 mg de vitamina B12, se lograría una reducción adicional del 7% (539). Sería de esperar que el tratamiento de la hiperhomocisteinemia con ácido fólico, al reducir las concentraciones de homocisteína y mejorar la función endotelial (540), redujese el riesgo de enfermedad cardiovascular en una proporción similar a la sugerida por los estudios epidemiológicos (532). Otros estudios clínicos han demostrado que los suplementos con ácido fólico mejoran la función endotelial en pacientes con arteriosclerosis coronaria (541), y en diabéticos tipo 2 (542), incluso independientemente de la disminución de la homocisteinemia (543). Un metaanálisis de 72 estudios de casos y controles y de 20 estudios prospectivos concluye que la reducción de la homocisteína plasmática en 3 µmol/l, que puede alcanzarse mediante el aumento del consumo de ácido fólico, reduciría en un 16% el riesgo de enfermedad coronaria, un 24% el riesgo de ictus isquémico y un 25% el riesgo de trombosis venosa (544). Sin embargo, hay escasos resultados de estudios clínicos que demuestren una disminución de la morbimortali120 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 dad asociada a la enfermedad cardiovascular mediante la reducción de las concentraciones de homocisteína (545). El estudio de Schnyder y cols. (546) demuestra que el tratamiento de la hiperhomocisteinemia disminuye la recurrencia de reestenosis postangioplastia en pacientes con enfermedad coronaria. Posteriormente, el mismo grupo de Schnyder evaluó la influencia de un suplemento de ácido fólico y de vitaminas B6 y B12 sobre episodios cardiacos fatales, de infarto agudo de miocardio no mortal y de necesidad de repetir la revascularización, en el seguimiento de 553 pacientes, después de que se les realizara una angioplastia, distribuidos aleatoriamente para recibir una combinación de ácido fólico (1 mg/día), vitamina B12 (cianocobalamina, 400 µg/día), y vitamina B6 (piridoxina, 10 mg/día) o placebo durante seis meses. Los resultados mostraron, al cabo de un año, que en el grupo de intervención se había producido una reducción significativa en el principal objetivo de valoración combinado (definido como muerte, infarto agudo de miocardio no mortal y necesidad de repetir la revascularización cardiaca), pero sólo significativo a favor del grupo de tratamiento en la necesidad de revascularización cuando se analizaron por separado los objetivos principales (547). Otro metaanálisis del año 2006 estudió el efecto de un suplemento de ácido fólico, vitamina B6 y vitamina B12 sobre la progresión de la arteriosclerosis, que se evaluó mediante técnicas de imagen como la ecografía carotídea o la angiografía coronaria, y no se encontraron pruebas de un efecto protector (548). En el estudio Vitamin Intervention for Stroke Prevention, hecho en pacientes con ictus isquémico, a los que se administraron dosis elevadas de ácido fólico y de vitaminas B6 y B12 a un grupo de intervención frente al grupo de control, que recibió dosis más bajas, se disminuyó la homocisteinemia un 15%, pero no se observó reducción del riesgo de ictus ni de infarto agudo de miocardio (549). Estos resultados son coincidentes con los de un amplio estudio de reciente publicación, en el que el suplemento de vitaminas no muestra beneficio cardiovascular alguno (550). De la misma manera, en otro estudio del año 2005, la disminución de un 29% de la homocisteinemia que se consiguió con un suplemento de vitaminas B6, B12 y ácido fólico administrados durante seis meses, no fue pareja con una reducción significativa de los marcadores vasculares inflamatorios, de disfunción endotelial o de hipercoagulabilidad en pacientes con isquemia vascular cerebral aguda transitoria o permanente (551). En ese sentido, en el reciente estudio NORVIT, llevado a cabo en pacientes que habían sufrido un infarto agudo de miocardio, se han evaluado los efectos de la disminución de la homocisteinemia con el tratamiento con vitaminas B6, B12 y ácido fólico. La homocisteinemia se redujo en un 27% entre los pacientes a los que se les había administrado ácido fólico y vitaminas del grupo B, pero no conllevó una reducción del riesgo de infarto agudo de miocardio o de ictus; además, se ha sugerido un efecto nocivo de la combinación de ácido fólico y vitamina B6. Se concluyó que no deben prescribirse altas dosis de vitaminas del grupo B para la prevención secundaria de enfermedades cardiovasculares, y que la combinación de ácido fólico y vitamina B6 podría aumentar el riesgo de enfermedad cardiovascular (552) (Figura 37). 121 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 0,30 Riesgo acumulado 0,25 p=0,029 0,20 0,15 Ácido fólico/Vit. B6 Ácido fólico Vit. B6 Placebo 0,10 0,05 0 0 1 2 3 4 Años FIGURA 37. Estudio NORVIT: efecto por grupos de tratamiento sobre el riesgo acumulado del criterio principal de valoración (infarto agudo de miocardio recurrente, ictus y muerte súbita atribuible a cardiopatía isquémica) (552) En definitiva, aunque la homocisteína se ha implicado en la aparición y en la progresión de la arteriosclerosis y en la enfermedad vascular aterotrombótica, no existen suficientes pruebas para recomendar el tratamiento con suplementos de ácido fólico o vitaminas del grupo B en pacientes con hiperhomocisteinemia para su prevención (553). Ello no significa que no debamos ingerir alimentos ricos en ácido fólico y vitaminas, pero no en forma de suplementos aislados. Los alimentos ricos en ácido fólico son: las frutas, las legumbres, los frutos secos, los cereales, hortalizas como la remolacha, y las verduras de hoja verde, como las acelgas y las espinacas (Tabla 41). La leche y los derivados lácteos, así como las carnes y los pescados, son, en general, fuentes pobres de folatos, a excepción del hígado (que, aunque es la fuente más rica de folatos, no es un alimento recomendable desde el punto de vista cardiovascular global). Hay que tener en cuenta que los alimentos ricos en ácido fólico y en vitaminas del complejo B pueden ver afectada su calidad nutritiva y su riqueza vitamínica en el proceso de elaboración y cocción. Los folatos son sensibles a la luz, a los ácidos, a los álcalis, a los oxidantes y a los reductores; y, por su carácter hidrosoluble, también pueden perderse con el agua de cocción de los alimentos. Por ello, se estima que prácticamente el 50% del contenido inicial 122 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA de folatos en los alimentos se pierde en los procesos de preparación alimentaria. Y si, en su elaboración culinaria, se hierven o se fríen, las pérdidas del contenido inicial en folatos de los alimentos pueden alcanzar hasta el 90%. Las verduras pierden casi el 70% de su contenido en folatos cuando se hierven durante ocho minutos, en gran parte por su disolución en el agua de cocción. Así pues, si se lavan en exceso o se remojan, si se cortan en trozos pequeños o si se pelan excesivamente antes de su consumo, si se exponen directamente a la luz solar, o si se cuecen a temperaturas altas o durante un período de tiempo muy prolongado, se puede reducir considerablemente el contenido en vitaminas del grupo B de los vegetales (554). Para conseguir una concentración de homocisteinemia normal, debe asegurarse un consumo de ácido fólico de 0,3 a 0,45 mg diarios, ya sea mediante la dieta, con alimentos ricos en este nutriente (Tabla 41) o bien con alimentos enriquecidos con ácido fólico (galletas, cereales TABLA 41. Contenido en arginina y ácido fólico de algunos alimentos de consumo . habitual. Alimentos (100 g) Arginina (mg) Ácido fólico (µg) Huevos 749 24 Ternera 1831 15 Cerdo 1684 5 Pollo 1410 8 Bacalao 1520 4 Caballa 1376 10 Salmón 1284 26 Cereales (secos) 1098 260 Arroz 174 10 Pan blanco 308 23 Judías verdes 370 31 Lentejas 659 11 Cebollas 120 15 Espinacas 324 153 Almendras 1995 70 Nueces 1580 200 Avellanas 1310 275 123 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA TABLA 42. Recomendaciones dietéticas de ácido fólico en España (555). Categoría y edad (años) Recomendaciones dietéticas (µg/día) Niños 0-0,5 40 0,5-1 60 1-10 100 Jóvenes y Adultos 11-14 100 15-64 200 Ancianos (≥ 65 años) 400 (?) Embarazo 200 Lactancia 100 para el desayuno, etc.), que ayudarán a complementar la dieta y a cubrir las necesidades de ácido fólico. En la Tabla 42 se recogen las recomendaciones dietéticas actuales de consumo de folato para la población española (555). Según datos de una encuesta poblacional, el consumo medio de ácido fólico en España mediante la dieta es de 317 µg/día en hombres y de 303 µg/día en mujeres (556). Un estudio ha valorado en 0,8 mg el aporte diario de ácido fólico necesario para conseguir una reducción máxima de las concentraciones de homocisteína (557). La carencia en folatos es una situación frecuente, fundamentalmente debido a un aumento en sus necesidades orgánicas (en el embarazo), por disminución en su absorción (en ancianos), y por interacción con diversos fármacos (antiepilépticos, anticonceptivos). Por ello, está indicada la administración de un suplemento en estas situaciones. Se ha planteado incluso que el enriquecimiento del pan con ácido fólico podría resultar una medida dirigida a contribuir al control del riesgo cardiovascular desde una perspectiva de salud pública (558). El ácido fólico es inocuo, incluso cuando se ingiere en cantidades que suponen 100 veces los requerimientos mínimos. Por su carácter hidrosoluble, las cantidades ingeridas en exceso tienden a ser eliminadas en la orina y no a acumularse en los tejidos. Por ello, no se han descrito efectos tóxicos de la vitamina cuando se ingiere mediante la dieta. Sin embargo, debe tenerse en cuenta, sobre todo en ancianos, el posible enmascaramiento de una anemia por déficit de vitamina B12 si se administran suplementos de ácido fólico sin conocer el estado vitamínico del paciente. 124 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 6.7. L-ARGININA Diversos estudios han demostrado que la administración de suplementos de L-arginina, un aminoácido precursor del vasodilatador endógeno óxido nítrico, produce dilatación arterial y mejora la función endotelial (559, 560), además de reducir la presión arterial (561). Una revisión evalúa su papel potencial en la hipertensión y estudia los posibles mecanismos implicados, entre los que encontramos, además de los citados, la posible mejora sobre la sensibilidad insulínica (562). Los efectos beneficiosos se han observado a partir de dosis de 2 g/día, particularmente en pacientes con una síntesis reducida de óxido nítrico, como son aquéllos con hipercolesterolemia o enfermedad coronaria ya establecida (560). Un estudio ilustró la capacidad de conseguir beneficios clínicos con un alimento funcional a base de L-arginina, que contenía también proteína de soja y varias vitaminas (563); su administración a pacientes con angina de esfuerzo estable, en comparación con un alimento placebo, mejoró la reactividad vascular en la arteria braquial, el intervalo de tiempo de ejercicio hasta la aparición de angina y la puntuación clínica de angina. En cambio, hay datos que muestran que la terapia oral con L-arginina en pacientes con cardiopatía isquémica no aporta beneficios (564) y, en otro trabajo reciente (565), el suplemento de arginina, a una dosis media de 9 g diarios durante seis meses, añadido a la terapia convencional en pacientes que habían sufrido un infarto, no mostró cambios en las medidas no invasivas de elasticidad vascular ni en la fracción de eyección y, además, se acompañó de una mayor mortalidad (de los 153 pacientes distribuidos aleatoriamente, 6 participantes del grupo de la arginina murieron durante el período de estudio, mientras que no murió ninguno de los incluidos en el grupo que había recibido placebo). Una hipótesis para explicar estos efectos deletéreos tras la administración de arginina es el incremento de la oxidación vascular por aumento de radicales libres que se puede producir en el paciente con aterotrombosis establecida (566), como se ha demostrado en modelos animales en los que los suplementos de L-arginina pueden, paradójicamente, coadyuvar para la formación de la lesión en lugar de contribuir a reducirla (567). Los alimentos ricos en este aminoácido son las nueces, las legumbres y el pescado (Tabla 41). En un estudio de Ros y cols. (335) se demostró que un suplemento de la dieta con nueces en pacientes con hipercolesterolemia es capaz de mejorar la función endotelial, y se ha especulado que este beneficio pudiera deberse a su elevado contenido en arginina, ácido alfa-linolénico y otros fitoquímicos. 6.8. L-CARNITINA La L-carnitina es un derivado del aminoácido lisina. Su nombre deriva del hecho de que, en primer lugar, se pudo aislar de la carne. Se sintetiza principalmente en el hígado y los riñones, 125 6 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA y se concentra sobre todo en los tejidos musculares (esquelético y cardiaco), que usan ácidos grasos como principal combustible dietético, y la L-carnitina sería un cofactor metabólico esencial para su normal metabolismo. La L-carnitina se encuentra, sobre todo, en carnes, pescados, frutas como el aguacate y en productos derivados de la soja. Se han realizado estudios sobre el papel de la suplementación con L-carnitina o propionil-L-carnitina, junto con la terapia estándar, en el infarto agudo de miocardio, en la insuficiencia cardiaca, en el angor, en la claudicación intermitente, etc. Algunos estudios (revisados en la referencia 568), demuestran que la L-carnitina podría tener propiedades antiisquémicas y actuar como un agente antianginoso, mediante mecanismos metabólicos y de mejora de la función vascular (569), y de esta forma podría contrarrestar en el miocardio los efectos tóxicos de las concentraciones elevadas de los ácidos grasos libres que están presentes en la isquemia, reducir la apoptosis y mejorar la reperfusión y la remodelación consecuentes del miocardio infartado, así como atenuar la dilatación ventricular. En pacientes con cardiopatía isquémica, se ha mostrado que el propionil-L-carnitina produce una reducción en la depresión del segmento ST y en la presión ventricular izquierda al final de la diástole del 12% y el 50%, respectivamente (570). También en pacientes con insuficiencia cardiaca, se evidenció que, si se añadía propionil-L-carnitina durante un mes al tratamiento médico estándar, se obtenía una mejor tolerabilidad al ejercicio y una reducción de la depresión del segmento ST, así como una ligera mejora de la presión ventricular izquierda al final de la diástole (571). Las intervenciones nutricionales con carnitina han demostrado efectos clínicos beneficiosos sobre la arteriopatía periférica, que es una manifestación de arteriosclerosis sistémica (572). La claudicación intermitente no es exclusivamente el resultado de la reducción del flujo sanguíneo sino que, además, en los músculos esqueléticos de las extremidades inferiores se producen alteraciones metabólicas que incluyen el deterioro en la actividad de la cadena del transporte mitocondrial de electrones y el acúmulo de intermediarios del metabolismo oxidativo. La L-carnitina y su derivado propionil-L-carnitina pueden mejorar el metabolismo y la capacidad ante el ejercicio de los músculos isquémicos (573), y se postulan como alternativas terapéuticas que se deben considerar en el tratamiento de la arteriopatía periférica, por la mejora de la sintomatología y de la calidad de vida que consiguen en estos pacientes (574). Así, en diabéticos con claudicación intermitente, un suplemento de propionil-L-carnitina (2 g/día durante un año) consiguió una mejora progresiva en la distancia de paseo libre de dolor (575). En otro estudio de distribución aleatoria, llevado a cabo en 485 pacientes con claudicación intermitente, se encontró que se había producido un beneficio con propionil-L-carnitina frente a placebo, tanto en la distancia que podían recorrer como en la calidad de vida, en aquellos pacientes que habían presentado al inicio del estudio una distancia máxima de paseo libre de dolor inferior o igual a 250 metros (576). Los beneficios sintomáticos de un suplemento oral 126 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ALIMENTOS FUNCIONALES EN ATENCIÓN PRIMARIA 6 de 2 g diarios durante seis meses de propionil-L-carnitina en pacientes con claudicación también se muestran en otro ensayo doble ciego de distribución aleatoria (577). Los pacientes con insuficiencia renal crónica en tratamiento con hemodiálisis tienen frecuentemente alteraciones del metabolismo de los ácidos grasos y significativas deficiencias plasmáticas y tisulares de carnitina que incrementan la permeabilidad mitocondrial, la insulinorresistencia y la formación de radicales libres. Estas anomalías están relacionadas con las condiciones clínicas patológicas comunes en los pacientes dializados que incluyen la cardiomiopatía y la resistencia al efecto terapéutico de la eritropoyetina. En 1999, la FDA aprobó la utilización de la L-carnitina para el tratamiento y la prevención de su déficit en pacientes dializados, y se señalaron como efectos beneficiosos de su administración en estos pacientes: el incremento del hematocrito, el descenso de la dosis que necesitaban de eritropoyetina, la mejora sintomática de la fatiga y la menor hipotensión en la diálisis (578). No obstante, las pruebas son limitadas para extender la recomendación del uso de suplementos con derivados de la carnitina a todos los dializados (579). La carnitina también se publicita como “devoragrasas”, y se incluye como suplemento dietético en algunos alimentos con el objeto de ayudar a la reducción de peso de las personas que los consumen y que, en muchos casos, buscan un “producto milagro” que permita una pérdida de peso sin esfuerzo y sin modificar su estilo de vida. Debido a la falta de pruebas al respecto, se debe avisar sobre lo inadecuado del uso de estos suplementos (580). Un estudio evaluó el efecto de complementar un programa de pérdida de peso con carnitina; no se encontraron diferencias significativas entre el grupo de carnitina y el de placebo sobre los parámetros antropométricos y la resistencia a la insulina en mujeres premenopáusicas, mientras que sí se encontraron beneficios atribuibles a las modificaciones dietéticas (dieta hipocalórica rica en proteínas) y al incremento de la actividad física (581). En definitiva, a pesar de que en campañas de marketing aparece la carnitina como útil para perder peso, prevenir el envejecimiento y mejorar el rendimiento atlético, la L-carnitina tiene sólo una indicación bien establecida, que es el tratamiento de su deficiencia. Según los ensayos clínicos parece también haber tenido efectos modestos en algunas otras condiciones, principalmente en la claudicación intermitente, en la insuficiencia renal crónica en pacientes en hemodiálisis y en la recuperación después de un infarto agudo de miocardio (582). 127 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 7. ALIMENTOS TRANSGÉNICOS El hombre ha buscado desde la antigüedad la mejora de las plantas que cultivaba para obtener variedades que ofrecieran mayor rendimiento, más facilidad de cultivo o mayor resistencia a las plagas. Durante los siglos pasados, los agricultores han ido mejorando sus cultivos mediante los tradicionales procedimientos de selección y cruce de variedades entre especies afines (podemos recordar los estudios de Mendel). Así, a lo largo de muchas generaciones, los agricultores llegaban a obtener una variedad mejorada. Frente a este tosco y azaroso procedimiento de fitogenética, actualmente podemos mejorar las características de las plantas a nuestra voluntad por medio de la manipulación genética “de laboratorio”. Entre los alimentos transgénicos destinados al consumo humano tenemos vegetales con el genoma modificado por técnicas de manipulación genética. La ingeniería genética permite introducir y modificar selectivamente genes procedentes de bacterias y otros organismos en plantas con el fin de mejorar sus características. Se crean así nuevos organismos inexistentes en la naturaleza, los llamados “organismos genéticamente modificados”. La tecnología del ADN recombinante permite la manipulación directa y altamente específica del material genético, a través de: (1) la transferencia de genes únicos o de pequeños grupos de genes de un organismo a otro; (2) la manipulación in vitro de los genes propios de una especie vegetal; y (3) la inactivación selectiva de los genes mediante la transcripción de genes antisentido. El objetivo de la manipulación genética de las plantas es doble. Por un lado, se pretende obtener una especie de plantas resistente a las plagas de insectos o a determinadas enfermedades infecciosas; de plantas capaces de crecer en condiciones ambientales adversas (resistentes, por ejemplo, a la congelación); de plantas con un crecimiento acelerado (donde se pueda acelerar la maduración del fruto); o de plantas resistentes al transporte; en definitiva, de plantas que aumenten el rendimiento, reduzcan los costes y disminuyan las pérdidas ocasionadas por las plagas o las enfermedades de las propias plantas. Pero más importantes por su trascendencia en la salud cardiovascular son los “alimentos transgénicos funcionales”, 129 7 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA que son alimentos en los que se aumenta la calidad nutritiva, por ejemplo, por haberse podido modificar el tipo y la concentración de sus grasas. Como ejemplo de alimentos transgénicos funcionales tenemos el denominado “arroz dorado”, que es un arroz modificado por ingeniería genética para producir carotenoides con el objetivo de suplir la deficiencia en vitamina A de muchos millones de personas malnutridas debido al consumo de dietas basadas en este cereal, con escaso o nulo consumo de frutas, legumbres y alimentos de origen animal. Otro ejemplo es el aceite de girasol rico en ácido oleico (y con bajo contenido de ácido linolénico). O la nueva soja transgénica, que contiene entre un 75% y un 80% de ácido oleico, mientras que presenta un bajo contenido en ácido palmítico (3,5%): recordemos que la soja común contiene entre un 15% y un 20% de ácido oleico y un 10% de ácido palmítico. Un último ejemplo es el aceite de canola o canola-colza. La canola es una planta oleaginosa muy consumida en EE.UU. y Canadá, pero no en España. Aunque en algunos ámbitos se habla de colza y de canola indistintamente, o de canolacolza, la planta de la colza no es la misma que la de la canola. Las dos son considerablemente distintas en su composición química y sus cualidades nutricionales. La colza ha formado parte de algunas culturas durante miles de años. Las civilizaciones antiguas en Asia y Europa utilizaban el aceite de colza como combustible de las lámparas. Más tarde, se usó en alimentos y como aceite para cocinar. La colza produce aceites que contienen grandes cantidades de ácidos eicosenoicos y erúcicos, que no se consideran saludables para el hombre. En los años 60 del siglo XX se consiguió producir plantas de colza con un contenido bajo en ácidos eicosenoico y erúcico, que son las plantas que, con los años, se bautizaron con el nombre de canola. Este término se utiliza para referirse “al aceite, grano molido, extractos de proteína, semilla y cáscara de semilla de la variedad o variedades con una presencia de 5% o menos de ácido erúcico en el aceite, y tres miligramos por gramo o menos de glucosinolatos en el grano molido” (583). Así, el aceite de canola es un aceite vegetal comercializado para usar en ensaladas y para cocinar; contiene un 7% de ácidos grasos saturados, un 61% de ácidos grasos monoinsaturados y un 32% de ácidos grasos poliinsaturados: 21% de ácido linoleico y 11% de ácido linolénico. Podemos identificar los alimentos transgénicos mediante la etiqueta de los productos que consumimos; en ella se debe indicar si entre sus ingredientes se encuentran productos modificados genéticamente. Al margen de consideraciones éticas, su consumo no presupone un riesgo para la salud mayor del esperable para otros alimentos “naturales” de composición similar, con la particularidad de que, mediante la manipulación genética, pueden conseguirse cambios cualitativos en los alimentos que mejoren su cardiosaludabilidad. 130 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 6 8. NUTRICIÓN Y GENÉTICA Desde hace años se vienen publicando numerosos trabajos que demuestran que hay diferencias interindividuales en la respuesta a la dieta, fundamentalmente en el ámbito de las enfermedades cardiovasculares (584). Estos estudios han clasificado a los individuos en normo, hipo o hiperrespondedores, en función de si su respuesta fenotípica a la dieta era la esperada, menor a la esperada o superior a la esperada, respectivamente. Sin embargo, a pesar de que se sepa que se producen estas distintas respuestas, los mecanismos que explicarían estas diferencias no se conocen en profundidad. Con el conocimiento del genoma humano, es probable que podamos llegar a descifrar los mecanismos moleculares que determinan la respuesta inter­ individual, y generar, así, una serie de biomarcadores de respuesta que permitan conocer, con antelación a la intervención dietética, el éxito de ésta. Así, en los últimos años, el estudio de la nutrición humana está asistiendo a la revolución genómica, a la transición desde la nutrición clásica a la nutrición molecular, y a la aparición de una nueva disciplina conocida como la genómica nutricional (585, 586). Y, como todo gran cambio, se acompaña de avances pero también de confusión. La genómica nutricional trata de elaborar recomendaciones específicas sobre la mejor composición de la dieta para conseguir el mayor beneficio en cada individuo en función de su dotación genética y, de esta forma, intenta aproximarse a una alimentación personalizada (587, 588). Incluye dos vertientes: la nutrigenética y la nutrigenómica (589). La nutrigenética estudia la respuesta de los individuos a la dieta en función de sus diferencias en el genoma. Incluye la identificación y la caracterización de variantes genéticas relacionadas con una respuesta diferente a los componentes de la dieta y su expresión fenotípica sobre marcadores o variables biológicas útiles desde el punto vista clínico como, por ejemplo, los efectos sobre las concentraciones plasmáticas de colesterol LDL. La nutrigenómica estudia los efectos de los nutrientes sobre el genoma, el proteoma y el metaboloma, y define así nuevas dianas terapéuticas (Figura 38). 131 8 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Nutrigenómicos Nutrigenética Componentes bioactivos de los alimentos ADN Epigenética nutricional ARN Transcriptómica nutricional FENOTIPOS: Proteómica PROTEÍNAS Metabolómica METABOLITOS Dislipemia Hipertensión arterial Enfermedades cardiovasculares Cáncer Diabetes mellitus Obesidad Osteoporosis Otros FIGURA 38. Relación entre los componentes bioactivos de los alimentos, la genética y los factores de riesgo o las enfermedades Ambas facetas aportan una nueva perspectiva sobre cuáles son las mejores recomendaciones alimentarias para mantener la salud y conseguir un envejecimiento óptimo (585). De forma más concreta, nos centraremos en la influencia de la alimentación y la genética sobre las enfermedades cardiovasculares y su principal objetivo terapéutico, la reducción de las concentraciones plasmáticas del colesterol LDL. Cuando se alcanza este objetivo, se procura aumentar el colesterol HDL, por su efecto como factor de protección cardiovascular. Relación de los factores genéticos y la dieta: ¿puede la variabilidad del genoma modificar las concentraciones de lípidos plasmáticos inducidos por la dieta? Las recomendaciones sobre la alimentación en prevención cardiovascular se centran en un bajo consumo de ácidos grasos saturados, colesterol y ácidos grasos de tipo trans (117, 590, 591). Pero es bien conocido que no todas las personas responden de la misma forma a las modificaciones de la dieta y que la respuesta individual a estas recomendaciones no es previsible. La nutrigenética puede aportar alguna explicación. Está claro que la modulación que los factores genéticos ejercen sobre la respuesta a la alimentación es compleja. Una reciente 132 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE NUTRICIÓN Y GENÉTICA EN ATENCIÓN PRIMARIA 8 propuesta apoya la interacción entre ciertos genes, componentes de la dieta y factores de riesgo cardiovascular (586). Los polimorfismos genéticos son variantes en la secuencia de un gen que se presenta en la población con una frecuencia superior al 1%. La mayoría de ellos describen cambios únicamente en un nucleótido (SNPs, Single Nucleotide Polymorphism) e, independientemente de su funcionalidad, pueden actuar como marcadores que relacionan un gen y una enfermedad (592, 593). Los polimorfismos funcionales son relativamente comunes e intervienen en regiones de los genes que regulan o codifican (592, 594). Así, por ejemplo, en relación con la presión arterial, los polimorfismos de la alfa-aducina intervienen en la relación entre ingestión de sal y presión arterial (593). De igual forma, las concentraciones de las apolipoproteínas (apo) y de los lípidos dependen en un 40%-60% de polimorfismos genéticos. La lipoproteína (a) supone su máxima expresión, ya que la determinación genética supera el 90%. La respuesta que se espera después de reducir el consumo de grasa saturada es una disminución de las concentraciones plasmáticas de colesterol LDL. Sin embargo, los datos disponibles muestran variaciones interindividuales que fluctúan desde incrementos del 10% hasta descensos del 50%. Estas diferencias se han vinculado al gen de la apoE, polimórfico en la población general, con tres alelos comunes (épsilon 2, épsilon 3 y épsilon 4), y cuya isoforma más frecuente es la apo E-3 (589). La presencia de una de las variantes guarda una estrecha relación con la concentración plasmática de colesterol, de tal forma que las concentraciones más bajas se presentan en los portadores de apo E-2, y las más altas están ligadas a apo E-4 (595). Asimismo, existen datos que muestran que los individuos que responden mejor a una dieta baja en grasa son los portadores del alelo E4 (585). Por su parte, las concentraciones plasmáticas de colesterol HDL se han relacionado con polimorfismos de la región promotora del gen de la apo A-1 (APOA1-75G→A). La expresión de este gen está modulada por el consumo de ácidos grasos poliinsaturados. Así, las mujeres portadoras del alelo variante (A) presentan un aumento de las concentraciones plasmáticas de colesterol HDL cuando incrementan el consumo de ácidos grasos poliinsaturados. En cambio, las portadoras de la forma más común del alelo (G) muestran una respuesta contraria: disminuyen las concentraciones de colesterol HDL; por ello, en estos casos, se debería recomendar la reducción del consumo de ácidos grasos poliinsaturados (596). Por otra parte, esta variabilidad no se ha confirmado en los hombres, en los cuales, sin embargo, el efecto beneficioso del alelo (A) sobre el HDL se neutraliza cuando son fumadores (597). Las concentraciones de colesterol HDL están relacionadas también con las variantes del gen de la proteína de transferencia de ésteres de colesterol (CETP, por sus siglas en inglés). Sus genotipos y los del enzima alcohol-deshidrogenasa modifican la respuesta entre el consumo de alcohol y las concentraciones de colesterol HDL en plasma (598). Igualmente, las variantes del gen de la lipasa hepática pueden afectar las concentraciones de colesterol HDL (4). Mien133 8 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA tras que los portadores de la forma más común entre los sujetos de raza blanca (el genotipo CC) ven incrementadas las concentraciones de las HDL cuando aumentan el consumo de grasa total (superior o igual al 30% de la energía consumida), de grasa saturada y de grasa monoinsaturada, los individuos no portadores responden con una disminución de sus concentraciones plasmáticas. Un aspecto de interés es que ambas formas se presentan con diferente frecuencia según los grupos étnicos, de tal forma que la respuesta al consumo de grasa y en las concentraciones de colesterol HDL podría variar entre etnias (4). Otro gen involucrado en la respuesta de los lípidos al consumo de ácidos grasos poliinsaturados es el del receptor nuclear activado por proliferadores de los peroxisomas (PPAR). El gen del PPAR-alfa presenta un polimorfismo (PPARA Leu162Val), cuya variante V162 se asocia a concentraciones plasmáticas más elevadas de colesterol total, de colesterol LDL y de apo B respecto a los portadores de la forma más común (L162). Esta diferencia se mantiene después de corregir por otros factores, como la edad, el índice de masa corporal, el consumo de tabaco, de diuréticos y de betabloqueantes. El efecto es más pronunciado entre los hombres que en las mujeres. También el gen del PPAR-alfa es sensible a los efectos de los ácidos grasos poliinsaturados; un consumo elevado induce una disminución importante de los triglicéridos en los portadores de la forma V162, mientras que el efecto es poco significativo en los portadores del alelo L162 (599). A la vista de los datos se podría decir que tanto la cantidad como el tipo de grasa interactúan con polimorfismos de genes reguladores del metabolismo lipídico (apo A-1, PPAR y lipasa hepática) y que estas interacciones afectan las concentraciones de colesterol HDL y de triglicéridos. Aplicación clínica futura de la genética nutricional: el diseño de dietas personalizadas Es evidente que la dieta puede modificar la expresión de ciertos genes, y que ello, a su vez, puede influir en el desarrollo de las enfermedades en función de la edad, el sexo o el origen étnico (585, 586). Así, la alimentación toma especial relevancia en determinadas situaciones específicas, como son el embarazo, la infancia o durante los años previos a la aparición de la enfermedad. En este sentido, los estudios de genómica nutricional podrían aportar nuevos enfoques para evitar el preocupante aumento de la obesidad infantil y juvenil, así como de sus consecuencias. Paralelamente, debería haber más información sobre la forma de valorar el consumo de alimentos y de sus componentes, sobre su composición nutricional y otros múltiples aspectos relacionados con la nutrición. 134 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE NUTRICIÓN Y GENÉTICA EN ATENCIÓN PRIMARIA 8 En cuanto a los métodos, es indispensable integrar toda la información que surge de la historia familiar, de los genes y de las variables o marcadores (fenotipos) disponibles. Para ello, contamos con los instrumentos que facilitan la biología molecular y de sistemas (metabolómica y otras ómicas). Para una eficaz aplicación clínica de esta información, es necesario hacer algunas consideraciones, ya que los datos presentados corresponden a estudios poblacionales. El efecto de un polimorfismo simple aislado sobre un paciente concreto será, en la gran mayoría de los casos, modesto y desigual. Por ello, si queremos valorar, por ejemplo, la influencia genética sobre el colesterol HDL de un paciente, deberemos conocer su genotipo para todos los polimorfismos simples relevantes e integrarlos con la información necesaria sobre los parámetros que van a modular el efecto de estos polimorfismos (sexo, consumo de alcohol, actividad física, tabaco, etnia, etc.). Así dispondremos de una información útil sobre el paciente concreto. Todavía queda por demostrar si la interacción entre alimentación y genes tiene efectos sustanciales sobre la evolución de la enfermedad. De momento, es probable que sólo se pueda demostrar un efecto sobre los factores de riesgo cardiovascular. Aunque ello no es aún posible en la práctica clínica diaria, los extraordinarios avances tecnológicos, tanto en biología molecular como en bioinformática, hacen que su aplicación en un futuro no sea una utopía. Conclusiones Así pues, podemos concluir que la respuesta de los factores lipídicos a los cambios de la dieta es muy compleja en la prevención cardiovascular. También es incierta la respuesta de la dieta en función de los genes y su relación con el riesgo de sufrir una enfermedad cardiovascular. Actualmente, se disponen de algunos ejemplos que explican la variabilidad de las concentraciones plasmáticas de colesterol LDL ante la reducción del consumo de grasa saturada y su relación con el gen de la apo E, o los cambios de las concentraciones de colesterol HDL en función del gen de apo A-1 y el consumo de ácidos grasos poliinsaturados. Aunque estos hallazgos son esperanzadores, para explicar la respuesta a la dieta se precisa la implicación y la interacción de varios genes, o de la presencia de otros factores ambientales, como la actividad o el consumo de tabaco, o bien de todo ello simultáneamente. Se podría decir que asistimos a un interesante proceso en que la ciencia de la nutrición se integra con la genética para analizar su interacción y obtener información del individuo que pueda trasladarse a la práctica clínica, con el objetivo de definir una alimentación cardiosaludable personalizada. 135 8 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Y, aunque se han realizado múltiples estudios que han aportado datos preliminares, todavía no se dispone del suficiente grado de evidencia científica para que sus resultados tengan una aplicación inmediata en la práctica clínica (600). 136 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 8 9. RECOMENDACIONES DIETÉTICAS Los hábitos alimentarios en la población española durante las últimas décadas se están modificando, se están distanciando de la dieta tradicional mediterránea para adoptar costumbres foráneas, más propias de países anglosajones, circunstancia que se hace más evidente entre la población infantil y juvenil. El estudio Cuatro Provincias (601) pone de manifiesto el elevado consumo de grasa de los niños españoles; este consumo, aun con un adecuado aporte de ácidos grasos monoinsaturados, presenta un porcentaje de grasa saturada sobre el total de calorías aportadas por la dieta, que duplica lo deseable (Tabla 43). También resulta preocupante el elevado consumo de azúcares simples y el bajo de hidratos de carbono complejos (602) (Tabla 43). TABLA 43. Dieta de los niños españoles según el estudio Cuatro Provincias (601). Recomendado Real 10-13 17,2 <35 45,9 15-20 18,3 <7 16,7 45-50 38,3 Simples <10 21,2 Complejos >40 17,8 Proteínas Lípidos Monoinsaturados Saturados Hidratos de carbono 137 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Cambios dietéticos en la población española (603) (Figuras 39 a 41): ● Una disminución del consumo de los hidratos de carbono complejos, en especial legumbres, patatas y pan. ● Un aumento del aporte proteico de la dieta en forma de un incremento del consumo de carnes y derivados. ● A pesar de mantener un consumo elevado de ácidos grasos monoinsaturados (aceite de oliva) en relación con los países del centro y el norte de Europa, se aprecia un aumento del consumo de grasa saturada (carne, lácteos no desnatados, embutidos), de grasas trans (pastelería y bollería industrial) y de ácidos grasos poliinsaturados n-6 (aceite de girasol); en cambio, conservamos una dieta rica en verduras, hortalizas, fruta y pescado. ● Un menor aporte de fibra dietética (legumbres, cereales integrales). ● Un mayor consumo de bebidas azucaradas. ● Un menor consumo de vino, con un incremento en el consumo alcohólico total (fundamentalmente en forma de bebidas destiladas). Los cambios sociales y laborales experimentados en los últimos años son, en gran medida, la causa de estas modificaciones: ● Aumento del número de comidas que se realizan fuera de casa; cuando se preparan en el hogar, prima la rapidez, de forma que se cocinan platos de preparación rápida, ricos en 1964 12 53 32 4 1981 13 43 40 4 1991 14 41 42 3 % FIGURA 39. Evolución del perfil calórico (% de energía) en España, desde 1964 hasta 1991 (603) 138 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE RECOMENDACIONES DIETÉTICAS EN ATENCIÓN PRIMARIA 1964 9 1981 4 11 17 6 12 1991 19 7 0% 9 19 20% 40% D lác eriv te ad os os FIGURA 40. Evolución del consumo de lípidos (% de energía) en España, desde 1964 hasta 1991 (603) 6 H fre ort sc aliz as a s 4 1 Ca 2 rn es 3 F fre rut sc a a es gu m br Ac e ch Le Pa ta ta s Le –4 ad os –3 sc –2 eit es Pa n 0 –1 Pe Diferencia % 1993-1999 5 FIGURA 41. Evolución del consumo alimentario en España, desde 1993 hasta 1999 (603) 139 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA grasas saturadas, en contraposición con el guiso tradicional realizado por nuestras abuelas, que requería más tiempo en su elaboración pero aportaba, además de una excelente palatabilidad, una mayor riqueza en nutrientes cardiosaludables. ● Con la incorporación al mundo laboral de la mujer, el trabajo fuera del hogar de todos los miembros de la familia y la jornada laboral intensiva, el “perder tiempo” cocinando se antoja difícil, aun cuando se gane en una mejora de la salud. ● Con mayor preocupación se constatan los cambios nutricionales entre la población infantil y juvenil, en la que, por mimetización con costumbres anglosajonas, existe un incremento del consumo tanto de pastelería, aperitivos y bollería industrial, como de platos precocinados y de comida rápida, que redundan en el incremento de la colesterolemia media en la población infantil. Digamos que en muchos casos se ha sustituido el bocadillo tradicional del desayuno o la merienda preparado en casa, por un bollo-pastel-aperitivo comprado en la tienda, que al niño le parece sabroso y que, además, por cada compra le proporciona un cromo o una pegatina con sus héroes televisivos, todo ello con una adicional campaña de marketing que va a condicionar el establecimiento y el mantenimiento de nuevos hábitos dietéticos con un mayor aporte de grasa no saludable. ● El aumento de la capacidad adquisitiva permite también el acceso a determinados alimentos, fundamentalmente proteínas (carnes y derivados, lácteos enriquecidos), que hace unas décadas estaban sólo al alcance de unos privilegiados y actualmente pueden formar parte de la cesta de la compra de una familia con ingresos medios. ● Por parte de la industria alimentaria, existe una mejora del procesado y la conservación de los alimentos para lograr tanto una mejora de sus cualidades organolépticas como, sobre todo, de la comodidad y la rapidez en su preparación, lo que hace que el consumo de alimentos preparados listos para su consumo se haya incrementado enormemente en los últimos años. La dieta que recomienda la Sociedad Española de Arteriosclerosis (SEA) (96) (Tabla 44) propugna un elevado contenido graso sobre el valor calórico total (30%-35%), con un aporte de menos del 10% de grasa saturada, del 7% de ácidos grasos poliinsaturados y de un 15%20% de monoinsaturados, que se adapta perfectamente a nuestras costumbres tradicionales en las que el aceite de oliva es la grasa culinaria principal, y que logra una excelente palatabilidad que redunda en un mejor cumplimiento de las pautas dietéticas recomendadas. Por otro lado, también hay los datos científicos que avalan la utilidad de esta dieta: aumenta el colesterol HDL y no induce hipertrigliceridemia. Esta dieta es aconsejable tanto en el síndrome plurimetabólico como en el paciente diabético, ya que no aumenta la resistencia a la insulina y, además, es adecuada en la hipertensión, ya que, al hacer los platos más apetitosos, se facilita que se limite el consumo de sal en la dieta. 140 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE RECOMENDACIONES DIETÉTICAS EN ATENCIÓN PRIMARIA TABLA 44. Dieta recomendable para la prevención de la aterosclerosis (según la Sociedad Española de Arteriosclerosis) (96). Calorías: Ajustar para mantener el peso ideal Grasa: 30%-35% Ácidos grasos saturados: <10% Ácidos grasos poliinsaturados: <7% Ácidos grasos monoinsaturados: 15%-20% Carbohidratos: 45%-50% Proteínas: 15% Colesterol: <300 mg/día Reducir el consumo de sal Más recientemente, las recomendaciones de las Guías europeas de prevención cardiovascular, adaptadas a la población española (604), enfatizan en la importancia del predominio, como fuente energética de la dieta, de los ácidos grasos monoinsaturados, mayoritariamente aportados por el aceite de oliva, y son especialmente restrictivas tanto con la ingestión de ácidos grasos saturados (<7% del valor calórico total), como de ácidos grasos trans; asimismo, señalan la conveniencia de fomentar el consumo de frutas, verduras, legumbres, pescado y cereales integrales e insisten en la importancia de ajustar el aporte calórico a la consecución o mantenimiento de un peso adecuado (Tabla 45). TABLA 45. Recomendaciones europeas adaptadas a la población española sobre el estilo de vida (604). Energía 30%-35%, predominio de ácidos grasos monoinsaturados: aceite de oliva Ajustada al peso adecuado Ácidos grasos saturados <7% Ácidos grasos trans Consumo bajo (<2%) Colesterol <300 mg/día Ácidos grasos n-3 2 g/día de ácido alfa-linolénico y 200 mg/día de ácidos grasos de cadena larga (ácidos eicosapentaenoico y docosahexaenoico) Frutas y verduras >400 g /día Legumbres, cereales integrales, pescado, aceite de oliva Fomentar su consumo Alcohol 20-30 g/día de etanol en hombres (máximo) 10-20 g/día de etanol en mujeres (máximo) En hipertensos 100 mmol/día (2,4 g de Na o 6 g de ClNa) 141 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Los alimentos que se propone limitar o evitar para la prevención de la arteriosclerosis y, en definitiva, para mejorar la salud cardiovascular, según las recomendaciones de los grupos de Nutrición y de Unidades de Lípidos de la Sociedad Española de Arteriosclerosis (605) se resumen en la Tabla 46. También las Dietary Guidelines para la población estadounidense del año 2005 (606) ofrecen, a la población general, consejos para conseguir mejorar la salud mediante la alimentación: ● Consumir nueve raciones de frutas y verduras al día (cuatro tazas y media para una dieta de 2000 kcal). Es importante su consumo variado (diferentes vegetales son ricos en diferentes nutrientes). ● Minimizar la sal que se añade a las comidas; elegir alimentos pobres en sal. ● A partir de los dos años de edad, el consumo de lácteos debe ser mediante productos desnatados o bajos en grasa. Los que no los consumen a diario deben buscar fuentes alimentarias alternativas de calcio (pescado, soja, cereales reforzados). ● Consumir a diario cereales integrales. Consumir legumbres varias veces a la semana. El aporte de fibra debe ser de 14 g por cada 1000 kcal de la dieta. ● Escoger grasas saludables, como el aceite de oliva. Evitar la ingestión de grasas saturadas y de grasas parcialmente hidrogenadas (trans). ● Comprobar los ingredientes de los alimentos preparados, de forma que se eviten aquellos que estén elaborados con grasas no recomendadas o no identificadas. ● Consumir pescado al menos dos veces por semana. ● Minimizar el consumo de bebidas y de alimentos con azúcares añadidos. ● Si se consume alcohol, debe hacerse con moderación. En el mismo sentido apunta la revisión sobre dieta y estilo de vida de la American Heart Association del año 2006 (117), que incluye como recomendaciones específicas para mejorar los hábitos dietéticos disminuyendo el riesgo cardiovascular, las siguientes: ● Consumir una gran variedad de frutas y verduras (cinco o más raciones al día). ● Consumir legumbres y cereales (especialmente integrales) (seis o más raciones al día). ● Limitar el consumo de grasas saturadas a un 7% del total calórico. ● Limitar el consumo de ácidos grasos trans, presentes en pastelería y bollería industrial, precocinados y aperitivos, a <1% del total calórico. 142 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE RECOMENDACIONES DIETÉTICAS EN ATENCIÓN PRIMARIA TABLA 46. Recomendaciones para prevenir las enfermedades cardiovasculares con una alimentación saludable. Alimentos (frescos Recomendados (pueden o congelados) consumirse a diario) Cereales Pan, pasta alimenticia, arroz, maíz (preferible cereales integrales). Alimentos que se deben limitar (2-3 veces por semana) Cereales no integrales. Bollería confeccionada con aceite de girasol (magdalenas, bizcocho). Patatas fritas de bolsa, preparadas con aceite de oliva o girasol. Frutas, verduras y legumbres Todas (es recomendable comer 3 raciones de fruta y 2 o más de otros vegetales al día). Huevos, lácteos y derivados Leche desnatada, yogur desnatado. Productos elaborados con leche desnatada. Clara de huevo. Queso fresco o con bajo contenido graso, leche semidesnatada. Huevo entero. Pescado y marisco Pescado blanco y azul. Marisco (cefalópodos, crustáceos y moluscos). Conservas al natural. Pollo, pavo, conejo (sin piel y sin grasa). Aves de caza. Conservas en aceite de oliva o girasol. Carnes y aves Grasas y aceites Dulces Bebidas Frutos secos Especias y salsas Ternera, buey, caballo, cordero, cerdo, jamón (sin grasa), hamburguesas magras. Caza mayor. Aceite, de oliva Margarinas en las que preferentemente. Aceites de conste que carecen de semillas (girasol, maíz). ácidos grasos trans. Repostería y postres Repostería y postres elaborados con leche caseros elaborados con desnatada y aceite sin yema leche desnatada y aceite de huevo. con yema de huevo. Mermelada, miel, azúcar, helados de agua, granizados, sorbetes. Turrón y mazapán. Chocolate con más del 75% de cacao y sin grasas trans. Agua mineral, zumos naturales, café (máximo 3 al día), té, infusiones. Almendras, avellanas, nueces, cacahuetes, etc. (preferiblemente crudos y sin sal). Todas las especias. Mayonesa hecha con huevo. Salsas elaboradas con aceite de oliva, vinagre, mostaza y alioli. No recomendados Bollería en general, galletas, aperitivos tipo ganchitos, cortezas, etc. Coco. Patatas fritas de bolsa preparadas con aceites de composición desconocida. Verduras y legumbres cocinadas con grasas tipo chorizo, beicon, etc. Leche entera. Todos los demás quesos. Nata y crema de leche. Flanes, natillas, cremas, cuajadas y batidos. Frituras comerciales o con aceites no recomendados. Embutidos, salchichas, beicon, hamburguesas, vísceras. Patés. Pato y ganso. Mantequilla, manteca de cerdo, tocino, sebo. Aceites de palma y coco. Pastelería y bollería en general. Postres que contengan lácteos enteros y/o mantequilla. Chocolate que contenga menos del 75% de cacao. Caramelos. Refrescos azucarados. Bechamel y salsas que contengan leche entera, mantequilla y/o grasas de origen animal. 143 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA ● Limitar el consumo de alimentos que tengan un elevado contenido de colesterol a menos de 300 mg/día. ● Consumir pescado (especialmente azul) al menos dos veces por semana. ● Conseguir un equilibrio calórico entre la ingesta y la actividad física que permita mantener un peso saludable. El último informe del NCEP Panel III, de EE.UU. (51), traslada los últimos datos científicos a sus recomendaciones dietéticas, que incluyen, como novedades, la reducción del consumo diario de ácidos grasos saturados por debajo del 7% del valor calórico total, pero permitiendo que hasta el 35% de las calorías diarias sean en forma de ingestión de grasas, lógicamente aportadas por grasas insaturadas. Las grasas insaturadas están representadas en nuestro medio por el aceite de oliva (rico en ácido oleico, un ácido graso monoinsaturado). Hemos de tener en cuenta la importancia de que el incremento calórico de la dieta, aunque sea en forma de alimentos saludables (bajos en grasa saturada y colesterol), puede incidir en un aumento indeseado del peso corporal, con los efectos deletéreos que ello comporta, tanto en cuanto a la presión arterial como al metabolismo hidrocarbonado y lipídico. Por ello, lógicamente, hay que comer sano, pero vigilar también el contenido calórico total de la dieta que, junto a la práctica habitual de ejercicio físico, permitirá mantener el peso lo más cerca posible del ideal. Lo más adecuado es mantener nuestras buenas costumbres tradicionales, intentando no adquirir hábitos que no nos son propios, divulgando las virtudes de la alimentación cardiosaludable en la población escolar y resaltando, sobre todo entre nuestra juventud, los beneficios de la denominada dieta mediterránea, que quedó definida por el Documento de Consenso Internacional (Roma, abril de 1997) de la siguiente manera: ”La dieta mediterránea tradicional se caracteriza por la abundancia de alimentos vegetales, como pan, pasta, verduras, ensaladas, legumbres, fruta y frutos secos; aceite de oliva como principal fuente de grasa; moderado consumo de pescado, aves de corral, productos lácteos y huevos; pequeñas cantidades de carnes rojas y de bajas a moderadas cantidades de vino, consumidas durante las comidas. Esta dieta es baja en ácidos grasos saturados, rica en hidratos de carbono y fibra, y tiene un alto contenido en ácidos grasos monoinsaturados que se derivan principalmente del aceite de oliva”. La cultura mediterránea no es tan sólo la cultura de esta dieta, es también la cultura del ocio, de la tertulia, una forma de vida en la que las cosas se toman con mayor sosiego, además de que los países ribereños del Mediterráneo poseen una bonanza climática que, en contraposición a países del centro y el norte de Europa, permite el desarrollo de actividades de esparcimiento al aire libre, de mayor contacto con la naturaleza. En definitiva, utilicemos la dieta no como un fin en sí misma, sino como un medio que, junto al aprovechamiento de nuestro clima para el desarrollo de actividades lúdicas y de la 144 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE RECOMENDACIONES DIETÉTICAS EN ATENCIÓN PRIMARIA 9 práctica habitual de ejercicio, nos permita vivir más y mejor, incrementando nuestra calidad de vida. PAUTAS QUE DEBEMOS TRANSMITIR PARA POTENCIAR UNA DIETA MÁS SANA ● Escoja alimentos con alto contenido en fécula y fibra. Los cereales, mejor si son integrales. Consuma legumbres al menos dos veces por semana. ● Coma pocos productos que tengan un contenido elevado en grasas. Consuma lácteos desnatados. ● Aporte a su alimentación el número de calorías necesario para mantener o alcanzar un peso adecuado. ● Las frutas o los zumos naturales y las verduras deben estar presentes en cada comida. ● Limite el consumo de grasas a un máximo de un 30%-35% del total de calorías diario. Coma más pescado y carne de pollo, pavo y conejo que carnes rojas y embutidos. Cuando prepare un caldo de carne, déjelo enfriar y retire la grasa que queda en la superficie; también retire la grasa visible de las carnes antes de cocinarlas. ● Sustituya parte de las grasas saturadas por no saturadas. Es preferible que la grasa culinaria sea aceite de oliva, y mejor si es virgen. ● Evite los refrescos azucarados. ● Evite añadir sal a las comidas en la mesa: puede utilizar libremente las especias. ¿QUÉ HAY QUE HACER PARA ESCOGER PRODUCTOS . CON BAJO CONTENIDO EN GRASAS? ● Acuda a la compra con una lista elaborada de alimentos cardiosaludables y procure ceñirse a ella. ● Lea las etiquetas de los productos alimenticios. ● Calcule el contenido graso total del alimento. ● Valore negativamente los productos con un contenido elevado en grasas saturadas (tanto grasas de origen animal como aceites vegetales que, sin otra especificación, pueden ser de coco o de palma) o en grasas trans (aceites parcialmente hidrogenados). 145 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA CONSEJOS PARA LAS COMIDAS FUERA DE CASA 1. Desayuno: – La leche y derivados, mejor desnatados (yogur, queso bajo en materia grasa). – Zumos naturales. – Evitar la pastelería y la bollería industrial; en su lugar, se pueden comer tostadas, cereales o galletas (preparadas con aceites mono o poliinsaturados, no trans). 2. Aperitivos: – Evitar el embutido y los quesos curados. – El marisco a la plancha o los moluscos al vapor (mejillones, berberechos, almejas) nos pueden ayudar a hacer más agradable la comida. 3. Ensaladas: – Además de nuestra clásica ensalada (lechuga, tomate, cebolla, pepino, rábanos, etc.), otras combinaciones que se pueden tener en cuenta en una ensalada son: fruta, arroz, legumbres o patatas. Eso sí, para aliñar, se utilizará un buen aceite de oliva, vinagre y no mucha sal. 4. Pan: – No utilizar bollos o panecillos de manteca. El mejor pan es el tradicional, ya sea blanco o integral (mayor aporte de fibra). El pan con tomate y aceite de oliva puede ser un buen acompañamiento de la comida, mejor que la mantequilla (poco utilizada en nuestro medio), que debemos evitar si es posible. 5. Verduras: – Las verduras asadas (berenjena y pimiento en escalibada, espárragos, etc.) o al horno pueden ser una alternativa tanto para el primer plato como para guarnición del segundo. – También las setas (níscalos, de cardo, champiñones, etc.) a la plancha, con una picada de ajo, perejil y aceite de oliva, pueden resultar un buen acompañamiento. 6. Arroz: – La paella valenciana de conejo, pollo y verduras (debe evitarse el sofrito con costilla de cerdo); la paella mixta o la de marisco son platos completos que pueden ser la base fundamental de una comida fuera de casa. 146 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE RECOMENDACIONES DIETÉTICAS EN ATENCIÓN PRIMARIA 9 7. Pasta: – Para su acompañamiento, se escogerá una salsa marinera o de tomate y/o cebolla sin sofrito de carne o embutido y evitando salsas cremosas hechas con nata, tipo carbonara. 8. Pizza: – Usar ingredientes vegetales, evitando el queso y los embutidos. 9. Carnes: – Pollo, pavo, conejo y avestruz son las carnes que, con un buen aporte proteico, presentan un menor contenido en grasas. – Retirar antes de cocinar, si es posible, la piel y la grasa visible. – Evitar los embutidos; el jamón serrano sin tocino puede ser una alternativa. 10. Pescado: – Puede ser blanco o azul; mejor a la plancha, al vapor, a la sal o hervido. 11. Postres: – La fruta o los sorbetes son buenas opciones. Una dieta sana Grupo 1 Leche y derivados (yogur, quesos, etc.): Alimentos indispensables ricos en proteínas e hidratos de carbono Grupo 2 Carnes, pescados y huevos: Fuente principal de proteínas de alto valor biológico y vitaminas Grupo 3 Legumbres, patatas y frutos secos: Principales suministradores de hidratos de carbono (proporcionan energía a nuestro organismo) y minerales Funciones principales de: Grupo 4 Verduras y hortalizas: Fuente importante de vitaminas y minerales, y pocas calorías • Proteínas: reparación y mantenimiento del organismo Grupo 5 Frutas: Como el grupo anterior, aportan vitaminas y minerales, además de hidratos de carbono • Hidratos de carbono: suministro de energía cotidiana Grupo 6 Cereales, pan, pastas, arroz, azúcar: Alimentos equilibrados con proteínas, hidratos de carbono, vitaminas y minerales. Fundamentales • Grasas: suministro y reserva de energía Grupo 7 Grasas, aceite y mantequilla: Principales suministradores de grasas (reserva de energía) FIGURA 42. Características de los alimentos que constituyen una alimentación saludable 147 9 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA ¿CÓMO DEBERÍAMOS DISTRIBUIR . NUESTROS ALIMENTOS? Véanse las Figuras 42 y 43. En la Figura 43 aparece la clásica pirámide de la dieta mediterránea, en cuanto a la estimación de la frecuencia recomendable de la ingestión de los diferentes alimentos y la distribución de ellos en grupos en razón de sus características nutricionales. Pocas veces/mes 2-3 veces/semana Pastelería Bollería Grupo 7 Quesos grasos Grupo 1 Carnes semigrasas Grupo 2 Grasas y derivados Pescado, huevos, pollo, Grupo 2 carnes magras Legumbres Aceite de oliva Diario 1-2 copas vino (opcional) Leche, yogur y queso no graso Verduras, hortalizas y frutas Pan, arroz, pasta, otros cereales y patatas Grupo 3 Grupo 7 Grupo 1 Grupos 4-5 Grupo 6 Recuerde siempre: Hacer una dieta variada, con productos naturales y sin exceso de grasas. Los adultos pueden tomar opcionalmente (si no está contraindicado) una copa de vino en comida y cena. Beba abundante agua (1,5-2 litros/día) y procure hacer 5 tomas de alimento (desayuno, media mañana, comida, merienda y cena). Los niños deben recibir mayores aportes de productos lácteos y deben desayunar adecuadamente. Ajuste las cantidades a su peso ideal. FIGURA 43. Pirámide de alimentos En la pirámide de la figura aparecen alimentos divididos en grupos, cada uno de los cuales debe formar parte a diario de la dieta. Probablemente, si el cambio hacia una dieta más cardiosaludable lo realizan todos los miembros de la familia (y no sólo el paciente), sea entonces mejor tolerada y se mantenga en el tiempo. 148 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 9 10. PROMOCIÓN DE LA ALIMENTACIÓN CARDIOSALUDABLE 10.1. ESTRATEGIA NAOS La obesidad adquiere, según la Organización Mundial de la Salud, caracteres de epidemia en los países desarrollados. Los cambios experimentados en la alimentación y el estilo de vida en los últimos años han sido claves en el incremento de su prevalencia, que afecta al conjunto de la población pero, de forma especialmente preocupante, al segmento poblacional infantil y juvenil, en el que durante las últimas décadas ha aparecido una tendencia creciente hacia el sobrepeso y la obesidad (607, 608). En un estudio epidemiológico de una muestra representativa de la población española de 2 a 24 años de edad (n = 3.534) se encuentra una prevalencia de obesidad de un 13,9%, mientras que la combinación de sobrepeso y obesidad es de un 26,3%; la obesidad es más común en los varones (15,6%) que en las mujeres (12%) y, en relación con la edad, la prevalencia más alta se encuentra en edades prepuberales (de 6 a 13 años) (607). En el estudio SEEDO 2000 (7) se observó que la prevalencia de obesidad en la población adulta española era de un 14,5% (intervalo de confianza del 95%: 13,93%-15,07%), significativamente superior entre las mujeres 15,75% (intervalo de confianza del 95%: 14,89%-16,61%), que entre los hombres 13,39% (intervalo de confianza del 95%: 11,84%-14,94%). En definitiva, la obesidad es un problema de salud que afecta a una proporción importante de la población española, con un gran impacto potencial en la salud pública, lo que exige el diseño de instrumentos para combatirla. Por estas razones, luchar contra la obesidad mediante estrategias poblacionales que incluyan la promoción de una alimentación saludable e incentivar la actividad física es uno de los mayores retos de la salud pública para el siglo XXI. De hecho, de los diez factores de riesgo identificados por la Organización Mundial de la Salud como claves para la aparición de enfer149 10 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA medades crónicas, cinco están estrechamente relacionados con la alimentación y el ejercicio físico: la obesidad, el sedentarismo, la hipertensión arterial, la hipercolesterolemia y el consumo insuficiente de frutas y verduras. El espectacular aumento de las cifras relacionadas con la obesidad y el sobrepeso en España en la edad escolar tiene, como principales causas, las siguientes: Alimentación inadecuada Como se ha comentado, las dietas tradicionales, ricas en frutas, verduras y legumbres, están siendo sustituidas por otras con mayor abundancia de grasas de origen animal y azúcares simples. Una alimentación variada y equilibrada es esencial en cualquier etapa de la vida, pero lo es todavía más en la infancia. Sin embargo, la dieta actual de los niños españoles se caracteriza por un exceso de carnes, embutidos, lácteos, productos de bollería y bebidas carbonatadas. Partiendo de un análisis de la situación actual, y con el objeto de mejorar la alimentación infantil, desde la Agencia Española de Seguridad Alimentaria, y en el marco de la estrategia NAOS, se proponen algunas recomendaciones al respecto (Figura 44). También resulta preocupante que un 8% de los niños vaya al colegio sin haber desayunado, cuando lo adecuado en la población escolar es que el desayuno y la comida de media mañana aporten un 25% de las necesidades nutritivas diarias (Figura 45). Además, la obesidad es más prevalente entre los niños y jóvenes que omitieron o consumieron un desayuno pobre (607). Escasa actividad física Cada vez hacemos menos ejercicio físico, tanto en el trabajo como en el tiempo dedicado al ocio y en los desplazamientos, en los que abusamos de los medios de transporte. Esta inactividad física se hace aún más grave en la infancia y la adolescencia. Los chicos españoles pasan una media de dos horas y media al día viendo televisión, y media hora jugando con videojuegos o conectados a Internet. Se ha demostrado que hay una relación directa entre las horas semanales frente a la televisión y la prevalencia de sobrepeso (610) (Figura 46). Con este tipo de hábitos, nuestro organismo va acumulando año tras año energía no consumida en forma de grasa. Para luchar contra el problema, el Ministerio de Sanidad y Consumo español ha elaborado la Estrategia NAOS (Nutrición, Actividad Física y prevención de la Obesidad) (611), que tiene como finalidad mejorar los hábitos alimentarios e impulsar la práctica regular de actividad física para prevenir la obesidad y el sobrepeso de todos los ciudadanos 150 10 GUÍA DE ALIMENTACIÓN PROMOCIÓN DECARDIOSALUDABLE LA ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Respecto al consumo de Situación actual Recomendaciones Productos lácteos Un elevado consumo en especial en forma de derivados lácteos, yogures, quesitos y postres lácteos El niño debe consumir leche (medio litro al menos al día). Salvo prescripción médica, no necesita ser descremada. Como complemento o sustituto de un vaso de leche, puede tomarse un yogur o una porción de queso Carne Suele consumirse todos los días y se abusa de carne de cerdo y embutidos, salchichas y hamburguesas No es necesario tomar carne todos los días. Conviene alternarla con pescado y hay que procurar que sea de diferentes especies: vacuno, cerdo, pollo, conejo, cordero, etc. Pescado Escaso consumo de pescado Debe ser estimulado el consumo de pescado, y muy especialmente el llamado pescado azul (pescado graso), como la sardina, la caballa, el boquerón, etc Huevos El consumo de huevos aparece bajo dos formas: directo (tortillas y huevos fritos) e indirecto (como ingrediente de salsas, flanes, natillas, bizcochos, etc.) El huevo tiene una excelente proteína, comparable a la de la carne o el pescado. Pero hay que tratar de no consumir más de 4 o 5 huevos a la semana Patatas Consumo elevado especialmente fritas Debe moderarse su consumo para dar entrada a otras guarniciones de hortalizas y ensaladas Legumbres Escaso consumo Debemos estimular el consumo de legumbres, que son ricas en fibra dietética y que tienen, además, proteínas vegetales de buen valor biológico Frutas Abuso de zumos de frutas, con frecuencia industriales. Escaso consumo de frutas enteras. Se debe insistir para que los niños tomen fruta natural FIGURA 44. Análisis de los hábitos alimentarios del escolar, con recomendaciones al respecto (609) (continúa) 151 10 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Respecto al consumo de Situación actual Recomendaciones Verduras y ensaladas Hay una cierta resistencia a tomar este tipo de alimentos, en especial las verduras Conviene acostumbrar a los niños a consumir hortalizas y verduras como plato base y como guarnición de platos de carne, pescado y huevos Pan Consumo moderado de pan normalizado y alto de panes especiales El consumo de pan debe ser recuperado, pues su aporte de hidratos de carbono contribuye al equilibrio de la dieta Pastas Consumo abundante de macarrones, espaguetis, pizzas, etc Hay que moderar este consumo para dar cabida a otro tipo de primeros platos que aporten mayor riqueza nutritiva, especialmente fibra, como legumbres, verduras, hortalizas, etc. Arroz Bien aceptado El arroz, como el trigo, es un cereal que acepta buenas combinaciones con otros alimentos, pero es muy importante que se alterne con verduras y hortalizas Dulces Consumo excesivo de dulces, generalmente elaborados por la industria Deben tomarse con moderación Refrescos Consumo elevado Cuando se toman a cualquier hora pueden provocar inapetencia. Debe ser una bebida ocasional Grasas Consumo alto, en forma de quesos grasos, mantequillas, margarinas aromatizadas, generalmente utilizadas para desayuno y meriendas. Igualmente, grasas contenidas en patés, pastas para untar, pan de molde y bollos diversos La grasa es necesaria para el organismo puesto que aporta vitaminas liposolubles y ácidos grasos esenciales, pero su consumo abusivo, en las formas señaladas, causa rápidamente saciedad e impide el consumo de otros alimentos más necesarios para el crecimiento y la salud del niño. El abuso de grasa no es recomendable en la dieta, puesto que el porcentaje de calorías aportado por este nutriente no debe ser superior al 30% del total FIGURA 44. Análisis de los hábitos alimentarios del escolar, con recomendaciones al respecto (609) (continuación) 152 GUÍA DE ALIMENTACIÓN PROMOCIÓN DECARDIOSALUDABLE LA ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Comida 10 Cena 30% 25% 10% 35% Desayuno, más media mañana Merienda FIGURA 45. Orientación en cuanto a la distribución de las necesidades nutritivas del escolar a lo largo del día (609) 40 Prevalencia de sobrepeso (%) 34,9 30 24,5 19,5 20 21,3 15,8 11,7 10 0 <1 2-5 6-10 11-20 21-40 41+ Televisión (horas/semana) FIGURA 46. Relación entre sobrepeso y horas semanales frente a la televisión (610) 153 10 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA pero, especialmente, en la población infantil, ya que está demostrado que un niño obeso será con toda probabilidad un adulto obeso. La solución al problema pasa por efectuar intervenciones en distintos ámbitos. En concreto, los medios que recoge la Estrategia NAOS son el familiar y comunitario, el escolar, los medios de comunicación y el ámbito sanitario. Asimismo, contempla la constitución de un Observatorio de la Obesidad, en el que participarán las comunidades autónomas, los ayuntamientos, las sociedades científicas y el sector privado, para analizar la prevalencia de la obesidad y hacer un seguimiento de la Estrategia. Su enfoque es positivo: “No hay alimentos buenos o malos, sino una dieta bien o mal equilibrada. Lo que hay que conseguir es un equilibrio entre las calorías que se ingieren y las calorías que se gastan”. La Estrategia NAOS es una plataforma que recoge, reúne e impulsa todas las iniciativas que contribuyen a lograr hábitos de vida más saludables. Empresas. Las acciones en el terreno empresarial son de las más importantes de la Estrategia, que contempla la firma de un total de seis convenios de colaboración entre el Ministerio de Sanidad y el sector privado. Las medidas que se proponen llevar a cabo son: ● La reducción progresiva del porcentaje de sal utilizado en la elaboración del pan, que pasará del 2,2% actual al 1,8% en cuatro años. ● Las máquinas expendedoras de comidas y bebidas no podrán instalarse en lugares de fácil acceso para alumnos de enseñanza infantil y primaria. Además, se eliminará su publicidad. ● Las etiquetas incluirán más información nutricional. También se favorecerá la comercialización de productos infantiles con mayor proporción de ácidos grasos insaturados y una menor proporción de ácidos grasos trans y, no se fomentarán las porciones de tamaño grande. ● Se desarrollará un código de autorregulación en publicidad y marketing, que regulará la publicidad de alimentos y bebidas destinados a niños menores de 12 años, las franjas de emisión, el modo de presentación de los productos y su promoción. ● Los supermercados y los almacenes se comprometen a difundir la Estrategia en sus puntos de venta. ● Los sectores de la hostelería y la restauración se comprometen a proporcionar a sus clientes información nutricional de sus menús y a fomentar el consumo de frutas, ensaladas y verduras. Escuelas. En el ámbito escolar, la medida más destacada es la regulación de los comedores escolares, ya que el 20% de los niños realiza, durante cinco días a la semana, su comida en el centro de estudios. También prevé incluir en el currículo académico conocimientos relativos 154 GUÍA DE ALIMENTACIÓN PROMOCIÓN DECARDIOSALUDABLE LA ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 10 a la alimentación y la nutrición, realizar talleres sobre cocina y promover la práctica frecuente de actividad física. Familia. El Ministerio tiene previsto realizar campañas informativas para fomentar hábitos saludables en el ámbito familiar, con la distribución del manual La alimentación de tus hijos (609), editado por el Ministerio, del que aparecen en la Figura 44 los consejos dietéticos que se proponen para mejorar la alimentación escolar, y la creación de una página web con recomendaciones nutricionales. Se promueve, además, la creación de espacios y zonas verdes en las ciudades para fomentar la práctica de ejercicio físico, y se involucra a personajes influyentes y deportistas para que el mensaje cale más entre la población joven. Sanidad. Se promueve que los médicos de atención primaria se formulen en la consulta aquellas preguntas necesarias para la detección a tiempo de este tipo de problemas, y que puedan facilitar consejos básicos sobre alimentación y ejercicio físico. Además, se realizarán campañas de detección precoz, se promoverá la lactancia materna y se procederá a la identificación y el seguimiento de los niños en riesgo. 10.2. ACTIVIDADES QUE SE PUEDEN LLEVAR A CABO . DESDE LA ATENCIÓN PRIMARIA En una medicina masificada, con una gran presión asistencial, es mucho más fácil prescribir un fármaco, sobre todo si el paciente ya viene predispuesto a ello, que dedicar cierto tiempo a conversar sobre la alimentación. Hay datos que muestran que el acceso de la población a un asesoramiento dietético por parte de personal cualificado mejora el control de las dislipemias, sin necesidad de utilizar un tratamiento farmacológico o con el uso de dosis más bajas para conseguir el objetivo en cuanto a la concentración deseable de colesterol LDL (612). El asesoramiento dietético, sobre todo a la población de riesgo, es una medida que debemos utilizar desde la atención primaria con el objeto de mejorar la salud cardiovascular de la población. Quizá sea mejor hablar de modificación de hábitos dietéticos que de dieta, ya que esta palabra tiene una connotación peyorativa, restrictiva; negativa, en definitiva. Hay que valorar con el paciente los cambios nutricionales que se deben introducir, más en forma de recomendaciones sobre la utilización de determinados alimentos y formas culinarias, que mediante prohibiciones. Las actividades de prevención y promoción de la salud son básicas en el seno del nuevo modelo de atención primaria. La divulgación de los beneficios de la alimentación cardiosaludable se ha de hacer extensiva al conjunto de la población, aunque, desde la atención primaria, la actuación prioritaria irá encaminada a la adopción de un estilo de vida y unos hábitos dietéticos cardiosaludables en aquellos pacientes con factores de riesgo asociados (hipertensos, obesos, dis155 10 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA lipémicos, diabéticos) incluidos en los diferentes programas de salud. En el marco de la atención primaria se desarrolla en España desde 1988 el PAPPS (Programa de Actividades Preventivas y de Promoción de la Salud en Atención Primaria), como ejemplo de lo que pueden ser unas actuaciones estructuradas que orientan sus actividades y objetivos hacia la prevención de las principales enfermedades crónicas, entre ellas las enfermedades cardiovasculares, mediante la lucha contra sus principales factores de riesgo, mediante recomendaciones y criterios consensuados de actuación (613). Un estudio (614), en el que se intervino de forma innovadora en la modificación del estilo de vida, ya que la intervención la llevó a cabo tanto personal médico como personal que no lo era, y en lugares como tiendas, lugar de trabajo, por teléfono y por Internet, se demostró que era eficaz y que tenía un coste menor en la reducción del riesgo cardiovascular, tanto en prevención primaria como secundaria. Es importante tener en cuenta que la modificación de hábitos dietéticos no es un factor aislado, sino que la incorporación en la vida diaria de nuevas prácticas positivas lleva a que se adopte un estilo de vida que mejore el perfil de conductas vitales. Las directrices para conseguir un estilo de vida cardiosaludable tienen que dirigirse no sólo hacia la modificación de la dieta, sino también a la práctica regular de ejercicio físico (por ejemplo, caminar a ritmo ágil durante 30 minutos al día), abstención tabáquica y control de peso. Es muy importante la valoración del riesgo cardiovascular global de cada individuo con el objeto de identificar a aquéllos de mayor riesgo, en los que la intensificación de las intervenciones tanto higiénico-dietéticas como farmacológicas pueden ser más efectivas. El objetivo nunca debe ser temporal, sino que debe permanecer a lo largo de toda la vida. Para ello es importante, en el ámbito del equipo de atención primaria: ● Llevar a cabo actividades formativas que permitan a todo el equipo de atención primaria el conocimiento de las características de una alimentación saludable, para que luego se sepa transmitir a la población que requiera asesoramiento dietético. ● Designar en cada centro a un responsable, que procurará la formación continuada del equipo de atención primaria al respecto, y velará por que se lleven a cabo actividades de promoción de la alimentación cardiosaludable, tanto individuales como comunitarias. ● Coordinar la actuación entre el personal médico y el de enfermería, de forma que permita la aplicación de criterios homogéneos sobre las recomendaciones que se deben transmitir a la población, de tal manera que siempre, ante un mismo problema (hipertensión, diabetes, dislipemia, obesidad, etc.), se den consejos dietéticos similares. ● Establecer unos criterios que evalúen anualmente las actividades que se han llevado a cabo, con el objeto de permitir la mejora continua de la calidad. ● Realizar actividades de promoción de los beneficios de la alimentación cardiosaludable, individualmente, sobre los grupos de riesgo (diabéticos, dislipémicos, hipertensos, obesos, 156 GUÍA DE ALIMENTACIÓN PROMOCIÓN DECARDIOSALUDABLE LA ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 10 etc.) incluidos en los programas del centro de salud, aprovechando tanto las visitas programadas como las charlas participativas en grupos reducidos, que estarán siempre adaptadas a la idiosincrasia y al nivel sociocultural de cada grupo. ● Realizar actividades comunitarias de educación sanitaria y promoción de la alimentación cardiosaludable. Por ejemplo: – Aulas de nutrición entre la población escolar, en las que se haga un especial hincapié en la modificación de los hábitos inadecuados. – Charlas comunitarias a asociaciones de vecinos, amas de casa, jubilados, etc. Plan de actuación individual Para instaurar una pauta dietética correcta, se debe realizar una anamnesis completa y se debe adecuar la dieta de forma personalizada; para ello, se tendrán en cuenta variables como edad, sexo, trabajo, horarios, actividad física, etc. Es importante también conocer las posibles alteraciones en los hábitos alimentarios del paciente, como si suele “picar” entre horas, si tiene una especial apetencia por lo dulce o lo salado, si suele presentar hambre vespertina, o si tiene antecedentes bulímicos. Desde el US Preventive Task Force se hacen recomendaciones con el objeto de promover una alimentación saludable desde la atención primaria; la intervención para la modificación de hábitos queda estructurada así en cinco pasos: averiguar, aconsejar, acordar, ayudar y asegurar (615). 1. Averiguando el tipo de alimentación, los factores de riesgo relacionados y evaluando el riesgo cardiovascular global. 2. Aconsejando el cambio hacia una alimentación más saludable. 3. Acordando los objetivos individuales del cambio dietético. 4. Ayudando y motivando al paciente para que cambien los hábitos dietéticos no saludables. 5. Asegurando el seguimiento con un apoyo regular. PRIMERA VISITA ● Evaluar los hábitos alimentarios del paciente con la realización de una encuesta dietética, como por ejemplo las indicadas en el Anexo I. Si se desea una mayor exactitud en la determinación del consumo de alimentos, se debe recurrir a su evaluación facilitando que el paciente recuerde, en múltiples ocasiones, la dieta que ha seguido en las últimas 24 horas, o bien mediante un registro de su dieta durante tres días. 157 10 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA ● Examinar la motivación, los conocimientos y la actitud del paciente respecto a la dieta, y el grado de apoyo familiar al respecto. ● Acordar con el paciente, en cuanto a los resultados de la encuesta dietética, un plan general de modificación de la dieta, con recomendaciones prácticas adaptadas a las necesidades y, si cabe, a las preferencias personales, explicando el fundamento de dichas modificaciones. ● Disponer unos acuerdos realistas acerca de los objetivos que se pretenden conseguir, siempre comenzando por objetivos sencillos y a corto plazo. SEGUNDA Y TERCERA VISITAS (mensuales): ● Establecer el grado de cumplimiento del plan de alimentación recomendado, con la realización de la misma encuesta dietética de la primera visita. ● Reforzar las medidas dietéticas que se introdujeron, velando por su mantenimiento. ● Valorar el grado de apoyo familiar. ● Determinar la consecución de los objetivos pactados. CUARTA Y QUINTA VISITAS (trimestrales) y SUCESIVAS (semestrales): ● Efectuar siempre la misma encuesta dietética y evaluar sus resultados con el paciente, comparando las respuestas con las de visitas anteriores. ● Incentivar al mantenimiento de las modificaciones, resaltando los aspectos positivos de su seguimiento (mejor control de la presión arterial, glucémico, lipídico, etc.) y el logro de los objetivos que se habían pactado. Estas medidas de actuación individual deben complementarse con la realización de reuniones de periodicidad semestral/anual con pequeños grupos de pacientes con similares características incluidos en el programa de promoción de la alimentación cardiosaludable, para así reforzar las modificaciones dietéticas introducidas. 158 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 10 11. INTERNET Y ALIMENTACIÓN El creciente uso de Internet para el acceso a la información es un hecho que ha implicado de forma plena al sector sanitario en general y al de la nutrición en particular. La mayoría de los profesionales de la salud utilizan hoy Internet como fuente de información y las páginas web van sustituyendo progresivamente el papel impreso. Ello supone un gran ahorro en materias primas que son necesarias para la elaboración de las revistas y, otra ventaja aún más relevante, un ahorro de tiempo. El acceso a la red nos ha permitido evitar los antes imprescindibles desplazamientos a las bibliotecas. La facilidad y la rapidez de acceso a la información que ha supuesto la disponibilidad de Internet ha favorecido el desarrollo del conocimiento y, por ello, ha contribuido a la mejora de la práctica de la medicina. Sin embargo, la utilización de Internet requiere contar con herramientas que faciliten la selección de las páginas web y de las áreas de éstas que nos aporten una información bien estructurada y de calidad, ya que la inmensidad del ciberespacio ha hecho que en él se incluyan un gran número de recursos con escaso rigor o con objetivos muy distantes de la mera difusión del conocimiento. Introducir el término nutrición en el buscador Google (Google Inc, Mountain View, CA) muestra actualmente 15.200.000 direcciones, el término nutrition aparece en 155.000.000. Por esta razón, el acceso a páginas de Internet que contengan información útil y rigurosa puede suponer una importante inversión de tiempo. Con objeto de facilitar la labor del profesional de la nutrición y de los profesionales sanitarios en general, en el presente capítulo se describen los recursos de Internet que se han considerado útiles por aportar información suficiente, bien estructurada y, en su gran mayoría, venir avaladas por sociedades científicas o instituciones oficiales. La mayoría de ellos utilizan el inglés como idioma, si bien se han incluido algunos recursos en español. 159 11 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Las direcciones que se han considerado de interés son las siguientes: www.searteriosclerosis.org Idioma: español La página web de la Sociedad Española de Arteriosclerosis (SEA) incluye, dentro del apartado sobre informes, guías y recomendaciones que se encuentra en la página principal, recomendaciones dietéticas para la población general y para los pacientes con dislipemia. También se pueden encontrar las guías europeas de prevención cardiovascular y un documento de consenso sobre la dislipemia diabética, entre otros muchos. www.secardiologia.es Idioma: español. La página web de la Sociedad Española de Cardiología tiene en su página principal el enlace con la Fundación Española del Corazón (www.fundaciondelcorazon.com), en cuya página inicial aparece un apartado dedicado a cada uno de los principales factores de riesgo y, dentro de éstos, se incluyen recetas saludables y la pirámide de alimentación saludable. www.seh-lelha.org Idioma: español La Sociedad Española de Hipertensión-Liga Española para la Lucha contra la Hipertensión Arterial incluye en su página web un apartado denominado Club del hipertenso, en el cual se encuentra una sección sobre nutrición dirigida a los pacientes hipertensos. En ella se ofrece información sobre las grasas de la dieta, sobre el contenido de sodio y potasio y, asimismo, sobre ejercicio, hábitos de vida y alimentación para los hipertensos diabéticos. www.americanheart.org Idioma: español En la página web de la American Heart Association (AHA) se ha incorporado un apartado titulado En español, donde la información se ofrece en ese idioma. En él se encuentra un subapartado sobre Prevención y dieta, en el que constan las recomendaciones dietéticas generales de la AHA, y distintas secciones con información nutricional de diferentes componentes de la dieta, la variedad en la dieta, la lectura de las etiquetas de los alimentos y las dietas para disminuir peso. 160 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INTERNET Y ALIMENTACIÓN EN ATENCIÓN PRIMARIA www.cfsan.fda.gov Idioma: inglés Es la dirección del Center for Food Safety & Applied Nutrition (Centro para la seguridad alimentaria y nutrición aplicada) de la U.S. Food & Drug Administration (FDA). Incluye distintos apartados de interés, entre ellos uno sobre las características de las etiquetas de los alimentos y su interpretación (Food Labeling and Nutrition). www.dietitians.ca Idioma: inglés La web de la sociedad de dietistas de Canadá, y dentro del apartado sobre comer bien y vivir bien (Eat well, Live well), cuenta con una sección interactiva para la planificación de comidas y menús saludables dirigida a la población general (Let’s make a meal). También dentro del mismo apartado, se incluye una sección titulada Virtual Grocery (que equivaldría a tienda de comestibles virtual). www.eatright.com Idioma: inglés Página de la American Dietetic Association. En la página principal se encuentra el apartado de información sobre alimentos y nutrición (Food and Nutrition Information) donde, a su vez, se pueden encontrar distintos contenidos dirigidos tanto a los profesionales sanitarios como a la población general. www.fda.gov Idioma: inglés La página web de la FDA incluye, dentro del apartado Hot Topics, una sección sobre pérdida de peso (Loosing Weight) en la que se incluye información para el público general sobre cómo contar las calorías, los criterios de valoración del peso corporal y los objetivos deseables y ofrece consejos nutricionales, entre otros aspectos de interés. www.fda.gov/diabetes Idioma: inglés Se trata de la web sobre diabetes de la FDA. Dentro de ella se encuentra un apartado sobre alimentación y planificación de las comidas. En esta página se incluyen además otras direccio161 11 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA nes de interés sobre la alimentación de la población diabética, entre ellas podemos encontrar la de www.care.diabetesjournals.org/cgi/content/full/25/suppl_1/s50, que incluye un extenso documento sobre los principios de la nutrición en la diabetes elaborado por la American Diabetes Association en 2002. www.healthierus.gov/dietaryguidelines Idioma: inglés Dentro del apartado Dietary Guidelines for Americans 2005 (recomendaciones dietéticas para los americanos 2005), proporciona la información para las personas de dos años o mayores sobre cómo alimentarse para promover la salud y prevenir las principales enfermedades crónicas. www.mayoclinic.com Idioma: inglés La página web de la Clínica Mayo de Estados Unidos cuenta con un apartado sobre vida sana (Healthy Living), en el que se incluye un subapartado sobre alimentos y nutrición (Food and Nutrition) con información para la población general sobre alimentos, menús y formas de cocinar saludables. http://naa.medicine.wisc.edu Idioma: inglés La Universidad de Wisconsin (EE.UU.) ha editado en formato electrónico un tratado de nutrición. Comprende distintos apartados, con información sobre el tratamiento dietético de la hipertensión, la obesidad, las dislipemias y el síndrome metabólico, entre otros. www.mypyramid.gov Idioma: inglés Entrando en el apartado My Piramid Plan e introduciendo la edad, el sexo y la cantidad de actividad física diaria se obtienen las recomendaciones personalizadas en cuanto al consumo de raciones de vegetales, cereales, frutas, leche, carne y legumbres. En el apartado Inside the Pyramid se encuentran los distintos grupos de alimentos y las equivalencias en cuanto a las cantidades. Existe también un apartado sobre alimentación infantil (For Kids), en el que se incluye la pirámide nutricional para los niños y un apartado para los profesionales. Este último se divide a su vez en múltiples subapartados, en los que podemos encontrar un menú de 2.000 kcal diarias, una herramienta para 162 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE INTERNET Y ALIMENTACIÓN EN ATENCIÓN PRIMARIA 11 el cálculo de las necesidades calóricas, así como algunos consejos o ideas sobre cómo llevar a cabo una tarea de educación, con materiales educativos sobre nutrición para los pacientes. www.nal.usda.gov/fnic/foodcomp/ Idioma: inglés Se trata de la página central del laboratorio de datos nutricionales de la United States Department of Agriculture (USDA) de Estados Unidos. Consta de un apartado que describe el contenido de los distintos nutrientes de una muy amplia variedad de alimentos. Si se pulsa sobre la palabra “search”, se abre un apartado de búsqueda en el que se puede escribir el alimento del que se quiere conocer la composición. Desde esta posición se abre una lista con los distintos ítems que se incluyen dentro de la palabra introducida, cada uno de los cuales puede, a su vez, ser conocido en cuanto a su composición nutricional. www.niddk.nih.gov/index.htm Idioma: inglés La web de la Weight-control Information Network (red de información para el control del peso) incluye un apartado con publicaciones en español dirigidas al público. Entre éstas, podemos encontrarla titulada Cómo alimentarse y mantenerse activo, con información general sobre nutrición y su relación con la obesidad, la actividad física y la alimentación, y en la que se incluyen recetas y consejos para limitar el aporte calórico de la dieta. www.nutrition.org.uk Idioma: inglés La web de la British Nutrition Foundation incluye un apartado sobre comer sano (Healthy ­Eating) para la población general. En un subapartado, se describen la energía y los nutrientes de los distintos grupos de alimentos, la alimentación saludable y los requerimientos nutricionales, entre otros. Asimismo, también ofrece información sobre la alimentación a lo largo de la vida y sobre el etiquetado de los alimentos. www.obesity.org Idioma: inglés En la web de la American Obesity Association se incluye un apartado sobre prevención, educación y tratamiento. En éste último, se redirecciona al internauta hacia la web del National 163 11 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Heart Lung and Blood Institute (Instituto del pulmón, del corazón y de la sangre) de National Institutes of Health (www.nhlbi.nih.gov/guidelines/obesity/ob_home.htm), en la que se incluyen documentos sobre el tratamiento de la obesidad con dieta y ejercicio, dirigidos tanto a los profesionales sanitarios como a los pacientes. www.who.int/nutrition Idioma: inglés La página de nutrición de la Organización Mundial de la Salud (OMS) incluye una amplia lista de publicaciones dirigidas a los profesionales sanitarios sobre los principales problemas de alimentación de la población mundial, incluyendo la malnutrición y la obesidad. Pueden obtenerse otras direcciones de Internet relacionadas con la nutrición en la referencia (616). 164 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 11 12. ANEXOS I. ENCUESTAS DIETÉTICAS Se muestran dos encuestas dietéticas, una sencilla, de 14 ítems, y otra, más compleja, que requiere una mayor disponibilidad de tiempo en la consulta. Encuesta dietética breve Está incluida en el estudio Predimed, que se inició con el objeto de evaluar los efectos de la dieta tipo mediterráneo en la prevención primaria de la morbilidad y la mortalidad cardiovascular, en una serie de 12.150 pacientes con alto riesgo vascular. Permite la valoración individual sencilla del grado de cumplimiento de la dieta mediterránea. Valoración individual del grado de cumplimiento inicial de la dieta mediterránea según la siguiente encuesta de 14 puntos. Puntuación: se suman todos los puntos obtenidos (columna derecha): 1 ¿Usa usted el aceite de oliva como principal grasa para cocinar? Sí = 1 punto 2 ¿Cuánto aceite de oliva consume en total al día (incluyendo el usado para freír, el de las comidas fuera de casa, las ensaladas, etc.)? 2 o más cucharadas = 1 punto 3 ¿Cuántas raciones de verdura u hortalizas consume al día? (las guarniciones o acompañamientos = ½ ración) 2 o más (al menos una de ellas en ensalada o crudas) = 1 punto 4 ¿Cuántas piezas de fruta (incluyendo zumo natural) consume al día? 3 o más al día = 1 punto 165 12 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 5 ¿Cuántas raciones de carnes rojas, hamburguesas, salchichas o Menos de 1 al día = embutidos consume al día? 1 punto (una ración = 100-150 g) 6 ¿Cuántas raciones de mantequilla, margarina o nata consume al día? (porción individual = 12 g) Menos de 1 al día = 1 punto 7 ¿Cuántas bebidas carbonatadas y/o azucaradas (refrescos, colas, tónicas, bíter) consume al día? Menos de 1 al día = 1 punto 8 ¿Bebe vino? ¿Cuánto consume a la semana? 3 o más vasos por semana = 1 punto 9 ¿Cuántas raciones de legumbres consume a la semana? (un plato o ración = 150 g) 3 o más por semana = 1 punto 10 ¿Cuántas raciones de pescado-mariscos consume a la semana? (un plato, pieza o ración = 100-150 g de pescado ó 4-5 piezas ó 200 g de marisco) 3 o más por semana = 1 punto 11 ¿Cuántas veces consume repostería comercial (no casera), como galletas, flanes, dulces o pasteles a la semana? Menos de 3 por semana = 1 punto 12 ¿Cuántas veces consume frutos secos a la semana? (una ración = 30 g) 1 o más por semana = 1 punto 13 ¿Consume preferentemente carne de pollo, pavo o conejo en vez de ternera, cerdo, hamburguesas o salchichas? (carne de pollo: una pieza o ración = 100-150 g) Sí = 1 punto 14 ¿Cuántas veces a la semana consume los vegetales cocinados, la pasta, el arroz u otros platos aderezados con una salsa de tomate, ajo, cebolla o puerro elaborada a fuego lento con aceite de oliva (sofrito)? 2 o más por semana = 1 punto Encuesta dietética extensa Instrucciones para la realización de la encuesta Para cada alimento, marque el recuadro correspondiente al consumo realizado, junto a él figurará la puntuación que se tiene que reseñar en la parte derecha en la columna correspondiente. Al final se deben sumar todas las puntuaciones. Cuanto más cercano sea el resultado final a 0, mayor cumplimiento de las recomendaciones de una dieta cardiosaludable. 166 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ANEXOS EN ATENCIÓN PRIMARIA 12 ENCUESTA DIETÉTICA HARINAS, CEREALES, FÉCULAS Excepcional- Varias veces mente, nunca semana A diario Pan, arroz, pasta, maíz, patatas, cereales de desayuno no chocolateados ni azucarados n7 n3 n0 Pan integral, cereales integrales no chocolateados ni azucarados, galletas integrales elaboradas con grasas mono o poliinsaturadas no trans n7 n3 n0 Excepcionalmente, nunca Varias veces semana A diario (*) n7 n3 n0 n7 n3 n0 FRUTAS, VERDURAS Frutas Verduras, ensaladas Puntuación Puntuación *El aporte combinado de frutas y verduras tiene que ser superior a 400 g al día. GRASAS Excepcional- Varias veces mente, nunca semana A diario Aceite oliva, de semillas, margarinas sin ácidos grasos trans, margarinas con sitostanol/sitosterol n7 n3 n0 Manteca, tocino, margarinas hidrogenadas, mantequilla, aceite de coco, de palma, productos para untar con grasas hidrogenadas n0 n3 n7 BOLLERÍA INDUSTRIAL Cruasanes, magdalenas, galletas de mantequilla, ensaimadas, bollos preparados con grasas no recomendables Excepcional- ≤3 raciones mente, nunca por semana n0 n3 ≥4 raciones por semana Puntuación Puntuación n7 167 12 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA LÁCTEOS Excepcional- ≤3 raciones mente, nunca por semana ≥4 raciones por semana Leche entera, leche condensada, nata, yogur normal, quesos grasos n0 n3 n7 Leche desnatada, leche enriquecida con grasas insaturadas, yogur desnatado, queso blanco n7 n3 n0 LEGUMBRES Alubias, garbanzos, lentejas, habas, guisantes, elaborados sin grasas animales SOPAS Sopas espesas o muy cremosas con elevado aporte graso. Sopas comerciales PESCADO Pescado blanco o azul, fresco o congelado (sin piel) MARISCO Mejillones, sepia, pulpo, calamares, gambas, cigalas, langosta, langostinos, almejas, chirlas, ostras 168 Excepcional- ≤3 raciones mente, nunca por semana n7 n3 Excepcional- ≤ 3 raciones mente, nunca por semana n0 n3 Excepcional- ≤3 raciones mente, nunca por semana n7 n3 Excepcional- ≤3 raciones mente, nunca por semana n0 n0 ≥4 raciones por semana Puntuación Puntuación n0 ≥4 raciones por semana Puntuación n7 ≥4 raciones por semana Puntuación n0 ≥ 4 raciones por semana n0 Puntuación GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ANEXOS EN ATENCIÓN PRIMARIA CARNES Conejo, pollo, pavo, avestruz Excepcional- ≤3 raciones mente, nunca por semana ≥4 raciones por semana n0 n0 n0 Buey, ternera (partes magras, solomillo, bistec de flanco, redondo) cordero magro, lomo o solomillo de cerdo, jamón serrano, embutido de pavo, de pollo, salchichas de ternera, cabrito n0 n0 n3 Pato, oca, beicon, embutido en general (salchichón, longaniza, chorizo, morcillas…), chuletas de ternera, de cordero, costilla de cerdo, salchichas Frankfurt, patés, vísceras, hamburguesas n0 n3 n7 HUEVOS (Nota 1) Huevos SALAZONES Conservas, salazones, frutos secos salados SALSAS Salsas hechas con nata (roquefort, pimienta), mantequilla, margarinas hidrogenadas, leche entera. Sofritos con grasas animales (costilla, beicon, longaniza, etc.) DULCES Chocolate, pastelería comercial, postres con nata o mantequilla, tartas comerciales, helados elaborados con leche entera y/o grasas hidrogenadas Excepcional- ≤3 raciones mente, nunca por semana n0 n0 Excepcional- ≤3 raciones mente, nunca por semana n0 n3 Excepcional- ≤3 raciones mente, nunca por semana n0 n3 Excepcional- ≤3 raciones mente, nunca por semana n0 n3 ≥4 raciones por semana 12 Puntuación Puntuación n0 ≥4 raciones por semana Puntuación n7 ≥4 raciones por semana Puntuación n7 ≥4 raciones por semana Puntuación n7 169 12 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA FRUTOS SECOS Ciruelas pasas, higos, dátiles, almendras, avellanas, nueces, castañas, piñones, pipas sin sal ALIMENTOS PREPARADOS Platos precocinados, comidas enlatadas APERITIVOS Patatas fritas industriales, ganchitos, galletas saladas, cortezas de cerdo, aperitivos diversos, chips de maíz BEBIDAS Bebidas azucaradas (colas, refrescos). Zumos con azúcar añadido ALCOHOL Excepcional- ≤3 raciones mente, nunca por semana n7 n3 Excepcional- ≤3 raciones mente, nunca por semana n0 n3 Excepcional- ≤3 raciones mente, nunca por semana n0 n3 Excepcional- ≤3 raciones mente, nunca por semana n0 n3 Diariamente Consumo de menos de 20 g/día en mujeres y 30 g/día en hombres. Equivalentes a una y dos copas de vino de 12º, respectivamente n0 Consumo de mayores cantidades alcohólicas n7 TOTAL ENCUESTA 170 ≥4 raciones por semana Puntuación n0 ≥4 raciones por semana Puntuación n7 ≥4 raciones por semana Puntuación n7 ≥4 raciones por semana Puntuación n7 Puntuación GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE ANEXOS EN ATENCIÓN PRIMARIA 12 ANEXO (Nota 2) VALORACIÓN ÍNDICE DE MASA CORPORAL (Peso/talla en metros²) NORMOPESO <25 SOBREPESO I 25-27 SOBREPESO II 27-30 OBESIDAD >30 (**) Puntuación n0 n3 n7 n 11 ** En caso de obesidad, si ha reducido más del 5% de su peso en los últimos 6 meses, restar 2 puntos. TOTAL ANEXO TOTAL ENCUESTA + TOTAL ANEXO (Nota 1) No se ha demostrado que el consumo de huevos esté relacionado con un incremento del riesgo cardiovascular. No obstante, por el elevado contenido de colesterol de la yema, en las recomendaciones de las diferentes guías se aconseja que su consumo sea de un máximo de tres a la semana. (Nota 2) Se valora el IMC (Índice de masa corporal: peso/altura²), atribuyéndose una puntuación a este epígrafe que se sumará al total anterior. El objeto es introducir un factor de corrección que permita tanto en la evaluación dietética inicial como en los controles sucesivos, tener en cuenta que uno de los objetivos de la alimentación cardiosaludable es el conseguir un peso adecuado; y, aun con un consumo apropiado de alimentos cardiosaludables (aceite de oliva, frutos secos, pescado, legumbres, etc.), si su aporte calórico excede al consumo energético, se inducirá sobrepeso u obesidad, que es siempre desaconsejable; por el contrario, una disminución del aporte calórico en personas con sobrepeso u obesidad producirá reducciones ponderales que, aunque sean modestas, causarán un beneficio en términos de riesgo cardiovascular. 171 12 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA II. CUESTIONARIO PARA EVALUAR EL ESTILO DE VIDA 1. ¿Consume un exceso de calorías, de alimentos Hacer una encuesta alimentaria que aumentan el colesterol (ácidos grasos saturados) o los triglicéridos (alcohol, azúcar)? 2. ¿Tiene sobrepeso? Calcular el índice de masa corporal 3. ¿Tiene obesidad abdominal? Medir el perímetro de la cintura 4. ¿Lleva una vida sedentaria o activa? Interrogatorio 5. ¿Es fumador? Interrogatorio 6. ¿Presenta un síndrome metabólico asociado? Valorar cinco factores: perímetro de cintura, presión arterial, glucemia, triglicéridos y colesterol HDL 172 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 12 13. BIBLIOGRAFÍA 1. Forman D, Bulwer BE. Cardiovascular disease: optimal approaches to risk factor modification of diet and lifestyle. Curr Treat Options Cardiovasc Med 2006; 8: 47-57. 2. Pekka, P., Pirjo, P., Ulla, U. Influencing public nutrition for non-communicable disease prevention: from community intervention to national programme-experiences from Finland. Public Health Nutr 2002; 5: 245-251. 3. Bennett K, Kabir Z, Unal B y cols. Explaining the recent decrease in coronary heart disease mortality rates in Ireland, 1985-2000. J Epidemiol Community Health 2006; 60: 322-327. 4. Ordovas JM, Corella D, Demissie S, Cupples LA, Couture P, Coltell O, Wilson PW, Schaefer, EJ, Tucker KL. Dietary fat intake determines the effect of a common polymorphism in the hepatic lipase gene promoter on high-density lipoprotein metabolism: evidence of a strong dose effect in this genenutrient interaction in the Framingham Study. Circulation 2002; 106: 2315-2321. 5. Plaza Pérez I, Villar Álvarez F, Mata López P, Pérez Jiménez F, Maiquez, Galan A, Casasnovas Lenguas JA, Banegas Banegas JR, Tomas Abadal L, Rodríguez Artalejo F, Gil López E. Control de la colesterolemia en España, 2000. Un instrumento para la prevención cardiovascular. Rev Esp Cardiol 2000; 53(6): 815-37. 6. Medrano MJ, Cerrato E, Boix R, Delgado-Rodríguez M. Factores de riesgo cardiovascular en la población española: metaanálisis de estudios transversales. Med Clin (Barc) 2005; 124(16): 606-612. 7. Aranceta J, Pérez Rodrigo C, Serra Majem L, Ribas Barba L, Quiles Izquierdo J, Vioque J, Tur Mari J, Mataix Verdú J, Llopis González J, Tojo R, Foz Sala M; Grupo colaborativo para el Estudio de la Obesidad en España. Prevalencia de la obesidad en España: resultados del estudio SEEDO 2000. Med Clin (Barc) 2003; 120(16): 608-612. 8. Dislipemia. Guía Práctica. Grupo de Lípidos del Bages y del Berguedà. Revisada y actualizada. Enero 2002. 9. Meco JF, Pintó X. Cálculo del riesgo cardiovascular. Clin Invest Arterioscler 2002; 14(4): 198-208. 10. Álvarez-Sala LA, Suárez C, Mantilla T, Franch J, Ruilope LM, Banegas JR, Barrios V; Grupo PREVENCAT. Estudio PREVENCAT: control del riesgo cardiovascular en atención primaria. Med Clin (Barc) 2005; 124(11): 406-410. 11. Llisterri Caro JL, Rodríguez Roca GC, Alonso Moreno FJ, Lou Arnal S, Divison Garrote JA, Santos Rodríguez JA, Raber Bejar A, De Castellar Sanso R, Ruilope Urioste LM, Banegas Banegas JR; Grupo de Trabajo de Hipertension Arterial de la Sociedad Espanola de Medicina Rural y Generalista (Grupo HTA/SEMERGEN); Investigadores del Estudio PRESCAP 2002. Control de la presión arterial en la población hipertensa española atendida en atención primaria. Estudio PRESCAP 2002. Med Clin (Barc) 2004; 122(5): 165-171. 173 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 12. De la Peña Fernández A, Suárez Fernández C, Cuende Melero I, Muñoz Rodríguez M, Garré Cánovas J, Camafort Babkowski M, Roca Villanueva B, Alcala Pedraja J; Grupo estudio CIFARC (Grupo Riesgo Vascular SEMI). Control integral de los factores de riesgo en pacientes de alto y muy alto riesgo cardiovascular en España. Estudio CIFARC. Med Clin (Barc) 2005; 124(2): 44-49. 13. Gabriel R, Saiz C, Susi R, Alonso M, Vega S, López I, Cruz Cardenal MM, Gómez-Gerique JA, Porres A, Muniz J. Epidemiología del perfil lipídico de la población anciana española: el estudio EPICARDIAN. Med Clin (Barc) 2004; 22(16): 605-609. 14. Serra-Majem L, Roman B, Estruch R. Scientific evidence of interventions using the Mediterranean diet: a systematic review. Nutr Rev 2006 ; 64(2 Pt 2): S27-S47. 15. Aldana SG, Greenlaw RL, Diehl HA, Salberg A, Merrill RM, Ohmine S, Thomas C. The behavioral and clinical effects of therapeutic lifestyle change on middle-aged adults. Prev Chronic Dis 2006; 3(1): A05. 16. Schuit AJ, Wendel-Vos GC, Verschuren WM, Ronckers ET, Ament A, Van Assema P, Van Ree J, Ruland EC. Effect of 5-year community intervention Hartslag Limburg on cardiovascular risk factors. Am J Prev Med 2006; 30(3): 237-242. 17. Rodríguez Cristóbal JJ, Benavides Márquez F, Villaverde Grote C, Peña Sendra E, Flor Serra F, Trave Mercade P; Grupo EFAP. Ensayo clínico aleatorizado de una intervención intensiva sobre los estilos de vida de pacientes con hiperfibrinogenemia en prevención primaria de las enfermedades cardiovasculares en el ámbito de la atención primaria de salud. Aten Primaria 2005; 35(5): 260-264. 18. Flight I, Clifton P. Cereal grains and legumes in the prevention of coronary heart disease and stroke: a review of the literature. Eur J Clin Nutr 2006; 60(10): 1145-1159. 19. Dreon DM, Fernstrom HA, Miller B, Krauss RM. Low-density lipoprotein subclass patterns and lipoprotein response to a reduced-fat diet in men. FASEB J 1994; 8(1): 121-126. 20. Starc TJ, Shea S, Cohn LC, Mosca L, Gersony WM, Deckelbaum RJ. Greater dietary intake of simple carbohydrate is associated with lower concentrations of high-density-lipoprotein cholesterol in hypercholesterolemic children. Am J Clin Nutr 1998; 67(6): 1147-1154. 21. Grundy SM. Comparison of monounsaturated fatty acids and carbohydrates for lowering plasma cholesterol. N Engl J Med 1986; 314(12): 745-748. 22. Garg A, Grundy SM, Koffler M. Effect of high carbohydrate intake on hyperglycemia, islet function, and plasma lipoproteins in NIDDM. Diabetes Care 1992; 15(11): 1572-1580. 23. Gerhard GT, Ahmann A, Meeuws K, McMurry MP, Duell PB, Connor WE. Effects of a low-fat diet compared with those of a high-monounsaturated fat diet on body weight, plasma lipids and lipoproteins, and glycemic control in type 2 diabetes. Am J Clin Nutr 2004; 80(3): 668-673. 24. Parks EJ, Hellerstein MK. Carbohydrate-induced hypertriacylglycerolemia: historical perspective and review of biological mechanisms. Am J Clin Nutr 2000; 71(2): 412-433. 25. Katan MB, Zock PL, Mensink RP. Effects of fats and fatty acids on blood lipids in humans: an overview. Am J Clin Nutr 1994; 60(6 Suppl): 1017-1022. 26. Anderson JW, Konz EC. Obesity and disease management: effects of weight loss on comorbid conditions. Obes Res 2001; 9(Suppl 4): 326-334. 27. Grundy SM. Hypertriglyceridemia, insulin resistance, and the metabolic syndrome. Am J Cardiol 1999; 83(9B): 25F-29F. 28. Krauss RM. Triglycerides and atherogenic lipoproteins: rationale for lipid management. Am J Med 1998; 105(1A): 58S-62S. 29. Pelkman CL. Effects of the glycemic index of foods on serum concentrations of high-density lipoprotein cholesterol and triglycerides. Curr Atheroscler Rep 2001; 3(6): 456-461. 30. Wolever TM. The glycemic index. World Rev Nutr Diet 1990; 62: 120-185. 174 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 31. Foster-Powell K, Holt SH, Brand-Miller JC. International table of glycemic index and glycemic load values: 2002. Am J Clin Nutr 2002; 76(1): 5-56. 32. Jenkins DJ, Kendall CW, Augustin LS, Franceschi S, Hamidi M, Marchie A, Jenkins AL, Axelsen M. Glycemic index: overview of implications in health and disease. Am J Clin Nutr 2002; 76(1): 266S273S. 33. WHO/FAO. Carbohydrates in Human Nutrition. Food and nutrition. Paper nº. 66. Rome, Italy. 1998. En Internet: http://www.fao.org/docrep/w8079e/w8079e00.htm. 34. Ludwig DS. The glycemic index: physiological mechanisms relating to obesity, diabetes, and cardiovascular disease. JAMA 2002; 287(18): 2414-2423. 35. Garg A, Bonanome A, Grundy SM, Zhang ZJ, Unger RH. Comparison of a high-carbohydrate diet with a high-monounsaturated-fat diet in patients with non-insulin-dependent diabetes mellitus. N Engl J Med 1988; 319(13): 829-834. 36. Reaven GM. Do high carbohydrate diets prevent the development or attenuate the manifestations (or both) of syndrome X? A viewpoint strongly against. Curr Opin Lipidol 1997; 8(1): 23-27. 37. Brand Miller J, Foster-Powell K. Diets with a low glycemic index: From theory to practice. Nutr Today 1999; 34: 64-72. 38. Brand JC, Colagiuri S, Crossman S, Allen A, Roberts DC, Truswell AS. Low-glycemic index foods improve long-term glycemic control in NIDDM. Diabetes Care 1991; 14(2): 95-101. 39. Opperman AM, Venter CS, Oosthuizen W, Thompson RL, Vorster HH. Meta-analysis of the health effects of using the glycaemic index in meal-planning. Br J Nutr 2004; 92(3): 367-381. 40. Pi-Sunyer FX. Glycemic index and disease. Am J Clin Nutr 2002; 76(1): 290S-298S. 41. Liu S, Manson JE, Stampfer MJ, Holmes MD, Hu FB, Hankinson SE, Willett WC. Dietary glycemic load assessed by food-frequency questionnaire in relation to plasma high-density-lipoprotein cholesterol and fasting plasma triacylglycerols in postmenopausal women. Am J Clin Nutr 2001; 73(3): 560566. 42. Salmeron J, Manson JE, Stampfer MJ, Colditz GA, Wing AL, Willett WC. Dietary fiber, glycemic load, and risk of non-insulin-dependent diabetes mellitus in women. JAMA 1997; 277(6): 472-477. 43. Salmeron J, Ascherio A, Rimm EB, Colditz GA, Spiegelman D, Jenkins DJ, Stampfer MJ, Wing AL, Willett WC. Dietary fiber, glycemic load, and risk of NIDDM in men. Diabetes Care 1997; 20(4): 545-550. 44. Liu S, Willett WC, Stampfer MJ, Hu FB, Franz M, Sampson L, Hennekens CH, Manson JE. A prospective study of dietary glycemic load, carbohydrate intake, and risk of coronary heart disease in US women. Am J Clin Nutr 2000; 71(6): 1455-1461. 45. Liu S, Manson JE, Stampfer MJ, Rexrode KM, Hu FB, Rimm EB, Willett WC. Whole grain consumption and risk of ischemic stroke in women: A prospective study. JAMA 2000; 284(12): 1534-1540. 46. Frost G, Leeds AA, Dore CJ, Madeiros S, Brading S, Dornhorst A. Glycaemic index as a determinant of serum HDL-cholesterol concentration. Lancet 1999; 353(9158): 1045-1048. 47. Slyper A, Jurva J, Pleuss J, Hoffmann R, Gutterman D. Influence of glycemic load on HDL cholesterol in youth. Am J Clin Nutr 2005; 81(2): 376-379. 48. Garg A. High-monounsaturated-fat diets for patients with diabetes mellitus: a meta-analysis. Am J Clin Nutr 1998; 67(3 Suppl): 577-582. 49. Ros E. Dietary cis-monounsaturated fatty acids and metabolic control in type 2 diabetes. Am J Clin Nutr 2003; 78(3 Suppl): 617-625. 50. Kris-Etherton PM, Kris-Etherton PM, Binkoski AE, Zhao G, Coval SM, Clemmer KF, Hecker KD, Jacques H, Etherton TD. Dietary fat: assessing the evidence in support of a moderate-fat diet; the benchmark based on lipoprotein metabolism. Proc Nutr Soc 2002; 61(2): 287-298. 51. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on 175 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285(19): 2486-2497. 52. Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, Pasternak RC, Smith SC Jr, Stone NJ, for the Coordinating Committee of the National Cholesterol Education Program. Endorsed by the National Heart, Lung, and Blood Institute, American College of Cardiology Foundation, American Heart Association. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation 2004; 110(2): 227-239. 53. Bowen PH, Guyton JR. Nonpharmacologic and pharmacologic treatment of patients with low levels of high-density lipoprotein cholesterol. Curr Atheroscler Rep 2000; 2(1): 58-63. 54. Ordóñez J, Sola R. Tratamiento de la hipoalfalipoproteinemia. Modificación no farmacológica de las concentraciones de cHDL. Clin Invest Arterioscler 2001; 13(Supl. 4): 43-48. 55. Wei M, Gaskill SP, Haffner SM, Stern MP. Effects of diabetes and level of glycemia on all-cause and cardiovascular mortality. The San Antonio Heart Study. Diabetes Care 1998; 21(7): 1167-1172. 56. Hanefeld M, Fischer S, Julius U, Schulze J, Schwanebeck U, Schmechel H, Ziegelasch HJ, Lindner J. Risk factors for myocardial infarction and death in newly detected NIDDM: the Diabetes Intervention Study, 11-year follow-up. Diabetologia 1996; 39(12): 1577-1583. 57. Kuusisto J, Mykkanen L, Pyorala K, Laakso M. NIDDM and its metabolic control predict coronary heart disease in elderly subjects. Diabetes 1994; 43(8): 960-977. 58. The Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Research Group. Intensive diabetes therapy and carotid intima-media thickness in type 1 diabetes mellitus. N Engl J Med 2003; 348: 2294-2303. 59. Levitan EB, Song Y, Ford ES, Liu S. Is nondiabetic hyperglycemia a risk factor for cardiovascular disease? A meta-analysis of prospective studies. Arch Intern Med 2004; 164(19): 2147-2155. 60. The DECODE study group on behalf of the European Diabetes Epidemiology Group. Glucose tolerance and mortality: comparison of WHO and American Diabetes Association diagnostic criteria. Lancet 1999; 354(9179): 617-621. 61. Coutinho M, Gerstein HC,Wang Y,Yusuf S. The relationship between glucose and incident cardiovascular events. A metaregression analysis of published data from 20 studies of 95,783 individuals followed for 12.4 years. Diabetes Care 1999; 22(2): 233-240. 62. Balkau B, Shipley M, Jarrett RJ, Pyorala K, Pyorala M, Forhan A, Eschwege E. High blood glucose concentration is a risk factor for mortality in middle-aged nondiabetic men. 20-year follow-up in the Whitehall Study, the Paris Prospective Study, and the Helsinki Policemen Study. Diabetes Care 1998; 21(3): 360-367. 63. De Vegt F, Dekker JM, Ruhe HG, Stehouwer CD, Nijpels G, Bouter LM, Heine RJ. Hyperglycaemia is associated with all-cause and cardiovascular mortality in the Hoorn population: the Hoorn Study. Diabetologia 1999; 42(8): 926-931. 64. Temelkova-Kurktschiev TS, Koehler C, Henkel E, Leonhardt W, Fuecker K, Hanefeld M. Postchallenge plasma glucose and glycemic spikes are more strongly associated with atherosclerosis than fasting glucose or HbA1c level. Diabetes Care 2000; 23(12): 1830-1834. 65. Flint A, Moller BK, Raben A, Pedersen D, Tetens I, Holst JJ, Astrup A. The use of glycaemic index tables to predict glycaemic index of composite breakfast meals. Br J Nutr 2004; 91(6): 979-989. 66. Wolever TM, Yang M, Zeng XY, Atkinson F, Brand-Miller JC. Food glycemic index, as given in glycemic index tables, is a significant determinant of glycemic responses elicited by composite breakfast meals. Am J Clin Nutr 2006; 83(6): 1306-1312. 67. Anderson JW, O’Neal DS, Riddell-Mason S, Floore TL, Dillon DW, Oeltgen PR. Postprandial serum glucose, insulin, and lipoprotein responses to high- and low-fiber diets. Metabolism 1995; 44(7): 848854. 176 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 68. Kelly S, Frost G, Whittaker V, Summerbell C. Low glycaemic index diets for coronary heart disease. Cochrane Database Syst Rev 2004; (4):CD004467. 69. Hu FB, Willett WC. Optimal diets for prevention of coronary heart disease. JAMA 2002; 288(20): 2569-2578. 70. Arteaga Llona A. El índice glicémico. Una controversia actual. Nutr Hosp 2006; 21(Supl 2): 55-60. 71. American Diabetes Association. Nutrition principles and recommendations in diabetes. Diabetes Care 2004; 27(Suppl.1): 36-46. 72. Farran, R. Zamora, P. Cervera y cols. Tablas de Composición de alimentos del CESNID (Centre d’Ensenyament Superior de Nutrició i Dietètica). Ediciones Universitat de Barcelona (Barcelona), McGraw-Hill Interamericana, Madrid, 2004. 73. Grundy SM, Denke MA. Dietary influences on serum lipids and lipoproteins. J Lipid Res 1990;31(7): 1149-72. 74. Lahoz C, Peña R, Mostaza JM. Lípidos, dieta mediterránea y enfermedad coronaria. Cardiovasc Risk Factors 2000; 9(5): 303-309. 75. Mattson FH, Grundy SM. Comparison of effects of dietary saturated, monounsaturated, and polyunsaturated fatty acids on plasma lipids and lipoproteins in man. J Lipid Res 1985; 26(2): 194202. 76. Mensink RP, Zock PL, Kester AD, Katan MB. Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trials. Am J Clin Nutr 2003; 77(5): 1146-1155. 77. Curb JD, Wergowske G, Dobbs JC, Abbott RD, Huang B. Serum lipid effects of a high-monounsaturated fat diet based on macadamia nuts. Arch Intern Med 2000; 160(8): 1154-1158. 78. Mensink RP, Katan MB. Effect of dietary fatty acids on serum lipids and lipoproteins. A meta-analysis of 27 trials. Arterioscler Thromb 1992; 12(8): 911-919. 79. Stone NJ. Fish consumption, fish oil, lipids, and coronary heart disease. Am J Clin Nutr 1997; 65(4): 1083-1086. 80. Caggiula AW, Mustad VA. Effects of dietary fat and fatty acids on coronary artery disease risk and total and lipoprotein cholesterol concentrations: epidemiologic studies. Am J Clin Nutr 1997; 65(5 Suppl): 1597-1610. 81. Varela G, Ruiz-Roso B. Some effects of deep frying on dietary fat intake. Nutr Rev 1992; 50(9): 256262. 82. Renaud S, Lanzmann-Petithory D. Dietary fats and coronary heart disease pathogenesis. Curr Atheroscler Rep 2002; 4(6): 419-424. 83. Bonanome A, Grundy SM. Effect of dietary stearic acid on plasma cholesterol and lipoproteins levels. N Engl J Med 1988; 318(19): 1244-1248. 84. Pérez-Jiménez F. International conference on the healthy effect of virgin olive oil. Eur J Clin Invest 2005; 35(7): 421-424. 85. Pascual Fuster V, Meco López JF. Nuevos conceptos en el tratamiento dietético del síndrome metabólico. Rev Clin Esp 2006; 206(2): 100-102. 86. Kris-Etherton PM, Pearson TA, Wan Y, Hargrove RL, Moriarty K, Fishell V, Etherton TD. Highmonounsaturated fatty acid diets lower both plasma cholesterol and triacylglycerol concentrations. Am J Clin Nutr 1999; 70(6): 1009-1015. 87. Shah M, Adams-Huet B, Bantle JP, Henry RR, Griver KA, Raatz SK, Brinkley LJ, Reaven GM, Garg A. Effect of a high-carbohydrate versus a high--cis-monounsaturated fat diet on blood pressure in patients with type 2 diabetes. Diabetes Care 2005; 28(11): 2607-2612. 88. Reaven PD, Witztum JL. Oxidized low density lipoproteins in atherogenesis: role of dietary modification. Annu Rev Nutr 1996; 16: 51-71. 177 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 89. Mata P, Alonso R, López-Farré A, Ordovas JM, Lahoz C, Garces C, Caramelo C, Codoceo R, Blázquez E, De Oya M. Effect of dietary fat saturation on LDL oxidation and monocyte adhesion to human endothelial cells in vitro. Arterioscler Thromb Vasc Biol 1996; 16(11): 1347-1355. 90. Ferrara LA, Raimondi AS, d’Episcopo L, Guida L, Dello Russo A, Marotta T. Olive oil and reduced need for antihypertensive medications. Arch Intern Med 2000; 160(6): 837-842. 91. López-Segura F, Velasco F, López-Miranda J, Castro P, López-Pedrera R, Blanco A, Jiménez-Perepérez J, Torres A, Trujillo J, Ordovas JM, Pérez-Jiménez F. Monounsaturated fatty acid-enriched diet decreases plasma plasminogen activator inhibitor type 1. Arterioscler Thromb Vasc Biol 1996; 16(1): 82-88. 92. Larsen LF, Jespersen J, Marckmann P. Are olive oil diets antithrombotic? Diets enriched with olive, rapeseed, or sunflower oil affect postprandial factor VII differently. Am J Clin Nutr 1999; 70(6): 976982. 93. Yaqoob P, Knapper JA, Webb DH, Williams CM, Newsholme EA, Calder PC. Effect of olive oil on immune function in middle-aged men. Am J Clin Nutr 1998; 67(1): 129-135. 94. Pérez-Jiménez F, Castro P, López-Miranda J, Paz-Rojas E, Blanco A, López-Segura F, Velasco F, Marín C, Fuentes F, Ordovas JM. Circulating levels of endothelial function are modulated by dietary monounsaturated fat. Atherosclerosis 1999; 145(2): 351-358. 95. Garg A, Grundy SM, Unger RH. Comparison of effects of high and low carbohydrate diets on plasma lipoproteins and insulin sensitivity in patients with mild NIDDM. Diabetes 1992; 41(10): 1278-1285. 96. Mata P, De Oya M, Pérez-Jiménez F, Ros E. Dieta y enfermedades cardiovasculares. Recomendaciones de la Sociedad Española de Arteriosclerosis. Clin Invest Arterioscler 1994; 6(2): 43-61. 97. Yu-Poth S, Zhao G, Etherton T, Naglak M, Jonnalagadda S, Kris-Etherton PM. Effects of the National Cholesterol Education Program’s Step I and Step II dietary intervention programs on cardiovascular disease risk factors: a meta-analysis. Am J Clin Nutr 1999; 69(4): 632-646. 98. Hu FB, Stampfer MJ, Manson JE, Rimm E, Colditz GA, Rosner BA, Hennekens CH, Willett WC. Dietary fat intake and the risk of coronary heart disease in women. N Engl J Med 1997; 337(21): 1491-1499. 99. Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr 1997; 65(5 Suppl): 1645-1654. 100. Roche HM, Gibney MJ. Effect of long-chain n-3 polyunsaturated fatty acids on fasting and postprandial triacylglycerol metabolism. Am J Clin Nutr 2000; 71(1 Suppl): 232-237. 101. McLennan PL, Abeywardena MY, Charnock JS. Dietary fish oil prevents ventricular fibrillation following coronary artery occlusion and reperfusion. Am Heart J 1988; 116(3): 709-717. 102. Nair SS, Leitch JW, Falconer J, Garg ML. Prevention of cardiac arrhythmia by dietary (n-3) polyunsaturated fatty acids and their mechanism of action. J Nutr 1997; 127(3): 383-393. 103. Albert CM, Campos H, Stampfer MJ, Ridker PM, Manson JE, Willett WC, Ma J. Blood levels of longchain n-3 fatty acids and the risk of sudden death. N Engl J Med 2002; 346(15): 1113-1118. 104. Sacks FM, Hebert P, Appel LJ, Borhani NO, Applegate WB, Cohen JD, Cutler JA, Kirchner KA, Kuller LH, Roth KJ, et al. The effect of fish oil on blood pressure and high-density lipoprotein-cholesterol levels in phase I of the Trials of Hypertension Prevention. Trials of Hypertension Prevention Collaborative Research Group. J Hypertens Suppl 1994; 12(7):S23-31. 105. Lahoz C, Alonso R, Ordovas JM, López-Farre A, De Oya M, Mata P. Effects of dietary fat saturation on eicosanoid production, platelet aggregation and blood pressure. Eur J Clin Invest 1997; 27(9): 780787. 106. Nestel P, Shige H, Pomeroy S, Cehun M, Abbey M, Raederstorff D. The n-3 fatty acids eicosapentaenoic acid and docosahexaenoic acid increase systemic arterial compliance in humans. Am J Clin Nutr 2002; 76(2): 326-330. 107. Alonso A, Martínez-González MA, Serrano-Martínez M. Ácidos grasos omega-3 de pescado y riesgo de enfermedad coronaria. Med Clin (Barc) 2003; 121(1): 28-35. 178 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 108. Carpentier YA, Portois L, Malaisse WJ. n-3 fatty acids and the metabolic syndrome. Am J Clin Nutr 2006; 83(6 Suppl): 1499-1504. 109. Nettleton JA, Katz R. n-3 long-chain polyunsaturated fatty acids in type 2 diabetes: a review. J Am Diet Assoc 2005; 105(3): 428-440. 110. Montori VM, Farmer A, Wollan PC, Dinneen SF. Fish oil supplementation in type 2 diabetes: a quantitative systematic review. Diabetes Care 2000; 23(9): 1407-1415. 111. Bang HO, Dyerberg J, Hjoorne N. The composition of food consumed by Greenland Eskimos. Acta Med Scand 1976; 200(1-2): 69-73. 112. Gurr MI. Dietary lipids and coronary heart disease: old evidence, new perspective. Prog Lipid Res 1992; 31(3): 195-243. 113. De Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation 1999; 99(6): 779-785. 114. Djousse L, Pankow JS, Eckfeldt JH, Folsom AR, Hopkins PN, Province MA, Hong Y, Ellison RC. Relation between dietary linolenic acid and coronary artery disease in the National Heart, Lung, and Blood Institute Family Heart Study. Am J Clin Nutr 2001; 74(5): 612-619. 115. Sandker GW, Kromhout D, Aravanis C, Bloemberg BP, Mensink RP, Karalias N, Katan MB. Serum cholesteryl ester fatty acids and their relation with serum lipids in elderly men in Crete and The Netherlands. Eur J Clin Nutr 1993; 47(3): 201-208. 116. Kagawa Y, Nishizawa M, Suzuki M, Miyatake T, Hamamoto T, Goto K, Motonaga E, Izumikawa H, Hirata H, Ebihara A. Eicosapolyenoic acids of serum lipids of Japanese islanders with low incidence of cardiovascular diseases. J Nutr Sci Vitaminol (Tokyo) 1982; 28(4): 441-453. 117. Lichtenstein AH, Appel LJ, Brands M, Carnethon M, Daniels S, Franch HA, Franklin B, Kris-Etherton P, Harris WS, Howard B, Karanja N, Lefevre M, Rudel L, Sacks F, Van Horn L, Winston M, Wylie-Rosett J; American Heart Association Nutrition Committee. Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee. Circulation 2006; 114(1): 82-96. 118. Katan MB, Zock PL, Mensink RP. Trans fatty acids and their effects on lipoproteins in humans. Annu Rev Nutr 1995; 15: 473-493. 119. Katan MB. V Simposio Internacional sobre Alimentación, Lípidos y Aterosclerosis. Madrid, 1996; Abst. Páginas 36-37. 120. Ascherio A, Katan MB, Zock PL, Stampfer MJ, Willett WC. Trans fatty acids and coronary heart disease. N Engl J Med 1999; 340(25): 1994-1948. 121. De Roos NM, Siebelink E, Bots ML, Van Tol A, Schouten EG, Katan MB. Trans monounsaturated fatty acids and saturated fatty acids have similar effects on postprandial flow-mediated vasodilation. Eur J Clin Nutr 2002; 56(7): 674-679. 122. Han SN, Leka LS, Lichtenstein AH, Ausman LM, Schaefer EJ, Meydani SN. Effect of hydrogenated and saturated, relative to polyunsaturated, fat on immune and inflammatory responses of adults with moderate hypercholesterolemia. J Lipid Res 2002; 43(3): 445-452. 123. Bray GA, Lovejoy JC, Smith SR, DeLany JP, Lefevre M, Hwang D, Ryan DH, York DA. The influence of different fats and fatty acids on obesity, insulin resistance and inflammation. J Nutr 2002; 132(9): 2488-2491. 124. Salmeron J, Hu FB, Manson JE, Stampfer MJ, Colditz GA, Rimm EB, Willett WC. Dietary fat intake and risk of type 2 diabetes in women. Am J Clin Nutr 2001; 73(6): 1019-1026. 125. Lichtenstein AH, Ausman LM, Jalbert SM, Schaefer EJ. Effects of different forms of dietary hydrogenated fats on serum lipoprotein cholesterol levels. N Engl J Med 1999; 340(25): 1933-1940. 179 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 126. Carbajal A, Cuadrado C, Núñez C, Beltrán B, Toledano G, Moreiras O. Estudio TRANSFAIR. (II) Ingesta de ácidos grasos –cis y trans– con la dieta total en España. Clin Invest Arterioscler 2000; 12(5): 256262. 127. Hu FB, Stampfer MJ, Manson JE, Rimm E, Colditz GA, Speizer FE, Hennekens CH, Willett WC. Dietary protein and risk of ischemic heart disease in women. Am J Clin Nutr 1999; 70(2): 221-227. 128. Snowdon DA, Phillips RL, Fraser GE. Meat consumption and fatal ischemic heart disease. Prev Med 1984; 13(5): 490-500. 129. Hecker KD. Effects of dietary animal and soy protein on cardiovascular disease risk factors. Curr Atheroscler Rep 2001; 3(6): 471-478. 130. Meisel H. Biochemical properties of regulatory peptides derived from milk proteins. Biopolymers 1997; 43(2): 119-128. 131. Denke MA, Fox MM, Schulte MC. Short-term dietary calcium fortification increases fecal saturated fat content and reduces serum lipids in men. J Nutr 1993; 123(6): 1047-1053. 132. Agerholm-Larsen L, Bell ML, Grunwald GK, Astrup A. The effect of a probiotic milk product on plasma cholesterol: a meta-analysis of short-term intervention studies. Eur J Clin Nutr 2000; 54(11): 856-860. 133. Ros E. Prebióticos y probióticos en la regulación del metabolismo de los lípidos. Gastroenterol Hepatol 2003; 26(Supl. 1): 31-36. 134. Keys A (Editor). Coronary heart disease in seven countries. Circulation 1970; 41(4 Suppl):I1-211. 135. Hu FB, Bronner L, Willett WC, Stampfer MJ, Rexrode KM, Albert CM, Hunter D, Manson JE. Fish and omega-3 fatty acid intake and risk of coronary heart disease in women. JAMA 2002; 287(14): 18151821. 136. Lemaitre RN, King IB, Mozaffarian D, Kuller LH, Tracy RP, Siscovick DS. n-3 Polyunsaturated fatty acids, fatal ischemic heart disease, and nonfatal myocardial infarction in older adults: the Cardiovascular Health Study. Am J Clin Nutr 2003; 77(2): 319-325. 137. Trichopoulou A, Orfanos P, Norat T, Bueno-de-Mesquita B, Ocke MC, Peeters PH, Van der Schouw YT, Boeing H, Hoffmann K, Boffetta P, Nagel G, Masala G, Krogh V, Panico S, Tumino R, Vineis P, Bamia C, Naska A, Benetou V, Ferrari P, Slimani N, Pera G, Martínez-García C, Navarro C, RodríguezBarranco M, Dorronsoro M, Spencer EA, Key TJ, Bingham S, Khaw KT, Kesse E, Clavel-Chapelon F, Boutron-Ruault MC, Berglund G, Wirfalt E, Hallmans G, Johansson I, Tjonneland A, Olsen A, Overvad K, Hundborg HH, Riboli E, Trichopoulos D. Modified Mediterranean diet and survival: EPIC-elderly prospective cohort study. BMJ 2005; 330(7498): 991. 138. Burr ML, Fehily AM, Gilbert JF, Rogers S, Holliday RM, Sweetnam PM, Elwood PC, Deadman NM. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet 1989; 2(8666): 757-761. 139. Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSIPrevenzione trial. Lancet 1999; 354(9177): 447-455. 140. The Long-term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998; 339(19): 1349-1357. 141. Sacks FM, Pfeffer MA, Moye LA, Rouleau JL, Rutherford JD, Cole TG, Brown L, Warnica JW, Arnold JMO, Wun C-C, Davis BR, Braunwald E, for the Cholesterol and Recurrent Events Trial Investigators. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996; 335(14): 1001-1009. 142. Pedersen TR, y el Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344(8934): 1383-1389. 180 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 143. De Lorgeril M, Salen P: Modified Cretan Mediterranean diet in the prevention of coronary heart disease and cancer. En: Simopoulos AP, Visioli F (Editores). Mediterranean Diets. Basel, Switzerland: Karger; 2000, World Rev Nutr Diet Series vol 87: 1-23. 144. Bucher HC, Hengstler P, Schindler C, Meier G. N-3 polyunsaturated fatty acids in coronary heart disease: a meta-analysis of randomized controlled trials. Am J Med 2002; 112(4): 298-304. 145. Von Schacky C. n-3 fatty acids and the prevention of coronary atherosclerosis. Am J Clin Nutr 2000; 71(1 Suppl): 224S-227S. 146. Rodríguez-Villar C, Manzanares JM, Casals E, Pérez-Heras A, Zambón D, Gomis R, Ros E. Highmonounsaturated fat, olive oil-rich diet has effects similar to a high-carbohydrate diet on fasting and postprandial state and metabolic profiles of patients with type 2 diabetes. Metabolism 2000; 49(12): 1511-1517. 147. Fuentes F, López-Miranda J, Sánchez E, Sánchez F, Páez J, Paz-Rojas E, Marín C, Gómez P, JiménezPereperez J, Ordovas JM, Pérez-Jiménez F. Mediterranean and low-fat diets improve endothelial function in hypercholesterolemic men. Ann Intern Med 2001; 134(12): 1115-1119. 148. Panagiotakos DB, Arapi S, Pitsavos C, Antonoulas A, Mantas Y, Zombolos S, Stefanadis C. The relationship between adherence to the Mediterranean diet and the severity and short-term prognosis of acute coronary syndromes (ACS): The Greek Study of ACS (The GREECS). Nutrition 2006; 22(7-8): 722-730. 149. Estruch R, Martínez-González MA, Corella D, Salas-Salvado J, Ruiz-Gutiérrez V, Covas MI, Fiol M, Gómez-Gracia E, López-Sabater MC, Vinyoles E, Aros F, Conde M, Lahoz C, Lapetra J, Saez G, Ros E; PREDIMED Study Investigators. Effects of a Mediterranean-style diet on cardiovascular risk factors: a randomized trial. Ann Intern Med 2006; 145(1): 1-11. 150. Knoops KT, De Groot LC, Kromhout D, Perrin AE, Moreiras-Varela O, Menotti A, Van Staveren WA. Mediterranean diet, lifestyle factors, and 10-year mortality in elderly European men and women: the HALE project. JAMA 2004; 292(12): 1433-1439. 151. Howard BV, Van Horn L, Hsia J, Manson JE, Stefanick ML, Wassertheil-Smoller S, Kuller LH, LaCroix AZ, Langer RD, Lasser NL, Lewis CE, Limacher MC, Margolis KL, Mysiw WJ, Ockene JK, Parker LM, Perri MG, Phillips L, Prentice RL, Robbins J, Rossouw JE, Sarto GE, Schatz IJ, Snetselaar LG, Stevens VJ, Tinker LF, Trevisan M, Vitolins MZ, Anderson GL, Assaf AR, Bassford T, Beresford SA, Black HR, Brunner RL, Brzyski RG, Caan B, Chlebowski RT, Gass M, Granek I, Greenland P, Hays J, Heber D, Heiss G, Hendrix SL, Hubbell FA, Johnson KC, Kotchen JM. Low-fat dietary pattern and risk of cardiovascular disease: the Women’s Health Initiative Randomized Controlled Dietary Modification Trial. JAMA 2006; 295(6): 655-666. 152. Barnard RJ, DiLauro SC, Inkeles SB. Effects of intensive diet and exercise intervention in patients taking cholesterol-lowering drugs. Am J Cardiol 1997; 79(8): 1112-1124. 153. Allison TG, Squires RW, Johnson BD, Gau GT. Achieving National Cholesterol Education Program goals for low-density lipoprotein cholesterol in cardiac patients: importance of diet, exercise, weight control, and drug therapy. Mayo Clin Proc 1999; 74(5): 466-473. 154. Wald NJ, Law MR. A strategy to reduce cardiovascular disease by more than 80%. BMJ 2003; 326(7404): 1419. 155. Franco OH, Bonneux L, De Laet C, Peeters A, Steyerberg EW, Mackenbach JP. The Polymeal: a more natural, safer, and probably tastier (than the Polypill) strategy to reduce cardiovascular disease by more than 75%. BMJ 2004; 329(7480): 1447-1450. 156. He J, Ogden LG, Vupputuri S, Bazzano LA, Loria C, Whelton PK. Dietary sodium intake and subsequent risk of cardiovascular disease in overweight adults. JAMA 1999; 282(21): 2027-2034. 157. The Trials of Hypertension Prevention Collaborative Research Group. Effects of weight loss and sodium reduction intervention on blood pressure and hypertension incidence in overweight people 181 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA with high-normal blood pressure. The Trials of Hypertension Prevention, phase II. Arch Intern Med 1997; 157(6): 657-667. 158. Rasmussen BM, Vessby B, Uusitupa M, Berglund L, Pedersen E, Riccardi G, Rivellese AA, Tapsell L, Hermansen K; The KANWU Study Group. Effects of dietary saturated, monounsaturated, and n-3 fatty acids on blood pressure in healthy subjects. Am J Clin Nutr 2006; 83(2): 221-226. 159. Bao DQ, Mori TA, Burke V, Puddey IB, Beilin LJ. Effects of dietary fish and weight reduction on ambulatory blood pressure in overweight hypertensives. Hypertension 1998; 32(4): 710-717. 160. Psaltopoulou T, Naska A, Orfanos P, Trichopoulos D, Mountokalakis T, Trichopoulou A. Olive oil, the Mediterranean diet, and arterial blood pressure: the Greek European Prospective Investigation into Cancer and Nutrition (EPIC) study. Am J Clin Nutr 2004; 80(4): 1012-1018. 161. Appel LJ, Sacks FM, Carey VJ, Obarzanek E, Swain JF, Miller ER 3rd, Conlin PR, Erlinger TP, Rosner BA, Laranjo NM, Charleston J, McCarron P, Bishop LM; OmniHeart Collaborative Research Group. Effects of protein, monounsaturated fat, and carbohydrate intake on blood pressure and serum lipids: results of the OmniHeart randomized trial. JAMA 2005; 294(19): 2455-2464. 162. Hodgson JM, Burke V, Beilin LJ, Puddey IB. Partial substitution of carbohydrate intake with protein intake from lean red meat lowers blood pressure in hypertensive persons. Am J Clin Nutr 2006; 83(4): 780-787. 163. Steffen LM, Kroenke CH, Yu X, Pereira MA, Slattery ML, Van Horn L, Gross MD, Jacobs DR Jr. Associations of plant food, dairy product, and meat intakes with 15-y incidence of elevated blood pressure in young black and white adults: the Coronary Artery Risk Development in Young Adults (CARDIA) Study. Am J Clin Nutr 2005; 82(6): 1169-1177. 164. Appel LJ, Moore TJ, Obarzanek E, Vollmer WM, Svetkey LP, Sacks FM, Bray GA, Vogt TM, Cutler JA, Windhauser MM, Lin P-H, Karanja N, Simons-Morton D, McCullough M, Swain J, Steele P, Evans MA, Miller ER, Harsha DW, for The DASH Collaborative Research Group. A clinical trial of the effects of dietary patterns on blood pressure. N Engl J Med 1997; 336(16): 1117-1124. 165. Sacks FM, Svetkey LP, Vollmer WM, Appel LJ, Bray GA, Harsha D, Obarzanek E, Conlin PR, Miller ER 3rd, Simons-Morton DG, Karanja N, Lin PH; DASH-Sodium Collaborative Research Group. Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group. N Engl J Med 2001; 344(1): 3-10. 166. Elmer PJ, Obarzanek E, Vollmer WM, Simons-Morton D, Stevens VJ, Young DR, Lin PH, Champagne C, Harsha DW, Svetkey LP, Ard J, Brantley PJ, Proschan MA, Erlinger TP, Appel LJ; PREMIER Collaborative Research Group. Effects of comprehensive lifestyle modification on diet, weight, physical fitness, and blood pressure control: 18-month results of a randomized trial. Ann Intern Med 2006; 144(7): 485495. 167. Nowson CA, Worsley A, Margerison C, Jorna MK, Godfrey SJ, Booth A. Blood pressure change with weight loss is affected by diet type in men. Am J Clin Nutr 2005; 81(5): 983-989. 168. Most MM. Estimated phytochemical content of the dietary approaches to stop hypertension (DASH) diet is higher than in the Control Study Diet. J Am Diet Assoc 2004; 104(11): 1725-1727. 169. Alonso A, De la Fuente C, Martín-Arnau AM, De Irala J, Martínez JA, Martínez-González MA. Fruit and vegetable consumption is inversely associated with blood pressure in a Mediterranean population with a high vegetable-fat intake: the Seguimiento Universidad de Navarra (SUN) Study. Br J Nutr 2004; 92(2): 311-319. 170. The INTERSALT study. An international co-operative study of electrolyte excretion and blood pressure: further results. J Hum Hypertens 1989; 3(5): 279-407. 171. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, Jones DW, Materson BJ, Oparil S, Wright JT Jr, Roccella EJ; Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. National Heart, Lung, and Blood Institute; National High 182 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA Blood Pressure Education Program Coordinating Committee. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. Hypertension 2003; 42(6): 1206-1252. 172. Holland B, Welch AA, Unwin ID, Buss DH, Paul AA, Southgate DA. McCance and Widdowson’s The Composition of Foods. 5th edition. The Royal Society of Chemistry. Cambridge (UK). 1993. 173. Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults--The Evidence Report. National Institutes of Health. Obes Res 1998; 6(Suppl 2): 51S-209S. 174. Pritchett AM, Foreyt JP, Mann DL. Treatment of the metabolic syndrome: the impact of lifestyle modification. Curr Atheroscler Rep 2005; 7(2): 95-102. 175. Klatsky AL, Friedman GD, Siegelaub AB, Gerard MJ. Alcohol consumption and blood pressure KaiserPermanente Multiphasic Health Examination data. N Engl J Med 1977; 296(21): 1194-1200. 176. Stamler J, Caggiula AW, Grandits GA. Relation of body mass and alcohol, nutrient, fiber, and caffeine intakes to blood pressure in the special intervention and usual care groups in the Multiple Risk Factor Intervention Trial. Am J Clin Nutr 1997; 65(1 Suppl): 338S-365S. 177. Whelton PK, He J, Cutler JA, Brancati FL, Appel LJ, Follmann D, Klag MJ. Effects of oral potassium on blood pressure. Meta-analysis of randomized controlled clinical trials. JAMA 1997; 277(20): 16241632. 178. Elliott P, Stamler J, Dyer AR, Appel L, Dennis B, Kesteloot H, Ueshima H, Okayama A, Chan Q, Garside DB, Zhou B. Association between protein intake and blood pressure: the INTERMAP Study. Arch Intern Med 2006; 166(1): 79-87. 179. Appel LJ, Brands MW, Daniels SR, Karanja N, Elmer PJ, Sacks FM; American Heart Association. Dietary approaches to prevent and treat hypertension: a scientific statement from the American Heart Association. Hypertension 2006; 47(2): 296-308. 180. Pietinen P, Tanskanen A, Nissinen A, Tuomilehto J, Puska P. Changes in dietary habits and knowledge concerning salt during a community-based prevention programme for hypertension. Ann Clin Res 1984; 16(Suppl 43): 150-155. 181. Weinberger MH, Cohen SJ, Miller JZ, Luft FC, Grim CE, Fineberg NS. Dietary sodium restriction as adjunctive treatment of hypertension. JAMA 1988; 259(17): 2561-2565. 182. Luque Otero M. Contenido en sodio de la dieta y enfermedades cardiovasculares. Cardiovasc Risk Factors 2000; 9(5): 319-325. 183. Burani J, Longo PJ. Low-glycemic index carbohydrates: an effective behavioral change for glycemic control and weight management in patients with type 1 and 2 diabetes. Diabetes Educ 2006; 32(1): 78-88. 184. Ostman EM, Frid AH, Groop LC, Bjorck IM. A dietary exchange of common bread for tailored bread of low glycaemic index and rich in dietary fibre improved insulin economy in young women with impaired glucose tolerance. Eur J Clin Nutr 2006; 60(3): 334-341. 185. Blades B, Garg A. Mechanisms of increase in plasma triacylglycerol concentrations as a result of high carbohydrate intakes in patients with non-insulin-dependent diabetes mellitus. Am J Clin Nutr 1995; 62(5): 996-1002. 186. Garg A. High-monounsaturated-fat diets for patients with diabetes mellitus: a meta-analysis. Am J Clin Nutr 1998; 67(3 Suppl): 577S-582S. 187. Ros E. Dietary cis-monounsaturated fatty acids and metabolic control in type 2 diabetes. Am J Clin Nutr 2003; 78(3 Suppl): 617S-625S. 188. Rodríguez-Villar C, Pérez-Heras A, Mercade I, Casals E, Ros E. Comparison of a high carbohydrate and a high-monounsaturated fat, olive oil-rich diet on the susceptibility of LDL to oxidative modification in subjects with type 2 diabetes mellitus. Diabet Med 2004; 21(2): 142-149. 183 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 189. Strychar I, Ishac A, Rivard M, Lussier-Cacan S, Beauregard H, Aris-Jilwan N, Radwan F, Yale JF. Impact of a high-monounsaturated-fat diet on lipid profile in subjects with type 1 diabetes. J Am Diet Assoc 2003; 103(4): 467-474. 190. Eckel RH, Krauss RM. American Heart Association call to action: obesity as a major risk factor for coronary heart disease. AHA Nutrition Committee. Circulation 1998; 97(21): 2099-2100. 191. Grundy SM. Obesity, metabolic syndrome, and coronary atherosclerosis. Circulation 2002; 105(23): 2696-2698. 192. American Diabetes Association. Standards of medical care in diabetes--2006. Diabetes Care 2006; 29(Suppl 1):S4-S42. 193. McManus K, Antinoro L, Sacks F. A randomized controlled trial of a moderate-fat, low-energy diet compared with a low fat, low-energy diet for weight loss in overweight adults. Int J Obes Relat Metab Disord 2001; 25(10): 1503-1511. 194. Pan XR, Li GW, Hu YH, Wang JX, Yang WY, An ZX, Hu ZX, Lin J, Xiao JZ, Cao HB, Liu PA, Jiang XG, Jiang YY, Wang JP, Zheng H, Zhang H, Bennett PH, Howard BV. Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance. The Da Qing IGT and Diabetes Study. Diabetes Care 1997; 20(4): 537-544. 195. Tuomilehto J, Lindstrom J, Eriksson JG, Valle TT, Hamalainen H, Ilanne-Parikka P, KeinanenKiukaanniemi S, Laakso M, Louheranta A, Rastas M, Salminen V, Uusitupa M, for the Finnish Diabetes Prevention Study Group. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344(18): 1343-1350. 196. Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, Nathan DM, for the Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346(6): 393-403. 197. Buchanan TA, Xiang AH, Peters RK, Kjos SL, Marroquin A, Goico J, Ochoa C, Tan S, Berkowitz K, Hodis HN, Azen SP. Preservation of pancreatic beta-cell function and prevention of type 2 diabetes by pharmacological treatment of insulin resistance in high-risk hispanic women. Diabetes 2002; 51(9): 2796-2803. 198. Chiasson JL, Josse RG, Gomis R, Hanefeld M, Karasik A, Laakso M; STOP-NIDDM Trail Research Group. Acarbose for prevention of type 2 diabetes mellitus: the STOP-NIDDM randomised trial. Lancet 2002; 359(9323): 2072-2077. 199. Torgerson JS, Hauptman J, Boldrin MN, Sjostrom L. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27(1): 155-161. 200. Gerstein HC, Yusuf S, Bosch J, Pogue J, Sheridan P, Dinccag N, Hanefeld M, Hoogwerf B, Laakso M, Mohan V, Shaw J, Zinman B, Holman RR; DREAM (Diabetes REduction Assessment with ramipril and rosiglitazone Medication) Trial Investigators. Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomised controlled trial. Lancet 2006; 368(9541): 1096-1105. 201. Steyn NP, Mann J, Bennett PH, Temple N, Zimmet P, Tuomilehto J, Lindstrom J, Louheranta A. Diet, nutrition and the prevention of type 2 diabetes. Public Health Nutr 2004; 7(1A): 147-165. 202. Schienkiewitz A, Schulze MB, Hoffmann K, Kroke A, Boeing H. Body mass index history and risk of type 2 diabetes: results from the European Prospective Investigation into Cancer and Nutrition (EPIC)Potsdam Study. Am J Clin Nutr 2006; 84(2): 427-433. 203. Ratner R, Goldberg R, Haffner S, Marcovina S, Orchard T, Fowler S, Temprosa M; Diabetes Prevention Program Research Group. Impact of intensive lifestyle and metformin therapy on cardiovascular disease risk factors in the diabetes prevention program. Diabetes Care 2005; 28(4): 888-894. 184 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 204. Trichopoulou A, Psaltopoulou T, Orfanos P, Trichopoulos D. Diet and physical activity in relation to overall mortality amongst adult diabetics in a general population cohort. J Intern Med 2006; 259(6): 583-589. 205. Herman WH, Hoerger TJ, Brandle M, Hicks K, Sorensen S, Zhang P, Hamman RF, Ackermann RT, Engelgau MM, Ratner RE; Diabetes Prevention Program Research Group. The cost-effectiveness of lifestyle modification or metformin in preventing type 2 diabetes in adults with impaired glucose tolerance. Ann Intern Med 2005; 142(5): 323-332. 206. Franz MJ, Warshaw H, Daly AE, Green-Pastors J, Arnold MS, Bantle J. Evolution of diabetes medical nutrition therapy. Postgrad Med J 2003; 79(927): 30-35. 207. Ros E. El colesterol de la dieta y su escasa influencia sobre la colesterolemia y el riesgo vascular. Clin Invest Arterioscler 2000; 12(Supl. 2): 20-26. 208. Stamler J, Shekelle R. Dietary cholesterol and human coronary heart disease. The epidemiologic evidence. Arch Pathol Lab Med 1988; 112(10): 1032-1040. 209. Hegsted DM, McGandy RB, Myers ML, Stare FJ. Quantitative effects of dietary fat on serum cholesterol in man. Am J Clin Nutr 1965; 17(5): 281-295. 210. Keys A, Parlin RW. Serum cholesterol response to changes in dietary lipids. Am J Clin Nutr 1966; 19(3): 175-181. 211. Clarke R, Frost C, Collins R, Appleby P, Peto R. Dietary lipids and blood cholesterol: quantitative metaanalysis of metabolic ward studies. BMJ 1997; 314(7074): 112-117. 212. Howell WH, McNamara DJ, Tosca MA, Smith BT, Gaines JA. Plasma lipid and lipoprotein responses to dietary fat and cholesterol: a meta-analysis. Am J Clin Nutr 1997; 65(6): 1747-1764. 213. McGill HC Jr. The relationship of dietary cholesterol to serum cholesterol concentration and to atherosclerosis in man. Am J Clin Nutr 1979; 32(12 Suppl): 2664-2702. 214. Hegsted DM. Serum-cholesterol response to dietary cholesterol: a re-evaluation. Am J Clin Nutr 1986; 44(2): 299-305. 215. Hopkins PN. Effects of dietary cholesterol on serum cholesterol: a meta-analysis and review. Am J Clin Nutr 1992; 55(6): 1060-1070. 216. Oh SY, Miller LT. Effect of dietary egg on variability of plasma cholesterol levels and lipoprotein cholesterol. Am J Clin Nutr 1985; 42(3): 421-431. 217. Buzzard IM, McRoberts MR, Driscoll DL, Bowering J. Effect of dietary eggs and ascorbic acid on plasma lipid and lipoprotein cholesterol levels in healthy young men. Am J Clin Nutr 1982; 36(1): 94-105. 218. Roberts SL, McMurry MP, Connor WE. Does egg feeding (i.e., dietary cholesterol) affect plasma cholesterol levels in humans? The results of a double-blind study. Am J Clin Nutr 1981; 34(10): 20922099. 219. Pyorala K. Dietary cholesterol in relation to plasma cholesterol and coronary heart disease. Am J Clin Nutr 1987; 45(5 Suppl): 1176-1184. 220. Grundy SM. Absorption and metabolism of dietary cholesterol. Annu Rev Nutr 1983; 3: 71-96. 221. Sehayek E, Nath C, Heinemann T, McGee M, Seidman CE, Samuel P, Breslow JL. U-shape relationship between change in dietary cholesterol absorption and plasma lipoprotein responsiveness and evidence for extreme interindividual variation in dietary cholesterol absorption in humans. J Lipid Res 1998; 39(12): 2415-2422. 222. Connor WE, Connor SL. Dietary cholesterol and coronary heart disease. Curr Atheroscler Rep 2002; 4(6): 425-432. 223. Macdonald IA, Bokkenheuser VD, Winter J, McLernon AM, Mosbach EH. Degradation of steroids in the human gut. J Lipid Res 1983; 24(6): 675-700. 224. Kern F Jr. Normal plasma cholesterol in an 88-year-old man who eats 25 eggs a day. Mechanisms of adaptation. N Engl J Med 1991; 324(13): 896-899. 185 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 225. Plat J, Mensink RP. Increased intestinal ABCA1 expression contributes to the decrease in cholesterol absorption after plant stanol consumption. FASEB J 2002; 16(10): 1248-1253. 226. Davis HR Jr, Zhu LJ, Hoos LM, Tetzloff G, Maguire M, Liu J, Yao X, Iyer SP, Lam MH, Lund EG, Detmers PA, Graziano MP, Altmann SW. Niemann-Pick C1 Like 1 (NPC1L1) is the intestinal phytosterol and cholesterol transporter and a key modulator of whole-body cholesterol homeostasis. J Biol Chem 2004; 279(32): 33586-33592. 227. Katan MB, Beynen AC, De Vries JH, Nobels A. Existence of consistent hypo- and hyperresponders to dietary cholesterol in man. Am J Epidemiol 1986; 123(2): 221-234. 228. Ros E. Intestinal absorption of triglyceride and cholesterol. Dietary and pharmacological inhibition to reduce cardiovascular risk. Atherosclerosis 2000; 151(2): 357-379. 229. Wilson MD, Rudel LL. Review of cholesterol absorption with emphasis on dietary and biliary cholesterol. J Lipid Res 1994; 35(6): 943-955. 230. Miettinen TA, Gylling H. Regulation of cholesterol metabolism by dietary plant sterols. Curr Opin Lipidol 1999; 10(1): 9-14. 231. Vahouny GV, Connor WE, Roy T, Lin DS, Gallo LL. Lymphatic absorption of shellfish sterols and their effects on cholesterol absorption. Am J Clin Nutr 1981; 34(4): 507-513. 232. McNamara DJ. The impact of egg limitations on coronary heart disease risk: do the numbers add up? J Am Coll Nutr 2000; 19(5 Suppl): 540-548. 233. Fernández ML. Dietary cholesterol provided by eggs and plasma lipoproteins in healthy populations. Curr Opin Clin Nutr Metab Care 2006; 9(1): 8-12. 234. Toldra F. Los lípidos de la carne y sus implicaciones en una dieta saludable. Simposium Internacional sobre Alimentación, Lípidos y Arteriosclerosis. Madrid 1996; Abstracts pag. 6-8. 235. Averette Gatlin L, See MT, Hansen JA, Odle J. Hydrogenated dietary fat improves pork quality of pigs from two lean genotypes. J Anim Sci 2003; 81(8): 1989-1997. 236. De Pedro E, Secondi F. Efecto de la raza y la alimentación en la composición de la grasa subcutánea del jamón del cerdo ibérico. ITEA 1991;II (Supl): 458-460. 237. Glaser KR, Wenk C, Scheeder MR. Effect of dietary mono- and polyunsaturated fatty acids on the fatty acid composition of pigs’ adipose tissues. Arch Tierernahr 2002; 56(1): 51-65. 238. Sandstrom B, Bugel S, Lauridsen C, Nielsen F, Jensen C, Skibsted LH. Cholesterol-lowering potential in human subjects of fat from pigs fed rapeseed oil. Br J Nutr 2000; 84(2): 143-150. 239. Stewart JW, Kaplan ML, Beitz DC. Pork with a high content of polyunsaturated fatty acids lowers LDL cholesterol in women. Am J Clin Nutr 2001; 74(2): 179-187. 240. Bourre JM. Effect of increasing the omega-3 fatty acid in the diets of animals on the animal products consumed by humans Med Sci (Paris). 2005 Aug-Sep; 21(8-9): 773-779. 241. Bourre JM. Where to find omega-3 fatty acids and how feeding animals with diet enriched in omega-3 fatty acids to increase nutritional value of derived products for human: what is actually useful? J Nutr Health Aging 2005; 9(4): 232-242. 242. Cooper SL, Sinclair LA, Wilkinson RG, Hallett KG, Enser M, Wood JD. Manipulation of the n-3 polyunsaturated fatty acid content of muscle and adipose tissue in lambs. J Anim Sci 2004; 82(5): 1461-1470. 243. Scollan ND, Enser M, Gulati SK, Richardson I, Wood JD. Effects of including a ruminally protected lipid supplement in the diet on the fatty acid composition of beef muscle. Br J Nutr 2003; 90(3): 709716. 244. Fung TT, Stampfer MJ, Manson JE, Rexrode KM, Willett WC, Hu FB. Prospective study of major dietary patterns and stroke risk in women. Stroke 2004; 35(9): 2014-2019. 245. Varela G. Tablas de Composición de Alimentos. Instituto de Nutrición CSK. 1980. 186 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 246. Martín Peña G, Carnicero Bujarabal M, Ruiz Galiana J. The Iberian pig: an animal with fat with a high content of monounsaturated fatty acids. Nutr Hosp 1992 Sep-Oct; 7(5): 329-332. 247. Mayoral P, Martínez-Salgado CS, Santiago JM, Rodríguez-Hernández MV, García-Gómez ML, Morales A, López-Novoa JM, Macías-Nuñez JF. Effect of ham protein substitution on oxidative stress in older adults. J Anim Sci 2003; 81(10): 2448-2456. 248. Murakami K, Okubo H, Sasaki S. Effect of dietary factors on incidence of type 2 diabetes: a systematic review of cohort studies. J Nutr Sci Vitaminol (Tokyo) 2005; 51(4): 292-310. 249. Fung TT, Schulze M, Manson JE, Willett WC, Hu FB. Dietary patterns, meat intake, and the risk of type 2 diabetes in women. Arch Intern Med 2004; 164(20): 2235-2240. 250. van Dam RM, Willett WC, Rimm EB, Stampfer MJ, Hu FB. Dietary fat and meat intake in relation to risk of type 2 diabetes in men. Diabetes Care 2002; 25(3): 417-424. 251. Pérez-Jiménez F, Castro P, López J, Blanco A, López F, Cruz G, Jiménez JA. Consumo de carne de cerdo y riesgo cardiovascular. En: Metabolismo lipídico. Sociedad y colesterol. Oya M, Garces C (Editores). Madrid Editorial IDEPSA 1997, p. 220-224. 252. Kromhout D, Bosschieter EB, De Lezenne Coulander C. The inverse relation between fish consumption and 20-year mortality from coronary heart disease. N Engl J Med 1985; 312(19): 1205-1209. 253. Bang HO, Dyerberg J, Sinclair HM. The composition of the Eskimo food in north western Greenland. Am J Clin Nutr 1980; 33(12): 2657-2661. 254. Crombie IK, McLoone P, Smith WC, Thomson M, Pedoe HT. International differences in coronary heart disease mortality and consumption of fish and other foodstuffs. Eur Heart J 1987; 8(6): 560563. 255. Kris-Etherton PM, Taylor DS, Yu-Poth S, Huth P, Moriarty K, Fishell V, Hargrove RL, Zhao G, Etherton TD. Polyunsaturated fatty acids in the food chain in the United States. Am J Clin Nutr 2000; 71(1 Suppl): 179S-188S. 256. Seierstad SL, Seljeflot I, Johansen O, Hansen R, Haugen M, Rosenlund G, Froyland L, Arnesen H. Dietary intake of differently fed salmon; the influence on markers of human atherosclerosis. Eur J Clin Invest 2005; 35(1): 52-59. 257. Salonen JT, Seppanen K, Lakka TA, Salonen R, Kaplan GA. Mercury accumulation and accelerated progression of carotid atherosclerosis: a population-based prospective 4-year follow-up study in men in eastern Finland. Atherosclerosis 2000; 148(2): 265-273. 258. Guallar E, Sanz-Gallardo MI, Van’t Veer P, Bode P, Aro A, Gómez-Aracena J, Kark JD, Riemersma RA, Martín-Moreno JM, Kok FJ; Heavy Metals and Myocardial Infarction Study Group. Mercury, fish oils, and the risk of myocardial infarction. N Engl J Med 2002; 347(22): 1747-1754. 259. Cohen JT, Bellinger DC, Connor WE, Kris-Etherton PM, Lawrence RS, Savitz DA, Shaywitz BA, Teutsch SM, Gray GM. A quantitative risk-benefit analysis of changes in population fish consumption. Am J Prev Med 2005; 29(4): 325-334. 260. Daviglus ML, Stamler J, Orencia AJ, Dyer AR, Liu K, Greenland P, Walsh MK, Morris D, Shekelle RB. Fish consumption and the 30-year risk of fatal myocardial infarction. N Engl J Med 1997; 336(15): 1046-1053. 261. He K, Song Y, Daviglus ML, Liu K, Van Horn L, Dyer AR, Greenland P. Accumulated evidence on fish consumption and coronary heart disease mortality: a meta-analysis of cohort studies. Circulation 2004; 109(22): 2705-2711. 262. Albert CM, Hennekens CH, O’Donnell CJ, Ajani UA, Carey VJ, Willett WC, Ruskin JN, Manson JE. Fish consumption and risk of sudden cardiac death. JAMA 1998; 279(1): 23-28. 263. Iso H, Kobayashi M, Ishihara J, Sasaki S, Okada K, Kita Y, Kokubo Y, Tsugane S; JPHC Study Group. Intake of fish and n3 fatty acids and risk of coronary heart disease among Japanese: the Japan Public Health Center-Based (JPHC) Study Cohort I. Circulation 2006; 113(2): 195-202. 187 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 264. Panagiotakos DB, Pitsavos C, Zampelas A, Chrysohoou C, Griffin BA, Stefanadis C, Toutouzas P. Fish consumption and the risk of developing acute coronary syndromes: the CARDIO2000 study. Int J Cardiol 2005; 102(3): 403-409. 265. Konig A, Bouzan C, Cohen JT, Connor WE, Kris-Etherton PM, Gray GM, Lawrence RS, Savitz DA, Teutsch SM. A quantitative analysis of fish consumption and coronary heart disease mortality. Am J Prev Med 2005; 29(4): 335-346. 266. Iso H, Rexrode KM, Stampfer MJ, Manson JE, Colditz GA, Speizer FE, Hennekens CH, Willett WC. Intake of fish and omega-3 fatty acids and risk of stroke in women. JAMA 2001; 285(3): 304-312. 267. Bouzan C, Cohen JT, Connor WE, Kris-Etherton PM, Gray GM, Konig A, Lawrence RS, Savitz DA, Teutsch SM. A quantitative analysis of fish consumption and stroke risk. Am J Prev Med 2005; 29(4): 347-352. 268. Mozaffarian D, Longstreth WT Jr, Lemaitre RN, Manolio TA, Kuller LH, Burke GL, Siscovick DS. Fish consumption and stroke risk in elderly individuals: the cardiovascular health study. Arch Intern Med 2005; 165(2): 200-206. 269. Dallongeville J, Yarnell J, Ducimetiere P, Arveiler D, Ferrieres J, Montaye M, Luc G, Evans A, Bingham A, Hass B, Ruidavets JB, Amouyel P. Fish consumption is associated with lower heart rates. Circulation 2003; 108(7): 820-825. 270. Zampelas A, Panagiotakos DB, Pitsavos C, Das UN, Chrysohoou C, Skoumas Y, Stefanadis C. Fish consumption among healthy adults is associated with decreased levels of inflammatory markers related to cardiovascular disease: the ATTICA study. J Am Coll Cardiol 2005; 46(1): 120-124. 271. Mozaffarian D, Gottdiener JS, Siscovick DS. Intake of tuna or other broiled or baked fish versus fried fish and cardiac structure, function, and hemodynamics. Am J Cardiol 2006; 97(2): 216-222. 272. Key TJ, Fraser GE, Thorogood M, Appleby PN, Beral V, Reeves G, Burr ML, Chang-Claude J, FrentzelBeyme R, Kuzma JW, Mann J, McPherson K. Mortality in vegetarians and nonvegetarians: detailed findings from a collaborative analysis of 5 prospective studies. Am J Clin Nutr 1999; 70(3 Suppl): 516S-524S. 273. Renaud S, De Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet 1992; 339(8808): 1523-1526. 274. Gaziano JM, Buring JE, Breslow JL, Goldhaber SZ, Rosner B, VanDenburgh M, Willett W, Hennekens CH. Moderate alcohol intake, increased levels of high-density lipoprotein and its subfractions, and decreased risk of myocardial infarction. N Engl J Med 1993; 329(25): 1829-1834. 275. Álvarez-Sala Walther L, Valderrama M, Rodríguez Gorostiza FJ, Torres E, Millan Núñez-Cortés J. El consumo de alcohol en la dieta mediterránea. Su papel cardioprotector. Clin Invest Arterioscler 2000; 12 (Supl 2): 49-58. 276. Hozumi T, Sugioka K, Shimada K, Kim S H, Kuo M Y, Miyake Y, Fujimoto K, Otsuka R, Watanabe H, Hosoda K, Yoshikawa J, Homma S. Beneficial effect of short term intake of red wine polyphenols on coronary microcirculation in patients with coronary artery disease. Public Health Nutr 2006; 9(3): 369-374. 277. Di Castelnuovo A, Rotondo S, Iacoviello L, Donati MB, De Gaetano G. Meta-analysis of wine and beer consumption in relation to vascular risk. Circulation 2002; 105(24): 2836-2844. 278. Bassus S, Mahnel R, Scholz T, Wegert W, Westrup D, Kirchmaier CM. Effect of dealcoholized beer (Bitburger Drive) consumption on hemostasis in humans. Alcohol Clin Exp Res 2004; 28(5): 786791. 279. Schroder H, Ferrandez O, Jiménez Conde J, Sánchez-Font A, Marrugat J. Cardiovascular risk profile and type of alcohol beverage consumption: A population-based study. Ann Nutr Metab 2005; 49(2): 100-106. 188 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 280. Hansen AS, Marckmann P, Dragsted LO, Finne Nielsen IL, Nielsen SE, Gronbaek M. Effect of red wine and red grape extract on blood lipids, haemostatic factors, and other risk factors for cardiovascular disease. Eur J Clin Nutr 2005; 59(3): 449-455. 281. Imhof A, Woodward M, Doering A, Helbecque N, Loewel H, Amouyel P, Lowe GD, Koenig W. Overall alcohol intake, beer, wine, and systemic markers of inflammation in western Europe: results from three MONICA samples (Augsburg, Glasgow, Lille). Eur Heart J 2004; 25(23): 2092-2100. 282. Rimm EB, Klatsky A, Grobbee D, Stampfer MJ. Review of moderate alcohol consumption and reduced risk of coronary heart disease: is the effect due to beer, wine, or spirits? BMJ 1996; 312(7033): 731736. 283. Grobbee DE, Rimm EB, Keil U, Renaud S. Alcohol and the cardiovascular system health issues related to alcohol consumption. Edit: MacDonald. Oxford: Blackwell Science Ltd. 1999: 125-179. 284. Mukamal KJ, Chung H, Jenny NS, Kuller LH, Longstreth WT Jr, Mittleman MA, Burke GL, Cushman M, Psaty BM, Siscovick DS. Alcohol consumption and risk of coronary heart disease in older adults: the Cardiovascular Health Study. J Am Geriatr Soc 2006; 54(1): 30-37. 285. Djousse L, Arnett DK, Eckfeldt JH, Province MA, Singer MR, Ellison RC. Alcohol consumption and metabolic syndrome: does the type of beverage matter? Obes Res 2004; 12(9): 1375-1385. 286. Beulens JW, Stolk RP, van der Schouw YT, Grobbee DE, Hendriks HF, Bots ML. Alcohol consumption and risk of type 2 diabetes among older women. Diabetes Care 2005; 28(12): 2933-2938. 287. Koppes LL, Dekker JM, Hendriks HF, Bouter LM, Heine RJ. Moderate alcohol consumption lowers the risk of type 2 diabetes: a meta-analysis of prospective observational studies. Diabetes Care 2005; 28(3): 719-725. 288. Goldberg IJ, Mosca L, Piano MR, Fisher EA; Nutrition Committee, Council on Epidemiology and Prevention, and Council on Cardiovascular Nursing of the American Heart Association. AHA Science Advisory: Wine and your heart: a science advisory for healthcare professionals from the Nutrition Committee, Council on Epidemiology and Prevention, and Council on Cardiovascular Nursing of the American Heart Association. Circulation 2001; 103(3): 472-475. 289. Stampfer MJ, Colditz GA, Willett WC, Speizer FE, Hennekens CH. A prospective study of moderate alcohol consumption and the risk of coronary disease and stroke in women. N Engl J Med 1988; 319(5): 267-273. 290. Rimm EB, Giovannucci EL, Willett WC, Colditz GA, Ascherio A, Rosner B, Stampfer MJ. Prospective study of alcohol consumption and risk of coronary disease in men. Lancet 1991; 338(8765): 464468. 291. De Gaetano G, De Curtis A, Di Castelnuovo A, Donati MB, Iacoviello L, Rotondo S. Antithrombotic effect of polyphenols in experimental models: a mechanism of reduced vascular risk by moderate wine consumption. Ann N Y Acad Sci 2002; 957: 174-188. 292. Mukamal KJ, Jensen MK, Gronbaek M, Stampfer MJ, Manson JE, Pischon T, Rimm EB. Drinking frequency, mediating biomarkers, and risk of myocardial infarction in women and men. Circulation 2005; 112(10): 1406-1413. 293. Alimentación y Corazón. J. Mataix Verdú. 1995. Editorial 3M. Farmacéutica. 294. Doll R, Peto R, Hall E, Wheatley K, Gray R. Mortality in relation to consumption of alcohol: 13 years’ observations on male British doctors. BMJ 1994; 309(6959): 911-918. 295. Boffetta P, Garfinkel L. Alcohol drinking and mortality among men enrolled in an American Cancer Society prospective study. Epidemiology 1990; 1(5): 342-348. 296. Mukamal KJ, Conigrave KM, Mittleman MA, Camargo CA Jr, Stampfer MJ, Willett WC, Rimm EB. Roles of drinking pattern and type of alcohol consumed in coronary heart disease in men. N Engl J Med 2003; 348(2): 109-118. 189 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 297. Renaud SC, Gueguen R, Schenker J, d’Houtaud A. Alcohol and mortality in middle-aged men from eastern France. Epidemiology 1998; 9(2): 184-188. 298. Klatsky AL, Armstrong MA, Friedman GD. Risk of cardiovascular mortality in alcohol drinkers, exdrinkers and nondrinkers. Am J Cardiol 1990; 66(17): 1237-1242. 299. Thun MJ, Peto R, López AD, Monaco JH, Henley SJ, Heath CW Jr, Doll R. Alcohol consumption and mortality among middle-aged and elderly U.S. adults. N Engl J Med 1997; 337(24): 1705-1714. 300. Camargo CA Jr, Stampfer MJ, Glynn RJ, Grodstein F, Gaziano JM, Manson JE, Buring JE, Hennekens CH. Moderate alcohol consumption and risk for angina pectoris or myocardial infarction in U.S. male physicians. Ann Intern Med 1997; 126(5): 372-375. 301. Camargo CA Jr, Hennekens CH, Gaziano JM, Glynn RJ, Manson JE, Stampfer MJ. Prospective study of moderate alcohol consumption and mortality in US male physicians. Arch Intern Med 1997; 157(1): 79-85. 302. Fuchs CS, Stampfer MJ, Colditz GA, Giovannucci EL, Manson JE, Kawachi I, Hunter DJ, Hankinson SE, Hennekens CH, Rosner B. Alcohol consumption and mortality among women. N Engl J Med 1995; 332(19): 1245-1250. 303. Álvarez-Sala LA, Valderrama M, Porres A, Gómez-Gerique JA, Rodríguez-Gorostiza FJ, Torres FJ, Millan J. Alcohol y enfermedad cardiovascular. Cardiovasc Risk Factors 2000; 9(5): 328-337. 304. Higdon JV, Frei B. Coffee and health: a review of recent human research. Crit Rev Food Sci Nutr 2006; 46(2): 101-123. 305. Van Dam RM, Feskens EJ. Coffee consumption and risk of type 2 diabetes mellitus. Lancet 2002; 360(9344): 1477-1478. 306. Petrie HJ, Chown SE, Belfie LM, Duncan AM, McLaren DH, Conquer JA, Graham TE. Caffeine ingestion increases the insulin response to an oral-glucose-tolerance test in obese men before and after weight loss. Am J Clin Nutr 2004; 80(1): 22-28. 307. Johnston KL, Clifford MN, Morgan LM. Coffee acutely modifies gastrointestinal hormone secretion and glucose tolerance in humans: glycemic effects of chlorogenic acid and caffeine. Am J Clin Nutr 2003; 78(4): 728-733. 308. McCarty MF. A chlorogenic acid-induced increase in GLP-1 production may mediate the impact of heavy coffee consumption on diabetes risk. Med Hypotheses 2005; 64(4): 848-853. 309. Watanabe T, Arai Y, Mitsui Y, Kusaura T, Okawa W, Kajihara Y, Saito I. The blood pressure-lowering effect and safety of chlorogenic Acid from green coffee bean extract in essential hypertension. Clin Exp Hypertens 2006; 28(5): 439-449. 310. Wu T, Willett WC, Hankinson SE, Giovannucci E. Caffeinated coffee, decaffeinated coffee, and caffeine in relation to plasma C-peptide levels, a marker of insulin secretion, in U.S. women. Diabetes Care 2005; 28(6): 1390-1396. 311. Salazar-Martínez E, Willett WC, Ascherio A, Manson JE, Leitzmann MF, Stampfer MJ, Hu FB. Coffee consumption and risk for type 2 diabetes mellitus. Ann Intern Med 2004; 140(1): 1-8. 312. Van Dam RM, Willett WC, Manson JE, Hu FB. Coffee, caffeine, and risk of type 2 diabetes: a prospective cohort study in younger and middle-aged U.S. women. Diabetes Care 2006; 29(2): 398-403. 313. Pereira MA, Parker ED, Folsom AR. Coffee consumption and risk of type 2 diabetes mellitus: an 11year prospective study of 28 812 postmenopausal women. Arch Intern Med 2006; 166(12): 13111316. 314. Van Dam RM, Hu FB. Coffee consumption and risk of type 2 diabetes: a systematic review. JAMA 2005; 294(1): 97-104. 315. Noordzij M, Uiterwaal CS, Arends LR, Kok FJ, Grobbee DE, Geleijnse JM. Blood pressure response to chronic intake of coffee and caffeine: a meta-analysis of randomized controlled trials. J Hypertens 2005; 23(5): 921-928. 190 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 316. Winkelmayer WC, Stampfer MJ, Willett WC, Curhan GC. Habitual caffeine intake and the risk of hypertension in women. JAMA 2005; 294(18): 2330-2335. 317. López-García E, Van Dam RM, Willett WC, Rimm EB, Manson JE, Stampfer MJ, Rexrode KM, Hu FB. Coffee consumption and coronary heart disease in men and women: a prospective cohort study. Circulation 2006; 113(17): 2045-2053. 318. Andersen LF, Jacobs DR Jr, Carlsen MH, Blomhoff R. Consumption of coffee is associated with reduced risk of death attributed to inflammatory and cardiovascular diseases in the Iowa Women’s Health Study. Am J Clin Nutr 2006; 83(5): 1039-1046. 319. Trevisanato SI, Kim YI. Tea and health. Nutr Rev 2000; 58(1): 1-10. 320. Widlansky ME, Duffy SJ, Hamburg NM, Gokce N, Warden BA, Wiseman S, Keaney JF Jr, Frei B, Vita JA. Effects of black tea consumption on plasma catechins and markers of oxidative stress and inflammation in patients with coronary artery disease. Free Radic Biol Med 2005; 38(4): 499-506. 321. Hertog MG, Feskens EJ, Hollman PC, Katan MB, Kromhout D. Dietary antioxidant flavonoids and risk of coronary heart disease: the Zutphen Elderly Study. Lancet 1993; 342(8878): 1007-1011. 322. Cabrera C, Artacho R, Giménez R. Beneficial effects of green tea: a review. J Am Coll Nutr 2006; 25(2): 79-99. 323. Sano J, Inami S, Seimiya K, Ohba T, Sakai S, Takano T, Mizuno K. Effects of green tea intake on the development of coronary artery disease. Circ J 2004; 68(7): 665-670. 324. Iso H, Date C, Wakai K, Fukui M, Tamakoshi A; JACC Study Group. The relationship between green tea and total caffeine intake and risk for self-reported type 2 diabetes among Japanese adults. Ann Intern Med 2006; 144(8): 554-562. 325. Sesso HD, Gaziano JM, Buring JE, Hennekens CH. Coffee and tea intake and the risk of myocardial infarction. Am J Epidemiol 1999; 149(2): 162-167. 326. Woodward M, Tunstall-Pedoe H. Coffee and tea consumption in the Scottish Heart Health Study follow up: conflicting relations with coronary risk factors, coronary disease, and all cause mortality. J Epidemiol Community Health 1999; 53(8): 481-487. 327. Geleijnse JM, Launer LJ, Hofman A, Pols HA, Witteman JC. Tea flavonoids may protect against atherosclerosis: the Rotterdam Study. Arch Intern Med 1999; 159(18): 2170-2174. 328. Kelly JH Jr, Sabate J. Nuts and coronary heart disease: an epidemiological perspective. Br J Nutr 2006; 96(Suppl 2):S61-7. 329. Griel AE, Kris-Etherton PM. Tree nuts and the lipid profile: a review of clinical studies. Br J Nutr 2006; 96(Suppl 2):S68-S78. 330. Salas-Salvado J, Ros E, Sabate J (Editores). Frutos secos, salud y culturas mediterráneas. Barcelona: Glosa Editores 2005; pág 1-337. 331. Sabate J, Ros E, Salas-Salvado J. Nuts: nutrition and health outcomes. Br J Nutr 2006; 96(Suppl 2): S1-S102. 332. US Food and Drug Administration. Qualified Health Claims: Letter of Enforcement Discretion – Nuts and Coronary Heart Disease. Rockville, MD: US Food & Drug Administration. 14 July 2003; pág. 1-4. 333. Datos obtenidos del sitio web del US Department of Agriculture Nutrient Data Base: http://www. nal.usda.gov/fnic/cgi-bin/nut_search.pl. 334. Ros E, Mataix J. Fatty acid composition of nuts - implications for cardiovascular health. Br J Nutr 2006; 96(Suppl 2):S29-S35. 335. Ros E, Núñez I, Pérez-Heras A, Serra M, Gilabert R, Casals E, Deulofeu R. A walnut diet improves endothelial function in hypercholesterolemic subjects: a randomized crossover trial. Circulation 2004; 109(13): 1609-1614. 336. Salas-Salvado J, Bullo M, Pérez-Heras A, Ros E. Dietary fibre, nuts and cardiovascular diseases. Br J Nutr 2006; 96(Suppl 2): S45-S51. 191 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 337. Segura R, Javierre C, Lizarraga MA, Ros E. Other relevant components of nuts: phytosterols, folate and minerals. Br J Nutr 2006; 96(Suppl 2):S36-S44. 338. Blomhoff R, Carlsen MH, Andersen LF, Jacobs DR Jr. Health benefits of nuts: potential role of antioxidants. Br J Nutr 2006; 96(Suppl 2): S52-S60. 339. Rajaram S, Sabate J. Nuts, body weight and insulin resistance. Br J Nutr 2006; 96(Suppl 2): S79-S86. 340. Crespo JF, James JM, Fernández-Rodríguez C, Rodríguez J. Food allergy: nuts and tree nuts. Br J Nutr 2006; 96(Suppl 2): S95-S102. 341. Álvarez-Sala Walther LA, Millan Nuñez-Cortes J, De Oya Otero M. La dieta mediterránea en España. ¿Leyenda o realidad? (I): El estudio Siete Países. Algunos elementos de la dieta mediterránea: El aceite de oliva y el vino tinto. Rev Clin Esp 1996; 196(8): 548-556. 342. Visioli F, Galli C. Antiatherogenic components of olive oil. Curr Atheroscler Rep 2001; 3(1): 64-67. 343. Josó Mataix Verdú. Aceite de oliva virgen y salud. Instituto de Nutrición y Tecnología de los Alimentos. Universidad de Granada. 344. Fernández-Jarne E, Martínez-Losa E, Prado-Santamaria M, Brugarolas-Brufau C, Serrano-Martínez M, Martínez-González MA. Risk of first non-fatal myocardial infarction negatively associated with olive oil consumption: a case-control study in Spain. Int J Epidemiol 2002; 31(2): 474-480. 345. Mattson FH, Grundy SM, Crouse JR. Optimizing the effect of plant sterols on cholesterol absorption in man. Am J Clin Nutr 1982; 35(4): 697-700. 346. Pérez-Jiménez F, López-Miranda J, Mata P. Protective effect of dietary monounsaturated fat on arteriosclerosis: beyond cholesterol. Atherosclerosis 2002; 163(2): 385-398. 347. Fitó M, Covas MI, Lamuela-Raventós RM, Vila J, Torrents L, De la Torre C, Marrugat J. Protective effect of olive oil and its phenolic compounds against low density lipoprotein oxidation. Lipids 2000; 35(6): 633-638. 348. Soriguer F, Rojo-Martínez G, Dobarganes MC, García Almeida JM, Esteva I, Beltran M, Ruiz De Adana MS, Tinahones F, Gómez-Zumaquero JM, García-Fuentes E, González-Romero S. Hypertension is related to the degradation of dietary frying oils. Am J Clin Nutr 2003; 78(6): 1092-1097. 349. Borek C. Garlic reduces dementia and heart-disease risk. J Nutr 2006; 136(3 Suppl): 810S-812S. 350. Tattelman E. Health effects of garlic. Am Fam Physician 2005; 72(1): 103-106. 351. Gonen A, Harats D, Rabinkov A, Miron T, Mirelman D, Wilchek M, Weiner L, Ulman E, Levkovitz H, Ben-Shushan D, Shaish A. The antiatherogenic effect of allicin: possible mode of action. Pathobiology 2005; 72(6): 325-334. 352. Lau BH. Suppression of LDL oxidation by garlic compounds is a possible mechanism of cardiovascular health benefit. J Nutr 2006; 136(3 Suppl): 765S-768S. 353. Dhawan V, Jain S. Effect of garlic supplementation on oxidized low density lipoproteins and lipid peroxidation in patients of essential hypertension. Mol Cell Biochem 2004; 266(1-2): 109-115. 354. Silagy C, Neil A. Garlic as a lipid lowering agent--a meta-analysis. J R Coll Physicians Lond 1994; 28(1): 39-45. 355. Warshafsky S, Kamer RS, Sivak SL. Effect of garlic on total serum cholesterol. A meta-analysis. Ann Intern Med 1993; 119(7 Pt 1): 599-605. 356. Ackermann RT, Mulrow CD, Ramírez G, Gardner CD, Morbidoni L, Lawrence VA. Garlic shows promise for improving some cardiovascular risk factors. Arch Intern Med 2001; 161(6): 813-824. 357. Kerckhoffs DA, Brouns F, Hornstra G, Mensink RP. Effects on the human serum lipoprotein profile of beta-glucan, soy protein and isoflavones, plant sterols and stanols, garlic and tocotrienols. J Nutr 2002; 132(9): 2494-2505. 358. Rahman K, Lowe GM. Garlic and cardiovascular disease: a critical review. J Nutr 2006; 136(3 Suppl): 736S-740S. 192 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 359. Milner JA, Rivlin RS (Editores). Recent Advances on the Nutritional Effects Associated with the Use of Garlic as a Supplement. November 15-17, 1998. Newport Beach, California, USA. Proceedings. J Nutr 2001; 131(3 Suppl): 951S-1123S. 360. Ding EL, Hutfless SM, Ding X, Girotra S. Chocolate and prevention of cardiovascular disease: a systematic review. Nutr Metab (Lond) 2006; 3: 2. 361. Thijssen MA, Mensink RP. Small differences in the effects of stearic acid, oleic acid, and linoleic acid on the serum lipoprotein profile of humans. Am J Clin Nutr 2005; 82(3): 510-516. 362. Steinberg FM, Bearden MM, Keen CL. Cocoa and chocolate flavonoids: implications for cardiovascular health. J Am Diet Assoc 2003; 103(2): 215-223. 363. Ross JA, Kasum CM. Dietary flavonoids: bioavailability, metabolic effects, and safety. Annu Rev Nutr 2002; 22: 19-34. 364. Natsume M, Osakabe N, Yamagishi M, Takizawa T, Nakamura T, Miyatake H, Hatano T, Yoshida T. Analyses of polyphenols in cacao liquor, cocoa, and chocolate by normal-phase and reversed-phase HPLC. Biosci Biotechnol Biochem 2000; 64(12): 2581-2587. 365. Fraga CG. Cocoa, diabetes, and hypertension: should we eat more chocolate? Am J Clin Nutr 2005; 81(3): 541-542. 366. Keen CL, Holt RR, Oteiza PI, Fraga CG, Schmitz HH. Cocoa antioxidants and cardiovascular health. Am J Clin Nutr 2005; 81(1 Suppl): 298S-303S. 367. Engler MB, Engler MM. The emerging role of flavonoid-rich cocoa and chocolate in cardiovascular health and disease. Nutr Rev 2006; 64(3): 109-118. 368. Murphy KJ, Chronopoulos AK, Singh I, Francis MA, Moriarty H, Pike MJ,Turner AH, Mann NJ, Sinclair AJ. Dietary flavanols and procyanidin oligomers from cocoa (Theobroma cacao) inhibit platelet function. Am J Clin Nutr 2003; 77(6): 1466-1473. 369. Sies H, Schewe T, Heiss C, Kelm M. Cocoa polyphenols and inflammatory mediators. Am J Clin Nutr 2005; 81(1 Suppl): 304S-312S. 370. Grassi D, Lippi C, Necozione S, Desideri G, Ferri C. Short-term administration of dark chocolate is followed by a significant increase in insulin sensitivity and a decrease in blood pressure in healthy persons. Am J Clin Nutr 2005; 81(3): 611-614. 371. Vlachopoulos C, Aznaouridis K, Alexopoulos N, Economou E, Andreadou I, Stefanadis C. Effect of dark chocolate on arterial function in healthy individuals. Am J Hypertens 2005; 18(6): 785-791. 372. Buijsse B, Feskens EJ, Kok FJ, Kromhout D. Cocoa intake, blood pressure, and cardiovascular mortality: the Zutphen Elderly Study. Arch Intern Med 2006; 166(4): 411-417. 373. McCullough ML, Chevaux K, Jackson L, Preston M, Martínez G, Schmitz HH, Coletti C, Campos H, Hollenberg NK. Hypertension, the Kuna, and the epidemiology of flavanols. J Cardiovasc Pharmacol 2006; 47(Suppl 2): S103-S109. 374. Duffy SJ, Vita JA. Effects of phenolics on vascular endothelial function. Curr Opin Lipidol 2003; 14(1): 21-27. 375. Actis-Goretta L, Ottaviani JI, Keen CL, Fraga CG. Inhibition of angiotensin converting enzyme (ACE) activity by flavan-3-ols and procyanidins. FEBS Lett 2003; 555(3): 597-600. 376. Serafini M, Bugianesi R, Maiani G, Valtuena S, De Santis S, Crozier A. Plasma antioxidants from chocolate. Nature 2003; 424(6952): 1013. 377. Bazzano LA, Serdula MK, Liu S. Dietary intake of fruits and vegetables and risk of cardiovascular disease. Curr Atheroscler Rep 2003; 5(6): 492-499. 378. López-Ridaura R, Willett WC, Rimm EB, Liu S, Stampfer MJ, Manson JE, Hu FB. Magnesium intake and risk of type 2 diabetes in men and women. Diabetes Care 2004; 27(1): 134-140. 379. Lundberg JO, Feelisch M, Bjorne H, Jansson EA, Weitzberg E. Cardioprotective effects of vegetables: is nitrate the answer? Nitric Oxide 2006; 15(4): 359-362. 193 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 380. Djousse L, Arnett DK, Coon H, Province MA, Moore LL, Ellison RC. Fruit and vegetable consumption and LDL cholesterol: the National Heart, Lung, and Blood Institute Family Heart Study. Am J Clin Nutr 2004; 79(2): 213-217. 381. Liu RH. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals. Am J Clin Nutr 2003; 78(3 Suppl): 517S-520S. 382. Voutilainen S, Nurmi T, Mursu J, Rissanen TH. Carotenoids and cardiovascular health. Am J Clin Nutr 2006; 83(6): 1265-1271. 383. Krauss RM, Eckel RH, Howard B, Appel LJ, Daniels SR, Deckelbaum RJ, Erdman JW Jr, Kris-Etherton P, Goldberg IJ, Kotchen TA, Lichtenstein AH, Mitch WE, Mullis R, Robinson K, Wylie-Rosett J, St Jeor S, Suttie J, Tribble DL, Bazzarre TL. Revision 2000: a statement for healthcare professionals from the Nutrition Committee of the American Heart Association. J Nutr 2001; 131(1): 132-146. 384. Liu S, Manson JE, Lee IM, Cole SR, Hennekens CH, Willett WC, Buring JE. Fruit and vegetable intake and risk of cardiovascular disease: the Women’s Health Study. Am J Clin Nutr 2000; 72(4): 922-928. 385. Thorogood M. Vegetarianism, coronary disease risk factors and coronary heart disease. Curr Opin Lipidol 1994; 5(1): 17-21. 386. Law MR, Morris JK.Law MR, Morris JK. By how much does fruit and vegetable consumption reduce the risk of ischemic heart disease? Eur J Clin Nutr 1998; 52(8): 549-556. 387. Tucker KL, Hallfrisch J, Qiao N, Muller D, Andres R, Fleg JL; Baltimore Longitudinal Study of Aging. The combination of high fruit and vegetable and low saturated fat intakes is more protective against mortality in aging men than is either alone: the Baltimore Longitudinal Study of Aging. J Nutr 2005; 135(3): 556-561. 388. Zyriax BC, Boeing H, Windler E. Nutrition is a powerful independent risk factor for coronary heart disease in women--The CORA study: a population-based case-control study. Eur J Clin Nutr 2005; 59(10): 1201-1207. 389. Joshipura KJ, Hu FB, Manson JE, Stampfer MJ, Rimm EB, Speizer FE, Colditz G, Ascherio A, Rosner B, Spiegelman D, Willett WC. The effect of fruit and vegetable intake on risk for coronary heart disease. Ann Intern Med 2001; 134(12): 1106-1114. 390. Johnsen SP, Overvad K, Stripp C, Tjonneland A, Husted SE, Sorensen HT. Intake of fruit and vegetables and the risk of ischemic stroke in a cohort of Danish men and women. Am J Clin Nutr 2003; 78(1): 57-64. 391. He FJ, Nowson CA, MacGregor GA. Fruit and vegetable consumption and stroke: meta-analysis of cohort studies. Lancet 2006; 367(9507): 320-326. 392. Dauchet L, Amouyel P, Dallongeville J. Fruit and vegetable consumption and risk of stroke: a metaanalysis of cohort studies. Neurology 2005; 65(8): 1193-1197. 393. Joshipura KJ, Ascherio A, Manson JE, Stampfer MJ, Rimm EB, Speizer FE, Hennekens CH, Spiegelman D, Willett WC. Fruit and vegetable intake in relation to risk of ischemic stroke. JAMA 1999; 282(13): 1233-1239. 394. Lock K, Pomerleau J, Causer L, Altmann DR, McKee M. The global burden of disease attributable to low consumption of fruit and vegetables: implications for the global strategy on diet. Bull World Health Organ 2005; 83(2): 100-108. 395. Naska A, Vasdekis VG, Trichopoulou A, Friel S, Leonhauser IU, Moreiras O, Nelson M, Remaut AM, Schmitt A, Sekula W, Trygg KU, Zajkas G. Fruit and vegetable availability among ten European countries: how does it compare with the ‘five-a-day’ recommendation? DAFNE I and II projects of the European Commission. Br J Nutr 2000; 84(4): 549-556. 396. Agudo A, Amiano P, Barcos A, Barricarte A, Beguiristain JM, Chirlaque MD, Dorronsoro M, González CA, Lasheras C, Martínez C, Navarro C, Pera G, Quiros JR, Rodríguez M, Tormo MJ. Dietary intake of vegetables and fruits among adults in five regions of Spain. EPIC Group of Spain. European Prospective Investigation into Cancer and Nutrition. Eur J Clin Nutr 1999; 53(3): 174-180. 194 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 397. Krauss RM, Deckelbaum RJ, Ernst N, Fisher E, Howard BV, Knopp RH, Kotchen T, Lichtenstein AH, McGill HC, Pearson TA, Prewitt TE, Stone NJ, Horn LV, Weinberg R. Dietary guidelines for healthy American adults. A statement for health professionals from the Nutrition Committee, American Heart Association. Circulation 1996; 94(7): 1795-1800. 398. Kearney M, Bradbury C, Ellahi B, Hodgson M, Thurston M. Mainstreaming prevention: prescribing fruit and vegetables as a brief intervention in primary care. Public Health 2005; 119(11): 981-986. 399. Ashfield-Watt PA, Welch AA, Day NE, Bingham SA. Is ‘five-a-day’ an effective way of increasing fruit and vegetable intakes? Public Health Nutr 2004; 7(2): 257-261. 400. Steptoe A, Perkins-Porras L, McKay C, Rink E, Hilton S, Cappuccio FP. Behavioural counselling to increase consumption of fruit and vegetables in low income adults: randomised trial. BMJ 2003; 326(7394): 855. 401. Daviglus ML, Liu K, Pirzada A, Yan LL, Garside DB, Wang R, Van Horn L, Manning WG, Manheim LM, Dyer AR, Greenland P, Stamler J. Relationship of fruit and vegetable consumption in middle-aged men to medicare expenditures in older age: the Chicago Western Electric Study. J Am Diet Assoc 2005; 105(11): 1735-1744. 402. López-Nomdedeu C, Ortega R, Sastre A y cols. Huevos. En: Guías alimentarias para la población española. IMC, S.A. ISBN 84-7867-169-2. Pág: 45-52, Madrid, 2001. 403. Blanco-Molina A, Castro G, Martín-Escalante D, Bravo D, López-Miranda J, Castro P, López-Segura F, Fruchart JC, Ordovas JM, Pérez-Jiménez F. Effects of different dietary cholesterol concentrations on lipoprotein plasma concentrations and on cholesterol efflux from Fu5AH cells. Am J Clin Nutr 1998; 68(5): 1028-1033. 404. Weggemans RM, Zock PL, Katan MB. Dietary cholesterol from eggs increases the ratio of total cholesterol to high-density lipoprotein cholesterol in humans: a meta-analysis. Am J Clin Nutr 2001; 73(5): 885-891. 405. Herron KL, McGrane MM, Waters D, Lofgren IE, Clark RM, Ordovas JM, Fernández ML. The ABCG5 polymorphism contributes to individual responses to dietary cholesterol and carotenoids in eggs. J Nutr 2006; 136(5): 1161-1165. 406. McDonald BE. The Canadian experience: why Canada decided against an upper limit for cholesterol. J Am Coll Nutr 2004; 23(6 Suppl): 616S-620S. 407. Herron KL, Lofgren IE, Sharman M, Volek JS, Fernández ML. High intake of cholesterol results in less atherogenic low-density lipoprotein particles in men and women independent of response classification. Metabolism 2004; 53(6): 823-830. 408. Ballesteros MN, Cabrera RM, Saucedo MS, Aggarwal D, Shachter NS, Fernández ML. High intake of saturated fat and early occurrence of specific biomarkers may explain the prevalence of chronic disease in northern Mexico. J Nutr 2005; 135(1): 70-73. 409. Knopp RH, Retzlaff B, Fish B, Walden C, Wallick S, Anderson M, Aikawa K, Kahn SE. Effects of insulin resistance and obesity on lipoproteins and sensitivity to egg feeding. Arterioscler Thromb Vasc Biol 2003; 23(8): 1437-1443. 410. Esrey KL, Joseph L, Grover SA. Relationship between dietary intake and coronary heart disease mortality: lipid research clinics prevalence follow-up study. J Clin Epidemiol 1996; 49(2): 211-216. 411. McNamara DJ. Dietary cholesterol and atherosclerosis. Biochim Biophys Acta 2000; 1529(1-3): 310320. 412. Dawber TR, Nickerson RJ, Brand FN, Pool J. Eggs, serum cholesterol, and coronary heart disease. Am J Clin Nutr 1982; 36(4): 617-625. 413. Gramenzi A, Gentile A, Fasoli M, Negri E, Parazzini F, La Vecchia C. Association between certain foods and risk of acute myocardial infarction in women. BMJ 1990; 300(6727): 771-773. 195 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 414. Fraser GE. Diet and coronary heart disease: beyond dietary fats and low-density-lipoprotein cholesterol. Am J Clin Nutr 1994; 59(5 Suppl): 1117-1123. 415. Hu FB, Stampfer MJ, Rimm EB, Manson JE, Ascherio A, Colditz GA, Rosner BA, Spiegelman D, Speizer FE, Sacks FM, Hennekens CH, Willett WC. A prospective study of egg consumption and risk of cardiovascular disease in men and women. JAMA 1999; 281(15): 1387-1394. 416. Nakamura Y, Okamura T, Tamaki S, Kadowaki T, Hayakawa T, Kita Y, Okayama A, Ueshima H; NIPPON DATA80 Research Group. Egg consumption, serum cholesterol, and cause-specific and allcause mortality: the National Integrated Project for Prospective Observation of Non-communicable Disease and Its Trends in the Aged, 1980 (NIPPON DATA80). Am J Clin Nutr 2004; 80(1): 58-63. 417. Ribaya-Mercado JD, Blumberg JB. Lutein and zeaxanthin and their potential roles in disease prevention. J Am Coll Nutr 2004; 23(6 Suppl): 567S-587S. 418. Clark RM, Herron KL, Waters D, Fernández ML. Classification of the response to dietary cholesterol provided by eggs and gender predict lutein and zeaxanthin plasma concentrations. FASEB J 2004; 18: A131-A135. 419. Clark RM, Herron KL, Waters D, Fernández ML. Hypo- and hyperresponse to egg cholesterol predicts plasma lutein and beta-carotene concentrations in men and women. J Nutr 2006; 136(3): 601-607. 420. Position of the American Dietetic Association: functional foods. J Am Diet Assoc 1999; 99(10): 12781285. 421. Roberfroid MB. Global view on functional foods: European perspectives. Br J Nutr 2002; 88(Suppl 2): S133-8. 422. Ros E. Introducción a los alimentos funcionales. Med Clin (Barc) 2001; 116(16): 617-619. 423. Hasler CM, Kundrat S, Wool D. Functional foods and cardiovascular disease. Curr Atheroscler Rep 2000; 2(6): 467-475. 424. Jenkins DJ, Marchie A, Augustin LS, Ros E, Kendall CW. Viscous dietary fibre and metabolic effects. Clin Nutr Suppl 2004; 1(2): 39-49. 425. Lichtenstein AH, Deckelbaum RJ. Stanol/Sterol ester-containing foods and blood cholesterol levels: a statement for healthcare professionals from the Nutrition Committee of the Council on Nutrition, Physical Activity, and Metabolism of the American Heart Association. Circulation 2001; 103(8): 11771179. 426. Ros E, Laguna JC. Tratamiento de la hipertrigliceridemia: fibratos frente a ácidos grasos omega-3. Rev Esp Cardiol Supl 2006; 6: 52D-61D. 427. Burkitt DP, Walker AR, Painter NS. Dietary fiber and disease. JAMA 1974; 229(8): 1068-1074. 428. Meseguer Soler I, Martínez Para MC, Farre Rovira R. La fibra alimentaria (I). Definición, propiedades y composición. Med Clin (Barc) 1997; 109(16): 641-644. 429. Anderson JW, Allgood LD, Lawrence A, Altringer LA, Jerdack GR, Hengehold DA, Morel JG. Cholesterol-lowering effects of psyllium intake adjunctive to diet therapy in men and women with hypercholesterolemia: meta-analysis of 8 controlled trials. Am J Clin Nutr 2000; 71(2): 472-479. 430. Roberfroid MB, Delzenne NM. Dietary fructans. Annu Rev Nutr 1998; 18: 117-143. 431. Marlett JA. Content and composition of dietary fiber in 117 frequently consumed foods. J Am Diet Assoc 1992; 92(2): 175-186. 432. Pereira MA, O’Reilly E, Augustsson K, Fraser GE, Goldbourt U, Heitmann BL, Hallmans G, Knekt P, Liu S, Pietinen P, Spiegelman D, Stevens J, Virtamo J, Willett WC, Ascherio A. Dietary fiber and risk of coronary heart disease: a pooled analysis of cohort studies. Arch Intern Med 2004; 164(4): 370-376. 433. Liu S. Whole-grain foods, dietary fiber, and type 2 diabetes: searching for a kernel of truth. Am J Clin Nutr 2003; 77(3): 527-529. 434. Meseguer Soler I, Martínez Para MC, Farre Rovira R. La fibra alimentaria (y II). Metabolismo e implicaciones fisiológicas. Med Clin (Barc) 1998; 110(1): 32-37. 196 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 435. Ros E. Prebióticos y probióticos en la regulación del metabolismo de los lípidos. Gastroenterol Hepatol 2003; 26(Supl 1): 31-36. 436. Brown L, Rosner B, Willett WW, Sacks FM. Cholesterol-lowering effects of dietary fiber: a metaanalysis. Am J Clin Nutr 1999; 69(1): 30-42. 437. Jenkins DJ, Goff DV, Leeds AR, Alberti KG, Wolever TM, Gassull MA, Hockaday TD. Unabsorbable carbohydrates and diabetes: Decreased post-prandial hyperglycaemia. Lancet 1976; 2(7978): 172174. 438. Potter JG, Coffman KP, Reid RL, Krall JM, Albrink MJ. Effect of test meals of varying dietary fiber content on plasma insulin and glucose response. Am J Clin Nutr 1981; 34(3): 328-334. 439. Chandalia M, Garg A, Lutjohann D, Von Bergmann K, Grundy SM, Brinkley LJ. Beneficial effects of high dietary fiber intake in patients with type 2 diabetes mellitus. N Engl J Med 2000; 342(19): 13921398. 440. Van Horn L. Fiber, lipids, and coronary heart disease. A statement for healthcare professionals from the Nutrition Committee, American Heart Association. Circulation 1997; 95(12): 2701-2704. 441. Ludwig DS, Pereira MA, Kroenke CH, Hilner JE, Van Horn L, Slattery ML, Jacobs DR Jr. Dietary fiber, weight gain, and cardiovascular disease risk factors in young adults. JAMA 1999; 282(16): 15391546. 442. Streppel MT, Arends LR, Van ‘t Veer P, Grobbee DE, Geleijnse JM. Dietary fiber and blood pressure: a meta-analysis of randomised placebo-controlled trials. Arch Intern Med 2005; 165(2): 150-156. 443. Landsberg L. Insulin-mediated sympathetic stimulation: role in the pathogenesis of obesity-related hypertension (or, how insulin affects blood pressure, and why). J Hypertens 2001; 19(3 Pt 2): 523528. 444. Pereira MA, Kartashov AI, Ebbeling CB, Van Horn L, Slattery ML, Jacobs DR Jr, Ludwig DS. Fast-food habits, weight gain, and insulin resistance (the CARDIA study): 15-year prospective analysis. Lancet 2005; 365(9453): 36-42. 445. Anderson JW. Whole grains and coronary heart disease: the whole kernel of truth. Am J Clin Nutr 2004; 80(6): 1459-1460. 446. Martínez-Tome M, Murcia MA, Frega N, Ruggieri S, Jiménez AM, Roses F, Parras P. Evaluation of antioxidant capacity of cereal brans. J Agric Food Chem 2004; 52(15): 4690-4699. 447. Food and Nutrition Board (FNB), Institute of Medicine (IOM). Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients). 2002. En Internet: http://books.nap.edu/books/0309085373/html. 448. Setchell KD. Soy isoflavones: benefits and risks from nature’s selective estrogen receptor modulators (SERMs). J Am Coll Nutr 2001; 20(Suppl.): 354S-362S. 449. Anderson JW, Johnstone BM, Cook-Newell ME. Meta-analysis of the effects of soy protein intake on serum lipids. N Engl J Med 1995; 333(5): 276-282. 450. Reynolds K, Chin A, Lees KA, Nguyen A, Bujnowski D, He J. A meta-analysis of the effect of soy protein supplementation on serum lipids. Am J Cardiol 2006; 98(5): 633-640. 451. Zhan S, Ho SC. Meta-analysis of the effects of soy protein containing isoflavones on the lipid profile. Am J Clin Nutr 2005; 81(2): 397-408. 452. Nestel P. Isoflavones: their effects on cardiovascular risk and functions. Curr Opin Lipidol 2003; 14(1): 3-8. 453. Messina MJ. Legumes and soybeans: overview of their nutritional profiles and health effects. Am J Clin Nutr 1999; 70(3 Suppl): 439S-450S. 454. Anderson JW, Story L, Sieling B, Chen WJ, Petro MS, Story J. Hypocholesterolemic effects of oat-bran or bean intake for hypercholesterolemic men. Am J Clin Nutr 1984; 40(6): 1146-1155. 197 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 455. Anderson JW, Gustafson NJ, Spencer DB, Tietyen J, Bryant CA. Serum lipid response of hypercholesterolemic men to single and divided doses of canned beans. Am J Clin Nutr 1990; 51(6): 1013-1019. 456. Ros E, Zambón D. Legumbres y colesterol. Clin Invest Arterioscler 1990; 2(4): 153-154. 457. Bazzano LA, He J, Ogden LG, Loria C, Vupputuri S, Myers L, Whelton PK. Legume consumption and risk of coronary heart disease in US men and women: NHANES I Epidemiologic Follow-up Study. Arch Intern Med 2001; 161(21): 2573-2578. 458. Ma Y, Chiriboga D, Olendzki BC, Nicolosi R, Merriam PA, Ockene IS. Effect of soy protein containing isoflavones on blood lipids in moderately hypercholesterolemic adults: a randomized controlled trial. J Am Coll Nutr 2005; 24(4): 275-285. 459. Dewell A, Hollenbeck PL, Hollenbeck CB. Clinical review: a critical evaluation of the role of soy protein and isoflavone supplementation in the control of plasma cholesterol concentrations. J Clin Endocrinol Metab 2006; 91(3): 772-780. 460. Sacks FM, Lichtenstein A, Van Horn L, Harris W, Kris-Etherton P, Winston M; American Heart Association Nutrition Committee. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation 2006; 113(7): 1034-1044. 461. Ostlund RE Jr. Phytosterols in human nutrition. Annu Rev Nutr 2002; 22: 533-549. 462. Turley SD, Dietschy JM. Sterol absorption by the small intestine. Curr Opin Lipidol 2003; 14(3): 233240. 463. Moreau RA, Whitaker BD, Hicks KB. Phytosterols, phytostanols, and their conjugates in foods: structural diversity, quantitative analysis, and health-promoting uses. Prog Lipid Res 2002; 41(6): 457-500. 464. Plaza I. Los fitoesteroles, el colesterol y la prevención de las enfermedades cardiovasculares. Clin Invest Arterioscler 2001; 13(5): 209-218. 465. Doornbos AM, Meynen EM, Duchateau GS, van der Knaap HC, Trautwein EA. Intake occasion affects the serum cholesterol lowering of a plant sterol-enriched single-dose yoghurt drink in mildly hypercholesterolaemic subjects. Eur J Clin Nutr 2006; 60(3): 325-333. 466. Miettinen TA, Puska P, Gylling H, Vanhanen H, Vartiainen E. Reduction of serum cholesterol with sitostanol-ester margarine in a mildly hypercholesterolemic population. N Engl J Med 1995; 333(20): 1308-1312. 467. Law M. Plant sterol and stanol margarines and health. BMJ 2000; 320(7238): 861-864. 468. Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R; Stresa Workshop Participants. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc 2003; 78(8): 965-978. 469. Gylling H, Puska P, Vartiainen E, Miettinen TA. Serum sterols during stanol ester feeding in a mildly hypercholesterolemic population. J Lipid Res 1999; 40(4): 593-600. 470. Volpe R, Niittynen L, Korpela R, Sirtori C, Bucci A, Fraone N, Pazzucconi F. Effects of yoghurt enriched with plant sterols on serum lipids in patients with moderate hypercholesterolaemia. Br J Nutr 2001; 86(2): 233-239. 471. Mensink RP, Ebbing S, Lindhout M, Plat J, Van Heugten MM. Effects of plant stanol esters supplied in low-fat yoghurt on serum lipids and lipoproteins, non-cholesterol sterols and fat soluble antioxidant concentrations. Atherosclerosis 2002; 160(1): 205-213. 472. Matvienko OA, Lewis DS, Swanson M, Arndt B, Rainwater DL, Stewart J, Alekel DL. A single daily dose of soybean phytosterols in ground beef decreases serum total cholesterol and LDL cholesterol in young, mildly hypercholesterolemic men. Am J Clin Nutr 2002; 76(1): 57-64. 198 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 473. Hyun YJ, Kim OY, Kang JB, Lee JH, Jang Y, Liponkoski L, Salo P. Plant stanol esters in low-fat yogurt reduces total and low-density lipoprotein cholesterol and low-density lipoprotein oxidation in normocholesterolemic and mildly hypercholesterolemic subjects. Nutr Res 2005; 25(8): 743-753. 474. Noakes M, Clifton PM, Doornbos AM, Trautwein EA. Plant sterol ester-enriched milk and yoghurt effectively reduce serum cholesterol in modestly hypercholesterolemic subjects. Eur J Nutr 2005; 44(4): 214-222. 475. Amundsen AL, Ntanios F, Put N, Ose L. Long-term compliance and changes in plasma lipids, plant sterols and carotenoids in children and parents with FH consuming plant sterol ester-enriched spread. Eur J Clin Nutr 2004; 58(12): 1612-1620. 476. Lau VW, Journoud M, Jones PJ. Plant sterols are efficacious in lowering plasma LDL and non-HDL cholesterol in hypercholesterolemic type 2 diabetic and nondiabetic persons. Am J Clin Nutr 2005; 81(6): 1351-1358. 477. Yoshida M, Vanstone CA, Parsons WD, Zawistowski J, Jones PJ. Effect of plant sterols and glucomannan on lipids in individuals with and without type II diabetes. Eur J Clin Nutr 2006; 60(4): 529-537. 478. Gylling H, Siimes MA, Miettinen TA. Sitostanol ester margarine in dietary treatment of children with familial hypercholesterolemia. J Lipid Res 1995; 36(8): 1807-1812. 479. Moruisi KG, Oosthuizen W, Opperman AM. Phytosterols/stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis. J Am Coll Nutr 2006; 25(1): 41-48. 480. Gylling H, Radhakrishnan R, Miettinen TA. Reduction of serum cholesterol in postmenopausal women with previous myocardial infarction and cholesterol malabsorption induced by dietary sitostanol ester margarine: women and dietary sitostanol. Circulation 1997; 96(12): 4226-4231. 481. Blair SN, Capuzzi DM, Gottlieb SO, Nguyen T, Morgan JM, Cater NB. Incremental reduction of serum total cholesterol and low-density lipoprotein cholesterol with the addition of plant stanol estercontaining spread to statin therapy. Am J Cardiol 2000; 86(1): 46-52. 482. Neil HA, Meijer GW, Roe LS. Randomised controlled trial of use by hypercholesterolaemic patients of a vegetable oil sterol-enriched fat spread. Atherosclerosis 2001; 156(2): 329-337. 483. O’Neill FH, Brynes A, Mandeno R, Rendell N, Taylor G, Seed M, Thompson GR. Comparison of the effects of dietary plant sterol and stanol esters on lipid metabolism. Nutr Metab Cardiovasc Dis 2004; 14(3): 133-142. 484. Cater NB, García-García AB, Vega GL, Grundy SM. Responsiveness of plasma lipids and lipoproteins to plant stanol esters. Am J Cardiol 2005; 96(1A): 23D-28D. 485. Jakulj L, Trip MD, Sudhop T, von Bergmann K, Kastelein JJ, Vissers MN. Inhibition of cholesterol absorption by the combination of dietary plant sterols and ezetimibe: effects on plasma lipid levels. J Lipid Res 2005; 46(12): 2692-2698. 486. Plat J, Mensink RP. Plant stanol and sterol esters in the control of blood cholesterol levels: mechanism and safety aspects. Am J Cardiol 2005; 96(1A): 15D-22D. 487. Clifton PM, Noakes M, Ross D, Fassoulakis A, Cehun M, Nestel P. High dietary intake of phytosterol esters decreases carotenoids and increases plasma plant sterol levels with no additional cholesterol lowering. J Lipid Res 2004; 45(8): 1493-1499. 488. Colgan HA, Floyd S, Noone EJ, Gibney MJ, Roche HM. Increased intake of fruit and vegetables and a low-fat diet, with and without low-fat plant sterol-enriched spread consumption: effects on plasma lipoprotein and carotenoid metabolism. J Hum Nutr Diet 2004; 17(6): 561-569. 489. Salen G, Shefer S, Nguyen L, Ness GC, Tint GS, Shore V. Sitosterolemia. J Lipid Res 1992; 33(7): 945955. 490. Jenkins DJ, Kendall CW, Marchie A, Faulkner DA, Wong JM, De Souza R, Emam A, Parker TL, Vidgen E, Trautwein EA, Lapsley KG, Josse RG, Leiter LA, Singer W, Connelly PW. Direct comparison of a dietary 199 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA portfolio of cholesterol-lowering foods with a statin in hypercholesterolemic participants. Am J Clin Nutr 2005; 81(2): 380-387. 491. Jenkins DJ, Kendall CW, Faulkner DA, Nguyen T, Kemp T, Marchie A, Wong JM, De Souza R, Emam A, Vidgen E, Trautwein EA, Lapsley KG, Holmes C, Josse RG, Leiter LA, Connelly PW, Singer W. Assessment of the longer-term effects of a dietary portfolio of cholesterol-lowering foods in hypercholesterolemia. Am J Clin Nutr 2006; 83(3): 582-591. 492. De Deckere EA, Korver O, Verschuren PM, Katan MB. Health aspects of fish and n-3 polyunsaturated fatty acids from plant and marine origin. Eur J Clin Nutr 1998; 52(10): 749-753. 493. Hooper L, Thompson RL, Harrison RA, Summerbell CD, Ness AR, Moore HJ, Worthington HV, Durrington PN, Higgins JP, Capps NE, Riemersma RA, Ebrahim SB, Davey Smith G. Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review. BMJ 2006; 332(7544): 752-760. 494. Wang C, Harris W, Chung M, Lichtenstein A, Balk E y cols. n-3 fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr 2006; 84(1): 5-17. 495. Howard BV, Kritchevsky D. Phytochemicals and cardiovascular disease. A statement for healthcare professionals from the American Heart Association. Circulation 1997; 95(11): 2591-2593. 496. Craig WJ. Phytochemicals: guardians of our health. J Am Diet Assoc 1997; 97(10 Suppl 2): S199S204. 497. Van Duyn MA, Pivonka E. Overview of the health benefits of fruit and vegetable consumption for the dietetics professional: selected literature. J Am Diet Assoc 2000; 100(12): 1511-1521. 498. Law MR, Morris JK. By how much does fruit and vegetable consumption reduce the risk of ischaemic heart disease? Eur J Clin Nutr 1998; 52(8): 549-556. 499. Hu FB, Rimm EB, Stampfer MJ, Ascherio A, Spiegelman D, Willett WC. Prospective study of major dietary patterns and risk of coronary heart disease in men. Am J Clin Nutr 2000; 72(4): 912-921. 500. Bazzano LA, He J, Ogden LG, Loria CM, Vupputuri S, Myers L, Whelton PK. Fruit and vegetable intake and risk of cardiovascular disease in US adults: the first National Health and Nutrition Examination Survey Epidemiologic Follow-up Study. Am J Clin Nutr 2002; 76(1): 93-99. 501. Steffen LM, Jacobs DR Jr, Stevens J, Shahar E, Carithers T, Folsom AR. Associations of whole-grain, refined-grain, and fruit and vegetable consumption with risks of all-cause mortality and incident coronary artery disease and ischemic stroke: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Clin Nutr 2003; 78(3): 383-390. 502. Halvorsen BL, Holte K, Myhrstad MC, Barikmo I, Hvattum E, Remberg SF, Wold AB, Haffner K, Baugerod H, Andersen LF, Moskaug O, Jacobs DR Jr, Blomhoff R. A systematic screening of total antioxidants in dietary plants. J Nutr 2002; 132(3): 461-471. 503. Shobana S, Naidu KA. Antioxidant activity of selected Indian spices. Prostaglandins Leukot Essent Fatty Acids 2000; 62(2): 107-110. 504. Gartner C, Stahl W, Sies H. Lycopene is more bioavailable from tomato paste than from fresh tomatoes. Am J Clin Nutr 1997; 66(1): 116-122. 505. Stahl W, Sies H. Uptake of lycopene and its geometrical isomers is greater from heat-processed than from unprocessed tomato juice in humans. J Nutr 1992; 122(11): 2161-2166. 506. Sutherland WH, De Jong SA, Walker RJ, Williams MJ, Murray Skeaff C, Duncan A, Harper M. Effect of meals rich in heated olive and safflower oils on oxidation of postprandial serum in healthy men. Atherosclerosis 2002; 160(1): 195-203. 507. Stoclet JC, Chataigneau T, Ndiaye M, Oak MH, El Bedoui J, Chataigneau M, Schini-Kerth VB. Vascular protection by dietary polyphenols. Eur J Pharmacol 2004; 500(1-3): 299-313. 200 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 508. Brighenti F, Valtuena S, Pellegrini N, Ardigo D, Del Rio D, Salvatore S, Piatti P, Serafini M, Zavaroni I. Total antioxidant capacity of the diet is inversely and independently related to plasma concentration of high-sensitivity C-reactive protein in adult Italian subjects. Br J Nutr 2005; 93(5): 619-625. 509. Labinskyy N, Csiszar A, Veress G, Stef G, Pacher P, Oroszi G, Wu J, Ungvari Z. Vascular dysfunction in aging: potential effects of resveratrol, an anti-inflammatory phytoestrogen. Curr Med Chem 2006; 13(9): 989-996. 510. Hao HD, He LR. Mechanisms of cardiovascular protection by resveratrol. J Med Food 2004; 7(3): 290298. 511. Wallerath T, Deckert G, Ternes T, Anderson H, Li H, Witte K, Forstermann U. Resveratrol, a polyphenolic phytoalexin present in red wine, enhances expression and activity of endothelial nitric oxide synthase. Circulation 2002; 106(13): 1652-1658. 512. Wallerath T, Poleo D, Li H, Forstermann U. Red wine increases the expression of human endothelial nitric oxide synthase: a mechanism that may contribute to its beneficial cardiovascular effects. J Am Coll Cardiol 2003; 41(3): 471-478. 513. Rakici O, Kiziltepe U, Coskun B, Aslamaci S, Akar F. Effects of resveratrol on vascular tone and endothelial function of human saphenous vein and internal mammary artery. Int J Cardiol 2005; 105(2): 209-215. 514. Wallerath T, Li H, Godtel-Ambrust U, Schwarz PM, Forstermann U. A blend of polyphenolic compounds explains the stimulatory effect of red wine on human endothelial NO synthase. Nitric Oxide 2005; 12(2): 97-104. 515. Lekakis J, Rallidis LS, Andreadou I, Vamvakou G, Kazantzoglou G, Magiatis P, Skaltsounis AL, Kremastinos DT. Polyphenolic compounds from red grapes acutely improve endothelial function in patients with coronary heart disease. Eur J Cardiovasc Prev Rehabil 2005; 12(6): 596-600. 516. Kaliora AC, Dedoussis GV, Schmidt H. Dietary antioxidants in preventing atherogenesis. Atherosclerosis 2006; 187(1): 1-17. 517. Yusuf S, Dagenais G, Pogue J, Bosch J, Sleight P, for the Heart Outcomes Prevention Evaluation Study Investigators. Vitamin E supplementation and cardiovascular events in high-risk patients. N Engl J Med 2000; 342(3): 154-160. 518. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of antioxidant vitamin supplementation in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360(9326): 23-33. 519. Lee IM, Cook NR, Gaziano JM, Gordon D, Ridker PM, Manson JE, Hennekens CH, Buring JE. Vitamin E in the primary prevention of cardiovascular disease and cancer: the Women’s Health Study: a randomized controlled trial. JAMA 2005; 294(1): 56-65. 520. Lee DH, Folsom AR, Harnack L, Halliwell B, Jacobs DR Jr. Does supplemental vitamin C increase cardiovascular disease risk in women with diabetes? Am J Clin Nutr 2004; 80(5): 1194-1200. 521. Kritharides L, Stocker R. The use of antioxidant supplements in coronary heart disease. Atherosclerosis 2002; 164(2): 211-219. 522. Hennekens CH, Buring JE, Manson JE, Stampfer M, Rosner B, Cook NR, Belanger C, LaMotte F, Gaziano JM, Ridker PM, Willett W, Peto R. Lack of effect of long-term supplementation with beta carotene on the incidence of malignant neoplasms and cardiovascular disease. N Engl J Med 1996; 334(18): 1145-1149. 523. The Alpha-Tocopherol, Beta Carotene Cancer Prevention Study Group. The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers. N Engl J Med 1994; 330(15): 1029-1035. 524. Yuen B, Furrer L, Ballmer PE. Antioxidanzien und Vitamine in der Prävention von kardiovaskulären Erkrankungen. Ther Umsch 2005; 62(9): 615-618. 201 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 525. Miller ER 3rd, Appel LJ, Risby TH. Effect of dietary patterns on measures of lipid peroxidation: results from a randomized clinical trial. Circulation 1998; 98(22): 2390-2395. 526. Brown AA, Hu FB. Dietary modulation of endothelial function: implications for cardiovascular disease. Am J Clin Nutr 2001; 73(4): 673-686. 527. West SG. Effect of diet on vascular reactivity: an emerging marker for vascular risk. Curr Atheroscler Rep 2001; 3(6): 446-455. 528. Malinow MR, Bostom AG, Krauss RM. Homocyst(e)ine, diet, and cardiovascular diseases: a statement for healthcare professionals from the Nutrition Committee, American Heart Association. Circulation 1999; 99(1): 178-182. 529. Eikelboom JW, Lonn E, Genest J Jr, Hankey G, Yusuf S. Homocyst(e)ine and cardiovascular disease: a critical review of the epidemiologic evidence. Ann Intern Med 1999; 131(5): 363-375. 530. Fernández-Miranda C, Aranda JL, Gómez González P, Díaz-Rubio P, Estenoz J, Gómez de la Cámara A. La hiperhomocisteinemia es frecuente en pacientes con enfermedad coronaria. Estudio de 202 enfermos. Med Clin (Barc) 1999; 113(11): 407-410. 531. Pintó X, Vilaseca MA, García-Giralt N, Ferrer I, Palá M, Meco JF, Mainou C, Ordovas JM, Grinberg D, Balcells S, and the Baix Llobregat Homocysteine Study Group. Homocysteine and the MTHFR 677C->Tallele in premature coronary artery disease. Case control and family studies. Eur J Clin Invest 2001; 31(1): 24-30. 532. Boushey CJ, Beresford SA, Omen GS, Motulsky AG. A quantitative assessment of plasma homocysteine as a risk factor for vascular disease. Probable benefits of increasing folic acid intakes. JAMA 1995; 274(13): 1049-1057. 533. Shai I, Stampfer MJ, Ma J, Manson JE, Hankinson SE, Cannuscio C, Selhub J, Curhan G, Rimm EB. Homocysteine as a risk factor for coronary heart diseases and its association with inflammatory biomarkers, lipids and dietary factors. Atherosclerosis 2004; 177(2): 375-381. 534. Jacques PF, Selhub J, Bostom AG, Wilson PW, Rosenberg IH. The effect of folic acid fortification on plasma folate and total homocysteine concentrations. N Engl J Med 1999; 340(19): 1449-1454. 535. Selhub J. The many facets of hyperhomocysteinemia: studies from the Framingham cohorts. J Nutr 2006; 136(6 Suppl): 1726S-1730S. 536. Robinson K, Arheart K, Refsum H, Brattstrom L, Boers G, Ueland P, Rubba P, Palma-Reis R, Meleady R, Daly L, Witteman J, Graham I. Low circulating folate and vitamin B6 concentrations: risk factors for stroke, peripheral vascular disease, and coronary artery disease. European COMAC Group. Circulation 1998; 97(5): 437-443. 537. Refsum H, Ueland PM, Nygard O, Vollset SE. Homocysteine and cardiovascular disease. Annu Rev Med 1998; 49: 31-62. 538. Guthikonda S, Haynes WG. Homocysteine: role and implications in atherosclerosis. Curr Atheroscler Rep 2006; 8(2): 100-106. 539. Homocysteine Lowering Trialists’ Collaboration. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. BMJ 1998; 316(7135): 894-898. 540. Woo KS, Chook P, Lolin YI, Sanderson JE, Metreweli C, Celermajer DS. Folic acid improves arterial endothelial function in adults with hyperhomocystinemia. J Am Coll Cardiol 1999; 34(7): 20022006. 541. Title LM, Cummings PM, Giddens K, Genest JJ Jr, Nasser BA. Effect of folic acid and antioxidant vitamins on endothelial dysfunction in patients with coronary artery disease. J Am Coll Cardiol 2000; 36(3): 758-765. 542. Mangoni AA, Sherwood RA, Asonganyi B, Swift LG, Thomas S, Jackson SH. Short-term oral folic acid supplementation enhances endothelial function in patients with type 2 diabetes. Am J Hypertens 2005; 18(2 Pt 1): 220-226. 202 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 543. Title LM, Ur E, Giddens K, Mc Queen MJ, Nassan BA. Folic acid improves endothelial dysfunction in type 2 diabetes —an effect independent of homocysteine- lowering. Vasc Med 2006; 11(2): 101109. 544. Wald DS, Law M, Morris JK. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. BMJ 2002; 325(7374): 1202-1206. 545. Stampfer MJ, Malinow MR. Can lowering homocysteine levels reduce cardiovascular risk? N Engl J Med 1995; 332(5): 328-329. 546. Schnyder G, Roffi M, Pin R, Flammer Y, Lange H, Eberli FR, Meier B, Turi ZG, Hess OM. Decreased rate of coronary restenosis after lowering of plasma homocysteine levels. N Engl J Med 2001; 345(22): 1593-1600. 547. Schnyder G, Roffi M, Flammer Y, Pin R, Hess OM. Effect of homocysteine-lowering therapy with folic acid, vitamin B12, and vitamin B6 on clinical outcome after percutaneous coronary intervention: the Swiss Heart study: a randomized controlled trial. JAMA 2002; 288(8): 973-979. 548. Bleys J, Miller ER 3rd, Pastor-Barriuso R, Appel LJ, Guallar E. Vitamin-mineral supplementation and the progression of atherosclerosis: a meta-analysis of randomized controlled trials. Am J Clin Nutr 2006; 84(4): 880-887. 549. Toole JF, Malinow MR, Chambless LE, Spence JD, Pettigrew LC, Howard VJ, Sides EG, Wang CH, Stampfer M. Lowering homocysteine in patients with ischemic stroke to prevent recurrent stroke, myocardial infarction, and death: the Vitamin Intervention for Stroke Prevention (VISP) randomized controlled trial. JAMA 2004; 291(5): 565-575. 550. Lonn E, Yusuf S, Arnold MJ, Sheridan P, Pogue J, Micks M, McQueen MJ, Probstfield J, Fodor G, Held C, Genest J Jr; Heart Outcomes Prevention Evaluation (HOPE) 2 Investigators. Homocysteine lowering with folic acid and B vitamins in vascular disease. N Engl J Med 2006; 354(15): 1567-1577. 551. Dusitanond P, Eikelboom JW, Hankey GJ, Thom J, Gilmore G, Loh K, Yi Q, Klijn CJ, Langton P, van Bockxmeer FM, Baker R, Jamrozik K. Homocysteine-lowering treatment with folic acid, cobalamin, and pyridoxine does not reduce blood markers of inflammation, endothelial dysfunction, or hypercoagulability in patients with previous transient ischemic attack or stroke: a randomized substudy of the VITATOPS trial. Stroke 2005; 36(1): 144-146. 552. Bonaa KH, Njolstad I, Ueland PM, Schirmer H, Tverdal A, Steigen T, Wang H, Nordrehaug JE, Arnesen E, Rasmussen K; NORVIT Trial Investigators. Homocysteine lowering and cardiovascular events after acute myocardial infarction. N Engl J Med 2006; 354(15): 1578-1588. 553. Kaul S, Zadeh AA, Shah PK. Homocysteine hypothesis for atherothrombotic cardiovascular disease: not validated. J Am Coll Cardiol 2006; 48(5): 914-923. 554. Pintó X. Frutas y verduras. El ácido fólico y la homocisteína como marcadores de riesgo cardiovascular. Clin Invest Arterioscler 2000; 12(Supl 2): 39-44. 555. Moreiras O, Carbajal A, Cabrera L. Tablas de composición de alimentos. 2ª edición 1996. Ediciones Pirámide, Madrid, España. 556. Serra Majem L, Ribas Barba L, García Closas R, Ballart JF, Guayta Escolier R. Llibre Blanc: Avaluació de l’estat nutricional de la població catalana (1992-1993). Barcelona, Generalitat de Catalunya 1996. 557. Wald DS, Bishop L, Wald NJ, Law M, Hennessy E, Weir D, McPartlin J, Scott J. Randomized trial of folic acid supplementation and serum homocysteine levels. Arch Intern Med 2001; 161(5): 695-700. 558. Hankey GJ, Eikelboom JW. Homocysteine and vascular disease. Lancet 1999; 354(9176): 407-413. 559. Cooke JP, Oka RK. Atherogenesis and the arginine hypothesis. Curr Atheroscler Rep 2001; 3(3): 252259. 560. Preli RB, Klein KP, Herrington DM. Vascular effects of dietary L-arginine supplementation. Atherosclerosis 2002; 162(1): 1-15. 203 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 561. Siani A, Pagano E, Iacone R, Iacoviello L, Scopacasa F, Strazzullo P. Blood pressure and metabolic changes during dietary L-arginine supplementation in humans. Am J Hypertens 2000; 13(5 Pt 1): 547-551. 562. Gokce N. L-arginine and hypertension. J Nutr 2004; 134(10 Suppl): 2807S-2811S. 563. Maxwell AJ, Zapien MP, Pearce GL, MacCallum G, Stone PH. Randomized trial of a medical food for the dietary management of chronic, stable angina. J Am Coll Cardiol 2002; 39(1): 37-45. 564. Blum A, Hathaway L, Mincemoyer R, Schenke WH, Kirby M, Csako G, Waclawiw MA, Panza JA, Cannon RO 3rd. Oral L-arginine in patients with coronary artery disease on medical management. Circulation 2000; 101(18): 2160-2164. 565. Schulman SP, Becker LC, Kass DA, Champion HC, Terrin ML, Forman S, Ernst KV, Kelemen MD, Townsend SN, Capriotti A, Hare JM, Gerstenblith G. L-arginine therapy in acute myocardial infarction: the Vascular Interaction With Age in Myocardial Infarction (VINTAGE MI) randomized clinical trial. JAMA 2006; 295(1): 58-64. 566. Loscalzo J. Adverse effects of supplemental L-arginine in atherosclerosis: consequences of methylation stress in a complex catabolism? Arterioscler Thromb Vasc Biol 2003; 23(1): 3-5. 567. Chen J, Kuhlencordt P, Urano F, Ichinose H, Astern J, Huang PL. Effects of chronic treatment with L-arginine on atherosclerosis in apoE knockout and apoE/inducible NO synthase double-knockout mice. Arterioscler Thromb Vasc Biol 2003; 23(1): 97-103. 568. Ferrari R, Merli E, Cicchitelli G, Mele D, Fucili A, Ceconi C. Therapeutic effects of L-carnitine and propionyl-L-carnitine on cardiovascular diseases: a review. Ann N Y Acad Sci 2004; 1033: 79-91. 569. Lango R, Smolenski RT, Rogowski J, Siebert J, Wujtewicz M, Slominska EM, Lysiak-Szydlowska W, Yacoub MH. Propionyl-L-carnitine improves hemodynamics and metabolic markers of cardiac perfusion during coronary surgery in diabetic patients. Cardiovasc Drugs Ther 2005; 19(4): 267275. 570. Bartels GL, Remme WJ, Pillay M, Schonfeld DH, Kruijssen DA. Effects of L-propionylcarnitine on ischemia-induced myocardial dysfunction in men with angina pectoris. Am J Cardiol 1994; 74(2): 125-130. 571. Vescovo G, Ravara B, Gobbo V, Sandri M, Angelini A, Della Barbera M, Dona M, Peluso G, Calvani M, Mosconi L, Dalla Libera L. L-Carnitine: a potential treatment for blocking apoptosis and preventing skeletal muscle myopathy in heart failure. Am J Physiol Cell Physiol 2002; 283(3) :C802-C810. 572. Carrero JJ, Grimble RF. Does nutrition have a role in peripheral vascular disease? Br J Nutr 2006; 95(2): 217-229. 573. Hiatt WR. Carnitine and peripheral arterial disease. Ann N Y Acad Sci 2004; 1033: 92-98. 574. Meru AV, Mittra S, Thyagarajan B, Chugh A. Intermittent claudication: An overview. Atherosclerosis 2006; 187(2): 221-237. 575. Santo SS, Sergio N, Luigi DP, Giuseppe M, Margherita F, Gea OC, Roberto F, Gabriella C, Giuseppe P, Massimiliano A. Effect of PLC on functional parameters and oxidative profile in type 2 diabetesassociated PAD. Diabetes Res Clin Pract 2006; 72(3): 231-237. 576. Brevetti G, Diehm C, Lambert D. European multicenter study on propionyl-L-carnitine in intermittent claudication. J Am Coll Cardiol 1999; 34(5): 1618-1624. 577. Hiatt WR, Regensteiner JG, Creager MA, Hirsch AT, Cooke JP, Olin JW, Gorbunov GN, Isner J, Lukjanov YV, Tsitsiashvili MS, Zabelskaya TF, Amato A. Propionyl-L-carnitine improves exercise performance and functional status in patients with claudication. Am J Med 2001; 110(8): 616-622. 578. Schreiber BD. Debate forum: levocarnitine therapy is rational and justified in selected dialysis patients. Blood Purif 2006; 24(1): 128-139. 579. Handelman GJ. Debate forum: carnitine supplements have not been demonstrated as effective in patients on long-term dialysis therapy. Blood Purif 2006; 24(1): 140-142. 204 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE BIBLIOGRAFÍA EN ATENCIÓN PRIMARIA 580. Saper RB, Eisenberg DM, Phillips RS. Common dietary supplements for weight loss. Am Fam Physician 2004; 70(9): 1731-1738. 581. Lofgren IE, Herron KL, West KL, Zern TL, Brownbill RA, Ilich JZ, Koo SI, Fernández ML. Weight loss favorably modifies anthropometrics and reverses the metabolic syndrome in premenopausal women. J Am Coll Nutr 2005; 24(6): 486-493. 582. L-carnitine. Med Lett Drugs Ther 2004; 46(1196): 95-96. 583. En Intenet: http://www.canola-council.org. 584. Kinney JM. Challenges to rebuilding the US food pyramid. Curr Opin Clin Nutr Metab Care 2005; 8(1): 1-7. 585. Ordovas JM. The quest for cardiovascular health in the genomic era: nutrigenetics and plasma lipoproteins. Proc Nutr Soc 2004; 63(1): 145-152. 586. Ordovas JM. Genetic interactions with diet influence the risk of cardiovascular disease. Am J Clin Nutr 2006; 83(2): 443S-446S. 587. Paoloni-Giacobino A, Grimble R, Pichard C. Genetics and nutrition. Clin Nutr 2003; 22(5): 429-435. 588. Mutch DM, Wahli W, Williamson G. Nutrigenomics and nutrigenetics: the emerging faces of nutrition. FASEB J 2005; 19(12): 1602-1616. 589. Ordovas JM, Mooser V. Nutrigenomics and nutrigenetics. Curr Opin Lipidol 2004; 15(2): 101-108. 590. De Backer G (Editor). Third Joint Task Force of European and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of eight societies and by invited experts). European guidelines on cardiovascular disease prevention. Eur J Cardiol Prev Rev 2003; 10(Suppl 1): 1-78. 591. Brotons C, Royo-Bordonada MA, Álvarez-Sala L, Armario P, Artigao R, Conthe P, De Álvaro F, De Santiago A, Gil A, Lobos JM, Maiques A, Marrugat J, Mauricio D, Rodríguez-Artalejo F, Sans S, Suárez C; Comité Español Interdisciplinario para la Prevención Cardiovascular (CEIPC). Adaptación española de la Guía Europea de Prevención Cardiovascular. Clin Invest Arterioscl 2005; 17(1): 19-33. 592. Visvikis-Siest S, Marteau JB. Genetic variants predisposing to cardiovascular disease. Curr Opin Lipidol 2006; 17(2): 139-151. 593. Marteau JB, Zaiou M, Siest G, Visvikis-Siest S. Genetic determinants of blood pressure regulation. J Hypertens 2005; 23(12): 2127-2143. 594. Masson LF, McNeill G. The effect of genetic variation on the lipid response to dietary change: recent findings. Curr Opin Lipidol 2005; 16(1): 61-67. 595. Ye SQ, Kwiterovich PO Jr. Influence of genetic polymorphisms on responsiveness to dietary fat and cholesterol. Am J Clin Nutr 2000; 72(5 Suppl): 1275S-1284S. 596. Ordovas JM, Corella D, Cupples LA, Demissie S, Kelleher A, Coltell O, Wilson PW, Schaefer EJ, Tucker K. Polyunsaturated fatty acids modulate the effects of the APOA1 G-A polymorphism on HDL-cholesterol concentrations in a sex-specific manner: the Framingham Study. Am J Clin Nutr 2002; 75(1): 38-46. 597. Sigurdsson G Jr, Gudnason V, Sigurdsson G, Humphries SE. Interaction between a polymorphism of the apo A-I promoter region and smoking determines plasma levels of HDL and apo A-I. Arterioscler Thromb 1992; 12(9): 1017-1022. 598. Boekholdt SM, Thompson JF. Natural genetic variation as a tool in understanding the role of CETP in lipid levels and disease. J Lipid Res 2003; 44(6): 1080-1093. 599. Tai ES, Demissie S, Cupples LA, Corella D, Wilson PW, Schaefer EJ, Ordovas JM. Association between the PPARA L162V polymorphism and plasma lipid levels: the Framingham Offspring Study. Arterioscler Thromb Vasc Biol 2002; 22(5): 805-810. 600. Haga SB, Khoury MJ, Burke W. Genomic profiling to promote a healthy lifestyle: not ready for prime time. Nat Genet 2003; 34(4): 347-350. 205 13 GUÍA DE ALIMENTACIÓN CARDIOSALUDABLE EN ATENCIÓN PRIMARIA 601. Rodríguez-Artalejo F, Garces C, Gorgojo L, López García E, Martín-Moreno JM, Benavente M, Del Barrio JL, Rubio R, Ortega H, Fernández O, De Oya M; Investigators of the Four Provinces Study. Dietary patterns among children aged 6-7 y in four Spanish cities with widely differing cardiovascular mortality. Eur J Clin Nutr 2002; 56(2): 141-148. 602. Royo-Bordonada MA, Gorgojo L, Martín-Moreno JM, Garces C, Rodríguez-Artalejo F, Benavente M, Mangas A, De Oya M; Investigators of the Four Provinces Study. Spanish children’s diet: compliance with nutrient and food intake guidelines. Eur J Clin Nutr 2003; 57(8): 930-939. 603. Villar Álvarez F, Banegas Banegas JR, Donado Campos JM, Rodríguez Artalejo F. Las enfermedades cardiovasculares y sus factores de riesgo en España: hechos y cifras. Informe SEA 2003, Sociedad Española de Arteriosclerosis, Ergon, Madrid, 2003. 604. Comité Español Interdisciplinario para la Prevención Cardiovascular. Adaptación española de la Guía Europea de Prevención Cardiovascular. Rev Esp Salud Publica 2004; 78(4): 435-438. 605. Pérez-Jiménez F, Ros E, Sola R, Godas G, Pérez-Heras A, Serra M, Mostaza J, Pintó X. Consejos para ayudar a controlar el colesterol con una alimentación saludable. Clin Invest Arterioscler 2006; 18(3): 104-110. 606. US Department of Health and Human Services, US Department of Agriculture. Dietary Guidelines for Americans. 6th ed. Washington, DC: US Government Printing Office; 2005. 607. Serra Majem L, Ribas Barba L, Aranceta Bartrina J, Pérez Rodrigo C, Saavedra Santana P, Peña Quintana L. Obesidad infantil y juvenil en España. Resultados del Estudio enKid (1998-2000). Med Clin (Barc) 2003; 121(19): 725-732. 608. Moreno LA, Mesana MI, Fleta J, Ruiz JR, González-Gross M, Sarria A, Marcos A, Bueno M; AVENA Study Group. Overweight, obesity and body fat composition in spanish adolescents. The AVENA Study. Ann Nutr Metab 2005; 49(2): 71-76. 609. La alimentación de tus niños. Nutrición saludable de la infancia a la adolescencia. Agencia Española de Seguridad Alimentaria. Ministerio de Sanidad y Consumo. Madrid. 2005. 610. Ching PL, Willett WC, Rimm EB, Colditz GA, Gortmaker SL, Stampfer MJ. Activity level and risk of overweight in male health professionals. Am J Public Health 1996; 86(1): 25-30. 611. Neira M, De Onis M. The Spanish strategy for nutrition, physical activity and the prevention of obesity. Br J Nutr 2006; 96(Suppl 1): S8-S11. 612. Pearson TA, Laurora I, Chu H, Kafonek S. The Lipid Treatment Assessment Project (L-TAP). A multicenter survey to evaluate the percentages of dyslipidemic patients receiving lipid-lowering therapy and achieving low-density lipoprotein cholesterol goals. Arch Intern Med 2000; 160(4): 459-467. 613. Sociedad Española de Medicina Familiar y Comunitaria. Programa de Actividades Preventivas y de Promoción de la Salud en Atención Primaria. Actualización 2003. Aten Primaria 2003; 32(Supl 2): 1-158. 614. Gordon NF, Salmon RD, Mitchell BS, Faircloth GC, Levinrad LI, Salmon S, Saxon WE, Reid KS. Innovative approaches to comprehensive cardiovascular disease risk reduction in clinical and community-based settings. Curr Atheroscler Rep 2001; 3(6): 498-506. 615. U.S. Preventive Services Task Force. Behavioral counseling in primary care to promote a healthy diet: recommendations and rationale. Am J Prev Med 2003; 24(1): 93-100. 616. Underbakke G, McBride PE, Spencer E. Web-based resources for medical nutrition education. Am J Clin Nutr 2006; 83(4): 951S-955S. 206 WWW.COLESTEROLFAMILIAR.COM