En 1808 Dalton formula su teoría atómica Postulados de Dalton:
Anuncio

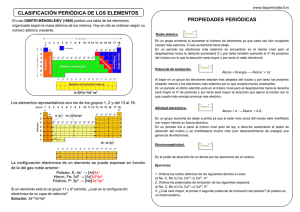
En 1808 Dalton formula su teoría atómica. Postulados de Dalton: • Los elementos químicos están constituídos por átomo, patículas indivisibles. • Átomos de un mismo elemento son iguales en masa y propiedades • Átomos de elementos diferentes son también distintos en masa y propiedades. • Las moléculas de un compuesto se forman siempre por una combinación de números enteros y sencillos. Ejemplos actuales que contradicen esta teoría 12 6 C Z=6 Electrones protones A=12 nº másico Contra el primer postulado de Dalton está la existencia de partículas más pequeñas que el átomo 4 QUARKS up down strange charm Contra el segundo postulado, la existencia de isótopos. 12 6 C A Z nº atómico indica: • Lugar en la tabla • Nº de protones • Nº de electrones A−Z=neutrones Isótopos: 2 elementos que tienen igual Z pero diferente A Contra el tercer postulado la existencia de isobaros 1 14 7 N 14 6 C Igual masa Contra el cuarto postulado, la existencia de macromoléculas Modelo atómico de Thompson Afinales del siglo XIX se habían descubierto el electrón y el protón. Las características son: Protón masa± 1 uma Carga positiva + Electrón masa= masa protón/1850 + Carga negativa MILLICAN Con estas 2 partículas Thompson formuló su modelo: El átomo esta formado por una mezcla homogenea de protonesy electrones de forma quecuandoel átomo es neutro el nº de los primeros iguala al de los segundos. A pesar de ser un modelo primitivo, Thompson justificaba fenómenos sencilhos como la ionización La ionización se da cuando un elemento químico gana o pierde electrones, en general tienden todos los elementos a adquirir la estructura de gas noble(no se combinan con casi nada) 10 F 9 20 Ne 10 10 10 F− protones 9+ electrones 10− 2