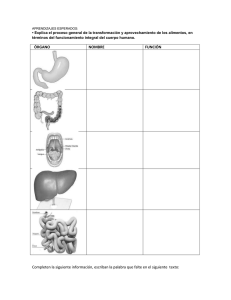
INFLUENCIA CONJUNTA DE LA VEGETACIÓN, ASENTAMIENTOS
Anuncio

FACULTAD DE CIENCIAS EXACTAS, FÍSICAS Y NATURALES UNIVERSIDAD NACIONAL DE CÓRDOBA TESIS DE DOCTORADO EN CIENCIAS BIOLOGICAS INFLUENCIA CONJUNTA DE LA VEGETACIÓN, ASENTAMIENTOS HUMANOS, CAMINOS Y ACTIVIDADES GANADERAS SOBRE LA OCURRENCIA Y DIETA DE LOS CARNÍVOROS TOPE DE ACHALA (CÓRDOBA, ARGENTINA) Por Biol. Mónica Valeria Pia Director: Dr. José Gustavo Haro Co-Director: Dr. Daniel Renison Lugar de Trabajo: Museo de Zoología, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba Córdoba, Argentina 2011 -1- Influencia conjunta de la vegetación, asentamientos humanos, caminos y actividades ganaderas sobre la ocurrencia y dieta de los carnívoros tope de Achala (Córdoba, Argentina) Resumen En la actualidad la ecología de las poblaciones de carnívoros está, en gran medida, modelada por las intervenciones humanas. En gran parte de la Argentina, el rol del puma y zorro colorado se ha modificado debido a cambios inducidos por el hombre en su base de presas y en la disponibilidad de hábitat apto para sobrevivir, entre otros. El objetivo de ésta tesis fue determinar cómo afectan a la ocurrencia y dieta de éstos carnívoros las modificaciones producidas en el ambiente por actividades humanas. El estudio se realizó en las Sierras Grandes de Córdoba, consideradas una isla biogeográfica, con un clima templado, temperatura media anual de 8 ºC y precipitaciones promedio de 850 mm anuales. Las Sierras están protegidas en diferentes categorías de conservación (Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala), y los carnívoros tope están representados por el puma (Puma concolor) y el zorro colorado, subespecie endémica de achala (Pseudalopex culpaeus smithersi). A partir de transectas se contó el número de signos de los carnívoros tope para determinar su ocurrencia en ambas áreas, y mediante un Sistema de Información Geográfico (SIG) se obtuvieron variables explicativas como indicadores de disturbio humano (distancia a casas y caminos) y de ambiente, como la vegetación. La asociación entre la ocurrencia de carnívoros y las variables explicativas se analizaron con modelos lineales generalizados. Para el análisis de la dieta, se recolectaron y analizaron heces de ambos carnívoros. Se analizó la amplitud, superposición de nicho trófico y peso promedio de las presas para evaluar su respuesta a largo plazo. También, se analizó la magnitud del conflicto carnívoro-humano, y su impacto sobre la ocurrencia y dieta de los carnívoros. Se encontró que la presencia de signos de ambos carnívoros fue mayor en áreas lejanas a las viviendas humanas y caminos, y en el área con protección activa de conservación (parque nacional). Por lo tanto, las zonas con escasa cobertura vegetal y cercanas a la presencia humana, se espera representen sitios de amenaza o barreras para el movimiento de éstos carnívoros. Los roedores pequeños constituyeron la mayor parte de presas consumidas por puma y zorro colorado. Ambos carnívoros, mostraron una diversidad trófica baja y una alta superposición en sus dietas. El peso promedio de las presas consumidas, reflejó el mayor interés por presas medianas y grandes por parte del puma, ya que cuando éstas estuvieron disponibles fueron consumidas. El puma se comportó como un predador generalista, cambiando sus hábitos alimenticios ante cambios en la disponibilidad de presas grandes, adquiriendo en su lugar, gran importancia las presas pequeñas. El zorro continuó con sus hábitos especialistas en pequeños mamíferos como se observó en años anteriores. Los pumas poseen la clásica adaptabilidad, cambiando su dieta en relación al cambio en sus presas, y dispersándose para reocupar áreas donde una vez fueron perseguidos, como en las estancias que hoy conforman el parque nacional. El problema de predación de ganado por puma y zorro colorado, es una fuente de conflicto importante que pone en riesgo la conservación de éstos carnívoros y en consecuencia altera su ocurrencia y dieta. -2- El parque podría estar cumpliendo el rol de refugio, donde la calidad de hábitat para su supervivencia es buena (mayor cobertura vegetal y menor impacto humano), pero para el caso de los pumas, ésta área para su reproducción podría ser pobre por la escasez de presas grandes. Al parecer éstos carnívoros se vieron beneficiados por la creación del parque nacional en cuanto a su conservación, y al menor acceso al ganado, lo que ayuda a disminuir el conflicto con los humanos, sin embargo el ensamble de presas se encuentra aún alterado. Los resultados son alentadores en términos de la capacidad de recuperación de al menos algunos componentes del ensamble de mamíferos predador-presa. Se observó, que el efecto de la ganadería en la abundancia de pequeños mamíferos, y la dieta de ambos carnívoros puede revertirse rápidamente, teniendo en cuenta el escaso tiempo que pasó desde la remoción del ganado en el parque. Palabras clave: carnívoros tope, Achala, ocurrencia, puma, dieta, pequeños mamíferos, zorro colorado, ganado doméstico, antrópico, modelos explicativos -3- Influence of vegetation, human settlements, roads and livestock activities on the occurrence and diet of Achala’s top carnivores (Córdoba, Argentina) Abstract At present, the ecology of carnivore populations is largely shaped by human intervention. In much of Argentina, the role of puma and culpeo fox has been changed due to human-induced changes in prey base and the availability of suitable habitat to survive, among others. The objective of this thesis was to determine how induced changes in the environment by some human activities affect the carnivore occurrence and diet. The study was conducted in the Sierras Grandes of Córdoba, considered a biogeographic island with a temperate climate, mean annual temperature of 8 ºC and average rainfall of 850 mm per year. The Sierras are protected in different categories of conservation (Quebrada del Condorito National Park and Achala Provincial Hidric Reserve), and top carnivores are represented by the puma (Puma concolor) and culpeo fox, an endemic subspecies (Pseudalopex culpaeus smithersi). Signs of top carnivores were counted from transects to determine their occurrence in both areas, and with a Geographic Information System (GIS) were measured the explicative variables as indicators of human disturbance (distance to settlements and roads) and vegetation types. The association between the occurrence of carnivores and the explicative variables were analyzed with generalized linear models. For the analysis of diet, feces were collected and analyzed for both carnivores. We described the dietary niche breadth, the dietary niche overlap and mean body masses of prey to assess their long-term response. Also, we analyzed the carnivore-human conflict magnitude and its impact on the carnivore’s occurrence and diet. We found that signs of both carnivores were higher in areas far away from human settlements and roads. Furthermore, the presence of signs was higher in the protected area with active conservation (national park). Therefore, areas with low vegetation cover and near-human presence are expected to represent threat sites or barriers to the movement of these carnivores. Small rodents were the most frequent food item consumed by pumas and culpeo fox. Both carnivores, showed a low trophic breadth and a high niche overlap in their diets. The mean body mass of prey consumed, showed the greatest interest in medium and large prey by the puma, as when they were available, were consumed. Puma behaved like a generalist predator, changing your diet according to changes of large prey availability, instead acquiring great importance the small preys. The culpeo fox continued his specialized habits in small mammals, as observed in previous years. Pumas have the classic adaptability, changing your diet in relation to prey changes, and dispersing to reoccupy areas where they were once persecuted, as in the ranches that actually form the national park. The problem of livestock predation by pumas and culpeo foxes is a source of major conflict that threatens the carnivore conservation and thus alters its occurrence and diet. The park could be play the role of refuge, where the habitat quality for survival is good (higher vegetation cover and less human impact), but in the case of the pumas, this area for breeding may be poor by the scarcity of large prey. Apparently, carnivores were benefit from the national park in terms of conservation, and less access to livestock, helping to reduce the human conflict, but the prey assemblage is still altered. The results are encouraging in terms of resilience of at least some -4- components of the predator-prey mammalian assemblage. It was observed that the effect of livestock on the small mammal’s abundance and both carnivores diet can be reversed quickly, given the short time occurred since the livestock removal in the park. Key words: top carnivores, Achala, occurrence, puma, diet, small mammals, culpeo fox, livestock, antropic, explicative models -5- Agradecimientos A lo largo de ésta experiencia en el desarrollo de mi carrera doctoral, han participado innumerables personas que me brindaron su apoyo y colaboración. A ellas debo mis agradecimientos que extiendo a continuación: A mi familia por toda la ayuda y el apoyo que me brindaron para hacer realidad éste sueño. A mi mamá, Susana y hermana, Cristina, que muchas veces me acompañaron en los viajes de campaña, en los que me ayudaron, y mate de por medio, nos divertimos mucho, y también me ayudaron en el laboratorio con el análisis de las muestras. A Sil, mi amiga, por siempre alentarme y tirarme buena onda en esos momentos en que son necesarios, por estar siempre y también por hacerme madrina! A Carolina (Colo), con la que compartí innumerables campañas y viajes. Largas caminatas y cabalgatas por las sierras, buscando a éstas especies que tanto nos apasionan, a veces con éxito y otras, no tanto, pero con la retribución de llevarnos el paisaje grabado en nuestra memoria, y la ilusión de la próxima vez. A Rocío Palacios a cargo del laboratorio de la Alianza Gato Andino Argentina, quien me abrió las puertas de su casa para poder hacer los análisis de dieta y que valoro inmensamente, ya que fue dificultoso encontrar un laboratorio que me permitiera hacer los análisis necesarios para la tesis. También por lo mates compartidos, las charlas y los buenos momentos. A mi director, Gustavo Haro, por ayudarme a hacer realidad ésta experiencia, aunque hasta el día de hoy él aun siga sorprendido! Y por apoyarme en mi insistencia a obtener una beca y tener la misma posibilidad de muchos. Y especialmente, por sus enseñanzas desde la carrera de grado y por creer en mí. Al Dr. Jaime Polop, por ayudarme en la obtención de la beca, sus aportes al proyecto, apoyo y confianza en mí. A mi codirector, Daniel Renison, por su apoyo y conocimientos, que aportaron al desarrollo de ésta tesis. A los miembros de la comisión asesora y tribunal, quienes me brindaron aportes y consejos importantísimos para mi tesis y futuros trabajos. A Lucia Ruiz y Julio Monguillot de la Delegación Regional Centro, de la Administración de Parques Nacionales, por la confianza y apoyo para que éste estudio se lleve a cabo, y Jael Dominino por sus aportes en el análisis de imágenes y Gpque. Oscar Gonzales por su apoyo en campañas y viajes. A los guardaparques nacionales de la Intendencia y Parque Nacional Quebrada del Condorito, Guardaparques auxiliares, brigadistas y voluntarios que me acompañaron en las campañas, y también colaboraron en la recolección de muestras. A Olalla Martínez, Verónica e Ismael Pino, Roberto y Jerónimo Altamirano, Hugo Merlo, Don Ponce por todas sus enseñanzas en el campo y momentos compartidos. A los guardaparques provinciales Walter Gonzales y Julio Guevara por su invalorable ayuda en los recorridos por la reserva. -6- A Cristian Schneider por ayudarme con la recolección de muestras en el parque. A mis amigos y compañeros que me ayudaron desinteresadamente en todo lo que necesité: Gabriela Cardozo, Paula Rivera, Valeria Di Cola y Leonardo Barrios Caro. A Arnaldo Mangeaud, que me dio una mano inmensa en los análisis estadísticos, por sus consejos y su predisposición en cada momento en que necesité de sus conocimientos y ayuda. A Carlos De Angelo, a quien le debo infinidad de conocimiento en el análisis de imágenes y programación, los que me ofreció de manera cordial y paciente. A todas las personas con las que compartí ésta etapa de mi vida, y que me ofrecieron toda su enseñanza y calidez, que nunca voy a olvidar. También quiero agradecer a las Instituciones que me brindaron su apoyo financiero e institucional indispensable para poder realizar ésta tesis: - Consejo Nacional de Investigaciones Científicas y Técnicas, Ministerio de Ciencia, Tecnología e Innovación Productiva, Presidencia de la Nación de la República Argentina. - Museo de Zoología y Cátedra de Diversidad Animal II, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba. - Laboratorio de la Alianza Gato Andino. - Delegación Regional Centro, Administración de Parques Nacionales. - Intendencia del Parque Nacional Quebrada del Condorito. - The Rufford Maurice Laing Foundation - Idea Wild -7- A mis padres y hermanos, A Santi y Agus, A mi amiga Sil -8- -9- TABLA DE CONTENIDOS INFLUENCIA CONJUNTA DE LA VEGETACIÓN, ASENTAMIENTOS HUMANOS, CAMINOS Y ACTIVIDADES GANADERAS SOBRE LA OCURRENCIA Y DIETA DE LOS CARNÍVOROS TOPE DE ACHALA (CÓRDOBA, ARGENTINA) ……………………………………………………………………..……I RESUMEN ……………………………………………………………………………………………………….…I ABSTRACT ………………………………………………………………………………………………….…....III AGRADECIMIENTOS ………………………………………………………………………………………..…..V TABLA DE CONTENIDOS …………………………………………………………………………………....VIII LISTA DE TABLAS Y ECUACIONES …………………………………………………………………………XI LISTA DE FIGURAS …………………………………………………………………………………………...XIII CAPITULO I. LOS CARNÍVOROS GRANDES Y EL PASTIZAL DE ALTURA DE LAS SIERRAS GRANDES DE LA PROVINCIA DE CÓRDOBA ……………………………………………………………...1 1.1. Introducción general …………………………………………………………………………………........1 1.1.1. Importancia de los carnívoros tope sobre el ecosistema ……………………………………..........................................1 1.1.2. Los carnívoros y el hombre …………………………………………………………………………………………………….2 1.1.3. Antecedentes de estudios de poblaciones de carnívoros en la Argentina ……………………………………................3 1.2. El paisaje: Pastizal de altura de las Sierras Grandes de la Provincia de Córdoba ……………..4 1.2.1. Características geográficas y ambientales ……………………………………………………………………….................4 1.2.2. Caracterización de su fauna …………………………………………………………………………………………………...6 1.2.3. Usos de la tierra a lo largo del tiempo …………………………………………………………………………….................8 1.2.4. Las Sierras Grandes y su estado de conservación ………………………………………………………………………....9 1.2.5. Manejo en relación a la categoría de conservación ……………………………………………………………………….11 1.3. El puma (Puma concolor) y el zorro colorado (Pseudalopex culpaeus) …………………….….14 1.4. Estudio de la población endémica de zorro colorado de Córdoba ……………………………..18 CAPITULO II. Efecto del grado de protección, las actividades humanas y la cobertura vegetal sobre la ocurrencia de los carnívoros tope en las Sierras Grandes de la Provincia de Córdoba, Argentina………………………………………………………………………………………………………….23 2.1. Introducción………………………………………………………………………………………………..23 2.1.1. Las especies y su relación con las variables ambientales…………………………………………………………………….23 2.1.2. Antecedentes de la relación carnívoros-variables ambientales………………………………………………………………25 - 10 - 2.1.3. Métodos de estudio de carnívoros: directos e indirectos…………………………………………………………………..….27 2.1.4. Identificación de huellas de Puma y Zorro colorado……………………………………………………………………….…..28 2.2. Materiales y métodos…………………………………………………………………………................32 2.2.1. Método indirecto para determinar la ocurrencia de pumas y zorro colorado: transectas para el monitoreo de Signos………………………………………………………………………………………………………………………..…32 2.2.2. Sitios y número de transectas recorridas para estimar ocurrencia de puma y zorro colorado……………………………………………………………………………………………………..…33 2.2.3. Medición de variables ambientales y antrópicas………………………………………………………………………..…35 2.2.4. Análisis de datos…………………………………………………………………………………………………..................36 2.3. Resultados……………………………………………………………………………………………….…37 2.3.1. Ocurrencia de Puma y Zorro colorado…………………………………………………………………………..................37 2.3.2. Efecto del grado de protección, las actividades humanas y la cobertura vegetal………………………………..…....38 2.4. Discusión………………………………………………………………………………………………..…..41 CAPITULO III. Respuesta a largo plazo de la dieta de carnívoros tope a un cambio en la base de presas en las Sierras Grandes de la provincia de Córdoba, Argentina……………………………… 47 3.1. Introducción……………………………………………………………………………………………...…47 3.1.1. Aspectos generales: Marco teórico en alimentación…………………………………………………………..................47 3.1.2. Balance neto de energía y tamaño corporal de los carnívoros………………………………………………………..…49 3.1.3. Partición del recurso y superposición del nicho trófico………………………………………………………..................51 3.1.4. Antecedentes de estudio de dieta en pumas y zorros colorados…………………………………………………..……53 3.2. Metodología……………………………………………………………………………………………..….56 3.2.1. Colecta, análisis e identificación de las heces…………………………………………………………………….……….56 3.2.2. Análisis de datos ……………………………………………………………………………………………………….……..58 3.2.2.1. Diámetro de las heces…………………………………………………………………………………………….….58 3.2.2.2. Frecuencia de ocurrencia y biomasa consumida…………………………………………………………….…...59 3.2.2.3. Variación temporal y entre especies de la dieta ………………………………………………………....….……60 3.2.2.4. Amplitud del nicho trófico……………………………………………………………………………………….……61 3.2.2.5. Superposición de nicho trófico……………………………………………………………………………………....61 3.2.2.6. Peso promedio de los mamíferos presa…………………………………………………………………….….…..62 3.3. Resultados…………………………………………………………………………………………..……..62 3.3.1. Recolección e identificación de las heces de puma y zorro colorado……………………………………….................62 3.3.2. Caracterización de las heces de puma y zorro colorado………………………………………………………………….63 3.3.3. Composición de la dieta en el Parque Nacional Quebrada del Condorito……………………………………………...64 3.3.3.1. Dieta del Puma ………………………………………………………………………………………………………..64 3.3.3.2 Dieta del zorro colorado ………………………………………………………………………………………………67 3.3.4 Composición de la dieta en la Reserva Hídrica Provincial de Achala………………………………………..................70 3.3.4.1. Dieta del Puma …………………………………………………………………………………………....................70 3.3.4.2. Dieta del Zorro colorado……………………………………………………………………………….....................73 3.3.5. Variación anual de la dieta…………………………………………………………………………………….....................75 3.3.6. Amplitud del nicho trófico………………………………………………………………………………………....................76 3.3.7. Superposición del nicho trófico ………………………………………………………………………………………...…...77 - 11 - 3.3.8. Peso promedio de los mamíferos presa…………………………………………………………………………….………78 3.4. Discusión …………………………………………………………………………………………………..79 CAPITULO IV. CONCLUSIONES GENERALES………………………..……………………………….…..85 CAPITULO V. BIBLIOGRAFIA…………………………………………………………………………………88 CAPITULO VI. ANEXOS…………………………………………………………………………………..…….99 Anexo 7.1. Denominación de los sitios donde se realizaron las transectas (el número corresponde al número de transecta de la Fig 2.4 del Capítulo II)………………………………………………………………………………………………………..…….99 Anexo 7.2. Valores de las variables medidas asociadas a cada transecta (m: metros, %: porcentaje de cobertura). ……………………………………………………………………………...101 - 12 - LISTA DE TABLAS Y ECUACIONES Tabla …………………………………………………………………………………………….………N° Página Tabla 1.1. Diversidad de especies y endemismos de los diferentes grupos taxonómicos de vertebrados en Pampa de Achala (Nores 1995, Cingolani y Falczuk 2003)…………………………………………………………………………………………………7 Tabla 1.2. Características morfométricas del zorro colorado de achala obtenidas de animales encontrados muertos en Pampa de Achala (Peso: Kg, Medidas: cm)……………………………………………………………………………….…………..21 Tabla 2.1. Modelo explicativo de la ocurrencia de Pumas en las Sierras Grandes de Córdoba (B: estimadores, P: significancia, AIC: Criterio de Información de Akaike)……………………………………………………………………...…………39 Tabla 2.2. Modelo explicativo de la ocurrencia de Zorro colorado en las Sierras Grandes de Córdoba (B: estimadores, P: significancia a un α= 0,05, AIC: Criterio de Información de Akaike)………………………………………………………….……..41 Tabla 3.1. Pesos corporales de las presas utilizadas para estimar la biomasa consumida por puma y zorro colorado (expresado en kilogramos), y bibliografía que se utilizó como fuente de información……………………………………………59 Ecuación 3.1. Fórmula estimada por Ackerman et al. 1984, para la obtención de factores de corrección para estimar la biomasa consumida de presas por pumas, donde Y representa los kilogramos de presa consumida por hez y X el peso promedio de un individuo adulto de cada presa…………………………………………………………………………………...…..60 Ecuación 3.2. Fórmula matemática utilizada para calcular la biomasa consumida de presas, donde D es la biomasa consumida de cada ítem presa, A es la frecuencia de ocurrencia de cada ítem presa y C el factor de corrección de cada ítem presa………………………………………………………………………………………………………………………………………..60 Ecuación 3.3. Índice de Levin´s utilizada para estimar la diversidad trófica de cada carnívoro, donde B es la medida de amplitud de nicho y pi es la proporción de individuos que utilizan el recurso i…………………………………………….………61 Ecuación 3.4. Índice de amplitud de nicho estandarizado por Colwell & Futuyma (1971) para medir la diversidad trófica de cada carnívoro en una escala de 0 a 1, donde Bsta representa la amplitud del nicho trófico, Bobs se calcula mediante la fórmula 1 / Σpi2 (donde pi es la proporción del taxón i en la dieta de una especie de predador), Bmin es el número mínimo posible de diversidad (=1) y Bmax es el máximo posible (=n, que es el número de taxones diferentes consumidos por el predador)……………………………………………………………………………………………………………………………….…..61 Ecuación 3.5. Índice de Pianka usado para estimar cuan diferente o similares son las dietas entre dos especies de carnívoros, donde α es la magnitud de superposición trófica, pi es la proporción de la presa «i» en la dieta de una especie de carnívoro y qi es la proporción de la misma presa en la dieta del segundo carnívoro con que se lo compara…………………………………………………………………………………………………………….……..61 Tabla 3.2. Detalle de la cantidad de heces de puma y zorro colorado recolectadas en el área de estudio y durante el periodo 2003-2008, y cantidad y porcentaje de heces analizadas en el laboratorio luego de su identificación final……….63 Tabla 3.3. Diámetro medio y error estándar asociado de las heces de puma y zorro colorado medidas cada año en el área de estudio (DM= diámetro medio, EE= error estándar, N= número de heces medidas, el diámetro esta expresado en centímetros)……………………………………………………………………………………………………………………………….63 Tabla 3.4. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de puma durante el período 20032008 en el Parque Nacional Quebrada del Condorito……………………………………………………………………………...…65 Tabla 3.5. Porcentaje de biomasa (%B) consumida durante el periodo 2003-2008 por puma. La biomasa se obtuvo a partir de la aplicación del factor de corrección de Ackerman et al. 1984 (Ecuación 3.1)……………………………………..…………66 Tabla 3.6. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de zorro colorado durante el periodo 2003-2008 en el Parque Nacional Quebrada del Condorito……………………………………………………………………….…68 Tabla 3.7. Porcentaje de biomasa (%B) consumida durante el periodo 2003-2008 por zorro colorado. La biomasa se obtuvo a partir de la aplicación del factor de corrección de Lockie (1959)………………………………………………………………….69 Tabla 3.8. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de puma en los años 2006 y 2007 en la Reserva Hídrica Provincial de Achala…………………………………………………………………………………………..……71 Tabla 3.9. Porcentaje de biomasa (%B) consumida durante los años 2006 y 2007 por puma en la Reserva Hídrica Provincial de Achala. La biomasa se obtuvo a partir de la aplicación del factor de corrección de Ackerman et al. 1984 (Ecuación 3.1)……………………………………………………………………………………………………….……………………………..…..72 Tabla 3.10. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de zorro colorado en el periodo 2003-2008 (excepto durante el año 2006) en la Reserva Hídrica Provincial de Achala…………………………………..……..73 - 13 - Tabla 3.11. Porcentaje de biomasa (%B) consumida en los periodos 2003-2005 y 2007-2008 por zorro colorado en la Reserva Hídrica Provincial de Achala………………………………………………………………………………………………..…74 Tabla 3.12. Valores de amplitud de nicho trófico de puma y zorro colorado dentro y fuera del área protegida. La amplitud del nicho trófico se obtuvo a partir de la ecuación de Colwell & Futuyma (1971) (Ecuación 3.4), donde valores cercanos a 0 corresponden a especies más especialistas y 1 a especies más generalistas……………………………………………….……77 Tabla 3.13. Superposición de nicho trófico estimado para puma y zorro colorado por año en el Parque Nacional Quebrada del Condorito. El índice se obtuvo a partir de la ecuación de Pianka (Ecuación 3.5), donde 0 indica que no hay superposición y 1 superposición completa………………………………………………………………………………………………………………77 Tabla 3.14. Peso medio de mamíferos presa (Kg) para puma y zorro colorado en el Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala durante el período 2003-2008………………………………………...……...78 - 14 - LISTA DE FIGURAS Figuras …………………………………………………………………………………………………..N° Figura Fig. 1.1. Ubicación de las Sierras Grandes y Pampa de Achala en la Provincia de Córdoba, Argentina……………..…………5 Fig 1.2. Porcentaje de biomasa de herbívoros nativos y exóticos existente dentro del Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala (Datos correspondientes al año 2000, ver Pia et al. 2003)……………..….8 Fig 1.3. Ubicación de las áreas protegidas en las Sierras Grandes de Córdoba (PNQC: Parque Nacional Quebrada del Condorito, RHPA: Reserva Hídrica Provincial de Achala, RNQC: Reserva Nacional Quebrada del Condorito)………………11 Fig 1.4. Sectorización de la Unidad de Conservación en relación a la abundancia de ganado doméstico (verde oscuro: abundancia alta de ganado, amarillo: abundancia media de ganado, verde claro: abundancia baja de ganado)……………13 Fig 1.5. Fotos de puma obtenidas de trampas cámaras instaladas en el Parque Nacional Quebrada del Condorito (Pia M, no publicado)…………………………………………………………………………………………………………………………………..17 Fig 1.6. Histograma de frecuencia de observaciones de zorro colorado con respecto a la altura sobre el nivel del mar, los datos fueron obtenidos de individuos hallados muertos (Pia M, no publicado, altura en metros)……………………….……...19 Fig 1.7. Histograma de frecuencia de la actividad horaria del zorro colorado durante el día, los datos fueron obtenidos por trampas-cámara (Pia M, no publicado)……………………………………………………………………………………...………….20 Fig 1.8. Histograma de frecuencia de la actividad horaria de zorro colorado, puma y zorrino en el área de estudio, los datos fueron obtenidos por trampas-cámara (Pia M, no publicado)……………………………………………………………….……….20 Fig 1.9. Fotos de zorro colorado de achala obtenidas de un estudio con trampas cámara dentro del Parque Nacional Quebrada del Condorito (Pia M, no publicado)………………………………………………………………………………..……....22 Fig 2.1. Características de la huella de: A: Zorro colorado, B: Puma, C: Puma hembra y su cría en el área de estudio…………………………………………………………………………………………………………………..30 Fig 2.2. Recorrido de transectas a pie a lo largo de ríos y quebradas, e identificación y registro de las huellas encontradas en el área de estudio……………………………………………………………………………………………………………………...32 Fig 2.3. Tipos de signos registrados en las transectas (A: huellas de puma, B: oveja predada por puma, C: avistaje de zorro colorado y D: foto de puma obtenido de trampa-cámara)……………………………………………………………………….…...33 Fig 2.4. Transectas recorridas en el Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala, para el registro de signos de predadores tope entre Septiembre de 2006 y Marzo de 2008 (Alto, medio y bajo: abundancia alta, media y baja de ganado doméstico, respectivamente)…………………………………………………………………………..…...34 Fig. 2.5. Número de signos de Puma registrados en función de (A) tipo de área protegida; (B) distancia a viviendas como indicador del impacto humando; y (C) proporción de pajonal en la transecta y sus inmediaciones. La barra y círculos negros señalan a las transectas dentro del Parque, mientras que la barra y círculos blancos señalan las transectas ubicadas en la Reserva. Las líneas de tendencia indican el mejor ajuste lineal al logaritmo natural del número de signos, las líneas continuas y cortadas corresponden, respectivamente, a las transectas dentro del Parque y la Reserva ………………………………………………………………………………………………………………………………………………38 Figura 2.6. Número de signos de Zorro Colorado registrados en función de (A) tipo de área protegida; (B) distancia a viviendas como indicador del impacto humando; (C) proporción de pajonal en la transecta y sus inmediaciones; (D y E) son igual que (B y C) pero con escala logarítmica para mejor visualizar los patrones lineales. La barra y círculos negros señalan a las transectas dentro del Parque, mientras que la barra y círculos blancos señalan las transectas ubicadas en la Reserva. Las líneas de tendencia indican el mejor ajuste lineal al logaritmo natural del número de signos, las líneas continuas y cortadas corresponden, respectivamente, a las transectas dentro del Parque y la Reserva…………………………...……….40 Fig 2.7. Características topográficas y de la vegetación asociada de los ríos A: dentro del parque(Aº Achala), y B: dentro de la reserva (Aº Barrancas) ...……………………………………………………………………………………………….……………..43 Fig 2.8. A: Cueros de puma y zorro colorado cazados en Pampa de Achala, B: cachorro de puma capturado para mascotismo por pescadores en cercanías del río Condorito…………………………………………………………………………44 Fig 2.9. A: Puma macho adulto, B: Zorro colorado adulto, atropellados en la ruta provincial Nº 34 que atraviesa al Parque Nacional Quebrada del Condorito………………………………………………………………………………………………….…...45 Fig 3.1. Partes de la hez utilizadas para el análisis de la dieta: A. Restos microscópicos de la hez, B. Restos macroscópicos de la hez………………………………………………………………………………………………………………………………...….57 Fig 3.2. Diámetros medios y error estándar asociado de las heces de puma y zorro colorado analizadas durante el periodo 2003-2008 (diámetro medido en centímetros)……………………………………………………………………………….………..64 - 15 - Fig 3.3. Biomasa de presas principales consumidas cada año por puma dentro del Parque Nacional Quebrada del Condorito (Gmay: ganado mayor, Gmen: ganado menor)……………………………………………………………………………………..…67 Fig 3.4. Presas principales consumidas cada año por zorro colorado según su biomasa consumida en el Parque Nacional Quebrada del Condorito (Gmen: ganado menor)………………………………………………………………………………….…..70 Fig 3.5. Biomasa de presas principales consumidas en los años 2006 y 2007 por puma en la Reserva Hídrica Provincial de Achala………………………………………………………………………………………………………………………………...…….72 Fig 3.6. Biomasa de presas principales consumidas cada año por zorro colorado en la Reserva Hídrica Provincial de Achala (Gmen: ganado menor)…………………………………………………………………………………………………………………..75 Fig 3.7. Variación anual de los ítems presas consumidos por puma y zorro colorado dentro y fuera del área protegida (# ítems: total de presas consumidas en ese año)…………………………………………………………………………………….…76 Fig 3.8. Patrón manifestado por el peso medio de mamíferos presa de puma y zorro colorado dentro del Parque nacional Quebrada del Condorito durante el período 2003-2008………………………………………………………………………………78 - 16 - CAPITULO I. Los carnívoros grandes y el pastizal de altura de las Sierras Grandes de la provincia de Córdoba 1.1. Introducción general 1.1.1. Importancia de los carnívoros tope sobre el ecosistema En los últimos años, numerosos estudios han demostrado que los carnívoros grandes, son especies clave para el mantenimiento del equilibrio de un ecosistema (Noss et al. 1996, Perovic y De Bustos 2001, Logan y Sweanor 2001, Crooks 2002, Gompper 2002, Novaro y Walker 2005), e inclusive para el incremento de su biodiversidad (Novaro y Walker 2005, Sergio et al. 2006). Power et al. (1996), definieron que una especie es clave cuando su efecto sobre la comunidad o ecosistema en el que habita es relativamente alto con respecto a su abundancia, e impactan profundamente sobre animales y ecosistemas (Gittleman et al. 2001, Miller et al. 2001, Logan y Sweanor 2001, Treves y Karanth 2003a, 2003b). Los grandes carnívoros son importantes reguladores de las poblaciones de herbívoros, disminuyendo la presión que éstos ejercen sobre la vegetación (Miller et al. 2001, Hebblewhite et al. 2005). A través de la predación, impactan en la dinámica de las poblaciones de sus presas, limitando o regulando su número, contribuyendo al sistema cíclico predador-presa, y transfiriendo materia y energía a niveles tróficos menores (Logan y Sweanor 2001). Los ecosistemas con ausencia de predadores tope generalmente, poseen altas densidades de herbívoros con impactos negativos asociados sobre las comunidades de plantas, conduciendo a reducciones en la biodiversidad (Sergio et al. 2006). Sin embargo, la disminución de carnívoros grandes en el ecosistema, también, puede provocar el incremento de carnívoros más pequeños, importantes predadores de mamíferos y aves. Éste fenómeno (denominado mesopredator release), tuvo implicancias en la declinación y extinción de especies de presas, y representó un punto de partida para programas de conservación fomentando la protección de los carnívoros grandes (Crooks y Soulé 1999). No obstante, son escasas las evidencias de cascadas tróficas iniciadas por vertebrados predadores terrestres. Los ejemplos más comunes corresponden a experimentos naturales en el trópico, como la desaparición del jaguar en la Isla Barro Colorado (Hebblewhite et al. 2005). Por otro lado, a pesar de su importante rol regulador, pueden afectar las poblaciones de sus presas cuando - 17 - éstas se encuentran en baja densidad, pudiendo causar su extinción, reduciendo la diversidad (Novaro y Walter 2005, Walker y Novaro 2010). 1.1.2. Los carnívoros y el hombre Numerosos estudios han demostrado que las poblaciones de carnívoros, principalmente la de félidos y cánidos grandes, están limitadas por intervenciones humanas (Woodroffe et al. 2005). A través de sus actividades económicas y productivas, el hombre provoca la pérdida y fragmentación del hábitat, como así también, la declinación de sus presas naturales, consideradas amenazas críticas para la supervivencia de éstos carnívoros (Logan y Sweanor 2001). Las características intrínsecas (densidad, amplitud de nicho, requerimientos ambientales, susceptibilidad a la caza o enfermedades) de las especies determinarán en gran medida la respuesta de éstas frente a los cambios ambientales ocasionados por el hombre (Logan y Sweanor 2001, Crooks 2002, Gompper 2002). Conservacionistas y especialistas, han advertido sobre el aumento en la gravedad de las dimensiones del conflicto entre humanos y félidos y cánidos grandes. Éste conflicto se incrementó en el último tiempo, debido a la recuperación de las poblaciones de algunos carnívoros que quisieron ser extirpados, y al crecimiento y expansión de las poblaciones humanas en sitios remotos donde habitan los carnívoros (Treves y Karanth 2003a, Novaro y Walter 2005). En éste contexto, el conflicto entre carnívoros grandes y humanos por la predación de ganado doméstico, representa una de las mayores amenazas a su declinación global (Ogada et al. 2003). Diversas razones favorecen la existencia de éste conflicto, como la necesidad de ocupar extensas áreas para cubrir sus amplios requerimientos, que incrementan la competencia con los humanos por necesidades similares como el ganado doméstico y el espacio (Woodrofe y Ginsberg 1998, Treves y Karanth 2003a). La creación de áreas protegidas solo ofrecen un paliativo para su conservación, pudiendo fracasar si éstas son muy pequeñas, si no poseen un ensamble de presas nativas sana o si están rodeadas por poblaciones humanas (Woodrofe y Ginsberg 1998, Woodroffe et al. 2005). Los carnívoros terrestres grandes son percibidos como competidores por los humanos debido a su interferencia con especies silvestres en peligro, especies de caza deportiva y ganado doméstico (Sillero-Zubiri & Laurenson 2001). Sin embargo, la conservación de los carnívoros tope es un tema conflictivo y relevante, principalmente en la periferia de las áreas protegidas (Hoogesteijn et al. 1993, Treves y Karanth 2003b, Wang y Macdonald 2006), donde sus pobladores se sienten perjudicados por considerar que éstas áreas actúan como refugios de carnívoros y otras especies que afectan sus actividades económicas (Woodroffe et al. 2005). Por lo tanto, la conservación de carnívoros dentro y en la periferia de áreas - 18 - protegidas es un tema relevante para su conservación a nivel global (Hoogesteijn et al. 1993, Wang y Macdonald 2006). Como se mencionara anteriormente, los grandes carnívoros, son especies clave y su remoción produce un efecto en cascada sobre la estructura del sistema, sin embargo, también, pueden causar pérdidas significantes sobre las actividades humanas. Ignorar éste hecho, no aporta a la conservación de éstas especies (Woodroffe et al. 2005). 1.1.3. Antecedentes de estudios de poblaciones de carnívoros en la Argentina En los últimos años creció el interés por el conocimiento de la biología de los carnívoros terrestres grandes y medianos, pero muchas veces, su naturaleza secretiva y bajas densidades, limitan la implementación de ciertas metodologías o el alcance de ciertos objetivos. Por éste motivo, no resulta extraño que los primeros estudios existentes atiendan a necesidades primarias de conocimiento de los carnívoros como su distribución, densidad, área de acción (Novaro 1991, 1997b, Novaro et al 2000a, 2000b, Perovic 2001, Travaini et al. 2003, Manfredi et al. 2006, Kelly et al. 2008), dieta (Iriarte et al. 1989, Ebensperger et al. 1991, Jaksic et al. 1992, Johnson y Franklin 1994, Meserve et al. 1996, Pia et al. 2003, Manfredi et al. 2004, Zapata et al. 2005, Pereira et al. 2006, Guzmán-Sandoval 2007, Walker et al. 2007) e interacción con sus presas (Branch et al. 1996, Novaro et al. 2000a, Pessino et al 2001, Pia et al. 2003). También, se han realizado numerosos estudios a lo largo del territorio, atendiendo a necesidades urgentes como disminuir el conflicto con los humanos por la predación de ganado doméstico y disminución de presas nativas. Por éste motivo, se evaluaron los efectos de las actividades humanas sobre las poblaciones de carnívoros, tal es el caso de los efectos directos e indirectos del ganado (Novaro et al. 2000a, Pia et al. 2003, Novaro et al. 2004, Pia y Novaro 2005, Novaro y Walker 2005), predación sobre el ganado doméstico (Bellati 1986, von Thungen 1997, Schiaffino et al. 2001), transmisión de enfermedades (Beldomenico et al. 2005), y la caza (Perovic y de Bustos 2001, Altrichter et al. 2006). Actualmente, y con el desarrollo de herramientas tecnológicas como los Sistemas de Información Geográfica y Teledetección, comenzaron a analizarse los efectos conjuntos de variables, ya sean ambientales o antrópicas, sobre las poblaciones de éstos carnívoros con el objetivo de ser utilizados en la delineación de planes de conservación y manejo (Kissling et al. 2009, De Angelo 2009). - 19 - Para la provincia de Córdoba, las publicaciones existentes sobre carnívoros corresponden a las descripciones realizadas por Thomas (1914) y Cabrera (1931, 1932), y a revisiones de la distribución del aguará guazú (Chrysocyon brachyurus) (Haro et al. 2001, Miatello y Cobos 2008). El único estudio que se realizó a nivel provincial sobre puma y zorro colorado, es el presente, el cual se realiza desde el año 2000 en Pampa de Achala y Sierras grandes. A lo largo de éstos años, se analizó la dieta, densidad relativa, disponibilidad de presas, efectos del ganado doméstico, predación de ganado, estado sanitario y se evaluó el conflicto con los humanos (Pia et al. 2003, Pia 2004, 2005, 2006, 2008, Pia et al. 2009, Pia 2010). En ésta tesis, se presentan los primeros datos obtenidos sobre la dieta y efectos conjuntos de variables ambientales y antrópicas sobre la ocurrencia de los dos carnívoros más grandes de las Sierras Grandes de la provincia de Córdoba. El objetivo general de éste estudio es evaluar cómo afectan las características del ambiente y las actividades humanas a la ocurrencia de puma y zorro colorado, y describir la dieta en relación a cambios en la base de sus presas en las Sierra Grandes de Córdoba. 1.2. El paisaje: Pastizal de altura de las Sierras Grandes de la Provincia de Córdoba 1.2.1. Características geográficas y ambientales El estudio se realizó en Pampa de Achala y Sierras Grandes (S 31º 50’, O 64º 52’) del oeste de la provincia de Córdoba. La toponimia Pampa de Achala significa “campo de cosas bellas, admirable, magnífico o imponente” en la lengua quichua (Manera 1991). Pampa de Achala está conformada por una plataforma basáltica, de naturaleza granítica, que se encuentra ubicada entre los 2000 y 2200 msnm, y se extiende a lo largo de 60 Km con un ancho de 8 Km. Se encuentra flanqueada en sus extremos norte y sur por los Cerros Los Gigantes (2370 msnm) y El Champaquí (2790 msnm), respectivamente, delimitando lo que se considera a las Sierras Grandes, y contribuyendo ésta topografía al aislamiento de la región (Capitanelli 1979) (Fig. 1.1). - 20 - Fig. 1.1. Ubicación de las Sierras Grandes y Pampa de Achala en la Provincia de Córdoba, Argentina. Su vegetación, pertenece al piso superior de pastizales de altura dentro del Distrito Chaqueño Serrano (Cabrera 1976), compuesto de céspedes, pastizales y pajonales (conocidos en general como pastizales), matorrales, bosques y vegetación con afloramientos rocosos. Éste piso se divide en dos subpisos, en los cuales la vegetación respondería esencialmente a diferencias en precipitación y temperatura; uno inferior, hasta los 1900 msnm; y otro, más frío y húmedo, por sobre esa altitud. El subpiso inferior está caracterizado por especies de Stipa y Festuca, mientras que el subpiso superior se caracteriza por la presencia de la rosácea Alchemilla pinnata. Estos pastizales, aparte de ser - 21 - determinados climáticamente (Cabido et al. 1987), responden a una larga historia de herbivoría silvestre (guanacos, Lama guanicoe), que luego fue reemplazada por el ganado doméstico. A pesar de que el sistema parece estar adaptado a tantos años de herbivoría, se observaron retrocesos de bosques y estados alternativos del sistema irreversibles y menos productivos (Cingolani et al. 2008, Renison et al. 2010). Éstos pastizales, se alternan con afloramientos graníticos, vegetación rupícola (Funes y Cabido 1995), y bosquecillos de tabaquillo (Polylepis australis) y maitén (Maytenus boaria) (Cabido y Acosta 1985). Resulta interesante destacar las condiciones de singularidad de estas serranías, ya que confluyen especies que provienen de regiones totalmente distintas, como el caso del "tabaquillo" y el "orco molle" o "maitén", siendo Pampa de Achala el único lugar en el mundo donde ambas especies conviven en el mismo espacio geográfico (Cabrera 1976). El clima es templado con inviernos fríos y veranos cálidos, y la temperatura media a 2100 msnm de invierno y verano es de 5 y 11,4 º C, respectivamente. Las precipitaciones alcanzan un valor promedio de 850 mm anuales y se concentran entre octubre y abril, con algunas nevadas en invierno y primavera (Cabrera 1976, Pucheta et al. 1998). 1.2.2. Caracterización de su fauna Las Sierras Grandes son consideradas una isla biogeográfica, debido a sus condiciones climáticas y de aislamiento geográfico (Luti et al. 1979). Allí habitan especies que se comparten únicamente con la cordillera andina, y otras que se comparten con la Patagonia, también, como se mencionó anteriormente, representa un sitio único donde coexisten tabaquillos y maitenes, y existen endemismos a nivel específico y subespecífico como el zorro colorado, objeto de estudio de la presente tesis doctoral (Luti et al. 1979, Novaro 1997a). Debido a su aislamiento geográfico, Pampa de Achala cuenta con un gran número de endemismos en varios taxones de vertebrados que allí habitan, principalmente en los anfibios (Tabla 1.1). - 22 - Tabla 1.1. Diversidad de especies y endemismos de los diferentes grupos taxonómicos de vertebrados presentes en Pampa de Achala (Cingolani y Falczuk 2003). Grupo Total de Especies Porcentaje de taxonómico especies endémicas endemismo Peces 4 0 0 Anfibios 10 3 30 Reptiles 21 1 5 Aves 176 12 7 Mamíferos 29 1 4 Introducidas 7 0 0 Existe evidencia de la antigua ocupación del Piso de Pastizales de Altura de las Sierras de Córdoba por grandes herbívoros antes de las extinciones pleistocénicas. En la región se han encontrado fósiles del Pleistoceno, como Glyptodon (Glyptodontidae), Scelidotherium (Mylodontidae), Lama y Paleolama (Camelidae), Macrauchenia (Macrauchenidae) y del Holoceno, como Equus (Equidae) y Toxodon (Toxodontidae) (Castellanos 1944). Posteriormente, el área estuvo ocupada por ungulados actuales antes de su drástica reducción a partir del siglo 19. La especie nativa más abundante era el guanaco (Lama guanicoe), y la presencia de camélidos domésticos en la región es incierta, pero hay grandes cantidades de restos de camélidos en los sitios arqueológicos y numerosas menciones en las crónicas (Díaz et al. 1987). En referencia a los mamíferos, el ensamble de herbívoros nativos, sufrió la extinción de muchas especies como el guanaco (Lama guanicoe), registrado por última vez en la década de 1930, la taruca o huemul del norte (Hippocamelus antisensis) del que no se conocen registros desde principios del siglo 20, y un ave de características similares al ñandú (Rhea sp) (Díaz et al. 1994). En la actualidad, existen 5 especies de roedores cricétidos (Akodon sp., Phyllotis darwinii, Oxymycterus paramensis, Reithrodon auritas y Oligoryzomys flavescens) (Polop 1989, 1991), al menos dos géneros de cuises (Microcavia, Galea), tucos (Ctenomys sp.) y vizcachas (Lagostomus maximus), éstas últimas, presentes solo en la zona norte de las Sierras Grandes. El herbívoro silvestre de mayor tamaño que se distribuye en Pampa de Achala está representado por la liebre europea (Lepus europaeus), una especie exótica introducida en la Argentina a fines del siglo 19 y principios del siglo 20, que junto con el ganado doméstico representan la mayor biomasa disponible de herbívoros para los carnívoros nativos medianos y grandes. Esta observación se desprende de un estudio realizado en el año 2000, donde se obtuvo la abundancia de cricétidos, liebres y ganado doméstico, y junto con el valor de peso corporal, se calculó biomasa de herbívoros existente dentro y fuera del parque (Fig 1.2, Pia et al. 2003). - 23 - 100 80 60 99,6 76,4 40 20 23,6 0 % 0,4 Reserva Parque Nativo Exótico Fig 1.2. Porcentaje de biomasa de herbívoros nativos y exóticos existente dentro del Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala (Datos correspondientes al año 2000, metodología en Pia et al. 2003). En Pampa de Achala, no se distribuye ningún miembro del orden Cingulata. Entre los carnívoros, se encuentran el puma y zorro colorado como los más abundantes, también son frecuentes los zorrinos y hurones, mientras que el zorro gris, y los gatos chicos (gato montés, gato de pajonal y yaguaroundi) son raros y solo se cuenta con pocas crónicas sobre sus registros. Dentro del parque, se registraron huellas de gato chico, pero no se pudo identificar la especie responsable. Los marsupiales son escasos también, sin embargo, a partir de los análisis de dieta, se logró identificar la presencia de Monodelphis dimidiata (colicorto) en el área de estudio. 1.2.3. Usos de la tierra a lo largo del tiempo A partir del siglo 17, las Sierras de Córdoba fueron utilizadas por los pobladores de origen español para la cría de ganado, donde al principio predominaron las mulas y luego las vacas y las ovejas. Es difícil estimar la carga ganadera, pero fue más alta que la presente (Díaz et al. 1987, Cingolani et al. 2008). La presencia de ungulados nativos en la región desde el Pleistoceno, y las altas cargas de ganado doméstico, que en los últimos trescientos años reemplazaron a los herbívoros nativos, han provocado profundos cambios en el sistema (Cingolani et al. 2008). A pesar de que se consideraba a la herbivoría doméstica incorporada al sistema desde mucho tiempo atrás como un factor estructurador intrínseco y - 24 - no una perturbación (Díaz et al. 1994), actualmente, se conoce que ésta provoca alteraciones en la productividad y el retroceso de los bosques nativos de estas montañas (Renison et al. 2010). El uso de la tierra durante el período prehispánico, se cree era estacional, donde los comechingones utilizaban las pampas de altura para llevar la veranada de llamas y alpacas (Pastor 2007). Durante el siglo 17, creció la producción de animales de carga de tipo mular, y a fines del siglo 19 comenzó la explotación ganadera a gran escala (Díaz et al. 1987). Pampa de Achala, sufre la presión del pastoreo desde hace 400 años, la cual fue en aumento registrándose majadas de más de 10.000 ovejas (sin contar el resto del ganado) hacia la década del 70, dando pauta del intenso uso ganadero y origen de la degradación ambiental hoy existente (Cáceres 2001). La principal actividad productiva en la actualidad es la ganadería extensiva de bovinos y ovinos principalmente, aunque también se crían caprinos y equinos (Cáceres 2001). La agricultura solo puede llevarse a cabo en las altiplanicies que tienen un mayor desarrollo edáfico que las laderas (Cabido et al. 1999), aunque ha sido abandonada en toda la región debido a que los suelos agrícolas sin cobertura vegetal son rápidamente erosionados. También, es común el uso de fuego para eliminar pajonales formados por grandes gramíneas en macolla (Cingolani et al. 2008). En éste sitio coexisten grandes y pequeños productores, donde éstos últimos poseen escasa infraestructura, y por lo general el sobrepastoreo en sus campos es mayor que en los campos de grandes productores. En los dos tipos de propiedades, la actividad de crianza de ganado se concentra en su mayoría en los alrededores de los asentamientos humanos, donde ovejas y cabras son encerradas en corrales durante la noche, y el ganado mayor pasta libremente campo adentro. Adicionalmente, cuando no existen alambrados en los campos los productores tienden a mantener a su ganado vacuno cerca de las casas (Pia 2004). 1.2.4. Las Sierras Grandes y su estado de conservación En el centro de las Sierras Grandes se encuentra el Parque Nacional Quebrada del Condorito (en adelante parque) (36.737 ha) constituido por Ley Nacional 24.749 en el año 1996 (http://www.condoritoapn.com.ar), rodeado por la Reserva Hídrica Provincial de Achala (en adelante reserva) (146.000 ha) creada por la ley Nº 6964, decreto Nº 361 del año 1999 (http://www.secretariadeambiente.cba.gov.ar/legislaciones.htm). También, existen dos áreas declaradas Reserva Nacional Quebrada del Condorito (RNQC) por la Administración de Parques Nacionales, propiedades que no fueron expropiadas y continúan con las prácticas ganaderas - 25 - tradicionales como en la reserva (Fig 1.3). Estas áreas fueron creadas con el objetivo de conservar la biodiversidad y las cabeceras de cuencas hídricas de la región. La reserva se encuentra rodeando al parque por el oeste y sus extremos norte y sur. A su vez, los límites norte y sur de la reserva están bien delimitados. Por el norte, llega hasta la ruta Provincial Nº 24 y hacia el sur hasta el camino que une Yacanto de Calamuchita con Yacanto de San Javier. Hacia el este y el oeste, la reserva llega hasta la cota de los 1.500 msnm. Para tener una idea de las dimensiones del área referida, cabe mencionar que tanto el cerro Champaquí por el sur, como Los Gigantes por el norte, se encuentran comprendidos dentro del área de reserva. Ésta gran Unidad de Conservación, se encuentra atravesada de este a oeste por la Ruta Provincial Nº 34, que une a la ciudad de Córdoba con la ciudad de Mina Clavero. Aunque la reserva y el parque pertenecen a distintos dominios jurisdiccionales (provincial y nacional, respectivamente), ambas forman parte de una unidad de conservación (UC), que ocupa una superficie de 154.000 ha (117.000 correspondientes a la reserva y 37.000 ha correspondientes al parque y reserva nacionales). - 26 - Fig 1.3. Ubicación de las áreas protegidas en las Sierras Grandes de Córdoba (PNQC: Parque Nacional Quebrada del Condorito, RHPA: Reserva Hídrica Provincial de Achala, RNQC: Reserva Nacional Quebrada del Condorito) 1.2.5. Manejo en relación a la categoría de conservación Estas dos áreas se encuentran sujetas a distintos tipos de manejo del ganado tradicional. Mientras en la reserva, se continúa con una actividad productiva tradicional, dentro del parque se comenzó con la remoción del ganado doméstico en el año 1998. Debido a ésta brusca extracción del ganado doméstico, se desencadenó un abrupto aumento en la biomasa vegetal de los pajonales y pastizales existentes, y por consiguiente, el riesgo de incendios. Por éste motivo, la autoridad de aplicación (Administración de Parques Nacionales), - 27 - comenzó a permitir el ingreso de ganado a sectores predeterminados dentro del parque. En el marco de “Acuerdos de herbivoría” con productores de Pampa de Achala, se permite el ingreso de ganado doméstico mayor en potreros donde urge la necesidad de disminuir la biomasa vegetal, y los cuales son monitoreados permanentemente por especialistas, para evaluar el progreso de los mismos. De ésta manera, el parque cuenta con dos sectores diferenciados en cuanto a la abundancia de ganado doméstico, un sector con baja carga (0,02 g/ha, para uso doméstico) (Pia 2004), y otro sector con carga media (0 – 0,4 g/ha, acuerdos de herbivoría). Debido a que fuera del parque, la actividad ganadera continúa de manera tradicional, se considera que alberga una carga alta de ganado (1,1 – 4,8 g/ha), en comparación con el parque nacional (Teich et al. 2005) (Fig 1.4). Ésta solución de carácter transitorio, pretende complementarse a largo plazo con la restitución de poblaciones de herbívoros nativos silvestres (guanacos) y domésticos (llamas), piezas ambientales fundamentales en la región. En consecuencia, en el año 2007, se comenzó con la reintroducción de grupos reducidos de guanacos (Lama guanicoe), con el objetivo de comenzar a reestablecer el ensamble de herbívoros nativos de Pampa de Achala (Tavarone 2007). - 28 - Fig 1.4. Sectorización de la Unidad de Conservación en relación a la abundancia de ganado doméstico (verde oscuro: abundancia alta de ganado, amarillo: abundancia media de ganado, verde claro: abundancia baja de ganado) - 29 - 1.3. El puma (Puma concolor) y el zorro colorado (Pseudalopex culpaeus) Los carnívoros actuales provienen de un grupo de mamíferos del inicio de la era cenozoica hace 60-70 millones de años (MA), y dentro de éste grupo, los Félidos y Cánidos, se separaron a partir de un antecesor común hace unos 50 MA (O`Brien 1992). El ancestro del género Puma, emigró a través del Estrecho de Bering hacia América, hace aproximadamente 8 MA atrás, y luego invadieron Sudamérica como parte del Gran Intercambio Americano por el istmo de Panamá. Los cánidos sudamericanos se originaron en norte y centro América y migraron al sur luego de emerger el istmo de Panamá, 3 MA atrás (Berta 1987). En Sudamérica, se produce la máxima diversificación de los cánidos, tal vez, como causa de la ausencia de otros carnívoros mamíferos placentarios, y la presencia de sólo algunos carnívoros didélfidos (Webb 1985). Los restos fósiles más antiguos que se conocen del género Pseudalopex son del norte-centro de Chile y tienen entre 3 - 1.8 MA. En Ecuador se encontraron los fósiles más antiguos de la especie Pseudalopex culpaeus con una antigüedad de entre 300-100 mil años (Pleistoceno tardío) (Novaro 1997a). El zorro colorado se separó de su pariente mas cercano, Pseudalopex griseus hace entre 250.000 y 500.000 mil años (Jiménez y Novaro 2004, Sunquist y Sunquist 2009). El hombre juega un rol importante sobre la distribución de los cánidos, diversidad y simpatría, por la alteración y fragmentación de su hábitat. Inclusive, el hombre ha sido responsable activamente de la extinción total o local de especies de cánidos (Ej. Zorro de Malvinas Dusicyon australis, lobo americano Canis lupus) (Johnson et al. 1995). El puma (Puma concolor Linnaeus 1771), perteneciente a la familia Felidae (Subfamilia Felinae), es el segundo felino más grande en tamaño de América (luego del yaguareté Panthera onca), y según las crónicas populares, en las Sierras Grandes, coexistiría con tres especies más de felinos: el gato montés (Leopardus geoffroyi d`Orbigny y Gervais 1844), el gato del pajonal (Leopardus colocolo Molina 1782) y el yaguarundí o gato moro (Puma yagouaroundi Lacépède 1865). Sin embargo, éstas especies son raras de observar en alturas mayores a los 1800 msnm, ya que en un monitoreo con trampas cámaras a alturas superiores, nunca fueron fotografiados (Pia M, datos no publicados). El zorro colorado (Pseudalopex culpaeus Molina 1782), perteneciente a la familia Canidae (Subfamilia Caninae), es el segundo cánido en tamaño de Sudamérica, y el mayor de su género. Su distribución se restringe a la región continental de Sudamérica y coexiste en gran parte de su distribución con otras especies de cánidos: zorro gris (Pseudalopex griseus Gray 1837), y el zorro de las pampas (Pseudalopex gymnocercus Fisher 1814). Aparentemente, desde el punto de vista genético, no existirían diferencias entre éstas dos últimas especies (Novaro et al. 2006). - 30 - El puma es el carnívoro terrestre nativo con la distribución más amplia del Nuevo Mundo. Su distribución histórica abarcaba toda la porción sur de Canadá, Estados Unidos de Norteamérica, México y la región continental de centro y Sudamérica, llegando hasta el estrecho de Magallanes en su extremo sur de distribución (Currier 1983). El puma aún persiste en gran parte del área original, aunque ha desaparecido de las áreas con mayor desarrollo humano, es decir en el centro y este de EEUU y Canadá, regiones más desarrolladas de Centroamérica, parte de la costa pacifica de Sudamérica, y el sudeste brasileño, desapareciendo además en gran parte del Uruguay y parte de la región pampeana Argentina (Parera 2002). Alrededor de 32 subespecies geográficas de pumas fueron descriptas en base a criterios geográficos y morfológicos (Currier 1983). Pero estudios más recientes, basados en técnicas moleculares, diferencia solo seis grupos filogenéticos que reemplazan la vieja clasificación (1 Norteamérica P. c. couguar, 2 Centro América P. c. costaricensis, 3 este de Sudamérica P. c. capricornensis, 4 norte de Sudamérica P. c. concolor, 5 centro de Sudamérica P. c. cabrerae, 6 sur de Sudamérica P. c. puma) (Culver et al. 2000, Logan y Sweanor 2001, Sunquist y Sunquist 2009). El zorro colorado, se distribuye desde la zona cordillerana de Ecuador hasta Tierra del Fuego y la estepa patagónica Argentina, y está representada por seis subespecies (Novaro 1997a). Cabrera (1931) las reconoce como: P. c. andina (Perú, Bolivia y Chile), P. c. culpaeus (zona de la patagonia y centro de Argentina y Chile), P. c. magellanica (extremo sur de Argentina y Chile), P. c. reissii (Ecuador), que se distribuyen a lo largo de la cordillera de los andes, pero sus límites de distribución no están bien establecidos. También, existen dos subespecies con sus poblaciones aisladas del resto, P. c. smithersi (Córdoba, Argentina) y P. c. lycoides (Tierra del Fuego, Argentina) (Novaro 1997a). La principal causa de muerte de los pumas a lo largo de su distribución, se debe a la caza, ya sea deportiva, de control o ilegal. También, están sujetos a muertes accidentales, como la colisión con vehículos, que probablemente aumente a medida que el hombre invada el hábitat y territorio de éste carnívoro. Otros tipos de accidentes resultan de encuentros con sus presas, caídas de acantilados, y ahogamiento (Currier 1983). La mayor longevidad en estado silvestre registrada fue de 18 años en Norteamérica (Anderson 1983), pero en promedio no debe superar los 12 años (Novell y Jackson 1996, Keister, Jr y Van Dyke 2002), mientras que en cautiverio hay registros de pumas que vivieron hasta los 22 años (Currier 1983, Seidensticker 1992, Sunquist y Sunquist 2009). En Córdoba, está protegido por la ley 7.343, “Ley Provincial del Ambiente” o “Ley General de Medio Ambiente” que si bien no especifica al puma, ampara a la Fauna Silvestre en general. La resolución de caza deportiva, que enumera las especies autorizadas a cazar y las vedadas, no menciona al puma, por lo que su caza debería estar prohibida en toda la provincia. Lamentablemente, el escaso control y falta de implementación de la ley, ocasionan que la caza ilegal sea frecuente, ya sea por predación de ganado doméstico u otras especies de valor económico para el hombre (cérvidos exóticos) y caza deportiva ilegal (coto de caza - 31 - ilegal). El tráfico y mascotismo son otra amenaza seria para la especie, no solo porque se da muerte a la madre para obtener los cachorros, si no, porque cuando éstos crecen muchas veces no pueden ser manejados por sus dueños y son liberados en zonas campestres, o escapan de sus recintos, ocasionando pánico en los poblados. En éste contexto, la Secretaría de Ambiente de Córdoba realiza liberaciones de pumas decomisados (traslocación), en diversos sitios de la provincia como manejo de la especie, sin realizar el monitoreo de los individuos liberados, ni contar con estudios de las poblaciones de pumas presentes en la zona de liberación (Fuente: Periódico Día a Día, 25 de octubre de 2011). Éste tipo de manejo, se desalienta a nivel mundial ya que no arroja resultados positivos para el manejo de la especie, y no representa una solución al conflicto con el hombre. Los zorros colorados, solo tienen como enemigo natural al puma. La persecución por el hombre representa la primera causa de mortalidad, debido a su reputación de predar sobre ganado doméstico (Sillero-Zubiri 2009). También, es envenenado con estricnina, cuyo uso y aplicación está prohibida por su alta toxicidad (Bellati y von Thüngen 1988). Hasta la década del 90 la principal causa de muerte fue la caza y trampeo por el valor peletero de su cuero (Novaro 1997a). Frecuentemente ocurren las colisiones vehiculares sobre rutas y caminos en el área de estudio, y también, es cazado por la predación de ganado doméstico ovino y caprino (M. Pia obs. pers.). La mayor longevidad conocida en zorros silvestres, basado en el conteo de anillos de cemento de caninos fue de 11 años (Novaro 1997b). El zorro colorado, en la provincia de Córdoba, es considerado una especie escasa. Actualmente, se encuentra protegida por la Veda Permanente de Caza, y las resoluciones anuales en marco de Decreto Ley de Caza 4046/58, sin embargo siguen siendo cazadas por el valor comercial de sus pieles y por predar sobre el ganado doméstico. No existen estudios sobre la biología del puma en la Provincia de Córdoba, por lo que la presente tesis representa el primer antecedente de investigación sobre aspectos de la biología y ecología de ésta especie en la provincia y en especial en la zona serrana de la misma (Fig 1.5). En la sección 1.4, se describen las características principales de la subespecie endémica de zorro colorado que se distribuye en las sierras de Córdoba, y se hace referencia a datos de simpatría con el puma. Estos datos, se desprenden del proyecto de investigación que se lleva a cabo hace varios años en las Sierras Grandes de Córdoba. Los siguientes capítulos de la tesis, arrojan los primeros resultados concernientes a la población de pumas y zorros colorados de la Sierras Grandes de la Provincia de Córdoba (Pampa de Achala). - 32 - Fig 1.5. Fotos de puma obtenidas de trampas cámaras instaladas en el Parque Nacional Quebrada del Condorito (Pia M, no publicado). - 33 - 1.4. Estudio de la población endémica de zorro colorado de Córdoba Nos existen estudios sobre la biología del zorro colorado de las Sierras Grandes de la Provincia de Córdoba, excepto los realizados por Pia et al. (2003), con anterioridad a ésta tesis. En la bibliografía, encontramos su descripción como subespecie (Thomas 1914) y datos observacionales (Cabrera 1958), que describen su distribución y características externas. La presente tesis, representa el primer antecedente de estudio sobre la población endémica de zorro colorado, donde se investigaron aspectos de base para el conocimiento de ésta subespecie y que servirán de puntapié inicial para futuras investigaciones. A continuación, se realiza una breve descripción de la subespecie Pseudalopex culpaeus smithersi, en base a datos obtenidos en el presente estudio. Pseudalopex culpaeus smithersi (Thomas 1914) Zorro colorado de Achala Orden Carnívora, Familia Canidae, Subfamilia, Caninae, Especie: Pseudalopex culpaeus P. c. smithersi, posee una distribución restringida a las Sierras Grandes de la provincia de Córdoba (Cabrera 1958). Sin embargo, su distribución requiere de confirmación, ya que, en base a entrevistas de pobladores de las sierras de Comechingones (ubicada inmediatamente al sur de las Sierras Grandes), encontramos que se lo reporta como un integrante de la fauna de la zona del siglo pasado (Pia M, no publicado). Los datos expuestos a continuación se desprenden de un estudio realizado sobre individuos de zorro colorado encontrados muertos en el área de estudio (por colisión con vehículos y naturalmente), y a partir de un monitoreo con trampas cámara realizado dentro del parque (Fig 1.9). Si bien, a priori se lo encuentra en diversos ambientes de Pampa de Achala, aparenta tener más preferencia por lugares con pajonales y poco escarpados. Los ejemplares fueron recolectados entre los 1500 y los 2200 msnm, pero la mayor frecuencia se observó entre los 2000 y 2200 msnm, a una altura promedio de 2010 msnm (Fig 1.6). - 34 - Fig 1.6. Histograma de frecuencia de observaciones de zorro colorado con respecto a la altura sobre el nivel del mar, los datos fueron obtenidos de individuos hallados muertos (Pia M, no publicado, altura en metros). El zorro colorado, no coexiste con el zorro gris (Pseudalopex griseus) en Pampa de Achala. La observación de los mismos es muy rara a partir de los 1800 msnm en los extremos de las Sierras Grandes, y los avistajes más frecuentes ocurrieron por debajo de los 1200 msnm. A pesar de que productores de parajes ubicados entre los 1800 y 1700 msnm, aseguran que las dos especies conviven en sus campos, éste dato ecológico aún no fue confirmado (excepto por avistajes excepcionales). Los zorros son activos principalmente desde el anochecer hasta el amanecer, pero con mayor frecuencia durante la noche. Su actividad es escasa hacia el mediodía y durante la tarde (Fig 1.7). - 35 - Fig 1.7. Histograma de frecuencia de la actividad horaria del zorro colorado durante el día, los datos fueron obtenidos por trampas-cámara (Pia M, no publicado) Con respecto a otros carnívoros con los que coexiste en el área, se observó una actividad diaria diferente con pumas (Puma concolor) y zorrinos (Conepatus chinga) (Fig 1.8). Fig 1.8. Histograma de frecuencia de la actividad horaria de zorro colorado, puma y zorrino en el área de estudio, los datos fueron obtenidos por trampas-cámara (Pia M, no publicado) - 36 - Los pumas utilizan exclusivamente la noche (con incursiones raras durante la mañana), mientras que los zorrinos utilizan en mayor medida la madrugada y mañana. En conjunto las actividades horarias de pumas y zorrinos, solapan totalmente la de los zorros colorados, sin embargo, el zorro utiliza con más frecuencia las primeras horas de la noche, y el zorrino las últimas horas de la noche (Fig 1.8). En Pampa de Achala, el peso corporal promedio del zorro colorado en los adultos es de 5.8 kg. y en los juveniles de 4.7 kg. El largo total en los adultos es de 116 cm y en los juveniles 107 cm (n=13). Poseen una cola muy larga que representa entre el 35 y 40 % del cuerpo. En cuanto a la estructura poblacional, los datos son escasos. De ejemplares encontrados muertos, el doble correspondió a juveniles y/o subadultos, y de cada 3 hembras se recogió 1 macho (Tabla 1.2, Pia M, no publicado). Tabla 1.2. Características morfométricas del zorro colorado de achala obtenidas de animales encontrados muertos en Pampa de Achala (Peso: Kg, Medidas: cm) Peso Largo cuerpo Largo cabeza Largo cola Altura cruz Largo total Adulto 5,80 56,33 18,33 41,33 43,50 116,00 Juvenil 4,71 51,00 15,60 44,75 35,75 107,25 - 37 - Fig 1.9. Fotos de zorro colorado de achala obtenidas de un estudio con trampas cámara dentro del Parque Nacional Quebrada del Condorito (Pia M, no publicado). - 38 - CAPITULO II. Efecto del grado de protección, las actividades humanas y la cobertura vegetal sobre la ocurrencia de los carnívoros tope en las Sierras Grandes de la Provincia de Córdoba, Argentina. 2.1. Introducción 2.1.1. Las especies y su relación con las variables ambientales El análisis de la relación especie-ambiente fue siempre un tema central en la ecología (Guisan y Zimmermann 2000). Las especies existen y prosperan dentro de rangos definidos de condiciones ambientales, es decir, en un nicho específico (Hutchinson 1957). Según Grinnell (1917), éste nicho, relaciona un conjunto de variables ambientales con la adecuación (fítness) de una especie, es decir, con la probabilidad de ocurrencia de esa especie sin inmigración (Hirzel y Le Lay 2008). Asimismo, éstas variables relacionan la ocurrencia de las especies y datos que abarquen dimensiones climáticas, topográficas y ecológicas (Soberon y Peterson 2005). Entonces, el área de distribución de una especie es producto de una expresión compleja de su historia ecológica y evolutiva, determinada por diversos factores, operando a intensidades y escalas diferentes (Soberón y Peterson 2005). Debido a que las especies nunca viven aisladas, y usualmente responden a un complejo de factores interdependientes de numerosas variables ambientales, la identificación de variables ambientales claves es uno de los aspectos más importantes para evaluar la ocurrencia de una especie ya que representan las dimensiones de su espacio ambiental (Riley y Malecki 2001, Hirzel y Le Lay 2008). Otro aspecto importante, es el efecto de la interacción con otras especies (Soberón 2007, Hirzel y Le Lay 2008). Los factores determinantes de las áreas donde se encuentran las especies, corresponden a condiciones abióticas, factores bióticos, accesibilidad a regiones para dispersarse y capacidad evolutiva de las especies a adaptarse a condiciones nuevas (Soberon y Peterson 2005). Éstos factores, delimitan el nicho, el cual se interpreta como la relación entre la ocurrencia de especies, y datos del clima, topografía, y otras dimensiones ecológicas, como combinaciones de variables ambientales (Soberon y Peterson 2005). Sin embargo, existen factores que pueden alterar éste nicho y en consecuencia la ocurrencia de una especie. El disturbio humano, puede modificar condiciones del ambiente - 39 - que hacen que el nicho de una especie cambie, y estos cambios pueden variar con el tiempo (Milesi y López de Casenave 2005). Con el advenimiento de los sensores remotos y sistemas de información geográfica, se contó con una mayor disponibilidad de información espacial que abarcó extensas áreas y a sus variables asociadas, y permitieron evaluar la influencia que tienen las variables sobre la distribución de las especies (Guisan y Zimmermann 2000, De Angelo 2009, Kissling et al. 2009). Los sistemas de información geográfica (SIG), son herramientas estadísticas multivariadas que nos permiten crear un enlace entre las especies y sus hábitats (Kissling et al. 2009), y cuantificar parámetros del hábitat (Guisan y Zimmermann 2000, Hirzel et al. 2002). El análisis de las interrelaciones entre especies y ambiente fueron siempre una discusión central en la ecología, y su cuantificación representa el eje de los modelos explicativos y predictivos, que nos permiten entender cómo los factores ambientales afectan o determinan la ocurrencia y distribución de las especies y comunidades (Guisan y Zimmermann 2000, Soberon 2007, Hirzel y Lay 2008). El muestreo de datos de presencia/ausencia es una parte crucial en estos análisis, pero, los datos de ausencia son frecuentemente difíciles de obtener con un alto grado de precisión (Soberon y Peterson 2005). Una localización puede ser categorizada como ausencia si las especies no pueden ser detectadas, aunque estén presentes, y por razones históricas la especie está ausente en su territorio. Éste es un supuesto importante, ya que para las predicciones, las falsas ausencias, causan desvíos considerables en el análisis (Hirzel et al. 2002, Gu y Swihart 2004). Las especies pueden especializarse en una combinación de variables, en vez de cada variable independientemente (Hirzel et al. 2002), por ello, muchas veces se utilizan indicadores de abundancia para evaluar la ocurrencia de ciertas especies en relación a variables del ambiente, cuando sus ausencias son difíciles o confusas de medir (Jędrzejewski et al. 2004, Rushton et al. 2004). Los modelos de distribución cuantitativos ofrecen métodos sencillos para la formulación de la relación especie-hábitat y representa un medio que no es sólo para la predicción de ocurrencia de las especies, sino también para la comprensión de los factores que intervienen. Los modelos lineales generalizados, en particular, vinculan la incidencia u ocurrencia de las especies a las variables de hábitat, y representan la base matemática y estadística de los métodos de modelado utilizados actualmente. Los SIG y la teledetección, han ampliado aún más éstas aplicaciones para casi cualquier sistema ecológico y cualquier especie para la que existen datos de distribución (Rushton et al. 2004). Como se mencionó anteriormente, en las últimas décadas se observó un auge en el desarrollo de herramientas y técnicas de análisis que permitieron relacionar las condiciones del paisaje con la ocurrencia de las especies (Guisan y Zimmermann 2000, Rushton et al. 2004), poniendo a prueba la relevancia de las variables para las interacciones especie-ambiente (Hirzel y Le Lay 2008), y se han convertido en herramientas de investigación importantes para evaluar el impacto de los cambios en el uso de la tierra y en el ambiente sobre la distribución de organismos. Éstos modelos estadísticos, están siendo utilizados para simular la distribución de fauna y flora y para establecer prioridades de conservación, entre otros tema de investigación (Guisan y Zimmermann 2000, Johnson y Omland 2004, Hirzel y Le Lay 2008). - 40 - Muchos análisis de aptitud de hábitat asumen que las especies están presentes en hábitats aptos y ausentes en hábitats no aptos, pero en la práctica ésta aseveración puede estar equivocada por numerosas razones. Muchas veces las presencias de las especies pueden no ser registradas por un muestreo incompleto, o selectivo, por presencia de especies raras o crípticas o determinaciones defectuosas (Soberon y Peterson 2005). Del mismo modo, el registro de ausencias falsas puede deberse a una baja dispersión o presencia de barreras que no permiten a la especie ocupar algunos sectores de su distribución potencial, extinciones locales, tamaño del parche, interacciones bióticas, entre otras (Hirzel et al. 2002). Las características del hábitat deben ser interpretadas cuidadosamente, especialmente en conservación, ya que los modelos ofrecen solo una visión parcial de la realidad (Hirzel y Le Lay 2008). Si bien comprender donde y porqué ocurren las especies es un requisito ecológico fundamental, la predicción de ocurrencia es esencial para la conservación y manejo de la población, permitiendo delinear los requerimientos ecológicos de las especies y sus factores limitantes, para entender su biogeografía, diseñar planes de conservación o creación de nuevas áreas protegidas, y para predecir efectos de la pérdida de hábitat y del impacto humano (Rushton et al. 2004). 2.1.2. Antecedentes de la relación carnívoros-variables ambientales El manejo de especies atractivas o no deseables requieren la comprensión de los factores que determinan sus distribuciones (Rushton et al. 2004). Las interacciones variables ambientales-especies, pueden cambiar ante intervenciones en el ambiente como cambios climáticos o la modificación del paisaje por el hombre. Las intervenciones humanas influyen de manera diferente sobre los factores abióticos y bióticos, ocasionando que las áreas no sean accesibles para las especies, el análisis en éste caso dependerá de la habilidad de la especie para adaptarse a nuevas condiciones. La fragmentación del hábitat es un claro ejemplo del efecto de la acción humana sobre todos estos factores en conjunto (Mech 1995, Mladenoff et al. 1995, Riley y Malecky 2001, De Angelo 2009). Numerosos estudios encontraron relaciones positivas y negativas entre factores ambientales y antrópicos y la ocurrencia o tendencia poblacional de carnívoros grandes (Seidensticker et al. 1973, Keith 1983, Riley y Malecky 2001, Hirzel et al. 2002, Naves et al. 2003, Fuller et al. 2003). Los carnívoros que ocupan grandes extensiones, son ampliamente utilizados como “especies paraguas” (Gittleman y Gompper 2005) en planes de conservación a escalas de paisaje, ya que son indicadores de la función y productividad del ecosistema, y son extremadamente vulnerables a la alteración del hábitat (Noss et al. 1996, Perovic & De Bustos 2001, Crooks 2002, Gompper 2002). Es por esto, que para la conservación y manejo de los grandes carnívoros, - 41 - es muy importante entender los efectos acumulativos de las actividades humanas sobre el ambiente (Gaines et al. 2005). Existen estudios que analizan el efecto de variables ambientales como la vegetación y disponibilidad de presas y aquellas derivadas de actividades humanas, como la ganadería, sobre las poblaciones de carnívoros. Como ejemplo, en América del Norte, se encontró que dos tercios de la variación en la densidad del lobo (Canis lupus), se debía por un lado a la disponibilidad de presas (Fuller et al. 2003, Keith 1983), y por otro al uso de áreas alejadas de humanos y del conflicto con éstos (Mech 1995, Mladenoff et al. 1995). Asimismo, el rol de los caminos sobre predadores está documentado en numerosos estudios, como ejemplo, Vulpes vulpes, utiliza caminos y otros senderos como cortafuegos o senderos debajo de líneas de alta tensión para desplazarse y cazar sus presas (Ramp et al. 2006). A su vez, los caminos, juegan un papel importante en la calidad de hábitat de lobos y otros carnívoros como los pumas, ya que, en algunos casos son utilizados como corredores (Theil 1985, Fuller et al. 1992, Mladenoff et al. 1995), y en otros, son evitados por ser altamente transitados y de fácil acceso para los humanos (Thurber et al. 1994), principal fuente de mortalidad de éstos carnívoros (Mech 1989, Dickson et al. 2005). También, se determinó, que el perfil del terreno posee efectos críticos en el uso de hábitat y dispersión de muchos mamíferos (Riley y Malecki 2001). La cobertura vegetal y geomorfología del terreno explican gran parte de la variación de poblaciones de pumas en Norteamérica, y representan componentes del paisaje importantes para su supervivencia (Riley y Malecky 2001). Seidensticker et al. (1973), determinaron que la densidad de pumas depende de la combinación de la vegetación, terreno, y abundancia y vulnerabilidad de sus presas, ya que requieren una cobertura densa para la caza, disponibilidad continua de alimento y protección para sus crías (Riley y Malecky 2001). En el bosque Atlántico del Alto Paraná, los jaguares y pumas prefieren áreas con presencia de bosque nativo y protegidas, evitando áreas modificadas y accesibles para el hombre, siendo más sensible a cambios y alteraciones, el jaguar (De Angelo 2009). Los impactos antrópicos sobre estos componentes del paisaje han aumentado, principalmente por el avance de las actividades productivas como la ganadería, que genera efectos directos e indirectos sobre las comunidades animales (Martin 1984, Fleischner 1994, Gardner et al. 1995, Hayward et al. 1997, Pia et al. 2003), provoca profundas transformaciones al paisaje (Cabido et al. 1999, Cingolani et al. 2008), e induce cambios en el rol de los carnívoros (Novaro y Walker 2005). Las actividades humanas también incrementan las extinciones locales de grandes carnívoros como los osos (Naves et al. 2003), afectan el movimiento y producen muerte de pumas (Riley 1998, Murphy et al. 1999, Maehr et al. 2004, Dickson et al. 2005), y alteran la distribución y riqueza de éstos y otros mamíferos (Real et al. 2003, Tognelli y Kelt 2004). En ambientes con un desarrollo creciente de actividades antrópicas y deterioro ambiental, estos modelos nos permiten conocer el estatus de una población, el riesgo de extinción de la misma y elaborar modelos que nos permitan la conservación de especies a escala de paisaje altamente fragmentado (Corsi et al. 1999, Keister, Jr y Van Dike 2002, Cardillo et al. 2004) Los modelos de hábitat, se han convertido en un campo importante de la biología de la conservación de los carnívoros. Los mismos, incrementan nuestro conocimiento sobre los factores que determinan la distribución - 42 - y los factores humanos que lideran los cambios de hábitat. La idea básica de los modelos de hábitat, es la de explicar o predecir la probabilidad de ocurrencia en base a un grupo explicativo de variables del paisaje (Hirzel y Le Lay 2008). 2.1.3. Métodos de estudio de carnívoros: directos e indirectos Debido a sus bajas densidades, comportamiento huidizo y amplios territorios, muchas veces resulta problemático medir precisamente las poblaciones de carnívoros, principalmente la de los felinos (Beier y Cunningham 1996). La pobre capacidad para monitorear, se debe a que los métodos simplemente no se encuentran accesibles para medir las poblaciones de carnívoros con la misma precisión con la que se monitorean otras especies (ej. herbívoros), y también, a que los fondos económicos rara vez se encuentran disponibles para utilizar estos métodos. El alto costo económico y de tiempo que implican realizar estimación de densidad poblacional de éstas especies con metodologías como la telemetría, han promovido el desarrollo de técnicas de monitoreo indirectos no invasivos mediante sus signos (Smallwood y Fitzhugh 1995, Beier y Cunningham 1996, Stander 1998). Por éste motivo, los mejores estimadores de las poblaciones provienen del trabajo intensivo de campo, mediante el conteo de signos, que ha sido utilizado en muchas áreas (Smallwood y Fitzhugh 1995, Beier y Cunningham 1996, Novaro et al. 2000b, Travaini et al. 2003). Las técnicas de monitoreo indirecto mediante conteo de signos proveen un índice de la abundancia poblacional, dependen de un buen sustrato para visualizar signos, son costosas y requieren de muchos años para obtener un buen estimador de la población. En general éstas técnicas no nos permiten el conteo de individuos por especie (Keister Jr. y Van Dyke 2002). Sin embargo, en Norteamérica se encontraron correlaciones positivas entre la densidad de signos registrados en transectas lineales y el tamaño poblacional de los pumas (Van Dike et al. 1986), con los que se pudo obtener un índice de densidad relativa (Smallwood y Fitzhough 1993, 1995, Cunningham et al. 1995). Las mediciones de densidades relativas mediante los signos, son una herramienta útil y relativamente sencilla para monitorear tendencias poblacionales a largo plazo en carnívoros. En Sudamérica, estudios que monitoreen y detecten tendencias poblacionales en pumas fueron realizados en la patagonia Argentina (Pia y Novaro 2005), Sierras Grandes de Córdoba (Pia 2008), y Bolivia (Pacheco 2004a), y para zorros, en la patagonia Argentina (Pia y Novaro 2005, Novaro et al. 2000b, Travaini et al 2003) y Sierras Grandes de Córdoba (Pia 2008). El escaso conocimiento sobre estas especies, pone en peligro su conservación, ya que generalmente se deciden medidas de conservación y manejo sin evaluaciones previas que las respalden. Por éste motivo, son importantes las mediciones sobre la abundancia y tendencias poblacionales de los carnívoros, que nos permitan entender los factores ambientales asociados con la ocurrencia, distribución y densidad de carnívoros tope en el - 43 - área de estudio. La estimación de abundancia absoluta o relativa, y su posterior inferencia sobre la variación espacial y temporal, es la base de la elaboración de programas de conservación y manejo sustentable (Walker et al. 2000). 2.1.4. Identificación de huellas de Puma y Zorro colorado Los signos (huellas, rastros y señales), son una valiosa herramienta para monitorear la ocurrencia de especies, especialmente cuando las especies de interés son difíciles de observar, nocturnas o difíciles de capturar (Simonetti y Huareco 1999). A través de las huellas podemos obtener información sobre la incidencia de la especie, sus actividades y hábitos, y sobre los ambientes que frecuenta. Los signos, representan una base de información útil, que se complementa a la de otros estudios como los de trampas cámara o telemetría. Sin embargo, para poder utilizar la información derivada de una huella, es necesaria su correcta identificación. Ésta tarea, es más complicada en áreas con escaso conocimiento sobre las especies presentes, o cuando coexisten dos o más especies similares. Como se mencionara anteriormente, el método de identificación de huellas depende del sustrato en el que se lo observe (Beier y Cunningham 1996, Keister Jr. y Van Dyke 2002). El tipo de sustrato, pendiente, factores climáticos y la actividad ganadera, afectan la calidad y correcta identificación de las huellas, y las escasas superficies que permiten un buen marcado de las huellas, complican la situación, ya que solo se encuentran una o pocas huellas de cada animal. Los pumas, son los felinos más grandes que se distribuyen en las Sierras Grandes de Córdoba, y comparten su distribución con los cánidos medianos, como el zorro colorado y el gris. A pesar de las diferencias morfológicas en las huellas de éstas especies, muchas veces su identificación se torna dudosa debido a que no se encontró la huella entera o no se marcó bien en el sustrato (Fig 2.1). Sin embargo, en el área de estudio, generalmente se encuentran grupos de huellas, por lo que ante una huella dudosa, se tuvieron en cuenta todos los signos de la transecta para la correcta identificación de la especie que dejó la impronta. En Pampa de Achala, el cánido dominante es el zorro colorado, ya que el zorro gris escasamente llega a zonas más altas y por lo general posee una distribución periférica a la del zorro colorado (ver Capítulo 1). Al parecer, el zorro colorado no se desplazaría a zonas por debajo de los 1500 msnm, y los zorros grises no superarían los 1700 msnm, por lo que la franja crítica de identificación se establecería entre los 1500 y 1700 msnm (Pia M. no publicado). En zonas cercanas a las viviendas (aproximadamente en un radio de 200 m.), se tuvo en cuenta la presencia de perros y el tamaño de los mismos, para comparar las medidas de las huellas encontradas. En base a zorros encontrados muertos se sabe que el tamaño promedio de la huella de un adulto es de 5 cm. de largo por 3.5 cm de ancho. Sólo en tres transectas durante los dos años de monitoreo, se encontraron 5 huellas dudosas de zorro colorado que fueron descartadas del estudio. - 44 - Fig 2.1 A) Fig 2.1 B) Fig 2.1 C) Fig 2.1. Características de la huella de: A: Zorro colorado, B: Puma, C: Puma hembra y su cría en el área de estudio. - 45 - Objetivo general Evaluar la influencia de variables ambientales y antrópicas sobre la ocurrencia de puma y zorro colorado en dos áreas con diferente grado de protección de las Sierras Grandes de Córdoba, Argentina Objetivos específicos Evaluar el efecto causado por el grado de protección sobre la ocurrencia de carnivoros tope de las Sierras Grandes de Córdoba, Argentina. Determinar si el impacto humano y la cobertura vegetal están asociadas a la ocurrencia del puma y zorro colorado de las Sierras Grandes de Córdoba, Argentina. Hipótesis La ocurrencia de pumas y zorros colorados es afectada por la abundancia de sus presas, por la presión de caza y disponibilidad de refugios. Predicciones La ocurrencia de signos de pumas y zorros colorados será más frecuente dentro del Parque, por ser ésta un área de recuperación de su vegetación nativa con mayor cantidad de presas como los roedores, de menor o nulo acceso a cazadores y mayor disponibilidad de refugios entre la vegetación. La ocurrencia de signos de pumas y zorros colorados será más frecuente en sitios alejados de viviendas donde la presencia humana, de perros y caza es menor, siendo más alejados en la reserva donde el control de cazadores es menor, que en el parque. - 46 - 2.2. Materiales y métodos 2.2.1. Método indirecto para determinar la ocurrencia de pumas y zorro colorado: transectas para el monitoreo de signos La experiencia a campo para realizar ésta tesis la adquirí en un estudio preliminar (años 2005 a 2006) donde registré signos de puma y zorro colorado desde varias fuentes: recorrido de transectas a pie (Fig 2.2), recorridos a caballo, búsqueda y recolección de heces (con colaboración del personal del Parque). Debido a las dificultades antes mencionadas para la estimación de densidad de estas especies, y a que los datos obtenidos con trampas cámara no convalidaban para estimar la abundancia (debido al bajo número de cámaras), se utilizó el número de signos de puma y zorro colorado como una medida de ocurrencia en el área de estudio. Fig 2.2. Recorrido de transectas a pie a lo largo de ríos y quebradas, e identificación y registro de las huellas encontradas en el área de estudio. Los signos, incluyen cualquier tipo de evidencia identificable, provocado por las especies de interés a estudiar, y éstos pueden ser huellas, heces, animales predados y fotos de trampas cámaras o avistajes directos de pumas y zorros colorados (Fig 2.3). En éste estudio preliminar (Pia 2008), determiné que los mejores sitios para las transectas son a lo largo de quebradas, sendas, rocas y ribera de los ríos, ya que representan sustratos apropiados - 47 - para la identificación de huellas y otros signos, tal como fuera enunciado por Smallwood y Fitzhugh (1995), Beier y Cunningham (1996) y Stander (1998). También, se determinó que para monitorear las tendencias poblacionales de éstos carnívoros, son suficientes 25 transectas anuales, ya que nos permiten observar una diferencia del 10% en sus poblaciones con una potencia mayor al 80% (α = 0.05) y un error pequeño (Pia 2008). Fig 2.3 A) Fig 2.3 B) Fig 2.3 C) Fig 2.3 D) Fig 2.3. Tipos de signos registrados en las transectas (A: huellas de puma, B: oveja predada por puma, C: hez de puma y D: foto de puma obtenido de trampa-cámara) - 48 - 2.2.2. Sitios y número de transectas recorridas para estimar ocurrencia de Puma y Zorro colorado Para el presente estudio se seleccionaron 27 transectas de 1 km de largo (Fig. 2.4), donde en dos ocasiones (año 2007 y 2008) se registraron signos de puma y zorro colorado en una faja de 5 metros de ancho, la coordenada del inicio y final de la transecta con GPS. El número de transectas necesarias fue determinado teniendo en cuenta los estudios preliminares realizados durante los años 2005 y 2006, en base a la disponibilidad de sustratos que permitan la identificación de huellas (Beier y Cunningham 1996), y para obtener un diseño lo más balanceado posible en cuanto al grado de protección, impacto humano y el tipo de vegetación. Las transectas representaron el 0,02% de la superficie total relevada que fue de 850 km2. Los sitios donde se realizaron las transectas se detallan en el Anexo 7.1. y a nuestro mejor conocimiento en las Sierras Grandes de Córdoba prácticamente no existen sitios adecuados donde ubicar más transectas que cumplan con los requisititos arriba mencionados. - 49 - Fig 2.4. Transectas recorridas en el Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala, para el registro de signos de predadores tope entre Septiembre de 2006 y Marzo de 2008 (Alto, medio y bajo: abundancia alta, media y baja de ganado doméstico, respectivamente). 2.2.3. Medición de variables ambientales y antrópicas Selección y medición de las variables ambientales y humanas: Sistema de Información Geográfica Las variables independientes fueron medidas con un SIG y por observaciones a campo. El SIG (Cingolani et al. 2004), incluye varias capas, entre ellas el mapa de vegetación que fue elaborado en base a una imagen satelital TM de enero de 2001, tiene una resolución de 30 x 30 metros, un 87 % de precisión y discrimina ocho unidades - 50 - de vegetación que fueron definidos como mosaicos de diferentes tipos de comunidades y parches de roca, y que abarcan 1246 km2 por arriba de los 1700 msnm, incluyendo al Parque y la Reserva. La selección de variables se realizó en base a antecedentes de estudios realizados con carnívoros que utilizan modelos para evaluar su presencia, ocurrencia y distribución, entre otros (cómo en Keith 1983, Theil 1985, Mech 1989, Fuller et al. 1992, Thurber et al. 1994, Mech 1995, Mladenoff et al. 1995, Guisan y Zimmermann 2000, Riley y Malecky 2001, Fuller et al. 2003 y Dickson et al. 2005, Hirzel y Le Lay 2008, De Angelo 2009). En éste contexto, se consideraron como importantes el tipo de área protegida, la distancia a viviendas y a caminos como indicadores de impacto humano directo, todos los tipos de cobertura vegetal y la presencia de ganado doméstico. Sin embargo, dadas las restricciones del área de estudio en que solo se podían ubicar 27 transectas de estudio, en que muchas variables están asociadas no pudiéndose separar el efecto de todas las variables por múltiples colinialidades, se realizó una selección de las variables independientes a utilizar usando nuestro conocimiento de la zona (Cingolani et al. 2004, 2008, Renison 2006) y de las especies en estudio (Pia et al. 2003), como recomiendan Flom et al. (2007). Las tres variables explicativas que consideramos más importantes fueron (1) área protegida, (2) distancia a viviendas y (3) pajonal, ya que éstas variables se relacionan mejor con las hipótesis del estudio. Se seleccionaron 14 transectas dentro del Parque Nacional y 13 transectas en la Reserva Provincial. La variable área protegida está relacionada con la caza, ya que hay menos caza dentro del Parque que en la Reserva, con la presencia de ganado que es baja en el Parque y alta en la Reserva, y con la presencia de presas ya que las presas pequeñas son abundantes en el Parque y las presas grandes (ganado) abundantes en la reserva. La variable distancia a viviendas se midió usando la capa temática denominada “asentamientos humanos” del SIG y que fue elaborada a partir de mapas del Instituto Geográfico Militar complementado con relevamientos a campo usando GPS (Cingolani et al. 2004). Ésta variable se midió como la distancia más cercana desde el centro de la transecta hacia la vivienda. Para medir la variable proporción de pajonal se utilizó el mapa de vegetación antes mencionado (Cingolani et al. 2004). Se delimitó un área buffer de 500 metros desde cualquier punto de la transecta, donde se contó la cantidad de píxeles correspondientes a la unidad de vegetación pajonal asociada a la transecta y se obtuvo el porcentaje en relación a todos los otros píxeles. Ésta variable porcentaje de pajonales fue considerada como importante debido a que las presas pequeñas que representan la mayor parte de la dieta de pumas y zorro colorado en el Parque está asociado a los pajonales (ver Capítulo 3). La variable ganado doméstico (a pesar de ser una presa potencial), no fue incluida ya que está representada por la variable área protegida, donde la abundancia de ganado baja corresponde al Parque, y la abundancia de ganado alta corresponde a la Reserva. Los bosques fueron excluidos por la baja representatividad en las transectas de estudio, y los roquedales porque en las transectas de estudio casi todo lo que no es pajonal es roquedal, por lo cual esta variable no aporta más información. Los caminos también fueron excluidos ya que se encuentran relacionados a la presencia de viviendas. - 51 - 2.2.4. Análisis de datos Ocurrencia de Puma y Zorro colorado Se realizaron réplicas de las transectas durante dos años para la obtención del número de signos de puma y zorro colorado. Las réplicas de cada transecta fueron sumadas debido a que durante los dos años de muestreo se observaron los mismos patrones en las huellas. Relación entre variables respuesta y variables independientes: Modelos Lineales Generalizados Se utilizó como variable respuesta a un indicador de la ocurrencia de pumas y zorros colorados, medido como el número de signos en una unidad muestral (transecta). Los indicadores de ocurrencia de especies, como índices de abundancia o densidad relativa, son utilizados frecuentemente como sustitutos de los conteos directos. Por ejemplo, Gibson et al. (2004), utilizó las llamada de las aves, y Jeganathan et al. (2004) utilizó la presencia de huellas en la arena para estimar la ocurrencia del amenazado corcel de Jerdon de la India. Dado que el número de signos es una variable que se origina de conteos, para los análisis utilizamos Modelos Lineales Generalizados (MLG) con una distribución de Poisson (Guisan y Zimmermann 2000). La función utilizada como enlace entre las variables respuesta y explicativas es una función de tipo "log", asumiendo una distribución de Poisson de la variable respuesta (Guisan y Zimmermann 2000). Las relaciones entre variables se consideraron significativas con un P≤0.05. Se utilizaron los estimadores Devianza y el Criterio de Información de Akaike (AIC) para evaluar el procedimiento y determinar el ajuste de los modelos. En los MLG, el modelo se optimiza a través de una reducción de estos estimadores, donde el menor valor indica un “peso o ajuste” mayor de la variable o modelo sobre la variable de respuesta (Guisan y Zimmermann 2000, Johnson y Omland 2004). Los MLG fueron realizados con el paquete estadístico R 2.10.1 (R Development Core Team. 2009). - 52 - 2.3. Resultados 2.3.1. Ocurrencia de Puma y Zorro colorado Puma El número promedio de signos registrados por transecta en los dos años de muestreo fue de 105, habiendo 11 transectas en que nunca se registraron signos de puma, y en el otro extremo una de las transectas en que se registró un máximo de 635 signos de puma, principalmente huellas. Zorro colorado El número promedio de signos registrados por transecta en los dos años de muestreo fue de 356, con 4 transectas en que nunca se registraron signos y en el otro extremo una de las transectas en que se registró un máximo de 1225 signos en los dos años de estudio. El número de signos de zorro colorado, fue 3.5 veces mayor que el de puma, siendo el patrón de signos registrados similar en ambos años, salvo que en el primer año de muestreo se observó un mayor registro de hembras con crías que en el segundo año de muestreo, y éste tipo de registro solo existió dentro del Parque (Χ2= 19.2, gl: 1, P=0.05). En el caso de los zorros no se diferenciaron huellas de adultos con crías. El registro de huellas de crías es más sencillo en pumas, posiblemente, debido a que el crecimiento en pumas es más lento con respecto a los zorros, ya que mientras los pumas llegan a un tamaño adulto entre el año y medio y los dos años, los zorros lo hacen a los 7 meses. 2.3.2. Efecto del grado de protección, las actividades humanas y la cobertura vegetal Puma El número de signos registrados fue mayor dentro del Parque Nacional que en la Reserva (χ2 de Wald = 109.7; P < 0.001), más frecuentes a distancias mayores de las viviendas (χ2 de Wald = 139.1; P < 0.001), patrón que fue más marcado dentro del Parque que en la Reserva donde casi no se registraron signos (Interacción área * - 53 - distancia a viviendas χ2 de Wald = 6.7; P = 0.010), mientras que el número de signos decreció con el aumento de la proporción de pajonales dentro del Parque pero no en la Reserva (Interacción área * pajonales χ2 de Wald = 4.9; P = 0.027) (Fig. 2.5; Tabla 1.2). Número de signos (Puma) Fig 2.5 A) 700 600 500 400 300 200 100 0 Parque Reserva Área protegida Fig 2.5 C) 700 700 Número de signos (Puma) Número de signos (Puma) Fig 2.5 B) 600 500 400 300 200 100 0 0 1000 2000 3000 4000 Distancia a viviendas (m) 5000 600 500 400 300 200 100 0 0 20 40 60 Pajonal (%) 80 100 Fig.2.5. Número de signos de Puma registrados en función de (A) tipo de área protegida; (B) distancia a viviendas como indicador del impacto humando; y (C) proporción de pajonal en la transecta y sus inmediaciones. La barra y círculos negros señalan a las transectas dentro del Parque, mientras que la barra y círculos blancos señalan las transectas ubicadas en la Reserva. Las líneas de tendencia indican el mejor ajuste lineal al logaritmo natural del número de signos, las líneas continuas y cortadas corresponden, respectivamente, a las transectas dentro del Parque y la Reserva. - 54 - Tabla 2.1. Modelo explicativo de la ocurrencia de pumas en las Sierras Grandes de Córdoba (B: estimadores, P: significancia, AIC: Criterio de Información de Akaike). Intervalo Confianza Wald 95% PARAMETRO B Mínimo Máximo P Intercepto 0.4386 -.341 1.218 0.270 Area=Parque 4.3146 3.507 5.122 < 0.001 Area=Reserva 0 Distancia a vivienda (m) 0.0007 0.001 0.001 < 0.001 Pajonal (%) -0.0007 -0.015 0.013 0.918 Parque* distancia a vivienda -0.0002 0 -5.929E-5 0.010 Reserva* distancia a vivienda 0 -0.030 -0.002 0.027 Parque* pajonal -0.0161 Reserva* pajonal 0 DEVIANZA: 1925.78; AIC: 2036.09 Modelo: (Intercepto) + Área + Distancia viviendas + Pajonal + Área*Distancia viviendas + Área*Pajonal Zorro colorado Todas las variables y sus interacciones con el factor área tuvieron efectos significativos sobre su ocurrencia (Fig. 2.6; Tabla 2.2). Como en el caso de los pumas, dentro del Parque el número de signos de zorro colorado registrados fue mayor que en la Reserva (χ2 de Wald = 768.4; P < 0.001). En cambio, el número de signos de zorro colorado registrados en relación a la distancia a viviendas tuvo un patrón menos marcado dentro del Parque que en la Reserva donde claramente la ocurrencia fue mayor a distancias más alejadas de las viviendas (Interacción área * distancia a viviendas χ2 de Wald = 330.5; P < 0.001). En relación a los pajonales, el número de signos de zorro colorado decreció con el aumento de la proporción de pajonales dentro del Parque y se incrementó en la Reserva (Interacción área * pajonales χ2 de Wald = 79.3; P < 0.001). - 55 - Nümero de signos (Zorro) Fig 2.6 A) 2500 2000 1500 1000 500 0 Parque Reserva Área protegida Fig 2.6 C) 2500 Número de signos (Zorro) Número de signos (Zorro) Fig 2.6 B) 2000 1500 1000 500 2500 2000 1500 1000 0 0 0 20 40 60 Pajonal (%) 80 100 Fig 2.6 E) 7 Número de signos (Zorro) Número de signos (Zorro) 0 1000 2000 3000 4000 5000 Distancia a viviendas (m) Fig 2.6 D) 500 e 6 e 5 e 4 e 3 e 2 e 1 e 0 1000 2000 3000 4000 5000 Distancia a viviendas (m) 7 e 6 e 5 e 4 e 3 e 2 e 1 e 0 20 40 60 80 Pajonal (%) 100 Fig.2.6. Número de signos de zorro colorado registrados en función de (A) tipo de área protegida; (B) distancia a viviendas como indicador del impacto humando; (C) proporción de pajonal en la transecta y sus inmediaciones; (D y E) son igual que (B y C) pero con escala logarítmica para mejor visualizar los patrones lineales. La barra y círculos negros señalan a las transectas dentro del Parque, mientras que la barra y círculos blancos señalan las transectas ubicadas en la Reserva. Las líneas de tendencia indican el mejor ajuste lineal al logaritmo natural del número de signos, las líneas continuas y cortadas corresponden, respectivamente, a las transectas dentro del Parque y la Reserva. - 56 - Tabla 2.2. Modelo explicativo de la ocurrencia de Zorro colorado en las Sierras Grandes de Córdoba (B: estimadores, P: significancia a un α= 0,05, AIC: Criterio de Información de Akaike). Intervalo Confianza Wald 95% PARAMETRO B Mínimo Máximo P Intercepto 0.5925 0.182 1.003 0.005 Area=Parque 5.9748 5.552 6.397 <0.001 Area=Reserva 0 Distancia a vivienda (m) 0.0009 0.001 0.001 <0.001 Pajonal (%) 0.0244 0.019 0.030 <0.001 Parque * distancia a vivienda -0.0009 0.000 0.000 <0.001 Reserva * distancia a vivienda 0 -0.033 -0.021 <0.001 Parque * pajonal -0.0271 Reserva * pajonal 0 DEVIANZA: 8520.48; AIC: 8677.632 Modelo: (Intercepto) + Área + Distancia a viviendas + Pajonal + Área*Distancia a viviendas + Área*Pajonal 2.4. Discusión En éste capítulo se formularon modelos para comprender cómo pumas y zorros colorados responden a diferencias ambientales provocadas por intervenciones humanas directas e indirectas y a acciones de conservación. La existencia de un área protegida, el efecto de las actividades humanas y de la proporción de pajonal demostraron tener importancia sobre los carnívoros tope en las Sierras Grandes, estando en primer lugar la abundancia de signos de ambos carnívoros relacionada preferentemente a la presencia del Parque Nacional - 57 - donde las actividades humanas están menos representadas y la cobertura vegetal se encuentra en recuperación. En sentido amplio, la cobertura vegetal estuvo asociada positivamente con pumas y zorros, donde ambos carnívoros se mostraron remisos a zonas de nula o escasa cobertura vegetal, como en la Reserva. Dentro del Parque, donde la vegetación se encuentra en recuperación, la abundancia de signos de ambos carnívoros fue mayor. La erosión por sobrepastoreo, afecta negativamente de manera directa e indirecta a los carnívoros, por la pérdida total de cobertura vegetal, ausencia de presas y mayor presencia humana. La presencia de cobertura vegetal es utilizada por éstas especies para la caza de sus presas que generalmente lo realizan al acecho, y también, les proporciona mayor disponibilidad de refugios que le brindan seguridad a sus crías y ante el hombre, como hipotetizaron varios autores en otros estudios (Woodrofe y Ginsberg 1998, Riley y Malecki 2001, Naves et al. 2003, Jędrzejewski et al. 2004). Y también, como se observó en años anteriores dentro del área de estudio, los pajonales están relacionados a la abundancia de pequeños mamíferos, presas principales de ambos carnívoros dentro del Parque (Pia et al. 2003). La muerte de especies de larga vida con bajas tasas de reproducción, como la mayoría de los carnívoros, es principalmente causada por los humanos (Woodrofe y Ginsberg 1998, Naves et al. 2003). Los carnívoros grandes se ven afectados por la caza directa, como es el caso del puma, en donde a pesar de ser una especie protegida, es perseguido por el conflicto con el ganado doméstico, como se registró en un relevamiento con encuestas a productores que habitan fuera del parque (Pia 2004). Los diferentes patrones de ocurrencia entre ambas áreas, hipotéticamente pueden deberse a que los carnívoros, principalmente los pumas, encuentren dificultades en establecer su territorio en la Reserva por el impacto humano, y en consecuencia no estén logrando su dispersión desde su territorio materno. Fuera del parque, donde la actividad ganadera es intensa, y existe mayor riesgo de predación de ganado por carnívoros, por la ausencia de presas nativas grandes y menor disponibilidad de presas pequeñas, los pumas y zorros son más perseguidos. Productores que habitan en el extremo norte de la reserva, donde la disponibilidad de presas nativas es menor, reportaron más pérdida de ganado que productores que habitan en los alrededores del parque, donde la disponibilidad de presas nativas es mayor (Pia 2004). Numerosos estudios determinaron asociaciones negativas entre presencia humana y ocurrencia de especies (aves: Haire et al. 2000, Pumas: Riley y Malecki 2001, riesgo de extinción de carnívoros: Cardillo et al. 2004, lobos: Jędrzejewski et al. 2004, huillines de la patagonia Argentina: Fasola et al. 2009, felinos de Sudamérica: De Angelo 2009). Las viviendas humanas y sobre todo los caminos que a ellas conducen, representan un acceso a cazadores y un foco de presión ya sea por las actividades ganaderas o turísticas (Renison et al. 2010; Heil et al. 2007). Probablemente, éste aumento en la frecuencia de encuentro o disturbio humano cercano a viviendas y caminos provoque que los carnívoros no se acerquen demasiado. Sin embargo, dentro del Parque, los caminos son menos transitados, por lo que usualmente se observa a zorros transitar por ellos, y en menos ocasiones a pumas, demostrando una efectividad mayor del Parque para los zorros. Éste comportamiento se sustenta por - 58 - otros estudios, donde se observó que los caminos son utilizados con frecuencia por los carnívoros más grandes, y éste patrón se acentúa dentro de áreas protegidas donde las especies son menos perseguidas y suelen ser más abundantes (Noss et al. 1996, Dickson et al. 2005, De Angelo 2009). En éste estudio, se observó también que los ríos son vías de acceso y dispersión importantes (Pia, datos no publicados), probablemente por sus características topográficas, constitución rocosa y en muchos casos con tupida vegetación ribereña (grandes pajonales o tabaquillos), que permiten a los carnívoros circular sin ser advertidos, o escapar rápidamente en caso de necesitarlo. Por el contrario, en la Reserva no se observa lo mismo, ya que el ganado generalmente se encuentra cerca de éstas fuentes de agua, eliminando gran parte de la cobertura vegetal, y muchas veces se encuentran asociados a la presencia humana y de perros (Fig. 2.7). En Norteamérica y Europa, se encontró que los territorios de lobos están caracterizados por baja densidad de caminos y humanos (Mladenoff et al. 1995, Jędrzejewski et al. 2004, Ramp et al. 2006), ya que actúan como barreras en la dispersión y representan una causa directa de mortalidad. Fig 2.7 A) Fig 2.7 B) Fig 2.7. Características topográficas y de la vegetación asociada de los ríos A: dentro del parque(Aº Achala), y B: dentro de la reserva (Aº Barrancas). La presencia de accesos como caminos, muchas veces culminan en la caza de estas especies o en su captura para mascotismo (Fig 2.8). Históricamente, los zorros fueron muy perseguidos por el valor peletero de su piel, lo que provocó disminuciones importantes en sus poblaciones, y hasta el día de hoy es frecuente encontrar las antiguas trampas de piedra utilizadas para cazar zorros en las cercanías de las viviendas. Actualmente, el cese de ésa actividad en el Parque parece estar contribuyendo a la recuperación de sus poblaciones (Pia, datos no publicados). - 59 - Fig 2.8 A) Fig 2.8 B) Fig 2.8. A: Cueros de puma y zorro colorado cazados en Pampa de Achala, B: cachorro de puma capturado para mascotismo por pescadores en cercanías del río Condorito. Los caminos, son además fuente de mortalidad por colisiones con vehículos. En el área de estudio, se han registrado numerosos animales atropellados sobre la ruta provincial que atraviesa ambas áreas protegidas, entre ellos, de puma y zorro colorado (Fig. 2.9), donde en 5 años se recolectaron 13 zorros y 2 pumas (entre otros carnívoros). Ésta cifra, está subestimada ya que no siempre se encuentra a todos los animales atropellados, y por la rápida acción de especies carroñeras. Ésta ruta se caracteriza por un recorrido muy sinuoso alternado con tramos de rectas, presenta un tráfico continuo que conduce a velocidades altas, y en muchas ocasiones excediendo las velocidades máximas permitidas. Esto, contribuye a que las colisiones con carnívoros sean frecuentes, y la mayoría se registre en los tramos rectos y de noche, donde se circula a mayor velocidad, y en un horario de máxima actividad de puma y zorro colorado. - 60 - Fig 2.9 A) Fig 2.9 B) Fig 2.9. A: Puma macho adulto, B: Zorro colorado adulto, atropellados en la ruta provincial Nº 34 que atraviesa al Parque Nacional Quebrada del Condorito. Al parecer, los pumas evitarían más el contacto con humanos que los zorros colorados, ya que, en áreas turísticas o sin protección es más frecuente avistar a zorros que a pumas. Sin embargo, en éste caso sería difícil interpretar si esto se debe a un efecto de la actividad turística, a una combinación con el factor protección o a características intrínsecas de la especie. Los disturbios humanos, también afectan la abundancia de las principales presas de éstos carnívoros (Pia et al. 2003). El sobrepastoreo, a través de la actividad ganadera, provoca la disminución en las poblaciones de los pequeños mamíferos, que representan las presas principales de ambos carnívoros (ver Capítulo 3), y esto también podría ser causa de su menor abundancia fuera del Parque. La caza de presas por los humanos, ha provocado que muchas hayan desaparecido de las sierras o se vieran diezmadas y retraídas de su distribución original, siendo menos accesibles a los carnívoros, como el caso de los guanacos y las vizcachas. Tal vez, el disturbio humano y la actitud negativa de los productores hacia los carnívoros, represente una variable determinante de la ocurrencia de puma y zorro colorado a lo largo del área de estudio. - 61 - En éste contexto, el Parque podría estar cumpliendo el rol de un hábitat de tipo refugio, donde la calidad de hábitat para su supervivencia es buena (mayor cobertura vegetal y menor impacto humano), pero para el caso de los pumas, ésta área podría ser pobre para su reproducción por la escasez de presas grandes. Sin embargo, a pesar de la escasez de presas grandes, el Parque ofrece un ambiente apto para la reproducción de los pumas, ya que en éste estudio solo se registraron signos de hembras con crías dentro del Parque. En conclusión, ambos carnívoros estuvieron asociados positivamente a áreas con protección activa, y negativamente a áreas con fácil acceso al hombre, lo que tiene una interpretación inmediata. Los pajonales tienen un efecto más positivo sobre zorros, principalmente por albergar a su presa principal, los pequeños roedores. Los pumas, a pesar de también alimentarse de presas pequeñas, incorporan a su dieta presas más grandes cuando éstas son disponibles, las cuales no siempre se asocian al pajonal (ver Capítulo 3). El Parque podría estar actuando como un área refugio, teniendo en cuenta que el riesgo de mortalidad de los carnívoros varía de bajo a alto dentro y fuera del Parque, respectivamente. Naves et al. (2003), observaron que la menor extinción de osos ocurre en áreas fuente o refugio, caracterizadas por una mejor calidad de hábitat y menor presencia humana, Riley y Malecky (2001), encontraron que la rugosidad y cobertura vegetal del terreno explicaban el 73% de la variación en índices de abundancias de pumas en Norteamérica, y Jędrzejewski et al. (2004), observaron que la cobertura vegetal, fue la variable que más influenció la distribución y abundancia de lobos en Europa. La preferencia por áreas refugio son más marcadas en carnívoros grandes, lo que podría explicar que los pumas prioricen el uso del Parque como un refugio, a pesar de que la disponibilidad de presas grandes sea escaso. Sin embargo, para los zorros la existencia del parque nacional, es positivo para su subsistencia. - 62 - CAPITULO III. Respuesta a largo plazo de la dieta de carnívoros tope a un cambio en la base de presas en las Sierras Grandes de la provincia de Córdoba, Argentina. 3.1. Introducción 3.1.1. Aspectos generales: Marco teórico en alimentación Las relaciones energéticas que se generan cuando un organismo utiliza como alimento a otros seres vivos, son denominadas nicho trófico, y representan un aspecto importante en el estudio de la ecología de los carnívoros, confirmando que los recursos tróficos dominan varios aspectos de su biología (Gittleman 1995, Aryal et al. 2010). El tiempo de búsqueda y de manipulación de los distintos tipos de presas, por parte del predador fueron las variables propuestas para la teoría del forrajeo óptimo (Emlen 1966; MacArthur y Pianka 1966). La predicción general de ésta teoría se refiere a que cuando el alimento es abundante un predador debería ser selectivo, prefiriendo presas más grandes y energéticamente más rentables (MacArthur y Pianka 1966, Griffiths 1975, Scognamillo et al. 2003). En contraste, cuando las densidades de presas son bajas el predador debería seleccionar a las mismas de acuerdo a su abundancia relativa, maximizando así el número de presas consumidas (Emlen 1966, MacArthur y Pianka 1966). Éste razonamiento nos lleva a la conclusión de que uno puede esperar selectividad por especies presa o por un tamaño apropiado cuando éstas son abundantes. La teoría predice que los ítems presa serán incorporados a la dieta cuando la ganancia de energía sea mayor que los costos invertidos en obtenerla (Emlen 1966, MacArthur y Pianka 1966, Polisar 2000). Los predadores modifican la estructura de la cadena trófica, controlando la abundancia y dinámica de las poblaciones de sus presas. Éste efecto se conoce como “Top-down”, donde cada nivel trófico está limitado por el nivel inmediatamente superior (Estes 1996, Mech 1996, Terborgh et al 1999), aunque también, las presas pueden afectar la ecología trófica de sus predadores, a través de su comportamiento y morfología (Sih et al. 1985). Los efectos “Top-down” de los predadores pueden ocasionar efectos cascadas a través de los niveles tróficos, ya que indirectamente pueden incrementar - 63 - la biomasa de las plantas mediante la reducción de la densidad de herbívoros y alteración de su comportamiento (Hebblewhite et al. 2005). Cuando el recurso presa es abundante factores ecológicos como disponibilidad de un tamaño apropiado de presa y características de hábitat, son de importancia prioritaria (Gittleman et al. 2001). Por otro lado, cuando el recurso clave disminuye, factores comportamentales, como la habilidad para usar áreas disturbadas por los humanos y flexibilidad en la dieta por el uso de presas pequeñas, puede ser más importante al promover la coexistencia y aumentar la amplitud de nicho de los predadores (Pianka 1973, Azevedo et al. 2008). La abundancia y disponibilidad de las presas son vitales en las interacciones entre carnívoros de tamaños similares, y ciertamente pueden alterar los patrones de coexistencia (Iriarte et al. 1990, Azevedo et al. 2008). Cuando la presa principal escasea los predadores cambian por una presa alternativa o especie buffer menos beneficiosa (Rosenzweig 1968). Por ejemplo, en la selva paranaense los jaguares y pumas, se alimentan de especies similares, pero el jaguar muestra una amplitud de nicho (diversidad trófica) mucho menor que la del puma. Su presa principal es el pecarí labiado, el cual ya ha desaparecido de muchas áreas por la caza furtiva, ocasionando que los jaguares deban alimentarse de ganado como presa alternativa, y aumentando el conflicto con los humanos (Azevedo et al. 2008). En el sur de Chile, los pumas predan sobre liebres (presa alternativa) cuando las poblaciones de guanacos (presa preferida) son bajas, pero cuando las poblaciones de guanaco se incrementan, los pumas incorporan más guanacos a su dieta (Iriarte et al. 1990). También, como se observó en ésta tesis, una presa pequeña más abundante, puede ser más provechosa para el predador, si invierte demasiada energía en la búsqueda de una presa mayor que existe en baja abundancia (Rosenzweig 1968). La flexibilidad del nicho trófico es uno de los principales componentes de la plasticidad ecológica de las especies, por lo que, en hábitats alterados por el hombre, significa una amenaza, que afecta la oportunidad de supervivencia de un carnívoro (Crooks 2002). De lo referido anteriormente, se desprende que, uno de los requisitos principales para la supervivencia de cualquier ser vivo, es el acceso al alimento. Y comprender en qué cantidad y de qué manera esto ocurre, constituye un aspecto importante de conocimiento básico de una especie y sus interacciones con el entorno (Estes 1996). Debido a que la disponibilidad y distribución del recurso no son uniformes en el ambiente, es importante conocer la composición en la dieta de los carnívoros para un mejor entendimiento de éstas especies y también para el manejo de las poblaciones de ambos, predadores y presas. En ésta tesis se evaluaron solo algunos de los aspectos del marco teórico en la interpretación de los resultados. - 64 - 3.1.2. Balance neto de energía y tamaño corporal de los carnívoros La adecuación (fítness) individual de un predador está determinado en gran parte por la calidad y cantidad de sus presas (Novack 2003). Muchos carnívoros, se ubican en el tope de la cadena trófica, y su biomasa poblacional, representa solo una pequeña fracción en comparación con la de sus presas. Carbone et al. (2007), proponen que la dieta de los predadores está determinada por el balance neto de energía. Bajo éste modelo indican que los carnívoros se dividen en dos grandes grupos: los carnívoros pequeños (<20 kg), que se alimentan de presas mucho menores a su masa corporal, las cuales demandan un bajo costo energético para atraparlas, pues pueden hacerlo a baja velocidad, con fases de captura y matanza muy cortas y con bajo riesgo de sufrir daños; y los carnívoros grandes (> 20 kg), que se caracterizan por alimentarse de grandes vertebrados (con masas similares o superiores a las propias), con costos energéticos de caza altos, ya que incluyen persecuciones a altas velocidades, capturas y matanzas de altos costos energéticos y gran riesgo de sufrir heridas durante la captura. Carbone et al. (1999), encontraron una correlación positiva entre el tamaño corporal de los carnívoros y la biomasa de sus presas. Los carnívoros que pesan 21.5 kg o menos, se alimentan principalmente de presas que representan el 45 % o menos de su masa corporal, por otro lado carnívoros por arriba de éste peso, generalmente se alimentan de presas mayores al 45% de su propia masa (excepto los carnívoros acuáticos y úrsidos). Bajo éstas sentencias, dentro de los cánidos y félidos, todas las especies que pesan más de 21.5 kg, se alimentan exclusivamente de vertebrados. Debajo de éste peso, el 53% de las especies se alimenta exclusivamente de vertebrados, el 29% son omnívoros, el 2% exclusivamente de invertebrados y el 16% se alimentan de vertebrados e invertebrados (Carbone et al. 1999). Los carnívoros que se alimentan de presas pequeñas, al parecer tienen un costo relativo de caza menor, ya que lo hacen al paso y sin riesgo a salir lastimados. Los carnívoros grandes sin embargo, tienen un alto costo energético en la caza de presas grandes, que implica carreras largas a alta velocidad, y un alto costo energético de captura y muerte de la presa. Los costos de caza y los requerimientos de energía resultantes, se incrementan con un aumento en el tamaño de la presa (Rosenzweig 1968). Los patrones de selección de presas con el tamaño de los carnívoros, son similares entre varias especies de carnívoros. Al comparar especies de cánidos con félidos, y a pesar de sus diferencias morfológicas, ecológicas y taxonómicas, los patrones en la selección de tamaño de presas, y necesidades energéticas en relación a su tamaño corporal, parecen muy similares. Estos estudios, nos permiten tener una amplia perspectiva de las necesidades energéticas y de tiempo en carnívoros terrestres, y nos provee ideas sobre la conservación y evolución de los carnívoros, - 65 - ayudándonos a entender la vulnerabilidad de los grandes carnívoros de históricas y futuras extinciones. Entre los carnívoros existentes, las especies grandes son particularmente vulnerables a los procesos de amenazas humanas, y está demostrado que poseen tazas mayores de extinción por el registro fósil que los carnívoros más pequeños, inclusive antes de la evolución del humano. Las perturbaciones ambientales, ya sean humanas u otras, encabezadas por la baja disponibilidad de presas, puede afectar fácilmente el balance energético (Carbone et al. 2007), y la dinámica social de los grandes carnívoros (Novack 2003). La caza y las actividades agrícolas usualmente alteran la dinámica y estructura de las poblaciones de los grandes ungulados, y dependiendo de la escala de las actividades humanas, pueden impactar negativamente sobre los grandes carnívoros que dependen de los ungulados como presa principal (Novack 2003). A pesar de que los carnívoros de tamaño grande tienden a alimentarse de presas de gran tamaño, existen numerosas excepciones. También, parece haber un patrón para éstas excepciones, ya que los grandes carnívoros que se alimentan de presas pequeñas, tienden a tomar una gran proporción de su alimento de la producción primaria. Por ejemplo los osos, se alimentan de presas menores que los pumas o lobos, a pesar de ser de mayor tamaño, y toman mucho de su alimento de la vegetación. Al parecer, el tamaño corporal de los carnívoros no solo depende del tamaño de la presa, sino también de la tasa en la que puede obtener energía (Rosenzweig 1968). El tamaño corporal en carnívoros cazadores activos, es importante en el mantenimiento de la coexistencia de especies altamente relacionadas. En consecuencia, para que los carnívoros altamente emparentados puedan coexistir, deberán reducir la competencia interespecífica particionando los recursos (Rosenzweig 1968). Emmons (1992), concluyó que los felinos de pequeño y gran tamaño parecen tener estrategias ecológicas diferentes relacionadas estrechamente con su tamaño corporal, lo cual impediría que algunas especies de felinos grandes puedan mantener una dieta y una estrategia propia de un felino de pequeño tamaño, y que otras especies serían demasiado pequeñas para que una estrategia de gran felino le resultase eficaz. Todos los pequeños felinos estudiados se alimentan principalmente de pequeños roedores o mamíferos, mientras que los grandes felinos capturan ungulados de mayor tamaño. Las presas de los felinos pequeños tienen un tamaño mucho menor que el suyo propio, y por lo tanto se ven obligados a capturar varios al día. Las presas de los grandes felinos en comparación, son mucho mayor de manera que tan solo necesitan cazarlas unas cuantas veces, e incluso una sola vez a la semana. Los felinos pequeños tienen que competir por sus presas con muchos otros predadores, mientras que los grandes felinos encuentran poca competencia por sus presas. Y los pequeños mamíferos están sujetos a ciclos poblacionales que pueden producir grandes oscilaciones en - 66 - las poblaciones de los felinos que les dan caza, echo que no sucede con los grandes ungulados y sus predadores (Emmons 1992). 3.1.3. Partición del recurso y superposición del nicho trófico Según la teoría ecológica, para que los competidores coexistan en un área, deben exhibir una diferenciación en los nichos reales particionando el recurso (Hutchinson 1957, Begon et al. 1990), de lo contrario, una especie excluirá a la otra por competencia (Gause 1934). Preguntas concernientes a amplitud o superposición de nicho, entre el gremio de los carnívoros, pueden ser especialmente problemáticas (Sih et al. 1985). El ensamble de carnívoros simpátricos, por lo general exhibe variabilidad en su amplitud y superposición de nicho (especialistas o generalistas) (Pianka 1980, Krebs 1985). La especialización, ha sido descripta como el uso de una porción relativamente angosta o pequeña del espectro de recurso, o el uso estable de un tipo particular de alimento (Sunquist et al. 1989, Azevedo y Murray 2007). Sin embargo, cuando la abundancia de las presas fluctúa dramáticamente durante un período de tiempo, incluso las supuestas especies especialistas, pueden exhibir patrones más generalistas de alimentación (Begon et al. 1990). También, en muchos casos la amplitud de nicho puede ser un fenómeno local, en vez de una característica inmutable de una especie (Azevedo et al. 2006, Azevedo 2008). Sin embargo, casi siempre existe un grado de preferencia por un tipo particular de alimento, que se manifiesta cuando la proporción de dicho alimento en la dieta es más elevada que la proporción en el ambiente. Por éste motivo, no solo la cantidad de alimento disponible es importante a tener en cuenta, si no, que la calidad y accesibilidad de los recursos también influyen en la incorporación de una presa a la dieta. Las diferencias entre especies simpátricas, en relación a aspectos de uso trófico, temporal y espacial de su ambiente, fueron frecuentemente utilizados para describir la estructura de las comunidades o para clarificar cómo las especies coexisten (Gause 1934, Hutchinson 1957, MacArthur 1965, Levins 1968, Pianka 1980; Krebs 1985, Emmons 1992). Entre especies de carnívoros simpátricos con morfología y estrategia de caza similares, se sugiere que la coexistencia está correlacionada con el tamaño, es decir, con especies grandes especializándose en presas grandes (Rosenzweig 1968). En algunos casos, solo la diferencia en el tamaño es insuficiente para permitir la coexistencia. Estudios realizados en especies simpátricas de Nairobi, sugieren que la coexistencia se ve facilitada principalmente por diferencias en la dieta, y en menor medida por diferencias espaciales y temporales. En España, un alto grado de especialización en la dieta favoreció la coexistencia de ocho especies de carnívoros. En Belice, no se encontraron similitudes significativas en la dieta de 4 especies - 67 - de carnívoros, y en Serengeti, se encontró una alta superposición en la dieta, comportamiento de forrajeo y uso de hábitat en pequeños carnívoros, sugiriendo que la coexistencia es posible debido a la alta tasa de renovación de presas invertebradas, que constituyen sus presas principales (Fedriani et al. 2000). También, en un estudio realizado en los llanos de Venezuela sobre cinco especies simpátricas, se encontró que la separación ecológica se debe principalmente a diferencias en la dieta, y no al uso de hábitat o actividad de tiempo (Sunquist et al. 1989). En Chile, Fuentes y Jaksíc (1979), hipotetizaron que la complementariedad de nicho, de dieta y hábitat influencian la distribución y tamaño corporal de los zorros colorados y grises (Pseudalopex culpaeus y Pseudalopex griseus, respectivamente). Donde, los zorros que eran simpátricos en el sur de Chile, diferían en tamaño corporal, y los zorros alopátricos en el centro de Chile, eran similares en tamaño corporal debido a la partición altitudinal de hábitat, que permite una competencia más tranquila entre especies de tamaños similares (Zunino et al. 1995). Así, el grado de competencia entre dos especies altamente emparentadas puede depender de diferencias en el tamaño corporal (Pacala y Roughgarden 1985). Más allá de que ambas especies preden esencialmente sobre las mismas categorías de vertebrados presas, la proporción de cada categoría en la dieta de cada uno de ellos debería diferir. Johnson y Franklin (1994), encontraron que el peso promedio de la presas de los zorros colorados era un poco mayor que el de los zorros grises, pero que ambos predaron sobre casi todas las mismas especies pero en diferente proporción. Los patrones de hábitos alimenticios se explican por, la partición de hábitat antes que la del recurso por ambos cánidos, o por la exclusión por parte del zorro colorado al gris de hábitats con presas óptimas. La comprensión de la interacción entre las densidades de carnívoros simpátricas es necesaria para adoptar medidas de conservación y así preservar tanto pequeños como grandes predadores, y mantener la integridad ecológica de la comunidad. 3.1.4. Antecedentes de estudio de dieta en pumas y zorros colorados Los pumas y zorros colorados son especies simpátricas en toda la extensión del área de estudio, y los dos son básicamente carnívoros y predan principalmente sobre mamíferos. Con la introducción de especies exóticas silvestres y domésticas, la interacción entre predadores y presas autóctonas se alteró en varios aspectos (Novaro y Walker 2005). Por un lado, aumentó la cantidad de alimento disponible para los predadores; mientras que los herbívoros nativos sufrieron los efectos de la competencia con las especies domésticas y silvestres exóticas. - 68 - A pesar de la disminución de las presas autóctonas, el suministro de alimento para los predadores se mantuvo constante debido a la presencia de ganado y otras especies exóticas. Por ésta razón, se ha registrado que las poblaciones de herbívoros y omnívoros autóctonos han disminuido, mientras que las poblaciones de carnívoros autóctonos se mantienen estables o están aumentando (Novaro y Walker 2005), potenciando el conflicto entre carnívoros y humanos. Los carnívoros, son especies relativamente difíciles de estudiar por su baja densidad y comportamiento huidizo (Estes 1996), por lo que no sorprende que el mayor volumen de trabajos disponibles, estén relacionadas al análisis de su dieta, relación del tamaño corporal y el tamaño de sus presas o simpatría con otras especies de carnívoros (Sunquist et al. 1989, Iriarte et al. 1990, Fedriani et al. 2000, Novaro et al. 2000, Pia et al. 2003, Azevedo et al. 2008). Los pumas en el P.N. Torres del Paine (Chile), consumen principalmente liebres y guanacos (Franklin et al. 1999, Iriarte et al. 1991). Lo mismo se observó en otras áreas protegidas del sur de Chile, donde el puma se comporta como un predador especialista en ungulados, reaccionando de manera oportunista ante presas alternativas como las liebres europeas (Rau et al. 1991, Rau et al. 1992, Rau y Jiménez 2002). La presencia de ganado doméstico en su dieta dentro de áreas protegidas es de aproximadamente un 10 %, mientras que ésta proporción puede incrementarse hasta un 25 % fuera de éstas áreas (Yañez et al. 1986, Rau et al. 1995). En Bolivia, el mayor aporte a la dieta según su número proviene de roedores, y según su biomasa lo constituyen los camélidos domésticos (alpaca y llama) y silvestres (vicuña), aunque seleccionan fuertemente sobre ésta última (Pacheco et al. 2004b). En Argentina, se realizaron estudios de su dieta en el centro, noroeste (Branch et al. 1996, Pessino et al. 2001, Perovic 2002), y en la Patagonia (Novaro et al. 2000, Pia y Novaro 2005). Los mamíferos pequeños y medianos nativos son sus principales presas según número y biomasa en la zona pampeana de Argentina, por la ausencia de presas nativas mayores o equivalentes en tamaño al ganado doméstico, y la poca accesibilidad que hay a éste tipo de presa exótica (Pia 2004). Por otro lado, las presas pueden alterar la dieta de éstos carnívoros, ya sea por un aumento o disminución en su abundancia o cambios comportamentales inducidos por factores externos. En el PN Lihue Calel (provincia de La Pampa), la vizcacha era la principal presa nativa del puma, representando entre un 52 y 85 % del total de la dieta, hasta que sus poblaciones declinaron hasta una 90%, provocando el cambio en la alimentación hacia presas mayores y menores que las vizcachas (Branch et al. 1996, Pessino et al. 2001). En el norte de la Patagonia, Novaro et al. (2000) concluyeron que las presas nativas grandes del puma se encuentran ecológicamente extintas debido a una gran reducción en sus abundancias, por lo tanto su dieta se basa en especies exóticas grandes y medianas (ciervos y liebres). Mientras que en el sur de la Patagonia, a pesar de que la abundancia de presas nativas grandes es mayor, las liebres y los cricétidos fueron los más consumidos, aunque dentro de un área protegida el - 69 - consumo de guanacos es mayor (Pia y Novaro 2005). En el sur de Brasil la pérdida de ganado menor adquiere valores altos en comparación con el ganado mayor, la que puede ser disminuida encerrando a los animales durante la noche y mejorando el manejo ganadero (Emmons 1987, Crawshaw 1995). En cuanto al zorro colorado, la mayor parte de la información disponible en Sudamérica proviene de estudios realizados en Chile y la Patagonia Argentina. Por su dieta, se lo considera polífago, principalmente carnívoro (Novaro 1997), incluyendo en su dieta tanto pequeños mamíferos, como presas mayores nativas y exóticas (Lepus europaues, Oryctolagus cuniculus, Ovis aries (corderos) Ctenomys sp), y también carroña de grandes ungulados (Bos taurus, Lama guanicoe, Ovis aries, Equs caballus). Otros estudios reportaron su comportamiento oportunista (Crespo y De Carlo 1963, Jacksic et al. 1980). Sin embargo estudios posteriores, reportaron una gran selectividad de sus presas (Iriarte et al. 1989, Ebensperger et al. 1991, Jaksic et al. 1992, Johnson y Franklin 1994, Meserve et al. 1996, Novaro et al. 2000a, Pia et al. 2003, Zapata et al. 2005, Guzmán-Sandoval et al. 2006, 2007, Walker et al. 2007). Los zorros colorados son considerados netamente carnívoros, alimentándose de mamíferos nativos pequeños en el centro de Argentina y Chile, y mamíferos medianos exóticos (liebre) en la Patagonia Argentina. Las actividades humanas, pueden influir en el comportamiento y supervivencia de los carnívoros de forma directa (caza) o indirecta (alterando la disponibilidad de las presas). En el centro de Chile se registró un cambio oportunista en la dieta de los zorros atribuidos a un aumento en la disponibilidad de una de sus presas (conejos) (Jacksic et al. 1980, Simonetti 1986). Así, las especies exóticas producen alteraciones en la dieta de los predadores, por convertirse en una presa y por competir con especies presas nativas. En el sur de Chile la liebre es la presa principal de los zorros, al igual que en el noroeste de la Patagonia Argentina (Johnson y Franklin 1994, Novaro et al. 2000). Objetivo general El objetivo de éste capítulo es describir los hábitos alimenticios en cuanto a composición de ítem presas y variación anual, dentro de un área protegida donde se removió el ganado doméstico y fuera de ésta donde se mantienen las cargas ganaderas tradicionales, y evaluar el rol de las presas nativas versus las exóticas en la dieta de los pumas y zorros colorados del pastizal de altura de las Sierras Grandes de la Provincia de Córdoba, Argentina Objetivos específicos Describir la composición y la variación anual de la dieta de puma y zorro colorado en áreas con diferente oferta de presas del pastizal de altura de las Sierras Grandes de la Provincia de Córdoba, Argentina. - 70 - Determinar si los cambios en la composición de presas nativas, provocaron un incremento en la diversidad de presas consumidas o la especialización hacia alguna otra presa. Analizar la amplitud de nicho trófico y variación temporal en ambos carnívoros y evaluar la respuesta ante los cambios en la abundancia de ganado doméstico. Comparar la superposición del nicho trófico de los carnívoros tope a lo largo de los años y luego de la remoción del ganado doméstico dentro de un área protegida del pastizal de altura de las sierras grandes de Córdoba, Argentina. Hipótesis Pumas y zorros colorados consumen presas energéticamente redituables a su tamaño corporal. La amplitud de la dieta depende de la disponibilidad de las presas consumidas de cada especie. La superposición del nicho trófico entre ambos carnívoros depende de la disponibilidad de presas de gran tamaño. Predicciones Las presas de tamaño grande serán más frecuentes en la dieta de pumas, mientras que los zorros colorados consumirán más presas medianas y pequeñas. Fuera del parque, los pumas tendrán una amplitud de la dieta mayor por alimentarse de presas grandes, a la de los zorros colorados, que se alimentan de presas medianas y pequeñas. Al disminuir la disponibilidad de ganado doméstico aumentará el consumo de presas pequeñas por el puma, ocasionando un aumento en la superposición de la dieta con los zorros colorados. - 71 - 3.2. Metodología 3.2.1. Colecta, identificación y análisis de las heces Desde el año 2003 hasta el 2008, se recolectaron heces de puma y zorro colorado, dentro y fuera del parque. Las heces fueron recolectadas utilizando diferentes métodos: a lo largo de transectas recorridas a pie, en áreas recorridas a caballo, y en sitios prefijados donde era frecuente encontrar heces. Para su conservación, las heces fueron colocadas en bolsas de papel, y secadas al aire para evitar la propagación de hongos. En cada bolsa se registraron datos de fecha, ambiente, lugar de recolección, coordenada de GPS y recolector. Las heces fueron sometidas a una segunda instancia de reconocimiento en el laboratorio, donde todas las heces de origen dudoso fueron descartadas. Las heces fueron analizadas en el laboratorio de la Alianza Gato Andino Argentina (AGA), sede Córdoba (Jenner 152, Villa Carlos Paz, Córdoba). Éste laboratorio, cuenta con todas las instalaciones necesarias para éste tipo de estudios de dieta de carnívoros (en cuanto a infraestructura, materiales de referencia guías y medidas sanitarias). Cada muestra fue remojada y lavada con agua caliente, para facilitar la extracción de la grasa contenida, producto de la alimentación de los carnívoros. Luego, cada muestra fue tamizada con un colador de malla fina, descartando todas las partes microscópicas, como proteínas, materia no absorbida e inorgánica, para luego ser depositadas en bandejas individuales. En ésta etapa, las heces fueron desagregadas en restos microscópicos (pelos, plumas, escamas) (Fig 3.1A) y macroscópicos (restos óseos) (Fig 3.1B). Los restos microscópicos fueron sometidos al mismo proceso del lavado reiteradamente, hasta retirar toda la grasa, y luego depositados y extendidos nuevamente en bandejas para su posterior secado e identificación. Los restos macroscópicos fueron depositados en cajas de Petri para su posterior identificación. - 72 - Fig 3.1 A) Fig 3.1 B) Fig 3.1. Partes de la hez utilizadas para el análisis de la dieta: A. Restos microscópicos de la hez, B. Restos macroscópicos de la hez Cada hez (bandeja y caja de Petri) fue identificada con un número y registrada en una planilla junto a los datos de sitio de recolección, fecha, especie y nombre del recolector. Para la identificación de los ítems presa contenidos en cada hez, se utilizó material de referencia de pelos y cráneos recogidos en el área de estudio, y a través de guías de pelos y cráneos realizados por especialistas en diferentes zonas de la Argentina (Chehebar y Martin 1989, Fernández y Rossi 1998, Vazquez et al. 2000). Los pelos fueron identificados mediante el reconocimiento de sus características estructurales y morfológicas, disciplina denominada Tricología. Cada género y especie, posee una estructura microscópica característica que se mantiene relativamente inalterada luego del proceso digestivo. Mediante la observación con un microscopio a 40x, los pelos, pueden ser reconocidos a partir de las escamas de la cutícula (parte externa del pelo) y la estructura de la medula de los pelos (parte interna del pelo) (Chehebar y Martin 1989). Se seleccionaron pelos de varios campos de cada bandeja, los que fueron depositados en alcohol 96º por unos minutos, luego presentados en un portaobjeto de vidrio y observados bajo el microscopio para la identificación de la medula. Para éste método de identificación, siempre es aconsejable la observación de la zona distal de pelos de tipo guardianes o cobertores (que son más pigmentados, largos y derechos), y que se encuentran en todas las muestras (Chehebar y Martin 1989). En los casos en que la identificación de la médula fue dudosa o nula, el pelo se identificó a partir del patrón de escamas cuticulares. Para esto, se colocó el pelo en una fina capa de líquido corrector de esténciles, previamente extendido en un portaobjetos. Una vez seco, se retiró el pelo y se observó el molde fijado por las escamas en microscopio a 40 o 100x de aumento. Los restos macroscópicos fueron identificados por la presencia de mandíbulas, molares, uñas y plumas bajo una lupa bifocal, con el material de referencia mencionado anteriormente. Los ítems presa fueron clasificados a nivel de especie, familia u orden según el grupo taxonómico representado. - 73 - Dentro de los mamíferos en el Orden Rodentia, solo se identificaron cricétidos, cuises y tucos a nivel de familia (Cricetidae, Cavidae y Ctenomidae, respectivamente), sin embargo, los molares y huesos diagnósticos encontrados pertenecientes a éstas familias fueron guardados para futuros análisis a nivel de especie. La Familia Chinchillidae posee como único representante en el área de estudio a la vizcacha (Lagostomus maximus), y el Orden Lagomorpha, cuenta solo con la presencia de la liebre europea (Lepus europaeus), y los marsupiales se clasificaron a nivel de orden (Morando y Polop 1997). Los carnívoros encontrados en las heces se identificaron a nivel de especie cuando fue posible, en caso contrario se agruparon a nivel de familia como el caso de los Mustélidos. Dentro del Orden Artiodactyla, se llegó a especie para el caso del guanaco (Lama guanicoe) o a grupos funcionales para las especies domésticas introducidas, ganado menor (integrado por oveja y cabra, Ovis aries y Capra sp), ganado mayor (integrado por vaca, Bos taurus y caballo, Equus caballus (Orden Perissodactyla) y camélido doméstico a la llama (Llama glama). Las aves o reptiles encontrados en las heces, fueron identificados hasta el nivel de clases. También, pueden encontrarse otras especies silvestres exóticas en el área de estudio como antílope (Cervicapra sp) y jabalí (Sus scrofa), pertenecientes a campos privados que se desempeñan como cotos en los alrededores del área protegida. 3.2.2. Análisis de datos 3.2.2.1. Diámetro de las heces Antes de comenzar con el procesamiento de las muestras, se midió el diámetro a cada hez, la que fue utilizada como criterio de clasificación en el laboratorio. Se realizaron análisis de la varianza y Prueba de Fisher para comparar los diámetros de las heces entre especies y años (Infostat 2002). 3.2.2.2. Frecuencia de ocurrencia y biomasa consumida Los datos se reportan como frecuencia de ocurrencia, definida como las veces que un ítem se hizo presente en el total de ítems presa encontrados en las heces para cada especie y cada año (Pia et al. 2003). Ésta frecuencia resulta de particular utilidad por la facilidad de transformar los resultados a valores porcentuales. Debido a la diferente digestibilidad de las presas según su tamaño, la descripción de la dieta basada en el análisis de heces puede desviarse de la realidad (Weaber 1993). Por éste motivo, se calculó el porcentaje de biomasa consumida (Ecuación 3.1) utilizando los factores de corrección - 74 - sugeridos por Ackerman (1984) (Ecuación 3.2) y Lockie (1959), para puma y cánido mediano, respectivamente, junto con los pesos corporales de las presas obtenidos en el presente estudio y de bibliografía existente (Tabla 3.1). Tabla 3.1. Pesos corporales de las presas utilizadas para estimar la biomasa consumida por puma y zorro colorado (expresado en kilogramos), y bibliografía que se utilizó como fuente de información. PRESA PESO (KG) Cricétido 0,04 Vacuno 178 Ovino 33 Llama 130 Antílope 100 Jabalí 200 Mustélido 1,85 Puma 50 Cuis 0,46 Tuco 0,15 Liebre 3,4 Guanaco 77 FUENTE Pia et al. 2003 Éste estudio Taraborelli, P com pers. Novaro et al. 2000 Ave 0,06 Marsupial 0,03 Redford y Eisenberg,1992 Vizcacha 4,4 Ferreyra H, com pers. La relación pelo y peso corporal consumido es mayor en las presas pequeñas, por lo tanto su representación en la dieta puede ser sobreestimada, en relación a presas más grandes. Por éste motivo se desarrollaron factores de corrección que tienen en cuenta la diferente digestibilidad de las presas según sea el carnívoro estudiado. Para pumas, Ackerman et al. (1984), encontraron una relación positiva entre el número de heces recogidas en el campo y el consumo de presas pequeñas. Esto significa que, las presas grandes resultarán en un menor número de heces colectadas que las presas pequeñas. Este fenómeno ocurre, porque las presas grandes están compuestas proporcionalmente por más cantidad de proteína digerible, pero las presas pequeñas están compuestas por una proporción relativamente mayor de pelos y huesos, que deben pasar por el tracto digestivo. Ackerman et al. (1984), encontraron una - 75 - relación lineal en una regresión entre la biomasa consumida por hez y el peso de la presa, la que se expresa en la siguiente ecuación: Y = 1.980+0.035*X Ecuación 3.1. Fórmula estimada por Ackerman et al. 1984, para la obtención de factores de corrección para estimar la biomasa consumida de presas por pumas, donde Y representa los kilogramos de presa consumida por hez y X el peso promedio de un individuo adulto de cada presa. Para zorros, se utilizaron los factores de corrección estimados por Lockie (1959) para la especie Vulpes vulpes, un carnívoro de tamaño corporal similar a Pseudalopex culpaeus (pesos corporales de Pseudalopex culpaeus y Vulpes vulpes entre 4-10 y 3-11 Kg, respectivamente, Lariviere y Pasitschniak-Arts 1996, Novaro 1997). La biomasa consumida por pumas y zorros colorados se calculó en base a la siguiente formula: D = (A x C) / SUM (A x C) Ecuación 3.2. Fórmula matemática utilizada para calcular la biomasa consumida de presas, donde D es la biomasa consumida de cada ítem presa, A es la frecuencia de ocurrencia de cada ítem presa y C el factor de corrección de cada ítem presa 3.2.2.3. Variación temporal y entre especies de la dieta Se utilizó la prueba de Chi2, para comparar la frecuencia de ocurrencia de los ítems presa entre años, sitios y especies (Zar 1996, Infostat 2002). 3.2.2.4. Amplitud del nicho trófico Se calculó la amplitud de nicho con el índice de Levin (1968) (Ecuación 3.3), el cual nos determina el grado de especialización en la dieta de las especies. Este índice se calcula con la ecuación: B = 1 / Σpi2 Ecuación 3.3. Índice de Levin utilizada para estimar la diversidad trófica de cada carnívoro, donde B es la medida de amplitud de nicho y pi es la proporción de individuos que utilizan el recurso i. - 76 - No obstante, se utilizó el índice de Levin estandarizado por Colwell y Futuyma (1971) (Ecuación 3.4), para obtener una escala de 0 a 1, donde valores cercanos a 0 corresponden a especies más especialistas, y 1 a especies más generalistas, con la siguiente formula: Bsta = (Bobs - Bmin) / (Bmax - Bmin) Ecuación 3.4. Índice de amplitud de nicho estandarizado por Colwell y Futuyma (1971) para medir la diversidad trófica de cada carnívoro en una escala de 0 a 1, donde Bsta representa la amplitud del nicho trófico, Bobs se calcula mediante la fórmula 1 / Σpi2 (donde pi es la proporción del taxón i en la dieta de una especie de predador), Bmin es el número mínimo posible de diversidad (=1) y Bmax es el máximo posible (=n, que es el número de taxones diferentes consumidos por el predador). 3.2.2.5. Superposición de nicho trófico La similitud o disimilitud trófica entre ambos carnívoros se estimó a partir del índice de superposición de Pianka (1973) (Ecuación 3.5). El índice puede tener valores de 0 (nula) a 1 (total) similitud o superposición en el uso del recurso trófico entre dos predadores. α = Σpi qi / (Σpi 2 Σqi 2) 1/2 Ecuación 3.5. Índice de Pianka usado para estimar cuan diferente o similares son las dietas entre dos especies de carnívoros, donde α es la magnitud de superposición trófica, pi es la proporción de la presa «i» en la dieta de una especie de carnívoro y qi es la proporción de la misma presa en la dieta del segundo carnívoro con que se lo compara. 3.2.2.6. Peso promedio de los mamíferos presa El tamaño de la presa puede influenciar la elección de una presa en particular por parte del predador. Como un método adicional para comparar partición de dieta entre los dos carnívoros, se utilizó el peso promedio de los mamíferos presa. El mismo se calculó a partir de la media aritmética de las masas corporales (Tabla 3.1) de todas las presas individuales encontradas en las heces (Walker et al. 2007). La presencia de ganado mayor y guanacos, fue incluida en el análisis solo para pumas, y excluida del análisis para zorro colorado, ya que asumimos que ésta especie solo carronea sobre presas de tamaño grande. Otros autores (Iriarte et al. 1990, Rau y Jiménez 2002), utilizan el promedio geométrico, sin embargo éste método tiende a subestimar el peso promedio de las presas, siendo el promedio aritmético un cálculo más realista. - 77 - 3.3. Resultados 3.3.1. Recolección e identificación de las heces de puma y zorro colorado Entre los años 2003 y 2008 se recolectaron 934 heces, correspondientes a ambos carnívoros. De las 330 y 604 heces recolectadas para puma y zorro colorado, respectivamente, el 25% y 28%, fueron descartadas en el laboratorio por identificación dudosa, respectivamente (Tabla 3.2). Se analizaron un total de 682 heces, 248 de puma y 434 de zorro colorado. Las heces fueron recolectadas en toda la extensión del Parque Nacional Quebrada del Condorito y en la zona centro y norte de la Reserva Hídrica Provincial de Achala. Tabla 3.2. Detalle de la cantidad de heces de puma y zorro colorado recolectadas en el área de estudio y durante el periodo 2003-2008, y cantidad y porcentaje de heces analizadas en el laboratorio luego de su identificación final. Puma Año Zorro colorado Recolectadas Analizadas % Analizado Recolectadas Analizadas % Analizado 2003 24 23 95,83 80 64 80,00 2004 41 35 85,37 148 114 77,03 2005 84 44 52,38 130 79 60,77 2006 71 50 70,42 62 48 77,42 2007 69 57 82,61 119 69 57,98 2008 41 39 95,12 65 59 90,77 Total 330 248 75,15 604 434 71,85 3.3.2. Caracterización de las heces de puma y zorro colorado Las heces de puma y zorro colorado, fueron fácilmente identificadas basándonos en diferencias morfológicas externas y el diámetro de las mismas entre las dos especies. El diámetro promedio de las heces de cada especie fue diferente. En la caracterización de las heces, no se tuvo en cuenta el largo de las mismas ya que muchas veces no se encontraron todos los fragmentos componentes de una - 78 - muestra individual. Los diámetros medios (DM) y su error estándar asociado (EE) se presentan en la Tabla 3.3. Tabla 3.3. Diámetro medio y error estándar asociado de las heces de puma y zorro colorado medidas cada año en el área de estudio (DM= diámetro medio, EE= error estándar, N= número de heces medidas, el diámetro esta expresado en centímetros) Puma Zorro colorado Año N DM EE N DM EE 2003 14 3,21 0,14 22 2,06 0,08 2004 29 2,90 0,11 36 1,93 0,06 2005 30 3,43 0,07 61 1,95 0,03 2006 39 3,39 0,06 37 1,84 0,05 2007 33 3,29 0,07 61 1,79 0,05 2008 27 3,44 0,08 51 1,84 0,04 Los diámetros de las heces identificadas y analizadas para cada carnívoro no se solaparon en ninguno de los años en que se describió su dieta (Fig 3.2). Dentro de cada especie, se observó una superposición en las medidas de los diámetros de las heces durante todos los años. Se encontraron diferencias significativas en el diámetro de las heces entre puma y zorro colorado en cada uno de los años (p < 0.001, α = 0.05). Fig 3.2. Diámetros medios y error estándar asociado de las heces de puma y zorro colorado analizadas durante el periodo 2003-2008 (diámetro medido en centímetros). - 79 - 3.3.3. Composición de la dieta en el Parque Nacional Quebrada del Condorito 3.3.3.1. Dieta del Puma Frecuencia de ocurrencia de los ítems presa: Se identificaron un total de 371 ítems presas en 234 heces. El 97.8 % de los ítems perteneció al grupo de los mamíferos y el resto a aves. Los mamíferos se dividieron en 14 categorías de ítems presas (Tabla 3.4). La presa más frecuente en la dieta fue el cuis en todos los años, seguido por los roedores cricétidos, excepto en el primer año de análisis donde el consumo de cuises fue seguido por el consumo de liebre europea y luego por el de ganado doméstico y cricétidos en la misma proporción (Tabla 3.4). - 80 - Tabla 3.4. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de puma durante el período 20032008 en el Parque Nacional Quebrada del Condorito Ítems presas 2003 2004 2005 2006 2007 2008 Cricétido 18,18 10,00 15,52 33,71 25,30 33,82 Cuis 39,39 75,00 72,41 42,70 45,78 51,47 Tuco tuco 0,00 2,50 1,72 2,25 4,82 4,41 Mustélido 0,00 0,00 0,00 1,12 2,41 0,00 Marsupial 0,00 0,00 0,00 0,00 1,20 0,00 Vizcacha 0,00 0,00 0,00 1,12 0,00 0,00 Guanaco 0,00 0,00 0,00 0,00 2,41 0,00 Puma 0,00 0,00 1,72 0,00 0,00 0,00 Aves 0,00 0,00 0,00 5,62 2,41 0,00 Reptiles 3,03 0,00 0,00 0,00 0,00 0,00 Total 60,61 87,50 91,38 86,52 84,34 89,71 Liebre 21,21 2,50 5,17 11,24 6,02 4,41 Ganado mayor 9,09 5,00 1,72 0,00 2,41 2,94 Ganado menor 9,09 2,50 1,72 1,12 6,02 2,94 Llama 0,00 0,00 0,00 0,00 1,20 0,00 Antílope 0,00 2,50 0,00 0,00 0,00 0,00 Jabalí 0,00 0,00 0,00 1,12 0,00 0,00 Total 39,39 12,50 8,62 13,48 15,66 10,29 Total ítems 33 40 58 89 83 68 Nº de heces 23 35 44 46 48 38 Nativos Mamíferos Exóticos Mamíferos Biomasa consumida de los ítems presa: Los pumas consumieron más cuises en cuanto a su biomasa en todos los años, seguido por roedores cricétidos, excepto en el año 2003, donde el consumo de ganado doméstico y liebre europea fue mayor que el de cricétidos (Tabla 3.5). - 81 - Tabla 3.5. Porcentaje de biomasa (%B) consumida durante el periodo 2003-2008 por puma. La biomasa se obtuvo a partir de la aplicación del factor de corrección de Ackerman et al. 1984 (Ecuación 3.1) Ítems presas 2003 2004 2005 2006 2007 2008 Cricétido 13,9 8,21 14,31 33,56 21,65 30,45 Cuis 30,4 62 67,26 42,83 39,47 46,68 Tuco tuco 0,00 2,1 1,59 2,24 4,13 3,98 Mustélido 0,00 0,00 0,00 1,15 2,13 0,00 Marsupial 0,00 0,00 0,00 0,00 1,03 0,00 Vizcacha 0,00 0,00 0,00 1,2 0,00 0,00 Guanaco 0,00 0,00 0,00 0,00 4,87 0,00 Puma 0,00 0,00 2,99 0,00 0,00 0,00 Ave 0,00 0,00 0,00 5,59 2,06 0,00 Total 44,3 72,31 86,145 86,576 75,342 81,11 Liebre 17,2 2,2 5,05 11,85 5,46 4,21 Ganado mayor 28,8 17 6,57 0,00 8,55 10,98 Ganado menor 9,8 2,88 2,23 1,57 7,25 3,72 Llama 0,00 0,00 0,00 0,00 3,398 0,00 Antílope 0,00 5,67 0,00 0,00 0,00 0,00 Jabalí 0,00 0,00 0,00 5,05 0,00 0,00 Total 55,8 27,75 13,85 18,47 24,658 18,91 Nativos Mamíferos Exóticos Mamíferos Los pumas consumieron más pequeños mamíferos ya sea por su frecuencia o biomasa consumida. La representación de presas más grandes como el ganado doméstico presentó fluctuaciones y disminuyó a lo largo de los años, observándose un patrón contrario con las presas pequeñas (Fig 3.3). - 82 - Fig 3.3. Biomasa de presas principales consumidas cada año por puma dentro del Parque Nacional Quebrada del Condorito. 3.3.3.2 Dieta del zorro colorado Frecuencia de ocurrencia de los ítems presa: Se encontraron un total de 533 ítems en 370 heces. El 97.6 % de los ítems perteneció al grupo de los mamíferos y el 2.4% a las aves. Los mamíferos se dividieron en 7 categorías de ítems presas. La presa más frecuente fue el cuis, representando entre un 50 y un 70 % de la dieta, seguido por los roedores cricétidos (Tabla 3.6). La presencia de ganado mayor en las heces, se debe a que éstos carnívoros pueden carroñar sobre animales muertos. - 83 - Tabla 3.6. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de zorro colorado durante el periodo 2003-2008 en el Parque Nacional Quebrada del Condorito Ítems Presa 2003 2004 2005 2006 2007 2008 Cricétidos 19,12 23,73 30,93 36,49 41,41 33,77 Cuis 63,24 74,58 67,01 54,05 45,45 51,95 Tuco tuco 0,00 0,00 2,06 2,70 6,06 6,49 Mustélido 1,47 0,00 0,00 0,00 2,02 0,00 Aves 2,94 0,00 0,00 4,05 3,03 2,60 Total 86,76 98,31 100,00 97,30 97,98 94,81 Liebre 10,29 0,00 0,00 2,70 1,01 1,30 Ganado mayor (carroña) 0,00 0,00 0,00 0,00 1,01 1,30 Ganado menor 1,47 0,00 0,00 0,00 0,00 2,60 Total 11,76 0,00 0,00 2,70 2,02 5,19 Total ítems 68 118 97 74 99 77 Nº de heces 49 90 74 48 58 51 Nativos Mamíferos Exóticos Biomasa consumida de los ítems presa: Los zorros colorados consumieron más cuises en cuanto a su biomasa en todos los años, seguido por roedores cricétidos, el consumo de ganado fue bajo y no se observó en todos los años (Tabla 3.7). - 84 - Tabla 3.7. Porcentaje de biomasa (%B) consumida durante el periodo 2003-2008 por zorro colorado. La biomasa se obtuvo a partir de la aplicación del factor de corrección de Lockie (1959). Ítems presa 2003 2004 2005 2006 2007 2008 Cricétidos 11,3 14,3 18,9 23,1 28,0 21,1 Cuis 71,6 85,7 78,6 65,4 58,8 62,1 Tuco tuco 0,00 0,00 2,7 3,3 7,9 7,8 Ave 3,4 0,00 0,00 5,0 4,0 3,2 Total 86,3 100 100 96,8 98,7 94,2 Liebre 11,4 0,00 0,00 3,2 1,3 1,5 Ganado menor 2,3 0,00 0,00 0,00 0,00 4,3 Total 13,7 0,00 0,00 3,2 1,3 5,8 Nativos Mamíferos Exóticos Los zorros colorados consumieron más pequeños mamíferos ya sea por su frecuencia o biomasa consumida. Los cuises representan un promedio de dos tercios de la dieta en todos los años analizados, mientras que el consumo de presas más grandes no fue considerable (Fig 3.4). - 85 - Fig 3.4. Presas principales consumidas cada año por zorro colorado según su biomasa consumida en el Parque Nacional Quebrada del Condorito. 3.3.4 Composición de la dieta en la Reserva Hídrica Provincial de Achala La cantidad de heces encontradas en la reserva fue menor a la del parque, principalmente para el caso de los pumas. Se presentan los datos con un objetivo descriptivo, y en los casos en que el número de muestras fue suficiente se analizaron diferencias entre especies y áreas. 3.3.4.1. Dieta del Puma Frecuencia de ocurrencia de los ítems presa: Se identificaron un total de 22 ítems presas en 11 heces en los años 2006 y 2007, separados en 6 categorías de presas. Todos los ítems presa correspondieron al grupo de los mamíferos. Los mamíferos se dividieron en 6 categorías de ítems presas (Tabla 3.8). El ganado menor fue el ítem más consumido durante los dos años, seguidos por las liebres en el año 2006 y los pequeños mamíferos durante el 2007. No se encontró consumo de ganado mayor. - 86 - Tabla 3.8. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de puma en los años 2006 y 2007 en la Reserva Hídrica Provincial de Achala. Ítems presa 2006 2007 Cricétido 0 25 Cuis 0 25 Guanaco 0 6,25 Total 0 56,25 33,33 6,25 50 37,5 16,67 0 100 43,75 Total ítems 6 16 Nº de heces 4 7 Nativos Mamíferos Exóticos Liebre Ganado menor Antílope Total Biomasa consumida de los ítems presa: Los pumas consumieron más ganado menor en cuanto a su biomasa en todos los años, seguido por antílope y liebre en el año 2006, y pequeños mamíferos y guanaco durante el 2007 (Tabla 3.9). - 87 - Tabla 3.9. Porcentaje de biomasa (%B) consumida durante los años 2006 y 2007 por puma en la Reserva Hídrica Provincial de Achala. La biomasa se obtuvo a partir de la aplicación del factor de corrección de Ackerman et al. 1984 (Ecuación 3.1) Ítems presa 2006 2007 Cricétidos 0 20,12 Cuis 0 20,27 Guanaco 0 11,27 Total 0 51,66 Liebre 23,28 5,33 Ganado menor 46,39 42,42 Antílope 30,35 0 Total 100,00 47,75 Nativos Mamíferos Exótica El ganado menor, dominó la dieta de los pumas fuera del área protegida ya sea por su frecuencia o biomasa consumida, mientras que los pequeños mamíferos tuvieron una representación de menor magnitud con respecto a la dieta dentro del parque (Fig 3.5). Fig 3.5. Biomasa de presas principales consumidas en los años 2006 y 2007 por puma en la Reserva Hídrica Provincial de Achala. - 88 - 3.3.4.2. Dieta del Zorro colorado Frecuencia de ocurrencia de los ítems presa: Se identificaron un total de 102 ítems presas en 61 heces entre los años 2003 y 2008. El 94% de los ítems presa correspondieron al grupo de los mamíferos y el resto a aves. Los mamíferos se dividieron en 5 categorías de ítems presas (Tabla 3.10). Los cricétidos fueron más consumidos durante los años 2003, 2007 y 2008, seguido por los cuises. Mientras que durante los años 2004 y 2005, fueron más consumidos los cuises, seguidos por los cricétidos. No se encontró consumo de ganado doméstico mayor. Tabla 3.10. Porcentaje de ocurrencia (%O) de los ítems presas identificados en la dieta de zorro colorado en el periodo 2003-2008 (excepto durante el año 2006) en la Reserva Hídrica Provincial de Achala. Ítems presa 2003 2004 2005 2007 2008 Cricétido 50,00 41,67 25,00 47,62 53,33 Cuis 27,27 41,67 62,50 38,10 40,00 Mustélido 0,00 0,00 0,00 4,76 0,00 Aves 4,55 8,33 12,50 0,00 6,67 Total 81,82 91,67 100,00 90,48 100,00 Liebre 13,64 5,56 0,00 4,76 0,00 Ganado menor 0,00 2,78 0,00 4,76 0,00 Total 13,64 8,33 0,00 9,52 0,00 Total ítems 22 36 8 21 15 Nº de heces 15 22 5 11 8 Nativos Mamíferos Exóticos Biomasa consumida de los ítems presa: Los zorros colorados consumieron más cuises en cuanto a su biomasa en todos los años, seguidos por los cricétidos (Tabla 3.11). - 89 - Tabla 3.11. Porcentaje de biomasa (%B) consumida en los periodos 2003-2005 y 2007-2008 por zorro colorado en la Reserva Hídrica Provincial de Achala. Ítems presa 2003 2004 2005 2007 2008 Cricétidos 36,6 26,8 14,79 33,53 37,32 Cuis 38,2 51,3 70,74 51,32 53,55 Ave 6,5 10,5 14,47 0 9,13 Total 81,3 88,6 100 84,85 100 18,7 6,7 0 6,57 0 0 4,7 0 8,89 0 18,7 11,4 0 15,46 0 Nativos Mamíferos Exóticos Liebre Ganado menor Total Los cuises representaron la principal presa en la dieta en cuanto a biomasa consumida en todos los años, y se observó mayor consumo de aves que en el parque, mientras que las presas exóticas consumidas fueron las liebres y el ganado menor en una baja proporción (Fig 3.6). - 90 - Fig 3.6. Biomasa de presas principales consumidas cada año por zorro colorado en la Reserva Hídrica Provincial de Achala. 3.3.5. Variación anual de la dieta Desde el año 2003 se observó un mayor consumo de ítems presas por parte de ambos carnívoros dentro del área protegida donde se retiró casi la totalidad del ganado doméstico. Sin embargo, en la reserva, donde la abundancia de ganado doméstico se mantiene, la cantidad de ítems presas incorporados en la dieta fue menor, en especial para los pumas (Fig 3.7). - 91 - Fig 3.7. Variación anual de los ítems presas consumidos por puma y zorro colorado dentro y fuera del área protegida (# ítems: total de presas consumidas en ese año). La dieta de los pumas dentro del parque fue diferente entre años (p=0.029, gl= 75, α=0.05), igual que en el caso de los zorros (p<0.0001, gl=40, α=0.05). Se encontraron diferencias en la dieta entre pumas y zorros colorados dentro del parque (p<0.0001, gl= 187, α=0.05). La dieta de los zorros en la reserva no difirió entre años (p=0.71, gl=24, α=0.05), y no se calculó para pumas por el número bajo de heces. 3.3.6. Amplitud del nicho trófico La diversidad trófica en la dieta de ambos carnívoros fue menor en el parque, observándose un comportamiento más especialista en comparación con la reserva (Tabla 3.12). - 92 - Tabla 3.12. Valores de amplitud de nicho trófico de puma y zorro colorado dentro y fuera del área protegida. La amplitud del nicho trófico se obtuvo a partir de la ecuación de Colwell & Futuyma (1971) (Ecuación 3.4), donde valores cercanos a 0 corresponden a especies más especialistas y 1 a especies más generalistas. Puma Zorro colorado Año Parque Reserva Parque Reserva 2003 0,60 - 0,25 0,63 2004 0,12 - 0,63 0,45 2005 0,14 - 0,42 0,57 2006 0,27 0,79 0,33 - 2007 0,25 0,66 0,27 0,41 2008 0,32 - 0,26 0,61 3.3.7. Superposición del nicho trófico La superposición de la dieta entre pumas y zorro colorado fue muy alta dentro del parque todos los años (Tabla 3.13). El menor valor de superposición en las dietas se observo el primer año de estudio donde el consumo de ganado fue mayor, principalmente en los pumas. Tabla 3.13. Superposición de nicho trófico estimado para puma y zorro colorado por año en el Parque Nacional Quebrada del Condorito. El índice se obtuvo a partir de la ecuación de Pianka (Ecuación 3.5), donde 0 indica que no hay superposición y 1 superposición completa. Puma Zorro colorado 2003 2004 2005 2006 2007 2008 0,92 0,98 0,97 0,98 0,96 0,99 La superposición de las dieta entre puma y zorro colorado fuera del parque, solo se estimó para el año 2007. El índice de Pianka estimado fue de α = 0.73, observándose una superposición trófica más baja en la reserva que en el parque, durante ese año. - 93 - 3.3.8. Peso promedio de los mamíferos presa Como era de suponer, el peso medio de los mamíferos presa fue mayor en pumas debido a su mayor tamaño y preferencia por ungulados grandes. Sin embargo, el peso promedio de las presas fue mayor en la reserva que dentro del parque por parte de los dos carnívoros (Tabla 3.14). Tabla 3.14. Peso medio de mamíferos presa (Kg) para puma y zorro colorado en el Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala durante el período 2003-2008. Parque Reserva Puma Zorro colorado Puma Zorro colorado 2003 19,78 1,03 0,67 2004 12,41 0,35 1,13 2005 4,85 0,32 0,34 2006 3,36 0,37 29,30 2007 9,81 0,32 13,78 2008 6,32 0,94 1,54 0,22 El peso promedio de presas para los pumas disminuyó a medida que pasaron los años dentro del parque y la reserva, patrón que no se observó con la misma tendencia para zorro colorado (Fig 3.8). Fig 3.8. Patrón manifestado por el peso medio de mamíferos presa de puma y zorro colorado dentro del Parque nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala durante el período 2003-2008. - 94 - 3.4. Discusión Los roedores pequeños constituyen la mayoría de las presas consumidas por puma y zorro colorado. Ésta dieta estaría asociada a efectos directos e indirectos del ganado doméstico, ya que ambos carnívoros, mostraron una clara respuesta a su remoción dentro del parque, donde en consecuencia debieron incorporar otro tipo de presas. Éste cambio de un mayor consumo de presas exóticas, como el ganado doméstico y liebres, a un mayor consumo de presas nativas pequeñas, como los cávidos y cricétidos, denota un comportamiento generalista en los pumas de presas grandes a presas pequeñas. Sin embargo, con el paso de los años ambos carnívoros tendieron a especializar su dieta al consumo de presas nativas pequeñas, como lo demuestra la baja diversidad y alta superposición de la dieta y disminución del peso promedio de las presas consumidas. Al parecer, la modificación en la dieta de ambos carnívoros a lo largo de los años, se debe a cambios en la disponibilidad de presas de acuerdo con el proceso de remoción del ganado y la reintroducción de herbívoros nativos grandes dentro del parque. La remoción del ganado influencia directamente la dieta, por la desaparición de una presa grande antes consumida, e indirectamente, porque causa el aumento de la abundancia de mamíferos pequeños, por la proliferación de biomasa vegetal que utilizan como refugio y alimento (Branch et al. 1996, Pia et al. 2003). En éste contexto, las diferencias encontradas en ambos carnívoros dentro y fuera del parque, son razonables. Las presas nativas pequeñas demostraron ser un recurso muy importante cuando disminuye la disponibilidad de presas medianas o grandes, ya que tanto pumas como zorros predaron principalmente sobre los cávidos y cricétidos dentro del parque y con una tendencia creciente. Se observó también, una disminución en el consumo de liebres, posiblemente por una reducción de su densidad dentro del parque debido a que el aumento de biomasa vegetal mencionado anteriormente, ocasionó el avance de los pajonales a áreas abiertas donde habitan preferentemente las liebres. También se observaron diferencias en el consumo de tucos, ya que fueron consumidos solo en el parque de manera creciente con los años. La ausencia de tucos en la dieta de éstos carnívoros en la reserva, puede estar asociado al sobrepastoreo causante de la compactación de suelos, destrucción de refugios utilizados por ésta especie, y disminución del hábitat óptimo para su distribución (Pia et al. 2003). A pesar del consumo de mamíferos pequeños en la reserva, también, se observó un aumento en el consumo de liebres, más consumo de aves por zorros, y más consumo de ganado por pumas, en relación al parque. En consecuencia, la proporción de especies exóticas medianas y grandes en la dieta de pumas y zorros, disminuyeron un 30 % y un 7 %, respectivamente dentro del parque, y en la - 95 - reserva, los pumas consumieron un 20 % más de especies exóticas para el mismo año que en el parque, mientras que la tendencia en los zorros fue la de disminuir el consumo de presas exóticas. La dieta fue más diversa en la reserva que en el parque en ambos carnívoros. Mientras que la superposición trófica entre pumas y zorros colorados dentro del parque fue alta (entre el 92 y el 99%). La presencia de ungulados grandes como ciervos en la dieta se debe a pumas que poseen sus territorios comprendiendo tanto parte del parque como de la reserva, motivo por el cual tienen acceso a presas más grandes como los ciervos presentes en cotos de caza aledaños al parque. En la reserva, la superposición de la dieta fue del 70% durante el año 2007, presentando un solapamiento mas bajo en comparación con el mismo año dentro del parque, lo que reafirma la importancia de las presas grandes para el puma. La respuesta de la dieta a cambios en la base de presa nos indica que cuando un predador se encuentra con una reducción en la disponibilidad de presas energéticamente más rentables, debe alimentarse de presas de menor calidad. Éstos resultados, son distintos a aquellos encontrados en ambas especies en el sur de Sudamérica, donde los guanacos y las liebres son por lejos las presas más importantes, y son consumidos a niveles esperados (Iriarte 1990). Sin embargo, en Pampa de Achala, las bajas densidades de liebres y guanacos, tal vez forzaron a los pumas a reducir su base de presas a especies más abundantes como los pequeños mamíferos, concluyendo como en otros trabajos, que ambos son predadores generalistas, capaces de alimentarse de un amplio rango de presas. Sin embargo, el guanaco es una presa importante para el puma, ya que cuando fue reintroducido dentro del parque, se registraron niveles altos de predación (34 %, en Schneider y Aprile 2009), consumo reflejado también en la dieta. La reintroducción de herbívoros nativos grandes afecta directamente a los pumas principalmente por ser integrante de su base de presas, sin embargo constituye solo una presa eventual debido a su baja disponibilidad. La escasa representación de ganado doméstico en la dieta de ambos carnívoros refleja las bajas densidades de éstas presas dentro del parque y no una evitación de ellas, como se observa en los datos preliminares de dieta obtenidos para la reserva. La dieta descripta en ambos predadores, puede enmarcarse en ciertos aspectos de la teoría de forrajeo óptimo y partición del recurso. Debido a que, ante una baja densidad de la presa energéticamente más rentable, se alimenta de una presa más abundante pero pequeña, por representar la búsqueda de presas más grandes en baja densidad, una elevada pérdida energética. Esto podría estar ocurriendo con los carnívoros dentro del parque, ya que consumieron presas pequeñas las que se encuentran en mayor abundancia que dentro de la reserva, y fuera del parque incorporaron una mayor proporción de presas medianas y grandes que se encuentran en mayor abundancia que dentro del parque. A pesar de la tendencia al consumo de presas pequeñas, los pumas consumieron presas medianas y grandes en más oportunidades que los zorros, reflejado en el - 96 - menor número de ítems presas consumidas y mayor peso promedio de presas consumidas por ambos carnívoros. El comportamiento alimenticio en los pumas es distinto al que se describió en otras partes del país donde consume preferentemente ungulados grandes como el guanaco (Iriarte et al. 1991, Pia y Novaro 2005, Fernández 2007, Donadio et al. 2010), o especies introducidas grandes y medianas cuando sus presas naturales se encuentran ecológica o geográficamente extintas (Rau et al. 1991, Novaro et al. 2000, Rau y Jiménez 2002). En Norteamérica y México, los pumas consumieron más presas grandes, en Brasil, Perú, Paraguay, Bolivia y centro y sur de Chile se alimentaron principalmente de presas medianas o chicas y en Centroamérica consumieron presas pequeñas (Iriarte et al. 1990, Pacheco et al. 2004b). Históricamente, los camélidos autóctonos representaron la principal presa de los pumas en gran parte de la Argentina, pero ésta interacción se perdió en gran parte de su rango de simpatría debido a la drástica disminución en las poblaciones de los camélidos silvestres (>90%, en Donadio et al. 2010). Los estudios de dieta que evidencian cambios en la selección de presas de los pumas hacia presas alternativas cuando sus presas preferidas son escasas, prueban la alteración a ésta interacción. Esto se observó al sur de Chile donde los pumas consumen más liebres cuando las densidades de guanacos son bajas (Iriarte 1990), y en La Pampa donde ante una declinación en las poblaciones de vizcachas, los pumas consumieron presas no registradas anteriormente para esa zona como ganado y pequeños mamíferos, diversificando así su dieta (Branch et al. 1996, Pessino et al. 2001). Y coincide con lo observado en éste estudio, donde los pumas consumieron más presas pequeñas ante la declinación de presas grandes y donde también incorporaron presas antes no registradas para el área de estudio. La dieta del zorro colorado en las áreas estudiadas del pastizal de altura está compuesta principalmente por presas nativas, como se encontró en la puna Argentina (Walker et al. 2007), la reserva de la Payunia (Berg 2007) y en estudios anteriores realizados en Pampa de Achala (Pia et al. 2003), y contrario a lo que sucede en la estepa patagónica (Novaro et al. 2000, Pia y Novaro 2005). Comparando los datos de dieta de éste estudio y los obtenidos por Pia et al. (2003) en el mismo sitio, se observó una disminución en el consumo de liebres y un aumento en el consumo de cuises dentro del parque, mientras que en la reserva consumieron más cricétidos y menos cuises y liebres, por lo que el patrón de la dieta de zorros en la reserva no sufrió modificaciones destacables. El mayor consumo en presas nativas, indica que dentro del parque, y en menor proporción fuera del mismo, la base de presas nativas para los zorros, se encuentra más intacta o en franca recuperación, y que el bajo consumo de liebres se debe a que su densidad es menor que en otras partes del país (9-13 versus 47 liebres/km2 en Patagonia, en Pia et al. 2003). Otra evidencia del efecto de la remoción del ganado doméstico es el aumento en el número de ítems presas consumidas a través de los años, a la - 97 - disminución del peso promedio de presas en pumas principalmente, y a la baja diversidad y alta superposición de la dieta entre ambos carnívoros. Esto se refleja notablemente cuando comparamos los datos de dieta de ambos predadores en la reserva, donde ocurre lo opuesto. Sin dudas, se observa una mayor preferencia de los pumas por presas grandes como ocurre en otros sitios. Como así también, el consumo de presas alternativas cuando las presas preferidas no se encuentran disponibles. El peso promedio de las presas consumidas, nos refleja el mayor interés por presas medianas y grandes por parte del puma, ya que cuando éstas se encuentran disponibles son consumidas. Sin embargo en éste estudio el peso promedio de las presas para los pumas es mucho menor al observado en otras zonas como Norteamérica (39.8-47.8 kg), Chile (29 kg), Brasil (32.4 kg), y México (25.2 kg) (Iriarte et al. 1990), y es solo comparable con los obtenidos para Centroamérica, Perú, Paraguay, y La Pampa Argentina (entre 0,4 y 12,7 Kg, Iriarte et al. 1990, Branch et al. 1996). Si bien ésta disminución en el peso promedio de las presas puede estar asociado a una menor disponibilidad de presas grandes o ausencia de las mismas, también puede deberse a un menor tamaño corporal de los pumas a medida que nos acercamos al ecuador. Ésta relación directa, fue explicada en Iriarte et al. (1991), donde también observaron una relación inversa entre la amplitud de nicho y el peso de las presas, por ejemplo en Norteamérica se observó una amplitud dietaria baja y un peso de las presas mayor que en Sudamérica. Sin embargo nuestros datos y los de Branch et al. (1996), indican que el tamaño pequeño de presas y una dieta diversa no están siempre relacionados. La coexistencia de éstos carnívoros parece estar facilitada por la partición del recurso alimenticio en la reserva, pero no dentro del parque, y la competencia interespecífica podría estar siendo evitada por otros mecanismos como diferentes patrones de actividad y la gran capacidad de reproducción de su presa principal. La competencia por el recurso se evidencia con las disminuciones en el peso promedio de las presas con el paso de los años, ya que los pumas comenzaron a incorporar presas pequeñas a la dieta en relación a otros años. Los pesos promedios de presas obtenidos para zorros, son clara evidencia de la alteración en la base de presas original, la que se mostró casi invariable con el correr de los años, ya que el ensamble de sus presas, sufrió fluctuaciones en la abundancia pero no en la diversidad de las mismas. Por lo que en mayor o menor medida, los zorros tuvieron una oferta de presas más estable que los pumas. Sin duda, éstos resultados nos demuestran que cuando se encuentran disponibles, los predadores grandes consumen presas grandes y los predadores medianos presas pequeñas. En conclusión, el puma se comportó como un predador generalista, cambiando sus hábitos alimenticios ante cambios en la disponibilidad de presas grandes, adquiriendo en su lugar, gran importancia las presas pequeñas, y demostrando cierto grado de especialización. La selectividad de presas pequeñas puede responder a un fenómeno local en ambos carnívoros, ya que ambos fuera del - 98 - parque consumen presas de mayor tamaño. Las presas nativas fueron más importantes en la dieta de ambos predadores, excepto para los pumas en la reserva, no obstante también mostraron una tendencia a especializar sus hábitos alimenticios al consumo de presas pequeñas. Al parecer éstos carnívoros se vieron beneficiados por la creación del parque nacional (principalmente los zorros colorados) en cuanto a su conservación, sin embargo el ensamble de presas se encuentra aún alterado, por lo que futuros estudios son necesarios para conocer la interacción predador-presa bajo las actuales circunstancias de disponibilidad del recurso. También el parque, influencia positivamente a ambos carnívoros, por provocar un menor consumo de ganado lo que ayuda a disminuir el conflicto con los humanos. Los resultados de éste estudio apoyan la hipótesis de otros trabajos donde, por ser más abundantes, una presa alternativa se convierte en una presa fácil para los carnívoros, desplazando a presas más redituables en su lugar. Debido a esto, la ecología trófica de los carnívoros cambió sustancialmente a cómo era originariamente (Iriarte et al. 1990, Novaro et al. 2000, Pessino et al. 2001, Rau y Jiménez 2002). Estos estudios y lo observado en la presente tesis, evidencian que sin importar que se trate de especies nativas o exóticas los pumas acceden a presas de gran tamaño cuando éstas son accesibles debido a sus requerimientos energéticos, como quedó demostrado por el consumo de guanacos dentro del parque y el consumo de ganado doméstico en la reserva. Los resultados son alentadores en términos de la capacidad de recuperación de al menos algunos componentes del ensamble de mamíferos predador-presa en el pastizal de Achala y Sierras Grandes. Se observó, que el efecto de la ganadería en la abundancia de pequeños mamíferos (cricétidos, cávidos y ctenómidos), y la dieta de ambos carnívoros puede revertirse rápidamente, teniendo en cuenta el escaso tiempo que pasó desde la remoción del ganado en el parque. A raíz de todos los años de estudio podemos concluir que el ensamble de éstos mamíferos demostró una notable resiliencia al efecto de la exclusión del ganado en el parque nacional, principalmente en los pequeños mamíferos y los zorros colorados. La drástica modificación en la base de presas como resultado de una declinación global de los ungulados nativos y la introducción extensiva de presas exóticas de mano del hombre, son responsables del escaso consumo de presas nativas medianas y grandes, provocando un cambio en el rol de nuestros carnívoros nativos. Sin embargo, estudios sobre los mecanismos que estarían actuando para evitar la competencia interespecífica entre éstos dos carnívoros son necesarios. - 99 - CAPITULO IV. Conclusiones generales El rol del puma y zorro colorado en el ecosistema, ha sido modificado a lo largo de cientos de años en gran parte del país, debido a cambios inducidos por el hombre en su base de presas y disponibilidad de hábitat apto para sobrevivir (Walker y Novaro 2010). Como pudimos observar, los modelos explicativos solo nos describen en forma simple cómo las variables se relacionan con la ocurrencia de una especie. En ésta tesis, se obtuvo un primer enfoque, donde se encontró que ambos carnívoros consistentemente evitan áreas cercanas a las viviendas humanas y sin cobertura vegetal, y que a su vez, prefieren áreas con protección activa de conservación (parque nacional). Por lo tanto, las zonas con escasa cobertura vegetal y cercanas a la presencia humana, se espera representen zonas de riesgo o barreras para el movimiento de éstos carnívoros. A pesar de la existencia de diferentes categorías de áreas protegidas en las sierras de Córdoba, solo el parque nacional posee un control activo, y por el contrario, en la reserva se mantienen las prácticas tradicionales productivas y de persecución de carnívoros ante la predación de ganado. El parque nacional es único en su tipo en la provincia, y su tamaño es relativamente pequeño, teniendo en cuenta los requerimientos de los carnívoros, careciendo de conectividad con otras áreas protegidas de la misma categoría. En consecuencia ésta área podría actuar como refugio por sus condiciones ambientales favorables y disponibilidad de presas, el cual se encuentra más intacto para zorro colorado que para los pumas (por la escasez de presas medianas y grandes). Teniendo en cuenta la alteración en la base de presas, el puma se comportó como un predador generalista, cambiando sus hábitos alimenticios ante cambios en la disponibilidad de presas grandes, adquiriendo en su lugar, gran importancia las presas pequeñas por ser más abundantes, sugiriendo cierto grado de especialización dentro del parque. Sin embargo, con el paso de los años ambos carnívoros tendieron a enfocar su dieta al consumo de presas nativas pequeñas. Ésta selección podría responder a un fenómeno local en ambos carnívoros, ya que fuera del parque consumen presas de mayor tamaño o diversifican más su dieta. La respuesta de la dieta a cambios en la base de presa nos indica que cuando un predador se encuentra con una reducción en la disponibilidad de presas energéticamente más rentables, debe alimentarse de presas de menor calidad (Rosenzweig 1968). En Pampa de Achala, las bajas densidades de presas silvestres medianas y grandes, forzaron a los pumas a cambiar su dieta a especies más abundantes como los pequeños mamíferos, sin embargo, el guanaco es una presa importante para el puma, ya que cuando fue reintroducido dentro del parque fueron consumidos por los pumas. La escasa representación de ganado doméstico en la dieta de ambos carnívoros refleja las bajas densidades de éstas presas dentro del parque y no una evitación de ellas, como nos indican los datos preliminares de dieta obtenidos para la reserva donde el consumo es mayor. La dieta descripta en ambos carnívoros, puede enmarcarse en ciertos aspectos de la teoría de forrajeo óptimo y partición del recurso, ya que ante una baja densidad de la presa energéticamente más rentable, se - 100 - alimenta de una presa más abundante pero pequeña, por representar la búsqueda de presas más grandes en baja densidad una elevada pérdida energética. Esto podría estar ocurriendo con los carnívoros dentro del parque, ya que consumieron presas pequeñas, las que se encuentran en mayor abundancia que en la reserva, y fuera del parque incorporaron una mayor proporción de presas medianas y grandes, las que están más representadas. A pesar de la tendencia al consumo de presas pequeñas, los pumas consumieron presas medianas y grandes en más oportunidades que los zorros, reflejado en el menor número de ítems presas consumidas y mayor peso promedio de presas consumidas por ambos carnívoros. Sin dudas, se observa una preferencia mayor de presas grandes por los pumas como ocurre en otros sitios. Como así también, el consumo de presas alternativas y diversificación de su dieta cuando las presas más redituables no se encuentran disponibles. Debido a que, el efecto de los disturbios ambientales produce cambios en la composición y distribución de las especies, en casos de endemismos, ésta distribución se reduce con especial o mayor impacto (Hirzel y Le Lay 2008). El zorro colorado endémico de Achala, al ser más pequeño, requerir menos recursos para su reproducción y supervivencia, y poseer su base de presas relativamente intacta, aparenta una mejor respuesta a las alteraciones en el ambiente que los pumas. Sin embargo, y dado a su carácter de endémico, cualquier disturbio importante en su área de distribución podría afectarlo sensiblemente, motivo por el cual, la protección de las Sierras Grandes es crucial para la perpetuidad de ésta subespecie. Incendios a gran escala en el área de estudio podrían significar un grave impacto directo sobre la población de zorro colorado, e indirecto por la muerte de sus presas principales y disminución de la cobertura vegetal. En éste contexto, el parque nacional, representa un área clave para la continuidad de ésta subespecie endémica, dada sus condiciones de protección ambiental y control de incendios que se realiza en su interior. La situación pasada y actual del puma en la provincia de Córdoba está poco documentada, sin embargo, las denuncias a entes oficiales de contacto con humanos, mascotismo y predación de ganado doméstico han aumentado. Futuros estudios son necesarios para conocer los motivos, pero la reducción de sus espacios naturales por el avance de la frontera agropecuaria y de las urbanizaciones, pueden ser la causa de que el contacto con los humanos sea cada vez mayor. En éste estudio se pudo comprobar, como se observó en el sur del país, que los pumas poseen la clásica adaptabilidad, cambiando su dieta en relación al cambio en sus presas, y dispersándose para reocupar áreas donde una vez fueron perseguidos, como el parque nacional. Por éste motivo, la caza de ésta especie para evitar conflictos no representa una solución viable, ya que no asegura la eliminación del problema. En su lugar, un manejo ganadero que evite el acceso de los carnívoros al ganado, la recuperación de sus presas nativas, y, un control activo de las áreas protegidas ya existentes que aseguren la disponibilidad de refugio y alimento, podrían aportar a la conservación de ésta especie y a la mitigación del conflicto. En cuanto a la coexistencia de las dos especies, ésta parece estar facilitada por la partición del recurso alimenticio en la reserva, pero no dentro del parque, y la competencia interespecífica podría estar siendo evitada - 101 - por otros mecanismos como diferentes patrones de actividad y la gran capacidad de reproducción de su presa principal. La alta tasa de reproducción y el aumento en la abundancia de sus presas pequeñas, representan una fuente continua de alimento para ambos carnívoros dentro del parque. Según estudios realizados en las Sierras Grandes, las densidades relativas de los zorros es mayor que la de los pumas en ambos sitios, los pumas poseen un rango horario nocturno más estrecho que los zorros, donde éstos últimos incluyen el atardecer y amanecer a sus horas de mayor actividad, y ambos carnívoros utilizan de manera similar los diferentes tipos de hábitat, observándose una mayor tendencia de uso de quebradas y bosques por los pumas y de pampas y pajonales por los zorros (Pia, datos no publicados). Sin embargo los zorros colorados son especies exclusivamente de altura, aproximadamente desde los 1800 msnm, y los pumas son especies más generalistas, que recorren extensiones muy amplias, pudiéndoselo encontrar en todo el gradiente altitudinal de las sierras. Otra característica que tal vez permita la coexistencia entre éstos carnívoros simpátricos, es la ausencia o muy baja densidad de otros carnívoros en la zona que compitan también por el recurso, ya que el zorro gris se distribuye en menores alturas que el zorro colorado, y la presencia de gatos medianos en el área de estudio es rara. Esto podría significar una respuesta evolutiva a la competencia interespecífica, que resultó en una separación espacial del ensamble de carnívoros de las sierras, y futuros estudios aportaran a corroborarlo. Éstos carnívoros se vieron beneficiados por la creación del parque nacional en cuanto a su conservación, sin embargo el ensamble de sus presas aún se encuentra alterado, por lo que futuros estudios son necesarios para conocer la interacción predador-presa bajo las actuales circunstancias de disponibilidad del recurso. También el parque, influencia positivamente a ambos carnívoros, por provocar un menor consumo de ganado lo que contribuye a disminuir el conflicto con los humanos. - 102 - CAPITULO V. BIBLIOGRAFIA Ackerman BB, Lindzey FG y Hemker TP 1984. Cougar food habits in southern Utah. Journal of Wildlife Management, 48 (1): 147-155. Altrichter M, Boaglio G y Perovic P 2006. The decline of jaguars Panthera onca in the Argentine Chaco. Oryx, 40: 302–309 Anderson AE 1983. A critical review of literatura on puma (Felis concolor). Colorado Division of Wildlife, Special Report Nº 54. Aryal A, Sathyakumar S y Kreigenhofer B 2010. Opportunistic animal’s diet depend on prey availability: Spring dietary composition of the red fox (Vulpes vulpes) in the Dhorpatan hunting reserve, Nepal. Journal of Ecology and the Natural Environment, 2 (4): 59-63. Azevedo FCC, Lester V, Gorsuch W, Lariviere S, Wirsing AJ y Murray DL 2006. Dietary breadth and overlap among five sympatric prairie. Carnivores Journal of Zoology, 269: 127–135 Azevedo FCC y Murray DL 2007. Spatial organization and food habits of jaguars (Panthera onca) in a floodplain forest. Biological Conservation, 137: 391-402. Azevedo FCC 2008. Food Habits and Livestock Depredation of Sympatric Jaguars and Pumas in the Iguacu National Park Area, South Brazil. Biotrópica, 40 (4): 494-500. Begon M, Harper JL y Townsend CR 1990. Ecology, individuals, populations and communities (2° Ed). Blackwell Scientific Publications, Cambridge. 945 pp. Beier P y Cunningham SC 1996. Power of track surveys to detect changes in cougar populations. Willife Society Bulletin, 24: 540-546. Beldoménico PM, Kinsella JM, Uhart MM, Gutierrez GL, Pereira J, Ferreira HV y Marrull CA 2005. Helmintos of geoffroyi`cats (Carnivora, Felidae) from the monte desert, central Argentina. Acta Parasicológica, 50: 263-266. Bellati J 1986. Prevención y control del daño producido por el zorro colorado en la Patagonia. INTA EEA Bariloche, Fauna Silvestre 63 pp. Bellati y von Thungen 1988. Mortalidad de corderos de hasta dos meses de edad en el oeste de la Provincia de Rio Negro. Revista Argentina de Producción Animal, 8(4): 359-363. Berg JE 2007. The carnivore assemblage of la Payunia Reserve, Patagonia, Argentina: dietary niche, prey availability, and selection. Master Thesis, University of Montana, 38 pp. Berta A 1987. Origin, diversification and zoogeography of the South American Canidae. Fieldiana Zoology, 39: 455-471. Branch LC, Pessino M y Villareal D 1996. Response of pumas to a population decline of the plains vizcacha. Journal of Mammalogy, 77 (4): 1132-1140. - 103 - Cabido, M. y A. Acosta, 1985. Estudio fitosociológico en bosques de Polylepis australis BITT. (“Tabaquillo”) en las Sierras de Córdoba. Argentina. Documents Phytosociologiques N.S., 9: 385-400. Cabido, M., Breimer, R., y Vega, G. 1987. Plant communities and associated soil types in a high plateau of the Córdoba mountains, central Argentina. Mountain research and development, 7: 25-42. Cabido M, Molina SI, Perez Harguindeguy N, Valladares G, Pucheta E y Gardner S 1999. Uso de la tierra, estructura del hábitat y biodiversidad, en ecosistemas del centro de la Argentina 421-442 pp. En: Matteucci SD, Solbrig OT, Morello J y Halffter G. Biodiversidad y uso de la tierra. Conceptos y ejemplos de Latinoamérica. Colección CEA, Universidad de Buenos Aires, 580 pp. Cabrera A 1931. On some South American canine genera. Journal of Mammalogy, 12: 54-67. Cabrera A 1932. Sinopsis de los cánidos Argentinos. Revista del Centro de Ingenieros Agrónomos y Centro de Estudios de Agronomía, 145: 489-505. Cabrera AL 1958. Catalogo de los mamíferos de América del Sur. Revista del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” Zoología, 4: 1-308. Cabrera AL 1976. Regiones Fitogeográficas Argentinas. Enciclopedia Argentina de Agricultura y Jardinería. Buenos Aires, 2: 85 pp. Cáceres D 2001. Diagnóstico Socio-Productivo de Pequeños Productores de la Reserva Hídrica Provincial Pampa de Achala. Administración de Parques Nacionales (APN), 90 pp Capitanelli R 1979. Clima. En Vazques JB, Miatello R, Roqué M (Eds) Geografía Física de la Provincia de Córdoba, Pp 214296. Ed. Boldt. Bs As., 464 pp. Carbone C, Mace GM, Roberts SC y Macdonald DW 1999. Energetic constraints on the diet of terrestrial carnivores. Nature, 402: 286–288. Carbone C, Teacher A y Rowcliffe JM 2007. The Costs of Carnivory. PLoS Biology, 5 (2): 1-6. Cardillo M, Purvis J, Bielby G, Mace M, Sechrest W y Gittleman JL 2004. Human population density and extinction risk in the world`s carnivores. PLoS Biology, 2: 909-914. Castellanos A 1944. Paleontología estratigráfica de los sedimentos neógenos de la Provincia de Córdoba. Publicaciones del instituto de fisiografía y geología de Rosario, 23: 3-47. Chehébar C y Martín S 1989. Guía para el reconocimiento microscópico de los pelos de mamíferos de la Patagonia. Doñana, Acta Vertebrata, 16 (2): 247-291. Cingolani A y Falczuk V 2003. Elaboración Plan de Manejo Integrado del Parque Nacional Quebrada del Condorito y la Reserva Hídrica Provincial de Achala. Cuarto informe de Consultoria. 222pp. Cingolani AM, Renison D, Zak MR y Cabido MR 2004. Mapping vegetation in a heterogeneous mountain rangeland using Landsat data: an alternative method to define and classify land-cover units. Remote Sensing of Environment, 92: 8497. Cingolani A, Renison D, Tecco P, Gurvich D y Cabido M 2008. Predicting cover types in a mountain range with long evolutionary grazing history: a GIS approach. Journal of Biogeography, 35: 538-551. - 104 - Colwell RR y Futuyma DJ 1971. On the measurement of niche breadth and overlap. Ecology, 52:567-572. Corsi F, Duprè E y Boitani L 1999. A large-scale model of Wolf distribution in Italy for conservation planning. Conservation Biology, 13(1): 150-159. Crawshaw Jr. PG 1995. Comparative ecology of ocelot (Felis pardalis) and jaguar (Panthera onca) in a protected subtropical forest in Brazil and Argentina. Dissertation of Doctor of Philosophy, University of Florida, 190 pp. Crespo JA y De Carlo JM 1963. Estudio ecológico de una población de zorros colorados. Revista Museo Argentino de Ciencias Naturales Bernardino Rivadavia, 1 (1): 1-65. Crooks KR y Soulé ME 1999. Mesopredator release and avifaunal extinction in a fragmented system. Nature, 400 (6744): 563-566. Crooks KR 2002. Relative sensitivities of mammalian carnivores to habitat fragmentation. Conservation Biology, 6: 488–502. Culver M, Johnson WE, Pecon-Slattery J y O´Brien SJ 2000. Genomic ancestry of the american puma (Puma concolor). Journal of Heredity, 91 (3): 186-197. Cunningham SC, Haynes LA, Gustavson C y Haywood DD 1995. Evaluation of the interaction between mountain lions and cattle in the Aravaipa-Klondyke area of southeast Arizona. Arizona Game and Fish Department Technical Report 17, Phoenix. Currier MJP 1983. Felis concolor. Mammalian species, 200: 1-7. De Angelo C 2009. El paisaje del bosque atlántico del alto Paraná y sus efectos sobre la distribución y estructura poblacional del jaguar (Panthera onca) y el puma (Puma concolor). Tesis doctoral, Universidad de Buenos Aires, 250 pp. Díaz S, M. Bonnin A, Laguens y MR Prieto 1987. Estrategias de Explotación de los Recursos Naturales y Procesos de Cambio de la Vegetación en la Cuenca del Río Copacabana (Dpto. Ischilín, Pcia. de Córdoba). I. Fines del siglo XVI – Fines del siglo XIX. En: Publicaciones del Instituto de Antropología de Córdoba. Nueva Serie, 45: 67 – 131. Díaz S, Acosta A y Cabido M 1994. Community structure in montane grasslands of central Argentina in relation to land use. Journal of Vegetation Science, 5: 483-488. Dickson BG, Jenness JS y Beier P 2005. Influence of vegetation, topography, and roads on cougars movement in southern California. Journal of Wildlife Managenment, 69: 264-276. Donadio E, Novaro AJ, Buskirk SW, Wurstten A, Vitali MS y Monteverde MJ 2010. Evaluating a potentially strong trophic interaction: pumas and wild camelids in protected areas of Argentina. Journal of Zoology, 280: 33–40. Ebensperger LA, Mella JE y Simonetti JA 1991. Trophic-niche relationships among Galictis cuja, Dusicyon culpaeus, and Tyto alba in central Chile. Journal of Mammalogy, 72: 820-823. Emlen JM 1966. The role of time and energy in food preference. American Naturalist 100: 611-617. - 105 - Emmons L 1992. Tamaño corporal y estrategias de alimentación, pag. 62. En Seidensticker J y Lumpkin S (Eds) Felinos, Edición española: Encuentro editorial SA Barcelona, 240 pp. Estes JA 1996. Predators and ecosystem management. Wildlife Society Bulletin, 24: 390–396. Fasola L, Chehebar C, Macdonald DW, Porro G y Cassini MH 2009. Do alien North American mink compete for resources with native South American river otter in Argentinean Patagonia? Journal of Zoology, 277: 187–195. Fedriani JM, Fuller TK, Sauvajot RM y York EC 2000. Competition and intraguild predation among three sympatric carnivores. Oecologia, 125: 258-270. Fernandez CS 2007. Hábitos alimentarios del Puma (Puma concolor) en la Patagonia Árida. Seminario de Licenciatura en Ciencias Biológicas. Universidad Nacional de la Patagonia San Juan Bosco, Facultad de Ciencias Naturales sede Puerto Madryn, 36 pp. Fernandez GJ y Rossi SM 1998. Medullar type and cuticular scale patterns of hairs of rodents and small marsupials from the Monte shrubland (San Luis province, Argentina). Mastozoología Neotropical, 5: 109-116. Fleischner TL 1994. Ecological costs of livestock grazing in western North America. Conservation Biology, 8: 629-644. Flom PL 2007. Stopping stepwise: Why stepwise and similar selection methods are bad, and what you should use. Statistics and Data Analysis 7 Pp, http://www.nesug.org/proceedings/nesug07/sa/sa07.pdf. Franklin WL, Jonson WE, Sarno RJ y Iriarte JA 1999. Ecology of the Patagonia puma Felis concolor patagonica in southern Chile. Biological Conservation, 90: 33-40. Freer RA 2004. The Spatial Ecology of the Güiña (Oncifelis guigna) in Southern Chile. Ph D Thesis, University of Durham, UK, 236 pp. Fuentes ER y Jaksíc FM 1979. Latitudinal size variation of Chilean foxes: tests of alternative hypotheses. Ecology, 60: 4347. Fuller TK 1989. Population dynamics of wolves in north-central Minnesota. Wildlife Monographs, 105: 1-41. Fuller TK, Berg WE, Radde GL, Lenarz MS, y Joselyn GB 1992. A history and current estimate of wolf distribution and numbers in Minnesota. Wildlife Society Bulletin, 20: 42-55. Fuller TK, Mech LD y Cochrane JF 2003. Wolf Population Dynamics pp 161-191. En: Mech LD y Boitani L (Eds.). Wolves: Behavior, Ecology, and Conservation. (Chicago: University of Chicago Press). Funes G y M Cabido 1995. Variabilidad local y regional de la vegetación rupícola de las Sierras Grandes de Córdoba, Argentina. Kurtziana, 24: 173-188. Gaines WL, Lyons AL, Lehmkuhl JF y Raedeke KL 2005. Landscape evaluation of female black bear habitat effectiveness and capability in the North Cascades, Washington. Biological Conservation, 125: 411-425. Gardner SM, Cabido MR, Valladares GR y Díaz S 1995. The influence of habitat structure on anthropod diversity in Argentine semi-arid Chaco forest. Journal of vegetation Science, 6: 349-356. - 106 - Gause GF 1934. The struggle for existence. Baltimore, MD: Williams & Wilkins. Gibson LA., Wilson BA, Cahill DM y Hill J 2004. Spatial prediction of rufous bristlebird habitat in a coastal heathland: a GISbased approach. Journal of Applied Ecology, 41, 213–223. Gittleman JL 1995. Carnivore Behavior, Ecology and Evolution. (Ed). Cornell Gittleman JL, Funk SM, Macdonald DW y Wayne RK (Eds) 2001. Carnivore Conservation. Cambridge University Press, Cambridge, UK Gittleman JL y Gompper ME 2005. Plight of predators – the importance of carnivores for understanding patterns of biodiversity and extinction risk. En: Ecology of predator – prey interactions, editado por Barbosa P y Castellanos I. Oxford University Press, Oxford, UK 370-388. Gompper ME 2002. Top carnivores in the suburbs? Ecological and conservation issues raised by colonization of northeastern North America by Coyotes. BioScience, 52 (2): 185-190. Griffiths D 1975. Prey availability and the food of predators. Ecology 56: 1209–1214. Grinnell J 1917.Field test of theories concerning distributional control. The American Naturalist, 51 (602): 115-128. Gu W y Swihart RK 2004. Absent or undetected? Effects of non-detection of species occurrence on wildlife-habitat models. Biological conservation, 116: 196-203. Guisan A y Zimmermann NE 2000. Predictive habitat distribution models in ecology. Ecological modeling, 135: 147-186. Guzman-Sandoval JA, D'Elía G y Ortiz JC 2006. Geographic variation of the fox Lycalopex culpaeus (Mammalia, Canidae) in Chile: taxonomic implications. Revista de Biología Tropical, 57 (1-2): 421-32. Guzmán-Sandoval J, Sielfeld W y Ferrú M 2007. Dieta de Lycalopex culpaeus (Mammalia: canidae) en el extremo norte de chile (Región de Tarapaca). Gayana, 71(1): 1-7. Haro JG, Torres RM y Bistoni MA 2001. Presencia del aguará guazú Chrysocyon brachyurus en el sistema de humedales de la Laguna Mar Chiquita - Bañados del Río Dulce. FACENA, Revista de las Facultad de Ciencias Exactas y Naturales y Agrimensura, Universidad Nacional del Nordeste, 17:95-98. Haire SL, Bock CE, Cade BS y Bennett BC 2000. The role of landscape and habitat characteristics in limiting abundance of grassland nesting songbird, in an urban open space. Landscape and Urban Planning, 48: 65-82. Hayward B, Heske EJ y Painter ChW 1997. Effects of livestock grazing on small mammals at a desert ciénaga. Journal of Wildlife Management, 61: 123-129. Hebblewhite M, White CA, Nietvelt CG, McKenzie JA, Hurd TE, Fryxell JM, Bayley SE y Paquet PC 2005. Human Activity Mediates a Trophic Cascade Caused by Wolves. Ecology, 86 (8): 2135-2144. Heil L, Fernández-Juricic E, Renison D, Cingolani AM y Blumstein DT 2007. Avian responses to tourism in the biogeographically isolated high Córdoba Mountains, Argentina. Biodiversity Conservation, 16: 1009-1026. - 107 - Hirzel AH, Hausser J, Chessel D y Perrin N 2002. Ecological-niche factor analysis: How to compute habitat-suitability maps without absence data? Ecology, 83 (7): 2027-2036. Hirzel AH y Le Lay GL 2008. Habitat suitability modelling and niche theory. Journal of Applied Ecology, 45: 1372-1381. Hoogesteijn R, Hoogesteijn A y Mondolfi E 1993. Jaguar predation and conservation: cattle mortality caused by felines on three ranches in the Venezuelan Llanos. En: Mammals as predators, Ed.: Dunstone, N. y M.L. Gorman. Zoological Society of London, 65: 391-407. Hutchinson GE 1957. Concluding remarks. Cold spring harbour symposium on quantitative biology, 22: 415-427. InfoStat 2002. InfoStat versión 1.1. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. Iriarte JA, Jiménez JE, Contreras LC y Jaksic FM 1989. Small-mammal availability and consumption by the fox, Dusicyon culpaeus, in central Chilean scrublands. Journal of Mammalogy 70: 641-645. Iriarte JA, Franklin WL, Johnson WE, y Redford H 1990. Biogreographic variation of food habits and body size the american puma. Oecología, 85: 185-190. Iriarte JA, Johnson E y Franklin WL 1991. Feeding ecology of the Patagonia puma in southernmost Chile. Revista Chilena de Historia Natural, 64: 145-156. Jacksic FM, Schlatter RP y Yañez JL 1980. Feeding ecology of central chilean foxes Dusicyon culpaeus and Dusicyon griseus. Journal of Mammalogy, 61 (2): 254-260. Jaksic FM, Jiménez JE, Castro SA y Feisinger P 1992. Numerical and functional response of predators to a long-term decline in mammalian prey at a semiarid Neotropical site. Oecologia, 89: 90-101. Jędrzejewski W, Niedzialkowska M, Nowak S y Jędrzejewska B 2004. Habitat variables associated with Wolf (Canis lupus) distribution and abundance in northern Poland. Diversity and Distributions, (Diversity Distrib.), 10: 225–233 Jeganathan P, Green RE, Norris K, Vogiatzakis IN, Bartsch A, Wotton SR, Bowden CGR, Griffiths GH, Pain D y Rahmani AR 2004. Modelling habitat selection and distribution of the critically endangered Jerdon’s courser Rhinoptilus bitorquatus in scrub jungle: an application of a new tracking method. Journal of Applied Ecology, 41, 224–237. Jiménez JE y Novaro AJ 2004. Culpeo. Pseudalopex culpaeus (Molina 1782). En Sillero-Zubiri C, Hoffmann M y Macdonald DW (Eds.) Canids: Foxes, Wolves, Jackals and Dogs. Status survey and Conservation Action Plan. IUCN/SSC Canid Specialist Group, 44-49 pp. Johnson WE y Franklin WL 1994. Role of body size in the diets of sympatric Gray and Culpeo foxes. Journal of Mammalogy, 75 (1): 163-174. Johnson WE, Fuller TK y Franklin W 1995. Sympatry in canids: A review and assessment 189-217. En University Press, Ithaca, Nueva York. XXX pags Johnson JB y Omland KS 2004. Model selection in ecology and evolution. Trends in ecology and evolution, 19 (2): 101-108. Keister GP Jr. y Van Dyke WA 2002. A predictive population model for cougars in Oregon. Northwest Science, 76 (1): 15-25. Keith LB 1983. Population dynamics of wolves. En: L.N. Carbyn (Ed.). Wolves in Canada and Alaska: Their status, biology, and management. Canadian Wildlife Service Report Series, No. 45. Edmonton, Alberta, Pp. 66-77. - 108 - Kelly MJ, Noss AJ, Di Bitetti MS, Maffei L, Arispe RL, Paviolo A, De Angelo CD y Di Blanco YE 2008. Estimating puma densities from camera trapping across three study sites: Bolivia, Argentina, and Belize. Journal of Mammalogy, 89 (2):408–418. Kissling WD, Fernández N y Paruelo JM 2009. Spatial risk assessment of livestock exposure to pumas in Patagonia, Argentina. Ecography, 32: 807-817. Krebs CJ 1985. Ecología: Estudio de la distribución y la abundancia. Ed. Harla. 753 pp. Lariviere S y Pasitschniak-Arts M 1996. Vulpes vulpes. Mammalian Species 537: 1-11. Levins R 1968. Evolution in changing environments. Princenton Univ. Press, Princenton, NJ. Lockie JD 1959. The estimation of the food of foxes. Journal of Wildlife Management, 23 (2): 224-227. Logan KA y Sweanor LL 2001. Desert puma. Evolutionary ecology and conservation of an enduring carnivore. Island press, 463 pp. Luti R, De Solis MAB, Galera FM, De Ferreira NM, Berzal M, Nores M, Herrera MA y Barrera JC 1979. Vegetación, 297-368 pp. En: Vazquez JB, Miatello R y Roqué M (Eds). Geografía Física de la Provincia de Córdoba. Ed. Boldt. Bs. As. MacArthur RH y Pianka E 1966. On optimal use of a patchy environment. American Naturalist, 100: 603-609. MacArthur RH 1965. Biol. Rev. (Camb), 40: 510. Maehr DS, Larkin JL y Cox JJ 2004. Shopping centers as Panther habitat: Inferring Animal locations from models. Ecology and Society, 9:1- 9. Manera E 1991. El quichua santiagueño en la toponimia cordobesa. Compartiendo el Camino Ediciones, Códona, 81 pp. Manfredi C, Lucherini M, Canepuccia AD y Casanave EB 2004. Geographical variation in the diet of geoffroy`s cat (Oncifelis geoffroyi) in pampas grassland of Argentina. Journal of Mammalogy, 85: 1111-1115. Manfredi C, Soler L, Lucherini M y Casanave EB 2006. Home range and habitat use by Geoffroy`s cat (Oncifelis geoffroyi) in a wet grassland in Argentina. Journal of Zoology, 268: 381-387. Martin TE 1984. Impact of livestock grazing on birds of a Colombian cloud forest. Tropical Ecology, 25: 158-171. Mech LD 1989. Wolf population survival in an area of high road density. American Midland Naturalist, 121: 387-389. Mech LD 1995. The challenge and opportunity of recovering wolf populations. Conservation Biology, 9: 270-278. Mech LD 1996. A new era for carnivore conservation. Wildlife Society Bulletin, 24: 390–396. Meserve PL, JR Gutiérrez, JA Yunger, LC Contreras y FM Jaksic 1996. Role of biotic interactions in a small Mammal assemblage in semiarid Chile. Ecology, 77: 133-148. Miatello R y Cobos V 2008. Nuevos aportes sobre la distribución del aguará guazú (Chrysocyon brachyurus, carnivora: canidae) en las provincias de Córdoba y Santiago del Estero, Argentina. Mastozool. neotrop. 15(2): 209-213. Milesi FA y López de Casenave J 2005. El concepto de nicho en Ecología Aplicada: del nicho al hecho hay mucho trecho. Ecología Austral, 15: 131-148. Miller B, Dugelby B, Foreman D, Martínez del Río C, Noss R, Phillips M, Reading R, Soulé ME, Terborgh J y Willcox L 2001. The importance of large carnivores to healthy ecosystems. Endangered species Update, 18 (5): 202-210. - 109 - Mladenoff DJ, Sickley TA, Haight RG, y Wydeven AP 1995. A regional landscape analysis and prediction of favorable gray wolf habitat in northern Great Lakes region. Conservation Biology, 9: 279-294. Morando M y Polop JJ 1997. Annotated checklist of mammal species of Córdoba province, Argentina. Mastozoología Neotropical, 4(2): 129-136. Murphy KM, Ross PI y Hornocker MG 1999. The ecology of anthropogenic influences on cougars. Pp 77-101 En Clark TW, Curlee AP, Minta SC y Kareiva PM, (Eds). Carnivores in ecosystems: The Yellowstone experience. Yale University Press, New Haven, Connecticut, USA. Naves J, Wiegand T, Revilla E y Delibes M 2003. Endangered species constrained by natural and human factors: the case of brown bears in Northern Spain. Conservation Biology, 17 (5): 1276-1289. Noss RF, Quigley HB, Hornocker MG, Merrill T y Paquet P 1996. Conservation biology and carnivore conservation in the Rocky Mountains. Conservation Biology, 10 (1): 949-963. Novack AJ 2003. Impact of subsistence hunting on the foraging ecology of jaguar and puma in the Maya Biosphere Reserve, Guatemala. Master of Science thesis, University of Florida, 38 pp. Novaro AJ 1991. Feeding ecology and abundance of a harvested population of culpeo fox (Dusicyon culpaeus) in Patagonia. MS Thesis, University of Florida, Gainesville, FL. Novaro AJ 1997a. Pseudalopex culpaeus. Mammalian Species, 558 :1–8. Novaro AJ 1997b. “Source-sink dynamics induced by hunting: case study of culpeo foxes on rangelands in Patagonia, Argentina”. Ph.D. dissertation, University of Florida, Gainesville, Florida, USA. Novaro AJ, Funes MC y Walker RS 2000a. Ecological extinction of native prey of a carnivore assemblage in Argentine Patagonia. Biological Conservation, 92: 25-33. Novaro AJ, Funes MC, Rambeaud C y Monsalvo O 2000b. Calibración del índice de estaciones odoríferas para estimar tendencias poblacionales del zorro colorado (Pseudalopex culpaeus) en Patagonia. Mastozoología Neotropical, 7: 81-88. Novaro AJ, Funes MC y Jiménez J 2004. Selection for introduced prey and conservation of culpeo and chilla zorros in Patagonia. Pp 243-254. En: MacDonald DW y Sillero C (Eds). The biology and conservation of wild canids. Oxford University Press, Oxford, UK. Novaro AJ y Walker RS 2005. Human-induced changes in the role of carnivores in Patagonia. Pp 267-287 en Ray JC, Redford KH, Stenneck R, y Berger J (Eds.) Large carnivores and the Conservation of Biodiversity. Island Press. Novaro AJ, Walker S y Radovani NI 2006. Determinación de la relación taxonómica entre Pseudalopex gymnocercus y Pseudalopex griseus por medio de técnicas de genética molecular. INFORME FINAL Presentado a la Dirección de Fauna y Flora Silvestre, FACIF y Direcciones de Fauna de las provincias de Río Negro y Chubut CONICET y Wildlife Conservation Society Junín de los Andes, Neuquén. Nowell K y Jackson P 1996. The Wild Cats: status survey and conservation action plan. International Union for Nature Conservation-Cat Specialist Group. Gland, Switzerland. 382 pp. - 110 - O´Brien SJ 1992. La evolución molecular de los felinos, Pp 18. En Seidensticker J y Lumpkin S (Eds) Felinos, Edición española: Encuentro editorial SA Barcelona, 240 pp. Ogada MO, Woodroffe R, Oguge NO y Frank LG 2003. Limiting depredation by African carnivores: the role of livestock husbandry. Conservation biology, 17 (6): 1521-1530. Pacala S y Roughgarden J 1985. Population experiments with de Anolis lizards of St. Maarten and St. Eustatius. Ecology, 66:129-141. Pacheco LF, Gallardo G y Nuñez A 2004a. Diseño de un programa de monitoreo para puma y zorro en el Altiplano. Ecología en Bolivia, 39(2): 21-32 Pacheco LF, Lucero A y Villca M 2004b. Dieta del puma (Puma concolor) en el Parque Nacional Sajama, Bolivia y su conflicto con la ganadería. Ecología en Bolivia, 39(1): 75-83. Parera A 2002. Los mamíferos de la Argentina y la región austral de Sudamérica. 1º ed. Buenos Aires: El Ateneo 454 p. Pastor S y Berberián E 2007. Arqueología del sector central de las Sierras de Córdoba (Argentina). Hacia una definición de los procesos sociales del período prehispánico tardío. Intersecciones en Antropología 8: 31-47. Pereira JA, Fracassi NG y Uhart MM 2006. Numerical and spatial responses of geoffroy’s cat (Oncifelis geoffroyi) to prey decline in Argentina Journal of Mammalogy, 87: 1132–1139. Perovic PG 2001. Conservación del jaguar en Argentina. En: Medellin RA, Rabinowitz A, Taber A y Redford K (Eds.) Jaguars in the New Milennium, Universidad Autónoma de México, Wildlife Conservation Society, México. Perovic PG y De Bustos S 2001. Los félidos como especies indicadoras de las Yungas de Jujuy y Salta. I Reunión Binacional Conjunta de la Asociación Argentina de Ecología y la Sociedad de Ecología de Chile, y la XX Reunión Argentina de Ecología. Bariloche, 23 al 27 de Abril del 2001. Perovic P 2002. Ecología de la comunidad de félidos en las selvas nubladas del Noroeste Argentino. PhD Thesis, Universidad Nacional de Córdoba, Córdoba, Argentina, 146 pp. Pessino M, Sarasola JH, Wander C y Besoky N 2001. Respuesta a largo plazo del puma (Puma concolor) a una declinación poblacional de la vizcacha (Lagostomus maximus) en el desierto de Monte, Argentina. Ecología Austral, 11: 61-67. Pia MV y Novaro AJ 2003. Evaluación y medidas de reducción del impacto del puma (Puma concolor) y zorro colorado (Pseudalopex culpaeus smithersi) sobre el ganado doméstico de productores de la Reserva Hídrica Provincial Pampa de Achala. Informe Técnico n° 2, Proyecto de conservación de la biodiversidad GEF/BIRF. Delegación Centro APN, Informe de divulgación interna. Pia MV, López MS y Novaro AJ 2003. Effects of livestock on the feeding ecology of endemic culpeo foxes (Pseudalopex culpaeus smithersi) in central Argentina. Revista Chilena de Historia Natural, 76: 313-321. Pia MV 2004. Evaluación sobre el estado de conflicto puma/zorro colorado y humanos en el Parque Nacional Quebrada del Condorito y área de amortiguamiento en relación a la actividad turística y la predación sobre ganado de productores. Informe final de consultoría. Delegación Regional Centro – APN, 40 Pp. - 111 - Pia MV 2005. Pumas (Puma concolor), comunidades locales y actividad turística en el Parque Nacional Quebrada del Condorito y Reserva Hídrica Provincial de Achala. Informe final de consultoría. Delegación Regional Centro – APN, 34 pp. Pia MV y Novaro AJ 2005. Monitoreo de poblaciones de carnívoros y análisis de alternativas para reducir conflictos con la ganadería del área circundante al Parque Nacional Monte León. Informe final de consultoría. Fundación Patagonia Natural 36 pp. Pia MV 2006. Pumas, pobladores locales, turismo y predación sobre el ganado doméstico y programa de monitoreo de predadores tope en el Parque Nacional Quebrada del Condorito y área de influencia. Informe final de consultoría. Delegación Regional Centro – APN, 78 pp. Pia MV 2008. Monitoreo de puma (Puma concolor) y zorro colorado (Lycalopex culpaeus smithersi) en Pampa de Achala (Pcia. de Córdoba). Informe final de consultoría. Delegación Regional Centro – APN, 26 pp. Pia MV, Mangeaud A, Renison D y Haro G 2009. Puma (Puma concolor) relative density and diet in central Argentina. Resumen en el 10 International Mammalogical Congress, Mendoza, Argentina, agosto de 2009. Pia MV 2010. Estudio a largo plazo sobre la dieta de carnívoros tope y el efecto de un área protegida, en el pastizal de altura de las sierras grandes de Córdoba. Resumen en la IV Reunión Binacional de Ecología, Buenos Aires, agosto 2010. Pianka ER 1973. The structure of lizard communities. Annu. Rev. Ecol. Syst. 4: 53-74. Pianka ER 1980. Ecología evolutiva. Ed. Omega. 365 pp. Polisar J 2000. Jaguars, pumas, their prey base, and cattle ranching: ecological perspectives of a management issue. Doctor of Philosophy Thesis, University of Florida, 227 pp. Polop JJ 1989. Distribution and ecological observations of wild rodents in Pampa de Achala, Cordoba, Argentina. Studies on Neotropical Fauna and Environment, 24: 53-59. Polop JJ 1991. Distribución de cricétidos en las Sierras de Achala (Provincia de Córdoba, Argentina). Revista Universidad Nacional Río Cuarto, 11: 115-121. Power ME, Tilman D. Estes JA, Menge BA, Bond WJ, Mills LS, Daily G, Castilla JC, Lubchenco J y Paine RT 1996. Challenges in the quest for keystones. Bioscience in press en: Estes JA. Predators and ecosystem management. Wildlife Society Bulletin, 24(3): 390-396. Pucheta E, Cabido M y Díaz S 1998. Floristic composition, biomass and aboveground net plant production in grazed and protected sites in a mountain grassland of Central Argentina. Acta Oecologica, 19: 97-105. R Development Core Team 2009. R: a language and environment for statistical computing 2.10.1. R Foundation for Statistical Computing, Vienna, Austria. Disponible en http://www.R-project.org (Fecha de acceso 10 Nov 2009). Ramp D, Wilson VK y Croft DB 2006. Assessing the impacts of roads in peri-urban reserves: road-based fatalities and road usage by wildlife in the Royal National Park, New South Wales, Australia. Biological Conservation 129: 348-359. - 112 - Rau JR, Tilleria MS, Martinez DR y Muñoz AH 1991. Dieta de Felis concolor (Carnívora: Felidae) en áreas silvestres protegidas del sur de Chile. Revista Chilena de Historia Natural, 64: 139-144. Rau JR, Martínez DR, Wolfe ML, Muñoz-Pedreros A, Alea JA, Tillería CS y Reyes CS 1992. Depredación de pumas (Felis concolor) sobre pudúes (Pudu pudu): rol de las liebres (Lepus europaeus) como presas alternativas. Actas II Congreso Internacional sobre Gestión en Recursos Naturales (Chile), 2:311-331. Rau JR, Martinez DR y Munoz-Pedreros A 1995. Trophic ecology of pumas in southern south America, Pp 602-604. En: Bissonette JA y Krausman PR (Eds), Integrating people and wildlife for a sustainable future. Proceedings of the first International Wildlife Management Congress, The Wildlife Society, Bethesda, Md. Rau JR y Jiménez JE 2002. Diet of Puma (Puma concolor, Carnivora: Felidae) in Coastal and Andean Ranges of Southern Chile. Studies on Neotropical Fauna and Environment, 37 XXXXX Real R, Barbosa AM, Porras D, Kin MS, Marquez AL, Guerrero JC, Palomo LJ, Justo ER y Vargas M 2003. Relative importance of environment, human activity and spatial situation in determining the distribution of terrestrial mammal diversity in Argentina. Journal of Biogeography, 30: 939-947. Redford KH y Eisenberg JF 1992. Mammals of the Neotropics: the southern cone. University of Chicago Press, Chicago, 2: 1-420. Renison D, Hensen I, Suarez R, Cingolani AM, Marcora P y Giorgis MA 2010. Soil conservation in Polylepis mountain forests of Central Argentina: Is livestock reducing our natural capital? Austral Ecology, 35, 435–443 Riley SJ 1998. Integration of environmental, biological, and human dimensions for management of mountain lions (Puma concolor) in Montana. Ph D Cornell University, 174pp. Riley SW y Malecki RA 2001. A landscape analysis of cougar distribution and abundance in Montana, USA. Environmental Management, 28: 317-323. Rosenzweig ML 1968. The strategy of body size in mammalian carnivores. The American Midland Naturalist, 80 (2): 299315. Rushton SP, Ormerod SJ y Kerby G 2004. New paradigms for modelling species distributions? Journal of Applied Ecology, 41, 193–200. Schiaffino K, Malmierca L y Perovic PG 2001. Depredation by jaguars around a National Park in Northeast Argentina, en: Jaguars in the New Milennium. En: Medellin RA, Rabinowitz A, Taber A y Redford K (Eds.), Universidad Autónoma de México, Wildlife Conservation Society, México. Schneider CF y Aprile G 2009. Monitoreo de la población de guanaco (Lama guanicoe) reintroducida en el Parque Nacional Quebrada del Condorito, Córdoba, Argentina. Resultados 2º etapa 2008-2009. Informe final de consultoría 62 pp. Scognamillo D, Maxit IE, Sunquist M y Polisar J 2003. Coexistence of jaguar (Panthera onca) and puma (Puma concolor) in a mosaic landscape in the Venezuelan llanos. Journal of Zoology, 259: 269–279. Seidensticker JC, Hornocker MG, Wiles WV y Messick JP 1973. Mountain lion social organization in the Idaho primitive area. Wildlife Monographs, Nº 35. - 113 - Seidensticker J 1992. Pumas. En: Seidensticker J y Lumpkin S (Eds). Felinos, Pp.130-137, Encuentro Editorial, Barcelona. Sergio F, Newton I, Marchesi L y Pedrini P 2006. Ecologically justified charisma: preservation of top predators delivers biodiversity conservation. Journal of Applied Ecology, 43: 1049-1055. Sih A, Crowley P, McPeek M, Petranka J y Strohmeier K 1985. Predation, competition, and prey communities: A review of field experiments. Ann. Rev. Ecol. Syst., 16: 269-311. Sillero-Zubiri C, Laurenson K 2001. Interactions between carnivores and local communities: conflict or co-existence? In: Gittleman JL, Funk SM, Macdonald D, Wayne RK (Eds.) Conservation Biology 5, Carnivore Conservation: 282-312, Cambridge University Press. Sillero-Zubiri C 2009. Family Canidae (Genus Pseudalopex). Pp: 352-446. En: Wilson DE y Mittermeier RA Eds. Handbook of the Mammals of the world. Vol 1. Carnivores, Lynx Edicions, Barcelona. Simonetti JA 1986. Human-induced dietary shift in Dusicyon culpaeus. Mammalia, 50: 406-408. Simonetti JA y Huareco I 1999. Uso de huellas para estimar diversidad y abundancia relativa de los mamíferos de la reserva la biosfera - estación biológica del Beni, Bolivia. Mastozoología Neotropical, 6 (1): 139-144. Smallwood KS y Fitzhough EL 1993. A rigorous technique for identifying individual mountain lion Felis concolor by Their tracks. Biological Conservation, 65: 51-59. Smallwood KS y Fitzhugh EL 1995. A track count estimating mountain lion Felis concolor californica population trend. Biological Conservation, 71: 251-259. Soberón J y Peterson T 2005. Interpretation of models on fundamental ecological niches and species`distributional areas. Biodiversity Informatics, 2: 1-10. Soberón J 2007. Grinnellian and eltonian niches and geografic distribution of species. Ecology letters, 10: 1115-1123. Stander PE 1998. Spoor counts as indices of large carnivore populations: The relationships between spoor frequency, sampling effort and true density. Journal of Applied Ecology, 35: 378-385. Sunquist ME, Sunquist F y Daneke DE 1989. Ecological separation in a Venezuelan llanos Carnivore community. Advances in Neotropical Mammalogy: 197-232 Sunquist ME y Sunquist FC 2009. Family Felidae (Genus Puma). Pp: 54-168, en: Wilson DE y Mittermeier RA Eds. Handbook of the Mammals of the world. Vol 1. Carnivores, Lynx Edicions, Barcelona. Tavarone EG 2007. Informe final primera etapa proyecto piloto de reintroducción del guanaco Parque Nacional Quebrada del Condorito, Abril 2005 – Agosto 2007.Delegacion Regional Centro, APN, 15 pp. Teich I, Cingolani AM, Renison D, Hensen I y Giorgis MA 2005. Do domestic herbivores retard Polylepis australis Bitt. Woodland recovery in the mountains of Co´rdoba, Argentina? Forest Ecology and Management 219: 229–241. - 114 - Terborgh J, Estes JA, Paquet P, Ralls K, Boyd-Heger D y Noss RF 1999. The role of top carnivores in regulating terrestrial ecosystems. Pp. 39-64. En: Solé ME y Terborgh J, Eds. Continental conservation: Scientific foundations of regional reserve networks. Island Press, Washington, 227 pp. Theil RP 1985. Relationship between road densities and wolf habitat suitability in Wisconsin. American Midland Naturalist, 113: 404-407. Thurber JM, Peterson RO, Drummer TR y Thomasma SA 1994. Gray wolf response to refuge boundaries and roads in Alaska. Wildlife Society Bulletin, 22: 61-68. Thomas O 1914. On various South-American mammals. Annals and Magazine of Natural History, Series 8, 13: 345-363. Tognelli MF y Kelt DA 2004. Analysis of determinant of mammalian species richness in South America using spatial autoregressive models. Ecography, 27: 427-436. Travaini A, Pereira J, Martínez-Peck R y Zapata SC 2003. Monitoreo de zorros colorados (Pseudalopex culpaeus) y grises (Pseudalopex griseus) en Patagonia: diseño y comparación de dos métodos alternativos. Mastozoología Neotropical, 10: 277-291. Treves A y Karanth KU 2003a. Human-Carnivore conflict and perspectivas on carnivore management worlwide. Conservation Biology, 17 (6): 1-9. Treves A y Karanth KU 2003b. Human-carnivore conflict: local solutions with global applications. Conservation Biology 17 (6): 1-2. Vázquez DV, Perovic PG y De Olsen AA 2000. Patrones cuticulares y medulares de pelos de mamíferos del noroeste Argentino (Carnívora y Artiodactyla). Mastozoología Neotropical, 7 (2): 131-147. Von Thungen J 1997. Diagnostico de la situación actual del puma en el chaco árido. Tesis de maestría, Centro de Zoología Aplicada, Universidad de Córdoba, 100 pp. Walker RS, Farmerie WG y Branco LC 2000. Characterization of microsatellite loci from the mountain vizcacha Lagidium viscacia and their use for the plains vizcacha Lagostomus maximus. Molecular Ecology, 9: 1661-1686. Walker RS, Novaro AJ, Perovic P, Palacios R, Donadio E, Lucherini M, Pia M y López MS 2007. Diet of the Andean mountain cat (Leopardus jacobita), colocolo (Leopardus colocolo), and culpeo (Lycalopex culpaeus) in high-altitude deserts of Argentina. Journal of Mammalogy, 88: 519-525. Walker RS y Novaro AJ 2010 The world’s southernmost cougars in Patagonia and the southern Andes. En M. Hornocker y S. Negri, eds. Cougar: Ecology and Conservation. University of Chicago Press, 91-99 pp. Wang SW y Macdonald DW 2006. Livestock predation by carnivores in Jigme Singye Wangchuck National Park, Bhutan Biological Conservation, 129: 558-565. Weaver JL 1993. Refining the equation for interpreting prey occurrence in gray Wolf scats. Journal of Wildlife Management, 57: 534-538. - 115 - Webb SD 1985. Late Cenozoic mammal dispersals between the American biotic interchange. Stheli FG y Webb SD (Eds). Plenum Press, New York, 532 pp. Woodroffe R y Ginsberg JR 1998. Edge effects and the extinction of populations inside protected areas. Science, 280: 21262128. Woodroffe R, Thirgood S y Rabinowitz A 2005. The impact of human-wildlife conflict on natural systems. En: Woodroffe R, Thirgood S y Rabinowitz A (Eds) People and wildlife: Conflict or coexistence. Cambridge University Press, 1-12 pp. Yánez JL, Cardenas JC, Gezelle P y Jaksic FM 1986. Food habits of the southernmost mountain lions (Felis concolor) in South America: natural versus livestocked ranges. Journal of Mammalogy, 67(3): 604-606. Zapata SC, Travaini A, Delibes M y Martinez-Peck R 2005. Food habits and resource partitioning between grey and culpeo foxes in southeastern Argentine Patagonia. Studies on Neotropical Fauna and Environment, 40(2): 97 – 103. Zar JH 1996. Biostatistical Analysis, Prentice Hall, Upper Saddle River NJ. Zunino GE, Vaccaro OB, Canevari M y Gardner AL 1995. Taxonomy of the genus Lycalopex (Carnivora: Canidae) in Agentina. Proceedings of the Biological Society of Washington, 108: 729-747. - 116 -