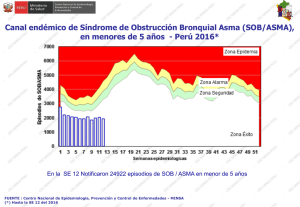
Asma I Fascículo 1 DEF.qxd - Plataforma de formación de SEPAR
Anuncio

Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 1 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 2 Curso de f.m.c. SEPAR con el patrocinio GlaxoSmithKline 2 Edita Depósito legal: MPrinted in Spain Imprime: José San Germán Impresor S.L. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 3 A s m a . D e f i n i c i ó n e h i s t o r i a n a t u r a l Capítulo I ASMA. DEFINICIÓN E HISTORIA NATURAL Dr. Joaquín Sanchis Aldás Departamento de Neumología Hospital "Santa Creu i Sant Pau" Correo-e: [email protected] 3 Correspondencia: Joaquín Sanchis Aldás Departament de Pneumologia del Hospital de la Santa Creu i Sant Pau C/ Sant Antoni María Claret 167, 08025 Barcelona Correo electrónico: [email protected] Tf. 93 2919010 / Fax: 93 2919266 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 4 4 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 5 A s m a . D e f i n i c i ó n e h i s t o r i a n a t u r a l ASMA. DEFINICIÓN E HISTORIA NATURAL Resumen El síndrome asmático se manifiesta por disnea, tos, sibilantes y tirantez torácica. Probablemente es expresión de varios procesos que causan obstrucción variable del flujo aéreo, hiperrespuesta bronquial e inflamación. Esta última es, con la mayor frecuencia, de naturaleza alérgica, manifestada comúnmente en las primeras edades. Sólo algunos individuos atópicos desarrollan asma, pero la atopia es un importante factor de riesgo en la aparición de asma. Aproximadamente el 50% de los niños con sibilantes en los primeros años seguirán presentando o volverán a tener síntomas en la edad adulta, con frecuencia e intensidad relacionadas con las de la niñez. Fumar en la adolescencia y juventud aumenta el riesgo. El asma puede remitir en un 10-15% de adultos, o empeorar hacia la obstrucción “fija” en un porcentaje similar, que se refuerza mucho por el tabaco y en menor grado por el sexo femenino, el comienzo temprano, la gravedad del curso y el retraso en iniciar el tratamiento con esteroide. La muerte por asma es muy infrecuente y, además, potencialmente evitable. En el asmático con crisis de riesgo vital la mortalidad en el primer año post-crisis alcanza el 10%. DEFINICIÓN (1). El asma es un síndrome clínicamente simple y etiológicamente incierto, que incluye varios fenotipos clínicos, expresados por manifestaciones comunes. Ello hace inalcanzable una definición precisa, por lo que ésta suele ser operativa y adaptarse al propósito al que se le destina. La misma dificultad se extiende a la descripción de su historia natural, como se verá más adelante. En términos clínicos, el asma se entiende como el estrechamiento de las vías respiratorias, reversible en cortos periodos de tiempo, sea espontáneamente o a consecuencia de su tratamiento. El énfasis de esta definición se centra en el carácter reversible de la obstrucción bronquial, con la intención de distinguirla de otros procesos que cursan con obstrucción más persistente. El asma es también hiperrespuesta bronquial, un exagerado estrechamiento de las vías respiratorias que puede pro- vocarse por diversos estímulos inespecíficos, como la hiperventilación, el ejercicio y la respiración de aire frío, la metacolina o la histamina, y también por estímulos específicos (alergenos) en enfermos hipersensibles a dichos alergenos. Además de obstrucción variable e hiperrespuesta bronquial, el asma es un proceso inflamatorio de la pared bronquial. La inflamación es característica en buena parte de los enfermos, instrumentada por linfocitos T, con producción de IgE, activación de mastocitos y reclutamiento de abundantes eosinófilos. Sin embargo, el predominio de la infiltración bronquial neutrofílica sobre la eosinofílica se ha reconocido en un número muy apreciable de asmáticos, hecho que habla a favor de la diversidad fenotípica del asma como síndrome (2). La obstrucción variable se manifiesta por síntomas clínicos que incluyen los sibilantes, la tos y la disnea, y se confirma fácilmente por la limitación del flujo aéreo, mediante la espirometría (por lo común, el VEMS o el Flujo Espiratorio Máximo) que, además, mejora a los pocos minutos de inhalar un broncodilatador agonista b2. Sin embargo, en los pacientes asmáticos que fuman, o en aquellos que trabajan en ambiente muy contaminado, la reversibilidad de la obstrucción puede disminuir hasta hacerse indistinguible de la del paciente con EPOC. Por su parte, los asmáticos con obstrucción reversible pueden presentar obstrucción “fija” en momentos de crisis intensa. Además, algunos enfermos con asma crónica intensa desarrollan obstrucción irreversible pese a no haber fumado nunca (3). En el mecanismo de producción de la tos y la tirantez torácica es difícil descartar la importancia de la hiperrespuesta y la propia inflamación bronquial. Aunque la hiperrespuesta bronquial acompaña usualmente a las manifestaciones asmáticas, no es “condicio sine qua non” ni exclusiva de asma. Puede estar ausente en algunos pacientes con clínica indudable de asma y, lo que es más común, estar presente en niños y adultos asintomáticos y en no asmáticos (4, 5, 6). En el asma, la tolerancia –u homeostasis inmunológica- está disminuida y las respuestas inmunes o infla- 5 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 6 matorias, activadas. La inflamación bronquial es un componente esencial del proceso asmático. La inflamación del asma crónica parece ser bastante más que una simple infiltración eosinofílica y supone la activación de todas las células de las vías respiratorias: las células epiteliales, fibroblastos, macrófagos y leiomiocitos, además de las mencionadas células T, mastocitos y eosinófilos (7). Estos últimos liberan mediadores proinflamatorios (8), mediadores citotóxicos y citocinas (9). El resultado es la extravasación, hipersecreción mucosa, contracción muscular, denudación epitelial y la hiperrespuesta bronquial. Paralelamente, el proceso de reparación que se pone en marcha produce un remodelado, con depósito de colágeno por debajo de la membrana basal, pérdida de células ciliadas y aumento de las caliciformes. Estos cambios pueden observarse incluso en la biopsia bronquial de enfermos con asma atópica leve (10) 6 El término atopia se suele usar para describir la predisposición hereditaria a producir anticuerpos IgE contra antígenos ambientales comunes. La palabra alergia se refiere hoy día a las reacciones inmunitarias con producción de IgE frente a dichos antígenos (alergenos). En la práctica clínica se usa como sinónimo de atopia. El asma, como enfermedad alérgica, puede relacionarse con la atopia a cualquier edad, aunque la relación es más intensa en el niño. Pero puede producirse asma alérgica en individuos no atópicos, como la originada por isocianatos y otras de carácter ocupacional. También se observan reacciones asmáticas por mecanismos no inmunológicos, como en el asma por intolerancia a AINE. El asma de individuos sin evidencia de atopia (intrínseca o criptogénica) ofrece algunas –pero no grandes- diferencias clínicas y patológicas respecto del asma alérgica (extrínseca)(11). Estas diferencias se han cuestionado en otros estudios (12), lo que ha llevado a algunos autores a propugnar que toda asma es extrínseca. SENSIBILIZACIÓN ALÉRGICA Sólo algunos individuos atópicos desarrollan asma, pero la coincidencia de hiperreactividad cutánea a uno o más alergenos y la aparición de asma en el niño de edad escolar y el adulto es muy alta (13), y sugiere que la atopia es un importante factor de riesgo en la aparición de asma. En el adulto, la atopia se asocia a la expresión de inmunidad específica a alergenos, caracterizada por la producción por los linfocitos T colaboradores tipo 2 (TH2), de citocinas como la IL-4 e IL-5, que promueven la producción de IgE y de eosinofilia (14, 15). La información actual sugiere que la compartimentación de la respuesta específica de las células T a los alergenos en los denominados patrones TH1 y TH2 ocurre en el niño, antes de los 5 años (16). El cebado inicial de las células T ocurre generalmente a través de la placenta (17); en particular por alergenos a los que la madre ha estado expuesta en el último trimestre del embarazo (18). En el periodo fetal, el fenotipo de citocinas de las células T es característicamente TH2 (19). Pero, hacia los 5 años de edad, casi todos los niños han regulado por reducción su reactividad de células T a los alimentos (16) y, paralelamente, han desarrollado por desviación inmunológica, células TH1 con memoria para alergenos inhalados, en el caso de los niños noatópicos, o incrementado las células TH2 con memoria, si son atópicos (18,20). Así, mientras el patrón de respuesta predominante en la vida intrauterina es el TH2, a partir del nacimiento la respuesta TH2 a alergenos inhalados va disminuyendo su intensidad en el niño no atópico. La situación inversa se observa en el niño que a la edad de 2 años ha desarrollado atopia. A dicha edad, el atópico muestra ya una respuesta TH2 consolidada y asociada a déficit de producción de interferón-g (21). La creciente tendencia al fracaso de la mencionada desviación inmunológica hacia la respuesta TH1, que permite el predominio de la TH2, parece estar en la base del aumento de prevalencia de la atopia y del asma, observado recientemente en numerosos países. EL DESARROLLO DEL ASMA Una vez desarrollada la alergia, sigue sin haber una explicación satisfactoria al hecho de que niveles de hipersensibilidad aparentemente similares y a los mismos alergenos se manifiesten clínicamente en unos individuos como dermatitis atópica, en otros como rinitis y en otros como asma. En el caso del asma, el problema es particularmente complejo: una mayoría de asmáticos son alérgicos a uno o más alergenos y sólo unos cuantos individuos desarrollan asma persistente. Parecería como si fuera necesario que el daño inflamatorio mediado por la reacción TH2 tuviera que alcanzar un determinado nivel y mantenerlo para producir las manifestaciones crónicas. El factor o factores necesarios para ese paso no se han identificado, pero podrían ser exógenos (infecciones víricas, aumento de los alergenos inhalados, partículas no alergénicas como las procedentes de la combustión de gasóleo, tabaquismo materno en el embarazo, etc.). También podrían invocarse factores endógenos, como el fracaso de los mecanismos inmuno-reguladores del epitelio bronquial. Es decir, el fracaso de los mecanismos de tolerancia, que afectaría directamente a la función de las células dendríticas (presentadoras de antígeno) y a los macrófagos, en particular a través de un gran aumento de la citocina GM-CSF (22). Estas posibilidades patogénicas se han revisado recientemente en detalle por PG. Holt y colaboradores (23) y M. Jordana y su grupo (24). En todo caso, puede decirse que la sensibilización alérgica comienza probablemente en las primeras fases de la vida extrauterina, y es demostrable ya hacia los dos años. Además de la inflamación bronquial, en el asma se observa un trastorno del epitelio bronquial, que parece incapaz de procesar adecuadamente los antígenos que C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 7 A s m a . le llegan con el aire y lo hace más vulnerable a agresiones ambientales. Consecuencia de este trastorno es la susceptibilidad a la denudación epitelial característica del asma, en oposición a la respuesta metapásica escamosa que convierte al epitelio en poliestratificado, como se observa en otro proceso inflamatorio bronquial, la EPOC. El trastorno epitelial del asma altera también la relación epitelio-submucosa, la denominada unidad trófica epitelio-mesenquimatosa (25). Como resultado, las células constitutivas de la unidad alteran su funcionamiento, lo que proporciona el adecuado microambiente de citocinas para mantener la cronicidad del asma (26). DEL NIÑO AL ADULTO Un análisis general de la historia natural del asma comienza por distinguir dos períodos evolutivos: el asma en el niño y en el adulto. En los dos, los datos son ciertamente conflictivos, lo que entre otras razones se debe a las diferencias en la selección de la población de estudio, su edad al comienzo del mismo, la definición de asma utilizada, la duración del seguimiento y las variables de resultado usadas en la valoración. Estos aspectos tienen especial trascendencia en los estudios referidos a niños (27). En el adulto hay que añadir otra complicación: la posible confusión clínica entre Asma y EPOC. En el niño no atópico, la historia de sibilantes leves se relaciona en los primeros años con la pequeñez de sus vías respiratorias y generalmente desaparece con el crecimiento pulmonar posterior. La remisión también puede observarse en algunos niños atópicos, pero su pronóstico es peor si la función pulmonar permanece más pequeña que en el sano, si muestra hiperrespuesta bronquial, signos marcados de atopia y otra enfermedad atópica concomitante. En un estudio australiano de una muestra aleatoria de niños de 7a. en 1963, se seleccionaron aquellos que referían una historia de “bronquitis con sibilantes”. Dichos niños fueron seguidos a intervalos, el último de los cuales, a los 35 años de edad (28), mostraba que el 20% tenía síntomas al menos semanalmente, el 15% refería síntomas en los últimos 3 meses y en otro 15% los síntomas eran infrecuentes y anteriores a los últimos 3 meses. Así pues, el 50% de aquellos niños con sibilantes en la niñez eran asintomáticos a la edad de 35 años. Otro estudio (29), este en Gran Bretaña, igualmente amplio (18.000 niños) y prolongado hasta los 33 a de edad, demostró también una reducción importante de individuos con síntomas entre la niñez y la adolescencia pero, además, la reaparición significativa de los síntomas en el adulto, hecho primariamente ligado a la atopia y al hábito de fumar en la adolescencia y juventud. Más recientemente, Sears y colaboradores (30) publicaron su seguimiento de 1037 niños neozelandeses, estudiados repetidamente entre los 9 y 26a. de edad. Los datos confirman los antes citados y señalan a la sensibilización a Dermatophagoides, hiperrespuesta bronquial, sexo femenino, fumar y D e f i n i c i ó n e h i s t o r i a n a t u r a l comienzo del asma en edad temprana, como los factores predictores de la persistencia del asma en la edad adulta. La práctica clínica habitual indica que la gravedad del asma cambia poco a lo largo de los años, si se hace abstracción del control de síntomas logrado con el tratamiento adecuado. El niño que padece más síntomas en la infancia suele mostrar el asma más intensa en el período escolar y más tarde en su vida (28, 29). Basándose en esta observación, Castro-Rodríguez y cols. (31) han desarrollado un índice clínico para definir el riesgo del asma aparecida en los primeros años de la niñez. El índice se construye con seis datos clínicos fáciles de obtener: frecuencia de sibilantes, sibilantes sin resfriados, historia de eczema, historia de asma en los padres, eosinofilia y rinitis alérgica. Su valor predictivo negativo es alto (86,5 a 93,9%) y el positivo bastante inferior (26 a 32%). En un estudio de asma en el adulto (32), prolongado durante 25 años, la remisión –definida como ausencia de síntomas, un FEV1 normal y respuesta bronquial normal- se observó en el 10,5% de los pacientes. La remisión se asoció a menor edad en la primera visita, mejor función pulmonar y sexo masculino. Como en el niño, el adulto con asma más leve tiene más posibilidades de remisión, aunque menos que el niño; sólo un 10-15%. La mayoría de asmáticos adultos muestra con el tiempo una disminución del FEV1 post-broncodilatador y su obstrucción se va haciendo más irreversible. A medida que la edad del asmático aumenta, las posibilidades de remisión son menores, alrededor del 6% (33). En menos del 25% de los casos, el asma aparece tardíamente, después de los 40 años, muestra características de asma intrínseca y suele tener un curso más agresivo. La influencia de la atopia en el adulto es controvertida y los factores de riesgo de muerte por asma incluyen la edad mayor, el tabaco, la reducción de función pulmonar y la hiperrespuesta bronquial moderada o intensa. El tratamiento mejora la función pulmonar, reduce la hiperrespuesta y mejora la calidad de vida, pero su efecto sobre la historia natural de la enfermedad no está establecido (34). Los factores de riesgo asociados con el empeoramiento del asma, identificados en diversos estudios longitudinales son: el sexo femenino, tabaco ambiental en la infancia, tabaquismo en la adolescencia y adulto, edad de comienzo de los síntomas, gravedad en la niñez, intensidad de la alteración de la función pulmonar en la niñez, reversibilidad al broncodilatador, duración del asma y retraso en iniciar el tratamiento con esteroide (34). Los estudios aleatorios controlados han demostrado que la evitación alergénica (a ácaros del polvo doméstico) produce una mejoría de los síntomas y la hiperrespuesta bronquial en niños y adultos sensibilizados (35, 36). El efecto de la evitación a largo plazo 7 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 8 se ha estudiado en el asma ocupacional por diversos agentes causales (37) y en pacientes que sufrieron la epidemia de asma por soja, registrada en Barcelona (38). Los datos indican una mejoría producida en los dos primeros años tras la epidemia y su posterior estancamiento. REVERSIBILIDAD 8 DE LA OBSTRUCCIÓN Aunque el asma se define clásicamente como una obstrucción reversible del flujo aéreo y así se mantiene, e incluso disminuye en muchos enfermos con asma leve, en otros, la reversibilidad va reduciéndose y la obstrucción se hace más fija. En una proporción menor, la limitación del flujo se transforma en irreversible, pese a un tratamiento correcto y a la ausencia de elementos de riesgo, como el tabaco o la contaminación ambiental (39, 40). La función pulmonar (FEV1) disminuye aceleradamente, incluso a pesar del tratamiento con esteroide sistémico (40). Lange y colaboradores (41) analizaron los datos de un estudio longitudinal de una muestra de la población general de Copenhague entre 1976 y 1994. En los individuos que se identificaron como asmáticos, el FEV1 disminuyó a lo largo del tiempo sustancialmente más que en los no asmáticos. El tabaco acentuó la reducción en ambos grupos. Además, la hipersecreción bronquial crónica fue un marcador significativo de mayor reducción del FEV1 en los asmáticos, tanto en los fumadores como en los no fumadores. También Ulrik et al. (42) encontraron una reducción acelerada del FEV1 en 143 asmáticos adultos seguidos durante 10 años. Pero notaron, además, que la pérdida de FEV1 era mayor en los enfermos con asma “intrínseca” que en los atópicos, extrínsecos. Una mayor respuesta al broncodilatador se asoció a una reducción de FEV1 más pronunciada en el asma intrínseca. Todos estos estudios y otros similares presentan el asma como un proceso capaz de generar obstrucción crónica, irreversible, independientemente de otros factores causales conocidos, como el tabaco. Sus autores son conscientes de las dificultades diagnósticas y semánticas. Y en los estudios se menciona frecuentemente la denominada hipótesis holandesa. Propugnada por Orie et al. (43) en 1961, dicha hipótesis propone que la hiperrespuesta bronquial y la atopia son marcadores de una constitución particular que predispone al desarrollo de EPOC. Según los autores holandeses, este proceso incluiría el asma crónica y a lo que hoy día se entiende por EPOC (limitación crónica del flujo aéreo, con o sin hipersecreción bronquial crónica). Los estudios epidemiológicos, y más recientemente los genéticos, han separado la atopia de la hiperrespuesta bronquial. Por otra parte, han generado serias dudas sobre el papel de la atopia como factor de riesgo en la EPOC (44). En el lado positivo, debe apuntarse que la hiperrespuesta sí es un factor de riesgo para la reducción acelerada del FEV1, es decir, la limitación del flujo aéreo (45). Además, el reconocimiento de la patología de vías aéreas pequeñas en el asma y su trascendencia en el desarrollo de obstrucción crónica, es un hecho de renovado interés en los últimos años (46). Consecuencia de todo esto es la conclusión de que la heterogeneidad del asma y la EPOC hace impensable que su patogenia pueda explicarse por entero con una sola hipótesis. Sin embargo, la demostración de que en el asma puede producirse un deterioro progresivo de la función pulmonar, convierte el asma crónica en un factor de riesgo para la limitación crónica del flujo aéreo, independiente de y sinérgico con el tabaco, y causa además de un aumento de su mortalidad (47). Así mismo, la importancia patogénica en el asma de los factores perinatales, y su influencia en el deterioro ulterior de la función pulmonar, devuelven a la hipótesis holandesa el mérito de proponer un “factor constitucional” básico también para la EPOC. La propuesta generó un enorme volumen de estudios a favor y en contra, que han llevado al reconocimiento del papel del asma como vía de llegada a la EPOC, y de la importancia relativa de la hiperrespuesta bronquial y la atopia en ambos procesos (48). MORTALIDAD La muerte por asma es rara y prevenible. Se produce predominantemente en adultos entre los 40 y 60 años, y en los niños menores de dos años. La tasa general es menor del 0’5 por 100.000, con diferencias por países posiblemente relacionadas con las limitaciones de acceso a la atención médica. En diversos periodos, particularmente en países anglosajones y en la polinesia, se han observado incrementos transitorios, de origen mal explicado, en ocasiones achacado al mal uso de la medicación (49, 50). En determinadas epidemias ha podido comprobarse su origen ambiental, como se puso de manifiesto en las epidemias por inhalación de polvo de soja acaecidas en Barcelona (51). El desarrollo de la exacerbación que precede a la muerte es indistinguible del episodio denominado de “riesgo vital” y puede tener un comienzo rápido o lento. Entre estas dos posibilidades se observan algunas diferencias. Así, el comienzo rápido suele responder a una provocación por agentes irritantes o intolerancia a AINE, el lento es con mayor frecuencia consecuencia de una infección respiratoria (52). Los factores de riesgo de muerte identificados son: historia de asma grave, acceso limitado a atención médica, farmacoterapia deficiente, depresión, problemas familiares, instauración rápida de la crisis y alergia al hongo Alternaria. (53, 54). El pronóstico de una crisis de riesgo vital es malo, pues aproximadamente un 10% de asmáticos muere en el primer año que sigue a tal episodio. A largo plazo, un 17% de estos enfermos muere de su enfermedad. No obstante, las cifras deben tomarse con cautela pues los datos dependen en parte de los criterios usados en la definición de la crisis (55). C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 9 A s m a . D e f i n i c i ó n e h i s t o r i a n a t u r a l Bibliografía 1. Sanchis J. Asma. Avances en su patogenia, diagnóstico y tratamiento. An Med. Interna (sem.) 2001; 18 monogr 2 pp 3-16. 2. Douwea J, Gibson P, Pekkanen J, Pearce N. Non-eosinophilic asthma: importance and possible mechanisms. Thorax 2002; 57: 643-8. 3. Brown PJ, Greville HW, Finucane KE. Asthma and irreversible airflow obstruction. Thorax 1984;39:131-6. 4. Sears MR, Jones DT, Holdaway MD. The prevalence of bronchial reactivity to inhaled methacholine in New Zealand children. Thorax 1986;41:283-9. 5. Salome CM, Peat JK, Britton WJ, Woolcock AJ. Bronchial hyperresponsiveness in two populations of Australian school children.I. Relation to respiratory symptoms and diagnosed asthma. Clin Allergy 1987;17:271-81. 6. Pattemore PK, Asher MI, Harrison AC, Mitchel EA, Rea HH, Sterart AW. The interrelationship among bronchial hyper- responsiveness, the diagnosis of asthma, and asthma symptoms. Am Rev Respir Dis 1990;142;549-54. 7. Jeffery PK. Pathology of asthma. Br Med Bull 1992;48:23-39. 8. Henderson W Jr. The role of leukotrienes in inflammation. Ann Intern Med. 1994;121:684-97. 9. Holgate S. Mediator and cytokine mechanisms in asthma. Thorax 1993;48:103-9. 10. Holgate ST, Roche W, Djukanovic R, Wilson J, Britten K, Howarth P. The need for a pathological classification of asth- ma. Eur Respir J 1991;4:113s-122s. 11. Walker C, Bode E, Boer L et al. Allergic and nonallergic asthmatics have distinct patterns of T-cell activation and cytokine production in peripheral blood and bronchoalveolar lavage. Am Rev Respir Dis 1992; 146: 109-15. 12. Humbert M, Durham SR, Ying S et al. IL-4 and Il-5 mRN and protein in bronchial biopsies from patients with atopic and nonatopic asthma: evidence against “intrinsic” asthma being a distinct immunopathologic entity. Am J Respir Clin Care Med 1996; 154: 1497- 504. 13. Woolcock AJ, Peat JR, Trevillion LM. Is the increase in asthma prevalence linked to increase in allergen load? Allergy 1995; 50:935-40. 14. Wierenga EA, Snoek, de Groot C et al. Evidence for compartmentalization of functional subjects of CD 2+T lympho- cytes in atopic patients. J Immunol 1990; 144: 4651-6. 15. Romagnani S. Induction of Th1 and Th2 responses: a key role for the “natural” immune response?. Immunol Today 1992; 13:379-81. 16. Yabuhara A, Macaubas C, Prescott SL et al. Th2-polarised immunological memory to inhalant allergens in atopics is established during infancy and early childhood. Clin Exp Allergy 1997; 27:1261-9. 17. Holt PG. Primary allergic sensitization to environmental antigens: perinatal T-cell priming as a determinant of responder phenotype in adulthood. J Exp Med 1996; 183:1297-301. 18. Warner JA, Miles EA, Jones C, Quint DJ, Colwell BM, Warner JO. Is deficiency of interferon gamma production by allergen triggered cord blood cells a predictor of atopic eczema? Clin Exp Allergy 1994; 24:423-40. 19. Prescott SL, Macaubas C, Holt BJ. Transplacental priming of the human immune system to environmental allergens: universal skewing of initial T-cell responses towards the Th-2 cytokine profile. J Immunol 1998;160:4730-7. 20. Piccinni MP, Beloni L, Giannarini L et al. Abnormal production of T helper 2 cytokines interlenkin-4 and interlenkin-5 by T cells from new-borns with atopic parents. Eur J. Immunol 1996;26:2293-8. 21. Prescott SL, Macaubas C, Smallacombe T, Holt BJ, Sly P, Holt PG. Development of allergen-specific T-cell memory in atopic and normal children. Lancet 1999;353:196-200. 22. Stämpfli MR, Wiley RE, Neigh GS, et al. GM-CSF transgene expression in the airway allows aerosolized ovalbumin to induce allergic sensitization in mice. J Clin Invest 1998; 102 : 1704-14. 9 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 10 23. Holt PG, Macaubas C, Strumbles PA, Sly PD. The role of allergy in the development of asthma. Nature 1999;402 (suppl): B12-B17. 24. Ritz SA, Gajewska BU, Stämpfli MR, Jordana M. Determinants of the immune –inflammatory response in allergic airways Inflammation. J Allergy Clin Immunol 2000; 106 : s206-s212. 25. Davies DE, Wicks J, Powell RM, Puddicombe SM, Holgate ST. Airway remodeling in asthma: New insights. J Allergy Clin Immunol 2003; 111: 215- 25. 26. Holgate ST, Holloway J, Wilson S, Bucchieri F, Puddicombe S, Davies DE. Epithelial-Mesenchymal communication in the pathogenesis of chronic asthma. Proc Am Thorac Soc 2004; 1: 93-8. 27. Sears MR. Growing up with asthma. The two thirds with milder symptoms should grow out of asthma. BMJ 1994;309:72-3. 28. Oswald H, Phelan PD, Lanigan A, Hibert M, Bowes G, Olinsky A. Outcome of childhood asthma in mid-adult life. BMJ 1994; 309: 95-6. 29. Strachan DP, Butland BK, Anderson HR. Incidence and prognosis of asthma and wheezing illness from early child- hood to age 33 in a national British Cohort. BMJ 1996;312: 1195-9. 30. Sears MR, Greene JM, Willan AR et al. A longitudinal, population-based, cohort study of childhood asthma followed to adulthood. N Engl J Med 2003; 349: 1414-22. 31. Castro-Rodriguez JA, Holberg Cj, Wright AL, Martinez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med 2000 ; 162 : 1403-6. 32. Panhuysen CIM, Vonk JM, Koeter GH et al. Adult patients may outgrow their asthma. A 25 year follow-up study. Am J Respir Crit Care Med 1997;155:1267-72. 33. Rönmark E, Jönsson E, Lundbäck B. Remission of asthma in the middle aged and elderly: report from the obstruc- tive lung disease in Northern Sweden study. Thorax 1999;54:611-3. 10 34. Sears MR. Consequences of long-term inflammation. The natural history of asthma. Clin Chest Med 2000;21:315-29. 35. Dorward AJ, Collof MJ, Mackay NS, McSharry C, Thomson NC. Effect of house dust mite avoidance measures on adult atopic asthma. Thorax 1988;43:98-102. 36. Ehnert B, Lau-Schadendorf S, Weber A, Buettner P, Schou C, Wahn U. Reducing domestic exposure to dust mite aller- gen reduces bronchial hyperreactivity in sensitive children with asthma. J. Allergy Clin Immunol 1992;90:135-8. 37. Newman Taylor AJ. Occupational asthma. Postgrad Med J 1988;64: 505-10. 38. Anto JM, Soriano JB, Sunyer J, Rodrigo MJ, Morell F, Roca J et al. Long term outcome of soybean epidemic asthma after an allergen reduction intervention. Thorax 1999; 54:670-4. 39. Brown PJ, Greville HW, Finucane KE. Asthma and irreversible airflow obstruction. Thorax 1984;39:131-6. 40. Backman KS, Greenberger PA, Patterson R. Airways obstruction in patients with long-term asthma consistent with “irreversible asthma”. Chest 1997;112:1234-40. 41. Lange P, Parner J, Vestbo J, Schnohr P, Jensen G. A 15-year follow-up study of ventilatory function in adults with asthma. N Engl J Med 1998;339:1194-200. 42. Ulrik CS, Backer V, Dirksen A. A 10-year follow-up of 180 adults with bronchial asthma: factors important for the decline in lung function. Thorax 1992;47:14-8. 43. Orie NGM, Smiter HJ, de Uries K. The host factor in bronchitis. En: Orie NGM, Smiter HJ, eds. Bronchitis: an inter- national symposium. Assen, Holanda. Royal van Gorcun, 1961. 44. Pride NB, Burrows B. Development of impaired lung function: natural history and risk factors. En: Calverley P, Pride NB, eds. Chronic obstructive pulmonary disease. Londres, Chapman & Hall, 1995. 45. Rijcken B, Weiss ST. Longitudinal analyses of airway responsiveness and pulmonary function decline. Am J Respir Crit Care Med 1996;154:s246-s249. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 11 A s m a . D e f i n i c i ó n e h i s t o r i a n a t u r a l 46. Kraft M. The distal airways: are they important in asthma?. Eur Respir J 1999;14:1403-17. 47. Lange P, Ulrik CS, Vestbo J, por The Copenhagen City Heart Study Group. Mortality in adults with self-reported bronchial asthma. A study of the general population. Lancet 1996; 347:1285-9. 48. Grootendorst DC, Rabe KF. Mechanisms of Bronchial Hyperreactivity in Asthma and Chronic Pulmonary Disease. Proc Am Thorac Soc 2004; 1: 77-87. 49. Crane J, Flatt A, Jackson R et al. Prescribed fenoterol and death from asthma in New Zealand 1981-83. Case control study. Lancet 1989; 1: 917-23. 50. Abramson MJ, Bailey MJ, Couper FJ et al. Are asthma medications and management related to deaths from asthma?. Am J Respir Crit Care Med 2001; 163: 12-8. 51. Antó JM, Sunyer J, Rodríguez-Roisin R et al. The toxicoepidemiological Committee. Community outbreaks of asthma associated with inhalation of soybean dust. N Engl J Med 1989; 320: 1097-102. 52. Plaza V, Serrano J, Picado C, Sanchis J for the High Risk Asthma Research Group. Frequency and clinical character- istics of rapid-onset fatal and near-fatal asthma. Eur Respir J 2002; 19: 846-52. 53. Hessel PA, Mitchell I, Tough S et al. Risk factors for death from asthma. Ann Allergy Asthma Immunol 1999; 83: 362-8. 54. Plaza V, Serrano J, Picado C et al. Características clínicas de las crisis de asma de riesgo vital en los pacientes sen- sibilizados a Alternaria alternata. Med Clin (Barc) 2003; 121: 721-4. 55. McFadden ER, Warren EL. Observations on Asthma Mortality. Ann Intern Med 1997; 127: 142-7. 11 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 12 CUESTIONARIO 1. La definición actual de alergia es: a) la reacción excesiva frente a proteínas exógenas o sus fragmentos b) la reacción excesiva frente antígenos ambientales c) la reacción inmunitaria con producción de IgE frente a antígenos ambientales comunes 2. Entre las siguientes hay una frase falsa. Indíquela. a) Atopia es la predisposición hereditaria a producir anticuerpos IgE contra b) La relación entre atopia y alergia puede producirse a cualquier edad c) La relación atopia-alergia es más frecuente en el niño d) Puede haber asma alérgica en individuos no atópicos e) El asma no se da sin mecanismos inmunológicos antígenos ambientales comunes 3. La hiperrespuesta bronquial (señale la falsa): a) Es una característica definitoria del asma b) Se correlaciona intensamente con la inflamación y la obstrucción variable c) Puede faltar en algunos asmáticos d) Puede observarse en individuos no asmáticos e) Es más intensa en el asma que en la EPOC 4. En la inflamación asmática puede haber (indique la Falsa) a) Activación de mastocitos b) Infiltración eosinofílica c) Infiltración neutrofílica d) Nivel de IgE normal e) Metaplasia escamosa del epitelio 5. La obstrucción del flujo aéreo en el asma: 12 a) b) c) d) En el niño no atópico suele relacionarse con el tamaño pulmonar y desaparecer con el crecimiento Progresa indefectiblemente a lo largo de la vida Tiene un componente “fijo” menor y constante Es siempre variable en el curso clínico 6. La gravedad del asma tratada (indique la falsa) a) b) c) d) Cambia poco a lo largo de los años Con la evitación alergénica disminuye hasta desaparecer En el adulto guarda relación con la que tenía de niño Aumenta si el paciente es fumador 7. En el asma, la función pulmonar (señale la falsa) a) b) c) d) e) Disminuye con la edad más aceleradamente que en el sano Acelera su disminución mucho más con el tabaco Disminuye más en el asma “intrínseca” que en la alérgica Disminuye más cuanto mayor es la respuesta al broncodilatador Frena su disminución con el tratamiento correcto con corticoide inhalado 8. Todos menos uno son factores de empeoramiento del asma. Indíquelo. a) b) c) d) e) Sexo masculino Tabaco ambiental en la niñez Tabaco en la adolescencia Edad temprana de comienzo Retraso en iniciar el tratamiento con corticoide C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 13 A s m a . D e f i n i c i ó n e h i s t o r i a n a t u r a l 9. La muerte por asma: a) b) c) d) e) Se produce predominantemente en niños <2 años y adultos de 40-60a Sobreviene en el contexto de una crisis grave muy característica En ocasiones acontece de forma epidémica Suele relacionarse con el mal uso de la medicación Depende mucho de las limitaciones de acceso a atención médica 10. Todos menos uno son factores de riesgo de muerte por asma. Señálelo. a) b) c) d) e) Historia de asma persistente Acceso limitado a atención médica Farmacoterapia deficiente Depresión Alergia al hongo Alternaria 13 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 14 14 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 15 A s m a . D e f i n i c i ó n e h i s t o r i a n a t u r a l Respuestas fascículo 1, capítulo I (Asma. Definición e historia natural) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 15 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 16 16 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 17 E p i d e m i o l o g í a d e l a s m a Capítulo II EPIDEMIOLOGÍA DEL ASMA. Manolis Kogevinas y Francesc Castro-Giner Unitat de Recerca Respiratoria i Ambiental Institut Municipal d’Investigació Mèdica C/ Doctor Aiguader, 80 - Barcelona 08003 Telf.: 93 225 75 68 - Fax: 93 221 64 48 Email: [email protected] 17 Correspondencia: Unitat de Recerca Respiratoria i Ambiental Institut Municipal d’Investigació Mèdica C/ Doctor Aiguader, 80 - Barcelona 08003 Telf.: 93 225 75 68 - Fax: 93 221 64 48 Email: [email protected] Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 18 18 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 19 E p i d e m i o l o g í a d e l a s m a EPIDEMIOLOGÍA DEL ASMA. Resumen El asma se produce por la exposición a factores ambientales como los alérgenos o las infecciones, probablemente en personas genéticamente susceptibles. Es una de las enfermedades crónicas más comunes en el mundo, con una estimación de 300 millones de afectados. En España se calcula que el 5% de la población adulta tiene síntomas de asma, siendo dicha proporción más alta en niños. Durante las últimas décadas la prevalencia de asma en niños y adultos ha incrementado. Este aumento se ha asociado con un incremento de atopia y es paralelo al incremento de otros síntomas alérgicos. La prevalencia de asma varia geográficamente, siendo más alta en países industrializados y, tanto en niños como en adultos, en países de habla inglesa. Aunque se conocen muchas de las causas que producen la enfermedad, no se ha logrado explicar la variabilidad geográfica y el incremento temporal. La hipótesis higiénica, atribuye parte del incremento a una menor tasa de infecciones en niños, lo que produciría la desviación del sistema inmune hacia una respuesta Th2 en contra de un fenotipo linfocítico Th1. Entre los factores de riesgo investigados se incluyen la contaminación atmosférica en el interior y exterior, exposiciones laborales, el tabaquismo pasivo y activo, la dieta y factores genéticos. Introducción El asma es una enfermedad crónica inflamatoria con un fenotipo heterogéneo atribuido al sinergismo entre muchos genes y factores medioambientales. Se estima que la padecen 300 millones de personas en el mundo, cifra que sigue en aumento (http://www.ginasthma.com/). Estudios epidemiológicos internacionales con criterios protocolizados, han demostrado la existencia de una amplia variación geográfica en su prevalencia. La misma variación se ha encontrado para la sensibilización atópica y la hiperreactividad bronquial. Aunque muchas de las causas de asma han sido identificadas mediante estudios clínicos y epidemiológicos, las causas responsables del aumento de prevalencia y de la varia- ción geográfica son aún desconocidas en su gran mayoría (1). Estudios epidemiológicos Los estudios epidemiológicos que evalúan asma se pueden clasificar según el tipo de diseño utilizado (estudios transversales o estudios de prevalencia, estudios prospectivos o de cohortes, y estudios casocontrol) o el tipo de población evaluada (estudios de base poblacional y estudios de poblaciones específicas). Los estudios transversales y los de cohortes son los diseños más aplicados, habitualmente sobre una muestra poblacional. En el caso particular de los estudios de asma laboral, la mayoría evalúan grupos específicos seleccionados por ocupación. En muchos países existen sistemas de vigilancia epidemiológicos que identifican casos de asma, normalmente asociados a exposiciones medioambientales y laborales. Definiciones de asma El asma se define como un síndrome caracterizado por la inflamación de las vías aéreas, función pulmonar variable e hiperreactividad bronquial. La definición de asma en estudios epidemiológicos no es siempre obvia ni está claramente protocolizada, por lo que muchos de los resultados contradictorios obtenidos se pueden atribuir a diferencias en la definición del fenotipo. Se han utilizado diferentes criterios para la definición, como la presencia de síntomas, el tiempo de inducción, los niveles de IgE, o la hiperreactividad bronquial. Habitualmente se suelen utilizar estos criterios de forma combinada. Dichos criterios se corresponden solo en parte con criterios clínicos, aunque frecuentemente se aplica un procedimiento secuencial parecido al procedimiento clínico, especialmente en estudios de asma laboral. Estudios poblacionales como el estudio ISAAC (International Study of Asthma and Allergies in Childhood) y el estudio ECRHS (European Community Respiratory Health Survey), aplican otro tipo de criterios que definen grupos poblacionales de alto riesgo, sin identificar necesariamente si los síntomas de asma de cada persona están asociados a factores de riesgo 19 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 20 específicos. La tabla I presenta un ejemplo de definición de asma en el ECRHS (2). En estudios poblacionales grandes, normalmente se utilizan cuestionarios de síntomas respiratorios más que el diagnostico clínico, por dos razones. Primero, en estudios de decenas de miles de personas es imposible evaluar clínicamente todos los sujetos con un protocolo estándar y reproducible. Segundo, el asma es una enfermedad con un fenotipo heterogéneo y por ello, los estudios poblacionales evalúan un amplio espectro de síntomas y no solamente sintomatología clínica. Tabla I. Definición de asma en un estudio poblacional (2). El estudio European Community Respiratory Health Survey (ECRHS) evaluó asma en más de 15,000 personas de varios países industrializados (www.ecrhs.org). Se evaluó mediante un cuestionario de síntomas. También se dispuso de espirometrías, evaluaciones de hiperreactividad bronquial y niveles de IgE, de la mitad de la muestra poblacional aproximadamente. Asma se definió como una combinación de las siguientes preguntas: 20 — ¿Se ha despertado por la noche a causa de un ataque de falta de aire alguna vez en los últimos 12 meses?, o — ¿ha tenido algún ataque de asma en los últimos 12 meses?, o — ¿toma actualmente alguna medicina (incluyendo inhaladores, aerosoles o pastillas) para el asma?. Sin embargo en varios análisis se identificó que el asma definido con criterios más específicos, como definiciones que se limitaban a los dos últimas preguntas (ataques de asma o medicación) o definiciones que combinaban síntomas con hiperreactividad bronquial, se asociaban más claramente a factores de riesgo conocidos, como por ejemplo, exposiciones laborales (2). Esto indica la importancia de una definición de asma en los estudios epidemiológicos. Prevalencia y incidencia de asma Varios estudios indican que en países industrializados, la prevalencia de asma esta incrementando en aproximadamente un 5% al año, en niños y adultos jóvenes (1). Entre los estudios internacionales más importantes se encuentran el estudio ISAAC en niños y el estudio ECRHS en jóvenes adultos, o los estudios NHANES (National Health and Nutrition Examination Survey) de EE.UU. Los estudios NHANES han situado la prevalencia de asma en EEUU entre el 5 y el 7%. El estudio ISAAC (3) ha incluido aproximadamente 500,000 niños en 155 centros de 56 países y ha demostrado una enorme variación geográfica (Figura 1) en prevalencia Figura 1. Variación geográfica de síntomas de asma en niños, estudio ISAAC (http://www.ginasthma.com/). de asma, rinoconjuntivitis y eczema. La prevalencia más alta se ha encontrado en centros de Inglaterra, Nueva Zelanda, Australia y EE.UU. En España se entrevistaron 27.407 niños de entre 13-14 años de edad, en 9 poblaciones españolas: Almería, Barcelona, Bilbao, Bahía de Cádiz, Cartagena, Castellón, Pamplona, Valencia y Valladolid (4). Se utilizó el cuestionario escrito y el vídeo-cuestionario sobre asma del estudio ISAAC. La prevalencia de sibilancias en reposo utilizando el vídeo-cuestionario fue mayor en los varones que en las mujeres (el 15,4% frente al 12,6%) para sibilancias alguna vez, mientras que en sibilancias en el último año fue del 7,8% en los varones y del 7,0% en las mujeres. Las prevalencias más elevadas se encontraron en Bilbao, Barcelona y Bahía de Cádiz, mientras que Valladolid, Almería, Castellón y Pamplona eran las zonas con menor prevalencia. El estudio Europeo de asma (ECRHS) evaluó la prevalencia de síntomas de asma en los últimos 12 meses C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 21 E p i d e m i o l o g í a en muestras aleatorias de hombres y mujeres de 20 a 44 años en 48 centros, principalmente de Europa occidental (5). Se utilizó un cuestionario breve de 7 preguntas. Se observó que la prevalencia de síntomas variaba considerablemente entre centros, siendo mayor en las islas Británicas, Nueva Zelanda, Australia y EE.UU., y más baja en países de Europa del norte, centro y sur (Figura 2). Sin embargo existía una variación considerable dentro de cada país. La participación española en este estudio se llevó a cabo en cinco áreas (Albacete, Barcelona, Galdakao, Huelva y Oviedo) e incluyó una muestra de 16,884 individuos entre 20 y 44 años (6). La frecuencia de síntomas relacionados con asma en el último año varió ampliamente entre áreas: ataque nocturno de falta de aire varió entre 3.6 y 11.6%; ataque de asma entre 1,4 y 3,4%; medicación para el asma entre 1,2 y 5,6%. La frecuencia global de estos síntomas en varones y mujeres respectivamente fue 4,9 y 5,0% en Galdakao, 6,3 y 6,6% en Barcelona; 9,4 y 9,3% en Oviedo; 10,7 y 9,1% en Albacete y 14,3 y 14,9% en Huelva. d e l a s m a Hay datos de incidencia disponibles de varios estudios de cohortes. Las tasas de incidencia varían entre 0 y 4% por año, dependiendo de la edad y el sexo, con tasas más altas en edades más jóvenes y niños. Un estudio reciente con una muestra de 15,813 personas en Suecia, en el que se evaluaba la incidencia de asma diagnosticado por un médico, obtuvo una tasa de incidencia de 1,3 casos por 1000 personas-año en mujeres y 1,0/1000 personas-año en hombres. La tasa de incidencia más alta fue en el grupo de mujeres jóvenes de entre 16-20 años (3.0/1000). Historia natural Aunque la historia natural del asma se ha descrito repetidamente, existen importantes dudas sobre la evolución de la enfermedad en las edades tempranas. Estudios en niños indican que la mayoría de los casos de asma empiezan en los primeros años de vida, posiblemente antes de los 3 años, y que las infecciones virales pueden jugar un papel importante en desencadenamiento de crisis asmáticas. En niños, la duración de los síntomas se asocia con menor función pulmonar, mayor hiperreactividad, peor gravedad y más síntomas. Existen menos datos de la historia natural en adultos. Factores de riesgo FACTORES SOCIODEMOGRÁFICOS. Varios estudios han encontrado una mayor prevalencia de asma en mujeres en comparación a hombres, aunque este patrón depende de la edad (7). La mayor incidencia de asma y hiperreactividad bronquial en mujeres adultas puede, al menos en parte, ser debida a la menor FEV1 de las mujeres. Varios estudios han encontrado mayor sensibilización a varios alérgenos en hombres que en mujeres. La asociación del nivel socioeconómico con el asma en adultos no está bien estudiada. Varios estudios han encontrado un aumento de admisiones hospitalarias y de severidad de asma en gente de bajo nivel socioeconómico. Igualmente, un análisis del estudio ECRHS observó un aumento de la prevalencia de síntomas de asma en clases más desfavorecidas (7). En España se ha encontrado un aumento de síntomas de asma entre personas en el paro en comparación a los empleados. Pese a estas evidencias, la asociación entre nivel socioeconómico y incidencia de asma no esta clara. INFECCIONES, Figura 2. Variación geográfica de síntomas de asma en adultos, estudio ECRHS (http://www.ginasthma.com/). ALÉRGENOS Y LA HIPÓTESIS HIGIÉNICA La prevalencia de asma se ha incrementado en muchos países durante las últimas décadas, coincidiendo con cambios en la economía y estilo de vida de las sociedades. El asma se produce por la exposición a factores ambientales como los alérgenos o las infecciones, probablemente en personas genética- 21 Asma I Fasc culo 1 DEF.qxd 22 30/05/2005 13:13 PÆgina 22 mente susceptibles. Muchos estudios, incluyendo estudios en España, han encontrado asociación entre sensibilización alergenica y síntomas de asma o hiperreactividad bronquial. También en España, se encontró una asociación independiente entre alternaria, olivo, hierba timotea y gato y niveles bajos de FEV1. La exposición a D. pteronyssinus es muy común como consecuencia de los cambios en el estilo de vida y las viviendas, y se ha asociado a síntomas más severos de asma en individuos sensibilizados. Sin embargo no se puede explicar porque existe un aumento en la sensibilización a muchos otros alérgenos, ni porque no se registra un aumento de la prevalencia de asma en sociedades menos industrializadas donde también se encuentran altos niveles de exposición a ácaros. Dichas observaciones junto a observaciones sobre una menor prevalencia de asma en niños con hermanos mayores, han apoyado propuesta de la hipótesis higiénica (8). Dicha hipótesis sostiene que los niños de las sociedades modernas están expuestos a menos infecciones que antes (por las mejores condiciones de vida, la implementación de sistemas de vacunación, el uso de antibióticos etc.), y que esto puede causar una polarización del sistema inmune hacia una respuestas Th2 en contra de un fenotipo linfocítico Th1 (9). Dicha desviación significaría más susceptibilidad a enfermedades alérgicas. Aunque se han propuesto varias causas de dicha desviación (pe. exposición a infecciones, adquisición de diferentes bacterias intestinales, exposición a endotoxinas por bacterias), las razones que producen el desarrollo de una respuesta sesgada Th2 del sistema inmune y la sobreproducción de citokinas como las interleukinas Il-4, IL-5, Il-9 o Il13, que caracterizan el asma, no están claras. Algunos estudios en niños han identificado menor prevalencia de síntomas entre niños que han crecido en ambiente rural con exposición a animales (y probablemente a parásitos) y con consumo de leche no pasteurizada. Estudios recientes están investigando otros factores de riesgo que ocurren en fases tempranas de la vida como el peso al nacer o la lactancia. Aunque la hipótesis higiénica ha encontrado mucho respaldo en los últimos años, existen muchas contradicciones que indican que el incremento de la prevalencia de asma puede ser debido a factores más complejos. Por ejemplo la hipótesis de la desviación Th2/Th1 debida a menor infección no se explica en países en desarrollo donde infecciones helmínticas que favorecen una respuesta sesgada Th2 y que son muy prevalentes no se asocian con un incremento claro de alergia. TABAQUISMO El humo pasivo contiene muchos potentes irritantes. Dicha exposición es muy alta en España. En niños, el tabaquismo de los padres se ha asociado con multitud de síntomas respiratorios y con peor función pulmonar. En el estudio de niños de Tucson, se encontró una asociación con el consumo de tabaco por la madre durante el embarazo y no en la fase postnatal, indicando un posible efecto en las fases iniciales de desarrollo del sistema respiratorio. En adultos se ha encontrado una asociación entre exposición a humo pasivo en el lugar del trabajo y síntomas de asma (10). Fuera del lugar de trabajo, el humo pasivo en adultos se ha asociado en algunos estudios con mayor riesgo de asma, empeoramiento de asma y con la hiperreactividad bronquial. El humo pasivo se ha asociado en varios estudios con altos niveles de IgE total. Aunque varios estudios han encontrado una mayor prevalencia de tos y sibilancias entre fumadores en relación a los no fumadores, la asociación del tabaquismo activo en adultos y asma es menos clara (1, 7). Algunos estudios han encontrado dicha asociación solamente en no-atópicos. Igualmente se ha encontrado que la hiperreactividad bronquial se asociaba con el tabaquismo activo solamente en los no-atópicos. El tabaquismo se asocia con niveles más altos de IgE total y en un estudio internacional se identificó más sensibilización a ácaros entre fumadores que no fumadores aunque otros estudios encuentran menos sensibilización a alérgenos en fumadores. CONTAMINACIÓN ATMOSFÉRICA La asociación entre contaminación atmosférica en ambientes exteriores e interiores se ha evaluado en estudios epidemiológicos y en estudios controlados de laboratorio. Sin embargo, dicha asociacion es compleja (11). Estudios incluyendo estudios españoles han demostrado un empeoramiento funcional y un aumento de la hospitalización por urgencias en relación a diferentes contaminantes como partículas, NO2 y SO2. Sin embargo dos tipos de evidencias son incongruentes con una asociación clara de contaminación atmosférica y ocurrencia de asma. Primero, que los niveles de contaminación atmosférica se han disminuido considerablemente en la mayoría de los países industrializados en el mismo tiempo que se aumentó la prevalencia de asma. Segundo, estudios en Alemania comparando prevalencia de síntomas de asma en ciudades de la parte occidental con la parte oriental, donde la contaminación era mucho más alta, indicaron una mayor prevalencia de asma en la parte occidental (1). Una posible explicación de estos hallazgos es que la exposición a contaminantes está asociada con el empeoramiento de síntomas en personas sensibilizadas, mientras que protege en relación a la aparición de casos de novo. Muchos estudios han demostrado que contaminantes atmosféricos como las partículas de emisiones diesel son potentes inductores de estrés oxidativo, involucrado en inflamación alérgica y exacerbación de crisis de asma. Estudios experimentales han indicado que ciertos contaminantes pueden promocionar la formación de IgE para alérgenos específicos y provocar síntomas en personas ya sensibilizadas. Existen varios estudios que indican la importancia de la contaminación en el interior de los edificios. Se ha asociado la prevalencia de asma, la hiperreactivi- C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 23 E p i d e m i o l o g í a dad bronquial y otros síntomas respiratorios con viviendas con humedad, moho, viviendas recientemente pintadas, niveles altos de CO2 en el interior, exposición a formaldehído y otros compuestos volátiles orgánicos. En el estudio ECRHS, las mujeres que utilizaban gas para cocinar (expuestas a altos niveles de NO2) tenían síntomas de asma y peor función pulmonar (FEV1 y FEV1/FVC) comparadas a mujeres que no utilizaban gas (12). Sin embargo estos hallazgos no se han comprobado en su totalidad en un estudio internacional. OCUPACIÓN En países industrializados el asma es la enfermedad respiratoria laboral más frecuente (2). Aproximadamente 250 agentes específicos en el lugar del trabajo se han asociado con el asma (como por ejemplo: enzimas, látex, isocianatos, metales). Pocos de estos se han evaluado en estudios epidemiológicos. Una revisión reciente evaluó que aproximadamente un 15% del a sma en adultos se puede atribuir a exposiciones en el lugar del trabajo. Uno de los más grandes estudios sobre asma laboral internacional en la población general encontró un aumento del riesgo entre agricultores, pintores, trabajadores de plástico, limpiadoras entre otros (Tabla II). En España, la proporción del asma laboral atribuida al trabajo de limpiadoras era muy alta y, se ha evaluado que la exposición a esprays, probablemente irritantes, esta asociada con un riesgo más alto en estos trabajadores (13). Existen pocas evidencias en relación a la importancia de exposiciones concomitantes para la aparición de asma laboral, como es el tabaquismo en trabajadores expuestos a anhídridos, exposición a humo pasivo u otros contaminantes del interior o la interacción de exposiciones laborales y factores genéticos. Tabla II. Ocupaciones en el estudio ECRHS en alto riesgo de asma definido como síntomas de asma o medicación y hiperreactividad bronquial (2) Ocupación No. personas OR (IC95%) Agricultores 71 2.6 (1.3 –5.4) Pintores, otros 65 2.3 (1.0 – 5.3) Trabajadores, Plásticos 34 2.2 (0.6 – 8.3) 443 2.0 (1.3 – 2.9) 56 2.0 (0.7 – 5.3) Limpiadores Pintores, espray d e l a s m a DIETA Estudios de intervención no han proporcionado resultados consistentes en relación a factores dietéticos y asma. Estudios observacionales han sugerido que dietas con bajo contenido en Vitaminas E y C, ácidos grasos polininsaturados ω-3 y alto consumo de sal están asociados con un mayor riesgo de asma. En el estudio ECRHS , no se observó asociación entre la aparición de sibilancias o alergia, con obesidad (7). FACTORES GENÉTICOS En la introducción ya se ha comentado que el asma se caracteriza por un fenotipo heterogéneo, producido por el sinergismo entre muchos genes y factores medioambientales. La variación geográfica y el aumento de la prevalencia en niños en un período corto de tiempo indican la importancia de los factores ambientales en la aparición de asma. Sin embargo, incluso en situaciones de alta exposición como determinados ambientes laborales, no todos los individuos desarrollan la enfermedad, lo que indica la influencia de factores propios del individuo. Estudios de historia familiar, como en el ECRHS, se observó que personas cuyos padre o madre eran asmáticos, tenían 3 veces más riesgo de tener síntomas de asma que personas sin historia familiar. Además, los individuos que descendían de dos padres con asma tenían un riesgo 7 veces mayor (7). Estudios en familias (estudios de segregación) y gemelos, también han demostrado la importancia de los factores genéticos (14). Numerosos loci y genes candidatos han sido asociados con asma y fenotipos relacionados como atopia y hiperreactividad bronquial. Entre las regiones cromosómicas que han sido evaluadas y en las que se ha observado asociación, encontramos: 2q14-q32, 5q31-q33, 6p21.3, 7q31, 11q13, 12q14.3-q24.31, 13q14, 14q11.2-q13, 16p21, 17q11.2, 20p13. También existen resultados consistentes para algunos genes candidatos, en los que se observó especificidad para diferentes fenotipos relacionados con asma: IL4R para atopia, ADAM33 para hiperreactividad bronquial o PHF11 para IgE. Solo recientemente se han comenzado a realizar estudios que evalúan las interacciones entre genes y ambiente (14). Se ha observado que algunos genes involucrados en el metabolismo de compuestos de contaminación atmosférica (como la superfamilia cyp450, N-acetyl transferasas, glutatión-S-transferasas o sulfotransferasas) o relacionados con asma mediante la regulación de mecanismos de inflamación, sistema inmune, hiperreactividad bronquial o “airway remodelling”, modifican el efecto de exposiciones ambientales y confieren protección o mayor riesgo entre sujetos con las diferentes variantes (Tabla III). No se han podido obtener grandes conclusiones en este campo debido a que la mayoría de información esta basada en muestras pequeñas y en evaluaciones limitadas de los genes candidatos y la exposición. 23 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 24 Exposición Genes evaluados Medioambiental Contaminación atmosférica interior GSTM1,GSTP1,GSTT1,GSTP1 β2AR IL4R-a CC16 Promotor TNF-α, TNF-β NQO1 Contaminación atmosférica exterior TLR4 HLA-DRB1 Tabaco ambiental GSTM1, GSTT1 Otros HLA-DRB1, HLAII-DQ Isocianatos GSTP1, GSTM1, GSTM3, GSTT1, HLAII-DQA1, HLAII-DQB1, HLAIIDRB1,2,3,4, HLA clase I TNF-α T-cell receptor V β AAT NAT1 y NAT2 Trabajadores en producción de aluminio βZAR Laboral 24 Receptor de alta afinidad de IgE TNFα-308 Alpha-1-antitripsina HLA Alotipos Ig Ácidos anhídridos HLAII-DP, HLAII-DQ5, HLAII-DR1 Granjas TLR2, TLR4 Alpha-1-antitripsina Madera HLAII-DRB1, HLAII-DQB1 Animales de laboratorio HLAII-DQB1, HLAII-DRB1, HLAIIA, HLAII-B, HLAII-C Complejos de sales de platino HLAII-DRB, HLAII-DPB, HLAIIDQA, HLAII-DQB Fumar βZAR Fármacos HLAII-DPB1,HLAII-DRB1 EP2 Estilos de vida y otros C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 25 E p i d e m i o l o g í a d e l a s m a Bibliografía 1. Tattersfield AE, Knox AJ, Britton JR, Hall IP. Asthma. Lancet. 2002; 360:1313-22. 2. Kogevinas M, Antó JM, Sunyer J, Tobías A, Kromhout H, Burney P, et al. A population based study on occupational asthma in Europe and other industrialised countries. Lancet 1999; 353: 1750-4. 3. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Worldwide variation in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. Lancet 1998; 351: 1225-32. 4. Aguinaga Ontoso I, Arnedo Pena A, Bellido J, Guillen Grima F, Suarez Varela MM. The prevalence of asthma-related symptoms in 13-14-year-old children from 9 Spanish populations. Med Clin (Barc). 1999;112:171-5. 5. European Community Respiratory Health Survey. Variations in the prevalence of respiratory symptoms, self-reported asthma attacks, and use of asthma medication in the European Community Respiratory Health Survey (ECRHS). European Respiratory Journal 1996; 9:687-95. 6. The European Asthma Study. The prevalence of asthma-related symptoms in 5 Spanish areas. The Spanish Group of the European Asthma Study. Med Clin (Barc). 1995;104:487-92. 7. Janson C, Anto J, Burney P, Chinn S, De Marco R, Heinrich J et al. The European Community Respiratory Health Survey: what are the main results so far? European Respiratory Journal 2001;18:598-611. 8. Strachan DP. Hay fever, hygiene, and household size. Br Med J 1989; 299:1259–1260. 9. Umetsu DT, McIntire JJ, Akbari O, Macaubas C, DeKruyff RH. Asthma: an epidemic of dysregulated immunity. Nat Immunol. 2002; 3:715-20. 10. Atkinson RW, Anderson HR, Sunyer J, et al Acute effects of particulate air pollution on respiratory admissions: results from APHEA 2 project. Air Pollution and Health: a European Approach. Am J Respir Crit Care Med. 2001; 164:1860-6. 11. Jarvis D, Chinn S, Luczynska C, Burney P. Association of respiratory symptoms and lung function in young adults with use of domestic gas appliances. Lancet 1996;347 :426-31. 12. Janson C, Chinn S, Jarvis D, Zock JP, Toren K, Burney P et al. Effect of passive smoking on respiratory symptoms, bronchial responsiveness, lung function, and total serum IgE in the European Community Respiratory Health Survey: a cross-sectional study. Lancet 2001; 358:2103-9. 13. Medina-Ramón M, Zock JP, Kogevinas M, Sunyer J, Antó JM. Asthma symptoms in women employed in domestic cleaning: a community-based study. Thorax 2003; 58: 950-4. 14. Cookson W. The alliance of genes and environment in asthma and allergy. Nature. 1999; 402 (6760 Suppl):B5-11. 25 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 26 CUESTIONARIO 1. La prevalencia del asma se ha incrementado a) Solo en jóvenes b) Solo en países anglosajones c) En casi todos los países que se ha evaluado d) No se puede evaluar el cambio en la prevalencia en el tiempo e) A y B 2. Las a) b) c) d) e) exposiciones laborales Producen entre 1 y 2% del asma en adultos Solo empeoran el asma y no producen asma de novo Solo producen asma agentes de alto peso molecular Solo producen asma agentes que actúan por un mecanismo IgE Ninguna de las respuestas 3. Las a) b) c) d) e) exposiciones laborales en España No se han evaluado Se asocian solo con asma en hombres Se han asociado con asma en limpiadoras Se han asociado con exposiciones solo en zonas urbanas Ninguna de las respuestas 4. La contaminación atmosférica a) Provoca asma solo en niños susceptibles b) Solo empeora el asma c) Provoca asma posiblemente promoviendo el estrés oxidativo d) No se asocia con asma en no atopicos e) A y C 26 5. Asma relacionado con la contaminación en el interior de los edificios a) Se ha asociado con el síndrome del edifico enfermo b) Se ha asociado con la aluminosi en los edificios c) Se provoca solo en edificios de los países nórdicos con alta humedad d) Se provoca solo en edificios en áreas muy contaminadas por la polución atmosférica e) Se ha asociado con edificios con humedad 6. Asma relacionado con la contaminación en el interior de los edificios a) Se ha asociado con la exposición a NO2 b) Se ha asociado solo con la exposición a casas con cocinas sin ventilación c) No se ha asociado con asma pero solamente con un aumento de alergias d) Se provoca solamente en casas con altos niveles de ácaros e) No se asocia en casas situadas cerca del mar 7. El humo pasivo a) Se asocia con asma solamente en niños b) Se asocia con asma solamente en adultos c) Se asocia con asma de los niños solamente con la exposición de las madres d) En el lugar del trabajo se asocia con asma en adultos e) En el lugar del trabajo se asocia solamente con la hiperreactividad bronquial 8. Los a) b) c) d) e) estudios epidemiológicos evaluando asma Son básicamente estudios de cohorte (estudios prospectivos) Son básicamente estudios transversales (estudios de prevalencia) Son básicamente estudios caso y control A, B y C AyB C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 27 E p i d e m i o l o g í a d e l a s m a 9. La hipótesis higiénica con relación al asma a) sostiene que la disminución de la capa de ozono afecta la respuesta inmunológica de los niños b) sostiene que los niños de las sociedades modernas están expuestos a menos infecciones que antes c) sostiene que los niños de las sociedades modernas están viviendo en casas con más ventilación d) sostiene que los niños de las sociedades tradicionales están viviendo en ambiente con menos ácaros e) sostiene que los niños de las sociedades modernas están expuestos a más infecciones que antes 10. La a) b) c) d) e) hipótesis higiénica sostiene que la prevalencia del asma ha incrementado por la desviación del sistema inmune hacia una respuesta Th2 en contra de un fenotipo linfocítico Th1. por la desviación del sistema inmune hacia una respuesta Th1 en contra de un fenotipo linfocítico Th2. Por cambios en el sistema inmune en edades precoces que afectan la susceptibilidad a enfermedades alérgicas AyC ByC 11. Con relación a la dieta: a) la dieta mediterránea se ha asociado con una menor prevalencia del asma b) un alto consumo de sal se ha asociado con asma solamente en personas jóvenes y no atopicas c) la obesidad se ha asociado con la hiperreactividad bronquial pero no con síntomas de asma d) la obesidad se ha asociado con asma en mujeres premenopáusicas e) ninguna 12. Asma ha sido asociado con la historia familial a) Solo en condiciones de altas exposiciones ambientales b) Solo en países anglosajones por la acumulación -“clustering”- de genes de susceptibilidad de asma en dichas poblaciones c) Solo con relación a las madres d) Con relación a las madres y los padres e) B y D 13. Con relación a los Factores genéticos y asma a) Se ha encontrado una asociación entre el gen ADAM33 y asma b) Se ha encontrado una asociación entre el gen EVA33 y asma c) Se ha encontrado una asociación entre en personas que tienen polimorfismos tanto en el gen ADAM33 y en el EVA33. d) se han evaluado genes solo con relación al sistema HLA e) a y b 14. La a) b) c) d) e) prevalencia de asma ha incrementado durante las ultimas décadas ha incrementado porque el asma se trata mejor mientras la incidencia no ha cambiado ha incrementado porque el asma se trata mejor mientras la incidencia ha bajado AyB AyC 15. Con relación a las exposiciones laborales a) Se han identificado aproximadamente 25 agentes en el ambiente de trabajo que provocan asma b) Se han identificado aproximadamente 50 agentes en el ambiente de trabajo que provocan asma c) Se han identificado aproximadamente 250 agentes en el ambiente de trabajo que provocan asma d) Se han evaluado solamente agentes que provocan agravación del asma e) A y D 16. El numero de personas con asma en el mundo a) Es aproximadamente unos 30 millones de personas b) Es aproximadamente unos 300 millones de personas c) No se puede calcular porque el asma en muchos países se confunde con las neumoconiosis d) No se puede calcular porque una gran proporción de la población no ha desarrollado aun asma pero lo hará en el futuro e) Ninguna de las respuestas 27 Asma I Fasc culo 1 DEF.qxd 17. La a) b) c) d) e) 30/05/2005 13:13 PÆgina 28 prevalencia de asma en España Es entre 17 y 18% en niños de 13-14 años Es entre 7 y 8% en niños de 13-14 años Es mas alta en niños de 13-14 años que en niñas de la misma edad Se ha evaluado solo en adultos No se puede decir porque no se han hecho estudios ajustando por edad y sexo 18. El incremento de la sensibilización a ácaros en las ultimas décadas a) se ha asociado a más severos síntomas de asma en individuos sensibilizados b) se ha encontrado básicamente en personas de nivel socioeconómico bajo c) se ha encontrado básicamente en ejecutivos por su trabajo en ambientes con moquetas d) A y B e) A y C 19. La prevalencia de asma en niños que han crecido en un ambiente rural a) Es mas alta que niños crecidos en ambientes urbanos b) No se puede comparar con la prevalencia de niños en áreas urbanas porque no se puede ajustar por otros factores de estilo de vida c) Se asocia con el agua que principalmente es de pozos d) Se asocia con la utilización de pesticidas y especialmente pesticidas basados en proteínas e) Ninguna de las respuestas 20. Con relación al tabaquismo a) Se ha encontrado un mayor prevalencia de tos y sibilancias entre fumadores con relación a los no fumadores b) No se puede evaluar su relación con el asma porque los fumadores tienen más bajos niveles de IgE total c) No se puede evaluar su relación con el asma porque los fumadores tienen más altos niveles de IgE total d) A y B e) A y C 28 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 29 E p i d e m i o l o g í a d e l a s m a Respuestas fascículo 1, capítulo II (Epidemiología del asma) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 29 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 13.- a b c d e 14.- a b c d e Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 30 15.- a b c d e 16.- a b c d e 17.- a b c d e 18.- a b c d e 19.- a b c d e 20.- a b c d e 30 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 31 E p i d e m i o l o g í a d e l a s m a 31 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 32 32 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 33 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a Capítulo III ASMA BRONQUIAL. ANATOMÍA PATOLÓGICA Dr. José Javier Gómez Román Dpto. Anatomía Patológica Hospital Universitario “Marqués de Valdecilla” Avda. Valdecilla s/n - 39008 Santander Telf.: 94 220 33 90 - Fax: 94 220 34 92 Email: [email protected] 33 Correspondencia: José Javier Gómez Román Dpto. Anatomía Patológica Hospital Universitario “Marqués de Valdecilla” Avda. Valdecilla s/n - 39008 Santander Telf.: 94 220 33 90 - Fax: 94 220 34 92 Email: [email protected] Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 34 34 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:13 PÆgina 35 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a ASMA BRONQUIAL. ANATOMÍA PATOLÓGICA ÍNDICE: Resumen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .2 Definición . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .3 Hallazgos macroscópicos . . . . . . . . . . . . . . . . . . . . .3 Hallazgos microscópicos . . . . . . . . . . . . . . . . . . . . .5 Tapones de moco . . . . . . . . . . . . . . . . . . . . . . . . . .6 Engrosamiento de la membrana basal . . . . . . . . . . .7 Descamación epitelial . . . . . . . . . . . . . . . . . . . . . . .8 Infiltrado eosinofílico . . . . . . . . . . . . . . . . . . . . . . . .9 Alteraciones en el músculo liso . . . . . . . . . . . . . . .11 Remodelado de la pared bronquial . . . . . . . . . . . . .12 Evolución de las lesiones asmáticas . . . . . . . . . . . .13 Inmunofluorescencia . . . . . . . . . . . . . . . . . . . . . . .14 Lesiones extrapulmonares . . . . . . . . . . . . . . . . . . .14 Heterogeneidad en el asma bronquial. Tipos de asma . . . . . . . . . . . . . . . . . . . . . . . . . . .15 Mecanismos de estudio de las lesiones asmáticas . .17 Bibliografía . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .19 Resumen El asma bronquial es una patología que tradicionalmente se ha estudiado en los pacientes que fallecían en “status asthmaticus”. Macroscópicamente la presencia de tapones de moco denso en las vías aéreas de mediano y pequeño calibre junto con áreas de hiperinsuflación o atelectasia son características. El aspecto microscópico revela un infiltrado inflamatorio en la vía aérea compuesto principalmente por eosinófilos o polimorfonucleares, dependiendo de la patogenia del cuadro asmático (atópico o no atópico). Otros fenómenos como el remodelado de la pared de la vía aérea son fundamentales en la evolución del asma. El estudio de biopsias en pacientes asmáticos puede proporcionar datos de interés para el seguimiento clínico. Definición El Instituto Nacional de la Salud (NIH) de los Estados Unidos en su Guía para el diagnóstico y el manejo del asma indica que el asma es una enfermedad crónica de la vía aérea en la cual muchas células y elementos celulares juegan un papel, en particular mastocitos, eosinófilos, linfocitos T, neutrófilos y células epiteliales y que provoca en los individuos susceptibles, episodios recurrentes de disnea, tiraje y tos, particularmente en la noche y en horas tempranas de la mañana. La mayor parte de las descripciones que se encuentran en la literatura clásica acerca de las lesiones asmáticas se han realizado a partir de la exploración de pacientes que fallecieron en “status asthmaticus”. Los primeros autores que publicaron los hallazgos patológicos del asma fueron Huber y Koessler en 1922 [1] y desde entonces, han sido los estudios de autopsia los que han proporcionado la base de conocimiento morfológico de la enfermedad. Sin embargo, en la última década han proliferado las publicaciones en donde se investigan los fenómenos presentes en la biopsia bronquial y transbronquial como elementos útiles para la valoración del estado y la gravedad del asma. Este cambio de orientación ha proporcionado muchos datos de gran valor en el conocimiento de las lesiones en la enfermedad leve, la respuesta al tratamiento y su evolución clínica. Hallazgos macroscópicos Los hallazgos macroscópicos de autopsia en pacientes que fallecieron en “status asthmaticus” son generalmente claros y constantes, en cuanto que revelan tapones de moco denso que obstruyen bronquios de pequeño y mediano calibre (de diámetro menor o igual a unos 5 mm), una hiperinsuflación pulmonar que hace que los pulmones no se colapsen a la apertura de la caja torácica en la autopsia, y la presencia de áreas de atelectasia hasta en un 50% de los casos [2] (Figura 1A). La existencia de dos fenómenos aparentemente contradictorios como hiperinsuflación y atelectasia en la misma enfermedad, tiene su correlato funcional en el hecho de que la vía aérea sufra una obstrucción al flujo parcial o total. En el caso que los tapones de moco provoquen una obstrucción parcial, se ejerce un mecanismo de válvula que hace que 35 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 36 el aire pueda entrar durante la inspiración pero no pueda ser expulsado, con lo que se produce un aumento del contenido aéreo pulmonar. Por el contrario, si la obstrucción que se produce es total, el aire no puede ser movilizado en ningún sentido, y la absorción alveolar distal, produce las lesiones de pérdida de volumen aéreo y colapso parenquimatoso. Y por último, aunque no menos importante, es preciso destacar la posibilidad de que los pacientes que fallecen de forma súbita no lleguen a desarrollar tapones de moco endobronquiales, con lo que faltaría el cortejo macroscópico clásico de hallazgos (Figura 1B). Se piensa que la causa de fallecimiento en estos pacientes sería una broncoconstricción extrema. La marcada hiperinsuflación pulmonar proporciona a menudo a los pulmones un aspecto macroscópico pálido e hipovascular. Este fenómeno, fue erróneamente interpretado por los autores clásicos, como correspondiente a lesiones de enfisema en los pacientes que fallecían en “status asthmaticus”. Sin embargo, es muy poco frecuente hallar otras lesiones enfisematosas como amplios espacios aéreos (bullas) subpleurales y destrucción parenquimatosa alrededor de los ejes broncovasculares en estos pacientes. Esto, junto con la presencia de tapones de moco son elementos que pueden resultar de ayuda en el diagnóstico diferencial macroscópico. De hecho, la visión actual es que las lesiones de enfisema son extremadamente infrecuentes en estos pacientes [2]. Las características macroscópicas del moco intrabronquial son peculiares, siendo éste muy denso y difícil de despegar del revestimiento mucoso epitelial (Figura 1A). Este mismo material cuando procede de las vías aéreas inferiores puede adoptar formas helicoidales y ser expectorado en forma de las conocidas espirales de Curschmann. 36 Figura 1B. Hallazgos microscópicos Los hallazgos histológicos en pacientes que fallecen en “status asthmaticus” son asimismo llamativos y relativamente constantes en la literatura (Figura 2). Esto ha permitido que algunos autores hayan establecido criterios histológicos de diagnóstico (Tabla 1) Para poder realizar el diagnóstico morfológico de asma, deberían estar presentes al menos cuatro de los cinco criterios expuestos [5]. Pasemos ahora a evaluar detenidamente cada uno de ellos. Figura 1A. Existen otras lesiones que pueden estar presentes, aunque con menor frecuencia, dentro del espectro de hallazgos macroscópicos. Así, hasta un 15-20% de los pacientes que han fallecido en situación de “status asthmaticus” presentan bronquiectasias saculares y fibrosis subpleural en áreas periféricas predominantemente localizadas en los campos pulmonares superiores. Se ha llegado a sugerir que la aparición aislada de bronquiectasias en el segmento anterior del lóbulo superior es casi diagnóstica de asma. La patogenia de las bronquiectasias en estos pacientes es controvertida, existiendo dos teorías clásicas que se refieren bien a los efectos de una posible obstrucción bronquial [3], o a la presencia de neumonía eosinófila asociada con fibrosis intersticial [4]. Figura 2. Tabla I. Criterios histológicos de diagnóstico de asma bronquial [5] Tapones mucosos Engrosamiento de la membrana basal Descamación epitelial Infiltración eosinofílica de la submucosa Hipertrofia de músculo liso C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 37 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a existen diferencias con la composición habitual del moco en pacientes no asmáticos, y se describen cantidades anormales de varias glicoformas de mucina como MUC5B y MUC2 en las secreciones asmáticas [6] así como una relación alterada entre glicoproteínas y proteoglicanos [7]. Este contenido mucoso no suele verse afectado por el tratamiento esteroideo en pacientes asmáticos. Figura 3. Figura 4. Los tapones de moco que ocluyen las vías aéreas (Figura 3) contienen en su interior remolinos de epitelio descamado (cuerpos de Creola), numerosos eosinófilos y cristales de Charcot-Leyden (Figura 4). Estos últimos no son exclusivos del asma y pueden verse en otras entidades como la sinusitis alérgica. Son debidos a la degranulación de los eosinófilos y a la acumulación de cristales pequeños, bipiramidales hexagonales compuestos de lisofosfolipasa. Los eosinófilos presentes en el moco asmático están bien preservados, presumiblemente porque su presencia en la luz bronquial es reciente, al contrario de lo que ocurre por ejemplo en la impactación mucosa. El contenido celular descamado endobronquial, es de intensidad variable, ya que es uno de los componentes sensible al tratamiento con esteroides y por tanto, puede disminuir de manera significativa en los pacientes tratados. El exceso de moco no sólo tiene un efecto obstructivo sobre la vía aérea, si no que contribuye a la hiperreactividad bronquial. Se podría decir que los pacientes asmáticos tienen un “fenotipo hipersecretor de moco”. Clásicamente se ha comunicado la doble naturaleza histoquímica del moco asmático, compuesto por un material puramente mucoso basófilo, magenta en la tinción de PAS y por otro componente eosinófilo, de naturaleza proteica. Profundizando más desde el punto de vista bioquímico, Sin embargo, a pesar de todo lo expuesto aquí, la presencia de moco denso en la vía aérea, no es exclusiva del asma bronquial, si no que puede aparecer en otras patologías como la Enfermedad pulmonar obstructiva crónica asociada al tabaco, la Impactación mucosa o la Fibrosis quística. Uno de los hallazgos más frecuentemente descritos es el engrosamiento de la membrana basal del epitelio bronquial (Figura 5). Mediante la observación con microscopía óptica convencional este fenómeno es claramente visible, aunque de forma irregular a lo largo de la vía aérea. Quizá esta irregularidad pueda justificar que algunos estudios clásicos hayan demostrado un adelgazamiento o incluso reduplicación de la misma [8]. Actualmente la mayor parte de los autores están de acuerdo en este tema y mientras que el grosor de la membrana basal normal oscila entre 6,2 y 7,1 mm, en pacientes asmáticos puede alcanzar rangos entre 8,8 y 17,5 mm [9]. De nuevo, este fenómeno no es exclusivo de esta enfermedad ya que se ha comunicado, aunque en menor medida, en todo tipo de afectación inflamatoria donde la vía aérea se encuentre implicada, como en la Bronquitis crónica, Bronquiectasias, e incluso se ha descrito como un efecto fisiológico asociado al envejecimiento. Desde el punto de vista morfológico y bioquímico se debe a la presencia de fibras de colágena de tipo III y V, junto con el depósito de otras sustancias como fibronectina, gammaglobulinas, IgA, albúmina y fibrinógeno [2]. Figura 5. Otra de las lesiones anatomopatológicas frecuentemente descrita es la descamación epitelial y la hiperplasia de células caliciformes. La existencia de áreas más o menos extensas de pérdida de las células cilíndricas origina que el revestimiento epite- 37 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 38 lial de la vía aérea consista únicamente en una capa de células basales (Figura 6). Sin embargo, existen autores que han cuestionado este hecho y postulan que la denudación del epitelio bronquial en biopsias de pacientes asmáticos con enfermedad de intensidad ligera o moderada es en realidad un artefacto de muestreo y no una verdadera característica patológica de la lesión. [10]. Por otro lado, no se ha conseguido establecer una correlación entre la extensión de epitelio denudado y la hiperreactividad bronquial o la magnitud del estrechamiento de la vía aérea, con lo que parece al menos, que dicho fenómeno no tendría significación clínica. Sin embargo, sí parece cierto que los pacientes asmáticos muestran un daño en las células epiteliales ciliadas, con pérdida de dichos orgánulos subcelulares debido al efecto ejercido sobre ellos por el exudado proteináceo intraluminal y la proteína mayor básica producida por los eosinófilos [7]. ca y en la Fibrosis quística, aunque en este último caso, el número de eosinófilos normales y activados es significativamente menor [12]. Se ha llegado al acuerdo de utilizar criterios cuantitativos, y que se debe alcanzar al menos un 3% de riqueza de eosinófilos en el infiltrado inflamatorio para llegar a un diagnóstico de seguridad de asma. Estas cifras son equivalentes a un rango de 10,3 a 441,6 eosinófilos por mm2 en pacientes asmáticos frente a 3,2 o menos eosinófilos por mm2 en bronquitis crónica [9], si bien es cierto que estos datos corresponden a pacientes con “status asthmaticus”, disminuyendo la diferencia en casos leves [9]. Figura 7. 38 Figura 6. Las células epiteliales bronquiales son capaces de fagocitar eosinófilos apoptóticos pero no neutrófilos, que en general son fagocitados por células de estirpe macrofágica [11]. En cuanto al otro componente celular del revestimiento bronquial de superficie, las células caliciformes, pueden mostrar áreas de hiperplasia (Figura 3). Sin embargo, este hecho no pasa de ser un hallazgo subjetivo que no ha sido adecuadamente cuantificado hasta la fecha si bien es cierto que es fácil apreciar células caliciformes en los bronquíolos periféricos donde normalmente no se encuentran [7]. Quizá la característica morfológica mejor definida en los pacientes asmáticos sea el infiltrado inflamatorio de eosinófilos (Figura 7), más prominente en los bronquios de pequeño y mediano calibre, de tal manera que en general se acepta que no se puede llegar a un diagnóstico de asma bronquial sin la presencia de dicho infiltrado. Sin embargo, es posible ver eosinófilos en las vías aéreas de pacientes que no sufren asma como por ejemplo en la Bronquitis cróni- Por otro lado, se ha descrito que el infiltrado inflamatorio eosinofílico está presente también en la mucosa nasal de pacientes asmáticos, incluso en ausencia de rinitis [13]. Este hecho apunta a la hipótesis de que el asma y la rinitis podrían ser expresiones clínicas diferentes de la misma entidad. Otros trabajos han comparado los hallazgos en la bronquitis eosinofílica y el asma y como única diferencia han encontrado una infiltración de la capa muscular lisa bronquial por mastocitos. Este hecho podría estar relacionado con una anomalía intrínseca o adquirida en el patrón de respuesta de la fibra muscular lisa. La inflamación sólo sería un marcador de dicha anomalía. [14]. La importancia de la célula mastocitaria en el asma bronquial también se pone de manifiesto al considerar que los pacientes con fracaso en la respuesta a tratamiento, muestran un mayor número de mastocitos en el estudio histológico al igual que un incremento en la cantidad de triptasa en el BAL [15]. Otros estudios muestran cómo los mastocitos aumentan en número en las regiones correspondientes a pequeñas vías aéreas, pero en contraposición su número está relacionado con una mejor fisiología respiratoria, con lo que se estima que la inducción de los mastocitos productores de quimasa puede ser de efecto protector para la función pulmonar en el asma severa [16]. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 39 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a El infiltrado linfocitario es asimismo importante en el asma (Figura 8). La literatura más reciente muestra que el inmunofenotipo linfoide en el asma severo, se corresponde con linfocitos T activados CD4-Th2 [17, 18]. Sin embargo, otros autores han encontrado un número importante de linfocitos T citotóxicos CD8 positivos con el marcador de activación CD25 en pacientes que fallecieron con crisis asmáticas [19]. Los mismos autores relacionan este inmunofenotipo linfocitario con una posible causa infecciosa viral (Rhinovirus y Virus Sincitial Respiratorio fundamentalmente) en los casos de asma fatal [19]. Figura 9. diferencial entre las dos entidades. Los mecanismos fisiopatológicos no están claros, y aunque clásicamente se pensaba en la hiperreactividad bronquial [7], se ha descubierto recientemente que la enzima elastasa procedente de los neutrófilos es mitogénica para las células musculares lisas de la pared bronquial [23]. Figura 8. Desde el punto de vista patogenético, se piensa que existe un disbalance entre los linfocitos T helper 1 y 2, responsables de las reacciones alérgicas inflamatorias y de los fenómenos de hipersenbilidad retardada. En el asma, el infiltrado eosinofílico estaría bajo el control de los linfocitos Th2 [20]. En cuanto a la especificidad del infiltrado inflamatorio, se han comparado sus características con Fibrosis quística y EPOC fundamentalmente. El número total de linfocitos se encuentra aumentado en los tres grupos frente a los individuos controles. Sin embargo en la Fibrosis quística, la población linfocitaria B predomina en número y por tanto el cociente entre linfocitos B y T es mayor que en el asma [12] y en los casos de EPOC predominan los linfocitos T CD8 positivos [21]. En cuanto a otros posibles hallazgos, la mayoría de los observadores encuentran una hiperplasia y una hipertrofia de las glándulas seromucosas bronquiales en el asma [9] con un aumento en el índice de Reid [9]. Sin embargo, si bien es cierto que existe una hiperplasia, no es tan marcada como la que se encuentra en los casos de Bronquitis crónica. Son controvertidos los datos acerca de la metaplasia de las células caliciformes. Este fenómeno histológico no puede ser un cambio de aparición súbita, así que si aceptamos que está presente en los casos de “status asthmaticus”, indicaría una lesión progresiva de varios días de evolución o bien cambios en los intervalos temporales entre los ataques. El engrosamiento de la pared de la vía aérea es mucho mayor del que se podría esperar del aumento de las glándulas y de la capa muscular lisa por sí solos. En las vías aéreas centrales es el edema uno de los principales responsables [9], aunque existen otros factores sobreañadidos como la congestión vascular submucosa (Figura 10) o el engrosamiento de la propia capa epitelial. El músculo liso de la vía aérea es muy prominente en los pacientes que fallecen en “status asthmaticus”. Los estudios cuantitativos revelan un aumento entre dos a tres veces en el grosor de la capa muscular lisa, siendo este incremento más aparente en los bronquios de mediano calibre [7] (Figura 9). Se han descrito dos patrones de afectación. Un patrón Tipo I en el que las fibras musculares aumentan en número (hiperplasia) y un patrón Tipo II en el que aumenta el tamaño de las fibras individuales (hipertrofia) en todas las vías aéreas mayores de 0,2 mm [22]. Este aumento de grosor de la capa muscular bien por hipertrofia o por hiperplasia, no se aprecia en los casos de Bronquitis crónica y es de ayuda en el diagnóstico Figura 9. 39 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 40 En las vías aéreas más periféricas la congestión vascular submucosa y la hipertrofia de la capa muscular son los elementos que más contribuyen al aumento de grosor parietal. En algunos casos, se pueden apreciar divertículos bronquiales, que probablemente representan dilatación de conductos de excreción de las glándulas bronquiales. El componente edematoso aparece cuando el plasma que se libera desde los vasos sanguíneos excede la capacidad de drenaje de los linfáticos. En la submucosa bronquial, existe un proceso de linfangiogénesis que contribuye a la recogida del fluido extravasado en determinadas situaciones, pero si por la razón que fuere este proceso no es efectivo, el linfedema resultante puede agravar la situación de obstrucción bronquial [24]. Todos estos procesos que inciden en la arquitectura de la vía aérea se recogen en el término de “remodelado”. Así pues, el remodelado de la vía aérea consiste principalmente en el engrosamiento de la membrana basal, la hipertrofia muscular, e hiperplasia de las células caliciformes y de las glándulas submucosas (Figura 12). Existen otros factores implicados en este proceso, como el mayor número de vasos sanguíneos de la lámina propia, que es directamente proporcional a la intensidad de afectación por el asma bronquial [25]. ción. En estos modelos existen alteraciones morfológicas consistentes en inflamación y remodelación de la arquitectura bronquiolar entre 6 y18 meses tras el cese de la exposición laboral [27, 28]. Este hecho, y la cuantificación del infiltrado inflamatorio han demostrado su importancia en el seguimiento y el pronóstico de los pacientes asmáticos. Así, la presencia de células inflamatorias en el esputo inducido de pacientes asmáticos es un marcador de evolución clínica [29]. Este hecho plantea la posible utilidad de evaluar la presencia de elementos inflamatorios mediante pruebas no invasivas como puede ser el esputo inducido, para delimitar el riesgo de nuevos ataques asmáticos sobre todo en el caso de asma ocupacional. Por otro lado, es preciso recordar aquí que en la evolución clínica del paciente asmático pueden aparecer otras complicaciones como bronquiolitis constrictiva, bronquiectasias una enfermedad fúngica broncopulmonar alérgica o un síndrome de Churg-Strauss. Estudios de inmunofluorescencia. Existen escasos artículos donde se describen depósitos de IgA, IgG e IgM en la membrana basal de pacientes asmáticos [30]. Sin embargo, un porcentaje significativo de controles presentan depósitos de las mismas Inmunoglobulinas en la membrana basal, aunque en menor cuantía. Otras comunicaciones relacionan la presencia de IgA, IgG e IgM con fenómenos inflamatorios y detectan depósitos de IgE sobre todo en las glándulas mucosas [31]. 40 Figura 12. Este fenómeno del remodelado bronquial, de reciente descripción, tiene su importancia en la evolución clínica de los pacientes, ya que existen numerosos casos descritos con muy escaso componente inflamatorio refractarios al tratamiento esteroideo. En estos casos no se puede establecer como causa del fracaso terapéutico factores asociados al infiltrado inflamatorio y es probable que otros elementos como la arquitectura de la vía aérea sean determinantes a la hora de considerar la respuesta clínica al tratamiento [26]. Evolución del paciente asmático. Existen modelos bien descritos que han demostrado la persistencia de síntomas asmáticos e hiperreactividad bronquial en casos de asma ocupacional tras el cese de la exposi- Figura 11. Lesiones extrapulmonares y añadidas: Existen pacientes diagnosticados de asma bronquial que fallecen por otras patologías pulmonares concomitantes, como por ejemplo bronquitis crónica o enfisema, bronquiectasias o fibrosis, y es en estos casos donde no se encuentran las lesiones clásicas del “Status asthmaticus” y pueden aparecer otras alteraciones como lesiones cardiacas del tipo de la hipertrofia de ventrículo derecho que en este caso se asocia a pacientes con asma, pero no es debida a ella o fenómenos de vasculitis (Figura 11). Es preciso tener en cuenta también C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 41 A s m a que otros pacientes fallecen por yatrogenia del tratamiento utilizado contra el asma, como las drogas simpaticomiméticas o los esteroides, con lo que las lesiones que encontraremos en el estudio de autopsia serán diferentes de las clásicas. Y por último, también cabe la posibilidad de que pacientes con asma declarada y que fallecen no muestren lesiones pulmonares significativas si el asma no se encontraba en un periodo de actividad. Heterogeneidad en las lesiones patológicas del asma. Tipos de asma A pesar de lo anteriormente descrito, existe un porcentaje variable de pacientes que no muestran eosinofilos en la vía aérea, y que en su lugar presentan un infiltrado inflamatorio de predominio neutrofílico. La divergencia en el aspecto morfológico está causada probablemente por diferencias en las características genéticas entre individuos, la existencia o no de atopia, factores ambientales y otros elementos como la presencia de rinosinusitis o reflujo gastroesofágico [20]. Por tanto, y en términos generales podríamos decir que existe un asma bronquial en los pacientes con sensibilización previa en la que predominan los eosinófilos en el infiltrado inflamatorio, y por otro lado un asma en pacientes sin sensibilización en los que predomina la célula neutrofílica. La existencia de estos dos tipos morfológicos de asma, correspondientes desde el punto de vista clínico a pacientes atópicos y no atópicos, se correlaciona con otros hallazgos experimentales, como la diferencia en la composición del BAL en ratones sensibilizados frente a Alternaria en los que predominaban los eosinófilos, frente a los que no se habían sensibilizado, en los que la célula predominante era el neutrófilo. En estos sistemas, los clásicos hallazgos histológicos del asma bronquial (hiperplasia caliciforme e infiltrado eosinofílico) sólo aparecen en los animales sensibilizados [32, 33]. Esta diferencia que podría parecer un tema sin importancia, sujeto únicamente a discusiones anatomopatológicas o fisiopatológicas, tiene su correlato clínico, ya que existe un porcentaje variable de pacientes asmáticos que no responden a la medicación clásica [20, 34] y se ha descrito además una relación de la composición del infiltrado inflamatorio con la intensidad de la afectación asmática. Así, en la mayoría de los estudios de pacientes con asma de intensidad ligera, la cantidad de neutrófilos en las vías aéreas no es diferente de los individuos controles, mientras que en los casos de asma grave, el número de neutrófilos está incrementado [35]. De acuerdo con esta hipótesis, los pacientes asmáticos no fumadores con obstrucción al flujo aéreo no reversible muestran mayor número de neutrófilos en el análisis del esputo [36]. En pacientes pediátricos, los episodios de broncoespasmo encuentran una muy b r o n q u i a l . A n a t o m í a p a t o l ó g i c a buena correlación con el número de neutrófilos en esputo o BAL y no con el número de eosinófilos [37]. Sin embargo, no todos los autores están de acuerdo ni encuentran los mismos fenómenos, ya que se ha comunicado que el porcentaje de eosinófilos pero no el de neutrófilos es el que aumenta en los pacientes asmáticos en los episodios de exacerbación [38]. Es preciso tomar todos estos datos con precaución, ya que en los mismos artículos donde se comunican estos hallazgos, hasta un 41% de los pacientes mostraban un análisis microbiológico positivo para agentes bacterianos o virales y muchos de ellos habían sido tratados con pulsos de esteroides [39]. Por otro lado, los hallazgos del BAL no deben ser tomados como absolutos, ya que las células que en él aparecen son las células que han “escapado” del pulmón, y podría existir una disociación entre la celularidad que aparece en el BAL y la que realmente se encuentra presente en el parénquima pulmonar. Para finalizar, existe otro tipo de asma bronquial que pertenece a los casos de pacientes que fallecen en ataques agudos asmáticos de muy corta evolución y que se ha conocido clásicamente como Asma asfíxica súbita [40], en el que el intervalo entre la aparición de los síntomas y la hospitalización es de unas 1,3 horas. Existen descripciones aisladas de los hallazgos de autopsia en pacientes que fallecieron en menos de una hora tras el inicio de los síntomas y contrastan con los hallazgos de los fallecidos en un intervalo mayor de dos horas. Los pacientes con la variante “súbita” de nuevo muestran más neutrófilos y menos eosinófilos en la submucosa bronquial [41]. El número de eosinófilos y de mastocitos correlaciona positivamente con la duración de los síntomas y la muerte [42]. Por tanto, los pacientes que fallecen de forma súbita puede que no lleguen a desarrollar tapones de moco y se cree que la obstrucción es debida a la broncoconstricción. Estos hechos sugieren de nuevo que el mecanismo puede ser diferente, e incluso se han propuesto mecanismos patogenéticos diferenciales como la inhalación de Alternaria [41]. Mecanismos de estudio de las lesiones de asma bronquial En la última década, han proliferado las investigaciones acerca de las características morfológicas del asma bronquial que se estudian desde el punto de vista morfológico convencional, ultraestructural o inmunohistoquímico a partir de muestras de biopsia. Hasta ahora no han aportado una información realmente revolucionaria, pero sí han proporcionado datos que pueden resultar de utilidad en el manejo del paciente asmático. La descripción del daño epitelial las características diferenciales del infiltrado inflamatorio, y la menor presencia de mastocitos en los casos de asma leve, así como los efectos del trata- 41 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 42 miento con esteroides sobre las lesiones han sido posibles gracias a estos estudios. Se puede obtener información sobre el estado del asma in vivo, tanto activo como quiescente mediante el estudio de diversos materiales como el esputo, el lavado bronquioloalveolar o la biopsia bronquial y transbronquial, siempre que la muestra contenga tejido correspondiente a pequeña vía aérea [43]. Algunos estudios a partir de tejido bronquial obtenido por broncoscopia ya han encontrado una correlación entre varios tipos de tratamiento utilizado y la reducción del infiltrado inflamatorio y la fibrosis subepitelial [44-48]. 42 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 43 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a Bibliografía 1. Huber HL, Koessler KK. The pathology of asthma. Arch Intern Med 1922;30:689-760. 2. Travis WD, Rosado de Christenson ML, Colby TV, Koss MN, Müller NL, Kina TE. Obstructive pulmonary diseases. Chapter 10. In Non-neoplastic disorders of the lower respiratory tract. Atlas of Nontumor pathology. Fascicle 2. Armed Forces Institute of Pathology. 2002. pp435-71. 3. Dunnill MS. The pathology of asthma with special reference to changes in the bronchial mucosa. J Clin Pathol 1960;13:27-33. 4. Leopold JG. A contrast of bronchitis and asthma. In Symposium on the Nature of Asthma. King Edward VII Hospital, 1964 pp 30-38. 5. Cluroe A, Holloway L, Thompson K, Purdie G, Beasley R. Bronchial gland duct ectasia in fatal bronchial asthma: Association with interstitial emphysema. J Clin Pathol 1989;42:1026-31. 6. Rogers DF. Airway mucus hypersecretion in asthma: un undervalued pathology? Curr Opin Pharmacol 2004;4:241-50. 7. Dail H. Eosinophilic infiltrates. Chapter 16. In Dail H and Hammar SP. Pumonary Pathology. 2nd Ed. Springer. NY. 1994. pp 537-66. 8. Messer JW, Peters GA, Bennet WA. Causes of death and pathological findings in 304 cases of bronchial asthma. Dis Chest 1960;38:616-24. 9. Thurlbeck WM. Chronic airflow obstruction. Chapter 26. In Thurlbeck and Churg. Pathology of the lung. 2nd Ed. Thieme Medical Publishers. NY. 1995. pp 741-55. 10. Ordóñez C, Ferrando R, Hyde DM, Wong HH, Fahy JV. Epithelial desquamation in asthma: artifact or pathology? Am J Respir Crit Care Med 2000;162:2324-9. 11. Sexton DW, Al-Rabia M, Blaylock MG, Walsh GM. Phagocytosis of apoptotic eosinophils but not neutrophils by bronchial epithelial cells. Clin Exp Allergy. 2004;34:1514-24. 12. Azzawi M, Johnston PW, Majumdar S, Jeffery PK. T lymphocytes and activated eosinophils in airway mucosa in fatal asthma and cystic fibrosis. Am Rev Respir Dis 1992;145:1477-82. 13. Gaga M, Lambrou P, Papageorgiou N, Koulouris NG, Kosmas E, Fragakis S, Sofios C, Rasidakis A, Jordanoglou J. Eosinophils are a feature of upper and lower airway pathology in non-atopic asthma, irrespective of the presence of rhinitis. Clin Exp Allergy 2000;30:663-9. 14. Wardlaw AJ, Brightling CE, Green R, Woltmann G, Bradding P, Pavord ID. New insights into the relationship between airway inflammation and asthma. Clin Sci (Lond) 2002;103:201-11. 15. Kraft M, Martin RJ, Lazarus SC, Fahy JV, Boushey HA, Lemanske RF Jr, Szefler SJ; Asthma Clinical Research Network. Airway tissue mast cells in persistent asthma: predictor of treatment failure when patients discontinue inhaled corticosteroids. Chest. 2003;124:42-50. 16. Balzar S, Chu HW, Strand M, Wenzel S. Relationship of Small Airway Chymase-Positive Mast Cells and Lung Function in Severe Asthma. Am J Respir Crit Care Med 2004 Nov 24. 17. Caramori G, Pandit A, Papi A. Is there a difference between chronic airway inflammation in chronic severe asthma and chronic obstructive pulmonary disease? Curr Opin Allergy Clin Immunol 2005;5:77-83. 18. Fabbri LM, Romagnoli M, Corbetta L, Casoni G, Busljetic K, Turato G, Ligabue G, Ciaccia A, Saetta M, Papi A. Differences in airway inflammation in patients with fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2003;167:418-24. 19. O’Sullivan S, Cormican L, Faul JL, Ichinohe S, Johnston SL, Burke CM, Poulter LW. Activated cytotoxic CD8(+) T lym- phocytes contribute to the pathology of asthma death. Am J Respir Crit Care Med 2001;164:560-4. 20. Peters SP. Heterogeneity in the pathology and treatment of asthma. Am J Med 2003;115:49S-54S. 21. Saetta M, Turato G. Airway pathology in asthma. Eur Respir J Suppl 2001;34:18s-23s. 43 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 44 22. Ebina M, Takahashi H, Chiba R, Takahashi T, Motomiya M, Tanemura M. Hyperreactive site in the airway tree of asth- matic patients revealed by thickening of bronchial muscles. Am Rev Respir Dis 1990;141:1327-32. 23. Huang CD, Chen HH, Wang CH, Chou CL, Lin SM, Lin HC, Kuo HP. Human neutrophil-derived elastase induces airway smooth muscle cell proliferation. Life Sci 2004;74:2479-92. 24. Baluk P, Tammela T, Ator E, Lyubynska N, Achen MG, Hicklin DJ, Jeltsch M, Petrova TV, Pytowski B, Stacker SA, Yla- Herttuala S, Jackson DG, Alitalo K, McDonald DM. Pathogenesis of persistent lymphatic vessel hyperplasia in chronic airway inflammation. J Clin Invest 2005;115:247-57. 25. Salvato G. Quantitative and morphological analysis of the vascular bed in bronchial biopsy specimens from asth- matic and non-asthmatic subjects. Thorax 2001;56:902-6. 26. Jenkins HA, Cool C, Szefler SJ, Covar R, Brugman S, Gelfand EW, Spahn JD. Histopathology of severe childhood asthma: a case series. Chest. 2003;124:32-41. 27. Saetta M, Di Stefano A, Maestrelli P, De Marzo N, Milani GF, Pivirotto F, Mapp CE, Fabbri LM. Airway mucosal inflam- mation in occupational asthma induced by toluene diisocyanate. Am Rev Respir Dis 1992;145:160-8. 28. Boulet LP, Boutet M, Laviolette M, Dugas M, Milot J, Leblanc C, Paquette L, Cote J, Cartier A, Malo JL. Airway inflam- mation after removal from the causal agent in occupational asthma due to high and low molecular weight agents. Eur Respir J 1994;7:1567-75. 29. Maghni K, Lemière C, Ghezzo H, Yuquan W, Malo JL. Airway inflammation after cessation of expossure to agents causing occupational asthma. Am J Respir Crit Care Med 2004;169:367-72. 30. Callerame ML, Condemi JJ. Immunoglobulins in bronchial tissues from patients with asthma with special reference to immunoglobulin E. Allergy 1971;47:187-97. 31. English GM, Spector S, Farr R, Carr R. Histopathology and immunofluorescent immunoglobulins in asthmatics with aspirin idiosyncrasy. Arch Otolaryngol Head Neck Surg 1987;113:377-9. 32. Havaux X, Zeine A, Dits A, Denis O. A new mouse model of lung allergy induced by the spores of Alternaria alterna- 44 ta and Cladosporium herbarum molds. Clin Exp Immunol 2005;139:179-88. 33. Amin K, Ludviksdottir D, Janson C, Nettelbladt O, Bjornsson E, Roomans GM, Boman G, Seveus L, Venge P. Inflammation and structural changes in the airways of patients with atopic and nonatopic asthma. BHR Group. Am J Respir Crit Care Med 2000;162:2295-301. 34. Gibson PG, Simpson JL, Saltos N. Heterogeneity of airway inflammation in persistent asthma: evidence of neu- trophilic inflammation and increased sputum interleukin-8. Chest 2001;119:1329-36. 35. Ennis M. Neutrophils in asthma pathophysiology. Curr Allergy Asthma Rep 2003;3:159-65. 36. Boulet LP, Turcotte H, Turcot O, Chakir J. Airway inflammation in asthma with incomplete reversibility of airflow obstruction. Respir Med 2003;97:739-44. 37. Le Bourgeois M, Goncalves M, Le Clainche L, Benoist MR, Fournet JC, Scheinmann P, de Blic J. Bronchoalveolar cells in children < 3 years old with severe recurrent wheezing. Chest 2002;122:791-7. 38. Di Franco A, Bartoli ML, Carnevali S, Cianchetti S, Bacci E, Dente FL, Giannini D, Taccola M, Vagaggini B, Paggiaro PL. Analysis of sputum cell counts during spontaneous moderate exacerbations of asthma in comparison to the stable phase. J Asthma 2003;40:155-62. 39. Cloutier MM. Neutrophils or eosinophils in young children with wheezing. Chest 2002;122:761-3. 40. Wasserfallen JB, Scaller MD, Feihl F, Perret CH. Sudden asphyxic asthma. A distinct entity. Am Rev Respir Dis 1990;142:108-11. 41. Sur S, Crotty TB, Kephart GM, Hyma BA, Colby TV, Reed CE, Hunt LW, Gleich GJ. Sudden-onset fatal asthma. A dis- tinct entity with few eosinophils and relatively more neutrophils in the airway submucosa? Am Rev Respir Dis 1993;148:713-19. 42. Chen FH, Samson KT, Miura K, Ueno K, Odajima Y, Shougo T, Yoshitsugu Y, Shioda S. Airway remodeling: a compar- ison between fatal and nonfatal asthma. J Asthma 2004;41:631-8. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 45 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a 43. Balzar S, Wenzel SE, Chu HW. Transbronchial biopsy as a tool to evaluate small airways in asthma. Eur Respir J 2002;20:254-9. 44. Boulet LP, Laviolette M, Turcotte H, Cartier A, Dugas M, Malo JL, Boutet M. Bronchial subepithelial fibrosis correlates with airway responsiveness to methacholine. Chest. 1997;112:45-52. 45. Djukanovic R, Homeyard S, Gratziou C, Madden J, Walls A, Montefort S, Peroni D, Polosa R, Holgate S, Howarth P. The effect of treatment with oral corticosteroids on asthma symptoms and airway inflammation. Am J Respir Crit Care Med 1997;155:826-32. 46. Wenzel SE, Szefler SJ, Leung DY, Sloan SI, Rex MD, Martin RJ. Bronchoscopic evaluation of severe asthma. Persistent inflammation associated with high dose glucocorticoids. Am J Respir Crit Care Med 1997;156:737-43. 47. Sont JK, Han J, van Krieken JM, Evertse CE, Hooijer R, Willems LN, Sterk PJ. Relationship between the inflammato- ry infiltrate in bronchial biopsy specimens and clinical severity of asthma in patients treated with inhaled steroids. Thorax 1996;51:496-502. 48. Djukanovic R, Wilson JW, Britten KM, Wilson SJ, Walls AF, Roche WR, Howarth PH, Holgate ST. Effect of an inhaled corticosteroid on airway inflammation and symptoms in asthma. Am Rev Respir Dis 1992;145:669-74. 45 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 46 CUESTIONARIO 1. ¿Qué hallazgos macroscópicos pueden encontrarse en un paciente que fallece en “status asthmaticus”? a) Bronquiectasias en el segmento anterior del lóbulo superior b) Hiperinsuflación pulmonar c) Áreas de atelectasia d) Tapones de moco denso en vías aéreas de mediano calibre e) Todas las anteriores 2. Los a) b) c) d) e) cuerpos de Creola son: Cristales brillantes procedentes del metabolismo de los eosinófilos Material proteinaceo Espirales de moco que procede de las vías aéreas inferiores Células epiteliales descamadas a la luz bronquial Ninguna de las anteriores 3. El tratamiento con esteroides puede cambiar el aspecto morfológico de: a) La cantidad de eosinófilos presentes en el moco b) La fibrosis submucosa c) El engrosamiento de la membrana basal d) La cantidad de células epiteliales descamadas a la luz e) La hiperplasia de células caliciformes 4. Respecto al engrosamiento de la membrana basal bronquial en asma, es cierto: a) El grosor oscila entre 8,8 y 17,5 mm b) Es específico del asma bronquial c) Puede aparecer asociado al envejecimiento d) Las respuestas a y c son ciertas e) Todas las anteriores son ciertas 46 5. El infiltrado inflamatorio de eosinófilos a) Es específico del asma bronquial b) Es más prominente en los bronquios de mediano y pequeño calibre c) Se encuentra en el espacio alveolar d) Debe superar un 10% para considerarlo compatible con el diagnóstico de asma e) Es exclusivo de la vía aérea inferior 6. El infiltrado linfoide en el asma a) Es de fenotipo CD4 Th2 b) Es de fenotipo B c) Es de fenotipo CD8 d) Tiene mayor proporción de linfocitos B que T e) Ninguna de las anteriores 7. El músculo liso de la pared bronquial en los casos de asma a) Es hipertrófico b) Es hiperplásico c) Aumenta en los casos de Bronquitis crónica d) Son ciertas a y b e) Todas las anteriores son ciertas 8. Respecto a las lesiones de la pared bronquial en el asma, señale la respuesta falsa: a) Existe un aumento en el índice de Reid b) La glándulas seromucosas aumentan en número y tamaño c) Las estructuras vasculares no están implicadas en el remodelado bronquial d) La capa muscular está aumentada de grosor e) El edema de la pared influye en el remodelado bronquial C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 47 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a 9. Señale las complicaciones que puede sufrir un enfermo asmático a) Aspergilosis broncopulmonar alérgica b) Bronquilitis constrictiva c) Síndrome de Churg-Strauss d) Todas las anteriores e) Solo a y c son ciertas 10. Respecto al infiltrado inflamatorio en el asma a) Los casos de asma en pacientes atópicos muestran un infiltrado de predominio eosinofílico b) Los casos de asma en pacientes no atópicos muestran un infiltrado de predominio eosinofílico c) Los cambios mostrados en el BAL son un reflejo exacto de la celularidad presente en el parénquima pulmonar d) La intensidad del infiltrado inflamatorio no tiene ninguna relación con la intensidad de la afectación asmática e) Todas son ciertas 11. Los pacientes que fallecen en un intervalo menor de una hora tras la aparición de los síntomas asmáticos a) Tienen mayor número de eosinófilos en el tejido b) Se denominan como Asma asfíxica súbita c) Tienen tapones de moco prominentes d) La patogenia del cuadro puede ser diferente y relacionada con la inhalación de agentes infecciosos e) Son correctas b y d 12. La a) b) c) d) membrana basal de los pacientes asmáticos Se encuentra engrosada a lo largo de todas las vías aéreas del paciente Puede tener depósitos de Inmunoglobulinas Tiene un componente importante de fibras elásticas Se precisan técnicas especiales de inmunofluorescencia o inmunohistoquímica para visualizar su engrosamiento e) Ninguna de las anteriores es cierta 13. El moco que ocupa las vías aéreas en los pacientes que fallecen en “status asthmaticus” a) Es de las mismas características que el moco de pacientes con bronquitis crónica b) Sólo está formado por un tipo de mucinas c) Se separa fácilmente del epitelio de revestimiento bronquial d) Los eosinófilos que contiene están bien preservados e) Al condensarse forma los cristales de Charcot-Leyden 14. ¿Cuáles de las siguientes no son células importantes en el desarrollo del asma bronquial? a) Mastocitos b) Eosinófilos c) Neutrófilos d) Condrocitos del cartílago bronquial e) Linfocitos T 15. Entre los agentes infecciosos que se han implicado en el asma bronquial están: a) Alternaria b) Virus respiratorio sincitial c) Rhinovirus d) Ameboflagelados e) Todos los anteriores 16. Señale la respuesta verdadera respecto al asma bronquial a) Las espirales de Curschmann proceden de los bronquios de gran calibre b) Es muy frecuente la aparición de enfisema asociado c) La broncoconstricción es uno de los mecanismos patogenéticos importantes en su desarrollo d) Predominan los linfocitos de fenotipo B en el infiltrado e) Ninguna es verdadera 47 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 48 48 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 49 A s m a b r o n q u i a l . A n a t o m í a p a t o l ó g i c a Respuestas fascículo 1, capítulo III (Asma bronquial. Anatomía patológica) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 49 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 13.- a b c d e 14.- a b c d e Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 50 15.- a b c d e 16.- a b c d e 50 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 51 E t i o p a t o g e n i a Capítulo IV ETIOPATOGENIA Pedro Cabrera Navarro Jefe de Servicio de Neumología Hospital Universitario Dr. Negrín Las Palmas de Gran Canaria Profesor titular de Neumología Universidad de Las Palmas Teresa Romero Saavedra Jefe de Sección de Anatomía Patológica Hospital Universitario Dr. Negrín Las Palmas de Gran Canaria 51 Correspondencia: Pedro Cabrera Navarro Hospital Universitario Dr. Negrín Servicio de Neumología C/ Barranco de la Ballena, s/n 35020 Las Palmas de Gran Canaria [email protected] Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 52 52 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 53 E t i o p a t o g e n i a ETIOPATOGENIA En la etiopatogenia del asma existen grandes áreas de incertidumbre, pero hay suficientes evidencias científicas para aceptar que la enfermedad surge de la conjunción de dos factores: predisposición genética y estímulos medio ambientales. Estos estímulos configuran lo que hoy se denomina factores de riesgo. Un extenso estudio con parejas de gemelos ha puesto de manifiesto que una parte importante del origen del asma se relaciona con el entorno del enfermo (1). En cuanto a las alteraciones genéticas, se han descrito polimorfismos relacionados a diferentes fenotipos del asma aunque todavía no existe una definición clara de la mayoría de las alteraciones genéticas relacionadas al asma. Las evidencias actuales determinan mutaciones y polimorfismos relacionados con alteraciones de los receptores de alta afinidad para la IgE, los receptores ?2 adrenérgicos, los receptores de interleucina-4 y genes que afectan al factor de necrosis tumoral y la 5-lipoxigenasa (2). El gran incremento que, en las últimas décadas, ha experimentado la prevalencia del asma en poblaciones genéticamente estables, hace pensar que los cambios medio ambientales estén jugando un papel primordial. Así por ejemplo, en Escocia la prevalencia del asma se incrementó de 4,1% en 1964 a 10,2% en 1989 (3). Además, esta tendencia se ha hecho más patente en los países industrializados, en los que en mayor medida ha cambiado el entorno social y los hábitos de vida (4). Durante años ha existido gran confusión entre factores de riesgo y factores precipitantes de la hiperrespuesta bronquial. Mientras que los primeros están relacionados con la causalidad del asma, como inductores de la inflamación bronquial, los precipitantes no juegan papel en los mecanismos etiopatogénicos del asma sino que se limitan a un agravamiento de la enfermedad al poner en marcha la hiperrespuesta bronquial, secundaria al proceso inflamatorio (figura 1). Factores de riesgo FACTORES PRENATALES. Como se detalla más adelante, la sensibilización alergénica se considera como el factor de riesgo de 53 Fig. 1. Diferentes mecanismos patogénicos de los factores medioambientales: relación causal o irritante inespecífico (Adaptada y modificada con permiso de Stephen T. Holgate, MD, D. Sc.). mayor peso específico para el desarrollo del asma. Existen algunas evidencias que orientan a que los procesos de sensibilización frente a alergenos comunes pueden iniciarse durante la vida fetal. Se ha objetivado células T del cordón umbilical, identificadas como fetales por análisis de ADN, que son capaces de proliferar ante estímulos específicos de alergenos comunes, tanto alimentarios (ovoalbúmina y ?-lactoglobulina), como inhalatorios (alergenos derivados de los ácaros del polvo doméstico –APD-, gato y polenes) (5-8). Las citocinas del patrón TH1, especialmente el interferon- ?, suponen una agresión importante a la placenta ejerciendo el daño bien directamente o bien a través de la activación de células citotóxicas. Por ello, el embarazo está ligado a un giro hacia el patrón de citocinas TH2 (9,10). La observación de que las madres atópicas son más prolíferas que las no atópicas ha dado pie a la hipótesis de que su patrón TH2 les proporciona cierta protección frente al aborto (11). Asma I Fasc culo 1 DEF.qxd 13:14 PÆgina 54 Existe cierto grado de controversia sobre la influencia que pueda tener el nacimiento prematuro sobre el posterior desarrollo de atopia y asma. Algunos otros autores ponen de manifiesto un riesgo mayor de los prematuros para padecer asma durante la infancia (12,13). APD, Alternaria sp., cucarachas y animales domésticos (35-37). La capacidad que tienen los alergenos en pruebas inhalatorias controladas en asmáticos sensibilizados, induciendo tanto la reacción asmática aguda como la tardía, se ha argumentado como razón evidente de la causalidad de la atopia en el asma (38-40). Especial consideración ha tenido a la exposición fetal al humo del tabaco. Se ha demostrado que los recién nacidos de madres fumadoras tienen peor función respiratoria y mayor prevalencia de enfermedad respiratoria o sibilancias (14,15). Dos estudios diferentes, uno de ellos con más de once mil escolares de Estados Unidos y Canadá, han puesto en evidencia una alta correlación entre el asma infantil y el tabaquismo materno durante el embarazo (16, 17). La atopia, valorada inicialmente por la eosinofilia, se valora actualmente por medio de pruebas cutáneas con alergenos o la cuantificación de IgE sérica, tanto total como específica. Mientras que las pruebas cutáneas se relacionan mejor con la rinitis alérgica, la IgE total es el mejor parámetro para relacionar el componente atópico del asma (41). Varios estudios epidemiológicos han puesto de manifiesto que el asma se relaciona con altos niveles de IgE (42). Pero, mientras esta relación es muy significativa en la infancia y adultos jóvenes, no ocurre igual en el asma del adulto en los que la atopia y el asma tienen una relación débil (43). FACTORES 54 30/05/2005 POSTNATALES. La lactancia materna tiene un efecto protector sobre la salud del recién nacido, supliendo sus carencias inmunológicas y aportándole anticuerpos y factores antimicrobianos. Se ha demostrado que los niños que mantienen la lactancia materna hasta los tres meses de edad tienen menor nivel de IgE a los seis y once años de edad en comparación con aquellos que siguieron lactancia artificial (18). Este hallazgo está en consonancia con estudios previos que demostraron una mayor protección frente a la atopia y el asma en niños con lactancia materna (19-23). Estas evidencias han permitido mantener la hipótesis de que aquellos niños con predisposición familiar para padecer asma tendrán síntomas más leves si siguen lactancia materna durante los primeros meses de vida. El sexo marca notables diferencias en la prevalencia del asma. La enfermedad predomina en niños durante toda la infancia, siendo su punto más alto en la pubertad (24). Después de los veinte años la prevalencia de la enfermedad se iguala entre ambos sexos hasta los cuarenta años en que se hace más prevalente en mujeres. Las razones de esta distribución etaria permanecen desconocidas. El número de hermanos mayores se ha relacionado repetidas veces con rasgos del fenotipo atópico. Se ha demostrado una relación inversa con la rinitis alérgica (25-28), la positividad de las pruebas cutáneas frente a diversos alergenos (29, 30) y los niveles de IgE sérica específica. Sin embargo, la relación del número de hermanos y asma o hiperrespuesta bronquial no es tan evidente. Algunos autores han encontrado también una relación inversa mientras que otros no han ratificado este hallazgo (31-33). ATOPIA. El asma, junto con la rinitis y la dermatitis atópica, se ha considerado una de las enfermedades paradigmáticas entre las de etiología alérgica. La sensibilización alergénica y la posterior exposición al alergeno se ha considerado un factor de riesgo mayor para asma, estimándose que incrementa el riesgo de padecer asma entre 10 y 20 veces (34). Esto es especialmente cierto en lo que se refiere a los alergenos derivados de los Estudios recientes han puesto de manifiesto que la sensibilización alergénica ocurre en los primeros años de la vida, aunque los síntomas asmáticos no se manifiesten hasta algunos años después y estén restringidos sólo a un subgrupo del conjunto de niños sensibilizados. Se estima que sólo un 25-30% de los niños sensibilizados desarrollan asma, por lo que cabe pensar que deben de existir factores concomitantes, no identificados, que modulen la evolución de este subgrupo (56). El modelo del asma ligado a la atopia ha sido el paradigma teórico de los mecanismos etiológicos y patogénicos de la enfermedad. Sin embargo, con frecuencia se olvida que existen cuadros clínicos de asma no relacionados a la atopia. A pesar de las evidencias referidas, existen epidemiólogos que ponen en duda la relación causal de la atopia en el asma, considerando la sensibilización alergénica y la exposición como factores precipitantes de la hiperrespuesta bronquial pero no causales de asma. Se ha especulado con la posibilidad de que una anomalía genética fuese responsable, simultáneamente, del aumento en la producción de IgE y por otra parte del asma, presentándose ambas situaciones como fenómenos coincidentes pero no causalmente relacionados (45). Revisiones sobre la causalidad de la atopia en el asma ponen en duda dicha relación, con el argumento de que en grandes estudios aleatorios de población general no existen datos epidemiológicos que mantengan esa asociación (46, 47). En este sentido se podrían interpretar los hallazgos descritos en algunos países de Africa y Europa del este en los que se ha observado un incremento de la sensibilización alergénica sin cambios en la prevalencia de la hiperrespuesta bronquial (48). Estos datos ponen de manifiesto que asma y alergia no son equivalentes ni, probablemente, estén relacionados de una forma lineal (49). ALERGENOS DOMÉSTICOS. Entre los factores de origen doméstico que se han relacionado con el asma, el de mayor relevancia es la sen- C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 55 E t i o p a t o g e n i a sibilización a los alergenos derivados de los APD. La investigación al respecto es ingente y aporta datos para mantener la hipótesis de que los alergenos de los APD, actuando sobre una parte de la población sensibilizada, cumplen todos los criterios de causalidad que exige la epidemiología actual (50). Existe una asociación significativa entre sensibilización a APD y asma. Esta relación se ha objetivado en diferentes poblaciones, tanto en adultos como niños, y bajo diferentes condiciones climáticas. Un estudio escandinavo realizado en adultos describe una sensibilización del 19% de la población control frente a un 39% en la población asmática (51). En poblaciones infantiles en Estados Unidos se han encontrado sensibilizaciones en población control de 16 y 36% frente a 73 y 89,6% en población asmática (52, 53). La especulación de que la asociación del asma con la sensibilización a los APD no sea causal sino concomitante, porque ambas se deriven de un mismo defecto genético, parece descartarse en un estudio reciente con cerca de seis mil parejas de gemelos. En este estudio, con una base genética uniforme, se valoran diferentes factores de riesgo que se han relacionado con el asma, el único factor de riesgo que tuvo una relación estadísticamente significativa con el asma fue la sensibilización a los APD (54). Otro alergeno doméstico relacionado con el asma es el derivado de las cucarachas que parece tener especial relevancia clínica en viviendas con muy malas condiciones higiénicas (55). La introducción de animales en la vivienda, como mascotas domésticas, también se ha relacionado como factor de riesgo con relación al asma (56). POLUCIÓN MEDIO AMBIENTAL. Aunque existen muchas evidencias acerca del agravamiento del asma por la polución medio ambiental, hay pocos datos acerca de que la misma incremente la prevalencia de la enfermedad (57). Estudios realizados en poblaciones genéticamente similares y de zonas geográficas próximas, sometidas a diferente grado de contaminación medio ambiental, han evidenciado que en las ciudades industrializadas, con mayor contaminación con SO2, hay menor prevalencia de asma y mayor prevalencia de bronquitis comunes en la población infantil (58-60). A escala global también se ha observado este fenómeno, países del este de Europa o regiones de China, sometidas a gran contaminación y altos niveles de SO2, tienen tasas de asma muy inferiores a países con niveles mínimos de contaminación como Australia o Nueva Zelanda (61). Se ha constatado que los asmáticos experimentan una disminución del FEV1 tras la exposición experimental a SO2, ozono y partículas procedentes de la combustión (62, 63). También se ha objetivado, en niños asmáticos, disminución del FEV1 tras la exposición a chimeneas de combustión de leña (64). Además, incrementos en la polución ambiental aumentan la frecuentación a servicios de urgencias por parte de estos enfermos, en localidades tan dispares como: Barcelona, Atlanta o Ciudad de México (65-67). El medio ambiente doméstico puede alcanzar niveles altos de polución por la utilización de calefacción por combustión de madera o el cocinar con gas. El producto más importante en la combustión del gas doméstico es el NO2, diferentes estudios han demostrado que los asmáticos aumentan su hiperrespuesta bronquial tras la inhalación de este gas y se potencia la respuesta a la inhalación de alergenos (68-70). El asma inducido por irritantes, conocido también como síndrome de disfunción reactiva de las vías aéreas, se refiere a la iniciación de asma tras la exposición accidental a grandes concentraciones de humo o vapores tóxicos (71-73). Se han detectado casos de origen doméstico relacionados con mezclas de aguafuerte (SO4H2) y amoníaco (NH3), utilizadas para limpieza o desatasco de piezas sanitarias de cuartos de baño. No obstante, la mayoría de este subgrupo de asma tiene la exposición en ambiente laboral (74-77). Especial consideración merece la exposición al humo del tabaco tanto en periodo prenatal, ya comentada, como en los primeros años de vida. Se ha puesto de manifiesto que los niños de madres fumadoras, durante su primer año de vida, multiplican entre 2,1 y 2,5 la posibilidad de desarrollar asma en comparación a los niños de madres no fumadoras (78, 79). Aunque la relación del tabaquismo materno con la presencia de sibilancias en los primeros años de vida podría explicarse por una mayor prevalencia de infecciones virales, la relación con el asma se mantiene a la edad de seis años (80). Un meta-análisis ha confirmado la relación significativa que existe entre la prevalencia y la incidencia del asma y la exposición de los niños al humo de tabaco materno. Aunque parece fuera de toda duda la existencia de una relación entre asma infantil y tabaquismo materno, no se ha demostrado relación entre humo de tabaco y atopia (124). INFECCIONES. Estudios epidemiológicos sobre poblaciones diferenciadas, que conviviendo en un mismo territorio mantienen diferentes situaciones sociales y económicas, han puesto de manifiesto que aquellas poblaciones con mayor índice de infecciones en la primera infancia, tienen menores índices de atopia y asma (58, 59,82-84). En un estudio de cohortes, los niños que tuvieron infecciones respiratorias sin sibilancias, especialmente neumonías y traqueobronquitis, en los tres primeros años de vida, presentaron, a los seis años de edad, menor tasa de pruebas cutáneas positivas con alergenos comunes y menor tasa de IgE sérica total (85). Especial relevancia se ha prestado a la flora intestinal como factor inductor del cambio del patrón fisiológico TH2 del recién nacido al patrón TH1 del niño y del 55 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 56 adulto. Algunos estudios han puesto de manifiesto que niños de grupos sociales con alta colonización intestinal tienen menor prevalencia de alergia que poblaciones cercanas, con diferentes pautas alimentarias y menor colonización intestinal (60). Otro de los argumentos esgrimidos a favor de la protección que las infecciones precoces ejercen sobre el asma, es la baja incidencia de enfermedades atópicas y asma que, en países centroeuropeos, se ha descrito en niños criados en ambientes de granja, donde coexiste un medio de alta contaminación bacteriana con alta concentración alergénica (86-88). Una excepción a la protección que ejercen las infecciones precoces sobre el posterior desarrollo del asma es la bronquiolitis por virus sincitial respiratorio (VSR). Diversos estudios, tanto retrospectivos como prospectivos, han ligado la bronquiolitis por VSR con la bronquitis sibilante de la primera infancia (89, 90). Su relación con el asma y la atopia en la segunda infancia ha sido menos evidente. Una publicación reciente, de carácter prospectivo, ha puesto de manifiesto que tanto el asma como la sensibilización alérgica es significativamente más prevalente, a la edad de siete años, en niños con bronquiolitis por VSR en la primera infancia. Siendo el mayor factor de riesgo en un análisis multivariante de un grupo de 140 niños 56 (91). La asociación entre bronquiolitis por VSR y asma sólo se ha demostrado en aquellas situaciones clínicas de mayor gravedad que han precisado de hospitalización (91, 92). Otro de los gérmenes implicados en el asma ha sido la Chlamydia pneumoniae. A principio de los años 90, por primera vez, un estudio con pocos enfermos pone de manifiesto una asociación entre asma de reciente instauración e infección reciente por C. pneumoniae (93). El mismo grupo ha publicado una serie de 163 individuos con hallazgos similares (94). Sin embargo, esta asociación no ha sido ratificada en estudios posteriores aunque sí han encontrado una asociación entre asma grave e infección por C. Pneumoniae (95, 96). La inflamación bronquial El asma es una enfermedad inflamatoria crónica, caracterizada por una importante infiltración celular de la pared bronquial. Las complejas relaciones intercelulares se llevan a cabo por medio de citocinas, quimiocinas y factores de crecimiento (tabla I) mientras que los efectos inflamatorios son secundarios a la liberación de mediadores procedentes de las dife- Citocina Fuente Principal Acción más relevante IL-2 Linfocitos Th0 y Th1 crecimiento y diferenciación de células T y B. IL-3 Linfocitos T y mastocitos Factor de crecimiento pluripotencial hematopoyético. IL-4 Linfocitos Th2, eosinófilos y mastocitos IgE, Th2 y eosinófilos. IL-5 Linfocitos T y eosinófilos Th2 y maduración de eosinófilos. IL-10 Linfocitos Th2 y mastocitos Th1 y Th2 y supervivencia de eosinófilos. IL-13 Linfocitos T Activa eosinófilos. IFN-γ Linfocitos Th1 Th2 , IgE y atracción de eosinófilos. GM-CSF Células inflamatorias y estructurales. Proliferación y maduración de células hematopoyéticas Activa eosinófilos y Supervivencia y liberación de leucotrienos. TGF-β Células inflamatorias y estructurales. Fibroblastos y mastocitos. TNF-α Mastocitos, eosinófilos, otras Activa células inflamatorias, endotelio y epitelio. RANTES Linfocitos T, eosinófilos y células epiteliales y musculares Quimiotaxis de eosinófilos y linfocitos T de memoria. Eotaxina Células epiteliales y musculares Quimiotaxis de eosinófilos. Th1. Apoptosis. IgE. Tabla I. Citocinas más relevantes en la inflamación asmática. IL, interleucina. IFN-γ , interferon gamma. GM-CSF, factor estimulador de las colonias de granulocitos y macrófagos. TGF-β, factor transformador del crecimiento beta. TNF-α, factor de necrosis tumoral alfa. RANTES, Regulated on Activation, Normal T cell Expressed, and Secreted. Disminuye o inhibe. Incrementa o potencia. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 57 E t i o p a t o g e n i a Células inflamatorias Mastocitos Eosinófilos Linfocitos TH2 Células estructurales Epitelio Músculo liso Endotelio Fibroblastos Histamina Leucotrienos PAF Prostanoides Oxido Nítrico Cininas PBME PCE Edema Hipersecreción Contracción muscular Hiperrespuesta bronquial Alteraciones estructurales (remodelado) Tabla II. Las células implicadas en el asma son capaces de producir la mayoría de los mediadores habituales de esta enfermedad. Por su número y grado de actividad tienen especial relevancia los eosinófilos. Entre los mediadores, por la potencia y persistencia de su efecto, tienen especial importancia los leucotrienos. PBME, proteína básica mayor de los eosinófilos. PCE, proteína catiónica de los eosinófilos. PAF, factor activador de plaquetas. rentes estirpes celulares (tabla II). En esta inflamación se implican diferentes líneas celulares y destaca el predominio de los eosinófilos. No obstante, se reconoce el papel preponderante que tienen los linfocitos CD4+, en concreto el subgrupo TH2, como células de mayor responsabilidad en la regulación del proceso inflamatorio. Otras células implicadas en la patogénesis del asma son: las células dendríticas, los mastocitos, los basófilos y los macrófagos. Recientemente, se ha implicado en la patogenia del asma a células estructurales de la vía respiratoria, especialmente a las células epiteliales y a los fibroblastos (97). Además, la inflamación de la pared bronquial en el asma implica: edema de la mucosa, ingurgitación capilar y oclusión de pequeñas vías aéreas con secreciones mucosas, exudado proteico, glucoproteínas de secreción epitelial y células epiteliales descamadas. Este escenario se puede objetivar en broncoscopia como una mucosa enrojecida y edematosa de manera uniforme y generalizada. quial del asmático, pudiéndose encontrar libres en la luz bronquial. Las células dendríticas son macrófagos diferenciados que se sitúan en la luz bronquial. Tienen una especial relevancia en los fenómenos de sensibilización alergénica. Fagocitan alergenos, los procesan en forma de péptidos y los exponen en superficie ligados a los antígenos mayores histocompatibilidad. Las células dendríticas tienen capacidad migratoria, desplazándose desde la luz bronquial hacia las estructuras linfáticas regionales: ganglios linfáticos u otros agregados linfoides, no capsulados, conocidos como tejido linfoide asociado a la mucosa bronquial (BALT en la literatura anglosajona). En estos territorios, estimulan a los linfocitos no diferenciados (TH0). Las células dendríticas tipo CD8?- inducen la diferenciación linfocitaria hacia TH2 mientras que las CD8?+ lo hacen hacia los TH1. (99-101). Figura 2. El patrón inflamatorio del asma es similar a la respuesta inflamatoria frente a párasitos; ambas respuestas tienen dos rasgos definitorios, la presencia de un mecanismo IgE dependiente y la infiltración eosinófila. No obstante, existe un pequeño grupo de asmáticos, en los que la enfermedad suele aparecer en la vida adulta, que no presentan evidencia de mecanismo IgE, aunque se ha especulado que esta inmunoglobulina tenga un papel restringido a la propia mucosa bronquial. Por otra parte, existen evidencias acerca de que el grado de inflamación se corresponde con la hiperrespuesta bronquial medida con histamina o metacolina y esta última se relaciona a los síntomas del asma. (98). Células inflamatorias Diversas estirpes celulares, procedentes de la médula ósea, constituyen el infiltrado celular de la pared bron- Fig. 2. Proceso de sensibilización alergénica. Las células dendríticas fagocitan alergenos, los procesan mostrando en su superficie sus diferente antígenos y emigran al tejido linfático (BALT, Bronchial Associated Lymphatic Tissue). Una vez allí, presenta los antígenos a los linfocitos TH0 que se diferencian prioritariamente hacia TH2, infiltrando posteriormente la pared bronquial. 57 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 58 Los linfocitos, el paradigma TH1/TH2. Mientras que los linfocitos TH1 tienen un patrón de secreción de interleucina 2 (IL-2) e interferón gamma (IFN-?) los TH2 producen IL-4, IL-5, IL-9, IL-10 e IL-13. Mientras que la producción de citocinas de los TH1 está dirigida a la activación macrofágica y a promocionar las reacciones de hipersensibilidad tardía, especialmente relacionadas a las enfermedades granulomatosas, los TH2 son los responsables de las reacciones alérgicas y de la defensa antiparasitaria induciendo la producción de IgE y la reacción eosinofílica, siendo los linfocitos B los responsables de la producción de IgE bajo el estímulo principal de la IL-4. (102). Como se observa en la figura 2, en el asma existe un desequilibrio de las poblaciones linfocitarias secundario a una producción excesiva de linfocitos TH2 (103). Esta situación condiciona que la pared bronquial del sujeto sensibilizado a un alergeno determinado se encuentre infiltrada por linfocitos TH2 capaces de producir IgE específica para ese alergeno. Esta IgE se encuentra bien libre o bien unida a receptores celulares, especialmente mastocitos y basófilos (figura 3). afectan a la osmolaridad del medio (ejercicio e hiperventilación) y pueden liberar diferentes citocinas capaces de mantener la inflamación bronquial. Especialmente ricos en triptasa juegan, a través de ella, un papel en el remodelado bronquial por estimular a los fibroblastos (107). Fig. 4. Reacción alérgica en la pared bronquial. La llegada del alergeno y su unión a la IgE enclavada en los mastocitos, origina liberación de mediadores de la inflamación con especial repercusión en los capilares de la pared. La reacción origina edema tisular e infiltración eosinófila que amplifica la respuesta inflamatoria. 58 Fig. 3. Situación habitual en la pared bronquial del asmático. Linfocitos TH2 e IgE específica libre y ligada a células, especialmente a mastocitos. Los mastocitos están ligados a la respuesta broncoconstrictora inmediata a través de mediadores preformados como la histamina y a la tardía por medio de mediadores derivados de los fosfolípidos de membrana como los leucotrienos y otros mediadores. Los asmáticos tienen mayor población de mastocitos tanto en la luz bronquial como en la pared bronquial e infiltrando el músculo liso y su control depende en gran parte de las citocinas de los linfocitos TH2 (104, 105). Los mastocitos de la luz bronquial juegan un papel inicial en el fenómeno inflamatorio. Bien por medio de un mecanismo atópico, en el que se implican diferentes alergenos e IgE específica unida a los receptores de membrana (figura 4), o bien por otros mecanismos menos conocidos (106). Además, los mastocitos de los asmáticos tiene especial facilidad para degranularse ante estímulos que Los eosinófilos son las células más características de la inflamación asmática. Procedentes de la médula ósea acuden a la pared bronquial por el estímulo de quimiocinas: eotaxina, RANTES (Regulated on Activation, Normal T cell Expressed, and Secreted) y proteína quimiotáctica de los monocitos. Todas ellas, quimiocinas liberadas por los mastocitos y expresadas también en las células epiteliales (figura 4). Una vez en la pared bronquial, los eosinófilos son activados e inhibida su apoptosis por diversos factores de crecimiento entre los que destacan el GM-CSF (factor estimulador de las colonias de granulocitos y macrófagos) e IL-5. Esta última citocina, generada por los TH2, ha podido ser inhibida por un anticuerpo monoclonal humanizado anti IL-5, produciendo una notoria eosinopenia. Sin embargo, este efecto no ha tenido repercusión sobre la hiperrespuesta bronquial (108). Los eosinófilos, capaces de producir la mayoría de los mediadores de la inflamación, amplifican la respuesta inflamatoria e inducen daño epitelial por liberación de proteína básica y radicales libres de oxígeno (104, 109). Otras células como macrófagos, neutrófilos, basófilos y plaquetas pueden jugar algún papel en la inflamación del asma pero, en la actualidad, su papel está peor definido. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 59 E t i o p a t o g e n i a Células estructurales Las observaciones epidemiológicas acerca de enfermos asmáticos sin evidencia de incremento de IgE y de sujetos con altas tasas de IgE específicas a alergenos relacionados al asma pero que no presentan enfermedad, han llevado a concebir el asma como una situación patológica por un defecto estructural primario. Se especula con un epitelio bronquial con mayor susceptibilidad a frente a diversas agresiones y con una respuesta retardada en el proceso de reparación. Esta situación conlleva la producción, por parte del epitelio, de una serie de factores de crecimiento, entre ellos el factor de crecimiento epitelial (EGF en siglas anglosajonas) y del factor de transformación del crecimiento beta (TGF?). Estos factores crean un micro ambiente en las capas más profundas de la pared bronquial que condicionan, a través de los fibroblastos, importantes cambios estructurales que originan el fenómeno anatómico conocido como remodelado bronquial, afectando a la mayoría de las estructuras anatómicas de la pared bronquial, especialmente a músculos y capilares sanguíneos. Esta hipótesis, conocida como la teoría de la activación de la unidad trófica epitelio-mesenquimal (referida con las siglas EMTU en lengua inglesa) deja un papel secundario al mecanismo alérgico en el asma (97, 110). La inmunoglobulina E Hace años que se aceptó que la elevación de la IgE sérica se asociaba al diagnóstico de asma y a la hiperrespuesta bronquial (111). Incluso entre los asmáticos no alérgicos se han demostrado niveles séricos de IgE superiores a los de la población general (112). La IgE se compone de dos cadenas pesadas y dos cadenas ligeras, la zona donde se sitúan estas últimas se conoce como región Fab y constituye el área de reconocimiento del alergeno. La región Fc, constituida exclusivamente por las cadenas largas, aloja el dominio C?3 punto de unión de la IgE con los receptores de membrana de las diferentes células, especialmente eosinófilos, basófilos y mastocitos (figura 5). Fig. 5. Estructura de la IgE. Para más detalles, ver texto. Existen numerosas evidencias que relacionan a la IgE con la respuesta TH2. La activación alergénica de la IgE unida a los mastocitos, por medio de los receptores de alta afinidad (Fc?RI), provoca la liberación de mediadores de la inflamación tanto preformados como sintetizados de novo. Por ello, la inhalación de alergenos en asmáticos sensibilizados provoca obstrucción temprana y tardía de las vías aéreas y caida del FEV1. Además, la unión del alergeno a la IgE facilita a las células dendríticas su capacidad de fagocitación y procesamiento de alergenos, así como su presentación a los linfocitos TH0 (113). Además, la IgE regula la producción de sus propios receptores celulares (Fc?RI) (114). El papel de la IgE en la patogenia del asma se ha realzado en estudios recientes que ponen de manifiesto que el descenso de la IgE libre, bloqueándola con un anticuerpo monoclonal humanizado recombinante (omalizumab) puede mejorar los síntomas del asma, incluso en el asma grave (115). Con el mismo anticuerpo, se ha demostrado que se controla la inflamación bronquial del asmático y disminuyen los receptores de membrana Fc?RI (116, 117). Alteraciones estructurales de la pared bronquial En los procesos inflamatorios crónicos, los ciclos continuados de daño/reparación, pueden llevar a una pérdida de la integridad anatómica del tejido determinando trastornos funcionales con cierto grado de irreversibilidad. El conjunto de cambios histológicos inducidos en la pared bronquial por la inflamación crónica en el asma (fenómenos de fibrosis, hiperplasia e hipertrofia, acompañados de pérdida de epitelio) se ha denominado remodelado bronquial y condiciona un engrosamiento y una mayor rigidez de la pared, con pérdida del calibre bronquial y mala respuesta terapéutica. El proceso inflamatorio afecta a casi todas las estructuras anatómicas de la pared bronquial. EPITELIO BRONQUIAL La presencia de conglomerados de células epiteliales en el esputo de los asmáticos (cuerpos de Creola) ha sido un hallazgo diagnóstico de primer orden. La presencia de amplias zonas de membrana basal denudada, o cubierta solo por algunas células basales, es un hallazgo habitual en el asma, incluso en aquella de carácter leve. Esta situación permite que partículas inhaladas puedan acceder con facilidad al territorio subepitelial lo que puede justificar la hiperrespuesta del enfermo asmático frente a estímulos inespecíficos (118, 119). La pérdida epitelial es una de las fases últimas del proceso inflamatorio que, en sus primeras etapas, se desarrolla con gran participación de las propias células epiteliales, que a través de dos potentes quimiocinas, RANTES y eotaxina, atraen eosinófilos activados responsables del daño epitelial (120). 59 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 60 Membrana basal. El engrosamiento observado en microscopía óptica se debe al depósito subyacente de colágeno I y III y la presencia de fibronectina, una de las alteraciones anatómicas de mayor relevancia en el asma. Este depósito, conocido como membrana o lámina reticular, difiere de otras enfermedades como la EPOC en la que se objetiva un acumulo de colágeno tipo V y VII y laminina (121, 122). CAPILARES SANGUÍNEOS. Biopsias bronquiales en asmáticos han demostrado un incremento de la superficie capilar que contribuye al aumento del grosor de la pared (123). Por otra parte, se ha demostrado que la angiogénesis inducida por los procesos inflamatorios resulta en capilares más permeables, con mayor facilidad para la producción de edema (124), y mayor expresión de moléculas de adhesión en las células endoteliales (125), lo que facilita la diapedesis celular. GLÁNDULAS La adventicia bronquial es la estructura anatómica más profunda de la pared bronquial constituyendo, en los pequeños bronquios, la frontera entre la vía aérea y el parénquima pulmonar adyacente. La estabilidad de estas vías depende de las fuerzas de tracción radial que ejercen las paredes alveolares y los tabiques conjuntivos a través de sus anclajes en la adventicia bronquial. Se ha puesto en evidencia la existencia de un depósito de colágeno adyacente a la adventicia, similar al que ocurre bajo la membrana basal (134). Esta situación puede disminuir la dilatación bronquial por pérdida de la tracción de las estructuras vecinas e incluso afectar a la relajación del músculo liso por abolir su estiramiento pasivo, un reconocido mecanismo miorrelajante (135). MUCOSAS. La pérdida del epitelio ciliado bronquial coincide, en los asmáticos, con una hipertrofia e hiperplasia de las células caliciformes que colonizan amplias zonas de la membrana basal, contribuyendo notoriamente a la formación de tapones mucosos. Por otra parte, las estructuras glandulares submucosas ocupan un volumen de hasta cuatro veces superior al de los sujetos normales, lo que confiere una gran rigidez a toda la pared bronquial (126, 127). 60 MÚSCULO LISO. El volumen de las estructuras musculares de los asmáticos llega a ser hasta cuatro veces superior al de los sujetos normales (129). La hipertrofia muscular parece secundaria a diversos estímulos: mediadores de la inflamación, citocinas y, especialmente, a la actividad de factores de crecimiento. Además, parece razonable la teoría de la hipertrofia secundaria a un estímulo contráctil repetido (124). Esta hipertrofia muscular, ausente en otras enfermedades obstructivas como la EPOC, aparte de conferir gran rigidez a toda la pared bronquial, tiene una especial capacidad para producir una gran constricción de los bronquiolos (130). Los fibroblastos son células residentes de especial importancia en el fenómeno del remodelado bronquial (131). Se ha demostrado que su número se encuentra incrementado, relacionándose su población con el grosor de la membrana reticular (132). La matriz conjuntiva extracelular de los asmáticos muestra un incremento de tenascina y colágeno, lo que le aporta mayor rigidez al conjunto de la pared bronquial (133). La mayoría de las células implicadas en el asma tienen mecanismos desarrollados tanto para inducir la producción de las macromoléculas que forman el esqueleto conjuntivo de la pared bronquial como productos para su degradación (elastasa, triptasa y otros enzimas proteolíticos). C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 61 E t i o p a t o g e n i a Bibliografía 1. Skadhauge LR, Chistsen K, Kyvik KO, Sigsgaard T. Genetic and environmental influence on asthma: a population- based study of 11,688 Danish twin pairs. Eur Respir J 1999; 13:8-14. 2. Nanavaty U, Goldstein AD, Levine SJ. Polymorphisms in candidate asthma genes. Am J Med Sci. 2001;321:11-6. 3. Ninan TK, Russel G. Respiratory symptoms and atopy in Aberdeen schoolchildren: evidence from two surveys 25 years apart. Br Med J 1992; 304:873-5. 4. International Study of Asthma and Allergies in Childhood Steering Comittee. Worldwide variation in the prevalence of symptoms of asthma allergic rhinoconjunctivitis and atopic eczema. Lancet 1998; 351:1225-32. 5. Rinas U, Horneff G, Wahn V. Interferon-gamma production by cord-blood mononuclear cells is reduced in newborns with a family history of atopic disease and is dependent from cord-blood IgE levels. Pediatr Allergy Immunol 1993; 4:60-4. 6. Warner JA, Miles EA, Jones AC, Quint DJ, Colwell BM, Warner JO. Is deficiency of interferon gamma production by allergen triggered cord blood cells a predictor of atopic eczema? Clin Exp Allergy 1994; 24:423-30. 7. Prescott S, Macaubas C, Smallacombe T, Holt B, Sly P, Holt P. Development of allergen specific T cell memory in atopic and normal children. Lancet 1999; 353:196-200. 8. Prescott S, Macaubas C, Holt B, Smallacombe TB, Loh R, Sly PD, Holt PG. Transplacental priming of the human immune system to environmental allergens: universal skewing of initial T cell responses towards the Th2 cytokine profile. J Immunol 1998; 160:4730-7. 9. Wegmann T, Lin H, Gulbert L, Mosmann T. Bidirectional cytokine interactions in the maternal-fetal relationship: is suc- cesuful pregnancy a Th2 phenomenon?. Immunol Today 1997; 14:453-6. 10. Holt PG, Macaubas C. Development of long term tolerance versus sensitisation to environmental allergens during the perinatal period. Curr Opin Immunol 1997; 9:782-7. 11. Nilsson L, Kjellman NI, Björksten B. Parity among atopic and non-atopic mothers. Pediatr Allergy Immunol 1997; 8:134-7. 13. von Mutius E, Nicolai T, Martinez FD. Prematurity as a risk factor for asthma in preadolescent children. J Pediatr 1993; 123:223-9 14. Frischer T, Kuehr J, Meinert R, Karmans W, Urbanek R. Risk factors for childhood asthma and recurrent wheezy bron- chitis. Eur J Pediatr 1993; 152:771-5. 15. Hanrahan JP, Tager IB, Segal MR, Tosteson TD, Castile RG, van Vunakis H, Weiss ST. The effect of maternal smoking during pregnancy on early infant lung function. Am Rev Respir Dis 1992; 145:1129-35. 16. Tager IB, Hanrahan JP, Tosteson TD, Castile RG, Brown RW, WeissST, Speizer FE. Lung function, pre- and post-natal smoke exposure, and wheezing in the first year of life. Am Rev Respir Dis 1993; 147:811-7. 17. Ehrlich RI, Du Toit D, Jordaan D, Zwarestein M, Potter P, Volmink JA, Weinberg E. Risk factors of childhood asthma and wheezing. Importance of maternal and household smoking. Am J Respir Crit Care Med 1996; 154:681-8. 18. Cunningham J, O`Connor GT, Dockery DW, Speizer FE. Environmental tobacco smoke, wheezing, and asthma in chil- dren in 24 communities. Am J Respir Crit Care Med 1996; 153:218-24. 19. Wright AL, Sherrill D, Holberg CJ, Halonen M, Martinez FD. Breast-feeding, maternal IgE, and total serum IgE in childhood. J Allergy Clin Immunol 1999; 104:589-94. 20. Chandra RK, Singh G, Shridhara B. Effect of feeding whey hydrolysate, soy and conventional cow milk formulas on incidence of atopic disease in high risk infants. Ann Allergy 1989; 63:102-6. 61 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 62 21. Burr ML, Limb ES, Maguire MJ, Amarah L, Eldridge BA, Layzell JMC, et al. Infant feeding, wheezing, and allergy: a prospective study. Arch Pediatr Adolesc Med 1993; 68:724-8. 22. Infante-Rivard C. Childhood asthma and indoor environmental risk factors. Am J Epidemiol 1993; 137:834-44. 23. Tariq SM, Matthews SM, Hakim EA, Stevens M, Arshad SH, Hide DW. The prevalence and risk factors for atopy in early childhood: a whole population birth cohort study. J Allergy Clin Immunol 1998; 101:587-93. 24. Rylander E, Pershagen G, Eriksson M, Nordvall L. Parental smoking an other risk factors for wheezing bronchitis in children. Eur J Epidemiol 1993; 9:517-26. 25. Weiss St, Gold DR. Gender differences in asthma. Pediatr Pulmonol 1995; 19:153-5. 26. Strachan DP. Hay fever, hygiene, and household size. Br Med J 1989; 299:1259-60. 27. Räsänen M, Laitinen T, Kaprio J, Koskenvuo M, Laitinen LA. Hay fever, asthma and number of older siblings-a twin study. Clin Exp Allergy 1997; 27:515-8. 28. Jarvis D, Chinn S, Luczynska C, Burney P. The association of family size with atopy and atopic disease. Clin Exp Allergy 1997; 27:240-5. 29. von Mutius E, Martinez FD, Fritzsch C, Nicolai T, Reitmeir P, Thiemann HH. Skin test reactivity and number of sib- lings. Br Med J 1994; 308:692-5. 30. Strachan DP, Harkins LS, Johnston IDA, Anderson HR. Childhood antecedents of allergic sensitization in young British adults. J Allergy Clin Immunol 1997; 99:6-12. 31. Matricardi PM, Franzinelli F, Franco A, Caprio G, Murru F, Cioffi D, et al. Sibship size, birth order, and atopy in 11,371 Italian young men. J Allergy Clin Immunol 1998; 101:439-44. 32. Sunyer J, Antó JM, Kogevinas M, Barceló MA, Soriano JB, Tobías A, Muniozguren N, Martínez-Moratalla J, Payo F, Maldonado JA. Risk factors for asthma in young adults. Eur Respir J 1997; 10:2490-4. 62 33. Rona RJ, Duran-Tauleria E, Chinn S. Family size, atopic disorders in parents, asthma in children, and ethnicity. J Allergy Clin Immunol 1997; 99:454-60. 34. Nowak D, Heinrich J, Jörres R, Wassmer G, Berger J, Beck E, Boczor S, Claussen M, Wichmann HE, Magnussen H. Prevalence of respiratory symptoms, bronchial hyperresponsiveness and atopy among adults: West and East Germany. Eur Respir J 1996; 9:2541-52. 35. Peat JK, Li J. Reversing the trend: reducing the prevalence of asthma. J Allergy Clin Immunol 1999; 103:1-10. 36. Sporik R, Holgate ST, Platts-Mills TAE, Cogswell JJ. Exposure to house-dust mite allergen (Der p I) and the develop- ment of asthma in childhood. A prospective study. N Engl J Med 1990; 323:502-7. 37. Peat JK, Tovey E, Brett G, Toelle G, Haby MM, Gray EJ, et al. House dust mite allergens. A major risk factor for child- hood asthma in Australia. Am J Respir Crit Care Med 1996; 153:141-6. 38. Custovic A, Smith A, Woodcock A. Indoor allergens are a primary cause of asthma. Eur Respir Rev 1998; 53:268-72. 39. Barnes PJ, Chung KF, Page CP. Inflammatory mediators of asthma: an update. Pharmacol Rev 1998; 50:515-96. 40. O’Byrne PM. Leukotrienes in the pathogenesis of asthma. Chest 1997; 111 (2 Suppl):27S-34S. 41. Galli SJ, Costa JJ. Mast-cell-leukocyte cytokine cascades in allergic inflammation. Allergy 1995; 50:851-62. 42. Burrows B, Martinez FD, Halonen A, Barbee RA, Cline MG. Association of asthma with serum IgE levels and skin test reactivity to allergens. N Engl J Med 1989; 320:271-7. 43. Sears MR, Burrows B, Flannery EM, Herbison GP, Hewitt CJ, Holloway MD. Relation between airway responsiveness and serum IgE in children with asthma and in apparentely normal children. N Engl J Med 1991; 325:1067-71. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 63 E t i o p a t o g e n i a 44. Antó JM, Sunyer J. Proportion of asthma attributable to sensitisation to aeroallergens. Eur Respir Rev 1998; 8:159-60. 45. Holt PG, Macaubas C, Stumbles PA. The role of allergy in the development of asthma. Nature 1999; 402 (Suppl):B12-B17. 46. Sunyer J, Antó JM, Castellsagué J, Soriano JB, Roca J and the Spanish Group of the European Study of Asthma. Total serum IgE is associated with asthma independently of specific IgE levels. Eur Respir J 1996; 9:1880-4. 47. Pearce N, Pekkanen J, Beasley R. How much asthma is really attributable to atopy?. Thorax 1999; 54:268-72. 48. Pearce N, Douwes J, Beasley R. Is allergen exposure the major primary cause of asthma?. Thorax 2000; 55:424-31. 49. von Mutius E. The rising trends in asthma and allergic disease. Clin Exp Allergy 1998; 28:45-9. 50. Holgate ST. Genetic and environmental interaction in allergy and asthma. J Allergy Clin Immunol 1999; 104:1139-46. 51. Sporik R, Chapman MD, Platts-Mills TAE. House dust mite exposure as a cause of asthma. Clin Exp Allergy 1992; 22:897-6. 52. Omenaas E, Bakke P, Eide GE, Elsayed S, Gulsvik A. Serum house-dust-mite antibodies and reduced FEV1 in adults of a norwegian community. Am J Respir Crit Care Med 1995; 152:1158-63. 53. Squillace SP, Sporik R, Rakes G, Couture N, Lawrence A, Merrian S, et al. Sensitization to dust mites as a dominant risk factor for asthma among adolescents living in central Virginia. Multiple regression analysis of a populationbased study. Am J Respir Crit Care Med 1997; 156:1760-64. 54. Nelson RP Jr, Di Nicolo R, Fernández-Caldas E, Seleznick MJ, Lockey RF, Good RA. Allergen-specific IgE levels and mite allergen exposure in children with acute asthma first seen in an emergency department and in nonasthmatic control subjects. J Allergy Clin Immunol 1996; 98:258-63. 55. Duffy DL, Mitchell CA, Martin NC. Genetic and environmental risk factors for asthma. A cotwin-control study. Am J Respir Crit Care Med 1998; 157:840-5. 56. Rosenstreich DL, Eggleston P, Kattan M, Baker D, Slavin RG, Gergen P, et al. The role of cockroach allergy and expo- sure to cockroach allergen in causing morbidity among inner-city children with asthma. N Engl J Med 1997; 336:1356-63. 57. Sporik R, Ingram JR, Price W, Sussman JH, Hosinger RW, Platts-Mills TAE. Association of asthma with serum IgE and skin test reactivity to allergens among children living at high altitude. Am J Respir Crit Care Med 1995; 151:1388-92. 58. Koenig JQ. Air pollution and asthma. J Allergy Clin Immunol 1999; 104:717-22. 59. von Mutius E, Martinez FD, Fritzsch C, Nicolai T, Roell G, Thiemann HH. Prevalence of asthma and atopy in two areas of West and East Germany. Am J Respir Crit Care Med 1994; 149:358-64. 60. Braback L, Breborowicz A, Dreborg S, Knutsson A, Pieklik H, Björksten B. Atopic sensitization and respiratory symp- toms among Polish and Swedish school children. Clin Exp Allergy 1994; 24:826-35. 61. Braback L, Breborowicz A, Julge K, Knutsson A, Riikjarv MA, Vasar M, et al. Risk factors for respiratory symptoms and atopic sensitisation in the Baltic area. Arch Dis Child 1995; 72:487-93. 62. Beasley R, Crane J, Lai CKW, Pearce N. Prevalence and etiology of asthma. J Allergy Clin Immunol 2000; 105 (Suppl):S466-72. 63. Koenig JQ, Pierson WE, Horike M, Frank R. Effects of SO2 plus NaCl aerosol combined with moderate exercise on pul- monary function in asthmatic adolescents. Environ Res 1981; 25:340-8. 64. Kreit JW, Gross KB, Moore TB, Lorenzen TJ, D’Arcy J, Eschenbacher WL. Ozone induced changes in pulmonary func- tion and bronchial responsiveness in asthmatics. J Appl Physiol 1989; 66:217-22. 65. Koenig JQ, Larson TV, Hamley QS, Rebolledo V, Dumler K, Checkoway H, et al. Pulmonary function changes in chil- dren associated with fine particulate matter. Environ Res 1993; 63:26-38. 63 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 64 66. Castellsagué J, Sunyer J, Saez M, Antó JM. Short term association between air pollution and emergency room visits for asthma in Barcelona. Thorax 1995; 50:1051-6. 67. White MC, Etzel RA, Wilcox WD, Lloyd C. Exacerbations of childhood asthma and ozone pollution in Atlanta. Environ Res 1994; 65:56-68. 68. Romieu I, Meneses F, Sienra-Monge JJL, Huerta J, Velasco SR, White MC, et al. Effects of urban air pollutants on emegency visits for childhood asthma in Mexico City. Am J Epidemiol 1995; 141:546-53. 69. Kerkhof M, de Monchy JGR, Rijken B, Schouten JP. The effect of gas cooking on bronchial hyperresponsiveness and the role of immunoglobulin E. Eur Respir J 1999; 14:839-44. 70. Tunnicliffe WS, Burge PS, Ayres JG. Effect of domestic concentrations of nitrogen dioxide on airway responses to inhaled allergen in asthmatic patients. Lancet 1994; 344:1733-6. 71. Rijcken B, Schouten JP, Weiss St, Speizer FE, van der Lende R. The relationship of nonspecific bronchial responsive- ness to respiratory symptoms in a radom population sample. Am Rev Respir Dis 1987; 136:62-8. 72. Brooks SM, Weiss MA, Bernstein IL. Reactive airways dysfunction syndrome (RADS). Persistent asthma syndrome after high level irritant exposures. Chest 1985; 88:376-84. 73. Chatkin JM, Tarlo SM, Liss G, Banks D, Broder I. The outcome of asthma related to workplace irritant exposures. A comparison of irritant induced asthma and irritant aggravation of asthma. Chest 1999; 116:1780-5. 74. Alberts WM, do Pico GA. Reactive Airways Dysfunction Syndrome. Chest 1996; 109:1618-26. 75. Tarlo SM, Broder I. Irritant induced occupational asthma. Chest 1989; 96:297-300. 76. Leroyer C, Perfetti L, Cartier A, Malo JL. Can reactive airways dysfunction syndrome (RADS) transform into occupa- tional asthma due to “sensitisation” to isocyanates?. Thorax 1998; 53:152-3. 64 77. Chan-Yeung M, Lam S, Kennedy SM, Frew AJ. Persistent asthma after repeated exposure to high concentrations of gases in pulpmills. Am J Respir Crit Care Med 1994; 149:1676-80. 78. Kern DG. Outbreak of the reactive airways dysfunction syndrome after a spill of glacial acetic acid. Am Rev Respir Dis 1991; 144:1058-64. 79. Weitzman M, Gortmaker S, Walker DK, Sobol A. Maternal smoking and childhood asthma. Pediatrics 1990; 85:505. 80. Martinez FD, Cline M, Burrows B. Increased incidence of asthma in children of smoking mothers. Pediatrics 1992; 89:21 81. Martinez FD, Wright AL, Taussig LM, Holberg CJ, Halonen A, Morgan WJ, et al. Asthma and wheezing in the first six years of life. N Engl J Med 1995; 332:133-38. 82. Forastiere F, Agabiti N, Corbo GM, Pistelli R, Dell’Orco V, Ciappi G, et al. Passive smoking as a determinant of bronchial resposiveness in children. Am J Respir Crit Care Med 1994; 149:365-70. 83. Anderson HR. The epidemiological and allergic features of asthma in the New Guinea Highlands. Clin Allergy 1974; 4:171-83. 84. Flynn MGL. Respiratory symptoms of rural Fijian and Indian children in Fiji. Thorax 1994; 49:1201-4. 85. Flynn MGL. Respiratory symptoms, bronchial responsiveness, and atopy in Fijian and Indian children. Am J Respir Crit Care Med 1994; 150:415-20. 86. Martinez FD, Stern DA, Wright AL, Taussig LM, Halonen M. Association of non-wheezing lower respiratory tract ill- nesses in the early life with persistently disminished IgE levels. Group Health Medical Associates. Thorax 1995; 50:1067-72. 87. Braun-Fahrländer CH, Gassner M, Grize L, Neu U, Sennhauser FH, Varonier HS, et al. Prevalence of hay fever and allergic sensitization in farmers’ children and their peers living in the same rural community. Clin Exp Allergy 1999; 29:28-34. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 65 E t i o p a t o g e n i a 88. von Ehrenstein O, von Mutius E, Illi S, Baumann L, Böhm O, von Kries R. Reduced risk of hay fever and asthma among children of farmers. Clin Exp Allergy 2000; 30:187-93. 89. Riedler J, Eder W, Oberfeld G, Schreuer M. Austrian children living on a farm have less hay fever, asthma and aller- gic sensitisation. Clin Exp Allergy 2000; 30:194-200. 90. Pullan CR, Hey EN. Wheezing, asthma and pulmonary dysfunction 10 years after infection with respiratory syncitial virus. Br Med J 1982; 284:1665-9. 91. Murray M, Webb MMS, O’Callaghan C, Swarbrick AS, Milner DA. Respiratory status and allergy after bronchiolitis. Arch Dis Child 1992; 67:482-7. 92. Sigurs N, Bjarnason R, Sigurbergsson F, Kjellman B. Respiratory syncitial virus bronchiolitis in infancy is an impor- tant risk factor for asthma and allergy at age 7. Am J Respir Crit Care Med 2000; 161:1501-7. 93. Stein RT, Sherril D, Morgan WJ, Holberg CJ, Halonen M, Taussig LM, et al. Respiratory syncitial virus in early life and risk of wheeze and allergy by age 13 yr. Lancet 1999; 354:541-5. 94. Hahn DL, Dodge RW, Golubjatnikiv R. Association of C. pneumoniae (strain TWAR) infection with wheezing, asth- matic bronchitis and adult-onset asthma. JAMA 1991; 266:2225-30. 95. Hahn DL, McDonald R. Can acute Chlamydia pneumoniae respiratory tract infection initiate chronic asthma?. Ann 96. Routes JM, Nelson HS, Noda JA, Simon FT. Lack of correlation between Chlamydia pneumoniae antibody titers and adult onset asthma. J Allergy Clin Immunol 2000; 105:391-2. 97. Holgate ST, Davies DE, Puddicombe S, Richter A, Lackie P, Lordan J, and Howarth P. Mechanisms of airway epithelial damage: epithelial-mesenchymal interactions in the pathogenesis of asthma. Eur Respir J 2003 22: 24S-29S. 98. Barnes PJ. Pathophysiology of asthma. En: Asthma European Respiratory Monograph, Volume 8, Monograph 23. 2003;84-113 . 99. Elias JA, Lee CG, Zheng T, Ma B, Homer RJ, Zhu Z. New insights into the pathogenesis of asthma. J Clin Invest. 2003;111:291-7. 100. Holt PG, Stumbles PA. Regulation of immunologic homeostasis in peripheral tissues by dendritic cells: the respira- tory tract as a paradigm. J Allergy Clin Immunol. 2000;105:421-9. 101. Lambrecht BN, De Veerman M, Coyle AJ, Gutierrez-Ramos JC, Thielemans K, Pauwels RA. Myeloid dendritic cells induce Th2 responses to inhaled antigen, leading to eosinophilic airway inflammation. J Clin Invest. 2000;106:551-9. 102. Prescott SL, Macaubas C, Smallacombe T, Holt BJ, Sly PD, Holt PG. Development of allergen-specific T-cell memo- ry in atopic and normal children. Lancet. 1999;353:196-200. 103. Larche M, Robinson DS, Kay AB. The role of T lymphocytes in the pathogenesis of asthma.J Allergy Clin Immunol. 2003;111:450-63 104. Robinson DS. The role of the mast cell in asthma: induction of airway hyperresponsiveness by interaction with smooth muscle?. J Allergy Clin Immunol. 2004;114:58-65. 105. Brightling CE, Bradding P, Symon FA, Holgate ST, Wardlaw AJ, Pavord ID. Mast-cell infiltration of airway smooth muscle in asthma. N Engl J Med. 2002;346:1699-705 106. Boyce JA. Mast cells: beyond IgE. J Allergy Clin Immunol 2003;111:24-33. 107. Akers IA, Parsons M, Hill MR, Hollenberg MD, Sanjar S, Laurent GJ, McAnulty RJ. Mast cell tryptase stimulates human lung fibroblast proliferation via protease-activated receptor-2. Am J Physiol Lung Cell Mol Physiol. 2000;278:L193-201. 108. Leckie MJ, ten Brinke A, Khan J, Diamant Z, O’Connor BJ, Walls CM, Mathur AK, Cowley HC, Chung KF, Djukanovic 65 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 66 R, Hansel TT, Holgate ST, Sterk PJ, Barnes PJ. Effects of an interleukin-5 blocking monoclonal antibody on eosinophils, airway hyper-responsiveness, and the late asthmatic response. Lancet. 2000;356:2144-8. 109. Gleich GJ. Mechanisms of eosinophil-associated inflammation. J Allergy Clin Immunol. 2000;105:651-63. 110. Holgate ST, Lackie P, Wilson S, Roche W, Davies D. Bronchial epithelium as a key regulator of airway allergen sen- sitization and remodeling in asthma. Am J Respir Crit Care Med. 2000;162(3 Pt 2):S113-7. 111. Sears MR, Burrows B, Flannery EM, Herbison GP, Hewitt CJ, Holdaway MD. Relation between airway responsiveness and serum IgE in children with asthma and in apparently normal children. N Engl J Med. 1991;325:1067-71. 112. Beeh KM, Ksoll M, Buhl R. Elevation of total serum immunoglobulin E is associated with asthma in nonallergic indi- viduals. Eur Respir J. 2000;16609-14. 113. van der Heijden FL, Joost van Neerven RJ, van Katwijk M, Bos JD, Kapsenberg ML. Serum-IgE-facilitated allergen presentation in atopic disease. J Immunol. 1993;150:3643-50. 114. Saini SS, MacGlashan DW Jr, Sterbinsky SA, Togias A, Adelman DC, Lichtenstein LM, Bochner BS. Down-regulation of human basophil IgE and FC epsilon RI alpha surface densities and mediator release by anti-IgE-infusions is reversible in vitro and in vivo. J Immunol. 1999;162:5624-30. 115. Bousquet J, Cabrera P, Berkman N, Buhl R, Holgate S, Wenzel S, Fox H,Hedgecock S, Blogg M, Cioppa GD. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy. 2005;60:302-8. 116. Djukanovic R, Wilson SJ, Kraft M, Jarjour NN, Steel M, Chung KF, Bao W,Fowler-Taylor A, Matthews J, Busse WW, Holgate ST, Fahy JV. Effects of treatment with anti-immunoglobulin E antibody omalizumab on airway inflammation in allergic asthma. Am J Respir Crit Care Med. 2004;170:583-93. 117. MacGlashan DW Jr, Bochner BS, Adelman DC, Jardieu PM, Togias A, :1438-45. 66 118 Jeffery PK, Wardlaw AJ, Nelson FC, Collins JV, Kay AB. Bronchial biopsies in asthma: an ultraestructural, quantitative study and correlation with hypereactivity. Am Rev Respir Dis 1989;140:1745-53. 119 Ohashi Y, Motojima S, Fukuda T, Makino S. Airways hyperresponsiveness, increased intracellular spaces of bronchial epithelium, and increased infiltration of eosinophils and lymphocytes in bronchial mucosa in asthma. Am Rev Respir Dis 1992;145:1469-76. 120 Berkman N, Robichaud A, Krishnan VL, Roesems G, Robbins R, Jose PJ, Barnes PJ, Chung KF. Expression of RANTES in human airway epithelial cells: effect of corticosteroids and interleukin-4, -10 and -13. Immunology. 1996;87:599-603. 121 Roche WR, Beasley R, Williams JH, Holgate ST. Subepithelial fibrosis in the bronchi of asthmatics. Lancet 1989;1 (8637):520-4. 122 Ollerenshaw SL, Woolcock AJ. Characteristics of inflammation in biopsies from large aiways of subjects with asthma and subjects with chronic airflow limitation. Am Rev Respir Dis 1992;145:922-7. 123 Li X, Wilson JW. Increased vascularity of the bronchial mucosa in mild asthma. Am J Respir Crit Care Med. 1997;156:229-33. 124 Bousquet J, Jeffery PK, Busse WW, Johnsosn M, Vignola AM. Asthma. From bronchoconstriction to airways inflammation and remodeling. Am J Respir Crit Care Med 2000;161:1720-45. 125 Vrugt B, Wilson S, Bron A, Holgate ST, Djukanovic R, Aalbers R. Bronchial angiogenesis in severe glucocorticoiddependent asthma. Eur Respir J 2000;15:1014-21. 126 Shimura S, Andoh Y, Haraguchi M, Shirato K. Continuity of airway goblet cells and intraluminal mucus in the airways of patients with bronchial asthma. Eur Respir J. 1996;9:1395-401. 127 Sheehan JK, Richardson PS, Fung DC, Howard M, Thornton DJ. Analysis of respiratory mucus glycoproteins in asthma: a detailed study from a patient who died in status asthmaticus. Am J Respir Cell Mol Biol. 1995;13:748-56. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 67 E t i o p a t o g e n i a 128 Saetta M, Turato G. Airway pathology in asthma. Eur Respir J Suppl. 2001;34:18s-23s. 129 Hogg JC. Pathology of asthma. J Allergy Clin Immunol. 1993;9:21-5. 130 Wiggs BR, Moreno R, Hogg JC, Hilliam C, Pare PD. A model of the mechanics of airway narrowing. J Appl Physiol. 1990;69:849-60. 131 Redington AE, Roche WR, Madden J, Frew AJ, Djukanovic R, Holgate ST, Howarth PH. Basic fibroblast growth factor in asthma: measurement in bronchoalveolar lavage fluid basally and following allergen challenge. J Allergy Clin Immunol. 2001;107:384-7. 132 Brewster CE, Howarth PH, Djukanovic R, Wilson J, Holgate ST, Roche WR. Myofibroblasts and subepithelial fibrosis in bronchial asthma. Am J Respir Cell Mol Biol. 1990;3:507-11. 133 Laitinen A, Altraja A, Kampe M, Linden M, Virtanen I, Laitinen LA. Tenascin is increased in airway basement membrane of asthmatics and decreased by an inhaled steroid. Am J Respir Crit Care Med. 1997;156:951-8. 134 Wilson JW, Li X. The measurement of reticular basement membrane and submucosal collagen in the asthmatic airway. Clin Exp Allergy. 1997;27:363-71. 135 Fredberg JJ. Airway smooth muscle in asthma: flirting with disaster. Eur Respir J. 1998;12:1252-6. 67 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 68 CUESTIONARIO 1. Entre los siguientes factores de riesgo, ¿cuál es el que mayor asociación tiene con la presencia de asma? a) Tabaquismo b) Inhalación de gases tóxicos c) Atopia d) Bronquiolitis en el primer año de vida e) Lactancia artificial 2. Aparte de las enfermedades atópicas, el patrón inmunológico TH2 se ha relacionado con: a) Embarazadas b) Enfermedades parasitarias c) Enfermedades autoinmunes d) Colitis ulcerosa e) A y B son correctas 3. El factor prenatal que mayor relación tiene con el asma es: a) Rubeóla materna b) Anoxia fetal pasajera c) Enfermedad vírica materna d) Tabaquismo materno e) Embarazo gemelar 4. ¿Cuál de las siguientes condiciones se considera protectora del asma en el periodo postnatal?: a) Dermatitis atópica del recién nacido b) Retraso en la colonización intestinal c) Prematuridad d) Índice de Apgar superior a 8 e) Lactancia materna 68 5. En asmáticos jóvenes la mejor técnica para relacionar su enfermedad con la atopia es: a) Determinación de IgE total b) Recuento de eosinófilos en sangre c) Pruebas alérgicas cutáneas d) Óxido nítrico exhalado e) Indistintamente a y c 6. ¿Cuál de los siguientes hongos de ambiente se ha relacionado con el asma?: a) Mucor sp. b) Penicillium sp. c) Aspergillus sp. d) Cladosporium sp. e) Alternaria sp. 7. Entre el cojunto de niños sensibilizados a un alergeno relacionado al asma, desarrollarán la enfermedad: a) Dos tercios ellos b) La mitad de ellos c) Un tercio d) Menos del 10% e) Los estudios son muy dispares 8. La polución medio ambiental del aire exterior se relaciona con: a) Mayor prevalencia del asma b) Agudización del asma c) Menor sensibilización alergénica d) Protección frente a bronquitis comunes e) A y B son correctas 9. Entre los alergenos relacionados con el asma los de mayor relevancia se asocian a: a) Ácaros del polvo doméstico b) Pólenes de gramíneas c) Hongos de ambiente d) Animales domésticos e) Sustancias ocupacionales C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 69 E t i o p a t o g e n i a 10. La ca a) b) c) d) e) 11. a) b) c) d) e) teoría acerca de que el asma se produce como un trastorno primario del aparato respiratorio, impliuna relación patológica entre: Mastocitos y linfocitos B Eosinófilos y linfocitos TH2 Células epiteliales y fibroblastos Endotelio vascular y moléculas de adhesión Células dendríticas y eosinófilos En el asma las células dendríticas juegan un papel relevante en: La pérdida epitelial La presentación de antígenos La broncoconstricción La vasodilatación La deposición de colágeno en la pared bronquial 12. Entre las siguientes interleucinas cuál es la que mejor se relaciona con el patrón de secreción de los linfocitos TH1: a) IL-2 b) IL-4 c) IL-5 d) IL-9 e) IL-10 13. La producción de IgE la realizan los: a) Linfocitos TH1 b) Linfocitos TH2 c) Eosinófilos d) Mastocitos e) Linfocitos B 14.La interleucina que mayor papel juega en la atracción y supervivencia de los eosinófilos en el asma es: a) IL-2 a) IL-4 a) IL-5 a) IL-9 a) IL-10 15. ¿Cuál de las siguientes interleucinas regula la producción de IgE?: a) IL-2 a) IL-4 a) IL-5 a) IL-9 a) IL-10 16. La a) b) c) d) e) lámina o membrana reticular en el bronquio del asmático: Se relaciona con la actividad y número de los fibroblastos Se forma sobre la mucosa por la organización del exudado bronquial Al igual que en la EPOC se constituye por colágeno tipo V y VII Se constituye por células caliciformes que colonizan las áreas de pérdida epitelial B y D son correctas 17. Entre los siguientes mediadores de la inflamación señalar cuál tiene efecto tóxico para el epitelio bronquial: a) Leucotrienos b) Histamina c) Proteína básica mayor del eosinófilo d) Prostanoides e) Factor activador de las plaquetas 18. La a) b) c) d) e) triptasa es un marcador de actividad de: Células dendríticas Eosinófilos Mastocitos Linfocitos TH2 Fibroblastos 69 Asma I Fasc culo 1 DEF.qxd 19. En a) b) c) d) e) 30/05/2005 13:14 PÆgina 70 el proceso de sensibilización alergénica, las células dendríticas emigran hacia: El bazo Los capilares sanguíneos Las agrupaciones linfáticas de la pared bronquial Los ganglios linfáticos regionales Las respuestas c y d son correctas 20. Los receptores de alta afinidad Fc_RI se relacionan con: a) IgE b) Leucotrienos c) Histamina d) Serotonina e) Prostanoides 70 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 71 E t i o p a t o g e n i a Respuestas fascículo 1, capítulo IV (Etiopatogenia) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 71 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 13.- a b c d e 14.- a b c d e Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 72 15.- a b c d e 16.- a b c d e 17.- a b c d e 18.- a b c d e 19.- a b c d e 20.- a b c d e 72 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 73 E t i o p a t o g e n i a 73 Asma I Fasc culo 1 DEF.qxd 30/05/2005 13:14 PÆgina 74 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 1 Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 10:56 PÆgina 2 Curso de f.m.c. SEPAR con el patrocinio GlaxoSmithKline 2 Edita Depósito legal: MPrinted in Spain Imprime: José San Germán Impresor S.L. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 3 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a Capítulo V DETERMINANTES GENÉTICOS DEL ASMA. Luis García-Marcos Álvarez Instituto de Salud Respiratoria. Universidad de Murcia. Juan José Tellería Orriols Laboratorio de Pediatría, Universidad de Valladolid e Instituto de Biología y Genética Molecular (IBGM). Universidad de Valladolid - CSIC. Manuel Sánchez-Solís de Querol Instituto de Salud Respiratoria, Universidad de Murcia y Servicio de Pediatría, Hospital Universitario “Virgen de Arrixaca”. Murcia. Correspondencia: Luis García-Marcos Álvarez Instituto de Salud Respiratoria Pabellón Docente HUVA Campus Ciencias de la Salud. 30120 El Palmar. Murcia. Correo electrónico: [email protected] Tf. 96 839 81 29 / Fax: 96 839 81 78 3 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 4 4 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 5 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a DETERMINANTES GENÉTICOS DEL ASMA 1. El asma, una enfermedad compleja Desde el punto de vista funcional el asma se caracteriza por una obstrucción bronquial que dificulta el paso de aire en los pulmones, que es variable y reversible, al menos en parte. La obstrucción es debida a diversos mecanismos entre los que se destaca la contracción del músculo liso y la inflamación bronquial. Estos dos componentes que gobiernan el acontecer clínico de la enfermedad y preceden en el tiempo a otros acontecimientos -como el remodelado de la arquitectura bronquial- que determinan alteraciones más permanentes, dependen en mucha medida del funcionamiento de sistema inmunológico. La complejidad de los mecanismos inmunológicos que pueden dar lugar a un asma clínico es inmensa. No puede parecer extraño, por tanto, que se hayan asociado a esta enfermedad un gran número de genes y que la replicación de los estudios de la genética del asma en diferentes poblaciones no sea tan fácil como se desearía. Además, sólo determinado ambiente podría revelar genes de susceptibilidad que, en ausencia de éste no se mostrarían ya que no se produciría clínica. Otra serie de consideraciones de tipo metodológico (como la selección de la muestra o su estructura) o estadístico (la estimación de la significación o la potencia del estudio) hacen que dicha replicación sea aún más difícil. La definición del fenotipo de asma (los criterios de selección del llamado caso índice) es el primero de los problemas. clínicos, usar subfenotipos graves, establecer una edad de comienzo y estudiar únicamente los individuos con antecedentes familiares de asma. Además, otros fenotipos que se pueden utilizar son aquellos con criterios definidos por la progresión de la enfermedad, la historia natural4, y la respuesta al tratamiento2-5. Los fenotipos intermedios son aquellos que utilizan marcadores cuantitativos (que no constituyen la enfermedad, pero son rasgos que suelen acompañarla). En el caso del asma, se han usado la hiperreactividad bronquial6, el volumen espirado en el primer segundo (FEV1)7,8, la variabilidad del flujo espiratorio máximo (PEFR), la reversibilidad a un broncodilatador4,7, la inmunoglobulina E (IgE) total9, la IgE específica10,11, el prick-test12 y los eosinófilos10-13. Muchos estudios exploran varios de estos parámetros a la vez7,8,14. Una forma de combinar varias características para perfilar mejor el fenotipo de asma es utilizar algoritmos que permiten una mejor clasificación de la población en asmáticos y controles. A veces este método es mejor que el propio diagnóstico de la enfermedad, debido a que, en general, el asma suele estar infradiagnosticada. 3. La heredabilidad del asma: estudios epidemiológicos y familiares 2. Delimitación del fenotipo El factor determinante clave para poder desarrollar cualquier tipo de estudio orientado a identificar los factores genéticos relacionados con la heredabilidad de un rasgo es la delimitación precisa del fenotipo a estudiar. Se han propuesto varias formas de concretar mejor el fenotipo asmático1 para intentar estrechar la búsqueda genética en esta enfermedad: usar subfenotipos El hecho de que el padre o la madre o ambos sufra de asma es un factor de riesgo de que la enfermedad la padezca el hijo. Esto es un dato perfectamente conocido, aunque parece que este riesgo es distinto cuando el asma es atópico o cuando no es atópico: en niños españoles de 10 años, el riesgo de asma atópico se multiplica por más de dos cuando el padre, la madre o ambos son asmáticos15. Este incremento del riesgo no hace más que mostrar que en el asma existe una heredabilidad de la enfermedad. Dicha heredabilidad se cifra entre un 36% y un 79%16-27 según los 5 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 6 estudios realizados en gemelos. Por contraste, estos datos ponen de manifiesto que al menos un 30% de la prevalencia del asma en una determinada población, en un momento dado, se debe a factores ambientales. Sólo un trabajo ha evaluado la influencia de la cigosidad y del ambiente compartido y el no compartido en gemelos mono y dicigóticos. El ambiente compartido no tuvo una gran influencia en la existencia de asma. Los autores concluyeron que existe un impacto considerable de los genes, que es aditivo, pero que también hay una parte sustancial del asma que se debe a un efecto del ambiente no-compartido26. Una vez conocido que existe una heredabilidad del asma, la genética clásica intenta comparar el patrón de esta herencia con los patrones conocidos, tanto de herencia monogénica (dominante, recesiva o ligada al sexo) como poligénica. A esta comparación se le conoce como estudio de segregación, es decir estudio de cómo el asma se transmite a lo largo de árboles genealógicos en distintas familias. Los estudios de este tipo realizados hasta el momento no han sido 6 concluyentes y la forma de herencia del asma sigue siendo un enigma, y los últimos datos encuentran modelos compatibles con un gen principal (bien sea dominante o recesivo) o con un modelo multifactorial (varios genes interaccionando con el ambiente y entre ellos) dependiendo del fenotipo intermedio utilizado28-41. Recientemente se ha sugerido que los niveles de IgE, los eosinófilos sanguíneos y la hiperrespuesta bronquial están codificados por genes distintos42. 4. Estrategias generales de la genética molecular en la búsqueda de genes relacionados con el asma La metodología genética descrita en el apartado anterior es fundamentalmente una genética clásica, ayudada en todo caso por programas informáticos. Sin embargo, los grandes avances actuales en el campo Figura 1. Mapa del cromosoma 6. A la izquierda el mapa físico con las clásicas bandas y su numeración a partir del centrómero. A la derecha el mapa genético con los marcadores y la distancia entre ellos en centimorgans (cM). Obsérvese que la distancia entre marcadores es mayor en el cromosoma de la mujer que en el del varón. En algunos casos (HLA, por ejemplo) se puede establecer una relación entre el mapa físico y el genético. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 7 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a de la genética vienen de la mano de la genética molecular. Este tipo de enfoque genético permite estudiar los genes relacionados con las enfermedades, en este caso con el asma, de dos maneras distintas: la primera estrategia busca variaciones en un gen relacionado con un mediador conocido de la enfermedad. La segunda estrategia consiste en estudiar la variabilidad del genoma, esto es, polimorfismos contenida tanto en genes como en regiones genómicas cuya función se desconoce y asociarla a la enfermedad. Para este tipo de estudios no es preciso conocer a priori qué función tiene la región o el gen que resulta relacionado con el fenotipo estudiado (en nuestro caso el asma); este es el caso del gen ADAM 33 relacionado con el asma hace unos tres años43. Al primer método -fácilmente comprensiblese le denomina búsqueda por genes candidatos; al segundo se le conoce como búsqueda amplia del genoma. Esta búsqueda se basa en la existencia de polimorfismos genéticos que son zonas variables del genoma sin repercusión fenotípica conocida y que se transmiten a la descendencia (segregan) junto con los genes cercanos. Esta segregación conjunta entre los polimorfismos y los genes cercanos ligados al fenotipo estudiado se identifican mediante estudios de ligamiento (figura 1). la vía aérea. Estos hallazgos sugieren que las variantes de la proteína ADAM33 puede tener un impacto considerable sobre la arquitectura pulmonar. Por otra parte y teniendo en cuenta que otras proteínas del grupo de las ADAM (acrónimo de "A Disintegrin And Metalloprotease") como las ADAM10 y 17 interaccionan con citoquinas inflamatorias, se especula con que ADAM33 tenga también efectos moduladores a este nivel44. Por medio de estos dos métodos se llega a localizar zonas u áreas (a veces conteniendo multitud de genes) que pueden tener relación con la enfermedad en estudio. Sin embargo, para localizar el gen concreto que tiene relación con la enfermedad se emplea una técnica conocida como clonación posicional. El segundo gen localizado por clonación posicional es un locus relacionado con los niveles totales de IgE y que se localizó en 13q1448. A diferencia de ADAM33 la región 13q14 se ha relacionado con el asma y la IgE sérica en muchos estudios41,49,50. Esta inmunoglobulina y sus receptores han sido elegidos en muchos estudios para las búsquedas por genes candidatos. Los investigadores del estudio de clonación posicional localizaron un gen (PHF11) que parece el reponsable máximo de la asociación con los niveles de IgE, al menos en esa región del genoma. De hecho, este gen es responsable del 11.5% de la variación de los niveles de IgE en el suero, y tres polimorfismos en este gen son los responsables de la mitad de la mencionada variación. Los hallazgos de este estudio han sido replicados posteriormente en otras poblaciones en Australia y Gran Bretaña51. 5. Genes relacionados con el asma: clonación posicional Recientemente se han descrito tres búsquedas por clonación posicional relacionadas con el asma. Los genes son los siguientes: 4.1.1 ADAM33 El gen conocido como ADAM33 se describió en 2002 por un grupo holandés y se asoció al asma y a la hiperreactividad bronquial43. Este grupo realizó una búsqueda amplia del genoma en 460 familias caucásicas e identificó un locus en el la región 20p13 del cromosoma 20 que mostraba ligamiento con los fenotipos citados. Aunque esta región contenía más de 40 genes, una búsqueda más fina les llevó hasta el gen ADAM33. La proteína codificada por este gen es una metaloproteinasa (conocida también por ADAM33) se expresa e muchos tejidos (incluyendo el pulmón) y de forma especial lo hace en las células musculares lisas y en los fribroblastos pulmonares, dos tipos de células relacionadas con el remodelado de Desafortunadamente, estos resultados no han podido ser replicados todavía y el estudio adolece de algunos defectos metodológicos que podrían explicar en parte sus resultados. Al menos dos estudios posteriores lo han intentado con resultados dispares, no encontrándose asociación alguna de este gen con el asma en una población mejicana y puertorriqueña45,46. Un análisis reciente de todas las poblaciones estudiadas hasta el momento sugiere que, aunque sobreestimada su influencia en el primer estudio, el gen ADAM33 sí tiene una relación con el asma, y que el polimorfismo ST+7 podría ser el responsable de un exceso de unos 50.000 casos de asma en la población de Inglaterra47. 4.1.2 PHF11 El gen PHF11 codifica una proteína (NY-REN-34) con dos elongaciones que contienen zinc. Este tipo de estructuras conocidas como "dedos de zinc" suelen ser reguladores de otros genes, lo que sugiere que este gen tiene un papel en la regulación de la transcripción de otros genes. PHF-11 se expresa en numerosos tejidos, pero de forma especial en tejidos relacionados con la regulación de la inmunidad. Incluso los autores del estudio original identificaron algunas isoformas que se expresan únicamente en el pulmón y en los leucocitos. Este gen no sólo se ha relacionado con las concentraciones de IgE sino también con las de IgM. Además se expresa en gran medida en los linfocitos B. Por ello se cree que debe tener un papel importante en la regulación de la síntesis de inmunoglobulinas. Recientemente se ha descrito una asocia- 7 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 8 ción entre algunos polimorfismos de este gen y la dermatitis atópica en niños australianos52. 6. Genes relacionados con el asma: 4.1.3 DPP10 áreas candidatas y búsquedas amplias Los polimorfismos en el gen de la interlequina 1 (IL1) se han asociado con el asma, aunque no de forma muy consistente53,54. Sí ha sido sin embargo consistente la asociación de la región genómica en que se encuentra el gen de la IL1 (2q14-q32) con el asma55,56. Recientemente se ha perfilado mejor esta zona por métodos de clonación posicional y se ha descubierto un nuevo gen, que codifica la proteína DPP1057 (dimetil-dipeptidasa 10). Se trata de una serin-proteasa similar a la DPP4, un enzima expresado ampliamente, que juega un papel crucial en el procesamiento de la quimioquinas del sistema inmunológico innato (inespecífico). Recientemente se ha relacionado la proteína DPP10 con la modulación de los canales de potasio58 que tienen un papel en la regulación del tono del músculo liso bronquial59. del genoma Hay un gran número de áreas genómicas relacionadas con el asma que se han descrito bien a partir de la localización del gen de una proteína implicada en la fisiopatología del asma (genes candidatos), bien a partir de búsquedas amplias del genoma. Se han encontrado áreas o genes relacionados con el asma en los cromosomas 1, 2, 5, 6, 7, 11, 13, 14 y 20. Las áreas concretas y sus funciones se recogen en la tabla I. Tienen un especial interés los genes relacionados con el estrés oxidativo por su relación con la lesión inflamatoria que es crucial en el fenotipo asmático. Dentro de los genes que codifican la glutation S-transferasa o GST (un enzima crucial para la reparación de las lesio- Tabla I. Principales regiones y genes relacionados con el asma 8 Región Gen Función 1p31 CLCA1 Canal del calcio activado por cloruros 1q32 A1AR Receptor de la adenosina (activación de monolitos y neutrófilos) 2q13 IL-1 Interleuquina 1 2q14 DPP10 Dimetil-dipeptidasa 5q34 IL-4, 5, 9, 13 Interleuquinas proinflamatorias 5q34 GM-CSF Factor estimulador de las colonias de granulocitos y macrófagos 6p21 HLA Presentación de antígenos 6p21 TNF-α y β Factor de necrosis tumoral 7p14 GPRA Receptor conjugado de la proteína G para la susceptibilidad al asma 7p14 TCRG Receptor gamma del linfocito T 7q36 eNOS Sintetasa del óxido nítrico endotelial 11q13 FcER1ß Receptor IgE alta afinidad 11q13 GSTP1 Glutatión S-transferasa 12q15 IFNG Interferón gamma 12q24 NOS1 Sintetasa 1 del óxido nítrico 13q14 PHF11 Proteína NY-REN-34 relacionada con la síntesis de IgE 14q22 PTGDR Receptor de la prostaglandina 2 (mastocitos y eosinófilos) 20p13 ADAM33 Metaloproteinasa C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 9 D e t e r m i n a n t e s nes producidas por los radicales superóxido), el gen GSTP1, localizado en 11q13, se expresa de forma muy intensa en el pulmón, por lo que es un gen candidato muy atractivo60. En poblaciones caucásicas un determinado polimorfismo de este gen es protector frente al fenotipo asmático de hiperreactividad bronquial y atopia en adultos61 y de forma particular frente al asma por isocianatos62. Además, las variaciones de este gen parecen influir en la susceptibilidad a las infecciones respiratorias en los niños63, al crecimiento pulmonar64 y a la hiperreactividad de la vía aérea65. 7. Farmacogenética del asma La investigación de los polimorfismos relacionados con el tratamiento del asma está aún dando sus primeros pasos y, hasta el momento no muchos de ellos reúnen las condiciones enumeradas anteriormente. Por ejemplo, la sustitución del aminoácido treonina por isoleucina en la posición 164 del receptor β2 adrenérgico (TreIle 164) es importante, pero poco frecuente. Los estudios in vitro demuestran que la variante Ile 164 tiene un acoplamiento muy reducido a los fármacos adrenérgicos y es predecible que los individuos homocigotos tengan un respuesta reducida a estos fármacos. Sin embargo, la frecuencia de este polimorfismo en la población caucásica es sólo del 3%66, lo que resta g e n é t i c o s d e l a s m a importancia a este polimorfismo. Por el contrario, el polimorfismo arginina-glicina (Arg-Gly) 16 del receptor β2 es bastante común en la población general66. La forma glicina 16 muestra, in vitro, una disminución de la sensibilidad a los agonistas 2, y dos estudios clínicos han puesto de manifiesto que los individuos homocigóticos para este polimorfismo muestran una respuesta reducida al tratamiento con estos fármacos67,68. Sin embargo, la cuestión principal de si existe o no una reducción de la sensibilidad a los agonistas β2 en estos individuos y si ésta es clínicamente importante es una cuestión que aún no se ha dilucidado. Otros polimorfismos que podrían tener importancia en cuanto al tratamiento del asma son los relacionados con la 5-lipooxigenasa, enzima crucial en la síntesis de leucotrienos. Parece que los individuos que detentan un determinado polimorfismo de una zona reguladora de la transcripción del gen de este enzima, que se relaciona con una baja capacidad de transcripción, muestran una disminución de la respuesta a los inhibidores de la 5-lipooxigenasa (zileuton)67,68. Sin embargo, no se sabe si este polimorfismo puede afectar a fármacos antagonistas competitivos de los leucotrienos como el montelukast o el zafirlukast. Aún existen otros polimorfismos relacionados con la farmacología que están comenzando a estudiarse, pero cuya repercusión es desconocida. La tabla II recoge los genes y los fármacos antiasmáticos a los que podrían afectar69-72. 9 Tabla II. Selección de genes cuyos polimorfismos pueden tener importancia farmacogenética Gen Localización Fármaco afectado Receptor β2 (ADBR2) 5q31.32 Agonistas β2 5-LOX (ALOX5) 10q11.12 Inhibidores de la 5-lipoxigenasa (zileuton), antagonistas CysLT1 (montelukast) Receptor M2 (CHRM2) 7q35.36 Antagonistas muscarínicos (bromuro ipratropio) Receptor M3 (CHRM3) 1q43.44 Antagonistas muscarínicos (bromuro ipratropio) GR (GRL) 5q31 Glucocorticoides PDE4A (PDE4A) 19p13.2 Teofilina PDE4D (PDE4D) 5q12 Teofilina CYP450 Varios Montelukast, salmeterol, budesonida, teofilina 5-LOX, 5 lipoxigenasa; CYP450, citocromo P450; GR, receptor de los glucocorticoides; PDE, fosfodiesterasa Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 10 8. Genes y medio ambiente Se han propuesto tres modelos para la interacción genes-ambiente73. Los estudios amplios del genoma han puesto de manifiesto que existen varios loci que contribuyen a la aparición del asma. Si, por ejemplo, existieran 5 genes mayores que contribuyeran a la aparición del asma y todo el mundo recibe la "dosis de ambiente" fija, entonces el riesgo de padecer asma está directamente relacionado con el número de genes mayores que contienen el/los polimorfismo(s) adecuados que una persona hereda. Este modelo no encaja con los estudios actuales (por ejemplo entre gemelos). En el segundo modelo existirían un número pequeño de individuos que tienen polimorfismos en los genes mayores de tal manera que si son (y sólo si son) expuestos a un estímulo ambiental desarrollarán con casi total certeza la enfermedad. El riesgo de sufrir asma queda aquí casi totalmente en manos del ambiente. Tampoco este modelo encaja con la información de que se dispone. Medio ambiente de la madre Lo más probable es que la interacción genesambiente sea una combinación de los dos modelos anteriores en el que exista un "efecto dosis" por parte de los genes y un efecto el mismo tipo por parte del ambiente. Acudiendo al ejemplo anterior en el que se suponía que el asma se debía a polimorfismos en cinco genes mayores, la dosis del ambiente necesaria para provocar la enfermedad sería menor si se tiene sólo un polimorfismo que si se tienen los cinco necesarios. Si no existe ni uno de los polimorfismos adecuados, un individuo no sufrirá asma, no importa cuan grande sea la dosis del ambiente. En la práctica, la mayoría de la gente tendría un número bajo o moderado de polimorfismos, lo que se observa tanto una contribución genética como ambiental. Por otro lado es también importante el momento en el que se recibe la dosis de ambiente. La "ventana de oportunidad" del período intraútero y neonatal pede tener una importancia crucial74 (figura 2). La interacción entre genes y ambiente puede tener una importancia particular en el asma profesional75. Genes maternos 10 Medio ambiente Intrauterino Medio ambiente Intrauterino Fenotipo inmune Neonatal Genes fetales Fenotipo inmune Neonatal Genes fetales Figura 2. Propuesta de interacción entre los genes y el ambiente para determinar el fenotipo de asma (adaptado de 76). El ambiente fetal y los genes conducen a un determinado fenotipo inmunológico en el recién nacido. La interacción posterior con el ambiente junto con la predisposición genética determina la aparición del asma. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 11 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a 9. Conclusiones El estudio de la genética del asma se ha visto dificultado por su complejidad y heterogeneidad. Con todo, se han realizado avances significativos: los estudios de clonación posicional tras búsquedas amplias del genoma han permitido conocer nuevos aspectos de la fisiopatología de la enfermedad (ADAM33, por ejemplo) y los estudios de áreas o genes candidatos, como en el caso del GSTP1 han confirmado la importancia de determinados mediadores. La mayoría de los estudios han planteado diseños para la búsqueda de un solo gen y la potencia de los mismos, por tanto, ha podido no ser adecuada para una enfermedad claramente poligénica. Esto explica en parte la discordancia de los resultados obtenidos hasta ahora. En el futuro son necesarios estudios más grandes con capacidad para detectar efectos genéticos moderados y un acuerdo más amplio sobre la definición del fenotipo asmático. 11 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 12 Bibliografía 1. Lander ES, Schork NJ. Genetic dissection of complex traits. Science 1994; 265: 2037-2048. 2. Drazen JM, Yandava CN, Dube L, Szczerback N, Hippensteel R, Pillari A et al. Pharmacogenetic association between ALOX5 promoter genotype and the response to anti-asthma treatment. Nat Genet 1999; 22: 168-170. 3. Panhuysen CI, Vonk JM, Koeter GH, Schouten JP, van Altena R, Bleecker ER et al. Adult patients may outgrow their asthma: a 25-year follow-up study. Am J Respir Crit Care Med 1997; 155: 1267-1272. 4. Ulrik CS, Kok-Jensen A. Different bronchodilating effect of salmeterol and formoterol in an adult asthmatic. Eur Respir J 1994; 7: 1003-1005. 5. Ulrik CS, Backer V. Nonreversible airflow obstruction in life-long nonsmokers with moderate to severe asthma. Eur Respir J 1999; 14: 892-896. 6. Van Eerdewegh P, Little RD, Dupuis J, Del Mastro RG, Falls K, Simon J et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness. Nature 2002; 418: 426-430. 7. Palmer LJ, Daniels SE, Rye PJ, Gibson NA, Tay GK, Cookson WO et al. Linkage of chromosome 5q and 11q gene mark- ers to asthma-associated quantitative traits in Australian children. Am J Respir Crit Care Med 1998; 158: 1825-1830. 8. Palmer LJ, Knuiman MW, Divitini ML, Burton PR, James AL, Bartholomew HC et al. Familial aggregation and heritabil- ity of adult lung function: results from the Busselton Health Study. Eur Respir J 2001; 17: 696-702. 9. Buckova D, Izakovicova HL, Vacha J. Polymorphism 4G/5G in the plasminogen activator inhibitor-1 (PAI-1) gene is associated with IgE-mediated allergic diseases and asthma in the Czech population. Allergy 2002; 57: 446-448. 10. Wjst M, Fischer G, Immervoll T, Jung M, Saar K, Rueschendorf F et al. A genome-wide search for linkage to asthma. German Asthma Genetics Group. Genomics 1999; 58: 1-8. 12 11. Wjst M. Specific IgE--one gene fits all? German Asthma Genetics Group. Clin Exp Allergy 1999; 29 Suppl 4: 5-10 12. Trabetti E, Patuzzo C, Malerba G, Galavotti R, Martinati LC, Boner AL et al. Association of a lymphotoxin alpha gene polymorphism and atopy in Italian families. J Med Genet 1999; 36: 323-325. 13. Bellibas SE. The effect of human calcitonin gene-related peptide on eosinophil chemotaxis in the rat airway. Peptides 1996; 17: 563-564. 14. Xu X, Niu T, Chen C, Wang B, Jin Y, Yang J et al. Association of airway responsiveness with asthma and persistent wheeze in a Chinese population. Chest 2001; 119: 691-700. 15. Garcia-Marcos L, Castro-Rodriguez JA, Morales Suarez-Varela M, Batlles Garido J, Garcia Hernandez G, Matinez Gimeno A et al. A different pattern of risk factors in atopic and non-atopic wheezing children 9-12 years-old. Pediatr Allergy Immunol 2005; (aceptado, en prensa). 16. Clarke JR, Jenkins MA, Hopper JL, Carlin JB, Mayne C, Clayton DG et al. Evidence for genetic associations between asthma, atopy, and bronchial hyperresponsiveness: a study of 8- to 18-yr-old twins. Am J Respir Crit Care Med 2000; 162: 2188-2193. 17. Duffy DL, Martin NG, Battistutta D, Hopper JL, Mathews JD. Genetics of asthma and hay fever in Australian twins. Am Rev Respir Dis 1990; 142: 1351-1358. 18. Edfors-Lubs ML. Allergy in 7000 twin pairs. Acta Allergol 1971; 26: 249-285. 19. Hanson B, McGue M, Roitman-Johnson B, Segal NL, Bouchard TJ, Jr., Blumenthal MN. Atopic disease and immunoglobulin E in twins reared apart and together. Am J Hum Genet 1991; 48: 873-879. 20. Harris JR, Magnus P, Samuelsen SO, Tambs K. No evidence for effects of family environment on asthma. A retro- spective study of Norwegian twins. Am J Respir Crit Care Med 1997; 156: 43-49. 21. Hopp RJ, Bewtra AK, Watt GD, Nair NM, Townley RG. Genetic analysis of allergic disease in twins. J Allergy Clin Immunol 1984; 73: 265-270. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:00 PÆgina 13 22. Huovinen E, Kaprio J, Laitinen LA, Koskenvuo M. Social predictors of adult asthma: a co-twin case-control study. Thorax 2001; 56: 234-236. 23. Koeppen-Schomerus G, Stevenson J, Plomin R. Genes and environment in asthma: a study of 4 year old twins. Arch Dis Child 2001; 85: 398-400. 24. Laitinen T, Rasanen M, Kaprio J, Koskenvuo M, Laitinen LA. Importance of genetic factors in adolescent asthma: a population-based twin-family study. Am J Respir Crit Care Med 1998; 157: 1073-1078. 25. Nieminen MM, Kaprio J, Koskenvuo M. A population-based study of bronchial asthma in adult twin pairs. Chest 1991; 100: 70-75. 26. Skadhauge LR, Christensen K, Kyvik KO, Sigsgaard T. Genetic and environmental influence on asthma: a popula- tion-based study of 11,688 Danish twin pairs. Eur Respir J 1999; 13: 8-14. 27. Strachan DP, Wong HJ, Spector TD. Concordance and interrelationship of atopic diseases and markers of allergic sensitization among adult female twins. J Allergy Clin Immunol 2001; 108: 901-907. 28. Genes for asthma? An analysis of the European Community Respiratory Health Survey. Am J Respir Crit Care Med 1997; 156: 1773-1780. 29. Amelung PJ, Postma DS, Xu J, Meyers DA, Bleecker ER. Exclusion of chromosome 11q and the FcepsilonRI-beta gene as aetiological factors in allergy and asthma in a population of Dutch asthmatic families. Clin Exp Allergy 1998; 28: 397-403. 30. Bleecker ER, Postma DS, Meyers DA. Genetic susceptibility to asthma in a changing environment. Ciba Found Symp 1997; 206: 90-99. 31. Chen Y, Schnell AH, Rennie DC, Elston RC, Lockinger LA, Dosman JA. Segregation analyses of asthma and respira- tory allergy: the Humboldt family study. Am J Med Genet 2001; 104: 23-30. 32. Holberg CJ, Elston RC, Halonen M, Wright AL, Taussig LM, Morgan WJ et al. Segregation analysis of physician-diag- nosed asthma in Hispanic and non-Hispanic white families. A recessive component? Am J Respir Crit Care Med 1996; 154: 144-150. 33. Holberg CJ, Morgan WJ, Wright AL, Martinez FD. Differences in familial segregation of FEV1 between asthmatic and nonasthmatic families. Role of a maternal component. Am J Respir Crit Care Med 1998; 158: 162-169. 34. Holberg CJ, Halonen M, Wright AL, Martinez FD. Familial aggregation and segregation analysis of eosinophil levels. Am J Respir Crit Care Med 1999; 160: 1604-1610. 35. Martinez FD, Holberg CJ. Segregation analysis of physician-diagnosed asthma in Hispanic and non-Hispanic white families. Clin Exp Allergy 1995; 25 Suppl 2: 68-70. 36. Sampogna F, Demenais F, Hochez J, Oryszczyn MP, Maccario J, Kauffmann F et al. Segregation analysis of IgE levels in 335 French families (EGEA) using different strategies to correct for the ascertainment through a correlated trait (asthma). Genet Epidemiol 2000; 18: 128-142. 37. Schnell AH, Palmer LJ, Elston RC. Segregation analysis of asthma and respiratory allergy in population-based sam- ples of families. Genet Epidemiol 2001; 21 Suppl 1: S30-S35. 38. Townley RG, Bewtra A, Wilson AF, Hopp RJ, Elston RC, Nair N et al. Segregation analysis of bronchial response to methacholine inhalation challenge in families with and without asthma. J Allergy Clin Immunol 1986; 77: 101-107. 39. Wang TN, Ko YC, Wang TH, Cheng LS, Lin YC. Segregation analysis of asthma: recessive major gene component for asthma in relation to history of atopic diseases. Am J Med Genet 2000; 93: 373-380. 40. Xu J, Levitt RC, Panhuysen CI, Postma DS, Taylor EW, Amelung PJ et al. Evidence for two unlinked loci regulating total serum IgE levels. Am J Hum Genet 1995; 57: 425-430. 41. Xu J, Postma DS, Howard TD, Koppelman GH, Zheng SL, Stine OC et al. Major genes regulating total serum immunoglobulin E levels in families with asthma. Am J Hum Genet 2000; 67: 1163-1173. 13 Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:00 PÆgina 14 42. Palmer LJ, Cookson WO, James AL, Musk AW, Burton PR. Gibbs sampling-based segregation analysis of asthma- associated quantitative traits in a population-based sample of nuclear families. Genet Epidemiol 2001; 20: 356-372. 43. Van Eerdewegh P, Little RD, Dupuis J, Del Mastro RG, Falls K, Simon J et al. Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness. Nature 2002; 418: 426-430. 44. Cookson W. A new gene for asthma: would you ADAM and Eve it? Trends Genet 2003; 19: 169-172. 45. Howard T, Postma D, Jongepier H, Moore W, Koppelman G, Zheng S et al. Association of a disintegrin and metallo- protease 33 (ADAM33) gene with asthma in ethnically diverse populations. J Allergy Clin Immunol 2003; 112: 717722. 46. Lind DL, Choudhry S, Ung N, Ziv E, Avila PC, Salari K et al. ADAM33 is not associated with asthma in Puerto Rican or Mexican populations. Am J Respir Crit Care Med 2003; 168: 1312-1316. 47. Blakey J, Halapi E, Bjornsdottir US, Wheatley A, Kristinsson S, Upmanyu R et al. Contribution of ADAM33 polymor- phisms to the population risk of asthma. Thorax 2005; 60: 274-276. 48. Zhang Y, Leaves NI, Anderson GG, Ponting CP, Broxholme J, Holt R et al. Positional cloning of a quantitative trait locus on chromosome 13q14 that influences immunoglobulin E levels and asthma. Nat Genet 2003; 34: 181-186. 49. Kimura K, Noguchi E, Shibasaki M, Arinami T, Yokouchi Y, Takeda K et al. Linkage and association of atopic asthma to markers on chromosome 13 in the Japanese population. Human Molecular Genetics 1999; 8: 1487-1490. 50. Koppelman GH, Stine OC, Xu J, Howard TD, Zheng SL, Kauffman HF et al. Genome-wide search for atopy suscepti- bility genes in Dutch families with asthma. J Allergy Clin Immunol 2002; 109: 498-506. 51. Weiss ST, Raby BA. Asthma genetics 2003. Human Molecular Genetics 2004; 13 Spec No 1: R83-R89. 52. Jang N, Stewart G, Jones G. Polymorphisms within the PHF11 gene at chromosome 13q14 are associated with child- hood atopic dermatitis. Genes Immun 2005; 6: 262-264. 14 53. Karjalainen J, Hulkkonen J, Pessi T, Huhtala H, Nieminen MM, Aromaa A et al. The IL1A genotype associates with atopy in nonasthmatic adults. J Allergy Clin Immunol 2002; 110: 429-434. 54. Pessi T, Karjalainen J, Hulkkonen J, Nieminen MM, Hurme M. A common IL-1 complex haplotype is associated with an increased risk of atopy. J Med Genet 2003; 40: e66- 55. Hizawa N, Freidhoff LR, Ehrlich E, Chiu YF, Duffy DL, Schou C et al. Genetic influences of chromosomes 5q31-q33 and 11q13 on specific IgE responsiveness to common inhaled allergens among African American families. Collaborative Study on the Genetics of Asthma (CSGA). J Allergy Clin Immunol 1998; 102: 449-453. 56. Wjst M, Fischer G, Immervoll T, Jung M, Saar K, Rueschendorf F et al. A genome-wide search for linkage to asthma. German Asthma Genetics Group. Genomics 1999; 58: 1-8. 57. Allen M, Heinzmann A, Noguchi E, Abecasis G, Broxholme J, Ponting CP et al. Positional cloning of a novel gene influ- encing asthma from chromosome 2q14. Nat Genet 2003; 35: 258-263. 58. Zagha E, Ozaita A, Chang SY, Nadal MS, Lin U, Saganich MJ et al. DPP10 modulates Kv4-mediated A-type potassi- um channels. J Biol Chem 2005; 280: 18853-18861. 59. Pelaia G, Gallelli L, Vatrella A, Grembiale RD, Maselli R, De Sarro GB et al. Potential role of potassium channel open- ers in the treatment of asthma and chronic obstructive pulmonary disease. Life Sci 2002; 70: 977-990. 60. Hayes JD, Strange RC. Potential contribution of the glutathione S-transferase supergene family to resistance to oxidative stress. Free Radic Res 1995; 22: 193-207. 61. Fryer AA, Bianco A, Hepple M, Jones PW, Strange RC, Spiteri MA. Polymorphism at the glutathione S-transferase GSTP1 locus. A new marker for bronchial hyperresponsiveness and asthma. Am J Respir Crit Care Med 2000; 161: 1437-1442. 62. Mapp CE, Fryer AA, De Marzo N, Pozzato V, Padoan M, Boschetto P et al. Glutathione S-transferase GSTP1 is a sus- ceptibility gene for occupational asthma induced by isocyanates. J Allergy Clin Immunol 2002; 109: 867-872. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:00 PÆgina 15 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a 63. Gilliland FD, Rappaport EB, Berhane K, Islam T, Dubeau L, Gauderman WJ et al. Effects of glutathione S-transferase P1, M1, and T1 on acute respiratory illness in school children. Am J Respir Crit Care Med 2002; 166: 346-351. 64. Gilliland FD, Gauderman WJ, Vora H, Rappaport E, Dubeau L. Effects of glutathione-S-transferase M1, T1, and P1 on childhood lung function growth. Am J Respir Crit Care Med 2002; 166: 710-716. 65. Child F, Lenney W, Clayton S, Davies S, Jones PW, Strange RC et al. Correction of bronchial challenge data for age and size may affect the results of genetic association studies in children. Pediatr Allergy Immunol 2003; 14: 193200. 66. Reihsaus E, Innis M, MacIntyre N, Liggett SB. Mutations in the gene encoding for the beta 2-adrenergic receptor in normal and asthmatic subjects. Am J Respir Cell Mol Biol 1993; 8: 334-339. 67. Martinez FD, Graves PE, Baldini M, Solomon S, Erickson R. Association between genetic polymorphisms of the beta2-adrenoceptor and response to albuterol in children with and without a history of wheezing. J Clin Invest 1997; 100: 3184-3188. 68. Tan S, Hall IP, Dewar J, Dow E, Lipworth B. Association between beta 2-adrenoceptor polymorphism and suscepti- bility to bronchodilator desensitisation in moderately severe stable asthmatics. Lancet 1997; 350: 995-999. 69. Fenech AG, Ebejer MJ, Felice AE, Ellul-Micallef R, Hall IP. Mutation screening of the muscarinic M(2) and M(3) recep- tor genes in normal and asthmatic subjects. Br J Pharmacol 2001; 133: 43-48. 70. Huizenga NA, Koper JW, de Lange P, Pols HA, Stolk RP, Burger H et al. A polymorphism in the glucocorticoid recep- tor gene may be associated with and increased sensitivity to glucocorticoids in vivo. J Clin Endocrinol Metab 1998; 83: 144-151. 71. Sanak M, Pierzchalska M, Bazan-Socha S, Szczeklik A. Enhanced expression of the leukotriene C(4) synthase due to overactive transcription of an allelic variant associated with aspirin-intolerant asthma. Am J Respir Cell Mol Biol 2000; 23: 290-296. 72. Silverman ES, Drazen JM. Genetic variations in the 5-lipoxygenase core promoter. Description and functional impli- cations. Am J Respir Crit Care Med 2000; 161: S77-S80. 73. Hall IP. The genetics of asthma. Candidate gene approaches: gene-environmental interactions. Clin Exp Allergy 1998; 28 Suppl 1: 74-76. 74. Tantisira KG, Weiss ST. Childhood infections and asthma: at the crossroads of the hygiene and Barker hypotheses. Respir Res 2001; 2: 324-327. 75. Mapp CE. Genetics and the occupational environment. Curr Opin Allergy Clin Immunol 2005; 5: 113-118. 76. Carroll W. Asthma genetics: pitfalls and triumphs. Paediatr Respir Rev 2005; 6: 68-74. 15 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 16 16 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:04 PÆgina 17 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a CUESTIONARIO 1. ¿Cuál de las siguientes razones hacen difícil la replicación de los estudios sobre genética del asma? a) La complejidad de sus mecanismos inmunológicos b) La influencia que tiene el ambiente en el desenmascaramiento de la enfermedad c) La selección de la muestra en el estudio d) La estructura de la muestra del estudio e) Todas las anteriores 2. Se cree que es atribuible al ambiente alrededor de ¿qué porcentaje de casos de asma? a) 10% b) 20% c) 30% d) 40% e) 50% 3. El gen ADAM33 sólo ha demostrado su relación con el asma en una población de raza: a) Hispana b) Caucásica c) Negra d) Asiática e) Esquimal 4. El gen ADAM 33 a) Se relaciona con la hiperreactividad bronquial b) Tiene función reguladora de otros genes c) Está relacionado con la IgE total y específica d) Codifica una metaloproteasa, probablemente relacionada con la remodelación bronquial e) A y D son ciertas 5. En relación con PHF11, señale la respuesta correcta a) Se expresa preferentemente en el músculo liso bronquial b) Tiene actividad moduladora de canales de potasio, regulando el tono del músculo liso bronquial c) Se encuentra en la región de la IL-1 d) La proteína posee estructuras en "dedos de Zinc" características de proteínas con actividad reguladora de la transcripción e) Participa en la remodelación bronquial 6. Señale la respuesta correcta a) Mediante la búsqueda amplia del genoma, se identifican áreas del genoma que contiene genes relacionados con el fenotipo estudiado b) Aunque no está claro el patrón de herencia del asma, la IgE, los eosinófilos en sangre y la hiperreactividad bronquial parecen estar codificados por los mismos genes c) Los genes candidatos se identifican entre los mediadores conocidos de la enfermedad d) A y C son ciertas e) Todas son ciertas 7. De a) b) c) d) e) entre los siguientes, qué gen se ha relacionado con la tasa de IgE ADAM33 PHF11 DPP10 IL-1 Todos 17 Asma I Fasc culo 2 Gon 05.qxd 8. Las a) b) c) d) e) 13/12/2005 11:04 PÆgina 18 variantes del gen ALOX5 influyen en la respuesta, ¿a qué fármacos? Glucocorticoides Teofilina b2-adrenérgicos Antagonistas muscarínicos (bromuro de ipratropio) Inhibidores de la 5-lipooxigenasa (zileuton) 9. Señale la respuesta incorrecta a) La presencia de asma en el padre, la madre o ambos, aumenta el riesgo de que el hijo también la padezca, siendo indiferente que el asma sea o no atópico. b) Los estudios de segregación encuentran modelos de heredabilidad compatibles con un efecto dosis por parte de los genes, y otro por parte del ambiente c) Lo que sabemos sobre la heredabilidad del asma, señala que si un individuo no tiene una cierta pre disposición a ser asmático, no lo será, independientemente de los factores del ambiente. d) El momento en que el individuo se expone a los factores medioambientales que favorecen el desarro llo de asma parece ser otro factor trascendente. e) Todas las respuestas son ciertas 10. Señale el fenotipo intermedio con el que se asoció originalmente el gen ADAM33 a) IgE total b) FEV1 c) Eosinófilos d) Hiperreactividad bronquial e) PEFR 18 11. Respecto al gen GSTP1, señale la afirmación falsa: a) Su proteína posee una estructura en dedos de Zinc con capacidad reguladora de la expresión de otros genes b) Se localiza en la región 11q13 c) Codifica la Glutation-S-Transferasa d) Se conoce un alelo protector frente al asma por isocianatos e) Sus variantes influyen en la susceptibilidad a infecciones respiratorias 12. Para llevar a cabo un estudio mediante el método de la búsqueda amplia del genoma, ¿cuál es a su juicio el aspecto más importante en su diseño? a) El tipo de marcadores genéticos b) La heterogeneidad genética de los marcadores c) La definición precisa del fenotipo a estudiar d) El método de análisis estadístico e) La distancia media entre marcadores 13. Señale el fenotipo intermedio con el que se asoció originalmente el gen ADAM33 a) IgE total b) FEV1 c) Eosinófilos d) Hiperreactividad bronquial e) PEFR 14. Respecto al gen GSTP1, señale la afirmación falsa: a) Su proteína posee una estructura en dedos de Zinc con capacidad reguladora de la expresión de otros genes b) Se localiza en la región 11q13 c) Codifica la Glutation-S-Transferasa d) Se conoce un alelo protector frente al asma por isocianatosl e) Sus variantes influyen en la susceptibilidad a infecciones respiratorias 15. ¿Qué polimorfismo del gen del receptor beta2 adregénico es el más frecuente en la población general? a) Tre-lle 164 b) Arg-Gly 16 c) Tre-lle 16 d) Arg-Gly 164 e) Tre-Arg 161 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:04 PÆgina 19 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a 16. Señale la afirmación incorrecta: a) Los fenotipos intermedios son rasgos cuantitativos b) La probabilidad de tener asma depende probablemente de genes que actúan con carácter aditivo c) Lo más probable es que para los factores ambientales, por el contrario, no exista efecto dosis d) Los fenotipos intermedios parecen ser codificados por genes diferentes e) La "ventana de oportunidad" del período intraútero y neonatal puede tener una importancia crucial en el riesgo individual de desarrollar asma 17. El polimorfismo ile 164 en el receptor beta2 adrenérgico tiene una frecuencia en la población general del: a) 80% b) 50% c) 30% d) 3% e) Éste no es un polimorfismo del receptor beta2 adrenérgico 18. Los genes relacionados con el citocromo p450 influyen en la respuesta del enfermo asmático a ¿qué fármacos? a) Montelukast b) Salmeterol c) Budesonida d) Teofilina e) Cualquiera de los anteriores 19. ¿Los polimorfismos de qué gen se han relacionados con las infecciones respiratorias en los niños? a) NOS1 b) GSTP1 c) PHF11 d) PTGDR e) ADAM33 20. ¿Qué polimorfismo del gen del receptor de beta2 adrenérgico se relaciona con una peor respuesta a estos fármacos? a) Glicina 16 b) Arginina 16 c) Treonina 16 d) Isoleucina 16 e) Treonina 164 19 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 20 20 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 21 D e t e r m i n a n t e s g e n é t i c o s d e l a s m a Respuestas fascículo 2, capítulo V (Determinantes genéticos del asma) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 21 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 22 13.- a b c d e 14.- a b c d e 15.- a b c d e 16.- a b c d e 17.- a b c d e 18.- a b c d e 19.- a b c d e 20.- a b c d e 22 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 23 23 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 24 24 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 25 D i e t a y A s m a Capítulo VI DIETA Y ASMA. Dra. María Teresa Bazús González Servicio de Neumología. Hospital Universitario Central de Asturias. 25 Correspondencia: Dra. María Teresa Bazús González Servicio de Neumología. Hospital Universitario Central de Asturias. C/ Doctor Bellmunt s/n. 33006 Oviedo. Correo electrónico: [email protected] Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 26 26 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 27 D i e t a y A s m a Resumen Introducción En las dos últimas décadas se ha formulado la hipótesis de que en la dieta occidental, la disminución de los antioxidantes (frutas y verduras), el descenso de PUFA omega 3 (aceite de pescado) y al mismo tiempo, el incremento de ácido graso poliinsaturado (PUFA) omega 6 (margarina y algunos aceites vegetales) han contribuido al incremento del asma y de las enfermedades atópicas. Disponemos de estudios que encuentran algunos efectos beneficiosos en el asma con la dieta de suplementos de antioxidantes y PUFA omega-3, pero sus resultados, que difieren parcialmente de la hipótesis mencionada, no logran una evidencia significativa, probablemente por las propias limitaciones de los diseños de los proyectos . Últimamente, el interés en este campo de investigación se ha incrementado, debido al hallazgo de que la ingesta de suplementos antioxidantes y PUFA omega-3, durante la gestación y los primeros años de vida, puede contribuir de manera significativa a disminuir el riesgo de padecer asma. La recomendación de una determinada dieta a los asmáticos debe estar basada más en la evidencia, que en suposiciones. En las últimas décadas, el incremento de la prevalencia del asma y de las enfermedades atópicas en los países industrializados es un hecho bien documentado. El cambio de dieta en los países occidentales durante éstos últimos años, es uno de los factores invocados como responsable del incremento de dicha prevalencia y muestra que la relación entre dieta y asma se ha incrementado sustancialmente. Este hecho se ha relacionado con el descenso de la ingesta de antioxidantes (ej; fruta y verduras) y el aumento del consumo de un tipo de grasas (ej; margarina). Ciertos trabajos han encontrado asociaciones en la presencia de atópia y asma con el incremento de la ingesta de margarina y grasas poliinsaturadas y con la reducción en la dieta de la cantidad de mantequilla y pescado1. Otros estudios epidemiológicos han evaluado los efectos beneficiosos que, sobre la función pulmonar, hiperreactividad bronquial (HRB), síntomas o uso de medicación de rescate, pudiera tener el aporte a la dieta de suplementos de vitaminas y aceite de pescado 2-3. El propósito de este capitulo es exponer las bases sobre las que se asienta la hipótesis de la relación de la dieta de antioxidantes y lípidos con el asma, así como la evidencia científica actual de los estudios epidemiológicos o de intervención y sus limitaciones y, finalmente las futuras áreas de investigación en este campo. No se aborda el apartado de los alimentos que desencadenan el asma. Abreviaturas usadas: AGEs: ácidos grasos esenciales DHA: ácido Docosahexanoide EPA: ácido eicosapentanoide HRB: hiperreactividad bronquial LTs: Leucotrienos Nutrientes y Alimentos Implicados PGEs: protaglandinas en la Etiología y/o Patogenia del Asma PUFAs: ácidos grasos poliinsaturados Tabla I. Nutrientes o grupos de nutrientes implicados en el asma Los nutrientes mas estrechamente implicados y estudiados en relación a la etiología y/o patogenia del asma y su mecanismo de acción o efecto potencial, pueden verse en la Tabla I. Nutrientes Actividad y Mecanismo o Efecto Potencial Vitaminas A, C y E Vitamina C Vitamina E Flavonas y flavonoides Magnesio Selenium Cobre y Zinc Acidos grasos n-3 Ácidos grasos poliinsaturados n-6 Sodio Antioxidante; protección contra la inflamación oxidante endógena y exógena. Inhibición de las prostaglandinas. Estabilización de la membrana, inhibición de la producción de la IgE. Antioxidante, estabilización de los mastocitos. Relajación del músculo liso, estabilización de los mastocitos. Co-factor antioxidante con la peroxidasa glutatiónica. Co-factor antioxidante con la superóxido dismutasa. Sustitución de leucotrienos, estabilización de las membranas frente a la inflamación. Incremento de producción de eicosanoides. Incremento de la contracción del músculo liso. 27 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 28 Hipótesis de los Mecanismos de Actuación de los Antioxidantes y Lípidos en el Asma 28 Seaton et al. en 19944 sugirieron que la modificación de la dieta en Occidente, que se había hecho más deficitaria en antioxidantes, había aumentado la susceptibilidad de la población para padecer asma y que, como consecuencia de ello, la prevalencia de la enfermedad había aumentado. Basaron esta afirmación en otro trabajo5, según el cual la fiebre del heno había incrementado su prevalencia pese a no haber aumentado los niveles de polen. El mecanismo propuesto fue que, al reducirse la defensas antioxidantes del pulmón por su disminución en la ingesta, se producía un incremento de la susceptibilidad de la vía aérea frente a los oxidantes, dando lugar a la inflamación bronquial y al asma. En 1997 Black y Sharpe6 señalaron que los cambios en la dieta occidental del tipo de ácidos grasos poliinsaturados (PUFAs), o también llamados ácidos grasos esenciales (AGEs), eran paralelos al aumento de prevalencia del asma y la enfermedad atópica. Estos cambios los relacionaron con la disminución de ingesta de grasas de pescado de aguas frías (atún fresco, arenque, caballa, trucha y salmón) o de los productos derivados de las grasas de pescado (aceite de hígado de bacalao) rico en ácidos grasos poliinsaturados n-3 (PUFAs n-3), como son el ácido eicosapentanoico (EPA; omega-3) y ácido docosahexanoico (DHA; omega-3), junto con el aumento de consumo de margarina y algunos aceites vegetales como maíz, soja, girasol, sésamo ( ac. araquidónico, omega-6)6. Los PUFAs, o ácidos grasos esenciales (AGEs), más comúnes en la dieta son el ácido linoleico n-6 (precursor de omega-6) y -linolénico n-3 (precursor de omega-3). Ambos son metabolizados en PUFAs de cadena larga por desaturación y elongación, mediante la vía enzimática (Fig 1). El ácido linoleico se convierte en ácido araquidónico (omega-6) que puede ser metabolizado por la COX y la enzima lipoxigenasa, dando lugar a dos tipos de prostaglandinas E2(PGE2), y cuatro tipos de leucotrienos. Estos cuatro tipos de leucotrienos tienen actividad pro-inflamatoria7, y se ha demostrado que los dos tipos de prostaglandina E2(PGE2), gozan de propiedades inmunomoduladoras, favoreciendo el desarrollo del fenotipo Th2, todo ello asociado con el asma y la enfermedad atópica. Black y Sharpe6 argumentaron, a la vista de lo expuesto anteriormente, que el incremento en la dieta del ácido linoleico n-6, tras su metabolización, producía un aumento del ácido araquidónico y de producción de PGE2, favoreciendo, por esta vía, la inflamación y un disbalance a favor de una predominio de linfocitos Th2 que justificaría el aumento de prevalencia de asma y enfermedad atópica en relación con los cambios de la dieta. Inversamente, postularon que el efecto beneficioso del incremento en la ingesta del ácido α-linolénico n-3 daría lugar a una disminución en la producción del ácido araquidónico y de la PGE2 , ya que el ácido α-linolénico inhibe competitivamente el metabolismo ácido linoleico mediante la cascada enzimática, y sus metabolitos EPA-DHA reducen la expresión del gen de la COX-2 e inhiben su actividad. Sin embargo, las consecuencias del incremento de la PUFA n-6 (omega-6) y descenso de la ingesta de PUFA n-3 (omega -3), son más complejas de lo que han descrito Black and Sharpe6. La vía de la COX -lipoxigenasa puede metabolizar el ácido dihomo linoleico y EPA, para producir prostaglandinas y leucotrienos (Fig.1) con actividad biológica, aunque menos potente que los metabolitos del ácido araquidónico. Además, algunos de los dos tipos de prostaglandinas, metabolizadas por el ácido araquidónico, se oponen a las acciones de la PGE27 y, por si esto fuera poco complejo, tanto los PUFAs n-3 como n-6, pueden, como componentes de la membrana celular, modular directamente la función de la células T determinando las características físico-químicas de la membrana, de la señal celular, y de la trascripción génica8. ÁCIDOS GRASOS OMEGA-6 ÁCIDOS GRASOS OMEGA-3 ac. Linoleico 18:2n-6 ac.α- Linolénico 18:3n-3 Δ6 Desaturasa ac. γ- Linoleico 18:3n-6 ac. Estaridónico 18:4n-3 Elongasa 20:40n-3 ac. Dihomo γ- Linoleico 20:3n-6 Δ5 Desaturasa 1 tipo PGs 3 tipos LTs ac. Eicosapentanoico (EPA) 20:5n-3 ac. Araquidónico 20:3n-6 2 tipos de PGs 2 4 tipos LTs 3 PGs 1,3 5 tipos LTs Elongasa Δ4 Desaturasa ac. Docosapentanoico 22:5n-3 ac. Docosahexanoico (DHA) 22:5n-3 Figura 1. Metabolismo de los ácidos grasos esenciales PGs, Prostaglandinas; LTs, Leucotrienos C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 29 D i e t a y A s m a Las vitaminas C, E y A/β-caroteno son aquellas cuyos efectos sobre el asma han sido estudiados más extensamente. Todas son antioxidantes, y además las vitaminas C y E tienen efectos antiinflamatorios y antialérgicos. que la incidencia del diagnóstico de asma tras un periodo de 10 años se asoció negativamente con la dieta rica en vitamina E13. En un reciente estudio rabdomizado placebo controlado, se dieron suplementos de vitamina E a 72 pacientes con asma, durante 6 semanas sin se pudiera encontrar un beneficio frente al tratamiento estándar del asma leve o moderada en adultos22. Vitamina C Vitamina A y β-caroteno Es la más extensamente investigada. Varios estudios publicados de casos y controles, así como transversales, la han asociado a una disminución del riesgo de padecer asma9-12. Solo hay un estudio longitudinal en el que no se observa ningún efecto de la vitamina C sobre la incidencia de asma13. En los estudios rabdomizados en los que la vitamina C se da en combinación con otros antioxidantes se observa que protege contra la broncoconstricción inducida por ozono1,14, mientras que, si se da sola, los resultados obtenidos son menos concluyentes en este sentido15. Algunos estudios epidemiológicos han demostrado que la dieta con vitamina C se asocia de manera positiva con la función respiratoria en niños y adultos16,17,18. En un estudio de casos y controles en adultos, la dieta de vitamina C tuvo una asociación negativa con la HRB demostrada por metacolina19. En "Third National Health and Nutrition Examination Survey" (NHANES III) se observó, en niños de 4 a 16 años, una correlación negativa entre el ácido ascórbico sérico y asma. En un estudio de casos y controles reciente, relacionaron la ingesta habitual de antioxidantes y sus niveles en suero. Encontraron que la ingesta de vitamina C y carotenos era significativamente más baja en los pacientes con asma grave y que el ácido ascórbico sérico era significativamente más bajo en los pacientes con asma grave que en los de asma moderada y los controles30. La Vitamina A comprende el retinol y más de 600 carotenoides, uno de los cuales es el β-caroteno. Tiene una importante actividad antioxidante. Aunque al retinol no se le considera habitualmente antioxidante, se le ha implicado en el desarrollo normal del pulmón y del epitelio respiratorio. No obstante, la evidencia de los efectos de la Vitamina A y β-caroteno son también limitados. Algunos estudios transversales sugieren un efecto protector9,12, 23, 24, pero los estudios longitudinales no indican que haya asociación con la incidencia de asma13. En su asociación en la dieta con otros antioxidantes hay cierta evidencia de que dan protección frente a los efectos del ozono en el asma9,14,21. Misso et al.30, en un reciente estudio de casos y controles, relacionaron la ingesta habitual de antioxidantes, sus niveles en suero y la gravedad del asma. Encontraron que la ingesta de carotenos era significativamente más baja en los pacientes con asma grave. Se han realizado ensayos clínicos estudiando el beneficio de suplementos de multinutrientes en la dieta, en tres importantes trabajos. En el "BetaCarotene Cáncer Prevention Study" , se randomizaron más de 29.000 adultos, quienes recibieron suplementos de α-tocoferol, β-caroteno, ambos o placebo, durante un periodo de 5 a 8 años, sin que se demostrara que estos suplementos tuvieran alguna incidencia o recurrencia en los síntomas de tos, producción de esputo o disnea38. En el "Carotene and Retinol Efficacy Trial", no hubo diferencia en la tasa de declinación de la función pulmonar en los 11 años de seguimiento de 18.000 sujetos randomizados que tomaron β-caroteno más retinol o placebo39. El más definitivo es el "Heart Protection Study"40, un ensayo en el que durante 5 años se aporto a la dieta de 20.000 adultos un suplemento de vitaminas antioxidantes (E, C, β-caroteno o matching placebo). Al final del estudio no encontraron diferencias en el FEV1 y FVC ni en el número de hospitalizaciones por asma. Estudios Antioxidantes Naturales (Tabla 1) Vitamina E La vitamina E liposoluble es la principal defensa contra los oxidantes que causan el daño en la membrana. Los efectos de la vitamina E han sido menos estudiados. Son pocos los estudios de corte trasversal que muestran una evidencia entre esta vitamina y el asma9-12. Sin embargo, hay una cierta evidencia en la asociación inversa, entre vitamina E y la sensibilidad cutánea a alérgenos y los niveles séricos totales de IgE en adultos20. Los estudios longitudinales señalan la evidencia entre la ingesta elevada de vitamina E y una disminución de la prevalencia de asma13. Como en el caso anterior, la vitamina E es efectiva cuando se asocia a otras vitaminas antioxidantes, actuando como protección frente a los efectos del ozono en el asma9,14,21. En el "US Nurses´Health Study" se señala Frutas Las frutas contienen potencialmente un importante número de antioxidantes. Podemos cuantificar las cantidades de fruta que se ingieren, pero no la cantidad de antioxidantes que se aportan, lo que puede ser un factor determinante a la hora de valorar los bene- 29 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 30 ficios de los diferentes antioxidantes aportados en la dieta en forma de alimentos (ej; las manzanas para el aporte de diferentes tipos de flavonas). En los estudios longitudinales de que disponemos hoy día, las evidencias de un potencial beneficio, parecen estar más en relación con la EPOC que con el asma9,10,11,12. En algunos estudios encuentran una asociación entre el consumo infrecuente de fruta y la mayor prevalencia de síntomas en relación con asma grave en adultos. Esta asociación parece estar restringida al grupo de pacientes fumadores, apareciendo el tabaquismo como un factor de confusión25. Flavonas Se encuentran en las frutas y en el vino tinto. Actúan como antioxidantes. Puede que exista una cierta protección asociada a la ingesta de este tipo de alimentos9-12. Solo hay un estudio que sugiera la acción protectora de las flavonas contra los marcadores de EPOC26. Un estudio recientemente publicado, realizado en Gran Bretaña, de casos y controles en 1.470 adultos, con edades entre 16 y 50 años, tampoco determinó ninguna evidencia de que la ingesta de diferentes tipos de flavonas tenga un efecto de protección frente al asma27. 30 Minerales Selenio (Se). Se comporta como antioxidante. En Nueva Zelanda, un primer estudio de casos y controles demostró que los niveles séricos de Se estaban bajos en pacientes con asma9-12. Este hallazgo fue posteriormente confirmado en Gran Bretaña28, pero no así en España, donde Picado C. et al29 no encontraron ninguna evidencia de que existiera una relación entre la ingesta micronutrientes/antioxidantes, sus niveles en plasma/suero y asma. Magnesio (Mg). Se ha descrito su potencial efecto broncodilatador cuando se da por vía intravenosa en el asma aguda3. Hay estudios epidemiológicos que encuentran un efecto protector frente al asma, mediante una ingesta de magnesio9-12. En España no se demostró ninguna evidencia del beneficio entre la ingesta de Mg en la dieta, sus niveles séricos y asma29. En un reciente estudio randomizado, placebocontrolado, tampoco encuentran beneficio tras cuatro meses de ingesta de suplementos de Mg3. Sodio (Na). Algunos estudios epidemiológicos sugieren que su alta ingesta puede esta relacionada con un aumento de la HRB9-12, pero no se ha podido demostrar que la restricción del Na en la dieta mejore el asma y solo existe un estudio que sugiera que su ingesta podría exacerbarla31. Cobre, Zinc y otros minerales. Solo hay una evidencia limitada. Los ensayos clínicos no son relevantes Estudios de Lípidos. Ácidos grasos poliinsaturados o esenciales Hace más de dos décadas que los estudios in vitro demostraron una acción antiinflamatoria de los ácidos grasos del pescado 32. La investigación de los efectos de los ácidos grasos se ha centrado principalmente en dos áreas: ácidos grasos poliinsaturados omega-3, potencialmente beneficiosos, obtenidos a partir de los aceites de pescado, y omega-6, que pueden deteriorar el asma 9-12. Los estudios observacionales presentan una evidencia relativa de que una ingesta frecuente de aceite de pescado ejerce un efecto protector contra el asma y la atopia 9-12. Este efecto es menos concluyente en los ensayos clínicos 33 y en los pacientes con asma sensible a la aspirina. Además de no tener efecto beneficioso, puede provocar un deterioro del asma de manera similar al resto de los inhibidores de la ciclooxigenasa, como demostraron Picado et al. Por otra parte, los estudios transversales confirman la hipótesis de que los ácidos omega-6 pueden incrementar el riesgo de asma 34, mientras otros encuentran que la crema de leche y la mantequilla (ricas en grasas saturadas) se asocian con un menor riesgo de asma en jóvenes y niños 35. La dieta rica en grasas se asocia positivamente en mujeres con atopia y asma 36. No hay estudios significativos de intervención en esta área. Limitaciones de los Estudios La falta de un grado de evidencia que permita hacer recomendaciones específicas a los asmáticos en relación a la dieta, puede deberse a que medir los nutrientes de la dieta es difícil y complejo, por lo que pueden dar lugar a posibles errores que influyan en los resultados. La dieta está también relacionada con otros factores de riesgo de asma, como el tabaquismo y el status socioeconómico, que juegan un papel de factor de confusión, siendo esta una de las limitaciónes de algunos estudios. A la vista de la evidencia de que disponemos, es posible que el aporte de un solo nutriente sea ineficaz. Además, tal vez los antioxidantes tengan una actividad prooxidante 41. Otra posible limitación que puede estar afectando los resultados es que quizás los nutrientes estudiados no sean los que tienen efectos sobre el asma. También es posible que los factores genéticos jueguen un papel, como es el caso de los polimorfismos del gen glutation S-transferasa 42 que determinan una susceptibilidad al daño por la oxidación. Un ensayo clínico en este subgupo de pacientes podría encontrar un efecto significativamente beneficioso por el aporte de antioxidantes a su dieta. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 31 D i e t a y A s m a fiesto que hay una asociación entre la ingesta de antioxidantes y tipos de ácidos grasos de la dieta, el asma y la enfermedad atópica. El empleo de suplementos de antioxidantes en la dieta de los asmáticos no tiene aún suficiente evidencia científica que justifique su recomendación (Tablas II y III). Hay una falta de relación entre la hipótesis de la influencia del tipo de los ácidos grasos esenciales en la dieta y el asma, y los resultados de los estudios (Tabla IV). Los estudios epidemiológicos e inmunológicos de los ácidos grasos esenciales de la dieta sugieren que actualmente los efectos de los lípidos en el asma son complejos e impredecibles. Es necesario intensificar la investigación en este campo, en particular, el papel de la dieta durante el embarazo y en los primeros años de vida, así como la susceptibilidad individual , ya que algunos subgrupos de asmáticos podrían obtener beneficios mediante su manipulación. La recomendación de una determinada dieta a los asmáticos debe estar basada más en la evidencia que en suposiciones. La única recomendación que podría hacerse actualmente es la misma que para la población general, una dieta rica en frutas y verduras,con una proporción omega-6/omega-3 de 2-1/1. Es posible que el diseño ideal para investigación en este campo, esté por hacer. Futuras Áreas de Investigación En 2004 el gobierno inglés inició un programa en el ámbito escolar infantil (de 4 a 6 años): cada día el niño debe tomar una pieza de fruta. Este programa intenta capitalizarlo un estudio, comparando los datos de la incidencia y prevalencia de asma entre los niños que siguen el programa y los que no. Es posible que los primeros datos podamos conocerlos pronto. Hay un importante interés de la industria de la alimentación frente a la escasa evidencia científica del beneficio de los suplementos de ácidos grasos poliinsaturados omega-3 en la dieta. En 2003 aparecieron ensayos clínicos 43,44,45 que hallaron beneficios frente al asma y la atopia, mediante el aporte de suplementos de omega-3 en la dieta durante el embarazo y la infancia. Recientemente, en Australia, Susan L. Prescott 46,47 et al. han confirmado estos primeros hallazgos. Estos trabajos pueden ser la base para futuras investigaciones a largo plazo. Conclusiones Los estudios epidemiológicos han puesto de mani- Tabla II. Nivel de evidencia de los estudios para la relación entre asma e ingesta de frutas y verduras. Nutrientes Transversal Casos-Controles Longitudinal Intervención Ingesta de frutas y vegetales Evidencia Evidencia limitada Evidencia limitada N/A Vitamina A o β-caroteno Evidencia limitada Evidencia Evidencia limitada Evidencia limitada Vitamina C Evidencia Evidencia Evidencia limitada Alguna evidencia Vitamina E Alguna evidencia Evidencia Evidencia limitada Evidencia limitada Difinición y abreviaturas: evidencia>10 estudios; evidencia limitada <5 estudios; N/A no videncia;alguna evidencia, 5-10 estudios. Tabla III. Nivel de evidencia de los estudios para la relación entre asma e ingesta de minerales Nutrientes Transversal Casos-Controles Longitudinal Intervención Pescado Evidencia Evidencia limitada Evidencia limitada N/A Omega-3 N/A N/A Evidencia limitada Evidencia Omega-6 Evidencia limitada Evidencia limitada Evidencia limitada Alguna evidencia Definición y abreviaturas: evidencia>10 estudios; evidencia limitada <5 estudios; N/A no videncia; alguna evidencia, 5-10 estudios. 31 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 32 Tabla IV. Nivel de evidencia de los estudios para la relación entre asma e ingesta Ácidos Grasos Esenciales Nutrientes Transversal Casos-Controles Longitudinal Intervención Pescado Evidencia Evidencia limitada Evidencia limitada N/A Omega-3 N/A N/A Evidencia limitada Evidencia Omega-6 Evidencia limitada Evidencia limitada Evidencia limitada Alguna evidencia Definición y abreviaturas: evidencia>10 estudios; evidencia limitada <5 estudios; N/A no videncia; alguna evidencia, 5-10 estudios. 32 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 33 D i e t a y A s m a Bibliografía 1. Calder PC. Dietary modificatión of inflamatión whith lipids. Proc Nutr Soc 2002 Aug;61(3):345-58. 2. Ram FS, Rowe BH, Kaur B, Vitamin C supplementation for asthma. Cochrane Database Syst Rev 2004;(4):CD001283 3. Fogarty A, Lewis SA, Scrivener SL, Antoniak M, Pacey S, Pringle M et al. Oral Magnesium and vitamin C supplements in asthma: a parallel group randomised placebo-controlled trial. Clin Exp Allergy 2003 Oct;33(10):1355-9. 4. Seaton A, Godden DJ, Brown K. Increase in asthma: a more toxic environment or a more susceptible population? Thorax 1994 Feb;49(2):171-4. 5. Seaton A, Soutar A,Mullins J.The increase hay fever: pollen, particulate matter and SO2 in ambient air. QJM 1996 Apr;89(4):279-84. 6. Black PN, Sharpe S. Dietary fat and asthma: is there a connection? Eur Respir J 1997 Jan;10(1):6-12. 7. Thien FCK, Walters EH. Eicosanoides y asthma update. Protaglandins Leukot Essent Fatty Acids 1995 May;52(5):271-88 8. Calder PC, Yaqoob P, Thies F, Wallace FA, Liles EA. Fatty acids and lymphocyte functions. Br J Nutr. 2002 Jan;87 (Suppl 1):S31-48. 9. Fogarty A, Briton J. The role of diet in aetiology of asthma. Clin Exp Allergy 2000 May;30(5):615-27. 10. Smit HA, Grievink L, Tabaak C. Dietary influences on chronic obstructive lung disease and asthma: a review of the epidemiological evidence. Proc Nutr Soc 1999 May;58(2)309-19 11. Smit HA. Chronic obstructive pulmonary disease, asthma and protective effects of food intake: from hypothesid to evidence. Resoir Res 2001 Jul;2(5):261-64. 12. Romieu I, Trenga C. Diet and obstructive lung diseases. Epidemol Rev 2001;23(2):268-87. 13. Troisi RJ, Willet WC, Weis ST, Trichopoulos D, Rosner B, Speizer FE. A prospective study of diet and adult-onset asth- ma. Am J Respir Crit Care Med 1995 May;151(5):1401-8. 14. Romieu I, Sienra-Monge JJ, Ramirez Agular M, Tellez-Rojo MM, Moreno -Macias H, Reyes-Ruiz NI, Rio-Navarro BE, Ruiz-Navarro MX, Hatch G, Slade R, et al. Antioxidant supplementation and lung functions among children with asthma exposed to high levels of air pollutants. Am J Respir Crit Care Med 2002 Sep 1;166(5):703-9. 15. Ram SFS, Rowe BH, Kaur B. Vitamin C supplementation for asthma (Cochrane Review). In: The Cochrane Library, Issue 1. 2004. Chichester, UK: John Wiley Sons, Ltd. 16. Gilliland FD, Berhane KT, Li YF Gauderman J, McConnell R, Peters J. Children´s lung function and antioxidant vitamin, fruit, juice and vegatable intake. Am J Epidemiol 2003 sep;158(6):576-84. 17. Britton JR, Pavord, Richards KA, Knox AJ, Wisniewski AF, Lewis SA, et al. Dietary antioxidant vitamin intake and func- tion in the general population. Am J Respir Crit Care Med 1995 May;151(5):1383-7. 18. Schwartz J, Weiss ST. Relationship between dietary vitamin C intake and pulmonary function in the First National Health and Nutrition Examination Survey (NHANES I). Am J Clin Nutr 1994 Jan;59:110-4. 19. Soutar A, Seaton A Brown K. Bronquial reactivity and dietary antioxidants. Thorax 1997 Feb;52(2):166-70. 20. Fogarty A, Lewis S, Weis S, Britton J. Dietary vitamin E, IgE concentrations, and atopy. Lancet 2000 Jan;356:1573-74 21. Trenga CA, Koening JQ, Williams PV. Dietary antioxidants and ozone-induced bronchial hyperresponsiveness in adults with asthma. Arch Environ Health 2001;56:242-49. 22. Pearson PJ, Lewis SA, Britton J, Fogarty A. Vitamin E supplements in asthma: a parallel group randomised placebo controlled trial. Thorax. 2004 Aug;59(8):652-6. 23. Harik-Khan RI, Muller DC, Wise RA. Serum vitamin levels and the risk of asthma in children. Am J Epidemiol. 2004 Feb 15;159(4):351-7. 33 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 34 24. Huang SL, Pan WH. Dietary fats and asthma in teenagers: analyses of the first Nutrition and Health Survey in Taiwan (NAHSIT).Clin Exp Allergy.2001Dec;31(12):1875-80. 25. Butland BK, Strachan HR, Anderson HR. Fresh fruit intake and asthma symptoms in young British adults: confounding or effect modification by smoking?. Eur Respir J. 1999 Apr;13(4):744-50.. 26. Tabak C, Arts IC, Smit HA, Heederik D, Kromhout D. Chronic obstructive pulmonary disease and intake of catechins, flavonols, and flavones: the MORGEN Study. Am J Respir Crit Care Med. 2001 Jul 1;164(1):61-4.. 27. Garcia, Arts ICW, Sterne JAC, Thompson RL, Shaheen SO. Dietary intake of flavonoids and asthma in adults Eur Respir J 2005 Sep;26(3): 449-452. 28. Shaheen SO, Sterne JA, Thompson RL, Songhurst CE, Margetts BM, Burney PG. Dietary antioxidants and asthma in adults: population-based case-control study. Am J Respir Crit Care Med. 2001 Nov 15;164(10 Pt 1):1823-8 29. PicadoC, Dulofeu R, Lleonart R, Agustí M, Mullol J, Quintó L, Torra M. Dietary micronutrients/antioxidants and their relationship with bronchial asthma severity. Allergy. 2001 Jan;56(1):43-9. 30. Misso NLA, Brooks-Wildhaber J, Ray S, Vally H, Thompson PJ.Plasma concentrations of dietary and nondietary antioxidants are low in severe asthma. Eur Respir J 2005 Aug; 26(2): 257-264. 31. Carey OJ, Locke C, Cookso JB. 1993 Jul;48(7):714-8. Effect of alterations of dietary sodium on the severity of asthma in men.Thorax. 32. Lee TH, Austen KF. Characterization and biologic properties of 5,12-dihydroxy derivatives of eicosapentaenoic acid, including leukotriene B5 and the double lipoxygenase product. J Biol Chem. 1984 Feb 25;259(4):2383-9. 33. De Luca S, Woods R, Thien FCK, Abramson MJ. . Dietary marine fatty acids (fish oil) for asthma in adults and chil- dren (Cochrane Review). In: The Cochrane Library, Issue 1. 2004. Chichester, UK: John Wiley Sons Ltd. 34. Bolte G, Frye C, Hoelscher B, Meyer I, Wjst M, Lindley MR. Margarine consumption and allergy in children.Am J Respir Crit Care Med. 2001 Jan;163(1):277-9. 34 35. Woods RK, Walters EH, Raven JM, Wolfe R, Ireland PD,Thien FC, Abramson MJ. Food and nutrient intakes and asth- ma risk in young adults.Am J Clin Nutr. 2003 Sep;78(3):414-21. 36. Trak-Fermeier MA, Brasche S, Winkler G, Koletzko B, Heinrich J. Food and fatty acid intake and atopic disease in adults. Eur Respir J. 2004 Apr;23(4):575-82. 37. Picado C, Castillo JA, Schinca N, Pujades N,Ordinas A, Coronas A, Agustí-Vidal A. Effects of a fish oil enriched diet on aspirin intolerant asthmatic patients: a pilot study.Thorax. 1988 Feb;43(2):93-7. 38. Rautalahti M, Virtamo J, Haukka J, Heinonen OP, Sundvall J, Albanes D, Huttunen JK. The effect of alpha-tocopherol and beta-carotene supplementation on COPD symptoms. Am J Respir Crit Care Med. 1997 Nov;156(5):1447-52 39. Balmes J, Ngo L, Keogh J,Cullen M, Brodkin c, Williams J et al. Effect of supplemental -caroteno and retinal on rate of decline in lung function. Am J Respir Crit Care Med 1998;157:A46(abstract) 40. Collins R, Armitage J, Parish S, Sleight P, Peto R. MRC/BHF Heart Protection Study of antioxidant vitamin supplemen- tation in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet. 2002 Jul 6;360(9326):23-33 41. Podmore ID, Griffiths HR, Herbert KE, Mistry P, Lunec J. Vitamin C exhibits pro-oxidant properties.Nature. 1998 Apr 9;392(6676):559. 42. Fryer AA, Bianco A, Hepple M, Jones PW, Strange RC, Spiteri MA. Polymorphism at the glutathione S-transferase GSTP1 locus. A new marker for bronchial hyperresponsiveness and asthma.Am J Respir Crit Care Med. 2000 May;161(5):1437-42. 43. Spector SL, Surette ME. Diet and asthma: has the role of dietary lipids been overlooked in the management of asthma?Ann Allergy Asthma Immunol. 2003 Apr;90(4):371-7; quiz 377-8, 421. 44. Dustan JA, Mori TA, Barden A, Beilin LJ, Holt PG et al. Fish oil supplementation in pregnancy modifies neonatal aller- gen-specific immune responses and clinical outcomes in infants at high risk of atopy: a randomized, controlled trial.J Allergy Clin Immunol. 2003 Dec;112(6):1178-84. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 35 D i e t a y A s m a 45. Mihrshahi S, Peat JK, Marks GB, Mellis CM, Tovey ER, Webb K et al. Eighteen-month outcomes of house dust mite avoidance and dietary fatty acid modification in the Childhood Asthma Prevention Study (CAPS). J Allergy Clin Immunol. 2003 Jan;111(1):162-8. Erratum in: J Allergy Clin Immunol. 2003 Apr;111(4):735. 46. Dustan JA, Prescott SL. Does fish oil supplementation in pregnancy reduce the risk of allergic disease in infants? Curr Opin Allergy Clin Immunol. 2005 Jun;5(3):215-21 47. Dustan JA, Mori Ta, Barden A, Beilin LJ, Taylor AL, Holt PG, Prescott SL. Fish oil supplementation in pregnancy modifies neonatal allergen-specific immune responses and clinical outcomes in infants at high risk of atopy: a randomized, controlled trial.J Allergy Clin Immunol. 2003 Dec;112(6):1178-84 35 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 36 36 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 37 D i e t a y A s m a CUESTIONARIO 1. Los a) b) c) d) factores de la dieta que se asocian a un aumento de prevalencia de asma y atopia son: Aumento de la ingesta de antioxidantes. Disminución de ácidos grasos omega-3 e incremento omega-6 en la ingesta. Disminución de la ingesta de antioxidantes byc 2. Los a) b) c) d) nutrientes implicados en la etiología o patogenia del asma son: Antioxidantes y ácidos grasos esenciales ó poliinsaturados. Vitaminas. Minerales. Ácidos poloiinsaturados. 3. Las a) b) c) d) principales fuentes de antioxidantes son : Frutas. Frutas y verduras Minerales: Se, Mg, Zinc. Vegetales de hoja verde. 4. Las a) b) c) d) principales fuentes de ácidos grasos esenciales (AGEs) ó ácidos grasos poliinsaturados (PUFAs) son: Bacalao y salmón. Pescados de aguas frías y aceite de oliva. Pescados de aguas frías y aceite de pescado. Mariscos y pescados. 5. Los ácidos grasos esenciales (AGEs) ó ácidos grasos poliinsaturados (PUFAs) más comunes en la dieta son: a) Ácido Oleico y omega-3 b) Ácido linoleico n-6 y -linolénico n-3. c) Ácido araquidónico y omega-6. d) Omega-6 y Omega-3. 6. Los a) b) c) d) ácidos grasos Omega-3 y Omega-6 se obtienen: Son nutrientes que se ingieren en la dieta directamente. Se obtienen por metabolización de los ácidos, linoleico n-6 y Son sintetizados endogenamente en cantidades suficientes. Omega-6 se ingiere directamente de la dieta de pescado. -linolénico n-3, ingeridos en la dieta. 7. El ácido linoleico n-6 (Omega-6) se metaboliza en ácido araquidónico: a) Favoreciendo la inflamación. b) Produciendo prostaglandinas ( PGE1 y 2) y un disbalance a favor de linfocitos Th2. c) a y b. d) No tiene relación con el asma. 8. El ácido α -linolénico n-3 (omega-3) se metaboliza en ácido eicosapentanoico (EPA) y docosahexanoico (DHA) y: a) Diminuyen la producción de ácido araquidónico y protaglandinas (PGE2). b) Estabilizan la membrana de los mastocitos. c) Inhiben la expresión del gen COX-2 y su actividad. d) a y c. 9. La vitamina C y el asma: a) Demuestra su beneficio en el asma, en los estudios transversales y de casos y controles. b) Es la vitamina más extensamente estudiada. c) Es antioxidante e inhibe las prostaglandinas. d) a, b y c. 37 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 38 10. La a) b) c) d) vitamina E y el asma: Es la principal defensa contra los oxidantes que causan el daño en la membrana. Se observa beneficio, cuando se asocia a otras vitaminas antioxidantes. Su ingesta no demostró un beneficio frente al tratamiento estándar del asma leve o moderada en adultos. a, b, c 11. La a) b) c) d) vitamina A y β-caroteno y el asma: Tienen poca actividad antioxidante. La evidencia de sus efectos es muy limitada. Su ingesta produce beneficio en el asma grave. Su ingesta deteriora el asma grave. 12. Las a) b) c) d) Flavonas (frutas y el vino tinto): Contienen un numero pequeño de antioxidantes. No se ha demostrado que tengan efecto protector en el asma. Contienen ácidos grasos poliinsaturados. Actuan como oxidantes. 13. Los a) b) c) d) minerales Se, Mg, Na, Cb y Zn y asma: Tienen efecto antioxidante. La restricción de la ingesta de Na mejora el asma. No se ha demostrado que su ingesta tenga efecto sobre el asma. a y c. 14. El ácido graso poliinsarurado linoleico n-6 (omega-6): a) Se encuentra principalmente en el pescado. b) El incremento de su ingesta puede deteriorar el asma. c) La margarina, los aceites de maíz, girasol y soja son ricos en omega-6. d) b y c. 38 15.El ácido graso poliinsarurado, -linolénico n-3 (omega-3): a) Se encuentra principalmente en el aceite de pescado. b) Parece tener efecto beneficioso en algunos subgrupos de asmáticos. c) La margarina, los aceites de maíz, girasol y soja son ricos en omega-3. d) a y b. 16. Recientes estudios sobre la relación entre la ingesta de suplementos omega-3 y el asma: a) Han encontrado un efecto beneficioso durante el embarazo e infancia. b) Han demostrado que deben recomendarse sistemáticamente. c) Han demostrado que no hay ninguna asociación. d) Han demostrado que deterioran el asma. 17. Los estudios epidemiológicos han puesto de manifiesto que hay una asociación: a) Entre el asma e ingesta de antioxidantes en la dieta. b) Entre el asma e ingesta de ácidos grasos esenciales en la dieta. c) Entre el asma y suplementos de antioxidantes en la dieta. d) a y b. 18. La correlación entre la hipótesis de la influencia del tipo de los ácidos grasos esenciales en la dieta de los asmáticos, y los resultados de los estudios es: a) Total. b) Desconocida. c) Parcial. d) No se ha estudiado. 19. En la actualidad recomendar la ingesta de suplementos de vitaminas y omega-3, en la dieta a los asmáticos: a) No debe de hacerse, ya que no hay suficiente evidencia científica. b) Solo debe de hacerse durante el embarazo. c) Solo debe de hacerse durante los primeros años de vida. d) Siempre, porque puede que se produzca algún beneficio. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 39 D i e t a 20. La a) b) c) d) y A s m a única recomendación sobre la dieta que podría hacerse a los asmáticos sería: La misma que a la población general. Que el balace omega-6/omega-3 sea de 2-1/1. Que sea rica en antioxidantes. a,b y c. 39 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 40 40 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 41 D i e t a y A s m a Respuestas fascículo 2, capítulo VI (Dieta y Asma) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 41 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 42 13.- a b c d e 14.- a b c d e 15.- a b c d e 16.- a b c d e 17.- a b c d e 18.- a b c d e 19.- a b c d e 20.- a b c d e 42 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 43 43 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 44 44 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 05/12/2005 “ Ta b a c o , 17:53 PÆgina 45 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” Capítulo VII ASMA Y “TABACO, CONTAMINACIÓN AMBIENTAL Y CONDICIONES METEREOLÓGICAS”. Antonio Pereira Vega Hospital Juan Ramón Jiménez. Huelva. Jesús Grávalos Guzmán Hospital Juan Ramón Jiménez. Huelva. Inmaculada Sánchez Rodríguez Hospital Juan Ramón Jiménez. Huelva. Maria de los Ángeles Sánchez Quiroga Hospital Juan Ramón Jiménez. Huelva. 45 Correspondencia: Antonio Pereira Vega C/Puerto 32, 7º izquierda. 21001 Huelva. Correo electrónico: [email protected] Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 46 46 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 05/12/2005 “ Ta b a c o , 17:53 PÆgina 47 c o n t a m i n a c i ó n Resumen El asma bronquial es una enfermedad cuya prevalencia parece estar aumentando en la mayoría de países industrializados en los últimos 25 años1,2,3. La causa de ese incremento es desconocida, aunque parece deberse más a la variación en factores ambientales que genéticos. Entre los factores ambientales, es probable que la creación de un microclima en los hogares (indoor) favorecedores de reservorios de alergenos sea un factor que contribuye a la mayor prevalencia de asma. El papel de la infección por virus en la primera infancia4, la teoría de la higiene, las variaciones en las condiciones meteorológicas y el tabaquismo pasivo5 son otros de los factores a tener en cuenta. Otro factor ambiental analizado en múltiples estudios es la contaminación ambiental (outdoor). El efecto de estos factores podría ser como favorecedores de exacerbaciones de un asma preexistente o bien, como verdadero agente causal de la enfermedad. En este sentido, hasta hace pocos años, diversos estudios han sugerido6 que mientras los factores genéticos y los alergenos interiores o indoor son causa directa de asma en la mayoría de los casos, los contaminantes exteriores o outdoor provocan exacerbación del asma pero no son causa directa del mismo. Este concepto, como después veremos, especialmente respecto al tabaquismo y cierto tipo de contaminación ambiental (O3 y partículas finas), ha variado recientemente7, 8, 9, 10, 11, 12 y se encuentra en discusión. En el siguiente capítulo vamos a revisar el efecto de tres de estos agentes ambientales, tabaco, contaminación ambiental y condiciones meteorológicas, sobre la enfermedad asmática. Asma y tabaco 1.INTRODUCCIÓN A pesar de todos los esfuerzos internacionales que se están haciendo para reducir la prevalencia del tabaquismo, como el Convenio Marco de la OMS, firmado por 192 países13, ésta sigue siendo muy alta. Dicha prevalencia, aunque está descendiendo ligeramente en los países desarrollados , donde están teniendo éxito las políticas de control del tabaquismo, está aumentando en los países en vías de desarrollo. En España, la prevalencia del tabaquismo sigue siendo alta. Según la Encuesta de Salud Pública de 2003, se sitúa en el 34,5%, bajando sólo algo mas de 1 punto respecto a la de 1997 en que era del 35,7%14. Seguidamente vamos a analizar como el tabaco, activo y pasivo (exposición involuntaria al humo del tabaco15), y tanto en niños como en adultos, puede provocar exacerbaciones de un asma preexistente o bien, actuar como posible factor causal de la enfermedad. a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” 2.TABAQUISMO PASIVO Y RIESGO DE ASMA EN LA INFANCIA La exposición al tabaquismo pasivo puede causar asma como consecuencia a largo plazo del aumento de las infecciones del tracto respiratorio inferior en la primera infancia, o por otros mecanismos fisiopatológicos, incluyendo la inflamación del epitelio respiratorio16. La exposición in útero17-19 al tabaquismo materno puede producir déficit persistentes en la función pulmonar y estos son mayores en los niños con predisposición a padecer asma. En el estudio longitudinal de Li et al17 los niños y niñas expuestos al tabaquismo pasivo (in útero) tenían déficit en la función pulmonar comparados con los no expuestos, y los niños con asma eran más sensibles a estos efectos. En el estudio que Gilliland et al18, realizado en más de 5000 escolares de California, se concluyó que los niños que habían estado expuestos al tabaquismo materno in útero tenían 1.8 mas probabilidades de ser diagnosticados de asma y de tener episodios de sibilancias a lo largo de la vida que los no expuestos. Como las madres que fuman durante el embarazo es muy probable que fumen también después del parto, es muy difícil aislar los efectos de la exposición in útero de los efectos de la exposición postnatal. Datos similares refieren Wietzman et al19 y los datos del Tercer Estudio Nacional de Salud y Nutrición de EE.UU. desarrollado desde 1988 a 1994. En el clásico estudio de Martínez et al20, realizado en 1995 en el que clasificaron a los niños con sibilancias por criterios temporales, sólo el tabaquismo materno se asoció con sibilancias transitorias (antes de los 3 años pero no a los 6 años), lo cual sugiere que el tabaquismo materno tiene un papel principal en el desarrollo de episodios repetidos de sibilancias en la primera infancia y que otros factores, historia familiar o alergia, llegan a ser más importantes en el mantenimiento de enfermedades respiratorias sibilantes. En un reciente trabajo, Cantani y Micera21 al estudiar 289 niños atópicos encontraron asociación estadísticamente significativa entre tabaquismo pasivo y desarrollo de asma. 3.TABAQUISMO PASIVO Y EMPEORAMIENTO DE LOS NIÑOS CON ASMA El tabaquismo pasivo también empeora la calidad de vida de los niños con asma como queda demostrado por las siguientes observaciones: Murray et al22, igual que diversos estudios poblacionales han demostrado aumento de la hiperreactividad bronquial en niños con asma expuestos al tabaquismo pasivo (ACHT)23. La exposición al humo del tabaco en el hogar aumenta el número de visitas a urgencias de los niños con asma. En el estudio de Evans et al24, de 276 niños con asma en edades comprendidas entre los 4 y los 47 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 48 17 años encontraron que el tabaquismo pasivo se asociaba a un aumento del 63% en las visitas a urgencias, aunque no a un aumento de las hospitalizaciones 4.TABAQUISMO PASIVO Y ASMA EN ADULTOS La exposición al humo de tabaco ambiental durante la infancia conduce al aumento de la prevalencia de asma en adultos nunca fumadores, especialmente en nunca fumadores sin historia familiar de asma25,26. La exposición al humo del tabaco ambiental fuera de la casa, especialmente en los lugares de trabajo, aumenta la prevalencia de síntomas respiratorios y de asma. Larsson et al27 encontraron que si la exposición fuera de casa excedía de 5 horas al día, el riesgo de tener sibilancias y de ser diagnosticados de asma aumentaban (OR 2.67 para sibilancias y OR 1.79 para asma.) En un estudio de Eisner et al28 de 1998 se analizó el impacto de la exposición al humo del tabaco ambiental sobre la gravedad del asma, estado de salud y utilización de los servicios de salud en 451 adultos no fumadores con un período de seguimiento de 18 meses. Los individuos con exposición al ACHT tenían una mayor puntuación en cuestionarios específicos de gravedad del asma, peor calidad de vida y más proporción de visitas a los servicios de urgencias. Aquellos individuos que redujeron o cesaron su exposición al ACHT experimentaron una mejora en su salud en relación con el asma. 48 5.TABAQUISMO ACTIVO Y ASMA La Hiperreactividad bronquial (HB) es una de las características del asma aunque también se puede demostrar en otras entidades distintas al asma. En varios estudios poblacionales se ha encontrado evidencia sobrada de un aumento de la HB en fumadores, tanto en individuos sintomáticos como asintomáticos. De todos modos, la relación entre tabaquismo e hiperreactividad bronquial continúa siendo objeto de debate en tanto que no está claro si el tabaquismo está directamente relacionado o sólo está enmascarando y agravando una HB preexistente29. El tabaquismo causa o aumenta la sensibilización a varios alergenos ocupacionales aunque no a los alergenos inhalados más comunes. También se ha demostrado un aumento de la incidencia de asma en los fumadores expuestos a agentes ocupacionales. Hay datos disponibles de que la sensibilización a los alergenos comunes está de hecho reducida en fumadores o que los fumadores son menos propensos a desarrollar sensibilización; esto podría explicarse por la reticencia de los pacientes atópicos o asmáticos a seguir fumando o a empezar a fumar porque esto probablemente aumente sus síntomas respiratorios30. El tabaquismo como factor de riesgo para asma continúa siendo debatido. Los asmáticos auténticos son generalmente considerados como no fumadores y en los estudios epidemiológicos el tabaquismo casi siempre se considera como criterio de exclusión para el diagnóstico de asma, aunque la evidencia de que hay una asociación entre tabaquismo y asma es inequívoca. El tabaquismo podría jugar el papel de desencadenante y actuar como factor agravante del asma. 6. RELACIÓN ENTRE ASMA Y EPOC La reversibilidad de la obstrucción bronquial en la EPOC sigue siendo objeto de debate desde que se conoce la asociación del tabaquismo con su patogenia y progresión. Uno de los problemas que queda por resolver es la cuestión de que no todos los fumadores tienen la misma susceptibilidad para el declive de la función pulmonar y que la reversibilidad de la obstrucción es demostrable solo en un subgrupo de pacientes; sin embargo, es importante identificarlos a la hora de tomar decisiones terapéuticas. Se ha propuesto que los fumadores con diátesis alérgica tienen mayor predisposición a desarrollar obstrucción crónica al flujo aéreo grave, lo que es popularmente conocido como la "hipótesis holandesa"31. Según ésta, el estrechamiento de las vías aéreas se desarrollaría en individuos hiperreactivos como la primera anormalidad resultante de la exposición al humo de tabaco o a otros contaminantes ambientales. La hipótesis holandesa apoya una amplia relación entre asma y EPOC . A pesar de las conocidas diferencias entre estas dos entidades, los fumadores que tienen un declive acelerado del FEV1 tienen notables similitudes con los pacientes asmáticos. Hay varios informes en los que se demuestra hiperreactividad bronquial, eosinofilia periférica y niveles elevados de IgE en fumadores. Además, la eosinofilia periférica se correlaciona con el deterioro de la función respiratoria. En un subgrupo de pacientes con EPOC ha sido claramente definida la existencia de inflamación por eosinófilos de las vías aéreas. Es este subgrupo en el que probablemente se demuestre la existencia de reversibilidad de la obstrucción bronquial y el que se beneficie tanto del tratamiento con broncodilatadores como con esteroides. Asma y contaminación ambiental INTRODUCCIÓN Los estudios sobre la influencia de la contaminación sobre el asma32,33 se basan en estudios epidemiológicos y estudios de exposición en laboratorio, en humanos y en animales, ambos con ventajas y desventajas. Los estudios epidemiológicos pueden mostrar asociaciones estadísticas entre niveles de uno o varios contaminantes asociados y prevalencia de asma, hospitalizaciones o visitas a urgencias por asma, pero no pueden probar una relación causal. Los estudios de exposición humana pueden medir la respuesta en C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:07 PÆgina 49 c o n t a m i n a c i ó n poblaciones, sana o de alto riesgo como asmáticos o ancianos, en ambientes controlados sin la presencia de factores confusores habitualmente presentes en los estudios epidemiológicos. Estos estudios pueden evaluar cambios en la función pulmonar secundarios a determinados niveles de contaminación pero no consideran el posible sinergismo entre múltiples contaminantes o contaminantes y alergenos. Los estudios sobre modelos animales, y estudios en tejidos y células, proporcionan más información sobre los mecanismos de respuesta, pero puede que no sean aplicables a los efectos en humanos. Todos estos estudios tienen además la dificultad añadida de evaluar el efecto de la contaminación ambiental en un paciente con hiperrespuesta a otros múltiples agentes, ambientales como los pólenes o hongos, o agentes físicos como el aire frío o humedad; efectos que a veces son difíciles de separar. A pesar de estos hechos, como señala Vedal33 en su revisión sobre los efectos de la polución aérea sobre la salud, se han producido significativos avances en la metodología y diseño de los estudios epidemiológicos en los últimos años. De esta forma, el desarrollo y aplicación de concentradores de partículas en estudios experimentales, tanto en humanos como en animales, el diseño de estudios epidemiológicos que incluyen múltiples ciudades y con metodología similar34,35, la utilización de análisis multivariante controlando diferentes factores de riesgo y el estudio de población infantil de familias que se trasladan de áreas de alta a baja contaminación o viceversa36, han producido significativos avances en el conocimiento de los efectos de la contaminación ambiental sobre la salud, y concretamente sobre el asma, en los últimos años32. Como consecuencia de ello, preguntas como: ¿Puede la polución ambiental aumentar el riesgo o exacerbar el asma o la rinitis alérgica?, ¿Qué contaminantes tienen peores efectos sobre la salud, en concreto sobre el asma, y deberían ser reducidos o evitados? o, ¿Tienen los asmáticos mayor riesgo de muerte por la polución?, tienen hoy día respuestas cada vez más precisas7,8,9,10,11,12. Sin embargo, todavía quedan muchos interrogantes por responder: ¿ La contaminación ambiental puede ser causa directa de asma?, ¿Existe nivel umbral mínimo de afectación para la salud de los distintos contaminantes?, y consecuentemente, ¿habría que revisar los estándar de dichos contaminantes?. ¿Estos estándar habría que referirlos a periodos determinados (24 horas o anuales) o a niveles pico?. En concreto, respecto a las PM, ¿tenemos que analizar su concentración o tiene más importancia su composición?. En cualquier caso, el papel de la contaminación ambiental está aún por determinar y, aunque parece aceptado, ya desde los graves episodios de elevados niveles de contaminación (SO2 y smog) ocurridos en Londres37 en 1952, que exposiciones agudas de contaminación atmosférica causan síntomas respiratorios y elevan la mortalidad, especialmente en pacientes con enfermedades crónicas como el asma, como hemos a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” indicado previamente quedan muchas preguntas por responder sobre los efectos de la exposición crónica. En este capítulo vamos a realizar una revisión sobre los efectos "crónicos" de la contaminación ambiental (outdoor), su posible efecto en las reagudizaciones de un asma preexistente y en su posible efecto iniciador (causal) de la enfermedad asmática. CONCEPTOS Existen diferentes posibilidades de definir contaminación ambiental; de forma amplia se podría definir como la presencia en el aire, agua o alimentos de cualquier sustancia(s) que sea tóxica o pueda tener efectos adversos o que sea molesta, aunque no necesariamente peligrosa para la salud38. En sentido más estricto, se llama contaminación a la descarga en la atmósfera de gases, vapores, gotitas y partículas de origen extraño y en cantidad anormalmente elevada39, de tal forma que la misma llega a ser menos aceptable para su uso preconcebido que, en este caso, es el mantenimiento de la salud, no considerándose contaminación, como en el primer caso, la presencia de determinadas partículas o sustancias que, pudiendo incomodar a algunas personas (ej. pólenes), son consideradas como constituyentes naturales. Nos referiremos en este artículo fundamentalmente a los efectos derivados de los contaminantes 49 Figura 1. Ejemplo de contaminación ambiental de origen industrial (fig 1), si bien, como es el caso del NO2, su presencia también dentro de los domicilios es muy importante. Aunque a efectos didácticos podemos hablar de efectos derivados de una exposición aguda (exposición a concentraciones muy elevadas de un contaminante en un corto espacio de tiempo) y de efectos derivados de una exposición crónica (exposiciones variables en su intensidad habitualmente no asociadas a situaciones catastróficas o accidentales, que componen una exposición ambiental más usual), sólo nos vamos a referir a esta última, sin incluir la exposición a neumoalergenos ni el asma ocupacional. En el resto de apartados de este capítulo nos referiremos a otro posibles factores Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:07 PÆgina 50 ambientales de influencia en el asma, el tabaquismo pasivo y las condiciones meteorológicas. CLASIFICACIÓN DE LOS CONTAMINANTES Son varias las clasificaciones que nos permiten acercarnos de una forma más sistemática al problema de la contaminación40 (tabla I): En la tabla II se muestran los niveles Standard de los distintos contaminantes. Estos niveles están en continua revisión, en función de los hallazgos de nuevos trabajos de investigación. Por otra parte, los periodos de tiempo analizados también son objeto de revisión actual. MECANISMOS DE ACCIÓN Y FACTORES DETERMINANTES EN LA EXPOSICIÓN A LOS CONTAMINANTES AMBIENTALES El mecanismo o mecanismos exactos por los que los distintos polucionantes producen los efectos adversos sobre la salud son complejos y no totalmente conocidos. En la tabla III se indican posibles mecanismos, siendo los más admitidos, la inflamación pulmonar y el stress oxidativo41. En este sentido, diversos autores refieren que una alteración en los mecanismos de defensa antioxidante pueden provocar inflamación de la vía aérea, incremento de la susceptibilidad a la infección y asma42, pudiendo explicar la existencia de diferente susceptibilidad individual a polucionantes. 50 Respecto a los factores determinantes en la exposición a contaminantes ambientales, éste es un proceso complejo que incluye desde las fuentes de emisión y concentraciones en el aire, según hablemos de contaminación outdoor o contaminación indoor, hasta una susceptibilidad personal de cada sujeto de la que dependerá, en base a la dosis real efectiva que reciba, el efecto final de la contaminación sobre la salud. De manera global, se puede sistematizar el proceso en cuatro fases (Fig. 2): 1.Fase de exposición, en la que habrá que valorar la proximidad al foco contaminante y su intensidad, las características físico-químicas de cada una de la sustancias, el tiempo de contacto con el contaminante así como el volumen de aire que se ha podido respirar. 2.La segunda fase se refiere a la dosis real efectiva que ha recibido un sujeto y que va depender del tamaño de la partícula y solubilidad de la misma, tipo de respiración (nasal o bucal), anatomía de las vías aéreas y eficacia de sus mecanismos de defensa (tos, inmunoglobulinas, macrófagos y sobre todo aclaramiento mucociliar). Todo ello va a determinar cual es la concentración real que alcanza las vías aéreas distales y de la que dependerá en definitiva el que el contaminante sea capaz de provocar efectos indeseables significativos. 3.En tercer lugar se encontraría la relación dosisrespuesta, ya que existen sustancias que necesitan alcanzar un umbral determinado para que aparezcan Tabla I.- Clasificación de los contaminantes ambientales. A.Según la fuente emisora: - Naturales: 80% de la contaminación total emitida (NO2, CO e hidrocarburos) - Humanos: Habitualmente industriales (contaminación urbana o rural y catástrofes*) B.Según su origen: - Primarios: proceden directamente del lugar de emisión: SO2, NO2, CO, hidrocarburos, pólenes y humo de tabaco. - Secundarios: precisan modificaciones o reacciones químicas entre sustancias precedentes: Ozono (O3), SO4H2 y NO3H C.Según su reactividad química: - Oxidantes (O3, NO2, NOx), Reductores (SO2) o Aerosoles ácidos (SO4H2, NO3H) D.Según el lugar de exposición: - Contaminantes más frecuentemente exteriores o OUTDOOR Gaseosos: O3, NO2, NOx y SO2, y SO4H2, NO3H. Partículas en suspensión: PM10 (entre 10 y 2.5 μm) , PM2.5 finas (<2.5 μm) y partículas ultrafinas (< 0.1 μm). Otros: SH2, mercaptanos, CO - Predominantemente INDOOR . NO2, NOx, tabaco y otros (radon, formaldehído) * Catástrofes: emisión descontrolada de sustancias tóxicas, como el accidente de Bhopal en la India (1984) por isocianato de metilo; el de Poza Rica en México (1950) por hidrógeno sulfuroso; y el más reciente accidente nuclear en la ciudad rusa de Chernobil C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:07 PÆgina 51 c o n t a m i n a c i ó n a m b i e n t a l efectos secundarios mientras que otras en cualquier nivel son susceptibles de inducir riesgos para la salud. 4.Por último, hay que contar con la susceptibilidad personal en función de la cual, determinados grupos de población son especialmente proclives a presentar efectos indeseables cuando son expuestos a la contaminación: niños, ancianos, asmáticos, bronquíticos crónicos y pacientes con patología crónica cardiovascular43 o diabéticos44. y c o n d i c i o n e s m e t e r e o l ó g i c a s ” EFECTOS CONOCIDOS DE LOS DISTINTOS CONTAMINANTES La Tabla IV intenta resumir los principales efectos demostrados en asma sobre el organismo de los contaminantes más conocidos. DIOXIDO DE AZUFRE (SO2). Considerado fundamentalmente un contaminante outdoor, es un contaminante reductor que contribuye a la deposición ácida, Tabla II.- Niveles estándar de los distintos contaminantes. Periodo de tiempo Contaminante PM10 (μg/m3) 150 (24 h) 50 (anual) PM2.5(μg/m3) 65 (24 h) 15 (anual) Ozono (ppm) 0.12 (1 h) 0.08 (8 h) NO2 (ppm) SO2 (ppm) CO (ppm) 0.053 (anual) 0.14 (24 h) 35 ppm (1h) 0.03 (anual) 9 ppm (8h) * Estándares de: US Environmental Protection Agency. U.S. Nacional Ambient Air quality Standard (NAAQS). Web: http://www.epa.gov/air/urbanair/6poll.htlm Contaminante Estándar primario Tipo de valor medio PM10 50 μg/m3 24 horas Ozono 180 μg/m3 (0.09 ppm) 1 hora 360 μg/m3 (0.018 pm) NO2 200 μg/m3 (0.1 ppm) 1 hora 400 μg/m3 (0.212 ppm) SO2 350 μg/m3 (0.112 ppm) 1 hora 500 μg/m3 (0.175 ppm) ** Estándares de calidad del aire (Diario Oficial de Comunidades Europeas 1999) Umbral alerta 51 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 52 Tabla III. Posibles mecanismos de los efectos adversos producidos por los distintos contaminantes13. 1. Ozono y PM inducen inflamación pulmonar. 2. Radicales libre y stress oxidativo por metales y componentes químicos orgánicos (hidrocarburos poliaromáticos). 3. Modificación covalente de "proteínas llave" intracelulares (enzimas) 4. Componentes biológicos, como endotoxinas, las cuales inducen inflamación y efectos en la inmunidad. 5. Estimulación de nociceptores y actividad del Sistema Nervioso Autónomo, el cual regula la frecuencia cardiaca y reactividad de la vía aérea. 6. Efectos adyuvantes en el sistema inmune (Incremento de la respuesta a alergenos ambientales comunes: partículas diesel y metales) 52 7. Actividad procoagulante de partículas ultrafinas después de acceder a la circulación sistémica. 8. Supresión de los mecanismos de defensa normal (supresión de la función de los macrófagos alveolares) al unirse a gotas de agua y formar SO4H2. El SO2 es un gas muy soluble con poca penetración en la vía aérea distal al absorberse en las vías aéreas superiores; sin embargo la respiración bucal que se produce durante el ejercicio físico facilita la penetración46. Sólo se han encontrado efectos de las concentraciones ambientales en asmáticos durante el ejercicio intenso provocando broncoconstricción importante47 y secundariamente, especialmente en niños, un incremento en el número de ingresos hospitalarios y visitas a urgencias48 (estudio APHEA) pero no existen evidencias sólidas de una relación clara entre exposición al SO2 y el desarrollo de asma. DIOXIDO DE NITROGENO (NO2). A diferencia de lo que ocurre con el resto de los contaminantes, el NO2 es fundamentalmente un contaminante dentro del domicilio (indoor)49,50 ,51 ,52. La toxicidad del NO2 está en relación a su capacidad oxidativa53, aunque como oxidante es menos reactivo que el ozono54. Se puede unir a gotitas de agua y formar ácido nítrico, constituyendo parte de la lluvia ácida (smog). Estudios empíricos y teóricos indican que el NO2 por su baja solubilidad penetra hasta la periferia pulmonar donde más del 60% se deposita en regiones centroacinares55. A este nivel y a elevadas concentraciones (20 ppm), produce una pérdida de estructuras alveolares de forma similar a como ocurre en el enfisema56. De todos los contaminantes comentados es el que con mayor frecuencia se relaciona con la aparición de hiperreactividad bronquial57,58,59 . Así mismo parece potenciar la sensibilidad a alergenos. La exposición combinada a varios contaminantes gaseosos (SO2 y NO2 o NO2 y O3) potencian sus efectos60. En las últimas tres décadas se han hecho grandes avances en el control de los diferentes contaminantes antes comentados, con efectos bien conocidos sobre la salud. No obstante, se ha progresado mucho menos en lo relativo a otros dos contaminantes con potencial efecto importante sobre la salud humana como son: el ozono (O3) y las partículas en suspensión. A ellos nos vamos a referir en las siguientes líneas. OZONO (O3). El mecanismo básico implicado en los efectos del ozono es el efecto oxidante e inflamatorio 61,62 pero podrían estar implicados otros mecanismos como la irritación de los receptores nerviosos sensoriales de la vía aérea y el aclaramiento mucociliar63. Estudios experimentales controlados han mostrado caídas de los volúmenes pulmonares64 y que produce HB65, sin que se haya constatado que exista una población especialmente susceptible. Estudios epidemiológicos han demostrado una asociación entre los picos de concentración de O3 durante el día con un mayor número de exacerbaciones de asma, visitas a los servicios de urgencias, ingresos hospitalarios y muertes62,66,67. Ahora bien no puede conocerse si estas asociaciones se deben exclusivamente al O3 o a su combinación y efecto sinérgico con otros contaminantes ambientales incluidas las partículas. Mención especial requieren los recientes estudios7 que relacionan el aumento de la prevalencia de asma con los niveles de O3 en individuos que realizan deporte al aire libre. PARTICULAS EN SUSPENSIÓN. Son partículas presentes en el aire de tamaño suficientemente reducido, de modo que no se depositan de forma rápida sobre la superficie68. Su fuente más importante son las centrales eléctricas, grandes plantas industriales (fábricas de acero, fundiciones), estufas de leña y, especialmente la combustión de diesel. Estas partículas de escape de los diesel (PEDs), tienen un núcleo de carbón sobre el que se depositan múltiples componentes, gases, hidrocarburos y, especialmente metales (Fe, Ni, Cu…). En este sentido, hay diversos estudios que consideran la posibilidad de que sean algunos de estos metales, C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 05/12/2005 “ Ta b a c o , 17:53 PÆgina 53 c o n t a m i n a c i ó n a m b i e n t a l m e t e r e o l ó g i c a s ” Dispersión, convección (var. ventilación) Dispersión, convección (var. metereológicas) Patrón de tiempo-actividad c o n d i c i o n e s Fuentes Emisión Indoor Fuentes Emisión Outdoor Concentración Outdoor y Penetración edificio Renovación del aire Exposición personal total Concentración Indoor Patrón de tiempo-actividad Dosis interna Susceptibilidad personal Dosis biológica efectiva Efecto sobre la salud Figura 2. Factores implicados en la exposición a contaminantes. más que la concentración de las PM, además de su tamaño, los que ocasionen un peor efecto sobre el aparato respiratorio35. En el ECRHS, nosotros hemos encontrado en Huelva (figura 3), ciudad con elevada prevalencia de síntomas asmáticos, niveles elevados de algunos metales (Ti, P), aunque los niveles globales de las concentraciones de PM10 y PM2.5 no eran excesivamente elevados. Estos datos serán fruto de posteriores estudios. Se designan habitualmente como partículas madre (PM) y se clasifican en tres categorías: PM10 (diámetro entre 2.5 y 10 μm), PM finas (< 2.5 μm) y ultrafinas (<0.1 μm). Se considera que las PM < de 5 μm pueden penetrar hasta los alveolos. Recientes69 estudios han mostrado que las partículas ultrafinas, más abundantes y potencialmente más tóxicas, a la vez que menos estudiadas, pueden penetrar en la circulación sanguínea. La medida más conocida de contaminación del aire por partículas es la llamada PM1070,71. Estas partículas, penetran desde la laringe a las vías aéreas, pero no suelen penetrar en las vías respiratorias distales. Sus efectos se deben, sobre todo, a su inhalación sinérgica con otros contaminantes como el SO2 o los aerosoles ácidos, y aunque algunos autores las relacionan con reagudizaciones de asma72 y descenso ligero del FEV1 y FVC en niños con asma73, no se han asociado de manera clara o independiente a efectos nocivos sobre el pulmón. Sí se han descrito como implicadas en un incremento de las tasas de infecciones respiratorias y mortalidad en cuantía de un 1% por cada incremento de 10mgr/m74. La fracción respirable, la que penetra hasta la periferia pulmonar es la conocida como PM2.5 (partículas finas), considerada actualmente en Estados Unidos como la medida estándar. PARTICULAS ULTRAFINAS. Estamos asistiendo en los últimos años al resurgimiento de un nuevo concepto: "las partículas ultrafinas" (fig 4): partículas de diámetro inferior a 100 nm (0'1 micras), las cuales sí parecen tener suficiente potencial para causar enfermedad y están siendo en la actualidad objeto de numerosas revisiones71. Aún teniendo en cuenta la 53 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 54 Tabla IV. Efectos conocidos de los distintos contaminantes25. Efecto S02 N02 PM 03 PFR ++ 0 + ++ HRB +/- + ? ++ Urgencias/Ingresos ? + ++ ++ Síntomas/Medicación ? + + + +/- +/- ? ++ Inflamación Respuesta alérgenos ? + ? +/- Cambios sitema inmune ? + ? + PFR: Pruebas funcionales respiratorias; HRB: Hiperreactividad bronquial 54 enorme dispersión en el tamaño de las distintas partículas que se encuentran en el aire, la existencia de una proporción elevada de estas partículas ultrafinas, de tamaño mínimo si se comparan con las estructuras celulares, debe jugar un papel importante a la hora de comprender los problemas que representan para el pulmón y ejercer mayores efectos tóxicos. Se ha descrito un incremento en la contaminación PM10 con una gran variedad de efectos. No obstante, los componentes de PM10 no parecen ser muy tóxicos cuando se les compara con la acción de sulfatos, nitratos, amonio, metales, etc. y parece demostrarse últimamente que la toxicidad de estas partículas radica sobre todo en las partículas ultrafinas71. Algunos estudios en humanos75 encuentran un descenso del pico de flujo por las tardes en pacientes asmáticos que se asocia al componente de partículas ultrafinas durante un episodio agudo de contaminación. No obstante, el peso de la evidencia de la importancia de estas partículas en la contaminación viene de estudios epidemiológicos y toxicológicos76 encontrándose una asociación con una mayor mortalidad por enfermedad cardiovascular y cáncer de pulmón en áreas urbanas77. También se describe una asociación aunque menor con un aumento en el número de hospitalizaciones, síntomas respiratorios y descenso en la función pulmonar78 sin poder, en este caso, eliminar el posible papel del tabaco, exposición ocupacional y otros factores79. Por último, se ha relacionado a las partículas finas y ultrafinas con el riesgo de desarrollar asma, especialmente en personas susceptibles80. De los estudios experimentales se deduce el impor- tante efecto inflamatorio de estas partículas ultrafinas que es mucho mayor que el de las partículas de mayor tamaño. COMENTARIOS FINALES Y CONCLUSIONES Indudablemente81, con los datos que tenemos podemos afirmar que la contaminación ambiental, aún considerando susceptibilidades individuales diferentes, es causa de síntomas respiratorios, exacerbaciones del asma y visitas a urgencias, deterioro en la función pulmonar, aumento del uso de medicación48, y posible aumento de la mortalidad. Finalmente, con todo lo anterior tenemos que intentar contestar a la siguiente pregunta: ¿la contaminación ambiental produce asma?. Esta pregunta no tiene una respuesta clara. Por una parte, los clásicos estudios de Alemania del este y del oeste82, en el que encuentra más prevalencia de asma en la zona menos contaminada; y los datos de los dos grandes últimos estudios epidemiológicos, European Community Respiratory Health Study (ECRHS) y el Internacional Study and Allergy in Childhood (ISAAC) en el que las mayores prevalencias de asma se encontraron en países como Nueva Zelanda y Australia, zonas donde la contaminación ambiental es escasa, parecen indicar que la contaminación ambiental no parece jugar un papel causal en el asma. Sin embargo, por otra parte, se han reportado recientemente datos que apoyan el papel causal de la contaminación en el asma. Niveles elevados de O37 incrementan el riesgo de asma en niños de California que realizan C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 05/12/2005 “ Ta b a c o , 17:53 PÆgina 55 c o n t a m i n a c i ó n deporte al aire libre, incrementando la inflamación de la vía aérea y la respuesta bronquial y también potenciando la respuesta a alergenos inhalados7,8. Así mismo, Brauer et al83, encuentran relación entre los niveles de PM2.5 y el diagnóstico de asma en niños de un año de edad. Por tanto, mientras que la mayoría de contaminantes conocidos provocan exacerbaciones de asma bronquial pero no parecen ser causa de la enfermedad, las partículas ultrafinas y el O3 a través de importantes efectos inflamatorios, potenciando los efectos de los alergenos inhalados e incluso activando el sistema inmunológico, no sólo causarían exacerbaciones sino que podrían ser causa de la enfermedad. Actualmente están en marcha distintos estudios longitudinales para intentar clarificar la relación entre polucionantes, en especial O3 y partículas finas y ultrafinas, y el desarrollo de asma, sobre todo en niños. a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” Figura 3.- Concentraciones de distintos metales en las PM. Estudio comparativo en las ciudades participantes en el ECRHS. Asma y condiciones metereológicas El posible efecto de las condiciones climáticas sobre la etiología del asma se ha evaluado desde hace años84,85,86. La mayoría de los estudios se refieren a la asociación entre las variaciones de las condiciones climatológicas, en corto espacio de tiempo, y la ocurrencia o severidad de síntomas en las enfermedades atópicas. Se ha asociado las exacerbaciones asmáticas con distintas estaciones87, caída de temperatura88, humedad relativa, días de niebla89 y tormentas90. Sin embargo, hay pocos estudios que evalúen los efectos de las condiciones climáticas en periodos largos de tiempo sobre la prevalencia de asma91. Respecto a la temperatura, las observaciones, en cortos espacios de tiempo, sobre los síntomas asmáticos muestran que las bajas temperaturas y, especialmente, las caídas bruscas de temperatura se asocian con exacerbación de la enfermedad asmática92,93. En el estudio de Weiland et al91 sobre los efectos del clima en largos periodos, basado en datos del estudio ISAAC, los autores encuentran una asociación positiva entre los síntomas asmáticos y la humedad relativa en el interior de las 55 Assessment of Chemical Elements on PM2.5 Collected in 21 European Cities of European Community Respiratory Health Survey II (ECRHS II)35. HU: Huelva. Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 56 casas (indoor), y una asociación negativa con la altitud, variación de temperatura y humedad relativa outdoor, indicando en sus conclusiones que el clima puede afectar la prevalencia de asma. La influencia de la altitud también ha sido evaluada94,95 en otros estudios encontrando datos similares. Respecto a la temperatura, Weiland et al91 no encuentran relación entre prevalencia de asma y la media anual de la temperatura outdoor, aunque sí la encuentra entre las medias de la temperatura mensual, especialmente en los fríos meses de invierno, y los síntomas asmáticos en niños europeos del estudio ISAAC. Resultados similares se aprecian en el ECRHS96, aunque estos datos no se confirman en otro estudio realizado en Nueva Zelanda97. En resumen, parece que algunas condiciones climáticas, especialmente en cortos periodos de tiempo, pueden provocar síntomas asmáticos y reagudizaciones. Por otra parte, algunos estudios recientes, aunque no hay uniformidad en los resultados, plantean la posibilidad de que determinadas condiciones climáticas pueden influir en la prevalencia de asma. De todas formas, como señalan diversos autores91 puede que los factores que causan exacerbaciones del asma sean diferentes a los que determinan un aumento de su prevalencia. Figura 4.- Relación entre tamaño de partículas y epitelio bronquial 56 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:13 PÆgina 57 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” Bibliografía 1. Linn William SA, Gong Henry Jr. The 21st century environment and air quality influences on asthma. Curr Opin Pulm Med 1999; 5(1): 21-29. 2. Thomas AE Platts-Mills, Kevin Blumenthal, Matthew Perzanowski and Judith A Woodfolk. Determinants of clinical allergic disease. The relevance of indoor allergens to the increase in asthma. Am J respir Crit Care Med 2000; 162: S128-S133. 3. Peat JK. The epidemiology of asthma. Curr Opin Pulm Med 1996; 2: 7-15. 4. Martínez FD, Stern DA, Wright AL, Taussing LM, Halonen M and the Group Health Medical Associates. Association of non- wheezing lower respiratory tract illnesses in early life with persistently diminished serum IgE levels. Torax 1995; 50:1067-72. 5. Forastire F, Agabiti N, Corbo GM, Pistelli R, Dell'Orco V, Ciappi G, Perucci C. Passive smoking as a determinant of bronchial responsiveness in children. Am J Respir Crit Care med 1994; 149: 365-70. 6. Duffy DL, Mitchell CA, Martin NG: Genetic and enviromental risk factors for asthma: a cotwin-control study. Am J respir Crit Care Med 1998; 157: 840-845. 7. McConnell R, Berhane K, Gilliband F et al. Asthma in exercicing children exposed to ozono: a cohort study. Lancet 2002; 359: 386-91. 8. Parnia S, Brown JL, Frew AJ. The ole of pollutants in allergic sensitization and the development of asthma. Allergy 2002; 57: 1111-7. 9. D`Amato G, Liccardi G, D`Amato M, Cazzola M. Respiratory allergic diseases induced by outdoor air pollution in urban areas. Monaldi Arch Chest Dis 2002; 57:161-3. 10. Sunyer J, Atkinson R, Ballester F et al. Respiratory effects of sulphur dioxide : a hierarchical multicity analysis in the APHEA 2 study. Occup Environ Med 2003; 60:e2. 11. Lin M, Chen Y, Villeneuve PJ, Burnett RT et al. Gaseosus air pollutants and asthma hospitalization of children with low household income in Vancouver. British Columbia. Canada. Am j Epidemiol 2004; 159: 294-303. 12. Wong GW, Lai CK. Outdoor air pollution and asthma. Curr Opin Pulm Med 2004; 10: 62-6.. 13. Convenio Marco de la OMS para el control del tabaco. Rev Esp. Salud Pública 2003;77:475-496. 14. Encuesta Nacional de Salud Pública 15. Carrión Valero, Hernández Hernández JR. El tabaquismo pasivo en adultos. Arch Bronconeumol 2002; 38 (3): 137-46 16. Samet JM; Tager IB, Speizer FE. The relationship between respiratory illness in childhood and chronic air-flow obstruction in adulthood. Am Rev Respir Dis 1983; 127:508. 17. Li YF, Gillilland FD, Berhane K, McConnell R, Gauderman WJ, Rappaport EB et al. Effects of in utero and environ- mental tobacco smoke exposure on lung function in boys and girls with and without asthma. Am J Respir Crit Care Med 2000;162:2097-104. 18. Gilliland FD, Li YF, Peters JM. Effects of maternal smoking during pregnancy environmental tobacco smoke on asth- ma and wheezing in children. Am J Respir Crit Care Med 2001; 163:429-36. 19. Weitzman M, Gortmaker S, Walker DK, et al: Maternal smoking and childhood asthma. Pediatrics 85:505-511, 1990. 20. Martinez FD, Wright AL, Taussig LM, et al: Asthma and wheezing in the first 6 years of life. N Engl J Med 332: 133- 138, 1995. 21. Cantani A, Micera M. Epidemiology of passive smoke: a prospective study in 589 children. Eur rev Med Pharmacol Sci 2005 Jan-Feb; 9(1): 23-30 22. Murray AB, Morrison BJ: The effect of cigarette smoke from the mother on bronchial responsiveness and severity of symptoms in children with asthma. J Allergy Clin Immunol 88:861-869, 1991. 57 Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:13 PÆgina 58 23. Peden DB. Influences on the development of allergy and asthma. Toxicology 2000;181-182:323-8. 24. Evans D, Levison J, Feldman CH, et al; The impact of passive smoking on emergency room visists of urban children with asthma. Am Rev Respir Dis 135; 567-572, 1987. 25. Larsson ML, Frisk M, Hallstrröm J, Kiviloog J, Lundbäck B. Environmental tobacco smoke exposure during childhood is associated with increased prevalence of asthma in adults. Chest 2001,120.711-7.-46 26. Leunberger P, Schwartz J, Ackermann-Liebrich U, Blaser K, Bolognini G, Bongard JP, et al. Passive smoking exposure in adults and chronic respiratory symptoms (SAPALDIA Study). Swiss Study on Air Pollution and Lung Diseases in Adults, SAPALDIA team. Am J Respir Crit Care Med 1994; 150:1222-8. 27. Larsson ML, Loit H-M, Meren M, Polluste J, Magnusson A, Larsson K, et al. Passive smoking exposure : a risk factor for chronic bronchitis and asthma in adults ? Chest 2002; 122:1086-90. 28. Eisner MD, Yelin EH, Henke J, SC, Blanc PD, Environmental tobacco smoke and adult asthma, the impact of chang- ing exposure status on health outcomes. Am J Respir Crit Care Med 1998; 158:170-5. 29. Burney PGJ, Britton JR, Chinn S, tattersfield AE, Papacosta AO, Kelson MC, et al. Descriptive epidemiology of brochial reactivity in an adult population: results from a community study. Thorax 1987; 42:38-44. 30. Gergen PJ. Environmental tobacco smoke as a risk factor for respiratory disease in children. Respir Physiol 2001; 128:39-46. 31. Jindal SK. Dutch Hypothesis revisited? Chest 2004;126: 329-31 32. Bernstein JA , Nel A, Peden D, et al. Healt effects o fair pollution. J Allergy Clin Inmunol 2004; 114 (5); 1116-23. 33. Vedal. Update on the health effects of outdoor air pollution. Clin Chest Med 23 (2002) 763-775 34. Samet JM, Zeger SL, Dominici F et al. The National Morbility, Mortality, and Air Pollution Study. Part II: Morbility and mortality from air pollution in the United States. Cambridge (MA): Health Effects Institute Reseach Report #94 (Pt 2); Jun 2000. 58 35. European Community Respiratory Health Survey (ECRHS). Report: página web ecrhs.org) 36. Avol EL, Gauderman WJ, Tan SM et al. Respiratory effects of relocation to areas of differing air pollution levels. Am J Respir Crit Care Med 2001; 164: 2067-72. 37. Mortality and morbidity during the London fog of December 1952. Report no.95 on Public Health and Medical Subjects. London: Her Majesty's Stationery Office: 1954. 38. Last JM. A dictionary of epidemiology. Oxford University Press 1983: 79. 39. Organisation mondiale de la santé, L'air. En : Risques pour la santé du fait de I'environnement. Ginebra 1972 : 21-50. 40. Agustí-Vidal A, Plaza V, Ramis L. Contaminación atmosférica y aparato respiratorio. JANO 1999; 39: 98-108. 41. Li N, Hao M, Phalen RF et al. Particulate air pollutants and asthma : a paradigm for the role of oxidative stress in PM-induced adverse health effects. Clin Inmunol 2003; 3: 250-65. 42. Harrod KS, Jaramillo RJ, Rosenberger CL et al. Increased susceptibility to RSV infection by exposure to inhaled diesel engine emissions. Am J Respir Cell Mol Biol 2003;28:541-63. 43. Goldberg M, Bailar III JC, Burnett RT et al. Identifying subgroups of the general population that may be susceptible to short-term increases in particulate air pollution: a time series study in Montreal, Québec. Cambridge MA). Health Effects Institute Research Report #9, October 2000. 44. Zanobetti A, Schwartz J. Are diabetics more susceptible to the health effects of airbone particles?. Am J Respir Crit Care Med 2001;164:831-3. 45. Ayerbe García R, Sánchez Rodríguez I, Huertas Cifredo MC, Pereira Vega A, Maldonado Pérez JA. Contaminación y asma. Otoneumoalergia Práctica 2002; 11 (3): 16-22. 46. Kirkpatrick MB, et al. Effect of the oronasal breathing route on sulfur dioxide-induced bronchoconstriction in exer- cising asthmatic subtects. Am Rev Respir Dis 1982; 125: 627-31. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:13 PÆgina 59 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” 47. Linn WS, et al. Respiratory effects of sulfur dioxide in heavily exercising asthmatic: A dose-response study. Am rev Respir Dis 1983; 127: 278-83. 48. Sunyer J, Spix C, Quenel P et al. Urban air pollution and emergency admissions for asthma in four European cities : the APHEA Project. Hhorax 1997; 52: 760-5. 49. Spengler J, Ryan PB, Schwab M, Colome S; Wilson AL, Billick I; Becker E. An overview of the los Angeles personal monitoring study. In: Total Exposure Assessment Methodology. Proceedings of the EPA/Air and Waste Management Associaton Specialty Conference. NV and Pittsburgh PA. AWMA. Las Vegas 1990: 65-85. 50. Quackenboss JJ, Spengler JD, Kanarek MS, Letz R, Duff CP. Personal exposure to nitrogen dioxide: relationship to indoor/outdoor air quality and activity patterns. Enviromental Science Technology 1986; 20:775-83. 51. Traynor GW, Apte MG, Arruthers AR, Dillworth JF, Prill RJ, Grimsrund DT, Turk BH. The effects of infiltration and insu- lation of the source strenghts and indoor air polution from combustion space heating appliances. Journal of the Air Pollution Control Association 1988; 38: 1011-15. 52. National Academy of Sciences Commission Of Life Sciences. Indoor Pollutants, National Academy Pres, washington DC 1981. 53. Pryor WA, Ligthsey JW. Mechanism of nitrogen dioxide reactions: initiation of lipid peroxidation and the production of nitrous acid. Science 1981; 214: 435-7. 54. Pryor WA. How far does 03 penetrate into the pulmonary air/tissue boundary before it reacts? Free Radic Biol Med 1992; 12: 83-88. 55. Overton JH, Miller FJ. Absorption of inhaled reactive gases. In: Gardner DE, Crapo JD, Massaro EJ, eds. Toxicology of th Lung. Raven Press, New York 1988: 477-508. 56. Evans MJ, Johnson LV, Stephens RJ, Freeman G. Renewal of the terminal bronchiolar epithelium in the rat following exposure to NO2 or 03. Lab Invest 1976; 35: 246-57. 57. MohseninV. Airway responses to 2.0 ppm nitrogen dioxide in normal subject. Arch Environ Health 1988; 43: 242-46. 58. Frampton MW, Morrow PE, Cox C, Gibb FR, Speers DM, Utell MJ. Effects of nitrogen dioxide exposure on pulmonary function and airway reactivity in normal humans. Am Rev respir Dis 1991; 143: 522-27. 59. Mohsenin V. Airway respones to nitrogen dioxide in asthmatic subjects. J Toxicol Environ Health 1987; 22: 371-80 60. Devalia JL, Rusznak C, Herdman MJ et al. Effect of nitrogen dioxide and sulphur dioxide on airway response of mild asthmatic patients to allergen inhalation. Lancet 1994; 344: 1668-70. 61. Devlin RB, McDonnell WF, Mann R, et al. Exposure of humans to ambient levels of ozone for 6'6 hours causes cellu- lar and biochemical changes in the lung. Am J Respir Cell Mol Biol 1991; 4: 72-81. 62. Patrick L Kinney. The pulmonary effects of ozone and particle air pollution. Sem Resp Crit Care Med 1999; 20 (6): 601-607. 63. Tarlo SM, Broder I,Corey P et al. The role of symptomatic colds in asthma exacerbations influence of outdoor aller- gens and air pollutans. J Allergy Clin Inmunol 2001; 108: 52-58. 64. Horstman DH, Folinsbee LJ, Ives PJ, Abdul-Salaam S, McDonnell WF. Ozone concentration and pulmonary response relationships fo 6'6 hour exposures with five hours of moderate exercise to 0'08, 0'10, and 0'12 ppm. Am Rev Respir Dis 1990; 142: 1158-1163. 65. Golden JA, Nadel JA, Boushey HA. Bronchial hyperirritability in healthy subjects after exposure to ozone. Am Rev Respir Dis 1978; 118: 287-94. 66. Thurston GD, Ito K, Kinney PL, Lippmann M, et al. A multi-year study of air pollution and respiratory hospital admis- sions in three New York State metropolitan areas: Results for 1988 and 1989 summers. J expo Anal Environ Epidemiol 1992; 2: 429-450. 67. Kinney PL, Ozkaynak H. Associations of daily mortality and air pollution in Los Angeles county. Environ Res 1991; 54: 99-120. 68. Feo Brito F, Gimeno Mur P, Martínez Delgado C y Suárez Lasierra. Asma y contaminación ambiental. Asma (volumen I): Capítulo 16; 257-271. mra ediciones. ISBN 84-88865-94-5. Depósito legal: B-47.797-2004. 59 Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:13 PÆgina 60 69. Nemmar A, Hoet PH, Vanquickenborne B et al. Pasaje of inhaled oarticles into the blood circulation in humans. Circulation 2002; 105:411-4. 70. Quality of Urban Air Review Group (QUARG). An excelent overview of the particle problem from sources and depo- sition curves to composition of PM 10 and source apportionment all the way to health effects. Airborne particulate matter in the United Kingdom: 3rd report of the Quality of Urban Air review Group. London: Quality of Urban Air review Group, 1996. 71. Donaldson K, Stone V, Clouter A, Renwick L, MacNee W. Ultrafine particles. Occup Environ Med 2001; 58 (3): 211-215. 72. Atkinson RW, Anderson HR, Sunyer J et al. Acute effects of particulate air pollution on respiratory admissions results from the APHEA 2 proyect. Am J Respir Crit Care Med 2001; 164: 1860-66. 73. Schwartz J, Slater D, Larson TV et al. Particulate air pollution and hospital emergency room visits for asthma in Seattle. Am Rev Respir Dis 1993; 147: 826-831. 74. Dockery D, Pope C, Xu X, Spengler J, Ware J, Fay M, Ferris B, Speizer F. An association between air pollution and mortality in six US cities. N Engl J Med 1993; 329: 1753-9. 75. Peters A, Wichmann HE, Tuch T, et al. Respiratory effects are associated with the number of ultrafine particles. Am J respir Crit Care Med 1997; 155: 1376-1383. 76. Serita f, Kyono H, Seky Y. Pulmonary clearance and lesions in rats after a sigle inhalation of ultrafine metallic nickel at dose levels comparable to the treshold limit value. Ind Health 1999; 37: 353-363. 77. CA Pope, RT Burnett, MJ Thun, et al. Lung Cancer, Cardiopulmonary mortality, and long-term exposure ti fine par- ticulate air pollution. JAMA 2002; 287: 1132-1141. 78. Schwartz J. Air pollution and hospital admissions for the elderly in Birminghan, Alabama. Am J Apidemiol 1994; 139: 589-598. 60 79. Evans JS, Tosteson T, Kinney PL. Cross-sectional mortality studies and air pollution risk assessment. Environ Internat 1984; 10: 55-83. 80. Tatum AJ, Shapiro GG. The effects ot outdoor air pollution and tobacco smoke on asthma. Inmunol Allergy Clin North Am 2005; 25 (1); 15-30. Review. 81. Gary W, Wong K and Leung TF. The effects af air pollution on asthma in children. Clin Pulm Med 2005; 12: 1-6. 82. Weiland SK, von Mutius E, Hirsch T et al. Prevalence of respiratory and atopic disorders among children in the East and West of Germany five years after unification. Eur Respir J 1999; 14: 862-870. 83. Brauer M, Hoek G, Van Vliet R et al. Air Pollution from traffic and the development of respiratory infections and asthmatic and allergic symptoms in children. Am J Respir Crit Care Med 2002; 166: 1092-8. 84. Tromp SW. Influence of weather and climate on asthma and bronchitis. Rev Allergy 1968;22:1027-44. 85. Cullen KJ. Climate and chest disorders in schoolchildren. BMJ 1972;4:65-7 86. Carey MJ, Cordon I. Asthma and climatic conditions: experience from Bermuda, an isolated island community. BMJ 1986;293:843-4. 87. Dales RE, Schweitzer I, Toogood JH, et al. Respiratory infections and the autumn increase in asthma morbidity. Eur Respir J 1996;9:72-7. 88. Harju T , Tuuponen T, Keistinen T, et al. Seasonal variations in hospital treatment periods and deaths among adult asthmatics. Eur Respir J 1998;12:1362-5. 89. Kashiwabaar K, Kohrogi H, Ota K, Moroi T. High frequency of emergency rooms visits of asthmatic children on misty or foggy nights. J Asthma 2002; 39(8): 711. 90. Celenza A, Fothergill J, Kupek E, et al. Thunderstorm associated asthma: a detailed analysis of environmental fac- tors. BMJ 1996;312:604-7. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:13 PÆgina 61 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” 91. Weiland SK, Hiising A, Strachan DP et al. Climate and the prevalence of symptoms of asthma, allergic rhinitis, and atopic eczema in children. Occupational and Environmental Medicine 2004;61:609-615. 92. Epton M, Martin I, Graham P. Climate and aeroallergen levels in asthma: a 12 month prospective study. Thorax 1997;52:528-34. 93. Larsson K, Ohlsen P, Larsson L, et al. High prevalence of asthma in cross-country skiers. BMJ 1993;307:1326-9. 94. Allegra L, Cogo A, Legnani D, et al. High-altitude exposure reduces bronchial responsiveness to hypoosmolar aerosol in lowland asthmatics. Eur Respir J 1995;8:1842-6. 95. Charpin D, Birnbaum J, Haddi E. Altitude and allergy to house dust mites. Am Rev Respir Dis 1991;143:983-6. 96. Verlato G, Calabrese R, De Marco R. Correlation between asthma and climate in the European Community Respiratory Health Survey. Arch Environ Health 2002;57:48-52 97. Hales S, Lewis S, Slater T, et al. Prevalence of adult asthma symptoms in relation to climate in New Zealand. Environ Health Perspect 1998;106:607-10 61 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 62 62 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:29 PÆgina 63 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” CUESTIONARIO 1. Según las últimas encuestas, la prevalencia del tabaquismo en España: a) Sigue aumentando b) Se mantiene sin cambios c) Disminuye, aunque muy lentamente d) Ha disminuido considerablemente e) Ninguna es correcta 2. La exposición al tabaquismo pasivo durante el embarazo y la primera infancia se asocia con: a) Déficits persistentes de la función pulmonar b) Episodios repetidos de sibilancias en los tres primeros años de la vida c) Mayor riesgo de padecer asma que los no expuestos d) Mayor riesgo de padecer episodios de sibilancias a lo largo de la vida e) Todas son correctas 3. En los niños con asma expuestos al tabaquismo pasivo, ¿Cuál afirmación no es correcta?: a) Tienen peor calidad de vida b) Sufren mas agudizaciones de asma c) Disminuye la hiperreactividad bronquial d) Aumenta el número de visitas a Urgencias e) C y D no son correctas 4. Según varios estudios, la relación entre tabaquismo pasivo y asma en adultos se distingue por: a) Entre los adultos no fumadores, los expuestos al tabaquismo pasivo tienen más prevalencia de asma que los no expuestos. b) La exposición al tabaquismo pasivo fuera de la casa -en los lugares de trabajo- se asocia con aumento del ries go de padecer sibilancias y asma c) La exposición al aire contaminado por el humo del tabaco (ACHT) se asoció con peor calidad de vida de los pacientes con asma pero no con mayor número de visitas a urgencias. d) Al cesar la exposición al ACHT los pacientes con asma no mejoran su calidad de vida e) C y D son falsas 5. ¿Cuál de las siguientes afirmaciones sobre la relación entre tabaquismo activo y asma es correcta? a) La hiperreactividad bronquial está aumentada en los fumadores sintomáticos pero no en los asintomáticos. b) El tabaquismo aumenta la sensibilización a los alergenos más comunes c) En los fumadores expuestos a agentes ocupacionales no se ha demostrado un aumento de la incidencia de asma d) Los fumadores activos no son menos propensos a desarrollar sensibilización alérgica e) El tabaquismo activo parece ser un factor desencadenante y agravante del asma 6. Entre los siguientes tipos de estudios, ¿cuál puede demostrar mejor una relación causal entre asma y contaminación ambiental? a) Estudios epidemiológicos b) Estudios de exposición en laboratorio en humanos c) Estudios de exposición en laboratorio en animales d) Todos ellos e) Ninguno de ellos 7. ¿Cuál de estos contaminantes se relaciona más como posible factor causal de asma? a) Ozono b) CO c) Partículas (PM) ultrafinas d) SO2 e) Ninguno de ellos 63 Asma I Fasc culo 2 Gon 05.qxd 13/12/2005 11:29 PÆgina 64 8. ¿Qué contaminante participa en la lluvia ácida? a) Ozono b) CO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos 9. ¿Qué población no es especialmente susceptible a la contaminación por PM ultrafinas? a) diabéticos b) asmáticos c) Pacientes con insuficiencia cardiaca d) Todos ellas e) Ninguno de ellas 10. ¿Qué contaminante se ha relacionado más con la broncoconstricción, sobre todo al realizar ejercicio? a) Ozono b) NO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos 11. ¿Qué contaminante se ha relacionado más con la hiperreactividad bronquial? a) Ozono b) NO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos 64 12. ¿Qué contaminante se ha relacionado como posible factor causal de asma? a) Ozono b) NO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos 13. ¿Qué contaminante se ha relacionado con la contaminación indoor? a) Ozono b) NO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos 14. ¿Respecto a los niveles Standard de los distintos contaminantes, cuál de las respuestas NO es cierta: a) Todos los contaminantes tienen un nivel umbral a partir del cual empiezan a ejercer efectos negativos sobre la salud. b) Los niveles permitidos pueden variar a lo largo de los años. c) Los niveles pueden variar en distintos países d) Todas son ciertas e) Ninguna es cierta 15. ¿Qué contaminante es reductor? a) Ozono b) NO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 13/12/2005 “ Ta b a c o , 11:29 PÆgina 65 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” 16. ¿Qué contaminante NO puede penetrar en las vías aéreas distales? a) Ozono b) NO2 c) Partículas Madre en suspensión(PM10) d) SO2 e) Ninguno de ellos 17. ¿Dónde parece que radica el principal efecto nocivo de las partículas en suspensión (PM)? a) Núcleo de carbón b) Su tamaño c) Metales adheridos al núcleo (P, Ti) d) Solubilidad e) Ninguno de ellos 18.¿Cuál es la afirmación incorrecta? a) La contaminación ambiental es causa de exacerbaciones del asma, sólo en algunos asmáticos predispuestos. b) La contaminación ambiental en asmáticos es causa de síntomas respiratorios, exacerbaciones de la enfermedad asmática, aumento del uso de medicación y deterioro de la función pulmonar. c) El ozono y las PM, especialmente las PM2.5 y partículas ultrafinas, pueden ser factores causales de asma. d) Están en marcha diversos estudios longitudinales para aclarar el papel causal de la contaminación ambiental sobre el asma. e) Ninguna es incorrecta. 19.¿ Se ha asociado a las exacerbaciones asmáticas con: a) distintas estaciones b) caída de temperatura c) humedad relativa, d) días de niebla y tormentas e) Todas ellas 20.En los estudios realizados en periodos de tiempo amplio, existe una asociación positiva entre los síntomas asmáticos y: a) la humedad relativa en el interior de las casas (indoor) b) la altitud c) variación de temperatura d) la humedad relativa outdoor e) Ninguna de ellas. 65 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 66 66 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd A s m a y 05/12/2005 “ Ta b a c o , 17:53 PÆgina 67 c o n t a m i n a c i ó n a m b i e n t a l y c o n d i c i o n e s m e t e r e o l ó g i c a s ” Respuestas fascículo 2, capítulo VII (Asma y “Tabaco, contaminación ambiental y condiciones metereológicas”) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 13.- a b c d e 67 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 68 14.- a b c d e 15.- a b c d e 16.- a b c d e 17.- a b c d e 18.- a b c d e 19.- a b c d e 20.- a b c d e 68 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 69 69 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 70 70 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 71 I n f e c c i ó n y a s m a Capítulo VIII INFECCIÓN Y ASMA . Fernando Duce Gracia Jefe de Servicio de Alergia Hospital Clínico Universitario “Lozano Blesa”. Zaragoza. Antonio Sebastián Ariño Medico adjunto del Servicio de Neumología Hospital Clínico Universitario “Lozano Blesa”. Zaragoza. 71 Correspondencia: Fernando Duce Gracia C/Condes de Aragón, 14 · 10ºB. 50009 Zaragoza. Correo electrónico: [email protected] Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 72 72 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 73 I n f e c c i ó n Resumen Algunas infecciones y subproductos bacterianos pueden ejercer efecto protector de atopia e indirectamente de asma, en contraste con ello infecciones por algunos virus respiratorios como el virus syncitial respiratorio (VSR) y parainfluenza pueden inducir el fenotipo asmático, sobretodo si se asocia con atopia. Por otra parte es bien conocido en estos últimos años la acción de los virus respiratorios en general y, preferentemente de los rinovirus, como responsables de ser la primera causa de exacerbación del asma. Existe controversia en la posibilidad de que infección por virus respiratorios y exposición alergénica tengan un efecto sinérgico en la producción de gravedad de las exacerbaciones. También es controvertido el papel de Clamidya pneumoniae y Micoplasma pneumoniae como responsables de exacerbación y modulación de la gravedad del asma. Introducción La relación entre infección y asma ha intrigado a clínicos y epidemiólogos en las dos últimas décadas. En la actualidad los puntos de estudio más destacados son el papel que juegan las infecciones en la primera infancia como inductoras del fenotipo asmático y, en contraposición, su acción protectora de atopia (asma, rinitis alérgica y dermatitis atópica). Por otra parte las infecciones por virus y algunas bacterias (Clamydia pneumoniae y Micoplasma pneumoniáe) pueden ser responsables de gran número de exacerbaciones de asma y posiblemente de modular la intensidad del asma crónico en términos de pérdida de función pulmonar o de requerimientos de medicación, véase tabla I. Infección en la primera infancia como protectora del fenotipo asmático Las enfermedades atópicas, como la dermatitis atópica, la fiebre del heno y el asma, han incrementado su prevalencia en todos los segmentos de edad en los países desarrollados, en contraposición con los no desarrollados. Esto ha llevado a plantear la hipótesis de la Higiene1,2. Existen estudios en que diversos factores se consideran protectores con respecto a desarrollar enfermedades atópicas, entre ellos, los más evidentes son el hecho de tener serología positiva al menos a dos de estas tres infecciones orofecales Hepatitis A, Toxoplasmosis y Helicobacter pylori3. Así mismo han sido considerados como factores protectores ir a las guardería4,5 o la exposición a endotoxinas en el primer año de vida6,7. En las últimas publicaciones sobre los posibles factores protectores e inducto- y a s m a Tabla I. Infección y asma. 1. Acción protectora de atopia (en el primer año de vida): Infecciones orofecales: Hepatitis A, Helicobacter Pylori y Toxoplasma gondii. Endotoxinas: Lipolisacáridos procedentes de bacteria gram negativas tipo E. coli 2. Acción Inductores de asma en la primera infancia Infecciones por virus respiratorios: Syncitial respiratorio. 3. Responsables de exacerbación de asma tanto en la infancia como en el adulto: Virus respiratorios: Rhinovirus, Parainfluenza A, Coronavirus. 4. Bacterias: Clamydia pneumoniae y Micoplasma pneumoniae Acción inductora de asma, modular gravedad del asma, responsable de exacerbaciones: ¿Clamydia pneumoniae? ¿¿ Micoplasma pneumoniae?? res del fenotipo de asma, a pesar de informes anteriores, han sido descartados como inductores la administración indiscriminada de antibióticos, las vacunas frente a diversas infecciones en la infancia. Se han descartado como protectores el haber sufrido Tuberculosis o haber sido vacunado con BCG. Las endotoxinas son lipopolisacáridos (LPS) que forman parte de la capa externa de la membrana celular de todas las bacterias gram negativas. Se encuentran en concentraciones elevadas en ambientes de granja (flora fecal de animales), pero también en guarderías, en el polvo de la casa y en ambientes sucios. Son un potente estimulador inmunológico de diversas células y pocos picogramos de ellas pueden inducir activación y secreción de citocinas TH1, como IL-12 e Interferon γ. Su acción inmunoestimuladora se realiza sobre el receptor CD14 y TLR4 de diversas células del sistema inmune. La exposición al ambiente de los establos y el consumo de leche de granja no pasteurizada, en niños 73 Asma I Fasc culo 2 Gon 05.qxd 74 05/12/2005 17:53 PÆgina 74 menores de 1 año, están asociados a menor frecuencia de asma comparado con los niños expuestos en edad más tardía, entre 1 y 5 años (1% vs 11%). De forma similar sucede con la fiebre del heno 3% vs 13% y la sensibilización atópica 12% vs 29%6. Las endotoxinas (LPS) presentes en los hogares también ejercían ese efecto protector. Braun-Farrländer y col7 estudiaron concentraciones de LPS en colchones de los dormitorios de los niños de edad escolar (6 a 13 años). En este trabajo se demostró que a mayor nivel de LPS en los colchones estudiados, los niños presentaban menos asma atópica, menos fiebre del heno y menos sensibilización atópica. Así mismo a mayor nivel de LPS se encontraban niveles inferiores de citocinas producidas por los lecucocitos, lo que indicaba una marcada regulación a la baja de la respuesta inmune de los sujetos expuestos. Posteriormente se ha defendido la hipótesis de que los LPS presentes en la leche no higienizada consumida durante el primer año de vida, inducen una respuesta inmune intestinal que desvía la respuesta TH2 hacia TH1. Sin embargo hay una subpoblación de niños de granjeros en los que el ambiente de la granja y la leche sin higienizar no ejerce su efecto protector8. Un polimorfismo del gen CD 14 interactúa con el medio ambiente de la granja y modifica la prevalencia de asma y alergia de los niños afectos a este polimorfismo. Estos niños no se benefician del efecto inmunomodular de los LPS y, por tanto, presentan la misma prevalencia de asma, fiebre del heno y atopia que los niños que no han estado sometidos a los ambientes de granja ni han bebido leche sin higienizar. Infecciones por virus en la primera infancia como responsables del fenotipo asmático. La infección por virus syncitial respiratorio (VSR) produce en los niños un patrón de síntomas llamado bronquiolitis que se parece mucho al cuadro clínico del asma infantil y del adulto. Desde 1980 a 1996 las cifras de ingresos hospitalarios de niños con bronquiolitis aumentaron substancialmente, como también lo hizo la proporción de ingresos por infecciones respiratorias que estaban asociadas con bronquiolitis . El VSR produjo el 70% de esos episodios, sin embargo, la bronquiolitis por VSR representa sólo la parte más grave de los casos de infección por VSR, ya que a la edad de un año el 50 al 65% de los niños han sido ya infectados por ese virus y a los dos años prácticamente el 100%. Los niños de 3 a 6 meses son los más proclives a desarrollar síntomas del tracto respiratorio inferior, lo que sugiere que debe de estar involucrado un componente del desarrollo (maduración pulmonar y/o inmunológica). Aunque existe controversia sobre la relevancia del antecedente de infección por VSR y desarrollo de sibilancias recurrentes, dos grandes estudios prospectivos a largo plazo han demostrado que dichas infecciones constituyen un factor de riesgo significativo e independiente para el desarrollo subsiguiente de sibilantes frecuentes, al menos en la primera década de la vida9,10,11. Se han involucrado tres posibles cofactores para determinar las relaciones entre la infección por VSR y asma. La respuesta inmune (innata y adaptativa como la posibilidad de desarrollar atopia) Diferencias relacionadas con el huésped (género masculino femenino, tamaño pulmonar, tabaquismo pasivo). La intensidad del daño de las vías aéreas inferiores que podrían influenciar el desarrollo de asma y sensibilización alérgica. Otros virus involucrados han sido el Parainfluenza e Influenza A. También han sido citados los Rinovirus como productores de bronquiolitis. Fernando Martinez y colaboradores son la referencia obligada cuando se estudia la evolución a largo plazo de las sibilancias recurrentes del niño. El mejor conocimiento de la maduración del sistema inmune y su respuesta a la acción de los virus a lo largo de los primeros años de la vida ha hecho que se vayan perfilando las hipótesis iniciales y que, poco a poco, conozcamos mejor aspectos de la patogénesis del asma. Por una parte se valoró la necesidad de que se asocie la existencia de atopia como determinante para que exista el fenotipo asmático, véase las figuras 1 y 2. Una contribución es que la presencia de Ig E específica frente algunos aeroalergenos es poco frecuente en los lactantes, sin embargo, cuando se presenta, se asocia de forma constante con asma futuro 14. En los dos últimos años han aparecido nuevos datos en que se valora más la respuesta TH1 gracias a las medidas de Interferon γ. La infección por Rinovirus produce una alteración en la respuesta TH1 pero no en la TH2, como consecuencia de ello se producen bajos niveles de Interferon gamma, lo que se asocia a infecciones agudas más intensas y retrasos en la eliminación del virus. Estos hechos repercuten en un aumento de la intensidad del asma medida por obstrucción al flujo aéreo e HRB . Las líneas de investigación actual sobre alteración de la regulación inmunológica en el asma se dirigen más hacia una respuesta deficiente TH1 que al clásico exceso de respuesta TH215. Infecciones por virus y exacerbaciones de asma. Las infecciones virales de las vías aéreas altas juegan un papel significativo en la producción de exacerbaciones agudas de asma, tanto en niños como en adultos. Estas exacerbaciones producen frecuentes visitas médicas e ingresos hospitalarios16. La enfermedad asmática se caracteriza por episodios de exacerbación que interrumpen épocas de buen control de los síntomas, que llamamos periodos intercríticos. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 75 I n f e c c i ó n y a s m a Figura 1.- Influencia de los virus sobre el asma. NIÑO SANO NIÑO O ADULTO ASMÁTICO VSR RINOVIRUS PIV Enfermedad sibilante Exacerbación asmática. Visitas a Urgencias Atopia Curación Ingresos Hospitalarios Asma PIV: Parainfluenza Figura 2.- Relaciones entre infecciones víricas, asma y alergia. 75 NIÑO SANO Genética Exposición ambiental: Contaminantes Alérgenos Sibilancias persistentes NIÑO O ADULTO ASMÁTICO Respuestas alérgicas aumentadas ¿Persistencia de virus? Th2 IL-4 IL-13 IL-5 Sibilancias agudas Expresión Moléculas adhesión Th1 IFN-γ IL-12 Aclaramiento virus Resolución Asma I Fasc culo 2 Gon 05.qxd 76 05/12/2005 17:53 PÆgina 76 Un problema al que nos enfrentamos es que no existe una definición universalmente aceptada de exacerbación asmática y, al plantearse los estudios, los investigadores utilizan de forma variable los síntomas, el consumo de agonistas Β2 adrenérgicos "a demanda", las caídas del FEM, la necesidad de curas de corticoides orales y los ingresos hospitalarios. En la actualidad se plantea que las exacerbaciones están producidas por causas diversas entre las que destacan las infecciones por virus respiratorios y la exposición alergénica, véase tabla II. La infección vírica más frecuente es el "resfriado común" que, a menudo, está causado por rinovirus, aunque existen otros virus que pueden producir síntomas de "resfriado común" como son Coronavirus, VSR, Parainfluenza tipos I-IV, Coxsackie A21 y B3, Echovirus tipos 11 y 20, Adenovirus y otros Picornavirus. Los rinovirus causan entre el 30-50% de todas las enfermedades respiratorias agudas. Su incidencia declina gradualmente con la edad, los niños se afectan varias veces por año y los ancianos algunas vez cada varios años. La infección puede darse durante todos los meses del año pero es más frecuentes a comienzos de otoño y entre la mitad y el final de la primavera. Se transmite por gotitas desde el estornudo, tos o contacto estrecho entre personas y puede extenderse a través de las manos o fomites con secreciones a partir de un enfermo. Hace ya 30 años que se demostró el papel de los virus respiratorios en las exacerbaciones de asma por medio de cultivo y métodos serológicos17. Posteriormente estos hallazgos se ratificaron en estudios en niños y adultos. El desarrollo de la reacción de la cadena de la polimerasa por transcripción inversa (RT-PCR) ha permitido estudiar mejor las infecciones virales y su posible relación con el asma. Nicholson y col.18 controlaron la evolución a 138 adultos con asma. Tomaron muestras de nariz, faringe y sangre periférica coincidiendo con síntomas de infección viral del tracto respiratorio o empeoramiento de su asma. Una cuarta parte de las infecciones víricas confirmadas se asociaron a descensos medios de FEM ≥50 ml/min y la mitad presentaron descensos medios ≥25 ml/min. En casi la mitad de exacerbaciones graves de asma (descensos de FEM ≥50 ml/min ) hubo patógenos respiratorios implicados, siendo los rinovirus los más frecuentemente identificados. Posteriormente se han realizado distintos estudios con diseños diferentes, pero globalmente sugieren que las infecciones víricas están involucradas en la mitad de las exacerbaciones asmáticas en los adultos y, en un número probablemente superior, en los niños. El virus más frecuentemente involucrado es el rinovirus19. Se han postulado diversos mecanismos de las exacerbaciones asmáticas inducidas por virus20, 21,22 véase tabla III y figura 3. Una pregunta que se plantean los investigadores es si los virus que exacerban el asma infectan o no las vías respiratorias inferiores como se expone en el trabajo de Gern y col 23. Busse y Gern24 revisan en una editorial reciente las diferencias existentes entre una exacerbación de asma causada por infección viral y aquellas producidas por exposición alergénica. La inoculación experimental por rinovirus (RV16) desencadena infección viral e incremento de los neutrófilos en sangre periférica y disminución de los linfocitos 48 después de la administración del virus. Así mismo se produce incremento del Factor estimulante de colonias de granulocitos (G-CSF) e IL-8 en el lavado nasal durante el "catarro agudo". La broncoscopia y el lavado broncoalveolar (BAL) permitieron valorar la presencia, a nivel bronquial, de neutrófilos activados e incremento del G-CSF25. Así se demostró que las exacerbaciones producidas por virus se caracterizan porque el neutrófilo es la célula inflamatoria predominante26 en contraste con lo que sucede en la provocación alergénica en que es el eosinófilo quien tiene el protagonismo. También se conoce que la broncodilatación inducida por los agonistas B2 adrenérgicos está atenuada por la acción de los virus, este hecho limita su efectividad 27. Por otra parte, en las exacerbaciones de asma por virus los esteroides inhalados ejercen menos beneficio tanto para prevenir como para revertirlas28. En el trabajo de Grissell y col.25 proponen a la IL-10 como un marcador de asma provocado por Rhinovirus tanto en niños como en adultos. Tabla II. Causas reconocidas de exacerbaciones de asma. Inhalación de alergenos Infección por virus respiratorios Contaminación atmosférica Tabaquismo Cumplimiento Accesibilidad al tratamiento Factores psicológicos Ingesta de fármacos. AINES en la idiosincrasia a los AINES. Betabloqueantes. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 77 I n f e c c i ó n y a s m a Tabla III. Posibles mecanismos responsables de las exacerbaciones asmáticas inducidas por virus. Infección directa del tracto respiratorio inferior Inducción de respuestas inflamatorias al rinovirus Reducción de la función pulmonar Exacerbación de la reactividad bronquial Regulación al alza de la expresión de ICAM-1 en el epitelio bronquial Mecanismos neuronales en la disfunción de la vías aéreas inducidas por virus Figura 3. Mecanismos neuronales en la disfunción de la vías aéreas inducidas por virus EFECTO DEL VIRUS EFECTO DEL VIRUS Respuesta parasimpática aumentada Aumento actividad eferente de los nervios colinérgicos eferentes Neuraminidasa viral Disfunción M2 inducida por PCE Mecanismos M2-independientes Broconstricción secundaria a fibras-C sensitivas Aumento de la respuesta contractil a neurokininas Inhibición de neuronas no adrenérgicas no colinérgicas Reducción de producción de NO Interacciones entre infecciones virales y exposición alergénica en personas con asma. En los últimos años han surgido algunos estudios que sugieren que los virus y los alergenos podrían poseer un efecto sinérgico en su acción inductora de exacerbaciones de asma. La actuación conjunta de virus y alergenos sería capaz de aumentar el número de exacerbaciones en comparación a cuando actúan de forma independiente. La utilización de la infección experimental en voluntarios, con y sin rinitis/asma alérgica, ha permitido la realización de comparaciones directas de síntomas del "resfriado común" en ambos grupos. La provocación 77 Asma I Fasc culo 2 Gon 05.qxd 78 05/12/2005 17:53 PÆgina 78 antigénica en un segmento pulmonar mediante broncoscopia ha sido utilizada para analizar directamente los aspirados bronquiales y los tejidos del las vías aéreas inferiores durante una infección vírica aguda. Esto nos han permitido conocer los mecanismos subyacentes de los efectos combinados de la infección vírica y la exposición a un alergeno sobre la inflamación y la función de las vías aéreas. Distintos estudios experimentales muestran datos contradictorios en el sentido de que alergenos y virus puedan actuar conjuntamente para exacerbar al asma. Por una parte nos encontramos trabajos como el de De Kluijver y col29 en el que, la exposición a bajas dosis repetidas de lunes a viernes dos semanas consecutivas con alergeno Der p 1 (alergeno principal del Dermatophagoides pteronyssinus) y posteriormente infectados con Rinovirus (RV16) los días 15 y 16, no mostraban sinergismo. La exposición al alergeno produjo caídas del FEV1 (p < 0.001), aumento de la hiperreactividad bronquial (HRB) a histamina (p < 0001) y aumento del NO exhalado (p < 0.01) así como del porcentaje de eosinófilos en esputo (p < 0.001). La infección experimental con RV 16 aplicando gotas en fosas nasales no tuvo efecto sinérgico, potenciando las alteraciones producidas por la inhalación del alérgeno. Calhoun y col.30 utilizaron provocación bronquial segmentaria con alergeno y BAL para investigar el efecto del la provocación alergénica en individuos sensibilizados y no sensibilizados antes, durante y después de la inoculación con RV-16. El BAL de los pacientes con rinitis alérgica durante la infección viral aguda y un mes después demostró una liberación de histamina significativamente aumentada inmediatamente después de la provocación antigénica local, así como un reclutamiento de eosínófilos a las vías aéreas significativamente mayor 48 horas post-provocación . Estos cambios no se observaron en los sujetos sanos ni en los alérgicos antes de la infección. Parece que, en los sujetos alérgicos, la infección por RV-16 determina un aumento de la inflamación de las vías aéreas después de la provocación antigénica local que persiste hasta un mes después de la infección. En la clínica diaria Green y col31 estudian la importancia de la sensibilización y exposición a alergenos y de la infección viral como factor precipitante de exacerbación de asma que requiere ingreso hospitalario en adultos. El diseño del estudio era de caso control con pacientes ingresados por asma, ingresados por otro motivo no respiratorio, y con pacientes asmáticos estables no ingresados. Detectaron infección por virus respiratorios en 31 de 177 pacientes: 10 por picornavirus y 21 por coronavirus, no se detectaron otros virus respiratorios ni bacterias atípicas. Se detectó infección en el 26.2 % de los ingresados por asma y solamente en el 8.5% del grupo control. Los pacientes hospitalizados con asma tenían en sus domicilios altos niveles de Der p 1(ácaro), Fel d 1 (gato), can f 1 (perro). Concluyen los autores que la combinación de sensibilización, exposición intensa a uno o más alergenos y detección de virus, aumentaba considerablemente el riesgo de ser ingresado por asma (OR = 8.4). Clamydia pneumoniae (Cpn) y Micoplasma pneumoniáe (M pn) como causantes de exacerbaciones e inductores de gravedad de asma. En las últimas décadas se han producido grandes avances en el conocimiento de la etiopatogenia del asma, sin embargo persisten lagunas con respecto a la causa de muchos casos de asma no relacionados con atopia. En 1991 Hahn y col. publicaron un estudio prospectivo32 en que relacionaban infección aguda respiratoria por Cpn y asma. A partir de entonces surgieron una serie de estudios que relacionaban el asma y las infecciones respiratorias por dos bacterias atípicas como son C pn y M pn. En la última década se están incrementando las evidencias del papel de esta bacteria atípica en el desarrollo de la inflamación típica de asma aumentando su gravedad, causando un asma "de novo" y como responsables de las exacerbaciones33. Aunque las dos bacterias han sido involucradas, la gran mayoría de estudios se han realizado con C pn. La mayor evidencia de relación entre C pn y desarrollo de asma posterior se sugirió a partir del seguimiento de los 20 pacientes con criterios serológicos de infección aguda por C pn realizada por Hahn32. Este autor comprobó que existían 2 patrones serológicos distintos. En ninguno de los 10 pacientes con asma crónico se habían cuadruplicado los títulos de anticuerpos, al contrario de los 10 pacientes que presentaban un primer episodio de sibilancias. Además, 8 pacientes de este último grupo presentaron Acs IgM detectables, lo que indicaba infección aguda. Cunningham y col34 realizan un estudio longitudinal de 13 meses en 108 niños de 9 a 11 años con síntomas asmáticos persistentes. La infección por C pn fue demostrada con PCR, serología de Ig A secretora específica de C pn. En este estudió se concluyó que no había evidencia que relacionase la infección aguda por C pn y las exacerbaciones agudas de asma. Sin embargo sí hubo evidencia de que la infección crónica por C pn era más frecuente en los niños con numerosas exacerbaciones. Estos resultados sugieren que la infección crónica por C pn promueve una inflamación persistente de las vías aéreas que aumenta la susceptibilidad a otros estímulos que exacerban el asma como puedan ser los virus respiratorios y los alergenos. Posteriormente se han realizado diversos estudios sobre la relación de C pn y asma con resultados muchas veces contradictorios, lo que podría deberse a diferencias metodológicas tanto en lo referente al diagnóstico de asma según se base en criterios clínicos o funcionales como al diagnóstico de la infección según se base en serología o cultivo o PCR. Estos hechos justifican la diferencia de resultados en cuanto a responsabilizar a estos gérmenes de las exacerba- C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 79 I n f e c c i ó n ciones y, sobre todo, de la modulación de la gravedad. Los trabajos clínicos investigando el papel de ambas bacterias se han realizado fundamentalmente en ámbito extrahospitalario. En ellos se ha demostrado que estas infecciones están asociadas con sibilancias "de novo" en algunos pacientes y que, en algunos de ellos, se hacen persistentes y lleva al diagnóstico de asma con todas sus características clínicas y funcionales típicas. Es interesante el limitado número de ejemplos en los que se ha conseguido remisiones completas (al menos durante uno o dos años) en algunos de esos pacientes después de tratamientos prolongados con antibióticos macrólidos. Algunas de esas publicaciones incluso han documentado la asociación de erradicación microbiana con remisión del asma. Podemos concluir que existe una evidencia que permite sugerir un papel de las infecciones por bacterias atípicas en la iniciación del asma al menos en una pequeña subpoblación de pacientes. Sin embargo, todos estos estudios pueden haber incluido pacientes asmáticos leves no diagnosticados. Se requiere que se realicen estudios prospectivos a largo plazo con pacientes no asmáticos. Las guías actuales recomiendan que no se utilicen antibióticos de forma rutinaria en las exacerbaciones de asma. A pesar de ello el estudio TELICAST35 comparó pacientes con exacerbación de asma tratados de la forma habitual más placebo en el grupo control en comparación con pacientes tratados de forma habitual más Telitromicina durante 10 días. Se demostró evi- y a s m a dencia de infección por Ç pn por PCR, cultivo y serología en 128 de 223 pacientes evaluados (57.3%). Los pacientes tratados con Telitromicina tuvieron mejoría relevante clínicamente en síntomas asmáticos y función pulmonar. Con respecto a M pn todavía sigue sin aclararse si juega un papel directo en la patogénesis del asma de algunos pacientes tanto de forma aguda como crónica o si su localización en las vías aéreas de los asmáticos se debe simplemente a la presencia de inflamación subyacentes de las vías aéreas que se da "per se" en el asma36. En resumen, parece existir una evidencia creciente de que las bacterias atípicas son contribuyentes a la patogenia e intensidad del asma. Está claro que las infecciones respiratorias por estas bacterias pueden inducir daño epitelial de las vías aéreas, véase tabla IV, que finalice en una obstrucción al flujo aéreo y clínica de asma. Es un tema que crea inquietud en la actualidad y moviliza nuevas investigaciones. La mejoría de los métodos de detección y de cultivo de C pn y M pn ayudará a determinar la prevalencia real de infección aguda y crónica por estas bacterias en los pacientes asmáticos. La investigación actual responderá a preguntas cruciales respecto a qué importancia tienen las bacterias atípicas en la patogénesis del asma o si su prevalencia está incrementada en los asmáticos simplemente porque hay una inflamación crónica de las vías aéreas u otros factores predisponentes todavía sin identificar37. 79 Tabla IV. Posibles puntos de actuación de Clamydia en la patogenia del asma. Observación Disminución de la motilidad ciliar Ig E específica de C pn, asociada con asma infantil y asma de comienzo del adulto, con cultivo (+). C pn infecta los monocitos e induce TNF- , IL1-b e IL-6 "in vitro" Papel potencial en la patogenia Alteración del aclaramiento mucociliar IgE incita broncoespasmo agudo y puede llevar a inflamación crónica en el niño y en el adulto. Inflamación pulmonar C pn infecta macrófagos alveolares in vivo e In vitro e induce especies reactivas de O2, TNF- , IL-1 e IL-8 in vitro in vitro. Inflamación y producción de radicales libres. Suprarregulación respuestas IgE C pn infecta células de músculo liso humano "in vivo" del músculo liso bronquial Efecto sobre la hiperreactividad del músculo liso bronquial C pn infecta células de músculo liso bronquial humano in vitro, para producir IL-6 y factor de crecimiento fibroblástico Basico. Inflamación y remodelado de las vías aéreas Tabla modificada de referencia38. Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 80 80 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 81 I n f e c c i ó n y a s m a Bibliografía 1. Strachan DP: Hay fever, higiene, and household sizze. BMJ 1989;299:1259-1260. 2. Weiss ST. Eat Dirt - The Hygiene Hypothesis and Allergy Diseases. N Engl J Med, 2002; 347:930-931. 3. Matricardi PM, Rosmini F, Riondino S . Exposure to foodborne and orofecal microbes versus airborne viruses in rela- tion to atopy and allergic asthma: Epidemiological study. BMJ 2000;320:412-417. 4. Von Mutius E, Martinez FD, Fritzsch C, Nicolai T, Roell G, Thieman HH. Prevalence of asthma and atopy in two area of West and East Germany. Am J Respir Crit Care Med 1994;149:358-364. 5. Kramer U, Heinrich J, Wjst M, Wichmann HE. Age of entry to day nursey and alergy in later childhood. Lancet 1999;353:450-454. 6. Riedler J, Braun-Fahrländer Ch, Eder W, Schreuer M, Waser M, L, Maisch S, Carr D, Schierl R, Nowak D, Von Mutius E. and the ALEX study Team. Exposure to farming in early life and development os athma and allergy: a cross-sectional survey. The Lancet. 2001. 358:1129-1133. 7. Braun-Fahrländer Ch, Tiedler J, Herz U, Eder W, Waser M, Grize L, Maisch S, Carr D, Gerlache AB, Von Mutius E. For The Allergy and Endotoxine Study Team. Enviromental exposure to endotoxin and its relation to asthma in school-age children. N Engl J Med, 2002; 347:869-877. 8. Eder W, Klimecki W, Yu L, von Mutius E, Riedler J, Braun-Fahrländer Ch, Nowak D, Martinez F. A Polimorphism in the CD14 Gene Is Associated with Asthma and Allergies in Rural Children Exposed To Farm Milk in Early Life. Am J Respir and Crit Care Medicine. 2003:A578. 9. Sigurs N, Bjarnason R, Sigurbergsson F: Respiratory Syncityal virus bronchiolitis in infancy is an important risk factor for asthma and allergy at age 7. Am J Respir Crit Care Med. 2000;161:1501-1507. 10. Sigurs N, Gustafsson PM, Bjarnason R, Lundberg F, Schmitdt S, Sigurbergsson F, Kjellman B. Severe Respiratorory Syncytial Virus Bronchiolitis in infancy and Asthma and Allergy at Age 13. Am J Respir Crit 2005;171:137-141 Care Med. 11. Castro-Rodriguez JA, Holberg CJ, Wright AL, Martinez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med 2000;162:1403-1406. 12. Ball TM, Castro-Rodriguez JA, Griffith KA, Holberg CJ, Martinez FD. Siblings, daycare attendance, and the risk of asthma and wheezing during childhood. N Engl J Med 2000; 343:538-543. 13. Martinez FD. Development of wheezing disorders and asthma in preschool children. Pediatrics 2002; 109:362-367. 14. Kotaqniemi-Syrjanen A, Reijonen TM, Romppanen J, Korhonen K, Savolainen K, Korppi M. Allergen specific immunoglobulin E antibodies in wheezing infants: the risk for asthma in later childhood. Pediatric 2003;111:255-61. 15. Brooks GD, Buchta KA, Swenson CA, Gem JE, Busse WW. Rhinovirus-induced interferon gamma and airway respon- siveness in asthma. Am J Respir Crit Care 2003;168:1091-94. 16. Murray CS, Simpson A, Custovic A: Allergens, viruses, and asthma exacerbations. Proc Am Thorac Soc. 2004; 1: 99-104. 17. Minor TE, Dick EC, De Meo AN, Ouellette JJ, Cohen M, Reed CE: Viruses as precipitants of asthmatic attacks in chil- dren. JAMA 1974; 227: 292-298. 18. Nicholson KG, Kent J, Ireland DC: respiratory viruses and exacerbations of asthma in adults BMJ 1993; 307: 982-986. 19. Johnston SL, Pattemore PK, Sanderson G, Smith S, Lampe F, Josephs L, Synington P, O´Toole S, Myint SH, Tyrrell DA. Community study of role of viral infections in exacerbations of asthma in 9-11 year old children. BMJ 1995; 310: 1225-1229). 20. Fraenkel SJ, Bardin PG, Sanderson G, Lampe F, Johnston SL, Holgate ST: Lower airways inflammation during rhi- novirus colds in normal and in asthmatics subjects. Am J Respir Crit Care Med 1995; 151: 879-886.1 81 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 82 21. Grunberg K, Sharon RF, Hilterman TJ, Brahim JJ, Dick EC, Sterk PJ, Van Krieken JH: Experimental rhinovirus 16 infection increases intercellular adhesión molecule-1 expression in bronchial apithelium of asthmatics regardless of inhaled steroid treatment. Clin Exp Allergy 2000; 30: 1015-1023. 22. Schwarze J, Gelfand EW. The role of viruses in development or exacerbation of atopic asthma. Clin Chest Med 2000;21:279-287. 23. Gern JE, Galagan DM, Jarjour NN, Dick EC, Busse WW: Detection of rhinovirus RNA in lower airway cells during experimentally induced infection. Am J Respir Crit Care Med 1997; 155: 1159-1161. 24. Busse WW, Gern JE: Is Interleukin-10 a in virus provoked asthma? Am J Respir Crit Care Med 2005; 172:405-409. 25. Grissell TV, Powell H, Shafren DR, Boyle MJ, Hemsley MJ, Jones PD. Interleukin-10 gene expression in acute virus- induced asthma. Am J Respir Crit Care Med 2005;172:433-439. 26. Jarjour NN, Gern JE, Kelly EA, Swenson CA, Dick CR, Busse WW. The effect of an experimental rhinovirus 16 infec- tion on bronchial lavage neutrophils. J Allergy Clin Immunol 2000;105:1169-1177. 27. Reddel H, Ware S, Marks G, Salome C, Jenkins C, Woolcock A. Differences between asthma exacerbations and poor asthma control. Lancet 1999;353:364-369. 28. Harrison TW, Oborne J, Newton S, Tattersfield AE. Doubling the dose of inhaled corticosteroid to prevent asthma exacerbations: randomised controlled trial. Lancet 2004;363:271-275. 29. De Kluijver J, Evertse CE, Sont JK, Schrumpf JA, Van Zeijl- Der Ham CJ, Dick CR, Rabe KF, Hiemstra PS, Sterk PJ,. ¿Are rhinovirus-induced airway responses in asthma aggravated by chronic allergic exposure? Am J Respir Crit Care Med (2004 on line) 30. Calhoun WJ, Swenson CA, Dick EC, Schwartz LB, Lemanske RF, Busse WW: Experimental rhinovirus 16 infection potentiates histamine release after antigen bronchoprovocation in allergic subjects. Am Rev Respir Dis 1991; 144: 1267-1273 31. Green RM, Custovic A, Sanderson G, Hunter J, Johnston SL, Woodcock A: Synergism between allergens and viruses 82 and risk of hospital admisión with asthma: case-control study. BMJ 2002; 324: 763. 32. Hahn DL, Dodge R, Golubjatnikov R. Association of Chlamydia pneumoniae (Strain TWAR) infection with wheezing, asthmatic bronchitis, and adult-onset asthma. JAMA 1991; 266:225-230. 33. Hahn DL, McDonald R: Can acute Chlmaydia pneumoniae infection initiate chronic asthma?. Ann Allergy Asthma Immunol 1998; 81: 339-344 34. Cunningham A, Johnston SL, Julious SA . Association between nasal sIgA to chronic Chlamydia oenumoniae infec- tion and asthma exacerbation in children. J Allergy Clin Immunol 1996;97:305. 35. Johnston SL, Blasi F, Black PN, , Martin RJ, Farrell DJ, Nieman RB. Telithromycin in acute exacerbations of asthma. The TELICAST study. Proceedings of the American Thoracic Society. 2005; 2: A569 36. Lemanske RF. Is Asthma an Infectious Disease?. Chest 2003;123:Suppl. 385S-390S. 37. Hahn DL. Chlamydia/Mycoplasma. Do they cause new-onset asthma in adult? En Respiratory Infections in Allergy and Asthma, ed Johnston Sl and Papadopoulos NG. Marcel Dekker Inc New York-Basel 2003; 645-662. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 83 I n f e c c i ó n y a s m a CUESTIONARIO 1. Uno de los siguientes hechos no supone efecto protector ni favorecedor para la atopia, "fiebre del heno" y asma atópico. a) Beber leche no higienizada en el primer año de la vida. b) Haber vivido durante el primer año de la vida en ambiente de granja c) Haber sido tratado de forma intensa y con frecuencia con antibióticos durante la primera infancia. d) Ir a la guardería en el primer año de vida. e) Tener serología positiva en la primera infancia al menos a dos de las tres infecciones siguientes: Hepatitis A, Toxoplasmoxis o infección por Helicobacter pylori. 2. Una de las siguientes afirmaciones no es cierta con respecto a las endotoxinas. a) Son Lipopolisacáridos b) Se encuentran en ambientes de granja, polvo de casa y guarderías. c) Su acción se realiza estimulando el receptor CD 14 de células del sistema inmune. d) Tener polimorfismo del gen CD 14 supone la mayor acción protectora de las endotoxinas para atopia, rinitis alérgica y asma. e) Los lipopolisacáridos forman parte de la capa externa de la membrana de las bacterias gram negativas. 3. Los siguientes virus producen infecciones agudas respiratorias pero, uno de ellos, ha sido el más estu diado desde el punto de vista epidemiológico como inductor del fenotipo de asma a) Adenovirus b) Virus syncitial respiratorio c) Coxsackie A 21 d) Rinovirus (V16) e) Coronavirus 4. Existen varios cofactores que, sumados a la acción de los virus, favorecen el fenotipo asmático. ¿Cuál de los siguientes es sin duda el más importante? a) Atopia b) Tabaquismo pasivo c) Sexo d) Tamaño pulmonar e) Inmunodeficiencia primaria 5. Los niños en el primer año de vida sufren bronquiolitis con gran frecuencia. ¿Cuál de las siguientes afirmaciones sobre bronquiolitis no es cierta? a) La mayor parte de ellas están producidas por el VRS. b) Los virus Parainfluenza y Rinovirus en algunas ocasiones también son responsables de bronquiolitis. c) La Bordetella pertusis en los lactantes produce bronquiolitis y aumenta el riesgo de sufrir asma a los diez años de edad. d) El hecho de sufrir un episodio grave de bronquiolitis por VSR favorece el desarrollo del fenotipo de asma. e) La combinación de atopia y bronquiolitis por VSR supone el mayor factor de riesgo para desarrollar el fenotipo asmático. 6. Las investigaciones que relacionan en niños lactantes bronquiolitis, sibilancias persistentes, atopia, interferon han dado lugar a diversas hipótesis. Indique cuál de las siguientes no ha sido emitida ni man tenida en los últimos 20 años a) La presencia de Ig E específica frente a aeroalergenos habituales en los lactantes se asocia de forma constante con asma en el futuro. b) La infección por Rinovirus en el lactante produce disminución en los niveles de Interferon . c) Los bajos niveles de interferon se asocia a infecciones agudas más frecuentes en el primer año de vida. d) Los bajos niveles de interferon se asocia con un retraso en la eliminación de virus tras la infección por rinovirus. e) La infección por bacterias gram positivas y gram negativas en el primer año de la vida y la posterior sensibili zación a las mismas condicionará la aparición de asma futuro. 83 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 84 7. Las infecciones respiratorias son responsables de exacerbaciones agudas de asma en el niño. ¿Cuál de los siguientes agentes infecciosos es el responsable de mayor número de exacerbaciones? a) Mycoplasma pneumoniae b) Clamydia pneumoniae c) Coronavirus d) Rinovirus e) Parainfluenzae tipos I - IV 8. Las infecciones respiratorias son responsables de exacerbaciones agudas de asma en el adulto. ¿Cuál de los siguientes agentes infecciosos es el responsable de mayor número de exacerbaciones? a) Neumococo b) Mycoplasma. Penumoniae. c) Clamydia pneumoniae d) Hemophilus influenzae e) Rinovirus 9. Están reconocidas las siguientes causas de exacerbación de asma. ¿Cuál de ellas es la que desencadena mayor número de episodios? a) Ingesta de fármacos AINES en la idiosincrasia a los AINES. b) Ingesta de fármacos betabloqueantes c) Factores psicológicos d) Tabaquismo e) Infecciones por virus respiratorios 84 10. Los virus que desencadenan las exacerbaciones asmáticas actúan posiblemente por los mecanismos siguientes. ¿Cuál de ellos no se ha considerado? a) Formación de complejos inmunes Ig A secretora/virus. b) Exacerbación de la reactividad bronquial. c) Regulación al alza de la expresión de ICAM-1 en el epitelio bronquial. d) Reducción de la función pulmonar e) Infección directa del tracto respiratorio inferior 11. Actualmente se conoce que la inoculación viral por Rinovirus (RV16) desencadena una serie de efectos en el sistema inmune. ¿Cuál de los siguientes no es cierto? a) Incremento del Factor estimulador de colonias de granulocitos (G-CSF). b) Incremento de neutrofilos en sangre periférica. c) Incremento de eosinófilos en la pared bronquial. d) Incremento de G-CSE en lavado nasal. e) Incremento de IL - 8 en lavado nasal. 12. Las exacerbaciones de asma inducidas por virus respiratorios producen los siguientes hechos menos uno, señálelo. a) La broncodilatación inducida por los agonistas B2 adrenérgicos es normal y no se atenúa su efectividad. b) Es causa de aumento de hospitalización en niños con asma c) Es causa de aumento de hospitalización en adultos con asma d) Aumentan el número de visitas no programadas en asmáticos tanto niños como adultos. e) Los controles de FEM durante las exacerbaciones están claramente disminuidos 13. ¿Cuál de las siguientes afirmaciones sobre las exacerbaciones de asma por virus es cierta. a) Los esteroides inhalados se ha demostrado que son útiles para prevenirlas b) Los esteroides inhalados se ha demostrado que son útiles para revertirlas c) Los antibióticos de amplio espectro disminuyen las complicaciones de las exacerbaciones por virus. d) Aumentan la hiperreactividad bronquial inespecífica. e) Se previenen con la vacunación para Influenza A 14. Todos los siguientes procedimientos menos uno se han utilizado en la investigación de las exacerbaciones de asma por virus. a) Serología b) Test cutáneos de hipersensibilidad C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 85 I n f e c c i ó n c) d) e) y a s m a Reacción de la cadena de la polimerasa por transcripción inversa. Lavado broncoalveolar Infección experimental con Rinovirus (RV16) 15. Los virus respiratorios inducen disfunción de las vías aéreas. Se defienden varios mecanismos neuronales en su producción. ¿Cuál de los siguientes es erróneo?. a) Aumento de la producción de NO b) Aumento de la respuesta contráctil a neurokininas c) Aumento actividad eferente de los nervios colinérgicos eferentes d) Neuraminidasa viral e) Disfunción de los receptores M2 16. Un tema a debate es las interacción entre infección respiratoria por virus y exposición alergénica en personas con asma. Se han expuesto varios resultados en este sentido menos uno de los siguientes. a) Poseen un efecto sinérgico. b) No poseen un efecto sinérgico c) La inoculación con RV-16 tras la exposición segmentaria alergénica aumenta la liberación de histamina de forma significativa en el individuo asmático y alérgico. d) La exposición alergénica repetida durante dos semanas produce caídas del FEV1, Hiperreactividad bronquial a histamina, aumento del NO exhalado y aumento de porcentaje de eosinófilos en esputo. e) La exposición alergénica repetida más la inoculación experimental con RV-16 favorece la sobreinfección por bacterias gram positivas. 17. En un estudio realizado para valorar la posible acción sinérgica de infección por virus respiratorios y exposición alergénica se demostraron una serie de hechos menos uno de los siguientes. a) La infección por virus respiratorio era más frecuente en los pacientes ingresados por asma que en el grupo ingresado por causa no respiratoria. b) La exposición intensa a uno o más alergenos y la detección de virus aumentaba considerablemente el riesgo de ser ingresado por asma. c) En los pacientes con asma estables no ingresados la infección por virus respiratorios era menos frecuente que en los pacientes ingresados. d) Los pacientes que habían recibido vacuna con virus influenza sufrieron menor número de exacerbaciones por virus. e) Los pacientes ingresados por asma y que eran alérgicos, muchos de ellos estaban polisensibilizados a varios aeroalergenos. 18. Señale uno de los siguientes métodos diagnósticos que no se ha utilizado en la investigación de la relación entre infección por C pn y exacerbación de asma. a) Serología de C pn en el inicio de la exacerbación de asma y seis semanas después. b) Tratamiento de prueba con macrólidos. c) PCR en exudado bronquial d) Cultivo e) Características clínicas de la exacerbación. 19. El estado actual del conocimiento sobre la implicación de C pn y M pn en el asma permite garantizar con base científica una de las siguientes afirmaciones. a) La C pn está demostrado que es la primera causa de exacerbaciones del asma. b) Parece existir una evidencia creciente de que C pn contribuye a la patogenia e intensidad del asma. c) M pn juega un papel directo e importante en la patogenesis del asma d) El tratamiento de las exacerbaciones de asma con macrólidos está indicado en las Guías actuales de asma. e) Hay evidencia definitiva que relaciona infección aguda por M pn y las exacerbaciones agudas por asma. 20. Se ha valorado el papel potencial de C pn en la patogenia del asma en todas las siguientes observaciones menos en una de ellas. a) C pn infecta células de músculo liso bronquial influyendo en la HRB b) Disminución del aclaramiento mucociliar c) Aumento de la motilidad ciliar d) C pn infecta macrófagos alveolares induce inflamación y producción de radicales libres. e) En estudios "in vitro" C pn infecta músculo liso bronquial humano produciendo factor del crecimienrto de fibroblástos. 85 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 86 86 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 87 I n f e c c i ó n y a s m a Respuestas fascículo 2, capítulo VIII (Infección y Asma) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 11.- a b c d e 12.- a b c d e 13.- a b c d e 87 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 88 14.- a b c d e 15.- a b c d e 16.- a b c d e 17.- a b c d e 18.- a b c d e 19.- a b c d e 20.- a b c d e 88 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 89 Asma I Fasc culo 2 Gon 05.qxd 05/12/2005 17:53 PÆgina 90 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 2 Curso de f.m.c. SEPAR con el patrocinio GlaxoSmithKline 2 Edita Depósito legal: MPrinted in Spain Imprime: José San Germán Impresor S.L. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 3 B a s e s a l é r g i c a s d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . Capítulo IX BASES ALÉRGICAS DEL ASMA. MASTOCITOS Y ANTICUERPOS IGE Santiago Quirce Gancedo Médico Adjunto del Servicio de Alergología. Fundación Jiménez Díaz. Madrid Teresa Carrillo Díaz Jefe de Sección. Servicio de Alergología. Hospital Universitario Dr. Negrín. Las Palmas de Gran Canaria. Profesora Asociada de Medicina. Universidad de Las Palmas de Gran Canaria. 3 Correspondencia: Santiago Quirce Gancedo Fundación Jiménez Díaz, Avda. Reyes Católicos, nº 2 28040-MADRID Correo electrónico: [email protected] Teresa Carrillo Díaz Hospital Universitario Dr. Negrín, Barranco de la Ballena s/n 35020-Las Palmas de Gran Canaria Correo electrónico: [email protected] Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 4 4 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 5 B a s e s a l é r g i c a s d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . BASES ALÉRGICAS DEL ASMA. MASTOCITOS Y ANTICUERPOS IGE Resumen Los anticuerpos IgE tienen un papel central en la patogenia de las enfermedades alérgicas, incluida el asma. Durante la respuesta alérgica, inicialmente se estimulan los linfocitos B alergeno-específicos, seguido de la producción de IgE específica para ese determinado alergeno gracias a la activación por IL-4 e IL-13, que son liberadas por los linfocitos T cooperadores de tipo Th2. Una vez que se producen estos anticuerpos IgE específicos, se fijan a los mastocitos y a otras células, como los linfocitos, que se verán estimuladas y activadas cuando entren de nuevo en contacto con el alergeno. Los anticuerpos IgE intervienen de forma crítica tanto en la respuesta asmática inmediata como en la respuesta tardía tras la inhalación del alergeno. La intervención de la IgE en estas respuestas y su participación en la reacción alérgica en general se debe a su interacción con los receptores de alta afinidad (FcεRI), localizados en mastocitos y basófilos, y con los receptores de baja afinidad (FcεRII) que amplifican las respuestas inmunes humorales y celulares. caracterizan al asma son las manifestaciones clínicas de la inflamación crónica y persistente de la vía aérea en la cual la IgE juega un papel fundamental. El concepto de que la IgE tiene un papel central en el asma alérgica deriva de un primer estudio poblacional en el que se demostró una relación muy significativa entre los niveles de IgE y la prevalencia de asma (5). Con posterioridad otros autores han confirmado la naturaleza alérgica de la mayoría de los asmas (6). Aunque en general, el fenotipo clínico dominante en el asma grave suele ser no alérgico, cursando con niveles más bajos de IgE que los que se detectan en pacientes con asma leve o moderada (7), sin embargo, en un estudio recientemente publicado, más de la mitad de pacientes con asma grave tenían pruebas cutáneas positivas frente a los aeroalergenos más comunes (8). Es posible que en pacientes con asma grave, la producción local de IgE sea más relevante que la IgE circulante, tal y como sugieren los resultados de algunos trabajos (9). Dominios variables (V): Región de unión al antígeno Dominios Constantes (C): VL Introducción Los anticuerpos conocidos como inmunoglobulinas E (IgE) tienen un papel fundamental en las enfermedades alérgicas. Prausnitz y Kütner (1) en 1921 demostraron por primera vez la existencia de un factor sanguíneo capaz de transferir desde un paciente alérgico a uno sano la sensibilidad a alergenos, pero hubo de pasar más de 50 años para que el matrimonio Ishizaka (2) identificara a este factor como un nuevo tipo de inmunoglobulina. La IgE fue oficialmente reconocida por la OMS en 1968 (3). Esta inmunoglobulina actúa como receptor para el alergeno en la superficie de los mastocitos y los basófilos, siendo la responsable de la constitución atópica, es decir de la predisposición genética a presentar reacciones de hipersensibilidad contra antígenos comunes en el medio ambiente (4). Se sabe en la actualidad que tanto la limitación al flujo aéreo como las crisis de disnea sibilante que Cadenas ligeras VH Bucles de Peptidos que contienen regiones hipervariables (CL) S S Cadena pesada (CH) Puentes Disulfuro S S Fragmentos de unión al antigeno (Fab) S S Cε2 Cε3 Dominios IgE Cε4 Fragmento cristalizable (Fc) Figura 1. Estructura básica de la IgE 5 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 6 IgE: propiedades diferenciales La IgE es sintetizada y segregada por linfocitos B estimulados por la interleucina 4 (IL-4) o la interleucina 13 (IL-13) durante la respuesta secundaria. Constituye menos del 0,001% de todas las inmunoglobulinas circulantes y tiene una concentración media en el suero de 0,1-0,4 µg/ml. Su semivida sérica es de aproximadamente 2,5 días prolongándose, sin embargo, hasta 12 semanas cuando se une a sus receptores específicos situados en la superficie de los mastocitos y los basófilos tisulares. 6 La IgE es una inmunoglobulina citofílica, que se une a las células por interacción de su fragmento Fc con receptores específicos de superficie. Su estructura básica, al igual que la del resto de las inmunoglobulinas, consta de dos cadenas polipeptídicas ligeras (clase κ o λ) y de dos cadenas polipeptídicas pesadas (clase ε), organizadas en cuatro dominios (figura 1). La IgE tiene un coeficiente de sedimentación de 8S, un peso molecular de 188.000 daltons y se caracteriza además, por su alto contenido en carbohidratos. Sus propiedades biológicas más destacadas son: a) Es termolábil, inactivándose a 56º C durante 2-4 horas; b) No activa el sistema del Complemento por la vía clásica, aunque si lo puede hacer por la alternativa; c) No atraviesa la placenta; d) Es capaz de sensibilizar tejidos homólogos, fijándose a mastocitos y basófilos; e) Se encuentra siempre en forma de monómero y f) Está presente en el suero en cantidades mínimas y no se detecta por los métodos habituales de cuantificación utilizados para el resto de inmunoglobulinas. La digestión enzimática de la IgE con papaína produce tres fragmentos, un fragmento constante (Fc) que contiene las porciones carboxiterminales de las cadenas pesadas y dos fragmentos variables (Fab) formados por las cadenas ligeras y las porciones aminoterminales de las cadenas pesadas (10). La IgE se une a los alergenos a través de la región Fab mientras que la interacción con sus receptores específicos se produce a través de la región Fc. Se ha identificado un segmento de la cadena pesada ε (330-335) como sitio de unión al receptor de alta afinidad para la IgE (FcεRI). Se trata de un segmento de 13 aminoácidos localizados en la región Cε3, siendo los 12 primeros aminoácidos imprescindibles para que la unión se produzca. La interacción de la IgE con el otro receptor específico, el receptor de baja afinidad (FcεRII) se produce también en el dominio Cε3, aunque en una localización distinta a la zona de unión del FcεRI. alta afinidad de la IgE, FcεRI, se expresa fundamentalmente en los mastocitos y los basófilos, aunque también puede estar presente en los eosinófilos, los neutrófilos, las plaquetas y en las células presentadoras de antígenos (CPAs) (11). Es el receptor responsable de la iniciación de las reacciones alérgicas mediadas por IgE. El número de FcεRI por mastocito o basófilo, es extraordinariamente alto, entre 104 y 106, pero, curiosamente, para que la degranulación celular tenga lugar, se necesita solamente la activación de un 1% a un 15% de los mismos. Se sabe que la interacción entre la IgE y los FcεRI de los mastocitos y los basófilos regula la expresión de estos receptores en estas células (12). Se ha demostrado que los individuos con altos niveles de IgE presentan un incremento de receptores por basófilo con respecto a la población general (13). El FcεRI, se compone de cuatro cadenas polipeptídicas estructuradas en: una unidad para la unión con la IgE, compuesta por la cadena α y una unidad de señalización del receptor formada por la cadena β y dos cadenas γ idénticas, (14). Como ya se ha mencionado, la unión de la IgE con el FcεRI se produce mediante la interacción del tercer dominio del Fc (Cε3) de la IgE con la cadena α (figura 2). La afinidad del receptor es muy alta por lo que consigue fijar IgE incluso a concentraciones mínimas. Su activación, que conduce a la liberación de los mediadores de estas células (15), es modulada por receptores inhibidores, siendo de gran relevancia el receptor denominado FcγRIIb (16). Ambos receptores pueden ser puenteados por IgG específica de alérgeno impidiendo la activación de los FcεRI y por ende la reacción alérgica (17). Se sabe que la estimulación del FcεRI en los mastocitos produce cambios sustanciales en la expresión de más de 2.400 genes, mientras que la activaSitio de la unión a la IgE VH VL CL Cε1 Cε2 Cε3 FcεRI α2 Cε4 α1 exterior Membrana celular Receptores de la IgE Se han identificado hasta la fecha dos tipos de receptores para la IgE estructural y funcionalmente muy diferentes: Receptor de alta afinidad (Fc εRI): El receptor de α β γ γ interior Figura 2. Interacción de la IgE y el FcεRI C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 7 B a s e s a l é r g i c a s ción de estos mismos receptores en los basófilos produce una respuesta similar pero no idéntica (18). Receptor de baja afinidad (Fc εRII): Los receptores de baja afinidad (FcεRII), están presentes en diversos tipos de células. Se han identificado dos subformas del FcεRII humano: FcεRIIa, expresado de forma constitutiva por las células B, y el FcεRIIb, también llamado CD23, inducido por la IL-4, y que se encuentra en las células T y B, los monocitos y los macrófagos. El FcεRII no pertenece a la superfamilia de las inmunoglobulinas (19) y en su secuencia extracelular presenta una estructura tipo lectina que parece actuar en la adhesión celular. Se encuentra en la superficie celular formando un trímero y se cree que su acción es dual, de modo que inicialmente produce un aumento en la producción de IgE, ayudando en la presentación del alergeno y posteriormente, en presencia de un exceso de IgE y de antígeno, actúa como un regulador negativo de la síntesis de IgE (20). Determinación de la IgE La presencia de IgE frente a alergenos se puede investigar mediante pruebas in vivo (fundamentalmente pruebas cutáneas) o mediante las pruebas in vitro (técnicas de laboratorio). A continuación se analizaran brevemente estos procedimientos: Tests in vivo (pruebas cutáneas): las pruebas cutáneas fueron utilizadas por primera vez en 1865 por Blackley y hasta hace muy pocos años eran el único método disponible para el diagnóstico de las enfermedades alérgicas. A pesar del desarrollo de potentes métodos de estudio in vitro, ninguna de estas técnicas es comparable a las pruebas cutáneas en cuanto a su bajo coste, simplicidad, rapidez de realización y alta sensibilidad. De todas las técnicas utilizadas, la prueba por punción o prick-test, es la más aceptada. Se realiza en la superficie volar del antebrazo a 5 cm de la muñeca y a 3 cm del codo al objeto de conseguir una zona de sensibilidad homogénea: se deposita sobre la superficie intacta de la piel una gota del extracto alergénico que se testa y a través de la misma se punciona la piel empleando una lanceta cuya punta arrastra una minúscula cantidad de alergeno y la introduce en las capas más superficiales de la piel (21). Las gotas de alergeno(s) se deben separar entre sí 2 o 3 cm como mínimo y se debe usar una lanceta por extracto para evitar la contaminación. La lectura de las pruebas se efectúa de 15 a 20 minutos después, valorándose la presencia de eritema y midiéndose el diámetro mayor del habón obtenido. La mayoría de los autores considera una prueba en prick positiva cuando el diámetro mayor de la pápula es igual o superior a 3 mm. La presencia de una prueba positiva no indica necesariamente alergia clínica y viceversa. Una prueba positiva sólo indica presencia de anticuerpos d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . homocitotrópicos fijados en la piel (normalmente IgE) para un alergeno determinado, pero no que haya una relación con los síntomas. Por ello, los resultados de las pruebas deben interpretarse, siempre, en relación con la historia clínica. Así, una prueba positiva con aeroalergenos junto a una historia de sensibilidad clínica compatible es indicativa de que el alergeno es la causa de la enfermedad y a la inversa, una prueba negativa con una historia no compatible descarta la enfermedad alérgica. Test in vitro: El descubrimiento en 1967 de la IgE y el desarrollo que experimentaron los métodos de laboratorio en la década de los 80, ha supuesto un cambio muy importante en el estudio de las enfermedades alérgicas. En la actualidad, la aplicación de los métodos de laboratorio para la detección de anticuerpos séricos se utiliza de manera complementaria en la evaluación alergológica, siendo las técnicas más utilizadas la cuantificación de la IgE sérica total y la detección de anticuerpos específicos de la clase IgE. Estos procedimientos presentan una serie de ventajas e inconvenientes respecto a las pruebas cutáneas mencionadas anteriormente. Las ventajas son que no hay riesgo para el paciente, que los resultados no están influenciados por la toma de fármacos y están más indicados en ciertos grupos de pacientes como los niños o los pacientes con dermografismo o con dermatitis atópica. Entre los inconvenientes destacan su menor sensibilidad, su mayor coste, la necesidad de infraestructura de laboratorio y, por último, que los resultados no se obtienen inmediatamente (22). Para la cuantificación de IgE total e IgE específica en suero se han desarrollado distintos métodos de inmunoanálisis basados en el radioinmunoanálisis (RIA) o en el enzimoinmunoanálisis (EIA). La mayoría de ellos son técnicas tipo sándwich, siendo las más utilizadas en la actualidad las técnicas de EIA. Son determinaciones semicuantitativas o cuantitativas en las que se emplea una mezcla de sueros de referencia del que se conoce la cantidad de IgE total que contiene. Estos sueros se han referenciado respecto a un patrón estándar de la Organización Mundial de la Salud (OMS) cuantificado en unidades internacionales (UI). De esta forma, las determinaciones de IgE se realizan en UI/ml o ng/ml (1 UI= 2,44 ng/ml). La cuantificación de IgE específica presenta varios problemas entre los que destacan la variación de las concentraciones de IgE específica en función de la exposición al alergeno, la posibilidad de que el paciente responda a la exposición al alergeno produciendo IgG y no IgE, el que los sueros con gran contenido en IgE total puedan producir falsos positivos y la incorrecta estandarización de alergenos (23). La determinación de IgE específica es una práctica habitual en alergología, utilizándose principalmente en: a) pacientes en los que las pruebas cutáneas son de difícil valoración (lactantes, pacientes con enfer- 7 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 8 medad cutánea diseminada, dermografismo o urticaria); b) en pacientes en los que las pruebas cutáneas pueden ser peligrosas por su elevada sensibilización; c) como apoyo al diagnóstico, ante unas pruebas cutáneas dudosas o de difícil interpretación; d) en algunas enfermedades alérgicas tales como la hipersensibilidad a veneno de himenópteros, en las que la determinación de IgE específica constituye uno de los criterios diagnósticos; e) cuando el paciente está siendo tratado con fármacos que influyen en la reacción cutánea tales como antihistamínicos o antidepresivos; f) en alergenos donde las pruebas cutáneas tienen escasa sensibilidad, tales como algunos alimentos; y g) para el estudio de sensibilización a alergenos que no pueden ser utilizados en las pruebas cutáneas tales como tóxicos o potentes sensibilizantes (24). importante en la defensa frente a parásitos y posiblemente frente a ciertas bacterias. Los MC están implicados en respuestas relacionadas con la hipersensibilidad inmediata, como el asma, la rinitis, la urticaria y la anafilaxia (26). En este tipo de respuesta alérgica, inicialmente se activan los linfocitos B alergeno-específicos. Esto va seguido de la producción de IgE específica para ese determinado alergeno gracias a la estimulación por IL-4 e IL-13, que son liberadas por los linfocitos T cooperadores de tipo Th2. Los anticuerpos IgE específicos se fijan a los mastocitos y a otras células, como los linfocitos, que se verán estimuladas y activadas cuando entren de nuevo en contacto con el alergeno (figura 3). La activación del MC a través del FcεRI requiere en primer lugar la unión de la IgE monοmérica, secreta- Mastocitos Los mastocitos (MC) son células mononucleares CD34+, derivadas de la médula ósea, que expresan en su superficie el receptor FcεRI. Se han identificado dos subpoblaciones de mastocitos: triptasa positivos y triptasa-quimasa positivos, si bien el papel exacto de estas dos subpoblaciones no está aún esclarecido. Los MC maduros poseen una marcada heterogeneidad y sus características morfológicas y funcionales dependen de su localización anatómica (25). 8 Los MC se encuentran presentes en prácticamente todos los tejidos, algunos de los cuales, como las mucosas, la dermis o los vasos sanguíneos, representan puertas de entrada de diversos agentes patógenos, lo que explicaría el papel de estas células en la inmunidad innata. Asimismo, los MC tienen un papel Figura 4. El entrecruzamiento de la IgE unida a los receptores de alta afinidad de los mastocitos provoca la desgranulación y conseguiente liberación de los mediadores contenidos en los gránulos y de los mediadores lipídicos recién sintetizados (adaptado de ref. 30). da por las células plasmáticas, al receptor de superficie seguida por la interacción de un alergeno multivalente que se une a dos moléculas de IgE; ambas uniones son necesarias para iniciar la desgranulación (27). La agregación de los receptores pone en marcha una serie de reacciones bioquímicas, con movilización del Ca++ intracelular, que finalmente se traducen en la liberación de mediadores preformados o sintetizados de novo con potentes efectos biológicos (figura 4). Figura 3. Principales mecanismos humorales y celulares de la respuesta alérgica mediada por IgE (ver texto) Tras su liberación, los mediadores de la hipersensibilidad inmediata causan rápidamente edema de la mucosa bronquial, secreción de moco y contracción del músculo liso y, además, intervienen en el reclutamiento de células inflamatorias que infiltran la mucosa bronquial. La secuencia de acontecimientos es muy similar en los basófilos. En pacientes asmáticos que inhalan un C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 9 B a s e s a l é r g i c a s alergeno al que están sensibilizados, estos acontecimientos celulares y moleculares se traducen en obstrucción aguda al flujo aéreo, causando la reacción asmática inmediata (28). En muchos de estos pacientes, la broncoprovocación con el alergeno induce, además de la respuesta asmática inmediata, una reacción asmática tardía, que tiene lugar 4 a 12 horas después. Los mecanismos por los que los mastocitos pueden intervenir en la respuesta tardía de la reacción alérgica incluyen la síntesis y liberación de quimiocinas, que atraen a células inflamatorias, y la liberación de citocinas, como TNF-α , que induce la expresión de moléculas de adhesión por las células endoteliales, lo que permite la adhesión y migración de las células inflamatorias desde el compartimiento vascular a la mucosa de las vías respiratorias (29). A continuación se repasan los principales mediadores derivados de los mastocitos (25, 30). HISTAMINA La histamina es producida por los MC, los basófilos y las plaquetas y se almacena en los gránulos secretores. Diferentes estímulos inmunológicos o no inmunológicos dan lugar a una rápida desgranulación con liberación de la histamina. Los efectos de la histamina se median por los receptores H1, H2, y H3. A través de los receptores H1 se produce aumento de la permeabilidad vascular, contracción del músculo liso bronquial e intestinal, aumento de la producción de moco, del ritmo y flujo cardiacos, flushing y reclutamiento de neutrófilos y eosinófilos. Los efectos mediados por los receptores H2 incluyen aumento de la permeabilidad vascular, de la secreción ácida gástrica y de la producción del moco en la vía aérea, junto con una inhibición del reclutamiento de neutrófilos y eosinófilos. El papel de los receptores H3, localizados en el cerebro, no está claramente establecido. d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . Entre las acciones de las triptasas in vitro se incluyen la inactivación del fibrinógeno y la inhibición de la fibrinogénesis, la activación de las metaloproteasas (MMP) de la matriz tisular incluyendo la MMP-3, la inactivación de algunos neuropéptidos como el VIP con acción broncodilatadora, la estimulación de la proliferación de fibroblastos y de la síntesis de procolágeno, la actividad quimiotáctica para eosinófilos y sobre la regulación de la síntesis de IL-8 y expresión de ICAM-1 (CD54) en células del epitelio bronquial. La población de MC humanos MCTC contiene quimasa y catepsina G. Entre las funciones de la quimasa mastocitaria cabe destacar que posee una eficacia 100 veces mayor que el enzima convertidor de la angiotensina para la conversión de la angiotensina I en angiotensina II, inactiva la bradicinina y los neuropétidos VIP y sustancia P, degrada la laminina, el colágeno tipo IV y la fibronectina y, por lo tanto, la membrana basal. La carboxipeptidasa A es específica de los MC y degrada los residuos carboxi terminal de los aminoácidos alifáticos y aromáticos de las proteínas tras la exposición a proteasas quimiotrípticas. MEDIADORES LIPÍDICOS Estos mediadores se generan después de la activación del MC, en contraste con los mediadores preformados y almacenados en los gránulos que se liberan por un proceso de exocitosis. Los fosfolípidos de la membrana son la fuente del ácido araquidónico utilizado para la síntesis de eicosanoides, prostaglandinas (PG) y leucotrienos (LT). Las fosfolipasas A2 liberan el ácido araquidónico de los fosfolípidos proporcionando el sustrato para los eicosanoides y para la síntesis del PAF. Las PG endoperóxido sintetasas (PGHS-1 y 2 o ciclooxigenasa 1 y 2) metabolizan directamente el ácido araquidónico a los intermediarios PGG2 y PGH2 que son ulteriormente procesados por las PG sintetasas terminales. PROTEOGLICANOS Los gránulos del MC humano son ricos en proteoglicanos, responsables de su metracromasia al teñirse con el azul de toluidina, que contienen heparina y condroitín sulfato. La heparina es un potente anticoagulante, inhibe la cascada del complemento, y potencia la acción de agentes angiogénicos como el bFGF (factor de crecimiento de fibroblastos). Los MC contienen PGD sintetasa, que convierte la PGH2 en PGD2, y 5-lipooxigenasa (5-LO) que convierte el araquidonato en el intermediario 5-HPETE, y éste en LTA4 que da origen al cisteinil leucotrieno LTC4 por la acción de la LTC4 sintetasa, o al dihidroxileucotrieno LTB4 por la acción de la LTA4 hidrolasa. PROTEASAS Las triptasas, las proteasas predominantes en los MC, son proteínas catiónicas tetraméricas que forman un complejo macromolecular con la heparina y tienen actividad serina endopeptidasa con una especificidad tripsina-like frente a aminoácidos básicos de las proteínas. Los niveles de β-triptasa en suero aumentan a los pocos minutos de una reacción anafiláctica y alcanzan su pico máximo entre una y dos horas después. Se ha detectado un aumento de la triptasa en el lavado broncoalveolar de los asmáticos y en la secreción nasal de pacientes con rinitis alérgica, lo que reflejaría la existencia de desgranulación mastocitaria confirmada por biopsia (31). La capacidad para producir eicosanoides por los MC humanos varía dependiendo de los tejidos. La inhalación de PGD2 produce contracción del músculo liso bronquial (32). La PGD2 inhibe la agregación plaquetaria, ejerce una acción quimiotáctica sobre los neutrófilos y activa a los eosinófilos. Los MC humanos activados producen el cisteinil leucotrieno LTC4 y, en mucha menor cantidad el LTB4. El LTC4 da origen a los metabolitos activos LTD4 y LTE4. Estos mediadores aumentan la permeabilidad vascular y son potentes inductores de las respuestas de eritema y mácula mantenidas. En respuesta a su inhalación se produce una broncoconstricción 100 veces más potente que la 9 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 10 inducida por la histamina y estas mismas diferencias relativas se mantienen en la respuesta de la vía aérea en los sujetos asmáticos (33). Los niveles de los cisteinil LT y sus metabolitos acilados LTE están elevados en la secreción nasal de los pacientes con rinitis alérgica y en el lavado broncoalveolar y la orina de sujetos asmáticos. El PAF (factor activador plaquetario) se produce y secreta por MC humanos estimulados (34). El PAF actúa, a través de un receptor específico, como quimioatrayente para los eosinófilos, los neutrófilos, los monocitos y los macrófagos. En los tejidos, el PAF induce broncoconstricción y aumento de la permeabilidad vascular. CITOCINAS El MC es una fuente de diversas citocinas que participan en el reclutamiento y activación de otras células en las zonas de inflamación (35). Los MC son una fuente de citocinas tipo Th2 cuya importancia en la perpetuación de la respuesta alérgica es bien conocida. Los MC humanos producen IL-4 in situ y los MC aislados de pulmón liberan IL-4 al ser activados con IgE y alergeno. También se han detectado IL-5 e IL-6 en los MC de pulmón y mucosa nasal en los sujetos alérgicos (30). Los MC aislados de pulmón activados a través del FcεRI producen IL-5 bioactiva que es un potente inductor de la maduración del eosinófilo. 10 El TNF-α puede ser constitutivamente almacenado en los gránulos, pero la mayoría se genera por activación inmunológica (36). El TNF-α mastocitario aumenta la expresión del ELAM-1 y del ICAM-1 (CD54) en las células endoteliales facilitando la adhesión y el aflujo de eosinófilos y linfocitos T al lugar de la inflamación. Figura 5. Los mastocitos son las células inflamatorias predominantes en el músculo liso bronquial de los pacientes con asma. Estos mastocitos se encuentran activados y producen autacoides como histamina, PGD2 y LTC4, que inducen broncoconstricción y estimulan la secreción de moco, contribuyendo a la patogenia del asma. Además, los mastocitos producen otros mediadores como el TGF-β , el factor de crecimiento derivado de las plaquetas (PDGF) y el factor de crecimiento de los fibroblastos (FGF), triptasa y quimasa que contribuyen a la hipertrofia y probablemente a la disfunción de músculo liso bronquial (modificado de ref. 38). INTERACCIÓN MÚSCULO LISO BRONQUIAL Y MASTOCITOS Estudios recientes han mostrado que los mastocitos infiltran los haces de células musculares lisas en el asma pero no en la bronquitis eosinofílica. Además, el número de mastocitos en el músculo liso se correlaciona con la hiperreactividad bronquial (HRB) (37). Los mastocitos producen una variedad de mediadores lipídicos, citocinas, quimiocinas y enzimas que pueden interaccionar con las células musculares lisas bronquiales, inducir proliferación del músculo liso y participar en el desarrollo de la HRB (figura 5) (38,39). A su vez, las células musculares lisas pueden producir factor stem cell y otras quimiocinas, citocinas y factores de crecimiento que actúan en el reclutamiento, diferenciación y retención de los mastocitos. En el asma, la infiltración de la vía aérea por mastocitos es dependiente de linfocitos T, y las citocinas Th2 provenientes de los linfocitos T y de otras células intervienen en la expansión de los mastocitos a partir de precursores circulantes o tisulares. Los datos recientes sobre la interacción mastocitos-músculo liso bronquial sugieren que este fenómeno podría contribuir de forma muy relevante en la HRB y la patogénesis del asma. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 11 B a s e s a l é r g i c a s d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . Bibliografía 1. Prausnitz C, Kütner H. Stüdien uber die Ueberempfindlichkeit. Zentralbl Bakteriol Parasit Infektion Hygiene 1921; 86: 160-9. 2. Ishizaka K, Ishizaka T. Identification of ?E-antibodies a carrier of reaginic activity. J immunol 1967; 99: 1187-98. 3. Bennich HH, Ishizaka K, Johansson SG, et al. Immunoglobulin E. A new class of human immunoglobulin. Bull World Health Org 1968; 38:151-12. 4. Johansson SG, Hourihane JO, Bousquest J, et al. A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force. Allergy 2001; 56:813-24. 5. Burrows B, Martinez FD, Halonen M, et al. Association asthma with serum IgE levels and skin-test reactivity to allergens. N Engl J Med 1989; 320:271-7. 6. Kay AB. Allergy and allergic diseases. N Engl J Med 2001; 344: 109-13; Holt PG, Macaubus C, Stumbles PA, Sly PD. The role of allergy in the development of asthma. Nature 1999; 402 (Suppl): B12-7. 7. Holgate S, Casale T, Wenzel S, Bousquet J, Deniz Y, Reisner C. The anti-inflamatory effects of omalizulab corfirm the central role of IgE in allergic inflammation. J Allergy Clin Immunol 2005; 115: 459-65. 8. European Network for Understanding Mechanisms of Severe Asthma (ENFUMOSA). The ENFUMOSA cross-sectional European multicenter study of the clinical phenotype of chronic severe asthma. Eur Respir J 2003;22: 470-7. 9. Fregonese L, Patel A, van Schadewijk A, Santos M, Dolhnikoff M, Sterjkp et al. Expresión of the high-affinity IgE receptor (Fc?RI) is increased in fatal asthma (abstract). Am J Respir Crit Care Med 2004; 169: A297. 10. Roitt IM, Delves PJ: Anticuerpos. En: Immunología, fundamentos. 10ª edición. Panamericana (ed). Madrid, 2003: 41-64. 11. mcGlashan D, Lichtenstein L, Mckenzie-WhiteJ, Chichester K, henry A, Sutton B et al. Upregulation of FcepsilonRI on human basophil by IgE antibody is mediated by interaction of IgE with FcepsilonRI. J Allergy Clin Immunol 1999; 104: 492-8. 12. Malveaux FJ, Conroy MC, Adkinson NF, Lichtenstein LM. IgE receptors on human basophils relationship to serum IgE concentration. J Clin Invest 1978; 62:176-81. 13. Coleman JW, Godfrey RC: The number and affinity of IgE receptors on dispersed human lung mast cells. Immunology 1981; 44:85963. 14. Siraganian R.Mast cell signal transduction from de the high affinity receptor. Curr Opin Immunol 2003; 15: 639-46. 15. Marone G Spadaro G, Palumbo C, Condorelli G. The anti-IgE/antiFc RIa autoantibody network in allergic and autoimmune diseases. Clin Exp Allergy 1999; 29:17-27. 16. Kinet J. A new strategy to counter allergy. N Engl J Med 2005; 353; 3: 310-2.. 17. Zu D. Kepley c, Zhang K, Terada T, Yamada T, Saxon A. A chimeric human-cat fusion protein blokcs cat-induced allergy. Nat Med 2005;11: 446-9. 18. Sayama K, Diehn M, Matsuda K, Lunderius C, Tsai M, Tan S et al. Transcriptional response of human mast cells stimulated via the Fc(epsilon)RI identification of mast cell as a source of IL-11.BMC Immunol 2002; 3: 5. 19. Delves P, Roitt M. The immune system. First of two parts. N Engl J Med 2000; 343: 108-17 20. Sutton BJ, Gould HJ. The human IgE network. Nature 1993; 366:421-8. 21. Brasó J, Jorro G. Pruebas cutáneas y otras exploraciones in vivo con alergenos. En: Manual de Alergia Clínica. J Brasó, G Jorro (ed). Ed Massón, 2003: 63-92. 22. Hamilton R, Adkinson F. In Vitro assays for the diagnosis of IgE-mediated disorders. J Allergy Clin Immunol 2004; 114: 213-25. 23. Hamilton R. Laboratory Test for allergic and immunodeficiency diseases. En: Adkinson F, Yuginger J, Busse W, Holgate S, Simons F (eds). Middleton´s,Allergy Principles and Practice. Mosby. Vol I, 2003: 611-30. 11 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 12 24. Mir A, Brasó J. Métodos de laboratorio en alergia. En: Manual de Alergia Clínica. J Braso, G Jorro (ed). Ed Massón, 2003: 93-114. 25. Escribano L, Castells M. Mastocitos. En: Asma, vol. I. Eds. Quirce S, Carrillo T, Olaguibel J. MRA Ediciones. Barcelona, 2004, pp: 97118. 26. Williams CMM, Galli SJ. The diverse potential effector and immunoregulatory roles of mast cells in allergic disease. J Allergy Clin Immunol 2000;105:847-59. 27. Jeffrey V, Ravetch, Jean-Pierre Kinet. Fc Receptors. Annu Rev Immunol. 1991;9:457-92. 28. Howarth PH, Durham SR, Kay AB, Holgate ST. The relationship between mast-cell-mediator release and bronchial reactivity in allergic asthma. J Allergy Clin Immunol 1987;80:703-11. 29. Oettgen HC, Geha RS. IgE regulation and roles in asthma pathogenesis. J Allergy Clin Immunol 2001;107:429-40. 30. Brodie DH. Molecular and cellular mechanisms of allergic disease. J Allergy Clin Immunol 2001;108:S65-71. 31. Wenzel SE, Fowler AA, Schwartz LB. Activation of pulmonary mast cells by bronchoalveolar allergen challenge. In vivo release of histamine and tryptase in atopic subjects with and without asthma. Am Rev Respir Dis 1988;137:1002-8. 32. Hardy CC, Robinson C, Tattersfield AE, Holgate ST. The bronchoconstrictor effect of inhaled prostaglandin D2 in normal and asthmatic men. N Engl J Med 1984;311:209-13. 33. Austen KF. From slow-reacting substance of anaphylaxis to leukotriene C4 synthase. Int Arch Allergy Immunol 1995;107:19-24. 34. Triggiani M, Hubbard WC, Chilton FH. Synthesis of 1-acyl-2-acetyl-sn-glycero-3-phosphocholine by an enriched preparation of the human lung mast cell. J Immunol 1990;144:4773-80. 35. Gordon JR, Burd PR, Galli SJ. Mast cells as a source of multifunctional cytokines. Immunol Today 1990;11:458-64. 12 36. Gordon JR, Galli SJ. Release of both preformed and newly synthesized tumor necrosis factor alpha (TNF-alpha)/cachectin by mouse mast cells stimulated via the Fc epsilon RI. A mechanism for the sustained action of mast cell-derived TNF-alpha during IgE-dependent biological responses. J Exp Med 1991;174:103-7. 37. Brightling CE, Bradding P, Symon FA, et al. Mast-cell infiltration of airway smooth muscle in asthma. N Eng J Med 2002;346:1699-705. 38. Brightling CE, Bradding P, Pavord ID, Wardlaw AJ. New insights into the role of the mast cell in asthma. Clin Exp Allergy 2003;33:550-6. 39. Robinson DS. The role of the mast cell in asthma: induction of airway hyperresponsiveness by interaction with smooth muscle? J Allergy Clin Immunol 2004;114:58-65. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 13 B a s e s a l é r g i c a s d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . 13 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 14 CUESTIONARIO 1. Es cierto de la IgE que: a) Contiene 5 dominios en cada una de las cadenas pesadas b) Su peso molecular es de 146.000 c) Su contenido de carbohidratos es del 3% d) Su vida media en suero no supera los 2 días e) Todas las anteriores son correctas 2. Señale la respuesta correcta en relación con la función de la IgE: a) Su unión a receptores de eosinófilos produce exocitosis b) Puede activar la vía alternativa del Complemento c) Su unión a receptores de linfocitos NK produce citolisis celular d) Puede activar la vía clásica del Complemento. e) Es fundamental en la defensa frente a parásitos 3. Señale la respuesta correcta en relación con la función del FcεRI: a) Actúa en la defensa frente a parásitos b) Interviene en la síntesis de IgE c) Participa en las reacciones alérgicas. d) Mejora la presentación de antígenos/alergenos e) Activa el sistema del Complemento 4. Es cierto en relación con las pruebas cutáneas en prick que: a) La respuesta característica es la aparición de eritema e induración b) Son un método sencillo, rápido y barato para el diagnóstico de la sensibilización alérgica mediada por IgE c) Se realizan indistintamente en cualquier superficie del tegumento d) Su principal ventaja es que se puede utilizar cualquier sustancia para su realización e) Su lectura se realiza entre 30 y 40 minutos después de su aplicación 14 5. Las a) b) c) d) e) principales ventajas de las técnicas de detección de IgE específica son: Economía Resultados independientes del uso concomitante de medicación Realización más rápida que las pruebas cutáneas No se precisa el uso de controles Ninguna de las anteriores es correcta 6. Respecto al mastocito, señale le respuesta falsa: a) Son células mononucleadas metacromáticas b) Están ampliamente distribuidas en numerosos tejidos c) Presentan receptores de baja afinidad (FcεRII) para la IgE d) Intervienen en la defensa frente a los parásitos e) Derivan de la médula ósea 7. Los a) b) c) d) e) mastocitos humanos liberan una serie de mediadores, excepto: Histamina Prostaglandinas Leucotrienos cisteinílicos Serotonina TNF-α 8. Señale la respuesta falsa sobre las acciones de los productos derivados del mastocito: a) Causan broncoconstricción, vasodilatación e hipercrinia b) En la piel producen habón, eritema y picor c) Tienen efectos biológicos transitorios, de pocos minutos de duración d) Participan en la fase inmediata y en la tardía de la respuesta alérgica e) En el proceso de desgranulación (exocitosis) participa el Ca++ intracelular C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 15 B a s e s a l é r g i c a s d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . 9. La triptasa es: a) Una citocina b) Un mediador lipídico c) Un proteoglicano d) Una proteasa con actividad serina endopetidasa e) Un eicosanoide 10. Señale la respuesta falsa respecto al PAF (factor activador plaquetario): a) Es un mediador lipídico derivado del ácido araquidónico b) No tiene efecto broncoconstrictor c) Se produce y secreta por mastocitos humanos estimulados d) Tiene actividad quimiotáctica para eosinófilos, neutrófilos y monocitos e) Promueve la adhesión endotelial de los neutrófilos 15 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 16 Respuestas fascículo 3, capítulo IX (Bases alérgicas del asma. Mastocitos y anticuerpos IgE) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 16 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 17 B a s e s a l é r g i c a s d e l a s m a . M a s t o c i t o s y a n t i c u e r p o s I g E . 17 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 18 18 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 19 L i n f o c i t o s T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o Capítulo X LINFOCITOS T Y CÉLULAS PRESENTADORAS DE ANTÍGENO Dr. Francisco Moreno Benítez Inmunólogo Director Unidad de Investigación Clínica Dr. Lobatón. Adjunto clínico Clínica Dr. Lobatón. Dra. Irene Salcedo González Inmunóloga. Adjunta Laboratorio de Inmunología Novo Sancti-Petri, S.L. Centro adscrito a la Unidad de Investigación Clínica Dr. Lobatón Dr. Pedro Lobatón Sánchez de Medina Alergólogo. Director Clínica Dr. Lobatón. Correspondencia y contacto: Dr. Francisco Moreno Benítez Avda. Fernández Ladreda, 9 11008 - Cádiz Tlf. 956 292 100 / 956 200 996 Fax.956 260 214 / 956 205 663 e-mail: [email protected] [email protected] 19 Asma I Fasc culo 3.qxd 10/03/2006 10:38 PÆgina 20 20 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 21 L i n f o c i t o s T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o LINFOCITOS T Y CÉLULAS PRESENTADORAS DE ANTÍGENO Resumen De la reacción de hipersensibilidad tipo I de Gell y Combs, hemos pasado a una pérdida de tolerancia al medio como principal factor causante del asma. El asma alérgica y no alérgica, sólo difieren en los linfocitos T (LT) reg que no han sido debidamente primados para ejercer su función reguladora o supresora. Diversos factores ambientales y genéticos nos ayudan a comprender cómo están implicados y conectados unos elementos efectores con otros. Los componentes celulares y sus mediadores, considerados elementos finales o ejecutores (mastocitos, basófilos, eosinófilos y posiblemente también neutrófilos), así como las células dendríticas, son primordiales en este proceso. No sólo los linfocitos T o B son capaces de discriminar entre lo propio y lo extraño. Las células del sistema inmunitario innato son la primera línea de defensa, siendo activadas ante la presencia de numerosos microorganismos. Este reconocimiento se realiza a través de un conjunto de receptores captadores de antígenos, como los receptores Toll-like (TLR) y otras moléculas. PRESENTACIÓN ANTIGÉNICA AL LINFOCITO T Las células capaces de reconocer un determinado antígeno son infrecuentes y las que los presentan también. Los LT pasan de la sangre a los órganos linfoides secundarios, uniéndose transitoriamente mediante su receptor (TCR o receptor de las células T) a los complejos MHC (del inglés Major Histocompatibility Complex) de las células presentadoras de antígeno (APC). El MHC de las APC porta un péptido y el conjunto de ambos constituye la presentación antigénica. El péptido es el antígeno (o alergeno) para el LT. Si no encuentran el antígeno (Ag) que es capaz de reconocer su receptor, se libera y retorna a la circulación sanguínea. Una APC, por ejemplo una célula dendrítica (del inglés Dendritic cells -DCs-) presenta miles de antígenos distintos. Las APC especializadas captan antígenos proteicos extracelulares, los internalizan y procesan, y 21 Introducción Las primeras investigaciones de las enfermedades alérgicas se enfocaron sobre la relación alergeno-IgE específica, mastocitos y la respuesta inmediata tipo I. Los hallazgos de Mosmann y Coffman (1) de que los subtipos de linfocitos T (LT) CD4 denominados Th1 y Th2 se regulan de forma cruzada y controlan la desviación de la respuesta inmunitaria, así como los datos sobre los Th2 productores de interleucina 4 (IL-4), que colabora en la síntesis de IgE, de la IL-5 como factor de diferenciación y crecimiento de eosinófilos, de la IL-9 que colabora en la diferenciación de mastocitos, o de la IL13 incrementando la producción de moco e induciendo hiperreactividad bronquial (HRB), han provocado que los linfocitos acaparen un gran protagonismo en la patogénesis del asma y de la respuesta alérgica (2-4). Debido a que los linfocitos Th1 y Th2 se autorregulan en algunos sistemas, particularmente en los modelos de enfermedades infecciosas, se asumió que los Th1 tenían un papel beneficioso en las enfermedades alérgicas y en el asma por los efectos de regulación a la baja de los Th2. Figura 1. Figura 2. presentan péptidos asociados a moléculas de clase II del MHC a linfocitos T CD4. El procesamiento del antígeno es la conversión de proteínas nativas en péptidos asociados a moléculas del MHC. Los LT CD4 reconocen antígenos asociados a los productos de los genes del MHC de clase II (reconocimiento restringido por MHC clase II). Los LT CD8 reconocen antígenos (recordemos péptidos) asociados a MHC de clase I. Ambas, CD4 y CD8, son mutuamente excluyentes en los linfocitos T maduros (figuras 1 y 2). Los LT sólo reconocen antígenos en forma de péptidos presentados por los MHC sobre la superficie de APC. Por el contrario, el linfocito B (LB) reconoce proteínas en su estructura terciaria, es decir tridimensionales, mediante su receptor específico de cada alerge- Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 22 no. El receptor de las células B (BCR) son las inmunoglobulinas (Igs) fijadas en su superficie celular. RECONOCIMIENTO ANTIGÉNICO POR EL LINFOCITO T El TCR está compuesto de dos cadenas polipeptídicas subgrupos de LT, CD28 es un receptor de los LT que se une a moléculas coestimuladoras CD80. El bloqueo de estas señales previene el desarrollo de inflamación e HRB en modelos de asma (5). Tras la activación del LT se induce un segundo receptor para CD80, denominado CD152 (anteriormente denominado CTLA-4), cuya función es terminar las respuestas iniciadas. ACTIVACIÓN Y DIFERENCIACIÓN DE LINFOCITOS T Los LB y T no estimulados se denominan vírgenes (o naïves). Son linfocitos maduros pero que no han sido estimulados por antígenos para convertirse en linfocitos diferenciados o activados. Los LT CD4 producen citocinas (también denominadas interleucinas), pero a su vez dependen de éstas para su proliferación y diferenciación. Figura 3. unidas por un puente disulfuro, denominadas α y β, que son homólogas a las cadenas pesadas y ligeras de las moléculas de Igs. Cada cadena del TCR αβ consta de una región variable (V) y una región constante (C). El TCR γδ es otro heterodímero de distribución clonal que se expresa en un pequeño subgrupo de LT. 22 Además de expresar el complejo TCR, los LT expresan varias moléculas accesorias que son importantes en la activación celular. Algunas de estas moléculas se unen a ligandos presentes en APC o en células diana, proporcionando así fuerzas de adhesión estabilizantes, mientras que otras transducen señales de activación a los LT. Así CD4 y CD8 son co-receptores expresados en La presencia en el ambiente celular de determinadas citocinas, que actúan como señales coestimuladoras solubles y secretadas por las células del entorno, permite la proliferación primero, y dirige la diferenciación, posteriormente, de los LT. En la proliferación intervienen IL-15 e IL-2. En la diferenciación participan citocinas específicas que generan unos subtipos funcionales de LT. Estos subtipos funcionales se caracterizan por el patrón de citocinas que producen y por la implicación de éstas en diferentes procesos (figura 3). Así tenemos: - Th1 cuando en el microambiente celular existe IL12, producida fundamentalmente por las APC. El subtipo Th1 produce fundamentalmente IFN-γ. - Th2 cuando en el microambiente existe IL-4, producida por LT, mastocitos, subtipos de células dendríticas (DCs), entre otras. El subtipo Th2 produce fundamentalmente IL-4. Ambas Th1 y Th2 actúan de forma mutuamente excluyente, como factor inhibidor cruza- Figura 4. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 23 L i n f o c i t o s Citocina Funciones T y c é l u l a s p r e s e n t a d o r a s Células productoras d e a n t í g e n o Efecto sobre el asma IL-2 Factor de crecimiento celular T TH1, Eos IL-3 Diferenciación y activación de Eos, Bas, Neu, MC TH1/ TH2, Eos, MC, Bas, Mac/Mono, Fib IL-4 Cambio de isotipo en células B hacia IgE, desarrollo de MC, activación de Eos y Bas, secreción de moco, T 2, Eos, MC, Bas favorece la producción TH2, aumenta la expresión de H VCAM en Endo Incremento; el receptor soluble de IL-4 tiene efecto esteroide moderado IL-5 Diferenciación, maduración y activación de Eos y Bas TH2, Bas, Eos, MC Incremento; los anticuerpos disminuyen los Eos pero no la HRB IL-6 Factor de crecimiento de células T y B; cofactor para T 1/ T 2, Mac, Endo H H síntesis de IgE Incremento (en asma severa) IL-8 Activación y quimiotaxis de Neu; débil quimioatracEndo, Epi, Mac, células T ción de Eos Incremento IL-9 Desarrollo de Mac y Eos, HRB, secreción de moco TH2, Eos, MC, Bas Incremento Incremento Incremento IL-10 Suprime la función TH1/ TH2 y la activación de Eos, Mac y Baso; favorece la producción de células T Células T, Mac reguladoras y el cambio de isotipo hacia IgG4 Disminución/incremento IL-11 Hiperreactividad bronquial, eosinofilia, hipersecreFib, Mac, Endo, Epi ción mucosa, remodelado de vías aéreas Incremento IL-12 Favorece la producción TH1, inhibe la síntesis de IgE Mac, células B Disminución, la IL-12 exógena disminuye los Eos pero no la HRB IL-13 Desarrollo de MC, cambio de isotipo hacia IgE, eosi- T 2, Eos, MC, Bas H nofilia, HRB, hipersecreción mucosa Incremento IL-15 Factor de crecimiento de células T, expande las céluMuchas células no T las T reguladoras Disminución IL-16 Quimioatrayente para células CD4+, Mono, Eos Incremento IL-17 Induce producción de citocinas inflamatorias por Fib, Células CD4+ memoria Mac, Epi, Endo Incremento IL-18 Induce la producción de IFNγ por células T y NK; Mac favorece la expansión TH1 Disminución IL-23 Cofactor para el desarrollo TH1, activa CD IL-25 Favorece el desarrollo TH2 y la producción deIL-4, ILCélulas TH2 5 e IL-13 No estudiado IL-27 Favorece la expansión TH1 No estudiado GM-CSF Diferenciación y activación de Eos, Neu, Bas, MC CD8+, MC, Eos 23 Varias células hematopoNo estudiado yéticas APC TH1/ TH2, Eos, MC, Bas, Incremento Mac, Fib, Epi, Endo TNF-α Activación de Endo y Epi TGF-β Suprime la función TH1/ TH2, favorece la inducción Eos. MC, Baso, células T, Incremento Mono, Mac Treg, cofactor para la secreción de IgA, fibrosis IFN-γ Inhibe la síntesis de IgE, inhibe la inducción TH2, Células TH1, NK activa Eos y Mac Mac, NK, Células T Incremento Incremento en infecciones virales y exacerbaciones Neu, Neutrófilo; Eos, Eosinófilo; MC, Mastocito; Bas, Basófilo; Mac, Macrófago; Mono, Monocito; Fib, Fibroblasto; NK, Natural Killer (citocida natural); Epi, Célula epitelial; Endo, Célula endotelial; CD, Célula dendrítica; APC, Célula presentadora de antígeno; HRB, Hiperreactividad bronquial. Tabla I. Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 24 do. Así, el INF-γ inhibe la diferenciación hacia Th2 y la IL-4 inhibe la diferenciación hacia Th1. - Th3. No está totalmente definido las citocinas ambientales que deben estar presentes para esta polarización. Este subtipo produce fundamentalmente TGFβ. Al igual que el subtipo siguiente tiene una gran importancia en mecanismos reguladores de tolerancia. - LTreg. Los LTreg constituyen un grupo de LT con capacidad reguladora inhibidora de respuesta de Th2 (figura 4 y Tabla I). con una especificidad determinada hacia un antígeno (igual que ocurre con los LT) y es capaz de producir anticuerpos tras el contacto con dicho antígeno específico. La variabilidad del BCR o inmunoglobulina de superficie necesaria para constituir todo el repertorio de anticuerpos se consigue mediante el reordenamientos de los diferentes genes que codifican las diferentes partes de las inmunoglobulinas, segmentos V, D y J, similar al TCR. ANTICUERPOS La cadena ligera (κ o λ) se asocia a la cadena pesada previamente traducida y se expresan como una inmunoglobulina completa de isotipo IgM en la membrana de la célula, siendo a partir de éste momento un linfocito virgen no activado. Las respuestas de los LB a los antígenos proteicos requieren la contribución de los LT colaboradores CD4 específicos y también del antígeno en cuestión. Como sabemos, cada clon de LB expresa en su membrana Igs Las respuestas de los LB, dependientes de LT, a los antígenos proteicos se inician con la presentación del antígeno por los LB a los LT y la activación de estos (los INTERACCIÓN LINFOCITO T- LINFOCITO B. PRODUCCIÓN DE Anticuerpo Subtipos Dominios constantes de cadena pesada (nº) IgA IgA1 IgA2 3 3 3 0,5 6 Monómero, dímero, trímero Monómero, dímero, trímero IgD Ninguno 3 0,4 3 - IgE Ninguno 4 0,0005 2 Concentración Semivida sérica sérica (días) (mg/ml) Forma secretora Pm (kDa) 150, 300 ó 400 150, 300 ó 400 Funciones Inmunidad de mucosas, inmunidad pasiva neonatal 24 IgG IgM IgG1 IgG2 IgG3 IgG4 Ninguna 3 3 3 3 4 9 3 1 0,5 1,5 23 23 23 23 5 Monómero Monómero Monómero Monómero Monómero 180 Receptor para el antígeno en las células B no estimuladas (vírgenes) 190 Hipersensibilidad inmediata 150 150 150 150 Pentámero 950 Opsonización, activación del complemento, citotoxicidad mediada por células dependiente de anticuerpo, inmunidad neonatal inmunidad pasiva, inhibición por retroalimentación de células B. Receptor para el antígeno en las células B no estimuladas (vírgenes), activación del complemento Tabla II. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 25 L i n f o c i t o s LT), en el límite de los folículos linfoides de los órganos linfoides periféricos. Los LT activados expresan en su membrana CD40L, que se une a la molécula CD40 presente en el LB, y secretan citocinas que se unen a los receptores de citocinas en los LB. La combinación de las señales de CD40 y de citocinas estimula la proliferación y la diferenciación de los LB en células secretoras de anticuerpos. La acción conjunta de IL-4 e IL-13 y CD40-CD40L activa la recombinación y transcripción selectiva del gen Cε, que permite a la célula B transformarse en una célula productora de IgE alergenoespecífica. Este proceso es dependiente de LT y específico para el antígeno. Por tanto, los LT CD4 regulan tanto la producción de Ac así como su isotipo, que determinará en última instancia la función efectora de dicho Ac (Tabla II). También puede llevarse a cabo la activación de LB, independientemente de las señales coestimuladoras T, por antígenos poliméricos con estructuras repetidas. Estos antígenos entrecruzan y agrupan los BCR de membrana. Los antígenos LT independientes incluyen los lipopolisacáridos bacterianos, glucolípidos y ácidos nucleicos. En este tipo de respuesta LT independiente generalmente no se producen mutaciones somáticas, la memoria inmunológica es menor, estando limitada como hemos dicho, a determinados antígenos, y el cambio de isotipo está limitado a IgG. DEL PARADIGMA TH1/TH2 A LT REGULADORES La idea de que los Th1 tenían un papel protector para las enfermedades alérgicas, y por tanto en el asma, era inicialmente consistente con los hallazgos existentes. Las citocinas IL-12, IL-18, IL-23 e IL-27 están implicadas en la diferenciación Th1 y en la producción de IFN-γ (6-8). La respuesta alergeno-específica generada en individuos no alérgicos mostraba un perfil de citocinas Th1 (9,10). Por otro lado los Th2 y por tanto sus citocinas contribuyen al asma a través de la síntesis de IgE, maduración y activación de mastocitos y basófilos e IL-5, todo lo cual produce daño epitelial en las vías aéreas e HRB (11). Se siguen agregando citocinas implicadas en asma con origen Th2, entre ellas: IL-4, IL-5, IL-9, IL11, IL-13, IL-16, IL-17, IL-25 (12-17, 21-24). Smart y Cols (25) evaluaron la evolución de la producción de IFN-γ (Th1) e IL-5 (Th2) y su relación con la resolución o persistencia de asma, observando que el asma persistente grava se asociaba con una reducción en la respuesta de citocinas Th1 (26). Con los datos expuestos, y antes de conocerse con mayor profundidad la presencia y repercusión de los LT reg, se esquematizó el proceso como una balanza, y la patogenia del asma podría explicarse como el resultado de una inclinación de la balanza. Efectivamente el paradigma Th1 /Th2 establece que existen dos tipos de LT CD4 antagónicos que producen citocinas que les polarizan, retroalimentan su crecimiento autocrino, y se neutralizan con los linfocitos del tipo contrario. Sin T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o embargo, este esquema no respondía a todas las preguntas y existían evidencias que contradecían la simplicidad del esquema creado. Por un lado, sólo un pequeño porcentaje de LT encaja en las categorías Th1 o Th2. La inmensa mayoría (95%) de los Th presentan patrones de producción de citocinas disociados (sólo producen una citocina). Por otro lado, la ecuación Th1 igual a inflamación y enfermedad autoinmune, mientras que Th2 igual a inflamación alérgica, se hacía cada vez menos sostenible, debido a la posibilidad de coexistir ambas enfermedades (autoinmunes - alergia) en un mismo paciente y además que tras un contacto con un antígeno se crean LT memoria Th1 y Th2 (27, 28). LINFOCITOS T REGULADORES El término de LT reguladoras se refiere a células que activamente controlan o suprimen la función de otras células, generalmente en su aspecto inhibitorio. Podemos describir (tabla III): - Th3, fue descrita por Chen y cols (29), como LT inducidos por antígenos orales en órganos linfoides del mesenterio que producen TGF-β, con diversa cantidad de IL-4 e IL-10. Se consideran de capital importancia en el desarrollo del sistema inmunitario asociado a mucosa y en la tolerancia de antígenos (alergenos) alimentarios e inhalados. - TR - TR1, fueron descritos por Groux y cols (30). Son LT CD4 con baja capacidad proliferativa pero que producen altos niveles de IL-10, bajos de IL-2 y nada de IL-4. Estos LT antígeno-específicos suprimen la proliferación de LT. - LT CD4+CD25+, fueron descritos por Sakaguchi y cols (31). Constituyen una fracción minoritaria (aproximadamente un 10%) de LT CD4 y juegan un papel crítico en la prevención de enfermedades autoinmunes órgano-específicas y reacción injerto contra huésped o mantenimiento de tolerancia (32). Estos LT CD25+ poseen una gran capacidad supresora de la respuesta inmune. Recientes estudios muestran que previene el asma inducido por ácaros (33). Los efectos supresores de LT CD25+ reg pueden ser bloqueados por la presencia de IL-6 y esta a su vez ser producida en niveles altos por DCs activadas, a través de receptores Toll-like, sugiriendo que este efecto inhibidor de los LT CD25+ es inhibido durante los procesos infecciosos (34). - NKT, comprende una población de LT que expresan en su superficie marcadores característicos tanto de NK (natural killer) como LT convencionales y que ha mostrado ejercer una actividad fuertemente reguladora en enfermedades autoinmunes (35). Los NKT están presentes en el pulmón y producen niveles elevados de IL4 e IL-13. En ausencia de NKT, ratones deficientes o knockout en estas células, no se puede inducir HRB por sensibilización a alergenos del tipo ovoalbúmina (OVA), seroalbúmina bovina (BSA) o aspergillus, pero cuando a estos ratones se le administran IL-13 recuperan la capacidad de inducción de HRB (17). 25 Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 26 Célula reguladora Citocinas producidas Marcadores celulares Comentarios Th1 INF-γ, IL-2, GMCSF CD4 Puede inhibir el desarrollo de Th2, pero no la función de la célula Th2 madura efectora. Th2 IL-4, IL-5, IL-9, IL13, CCL-2, CCL-5. CD4 Contribuye a la respuesta humoral alérgica y frente a parásitos. Inhibe la diferenciación hacia Th1. su población aumenta en los asmáticos (alérgicos o no) y en sujetos sanos provocados por alergenos. Th3 TGF-β CD4 Se presenta durante el desarrollo de la tolerancia oral. CD4 Se desarrollan en presencia de IL-10 y producen esta misma citocina. Las TR1 han demostrado inhibir la creación de colitis experimental y la respuesta Th2. CD4 Se desarrollan durante el cultivo con DCs produciendo IL-10 e interviene posiblemente en la tolerancia inmune del aparato respiratorio. TR ha demostrado inhibir el desarrollo de HRB. Aparecen de forma natural como células reguladoras y están involucradas en la prevención de enfermedades autoinmunes. Estas CD25+ han demostrado inhibir la respuesta Th2 pero no la HRB. TR1 IL-10 26 TR IL-10 CD25+ IL-10, TGF-β CD4, CD25, Foxp3 NKT IL-4, IL-13, IFN-γ, TCR con repertorio restringido En su forma natural producen grandes cantidades de citocinas. Regulan el CD4 o doble negativa desarrollo de enfermedades autoinmuCD4 - CD8 nes y parece exacerbar el desarrollo de asma en modelos de animales. Tabla III. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 27 L i n f o c i t o s T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o torio). La profundidad de esa alteración ocasionará la gravedad del cuadro. Figura 5. ASMA Y LT REG El papel de los LT reg en el asma se basa en: - Los LT secretores de TGF-β, en contraposición a los Th1, reducen de forma efectiva la inflamación e HRB de las vías respiratorias (36, 37). - IL-10 también disminuye la inflamación bronquial (38) (figura 5). Aún no está claro cual de los LT reg es el más importante en el control del desarrollo del asma. Es posible que los Th3 estén involucrados en regular enfermedades gastrointestinales y el sistema inmunitario asociado a mucosas en su etapa más precoz "intraútero", mientras que el resto de los TR estén involucrados en enfermedades respiratorias, pues las DCs de las vías respiratorias producen IL-10, la cual es requerida para el desarrollo de los TR mientras que las del aparato digestivo producen tanto IL-10 como TGF-β, las cuales son requeridas para el desarrollo de Th3. La respuesta Th2 sola no es suficiente para inducir HRB (por ejemplo no todo paciente que tiene rinitis desarrolla asma), los TR1 han mostrado inhibir la respuesta tanto Th1 como Th2, mientras las TR regulan el desarrollo de Th2 e HRB y las CD4+CD25+ inhiben el desarrollo de eosinofilia e inflamación en las vías aéreas pero no parece inhibir el desarrollo de HRB (39, 40). Los NKT parecen esenciales para la inducción de HRB, como evidencian los estudios en animales de experimentación, pero su importancia en humanos aún está por dilucidar. Las alteraciones en su capacidad de inhibición de uno o varios de los LT reg frente a diversos agentes externos (endotoxinas, virus, descamaciones dérmicas de animales, ácaros, pólenes, hongos, etc.), dará lugar a las distintas manifestaciones clínicas del asma (alérgica o no alérgica, eosinofílico o con otro patrón inflama- ESQUEMA GENERAL: CÉLULA DENDRÍTICA (DCS). LINFOCITO T. LINFOCITO B. CÉLULAS EFECTORAS Un paso crítico en la inducción de la respuesta inmunológica del LT es la captura, procesado y presentación del antígeno por las células procesadoras de Ag. En el pulmón, la DCs está particularmente bien desarrollada y su localización bajo la membrana basal permite una gran accesibilidad a antígenos inhalados. Desde allí emigran hacia nódulos linfáticos donde interactúan, tal como se indicó previamente, con LT vírgenes (41). Pronto se observó que no sólo incidían sobre LT sino también sobre LB (42), y más importante aún es que influyen en procesos de activación linfocitaria y de tolerancia (43). En el extraordinario trabajo de Lambrecht (44) se evidenció que las DCs son esenciales para la presentación de antígenos inhalados a los linfocitos Th2, en un modelo de ratones previamente sensibilizados a OVA. Sin DCs no existía inflamación eosinofílica de las vías respiratorias. Se describen dos tipos diferentes de DCs, una de ellas tiene funciones inmunoestimuladoras y cuyo origen parece ser mieloide, mientras otra tiene funciones de inducción de tolerancia y cuyo origen parece ser linfoide (también denominadas plasmocitoide) que tiene un carácter protector en la inducción de asma (45-47). La DC en sujetos atópicos tiene capacidad para dirigir hacia una respuesta de tipo Th2 debido a su bajo nivel de expresión de IL-12 así como de IL-10. Cuando se dan ambas condiciones se desarrollará asma en el niño (48-50). Por tanto, las DCs parecen tener un papel central en la inducción de tolerancia, y de no existir esta tolerancia, del desarrollo polarizado hacia Th1 o Th2 (52-54). Numerosos estudios nos muestran que el patrón de células que infiltran las vías aéreas en el asma no es muy diferente entre los diversos fenotipos de asmas (alérgica, no alérgica u ocupacional) (55-59). Además nos indica que el proceso puede ser muy precoz en su génesis y que elementos locales, localizados a nivel de la mucosa de las vías respiratorias, están implicados en su regulación (60). 27 Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 28 Bibliografía 1. Mosmann TR and Coffman RL. Th1 and Th2 cells: different patterns of lymphokin secretion lead to different functional properties. Annu Rev Immunol 1989;7:145-147. 2. Umetsu DT, Jabara HH, Dekruyff RH, Abbas AK, Abrams JS and Geha RS. Functional heterogeneity among human inducer T cell clones. J Immunol 1988;140:4211-69. 3. Wills-Karp M. Immunologic basis of antigen-induced airway hyperresponsiveness. Annu Rev Immunol 1999;17:255-81. 4. Busse WW, Coffman Rl, Gelfand EW, Kay Ab and Rosenwasser LJ. Mechanisms of persistent airway inflammation in asthma. A role for T cells and T cell products. Am J Respir Crit Care Med 1995;152:388-93. 5. Kimzey SL, Liu P and Green JM. Requirement for CD 28 in the effector phase of allergic airway inflammation. J Immunol 2002;173(1):632-40. 6. Corry DB, Folkesson HG, Warnock ML, Erle DJ, Matthay MA, Wiener-Kronish JP, et al. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J Exp Med 1996;183:109-17. 7. Szabo SJ, Kim ST, Costa GL, Zhang X, Fathman CG, Glimcher LH. A novel transcription factor, T-bet, directs Th1 lineage commitment. Cell 2000;100:655-69. 8. Afkarian M, Sedy JR, Yang J, Jacobson NG, Cereb N, Yang SY, et al. T-bet is STAT1-induced regulator of IL12R expression en naïve CD4+ T cells. Nat Immunol 2002;3:549-57. 9. Finotto S, Neurath MF, Glickman JN, Quin S, Lehr HA, Green FH, et al. Development of spontaneous airway changes consistent with human asthma in mice lacking T-bet. Science 2002;295:336-8. 10. Wierenga EA, Snack M, Cansen HM, Bos JD, von Lier RAW and Kapsenberg ML. Human atopen-specific types 1 and 2 T cell clones. J Immunol 1991;147:2942-9. 28 11. Kay AB. Allergy and allergic diseases. First o two parts. N Engl J Med 2001;344:30-7. 12. Foster Ps, Hogan Sp, Ramsay AJ, Matthaei KI, Young IG. Interleukin 5 deficience abolishes eosinophilia, airways hyperreactivity and ling damage in a Mouse asthma model. J Exp Med 1996;183:195-201. 13. Temann UA, Geba GP, Ramkin JA, Clavell RA. Expresión of interleukin 9 in the lungs of transgenic mice causes airway inflammation, mast cell hyperplasia and bronchial hyperresponsiveness. J Exp Med 1998;188:1307-2. 14. McMillan Sj, Bishop B, Townsend MJ, McKenzie AN, Lloyd CM. The absence of interleukin 9 does not affect the development of allergen-induced pulmonary inflammation or airways obstruction. J Clin Invest 1996;98:2845-53. 15. Wang J, Homer RJ, Hong L, Cohn L, Lee CG, Jung S et al. IL 11 selectively inhibits aeroallergen-induced pulmonary eosinophilia and Th2 cytokine production. J Immunol 2000;165:2222-31. 16. Curti A, Ratta M, Corini S, Girolomondi G, Ricci F, Tazzari P et al. Interleukin 11 induces Th2 polarization of human CD4+ T cells. Blood 2001;97:2758-63. 17. Akbari O, Stock P, Meyer E, Kronenberg M, Sidobre S, Nakayama T, et al. Esencial role of NKT cells producing IL 4 and IL 13 in the development of allergen-induced airway hyperreactivity. Nat Med 2003;9:582-8. 18. Gruning G, Warnock M, Wakil AE, Venkayya R, Brombacher F, Rennick DM et al. Requirement for IL 13 independently of IL 4 in experimental asthma. Science 1998;282:2261-3. 19. Wills-Karp M, Luyimbazi J, Xu X, Schofield B, Neben TY, Karp CL et al. Interleukin 13 central mediator of allergic asthma. Science 1998;282:2258-61. 20. Molet S, Hamid Q, Davoine F, Nutku E, Taha R, Page N et al. IL 17 is increased in asthmatic airways and induces human bronchial fibroblasts to produce cytokines. J Allergy Clin Immunol 2001;108:430-8. 21. Hurst SD, Muchamuel T, Gorman Dm, Gilbert JM, Cliford T, Kwan S et al. New IL 17 family members promote Th1 or Th2 responses in the lung: in vivo function of the novel cytokine IL 25. J Immunol 2002;169:443-53. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 29 L i n f o c i t o s T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o 22. Ying S, Meng Q, Kay AB, robinson DS. Elevated expresión of interleukin 9 mRNA in the bronchial mucosa of atopic asthmatics and allergen-induced cutaneous late-phase reaction: relationships to eosinophils, mast cells and T lymphocytes. Clin Exp Allergy 2002;32:866-71. 23. Minshall E, Chakir J, Laviolette M, Molet S, Zhu Z, Olivenstein R et al. IL 11 expresion is increased in severe asthma: association with epithelial cells and eosinophils. J Allergy Clin Immunol 2000;105:232-8. 24. Humbert M, Durham SR, Kimmitt P, Powell N, Assoufi B, Pfister R et al. elevated expression of messenger ribonucleic acid encoding IL 13 in the bronchial mucosa of atopic and nonatopic subjects with asmthma. J Allergy Clin Immunol 1997;99:657-65. 25. Smart JM, Horak E, Kemp AS, Robertson CF and Tang ML. Polyclonal and allergen-induced cytokine responses in adults with asthma: resolution of asthma in associated with normalization of INF-gamma responses. J allergy Clin Immunol 2002;110:450-6. 26. De Rose V, Cappello P, Sorbillo V, Ceccarini B, Gani F, Bosticardo M, Fassio S and Novelli F. INFγ inhibits the proliferation of allergen-activated T lymphocytes from atopic,asthmatic patients by inducing Fas/FasL-mediated apoptosis. J Leukoc Biol 2004;3. 27. Prieto Martín A, García de Tena J, Manazano Espinosa L y Álvarez -Mon Soto M. Activación y especialización funcional de linfocitos T y B. En. Idepsa eds. MEDICINE 8ª ed. Madrid 2000;26:43-62. 28. Kon OM, Sihra BS, Loh LC, Barkans J, Compton CH, Barnes NC, Larche M, Kay AB. The effects of an anti-CD4 monoclonal antibody, keliximab, on peripheral blood CD4+T-cells in asthma. Eur Respir J 2001;18:45-52. 29. Chen Y, Kuchroo VK, Inobe J, Hafler DA and Weiner HL. Regulatory T cell clones induced by oral tolerance: suppression of autoimmune encephalomyelitis. Science 1994;265:1237-40. 30. Groux H, O'Garra A, Bigler M, Rouleau M, Antonenko S, de Vries JE, et al. A CD4+ T-cell subset inhibits antigen-specific T-cell responses and prevents colitis. Nature 1997;389:737-42. 31. Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self toelrance maintained by activated T cells expressing IL 2 receptor ?-chains (CD25). J Immunol 1995;160:1151-64. 32. Hori S, Nombra T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science 2003;299:105761. 33. Chen W, Jin W, Hardegen N, Lei KJ, Li L, Marinos N, McGrady G, Wahl SM. Conversion of peripheral CD4+CD25- naive T cells to CD4+CD25+ regulatory T cells by TGFβ induction of transcription factor Foxp3. J Exp Med 2003;198:1875-86. 34. Pasare C, Medzhitov R. Toll pathway-depedent blockade of CD4+CD25+ T cell mediated supresión by dendritic cells. Science 2003;299:1033-6. 35. Miyamoto K, Miyake S and Yamamura T. A synthetic glycolipid prevents autoimmune encephalomyelitis by inducing TH2 bias of natural killer T cells. Nature 2001;413:531-4. 36. Hansen G, McIntire JJ, Yeung VP, Berry G, Thorbecke GJ, Chen L, et al. CD4+ Th cells engineered to produce latent TGF reverse allergen induced airway hyperreactivity and inflammation. J Clin Invest 2000;11:89-96. 37. Nakao A, Miike S, Hatano M, Okumura K, Tokuhisa T, Ra C et al. Blockade of transforming growth factor β/Smad signalling in T cell by overexpression of Smad enhanced antigen-induced airway inflammation and airway reactivity. J Exp Med 2000;192:151-8. 38. Oh JW, Seroogy Cm, Meyer EH, Akbari O, Berry G, Fathman CG et al. CD4 T helper cells engineered to produce IL 10 reverse allergen-induced airway hyperreactivity and inflammation. J Alergy Clin Immunol 2002;110:460-8 39. Cottrez F, Hurst SD, Coffman RL, Groux H. T regulatory cells 1 inhibit a Th2 specific response in vivo. J Immunol 2000;165:484853. 40. Hadeiba H, Locksley R. Lung CD25 CD4 regulatory cells suppress type 2 immune responses but not bronchial hyperreactivity. J Immunol 2003;170:5502-10. 41. Weijia X, Pinto CE and Kradin RL. The antigen-presenting activities of Ia+ Dendritic Cells shif dynamically from lung to lymph node alter an airway challenge with soluble antigen. J Exp Med 1995;181:1275-83. 42. Foster B, Metcalfe DD, Prussin C. Human dendritic cell 1 and dendritic cell 2 subsets express FcεRI: correlation with serum IgE and allergic asthma. J Allergy Clin Immunol 2003;112:1132-8.. 29 Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 30 43. Banchereau J and Steinman RM. Dendritic cells and the control of immunity. Dendritic cells and the control of immunity. Nature 1998 Mar 19;392 (6673):245-52. 44. Lambrecht BN, Salomón B, Klatzmann D y Pauwels RA. Dendritic cells are required for the development of chronic eosinophilic airway inflammation in response to inhaled antigen in sensitized mice. J Immunol 1998;160:4090-7. 45. Fazekas B. the evolution of self-tolerance: a new cell arises to meet the challenge of self-reactivity. Immunology Today 1998;19:448-54. 46. De Heer HJ, Hammad H, Soullie T, Hijdra D, Vos N, Willart MA, Hoogsteden HC, Lambrecht BN. Essential role of lung plasmacytoid dendritic cells in preventing asthmatic reactions to harmless inhaled antigen. J Exp Med 2004;200:89-98. 47. Kapsenber ML, Hilkens CM, Wierenga EA y Kalinski P. The paradigm of type 1 and type 2 antige-presenting cells. Implications for atopic allergy. Clin Exp Allergy 1999;29(suppl 2):33-36. 48. Rieder N, reidor D, Ebner S et al. Dendritic cells contribute to the development of atopy by an insufficiency in IL-12 production. J Allergy Clin Immunol 2002;109:89-95. 49. Gentile DA, Schreiber R, Howe-Adams J, Trecki J, Patel A, Angelini B, Skoner DP. Diminished dendritic cell interleukin 10 production in atopic children. Ann Allergy Asthma Immunol 2004;92:538-44. 50. Hagendorens MM, Ebo DG, Bridts CH, De Clerck LS, Stevens WJ. Flow cytometrical determination of regulatory cytokines (IL-10, IL12) and circulating dendritic cell cytokines in allergic asthmatic children. Cytokine. 2004;26:82-8. 51. Hill SJ, Francis JN, Nouri-Aria K, Path FRC and Durhan SR. J Allergy Clin Immunol 2004;113:1025-34. 52. Holt PG, Upham JW. The role of dendritic cells in asthma. Curr Opin Allergy Clin Immunol 2004;4:39-44. 53. Gutzmer R, Langer K, LIsewski M, Mommer S, Rieckborn D, Kapp A et al. Expression and function of histamine receptors 1 and 2 on human monocyte-derived dendritic cells. J Allergy Clin Immunol 2002;109:524-31. 54. Idzko M, la Sala A, Ferrari D, Panther E, Herouy S, et al. Expresión and function of histamine receptors in human monocyte derived dendritic cells. J Allergy Clin Immunol 2002;109:839-46. 30 55. Brightling CE, Bradding P, Symon FA, Holgate ST, Wardlaw AJ, Pavord ID. Mast cell infiltration of airway smooth muscle in asthma. N Engl J Med 2002;346:1699-705. 56. Hamid Q, Song Y, Kotsimbos TC, Minshall E, Bai TR, Hegele RG, et al. Inflmmation of small airways in asthma. J Allergy Clin Immunol 1997;100:44-51. 57. Bently AM, Maestrelli P, Saetta M, Fabbri LM, Robinson DS, Bradley BL, et al. Activated T liymphocytes and eosinophils in the bronchial mucosa in isocyanate-induced asthma. J Allergy Clin Immunol 1992;89:821-9. 58. Maestrelli P, Occari P, Turato G, Papiris SA, Di Stephano A, Mapp CE, et al. Expression of interleukin (IL)-4 and IL 5 proteins in asthma induced by toluene diisocyanate (TDI). Clin Exp Allergy 1997;27:1292-8. 59. Ying S, Humber M, Barkans J, Corrigan CJ, Pfister R, Menz G et al. Expresión of IL 4 and IL 5 mRNA and protein product by CD4+ and CD8+ T cells, eosinophils and mast cells in bronchial biopsias obtained from atopic and nonatopic (intrinsic) asthmatics. J Immunol 1997;158:3539-44. 60. Aalberse RC and Platts-Mills TAE. How do we avoid developing allergy: Modifications of the Th2 response from a B cell perspective. J Allergy Clin Immunol 2004;113:983-6. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 31 L i n f o c i t o s T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o CUESTIONARIO 1. El receptor específico del linfocito T es: a) CD 95 b) BCR c) TCR d) IgG e) IgG, IgA, IgM e IgE 2. El MHC tipo II está presente en: a) Linfocito B b) Células dendrítica c) Macrófagos d) Linfocito T CD8 e) a, b y c son ciertas 3. Los a) b) c) d) e) linfocitos T reconocen: Alergenos en forma terciaria Alergenos de más de 100 aminoácidos Péptidos libres de menos de 30 aminoácidos Péptidos presentados por MHC de más de 30 aminoácidos Péptidos presentados por MHC de menos de 30 aminoácidos 4. Los a) b) c) d) e) linfocitos T CD4 de tipo Th1, producen fundamentalmente: IL-2 IL-10 IL-4 INF-γ TGF-β 5. Los a) b) c) d) e) linfocitos CD4 denominados Th3, producen fundamentalmente: IL-2 IL-10 IL-4 IFN-γ TGF-β 6. Señale la afirmación correcta: a) IgE es la molécula más pequeña de todas las Igs. b) Es la segunda más abundante en sangre periférica c) Tiene escasa relevancia en alergia d) Tiene una alta afinidad por su receptor de membrana e) Su valor permanece invariable a lo largo de la vida 7. Respecto a TGF-? a) No participa en fenómenos de hiperreactividad bronquial b) Es producido por linfocitos B c) No se asocia a enfermedades autoinmunes d) Participa en fenómenos de hiperreactividad bronquial e) No se encuentra en el aparato respiratorio 8. Respecto a las células dendríticas a) No participa en fenómenos de inflamación bronquial b) No esta asociada a inmunidad de mucosas, solo de piel c) No se asocia a fenómenos de sensibilización d) Participa en fenómenos de inflamación bronquial e) No se encuentra en el aparato respiratorio 31 Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 32 9. En la "hipótesis de la higiene", se establece un aumento de enfermedades alérgicas debido a: a) El descenso de la tuberculosis en la población b) Las medidas de aseo cotidiano principalmente c) No parece influir VHA d) No existen diferencia en la flora bacteriana digestiva en niños alérgicos y no alérgicos e) Ninguna de las anteriores son correctas 10. Respecto a IgE a) Sólo existen receptores de alta afinidad b) Sólo existen receptores de baja afinidad c) Los receptores solo están presentes en mastocitos d) Los receptores solo están presentes en mastocitos y eosinófilos e) Ninguna es cierta 32 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 33 L i n f o c i t o s T y c é l u l a s p r e s e n t a d o r a s d e a n t í g e n o Respuestas fascículo 3, capítulo X (Linfocitos en el asma) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 33 Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 34 34 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 35 I n f l a m a c i ó n e o s i n o f í l i c a e n e l a s m a Capítulo XI INFLAMACIÓN EOSINOFÍLICA EN EL ASMA Victoria del Pozo Abejón Adjunto Contratada del Servicio de Inmunología de la Fundación Jiménez Díaz Carlos Lahoz Navarro Consultor Jefe del Servicio de Inmunología de la Fundación Jiménez Díaz 35 Correspondencia y contacto: Dra. Victoria del Pozo Abejón e-mail: [email protected] FAX 91 5448246 Fundación Jiménez Díaz Servicio de Inmunología Av. Reyes Católicos 2 28040 Madrid Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 36 36 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 37 I n f l a m a c i ó n e o s i n o f í l i c a e n e l a s m a INFLAMACIÓN EOSINOFÍLICA EN EL ASMA Introducción La participación de los eosinófilos en los procesos que acompañan a la patología del asma se describió ya hace más de 80 años y nuestros conocimientos sobre el papel de estas células continua evolucionando en relación con los nuevos descubrimientos que se realizan en este campo (1). Son muchos los esfuerzos que se han hecho para entender el papel preciso que tienen los eosinófilos en la patología del asma, así como el de los mediadores de inflamación, del daño tisular y de los procesos de reparación. De hecho, se ha demostrado que una de las características del asma es la infiltración e inflamación eosinofílica, siendo estas células las principalmente implicadas en dicha patología (2-4) y por tanto las células diana en la terapéutica antiasmática. Es bien sabido que los corticosteroides disminuyen el número de eosinófilos en sangre, en esputo y en el lavado broncoalveolar (BAL), y que mejoran la gravedad del asma así como sus síntomas. Con el descubrimiento de la interleucina 5 (IL-5) en los años 80 como la principal citocina implicada en la regulación y diferenciación de los eosinófilos comenzaron las investigaciones intentando antagonizar la IL-5 y así bloquear la eosinofilia tisular y presumiblemente inhibir las secuelas derivadas de ello. Sin embargo, el papel de los eosinófilos como células efectoras en la patogénesis del asma se ha cuestionado a raíz de un controvertido estudio sobre la utilización de un anticuerpo monoclonal anti-IL-5 -mepolizumab- (5). Con este tratamiento se consiguió deplecionar los eosinófilos, tanto en sangre como en esputo, pero no se inhibió la broncoconstricción inducida por alergeno. Aunque posteriormente, en nuevas publicaciones aparecidas en Science, con dos modelos diferentes en los que se eliminan selectivamente los eosinófilos, han demostrado que estas células son requeridas para la hiperreactividad bronquial (HRB) y la producción de moco y que tienen un papel critico en la remodelación (6). Los eosinófilos son células fundamentalmente titulares, que provienen de la medula ósea y que no tienen capacidad de proliferar (7). Tienen aproximadamente 8 µm de diámetro y un núcleo bilobulado. Lo más característico de este tipo celular es que en el citoplasma celular existen unos gránulos específicos que contienen proteínas básicas . Estos gránulos tienen gran capaci- dad para captar colorantes ácidos como la eosina, lo que da al eosinófilo una apariencia característica al microscopio, que fue lo que hizo a Paul Ehrlich en 1879 descubrir y describir al eosinófilo. Los eosinófilos producen mediadores tóxicos enzimáticos y proinflamatorios que se almacenan en gránulos. Estos, contienen una parte central o core cristaloide compuesto de la proteína mayor básica (MBP) y una matriz que contiene la proteína catiónica del eosinófilo (ECP), la neurotoxina (EDN) y la peroxidasa (4). La ECP y EDN son ribonucleasas (8) y gracias a la peroxidasa del eosinófilo se produce peróxido de hidrógeno y otros derivados oxigenados que también son tóxicos para las células. Las enzimas ciclooxigenasa y 5-lipooxigenasa generan grandes cantidades de leucotrienos cisteinílicos producidos a partir de los fosfolípidos de la membrana (9). Los eosinófilos contienen además fosfatasas y arilsulfatasas (10) y unos gránulos primarios de un tamaño variable con la proteína de Charcot-Leyden que aparece en el esputo de los pacientes asmáticos, y que es una proteína de la familia de las galectinas. Los eosinófilos expresan una amplia gama de receptores y antígenos de superficie del tipo moléculas de adhesión, receptores para citocinas, quimioatrayentes, e inmunoglobulinas, así como estructuras transmembranales implicadas en transducción de señales. La mayoría de los receptores que tienen los eosinófilos responden a una necesidad funcional, ya que primariamente los eosinófilos tienen que migrar desde la médula ósea hacia la sangre y de ahí a los tejidos. La acumulación de eosinófilos en las enfermedades alérgicas se debe a una combinación de factores que incluyen vías selectivas de adhesión, de quimioatracción y a una larga supervivencia debido a la influencia de citocinas generadas localmente (11). Los receptores de adhesión de los eosinófilos además de intervenir en la migración de éstos desde la sangre a los tejidos, influyen en la hematopoyesis en la medula ósea, en la supervivencia en los tejidos a través de su interacción con las proteínas de la matriz y en interacciones con células residentes, tales como las del epitelio, y en el aclarado de células apoptóticas por los macrófagos (12, 13). Los eosinófilos expresan receptores Fc para IgG, IgA e IgE. El principal receptor para la IgG presente en los eosinófilos es el CD32 (FcγRII) aunque bajo la induc- 37 Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 38 ción de IFN-γ pueden expresar CD64 (FcγRI) y CD16 (FcγRIII). La importancia funcional de los receptores para la IgE en los eosinófilos es incierta y controvertida a pesar de la intensa investigación que se ha llevado a cabo sobre ellos. Los eosinófilos activados expresan CD23, y también una proteína con capacidad para unir IgE, la galectina-3, con funciones importantes en la regulación de la síntesis de IL-5 (14, 15). En la acumulación de eosinófilos en los tejidos intervienen cuatro procesos: 38 1.- Diferenciación de las células progenitoras y proliferación de los eosinófilos en la medula ósea. Los eosinófilos se producen en la medula ósea a partir de la células pluripotenciales, que se diferencian primero en precursores híbridos con propiedades de basófilos y eosinófilos, para posteriormente separarse en el linaje eosinofílico. En la regulación de este proceso son particularmente importantes tres citocinas: IL-3, IL-5 y GM-CSF. Los genes que codifican para estas citocinas se encuentran muy cerca unos de otros y todos están en el cromosoma 5q31. De las tres citocinas, la IL-5 es la más específica para los eosinófilos y es la responsable de su diferenciación selectiva, también estimula la liberación de los eosinófilos desde la médula ósea a la circulación periférica (16). El importante papel que tiene la IL-5 en la producción de eosinófilos se ha demostrado en ratones transgénicos, en los cuales la superproducción de IL-5 produce una gran eosinofilia y por el contrario, la delección del gen de la IL-5 produce una marcada reducción del número de eosinófilos en sangre y en los pulmones, tras la provocación con un alergeno (17, 18). Las enfermedades que implican eosinofilia sin incremento de otras células normalmente van acompañadas de una superproducción de IL-5. 2.- Interacción entre eosinófilos y células endoteliales: esto implica el rodamiento (rolling), adhesión y migración de eosinófilos La migración de los eosinófilos desde la circulación hasta los tejidos implica una serie de pasos intermedios en los cuales se producen interacciones de los eosinófilos con las células endoteliales. Estos pasos están mediados por moléculas de adhesión, que se encuentran localizadas en las células endoteliales y sus ligandos en los eosinófilos y que conlleva el paso de los eosinófilos a través de dichas células. Los eosinófilos se adhieren en primer lugar al endotelio a través de las selectinas y sus ligandos correspondientes. El rodamiento o rolling de los eosinófilos en el endotelio esta mediado por la P-selectina. Tras la activación celular (por exposición a otras quimiocinas como la eotaxina), los eosinófilos se adhieren firmemente al endotelio a través de las moléculas de adhesión de la familia de las integrinas: CD18 (β2-integrinas), VLA-4 (β1-integrinas). Las β2-integrinas interaccionan con ICAM-1 en las células endoteliales y las β1-integrinas con VCAM-1. 3.- Quimioatracción de los eosinófilos al sitio especifico de la inflamación: La migración de los eosinófilos en los tejidos es iniciada por una serie de moléculas que son quimioatrayentes locales. Estas moléculas son las responsables del reclutamiento de los eosinófilos en los tejidos inflamados. Existen muchas sustancias con estas características que actúan sobre los eosinófilos, incluyendo derivados del ácido araquidónico, como LTB4 y PAF, productos bacterianos, interleucinas y quimiocinas (9). Aunque estas sustancias median el reclutamiento de los eosinófilos, la mayoría no son selectivas para los eosinófilos. Sin embargo, se han descrito una familia de moléculas que son quimiocinas como la eotaxina-1, eotaxina-2 y eotaxina-3 que son relativamente especificas para eosinófilos y que se unen específicamente al receptor CCR3 (19, 20). Las quimiocinas son una familia de moléculas de bajo peso molecular (8-10 kDa) con actividad quimiotáctica que regulan el movimiento de los leucocitos. Muchas quimiocinas interaccionan con los eosinófilos por interacción con el receptor CCR3, que está relativamente restringido a los eosinófilos. El efecto quimiotáctico de la eotaxina se ve potenciado por la IL-5. Es notable que dos pasos distintos en la acumulación de los eosinófilos en los tejidos, como la proliferación y la quimioatracción, sean regulados por dos moléculas que son relativamente especificas para los eosinófilos y que actúan de una forma sinérgica promoviendo su acumulación (21). 4.- Activación y destrucción de eosinófilos: Los eosinófilos, al contrario que los neutrófilos, pueden sobrevivir en los tejidos un periodo de tiempo muy largo (incluso semanas), dependiendo, eso sí, de las citocinas que haya en el microambiente. Sólo los eosinófilos y los basófilos tienen receptores para IL-3, IL-5 y GMCSF, que están también en los precursores en la medula ósea y en las células circulantes. Aunque la vida media de los eosinófilos tisulares no se conoce con exactitud, si se sabe que la IL-3, la IL-5 y el GM-CSF inhiben la apoptosis de los eosinófilos al menos 12 ó 14 días in vitro y en explantes de tejido sinusal de pacientes alérgicos, sin embargo, en ausencia de estas citocinas los eosinófilos sobreviven menos de 48 horas, además los eosinófilos regulan su propia supervivencia a través de una vía autocrina. Así pues, la permanencia de los eosinófilos en los pulmones depende de las señales pro y antiapoptóticas presentes en el tejido (22, 23). MECANISMOS DE LA INFLAMACIÓN EOSINOFÍLICA El asma es una enfermedad compleja que se manifiesta con diferentes fenotipos. La evidencia de que el asma es una enfermedad inflamatoria deriva del hallazgo de infiltrados de eosinófilos y otras células inflamatorias en las vías respiratorias de los pacientes asmáticos. Este componente inflamatorio consiste principalmente en eosinófilos, mastocitos y células T CD4+ (24). Son varios los mecanismos independientes que permiten al eosinófilo modular la intensidad de la inflama- C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 39 I n f l a m a c i ó n e o s i n o f í l i c a e n Importantes en la remodelación tisular e l a s m a Citotóxicas PROTEÍNAS BASICAS MBP, EPO, EDN, ECP FACTORES DE CRECIMIENTO O FIBRÓGENICOS TGF-α, TGF-β, Angiogenina, FGF-2, HB-EGF, NGF, PDGF, VEGF, SCF CITOCINAS Eosinófilopoyesis Activación celular Proinflamatorias IL-1, -2, -3, -5, -4, -6, -9, -10, -11, -12, -13, -16, -17, IFN-γ, GM-CSF, TNF-α QUIMIOCINAS Eoxatina, Rantes, MCP-1, -3, -4, IL-8, MIP-1α Lesión tisular Broncocostricción OTROS especies reactivas de oxígeno, Neuropéptidos, MMP-9 y derivadas de fosfolípidos de membrana Importantes en la migración celular Figura 1. Mediadores inflamatorios derivados de los eosinófilos ción pulmonar: a) Como células inmunoreguladoras son capaces de generar citocinas (25). b) Además, los eosinófilos activados generan y liberan cantidades importantes de reactivos intermediarios de oxígeno (anión superóxido, peróxido de hidrógeno y radicales hidroxi) y de nitrógeno (NOx) y lípidos que son mediadores de la inflamación, como los derivados de leucotrienos cisteinílicos, 5-HETE, PGE2, PAF etc., (26, 27, 28). c) Los eosinófilos segregan una serie de enzimas degradativas como la elastasa, la colagenasa, las ribonucleasas etc, las cuales afectan a la estructura del pulmón. Por último, d) los eosinófilos liberan las proteínas catiónicas de sus gránulos (MBP, ECP), altamente tóxicas para el epitelio pulmonar, que además incrementan la permeabilidad vascular, inducen la contracción de la musculatura lisa bronquial, y activan otras células del pulmón (29). En la Figura 1 se incluyen una serie de mediadores derivados de los eosinófilos. Tras la exposición a un alergeno, en los individuos sensibilizados se produce una respuesta tardía que comienza a las 3-4 horas y que alcanza el pico a las 8 horas, que se caracteriza por la acumulación de eosinófilos y células T. Podemos pues decir que ambas estirpes celulares son las más importantes que conducen a la inflamación pulmonar, existiendo además múltiples interacciones entre ambos tipos de células con la presencia de neutrófilos y macrófagos. En nuestro laboratorio se demostró en 1992 el papel que los eosinófilos pueden tener como células accesorias presentadoras de antígeno, y ya entonces pensábamos que este podía ser una manera de actuar en los procesos alérgicos (30). Esto se vio posteriormente en modelos humanos, y muy recientemente se ha demostrado el papel de los eosinófilos endobronquiales en la presentación de alergenos inhalados a los linfocitos T y la inducción de una respuesta preferentemente de tipo Th2 (31). Existen considerables evidencias que apoyan el papel de las células T en el asma, particularmente se ha implicado a las células Th2 y quizás contribuyan aunque en menor medida las células Tc2 CD8+ (32). Varias citocinas derivadas de las células Th2 contribuyen a la patogenia del asma a través de diferentes mecanismos, como la síntesis de IgE, activación y maduración de mastocitos y basófilos, infiltración de eosinófilos, etc. Además, en los últimos años se ha descrito un amplio conjunto de nuevas citocinas, y nuestro conocimiento y entendimiento de los mecanismos de control molecular de la activación y diferenciación de las células T, así como su relación con otras células, ha mejorado notablemente, de forma que son muchas más las citocinas que potencialmente pueden actuar en el asma. En la Tabla 1 se resumen algunas de ellas así como sus acciones relacionadas con la patología del asma. De la observación de la tabla podemos concluir como ha aumentado considerablemente el número de citocinas que contribuyen a la patogenia del asma. Esta abundancia junto con la redundancia de funciones explica en parte los resultados contradictorios obtenidos cuando se han utilizado terapias frente a una única citocina. Un factor importante en este contexto es el control de la producción de citocinas; se han descrito una serie de factores de transcripción y moléculas de señalización que intervienen en este control: c-maf, NF-κB, STAT-6 y GATA-3. GATA-3 es un fuerte controlador del gen de la IL-5 y parece que NF-κB podría controlar la expresión de GATA-3. Recientemente se ha 39 Asma I Fasc culo 3.qxd 40 10/03/2006 10:39 PÆgina 40 Citocinas Células productoras Funciones IL-2 Th1, Eos Factor de crecimiento de cel. T IL-3 Th1, Th2, Eos, Mast, Baso, Mac/Mono, Fib Diferenciación y activación de Eos, Neu, Baso y Mast IL-4 Th2, Eos, Mast, Baso Síntesis de IgE, desarrollo de Mast, activación de Eos y Baso, secreción de moco, aumenta la expresión de VCAM en endotelio. IL-5 Th2, Eos, Mast, Baso Diferenciación, maduración y activación de Eos y Baso IL-6 Th1, Th2, Mac, Endo Factor de crecimiento de c. T y B, cofactor para la síntesis de IgE. IL-8 Endo, Epi, Mac, Fib, T Activación y quimiotaxis de Neu, ligera quimiotaxis de Eos IL-9 Th2, Eos, Mast, Baso Desarrollo de Mast y Eos, Hiperreactividad bronquial, secrección de moco. IL-10 T, Mac Suprime la función Th1/Th2, activación de Eos, Mast, Baso, favorece la producción de T reg, y la producción de IgG4 IL-11 Fib, Mac, Endo, Epi Hiperreactividad bronquial, eosinofilia, hipersecreción de moco, y remodelación de las vías aéreas IL-12 Mac, B Favorece la producción de Th1, inhibe la síntesis de IgE IL-13 Th2, Eos, Mast, Baso Desarrollo de Mast, Producción de IgE, eosinofilia, hiperreactividad bronquial, producción de moco IL-15 Muchas cel. no T Factor de crecimiento de T, expande Treg IL-16 CD8+, Mast, Eos Quimioatrayente para CD4, mono y eos IL-17 CD4 memoria Induce la producción de citocinas inflamatorias en Fib, Mac, Epi, Endo IL-18 Mac Induce producción de IFN- en T y NK, favorece la expansión de Th1. IL-23 Varias cel. hematopoyéticas Cofactor para el desarrollo de Th1, activa a cel. Dendríticas. IL-25 Th2 Favorece el desarrollo de Th2 y la producción de IL-4, IL-5 e IL-13. IL-27 CPA Favorece la expansión de Th1 GM-CSF Th1, Th2, Mac, Eos, Mast, Baso, Fib, Epi, Endo Diferenciación y activación de Eos, Neu, Baso, Mast TNF-α Mac, NK, T Diferenciación y activación de Eos, Neu, Baso, Mast TGF-β Eos, Mast, Baso, T, mono, Mac Suprime la función Th1/Th2, favorece la inducción de Treg, cofactor para la secreción de IgA, fibrosis IFN-γ Th1, NK Inhibe la síntesis de IgE y la inducción de Th2 activa Eos y Mac Treg, células T reguladoras; Eos, eosinófilos; Neu, neutrófilos; Baso, basófilos, Mast, mastocitos; Mac, macrófagos; Mono, monocitos; Fib, fibroblastos; VCAM, molécula de adhesión celular vascular; Endo, células endoteliales; Epi, células epiteliales; CPA, células presentadoras de antígeno. Tabla I. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:39 PÆgina 41 I n f l a m a c i ó n e o s i n o f í l i c a e n e l a s m a Figura 2. Diagrama de los factores que influyen en la regulación reclutamiento y funciones efectoras de las células Th2. Modificado de Larché M., Robinson D.S., Kay A.B. The role of T lymphocytes in the pathogenesis of asthma. J Allergy Clin Immunol 2003;111:450-63 descrito un factor, el T-bet, que parece controlar el desarrollo de Th1, sugiriéndose que el defecto en el desarrollo de las células Th1 observada en los individuos asmáticos, a través de una deficiencia en T-bet, predispondría a una respuesta Th2. En la Figura 2 se representan esquemáticamente los factores y citocinas que influyen en la regulación, reclutamiento y funciones efectoras de las células Th2. EOSINÓFILOS Y CAMBIOS ESTRUCTURALES DE LA VÍAS AERÉAS El asma alérgica se caracteriza, además de la inflamación eosinofílica, por una serie de cambios estructurales en las paredes de las vías aéreas que en conjunto se denominan remodelación. El fenotipo de la remodelación es consecuencia de un excesivo proceso de reparación tras repetidos ataques, que incluye un incremento en los depósitos de proteínas de la matriz extracelular (MEC) en la membrana basal reticular y en la submucosa bronquial. Estas proteínas son fundamentalmente procolágeno III y proteoglicanos (tenascina y lumican). Otras características de este proceso incluyen un incremento de la musculatura lisa, hiperplasia de las células caliciformes y la formación de nuevos vasos sanguíneos (33). Existen pocos datos concluyentes de la participación de los eosinófilos en el proceso de reparación y remodelación de las vías respiratorias. La razón por la que se cree que los eosinófilos participan en estos procesos es que recientemente se ha descrito que los eosinófilos producen metaloproteinasas, colagenasas y factores de crecimiento (TGF-βy PDGF) que regulan la proliferación y producción de fibroblastos en la matriz y otros tejidos estromales. Además, estas células liberan colágeno y factores de crecimiento del tipo de endotelina 1 y VEGF que son mitogénicos paras las células endoteliales, así pues a partir de la producción de TGF-β se inician y se propagan las señales de la remodelación (34, 35). Se ha sugerido que otras citocinas intervienen en este proceso, como la IL-4 y la IL-13 que son citocinas del tipo Th2, aunque parecen menos potentes que el TGF-β. Los eosinófilos liberarían TGF-β latente, este factor latente se activaría por la integrina αVβ6 que se expresa en células epiteliales y así el TGF-β mediaría la inducción de miofibroblastos, la secreción de proteínas de la matriz extracelular y de factores de crecimiento que estimularían la hiperplasia de la musculatura lisa pulmonar (36). Estos datos han sido confirmados recientemente en diversos artículos, así en el modelo de ratón con el gen de la IL-5 anulado o desactivado se ha visto que la remodelación del tejido pulmonar está inhibida, coincidiendo con una disminución en la cantidad de TGF-β. En el mismo sentido, se ha demostrado que en los pacientes que reciben tratamiento con el anticuerpo monoclonal anti-IL-5 se observa una disminución de TGF-β en el BAL (37, 38). Otro hallazgo importante en relación con la reestructuración del tejido dañado ha sido la identificación del gen 41 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 42 ADAM33 como el nuevo gen del asma, que se ha asociado significativamente al fenotipo HRB. Este gen pertenece a la familia de genes ADAM, que son metaloproteinasas dependientes de Zn++. Su estructura genética es compleja, implicando secuencias de transmisión o transducción de señales, dominios procatalíticos y catalíticos, dominios desintegrinas, etc. Este gen se expresa preferentemente en las células de la musculatura lisa, miofibroblastos y fibroblastos y no en células epiteliales, células T o leucoci- presencia causa en las enfermedades alérgicas. No es sorprendente que debido a la carga de proteínas catiónicas y enzimas, así como, de derivados reactivos del oxígeno e hidrógeno y la capacidad de liberar mediadores lipídicos y citocinas proinflamatorias, estas células sean junto con los linfocitos, macrófagos (40), neutrófilos (41) y las principales efectoras de los procesos inflamatorios de las vías respiratorias. IL-9 IL-9 IL-13 EOSINÓFILOS Y BASÓFILOS IL-13 IL-5 IL-13 IL-13 IL-4 IL-4 SECRECIÓN DE MOCO HRB SÍNTESIS DE IgE IL-4 CD4+ Th2 CITOCINAS EFECTORAS T reg L-10 GATA-3 STAT4 STAT6 favorecen Th-1 C-maf IL-12 42 }+ T-bet IL-18 favorecen Th-2 IL-23 IL-4 IL-27 IL-25 Il-9 MASTOCITOS IL-9 IL-13 IL-4 RECLUTAMIENTO CCR3 (Eotaxina, RANTESs, MCP-3 y 4 CCR4 (MDC/TARC) CCR8 (I-309) CrTh2 (PGD2) CD4 (IL-16) Figura 2. Diagrama de los factores que influyen en la regulación, reclutamiento y funciones efectoras de las células Th2 y en la inflamación eosinofílica. (Modificado de Larché M., Robinson D.S., Kay A.B. The role of lymphocytes in the pathogenesis of asthma. J. Allergy Clin Immunol 2003; 111: 450-63). tos. Esta localización preferente en células mesenquimales, sugiere que una actividad anormal de este gen podría estar relacionado con la HRB observada en el asma. Aunque la función exacta de ADAM33 no se conoce, parece que puede tener funciones asociadas con la adhesión y funciones proteolíticas basados en los dominios que tiene, de manera que según sean los empalmes alternativos en el ARNm, se producirán proteínas que participen en unas u otras funciones. De hecho se han descrito polimorfismos que afectan a intrones funcionales y que conducen a alguna de las anormalidades descritas en el asma. En cualquier caso, el entendimiento de la función de este gen aclarará la contribución de ADAM33 en el asma (39). Anteriormente se han enumerado las citocinas y mediadores que son capaces de almacenar los eosinófilos, pero son la IL-4, IL-5 y la IL-13 las más importantes, junto con TNF-α y TGF-β y que se han demostrado en el sobrenadante del BAL y en el propio tejido pulmonar con un aumento de la expresión del ARNm para estas citocinas (42-44). Además, corroborando el papel importante del eosinófilo en el asma, se ha demostrado que existe una relación entre el número de estas células y la gravedad de la enfermedad, y por inmunofluorescencia se sabe que hay un depósito de proteínas catiónicas en la submucosa bronquial en el asma (45). Podemos concluir pues que los eosinófilos tienen la capacidad de dañar y de reparar los tejidos. Como anteriormente se ha avanzado, la IL-5 está aumentada en el líquido del BAL de los asmáticos extrínsecos y en la mucosa bronquial sobre todo después de la estimulación con el antígeno. Este incremento desaparece con el tratamiento con corticosteroides (46). A raíz de los estudios de Leckie y cols (5), ASMA Y EOSINÓFILOS Una de las formas de analizar el poder lesivo de los eosinófilos activados es estudiando los efectos que su C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 43 I n f l a m a c i ó n se ha discutido el papel de los eosinófilos en el asma, debido entre otros factores a que la HRB persiste en los asmáticos después del tratamiento (47-49). Esto podría ser debido a que los tratamientos de ablación de los eosinófilos con anticuerpos afectan solo a los eosinófilos, pero no a los linfocitos T, que secretan la IL-13 que es Th2 dependiente y es una de las citocinas responsables de esa HRB. No obstante, hay estudios experimentales en los que la depleción de eosinófilos disminuye no sólo la presencia de éstos en el líquido del BAL sino también en el parénquima (50, 51), además, la HRB revierte. Entre ellos están los realizados por nuestro grupo, en los que el tratamiento de ratas asmáticas con el gen que codifica para Galectina-3 mejora espectacularmente el asma en esos roedores (52). Lo más importante en esos estudios experimentales es que en un modelo de asma crónica en ratones se ha demostrado que la galectina, posiblemente a través de su modulación de la IL-5, es capaz no solo de prevenir el asma aguda, sino que puede evitar las modificaciones titulares que dan lugar a la remodelación pulmonar que se produce como consecuencia del asma crónica (53). También la utilización de otros anticuerpos monoclonales que no son anti-IL-5, como pueden ser los anticuerpos anti-receptor CCR3 (en relación con la eotaxina), producen un efecto similar en ratones (54). Estas estrategias son especialmente importantes en los casos de asma grave corticoresistentes, dado que constituyen una importante alternativa de futuro que además de actuar por otras vías, disminuiría el coste farmacéutico de los tratamientos actuales. Resumiendo, para analizar el papel de los eosinófilos en la patología respiratoria a través de los experimentos en modelos de asma en animales y de ensayos clínicos con anticuerpos monoclonales, hay que tener en cuenta varias consideraciones como son: a) la fiabilidad de los modelos animales en cuanto a la reproducibilidad de la enfermedad b) validación de los ensayos clínicos según diferentes variables: análisis de BAL vs estudio celular en parénquima pulmonar, medicación sistémica vs aerosoles, modelos como la bronquitis eosinofílica y su validez para estudiar la patogenicidad del eosinófilo, etc (55). En el momento presente, vuelve a tomar fuerza la importancia del eosinófilo en el asma y el reciente descubrimiento de la presencia de progenitores de eosinófilos que son células que expresan la cadena alfa del receptor de IL-5 y además son CD34 positivas, en el esputo inducido en asmáticos, corrobora esta importancia (56, 57). Por estas razones son importantes las investigaciones dirigidas a la neutralización de las citocinas que promueven la producción, activación y movilización de los progenitores de los eosinófilos, pues se sabe que la normalización de los eosinófilos en el esputo conduce a una disminución de la exacerbación del asma y disminuye el número de ingresos (58). Además, recientemente se han publicado dos artículos en Science estudiando el papel de los eosinófilos en el e o s i n o f í l i c a e n e l a s m a asma, produciendo para ello ratones en los que la línea eosinofílica ha sido completamente deplecionada, demostrándose que los eosinófilos son necesarios para la HRB y la acumulación de moco (6, 59), resultados que aunque requieran confirmación tanto en ratones como en humanos, vuelven a colocar a los eosinófilos como células importantes en el desarrollo del asma y hace que se sigan buscando terapias que deplecionen los eosinófilos para su uso clínico. Los futuros estudios tendrán como diana a los eosinófilos y estructuras relacionadas con los eosinófilos que, en última instancia, nos servirán para clarificar el papel de esta enigmática célula en el asma y en la inflamación alérgica de manera que en cualquier caso la muerte de "la hipótesis del eosinófilo" es prematura y exagerada (60). 43 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 44 Bibliografía 1. Huber HL., Koesler KK. The pathology of bronchial asthma. Arch Int Med 1922; 30:689-760. 2. Busse WW., Lemanske RF. Asthma. N Engl J Med 2001; 344:350-62. 3. Tattersfield AE., Knox AJ., Britton JR., Hall IP. Asthma . Lancet 2002; 360:1313-22. 4. Rothenberg ME. Eosinophilia. N Engl J Med 1998; 338:1592-1600. 5. Leckie M, Brinke A, Khan J, Diamant Z, O'Connor BJ, Walls CM, Mathur AK, Cowley HC, Chung KF, Dukanovic R, Hansel TT, Holgate ST, Sterk PJ, Barnes PJ. Effects of and interleukin-5 blocking monoclonal antibody on eosinophils, airway hyper-responsiveness, and the late asthmatic response. Lancet 2000; 356:2144-2148. 6. Humbles AA. Et al (2004) a critical role for eosinophils in allergic airways remodeling. Science 305, 1776-1779. 7. Spry CJF. Eosinophils: A comprehensive review, and guide to the scientific and medical literature, p 3, Oxford University Press, Oxford. 8. Slifman NR, Loegering DA, McKean DJ, Gleich GJ. Ribonuclease activity associated with human eosinophil-derived neurotoxin and eosinophil cationic protein. J. Immunol 1986; 137:2913-7. 9. Nagata M., Saito K. The roles of cysteinyl leukotrienes in eosinophilic inflammation of asthmatic airways. Int Arch Allergy Immunol 2003; 131(S1):7-10. 10. Walsh GM. Advances in the immunobiology of eosinophils and their role in disease. Crit Rev Clin Lab Sci. 1999; 36:453-496. 11. Bochner BS. Verdict in the case of therapies versus eosinophils: The jury is still out. J Allergy Clin Immunol 2004; 113:1-7. 44 12. Teixeira MM, Williams TJ, Hellewell PG. Mechanism and pharmacological manipulation of eosinophil accumulation in vivo. Trends Pharmacol Sci 1995; 16:418-23. 13. Frenette PS, Wagner DD. Adhesion molecules- Parts I and II. N Engl J Med 1994; 334:1526-9, 335:43-5. 14. Cortegano I, del Pozo V, Cárdaba B, de Andrés B, Gallardo S, del Amo A, Arrieta I, Jurado A, Palomino P, Liu F-T, Lahoz C. .Galectin-3 down-regulates IL-5 gene expression on different cell types. Journal of Immunology 1998; 161:385-89. 15. Cortegano I, del Pozo V, Cardaba B, Arrieta I, Gallardo S, Rojo M, Aceituno E, Takai T, Verbeek S, Palomino P, Liu F-T, Lahoz C. Interaction between galectin-3 and Fc RII induces down-regulation of IL-5 gene.Implication of the promoter sequence IL-5REIII. Glicobiology 1999; 10: 237-242. 16. Stirling RG., Van Rensen ELJ., Barnes PJ., Chung KF. Interleukin-5 induces CD34+ eosinophils progenitor mobilization and eosinophils CCR3 expression in asthma. Am J Respir Crit Care Med 2001; 164:1403-1409. 17. Foster PS, hogan SP, Ramsay AJ, Matthaei KI, Young IG. Interleukin-5 deficiency abolishes eosinophilia, airways hyperreactivity, and lung damage in a mouse asthma model. J Exp Med. 1996; 183:195:201. 18. Lee JJ., McGarry MP., Farmer SC., Denzler KL., Larson KA., Carrigan PE., Brenneise IE., Horton MA., Haczku A., Gelfand EW., Leikauf GD., Lee NA. Interleukin-5 expression in the lung ephitelium of transgenic mice leads to pulmonary changes pathognomonic of asthma. J Exp Med 1997; 185:2143-2156. 19. Shin HD., Kim LH., Jung JH., Chung IY, Kim JS, Lee JH, Chung SH., Kim YH, Park HS, Choi JH, Lee Sw, Choi BW, Hong SJ., Park CS. Association of eotaxin gene family with asthma and serum total IgE. Hum Mol Genet 2003; 12(11):1279-85. 20. Komiya A, Nagase H., Yamada Hirai K. Concerted expresión 225(2):91-100. 21. Oliveira SHP., Lukacs NW. The reactions. Braz J Med Biol Res H., Sekiya T., Yamaguchi M., Sano Y., Hanai N., Furuya A., Ohta K., Matsushima K., Yamamoto K., of eotaxin-1, eotaxin-2, and eotaxin-3 in human bronquial epithelial cells. Cell Immunol 2003; role of chemokines and chemokine receptors in eosinophil activation during inflammatory allergic 2003; 36:1455-63. 22. Walsh G.M., Sexton D.W., Blaylock M.G. Mechanisms of steroid action and resistance in inflammation. Corticosteroids, eosinophils ans bronchial epithelial cells: new insights into resolution of inflammation in asthma. J Endocrinology 2003; 178:37. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 45 I n f l a m a c i ó n e o s i n o f í l i c a e n e l a s m a 23. Dewson G., Cohen GM., Wardlaw AJ. Interleukin-5 inhibits translocation of Bax to the mitochondria, cytochrome c release, and activation of caspases in human eosinophils. Blood 2001; 98:2239-47. 24. Hamid Q, Tulic' MK, Liu MC, Moqbel R. Inflammatory cells in asthma: mechanisms and implications for therapy J Allergy Clin Immunol. 2003;111:S5-S17. 25. Lamkhioued B, Aldebert D, Gounni AS, Delaporte E, Goldman M, Capron A, Capron M. Synthesis of cytokines by eosinophils and their regulation. Int Arch Allergy Immunol. 1995 May-Jun;107(1-3):122-3. 26. de Andres B, del Pozo V, Martin E, Palomino P, Lahoz C. Release of O2- and LTC4 by murine eosinophils: role of intra- and extracellular calcium. Immunology. 1990 ;69(2):271-6. 27. Del Pozo V, De Andres B, Martin E, Maruri N, Zubeldia JM, Palomino P, Lahoz C. Murine eosinophils and IL-1: alpha IL-1 mRNA detection by in situ hybridization. Production and release of IL-1 from peritoneal eosinophils. J Immunol. 1990; 144:3117-22. 28. del Pozo V, de Arruda-Chaves E, de Andres B, Cardaba B, Lopez-Farre A, Gallardo S, Cortegano I, Vidarte L, Jurado A, Sastre J, Palomino P, Lahoz C. Eosinophils transcribe and translate messenger RNA for inducible nitric oxide synthase. J Immunol. 1997; 158:859-64. 29. Lacy P., Weller PF., Moqbel R. A report from the international eosinophil society: eosinophils in a tug of war. J Allergy Clin Immunol 2001; 108:895-900. 30. Del Pozo V, De Andres B, Martin E, Cardaba B, Fernandez JC, Gallardo S, et al. Eosinophil as antigen- presenting cell: activation of T cell clones and T cell hybridoma by eosinophils after antigen processing. Eur J Immunol 1992;22:1919-1925. 31. Shi, H.-Z; Xiao, C.-Q.; Li, C.-Q; Mo, X.-Y.; Yang, Q.-L.; Leng, J.; Chen, Y.-Q Endobronchial eosinophils preferentially stimulate T helper cell type 2 responses.1 Volume 59(4)April 2004 p 428-435. 32. Kay AB. Allergy and allergic diseases. N Engl J Med 2001; 344:30-37. 33. Busse W., Elias J., Sheppard D., Banks-Schlegel S. Airway remodeling and repair. Am J Respir Crit Care Med 1999; 160:1035-1042. 34. Flood-Page P., Menzies-Gow A., Phipps S., Ying S., Wangoo A., Ludwing MS, Barnes N., Robinson DS., Kay AB. Anti-IL-5 treatment reduces deposition of ECM proteins in the bronchial subepithelial besement membrane of mild atopic asthmatics. J Clin Invest 2003; 112:1029-36. 35. Davies DE., Wicks J., Powel RM., Puddicombe SM., Holgate T. Airway remodeling in asthma: new insights. J Allergy Clin Immunol 2003;111:215-25. 36. Williams TJ. The eosinophil enigma. J Clin Invest 2004; 113:507-509. 37. Cho JY., Miller M., Baek KJ., Han JW., Nayar J., Lee SY., McElwain K., McElwain S., Friedman S., Broide DH. Inhibition of irway remodeling in IL-5-deficient mice. J Clin Invest 2004; 113:551-560. 38. Biulay M-E., Boulet L-P. Airway response to low-dose allergen exposure in allergic nonasthmatic and asthmatic subjects. Eosinophils, fibronectin, and vascular endothelial growth factor. Chest 2003; 123:430S. 39. Shapiro SD., Owen CA. ADAM-33 surfaces as an asthma gene. N Engl J Med 2002; 347:936-938. 40. Specific allergens enhance elastase release in stimulated neutrophils from asthmatic patients. Int Arch Allergy Immunol. 2003 Jul;131(3):174-81. 41. Monteseirin J, Bonilla I, Camacho MJ, Chacon P, Vega A, Chaparro A, Conde J, Sobrino F. Monteseirin J, Bonilla I, Chacon P, Vega A, Camacho MJ, Guardia P, Conde J, Sobrino F Allergen-dependent CD14 modulation and apoptosis in monocytes from allergic patients. Allergy. 2003 Oct; 58(10):1027-3. 42. Humbert MC, Corrigan P, Kimmit SJ, .et al 1997. Relationship between IL-4 and IL-5 mRNA expression and disease severity in atopic astma. Am J Resp Crit Care Med 156:704-708). 43. Humbert M, Corrigan CJ, Durham SR, Kimmit P, Till SJ, Kay AB. Relationship between bronchial mucosal IL-4 and IL-5 mRNA expression and disease severity in atopic asthma. Am J Repsir Crit Care Med 1997; 156:704-8. 44. Robinson DS, Hamid Q, Bentley A, Ying S, Kay AB, Durham SR. Activation of CD4+ Tcells, increased Th2-type cytokine mRNA expression, and eosinophil recruitment in bronchoalveolar lavage after allergen inhalation challenge in atopic asthmatics. J Allergy Clin Immunol 1993; 92:313-24. 45 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 46 45. Filley WV, Holley KE, Kephart GM, Gleich GJ. Identification by immunoflourescence of eosinophil granule major basic protein in lung tissue of patients with bronchial asthma. Lancet 1982; 2 (8288):11-16. 46. Hamid Q, Azzawi M, Ying S, Moqbel R, Wardlaw AJ, Corrigan CJ, Bradley B, Durham SR, Collins JV, Jeffrey PK, Quint DJ, Kay AB. Expression of mRNA for IL-5 in mucosal bronchial biopsies from asthma. J Clin Invest 1991; 87:1541-6. 47. Kips JC., O´Connor BJ., Langley SJ., Woodcock A., Kerstjens HAM, Postma DS., Danzig M., Cuss F., Pauwels RA. Effect of SCH55700, a humanizad anti-human interluukin-5 antibody, in severe persistent asthma. A pilot study. Am J Respir Crit Care Med 2003; 167:1655-1659. 48. O´Byrne PM., Inman MD., Parameswaran K. The trials ans tribulations of IL-5, eosinophils, and allergic asthma. J allergy Clin Inmunol 2001; 108:503-8. 49. Kay AB, Menzies-Gow A. Eosinophils and interleukin-5. The debate continues. Am J Respir Crit Care Med 2003; 167:1586-87. 50. Kay AB, Menzies-Gow A. Eosinophils and interleukin-5. The debate continues. Am J Respir Crit Care Med 2003; 167:1586-87. 51. Lee JJ, McGarry MP, Farmer SC, Denzler KL, Larson KA, Cardigan PE, Brenneise IE, Horton MA, Haczku A, Gelfand EW et al.: Interleukin-5 expression in the lung epithelium of transgenicmice leads to pulmonary changes pathognomonic of asthma.J Exp Med 1997, 185:2143-2156. 52. del Pozo V, Rojo M, Rubio ML, Cortegano I, Cárdaba B, Gallardo S, Ortega M, Civantos E, López E, Martín-Mosquero C, Peces-Barba G, Palomino P, Gonzalez-Mangado N, and Lahoz C. Gene Therapy with Galectin-3 Inhibits Bronchial Obstruction and Inflammation in Antigen-challenged Rats through Interleukin-5 Gene Downregulation. Am J Respir Crit Care Med Vol 166. pp 732-737, 2002. 53. López E, del Pozo V, Miguel T, Sastre B, Seoane C, Civantos E, Llanes E, Baeza ML, Palomino P, Cárdaba B, Gallardo S, Manzarbeitia F,. Zubeldia JM,, Lahoz C. Inhibition of chronic airway inflammation and remodeling by galectin-3 gene therapy in a murine model. Aceptado en Journal of Immunology. Dic. 2005. 54. Lukacs NW, Standiford TJ, Chensue SW, Kunkel RG, Strieter RM, Kunkel SL. C-C chemokine-induced eosinophil chemotaxis during allergic airway inflammation J Leukoc Biol. 1996 Nov;60(5):573-8. 46 55. Adamko D, Odemuyiwa SO and Moqbel R. The eosinophil as a therapeutic target in asthma: beginning of the end, or end of the beginning? Current Opinion in Pharmacology 2003, 3:227-232. 56. Sterk PJ, Hiemstra PS. Eosinophil progenitors in sputum:Throwing out with the bath water? Am J resp Critical Care Med 2004. 169:549. 57. Yamaguchi Y, Duda T, Suda J, Eguchi M, Miura Y, Harada N, Tominaga A, Takatsu. Purified interleukin-5 supports the terminal differentiation and proliferation of murine eosinophil precursors. J Exp Med 1988; 167:43-56. 58. Green RH, Brightling CE, McKenna S, Hargadon B, Parker D, Bradding P, Wardlaw AJ, Pavord ID: Asthma exacerbations and sputum eosinophil counts: a randomised controlled trial. Lancet 2002, 360:1715-1721.7 59. Lee J.J et al (2004) Defining a link with asthma in mice congenitally deficient in Eosinophils. Science 305, 1773-1776. 60. Foster PS, Hogan SP, Yang M, Mattes J, Young IG, Matthaei KI, Kumar RK, Mahalingam S, Webb DC. Interleukin-5 and eosinophils as therapeutic targets for asthma. Trends Mol Med. 2002 Apr;8(4):162-7. C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 47 I n f l a m a c i ó n e o s i n o f í l i c a e n e l a s m a CUESTIONARIO 1. Cuáles son las células más importantes que median el asma alérgica: a) Neutrófilos b) Eosinófilos. c) Linfocitos T CD 4+, CD 8+. d) Ninguna de ellas. e) Todas ellas 2. Los a) b) c) d) e) eosinófilos son: Células circulantes en sangre periférica. Células titulares. Células con capacidad de proliferar. Células con núcleo característico redondeado. Todas las respuestas son válidas. 3. Cuál es la función principal de los gránulos contenidos en los eosinófilos del tipo de la Proteína Mayor Básica (MBP): a) Proteger la integridad de los eosinófilos debido a su alto contenido enzimático. b) No intervienen en la inflamación aunque si en la reparación. c) Actúan como sustancias citotóxicas en los tejidos pulmonares lesionando el epitelio bronquial. d) Producen la lisis de los hematíes. e) Promueven la liberación de LTC4 con lo que contribuyen a la broncoconstricción. 4. En la migración de los eosinófilos al foco inflamatorio de la pared bronquial son necesarios: a) Una eosinófilopoyesis previa mediada por IL-5. b) Es fundamental la adhesión específica a la pared vascular. c) Tienen que actuar factores quimiotácticos. d) Todo lo dicho en A, B y C es cierto y necesario para la migración. e) Alguno de los puntos anteriores no es imprescindible. 5. La reacción alérgica tardía se produce: a) A las 4- 6 horas de la reacción aguda inicial. b) Es una reacción celular que se inicia a las 48 horas, de las del tipo IV de hipersensibilidad. c) Se produce simultáneamente con la inicial. d) Nunca se produce si la reacción esta mediada por un alergeno. e) Ninguna respuesta es válida. 6. La IL-4 podría estar producida por todas las células descritas menos por una: a) Linfocitos CD4+. b) Eosinófilos. c) Macrófagos. d) Mastocitos. e) Ninguna de ellas. 7. La Galectina 3 es una proteína con capacidad de: a) Prevenir el asma experimental. b) Estabilizar la membrana de los mastocitos. c) Aumentar los niveles de IL-5. d) No tiene efecto en el asma e) Favorece la inflamación alérgica. 8. Indique cuál de estas citocinas no favorece la reacción alérgica: a) IL-4. b) IL-12. c) IL-5. d) IL-13. e) IL-25. 47 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 48 9. El gen ADAM33 es importante como gen candidato en el asma alérgica ya que interviene: a) En regular los niveles de IgE. b) En la estabilización de la membrana los mastocitos c) En la regulación de los receptores b adrenérgicos. d) En la transmisión autonómica ligada al sexo. e) En la remodelación. 10. En de a) b) c) d) e) la terapéutica antiasmática se están utilizando tratamientos que deplecionan los eosinófilos. ¿Cuál ellos no tiene acción eosinopénica? Corticosteroides. Galectina-3. Anticuerpos anti ICAM 1. Mepolulizumab. Anticuerpos anti-CCR3. 48 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 49 I n f l a m a c i ó n e o s i n o f í l i c a e n e l a s m a Respuestas fascículo 3, capítulo XI (Eosinófilos y asma) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e 49 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 50 50 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 51 A e r o a l e r g e n o s c o m u n e s Capítulo XII AEROALERGENOS COMUNES Manuel Lombardero Vega Investigación y Desarrollo. ALK-Abelló, S.A.. Madrid Domingo Barber Hernández Jefe del Departamento de Desarrollo. ALK-Abelló, S.A.. Madrid 51 Departamento de I+D. ALK-Abelló, S.A. Miguel Fleta 19 28037 Madrid [email protected] [email protected] Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 52 52 C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 53 A e r o a l e r g e n o s c o m u n e s INFLAMACIÓN EOSINOFÍLICA EN EL ASMA Resumen Grupo Ejemplos Pólenes Granos de polen de gramíneas, árboles y malezas Ácaros Partículas fecales y de los cuerpos de los ácaros domésticos Hongos Esporas de Alternaria, Aspergillus, Cladosporium y Penicillium Los alergenos son un tipo especial de antígenos ambientales que en ciertos individuos inducen una respuesta IgE y, como consecuencia, una reacción alérgica en exposiciones sucesivas. La vía respiratoria es la ruta más común de sensibilización y probablemente la más potente. Las fuentes más importantes de alergenos inhalados son: ácaros domésticos, pólenes, esporas de hongos y derivados epidérmicos de animales. En la actualidad están caracterizadas unas 500 moléculas alergénicas de diferentes fuentes. Muchas de estás moléculas tienen actividad enzimática, principalmente hidrolítica, pero no se puede establecer una relación causal entre actividad enzimática y alergenicidad. Las propiedades mas importantes de los alergenos inhalados son: peso molecular pequeño, 10-50 kDa, facilidad de disolución y estructura compacta. El conocimiento de la estructura primaria de numerosos alergenos ha permitido clasificarlos en diferentes familias de proteínas y explicar el fenómeno de la reactividad cruzada. Tabla I.- Fuentes más importantes Introducción de alergenos inhalados Los alergenos son antígenos capaces de inducir una respuesta IgE y una reacción de hipersensibilidad tipo I en ciertos individuos. La mayor parte de los alergenos son proteínas o glicoproteínas presentes en diferentes materiales biológicos. Las vías de acceso de los alergenos al organismo es variada. Existen alergenos que entran en el organismo a través de la piel (alergenos de contacto), a través de las membranas mucosas (alergenos inhalados y alimentarios) e incluso por vía parenteral (venenos de himenópteros). De todas estas vías, es la respiratoria la más importante y en el presente capítulo nos vamos a centrar en los aeroalergenos más comunes. La Tabla I muestra las fuentes más importantes de alergenos inhalados. En general, las moléculas alergénicas no se presentan aisladas en el ambiente, sino asociadas a partículas cuyas propiedades aerodinámicas permiten su suspensión en el aire. Después del impacto de la partícula con la fase acuosa de la mucosa respiratoria, se produce la lixiviación de las proteínas alergénicas que, una vez disueltas, tienen que cruzar la membrana epitelial para interaccionar con el sistema inmune. Este mecanismo explica ciertos prerrequisitos que debe tener una proteína para compor- Animales Derivados epidérmicos de mamíferos y aves Insectos Cucaracha tarse como alergénica, y que están relacionados con la facilidad de penetración por las membranas mucosas. Por un lado, facilidad de disolución y por otro, estructura tridimensional compacta y un p. m. relativamente bajo. En este sentido, la mayoría de los alergenos inhalados tienen un p. m. comprendido entre 10 y 50 kDa (1). La introducción en el campo de la Alergia de las técnicas del DNA recombinante y de los anticuerpos monoclonales ha permitido caracterizar un gran número de moléculas alergénicas Con el fin de evitar la complejidad inicial existente en la denominación de los diferentes alergenos, se publicó en 1986 la primera nomenclatura sistemática oficial de alergenos (2) y en 1994 (3) se editó una forma revisada. Los alergenos se designan en función del nombre taxonómico aceptado de la fuente de procedencia de la siguiente forma: las 3 primeras letras del género, un espacio, la primera letra de la especia, otro espacio y un número árabe. Los números se asignan por el orden de identificación de los alergenos, y se intenta usar el mismo número para alergenos homólogos de especies relacionadas. P.ej., Lol p 1 es el primer alergeno identifi- 53 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 54 no potencial, pero la mayoría de los pacientes alérgicos producen IgE contra un número limitado de componentes, que se conocen como alergenos mayoritarios. En la nomenclatura oficial de alergenos se ha establecido un punto de corte del 50% en la prevalencia de IgE para clasificar a un alergeno como mayoritario o minoritario. Fig 1.- Estructura 3D de: A, Der p 2 (1KTJ). B, Equ c 1 (1EW3). C, Bet v 1 (1BV1). D, Fel d 1 (1PUO). Entre paréntesis se indica el código PDB que identifica a la estructura en la base de datos. 54 cado en el polen de la gramínea Lolium perenne y Cyn d 1, el alergeno homólogo del polen de Cynodon dactylon (otra gramínea). Dentro del mismo grupo alergénico de una determinada especie puede existir microheterogeneidad debido a la presencia de proteínas con diferencias puntuales en la secuencia de aminoácidos, codificadas por varios genes en un mismo individuo o por diferentes alelos (4). Estas moléculas se conocen como isoalergenos y la nomenclatura oficial de alergenos también tiene normas para designarlos. Finalmente, un alergeno que se prepare mediante tecnología recombinante (r) o mediante síntesis química (s) se diferencia del alergeno natural (n) mediante la adición del prefijo "r" o "s". La lista oficial de alergenos se puede consultar en Internet en la dirección www.allergen.org. Actualmente existen unos 500 alergenos en la lista de los que en la mayoría de ellos se conoce la estructura 1ª, es decir, la secuencia de aminoácidos. Esta estructura está identificada con un determinado nº de acceso, y se puede consultar en bancos de datos tales como el "ExPASy Proteomics Server" del Instituto Suizo de Bioinformática (www. expasy.ch). También se conoce la estructura tridimensional (3D) de 45 alergenos diferentes que se puede consultar en la página de Internet www.rcsb.org/pdb. La fig. 1 muestra la estructura 3D de 4 alergenos inhalados importantes. Un aspecto importante es el concepto de alergeno mayoritario y minoritario. Por definición, toda proteína inmunogénica de la fuente alergénica es un alerge- Otro punto importante es el de la reactividad cruzada. Dos o más alergenos tienen reactividad cruzada si son reconocidos por la misma molécula de IgE. La reactividad cruzada explica fenómenos de sensibilización en ausencia de exposición. Por el contrario, se habla de cosensibilización cuando existen moléculas de IgE independientes contra los alergenos. La distinción entre cosensibilización y reactividad cruzada requiere experimentos "in vitro", pero es posible predecir la presencia de reactividad cruzada ya que este fenómeno tiene una clara base estructural. Se precisa al menos un 50% de identidad en la secuencia de aminoácidos (5). En general, existe reactividad cruzada entre alergenos de especies relacionadas filogenéticamente, aunque a veces existe entre especies distantes debido a la presencia de proteínas homólogas con la estructura 1ª conservada. En este caso se habla de panalergenos. ALERGENOS DE ÁCAROS Los ácaros son probablemente a nivel mundial la causa más importante de alergia respiratoria. Los ácaros de interés en Alergia pertenecen al orden Astigmata, siendo la familia Pyroglyphidae la más importante. Las especies más comunes encontradas en el polvo doméstico son Dermatophagoides pteronyssinus, Dermatophagoides farinae, y Euroglyphus maynei. Otras familias importantes son Echimyopodidae (Blomia tropicalis), Glycyphagidae (Lepidoglyphus destructor y Glycyphagus domesticus), Chortoglyphidae (Chortoglyphus arcautus) y Acaridae (Tyrophagus putrescentiae y Acarus siro). Los ácaros adquieren el agua de la humedad ambiental y por lo tanto su crecimiento es muy dependiente del microclima. Las condiciones óptimas de crecimiento son una temperatura de 25º C y una humedad relativa del 80%. En la actualidad existen 20 alergenos con nombre oficial (6). Muchos de estos alergenos se han detectado en diferentes especies de ácaros, por lo que se puede hablar de grupos alergénicos sobre la base de similitudes inmunológicas y físico-químicas. Varios de los alergenos caracterizados son enzimas, principalmente hidrolasas, localizándose fundamentalmente en las partículas fecales. Los grupos 1 y 2 son los alergenos mayoritarios en términos de prevalencia de IgE y se detectan en altas concentraciones en el polvo doméstico (hasta más de 100 µg alergeno/g polvo). El grupo 1 (Der p 1, Der f 1, Eur m 1) es una cisteinil-proteasa con un p.m. de ~25kDa (222 residuos) que se secreta en las partículas fecales. Hasta hace C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 55 A e r o a l e r g e n o s c o m u n e s poco, se pensaba que el grupo 1 estaba presente exclusivamente en ácaros piroglífidos, sin embargo, se ha detectado recientemente un representante de grupo 1 (Blo t 1) en B. tropicalis (7). Existe una identidad de secuencia importante (> 80%) entre los alergenos grupo 1 de ácaros piroglífidos lo que indica la existencia de reactividad cruzada. Los alergenos del grupo 2 son proteínas de ~14kDa (129 residuos) presentes principalmente en el cuerpo del ácaro. Se han detectado representantes del grupo 2 en las diferentes familias taxonómicas de ácaros domésticos y es el alergeno más ubicuo. Al igual que con el grupo 1, existe una importante identidad de secuencia entre los alergenos grupo 2 de ácaros piroglífidos. Similarmente, también existe esta identidad entre alergenos grupo 2 de ácaros glicifágidos. Sin embargo, la identidad de secuencia es mucho más reducida cuando se comparan alergenos de familias taxonómicas diferentes (8) lo que implica una reactividad cruzada mucho más reducida o ausente. Otras especies de interés en Alergia, de zonas templadas y subtropicales, pertenecen a las subfamilias Panicoideae (Paspalum), Chloridoideae (Cynodon) y Arundinoideae (Phragmites). Actualmente están descritos 15 grupos de alergenos (10), siendo los grupos 1 y 5 los más importantes en términos de prevalencia de IgE. Los alergenos del grupo 1 son glicoproteínas con un p. m. de ~30 kDa y que se han detectado en virtualmente todas las especies de gramíneas estudiadas. Parece que estas proteínas son β-expansinas implicadas en el crecimiento del tubo polínico en el pistilo después de la germinación. Existe una elevada identidad de secuencia entre los alergenos grupo 1 de gramíneas poideas (~90% entre Lol p 1, Phl p 1 y Dac g 1), que disminuye cuando se comparan alergenos de diferentes subfamilias. Los alergenos de los grupos 2 y 3 son proteínas de unos 100 residuos que presentan identidad de secuencia con la parte C-terminal de los alergenos grupo 1, sugiriendo un origen común por duplicación génica. Además del grupo 1, los grupos 3, 6 y 9 también son proteasas de 25 kDa, y los grupos 4 (57 kDa), 8 (26 kDa), 15 (98 kDa), 18 (60 kDa) y 20 (40 kDa) son enzimas. Se ha especulado con la relación existente entre actividad enzimática y alergenicidad. El ejemplo clásico es el alergeno Der p 1, que puede cortar "in vitro" el CD23 (receptor de baja afinidad de la IgE) de la superficie de los linfocitos B, producir CD23 soluble e incrementar mediante un mecanismo "feedback" la síntesis de IgE (9). Sin embargo, en el caso de otros alergenos (p. ej.: el grupo 2) no se ha establecido una relación entre actividad enzimática y alergenicidad. Es posible, no obstante, que alguna enzima de la fuente alergénica natural actúe como adyuvante para otros componentes. Los alergenos del grupo 4 son glicoproteínas básicas con un p. m. de ~55 kDa que se han detectado en diferentes especies de gramíneas. Su prevalencia está por encima del 50%. Los grupos 10 (33 kDa), 11 (96 kDa) y 16 (55 kDa) están relacionados con citoesqueleto, y en concreto el grupo 10 se corresponde con la tropomiosina del ácaro. Este alergeno es de interés debido a que está implicado en fenómenos de reactividad cruzada con tropomiosinas de otros invertebrados como la gamba (Pen a 1) y la cucaracha (Per a 7) y se puede considerar como un panalergeno de invertebrados. El grupo 19 (7 kDa) es el alergeno mas pequeño descrito en ácaros y parece que tiene actividad antimicrobiana y los grupos 5 (14 kDa), 7 (25 kDa) y 12 (14 kDa) no tienen una actividad biológica conocida. ALERGENOS DE PÓLENES Las plantas anemófilas producen grandes cantidades de polen que es una fuente importante de alergenos inhalados. Los 3 tipos de plantas más relevantes son gramíneas, árboles y malezas, y su importancia relativa es muy dependiente de la zona geográfica, aunque son las gramíneas (familia Poaceae) las plantas más ubicuas y las que tienen un mayor impacto en Alergia. La mayoría de las especies que crecen en las zonas de clima templado pertenecen a la subfamilia Pooideae (p. ej.: Lolium, Phleum, Dactylis, Festuca, Poa, Secale) . El grupo 5 es exclusivo de las poideas. El tamaño molecular es ligeramente superior al grupo 1 y, a diferencia del grupo 1, no tienen puentes disulfuro intracatenarios ni azúcares. Existe una elevada identidad de secuencia entre los alergenos grupo 5 de gramíneas poideas, lo que explica la alta reactividad cruzada existente entre las diferentes especies de esta subfamilia. Tanto el grupo 1 como el 5 difunden rápidamente del grano de polen tras su hidratación en medio isotónico (p.ej. la secreción de la mucosa nasal), o se expulsan en partículas submicrónicas por rotura osmótica del grano de polen (11), lo que explica su comportamiento como alergenos mayoritarios. Los alergenos del grupo 6 sólo se han detectado en las especies Phleum pratense y Poa pratensis (Phl p 6 y Poa p 6). Tienen un p. m. de ~13 kDa e identidad de secuencia con la parte C-terminal de los alergenos grupo 5. El grupo 7 se corresponde con las polcalcinas, proteínas de unos 80 residuos, con un p. m. de ~9 kDa, que contienen 2 dominios cada uno con un motivo "EF-hand" ligante de Ca2+. Este tipo de proteínas se han detectado no sólo en gramíneas sino también en pólenes de árboles y de malezas, tienen una estructura 1ª conservada y se consideran como panalergenos de pólenes. De los restantes grupos de alergenos, el más importante es el grupo 12 (~14 kDa) que pertenece a la familia de las profilinas. Se trata de un grupo de proteínas conservadas, relacionadas con la polimerización de la actina, presentes en todas las células eucarióticas, y que se han detectado como alergenos en pólenes de gramíneas, árboles y malezas y alimen- 55 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 56 tos vegetales. La prevalencia de IgE de las profilinas y polcalcinas está en el 10-20%. Los pólenes de árboles inductores de alergia más importantes pertenecen a las familias Betulaceae, Platanaceae, Oleaceae y Cupressaceae (12). Dentro de la familia Betulaceae, la especie más representativa es Betula verrucosa (abedul). Bet v 1 es el alergeno principal, con una prevalencia de IgE en torno al 90%. Se trata de una proteína de 159 residuos, con un p. m. de 17 kDa, que pertenece al grupo PR-10 (PR de "pathogenesis related", proteínas de defensa cuya función es proteger a las plantas contra diferentes patógenos). Se han detectado homólogos de Bet v 1 en pólenes de otras especies de árboles, todas ella pertenecientes al orden Fagales, tales como el Aln g 1 (Alnus glutinosa, aliso), Cor a 1 (Corylus avellana, avellano), Carb b 1 (Carpinus befulus, hojaranzo), Que a 1 (Quercus alba, roble) y Cas s 1 (Castanea sativa, castaño). También se han detectado proteínas tipo Bet v 1 en diferentes alimentos vegetales (manzana, pera, zanahoria, apio, etc) que lógicamente se comportan como alergenos alimentarios. Estas proteínas están conservadas y tienen reactividad cruzada. Además de Bet v 1 existen otros alergenos en el polen del abedul, aunque con una importancia en términos de prevalencia claramente menor. Así, Bet v 2 (14 kDa) pertenece a la familia de las profilinas y Bet v 4 (9 kDa) es una polcalcina. 56 Mientras que el abedul está muy extendido en el Norte y Centro de Europa, el olivo (Olea europaea) tiene un papel equivalente en la cuenca Mediterránea. El alergeno principal del polen del olivo es el Ole e 1. Se trata de una proteína de 145 residuos, mayoritariamente N-glicosilada y punto isoeléctrico ligeramente ácido. Se han caracterizado proteínas homólogas del Ole e 1 en otras oleaceas tales como Fraxinus excelsior (Fra e 1), Ligustrum vulgare (Lig v 1) y Syringa vulgaris (Syr v 1). Todas estas proteínas tienen una identidad en la secuencia de aminoácidos bastante alta y una reactividad cruzada elevada. También se han detectado homólogos de Ole e 1 en especies taxonómicamente alejadas tales como Lolium perenne (Lol p 11), Plantago lanceolata (Pla l 1) y Chenopodium album (Che a 1). La identidad en la sencuencia de aminoácidos entre Ole e 1 y estas moléculas es considerablemente menor (~ 40%) y de ahí que exista una baja reactividad cruzada. Aparte del Ole e 1, se han caracterizado 9 alergenos más. El Ole e 2 (14 kDa) es una profilina y el Ole e 3 (9 kDa) una polcalcina. El Ole e 7 (~ 10 kDa) pertenece a la familia de las proteínas transferidoras de lípidos (LTP) y el Ole e 9 (~ 45 kDa) es una β-glucanasa. Es interesante destacar que las prevalencias de IgE a Ole e 7 y Ole e 9 aumentan de modo importante en pacientes de zonas con un nivel ambiental elevado de polen de olivo. Las cupresaceas son plantas gimnospermas distribuidas por todo el mundo. Los géneros más importantes son Cupressus, Juniperus y Cryptomeria. En el polen de todas estas plantas se detecta un componente alergénico mayoritario. Se trata de una glicoproteína de 40-45 kDa (Cry j 1, Cup a 1, Cup s 1, Jun a 1, Jun o 1) que tiene actividad pectato-liasa. La identidad en la secuencia de aminoácidos entre estos alergenos es bastante alta y existe una reactividad cruzada elevada. Platanus acerifolia es un árbol ornamental presente en la mayor parte de las ciudades europeas. El alergeno principal del polen es el Pla a 1, proteína de 18 kDa de función biológica no conocida. El último grupo de plantas alergénicas del que vamos a tratar es el de las malezas (13). Las familias más importantes son: Compositae, Urticaceae, Amarantaceae y Plantaginaceae. Dentro de la familia de las compuestas las especies con mayor impacto en Alergia son Ambrosia artemisifolia y Artemisia vulgaris. El polen de Ambrosia artemisifolia es la causa más importante de polinosis en América del Norte de donde esta planta es nativa. En el siglo pasado esta planta se introdujo en Europa (Hungría) y actualmente se está expandiendo rápidamente por Centro Europa, Norte de Italia y Sur de Francia. Existen 9 alergenos descritos en el polen de A. artemisifolia, de los que el más importante es Amb a 1 (antígeno E), con una prevalencia de IgE superior al 90%. Se trata de una proteína de 38 kDa, que pertenece a la familia de las pectato-liasas. Amb a 8 (~14 kDa) es una profilina y Amb a 9 (~9 kDa) una polcalcina. En el caso de A. vulgaris se han detectado 6 alergenos de los que son mayoritarios el Art v 1 (~25 kDa), Art v 2 (~60 kDa) y Art v 3 (~10 kDa, LTP). Art v 4 (14 kDa) es una profilina, Art v 5 (9 kDa) una polcalcina. En la familia de las urticaceas, las especies más importantes son Parietaria officinalis y judaica. Estas plantas son muy abundantes en la zona mediterránea. En P. judaica, están descritos 3 alergenos. Par j 1 y Par j 2 son claramente mayoritarios, tienen un p. m. de alrededor de 12 kDa y un 40% de identidad de secuencia entre ellos. Ambos alergenos pertenecen a la familia de las LTPs. Estas proteínas tienen alrededor de 95 residuos y punto isoeléctrico básico (14). Se han detectado en pólenes pero también en frutas y otros órganos vegetales y por lo tanto es un alergeno tanto respiratorio como alimentario. La estructura tridimensional de las LTPs está conservada, pero el grado de identidad en la secuencia de aminoácidos es variable (30% - 95%) y sólo se da reactividad cruzada entre especies taxonómicamente relacionadas. En la familia de las amarantaceas, las especies más importantes son Chenopodium album y Salsola kali, que se encuentran principalmente en zonas semidesérticas. Se han descrito 3 alergenos en C. album. Che a 1 es el alergeno mayoritario (~80% de prevalencia). Tiene un p. m. de aproximadamente 18 kDa y C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 57 A e r o a l e r g e n o s pertenece a la familia del Ole e 1. Che a 2 (~14 kDa) es una profilina y Che a 3 (~9 kDa) una polcalcina. En S. kali se ha descrito un alergeno principal, Sal k 1, como un p. m. de ~40 kDa. c o m u n e s En el género Penicillium se han caracterizado alergenos principalmente de las especies P. citrinum y P. chrysogenum (antiguamente notatum). Los alergenos más importantes son el Pen c 13/Pen ch 13 que es una serin-proteasa alcalina de 33 kDa, el Pen c 18/Pen ch Finalmente, en la familia Plantaginaceae la especie representativa es Plantago lanceolata. El alergeno mayoritario es Pla l 1 (> 80% de prevalencia) que también pertenece a la familia del Ole e 1. ALERGENOS DE HONGOS Los hongos más importantes causantes de alergia pertenecen a los géneros Aspergillus, Alternaria, Cladosporium y Penicillium que contienen muchas especies ampliamente distribuidas por todo el mundo (15). Las fuentes más importantes de Alternaria y Cladosporium se encuentran en la vegetación al aire libre, aunque también se detectan esporas en el interior de las viviendas. Aspergillus y Penicillium se consideran hongos de espacios cerrados. Alta a 1 es claramente el alergeno más importante de Alternaria alternata, con una prevalencia superior al 90%. Se trata de un homodímero, teniendo cada subunidad 129 residuos. Las 2 subunidades están unidas por puentes disulfuro. Homólogos de Alt a 1 sólo se han encontrado en el género Alternaria y en géneros muy próximos. Además de Alt a 1, se han detectado en librerías de cDNA de A. alternata 8 polipéptidos con capacidad de unir IgE, todos ellos alergenos minoritarios. Los más importantes en términos de prevalencia de IgE son el Alt a 6, que es una enolasa de 45 kDa (se han detectado enolasas con estructuras primarias bastante conservadas en diferentes hongos), y el Alt a 8, que es una manitol deshidrogenasa dependiente de NADPH de 29 kDa. Cladosporium herbarum está relacionado taxonómicamente con A. alternata. Existen actualmente 8 alergenos de C. herbarum con nombre oficial, de los que los más importantes son: Cla h 6 (enolasa de 46 kDa), Cla h 8 (manitol deshidrogenasa dependiente de NADPH de 28 kDa) y Cla h 10 (aldehido deshidrogenasa de 53 kDa). La especie más representativa del género Aspergillus es A. fumigatus, que es el agente causal de la aspergilosis broncopulmonar, y que también produce asma alérgico. Se han caracterizado hasta 22 moléculas alergénicas en este hongo. Asp f 1 es una mitogilina de 18 kDa. Es una proteína bastante tóxica, que inhibe la síntesis de proteínas mediante la rotura del rRNA 28 S. Tiene una alta prevalencia de IgE (>80%) tanto en pacientes asmáticos como con aspergilosis. Los alergenos Asp f 2 (~37 kDa), Asp f 3 (~19 kDa), Asp f 4 (~30 kDa), Asp f 6 (~27 kDa) y Asp f 9 (~34 kDa) tienen una prevalencia de IgE elevada en pacientes con aspergilosis pero no en pacientes asmáticos, y se pueden considerar como marcadores de esta enfermedad (16). También se ha detectado una enolasa de 46 kDa, Asp f 22, en A. fumigatus. Fig.2. - Topología del barril-β de las lipocalinas 18 que es otra proteasa de origen vacuolar de 39 kDa, el Pen c 19 que es una proteína de choque térmico de 70 kDa y el Pen c 22 que es una enolasa de 46 kDa. ALERGENOS DE ANIMALES La mayoría de los alergenos de animales que causan sensibilización por vía respiratoria, pertenecen a una familia de proteínas llamadas lipocalinas (17). Se trata de un grupo de proteínas secretorias, relativamente pequeñas, que a pesar de que no tienen entre ellas identidades elevadas en su secuencia de aminoácidos, tienen una estructura tridimensional muy conservada. El motivo estructural más característico es un barril-β (fig. 2) formado por 8 cadenas-β antiparalelas que engloban una cavidad interna en la que se pueden transportar pequeñas moléculas hidrofóbicas como p. ej.: vitaminas, feromonas, esteroides y lípidos. La mayoría de las lipocalinas se sintetizan en el hígado y en glándulas exocrinas y se localizan en la piel y en diferentes fluidos corporales del animal, desde donde pueden emanar al ambiente y sensibilizar por vía respiratoria. La Tabla II muestra los alergenos de naturaleza lipocalínica de mamíferos más importantes. Tienen una prevalencia de IgE superior al 70% y la identidad de su secuencia de aminoácidos es relativamente baja, lo que explica su baja reactividad cruzada. Curiosamente, uno de los alergenos mayoritarios de 57 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 58 la cucaracha, Blatella germanica, Bla g 4, es también una lipocalina. Además de las lipocalinas, existe un segundo grupo de proteínas, las secretoglobinas, que en algunas especies (gato, hámster común) se comportan como alergénicas. Son proteínas pequeñas de mamíferos (<100 residuos) que forman dímeros mediante puentes disulfuro, formándose una cavidad hidrofóbica entre los monómeros. Tienen una expresión exocrina ligada a tejidos epiteliales (pulmón, tracto genital, glándulas salivares) y una función fisiológica no muy clara. La proteína modelo de este grupo es la uteroglobina de conejo. El alergeno principal del gato, Fel d 1, es una secretoglobina (18). Se trata de un tetrámero (38 kDa) formado por 2 dímeros de 19 kDa. Cada dímero está formado por 2 cadenas polipeptídicas de 70 y 90-92 residuos respectivamente unidas Fuente Alergeno Nº residuos Localización Can f 1 Can f 2 156 162 Saliva/piel Saliva/piel Equ c 1 Equ c 2 172 -1 Saliva/piel/orina Saliva/piel/orina Vaca Bos d 2 Bos d 52 156 162 Piel Leche Ratón Mus m 1 162 Rata Rat n 1 162 Orina Conejo Ory c 1 -1 Piel Cobaya Cav p 1 Cav p 2 -1 -1 Piel/orina Piel/orina Perro Caballo por 3 puentes disulfuro. La cadena más pesada está N-glicosilada. Recientemente se ha determinado su estructura tridimensional, que es muy parecida a la de la uteroglobina. El alergeno principal del hámster común (Mes a 1) es también una secretoglobina, pero no presenta reactividad cruzada con el Fel d 1. Finalmente, un tercer grupo de proteínas alergénicas de animales son las albúminas séricas. Son proteínas de transporte que representan el componente proteico principal del plasma de mamíferos. Tienen un p. m. de alrededor de 65 kDa, un punto isoeléctrico de 4-5, no están glicosiladas y presentan varios puentes disulfuto intracatenarios. Tienen una prevalencia de IgE del 1020% (no son alergenos mayoritarios), pero presentan una elevada identidad de secuencia, que explica casos de reactividad cruzada entre diferentes especies. Funcionan como alergenos por vía respiratoria y digestiva. Como ejemplos tenemos los alergenos Bos d 6, Can f 3, Equ c 3 y Fel d 2. 58 Orina (1) Secuencia de aminoácidos completa no disponible β−lactoglobulina, alergeno alimentario de la leche de vaca (2) Tabla II.- Alergenos de mamíferos de naturaleza lipocaínica C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 59 A e r o a l e r g e n o s c o m u n e s Bibliografía 1. Vratala S, Grote M, Duchene M, van Ree R, Kraft D, Scheiner O, Valenta R. Properties of tree and grass pollen allergens: reinvestigation of the linkage between solubility and allergenicity. Int Arch Allergy Immunol. 1993;102:160-9. 2. Marsh D G, Goodfriend L, King T P, Lowenstein H, Platts-Mills T A E. Allergen nomenclature. Bull WHO 1986;64:767-770. 3. Hoffman D, Lowenstein H, Marsh D G, Platts-Mills T A E, Thomas W. Allergen nomenclature. Bull WHO 1994;72:796-806. 4. Larsen J N. Isoallergens. Significance in allergen exposure and response. ACI News 1995;7/5:141-160. 5. Ferreira F, Hawranek T, Gruber P, Wopfner N, Mari A. Allergic cross-reactivity: from gene to the clinic. Allergy 2004;59:243-267. 6. Thomas W R, Smith W-A, Hales B J, Mills K L, O'Brien R M. Characterization and immunobiology of house dust mite allergens. Int Arch Allergy Immunol 2002;129:1-18. 7. Mora C, Flores I, Montealegre F, Díaz A. Cloning and expression of Blo t 1, a novel allergen from the dust mite Blomia tropicalis, homologous to cysteine proteases. Clin Exp Allergy 2003;33:28-34. 8. Smith A. M. et al. The molecular basis of antigenic cross-reactivity between the group 2 mite allergens . J Allergy Clin Inmunol 2001; 107:977-84. 9. Hewitt C R A, Brown A P, Hart B J, Pritchard D I. A major house dust mite allergen disrupts the IgE network by selectively cleaving CD23: innate protection by antiproteases. J Exp Med 1995:182:1537-1544. 10. Andersson K, Lidholm J. Characteristics and immunobiology of grass pollen allergens. Int Arch Allergy Immunol 2003;130:87-107. 11. Grote M, Vrtala S, Niederberger V, Wiermann R, Valenta R, Reichelt R. Release of allergen-bearing cytoplasm from hydrated pollen: A mechanism common to a variety of grass (Poaceae) species revealed by electron microscopy. J Allergy Clin Immunol 2001;108:109-15. 12. Mothes N, Valenta R. Biology of tree pollen allergens. Curr Allergy Asthma Rep 2004;4:384-390. 13. Gadermaier G, Dedic A, Obermeyer G, Frank S, Himly M, Ferreira F. Biology of weed pollen allergens. Curr Allergy Asthma Rep 2004;4:391-400. 14. Salcedo G, Sánchez-Monge R, Díaz-Perales A, García-Casado G, Barber D. Plant non-specific lipid transfer proteins (LTPs) as food and pollen allergens. Clin Exp Allergy 2004;34:1336-1341. 15. Kurup V P. Fungal allergens. Curr Allergy Asthma Rep 2003;3:416-423. 16. Kurup V P, Banerjee B, Hemmann S, Greenberger P A, Blaser K, Crameri R. Selected recombinant Aspergillus fumigatus allergens bind specifically to IgE in ABPA. Clin Exp Allergy 2000;30:988-993. 17. Virtanen K. Lipocalin allergens. Allergy 2001.56:48-51. 18. Kaiser L, Gronlund H, Sandalova T, Ljunggren H-G, van Hage-Hamsten M, Achour A, Schneider G. The crystal structure of the major cat allergen Fel d 1,a member of the secretoglobin family. J Biol Chem 2003.278:37730-37735 59 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 60 CUESTIONARIO 1. Los a) b) c) d) e) alérgenos son moléculas del tipo: Proteínas Glicoproteínas Lípidos a y b son ciertas a, b y c son ciertas 2. ¿Cuántos alergenos mayoritarios hay en una fuente alergénica? a) Uno b) Más de uno c) Depende de la fuente d) No se puede determinar e) b y c son ciertas 3. Las a) b) c) d) e) características de un alérgeno inhalado son: Proteína de p. m. entre 10 y 50 kDa Facilidad de disolución Estructura 3D compacta Presente en partículas aerovagantes Todas son ciertas 4. El nombre sistemático del alérgeno 5 del polen de la gramínea Dactylis glomerata es: a) D g 5 b) Dac g 5 c) Dac g V d) D glo 5 e) Ninguna es correcta 60 5. La reactividad cruzada: a) Se puede predecir si se conoce la estructura de los alérgenos implicados b) Normalmente se da entre especies filogenéticamente relacionadas c) Se puede dar entre especies alejadas d) Explica sensibilización en ausencia de exposición e) Todas las respuestas anteriores son válidas 6. El panalérgeno más importante de ácaros es: a) El grupo 1 b) El grupo 2 c) El grupo 10 (la tropomiosina) d) El grupo 1 y 2 e) Ninguno de los anteriores 7. El alérgeno mayoritario detectado en todas las especies de gramíneas es: a) Grupo 1 b) Grupo 5 c) Profilina d) Polcalcina e) Todos los anteriores 8. Las a) b) c) d) e) polcalcinas: Se detectan sólo en pólenes Son proteínas ligantes de Ca2+ Son panalérgenos de pólenes Son alérgenos minoritarios Todas las respuestas anteriores son correctas C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 61 A e r o a l e r g e n o s c o m u n e s 9. Un paciente de Jaén, alérgico al polen del olivo, viaja a Alemania a una zona sin olivos y presenta síntomas alérgicos respiratorios en primavera, ¿cuál es la explicación? a) En la zona de Alemania existen fresnos (Fraxinus) b) Está sensibilizado a profilinas c) Está sensibilizado a polcalcinas d) Las tres respuestas anteriores pueden ser posibles e) Es imposible una respuesta alérgica a una determinada fuente alergénica sin exposición previa 10. Los alérgenos más importantes responsables de la reactividad cruzada entre diferentes especies de mamíferos son: a) Albúminas b) Lipocalinas c) Profilinas d) Ninguna de las anteriores e) No hay reactividad cruzada 61 Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 62 Respuestas fascículo 3, capítulo IV (Aeroalergenos comunes) Los alumnos inscritos deberán enviar contestado el cuestionario a la siguiente dirección: Fmc SEPAR, c/Provenza 108, bajos 2ª · 08029 Barcelona · Fax: 93 410 71 20 Nombre:____________________________________________________________________ Centro de trabajo:____________________________________________________________ Señale con un círculo la respuesta correcta 62 1.- a b c d e 2.- a b c d e 3.- a b c d e 4.- a b c d e 5.- a b c d e 6.- a b c d e 7.- a b c d e 8.- a b c d e 9.- a b c d e 10.- a b c d e C u r s o s d e f o r m a c i ó n c o n t i n u a d a Asma I Fasc culo 3.qxd 10/03/2006 10:40 PÆgina 63 A e r o a l e r g e n o s c o m u n e s 63